Comment déterminer la concentration en ions chlorure dans des solutions de traitement du fer à l'aide de nitrate d'argent – Institut canadien de conservation (ICC) Notes 4/5
Liste des abréviations et des symboles
Abréviations
- ICC
- Institut canadien de conservation
- format de document portable
- ppm
- partie par million
Symboles
- μS/cm
- microsiemens par centimètre
- Ag
- argent
- AgCl
- chlorure d'argent
- Cl-
- ion chlorure
- g
- gramme
- g/mL
- gramme par millilitre
- HNO3
- acide nitrique
- M
- molarité
- mg
- milligramme
- mL
- millilitre
- mm
- millimètre
- pH
- potentiel hydrogène
- v/v
- volume sur volume
- w/v
- poids sur volume
Introduction
Les objets provenant de sites immergés ou enfouis peuvent être contaminés par des concentrations élevées d'ions chlorure, comme cela est expliqué à la section Origine des sels présents dans les objets. Cette contamination est particulièrement nuisible aux objets contenant du fer (Selwyn et coll. 1999). Comme le savent très bien les automobilistes qui empruntent des routes déglacées avec du sel de voirie (principalement du chlorure de sodium), les ions chlorure accélèrent la corrosion du fer. Les restaurateurs doivent procéder à l'élimination des ions chlorure, étape importante du traitement des objets contaminés au chlorure. En principe, ce traitement est relativement simple : les objets sont immergés dans un bain alcalin jusqu'à ce que les ions chlorure qui les contaminent soient dissous (Selwyn, 2004). En pratique, le bain doit être remplacé régulièrement, parce qu'il perd de son efficacité à mesure que les ions chlorure s'y accumulent. Rimmer et coll. (2013) recommandent d'arrêter le traitement du fer lorsque la concentration en ions chlorure est inférieure à 5 parties par million (ppm). Il faut effectuer un test relativement simple pour déterminer si le bain doit être remplacé ou si le traitement peut être arrêté.
Le test de détection des ions chlorure décrit dans la présente Note de l'ICC est basé sur la précipitation d'un sel chloré insoluble. Lorsque quelques gouttes d'une solution de nitrate d'argent sont ajoutées à une solution aqueuse légèrement acide contenant des ions chlorure, un précipité de chlorure d'argent de couleur blanche se forme. Si l'on dispose, pour effectuer une comparaison, de solutions étalons dont la concentration en ion chlorure est connue, la quantité de précipité produite peut alors être utilisée pour estimer la concentration en ions chlorure. Ce test devrait permettre de détecter des concentrations en ions chlorure aussi faibles que 1 ppm. Pour en apprendre davantage sur les réactions en jeu, consulter la section Aspects scientifiques du test de détection des ions chlorure.
La présente Note de l'ICC décrit la procédure à suivre et le matériel requis pour détecter les ions chlorure dans une solution. La première étape de cette procédure consiste à tester des solutions dont la concentration en ions chlorure est connue pour apprendre à utiliser le nitrate d'argent et confirmer que le test fonctionne correctement. Il est ensuite possible de tester des solutions de traitement ou des solutions dont la concentration en ions chlorure est inconnue. Il n'est pas nécessaire d'effectuer ces essais dans un laboratoire équipé d'un système de ventilation, sauf si de l'acide nitrique doit être utilisé pour ajuster l'acidité de la solution. Le cas échéant, consulter la fiche signalétique (FS) de l'acide nitrique afin de connaître l'information de santé et sécurité qui s'y rapporte.
Procédure : comment détecter les ions chlorure dans une solution à l'aide de nitrate d'argent
Équipement et matériel requis pour effectuer un test de détection des ions chlorure à l'aide de nitrate d'argent
- Solutions dont la concentration en ions chlorure est connue ou inconnue.
- Les solutions dont la concentration en ions chlorure est connue doivent être achetées ou préparées. La procédure utilisée pour préparer des solutions d'ions chlorure à 5 ppm, à 30 ppm, à 300 ppm et à 3 000 ppm est décrite à la section Préparation des échantillons de solutions d'ions chlorure.
- Les solutions dont la concentration en ions chlorure est inconnue peuvent être, notamment, une solution de dessalement ou toute autre solution devant être testée.
- Éprouvettes en verre (par exemple, une éprouvette d'un diamètre extérieur de 16 mm et d'une longueur égale à 125 mm contient environ 20 mL)
- Support pour éprouvettes
- Matériau foncé qui servira d'arrière-plan (par exemple, Coroplast ou bristol noir)
- Source lumineuse de forte intensité (par exemple, une lampe de bureau)
- Une pipette Pasteur ou un compte-gouttes par solution
- Eau distillée ou déionisée
- Solution d'acide nitrique dilué (HNO3, 5 % [v/v]); la procédure pour préparer la solution est décrite à la section Préparation des solutions
- Cylindre gradué (10 mL)
- Fioles jaugées (100 mL)
- Solution de nitrate d'argent (2 % [p/v]); la procédure pour préparer la solution est décrite à la section Préparation des solutions
- Petit bécher pour transférer la solution de nitrate d'argent
- Bouteille en verre brun pour entreposer la solution de nitrate d'argent (par exemple, 125 mL). Le nitrate d'argent est sensible à la lumière. Si l'on ne dispose pas de ce type de bouteille, utiliser une bouteille en verre transparent recouvert de papier d'aluminium
- Bouteille d'entreposage en verre (par exemple, 125 mL) pour la solution d'acide nitrique
- Balance (d'une précision minimale de 0,01 g)
- Papier indicateur de pH
- Chlorure de sodium (NaCl)
- Papier filtre (facultatif)
- Entonnoir (facultatif)
Procédure pour détecter les ions chlorure
Les substances chimiques, comme l'acide nitrique et le nitrate d'argent, doivent être utilisées avec précaution, et il est nécessaire de porter un équipement de protection individuelle, tels des gants, des lunettes de sécurité et des vêtements de protection, pour les manipuler. Le nitrate d'argent peut noircir la peau et les vêtements. Ne jamais prélever un échantillon directement dans la réserve de solution. Transférer plutôt la quantité voulue dans un petit bécher, puis y prélever un échantillon. Travailler dans un endroit équipé d'un système de ventilation, surtout si l'on utilise de l'acide nitrique concentré. Pour obtenir des renseignements supplémentaires sur la préparation de solutions chimiques, consulter Odegaard et coll. (2005) et Skoog et coll. (2014).
Préparation des solutions
- Solution d'acide nitrique (HNO3, 5 % [v/v])
- Travailler sous une hotte.
- Remplir partiellement une fiole jaugée de 100 mL avec de l'eau distillée.
- Mesurer 5 mL d'acide nitrique concentré (à 68-70 % de HNO3 en poids) dans un cylindre gradué de 10 mL.
- Transférer l'acide nitrique dans la fiole jaugée (important : toujours ajouter l'acide concentré à l'eau, et non l'inverse).
- Mélanger en tournant.
- Ajouter de l'eau distillée dans la fiole jaugée jusqu'à la marque de 100 mL.
- Transvider dans une bouteille d'entreposage en verre et étiqueter la solution.
- La solution obtenue contient environ 0,8 M HNO3.
- Solution de nitrate d'argent (AgNO3, 2 % [p/v])
- Remplir partiellement une fiole jaugée de 100 mL avec de l'eau distillée.
- Peser 2,0 g de nitrate d'argent.
- Transférer le nitrate d'argent dans la fiole et mélanger en tournant pour dissoudre le solide.
- Ajouter de l'eau distillée dans la fiole jaugée jusqu'à la marque de 100 mL.
- Transvider dans une bouteille d'entreposage en verre brun de 125 mL et étiqueter la solution.
Préparation des échantillons de solutions d'ions chlorure
Deux échantillons de solution contenant respectivement 30 ppm et 5 ppm d'ions chlorure peuvent être préparés de la façon décrite ci-dessous. Ces deux concentrations ont été choisies parce qu'elles avoisinent la limite inférieure et la valeur médiane de l'intervalle compris entre 1 et 100 ppm, mais on peut opter pour d'autres valeurs de concentration. Il est également possible d'acheter des solutions étalons d'ions chlorure.
Les échantillons de solution requis ont une concentration en ions chlorure tellement faible qu'ils doivent être préparés par dilution. Préparer une solution de départ avec une quantité de chlorure de sodium facile à mesurer. La procédure décrite ci-dessous suppose l'utilisation d'une balance dont la précision minimale est de 0,01 g. La solution de départ doit contenir environ 0,5 g de chlorure de sodium pour que la mesure du poids soit suffisamment précise. Préparer une deuxième solution en diluant 10 mL de la première solution dans de l'eau de façon à obtenir 100 mL de solution. Diluer la deuxième solution de la même manière pour obtenir une troisième solution. Il est important que les récipients en verre soient bien propres pour empêcher toute contamination par des ions chlorure provenant d'une utilisation antérieure.
- Solution A : contenant 3 000 ppm d'ions chlorure
- Remplir partiellement une fiole jaugée de 100 mL avec de l'eau distillée.
- Peser 0,49 g de chlorure de sodium.
- Verser le chlorure de sodium dans la fiole et mélanger en tournant pour dissoudre le solide.
- Ajouter de l'eau distillée dans la fiole jusqu'à la marque de 100 mL.
- Inscrire « A : ions chlorure 3 000 ppm » sur la fiole.
- Solution B : contenant 300 ppm d'ions chlorure
- Remplir partiellement une fiole jaugée de 100 mL avec de l'eau distillée.
- Mesurer 10 mL de la solution A (3 000 ppm) dans un cylindre gradué de 10 mL.
- Transférer la solution A dans la fiole jaugée.
- Mélanger en tournant.
- Ajouter de l'eau distillée dans la fiole jusqu'à la marque de 100 mL.
- Inscrire « B : ions chlorure 300 ppm » sur la fiole.
- Solution C : contenant 30 ppm d'ions chlorure
- Remplir partiellement une fiole jaugée de 100 mL avec de l'eau distillée.
- Mesurer 10 mL de la solution B (300 ppm) dans un cylindre gradué de 10 mL.
- Transférer la solution B dans la fiole jaugée.
- Mélanger en tournant.
- Ajouter de l'eau distillée dans la fiole jusqu'à la marque de 100 mL.
- Inscrire « C : ions chlorure 30 ppm » sur la fiole.
- Solution D : contenant 5 ppm d'ions chlorure (remarque : fabriquée à partir de la solution B)
- Remplir partiellement une fiole jaugée de 100 mL avec de l'eau distillée.
- Mesurer 1,7 mL de la solution B (300 ppm) dans un cylindre gradué de 10 mL.
- Transférer la solution B dans la fiole jaugée.
- Mélanger en tournant.
- Ajouter de l'eau distillée dans la fiole jusqu'à la marque de 100 mL.
- Inscrire « D : ions chlorure 5 ppm » sur la fiole.
Analyse des ions chlorure
- Si la solution d'ions chlorure testée contient des particules en suspension, la filtrer à l'aide d'un entonnoir et d'un papier filtre.
- Mesurer 10 mL d'eau distillée dans un cylindre gradué de 10 mL.
- Transférer l'eau distillée dans une éprouvette propre. Cette « solution témoin » ne devrait pas contenir d'ions chlorure.
- De la même façon, mesurer 10 mL de la solution C (30 ppm) et la verser dans une autre éprouvette. Cette solution constitue « l'échantillon ».
- Ajouter une ou deux gouttes d'acide nitrique à 5 % (v/v) dans chaque éprouvette et mélanger en tournant. Vérifier le pH à l'aide d'un papier indicateur de pH. Il devrait se situer entre 2 et 3. Ajouter de l'acide nitrique à l'échantillon si celui-ci est alcalin (par exemple, s'il contient de l'hydroxyde de sodium).
- Éclairer latéralement les éprouvettes avec une lumière de forte intensité. Dans la mesure du possible, placer un arrière-plan noir derrière et sous les éprouvettes.
- Ajouter deux gouttes de la solution de nitrate d'argent dans chaque éprouvette et observer les solutions pour vérifier si un précipité blanc apparaît.
- Répéter les étapes 1 à 7 avec un échantillon de 10 mL de la solution D (5 ppm).
Résultats du test
Si la concentration en ions chlorure est inférieure à 1 ppm, comme dans l'échantillon témoin, la solution d'essai devrait rester transparente à l'issue du test (voir la figure 1a). Si la concentration en ions chlorure dans l'échantillon est supérieure à environ 1 ppm, un précipité blanc (chlorure d'argent) devrait apparaître. Le précipité sera plus prononcé dans la solution C (30 ppm, figure 1b) que dans la solution D (5 ppm, figure 1c). (Dans une solution d'essai alcaline, un précipité d'oxyde d'argent brun sera produit et interférera avec le test de détection des ions chlorure. On peut résoudre ce problème en ajustant le pH pour qu'il se situe entre 2 et 3.)

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0385
Figure 1a. Solution d'essai transparente avant l'ajout d'une goutte de nitrate d'argent.
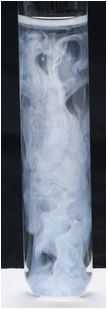
© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0394
Figure 1b. Solution d'essai présentant un précipité de chlorure d'argent de couleur blanche, 40 secondes après l'ajout de nitrate d'argent à une solution dont la concentration en ions chlorure est égale à 30 ppm.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0394
Figure 1c. Solution d'essai présentant un précipité de chlorure d'argent de couleur blanche, 40 secondes après l'ajout de nitrate d'argent à une solution dont la concentration en ions chlorure est égale à 5 ppm.
La concentration en nitrate d'argent choisie dans le cadre de cette procédure est égale à 2 % (p/v) (0,1 M), comme le recommandent Plenderleith et Werner (1971) et Riss (1993). Puisque cette concentration donne des résultats satisfaisants, il n'est pas nécessaire de fixer la concentration à la valeur plus élevée de 0,2 M (3,4 % [p/v]) recommandée par Lagowski et Sorum (2005) et Odegaard et coll. (2005) (p. 108-109).
Renseignements supplémentaires
Estimation de la concentration en ions chlorure
Entre environ 1 ppm et 100 ppm, il est possible d'estimer de façon très approximative la concentration en ions chlorure d'un échantillon, et ce, en comparant visuellement la densité du précipité blanc avec la densité des précipités des solutions étalons d'ions chlorure (Semczak, 1977). Le degré de turbidité de la solution testée, après l'ajout de deux gouttes de nitrate d'argent à 2 % (p/v), est quasi proportionnel à la concentration en ions chlorure. Plus la solution est trouble, plus son contenu en ions chlorure est élevé. Au-dessus de 100 ppm, toutes les solutions présentent la même turbidité. Au-dessous de 1 ppm, le précipité est trop faible pour être visible. Il est possible de préparer les autres solutions apparaissant à la figure 2 en suivant les étapes de préparation de la solution D (5 ppm), mais en utilisant 5 mL de solution B pour obtenir une solution à 15 ppm ou 3,3 mL de solution A pour obtenir une solution à 100 ppm.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0394
Figure 2. Éprouvettes contenant des concentrations en ions chlorure de 0, 5, 15, 30 et 100 ppm (de gauche à droite), environ 40 secondes après l'ajout de deux gouttes de nitrate d'argent à 2 % (p/v).
L'aspect que prennent les éprouvettes au cours des 40 secondes suivant l'ajout du nitrate d'argent est montré dans une vidéo.
Autres méthodes de mesure des ions chlorure
Il existe d'autres méthodes, plus précises, pour mesurer la concentration des ions chlorure dans les solutions aqueuses. La concentration en ions chlorure peut notamment être mesurée de manière quantitative à l'aide de papier test commercial, comme cela est expliqué dans la Note de l'ICC 4/4 Comment déterminer la concentration en ions chlorure dans des solutions de traitement du fer avec des bandelettes réactives Quantab. Une analyse semi-quantitative peut être réalisée à l'aide des bandelettes réactives EM Quant servant à détecter le chlorure (Odegaard et coll. 2011). Une autre méthode plus précise consiste à effectuer un titrage avec du nitrate d'argent (Selwyn, 1999). D'autres méthodes sont mentionnées et examinées par Wang et coll. (2008) et Rimmer et coll. (2012).
Surveillance du dessalement par la mesure de la conductivité
La conductivité est la propriété électrique d'un matériau qui détermine sa capacité à conduire l'électricité. Plus la conductivité d'un liquide est élevée, plus le courant ionique circule facilement dans ce liquide. L'unité SI de la conductivité est le siemens par mètre (S/m). La conductivité est généralement mesurée en millisiemens par centimètre (mS/cm) ou en microsiemens par centimètre (μS/cm).
La conductivité d'une solution aqueuse dépend du mouvement des ions provenant des sels dissous et d'autres particules chargées. La conductivité d'une eau relativement pure est inférieure à celle des solutions dont la teneur en sels dissous est élevée. La conductivité de l'eau ultrapure est de 0,055 μS/cm, alors que celle de l'eau purifiée par osmose inverse est de 3,8 μS/cm, et que celle de l'eau potable est comprise entre 5 et 500 μS/cm. Une solution de chlorure de sodium contenant 100 ppm d'ions chlorure présente une conductivité de 340 μS/cm, laquelle augmente jusqu'à atteindre 3 200 μS/cm pour une solution à 1 000 ppm. La conductivité de l'eau de mer se situe entre 50 000 et 53 000 μS/cm, une valeur similaire à celle d'une solution d'hydroxyde de sodium (NaOH) à 1 %, soit 48 600 μS/cm.
La conductivité d'une solution peut être mesurée rapidement et facilement à l'aide d'un conductimètre. Dans certains cas, il est plus simple de surveiller le dessalement d'un objet en mesurant la conductivité plutôt que la concentration en ions chlorure. Toutefois, cette méthode ne peut être utilisée que si l'objet peut être immergé dans de l'eau raisonnablement pure. Les céramiques peuvent être trempées dans de l'eau pure. En revanche, dans le cas du fer, qui rouille dans l'eau pure, une solution alcaline d'hydroxyde de sodium doit être utilisée. La forte conductivité de cette dernière masque tout changement de conductivité résultant du processus de dessalement. Il est donc dans ce cas impossible d'utiliser la mesure de la conductivité pour surveiller la progression d'un processus de traitement du fer.
Aspects scientifiques du test de détection des ions chlorure
La réaction entre le nitrate d'argent et les ions chlorure
Lorsqu'un sel comme le chlorure de sodium (NaCl) est dissous dans l'eau, les ions qui le composent se dispersent dans la solution, mais seulement jusqu'à une certaine limite (appelée « solubilité »). Si l'on tente de préparer une solution en dépassant cette limite, les ions se combineront pour former du sel solide, que l'on qualifie de « précipité ». L'élément clé du test décrit dans la présente procédure est la faible solubilité du chlorure d'argent dans l'eau.
La plupart des sels chlorés sont fortement solubles dans l'eau (Weast, 1974). Par exemple, la solubilité du chlorure de sodium est de 357 g/L à 0 °C, ce qui correspond à une concentration en ions chlorure de 220 000 ppm. Le chlorure d'argent, quant à lui, est l'un des rares sels chlorés qui présentent une faible solubilité, soit 0,89 mg/L à 10 °C, ce qui équivaut à une concentration en ions chlorure de 0,22 ppm.
Si une solution contenant des ions argent (Ag+) est ajoutée à une solution contenant des ions chlorure (Cl-), un précipité blanc de chlorure d'argent (AgCl) se formera, à moins que la concentration en ions chlorure soit très faible. La réaction qui se produit s'écrit comme suit :
Cl- (aqueux) + Ag+ (aqueux) → AgCl (solide blanc)
Plus les concentrations en ions argent et en ions chlorure sont élevées au départ, plus le précipité formé est important.
Définition de « partie par million (ppm) »
La concentration en ions chlorure est souvent exprimée en parties par million (ppm). La partie par million est une unité de concentration définie comme étant le poids d'un soluté (ion ou composé ajouté) divisé par le poids de la solution (après l'ajout de l'ion ou du composé) multiplié par un million (106). Pour les solutions aqueuses diluées, on suppose généralement que l'ajout d'ions ne modifie pas la densité de l'eau; ainsi, la densité de la solution est la même que celle de l'eau pure à la température ambiante (environ 1 g/mL) (Skoog et coll. 2014, p. 72). Partant de ce principe, la définition de « partie par million » est simplifiée de la façon suivante :
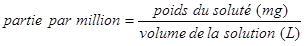
Ici, le soluté est l'ion chlorure, ce qui signifie qu'une solution de 1 ppm d'ions chlorure contient 1 milligramme (mg) d'ions chlorure par litre (L) de solution.
Dans la présente procédure, on mesure 0,49 g de chlorure de sodium pour préparer 100 mL (0,1 L) de solution A (3 000 ppm). Le chlorure de sodium contient 39,3 % de sodium et 60,7 % de chlorure (en poids), comme on peut le déterminer à partir des masses atomiques du sodium (22,99 g/mol) et du chlore (35,45 g/mol). Cela signifie que, lorsque le chlorure de sodium est dissous dans la solution, celle-ci contient 0,30 g (300 mg) d'ions chlorure et 0,19 g d'ions sodium. La concentration en ions chlorure, en ppm, est donc de 300 mg divisés par 0,1 L, ce qui équivaut à 3 000 ppm (et non 4 900 ppm).
Pour mieux se représenter l'échelle des parties par million, il faut imaginer la quantité de sodium contenue dans 10 mL d'une solution dont la concentration en ions chlorure est égale à 10 ppm. Ce volume contient 0,1 mg d'ions chlorure et 0,065 mg d'ions sodium, ou 0,165 mg de chlorure de sodium, soit un poids trop faible pour pouvoir être mesuré à l'aide d'une balance de laboratoire. Ce même volume équivaut à un cube de chlorure de sodium de 0,42 mm de côté, soit environ la taille d'un grain de sel.
Pourquoi acidifier les échantillons de solution
L'acide nitrique dilué est utilisé pour acidifier les solutions et empêcher ainsi des sels d'argent autres que le chlorure d'argent de précipiter lorsque du nitrate d'argent est ajouté. Dans les solutions neutres, du phosphate d'argent ou du carbonate d'argent peut se former en présence d'une quantité suffisante d'ions phosphate ou carbonate (Bassett et coll. 1978). Si le pH d'une solution d'essai est supérieur à environ 8, les ions argent du nitrate d'argent réagiront avec les ions hydroxyde (OH-) pour former de l'hydroxyde d'argent (AgOH) ou de l'oxyde d'argent (Ag2O). La réaction qui se produit est la suivante :
AgNO3 + OH- → AgOH (brun pâle)
puis
2AgOH → H2O + Ag2O (brun foncé ou noir)
La figure 3 montre ce qui se produit lorsque du nitrate d'argent est ajouté à une solution alcaline contenant environ 200 ppm d'ions chlorure. Cet échantillon provient d'une solution contenant 1 % (p/v) d'hydroxyde de sodium, utilisée pour le traitement du fer archéologique.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0413
Figure 3. L'oxyde d'argent précipite dans une solution alcaline, environ 20 secondes après que deux gouttes de nitrate d'argent à 2 % (p/v) ont été ajoutées à une solution alcaline contenant de l'hydroxyde de sodium à 1 % (p/v) et dont la concentration en ions chlorure est d'environ 200 ppm.
L'aspect que prennent les précipités d'hydroxyde d'argent, d'oxyde d'argent et de chlorure d'argent dans les éprouvettes au cours des 20 secondes suivant l'ajout de nitrate d'argent est montré dans une vidéo.
Origine des sels présents dans les objets
Les objets sont contaminés par les matières présentes dans l'environnement où ils étaient enfouis. Ces objets contiennent souvent divers types de sels, en particulier s'ils ont été récupérés en mer. Dans l'eau de mer, les ions les plus présents (Weast, 1974) sont les ions chlorure (Cl-, 19 000 ppm) et les ions sodium (Na+, 10 600 ppm), mais aussi les ions magnésium (Mg2+, 1 270 ppm), les ions du soufre (principalement sous forme d'ions sulfate, SO42-, 880 ppm), les ions calcium (Ca2+, 400 ppm), les ions potassium (K+, 380 ppm) et différents autres ions à des concentrations inférieures à 100 ppm.
Ces ions, ou les sels provenant de ces ions, peuvent endommager les objets s'ils ne sont pas éliminés. Les ions chlorure sont particulièrement nuisibles aux objets métalliques, en particulier aux objets en fer. Lorsqu'un objet en fer rouille, il se recouvre d'une couche d'oxydes et d'hydroxydes de fer, laquelle offre une certaine protection contre la corrosion et empêche le fer de rouiller davantage. Toutefois, les ions chlorure interfèrent avec cette couche et accélèrent considérablement la corrosion (Selwyn et coll. 1999).
Les objets fabriqués à partir de matériaux poreux, comme les céramiques, sont également endommagés par les sels (Odegaard et coll. 2011). Les dommages occasionnés résultent de la transformation de sels dissous, sous forme d'ions en solution, en cristaux solides, à mesure que l'eau s'évapore. L'augmentation du volume de certains sels (en particulier le sulfate de sodium) au moment de la cristallisation est telle qu'elle endommage de manière importante les matériaux avoisinants si la cristallisation se produit à l'intérieur d'une structure poreuse (Waller, 1992).
Remerciements
Merci tout spécialement à Ute Werner, à Lucy 't Hart, à Catherine Machado et à Meaghan Whalley, anciennes stagiaires à l'ICC, d'avoir contribué à l'élaboration de la présente Note.
Fournisseurs
Remarque : Les renseignements qui suivent visent uniquement à informer le lecteur. Le fait qu'une entreprise figure dans la présente liste ne signifie pas pour autant qu'elle est approuvée par l'Institut canadien de conservation.
Produits chimiques
Le nitrate d'argent, l'acide nitrique concentré et le papier indicateur de pH sont vendus par des distributeurs de produits chimiques tels que Fisher Scientific.
Solutions étalons d'ions chlorure
Trois solutions étalons d'ions chlorure de marque Orion (0,1 M, 1 000 ppm et 100 ppm) sont fabriquées par Thermo Scientific. Quatorze solutions étalons d'ions chlorure de concentration variable (comprise entre 1 ppm et 100 000 ppm) sont fabriquées par Ricca Chemical. Ces produits sont distribués par des fournisseurs de produits chimiques tels que Fisher Scientific.
- Thermo Scientific (en anglais seulement)
- Ricca Chemical (en anglais seulement)
- Fisher Scientific
Références
Bassett, J., R. C. Denney, G. H. Jeffery et J. Mendham. Vogel's Textbook of Quantitative Inorganic Analysis, 4e éd., Harlow (Royaume-Uni), Longman Group, 1978.
Lagowski, J. J., et C. H. Sorum. Introduction to Semimicro Qualitative Analysis, 8e éd., Upper Saddle River (New Jersey), Pearson Prentice Hall, 2005.
Odegaard, N., S. Carroll et W. S. Zimmt. Material Characterization Tests for Objects of Art and Archaeology, 2e éd.,Londres (Royaume-Uni), Archetype Publications, 2005.
Odegaard, N., P. Hill, B. Santarelli et W. Zimmt. « Detecting and Identifying Salts During the Desalination Process with Spot Test Papers », WAAC (Western Association for Art Conservation) Newsletter, vol. 33 (2011), p. 14-17.
Plenderleith, H. J., et A. E. A. Werner. The Conservation of Antiquities and Works of Art, 2e éd., Londres (Royaume-Uni), Oxford University Press, 1971, p. 201.
Rimmer, M., D. Watkinson et Q. Wang. « The Efficiency of Chloride Extraction from Archaeological Iron Objects Using Deoxygenated Alkaline Solutions », Studies in Conservation, vol. 57 (2012), p. 29-41.
Rimmer, M., D. Watkinson et Q. Wang. « The Impact of Chloride Desalination on the Corrosion Rate of Archaeological Iron », Studies in Conservation, vol. 58 (2013), p. 326-337.
Riss, D. Testing for Chlorides with Silver Nitrate (format PDF) (en anglais seulement), Conserve O Gram 6/3, Washington (D.C.), National Park Service, 1993.
Semczak, C. M. « A Comparison of Chloride Tests », Studies in Conservation, vol. 22 (1977), p. 40-41.
Selwyn, L. Détermination de la concentration des ions chlorure en solutions aqueuses par titrage potentiométrique, Rapport de recherche no 2 de l'Institut canadien de conservation, Ottawa (Ontario), Institut canadien de conservation, 2001.
Selwyn, L. « Overview of Archaeological Iron: The Corrosion Problem, Key Factors Affecting Treatment, and Gaps in Current Knowledge » (format PDF) (en anglais seulement), dans Metal 2004: Proceedings of the International Conference on Metals Conservation (sous la direction de J. Ashton et D. Hallam), Canberra (Australie), National Museum of Australia, 2004, p. 294-306.
Selwyn, L. S., P. J. Sirois et V. Argyropoulos. « The Corrosion of Excavated Archaeological Iron with Details on Weeping and Akaganéite », Studies in Conservation, vol. 44 (1999), p. 217-232.
Skoog, D. A., D. M. West, F. J. Holler et S. R. Crouch. Fundamentals of Analytical Chemistry, 9e éd., Belmont (Californie), Brooks/Cole, 2014.
Waller, R. « Temperature- and Humidity-sensitive Mineralogical and Petrological Specimens », dans The Care and Conservation of Geological Material: Minerals, Rocks, Meteorites and Lunar Finds (sous la direction de F. M. Howie), Oxford (Royaume-Uni), Butterworth-Heinemann, 1992, p. 25-50.
Wang, Q., S. Dove, F. Shearman et M. Smirniou. « Evaluation of Methods of Chloride Ion Concentration Determination and Effectiveness of Desalination Treatments Using Sodium Hydroxide and Alkaline Sulphite Solutions », The Conservator, vol. 31 (2008), p. 67-74.
Weast, R. C. (directeur de publication). Handbook of Chemistry and Physics, 54e éd., Cleveland (Ohio), CRC Press, 1974.
Rédigé par Lyndsie Selwyn
© Gouvernement du Canada, Institut canadien de conservation, 2016
ISSN 1928-5272