Projet de lignes directrices sur la qualité de l'air intérieur résidentiel pour les xylènes
Télécharger en format PDF
(2.3 Mo 75 pages)
Organisation : Santé Canada
Date de publication : 31 mars 2022
Pour consultation publique
La période de consultation se termine le
25 mai
Objet de la consultation
La présente consultation vise à solliciter des commentaires sur le projet de Lignes directrices sur la qualité de l'air intérieur résidentiel (LDQAIR) relativement aux xylènes. Ce document passe en revue les recherches épidémiologiques, toxicologiques et sur l'exposition axées sur les xylènes, ainsi que les conclusions découlant d'examens complets effectués par des organisations reconnues à l'échelle internationale se consacrant à la santé et à la protection de l'environnement. L'intention est de proposer des limites d'exposition à l'air intérieur de courte et de longue durées qui réduiraient les risques pour la santé humaine, et de recommander diverses mesures d'atténuation des risques pour réduire l'exposition aux xylènes.
En 2017, un niveau de référence dans l'air intérieur (NRAI) de 100 µg/m3 a été établi pour les xylènes. Depuis lors, des études ont montré que les niveaux dans certaines résidences canadiennes pouvaient dépasser le NRAI recommandé; une priorité élevée a donc été accordée à l'évaluation complète des risques pour la santé des xylènes et à l'élaboration d'une LDQAIR visant cette substance.
Ce document propose 1) une limite d'exposition de courte durée de 7 000 µg3/m3 (une heure) afin d'assurer une protection contre les symptômes neurologiques, contre l'irritation des yeux, du nez et de la gorge, et contre les effets respiratoires et 2) une limite d'exposition de longue durée de 150 µg3/m3 (selon une moyenne de 24 heures) pour assurer une protection contre l'altération de la coordination motrice. Étant donné que les niveaux de xylènes dans les foyers canadiens pourraient dépasser la limite d'exposition de longue durée, Santé Canada recommande aux particuliers de s'efforcer de réduire les niveaux intérieurs de xylènes en assurant une ventilation adéquate et en contrôlant les sources intérieures.
Ce document est mis à la disposition du public pour une période de consultation de 60 jours. Veuillez faire parvenir vos commentaires (avec justification, au besoin) à Santé Canada par courriel : air@hc-sc.gc.ca. Tous les commentaires doivent avoir été reçus avant le 25 mai 2022.
Il convient de préciser que ce document pourrait être révisé après l'analyse des commentaires reçus et que, s'il y a lieu, des LDQAIR relativement aux xylènes seront formulées. Il s'agit donc d'une ébauche aux fins de commentaires seulement.
Préambule
Santé Canada évalue les risques pour la santé que posent certains polluants dans l'air intérieur résidentiel et formule des recommandations sur les façons de réduire ces risques. Les Lignes directrices sur la qualité de l'air intérieur résidentiel (LDQAIR) résument les effets connus sur la santé, les sources de polluants et les niveaux d'exposition dans les habitations canadiennes, et caractérisent les risques pour la santé à partir des meilleures données scientifiques disponibles. Des limites d'exposition recommandées (également appelées valeurs guides) de courte et/ou de longue durées au polluant, qui représentent les concentrations dans l'air intérieur sous lesquelles des effets sur la santé sont peu probables, sont aussi élaborées. Les limites d'exposition recommandées tiennent compte des concentrations de référence (CRf) de ce polluant et la possibilité d'atteindre un tel niveau à partir du contrôle des sources intérieures. Les LDQAIR comprennent aussi des recommandations pour le contrôle des sources ou d'autres mesures de réduction de l'exposition à ce polluant.
Les LDQAIR et les documents d'orientation servent de base scientifique aux mesures visant à évaluer et réduire les risques des polluants de l'air intérieur, notamment :
- les évaluations de risques pour la santé liés aux polluants de l'air intérieur effectuées par les responsables de la santé publique dans les habitations ou des milieux similaires;
- les normes de performance pouvant s'appliquer aux matériaux, aux produits et aux appareils qui émettent des polluants pour éviter que leur utilisation normale ne conduise à des concentrations de polluants dans l'air dépassant les limites d'exposition recommandées;
- les produits de communication visant à informer les Canadiens des mesures à prendre pour réduire leur exposition aux polluants de l'air intérieur et aider à protéger leur santé.
Les LDQAIR et les documents d'orientation remplacent une série de valeurs limites d'exposition aux polluants de l'air intérieur publiées dans un rapport intitulé Directives d'exposition concernant la qualité de l'air des résidences (Santé Canada, 1987). En plus des mises à jour relatives aux substances figurant dans le rapport de 1987, des lignes directrices ou des documents d'orientation seront élaborés pour d'autres substances ayant le potentiel d'influer sur la santé humaine dans l'air intérieur.
Table des matières
- Résumé
- 1.0 Caractéristiques physiques et chimiques
- 2.0 Sources dans l'air
- 3.0Concentrations dans l'air intérieur et extérieur
- 4.0 Toxicocinétique
- 5.0 Effets sur la santé
- 6.0 Établissement des concentrations de référence pour les expositions de courte et de longue durées
- 7.0 Lignes directrices proposée
- 8.0 Références
- Annexe A : Liste des acronymes et abréviations
- Annexe B : Études d'exposition humaine
- Annexe C : Études toxicologiques
- Annexe D : Autres lignes directrices
Liste des tableaux
- Tableau 1. Propriétés physiques et chimiques des xylènes
- Tableau 2. Concentrations (µg/m3) de xylènes dans l'air intérieur et extérieur au Canada
- Tableau 3.Limites d'exposition aux xylènes recommandées dans le milieu intérieur
- Tableau B1. Études sur l'exposition unique de volontaires sains
- Tableau B2. Études d'exposition de longue durée chez l'humain
- Tableau C1. Études d'exposition aiguë chez des animaux de laboratoire
- Tableau C2. Études d'exposition répétée chez des animaux de laboratoire
- Tableau D1. Autres lignes directrices pour l'exposition de courte durée
- Tableau D2. Autres lignes directrices pour l'exposition produisant des effets non néoplasiques
Liste des figures
- Figure 1. Distribution des concentrations de xylènes dans l'air intérieur par saison dans les études de Santé Canada
- Figure 2. Distribution des ratios I/E par saison dans les études de Santé Canada
- Figure 3. Distribution des ratios I/E par saison dans les études de Santé Canada
Résumé
| Limite d'exposition | Concentration | Effets critiques | |
|---|---|---|---|
| µg/m3 | ppb | ||
| Courte durée (1 h) |
7 000 | 1 700 | Symptômes neurologiques (maux de tête, fatigue); irritation des yeux, du nez et de la gorge; effets respiratoires |
| Longue durée (24 h) |
150 | 36 | Altération de la coordination motrice |
La limite d'exposition de courte durée (une heure) recommandée concernant les xylènes est de 7 000 µg/m3 et celle de longue durée, de 150 µg/m3 (basée sur une moyenne de 24 heures). Les limites d'exposition recommandées s'appliquent aux trois isomères du xylène (p-xylène, m-xylène et o-xylène), peu importe la combinaison.
Les niveaux de xylènes dans les résidences canadiennes se situent sans doute sous la limite d'exposition de courte durée. Cependant, la limite d'exposition de longue durée pourrait être dépassée dans certaines habitations et, par conséquent, ces niveaux pourraient représenter un risque pour la santé. Il est donc recommandé de réduire l'exposition aux xylènes en assurant une ventilation adéquate et en contrôlant les sources intérieures.
Contexte
Le xylène (diméthylbenzène) est un hydrocarbure aromatique comportant trois isomères (p-xylène, m-xylène et o -xylène), lesquels diffèrent les uns des autres par la position des deux groupes méthyles sur le noyau benzénique. Les concentrations intérieures de xylènes dépassent en général les concentrations extérieures. Les termes xylène et xylènes peuvent être utilisés de manière interchangeable.
En 1993, Santé Canada a établi une concentration tolérable provisoire de 180 µg/m3 à l'égard des xylènes. Par la suite, en 2017, il a établi un niveau de référence dans l'air intérieur (NRAI) de 100 µg/m3 pour les xylènes, selon des signes de neurotoxicité chez le rat tirés d'une évaluation faite par l'Environmental Protection Agency des États-Unis (US EPA). Les NRAI représentent les concentrations associées à des niveaux de risques acceptables liés à une exposition de longue durée à un composé organique volatil (COV) précis, établis par les organisations ou autorités ayant réalisé les évaluations de risques. Les concentrations de xylènes dans certaines habitations du Canada peuvent dépasser le NRAI recommandé; c'est pourquoi une priorité élevée a été accordée à l'évaluation complète des risques pour la santé des xylènes et l'élaboration de lignes directrices sur la qualité de l'air intérieur résidentiel (LDQAIR) visant cette substance.
Ce document d'orientation passe en revue les recherches épidémiologiques, toxicologiques et sur l'exposition axées sur les xylènes ainsi que les conclusions découlant d'examens complets menés par des organisations reconnues à l'échelle internationale se consacrant à la santé et à la protection de l'environnement. Les LDQAIR recommandent des limites d'exposition à l'air intérieur de courte et de longue durées qui réduiraient les risques pour la santé humaine, ainsi que l'élaboration de mesures visant à réduire les émissions intérieures de xylènes. Ce document recommande aussi diverses mesures d'atténuation des risques pour réduire l'exposition aux xylènes.
Sources et exposition
Les xylènes sont naturellement présents dans le pétrole et le goudron de houille, et on en a mesuré lors de feux de forêt dans une moindre mesure. Cependant, la plupart des sources ambiantes de xylènes proviennent de l'activité humaine, notamment les sources industrielles comme les raffineries de pétrole et les usines chimiques, et de la combustion de carburants dans des véhicules motorisés, ce qui inclut les sources mobiles de transport routier comme les voitures et les camions, ainsi que les sources mobiles hors route telles que les tondeuses à gazon, les motoneiges et les véhicules de construction lourds.
Dans les résidences canadiennes, les concentrations intérieures de xylènes sont au moins trois fois supérieures aux concentrations extérieures, ce qui indique une prédominance des sources intérieures. Les émissions par évaporation provenant d'articles rangés dans un garage, dont les voitures, les pièces d'équipement alimentées à l'essence et les contenants d'essence, représentent une importante source intérieure de xylènes. Certains matériaux de construction et produits de rénovation, comme les calfeutrants, les revêtements et les teintures, ainsi que l'usage du tabac à la maison peuvent aussi contribuer aux concentrations intérieures de xylènes. À l'échelle internationale, des xylènes ont été repérés dans plusieurs produits de consommation (entre autres dans les assainisseurs d'air); cependant, il n'existe aucun renseignement sur la contribution possible de ces produits aux concentrations intérieures de xylènes au Canada.
Dans des études de Santé Canada menées dans plusieurs villes en hiver et en été entre 2005 et 2014, les concentrations médianes mesurées de xylènes à l'intérieur variaient de 2,0 à 11,1 µg/m3, et les valeurs du 95e centile allaient de 15,6 à 212,7 µg/m3. Les données préliminaires d'une étude de Santé Canada suggèrent que les concentrations de xylènes sont variables, mais qu'elles pourraient être plus élevées dans les habitations récemment construites.
Effets sur la santé
Chez l'humain, il a été démontré que l'exposition aux xylènes causait l'irritation des yeux, du nez et de la gorge, ainsi que certains symptômes neurologiques comme les maux de tête, les étourdissements et les nausées. Dans certaines études, des effets ont aussi été observés durant des tests de mémoire ou de temps de réaction, ainsi que relativement à la perception des couleurs et au système nerveux auditif central. Chez les animaux de laboratoire, l'effet le plus sensible associé à l'inhalation de xylènes est une altération neurologique (déficits lors de tests de coordination motrice, sensibilité à la douleur, mouvements spontanés et problèmes d'apprentissage). À des concentrations élevées, on a parfois aussi observé d'autres effets comme des pertes auditives, une diminution du poids corporel, des modifications hépatiques d'adaptation, une irritation respiratoire, une inflammation des poumons, et une réduction de la taille des portées. Les données ne suffisent pas à déterminer si les xylènes sont cancérogènes, mais on ne les considère pas comme mutagènes ou génotoxiques en général.
Généralement, il n'existe pas d'écart de toxicité clair entre les trois isomères du xylène; le m-, le p- et l'o -xylène devraient avoir un comportement comparable chez l'humain.
On ne dispose pas d'assez de données pour établir quelles populations pourraient avoir une sensibilité accrue aux effets de l'inhalation de xylènes. Divers facteurs peuvent contribuer aux différences de sensibilité entre les individus, dont l'âge, le poids corporel, le sexe, l'alimentation, la consommation d'alcool, l'exercice et les états pathologiques. En général, les enfants peuvent inhaler de plus grandes doses internes de substances toxiques que les adultes aux mêmes concentrations d'exposition. Toutefois, aucune donnée particulière aux xylènes n'est disponible quant aux doses internes pour différents groupes d'âge.
Limite d'exposition de courte durée proposée pour la qualité de l'air intérieur résidentiel
Pour l'exposition de courte durée aux xylènes, les critères d'effet dénotant la plus grande sensibilité consistaient en des symptômes neurologiques légers ainsi qu'une irritation oculaire et respiratoire dans des études sur l'exposition aiguë chez des volontaires sains. Une dose minimale avec effet nocif observé (DMENO) de 50 ppm (217 mg/m3) tirée d'une étude de deux heures a été retenue comme point de départ, et les facteurs d'incertitude suivants ont été appliqués : 10 pour tenir compte de la sensibilité au sein de la population humaine et 3 pour tenir compte de l'utilisation d'une DMENO. Ainsi, la concentration de référence (CRf) proposée est de 7 000 µg/m3 (1 700 ppb).
Les études de la qualité de l'air intérieur résidentiel de Santé Canada fournissent des échantillons de mesures des xylènes relevées sur une période de 24 heures, qui ne représentent pas une exposition aiguë ou maximale. Ces mesures indiquent que la CRf pour l'exposition de courte durée est plus élevée que la plage des concentrations médianes dans l'air intérieur. Comme cette CRf est réalisable dans les habitations canadiennes, la limite d'exposition recommandée pour l'exposition de courte durée aux xylènes (somme des isomères) est de 7 000 µg/m3 (7 mg/m3). Il est recommandé de comparer la limite d'exposition de courte durée à un échantillon d'air d'une heure.
Des niveaux de référence pour l'exposition de courte durée ou aiguë aux xylènes ont été établis par la California Environmental Protection Agency (CalEPA, 1999; 22 mg/m3); la Commission européenne (2005; 20 mg/m3); l'Agency for Toxic Substances and Disease Registry (ATSDR, 2007; 8,7 mg/m3); et le National Research Council des États-Unis (NRC, 2010; 560 mg/m3). Les différences entre les divers niveaux de référence découlent de l'étude principale ou du critère d'effet retenu ainsi que des facteurs d'incertitude appliqués.
Limite d'exposition de longue durée proposée pour la qualité de l'air intérieur résidentiel
Pour l'exposition de longue durée aux xylènes, la réduction de la coordination motrice chez le rat constitue l'effet le plus sensible. Une dose sans effet nocif observé (DSENO) de 50 ppm (217 mg/m3) a été retenue comme point de départ, et cette concentration a été corrigée en fonction d'une exposition continue, ce qui a mené à une DSENO corrigée de 9 ppm (39 mg/m3). Les facteurs d'incertitude suivants ont été appliqués : 1 pour tenir compte des différences toxicocinétiques, 2,5 pour tenir compte des différences toxicodynamiques entre le rat et l'humain, 10 pour tenir compte de la sensibilité au sein de la population humaine et 10 pour tenir compte des lacunes de la base de données et de l'utilisation d'une étude de toxicité subchronique. La CRf pour l'exposition de longue durée est donc de 150 µg/m3 (36 ppb).
Les données de Santé Canada révèlent que la concentration de xylènes présente dans certaines habitations canadiennes pourrait dépasser la CRf pour l'exposition de longue durée. Cependant, la CRf a été établie avec les dernières données scientifiques pertinentes et se compare au NRAI fixé par Santé Canada et à des valeurs d'autres instances. En outre, on peut réduire la concentration de xylènes dans l'air intérieur par la ventilation et le contrôle des sources. La limite d'exposition proposée pour l'exposition de longue durée au xylène (somme des isomères) est donc de µg/m3.
La durée d'échantillonnage utilisée lors de la comparaison de la concentration mesurée de xylènes avec la limite d'exposition de longue durée devrait être d'au moins 24 heures.
Des niveaux de référence pour l'exposition de longue durée ou chronique par inhalation aux xylènes ont été établis par la CalEPA (2000; 700 µg/m3); l'Institut national de la santé publique et de l'environnement (RIVM) aux Pays-Bas (2001; 870 µg/m3); l'US EPA (2003; 100 µg/m3); la Commission européenne (2005; 200 µg/m3); et l'ATSDR (2007; 220 µg/m3). Les différences entre les divers niveaux découlent de l'étude principale ou du critère d'effet retenu ainsi que des facteurs d'incertitude appliqués.
Recommandations pour la gestion des risques
L'exposition aux xylènes dans l'air intérieur devrait être limitée en assurant une ventilation adéquate et en contrôlant les sources intérieures au moyen des stratégies énoncées ci-après. En outre, plusieurs de ces mesures contribueront aussi à réduire les concentrations d'autres contaminants de l'air intérieur, ce qui en améliorera la qualité générale.
- Augmenter la ventilation, surtout lorsqu'on utilise des produits de
construction ou de rénovation comme les calfeutrants, les revêtements
et les teintures :
- En ouvrant les fenêtres lorsque c'est possible (vérifier la qualité de l'air extérieur dans votre région avant d'ouvrir les fenêtres : Cote air santé ).
- En ayant recours à des stratégies de ventilation mécanique.
- Pour en savoir plus, consulter le document Fiche de renseignements : La ventilation et le milieu intérieur (Santé Canada, 2018).
- Dans la mesure du possible, ne pas entreposer de l'essence ou d'autres produits chimiques dans votre résidence ou dans le garage; si ces produits doivent être entreposés, il faut alors bien sceller leurs contenants.
- S'il y a un garage attenant à votre maison :
- Envisager d'installer un ventilateur d'évacuation dans le garage.
- S'assurer que l'interface entre le garage attenant et la résidence est bien scellée.
- Éviter de faire tourner au ralenti dans le garage la voiture, la souffleuse à neige, la tondeuse à gazon ou tout autre appareil à essence, et ce, même si la porte du garage est ouverte.
- Ne pas fumer à l'intérieur de votre résidence.
- Choisir des produits à faible taux d'émission dans la mesure du possible.
- Réduire l'utilisation de produits parfumés et d'assainisseurs d'air.
1.0 Caractéristiques physiques et chimiques
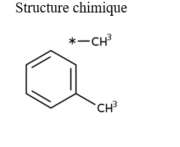
Le tableau 1 résume les propriétés physiques et chimiques des xylènes (US EPA, 2003; NLM, 2020). Il existe trois isomères du xylène : le p-xylène, le m-xylène et l'o-xylène, qui diffèrent les uns des autres par la position des deux groupes méthyles sur le noyau benzénique. Le m-xylène est généralement le composant prédominant dans les mélanges commerciaux de xylènes (de 40 % à 77 %), les autres isomères composant chacun jusqu'à 20 % de la masse des mélanges (US EPA, 2003). Du xylène de qualité technique pourrait aussi contenir de l'éthylbenzène, du toluène et des composés aromatiques C9 (CalEPA, 2000). Plusieurs études sur les xylènes dans l'air font état de la présence des isomères m- et p -xylène ensemble, car ces derniers ne se séparent pas facilement. Les termes xylène et xylènes peuvent être utilisés de manière interchangeable.
Propriété |
Valeur |
Structure chimique |
|---|---|---|
Formule moléculaire |
C8H10 |
|
Poids moléculaire |
107,17 g/mol |
|
Numéro de registre CAS |
1330-20-7 (isomères mélangés); 95-47-6 (o -xylène); 108-38-3 (m-xylène); 106-42-3 ( p-xylène) |
|
Masse volumique |
0,864 g/cm3 (isomères mélangés) |
|
Pression de vapeur |
1,065 kPa à 25 °C (isomères mélangés) |
|
Solubilité dans l'eau |
106 mg/L (isomères mélangés) |
|
Point d'ébullition |
138,5 °C (isomères mélangés) |
|
Coefficient de partage octanol-eau (log Koe) |
3,16 (isomères mélangés) |
|
Synonymes courants |
Diméthylbenzène, méthyltoluène p -xylène = 1,4-diméthylbenzène m -xylène = 1,3-diméthylbenzène o -xylène = 1,2-diméthylbenzène |
|
Facteurs de conversion |
1 ppm = 4,34 mg/m3 à 25 °C 1 mg/m3 = 0,23 ppm |
2.0 Sources dans l'air
Cette section se concentre sur les sources de xylènes dans l'air extérieur et intérieur. Bien qu'elles contribuent à l'exposition aux xylènes, les sources présentes dans les milieux autres que l'air comme les aliments, l'eau et le sol dépassent la portée du présent document.
2.1 Sources extérieures
Les xylènes sont omniprésents dans le milieu ambiant, libérés par des sources naturelles et anthropiques. Ils sont naturellement présents dans le pétrole et le goudron de houille, et on en a mesuré lors de feux de forêt dans une moindre mesure (ATSDR, 2007). Cependant, la plupart des sources ambiantes de xylènes proviennent de l'activité humaine, notamment les sources industrielles comme les raffineries de pétrole et les usines chimiques (Environnement Canada et Santé Canada, 1993; VCCEP, 2005; ATSDR, 2007). Les xylènes sont employés comme solvants dans divers produits comme les peintures, les vernis, les diluants à peinture, les laques, les revêtements, les adhésifs et les scellants, et peuvent aussi entrer dans la production de plastiques et de fibres synthétiques (Environnement Canada et Santé Canada, 1993; VCCEP, 2005; ATSDR, 2007). Selon l'Inventaire national des rejets de polluants (INRP) du Canada, de 2015 à 2017, les rejets annuels de xylènes sur place provenant de l'ensemble des installations industrielles se chiffraient à plus de 3 200 tonnes (INRP, 2021). La majorité des xylènes libérés (97 % à 99 %) l'ont été dans l'air, alors que la quantité restante l'a été dans l'eau et dans le sol.
La combustion représente une autre source anthropique majeure de xylènes, en particulier la combustion de carburants dans des véhicules motorisés, ce qui inclut les sources mobiles de transport routier comme les voitures et les camions, ainsi que les sources mobiles hors route telles que les tondeuses à gazon, les motoneiges et les véhicules de construction lourds (Environnement Canada et Santé Canada, 1993; VCCEP, 2005; ATSDR, 2007). Des xylènes sont également libérés durant la combustion de la biomasse (VCCEP, 2005).
2.2 Sources intérieures
Les concentrations de xylènes sont généralement plus élevées dans l'air intérieur que dans l'air extérieur (Environnement Canada et Santé Canada, 1993; VCCEP, 2005; Stocco et coll., 2008). Dans les habitations canadiennes, les concentrations intérieures de xylènes sont au moins trois fois supérieures aux concentrations extérieures (voir la section 3). Dans une étude de Santé Canada réalisée à Windsor (Stocco et coll., 2008), bien qu'une foule de sources industrielles de composés organiques volatils (COV) aient été recensées dans le secteur, la distance jusqu'à des sources extérieures précises et le nombre de sources ponctuelles à l'intérieur d'un rayon donné n'étaient pas des prédicteurs importants de l'exposition personnelle. De manière similaire, la concentration extérieure ne prédisait pas fortement l'exposition personnelle, alors que la concentration intérieure de m- et p-xylène était un bon prédicteur de l'exposition personnelle. Ces données révèlent une prédominance des sources intérieures comparativement aux sources extérieures.
2.2.1 Garages
Une importante source intérieure d'exposition aux xylènes est la présence d'un garage attenant (Batterman et coll., 2007; Héroux et coll., 2008; Stocco et coll., 2008; Wheeler et coll., 2013; Mallach et coll., 2017; Cakmak et coll., 2020). Les propriétaires canadiens utilisent généralement leur garage pour y garer des véhicules et y ranger des articles comme des produits automobiles, des appareils fonctionnant à l'essence et des solvants (Mallach et coll., 2017). Il a été démontré que plusieurs de ces articles libéraient des xylènes lors d'essais en laboratoire, même lorsqu'ils étaient bien scellés et qu'ils ne fonctionnaient pas (Won et coll., 2015).
Lors d'une analyse des données sur l'air intérieur de nombreuses villes réalisée par Santé Canada, la présence d'un garage attenant à une résidence par une porte a été associée à une concentration moyenne de xylènes nettement supérieure (de 86 % à Edmonton en été, et de 255 % et 134 % à Regina en été et en hiver, respectivement). Des concentrations de xylènes beaucoup plus élevées ont aussi été associées aux habitations où des outils à moteur ou de l'essence étaient entreposés dans le garage (de 139 % à 215 % à Edmonton et Halifax), ou lorsqu'au moins deux véhicules étaient stationnés dans le garage (de plus de 750 % à Halifax) (Santé Canada, 2021a). De même, dans une étude de Santé Canada sur des résidences de Windsor, Stocco et coll. (2008) ont constaté que la présence d'un garage attenant constituait un important prédicteur de concentrations de m- et p-xylène (l' o-xylène a été mesuré séparément), et Héroux et coll. (2008) ont relevé que la présence d'un garage attenant était associée à des concentrations supérieures de xylènes dans des résidences de la ville de Québec. En se fondant sur des données de l'Enquête canadienne sur les mesures de la santé (ECMS), Wheeler et coll. (2013) ont relevé qu'une « maison munie d'un garage attenant » était un prédicteur de niveaux accrus de xylènes, et ont constaté que les concentrations moyennes de xylènes dans les résidences munies d'un garage attenant étaient environ deux fois supérieures à celles dans les résidences dépourvues d'un tel garage. Cakmak et coll. (2020) ont aussi relevé que les maisons munies d'une porte communiquant avec un garage attenant présentaient des concentrations de xylènes plus élevées que celles qui en étaient dépourvues.
Une étude de Santé Canada portant sur 33 maisons à Ottawa munies d'un garage attenant a relevé que les rapports médians des concentrations de xylènes dans les garages/concentrations extérieures (rapports G/E) étaient de 80,9 et 75,8 pour les m- et p-xylène et l' o-xylène, respectivement, ce qui atteste de la présence de sources dans les garages (Mallach et coll., 2017) (les isomères m- et p-xylène ont été traités ensemble, tandis que l'o-xylène a été traité séparément). Les rapports G/E diminuaient considérablement (p < 0,05) lorsqu'un ventilateur d'évacuation fonctionnait dans le garage (de 12,9 et 10,9 pour les m- et p-xylène et l'o-xylène, respectivement). L'utilisation d'un ventilateur dans le garage réduisait aussi de manière importante les rapports moyens des concentrations intérieures/extérieures (rapports I/E) de m- et p-xylène et d'o-xylène (de 16,09 à 10,3 et de 14,7 à 9,9, respectivement); et diminuait les concentrations intérieures de m- et p-xylène et d'o-xylène de 45 % et de 43 %, respectivement. Cela démontre que les sources dans les garages contribuent grandement aux concentrations intérieures de xylènes, et que cette contribution peut être réduite grâce à l'utilisation d'un ventilateur dans le garage.
Les rapports médians des concentrations dans les garages/concentrations intérieures (rapports G/I) pour les m- et p-xylène et l'o-xylène dans l'étude réalisée à Ottawa étaient de 2,4 et 4,0, respectivement (Mallach et coll., 2017), tandis qu'une étude menée dans 15 maisons du Michigan aux États-Unis a fait état de rapports G/I dépassant 10 (Batterman et coll., 2007). Les rapports G/I les moins élevés de l'étude de Santé Canada, comparativement à l'étude américaine, ont été attribués à l'effet cheminée et aux vents accrus durant l'échantillonnage d'hiver, ce qui a favorisé le transfert d'air dans le garage attenant vers l'intérieur de la maison, si l'on compare avec les échantillons prélevés au printemps et en été par Batterman et coll. (2007).
Une étude canadienne portant sur des essais en laboratoire des émissions de COV provenant de sources d'évaporation dans des garages résidentiels a révélé que les produits liés à l'essence étaient d'importants émetteurs de BTEX (benzène, toluène, éthylbenzène et xylènes) (Won et coll., 2015). Parmi les produits testés fonctionnant à l'essence qui émettaient des niveaux élevés de xylènes, mentionnons les souffleuses à neige, les tondeuses à gazon, les coupe-bordures et les tronçonneuses. On a fait fonctionner les appareils pendant 30 minutes avant de les essuyer et de les placer dans la chambre d'essais. Les facteurs d'émissions de xylènes des produits anciens (une souffleuse à neige, une tondeuse à gazon et un coupe-bordure achetés en 2002 ou 2003) surpassaient de 10 à 20 fois ceux d'appareils achetés en 2014 (p. ex., le facteur d'émissions de m- et p‑xylène de l'ancienne souffleuse était de 4 451 µg/h comparativement à 218 µg/h pour la souffleuse récente). Un bidon d'essence ordinaire de 5 L s'est aussi révélé un important émetteur de xylènes (le bouchon fermé, le facteur d'émissions de m- et p-xylène était de 2 634 µg/h). Parmi les autres émetteurs de xylènes couramment trouvés dans des garages résidentiels, mentionnons les produits de peinture comme les diluants à peinture, les apprêts/scellants à base d'huile et la peinture en aérosol (le bouchon fermé, les facteurs d'émissions de m- et p-xylène étaient de 9, 3 et 0,4 µg/h, respectivement). Un test de l'étanchéité des bouchons/capuchons a montré que les contenants d'apprêt et de diluant à peinture dont le bouchon était partiellement serré libéraient plus d'émissions que les contenants dont le bouchon ou le couvercle était hermétiquement fermé. Des facteurs d'émissions faibles ont été obtenus concernant un produit adhésif, un dégraissant, des produits automobiles, des cires ou produits à polir, des lubrifiants, des produits pour le toit, l'entretien de la pelouse et le soin des plantes, et des produits pour l'entrée (facteurs d'émissions de m- et p-xylène de 2,5 µg/h ou moins). Les facteurs d'émissions pour l'o-xylène étaient en règle générale deux à quatre fois inférieurs à ceux pour le m- et le p-xylène.
2.2.2 Infiltration provenant du trafic routier
La présence de xylènes à l'intérieur pourrait s'expliquer en partie par l'infiltration d'émissions provenant de sources de combustion routières extérieures, puisque les xylènes sont aussi des COV liés au trafic routier (Stocco et coll., 2008; Bari et coll., 2015). Dans deux études, l'une menée en Grèce et l'autre en Chine, il a été constaté que les concentrations intérieures de xylènes étaient influencées par l'emplacement des résidents, les concentrations étant plus élevées dans les zones urbaines qu'en banlieue (Alexopoulos et coll., 2006; Du et coll., 2014). Dans l'étude grecque, il a aussi été révélé que la proximité d'une route achalandée ou d'une station-service influait sur les concentrations intérieures de xylènes (Alexopoulos et coll., 2006). Une étude australienne a également montré que les concentrations de xylènes étaient passablement élevées dans les résidences à proximité d'une route principale par comparaison aux habitations qui en étaient éloignées (Cheng et coll., 2016). Dans une étude réalisée dans quatre écoles d'Ottawa, MacNeill et coll. (2016) ont démontré que les concentrations intérieures de m- et p-xylène diminuaient de 25 % à 42 % lorsque les périodes de forte ventilation étaient déplacées afin de ne pas correspondre aux heures de pointe du trafic. Cependant, comme on l'a vu plus haut, la concentration extérieure n'est pas un bon prédicteur de l'exposition aux xylènes. Globalement, l'infiltration provenant du trafic routier ne devrait pas être une source majeure de xylènes dans les habitations canadiennes.
2.2.3 Matériaux de construction et produits de consommation
Une base de données sur les émissions mesurées en chambre d'essai de matériaux de construction d'usage courant dans les résidences du Canada a révélé que des xylènes avaient été détectés dans 72 % à 84 % des matériaux secs (dont les produits de revêtement de sol, les matériaux à base de bois, les dalles de plafond et les matériaux d'isolation), et dans 93 % à 100 % des matériaux humides (dont les revêtements, les adhésifs, les calfeutrants, la peinture, les teintures pour le bois et les scellants à base de mousse) (Won et coll., 2013). Dans le cas des matériaux secs, les facteurs d'émissions sur 24 heures étaient généralement faibles (< 10 µg/m2/h), excepté dans le cas des carreaux de plafond insonorisants, dont le facteur d'émissions était le plus élevé de tous les matériaux secs (285,2 µg/m2 /h pour le m- et le p-xylène). En règle générale, les matériaux humides présentaient des facteurs d'émissions supérieurs à ceux des matériaux secs. Les facteurs d'émissions de xylènes les plus élevés ont été observés dans le cas d'un échantillon de calfeutrant amovible à base d'huile (plus de 1 500 000 µg/m2/h pour le m- et le p-xylène). D'autres échantillons de calfeutrant présentaient aussi des concentrations d'émissions relativement élevées. Les facteurs d'émissions des revêtements de polyuréthane à base d'huile et à base d'eau ainsi que des teintures pour le bois à base d'huile variaient de 236,6 à 1 370,7 µg/m2/h pour le m- et le p‑xylène. Les émissions du scellant en mousse à base d'huile, ainsi que des adhésifs et des peintures, étaient faibles (< 15 µg/m2/h). Ces résultats concordent avec ceux d'une autre étude sur les émissions, dans laquelle des xylènes avaient été détectés dans seulement 14 % des matériaux testés (peinture, bois et matériaux isolants) (Won et coll., 2014). Le facteur d'émissions sur 24 heures le plus élevé a été détecté dans le cas d'un scellant en mousse à base de latex (127 µg/m 2/h pour le m- et le p-xylène). Dans ces études, les facteurs d'émissions de l'o-xylène étaient deux à sept fois moindres que ceux du m- et du p-xylène.
Selon les résultats de tests d'émissions ainsi que de scénarios et de paramètres de simulation d'utilisation des matériaux tels que le volume de la résidence, les concentrations dans l'air intérieur de COV ont été prédites sur une période de 10 jours (Won et coll., 2013, 2014, 2015). Ces simulations ont révélé que les sources dominantes de xylènes, comme les teintures pour bois à base d'huile, les vernis et les calfeutrants en mousse, se dégradaient le plus vite au début de la période de 10 jours, et que leur contribution aux concentrations dans l'air intérieur diminuait avec le temps jusqu'à atteindre un plateau. D'autres sources non dominantes de prime abord, telles que les isolants thermiques, les portes et les revêtements de plancher (sous-planchers et bois massif), devenaient dominantes par la suite (c'est-à-dire qu'elles contribuaient plus aux concentrations dans l'air qu'au début de la période). De plus, après la dégradation des sources dominantes (matériaux humides) durant les 10 premiers jours, l'infiltration provenant du garage devenait la source dominante de xylènes; les principales sources dans le garage étaient les contenants d'essence et les pièces d'équipement fonctionnant à l'essence (Won et coll., 2015).
Les tests d'émissions en chambre ont été menés sur des produits de construction neufs recueillis sur les chantiers de deux nouvelles résidences ou des matériaux correspondants provenant de distributeurs au détail (selon les besoins, s'il était impossible de se procurer des échantillons propres). Parmi les produits testés se trouvaient des revêtements de plancher (placage de chêne blanc, laminé de chêne rouge, sous-couche de contreplaqué, tapis de polyester, sous-plancher de panneaux à copeaux orientés, et assemblage de carreaux de céramique avec adhésif et sous-couche de contreplaqué), des armoires neuves, une plinthe peinte faite de panneaux de fibres de densité moyenne, un comptoir laminé, des poutrelles en « I » structurelles ainsi qu'une cloison sèche peinte. Du m- et du p-xylène ont été détectés dans 71 % des produits, et le facteur d'émissions sur 14 jours le plus élevé qui a été prédit concernait le calfeutrant au latex utilisé pour installer la plinthe (la fréquence de détection et les facteurs d'émissions prédits étaient inférieurs dans le cas de l' o-xylène) (Santé Canada et Conseil national de recherches Canada, 2019).
Au moyen des facteurs d'émissions des produits de construction ainsi que de la quantité de chaque produit et du calendrier d'installation, on a modélisé la concentration de xylènes dans chaque habitation, puis on a comparé les concentrations prédites aux concentrations mesurées. Les concentrations modélisées de xylènes et d'autres hydrocarbures ont été grandement sous-estimées, ce qui était prévu, car les produits de bois composite ne sont pas une source importante de ce type de contaminant. Par conséquent, une modélisation supplémentaire a été réalisée à l'aide du scénario additionnel de l'application d'un fini à base d'huile dans une petite portion de la résidence 24 heures avant l'échantillonnage. Même si les nouveaux résultats représentaient une amélioration, les concentrations prédites se situaient à seulement 10 % à 50 % des valeurs mesurées, ce qui attestait de la présence d'autres sources de xylènes dans les habitations neuves (Santé Canada et Conseil national de recherches Canada, 2019).
Des études canadiennes ont révélé des concentrations accrues de xylènes dans les habitations ayant fait l'objet de rénovations majeures au cours du dernier mois (Wheeler et coll., 2013; Cakmak et coll., 2020). Les augmentations d'o-xylène et de m- et p -xylène se chiffraient à 35 % et 43 %, respectivement (Wheeler et coll., 2013). Ces études se fondaient sur les mesures de l'air intérieur et les enquêtes sur les activités menées pour l'ECMS. Une association entre les rénovations et les concentrations de xylènes a également été constatée dans une étude réalisée en Chine, où les rénovations englobaient la redécoration et/ou le renouvellement du mobilier (Du et coll., 2014). Dans une étude américaine (Dodson et coll., 2017), la concentration moyenne de xylènes était beaucoup plus élevée dans 10 habitations ayant fait l'objet d'un prélèvement tout de suite après la rénovation (préalable à l'occupation) comparativement aux concentrations dans 27 habitations où le prélèvement a été effectué de 1 à 9 mois plus tard (postérieur à l'occupation).
Cakmak et coll. (2020) ont aussi observé que les passe-temps pratiqués au cours des trois derniers mois étaient associés à des concentrations accrues de xylènes dans les habitations canadiennes. Il pouvait s'agir d'activités comme la peinture artistique, la poterie et la céramique nécessitant l'utilisation d'un four, la fabrication de maquettes requérant l'emploi de colles, de soudures, de peintures ou de métaux, la fabrication de pesées de pêche, le soudage ou le brasage, la réparation d'automobiles, l'assemblage ou la réparation de pièces électroniques, la plomberie, la restauration de meubles et la menuiserie. Wheeler et coll. (2013) ont aussi établi que l'utilisation de parfums durant les 24 heures précédentes et l'utilisation de décapant à peinture au cours de la semaine précédente constituaient des prédicteurs de concentrations accrues de xylènes (des augmentations de 22 % et de 86 % à 88 %, respectivement).
À l'échelle internationale, des xylènes ont été repérés dans un certain nombre de produits de consommation (marqueurs permanents, cirage à chaussures, produits de nettoyage pour le cuir, détergents à lessive et assainisseurs d'air) (Commission européenne, 2021; Shrubsole et coll., 2019; Steinemann, 2017; Lim et coll., 2014). Cependant, il n'existe pas de données sur la contribution possible de ces produits aux concentrations de xylènes dans l'air intérieur au Canada.
2.2.4 Usage du tabac
La fumée du tabac peut aussi être une source de xylènes dans les habitations (ATSDR, 2007; Wheeler et coll., 2013; Niaz et coll., 2015). Des xylènes sont présents à la fois dans la fumée de tabac principale inhalée directement par le fumeur et dans la fumée secondaire libérée dans l'environnement à l'autre extrémité de la cigarette (VCCEP, 2005). Les facteurs d'émissions de xylènes des cigarettes commerciales varient de 85 à 470 µg/cigarette dans le cas du m- et du p ‑xylène et de 40 à 98 µg/cigarette dans le cas de l'o-xylène (Charles et coll., 2007). Dans l'ECMS, des concentrations moyennes plus élevées de m-/p-xylène ont été observées dans des habitations où vivaient des fumeurs comparativement à des résidences de non-fumeurs en 2012 et 2013 (cycle 3) (Li et coll., 2019). Lors du cycle 2 de l'ECMS, en 2009-2011, Wheeler et coll. (2013) ont aussi relevé que l'usage régulier du tabac dans une maison constituait un prédicteur de concentrations accrues de m- et p-xylène (de 20 %).
3.0 Concentrations dans l'air intérieur et extérieur
3.1 Concentrations extérieures
Le Réseau national de surveillance de la pollution atmosphérique (RNSPA) a indiqué qu'en 2019, dans 32 stations de surveillance fournissant des données valides, la concentration moyenne nationale de xylènes était de 0,91 µg/m3. Cette valeur englobait une moyenne rurale de 0,08 µg/m3(3 stations), une moyenne urbaine de 0,75 µg/m3 (17 stations), et une moyenne de sources ponctuelles de 1,34 µg/m3(12 stations, dont des stations de gestion du trafic) (Environnement et Changement climatique Canada, 2021).
Dans des études de Santé Canada réalisées dans plusieurs villes, les concentrations extérieures médianes de xylènes (somme des isomères)Note de bas de page 1 variaient de 0,3 à 2,1 µg/m3; les valeurs du 95e centile allaient de 1,0 à 9,6 µg/m3 (Santé Canada, 2021b; 2013; 2012; 2010a; 2010b; Mallach et coll., 2017; Goldberg et coll., 2015; Weichenthal et coll., 2013). Les données de ces études sont présentées dans le tableau 2.
3.2 Concentrations intérieures
Dans des études de Santé Canada menées dans plusieurs villes (Edmonton, Regina, Halifax, Windsor, Ottawa, Montréal) et une réserve des Premières Nations au Manitoba (Swan Lake), les concentrations intérieures médianes de xylènes (somme des isomères)Note de bas de page 1 variaient de 2,1 à 11,1 µg/m3; les valeurs du 95e centile allaient de 15,6 à 212,7 µg/m3. Les niveaux les plus élevés ont été mesurés à Windsor. Une surveillance personnelle a également été effectuée à Windsor; les concentrations médianes de xylènes (somme des isomères)Note de bas de page 1 y variaient de 4,7 à 9,0 µg/m3; les valeurs du 95e centile allaient de 42,2 à 119,5 µg/m3 (Santé Canada, 2021b; 2013; 2012; 2010a; 2010b; Mallach et coll., 2017; Goldberg et coll., 2015; Weichenthal et coll., 2013). Ces études ont toutes fait appel à des canisters passivés pour l'échantillonnage d'air.
Des concentrations analogues de xylènes ont été observées dans d'autres études canadiennes, notamment dans des habitations de Québec, de Sioux Lookout, du Nunavik et d'Ottawa, ainsi que dans le cadre de l'ECMS. Ces études ont fait appel à des méthodes d'échantillonnage et d'analyse différentes, et ne sont donc pas incluses dans les plages de données ci-dessus (Conseil national de recherches Canada, 2021; INSPQ, 2021; Santé Canada, 2021b; Li et coll., 2019; Héroux et coll., 2008; Zhu et coll., 2005).
Une étude pilote canadienne examinant les concentrations de COV dans deux habitations neuves a révélé que dans une des résidences, les concentrations de m- et p-xylène et d'o -xylène étaient de 154,9 et 63 µg/m3, respectivement (échantillonnage actif sur 24 heures). Dans la seconde habitation, les concentrations de m- et p-xylène et d'o -xylène étaient de 27,8 et 10,1 µg/m3, respectivement (Santé Canada et Conseil national de recherches Canada, 2019).
Les données de ces études sont présentées dans le tableau 2.
Les données préliminaires d'une étude de Santé Canada en cours suggèrent que les concentrations de xylènes pourraient être supérieures dans les habitations récemment construites.
| Lieu | Période d'échantil-lonnage | Méthode d'échantil-lonnageNote de bas de page a | Saison | Nombre d'habita-tions | Usage du tabac | Nombre d'échan-tillonsNote de bas de page b | Concentration (mg/m3)Note de bas de page c | Étude de référence | |
|---|---|---|---|---|---|---|---|---|---|
| Médiane | 95e centile |
||||||||
| INTÉRIEUR | |||||||||
| Edmonton, Alberta | 2010 | Canisters passivés (7 jours × 24 heures) |
Été Hiver |
50 50 |
Non-fumeurs | 328 337 |
3,2 6,2 |
39,6 82,4 |
Santé Canada (2013) |
| Halifax, Nouvelle-Écosse | 2009 | Canisters passivés (7 jours × 24 heures) |
Été Hiver |
50 50 |
Non-fumeurs | 331 312 |
3,1 4,0 |
105,8 49,7 |
Santé Canada (2012) |
| Regina, Saskat-chewan |
2007 | Canisters passivés (24 heures) |
Été Hiver |
111 106 |
Non-fumeurs Fumeurs Non-fumeurs Fumeurs |
91 13 84 21 |
6,9 5,2 4,3 3,3 |
79,9 55,8 25,2 22,7 |
Santé Canada (2010a) |
| Windsor, Ontario | 2006 | Canisters passivés (5 jours × 24 heures) |
Été Hiver |
46 47 |
Non-fumeurs | 211 224 |
10,2 4,1 |
212,7 43,5 |
Santé Canada (2010b) |
| Windsor, Ontario | 2005 | Canisters passivés (5 jours × 24 heures) |
Été Hiver |
45 48 | Non-fumeurs | 217 232 |
11,1 4,2 |
159,2 45,7 |
Santé Canada (2010b) |
| Ottawa, Ontario | 2014 | Canisters passivés (48 heures) |
Hiver | 33 (toutes avec garage attenant) | Non-fumeurs | 62 (ventilateur de garage éteint) 61 (ventilateur de garage en fonction) |
4,3 3,4 |
62,9 21,1 |
Mallach et coll., 2017 |
| Montréal, Québec | 2008-2011 | Canisters passivés (24 heures) |
Toutes | 55 | – | 285 | 8,2 | 130,9 | Goldberg et coll., 2015 |
| Swan Lake, Manitoba | 2011 | Canisters passivés (7 jours) |
Hiver | 20 | – | 53 | 2,1 | 15,6 | Weichenthal et coll., 2013 |
| Québec, Québec | 2008-2011 | Tubes de DT (6-8 jours) |
Hiver Été | 82 | Fumeurs et non-fumeurs | 317 158 | 17,3 15,8 | 151,7 143,1 | Conseil national de recherches Canada, 2021 |
| Sioux Lookout, Ontario | 2017-2019 | Tubes de DT (5 jours) | Hiver | 98 | Fumeurs et non-fumeurs | 98 | 3,12 | 29,08 | Santé Canada, 2021b |
| Nunavik | 2018 | Tubes de DT (7 jours) | Hiver–"avant" Hiver – "après"Note de bas de page d | 54 | Fumeurs et non-fumeurs | 52 54 |
9,8 4,8 |
107,2 35,5 |
INSPQ, 2021 |
| Québec, Québec | 2005 | Détecteurs de vapeurs organiques 3M (7 jours) | Hiver | 96 | Fumeurs et non-fumeurs | 96 | m -, p- : 9,2 o - : 3,0 | m -, p- : 77,1 (max) o - : 26,4 (max) | Héroux et coll., 2008 |
| Ottawa, Ontario | 2002-2003 | Tubes de DT (100 min) | Hiver | 75 | Fumeurs et non-fumeurs | 75 | m -, p- : 3,59 o - : 1,22 | m -, p- : 16,35 (90e) o - : 6,48 (90e) | Zhu et coll., 2005 |
| Partout au Canada | 2012-2013 | Tube de DT (7 jours) | Toutes | 3 524 | Fumeurs et non-fumeurs | 3 524 | m -, p- : 3,54 o - : 1,13 | m -, p- : 36,2 o - : 10,5 | Li et coll., 2019 |
| Ottawa, Ontario | 2016 | Tube de DT (24 heures) | Automne | 2 | – | 2 | m -, p- : 27,8 o - : 10,1 (maison 1) | m -, p- : 154,9 o - : 63 (maison 2) | Santé Canada et Conseil national de recherches Canada, 2019 |
| EXTÉRIEUR | |||||||||
| Edmonton, Alberta | 2010 | Canisters passivés (7 jours × 24 heures) |
Été Hiver |
50 50 |
– | 324 332 |
1,1 1,2 |
3,4 9,6 |
Santé Canada, 2013 |
| Halifax, Nouvelle-Écosse | 2009 | Canisters passivés (7 jours × 24 heures) | Été Hiver |
50 50 |
– | 324 287 |
0,6 0,3 |
2,2 1,4 |
Santé Canada, 2012 |
| Regina, Saskat-chewan |
2007 | Canisters passivés (24 heures) |
Été Hiver |
111 106 |
– | 108 95 | 0,7 0,7 | 2,2 4,5 |
Santé Canada, 2010a |
| Windsor, Ontario | 2006 | Canisters passivés (5 jours × 24 heures) |
Été Hiver |
46 47 |
– | 214 214 |
2,1 1,1 |
7,1 3,3 |
Santé Canada, 2010b |
| Windsor, Ontario | 2005 | Canisters passivés (5 jours × 24 heures) |
Été Hiver |
45 48 |
– | 216 201 |
2,0 1,1 |
7,0 3,2 |
Santé Canada, 2010b |
| Ottawa, Ontario | 2014 | Canisters passivés (48 heures) |
Hiver | 33 (toutes avec garage attenant) | Non-fumeurs | 127 | 0,4 | 1,0 | Mallach et coll., 2017 |
| Montréal, Québec | 2008-2011 | Canisters passivés (24 heures) |
Tous | 55 | – | 200 | 1,5 | 6,1 | Goldberg et coll., 2015 |
| Plage provenant de six études | 0,3–2,1 | 1,0–9,6 | |||||||
| PERSONNEL | |||||||||
| Windsor, Ontario | 2005 | Canisters passivés (5 jours × 24 heures) |
Été Hiver |
45 48 |
– | 207 225 |
9,0 4,7 |
119,5 42,2 |
Santé Canada, 2010b |
|
|||||||||
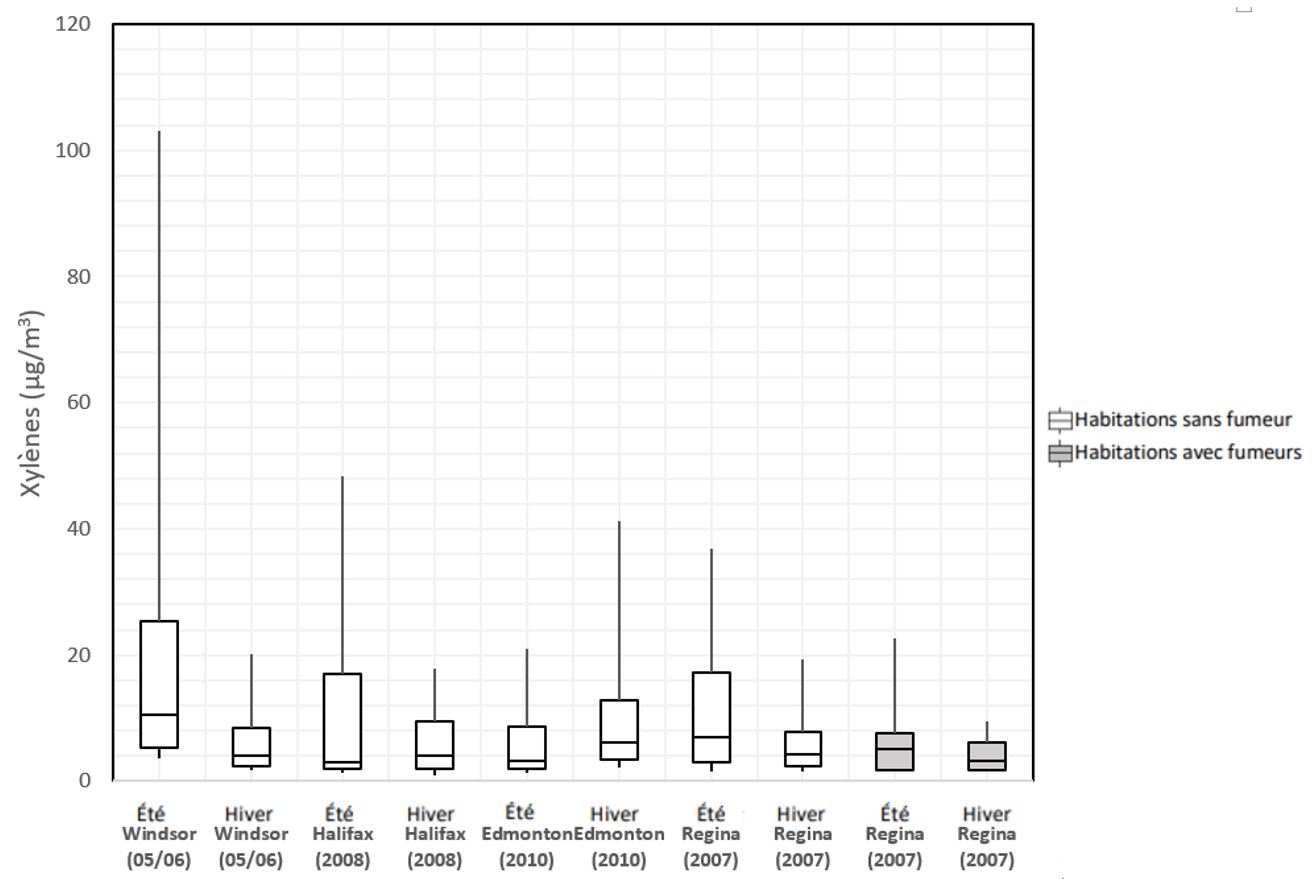
Figure 1 - Équivalent textuel
La figure 1 présente la distribution des concentrations de xylènes dans l'air intérieur dans les études de Santé Canada sous forme de boîtes à moustaches. L'axe vertical indique la concentration de xylènes en µg/m 3 se situant entre 0 et 120 et l'axe horizontal indique la ville, l'année et la saison de l'étude. Pour chaque étude, les 75 e, 50e et 25e centiles sont représentés par le haut, le centre et le bas des boîtes, alors que les moustaches représentent les 90e et 10e centiles. Les concentrations mesurées en été et en hiver dans les habitations sans fumeur sont indiquées pour Windsor en 2005-2006, Halifax en 2008, Edmonton en 2010 et Regina en 2007. Les concentrations mesurées en été et en hiver dans les habitations avec fumeurs sont indiquées pour Regina en 2007. Les valeurs médianes et les 95e centiles de chaque étude sont présentés dans le Tableau 2.
3.3 Ratios intérieur/extérieur (I/E)
Le ratio I/E compare les concentrations de xylènes mesurées dans une habitation donnée à celles mesurées immédiatement à l'extérieur de cette même habitation. La figure 2 présente la distribution des ratios intérieur/extérieur (I/E) pour chaque habitation dans quatre études de Santé Canada. Dans ces quatre villes canadiennes, les ratios I/E médians de xylènes varient de 2,6 à 12,3, indiquant une prédominance des sources intérieures. Dans une étude de Santé Canada menée dans 33 habitations d'Ottawa avec garage attenant, les ratios I/E médians de m- et de p-xylène des habitations lorsque le ventilateur de garage était éteint ou en fonction étaient de 16,09 et 10,3, respectivement (des ratios comparables ont été obtenus pour l' o-xylène) (Mallach et coll., 2017).
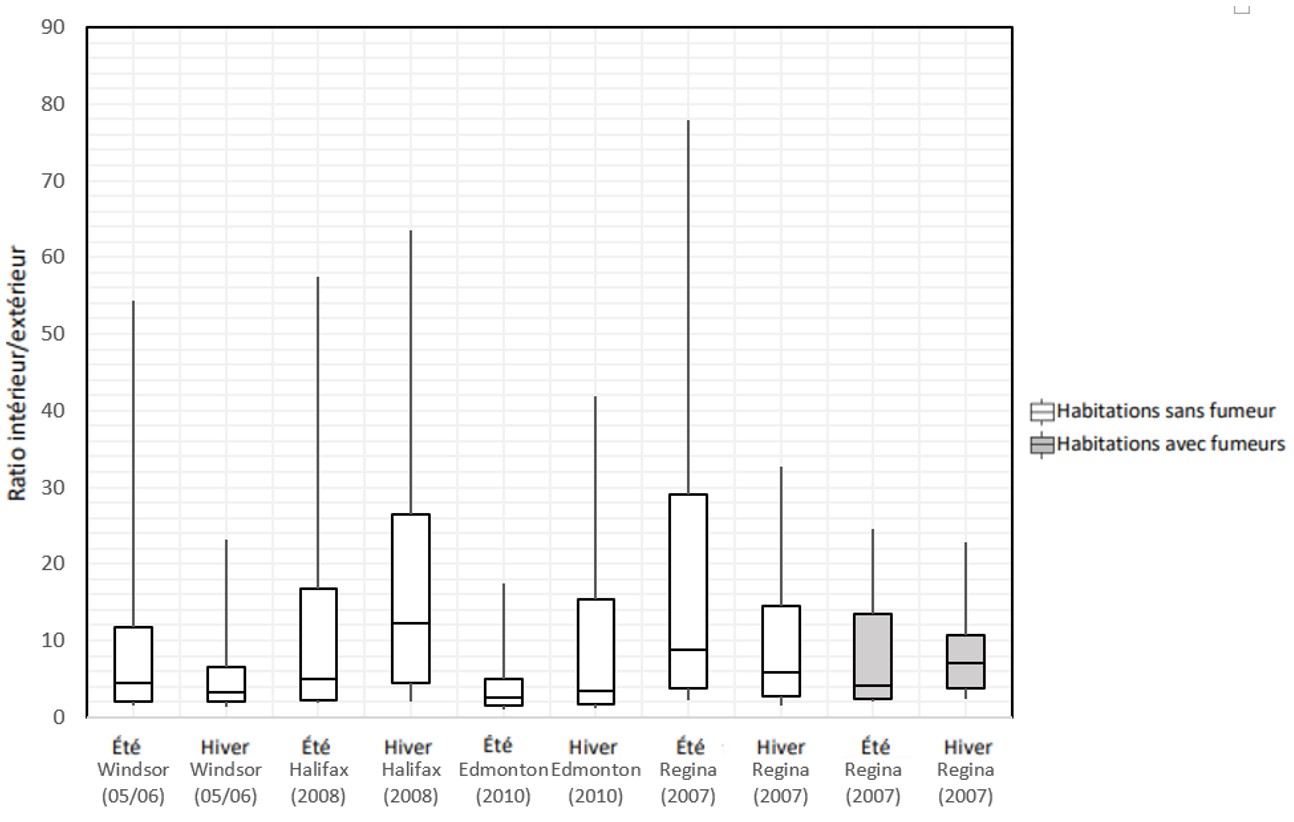
Figure 2 - Équivalent textuel
La figure 2 présente la distribution des ratios intérieur/extérieur des concentrations de xylènes apparaissant dans les études de Santé Canada sous forme de boîtes à moustaches. L'axe vertical indique le ratio intérieur/extérieur (sans unité) se situant entre 0 et 90, et l'axe horizontal indique la ville, l'année et la saison de l'étude. Pour chaque étude, les 75e, 50e et 25e centiles sont représentés par le haut, le centre et le bas des boîtes, alors que les moustaches représentent les 90e et 10e centiles. Les concentrations mesurées en été et en hiver dans les habitations sans fumeur sont indiquées pour Windsor en 2005-2006, Halifax en 2008, Edmonton en 2010 et Regina en 2007. Les concentrations mesurées en été et en hiver dans les habitations avec fumeurs sont indiquées pour Regina en 2007. La figure indique que les ratios médians intérieur/extérieur sont supérieurs à 2,5 pour toutes les villes et toutes les saisons.
3.4 Incidence de la ventilation
Dans une analyse menée par Santé Canada des données sur l'air intérieur de trois villes, un taux moyen quotidien plus élevé de renouvellement de l'air intérieur a été associé à des concentrations moyennes de xylènes beaucoup plus basses en été à Edmonton ainsi qu'en été et en hiver à Halifax (une diminution de 29 % à 73 % avec une augmentation du taux de renouvellement de l'air de 1/heure) (Santé Canada, 2021a). De plus, comme l'explique la section 2.2.1, dans une étude portant sur 33 habitations d'Ottawa, l'utilisation d'un ventilateur d'évacuation dans le garage attenant a grandement réduit les concentrations de m - et p-xylène et d'o-xylène dans les habitations, soit de 45 % et 43 %, respectivement. Dans une étude portant sur 54 habitations au Nunavik, l'optimisation du système de ventilation a réduit les concentrations de m- et p-xylène et d' o-xylène de 52 % et 53 %, respectivement, par comparaison avec les concentrations antérieures à l'optimisation (INSPQ, 2021). À l'opposé, dans une étude réalisée à Québec, même si le taux moyen de ventilation des habitations a monté à la suite de l'installation ou de l'optimisation d'un système de ventilation comparativement aux habitations témoins, les concentrations de xylènes étaient semblables dans les deux groupes d'habitations (Lajoie et coll., 2015; Conseil national de recherche Canada, 2021).
4.0 Toxicocinétique
4.1 Absorption, distribution, métabolisme et excrétion
Les caractéristiques de la pharmacocinétique des xylènes sont bien comprises; l'US EPA (2003) et l'ATSDR (2007) les décrivent en détail. Chez les rongeurs et les humains, suivant une exposition par inhalation, plus de 60 % de la dose de xylène inhalée est rapidement absorbée dans le sang et distribuée partout dans le corps. En raison de sa lipophilie (Koe élevé), les xylènes se déplacent principalement dans les tissus riches en lipides comme les graisses et le cerveau. La concentration de xylène dans le sang baisse rapidement dès que cesse l'exposition. Le mouvement du xylène à l'extérieur du sang suit une cinétique du premier ordre en présentant un profil biphasique. La demi-vie de la première phase est de 0,5 à 1 heure et celle de la deuxième phase est de 20 à 30 heures.
Le métabolisme du xylène se fait rapidement dans le foie, et la voie principale débute par l'oxydation d'un groupe méthyle par le CYP2E1 microsomal, puis est suivie d'une conjugaison avec la glycine et d'une excrétion dans l'urine sous forme de dérivés d'acides méthylhippuriques (AMH). Les AMH urinaires représentent plus de 95 % du xylène absorbé, et les niveaux augmentent rapidement durant les deux premières heures de l'exposition. Le pic est atteint au moment où cesse l'exposition ou immédiatement après; la concentration décline ensuite de façon marquée, mais demeure détectable pendant quelques jours. Les métabolites mineurs comprennent les alcools méthylbenzyliques, les conjugués glucuronides et les xylénols. Une petite proportion (moins de 5 %) du xylène absorbé est rapidement éliminée sous forme inchangée dans l'air expiré, et des quantités infimes de xylène sont éliminées sous forme inchangée dans l'urine. La voie métabolique du p-xylène est illustrée à la figure 3.
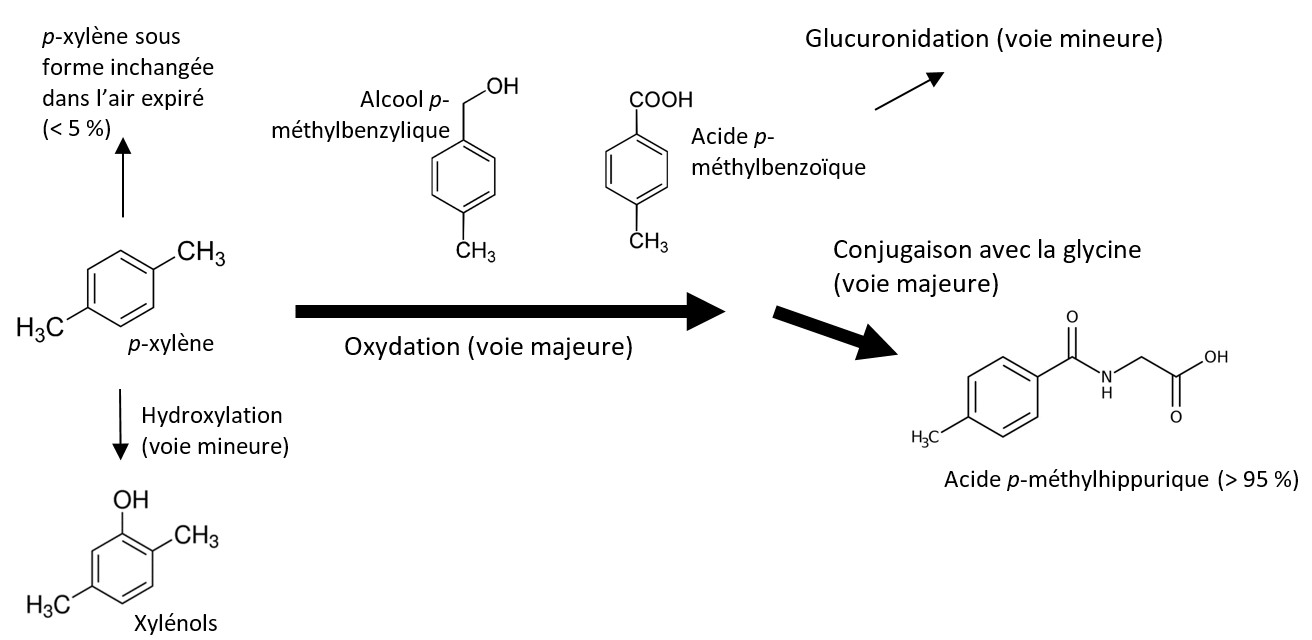
Figure 3 - Équivalent textuel
La figure 3 présente la principale voie métabolique du xylène. Le p-xylène au centre-gauche de la figure est le point de départ. À droite du p-xylène apparait une grande flèche représentant le processus d'oxydation menant aux intermédiaires alcool p-méthylbenzylique et acide p-méthylbenzoïque illustrés au-dessus de la flèche. Une autre grande flèche représentant la conjugaison avec la glycine pointe en bas à droite vers l'acide p-méthylhippurique. Une petite flèche pointe vers le haut de p-xylène vers du p-xylène inchangé mais expiré; et une autre petite flèche représentant la voie mineure de l'hydroxylation pointe vers le bas, de p-xylène à xylénols. Une dernière petite flèche représentant la glucuronidation pointe en haut à droite de l'acide p-méthylbenzoïque.
Les trois isomères du xylène ont des propriétés chimiques analogues, par exemple le log Koe, et suivent des modèles semblables d'absorption et de distribution. De plus, les coefficients de partage tissus/air (foie, graisses et muscles) sont comparables aux coefficients de partage sang/air (Adams et coll., 2005; ATSDR, 2007). Le métabolisme des trois isomères se fait selon la même voie enzymatique, ce qui mène à l'excrétion par voie urinaire de l'isomère correspondant d'AMH comme métabolite principal (voir la figure 3). Cependant, Adams et coll. (2005) ont constaté une élimination sanguine légèrement supérieure du m‑xylène, ce qui concordait avec des résultats antérieurs d'élimination urinaire accrue de cet isomère. Le p-xylène et l'o-xylène traversent aisément le placenta et sont distribués dans le liquide amniotique et les tissus embryonnaires et fœtaux chez la souris (ATSDR, 2007). Ungváry et coll. (1980) ont démontré la présence d'o‑xylène dans le sang fœtal et le liquide amniotique de rats.
Le métabolisme du xylène est un processus saturable, mais la saturation devrait survenir uniquement dans le cas de concentrations élevées. Par exemple, une étude menée sur des rats suggère que la saturation se produit à une concentration supérieure à 225 ppm; et les modèles pharmacocinétiques à base physiologique (PBPK) chez l'humain suggèrent une relation linéaire jusqu'à une concentration de 500 ppm (ATSDR, 2007). Comme il est expliqué à la section 3, les niveaux dans les habitations canadiennes sont bien inférieurs à ces concentrations (le 95e centile le plus élevé est de 213 µg/m3 ou moins de 0,05 ppm).
D'autres COV comme le benzène, le toluène et l'éthylbenzène inhibent le métabolisme du xylène en entrant en compétition pour les mêmes enzymes hépatiques (p. ex. CYP2E1). Cependant, les données chez les humains et les modèles PBPK chez les rats et les humains suggèrent qu'il est peu probable que le métabolisme du xylène soit inhibé aux concentrations de COV auxquelles la population générale est exposée (ATSDR, 2007; Santé Canada, 2014; Valcke et Haddad, 2015; Marchand et coll., 2016). L'éthanol est aussi un substrat de CYP2E1; en plus d'entrer en compétition pour des sites de liaison, il induit l'activité enzymatique. Par conséquent, la consommation d'alcool pourrait influer sur le métabolisme du xylène chez les individus (MacDonald et coll., 2002).
Plusieurs polymorphismes relevés influent sur l'expression génétique ou l'activité enzymatique de CYP2E1 (examiné par Wang et coll., 2020); toutefois, aucune étude disponible n'examine le polymorphisme de CYP2E1 et le métabolisme du xylène en particulier. Dans une étude menée auprès de 17 sujets humains, Ernstgård et coll. (2003) ont constaté que malgré une différence plus de 10 fois supérieure dans l'activité de CYP2E1 parmi les individus, il n'y avait aucune corrélation avec les paramètres toxicocinétiques du m-xylène. Étant donné qu'un seul sujet avait un génotype de CYP2E1 différent, aucune comparaison ne pouvait être faite entre le génotype de CYP2E1 et le métabolisme du xylène. Malgré l'expression et l'activité plus faibles des cytochromes, dont CYP2E1 chez les nouveau-nés et les jeunes enfants, la modélisation PBPK ne suggère pas de variabilité importante quant au taux métabolique du xylène chez les enfants comparativement à celui des adultes (Pelekis et coll., 2001; Valcke et Krishnan, 2011; Valcke et Haddad, 2015).
4.2 Modélisation pharmacocinétique à base physiologique
Plusieurs modèles PBPK relatifs à l'inhalation du m-xylène chez le rat ont été décrits par l'US EPA (2003) et l'ATSDR (2007). Ces modèles utilisent des concentrations de xylène inhalé et exhalé et des coefficients de partage sang/gaz et tissus/gaz pour prédire les concentrations sanguines et tissulaires en supposant un métabolisme hépatique saturable. Certains modèles ont aussi été appliqués à des mélanges (p. ex. du xylène et d'autres composés aromatiques comme le toluène, le benzène et l'éthylbenzène). L'US EPA (2003) et l'ATSDR (2007) ont aussi indiqué une validation de certains modèles chez le rat et l'humain.
L'US EPA (2003) a utilisé le modèle du rat pour prédire la concentration sanguine à une DSENO ajustée en fonction de la durée de 39 mg/m3, tirée de l'étude critique choisie pour le calcul de sa CRf (Korsak et coll., 1994). La concentration sanguine qui en a résulté, soit 144 µg/L, a été utilisée dans le modèle humain pour prédire une concentration d'exposition humaine (CEH) correspondante de 41 mg/m3. L'US EPA (2003) a également utilisé le modèle du rat pour prédire la concentration sanguine artérielle chez les rats lors de la même étude de 13 semaines. L'exposition durant l'étude était intermittente (6 heures par jour, 5 jours par semaine), et le modèle a révélé une hausse et une chute rapides de la concentration sanguine correspondant à chaque période d'exposition. L'US EPA a ensuite estimé la CEH équivalente au moyen de diverses approches (une moyenne pondérée dans le temps [TWA] globale de la concentration sanguine à intervalles de 1 heure pendant 13 semaines, la concentration sanguine maximale toutes expositions confondues, et le point milieu entre le maximum et le minimum toutes journées d'exposition confondues). Les chercheurs ont remarqué que l'approche employant la TWA donnait sans doute l'estimation la plus réaliste de l'exposition dans l'étude menée sur les rats; cette approche a permis d'obtenir une CEH de 46 mg/m3.
L'ATSDR (2007) a noté que les modèles PBPK suggéraient que l'excrétion urinaire de m-AMH à la suite de l'exposition au m -xylène chez les humains était linéaire à une concentration d'exposition allant jusqu'à 500 ppm (2 170 mg/m3) et pouvait être ralentie chez les individus présentant un pourcentage accru de graisse corporelle. Parmi les autres paramètres qui influent sur la variabilité intraspécifique des doses tissulaires et sanguines suivant des expositions par inhalation, mentionnons le poids corporel, le taux de renouvellement de l'air, la fraction du débit cardiaque se rendant au foie, le coefficient de partage sang/air et le taux d'extraction hépatique (ATSDR, 2007). À l'aide de données mesurées individuellement et de modèles PBPK, Adams et coll. (2005) ont suggéré que la charge corporelle réelle du xylène pouvait beaucoup varier, même parmi des sujets exposés de façon équivalente. Des différences sur le plan de l'alimentation, de la consommation d'alcool et du stress pouvaient influer sur la variation des paramètres physiologiques sanguins et respiratoires, ce qui représentait une partie de cette variabilité (ATSDR, 2007).
4.3 Biosurveillance
La concentration sanguine de xylène est mesurée dans la population générale comme indicateur d'une exposition récente. Durant le cycle 5 de l'ECMS, des COV ont été mesurés dans le sang de plus de 2 500 sujets âgés de 12 à 79 ans (Santé Canada, 2019). La médiane et la valeur du 95e centile des concentrations mesurées de m- et p-xylène dans le sang étaient de 0,065 et 0,39 µg/L, respectivement; la médiane et la valeur du 95e centile des concentrations mesurées d'o‑xylène dans le sang étaient de 0,020 et 0,10 µg/L, respectivement. Les données de biosurveillance nationales américaines du National Health and Nutrition Examination Survey (NHANES) peuvent aussi être consultées; des concentrations sanguines médianes de m- et p‑xylène et d'o -xylène de 0,19 et 0,11 µg/L, respectivement, ont été obtenues à partir d'un échantillon de 1988 à 1994, et des concentrations analogues ont été déclarées dans des études ultérieures sur la population générale des États-Unis (US CDC, 2017). Dans plusieurs autres pays dont le Mexique, l'Italie et l'Allemagne, des concentrations de xylène dans le sang de 0,05 à 0,7 µg/L ont été relevées chez des sujets exposés ailleurs qu'au travail (ATSDR, 2007).
Les concentrations sanguines d'o-, de m- et de p-xylène des fumeurs peuvent être chacune deux fois plus élevées que celles des non-fumeurs (US CDC, 2017). Kirman et coll. (2012) ont utilisé des données du NHANES portant sur 314 fumeurs et 876 non-fumeurs, et ont noté que la moyenne géométrique (MG) des concentrations sanguines de xylène total des fumeurs était de 0,26 µg/L, tandis que la MG des non-fumeurs était de 0,16 µg/L. De même, Faure et coll. (2020) ont calculé les concentrations de xylène dans le sang de 402 fumeurs et 1 967 non-fumeurs ayant pris part à l'ECMS. Ils ont signalé que les MG et les valeurs du 95e centile étaient beaucoup plus élevées pour les fumeurs (0,17 µg/L et 0,44 µg/L) que pour les non-fumeurs (0,066 µg/L et 0,26 µg/L).
Aylward et coll. (2010) ont utilisé des modèles PBPK pour estimer que la concentration de xylène dans le sang à l'état d'équilibre à la CRf de 100 µg/m3 de l'US EPA serait de 0,3 µg/L. Les concentrations sanguines supérieures à cet équivalent de biosurveillance (EB) pourraient indiquer que la population est exposée à une concentration de xylène au-delà de la CRf de l'US EPA. Les données présentées par Faure et coll. (2020) indiquent que la MG de la concentration de xylène dans le sang de la population générale au Canada est en deçà de l'EB. Bien que la valeur du 95e centile pour les fumeurs ne dépasse pas l'EB, la MG constitue généralement une mesure plus appropriée de la concentration de biomarqueurs à long terme chez la population (Aylward et coll., 2013).
Le principal métabolite urinaire du xylène, l'AMH, n'est mesuré en général que dans des contextes professionnels et reflète une exposition récente. Les méthodes de mesure de l'AMH dans l'urine ne sont peut-être pas assez sensibles pour qu'on les utilise dans le cadre d'enquêtes sur l'exposition au xylène de la population générale (ATSDR, 2007).
5.0 Effets sur la santé
Les études pertinentes sur les effets du xylène sur la santé (dont celles sur les isomères seuls, les mélanges d'isomères et le xylène de qualité technique) publiées jusqu'en avril 2020 ont été passées en revue. Bien que le xylène soit un composant de la fumée du tabac, les études traitant de la fumée du tabac n'ont pas été prises en compte, cette fumée étant un mélange complexe de nombreux cancérogènes et toxines connus, et ses effets sur la santé ne sont pas abordés dans ce document. Les voies d'exposition autres que l'inhalation, soit l'ingestion et la voie cutanée, n'ont pas été considérées comme pertinentes du point de vue physiologique. Santé Canada a évalué les études originelles considérées comme essentielles à l'établissement des limites d'exposition recommandées relatives au xylène (voir la section 6). Des examens des effets sur la santé des xylènes faisant autorité ont également permis de recueillir d'autres données pertinentes : a)Toxicological Profile for Xylene de l'ATSDR (2007); b) Toxicological Review of Xylenes de l'US EPA (2003); c) Xylenes Reference Exposure Levels de la CalEPA (2000); d) Evidence on the Developmental and Reproductive Toxicity of Xylene de la CalEPA (2012); et e) Liste des substances d'intérêt prioritaire, rapport d'évaluation : xylènes d'Environnement Canada et Santé Canada (1993).
De plus amples détails sur les études toxicologiques et d'exposition humaine présentées ci-dessous se trouvent également dans les annexes B et C.
5.1 Effets chez l'humain
Les renseignements disponibles limités sur la toxicité des xylènes pour l'humain proviennent d'études portant sur des volontaires soumis à une exposition unique, de rapports d'observation d'expositions accidentelles à des concentrations très élevées, et d'études sur des expositions professionnelles durant lesquelles les sujets ont été exposés à un mélange de solvants.
Des études d'exposition contrôlée unique menées sur des volontaires et une étude de cas d'une exposition accidentelle à une concentration élevée ont mentionné une irritation des yeux, du nez et de la gorge, ainsi que certains symptômes neurologiques, dont des maux de tête, des étourdissements et des nausées. Des résultats mitigés ont été observés lors de tests de mémoire ou de temps de réaction à la suite d'une exposition aiguë de volontaires sains.
Des études portant sur l'exposition professionnelle ont révélé des effets comparables tels que l'irritation (des yeux, de la gorge) et des symptômes liés au système nerveux central (SNC), dont une sensation de flottement, des maux de tête et de la confusion, ainsi que certains effets neurologiques touchant la mémoire, la perception des couleurs et le système nerveux auditif central. Ces études comportaient certaines limites : les concentrations et durées d'exposition étaient mal définies, elles portaient sur une exposition simultanée à plusieurs substances chimiques, et le moment de l'enquête sur les symptômes posait problème ainsi que, dans certains cas, la nature subjective de l'autodéclaration des symptômes.
Les quelques études épidémiologiques disponibles sur des groupes exposés dans des contextes non professionnels n'étaient pas de qualité suffisante pour permettre de tirer des conclusions sur les effets de l'exposition aux xylènes. Cependant, elles viennent appuyer l'ensemble de la preuve montrant que les xylènes produisent des effets neurologiques.
5.1.1 Exposition aiguë
Dans le cadre d'une étude, une hausse minime des symptômes subjectifs (maux de tête, étourdissements, sensation d'intoxication) a été observée chez 56 volontaires sains (28 hommes et 28 femmes) exposés pendant deux heures à 50 ppm de m-xylène, par comparaison à une exposition à de l'air propre ou à 150 ppm d'isopropanol (chaque sujet a été) soumis aux trois expositions, à deux semaines d'intervalle chaque fois) (Ernstgård et coll., 2002). De légers effets respiratoires ont aussi été signalés par les sujets durant l'exposition (gêne accrue dans la gorge et les voies respiratoires chez les femmes et difficulté à respirer chez les deux sexes). Il n'a pas été mentionné si les symptômes subjectifs se sont poursuivis une fois l'exposition terminée, même si le protocole de l'étude comprenait l'administration d'un questionnaire 20 minutes puis 230 minutes après l'exposition. En plus de l'évaluation des symptômes, l'étude comprenait des mesures de la fonction pulmonaire et des évaluations de l'œdème nasal, de l'inflammation nasale et de la perception des couleurs avant, tout de suite après, et trois heures après l'exposition. La seule différence observée a été une légère réduction de la capacité vitale forcée (CVF) chez les femmes seulement, trois heures après (mais non immédiatement après) la fin de l'exposition aux xylènes. Cette différence a été exprimée sous forme de variation en pourcentage en comparaison avec la période précédant l'exposition aux xylènes, et elle était considérable par rapport à l'exposition à l'air propre. Les auteurs de l'étude ont suggéré que les facteurs contribuant à la différence entre les hommes et les femmes pouvaient inclure les œstrogènes et la taille corporelle moindre (et, donc, la taille moindre des voies respiratoires et une sensibilité accrue). Des études supplémentaires sont nécessaires pour explorer ces différences entre les sexes. L'ATSDR (2007) a établi une DMENO minimale de 50 ppm (217 mg/m3) pour le m -xylène à partir de cette étude, et a utilisé cette valeur pour calculer le niveau de risque minimal (NRM) pour une exposition aiguë.
L'US EPA (2003) a cité plusieurs études menées sur des volontaires exposés à 100 à 400 ppm de xylènes pour une période allant jusqu'à quatre heures, ce qui suggère des effets sur le SNC comme des nausées légères, des maux de tête, des effets réversibles sur l'équilibre et le temps de réaction, ainsi qu'un rendement altéré lors de tests de mémoire et de temps de réaction. Cependant, dans d'autres études faisant appel à des concentrations et des durées d'exposition analogues, ces effets n'ont pas été observés; par exemple, il n'y a eu aucune perturbation lors de tests de temps de réaction simples, de mémoire à court terme ou de temps de réaction de choix, et aucun changement dans les potentiels cérébraux évoqués visuellement ou les tracés d'électroencéphalogrammes n'a été observé dans plusieurs études à 200 ppm (US EPA, 2003). Carpenter et coll. (1975) ont fait remarquer qu'à 230 ppm, un des six volontaires s'est senti étourdi durant les 2 dernières minutes de l'exposition de 15 minutes; aucun volontaire n'a signalé d'étourdissement à 110 ppm.
Des symptômes d'irritation (dont le larmoiement et le mal de gorge) ont été signalés dans des études sur des volontaires exposés à 200 à 400 ppm de xylènes pendant des périodes de 15 minutes à 4 heures (US EPA, 2003). L'irritation du nez et de la gorge a aussi été mentionnée à la suite d'une exposition à un mélange de xylènes à une concentration estimée de 200 ppm (mais non de 100 ppm) pendant 3 à 5 minutes (Nelson et coll., 1943). Aucune hausse des signalements d'irritation du nez et de la gorge n'a été observée, et aucun changement dans le nombre de clignements d'yeux par minute ou de respirations par minute n'a été observé dans une étude sur 50 sujets masculins sains exposés à un mélange de xylènes à une concentration pouvant aller jusqu'à 400 ppm pendant 30 minutes. Dans la même étude, l'irritation des yeux a été mentionnée par 90 % des sujets à 400 ppm, par 70 % des sujets à 200 ppm, et par 60 % des sujets à 100 ppm, comparativement à 56 % des sujets témoins (Hastings et coll., 1984 cité dans NRC, 2010; CalEPA, 1999).
L'US EPA (2003) a noté que [traduction] « les concentrations d'environ 100 à 200 ppm sont situées près du seuil de déclenchement des effets neurologiques réversibles à court terme et des effets irritants des xylènes ». La CalEPA (1999) et la Commission européenne (2005) ont calculé des CRf pour l'exposition aiguë (1 heure) en se basant sur une DSENO de 100 ppm (434 mg/m3) pour l'irritation des yeux, du nez et de la gorge tirée des études de Hastings et coll. (1984), de Nelson et coll. (1943), et de Carpenter et coll. (1975).
Dans une étude de cas portant sur 15 travailleurs accidentellement exposés à des vapeurs de xylène d'une concentration estimée jusqu'à 700 ppm pendant une période allant jusqu'à une heure, chaque travailleur a éprouvé au moins deux symptômes, dont des maux de tête, des nausées, des vomissements, des étourdissements ou une sensation de vertige, une irritation des yeux, ou une irritation du nez ou de la gorge (US EPA, 2003).
5.1.2 Exposition de longue durée
Effets neurologiques
Une étude sur l'exposition professionnelle a été relevée dans laquelle le xylène était indiqué comme l'exposition principale (Uchida et coll., 1993), même si d'autres solvants étaient aussi présents. Des travailleurs ont été choisis en fonction d'une exposition personnelle d'une seule journée. Au moins 70 % des solvants détectés étaient des xylènes, et il a été présumé que l'exposition était la même pour toute la durée de l'étude, soit sept ans. La concentration moyenne de xylènes (TWA de la mesure de l'exposition personnelle) était de 14 ppm. La journée après la mesure de l'exposition, une enquête sur la santé a été effectuée. La prévalence des symptômes subjectifs durant le quart de travail et les trois mois précédents était bien plus élevée chez les travailleurs exposés par rapport aux travailleurs non exposés. Lorsque les individus exposés ont été répartis selon la concentration d'exposition aux xylènes (de 1 à 20 ppm ou > 21 ppm), une hausse liée à la concentration de l'irritation des yeux, du mal de gorge et d'une sensation de flottement a été observée lors du signalement des symptômes éprouvés durant le quart de travail, tandis qu'un manque d'appétit a été le seul symptôme dépendant de la concentration signalé au cours des trois mois précédents. L'ATSDR (2007), la CalEPA (2000) et l'Union européenne (2005) ont considéré que la concentration moyenne TWA de 14 ppm (61 mg/m3) était la DMENO et l'ont utilisée comme base pour établir leurs limites d'exposition. L'US EPA (2003) n'a pas eu recours à cette étude pour calculer sa CRf et a mentionné de nombreuses limites associées à l'étude, dont un manque de données sur la durée de l'exposition, une exposition simultanée à d'autres substances chimiques, aucune démonstration claire des liens entre la réponse et la dose ou la durée, et le biais inhérent associé à l'autodéclaration de symptômes.
Des études menées récemment sur l'exposition professionnelle suggèrent également une neurotoxicité, mais présentent des limites comme l'étude menée par Uchida. Dans une étude menée sur des peintres de chantier naval (Lee et coll., 2005), bien qu'une exposition simultanée à de nombreux solvants ait été établie, les xylènes présentaient la concentration la plus élevée dans l'air. Les peintres exposés ont obtenu des résultats très différents lors d'un test de mémoire (SD, test de substitution symboles-chiffres) et de vitesse de tapotement des doigts (FT), par comparaison à des témoins non exposés. L'accroissement de la durée de l'exposition (< 10 ans contre > 20 ans) a aussi engendré des différences dans les résultats de ces tests. Le temps de réaction simple n'a été touché dans aucune des analyses. Les auteurs n'ont pas vérifié si du plomb ou d'autres contaminants inorganiques avaient pu être présents dans le milieu de travail. Une étude ultérieure sur des peintres de chantier naval a aussi mentionné que, parmi les solvants répertoriés, le xylène présentait la concentration la plus élevée dans l'air (concentration moyenne de 10 ppm), et donc que l'AMH, métabolite urinaire, a été mesuré chez les travailleurs exposés et les témoins. La concentration d'AMH dans l'urine était associée de façon significative aux résultats du test d'indice de confusion des couleurs; les auteurs soulignent que cela peut être un indicateur important des stades préliminaires d'affections du système nerveux chez des travailleurs exposés à de multiples solvants (Lee et coll., 2013). Ces études sont de valeur limitée à cause des nombreuses expositions simultanées, dont au toluène, à l'éthylbenzène et au méthyl isobutyl cétone.
Une étude de cas portant sur cinq femmes travaillant dans un laboratoire et exposées aux xylènes pendant 1,5 à 18 ans a fait état d'effets sur le SNC, dont des maux de tête et de la confusion (US EPA, 2003). Les sujets ont également signalé des douleurs à la poitrine, des anomalies de l'électrocardiogramme, une dyspnée, une cyanose des mains et une fonction pulmonaire altérée.
Deux études récentes portant sur des populations exposées ailleurs qu'au travail ont été relevées; elles examinent les liens entre l'exposition aux xylènes et les symptômes neurologiques. Werder et coll. (2019) ont mesuré les concentrations de xylènes et d'autres substances chimiques dans le sang de 690 adultes exposés ailleurs qu'au travail et ont mené une enquête sur la fréquence des symptômes neurologiques durant les 30 jours précédents. Les concentrations sanguines de xylènes étaient de 0,06, 0,13 et 0,25 ng/mL (µg/L) aux 25 e, 50e et 75e centiles, respectivement. Les auteurs de l'étude ont affirmé que dans le cas du xylène, la plupart des associations ont été faussées par des expositions simultanées à d'autres substances. Cependant, dans les modèles limités aux non‑fumeurs et ajustés en fonction des facteurs de confusion (dont les concentrations sanguines de benzène, de toluène et d'éthylbenzène), il y a eu une association entre de nombreux symptômes du SNC ainsi que les deuxième, troisième et quatrième quartiles de la concentration de xylène dans le sang, ainsi qu'une tendance exposition-réponse. Les symptômes relatifs au SNC étudiés étaient les étourdissements, les maux de tête, les nausées, la transpiration et les palpitations. Norback et coll. (2017) ont mesuré les concentrations intérieures de nombreux polluants dans 32 salles de classe de 8 écoles en Malaisie. La concentration médiane de xylène mesurée par échantillonnage passif pendant une semaine était de 78,4 µg/m3 (0,02 ppm). Des niveaux plus élevés de xylène ont été associés à une fatigue autodéclarée au cours des trois derniers mois par les 462 étudiants participant à l'étude; cependant, aucun ajustement n'a été apporté en fonction de l'exposition simultanée à d'autres contaminants. Aucune association n'a été observée entre les concentrations de xylène et les maux de tête ou symptômes aux muqueuses signalés. Ces études n'étaient pas de qualité suffisante pour permettre de tirer des conclusions sur les effets de l'exposition à des concentrations élevées de xylène sur la population générale. Cependant, elles viennent appuyer l'ensemble de la preuve montrant que l'exposition aux xylènes produit des effets neurologiques.
Effets sur l'audition
Plusieurs études ont établi que l'exposition professionnelle aux solvants et au bruit constituait un facteur de risque de perte auditive. Or, dans la plupart de ces études, les travailleurs ont été exposés à de nombreux solvants avec ou sans exposition simultanée à un bruit excessif; ainsi, on ne peut tirer de conclusion quant aux effets des xylènes sur la perte d'audition en particulier.
Une étude (Fuente et coll., 2013) relevée examinait précisément les effets de l'exposition professionnelle aux xylènes (sans exposition simultanée à d'autres solvants) sur le système auditif. Les 30 sujets exposés, des employés de laboratoire médical, étaient principalement exposés à des xylènes selon toute vraisemblance, étant donné leur utilisation de la substance comme agent de traitement d'échantillons de tissus. Aucun travailleur n'était exposé à un bruit excessif. Les sujets ont décrit leur historique de travail afin d'estimer la durée de leur exposition, la concentration de xylène dans l'air a été mesurée une seule journée, et des échantillons d'urine ont été prélevés après la dernière journée d'une semaine de travail afin que les AMH soient mesurés. La concentration moyenne de xylène dans l'air était de 36,5 mg/m3 (plage de 8 à 217 mg/m3), et la durée moyenne d'exposition était de 11,8 ans (plage de 2 à 29 ans). Des tests des fonctions auditives centrale et périphérique ont été effectués sur tous les sujets exposés et témoins. Les participants exposés au xylène ont obtenu des résultats très faibles à certains tests, notamment les seuils de détection des tons purs, le test de séquence des motifs de hauteur tonale, le test d'écoute dichotique, le test de reconnaissance vocale dans le bruit et la réponse évoquée auditive du tronc cérébral. Les auteurs ont estimé la dose cumulée en utilisant la durée d'exposition déclarée et la concentration d'AMH dans l'urine. Les participants présentant une dose cumulée plus élevée ont obtenu des résultats inférieurs aux participants dont la dose cumulée était faible. Les auteurs ont suggéré que le xylène était associé à des effets nocifs sur le système nerveux auditif central et sur les capacités de détection sonore des humains, et ont proposé que les effets du xylène sur le système auditif fussent liés du moins en partie à une neurotoxicité dans le tronc cérébral. Ils reconnaissent toutefois les limites de l'étude, notamment le moment de la prise de mesures de l'exposition et de la réalisation des tests.
Une étude de cas (Fuente et coll., 2012) a mentionné que la cause soupçonnée de la perte auditive d'un employé de laboratoire d'histologie était une exposition au xylène pendant 20 ans.
Effets sur la reproduction et le développement
L'US EPA (2003) a décrit des études d'exposition professionnelle examinant les taux d'avortements spontanés chez les travailleuses; cependant, plusieurs substances chimiques étaient à l'origine de l'exposition et le nombre de cas était faible. Ces études ne permettent donc pas de caractériser la toxicité du xylène. Des limites comparables ont été remarquées dans certaines études ultérieures. Cho et coll. (2001) ont noté une prévalence accrue de cas d'oligoménorrhée (cycles menstruels de plus de 35 jours) chez des travailleuses exposées du secteur pétrochimique comparativement à des témoins, mais toutes les travailleuses exposées au xylène l'ont aussi été au toluène et au benzène, et certaines l'ont aussi été au styrène. De même, Desrosiers et coll. (2015) se sont penchés sur le poids à la naissance de bébés nés de mères exposées à des solvants dans leur milieu de travail; cependant, les auteurs n'ont pu estimer les effets de l'exposition au xylène à cause du petit nombre de femmes exposées au xylène et à d'autres produits chimiques. Lehman et coll. (2002, cité dans CalEPA, 2012) ont noté que les concentrations de m- et p -xylène dans l'air des maisons où vivaient les nourrissons étaient liées à des lymphocytes T de sang ombilical produisant des cytokines dans des analyses non corrigées, mais pas après la correction en fonction du tabagisme des mères durant la grossesse, des antécédents familiaux d'atopie et du sexe.
Effets respiratoires
De nombreuses études qui examinent les associations entre les concentrations de polluants atmosphériques (dont le xylène) et des effets respiratoires comme la fonction pulmonaire, l'asthme, la rhinite ou la respiration sifflante ont été recensées. Bien que certains liens aient été observés, aucune conclusion n'a pu être tirée au regard de l'effet de l'exposition au xylène, principalement en raison de l'exposition à de multiples polluants.
Quelques études portant entre autres sur la biosurveillance ont été relevées; néanmoins, ces études ont aussi été faussées par des expositions à de multiples polluants. Elliott et coll. (2006) ont mesuré la fonction pulmonaire associée aux concentrations sanguines de xylène et d'autres COV dans la population générale américaine. Aucun lien n'a été observé entre le xylène et les tests de fonction pulmonaire. Kwon et coll. (2018) ont étudié 34 sujets avant et après leur installation dans un nouvel établissement de réadaptation, où ils ont passé au moins 8 heures par jour. Les concentrations urinaires d' o-AMH, de m-AMH et de p-AMH ont beaucoup augmenté après le déplacement, indiquant une hausse de l'exposition au xylène. Aucun changement n'a été relevé dans les concentrations des autres métabolites de COV. Aucune corrélation importante n'a été constatée entre les changements dans les concentrations urinaires de métabolites du xylène et les tests de fonction pulmonaire avant et après le déplacement. Yoon et coll. (2010) ont étudié 154 Coréens pour comparer les métabolites urinaires de BTEX avec la fonction pulmonaire. Les concentrations d'AMH ont été associées négativement avec le volume expiratoire maximal en une seconde (VEMS) et le VEMS/la CVF. Aucune association entre le xylène dans l'air et l'AMH dans l'urine n'a été observée; il est donc difficile de tirer des conclusions.
5.1.3 Cancérogénicité
Le Centre international de recherche sur le cancer (CIRC) (1999) a déterminé que les xylènes étaient « inclassables quant à leur cancérogénicité pour les humains » (groupe 3), compte tenu des éléments de preuve insuffisants recueillis chez les humains. Le CIRC a passé en revue plusieurs études examinant la cancérogénicité des xylènes chez les humains, mais a conclu que [traduction] « étant donné les circonstances d'expositions multiples de la plupart des études, le contexte d'inférences multiples de ces études et la faible cohérence des constatations, ces résultats ne sont pas assez solides pour établir s'il existe une association avec l'exposition aux xylènes ».
De même, l'US EPA (2003) affirme qu'en vertu des Draft Revised Guidelines for Carcinogen Risk Assessment (1999), les données ne permettent pas d'évaluer le potentiel cancérogène des xylènes. Bien que certaines études sur l'exposition professionnelle aient suggéré une possible cancérogénicité de l'exposition aux xylènes, elles n'ont pas été considérées comme adéquates pour déterminer le potentiel cancérogène des xylènes en raison de la petite taille de leur échantillonnage (dont un petit nombre de cas), de l'incertitude liée à la concentration d'exposition, de l'exposition à de multiples solvants et de la courte période de latence (US EPA, 2003).
Des études ultérieures examinant les liens entre les expositions professionnelles et le risque de cancer du poumon, de cancer de la prostate, de leucémie, de lymphome ou de myélome multiple n'ont pas fourni de données additionnelles sur le potentiel cancérogène des xylènes, puisqu'il y avait eu exposition à de multiples solvants dont le benzène et le toluène (Miligi et coll., 2006; Costantini et coll., 2008; Cocco et coll., 2010; Blanc-Lapierre et coll., 2018; DeRoos et coll., 2018; Warden et coll., 2018).
5.1.4 Génotoxicité
Aucune hausse de la fréquence des échanges de chromatides sœurs ou des aberrations chromosomiques n'a été notée dans les lymphocytes périphériques d'individus exposés à des xylènes par inhalation dans un contexte professionnel ou expérimental (US EPA, 2003; ATSDR, 2007).
Des études menées récemment n'ont pas été concluantes au regard d'une association possible entre l'exposition aux xylènes et des dommages à l'acide désoxyribonucléique (ADN). Dans une étude portant sur des techniciens de laboratoire de pathologie, où le xylène était le principal solvant utilisé, De Aquino et coll. (2016) ont constaté une fréquence accrue de ruptures de brins d'ADN dans les cellules sanguines (test des comètes) des techniciens comparativement aux témoins, ainsi que dans le sang des techniciens à la fin d'une semaine de travail par comparaison au début de la semaine (vendredi par rapport à lundi). Aucune différence n'a été observée quant à la fréquence des micronoyaux dans les cellules buccales. Bagryantseva et coll. (2010) ont démontré une fréquence accrue de ruptures de brins d'ADN dans les lymphocytes périphériques des employés de garages comparativement aux témoins. Cependant, en plus d'une exposition à une forte concentration de xylènes, les travailleurs ont aussi été exposés à des concentrations élevées d'autres solvants, dont le benzène et les hydrocarbures aromatiques polycycliques.
Des résultats mitigés ont été obtenus lors d'études examinant l'exposition aux xylènes, les marqueurs de stress oxydatif et les dommages oxydatifs à l'ADN. Moro et coll. (2010) ont fait état d'une corrélation entre les AMH urinaires avec le malondialdéhyde (un biomarqueur de la peroxydation lipidique) et l'acide delta-aminolévulinique déshydratase (un biomarqueur de stress oxydatif) chez des peintres exposés au travail, et Yoon et coll. (2010) ont mentionné une association entre les AMH urinaires avec le malondialdéhyde et le 8‑OHdG (un marqueur de dommages oxydatifs à l'ADN) chez des sujets exposés ailleurs qu'au travail. Or, plusieurs autres études récentes n'ont pas signalé de lien entre les concentrations de métabolites urinaires du xylène et les biomarqueurs de stress oxydatif chez des sujets exposés dans leur milieu de travail et ailleurs qu'au travail (Bagryantseva et coll., 2010; Kim et coll., 2011; Kwon et coll., 2018).
Dans l'ensemble, les éléments probants limités n'indiquent pas que les xylènes sont génotoxiques pour les humains.
5.2 Études toxicologiques
5.2.1 Effets neurologiques
Neurotoxicité générale (mouvements, comportement et tests d'apprentissage)
Plusieurs études d'exposition répétée (de 1 à 6 mois) menées sur des rats ont mentionné une dose d'effet de 100 ppm lors de tests de coordination motrice, de sensibilité à la douleur, de mouvement spontané et d'apprentissage. De plus, des études d'exposition unique menées sur des rats et des souris ont révélé des déficits durant des tests de neurotoxicité après aussi peu que 30 minutes d'exposition à au moins 1 400 ppm de xylènes.
Dans la principale étude ayant servi au calcul de la CRf de l'Integrated Risk Information System de l'US EPA (US EPA, 2003), Korsak et coll. (1994) ont exposé des rats par inhalation à 0, 50 ou 100 ppm de m-xylène 6 heures par jour, 5 jours par semaine, pendant 3 mois. Un test de la tige tournante pour évaluer la coordination motrice a été réalisé après un, deux et trois mois d'exposition, et un test de la plaque chaude pour évaluer la sensibilité à la douleur a été effectué uniquement à la fin de la période de trois mois. Les deux tests ont été effectués 24 heures après la fin de l'exposition. Lors du premier test, les animaux ont été placés sur une tige tournante et leur capacité à rester sur la tige pendant deux minutes a été évaluée. Les rats exposés au m-xylène ont été moins performants lors des trois temps de mesure; les animaux exposés à 50 ppm ont échoué dans 8 % des cas et ceux exposés à 100 ppm ont échoué dans 33 % des cas, par comparaison à 0 % pour les témoins (des résultats significatifs sur le plan statistique pour le groupe exposé à 100 ppm). Les taux d'échec étaient les mêmes après un, deux ou trois mois d'exposition. Lors du deuxième test, on a mesuré le temps entre le moment où l'animal est placé sur une plaque chaude et où celui‑ci se lèche la patte. La sensibilité à la douleur a augmenté de façon importante sur le plan statistique chez les rats exposés au m-xylène (des temps de réponse de 12,2, 8,6, et 8,7 secondes pour les témoins, les sujets exposés à 50 ppm et les sujets exposés à 100 ppm, respectivement). L'US EPA (2003) a déterminé que 100 ppm (434 mg/m3) était la DMENO, et 50 ppm (217 mg/m3) était la DSENO pour l'étude, selon les résultats du test de la tige tournante. Les résultats du test de la plaque chaude n'ont pas été considérés comme fiables, parce que l'effet inverse (une diminution de la sensibilité à la douleur) a été observé dans une autre étude (Gralewicz et Wiaderna, 2001).
Dans une étude apparentée, Korsak et coll. (1992) ont exposé des rats à 100 ppm de m-xylène pendant 6 mois ou à 1 000 ppm pendant 3 mois (6 heures par jour, 5 jours par semaine). Le taux d'échec du test de la tige tournante était d'environ 35 % 24 heures après l'exposition à 100 ppm pendant 6 mois, et de 60 % 24 heures après l'exposition à 1 000 ppm pendant 3 mois (il était de 0 % chez les témoins; les deux groupes exposés étaient statistiquement différents des témoins). Les mouvements spontanés ont aussi beaucoup diminué en raison de l'exposition; ils sont passés d'environ 800 par heure chez les témoins à 400 par heure après 6 mois d'exposition à 100 ppm de m -xylène. Les résultats de l'exposition à 1 000 ppm pendant 3 mois ne sont pas indiqués, mais les auteurs affirment avoir observé une baisse chez tous les groupes exposés. La DMENO de cette étude est la plus faible concentration d'essai de 100 ppm (aucune DSENO n'a pu être déterminée).
Dans une étude visant à vérifier l'apprentissage, un test du labyrinthe radial a été effectué chez des rats témoins et des rats exposés à 100 ou 1 000 ppm de m-xylène pendant 3 mois. Le test a été réalisé de 70 à 83 jours après la fin de l'exposition. Contrairement aux témoins, les rats exposés (aux deux concentrations) n'avaient pas besoin de moins de temps pour terminer un test et ne faisaient pas moins d'erreurs d'omission lors de tests quotidiens successifs. Les auteurs suggèrent que ces résultats indiquent un déficit d'apprentissage chez les rats exposés (Gralewicz et coll., 1995). Dans une étude de suivi, Gralewicz et Wiaderna (2001) ont exposé des rats à 100 ppm de m-xylène pendant 4 semaines. Ils n'ont observé aucune différence dans les résultats du test du labyrinthe radial de 14 à 18 jours après la fin de l'exposition. Or, ils ont relevé une importante réduction du temps requis pour se retirer chez des rats exposés comparativement à des rats témoins lors de tests d'évitement passif effectués de 39 à 48 jours après la fin de l'exposition (au dernier des six tests seulement), ainsi qu'une augmentation considérable du temps d'attente avant que les animaux se lèchent la patte durant des tests de la plaque chaude réalisés de 50 à 51 jours après l'exposition (au dernier des trois tests seulement). Les auteurs suggèrent que ces changements montrent une réduction de la capacité à inhiber la réponse locomotrice dans un milieu engendrant de la peur. L'US EPA s'est appuyée sur ces deux études pour calculer sa CRf (US EPA, 2003).
Armenta-Resendiz et coll. (2019) ont exposé des rats mâles à 0, 500, 1 000, 2 000, 4 000 ou 8 000 ppm de m-xylène pendant 30 minutes. Après une pause de trois minutes, des tests de comportement ont été effectués (tâche d'enfouissement défensif, tâche d'évitement avec parcours, test de la plaque chaude, test de seuil de tressaillement, interaction sociale et test de la tige tournante). Les résultats des groupes exposés à 500 et 1 000 ppm n'ont pas été indiqués. À 2 000 ppm, une réduction évidente et importante du temps d'attente qui était dépendante de la concentration a été observée durant le test d'évitement passif. À 4 000 ppm et plus, le temps d'attente avant que l'animal se lèche la patte a beaucoup augmenté lors du test de la plaque chaude. Tous les autres tests ont révélé des changements importants uniquement à la concentration la plus élevée (8 000 ppm).
Korsak et coll. (1990, cité dans US EPA, 2003) ont exposé des rats à environ 3 000 ppm d'un seul isomère du xylène pendant 6 heures. Ils ont indiqué que le nombre de rats ayant échoué au test de la tige tournante était de 19/20, 6/20 et 1/20 dans le cas de l'o-, du m- et du p-xylène, respectivement. L'exposition à du xylène pendant 4 heures a mené à une baisse de l'activité des rats à des concentrations supérieures à 1 900 ppm (US EPA, 2003). Dans une étude où des souris ont été exposées à des isomères seuls du xylène pendant 30 minutes, des concentrations minimalement efficaces de 1 400 à 3 000 ppm ont été établies au regard de perturbations durant deux tests neurologiques (pression d'une manette et test de l'écran inversé) (US EPA, 2003).
Effets neurologiques dans des études sur le développement
Plusieurs études sur la toxicité pour le développement menées sur des rats ont examiné des critères d'effet de neurotoxicité.
Dans une étude sur les effets neurologiques d'une exposition prénatale, Hass et Jacobsen (1993) ont exposé des rates gravides à 200 ppm de xylène de qualité technique aux jours de gestation (JG) 6 à 20. La composition exacte du matériel de test n'a pas été donnée, mais les auteurs ont souligné que le xylène de qualité technique était un mélange des trois isomères et pouvait contenir jusqu'à 35 % d'éthylbenzène. Aucune toxicité maternelle n'a été observée chez les mères exposées. Des baisses de rendement importantes sur le plan statistique lors de tests de la tige tournante ont été observées chez des petits femelles au jour postnatal (JPN) 22 et au JPN 23 (mais pas au JPN 24), et chez des petits mâles au JPN 23 (mais pas aux JPN 22 et 24). Cependant, les auteurs ont mentionné que les testeurs connaissaient le contexte d'exposition des animaux, et les rats n'ont pas tous fait les tests le même jour. Aucune différence n'a été remarquée dans le temps nécessaire au développement du réflexe de redressement en fonction de la surface, du réflexe d'évitement de falaise ou du réflexe de sursaut auditif. Ni les auteurs de l'étude ni l'US EPA n'ont établi de DMENO ou de DSENO au regard de la toxicité pour le développement. Cependant, le RIVM (2001) a calculé sa concentration tolérable dans l'air (CTA) en fonction de la DMENO de 200 ppm (868 mg/m3) déterminée par Hass et Jacobsen (1993), concernant la « perturbation du comportement chez les petits ».
Dans une étude ultérieure, Hass et coll. (1995) ont exposé des rates gravides à 500 ppm de xylènes mélangés (19 % d'o-xylène, 45 % de m-xylène, 20 % de p-xylène, et 15 % d'éthylbenzène) aux JG 7 à 20. Aucune toxicité maternelle n'a été observée chez les mères exposées, et aucune différence importante sur le plan statistique n'a été relevée concernant le poids de naissance, le poids des petits ou le poids des organes, bien que le poids moyen à la naissance par portée et le poids moyen des cerveaux au jour 28 aient légèrement diminué. Lors du test de la tige tournante (réalisé entre 24 et 26 jours de vie), le pourcentage d'animaux incapables de rester sur la tige pendant 30 secondes a été supérieur chez les rats exposés pendant les trois jours du test, et la différence la plus grande a été notée chez les femelles au jour 3. Le temps moyen était aussi plus court chez les animaux exposés lors de chaque test. Toutefois, aucune différence n'était significative sur le plan statistique. Il n'y a pas eu de différence entre les petits témoins et exposés concernant les jalons du développement, dont le réflexe de redressement en fonction de la surface et le réflexe de sursaut auditif; néanmoins, le réflexe de redressement en chute a été retardé d'une journée chez les petits exposés. Aucune différence n'a été remarquée lors d'un test de l'activité en enceinte expérimentale (à 27-34 jours de vie). Lors de tests d'apprentissage et de mémoire (labyrinthe aquatique de Morris; à 3 mois de vie), aucune différence n'a été relevée dans le temps nécessaire pour trouver la plateforme cachée dans la piscine entre les petits témoins et les petits exposés qui étaient placés dans un environnement « enrichi » (avec des jouets). Cependant, chez les petits exposés qui avaient été placés dans un environnement standard, une tendance a été observée (négligeable sur le plan statistique) quant à une augmentation du temps requis pour trouver la plateforme durant la phase d'apprentissage du test. Lors d'un test subséquent où la plateforme avait été déplacée, la différence de temps était importante chez les femelles exposées situées dans un environnement standard comparativement aux témoins. Le temps de nage des femelles du groupe exposé qui vivaient dans l'environnement standard a aussi beaucoup augmenté, mais il n'y a pas eu de différence dans la vitesse de nage par comparaison aux témoins. Des différences notables entre les petits femelles exposés et témoins quant au temps nécessaire pour trouver la plateforme dans le labyrinthe aquatique de Morris ont été observées à 16 et à 28 semaines, mais pas à 55 semaines de vie (Hass et coll., 1997). Les auteurs ont suggéré que cela pouvait être attribuable à l'inversion partielle de l'effet ou de la compensation découlant de la pratique. Une DMENO de 500 ppm (2 170 mg/m3) a été établie pour les effets dans le labyrinthe aquatique (Hass et coll., 1995). L'US EPA a remarqué que l'effet était minimalement nocif et possiblement réversible.
Aucun effet sur le réflexe de sursaut auditif ou sur le test du labyrinthe en 8 n'a été observé sur des petits rats témoins ni sur des petits rats nés de mères ayant été exposées à 800 ou 1 600 ppm de p‑xylène aux JG 7 à 16 (Rosen et coll., 1986).
5.2.2 Effets sur l'audition
Dans des études menées sur des rats exposés à des xylènes pendant 3 à 13 semaines, des DMENO entre 250 et 1 800 ppm (1 085 et 7 812 mg/m3) ont été établies au regard des pertes auditives, de l'augmentation des seuils de réaction auditive ou de la perte de cellules ciliées.
Gagnaire et coll. (2001) ont exposé des rats mâles à 0, 450, 900 ou 1 800 ppm d'isomères de xylènes seuls pendant 13 semaines (6 heures/jour, 5 jours/semaine). Ils ont mené des examens audiométriques et des cochléogrammes pendant et après l'exposition. Des réductions notables du potentiel évoqué auditif du tronc cérébral ainsi que du nombre de cellules ciliées de la cochlée ont été observées à chaque intervalle de temps défini, notamment après une période de récupération de 8 semaines, chez les sujets exposés à 1 800 ppm de p-xylène. Une perte modérée de cellules ciliées externes (CCE) a été remarquée chez le groupe exposé à 900 ppm de p-xylène, mais aucun impact n'a été constaté sur les seuils auditifs. Aucun effet n'a été observé dans le cas de l'o- ou du m‑xylène, peu importe la concentration.
Gagnaire et coll. (2007a) ont exposé des rats mâles pendant 13 semaines à 0, 250, 500, 1 000 ou 2 000 ppm de xylènes mélangés de deux compositions différentes (6 heures par jour, 6 jours par semaine, 14 animaux par groupe). Les seuils auditifs ont été vérifiés à la fin de la 4e, de la 8e et de la 13e semaine d'exposition ainsi qu'à la fin d'une période de récupération de 8 semaines. Aucune modification des seuils auditifs n'a été observée chez les témoins ni chez les groupes exposés à 250 et 500 ppm des deux mélanges de test. Des modifications des seuils chez les groupes exposés à des concentrations élevées ont été observées et ont légèrement augmenté tout au long de l'exposition. Aucune récupération n'a été constatée 8 semaines après la fin de l'exposition. Après la période de récupération de 8 semaines, un examen histologique a été réalisé pour déterminer la quantité et l'emplacement des cellules ciliées perdues dans la cochlée. Un des mélanges de xylènes était composé de 20 % d' o-xylène, de 20 % de p-xylène, de 40 % de m ‑xylène et de 20 % d'éthylbenzène. Des pertes marquées de CCE dans l'organe de Corti ont été observées chez un animal du groupe exposé à 250 ppm de ce mélange et chez un autre du groupe exposé à 500 ppm du mélange. Les animaux du groupe exposé à 1 000 ppm présentaient aussi une perte appréciable de CCE, et les rats du groupe exposé à 2 000 ppm avaient perdu presque toutes leurs CCE et certaines cellules ciliées internes. Les dommages étaient moins étendus chez les animaux exposés à un mélange de xylènes contenant plus d'o-xylène (30 %) et de m-xylène (50 %) et moins de p‑xylène (10 %) et d'éthylbenzène (10 %). La DMENO pour le critère d'effet le plus sensible (perte de cellules ciliées) est de 250 ppm (aucune DSENO), tandis que la DMENO et la DSENO à l'égard de la perte auditive irréversible sont de 1 000 et 500 ppm, respectivement. Puisque les deux mélanges de test contenaient de l'éthylbenzène, qui a aussi des propriétés ototoxiques (Gagnaire et Langlais, 2005), on ne peut pas nécessairement attribuer les effets aux xylènes; or, les auteurs mentionnent que le rôle joué par le p-xylène dans les mélanges ne peut être complètement exclu.
Maguin et coll. (2006) ont aussi mené des examens otologiques sur des rats 4 semaines après leur exposition à 0 ou 1 800 ppm d'o-, de p- ou de m-xylène pendant 3 semaines (6 heures par jour, 5 jours par semaine). Une modification permanente du seuil auditif et de graves pertes de CCE dans la cochlée ont été observées chez le groupe exposé à du p-xylène, mais pas chez des témoins ni chez les rats exposés à de l'o- ou du m-xylène. La DMENO pour le p-xylène est de 1 800 ppm (aucune DSENO).
Une perte auditive mesurée au moyen d'une évaluation comportementale des seuils auditifs et du potentiel évoqué auditif du tronc cérébral a été observée chez des rats exposés à 800 ppm d'un mélange de xylènes (10 % de p-xylène, 80 % de m-xylène, et 10 % d' o-xylène) pendant 6 semaines. Une réduction de l'acuité auditive (réponse auditive du tronc cérébral) a été remarquée chez les rats après 9 semaines d'exposition à 1 000 ppm du mélange de xylènes (US EPA, 2003).
Wathier et coll. (2019, 2016) ont examiné le réflexe de l'oreille moyenne (ROM) et l'histologie cochléaire de rats anesthésiés et trachéotomisés exposés à 3 000 ppm d'isomères du xylène pendant 15 minutes à deux reprises, avec une pause de 20 minutes entre les expositions. Une augmentation transitoire de l'amplitude du ROM a été relevée pendant et après l'exposition; elle a été la plus marquée dans le cas du p-xylène et moins prononcée dans le cas du m-xylène, quoique tout de même notable. Aucune différence n'a été observée quant au ROM des animaux exposés à de l'o-xylène, ni dans la morphologie de la cochlée tous isomères confondus, et aucune corrélation n'a été remarquée entre le changement du ROM et la concentration de xylène dans le cerveau.
5.2.3 Effets sur la reproduction et le développement
Les études de toxicité pour le développement comprennent des critères d'effets de tests de neurotoxicité, comme le mentionne la section 5.2.1. Une DMENO développementale de 500 ppm (2 170 mg/m3) chez les rats a été établie en fonction des diminutions minimales et réversibles du rendement dans le labyrinthe aquatique de Morris (Hass et coll., 1995, 1997).
Dans l'étude réalisée par Hass et Jacobsen (1993) (décrite à la section 5.2.1), aucune toxicité maternelle n'a été constatée chez des rates gravides exposées à 200 ppm de xylène de qualité technique aux JG 6 à 20. Les fœtus de mères exposées présentaient une incidence accrue de retard de l'ossification de l'os maxillaire dans le crâne; 18 sur les 26 portées exposées étaient touchées, comparativement à 2 portées témoins sur 22. Les auteurs de l'étude ont aussi noté une augmentation du poids des petits (appréciable chez les mâles à la naissance, et tant chez les mâles que les femelles au jour 28, mais pas au jour 14), ainsi qu'une ouverture des yeux et un dépliement des oreilles survenant beaucoup plus tôt. Aucune DSENO ou DMENO n'a été déterminée, en partie à cause des limites de l'étude (voir la section 5.2.1).
D'autres études de toxicité pour le développement et la reproduction sont résumées dans les paragraphes suivants. Dans plusieurs de ces études, des diminutions du poids corporel des mères rates ont été observées à 500 ppm et au-delà. Dans une étude, une toxicité maternelle sévère chez des lapins a été observée à 230 ppm, mais pas à 115 ppm. Aucune toxicité pour la reproduction n'a été relevée à des concentrations allant jusqu'à 500 ppm dans une étude portant sur une génération de rats, et aucun effet sur la fertilité masculine n'a été constaté à des concentrations allant jusqu'à 1 000 ppm dans une autre étude menée sur des rats. Le poids corporel des fœtus de rats était réduit à des concentrations de 350 ppm et plus dans plusieurs études, et dans certaines études on a observé une hausse du nombre de fœtus morts ou résorbés ou une réduction de la taille des portées à des concentrations de 700 ppm et plus.
Dans une étude portant sur une génération (Bio/dynamics, 1983, cité dans US EPA, 2003), aucune toxicité maternelle ou pour le développement n'a été observée chez des rats exposés à une concentration de xylène de qualité technique allant jusqu'à 500 ppm avant l'accouplement, durant la gestation et durant la lactation (6 heures par jour, 5 jours par semaine). De plus, aucun effet sur la reproduction n'a été constaté chez les rats de la génération des parents. Une DSENO de 500 ppm a été établie à l'égard de la toxicité pour la reproduction et le développement (US EPA, 2003).
Nylén et coll. (1989) ont exposé des rats mâles à 0 ou 1 000 ppm de xylène (isomère/composition non précisée) pendant 61 jours (18 heures par jour, 7 jours par semaine). Deux ou dix semaines après la fin de l'exposition, le pourcentage de spermatozoïdes intacts n'avait pas changé, de même que le pourcentage de spermatozoïdes dotés de têtes et de flagelles normaux et le poids des testicules. Il n'y avait pas non plus de changement dans le poids de la prostate ventrale, dans la concentration de noradrénaline dans le canal déférent ni dans la testostérone du plasma 2 semaines après la fin de l'exposition (ces paramètres n'ont pas été examinés après la période de 10 semaines). En outre, trois rats exposés auraient été déclarés fertiles lors de tests 14 mois après la fin de l'exposition. L'US EPA (2003) a fait état d'une DSENO de 1 000 ppm de xylène à l'égard des effets sur les testicules et la fertilité des rats mâles tirée de cette étude.
On n'a remarqué aucun effet sur la taille des portées, le poids des petits ou le taux de croissance tant sur les petits rats témoins que sur les petits de rates ayant été exposées à 800 ou 1 600 ppm de p-xylène aux JG 7 à 16 (Rosen et coll., 1986). Le gain de poids corporel des mères a diminué à une exposition de 1 600 ppm, mais pas à 800 ppm, comparativement aux témoins. L'US EPA a considéré que 800 ppm était la DSENO au regard de la toxicité maternelle (DMENO de 1 600 ppm), et que 1 600 ppm était la DSENO au regard de la toxicité pour le développement.
Ungváry et coll. (1980) ont exposé des rates gravides à des isomères de xylène seuls 24 heures par jour aux JG 7 à 14. L'US EPA (2003) a établi des DSENO maternelles de 350 ppm et des DMENO de 700 ppm pour chaque isomère en fonction de la réduction du poids corporel. Des DSENO développementales de 350 ppm pour le m-xylène (diminution du poids corporel des fœtus à 700 ppm) et de p-xylène (diminution du poids corporel des fœtus, réduction de la taille des portées et pertes post-implantatoires à 700 ppm), et de 35 ppm pour l'o -xylène (diminution du poids corporel des fœtus à 350 ppm) ont aussi été déterminées (US EPA, 2003). L'US EPA (2003) a aussi établi des DSENO de 230 ppm à l'égard de la toxicité maternelle et pour le développement chez des rats exposés à du xylène de qualité technique 24 heures par jour aux JG 9 à 14 (230 ppm était la seule concentration d'essai figurant dans l'étude) (Hudak et Ungváry, 1978). De même, aucune toxicité maternelle ou pour le développement n'a été observée à une concentration allant jusqu'à 400 ppm de xylènes mélangés chez des rats exposés 6 heures par jour aux JG 6 à 15 (Litton, 1978, cité dans US EPA, 2003). Cependant, concernant des rats exposés à des mélanges de xylènes 24 heures par jour aux JG 7 à 14, une DSENO de 440 ppm a été établie en fonction d'une augmentation du nombre de fœtus morts ou résorbés à 780 ppm (Ungváry et Tátrai, 1985).
Une seule étude menée sur des lapins a été relevée (Ungváry et Tátrai, 1985). Des lapines gravides ont été exposées à un mélange de xylènes ou à un isomère seul aux JG 7 à 20 (24 heures par jour). À une concentration de 230 ppm, on a observé une toxicité maternelle sévère et aucun fœtus vivant, mais à 115 ppm, rien n'indiquait une toxicité maternelle ou pour le développement (selon la survie des fœtus, leur poids et toute malformation ou variation). Cette étude constituait aussi la seule étude relevée sur la toxicité pour le développement chez les souris : on n'a remarqué aucune malformation ou variation fœtales chez des petits de souris jusqu'à la concentration d'essai la plus élevée de xylènes mélangés (230 ppm) et d'isomères seuls (115 ppm).
Selon l'US EPA (2003), les études menées par Ungváry (Hudak et Ungváry, 1978; Ungváry et coll., 1980; Ungváry et Tátrai, 1985) sont limitées parce qu'elles manquent de détails. L'US EPA a déclaré que [traduction] « l'interprétation de conclusions significatives sur le plan statistique sur l'incidence accrue de cas de fœtus présentant un retard de l'ossification du squelette est ardue, étant donné l'incapacité d'adaptation à une covariation possible de la taille des portées et l'ampleur relativement restreinte de l'augmentation des incidences ». L'organisme a aussi affirmé qu'Ungváry et Tátrai (1985) n'avaient pas déclaré le poids corporel des mères de façon à permettre la détermination de DSENO et DMENO maternelles pour les rats et les souris (US EPA, 2003).
Dans une étude récente sur la toxicité des xylènes pour le développement, Saillenfait et coll. (2003) ont exposé des rates gravides à 0, 100, 500, 1 000 ou 2 000 ppm d'o-, de m - ou de p-xylène ou de xylène de qualité technique aux JG 6 à 20 (6 heures par jour). Aucun changement notable n'a été observé dans les nombres moyens d'implantations et de fœtus vivants, dans l'incidence d'implantations et de résorptions de fœtus non vivants, ou dans le ratio sexuel des fœtus, et aucune malformation n'a été signalée chez les petits. Cependant, on a constaté une réduction du gain de poids corporel maternel à 1 000 ppm, une réduction du poids corporel fœtal à 500 ou 1 000 ppm, et des signes de retard de l'ossification ou une hausse des variations squelettiques à 2 000 ppm. La DMENO à l'égard de la toxicité maternelle basée sur la réduction corrigée de gain de poids corporel a été établie à 1 000 ppm pour les trois isomères (DSENO de 500 ppm). Le poids corporel des fœtus avait diminué à des concentrations d'exposition de 500 ppm et plus d'o-xylène et de xylène de qualité technique (DSENO de 100 ppm); et à des concentrations de 1 000 ppm et plus de p- et de m -xylène (DSENO de 500 ppm).
5.2.4 Autres effets
L'US EPA (2003) a décrit plusieurs études par gavage de la toxicité subchronique et chronique menées sur des rats et des souris durant lesquelles une histopathologie complète a été réalisée. Les seuls effets observés lors d'une étude de toxicité chronique chez les rats ont été une diminution du poids corporel et une baisse du taux de survie des mâles ayant reçu des doses élevées. Les effets constatés lors d'études de la toxicité subchronique chez les rats se sont limités à une réduction du poids corporel ainsi qu'à une hausse du poids du foie et des changements enzymatiques sans histopathologie (indicateur d'une réaction adaptative), ainsi qu'à une augmentation du poids des reins et une certaine néphropathie dans une étude. Chez la souris, on a noté une réduction du poids corporel et des signes transitoires de dépression du système nerveux lors d'une étude de la toxicité subchronique, et l'hyperactivité a été le seul effet observé lors d'une étude de la toxicité chronique. L'US EPA (2003) a conclu que le foie et les reins n'étaient pas des tissus cibles sensibles chez les animaux.
Aucun effet sur le poids corporel, le poids des organes, l'hématologie, la chimie clinique ou l'histologie n'a été observé chez des rats ou des chiens exposés par inhalation à jusqu'à 810 ppm d'un mélange de xylènes pendant 13 semaines (Carpenter et coll., 1975). Korsak et coll. (1994) n'ont aussi relevé aucun changement dans le poids corporel ou des organes ou dans les paramètres de biochimie clinique chez des rats exposés à 50 ou 100 ppm de m-xylène pendant 3 mois. Toutefois, dans certaines études menées sur des animaux de laboratoire, des manifestations de toxicité générale comme la réduction du poids corporel et des modifications hépatiques d'adaptation ont été observées à la suite d'une exposition répétée au xylène par inhalation. Lors d'études de toxicité aiguë par inhalation, une irritation respiratoire (indiquée par une baisse de la fréquence respiratoire) chez les souris et une baisse de l'activité enzymatique microsomale des poumons chez les rats ont été observées. Une inflammation des poumons a aussi été constatée durant une étude de six semaines menée sur des rats et durant une étude menée sur des souris sensibilisées. Des changements dans les enzymes rénales ont été constatés lors de certaines études d'exposition répétée par inhalation. Tous ces effets se sont produits à des concentrations d'essai supérieures à celles où le critère d'effet le plus sensible (neurotoxicité) est survenu.
Après une exposition de 6 semaines à 3 500 ppm d'o-xylène, le poids corporel de rats mâles a considérablement baissé sur le plan statistique et des changements hépatiques sont survenus (dont une hausse des poids absolu et relatif, une hypertrophie, une baisse du glycogène et une augmentation des peroxysomes); les auteurs ont affirmé que les effets sur le foie étaient adaptatifs plutôt que néfastes (US EPA, 2003). Une diminution des gains de poids corporel a aussi été signalée chez des rats mâles exposés pendant 6 ou 12 mois à 1 090 ppm d'o-xylène; et des effets hépatiques réversibles (hausse du poids relatif, hypertrophie et changements enzymatiques) ont été observés chez des rats exposés à un mélange de xylènes pendant 6 mois à une concentration de 920 ppm, mais non à 350 ppm (US EPA, 2003). Personne n'a précisé si des paramètres autres que le poids corporel et les effets hépatiques avaient été examinés dans le cadre de ces études. Lors d'une étude ultérieure des effets du xylène sur le foie, Kum et coll. (2007a) ont noté une diminution du poids corporel et du poids absolu du foie chez des rates exposées à 300 ppm de xylène de qualité technique à partir du JG 1 pendant 3 semaines, ou à partir du JPN 1 pendant 6 semaines; des modifications inconstantes des enzymes hépatiques ont été notées. L'activité des enzymes P450 du foie a augmenté chez des rats après une exposition de 6 heures à 300 ppm de m‑xylène; l'activité est retournée aux valeurs témoins 5 jours après la fin de l'exposition (Foy et Schatz, 2004).
Contrairement au foie, l'activité enzymatique microsomale a diminué dans la muqueuse nasale et les poumons de rats après une exposition aiguë au xylène (Foy et Schatz, 2004; ATSDR, 2007). Une exposition aiguë (de 1 à 6 minutes) à plus de 1 300 ppm de xylène a provoqué une réduction de 50 % de la fréquence respiratoire de souris dans plusieurs études, ce qui indique une irritation respiratoire (Carpenter et coll., 1975; ATSDR, 2007). Une augmentation notable du nombre de cellules apoptotiques a été observée dans les poumons de rats jeunes (âgés de 4 semaines) et adultes (âgés de 12 semaines) exposés à du xylène de qualité technique pendant 6 semaines. Les auteurs ont suggéré que l'augmentation était due à une inflammation (Sandikci et coll., 2009). L'augmentation de l'inflammation pulmonaire et de l'hyperréactivité des voies aériennes a aussi été constatée chez des souris exposées par voie intranasale à du xylène après une sensibilisation par injection intrapéritonéale (Hong et coll., 2019).
Une augmentation de l'activité enzymatique des reins et du contenu du cytochrome P450 a été observée durant certaines études d'exposition répétée (ATSDR, 2007). Dans une étude examinant les effets sur les reins, une hausse importante sur le plan statistique de l'urée sérique, du glutathion rénal et du malondialdéhyde a été observée chez des rats après une exposition à 300 ppm de xylène de qualité technique pendant 6 semaines (Kum et coll., 2007b). Aucune différence n'a été relevée concernant la superoxyde dismutase des reins, la catalase, la glutathion peroxydase, ou encore la quantité totale de protéines, d'albumine ou de créatinine dans le sang.
Aucun effet n'a été observé sur le poids des organes et aucun changement histopathologique n'a été constaté dans les poumons ou les reins durant plusieurs études d'exposition répétée par inhalation à du xylène (Carpenter et coll., 1975; Korsak, 1994; ATSDR, 2007).
5.2.5 Cancérogénicité
Aucune étude de cancérogénicité portant sur des animaux exposés aux xylènes par inhalation n'est disponible. L'US EPA (2003) a souligné que les données accessibles sur des animaux ne permettaient pas de conclure avec certitude que les xylènes ont la capacité de provoquer une réponse cancérogène. De même, le CIRC (1999) a affirmé que les données actuelles sur des animaux de laboratoire ne permettaient pas de conclure à la cancérogénicité des xylènes. Le CIRC (1999) a passé en revue plusieurs études par gavage oral et n'a constaté aucune augmentation de l'incidence de tumeurs chez la souris ou le rat à la suite de l'administration de xylène de qualité technique. Aucune étude plus récente n'a été relevée.
5.2.6 Génotoxicité
Globalement, les xylènes ne sont pas considérés comme génotoxiques. Les xylènes ne sont pas mutagènes dans les systèmes de tests bactériens ou dans les cellules cultivées de mammifères, et ne provoquent pas d'aberration chromosomique ou d'échange de chromatides sœurs dans les cellules cultivées de mammifères (US EPA, 2003). In vivo, les xylènes n'ont pas causé d'aberration chromosomique ou de micronoyaux dans les cellules de la moelle osseuse de rongeurs, ni d'anomalie de la tête des spermatozoïdes de rats; cependant, il a été constaté que les xylènes de qualité technique étaient faiblement mutagènes lors de tests de mutation létale récessive associée chez la drosophile (US EPA, 2003).
Certaines études ont montré une fragmentation de l'ADN dans la peau de rats après une application cutanée de m-xylène; toutefois, celle-ci était sans doute liée à la mort des cellules (ATSDR, 2007). Une autre étude plus récente a révélé que des dommages à l'ADN (cassures monocaténaires et bicaténaires) étaient causés par le m-, l'o- et le p-xylène dans des lymphocytes humains cultivés, effet qui a été atténué lorsque les cellules ont été traitées avec des phagocytes de radicaux libres, ce qui suggère que les dommages causés par les xylènes pourraient être attribuables à la génération de radicaux libres (Chen et coll., 2008).
5.3 Résumé des effets sur la santé et mécanisme d'action
5.3.1 Résumé des effets sur la santé
Des études d'exposition unique sur des volontaires humains et une étude de cas d'une exposition accidentelle à une concentration élevée ont fait état d'une irritation des yeux, du nez et de la gorge ainsi que de certains symptômes liés au SNC comme les maux de tête, les étourdissements et les nausées. Des résultats mitigés ont été obtenus lors de tests de mémoire ou de temps de réaction suivant l'exposition aiguë de volontaires sains. Des études d'exposition professionnelle ont montré des effets analogues dont l'irritation (des yeux, de la gorge) et des symptômes liés au SNC comme une sensation de flottement, des maux de tête et de la confusion ainsi que des effets sur certains critères d'effet neurologiques dont les tests de mémoire, la perception des couleurs et le système nerveux auditif central. Ces études étaient limitées par des concentrations et des durées d'exposition mal définies et par l'exposition simultanée à de multiples substances chimiques, ainsi que par le moment où les symptômes ont été examinés et, dans certains cas, par la nature subjective de l'autodéclaration des symptômes.
Les résultats d'études menées sur des animaux de laboratoire indiquent clairement que les troubles neurologiques sont l'effet le plus sensible du xylène inhalé. L'exposition répétée de rats à des concentrations de 100 ppm (434 mg/m3) et plus (généralement 6 heures par jour, 5 jours par semaine, pendant 1 à 6 mois) a causé des lacunes lors de tests de coordination motrice, de mouvements spontanés et d'apprentissage. Des études sur l'exposition unique menées sur des rats et des souris ont également révélé des lacunes lors de tests de neurotoxicité après une exposition d'aussi peu que 30 minutes à des concentrations de 1 400 ppm (6 076 mg/m3) et plus.
Une neurotoxicité pour le développement n'a pas été systématiquement observée lors d'études de l'exposition gestationnelle menées sur des rats. Durant une étude, on a observé des baisses de rendement minimes et réversibles lors d'un test de mémoire et d'apprentissage, une légère réduction négligeable du poids de naissance moyen et du poids du cerveau des petits, et une diminution négligeable du nombre de petits capables de réussir le test de la tige tournante à l'égard de la coordination motrice, et ce, à l'unique concentration d'essai de 500 ppm (2 170 mg/m3). Dans une autre étude, une baisse du rendement lors du test de la tige tournante a été observée à certains moments seulement, chez des petits rats de mères exposées à une concentration de 200 ppm (868 mg/m3); cette étude présentait des limites importantes.
Durant d'autres études de l'exposition gestationnelle menée sur des rats, des souris et des lapins, les DMENO étaient fondées sur la réduction du poids corporel des mères et des fœtus. Une augmentation du nombre de fœtus morts ou résorbés ou de la taille des portées a parfois été observée à des concentrations d'essai plus élevées. Une réduction du poids corporel des fœtus et certains signes d'un retard de l'ossification ou une hausse des variations squelettiques ont en général été constatés uniquement à des concentrations supérieures à celles ayant causé une réduction du gain de poids des mères. Cependant, l'o-xylène a entraîné une diminution du poids corporel des fœtus à une concentration inférieure à celle ayant engendré une baisse du poids corporel des mères lors de deux études (DMENO fœtales de 350 ppm et 500 ppm). Tous ces effets ont été observés seulement à des concentrations supérieures à celles auxquelles des effets neurocomportementaux avaient été constatés chez des rats adultes.
Aucune toxicité pour la reproduction n'a été observée lors d'une étude menée sur une génération de rats, et durant une autre étude réalisée sur des rats, aucun effet sur la fertilité des mâles n'a été relevé même aux concentrations d'essai les plus élevées. Des études sur la perte auditive ont fait état de déficits auditifs, d'une augmentation des seuils de réponse auditive et de perte de cellules ciliées chez des rats âgés de 3 à 13 semaines exposés à 250 ppm (1 085 mg/m3) et plus de xylène. D'autres effets sur des animaux de laboratoire, comme une réduction du poids corporel, des modifications hépatiques d'adaptation, une irritation respiratoire et une inflammation des poumons ont été notés durant certaines études, mais seulement à des concentrations supérieures à celles auxquelles les effets neurocomportementaux se sont produits. Bien que les données manquent pour qu'on puisse déterminer si les xylènes sont cancérogènes, ces derniers ne sont pas généralement considérés comme mutagènes ou génotoxiques.
En règle générale, il n'y a pas de différence de toxicité manifeste entre les trois isomères du xylène, exception faite du potentiel accru d'ototoxicité du p-xylène chez les rats, tel qu'il est expliqué ci-après. La plupart des études de neurotoxicité chez les rats ont été réalisées avec du m‑xylène; peu d'études ont été relevées dans lesquelles les trois isomères étaient testés individuellement. Durant l'une de ces études, des rats ont été exposés à chaque isomère du xylène pendant 6 heures; le nombre de rats ayant échoué au test de la tige tournante à l'égard de la coordination motrice était le plus élevé dans le cas de l'o-xylène et le plus bas dans le cas du p‑xylène. Lors d'une autre étude, des souris ont été exposées à un isomère seul pendant 30 minutes. Le p-xylène s'est révélé l'isomère le plus puissant lors du test de l'écran inversé évaluant le rendement moteur, et l'o-xylène s'est révélé l'isomère le plus puissant lors du test de pression de la manette évaluant le comportement opérant; les différences étaient subtiles (US EPA, 2003). La plupart des tests de toxicité pour le développement ont été réalisés avec un mélange d'isomères, quoique dans deux études, l'o-xylène ait donné lieu à une DMENO inférieure à l'égard de la diminution du poids corporel des fœtus par comparaison au m- et au p-xylène. Dans l'ensemble, les différences de puissance sont incohérentes et semblent propres à l'étude et au critère d'effet.
5.3.2 Mécanisme d'action
Les effets irritants du xylène sur les yeux, le nez et la gorge, ainsi que les effets neurologiques aigus, sont considérés comme attribuables à sa solubilité dans les lipides, ce qui lui permet d'interagir directement avec les membranes tissulaires et ce qui provoque des changements dans la structure et la géométrie des membranes (de Groot, 2017). Chez les rats et les cochons d'Inde, la concentration de p-xylène dans le cerveau a chuté tout de suite après la fin de l'exposition (Gagnaire et coll., 2007b). De plus, l'US EPA (2003) a réalisé une modélisation PBPK des données des études de Korsak et al (1994) et a démontré que la concentration de xylène dans le sang était essentiellement de zéro lors des tests de neurotoxicité (24 heures après la fin de l'exposition). Cela rendrait compte de la réversibilité des effets aigus après la fin de l'exposition. Néanmoins, une exposition prolongée ou à une concentration élevée pourrait causer une toxicité durable pour le système nerveux central. Cette situation pourrait être attribuable à une perturbation des protéines intervenant dans le fonctionnement normal de la membrane neuronale (US EPA, 2003).
Les effets des solvants organiques sur le système nerveux semblent découler d'interactions avec certaines cibles comme les récepteurs de neurotransmetteurs (de Groot, 2017). Certaines études ont montré des changements dans les concentrations de divers neurotransmetteurs et la composition des lipides dans le cerveau après une exposition au xylène (US EPA, 2003). Ito et coll. (2002) ont noté des modifications dans la liaison du t-butylbicyclophosphorothionate (TBPS) (ligand du récepteur de l'acide gamma-aminobutyrique de type A [GABAa]) dans le cervelet des rats, et ont proposé que le xylène ait pu augmenter la libération des GABA et/ou améliorer la fonction du récepteur. Le récepteur du GABAa est une cible possible de la toxicité pour le système nerveux causée par le xylène, et comme ce récepteur peut se comporter différemment lors du développement du cerveau, une exposition au xylène durant cette période de croissance du cerveau pourrait s'avérer critique (de Groot, 2017).
Le stress oxydatif peut aussi jouer un rôle dans la toxicité du xylène. Par exemple, Savolainen et coll. (1979, cité dans US EPA, 2003) ont fait état d'une augmentation de l'activité de la superoxyde dismutase microsomale dans le cerveau du rat. Néanmoins, des études examinant les biomarqueurs de dommages oxydatifs chez l'humain ont donné des résultats mitigés (Bagryantseva et coll., 2010; Moro et coll., 2010; Yoon et coll., 2010; Kim et coll., 2011; Kwon et coll., 2018).
Certaines études sur des animaux ont montré que la perte auditive irréversible causée par le xylène est liée à la perte de cellules ciliées dans la cochlée (Gagnaire et coll., 2001; Maguin et coll., 2006; Gagnaire et coll., 2007a). Cependant, Wathier et coll. (2019, 2016) ont constaté une augmentation transitoire de l'amplitude du ROM en l'absence de changements morphologiques dans la cochlée. Puisque les trois isomères sont semblables en matière de lipophilie, mais présentent une puissance variable, la toxicité pour l'audition n'est sans doute pas attribuable à une interaction avec les membranes cellulaires; elle peut être causée par l'interaction directe du xylène avec les neurones (ATSDR, 2007). Le p-xylène est l'isomère le plus puissant, ce qui suggère que la présence de groupes méthyles à la position m- ou o- provoque un encombrement stérique et empêche donc les effets de ces isomères. Chez les humains, selon les résultats de tests du traitement des informations auditives comportementales et de perception de la parole, ainsi que de la réponse évoquée auditive du tronc cérébral, Fuente et coll. (2013) ont proposé que le xylène influe sur le système nerveux auditif central et que la toxicité pour le système auditif soit donc liée en partie à la neurotoxicité. Globalement, le lien entre la neurotoxicité et la toxicité pour l'audition est incertain.
5.4 Populations sensibles
On ne dispose pas de données suffisantes pour désigner les populations qui peuvent être plus sensibles aux effets de l'inhalation de xylène. De multiples facteurs peuvent contribuer aux différences de sensibilité au xylène parmi les individus, notamment l'âge, le poids corporel, le sexe, l'alimentation, la consommation d'alcool, l'exercice et les états pathologiques (MacDonald et coll., 2002; ATSDR, 2007). Comme il est expliqué à la section 4.1, des polymorphismes de l'enzyme de métabolisation principal du xylène (CYP2E1) ont été relevés; or, compte tenu des données limitées disponibles et des résultats de modélisation, ces polymorphismes ne semblent pas influer sur la variabilité du métabolisme des xylènes (Ernstgård et coll., 2003; Valcke et Krishnan, 2011).
En règle générale, dans le cas de plusieurs substances toxiques, les enfants peuvent recevoir une plus grande dose interne par inhalation que les adultes aux mêmes concentrations d'exposition. Chez les rats, les fœtus en développement ne semblent pas être plus sensibles que les adultes aux effets du xylène; cependant, aucune étude n'a été menée sur des nouveau-nés ou de jeunes animaux exposés à du xylène. Malgré l'activité enzymatique métabolique plus basse chez les nouveau-nés et les jeunes enfants, la modélisation suggère qu'il n'y a aucune variabilité importante quant au niveau de métabolisme du xylène chez les enfants comparativement aux adultes (Pelekis et coll., 2001; Valcke et Krishnan, 2011; Valcke et Haddad, 2015).
6.0 Établissement des concentrations de référence pour les expositions de courte et de longue durées
6.1 Concentration de référence pour l'exposition de courte durée
Les critères d'effet nocifs les plus sensibles quant à l'exposition aiguë au xylène sont des symptômes neurologiques et d'irritation légers signalés par des sujets humains lors de l'étude menée par Ernstgård et coll. (2002). La DMENO de 50 ppm (217 mg/m3) tirée de cette étude se fonde sur une légère augmentation de la déclaration de symptômes subjectifs durant la période d'exposition de deux heures (maux de tête, étourdissements, sensation d'intoxication, inconfort dans la gorge et les voies aériennes, et difficultés respiratoires), ainsi que sur une diminution légère, mais notable de la CVF des femmes trois heures après l'exposition. L'étude n'a pas établi de DSENO, puisqu'une seule concentration d'essai a été utilisée. D'autres études sur des volontaires humains n'ont testé que des concentrations d'exposition élevées, et ont également signalé de l'irritation et des effets neurologiques. Par exemple, on a signalé une irritation du nez, de la gorge et des yeux, ainsi que des nausées légères, des maux de tête, des effets réversibles sur l'équilibre et les temps de réaction et une baisse du rendement lors de tests de mémoire et de temps de réaction à la suite d'expositions à des concentrations de 100 à 400 ppm (de 434 à 1 736 mg/m3) (Nelson et coll., 1943; US EPA, 2003). Cependant, ces effets n'ont pas été observés dans d'autres études faisant appel à des concentrations d'essai comparables (de 100 à 400 ppm) (Carpenter, 1975; Hastings et coll., 1984 cité dans NRC, 2010 et CalEPA, 1999; US EPA, 2003).
L'US EPA (2003) a souligné que [traduction] « des concentrations d'environ 100 à 200 ppm (434 à 868 mg/m3) se situent près du seuil pour les effets d'irritation et neurologiques réversibles à court terme associés aux xylènes ». L'étude d'Ernstgård et coll. (2002) n'a pas été incluse dans l'évaluation de l'US EPA, et il s'agit de la seule étude relevée qui ait utilisé une concentration d'essai inférieure à 100 ppm (434 mg/m3). Cette étude est aussi la seule à avoir examiné des mesures objectives de la toxicité pour le système respiratoire chez des volontaires humains. Les auteurs ont fait uniquement état d'un effet minime sur un paramètre objectif, pour un sexe seulement, et à un seul moment; l'importance de cette observation est incertaine. Les résultats des questionnaires subjectifs d'Ernstgård et coll. (2002) concordent avec ceux d'autres études ayant utilisé des concentrations élevées et qui montraient certains signes d'irritation et des symptômes neurologiques légers provoqués par une exposition aiguë au xylène. Cependant, aucune des études accessibles (y compris celle d'Ernstgård et coll., 2002) n'a fourni de preuve de dose-réponse, et les concentrations exactes auxquelles ces effets à court terme se produisent sont incertaines. Il faut également noter que le seuil olfactif du xylène se trouve bien en deçà des concentrations d'essai de toutes les études menées sur des volontaires. Par conséquent, il est probable que les sujets aient senti la substance, ce qui pourrait avoir influencé leurs réponses. L'étude d'Ernstgård et coll. (2002) comportait un plus grand nombre de volontaires des deux sexes comparativement à la plupart des études antérieures, qui ne comportaient qu'un petit nombre de sujets masculins. Cependant, les volontaires étaient tous à peu près du même âge et il y avait vraisemblablement un certain biais de sélection, les auteurs ayant décrit une difficulté à recruter des sujets répondant à leurs critères.
Dans des études de toxicité aiguë menées sur des animaux, les effets observés (irritation respiratoire et neurotoxicité) appuient qualitativement les études réalisées sur des humains, mais ces études ont fait appel à des concentrations d'essai élevées (des DMEO supérieures à 1 000 ppm [4 340 mg/m3]). Lors d'études avec exposition à des doses répétées sur des animaux, une DSENO de 50 ppm (217 mg/m3) à l'égard de la neurotoxicité a été déterminée selon les effets observés à 100 ppm (434 mg/m3). Une inflammation des poumons a été observée dans une étude à une concentration de 300 ppm (1 300 mg/m3), mais aucun autre effet clinique ou histopathologique sur le système respiratoire n'a été observé durant plusieurs études utilisant des concentrations de 50 ppm à 810 ppm (217 à 3 515 mg/m3) (voir la section 5 pour connaître tous les détails).
Compte tenu des données disponibles, l'étude d'Ernstgård et coll. (2002) a été retenue comme étude principale, car elle est récente, compte un grand nombre de volontaires des deux sexes et fait appel à une concentration d'essai inférieure à celles utilisées par des études antérieures sur des humains, des critères d'effet objectifs ont été mesurés, et les effets observés sont appuyés par d'autres études sur des humains et des animaux. Ainsi, la DMENO de 2 heures d'exposition à une concentration de 50 ppm (217 mg/m3) à l'égard d'une irritation respiratoire légère, de symptômes neurologiques et d'une CVF un peu réduite a été choisie comme point de départ critique du calcul d'une CRf pour l'exposition de courte durée.
Aucune correction n'est requise concernant la durée de l'exposition (deux heures) de l'étude principale, car aucune relation de réponse temporelle n'a été démontrée (certains symptômes étaient notables après une heure et les évaluations subjectives moyennes n'ont pas augmenté lors de la deuxième heure de l'exposition). Aucun facteur d'incertitude interspécifique n'est nécessaire, puisque l'étude portait sur des volontaires humains. Un facteur d'incertitude intraspécifique par défaut de 10 a été appliqué, parce que tous les hommes et femmes testés étaient en bonne santé et d'âges similaires. Un facteur d'incertitude de 3 plutôt que 10 au regard de l'utilisation d'une DMENO avec effets minimes a été appliqué. Bien qu'on ait observé une légère différence dans une mesure objective (réduction de la CVF) chez des femmes à un seul moment, l'importance de cette observation n'est pas établie avec certitude.
En conséquence, la CRf proposée pour l'exposition de courte durée est de 7 000 µg/m3 (1 700 ppb).
En général, il n'y a pas de différence évidente entre les trois isomères du xylène quant à leur toxicité; bien que l'étude critique ait été menée avec du m-xylène, les isomères p- et o- devraient se comporter de la même manière. Ainsi, la CRf s'appliquerait aux trois isomères du xylène, quelle que soit la combinaison.
6.2 Concentration de référence pour l'exposition de longue durée
Aucune étude sur des humains n'a été considérée comme adéquate pour servir de base au calcul d'une CRf pour l'exposition de longue durée. Bien que certains organismes aient choisi l'étude réalisée par Uchida et coll. (1993) comme étude principale, celle-ci présentait de nombreuses limites comme une absence de déclaration de la durée de l'exposition, une exposition simultanée à d'autres substances chimiques, aucune démonstration claire des liens entre la réponse et la dose ou la durée, et le biais inhérent à l'autodéclaration de symptômes. Des études ultérieures de l'exposition professionnelle, comme celles de Lee et coll. (2005, 2013) et de Fuente et coll. (2013), et des études sur la population générale comme celles de Werder et coll. (2019) et de Norback et coll. (2017) présentent des limites analogues. Toutefois, ces études s'ajoutent aux éléments probants voulant que le xylène soit une substance neurotoxique.
L'effet le plus sensible observé chez des animaux de laboratoire a été une réduction significative sur le plan statistique de la coordination motrice chez des rats après une exposition de 1 à 3 mois à 100 ppm (434 mg/m3) de m-xylène (6 heures par jour, 5 jours par semaine) (Korsak et coll., 1994). Dans cette étude, on a également constaté une augmentation statistiquement significative de la sensibilité à la douleur à 50 ppm (217 mg/m3); cependant, cet effet ne dépendait pas de la concentration, et l'effet inverse a été observé dans une autre étude à 100 ppm (Gralewicz et Wiaderna, 2001). Par conséquent, ce critère d'effet est considéré comme moins fiable. Un appui à la neurotoxicité comme critère d'effet critique vient de Korsak et coll. (1992), qui ont également noté une réduction de la coordination motrice chez des rats après une exposition de 6 mois à 100 ppm de xylène; de Gralewicz et coll. (1995), qui ont relevé des déficits d'apprentissage chez des rats exposés à 100 ppm de xylène pendant 3 mois; et de Gralewicz et Wiaderna (2001), qui ont constaté une baisse de la réponse locomotrice dans un milieu engendrant de la peur chez des rats exposés à 100 ppm de xylène pendant 4 semaines. Étant donné que 100 ppm était la seule ou la plus basse concentration d'essai de ces études, aucune DSENO n'a été déterminée. Bien qu'une DSENO moindre de 35 ppm (152 mg/m3) à l'égard de l' o-xylène ait été établie lors d'une étude de toxicité pour le développement menée sur des rats (selon une baisse du poids corporel des fœtus à une concentration de 350 ppm [1 520 mg/m3]; Ungváry et coll., 1980), elle n'a pas été retenue pour servir de base au calcul de la CRf pour l'exposition de longue durée à cause de sa DMENO plus élevée et des importantes limites de l'étude (voir la section 5.2.3). De même, la DSENO plus élevée de 100 ppm pour la réduction du poids corporel des fœtus à 500 ppm (Saillenfait et coll., 2003) n'a pas été retenue. L'étude de Korsak et coll. (1994) a donc été choisie comme étude critique. Puisqu'il manquait de données pour la modélisation de la concentration de référence, la DSENO de 50 ppm (217 mg/m3) de l'étude a été sélectionnée comme point de départ pour le calcul de la CRf pour l'exposition de longue durée.
La DSENO de 50 ppm déterminée par Korsak et coll. (1994) pour l'exposition des animaux étudiés (6 heures par jour, 5 jours par semaine) a été ajustée selon une exposition continue (24 heures par jour, 7 jours par semaine), ce qui a mené à une DSENO ajustée de 9 ppm (39 mg/m3).
Un facteur d'incertitude par défaut de 10 pour la variabilité intraspécifique ([FIH], qui tient compte de la sensibilité au sein de la population humaine) a été appliqué, car aucune information propre aux xylènes n'était disponible sur la variation de la pharmacocinétique ou la réponse chez les humains. En général, il a été démontré que, dans le cas de nombreuses substances toxiques, les enfants recevaient une dose par inhalation de deux à trois fois plus grande que celle des adultes exposés aux mêmes concentrations (US EPA, 2012); cette variation est intégrée au FIH par défaut. Des études explorant les différences cinétiques potentielles liées à l'âge des xylènes (Pelekis et coll., 2001) ou la voie métabolique de CYP2E1 (Valcke et Krishnan, 2011) indiquent que le composant pharmacocinétique du FIH par défaut suffit pour tenir compte des différences entre les enfants et les adultes. Bien que les fœtus de rats en développement ne semblent pas plus sensibles que les adultes aux effets des xylènes, aucune étude n'a étudié des nouveau-nés ou de jeunes animaux exposés à des xylènes. De plus, une multitude de facteurs peut contribuer aux différences de sensibilité entre les individus, dont l'âge, le sexe, l'alimentation, l'exercice et les états pathologiques (US EPA, 2003; Adams et coll., 2005).
De même, en l'absence de données propres à la substance chimique, un facteur d'incertitude par défaut de 2,5 a été appliqué en raison des différences toxicodynamiques entre les rats et les humains. Pour tenir compte des différences toxicocinétiques entre les rats et les humains, on a comparé les coefficients de partage sang/gaz (Hb/g). Cette approche est considérée comme adéquate à l'égard des COV produisant des effets systémiques (US EPA, 2012). L'US EPA (2003) a utilisé un (Hb/g)H de 26,4 pour le m -xylène chez les humains, une valeur tirée de Tardif et coll. (1995, citée dans US EPA, 2003), et un (Hb/g)A de 46,0 pour le m-xylène chez les rats, une valeur tirée du même groupe (Tardif et coll., 1993, citée dans US EPA, 2003), pour calculer un ratio rat/humain de 1,7. Dans d'autres études estimant le H b/g chez les rats et les humains, la valeur pour les rats dépassait systématiquement celle pour les humains (Adams et coll., 2005; ATSDR, 2007; McNally et coll., 2012). Lorsque le ratio (H b/g)A:(Hb/g)H est supérieur à 1, l'US EPA (2012) recommande d'utiliser la valeur par défaut plus prudente de 1. L'approche est appuyée par une analyse des modèles PBPK, qui prédisent des concentrations d'exposition chez les humains très semblables à la DSENO pour les rats ajustée selon la durée (voir la section 4.2 pour les détails). Un facteur d'incertitude par défaut de 1 a donc été appliqué pour tenir compte des différences toxicocinétiques interspécifiques.
Finalement, un facteur d'incertitude de 10 pour la base de données a été appliqué, ce qui englobe la prise en compte de l'utilisation d'une étude de toxicité subchronique ainsi que les lacunes de la base de données utilisée. Même si l'étude critique portait sur la toxicité subchronique, aucun accroissement de la fréquence ou de la gravité des effets entre un et trois mois n'a été observé dans l'étude critique (Korsak et coll., 1994) ni dans une étude apparentée s'étendant sur six mois (Korsak et coll., 1992). La base de données sur la toxicité pour les animaux désigne la neurotoxicité comme critère d'effet le plus sensible; cependant, les quelques études accessibles sur la neurotoxicité développementale présentent d'importantes limites. Bien qu'une DMENO pour des effets légers et réversibles ait été déterminée dans une étude (Hass et coll., 1995), aucune DSENO n'a été établie, car une seule concentration a fait l'objet de tests (500 ppm). Une incertitude entoure donc la dose la plus faible (ou l'âge potentiellement sensible) à laquelle des troubles d'apprentissage ou de mémoire seraient observés, et quant à savoir si la neuropathologie est concernée. Aucune toxicité pour la reproduction n'a été observée lors d'une étude portant sur une génération; aucune étude portant sur deux générations n'était disponible.
Le lecteur trouvera une description et une justification détaillées des facteurs d'incertitude par défaut utilisés pour l'établissement d'une CRf pour l'exposition de longue durée dans l'étude de Ritter et coll. (2007).
Le facteur d'incertitude total qui sera appliqué au point de départ (DSENO ajustée en fonction de la durée) est de 250 (FIH = 10; FIA = 2,5; FID = 10). Par conséquent, la CRf proposée pour l'exposition de longue durée est de 150 µg/m3 (36 ppb).
En général, il n'existe pas de différence évidente entre les trois isomères du xylène sur le plan de la toxicité. Bien que les études critiques et d'appui sur la neurotoxicité chez les rats aient été réalisées avec du m-xylène, les isomères p- et o- devraient se comporter d'une manière analogue. Par conséquent, la CRf s'appliquerait aux trois isomères du xylène, quelle que soit la combinaison. La CRf devrait protéger des effets potentiels sur le développement.
Pour appuyer cette CRf basée sur la DSENO pour les rats, on a aussi calculé une CRf en fonction de la DMENO de 14 ppm (61 mg/m3) établie dans l'étude sur l'exposition professionnelle d'Uchida et coll. (1993). La DMENO pour l'exposition professionnelle (8 heures par jour, 5 jours par semaine) a été ajustée selon une exposition continue (24 heures par jour, 7 jours par semaine), et des facteurs d'incertitude par défaut de 10 chacun pour tenir compte des individus sensibles et de l'utilisation d'une DMENO ont été appliqués, ce qui a donné une CRf potentielle de 150 µg/m3.
6.3 Comparaison entre l'exposition dans les habitations canadiennes et la concentration de référence, et établissement des limites d'exposition recommandées
Au cours des dernières années, Santé Canada a mené plusieurs études d'exposition dans de nombreuses villes canadiennes, dont Edmonton, Halifax, Windsor, Regina, Ottawa et Montréal, ainsi que dans une réserve des Premières Nations au Manitoba (Swan Lake) (Santé Canada, 2010a, 2010b, 2012, 2013; Mallach et coll., 2017; Goldberg et coll., 2015; Weichenthal et coll., 2013) (voir la section 3.2). Ce sont là les plus récentes données représentatives permettant de quantifier les niveaux d'exposition de longue durée dans les habitations canadiennes. D'autres études canadiennes utilisant des méthodes différentes d'analyse et d'échantillonnage appuient ces données (Conseil national de recherche Canada, 2021; INSPQ, 2021; Santé Canada, 2021b; Li et coll., 2019). Les données préliminaires suggèrent que les concentrations de xylène peuvent être plus élevées dans les habitations récemment construites (Santé Canada et Conseil national de recherches Canada, 2019; Santé Canada, 2021b).
Les CRf de courte et de longue durées reposent sur la caractérisation de la relation concentration-réponse et l'application de facteurs d'incertitude tenant compte de certaines variabilités et de données manquantes. Bien que le contexte d'application des CRf, la faisabilité technique et la possibilité de mettre en œuvre des mesures d'atténuation du risque n'entrent pas dans la détermination des CRf, ils sont pris en compte lors de l'établissement des limites d'exposition de courte et de longue durées proposées.
Pour établir les limites d'exposition recommandées, les CRf pour les expositions de courte et de longue durées sont d'abord comparées aux données d'exposition disponibles sur les habitations canadiennes, puis évaluées selon leur faisabilité par la mise en œuvre de mesures de contrôle des sources intérieures. Si la CRf peut être atteinte, la limite d'exposition recommandée sera alors égale à la CRf. Sinon, une concentration plus élevée pourra être choisie en fonction des données actuelles, tout en gardant à l'esprit que la limite d'exposition doit protéger la santé.
Les critères de la présente évaluation servant à établir les limites recommandées d'exposition de courte et de longue durées aux xylènes sont les suivants :
- une valeur généralement réalisable dans les habitations canadiennes en l'absence d'une importante source de xylènes dans l'air intérieur;
- une valeur qui n'est pas associée à d'importants effets sur la santé, étant donné les niveaux d'exposition établis et les données probantes disponibles.
6.3.1 Concentration de référence et limite d'exposition recommandée pour l'exposition de courte durée
La base de données documentaire a fourni des données suffisantes sur les effets chez l'humain permettant d'établir une CRf pour l'exposition de courte durée aux xylènes de 7 000 µg/m3. La plage des concentrations médianes de xylènes mesurées dans les habitations canadiennes dans le cadre des études de la qualité de l'air intérieur résidentiel de Santé Canada varie entre 2,1 et 11,1 µg/m3, la valeur du 95e centile se situant entre 15,6 et 212,7 µg/m3 (voir le tableau 2) (Santé Canada, 2021b). Les échantillons sur 24 heures prélevés dans le cadre de ces études ne représentent pas une exposition aiguë ou maximale. Des pointes de xylènes de courte durée peuvent survenir lors de la consommation de tabac ou l'utilisation de produits tels que les calfeutrants, les revêtements ou les teintures. Selon les données d'échantillonnage recueillies au cours d'une période de 24 heures et les sources présumées, la CRf pour l'exposition de courte durée devrait être réalisable dans les habitations canadiennes. La limite d'exposition de courte durée aux xylènes est donc de 7 000 µg/m3 pour les trois isomères, quelle que soit la combinaison.
6.3.2 Concentration de référence et limite d'exposition recommandée pour l'exposition de longue durée
La base de données documentaire a permis d'établir une CRf pour l'exposition de longue durée de 150 µg/m3 en fonction d'une réduction de la coordination motrice. Les études de la qualité de l'air intérieur résidentiel de Santé Canada menées dans plusieurs villes à l'aide d'une méthode d'échantillonnage faisant appel aux canisters passivés fournissent la meilleure mesure de l'exposition chronique dans les habitations canadiennes. La plage des concentrations médianes de xylènes mesurées au cours d'une période de 24 heures dans les habitations canadiennes dans le cadre des études de la qualité de l'air intérieur résidentiel de Santé Canada varie entre 2,1 et 11,1 µg/m3, la valeur du 95e centile se situant entre 15,6 et 212,7 µg/m3 (voir le tableau 2) (Santé Canada, 2021b). Des concentrations analogues de xylènes ont été observées dans d'autres études canadiennes utilisant des méthodes différentes d'analyse et d'échantillonnage (voir la section 3.2). Les données montrent que la concentration de xylènes présente dans certaines habitations canadiennes pourrait dépasser la CRf. Cependant, la CRf a été établie avec les dernières données scientifiques et se compare au NRAI de 100 µg/m3 fixé par Santé Canada et à des valeurs de référence d'autres instances (voir l'annexe D). Parmi les sources importantes de xylènes dans les habitations canadiennes, mentionnons les appareils à essence rangés dans le garage; les produits de construction et de rénovation comme les calfeutrants, les revêtements et les teintures; ainsi que l'usage du tabac. Il est possible de réduire la concentration de xylène dans l'air intérieur par la ventilation et le contrôle des sources. La limite d'exposition de longue durée aux xylènes recommandée est donc de 150 µg/m3, et ce, pour les trois isomères, quelle que soit la combinaison.
7.0 Lignes directrices proposée
7.1 Limites d'exposition proposées
| Limite d'exposition | Concentration | Effets critiques | |
|---|---|---|---|
| µg/m3 | ppb | ||
| Courte durée (1 h) |
7 000 | 1 700 | Symptômes neurologiques (maux de tête, fatigue); irritation des yeux, du nez et de la gorge; effets respiratoires |
| Longue durée (24 h) |
150 | 36 | Altération de la coordination motrice |
Les limites proposées s'appliquent aux trois isomères du xylène, quelle que soit la combinaison.
On recommande de comparer la limite d'exposition de courte durée à un échantillon d'air d'une heure.
Lors de la comparaison de la concentration de xylène mesurée avec la limite d'exposition de longue durée, le temps d'échantillonnage devrait être d'au moins 24 heures dans des conditions normales. Par ailleurs, la moyenne des résultats obtenus à partir d'échantillons successifs prélevés à divers moments de l'année permettra d'obtenir une estimation plus représentative de l'exposition de longue durée.
7.2 Recommandations pour la gestion des risques
La concentration de xylènes de certaines habitations du Canada pourrait dépasser la limite d'exposition de longue durée offrant une protection contre l'altération de la coordination motrice. Il faut limiter l'exposition aux xylènes dans l'air intérieur en assurant une ventilation adéquate et en contrôlant les sources intérieures.
La présence d'un garage attenant et l'entreposage d'automobiles, d'outils fonctionnant à l'essence ou d'essence dans le garage sont associés à des concentrations accrues de xylènes dans les habitations. Certains produits de constructions peuvent libérer de grandes quantités de xylènes, et les concentrations de xylènes dans les habitations peuvent augmenter pendant et après des rénovations. Les résidences où on fait un usage régulier du tabac ont aussi tendance à présenter des concentrations accrues de xylènes. D'autres produits de consommation comme les assainisseurs d'air peuvent libérer des xylènes, mais leur contribution aux concentrations intérieures de xylènes reste inconnue. Il a été démontré que l'augmentation de la ventilation et l'utilisation d'un ventilateur d'évacuation réduisaient les concentrations de xylènes dans l'air intérieur.
L'exposition aux xylènes dans l'air intérieur peut être réduite au moyen des stratégies présentées ci-après. En outre, plusieurs mesures énumérées ci-dessous permettront également de réduire les concentrations d'autres contaminants de l'air intérieur, améliorant ainsi la qualité de l'air intérieur.
- Augmenter la ventilation, en particulier lorsqu'on utilise des
produits de construction ou de rénovation comme les calfeutrants, les
revêtements et les teintures :
- En ouvrant les fenêtres (quand cela est possible et vérifier la qualité de l'air extérieur dans votre région avant d'ouvrir les fenêtres : Cote air santé ).
- En utilisant des stratégies de ventilation mécanique.
- Pour en savoir davantage, consulter la Fiche de renseignements : La ventilation et le milieu intérieur (Santé Canada, 2018).
- Dans la mesure du possible, ne pas entreposer de l'essence ou d'autres produits chimiques dans votre résidence ou dans le garage; si ces produits doivent être entreposés, il faut alors bien sceller leurs contenants.
- S'il y a un garage attenant à votre maison :
- Envisager d'installer un ventilateur d'évacuation dans le garage.
- S'assurer que l'interface entre le garage attenant et la résidence est bien scellée.
- Éviter de faire tourner au ralenti dans le garage la voiture, la souffleuse à neige, la tondeuse à gazon ou tout autre appareil à essence.
- Ne pas fumer à l'intérieur de votre résidence.
- Choisir des produits à faible taux d'émission dans la mesure du possible.
- Réduire l'utilisation de produits parfumés et d'assainisseurs d'air.
8.0 Références
Adams J.C., Dills R.L., Morgan M.S., Kalman D.A. et Pierce C.H. (2005). A physiologically based toxicokinetic model of inhalation exposure to xylenes in Caucasian men. Regulatory Toxicology and Pharmacology, 43(2): 203–214. http://dx.doi.org/10.1016/j.yrtph.2005.07.005
Alexopoulos E.C., Chatzis C. et Linos A. (2006). An analysis of factors that influence personal exposure to toluene and xylene in residents of Athens, Greece. BMC Public Health, 6: 50. http://dx.doi.org/10.1186/1471-2458-6-50
ANSES (2020). Valeurs toxicologiques de référence : Les xylènes. Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail. https://www.anses.fr/fr/system/files/VSR2018SA0152Ra.pdf
Armenta-Reséndiz M., Ríos-Leal E., Rivera-García M.T., López-Rubalcava C. et Cruz S.L. (2019). Structure-activity study of acute neurobehavioral effects of cyclohexane, benzene, m-xylene, and toluene in rats. Toxicology and Applied Pharmacology, 376: 38–45. http://dx.doi.org/10.1016/j.taap.2019.05.016
ATSDR (2007). Toxicological Profile for Xylene. Agency for Toxic Substances and Disease Registry, Public Health Service, US Department of Health and Human Services, Atlanta, GA. http://www.atsdr.cdc.gov/toxprofiles/tp71.pdf
Aylward L.L., Kirman C.R., Blount, B.C. et Hays, S.M. (2010). Chemical-specific screening criteria for interpretation of biomonitoring data for volatile organic compounds (VOCs)–Application of steady-state PBPK model solutions. Regulatory Toxicology and Pharmacology, 58(1): 33–44.10.1016/j.yrtph.2010.05.011
Aylward L.L., Kirman C.R., Schoeny R., Portier C.J. et Hays S.M. (2013). Evaluation of biomonitoring data from the CDC National Exposure Report in a risk assessment context: Perspectives across chemicals. Environmental Health Perspectives, 121(3): 287–294. http://dx.doi.org/10.1289/ehp.1205740
Bagryantseva Y., Novotna B., Rossner P., Chvatalova I., Milcova A., Svecova V., Lnenickova Z., Solansky I. et Sram R.J. (2010). Oxidative damage to biological macromolecules in Prague bus drivers and garagemen: Impact of air pollution and genetic polymorphisms. Toxicology Letters, 199(1): 60–68. http://dx.doi.org/10.1016/j.toxlet.2010.08.007
Bari M.A., Kindzierski W.B., Wheeler A.J. Héroux, M.-E. et Wallace L.A. (2015). Source apportionment of indoor and outdoor volatile organic compounds at homes in Edmonton, Canada. Building and Environment, 90: 114–124. 10.1016/j.buildenv.2015.03.023
Batterman S., Jia C. et Hatzivasilis G. (2007). Migration of volatile organic compounds from attached garages to residences: a major exposure source. Environmental Research, 104(2): 224–240. 10.1016/j.envres.2007.01.008
Bio/dynamics Inc. (1983). Parental and fetal reproduction toxicity study in rats with mixed xylene. EPA/OTS public files. Bio/dynamics Inc., East Millstone, NJ; Document no FYI-AX-0983-0209. [cité dans US EPA 2003].
Blanc-Lapierre A., Sauvé J.F. et Parent M.E. (2018). Occupational exposure to benzene, toluene, xylene and styrene and risk of prostate cancer in a population-based study. Occupational and Environmental Medicine, 75(8):562–572
Cakmak S., Kauri L.M., Andrade J. et Dales R. (2020). Factors influencing volatile organic compounds in Canadian homes. Indoor and Built Environment: 1420326X20926229.
CalEPA (1999). Appendix D.2 Acute RELs and toxicity summaries using the previous version of the Hot Spots Risk Assessment guidelines. California Environmental Protection Agency, Office of Environmental Health Hazard Assessment. Disponible à : https://oehha.ca.gov/media/downloads/crnr/appendixd2final.pdf
CalEPA (2000). Chronic Toxicity Summary: Xylenes. Appendix D.3 Determination of Noncancer Chronic Reference Exposure Levels. Office of Environmental Health Hazard Assessment, California Environmental Protection Agency, Sacramento, CA. http://www.oehha.ca.gov/air/hot_spots/2008/AppendixD3_final.pdf#page=602
CalEPA (2012). Evidence on the Developmental and Reproductive Toxicity of Xylene. California Environmental Protection Agency, Sacramento, CA.
Carpenter C.P., Kinkead E.R., Geary D.L. Jr., Sullivan L.J. et King J. M. (1975). Petroleum hydrocarbon toxicity studies. V. Animal and human response to vapors of mixed xylenes. Toxicology and Applied Pharmacology, 33(3): 543–558.
Charles S.M., Batterman S. et Jia C. (2007). Composition and emissions of VOCs in main- and side-stream smoke of research cigarettes. Atmospheric Environment, 41(26): 5371–5384.
Chen C.S., Hseu Y.C., Liang S.H., Kuo J. et Chen S.C. (2008). Assessment of genotoxicity of methyl-tert-butyl ether, benzene, toluene, ethylbenzene, and xylene to human lymphocytes using comet assay. Journal of Hazardous Materials, 153(1-2): 351–356.
Cheng M., Galbally I.E., Molloy S.B., Selleck P.W., Keywood M.D., Lawson S.J., Powell J.C., Gillett R.W. et Dunne E. (2016). Factors controlling volatile organic compounds in dwellings in Melbourne, Australia. Indoor Air, 26: 219–230.
Cho S., Damokosh A.I., Ryan L.M., Chen D., Hu Y.A. Smith T.J., Christiani D.C. et Xu X. (2001). Effects of exposure to organic solvents on menstrual cycle length. Journal of Occupational and Environmental Medicine, 43(6): 567–575.
CIRC (1999). Re-evaluation of some Organic Chemicals, Hydrazine and Hydrogen Peroxide. IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans, 71: 1189.
Cocco P., t'Mannetje A., Fadda D., Melis M., Becker N., de Sanjosé S, Foretova L., Mareckova J., Staines A., Kleefeld S., Maynadié M., Nieters A., Brennan P. et Boffetta P. (2010). Occupational exposure to solvents and risk of lymphoma subtypes: Results from the Epilymph case-control study. Occupational and Environmental Medicine, 67(5): 341–347. http://dx.doi.org/10.1136/oem.2009.046839
Conseil national de recherches Canada (2021). Data on xylene concentrations in Canadian homes. Disponible sur demande.
Costantini A.S., Benvenuti A., Vineis P., Kriebel D., Tumino R., Ramazzotti V., Rodella S., Stagnaro E., Crosignani P., Amadori D., Mirabelli D., Sommani L., Belletti I., Troschel L., Romeo L., Miceli G., Tozzi G.A., Mendico I., Maltoni S.A. et Miligi L. (2008). Risk of leukemia and multiple myeloma associated with exposure to benzene and other organic solvents: Evidence from the Italian multicenter case-control study. American Journal of Industrial Medicine, 51(11): 803–811. http://dx.doi.org/10.1002/ajim.20592
De Aquino T., Zenkner F.F., Ellwanger J.H., Prá D. et Rieger A. (2016). DNA damage and cytotoxicity in pathology laboratory technicians exposed to organic solvents. Anais Da Academia Brasileira De Ciêencias, 88(1): 227–236. http://dx.doi.org/10.1590/0001-3765201620150194
de Groot, D.M.G. (2017). Scientific review on the link between the narcotic effects of solvents and (developmental) neurotoxicity. Final report. Prepared for ECHA. Contract number ECA.6677-E3. Netherlands.
De Roos A.J., Spinelli J., Brown E.B., Atanackovic D., Baris D., Bernstein L., Bhatti P., Camp N.J., Chiu B.C., Clavel J., Cozen W., de Sanjosé, S., Dosman J.A., Hofmann J.N., McLaughlin J.R., Miligi L., Monnereau A., Orsi L., Purdue M.P., Schinasi L.H., Tricot G.J., Wang S.S., Zhang Y., Birmann B.M. et Cocco P. (2018). Pooled study of occupational exposure to aromatic hydrocarbon solvents and risk of multiple myeloma. Occupational and Environmental Medicine, 75(11): 798–806. http://dx.doi.org/10.1136/oemed-2018-105154
Desrosiers T.A., Lawson C.C., Meyer R.E., Stewart P.A., Waters M.A., Correa A. et Olshan A.F. (2015). Assessed occupational exposure to chlorinated, aromatic and Stoddard solvents during pregnancy and risk of fetal growth restriction. Occupational and Environmental Medicine, 72(8): 587–593. http://dx.doi.org/10.1136/oemed-2015-102835
Dodson R.E., Udesky J.O., Colton M.D., McCauley M., Camann D.E., Yau A.Y., Adamkiewicz G. et Rudel R.A. (2017). Chemical exposures in recently renovated low-income housing: Influence of building materials and occupant activities. Environment International.109: 114–127. https://doi.org/10.1016/j.envint.2017.07.007
Du Z., Mo J., Zhang Y. et Xu Q. (2014). Benzene, toluene and xylenes in newly renovated homes and associated health risk in Guangzhou, China. Building and Environment, 72: 75–81.
Elliott L., Longnecker M.P., Kissling G.E. et London S.J. (2006). Volatile organic compounds and pulmonary function in the Third National Health and Nutrition Examination Survey, 1988-1994. Environmental Health Perspectives, 114(8): 1210–1214.10.1289/ehp.9019
Environnement et Changement climatique Canada (2021). Programme de surveillance national de la pollution atmosphérique (SNPA) - Portail de données ouvertes du gouvernement du Canada. https://open.canada.ca/data/fr/dataset/1b36a356-defd-4813-acea-47bc3abd859b [mise à jour : décembre 2020; consultation : mars 2021]
Environnement Canada et Santé Canada (1993). Loi canadienne sur la protection de l'environnement. Liste des substances d'intérêt prioritaire - Rapport d'évaluation - Xylènes. En40‑215/22F, Ministre des Approvisionnements et Services Canada, Ottawa, Ontario.
Ernstgård L., Gullstrand E., Lof A. et Johanson G. (2002). Are women more sensitive than men to 2-propanol and m-xylene vapours? Occupational and Environmental Medicine, 59(11): 759–767.10.1136/oem.59.11.759 [doi]
Ernstgård L., Sjögren B., Warholm M. et Johanson G. (2003). Sex differences in the toxicokinetics of inhaled solvent vapors in humans 1. m-Xylene. Toxicology and Applied Pharmacology, 193(2): 147–157.
European Commission (2005). Final Report – The INDEX project: Critical Appraisal of the Setting and Implementation of Indoor Exposure Limits in the EU. European Commission - Directorate-General Joint Research Centre - Institute for Health and Consumer Protection - Physical and Chemical Exposure Unit. Ispra, Italy. EUR 21590 EN
European Commission (2021). Final opinion on toxicological reference values for certain organic chemicals emitted from squishy toys with regard to adopting limit values under the Toy Safety Directive 2009/48/EC 'Chemicals in squishy toys'. Scientific Committee on Health, Environmental and Emerging Risks (SCHEER).
Faure S., Noisel N., Werry K., Karthikeyan S., Aylward L.L. et St-Amand A. (2020). Evaluation of human biomonitoring data in a health risk based context: An updated analysis of population level data from the Canadian Health Measures Survey. International Journal of Hygiene and Environmental Health, 223(1): 267–280.
Foy J.W. D. et Schatz R.A. (2004). Inhibition of rat respiratory-tract cytochrome p-450 activity after acute low-level m-xylene inhalation: role in 1-nitronaphthalene toxicity. Inhalation Toxicology, 16(3): 125–132.
Fuente A., McPherson B. et Cardemil F. (2013). Xylene-induced auditory dysfunction in humans. Ear and Hearing, 34(5): 651–660. http://dx.doi.org/10.1097/AUD.0b013e31828d27d7
Fuente A., McPherson B. et Hood L.J. (2012). Hearing loss associated with xylene exposure in a laboratory worker. Journal of the American Academy of Audiology, 23(10): 824–830. http://dx.doi.org/10.3766/jaaa.23.10.7
Gagnaire F. et Langlais C. (2005). Relative ototoxicity of 21 aromatic solvents. Archives of Toxicology, 79(6): 346–354.
Gagnaire F., Langlais C., Grossmann S. et Wild P. (2007a). Ototoxicity in rats exposed to ethylbenzene and to two technical xylene vapours for 13 weeks. Archives of Toxicology, 81(2): 127–143. http://dx.doi.org/10.1007/s00204-006-0124-y
Gagnaire F., Marignac B., Blachere V., Grossmann S. et Langlais C. (2007b). The role of toxicokinetics in xylene-induced ototoxicity in the rat and guinea pig. Toxicology, 231(2-3): 147–158.
Gagnaire F., Marignac B., Langlais C. et Bonnet P. (2001). Ototoxicity in Rats Exposed to Ortho-, Meta‐and Para‐Xylene Vapours for 13 Weeks. Pharmacology & Toxicology, 89(1): 6–14.
Goldberg M., Wheeler A., Burnett R., Mayo N., Valois M., Brophy M. et Giannetti N. (2015). Physiological and perceived health effects from daily changes in air pollution and weather among persons with heart failure: A panel study. Journal of Exposure Science and Environmental Epidemiology, 25: 187–199. https://doi.org/10.1038/jes.2014.43
Gralewicz S. et Wiaderna D. (2001). Behavioral effects following subacute inhalation exposure to m-xylene or trimethylbenzene in the rat: a comparative study. Neurotoxicology, 22(1): 79–89.
Gralewicz S., Wiaderna D. et Tomas T. (1995). Development of spontaneous, age-related nonconvulsive seizure electrocortical activity and radial-maze learning after exposure to m-xylene in rats. International Journal of Occupational Medicine and Environmental Health, 8(4): 347–360.
Hass U. et Jakobsen B.M. (1993). Prenatal toxicity of xylene inhalation in the rat: a teratogenicity and postnatal study. Pharmacology & Toxicology, 73(1): 20–23.
Hass U., Lund S.P. et Simonsen L. (1997). Long-lasting neurobehavioral effects of prenatal exposure to xylene in rats. Neurotoxicology, 18(2): 547–551.
Hass U., Lund S.P., Simonsen L. et Fries A.S. (1995). Effects of prenatal exposure to xylene on postnatal development and behavior in rats. Neurotoxicology and Teratology, 17(3): 341–349.
Hastings L, Cooper G.P. et Burg W. 1984. Human sensory response to selected petroleum hydrocarbons. Dans : MacFarland H.N., Holdsworth C.E., MacGregor J.A., Call R.W. et Lane, M.L. Advances in modern environmental toxicology. Vol. 6. Applied toxicology of petroleum hydrocarbons. Princeton, NJ: Princeton Scientific Publishers, 255–270. [citée dans CalEPA 1999; NRC 2010]
Héroux M.-E., Gauvin D., Gilbert N.L., Guay M., Dupuis G., Legris M. et Levesque B. (2008). Housing characteristics and indoor concentrations of selected volatile organic compounds (VOCs) in Quebec City, Canada. Indoor and Built Environment, 17(2): 128–137. http://dx.doi.org/10.1177/1420326X07089005
Hong S.-G., Hwang Y.-H., Mun S.-K., Kim S.-J., Jang H.-Y., Kim H., Paik M.-J. et Yee S.-T. (2019). Role of Th2 cytokines on the onset of asthma induced by meta-xylene in mice. Environmental Toxicology. http://dx.doi.org/10.1002/tox.22814
Hudák A. et Ungváry G. (1978). Embryotoxic effects of benzene and its methyl derivatives: toluene, xylene. Toxicology, 11: 55–63.
[INRP] Inventaire national des rejets de polluants (2021) Ottawa, Ontario : Gouvernement du Canada. Résultats de recherche pour les xylènes. [Consultation : mars 2021]. https://pollution-dechets.canada.ca/inventaire-national-rejets/archives/index.cfm?lang=Fr
INSPQ (2021). Amélioration de la qualité de l'air intérieur par l'optimisation de la ventilation dans des logements du Nunavik. Rapport de recherche. Disponible à : https://www.inspq.qc.ca/sites/default/files/publications/2769-amelioration-qualite-air-interieur-logements-nunavik.pdf
Ito T., Yoshitome K., Horike T. et Kira S. (2002). Distribution of inhaled m-xylene in rat brain and its effect on GABAA receptor binding. Journal of Occupational Health, 44(2): 69–75.
Kim J.H., Moon J.Y., Park E.-Y., Lee K.-H. et Hong Y.-C. (2011). Changes in oxidative stress biomarker and gene expression levels in workers exposed to volatile organic compounds. Industrial Health, 49(1): 8–14. http://dx.doi.org/10.2486/indhealth.MS1112
Kirman C.R., Aylward L.L., Blount B.C., Pyatt D.W. et Hays S.M. (2012). Evaluation of NHANES biomonitoring data for volatile organic chemicals in blood: Application of chemical-specific screening criteria. Journal of Exposure Science & Environmental Epidemiology, 22(1): 24–34.
Korsak Z., Sokal J.A. et Górny R. (1992). Toxic effects of combined exposure to toluene and m‑xylene in animals. III. Subchronic inhalation study. International Journal of Occupational Medicine and Environmental Health, 5(1): 27–33.
Korsak Z., Sokal J.A., Wasiela T. et Swiercz R. (1990). Toxic effects of acute exposure to particular xylene isomers in animals. Polish Journal of Occupational Medicine, 3(2): 221–226.
Korsak Z., Wisniewska-Knypl J. et Swiercz R. (1994). Toxic effects of subchronic combined exposure to n-butyl alcohol and m-xylene in rats. International Journal of Occupational Medicine and Environmental Health, 7(2): 155–166.
Kum C., Kiral F., Sekkin S., Seyrek K. et Boyacioglu M. (2007a). Effects of xylene and formaldehyde inhalations on oxidative stress in adult and developing rats livers. Experimental Animals, 56(1): 35–42. http://dx.doi.org/10.1538/expanim.56.35
Kum C., Sekkin S., Kiral F. et Akar F. (2007b). Effects of xylene and formaldehyde inhalations on renal oxidative stress and some serum biochemical parameters in rats. Toxicology and Industrial Health, 23(2): 115–120. http://dx.doi.org/10.1177/0748233707078218
Kwon J.-W., Park H.-W., Kim W.J., Kim M.-G. et Lee S.-J. (2018). Exposure to volatile organic compounds and airway inflammation. Environmental Health, 17(1): 65. http://dx.doi.org/10.1186/s12940-018-0410-1
Lajoie P., Aubin D., Gingras V., Daigneault P., Ducharme F., Gauvin D., Fugler D., Leclerc J., Won D., Courteau M., Gingras S., Héroux M.E., Yang W. et Schleibinger, H. (2015). The IVAIRE project: a randomized controlled study of the impact of ventilation on indoor air quality and the respiratory symptoms of asthmatic children in single family homes. Indoor Air, 25(6): 582–597.
Lee C.R., Jeong K.S., Kim Y., Yoo C.I., Lee J.H. et Choi Y.H. (2005). Neurobehavioral changes of shipyard painters exposed to mixed organic solvents. Industrial Health, 43(2): 320–326. http://dx.doi.org/10.2486/indhealth.43.320
Lee E.-H., Paek D., Kho Y.L., Choi K. et Chae H.J. (2013). Color vision impairments among shipyard workers exposed to mixed organic solvents, especially xylene. Neurotoxicology and Teratology, 37: 39–43. http://dx.doi.org/10.1016/j.ntt.2013.02.005
Lehmann I., Thoelke A., Rehwagen M., Rolle‐Kampczyk U.E., Schlink U., Schulz R., Borte M., Diez U. et Herbarth O. (2002). The influence of maternal exposure to volatile organic compounds on the cytokine secretion profile of neonatal T cells. Environmental Toxicology, 17(3): 203–210.
Li Y., Cakmak S. et Zhu J. (2019). Profiles and monthly variations of selected volatile organic compounds in indoor air in Canadian homes: Results of Canadian national indoor air survey 2012‑2013. Environment International, 126: 134–144.
Lim S.K., Shin H.S., Yoon K.S., Kwack S.J., Um Y.M., Hyeon J.H., Kwak H.M., Kim J.Y., Kim T.H., Kim Y.J. et Roh T.H., 2014. Risk assessment of volatile organic compounds benzene, toluene, ethylbenzene, and xylene (BTEX) in consumer products. Journal of Toxicology and Environmental Health, Part A. 77(22−24): 1502−1521.
Litton Bionetics. (1978a). Teratology study in rats - xylene. Rapport final de l'EPA/dossiers publics de l'OTS. Litton Bionetics, Kensington, MD. Document 878210350 [cité dans US EPA 2003].
MacDonald A., Rostami-Hodjegan A., Tucker G. et Linkens D. (2002). Analysis of solvent central nervous system toxicity and ethanol interactions using a human population physiologically based kinetic and dynamic model. Regulatory Toxicology and Pharmacology, 35(2): 165–176.
MacNeill M., Dobbin N., St‐Jean M., Wallace L., Marro L., Shin T., You H., Kulka R., Allen R.W. et Wheeler A.J. (2016). Can changing the timing of outdoor air intake reduce indoor concentrations of traffic‐related pollutants in schools? Indoor Air, 26(5): 687–701.
Maguin K., Lataye R., Campo P., Cossec B., Burgart M. et Waniusiow D. (2006). Ototoxicity of the three xylene isomers in the rat. Neurotoxicology and Teratology, 28(6): 648–656. http://dx.doi.org/10.1016/j.ntt.2006.08.007
Mallach G., St-Jean M., MacNeill M., Aubin D., Wallace L., Shin T., Van R.K., Kulka R., You H., Fugler D., Lavigne E. et Wheeler A.J. (2017). Exhaust ventilation in attached garages improves residential indoor air quality. Indoor Air, 27(2): 487–499. http://dx.doi.org/10.1111/ina.12321
Marchand A., Aranda-Rodriguez R., Tardif R., Nong A. et Haddad S. (2016). Evaluation and modeling of the impact of coexposures to VOC mixtures on urinary biomarkers. Inhalation Toxicology, 28(6): 260–273. http://dx.doi.org/10.3109/08958378.2016.1162232
Miligi L., Costantini A.S., Benvenuti A., Kriebel D., Bolejack V., Tumino R., Ramazzotti V., Rodella S., Stagnaro E., Crosignani P., Amadori D., Mirabelli D., Sommani L., Belletti I., Troschel L., Romeo L., Miceli G., Tozzi G.A., Mendico I. et Vineis P. (2006). Occupational exposure to solvents and the risk of lymphomas. Epidemiology, 17(5): 552–561. http://dx.doi.org/10.1097/01.ede.0000231279.30988.4d
Moro A.M., Charao M., Brucker N., Bulcao R., Freitas F., Guerreiro G., Baierle M., Nascimento S., Waechter F., Hirakata V., Linden R., Thiesen F.V. et Garcia S.C. (2010). Effects of low-level exposure to xenobiotics present in paints on oxidative stress in workers. Science of the Total Environment, 408(20): 4461–4467. http://dx.doi.org/10.1016/j.scitotenv.2010.06.058
Nelson K.F., Ege J.F. Jr., Ross M., Woodman L.E. et Silverman L. (1943). Sensory Response to Certain Industrial Solvent Vapors. Journal of Industrial Hygiene and Toxicology, 25(7): 282–285.
Niaz K., Bahadar H., Maqbool F. et Abdollahi M. (2015). A review of environmental and occupational exposure to xylene and its health concerns. EXCLI Journal, 14: 1167–1186. http://dx.doi.org/10.17179/excli2015-623
[NLM] National Library of Medicine (US) (2020). ChemIDPlus (Internet database). Substance Name: Xylenes. Disponible à : https://chem.nlm.nih.gov/chemidplus/name/Xylene [consultation : septembre 2020].
Norback D., Hashim J.H., Hashim Z. et Ali F. (2017). Volatile organic compounds (VOC), formaldehyde and nitrogen dioxide (NO2) in schools in Johor Bahru, Malaysia: Associations with rhinitis, ocular, throat and dermal symptoms, headache and fatigue. Science of the Total Environment, 592: 153–160. http://dx.doi.org/10.1016/j.scitotenv.2017.02.215
NRC (2010). Acute Exposure Guideline Levels for Selected Airborne Chemicals, Volume 9. Washington, DC: The National Academies Press. https://doi.org/10.17226/12978
Nylén P., Ebendal T., Eriksdotter-Nilsson M., Hansson T., Henschen A., Johnson A., Kronevi T., Kvist U., Sjöstrand N.O., Höglund G. et Olson L. (1989). Testicular atrophy and loss of nerve growth factor-immunoreactive germ cell line in rats exposed to n-hexane and a protective effect of simultaneous exposure to toluene or xylene. Archives of Toxicology, 63(4): 296–307.
Pelekis M., Gephart L. et Lerman S. (2001). Physiological-model-based derivation of the adult and child pharmacokinetic intraspecies uncertainty factors for volatile organic compounds. Regulatory Toxicology and Pharmacology, 33(1): 12–20.
Ritter L., Totman C., Krishnan K., Carrier R., Vézina A. et Morisset V. (2007). Deriving uncertainty factors for threshold chemical contaminants in drinking water. Journal of Toxicology and Environmental Health, Part B, 10(7): 527–557.
RIVM (2001). Rijksinstituut Voor Volksgezondheid En Milieu National Institute of Public Health and the Environment. RIVM Report 711701025. Baars, AJ et al. 2001. Re-evaluation of human-toxicological maximum permissible risk levels. Bilthoven, Netherlands.
Rosen M.B., Crofton K.M. et Chernoff N. (1986). Postnatal evaluation of prenatal exposure to p‑xylene in the rat. Toxicology Letters, 34(2-3): 223–229.
Saillenfait A., Gallissot F., Morel G. et Bonnet P. (2003). Developmental toxicities of ethylbenzene, ortho-, meta-, para-xylene and technical xylene in rats following inhalation exposure. Food and Chemical Toxicology, 41(3): 415–429.
Sandikci M., Seyrek K., Aksit H. et Kose H. (2009). Inhalation of formaldehyde and xylene induces apoptotic cell death in the lung tissue. Toxicology and Industrial Health, 25(7): 455–461. http://dx.doi.org/10.1177/0748233709106824
Santé Canada (1987). Directives d'exposition concernant la qualité de l'air des résidences. Rapport du Comité consultatif fédéral-provincial de l'hygiène du milieu et du travail. Santé Canada, Ottawa, Ontario.
Santé Canada (1996). Loi canadienne sur la protection de l'environnement - Liste des substances d'intérêt prioritaire. Documentation à l'appui : Concentrations/doses journalières admissibles et concentrations/doses tumorigènes des substances d'intérêt prioritaire calculées en fonction de critères sanitaires. Centre d'hygiène du milieu, Ottawa.
Santé Canada (2010a). Étude de la qualité de l'air intérieur à Regina (2007) : Sommaire des données d'échantillonnage des composés organiques volatiles. Santé Canada, Ottawa, Ontario.
Santé Canada (2010b). Étude d'évaluation de l'exposition à Windsor (2005-2006) : Sommaire des données d'échantillonnage des composés organiques volatils. Santé Canada, Ottawa, Ontario.
Santé Canada (2012). Étude de la qualité de l'air intérieur à Halifax (2009) : Sommaire des données d'échantillonnage des composés organiques volatils (COV). Santé Canada, Ottawa, Ontario.
Santé Canada. (2013). Étude de la qualité de l'air intérieur à Edmonton (2010) : Sommaire des données des composés organiques volatils (COV). Santé Canada, Ottawa, Ontario.
Santé Canada (2014). Recommandations pour la qualité de l'eau potable au Canada : document technique – le toluène, l'éthylbenzène et les xylènes. https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-toluene-ethylbenzene-et-xylenes.html
Santé Canada (2018). Fiche de renseignements : La ventilation et le milieu intérieur. Gouvernement du Canada, Ottawa. No de cat. : H144-54/2-2018F-PDF.
Santé Canada (2019). Cinquième rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada. Résultats de l'Enquête canadienne sur les mesures de la santé cycle 5 (2016 à 2017). Disponible à : https://www.canada.ca/fr/sante-canada/services/sante-environnement-milieu-travail/rapports-publications/contaminants-environnementaux/cinquieme-rapport-biosurveillance-humaine.html [consultation : mars 2021]
Santé Canada (2021a). Xylene source analysis from data in Canadian homes. Disponible sur demande.
Santé Canada (2021b). Data on xylene concentrations in Canadian homes. Disponible sur demande.
Santé Canada et Conseil national de recherches Canada (2019). Les composés organiques volatils présents dans les maisons neuves : rapport de l'étude pilote sur les émissions des produits de construction et la qualité de l'air intérieur. https://publications.gc.ca/site/fra/9.875561/publication.html
Savolainen K. et Linnavuo M. (1979). Effects of m‐xylene on human equilibrium measured with a quantitative method. Acta Pharmacologica et Toxicologica, 44(4): 315–318. [citée dans US EPA 2003].
Shrubsole C., Dimitroulopoulou S., Foxall K., Gadeberg B. et Doutsi A. (2019). IAQ guidelines for selected volatile organic compounds (VOCs) in the UK. Building and Environment, 165: 106382.
Steinemann A. (2017). Ten questions concerning air fresheners and indoor built environments. Building and Environment, 111: 279–284.
Stocco C., MacNeill M., Wang D., Xu X., Guay M., Brook J. et Wheeler A.J. (2008). Predicting personal exposure of Windsor, Ontario residents to volatile organic compounds using indoor measurements and survey data. Atmospheric Environment, 42(23): 5905–5912. 10.1016/j.atmosenv.2008.03.024
Tardif R., Laparé S., Charest‐Tardif G., Brodeur J. et Krishnan K. (1995). Physiologically‐based pharmacokinetic modeling of a mixture of toluene and xylene in humans. Risk Analysis, 15(3): 335–342 [citée dans US EPA 2003].
Tardif, R., Laparé S., Krishnan K. et Brodeur J. (1993). Physiologically based modeling of the toxicokinetic interaction between toluene and m-xylene in the rat. Toxicology and Applied Pharmacology, 120(2): 266–273 [citée dans US EPA 2003].
Uchida Y., Nakatsuka H., Ukai H., Watanabe T., Liu Y., Huang M., Wang Y., Zhu F., Yin H. et Ikeda M. (1993). Symptoms and signs in workers exposed predominantly to xylenes. International Archives of Occupational and Environmental Health, 64(8): 597–605.
Ungváry G. et Tátrai E. (1985). On the embryotoxic effects of benzene and its alkyl derivatives in mice, rats and rabbits. Dans : Chambers P.L., Cholnoky E., Chambers C.M. (éditeurs) Receptors and Other Targets for Toxic Substances. Archives of Toxicology (Supplement), vol 8. Springer, Berlin, Heidelberg. https://doi.org/10.1007/978-3-642-69928-3_95 .
Ungváry G., Tátrai E., Hudák A., Barcza G. et Lõrincz M. (1980). Studies on the embryotoxic effects of ortho-, meta- and para-xylene. Toxicology, 18(1): 61–74.
US CDC (2017). Centers for Disease Control and Prevention. National Biomonitoring Program: Biomonitoring Summary – Xylenes. Disponible à : https://www.cdc.gov/biomonitoring/Xylenes_BiomonitoringSummary.html [consultation : mars 2021].
US EPA (2003). Toxicological Review of Xylenes (CAS No. 1330-20-7). In Support of Summary Information on the Integrated Risk Information System (IRIS). EPA/635/R-03/001, Environmental Protection Agency des États-Unis, Washington, D.C. http://cfpub.epa.gov/ncea/iris/iris_documents/documents/toxreviews/0270tr.pdf
US EPA (2012). Advances in Inhalation Gas Dosimetry for Derivation of a Reference Concentration (RfC) and Use in Risk Assessment. EPA/600/R-12/044. Environmental Protection Agency des États-Unis, Washington, D.C.
Valcke M. et Haddad S. (2015). Assessing Human Variability in Kinetics for Exposures to Multiple Environmental Chemicals: A Physiologically Based Pharmacokinetic Modeling Case Study with Dichloromethane, Benzene, Toluene, Ethylbenzene, and m-Xylene. Journal of Toxicology and Environmental Health - Part A: Current Issues, 78(7): 409–431. http://dx.doi.org/10.1080/15287394.2014.971477
Valcke M. et Krishnan K. (2011). An assessment of the impact of physico-chemical and biochemical characteristics on the human kinetic adjustment factor for systemic toxicants. Toxicology, 286(1-3): 36–47.
VCCEP (2005). Xylenes Category: m-Xylene (CAS No. 108-38-3), o-Xylene (CAS No. 95-47-6), p-Xylene (CAS No. 106-42-3), Mixed Xylenes (CAS No. 1330-20-7). Voluntary Children's Chemical Evaluation Program (VCCEP) Tier 1 Pilot Submission. Docket Number OPPTS - 00274D. American Chemistry Council. Benzene, Toluene and Xylenes VCCEP Consortium. http://www.tera.org/peer/VCCEP/xylenes/Xylenes%20VCCEP%20Submission%2010-6-05.pdf
Wang T., Du, H., Ma J., Shen L., Wei M., Zhao X., Chen L., Li M., Li G. et Xing Q. (2020). Functional characterization of the chlorzoxazone 6-hydroxylation activity of human cytochrome P450 2E1 allelic variants in Han Chinese. PeerJ, 8: e9628.
Warden H., Richardson H., Richardson L., Siemiatycki J. et Ho V. (2018). Associations between occupational exposure to benzene, toluene and xylene and risk of lung cancer in Montréal. Occupational and Environmental Medicine, 75(10): 696–702. http://dx.doi.org/10.1136/oemed-2017-104987
Wathier L., Venet T., Bonfanti E., Nunge H., Cosnier F., Parietti-Winkler C., Campo P. et Pouyatos B. (2019). Measuring the middle-ear reflex: A quantitative method to assess effects of industrial solvents on central auditory pathways. Neurotoxicology, 74: 58–66. http://dx.doi.org/10.1016/j.neuro.2019.05.007
Wathier L., Venet T., Thomas A., Nunge H., Bonfanti E., Cosnier F., Parietti-Winkler C., Campo P., Tsan P., Bouguet-Bonnet S. et Gansmüller A. (2016). Membrane fluidity does not explain how solvents act on the middle-ear reflex. Neurotoxicology, 57: 13–21. http://dx.doi.org/10.1016/j.neuro.2016.08.001
Weichenthal S., Mallach, G., Kulka, R., Black A., Wheeler A., You H., St-Jean M., Kwiatkowski R. et Sharp D. (2013). A randomized double-blind crossover study of indoor air filtration and acute changes in cardiorespiratory health in a First Nations community. Indoor Air, 23(3): 175‑184. https://doi.org/10.1111/ina.12019
Werder E.J., Engel L.S., Blair A., Kwok R.K., McGrath J.A. et Sandler D.P. (2019). Blood BTEX levels and neurologic symptoms in Gulf states residents. Environmental Research, 175: 100–107. http://dx.doi.org/10.1016/j.envres.2019.05.004
Wheeler A.J., Wong S.L., Khouri C. et Zhu J. (2013). Prédicteurs des concentrations intérieures de composés BTEX dans les immeubles résidentiels au Canada. Rapports sur la santé, 24(5): 12‑19.
Won D., Nong G., Yang W. et Collins P. (2014). Material emissions testing: VOCs from wood, paint, and insulation materials. Conseil national de recherches du Canada, Ottawa, Ontario. https://nrc-publications.canada.ca/fra/voir/objet/?id=77464aff-3278-4693-9f2c-b87ba98a8f0e
Won D., Nong G., Yang W. et Lusztyk E. (2015). VOC emissions from evaporative sources in residential garages. Conseil national de recherches du Canada, Ottawa, Ontario. https://nrc-publications.canada.ca/fra/voir/objet/?id=0132321b-b7b6-439a-b17c-9d69d1f9020b
Won D., Nong G., Yang W. et Schleibinger H. (2013) Material emissions data: 52 building materials tested for 124 compounds. Conseil national de recherches du Canada, Ottawa, Ontario. https://nrc-publications.canada.ca/fra/voir/objet/?id=7d952eef-fe7e-474e-855d-e5b6442280b1
Yoon H.I., Hong Y.-C., Cho S.-H., Kim H., Kim Y.H., Sohn J.R., Kwon M., Park S.-H., Cho M.-H. et Cheong H.-K. (2010). Exposure to volatile organic compounds and loss of pulmonary function in the elderly. European Respiratory Journal, 36(6): 1270–1276. http://dx.doi.org/10.1183/09031936.00153509
Zhu J., Newhook R., Marro L. et Chan C.C. (2005). Selected volatile organic compounds in residential air in the city of Ottawa, Canada. Environmental Science and Technology, 39: 3964–3971. https://doi.org/10.1021/es050173u
Annexe A : Liste des acronymes et abréviations
- ADN
- acide désoxyribonucléique
- AEGL
- valeur limite pour l'exposition aiguë
- AMH
- acide méthylhippurique
- ANSES
- Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (France)
- ATSDR
- Agency for Toxic Substances and Disease Registry
- BTEX
- benzène, toluène, éthylbenzène et xylènes
- CalEPA
- California Environmental Protection Agency
- CCE
- cellule ciliée externe
- CDC
- Centers for Disease Control and Prevention
- CEH
- concentration équivalente chez l'humain
- CIRC
- Centre international de recherche sur le cancer
- COV
- Composé organique volatil
- CRf
- concentration de référence
- CTA
- concentration tolérable dans l'air
- CVF
- capacité vitale forcée
- DMENO
- dose minimale avec effet nocif observé
- DMEO
- dose minimale avec effet observé
- DSENO
- dose sans effet nocif observé
- EB
- équivalent de biosurveillance
- ECMS
- Enquête canadienne sur les mesures de la santé
- É.-U.
- États-Unis
- FI
- facteur d'incertitude
- FT
- test de vitesse de tapotement des doigts
- G/I
- concentrations dans les garages/concentrations intérieures
- I/E
- concentrations intérieures/concentrations extérieures
- INRP
- Inventaire national des rejets de polluants
- INSPQ
- Institut national de santé publique du Québec
- JG
- jour de gestation
- JPN
- jour postnatal
- LDQAIR
- lignes directrices sur la qualité de l'air intérieur résidentiel
- MG
- moyenne géométrique
- NHANES
- National Health and Nutrition Examination Survey
- NLM
- National Library of Medicine
- NRAI
- niveau de référence dans l'air intérieur
- NRC
- National Research Council
- NRM
- niveau de risque minimal
- PBPK
- pharmacocinétique à base physiologique
- ppb
- parties par milliard
- ppm
- parties par million
- RIVM
- Institut national de la santé publique et de l'environnement (Pays-Bas)
- RNSPA
- Réseau national de surveillance de la pollution atmosphérique
- ROM
- réflexe de l'oreille moyenne
- SD
- test de substitution symboles-chiffres
- SNC
- système nerveux central
- TBPS
- t-butylbicyclophosphorothionate
- TWA
- moyenne pondérée dans le temps
- US EPA
- Environmental Protection Agency des États-Unis
- VEMS
- volume expiratoire maximal en une seconde
- VCCEP
- Voluntary Children's Chemical Evaluation Program
Annexe B : Études d'exposition humaine
| Étude | Participants | Exposition | Résultats | DSENO/DMENO |
|---|---|---|---|---|
Ernstgård et coll., 2002 |
56 volontaires sains (28 hommes, 28 femmes) |
50 ppm de m-xylène pendant 2 heures (ou air propre, ou 150 ppm d'isopropanol – chaque sujet a été soumis aux 3 expositions avec un intervalle de 2 semaines entre chacune) |
Par comparaison avec l'air propre : hausse des symptômes subjectifs (maux de tête, étourdissements, sensation d'intoxication) lors de l'exposition au xylène Légers effets respiratoires : baisse de la CVF chez les femmes 3 heures après (mais pas tout de suite après) la fin de l'exposition, hausse de l'inconfort dans la gorge et les voies aériennes chez les femmes lors de l'exposition (autodéclaration), et difficultés à respirer durant l'exposition chez les deux sexes (autre autodéclaration) |
DMENO de 50 ppm (aucune DSENO) L'ATSDR a utilisé cette valeur comme point de départ pour calculer son NRM |
Carpenter et coll., 1975 |
6 volontaires |
0, 110, 230, 460, 690 ppm d'un mélange de xylènes pendant 15 minutes |
À 230 ppm, 1 des 6 volontaires s'est senti étourdi pendant les 2 dernières minutes de l'exposition de 15 minutes; aucun étourdissement déclaré à 110 ppm. Un volontaire a signalé un léger inconfort dans la gorge lors de la première minute de l'exposition à 110 et 230 ppm. Irritation des yeux et du nez signalée à 230 ppm et plus (transitoire) |
Non déterminé |
Nelson et coll., 1943 |
10 volontaires (sexe non précisé) |
Mélange de xylènes pendant 3 à 5 minutes (concentrations non précisées) |
Irritation des yeux, du nez et de la gorge pour la majorité des volontaires à 200 ppm. Il a été estimé que la concentration la plus élevée à laquelle la majorité des sujets pourrait être exposée pendant 8 heures sans irritation est de 100 ppm. |
Non déterminé |
Hastings et coll., 1984 (cité dans NRC, 2010; CalEPA, 1999) |
50 volontaires de sexe masculin sains |
Mélange de xylènes pendant 30 minutes; 0, 100, 200, 400 ppm |
Aucun signalement d'irritation au nez ou à la gorge. Le pourcentage de sujets ayant signalé une irritation des yeux était de 56 % pour les témoins (air propre), de 60 % à 100 ppm, de 70 % à 200 ppm, et de 90 % à 400 ppm. |
La CalEPA (1999) a considéré que 100 ppm était une DSENO. Le NRC (2010) a considéré que 400 ppm était une DMENO. |
| Étude | Participants | Exposition | Résultats | DSENO/DMENO |
|---|---|---|---|---|
Uchida et coll., 1993 |
175 travailleurs exposés à du xylène (107 hommes, 68 femmes) pour lesquels la somme des trois isomères représentait 70 % ou plus de l'exposition totale aux solvants. Les témoins étaient 241 travailleurs non exposés des mêmes usines ou d'usines de la même région. |
Mesure de l'exposition personnelle sur une seule journée. L'exposition a été présumée identique pour toute la période couverte par l'étude (sept ans). La concentration moyenne de xylène (TWA) était de 14 ppm (61 mg/m3). |
Enquête sur la santé menée le jour après la mesure de l'exposition. La prévalence des symptômes subjectifs durant le quart de travail et lors des trois mois précédents a été beaucoup plus élevée chez les travailleurs exposés que chez les travailleurs non exposés. Lorsque les individus exposés ont été répartis selon la concentration d'exposition de xylène (1–20 ppm ou > 21 ppm), une irritation des yeux, un mal de gorge et une sensation de flottement ont suivi une hausse liée à la concentration des symptômes signalés durant le quart de travail, tandis que le manque d'appétit a été le seul symptôme lié à la concentration déclaré pour la période des trois mois précédents. |
L'ATSDR (2007), la CalEPA (2000) et l'Union européenne (2005) ont considéré que 14 ppm (61 mg/m3), la TWA de la MG, était une DMENO et l'ont utilisée comme base pour calculer leurs limites d'exposition. |
Lee et coll., 2005 |
180 peintres de chantier naval exposés à un mélange de solvants organiques; 60 travailleurs de référence n'ayant pas été exposés à des solvants organiques formaient le groupe de sujets témoins |
Échantillonnage de l'air de l'exposition cumulative pour 61 des 180 peintres, 3 jours différents chacun. Niveaux les plus élevés : xylènes. Calcul de l'indice d'exposition cumulée (plusieurs substances chimiques). Concentration de xylènes : moyenne géométrique (écart-type géométrique) de 22,70 ppm (4,10 ppm); plage de 1,6 à 591,2 ppm |
Les individus exposés (peintres) présentaient des différences notables lors de tests SD (substitution de symboles-chiffres, tests de la mémoire occasionnelle) et FT (vitesse de tapotement des doigts) de la main dominante et de tests FT de la main non dominante (les facteurs de confusion d'âge et d'éducation étant pris en compte). Aucune différence notée dans les tests lorsque l'indice d'exposition réel a été utilisé à des fins de comparaison (durée du travail x expositions totales aux solvants). Par contre, l'augmentation de la durée de l'exposition (selon l'enquête, < 10 ans contre > 20 ans) s'est traduite par une différence lors des tests SD (p < 0,05) et FT de la main dominante (p = 0,052). Le temps de réaction simple n'a été touché dans aucune analyse. |
Non déterminé |
Lee et coll., 2013 |
63 peintres de chantier naval exposés à des solvants organiques, surtout le xylène Témoins : 122 travailleurs de bureau non exposés de la même industrie et 185 sujets de la population générale |
Xylène : concentration la plus élevée dans l'air (concentration moyenne 10 ppm = 46 mg/m3) Le métabolite urinaire AMH a aussi été mesuré chez les travailleurs exposés et les témoins. |
La concentration d'AMH dans l'urine a été corrélée de façon significative avec les résultats du test de l'indice de confusion des couleurs. Corrigé selon l'âge et le nombre d'années d'études, mais non en fonction des autres solvants. |
Non déterminé |
Fuente et coll., 2013 |
30 travailleurs d'un laboratoire médical |
Le xylène devait être la substance d'exposition principale à cause de son utilisation comme agent de traitement d'échantillons de tissus. Concentration moyenne de xylène : 36,5 mg/m3 ; plage de 8 à 217 mg/m3 (mesuré en un seul jour) L'AMH urinaire a été mesuré après le dernier jour de travail de la semaine. Durée d'exposition estimée selon la description par les travailleurs de leurs antécédents de travail. Durée moyenne de l'exposition : 11,8 ans (plage de 2 à 29 ans) |
Les participants exposés au xylène ont obtenu des résultats très faibles à certains tests, notamment les seuils de détection des tons purs, le test de séquence des motifs de hauteur tonale, le test d'écoute dichotique, le test de reconnaissance vocale dans le bruit et la réponse évoquée auditive du tronc cérébral. Une estimation de la dose cumulée a aussi été réalisée au moyen de la durée d'exposition déclarée et de la concentration d'AMH dans l'urine; les participants présentant une dose cumulée plus élevée ont obtenu des résultats inférieurs aux participants dont la dose cumulée était faible. Les auteurs ont suggéré que le xylène était associé à des effets nocifs sur le système nerveux auditif central et les capacités de détection sonore des humains, et ont proposé que les effets du xylène sur le système auditif fussent liés du moins en partie à une neurotoxicité dans le tronc cérébral. |
Non déterminé |
Fuente et coll., 2012 |
1 employé de laboratoire d'histologie (étude de cas) |
Durée d'exposition estimée : 20 ans. Concentration moyenne de xylène dans l'air : 60 mg/m3 |
Il a été proposé que la perte auditive était attribuable à une exposition professionnelle de longue durée au xylène. |
Non déterminé |
Werder et coll., 2019 |
690 adultes exposés ailleurs qu'au travail |
Du xylène et d'autres substances chimiques ont été mesurés dans le sang. Les concentrations sanguines de xylène étaient de 0,06, 0,13 et 0,25 ng/mL aux 25 e, 50e et 75e centiles, respectivement. |
Enquête menée sur la fréquence des symptômes neurologiques durant les 30 jours précédents. Dans le cas du xylène, la plupart des associations ont été faussées par des expositions simultanées à d'autres substances. Cependant, dans les modèles limités aux non-fumeurs et ajustés selon les facteurs de confusion (dont les concentrations sanguines de benzène, de toluène et d'éthylbenzène), il y a eu un lien entre de nombreux symptômes du SNC ainsi que les deuxième, troisième et quatrième quartiles de la concentration de xylène dans le sang, et une tendance exposition-réponse. Les symptômes du SNC étudiés étaient les étourdissements, les maux de tête, les nausées, la transpiration et les palpitations. |
Non déterminé |
Norback et coll., 2017 |
462 élèves dans 8 écoles (Malaisie) |
La concentration médiane de xylène dans l'air pendant une semaine était de 78 mg/m3 |
Des niveaux élevés de xylène ont été liés à une fatigue autodéclarée lors des trois derniers mois (aucun ajustement n'a été apporté en fonction de l'exposition simultanée à d'autres contaminants). Aucun lien n'a été noté entre les concentrations de xylène et les maux de tête ou symptômes aux muqueuses signalés. |
Non déterminé |
Cho et coll., 2001 |
1 408 travailleurs du secteur pétrochimique. 284 femmes exposées à du xylène et à d'autres solvants. Les 968 témoins étaient des travailleurs non exposés (à aucun solvant) de la même entreprise. |
Les travailleurs ont été exposés à une multitude de solvants; aucun n'a été exposé à du xylène seul |
Comparativement au groupe non exposé, les travailleuses exposées présentaient une prévalence accrue d'oligoménorrhée (cycles menstruels de plus de 35 jours, déterminés par un questionnaire) |
Non déterminé |
Desrosiers et coll., 2015 |
Un échantillon fondé sur la population de 2 861 couples mères-nourrissons des É.-U. |
Exposition professionnelle déterminée par des entrevues/descriptions de postes et des bases de données |
Hausse modeste, mais imprécise des probabilités de nourrissons de faible poids pour l'âge gestationnel chez les mères exposées à des solvants aromatiques. Cependant, toutes les femmes exposées au xylène l'ont aussi été au toluène. |
Non déterminé |
Elliott et coll., 2006 |
Population générale des É.‑U. |
Mesure de la concentration de xylène dans le sang |
Pas d'association entre aucun test de fonction pulmonaire et la concentration de xylène dans le sang |
Non déterminé |
Kwon et coll., 2018 |
34 sujets avant et après leur installation dans un nouvel établissement de réadaptation, où ils passaient au moins 8 heures par jour. |
Mesure de la concentration de métabolites du xylène dans l'urine |
Aucune corrélation significative n'a été observée entre des modifications des concentrations urinaires de métabolites de xylène et les tests de fonction pulmonaire avant et après le déplacement. |
Non déterminé |
Yoon et coll., 2010 |
154 Coréens |
Mesure de la concentration de métabolites du xylène dans l'urine |
Les concentrations d'AMH ont été associées négativement avec le VEMS et le VEMS/CVF. Aucun lien entre le xylène dans l'air et l'AMH dans l'urine n'a été observé. |
Non déterminé |
Annexe C : Études toxicologiques
| Étude | Espèce, sexe et nombre | Exposition | Résultats | DSENO/DMENO |
|---|---|---|---|---|
Armenta-Resendiz et coll., 2019 |
Rats Wistar mâles, 10 par groupe |
0, 500, 1 000, 2 000, 4 000 ou 8 000 ppm de m ‑xylène pendant 30 minutes |
Tests effectués 3 minutes après la fin de l'exposition. Résultats non indiqués ou abordés pour les groupes exposés à 500 ou 1 000 ppm. À 2 000 ppm, une réduction évidente et importante du temps d'attente qui était dépendante de la concentration a été observée durant le test d'évitement passif. À 4 000 ppm et plus, le temps d'attente avant que l'animal se lèche la patte a beaucoup augmenté lors du test de la plaque chaude. Tous les autres tests (tâche d'enfouissement défensif, test de seuil de tressaillement, interactions sociales et test de la tige tournante) ont révélé des changements importants uniquement à 8 000 ppm. |
Non déterminé |
Korsak et coll., 1990 (cité dans US EPA, 2003) |
Rats Wistar mâles, 10 par groupe |
Isomères de xylène seuls à 3 000 ppm pendant 6 heures |
Test de la tige tournante : les nombres d'échecs par nombre d'animaux testés étaient de 19/20 pour l' o-xylène, de 6/20 pour le m-xylène et de 1/20 pour le p-xylène |
DMEO : 3 000 ppm (concentration d'essai la plus faible) Aucune dose sans effet observé |
Wathier et coll., 2019, 2016 |
Rats bruns de Norvège mâles, anesthésiés et trachéotomisés, n = 3 à 5 par groupe |
Isomères du xylène seuls à 3 000 ppm pendant 2 x 15 minutes, avec 20 minutes entre chaque séance |
Augmentation transitoire de l'amplitude du réflexe de l'oreille moyenne (ROM) durant et pendant l'exposition, laquelle était plus marquée dans le cas du p -xylène, et moindre, mais tout de même notable, dans le cas du m-xylène. Aucune différence n'a été notée concernant le ROM des animaux exposés à de l' o‑xylène, ni dans la morphologie de la cochlée tous isomères confondus. |
Non déterminé |
| Étude | Espèce, sexe et nombre | Exposition | Résultats | DSENO/DMENO |
|---|---|---|---|---|
Korsak et coll., 1994 |
Rats Wistar mâles, 12 par groupe exposé et 24 témoins |
0, 50 ou 100 ppm de m-xylène pendant 3 mois (6 heures par jour, 5 jours par semaine) |
Des rats exposés ont montré une baisse de rendement lors du test de la tige tournante à l'égard de la coordination motrice. Taux d'échec de 8 % pour le groupe exposé à 50 ppm et de 33 % pour le groupe exposé à 100 ppm, par comparaison à 0 % pour les témoins (statistiquement significatif dans le cas du groupe exposé à 100 ppm). Les taux d'échec étaient les mêmes après 1, 2 et 3 mois d'exposition (test mené 24 heures après la dernière exposition). Les rats exposés montraient aussi une hausse statistiquement significative de la sensibilité à la douleur lors du test de la plaque chaude. |
DMENO (neurotoxicité) : 100 ppm DSENO : 50 ppm Choisie comme étude critique pour le calcul de la CRf de l'US EPA |
Korsak et coll., 1992 |
Rats Wistar mâles, 12 par groupe |
0 ou 100 ppm de m‑xylène pendant 6 mois ou 1 000 ppm pendant 3 mois (6 heures par jour, 5 jours par semaine) |
Taux d'échec au test de la tige tournante d'environ 35 % après 6 mois d'exposition à 100 ppm, et de 60 % après 3 mois d'exposition à 1 000 ppm (0 % dans le cas des témoins; les deux groupes exposés différaient des témoins sur le plan statistique). Baisse importante des mouvements spontanés dans les deux groupes exposés comparativement aux témoins |
DMENO (neurotoxicité) : 100 ppm (concentration d'essai la plus faible) Aucune DSENO |
Gralewicz et coll., 1995 |
Rats mâles, 20 au total |
0, 100 ou 1 000 ppm de m‑xylène pendant 3 mois (6 heures par jour, 5 jours par semaine) |
Dans un test du labyrinthe radial mené de 70 à 83 jours après la dernière exposition, les rats exposés n'avaient pas besoin de moins de temps pour terminer un test et ne faisaient pas moins d'erreurs d'omission lors de tests quotidiens successifs. |
DMENO (neurotoxicité) : 100 ppm (concentration d'essai la plus faible) Aucune DSENO |
Gralewicz et Wiaderna, 2001 |
Rats Wistar mâles, 11 par groupe |
0 ou 100 ppm de m‑xylène pendant 4 semaines (6 heures par jour, 5 jours par semaine) |
Une différence significative a été observée entre les rats exposés et les rats témoins lors d'un test d'évitement passif mené de 39 à 48 jours après la fin de l'exposition (au dernier des six tests seulement), et lors d'un test d'évitement actif mené de 50 à 51 jours après la fin de l'exposition (au dernier des trois tests seulement). Aucune différence dans les résultats du test du labyrinthe radial mené de 14 à 18 jours après la fin de l'exposition. |
DMENO (neurotoxicité) : 100 ppm (concentration d'essai la plus faible) Aucune DSENO |
Gagnaire et coll., 2001 |
Rats Sprague-Dawley mâles, 16 par groupe |
Isomères du xylène seuls à 0, 450, 900 ou 1 800 ppm pendant 13 semaines (6 heures par jour, 5 jours par semaine) |
Réductions notables du potentiel évoqué auditif du tronc cérébral et du nombre de cellules ciliées de la cochlée observées à chaque intervalle de temps défini, notamment après une période de récupération de 8 semaines, chez les sujets exposés à 1 800 ppm de p‑xylène. Perte modérée de CCE remarquée chez le groupe exposé à 900 ppm de p-xylène, mais aucun impact constaté sur les seuils auditifs. Aucun effet observé dans le cas de l'o- ou du m-xylène, peu importe la concentration. |
DMENO (perte de cellules ciliées) : 900 ppm DSENO : 450 ppm |
Gagnaire et coll., 2007a |
Rats Sprague-Dawley mâles, 14 par groupe |
0, 250, 500, 1 000 ou 2 000 ppm de xylènes pendant 13 semaines (6 heures par jour, 6 jours par semaine) Mélange A : 20 % d'o-xylène, 20 % de p-xylène, 40 % de m-xylène, et 20 % d'éthylbenzène. Mélange B : 30 % d'o-xylène, 10 % de p-xylène, 50 % de m-xylène, et 10 % d'éthylbenzène. |
Aucun changement des seuils audiométriques noté chez les témoins ni chez les groupes exposés à 250 et 500 ppm. Changements des seuils observés chez les groupes exposés à des concentrations élevées; ont augmenté légèrement tout au long de l'exposition. Aucune récupération observée 8 semaines après la fin de l'exposition. Dans le cas du mélange A, après une période de récupération de 8 semaines, un animal du groupe exposé à 250 ppm et un du groupe exposé à 500 ppm avaient subi de graves pertes de CCE dans l'organe de Corti. Les animaux du groupe exposé à 1 000 ppm présentaient aussi une perte importante de CCE, et les animaux exposés à 2 000 ppm avaient perdu presque toutes leurs CCE et certaines cellules ciliées internes. Les dommages étaient moins étendus chez les animaux exposés au mélange B. |
DMENO (perte de cellules ciliées) : 250 ppm (concentration d'essai la plus faible). Aucune DSENO (perte de cellules ciliées) DMENO (perte auditive irréversible) : 1 000 ppm DSENO (perte auditive irréversible) : 500 ppm *Noter que le matériel de test contenait de l'éthylbenzène, une substance connue pour être ototoxique |
Maguin et coll., 2006 |
Rats Long-Evans mâles, 8 par groupe |
0 ou 1 800 ppm |
Quatre semaines après l'exposition, une modification permanente du seuil auditif et de graves pertes de CCE dans la cochlée ont été observées chez le groupe exposé au p-xylène, mais pas chez des animaux témoins ni chez les rats exposés à l'o- ou au m-xylène. |
DMENO (perte auditive) : 1 800 ppm (concentration d'essai la plus faible) Aucune DSENO |
Nylén et coll., 1989 |
Rats Sprague-Dawley mâles, 72 au total |
0 ou 1 000 ppm de xylène (isomère/ composition non précisée) pendant 61 jours (18 heures par jour, 7 jours par semaine) |
Aucun changement dans le pourcentage de spermatozoïdes intacts, le pourcentage de spermatozoïdes dotés de têtes et de flagelles normaux, le poids des testicules (2 ou 10 semaines après la fin de l'exposition), la testostérone plasmatique, le poids de la prostate ventrale, et la concentration de noradrénaline dans les canaux déférents (2 semaines après la fin de l'exposition). Trois rats exposés auraient été déclarés fertiles lors de tests 14 mois après la fin de l'exposition. |
DSENO (fertilité testiculaire des mâles) 1 000 ppm (concentration d'essai la plus élevée) (US EPA, 2003). |
Bio/dynamics Inc., 1983 (cité dans US EPA, 2003) |
Rats mâles et femelles |
500 ppm de xylène de qualité technique chez des rats exposés avant l'accouplement, durant la gestation et durant la lactation |
Aucune toxicité pour les parents, pour la reproduction ou pour le développement |
DSENO (toxicité pour les parents, pour la reproduction ou pour le développement) : 500 ppm (concentration d'essai la plus élevée) |
Hass et Jacobsen, 1993 |
72 rates Wistar gravides, 36 par groupe |
0 ou 200 ppm de xylène de qualité technique (composition non précisée), 6 heures par jour aux JG 6 à 20 |
Aucune toxicité maternelle observée chez les mères exposées. Chez les petits, incidence accrue de retard de l'ossification de l'os maxillaire dans le crâne. Augmentation du poids des petits (appréciable chez les mâles à la naissance, et tant chez les mâles que les femelles au jour 28, mais pas au jour 14). Ouverture des yeux et dépliement des oreilles survenant beaucoup plus tôt chez les petits exposés. Des diminutions importantes sur le plan statistique du rendement lors de tests de la tige tournante ont été observées chez des petits femelles lors du JPN 22 et du JPN 23 (mais pas lors du JPN 24), et chez des petits mâles lors du JPN 23 (mais pas lors des JPN 22 et 24). Aucune différence remarquée dans le temps nécessaire au développement du réflexe de redressement en fonction de la surface, du réflexe d'évitement de falaise, ou du réflexe de sursaut auditif. |
DSENO (toxicité maternelle) : 200 ppm (concentration d'essai la plus élevée) Aucune DMENO ou DSENO établie à l'égard de la toxicité pour le développement (par les auteurs de l'étude ou l'US EPA). Cependant, le RIVM (2001) a calculé une concentration tolérable dans l'air (CTA) en se fondant sur une DMENO de 200 ppm tirée de cette étude. |
Hass et coll., 1995; Hass et coll., 1997 |
28 rates gravides, 15 rates exposées et 13 témoins |
0 ou 500 ppm d'un mélange de xylènes (19 % o -xylène, 45 % m-xylène, 20 % p -xylène, et 15 % éthylbenzène), 6 heures par jour aux JG 7 à 20 |
Aucun effet sur les signes cliniques, le gain de poids corporel ou la consommation de nourriture des mères, ni sur la période de gestation, le nombre de petits par portée, et la répartition des sexes par portée. Les portées exposées présentaient une légère baisse du poids moyen à la naissance (5 %) et une tendance à la baisse du poids corporel après la naissance (non significatif). Réduction notable du poids absolu du cerveau chez les petits mâles et femelles combinés (JPN 28). Lors du test de la tige tournante (rats âgés de 24 à 26 jours), le pourcentage d'animaux incapables de rester sur la tige était plus élevé dans le cas des rats exposés durant les trois jours du test – différence la plus grande chez les femelles au jour 3 (non significatif sur le plan statistique.) Aucune différence entre les petits témoins et exposés concernant le réflexe de redressement en fonction de la surface et le réflexe de sursaut auditif; néanmoins, réflexe de redressement retardé d'une journée chez les petits exposés. Aucune différence notée lors d'un test de l'activité en enceinte expérimentale (à 27-34 jours de vie). Lors de tests d'apprentissage et de mémoire (labyrinthe aquatique de Morris; à 3 mois de vie), aucune différence dans le temps nécessaire pour trouver la plateforme entre les petits témoins et les petits exposés qui étaient placés dans un environnement « enrichi » (avec des jouets). Cependant, chez les petits exposés qui avaient été placés dans un environnement standard, tendance observée (non significatif sur le plan statistique) quant à une augmentation du temps requis pour trouver la plateforme durant la phase d'apprentissage du test. Lors d'un test subséquent où la plateforme avait été déplacée, importante différence de temps et hausse considérable du temps de nage chez les femelles exposées situées dans un environnement standard par comparaison aux témoins. Aucune différence dans la vitesse de nage. Différences notables observées à 16 et à 28 semaines, mais pas à 55 semaines (effet réversible). |
DSENO (toxicité maternelle) : 500 ppm (concentration d'essai la plus élevée) DMENO (toxicité pour le développement – réversible, labyrinthe aquatique) : 500 ppm (concentration d'essai la plus faible) Aucune DSENO |
Rosen et coll., 1986 |
Rates gravides, 18 à 21 par groupe |
0, 800 ou 1 600 ppm de p‑xylène aux JG 7 à 16 |
Réduction du gain de poids corporel des mères à 1 600 ppm, mais non à 800 ppm, par comparaison aux témoins. Aucun effet sur la taille des portées, le poids de naissance des petits, le poids des petits au JPN 3 ou le taux de croissance des petits. Aucune différence observée dans le réflexe de sursaut auditif (jours 13, 17, 21 et 63) ou dans le test du labyrinthe en 8 (jours 22 et 65). |
DMENO : 1 600 ppm (toxicité maternelle) DSENO : 800 ppm (toxicité maternelle) DSENO (toxicité pour le développement) : 1 600 ppm (concentration d'essai la plus élevée) |
Saillenfait et coll., 2003 |
Rates Sprague-Dawley gravides, groupes de 20 à 26 |
0, 100, 500, 1 000 ou 2 000 ppm d'o-, de m- ou de p‑xylène ou xylène de qualité technique aux JG 6 à 20 (6 heures par jour) |
Diminution du gain de poids maternel des mères à 1 000 ppm et du poids corporel des fœtus à 500 ppm ( o-xylène ou xylène de qualité technique) ou 1 000 ppm (m-, p‑xylène). Aucun changement notable dans le nombre moyen d'implantations et de fœtus vivants, dans l'incidence d'implantation de fœtus non vivants et de résorptions, ou dans le ratio sexuel des fœtus. Aucune malformation chez les petits, mais certains signes d'un retard de l'ossification ou une augmentation des variations squelettiques à 2 000 ppm. |
DMENO (toxicité maternelle) : 1 000 ppm DSENO : 500 ppm DMENO (toxicité pour le développement) : 500 ppm DSENO : 100 ppm |
Litton, 1978 (cité dans US EPA, 2003) |
Rates gravides |
400 ppm d'un mélange de xylènes aux JG 6 à 15 |
Aucune toxicité maternelle ou pour le développement |
DSENO (toxicité maternelle, pour le développement) : 400 ppm (concentration d'essai la plus élevée) |
Hudak et Ungváry, 1978 |
Rates CFY gravides, 20 exposées et 28 témoins |
230 ppm d'un mélange de xylènes (10 % o -xylène, 50 % m-xylène, 20 % p -xylène, 20 % éthylbenzène) aux JG 9 à 14 (24 heures par jour) |
Aucune toxicité maternelle ou pour le développement |
DSENO (toxicité maternelle, pour le développement) : 230 ppm (concentration d'essai la plus élevée) (US EPA, 2003) |
Ungváry et coll., 1980 |
Rates CFY gravides, 60 à 70 par groupe (60 témoins au total) |
0, 35, 350 ou 700 ppm o-, m- ou p-xylène 24 heures par jour aux JG 7 à 14 (24 heures par jour) |
Réduction du poids corporel des mères à 700 ppm d'o-xylène, de p-xylène ou de m-xylène 700 ppm de m-xylène : baisse légère, mais statistiquement significative du nombre moyen d'implantations par mère (les mères de ce groupe sont mortes) 700 ppm de p-xylène : perte post-implantation marquée et baisse correspondante de la taille moyenne des portées Réduction du poids corporel moyen des fœtus à 350 et 700 ppm d'o-xylène, à 700 ppm de m- ou p-xylène. |
DMENO (toxicité maternelle) : 700 ppm DSENO : 350 ppm DMENO (toxicité pour le développement) : 350 ppm DSENO : 35 ppm (US EPA, 2003) |
Ungváry et Tátrai, 1985 |
Rates CFY gravides, 20 à 23 par groupe |
0, 60, 440 ou 780 ppm de xylènes mélangés (composition non précisée) aux JG 7 à 15 (24 heures par jour) |
À 780 ppm, augmentation substantielle du pourcentage de fœtus morts ou résorbés |
DMENO (toxicité pour le développement) : 780 ppm DSENO : 440 ppm |
Ungváry et Tátrai, 1985 |
Lapines de Nouvelle-Zélande gravides, 9 ou 10 par groupe (60 témoins) |
0, 115 ou 230 ppm de xylènes mélangés (composition non précisée) ou isomères seuls aux JG 7 à 20 (24 heures par jour) |
À 230 ppm, grave toxicité maternelle et aucun fœtus vivant Aucune preuve de toxicité maternelle ou pour le développement à 115 ppm |
DMENO (toxicité maternelle, pour le développement) : 230 ppm DSENO : 115 ppm |
Ungváry et Tátrai, 1985 |
Souris CFLP gravides, 15 à 18 par groupe (115 témoins) |
0, 115 ou 230 ppm de xylènes mélangés (composition non précisée) ou isomères seuls aux JG 6 à 15 (3 x 4 heures par jour) |
Aucune preuve de toxicité maternelle ou pour le développement |
DSENO (toxicité maternelle, pour le développement) : 230 ppm (concentration d'essai la plus élevée) |
Annexe D : Autres lignes directrices
D1. Lignes directrices pour l'exposition de courte durée
Dans la Liste des substances d'intérêt prioritaire, rapport d'évaluation : xylènes , d'Environnement Canada et Santé Canada, aucune ligne directrice n'a été élaborée à l'égard de l'exposition de courte durée aux xylènes (Environnement Canada et Santé Canada, 1993).
La CalEPA (1999) a calculé une concentration de référence pour l'exposition aiguë (1 heure) de 22 mg/m3 en se basant sur une DSENO de 100 ppm (430 mg/m3) concernant l'irritation des yeux, du nez et de la gorge chez des volontaires exposés à des xylènes pendant 30 minutes (Nelson et coll., 1943; Hastings et coll., 1984; Carpenter et coll., 1975). La DSENO a été ajustée en fonction de la durée de l'exposition (de 30 minutes à 1 heure), et un facteur d'incertitude de 10 a été appliqué pour la variabilité intraspécifique.
La Commission européenne (2005) a retenu le même critère d'effet, le même ajustement en fonction de la durée et les mêmes facteurs d'incertitude que la CalEPA (1999), mais en raison d'une différence dans l'arrondissement, elle a établi une limite pour l'exposition de courte durée à 20 mg/m3.
Le NRC des États-Unis (2010) a établi une valeur limite pour l'exposition aiguë (AEGL-1) de 130 ppm (560 mg/m3) pour des effets non invalidants et une durée d'exposition de 10 minutes à 8 heures, qui repose sur l'irritation oculaire à 400 ppm chez l'humain après une exposition au xylène pendant 30 minutes (Hastings et coll., 1984). Un facteur d'incertitude de 3 a ensuite été appliqué pour prendre en compte la variabilité intraspécifique.
L'ATSDR (2007) a établi un niveau minimal de risque de 2 ppm (8,7 mg/m3) pour l'exposition aiguë (14 jours ou moins) qui repose sur une DMENO de 50 ppm pour les effets respiratoires et neurologiques (irritation des yeux, du nez et de la gorge; réduction de la CVF et difficultés à respirer; nausées, maux de tête, fatigue et étourdissements), laquelle est tirée d'une étude menée sur 56 volontaires exposés à du xylène pendant deux heures (Ernstgård et coll., 2002). Un FI total de 30 a ensuite été appliqué, soit 3 pour l'utilisation d'une DMENO et 10 pour la variabilité intraspécifique. L'ANSES (2020) a adopté le NRM de l'ATSDR comme valeur de référence pour la toxicité aiguë.
| Organisation | Limite d'exposition | Effet sur la santé |
|---|---|---|
CalEPA (2000) |
22 mg/m3 |
Irritation des yeux, du nez et de la gorge |
Union européenne (2005) |
20 mg/m3 |
Irritation des yeux, du nez et de la gorge |
NRC des É.-U. (2010) |
560 mg/m3 |
Irritation des yeux |
ATSDR (2007), ANSES (2020) |
8,7 mg/m3 (2 ppm) |
Effets neurologiques et respiratoires |
D2. Lignes directrices pour l'exposition chronique produisant des effets non néoplasiques
Des évaluations antérieures ont permis de fixer des limites d'exposition relatives à l'exposition chronique ou de longue durée aux xylènes reposant sur les symptômes neurotoxiques (anxiété, pertes de mémoire, sensation de flottement) et l'irritation des yeux, du nez et de la gorge chez les humains exposés dans un contexte professionnel, ou sur la toxicité pour le développement ou la neurotoxicité chez les rats.
L'ATSDR (2007) a déterminé un niveau de risque minimal pour l'exposition chronique de 220 mg/m3 en fonction de la DMENO de 14 ppm (61 mg/m3) chez les humains exposés dans un contexte professionnel établie par Uchida et coll. (1993). Un FI total de 300 a ensuite été appliqué, soit 10 pour les populations humaines sensibles, 10 pour l'utilisation d'une DMENO et 3 pour le manque d'études complémentaires sur la neurotoxicité découlant de l'exposition chronique.
La Commission européenne (2005) a déterminé une limite pour l'exposition chronique de 200 mg/m3 en se fondant sur la DMENO de 14 ppm (61 mg/m3) chez les humains exposés dans un contexte professionnel établie par Uchida et coll. (1993). La DMENO a été ajustée en fonction du temps d'exposition (quart de travail de 8 heures) et un FI total de 100 a été appliqué, soit 10 pour les populations humaines sensibles et 10 pour l'utilisation d'une DMENO.
L'US EPA (2003) a déterminé une CRf de 100 mg/m3 pour l'exposition par inhalation selon la DSENO de 50 ppm (217 mg/m3) tirée d'une étude de 13 semaines menée sur des rats (Korsak et coll., 1994). La DSENO a été ajustée en fonction d'une exposition continue (6 heures/24 heures et 5 jours/7 jours). Un FI total de 300 a été appliqué, soit 3 pour les différences interspécifiques, 10 pour les populations humaines sensibles, 3 pour l'utilisation d'une étude de toxicité subchronique, et 3 pour les lacunes dans la base de données. L'ANSES (2020) a adopté la CRf de l'US EPA comme valeur de référence pour la toxicité découlant de l'exposition chronique.
Le RIVM (2001) a établi une concentration tolérable dans l'air (CTA) de 870 mg/m3 en fonction de la DMENO de 200 ppm (870 mg/m3) tirée d'une étude sur la toxicité pour le développement chez les rats (Hass et Jakobsen, 1993). Un FI total de 1 000 a été appliqué, soit 10 pour l'extrapolation interspécifique, 10 pour les populations humaines sensibles, et 10 pour l'utilisation d'une DMENO.
La CalEPA (2000) a déterminé une concentration de référence de 700 mg/m3 pour l'exposition chronique en fonction de la DMENO de 14 ppm (61 mg/m3) chez les humains exposés dans un contexte professionnel établie par Uchida et al (1993), laquelle a été ajustée selon le temps d'exposition (quart de travail de 8 heures). Un FI total de 30 a été appliqué, soit 10 pour les populations humaines sensibles et 3 pour l'utilisation d'une DMENO.
Le gouvernement du Canada (Santé Canada, 1996) a établi une concentration tolérable provisoire de 180 mg/m3 en fonction de la DMEO de 58 ppm (250 mg/m3) tirée d'une étude sur le développement des rats (Ungváry et Tátrai, 1985), concentration qui a été ajustée pour tenir compte des différences de volumes d'inhalation et de poids corporel entre le rat et l'humain. Un FI total de 1 000 a été appliqué, soit 10 pour l'extrapolation interspécifique, 10 pour les populations humaines sensibles, et 10 pour l'utilisation d'une DMEO et les limites de l'étude.
| Organisation | Limite d'exposition | Effets sur la santé |
|---|---|---|
| ATSDR, 2007 | 220 µg/m3 | Symptômes de neurotoxicité (anxiété, pertes de mémoire, sensation de flottement) et irritation des yeux, du nez et de la gorge |
| Commission européenne, 2005 | 200 µg/m3 | Irritation des yeux, maux de gorge, sensation de flottement et perte d'appétit |
| US EPA, 2003; ANSES, 2020 | 100 µg/m3 | Altération de la coordination motrice |
| RIVM, 2001 | 870 µg/m3 | Neurotoxicité pour le développement |
| CalEPA, 2000 | 700 µg/m3 | Symptômes de neurotoxicité (anxiété, pertes de mémoire, sensation de flottement) et irritation des yeux, du nez et de la gorge |
| Santé Canada et Environnement Canada, 1993 | 180 µg/m3 | Toxicité pour le développement |
Notes de bas de page
- Note de bas de page 1
-
Les rapports et publications découlant de ces études montrent les données du m- et p-xylène ensemble et celles de l'o-xylène séparément. D'autres analyses ont été faites pour générer des statistiques sommaires sur la somme des trois isomères.