Proposition de frais révisée pour les médicaments et les instruments médicaux
Le 24 mai 2018
Table des matières
- Sommaire
- Section I : Introduction
- Section II : Processus de consultation
- Section III : Réponse de Santé Canada
- Section IV : Processus de rétroaction
- Conclusion
- Annexe A : Résumé des frais révisés
- Annexe B : Liste des activités de mobilisation des intervenants et participants
- Annexe C : Sommaire des commentaires reçus par secteur
- Annexe D : Évaluation des répercussions du recouvrement des coûts
- Annexe E : Frais et normes de service pour les médicaments et les instruments médicaux (2019)
Sommaire
Santé Canada est l’organisme de réglementation responsable d’aider les Canadiens à maintenir et à améliorer leur santé. En tant qu’organisme de réglementation des médicaments pour usage humain, des médicaments vétérinaires et des instruments médicaux, Santé Canada effectue des évaluations scientifiques des produits avant que la vente en soit autorisée, surveille ces produits lorsqu’ils sont accessibles à la population canadienne, vérifie la conformité et prend des mesures en cas de non-conformité, comme des inspections. Vers le milieu des années 1990, Santé Canada a introduit des frais pour les activités de réglementation qui sont facturés à l’industrie. La pratique de facturer des frais pour ces activités est conforme aux pratiques d’autres organismes de réglementation à l’échelle internationale.
Dans le budget de 2017, le gouvernement du Canada s’est engagé à respecter son approche en matière de frais et a indiqué que « les entreprises devraient payer leur juste part pour les services que le gouvernement fournit. » Entre octobre 2017 et janvier 2018, Santé Canada a organisé des consultations officielles sur la Proposition de frais pour les médicaments et les instruments médicaux (Proposition de frais) qui visaient à mettre à jour les frais de réglementation pour les médicaments pour usage humain, les instruments médicaux et les médicaments vétérinaires de manière à tenir compte des coûts actuels. Les intervenants ont participé activement au processus de consultation. Les principales inquiétudes soulevées ont été notamment l’ampleur de l’augmentation des frais, le fait que la mise en application ne soit pas échelonnée et l’approche proposée pour les petites entreprises. Les commentaires reçus par Santé Canada ont été essentiels pour élaborer les modifications suivantes de la Proposition de frais (Voir l’Annexe A pour un résumé de toutes les modifications) :
- Établir le ratio d’établissement des frais à 75 % des coûts pour les frais préalables à la mise en marché pour les médicaments et les instruments médicaux (50 % pour les médicaments vétérinaires) et à 67 % pour les frais liés au droit de vente;
- Introduire une période de mise en œuvre progressive sur quatre ans (sept ans pour les frais préalables à la mise en marché pour les médicaments vétérinaires) avec une augmentation annuelle maximale de 25 % pour les frais préalables à la mise en marché et les frais de licence d’établissement et de 50 % pour les frais liés au droit de vente;
- Un allègement élargi des frais pour les petites entreprises, y compris des exonérations accordées aux petites entreprises pour les frais préalables à la mise en marché (50 %) et les frais liés au droit de vente et les frais de licence d’établissement (25 %);
- Mesures d’atténuation élargies relativement à l’annulation des frais pour tous les établissements de soins de santé subventionnés par l’État.
Pour apporter ces modifications, Santé Canada a utilisé cinq principes directeurs :
- Agir de manière raisonnable et équitable
- Réduire les incidences sur les petites entreprises
- Prendre les mesures d’atténuation et appliquer les exonérations des frais pertinentes
- Augmenter les frais de manière progressive et prévisible
- Assurer la responsabilisation
Pour démontrer son engagement envers l’ouverture et la transparence, Santé Canada donne aux intervenants une dernière possibilité de soulever des préoccupations pendant le processus de rétroaction qui aura lieu en juin 2018.
Section I : Introduction
Santé Canada a adopté des frais pour les services de réglementation vers le milieu des années 1990 pour recouvrir partiellement les coûts liés aux activités de réglementation. En 2011, Santé Canada a mis à jour les frais pour les médicaments pour usage humain et les instruments médicaux. Toutefois, les frais pour les médicaments vétérinaires n’ont pas été mis à jour depuis leur adoption.
Dans le budget de 2017, la ministre de la Santé a obtenu les autorisations de fixer des frais par décret ministériel en vertu de la Loi sur les aliments et drogues. Il s’agit de pouvoirs administratifs qui sont simplement un autre mécanisme réglementaire qui permet d’établir ou de modifier des frais. Santé Canada exerce actuellement ces nouveaux pouvoirs permettant de modifier les frais pour les médicaments pour usage humain, les médicaments vétérinaires et les instruments médicaux. La présente proposition ne vise pas les frais pour les aliments et les produits de santé naturels pour usage humain.
Les frais révisés sont classés dans trois catégories de frais :
- Présentation préalable à la mise en marché / frais d’évaluation des demandes
- Frais de licence d’établissement
- Droit de vente
D'autres juridictions, y compris les États-Unis, l’Australie et l’Europe, facturent des frais pour les services de réglementation pour les médicaments et les instruments médicaux. Compte tenu de la rentabilité de l’industrie et de la valeur des services de réglementation, certains pays ont établi des frais correspondant à 90-100 % des coûts et mettent à jour régulièrement les frais.
Les frais existants de Santé Canada ne reflètent pas les coûts actuels liés à la prestation des programmes de réglementation. De nombreux médicaments et instruments médicaux passent par divers processus complexes en franchissant de multiples étapes de chaînes d’approvisionnement avant d’atteindre le Canada. Ces réalités mondiales ont fondamentalement modifié l’environnement de réglementation de ces produits, accru la complexité des efforts de réglementation et créé de nouveaux défis réglementaires pour Santé Canada. Santé Canada doit s’adapter à ces changements pour s’assurer d’effectuer ses activités de réglementation de manière efficace et efficiente. Au cours de la dernière décennie, le nombre de produits importés au Canada a dépassé de manière considérable la croissance de la production à l’échelle nationale, ce qui expose les Canadiens à des plus grands risques en raison des produits contrefaits ou contaminés et des produits fabriqués dans des pays où la surveillance réglementaire est réduite ou le régime de réglementation est moins développé.
Santé Canada est confronté à une augmentation du volume de travail et, de surcroît, à une complexité croissante en raison des progrès technologiques et des données et systèmes plus sophistiqués. Même si Santé Canada est demeuré concurrentiel à l’échelle internationale lorsqu’il s’agit de respecter les normes de rendement, cette situation a fait augmenter les coûts des activités et exerce des pressions sur le système de réglementation.
Section II : Processus de consultation
En avril 2017, Santé Canada a communiqué son intention de mettre à jour les frais et a lancé un processus de mobilisation auprès des intervenants. Les associations de l’industrie de différents secteurs (par exemple, instruments médicaux, désinfectants, médicaments génériques, médicaments novateurs, médicaments biologiques, médicaments en vente libre, médicaments radio-pharmaceutiques et médicaments vétérinaires) et un certain nombre d’entreprises ont participé.
Santé Canada a officiellement lancé sa consultation publique avec la publication de la Proposition de frais pour les médicaments et les instruments médicaux (Proposition de frais), le 11 octobre 2017. La consultation a pris fin le 4 janvier 2018. En plus de publier la Proposition de frais sur le site Web de Santé Canada, Santé Canada a publié un Document d’accompagnement de l’établissement des coûts et a rencontré les associations et des entreprises et a organisé des séances visant des secteurs précis avec les associations de l’industrie pour discuter davantage les questions et les commentaires sur la Proposition de frais. Vous trouverez une liste des activités de mobilisation à l’Annexe B. Vous trouverez un résumé des commentaires formulés pendant ces séances et la consultation à l’Annexe C.
Résultats de la consultation et réponses
Généralement, les intervenants ont appuyé la révision et la mise à jour des frais. Les commentaires reçus ont été regroupés selon six thèmes clés :
- Établissement des frais
- Établissement des coûts
- Rajustement annuel des frais
- Petites entreprises et mesures d’atténuation
- Normes de rendement et disposition relative aux pénalités
- Calendrier de paiement des frais
On a aussi reçu des commentaires sur des catégories de frais précises qui ont été pris en considération.
Section III : Réponse de Santé Canada
Après avoir analysé tous les commentaires formulés par les intervenants, Santé Canada a préparé des réponses et des révisions pour la Proposition de frais en utilisant les cinq principes directeurs suivants :
Agir de manière raisonnable et équitable : puisque les entreprises devraient payer leur juste part et pour réduire le fardeau des contribuables, Santé Canada a établi des frais raisonnables qui sont mis en œuvre de façon progressive
Réduire les incidences sur les petites entreprises : les frais ne doivent pas empêcher les petites entreprises de faire affaire au Canada
Prendre des mesures d’atténuation et appliquer les exonérations des frais pertinentes : il est nécessaire de réduire ou d’annuler les frais dans des circonstances particulières pour appuyer le système de soins de santé
Augmenter les frais de manière progressive et prévisible : les frais sont échelonnés sur un certain nombre d’années
Assurer la responsabilisation : agir de manière transparente et responsable avec les intervenants au moyen de rapports annuels et d’un engagement annuel est la clé pour élaborer une structure de frais agile et souple.
Les sous-sections suivantes résument selon les thèmes les éléments de la Proposition de frais d’octobre 2017, les réactions des intervenants et les réponses de Santé Canada. L’Annexe E indique en détail les frais révisés, les normes de rendement et les processus liés aux frais.
Établissement des frais
| Thème | Actuels | Proposition d’octobre 2017 | Révisée en mai 2018 |
|---|---|---|---|
| Ratios d’établissement des frais | Frais établis à 40 %-100 % des coûts (de 2007 pour les médicaments et les instruments et de 1995 pour les médicaments vétérinaires) | Évaluation préalable à la mise en marché Médicaments / instruments : 90 % Médicaments vétérinaires : 75 % année 1, 90 % année 2 Droit de vente : 90 % pour tous les produits Frais de licence d’établissement : 100 %; un frais unique par établissement qu’il s’agisse d’activités visant des médicaments pour usage humain ou des médicaments vétérinaires |
Évaluation préalable à la mise en marché Médicaments / instruments : 75 % Médicaments vétérinaires : 50 % Droit de vente : 67 % pour tous les produits Droit de vente de médicaments : trois catégories de frais : médicaments sur ordonnance, médicaments en vente libre, désinfectants Frais de licence d’établissement : Aucun changement par rapport à la Proposition d’octobre |
| Calendrier de mise en œuvre | S.O. | Immédiat | Mise en œuvre progressive sur quatre ans (sept ans pour les frais préalables à la mise en marché pour les médicaments vétérinaires) avec une augmentation annuelle maximale de 25 % pour les frais préalables à la mise en marché et les frais de licence d’établissement en toute année et de 50 % pour les frais liés au droit de vente en toute année (sauf les rajustements en fonction de l’Indice des prix à la consommation) |
Ce que nous avons entendu
En règle générale, les intervenants ont convenu que Santé Canada doit mettre à jour les frais et ont admis que les frais actuels sont désuets. Toutefois, un grand nombre d’intervenants ont considéré que l’augmentation des frais était excessive et étaient préoccupés de l’incidence négative que cette augmentation pourrait avoir sur la croissance financière des entreprises, surtout l’augmentation des frais pour le droit de vente de médicaments. Les intervenants ont recommandé que Santé Canada continue d’utiliser les mêmes ratios d’établissement des frais ou utilise une approche progressive ou échelonnée pour la modification des frais pour permettre à l’industrie de s’adapter aux augmentations ou établisse des frais en fonction de la taille du marché canadien.
Réponse
Dans le budget de 2017, le gouvernement du Canada s’est engagé à moderniser les frais pour les entreprises, affirmant que « les entreprises devraient payer leur juste part pour les services que le gouvernement fournit. » Santé Canada affirme que l’industrie doit payer des frais en fonction des coûts engagés par Santé Canada pour fournir des services de réglementation et non en fonction de la taille du marché canadien, et que les frais ne seront pas supérieurs aux coûts conformément à la Loi sur les aliments et drogues.Note de bas de page 1
Santé Canada est conscient que l’augmentation des frais a des incidences sur l’industrie. Pour répondre à cette préoccupation, Santé Canada propose une mise en œuvre progressive des frais révisés sur plusieurs années et des ratios d’établissement des frais révisés pour la plupart des catégories de frais. Les changements apportés aux ratios d’établissement des frais devraient répondre aux préoccupations des intervenants au sujet de l’augmentation des frais, surtout pour les médicaments vétérinaires, puisque les frais pour les médicaments vétérinaires n’ont pas été mis à jour depuis l’adoption au milieu des années 1990.
Pour répondre aux préoccupations des intervenants au sujet du niveau d’effort nécessaire pour les activités prévues pour les frais liés au droit de vente de médicaments, Santé Canada a établi des frais liés au droit de vente de médicaments à différents niveaux qui tiennent compte du niveau d’effort plus bas pour les désinfectants et les produits en vente libre par rapport aux médicaments sur ordonnance. Toutefois, après avoir recalculé les frais, ceux-ci étaient plus élevés par rapport aux frais proposés initialement pour les médicaments sur ordonnance. En raison des consultations initiales sur les frais proposés de 4 587 $, Santé Canada a décidé de maintenir ces frais pour les médicaments sur ordonnances même si le coût unitaire révisé était plus élevé. Ces changements ont donné un ratio d’établissement des frais correspondant à 67 % des coûts. Ce ratio a été appliqué aux autres frais liés au droit de vente, y compris pour les instruments médicaux et les médicaments vétérinaires. Santé Canada prévoit adopter un ratio d’établissement des frais de 75 % lorsque les frais seront mis à jour la prochaine fois.
Pour répondre aux préoccupations au sujet de la prévisibilité et de l’incidence des frais révisés, Santé Canada échelonnera progressivement les frais sur plusieurs années pour donner à l’industrie plus de temps pour s’adapter et pour modifier ses plans d’affaires et ses budgets en conséquence.Note de bas de page 2 Santé Canada s’est assuré d’une augmentation annuelle maximale de 25 % par année pour les frais d’évaluation préalables à la mise en marché et les frais de licence d’établissement et de 50 % par année pour les frais liés au droit de vente.
Cadre de référence pour les produits d’auto-soins :
Les intervenants des secteurs des médicaments en vente libre et des cosmétiques ont demandé de ne pas réviser les frais pour leurs produits (y compris, le dentifrice, le rince-bouche, le nettoyant antiseptique pour la peau, les crèmes solaires secondaires et le shampooing antipelliculaire) avant la mise en œuvre du nouveau Cadre de référence pour les produits d’auto-soins. Santé Canada admet que ces produits présentent moins de risques et que les activités de surveillance doivent être proportionnées en fonction de leur risque global. Les frais actuels visent les coûts liés à la réalisation du programme de réglementation actuel. Au fur et à mesure que le Cadre de référence pour les produits d’auto-soins, sera élaboré et mis en œuvre, les frais connexes seront révisés de manière à correspondre aux coûts liés à la réalisation du nouveau programme.
Établissement des coûts
Ce que nous avons entendu
Plusieurs intervenants ont exprimé des préoccupations au sujet de la méthodologie d’établissement des coûts et d’un manque perçu de transparence de Santé Canada. Les intervenants ont déclaré qu’ils veulent plus de clarté relativement à la méthodologie d’établissement des coûts (surtout pour certains secteurs) et veulent s’assurer qu’ils ne subventionnent pas de manière indirecte d’autres secteurs et catégories de frais.
Réponse
Santé Canada a mis à jour ses frais pour les médicaments pour usage humain et les instruments médicaux en 2011; les frais pour les médicaments vétérinaires ont été établis entre 1995 et 1998 et n’ont pas été mis à jour depuis ce temps. Les frais actuels ne correspondent pas aux coûts actuels engagés pour fournir des services de réglementation. Pour déterminer les frais révisés, Santé Canada a utilisé les Lignes directrices sur l’établissement des coûtsNote de bas de page 3 du Secrétariat du Conseil du Trésor et les coûts se fondent sur les données de 2014-2017. Les données ont été obtenues au moyen d’un système de saisie du temps qui détermine le niveau d’effort nécessaire pour chaque activité, y compris le temps nécessaire pour examiner les présentations et les demandes. Les frais ont été établis en se fondant sur le coût pour réaliser les programmes de réglementation actuels. Santé Canada a élaboré et publié un Document d’accompagnement de l’établissement des coûts qui indique la méthodologie détaillée pour établir les frais et les coûts détaillés.
Conformément au principe de responsabilisation, Santé Canada démontre son engagement envers la transparence et, à l’avenir, les renseignements sur les coûts seront communiqués chaque année aux intervenants.
Rajustement annuel des frais
| Thème | Actuels | Proposition d’octobre 2017 | Révisée en mai 2018 |
|---|---|---|---|
| Rajustements annuels des frais | 2 % par année | Rajustement annuel des frais en fonction de l’Indice des prix à la consommation (IPC) de l’année précédente | Aucun changement par rapport à la proposition d’octobre |
Ce que nous avons entendu
Les intervenants ont généralement appuyé l’approche de Santé Canada aux rajustements annuels des frais en fonction de l’Indice des prix à la consommation. Toutefois, certains intervenants ont souligné que, si on utilise l’Indice des prix à la consommation, il est plus difficile de prévoir les frais lors de l’établissement du budget et d’autres intervenants ont indiqué que cette nouvelle approche n’indique pas clairement quand et comment l’industrie sera informée de ces rajustements annuels. Ils ont recommandé que Santé Canada donne un avis d’au moins 12 mois.
Certains intervenants ont posé la question de savoir comment Santé Canada exercera les nouveaux pouvoirs en matière d’établissement des frais et ont suggéré qu’il faudrait obtenir l’autorisation du Parlement pour modifier les frais.
Réponse
Les rajustements annuels en fonction de l’Indice des prix à la consommation sont en harmonie avec l’approche de la Loi sur les frais de service. Santé Canada publiera les rajustements des frais chaque novembre en vue de donner aux intervenants un avis de quatre ou cinq mois pour leur permettre de déterminer le montant exact de l’augmentation chaque année. Le taux d’augmentation sera disponible sur le site Web de Statistique Canada avant la publication du montant des frais et les entreprises seront en mesure d’évaluer les frais et de planifier en conséquence.
Indépendamment des mises à jour en fonction de l’Indice des prix à la consommation, la possibilité que Santé Canada puisse établir et mettre à jour les frais en temps opportun est un avantage. Le rajustement des frais (diminution et augmentation) est un élément clé pour le succès du programme et permet de s’assurer que les frais sont à jour et correspondent aux coûts. Santé Canada s’engage à améliorer l’efficacité du programme et à s’assurer que son programme de réglementation est agile et adapté aux changements. Les documents d’orientation qui expliquent en détail le processus de rajustement annuel des frais seront mis à jour et distribués aux intervenants. Vous trouverez d’autres détails à l’Annexe E.
Par suite de la nouvelle Loi sur les frais de service, le dépôt des propositions de frais au Parlement n’est plus un élément normalisé du processus pour tous les ministères. Santé Canada a obtenu une exemption de l’application de la Loi sur les frais de service, toutefois, le Ministère s’engage à assurer la responsabilisation et la transparence. Santé Canada organisera des réunions avec les intervenants chaque année pour examiner les frais et les normes de service. Les changements réglementaires des frais seront effectués probablement selon un cycle de deux à trois ans.
Petites entreprises et mesures d’atténuation
| Thème | Actuels | Proposition d’octobre 2017 | Révisée en mai 2018 |
|---|---|---|---|
| Petites entreprises | Frais annulés en fonction des ventes par produit, frais reportés pour la première année en affaires | Utiliser la définition de « petite entreprise » du Secrétariat du Conseil du TrésorNote de bas de page 4 « Toute entreprise, y compris ses filiales, qui compte moins de 100 employés ou dont les revenus bruts annuels vont de 30 000 $ à 5 millions de dollars » : les nouvelles sociétés qui correspondent à cette définition seront admissibles à l’évaluation gratuite de leur première présentation préalable à la mise en marché si les frais sont supérieurs à 10 000 $ – cette mesure ne s’applique qu’une seule fois | Utiliser la définition de « petite entreprise » du Secrétariat du Conseil du Trésor : Frais annulés pour la première présentation préalable à la mise en marché indépendamment du montant des frais Remise de 50 % pour tous les frais d’évaluation préalable à la mise en marché Remise de 25 % pour tous les frais liés au droit de vente Remise de 25 % pour tous les frais de licence d’établissement |
| Atténuation des frais | Frais annulés en fonction des ventes par produit, frais reportés pour la première année en affaires | Frais annulés pour la première présentation de médicaments préalable à la mise en marché pour un médicament sur la Liste des médicaments pour un besoin urgent en matière de santé publique conformément à la Réglementation visant l’accès à des drogues dans des circonstances exceptionnelles Élimination du report des frais |
En plus de la proposition d’octobre : Frais annulés pour les établissements de soins de santé subventionnés par l’État Frais de licence d’établissement de médicaments au prorata par trimestre pour une nouvelle demande |
Ce que nous avons entendu
La plupart des participants ont accueilli favorablement le point de vue de Santé Canada qui tient compte des besoins des petites entreprises. Toutefois, les intervenants ont mis en évidence que la proposition se concentrait uniquement sur les nouvelles petites entreprises. En outre, certains intervenants ont dit que la définition de « petite entreprise » du Secrétariat du Conseil du Trésor ne tient pas compte de certaines structures organisationnelles particulières telles que les universités ou les établissements de soins de santé.
Les intervenants des secteurs des instruments médicaux, des médicaments radio-pharmaceutiques et des médicaments vétérinaires ont exprimé des préoccupations au sujet des conséquences découlant de l’élimination des mesures d’atténuation actuelles et des nouvelles mesures d’atténuation limitées. Certains intervenants ont indiqué que l’élimination des mesures d’atténuation actuelles peut avoir des incidences négatives sur les produits qui ont un bas volume de vente et qui visent des marchés à créneaux et ont proposé de maintenir les pratiques actuelles. Certains intervenants ont dit qu’ils doivent payer les frais de licence d’établissement pour une année même s’ils ne reçoivent pas la première licence pour toute l’année.
Réponse
Petites entreprises :
Santé Canada reconnaît qu’il est nécessaire de réduire l’incidence des frais sur les petites entreprises et a révisé sa stratégie pour les petites entreprises de manière à offrir des mesures d’atténuation pour les activités préalables à la mise en marché et après la mise en marché aux entreprises qui correspondent à la définition du Secrétariat du Conseil du Trésor. Santé Canada prévoit qu’un nombre considérable d’entreprises sera admissible à l’aide pour les petites entreprises.
Mesures d’atténuation supplémentaires :
En plus des mesures d’atténuation qui permettent d’avoir un accès continu à certains médicaments pour un besoin urgent en matière de santé publique, Santé Canada prendra les mesures suivantes :
- Les intervenants du secteur des médicaments radio-pharmaceutiques ont dit que les frais proposés peuvent avoir une incidence considérable et être un lourd fardeau pour les installations de soins de santé subventionnées par l’État. Santé Canada répond à ces préoccupations en annulant tous les frais pour les installations de soins de santé subventionnées par l’État.
- Relativement aux frais de licence d’établissement de médicaments, les nouveaux demandeurs payeront les frais au prorata pour la partie de l’exercice financier du gouvernement du Canada pour laquelle ils présentent une demande. Lors du renouvellement de la licence pour les années suivantes, tous les frais applicables seront facturés.
Normes de rendement et disposition relative aux pénalités
| Thème | Actuels | Proposition d’octobre 2017 | Révisée en mai 2018 |
|---|---|---|---|
| Disposition relative aux pénalités | Si le rendement moyen dépasse les normes de rendement de 10 % ou plus, le frais est réduit l’année suivante | Une présentation individuelle qui dépasse la norme de rendement reçoit une remise de 25 %. Une disposition « arrêt du temps » aux fins de la norme de rendement de manière à limiter le temps consacré par Santé Canada à la présentation | Aucun changement par rapport à la proposition d’octobre |
| Normes de rendement | Tous les frais existants comportent une norme de rendement | Toutes les normes existantes demeurent inchangées, sauf :
Une norme de service est proposée pour chaque nouvelle catégorie de frais |
Aucun changement par rapport à la proposition d’octobre, sauf Désinfectants – étiquetage seulement (90 jours) |
Ce que nous avons entendu
En général, les intervenants ont soulevé peu de questions et de préoccupations sur les normes de rendement de Santé Canada, à l’exception de certains intervenants du secteur des désinfectants qui ont contesté les modifications proposées pour les normes de rendement pour certaines présentations. En général, les intervenants ont appuyé la disposition relative aux pénalités proposée. Certains intervenants ont proposé que Santé Canada mette en place une échelle mobile prévoyant l’augmentation des pénalités si la norme de rendement n’est pas respectée en fonction de la longueur du délai et ont souligné que ces mesures permettront de s’assurer que les examens sont effectués le plus rapidement possible même si la norme n’est pas respectée. Les méthodes utilisées pour déterminer les pénalités pour les examens conjoints avec d’autres organismes de réglementation étrangers a été un autre point mis en évidence par les intervenants.
En outre, certains intervenants ont demandé des précisions sur les modifications proposées aux normes de rendement et des détails sur la politique « arrêt du temps » proposée. Les intervenants de tous les secteurs ont recommandé que Santé Canada communique avec les intervenants pour l’élaboration de la politique « arrêt du temps » et permette de formuler des commentaires pour s’assurer que la politique est constructive et transparente.
Réponse
Santé Canada confirme que les normes de rendement proposées sont pertinentes et comparables sur le plan international. Santé Canada admet que le délai pour obtenir l’approbation est un paramètre important pour l’industrie et les Canadiens, toutefois, l’examen des présentations des produits pour l’évaluation préalable à la mise en marché (soit, l’examen 1) est la norme qui sera utilisée pour mesurer la responsabilité et déterminer les pénalités financières. Cette pratique est en harmonie avec les organismes de réglementation étrangers et permet à Santé Canada de continuer d’évaluer si son rendement est comparable à l’échelle internationale. Santé Canada continuera d’évaluer si d’autres paramètres doivent être adoptés pour renforcer et améliorer davantage les rapports et les analyses du rendement.
Pour répondre aux préoccupations des intervenants du secteur des désinfectants et tenir compte du niveau d’effort différent nécessaire pour examiner les présentations de désinfectants (étiquetage seulement), Santé Canada propose une norme de service de 90 jours par rapport aux 120 jours indiqués dans la proposition d’octobre.
Compte tenu de l’appui général à la disposition relative aux pénalités, Santé Canada n’apporte aucun changement à la proposition originale et s’engage à fournir des services concurrentiels et fiables. Compte tenu du fait que la responsabilité demeure même si une norme n’a pas été respectée, Santé Canada continuera de communiquer les données pour assurer la transparence et la responsabilisation relativement aux normes de présentation. Le non-respect des normes de rendement pour les demandes d’examen conjoint et d’examen parallèle avec d’autres organismes de réglementation étrangers ne donnera pas lieu à des pénalités. En outre, les demandes pour les instruments médicaux mixtesNote de bas de page 5 ne feront pas l’objet de pénalités. D’autres renseignements sur la détermination des pénalités sont indiqués à l’Annexe E et seront expliqués en détail dans les documents d’orientation mis à jour.
Santé Canada élaborera des politiques et mettra à jour les documents d’orientation sur la disposition « temps de pause ».Note de bas de page 6 Santé Canada convient que les intervenants devraient participer à l’élaboration et à la mise en œuvre de ce nouveau mécanisme. Des consultations distinctes sur les initiatives visant la disposition « temps de pause » seront organisées en 2018-2019.
Calendrier de paiement des frais
| Thème | Actuels | Proposition d’octobre 2017 | Révisée en mai 2018 |
|---|---|---|---|
| Calendrier de paiement des frais | Pour certains frais préalables à la mise en marché 75 % des frais sont perçus avant l’examen et 25 % après la décision | Tous les frais préalables à la mise en marché perçus à l’avance | Aucun changement par rapport à la proposition d’octobre |
Ce que nous avons entendu
Certains intervenants ont souligné qu’il faudrait maintenir le modèle de paiements échelonnés pour les frais d’évaluation actuel, puisque payer tous les frais à l’avance peut créer des obstacles pour le développement des produits, puisque les entreprises établissent le budget en fonction du paiement des frais sur deux exercices financiers.
Réponse
Dans le système actuel, la plupart des frais sont perçus avant l'examen d'une présentation de médicament. Modifier le calendrier de paiement simplifie le processus de facturation et est en harmonie avec les pratiques des organismes de réglementation étrangers. Par exemple, aux États-Unis une présentation n'est pas admissible à l'examen si les frais n'ont pas été payés. Santé Canada n'apporte aucun changement à sa proposition originale.
Modification des frais précis
En plus des commentaires reçus sur les éléments applicables à tous les frais comme susmentionné, les intervenants ont formulé des commentaires sur des frais précis indiqués dans la proposition. Vous trouverez ci-après les commentaires et les réponses de Santé Canada.
Frais d'évaluation – ce que nous avons entendu et réponse
Mises à jour des mentions relatives à l'innocuité sur l'étiquetage :
Certains intervenants ont contesté les frais proposés pour les mises à jour des mentions relative à l'innocuité sur l'étiquetage en mettant en évidence qu'ils ne devraient pas être tenus de payer si Santé Canada demande de déposer une présentation. Santé Canada peut, dans certains cas, demander de déposer une présentation pour régler des problèmes liés à l'innocuité, toutefois, le promoteur doit s'assurer que le produit est conforme aux exigences réglementaires, surtout en cas de nouveaux renseignements sur l'innocuité, indépendamment de l'origine des données. Les mises à jour sur l'innocuité des médicaments du Titre 1 continueront de respecter les exigences énoncées dans le document d'orientation sur les changements à l'identification numérique des médicaments.
Mises à jour des mentions relatives à l'innocuité pour les désinfectants :
Les mises à jour des mentions relatives à l'innocuité pour les désinfectants pour les produits relevant du Titre 8 seront ajoutées à la catégorie de frais « Désinfectants (étiquetage seulement) » et non à la catégorie de frais « données cliniques ou non cliniques seulement, à l'appui des mises à jour des mentions d'innocuité sur l'étiquetage » et les frais sont identiques. La redéfinition de la catégorie de frais tient compte de la charge de travail connexe et permet d'établir des frais qui sont en harmonie avec le niveau d'effort nécessaire pour ces présentations.
Frais de la catégorie données publiées seulement :
Certains intervenants du secteur pharmaceutique ont contesté l'élimination des frais de la catégorie Données publiées seulement. Santé Canada confirme que, en raison de la charge de travail et du niveau d'effort et des méthodes utilisées pour classer et traiter certaines présentations concernant les données publiées, il est approprié de regrouper ces présentations dans d'autres catégories de frais en fonction des données présentées.
Présentations multiples pour des médicaments biosimilaires :
Les intervenants du secteur des médicaments biosimilaires ont mis en évidence l'incidence cumulative découlant du fait de déposer plusieurs présentations de nouveaux médicaments avec des indications différentes pour un seul médicament biosimilaire et ont contesté l'établissement des coûts pour l'examen de ces présentations qui se chevauchent. Lorsque des entreprises prennent la décision de déposer plusieurs présentations simultanément pour gérer des questions relatives aux brevets pour des médicaments biosimilaires ou d'autres produits, le coût de l'examen n'est pas nécessairement inférieur pour Santé Canada. Certaines données contenues dans différentes présentations peuvent être identiques, toutefois, l'objectif de chaque présentation est différent et les présentations doivent être examinées en conséquence. Des présentations multiples qui se chevauchent nécessitent plus d'efforts relativement à la correspondance, au traitement des données et à l'harmonisation de l'étiquetage Approuvé.
Médicaments vétérinaires à utilisations mineures et pour espèces mineures :
Pour se conformer aux régimes de réglementation d'autres pays, les intervenants du secteur des médicaments vétérinaires ont demandé des frais et des mesures de stimulation précis pour les produits à utilisations mineures et pour espèces mineures. Santé Canada examinera les structures de frais pour les médicaments vétérinaires et communiquera avec les intervenants à partir de 2019 en vue d'élaborer une structure révisée.
Frais de licence d'établissement – ce que nous avons entendu et réponse
Les intervenants ont posé la question de savoir pourquoi les frais de licence d'établissement de médicaments ont été calculés en utilisant les coûts moyens lorsque le niveau d'effort dans l'ensemble des secteurs n'est pas uniforme, ce qui donne lieu à des subventions indirectes.
La Proposition de frais ne traite pas les types de produits (par exemple, médicaments sur ordonnance et en vente libre) différemment pour le calcul des frais de licence d'établissement de médicaments. Le même cadre réglementaire s'applique à chaque installation en fonction des activités les plus en amont, indépendamment du type de produit traité dans l'installation. Les frais de licence d'établissement de médicaments ont été calculés par installation en utilisant le niveau d'effort relatif nécessaire pour inspecter chaque type d'installation. Les coûts du programme ont été répartis entre les installations en fonction du type d'activité. Les preuves relativement aux coûts liés à la surveillance réglementaire et à l'historique de conformité pour chaque produit confirment cette approche.
Frais liés au droit de vente – ce que nous avons entendu et réponse
Droit de vente de médicaments génériques :
Les intervenants du secteur des médicaments génériques ont mis en évidence l'incidence cumulative de l'augmentation des frais liés au droit de vente de médicaments sur les entreprises qui vendent plusieurs centaines de produits en tant que point de prise de décision potentiel pour continuer de vendre les produits sur le marché canadien. Les frais liés au droit de vente de médicaments proposés pour un médicament sur ordonnance tiennent compte des coûts pour réaliser le programme après la mise en marché actuel.
Numéro d'identification du médicament dormant :
Plusieurs intervenants ont demandé s'il faudra payer des frais pour les produits ayant des numéros d'identification du médicament dormants (par exemple, des produits qui ne sont pas vendus au Canada) dans le cadre du nouveau programme, puisque les mesures d'atténuation qui prévoyaient une remise complète des frais ont été éliminées. Santé Canada confirme qu'il ne prévoit pas facturer les frais liés au droit de vente de médicaments lorsque le fabricant avise officiellement Santé Canada qu'un produit est dormant. Toutefois, si un médicament devient dormant pendant l'année, les frais liés au droit de vente ne seront pas réduits.
Section IV : Processus de rétroaction
Dans le cadre de son engagement à tenir des consultations constructives, Santé Canada s’est engagé à donner aux intervenants une dernière possibilité de soulever des préoccupations au sujet de la Proposition de frais.
Par suite de la publication de la Proposition de frais révisée, Santé Canada invite les intervenants à formuler des commentaires finaux, s’il y a lieu, dans le cadre du processus de rétroaction. Santé Canada prendra en considération les commentaires obtenus pour finaliser les frais révisés pour les médicaments et les instruments médicaux.
Portée du processus de rétroaction
Santé Canada accepte des commentaires sur tous les aspects des frais révisés, sauf pour les éléments suivants :
- Méthodologie d’établissement des coûts
- Autorité législative et processus révisé pour établir les frais
Processus
Santé Canada obtiendra les commentaires au moyen de présentations écrites et dans le cadre de réunions avec les intervenants, selon les besoins. Les commentaires découlant du processus de rétroaction seront pris en considération pour finaliser les frais révisés.
Présentations écrites
Les intervenants peuvent formuler des commentaires officiels jusqu’au 14 juin 2018 en présentant à Santé Canada une feuille de commentaires remplie, qui est disponible en ligne. Les intervenants doivent indiquer le sujet ou le domaine pour lequel ils formulent des commentaires.
Santé Canada examinera toutes les feuilles de commentaires pour déterminer si les commentaires sont pertinents pour le processus tel qu’il est expliqué ci-dessus. Les commentaires qui ne sont pas pertinents pour le processus ne seront pas pris en considération et Santé Canada informera les intervenants que les commentaires ne seront pas pris en considération.
L’engagement du Canada envers un gouvernement ouvert est un élément des efforts du gouvernement fédéral visant à encourager une plus grande ouverture et transparence pour avoir un gouvernement plus souple. Dans le cadre de cet engagement, Santé Canada vise à assurer l’ouverture et la transparence, à prendre des décisions fondées sur les données probantes et à fournir plus de renseignements aux Canadiens. Après avoir terminé le processus de rétroaction, Santé Canada publiera une liste des commentaires formulés par les intervenants. Les renseignements reçus dans le cadre du processus de rétroaction ne seront pas considérés comme des renseignements confidentiels. Le public pourra consulter les présentations indiquées sur demande aux fins d’assurer la transparence.
Réunions avec les intervenants
En fonction du type et du nombre de commentaires reçus, Santé Canada pourrait organiser des réunions visant des secteurs précis. Pour pouvoir participer à une ou plusieurs réunions, les intervenants doivent présenter une feuille de commentaires. Le Ministère communiquera avec les intervenants après la fin du processus de rétroaction et indiquera les détails relatifs à la participation.
Rapport
Un rapport qui résume les commentaires et les réponses de Santé Canada sera publié sur le site Web de Santé Canada.
Conclusion
Santé Canada a révisé sa Proposition de frais originale de manière à tenir compte des préoccupations exprimées pendant les consultations et présente des frais révisés équilibrés et adaptés. Après le processus de rétroaction, le nouveau règlement sur les frais sera publié dans la Gazette du Canada, Partie II et mis en œuvre au printemps 2019.
Les problèmes liés à la transition seront abordés dans les documents d’orientation révisés, y compris les méthodes pour gérer la vérification des frais et le report des frais pour les frais facturés avant la mise en œuvre des frais révisés.
Annexe A : Résumé des frais révisés
| Thème | Actuels | Proposition d’octobre 2017 | Révisée en mai 2018 |
|---|---|---|---|
Ratios d’établissement des frais |
Frais à 40 %-100 % des coûts (de 2007 pour les médicaments et les instruments et de 1995 pour les médicaments vétérinaires) |
Évaluation préalable à la mise en marché Droit de vente : 90 % pour tous les produits Frais de licence d’établissement : 100 % : Frais unique par établissement, qu’il s’agisse d’activités visant des médicaments pour usage humain ou des médicaments vétérinaires |
Évaluation préalable à la mise en marché Droit de vente : 67 % pour tous les produits. Pour les médicaments, trois catégories de frais : médicaments sur ordonnance, médicaments en vente libre, désinfectants Frais de licence d’établissement : |
Calendrier de mise en œuvre |
S.O. |
Immédiat |
Mise en œuvre progressive sur quatre ans (sept ans pour les frais préalables à la mise en marché pour les médicaments vétérinaires) avec une augmentation annuelle maximale de 25 % pour les frais préalables à la mise en marché et les frais de licence d’établissement en toute année et de 50 % pour les frais liés au droit de vente en toute année (sauf les rajustements en fonction de l’Indice des prix à la consommation) |
Rajustement annuels des frais |
2 % par année |
Rajustement annuel des frais en fonction de l’Indice des prix à la consommation (IPC) de l’année précédente |
Aucun changement par rapport à la proposition d’octobre |
Petites entreprises |
Frais annulés en fonction des ventes par produit, frais reportés pour la première année en affaires |
Utiliser la définition de « petite entreprise » du Secrétariat du Conseil du Trésor « Toute entreprise, y compris ses filiales, qui compte moins de 100 employés ou dont les revenus bruts annuels vont de 30 000 $ à 5 millions de dollars » : les nouvelles sociétés qui correspondent à cette définition seront admissibles à l’évaluation gratuite de leur première présentation préalable à la mise en marché si les frais sont supérieurs à 10 000 $ – cette mesure ne s’applique qu’une seule fois |
Utiliser la définition de « petite entreprise » du Secrétariat du Conseil du Trésor : Frais annulés pour la première présentation préalable à la mise en marché indépendamment du montant des frais Remise de 50 % pour tous les frais d’évaluation préalable à la mise en marché Remise de 25 % pour tous les frais liés au droit de vente Remise de 25 % pour tous les frais de licence d’établissement |
Atténuation des frais |
Frais annulés en fonction des ventes par produit, frais reportés pour la première année en affaires |
Frais annulés pour la première présentation préalable à la mise en marché pour un médicament sur la Liste des médicaments pour un besoin urgent en matière de santé publique conformément à la Réglementation visant l’accès à des drogues dans des circonstances exceptionnelles Élimination du report des frais |
En plus de la proposition d’octobre : Frais annulés pour les établissements de soins de santé subventionnés par l’État Frais de licence d’établissement au prorata par trimestre pour une nouvelle demande |
Calendrier de paiement des frais |
Pour certains frais préalables à la mise en marché 75 % des frais sont perçus avant l’examen et 25 % après la décision |
Tous les frais préalables à la mise en marché sont perçus au préalable |
Aucun changement par rapport à la proposition d’octobre |
Disposition relative aux pénalités |
Si le rendement moyen dépasse les normes de rendement de 10 % ou plus, le frais est réduit l’année suivante |
Une présentation individuelle qui dépasse les normes de rendement reçoit une remise 25 %. Disposition « arrêt du temps » aux fins de la norme de rendement de manière à limiter le temps consacré par Santé Canada à la présentation |
Aucun changement par rapport à la proposition d’octobre |
Non-paiement |
S.O. |
Pouvoir de retirer ou de refuser le service ou l’approbation si les frais ne sont pas acquittés |
Aucun changement par rapport à la proposition d’octobre |
Normes de rendement |
Tous les frais existants comportent une norme de rendement |
Toutes les normes existantes demeurent inchangées, sauf :
Une norme de service est proposée pour chaque nouvelle catégorie de frais |
Aucun changement par rapport à la proposition d’octobre, sauf |
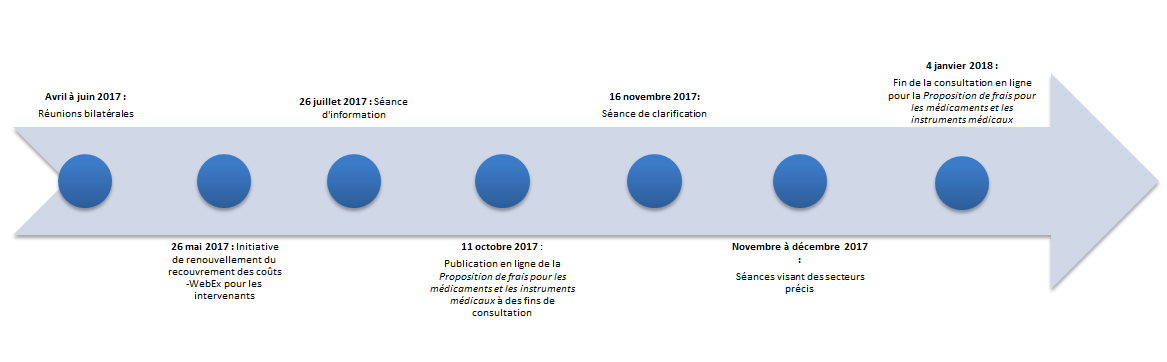
Annexe B : Liste des activités de mobilisation des intervenants et participants
La figure 1 ci-dessous décrit les activités de mobilisation des intervenants qu'à entreprit Santé Canada pendant la période de consultation:
- Réunions bilatérales de l'industrie (avril à juin 2017)
- Initiative de renouvellement du recouvrement des coûts – WebEx pour les intervenants (26 mai 2017)
- Séance d'information (26 juillet 2017)
- Publication en ligne de la Proposition de frais pour les médicaments et les instruments médicaux à des fins de consultation (du 11 octobre 2017 au 4 janvier 2018)
- Séance de clarification (16 novembre 2017)
- Séances visant des secteurs précis (novembre à décembre 2017)
Figure 1 – Liste chronologique des activités de mobilisation des intervenants
Publication en ligne de la proposition de frais pour les médicaments et les instruments médicaux (du 11 octobre 2017 au 4 janvier 2018)
| Type d’intervenant | Nombre de présentations | Associations | Entreprise individuelle / personne |
|---|---|---|---|
| Université | 2 | 0 | 2 |
| Consultant | 2 | 1 | 1 |
| Organisme à but non lucratif | 2 | 0 | 2 |
| En vente libre (cosmétiques) | 1 | 1 | 0 |
| Désinfectants | 6 | 2 | 4 |
| Pharmaceutiques | 42 | 8 | 34 |
| Radio-pharmaceutiques | 5 | 5 | 0 |
| Médicaments vétérinaires | 22 | 11 | 11 |
| Instruments médicaux | 25 | 1 | 24 |
| Autre | 2 | 0 | 2 |
Annexe C : Sommaire des commentaires reçus par secteur
Instruments médicaux
Frais et rendement
- La mise en œuvre des frais révisés devrait être échelonnée, puisque les répercussions seront importantes. Les fabricants pourraient devoir réévaluer s’il convient de continuer de vendre les instruments médicaux sur le marché canadien à un coût plus élevé.
- Les frais révisés ne tiennent pas compte du vaste éventail des entreprises d’instruments médicaux (c’est-à-dire les petites entreprises).
- Une justification et des éclaircissements supplémentaires sont nécessaires à l’égard des coûts, y compris la justification du ratio d’établissement des frais. L’analyse des avantages pour le secteur public et le secteur privé ne reflète pas l’industrie des instruments médicaux.
- Un examen indépendant des coûts que Santé Canada doit assumer doit être réalisé afin de s’assurer que les coûts sont appliqués de façon appropriée et qu’ils sont justifiés.
- L’ajout de frais d’administration seulement pour certaines demandes et de frais distincts pour les présentations d’instruments diagnostiques cliniques in vitro de classe IV devrait être envisagé.
- Il n’est peut-être pas approprié de comparer les frais à ceux des autres pays compte tenu de la réalité du marché canadien des instruments médicaux.
- Une approche similaire à celle des États-Unis devrait être envisagée lorsque la norme de rendement pour la présentation d’un avis 510(k) n’est pas respectée (p. ex. explication écrite et échéancier prévu).
- Les normes de rendement devraient inclure le délai de présélection dans le « délai jusqu’à la première décision ». Les normes devraient mieux refléter la nature du processus d’examen des instruments médicaux.
- L’industrie devrait être consultée au sujet de la disposition d’« arrêt du temps ».
- Les rapports sur le rendement des instruments médicaux et les paramètres supplémentaires (trimestriels, annuels) devraient être communiqués en temps opportun.
Petites entreprises et atténuation
- Les frais proposés pour les licences d’établissement d’instruments médicaux, qui s’ajoutent au Programme unique d’audit pour le matériel médical au cours de la même année, seront préjudiciables pour les petites entreprises importatrices.
- Il faudrait conserver le modèle d’atténuation actuel ou réévaluer le nouveau modèle (particulièrement pour les frais liés au droit de vente), parce qu’il y aura des conséquences imprévues sur les soins aux patients et l’accès pour les patients.
- Il faudrait demander des conseils de l’industrie afin d’aplanir les difficultés liées au modèle actuel d’atténuation des frais.
Calendrier de paiement des frais
- S.O.
Rajustement annuel
- Il faut préciser quand et comment l’industrie sera avisée du rajustement annuel.
- L’industrie a besoin d’un préavis de 12 mois afin d’établir ses budgets de façon appropriée.
Disposition relative aux pénalités
- S.O.
Autres
- Santé Canada devrait organiser avec les intervenants des réunions annuelles en personne portant sur les frais liés aux instruments médicaux et les améliorations apportées aux processus connexes.
Désinfectants
Frais et rendement
- On doit tenir compte de l’intérêt public et des avantages pour le secteur privé.
- Les revenus provenant des désinfectants semblent subventionner de façon indirecte d’autres produits.
- Les frais ne devraient pas inclure les coûts indirects.
- L’augmentation de 400 % des frais liés au droit de vente d’un médicament est trop élevée. Les frais individuels liés au droit de vente devraient être les mêmes que pour les instruments médicaux.
- L’augmentation de 810 % des frais d’examen d’une présentation visant l’étiquetage seulement est trop élevée.
- Les frais devraient correspondre à ceux qui sont facturés par les États-Unis pour les désinfectants pour surfaces dures.
- Les normes de rendement devraient être améliorées. La norme de rendement pour l’examen des présentations de désinfectants (étiquetage seulement) devrait être de 60 jours.
- La disposition d’« arrêt du temps » doit être stricte et transparente et être élaborée avec la participation de l’industrie.
- Santé Canada devrait s’assurer que les intervenants participent chaque année à l’examen des frais et du rendement.
Petites entreprises et atténuation
- Les mesures d’atténuation devraient aider les petites entreprises, particulièrement celles dont les ventes sont faibles.
- Les frais liés au droit de vente des médicaments devraient être atténués en fonction des ventes.
Calendrier de paiement des frais
- S.O.
Rajustement annuel
- S.O.
Disposition relative aux pénalités
- La remise de 25 % est appropriée.
Autre
- Il y a un manque de transparence et de surveillance associé au nouveau processus d’établissement des frais.
- Il faut retirer l’exemption de l’application de la Loi sur les aliments et drogues de la Loi sur les frais de service.
Médicaments génériques et biosimilaires
Frais et rendement
- Les frais révisés seront mis en œuvre en même temps que d’autres changements touchant l’industrie (p. ex. listes provinciales des médicaments assurés). Santé Canada doit tenir compte de l’impact global des frais proposés. Une période de transition devrait être envisagée.
- Les intervenants ne tirent aucun profit de l’augmentation des frais. En particulier, Santé Canada n’a pas adopté de marche à suivre pour les médicaments génériques, ce qui signifie qu’il est toujours difficile de présenter une demande d’inscription sur la liste provinciale des médicaments assurés.
- Les frais plus élevés pourraient entraîner des pénuries de médicaments. Les frais liés au droit de vente qui sont proposés et les frais associés aux numéros d’identification de drogue auront pour effet de restreindre l’accès des patients aux médicaments.
- Les ratios d’établissement des frais devraient refléter l’intérêt public et être retournés à 50:50, particulièrement en ce qui concerne les frais liés au droit de vente, qui ne sont pas justifiés. Les coûts demeurent les mêmes qu’auparavant, mais Santé Canada termine maintenant le travail en moins de temps (100 jours de moins). De plus, les écarts de coût entre les frais liés au droit de vente des médicaments et les frais liés au droit de vente des instruments médicaux doivent être mieux expliqués.
- Les frais pour l’étiquetage seulement (produits génériques) ne sont pas appropriés, puisque ce changement est amorcé par l’entreprise innovatrice, et non par l’entreprise de produits génériques.
- Les produits dormants qui ont un numéro d’identification de drogue devraient être exemptés des frais annuels.
- L’augmentation des frais d’évaluation des médicaments biosimilaires sera exacerbée dans les situations où plusieurs présentations sont déposées pour une même indication thérapeutique.
- Le Document complémentaire sur la tarification ne contenait pas suffisamment de précisions sur chacune des activités pour les différentes catégories de frais. Santé Canada doit fournir des données détaillées pour justifier les frais proposés.
- Les revenus peuvent subventionner de façon indirecte d’autres industries (c.-à-d. les revenus peuvent ne pas être investis dans la même gamme de produits que celle qui les a générés).
- Santé Canada devrait s’engager à être plus efficiente afin de favoriser l’accès au marché des médicaments génériques. L’augmentation des frais pourrait diminuer l’efficience de Santé Canada, ce qui permettrait à des pratiques inefficientes de se poursuivre.
- L’industrie devrait être consultée au sujet de la disposition d’« arrêt du temps ».
Petites entreprises et atténuation
- Il sera difficile de répondre à la définition de « petite entreprise » du Secrétariat du Conseil du Trésor.
- La mesure d’atténuation proposée ne profite qu’aux nouvelles petites entreprises. Le modèle ne tient pas compte de l’impact sur les petites entreprises existantes qui desservent des marchés à créneaux ou celles qui vendent des produits à perte pour répondre aux besoins des patients. Le modèle d’atténuation devrait inclure toutes les entreprises afin que les produits de créneau demeurent viables.
Calendrier de paiement des frais
- Les frais devraient être payés conformément au calendrier des travaux qui sont réalisés.
Rajustement annuel
- L’utilisation de l’Indice des prix à la consommation pour déterminer l’augmentation annuelle rend difficile la planification budgétaire. L’industrie a besoin d’un préavis suffisant.
Disposition relative aux pénalités
- Quand une norme de rendement n’est pas respectée, rien n’incite Santé Canada à terminer les travaux.
Autres
- L’exemption de la Loi sur les frais d’utilisation crée un manque de transparence. Rien ne garantit que Santé Canada consultera les intervenants à l’avenir.
- Il y a un manque de contrôle parlementaire, et rien n’incite Santé Canada à accroître son efficience et à réduire les coûts. L’industrie devrait participer à l’établissement et à la mise en œuvre des frais et pouvoir consulter les budgets et les coûts de façon périodique.
Produits pharmaceutiques de marque
Frais et rendement
- Comme les nouveaux frais seront mis en œuvre en même temps que d’autres changements touchant l’industrie (Agence canadienne des médicaments et des technologies de la santé, Conseil d’examen du prix des médicaments brevetés), Santé Canada doit tenir compte de l’impact global sur l’industrie. Les changements devraient être reportés jusqu’à ce que de nouvelles normes de rendement soient établies et que des gains d’efficience soient réalisés.
- La justification concernant le ratio d’établissement des frais est inadéquate. Les frais devraient être établis à l’aide d’un ratio de 50:50, ou les nouveaux frais devraient être reportés ou échelonnés sur une période donnée.
- Les frais devraient être établis de façon à maintenir l’approvisionnement en agents d’immunisation et devraient être réduits pour les produits de faible volume. Les produits dormants qui ont un numéro d’identification de drogue devraient être exemptés des frais annuels.
- Les coûts doivent être réévalués. La méthodologie d’établissement des coûts n’est pas transparente. Seuls les coûts de programme et les coûts ministériels sont quantifiés. Les coûts en capital ne sont pas identifiés, et les coûts d’infrastructure devraient être exclus. De plus, un seul type de frais d’évaluation de médicaments est décrit en détail, mais la formule se répercute sur 27 types de frais distincts, en tout. Finalement, il n’est pas fait mention du calcul des coûts des nouvelles activités de réglementation prévues.
- Il n’y a pas d’incitation à mettre en marché des médicaments orphelins au Canada.
- L’augmentation des frais pourrait diminuer l’efficience et permettre à Santé Canada de continuer à adopter des pratiques d’affaires inefficientes. Santé Canada devrait réaliser un examen annuel du rendement et rendre compte de la façon dont elle a amélioré ses processus et l’impact des nouveaux éléments de programme sur le modèle d’établissement des coûts. Des gains d’efficience pourraient entraîner une réduction concrète des frais au fil du temps.
- Les frais de la catégorie Données publiées seulement devraient être maintenus, plutôt que remplacés par les frais liés aux données cliniques ou non cliniques seulement et les frais liés aux données cliniques ou non cliniques et aux données sur la chimie et la fabrication.
- Les revenus devraient être appliqués au secteur de programme qui les a générés. De plus, un rapport annuel consacré à cette question devrait être préparé et publié.
- Les frais proposés devraient faire l’objet d’une vérification par un tiers indépendant, comme le vérificateur général, pour s’assurer qu’ils sont équitables.
- La disposition « temps de pause » devrait être examinée indépendamment des changements apportés aux frais.
Petites entreprises et atténuation
- Peu de sociétés répondront à la définition d’une « petite entreprise ».
- Les mesures d’atténuation devraient tenir compte de la taille du marché.
Calendrier de paiement des frais
- S.O.
Rajustement annuel
- S.O.
Disposition relative aux pénalités
- Santé Canada devrait utiliser une pénalité variable afin de s’assurer que les examens soient terminés le plus tôt possible. Par exemple, une remise de 10 % devrait être accordée lorsque l’examen est terminé dans les 30 jours suivant la norme de rendement, et cette remise devrait passer à 25 % lorsque l’examen est terminé plus de 30 jours après la norme.
Autres
- On ne disposera pas d’assez de temps pour des consultations avant la publication de la réglementation définitive.
- Le contrôle parlementaire devrait être rétabli afin de permettre la réalisation d’un examen indépendant par lequel on rendrait des comptes au public.
- Il faut permettre à l’industrie de mieux comprendre les nouveaux frais qui sont proposés, au-delà des augmentations annuelles se fondant sur l’Indice des prix à la consommation.
Produits en vente libre (sans ordonnance)
Frais et rendement
- Les réformes de la réglementation qui étaient proposées dans le Cadre régissant les produits d’autosoins n’ont pas été prises en compte. La modification des frais pour les produits abordés dans le Cadre régissant les produits d’autosoins devrait être reportée. Le fait d’inclure les produits à faible risque dans la proposition de frais crée pour les produits de santé des inégalités que le Cadre régissant les produits d’autosoins est conçu pour corriger. Les produits de santé naturels nécessitent un modèle différent de recouvrement des coûts – un modèle qui est lié aux ventes.
- Il faut mieux justifier les changements apportés aux frais, aux coûts et au rendement. Les rations de 100 % auront un impact négatif sur l’industrie et ne tiennent pas compte des avantages publics-privés. L’analyse doit être axée sur les dollars, et non seulement sur le ratio des frais. Il faut poursuivre le dialogue afin de comprendre quelles sont les considérations que Santé Canada a utilisées dans les comparaisons avec les autres pays et comment on peut créer un modèle plus efficient.
- Le processus d’établissement des frais n’était pas assez transparent. Les intervenants n’ont pas eu accès aux données sur les coûts. Une consultation distincte est nécessaire pour déterminer le partage des coûts en capital non récurrents.
- Le mécanisme et les frais pour les produits pour lesquels il n’y a pas de ventes à déclarer doivent être clarifiés.
- Les écarts entre les frais reflètent des manques d’efficience dans le système. Les frais imposés après la mise en marché ne devraient pas être plus élevés que les frais d’inscription des produits.
- Santé Canada devrait montrer comment les frais liés aux licences d’établissement de produits pharmaceutiques ont été calculés avant et après.
- Les frais liés à des activités comme le traitement des rapports sur les effets indésirables, l’évaluation de la causalité, la communication des risques, la surveillance après la mise en marché, le contrôle de la conformité et l’application de la loi et l’élaboration de politiques et la mise au point de technologies sont mieux adaptés aux produits monographiés de catégorie IV d’aujourd’hui, selon le Cadre régissant les produits d’autosoins, qu’au modèle proposé pour les médicaments et les instruments médicaux.
- Des explications supplémentaires devraient être fournies en ce qui concerne les frais pour la fabrication, l’emballage, l’étiquetage, la mise à l’essai et l’importation des ingrédients pharmaceutiques actifs.
- Les coûts d’entretien suite à la mise en marché doivent être plus précis afin que les coûts d’examen préalable à la mise en marché puissent être harmonisés avec les coûts liés au droit de vente.
- La structure tarifaire pour le droit de vente doit être différente afin de s’assurer que ces frais concordent avec les activités de réglementation appropriées. Le modèle uniformisé doit être repensé. Les produits à faible risque et ceux pour lesquels il n’y a pas de déclaration de mise en marché devraient être exemptés des frais liés au droit de vente. L’industrie des produits sans ordonnance subventionnera d’autres médicaments, puisque les produits sans ordonnance représentent moins de 10 % du travail, mais assumeraient 25 % des frais. Des frais liés au droit de vente distincts devraient être établis pour les produits sans ordonnance.
- Les frais pour l’étiquetage seulement devraient se fonder sur le temps et les efforts qui sont nécessaires pour examiner les présentations de produits sur ordonnance par rapport aux présentations de produits sans ordonnance et être assujettis à des normes de rendement différentes. De plus, ces frais sont trop élevés, et il faudrait mieux préciser si les évaluations du nom de marque devront faire l’objet d’une présentation supplémentaire visant l’étiquetage seulement.
- Aucune justification n’est fournie pour expliquer l’augmentation des frais d’évaluation pour les médicaments à risque faible et l’allongement de la norme de rendement.
- L’élimination des frais de la catégorie Données publiées seulement et leur remplacement par les frais liés aux données cliniques ou non cliniques et aux données sur la chimie et la fabrication représente des frais seize fois supérieurs et découragera les entreprises, particulièrement les petites entreprises, de mettre en marché de nouveaux produits. Les frais de la catégorie Données publiées seulement devraient être conservés.
- Les frais proposés pour les mises à jour en matière d’innocuité devraient seulement s’appliquer aux changements importants et aux effets secondaires, conformément à la Loi sur les aliments et drogues.
- Conformément au Règlement sur les aliments et drogues, le changement de nom d’un produit devrait être traité comme une présentation administrative; des frais qui s’appliquent une seule fois pour plusieurs noms commerciaux dans une seule présentation.
- Santé Canada n’a pas besoin de ressources supplémentaires pour mettre en œuvre les exigences en matière d’étiquetage en langage clair.
- Les frais sont moins élevés en Australie qu’au Canada.
- Une proportion d’au plus 75 à 80 % des coûts devrait être recouvrée, ce qui est conforme à la moyenne de l’Organisation de coopération et de développement économiques (OCDE).
- Santé Canada devrait accroître l’efficience, la transparence et la responsabilisation en ce qui concerne le respect des normes de rendement. Il y a peu d’incitatifs pour Santé Canada d’élaborer des processus efficients pour les activités de réglementation.
- La norme de rendement pour le titre 1 devrait être la même que pour le titre 8.
- Le numéro d’identification de drogue – la norme de rendement devrait être de 10 à 30 jours.
- La norme de rendement relative au droit de vente devrait être une norme minimale de moins de 20 jours.
- La disposition « temps de pause » ne serait profitable qu’à Santé Canada, et non à l’industrie. Le processus doit être prévisible et transparent et être élaboré avec la participation de l’industrie.
- Les produits monographiés de catégorie IV peuvent avoir un impact négatif sur l’industrie; des produits peuvent être distribués en tant que cosmétiques, en renonçant aux exigences en matière de permis. Transition des produits monographiés en vente libre de catégorie IV vers le Cadre régissant les produits d’autosoins.
Petites entreprises et atténuation
- L’impact négatif des frais proposés sur les petites entreprises doit être pris en compte, tout comme l’impact sur le secteur manufacturier canadien. Santé Canada devrait réaliser une analyse coûts/avantages à cette fin.
- La mesure d’atténuation proposée ne profite qu’aux nouvelles petites entreprises, et non aux petites entreprises existantes.
- L’atténuation des frais pour certains titulaires de licence de mise en marché ne doit pas entraîner des frais plus élevés pour l’ensemble des titulaires de licence, puisque cela aurait pour effet de subventionner les premiers.
- Aucune aide n’est offerte aux petites entreprises à l’égard des nombreux frais inférieurs à 10 000 $.
Calendrier de paiement des frais
- Le paiement des frais à l’avance entraînera des problèmes financiers et des problèmes de comptabilité. La répartition des frais sur deux exercices financiers a facilité la gestion des budgets; les intervenants ont besoin de suffisamment de temps pour s’adapter.
Rajustement annuel
- S.O.
Disposition relative aux pénalités
- D’autres précisions sont nécessaires pour expliquer comment la disposition relative aux pénalités a été élaborée.
- Une pénalité variable permettrait de s’assurer que la priorité est accordée aux examens pour lesquels la norme de rendement n’a pas été respectée.
Autres
- Il y a eu un manque de transparence/dialogue en ce qui concerne les changements proposés ainsi que les coûts connexes.
- Le processus d’établissement des frais devrait être surveillé par un organisme central.
- Le fait de payer des frais qui dépassent les coûts réels des activités de réglementation n’est pas conforme à la Politique du Conseil du Trésor.
- La surveillance par un organisme central ou un contrôle parlementaire est nécessaire, ou à tout le moins, un processus clair de règlement des différends géré par un organisme central doit être mis en place.
- Les intervenants doivent se voir offrir plus d’occasions d’examiner les frais proposés plus en détail. Santé Canada devrait collaborer avec les intervenants afin d’établir un processus de consultation au sujet des frais.
- Santé Canada devrait préparer un Résumé de l’étude d’impact de la réglementation.
Produits radiopharmaceutiques
Frais et rendement
- Les produits radiopharmaceutiques devraient avoir leur propre structure tarifaire afin de refléter le marché pour ces produits, les coûts de production élevés et le fait que les promoteurs sont souvent des organismes à but non lucratif ou des établissements universitaires. De plus, la réglementation des produits radiopharmaceutiques représente un fardeau moins lourd en raison des profils d’innocuité favorables et des faibles taux d’effets indésirables. Les frais demandés pour les produits radiopharmaceutiques devraient correspondre à 10 % des frais demandés pour les produits pharmaceutiques afin de faciliter l’accès aux produits de créneau pour la population canadienne.
- L’augmentation proposée des frais, particulièrement pour les nouvelles substances actives et les données cliniques ou non cliniques et données sur la chimie et la fabrication, limitera l’innovation et l’accès aux produits radiopharmaceutiques et pourrait entraîner l’utilisation d’agents inférieurs.
- Il pourrait y avoir un écart important entre les régions en ce qui concerne l’accès aux essais/traitements si les coûts des produits radiopharmaceutiques augmentent, puisque les fournisseurs de soins de santé ne seront pas tous en mesure de se les payer.
- L’établissement des coûts n’était pas assez transparent. Les calculs des frais, y compris une ventilation de chacun des frais, des coûts en capital, des coûts ministériels et des coûts de programme, devraient être communiqués.
- L’analyse de Santé Canada ne comprenait pas le fardeau financier et administratif associé à l’approbation au cas par cas des produits radiopharmaceutiques par l’entremise du Programme d’accès spécial (PAS). Le PAS dissuade les professionnels de la santé d’utiliser les meilleures options pour leurs patients, et la proposition de frais aggravera ce problème. L’augmentation des frais pourrait entraîner l’augmentation du nombre de produits radiopharmaceutiques qui sont distribués par l’entremise du Programme d’accès spécial.
- Les augmentations des frais ne s’accompagnent pas d’une amélioration des normes de rendement.
- L’exonération des frais pour les médicaments orphelins devrait être adoptée, comme dans le modèle de l’Australie.
- Les écarts entre les frais liés aux médicaments à usage humain et les médicaments vétérinaires doivent être expliqués.
Petites entreprises et atténuation
- Le modèle d’atténuation actuel devrait être conservé. Des mesures supplémentaires devraient être adoptées afin d’inciter les petites et moyennes entreprises et les institutions du secteur public à mettre en marché de nouveaux produits.
- Les mesures d’atténuation sont trop restrictives et limitées et ne tiennent pas compte des petites et moyennes entreprises ou des institutions du secteur public. Les petites et moyennes entreprises devraient avoir un accès continu aux mesures d’atténuation – et non pas seulement lors de la première demande/présentation.
- Les sociétés radiopharmaceutiques ont des possibilités de commercialisation limitées et fonctionnent comme des institutions à but non lucratif ou des établissements de santé publique. Elles ne répondent pas à la définition de « petite entreprise » en raison de leur structure organisationnelle et devraient être exonérées des frais.
Calendrier de paiement des frais
- Le paiement de la totalité des frais à l’avance a un effet dissuasif pour l’industrie. Il faudrait plutôt adopter l’approche australienne de répartition et d’échelonnement des frais.
Rajustement annuel
- L’examen et l’augmentation annuels des frais en fonction de l’Indice des prix à la consommation représentent un fardeau trop lourd pour l’industrie. Un cycle d’examen de trois ans pour les frais est plus approprié.
Disposition relative aux pénalités
- S.O.
Autres
- S.O.
Médicaments vétérinaires
Frais et rendement
- Les médicaments vétérinaires et les médicaments à usage humain ne devraient pas être assujettis aux mêmes frais, puisque la taille des deux marchés n’est pas comparable. De plus, les frais ne reflètent pas le fait que la médecine humaine est socialisée.
- En raison de la petite taille du marché canadien, les sociétés pharmaceutiques sont réticentes à faire enregistrer leurs produits, ce qui entraîne une pénurie de médicaments vétérinaires; cette tendance pourrait s’aggraver en raison des nouveaux frais proposés.
- Le ratio d’établissement des frais ne reflète pas l’intérêt public que présentent les médicaments vétérinaires, la taille du marché ou les répercussions sur le commerce international.
- L’augmentation des frais nuira à la compétitivité de l’industrie canadienne de l’élevage et à la bonne pratique de la médecine vétérinaire, ce qui accroîtra les risques pour la salubrité des aliments et la sécurité des consommateurs, ainsi que pour la santé des animaux. L’augmentation des frais pourrait aussi limiter l’innovation, entraîner des pénuries de médicaments ou réduire l’accès aux produits, et augmentera les coûts des médicaments vétérinaires. Les nouveaux frais sont trop élevés pour assurer la rentabilité des investissements.
- Un moins grand nombre d’entreprises pourraient commercialiser leurs produits au Canada. Cela pourrait faire augmenter le nombre de demandes de distribution de médicaments d’urgence, exerçant ainsi une pression sur Santé Canada.
- Les frais devraient être augmentés progressivement pour refléter le fait qu’aucune augmentation n’a été apportée en 2011.
- Les frais proposés pour les licences d’établissement de produits pharmaceutiques ne sont pas transparents lorsqu’ils sont communiqués en tant que moyenne.
- Santé Canada propose des frais qui sont considérablement plus élevés que ceux de pays similaires comme l’Australie. Ces augmentations des frais équivalent à 10 à 15 années de ventes.
- Santé Canada devrait revoir les frais et la norme de rendement pour l’examen de l’innocuité des substances admissibles.
- Des incitatifs devraient être inclus pour les évaluations concertées / examens conjoints. Le fait d’accepter les examens d’organismes étrangers compétents, comme la FDA des États-Unis, permettrait d’éliminer le chevauchement des services et de rajuster les frais à la baisse. Santé Canada devrait envisager de reconnaître les examens provenant d’organismes étrangers compétents et de réduire le fardeau réglementaire pour les produits destinés aux animaux de compagnie.
- Les frais devraient permettre d’accroître la disponibilité des produits dans un petit marché. De nouvelles catégories de frais devraient être créées, et des incitatifs devraient être ajoutés pour les médicaments à utilisations mineures et pour espèces mineures ainsi que les présentations examinées par le Conseil de coopération en matière de réglementation.
- Les frais ne devraient pas être facturés en l’absence de lignes directrices mises à jour facilitant la préparation de présentations de qualité.
- Les activités atypiques ou les anciennes activités visées par les frais liés aux licences d’établissement de produits pharmaceutiques pour les sites d’ingrédients pharmaceutiques actifs devraient être exemptées, puisque ces frais entraîneront un retrait important de produits du marché canadien. Les ingrédients pharmaceutiques actifs atypiques qui sont énumérés ne devraient pas être visés par les frais liés aux licences d’établissement de produits pharmaceutiques si les exigences relatives aux bonnes pratiques de fabrication ne sont pas les mêmes.
- Les services, la structure tarifaire et les normes de service de Santé Canada devraient être modernisés. De plus, les frais devraient permettre d’accroître la disponibilité des produits homologués dans le petit marché canadien.
- La seule norme de rendement qui s’améliore (l’affichage des renseignements sur le droit de vente dans la Base de données sur les produits pharmaceutiques) est sans importance pour l’industrie.
- La norme de rendement de 250 jours pour délivrer ou renouveler une licence ou ajouter un site étranger est inacceptable.
- Santé Canada doit envisager de facturer des frais pour l’examen de l’innocuité des substances admissibles qui peuvent être utilisées dans un produit qui a fait l’objet d’un avis ainsi qu’une norme de rendement connexe.
- Un processus d’appel robuste doit être prévu afin que les entreprises puissent remettre en question le rendement en cas de désaccord.
- La disposition « temps de pause » doit être clairement définie et bien comprise.
Petites entreprises et atténuation
- La mesure d’atténuation proposée, qui ne s’appliquera qu’une seule fois, n’est pas utile étant donné que les frais pour l’examen pourraient dépasser 200 000 $ (animaux destinés à la consommation) et 125 000 $ (animaux de compagnie).
- Le modèle d’atténuation actuel devrait être conservé (particulièrement pour les frais de licence d’établissement de médicaments vétérinaires), puisqu’il encourage les entreprises à commercialiser de nouveaux produits, y compris des produits de créneau.
Calendrier de paiement des frais
- Le paiement des frais à l’avance rendra difficile la gestion de trésorerie et grèvera les budgets.
- Cette situation sera amplifiée au cours de la première année de mise en œuvre, puisque les entreprises devront payer tous les frais restants pour les présentations existantes ainsi que la totalité des frais pour toutes les nouvelles présentations déposées en 2019.
Rajustement annuel
- Les mises à jour annuelles des frais doivent être transparentes et tenir compte de la taille du marché et de l’intérêt public.
Disposition relative aux pénalités
- La remise de 25 % qui est proposée est appropriée.
- Il faut mieux préciser ce qui constitue une demande de renseignements mineurs et ce qui constitue un avis d’insuffisance qui arrête le compte à rebours de l’examen.
- Principes énoncés dans le Document d’orientation de la Direction des médicaments vétérinaires à l’intention de l’industrie : la « gestion des présentations réglementaires » doit demeurer conforme au délai de réponse aux demandes de renseignements mineurs (15 jours).
Annexe D : Évaluation des répercussions du recouvrement des coûts
Résumé
Enjeu
Les frais existants pour les médicaments et les instruments médicaux sont désuets et ne reflètent pas les coûts associés à la prestation des programmes de réglementation actuels.
Description
Se fondant sur un exercice exhaustif d’établissement des coûts, les frais révisés reflètent les coûts et les programmes de réglementation actuels et s’accompagnent de mesures d’atténuation et de soutien pour les petites entreprises ainsi que d’un solide régime de reddition de comptes assorti de pénalités financières pour les normes de rendement qui ne sont pas respectées.
Énoncé des coûts et avantages
L’augmentation des recettes provenant de l’industrie compenserait les crédits financés par l’argent des contribuables, donnant lieu à un avantage net qui est nul.
Règle du « un pour un » et lentille des petites entreprises
Le nouveau règlement sur les frais, adopté par décret ministériel en vertu de la Loi sur les aliments et drogues, remplace le règlement sur les frais existant adopté en vertu de la Loi sur la gestion des finances publiques, qui sera abrogé.
Toutes les sociétés qui répondent à la définition de « petite entreprise » du Secrétariat du Conseil du Trésor (toute entreprise, y compris ses filiales, qui compte moins de 100 employés ou dont les revenus bruts annuels vont de 30 000 $ à 5 millions de dollars) seront admissibles à d’importantes dispenses des frais et paieront entre 25 % et 50 % de moins que les autres sociétés.
Coordination et coopération à l’échelle nationale et internationale
Les États-Unis, l’Australie et l’Europe facturent des frais pour la prestation des services réglementaires touchant les produits de santé et révisent périodiquement leurs frais.
Introduction
Le marché canadien
Le Canada est le 8e marché en importance dans le monde en ce qui concerne les médicaments et les instruments médicaux, et il représente un peu plus de 2,4 % d’un marché mondial dont la valeur s’élevait à environ 1 billion de dollars américains en 2017. En 2015, le marché canadien était estimé à environ 24,3 milliards de dollars américainsNote de bas de page 7(instruments médicaux – 6,2 G$, médicaments en vente libre – 3 G$, médicaments brevetés sur ordonnance – 10,8 G$ et médicaments génériques sur ordonnance – 4,3 G$). La plupart des médicaments et instruments médicaux vendus au Canada sont importés d’autres pays. Par exemple, les produits pharmaceutiques génériques fabriqués au Canada représentent seulement 20,4 % du marché canadien, tandis que les produits pharmaceutiques de marque et les produits pharmaceutiques novateurs fabriqués au Canada constituent seulement 8,8 % du marché canadien.
Un rapport publié par le Conseil d’examen du prix des médicaments brevetés (CEPMB) indique que le Canada vient généralement au 5e rang (après les États-Unis, la Suède, l’Allemagne et le Royaume-Uni) des marchés dans lesquels de nouvelles substances actives (NSA) sont lancées.Note de bas de page 8
Le CEPMB signale aussi que 210 NSA ont été lancées au Canada entre 2009 et 2014 et que les ventes de chacun des médicaments se sont élevées à 250 M$ pour les 30 NSA les plus vendues, et à 25 M$ pour les NSA les moins vendues.Note de bas de page 9
Le modèle de tarification
Le gouvernement du Canada offre des services qui profitent à un groupe spécifique en plus des avantages que le contribuable ordinaire en retire. Le principe clé qui sous-tend le recouvrement des coûts est que, dans de tels cas, le groupe qui reçoit les avantages supplémentaires est tenu d’assumer au moins une partie des coûts liés à ces services sous forme de frais d’utilisation.
Énoncé des coûts et avantages
| Répercussions quantifiées | 2019-2020 | 2020-2021 | 2021-2022 | 2022-2023 | Total | |
|---|---|---|---|---|---|---|
| Avantages | ||||||
| Montant économisé grâce à la proposition de frais | Contribuables canadiens | 38,7 M$ | 54,1 M$ | 72,7 M$ | 85,9 M$ | 251,4M$ |
| Coûts | ||||||
| Augmentation proposée des frais | Consommateurs, patients, industrie, assureurs FPT et privés | 38,7 M$ | 54,1 M$ | 72,7 M$ | 85,9 M$ | 251,4M$ |
| Avantages nets (coûts) | 0 | 0 | 0 | 0 | 0 | |
B. Répercussions non financières quantifiées
Pas de données disponibles
C. Répercussions qualitatives
- Amélioration du rendement pour des décisions plus opportunes
- Amélioration de l'efficience dans les processus d'examen
- Amélioration de la prévisibilité et de la transparence pour l'industrie
Coûts
Santé Canada propose de recouvrer auprès de l'industrie environ 86 M$ de plus sous forme de frais d'ici la 4e année (2022-2023) de la proposition.
Tableau 1 – Coûts de programme prévusNote de bas de page 10
| 2019-2020 | Financement public | Revenus actuels | Augmentation proposée | Coût total | Pourcentage du coût assumé par l’industrie |
|---|---|---|---|---|---|
| Programme des matériels médicaux | 20 517 392 | 25 329 621 | 2 630 539 | 48 477 552 | 57,7 % |
| Programme des médicaments à usage humain | 95 384 255 | 72 048 151 | 35 890 278 | 203 322 684 | 53,1 % |
| Programme des médicaments vétérinaires | 7 210 477 | 1 176 650 | 138 472 | 8 525 599 | 15,4 % |
| Total | 123 112 124 | 98 554 422 | 38 659 290 | 260 325 835 | 52,7 % |
| 2020-2021 | Financement public | Revenus actuels | Augmentation proposée | Coût total | Pourcentage du coût assumé par l’industrie |
|---|---|---|---|---|---|
| Programme des matériels médicaux | 19 404 824 | 25 329 621 | 3 743 108 | 48 477 552 | 59,97 % |
| Programme des médicaments à usage humain | 81 382 344 | 72 048 151 | 49 892 189 | 203 322 684 | 59,97 % |
| Programme des médicaments vétérinaires | 6 909 808 | 1 176 650 | 439 141 | 8 525 599 | 18,95 % |
| Total | 107 696 976 | 98 554 422 | 54 074 437 | 260 325 835 | 58,63 % |
| 2021-2022 | Financement public | Revenus actuels | Augmentation proposée | Coût total | Pourcentage du coût assumé par l’industrie |
|---|---|---|---|---|---|
| Programme des matériels médicaux | 18 288 984 | 25 329 621 | 4 858 947 | 48 477 552 | 62,3 % |
| Programme des médicaments à usage humain | 64 234 063 | 72 048 151 | 67 040 470 | 203 322 684 | 68,4 % |
| Programme des médicaments vétérinaires | 6 551 029 | 1 176 650 | 797 920 | 8 525 599 | 23,2 % |
| Total | 89 074 076 | 98 554 422 | 72 697 337 | 260 325 835 | 65,8 % |
| 2022-2023 | Financement public | Revenus actuels | Augmentation proposée | Coût total | Pourcentage du coût assumé par l’industrie |
|---|---|---|---|---|---|
| Programme des matériels médicaux | 17 148 652 | 25 329 621 | 5 999 280 | 48 477 552 | 64,6 % |
| Programme des médicaments à usage humain | 52 450 512 | 72 048 151 | 78 824 021 | 203 322 684 | 74,2 % |
| Programme des médicaments vétérinaires | 6 200 094 | 1 176 650 | 1 148 855 | 8 525 599 | 27,3 % |
| Total | 75 799 258 | 98 554 422 | 85 972 155 | 260 325 835 | 70,9 % |
Élasticité des prix et répercussion des coûts sur les consommateurs
L’incidence de l’augmentation proposée des frais sur le prix payé par les payeurs publics et privés est directement liée à l’élasticité des prix. Les changements réglementaires apportés au cadre du CEPMB ont pour but de protéger la population canadienne contre les prix excessifs pour les médicaments brevetés. En ce qui concerne les NSA, dont le prix est fixé par le CEPMB, les coûts de la réglementation seront probablement absorbés par l’industrie. Dans le cas des médicaments génériques et des médicaments biosimilaires, les coûts de la réglementation seraient plus susceptibles d’être répercutés sur les payeurs, selon le niveau de concurrence dans la catégorie de produits. Toutefois, en vertu d’une nouvelle entente qui a été conclue entre les payeurs publics et les entreprises canadiennes de médicaments génériques et qui a pris effet le 1er avril 2018, le prix de près de 70 des médicaments les plus fréquemment prescrits sera réduit de 25 à 40 %. Pour ce qui est des instruments médicaux, aucune entité ne fixe les prix, et les coûts de la réglementation seraient probablement répercutés sur les payeurs si la probabilité d’une substitution de produits est faible, mais seraient absorbés par l’industrie si la probabilité d’une substitution de produits est élevée.
Décision de ne pas mettre en marché des produits au canada
L’industrie pourrait décider de ne pas mettre en marché certains produits au Canada en raison de l’augmentation des frais, et la population canadienne n’aurait donc pas accès à ces produits. Toutefois, ce scénario est peu probable en raison des caractéristiques uniques de nombreux instruments médicaux et médicaments. En effet, comme les produits de soins de santé sont généralement plus spécialisés que les biens de consommation courants, les fluctuations des prix n’influent pas autant sur la demande pour ces produits.Note de bas de page 11
Une étude publiée en 2014 dans le Journal de l’Association médicale canadienne indiquait que la raison pour laquelle les sociétés choisissent souvent de mettre en marché leurs produits dans d’autres marchés avant de les lancer sur le marché canadien est que les sociétés ne peuvent pas déposer plusieurs présentations simultanées et qu’elles décident donc de maximiser leurs taux de rendement financier au moment de déterminer l’ordre dans lequel les présentations seront soumises aux organismes internationaux de réglementation.Note de bas de page 12 Ce choix n’était pas attribuable aux coûts associés au dépôt d’une présentation de drogue, ni au temps que prend Santé Canada pour en arriver à une décision à l’égard d’un produit.
L'augmentation proposée des frais n’influencera probablement pas non plus l’ordre dans lequel les sociétés choisissent de déposer leurs présentations, puisque le marché canadien devrait demeurer lucratif pour les sociétés compte tenu de l’augmentation de la demande découlant du vieillissement des populations à court et à moyen terme. Par conséquent, malgré l’augmentation proposée des frais, les marges de profit sur les nouveaux produits devraient demeurer attrayantes par rapport aux marchés mondiaux. En effet, malgré les frais actuels moins élevés et les normes de service concurrentielles du Canada, l’industrie lance rarement ses produits au Canada en premier.
Même si certaines sociétés peuvent décider de ne pas mettre en marché certains produits de soins de santé au Canada, Santé Canada maintient différents mécanismes pour s’assurer que des produits puissent tout de même être importés au pays en cas de besoin. Par exemple, le Programme d’accès spécial permet aux sociétés de mettre des produits à la disposition des médecins sur demande.
Toutefois, les principes économiques suggèrent que dans la grande majorité des cas, l’augmentation proposée des frais n’est pas susceptible de se répercuter sur la disponibilité des produits sur le marché canadiens puisque les marges de profit et les taux de croissance au Canada ont été solides au cours de 5 dernières années et que les prévisions demeurent positives (bien que la croissance dans le secteur des instruments médicaux puisse être faible à court terme).
Avantages
Réduction du temps d’absorption et des coûts de renonciation
Les coûts de la recherche et du développement pour les nouveaux médicaments brevetés sont élevés. D'après la quatrième d'une série d'études détaillées axées sur les composés et portant sur les coûts de développement des nouveaux médicamentsNote de bas de page 13, les coûts décaissés et des coûts capitalisés de R-D par nouveau médicament s'élevaient respectivement à 1 395 M$ et à 2 558 M$ en dollars américains de 2013. Lorsque les coûts de R-D étaient examinés sur l'ensemble du cycle de développement des produits, les coûts décaissés par médicament approuvé passaient à 1 861 M$ et les coûts capitalisés, à 2 870 M$. Par rapport aux résultats de l'étude précédente de la série, les coûts capitalisés totaux ont augmenté à un rythme annuel de 8,5 % de plus que l'inflation générale des prix.
Si l’on tient compte de l’amortissement des échecs de recherche et du coût de renonciation du capital, les coûts moyens augmentent à 900 M$ (américains) pour les petites molécules et à 1,24 G$ (américains) pour les produits biologiques. Une firme américaine d’experts-conseils a estimé que ce montant s’élevait plutôt à 2,2 G$ (américains).Note de bas de page 14 Toutefois, ces chiffres sur les coûts et la durée du développement sont controversés et ont souvent été contestés; la valeur réelle pourrait être jusqu’à quatre-vingts pour cent moins élevée.Note de bas de page 15Note de bas de page 16
Les coûts liés au développement des médicaments génériques sont moins contestés. L’Association canadienne du médicament générique indique qu’il en coûte environ 3,5 M$ et qu’il faut entre trois et six ans pour mettre en marché un produit générique au Canada. Cela comprend les coûts liés aux études de bioéquivalence, au développement et à l’approbation réglementaire.
La proposition de frais devrait permettre à Santé Canada de produire des décisions réglementaires plus opportunes, ce qui profitera à l’industrie en réduisant le temps d’absorption (la période durant laquelle la société dépense plus d’argent que ses revenus) et le coût de renonciation (l’avantage dont une société aurait pu profiter si elle avait choisi une autre option). Par exemple, plus tôt un fabricant de produits thérapeutiques reçoit une décision réglementaire négative, plus vite il peut décider de modifier son approche quant au développement du produit ou d’y mettre fin, ce qui lui permet de réduire ses pertes. Par contre, si la décision réglementaire s’avère favorable, le fabricant peut mettre en marché le produit et en tirer des revenus plus tôt.
Le rapport du CEPMB sur les ventes de médicaments indique que les revenus quotidiens vont de 68 500 $ à 685 000 $. Des décisions réglementaires plus opportunes permettraient aux détenteurs d’autorisation de mise en marché de ces produits d’accéder au marché et de recouvrer leurs coûts de développement et leurs coûts réglementaires plus tôt.
Dans le cadre du système actuel, Santé Canada est uniquement tenu de respecter ses échéanciers d’approbation selon une moyenne cumulative. La moyenne de toutes les approbations de Santé Canada dans une catégorie donnée doit respecter la norme de service. Si Santé Canada ne respecte pas cette norme de service, les frais sont réduits pour l’année subséquente. Dans le cadre de la proposition de frais révisée, Santé Canada serait tenu de respecter ses échéanciers pour chaque examen/demande, sans quoi les frais facturés à l’entreprise concernée seraient réduits. Ainsi, compte tenu de cette nouvelle responsabilité à l’égard de chaque entreprise, le rendement global devrait s’améliorer.
Petites entreprises et mesures d’atténuation
L’approche adoptée par Santé Canada en matière d’atténuation des frais vise à faciliter l’accès aux produits pour les Canadiens afin de les aider à maintenir et à améliorer leur état de santé. Dans certaines situations, Santé Canada reconnaît que l’augmentation des frais peut imposer un fardeau indu aux petites entreprises et entraver l’accès aux marchés.
Santé Canada propose d’utiliser la définition de « petite entreprise » du Secrétariat du Conseil du Trésor (toute entreprise, y compris ses filiales, qui compte moins de 100 employés ou dont les revenus bruts annuels vont de 30 000 $ à 5 millions de dollars) comme principal critère pour déterminer si une société est admissible à l’exonération des frais accordée aux petites entreprises.
Santé Canada propose aussi d’autres mesures d’atténuation, notamment l’exonération de tous les frais pour les établissements de soins de santé subventionnés par l’État et pour les présentations de produits figurant sur la Liste des médicaments pour un besoin urgent en matière de santé publique, ainsi que le calcul proportionnel trimestriel des frais de licence d’établissement pour les nouvelles demandes.
Tableau 2 – Revenus prévus avec l'application des mesures d'atténuation destinées aux petites entreprisesNote de bas de page 17
| Total | |||
|---|---|---|---|
| 2019-2020 | Revenus prévus sans l’application des mesures d’atténuation | Application des mesures d’atténuation destinées aux PE | Revenus prévus avec l’application des mesures d’atténuation |
| Médicaments à usage humain | 114 460 034 | -6 521 604 | 107 938 429 |
| Instruments médicaux | 32 696 571 | -4 736 411 | 27 960 160 |
| Médicaments vétérinaires | 1 564 315 | -249 193 | 1 315 122 |
| Total des revenus prévus – Année 1 | 148 720 920 | -11 507 208 | 137 213 712 |
| Total | |||
|---|---|---|---|
| 2020-2021 | Revenus prévus sans l’application des mesures d’atténuation | Application des mesures d’atténuation destinées aux PE | Revenus prévus avec l’application des mesures d’atténuation |
| Médicaments à usage humain | 129 155 232 | -7 214 892 | 121 940 340 |
| Instruments médicaux | 33 981 443 | -4 908 714 | 29 072 729 |
| Médicaments vétérinaires | 1 924 622 | -308 831 | 1 615 791 |
| Total des revenus prévus – Année 2 | 165 061 297 | -12 432 438 | 152 628 859 |
| Total | |||
|---|---|---|---|
| 2021-2022 | Revenus prévus sans l’application des mesures d’atténuation | Application des mesures d’atténuation destinées aux PE | Revenus prévus avec l’application des mesures d’atténuation |
| Médicaments à usage humain | 147 121 755 | -8 033 134 | 139 088 621 |
| Instruments médicaux | 35 270 093 | -5 081 525 | 30 188 568 |
| Médicaments vétérinaires | 2 356 335 | -381 765 | 1 974 570 |
| Total des revenus prévus – Année 3 | 184 748 183 | -13 496 424 | 171 251 759 |
| Total | |||
|---|---|---|---|
| 2022-2023 | Revenus prévus sans l’application des mesures d’atténuation | Application des mesures d’atténuation destinées aux PE | Revenus prévus avec l’application des mesures d’atténuation |
| Médicaments à usage humain | 159 533 499 | -8 661 327 | 150 872 172 |
| Instruments médicaux | 36 587 029 | -5 258 128 | 31 328 901 |
| Médicaments vétérinaires | 2 778 409 | -452 904 | 2 325 505 |
| Total des revenus prévus – Année 4 | 198 898 937 | -14 372 359 | 184 526 577 |
Annexe E : Frais et normes de service pour les médicaments et les instruments médicaux (2019)
But
La présente annexe fournit des renseignements supplémentaires sur les frais et les normes de service pour les médicaments et les instruments médicaux. Les documents d’orientation seront mis à jour et diffusés en conséquence.
Calendrier de paiement des frais
Quel que soit le montant des frais, Santé Canada facturera la totalité des frais d’évaluation une fois que la présentation aura été acceptée pour examen. Si la présentation n’est pas acceptée pour examen, elle sera facturée à hauteur de 10 % des frais au moment de son rejet à l’étape de la présélection. Dans le cas des demandes qui ne sont assujetties à aucun délai de présélection ou pour lesquelles les normes de rendement sont très courtes, la facturation se poursuivra conformément à la pratique actuelle.
Stratégie visant les petites entreprises
Les sociétés qui répondent à la définition de « petite entreprise » du Secrétariat du Conseil du Trésor pourront demander de l’aide destinée aux petites entreprises. Pour être admissible, une société devra fournir à Santé Canada une déclaration certifiée attestant que la société répond à la définition. Les formulaires de présentation / demande de licence seront modifiés pour inclure cette option. Santé Canada conservera le pouvoir de demander des documents justificatifs, comme une ventilation du nombre de personnes employées au cours des 12 derniers mois ou des états financiers certifiés ou vérifiés qui attestent les revenus globaux de la société (y compris les filialesNote de bas de page 18).
Mesures d’atténuation
Si un produit a été publié dans la Liste des médicaments pour un besoin urgent en matière de santé publique, conformément à la réglementation visant l’accès à des drogues dans des circonstances exceptionnelles, la présentation doit inclure une note demandant l’exonération des frais d’évaluation préalable à la mise en marché. Santé Canada examinera la demande et inclura dans les documents de présélection un avis indiquant si la demande est approuvée ou rejetée.
Lors du développement de la définition de « établissements de soins de santé subventionnés par l’État », le ministère examinera les définitions existantes, comme celle décrite dans le Règlement sur les prix à payer à l’égard des drogues et instruments médicaux en vigueur : « Établissement qui fournit des services diagnostiques ou thérapeutiques à des patients. Est également visé tout groupement de tels établissements dont les activités relèvent d’une même entité administrative ». Les établissements de soins de santé subventionnés par l’État devront fournir la preuve qu’ils répondent à la définition, par exemple une déclaration certifiée du dirigeant de l’institution. Santé Canada examinera la demande et inclura dans les documents de présélection un avis indiquant si la demande est approuvée ou rejetée. Pour les frais liés au droit de vente, la trousse de notification annuelle comprendra des consignes sur la façon de présenter une demande d’exonération pour les établissements admissibles. Pour les licences d’établissement, il n’y a aucun changement par rapport à la pratique actuelle.
Calcul proportionnel des frais de licence d’établissement de produits pharmaceutiques
Le calcul proportionnel des frais de licence d'établissement de médicaments sera offert aux nouveaux demandeurs qui ne pourront plus bénéficier d’une remise des frais. Les frais facturés aux nouveaux demandeurs de licence d’établissement de médicaments seront calculés au prorata en fonction de la date à laquelle ils présentent leur demande durant l’exercice financier du gouvernement du Canada (du 1er avril au 31 mars).
| Date de la demande | Réduction des frais | Exemple |
|---|---|---|
| Entre le 1er avril et le 30 juin | 0 % | La société A, dont la totalité des frais s’élève à 10 000 $, présente une demande le 15 mai. Des frais de 10 000 $ lui seront facturés. |
| Entre le 1er juillet et le 30 septembre | 25 % | La société B, dont la totalité des frais s’élève à 10 000 $, présente une demande le 6 juillet. Des frais de 7 500 $ lui seront facturés. |
| Entre le 1er octobre et le 31 décembre | 50 % | La société C, dont la totalité des frais s’élève à 10 000 $, présente une demande le 10 octobre. Des frais de 5 000 $ lui seront facturés. |
| Entre le 1er janvier et le 31 mars | 75 % | La société D, dont la totalité des frais s’élève à 10 000 $, présente une demande le 31 mars. Des frais de 2 500 $ lui seront facturés. |
Le calcul proportionnel des frais s’applique seulement aux nouveaux demandeurs de licence d’établissement de médicaments. Lors du renouvellement de la licence les années subséquentes, les frais applicables seront facturés en entier.
Rapports sur le rendement
Les renseignements sur le rendement, les coûts et les revenus seront communiqués conformément aux consignes du Secrétariat du Conseil du Trésor; ces renseignements sont actuellement communiqués dans le Rapport sur les résultats ministériels.
Disposition relative aux pénalités
Les frais liés à toutes les demandes, licences et décisions qui ne sont pas traitées avant l’échéance de la norme de rendement établie seront réduits de 25 %. Cette remise sera portée au crédit du compte de la société.
La Ligne directrice sur la gestion des présentations de drogues, le document Gestion des demandes d’homologation d’instruments médicaux et d’autorisation d’essais expérimentaux et les directives complémentaires pour les licences d’établissement comprendront des renseignements détaillés sur les dispositions « temps de pause »Note de bas de page 19. Certains types de présentations seront exemptés de la disposition relative aux pénalités, notamment les examens conjoints, les examens parallèles et les produits mixtes médicaments/matériels médicaux.
Rajustement annuel
Chaque année, le 1er avril, les frais seront rajustés en fonction de l’Indice des prix à la consommation (IPC). L’augmentation des frais se fondera sur l’IPC d’ensemble (c.-à-d. le panier global, en ne retirant aucun secteur) pour l’année précédente. Elle sera calculée d’après l’augmentation en pourcentage de l’IPC d’une année à l’autre. Si l’IPC venait à chuter au cours de l’année, il n’y aurait aucun rajustement en fonction de l’inflation pour l’année en question.
Exemple : En mars 2018, l’IPC d’ensemble était de 132,9. En mars 2017, il était de 129,9. D’après ces données, l’augmentation des frais pour l’année suivante serait de ((132,9 / 129,9) – 1)*100 = 2,3 %.
Les rajustements seront cumulatifs d’une année à l’autre. Par exemple, les frais pour 2022-2023 seront rajustés en fonction de l’IPC de 2020-2021, puis rajustés de nouveau en fonction de l’IPC de 2021-2022.
| Année | 2019-2020 | 2020-2021 | 2021-2022 | 2022-2023 |
|---|---|---|---|---|
| Frais publiés (pas encore rajustés en fonction de l’IPC) | 1 800 $ | 2 700 $ | 4 000 $ | 4 587 $ |
| IPC cumulatif | S.O. | 2 700 $ + IPC de 2019-2020 | 4 000 $ + IPC de 2019-2020 + IPC de 2020-2021 | 4 587 $ + IPC de 2019-2020 + IPC de 2020-2021 + IPC de 2021-2022 |
| Échantillon de l’IPC | S.O. | 2,2 | 1,9 | 2,1 |
| Formule | S.O. | 2 700 $ x 1,022 | 4 000 $ x 1,022 x 1,019 | 4 587 $ x 1,022 x 1,019 x 1,021 |
| Montants potentiels des frais | 1 800 $ | 2 759 $ | 4 166 $ | 4 877 $ |
Processus
Santé Canada affichera ses frais rajustés en novembre de chaque année, dans le but d'informer les intervenants 4 à 5 mois à l'avance de l'augmentation exacte des frais. Le calendrier proposé est le suivant :
Août : L'IPC est publié par Statistique Canada.
Août : Santé Canada calcule l'augmentation des frais et prépare les documents nécessaires pour afficher les frais.
Novembre : Les changements sont soumis à la Gazette du Canada.
Décembre : L'augmentation des frais est publiée.
1er avril : Les frais rajustés prennent effet.
Participation des intervenants
Chaque année, Santé Canada invitera les intervenants à se réunir et à discuter des questions d'intérêt associées aux frais, notamment le rendement, les coûts, les revenus, les mesures de limitation des coûts ainsi que les changements potentiels apportés aux frais. Les ordres du jour et les comptes rendus de discussion seront publiés en ligne, et les intervenants seront en mesure de participer en personne ou par le biais de WebEx, si possible.
Frais et normes de rendement
Remarque : Tous les frais pour 2020-2021 et les années subséquentes devront être rajustés en fonction d'un IPC cumulatif; les frais réels qui devront être payés ne seront pas les mêmes que ceux publiés dans ces tableaux et seront fonction des taux de l'IPC au cours des prochaines années.
| Appellation des frais | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Norme de rendement |
|---|---|---|---|---|---|---|
| Classe II – Demande de licence | Demande de licence pour instruments médicaux de classe II. | 441 $ | 468 $ | 495 $ | 522 $ | 15 jours civils pour traiter la demande |
| Classe II – Modification de la licence | Demande de modification de licence pour instruments médicaux de classe II. | 266 $ | 266 $ | 266 $ | 266 $ | 15 jours civils pour traiter la demande |
| Classe III – Demande de licence | Demande de licence pour instruments médicaux de classe III. | 7 330 $ | 8 737 $ | 10 144 $ | 11 551 $ | 60 jours civils pour terminer l’examen 1 |
| Classe III – Demande de licence (clinique) | Demande de licence pour instruments médicaux de classe III pour un instrument diagnostique clinique in vitro. | 12 599 $ | 15 749 $ | 19 687 $ | 24 609 $ | 60 jours civils pour terminer l’examen 1 |
| Classe III – Modification des procédés de fabrication | Modification des procédés de fabrication, au niveau des installations, de l’équipement ou des procédures de contrôle de la qualité. | 1 865 $ | 2 332 $ | 2 915 $ | 3 644 $ | 60 jours civils pour terminer l’examen 1 |
| Classe III – Changements importants | Changements importants – classe III (non liés aux procédés de fabrication). | 6 478 $ | 7 409 $ | 8 341 $ | 9 272 $ | 60 jours civils pour terminer l’examen 1 |
| Classe IV – Demande de licence | Demande de licence pour instruments médicaux de classe IV. | 23 867 $ | 24 262 $ | 24 657 $ | 25 052 $ | 75 jours civils pour terminer l’examen 1 |
| Classe IV – Modification des procédés de fabrication | Modifications visées à l’alinéa 34a) du Règlement sur les instruments médicaux concernant les procédés de fabrication. | 1 865 $ | 2 332 $ | 2 915 $ | 3 644 $ | 75 jours civils pour terminer l’examen 1 |
| Classe IV – Changements importants (non liés aux procédés de fabrication) | Toute autre modification visée à l’alinéa 34a) et b) du Règlement sur les instruments médicaux. | 7 899 $ | 9 787 $ | 11 521 $ | 13 255 $ | 75 jours civils pour terminer l’examen 1 |
| Demandes d’homologation pour les instruments médicaux de marque privée et modifications | Demandes de licences nouvelles ou modifiées pour des instruments médicaux de marque privée. | 144 $ | 144 $ | 144 $ | 144 $ | 15 jours civils pour traiter la demande |
| Appellation des frais | Description | Frais de 2019-2020 | Norme de rendement |
|---|---|---|---|
| Licence d'établissement d'instruments médicaux | Demandes d'une nouvelle licence ou du renouvellement de licence. | 4 500 $ | 120 jours civils pour délivrer une décision |
| Appellation des frais | Description | Frais de 2019-2020 | Norme de rendement |
|---|---|---|---|
| Droit de vente d’instruments médicaux | Frais annuels pour le droit de continuer à vendre un instrument médical sur le marché canadien. | 373 $ | 20 jours pour mettre à jour la base de données de la liste des instruments médicaux homologués après avoir reçu un avis annuel complet |
| Appellation des frais | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Norme de rendement |
|---|---|---|---|---|---|---|
| Nouvelle substance active | Présentations à l’appui d’un médicament, à l’exclusion d’un désinfectant, contenant un ingrédient médicinal jamais approuvé dans un médicament pour la vente au Canada et ne constituant pas une variante d’un ingrédient médicinal déjà approuvé, notamment un sel, un ester, un énantiomère, un solvate ou un polymorphe. | 392 439 $ | 429 298 $ | 466 157 $ | 503 016 $ | 300 jours civils pour terminer l’examen 1 |
| Données cliniques ou non cliniques et données sur la chimie et la fabrication | Présentations fondées sur des données cliniques ou non cliniques et des données sur la chimie et la fabrication d’un médicament exempt de nouvelle substance active. | 200 193 $ | 220 285 $ | 240 377 $ | 260 468 $ | Titre 1 – 210 jours civils Titre 8 – 300 jours civils pour terminer l’examen 1 |
| Données cliniques ou non cliniques seulement | Présentations fondées uniquement sur des données cliniques ou non cliniques pour un médicament exempt de nouvelle substance active. | 89 082 $ | 94 104 $ | 99 127 $ | 104 149 $ | Titre 1 – 210 jours civils Titre 8 – 300 jours civils pour terminer l’examen 1 |
| Études comparatives | Présentations fondées sur des études comparatives sur la biodisponibilité, la pharmacodynamique ou des études cliniques avec ou sans données sur la chimie et la fabrication pour un médicament exempt de nouvelle substance active. | 52 780 $ | 54 752 $ | 56 724 $ | 58 696 $ | Titre 1 – 210 jours civils Titre 8 – 180 jours civils pour terminer l’examen 1 |
| Données sur la chimie et la fabrication seulement | Présentations fondées uniquement sur les données sur la chimie et la fabrication pour un médicament exempt de nouvelle substance active. | 27 046 $ | 30 068 $ | 33 090 $ | 36 112 $ | Titre 1 – 210 jours civils Titre 8 – 180 jours civils pour terminer l’examen 1 |
| Données cliniques ou non cliniques seulement, à l’appui des mises à jour d’innocuité concernant l’étiquetage | Présentations fondées uniquement sur des données cliniques ou non cliniques, à l’appui des mises à jour d’innocuité concernant le matériel d’étiquetage, pour un médicament visé au titre 8 qui est exempt de nouvelle substance active. | 19 060 $ | 19 060 $ | 19 060 $ | 19 060 $ | 120 jours civils |
| Étiquetage seulement | Les présentations de matériel d'étiquetage, y compris les données à l'appui d'une évaluation du nom de marque, des méthodes d'essai normalisées/publiées ou données in vitro/in vivo sur la photostabilité ou modifications apportées aux noms de marque pour les demandes de produits sans ordonnance ayant un numéro DIN, (mais n'incluant pas d'autres données cliniques ou non cliniques, données comparatives ou données sur la chimie et la fabrication); ne s'appliquent pas aux désinfectants ni aux présentations à l'appui d'une norme d'étiquetage. | 3 741 $ | 4 243 $ | 4 746 $ | 5 248 $ | Titre 1 – 180 jours civils Titre 8 – 60 jours civils pour terminer l’examen 1 |
| Étiquetage seulement (générique) | Présentations à l’appui des changements apportés à l’étiquetage doivent être conformes au produit de référence canadien, ce qui ne comprend pas d’autres mises à jour d’étiquetage nécessitant une évaluation de l’étiquetage. | 1 970 $ | 1 970 $ | 1 970 $ | 1 970 $ | 90 jours civils/60 jours civils pour terminer l’examen 1 |
| Présentation administrative | Présentations à l’appui d’un changement apporté au nom du fabricant ou au nom du produit à la suite de changements de propriété du produit, d’une fusion ou d’un rachat; lorsque les fabricants demandent un nom de produit supplémentaire (même produit et fournisseur), et lorsque deux fabricants concluent un accord de licence (y compris les changements d’étiquette après autorisation dont la demande provient des titulaires de licence pour respecter le produit du concédant et mises à jour des données sur la chimie et la fabrication suite à l’autorisation accordée pour les produits visés aux annexes C et D du Règlement) qui n’exigent pas d’examen du matériel d’étiquetage ou du nom de marque. | 423 $ | 529 $ | 662 $ | 828 $ | 45 jours civils pour terminer l’examen 1 |
| Désinfectant – Examen complet | Présentations et demandes qui comprennent des données à l’appui d’un désinfectant (plus que l’étiquetage seulement. | 5 600 $ | 7 000 $ | 8 750 $ | 10 938 $ | Titre 1 – 210 jours civils Titre 8 – 300 jours civils pour terminer l’examen 1 |
| Étiquetage seulement (désinfectant) | Présentations de matériel d’étiquetage à l’appui de modifications apportées au DIN dans les cas où aucune preuve à l’appui n’est requise; à l’appui des mises à jour d’innocuité concernant un désinfectant visé au titre 8; ou à l’appui d’un changement de nom du fabricant ou du produit qui doit être traité en dehors du volet administratif (c.-à-d. nécessite un examen du matériel d’étiquetage en raison d’écarts par rapport à l’étiquetage ou au produit préalablement autorisé). | 2 457 $ | 2 457 $ | 2 457 $ | 2 457 $ | 90 jours civils pour terminer l’examen 1 |
| Identification numérique de drogue – Norme d’étiquetage | Demandes qui attestent la conformité à une norme d’étiquetage ou à une monographie de catégorie IV pour un médicament et qui ne comprennent pas de données cliniques ou non cliniques ou de données sur la chimie et la fabrication. Il faut mener un examen de l’étiquette et une évaluation du nom de marque (ne comprend pas les données à l’appui d’une évaluation du nom de marque). | 1 584 $ | 1 584 $ | 1 584 $ | 1 584 $ | 60 jours civils pour terminer l’examen 1 |
| Appellation des frais | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Norme de rendement |
|---|---|---|---|---|---|---|
| Examen annuel de la licence | Demandes d’une nouvelle licence ou du renouvellement de licence. | - | - | - | - | 250 jours civils pour délivrer une décision |
| Fabricant de produits stériles | - | 40 809 $ | 40 911 $ | 41 013 $ | 41 114 $ | |
| Fabricant de produits non stériles | - | 26 470 $ | 27 807 $ | 29 144 $ | 30 481 $ | |
| Emballeur et étiqueteur | - | 5 942 $ | 5 942 $ | 5 942 $ | 5 942 $ | |
| Importateur | - | 26 822 $ | 28 463 $ | 30 104 $ | 31 745 $ | |
| Distributeur | - | 12 313 $ | 13 609 $ | 14 906 $ | 16 202 $ | |
| Grossiste | - | 4 840 $ | 6 050 $ | 7 563 $ | 9 454 $ | |
| Testeur | - | 2 509 $ | 3 137 $ | 3 922 $ | 4 903 $ | |
| Site étranger (chacun) | - | 900 $ | 900 $ | 900 $ | 900 $ |
| Appellation des frais | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Norme de rendement |
|---|---|---|---|---|---|---|
| Droit de vente d’un médicament | Frais annuels pour le droit de maintenir un médicament sur le marché canadien. | - | - | - | - | 20 jours civils pour mettre à jour la base de données sur les produits pharmaceutiques après réception d’un avis annuel complet |
| Médicament sur ordonnance | - | 1 800 $ | 2 700 $ | 4 000 $ | 4 587 $ | |
| Médicament sans ordonnance | - | 1 591 $ | 1 982 $ | 2 373 $ | 2 764 $ | |
| Désinfectant | - | 1 259 $ | 1 317 $ | 1 375 $ | 1 433 $ |
| Appellation des frais | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Norme de rendement |
|---|---|---|---|---|---|---|
| Droit de vente d’un médicament vétérinaire | Frais annuels pour le droit de maintenir un médicament vétérinaire sur le marché canadien. | 305 $ | 359 $ | 413 $ | 467 $ | 20 jours civils pour mettre à jour la base de données sur les produits pharmaceutiques après réception d’un avis annuel complet |
Évaluation des présentations de médicaments vétérinaires
| Nombre | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Frais de 2023-2024 | Frais de 2024-2025 | Frais de 2025-2026 | Norme de rendement |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Avis sur un produit de santé vétérinaire | 476 $ | 476 $ | 476 $ | 476 $ | 476 $ | 476 $ | 476 $ | 30 jours civils pour terminer l’examen |
| Nombre | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Frais de 2023-2024 | Frais de 2024-2025 | Frais de 2025-2026 | Norme de rendement |
|---|---|---|---|---|---|---|---|---|---|
| - | Présentations de drogues nouvelles (PDN) | 300 jours civils pour terminer l’examen 1 | |||||||
| 1 | Données sur l’efficacité et l’innocuité (pour l’espèce visée) à l’appui d’une voie d’administration, d’une forme posologique et d’une indication thérapeutique chez une espèce animale. Dans le cas d’un médicament antiparasitaire, plusieurs indications thérapeutiques chez une espèce animale destinée à l’alimentation. | 19 975 $ | 24 969 $ | 31 212 $ | 37 287 $ | 42 614 $ | 47 941 $ | 53 267 $ | |
| 2 | Données sur l’efficacité et l’innocuité (pour l’espèce visée) à l’appui d’une voie d’administration et d’une forme posologique pour un médicament antiparasitaire chez une espèce animale non destinée à l’alimentation. | 12 100 $ | 15 125 $ | 18 907 $ | 22 587 $ | 25 814 $ | 29 041 $ | 32 267 $ | |
| 3 | Données sur l’efficacité et l’innocuité (pour l’espèce visée) à l’appui d’une voie d’administration, d’une forme posologique et d’une indication thérapeutique chez deux espèces animales ou d’une voie d’administration, d’une forme posologique et de deux indications thérapeutiques chez une espèce animale. | 29 050 $ | 36 313 $ | 45 392 $ | 54 227 $ | 61 974 $ | 69 721 $ | 77 467 $ | |
| 4 | Données sur l’efficacité et l’innocuité (pour l’espèce visée) à l’appui d’une indication thérapeutique touchant la stimulation de la croissance ou l’augmentation de la production chez une espèce animale. | 39 338 $ | 49 173 $ | 61 467 $ | 73 430 $ | 83 920 $ | 94 410 $ | 104 900 $ | |
| 5 | Données comparatives (pharmacodynamiques, cliniques ou relatives à la biodisponibilité) à l’appui d’une voie d’administration additionnelle. (En sus de la voie d’administration mentionnée aux articles 1, 2 ou 3.) | 3 625 $ | 4 532 $ | 5 665 $ | 6 767 $ | 7 734 $ | 8 701 $ | 9 667 $ | |
| 6 | Données comparatives (pharmacodynamiques, cliniques ou relatives à la biodisponibilité) à l’appui de chaque concentration additionnelle. (Une étude à l’appui de plusieurs concentrations peut accompagner une présentation de drogue nouvelle, en vertu des articles 1, 2 ou 3, sans paiement de ces frais.) |
600 $ | 750 $ | 938 $ | 1 120 $ | 1 280 $ | 1 440 $ | 1 600 $ | |
| 7 | Dans le cas d’animaux destinés à l’alimentation, études sur la toxicité, le métabolisme et la déplétion des résidus servant à établir une dose journalière admissible avec un facteur de sécurité de 1 000, une limite maximale de résidu et une période de retrait pour une forme posologique, une posologie et une voie d’administration chez une espèce. |
27 238 $ | 34 048 $ | 42 560 $ | 50 844 $ | 58 107 $ | 65 370 $ | 72 633 $ | |
| 8 | Dans le cas d’animaux destinés à l’alimentation, études sur la toxicité, le métabolisme et la déplétion des résidus servant à établir une dose journalière admissible avec un facteur de sécurité de moins de 1 000, une limite maximale de résidu et une période de retrait pour une forme posologique, une posologie et une voie d’administration chez une espèce. | 36 313 $ | 45 392 $ | 56 740 $ | 67 784 $ | 77 467 $ | 87 150 $ | 96 833 $ | |
| 9 | Dans le cas d’animaux destinés à l’alimentation, études sur la déplétion des résidus servant à établir une période de retrait pour une forme posologique, une posologie ou une voie d’administration additionnelles. | 3 625 $ | 4 532 $ | 5 665 $ | 6 767 $ | 7 734 $ | 8 701 $ | 9 667 $ | |
| 10 | Dans le cas d’animaux destinés à l’alimentation (une fois la dose journalière admissible avec un facteur de sécurité de 1 000 ou moins établie), études sur le métabolisme et la déplétion des résidus servant à établir une limite maximale de résidu et une période de retrait pour une forme posologique, une posologie et une voie d’administration chez une espèce additionnelle. | 18 150 $ | 22 688 $ | 28 360 $ | 33 880 $ | 38 720 $ | 43 560 $ | 48 400 $ | |
| 11 | Données sur la chimie et la fabrication d’un ingrédient médicinal non officinal d’un médicament. (Un ingrédient médicinal qui, au cours des trois dernières années, a déjà fait l’objet d’une évaluation dans une autre présentation à laquelle il est fait référence n’est pas à réévaluer). | 6 050 $ | 7 563 $ | 9 454 $ | 11 294 $ | 12 907 $ | 14 520 $ | 16 133 $ | |
| 12 | Données sur la chimie et la fabrication à l’appui d’une concentration d’une forme posologique. | 6 050 $ | 7 563 $ | 9 454 $ | 11 294 $ | 12 907 $ | 14 520 $ | 16 133 $ | |
| 13 | Données sur la chimie et la fabrication à l’appui d’une concentration additionnelle d’une forme posologique soumise en même temps que la composante visée à l’article 12. | 3 025 $ | 3 782 $ | 4 728 $ | 5 647 $ | 6 454 $ | 7 261 $ | 8 067 $ | |
| 14 | Documentation à l’appui d’un changement de fabricant. (Cet article s’applique seulement aux présentations de drogue nouvelle qui ne comportent aucune des composantes prévues aux articles 1 à 13). | 313 $ | 392 $ | 490 $ | 584 $ | 667 $ | 750 $ | 833 $ | |
| Nombre | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Frais de 2023-2024 | Frais de 2024-2025 | Frais de 2025-2026 | Norme de rendement |
|---|---|---|---|---|---|---|---|---|---|
| - | Supplément à une présentation de drogue nouvelle (SPDN) | 240 jours civils pour terminer l'examen 1 | |||||||
| 1 | Données sur l’efficacité à l’appui d’une indication thérapeutique additionnelle chez une espèce animale. | 15 738 $ | 19 673 $ | 24 592 $ | 29 377 $ | 33 574 $ | 37 771 $ | 41 967 $ | |
| 2 | Données sur l’efficacité et l’innocuité (pour l’espèce visée) à l’appui d’une voie d’administration et d’une forme posologique pour un médicament antiparasitaire chez une espèce animale non destinée à l’alimentation. | 12 100 $ | 15 125 $ | 18 907 $ | 22 587 $ | 25 814 $ | 29 041 $ | 32 267 $ | |
| 3 | Données sur l’efficacité et l’innocuité (pour l’espèce visée) à l’appui d’une indication thérapeutique chez une autre espèce animale. | 19 975 $ | 24 969 $ | 31 212 $ | 37 287 $ | 42 614 $ | 47 941 $ | 53 267 $ | |
| 4 | Données sur l’efficacité et l’innocuité (pour l’espèce visée) à l’appui d’une voie d’administration, d’une forme posologique et d’une indication thérapeutique chez deux espèces animales ou d’une voie d’administration, d’une forme posologique et de deux indications thérapeutiques chez une espèce animale. | 29 050 $ | 36 313 $ | 45 392 $ | 54 227 $ | 61 974 $ | 69 721 $ | 77 467 $ | |
| 5 | Données sur l’efficacité et l’innocuité (pour l’espèce visée) à l’appui d’une indication thérapeutique touchant la stimulation de la croissance ou l’augmentation de la production chez une espèce animale. | 39 338 $ | 49 173 $ | 61 467 $ | 73 430 $ | 83 920 $ | 94 410 $ | 104 900 $ | |
| 6 | Données sur l’efficacité et l’innocuité (pour l’espèce visée) à l’appui de l’administration simultanée de deux drogues approuvées pour la même espèce animale. | 9 675 $ | 12 094 $ | 15 118 $ | 18 060 $ | 20 640 $ | 23 220 $ | 25 800 $ | |
| 7 | Données comparatives (pharmacodynamiques, cliniques ou relatives à la biodisponibilité) à l’appui d’une voie d’administration additionnelle. (En sus de la voie d’administration mentionnée aux articles 2 ou 4.) |
3 625 $ | 4 532 $ | 5 665 $ | 6 767 $ | 7 734 $ | 8 701 $ | 9 667 $ | |
| 8 | Données comparatives pharmacodynamiques, cliniques ou relatives à la biodisponibilité) à l’appui de chaque concentration additionnelle. (Une étude à l’appui de plusieurs concentrations peut accompagner le supplément à une présentation de drogue nouvelle, en vertu des articles 1, 2 ou 3, sans paiement du prix visé à l’article 8.) |
600 $ | 750 $ | 938 $ | 1 120 $ | 1 280 $ | 1 440 $ | 1 600 $ | |
| 9 | Dans le cas d’animaux destinés à l’alimentation, études sur la déplétion des résidus servant à établir une nouvelle période de retrait lors d’un changement dans la posologie ou la voie d’administration d’une forme posologique approuvée pour une espèce. | 3 625 $ | 4 532 $ | 5 665 $ | 6 767 $ | 7 734 $ | 8 701 $ | 9 667 $ | |
| 10 | Dans le cas d’animaux destinés à l’alimentation, études sur le métabolisme et la déplétion des résidus servant à établir une limite maximale de résidu et une période de retrait pour une posologie et une voie d’administration d’une forme posologique approuvée chez une espèce additionnelle. | 18 150 $ | 22 688 $ | 28 360 $ | 33 880 $ | 38 720 $ | 43 560 $ | 48 400 $ | |
| 11 | Dans le cas d’animaux destinés à l’alimentation, études sur la toxicité à l’appui d’un changement apporté à une dose journalière admissible établie, à une limite maximale de résidu et à une période de retrait. | 9 075 $ | 11 344 $ | 14 180 $ | 16 940 $ | 19 360 $ | 21 780 $ | 24 200 $ | |
| 12 | Dans le cas de l’administration simultanée de deux drogues chez une espèce animale destinée à l’alimentation, études sur la déplétion des résidus servant à déterminer s’il faut prolonger les périodes de retrait existantes. | 7 263 $ | 9 079 $ | 11 349 $ | 13 557 $ | 15 494 $ | 17 431 $ | 19 367 $ | |
| 13 | Données sur la chimie et la fabrication à l’appui d’un changement dans la source ou le mode de fabrication d’un ingrédient médicinal non officinal ou de son procédé de fabrication. | 6 050 $ | 7 563 $ | 9 454 $ | 11 294 $ | 12 907 $ | 14 520 $ | 16 133 $ | |
| 14 | Données sur la chimie et la fabrication à l’appui d’un changement dans la formulation ou la forme posologique. | 3 025 $ | 3 782 $ | 4 728 $ | 5 647 $ | 6 454 $ | 7 261 $ | 8 067 $ | |
| 15 | Données sur la chimie et la fabrication à l’appui d’un changement dans la méthode de conditionnement ou de stérilisation. | 2 413 $ | 3 017 $ | 3 772 $ | 4 504 $ | 5 147 $ | 5 790 $ | 6 433 $ | |
| 16 | Données sur la chimie et la fabrication à l’appui du prolongement de la date de péremption. | 1 813 $ | 2 267 $ | 2 834 $ | 3 384 $ | 3 867 $ | 4 350 $ | 4 833 $ | |
| 17 | Données sur la chimie et la fabrication à l’appui de l’administration simultanée de deux drogues. | 1 813 $ | 2 267 $ | 2 834 $ | 3 384 $ | 3 867 $ | 4 350 $ | 4 833 $ | |
| 18 | Données sur la chimie et la fabrication à l’appui d’un changement dans le lieu de fabrication de la forme posologique des préparations injectables ou stériles. | 600 $ | 750 $ | 938 $ | 1 120 $ | 1 280 $ | 1 440 $ | 1 600 $ | |
| 19 | Documentation à l’appui d’un changement de nom du fabricant ou de la marque nominative de la drogue. (Cet article s’applique seulement au supplément à une présentation de drogue nouvelle qui ne comporte aucune des composantes prévues aux articles 1 à 18.) | 313 $ | 392 $ | 490 $ | 584 $ | 667 $ | 750 $ | 833 $ | |
| Nombre | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Frais de 2023-2024 | Frais de 2024-2025 | Frais de 2025-2026 | Norme de rendement |
|---|---|---|---|---|---|---|---|---|---|
| - | Présentation abrégée de drogue nouvelle (PADN) et supplément à une telle présentation | PADN = 300 jours civils pour terminer l’examen 1 SPADN = 240 jours civils pour terminer l’examen 1 |
|||||||
| 1 | Données comparatives (pharmacodynamiques, cliniques ou relatives à la biodisponibilité) à l’appui d’une voie d’administration et d’une forme posologique. | 3 625 $ | 4 532 $ | 5 665 $ | 6 767 $ | 7 734 $ | 8 701 $ | 9 667 $ | |
| 2 | Dans le cas d’animaux destinés à l’alimentation, études sur la déplétion des résidus servant à confirmer que les périodes de retrait pour chaque espèce satisfont aux conditions d’utilisation du produit de référence canadien. | 3 625 $ | 4 532 $ | 5 665 $ | 6 767 $ | 7 734 $ | 8 701 $ | 9 667 $ | |
| 3 | Données sur la chimie et la fabrication d’un ingrédient médicinal non officinal d’un médicament. (Un ingrédient médicinal qui, au cours des trois dernières années, a déjà fait l’objet d’une évaluation dans une autre présentation à laquelle il est fait référence n’est pas à réévaluer). | 6 050 $ | 7 563 $ | 9 454 $ | 11 294 $ | 12 907 $ | 14 520 $ | 16 133 $ | |
| 4 | Données sur la chimie et la fabrication à l’appui d’une forme posologique. | 6 050 $ | 7 563 $ | 9 454 $ | 11 294 $ | 12 907 $ | 14 520 $ | 16 133 $ | |
| 5 | Changement de nom du fabricant ou de la marque nominative de la drogue (s’applique seulement lorsqu’une présentation abrégée ne comporte aucune des composantes prévues). | 313 $ | 392 $ | 490 $ | 584 $ | 667 $ | 750 $ | 833 $ | |
| Nombre | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Frais de 2023-2024 | Frais de 2024-2025 | Frais de 2025-2026 | Norme de rendement |
|---|---|---|---|---|---|---|---|---|---|
| - | Identification numérique de médicament | 120 jours civils pour terminer l'examen 1 | |||||||
| 1 | Renseignements, autres que ceux visés à l’article 2, à l’appui d’une demande de DIN, y compris la présentation du matériel d’étiquetage pour un second examen, au besoin. | 900 $ | 1 125 $ | 1 407 $ | 1 680 $ | 1 920 $ | 2 160 $ | 2 400 $ | |
| 2 | Références publiées ou autres données. | 625 $ | 782 $ | 978 $ | 1 167 $ | 1 334 $ | 1 501 $ | 1 667 $ | |
| 3 | Documentation à l’appui d’un changement de fabricant ou d’un changement de nom du fabricant ou de la marque nominative du médicament. Cet article s’applique seulement aux demandes de DIN qui ne comportent aucune des composantes prévues aux articles 1 ou 2.) | 313 $ | 392 $ | 490 $ | 584 $ | 667 $ | 750 $ | 833 $ | |
| Nombre | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Frais de 2023-2024 | Frais de 2024-2025 | Frais de 2025-2026 | Norme de rendement |
|---|---|---|---|---|---|---|---|---|---|
| - | Présentation préclinique de nouvelle drogue | 60 jours civils pour examiner la demand | |||||||
| 1 | Données sur l’efficacité et l’innocuité (pour l’espèce visée) et protocole à l’appui de la réalisation d’études cliniques portant sur une forme posologique, une voie d’administration et une indication thérapeutique chez une espèce. | 6 050 $ | 7 563 $ | 9 454 $ | 11 294 $ | 12 907 $ | 14 520 $ | 16 133 $ | |
| 2 | Données sur l’efficacité et protocole à l’appui de la réalisation d’études cliniques portant sur une voie d’administration et une indication thérapeutique dans le cas d’une forme posologique pour laquelle un avis de conformité a été délivré pour administration à l’espèce à traiter. |
4 838 $ | 6 048 $ | 7 560 $ | 9 030 $ | 10 320 $ | 11 610 $ | 12 900 $ | |
| 3 | Dans le cas d’animaux destinés à l’alimentation, études sur la toxicité, le métabolisme et la déplétion des résidus servant à établir une dose journalière admissible temporaire, une limite maximale de résidu et une période de retrait pour une forme posologique, une posologie et une voie d’administration chez une espèce. |
18 150 $ | 22 688 $ | 28 360 $ | 33 880 $ | 38 720 $ | 43 560 $ | 48 400 $ | |
| 4 | Dans le cas d’animaux destinés à l’alimentation, études sur la toxicité, le métabolisme et la déplétion des résidus servant à établir une dose journalière admissible avec un facteur de sécurité de 1 000, une limite maximale de résidu et une période de retrait pour une forme posologique, une posologie et une voie d’administration chez une espèce. |
27 238 $ | 34 048 $ | 42 560 $ | 50 844 $ | 58 107 $ | 65 370 $ | 72 633 $ | |
| 5 | Dans le cas d’animaux destinés à l’alimentation, études sur la toxicité, le métabolisme et la déplétion des résidus servant à établir une dose journalière admissible avec un facteur de sécurité de moins de 1 000, une limite maximale de résidu et une période de retrait pour une forme posologique, une posologie et une voie d’administration chez une espèce. | 36 313 $ | 45 392 $ | 56 740 $ | 67 784 $ | 77 467 $ | 87 150 $ | 96 833 $ | |
| 6 | Dans le cas d’animaux destinés à l’alimentation (une fois la dose journalière admissible avec un facteur de sécurité de 1 000 ou moins établie), études sur le métabolisme servant à établir une période de retrait pour une forme posologique, une posologie et une voie d’administration chez une espèce additionnelle. | 9 075 $ | 11 344 $ | 14 180 $ | 16 940 $ | 19 360 $ | 21 780 $ | 24 200 $ | |
| 7 | Données sur la chimie et la fabrication à l’appui d’une forme posologique contenant un ingrédient médicinal non officinal. (Un ingrédient médicinal qui, au cours des trois dernières années, a déjà fait l’objet d’une évaluation dans une autre présentation à laquelle il est fait référence n’est pas à réévaluer. Dans ce cas, le prix visé à l’article 8 s’applique). | 6 050 $ | 7 563 $ | 9 454 $ | 11 294 $ | 12 907 $ | 14 520 $ | 16 133 $ | |
| 8 | Données sur la chimie et la fabrication à l’appui d’une forme posologique contenant un ingrédient médicinal officinal. | 3 025 $ | 3 782 $ | 4 728 $ | 5 647 $ | 6 454 $ | 7 261 $ | 8 067 $ | |
| Nombre | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Frais de 2023-2024 | Frais de 2024-2025 | Frais de 2025-2026 | Norme de rendement |
|---|---|---|---|---|---|---|---|---|---|
| - | Changement à la déclaration obligatoire ou à l'évaluation de protocole | 90 jours civils pour examiner la demande | |||||||
| 1 | Renseignements et matériel à l’appui d’une demande pour un changement à la déclaration obligatoire. | 1 625 $ | 2 032 $ | 2 540 $ | 3 034 $ | 3 467 $ | 3 900 $ | 4 333 $ | |
| 2 | Demande pour l’évaluation de renseignements scientifiques séparément d’une présentation de médicament régulière (p. ex., évaluation d’un protocole d’une étude proposée). | 1 625 $ | 2 032 $ | 2 540 $ | 3 034 $ | 3 467 $ | 3 900 $ | 4 333 $ | |
| Nombre | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Frais de 2023-2024 | Frais de 2024-2025 | Frais de 2025-2026 | Norme de rendement |
|---|---|---|---|---|---|---|---|---|---|
| - | Certificat d'études expérimentales | 60 jours civils pour examiner la demande | |||||||
| 1 | Renseignements et matériel à l’appui de la délivrance d’un certificat d’études expérimentales pour une drogue qui sera administrée à un animal non destiné à l’alimentation. | 960 $ | 960 $ | 960 $ | 960 $ | 960 $ | 960 $ | 960 $ | |
| 2 | Renseignements et matériel à l’appui de la délivrance d’un certificat d’études expérimentales dont le protocole est le même que celui d’un certificat d’études expérimentales déjà approuvé pour un médicament qui sera administrée à un animal non destiné à l’alimentation. | 480 $ | 480 $ | 480 $ | 480 $ | 480 $ | 480 $ | 480 $ | |
| 3 | Renseignements et matériel à l’appui de la délivrance d’un certificat d’études expérimentales pour un médicament qui sera administrée à un animal destiné à l’alimentation. | 2 900 $ | 2 900 $ | 2 900 $ | 2 900 $ | 2 900 $ | 2 900 $ | 2 900 $ | |
| 4 | Renseignements et matériel à l’appui de la délivrance d’un certificat d’études expérimentales dont le protocole est le même que celui d’un certificat d’études expérimentales déjà approuvé pour un médicament qui sera administrée à un animal destiné à l’alimentation. | 480 $ | 480 $ | 480 $ | 480 $ | 480 $ | 480 $ | 480 $ | |
| Nombre | Description | Frais de 2019-2020 | Frais de 2020-2021 | Frais de 2021-2022 | Frais de 2022-2023 | Frais de 2023-2024 | Frais de 2024-2025 | Frais de 2025-2026 | Norme de rendement |
|---|---|---|---|---|---|---|---|---|---|
| - | Vente de médicament pour traitement d'urgence | 2 jours ouvrables pour examiner la demande | |||||||
| 1 | Renseignements et matériel à l’appui de la vente d’un médicament pour le traitement d’urgence d’un animal non destiné à l’alimentation. | 50 $ | 50 $ | 50 $ | 50 $ | 50 $ | 50 $ | 50 $ | |
| 2 | Renseignements et matériel à l’appui de la vente d’un médicament pour le traitement d’urgence d’un animal destiné à l’alimentation. | 100 $ | 100 $ | 100 $ | 100 $ | 100 $ | 100 $ | 100 $ | |