AUVI-Q information posologique
Principaux éléments de l'information posologique
Les éléments mentionnés ci-dessous ne comprennent pas tous les renseignements nécessaires pour utiliser AUVI-Q® de manière sûre et efficace. Voir l'information posologique complète d'AUVI-Q.
AUVI-Q® (épinéphrine injectable, USP) 0,3 mg; 0,15 mg; 0,1 mg
Auto-injecteur, pour utilisation intramusculaire ou sous-cutanée
Approbation initiale par les États-Unis : 1939
Changements majeurs récents
- Posologie et administration (2) 11-2017
Indications et utilisation
AUVI-Q contient de l'épinéphrine, un agoniste non sélectif des récepteurs alpha-adrénergiques et bêta-adrénergiques, indiquée dans le traitement d'urgence des réactions allergiques (type I), dont l'anaphylaxie. (1)
Posologie et administration
- Patients dont le poids est supérieur ou égal à 30 kg (66 lb) : AUVI-Q 0,3 mg (2)
- Patients de 15 à 30 kg (33 à 66 lb) : AUVI-Q 0,15 mg (2)
- Patients de 7,5 à 15 kg (16,5 à 33 lb) : AUVI-Q 0,1 mg (2)
Injecter AUVI-Q par voie intramusculaire ou sous-cutanée dans la partie antérolatérale de la cuisse, à travers les vêtements si nécessaire. Chaque auto-injecteur est un dispositif à usage unique. (2)
Formes posologiques et concentrations
- Injection, 0,3 mg : épinéphrine injectable 0,3 mg/0,3 ml, USP, auto-injecteur prérempli (3)
- Injection, 0,15 mg : épinéphrine injectable 0,15 mg/0,15 ml, USP, auto-injecteur prérempli (3)
- Injection, 0,1 mg : épinéphrine injectable 0,1 mg/0,1 ml, USP, auto-injecteur prérempli (3)
Contre-indications
Aucune. (4)
Mises en garde et précautions
- Après l'administration d'épinéphrine, obtenir immédiatement des soins médicaux ou hospitaliers. (5.1)
- Ne pas injecter par voie intraveineuse ou dans les fesses, les doigts, les mains ou les pieds. (5.2)
- Pour minimiser le risque de blessure due à l'injection, aviser les soignants de bien tenir la jambe de l'enfant ou du nourrisson et de limiter ses mouvements avant et pendant l'injection. (5.2)
- De rares cas d'infections graves de la peau et des tissus mous ont été signalés après l'injection d'épinéphrine. Aviser les patients d'obtenir des soins médicaux s'ils présentent des signes ou des symptômes d'infection au point d'injection. (5.3)
- La présence de sulfite dans ce produit ne doit pas en empêcher l'utilisation. (5.4)
- Administrer avec prudence chez les patients atteints de maladies cardiaques; peut aggraver l'angine de poitrine ou provoquer des arythmies ventriculaires. (5.5)
Effets indésirables
Les effets indésirables de l'épinéphrine incluent l'anxiété, l'appréhension, l'agitation, les tremblements, la faiblesse, les étourdissements, la transpiration, les palpitations, la pâleur, les nausées et vomissements, les céphalées et/ou les difficultés respiratoires. (6)
Pour signaler des EFFETS INDÉSIRABLES SOUPÇONNÉS, communiquer avec kaleo inc. Au 1-844-828-8472 ou avec la FDA au 1-800-FDA-1088 ou www.fda.gov/medwatch. (anglais seulement)
Interactions médicamenteuses
- Glucosides et diurétiques : surveiller l'apparition d'arythmies cardiaques. (7)
- Antidépresseurs tricycliques, inhibiteurs de la monoamine-oxydase, lévothyroxine sodique et certains antihistaminiques : accentuent les effets de l'épinéphrine. (7)
- Bêtabloquants : antagonistes des effets cardiostimulateurs et bronchodilatateurs de l'épinéphrine. (7)
- Alphabloquants : antagonistes des effets vasoconstricteurs et hypertenseurs de l'épinéphrine. (7)
- Alcaloïdes de l'ergot : peuvent renverser les effets vasopresseurs de l'épinéphrine. (7)
Utilisation chez des populations particulières
- Les personnes âgées peuvent présenter un risque accru de réactions indésirables. (5.5, 8.5)
Voir, à la partie 17, les CONSEILS À L'INTENTION DES PATIENTS ainsi que l'étiquetage destiné aux patients approuvé par la FDA.
Révisé : 2017-11-20
Renseignements d'ordonnance : contenu*
- 1 indications et utilisation
- 2 Posologie et administration
- 3 Formes posologiques et concentrations
- 4 Contre-indications
- 5 Mises en garde et précautions
- 6 Effets indésirables
- 7 Interactions médicamenteuses
- 8 Utilisation chez des populations particulières
- 10 Surdosage
- 11 Description
- 12 Pharmacologie clinique
- 13 Toxicologie non clinique
- 16 Conditionnement, entreposage et manipulation
- 17 Conseils à l'intention des patients
*Les sections ou sous-sections omises des renseignements d'ordonnance ne sont pas indiquées.
Renseignements d'ordonnance
1 Indications et utilisation
AUVI-Q® est indiqué dans le traitement d'urgence des réactions allergiques (type I), y compris les réactions anaphylactiques aux insectes piqueurs (p. ex., ordre des Hyménoptères, qui comprennent les abeilles, les guêpes, les frelons, les guêpes jaunes et les fourmis de feu) et mordeurs (p. ex, triatomes, moustiques), dans l'immunothérapie contre les allergènes, dont les aliments, les médicaments, les substances de diagnostic (p. ex., milieux de contraste radioactif), ainsi que dans le traitement de l'analphylaxie idiopathique ou l'anaphylaxie d'effort.
AUVI-Q est destiné à l'administration immédiate chez les patients qui présentent un risque accru d'anaphylaxie, notamment les personnes ayant des antécédents de réactions anaphylactiques.
Une réaction anaphylactique peut survenir quelques minutes après l'exposition et consiste en des bouffées vasomotrices, de l'appréhension, une syncope, de la tachycardie, un pouls filiforme ou impossible à obtenir associé à une chute de la tension artérielle, des convulsions, des vomissements, de la diarrhée et des crampes abdominales, des mictions involontaires, une respiration sifflante, de la dyspnée due à un spasme laryngé, un prurit, des éruptions cutanées, de l'urticaire ou un angio-œdème.
AUVI-Q est destiné à l'auto-administration immédiate uniquement en tant que thérapie de soutien d'urgence et n'est pas un substitut aux soins médicaux immédiats.
2 Posologie et administration
Le choix de la dose appropriée (AUVI-Q 0,3 mg, AUVI-Q 0,15 mg ou AUVI-Q 0,1 mg) est déterminé en fonction du poids corporel du patient.
- Patients pesant plus de 30 kg (environ 66 livres ou plus) : AUVI-Q 0,3 mg
- Patients de 15 à 30 kg (33 à 66 livres) : AUVI-Q 0,15 mg
- Patients de 7,5 à 15 kg (16,5 à 33 livres) : AUVI-Q 0,1 mg
Injecter AUVI-Q par voie intramusculaire ou sous-cutanée dans la partie antérolatérale de la cuisse, à travers les vêtements si nécessaire. Demander aux personnes qui s'occupent des jeunes enfants et des nourrissons à qui on a prescrit AUVI-Q et qui pourraient ne pas coopérer et donner des coups de pied ou bouger pendant l'injection, de tenir fermement la jambe de l'enfant en place et de limiter ses mouvements avant et pendant l'injection (voir MISES EN GARDE ET PRÉCAUTIONS [5.2]).
Chaque AUVI-Q est un auto-injecteur à usage unique qui contient une seule dose d'épinéphrine. Comme la dose d'épinéphrine injectée par AUVI-Q est fixe, il est préférable d'utiliser d'autres formes d'épinéphrine injectable si des doses inférieures à 0,1 mg sont jugées nécessaires.
Le médecin prescripteur doit évaluer soigneusement chaque patient afin de déterminer la dose d'épinéphrine la plus appropriée, en tenant compte de la nature potentiellement mortelle des réactions pour lesquelles ce médicament est indiqué. En cas d'anaphylaxie grave et persistante, il peut être nécessaire de répéter les injections avec un AUVI-Q supplémentaire. L'administration de plus de deux doses consécutives d'épinéphrine ne doit être effectuée que sous surveillance médicale directe (voir MISES EN GARDE ET PRÉCAUTIONS [5.1]).
Il faut inspecter la solution d'épinéphrine par la fenêtre du dispositif AUVI-Q pour s'assurer qu'elle ne contient pas de particules et n'a pas changé de couleur. L'épinéphrine est sensible à la lumière et doit être conservée à l'abri de la lumière dans le boîtier prévu à cet effet (voir ENTREPOSAGE ET MANIPULATION [16.2]).
3 Formes posologiques et concentrations
- Injection, 0,3 mg/0,3 ml épinéphrine injectable, USP, auto-injecteur prérempli
- Injection, 0,15 mg/0,15 ml épinéphrine injectable, USP, auto-injecteur prérempli
- Injection, 0,1 mg/0,1 ml épinéphrine injectable, USP, auto-injecteur prérempli
4 Contre-indications
Aucune.
5 Mises en garde et précautions
5.1 Traitement d'urgence
AUVI-Q n'est pas destiné à remplacer des soins médicaux immédiats. Après l'administration d'épinéphrine, le patient doit immédiatement obtenir des soins médicaux ou hospitaliers. L'administration de plus de deux doses consécutives d'épinéphrine ne doit être effectuée que sous surveillance médicale directe (voir INDICATIONS ET UTILISATION [1], POSOLOGIE ET ADMINISTRATION [2] et CONSEILS À L'INTENTION DES PATIENTS [17.1]).
5.2 Complications liées à l'injection
AUVI-Q ne doit être injecté QUE dans l'aspect antérolatéral de la cuisse (voir POSOLOGIE ET ADMINISTRATION (2) et CONSEILS À L'INTENTION DES PATIENTS [17.1]).
- Ne pas injecter par voie intraveineuse. De fortes doses ou l'injection intraveineuse accidentelle d'épinéphrine peuvent entraîner une hémorragie cérébrale en raison d'une hausse soudaine de la tension artérielle. Les vasodilatateurs à action rapide peuvent contrecarrer les effets vasopresseurs marqués de l'épinéphrine en cas d'administration par inadvertance.
- Ne pas injecter dans la fesse. L'injection dans la fesse peut ne pas fournir un traitement efficace de l'anaphylaxie. Conseiller au patient de se rendre immédiatement à la salle d'urgence la plus proche pour poursuivre le traitement de l'anaphylaxie. De plus, l'injection dans la fesse a été associée à des infections clostridiales (gangrène gazeuse). Le nettoyage à l'alcool ne tue pas les spores bactériennes et, par conséquent, ne diminue pas ce risque.
- Ne pas injecter dans les doigts, les mains ou les pieds. Comme l'épinéphrine est un puissant vasoconstricteur, l'injection accidentelle dans les doigts, les mains ou les pieds peut entraîner une perte de flux sanguin vers la zone affectée. Conseiller au patient de se rendre immédiatement à la salle d'urgence la plus proche et d'informer le prestataire de soins de la salle d'urgence du lieu de l'injection accidentelle. Le traitement d'une telle administration par inadvertance devrait consister en une vasodilatation, en plus du traitement approprié de l'anaphylaxie (voir EFFETS INDÉSIRABLES [6]).
- Tenir fermement la jambe du patient pendant l'injection. Pour minimiser le risque de blessure liée à l'injection lors de l'administration d'AUVI-Q à de jeunes enfants ou à des nourrissons, demander aux personnes qui s'occupent de l'enfant de tenir fermement sa jambe en place et de limiter ses mouvements avant et pendant l'injection.
5.3 Infections graves au point d'injection
De rares cas d'infections graves de la peau et des tissus mous, y compris la fasciite nécrosante et la myonécrose causée par des bactéries de la classe des Clostridia (gangrène gazeuse), ont été signalés au point d'injection après l'injection d'épinéphrine pour l'anaphylaxie. Les spores de Clostridium peuvent être présentes sur la peau et introduites dans les tissus profonds par injection sous-cutanée ou intramusculaire. Bien que le nettoyage à l'alcool puisse réduire la présence de bactéries sur la peau, il ne tue pas les spores de Clostridium. Pour diminuer le risque d'infection à Clostridium, rare mais grave, ne pas injecter AUVI-Q dans la fesse (voir MISES EN GARDE ET PRÉCAUTIONS [5.2]). Conseiller aux patients de consulter un médecin s'ils présentent des signes ou des symptômes d'infection, comme une rougeur, de la chaleur, un gonflement ou une sensibilité persistante au point d'injection de l'épinéphrine.
5.4 Réactions allergiques associées au sulfite
L'épinéphrine est le traitement de choix pour les réactions allergiques graves ou d'autres situations d'urgence, même si ce produit contient du bisulfite de sodium, un sulfite qui peut, dans d'autres produits, causer des réactions de type allergique, y compris des symptômes anaphylactiques ou des épisodes d'asthme mettant la vie en danger ou moins graves chez certaines personnes sensibles.
La présence d'un sulfite dans ce produit ne doit pas empêcher l'administration du médicament pour le traitement de situations allergiques graves ou d'autres situations d'urgence, même si le patient est sensible aux sulfites.
Les solutions de rechange à l'utilisation de l'épinéphrine dans une situation où la vie est en danger peuvent ne pas être satisfaisantes.
5.5 Interactions pathologiques
Certains patients peuvent être plus à risque de développer des réactions indésirables après l'administration d'épinéphrine. Malgré ces préoccupations, il faut reconnaître que la présence des affections ci-dessous ne constitue pas une contre-indication à l'administration d'épinéphrine dans une situation aiguë mettant la vie en danger. Par conséquent, les patients atteints des affections suivantes ou toute autre personne qui pourrait être en mesure d'administrer AUVI-Q à un patient présentant une réaction anaphylactique doivent être bien informés des circonstances dans lesquelles l'épinéphrine doit être utilisée.
- Patients atteints d'une maladie du cœur
L'épinéphrine doit être administrée avec prudence aux patients atteints d'une maladie cardiaque, y compris ceux atteints d'arythmies cardiaques, de maladie coronarienne, de cardiopathie organique ou d'hypertension. Chez ces patients ou chez les patients qui prennent des médicaments susceptibles de sensibiliser le cœur aux arythmies, l'épinéphrine peut précipiter ou aggraver l'angine de poitrine et provoquer des arythmies ventriculaires (voir INTERACTIONS MÉDICAMENTEUSES [7] et EFFETS INDÉSIRABLES [6]).
- Autres patients et maladies
L'épinéphrine doit être administrée avec prudence aux patients atteints d'hyperthyroïdie ou de diabète, ainsi qu'aux personnes âgées et aux femmes enceintes. Les patients atteints de la maladie de Parkinson peuvent remarquer une aggravation temporaire de leurs symptômes.
6 Effets indésirables
Parce qu'aucun essai clinique contrôlé randomisé n'a été mené relativement à l'administration d'épinéphrine pour le traitement de l'anaphylaxie, il est difficile d'établir la véritable incidence des effets indésirables associés à l'administration d'épinéphrine par voie générale. Les effets indésirables signalés dans les études observationnelles, les rapports de cas et les autres études sont énumérés ci-dessous.
Les effets indésirables courants de l'administration d'épinéphrine par voie générale sont les suivants : anxiété, inquiétude, agitation, tremblements, faiblesse, étourdissements, transpiration, palpitations, pâleur, nausées et vomissements, céphalées et/ou difficultés respiratoires. Ces symptômes peuvent survenir chez certaines personnes traitées par l'épinéphrine, mais ils se manifestent plus fréquemment chez les patients atteints d'hypertension ou d'hyperthyroïdie [voir MISES EN GARDE ET PRÉCAUTIONS (5.5)].
Des cas d'arythmie, y compris de fibrillation ventriculaire mortelle, ont été signalés, notamment chez des patients ayant une cardiopathie sous-jacente ou recevant certains autres médicaments [voir MISES EN GARDE ET PRÉCAUTIONS (5.5) et INTERACTIONS MÉDICAMENTEUSES (7)].
L'élévation rapide de la pression artérielle a entraîné des cas d'hémorragie cérébrale, surtout chez des patients âgés atteints de maladie cardiovasculaire [voir MISES EN GARDE ET PRÉCAUTIONS (5.5)].
Une angine de poitrine peut survenir chez les patients atteints de coronaropathie [voir MISES EN GARDE ET PRÉCAUTIONS (5.5)].
De rares cas de cardiomyopathie provoquée par le stress ont été signalés chez des patients traités par l'épinéphrine.
L'administration accidentelle dans les doigts, les orteils, les mains ou les pieds peut entraver la circulation sanguine dans la région touchée [voir MISES EN GARDE ET PRÉCAUTIONS (5.2)].
Les réactions indésirables observées à la suite d'injections accidentelles incluent une augmentation de la fréquence cardiaque, des réactions locales telles qu'une pâleur, une froideur et une hypoesthésie au point d'injection, ou encore des lésions au point d'injection (ecchymoses, saignements, changements de coloration, érythème ou lésions squelettiques).
Des cas de gangrène gazeuse ont été recensés après l'injection d'épinéphrine dans la fesse [voir MISES EN GARDE ET PRÉCAUTIONS (5.2)].
De rares cas d'infections graves de la peau et des tissus mous au point d'injection, y compris une fasciite nécrosante et une myonécrose à Clostridium (gangrène gazeuse), ont été signalés après l'injection d'épinéphrine dans la cuisse [voir MISES EN GARDE ET PRÉCAUTIONS (5.2)].
7 Interactions médicamenteuses
Les patients qui prennent des digitaliques, des diurétiques ou des antiarythmiques doivent faire l'objet d'une observation étroite lorsqu'ils reçoivent de l'épinéphrine, en vue de surveiller l'apparition d'arythmies cardiaques [voir MISES EN GARDE ET PRÉCAUTIONS (5.5)].
Les effets de l'épinéphrine peuvent être potentialisés par les antidépresseurs tricycliques, les inhibiteurs de la monoamine oxydase, la lévothyroxine sodique et certains antihistaminiques, notamment la chlorphéniramine, la tripélennamine et la diphénhydramine.
Les bêtabloquants comme le propranolol s'opposent aux effets cardiostimulants et bronchodilatateurs de l'épinéphrine.
Les effets vasoconstricteurs et hypertenseurs de l'épinéphrine sont contrecarrés par les alphabloquants comme la phentolamine.
Les alcaloïdes de l'ergot peuvent également renverser l'action vasopressive de l'épinéphrine.
8 Utilisation chez des populations particulières
8.1 Grossesse
Effets tératogènes : Classe C pendant la grossesse.
Aucune étude adéquate et bien contrôlée n'a été menée sur l'effet aigu de l'épinéphrine chez les femmes enceintes.
L'épinéphrine s'est révélée tératogène chez le lapin, la souris et le hamster. L'épinéphrine ne doit être administrée pendant la grossesse que si les bienfaits escomptés pour la mère l'emportent sur les risques pour le fœtus (anoxie fœtale, avortement spontané ou les deux).
L'administration d'épinéphrine par voie sous-cutanée a eu des effets tératogènes chez les lapins ayant reçu une dose d'environ 30 fois la dose quotidienne maximale recommandée par voie sous-cutanée ou intramusculaire (en mg/m2, dose maternelle de 1,2 mg/kg/jour pendant 2 ou 3 jours), chez les souris ayant reçu une dose d'environ 7 fois la dose quotidienne maximale recommandée par voie sous-cutanée ou intramusculaire (en mg/m2, dose maternelle de 1 mg/kg/jour pendant 10 jours) et chez les hamsters ayant reçu une dose d'environ 5 fois la dose quotidienne maximale recommandée par voie sous-cutanée ou intramusculaire (en mg/m2, dose maternelle de 0,5 mg/kg/jour pendant 4 jours).
Ces effets n'ont pas été observés chez la souris à une dose correspondant à environ 3 fois la dose quotidienne maximale recommandée par voie sous-cutanée ou intramusculaire (en mg/m2, dose maternelle de 0,5 mg/kg/jour pendant 10 jours).
8.3 Mères qui allaitent
On ignore si l'épinéphrine est excrétée dans le lait maternel chez l'humain. Parce que de nombreux médicaments le sont, la prudence est de mise lorsqu'AUVI-Q est administré à une femme qui allaite.
8.4 Utilisation pédiatrique
AUVI-Q peut être administré à des enfants selon une posologie appropriée en fonction du poids corporel [voir POSOLOGIE ET ADMINISTRATION (2)]. L'expérience clinique semble indiquer que l'utilisation de l'épinéphrine chez les enfants comporte des effets indésirables qui sont comparables, par leur nature et leur étendue, aux effets attendus et signalés chez les adultes. Comme AUVI-Q libère des doses fixes d'épinéphrine, l'utilisation d'autres formes d'épinéphrine injectable doit être envisagée si des doses inférieures à 0,1 mg sont requises.
8.5 Utilisation gériatrique
Les études cliniques sur AUVI-Q n'incluaient pas un nombre suffisant de sujets âgés de 65 ans et plus pour que l'on puisse établir si ceux-ci réagissent différemment des sujets plus jeunes. Les autres données tirées de l'expérience clinique n'ont pas fait ressortir de différence entre les réponses des personnes âgées et celles des patients plus jeunes. L'épinéphrine doit être administrée avec prudence aux personnes âgées en raison du risque supérieur d'effets indésirables liés à son administration [voir MISES EN GARDE ET PRÉCAUTIONS (5.5) et SURDOSAGE (10)].
10 Surdosage
Le surdosage de l'épinéphrine peut provoquer une hausse très marquée de la pression artérielle, ce qui risque d'entraîner une hémorragie vasculaire cérébrale, surtout chez les personnes âgées. Le surdosage peut également causer un œdème pulmonaire, en raison de la vasoconstriction périphérique et de la stimulation cardiaque. Le traitement consiste en l'administration de vasodilatateurs à action rapide ou d'alphabloquants, avec ou sans assistance respiratoire.
Le surdosage de l'épinéphrine peut aussi entraîner une bradycardie transitoire suivie d'une tachycardie pouvant conduire à une arythmie cardiaque potentiellement mortelle. Des contractions ventriculaires prématurées peuvent apparaître dans la minute qui suit l'injection et donner lieu à une tachycardie ventriculaire multifocale (état préfibrillatoire). L'atténuation des effets ventriculaires peut être suivie d'une tachycardie atriale et, à l'occasion, d'un bloc atrio-ventriculaire. Les arythmies peuvent être traitées par l'administration d'un bêtabloquant comme le propranolol.
Le surdosage peut parfois entraîner une pâleur extrême et un refroidissement de la peau, une acidose métabolique et une insuffisance rénale. En pareil cas, la prise de mesures correctives adéquates s'impose.
11 Description
L'auto-injecteur AUVI-Q (épinéphrine injectable, USP) à 0,3 mg, 0,15 mg et 0,1 mg est un produit mixte, qui associe un médicament et un instrument médical.
AUVI-Q fournit des indications sonores (directives vocales, signaux sonores) et visuelles (témoins lumineux) lors de l'utilisation. L'aiguille se rétracte automatiquement après l'injection.
Chaque auto-injecteur AUVI-Q 0,3 mg fournit une dose unique de 0,3 mg d'épinéphrine à partir d'une solution stérile d'épinéphrine injectable, USP (0,3 ml).
Chaque auto-injecteur AUVI-Q 0,15 mg fournit une dose unique de 0,15 mg d'épinéphrine à partir d'une solution stérile d'épinéphrine injectable, USP (0,15 ml).
Chaque auto-injecteur AUVI-Q 0,1 mg fournit une dose unique de 0,1 mg d'épinéphrine à partir d'une solution stérile d'épinéphrine injectable, USP (0,1 ml).
Les dispositifs AUVI-Q 0,3 mg, AUVI-Q 0,15 mg et AUVI-Q 0,1 mg contiennent chacun 0,76 ml de solution d'épinéphrine. Les volumes de solution d'épinéphrine administrés sont respectivement de 0,3 ml, 0,15 ml et 0,1 ml lorsqu'AUVI-Q 0,3 mg, AUVI-Q 0,15 mg et AUVI-Q 0,1 mg sont activés. Le reste de la solution ne peut être utilisé et doit être éliminé.
Chaque 3 ml de la solution contenue dans l'auto-injecteur AUVI-Q 0,3 mg renferme 0,3 mg d'épinéphrine, 2,3 mg de chlorure de sodium, 0,5 mg de bisulfite de sodium, de l'acide chlorhydrique pour ajuster le pH et de l'eau pour préparations injectables. Le pH se situe entre 2,2 et 5,0.
Chaque 0,15 ml de la solution contenue dans l'auto-injecteur AUVI-Q 0,15 mg renferme 0,15 mg d'épinéphrine, 1,2 mg de chlorure de sodium, 0,2 mg de bisulfite de sodium, de l'acide chlorhydrique pour ajuster le pH et de l'eau pour préparations injectables. Le pH se situe entre 2,2 et 5,0.
Chaque 0,1 ml de la solution contenue dans l'auto-injecteur AUVI-Q 0,1 mg renferme 0,1 mg d'épinéphrine, 0,78 mg de chlorure de sodium, 0,15 mg de bisulfite de sodium, de l'acide chlorhydrique pour ajuster le pH et de l'eau pour préparations injectables. Le pH se situe entre 2,2 et 5,0.
L'épinéphrine est une catécholamine sympathomimétique. La dénomination chimique de l'épinéphrine est alcool (−)-3,4-dihydroxy-α-[(méthylamino)méthyl]benzylique, et sa structure est la suivante :
Structure moléculaire de l'épinéphrine - Étiquetage et emballage approuvés par la FDA

Description textual
Une image de la structure moléculaire de l'épinéphrine en 2 D.
La solution d'épinéphrine se détériore rapidement si elle est exposée à l'air ou à la lumière; l'adrénochrome issu de l'oxydation lui donnera une coloration rose, tandis que la formation de mélanine lui donnera une coloration brune.
AUVI-Q n'est pas fait en latex de caoutchouc naturel.
Il faut expliquer en détail le mode d'emploi et les caractéristiques de sécurité d'AUVI-Q au patient ou à son fournisseur de soins avant l'utilisation [voir CONSEILS À L'INTENTION DES PATIENTS (17.1)].
12 Pharmacologie clinique
12.1 Mécanisme d'action
L'épinéphrine agit sur les récepteurs alpha et bêta adrénergiques.
12.2 Pharmacodynamique
Par son action sur les récepteurs alpha adrénergiques, l'épinéphrine atténue la vasodilatation et augmente la perméabilité vasculaire que l'anaphylaxie provoque et qui peut entraîner une perte de volume du liquide intravasculaire et de l'hypotension.
Par son action sur les récepteurs bêta adrénergiques, l'épinéphrine détend les muscles lisses des bronches et contribue à atténuer les bronchospasmes, les éternuements et la dyspnée qui peuvent survenir lors de l'anaphylaxie.
L'épinéphrine atténue également le prurit, l'urticaire et l'angioœdème, et peut soulager les symptômes gastro-intestinaux et génito-urinaires associés à l'anaphylaxie, grâce à son effet relaxant sur les muscles lisses de l'estomac, de l'intestin, de l'utérus et de la vessie.
Lorsqu'elle est administrée par voie sous-cutanée ou intramusculaire, l'épinéphrine agit rapidement et son effet est de courte durée.
13 Toxicologie non clinique
13.1 Cancérogenèse, mutagenèse, inhibition de la fertilité
Aucune étude de longue durée visant à évaluer le potentiel cancérogène de l'épinéphrine n'a été menée.
Dans un essai de mutation inverse sur bactéries WP2, il a été démontré que l'épinéphrine et d'autres catécholamines ont un potentiel mutagène in vitro et qu'elles sont des mutagènes oxydatifs.
Dans un test de recombinaison avec B. subtilis, l'épinéphrine a donné un résultat positif, mais n'a pas été mutagène dans un essai de mutation inverse sur bactéries du genre Salmonella.
Le potentiel de l'épinéphrine à inhiber la fertilité n'a pas été évalué.
Cela ne devrait pas empêcher l'utilisation de l'épinéphrine dans les conditions indiquées dans la section DIRECTIVES ET UTILISATION (1).
16 Méthode d'approvisionnement/entreposage et manutention
16.1 Méthode d'approvisionnement
La boîte contient deux auto-injecteurs AUVI-Q (injection d'épinéphrine, USP) à 0,3 mg et un seul Formateur AUVI-Q (NDC 60842-023-01).
La boîte contient deux auto-injecteurs AUVI-Q (injection d'épinéphrine, USP) à 0,15 mg et un seul Formateur AUVI-Q (NDC 60842-022-01)
La boîte contient deux auto-injecteurs AUVI-Q (injection d'épinéphrine, USP) à 0,1 mg et un seul Formateur AUVI-Q (NDC 60842-021-01).
Sur ordonnance uniquement.
16.2 Entreposage et manutention
L'épinéphrine est sensible à la lumière et devrait être entreposée dans l'étui fourni pour le protéger de la lumière. L'entreposer à une température de 20 à 25 °C (68 à 77 °F); les excursions sont permises à 15 à 30 °C (59 à 86 °F) [voir la température ambiante contrôlée de l'USP]. Ne pas réfrigérer. Avant l'utilisation, s'assurer que la solution dans l'auto-injecteur est claire et incolore. Remplacer l'auto-injecteur si la solution est d'une mauvaise couleur ou brouillée, ou si elle contient des particules.
17 Fiche-conseil à l'intention des patients
[Voir l'étiquette destinée aux patients approuvée par la FDA (renseignements destinés aux patients et mode d'emploi).]
Un fournisseur de soins de santé doit passer en revue les directives et le fonctionnement d'AUVI-Q en détail avec le patient ou la personne qui s'en occupe.
L'épinéphrine est essentielle au traitement de l'anaphylaxie. Les patients qui sont à risque d'avoir une réaction allergique ou qui ont déjà eu une réaction allergique grave (anaphylaxie) à une piqûre ou à une morsure d'insecte, à des aliments, à des médicaments et à d'autres allergènes, ou une anaphylaxie idiopathique ou induite par l'exercice, devraient être bien informés des situations dans lesquelles l'épinéphrine devrait être utilisée.
Administration et formation
Informer le patient et/ou la personne qui s'en occupe de la bonne façon d'utiliser AUVI-Q. AUVI-Q devrait être injecté dans le milieu du côté extérieur de la cuisse (à travers les vêtements, si nécessaire). Chaque dispositif ne sert qu'à une seule injection. Informer les patients de consulter immédiatement un médecin en conjonction avec l'administration d'AUVI-Q.
Il est possible que les jeunes enfants et les nourrissons ne coopèrent pas et qu'ils bottent ou bougent pendant une injection. Aviser la personne s'occupant de l'enfant de tenir fermement la jambe du jeune enfant ou du nourrisson pour limiter les mouvements avant et pendant l'injection. [Voir MISES EN GARDE ET PRÉCAUTIONS (5.2)]
Les renseignements complets destinés aux patients, y compris la posologie, le mode d'emploi pour bien l'administrer et les mises en garde, se trouvent à l'intérieur de la boîte de chaque auto-injecteur AUVI-Q. Passer en revue les systèmes renseignant sur le mode d'utilisation et la sûreté d'AUVI-Q avec le patient et/ou la personne qui s'en occupe. Ces systèmes comprennent l'étiquette imprimée sur la surface d'AUVI-Q sur laquelle on trouve le mode d'emploi et une illustration de l'injection, du système automatique de retrait de l'aiguille, des aides visuelles, des bips et le mode d'emploi vocal. Informer le patient et/ou la personne qui s'en occupe que l'aiguille n'est pas visible après l'injection et qu'il est possible que le patient ne sente pas l'injection.
Informer le patient qu'AUVI-Q comprend un compte à rebours de 2 secondes après avoir été activé. Puis, des directives vocales indiqueront que l'injection est terminée et de solliciter une attention médicale d'urgence. Informer le patient que la base noire d'AUVI-Q se verrouillera sur le boîtier du dispositif et que des lumières scintillantes seront rouges lorsque l'injection sera achevée. Ces indicateurs de post-utilisation aident le patient et/ou la personne qui s'en occupe à savoir qu'AUVI-Q a été activé et que l'épinéphrine a été injectée.
Informer le patient et/ou la personne qui s'en occupe d'utiliser le Formateur et de s'exercer avec pour mieux savoir comment utiliser AUVI-Q en cas d'urgence allergique. Le Formateur peut être utilisé plusieurs fois.
Effets indésirables
L'épinéphrine peut produire des symptômes et des signes, dont une augmentation du rythme cardiaque, la sensation que le cœur bat plus fort, des palpitations, de la transpiration, de la nausée et des vomissements, de la difficulté à respirer, une pâleur, des étourdissements, de la faiblesse ou des tremblements, un mal de tête, une crainte raisonnable, de la nervosité ou de l'anxiété. Ces symptômes et ces signes disparaissent généralement rapidement, surtout avec le repos, le calme et la position couchée. Les patients atteints d'hypertension ou d'hyperthyroïdisme peuvent subir des effets plus graves ou persistants et ceux atteints d'une maladie de l'artère coronarienne pourraient avoir de l'angine. Les patients diabétiques peuvent voir leur glycémie augmenter après l'administration d'épinéphrine. Les patients atteints de la maladie de Parkinson peuvent constater une exacerbation temporaire des symptômes [voir MISES EN GARDE ET PRÉCAUTIONS (5.5)].
Injection accidentelle
Les patients doivent être informés de consulter un médecin immédiatement, dans le cas d'une injection accidentelle. Comme l'épinéphrine est un vasoconstricteur puissant lorsqu'il est injecté dans un doigt, une main ou un pied, le traitement doit être orienté vers une vasodilatation, si l'épinéphrine était injectée par accident [voir MISES EN GARDE ET PRÉCAUTIONS (5.2)].
Infection grave au point d'injection
Des cas rares d'infection grave de la peau et de tissus, y compris une fasciite nécrosante et une myonécrose causée par Clostridia (gangrène gazeuse), au point d'injection, après une injection d'épinéphrine en cas d'anaphylaxie, ont été signalés. Informer les patients qu'il leur faut solliciter une aide médicale si des signes ou des symptômes d'infection apparaissent, comme une rougeur, une chaleur, une enflure ou une sensibilité persistante au point d'injection de l'épinéphrine [voir MISES EN GARDE ET PRÉCAUTIONS (5.3)].
Entreposage et manutention
Il faut informer les patients d'examiner régulièrement la solution d'épinéphrine par la fenêtre. AUVI-Q doit être remplacé si la solution d'épinéphrine semble avoir une couleur inhabituelle (couleur rosâtre ou plus foncée que légèrement jaune), être brouillée ou contenir des particules. L'épinéphrine est sensible à la lumière et doit être entreposée dans l'étui fourni pour la protéger de la lumière. Informer les patients qu'AUVI-Q doit être utilisé ou éliminé adéquatement une fois que le dispositif de sécurité rouge est enlevé [voir ENTREPOSAGE ET MANUTENTION (16.2)].
Les renseignements complets destinés aux patients, y compris la posologie, le mode d'emploi pour bien l'administrer et les mises en garde, se trouvent à l'intérieur de chaque boîte d'AUVI-Q.
Fabriqué pour : Kaleo Inc.
Richmond, VA 23219 États-Unis
Le présent produit peut être protégé par un ou plusieurs brevets américains ou demandes de brevets en traitement. Pour de plus amples renseignements, consulter www.kaleopharma.com/pat.
*Pour la Californie uniquement : Le présent produit contient des piles renfermant du perchlorate – il pourrait falloir le manipuler de manière spéciale. Consulter www.dtsc.ca.gov/hazardouswaste/perchlorate. (anglais seulement)
Renseignements à l'intention du patient
Auto-injecteur AUVI-Q® (épinéphrine injectable)
Pour les urgences dues à une réaction allergique (anaphylaxie)
Veuillez lire ce feuillet de renseignements à l’intention du consommateur avant d’utiliser AUVI-Q et lors de chaque renouvellement, car de nouveaux renseignements peuvent y être inscrits. Vous devez savoir comment utiliser le dispositif AUVI-Q avant une éventuelle urgence due à une réaction allergique. Ces renseignements ne remplacent pas une conversation avec votre professionnel de la santé au sujet de votre état de santé ou de votre traitement.
Quels sont les renseignements les plus importants à connaître au sujet d'AUVI-Q?
- Veuillez toujours conserver le dispositif AUVI-Q avec vous, car vous ne savez pas quand vous subirez une réaction allergique (réaction anaphylactique) potentiellement mortelle. Adressez-vous à votre médecin s’il vous faut des auto-injecteurs supplémentaires à laisser à l’école, au travail, etc. Une réaction anaphylactique est une réaction allergique potentiellement mortelle qui peut apparaître quelques minutes après l’exposition à un déclencheur, comme une piqûre d’insecte (abeilles, guêpes, frelons et moustiques), une injection pour traiter une allergie, un aliment, un médicament, uneactivité physique, etc. Veuillez suivre les instructions de votre professionnel de la santé concernant le moment au cours duquel vous devrez utiliser le dispositif AUVI-Q si vous présentez les symptômes d’une réaction anaphylactique, tels que :
- difficulté à respirer;
- respiration sifflante;
- enrouement (modification du son de votre voix);
- urticaire (éruption cutanée avec rougeur pouvant causer de la démangeaison);
- démangeaisons intenses;
- enflure du visage, des lèvres, de la bouche ou de la langue;
- éruption cutanée, rougeurs ou enflure;
- accélération de la fréquence cardiaque;
- baisse de la tension artérielle (pression sanguine);
- forte anxiété;
- confusion;
- douleurs à l'estomac;
- incontinence;
- étourdissements ou perte de conscience.
- Indiquez aux membres de votre famille et à d’autres personnes où vous gardez votre dispositif AUVI-Q et comment l’utiliser, avant d’en avoir besoin. Sachez que vous pourriez être incapable de parler au cours d’une réaction allergique.
- Obtenez des soins médicaux immédiatement après avoir utilisé le dispositif AUVI-Q. Si vous subissez une réaction allergique grave, il est possible que d’autres médicaments soient nécessaires.
Qu'est-ce que le dispositif AUVI-Q?
Le dispositif AUVI-Q est un médicament sur ordonnance utilisé pour traiter les réactions allergiques potentiellement mortelles, notamment l’anaphylaxie, chez les personnes à risque ou présentant des antécédents de réactions allergiques graves.
Le dispositif AUVI-Q est destiné à une auto-administration immédiate ou à une administration immédiate par un soignant et ne remplace pas les soins médicaux d’urgence. Vous devriez recevoir une aide médicale d’urgence immédiatement après avoir utilisé le dispositif AUVI-Q.
L’innocuité et l’efficacité d’AUVI-Q n’ont pas été démontrées chez les enfants pesant moins de 16,5 livres (7,5 kg).
Que devrais-je dire à mon professionnel de la santé avant d'utiliser AUVI-Q?
Avant d'utiliser AUVI-Q, parlez à votre médecin et votre pharmacien si vous :
- souffrez de problèmes cardiaques ou d'hypertension;
- êtes diabétique;
- avez des problèmes avec votre glande thyroïde;
- avez des antécédents de dépression;
- souffrez de la maladie de Parkinson;
- avez tout autre problème de santé;
- vous êtes enceinte ou avez l'intention de le devenir; l'innocuité du produit pour les fœtus n'a pas été démontrée;
- vous allaitez ou prévoyez allaiter; on ignore si ce produit passe dans le lait maternel.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, notamment les médicaments vendus avec ou sans ordonnance, les vitamines et les suppléments à base d’herbes médicinales.
AUVI-Q peut interagir avec d’autres médicaments et provoquer des effets secondaires. AUVI-Q peut influencer l’activité d’autres médicaments, et certains médicaments peuvent également avoir un effet sur l’activité d’AUVI-Q.
Sachez quels médicaments vous prenez et tenez-en une liste, que vous pourrez présenter à votre médecin et à votre pharmacien lorsqu’un nouveau médicament vous est prescrit.
Comment devrais-je utiliser AUVI-Q?
- Chaque dispositif AUVI-Q contient une seule dose de médicament.
- AUVI-Q ne doit être injecté que dans le muscle de la cuisse, du côté extérieur de la jambe. Il peut être injecté à travers les vêtements, au besoin.
- Veuillez lire les instructions fournies à la fin de ce feuillet de renseignements pour savoir comment bien utiliser le dispositif AUVI-Q.
- Utilisez le dispositif AUVI-Q exactement de la manière indiquée par votre professionnel de la santé.
- Un dispositif de formation ainsi qu'un dépliant comprenant le mode d'emploi du dispositif de formation sont inclus. D'autres ressources de formation pour l'utilisation du dispositif sont disponibles au www.auvi-q.com.
- Exercez-vous avec le dispositif de formation avant qu’une situation d’urgence survienne, afin de savoir utiliser le véritable AUVI-Q en toute sécurité en cas d’urgence due à une réaction allergique.
- Le dispositif de formation ne contient ni aiguille ni médicament et peut être réutilisé afin de vous exercer à effectuer une injection.
Quels sont les effets secondaires possibles d'AUVI-Q?
AUVI-Q peut provoquer des effets secondaires graves.
- AUVI-Q ne doit être injecté que dans la cuisse, du côté extérieur. N’injectez pas AUVI-Q dans vos :
- veines;
- muscle de la fesse;
- doigts, orteils, mains ou pieds
En cas d’injection accidentelle dans une autre partie du corps, rendez-vous immédiatement au service des urgences de l’hôpital le plus proche. Indiquez au professionnel de la santé l’endroit où l’injection accidentelle a été effectuée.
- Dans de rares cas, une infection peut apparaître au point d’injection quelques jours après l’utilisation d’AUVI-Q, et certaines infections peuvent être graves. Veuillez communiquer immédiatement avec votre professionnel de la santé si vous observez l’un ou l’autre des symptômes suivants au point d’injection :
- une rougeur qui ne disparaît pas;
- une enflure;
- une sensibilité;
- une sensation de chaleur au toucher.
- Si vous injectez AUVI-Q à un jeune enfant ou un nourrisson, tenez fermement sa jambe en place avant et pendant l’injection afin d’éviter une blessure. Demandez à votre professionnel de la santé de vous expliquer comment tenir correctement la jambe d’un jeune enfant ou d’un nourrisson pendant une injection.
Si vous souffrez de certains problèmes de santé ou prenez certains médicaments, votre état pourrait s’aggraver ou vous pourriez subir plus d’effets secondaires ou ceux-ci pourraient durer plus longtemps lors de l’utilisation d’AUVI-Q. Mentionnez tous vos problèmes de santé à votre professionnel de la santé.
Les effets secondaires les plus fréquents associés à l’utilisation d’AUVI-Q incluent :
- battements cardiaques rapides, irréguliers, ou très forts;
- transpiration;
- tremblements;
- maux de tête;
- pâleur;
- sentiments de surexcitation, de nervosité ou d'anxiété;
- faiblesse;
- étourdissements;
- nausées et vomissements;
- difficulté à respirer.
Communiquez avec votre professionnel de la santé si vous ressentez des effets secondaires qui vous dérangent ou qui ne disparaissent pas.
Il ne s'agit pas de tous les effets secondaires possibles d'AUVI-Q. Pour obtenir de plus amples renseignements, consultez votre médecin ou votre pharmacien.
Communiquez avec votre médecin pour des conseils médicaux concernant les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment devrais-je entreposer AUVI-Q?
- Entreposez le dispositif AUVI-Q à une température comprise entre 68°F et 77°F (de 20°C à 25°C).
- Ne pas exposer le dispositif à des températures extrêmes, froides ou chaudes. Par exemple, ne l'entreposez pas dans le coffre à gants de votre véhicule. Ne conservez pas AUVI-Q au réfrigérateur ni au congélateur.
- Examinez périodiquement l'état du contenu à travers la partie transparente de l'emballage. La solution devrait être transparente. Si la solution présente une couleur anormale (rosâtre ou plus foncée que légèrement jaune), si elle est trouble ou si elle contient des particules solides, remplacez le dispositif.
- Votre dispositif AUVI-Q a une date d'expiration. Remplacez-le avant cette date.
- Gardez le dispositif AUVI-Q dans l'étui fourni afin de le protéger de la lumière.
Gardez le dispositif AUVI-Q et tout autre médicament hors de la portée des enfants.
Renseignements généraux sur l'utilisation sécuritaire et efficace du dispositif AUVI-Q
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans le feuillet de renseignements à l’intention du consommateur. N’utilisez pas AUVI-Q pour traiter un problème de santé pour lequel il n’a pas été prescrit. Ne donnez pas le dispositif AUVI-Q à d’autres personnes, même si elles présentent des réactions allergiques ou les mêmes symptômes que vous. Cela peut être dangereux pour ces personnes.
Ce feuillet de renseignements à l’intention du consommateur résume les renseignements les plus importants sur le dispositif AUVI-Q. Si vous désirez obtenir plus d’information, adressez-vous à votre professionnel de la santé. Vous pouvez demander à votre pharmacien ou à votre médecin des renseignements sur AUVI-Q qui sont rédigés à l’intention des professionnels de la santé.
Pour obtenir de plus amples renseignements et des instructions vidéo sur l'utilisation d'AUVI-Q, consultez www.auvi-q.com ou composez le 1-844-828-8472.
Quels sont les ingrédients d'AUVI-Q?
Ingrédient actif : épinéphrine
Ingrédients inactifs : chlorure de sodium, bisulfite de sodium, acide chlorhydrique et eau.
AUVI-Q ne contient pas de latex.
Mode d'emploi
Veuillez lire attentivement ces instructions avant d'avoir besoin d'utiliser le dispositif AUVI-Q. Assurez-vous également que votre professionnel de la santé vous montre la bonne façon de vous servir du dispositif. Pour toute question, adressez-vous à votre professionnel de la santé.
Si vous injectez AUVI-Q à un jeune enfant ou un nourrisson, maintenez la jambe de l'enfant fermement en place pour en limiter les mouvements avant et pendant l'injection.
Instructions vocales automatisées
Un système d’instructions vocales électroniques intégré vous guide à chaque étape de l’injection. Si les instructions vocales ne fonctionnent pas pour quelque raison que ce soit, veuillez utiliser le dispositif AUVI-Q comme indiqué ci-dessous; il fonctionnera quand même en cas d’urgence due à une réaction allergique.
Comment utiliser le dispositif AUVI-Q
Figure A – Étiquetage et emballage approuvés par la FDA.

Description textual
Sur la figure A, il y a une image du dispositif et de son étui. L'image du dispositif montre cinq caractéristiques principales du dispositif. Voici ces caractéristiques :
- Un haut-parleur situé au coin supérieur droit du dispositif;
- Une fenêtre au centre du dispositif;
- Des lumières DEL situées sous la fenêtre;
- La base du dispositif;
- Le dispositif de sécurité rouge situé au-dessous, ou à l'extrémité du dispositif où est l'aiguille.
L'image de l'étui montre le boîtier du produit qui comprend deux dents sur le dessus ainsi qu'une flèche orientée vers elles.
Étape 1. Retirez le dispositif de l'étui. Consultez la figure B.
Ne passez pas à l’étape 2 avant d’être prêt à utiliser AUVI-Q. Si vous n’êtes pas prêt à l’utiliser, remettez-le dans l’étui.
Figure B – Étiquetage et emballage approuvés par la FDA.

Description textual
La figure B illustre comment enlever le dispositif de son étui. Le pouce et l'index retirent le dispositif de l'étui. Des flèches de direction indiquent que le dispositif se fait retirer de l'étui.
Étape 2. Tirez le dispositif de protection rouge vers le bas jusqu'à ce qu'il se détache. Consultez la figure C.
Pour réduire les risques d’injection accidentelle, ne touchez pas à la base noire de l'auto-injecteur, car l’aiguille sort de cet endroit. En cas d’injection accidentelle, obtenez des soins médicaux sans tarder.
Remarque : Le dispositif de protection rouge est difficile à retirer. Tirez-le fermement.
Figure C – Étiquetage et emballage approuvés par la FDA.

Description textual
La figure C illustre comment enlever le dispositif de sécurité rouge du dispositif. Elle montre une main qui tient le dispositif et deux doigts qui tirant fermement vers le bas pour retirer le protège-aiguille de la base du dispositif.
Étape 3. Placez l'extrémité noire du dispositif AUVI-Q du côté extérieur de la jambe au centre de la cuisse (par-dessus les vêtements, au besoin), puis appuyez fermement jusqu'à ce que vous entendiez un clic et un sifflement. Maintenez le dispositif en place pendant 2 secondes. Consultez la figure D.
Injectez le produit seulement au centre de la cuisse, du côté extérieur de la jambe. N’injectez pas le produit dans une autre partie du corps.
Si vous utilisez AUVI-Q chez un jeune enfant ou un nourrisson, maintenez sa jambe fermement en place pendant l'injection. Consultez la figure E.
Figure D – Étiquetage et emballage approuvés par la FDA.
(Pour AUVI-Q 0,3 mg et AUVI-Q 0,15 mg)

Description textual
La figure D montre deux images. La première image illustre comment administrer une dose avec AUVI-Q. Elle montre une main tenant le dispositif, le protège-aiguille retiré, avec la base du dispositif appuyée contre la cuisse. Une flèche de direction montre que le dispositif a été placé contre la cuisse. Sur la deuxième image, il y a un chronomètre avec les mots « 2 seconds » (2 secondes) inscrits près du chronomètre.
| 2 seconds | 2 secondes |
Figure E – Étiquetage et emballage approuvés par la FDA.
(Pour AUVI-Q 0,1 mg)

Description textual
La figure E montre deux images. La première image indique le son particulier (déclic et léger sifflement) émis par le dispositif pour indiquer qu'AUVI-Q fonctionne correctement. Elle montre une main qui tient un dispositif contre la cuisse avec des lignes circulaires rouges émanant du site d'injection. Sur la deuxième image, il y a un chronomètre avec les mots « 2 seconds » inscrits près du chronomètre.
| 2 seconds | 2 secondes |
Remarque : AUVI-Q produit un son distinct (un clic et un sifflement) lorsque vous le pressez contre l'extérieur de votre cuisse. C'est normal et indique que le dispositif AUVI-Q fonctionne correctement. N'éloignez pas le dispositif de votre jambe lorsque vous entendez le clic et le sifflement.
L’aiguille se rétracte automatiquement après l’injection, de sorte qu’elle n’est plus visible après celle-ci. Le déclenchement du dispositif AUVI-Q est suivi d’un compte à rebours de 2 secondes, après quoi le système d’instruction vocale indiquera que l’injection est terminée et que vous devez obtenir des soins médicaux d’urgence. Le dispositif AUVI-Q émettra un bip et des lumières rouges clignoteront.
Étape 4. Obtenez des soins médicaux d'urgence immédiatement.
Veuillez replacer le dispositif AUVI-Q dans l'étui et demander à votre professionnel de la santé comment vous en débarrasser.
Demandez à votre professionnel de la santé de renouveler votre ordonnance.
Après avoir utilisé AUVI-Q :
- La base noire se verrouillera en place.
- Le système d’instructions vocales indiquera qu’il faut obtenir des soins médicaux d’urgence et que le dispositif a été utilisé; les lumières rouges clignoteront.
- Le dispositif de protection rouge ne peut être remis en place.
- La fenêtre de visualisation ne sera plus transparente.
- Il est normal qu’une certaine quantité de médicament demeure dans le dispositif après une injection.
- Discutez avec votre professionnel de la santé de la bonne façon de jeter votre AUVI-Q. AUVI-Q est un auto-injecteur à usage unique qui ne peut être réutilisé.
Jusqu’à ce que vous jetiez le dispositif AUVI-Q utilisé, le système d’instruction vocale électronique vous rappellera qu’il a été utilisé, et ce chaque fois que vous retirerez le dispositif de son étui.
Si vous utilisez AUVI-Q pour un jeune enfant ou un nourrisson, demandez à votre professionnel de la santé de vous montrer comment tenir correctement la jambe de l’enfant en place pendant que vous procédez à l’injection.
Ce feuillet de renseignements à l’intention du consommateur a été approuvé par la Food and Drug Administration des États-Unis.
Rév. Nov. 2017
Fabriqué pour : Kaleo, Inc.
Richmond, VA 23219 États-Unis
Ce produit peut être couvert par un ou plusieurs brevets américains ou demandes de brevet en instance. Veuillez consulter www.kaleopharma.com/pat pour plus de détails.
*Pour la Californie uniquement : Le présent produit contient des piles renfermant du perchlorate – il pourrait falloir le manipuler de manière spéciale. Consulter www.dtsc.ca.gov/hazardouswaste/perchlorate.
Simulateur AUVI-Q®
Instructions du simulateur
Important :
Le SIMULATEUR AUVI-Q ne contient aucune aiguille ni médicament.
Pour le traitement d'urgence d'une réaction allergique, utilisez le véritable AUVI-Q et non le simulateur gris. En tout temps, transportez le véritable AUVI-Q avec vous en cas d'urgence.
Renseignements importants au sujet du SIMULATEUR AUVI-Q :
À l'intérieur de votre SIMULATEUR AUVI-Q, vous trouverez
- Des piles
- Un haut-parleur par lequel vous entendrez un bip sonore et une voix électronique qui vous donne des instructions
- Des voyants lumineux rouge et vert clignotants
Les piles du SIMULATEUR AUVI-Q ont été conçues pour durer le temps que vous puissiez vous exercer une fois par jour pendant deux ans. Si votre SIMULATEUR AUVI-Q ne fonctionne pas bien, communiquez avec votre médecin pour obtenir un nouveau.
Qu'est-ce que le simulateur AUVI-Q?
- Le SIMULATEUR AUVI-Q ne contient pas d'aiguille ni de médicament et peut être réutilisé pour vous exercer aux injections.
- Exercez-vous avec le SIMULATEUR AUVI-Q avant l'apparition d'une réaction allergique nécessitant un traitement d'urgence. Ainsi, en cas d'urgence, vous serez en mesure d'utiliser le véritable AUVI-Q en toute sécurité.
Le simulateur AUVI-Q
Figure A - Étiquetage et emballage approuvés par la FDA

Description textual
Sur la figure A, il y a une image du dispositif et de son étui. L'image du dispositif montre cinq caractéristiques principales du dispositif. Voici ces caractéristiques :
- Un haut-parleur situé au coin supérieur droit du dispositif;
- Une fenêtre au centre du dispositif;
- Des lumières DEL situées sous la fenêtre;
- La base du dispositif;
- Le dispositif de sécurité rouge situé au-dessous, ou à l'extrémité du dispositif où est l'aiguille.
L'image de l'étui montre le boîtier du produit qui comprend deux dents sur le dessus ainsi qu'une flèche orientée vers elles.
| Outer case | Étui |
| Speaker | Haut-parleur |
| Device | Dispositif |
| Housing | Boîtier |
| LED | LED |
| Base | Base |
| Safety Guard | Dispositif de sécurité |
Le simulateur AUVI-Q :
- Est contenu dans un étui gris;
- Ne contient pas d'aiguille ou de médicament
- Peut être réutilisé (le dispositif de sécurité rouge peut être replacé sur la base du simulateur après utilisation)
- N'a pas de date d'expiration
- Le mot « SIMULATEUR » est en relief sur le dessus du dispositif
AUVI-Q :
- Étui orange (0,3 mg) ou bleu (0,15 mg) ou blanc et lilas (0,1 mg)
- Contient une aiguille et de l'épinéphrine
- Ne peut être réutilisé (le dispositif rouge de sécurité ne peut être replacé sur la base de l'AUVI-Q après utilisation)
- Le dispositif présente une date d'expiration
Pour le traitement d'urgence d'une réaction allergique, utilisez le véritable AUVI-Q et non le simulateur gris.
Qui devrait s'exercer à utiliser le simulateur AUVI-Q?
Quiconque qui pourrait vous aider à vous injecter AUVI-Q d'urgence en cas de réaction allergique:
- Vous
- Personnes soignantes
- Membres de votre famille
- Amis
- Collègues
- Enseignants
- Travailleurs des garderies ou personnel du service de garde
Demandez-leur de s'exercer avec le simulateur et lisez le dépliant destiné au patient qui accompagne l'emballage de chaque ordonnance d'AUVI-Q.
Pour de plus amples renseignements et des instructions vidéo sur la manipulation d'AUVI-Q, consultez http://www.AUVI-Q.com ou appelez au 1-844-828-8472.
S'exercer avec le simulateur AUVI-Q
Exercez-vous avec le SIMULATEUR AUVI-Q avant l'apparition d'une réaction allergique nécessitant un traitement d'urgence. Ainsi, en cas d'urgence, vous serez en mesure de manipuler le véritable AUVI-Q en toute sécurité.
- Exercez-vous tous les jours dans la première semaine suivant la réception du SIMULATEUR AUVI-Q pour que vous soyez à l'aise de manipuler AUVI-Q rapidement et en toute sécurité. Même lorsque vous êtes à l'aise avec le simulateur, continuez à vous exercer souvent.
Comment utiliser le simulateur
Comment fonctionne le simulateur AUVI-Q
Même si le simulateur ne contient pas d'aiguille et de médicament, il fonctionne de la même façon que le véritable AUVI-Q.
Tout comme le véritable AUVI-Q, le SIMULATEUR AUVI-Q contient une voix électronique donnant des instructions pour vous guider à travers toutes les étapes de l'injection. Si vous n'entendez pas les instructions sonores du SIMULATEUR AUVI-Q pour une raison quelconque, vous pouvez tout de même utiliser le SIMULATEUR AUVI-Q pour vous exercer comme il est indiqué dans le dépliant.
Le SIMULATEUR AUVI-Q affiche les mêmes voyants clignotants rouge et vert que le véritable AUVI-Q.
Comme avec le véritable AUVI-Q, si vous vous exercez avec un jeune enfant ou un nourrisson, maintenez fermement la jambe lorsque vous utilisez le SIMULATEUR AUVI-Q. Demandez à votre médecin de vous montrer comment maintenir adéquatement la jambe pour vous exercer. Ainsi, vous serez préparé au moment de traiter de façon urgente une réaction allergique.
Suivez ces étapes
- Sortez le simulateur AUVI-Q de son étui. Voir la figure B.
- Tirez sur le dispositif de sécurité rouge vers le bas pour le retirer du simulateur.Voir la figure C.
Figure B - Étiquetage et emballage approuvés par la FDA

Description textual
La figure B illustre comment enlever le dispositif de son étui. Un pouce et un index retirent le dispositif de son étui. Des flèches de direction indiquent que le dispositif se fait retirer de l'étui.
Figure C - Étiquetage et emballage approuvés par la FDA

Description textual
La figure C illustre comment enlever le dispositif de sécurité rouge du dispositif. Elle montre une main qui tient le dispositif et deux doigts qui tirent fermement vers le bas pour retirer le protège-aiguille de la base du dispositif.
Remarque : Le dispositif de sécurité rouge a été conçu pour être bien retenu, tout comme celui du véritable AUVI-Q. Tirez fermement dessus.
3. Placez l'extrémité noire contre la cuisse (par-dessus les vêtements, au besoin), à mi-hauteur de celle-ci, du côté extérieur de la jambe, puis poussez fermement jusqu'à ce que vous entendiez un déclic et un sifflement léger, et attendez 2 secondes. Voir la figure D.
Comme avec le véritable AUVI-Q, si vous vous exercez avec un jeune enfant ou un nourrisson, maintenez fermement la jambe en place lorsque vous utilisez le simulateur AUVI-Q. (voir la figure E).
Figure D - Étiquetage et emballage approuvés par la FDA

Description textual
La figure D montre deux images. La première image montre comment simuler l'administration d'une dose d'AUVI-Q lorsque le simulateur est utilisé. Elle montre une main qui tient le dispositif, le protège-aiguille retiré, avec la base du dispositif appuyée contre la cuisse. Une flèche de direction montre que le dispositif a été placé contre la cuisse. Sur la deuxième image, il y a un chronomètre avec les mots « 2 seconds » (2 secondes) inscrits près du chronomètre.
| 2 seconds | 2 secondes |
Figure E - Étiquetage et emballage approuvés par la FDA

Description textual
La figure E indique le son particulier (déclic et léger sifflement) émis par le dispositif pour indiquer que le simulateur AUVI-Q fonctionne correctement. Elle montre une main qui tient un dispositif contre la cuisse avec des lignes circulaires rouges émanant du site d'injection. Sur la deuxième image, il y a un chronomètre avec les mots « 2 seconds » (2 secondes) inscrits près du chronomètre.
Remarque : Lors d'une urgence, après l'injection, il faut consulter un médecin immédiatement.
Exercez-vous uniquement sur le milieu de la cuisse, du côté extérieur de la jambe. Cet endroit est celui où vous injecteriez le véritable AUVI-Q.
Remarque : Le SIMULATEUR AUVI-Q fait un son particulier (déclic et léger sifflement) lorsque vous le pressez fermement contre la cuisse, du côté extérieur de la jambe. Il s'agit du même son que celui du véritable AUVI-Q. Ce son est normal et indique qu'AUVI-Q fonctionne correctement. Ne retirez pas AUVI-Q de la cuisse tant que vous entendez le déclic et le léger sifflement.
4. Après vous être exercé, réinitialisez le SIMULATEUR AUVI-Q :
- Remettez le dispositif de sécurité rouge en place. Ne tenez pas le simulateur par la base noire lorsque vous insérez le dispositif de sécurité rouge en place. La base noire retournera à sa position d'origine pendant l'insertion du dispositif de sécurité. Voir la figure F.
- Glissez complètement le SIMULATEUR AUVI-Q dans son étui gris pour réinitialiser la voix électronique. Voir la figure G.
Figure F - Étiquetage et emballage approuvés par la FDA
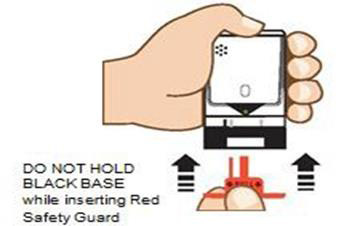
Description textual
La figure F montre comment insérer le dispositif de sécurité rouge dans le simulateur. Elle montre une main qui tient le dispositif et deux doigts qui tiennent le dispositif de sécurité, et des flèches de direction indiquent qu'il doit être inséré dans la base du simulateur. Le texte indique « NE PAS TENIR LE SIMULATEUR PAR LA BASE NOIRE lorsque vous insérez le dispositif de sécurité rouge ».
| DO NOT HOLD BLACK BASE while inserting Red Safety Guard | NE PAS TENIR LE SIMULATEUR PAR LA BASE NOIRE lorsque vous insérez le dispositif de sécurité rouge. |
Figure G - Étiquetage et emballage approuvés par la FDA

Description textual
La figure B illustre comment le dispositif se remet dans son étui. Un pouce et un index tiennent le dispositif d'une main et une autre main tient l'étui en dessous. Des flèches de direction indiquent que le dispositif se fait pousser dans l'étui.
Remarque : Laissez le SIMULATEUR AUVI-Q dans son étui pendant au moins 5 secondes entre vos moments où vous vous exercez pour permettre à la voix électronique de to reset.
Rangement
- Gardez le SIMULATEUR AUVI-Q à la température ambiante; le SIMULATEUR AUVI-Q ne devrait pas être utilisé lorsque la température est inférieure à 10 °C (50 °F) ou supérieure à 40 °C (104 °F).
- Rangez le SIMULATEUR AUVI-Q dans son étui.
- Gardez le SIMULATEUR AUVI-Q à l'abri de la poussière, des substances chimiques et de l'eau.
Élimination
Le SIMULATEUR AUVI-Q contient des composantes électroniques et des piles boutons au lithium, et doit être convenablement éliminé. Suivez la réglementation en matière d'environnement de votre province et de votre région.
Californie uniquement : Ce produit utilise des piles contenant du perchlorate – des instructions particulières de manipulation peuvent s'appliquer. Consulter www.dtsc.ca.gov/hazardouswaste/perchlorate.
Fabriqué pour :
Kaleo, Inc.
Richmond, VA 23219 USA
Ce produit peut être l'objet d'un ou de plusieurs brevets ou demandes de brevet en instance des États-Unis. Consultez www.kaleopharma.com/pat pour plus de détails.
Révision novembre 2017
AIRE D'AFFICHAGE PRINCIPALE - NDC: 60842-023-01 – Étiquette de la boîte 0,3 mg 2-plus-1

Description textual
Une image de l'aire d'affichage principale de l'étiquette de la boîte d'AUVI-Q 0,3 mg.
| TRAINER | SIMULATEUR |
| For single-use injection. Refill prescription after use. | Injection à usage unique. Renouveler l'ordonnance après l'utilisation. |
| NDC 60842-023-01 | NDC 60842-023-01 |
| FOR ALLERGIC EMERGENCIES in patients weighing over 66 lb | POUR TRAITER D'URGENCE UNE RÉACTION ALLERGIQUE chez un patient de moins de 30 kg (66 lb) |
| PUSH HERE AND LIFT | APPUYEZ ICI ET RETIREZ |
| Rx only | Sur ordonnance uniquement |
| Read enclosed Patient Information leaflet and Trainer Instructions for Use found inside. Trainer does not contain active drug or needle. | Lire le dépliant sur les renseignements sur le patient et le mode d'emploi du simulateur fournis dans la boîte. Le simulateur ne contient pas de médicament actif ou d'aiguille. |
| Each 0.3 ml contains: | Un volume de 0,3 ml contient : |
| 0.3 mg epinephrine | 0,3 mg d'épinéphrine |
| 2.3 mg sodium chloride | 2,3 mg de chlorure de sodium |
| 0.5 mg sodium bisulfite | 0,5 mg de bisulfite de sodium |
| Water for injection | Eau pour injection |
| ATTENTION PHARMACIST: Dispense this entire carton as a unit | À L'ATTENTION DU PHARMACIEN : fournir toute la boîte comme étant une unité |
| AUVI-Q epinephrine injection, USP | AUVI-Q, épinéphrine par injection, USP |
| 0.3 mg auto-injector | Auto-injecteur de 0,3 mg |
| 2 PREFILLED AUTO-INJECTORS + 1 TRAINER | 2 AUTO-INJECTEURS PRÉREMPLIS + 1 SIMULATEUR |
| Kaleo | Kaleo |
| Do not refrigerate of freeze | Ne pas réfrigérer ou congeler |
| Protect from heat and light | Protéger de la chaleur et de la lumière |
| Store at room temperature 68° to 77°c (20° to 25°c); excursions permitted to 59° to 86°f (15° to 30°c) | Conserver à la température ambiante 20 °c à 25 °c (68 °f à 77 °f); variations permises entre 15 °c à 30 °c (59 °f à 86 °f) |
| Replace auto-injector if solution is discolored, cloudy, or contains particles | Remplacer l'auto-injecteur si la solution a changé de couleur, est trouble ou contient des particules |
| Manufactured for Kaleo, Inc. / Richmond, VA 23219 USA | Fabriqué pour Kaleo, Inc. / Richmond, VA 23219 États-Unis |
| 2016 kaleo, Inc. | 2016 Kaleo, Inc. |
| PLACE PHARMACY PATIENT LABEL HERE | COLLER L'ÉTIQUETTE DU PATIENT ICI |
AIRE D'AFFICHAGE PRINCIPALE - NDC: 60842-023-01 – Étiquette du boîtier externe 0,3 mg Étiquette

Description textual
Une image de l'aire d'affichage principale de l'étiquette du boîtier extérieur d'AUVI-Q 0,3 mg.
| NDC 60842-023-01 | NDC 60842-023-01 |
| Rx Only | Sur ordonnance uniquement |
| Keep AUVI-Q in this case until you need to use it | Conserver AUVI-Q dans cet étui jusqu'à son utilisation |
| Pull device up from this case | Retirer le dispositif de son étui |
| AUVI-Q epinephrine injection, USP | AUVI Q épinéphrine pour injection, USP |
| 0.3 mg auto-injector | Auto-injecteur de 0,3 mg |
| SA6017-01-10 | SA6017-01-10 |
| Do not refrigerate of freeze | Ne pas réfrigérer ou congeler |
| Protect from heat and light | Protéger de la chaleur et de la lumière |
| Store at room temperature 68° to 77°c (20° to 25°c); excursions permitted to 59° to 86°f (15° to 30°c) | Conserver à la température ambiante 20 °c à 25 °c (68 °f à 77 °f); variations permises entre 15 °c à 30 °c (59 °f à 86 °f) |
| Replace auto-injector if solution is discolored, cloudy, or contains particles | Remplacer l'auto-injecteur si la solution a changé de couleur, est trouble ou contient des particules |
| For single-use injection. Refill prescription after use. | Injection à usage unique. Renouveler l'ordonnance après l'utilisation. |
| FOR ALLERGIC EMERGENCIES in patients weighing over 66 lb | POUR TRAITER D'URGENCE UNE RÉACTION ALLERGIQUE chez un patient de plus de 30 kg (66 lb) |
| Instructions for use found inside on device | Mode d'emploi à l'intérieur, sur le dispositif |
| FRONT | Devant |
| BACK | Dos |
| Manufactured for Kaleo | Fabriqué pour Kaleo |
| www.auvi-q.com | www.auvi-q.com |
| Origin Germany | Origine : Allemagne |
| IMO-MJL | IMO-MJL |
AIRE D'AFFICHAGE PRINCIPALE - NDC: 60842-023-01 – Étiquette du dispositif 0,3 mg
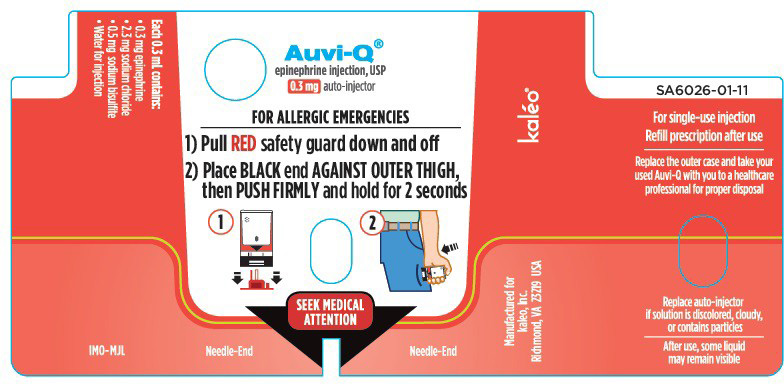
Description textual
Une image de l'aire d'affichage principale de l'étiquette du dispositif AUVI-Q 0,3 mg.
| Each 0.3 ml contains: | Un volume de 0,3 ml contient : |
| 0.3 mg epinephrine | 0,3 mg d'épinéphrine |
| 2.3 mg sodium chloride | 2,3 mg de chlorure de sodium |
| 0.5 mg sodium bisulfite | 0,5 mg de bisulfite de sodium |
| Water for injection | Eau pour injection |
| AUVI-Q epinephrine injection, USP | AUVI-Q, épinéphrine pour injection, USP |
| 0.3 mg auto-injector | Auto-injecteur de 0,3 mg |
| FOR ALLERGIC EMERGENCIES | POUR TRAITER D'URGENCE UNE RÉACTION ALLERGIQUE |
| 1) Place BLACK end AGAINST OUTER THIGH, then PUSH FIRMLY and hold for 2 seconds | 1) PLACEZ L'EXTRÉMITÉ NOIRE CONTRE LA CUISSE, DU CÔTÉ EXTÉRIEUR DE LA JAMBE, PUIS POUSSEZ FERMEMENT, ET ATTENDEZ 2 SECONDES |
| IMO-MJL | IMO-MJL |
| Needle-End | Extrémité de l'aiguille |
| SEEK MEDICAL ATTENTION | CONSULTER UN MÉDECIN |
| Manufactured for Kaleo, Inc. Richmond, VA 23219 USA |
Fabriqué pour Kaleo, Inc. / Richmond, VA 23219 États-Unis |
| Kaléo | Kaleo |
| SA6026-01-11 | SA6026-01-11 |
| For single-use injection. Refill prescription after use. | Injection à usage unique. Renouveler l'ordonnance après l'utilisation. |
| Replace the outer case and take your used AUVI-Q with you to a healthcare professional for proper disposal | Remettre l'étui en place et apporter l'AUVI-Q utilisé chez le médecin pour une élimination appropriée |
| Replace auto-injector if solution is discolored, cloudy, or contains particles | Remplacer l'auto-injecteur si la solution est colorée, est trouble ou contient des particules |
| Afteruse, some liquid may remain visible | Après utilisation, vous verrez une certaine quantité de liquide résiduelle. |
AIRE D'AFFICHAGE PRINCIPALE - NDC: 60842-022-01 – Étiquette de la boîte 0,15 mg 2-plus-1

Description textual
Une image de l'aire d'affichage principale de l'étiquette de la boîte d'AUVI-Q 0,15 mg.
| TRAINER | SIMULATEUR |
| For single-use injection. Refill prescription after use. | Injection à usage unique. Renouveler l'ordonnance après l'utilisation. |
| AUVI-Q epinephrine injection, USP | AUVI-Q, épinéphrine pour injection, USP |
| 0.15 mg auto-injector | Auto-injecteur de 0,15 mg |
| FOR ALLERGIC EMERGENCIES in patients weighing 33 lb to 66 lb | POUR TRAITER D'URGENCE UNE RÉACTION ALLERGIQUE chez un patient pesant entre 15 kg et 30 kg (33 lb à 66 lb) |
| NDC 60842-022-01 | NDC 60842-022-01 |
| 2 PREFILLED AUTO-INJECTORS + 1 TRAINER | 2 AUTO-INJECTEURS PRÉREMPLIS + 1 SIMULATEUR |
| Kaléo | Kaleo |
| SA6067-02-05 | SA6067-02-05 |
| For California Only: this product uses batteries containing Perchlorate Materiel – special handling may apply. See www.dtsc.ca.gov/hazardouswaste/perchlorate | Californie uniquement : Ce produit utilise des piles contenant du perchlorate – des instructions particulières de manipulation peuvent s'appliquer. Consulter www.dts c.ca.gov/hazardous was te/perchlorate |
| Read enclosed Patient Information leaflet and Trainer Instructions for Use found inside. Trainer does not contain active drug or needle. | Lire le dépliant sur les renseignements sur le patient et le mode d'emploi du simulateur fournis dans la boîte. Le simulateur ne contient pas de médicament actif ou d'aiguille |
| Each 0.15 ml contains: | Un volume de 0,15 ml contient : |
| 0.15 mg epinephrine | 0,15 mg d'épinéphrine |
| 1.2 mg sodium chloride | 1,2 mg de chlorure de sodium |
| 0.2 mg sodium bisulfite | 0,2 mg de bisulfite de sodium |
| Water for injection | Eau pour injection |
| Do not refrigerate of freeze | Ne pas réfrigérer ou congeler |
| Protect from heat and light | Protéger de la chaleur et de la lumière |
| Store at room temperature 68° to 77°c (20° to 25°c); excursions permitted to 59° to 86°f (15° to 30°c) | Conserver à la température ambiante 20 °c à 25 °c (68 °f à 77 °f); variations permises entre 15 °c à 30 °c (59 °f à 86 °f) |
| Replace auto-injector if solution is discolored, cloudy, or contains particles | Remplacer l'auto-injecteur si la solution a changé de couleur, est trouble ou contient des particules |
| Manufactured for Kaleo, Inc. / Richmond, VA 23219 USA | Fabriqué pour Kaleo, Inc. / Richmond, VA 23219 États-Unis |
| 2016 kaleo, Inc. | 2016 Kaleo, Inc. |
| www.auvi-q.com | www.auvi-q.com |
| ATTENTION PHARMACIST: Dispense this entire carton as a unit | À L'ATTENTION DU PHARMACIEN : fournir toute la boîte comme étant une unité |
| PLACE PHARMACY PATIENT LABEL HERE | COLLER L'ÉTIQUETTE DU PATIENT ICI |
AIRE D'AFFICHAGE PRINCIPALE - NDC: 60842-022-01 – Étiquette du boîtier extérieur 0,15 mg

Description textual
Une image de l'aire d'affichage principale de l'étiquette du boîtier extérieur d'AUVI-Q 0,15 mg.
| Keep AUVI-Q in this case until you need to use it | Conserver AUVI-Q dans cet étui jusqu'à son utilisation |
| NDC 60842-022-01 | NDC 60842-022-01 |
| Pull device up from this case | Retirer le dispositif de cet étui |
| AUVI-Q epinephrine injection, USP | AUVI-Q épinéphrine pour injection, USP |
| 0.15 mg auto-injector | Auto-injecteur de 0,15 mg |
| For single-use injection. Refill prescription after use. | Injection à usage unique. Renouveler l'ordonnance après l'utilisation. |
| FOR ALLERGIC EMERGENCIES in patients weighing 33 lb to 66 lb | POUR TRAITER D'URGENCE UNE RÉACTION ALLERGIQUE chez les patients pesant entre 15 kg et 30 kg (33 lb à 66 lb) |
| Instructions for use found inside on device | Mode d'emploi à l'intérieur, sur le dispositif |
| FRONT | Devant |
| Rx Only | Sur ordonnance uniquement |
| SA6017-02-10 | SA6017-02-10 |
| Do not refrigerate of freeze | Ne pas réfrigérer ou congeler |
| Protect from heat and light | Protéger de la chaleur et de la lumière |
| Store at room temperature 68° to 77°c (20° to 25°c); excursions permitted to 59° to 86°f (15° to 30°c) | Conserver à la température ambiante 20 °c à 25 °c (68 °f à 77 °f); variations permises entre 15 °c à 30 °c (59 °f à 86 °f) |
| Replace auto-injector if solution is discolored, cloudy, or contains particles | Remplacer l'auto-injecteur si la solution est colorée, est trouble ou contient des particules |
| Manufactured for kaléo | Fabriqué pour Kaleo |
| www.auvi-q.com | www.auvi-q.com |
| Origin: Germany | Origine : Allemagne |
| IMO-MJL | IMO-MJL |
| BACK | Dos |
AIRE D'AFFICHAGE PRINCIPALE - NDC: 60842-022-01 – étiquette du dispositif de 0,15 mg

Description textual
Une image de l'aire d'affichage principale de l'étiquette du dispositif AUVI-Q 0,15 mg.
| Each 0.15 ml contains: | Un volume de 0,15 ml contient : |
| 0.15 mg epinephrine | 0,15 mg d'épinéphrine |
| 1.2 mg sodium chloride | 1,2 mg de chlorure de sodium |
| 0.2 mg sodium bisulfite | 0,2 mg de bisulfite de sodium |
| Water for injection | Eau pour injection |
| AUVI-Q epinephrine injection, USP | AUVI-Q, épinéphrine pour injection, USP |
| 0.15 mg auto-injector | Auto-injecteur de 0,15 mg |
| FOR ALLERGIC EMERGENCIES | POUR TRAITER D'URGENCE UNE RÉACTION ALLERGIQUE |
| 1) Pull RED safety guard down and off | 1) Tirer fermement le dispositif de sécurité ROUGE vers le bas pour l'enlever |
| 2) Place BLACK end AGAINST OUTER THIGH, then PUSH FIRMLY and hold for 2 seconds | 2) PLACER L'EXTRÉMITÉ NOIRE CONTRE LA CUISSE, DU CÔTÉ EXTÉRIEUR DE LA JAMBE, PUIS POUSSER FERMEMENT, ET ATTENDRE 2 SECONDES |
| SEEK MEDICAL ATTENTION | Consulter un médecin |
| IMO-MJL | IMO-MJL |
| Needle-End | Extrémité de l'aiguille |
| SA6026-02-11 | SA6026-02-11 |
| For single-use injection. Refill prescription after use. | Injection à usage unique. Renouveler l'ordonnance après l'utilisation. |
| Replace the outer case and take your used AUVI-Q with you to a healthcare professional for proper disposal | Remettre l'étui en place et apporter l'AUVI-Q utilisé chez le médecin pour une élimination appropriée |
| Replace auto-injector if solution is discolored, cloudy, or contains particles | Remplacer l'auto-injecteur si la solution a changé de couleur, est trouble ou contient des particules |
| After use, some liquid may remain visible | Après utilisation, vous verrez une certaine quantité de liquide résiduelle |
| Manufactured for Kaleo, Inc. Richmond, VA 23219 USA |
Fabriqué pour Kaleo, Inc. / Richmond, VA 23219 États-Unis |
| 2016 kaleo, Inc. | 2016 Kaleo, Inc. |
AIRE D'AFFICHAGE PRINCIPALE - NDC: 60842-024-01 – Étiquette de la boîte du simulateur (fourni avec les auto-injecteurs de 0,3 mg et de 0,15 mg)

Description textual
Une image de l'aire d'affichage principale de l'étiquette de la boîte du simulateur AUVI-Q.
| TRAINER FOR AUVI-Q | SIMULATEUR AUVI-Q |
| CONTAINS NO ACTIVE DRUG OR NEEDLE | NE CONTIENT AUCUN MÉDICAMENT ACTIF NI AIGUILLE |
| Read enclosed Trainer Instructions for Use found inside. | Lisez le mode d'emploi du simulateur fourni dans la boîte |
| Use this TRAINER to practice often. Register for refill reminder, helpful resources and tools at: www.auvi-q.com | Utiliser souvent le SIMILATEUR pour vous exercer. S'inscrire à www.auvi-q.com pour obtenir un rappel de renouvellement, des ressources utiles et des outils. |
| For Practice Only – Reusable | Uniquement pour s'exercer – Réutilisable |
| Manufactured for kaleo Inc. Richmond, VA 23219 USA |
Fabriqué pour Kaleo, Inc. / Richmond, VA 23219 États-Unis |
| 2016 kaleo, Inc. | 2016 kaleo, Inc. |
| Origin Thailand | Origine : Thaïlande |
| IMO-MJL | IMO-MJL |
| Kaléo | Kaleo |
| PUSH HERE & LIFT | APPUYEZ ICI ET RETIREZ |
AIRE D'AFFICHAGE PRINCIPALE - NDC: 60842-024-01 – Étiquette du boîtier extérieur du simulateur (fourni avec les auto-injecteurs de 0,3 mg et 0,15 mg)

Description textual
Une image de l'aire d'affichage principale de l'étiquette du boîtier extérieur du simulateur AUVI-Q.
| TRAINER FOR AUVI-Q | SIMULATEUR AUVI-Q |
| CONTAINS NO ACTIVE DRUG OR NEEDLE | NE CONTIENT AUCUN MÉDICAMENT ACTIF NI AIGUILLE |
| Pull device up from this case | Retirer le dispositif de son étui |
| Instructions for use found inside on TRAINER | Mode d'emploi à l'intérieur, sur le simulateur |
| FRONT | DEVANT |
| BACK | DOS |
| Use this TRAINER to practice often | Utiliser souvent le SIMILATEUR pour vous exercer. |
| Register for refill reminder, helpful resources and tool at: www.auvi-q.com | S'inscrire à www.auvi-q.com pour obtenir un rappel de renouvellement, des ressources utiles et des outils. |
| For practice only – reusable | Uniquement pour s'exercer – réutilisable |
| Manufactured for kaléo | Fabriqué pour Kaleo |
| Origin: Thailand | Origine : Thaïlande |
| IMO-MJL | IMO-MJL |
AIRE D'AFFICHAGE PRINCIPALE - NDC: 60842-024-01 – Étiquette du simulateur (fourni avec les auto-injecteurs de 0,3 mg et 0,15 mg)

Description textual
Une image de l'aire d'affichage principale de l'étiquette du simulateur AUVI-Q.
| TRAINER FOR AUVI-Q | SIMULATEUR AUVI-Q |
| For practice only – reusable | Uniquement pour s'exercer – réutilisable |
| 1) Pull RED safety guard down and off | 1) Tirer fermement le dispositif de sécurité ROUGE vers le bas pour l'enlever |
| 2) Place BLACK end AGAINST OUTER THIGH, then PUSH FIRMLY and hold for 2 seconds | 2) PLACEZ L'EXTRÉMITÉ NOIRE CONTRE LA CUISSE, DU CÔTÉ EXTÉRIEUR DE LA JAMBE, PUIS POUSSEZ FERMEMENT, ET ATTENDEZ 2 SECONDES |
| CONTAINS NO ACTIVE DRUG OR NEEDLE | NE CONTIENT AUCUN MÉDICAMENT ACTIF NI AIGUILLE |
| IMO-MJL | IMO-MJL |
| TRAINER RESET INSTRUCTIONS | INSTRUCTIONS DE RÉINITIALISATION DU SIMULATEUR |
| Replace RED Safety Guard | Remettre le dispositif de sécurité ROUGE en place |
| Replace GRAY Outer Case | Remettre l'étui GRIS |
| Manufactured for kaleo, Inc. Richmond, VA 23219 USA |
Fabriqué pour Kaleo, Inc. / Richmond, VA 23219 États-Unis |
AIRE D'AFFICHAGE PRINCIPALE - NDC: 60842-021-01 – Étiquette du boîtier 0,1 mg 2-plus-1

Description textual
Une image de l'aire d'affichage principale de la boîte d'AUVI-Q 0,1 mg.
| TRAINER | SIMULATEUR |
| For single-use injection. Refill prescription after use. | Injection à usage unique. Renouveler l'ordonnance après l'utilisation. |
| AUVI-Q epinephrine injection, USP | AUVI-Q, épinéphrine pour injection, USP |
| 0.1 mg auto-injector | Auto-injecteur de 0,1 mg |
| FOR ALLERGIC EMERGENCIES in patients weighing 16.5 lb to 33 lb | POUR TRAITER D'URGENCE UNE RÉACTION ALLERGIQUE |
| NDC 60482-021-01 | NDC 60482-021-01 |
| Rx only | Sur ordonnance uniquement |
| 2 PREFILLED AUTO-INJECTORS + 1 TRAINER | 2 AUTO-INJECTEURS PRÉREMPLIS + 1 SIMULATEUR |
| For California Only; this product uses batteries containing Perchlorate Material – special handling may apply. See www.dtsc.ca.gov/hazardouswaste/perchlorate | Californie uniquement : Ce produit utilise des piles contenant du perchlorate – des instructions particulières de manipulation peuvent s'appliquer. Consulter www.dts c.ca.gov/hazardous was te/perchlorate |
| Read enclosed Patient Information leaflet and Trainer Instructions for Use found inside. Trainer does not contain active drug or needle. | Lire le dépliant sur les renseignements sur le patient et le mode d'emploi du simulateur fournis dans la boîte. Le simulateur ne contient pas de médicament actif ou d'aiguille |
| Each 0.1 ml contains: | Un volume de 0,1 ml contient : |
| 0.1 mg epinephrine | 0,1 mg d'épinéphrine |
| 0.78 mg sodium chloride | 0,78 mg de chlorure de sodium |
| 0.15 mg sodium bisulfite | 0,15 mg de bisulfite de sodium |
| Water for injection | Eau pour injection |
| Do not refrigerate of freeze | Ne pas réfrigérer ou congeler |
| Protect from heat and light | Protéger de la chaleur et de la lumière |
| Store at room temperature 68° to 77°c (20° to 25°c); excursions permitted to 59° to 86°f (15° to 30°c) | Conserver à la température ambiante 20 °c à 25 °c (68 °f à 77 °f); variations permises entre 15 °c à 30 °c (59 °f à 86 °f) |
| Replace auto-injector if solution is discolored, cloudy, or contains particles | Remplacer l'auto-injecteur si la solution est colorée, est trouble ou contient des particules |
| Manufactured for kaleo, Inc. / Richmond, VA 23219 USA | Fabriqué pour Kaleo, Inc. / Richmond, VA 23219 États-Unis |
| 2017 kaleo, Inc. | 2017 Kaleo, Inc. |
| www.auvi-q.com | www.auvi-q.com |
| ATTENTION PHARMACIST: Dispense this entire carton as a unit | À l'attention du pharmacien : fournir toute la boîte comme étant une unité |
| Place pharmacy patient label here | Coller l'étiquette du patient ici |
AIRE D'AFFICHAGE PRINCIPALE - NDC: 60842-021-01 – Étiquette du boîtier externe 0,1 mg

Description textual
Une image de l'aire d'affichage principale de l'étiquette du boîtier extérieur d'AUVI-Q 0,1 mg.
| Keep AUVI-Q in this case until you need to use it. | Conserver AUVI-Q dans cet étui jusqu'à son utilisation |
| NDC 60842-021-01 | NDC 60842-021-01 |
| Rx Only | Sur ordonnance uniquement |
| Pull device up from this case | Retirer le dispositif de son étui |
| AUVI-Q epinephrine injection, USP | AUVI-Q, épinéphrine pour injection, USP |
| 0.1 mg auto-injector | Auto-injecteur de 0,1 mg |
| For single-use injection. Refill prescription after use. | Injection à usage unique. Renouveler l'ordonnance après l'utilisation. |
| FOR ALLERGIC EMERGENCIES in patients weighing 16.5 lb to 33 lb | POUR TRAITER D'URGENCE UNE RÉACTION ALLERGIQUE chez les patients pesant entre 7,5 kg à 15 kg (16,5 lb à 33 lb) |
| Instructions for use found inside on device | Mode d'emploi à l'intérieur, sur le dispositif |
| FRONT | DEVANT |
| SA6017-03-04 | SA6017-03-04 |
| Protect from heat and light | Protéger de la chaleur et de la lumière |
| Store at room temperature 68° to 77°c (20° to 25°c); excursions permitted to 59° to 86°f (15° to 30°c) | Conserver à la température ambiante 20 °c à 25 °c (68 °f à 77 °f); variations permises entre 15 °c à 30 °c (59 °f à 86 °f) |
| Replace auto-injector if solution is discolored, cloudy, or contains particles | Remplacer l'auto-injecteur si la solution a changé de couleur, est trouble ou contient des particules |
| Manufactured for kaleo | Fabriqué pour Kaleo |
| www.auvi-q.com | www.auvi-q.com |
| Origin: Germany | Origine : Allemagne |
| IMO-MJL | IMO-MJL |
| BACK | DOS |
AIRE D'AFFICHAGE PRINCIPALE – NDC : 60842-021-01 – Étiquette du dispositif de 0,1 mg

Description textual
Une image de l'aire d'affichage principale de l'étiquette du dispositif AUVI-Q 0,1 mg.
| Each 0.1 ml contains: | Un volume de 0,1 ml contient : |
| 0.1 mg epinephrine | 0,1 mg d'épinéphrine |
| 0.78 mg sodium chloride | 0,78 mg de chlorure de sodium |
| 0.15 mg sodium bisulfite | 0,15 mg de bisulfite de sodium |
| Water for injection | Eau pour injection |
| AUVI-Q epinephrine injection, USP | AUVI-Q épinéphrine pour injection, USP |
| 0.1 mg auto-injector | Auto-injecteur 0,1 mg |
| FOR ALLERGIC EMERGENCIES | POUR TRAITER D'URGENCE UNE RÉACTION ALLERGIQUE |
| 1) Pull RED safety guard down and off | 1) TIRER le dispositif de protection ROUGE vers le bas jusqu'à ce qu'il se détache |
| 2) Place BLACK end AGAINST OUTER THIGH, then PUSH FIRMLY and hold for 2 seconds | 2) Placer l'extrémité NOIRE du dispositif contre le côté extérieur de la cuisse, puis POUSSER fermement et attendre 2 secondes |
| SEEK MEDICAL ATTENTION | OBTENIR DES SOINS MÉDICAUX |
| IMO-MJL | IMO-MJL |
| Needle-End | Extrémité de l'aiguille |
| Kaléo | Kaléo® |
| SA6026-03-04 | SA6026-03-04 |
| For single-use injection. Refill prescription after use. | Injection à usage unique. Renouveler l'ordonnance après l'utilisation |
| Replace the outer case and take your used AUVI-Q with you to a healthcare professional for proper disposal | Remettre l'étui en place et apporter l'AUVI-Q utilisé chez le médecin pour une élimination appropriée. |
| Replace auto-injector if solution is discolored, cloudy, or contains particles | Remplacer l'auto-injecteur si la solution a changé de couleur, est trouble ou contient des particules. |
| After use, some liquid may remain visible | Après utilisation, vous verrez une certaine quantité de liquide résiduelle. |
| Manufactured for Kaleo, Inc. Richmond, VA 23219 USA |
Fabriqué pour kaléo, Inc. Richmond, VA 23219 États-Unis |
AIRE D'AFFICHAGE PRINCIPALE – NDC : 60842-025-01 – Étiquette de la boîte du simulateur (fourni avec les auto-injecteurs de 0,1 mg)

Description textual
Une image de l'aire d'affichage principale de l'étiquette de la boîte du simulateur AUVI-Q.
| TRAINER FOR AUVI-Q | SIMULATEUR POUR AUVI-Q |
| CONTAINS NO ACTIVE DRUG OR NEEDLE | NE CONTIENT AUCUN MÉDICAMENT ACTIF NI AIGUILLE |
| Read enclosed Trainer Instructions for Use found inside. | Lire le mode d'emploi du simulateur fourni dans la boîte. |
| Use this TRAINER to practice often. Register for refill reminder, helpful resources and tools at: www.auvi-q.com | Utiliser souvent le SIMULATEUR pour vous exercer. S'inscrire à www.auvi-q.com pour obtenir un rappel de renouvellement, des ressources utiles et des outils. |
| For Practice Only – Reusable | Uniquement pour s'exercer – réutilisable |
| Manufactured for Kaleo, Inc. Richmond, VA 23219 USA |
Fabriqué pour kaléo, Inc. / Richmond, VA 23219 États-Unis |
| 2017 kaleo, Inc. | 2017 kaléo, Inc. |
| Origin: Thailand | Origine : Thaïlande |
| IMO-MJL | IMO-MJL |
| Kaléo | Kaléo |
| PUSH HERE AND LIFT | APPUYER ICI ET RETIRER |
| For California Only: this product uses batteries containing Perchlorate Material – special handling may apply. See www.dtsc.ca.gov/hazardouswaste/perchlorate | Californie uniquement : Ce produit utilise des piles contenant du perchlorate – des instructions particulières de manipulation peuvent s'appliquer. Consulter www.dtsc.ca.gov/hazardouswaste/perchlorate |
AIRE D'AFFICHAGE PRINCIPALE – NDC : 60842-025-01 – Étiquette du boîtier extérieur du simulateur (fourni avec les auto-injecteurs de 0,1 mg)

Description textual
Une image de l'aire d'affichage principale de l'étiquette du boîtier extérieur du simulateur AUVI-Q.
| CONTAINS NO ACTIVE DRUG OR NEEDLE | NE CONTIENT AUCUN MÉDICAMENT ACTIF NI AIGUILLE |
| TRAINER for AUVI-Q | SIMULATEUR POUR AUVI-Q |
| Pull TRAINER up from this case | Retirer le SIMULATEUR de son étui |
| Instructions for use found inside on TRAINER | Mode d'emploi à l'intérieur, sur le SIMULATEUR |
| Front | Devant |
| Back | Dos |
| Use this TRAINER to practice often | Utiliser souvent le SIMULATEUR pour vous exercer |
| Register for refill reminder, helpful resources and tools at: www.auvi-q.com | S'inscrire à www.auvi-q.com pour obtenir un rappel de renouvellement, des ressources utiles et des outils |
| For Practice Only – Reusable | Uniquement pour s'exercer – réutilisable |
| Manufactured for kaléo | Fabriqué pour kaléo® |
| SA6079-03-01 | SA6079-03-01 |
| Origin: Thailand | Origine : Thaïlande |
| IMO-MJL | IMO-MJL |
AIRE D'AFFICHAGE PRINCIPALE – NDC : 60842-025-01 – Étiquette du simulateur (fourni avec les auto-injecteur de 0,1 mg)

Description textual
Une image de l'aire d'affichage principale de l'étiquette du simulateur AUVI-Q.
| TRAINER FOR AUVI-Q | SIMULATEUR POUR AUVI-Q |
| CONTAINS NO ACTIVE DRUG OR NEEDLE | NE CONTIENT AUCUN MÉDICAMENT ACTIF NI AIGUILLE |
| For Practice Only – Reusable | Uniquement pour s'exercer – réutilisable |
| 1) Pull RED safety guard down and off | 1) TIRER le dispositif de protection ROUGE vers le bas jusqu'à ce qu'il se détache |
| 2) Place BLACK end AGAINST OUTER THIGH, then PUSH FIRMLY and hold for 2 seconds | 2) Placer l'extrémité NOIRE du dispositif contre le côté extérieur de la cuisse, puis POUSSER fermement et attendre 2 secondes |
| Trainer reset instructions | Instructions de réinitialisation du simulateur |
| Replace RED Safety Guard | Remettre le dispositif de sécurité ROUGE en place |
| Replace GRAY Outer Case | Remettre l'étui GRIS |
| Manufactured for kaleo, Inc. Richmond, VA 23219 USA |
Fabriqué pour kaléo, Inc. Richmond, VA 23219 États-Unis |
| Renseignements sur le produit | ||||
|---|---|---|---|---|
| Type de produit | Médicament d'ordonnance pour usage humain | Code d'article (source) | NDC : 60842-023 | |
| Voie d'administration | Intramusculaire | |||
| Ingrédient actif / fraction active | ||||
| Nom d'ingrédient | Ingrédient actif | Concentration | ||
| Épinéphrine (UNII : YKH834O4BH) (Épinéphrine - UNII : YKH834O4BH) | Épinéphrine | 0,3 mg dans 0,3 ml | ||
| Ingrédients inactifs | ||||
| Nom d'ingrédient | Concentration | |||
| Chlorure de sodium (UNII : 451W47IQ8X) | 2,3 mg dans 0,3 ml | |||
| Bisulfite de sodium (UNII : TZX5469Z6I) | 0,5 mg dans 0,3 ml | |||
| Eau (UNII : 059QF0KO0R) | ||||
| Acide chlorhydrique (UNII : QTT17582CB) | ||||
| Emballage | ||||
| # | Code d'article | Description de l'emballage | Date de début de la commercialisation | Date fin commercialisation |
| 1 | NDC:60842-023-01 | 2 dans 1 BOÎTE | 11/15/2012 | |
| 1 | 0,3 ml dans 1 EMBALLAGE DE DOSES; Type 2 : Système/dispositif d'administration de médicament prérempli (seringue, timbre, etc.) | |||
| Renseignements relatifs à la commercialisation | ||||
| Catégorie de commercialisation | Numéro de demande ou citation de monographie | Date de début de la commercialisation | Date fin commercialisation | |
| NDA | NDA201739 | 11/15/2012 | ||
| Renseignements sur le produit | ||||
|---|---|---|---|---|
| Type de produit | Médicament d'ordonnance pour usage humain | Code d'article (source) | NDC : 60842-022 | |
| Voie d'administration | Intramusculaire | |||
| Ingrédient actif / fraction active | ||||
| Nom d'ingrédient | Ingrédient actif | Concentration | ||
| Épinéphrine (UNII : YKH834O4BH) (Épinéphrine - UNII :YKH834O4BH) | Épinéphrine | 0,15 mg dans 0,15 ml | ||
| Ingrédients inactifs | ||||
| Nom d'ingrédient | Concentration | |||
| Chlorure de sodium (UNII : 451W47IQ8X) | 1,2 mg dans 0,15 ml | |||
| Bisulfite de sodium (UNII : TZX5469Z6I) | 0,2 mg dans 0,15 ml | |||
| Eau (UNII : 059QF0KO0R) | ||||
| Acide chlorhydrique (UNII : QTT17582CB) | ||||
| Emballage | ||||
| # | Code d'article | Description de l'emballage | Date de début de la commercialisation | Date fin commercialisation |
| 1 | NDC: 60842-022-01 | 2 dans 1 BOÎTE | 11/15/2012 | |
| 1 | 0,15 ml dans 1 EMBALLAGE DE DOSES; Type 2 : Système/dispositif d'administration de médicament prérempli (seringue, timbre, etc.) | |||
| Renseignements relatifs à la commercialisation | ||||
| Catégorie de commercialisation | Numéro de demande ou citation de monographie | Date de début de la commercialisation | Date fin commercialisation | |
| NDA | NDA201739 | 11/15/2012 | ||
| Renseignements sur le produit | ||||
|---|---|---|---|---|
| Type de produit | Médicament d'ordonnance pour usage humain | Code d'article (source) | NDC : 60842-021 | |
| Voie d'administration | Intramusculaire | |||
| Ingrédient actif / fraction active | ||||
| Nom d'ingrédient | Ingrédient actif | Concentration | ||
| Épinéphrine (UNII : YKH834O4BH) (Épinéphrine - UNII :YKH834O4BH) | Épinéphrine | 0,1 mg dans 0,1 ml | ||
| Ingrédients inactifs | ||||
| Nom d'ingrédient | Concentration | |||
| Chlorure de sodium (UNII : 451W47IQ8X) | 0,78 mg dans 0,1 ml | |||
| Bisulfite de sodium (UNII : TZX5469Z6I) | 0,15 mg dans 0,1 ml | |||
| Eau (UNII : 059QF0KO0R) | ||||
| Acide chlorhydrique (UNII : QTT17582CB) | ||||
| Emballage | ||||
| # | Code d'article | Description de l'emballage | Date de début de la commercialisation | Date fin commercialisation |
| 1 | NDC : 60842-021-01 | 2 dans 1 BOÎTE | 11/17/2017 | |
| 1 | 0,1 ml dans 1 EMBALLAGE DE DOSES; Type 2 : Système/dispositif d'administration de médicament prérempli (seringue, timbre, etc.) | |||
| Renseignements relatifs à la commercialisation | ||||
| Catégorie de commercialisation | Numéro de demande ou citation de monographie | Date de début de la commercialisation | Date fin commercialisation | |
| NDA | NDA201739 | 11/17/2017 | ||
| Étiqueteur - kaléo, Inc. (182938485) | ||||