Page 13 : Recommandations pour la qualité de l'eau potable au Canada : document technique – les trihalométhanes
11.0 Classification et évaluation
Les données disponibles concernant les différents THM examinés dans ce document ne sont pas suffisantes pour permettre d'élaborer une recommandation distincte pour chacun d'entre eux. On a donc choisi d'établir une CMA pour les THM en tant que groupe, fondée sur les données recueillies sur le chloroforme, et une CMA distincte pour le BDCM.
Comme le chloroforme est le THM dont la concentration est la plus élevée dans l'eau potable, et celui sur lequel on dispose du plus grand nombre de données scientifiques, une recommandation fondée sur les informations disponibles sur ce composé devrait être applicable à tous les THM examinés dans ce document (chloroforme, bromodichlorométhane, dibromochlorométhane et bromoforme). Bien qu'incomplètes, les données épidémiologiques disponibles concordent avec l'hypothèse selon laquelle il est possible d'établir un lien entre l'ingestion d'eau potable chlorée, sinon de THM spécifiquement, et les cancers de la vessie et du côlon (Krasner et coll., 1989). Des données épidémiologiques disponibles depuis 1993 ont en outre établi un lien entre des résultats indésirables pour la reproduction et une exposition aux THM, même si l'on n'a constaté ni de tendance dose-réponse quant à l'augmentation du risque en fonction de la concentration de THM totaux, ni de preuve claire de l'existence d'un seuil (Reif et coll., 2000).
Au cours de cette évaluation, le chloroforme a été classe dans le group IIIC, celui des substances possiblement cancérogènes pour les humains compte tenu de preuves limitées chez les animaux de laboratoire mais de donnée insuffisantes relatives à la cancérogénicité dans le cas des êtres humains (Santé Canada, 1994). Des preuves mécanistes convaincantes indiquent que les réactions tumorigènes observées dans le foie et les reins au cours d'études antérieures sur la cancérogénicité du chloroforme (NCI, 1976a; Jorgenson et coll., 1985) découlent de la médiation d'un mécanisme non génotoxique (PISC, 2000). Un des modes hypothétiques d'intervention du chloroforme dans l'induction des tumeurs chez les rongeurs comprend les precurseurs obligatoires suivants du cancer : 1) métabolisme du chloroforme par la population des cullules cibles; 2) induction d'une cytotoxicité soutenue par des métabolites; 3) prolifération persistante subséquente des cellules régénératives (Environnement Canada et Santé Canada, 2001)
La nature du véhicule utilisé semble constituer un facteur important de la toxicité et de la cancérogénicité du chloroforme. On observe chez le rat et la souris des effets hépatotoxiques plus prononces et une incidence accrue de tumeurs de foie lorsque le chloroforme est administré dans l'huile de maïs plutôt que dans l'eau portable, ce qui s'explique probablement par la différence importante dan la nature de l'apport calorique du premier de ces deux véhicules.
On a procédé à une modélisation pharmacocinétique physiologique pour le chloroforme dans le rapport d'évaluation produit en 2001 en vertu de las LCPE afin d'estimer les doses toxiques dans des organes en particulier. Une recommandation sur l'eau portable au Canada fondée sur une telle modélisation entraînerait une augmentation considérable de la CMA. En raison des incertitudes quant aux effets potentiels sur la santé humaine de la présence de THM dans l'eau portable, et comme on utilise le chloroforme comme substitut des THM, il est jugé approprié d'utiliser la méthode plus conservatrice de la dose journalière tolérable (DJT) pour calculer la CMANote de bas de page 4.
On a tenu compte de deux études clés dans l'évaluation du risque posé par le chloroforme : l'étude réalisée par Heywood et coll. (1979) sur des chiens et celle de Larson et coll. (1994b) sur des souris. Les deux études ont porté sur le foie. Bien que l'étude réalisée par Heywood et coll. (1979) ait porté sur une espèce de mammifère d'un ordre relativement plus élevé (chien) et ait duré assez longtemps (7,5 ans), elle est assez ancienne, a utilisé le gavage à base de dentifrice en gélule et n'a pas couvert toute la vie du chien. De leur côté, Larson et coll. (1994b) on mené leur étude sur une espèce de mammifère d'un ordre relativement plus bas (souris) et utilisé comme véhicule de l'huile de maïs (ce qui a pu influer sur les caractéristiques pharmacocinétiques et la toxicité du composé à l'étude) par gavage, ou de l'eau portable administrée ad libitum, mais la durée de l'étude était brève (trois semaines), ce qui ne suffit pas pour évaluer convenablement une exposition à vie.
Dans le cas des changements reliés à l'exposition survenus dans le foie (cytolétalité et hyperplasie régénérative) et déterminés au cours de l'étude réalisée sur des souris (Larson et coll., 1994b) exposées à du chloroforme dans de l'huile maïs, la NOAEL a été de 10 mg/kg p.c. par jour (corrigée à 7 mg/kg p.c. par jour parce que la dose a été administrée cinq jours par semaine). Au cours de la même étude (Larson et coll., 1994b), les souris exposées à du chloroforme administré dans l'eau potable n'ont subi aucun changement relié à l'exposition jusqu'à une dose de 329 mg/kg p.c. par jour. Dans l'étude qu'ils ont réalisée sur des chiens, Heywood et coll. (1979) ont observé des changements hépatiques reliés à l'exposition (kystes graisseux) à la dose la plus faible administrée (LOAEL = 15 mg/kg p.c. par jour, corrigée à 13 mg/kg p.c. par jour parce que la dose a été administrée six jours par semaine) et l'on n'a établi aucune NOAEL.
On a choisi l'étude réalisée par Heywood et coll. (1979) sur des chiens comme celle qui convient le plus pour évaluer le risque, en raison de sa longue durée et des répercussions possibles du véhicule, soit l'huile de maïs, sur les effets observés pendant l'étude de courte durée que Larson et coll. (1994b) ont effectuée sur la souris. On calcule ainsi la DJT :
DJT = [13 mg/kg p.c. par jour] / 2100 ≈ 0,0062 mg/kg p.c. par jour
où :
- 13 mg/kg p.c. par jour représente la LOAEL établie par Heywood et coll. (1979) au cours de leur étude sur des chiens, corrigée de 15 mg/kg p.c. par jour à 13 mg/kg p.c. par jour pour tenir compte du dosage à six jours par semaine;
- 2 100 représente le facteur d'incertitude (×10 pour tenir compte de la variation à l'intérieur de l'espèce; ×10 pour tenir compte de la variation entre les espèces; ×7 pour tenir compte d'une exposition qui ne dure pas toute la vie; ×3 pour tenir compte de l'utilisation d'une LOAEL au lieu d'une NOAEL). On a choisi un facteur d'incertitude intermédiaire de 7 pour tenir compte de l'exposition qui ne dure pas toute une vie parce que l'on a considéré que 7,5 ans représentaient une période raisonnablement longue dans la durée de vie d'un chien. On a utilisé un facteur d'incertitude modeste de 3 pour tenir compte de l'utilisation d'une LOAEL, à cause de la nature subtile du point final (kystes graisseux) observé au cours de l'étude réalisée sur des chiens. L'absence d'effets sur le foie à une dose beaucoup plus élevée pouvant atteindre 329 mg/kg p.c. par jour lorsqu'on a ajouté du chloroforme dans l'eau potable destinée à une espèce qui semblait plus sensible (souris) appuie aussi ce facteur d'incertitude.
La valeur cible basée sur des critères de santé pour les THM (fondée sur le chloroforme) se calcule de la façon suivante :
[6,2 µg/kg p.c. par jour × 70 kg × 0,80] / [4,11 Leq/j] ≈80 µg/L
où :
- 6,2 µg/kg p.c. par jour représente la DJT calculée ci-dessus;
- 70 kg représente le poids corporel moyen d'un adulte;
- 0,80 représente le facteur d'attribution, compte tenu des estimations de la LCPE (Environnement Canada et Santé Canada, 2001) et du fait que le chloroforme constitue un SPD important dans l'eau traitée. Parmi toutes les voies d'exposition, l'eau potable représente la principale source d'exposition au chloroforme;
- 4,11 Leq/j représente l'exposition totale provenant de l'eau potable (voir la section sur l'exposition multiple par l'eau potable).
Le BDCM est utilisé comme substitut pour ce qui est de la présence de THM bromés, mais la CMA établie s'applique à la teneur de l'eau potable en BDCM.
Les études sur la génotoxicité indiquent que le BDCM est faiblement mutagène, probablement à cause de la conjugaison avec le glutathion. Des études sur la cancérogénicité montrent que le BDCM administré à des rats par gavage dans de l'huile de maïs pendant 102 semaines, à des doses variant de 50 à 100 mg/kg p.c. par jour, a entraîné une augmentation des incidences d'adénomes et d'adénocarcinomes des cellules des tubules rénaux chez les deux sexes et une augmentation marquée de l'incidence des tumeurs du gros intestin (adénomes et carcinomes combinés) chez les deux sexes. Chez la souris, le BDCM administré par gavage dans de l'huile de maïs pendant 102 semaines à des doses de 0, 25 ou 50 mg/kg p.c. par jour ou de 0, 75 ou 150 mg/kg p.c. par jour à des mâles et des femelles respectivement a causé une cytomégalie rénale et une stéatose hépatique, des incidences accrues d'adénomes et de carcinomes des tubules rénaux chez les mâles et une incidence accrue d'adénomes et de carcinomes hépatocellulaires combinés chez les femelles. Des études épidémiologiques révélant un lien apparent entre le groupe de composés des THM et le cancer colorectal chez les êtres humains appuient ces études sur la cancérogénicité.
Le BDCM a été classé dans le groupe II, celui des substances probablement cancérogènes pour les humains compte tenu de données suffisantes sur les animaux et insuffisantes sur les êtres humains (Santé Canada, 1994). Des quatre THM que l'on trouve couramment dans l'eau potable, le BDCM semble être le cancérogène le plus puissant pour les rongeurs. Il a causé l'apparition de tumeurs à des doses moins élevées et dans plus de sites cibles que les autres THM (PISC, 2000).
Pour évaluer le risque de cancer, on a choisi les tumeurs du gros intestin (polypes adénomateux et carcinomes combinés) chez le rat, car elles étaient les plus fréquentes et ont touché les deux sexes au cours de l'étude, et parce qu'il semble y avoir un lien épidémiologique entre ce groupe de composés (THM) et le cancer colorectal chez les êtres humains. Ces tumeurs semblent en outre les plus susceptibles d'être associées à un mécanisme mutagène, car on n'a pas établi de lien entre elles et la cytotoxicité sous-jacente ou un autre mécanisme non épigénétique. Les tumeurs combinées du gros intestin présentaient une valeur de risque unitaire élevée, égale ou supérieure aux risques unitaires des autres types de tumeurs (rein et foie) établis au cours d'études sur la cancérogénicité de ce composé.
On a estimé les risques de cancer en fonction du seul biodosage adéquat de la cancérogenèse, effectué par le NTP en 1987. Il faut toutefois signaler que le composé a été administré par gavage dans de l'huile de maïs et qu'il est possible qu'on ait surestimé les risques quantitatifs. Il existe bien un biodosage de la cancérogenèse au cours duquel on a administré du BDCM par un véhicule plus approprié (c.-à-d. l'eau potable) (Tumasonis et coll., 1985), mais on l'a jugé inadéquat pour une estimation du risque quantitatif compte tenu des limites mentionnées dans la section sur la toxicité chronique et la cancérogénicité. De plus, les augmentations des adénomes et des adénocarcinomes du rein chez la souris mâle et des adénomes et des carcinomes hépatocellulaires chez la souris femelle révélées par le biodosage effectué par le NTP n'ont pas été prises en considération dans l'estimation quantitative des risques de cancer, parce qu'elles étaient limitées à un sexe seulement et que l'huile de maïs a pu contribuer à l'induction des tumeurs du foie chez la souris.
En se fondant sur les tumeurs dont l'incidence a augmenté considérablement chez le rat F344/N au cours du biodosage réalisé par le NTP (1987) (c.-à-d. polypes adénomateux et adénocarcinomes de l'intestin; adénomes et adénocarcinomes des cellules des tubules rénaux), on a calculé les risques unitaires au moyen de la méthode linéarisée à degrés multiples de Howe (1995). On a appliqué un facteur d'échelle allométrique au risque unitaire final en supposant qu'un rat pèse 0,35 kg, une souris, 0,03 kg et un être humain, 70 kg. On n'a pas utilisé les données corrigées de la mortalité de Kaplan-Meier puisque ces données ont en général produit une concordance moins bonne sans modifier le risque unitaire de façon appréciable. On a plutôt utilisé les données sur l'incidence brute.
On a adapté d'abord le modèle à degrés multiples aux données de biodosage. Le modèle à degrés multiples est produit par l'équation
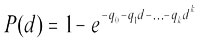
où d représente la dose, k, le nombre de groupes exposés pendant l'étude (sauf le groupe témoin), P(d), la probabilité qu'une tumeur fasse son apparition chez l'animal à la dose d, et qi > 0, i = 0,...,k, les paramètres à estimer.
Le risque unitaire est défini par l'augmentation du risque excédentaire par dose unitaire, le risque excédentaire étant calculé au moyen de la formule suivante :
P(d) - P(0) / 1 - P(0)
Le risque unitaire est applicable à des doses très faibles, probablement de l'ordre de celles auxquelles on suppose que les êtres humains seront exposés. Dans le cas d'une faible dose d, on peut démontrer que le risque excédentaire est à peu près égal à q1d. Ainsi, lorsque le fond P(0) est faible, q1 représente la pente (c.-à-d. le changement du risque en fonction de l'augmentation de la dose unitaire) de la courbe dose-réponse dans la région à faible dose. En pratique, on utilise la limite supérieure de confiance à 95 % sur q1, représentée par q1Note de bas de page *. Il s'agit du risque unitaire calculé par la méthode linéarisée à degrés multiples.
On a procédé à un test chi-carré pour déterminer l'absence de concordance entre les modèles. Les degrés de liberté de ce test sont égaux à k moins le nombre de qis dont les estimations n'équivalent pas à zéro. Une valeur P de moins de 0,05 indique un manque important de concordance. Certains modèles ont montré un manque important de concordance, mais comme il y avait seulement trois groupes de doses (y compris les sujets témoins), il est déconseillé d'enlever le groupe exposé à la dose la plus élevée. L'Annexe 1 du document de Santé Canada (2003b) indique les risques unitaires et les valeurs P concernant le manque de concordance.
Le facteur d'échelle allométrique est produit par (0,35/70)1/4 ou (0,03/70)1/4, où 0,35 kg représente le poids corporel du rat, 0,03 kg, celui de la souris, et 70 kg, celui de l'être humain. On divise les risques unitaires « bruts » par ce facteur pour calculer les risques unitaires « convertis » indiqués dans le tableau 2 du document de Santé Canada (2003b). En utilisant le modèle linéarisé à degrés multiples pour les tumeurs ayant augmenté de façon significative chez les rats F344/N au cours du biodosage effectué par le NTP (1987), on a calculé que les risques unitaires à vie de cancer humain associés à l'ingestion de 1 µg/L de BDCM dans l'eau potable allaient de 2,06 x 10-7Note de bas de page * (sur base des carcinomes et polypes adénomateux combinés du gros intestin chez les rats femelles) à 6,33 x 10-7Note de bas de page * (sur base des carcinomes et polypes adénomateux combinés du gros intestin chez les rats mâles).
Dans le cadre des recommandations pour la qualité de l'eau potable, Santé Canada entend par « essentiellement négligeable » une plage allant d'un nouveau cas de cancer de plus que le niveau de fond pour 100 000 personnes à un nouveau cas de cancer de plus que le niveau de fond pour 1 million de personnes (c.-à-d. 10-5 à 10-6) au cours de la durée d'une vie. Le tableau suivant indique les concentrations estimatives qui correspondent à des risques à vie de cancer de 10-5, 10-6 et 10-7 pour ces types de tumeurs chez l'être humain, et qui sont fondées sur le modèle décrit ci-dessus et les risques unitaires à vie de cancer humain calculés :
| Risque à vie | Concentrations dans l'eau potable (µg/L) |
|---|---|
| 10-5 | 15,8-48,5 |
| 10-6 | 1,6-4,9 |
| 10-7 | 0,2-0,5 |
En se basant sur la concentration la plus conservatrice dans l'eau potable estimée pour un risque à vie de cancer de 10-5, on a calculé une valeur cible basée sur des critères de santé de 16 µg/L (valeur arrondie).
Le DBCM a été classé dans le groupe IIID, celui des substances possiblement cancérogènes pour les humains compte tenu de données limitées sur la cancérogénicité dans le cas d'une espèce d'animaux de laboratoire et de l'absence de données sur les humains (Santé Canada, 1994). Un groupe d'experts convoqués par Santé Canada en 2002 pour évaluer les données toxicologiques et épidémiologiques sur les THM afin de rédiger une mise à jour de la recommandation sur l'eau potable au Canada a conclu qu'il n'y avait pas suffisamment d'informations disponibles pour établir une recommandation sur l'eau potable dans le cas du DBCM (Santé Canada, 2003b).
Le bromoforme a été classé dans le groupe IIID, celui des substances possiblement cancérogènes pour les humains compte tenu de données limitées sur la cancérogénicité dans le cas d'une espèce d'animaux de laboratoire et de l'absence de données sur les humains (Santé Canada, 1994). Un groupe d'experts convoqués par Santé Canada en 2002 pour évaluer les données toxicologiques et épidémiologiques sur les THM afin de rédiger une mise à jour de la recommandation sur l'eau potable au Canada a conclu qu'il n'y avait pas suffisamment d'informations disponibles pour établir une recommandation sur l'eau potable dans le cas du bromoforme (Santé Canada, 2003b).