Dosage de l’ammoniac dans le tabac entier : T-302
1 Portée
1.1
La présente méthode s'applique à la séparation et au dosage de l'ammoniac dans le tabac entier, par chromatographie en phase liquide haute performance (CLHP).
2 Normes applicables
2.1
Méthode officielle T-115 de Santé Canada, Dosage du goudron, de l'eau, de la nicotine et du monoxyde de carbone dans la fumée principale de tabac, 2016.
2.2
Méthode officielle T-402 de Santé Canada. Préparation de cigarettes, de bâtonnets de tabac, de tabac à cigarette, de cigares, de petits cigares, de kreteks, de bidis, de tabac en feuille, de tabac à pipe ou de tabac sans fumée aux fins d'essais, 2016.
2.3
Organisation internationale de normalisation, ISO 8243, Cigarettes - Échantillonnage, 2013.
2.4
Organisation internationale de normalisation, ISO 15592-1, Tabac à rouler et objets confectionnés à partir de ce type de tabac - Méthodes d'échantillonnage, de conditionnement et d'analyse - Partie 1 : Échantillonnage, 2001.
3 Définitions
3.1
Pour les définitions et les termes utilisés dans le présent document, se reporter à la méthode officielle T-301.
4 Résumé de la méthode
4.1
Le tabac est placé dans un contenant et lyophilisé pendant 48 heures. Le tabac ainsi séché est ensuite broyé à l'aide d'un broyeur de laboratoire muni d'un tamis.
4.2
Le tabac lyophilisé et broyé est pesé dans un tube à culture muni d'un bouchon. L'échantillon est extrait avec du H2SO4 dilué, sur un agitateur oscillant. Le mélange obtenu est ensuite filtré et recueilli dans un contenant à scintillation et conservé ainsi. Une partie de cet échantillon est ensuite prélevée afin d'en faire l'analyse par chromatographie d'échange de cations.
4.3
On injecte l'échantillon dans une colonne analytique échangeuse de cations, qui permet la séparation de l'ion ammonium et des cations monovalents grâce à des groupements fonctionnels acide carboxylique/acide phosphonique. Afin d'assurer une résolution adéquate des ions sodium et ammonium en vue du dosage de ces derniers, on utilise une solution d'acide méthane-sulfonique comme phase mobile. Après l'élution de l'ion ammonium, les cations divalents et les amines quaternaires qui auraient pu se trouver dans l'échantillon sont élués par gradient de H2SO4.
4.4
Le dosage est réalisé en mesurant la surface du pic de sulfate d'ammonium obtenu grâce à un détecteur de conductivité.
Avertissement : L'analyse et l'évaluation de certains produits à l'aide de cette méthode d'essai peuvent nécessiter l'utilisation de substances et/ou d'équipement potentiellement dangereux. Le présent document n'entend pas répondre à tous les aspects concernant la sécurité de son utilisation. Avant d'utiliser cette méthode d'essai, toute personne a la responsabilité de consulter les autorités compétentes et de prendre des mesures de protection de la santé et des mesures de sécurité qui tiennent compte de tous les règlements en vigueur.
5 Appareillage et équipement
5.1
Lyophilisateur, ou l'équivalent.
5.2
Agitateur oscillant.
5.3
Balance analytique précise à au moins quatre décimales.
5.4
Broyeur de laboratoire avec tamis no 40 (40 mailles au pouce carré).
5.5
Filtre à seringue en fibre de verre de 25 mm × 0,45 µm, ou l'équivalent.
5.6
Fioles jaugées de 25, 50 et 100 mL.
5.7
Seringues jetables de 5 mL, ou l'équivalent.
5.8
Flacons de 7 mL à bouchon vissant recouvert d'aluminium, ou l'équivalent.
5.9
Septum, 8 mm, bleu, TFE/SIL, 60 MIL, ou l'équivalent.
5.10
Flacons de 2 mL pour échantillonneur automatique, avec bouchon, ou l'équivalent.
5.11
Chromatographe en phase liquide haute performance (CLHP) comprenant :
5.11.1
Échantillonneur automatique réfrigéré.
5.11.2
Détecteur de conductivité Dionex, ou l'équivalent.
5.11.3
Piège à cations Dionex, ou l'équivalent.
5.11.4
Suppresseur de conductivité, Dionex, ou l'équivalent.
5.12
Colonne d'analyse échangeuse de cations de 250 mm × 4 mm, Dionex IonPac, ou l'équivalent.
5.13
Colonne de garde échangeuse de cations Dionex IonPac, ou l'équivalent.
5.14
Erlenmeyers de 125 mL en polyméthylpentène (PMP), à bouchon à vis, et/ou tubes à culture de 16 mL en polyéthylène haute densité (HDPE), à bouchon à vis (en fonction des poids d'extraction et des volumes utilisés), ou l'équivalent.
6 Réactifs et matériel
6.1
Tous les réactifs doivent être, au minimum, de qualité pure pour analyses.
Remarque : lorsque cela était possible, le numéro de registre des Chemical Abstracts [numéro CAS] a été ajouté entre crochets à la suite de chaque réactif.
6.2
Sulfate d'ammonium - [7783-20-2] - pureté > 99 %.
6.3
Acide méthane-sulfonique (MSA) - [75-75-2] - pureté de 100 %.
6.4
Acide sulfurique - [7664-93-9] - pureté > 96 %.
6.5
Eau de type I, tyel que stipulé dans le tableau 1 de la méthode D1193 de l'ASTM, Processes for Reagent Water Production, Note A.
7 Préparation de la verrerie
7.1
Nettoyer et sécher la verrerie de manière à s'assurer qu'il n'y ait aucune contamination.
7.2
Immédiatement avant de les utiliser, rincer tous les tubes à extraction avec du H2SO4 0,1N, puis trois fois avec de l'eau de type I.
8 Préparation des solutions
8.1
Solution d'acide sulfurique, 0,10 N - pour les solutions mères étalons
8.1.1
Mettre 900 mL d'eau de type I dans une fiole jaugée de 1 L, puis y ajouter avec précaution 5,108 g de H2SO4 (96 % p/p).
8.1.2
Mélanger, puis compléter avec de l'eau de type I.
8.2
Solution d'acide sulfurique 0,025 N - pour l'extraction
8.2.1
Mettre 900 mL d'eau de type I dans une fiole jaugée de 1 L, puis y ajouter avec précaution 1,277 g de H2SO4 (96 % p/p).
8.2.2
Mélanger, puis compléter avec de l'eau de type I.
8.3
Acide sulfurique 0,20 N - solution C (pour la chromatographie par échange d'ions)
8.3.1
Mettre 900 mL d'eau de type I dans une fiole jaugée de 1 L, puis y ajouter avec précaution 10,216 g de H2SO4 (96 % p/p).
8.3.2
Mélanger, puis compléter avec de l'eau de type I.
8.4
MSA 0,003 N - solution A (pour la chromatographie par échange d'ions)
8.4.1
Mettre 900 mL d'eau de type I dans une fiole jaugée de 1 L, puis y ajouter avec précaution 0,2883 g d'acide méthane-sulfonique (MSA).
8.4.2
Mélanger, puis compléter avec de l'eau de type I.
9 Préparation des étalons
9.1
Solution mère étalon d'ammonium :
9.1.1
Peser 0,20 g de sulfate d'ammonium dans une fiole jaugée de 50 mL.
9.1.2
Dissoudre dans du H2SO4 0,10N.
9.1.3
Compléter avec du H2SO4 0,10N.
9.1.4
Préparer une solution mère étalon fraîche tous les 10 jours.
Remarque : cette solution mère contient 1,0898 mg/mL de NH4+.
9.1.5
Étalons de travail :
| Étalons no |
Volume de solution mère primaire (µL) |
Volume final (mL) |
Concentration [µg/mL] |
|---|---|---|---|
| 0 | 0 | 25 | 0,000 |
| 1 | 250 | 25 | 10,898 |
| 2 | 175 | 25 | 7,6283 |
| 3 | 75 | 25 | 3,2693 |
| 4 | 75 | 50 | 1,6346 |
| 5 | 50 | 100 | 0,5449 |
| 6 | 20 | 100 | 0,2180 |
Remarque : tous les étalons analysés ont une concentration 0,025N en H2SO 4.
Remarque : préparer des étalons de travail frais tous les cinq jours.
Remarque : tous les poids, volumes et puretés doivent être consignés et utilisés pour calculer exactement la concentration des étalons.
Remarque : il peut être nécessaire de préparer d'autres étalons pour couvrir l'intervalle de réponses prévues avec les échantillons.
10 Échantillonnage
10.1
L'échantillonnage des produits du tabac à analyser doit être effectué conformément à la norme ISO 8243.
10.2
L'échantillonnage des kreteks, des petits cigares, des bidis, des bâtonnets de tabac aux fins des tests doit être effectué conformément à la norme ISO 8243, mais modifié en remplaçant le terme cigarettes par kreteks, petits cigares, bidis ou bâtonnets de tabac, pour lesquels le terme carton est équivalent à 200 unités.
10.3
L'échantillonnage des cigares aux fins des tests doit être effectué conformément à la norme ISO 8243, mais modifié en remplaçant le terme cigarettes par cigares, pour lesquels 200 unités de cigarettes est équivalent à 200 grammes de cigare.
10.4
L'échantillonnage du tabac à cigarette aux fins des tests doit être effectué conformément à la norme ISO 15592-1
10.5
L'échantillonnage des feuilles de tabac, du tabac à pipe et du tabac sans fumée aux fins des tests doit être effectué conformément à la norme ISO 15592-1, mais modifié en remplaçant le terme tabac à rouler par le terme feuilles de tabac, tabac à pipe ou tabac sans fumée.
11 Préparation des produits du tabac
11.1
La préparation initiale des produits du tabac aux fins de tests doit être effectuée conformément à la méthode T-402.
12 Préparation des échantillons
12.1
Sécher le tabac entier dans un lyophilisateur pendant au moins 48 heures.
12.2
Broyer le tabac entier avec un broyeur de laboratoire muni d'un tamis de 40 mesh.
12.3
Peser 100 mg de tabac broyé dans un tube à culture de 16 mL.
Remarque : selon la quantité d'échantillon disponible, la quantité d'échantillon utilisé pour l'analyse peut être modifié tant que l'échantillon semble rester homogène et que le rapport poids d'échantillon sur poids de solution d'extraction reste le même (p. ex 0,1 g pour 10 mL de solution, 1/100).
12.4
Ajouter 10 mL de solution d'extraction et agiter pendant 60 minutes sur un agitateur oscillant.
12.5
Laisser décanter le mélange (environ une heure), puis filtrer la solution sur un filtre à seringue et recueillir le filtrat dans un flacon de conservation de 8 mL, en ayant soin de rincer d'abord le flacon avec environ 1 mL d'échantillon.
12.6
Pipetter 250 µL de filtrat directement dans un contenant de 2 mL pour échantillonneur automatique et y ajouter 1000 µL de solution d'extraction (dilution 1:5).
Remarque : la dilution réelle dépend de la teneur anticipée de l'échantillon. Le filtrat pourrait devoir être dilué différemment (ou pas du tout) afin de rester dans l'intervalle d'étalonnage. Toutes les dilutions sont réalisées avec la solution d'extraction.
Remarque : les dilutions ne doivent pas nécessairement être réalisées de cette manière. Il est possible de les faire à l'aide de fioles jaugées (ceci est plus laborieux et plus susceptible à la contamination).
13 Analyses des échantillons
13.1
Conditions pour le Dionex ED-40
- Suppresseur de conductivité (SRS) :
- 100 mA
- Échelle :
- 20 µS
- Sortie :
- Déport
- Décalage :
- 1 % de la pleine échelle
Remarque : ces réglages dépendent du détecteur et peuvent devoir être modifiés afin d'obtenir une réponse linéaire dans tout l'intervalle des concentrations pertinentes, pour l'analyte d'intérêt.
Remarque : selon les concentrations prévues, il peut être, ou non, nécessaire d'effectuer la suppression de conductivité.
13.2
Échantillonneur automatique : volume d'injection
13.2.1
Analyser en injectant 20 µL.
13.3 Température de la colonne : 30 °C
13.4
Conditions pour la phase mobile et le gradient (système de gradient ternaire)
- Solvant A :
- MSA 0,003 N
- Solvant B :
- eau de type I
- Solvant C :
- H2SO4 0,2 N
- Débit :
- 1,0 mL/minute
| Temps (min) |
Composition | ||
|---|---|---|---|
| A (%) |
B (%) |
C (%) |
|
| 0,00 | 100 | 0 | 0 |
| 24,00 | 100 | 0 | 0 |
| 24,01 | 50 | 39 | 11 |
| 40,00 | 50 | 39 | 11 |
| 42,00 | 99 | 1 | 0 |
| 45,00 | 99 | 1 | 0 |
| 45,00 | Fin de la méthode | Équilibrage | |
Durée d'équilibrage : 9,00 minutes
Remarque : il sera peut-être nécessaire de régler les conditions du gradient en fonction de l'appareil et de la colonne, ainsi que de la résolution du signal (pic) de l'analyte.
14 Calculs
14.1
Détermination du facteur de réponse (FR)
14.1.1
Préparer une courbe d'étalonnage de la concentration de NH4+ en fonction de la réponse (aire sous le pic) du détecteur de conductivité.
Remarque : injecter le premier étalon au moins deux fois, jusqu'à ce que la réponse et le temps de rétention soient constants.
14.1.2
Le FR est égal à la pente de la droite calculée par régression linéaire (aire sous le pic/concentration).
Remarque : une courbe d'étalonnage quadratique pourrait être requise à de concentrations plus élevées.
14.2
Calcul de la teneur en ion ammonium
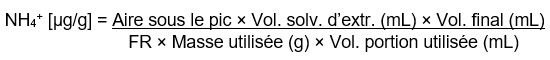
Calcul de la teneur en ion ammonium : Équivalent textuel
NH4+ [µg/g] = Aire sous le pic × Vol. solv. d'extr. (mL) × Vol. final (mL)
divisé par
FR × Masse utilisée (g) × Vol. portion utilisée (mL)
où le volume de la portion utilisé (mL) représente le volume transvasé dans le contenant à échantillonneur automatique.
Remarque : le poids utilisé étant celui d'un échantillon sec, les résultats des calculs sont exprimés en « matière sèche ».
14.3
Calcul de la teneur en ammoniac
NH3 [µg/g] = NH4+ [µg/g] × 17/18 dans laquelle 17/18 représente une correction pour le rapport entre les masses moléculaires de NH4+et de NH3.
15 Contrôle de la qualité
15.1
Pour un chromatogramme typique : voir l'annexe 1.
15.2
Paramètres typiques de contrôle
Remarque : si les mesures de contrôle dépassent les limites de tolérance des valeurs prévues, il faut procéder à une étude appropriée et prendre les mesures qui s'imposent.
15.2.1
Blanc de réactifs (BR)
Chaque série d'analyse doit comprendre un blanc de réactifs (BR) afin de détecter toute contamination pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BR est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin. Le BR est analysé comme s'il s'agissait d'un échantillon.
15.2.2
Blanc fortifié (BF)
Chaque série d'analyse doit comprendre un blanc fortifié (BF) afin de détecter toute perte d'analytes pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BF est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin, et doit avoir été fortifié par l'ajout d'une quantité connue d'au moins un des analytes d'intérêt. Le degré de fortification doit refléter l'intervalle de résultats caractéristiques de l'échantillon. Le BF est analysé comme s'il s'agissait d'un échantillon.
15.2.3
Matrice fortifiée (MF)
Chaque série d'analyse doit comprendre une matrice fortifiée (MF) afin de détecter toute interférence provenant de la matrice. Lors de la préparation des échantillons et/ou pendant l'exécution des analyses, diviser un échantillon et fortifier une des portions avec une quantité, de concentration connue, d'au moins un des analytes d'intérêt. Le degré de fortification doit refléter l'intervalle de résultats caractéristiques de l'échantillon. La MF est analysée comme s'il s'agissait d'un échantillon.
15.2.4
Échantillon de contrôle
Afin d'évaluer la performance globale d'une méthode d'analyse, procéder à l'analyse d'un échantillon de contrôle. En utilisant des méthodes statistiques appropriées, comparer les résultats ainsi obtenus aux « valeurs prévues » obtenues dans le laboratoire ou, en l'absence de tels résultats, aux valeurs publiées dans la littérature. Le laboratoire obtiendra des données sur l'exactitude et la précision de la méthode d'analyse.
15.2.5
Échantillon-étalon
Pour évaluer la stabilité du système d'analyse, analyser un étalon comme s'il s'agissait d'un échantillon. En utilisant des méthodes statistiques appropriées, comparer les résultats obtenus aux concentrations prévues.
15.3
Taux de récupération et niveaux de contamination
15.3.1
Les taux de récupération typiques observés pour des blancs fortifiés (BF) sont de 60 à 100 % et ceux des matrices fortifiées (MF), de 95 à 120 %, lorsqu'une solution dopée (ou un échantillon dopé) est soumise à tout le processus d'extraction.
15.3.2
La valeur typique des blancs de réactifs (BR) est de 2 ± 8 µg/g. La contamination est en général due à un mauvais nettoyage de la verrerie.
15.4
Limite de détection (LD) et Limite de quantification (LQ)
15.4.1
La limite de détection (LD) est égale à trois fois l'écart-type des résultats obtenus en analysant l'étalon de plus faible concentration, au moins 10 fois pendant plusieurs jours.
15.4.1.1
La valeur typique de la LD ainsi déterminée est de 18 µg/g.
15.4.2
La limite de quantification (LQ) est égale à 10 fois l'écart-type des résultats obtenus en analysant l'étalon de plus faible concentration, au moins 10 fois pendant plusieurs jours.
15.4.2.1
La valeur typique de la LQ ainsi déterminée est de 60 µg/g.
15.5
Stabilité des réactifs et des échantillons
15.5.1
Il faut préparer des solutions mères étalons fraîches tous les 10 jours et les conserver à 4 °C.
15.5.2
Préparer les étalons de travail toutes les semaines à partir de la solution mère et les conserver à 4 °C.
15.5.3
Les échantillons sont stables pendant environ une semaine, s'il sont conservés dans un contenant bouché à 4 °C.
16 Références
16.1
Dionex Corporation. Colonne d'analyse IonPac CS12A, Installation Instructions and Troubleshooting Guide, document no 031132: Révision 01. 1995.
16.2
Nanni, E. J. et al. 1990. Separation and quantitation of monovalent and cationic species in mainstream cigarette smoke aerosols by High-Performance Ion Chromatography; Journal of Chromatographic Science, 28, 432-436.
16.3
Risner, C. H.; Conner, J. M. 1991. Collection of Ammonia in Indoor Air by Means of a Weak Cation Exchange Cartridge; Environmental Toxicology and Chemistry, 10, 1417-1423.
16.4
ASTM International, Méthode ASTM D1193-06(2011), Standard Specifications for Reagent Water.
Annexe 1
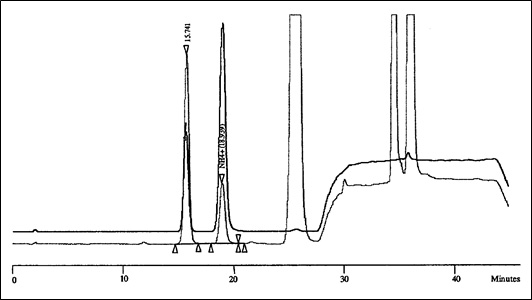
Chromatogramme typique - superposition, avec décalage de 5 %, des chromatogrammes obtenus avec un étalon (ligne foncée) et un échantillon de tabac de référence (ligne claire). : Équivalent textuel
Cette figure présente un chromatogramme typique, où sont superposées les courbes obtenues avec un étalon et le tabac d'une cigarette témoin, avec un décalage de 5 %.