Dosage du propionate de sodium dans le tabac entier : T-312
1 Portée
1.1
La présente méthode sert à doser par chromatographie en phase gazeuse, avec détection par ionisation de flamme, le propionate de sodium ajouté au tabac entier comme agent antimoisissure ou fongicide. Elle est conçue pour l'analyse de routine sans préparation d'un dérivé.
1.2
Elle ne permet pas de distinguer le propionate de sodium ajouté au tabac entier de l'acide propionique d'origine naturelle présent (le cas échéant) dans le tabac et les produits du tabac. Elle ne permet pas de distinguer le propionate de sodium de l'acide propionique qui peut être produit par certaines formes de fermentation anaérobie.
Remarque : cette méthode n'est pas destinée à servir au dosage de traces de propionate de sodium, mais plutôt au dosage du propionate de sodium utilisé comme additif en concentration de l'ordre de 0,4 %.
2 Normes applicables
2.1
Méthode officielle de Santé Canada T-115, Dosage du goudron, de l'eau, de la nicotine et du monoxyde de carbone dans la fumée principale de tabac, 2016.
2.2
Méthode officielle T-402 de Santé Canada. Préparation de cigarettes, de bâtonnets de tabac, de tabac à cigarette, de cigares, de petits cigares, de kreteks, de bidis, de tabac en feuille, de tabac à pipe ou de tabac sans fumée aux fins d'essais, 2016.
2.3
Organisation internationale de normalisation, ISO 8243, Cigarettes – Échantillonnage, 2013.
2.4
Organisation internationale de normalisation, ISO 15592-1, Tabac à rouler et objets confectionnés à partir de ce type de tabac – Méthodes d'échantillonnage, de conditionnement et d'analyse – Partie 1 : Échantillonnage, 2001.
2.5
AOAC INTERNATIONAL, méthode officielle 971.11, Fatty Acids (Volatile) in Eggs, Gas Chromatographic Method, Official Methods of Analysis of AOAC INTERNATIONAL, 20ème édition, 2016.
3 Définitions
3.1
Pour une définition des termes utilisés dans le présent document, se reporter à la méthode T-301.
4 Résumé de la méthode
4.1
Le tabac est extrait avec une solution de H2SO4 dans le méthanol, dans des conditions extrêmement douces.
4.2
On ajoute du chlorure de calcium (CaCl2) pour saturer les espèces ioniques. L'équilibre propionate-acide propionique est déplacé quantatitativement vers l'acide libre en raison de la faible valeur de son Ka, soit 1,34 X 10-5 M.
4.3
L'acide isobutyrique (Ka = 1,44 X 10-5 M) est utilisé comme étalon interne (il a aussi pour effet de réduire au minimum les différences potentielles de pH entre les échantillons et les étalons, ce qui pourrait influer sur le rapport ion/acide libre).
4.4
L'acide libre est ensuite dosé par chromatographie en phase gazeuse (CG), par injection, sans division de débit, de la solution méthanolique sur une colonne capillaire Stabilwax-DA en silice fondue (ou l'équivalent), et détection par ionisation de flamme (DIF).
4.5
Le dosage est réalisé par étalonnage avec un étalon interne. La réponse obtenue avec l'échantillon est comparée à une courbe d'étalonnage tracée à partir de l'acide correspondant du même type de solution.
Avertissement : L'analyse et l'évaluation de certains produits à l'aide de cette méthode peuvent nécessiter l'utilisation de substances et/ou d'équipement potentiellement dangereux. Le présent document n'entend pas répondre à tous les aspects concernant la sécurité de son utilisation. Avant d'utiliser cette méthode normalisée, toute personne a la responsabilité de consulter les autorités compétentes et de prendre des mesures de protection de la santé et des mesures de sécurité qui tiennent compte de tous les règlements en vigueur.
5 Appareillage et équipement
5.1
Erlenmeyers de 125 mL, en polyméthylpentène (PMP), avec col à vis ou l'équivalent.
5.2
Fioles jaugées de 100 et 2000 mL.
5.3
Éprouvette graduée de 100 mL.
5.4
Tubes à culture de 16 × 25 mm avec bouchons à vis (sans revêtement).
5.5
Finnpipette, 0 - 5 mL ou l'équivalent.
5.6
Micropipettes de 25 µL et de 200 µL ou l'équivalent.
5.7
Distributeur, 10 - 50 mL ou l'équivalent.
5.8
Système de chromatographie en phase gazeuse comprenant un injecteur sans division de débit et un détecteur à ionisation de flamme (DIF) ou l'équivalent.
5.9
Flacons pour échantillonneur automatique, avec bouchons à vis et septums recouverts de téflon.
5.10
Colonne Stabilwax-DA de 30 m × 0,32 mm × 1,0 µm (revêtement mixte Carbowax – PEG, pour les composés acides); ou Nukol de 30 m × 0,32 mm × 0,25 µm, ou l'équivalent.
5.11
Centrifugeuse.
5.12
Agitateur vortex.
5.13
Agitateur oscillant.
6 Réactifs et matériel
6.1
Tous les réactifs doivent être, au minimum, de qualité réactif pour analyses.
Remarque : lorsque cela était possible, le numéro de registre des Chemical Abstracts [numéro CAS] a été ajouté entre crochets à la suite de chaque réactif.
6.2
Chlorure de calcium - [7774-34-7].
6.3
Acide isobutyrique - [79-31-2].
6.4
Méthanol - [67-56-1].
6.5
Propionate de sodium - [137-40-6].
6.6
Acide sulfurique - [7664-93-9] à 95-97 %.
6.7
Eau de type I, tel que stipulé dans le tableau 1 de la méthode D1193 de l'ASTM, Processes for Reagent Water Production, Note A.
6.8
Parafilm® ou l'équivalent.
7 Préparation de la verrerie
7.1
Nettoyer ou sécher la verrerie de manière à s'assurer qu'il n'y ait aucune contamination.
8 Préparation des solutions
8.1
Solution d'extraction du tabac (composant aqueux)
8.1.1
Mettre 35 g de CaCl2 dans une fiole jaugée de 2000 mL.
8.1.2
Ajouter environ 1 L d'eau de type I et mélanger jusqu'à dissolution complète du CaCl2.
8.1.3
Rincer le col de la fiole pour entraîner le CaCl2 qui pourrait s'y trouver. Si un précipité blanc se forme, refaire la solution, en prenant soin de mieux rincer le col de la fiole avec de l'eau de type I.
8.1.4
Ajouter 0,54 mL de H2SO4 concentré à environ 100 mL d'eau de type I dans un bécher en verre. Ajouter la solution diluée de H2SO4 à la solution de CaCl2 dans la fiole jaugée de 2000 mL.
Remarque : si on ajoute directement 0,54 mL de H2SO4 concentré, un précipité peut se former.
8.1.5
Compléter avec de l'eau de type I.
8.2
Solution de H2SO4 0,01 N
8.2.1
Ajouter 0,27 mL de H2SO4 concentré à environ 700 mL d'eau de type I dans une fiole jaugée de 1 L.
8.2.2
Compléter avec de l'eau de type I.
9 Préparation des étalons
9.1
Étalon primaire de propionate de sodium (concentration finale : environ 20 mg/mL)
9.1.1
Peser avec précision 2 g de propionate de sodium dans une fiole jaugée de 100 mL.
9.1.2
Compléter avec du H2SO4 0,01N.
9.2
Étalon d'acide isobutyrique – étalon interne (concentration finale : environ 100 mg/mL)
9.2.1
Peser avec précision 2,5 g d'acide isobutyrique dans une fiole jaugée de 25 mL.
9.2.2
Compléter avec du H2SO4 0,01N.
9.3
Étalons de travail
9.3.1
Tous les étalons sont préparés par dilution avec du méthanol dans des fioles jaugées de 25 mL.
9.3.2
Tenter de maintenir la proportion d'eau à 10 % dans chacun des étalons en ajoutant la quantité appropriée de composant aqueux pour l'extraction (à 0,05 mL près). Ceci est nécessaire pour maintenir constant le rapport phase organique/ phase aqueuse dans les échantillons et les étalons.
Étalons de propionate de sodium
| Étalon no | Volume (µL) d'étalon primaire de propionate de Na | Volume (µL) d'étalon interne d'acide isobutyrique | Volume (mL) de solution d'extraction | Propionate de Na (µg/mL) |
|---|---|---|---|---|
| 0 | 0 | 25 | 2,50 | 0 |
| 1 | 20 | 25 | 2,50 | 16 |
| 2 | 50 | 25 | 2,45 | 40 |
| 3 | 125 | 25 | 2,40 | 100 |
| 4 | 200 | 25 | 2,30 | 160 |
| 5 | 300 | 25 | 2,20 | 240 |
Remarque : il peut être nécessaire de préparer d'autres étalons pour couvrir l'intervalle de réponses prévues avec les échantillons.
Remarque : la concentration de propionate de sodium varie selon la concentration exacte de la solution mère préparée.
Remarque : la concentration de l'étalon interne est d'environ 100 µg/mL (selon la concentration exacte de la solution mère primaire).
10 Échantillonnage
10.1
L'échantillonnage des cigarettes aux fins des tests doit être effectué conformément à la norme ISO 8243.
10.2
L'échantillonnage des kreteks, des petits cigares, des bidis, des bâtonnets de tabac aux fins des tests doit être effectué conformément à la norme ISO 8243, mais modifié en remplaçant le terme cigarettes par kreteks, petits cigares, bidis ou bâtonnets de tabac, pour lesquels le terme carton est équivalent à 200 unités.
10.3
L'échantillonnage des cigares aux fins des tests doit être effectué conformément à la norme ISO 8243, mais modifié en remplaçant le terme cigarettes par cigares, pour lesquels 200 unités de cigarettes est équivalent à 200 grammes de cigare.
10.4
L'échantillonnage du tabac à cigarette aux fins des tests doit être effectué conformément à la norme ISO 15592-1
10.5
L'échantillonnage des feuilles de tabac, du tabac à pipe et du tabac sans fumée aux fins des tests doit être effectué conformément à la norme ISO 15592-1, mais modifié en remplaçant le terme tabac à rouler par le terme feuilles de tabac, tabac à pipe ou tabac sans fumée.
11 Préparation des produits du tabac
11.1
Préparer les produits du tabac à analyser conformément à la méthode T-402.
12 Préparation des échantillons
12.1
Extraction du tabac entier
12.1.1
Peser avec précision 5 g de l'échantillon à analyser dans un erlenmeyer en PMP.
12.1.2
Ajouter 10 mL de composant aqueux pour extraction.
12.1.3
Ajouter 100 µL de solution mère d'acide isobutyrique, comme étalon interne.
12.1.4
Imbiber le tabac en agitant le flacon d'un mouvement de rotation, jusqu'à ce que toute la solution soit absorbée par le tabac ou que le tabac semble saturé.
12.1.5
Ajouter 40 mL de méthanol à chacun des échantillons.
12.1.6
Boucher le flacon (le sceller avec du Parafilm® au besoin) et l'agiter pendant 30 minutes.
12.1.7
Laisser l'échantillon reposer au moins une heure après l'agitation.
12.1.8
Agiter de nouveau l'échantillon pendant 30 secondes.
12.1.9
Décanter le liquide dans un tube à culture à col fileté, et boucher le tube pour éviter toute évaporation.
12.2
Purification des échantillons
12.2.1
Laisser le précipité se déposer au fond du tube à culture, en le laissant reposer pendant deux heures. On peut autrement centrifuger à faible vitesse.
12.2.2
Transvaser quantitativement 2 mL de surnageant dans un deuxième tube à culture de 16 × 25 mm, à col à vis.
12.2.3
Ajouter exactement 2 mL de méthanol à chaque tube et boucher les tubes.
12.2.4
Agiter sur agitateur vortex, pendant 10 secondes à haute vitesse.
Remarque : agiter également le reste du surnageant sur un agitateur Vortex et le conserver au réfrigérateur au cas où il serait nécessaire de refaire l'analyse de cet échantillon.
12.2.5
Centrifuger l'échantillon dilué, à vitesse moyenne, pour précipiter tout sel qui aurait pu se former lors de l'étape de dilution.
12.2.6
Transvaser le surnageant dans un flacon à échantillonneur automatique en vue de l'analyser par chromatographie en phase gazeuse.
13 Analyse des echantillons
13.1
Paramètres pour le système de chromatographie en phase gazeuse
- Injecteur :
-
Sans division de débit, avec délai de purge de 0,10 minute tube
D'insertion désactivé, pour injection sans division du débit
- Détecteur :
- ionisation de flamme (DIF)
- Gaz vecteur :
- He, 12,0 lb/po2, débit = 2,3 mL/minute à 70 ° C
- Division (débit de purge) :
- 20 mL/minute
- Colonne :
- Stabilwax-DA
Remarque : régler les débits de gaz du détecteur conformément aux spécifications du fabricant.
Remarque : le pic dû au méthanol laisse une traînée énorme. On peut réduire cet effet au minimum en prévoyant un délai de purge (temps de relais) très court et une température de l'injecteur relativement basse. Idéalement, l'injection avec division de débit élimine cette traînée mais réduit considérablement la sensibilité de la méthode.
13.2
Paramètres pour la chromatographie en phase gazeuse
- Injecteur :
- 225 ° C
- Détecteur :
- 230 ° C
Profil de température pour la colonne :
- Température initiale :
- 70 ° C, maintenir deux minutes
- Programmation :
- 7,5 ° C/minute, jusqu'à 155 ° C, maintenir 2,67 minutes
- Programmation :
- 7,5 ° C/minute, jusqu'à 205 ° C, maintenir 4,0 minutes
- Durée totale de l'analyse :
- 25,00 minutes
Remarque : il sera peut-être nécessaire de régler les paramètres de dosage, selon les paramètres de l'instrument et de la colonne, et la résolution du pic de l'analyte.
13.3
Paramètres pour l'échantillonneur automatique
Volume injecté : 1,0 µL
14 Calculs
14.1
Effectuer tous les calculs en utilisant un facteur de réponse établi à partir de l'aire sous le pic obtenue avec les solutions étalons.
14.2
Utiliser ces facteurs de réponse pour calculer la concentration, exprimée en µg/mL, de chaque analyte dans l'échantillon. En introduisant les valeurs appropriées du multiplicateur (volume total, en mL) et du diviseur (poids de l'échantillon d'origine, en g) on obtient la concentration de propionate de sodium.
14.3
Pour convertir cette teneur en pourcentage (%), il faut diviser le résultat exprimé en µg/g par 10 000.
14.4
Tous les résultats sont exprimés en fonction du tabac « tel que reçu ». Ils peuvent être exprimés en « matière sèche » en tenant compte du degré d'humidité déterminé.
14.5
Calculs typiques :
14.5.1
Résultat d'analyse

Figure 14-5-1 : Équivalent textuel
NaProp [µg/g] =
Aire sous le pic de l'analyte
divisé par
Aire sous le pic de l'étalon interne
×
FR µg/mL
×
Multiplicateur (mL)
divisé par
Diviseur (g)
où FR est calculé à partir de la courbe d'étalonnage (ou en concentration par unité d'aire).
14.5.2
Conversion en % (« tel que reçu »)
NaProp (%) « tel que reçu » = Résultat en µg/g / 10 000
14.5.3
Conversion en « matière sèche »

Figure 14-5-3 : Équivalent textuel
NaProp (%)« matière sèche » =
NaProp (%) « tel que reçu »
divisé par
[1- (% Humidité)/100]
où le degré d'humidité (%) est déterminé dans le même échantillon « tel que reçu » utilisé pour le dosage du propionate de sodium.
15 Contrôle de la qualité
15.1
Chromatogramme typique, voir l'annexe 1.
15.2
Paramètres de contrôle typiques
Remarque : si les mesures de contrôle dépassent les limites de tolérance des valeurs prévues, il faut procéder à une étude appropriée et prendre les mesures qui s'imposent.
15.2.1
Blanc de réactifs (BR)
Chaque série d'analyse doit comprendre un blanc de réactifs (BR) afin de détecter toute contamination pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BR est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin. Le BR est analysé comme s'il s'agissait d'un échantillon.
15.2.2
Blanc fortifié (BF)
Chaque série d'analyse doit comprendre un blanc fortifié (BF) afin de détecter toute perte d'analytes pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BF est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin, et doit avoir été fortifié par l'addition d'une quantité connue d'au moins un des analytes d'intérêt. Le degré de fortification doit refléter l'intervalle de résultats caractéristiques de l'échantillon. Le BF est analysé comme s'il s'agissait d'un échantillon.
15.2.3
Matrice fortifiée (MF)
Chaque série d'analyse doit comprendre une matrice fortifiée (MF) afin de détecter tout interférence provenant de la matrice. Lors de la préparation et/ou de l'analyse des échantillons, diviser un échantillon et fortifier une des portions avec une quantité connue d'au moins un des analytes d'intérêt. Le degré de fortification doit refléter l'intervalle de résultats caractéristiques de l'échantillon. La MF est analysée comme s'il s'agissait d'un échantillon.
15.2.4
Échantillon de contrôle
Pour évaluer la performance globale d'une méthode d'analyse, procéder à l'analyse d'un échantillon de contrôle. En utilisant des méthodes statistiques appropriées, comparer les résultats ainsi obtenus aux « valeurs prévues » obtenues dans le laboratoire ou, en l'absence de tels résultats, aux valeurs publiées dans la littérature. Le laboratoire obtiendra ainsi des données sur l'exactitude et la précision de la méthode d'analyse.
15.2.5
Échantillon-étalon
Pour évaluer la stabilité du système d'analyse, analyser un étalon comme s'il s'agissait d'un échantillon. En utilisant des méthodes statistiques appropriées, comparer les résultats ainsi obtenus aux concentrations prévues.
15.3
Taux de récupération et niveaux de contamination
15.3.1
La valeur typique du BR est de 3,2 ± 2,7 μg/g de propionate de sodium.
15.3.2
Les taux de récupération typiques du BF se situent habituellement dans l'intervalle de 90 - 110 %.
15.3.3
Les taux de récupération typiques de la MF se situent habituellement dans l'intervalle de 95 - 120 %.
15.4
Limite de détection (LD) et limite de quantification (LQ)
15.4.1
La limite de détection est égale à 3/10 de la limite de quantification.
15.4.1.1
Une valeur typique de la LD, déterminée par la méthode ci-dessus, est de 96 μg/g.
15.4.2
La limite de quantification peut être déterminée par analyse de l'étalon le moins concentré utilisé pour préparer la courbe d'étalonnage (à l'exclusion du blanc).
15.4.2.1
Une valeur typique de la LQ, déterminée par la méthode ci- dessus, est de 320 μg/g.
15.5
Stabilité des réactifs et des échantillons
15.5.1
Préparer de nouveaux étalons primaires de proprionate de sodium toutes les semaines.
15.5.2
Préparer de nouveaux étalons de travail et de nouveaux solvants d'extraction toutes les semaines.
15.5.3
Analyser tous les échantillons dans la semaine qui suit l'extraction.
16 Références
16.1
CRC Press Inc. CRC Handbook of Chemistry and Physics. 58th Edition., D-150–151. 1977-1978.
16.2
Fessenden, R. J.; Fessenden, J. S. 1979. Organic Chemistry, 2nd Edition. Willard Grant Press. 588, 627, 628.
16.3
Merck & Co. Inc. The Merck Index: An Encyclopedia of Chemicals and Drugs, 8th Edition. 1968.
16.4
RJR Macdonald R & D. Determinat ion of Sorbic Acid in Tobacco. 56-60.
16.5
ASTM International, Méthode ASTM D1193-06(2011), Standard Specifications for Reagent Water.
Annexe 1
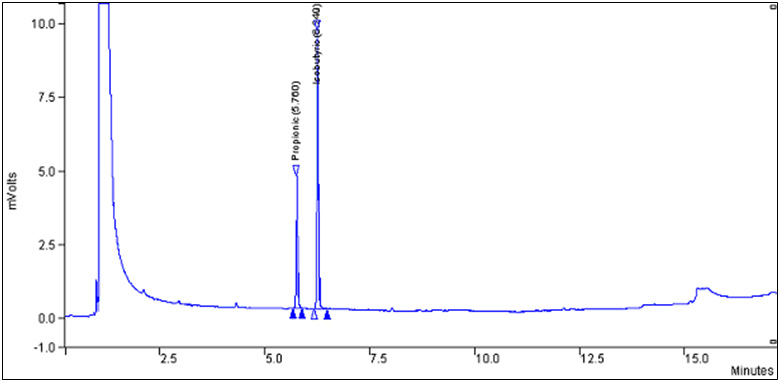
Chromatogramme typique obtenu avec un étalon de propionate de sodium de 100 μ g/mL (l'acide isobutyrique est utilisé comme étalon interne) : Équivalent textuel
La figure montre un chromatogramme typique d'un étalon de 100 μg/ml de propionate de sodium. (l'acide isobutyrique est utilisé comme étalon interne)