Effets secondaires suivant l’immunisation (ESSI) Rapport semestriel du 1er janvier au 30 juin 2019
Pour les données relatives à la COVID-19, se référer aux effets secondaires de la COVID-19 suivant l'immunisation.
Résumé des analyses de l’innocuité pour la période du 1er janvier au 30 juin 2019
- Aucun signe de préoccupation concernant l'innocuité des vaccins n'a été observé au cours de la période du 1er janvier au 30 juin 2019.
- Le présent rapport présente 1 757 déclarations d'ESSI reçues périodiquement des autorités fédérales, provinciales et territoriales entre juillet et décembre 2019.
Contexte
Les vaccins sont surveillés de près au Canada lors de toutes les phases du « cycle de vie » du produit vaccinal, depuis sa découverte jusqu’à l’autorisation de mise en marché (avant commercialisation) et au-delà, au fur et á mesure que les gens commencent à les utiliser (après commercialisation). De nombreux intervenants participent à la surveillance de l’innocuité des vaccins, y compris l’administration fédérale, les autorités sanitaires publiques provinciales, territoriales et locales, les fournisseurs de soins de santé, l’industrie des vaccins et le public. Les programmes d’immunisation provinciaux et territoriaux effectuent le suivi des ESSI et déclarent leurs préoccupations à l'Agence de la santé publique du Canada (ASPC). ASPC assure une surveillance de l’innocuité après commercialisation par l’intermédiaire du Système canadien de surveillance des effets secondaires suivant l’immunisation (SCSESSI). Le SCSESSI est géré par ASPC et présente la particularité d'inclure à la fois une surveillance passive (rapports spontanés des autorités de santé publique fédérales, provinciales et territoriales (FPT)) et une surveillance active. La surveillance active est assurée par le programme canadien de surveillance active de l'immunisation (IMPACT); un réseau de 12 hôpitaux pédiatriques canadiens qui scrutent les cas d'hospitalisation afin de détecter les patients ayant eu des effets secondaires suivant l'immunisation (ESSI). Les préoccupations en matière d’innocuité des vaccins sont surveillées et abordées par l’intermédiaire du Groupe de travail sur la vaccinovigilance (GTV).
Un effet secondaire suivant l'immunisation (ESSI) se veut tout événement médical fâcheux qui se produit à la suite de l’administration d’un vaccin et qui n’a pas nécessairement de lien causal avec l’utilisation du vaccin. L’effet secondaire peut correspondre à un signe défavorable ou non intentionnel, un résultat de laboratoire anormal, un symptôme ou une maladie. Les ESSI graves sont les effets qui menacent le pronostic vital, entraînent l’hospitalisation ou la prolongation de l’hospitalisation, occasionnent une invalidité permanente ou marquée, ou qui mènent à une malformation congénitale ou la mort, comme le définit l’Organisation mondiale de la Santé (OMS) (PDF, anglais seulement). Les ESSI ne répondant pas à la définition d’effet grave sont classés en tant qu’effets non graves.
L’OMS définit un signe de préoccupation concernant l’innocuité des vaccins comme étant un élément d’information (provenant d’une ou de plusieurs sources) qui indique l’existence d’un nouveau lien de causalité potentiel ou d’un nouvel aspect d’un lien de causalité connu, entre une vaccination et un effet secondaire précédemment inconnu ou insuffisamment documenté, susceptible de nuire à la santé. En général, des études épidémiologiques sont nécessaires à l’évaluation du lien de causalité entre le vaccin et le signe de préoccupation. L’objectif principal de la surveillance après commercialisation des vaccins est de déceler les préoccupations concernant leur innocuité. Ces préoccupations comprennent une possible augmentation de la gravité ou de la fréquence des ESSI attendus, ou encore la survenue d’un ou de plusieurs effets secondaires inattendus (c’est á dire un effet secondaire qui ne correspond pas aux renseignements ou à l’étiquette du produit au Canada). Cette situation permet aux vaccinateurs et aux fournisseurs de programmes d’immunisation de santé publique de prendre des mesures dans le domaine de la santé publique sur le plan :
- de la personne (p. ex., une enquête plus poussée afin de confirmer un diagnostic et de déterminer les causes possibles, une consultation en vue d’écarter la possibilité d’une allergie à un ou à plusieurs composantes du vaccin, ou encore une décision d’administrer ou non des doses ultérieures du vaccin), ou
- du programme d’immunisation (p. ex., une enquête menée sur un ensemble d’effets secondaires, un examen des procédures pour s’assurer que les exigences relatives à l’entreposage des vaccins ont été suivies avec rigueur, ou encore un changement de politique permettant d’adopter un vaccin moins réactogène)
ASPC partage aussi les données sur les ESSI avec la Direction générale des produits de santé et des aliments de Santé Canada, l’organisme de réglementation national pour les vaccins au Canada. Des mesures officielles associées aux vaccins commercialisés au Canada peuvent ainsi être prises, au besoin. Il peut s’agir de diffuser des communications aux vaccinateurs ou au public par rapport à la préoccupation en matière d’innocuité, d’exiger de l’information ou une enquête supplémentaire de la part du distributeur du vaccin, ou encore d’apporter des changements à l’étiquette du produit.
ASPC diffuse des déclarations périodiques de surveillance de l’innocuité des vaccins qui résument les données du SCSESSI. Les déclarations semestrielles, de manière semblable aux déclarations trimestrielles précédentes, présentent un sommaire des déclarations d’ESSI reçu par ASPC de janvier à juin et de juillet à décembre, indépendamment de la date à laquelle le vaccin a été administré.
Dans la présente déclaration, on indique les données qui concernent janvier à juin 2019, ainsi que les moyennes des 4 dernières années pour la même période. Cependant, étant donné que ces données reflètent la date à laquelle on a reçu les déclarations et non la date la laquelle le vaccin a été administré, la capacité à comparer et interpréter les tendances est limitée. La déclaration fournit un aperçu des données qui met en évidence les déclarations d’ESSI graves et non graves reçues à des fins descriptives.
Remarques sur l’interprétation : Les déclarations d’ESSI à l’Agence de la santé publique du Canada représentent un soupçon, une opinion ou une observation par le déclarant plutôt qu’une affirmation ou une preuve que le vaccin a pu causer l’effet secondaire. D’autres restrictions sur les données des déclarations d’ESSI comprennent une sous déclaration potentielle, un manque de certitude quant à la validité du diagnostic d’un effet secondaire signalé, un manque de renseignements en ce qui concerne d’autres causes potentielles et d’autres biais de déclaration. Ces biais sont atténués par ASPC en utilisant un formulaire de déclaration de MCI (PDF) accompagné d’un guide d’utilisation, la codification médicale normalisée du Dictionnaire médical international des activités de réglementation (MedDRA), un suivi auprès des autorités provinciales et territoriales pour assurer l’exhaustivité des données, des taux élevés de déclaration et l’inclusion d’un élément de surveillance pédiatrique active dans le SCSESSI.
Résultats mis en évidence pour la période du 1er janvier au 30 juin 2019
Les données présentées dans la présente déclaration semestrielle comprennent les déclarations d’ESSI reçues de façon périodique entre le 1er janvier et le 30 juin 2019 et des comparaisons sont faites par rapport au nombre moyen de déclarations reçues au cours de la même période lors des quatre années civiles précédentes (de 2015 à 2018). ASPC a extrait les données analysées de la base de données du SCSESSI le 24 juillet 2019.
Il convient de noter que dans les déclarations précédentes, une autorité a été exclue en raison de problèmes techniques avec la transmission des données. En date de janvier 2018, les problèmes ont été réglés et on a maintenant la déclaration complète de l’ensemble des autorités. Cette situation se reflète par la hausse du nombre total de déclarations et dans les résultats de l’analyse pour la présente période de déclaration.
Toutes les déclarations sont traitées et codées à l’aide du MedDRA, soit la source de terminologie médicale normalisée qui soutient la saisie, la récupération, l’évaluation et la présentation des données cliniques, ainsi que codées selon la principale raison de déclaration au moyen d’un examen détaillé de chaque déclaration de cas d’innocuité. Par conséquent, si plus d’un effet secondaire est décrit, l’effet déterminé comme étant celui ayant entraîné la déclaration est codé comme étant le principal ESSI. En outre, toutes les déclarations décrivant un effet grave ont été examinées et, sauf indication contraire dans la présente déclaration, on a établi que l’effet était prévisible (en fonction des effets indésirables connus associés au vaccin) ou explicable par d’autres raisons non associées à la vaccination, ou encore qu’il fait actuellement l’objet d’une surveillance ou d’une enquête plus en profondeur.
Nombre de déclarations d’ESSI et d’ESSI graves
De janvier à juin 2019, ASPC a reçu un total de 1 757 déclarations d’ESSI. Pendant la même période en 2015, 2016, 2017 et 2018, ASPC a reçu une moyenne de 1 473 déclarations d’ESSI (plage : 1 229 à 1 747) [Figure 1].
Un total de 115 déclarations d’ESSI reçues par ASPC de janvier à juin 2019 ont été catégorisées comme étant graves (7 % de l’ensemble des déclarations d’ESSI). Pendant la même période en 2015, 2016, 2017 et 2018, ASPC a reçu une moyenne de 121 (plage : 91 à 175) déclarations d’ESSI graves (7 % à 11 % de l’ensemble des déclarations d’ESSI). Comme indiqué ci-dessus, tous les problèmes techniques ont été résolus, et depuis janvier 2018 toutes les autorités provinciales et territoriales envoient leurs rapports, ce qui a donné une légère augmentation du nombre de déclarations d’ESSI reçues pendant cette période. Le pourcentage de déclarations graves était semblable à celui des périodes précédentes.
Figure 1 : Total de déclarations d’ESSI reçues (graves et non graves), par semestre civil pour 2019, comparé à la moyenne des quatre années précédentes

Figure 1 - Équivalent textuel
| Semestre | Année | Nombre de déclarations d'ESSI | |
|---|---|---|---|
| Non graves | Graves | ||
| Juillet à décembre | 2017 | 1 284 | 115 |
| Janvier à juin | 2018 | 1 637 | 110 |
| Juillet à décembre | 2018 | 1 257 | 111 |
| Janvier à juin | 2019 | 1 642 | 115 |
| Semestre | Année | Nombre de déclarations d'ESSI | |
|---|---|---|---|
| Non graves | Graves | ||
| Juillet à décembre | 2013-2016 | 1 073 | 107 |
| Janvier à juin | 2014-2017 | 1 220 | 119 |
| Juillet à décembre | 2014-2017 | 1 150 | 116 |
| Janvier à juin | 2015-2018 | 1 352 | 121 |
Fréquence des déclarations d’ESSI graves et non graves par groupe d’âge
Le tableau 1 présente le nombre de déclarations d’ESSI graves et non graves par groupe d’âge de janvier à juin 2019 comparativement à la moyenne de 2015 à 2018 pour la même période. La plupart des effets secondaires graves (ESG) ont été observés chez les moins de 18 ans (85 %, n = 98) et environ les deux tiers (65 %, n = 75) des cas graves signalés chez des enfants de moins de deux ans. Le système de surveillance IMPACT, qui recherche activement des objectifs de surveillance spécifiques chez les enfants admis dans des hôpitaux de soins tertiaires pédiatriques, pourrait expliquer cette forte proportion d’ESG chez les moins de 18 ans. En outre, le nombre de vaccins reçus par les enfants de moins de 2 ans crée davantage de possibilités de survenue des cas des effets secondaires temporairement associés à la vaccination et des rapports à fournir à l’agent de santé. Comme indiqué ci-dessus, tous les problèmes techniques ont été résolus, et depuis janvier 2018 toutes les autorités provinciales et territoriales envoient leurs rapports, ce qui a donné une légère augmentation du nombre de déclarations reçues pendant cette période. Le pourcentage de déclarations graves était semblable à celui des périodes précédentes.
| Groupe d’âge | Déclarations graves | Déclarations non graves | ||
|---|---|---|---|---|
| 2019 | Moyenne 2015 à 2018 |
2019 | Moyenne 2015 à 2018 |
|
| 0 à <1 an | 36 (31 %) | 36 (30 %) | 237 (14 %) | 177 (13 %) |
| 1 à <2 ans | 39 (34 %) | 39 (32 %) | 258 (16 %) | 191 (14 %) |
| 2 à <7 ans | 12 (10 %) | 13 (10 %) | 170 (10 %) | 124 (9 %) |
| 7 à <18 ans | 11 (10 %) | 13 (10 %) | 224 (14 %) | 242 (18 %) |
| 18 à <65 ans | 13 (11 %) | 15 (12 %) | 513 (31 %) | 442 (33 %) |
| 65 ans et plus | 3 (3 %) | 6 (5 %) | 231 (14 %) | 162 (12 %) |
| Inconnu | 1 (1 %) | 1 (1 %) | 9 (1 %) | 14 (1 %) |
| Total | 115 | 121 | 1 642 | 1 352 |
Rapports sur les ESSI reçus par type de déclarant
La figure 2 présente le rédacteur de rapport des déclarations de ESSI (graves et non graves) reçues de janvier à juin 2019. La majorité des déclarations reçues provenaient d’infirmièr(e)s clinicien(ne)s (69 %), suivies des médecins (13 %) et des consommateurs (8 %).
Figure 2: Rapports reçus par type de déclarant, janvier à juin 2019note de bas de page a
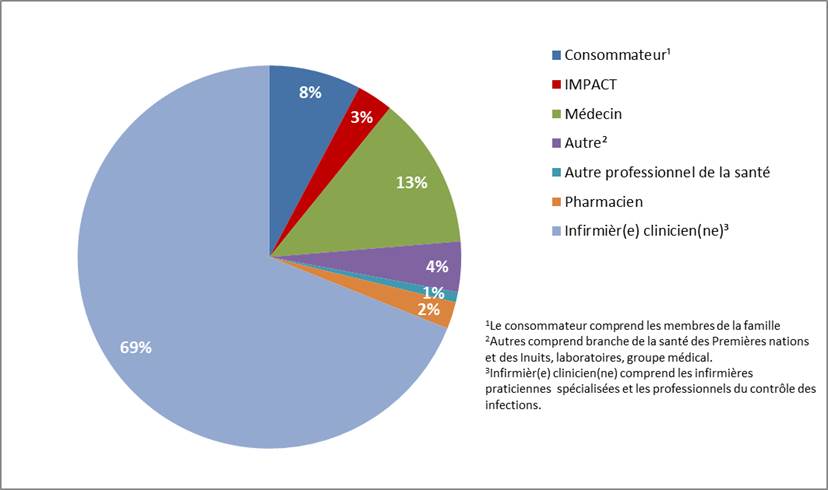
Figure 2 - Équivalent textuel
| Déclarations d’ESSI reçues par type de déclarant | Pourcentage de déclarations d'ESSI total |
|---|---|
| Consommateurnote de bas de page 1 | 8 % |
| IMPACT | 3 % |
| Médecin | 13 % |
| Autrenote de bas de page 2 | 4 % |
| Autre professionnel de la santé | 1 % |
| Pharmacien | 2 % |
| Infirmièr(e) clinicien(ne)note de bas de page 3 | 69 % |
|
|
ESSI par ordre d’importance
La figure 3 présente les principaux types d’ESSI (graves et non graves) déclarés de janvier à juin 2019. À l’exclusion de la catégorie « Autres effets », la plupart des ESSI déclarés étaient des réactions au point de vaccination, suivis de manifestations allergiques ou de type allergique.
Figure 3 : Principale raison de la déclaration d’ESSI (graves et non graves), janvier à juin 2019

Figure 3 - Équivalent textuel
| La principale raison d'effectuer une déclaration d'effet secondaire suivant l'immunization (ESSI) | Pourcentage de déclarations d'ESSI total |
|---|---|
| Réaction au site de vaccination ou à proximité | 39 % |
| Manifestation allergique ou de type allergique | 15 % |
| Autre effetsnote de bas de page 1 | 20 % |
| Éruption cutanée | 13 % |
| Manifestation systémique | 5 % |
| Manifestation neurologique | 6 % |
| Anxiété due à la vaccination | 1 % |
|
|
Les principaux types d’ESSI déclarés par degré de gravité entre janvier à juin 2019 comparativement à la moyenne de 2015 à 2018 pour la même période sont présentés au tableau 2. Entre janvier à juin 2019, comme pour les quatre dernières années, à l’exception de la catégorie « Autres effets », les réactions au point de vaccination ou à proximité, les manifestations allergiques ou de type allergique et les éruptions cutanées ont constitué les ESSI non graves les plus souvent signalés. À l’exception de la catégorie « Autres effets », les manifestations neurologiques (le plus souvent des convulsions déclenchées par une fièvre), des manifestations systémiques (effets qui touchent de nombreux systèmes de l'organisme, souvent accompagnés de fièvre), ainsi que les réactions au site de vaccination ou à proximité, ont constitué les ESSI graves les plus souvent signalés entre janvier et juin 2019 comme pour les quatre dernières années.
| Principaux ESSI déclarés | Déclarations graves | Déclarations non graves | ||
|---|---|---|---|---|
| 2019 | Moyenne 2015 à 2018 |
2019 | Moyenne 2015 à 2018 |
|
| Réaction au site de vaccination ou à proximité | 13 (11 %) | 11 (9 %) | 676 (41 %) | 602 (45 %) |
| Événement allergique ou de type allergique | 6 (5 %) | 8 (7 %) | 260 (16 %) | 217 (16 %) |
| Éruption cutanée | 1 (1 %) | 1 (0 %) | 224 (14 %) | 194 (14 %) |
| Effet systémique | 20 (17 %) | 29 (24 %) | 76 (5 %) | 94 (7 %) |
| Événment neurologique | 39 (34 %) | 41 (34 %) | 73 (4 %) | 49 (4 %) |
| Anxiété due à la vaccination | 1 (1 %) | 0 (0 %) | 16 (1 %) | 17 (1 %) |
| Erreur de vaccination | 0 (0 %) | 0 (0 %) | 0 (0 %) | 1 (0 %) |
| Autres effets note de bas de page 1 | 35 (30 %) | 31 (26 %) | 317 (19 %) | 179 (13 %) |
| Total | 115 | 121 | 1 642 | 1 352 |
|
||||
Vaccins administrés mentionnés dans les déclarations d’ESSI
Le tableau 3 énumère les vaccins administrés les plus souvent mentionnés dans les déclarations d’ESSI reçues entre juillet et décembre 2018. Les vaccins antipneumococciques présentaient le nombre le plus élevé de déclarations d’ESSI (combiné graves et non graves), suivis des vaccins contre la rougeole, les oreillons, la rubéole et la varicelle (RROV et RRO + V). Comme on l'a vu les années précédentes, la proportion la plus élevée de cas graves signalés était liée à l'administration de vaccins infantiles contre le pneumocoque, RROV et RRO + V, et les vaccins de série DCaT pour les nourrissons. Une augmentation du nombre de déclarations reçues pour certains vaccins a été notée au cours de la période considérée, notamment des vaccins contre le zona et le vaccin antipneumococcique. Cela pourrait s'expliquer par les changements apportés aux programmes d'immunisation provinciales et territoriales (par exemple : intégration du vaccin antipneumococcique à la plupart des programmes de vaccination provinciales et territoriales. Comme indiqué ci-dessus, tous les problèmes techniques ont été résolus, et depuis janvier 2018 toutes les autorités provinciales et territoriales envoient leurs rapports, ce qui a donné une légère augmentation du nombre de déclarations reçues pendant cette période. Le pourcentage de déclarations graves était semblable à celui des périodes précédentes.
| Vaccins administrés | Déclarations graves | Déclarations non graves | ||
|---|---|---|---|---|
| 2018 | Moyenne 2014 à 2017 |
2018 | Moyenne 2014 à 2017 |
|
| 1. Dose de rappel du vaccin DCaT | 0 (0 %) | 2 (1 %) | 5 (0 %) | 18 (1 %) |
| 2. Vaccins de série DCaT pour les nourrissons | 45 (16 %) | 44 (17 %) | 342 (12 %) | 251 (12 %) |
| 3. Hépatite B | 5 (2 %) | 5 (2 %) | 93 (3 %) | 98 (4 %) |
| 4. Virus du papillome humain (VPH) | 6 (2 %) | 4 (2 %) | 109 (4 %) | 110 (5 %) |
| 5. Grippe | 19 (7 %) | 32 (12 %) | 419 (15 %) | 392 (18 %) |
| 6. Rougeole, rubéole, oreillons, varicelle (RROV et RRO+V) | 54 (20 %) | 45 (17 %) | 411 (14 %) | 280 (13 %) |
| 7. Méningocoque | 44 (16 %) | 39 (15 %) | 290 (10 %) | 221 (10 %) |
| 8. Autres vaccins | 1 (0 %) | 1 (0 %) | 30 (1 %) | 15 (1 %) |
| 9. Pneumocoque | 59 (22 %) | 54 (21 %) | 461 (16 %) | 341 (16 %) |
| 10. Rotavirus | 25 (9 %) | 22 (8 %) | 171 (6 %) | 95 (4 %) |
| 11. Dose de rappel du vaccin dcaT | 7 (3 %) | 6 (2 %) | 279 (10 %) | 199 (9 %) |
| 12. Vaccins pour les voyageurs | 6 (2 %) | 5 (2 %) | 102 (4 %) | 82 (4 %) |
| 13. Virus varicelle-zona | 2 (1 %) | 1 (0 %) | 140 (5 %) | 80 (4 %) |
| Total | 273 | 261 | 2 852 | 2 182 |
|
||||
Résumé
La présente déclaration semestrielle pour 2019 est fondée sur les déclarations d’effets secondaires transmises à ASPC par les autorités fédérale, provinciales et territoriales de santé publique et la surveillance active dans les hôpitaux pédiatriques. L’évaluation détaillée des déclarations et des tendances de déclaration, en collaboration avec les centres de liaison provinciaux et territoriaux pour l’innocuité des vaccins du GTV et Santé Canada, n’a pas permis de déceler de signal préoccupant concernant l’innocuité des vaccins. Les tableaux et les chiffres de la présente déclaration fournissent un aperçu des données reçues et examinées par ASPC.