Recherche quantitative originale – Cancer du sein : méthode de détection, intervalle diagnostique et recours aux unités d’évaluation diagnostique spécialisées en Ontario (Canada)
Promotion de la santé et prévention des maladies chroniques au Canada
Li Jiang, M. Sc.Rattachement de l'auteur 1Rattachement de l'auteur 2; Julie Gilbert, Ph. D.Rattachement de l'auteur 3; Hugh Langley, M.D.Rattachement de l'auteur 4; Rahim Moineddin, Ph. D.Rattachement de l'auteur 5; Patti A. Groome, Ph. D.Rattachement de l'auteur 1Rattachement de l'auteur 2
https://doi.org/10.24095/hpcdp.38.10.02f
Cet article a fait l'objet d'une évaluation par les pairs.
Rattachement de l'auteurs :
- Rattachement de l'auteur 1
Division des soins contre le cancer et d'épidémiologie, Institut de recherche sur le cancer de l'Université Queen's, Kingston (Ontario), Canada
- Rattachement de l'auteur 2
Institut de recherche en services de santé, Toronto (Ontario), Canada
- Rattachement de l'auteur 3
Action Cancer Ontario, Toronto (Ontario), Canada
- Rattachement de l'auteur 4
South East Regional Cancer Program, Kingston General Hospital, Kingston (Ontario), Canada
- Rattachement de l'auteur 5
Département de médecine familiale et communautaire, Université de Toronto, Toronto (Ontario), Canada
Correspondance : Patti A. Groome, Division des soins contre le cancer et d'épidémiologie, Institut de recherche sur le cancer de l'Université Queen's, 10 rue Stuart, 2e étage, Kingston (Ontario) K7L 3N6 Tél. : 613-533-6000, poste 78512; téléc. : 613-533-6794; courriel : groomep@queensu.ca
Résumé
Introduction. Le cancer du sein est détecté soit par un examen de dépistage, soit à l'aide de signes et symptômes. Au Canada, les mammographies pour le dépistage du cancer du sein sont offertes dans le cadre de programmes organisés ainsi qu'en contexte indépendant (dépistage opportuniste). Les unités d'évaluation diagnostique (UED) de la province de l'Ontario sont des programmes en établissement qui fournissent des services diagnostiques coordonnés pour le cancer du sein, à la différence des soins habituels où le fournisseur de soins de première ligne organise les examens et les consultations. Cette étude décrit les méthodes de détection, l'intervalle diagnostique et l'utilisation des UED pour le cancer du sein en Ontario.
Méthodologie. L'étude a porté sur une cohorte de 6 898 femmes ayant reçu un diagnostic de cancer du sein envahissant en 2011. Nous avons utilisé le Registre d'inscription des cas de cancer de l'Ontario jumelé à des bases de données administratives sur les soins de santé. Nous avons déterminé la méthode de détection à l'aide des données du Programme ontarien de dépistage du cancer du sein (PODCS) et des demandes de règlement des médecins. L'intervalle diagnostique a été défini comme le temps écoulé entre le dépistage initial, l'aiguillage vers un spécialiste ou la première épreuve diagnostique et le diagnostic de cancer lui-même. Le parcours diagnostique (qu'il passe par les UED ou les soins habituels) a été déterminé en fonction des dossiers du PODCS et du lieu de biopsie ou d'intervention chirurgicale. Nous avons cartographié l'intervalle diagnostique et de la couverture des UED en fonction du lieu de résidence des femmes.
Résultats. En 2011, 36 % des cas de cancer du sein en Ontario ont été détectés par dépistage, dont 48 % chez des femmes de 50 à 69 ans. L'intervalle diagnostique provincial médian était de 32 jours, les médianes par comté variant entre 15 et 65 jours. À l'échelle provinciale, 48,4 % des cas ont été diagnostiqués dans une UED, ce pourcentage variant entre 0 et 100 % selon les comtés.
Conclusion. Le taux de détection au dépistage correspondant aux patientes admissibles du fait de leur âge s'est révélé inférieur au taux de dépistage officiel du cancer du sein pour l'ensemble de la population. La répartition géographique de l'intervalle diagnostique et du recours aux UED révèle des variations régionales dans les soins diagnostiques en oncologie qu'il est nécessaire de corriger.
Mots-clés : diagnostic ou tumeurs du sein, femme, services diagnostiques, détection précoce du cancer, diagnostic précoce, études transversales, recherche de services de santé
Points saillants
- En 2011, 48,4 % des cas de cancer du sein en Ontario chez les patientes qui étaient admissibles au dépistage du fait de leur âge ont été détectés par un examen de dépistage.
- Le délai médian entre la détection et le diagnostic de cancer du sein était de 4,6 semaines.
- On a relevé des écarts géographiques importants dans l'intervalle diagnostique et le recours aux services d'une unité d'évaluation diagnostique (UED) à l'échelle de l'Ontario.
Introduction
Le dépistage est important pour assurer un diagnostic précoce du cancer et améliorer ainsi les chances de survieNote de bas de page 1. Au Canada, les mammographies de dépistage du cancer du sein sont offertes dans le cadre de programmes organisés ainsi qu'en contexte indépendant (dépistage opportuniste)Note de bas de page 2. Le taux de participation aux programmes de dépistage du cancer du sein au sein de la population admissible au dépistage est considéré comme un indicateur important de l'efficacité du programme et est, de ce fait, surveillé systématiquement par les programmesNote de bas de page 3. Un taux de participation élevé au dépistage ne signifie pas nécessairement que tous les cancers du sein sont détectés par un programme. En fait, de nombreux cas sont détectés lorsque la patiente consulte son médecin pour des signes ou symptômes de cancer du seinNote de bas de page 4. On manque d'études décrivant la proportion de patientes atteintes d'un cancer du sein détecté par examen de dépistage et non par manifestation symptomatique.
La période de diagnostic du cancer du sein est caractérisée par de nombreux rendez-vous pour des tests et des consultations diagnostiques et cette situation provoque souvent une détresse et une anxiété importantes chez les femmes et les personnes de leur entourageNote de bas de page 5Note de bas de page 6Note de bas de page 7. Un délai de trois mois ou plus peut faire en sorte que le cancer soit à un stade avancé au moment du diagnostic, ce qui réduit les chances de survieNote de bas de page 8. Selon les recommandations tirées des lignes directrices de 2007 pour la surveillance de la performance des programmes de dépistage du cancer du sein, 90 % des tests de dépistage anormaux doivent être traités dans un délai de 5 semaines, ou de 7 semaines si une biopsie tissulaire (par forage ou par chirurgie ouverte) est nécessaireNote de bas de page 9. Nous comparons donc systématiquement l'intervalle de temps entre un examen de dépistage anormal et un diagnostic final à ces cibles nationales des programmes de dépistage. En 2011, le Programme ontarien de dépistage du cancer du sein (PODCS) a fait état d'une variation régionale importante relativement à l'atteinte des délais cibles pour les femmes dont les résultats au test de dépistage étaient anormauxNote de bas de page 3. Cependant, on en sait peu sur la durée de l'intervalle diagnostique à l'échelle de la population et sur ses variations possibles entre les régions de la province.
Les UED sont des programmes en établissement innovateurs qui visent à améliorer la rapidité et la qualité des services de soins diagnostiquesNote de bas de page 7. Des initiatives similaires sont en place dans bon nombre d'administrations dans le mondeNote de bas de page 10Note de bas de page 11. En Ontario, les UED se présentent sous deux formes : centres affiliés d'évaluation de la santé du sein (centres affiliés)Note de bas de page 12 et centres régionaux d'évaluation de la santé du sein. Les soins diagnostiques dans les centres affiliés sont fournis par une équipe de soins de santé multidisciplinaire qui compte une infirmière pivot chargée de coordonner le processus. Cela diffère du parcours diagnostique des soins habituels, au cours duquel le fournisseur de soins de première ligne de la patiente joue un rôle central pour l'aiguillage et la recommandation d'évaluations diagnostiques appropriées et de consultations de spécialistesNote de bas de page 12Note de bas de page 13Note de bas de page 14. L'infirmière pivot fournit aussi à la patiente un soutien psychologique et informationnel. Tout centre affilié doit satisfaire à des critères organisationnels minimaux en matière de ressources de services diagnostiques pour le cancer du sein et de disponibilité pour conserver son titreNote de bas de page 13. Le processus diagnostique dans les centres régionaux d'évaluation de la santé du sein est moins bien documenté, mais les objectifs et les structures de ces centres sont similaires à ceux des centres affiliés.
Notre étude vise à décrire, pour l'ensemble des patientes atteintes du cancer du sein en Ontario, 1) la méthode de détection du cancer, 2) la durée de l'intervalle diagnostique et ses variations géographiques et 3) la couverture des UED et ses variations géographiques. Elle constitue l'un des trois rapports découlant de notre étude en population générale sur l'utilisation des UED et sur l'intervalle diagnostiqueNote de bas de page 14Note de bas de page 15Note de bas de page 16.
Méthodologie
Population à l'étude
La population à l'étude est composée de femmes atteintes d'un cancer du sein envahissant primitif diagnostiqué en 2011 en Ontario (Canada). Nous avons exclu : 1) les femmes dont le dossier au registre d'inscription ne pouvait être jumelé à des données administratives, 2) les femmes vivant à l'extérieur de l'Ontario au moment du diagnostic et 3) les femmes n'étant pas assurées par le Régime d'assurance-santé de l'Ontario depuis au moins trois ans avant le diagnosticNote de bas de page 14Note de bas de page 15.
Sources de données
Les données de l'étude sont issues du jumelage entre le Registre d'inscription des cas de cancer de l'Ontario et les données administratives de l'Institut de recherche en services de santé (IRSS) et d'Action Cancer Ontario. Nous avons utilisé le Registre pour isoler les cas de cancer du sein et déterminer la date du diagnostic. Nous avons utilisé les données jumelées de stadification pour établir l'histologie et les stades de cancer. Nous avons défini le stade au moment du diagnostic à l'aide la 7e édition de la classification TNMNote de bas de page 17Note de bas de page 18. La base de données du PODCS a fourni des renseignements sur les dates de dépistage, les résultats des examens de dépistage et le recours aux centres affiliés. La base de données des demandes de règlement du Régime d'assurance-santé de l'Ontario, le Système national d'information sur les soins ambulatoires (SNISA), la base de données sur les congés des patients (BDCP) et la base de données sur la chirurgie d'un jour de l'Institut canadien d'information sur la santé (ICIS) contiennent des renseignements sur les procédures diagnostiques du cancer du sein ainsi que sur les dates et les médecins associés. Le PODCS a fourni une liste des hôpitaux affiliés et nous avons élaboré une liste des centres régionaux d'évaluation de la santé du sein en réalisant un sondage par courriel auprès des directeurs régionaux des soins primaires d'Action Cancer Ontario et des gestionnaires de programmes régionaux du PODCS.
Définitions de la méthode de détection, de l'intervalle diagnostique et de l'utilisation des UED
Nous avons déterminé les cas de cancer détectés au dépistage en remontant 12 mois avant la date de diagnostic de cancer pour les examens de dépistage anormaux selon le PODCS et 6 mois pour le dépistage opportuniste. Nous avons supposé qu'une patiente qui consultait pour des signes ou symptômes n'avait pas eu de cancer détecté au dépistage. Nous avons réduit la période de recherche à 6 mois plutôt que 12 pour les cas relevés au moyen du dépistage opportuniste car ces cas ont été isolés à l'aide des données des demandes de règlement, et celles-ci ne donnent pas les résultats des tests (ils se trouvent dans la base de données du PODCS). Le choix de la période de 6 mois repose sur les données probantes tirées des lignes directrices canadiennesNote de bas de page 9Note de bas de page 19 et sur notre observation selon laquelle moins de 5 % des résultats anormaux au dépistage du PODCS sont survenus entre 6 et 12 mois avant le diagnosticNote de bas de page 15.
Nous avons défini l'intervalle diagnostique en calculant le nombre de jours entre la date du diagnostic de cancer et soit le dépistage initial, soit l'aiguillage à un spécialiste ou la première épreuve diagnostique en l'absence de dépistage (figure 1). Il s'agit de l'adaptation d'une stratégie utilisée pour le cancer colorectalNote de bas de page 20. La date du diagnostic de cancer a été obtenue dans le Registre d'inscription des cas de cancer de l'Ontario, et correspond généralement à la première occurrence d'une tumeur confirmée par un examen histologique ou cytologique, à une admission à l'hôpital ou encore à une consultation externe. L'intervalle diagnostique a été analysé en tant que résultat à la fois continu et dichotomique à sept semaines, ce dernier résultat étant basé sur le plus long des deux délais cibles mentionnés précédemmentNote de bas de page 9Note de bas de page 19.
Figure 1. Mesure de l'intervalle diagnostique pour le cancer du sein
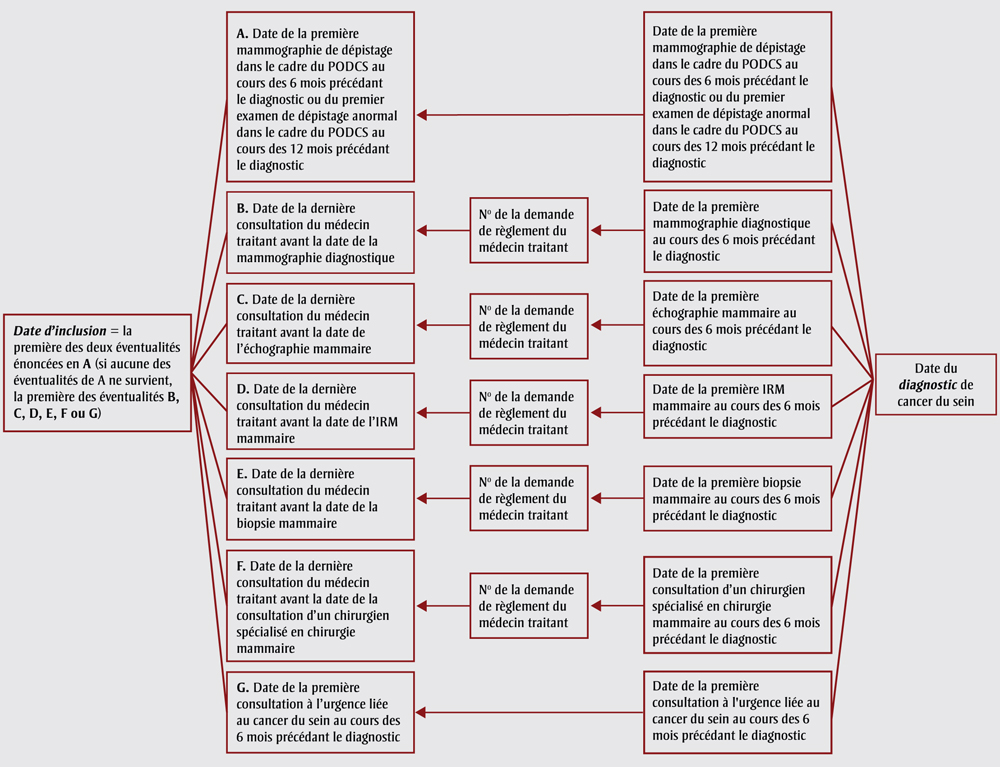
Source : Selon la méthodologie décrite dans Singh et collab.20
Équivalent textuel
Nous avons défini l'intervalle diagnostique en calculant le nombre de jours entre la date du diagnostic de cancer et soit le dépistage initial, soit l'aiguillage à un spécialiste ou la première épreuve diagnostique en l'absence de dépistage. Cette figure est un organigramme qui illustre ce processus, et qui est reproduit dans le tableau ci-dessous :
| Date d'inclusion | Date de la consultation | No de la demande de règlement du médecin traitant | Date du examen | Date du diagnostic de cancer du sein |
|---|---|---|---|---|
| Date d'inclusion = la première des deux éventualités énoncées en A (si aucune des éventualités de A ne survient, la première des éventualités B, C, D, E, F ou G) | A. Date de la première mammographie de dépistage dans le cadre du PODCS au cours des 6 mois précédant le diagnostic ou du premier examen de dépistage anormal dans le cadre du PODCS au cours des 12 mois précédant le diagnostic | Sans objet | Date de la première mammographie de dépistage dans le cadre du PODCS au cours des 6 mois précédant le diagnostic ou du premier examen de dépistage anormal dans le cadre du PODCS au cours des 12 mois précédant le diagnostic | Date du diagnostic de cancer du sein |
| Date d'inclusion = la première des deux éventualités énoncées en A (si aucune des éventualités de A ne survient, la première des éventualités B, C, D, E, F ou G) | B. Date de la dernière consultation du médecin traitant avant la date de la mammographie diagnostique | No de la demande de règlement du médecin traitant | Date de la première mammographie diagnostique au cours des 6 mois précédant le diagnostic | Date du diagnostic de cancer du sein |
| Date d'inclusion = la première des deux éventualités énoncées en A (si aucune des éventualités de A ne survient, la première des éventualités B, C, D, E, F ou G) | C. Date de la dernière consultation du médecin traitant avant la date de l'échographie mammaire | No de la demande de règlement du médecin traitant | Date de la première échographie mammaire au cours des 6 mois précédant le diagnostic | Date du diagnostic de cancer du sein |
| Date d'inclusion = la première des deux éventualités énoncées en A (si aucune des éventualités de A ne survient, la première des éventualités B, C, D, E, F ou G) | D. Date de la dernière consultation du médecin traitant avant la date de l'IRM mammaire | No de la demande de règlement du médecin traitant | Date de la première IRM mammaire au cours des 6 mois précédant le diagnostic | Date du diagnostic de cancer du sein |
| Date d'inclusion = la première des deux éventualités énoncées en A (si aucune des éventualités de A ne survient, la première des éventualités B, C, D, E, F ou G) | E. Date de la dernière consultation du médecin traitant avant la date de la biopsie mammaire | No de la demande de règlement du médecin traitant | Date de la première biopsie mammaire au cours des 6 mois précédant le diagnostic | Date du diagnostic de cancer du sein |
| Date d'inclusion = la première des deux éventualités énoncées en A (si aucune des éventualités de A ne survient, la première des éventualités B, C, D, E, F ou G) | F. Date de la dernière consultation du médecin traitant avant la date de la consultation d'un chirurgien spécialisé en chirurgie mammaire | No de la demande de règlement du médecin traitant | Date de la première consultation d'un chirurgien spécialisé en chirurgie mammaire au cours des 6 mois précédant le diagnostic | Date du diagnostic de cancer du sein |
| Date d'inclusion = la première des deux éventualités énoncées en A (si aucune des éventualités de A ne survient, la première des éventualités B, C, D, E, F ou G) | G. Date de la première consultation à l'urgence liée au cancer du sein au cours des 6 mois précédant le diagnostic | Sans objet | Date de la première consultation à l'urgence liée au cancer du sein au cours des 6 mois précédant le diagnostic | Date du diagnostic de cancer du sein |
Nous avons distingué l'utilisation des UED par les patientes ayant d'abord fait l'objet d'un dépistage dans le cadre du PODCS (patientes du PODCS) des autres, étant donné que le PODCS dispose d'une base de données qui assure le suivi de l'utilisation des centres affiliés d'évaluation de la santé du sein. On a considéré que les patientes du PODCS avaient reçu un diagnostic par une UED soit si elles avaient un dossier de règlement dans un centre affilié du PODCS, soit si elles avaient subi une biopsie ou une intervention chirurgicale dans le centre hospitalier d'une UED. On a supposé que sinon, le diagnostic avait été posé dans le cadre des soins habituels. On a considéré que les patientes restantes (dépistages opportunistes et patientes symptomatiques) avaient reçu un diagnostic d'une UED si elles avaient subi une biopsie ou une intervention chirurgicale dans le centre hospitalier d'une UED. Nous avons validé cette stratégie à l'aide du dossier du PODCS et avons établi que l'utilisation du dossier de biopsie ou d'intervention chirurgicale permettait d'obtenir une sensibilité de 90,1 % et une spécificité de 84,6 %Note de bas de page 15.
Analyse statistique
Nous avons utilisé des proportions pour décrire les taux de détection de cancer du sein au dépistage et l'utilisation des UED. Les taux de détection au dépistage ont été répartis en trois groupes d'âge (moins de 50 ans, 50 à 69 ans, plus de 69 ans) en fonction des dernières lignes directrices canadiennes au moment de l'étude, bien que les lignes directrices en vigueur depuis novembre 2011 aient augmenté la limite d'âge supérieure pour l'établir à 74 ansNote de bas de page 21. Nous rendons compte de l'intervalle diagnostique médian puisque sa distribution est désaxée vers la droite. Nous faisons état de l'intervalle diagnostique et de la couverture des UED par réseau local d'intégration des services de santé (RLISS) et par comté, les deux étant fondés sur le lieu de résidence de la patiente au moment du diagnostic. L'intervalle diagnostique à l'échelle du comté a été divisées en catégories pour la cartographie, avec des seuils assurant la présence d'un nombre raisonnable de comtés dans chaque catégorie. La couverture des UED a aussi été catégorisée pour la cartographie. Afin de déterminer si des comtés adjacents pouvaient être combinés, nous avons calculé l'autocorrélation spatiale sur l'intervalle diagnostique à l'aide de l'indice global de Moran I, lequel prend des valeurs comprises entre −1 (dispersion spatiale parfaite) et 1 (agrégation spatiale parfaite), 0 représentant un modèle géographique aléatoireNote de bas de page 22. Pour l'analyse à l'échelle du comté, nous avons appliqué des régressions médianes unidimensionnelles et multidimensionnelles afin d'évaluer les variations géographiques non ajustées et ajustées selon le stade de l'intervalle diagnostique, puisque le diagnostic à un stade précoce s'est avéré de façon constante être associé à un intervalle diagnostique plus longNote de bas de page 23. L'étude a été approuvée sur le plan de l'éthique par le Health Sciences and Affiliated Teaching Hospitals Research Ethics Board de l'Université Queen's à Kingston (Ontario).
Résultats
La cohorte finale comptait 6 898 sujets. L'organigramme de la figure 2 décrit le processus de sélection de la cohorte. L'âge moyen était de 61,2 (écart-type : 13,5).
Figure 2. Processus de sélection de la cohorte
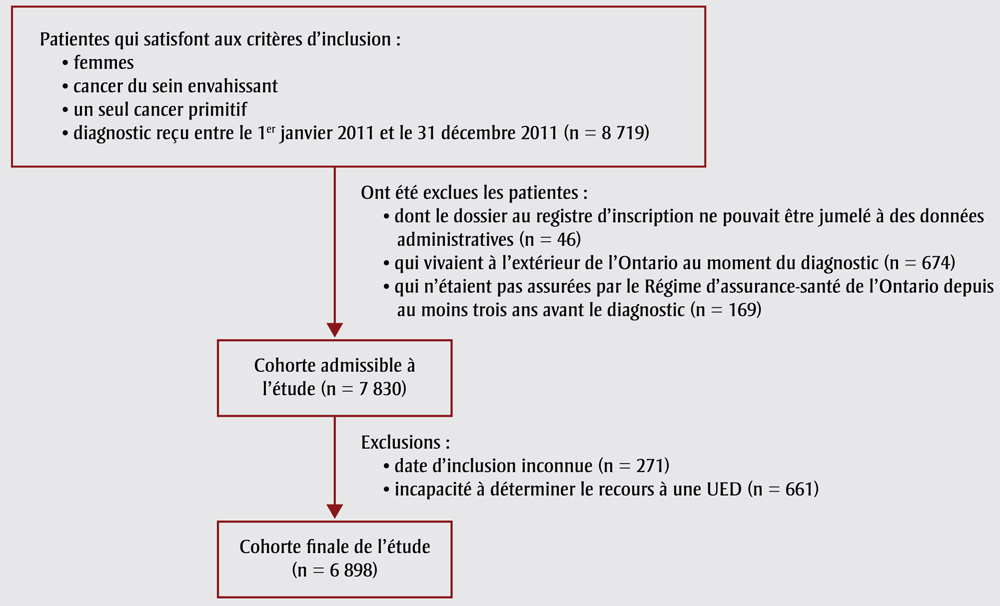
Équivalent textuel
La cohorte finale comptait 6 898 sujets. L'organigramme de cette figure décrit le processus de sélection de la cohorte, comme suit :
Patientes qui satisfont aux critères d'inclusion :
- femmes
- cancer du sein envahissant
- un seul cancer primitif
- diagnostic reçu entre le 1er janvier 2011 et le 31 décembre 2011 (n = 8 719)
Ont été exclues les patientes :
- dont le dossier au registre d'inscription ne pouvait être jumelé à des données administratives (n = 46)
- qui vivaient à l'extérieur de l'Ontario au moment du diagnostic (n = 674)
- qui n'étaient pas assurées par le Régime d'assurance-santé de l'Ontario depuis au moins trois ans avant le diagnostic (n = 169)
Cohorte admissible à l'étude (n = 7 830)
Exclusions additionnelles :
- date d'inclusion inconnue (n = 271)
- incapacité à déterminer le recours à une UED (n = 661)
Cohorte finale de l'étude (n = 6 898)
Sur les 6 898 patientes, 2 499 (36,2 %) avaient reçu un diagnostic de cancer après un dépistage et 4 399 (63,8 %) étaient symptomatiques. Le tableau 1 rend compte des taux de détection au dépistage par groupe d'âge. Chez les patientes dont le cancer avait été diagnostiqué par dépistage, 1 986 (79,5 %) avaient fait l'objet d'un dépistage par l'entremise du PODCS et pour 513 patientes (20,5 %), il s'agissait d'un dépistage opportuniste.
| Groupe d'âge | Cas détectés au dépistage | Cas symptomatiques |
|---|---|---|
| Total (rang en %) | Total (rang en %) | |
| Moins de 50 ans | 158 (11,1) | 1 270 (88,9) |
| 50 à 69 ans | 1 736 (48,4) | 1 851 (51,6) |
| Plus de 69 ans | 605 (32,1) | 1 278 (67,9) |
| Tous âges (total) | 2 499 (36,2) | 4 399 (63,8) |
L'intervalle diagnostique médian était de 32 jours (écart interquartile : 17 à 60). Soixante-huit pour cent des patientes atteintes du cancer du sein ont reçu un diagnostic dans les limites de la cible de 7 semaines, et 10 % ont dû attendre 107 jours ou plus. Près de la moitié (48,4 %) des patientes ont reçu un diagnostic dans une UED. Le tableau 2 décrit l'intervalle diagnostique et l'utilisation des UED par RLISS. L'intervalle diagnostique médian variait entre 24 jours (intervalle de confiance [IC] à 95 % : 20,6 à 27,4) dans le RLISS du Sud-Est et 41 jours (IC à 95 % : 34,7 à 47,3) dans le RLISS du Nord-Ouest (p < 0,001). Le pourcentage de patientes dont le diagnostic a été posé par l'entremise d'une UED varie entre 2,6 % (IC à 95 % : 0,7 % à 4,6 %) dans le RLISS de Simcoe-Nord Muskoka et 93 % (IC à 95 % : 90,2 à 95,8 %) dans le RLISS du Sud-Est (p < 0,001), ce qui prouve l'existence de différences régionales quant à la disponibilité des UED.
| RLISS | Effectifs (n) | Intervalle diagnostique médian (IC à 95 %) | Taux de couverture des UEDTableau 1 Note de bas de page a (IC à 95 %) |
|---|---|---|---|
| Érié St. Clair | 412 | 27,5 (25,1–30,0) | 81,6 (77,8–85,3) |
| Sud-Ouest | 594 | 35,0 (30,6–39,4) | 81,6 (78,5–84,8) |
| Waterloo Wellington | 380 | 30,0 (27,9–32,1) | 51,3 (46,3–56,3) |
| Hamilton Niagara Haldimand Brant | 697 | 29,0 (27,7–30,3) | 53,4 (49,7–57,1) |
| Centre-Ouest | 311 | 37,0 (33,7–40,3) | 12,9 (9,1–16,6) |
| Mississauga Halton | 571 | 36,0 (32,4–39,6) | 29,1 (25,3–32,8) |
| Toronto-Centre | 553 | 34,0 (30,8–37,2) | 37,4 (33,4–41,5) |
| Centre | 863 | 36,0 (33,3–38,7) | 21,2 (18,5–23,9) |
| Centre-Est | 740 | 35,5 (34,3–36,6) | 38,0 (34,5–41,5) |
| Sud-Est | 315 | 24,0 (20,6–27,4) | 93,0 (90,2–95,8) |
| Champlain | 758 | 29,0 (27,8–30,2) | 69,5 (66,2–72,8) |
| Simcoe-Nord Muskoka | 266 | 29,8 (23,7–35,8) | 2,6 (0,7–4,6) |
| Nord-Est | 316 | 28,0 (25,3–30,7) | 45,6 (40,1– 51,1) |
| Nord-Ouest | 120 | 41,0 (34,7–47,3) | 80,8 (73,8–87,9) |
| Inconnu/RLISS partagé | — | — | — |
Abréviations : IC, intervalle de confiance; RLISS, Réseau local d'intégration des services de santé; UED, unité d'évaluation diagnostique. Remarque : — correspond à des cellules comptant moins de 10 éléments et n'ayant donc pas été documentées en raison de la réglementation en matière de vie privée de l'Institut de recherche en services de santé (IRSS).
|
|||
La carte de la figure 3 représente la répartition de l'intervalle diagnostique médian selon les comtés ontariens. Rien n'indiquait la présence d'une corrélation spatiale quant aux intervalles diagnostiques (indice global de Moran I = −0,02, p = 0,95), ce qui signifie que le regroupement des comtés voisins (tel qu'il est fait dans les rapports du RLISS) masque les variations. Les comtés affichant des intervalles diagnostiques plus longs sont répartis à l'échelle de la province, et les régions les plus peuplées (région du Grand Toronto) se classent au deuxième rang pour ce qui est de la longueur du temps d'attente pour les patientes. Comme le montre le tableau 3, 13 comtés sur 47 (deux comtés affichant des nombres inférieurs ne figurent pas dans cet article) ont affiché un intervalle diagnostique médian de plus de 7 semaines, la médiane variant entre 15 jours (IC à 95 % : 7,6 à 22,4) et 65 jours (IC à 95 % : 39,6 à 90,4). L'ajustement en fonction du stade n'a pas eu d'incidence importante sur cette variation (résultats non présentés ici).
Figure 3. Durée de l'intervalle diagnostique pour les patientes atteintes du cancer du sein, selon les comtés, Ontario (Canada), 2011
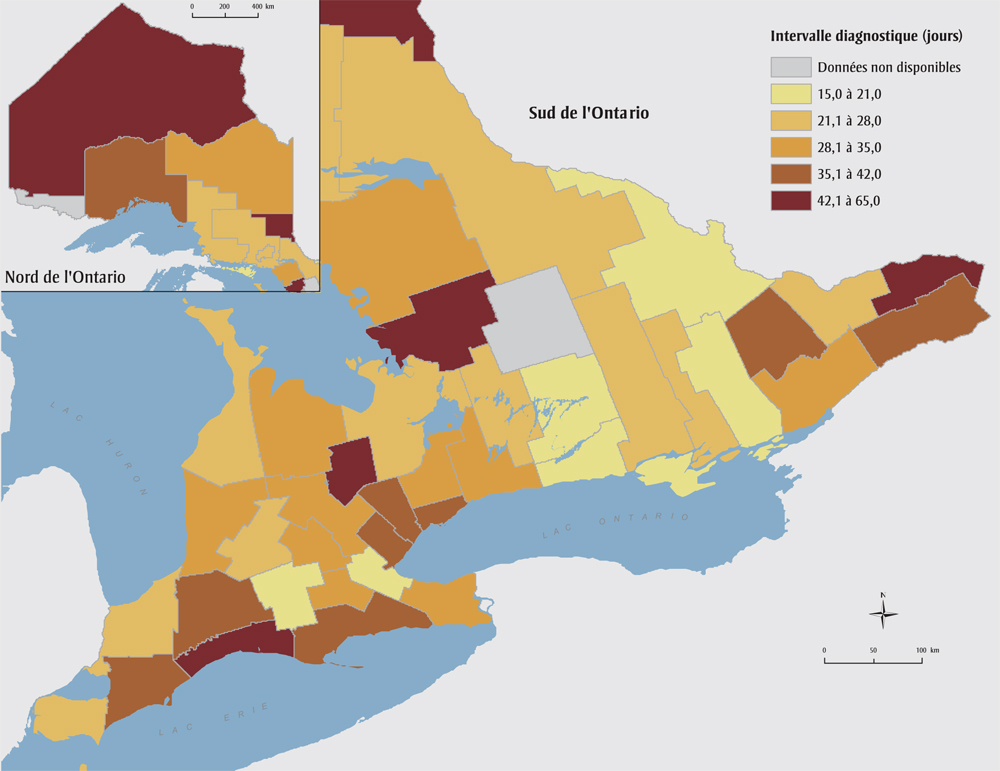
Équivalent textuel
| Comté | Intervalle diagnostique, en jours (intervalle de confiance à 95 %) |
|---|---|
| Comté de Brant | 31,0 (23,8–38,2) |
| Comté de Bruce | 21,9 (14,6–29,2) |
| Comté de Dufferin | 46,9 (32,5–61,3) |
| Comté d'Elgin | 49,0 (36,2–61,8) |
| Comté d'Essex | 25,0 (20,8–29,2) |
| Comté de Frontenac | 21,0 (17,7–24,3) |
| Comté de Grey | 30,0 (23,3–36,7) |
| Municipalité régionale de Haldimand-Norfolk | 37,8 (32,6–43,0) |
| Comté de Haliburton | — |
| Municipalité régionale de Halton | 36,0 (30,1–41,9) |
| Comté de Hastings | 22,0 (16,4–27,6) |
| Comté de Huron | 30,1 (18,0–42,3) |
| Division de Chatham-Kent | 40,5 (23,9–57,1) |
| Comté de Lambton | 25,4 (15,5–35,3) |
| Comté de Lanark | 38,0 (30,5–45,5) |
| Comtés unis de Leeds et Grenville | 31,7 (26,1–37,3) |
| Comté de Lennox et Addington | 27,0 (9,5–44,5) |
| Division de Toronto | 38,0 (36,0–40,0) |
| Comté de Middlesex | 42,0 (36,6–47,4) |
| Municipalité de district de Muskoka | 65,0 (39,6–90,4) |
| Municipalité régionale de Niagara | 35,0 (31,3–38,7) |
| Comté de Northumberland | 20,0 (13,7–26,3) |
| Municipalité régionale de Durham | 33,0 (28,6–37,4) |
| Division d'Ottawa | 28,0 (24,2–31,8) |
| Comté d'Oxford | 16,4 (10,7–22,1) |
| Municipalité régionale de Peel | 37,0 (34,0–40,0) |
| Comté de Perth | 23,0 (15,5–30,5) |
| Comté de Peterborough | 20,0 (14,3–25,7) |
| Comtés unis de Prescott et Russell | 48,7 (36,9–60,5) |
| Division du Prince Édouard | 15,0 (7,6–22,4) |
| Comté de Renfrew | 15,0 (6,8–23,2) |
| Comté de Simcoe | 24,0 (19,4–28,6) |
| Comtés unis de Stormont, Dundas et Glengary | 40,8 (32,3–49,2) |
| Division des lacs Kawartha | 23,0 (10,6–35,4) |
| Municipalité régionale de Waterloo | 30,0 (26,8–33,2) |
| Comté de Wellington | 32,0 (27,5–36,5) |
| Division de Hamilton | 19,7 (16,5–22,9) |
| Municipalité régionale de York | 32,0 (28,8–35,2) |
| District d'Algoma | 24,0 (13,5–34,5) |
| District de Cochrane | 35,0 (28,0–41,9) |
| District de Kenora | 50,0 (30,8–69,2) |
| District de Manitoulin | 19,7 (6,3–33,2) |
| District de Nipissing | 22,0 (13,2–30,8) |
| District de Parry Sound | 32,5 (19,6–45,3) |
| District de Rainy River | — |
| Division du Grand Sudbury | 24,0 (18,1–29,9) |
| District de Sudbury | 22,0 (2,9–41,1) |
| District de Thunder Bay | 40,0 (34,8–45,2) |
| District de Timiskaming | 53.0 (14,2–91,8) |
| Comté | n | Intervalle diagnostique médian (IC à 95 %) | Taux de couverture des UEDTableau 3 Note de bas de page a (IC à 95 %) |
|---|---|---|---|
| Comté de BrantTableau 3 Note de bas de page b | 60 | 31,0 (23,8–38,2) | 6,6 (0,4–13,0) |
| Comté de BruceTableau 3 Note de bas de page b | 46 | 21,9 (14,6–29,2) | 73,9 (61,2–86,6) |
| Comté de DufferinTableau 3 Note de bas de page b | 30 | 46,9 (32,5–61,3) | 6,7 (−2,3–15,59) |
| Comté d'ElginTableau 3 Note de bas de page b | 59 | 49,0 (36,2–61,8) | 18,6 (8,7–28,6) |
| Comté d'Essex | 251 | 25,0 (20,8–29,2) | 85,7 (81,3–90,0) |
| Comté de Frontenac | 89 | 21,0 (17,7–24,3) | 98,9 (96,7–101,1) |
| Comté de Grey | 63 | 30,0 (23,3–36,7) | 76,2 (65,7–86,7) |
| Municipalité régionale de Haldimand-NorfolkTableau 3 Note de bas de page b | 68 | 37,8 (32,6–43,0) | 17,6 (8,6–26,7) |
| Comté de HaliburtonTableau 3 Note de bas de page b | — | — | — |
| Municipalité régionale de HaltonTableau 3 Note de bas de page b | 215 | 36,0 (30,1–41,9) | 26,0 (20,2–31,9) |
| Comté de Hastings | 89 | 22,0 (16,4–27,6) | 96,6 (92,9–100,4) |
| Comté de HuronTableau 3 Note de bas de page b | 36 | 30,1 (18,0–42,3) | 88,9 (78,6–99,2) |
| Division de Chatham-Kent | 62 | 40,5 (23,9–57,1) | 91,9 (85,2–98,7) |
| Comté de Lambton | 98 | 25,4 (15,5–35,3) | 64,3 (54,8–73,8) |
| Comté de LanarkTableau 3 Note de bas de page b | 41 | 38,0 (30,5–45,5) | 53,7 (38,4–68,9) |
| Comtés unis de Leeds et Grenville | 68 | 31,7 (26,1–37,3) | 86,8 (78,7–94,8) |
| Comté de Lennox et AddingtonTableau 3 Note de bas de page b | 19 | 27,0 (9,5–44,5) | 100,0 (100,0–100,0) |
| Division de Toronto | 1 289 | 38,0 (36,0–40,0) | 25,5 (23,1–27,9) |
| Comté de Middlesex | 285 | 42,0 (36,6–47,4) | 94,0 (91,3–96,8) |
| Municipalité de district de MuskokaTableau 3 Note de bas de page b | 49 | 65,0 (39,6–90,4) | 0,0 (0,0–0,0) |
| Municipalité régionale de Niagara | 241 | 35,0 (31,3–38,7) | 90,9 (87,2–94,5) |
| Comté de Northumberland | 57 | 20,0 (13,7–26,3) | 94,7 (88,9–100,5) |
| Municipalité régionale de Durham | 283 | 33,0 (28,6–37,4) | 54,1 (48,3–59,9) |
| Division d'Ottawa | 549 | 28,0 (24,2–31,8) | 74,7 (71,0–78,3) |
| Comté d'Oxford | 62 | 16,4 (10,7–22,1) | 85,5 (76,7–94,3) |
| Municipalité régionale de Peel | 567 | 37,0 (34,0–40,0) | 27,5 (23,8–31,2) |
| Comté de Perth | 43 | 23,0 (15,5–30,5) | 100,0 (100,0–100,0) |
| Comté de Peterborough | 73 | 20,0 (14,3–25,7) | 41,1 (29,8–52,4) |
| Comtés unis de Prescott et Russell | 52 | 48,7 (36,9–60,5) | 48,1 (34,5–61,7) |
| Division du Prince Édouard | 19 | 15,0 (7,6–22,4) | 94,7 (84,7–104,8) |
| Comté de Renfrew | 51 | 15,0 (6,8–23,2) | 90,2 (82,0–98,4) |
| Comté de Simcoe | 245 | 24,0 (19,4–28,6) | 4,1 (1,6–6,6) |
| Comtés unis de Stormont, Dundas et Glengary | 74 | 40,8 (32,3–49,2) | 36,5 (25,5–47,5) |
| Division des lacs Kawartha | 45 | 23,0 (10,6–35,4) | 28,9 (15,6–42,1) |
| Municipalité régionale de Waterloo | 281 | 30,0 (26,8–33,2) | 61,9 (56,2–67,6) |
| Comté de WellingtonTableau 3 Note de bas de page b | 94 | 32,0 (27,5–36,5) | 19,1 (11,2–27,1) |
| Division de Hamilton | 266 | 19,7 (16,5–22,9) | 41,0 (35,1–46,9) |
| Municipalité régionale de York | 528 | 32,0 (28,8–35,2) | 23,9 (20,2–27,5) |
| District d'Algoma | 68 | 24,0 (13,5–34,5) | 88,2 (80,6–95,9) |
| District de Cochrane | 42 | 35,0 (28,0–41,9) | 38,1 (23,4–52,8) |
| District de KenoraTableau 3 Note de bas de page b | 31 | 50,0 (30,8–69,2) | 41,9 (24,6–59,3) |
| District de ManitoulinTableau 3 Note de bas de page b | 14 | 19,7 (6,3–33,2) | 50,0 (23,8–76,2) |
| District de NipissingTableau 3 Note de bas de page b | 53 | 22,0 (13,2–30,8) | 13,2 (4,1–22,3) |
| District de Parry SoundTableau 3 Note de bas de page b | 28 | 32,5 (19,6–45,3) | 17,9 (3,7–32,0) |
| District de Rainy RiverTableau 3 Note de bas de page b | — | — | — |
| Division du Grand Sudbury | 87 | 24,0 (18,1–29,9) | 46,0 (35,5–56,4) |
| District de SudburyTableau 3 Note de bas de page b | 15 | 22,0 (2,9–41,1) | 40,0 (15,2–64,8) |
| District de Thunder Bay | 84 | 40,0 (34,8–45,2) | 97,6 (94,4–100,9) |
| District de TimiskamingTableau 3 Note de bas de page b | 11 | 53,0 (14,2–91,8) | 36,4 (7,9–64,8) |
Remarque : — correspond à des cellules comptant moins de 10 éléments qui n'ont pas été documentées en raison de la réglementation en matière de vie privée de l'Institut de recherche en services de santé (IRSS).
|
|||
La carte de la figure 4 illustre la répartition de l’utilisation des services des UED selon les comtés ontariens. Les taux varient de 0 % à 100 %, ce qui s’explique en partie par le fait que, au moment de l’étude, il n’y avait pas d’UED dans 19 comtés (38,8 %) (voir tableau 3). De ces 19 comtés, 11 avaient un intervalle diagnostique médian supérieur ou égal à la médiane provinciale.
Figure 4. Couverture des unités d’évaluation diagnostique (UED) pour le cancer du sein, selon les comtés, Ontario (Canada), 2011
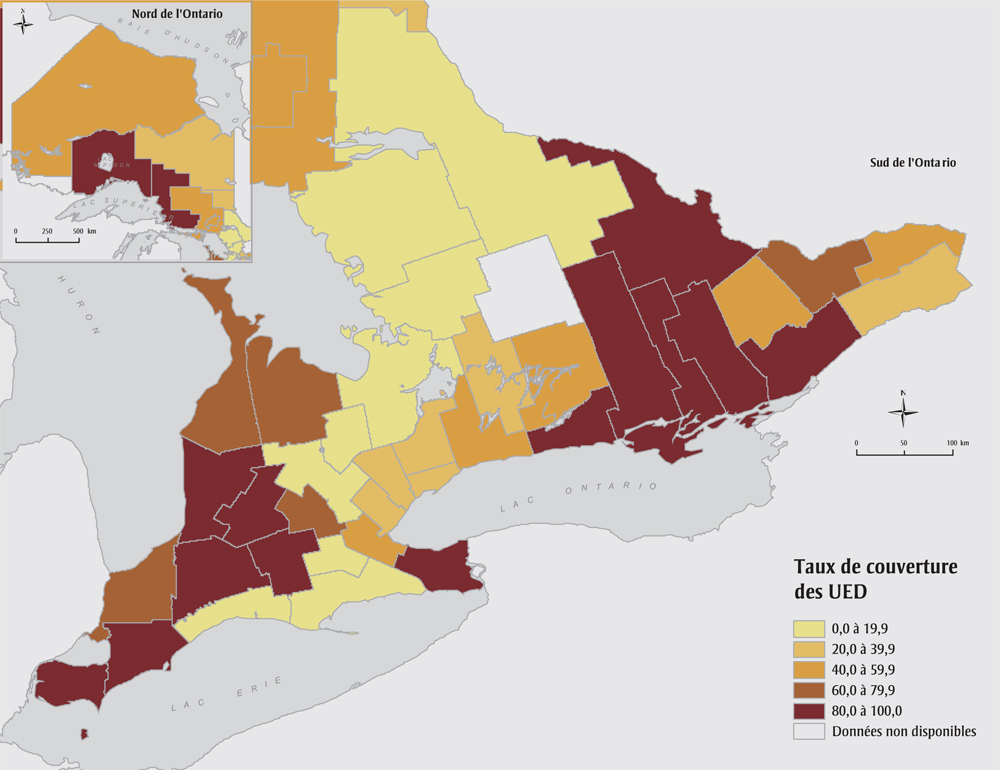
Équivalent textuel
| Comté | Taux de couverture des unités d'évaluation diagnostique (intervalle de confiance à 95 %) |
|---|---|
| Comté de Brant | 6,6 (0,4–13,0) |
| Comté de Bruce | 73,9 (61,2–86,6) |
| Comté de Dufferin | 6,7 (−2,3–15,59) |
| Comté d'Elgin | 18,6 (8,7–28,6) |
| Comté d'Essex | 85,7 (81,3–90,0) |
| Comté de Frontenac | 98,9(96,7–101,1) |
| Comté de Grey | 76,2 (65,7–86,7) |
| Municipalité régionale de Haldimand-Norfolk | 17,6 (8,6–26,7) |
| Comté de Haliburton | — |
| Municipalité régionale de Halton | 26,0 (20,2–31,9) |
| Comté de Hastings | 96,6 (92,9–100,4) |
| Comté de Huron | 88,9 (78,6–99,2) |
| Division de Chatham-Kent | 91,9 (85,2–98,7) |
| Comté de Lambton | 64,3 (54,8–73,8) |
| Comté de Lanark | 53,7 (38,4–68,9) |
| Comtés unis de Leeds et Grenville | 86,8 (78,7–94,8) |
| Comté de Lennox et Addington | 100,0 (100,0–100,0) |
| Division de Toronto | 25,5 (23,1–27,9) |
| Comté de Middlesex | 94,0 (91,3–96,8) |
| Municipalité de district de Muskoka | 0,0 (0,0–0,0) |
| Municipalité régionale de Niagara | 90,9 (87,2–94,5) |
| Comté de Northumberland | 94,7 (88,9–100,5) |
| Municipalité régionale de Durham | 54,1 (48,3–59,9) |
| Division d'Ottawa | 74,7 (71,0–78,3) |
| Comté d'Oxford | 85,5 (76,7–94,3) |
| Municipalité régionale de Peel | 27,5 (23,8–31,2) |
| Comté de Perth | 100,0 (100,0–100,0) |
| Comté de Peterborough | 41,1 (29,8–52,4) |
| Comtés unis de Prescott et Russell | 48,1 (34,5–61,7) |
| Division du Prince Édouard | 94,7 (84,7–104,8) |
| Comté de Renfrew | 90,2 (82,0–98,4) |
| Comté de Simcoe | 4,1 (1,6–6,6) |
| Comtés unis de Stormont, Dundas et Glengary | 36,5 (25,5–47,5) |
| Division des lacs Kawartha | 28,9 (15,6–42,1) |
| Municipalité régionale de Waterloo | 61,9 (56,2–67,6) |
| Comté de Wellington | 19,1 (11,2–27,1) |
| Division de Hamilton | 41,0 (35,1–46,9) |
| Municipalité régionale de York | 23,9 (20,2–27,5) |
| District d'Algoma | 88,2 (80,6–95,9) |
| District de Cochrane | 38,1 (23,4–52,8) |
| District de Kenora | 41,9 (24,6–59,3) |
| District de Manitoulin | 50,0 (23,8–76,2) |
| District de Nipissing | 13,2 (4,1–22,3) |
| District de Parry Sound | 17,9 (3,7–32,0) |
| District de Rainy River | — |
| Division du Grand Sudbury | 46,0 (35,5–56,4) |
| District de Sudbury | 40,0 (15,2–64,8) |
| District de Thunder Bay | 97,6 (94,4–100,9) |
| District de Timiskaming | 36,4 (7,9–64,8) |
Analyse
À notre connaissance, il s’agit de la première étude ontarienne et de l’une des premières études canadiennes décrivant les taux de détection du cancer du sein au dépistage et les temps d’attente avant le diagnostic pour une cohorte en population générale de patientes atteintes de cancer du seinNote de bas de page 24Note de bas de page 25. Les rapports ontariens précédents ne portaient que sur les cas visés par des programmes de dépistage du cancer du sein organisésNote de bas de page 12Note de bas de page 26, alors que notre étude englobe aussi les 63,8 % de patientes atteintes de cancer du sein qui ont reçu un diagnostic à la suite de la manifestation de symptômes et les 7,4 % de cas détectés lors d'un dépistage opportuniste.
Le taux de détection du cancer du sein au dépistage que nous avons observé (48,4 % des patientes atteintes de cancer du sein âgées de 50 à 69 ans) était inférieur au taux de participation de la population générale au dépistage signalé par le PODCS. En 2007 et 2008, le PODCS a calculé que 66,3 % des femmes ontariennes âgées de 50 à 69 ans s’étaient soumises à un dépistage (dans le cadre du PODCS ou du dépistage opportuniste)Note de bas de page 27, et une couverture semblable a été estimée pour 2011Note de bas de page 3. L’écart entre le taux de participation aux programmes de dépistage et le taux de détection au dépistage est compatible avec les données probantes, à savoir que les femmes dont les facteurs de risque de cancer du sein sont les plus importants, notamment un âge plus avancé et le manque d’exercice, sont moins susceptibles de se soumettre à un dépistageNote de bas de page 28, et que certaines femmes reçoivent un diagnostic de cancer du sein entre deux examens de dépistage. À propos de ce dernier point, Kirsh et ses collaborateurs ont estimé que 13,8 % des patientes atteintes du cancer du sein affectées à une cohorte de participantes au PODCS entre 1994 et 2002 ont reçu un diagnostic dans les 24 mois suivant une mammographie de dépistage négative (on parle alors de cancer d’intervalle)Note de bas de page 29.
Les seules autres données probantes sur le taux de détection du cancer du sein au dépistage au Canada proviennent de deux études récentes réalisées en Alberta, l’une révélant que 44 % de tous les cancers du sein avaient été détectés au dépistage entre 2007 et 2010Note de bas de page 24 et l’autre faisant état d’un taux de détection au dépistage de 38 % pour 2004 à 2010Note de bas de page 25 (le taux observé était de 36 % en Ontario en 2011). Les critères d’admissibilité au dépistage diffèrent entre les deux provinces, le Programme de dépistage du cancer de l’Alberta acceptant aussi les patientes de 40 à 49 ansNote de bas de page 30. Cependant, le taux de participation au dépistage du cancer du sein biennal (dans le cadre d’un programme ou non) chez les femmes de 50 à 69 ans est plus faible en Alberta (55,1 % à 57,3 % pour 2007 à 2010)Note de bas de page 31 qu’en Ontario (66,3 % pour les années 2007 et 2008)Note de bas de page 27.
Deux études en population générale réalisées aux États-Unis ont rendu compte de proportions de cas de cancer détectés au dépistage de respectivement 22 % et 30,2 %Note de bas de page 32Note de bas de page 33, la seconde étant limitée aux femmes de 40 à 49 ans. Ces taux plus faibles pourraient avoir changé puisque ces études ont été réalisées dans les années 1990. Une étude plus récente réalisée au MexiqueNote de bas de page 34 a fait état d’un taux de détection au dépistage de 58,3 % chez les patientes atteintes du cancer du sein de tous âges. Ce taux plus élevé pourrait être en partie attribuable à une définition plus large du terme « cancer détecté au dépistage », soit un cancer diagnostiqué dans les 270 jours suivant une mammographie de dépistage bilatérale (des deux seins).
L’attente d’un diagnostic pouvant avoir des répercussions psychologiques importantes sur les patientes et leur entourage, la réduction des temps d’attente est susceptible de diminuer considérablement l’anxiétéNote de bas de page 6. Au Canada, on trouve peu de directives portant sur les temps d’attente pour un diagnostic de cancer du sein : les cibles temporelles relatives au dépistage du cancer du sein au moment de cette étude recommandaient un délai de résolution de 5 semaines pour 90 % des tests de dépistage anormaux, ou un délai d’au plus 7 semaines si une biopsie tissulaire avait été nécessaireNote de bas de page 9. En appliquant la limite plus souple de 7 semaines, nous avons observé que 68,3 % des patientes atteintes du cancer du sein dans notre étude avaient reçu leur diagnostic dans le délai de 7 semaines. Le taux que nous avons observé est semblable au taux de 64 % signalé en 2010 pour la résolution de tous les résultats anormaux aux tests de dépistage du cancer du sein ayant nécessité une biopsie tissulaire en OntarioNote de bas de page 30.
Dans notre étude, l’intervalle diagnostique médian pour le cancer du sein en Ontario en 2011 était de 4,6 semaines (32 jours), et 690 patientes (10 %) ont attendu 3,6 mois ou plus, un délai qui a été associé à un taux de survie inférieurNote de bas de page 8. La médiane que nous avons observée était plus courte que la médiane du délai entre le résultat anormal au dépistage et le diagnostic fondé sur une biopsie tissulaire déclarée pour les autres provinces canadiennes en 2010 (plage : 5 à 7 semaines)Note de bas de page 30. Ce fait s’explique probablement par les limites que nous avons imposées à notre population cancéreuse. Nous avons fait état de l’intervalle diagnostique séparément pour les patientes dont le cancer avait été détecté au dépistage et les patientes symptomatiques dans deux articles complémentairesNote de bas de page 14Note de bas de page 16, les délais médians étant de respectivement 29 jours et 34 jours. Nos observations diffèrent des constatations faites en Alberta, lesquelles font état d’une médiane de 19 jours pour les cas détectés au dépistage et de 21 jours pour les cas symptomatiques entre 2004 et 2010Note de bas de page 25.
En Ontario, nous avons observé des variations régionales importantes de l’intervalle diagnostique, avec un écart maximal de 2,4 semaines (17 jours) entre les RLISS. Les femmes habitant les régions desservies par les RLISS du Nord-Ouest, du Centre-Ouest et de Mississauga Halton ont dû attendre le plus longtemps, c’est-à-dire au-delà de 5 semaines. En 2011, le PODCS a révélé que ces régions étaient parmi celles qui avaient les taux d’atteinte des délais cibles (7 semaines pour les cas exigeant une biopsie tissulaire) les plus faiblesNote de bas de page 3. Les raisons qui expliquent ces faibles taux varient probablement entre ces trois RLISS, car ils sont très différents sur les plans géographique et démographique. Des études plus poussées seront nécessaires pour mieux comprendre ces différences.
Nous avons observé des variations plus grandes entre les comtés que dans l’analyse à l’échelle des RLISS, avec un écart maximal entre comtés de 7,1 semaines (50 jours), signe de variations probables à l’intérieur des RLISS. Comme nous l'avons constaté à l’échelle des RLISS, les intervalles diagnostiques les plus longs ont été observés dans la région la plus peuplée (région du Grand Toronto) et la région la moins peuplée (Nord de l’Ontario). Nous avons également observé des variations importantes entre comtés dans l’utilisation des services des UED. Le comté qui n’a pas utilisé les services des UED (0 %) a affiché l’intervalle diagnostique le plus long tant pour la médiane (65 jours) que pour le 75e percentile (108 jours), et le comté dans lequel 100 % des patientes ont utilisé les services des UED a affiché l’un des intervalles diagnostiques médians les plus courts (27 jours).
Nous avions déjà émis l’hypothèse selon laquelle la variation de l’intervalle diagnostique pourrait être en partie attribuable à la couverture variable offerte par les UED selon les régionsNote de bas de page 14Note de bas de page 15. Après ajustement des facteurs de confusion potentiels dans les analyses multivariées, nous avons constaté que l’utilisation des UED était associée à une réduction du délai avant diagnostic à la fois pour les cas détectés au dépistage et pour les patientes symptomatiquesNote de bas de page 14Note de bas de page 16. Il convient de souligner que d’autres facteurs régionaux comme les données démographiques des patientes, les processus d’aiguillage des soins et les programmes locaux pourraient avoir contribué à la variation observée, puisque les régions qui offrent une vaste couverture en matière d’UED ne sont pas toujours associées à des intervalles diagnostiques plus courts. L’Organisation mondiale de la santé a déterminé que les variations géographiques constituaient une préoccupation en matière de qualité des soins de santé dans deux dimensions : l’équité et l’accessibilitéNote de bas de page 35. Les causes des variations observées justifient donc un examen plus approfondi afin d’améliorer l’accès aux soins et l’équité des soins diagnostiques pour le cancer du sein.
Forces et limites
Cette étude a plusieurs points forts. Nous avons démontré la pertinence du recours à des données administratives de routine en santé pour comprendre le processus diagnostique du cancer du sein. Notre approche offre une référence méthodologique pour le choix de la méthode de détection du cancer du sein, de l’intervalle diagnostique et du recours à des unités d’évaluation diagnostique de la santé du sein spécialisées qui peut être adaptée à d'autre périodes en Ontario et à d’autres provinces canadiennes. Il s’agit de la première étude ontarienne à fournir des données probantes à l'échelle de la population quant au taux de détection au dépistage du cancer du sein, à l’intervalle diagnostique et au recours aux unités d’évaluation diagnostique. Ces renseignements sur l’ensemble de la population ont mis en lumière le faible taux de détection au dépistage (36 %) si l’on tient compte des patientes atteintes du cancer du sein de tout âge, et ils donnent une vue d’ensemble de l’expérience relative au cancer du sein en incluant les patientes qui se sont soumises à un dépistage opportuniste et celles qui ont consulté pour des symptômes, soit des groupes habituellement exclus des études portant sur le diagnostic du cancer du sein. Nos constatations fournissent ainsi une perspective originale à l'échelle de la population quant au rôle du dépistage pour la détection du cancer du sein, à l’accès aux UED et au délai nécessaire pour poser un diagnostic, des données utiles pour les politiques des programmes sur le cancer et les interventions ainsi que pour leur évaluation. Les variations géographiques observées fournissent des renseignements importants pour les administrateurs appelés à comparer les régions entre elles et à sélectionner les initiatives régionales concluantes pour qu'elles soient mises en œuvre à grande échelle. Ces renseignements pourraient en outre favoriser l’échange de connaissances et faciliter la collaboration entre les régions afin d’accélérer la prestation des soins et, à terme, améliorer l’expérience des patientes. La présence d’une aussi grande variation entre comtés constitue un élément à surveiller pour d’autres systèmes de soins de santé.
Notre étude comporte aussi certaines limites. Premièrement, nous n’avons pas estimé l’intervalle jusqu’au diagnostic ou l’intervalle jusqu’à la résolution pour toutes les patientes soumises à des examens pour le cancer du sein, mais nous avons plutôt mis l’accent sur le groupe de femmes ayant reçu un diagnostic de cancer du sein. Si les patientes soumises à des examens sont facilement identifiables dans le programme de dépistage, elles sont beaucoup plus difficiles à repérer dans les données administratives, données dont nous avons eu besoin pour inclure les patientes symptomatiques. Les données recueillies semblent indiquer que les femmes atteintes d’un cancer du sein envahissant obtiennent un diagnostic plus rapidement que les femmes atteintes de maladies bénignesNote de bas de page 36Note de bas de page 37, de sorte que les intervalles que nous signalons sont probablement plus courts que ceux associés aux femmes atteintes d’une forme bénigne de maladie, et ils s’appliquent donc seulement aux femmes atteintes de cancer du sein.
Deuxièmement, les bases de données administratives ne rendent pas compte des résultats, ce qui fait que quelques patientes parmi les 7,4 % ayant été répertoriées dans le groupe des dépistages opportunistes ont pu avoir une mammographie négative, ce qui a peut-être conduit à une surestimation de l’intervalle diagnostique et à leur classement erroné dans le groupe des patientes dont le cancer avait été détecté au dépistage. À l’inverse, une faible proportion de patientes apparemment symptomatiques pourraient avoir fait l’objet d’un dépistage opportuniste anormal plus de six mois avant le diagnostic, ce qui a pu conduire à une sous-estimation de leur intervalle diagnostique (et à leur classement erroné dans le groupe des patientes symptomatiques).
Troisièmement, le fait de définir la date d’inclusion pour les patientes symptomatiques comme étant la consultation plus récente d’un médecin de première ligne avant la première épreuve diagnostique constituait un choix prudent en ce qui a trait au calcul de l’intervalle diagnostique, puisque la date d’aiguillage réelle pourrait être survenue antérieurement.
Quatrièmement, de nouveaux codes de facturation pour les médecins, précisant le motif de la mammographie (symptomatique ou asymptomatique), ont été mis en œuvre le 1er octobre 2010 et n’avaient peut-être pas été entièrement adoptés au moment de la réalisation de notre étude. Par conséquent, certaines patientes soumises à un dépistage opportuniste pourraient avoir été répertoriées dans le mauvais groupe, ce qui peut avoir conduit à une sous-estimation de la proportion de patientes dont le cancer avait été détecté au dépistage. Nous supposons que l’incidence de ce dernier facteur a été faible, car la fréquence d’utilisation de ce nouveau code a considérablement augmenté dans les trois mois après sa mise en vigueur et s’était stabilisée au moment de la réalisation de notre étudeNote de bas de page 38.
Enfin, la détermination de l’utilisation des UED a pu faire l’objet d’un mauvais classement, la sensibilité étant évaluée à 90,1 % et la spécificité, à 84,6 %Note de bas de page 15.
Conclusion
Notre rapport fournit des renseignements sur l’accès au diagnostic chez les femmes qui recevront un diagnostic de cancer du sein. Chez les patientes atteintes de cancer du sein qui se situent dans le groupe d’âge admissible, nous avons observé des taux de détection au dépistage plus bas que les taux de participation au dépistage dans la population générale. Ce résultat donne à penser que les efforts de dépistage du cancer à venir devraient cibler les femmes dont le risque de cancer du sein est plus élevé et que le taux de cancers d’intervalle doit être amélioré. Nous avons également observé des variations géographiques importantes dans la durée de l’intervalle diagnostique et dans le recours aux UED. D’autres recherches sont nécessaires pour comprendre les facteurs attribuables à ces variations et pour cerner des possibilités d’amélioration du système. Enfin, les efforts à venir pour comprendre les délais d’attente pour un diagnostic ainsi que l’influence des programmes conçus pour les réduire doivent cibler l’ensemble de la population plutôt que seulement les programmes de dépistage organisés.
Remerciements
Les auteurs tiennent à remercier Mme Marlo Whitehead pour le jumelage et la préparation des données, le Dr Marcy Winget pour ses conseils sur la méthodologie, M. Peter Gozdyra pour son aide pour la cartographie et Mme Melissa Enmore pour son aide relativement à la diffusion du sondage. Cette recherche a été financée par une subvention des Instituts de recherche en santé du Canada. Li Jiang a reçu des bourses d’études supérieures de l’Ontario et de l’Université Queen’s. Certaines sections de cette étude sont fondées sur des données fournies par Action Cancer Ontario. Les opinions, résultats et conclusions qui s’en dégagent sont ceux des auteurs et ne reflètent pas nécessairement ceux d’Action Cancer Ontario. Il ne faut donc pas en déduire qu’ils ont été approuvés par Action Cancer Ontario. Certaines sections de cette étude sont fondées sur des données compilées et fournies par l’ICIS. Toutefois, les analyses et les conclusions présentées ainsi que les opinions et les déclarations contenues dans cet article sont celles des auteurs et ne reflètent pas nécessairement la position de l’ICIS. L’étude a aussi été appuyée par l’Institut de recherche en services de santé (IRSS), qui est financé par une subvention annuelle du ministère de la Santé et des Soins de longue durée de l’Ontario (MSSLDO). Les opinions, résultats et conclusions qui s’en dégagent sont ceux des auteurs et sont indépendants des sources de financement. Ils ne doivent donc pas être perçus comme approuvés par l’IRSS ou par le MSSLDO.
Conflits d’intérêts
Les auteurs déclarent n'avoir aucun conflit d’intérêts.
Contributions des auteurs et avis
Tous les auteurs ont contribué à la conception de l’étude, à l’interprétation des résultats et à la révision du manuscrit. Patti A. Groome a supervisé la méthodologie de recherche. Li Jang a réalisé l’analyse et a joué un rôle majeur dans la rédaction et la révision du manuscrit.
Le contenu de l'article et les points de vue qui y sont exprimés n'engagent que les auteurs et ne sont pas nécessairement représentatifs de la position du gouvernement du Canada.
Références
- Note de bas de page 1
-
Fletcher SW, Black W, Harris R, et al. Report of the International Workshop on Screening for Breast Cancer. JNCI. 1993;85(20):1644-1656.
- Note de bas de page 2
-
Partenariat canadien contre le cancer. Dépistage du cancer au Canada : aperçu de la participation au dépistage du cancer du sein, du col de l’utérus et colorectal [Internet]. Toronto (Ont.) : Partenariat canadien contre le cancer; 2015 [consultation le 15 juillet 2017]. En ligne à : http://www.cancerview.ca/fr/prevention_et_depistage/depistage_du_cancer_du_sein_au_canada/
- Note de bas de page 3
-
Cancer Care Ontario. Ontario Breast Screening Program 2011 report [Internet]. Toronto (Ont.) : Cancer Care Ontario; 2013. En ligne à : https://archive.cancercare.on.ca/common/pages/UserFile.aspx?fileId=288834
- Note de bas de page 4
-
Arndt V, Stürmer T, Stegmaier C, et al. Provider delay among patients with breast cancer in Germany: a population-based study. J Clin Oncol. 2003;21(8):1440-1446.
- Note de bas de page 5
-
Morse JM, Pooler C, Vann-Ward T, et al. Awaiting diagnosis of breast cancer: strategies of enduring for preserving self. Oncol Nurs Forum. 2014;41(4):350-359.
- Note de bas de page 6
-
Harcourt D, Rumsey N, Ambler N. Same-day diagnosis of symptomatic breast problems: psychological impact and coping strategies.
- Note de bas de page 7
-
Gilbert JE, Dobrow MJ, Kaan M, et al. Creation of a diagnostic wait times measurement framework based on evidence and consensus. J Oncol Pract. 2014;10(5):e373-e379.
- Note de bas de page 8
-
Richards MA, Westcombe AM, Love SB, et al. Influence of delay on survival in patients with breast cancer: a systematic review. Lancet. 1999;353(9159):1119-1126.
- Note de bas de page 9
-
Agence de la santé publique du Canada (ASPC). Lignes directrices pour la surveillance de la performance des programmes de dépistage du cancer du sein : rapport du Groupe de travail sur les indicateurs d’évaluation. Ottawa (Ont.) : ASPC; 2007. En ligne à : http://www.phac-aspc.gc.ca/publicat/2007/gmbspp-ldsppdcs/pdf/gmbspp-ldsppdcs_f.pdf
- Note de bas de page 10
-
Palmieri F, DePeri E, Mincey B, et al. Comprehensive diagnostic program for medically underserved women with abnormal breast screening evaluations in an urban population. Mayo Clin Proc. 2009;84(4):317-322.
- Note de bas de page 11
-
Dey P, Bundred N, Gibbs A, et al. Costs and benefits of a one stop clinic compared with a dedicated breast clinic: randomised controlled trial. BMJ. 2002;324(7336):507.
- Note de bas de page 12
-
Quan ML, Shumak RS, Majpruz V, et al. Improving work-up of abnormal mammogram through organized assessment: results from the Ontario Breast Screening Program. J Oncol Pract. 2012;8(2):107-112.
- Note de bas de page 13
-
Cancer Care Ontario. Ontario Breast Screening Program: Breast Assessment Initiative orientation. Toronto (Ont.) : Cancer Care Ontario; 2004.
- Note de bas de page 14
-
Jiang L, Gilbert J, Langley H, et al. Effect of specialized diagnostic assessment units on the time to diagnosis in screen-detected breast cancer patients. Br J Cancer. 2015;112(11):1744-1750.
- Note de bas de page 15
-
Jiang L. Association between use of a specialized diagnostic assessment unit and the diagnostic interval in Ontario breast cancer patients [Mémoire de maîtrise en ligne]. Kingston (Ont.) : Queen’s University; 2013. En ligne à : https://qspace.library.queensu.ca/jspui/bitstream/1974/8466/1/Jiang_Li_201311_MSc.pdf
- Note de bas de page 16
-
Jiang L, Gilbert J, Langley H, et al. Is being diagnosed at a dedicated breast assessment unit associated with a reduction in the time to diagnosis for symptomatic breast cancer patients? Eur J Cancer Care. 2018;27:e12864. doi: 10.1111/ecc.12864.
- Note de bas de page 17
-
Edge S, Byrd DR, Compton CC, et al (dir.). AJCC cancer staging manual. 7th edition. New York (NY) : Springer New York; 2009. 718 p.
- Note de bas de page 18
-
Sobin LH, Gospodarowicz MK, Wittekind C (dir.). TNM : classification des tumeurs malignes. 7e édition. Paris : Cassini; 2010.
- Note de bas de page 19
-
Partenariat canadien contre le cancer. Lignes directrices pour la surveillance de la performance des programmes de dépistage du cancer du sein : rapport du Groupe de travail sur les indicateurs d’évaluation. Troisième édition. [Internet]. Toronto (Ont.) : Partenariat canadien contre le cancer; 2013. En ligne à : https://content.cancerview.ca/download/cv/prevention_and_screening/screening_and_early_diagnosis/documents/guidelinemonitoringbreastfrpdf?attachment=0
- Note de bas de page 20
-
Singh H, De Coster C, Shu E, et al. Wait times from presentation to treatment for colorectal cancer: a population-based study. Can J Gastroenterol. 2010;24(1):33-39.
- Note de bas de page 21
-
Tonelli M, Connor Gorber S, Joffres M, et al. Recommendations on screening for breast cancer in average-risk women aged 40–74 years. CMAJ. 2011;183(17):1991-2001.
- Note de bas de page 22
-
Sawada M. Global spatial autocorrelation indices—Moran’s I, Geary’s C and the general cross-product statistic [Internet]. 2009 [consultation le 22 mars 2017]. En ligne à : http://www.lpc.uottawa.ca/publications/moransi/moran.htm
- Note de bas de page 23
-
Williams DL, Tortu S, Thomson J. Factors associated with delays to diagnosis and treatment of breast cancer in women in a Louisiana urban safety net hospital. Women Health. 2010;50(8):705-718.
- Note de bas de page 24
-
Yuan Y, Li M, Yang J, et al. Using administrative data to estimate time to breast cancer diagnosis and percent of screen-detected breast cancers — a validation study in Alberta, Canada. Eur J Cancer Care (Engl). 2015; 24(3):367-375.
- Note de bas de page 25
-
Yuan Y, Li M, Yang J, et al. Factors related to breast cancer detection mode and time to diagnosis in Alberta, Canada: a population-based retrospective cohort study. BMC Health Serv Res [Internet]. 2016;16:65. doi : 10.1186/s12913-016-1303-z.
- Note de bas de page 26
-
Olivotto IA, Bancej C, Goel V, et al. Waiting times from abnormal breast screen to diagnosis in 7 Canadian provinces. CMAJ. 2001;165(3):277-283.
- Note de bas de page 27
-
Cancer Care Ontario. Ontario Breast Screening Program 20th Anniversary Report 1990–2010 [Internet]. Toronto: Cancer Care Ontario; 2010. En ligne à : http://www.ontla.on.ca/library/repository/mon/25001/307022.pdf
- Note de bas de page 28
-
Hanson K, Montgomery P, Bakker D, et al. Factors influencing mammography participation in Canada: an integrative review of the literature. Curr Oncol. 2009;16(5):65-75.
- Note de bas de page 29
-
Kirsh VA, Chiarelli AM, Edwards SA, et al. Tumor characteristics associated with mammographic detection of breast cancer in the Ontario Breast Screening Program. J Natl Cancer Inst. 2011; 103(12):942-950.
- Note de bas de page 30
-
Partenariat canadien contre le cancer. Lutte contre le cancer du sein au Canada : rapport thématique spécial sur le rendement du système [Internet]. Toronto (Ont.) : Partenariat canadien contre le cancer; 2012. En ligne à : https://content.cancerview.ca/download/cv/quality_and_planning/system_performance/documents/breastcancercontrolrepfrpdf?attachment=0
- Note de bas de page 31
-
Alberta Health Services. Alberta Health Services: Q4 performance report 2012/13 [Internet]. Edmonton (Alberta) : Alberta Health Services; 2013. En ligne à : http://www.albertahealthservices.ca/Publications/ahs-pub-pr-2013-06-performance-report.pdf
- Note de bas de page 32
-
Reeves MJ, Newcomb PA, Remington PL, et al. Body mass and breast cancer: relationship between method of detection and stage of disease. Cancer. 1996;77(2):301-307.
- Note de bas de page 33
-
McPherson CP, Swenson KK, Jolitz G, et al. Survival of women ages 40-49 years with breast carcinoma according to method of detection. Cancer. 1997;79(10):1923-1932.
- Note de bas de page 34
-
Hill DA, Nibbe A, Royce ME, et al. Method of detection and breast cancer survival disparities in Hispanic women. Cancer Epidemiol Biomarkers Prev. 2010;19(10):2453-2460.
- Note de bas de page 35
-
World Health Organization. Quality of care: a process for making strategic choices in health systems. Genève (CH) : WHO Press; 2006.
- Note de bas de page 36
-
Borugian MJ, Kan L, Chu CC, et al. Facilitated “fast track” referral reduces time from abnormal screening mammogram to diagnosis. Can J Public Health. 2008;99(4):252-256.
- Note de bas de page 37
-
Chiarelli AM, Mai V, Halapy EE, et al. Effect of screening result on waiting times to assessment and breast cancer diagnosis: results from the Ontario Breast Screening Program. Can J Public Health. 2005;96(4):259-263.
- Note de bas de page 38
-
Institute for Clinical Evaluative Sciences. Fee codes descriptions and counts by year [Internet]. Toronto (Ont.) : Institute for Clinical Evaluative Sciences. 2011 [consultation le 30 septembre 2013].