Recherche quantitative originale – Le système de surveillance des anomalies congénitales de l’Alberta : compte rendu des données sur 40 ans avec prévalence et tendances de certaines anomalies congénitales entre 1997 et 2019

Accueil Revue PSPMC
Publié par : L'Agence de la santé publique du Canada
Date de publication : janvier 2023
ISSN: 2368-7398
Soumettre un article
À propos du PSPMC
Naviguer
Page précedente | Table des matières | Page suivante
R. Brian Lowry, M.D.Note de rattachement des auteurs 1Note de rattachement des auteurs 2Note de rattachement des auteurs 3; Tanya Bedard, M.S.P.Note de rattachement des auteurs 1; Xin Grevers, M.S.P.Note de rattachement des auteurs 1; Susan Crawford, M. Sc.Note de rattachement des auteurs 4; Steven C. Greenway, M.D.Note de rattachement des auteurs 3Note de rattachement des auteurs 5Note de rattachement des auteurs 6Note de rattachement des auteurs 7; Mary E. Brindle, M.D.Note de rattachement des auteurs 5Note de rattachement des auteurs 8; Harvey B. Sarnat, M.D.Note de rattachement des auteurs 3Note de rattachement des auteurs 9; A. Robertson Harrop, M.D.Note de rattachement des auteurs 5Note de rattachement des auteurs 10Note de rattachement des auteurs 11; Gerhard N. Kiefer, M.D.Note de rattachement des auteurs 11Note de rattachement des auteurs 12; Mary Ann Thomas, M.D.Note de rattachement des auteurs 1Note de rattachement des auteurs 2Note de rattachement des auteurs 3
https://doi.org/10.24095/hpcdp.43.1.04f
Cet article a fait l’objet d’une évaluation par les pairs.
Rattachement des auteurs
Correspondance
Dr R. Brian Lowry, Système de surveillance des anomalies congénitales de l’Alberta, Génétique clinique, Alberta Health Services, 28 Oki Drive NW, Calgary (Alberta) T3B 6A8; courriel : brian.lowry@ahs.ca; tél. : 403‑955‑7370
Citation proposée
Lowry RB, Bedard T, Grevers X, Crawford S, Greenway SC, Brindle ME, Sarnat HB, Harrop AR, Kiefer GN, Thomas MA. Le système de surveillance des anomalies congénitales de l’Alberta : compte rendu des données sur 40 ans avec prévalence et tendances de certaines anomalies congénitales entre 1997 et 2019. Promotion de la santé et prévention des maladies chroniques au Canada. 2023;43(1):42-51. https://doi.org/10.24095/hpcdp.43.1.04f
Résumé
Introduction. On manque de données provinciales ou territoriales à long terme publiées et actuelles sur les anomalies congénitales Au Canada. Cette étude fait état de la prévalence (pour 1000 naissances totales) et des tendances pour diverses anomalies congénitales de 1997 à 2019 en Alberta (Canada). Les facteurs de risque associés sont également abordés.
Méthodologie. Nous avons utilisé les données du Système de surveillance des anomalies congénitales de l’Alberta (ACASS) pour calculer la prévalence et effectuer des analyses de tendance linéaire par test du chi carré.
Résultats. Entre 1997 et 2019, la prévalence globale des anomalies du tube neural est demeurée stable, à 0,74 pour 1000 naissances totales. C’était également le cas pour le spina bifida (0,38), les fentes orofaciales (1,99), les cardiopathies congénitales graves (transposition des grandes artères, 0,38; tétralogie de Fallot, 0,33; hypoplasie du cœur gauche, 0,32) et le gastroschisis (0,38). L’anencéphalie, la fente palatine et les anomalies anorectales ont diminué significativement, avec une prévalence de respectivement 0,23, 0,75 et 0,54 pour 1000 naissances totales. Une tendance significativement à la hausse a été relevée pour l’anotie/microtie (0,24), les anomalies de raccourcissement des membres (0,73), l’omphalocèle (0,36) et le syndrome de Down (2,21), ainsi que pour l’hypospadias et la cryptorchidie (respectivement 4,68 et 5,29 pour 1 000 naissances masculines).
Conclusion. Les anomalies congénitales constituent un important problème de santé publique, qui est associé à des coûts sociaux et sociétaux substantiels. Les données de surveillance recueillies par l’ACASS sur plus de 40 ans peuvent servir à la planification et aux décisions en matière de politiques ainsi qu’à l’évaluation des stratégies de prévention. Les facteurs génétiques et environnementaux contributifs sont abordés, de même que la nécessité de poursuivre la surveillance et la recherche.
Mots-clés : anomalies congénitales, surveillance, prévalence, tendances, Alberta
Points saillants
- Le système de surveillance des anomalies congénitales de l’Alberta fournit la prévalence des anomalies et des tendances de 1997 à 2019 relevées dans les naissances vivantes, les mortinaissances et les interruptions de grossesse à moins de 20 semaines de gestation.
- La prévalence globale de chacune des affections suivantes est demeurée stable, sans tendance significative : anomalies du tube neural, spina bifida, fentes orofaciales, fente labiale avec ou sans fente palatine, cardiopathies congénitales graves et gastroschisis.
- L’anencéphalie, la fente palatine et les anomalies anorectales ont connu une tendance significativement à la baisse.
- Dans le cas de l’anotie/microtie, de la communication interventriculaire, de l’hypospadias, de la cryptorchidie, du raccourcissement des membres, de l’omphalocèle et du syndrome de Down, la tendance a été significativement à la hausse.
- Les facteurs de risque précis sont difficiles à maîtriser, ce qui confirme la nécessité de faire de la surveillance et de la recherche continues sur les anomalies congénitales une partie intégrante de la santé publique.
Introduction
La surveillance des anomalies congénitales en Alberta a débuté en 1963, à la suite des malformations causées par la thalidomide à la fin des années 1950. En plus de recueillir des données sur les anomalies congénitales structurales, ce système de surveillance a commencé à recenser tous les handicaps physiques et neurodéveloppementaux des enfants et à intégrer également des données provenant d’adultes. En 1979, le gouvernement de l’Alberta a limité la surveillance aux seules anomalies congénitales. En 1982, le gouvernement a décidé d’interrompre complètement la surveillance des anomalies congénitales, mais a accepté de transférer le système de surveillance au Département de génétique médicale de l’Alberta Children’s Hospital, sans transfert de fonds. Un financement a été obtenu par le biais de demandes de subvention jusqu’en 1994, date à laquelle le gouvernement a recommencé à financer ce système.
Le système de surveillance des anomalies congénitales de l’Alberta (Alberta Congenital Anomalies Surveillance System, ACASS) est un programme provincial qui recueille des données populationnelles depuis 1980. Au Canada, on dispose de peu de données nationales, provinciales ou territoriales à long terme publiées et actuelles sur les anomalies congénitales.
L’objectif de cet article est de présenter les taux de prévalence et les tendances de 1997 à 2019, calculés à l’aide des données de l’ACASS, pour les anomalies du tube neural, l’anotie/microtie, les fentes orofaciales, les anomalies anorectales, certaines cardiopathies congénitales en particulier, l’hypospadias, la cryptorchidie, les anomalies de raccourcissement des membres, le gastroschisis, l’omphalocèle et le syndrome de Down. Ces données permettent aux autres provinces et territoires du Canada ainsi qu’au Système canadien de surveillance des anomalies congénitales (SCSAC) de comparer les taux et les tendances.
L’ACASS est l’un des seuls systèmes de surveillance au Canada comportant des données sur les interruptions de grossesse à moins de 20 semaines de gestation, ce qui permet la détermination complète des cas et contribue à une meilleure estimation de la prévalence. Bien que l’inclusion de la détermination des cas d’interruption de grossesse dans les données du SCSAC ait été recommandée en 1997Note de bas de page 1, cette information n’est pas encore suffisamment incluse.
L’ACASS fournit également un contexte aux taux et aux tendances présentés, ce qui est nécessaire pour une interprétation valide. À l’heure actuelle, le SCSAC présente aussi des chiffres sans contexte par le biais de son Infobase de la santé publiqueNote de bas de page 2, et son dernier rapport complet, publié en 2013, contient des données jusqu’en 2009Note de bas de page 3.
Méthodologie
L’ACASS est, à la base, un système passif qui s’appuie sur les professionnels de la santé et les données administratives pour la détermination des cas, à l’opposé d’un système actif où du personnel de surveillance formé procède à l’extraction des données des cas. Néanmoins, il serait plus juste de le décrire comme un système actuellement hybride, puisqu’il comporte ces deux dimensions et que nous avons l’autorisation légale de consulter les dossiers médicaux des patients, dont les documents à l’appui (comme les rapports de consultation, d’intervention, de cytogénétique, d’imagerie diagnostique et de pathologie). Ainsi, nous pouvons vérifier ou préciser les diagnostics, incluant ceux qui sont posés après une interruption de grossesse à moins de 20 semaines de gestation. Les cas admissibles sont les patients nés en Alberta de mères résidant en Alberta au moment de l’accouchement. Les cas présentant des anomalies structurales, syndromiques, chromosomiques, néoplasiques, endocriniennes ou métaboliques sont vérifiés jusqu’à un an après l’accouchement. Les anomalies sont codées selon le système du Royal College of Paediatrics and Child Health (RCPCH), adapté de la 10e version de la Classification internationale des maladies (CIM-10). Seules certaines anomalies congénitales sont abordées dans cet article, mais il est possible de consulter ailleurs les données sur les autres anomaliesNote de bas de page 4.
Plusieurs sources de vérification sont utilisées (voir le tableau 1) pour inclure les naissances vivantes et les mortinaissances (> 20 semaines de gestation ou > 500 g) survenues depuis le 1er janvier 1980. Depuis le 1er janvier 1997, les données comprennent également les morts fœtales précoces et les interruptions de grossesse (< 20 semaines de gestation ou < 500 g), ce qui explique pourquoi cet article porte sur la période du 1er janvier 1997 au 31 décembre 2019.
| Bureau de l’état civil de l’Alberta | Déclaration de naissance par le médecin |
|---|---|
| Certificat médical de décès | |
| Certificat médical de mortinaissance | |
| Tous les hôpitaux de l’Alberta | Déclarations de cas du service des archives hospitalières de l’Alberta tirées du formulaire de déclaration des anomalies congénitales (Congenital Anomalies Reporting Form, CARF) |
| Alberta Children’s Hospital (Calgary) et Stollery Children’s Hospital (Edmonton) | |
| Sources de données spécialisées | Cliniques ambulatoires (données génétiques, prénatales, métaboliques, etc.) |
| Alberta Precision Laboratories (cytogénétique, dépistage métabolique des nouveau-nés, etc.) | |
| Laboratoires de pathologie de Calgary et d’Edmonton |
La méthodologie de l’ACASS a été décrite en détail ailleurs par Lowry et ses collaborateursNote de bas de page 4.
Les dénominateurs proviennent des données du bureau de l’état civil de l’Alberta. Nous avons calculé la prévalence en divisant le nombre de cas par le nombre total de naissances vivantes et de mortinaissances et, pour les cas d’hypospadias et de cryptorchidie, en divisant le nombre de cas par le nombre total de naissances vivantes et de mortinaissances de garçons, avec des intervalles de confiance à 95 %. Nous avons également effectué une analyse de tendance linéaire par test du chi carré.
Étant donné que le registre consulté fait partie du programme de surveillance de la santé publique de l’Alberta, qui est couvert par la loi provinciale, il n’a pas été nécessaire d’obtenir d’approbation en matière d’éthique de la part du ministère de la Santé de l’Alberta ou de l’Université de Calgary.
Résultats
Le tableau 2 illustre la prévalence des cas de diverses anomalies congénitales pour 1 000 naissances totales. Le taux global d’anomalies du tube neural est de 0,74 et celui des fentes orofaciales est de 1,99. Les cardiopathies congénitales les plus fréquentes sont les malformations septales (taux des communications interventriculaires [CIV] de 3,10 et taux des communications interauriculaires [CIA] de 2,01). Les taux de cardiopathies congénitales graves, soit l’hypoplasie du cœur gauche (0,32), la transposition des grandes artères (0,38) et la tétralogie de Fallot (0,33), sont comparables. Les taux de gastroschisis et d’omphalocèle sont similaires (respectivement 0,38 et 0,36). Le taux de syndrome de Down est de 2,21. La prévalence de l’hypospadias, pour 1 000 naissances masculines totales, est de 4,68, alors que celle de la cryptorchidie est de 5,29.
| Anomalie congénitale |
Code du RCPCH adapté de la CIM-10 |
Prévalence pour 1 000 naissances totalesNote de bas de page a (IC à 95 %) |
|---|---|---|
| Anomalies du tube neural (toutes) | Q00…, Q01…, Q05… | 0,74 (0,69 à 0,79) |
| Anencéphalie | Q00.00, Q00.01, Q00.1 | 0,23 (0,20 à 0,26) |
| Spina bifida | Q05… | 0,38 (0,35 à 0,42) |
| Anotie/microtie | Q16.0, Q17.2 | 0,24 (0,21 à 0,27) |
| Fentes orofaciales (toutes) | Q35…, Q36…, Q37… | 1,99 (1,91 à 2,08) |
| FLP | Q36…, Q37… | 1,23 (1,17 à 1,30) |
| Fente palatine seulement | Q35… | 0,75 (0,70 à 0,81) |
| Anomalies anorectales | Q42… | 0,54 (0,50 à 0,58) |
| Cardiopathies congénitales | ||
| Transposition des grandes artères | Q20.11, Q20.3, Q20.5 | 0,38 (0,34 à 0,42) |
| Tétralogie de Fallot | Q21.3…, Q21.82 | 0,33 (0,30 à 0,36) |
| CIV | Q21.0 | 3,10 (3,00 à 3,21) |
| CIAb | Q21.1… | 2,01 (1,93 à 2,10) |
| Hypoplasie du cœur gauche | Q23.4 | 0,32 (0,29 à 0,35) |
| HypospadiasNote de bas de page c | Q54… (à l’exclusion de Q54.4) | 4,68 (4,51 à 4,87) |
| CryptorchidieNote de bas de page bNote de bas de page c | Q53… | 5,29 (5,10 à 5,48) |
| Raccourcissement des membres | Q71…, Q72… | 0,73 (0,68 à 0,78) |
| Gastroschisis | Q79.3 | 0,38 (0,35 à 0,42) |
| Omphalocèle | Q79.2 | 0,36 (0,32 à 0,39) |
| Syndrome de Down | Q90… | 2,21 (2,12 à 2,30) |
Les résultats des analyses de tendance linéaire par test du chi carré pour la période 1997-2019 sont présentés dans le tableau 3. Bien qu’il n’y ait pas de tendance significative pour les anomalies du tube neural en général ou pour le spina bifida, une baisse significative est observable pour l’anencéphalie. Le taux de fente palatine est également en baisse, tandis que le taux de fente labiale avec ou sans fente palatine (FLP) et celui des fentes orofaciales en général ne montrent aucune variation significative. Le taux d’anomalies anorectales est en baisse significative. Bien que le taux de la plupart des cardiopathies congénitales sélectionnées ne présente aucune variation, le taux de CIV montre une hausse significative. Le taux d’hypospadias et le taux de cryptorchidie montrent une hausse significative, tout comme celui des anomalies de raccourcissement des membres. Le taux de gastroschisis s’est stabilisé, tandis que celui de l’omphalocèle est en augmentation significative, tout comme celui du syndrome de Down.
| Anomalie congénitale | Direction de la tendance | Analyse du chi carré (TL Χ2) | Valeur de p |
|---|---|---|---|
| Anomalies du tube neural (toutes) | Aucune variation significative | 3,58 | 0,0585 |
| Anencéphalie | En baisse | 7,00 | 0,0082 |
| Spina bifida | Aucune variation significative | 0,01 | 0,9203 |
| Anotie/microtie | En hausse | 5,67 | 0,0173 |
| Fentes orofaciales (toutes) | Aucune variation significative | 0,88 | 0,3482 |
| FLP | Aucune variation significative | 0,32 | 0,5716 |
| Fente palatine seulement | En baisse | 5,05 | 0,0246 |
| Anomalies anorectales | En baisse | 10,39 | 0,0013 |
| Cardiopathies congénitales | |||
| Transposition des grandes artères | Aucune variation significative | 1,14 | 0,2857 |
| Tétralogie de Fallot | Aucune variation significative | 0,90 | 0,3428 |
| CIV | En hausse | 4,79 | 0,0286 |
| CIANote de bas de page a | Aucune variation significative | 0,08 | 0,7773 |
| Hypoplasie du cœur gauche | Aucune variation significative | 2,26 | 0,1328 |
| Hypospadias | En hausse | 55,83 | < 0,0001 |
| CryptorchidieNote de bas de page a | En hausse | 14,22 | 0,0002 |
| Raccourcissement des membres | En hausse | 4,49 | 0,0341 |
| Gastroschisis | Aucune variation significative | 0,07 | 0,7913 |
| Omphalocèle | En hausse | 12,07 | 0,0005 |
| Syndrome de Down | En hausse | 23,54 | < 0,0001 |
Analyse
Anomalies du tube neural
Les anomalies du tube neural ne présentent aucune variation significative (p = 0,0585). Le taux de prévalence de l’anencéphalie a commencé à diminuer en 2016, baisse qui s’est poursuivie jusqu’en 2019. En revanche, le taux de spina bifida est demeuré stable.
Le taux d’anencéphalie est influencé par les interruptions très précoces de grossesse. Il peut également l’être par la terminologie utilisée pour décrire les résultats prénataux : par exemple, dans la classification RCPCH CIM-10, « absence de la voûte crânienne » relève de la catégorie du système musculo-squelettique (Q75.8) et non de l’anencéphalie/exencéphalie. Par conséquent, ces cas ne sont pas classés comme des anomalies du tube neural.
L’acrânie peut progresser vers l’exencéphalie et l’anencéphalieNote de bas de page 5. La méthode utilisée pour interrompre la grossesse empêche souvent l’établissement d’un diagnostic post mortem exact.
Les statistiques les plus récentes de l’Agence de la santé publique du Canada (ASPC), qui contiennent les données jusqu’en 2014, ne montrent aucune tendance pour les anomalies du tube neural Note de bas de page 2.
L’enrichissement en acide folique a été mis en œuvre au Canada en 1998 et a eu un effet important sur la prévalence des anomalies du tube neural. Néanmoins, il subsiste un nombre important de ces anomaliesNote de bas de page 6, qui peuvent être dues à un taux de folate dans les globules rouges inférieur à 906 nmol/l ainsi qu’à la nécessité de prendre des suppléments de vitamine B12Note de bas de page 7 ou d’inositolNote de bas de page 8. Les autres facteurs de risque sont l’obésité maternelle, le diabète et l’utilisation d’anticonvulsivants et d’antagonistes de l’acide foliqueNote de bas de page 9.
Anotie/microtie
La plupart des cliniciens et des programmes de surveillance classent l’anotie/microtie en quatre catégories, l’anotie de type 4 correspondant à la forme la plus grave alors que le type 1 décrit une oreille de taille réduite dont la structure est normale. Certaines études ne consignent que les types 2 à 4Note de bas de page 10, dont font partie la plupart des cas recensés par l’ACASS. Bien que le taux de ce type d’anomalie ait fortement chuté en 2019, l’ACASS surveille de près la tendance générale à la hausse significative, qui reste inexpliquée.
Les facteurs de risque sont le sexe masculin, le diabète et l’obésité chez la mère, l’origine hispanique, un âge maternel avancé, une parité élevée, une gestation multifœtale, des symptômes de rhume et des infections viralesNote de bas de page 10. Luquetti et ses collaborateurs ont synthétisé l’épidémiologie et la génétique de la microtie, en particulier les risques accrus associés à l’origine ethnique asiatique, insulaire du Pacifique, autochtone de l’Alaska ou autochtoneNote de bas de page 11. Le fait de vivre à une altitude supérieure à 2 000 m constitue un facteur de risque, mais qui ne s’applique pas à l’Alberta (Calgary est à 1 048 m et Edmonton à 645 m d’altitude). Les facteurs de risque qui ont été mentionnés sont le tabagisme et l’alcool chez la mère pour les cas non isolésNote de bas de page 10 et l’exposition à l’alcool pour les cas isolésNote de bas de page 11. Les tératogènes connus sont la thalidomide, l’isotrétinoïne et le mofétilmycophénolateNote de bas de page 11.
Fentes orofaciales
Le taux global de FLP est stable depuis plus de 40 ans en Alberta et depuis plus de 30 à 50 ans dans d’autres administrationsNote de bas de page 12. En revanche, la fente palatine offre une tendance à la baisse significative (voir le tableau 3). Une baisse a été signalée en Californie pour la FLP, mais pas pour la fente palatine (1987-2010), ce qui laisse penser que l’enrichissement en acide folique a pu jouer un rôle dans cette baisseNote de bas de page 13. Lowry et ses collaborateursNote de bas de page 14 ont comparé la période précédant la mise en œuvre de l’enrichissement en acide folique (1993-1997) à deux périodes ultérieures (2000-2004 et 2012-2016) en Alberta mais ils n’ont relevé aucune baisse du nombre total de cas de FLP ou du nombre de cas isolés au cours de ces trois périodes.
Une baisse de la prévalence des fentes orofaciales a été signalée en Ontario pour 1994 à 2017, en particulier pour les fentes palatines, mais sans inclure de données pour les mortinaissances et les interruptions de grossesseNote de bas de page 15. Les seules données nationales canadiennes publiées couvrent la période 2005-2014 et ne montrent aucune variation de tendance des FLP en général, mais une possible tendance à la baisse pour les fentes palatinesNote de bas de page 2.
Les facteurs de risque sont le tabagisme actif et passif, la consommation d’alcool, en particulier l’hyperalcoolisation rapide, ainsi que l’obésité maternelle. Les polymorphismes génétiques jouent également un rôleNote de bas de page 16Note de bas de page 17. Une méta-analyse d’études sur la prise de suppléments par la mère indique que l’apport périconceptionnel en acide folique et en multivitamines peut réduire l’occurrence ainsi que la récurrence des fentes orofacialesNote de bas de page 18. La communauté huttérite, dont la consommation de tabac et d’alcool est limitée et dont l’alimentation est probablement adéquate, n’a connu aucun cas de fente labiale avec fente palatine entre 1980 et 2016Note de bas de page 19.
Anomalies anorectales
La tendance générale est significativement à la baisse (p = 0,0013). Une étude de l’ACASS réalisée en 2007 pour la période 1990-2004 a fait état d’un taux stableNote de bas de page 20, qui se compare avantageusement aux résultats d’autres études portant sur la même période. La baisse actuelle concerne autant les cas d’anomalie isolée que les cas d’anomalie associée. Khanna et ses collaborateursNote de bas de page 21 ont étudié les facteurs génétiques contribuant à l’étiopathogenèse des cas isolés et ont déterminé que plusieurs nombres de copies variables ou variants mononucléotidiques contribuaient à l’anomalie. Des rapports ont fait état de l’existence de familles présentant un mode de transmission autosomique dominantNote de bas de page 21.
Les facteurs de risque sont le tabagisme maternel, un indice de masse corporelle (IMC) maternel supérieur à 30, le recours à la procréation assistée, des maladies respiratoires chroniques maternelles et l’utilisation maternelle de médicaments contre l’asthme, d’hypnotiques et de benzodiazépinesNote de bas de page 22. Zwink et JenetzkyNote de bas de page 22 ont fait état de résultats ambigus sur les effets protecteurs des suppléments d’acide folique.
Dans la même étude 22, les auteurs ont constaté que, dans la majorité des études de leur revue systématique, environ 60 % des cas présentaient une anomalie associée, contre 82 % des cas recensés par l’ACASS. Cette différence est à interpréter avec prudence, car les critères d’inclusion et la classification des cas utilisés sont différents. D’autres études incluent uniquement les cas survenus dans les naissances vivantes et les cas traités par réparation chirurgicale.
Cardiopathies congénitales
Les anomalies les plus graves ne montrent aucune tendance significative et présentent des taux de prévalence de cas similaires (pour 1 000 naissances totales : hypoplasie du cœur gauche = 0,32; tétralogie de Fallot = 0,33; transposition des grandes artères = 0,38). Öhman et ses collaborateursNote de bas de page 23 ont signalé une baisse des cas d’hypoplasie du cœur gauche dans les naissances vivantes en Suède, et laissent entendre que cette diminution serait due à une augmentation du dépistage prénatal et des interruptions de grossesse. Ces observations soulignent l’importance de la détermination des cas d’interruption de grossesse afin d’établir la prévalence avec exactitude.
Alors que la prévalence des CIA est restée stable entre 1997 et 2019 (p = 0,7773), celle des CIV a présenté une hausse statistiquement significative (p = 0,0286), probablement en raison de l’amélioration du diagnostic des petites anomalies septales induite par les progrès de l’échocardiographie. Toutefois, l’ACASS ne consigne pas les cas de persistance du foramen ovale, de CIA chez les bébés prématurés ou de CIA inférieure à 3 mm qui se referme spontanément. À l’inverse, l’ACASS consigne toutes les CIV, indépendamment de la taille, de la nécessité d’une intervention ou de la fermeture spontanée.
Bien que la plupart des cardiopathies congénitales soient multifactorielles, un diagnostic génétique a été porté dans 15,7 % des cas graves nécessitant une intervention chirurgicale ou thérapeutique au cours de la première année de vieNote de bas de page 24. Les cas d’aneuploïdie connue ont été exclusNote de bas de page 24. De nouvelles données probantes indiquent que les maladies monogéniques complexes se présentent souvent comme des cardiopathies congénitales isolées avant la naissance, étant donné qu’il n’est sans doute pas possible de procéder à un phénotypage completNote de bas de page 25. Au cours des deux dernières décennies, des variants génétiques ont été associés à des cardiopathies congénitales non syndromiques ou isolées, en particulier dans les cas impliquant des facteurs de transcription hautement conservés essentiels au développement cardiaque (comme les variants de GATA4 associés à la tétralogie de Fallot, à la CIA, à la CIV, à la communication auriculo-ventriculaire et à la sténose pulmonaire)Note de bas de page 26.
Les facteurs de risque mentionnés pour les cardiopathies congénitales sont les tératogènes (en particulier thalidomide, isotrétinoïne, anticonvulsivants, inhibiteurs des canaux potassiques, lithium, alcool), les carences alimentaires (dont la vitamine A et la vitamine B3) et les affections maternelles (diabète, obésité, phénylcétonurie, infections virales et hyperthermie)Note de bas de page 27. Dolk et ses collaborateursNote de bas de page 28 ont signalé des associations significatives avec le faible niveau de scolarité de la mère, des infections vaginales, des coagulopathies maternelles et la prescription du médicament anticoagulant énoxaparine. Étant donné le manque de données probantes à l’appui de l’association avec l’énoxaparine, d’autres études de recherche sont nécessaires pour confirmer le risque accru relevé. Bien que les données n’aient pas validé l’effet protecteur des suppléments d’acide folique, le risque était significativement accru chez les mères ayant une alimentation particulièrement faible en fruits et légumes, ce qui souligne la nécessité de tenir compte de l’ensemble du contexte alimentaireNote de bas de page 28.
Une association entre les anomalies placentaires (comme un faible poids placentaire ou une altération de l’expression génique dans le tissu placentaire) et les cardiopathies congénitales a également été relevéeNote de bas de page 29. Un cadre plus complet a été proposé, comprenant l’exposome, un domaine émergent qui examine le pendant environnemental du génomeNote de bas de page 30. Au lieu de recourir à une démarche cloisonnée, il faudrait privilégier l’analyse des interactions entre les expositions environnementales prénatales internes et externes qui influencent la vascularisation placentaire et la croissance et le développement fœtaux subséquentsNote de bas de page 30.
Hypospadias
La prévalence des cas d’hypospadias, autant isolé que non isolé, a atteint un sommet en 2015 et montre une augmentation globale significative (p < 0,0001) pour la période 1997-2019. Il est difficile de comparer les taux de prévalence en raison de différences méthodologiques telles que des différences dans le degré de gravité, l’inclusion uniquement des cas traités par chirurgie ou le fait que le taux soit calculé en fonction soit des naissances totales, soit des naissances masculines. Le rapport EUROCAT a montré une grande variabilité de la prévalence, de 0,51 pour 1 000 au Portugal à 3,68 pour 1 000 à Mayence (Allemagne)Note de bas de page 31.
George et ses collaborateursNote de bas de page 32 ont décrit les défis liés à l’utilisation d’associations pour déterminer la cause de l’hypospadias et ont résumé les facteurs génétiques et environnementaux qui y sont associés. Les facteurs de risque invariablement associés sont des antécédents familiaux positifs, un faible poids à la naissance ou un jeune âge gestationnel, une hypertension maternelle, la prééclampsie, des grossesses multiples, une insuffisance placentaire, le diabète et l’exposition à certains médicaments comme les dérivés de la progestérone ou l’acide valproïque. Les données probantes ne sont pas cohérentes pour les facteurs de risque tels que l’âge et le poids de la mère, l’emploi du père ou de la mère et les pratiques agricoles.
Certains variants génétiques, comme les variants du gène de la diacylglycérol kinase kappa (DGKK), ont été déterminés comme des facteurs de risque importantsNote de bas de page 33. En Californie, les cas porteurs d’un variant du gène DGKK et les cas résidant à proximité de zones d’application de pesticides présentaient les rapports de cotes les plus élevés pour l’hypospadiasNote de bas de page 34. En Nouvelle-Écosse, les taux de prévalence de l’hypospadias les plus élevés ont été relevés dans deux comtés associés à une agriculture intensiveNote de bas de page 35. La prévalence des cas d’hypospadias isolé dans la communauté huttérienne est environ le double de celle de la population générale de l’Alberta, une augmentation en lien avec l’agriculture et les pratiques agricolesNote de bas de page 19.
Cryptorchidie
Bien qu’une forte baisse du taux de cryptorchidie ait été observée en 2019, la tendance entre 1997 et 2019 est une hausse significative (p = 0,0002). Ces résultats doivent être interprétés avec prudence, car cette affection peut soit se résoudre spontanément, soit s’avérer correspondre à des testicules rétractiles. Pour déterminer la prévalence avec exactitude, il faudrait savoir quels cas, chez des bébés nés à terme et de poids normal à la naissance, ont été traités par orchidopexie. Les chiffres concernant les interventions chirurgicales incluent parfois les bébés prématurés et les bébés de faible poids à la naissance, d’où la difficulté à obtenir un taux de prévalence réelle.
L’ACASS ne consigne pas les cas chez les bébés nés avant 37 semaines de gestation ou dont le poids à la naissance est inférieur à 2 500 g, considérant plutôt ces cas comme physiologiques et causés par l’immaturité.
Bien que la cause soit probablement multifactorielle, il existe certains cas familiaux ainsi que plusieurs gènes de susceptibilitéNote de bas de page 36. Les facteurs de risque invariablement associés sont le tabagisme et le diabète chez la mère, alors que l’obésité maternelle, la consommation d’alcool, l’utilisation d’analgésiques et l’exposition à des substances chimiques perturbant le système endocrinien, comme les pesticides agricoles, ne sont pas systématiquement signalées comme étant des facteurs de risqueNote de bas de page 37. Aucune différence n’a été signalée entre la prévalence de la cryptorchidie au sein de la population huttérienne et au sein de la population générale de l’AlbertaNote de bas de page 19.
Raccourcissement des membres
Depuis 1980, les taux ont fluctuéNote de bas de page 38, avec une hausse significative (p = 0,0341) pour la période 1997-2019. Comme un cas peut présenter plusieurs anomalies de raccourcissement des membres, nous indiquons à la fois le taux d’anomalies et le taux de cas. Notre taux de 0,73 pour 1 000 naissances totales est comparable à celui d’études menées par exemple dans le nord des Pays-Bas (0,64/1 000 pour la période 1981-2017), mais pour lequel les auteurs n’ont pas fait état d’une tendanceNote de bas de page 39.
Les résultats d’études sur l’acide folique, avec ou sans suppléments, montrant une réduction du risque de raccourcissement des membres sont équivoquesNote de bas de page 40, mais il apparaît clairement que l’enrichissement en acide folique n’a eu aucun effet en Alberta. Dans la plupart des cas, la cause exacte est inconnue. Bergman et ses collaborateursNote de bas de page 39 ont constaté récemment qu’il était plus probable qu’un facteur causal soit déterminé dans le cas où plus d’un membre est touché ou dans le cas d’anomalies congénitales multiples comprenant un membre touché, comparativement aux cas présentant un seul membre touché et aucune autre anomalie congénitale. Les facteurs de risque sont le tabagisme maternel, le diabète prégestationnel, l’hypertension gestationnelle, un âge maternel inférieur à 25 ans, une infection des voies respiratoires supérieures au premier trimestre, la prise de médicaments antiépileptiques et un niveau de scolarité peu élevé des parentsNote de bas de page 41.
Gastroschisis
Une hausse de la prévalence du gastroschisis a été observée au début des années 1970 dans de nombreuses administrations. En Alberta, la prévalence est passée de 0,15 à 0,57 pour 1 000 naissances totales entre 1980 et 2011. Par la suite, le taux a diminué chaque année et est maintenant stabilisé (figure 1), ce qui coïncide avec une baisse du nombre de grossesses chez les adolescentes (mères de moins de 20 ans) (figure 2). Le jeune âge maternel est en effet un facteur de risque connu et le pourcentage de mères de moins de 20 ans en Alberta est passé de 7,3 % en 2000 à 1,8 % en 2019Note de bas de page 4.
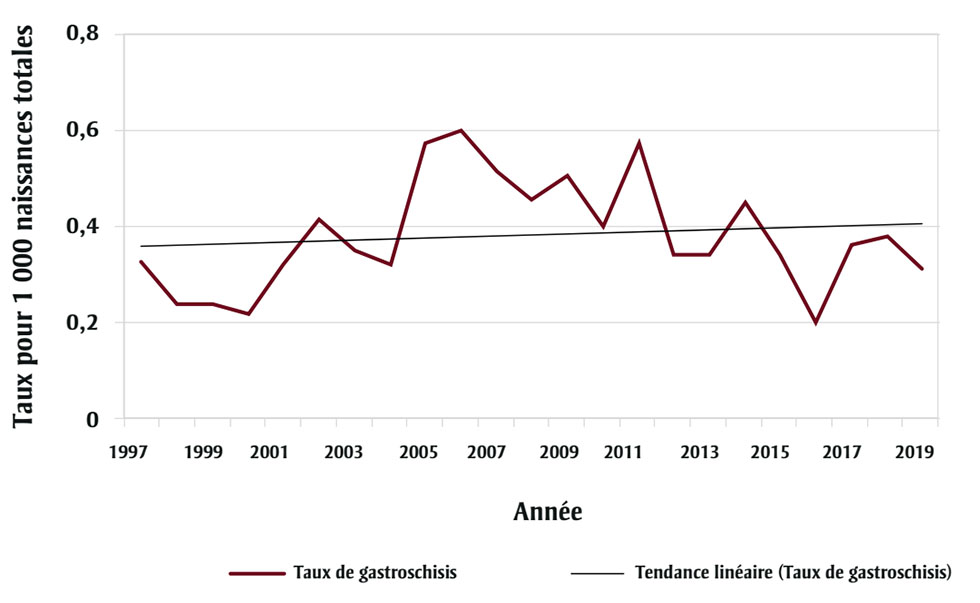
Figure 1 - Équivalent textuel
| Année | Taux pour 1 000 naissances totales |
|---|---|
| 1997 | 0,33 |
| 1998 | 0,24 |
| 1999 | 0,24 |
| 2000 | 0,22 |
| 2001 | 0,32 |
| 2002 | 0,42 |
| 2003 | 0,35 |
| 2004 | 0,32 |
| 2005 | 0,57 |
| 2006 | 0,60 |
| 2007 | 0,51 |
| 2008 | 0,46 |
| 2009 | 0,51 |
| 2010 | 0,40 |
| 2011 | 0,57 |
| 2012 | 0,34 |
| 2013 | 0,34 |
| 2014 | 0,45 |
| 2015 | 0,34 |
| 2016 | 0,20 |
| 2017 | 0,36 |
| 2018 | 0,38 |
| 2019 | 0,31 |
* p = 0,7913.
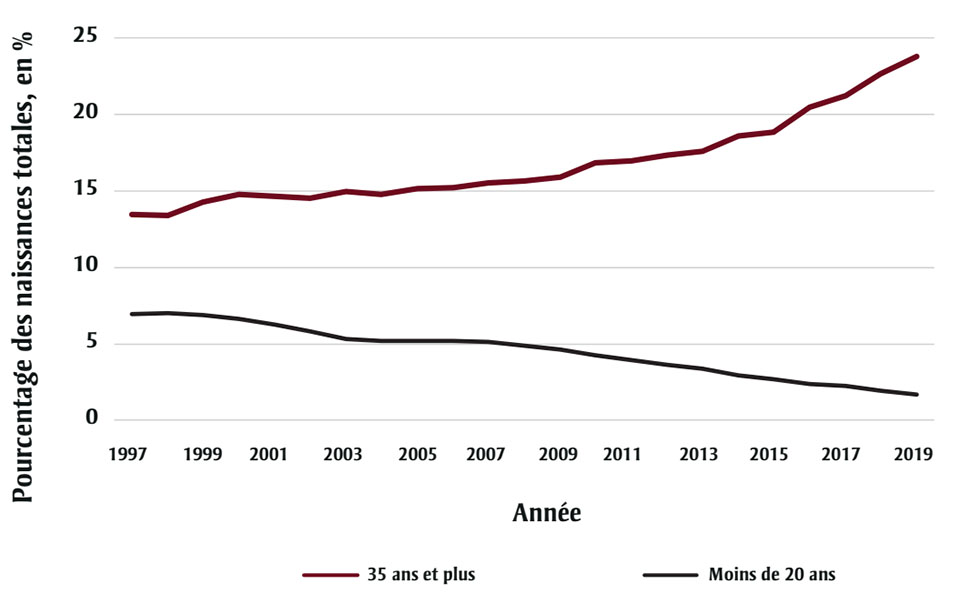
Figure 2 - Équivalent textuel
| Année | Pourcentage des naissances totales, en %, femmes de 35 ans ou plus |
Pourcentage des naissances totales, en %, femmes moins de 20 ans |
|---|---|---|
| 1997 | 13,48 | 6,97 |
| 1998 | 13,36 | 7,00 |
| 1999 | 14,27 | 6,89 |
| 2000 | 14,74 | 6,66 |
| 2001 | 14,63 | 6,23 |
| 2002 | 14,54 | 5,81 |
| 2003 | 14,94 | 5,35 |
| 2004 | 14,78 | 5,21 |
| 2005 | 15,16 | 5,18 |
| 2006 | 15,23 | 5,17 |
| 2007 | 15,54 | 5,14 |
| 2008 | 15,67 | 4,87 |
| 2009 | 15,87 | 4,63 |
| 2010 | 16,82 | 4,25 |
| 2011 | 16,94 | 3,91 |
| 2012 | 17,33 | 3,62 |
| 2013 | 17,60 | 3,39 |
| 2014 | 18,60 | 2,92 |
| 2015 | 18,86 | 2,67 |
| 2016 | 20,46 | 2,37 |
| 2017 | 21,20 | 2,24 |
| 2018 | 22,69 | 1,93 |
| 2019 | 23,79 | 1,69 |
Une étude canadienne récente, réalisée à l’aide des données de 2006 à 2017, a révélé des résultats similaires à ceux de l’ACASS pour la tendance et une diminution du nombre de mères de moins de 20 ansNote de bas de page 42. Cependant, la méthode de classification Nord-Sud utilisée par les auteurs et leur interprétation de l’existence d’une variation géographique sont problématiquesNote de bas de page 42. Une étude menée en Ontario (2012-2018) n’a révélé aucune tendanceNote de bas de page 43. Aucune de ces deux études n’incluait les morts fœtales précoces ou les interruptions de grossesseNote de bas de page 42Note de bas de page 43.
Les autres facteurs sociaux de risque sont le tabagisme maternel, la consommation de marijuana, de drogues illicites et d’alcool, un IMC faible, une mauvaise alimentation et un statut socio-économique défavorableNote de bas de page 43. Il y a moins d’exposition à bon nombre de ces facteurs de risque dans la population huttérienne, où aucun cas de gastroschisis n’a été signalé entre 1980 et 2016Note de bas de page 19. On a récemment établi comme facteur de risque l’exposition aux feux de forêt avant la grossesse et au cours du premier trimestre de gestationNote de bas de page 44.
Bien que le gastroschisis soit habituellement une anomalie isolée, 28 % des cas recensés par l’ACASS (données non présentées) présentaient une anomalie concomitante, des résultats similaires à ceux d’une étude réalisée en SuèdeNote de bas de page 45, mais aucune des deux études canadiennes récentes n’a fourni de données à ce sujetNote de bas de page 42Note de bas de page 43. Bien que les cas de gastroschisis soient habituellement sporadiques, il y a des rapports de transmission familiale, en particulier de parent à enfant, chez des frères et sœurs germains, chez des demi-frères et demi-sœurs et dans la parenté éloignéeNote de bas de page 46. Des études géospatiales ont signalé des différences et des grappes provinciales et fait état de différences entre les régions urbaines et rurales en OntarioNote de bas de page 43.
Omphalocèle
Des taux de prévalence comparables d’omphalocèle pour 1 000 naissances totales ont été relevés dans plusieurs administrations malgré les différentes années d’étude : 0,31 pour 1997-2016Note de bas de page 47, 0,47 pour 1993-2014Note de bas de page 48 et 0,38 pour 2005-2011Note de bas de page 49. La tendance pour les naissances vivantesNote de bas de page 47Note de bas de page 48 ou pour les naissances totalesNote de bas de page 49 n’a pas été mentionnée, mais les données de l’ACASS indiquent une tendance significativement à la hausse pour la période 1997-2019 (p = 0,005) (figure 3).
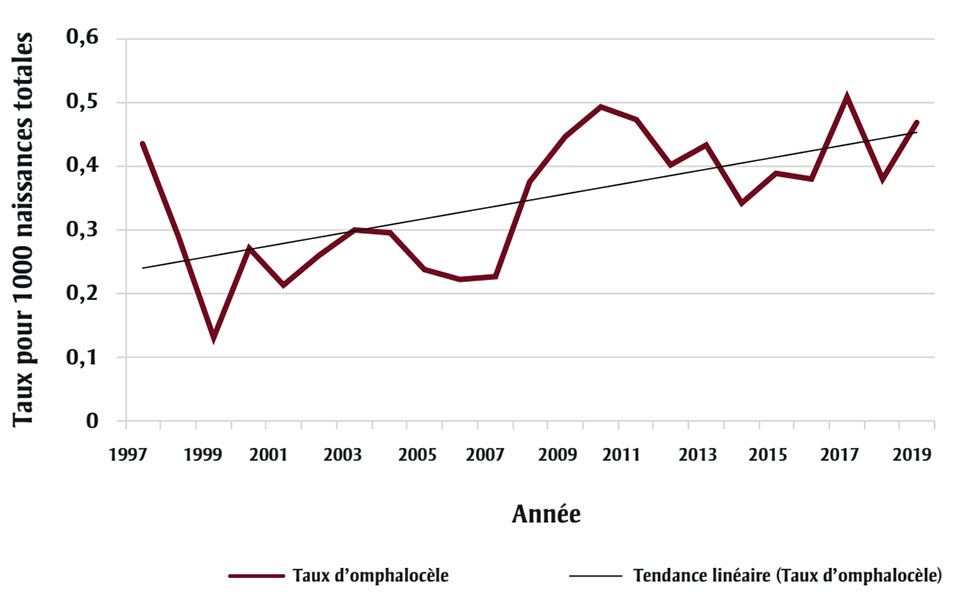
Figure 3 - Équivalent textuel
| Année | Rate per 1000 total births |
|---|---|
| 1997 | 0,43 |
| 1998 | 0,29 |
| 1999 | 0,13 |
| 2000 | 0,27 |
| 2001 | 0,21 |
| 2002 | 0,26 |
| 2003 | 0,30 |
| 2004 | 0,30 |
| 2005 | 0,24 |
| 2006 | 0,22 |
| 2007 | 0,23 |
| 2008 | 0,38 |
| 2009 | 0,45 |
| 2010 | 0,49 |
| 2011 | 0,47 |
| 2012 | 0,40 |
| 2013 | 0,43 |
| 2014 | 0,34 |
| 2015 | 0,39 |
| 2016 | 0,38 |
| 2017 | 0,51 |
| 2018 | 0,38 |
| 2019 | 0,47 |
* p = 0,0005.
Des anomalies associées, en particulier une malformation dans un autre système organique ainsi que des anomalies et syndromes chromosomiques, sont présentes dans 78 % des cas consignés par l’ACASS. Outre une trisomie 18 très fréquente, une grande variété de caryotypes anormaux a été mentionnée.
Les facteurs de risque sont un âge maternel supérieur à 35 ans ou inférieur à 20 ans, l’obésité maternelle et le diabète. Les données sur les risques liés à l’exposition au tabagisme et à l’alcool ne sont pas concluantesNote de bas de page 50. Une étude récente a établi un lien entre le traitement à la pénicilline à large spectre au cours du premier trimestre et un risque réduitNote de bas de page 51.
Syndrome de Down
Le syndrome de Down est significativement en hausse (p < 0,0001) et présente une forte corrélation avec l’augmentation de l’âge maternel. En 1983, environ 4 % des mères étaient âgées de 35 ans ou plus; en 2019, 24 % des mères appartenaient à ce groupe d’âgeNote de bas de page 4.
Les malformations majeures fréquemment associées sont les cardiopathies congénitales et l’atrésie duodénale. Comme la plupart des bébés nés vivants atteints de trisomie 21 ont besoin de services de santé de longue durée, la détermination des anomalies associées peut aider à la planification des soins de santé à venir.
Points forts et limites
Les points forts de cette étude relèvent des caractéristiques principales de l’ACASS et proviennent de l’existence de données de référence à long terme, qui sont fondamentales pour produire des études descriptives et analytiques valides. Parmi les autres caractéristiques, mentionnons une analyse de population à l’échelle provinciale, des sources multiples de détermination des cas, la capacité d’évaluer de façon critique les déclarations et de vérifier les diagnostics signalés au système ainsi que l’expertise du personnel de l’ACASS.
Une limite est que l’ACASS est techniquement un système « passif », bien qu’il soit enrichi par des éléments actifs, tels que l’accès aux dossiers hospitaliers et la correspondance avec les médecins traitants pour vérification. Comme l’ACASS dépend principalement de personnes externes pour la déclaration des cas, cette dernière peut s’avérer incomplète. Les meilleurs systèmes, utilisés dans de nombreux États américains (comme le Texas et l’Utah) et pays d’Europe et d’Amérique du Sud, ont recours à une détermination « active ».
Conclusion
Des anomalies congénitales surviennent dans environ 3 à 5 % des naissances vivantes et 15 % des mortinaissances. Elles constituent une préoccupation de santé publique importante et ont des coûts sociaux et sociétaux importants. La plupart des anomalies congénitales sont multifactorielles et sont liées à des facteurs de risque établis qui exigent souvent un changement de comportement difficile à réaliser (comme l’abandon du tabac et de l’alcool, un meilleur contrôle de l’obésité et du diabète chez la mère, la prise de supplément d’acide folique ou de multivitamines et une meilleure alimentation).
Les données de surveillance des anomalies congénitales sont utilisables pour la planification et les décisions en matière de politiques ainsi que pour l’évaluation des stratégies de prévention, comme en témoigne le succès de l’enrichissement en acide folique dans la prévention des anomalies du tube neural. Ces données sont également nécessaires pour répondre aux nouvelles menaces réelles et potentielles telles que le virus Zika et la découverte du syndrome associé à l’infection congénitale à virus Zika. De nombreux programmes de surveillance des anomalies congénitales consignent désormais les résultats de l’infection au virus de la COVID-19 pendant la grossesse.
Bien que le financement soit souvent difficile à obtenir et à conserver au Canada, l’ASPC travaille avec les provinces et les territoires pour améliorer les données du SCSAC en y ajoutant davantage d’ensembles de données locaux, ce qui permettra d’améliorer l’exactitude des taux de prévalence des anomalies congénitales pour les différentes régions du Canada. Le dernier rapport complet sur les anomalies congénitales publié par l’ASPC portait sur les données de l’Institut canadien d’information sur la santé pour la période 1998-2009Note de bas de page 3. Le registre sur l’état de santé de la Colombie-Britannique a été un système de surveillance des anomalies congénitales de classe mondiale mais, après 70 ans d’existence, les données ont été archivées en 2021. Le dernier rapport de ce registre, publié en 2005, a porté sur les données recueillies jusqu’en 2002.
En fonction depuis plus de 40 ans, l’ACASS possède la plus grande quantité de données publiées sur la prévalence au Canada et fournit un contexte apte à favoriser un degré accru de prévention. La surveillance des anomalies congénitales constitue une source de données essentielle pour poursuivre la recherche et orienter les mesures en santé publiqueNote de bas de page 52.
Remerciements
Nous tenons à reconnaître que notre travail est effectué sur des terres autochtones historiques et contemporaines, dont les territoires visés par les traités 6, 7 et 8 et le territoire ancestral des Métis. Nous reconnaissons également les nombreuses collectivités autochtones établies dans les centres urbains de l’Alberta.
Le système de surveillance des anomalies congénitales de l’Alberta (ACASS) reçoit du financement d’Alberta Health Services. Nous sommes reconnaissants de recevoir ce soutien et de faire partie du Programme de génétique clinique et métabolique. Nous remercions le ministère de la Santé de l’Alberta et le bureau de l’état civil de l’Alberta de nous fournir de façon continue les documents de déclaration des anomalies congénitales et les données sur les dénominateurs. Notre succès dépend de l’intérêt et des activités du personnel des archives médicales des hôpitaux, des professionnels paramédicaux, du personnel infirmier et des médecins.
L’ACASS tient également à remercier Caroline Kokorudz pour son aide à la recherche bibliographique et Esteban Soriano pour son soutien administratif à la préparation de cet article.
Conflits d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts.
Contributions des auteurs et avis
RBL : rédaction de la première version du manuscrit. RBL, TB : conception de la recherche. RBL, TB, XG, SC, MAT : gestion et analyse des données.
Tous les auteurs ont revu le contenu intellectuel pertinent et important du manuscrit, ont revu le manuscrit de travail et en ont approuvé la version finale.
Le contenu de cet article et les points de vue qui y sont exprimés n’engagent que les auteurs; ils ne correspondent pas nécessairement à ceux du gouvernement du Canada.
