Lignes directrices du RLSPC relatives à l’étude microbiologique de l’émergence d’infections respiratoires

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L’Agence de la santé publique du Canada
Numéro : Volume 46–6 : Intelligence artificielle en santé publique
Date de publication : 4 juin 2020
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 46–6, le 4 juin 2020 : Intelligence artificielle en santé publique
Lignes directrices
Protocole du Réseau de laboratoires de santé publique du Canada pour les enquêtes microbiologiques sur les nouveaux agents pathogènes respiratoires, notamment les infections respiratoires aiguës graves
Groupe de travail sur les infections virales respiratoires1
Affiliation
1 Réseau de laboratoires de santé publique du Canada, Winnipeg, MB
Correspondance
Citation proposée
Groupe de travail sur les infections virales respiratoires. Protocole du Réseau de laboratoires de santé publique du Canada pour les enquêtes microbiologiques sur les nouveaux agents pathogènes respiratoires, notamment les infections respiratoires aiguës graves. Relevé des maladies transmissibles au Canada 2020;46(6):232–6. https://doi.org/10.14745/ccdr.v46i06a09f
Mots-clés : protocole, COVID-19, pathogènes respiratoires émergents, IRAS, Canada, RLSPC
Introduction
Un protocole pour les infections respiratoires aiguës graves (IRAS) a été élaboré initialement en réponse à l’éclosion du syndrome respiratoire aigu sévère (SARS) de 2003Note de bas de page 1. L’utilisation prévue du protocole était de faciliter le diagnostic d’infections respiratoires nouvelles et émergentes, notamment les IRAS, en raison de pathogènes respiratoires inconnus et connus qui pourraient entraîner des épidémies à grande échelle. Dans le cas du coronavirus du syndrome respiratoire du Moyen-Orient (MERS-CoV) et du virus de l’influenza A (H7N9), un facteur clé du diagnostic est la détermination du risque en fonction de facteurs épidémiologiques qui, à leur tour, sont liés à l’exposition dans un « secteur préoccupant ». Avec le coronavirus 2 (SARS-CoV-2), syndrome respiratoire aigu sévère plus transmissible, la cause de la pandémie du coronavirus 2019 (COVID-19), les lignes directrices en matière de dépistage ont changé à mesure que la pandémie s’est répandue. Au départ, les tests étaient axés sur les personnes présentant des facteurs de risque liés aux voyages; puis la portée des tests a augmenté une fois qu’un plus grand nombre de cas ont été signalés (au Canada). Cette évaluation initiale des risques doit être effectuée de concert avec le ministère de la Santé local. Les signaux d’infections respiratoires nouvelles et émergentes, notamment les alertes d’IRAS, devraient inciter les cliniciens à « réfléchir, déclarer et tester » :
- Réfléchir à la possibilité d’une infection respiratoire émergente (e.g. nouveau virus de l’influenza A)
- Déclarer le cas au médecin hygiéniste local ou au responsable local de la santé publique; aviser le laboratoire local et le laboratoire provincial de santé publique (LPSP) du soupçon d’un nouvel agent pathogène
- Tester pour le dépistage des agents pathogènes fondé sur les symptômes cliniques et seulement après une consultation appropriée
Protocole de laboratoire
Quand procéder au test
De nombreux facteurs épidémiologiques influent les directives sur le moment de procéder à des tests de dépistage de pathogènes nouveaux ou émergents. Au moment de l’apparition d’un nouvel agent pathogène, avant l’infection humaine généralisée, la probabilité qu’une IRAS soit due à un nouvel agent pathogène est extrêmement faible. Par conséquent, chez les patients qui n’ont aucun facteur de risque épidémiologique, les agents pathogènes les plus courants devraient être écartés avant d’envisager un agent pathogène nouveau, inhabituel ou plus virulent. Lorsque des facteurs de risque appropriés existent, les nouveaux agents pathogènes doivent être exclus, qu’un autre agent pathogène soit détecté ou non, car les co-infections virales ont été bien documentées avec de nouveaux agents pathogènes respiratoires viraux (e.g. MERS-CoV, influenza A (H7N9) et SARS-CoV-2) (figure 1).
Figure 1 : Protocole de laboratoire
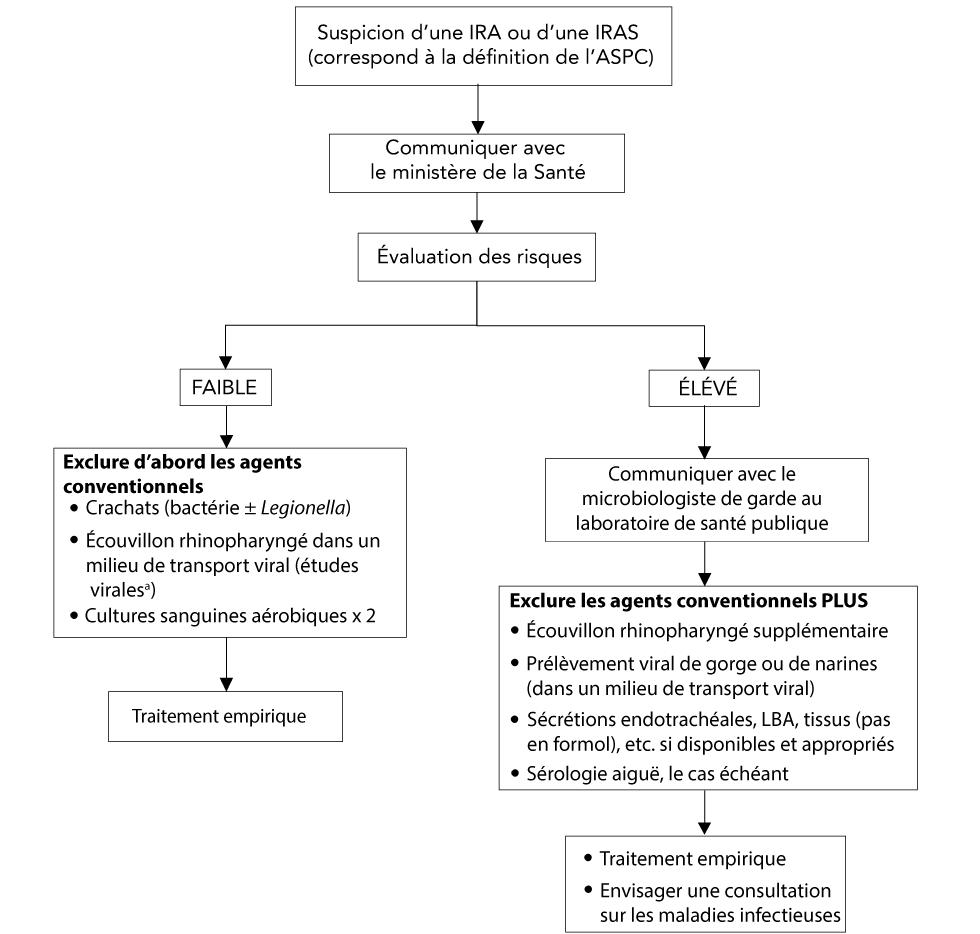
Description textuelle : Figure 1
Figure 1 : Protocole de laboratoire
La figure 1 présente un organigramme des protocoles de laboratoire pour les cas suspectés d’infection respiratoire aiguë (IRA) et d’infection respiratoire aiguë sévères (IRAS). Lorsqu’une nouvelle IRA ou une IRAS présumée a été identifiée sur la base de la définition de l’Agence de santé publique du Canada (ASPC), la première étape consiste à contacter le ministère de la Santé. Ensuite, on procède à une évaluation des risques. Si le risque est faible, l’étape suivante consiste à exclure les agents conventionnels. Pour ce faire, on teste les expectorations (bactérie Legionella), on effectue un prélèvement par écouvillons rhinopharyngés dans les milieux de transport viral et on effectue deux cultures sanguines aérobiques. Lorsque vous effectuez un prélèvement rhinopharyngé, il faut communiquer avec un microbiologiste de garde pour obtenir des conseils sur le test approprié. Après avoir écarté les agents conventionnels, l’infection doit être traitée de façon empirique.
Si l’évaluation des risques indique un risque élevé, la première étape consiste à communiquer avec le microbiologiste de garde au laboratoire provincial de santé publique. La prochaine étape consiste à exclure les agents conventionnels de la même façon que lorsque le risque est faible, mais avec quelques tests supplémentaires. Ceux-ci incluent un écouvillon rhinopharyngé supplémentaire, un échantillon de la gorge ou du nez combiné viral (dans les milieux de transport viral) et une sérologie en phase aiguë, le cas échéant. Si des sécrétions endotrachéales, un lavage bronchoalvéolaire (LBA) et des tissus (qui ne sont pas dans du formol), etc. sont disponibles et appropriés, il faut également les prélever. Une fois que les agents conventionnels ont été écartés, traitez le patient de façon empirique et envisagez une consultation sur les maladies infectieuses.
Bien que les tests soient initialement concentrés sur les personnes ayant des liens épidémiologiques, comme celles qui se sont rendues dans une région où le pathogène circule, une fois que l’activité est généralisée, comme dans le cas de la pandémie de COVID-19, les fournisseurs de soins de santé devraient avoir un seuil peu élevé pour envisager de tester le nouvel agent pathogène lorsqu’ils examinent des patients atteints d’une infection respiratoire aiguë (IRA). Ce seuil de dépistage reste influencé par l’épidémiologie de l’infection, comme 1) le stade de la vague pandémique dans laquelle se trouve la province ou le territoire, 2) s’il y a une activité locale ou généralisée et 3) si l’intervention correspond à une phase de confinement ou d’atténuation. Des lignes directrices précises sur les tests sont élaborées à l’échelle provinciale et varieront d’un bout à l’autre du Canada. D’autres facteurs peuvent influencer les approches en matière de tests, notamment la disponibilité des fournitures et des réactifs de test, qui peuvent être en quantité limitée à différents moments durant une pandémie. Ces tests peuvent être effectués au laboratoire local ou au LPSS en fonction des capacités et de l’expertise locales.
Spécimens à recueillir
Jusqu’à ce que le spécimen idéal pour détecter un agent pathogène émergent ait été identifié, une vaste gamme de spécimens doivent être prélevés, notamment un écouvillon rhinopharyngé (RP), un écouvillon de gorge ou un écouvillon combiné de gorge/narines, un lavage bronchoalvéolaire (LBA), des sécrétions endotrachéales et des expectorations. Pour les patients pédiatriques, une aspiration rhinopharyngée est un substitut approprié à un écouvillon RP, bien qu’il s’agisse d’une procédure médicale générant des aérosols qui nécessite des précautions aéroportées, ce qui n’est pas le cas des écouvillons RP. Bien que la salive ait été suggérée pour la détection de certains pathogènes émergents comme le SARS-CoV-2, l’option doit être davantage validée avant d’être recommandée comme unique spécimen pour le prélèvement.
Pour les patients qui ne sont pas admis à l’hôpital, notamment ceux qui se trouvent dans une salle d’urgence, un seul spécimen des voies respiratoires supérieures est habituellement suffisant pour tester les pathogènes respiratoires viraux émergents (comme SARS-CoV-2 ou H7N9). Les spécimens prélevés dans les voies respiratoires supérieures comprennent un écouvillon RP, un prélèvement de gorge OU un écouvillon combiné gorge/narines prélevé dans un milieu de transport universel. Un écouvillon RP est le spécimen préféré en raison d’une sensibilité accrue possible par rapport à un écouvillon de gorge. Un spécimen combiné de gorge/narines peut également être prélevé, à condition que le laboratoire de test ait approuvé la soumission de ce type de source combiné de spécimen.
Pour les patients hospitalisés, en particulier ceux qui ont une IRAS, la soumission de spécimens des voies respiratoires supérieures et inférieures est recommandée dans la mesure du possible. Comme ci-dessus, l’écouvillon RP est l’échantillon préféré des voies respiratoires supérieures. Un écouvillon de gorge ou un écouvillon combiné de gorge/narines prélevé dans un milieu de transport universel peut être soumis comme spécimen supplémentaire des voies supérieures. Les spécimens des voies respiratoires inférieures doivent également être soumis dans la mesure du possible. Ces spécimens des voies inférieures comprennent les expectorations, une aspiration endotrachéale et le LBA. Pour un certain nombre de nouveaux pathogènes, notamment l’influenza aviaire et le nouveau coronavirus, on a signalé des cas de patients qui ont obtenu des résultats négatifs au test des voies respiratoires supérieures, mais positifs au test des voies respiratoires inférieures.
Pathogènes recommandés et spécimens à tester
Au moment de l’apparition d’un nouvel agent pathogène, avant l’infection humaine généralisée, la probabilité qu’une maladie respiratoire aiguë grave soit due à ce nouvel agent pathogène est extrêmement faible. Par conséquent, chez les patients qui n’ont aucun facteur de risque épidémiologique, les agents pathogènes les plus courants devraient être écartés avant d’envisager un agent pathogène inhabituel ou plus virulent. Cela comprend ce qui suit :
Bactéries conventionnelles
- Crachats pour les taches et les cultures bactériennes de routine
Bactéries atypiques
- Legionella – crachat, LBA, aspiration endotrachéale, tissu pulmonaire pour réaction en chaîne de la polymérase (PCR) et/ou culture
- Analyse d’urine pour l’antigène urinaire de la Legionella
- Mycoplasme/Chlamydia – écouvillon RP, échantillon par prélèvement de gorge et/ou de voies respiratoires inférieures pour PCR et/ou culture
Virus respiratoires classiques
- Influenza humain, parainfluenza, virus respiratoire syncytial, adénovirus, métapneumovirus humain, rhinovirus/entérovirus, coronavirus)
- Échantillons – écouvillon RP, sécrétions endotrachéales, LBA, avec ou sans écouvillon de gorge (ou écouvillon combiné gorge/narines) et crachats
- L’écouvillon RP est le principal type d’échantillon pour les virus respiratoires, notamment l’influenza saisonnier. Toutefois, d’après notre expérience de l’influenza H1N1 pandémique, des spécimens plus profonds, comme les sécrétions endotrachéales ou le LBA, doivent être prélevés dans les cas d’infection respiratoire grave avec un résultat d’écouvillon RP négatif
- Un certain nombre de virus de l’influenza A aviaire, notamment le virus H7N9, ont été détectés dans des écouvillons de gorge. L’influenza A (H7N9) n’était détectable que chez l’un des quatre patients. Bien que les écouvillons d’expectoration et de gorge ne soient pas idéaux pour la plupart des virus de l’influenza, il faut envisager plusieurs types d’échantillons chez les patients soupçonnés d’être porteurs de virus de l’influenza A aviaire
Méthodes de test
Les tests devraient être effectués à l’aide de tests validés pour l’agent pathogène en question :
- le SARS-CoV-2 doit être testé par transcription inverse-PCR en temps réel (rRT-PCR) (voir ci-dessus)
- La principale méthode de détection de l’influenza A et B (délai de 24 heures) devrait être le rRT-PCR avec sous-typage (H3N2 ou H1N1). Les protocoles préférés pour la détection de nouveaux virus de l’influenza sont ceux élaborés par les Centers for Disease Control des États-Unis
- Pour le parainfluenza, le métapneumovirus humain, le coronavirus, le rhinovirus/entérovirus et l’adénovirus, la RT-PCR multiplex respiratoire doit être effectuée sur tous les spécimens, si possible, ou sur les spécimens négatifs pour l’influenza lorsqu’il y a une indication clinique pour détecter les virus non invasifs
- Les tests de diagnostic rapide de l’influenza ne devraient pas être utilisés pour exclure l’influenza A. La sensibilité des tests de diagnostic rapide de l’influenza actuellement disponibles pour les souches de l’influenza humaines est sous-optimale. La sensibilité des tests commerciaux actuellement disponibles pour la détection du H7N9 est faible et ne doit pas être utilisée pour les tests cliniques
- Le SARS-CoV-2, les nouveaux virus de l’influenza A et le MERS-CoV sont classés comme pathogènes RG3. La culture de routine de spécimens de patients suspects ne devrait être envisagée que dans les LPSS avec des installations de niveau de confinement (NC) 3. La culture du virus dans un laboratoire de NC2 peut être envisagée si le spécimen a été testé pour les pathogènes émergents pertinents et est négatif avec le test rRT-PCR
Si des échantillons plus invasifs sont prélevés, ils devraient être traités pour un large éventail d’agents pathogènes :
- LBA pour le dépistage d’un large éventail de pathogènes (bactéries, virus, mycobactéries, champignons)
- biopsie pulmonaire ouverte - bactérienne, mycobactérienne et fongique, cultures, RT-PCR et histologie (s’Assurer que le spécimen n’est PAS MIS DANS DU FORMOL)
Quand soupçonner le virus SARS-CoV-2
Au cours des premières phases de la pandémie, qui a commencé à Wuhan, en Chine, en décembre 2019, seules les personnes qui revenaient de Wuhan, puis de la province du Hubei, en Chine, ont été testées lorsqu’elles présentaient une IRA. Compte tenu de la progression de l’épidémie, on a recommandé le dépistage des personnes atteintes d’IRA après leur retour d’un voyage dans un pays où il y avait des cas de COVID-19.
À la suite de l’évolution de la COVID-19| vers une pandémie et une transmission locale dans la plupart des provinces et territoires du Canada, les approches de test ont été élargies, en mettant d’abord l’accent sur l’identification des cas pour le dépistage des contacts et les tests à l’appui de la stratégie de confinement. Les tests portent sur les groupes suivants :
- Personnes avec IRA qui sont des voyageurs revenant de régions où il y a des cas locaux actifs de COVID-19
- Personnes hospitalisées; contacts de cas d’éclosion
- Personnes institutionnalisées
- Travailleurs de la santé
- Collectivités éloignées, isolées ou autochtones
- Populations vulnérables
Lorsque le nombre de cas augmentera, avec une transmission communautaire plus étendue et des pressions sur les ressources de test, il faudra peut-être prioriser l’objectif des tests pour appuyer la stratégie d’atténuation, notamment avec les mesures suivantes :
- Test des personnes à risque de maladie grave
- Personnes susceptibles de transmettre le virus dans un établissement de soins de santé ou un milieu communautaire vulnérable
- Personnes dont la maladie de la COVID-19 aurait une incidence sur la prestation de soins de santé ou sur les infrastructures essentielles
- Personnes auxquelles l’exposition les exposerait à un risque de test positif
Des groupes supplémentaires peuvent être envisagés pour les tests, selon le stade de la pandémie, la politique locale et la disponibilité des réactifs.
Le test pour la COVID-19 devrait être effectué pour les patients qui répondent aux critères du test, qu’un autre agent pathogène soit identifié ou non. Les premières données indiquent que jusqu’à 30 % des patients atteints de la COVID-19 peuvent avoir une co-infection avec d’autres virus respiratoires.
De plus amples renseignements sur les tests en laboratoire pour la COVID-19 sont disponibles dans le document sur les pratiques exemplaires sur la COVID-19 du Réseau de laboratoires de santé publique du Canada (RLSPC)Note de bas de page 2.
Quand soupçonner le coronavirus du syndrome respiratoire du Moyen-Orient
Des données limitées suggèrent que le MERS-CoV peut se présenter comme une co-infection avec d’autres pathogènes viraux. Par conséquent, en plus des spécimens qui sont négatifs pour les agents pathogènes conventionnels, ceux qui ont d’autres agents pathogènes identifiés, mais qui correspondent à des cas suspects de MERS-CoV selon la définition de cas de l’Agence de la santé publique du Canada (ASPC), ou encore les lignes directrices provinciales en matière de dépistage devraient être testés. Les détails concernant les tests et certains matériaux de contrôle pour le développement de la méthode sont disponibles auprès du Laboratoire national de microbiologie (LNM). À ce jour, seuls quelques LPSS ont développé la capacité de tester cet agent pathogène à l’interne; tous les autres LPSS doivent acheminer les spécimens suspects au LNM pour des tests plus poussés.
Quand soupçonner un nouveau virus de l’influenza (y compris le H7N9)
Les virus de l’influenza qui sont positifs au test initial d’identification de l’influenza, mais qui ne peuvent pas être sous-typés au moyen du test RT-PCR devraient être caractérisés davantage. Les laboratoires qui ont la capacité de caractériser davantage les spécimens au moyen de nouvelles PCR de sous-typage ou de méthodes de séquençage (e.g. séquencer le HA, le N, le M ou d’autres gènes) pour déterminer le sous-type du virus devraient le faire. Ceux qui n’ont pas cette capacité devraient se fier au LNM pour une caractérisation plus poussée. Toutefois, étant donné que les tests de sous-typage sont généralement moins sensibles que les tests d’identification, les résultats positifs faibles peuvent ne pas être typables. Chaque laboratoire devrait évaluer ces résultats au cas par cas, en se basant sur l’expérience locale, de concert avec ses cliniciens locaux et ses collègues de la santé publique.
Les échantillons positifs pour l’influenza en dehors de la saison grippale ou obtenus de patients ayant des antécédents d’exposition à des animaux (e.g. des porcs ou des poulets) doivent être systématiquement soumis au LPSS et/ou au LNM à des fins de caractérisation.
Remarque : Bien que l’analyse initiale des tests internes utilisés par de nombreux laboratoires indique qu’ils devraient être efficaces pour identifier le H7N9, il est difficile de déterminer leur effet sur la sensibilité des tests. Cela est particulièrement vrai pour le rendement des tests commerciaux dont les séquences d’amorces ne sont pas connues. Il est important que les laboratoires demandent aux fournisseurs de donner des renseignements sur la capacité de leurs tests à détecter de nouveaux virus de l’influenza. Les laboratoires qui utilisent des tests de niveau de détection devraient surveiller les séquences virales et leur correspondance avec les amorces et les sondes des tests.
Si un laboratoire de première ligne soupçonne un nouvel agent pathogène respiratoire
Les tests initiaux (comme décrits ci-dessus) seraient semblables, mais des tests supplémentaires seront exigés au LPSS. Le laboratoire doit communiquer avec le clinicien pour s’assurer que les spécimens suivants sont prélevés :
- Une deuxième aspiration endotrachéale, un autre écouvillon RP ou LBA (à utiliser pour confirmation par le LNM)
- Un écouvillon viral dans la gorge (dans les milieux de transport viral). Un certain nombre de virus de l’influenza A aviaire, notamment le virus H7N9, ont été détectés dans les écouvillons dans la gorge. Plusieurs types de spécimens devraient être prélevés lorsque de nouveaux virus de l’influenza sont envisagés et, dans la mesure du possible, inclure des spécimens des voies respiratoires supérieures et inférieures
- Une collecte de sérums en phase aiguë et en phase de convalescence peut être appropriée, en fonction du virus particulier suspecté et des conseils du LNM et des LPSS. On ne recommande pas de test sérologique pour les patients soupçonnés d’être infectés par l’influenza A (H7N9) ou le MERS-CoV. Certains tests sérologiques du SARS-CoV-2 ont été mis au point par plusieurs fournisseurs commerciaux et sont évalués par le LNM et certains LPSS. Il s’agit notamment de tests ELISA et de tests immunochromatographiques au point de service. Leur rôle dans les essais cliniques et la santé publique n’a pas encore été clarifié, car les données disponibles sur la sensibilité, la spécificité et les valeurs prédictives positives et négatives sont insuffisantes. Des lignes directrices seront élaborées une fois que les caractéristiques de rendement des tests auront été élucidées et que les tests auront été validés pour les essais cliniques
Si un laboratoire provincial de santé publique soupçonne un nouvel agent pathogène respiratoire
- Le LPSS doit aviser immédiatement le fournisseur de soins de santé du patient, le bureau de santé publique local et le ministère de la Santé lorsqu’un spécimen suspect est identifié
- Tous les spécimens soupçonnés d’être porteurs de nouveaux agents pathogènes respiratoires (décrits ci-dessous) doivent être envoyés au LNM pour des tests de confirmation. Si un nouvel agent pathogène respiratoire cause une épidémie ou une pandémie, avec transmission locale, seuls les spécimens précoces seront envoyés au LNM pour des tests de confirmation. De plus, des tests peuvent être effectués dans des laboratoires hospitaliers ou communautaires, comme cela s’est produit pendant la pandémie de SARS-CoV-2
- Les échantillons suspectés de contenir un nouveau virus respiratoire doivent être manipulés en utilisant le NC2 avec un équipement de protection individuelle renforcé s’ils sont manipulés en dehors d’une enceinte de biosécurité
Remarque : la culture de virus ne doit pas être effectuée sur des échantillons respiratoires dans un laboratoire de NC2 lorsqu’on suspecte un pathogène nouveau ou émergent, car il s’agit de pathogènes de catégorie RG3. La culture de virus, si nécessaire, peut être envisagée dans un cadre de NC2 si l’échantillon a été testé pour ces pathogènes et est négatif selon le test RT-PCR.
Transport de spécimens
Les spécimens doivent être transportés au laboratoire dès que possible, de préférence dans les 72 heures avec des blocs réfrigérants. Si on prévoit un délai plus long, les spécimens doivent être congelés à -70°C et transportés sur de la glace sèche. Toutefois, les spécimens ne doivent pas être congelés à -20°C, car cela peut avoir une incidence sur la récupération du virus si une culture est nécessaire. S’il n’est pas possible de congeler les spécimens à -70°C ou d’utiliser de la glace sèche, les spécimens doivent rester à 4°C et être expédiés dès que possible. Les spécimens doivent être transportés comme spécimens diagnostiques conformément à la pratique habituelle pour les spécimens de l’influenza saisonnier, et aucune précaution accrue n’est nécessaire. Voir l’avis de biosécurité du SARS-CoV-2 de l’ASPC pour de plus amples renseignementsNote de bas de page 3.
On doit étiqueter les tubes de prélèvement et faire une demande adéquate et complète avec les noms de patients correspondants, les identifiants uniques et les informations cliniques pertinentes.
Déclaration des auteurs
Le Groupe de travail sur l’infection par le virus respiratoire du Réseau des laboratoires de santé publique du Canada (RLSPC) se consacre à fournir un leadership et des conseils sur des sujets liés aux agents pathogènes viraux respiratoires, notamment la réponse en laboratoire aux virus respiratoires émergents. Le Groupe de travail sur les infections virales respiratoires est composé de dirigeants de laboratoires de santé publique de partout au Canada.
Remerciements
Le Groupe de travail sur les infections virales respiratoires aimerait remercier les membres du Secrétariat du Réseau de laboratoires de santé publique du Canada, S. Radons Arneson et D. Marcino pour la coordination de la synthèse de ce document. Nous aimerions également remercier le Conseil des directeurs de laboratoire du RLSPC pour l’examen du présent document.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International