Quantifier les gains économiques associés à la vaccination contre la COVID-19

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L'Agence de la santé publique du Canada
Numéro : Volume 49-6, juin 2023 : Les hépatites aiguës chez les enfants au Canada
Date de publication : juin 2023
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
RMTC : Volume 49-6, juin 2023 : Les hépatites aiguës chez les enfants au Canada
Évaluation
Quantifier les gains économiques associés à la vaccination contre la COVID-19 dans la population canadienne : une analyse coûts-avantages
Ashleigh R Tuite1,2, Victoria Ng3, Raphael Ximenes1, Alan Diener4, Ellen Rafferty5, Nicholas H Ogden3, Matthew Tunis1
Affiliations
1 Centre de l’immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada, Ottawa, ON
2 Dalla Lana School of Public Health, Université de Toronto, Toronto, ON
3 Division des sciences des risques pour la santé publique, Laboratoire national de microbiologie, Agence de la santé publique du Canada, Saint-Hyacinthe, QC et Guelph, ON
4 Unité de recherche en matière de politiques, d’économie et d’analyse, Direction générale de la politique stratégique, Santé Canada, Ottawa, ON
5 Institute of Health Economics, Edmonton, AB
Correspondance
Citation proposée
Tuite AR, Ng V, Ximenes R, Diener A, Rafferty E, Ogden NH, Tunis M. Quantifier les gains économiques associés à la vaccination contre la COVID-19 dans la population canadienne : une analyse coûts-avantages. Relevé des maladies transmissibles au Canada 2023;49(6):293–304. https://doi.org/10.14745/ccdr.v49i06a03f
Mots-clés : SRAS-CoV-2, COVID-19, vaccination, analyse coûts-avantages, économie de la santé, modélisation
Résumé
Contexte : La vaccination a été un élément central de la réponse pandémique à la maladie à coronavirus 2019 (COVID-19) au Canada. Bien que les avantages cliniques de la vaccination soient évidents, il est utile de comprendre les avantages de la vaccination au niveau de la population par rapport aux coûts du programme. L’objectif du présent article est de quantifier l’impact économique de la vaccination contre la COVID-19 dans la population canadienne entre décembre 2020 et mars 2022.
Méthodes : Nous avons effectué une analyse coûts-avantages basée sur un modèle du programme canadien de vaccination contre la COVID-19. Nous avons utilisé un modèle épidémiologique pour estimer le nombre de cas symptomatiques de COVID-19, d’hospitalisations, de cas de syndrome post-COVID-19 (SPC) et de décès en présence et en absence de vaccination. Les valeurs médianes, inférieures et supérieures d’intervalle crédible à 95 % des résultats de 100 simulations de modèle ont été utilisées pour estimer les coûts directs et indirects de maladie, y compris la valeur de la santé. Nous avons utilisé une perspective sociétale et un taux d’actualisation de 1,5 %.
Résultats : Nous avons estimé que les coûts du programme de vaccination étaient largement compensés par les économies associées aux infections évitées et aux conséquences en aval connexes. La vaccination a augmenté l’avantage net de 298,1 milliards de dollars canadiens (intervalle de crédibilité à 95 % : 27,2–494,6) par rapport au contrefactuel d’absence de vaccination. Les plus grands avantages étaient dus à la mortalité prématurée évitée, ce qui a entraîné un avantage estimé de 222,0 milliards de dollars (intervalle de crédibilité à 95 % : 31,2–379,0).
Conclusion : Notre évaluation économique basée sur un modèle fournit une évaluation rétrospective de la vaccination contre la COVID-19 au cours des 16 premiers mois du programme au Canada et suggère qu’elle améliorait le bien-être, compte tenu de la diminution des hospitalisations et de l’utilisation des ressources en soins de santé, de la prévention des décès et de la diminution de la morbidité liée à des conditions comme le SPC.
Introduction
La disponibilité des vaccins contre la maladie à coronavirus 2019 (COVID-19) a marqué un tournant dans la réponse pandémique du Canada, permettant une réduction du recours aux interventions non pharmaceutiques (INP) pour protéger la santé de la population. Malgré l’efficacité démontrée des vaccins contre la COVID-19 pour prévenir les effets graves associés aux infections causées par le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2)Note de bas de page 1, il est difficile de quantifier l’effet des programmes de vaccination contre la COVID-19 sur la trajectoire pandémique du Canada. On peut utiliser une modélisation mathématique pour comparer l’expérience pandémique canadienne à un scénario contrefactuel de la façon dont la pandémie aurait pu se dérouler en l’absence de vaccination. La modélisation a montré les avantages cliniques substantiels de la vaccination contre la COVID-19 pour prévenir les infections, les hospitalisations et les décès dus au SRAS-CoV-2Note de bas de page 2Note de bas de page 3.
Bien que l’on discute fréquemment des répercussions de la vaccination contre la COVID-19 sur la population en ce qui concerne les résultats de santé, l’analyse coûts-avantages permet une évaluation exhaustive. Dans une analyse coûts-avantages, tous les résultats sont évalués en termes monétaires, ce qui permet d’inclure les résultats non liés à la santéNote de bas de page 4. Cette optique permet de comptabiliser de manière exhaustive les coûts de la maladie, y compris la réduction de la qualité de vie et les effets sur le marché du travail en raison de l’invalidité et la mortalité liées à la maladie, en plus des coûts directs des soins de santéNote de bas de page 5. Cela est particulièrement pertinent pour le syndrome post-COVID-19 (SPC, aussi connu sous le nom de COVID-19 longue), compte tenu des nouvelles données montrant la forte prévalence du SPC dans les pays présentant des taux élevés d’infection au SRAS-CoV-2Note de bas de page 6Note de bas de page 7. De plus, le SPC entraîne des répercussions négatives mesurables sur la productivité de la main-d’œuvre, notamment l’absentéisme des travailleurs et la sortie de la population activeNote de bas de page 8Note de bas de page 9.
Les premières évaluations économiques de la vaccination contre la COVID-19 en Amérique du Nord ont démontré que les programmes de vaccination contre la COVID-19 ont produit des avantages économiques substantiels Note de bas de page 10Note de bas de page 11. Une analyse du programme canadien de vaccination a estimé un coût-avantages net de −0,4 milliard de dollars à 2,1 milliards de dollars pour les coûts de traitement et la perte de productivité due à la maladie, et un avantage supplémentaire de 27,6 milliards de dollars pour la mortalité évitéeNote de bas de page 11. Cette étude a notamment utilisé un modèle statistique qui ne tenait pas compte de la transmissibilité du SRAS-CoV-2, de sorte que les estimations des cas de COVID-19 évités par la vaccination sont susceptibles d’être sous-estimées.
Nous avons utilisé une modélisation de la transmission pour rétrospectivement quantifier l’impact économique de la vaccination dans la population canadienne en raison de la prévention des infections par le SRAS-CoV-2 et des hospitalisations, décès et cas de SPC associés. L’analyse porte sur une période de 16 mois, après la première autorisation de vaccins en décembre 2020 jusqu’en mars 2022. Au cours de cette période, environ 87,5 % des Canadiens âgés de cinq ans et plus avaient reçu au moins une dose de vaccin, 84 % avaient terminé leur série primaire et 48,8 % avaient reçu trois doses ou plus Note de bas de page 12.
Méthodes
Nous avons effectué une analyse coûts-avantages de la vaccination contre la COVID-19 dans la population canadienne. Nous avons utilisé un modèle épidémiologique de transmission du SRAS-CoV-2 pour évaluer l’impact de la vaccination sur le fardeau de l’infection à la COVID-19 et évaluer l’avantage net qui y est associé.
Présentation du modèle de transmission et scénarios
Nous avons adapté un modèle structuré selon l’âge qui a déjà été signalé et qui décrit la transmission du SRAS-CoV-2 dans la population canadienne pour estimer les cas de COVID-19 en présence et en absence de vaccins contre ce coronavirusNote de bas de page 3Note de bas de page 13. Le modèle simule la transmission dans un milieu communautaire général et exclut les éclosions dans des milieux discrets comme les foyers de soins de longue durée, qui ont connu des taux élevés d’infection. Les résultats du modèle ont été validés par comparaison avec les données administratives disponiblesNote de bas de page 3.
Nous avons élaboré deux scénarios de rechange en utilisant des paramètres de modèle qui n’étaient pas modifiés par rapport à l’analyse décrite précédemmentNote de bas de page 3 : un scénario de référence « ce qui s’est passé » et un scénario contrefactuel « pas de vaccin ». Le scénario de référence reflétait le déploiement observé des programmes de vaccination, en termes de groupes d’âge admissibles à la vaccination et de couverture atteinteNote de bas de page 14. La période du modèle comprenait l’émergence du variant préoccupant Omicron, qui a déclenché un déploiement accéléré de la troisième dose dans la population générale au cours de l’hiver 2021–2022Note de bas de page 15. Des détails supplémentaires sur la période modélisée sont fournis dans Ogden et al.Note de bas de page 3. Les données de référence incluaient les niveaux observés des interventions non pharmaceutiques (INP) au cours de cette période, étant donné que la disponibilité de vaccins n’a pas entraîné l’élimination immédiate de ces interventions.
Le scénario contrefactuel représentait ce qui aurait pu se produire en l’absence de vaccination, avec l’utilisation continue d’INP pour atténuer les vagues récurrentes d’infection et de souche du système de santé. Le moment de l’introduction et de la levée des INP (« arrêts ») dans le scénario contrefactuel était fondé sur l’occupation de l’unité de soins intensifs (USI), avec des seuils basés sur l’occupation observée de l’unité de soins intensifs à l’introduction des INP au cours de la deuxième vague de la pandémie (septembre 2020 à février 2021). Étant donné que le modèle est stochastique, le moment et la durée de l’utilisation des INP variaient d’un modèle à l’autre pour le scénario contrefactuel. Dans les deux scénarios, la levée des INP s’est faite graduellement sur une période de quatre semaines.
La taille de la population du modèle était de 100 000 et les extrants ont été revus pour représenter la taille de la population canadienne. Chaque scénario de modèle a été exécuté 100 fois. Le modèle a été exécuté du 7 février 2020 au 31 mars 2022, et les résultats ont été calculés à partir du 14 décembre 2020, afin de saisir la période de divergence entre les scénarios de référence et les scénarios contrefactuels qui ont suivi le début de la vaccination. Les résultats du modèle comprenaient les cas cliniques de COVID-19 (tous les cas présentant des symptômes, quelle que soit leur gravité), les hospitalisations, les admissions aux soins intensifs et les décès dans le scénario de référence par rapport au scénario contrefactuel. Nous avons également calculé le nombre de doses de vaccin administrées pour le scénario de référence, ainsi que le nombre et la durée des fermetures. Pour l’analyse économique, les valeurs médianes, inférieures et supérieures d’intervalle de crédibilité à 95 % des résultats ont été utilisées.
Estimation des cas de syndrome post-COVID-19 évités
On a utilisé des modèles de cas cliniques prévus (à l’exclusion des cas mortels) pour estimer l’incidence du SPC après l’infection par le SRAS-CoV-2 en présence et en absence de vaccination. Dans la mesure du possible, nous avons utilisé la définition de cas de SPC de l’Organisation mondiale de la SantéNote de bas de page 16. La probabilité de contracter le SPC dans les cas cliniques a été tirée d’une cohorte de population générale ayant des contrôles selon l’âge et le sexeNote de bas de page 17. Nous n’avons pas appliqué de risques différentiels de développement de SPC selon l’âge ou la gravité de l’infection.
On a supposé que la vaccination empêchait le SPC de deux façons : d’abord, en prévenant l’infection par le SRAS-CoV-2, puis en réduisant la probabilité de contracter le SPC si on est infecté. On a supposé que l’efficacité vaccinale à prévenir l’infection dépendait du variant principal qui circule au moment de l’infectionNote de bas de page 3, tandis que l’efficacité vaccinale à prévenir le SPC après l’infection était supposée constante (15 %), quel que soit le variant d’infection préoccupantNote de bas de page 18. La protection contre le SPC n’a été assumée que parmi les personnes qui avaient reçu deux doses de vaccin ou plus avant l’infection. Nous n’avons pas modélisé une réduction du risque de SPC chez les personnes vaccinées après l’infection par le SRAS-CoV-2 et n’avons pas inclus une diminution de la protection contre le SPC sur l’horizon temporel du modèle.
Incidence économique des cas de COVID-19 évités
Nous avons estimé le coût total de la maladie, y compris les coûts directs et indirects et la valeur de la santé (morbidité et mortalité)Note de bas de page 5 pour énumérer l’incidence économique des cas de COVID-19 évités en raison de la vaccination dans une perspective sociétale. Nous avons utilisé un horizon temporel à vie pour énumérer les coûts et les conséquences pour la santé associés à la mortalité attribuable à la COVID-19. Pour le SPC, nous avons estimé les coûts et les effets sur la santé pour la première année suivant le début, compte tenu de données limitées sur la trajectoire à long terme de ce syndrome. Les coûts sont en dollars canadiens de 2021 et, au besoin, ont été convertis à l’aide de l’Indice canadien des prix à la consommationNote de bas de page 19. Nous avons utilisé un taux d’actualisation de 1,5 % par an. Les paramètres d’entrée pour le modèle économique ont été tirés des études publiées, dans la mesure du possible, ainsi que par hypothèse et avis d’experts (tableau 1).
| Résultat applicable | Paramètre | Valeur | Source |
|---|---|---|---|
| Coûts directs | |||
| Cas clinique | Coût médical net par patient externe ($) | 165,2 | Tsui et al.Note de bas de page 20 |
| Test RCP ($) | 60,7 | Campbell et al.Note de bas de page 21 | |
| Hospitalisation (y compris l’USI) | Coût des soins de santé par hospitalisation ($) | 25 103 | ICISNote de bas de page 22 |
| Cas de SPC | Coût par cas ($, première année) | 9 683 | Institute of Health Economics, communication personnelle |
| Vaccination | Coût du vaccin par dose ($) | 30 | Bureau du vérificateur général du CanadaNote de bas de page 23 |
| Coûts administratifs par dose ($) | 34 | Bureau de la vérificatrice générale de l’OntarioNote de bas de page 24 | |
| Autres coûts programmatiques par dose ($) | 27 | Hypothèse fondée sur Sah et al.Note de bas de page 10 | |
| Coûts indirects | |||
| Tous | Revenu d’emploi moyen, 16 ans et plus ($) | 49 095 | Statistique CanadaNote de bas de page 25 |
| Revenu d’emploi moyen, 25 à 54 ans ($) | 58 811 | Statistique CanadaNote de bas de page 25 | |
| Revenu d’emploi moyen ($) | Valeurs par âge | Statistique CanadaNote de bas de page 25 | |
| Perte de productivité | |||
| Cas clinique | Congé (jours) | 10 | Gouvernement du CanadaNote de bas de page 26 |
| Hospitalisation (y compris l’USI) | Durée du séjour à l’hôpital (jours) | 13 | ICISNote de bas de page 22 |
| Délai entre la sortie de l’hôpital et le retour au travail (jours) | 27 | Chopra et al.Note de bas de page 27 | |
| Cas de SPC | Proportion de cas de SPC présentant des symptômes continus après un an | 0,15 | Waters et WernhamNote de bas de page 8 |
| Diminution moyenne des gains au cours des six premiers mois de maladie (%) | 11 | Wulf HansonNote de bas de page 28 | |
| Réduction annuelle moyenne du salaire (%) | 8,3 | Extrapolé deNote de bas de page 8 etNote de bas de page 28 | |
| Vaccination | Congé pour recevoir le vaccin (jours) | 0,4 | Gouvernement de l’AlbertaNote de bas de page 29 |
| Proportion incapable de travailler un jour après la vaccination, dose 1 | 0,05 | Rosenblum et al.Note de bas de page 30 | |
| Proportion incapable de travailler un jour après la vaccination, dose 2 | 0,23 | Rosenblum et al.Note de bas de page 30 | |
| Proportion incapable de travailler un jour après la vaccination, doses de rappel | 0,23 | Présumé | |
| Tous | Taux de participation au marché du travail, 15 ans et plus (%) | 64,6 | Statistique CanadaNote de bas de page 31 |
| Taux de participation au marché du travail, 25 à 54 ans (%) | 87 | Statistique CanadaNote de bas de page 31 | |
| Participation à la population active (%) | Valeurs par âge | Statistique CanadaNote de bas de page 31 | |
| Perte d’AVAQ | |||
| Cas clinique | 0 à 14 ans | 0,0050 | Kirwin et al.Note de bas de page 32 |
| 15 à 64 ans | 0,0077 | Kirwin et al.Note de bas de page 32 | |
| 65 ans et plus | 0,012 | Kirwin et al.Note de bas de page 32 | |
| Hospitalisation (y compris l’USI) | Perte d’AVAQ (par an) | 0,58 | Kirwin et al.Note de bas de page 32; rajusté en fonction de la durée du séjour à l’hôpital |
| Perte d’AVAQ à la sortie (par cas) | 0,1 | Kirwin et al.Note de bas de page 32 | |
| Cas de SPC | Perte d’AVAQ à (1 an après la sortie) | 0,2937 | Diminution pondérée des maladies chroniques courantes associées au SPC, Institute for Health Economics, communication personnelle |
| Décès (valeur actualisée nette) | 0 à 9 ans | 41,37 | Kirwin et al.Note de bas de page 32 |
| 10 à 19 ans | 37,19 | Kirwin et al.Note de bas de page 32 | |
| 20 à 29 ans | 33,37 | Kirwin et al.Note de bas de page 32 | |
| 30 à 39 ans | 29,4 | Kirwin et al.Note de bas de page 32 | |
| 40 à 49 ans | 24,9 | Kirwin et al.Note de bas de page 32 | |
| 50à 59 ans | 20,18 | Kirwin et al.Note de bas de page 32 | |
| 60 à 69 ans | 15,36 | Kirwin et al.Note de bas de page 32 | |
| 70 à 74 ans | 10,35 | Kirwin et al.Note de bas de page 32 | |
| 75 ans | 5,17 | Kirwin et al.Note de bas de page 32 | |
| Vaccination | Perte d’AVAQ en cas d’événement indésirable suivant l’immunisation | 0,00027 | Sandmann et al.Note de bas de page 33 |
| Autre | |||
| Cas de SPC | Efficacité vaccinale à prévenir le SPC après l’infection | 0,15 | Al-AlyNote de bas de page 18 |
| Cas clinique | Pourcentage de cas cliniques contractant le SPC | 12,7 (7,8–17,0) |
Ballering Note de bas de page 17; ThompsonNote de bas de page 34 |
| Tous | Gaspillage de vaccins (%) | 3 | Bureau de la vérificatrice générale de l’OntarioNote de bas de page 24, de décembre 2020 à janvier 2022 |
| Pourcentage de cas testés par le SPC | 20 | Statistique CanadaNote de bas de page 35 et présumé | |
| Taux d’actualisation (%) | 1,5 | ACMTSNote de bas de page 36 | |
| Coût par seuil d’AVAQ ($) | 30 000 (20 000–100 000) |
Ochalek et al.Note de bas de page 37 | |
Les coûts directs comprenaient les frais médicaux liés aux cas de COVID-19, notamment les services de consultation externe et l’hospitalisation pour les cas de COVID-19 aigus et le traitement du SPC. Les coûts du programme de vaccination comprenaient le coût de l’achat et de l’administration des vaccins contre la COVID-19, y compris le gaspillage estimé, ainsi que les coûts associés à la prestation du programme à la population, tel que le stockage et le transport, la mise en place d’une clinique, la publicité et la sensibilisationNote de bas de page 10. Le coût des doses gaspillées excluait les coûts d’administration des vaccins.
Les coûts indirects comprenaient la valeur de la perte de production due aux jours de perte d’emploi dus à la maladie, à l’incapacité, au décès ou à la prestation de soins, ainsi que les pertes de production associées au temps nécessaire pour recevoir un vaccin et aux effets secondaires suivant l’immunisation (ESSI). Nous n’avons pas inclus les frais médicaux directs (e.g. les frais pharmaceutiques). La perte de productivité a été quantifiée selon l’approche du capital humainNote de bas de page 4. Nous avons utilisé des estimations par âge de la participation à la population active pour les années 2020 et 2021Note de bas de page 31 et le revenu d’emploi moyen pour 2020Note de bas de page 25. Les coûts des aidants naturels étaient fondés sur des estimations du revenu moyen d’emploi et de la participation des personnes âgées de 25 à 54 ans au marché du travail, rajustées en fonction de la perte de productivité estimée des aidants naturelsNote de bas de page 38. Nous avons inclus les coûts des aidants naturels associés aux infections externes des enfants de moins de 15 ans et les coûts des aidants naturels pour les cas hospitalisés des enfants de moins de 15 ans et des adultes de 65 ans et plus. Pour estimer la perte de production associée à la vaccination, nous avons utilisé les taux de participation au marché du travail et le salaire moyen de la population âgée de 16 ans et plus pour tenir compte du congé des aidants pour accompagner les enfants à des rendez-vous de vaccination.
Parmi les effets sur la santé, mentionnons l’inutilité de l’infection symptomatique, l’hospitalisation, le SPC, le décès et les ESSI. Les années de vie ajustée en fonction de la qualité (AVAQ) ont été monétisées en utilisant un coût par seuil d’AVAQ de 30 000 $Note de bas de page 37. L’avantage net a été estimé à l’aide du scénario contrefactuel « pas de vaccination » comme base de référence. Le modèle de transmission a été construit dans AnyLogic 8 Professional 8.7.2 et l’analyse économique a été effectuée à l’aide de RNote de bas de page 39.
Analyses de sensibilité
Pour dissiper l’incertitude entourant les coûts des vaccins, y compris les coûts programmatiques, nous avons estimé un coût seuil pour déterminer le coût maximal du vaccin par dose pour lequel une vaccination contre la COVID-19 aurait été rentable. Nous avons supposé que les coûts d’administration étaient fixés à la valeur utilisée dans l’analyse principale.
Nous avons étudié les coûts par seuil d’AVAQ de 20 000 $, 50 000 $ et 100 000 $ en analyse de sensibilité. Nous avons évalué des estimations de risque de SPCNote de bas de page 34 inférieures (7,8 %) et supérieures (17,0 %) afin d’en évaluer l’incidence sur les résultats.
Nous avons réévalué les pertes de production en utilisant l’approche des coûts de friction. Contrairement à l’approche du capital humain, l’approche du coût de la friction suppose qu’après une « période de friction », les travailleurs qui ont quitté le marché du travail finiront par être remplacés par des travailleurs actuellement en chômageNote de bas de page 40. Nous avons utilisé une période de friction de trois mois pour les personnes atteintes de SPC ou qui sont mortes de COVID-19Note de bas de page 41.
Résultats
Avec la vaccination, l’expérience moyenne de la population canadienne de la pandémie de décembre 2020 à mars 2022 a été représentée dans le modèle sous la forme de trois périodes d’arrêt pour une durée totale de 112 jours. En revanche, en l’absence de vaccination, mais avec la mise en œuvre continue des INP face à la pression sur le système de santé, nous nous attendions à quatre périodes d’arrêt prolongées (intervalle de crédibilité à 95 % : 3–5) pour une durée totale de 343 jours (intervalle de crédibilité à 95 % : 268–399).
Les résultats de santé estimés par le modèle utilisés pour l’analyse économique sont présentés au tableau 2 et à la figure 1. Pour la limite inférieure et médiane des estimations du modèle, l’incidence de tous les résultats de la COVID-19 était plus élevée dans le scénario contrefactuel « pas de vaccin » que dans le scénario de référence. Pour la limite inférieure des estimations du modèle, bien que l’incidence des infections symptomatiques et du SPC ait été plus élevée dans le scénario de référence, l’incidence des hospitalisations et des décès était plus élevée pour le contrefactuel « non vacciné », en raison de l’efficacité de la vaccination à prévenir des résultats graves.
| Résultats cliniques | Scénario | Évités (contrefactuel moins référence) |
|
|---|---|---|---|
| Référence | Contrefactuel (aucune vaccination)Note de bas de page b |
||
| Cas cliniques | 13 618 980 (11 709 360–15 704 590) |
24 713 530 (10 327 700–30 926 840) |
11 094 550 (−1 381 660–15 222 240) |
| Cas hospitalisés (excluant l’USI) | 86 090 (50 930–131 510) |
1 270 100 (296 480–1 880 730) |
1 184 010 (245 540–1 749 220) |
| Cas dans l’USI | 25 660 (14 440–41 810) |
375 730 (86 660–590 300) |
350 070 (72 220–548 480) |
| Cas de SPC | 1 566 540 (1 341 560–1 815 660) |
3 070 700 (1 301 046–3 823 630) |
1 504 160 (−40 510–2 007 970) |
| Décès | 10 640 (4 180–19 770) |
534 800 (83 240–819 500) |
524 160 (79 060–799 730) |
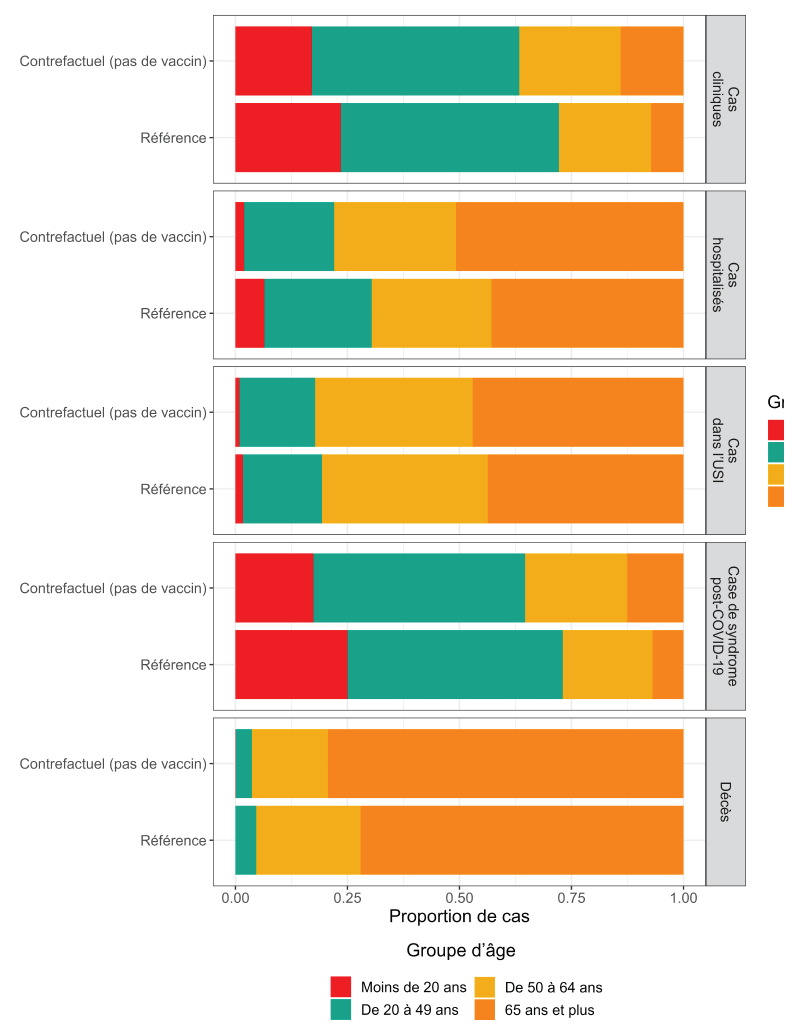
Figure 1 - Équivalent textuel
Groupe d’âge |
Résultat | Comparateur | Proportion de cas |
|---|---|---|---|
| Moins de 20 ans | Cas cliniques | Référence | 0,235 |
| De 20 à 49 ans | Cas cliniques | Référence | 0,487 |
| De 50 à 64 ans | Cas cliniques | Référence | 0,206 |
| 65 ans et plus | Cas cliniques | Référence | 0,072 |
| Moins de 20 ans | Cas cliniques | Contrefactuel (pas de vaccin) | 0,170 |
| De 20 à 49 ans | Cas cliniques | Contrefactuel (pas de vaccin) | 0,463 |
| De 50 à 64 ans | Cas cliniques | Contrefactuel (pas de vaccin) | 0,226 |
| 65 ans et plus | Cas cliniques | Contrefactuel (pas de vaccin) | 0,140 |
| Moins de 20 ans | Cas hospitalisés | Référence | 0,065 |
| De 20 à 49 ans | Cas hospitalisés | Référence | 0,240 |
| De 50 à 64 ans | Cas hospitalisés | Référence | 0,267 |
| 65 ans et plus | Cas hospitalisés | Référence | 0,429 |
| Moins de 20 ans | Cas hospitalisés | Contrefactuel (pas de vaccin) | 0,020 |
| De 20 à 49 ans | Cas hospitalisés | Contrefactuel (pas de vaccin) | 0,201 |
| De 50 à 64 ans | Cas hospitalisés | Contrefactuel (pas de vaccin) | 0,272 |
| 65 ans et plus | Cas hospitalisés | Contrefactuel (pas de vaccin) | 0,508 |
| Moins de 20 ans | Cas dans l’USI | Référence | 0,017 |
| De 20 à 49 ans | Cas dans l’USI | Référence | 0,176 |
| De 50 à 64 ans | Cas dans l’USI | Référence | 0,370 |
| 65 ans et plus | Cas dans l’USI | Référence | 0,437 |
| Moins de 20 ans | Cas dans l’USI | Contrefactuel (pas de vaccin) | 0,009 |
| De 20 à 49 ans | Cas dans l’USI | Contrefactuel (pas de vaccin) | 0,169 |
| De 50 à 64 ans | Cas dans l’USI | Contrefactuel (pas de vaccin) | 0,351 |
| 65 ans et plus | Cas dans l’USI | Contrefactuel (pas de vaccin) | 0,471 |
| Moins de 20 ans | Syndrome post-COVID-19 | Référence | 0,250 |
| De 20 à 49 ans | Syndrome post-COVID-19 | Référence | 0,480 |
| De 50 à 64 ans | Syndrome post-COVID-19 | Référence | 0,200 |
| 65 ans et plus | Syndrome post-COVID-19 | Référence | 0,069 |
| Moins de 20 ans | Syndrome post-COVID-19 | Contrefactuel (pas de vaccin) | 0,174 |
| De 20 à 49 ans | Syndrome post-COVID-19 | Contrefactuel (pas de vaccin) | 0,472 |
| De 50 à 64 ans | Syndrome post-COVID-19 | Contrefactuel (pas de vaccin) | 0,228 |
| 65 ans et plus | Syndrome post-COVID-19 | Contrefactuel (pas de vaccin) | 0,126 |
| Moins de 20 ans | Décès | Référence | 0,000 |
| De 20 à 49 ans | Décès | Référence | 0,047 |
| De 50 à 64 ans | Décès | Référence | 0,233 |
| 65 ans et plus | Décès | Référence | 0,721 |
| Moins de 20 ans | Décès | Contrefactuel (pas de vaccin) | 0,001 |
| De 20 à 49 ans | Décès | Contrefactuel (pas de vaccin) | 0,036 |
| De 50 à 64 ans | Décès | Contrefactuel (pas de vaccin) | 0,169 |
| 65 ans et plus | Décès | Contrefactuel (pas de vaccin) | 0,794 |
La vaccination était associée à 6,61 millions d’AVAQ acquises (intervalle de crédibilité à 95 % : 0,88–10,8) et augmentation de l’avantage net de 298,1 milliards de dollars canadiens (intervalle de crédibilité à 95 % : 27,2–494,6) par rapport au contrefactuel d’absence de vaccination (tableau 3). Cela représente un rapport avantages-coûts de 26,7 (intervalle de crédibilité 3,6–43,3). Les plus grands avantages étaient dus à la mortalité prématurée évitée, ce qui a entraîné un avantage estimé de 222,0 milliards de dollars (intervalle de crédibilité à 95 % : 31,2–379,0).
Résultats cliniques |
Avantages supplémentaires (milliards de dollars) | ||
|---|---|---|---|
| Directs | Indirects | Total | |
| Cas cliniques | 2 (−0,176–2,77) |
12,8 (−1,1–18) |
14,8 (−1,28–20,8) |
| Cas hospitalisés (y compris l’USI) | 29,6 (6,26–45,9) |
10,9 (2,31–17) |
40,6 (8,57–62,9) |
| Cas de SPC | 14,8 (0,0342–19,8) |
17,5 (0,222–23,7) |
32,3 (0,256–43,5) |
| Décès | s.o. | 222 (31,2–379) |
222 (31,2–379) |
| Vaccination | −7,56 (−7,54–−7,59) |
−4,05 (−4,04–−4,07) |
−11,6 (−11,6–−11,7) |
| Total | 38,83 (−1,426–60,88) |
259,3 (28,59–433,7) |
298,1 (27,16–494,6) |
Nous avons estimé que si les coûts de la vaccination étaient 64 fois la valeur de référence présumée (intervalle de crédibilité à 95 % : 7–104), le programme de vaccination aurait toujours procuré un avantage net, en utilisant une perspective sociétale qui inclut les coûts directs et indirects. Pour l’estimation de la limite inférieure du modèle, cela signifie que, pour un coût pouvant atteindre 410 $ par dose (excluant les frais d’administration), le programme de vaccination serait considéré comme rentable; pour les estimations médianes et supérieures, ces valeurs sont respectivement de 3 630 $ et de 5 950 $ par dose. Compte tenu des coûts médicaux directs et des AVAQ monétisées seulement, qui reflètent la perspective du payeur de soins de santé généralement utilisée dans la prise de décision en soins de santé, un coût par dose allant jusqu’à 390 $, 2 910 $ et 4 640 $ serait bénéfique pour les scénarios de limite inférieure, médiane et supérieure, respectivement.
L’utilisation de coûts supérieurs par seuil d’AVAQ a augmenté le gain de bien-être de la vaccination par rapport au contrefactuel (figure 2), avec un avantage maximal de 1,25 billion de dollars pour l’estimation à la limite supérieure du modèle et un seuil de 100 000 $ par AVAQ. L’utilisation d’un seuil inférieur de 20 000 $ par AVAQ et les estimations de modèle les plus prudentes de l’incidence des vaccins ont donné un bénéfice net estimé de 18,3 milliards de dollars.

Figure 2 - Équivalent textuel
| Mesure du résultat du modèle | Composante de coût | Seuil d’AVAQ ($ par AVAQ gagnée) |
Avantages supplémentaires (en milliards de dollars) |
|---|---|---|---|
| Limite inférieure | Total | 100 000 $ | 89,1 |
| Limite inférieure | Total | 50 000 $ | 44,9 |
| Limite inférieure | Total | 30 000 $ | 27,2 |
| Limite inférieure | Total | 20 000 $ | 18,4 |
| Limite inférieure | Direct uniquement | s.o. | -1,4 |
| Médiane | Total | 100 000 $ | 760,6 |
| Médiane | Total | 50 000 $ | 430,3 |
| Médiane | Total | 30 000 $ | 298,1 |
| Médiane | Total | 20 000 $ | 232,1 |
| Médiane | Direct uniquement | s.o. | 38,8 |
| Limite supérieure | Total | 100 000 $ | 1247,9 |
| Limite supérieure | Total | 50 000 $ | 709,8 |
| Limite supérieure | Total | 30 000 $ | 494,6 |
| Limite supérieure | Total | 20 000 $ | 387 |
| Limite supérieure | Direct uniquement | s.o. | 60,9 |
Le risque plus faible ou élevé de SPC après l’infection n’a pas eu d’incidence importante sur l’avantage estimé du programme de vaccination. Le bénéfice net a été estimé à 285,7 milliards de dollars (intervalle de crédibilité à 95 % : 27,1–477,8) et 309,1 milliards de dollars (intervalle de crédibilité à 95 % : 27,2–509,3), lorsque le SPC a été observé dans 7,8 % ou 17 % des cas cliniques, respectivement.
L’avantage net de la vaccination a été réduit lorsque l’on a utilisé le coût de friction au lieu de l’approche du capital humain pour estimer les pertes de production, mais il est demeuré élevé à 251,0 milliards de dollars (intervalle de crédibilité à 95 % : 21,6–406,3). La plus grande partie de l’avantage réduit était attribuable à des coûts indirects estimés moins élevés en raison de la mortalité, une réduction de 44,4 milliards de dollars (intervalle de crédibilité à 95 % : 5,4–84,5).
Discussion
Nous estimons que le programme de vaccination COVID-19 du Canada a donné lieu à des avantages monétaires de dizaines à des centaines de milliards de dollars comparativement à une situation sans vaccination et à une dépendance exclusive aux INP pour contrôler la transmission. Les coûts du programme de vaccination ont été largement compensés par les économies associées aux infections évitées et aux conséquences en aval connexes. Bien que l’avantage le plus important ait été tiré de la mortalité prématurée évitée, l’avantage indirect associé à la réduction de la maladie et de l’incapacité était également important.
Nos résultats sont conformes à une analyse de la campagne de vaccination contre la COVID-19 de la ville de New YorkNote de bas de page 10. En dépit de différentes méthodes épidémiologiques et d’un système de santé différent, cette étude a également permis de réaliser des économies substantielles liées au programme de vaccination contre la COVID-19 de la villeNote de bas de page 10. Une analyse récente du programme de vaccination du Canada a également révélé sa rentabilité, avec un avantage monétaire net de −0,4 milliard de dollars à 2,1 milliards de dollars, et un avantage économique additionnel de 27,6 milliards de dollars associé à la mortalité évitéeNote de bas de page 11. Cette analyse, qui n’a pas utilisé de modèle de transmission pour estimer les résultats pour la santé évités grâce à la vaccination, a probablement sous-estimé les avantages du programme. À titre de comparaison, l’analyse de 2022Note de bas de page 11 a estimé que le programme de vaccination a empêché 30 900 décès entre janvier 2021 et mai 2022, tandis que notre analyse a estimé à 524 000 le nombre de décès évités sur une période similaire (de décembre 2020 à mars 2022). Une autre analyse fondée sur un modèleNote de bas de page 2 a permis d’estimer à 314 100 le nombre de décès évités au cours de la première année du programme de vaccination du Canada (de décembre 2020 à décembre 2021).
Forces et faiblesses
Nos estimations des avantages ne comprennent pas une comptabilisation complète de l’impact sociétal des vaccins pour accélérer la reprise économiqueNote de bas de page 42. Le modèle contrefactuel a montré que, sans vaccination, le nombre de jours avec des INP en place aurait pu être trois fois plus élevé que ce qui a été observé. Selon une analyse récente, un retard de six mois dans l’accès aux vaccins aurait entraîné des pertes de 156 milliards de dollars en activité économique (soit 12,5 % du produit intérieur brut du Canada)Note de bas de page 11. Nous n’avons pas tenu compte des coûts sociétaux associés à l’utilisation prolongée des INP ni des effets en aval sur le système de soins de santé résultant d’un fardeau plus lourd pour les cas de COVID-19 et du report des soins pour d’autres besoins en santéNote de bas de page 43Note de bas de page 44. L’inclusion de ces coûts augmenterait encore les avantages économiques associés à la vaccination.
En raison de la confidentialité de l’information sur les prix des vaccins contre la COVID-19, nous n’avons pas utilisé ces données ou n’y avons pas accès. Au lieu de cela, nous avons utilisé des estimations accessibles au public du coût moyen du vaccin par dose, ce qui peut surestimer ou sous-estimer le coût réel des vaccins. De même, l’information sur les autres coûts associés aux programmes de vaccination, y compris l’entreposage, le transport, la sensibilisation et le gaspillage, était fondée sur l’information du public, les hypothèses et l’opinion d’experts. En dépit de l’incertitude entourant ces valeurs, nous avons estimé que les coûts de vaccination auraient pu être de 10 à 100 fois plus élevés et qu’ils auraient pu être considérés comme une intervention rentable.
Nous avons comparé la trajectoire de pandémie observée à un scénario contrefactuel « pas de vaccin » où la mise en œuvre des INP était liée à la capacité des USI. Il est impossible de connaître la nature précise de la gestion éventuelle de la pandémie au Canada sans vaccin. Nous n’avons notamment pas modélisé d’interventions comme le port continu du masque ou des améliorations à la ventilation, qui auraient pu être plus largement adoptés si la vaccination n’avait pas été disponible. Compte tenu de l’incertitude associée au contrefactuel, nous avons inclus les extrants de modèle aux limites inférieures et supérieures dans l’évaluation économique. Nous avons également noté que la vaccination demeurait une intervention rentable pour l’estimation prudente de la limite inférieure, où le modèle prédisait un nombre plus élevé de cas symptomatiques avec vaccination, mais où il réduisait les infections graves, par rapport au contrefactuel.
Les avantages de la vaccination pour la prévention du SPC demeurent difficiles à quantifier. Nous avons limité nos estimations des effets du SPC au cours de la première année suivant l’infection, étant donné l’incertitude quant à la trajectoire à long terme de la maladie parmi les cas, et avons donc probablement sous-estimé le fardeau total associé au SPC. Nos estimations de modèle du SPC de 4,1 % dans la population canadienne (intervalle : 3,5 %–4,7 %) au cours de la période modélisée sont conformes aux données de l’enquête canadienne qui indiquent que 4,6 % de la population canadienne de 18 ans et plus a signalé des symptômes persistants au moins trois mois après l’infection par le SRAS-CoV-2, d’après les données recueillies entre avril et août 2022Note de bas de page 35. Nous avons supposé que le risque de contracter le SPC s’appliquait également, quelle que soit la gravité de l’infection initiale. Les données suggèrent un risque accru de SPC parmi les cas les plus gravesNote de bas de page 7Note de bas de page 35 et, par conséquent, l’impact estimé de la vaccination pour prévenir le SPC peut être sous-estimé dans notre modèle. Des analyses de sensibilité ont révélé que les différentes hypothèses concernant le taux de SPC ne sont pas susceptibles d’affecter considérablement les coûts évités par le programme de vaccination.
Nous avons monétisé les AVAQ pour estimer les avantages associés à la morbidité et à la mortalité de COVID-19 évitées. L’approche de la valeur d’une vie statistique (VVS) est une solution de rechange pour quantifier les effets sur la santé d’une intervention dans les analyses coûts-avantagesNote de bas de page 4. La VVS permet de tenir compte de l’incidence de la réduction du risque de mortalité sur tous les aspects du bien-être, comme les dépenses médicales évitées et la douleur et la souffrance associées à la maladieNote de bas de page 4. Sa faiblesse est de ne pas tenir compte de la morbidité associée aux cas non mortelsNote de bas de page 4. Une comparaison des approches de VVS et d’AVAQ monétisées pour les programmes de vaccination contre le virus du papillome humain a montré que l’approche de VVS était associée à des avantages estimés plus élevésNote de bas de page 4. Compte tenu du lourd fardeau de morbidité associé à la COVID-19, nous avons utilisé une approche monétisée des AVAQ, mais nous avons noté que d’autres approches peuvent donner lieu à différentes estimations de l’avantage monétaire de la vaccination contre la COVID-19.
Conclusion
Notre évaluation économique basée sur un modèle fournit une évaluation rétrospective de la vaccination contre la COVID-19 au cours des 16 premiers mois du programme au Canada et suggère qu’elle améliorait le bien-être, compte tenu de la diminution des hospitalisations et de l’utilisation des ressources en soins de santé, de la prévention des décès et de la diminution de la morbidité liée à des conditions comme le SPC, y compris les bénéfices associés à la reprise économique due à un nombre réduit de jours dans les scénarios de fermeture, ce qui montrerait une augmentation encore plus importante des bénéfices nets. Cette analyse peut aider à jeter les bases d’une évaluation de la rentabilité et des décisions d’achat de vaccins au cours des prochaines pandémies.
Déclaration des auteurs
- A. R. T — Conceptualisation, analyse, rédaction de manuscrits
- V. N. — Conceptualisation, modélisation, révision et édition de manuscrits
- R. X. — Conceptualisation, révision et édition de manuscrits
- A. D. — Conceptualisation, révision et édition de manuscrits
- E. R. — Analyse, révision et édition de manuscrits
- N. H. O — Conceptualisation, révision et édition de manuscrits
- M. T. — Conceptualisation, révision et édition de manuscrits
Intérêts concurrents
Aucun.
Financement
Ces travaux ont été soutenus par l’Agence de la santé publique du Canada.
Remerciements
Les auteurs aimeraient remercier H. Kim, L. Waddell, F. Reyes Domingo, R. Edjoc, E. Kirwin et A. Unsal pour leurs commentaires et leurs discussions utiles.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International