Ébauche d’évaluation préalable - Groupe d’alcools C3-C5 sélectionnés
Titre officiel : Ébauche d’évaluation préalable
Groupe d’alcools C3-C5 sélectionnés
Numéros de registre du Chemical Abstracts Service
71-23-8
67-63-0
57-55-6
78-83-1
75-65-0
71-41-0
Environnement et Changement climatique Canada
Santé Canada
Juin 2023
Résumé
En vertu de l’article 68 ou de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], le ministre de l’Environnement et le ministre de la Santé ont procédé à l’évaluation préalable de six substances collectivement appelées « groupe d’alcools C3-C5 sélectionnés » dans le cadre du Plan de gestion des produits chimiques. Le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 1 ), le nom dans la Liste intérieure (LI) et le nom commun de chaque substance figurent dans le tableau ci-dessous.
| No CAS | Nom dans la LI | Nom commun |
|---|---|---|
| 71-23-8 | Propan-1-ol | Alcool propylique |
| 67-63-0 | Propan-2-ol | Alcool isopropylique |
| 57-55-6 | Propane-1,2-diol | Propylèneglycol |
| 78-83-1 | 2-Méthylpropan-1-ol | Alcool isobutylique |
| 75-65-0a | 2-Méthylpropan-2-ol | tert-Butanol |
| 71-41-0 | Pentan-1-ol | S. O. |
Abréviation : S. O., sans objet
a Cette substance n’a pas satisfait aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE et a été désignée prioritaire par d’autres mécanismes.
Le propan-1-ol et le propan-2-ol sont présents à l’état naturel dans l’environnement. Les autres substances faisant partie du groupe d’alcools C3-C5 sélectionnés ne sont pas présentes à l’état naturel dans l’environnement.
Les substances de ce groupe, à l’exception du propylèneglycol, ont été visées par une enquête menée en vertu de l’article 71 de la LCPE. En 2011, des quantités fabriquées au Canada ont été déclarées pour le propan-1-ol (1 410 kg), le propan-2-ol (plus de 10 000 000 kg), l’alcool isobutylique (17 800 kg) et le tert-butanol (plus de 10 000 000 kg), tandis que le pentan-1-ol n’a pas été fabriqué en quantités supérieures au seuil de déclaration de 100 kg. Pour la même année, des quantités importées au Canada ont été déclarées pour le propan-1-ol (8 285 724 kg), le propan-2-ol (17 934 589 kg), l’alcool isobutylique (plus de 10 000 000 kg), le tert-butanol (10 000 à 100 000 kg) et le pentan-1-ol (104 863 kg). D’après l’application Web sur le commerce international de marchandises du Canada, 24 199 865 kg de propylèneglycol ont été importés au Canada en 2021.
Selon les renseignements déclarés en réponse à une enquête menée en vertu de l’article 71 de la LCPE pour ces substances (à l’exception du propylèneglycol), la principale utilisation déclarée est dans les peintures et les revêtements. Les autres utilisations importantes comprennent l’encre, les toners et les colorants, les produits de nettoyage et d’entretien de mobilier (propan-1-ol, propan-2-ol et alcool isobutylique), les automobiles, les aéronefs et les transports (propan-2-ol et pentan-1-ol), les produits de soins personnels, les adhésifs et les scellants ainsi que l’extraction du pétrole et du gaz naturel (propan-2-ol). Les substances faisant partie du groupe d’alcools C3-C5 sélectionnés peuvent aussi être utilisées dans les cosmétiques (toutes, sauf le pentan‑1‑ol), comme additifs alimentaires (propan-2-ol et propylèneglycol) et aromatisants alimentaires (propan-1-ol, propan-2-ol, alcool isobutylique et pentan-1-ol), comme composantes dans la fabrication de matériaux d’emballage alimentaire (toutes), comme additifs indirects (tert-butanol), comme ingrédients médicamenteux et non médicamenteux dans des médicaments (toutes, sauf le pentan-1-ol), y compris des produits de santé naturels (propan-1-ol, propan-2-ol, propylèneglycol et tert-butanol), comme principes actifs dans les produits antiparasitaires (propan-2-ol et propylèneglycol), comme formulants dans les produits antiparasitaires (toutes) et dans d’autres produits offerts aux consommateurs.
Les risques pour l’environnement associés aux substances du groupe d’alcools C3-C5 sélectionnés ont été caractérisés à l’aide de la Classification du risque écologique (CRE) des substances organiques, une approche fondée sur le risque qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des multiples éléments de preuve pour déterminer la classification du risque. Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne établis à partir du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Parmi les paramètres pris en compte dans les profils d’exposition, on retrouve le taux d’émission potentiel, la persistance globale et le potentiel de transport sur de grandes distances. Une matrice de risque est utilisée pour attribuer aux substances un degré de préoccupation potentielle faible, modéré ou élevé, selon leurs profils de danger et d’exposition. D’après les résultats de l’analyse de la CRE, il est peu probable que les six substances faisant partie du groupe d’alcools C3-C5 sélectionnés aient des effets nocifs sur l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, les six substances du groupe d’alcools C3-C5 sélectionnés présentent un faible risque d’effets nocifs sur l’environnement. Il est proposé de conclure que les six substances qui font partie du groupe des alcools C3-C5 sélectionnés ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière de la classification sur le plan de la cancérogénicité, de la génotoxicité et de la toxicité pour le développement ou la reproduction réalisée par d’autres organismes nationaux ou internationaux, le propan-1-ol, le propan-2-ol, le propylèneglycol, l’alcool isobutylique et le pentan-1-ol n’ont pas été jugés très dangereux pour la santé humaine. Ces substances ont été évaluées au moyen de l’approche décrite dans le document d’évaluation scientifique concernant les substances présentant un faible danger pour la santé humaine. Étant donné que ces cinq substances sont considérées comme ayant un faible potentiel de danger, les estimations quantitatives d’exposition n’ont pas été calculées, et le risque qu’elles présentent pour la santé humaine est jugé faible.
La population générale devrait être exposée au tert-butanol à partir de l’air et de l’eau potable, et de l’utilisation de divers produits offerts aux consommateurs, comme les cosmétiques et les médicaments, dont les produits de santé naturels. Dans le cadre d’études en laboratoire portant sur le tert-butanol, un nombre accru d’effets non cancérogènes (néphropathie) sur les reins ont été observés. On a observé un nombre accru de tumeurs rénales et thyroïdiennes, bien que leur pertinence relativement à la hausse des cas de tumeurs rénales chez les humains était incertaine. Le tert-butanol ne s’est pas révélé génotoxique. Une comparaison entre les effets critiques cancérogènes et non cancérogènes et les concentrations de tert-butanol auxquelles la population générale peut être exposée à partir des milieux de l’environnement, de cosmétiques (comme les traitements de blanchiment dentaire, les lotions corporelles et les fixatifs), de produits de santé naturels (comme les désinfectants pour les mains), de médicaments sans ordonnance (comme les écrans solaires), de marqueurs et de vaporisateurs anti-odeurs tout usage a donné des marges d’exposition jugées adéquates pour tenir compte des incertitudes liées aux données sur les effets sur la santé et l’exposition utilisées pour caractériser les risques.
L’évaluation des effets sur la santé humaine a tenu compte des groupes de personnes de la population canadienne qui, en raison d’une vulnérabilité accrue ou d’une plus grande exposition, peuvent être plus susceptibles de subir des effets nocifs pour la santé découlant de l’exposition à des substances. Le potentiel d’une vulnérabilité accrue durant le développement et la reproduction a été évalué, et l’exposition selon l’âge a été estimée. Les nourrissons et les jeunes enfants devraient être davantage exposés au tert-butanol que les adultes. Les personnes vivant près de rejets industriels ont aussi été prises en compte dans l’évaluation préalable du tert-butanol. Toutes ces populations ont été prises en considération lors de l’évaluation des dangers potentiels pour la santé humaine.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que les six substances du groupe d’alcools C3-C5 sélectionnés ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc proposé de conclure que les six substances du groupe d’alcools C3-C5 sélectionnés ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], le ministre de l’Environnement et le ministre de la Santé ont procédé à l’évaluation préalable de six substances appelées collectivement « groupe d’alcools C3-C5 sélectionnés » dans le cadre du Plan de gestion des produits chimiques, afin d’établir si elles présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Les substances de ce groupe ont été désignées prioritaires aux fins de l’évaluation, car elles satisfont aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE ou ont été désignées prioritaires par d’autres mécanismes (ECCC, SC [modifié, 2017]).
Les risques pour l’environnement associés aux substances du groupe d’alcools C3-C5 sélectionnés ont été caractérisés à l’aide de l’approche de classification du risque écologique (CRE) des substances organiques (ECCC, 2016a). La CRE décrit le danger posé par une substance à l’aide de paramètres clés comme le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne établis à partir du réseau trophique, la biodisponibilité et l’activité chimique et biologique, et tient compte de l’exposition potentielle des organismes dans les milieux aquatique et terrestre en fonction de facteurs, dont le taux d’émission potentiel, la persistance globale et le potentiel de transport atmosphérique sur de grandes distances. Les divers éléments de preuve sont rassemblés pour déterminer les substances qui nécessitent une évaluation approfondie de leur potentiel de causer des effets nocifs pour l’environnement ou dont la probabilité d’entraîner des effets nocifs sur l’environnement est faible.
Certaines substances du groupe d’alcools C3-C5 sélectionnés visées par la présente ébauche d’évaluation préalable ont été examinées à l’échelle internationale par l’Organisation de coopération et de développement économiques (OCDE), et les ensembles de données de dépistage (EDD) de l’OCDE ainsi que les rapports d’évaluation initiale des EDD sont accessibles. Ces évaluations ont été soumises à un examen rigoureux (y compris par des pairs) et à l’approbation d’autorités gouvernementales d’autres pays. Santé Canada et Environnement et Changement climatique Canada sont des participants actifs à ce processus et jugent que ces évaluations sont fiables. En outre, les effets sur la santé de certaines substances du groupe d’alcools C3-C5 sélectionnés ont été examinés par le Programme international sur la sécurité des substances chimiques (PISSC), l’Environmental Protection Agency (EPA) des États-Unis, le National Toxicology Program (NTP) des États-Unis, la Commission européenne (CE) et l’Agence européenne des produits chimiques (ECHA). L’Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada a aussi examiné le propan-2-ol (Santé Canada, 2017a, 2018b) et le propylèneglycol en tant qu’ingrédients actifs dans les pesticides (Santé Canada, 2008a, 2008b). Les examens effectués par ces organisations servent à éclairer la caractérisation des effets sur la santé dans la présente ébauche d’évaluation préalable. L’Autorité européenne de sécurité des aliments (EFSA) et l’Australian Industrial Chemicals Introduction Scheme ont également effectué des examens.
La présente ébauche d’évaluation préalable tient compte de renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, y compris les renseignements soumis par des parties intéressées. Des données pertinentes ont été recensées jusqu’en décembre 2021. Des données empiriques d’études clés ainsi que certains résultats obtenus par modélisation ont servi à formuler les conclusions proposées. Lorsqu’ils étaient disponibles et pertinents, les renseignements contenus dans les évaluations effectuées par d’autres instances ont été utilisés.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE à Santé Canada et à Environnement et Changement climatique Canada, et comprend des observations provenant du personnel d’autres programmes relevant de ces ministères. La partie de l’évaluation portant sur l’environnement repose sur le document de CRE (publié le 30 juillet 2016), lequel a fait l’objet d’un examen externe et d’une période de consultation publique de 60 jours. Bien que des commentaires externes aient été pris en compte, Environnement et Changement climatique Canada et Santé Canada sont responsables du contenu final et des conclusions de la présente évaluation préalable.
La présente ébauche d’évaluation préalable repose sur des renseignements essentiels pour déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. À cette fin, des renseignements scientifiques ont été examinés et une approche fondée sur le poids de la preuve et le principe de précaution a été adoptéeNote de bas de page 2 . La présente ébauche d’évaluation préalable expose les données essentielles et les considérations sur lesquelles les conclusions proposées s’appuient.
2. Identité des substances
Les numéros de registre du Chemical Abstracts Service (no CAS), les noms figurant sur la Liste intérieure (LI) et les noms communs des substances individuelles du groupe d’alcools C3-C5 sélectionnés sont présentés au tableau 2-1. Dans la présente ébauche d’évaluation préalable, le nom commun « alcool propylique » peut désigner le propan‑1‑ol ou le propan-2-ol. Pour éliminer toute ambiguïté, les noms communs sont utilisés pour désigner les substances lorsque possible, sauf pour le propan-1-ol et le propan-2-ol, lesquels sont désignés par le nom qui figure sur la LI.
| No CAS | Nom figurant sur la LI (nom commun) |
Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 71-23-8 | Propan-1-ol (alcool propylique) |
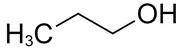 C3H8O |
60,09 |
| 67-63-0 | Propan-2-ol (alcool isopropylique) |
 C3H8O |
60,09 |
| 57-55-6 | Propane-1,2-diol (propylèneglycol) |
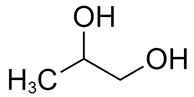 C3H8O2 |
76,09 |
| 78-83-1 | 1-Méthylpropan-2-ol (alcool isobutylique) |
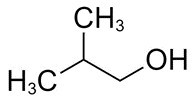 C4H10O |
74,12 |
| 75-65-0 | 2-Méthylpropan-2-ol (tert-butanol) |
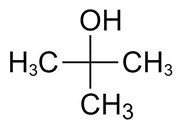 C4H10O |
74,12 |
| 71-41-0 | Pentan-1-ol |
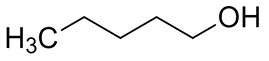 C5H12O |
88,15 |
a PubChem, 2004.
2.1 Sélection d’analogues
Une méthode de lecture croisée fondée sur les données d’analogues a été utilisée pour éclairer l’évaluation des effets sur la santé humaine du propan-1-ol, de l’alcool isobutylique et du pentan-1-ol. On a choisi des analogues dont la structure ou la fonction était semblable à celle des substances du groupe (propriétés physico-chimiques semblables) et pour lesquels on disposait de données empiriques pertinentes permettant d’effectuer une lecture croisée pour des substances ayant des données empiriques limitées. Le propan-2-ol a été jugé un analogue adéquat pour éclairer les effets du propan-1-ol sur la santé, étant donné que les deux substances sont des isomères et présentent les propriétés physico-chimiques les plus semblables. Le tableau 2‑2 présente des renseignements sur l’identité et les structures chimiques des autres analogues utilisés pour éclairer l’évaluation des effets sur la santé humaine.
| No CAS | Nom figurant sur la LI (nom commun) |
Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 71-36-3 | Butan-1-ol (alcool n-butylique) |
 C4H10O |
74,12 |
| 123-51-3 | 3-Méthylbutan-1-ol (alcool isopentylique) |
 C5H12O |
88,15 |
a PubChem, 2004.
Dans la présente ébauche d’évaluation préalable, ces analogues seront désignés sous les noms de butan-1-ol et d’alcool isopentylique, respectivement. Le butan-1-ol a été considéré comme un analogue approprié par l’OCDE dans le cadre de son évaluation des risques de l’alcool isobutylique pour l’environnement (OCDE, 2004a); il a été inclus dans la présente ébauche d’évaluation préalable pour éclairer l’évaluation des effets de l’alcool isobutylique sur la santé humaine. L’alcool isopentylique a été utilisé comme analogue pour éclairer l’évaluation des effets du pentan-1-ol sur la santé humaine. Les effets sur la santé et les propriétés physico-chimiques des analogues sont présentés à l’annexe A. Des détails sur les données de lecture croisée retenues pour éclairer l’évaluation des effets sur la santé humaine des substances du groupe d’alcools C3-C5 sélectionnés sont abordés ultérieurement dans les sections pertinentes du présent rapport.
3. Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques des substances du groupe d’alcools C3-C5 sélectionnés est présenté dans le tableau 3‑1. D’autres propriétés physiques et chimiques sont fournies dans le document ECCC, 2016b.
| Substance | Point de fusion (°C) | Pression de vapeur (Pa) | Constante de Henry (Pa·m3/mol) | Solubilité dans l’eau (mg/L) | Log Koe (sans dimension) |
|---|---|---|---|---|---|
| Propan-1-ol | −126 | 2 798 | 0,75 | 1,0 × 106 | 0,25 |
| Propan-2-ol | −90 | 6 063 | 0,82 | 1,0 × 106 | 0,05 |
| Propylèneglycol | −60 | 17 | 0,00013 | 1,0 × 106 | −0,92 |
| Alcool isobutylique | −108 | 1 400 | 0,99 | 8,5 × 104 | 0,76 |
| tert-Butanol | 25 | 5 426 | 0,92 | 1,0 × 106 | 0,35 |
| Pentan-1-ol | −78 | 293 | 1,32 | 2,2 × 104 | 1,51 |
Abréviation : Koe, coefficient de partage octanol-eau
a ChemIDPlus, 1993.
4. Sources et utilisations
Le propan-1-ol et le propan-2-ol sont présents à l’état naturel dans l’environnement (PISSC, 1990a, b). Le propan-1-ol est produit dans la nature par la décomposition de matières organiques par une variété de micro-organismes, et est présent dans les plantes et le mazout (PISSC, 1990a). Le propan-1-ol est présent en tant que produit de fermentation dans des boissons alcoolisées comme la bière, le vin et les spiritueux, et en tant que saveur naturelle dans diverses boissons non alcoolisées (kéfir, crème, lait et jus de pomme, de tomate et d’orange) et divers aliments (pommes, tomates, pains blancs, beurres, fromages et fèves de soja) (PISSC, 1990a). Le propan-2-ol est présent en tant que produit du métabolisme microbien dans certains aliments (comme le fromage) et en tant que saveur naturelle dans certains aliments (pommes, tomates, champignons, endives et fèves de soja) (PISSC, 1990b).
Toutes les substances du groupe d’alcools C3-C5 sélectionnés, sauf le propylèneglycol, ont été visées par une enquête réalisée en vertu de l’article 71 de la LCPE (Canada, 2012). Le tableau 4‑1 présente un résumé des données déclarées sur les quantités totales fabriquées et importées pour les substances du groupe d’alcools C3-C5 sélectionnés en 2011 (Environnement Canada, 2013), y compris les quantités de propylèneglycol importées d’après l’application Web sur le commerce international de marchandises du Canada.
| Substance | Quantité totale fabriquéea (kg) | Quantité totale importéea (kg) |
|---|---|---|
| Propan-1-ol | 1 410 | 8 285 724 |
| Propan-2-ol | Plus de 10 000 000 | 17 934 589 |
| Propylèneglycol | S. O. | 24 199 865b |
| Alcool isobutylique | 17 800 | Plus de 10 000 000 |
| tert-Butanol | Plus de 10 000 000 | 10 000 à 100 000 |
| Pentan-1-ol | N. D. | 104 863 |
Abréviations : S. O., car substance non visée par l’enquête menée en vertu de l’article 71 de la LCPE; N. D., fabrication non déclarée en quantités supérieures au seuil de déclaration de 100 kg.
a Les valeurs reflètent les quantités déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), sauf pour le propylèneglycol, qui n’était pas visé par l’enquête. Voir l’enquête pour les inclusions et exclusions précises (Canada, 2012 − annexes 2 et 3).
b Les données sur les importations annuelles au Canada de propylèneglycol (propane-1,2-diol) pour 2021 sont tirées de l’application Web sur le commerce international de marchandises du Canada (Statistique Canada [modifié, 2022]).
D’après les renseignements présentés en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Canada, 2012), les substances du groupe d’alcools C3-C5 sélectionnés, à l’exception du propylèneglycol qui n’était pas visé par l’enquête, sont utilisées dans une variété d’applications commerciales, industrielles et de consommation (Environnement Canada, 2013). Les substances du groupe d’alcools C3-C5 sélectionnés, à l’exception du propylèneglycol, sont principalement utilisées dans les peintures et les revêtements. D’autres utilisations importantes du propan-1-ol, du propan-2-ol et de l’alcool isobutylique comprennent l’encre, les toners et les colorants, ainsi que les produits de nettoyage et d’entretien de mobilier. Le propan-2-ol et le pentan-1-ol sont aussi utilisés dans les automobiles, les aéronefs et les transports. Le propan-2-ol est également employé dans les produits de soins personnels, les adhésifs et les scellants, l’extraction du pétrole et du gaz naturel, les produits d’entretien automobile, les lubrifiants et les graisses, les médicaments ainsi que les produits antigel et de dégivrage (Environnement Canada, 2013). D’autres utilisations des substances du groupe d’alcools C3-C5 sélectionnés dans des produits de consommation au Canada sont indiquées dans le tableau 4‑2.
| Utilisation | Propan-1-ol | Propan-2-ol | Propylèneglycol | Alcool isobutylique | tert-Butanol | Pentan-1-ol |
|---|---|---|---|---|---|---|
| Additif alimentairea | N | O | O | N | N | N |
| Aromatisant alimentairea | O | O | N | O | N | O |
| Additif indirecta,b | N | N | N | N | O | N |
| Matériaux d’emballage alimentairea | O | O | O | O | O | O |
| Ingrédient médicamenteux ou non médicamenteux utilisé dans les désinfectants et les produits pharmaceutiques destinés aux humains ou aux animauxc | O | O | O | O | O | N |
| Ingrédient médicamenteux ou non médicamenteux utilisé dans les produits de santé naturels homologuésd | O | O | O | N | O | N |
| Présence déclarée dans des cosmétiques visés par le Règlement sur les cosmétiquese | O | O | O | O | O | N |
| Principe actif ou formulant dans des produits antiparasitaires homologuésf | O(F) | O(PI, F) | O(PI, F) | O(F) | O(F) | Og |
Abréviations : PI = principe actif; F = formulant; N = utilisation non déclarée pour cette substance; O = utilisation déclarée pour cette substance.
a Communication personnelle, courriel de la Direction des aliments, Santé Canada (SC), au Bureau d’évaluation du risque des substances existantes (BERSE), SC, 5 octobre 2021; source non citée.
b Bien qu’ils ne soient pas définis dans la Loi sur les aliments et drogues, les additifs indirects peuvent être considérés, à des fins administratives, comme des substances utilisées dans les usines de transformation des aliments qui sont susceptibles de devenir des résidus fortuits dans les aliments (comme les nettoyants et les désinfectants).
c Communication personnelle, courriel de la Direction des médicaments pharmaceutiques (DMP), SC, au BERSE, SC, 28 septembre 2021; source non citée.
d Communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance (DPSNSO), SC, au BERSE, SC, 14 octobre 2021; source non citée.
e Communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux (DSPCPD), SC, au BERSE, SC, 29 septembre 2021 et 4 mai 2022; source non citée.
f Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire (ARLA), SC, au BERSE, SC, 22 septembre 2021; source non citée.
g Bien que le pentan-1-ol figure dans la base de données de l’ARLA en tant que formulant, il n’est pas actuellement utilisé dans les produits antiparasitaires (communication personnelle, courriel de l’ARLA, SC, au BERSE, SC, 22 septembre 2021; source non citée).
Outre les utilisations susmentionnées, d’autres importantes utilisations des substances du groupe d’alcools C3-C5 sélectionnés ont été déterminées dans des produits offerts aux consommateurs au Canada. Le propylèneglycol est présent surtout dans les produits de nettoyage et d’entretien de mobilier (FDS, 2013a), les détergents à lessive et à vaisselle (FDS, 2016a) et les peintures et revêtements (FDS, 2014). Le tert-butanol est présent dans les bâtons phosphorescents (FDS, 2007), les marqueurs (FDS, 2016b), les nettoyants de moteur automobile (FDS, 2013b) et les vaporisateurs anti-odeurs (FDS, 2015).
Quatre des substances du groupe d’alcools C3-C5 sélectionnés, soit le propan-1-ol, le propan-2-ol, l’alcool isobutylique et le tert-butanol, doivent être déclarées à l’Inventaire national des rejets de polluants (INRP). Pour 2018, les rejets totaux (dans l’air, l’eau et le sol), les éliminations, les transferts aux fins de traitement et les transferts aux fins de recyclage ont été déclarés pour le propan-1-ol (1 800 tonnes rejetées dans l’air), le propan-2-ol (2 200 tonnes transférées aux fins de traitement, 1 700 tonnes rejetées dans l’air, 800 tonnes transférées aux fins de recyclage), l’alcool isobutylique (350 tonnes transférées aux fins de recyclage, 180 tonnes rejetées dans l’air, 80 tonnes transférées aux fins de traitement) et le tert-butanol (2,3 tonnes transférées aux fins de recyclage, 1,2 tonne transférée aux fins de traitement) (INRP, 2022).
5. Potentiel de causer des effets nocifs pour l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques pour l’environnement associés aux substances du groupe d’alcools C3-C5 sélectionnés ont été caractérisés à l’aide de l’approche de classification du risque écologique (CRE) des substances organiques (ECCC, 2016a). La CRE est une approche fondée sur le risque qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des multiples éléments de preuve pour déterminer la classification du risque. Les divers éléments de preuve sont rassemblés pour que l’on puisse distinguer les substances présentant un potentiel toxique faible ou élevé ainsi qu’un risque d’exposition faible ou élevé dans divers milieux. Une telle approche permet de réduire l’incertitude globale de la caractérisation des risques comparativement à une approche qui reposerait sur un paramètre unique dans un seul milieu (par exemple la concentration létale médiane) pour la caractérisation. Les paragraphes suivants résument l’approche, décrite en détail dans un document d’ECCC (2016a).
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration chez les poissons), l’écotoxicité aiguë pour les poissons et les volumes de produits chimiques importés et fabriqués au Canada proviennent de publications scientifiques, de bases de données empiriques accessibles (par exemple la boîte à outils QSAR de l’OCDE, 2014), et des réponses aux enquêtes menées en vertu de l’article 71 de la LCPE, ou ont été produites par la modélisation de la relation (quantitative) structure-activité ([Q]SAR), du devenir du bilan massique ou de la bioaccumulation. Ces données ont servi à alimenter d’autres modèles du bilan massique ou à compléter les profils de danger et d’exposition des substances.
Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne établis à partir du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition sont aussi basés sur de nombreux paramètres, dont le taux d’émission potentiel, la persistance globale et le potentiel de transport sur de grandes distances. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de catégoriser le potentiel de danger et d’exposition de chaque substance organique comme étant faible, modéré ou élevé. D’autres règles ont été appliquées (cohérence de la classification, marge d’exposition) pour affiner la classification préliminaire du danger ou de l’exposition.
Une matrice de risques a été utilisée pour classer le risque potentiel associé à chaque substance comme étant faible, modéré ou élevé, suivant la classification du danger et de l’exposition. Les classifications du risque potentiel obtenues à l’aide de la CRE ont subi une vérification en deux étapes. La première étape consistait à modifier à la baisse la classification du risque (de modéré ou élevé à faible) des substances présentant un faible taux d’émission dans l’eau estimé après le traitement des eaux usées, ce qui représente un faible potentiel d’exposition. La deuxième étape consistait à réévaluer la classification du faible potentiel de risque à l’aide de scénarios de risque relativement prudents et à échelle locale (c’est-à-dire la zone entourant directement le point de rejet), conçus pour protéger l’environnement, afin de déterminer si la classification du risque potentiel devrait être revue à la hausse.
La CRE est fondée sur une approche pondérée pour réduire au minimum la possibilité d’une classification trop élevée ou trop faible du danger et de l’exposition ainsi que du risque subséquent. Les approches équilibrées tenant compte des incertitudes sont décrites en détail dans un document d’ECCC (2016a). Deux des domaines d’incertitude les plus importants sont décrits ci-dessous. Des erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient entraîner des modifications de la classification du danger, en particulier dans le cas des paramètres dépendant des valeurs liées aux résidus présents dans les tissus (par exemple le mode d’action toxique), nombre de ces valeurs étant prédites à l’aide de modèles (Q)SAR (Boîte à outils QSAR de l’OCDE, 2014). Toutefois, l’incidence de telles erreurs est atténuée par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) des résidus présents dans les tissus, laquelle sera utilisée pour l’analyse des résidus corporels critiques. Une erreur due à une sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, tels que le profilage structural du mode d’action, la réactivité ou l’affinité de liaison à l’œstrogène. Les changements ou les erreurs touchant les quantités de substances chimiques pourraient conduire à des classifications différentes de l’exposition, la classification de l’exposition et du risque étant très sensible au taux d’émission et aux quantités utilisées. Les classifications obtenues au moyen de la CRE reflètent donc l’exposition et le risque au Canada, compte tenu de l’estimation des quantités utilisées actuellement, et pourraient ne pas rendre compte des tendances futures.
Les données essentielles et les éléments pris en compte pour produire les profils propres aux substances du groupe d’alcools C3-C5 sélectionnés ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans un document d’ECCC (2016b).
Les classifications du danger et de l’exposition des six substances du groupe d’alcools C3-C5 sélectionnés sont résumées dans le tableau 5‑1.
| Nom commun | Classification du danger selon la CRE | Classification de l’exposition selon la CRE | Classification du risque selon la CRE |
|---|---|---|---|
| Propan-1-ol | faible | faible | faible |
| Propan-2-ol | faible | faible | faible |
| Propylèneglycol | faible | faible | faible |
| Alcool isobutylique | faible | faible | faible |
| tert-Butanol | faible | élevée | faible |
| Pentan-1-ol | faible | faible | faible |
D’après les renseignements pris en compte lors de la CRE, le propan-1-ol, le propan‑2‑ol, le propylèneglycol, l’alcool isobutylique et le pentan-1-ol présentent un faible potentiel de danger. Bien qu’on ait déclaré d’importantes quantités utilisées pour ces substances en réponse à une enquête menée en vertu de l’article 71 de la LCPE (sauf pour le propylèneglycol, qui n’était pas visé par l’enquête) (Canada, 2012), on considère que le propan-1-ol, le propan-2-ol, le propylèneglycol, l’alcool isobutylique et le pentan-1-ol présentent une brève persistance globale de moins de 13 jours et qu’ils ne devraient pas être transportés dans l’air sur de grandes distances. Par conséquent, ces substances ont été classées comme présentant un faible potentiel d’exposition. Compte tenu des classifications de danger faible et d’exposition faible établies d’après les renseignements examinés dans le cadre de la CRE, le propan-1-ol, le propan-2-ol, le propylèneglycol, l’alcool isobutylique et le pentan-1-ol ont été classés comme présentant un faible potentiel de risque pour l’environnement. Il est donc improbable que ces substances soient préoccupantes pour l’environnement au Canada.
D’après les renseignements examinés dans le cadre de la CRE, le tert-butanol a été classé comme présentant un faible potentiel de danger. D’après la demi-vie extrêmement longue et les importantes quantités utilisées de la substance selon les renseignements déclarés en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), le tert-butanol a été classé comme présentant un potentiel d’exposition élevé. Étant donné son faible potentiel de danger, le tert‑butanol a été classé comme ayant un faible potentiel de risque pour l’environnement. Bien que les profils d’emploi actuels entraînent un potentiel d’exposition élevé, il est peu probable que le tert-butanol, compte tenu de son faible potentiel de danger, soit préoccupant pour l’environnement au Canada.
6. Potentiel de causer des effets nocifs pour la santé humaine
6.1 Évaluation de l’exposition
Les expositions potentielles aux substances du groupe d’alcools C3-C5 sélectionnés à partir des milieux de l’environnement, des aliments et des produits offerts aux consommateurs sont présentées dans cette section.
6.1.1 Propan-1-ol, propan-2-ol, propylèneglycol, alcool isobutylique et pentan-1-ol
Les expositions par voie orale, par inhalation et par voie cutanée au propan-1-ol, au propan-2-ol, au propylèneglycol, à l’alcool isobutylique et au pentan-1-ol peuvent se produire à partir des milieux de l’environnement, des aliments et de l’utilisation de produits de consommation contenant ces substances. Les estimations quantitatives de l’exposition de la population générale n’ont pas été calculées pour le propan-1-ol, le propan-2-ol, le propylèneglycol, l’alcool isobutylique et le pentan-1-ol, car ces substances sont considérées comme présentant un faible potentiel de danger d’après l’approche décrite dans le document d’évaluation scientifique concernant les substances présentant un faible danger pour la santé humaine (Santé Canada, 2019).
Les résultats d’un modèle de fugacité de niveau III (ChemCAN, 2003) semblent indiquer que le propan-2-ol se répartit principalement dans l’air et, dans une moindre mesure, dans l’eau, tandis que le propan-1-ol, l’alcool isobutylique et le pentan-1-ol se répartissent principalement dans l’eau et, dans une moindre mesure, dans l’air. À l’opposé, le propylèneglycol se répartit principalement dans l’eau et, dans une moindre mesure, dans le sol et l’air. Au Canada, les concentrations de propan-1-ol et de propan‑2-ol dans l’air intérieur et extérieur ont été mesurées dans le cadre d’études de surveillance réalisées à Edmonton (Santé Canada, 2013), à Regina (Santé Canada, 2010a), à Windsor (Santé Canada, 2010b) et à Halifax (Santé Canada, 2012) (voir le tableau 6‑1).
| Alcool | Saison | Moyenne géométrique pour l’intérieur (µg/m3) |
5e – 95e centile pour l’intérieur (µg/m3) |
Moyenne géométrique pour l’extérieur (µg/m3) |
5e – 95e centile pour l’extérieur (µg/m3) |
|---|---|---|---|---|---|
| Propan-1-ol | Été | 2,102 | 0,400 – 7,713 | 0,178 | 0,074 – 0,375 |
| Propan-1-ol | Hiver | 1,580 | 0,453 – 4,793 | 0,072 | 0,031 – 0,226 |
| Propan-2-ol | Été | 25,69 | 1,148 – 8227,0 | 4,111 | 0,328 – 18,60 |
| Propan-2-ol | Hiver | 26,11 | 3,444 – 456,66 | 2,107 | 0,369 – 9,41 |
a La moyenne géométrique la plus élevée parmi les quatre villes est indiquée pour chaque saison, tout comme la fourchette du 5e au 95e centile [µg/m3] pour la même ville.
Les aliments constituent une source d’exposition potentielle au propan-1-ol et au propan-2-ol (PISSC, 1990a, b). Le propylèneglycol est utilisé dans la fabrication de certains matériaux d’emballage alimentaire pouvant entrer en contact direct avec les aliments, ce qui peut entraîner une exposition de la population générale par le régime alimentaire. Le propan-1-ol, le propan-2-ol, l’alcool isobutylique et le pentan-1-ol peuvent aussi être utilisés en tant que solvants dans la fabrication de certains matériaux d’emballage alimentaire, mais il n’y a aucun potentiel de contact direct avec les aliments. Le propan-1-ol, le propan-2-ol, l’alcool isobutylique et le pentan-1-ol sont utilisés comme aromatisants alimentaires à l’échelle internationale (Burdock, 2010), et il est possible que ces substances soient présentes en tant qu’aromatisants dans des aliments vendus au Canada. Une exposition au propan-2-ol et au propylèneglycol peut aussi découler de leur utilisation en tant qu’additifs alimentaires. Le propan-2-ol est autorisé comme solvant véhiculeur ou d’extraction dans les protéines de poisson et les extraits et préparations d’aromatisants alimentaires, ainsi que dans les encres de marquage de la viande et des œufs qui sont appliqués directement sur la viande ou la coquille d’œuf à des fins de marquage ou d’autres fins. Le propylèneglycol est autorisé comme solvant véhiculeur ou d’extraction dans divers extraits et préparations d’additifs et d’aromatisants alimentaires. Son utilisation comme agent anti-agglomérant dans le sel et comme humectant dans une variété d’aliments est également autorisée (communication personnelle, courriel de la Direction des aliments, SC, au BERSE, SC, 5 octobre 2021; source non citée).
6.1.2 tert-Butanol
En ce qui concerne le tert-butanol, les scénarios d’exposition sentinelles donnant les expositions les plus élevées pour les groupes d’âge pertinents sont présentés afin de caractériser les risques.
Milieux de l’environnement et aliments
Aucune donnée canadienne ou étrangère sur la présence de tert-butanol dans l’eau potable, l’air ambiant (extérieur), le sol ou la poussière n’a été recensée. D’après les résultats d’un modèle de fugacité de niveau III (ChemCAN, 2003), le tert-butanol se répartit principalement dans l’eau (84,5 %) et dans l’air (15,3 %), et très peu dans le sol (0,2 %). ChemCAN (2003) a été utilisé pour calculer les concentrations de tert-butanol dans l’eau potable, l’air ambiant et le sol à partir des quantités totales commercialisées (voir le tableau 4‑1). Les concentrations maximales estimées de tert-butanol dans l’eau potable, l’air ambiant et le sol étaient de 3,06 µg/L, de 0,72 µg/m3 et de 13,5 µg/kg, respectivement. Ces concentrations modélisées ont servi à estimer les expositions de la population générale. Le potentiel du tert-butanol d’être rejeté dans l’environnement à partir d’activités de fabrication industrielle a aussi été examiné et ne devrait pas être préoccupant. Par conséquent, la population générale ne devrait pas être exposée au tert-butanol à partir de cette source.
Le tert-butanol a été mesuré dans 29 échantillons d’air intérieur prélevés dans 50 résidences de Québec entre 2008 et 2010. La concentration moyenne géométrique mesurée était de 0,18 µg/m3 et la concentration maximale, de 2,37 µg/m3 (Won et Lustyk, 2011). Le tert-butanol a été mesuré dans le cadre des cycles 2 et 3 de l’Enquête canadienne sur les mesures de la santé (Zhu et al., 2013 et Li et al., 2019, respectivement). Pour les cycles 2 et 3, respectivement, les taux de détection du tert‑butanol étaient de 90 % et de 96 %, les moyennes géométriques étaient de 0,20 µg/m3 et de 0,19 µg/m3, et les concentrations au 95e centile étaient de 2,49 µg/m3 et de 1,35 µg/m3. La concentration la plus élevée mesurée dans l’air intérieur parmi toutes ces études (95e centile, 2,49 µg/m3, Zhu et al., 2013) a été utilisée pour estimer les expositions de la population générale à partir de l’air intérieur.
Les estimations de l’exposition au tert-butanol à partir des milieux de l’environnement allaient de 0,53 µg/kg p.c./j pour les adultes (âgés de 19 ans et plus) à 1,75 µg/kg p.c./j pour les nourrissons (de 1 an). L’absorption quotidienne totale pour les autres groupes d’âge ainsi que les paramètres pour estimer l’exposition à partir des milieux de l’environnement sont décrits à l’annexe B.
Bien que le tert-butanol puisse être utilisé comme solvant dans la fabrication de certains matériaux d’emballage alimentaire pouvant entrer en contact direct avec les aliments, l’exposition par le régime alimentaire découlant de cette utilisation devrait être faible. Le tert-butanol peut aussi être présent dans des additifs indirects, sans potentiel de contact direct avec les aliments, et une exposition n’est donc pas prévue (communication personnelle, courriel de la Direction des aliments, SC, au BERSE, SC, 5 octobre 2021; source non citée).
Exposition à partir de produits offerts aux consommateurs
Le tert-butanol est principalement utilisé comme intermédiaire, additif (Environnement Canada, 2013), parfum, solvant et dénaturant pour l’éthanol (communication personnelle, courriel de la DPSNSO, SC, au BERSE, SC, 14 octobre 2021; source non citée) dans des produits offerts aux consommateurs.
D’après les renseignements présentés en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Canada, 2012), le tert-butanol est utilisé dans les peintures et revêtements (Environnement Canada, 2013). D’après les déclarations présentées à Santé Canada au titre du Règlement sur les cosmétiques, le tert-butanol est utilisé dans divers cosmétiques au Canada, dont les traitements de blanchiment dentaire, le maquillage, les parfums en vaporisateur, les désodorisants, les produits autobronzants, les lotions après rasage, les produits pour les cheveux ainsi que les crèmes, nettoyants et masques pour le corps et le visage (communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 29 septembre 2021 et 4 mai 2022; source non citée). Le tert-butanol est aussi présent comme ingrédient non médicamenteux dans divers produits de santé naturels topiques, dont les désinfectants pour les mains (communication personnelle, courriel de la DPSNSO, SC, au BERSE, SC, 14 octobre 2021; source non citée), et dans les médicaments sans ordonnance, dont les écrans solaires (communication personnelle, courriel de la DMP, SC, au BERSE, SC, 28 septembre 2021; source non citée). Le tert-butanol est également utilisé dans des produits offerts aux consommateurs, comme les bâtons phosphorescents (FDS, 2007), les marqueurs (FDS, 2016b), les nettoyants de moteur automobile (FDS, 2013b) et les vaporisateurs anti-odeurs (FDS, 2015).
Bien que l’exposition par voie cutanée devrait contribuer à l’exposition globale pendant l’utilisation de produits offerts aux consommateurs, la voie principale est considérée comme étant l’inhalation ou la voie orale, selon le scénario d’utilisation du produit. L’absorption cutanée du tert-butanol a été étudiée dans le cadre d’une étude toxicocinétique lors de laquelle des rats Sprague-Dawley (SD) mâles ont été exposés par voie cutanée (zone partiellement recouverte) à une seule dose de [14C]-tert-butanol pendant six heures (Huntington Life Sciences, 1998, cité dans ECHA, c2020b). La majeure partie de la dose appliquée (89 %, 1 h après l’application) s’est évaporée et a été retenue dans des filtres au charbon placés au-dessus du site de traitement. Soixante-douze heures après l’application, moins de 1,5 % de la dose appliquée a été détectée dans l’urine, les fèces et les tissus. Une autre matière organique volatile radioactive (de 4,4 à 8,4 %, 1 h après l’application) a été mesurée et présumée être le résultat de l’évaporation provenant du site de traitement et n’ayant pas été retenue par les filtres au charbon (Huntington Life Sciences, 1998, cité dans ECHA, c2020b). Un examen toxicologique fondé sur l’absorption de 1,5 % rapportée dans cette étude a décrit l’absorption cutanée du tert-butanol comme étant faible (McGregor, 2010). Comme la source de la matière volatile n’a pas été déterminée avec certitude, l’ECHA (c2020b) a présumé que la matière a pu être expirée par les rats et l’a donc incluse dans les calculs de l’absorption, ce qui a donné une valeur d’absorption cutanée située entre 6 et 11 % (ECHA, c2020b). Compte tenu des données disponibles sur l’absorption cutanée et de la forte volatilité du tert-butanol, l’exposition cutanée devrait être négligeable par rapport aux expositions par voie orale et par inhalation. Par conséquent, seules des estimations pour ces voies d’exposition sont présentées.
Les estimations d’exposition par événement n’ont pas été calculées pour le tert-butanol, car aucun paramètre d’effet nocif sur la santé humaine pertinent pour l’exposition par événement n’a été recensé. Pour caractériser les expositions quotidiennes au tert‑butanol découlant de l’utilisation de produits offerts aux consommateurs, les estimations d’exposition ont été calculées au moyen de ConsExpo Web (2021) ou d’algorithmes d’exposition propres au produit et à la voie d’exposition (voir l’annexe C). Les estimations d’exposition interne ont été calculées en présumant d’une absorption complète par inhalation ou par voie orale. Les estimations pour les scénarios de produits entraînant l’exposition potentielle la plus élevée (appelés « scénarios sentinelles ») pour chaque grand type de produit sont présentées dans le tableau 6‑2. L’exposition à partir d’autres produits offerts aux consommateurs devrait être plus faible que les expositions sentinelles estimées présentées dans cette évaluation.
| Scénario | Âge (ans) | Concentration maximale dans le produit (%) | Exposition estimée (mg/kg p.c./j)a |
|---|---|---|---|
| Traitement de blanchiment dentaire (voie orale) | 19 et plus | 3b | 2,9 × 10-1 |
| Marqueurs (voie orale) | 0,5 à 1 | 5c | 2,7 × 10-1 |
| Lotion corporelle (inhalation) | 9 à 13 | 0,1b | 2,6 × 10-3 |
| Fixatif (inhalation) | 19 et plus | 0,3b | 3,2 × 10-3 |
| Désinfectant pour les mains (inhalation) | 4 à 8 | 1e | 6,2 × 10-3 |
| Désinfectant pour les mains (inhalation) (scénarios préoccupants pour la santé publiqued) | 2 à 3 | 1e | 1,4 × 10-1 |
| Écran solaire (inhalation) | 4 à 8 | 0,2f | 3,0 × 10-2 |
| Vaporisateur anti-odeurs tout usage (inhalation) | 19 et plus | 1g | 4,2 × 10-3 |
a Les expositions sont estimées à partir de la « dose interne le jour de l’exposition », calculée à l’aide de ConsExpo Web (2021). Cette valeur représente la somme des doses internes pour de multiples événements qui ont lieu la même journée, le cas échéant. Voir l’annexe C pour obtenir plus de détails.
b Communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 29 septembre 2021 et 4 mai 2022; source non citée.
c FDS, 2016b.
d Dans les cas préoccupants pour la santé publique, l’utilisation de désinfectant pour les mains dans la population générale peut atteindre jusqu’à 25 applications par jour (utilisation personnelle par les adultes, utilisation accrue chez les enfants dans les écoles et les garderies) (RIVM, 2021).
e FDS, 2020.
f Communication personnelle, courriel de la DMP, SC, au BERSE, SC, 28 septembre 2021; source non citée.
g FDS, 2015.
6.1.3 Prise en compte des sous-populations qui peuvent être plus fortement exposées
Certains groupes de personnes de la population canadienne, en raison d’une plus grande exposition, peuvent être plus susceptibles de subir des effets nocifs pour la santé découlant de l’exposition à des substances. Le potentiel d’exposition élevée dans la population canadienne a été étudié. Les estimations d’exposition sont régulièrement évaluées selon l’âge pour tenir compte des différences physiques et comportementales à différentes étapes de la vie. Lors de l’évaluation de l’exposition de fond à partir des milieux de l’environnement, des aliments et de l’eau potable, les jeunes enfants étaient plus exposés que les adultes. Les nourrissons nourris aux préparations pour nourrissons étaient plus exposés que ceux nourris au lait maternel (en raison de l’eau potable utilisée pour reconstituer la préparation) et que les adultes. Dans le cadre de l’évaluation de l’exposition au tert-butanol à partir de produits offerts aux consommateurs, les produits utilisés par les enfants qui ont été évalués comprenaient les marqueurs, les lotions corporelles, les fixatifs, les écrans solaires et les désinfectants pour les mains. Les personnes vivant près de rejets industriels ont aussi été prises en compte dans l’évaluation du tert-butanol.
6.2 Évaluation des effets sur la santé
Le propan-1-ol (PISSC, 1990a; CE, 2008; EPA, 2005, 2007a), le propan-2-ol (EPA, 2007b, 2014; CE, 2015), le propylèneglycol (OCDE, 2001; EPA, 2008), l’alcool isobutylique (OCDE, 2004a) et le tert-butanol (ECHA, 2019; EPA, 2021) ont été examinés à l’échelle internationale. L’ARLA de Santé Canada a aussi examiné le propan-2-ol (sous le nom « alcool isopropylique ») (2017a, 2018b) et le propylèneglycol (2008a, 2008b). Le propan-2-ol n’est pas classé d’après sa cancérogénicité pour les humains (CIRC, groupe 3) (CIRC, 1999). L’ébauche d’évaluation préalable du groupe d’alcools présente des renseignements sur les risques pour la santé associés au butan‑1-ol (ECCC, SC, 2022). Il existe également un examen d’un rapport d’évaluation de l’ECHA (2018) portant sur le butan-1-ol, l’analogue de l’alcool isobutylique. Le tert‑butanol a aussi été examiné par le NTP (1995, 1997). Ces examens ont servi à étayer la caractérisation des effets sur la santé dans la présente ébauche d’évaluation préalable. À la lumière de la classification sur le plan de la cancérogénicité, de la génotoxicité et de la toxicité pour le développement ou la reproduction réalisée par d’autres organismes nationaux ou internationaux, aucune de ces substances n’a été jugée très dangereuse pour la santé humaine.
À l’opposé du tert-butanol, cinq substances (propan-1-ol, propan-2-ol, propylèneglycol, alcool isobutylique et pentan-1-ol) ont été évaluées au moyen de l’approche décrite dans le document d’évaluation scientifique concernant les substances présentant un faible danger pour la santé humaine (Santé Canada, 2019). On considère que ces substances présentent un faible potentiel de danger, étant donné qu’aucun effet nocif n’a été observé après des expositions systémiques par inhalation ou par voie orale à des doses allant jusqu’à 1000 mg/kg p.c./j (aucune étude de toxicité par voie cutanée pertinente n’était accessible) et que les renseignements disponibles indiquent une préoccupation faible à l’égard d’effets génotoxiques, pour le développement ou pour la reproduction.
6.2.1 Propan-1-ol
Le propan-1-ol se répartit rapidement dans l’ensemble du corps à la suite d’une exposition orale. Il est métabolisé en propionaldéhyde et en acide propionique par l’alcool et l’aldéhyde déshydrogénases. Le propan-1-ol est rapidement éliminé du corps; sa demi-vie chez le rat est de 45 minutes après l’administration par voie orale d’une dose de 1000 mg/kg p.c. Il est excrété (inchangé et/ou sous forme de métabolites) par l’urine ou l’air expiré (PISSC, 1990a).
Dans le cadre d’une étude par voie orale de quatre mois réalisée avec des rats mâles exposés à des concentrations de 0 ou 60,1 g/L (3300 mg/kg p.c./j) de propan-1-ol dans l’eau potable (Lington et Bevan, 1991, cité dans PISSC, 1990a, et EPA, 2005), aucun effet n’a été observé.
Dans le cadre d’une étude sur la tératologie comportementale chez des rats SD, les animaux ont été exposés (corps entier) à des concentrations de 0, 8 700 ou 17 000 mg/m3 (équivalant à 0, 2 870 ou 5 608 mg/kg p.c./j) de propan-1-ol par inhalation (7 h/j, 7 j/sem.) pendant la période gestationnelle pour les femelles et six semaines pour les mâles. Sept essais réalisés du jour postnatal (JPN) 10 au JPN 90 environ ont servi à évaluer les fonctions du système nerveux central (SNC) comme la capacité neuromusculaire, l’activité et l’apprentissage chez les petits. Aucune différence entre les groupes exposés et les groupes témoins n’a été observée dans aucun des essais. Aucune différence dans le nombre de petits vivants par portée, la durée de la gestation, le poids à la naissance ou la survie néonatale n’a été observée entre les groupes exposés et les groupes témoins. On a observé des cas d’infertilité chez les mâles et des queues croches chez les petits à la dose la plus élevée. Toutefois, tous les mâles infertiles ont pu produire des portées dans les 13 semaines suivant l’exposition et ont donc retrouvé leur fertilité (Nelson et al., 1989a, cité dans PISSC, 1990a).
Dans le cadre d’une étude de toxicité pour le développement, des rats SD ont été exposés (7 h/j) par inhalation (corps entier) à des concentrations de 0, 8 600, 17 000 ou 26 000 mg/mg3 (équivalant à 0, 2 837, 4 948 ou 7 917 mg/kg p.c./j) de propan-1-ol aux jours de gestation (JG) 1 à 19. Aucune toxicité maternelle n’a été observée jusqu’à la dose d’essai la plus élevée. À 17 000 mg/m3 et plus, on a observé une baisse du poids corporel des fœtus et une diminution de la consommation alimentaire. À 26 000 mg/m3, on a observé des malformations externes (queue courte ou manquante, ectrodactylie), des malformations squelettiques (côtes cervicales rudimentaires) et des malformations viscérales (malformations cardiovasculaires ou urinaires) (Belson et al., 1988, cité dans PISSC, 1990a).
Globalement, un potentiel génotoxique a été relevé pour le propan-1-ol, d’après les essais de mutation inverse in vitro négatifs (Hudolei et al., 1987, cité dans PISSC, 1990a) ainsi que le test du micronoyau et l’essai d’échange de chromatides sœurs in vitro négatifs (Hilscher, 1969, cité dans PISSC, 1990a). Aucune étude de cancérogénicité portant sur le propan-1-ol n’a été recensée.
6.2.2 Propan-2-ol
Bien que des examens effectués par l’ARLA (Santé Canada, 2017a, 2018b) et l’EPA (2007b, 2014) soient disponibles pour le propan-2-ol, l’examen de la CE (2015) a servi de base pour décrire les effets sur la santé humaine, puisque plus de détails sur les études étaient rapportés dans ce document.
Plus de 99 % du propan-2-ol est absorbé après l’administration d’une seule dose par voie orale (Slauter et al., 1995, cité dans CE, 2015) et une exposition par inhalation (Laham et al., 1980, cité dans CE, 2015). L’oxydation produit de l’acétone comme principal métabolite. Environ 60 % de la dose de propan-2-ol administrée est récupérée sous forme d’acétone dans l’air expiré, et 4 % dans l’urine. La part de propan-2-ol excrétée était de 15 % dans l’air et de moins de 1 % dans l’urine (Slauter et al., 1994, cité dans CE, 2015).
Dans le cadre d’une étude de 12 semaines sur l’eau potable, une exposition à des doses de 0, 870 ou 1 280 mg/kg p.c./j de propan-2-ol n’a entraîné aucun effet nocif chez des rats Wistar (Pilegaard et Ladefoged, 1993, cité dans CE, 2015).
Dans le cadre d’une étude de 13 semaines sur l’exposition de rats Fischer 344 (F344) et de souris CD-1 par inhalation (corps entier) à des concentrations de 0, 246, 1 229, 3 687 ou 12 300 mg/m3 de propan-2-ol (ce qui équivaut respectivement à des doses de 0, 97, 487, 2 433 ou 4 865 mg/kg p.c./j et de 0, 132, 659, 3 295 ou 6 589 mg/kg p.c./j) pendant 6 h/j, 5 j/sem., on a observé une hausse du poids relatif des reins chez les rats mâles à la dose la plus élevée, ainsi qu’une hausse de la taille et de la fréquence de formation de gouttelettes hyalines à toutes les doses. Une hausse du volume corpusculaire moyen (VCM) des érythrocytes et de la teneur corpusculaire moyenne en hémoglobine (TCMH) a été observée chez les rats mâles traités, et une hausse du VCM et de la consommation d’eau a été rapportée pour les rats femelles à une concentration de 1 229 mg/m3 et plus. Des valeurs élevées de VCM et de TCMH ont aussi été observées chez les souris femelles à la dose la plus élevée (Burleigh-Flayer et al., 1994, cité dans CE, 2015). Conformément à la ligne directrice de l’EPA sur l’α2µ-globuline, les effets rénaux chez les rats mâles n’ont pas été jugés significatifs sur le plan toxicologique, car on ne dispose pas de suffisamment de données pour déterminer la contribution relative d’une néphropathie induite par les α2µ-globulines aux effets rénaux et sa pertinence pour les humains (EPA, 2021).
Dans le cadre d’une étude de toxicité pour la reproduction réalisée sur deux générations, aucun effet nocif n’a été observé chez des rats SD ayant reçu par gavage une dose quotidienne de 0, 100, 500 ou 1 000 mg/kg p.c./j de propan-2-ol (Bevan, 1995, cité dans CE, 2015). Lors d’une étude de toxicité pour le développement, une exposition par gavage de rats femelles à des doses de 0, 400, 800 ou 1 200 mg/kg p.c./j de propan-2-ol aux JG 6 à 15 n’a entraîné aucun effet sur le développement. De même, l’exposition par gavage de lapins blancs néo-zélandais femelles à des doses de 0, 120, 240 ou 480 mg/kg p.c./j de propan-2-ol aux JG 6 à 18 dans le cadre de la même étude n’a entraîné aucune toxicité pour le développement des fœtus (Tyl et al., 1994, cité dans CE, 2015). De plus, dans le cadre d’une étude de neurotoxicité pour le développement, aucun effet nocif n’a été observé sur le système nerveux en développement des petits à la suite de l’administration par voie orale (gavage) de doses de 0, 200, 700 ou 1 200 mg/kg p.c./j de propan-2-ol à des rats SD du JG 6 au JPN 21 (Bates et al., 1994, cité dans CE, 2015).
Le propan-2-ol ne s’est pas révélé mutagène dans des systèmes de cellules bactériennes et mammaliennes in vitro, avec et sans activation métabolique (essai de mutation inverse, SOS Chromotest, échange de chromatides sœurs de cellules de mammifères et essai sur des cellules de mammifères HGPRT) ni dans des systèmes in vivo (test du micronoyau) (CE, 2015).
Dans le cadre d’une étude de deux ans sur l’exposition par inhalation (corps entier) combinant la toxicité chronique et la cancérogénicité, des rats F344 (65 sujets/sexe/dose, dont 10 sujets/sexe/dose ont été sacrifiés après 54 semaines) ont été exposés à des concentrations de 0, 1 239, 6 167 ou 12 380 mg/m3 (équivalant à 0, 490, 2 441 ou 4 901 mg/kg p.c./j) de propan-2-ol (6 h/j, 5 j/sem.). À 490 mg/kg p.c./j, une hausse du poids des testicules a été observée chez les mâles, et une hausse du poids relatif et absolu du foie a été observée tant chez les mâles que chez les femelles. À une dose de 2 441 mg/kg p.c./j et plus, une hausse du poids corporel ou du gain de poids corporel ainsi qu’une hausse du poids relatif et/ou absolu des reins ont été observées chez les mâles et les femelles. Des effets rénaux ont été observés chez les mâles (hausse des cas de protéinose des tubules rénaux, de glomérulosclérose, de néphrite interstitielle, de fibrose interstitielle, de minéralisation, de dilatation des tubules rénaux, d’hydronéphrose et d’hyperplasie des cellules transitionnelles). Aux mêmes doses, une hausse des cas d’adénomes des cellules interstitielles des testicules a aussi été observée chez les mâles, mais la CE (2015) n’a pas jugé que cet effet était lié au traitement en raison du nombre anormalement bas de cas dans le groupe témoin. L’EPA (2007b) a attribué cet effet à une hyperplasie marquée plutôt qu’à une croissance autonome. Une baisse de l’osmolalité et une hausse des protéines totales, du volume et du taux de glucose ont aussi été observées chez les mâles aux deux doses les plus élevées et chez les femelles à 4 901 mg/kg p.c./j (Burleigh-Flayer et al., 1997, cité dans CE, 2015).
Dans le cadre d’une étude de 78 semaines sur l’exposition par inhalation (corps entier) combinant la toxicité chronique et la cancérogénicité, des groupes de 45 souris CD-1 (55 sujets/sexe/dose, dont 10 sujets/sexe/dose ont été sacrifiés après 54 semaines) ont été exposés à des concentrations de 0, 1 239, 6 167 ou 12 380 mg/m3 (équivalant à 0, 664, 3 306 ou 6 638 mg/kg p.c./j) de propan-2-ol. Une hausse des cas de protéinose des tubules rénaux a été observée à toutes les doses d’essai chez les mâles et les femelles. À 3 306 mg/kg p.c./j, une hausse des cas d’hypertrophie de la vésicule séminale a été observée chez les mâles (Burleigh-Flayer et al., 1997, cité dans CE, 2015).
6.2.3 Propylèneglycol
Le propylèneglycol est absorbé par le tractus gastro-intestinal à la suite d’une administration orale. Il est rapidement éliminé du sang, sa demi-vie étant d’environ 2 heures (OCDE, 2001).
Une exposition à doses répétées par le régime alimentaire à 0 ou 50 000 ppm (2 500 mg/kg p.c./j) de propylèneglycol pendant 15 semaines n’a entraîné aucune toxicité chez des rats SD (Gaunt et al., 1972, cité dans ECHA, c2020a).
Dans le cadre d’une étude de 140 jours sur l’eau potable, des rats de race inconnue ont été exposés à des doses de 0, 1 600, 3 680, 7 700, 13 200, 21 000 ou 37 000 mg/kg p.c./j de propylèneglycol. Peu de paramètres ont été examinés. Tous les animaux recevant les deux doses les plus élevées sont morts. Aucun effet nocif n’a été observé aux autres doses (Seidenfeld et Hanzlik, 1932, cité dans ECHA, c2020a). Dans le cadre d’une étude de toxicité chronique de deux ans, des chiens de race Beagle ont reçu dans leur alimentation des doses de 0, 2 000 ou 5 000 mg/kg p.c./j de propylèneglycol. À la dose d’essai la plus élevée, on a observé des effets (comme une diminution du nombre d’érythrocytes, du taux d’hémoglobine et de l’hématocrite, et une hausse du nombre de réticulocytes) indiquant une destruction des érythrocytes accompagnée d’un remplacement accéléré à partir de la moelle osseuse. Aucun autre effet nocif n’a été observé (Wiel et al., 1971, cité dans ECHA, c2020a).
Dans le cadre d’une étude de toxicité pour la reproduction réalisée sur deux générations, des rats ont été exposés au propylèneglycol dans l’eau potable à des doses de 0, 1 820, 4 800 ou 10 100 mg/kg p.c./j. Aucun effet sur les parents, la reproduction ou les petits n’a été observé (Morrissey et al., 1989, cité dans ECHA, c2020a).
Aucune preuve de génotoxicité n’a été relevée dans le cadre d’études in vitro (cultures et cellules bactériennes et mammaliennes) ou in vivo (test du micronoyau, essai de létalité dominante, test d’aberration chromosomique) réalisées avec du propylèneglycol (OCDE, 2001).
Dans le cadre d’une étude de cancérogénicité de deux ans, des groupes de 30 rats SD ont reçu dans leur alimentation des concentrations de 0, 6 250, 12 500, 25 000 ou 50 000 ppm (équivalant à 0, 312, 625, 1 250 ou 2 500 mg/kg p.c./j) de propylèneglycol. Aucun effet nocif ni potentiel de cancérogénicité n’a été observé (Gaunt et al., 1972, cité dans ECHA, c2020a).
6.2.4 Alcool isobutylique
L’alcool isobutylique est rapidement absorbé après une exposition par inhalation ou par voie orale. Il est métabolisé en isobutyraldéhyde et en acide isobutyrique par l’alcool et l’aldéhyde déshydrogénases. L’alcool isobutylique est rapidement éliminé du sang (OCDE, 2004a).
Aucun effet important n’a été observé dans le cadre d’une étude de 13 semaines sur l’exposition orale (par gavage) de rats SD à des doses de 0, 100, 316 ou 1 000 mg/kg p.c./j d’alcool isobutylique. Une hypoactivité et une ataxie transitoires observées à la dose d’essai la plus élevée (1 000 mg/kg p.c./j) n’ont pas été considérées comme des effets nocifs, étant donné que le nombre de cas a diminué à la semaine 4 et que les effets n’ont été observés que sporadiquement par la suite (EPA, 1986). De même, lors d’une étude de neurotoxicité de 13 semaines portant sur l’exposition par inhalation (corps entier), aucun effet n’a été observé après l’exposition de rats SD à des concentrations de 0, 760, 3 030 ou 7 580 mg/m3 (équivalant à 0, 860, 3 427 ou 8 573 mg/kg p.c./j) d’alcool isobutylique (Branch, 1996, cité dans OCDE, 2004a).
Dans le cadre d’une étude de toxicité pour la reproduction réalisée sur deux générations, aucune toxicité pour les parents, la reproduction ou les petits n’a été observée chez des rats SD exposés par inhalation (corps entier) à des concentrations de 0, 1 520, 3 030 ou 7 580 mg/m3 (équivalant à 0, 430, 857 ou 2 143 mg/kg p.c./j) d’alcool isobutylique (6 h/j, 7 j/sem.) (WIL Res. Labs, 2003, cité dans OCDE, 2004a). Lors d’études de toxicité pour le développement, l’exposition par inhalation de rats SD (JG 6 à 15) et de lapins (JG 7 à 19) à des concentrations de 0, 500, 1 000 ou 10 000 mg/m3 (équivalant à 0, 141, 283 ou 2 828 mg/kg p.c./j pour les rats) d’alcool isobutylique (6 h/j, 7 j/sem.) n’a entraîné aucun effet observable chez les mères ou les fœtus (BASF, 1990a, 1990b).
Dans le cadre d’une étude de toxicité pour le développement réalisée avec des rats SD, les mères ont reçu des doses de 0, 316, 1 454 ou 5 654 mg/kg p.c./j de l’analogue butan-1-ol dans l’eau potable tout au long de la grossesse (JG 0 à 20) (Ema et al., 2005, cité dans ECHA, 2018). Une dose sans effet nocif observé (DSENO) de 1 454 mg/kg p.c./j a été déterminée pour les effets sur les mères et le développement, d’après une diminution du gain de poids corporel chez les mères, une diminution du poids des fœtus et une hausse des variations squelettiques (surtout des côtes surnuméraires courtes) à 5 654 mg/kg p.c./j, ce qui dépasse la dose limite (ECHA, 2018).
L’alcool isobutylique ne s’est pas révélé mutagène dans le cadre de plusieurs études in vitro et d’un test du micronoyau in vivo réalisé avec des souris. Bien qu’aucune étude de cancérogénicité n’ait été recensée, la cancérogénicité de l’alcool isobutylique est peu préoccupante, étant donné la génotoxicité négative et l’absence de cancérogénicité pour le propan-1-ol, le propan-2-ol et le propylèneglycol.
6.2.5 Pentan-1-ol
Le pentan-1-ol se répartit rapidement dans le corps après une seule exposition par inhalation (Oxo Process Panel – ACC, 2004, cité dans ECHA, c2020c). Il est métabolisé en acide pentanoïque par l’alcool déshydrogénase (Ehrig et al., 1988, cité dans ECHA, c2020c). Le pentan-1-ol est excrété par l’urine ou l’air expiré (Haggardet et al., 1945, cité dans ECHA, c2020c).
Dans le cadre d’une étude de 13 semaines à doses répétées, des rats Ash/CSE ont été exposés par voie orale (gavage) à des doses de 0, 50, 150 ou 1 000 mg/kg p.c./j de pentan-1-ol. Aucun effet lié au traitement n’a été observé (Butterworth et al., 1978, cité dans ECHA, c2020c).
Dans le cadre d’une étude de toxicité pour le développement, des rats SD ont été exposés par inhalation (corps entier) à des concentrations de 0 ou 14 000 mg/mg3 (équivalant à 0 ou 4 618 mg/kg p.c./j) de pentan-1-ol pendant 7 heures par jour durant les JG 1 à 19 (Nelson et al., 1989b). Aucun effet sur les mères ou le développement n’a été observé.
Lors d’une étude de toxicité à doses répétées combinée à un essai de dépistage de la toxicité pour la reproduction et le développement, des rats Wistar ont été exposés à des doses de 0, 77, 254 ou 842 mg/kg p.c./j (mâles), ou de 0, 177, 372 ou 1 239 mg/kg p.c./j (femelles) d’alcool isopentylique, un analogue, dans l’eau potable. Aucun effet nocif n’a été observé jusqu’à la dose d’essai la plus élevée (ECHA, c2020c).
Le pentan-1-ol ne s’est pas révélé génotoxique dans le cadre d’un essai de mutation inverse. De plus, on a obtenu des résultats négatifs lors d’études in vitro (Szybalski, 1958, cité dans ECHA, c2020c) et in vivo (essai de mutation inverse, essai de mutation génique sur des cellules de mammifères et test du micronoyau) réalisées avec son analogue, l’alcool isopentylique (ECHA, c2020c). Bien qu’aucune étude de cancérogénicité n’ait été recensée pour le pentan-1-ol ou l’alcool isopentylique, la cancérogénicité du pentan-1-ol est peu préoccupante, étant donné la génotoxicité négative et l’absence de cancérogénicité pour le propan-1-ol, le propan-2-ol et le propylèneglycol.
6.2.6 tert-Butanol
Le tert-butanol est un dépresseur du SNC qui touche les reins (LeBlanc et Kalant, 1975, cité dans NTP, 1997). L’interprétation des effets rénaux chez les rats F344/N mâles est perturbée par la contribution incertaine de l’α2µ-globuline, étant donné qu’une néphropathie induite par les α2µ-globulines touchant les mâles n’est pas considérée comme pertinente pour les humains. L’EPA (2021) a jugé qu’en général, les renseignements disponibles démontrent que le tert-butanol entraîne une néphropathie induite par les α2µ-globulines, tandis que l’ECHA (2019) n’a pas écarté le fait qu’une néphropathie progressive chronique puisse constituer un autre mécanisme d’action potentiel. Cette divergence d’opinions a influé sur le choix des points de départ de chaque organisation, qui sont présentés lorsque disponibles. La présente évaluation concorde avec les points de départ choisi par l’EPA et concorde en général avec ceux choisis par l’ECHA, sauf indication contraire.
L’EPA (2021) a rapporté que le tert-butanol est rapidement absorbé après une exposition par inhalation ou par voie orale, des études indiquant que la substance est absorbée à 99 % après une administration orale. Les concentrations sanguines observées de tert-butanol sont comparables après une exposition aiguë par voie orale et par inhalation. La substance se répartit dans tout le corps après l’exposition (ARCO, 1983, cité dans EPA, 2021). D’après McGregor (2010), le tert-butanol n’est pas métabolisé par l’alcool déshydrogénase, contrairement aux autres alcools, mais par un système d’oxydases microsomales (cytochrome P450). Dans le cadre d’études chez les humains réalisées avec du 2-méthoxy-2-méthylpropane et de l’éther de t-butyle et d’éthyle, qui se métabolisent en tert-butanol, l’excrétion urinaire du tert-butanol était inférieure à 1 % de l’absorption, avec une demi-vie d’excrétion d’environ 8 heures (Nihlén et al., 1998, cité dans EPA, 2021). D’autres études rapportent qu’à des doses plus élevées, la voie de l’excrétion urinaire devient saturée et que le tert-butanol est alors excrété par l’air expiré. L’élimination, qui se faisait principalement par l’urine à une concentration de 500 ppm (équivalant à 1 401 mg/kg p.c./j), s’est donc ensuite faite principalement par l’expiration, à une concentration de 5 000 ppm (équivalant à 14 003 mg/kg p.c./j) chez des rats F344/N (Borghoff et Asgharian, 1996, cité dans EPA, 2021).
Dans le cadre d’une étude de 13 semaines par voie orale, des rats F344/N adultes (10 sujets/sexe/groupe) ont été exposés à des doses de 0, 230/290, 490/590, 840/850, 1 520/1 560 ou 3 610/3 620 mg/kg p.c./j (mâles/femelles) de tert-butanol dans l’eau potable (NTP, 1995). Aux doses de 230/290 mg/kg p.c./j et plus, on a observé des cas de néphropathie chez les mâles et une hausse du poids absolu et relatif des reins chez les femelles. À 490 mg/kg p.c./j et plus, une hausse du poids relatif du foie et une accumulation de gouttelettes hyalines dans les reins ont été observées chez les mâles. Aux doses de 840/850 mg/kg p.c./j et plus, on a observé des effets généraux et sur le système urinaire, comme une diminution du volume d’urine chez les deux sexes, une minéralisation accrue dans les reins et une baisse du poids corporel chez les mâles, ainsi que des cas de néphropathie chez les femelles, d’une gravité semblable à celle des cas chez les sujets témoins. À 1 520 mg/kg p.c./j et plus chez les mâles et 3 620 mg/kg p.c./j chez les femelles, on a observé une hausse des cas d’hyperplasie des cellules transitionnelles et d’inflammation de la muqueuse vésicale. Aux doses de 3 610/3 620 mg/kg p.c./j, on a observé de la mortalité chez les deux sexes et une baisse du poids corporel chez les femelles. L’ECHA (2019) a choisi une dose minimale avec effet nocif observé (DMENO) de 230 mg/kg p.c./j pour cette étude d’après les effets rénaux observés chez les rats mâles. Dans la présente évaluation, on considère que sa pertinence pour les humains est perturbée par la contribution potentielle d’une néphropathie induite par les α2µ-globulines, un résultat d’une pertinence incertaine pour les humains (comme abordé précédemment; voir plus bas). Une hausse du poids du foie chez les mâles à une dose de 490 mg/kg p.c./j et une hausse du poids des reins chez les femelles à 290 et 590 mg/kg p.c./j n’ont pas été considérées comme des effets nocifs en l’absence d’autres changements appuyant cette hypothèse. Dans la présente évaluation, on a considéré que la DSENO est de 490 mg/kg p.c./j.
Dans le cadre d’une étude de 13 semaines par voie orale, des souris B6C3F1 adultes (10 sujets/sexe/groupe) ont été exposées à des doses de 0, 350/500, 640/820, 1 590/1 660, 3 940/6 430 ou 8 210/11 620 mg/kg p.c./j (mâles/femelles) de tert-butanol dans l’eau potable (NTP, 1995). Une diminution du poids corporel moyen final ainsi qu’une hausse des cas d’hyperplasie des cellules transitionnelles et d’inflammation de la muqueuse vésicale ont été observées à 3 940 mg/kg p.c./j et plus chez les mâles et à 11 620 mg/kg p.c./j chez les femelles. On a observé de la mortalité chez les deux sexes à la dose la plus élevée. L’ECHA (2019) a choisi une DSENO de 1 590 mg/kg p.c./j.
Dans le cadre d’une étude de 18 jours sur l’exposition par inhalation (corps entier), des rats F344/N ont été exposés à des concentrations de 0, 406, 825, 1 643, 3 274 ou 6 369 mg/m3 de tert-butanol (ce qui équivaut à 0, 463, 926, 1 852 ou 3 703 mg/kg p.c./j) (NTP, 1997). Chez les rats recevant une concentration de 825 mg/m3 et plus, on a observé une ataxie, une hyperactivité et une hypoactivité. À 3 274 mg/m3, une diminution du poids corporel et du poids du thymus a été observée chez les deux sexes. Tous les rats sont morts à la dose la plus élevée. Pour cette étude, l’ECHA (2018) a choisi une concentration sans effet nocif observé (CSENO) de 406 mg/m3.
Dans le cadre d’une étude de 13 jours sur l’exposition par inhalation (corps entier), des rats F344/N ont été exposés à des concentrations de 0, 406, 825, 1 643, 3 274 ou 6 369 mg/m3 de tert-butanol (ce qui équivaut à 0, 162, 324, 648, 1 296 ou 2 520 mg/kg p.c./j), 6 h/j, 5 j/sem. (NTP, 1997). Une hausse de la gravité des cas de néphropathie chez les mâles a été observée à toutes les doses d’essai. À une concentration de 3 274 mg/m3 et plus, on a observé une diminution des valeurs de l’hématocrite, des concentrations en hémoglobine et du nombre d’érythrocytes ainsi qu’une hausse du poids absolu et relatif des reins chez les mâles. Chez les femelles, une hausse du poids relatif du foie a été observée à 3 274 mg/m3 et plus, et une hausse du poids relatif des reins, à 6 369 mg/m3. Une diminution de l’activité de la phosphatase alcaline a été observée à une concentration de 3 274 mg/m3 et plus chez les deux sexes. Il y avait également une baisse du pH de l’urine à 3 274 mg/m3 et plus chez les rats femelles et à 6 369 mg/m3 chez les mâles. L’ECHA (2019) a choisi une concentration minimale avec effet nocif observé (CMENO) de 406 mg/m3 d’après les cas de néphropathie chez les mâles, bien que la contribution de l’α2µ-globuline à la toxicité rénale chez les mâles soit incertaine. À l’opposé, l’EPA (2021) a choisi une CSENO de 6 369 mg/m3 d’après les effets rénaux chez les femelles, puisque la pertinence pour les humains des effets rénaux observés chez les rats mâles était perturbée par la contribution incertaine de l’α2µ-globuline. Dans la présente évaluation, les effets observés chez les femelles à une concentration de 3 274 mg/m3 (hausse du poids relatif du foie, diminution de l’activité de la phosphatase alcaline, baisse du pH de l’urine) n’ont pas été considérés comme nocifs en l’absence d’autres changements, et on a déterminé que la CSENO était de 6 369 mg/m3, ce qui concorde avec la conclusion de l’EPA (2021).
Dans le cadre d’une étude de 18 jours sur l’exposition par inhalation (corps entier), des souris B6C3F1 ont été exposées à des concentrations de 0, 1 385, 2 759, 5 305, 10 683 ou 21 294 mg/m3 de tert-butanol (ce qui équivaut à 0, 627, 1 254, 2 508, 5 015 ou 9 752 mg/kg p.c./j) (NTP, 1997). On a observé des cas d’ataxie, d’humidité de la région urogénitale, d’hypoactivité ou d’hyperactivité chez les deux sexes à une concentration de 5 305 mg/m3 et plus. À 10 683 mg/m3, il y avait aussi une respiration rapide et une hausse du poids relatif du foie chez les deux sexes, la mort d’un mâle et une diminution du poids absolu et relatif du thymus chez les femelles. Toutes les souris sont mortes à la dose la plus élevée. Pour cette étude, l’ECHA (2019) a choisi une CSENO de 2 759 mg/m3.
Lors d’une étude de 13 jours sur l’exposition par inhalation (corps entier), des souris B6C3F1 ont été exposées à des concentrations de 0, 406, 825, 1 643, 3 274 ou 6 369 mg/m3 de tert-butanol (ce qui équivaut à 0, 219, 439, 878, 1 755 ou 3 413 mg/kg p.c./j), 6 h/j, 5 j/sem. Chez les femelles, une diminution du gain de poids corporel moyen ainsi que du poids corporel moyen final a été observée à 3 274 mg/m3 et plus et à 6 369 mg/m3, respectivement. Une hausse du poids du foie a aussi été observée chez les femelles à une concentration de 3 274 mg/m3 et plus. Un nombre accru de neutrophiles segmentés a été observé chez les mâles à 6 369 mg/m3, tandis qu’une mortalité a touché les mâles à une concentration de 3 274 mg/m3 et plus (NTP, 1997). Pour cette étude, l’ECHA (2019) a choisi une CSENO de 1 643 mg/m3.
Dans le cadre d’une étude de toxicité pour la reproduction et le développement, des rats SD ont été exposés par voie orale (gavage) à des doses de 0, 64, 160, 400 ou 1 000 mg/kg p.c./j de tert-butanol, 4 semaines avant l’accouplement, puis ont été sacrifiés après 9 semaines pour les parents mâles, au JPN 21 pour les parents femelles et au JPN 27 pour les petits. À une dose de 160 mg/kg p.c./j et plus, une hausse du poids relatif des reins chez les parents mâles a été observée. À 400 mg/kg p.c./j, une réduction de la consommation alimentaire et une diminution du gain de poids ont été observées chez les parents. À 1 000 mg/kg p.c./j, on a observé des effets sur le SNC (léthargie, ataxie, vocalisation accrue et respiration rapide) chez les parents ainsi qu’une hausse du poids des organes (hausse du poids absolu des reins, du poids relatif du foie et du poids relatif des testicules) chez les parents mâles. Aucun effet nocif sur l’efficacité de reproduction, la fertilité ou les organes reproducteurs n’a été observé. À 1 000 mg/kg p.c./j, on a observé une réduction de la taille moyenne des portées et du nombre de petits vivants par grossesse, une hausse du nombre de petits mort-nés et de la mortalité chez les petits, ainsi qu’un poids corporel moyen réduit chez les petits à la naissance, lequel a persisté jusqu’au sevrage (ECHA, c2020b). Pour cette étude, l’ECHA (2019) a choisi une DSENO de 64 mg/kg p.c./j pour les effets sur les parents, de 1 000 mg/kg p.c./j pour la toxicité pour la reproduction et de 400 mg/kg p.c./j pour les effets sur les petits.
L’ECHA (2019) a décrit une étude de toxicité pour le développement prénatal réalisée sans ligne directrice, lors de laquelle des souris Swiss Webster ont été exposées dans leur alimentation à des doses de 0, 3 270, 4 521 ou 6 250 mg/kg p.c./j de tert-butanol aux JG 6 à 20 (Daniel et Evans, 1982, cité dans ECHA, 2019). Le poids des mères a été consigné aux jours 5, 10, 15 et 20 de grossesse. Des mesures physiologiques comprenant la durée de la gestation, les anomalies structurales importantes et le nombre de morts ont été consignées dans les 24 heures suivant la parturition. Des portées ont été choisies pour la réalisation d’études comportementales (réflexe de redressement, géotaxie négative, comportement en arène ouverte, évitement de chute, performance au test de la tige tournante). Les résultats des essais, à l’exception du test de la tige tournante, ont été consignés un jour sur deux, du jour 2 au jour 10. Les évaluations du test de la tige tournante ont été effectuées un jour sur deux, du jour 14 au jour 22, inclusivement. Le poids corporel des mères a diminué au jour 20 de grossesse à une dose de 4 521 mg/kg p.c./j et plus. Une diminution de la taille, du nombre, du poids et de la viabilité des portées a été observée à une dose de 3 270 mg/kg p.c./j et plus. À 4 521 mg/kg p.c./j et plus, il y avait aussi des effets chez les petits, comme un réflexe de redressement retardé (jours 4 à 6), des différences de performance à l’essai en arène ouverte (jours 4 à 6), des retards dans l’évitement de chute (jours 6 à 10) et une performance moindre au test de la tige tournante (jours 18 à 22). L’étude était limitée par un manque de détails (par exemple moment où les fœtus ont été sacrifiés). L’ECHA (2019) n’a pas déterminé de DSENO ni de DMENO pour cette étude.
Dans le cadre d’une étude de toxicité pour le développement prénatal, des rats SD ont été exposés par inhalation (corps entier) à des concentrations de 0, 6 063, 10 610 ou 15 158 mg/m3 de tert-butanol, 7 h/j aux JG 1 à 19. L’ECHA (2019) a choisi une CMENO de 6 063 mg/m3 pour la toxicité pour les mères et le développement, d’après le poids corporel des fœtus en présence d’une démarche instable à 6 063 mg/m3 et plus, des malformations et variations squelettiques observées à 10 610 mg/m3 ainsi qu’une diminution du poids corporel des mères, une diminution de la consommation alimentaire et la présence de signes cliniques à 15 158 mg/m3 (Nelson, 1989b; ECHA, 2019).
Bien que les essais de mutation génique aient donné des résultats mitigés (McGregor, 2010), dans l’ensemble, on considère que les études de génotoxicité réalisées avec le tert-butanol ont donné des résultats négatifs in vitro (essais de mutation génique, d’échange de chromatides sœurs et d’aberration chromosomique) (NTP, 1995; McGregor, 2010; EPA, 2021). Quand on a administré du tert-butanol à des souris dans l’eau potable pendant 13 semaines (0, 350/500, 640/820, 1 590/1 660, 3 940/6 430 ou 8 210/11 620 mg/kg p.c./j [mâles/femelles]), il n’y a eu aucune augmentation du nombre d’érythrocytes micronucléés (NTP, 1995; McGregor, 2010; EPA, 2021).
Dans le cadre d’une étude combinée de toxicité chronique et de cancérogénicité d’une durée de deux ans, des groupes de 50 rats F344/N ont été exposés à des doses de 0, 90/180, 200/330 ou 420/650 mg/kg p.c./j de tert-butanol (mâles/femelles) dans l’eau potable (NTP, 1995). À une dose de 90 mg/kg p.c./j et plus, on a observé une diminution du poids corporel ainsi que des effets rénaux chez les mâles (hausse des cas d’hyperplasie focale des tubules rénaux, d’adénomes et de carcinomes, néphropathie, hyperplasie des cellules transitionnelles du rein). À 180 mg/kg p.c./j et plus, une hausse du poids absolu et relatif des reins a été observée chez les rats femelles exposés, accompagnée d’une hausse de la gravité des cas de néphropathie. Chez les rats mâles, la présence de gouttelettes hyalines et d’une régénération de l’épithélium des tubules rénaux ainsi qu’une hausse du poids relatif des reins ont été observées à une dose de 200 mg/kg p.c./j et plus. Une inflammation des reins a été observée à 330 mg/kg p.c./j et plus chez les femelles. Aux doses de 420/650 mg/kg p.c./j, une diminution du gain de poids corporel a été observée chez les mâles et une diminution du poids corporel, chez les femelles. Une hyperplasie des tubules rénaux a aussi été observée chez une femelle. L’ECHA (2019) a choisi une DMENO de 90 mg/kg p.c./j pour cette étude, d’après les effets rénaux chez les rats mâles, mais dans la présente évaluation, on considère que leur pertinence pour les humains est perturbée par la contribution potentielle d’une néphropathie induite par les α2µ-globulines, un résultat d’une pertinence incertaine pour les humains (comme abordé précédemment; voir plus bas).
Dans le cadre d’une étude combinée de toxicité chronique et de cancérogénicité d’une durée de deux ans, des groupes de 60 souris B6C3F1 ont été exposés à des doses de 0, 540/510, 1 040/1 020 ou 2 070/2 110 mg/kg p.c./j (mâles/femelles) de tert-butanol dans l’eau potable (NTP, 1995). À 540 mg/kg p.c./j et plus chez les mâles, il y a eu une hausse des cas d’hyperplasie des cellules folliculaires de la thyroïde, un effet qui n’a pas été observé chez les femelles avant une dose de 1 020 mg/kg p.c./j. Il y avait également une hyperplasie de l’épithélium des cellules transitionnelles et une inflammation chronique de la vessie, des effets qui n’ont pas été observés chez les femelles avant une dose de 2 110 mg/kg p.c./j. À 1 040 mg/kg p.c./j, il y avait une hausse des cas d’adénomes ou de carcinomes (combinés) des cellules folliculaires de la thyroïde chez les mâles. Aux doses de 2 070/2 110 mg/kg p.c./j (mâles/femelles), il y avait une hausse des cas de carcinomes bénins des cellules folliculaires de la thyroïde chez les mâles et d’adénomes chez les femelles (EPA, 2021). On a aussi observé une diminution du poids corporel chez les femelles ainsi qu’une diminution du gain de poids corporel chez les deux sexes. Bien que des effets aient été observés seulement chez les mâles à la plus faible dose, l’ECHA (2019) a choisi une DMENO de 510 mg/kg p.c./j pour cette étude, d’après les effets rénaux et sur la thyroïde chez les souris mâles. Un coefficient de cancérogénicité de 5 × 10-4 (mg/kg p.c./j)-1 pour l’exposition par voie orale a été déterminé d’après la hausse des cas d’adénomes ou de carcinomes des cellules folliculaires de la thyroïde observés chez les souris B6C3F1 mâles ou femelles (EPA, 2021).
L’exposition au tert-butanol entraîne une néphropathie propre aux rats mâles associée à la liaison du tert-butanol avec l’α2µ-globuline (Williams et Borghoff, 2001, cité dans EPA, 2021). Conformément à la ligne directrice de l’EPA sur l’α2µ-globuline, les tumeurs rénales chez les rats mâles ne conviennent pas à une analyse quantitative, car on ne dispose pas de suffisamment de données pour déterminer la contribution relative d’une néphropathie induite par les α2µ-globulines et d’autres processus à la réponse tumorale globale dans les reins (EPA, 2021). Une néphropathie progressive chronique peut aussi entraîner certains effets non cancérigènes, mais ces données sont compliquées par la néphropathie induite par les α2µ-globulines chez les mâles (EPA, 2021; NTP, 1995). En accord avec l’EPA (2021), dans la présente évaluation des effets sur la santé, les effets rénaux chez les rats F344/N mâles n’ont pas été pris en compte dans la caractérisation des risques, car on ne dispose pas de suffisamment de données pour déterminer la contribution relative d’une néphropathie induite par les α2µ-globulines aux effets rénaux et sa pertinence pour les humains.
6.2.7 Prise en compte des sous-populations qui peuvent être plus vulnérables
Certains groupes de personnes de la population canadienne, en raison d’une vulnérabilité accrue, peuvent être plus susceptibles de subir des effets nocifs pour la santé découlant de l’exposition à des substances. Le potentiel de vulnérabilité à différentes étapes de la vie ou selon le sexe a été étudié à partir des études disponibles. Dans la présente évaluation des effets sur la santé, les études ont notamment porté sur les différents sexes des animaux de laboratoire ainsi que sur les effets neurotoxiques et sur le développement chez les petits, les effets sur la reproduction chez les animaux gravides et les effets chroniques et cancérigènes chez les sujets plus vieux. D’après les renseignements disponibles, aucune étape de la vie ni aucun sexe en particulier n’a été jugé plus vulnérable que les autres pour n’importe quelle substance de ce groupe.
6.3 Caractérisation des risques pour la santé humaine
6.3.1 Propan-1-ol, propan-2-ol, propylèneglycol, alcool isobutylique et pentan-1-ol
On considère que le propan-1-ol, le propan-2-ol, le propylèneglycol, l’alcool isobutylique et le pentan-1-ol présentent un faible potentiel de danger, étant donné qu’aucun effet nocif n’a été observé après des expositions orales ou des expositions systémiques équivalentes par inhalation à des doses allant jusqu’à la dose limite de 1 000 mg/kg p.c./j et que les renseignements disponibles indiquent une préoccupation faible à l’égard d’effets génotoxiques, pour le développement ou pour la reproduction. Bien qu’aucune étude de cancérogénicité n’ait été recensée pour l’alcool isobutylique et le pentan-1-ol, leur cancérogénicité est peu préoccupante, étant donné la génotoxicité négative et l’absence de cancérogénicité pour le propan-1-ol, le propan-2-ol et le propylèneglycol. Par conséquent, les estimations quantitatives de l’exposition n’ont pas été calculées pour ces substances, et le risque pour la santé humaine associé au propan-1-ol, au propan-2-ol, au propylèneglycol, à l’alcool isobutylique et au pentan-1-ol est jugé faible.
6.3.2 tert-Butanol
Effets non cancérigènes sur la santé
Pour l’estimation des risques associés aux paramètres non cancérigènes du tert-butanol, une DMENO de 180 mg/kg p.c./j a été choisie d’après la hausse du poids absolu et relatif des reins et la gravité accrue des cas de néphropathie chez les rats femelles observées dans le cadre d’une étude combinée de toxicité chronique et de cancérogénicité d’une durée de deux ans avec exposition par l’eau potable (NTP, 1995). Elle a été choisie à des fins de comparaison avec les expositions par inhalation et par voie orale à long terme.
Bien que le rapport d’évaluation de l’ECHA (2019) indique une DMENO de 90 mg/kg p.c./j pour l’étude de toxicité chronique et de cancérogénicité avec exposition par l’eau potable d’après les effets rénaux observés chez les rats mâles ainsi qu’une DSENO de 64 mg/kg p.c./j pour l’essai de dépistage de la toxicité pour la reproduction et le développement par gavage d’après une hausse du poids des reins chez les rats parents mâles à une dose de 160 mg/kg p.c./j, cette étude et cet essai n’ont pas servi à caractériser les risques dans la présente évaluation des effets sur la santé humaine en raison de l’effet potentiellement confondant de l’α2µ-globuline sur les effets rénaux observés chez les mâles.
L’utilisation d’une DMENO de 180 mg/kg p.c./j pour estimer le risque associé aux expositions quotidiennes par inhalation et par voie orale est en accord avec l’EPA (2021). Toutefois, pour les expositions par voie orale, l’EPA (2021) a en plus appliqué un poids corporel à la mise à l’échelle à la puissance ¾ pour convertir la dose orale pour les animaux en une dose orale équivalente pour les humains de 43,2 mg/kg p.c./j. Pour les expositions par inhalation, l’EPA (2021) a converti cette DMENO en une concentration équivalente pour les humains au moyen d’un modèle pharmacocinétique basé sur la physiologie (PBPK) et d’un modèle de simulation en présumant de la même concentration sanguine moyenne de tert-butanol chez les deux espèces, ce qui a donné une concentration de 491 mg/m3 (188 mg/kg p.c./j).
D’après les incertitudes entourant l’utilisation d’un modèle PBPK pour extrapoler entre les voies d’exposition, la DMENO de 180 mg/kg p.c./j a été utilisée dans la présente évaluation des effets sur la santé humaine pour tenir compte du risque associé aux expositions quotidiennes par inhalation et par voie orale. De plus, pour l’inhalation, une DMENO de 180 mg/kg p.c./j accompagnée d’une marge d’exposition (ME) cible de 300 (10 fois pour l’extrapolation intraspécifique et la variation interspécifique, 3 fois pour l’utilisation d’une DMENO) se situe dans la même fourchette que la dose orale équivalente pour les humains de 43,2 mg/kg p.c./j utilisée par l’EPA. Les estimations d’exposition par événement et les ME n’ont pas été calculées pour le tert-butanol, car on n’a recensé aucun paramètre d’effet nocif pour la santé humaine pertinent pour l’exposition par événement.
Le tableau 6‑3 présente les expositions quotidiennes estimées et les doses d’effet critique pour le tert-butanol ainsi que les ME résultantes pour la détermination des risques d’effets non cancérigènes sur la santé.
| Scénario d’exposition | Groupe d’âge (ans) | Exposition systémique (mg/kg p.c./j)a | Dose d’effet critique (DMENO) (mg/kg p.c./j) | Paramètre d’effet critique pour la santé | ME |
|---|---|---|---|---|---|
| Milieux de l’environnement (voie orale et inhalation) | 1 | 1,8 × 10-3 | 180 | Effets rénaux (hausse du poids absolu et relatif des reins et gravité accrue des cas de néphropathie) chez les rats femelles lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable. | 100 000 |
| Traitement de blanchiment dentaire (voie orale) | 19 et plus | 2,9 × 10-1 | 180 | Effets rénaux (hausse du poids absolu et relatif des reins et gravité accrue des cas de néphropathie) chez les rats femelles lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable. | 620 |
| Marqueurs (voie orale) | 0,5 à 1 | 2,7 × 10-1 | 180 | Effets rénaux (hausse du poids absolu et relatif des reins et gravité accrue des cas de néphropathie) chez les rats femelles lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable. | 670 |
| Lotion corporelle (inhalation) | 9 à 13 | 2,6 × 10-3 | 180 | Effets rénaux (hausse du poids absolu et relatif des reins et gravité accrue des cas de néphropathie) chez les rats femelles lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable. | 69 000 |
| Fixatif (inhalation) | 19 et plus | 3,2 × 10-3 | 180 | Effets rénaux (hausse du poids absolu et relatif des reins et gravité accrue des cas de néphropathie) chez les rats femelles lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable. | 56 000 |
| Désinfectant pour les mains (inhalation) | 4 à 8 | 6,2 × 10-3 | 180 | Effets rénaux (hausse du poids absolu et relatif des reins et gravité accrue des cas de néphropathie) chez les rats femelles lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable. | 29 000 |
| Désinfectant pour les mains (inhalation) (scénarios préoccupants pour la santé publique) | 2 à 3 | 1,4 × 10-1 | 180 | Effets rénaux (hausse du poids absolu et relatif des reins et gravité accrue des cas de néphropathie) chez les rats femelles lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable. | 1 300 |
| Écran solaire (inhalation) | 4 à 8 | 3,0 × 10-2 | 180 | Effets rénaux (hausse du poids absolu et relatif des reins et gravité accrue des cas de néphropathie) chez les rats femelles lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable. | 6 000 |
| Vaporisateur anti-odeurs tout usage (inhalation) | 19 et plus | 4,2 × 10-3 | 180 | Effets rénaux (hausse du poids absolu et relatif des reins et gravité accrue des cas de néphropathie) chez les rats femelles lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable. | 43 000 |
Abréviations : DMENO, dose minimale avec effet nocif observé; ME, marge d’exposition.
a Les expositions sont estimées à partir de la « dose interne le jour de l’exposition », calculée à l’aide de ConsExpo Web (2021). Cette valeur représente la somme des doses internes pour de multiples événements qui ont lieu la même journée, le cas échéant. Voir l’annexe C pour obtenir plus de détails.
En ce qui concerne l’exposition au tert-butanol à partir des milieux de l’environnement, des traitements de blanchiment dentaire, des lotions corporelles, des fixatifs, des désinfectants pour les mains, des écrans solaires et des vaporisateurs anti-odeurs tout usage, les marges calculées pour les effets non cancérigènes sur la santé sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur les effets sur la santé et l’exposition.
Effets cancérigènes sur la santé
Un coefficient de cancérogénicité de 5 × 10-4 (mg/kg p.c./j)-1 pour l’exposition par voie orale calculé par l’EPA (2021) d’après la hausse des cas de tumeurs thyroïdiennes chez les souris a été utilisé pour estimer le risque quantitatif de cancer associé au tert-butanol pour la population canadienne. L’EPA (2021) n’a pas présenté de coefficient de cancérogénicité pour calculer le risque de cancer associé à l’exposition par inhalation en raison du nombre insuffisant d’études de toxicité chronique par inhalation et de données PBPK pour les souris. Étant donné la grande volatilité du tert-butanol, le risque quantitatif de cancer associé à l’exposition par inhalation a été estimé dans la présente évaluation des effets sur la santé humaine au moyen du coefficient de cancérogénicité pour l’exposition par voie orale calculé par l’EPA (2021). Les doses quotidiennes moyennes à vie (DQMV) pour le tert-butanol ont été calculées pour les expositions à partir des milieux de l’environnement, des traitements de blanchiment dentaire, des lotions corporelles, des fixatifs, des désinfectants pour les mains, des écrans solaires et des vaporisateurs anti-odeurs tout usage (annexe D) afin de calculer les valeurs de risque de cancer. Le tableau 6‑4 présente les DQMV, les doses d’effet critique ainsi que les valeurs de risque de cancer résultantes pour la détermination des risques d’effets cancérigènes associés au tert-butanol.
| Scénario d’exposition | Dose quotidienne moyenne à vie (mg/kg p.c./j)a | Dose d’effet critique (coefficient pour l’exposition par voie orale) (mg/kg p.c./j)-1 | Paramètre d’effet critique pour la santé | Valeur de risque de cancer |
|---|---|---|---|---|
| Milieux de l’environnement (voie orale et inhalation) | 6,4 × 10-4 | 5 × 10-4 | Hausse des cas de tumeurs thyroïdiennes chez les souris lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable | 3,2 × 10-7 |
| Traitement de blanchiment dentaire (voie orale) | 1,7 × 10-2 | 5 × 10-4 | Hausse des cas de tumeurs thyroïdiennes chez les souris lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable | 8,5 × 10-6 |
| Marqueurs (voie orale) | 2,4 × 10-3 | 5 × 10-4 | Hausse des cas de tumeurs thyroïdiennes chez les souris lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable | 1,2 × 10-6 |
| Lotion corporelle (inhalation) | 2,0 × 10-3 | 5 × 10-4 | Hausse des cas de tumeurs thyroïdiennes chez les souris lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable | 1,0 × 10-6 |
| Fixatif (inhalation) | 2,6 × 10-3 | 5 × 10-4 | Hausse des cas de tumeurs thyroïdiennes chez les souris lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable | 1,3 × 10-6 |
| Désinfectant pour les mains (inhalation) | 5,0 × 10-3 | 5 × 10-4 | Hausse des cas de tumeurs thyroïdiennes chez les souris lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable | 2,5 × 10-6 |
| Désinfectant pour les mains (inhalation) (scénarios préoccupants pour la santé publique) | 9,8 × 10-3 | 5 × 10-4 | Hausse des cas de tumeurs thyroïdiennes chez les souris lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable | 4,9 × 10-6 |
| Écran solaire (inhalation) | 1,0 × 10-2 | 5 × 10-4 | Hausse des cas de tumeurs thyroïdiennes chez les souris lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable | 5,0 × 10-6 |
| Vaporisateur anti-odeurs tout usage (inhalation) | 4,5 × 10-4 | 5 × 10-4 | Hausse des cas de tumeurs thyroïdiennes chez les souris lors d’une étude de toxicité chronique et de cancérogénicité de deux ans avec exposition par l’eau potable | 2,3 × 10-7 |
a Les expositions sont estimées à partir de la « dose interne moyenne annuelle », calculée à l’aide de ConsExpo Web (2021). Voir l’annexe C pour obtenir plus de détails.
b Risque de cancer cumulatif à vie corrigé = somme de [coefficient de cancérogénicité (mg/kg p.c./j)-1 × DQMVgroupe d’âge]
D’après la génotoxicité négative et la nature bénigne des tumeurs thyroïdiennes observées dans le cadre d’études sur la toxicité chronique et la cancérogénicité du tert-butanol, on a jugé que les produits présentant un risque de cancer inférieur à 1 × 10-5 n’étaient pas préoccupants pour la santé humaine. En ce qui concerne l’exposition au tert-butanol à partir des milieux de l’environnement, des traitements de blanchiment dentaire, des lotions corporelles, des fixatifs, des désinfectants pour les mains, des écrans solaires et des vaporisateurs anti-odeurs tout usage, les valeurs de risque de cancer cumulatif à vie corrigé ne constituent pas une préoccupation pour la santé humaine.
6.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude dans la caractérisation des risques associés au groupe d’alcools C3-C5 sélectionnés sont présentées au tableau 6‑5.
| Principale source d’incertitude | Incidence |
|---|---|
| Le tert-butanol peut être utilisé dans les désinfectants pour les mains. Une incertitude entoure la période durant laquelle des désinfectants pour les mains peuvent être utilisés de façon accrue lors de cas préoccupants pour la santé publique. | +/- |
| Pour le tert-butanol, il n’existe aucune étude sur l’exposition à long terme par inhalation. | +/- |
| Pour l’alcool isobutylique et le pentan-1-ol, il n’existe aucune étude de cancérogénicité. | +/- |
+/- = potentiel inconnu de surestimation ou de sous-estimation du risque.
7. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, les six substances du groupe d’alcools C3-C5 sélectionnés présentent un faible risque d’effets nocifs sur l’environnement. Il est proposé de conclure que les six substances qui font partie du groupe d’alcools C3-C5 sélectionnés ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que les six substances du groupe d’alcools C3-C5 sélectionnés ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc proposé de conclure que les six substances du groupe d’alcools C3-C5 sélectionnés ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Références
Avis sur les langues officielles
Les publications d’Environnement et Changement climatique Canada sont conformes à la Loi sur les langues officielles. Le Ministère s’est engagé à publier les renseignements en français et en anglais. Toutefois, les utilisateurs doivent savoir que certains documents cités à l’appui des données proviennent de sources non gouvernementales ou non canadiennes et ont été publiés dans la langue dans laquelle ils ont été rédigés. Citons notamment les publications d’organisations étrangères et les articles parus dans des revues savantes qui ne sont pas assujettis à cette Loi.
[AGDH] Australian Government Department of Health. 2013. 1-Propanol: IMAP (inventory multi-tiered assessment and prioritisation) tier II assessment. Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS) [consulté le 13 juillet 2022]. (Disponible en anglais seulement.)
[AGDH] Australian Government Department of Health. 2013. 2-Propanol: IMAP (inventory multi-tiered assessment and prioritisation) tier II assessment. Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS) [consulté le 13 juillet 2022]. (Disponible en anglais seulement.)
[AGDH] Australian Government Department of Health. 2013. 2-Propanol, 2-methyl: IMAP (inventory multi-tiered assessment and prioritisation) tier II assessment. Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS) [consulté le 13 juillet 2022]. (Disponible en anglais seulement.)
Bansaghi S, Soule H, Guitart C, Pittet D, Haidegger T. 2020. Critical Reliability Issues of Common Type Alcohol-Based Handrub Dispensers. Antimicrob Resist Infect Control. 9 (90). (Disponible en anglais seulement.)
BASF AG. 1990a. Product Safety, Prenatal Toxicity of 2-methyl-1-propanol in rats after inhalation. Project No. 37R0057/88047. BASF AG. 1990b. Product Safety, Prenatal toxicity of 2-methyl-1-propanol in rabbits after Inhalation. BASF Project No. 90R0057/88048, Experimental Toxicology and Ecology, BASF AG, Ludwigshafen, Allemagne, rapport inédit, 1990. (Disponible en anglais seulement.)
BASF AG. 1990b. Product Safety, Prenatal toxicity of 2-methyl-1-propanol in rats after inhalation. BASF Project No. 90R0057/88048, Experimental Toxicology and Ecology, BASF AG, Ludwigshafen, Allemagne, rapport inédit, 14 décembre 1990. (Disponible en anglais seulement.)
Boîte à outils QSAR de l’OCDE [outil de lecture croisée]. 2014. Version 3.3. Paris (FR): Organisation de coopération et de développement économiques, Laboratory of Mathematical Chemistry. (Disponible en anglais seulement.
Burdock, GA. 2010. Fenaroli’s handbook of flavor ingredients. 6e éd. Boca Raton (FL): CRC Press. (Disponible en anglais seulement.)
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, n° 3.
Canada, Ministère de l’Environnement. 2012. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF]. Gazette du Canada, Partie I, vol. 146, n° 48, Supplément.
[CE] Commission européenne. 2008. European Union Risk Assessment Report: Propan-1-ol: CAS No. 71-23-8 [PDF]. Luxembourg (LU): Office for Official Publications of the European Communities. Rapport no EUR 22159 EN [consulté le 3 mars 2022]. (Disponible en anglais seulement.)
[CE] Commission européenne. 2015. European Union Evaluation of Active Substances; Assessment Report: Propan-2-ol [PDF]. Luxembourg (LU): Office for Official Publications of the European Communities. Regulation (EU) No 528/2012 concerning the making available on the market and use of biocidal products [consulté le 10 janvier 2022]. (Disponible en anglais seulement.)
ChemCAN [level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (ON): Trent University, Canadian Centre for Environmental Modelling and Chemistry. (Disponible en anglais seulement.)
ChemIDplus [database]. 1993. Bethesda (MD): US National Library of Medicine [consulté le 2 février 2023]. (Disponible en anglais seulement.)
[CIRC] Centre international de recherche sur le cancer. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1999. Isopropanol. IARC Monogr Eval Carcinog Risks Hum. 71:1034. (Disponible en anglais seulement.)
[ConsExpo Web] Consumer Exposure Web Model. 2021. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. (Disponible en anglais seulement.)
[ECCC] Environnement et Changement Canada. 2016a. Document sur l'approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ont.) : Gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Données utilisées pour établir les profils d’exposition et de danger propres aux substances et attribuer des classifications du risque dans la Classification du risque écologique des substances organiques. Gatineau (Qc) : ECCC. Renseignements à l’appui du Document sur l’approche scientifique : classification du risque écologique des substances organiques. Disponible sur demande au : substances@ec.gc.ca.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada [modifié le 15 décembre 2011]. Statut des substances priorisées. Ottawa (Ont.) : Gouvernement du Canada [consulté le 25 septembre 2015].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada [modifié le 12 mars 2017]. Catégorisation de substances chimiques. Ottawa (Ont.) : Gouvernement du Canada [consulté le 10 janvier 2022].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2022. Ébauche d'évaluation préalable – Groupe des alcools. Ottawa (Ont.) : Gouvernement du Canada [consulté le 30 juin 2022
[ECHA] Agence européenne des produits chimiques. 2018. Substance evaluation conclusion document. Evaluation report for Butan-1-ol (CAS No 71-36-3). Evaluating Member State: Hungary. Helsinki (FI): ECHA. Rapport no EC No 200-751-6 [consulté le 4 février 2022]. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. 2019. Substance evaluation conclusion document. Evaluation report for 2-methylpropan-2-ol (tertiary butyl alcohol) (CAS No 75-65-0). Evaluating Member State: United Kingdom. Helsinki (FI): ECHA. Rapport no EC No 200-889-7. [consulté le 3 mars 2022]. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques [base de données]. c2020a. Registered Substances Database; Search Results for CAS RN 57-55-6. Helsinki (FI): ECHA. [mis à jour le 28 septembre 2021; consulté le 7 janvier 2022]. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques [base de données]. c2020b. Registered Substances Database; Search Results for CAS RN 75-65-0. Helsinki (FI): ECHA. [mis à jour le 9 août 2021; consulté le 7 janvier 2022]. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques [base de données]. c2020c. Registered Substances Database; Search Results for CAS RN 71-41-0. Helsinki (FI): ECHA. [mis à jour le 9 août 2021; consulté le 4 février 2022]. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques [base de données]. c2020d. Registered Substances Database; Search Results for CAS RN 123-51-3. Helsinki (FI): ECHA. [mis à jour le 9 août 2021; consulté le 4 février 2022]. (Disponible en anglais seulement.)
[EFSA] Autorité européenne de sécurité des aliments. 2009. Scientific Opinion on the evaluation of substances as acceptable previous cargoes for edible fats and oils. EFSA Panel on Contaminants in the Food Chain (CONTAM). EFSA J. 7(11):1391. (Disponible en anglais seulement.)
[EFSA] Autorité européenne de sécurité des aliments. 2011. Scientific Opinion on the evaluation of the substances currently on the list in the Annex to Commission Directive 96/3/EC as acceptable previous cargoes for edible fats and oils – Part I of III. EFSA J. 9(12):2482. (Disponible en anglais seulement.)
[EFSA] Autorité européenne de sécurité des aliments. 2012. Scientific Opinion on the evaluation of the substances currently on the list in the annex to Commission Directive 96/3/EC as acceptable previous cargoes for edible fats and oils – Part II of III. EFSA J. 10(5):2703. (Disponible en anglais seulement.)
[EFSA] Autorité européenne de sécurité des aliments. 2018. Scientific Opinion. Re-evaluation of propane-1,2-diol (E 1520) as a food additive. EFSA J. 16(4): e05235. (Disponible en anglais seulement.)
Environnement Canada. 2013. Données de la Mise à jour de l'inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l'environnement, 1999: Avis concernant certaines substances de la Liste intérieure; Données préparées par : Environnement Canada, Santé Canada; Programme des substances existantes.
[EPA] Environmental Protection Agency des États-Unis. 1986. Rat oral subchronic toxicity study. Final report. Compound: isobutyl alcohol. TRL Study # 032-002. Toxicity Research Laboratories, Ltd., Muskegon, MI. (Disponible en anglais seulement.)
[EPA] Environmental Protection Agency des États-Unis. 2005. Inert Reassessment-n-propanol, CAS# 71-23-8. US EPA, Office of Prevention, Pesticides and Toxic Substances. Washington (DC) [consulté le 7 janvier 2022]. (Disponible en anglais seulement.)
[EPA] Environmental Protection Agency des États-Unis. 2007a. Provisional Peer Reviewed Toxicity Values for n-Propyl Alcohol, CASRN 71-23-8. US EPA, Office of Prevention, Pesticides and Toxic Substances. Washington (DC) [consulté le 29 juin 2022]. (Disponible en anglais seulement.)
[EPA] Environmental Protection Agency des États-Unis. 2007b. Reregistration Eligibility Decision (RED) Aliphatic Alcohols. US EPA, Office of Prevention, Pesticides and Toxic Substances. Washington (DC) [consulté le 8 mars 2022]. (Disponible en anglais seulement.)
[EPA] Environmental Protection Agency des États-Unis. 2008. Provisional Peer Reviewed Toxicity Values for Propylene Glycol, CASRN 57-55-6. US EPA, Office of Research and Development, National Center for Environmental Assessment. Washington (DC) [consulté le 3 mars 2022]. (Disponible en anglais seulement.)
[EPA] Environmental Protection Agency des États-Unis. 2011. Exposure Factors Handbook: 2011 Edition. National Center for Environmental Assessment, Office of Research and Development. Washington (DC) [consulté le 3 mars 2022]. (Disponible en anglais seulement.)
[EPA] Environmental Protection Agency des États-Unis. 2014. Provisional Peer Reviewed Toxicity Values for Isopropanol, CASRN 67-63-0. US EPA, Office of Research and Development, National Center for Environmental Assessment. Washington (DC) [consulté le 3 mars 2022]. (Disponible en anglais seulement.)
[EPA] Environmental Protection Agency des États-Unis. 2021. Toxicological Review of tert-Butyl Alcohol (tert-Butanol) [CASRN 75-65-0]. US EPA, Office of Research and Development, Integrated Risk Information System Center for Public Health and Environmental Assessment. Washington (DC) [consulté le 3 mars 2022]. (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2007. ACTIVATED” Chemiluminescent Product (Reverse Oxalate Component) All Colors [PDF]. Indian Orchard [MA]: Omniglow LLC [consulté le 25 avril 2022]. (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2013a. Weiman Silver Wipes [PDF]. Gurnee [IL]: Weiman Products [consulté le 25 avril 2022]. (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2013b. Wynn’s Hot Shot Injector Cleaner With Octane Booster [PDF]. Mississauga [ON]: Wynn’s Canada LTD [consulté le 25 avril 2022]. (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2014. Origins By Benjamin Moore Ultimate Interior [PDF]. Montvale [NJ]: Benjamin Moore & Cie [consulté le 25 avril 2022].
[FDS] Fiche de données de sécurité. 2015. General Formula [PDF]. Litchfield (CT): Zero Odor LLC. [consulté le 25 avril 2022]. (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2016a. Tide Pods [PDF]. Toronto [ON]: Procter & Gamble Inc. [consulté le 25 avril 2022]. (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2016b. ColorBlast! Markers [PDF]. Westport (CT): Melissa & Doug, LLC. [consulté le 25 avril 2022]. (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2020. Scott® Pro Moisturizing Foam Hand Sanitizer [PDF]. Roswell [GA]: Kimberly-Clark Corporation [consulté le 2 février 2023]. (Disponible en anglais seulement.)
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC. 2015. Consumption of cosmetic products by the French population. First part: Frequency data. Food Chem Toxicol. 78:159-169. (Disponible en anglais seulement.)
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, Creusot T, Simon E, Roudot AC et al. 2016. Consumption of cosmetic products by the French population. Second part: Amount data. Food Chem Toxicol. 90:130-141. (Disponible en anglais seulement.)
Hansen PL, Tønning K, Malmgren-Hansen B. 2008. Survey and health assessment of chemical substances in hobby products for children [PDF]. Survey of Chemical Substances in Consumer Products, No. 93. Denmark: Danish Ministry of the Environment, Environmental Protection Agency [consulté le 3 mars 2022]. (Disponible en anglais seulement.)
[INRP] Inventaire national des rejets de polluants. 2022. Tableau de données sur les transferts et les rejets de polluants déclarés pour une année, par installation – Inventaire national des rejets de polluants (INRP). Ensemble de données de l’INRP pour 2018 [Internet]. Gatineau (Qc) : Environnement et Changement climatique Canada [consulté le 3 mars 2022].
Kampf G, Ruselack S, Eggerstedt S, Nowak N, Bashir M. 2013. Less and less–influence of volume on hand coverage and bactericidal efficacy in hand disinfection. BMC Infect Dis. 13:472. (Disponible en anglais seulement.)
KWF (Koningin Wilhelmina Fonds voor de Nederlandse Kankerbestrijding). 2018. Slim met de zon. Zonprotocol, 2018. (Disponible en anglais seulement.)
Li Y, Cakmak S, Zhu J. 2019. Profiles and monthly variations of selected volatile organic compounds in indoor air in Canadian homes: Results of Canadian national indoor air survey 2012–2013. Environ Int. 126:134-144. (Disponible en anglais seulement.)
Lington AW, Bevan C. 1991. Alcohols, in Patty's Industrial Hygiene and Toxicology, 4th edition. John Wiley & Sons, Inc. (Disponible en anglais seulement.)
Loretz LG, Api AM, Babcock L, Barraj LM, Burdick J, Cater KC, Jarrett G, Mann S, Pan YHL, Re TA, et al. 2008. Exposure data for cosmetic products: Facial cleanser, hair conditioner, and eye shadow. Food Chem Toxicol 46:1516-1524. (Disponible en anglais seulement.)
Macinga DR, Edmonds SL, Campbell E, Shumaker BS, Arbogast, JW. 2013. Efficacy of Novel Alcohol-Based Hand Rub Products at Typical In-Use Volumes. Inspection Control and Hospital Epidemiology. 34 (3):299-301. (Disponible en anglais seulement.)
McGregor D. 2010. Tertiary-Butanol: A toxicological review. Crit. Rev. Toxicol. 40(8):697-727. (Disponible en anglais seulement.)
Nelson BK, Brightwell WS, Taylor BJ, Khan A, Burg JR, Krieg EF JR, Massari VJ. 1989a. Behavioral teratology investigation of propan-1-ol administered by inhalation to rats. Neurotoxicol Teratology. 11:153-159. (Disponible en anglais seulement.)
Nelson BK, Brightwell WS, Khan A, Burg JR, Goad PT. 1989b. Developmental toxicology evaluation of 1-pentanol, 1-hexanol, and 2-ethyl-1-hexanol administered by inhalation to rats. J Am Coll Toxicol. 8(2):405–410. (Disponible en anglais seulement.)
[NTP] National Toxicology Program (US). 1995. NTP Technical Report Series: Toxicology and carcinogenesis studies of t-butyl alcohol (CAS no. 75-65-0) in F344/N rats and B6C3F1 mice (Drinking water studies). Research Triangle Park, (NC): US Department of Health and Human Services, National Toxicology Program. (Disponible en anglais seulement.)
[NTP] National Toxicology Program (US). 1997. NTP Technical Report Series: Toxicity of t-butyl alcohol (CAS no. 75-65-0) Administered by Inhalation to F344/N rats and B6C3F1 mice. Research Triangle Park, (NC): US Department of Health and Human Services, National Toxicology Program. (Disponible en anglais seulement.)
[OCDE] Organisation de coopération et de développement économiques. 2001. SIDS Initial Assessment Report 1,2-dihydroxypropane: CAS No. 57-55-6. SIAM [SIDS Initial Assessment Meeting] 11; janvier 2001; DC, É.-U. [consulté le 7 janvier 2022]. (Disponible en anglais seulement.)
[OCDE] Organisation de coopération et de développement économiques. 2004a. SIDS Initial Assessment Report Isobutanol: CAS No. 78-83-1. SIAM [SIDS Initial Assessment Meeting] 19; octobre 2004; Berlin, Allemagne [consulté le 7 janvier 2022]. (Disponible en anglais seulement.)
[OCDE] Organisation de coopération et de développement économiques. 2004b. SIDS Initial Assessment Report n-Butyl Alcohol: CAS No. 71-36-3. SIAM [SIDS Initial Assessment Meeting] 19; octobre 2004; Berlin, Allemagne [consulté le 7 janvier 2022]. (Disponible en anglais seulement.)
[PISSC] Programme international sur la sécurité des substances chimiques. 1990a. 1-Propanol. Geneva (CH): United Nations Environment Programme, International Labour Organisation, World Health Organization [consulté le 10 janvier 2022]. (Disponible en anglais seulement.)
[PISSC] Programme international sur la sécurité des substances chimiques. 1990b. 2-Propanol. Geneva (CH): United Nations Environment Programme, International Labour Organisation, World Health Organization [consulté le 10 janvier 2022]. (Disponible en anglais seulement.)
PubChem [base de données]. 2004. Bethesda (MD): US National Library of Medicine, National Center for Biotechnology Information [consulté le 16 novembre 2021]. (Disponible en anglais seulement.)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2021. Health Risk Assessment when using ethanol-containing hand gel. Bilthoven (NL): RIVM. Rapport no 2021-0026. (Disponible en anglais seulement.)
Santé Canada. 2008a. Projet de décision de réévaluation. Propylène glycol [PDF]. Ottawa (Ont.) : Gouvernement du Canada. N° de pub. de SC : PRVD2008-17 [consulté le 3 mars 2022].
Santé Canada. 2008b. Décision de réévaluation. Propylène glycol [PDF]. Ottawa (Ont.) : Gouvernement du Canada. N° de pub. de SC : RVD2008-31 [consulté le 3 mars 2022].
Santé Canada. 2010a. Étude de la qualité de l'air intérieur à Regina (2007) : Sommaire des données d'échantillonnage des composés organiques volatiles. Ottawa (Ont.) : Gouvernement du Canada [consulté en juin 2017].
Santé Canada. 2010b. Étude d'évaluation de l'exposition à Windsor (2005-2006) : Sommaire des données d'échantillonnage des composés organiques volatiles. Ottawa (Ont.) : Gouvernement du Canada [consulté en juin 2017].
Santé Canada. 2012. Étude de la qualité de l'air intérieur à Halifax (2009) : Sommaire des données des composés organiques volatils (COV). Ottawa (Ont.) : Gouvernement du Canada [consulté en juin 2017].
Santé Canada. 2013. Étude de la qualité de l'air intérieur à Edmonton (2010) : Sommaire des données des composés organiques volatils (COV). Ottawa (Ont.) : Gouvernement du Canada [consulté le 14 février 2018].
Santé Canada. 2015. Tableau de la consommation alimentaire obtenu à l'aide de Statistique Canada, Enquête sur la santé dans les collectivités canadiennes, Nutrition (2004), fichier partagé.. Ottawa (Ont.) : Gouvernement du Canada.
Santé Canada. 2017a. Projet de décision de réévaluation. Alcool isopropylique [PDF]. Ottawa (Ont.) : Gouvernement du Canada. N° de pub. de SC : PRVD2017-09 [consulté le 3 mars 2022].
Santé Canada. 2017b. Tableau de la consommation d'eau obtenu à l'aide de Statistique Canada, Enquête sur la santé dans les collectivités canadiennes, Nutrition (2004), fichier partagé. Ottawa (Ont.) : Gouvernement du Canada [consulté le 3 mars 2022].
Santé Canada. 2018a. Draft backgrounder document on default values for breast milk and formula intakes. Ottawa (Ont.) : Gouvernement du Canada. (Disponible en anglais seulement.)
Santé Canada. 2018b. Décision de réévaluation. Alcool isopropylique et préparations commerciales connexes [PDF]. Ottawa (Ont.) : Gouvernement du Canada. N° de pub. de SC : RVD2018-14 [consulté le 3 mars 2022].
Santé Canada. 2019. Document sur l’approche scientifique. Document sur l'approche scientifique concernant les substances présentant un faible danger pour la santé humaine [PDF]. Ottawa (Ont.) : Santé Canada [consulté le 3 mars 2022].
Santé Canada. 2020. Personal Care Products Workbook. Recommended Defaults. Dernière mise à jour : 19 octobre 2020. Ébauche interne. Rapport inédit. Ottawa (Ont.) : Bureau d’évaluation du risque des substances existantes, Santé Canada. (Disponible en anglais seulement.)
Santé Canada [modifié le 11 février 2022]. Facteurs d'exposition utilisés dans les évaluations des risques pour la santé humaine au Canada. Ottawa (Ont.) : Gouvernement du Canada [consulté le 3 mars 2022].
Statistique Canada [modifié le 8 février 2022]. [Application Web sur le commerce international de marchandises du Canada]. Résultats de recherche pour 2905.32.00.00 — Importations de Propylèneglycol (propane-1,2-diol). Ottawa (Ont.) : Statistique Canada [consulté le 27 juillet 2022].
Won D, Lusztyk E. 2011. Data gathering on chemicals released to indoor air of residences from building materials and furnishings. Final Report. Ottawa (ON): NRC. 158 pp. Report No.: B3332.2. (Disponible en anglais seulement.)
Wu X, Bennett DH, Ritz B, Cassady DL, Lee K, Hertz-Picciotto I. 2010. Usage pattern of personal care products in California households. Food Chem Toxicol. 48:3109-3119. (Disponible en anglais seulement.)
Zhu J, Wong SL, Cakmak S. 2013. Nationally representative levels of selected volatile organic compounds in Canadian residential indoor air: Population-based survey. Environ Sci Technol. 47:13276-13283. (Disponible en anglais seulement.)
Annexe A. Tableau récapitulatif de la lecture croisée effectuée pour déterminer les paramètres d’effets sur la santé
| Propriété ou effet sur la santé | Alcool isobutylique (cible) | Butan-1-ol (analogue) |
|---|---|---|
| Structure |  |
 |
| Point de fusion (°C) | −108 | −89,8 |
| Pression de vapeur (Pa) | 1 400 | 893 |
| Constante de Henry (Pa·m3/mol) | 0,99 | 0,89 |
| Solubilité dans l’eau (mg/L) | 8,5 × 104 | 6,32 × 104 |
| Log Koe (sans dimension) | 0,76 | 0,88 |
| Toxicité aiguë par voie orale | Rat, DL50 > 2 830 mg/kg (mâles); = 3 350 mg/kg (femelles) (OCDE, 2004a). |
Rat, DL50 = 2 290 mg/kg p.c. (femelles) (ECHA, 2018). |
| Toxicité aiguë par voie cutanée | Lapin, DL50 > 2 000 mg/kg p.c. (mâles); = 2 460 mg/kg p.c. (femelles) (OCDE, 2004a). |
Lapin, DL50 = 3 402 mg/kg (OCDE, 2004b). |
| Toxicité aiguë par inhalation | Rat, CL50 > 6 000 ppm (18 120 mg/m3) (OCDE, 2004a). |
Rat, CL0= 8 000 ppm (18 120 mg/m3) (OCDE, 2004b). |
| Toxicité à court terme par voie orale | S. O. | Activation accrue de l’alcool déshydrogénase et de la catalase dans le sérum, lésions des membranes des hépatocytes et des lysosomes, et diminution du poids des glandes surrénales à une dose de 0,2 mg/kg p.c./j lors d’une étude par gavage de 30 jours avec des rats mâles. Aucun détail sur les observations cliniques et d’autres paramètres (ECHA, 2018). |
| Toxicité à court terme par inhalation | S. O. | S. O. |
| Toxicité à court terme par voie cutanée | S. O. | Dessèchement de la peau, gerçures, fissures et exfoliation de l’épiderme lorsque du butan-1-ol a été appliqué sur la peau de lapin à une concentration de 100 % dans des conditions occlusives à 12 reprises pour une durée de 5 heures sur une période de 21 jours (ECHA, 2018). |
| Toxicité subchronique par voie orale | Aucun effet nocif (étude par gavage de 13 semaines avec des rats SD; DEM = 1 000 mg/kg p.c./j). Hypoactivité et ataxie transitoires observées à 1 000 mg/kg p.c./j (pas à 316 mg/kg p.c./j ou moins) qui n’ont pas été considérées comme des effets nocifs, car ces effets étaient réversibles à la quatrième semaine de l’étude (EPA, 1986). | DSENO = 125 mg/kg p.c./j (ataxie et hypoactivité à 500 mg/kg p.c./j lors d’une étude par gavage de 13 semaines avec des rats) (EPA, 1986). |
| Toxicité subchronique par inhalation | CSENO = 7 580 mg/m3 (étude de neurotoxicité de 13 semaines avec des rats SD; inhalation par exposition du corps entier) (Branch et al., 1996, cité dans OCDE, 2004a). | S. O. |
| Génotoxicité | Pas génotoxique selon les résultats d’études in vitro et in vivo (OCDE, 2004a). | Pas génotoxique selon les résultats d’études in vitro et in vivo (OCDE, 2004b). |
| Cancérogénicité | S. O. | S. O. |
| Toxicité pour la reproduction et/ou le développement | Aucune toxicité pour les parents, la reproduction ou les petits (étude par inhalation réalisée sur deux générations avec des rats SD; DEM = 7 580 mg/m3); aucun effet sur les mères ou le développement (étude par inhalation réalisée sur deux générations avec des rats SD et des lapins; DEM = 10 000 mg/m3) (WIL Res. Labs, 2003, cité dans OCDE, 2004a). | DMENO = 5 654 mg/kg p.c./j (étude de toxicité pour le développement avec exposition par l’eau potable, réalisée avec des rats SD; diminution du poids corporel des fœtus et hausse des cas de variations squelettiques) (Ema et al., 2005, cité dans ECHA, 2018). |
| Neurotoxicité | Aucun effet observé (étude de neurotoxicité de 13 semaines avec des rats SD, inhalation par exposition du corps entier; CSENO = 7 580 mg/m3 [DEM]) (Branch et al., 1996, cité dans OCDE, 2004a). | CSENO = 6 000 ppm/18 000 mg/m3 (DEM). Aucun effet observé de toxicité générale pour les parents ou sur le taux de gestation (étude de neurotoxicité pour le comportement et le développement périnatal et postnatal avec des rats SD, inhalation par exposition du corps entier) (ECHA, 2018). |
Abréviations : DEM, dose d’essai maximale; Koe, coefficient de partage octanol-eau; DMENO, dose minimale avec effet nocif observé; S. O., sans objet.
a ChemIDPlus, 1993.
| Propriété ou effet sur la santé | Pentan-1-ol (cible) | Alcool isopentylique (analogue) |
|---|---|---|
| Structure |  |
 |
| Point de fusion (°C) | −78 | −117 |
| Pression de vapeur (Pa) | 293 | 316 |
| Constante de Henry (Pa·m3/mol) | 1,32 | 1,43 |
| Solubilité dans l’eau (mg/L) | 2,2 × 104 | 2,67 × 104 |
| Log Koe (sans dimension) | 1,51 | 1,16 |
| Toxicité aiguë par voie orale | Rat Osborne-Mendel, DL50 = 3 030 mg/kg p.c./j (ECHA, c2020c). | Rat SD, DL50 > 5 000 mg/kg p.c. (ECHA, c2020d). |
| Toxicité aiguë par voie cutanée | Lapin albinos, DL50= 2 292 mg/kg p.c. (mâles) (ECHA, c2020c). | Lapin blanc néo-zélandais, DL50 = 3 216 mg/kg p.c. (mâles) (ECHA, c2020d). |
| Toxicité aiguë par inhalation | Rat SD, CL0 = 8,29 mg/L d’air (ECHA, c2020c). | Rat SD, CL0 = 11,05 mg/L d’air (ECHA, c2020d). |
| Toxicité à court terme par voie orale | S. O. | DSENO = 250 mg/kg p.c./j (étude par gavage de 14 jours avec des rats SD [solution de CMC-Na à 1 %, contenant 1 % de Tween 80], mortalité à 1 000 mg/kg p.c./j) (ECHA, c2020d). |
| Toxicité subchronique par voie orale | Aucun effet nocif (étude par gavage de 13 semaines avec des rats Ash/CSE; DEM = 1 000 mg/kg p.c./j) (ECHA, c2020c). | Aucun effet nocif (étude de 13 semaines avec exposition par l’eau potable, réalisée avec des rats Wistar; DEM = 1 250 mg/kg p.c./j) (ECHA, c2020c). |
| Génotoxicité | Pas génotoxique selon les résultats d’études in vitro (ECHA, c2020c). | Pas génotoxique selon les résultats d’études in vitro et in vivo (ECHA, c2020c). |
| Cancérogénicité | S. O. | S. O. |
| Toxicité pour la reproduction et/ou le développement | Aucun effet sur le développement (étude d’inhalation par exposition du corps entier avec des rats SD; DEM = 14 000 mg/m3) (ECHA, c2020c). | Aucun effet nocif (étude de toxicité à doses répétées combinée à un essai de dépistage de la toxicité pour la reproduction et le développement, réalisée avec des rats Wistar; DEM = 875/1 273 mg/kg p.c./j [mâles/femelles]) (ECHA, c2020c). |
Abréviations : DEM, dose d’essai maximale; Koe, coefficient de partage octanol-eau; S. O., sans objet.
a ChemIDPlus, 1993.
Annexe B. Estimations déterministes de l’exposition quotidienne des humains au tert-butanol dans les milieux de l’environnement
| Groupe d’âge (ans) | Taux d’inhalation (m3/j) | Poids corporel (kg) | Taux de consommation d’eau (L/j) |
|---|---|---|---|
| 0 à 0,5 | 3,7 | 6,3 | 0 à 0,8 |
| 0,5 à 1 | 5,4 | 9,1 | 0 à 0,8 |
| 1 | 8 | 11 | 0,36 |
| 2 à 3 | 9,2 | 15 | 0,43 |
| 4 à 8 | 11,1 | 23 | 0,53 |
| 9 à 13 | 13,9 | 42 | 0,74 |
| 14 à 18 | 15,9 | 62 | 1,09 |
| 19 et plus | 15,1 | 74 | 1,53 |
| Voie d’exposition | 0 à 0,5a | 0 à 0,5b | 0,5 à 1a | 0,5 à 1b | 1 | 2 à 3 | 4 à 8 | 9 à 13 | 14 à 18 | 19 et plus |
|---|---|---|---|---|---|---|---|---|---|---|
| Air ambiantc | 0,05 | 0,05 | 0,05 | 0,05 | 0,07 | 0,06 | 0,04 | 0,03 | 0,02 | 0,02 |
| Air intérieurd | 1,28 | 1,28 | 1,29 | 1,29 | 1,58 | 1,34 | 1,05 | 0,72 | 0,56 | 0,44 |
| Eau potablee | S. O. | 0,40 | S. O. | 0,26 | 0,10 | 0,09 | 0,07 | 0,05 | 0,05 | 0,06 |
| Absorption totale | 1,33 | 1,73 | 1,35 | 1,60 | 1,75 | 1,48 | 1,17 | 0,80 | 0,64 | 0,53 |
Abréviation : S. O., sans objet.
a Le lait maternel humain est présumé être la seule source alimentaire pour les nourrissons nourris au lait maternel.
b Les préparations pour nourrissons sont présumées être la seule source alimentaire pour les nourrissons nourris aux préparations pour nourrissons.
c L’absorption a été estimée à partir de la concentration maximale estimée de 0,72 ng/m3 dans l’air ambiant, modélisée au moyen de ChemCAN (2003).
d L’absorption a été estimée à partir de la concentration la plus élevée de 2,49 µg/m3 mesurée dans l’air intérieur des résidences canadiennes (95e centile, Zhu et al., 2013).
e L’absorption a été estimée à partir de la concentration maximale estimée de 3,06 µg/L dans l’eau potable, modélisée au moyen de ChemCAN (2003).
Annexe C. Paramètres ayant servi à estimer les expositions des humains à partir de produits offerts aux consommateurs
Sauf indication contraire, l’exposition des humains à partir de l’utilisation de produits de consommation contenant du tert-butanol a été estimée au moyen de ConsExpo Web (2021) avec la concentration la plus élevée de tert-butanol trouvée par type de produit ou par scénario. Sauf indication contraire, les valeurs pour la durée d’exposition, la durée d’émission, le volume de la pièce et le taux de renouvellement d’air de la pièce sont fondées sur la fiche d’information pertinente de ConsExpo pour le scénario présenté. En raison de la forte volatilité du tert-butanol, le modèle d’exposition par inhalation à la vapeur par évaporation à partir d’une surface d’émission constante a été utilisé pour estimer les expositions par inhalation découlant de l’utilisation de produits offerts aux consommateurs (y compris les produits en vaporisateur), en présumant que 100 % de la substance contenue dans la quantité de produit utilisée peut se volatiliser. On a présumé que l’absorption par inhalation et par voie orale était de 100 %. Sauf indication contraire, l’option « le produit est la substance à l’état pur » a été sélectionnée pour la matrice de la masse moléculaire, et la température d’application était de 32 °C.
Les taux d’inhalation, les surfaces cutanées et les poids corporels utilisés pour estimer les expositions à partir de produits offerts aux consommateurs sont décrits dans la fiche de renseignements intitulée Facteurs d’exposition utilisés dans les évaluations des risques pour la santé humaine au Canada (Santé Canada [modifié, 2022]). Sauf indication contraire, les valeurs de la quantité de produit utilisée et de la fréquence d’utilisation pour les estimations concernant les produits de soins personnels ont été présumées à partir des valeurs internes par défaut, qui ont été mises au point lors d’un processus établi pour les évaluations effectuées dans le cadre du Plan de gestion des produits chimiques (PGPC) (Santé Canada, 2020). Ce processus comprend l’examen des données disponibles sur la quantité de produit utilisée et la fréquence d’utilisation des produits de soins personnels à des fins d’exhaustivité de l’étude ou de l’enquête, ainsi que l’examen de la pertinence des données recueillies et du type de renseignements recueillis. La tendance centrale la plus forte se dégageant des études de la plus haute qualité est choisie pour être utilisée dans les évaluations du PGPC, et les études sous-jacentes sont citées. Les paramètres utilisés pour estimer l’exposition par inhalation et par voie cutanée découlant de l’utilisation de produits offerts aux consommateurs sont décrits dans le tableau C-1.
| Scénario de produit | Hypothèses |
|---|---|
| Traitement de blanchiment dentaire | Âge : 19 ans et plus (d’après l’emballage du produit) Concentration maximale : 3 %a Fréquence : 0,15/jour (d’après l’emballage du produit) Quantité de produit : 0,36 g/utilisation (d’après l’emballage du produit) Exposition quotidienne estimée par voie orale = [fréquence (nb fois/j) × concentration (%) × quantité de produit (mg)]/poids corporel (kg) |
| Marqueurs | Âge : 0,5 à 1 an, 1 an, 2 à 3 ans, 4 à 8 ans, 9 à 13 ans, 14 à 18 ans, 19 ans et plus Concentration maximale : 5 %b Quantité estimée d’encre par exposition : 50 mg (Hansen et al., 2008) Exposition quotidienne estimée par voie orale (en présumant que le pire scénario se produit quotidiennement) = [concentration (%) × quantité estimée d’encre par exposition (mg)]/poids corporel (kg) |
| Lotion corporelle | Âge : 0 à 0,5 an, 0,5 à 1 an, 1 an, 2 à 3 ans, 4 à 8 ans, 9 à 13 ans, 14 à 18 ans, 19 ans et plus Concentration maximale : 0,1 %a Fréquence : 0,8/j (0 à 0,5 an, 0,5 à 1 an, 1 an, 2 à 3 ans; Ficheux et al., 2015), 0,8/j (4 à 8 ans, 9 à 13 ans, 14 à 18 ans; Wu et al., 2010), 1/j (19 ans et plus; Ficheux et al., 2015; Wu et al., 2010) Quantité de produit : 2 g/utilisation (0 à 0,5 an); 2,5 g/utilisation (0,5 à 1 an); 3,1 g/utilisation (1 an) (Ficheux et al., 2016; correction de la surface); 4,1 g/utilisation (2 à 3 ans; Ficheux et al., 2016); 5 g/utilisation (4 à 8 ans); 7,7 g/utilisation (9 à 13 ans) (Ficheux et al., 2016; correction de la surface); 10 g/utilisation (14 à 18 ans, 19 ans et plus; Ficheux et al., 2016) Durée d’exposition et d’émission : 20 minutes (temps dans la salle de bain) Volume de la pièce : 10 m3 (salle de bain) Taux de renouvellement d’air de la pièce : 2 renouvellements par heure (salle de bain) Surface d’émission : 2 860 cm2 (0 à 0,5 an); 3 680 cm2 (0,5 à 1 an); 4 430 cm2 (1 an); 5 950 cm2 (2 à 3 ans); 8 290 cm2 (4 à 8 ans); 12 700 cm2 (9 à 13 ans); 16 460 cm2 (14 à 18 ans); 17 530 cm2 (19 ans et plus) (tout le corps, sauf la tête) |
| Fixatif (en pompe) | Âge : 4 à 8 ans, 9 à 13 ans, 14 à 18 ans, 19 ans et plus
Concentration maximale : 0,3 %a Fréquence : 0,63/j (4 à 8 ans; 9 à 13 ans; 14 à 18 ans) (Wu et al., 2010); 1,5/j (19 ans et plus) (Loretz et al., 2008) Quantité de produit : 1,1 g/utilisation (4 à 8 ans; 9 à 13 ans; 14 à 18 ans) (Ficheux et al., 2016); 3,6 g/utilisation (19 ans et plus) (Loretz et al., 2008) Durée d’exposition et d’émission : 20 minutes (temps dans la salle de bain) Volume de la pièce : 10 m3 (salle de bain) Taux de renouvellement d’air de la pièce : 2 renouvellements par heure (salle de bain) Surface d’émission : 305 cm2 (4 à 8 ans, demi-tête); 350 cm2 (9 à 13 ans, demi-tête); 370 cm2 (14 à 18 ans, demi-tête); 585 cm2 (19 ans et plus, demi-tête) |
| Désinfectant pour les mains | Âge : 2 à 3 ans, 4 à 8 ans, 9 à 13 ans, 14 à 18 ans, 19 ans et plus Concentration maximale : 1 %c Fréquence : 0,8/j (2 à 3 ans); 1,4/j (4 à 8 ans, 9 à 13 ans, 14 à 18 ans); 2,9/j (19 ans et plus) (Wu et al., 2010) Quantité de produit : 1,5 g/utilisation (Bansaghi et al., 2020; Kampf et al., 2013; Macinga et al., 2013) Durée d’exposition et d’émission : 20 minutes Volume de la pièce : 20 m3 (pièce non précisée) Taux de renouvellement d’air de la pièce : 0,6 renouvellement par heure (pièce non précisée) Surface d’émission : 310 cm2 (2 à 3 ans); 430 cm2 (4 à 8 ans); 610 cm2 (9 à 13 ans); 770 cm2 (14 à 18 ans); 910 cm2 (19 ans et plus) (mains) |
| Désinfectant pour les mains (scénarios préoccupants pour la santé publique) | Âge : 2 à 3 ans, 4 à 8 ans, 9 à 13 ans, 14 à 18 ans, 19 ans et plus Concentration maximale : 1 %c Fréquence : 25/j (Wu et al., 2010; RIVM, 2021) Quantité de produit : 1,5 g/utilisation (Bansaghi et al., 2020; Kampf et al., 2013; Macinga et al., 2013) Durée d’exposition et d’émission : 20 minutes Volume de la pièce : 20 m3 (pièce non précisée) Taux de renouvellement d’air de la pièce : 0,6 renouvellement par heure (pièce non précisée) Surface d’émission : 310 cm2 (2 à 3 ans); 430 cm2 (4 à 8 ans); 610 cm2 (9 à 13 ans); 770 cm2 (14 à 18 ans); 910 cm2 (19 ans et plus) (mains) |
| Écran solaire | Âge : 0,5 à 1 an, 1 an, 2 à 3 ans, 4 à 8 ans, 9 à 13 ans, 14 à 18 ans, 19 ans et plus Concentration maximale : 0,2 %d Fréquence : 1,4/j (0,5 à 1 an, 9 à 13 ans, 14 à 18 ans, 19 ans et plus); 1,6/j (1 an, 2 à 3 ans, 4 à 6 ans) (Ficheux et al., 2015) Quantité de produit : 5,4 g/utilisation (0,5 à 1 an, 1 an, 2 à 3 ans); 6,3 g/utilisation (4 à 8 ans, 9 à 13 ans); 18,2 g/utilisation (14 à 18 ans, 19 ans et plus) (Ficheux et al., 2016) Durée d’exposition et d’émission : 30 minutes (KWF, 2018) Volume de la pièce : 20 m3 (pièce non précisée) Taux de renouvellement d’air de la pièce : 0,6 renouvellement par heure (pièce non précisée) Surface d’émission : 3 680 cm2 (0,5 à 1 an); 4 430 cm2 (1 an); 5 950 cm2 (2 à 3 ans); 8 290 cm2 (4 à 8 ans); 12 700 cm2 (9 à 13 ans); 16 460 cm2 (14 à 18 ans); 17 530 cm2 (19 ans et plus) (tout le corps, sauf la tête) |
| Vaporisateur anti-odeurs tout usage | Âge : 19 ans et plus Concentration maximale : 1 %e Sauf indication contraire, les valeurs sont fondées sur une communication personnelle avec RIVM (2021). Scénario d’exposition général pour les applications en vaporisateur Fréquence : 0,14/j (52/an) (en présumant d’une fréquence d’utilisation semblable à celle d’un désodorisant textile en vaporisateur pour l’intérieur servant à traiter les meubles) Quantité de produit : 4,2 g/utilisation (en présumant d’une quantité semblable à celle d’un vaporisateur pour toilette) Durée d’exposition et d’émission : 20 minutes Volume de la pièce : 20 m3 (pièce non précisée) Taux de renouvellement d’air de la pièce : 0,6 renouvellement par heure (pièce non précisée) Surface d’émission : 2 190 cm2 (mains et avant-bras) |
a Communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 29 septembre 2021 et 4 mai 2022; source non citée.
b FDS, 2016b.
c FDS, 2020.
d Communication personnelle, courriel de la DMP, SC, au BERSE, SC, 28 septembre 2021; source non citée.
e FDS, 2015.
Annexe D. Calcul des doses quotidiennes moyennes à vie de tert-butanol
Pour estimer le risque de cancer découlant de l’exposition au tert-butanol, les doses quotidiennes moyennes à vie (DQMV) d’exposition à partir des milieux de l’environnement et d’exposition par inhalation et par voie orale à partir de produits offerts aux consommateurs ont été calculées comme suit.
DQMV (mg/kg p.c./j) = [Somme de (taux d’exposition quotidienne (mg/kg p.c./j)groupe d’âge) × (durée d’exposition (années)groupe d’âge)] / (durée de vie (78 ans; EPA, 2011)); (Santé Canada, 2013)
Pour les cas préoccupants pour la santé publique, la DQMV pour le désinfectant pour les mains a été estimée en présumant d’une exposition accrue pendant une durée de 3 ans par vie. Les expositions estimées les plus élevées sur 3 ans pour les cas préoccupants pour la santé publique visaient les personnes de 2 à 5 ans.
