Ébauche d’évaluation préalable terpènes et terpénoïdes groupe des sesquiterpènes monocycliques et bicycliques
Titre officiel : Ébauche d’évaluation préalable - Terpènes et terpénoïdes - Groupe des sesquiterpènes monocycliques et bicycliques
Environnement et Changement Climatique Canada
Santé Canada
Mai 2021
Résumé
En vertu de l’article 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], le ministre de l’Environnement et la ministre de la Santé ont réalisé une évaluation préalable de 16 des 76 substances appelées collectivement groupe des terpènes et des terpénoïdes dans le cadre du Plan de gestion des produits chimiques. Ces 16 substances ont été jugées d’intérêt prioritaire pour une évaluation, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou en raison d’autres préoccupations pour la santé. Les 16 substances visées par la présente ébauche d’évaluation préalable seront appelées ci-après groupe des sesquiterpènes monocycliques et bicycliques. Il est constitué de 14 substances qui ont été réparties en trois sous‑groupes basés sur la structure chimique, les propriétés ou la toxicité. De plus, il contient deux autres substances, à savoir l’essence de santal et le guaiazulène. Nous donnons dans le tableau ci-après le numéro de registre du Chemical Abstracts Service (NR CASNote de bas de page 1), le sous-groupe, le nom sur la Liste intérieure des substances (LIS) et le nom commun utilisé dans la présente évaluation de ces substances.
| NR CAS | Sous-groupe | Nom sur la LIS | Nom commun utilisé dans la présente évaluation |
|---|---|---|---|
| 495-62-5 | 1 | 6-méthyl-2-(4-méthylcyclohex-3-ènyl)hept-1,5-diène | Bisabolène |
| 8001-61-4a,b | 1 | baume de copahu | Copaïba |
| 8007-08-7a,b | 1 | essences de gingembre | Essence de gingembre |
| 17627-44-0 | 1 | 6-méthyl-2-(4-méthylcyclohex-3-ènyl)hept-2,5-diène | alpha-Bisabolène |
| 65113-99-7 | 1 | α,β,2,2,3-pentaméthylcyclopent-3-ène-1-butanol, | Sandalore |
| 107898-54-4 | 1 | 3,3-diméthyl-5-(2,2,3-triméthylcyclopent-3-ènyl)pent-4-èn-2-ol | Santol-penténol |
| 87-44-5 | 2 | caryophyllène | bêta-caryophyllène |
| 88-84-6 | 2 | (1S-cis)-1,2,3,4,5,6,7,8-octahydro-7-isopropylidène-1,4-diméthylazulène | Guaiène |
| 3691-12-1 | 2 | α-guaiène | alpha-guaiène |
| 4630-07-3 | 2 | [1R-(1α,7β,8α)]-1,2,3,5,6,7,8,8a-octahydro-1,8a-diméthyl-7-isopropylidènenaphtalène | Valencène |
| 68917-29-3b | 2 | terpènes et terpénoïdes de l’essence de clou de girofle | T et T de l’essence de clou de girofle |
| 489-86-1 | 3 | 2-[(3S,8S)-1,2,3,4,5,6,7,8-octahydro-3,8-diméthylazulèn-5-yl)propan-2-ol | Guaiol |
| 639-99-6 | 3 | [1R,2S,4R-(-)-α,α-diméthyl-1-vinyl-o-menth-8-ène-4-méthanol | Élémol |
| 22451-73-6 | 3 | bulnésol | Bulnésol |
| 489-84-9 | individuel | 7-isopropyl-1,4-diméthylazulène | Guaiazulène |
| 8006-87-9a,b | individuel | essences de santal | Essence de santal |
a Cette substance n’est pas visée par le paragraphe 73(1) de la LCPE, mais a été incluse dans la présente évaluation, car elle est jugée d’intérêt prioritaire en raison d’autres préoccupations pour la santé humaine.
b Cette substance est un UVCB (substances de composition inconnue ou variable, produits de réaction complexe ou matières biologiques).
Les terpènes sont constitués d’une répétition d’unités d’isoprène et sont classés en fonction du nombre d’unités qu’ils contiennent. Les monoterpènes sont les plus petits et ne comportent que deux unités d’isoprène. Les sesquiterpènes sont plus grands et contiennent trois unités d’isoprène. Comme les monoterpènes, les sesquiterpènes peuvent être acycliques ou cycliques, en de nombreuses combinaisons uniques. Ces substances sont des composants des huiles essentielles d’une grande variété de plantes.
La plupart des substances du groupe des sesquiterpènes monocycliques et bicycliques, à l’exception de l’alpha-guaiène, ont été visées par une enquête menée en vertu de l’article 71 de la LCPE. Aucune de ces substances n’a alors été déclarée produite en une quantité supérieure au seuil de déclaration de 100 kg. Le santol-penténol, le sandalore et le bêta-caryophyllène ont été déclarés importés au Canada en quantités allant jusqu’à 10 000 kg, alors qu’aucune importation des autres substances n’a été déclarée. Ces substances sont généralement utilisées en tant que parfum dans des produits de soins personnels (p. ex. lotion pour le corps, produits pour le massage, produits pour soins capillaires, produits pour soins oraux, drogues, drogues sans ordonnance et produits de santé naturels), dans des produits de nettoyage et dans des assainisseurs d’air. Elles sont aussi présentes dans des produits antiparasitaires en tant que formulant. De plus, certaines sont présentes naturellement dans des aliments et/ou peuvent être utilisées comme aromatisants alimentaires.
Les risques posés à l’environnement par les substances du groupe des sesquiterpènes monocycliques et bicycliques ont été caractérisés au moyen de l’approche de classification du risque écologique des substances organiques (CRE). La CRE est une approche basée sur le risque qui tient compte de multiples paramètres liés au danger et à l’exposition et d’une pondération des éléments de preuve pour classer le risque (ECCC 2016a). Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les paramètres pris en compte pour les profils d’exposition incluent la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque est utilisée pour attribuer aux substances un potentiel faible, modéré ou élevé, selon leurs profils de danger et d’exposition. D’après les résultats de l’analyse de la CRE, il est improbable que les substances du groupe des sesquiterpènes monocycliques et bicycliques aient des effets nocifs sur l’environnement.
Compte tenu de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, les substances du groupe des sesquiterpènes monocycliques et bicycliques présentent un faible risque d’effets nocifs sur l’environnement. Il est conclu que les 16 substances du groupe des sesquiterpènes monocycliques et bicycliques ne satisfont à aucun des critères des alinéas 64 a) et 64 b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique, ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel à la vie.
Pour l’évaluation des risques ayant trait à la santé humaine, 14 des substances de ce groupe ont été regroupées en trois sous-groupes, en raison de similarités de leurs structures chimiques, de leurs propriétés et/ou de leurs toxicités. Les deux autres substances ont été traitées individuellement. L’exposition à ces substances dans les milieux de l’environnement ne devrait avoir aucun impact sur la santé humaine. Quand cela était applicable, des expositions aux sesquiterpènes monocycliques et bicycliques dues à l’utilisation de produits de soins personnels, d’aromatisants alimentaires, de produits de nettoyage ou d’assainisseurs d’air ont été caractérisées. Elles devraient se produire principalement par voie dermique et par inhalation.
Pour le sous-groupe 1, l’essence de gingembre, le bisabolène, l’alpha‑bisabolène, le santol-penténol, le sandalore et le copaiba ont présenté un faible potentiel de danger. Le risque pour la santé humaine a donc aussi été jugé faible.
Pour le sous-groupe 2, le bêta-caryophyllène, les T et T de l’essence de clou de girofle, le guaiène, l'alpha-guaiène et le valencène, nous avons utilisé les renseignements sur le danger du bêta‑caryophyllène pour informer l’évaluation du danger. Le bêta‑caryophyllène est le principal composant des T et T de l’essence de clou de girofle. Il a aussi été utilisé comme analogue pour une lecture croisée pour le guaiène, l’alpha-guaiène et le valencène. Pour le bêta-caryophyllène, les effets critiques sur la santé étaient ceux sur le système lymphoïde, le foie et les ganglions lymphatiques mésentériques. Une comparaison des niveaux estimés d’exposition au guaiène et au valencène due aux aliments, au bêta‑caryophyllène due aux aliments, aux produits de nettoyage, aux assainisseurs d’air et aux crèmes pour herpès labial, aux T et T de l’essence de clou de girofle due aux lotions pour le corps, aux huiles pour massage et aux bains de bouche, et à l’alpha-guaiène due à son utilisation potentielle comme ingrédient de parfum, avec les niveaux d’effet critique a conduit à calculer des marges jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. Une comparaison des niveaux estimés d’exposition aux T et T de l’essence de clou de girofle due à l’utilisation comme parfum pour le corps avec les niveaux d’effet critique a conduit à calculer des marges jugées potentiellement inadéquates pour tenir compte des incertitudes des données sur les effets sur la santé et l’exposition.
Pour le sous-groupe 3, le guaiol, le bulnésol et l’élémol, nous avons utilisé des données croisées de l’analogue alpha-terpinéol pour informer l’évaluation du danger. Les effets critiques ont été observés sur le système reproducteur mâle. Une comparaison des niveaux estimés d’exposition au bulnésol et à l’élémol due aux aliments avec les niveaux d’effet critique a conduit à calculer des marges jugées adéquates pour tenir compte des incertitudes des données sur les effets critiques et l’exposition. De plus, les marges calculées pour l’exposition à l’élémol due à son utilisation potentielle comme ingrédient de parfum sont jugées adéquates pour tenir compte des incertitudes des données sur les effets sur la santé et l’exposition. Puisque aucune source d’exposition de la population générale n’a été identifiée pour le guaiol, nous avons suivi une approche qualitative pour la caractérisation des risques, et le risque posé à la santé humaine par le guaiol a été jugé faible.
Pour l’essence de santal, nous avons utilisé des données croisées de l’analogue bisabolol pour informer l’évaluation du danger. Les effets critiques sur la santé dus à une exposition par voir dermique étaient une diminution du gain de poids corporel, une diminution de l’efficacité alimentaire, une diminution du poids absolu du foie et une augmentation du poids relatif des testicules. Les effets critiques sur la santé dus à une exposition par voie orale étaient une sédation, une ataxie, une consommation moindre d’aliments et une réduction du gain de poids corporel chez les femelles, ainsi qu’une réduction significative du nombre de fœtus et une augmentation du taux de résorption. Une comparaison des niveaux estimés d’exposition à l’essence de santal due aux aliments, aux huiles de massage (chez les personnes neuf ans et plus), aux hydratants pour le visage, aux shampooings, aux médicaments contre l’acné (système de nettoyage du visage), aux écrans solaires, aux produits de nettoyage, à la lessive ou comme utilisation lors d'aromathérapie avec les niveaux d’effet critique a conduit à calculer des marges jugées adéquates pour tenir compte des incertitudes des données sur les effets sur la santé et l’exposition. Une comparaison des niveaux estimés d’exposition à l’essence de santal due aux lotions pour le corps, aux huiles pour massage (tout‑petits et enfants jusqu’à huit ans) et à l’utilisation de cette huile essentielle comme parfum pour le corps avec les niveaux d’effet critique a conduit à calculer des marges jugées potentiellement inadéquates pour tenir compte des incertitudes des données sur les effets sur la santé et l’exposition.
Pour le guaiazulène, le naphtalène a été utilisé comme analogue pour informer l’évaluation du danger. Les effets critiques sur la santé dus à une exposition par voie dermique étaient des effets sur les testicules et des lésions non néoplasiques dans les ganglions lymphatiques cervicaux, le foie, la thyroïde, les reins, la vessie et la peau. Les effets critiques sur la santé dus à une exposition par inhalation étaient une atrophie/désorganisation de l’épithélium olfactif et une hyperplasie de l’épithélium respiratoire et transitionnel. Une comparaison des niveaux estimés d’exposition au guaiazulène due aux lotions pour le corps, aux hydratants pour le visage, aux conditionneurs ou aux produits d’après-rasage avec les niveaux d’effet critique a conduit à calculer des marges jugées adéquates pour tenir compte des incertitudes des données sur les effets sur la santé et l’exposition. Une comparaison des niveaux estimés d’exposition par voie dermique ou par inhalation au guaiazulène due aux produits de permanente ou de défrisage avec les niveaux d’effet critique a conduit à calculer des marges jugées potentiellement inadéquates pour tenir compte des incertitudes des données sur les effets sur la santé et l’exposition.
Compte tenu de tous les renseignements présentés dans la présente ébauche d’évaluation préalable, il est conclu que le bisabolène, le copaiba, l’essence de gingembre, l’alpha-bisabolène, le sandalore, le santol-penténol, le bêta‑caryophyllène, le guaiène, l’alpha-guaiène, le valencène, le guaiol, l’élémol et le bulnésol ne satisfont à aucun des critères de l’alinéa 64 c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Compte tenu de tous les renseignements présentés dans la présente ébauche d’évaluation préalable, il est conclu que les T et T de l’essence de clou de girofle, l’essence de santal et le guaiazulène satisfont aux critères de l’alinéa 64 c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Il est donc conclu que les T et T de l’essence de clou de girofle, l’essence de santal et le guaiazulène satisfont à un ou plusieurs des critères de l’article 64 de la LCPE, et que les 13 autres substances du groupe des sesquiterpènes monocycliques et bicycliques n’y satisfont pas.
Il a aussi été déterminé que les T et T de l’essence de clou de girofle et le guaiazulène satisfont aux critères de persistance et de bioaccumulation du Règlement sur la persistance et la bioaccumulation de la LCPE, alors que l’essence de santal n’y satisfait pas.
1. Introduction
En vertu de l’article 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE] (Canada 1999), le ministre de l’Environnement et la ministre de la Santé ont réalisé une évaluation préalable de 16 des 76 substances appelées collectivement groupe des terpènes et des terpénoïdes dans le cadre du Plan de gestion des produits chimiques, afin de déterminer si ces 16 substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Ces 16 substances ont été jugées d’intérêt prioritaire pour une évaluation, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou en raison d’autres préoccupations pour la santé humaine (ECCC et SC 2017a).
Des 60 autres substances du groupe des terpènes et des terpénoïdes, 19 ont fait l’objet d’une évaluation des risques qu’elles posent sur l’environnement et la santé humaine. Les décisions prises pour ces substances figurent dans des rapports distinctsNote de bas de page 2. Les décisions pour les 41 substances restantes seront communiquées dans des évaluations préalables distinctes. Ces 60 substances ne seront donc plus mentionnées dans le présent rapport.
Les 16 substances visées par la présente ébauche d’évaluation préalable seront dans les présentes appelées collectivement groupe des sesquiterpènes monocycliques et bicycliques. Certaines substances sont traitées en tant que sous-groupes en raison de similitudes dans leur structure chimique, de leurs propriétés ou de leur toxicité. Étant donné que ces substances peuvent être potentiellement utilisées de la même manière et pour de mêmes utilisations, le potentiel de risque pour la santé humaine est traité en utilisant des hypothèses d’exposition similaires pour chaque sous-groupe.
Le sous-groupe 1 inclut des substances pour lesquelles une démarche d’évaluation des risques qualitative a été suivie, étant donné le faible potentiel de danger. Pour le sous-groupe 2, les renseignements sur le danger du bêta-caryophyllène ont été utilisés pour éclairer la caractérisation des risques. Le bêta-caryophyllène est une substance discrète du sous-groupe 2, le principal composant des T et T de l’essence de clou de girofle, et il a été désigné comme analogue pour lecture croisée pour le guaiène, l’alpha-guaiène et le valencène. Pour le sous-groupe 3, l’analogue pour lecture croisée, l’alpha-terpinéol, a été utilisé pour éclairer la caractérisation du danger. L’essence de santal et le guaiazulène ont été évalués individuellement.
Les risques posés à l’environnement par les substances du groupe des sesquiterpènes monocycliques et bicycliques ont été caractérisés au moyen de la démarche de classification du risque écologique des substances organiques (CRE) [ECCC 2016a]. Avec la CRE, on décrit le danger au moyen de plusieurs paramètres clés, dont le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité chimique et biologique. La CRE tient compte de l’exposition possible des organismes dans des environnements terrestres ou aquatiques, basée sur des facteurs tels que les vitesses d’émission potentielles, la persistance globale et le potentiel de transport aérien sur de grandes distances. Les différents éléments de preuve sont combinés afin de déterminer quelles substances nécessitent une évaluation plus poussée de leur potentiel d’effets nocifs sur l’environnement ou lesquelles ont une faible probabilité d’effets nocifs sur l’environnement.
Certaines des substances du groupe des sesquiterpènes monocycliques et bicycliques actuellement évaluées ou certains des analogues utilisés pour la lecture croisée ont fait l’objet d’une étude par l’Environmental Protection Agency des États-Unis (EPA), l’Agence européenne des produits chimiques (ECHA), l’Autorité européenne de sécurité des aliments (EFSA), le Comité scientifique européen pour la sécurité des consommateurs (SCCS) et l’Organisation mondiale de la santé (OMS). De plus, le naphtalène, un analogue utilisé pour une lecture croisée pour le guaiazulène, a déjà été étudié par Environnement Canada et Santé Canada (2008). Les études réalisées par ces organismes ont été utilisées pour éclairer la caractérisation des effets sur la santé de la présente évaluation.
Pour la présente ébauche d’évaluation préalable, nous avons pris en compte des renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, dont des renseignements soumis par des parties intéressées. Des données pertinentes ont été identifiées jusqu’en mars 2019. Nous avons aussi utilisé des données empiriques tirées d’études clés et certains résultats de modélisations pour tirer nos conclusions.
Le bêta-caryophyllène et le valencène ont été détectés dans des produits de vapotage, aussi appelés cigarettes électroniques (EPA 2019). L’évaluation des risques subis par la population générale découlant de cette utilisation, y compris le risque relatif à celui associé aux cigarettes classiques, et les options possibles pour réduire les risques associés à ces produits sont traitées dans un cadre législatif distinct (SC modifié en 2020).
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE travaillant à Santé Canada et Environnement et Changement climatique Canada. Elle inclut des contributions d’autres programmes de ces ministères. Les parties de la présente évaluation portant sur la santé humaine ont fait l’objet d’un examen externe ou de consultations de pairs. Mme Christine F. Chaisson, Ph. D., le Pr Ricardo Andrade Furtado, Ph. D. et M. George Burdock, Ph. D. (Risk Sciences International) ont commenté portions techniques portant sur la santé humaine. La partie de la présente évaluation sur l’environnement est basée sur le document de définition de la CRE (publié le 30 juillet 2016), qui fut soumis à un examen externe et à une période de commentaires du public de 60 jours. Santé Canada et Environnement et Changement climatique Canada ont tenu compte des commentaires de l’extérieur, mais ces ministères restent responsables du contenu et des conclusions de la présente évaluation préalable.
La présente ébauche d’évaluation préalable est centrée sur des renseignements critiques pour déterminer si les substances visées satisfont aux critères de l’article 64 de la LCPE. Pour ce faire, nous avons examiné des renseignements scientifiques et suivi une démarche basée sur le poids de la preuve et le principe de précautionNote de bas de page 3. Nous présentons dans la présente évaluation les renseignements critiques et les éléments pris en compte à partir desquels nous avons tiré nos conclusions.
2. Identité des substances
Nous énumérons au tableau 2-1 le numéro de registre du Chemical Abstracts Service (NR CAS), le nom sur la Liste intérieure des substances (LIS) et le nom commun des substances discrètes du groupe des sesquiterpènes monocycliques et bicycliques, ainsi que le nom de substances représentatives des UVCB utilisées pour éclairer les évaluations relatives à la santé humaine. Les substances visées par la présente évaluation ont été réparties en trois sous‑groupes, basés sur les structures chimiques, les propriétés ou les toxicités, et deux substances individuelles.
Les terpènes sont des hydrocarbures simples constitués d’une répétition d’unités d’isoprène à cinq atomes de carbone (figure 2-1). Les terpénoïdes sont une classe de terpènes modifiés avec différents groupes fonctionnels et un groupe méthyle oxydé déplacé ou éliminé à diverses positions. Les terpènes et les terpénoïdes sont classés en fonction du nombre d’unités d’isoprène qu’ils contiennent (Caputi et Aprea 2011, Perveen 2018). Les monoterpènes contiennent deux unités d’isoprène. Les préfixes mono-, di-, tri- or tétra- indiquent la présence d’une, deux, trois ou quatre unités de terpènes. Les sesquiterpènes et les sesterpènes contiennent respectivement trois et cinq unités d’isoprène.
![[C(C=C)(=C)C]](/content/canadasite/fr/environnement-changement-climatique/services/evaluation-substances-existantes/ebauche-evaluation-prealable-terpenes-terpenoides-sesquiterpenes-monocycliques-bicycliques/_jcr_content/par/mwsadaptiveimage/image.img.jpg/1614278422461.jpg)
Ces substances sont des composants d’huiles essentielles présentes dans une grande variété de plantes. Les huiles essentielles sont des mélanges de composés organiques volatils provenant d’une seule source botanique, et elles contribuent à la flaveur d’une plante. Ces huiles essentielles dérivées de plantes renferment de nombreux composants qui peuvent être extraits de différentes parties de la plante (feuilles, graines, tiges, fleurs, racines, fruits, bois, herbe, gomme, bourgeons, bulbes) (Tisserand et Young 2014). De plus, la concentration de ces principaux composants peut être affectée par différents facteurs, tels que l’origine de la plante, l’espèce, la température, le sol et la géographie. Même si elles ont la même origine, des huiles essentielles extraites de plantes du même genre et de la même espèce peuvent être chimiquement différentes.
| Sous-groupea | NR CAS | Nom sur la LIS(nom commun) | Structure chimique ou nom chimique représentatif, structure, gamme de concentrations dans l’huile essentielle et formule moléculaire |
|---|---|---|---|
| 1 | 8007-08-7 | Essences de gingembreb(essence de gingembre) |
Zingibérène alpha-Curcumène bêta-Sesquiphellandrène |
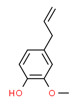
| 1 | 495-62-5 | 6-Méthyl-2-(4-méthylcyclohex-3-ènyl)hept-1,5-diène(bisabolène) | Bisabolène C15H24 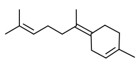
|
| 1 | 17627-44-0 | 6-Méthyl-2-(4-méthylcyclohex-3-ènyl)hept-2,5-diène(alpha-bisabolène) | alpha-Bisabolène C15H24 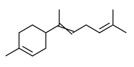
|
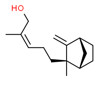
| 1 | 107898-54-4 | 3,3-Diméthyl-5-(2,2,3-triméthylcyclopent-3-ènyl)pent-4-èn-2-ol(santol-penténol) | Santol-penténol C15H26O 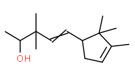
|
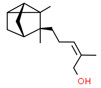
| 1 | 65113-99-7 | α,β,2,2,3-Pentaméthylcyclopent-3-ène-1-butanol (sandalore) | Sandalore C14H26O 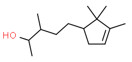
|
| 1 | 8001-61-4 | Baume de copahub(copaïba) |
bêta-Caryophyllène alpha-Copaène trans-alpha-Bergamotène |
| 2 | 87-44-5 | Caryophyllène(bêta-caryophyllène) | bêta-Caryophyllène C15H24 ![[C(=CCCC(C(C(C1(C)C)C2)C1)=C)(C2)C]](/content/dam/eccc/images/pded/terpenes-group-2/20210203-Table2-1-8.jpg)
|
| 2 | 68917-29-3 | Terpènes et terpénoïdes de l’essence de clou de girofleb(T et T de l’essence de clou de girofle) |
bêta-Caryophyllène Eugénol |
| 2 | 88-84-6 | (1S-cis)-1,2,3,4,5,6,7,8-Octahydro- -7-isopropylidène-1,4-diméthylazulène (guaiène) | Guaiène C15H24 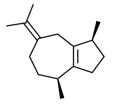
|
| 2 | 3691-12-1 | α-Guaiène (alpha-guaiène) | alpha-Guaiène C15H24 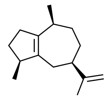
|
| 2 | 4630-07-3 | [1R-(1α,7β,8α)]-1,2,3,5,6,7,8,8a-octahydro-1,8a-diméthyl-7-isopropylidènenaphtalène (valencène) | Valencène C15H24 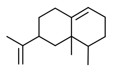
|
| 3 | 489-86-1 | 2-[(3S,8S)-1,2,3,4,5,6,7,8-Octahydro-3,8-diméthylazulèn-5-yl)propan-2-ol (guaiol) | Guaiol C15H26O 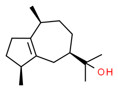
|
| 3 | 22451-73-6 | Bulsénol(bulnésol) | Bulnésol C15H26O 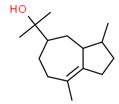
|
| 3 | 639-99-6 | [1R,2S,4R-(-)-α,α-Diméthyl-1-vinyl-o-menth-8-ène-4-méthanol(élémol) | Élémol C15H26O 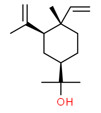
|
| Individuel | 8006-87-9 | Essences de santalb(essence de santal) |
alpha-Santalol bêta-Santalol |
| Individuel | 489-84-9 | 7-Isopropyl-1,4-diméthylazulène (guaiazulène) | Guaiazulène C15H18 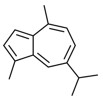
|
a Le groupe des sesquiterpènes monocycliques et bicycliques a été divisé en trois sous-groupes et deux substances individuelles pour l’évaluation. Le sous-groupe 1 comprend des substances pour lesquelles une approche d’évaluation des risques qualitative a été suivie, étant donné leur faible potentiel de danger. Pour le sous-groupe 2, les renseignements sur le danger du bêta-caryophyllène ont été utilisés pour éclairer la caractérisation des risques. Le bêta-caryophyllène est une substance discrète du sous-groupe 2, le principal composant des T et T de l’essence de clou de girofle, qui a été identifié comme analogue pour une lecture croisée pour le guaiène, l’alpha-guaiène et le valencène. Pour le sous-groupe 3, l’analogue pour lecture croisée, l’alpha-terpinéol, a été utilisé pour éclairer la caractérisation des risques. L’essence de santal et le guaiazulène ont été évalués individuellement.
b Substance de composition inconnue ou variable, produits de réaction complexes ou matières biologiques (UVCB). Ces substances sont des combinaisons complexes de molécules pouvant provenir de la nature ou être le résultat de réactions et processus chimiques ayant lieu lors du procédé de distillation. Étant donné leurs compositions complexes et variables, elles ne pourraient pas être formées simplement en combinant des constituants individuels.
c Gamme de concentrations du ou des principaux composants de l’huile essentielle de Zingiber officinale Roscoe, telle que citée dans Tisserand et Young (2014), Rania et coll. (2005), Pino et coll. (2004) et Onyenekwe et Hashimoto (1999).
d Gamme de concentrations du ou des principaux composants de l’huile essentielle de Copaifera langsdorffii/Copaifera officinalis, telle que citée dans Tisserand et Young (2005) et Swift (2005).
e Gamme de concentrations du ou des principaux composants pour les terpènes et les terpénoïdes, l’essence de clou de girofle, telle que citée dans les fiches techniques de deux producteurs (FDT 2018, FDS 2009).
f Gamme de concentrations du ou des principaux composants de l’huile essentielle de Santalum album L., Santalum austrocaledonicum Vieill. et Santalum spicatum, telle que citée dans Tisserand et Young (2014), Xin-Hua et coll. (2012), Brand et coll. (2007) et Verghese et coll. (1990).
2.1 Sélection d’analogues
Une approche de lecture croisée à partir des données d’analogues ou de composants des substances ciblées, suivant le cas, a été suivie pour éclairer l’évaluation des effets sur la santé humaine et la caractérisation des risques. Les analogues ont été sélectionnés à partir d’une longue liste de substances ayant des propriétés et des structures similaires à celles des substances de ce groupe (p. ex. propriétés physico-chimiques, toxicocinétiques) et pour lesquelles il existait des données empiriques sur les effets sur la santé.
La sélection des analogues a été basée sur une analyse réalisée en utilisant la version 4.2 de la boîte à outils QSAR (relation quantitative structure/activité) de l’Organisation de coopération et de développement économiques (OCDE, Boîte à outils QSAR 2019). En l’absence de données empiriques sur les effets sur la santé du bisabolène et de l’alpha-bisabolène, l’évaluation a été basée sur une approche de lecture croisée de l’EFSA pour laquelle le limonène a été utilisé comme analogue (EFSA 2015b). Des détails sur les données de lecture croisée choisies pour éclairer la caractérisation des effets sur la santé humaine des substances du groupe des sesquiterpènes monocycliques et bicycliques sont donnés dans les sections pertinentes du présent rapport. Nous présentons dans le tableau 2-2 les renseignements sur les identités et les structures chimiques des analogues utilisés pour éclairer l’évaluation ayant trait à la santé humaine pour les sesquiterpènes monocycliques et bicycliques (c.-à-d. le sous-groupe 3, l’essence de santal (UVCB) et le guaiazulène). Les données toxicologiques sur les analogues sont présentées à l’annexe A.
| Sous-groupe ou substance évaluéa | NR CAS de l’analogue | Nom commun | Structure chimique, formule moléculaire et SMILES | Masse moléculaire (g/mol) |
|---|---|---|---|---|
| 3 | 10482-56-1 | alpha-Terpinéol | 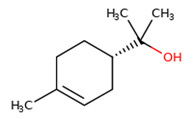 C10H18O C10H18OCC1=CCC(CC1)C(C)(C)O |
154,25 |
| Essence de santal | 515-69-5 | Bisabolol | 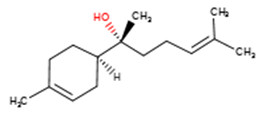 C15H26O C15H26OCC1=CCC(CC1)C(C)(CCC=C(C)C)O |
222,72 |
| Guaiazulène | 91-20-3 | Naphtalène |  C10H8 C10H8c1ccc2ccccc2c1 |
128,17 |
a Sections 7.2.2.2 et 7.2.2.3 pour le bisabolène et l’alpha-bisabolène, section 9.2 pour le sous-groupe 3, section 10.2.3 pour l’essence de santal et section 11.2.2 pour le guaiazulène.
3. Propriétés physiques et chimiques
Nous résumons aux tableaux 3-1 à 3-4 les principales propriétés physiques et chimiques des substances du groupe des sesquiterpènes monocycliques et bicycliques. Quand des données expérimentales n’étaient pas disponibles, nous avons utilisé des données sur des analogues pour une lecture croisée ou des modèles (Q)SAR (OCDE 2019) pour générer des valeurs prédites pour la substance. Les propriétés des substances analogues sont présentées dans l’annexe A. Des propriétés physiques et chimiques supplémentaires sont rapportées dans un document d’ECCC (2016b).
| Substance | Structure représentative, nom commun (NR CAS) | Masse moléculaire (g/mol)a | Solubilité dans l’eau (mg/L)a | Pression de vapeur (Pa)a | log Koea |
|---|---|---|---|---|---|
| Essence de gingembre | Zingibérène (495-60-3) | 204,19 | 1,50 × 10-2 (M) | 3,27(M) | 6,92(M) |
| Essence de gingembre | alpha-Curcumène (644‑30-4) | 202,17 | 1,80 × 10-2 (M) | 1,11(M) | 6,29(M) |
| Essence de gingembre | bêta-Sesquiphellandrène (20307-83-9) | 204,19 | 1,28 × 10-2 (M) | 4,23(M) | 6,99(M) |
| Bisabolène | N/A | 204,36 | 9,95 × 10-3 (M) | 2,93(M) | 7,12(M) |
| alpha-Bisabolène | N/A | 204,36 | 1,16 × 10-2 (M) | 2,11(M) | 7,05(M) |
| Santol-penténol | N/A | 222,37 | 2,71(M) | 1,66 × 10-2(M) | 5,39(M) |
| Sandalore | N/A | 210,36 | 5,01(M) | 5,90 × 10-2(M) | 5,15(M) |
| Copaïba | bêta-Caryophyllène (87‑44-5) | 204,36 | 5,01 × 10-2 (M) | 4,16(M) | 6,30(M) |
| Copaïba | alpha-Copaène (3856‑25‑5) | 204,36 | 3,16 × 10-1 (M) | 6,35(M) | 5,36(M) |
| Copaïba | trans-alpha-Bergamotène (13 474‑59‑4) | 204,36 | 2,99 × 10-2 (M) | 3,69(M) | 6,57(M) |
Abréviations : N/A = non applicable; Koe = coefficient de partage octanol-eau
(M) = modélisé
a EPA 2012a
| Substance | Structure représentative, nom commun (NR CAS) | Masse moléculaire (g/mol)a | Solubilité dans l’eau (mg/L)a | Pression de vapeur (Pa)a | log Koea |
|---|---|---|---|---|---|
| bêta-Caryophyllène | N/A | 204,36 | 5,01 × 10-2(M) | 4,16(M) | 6,30(M) |
| Terpènes et terpénoïdes de l’essence de clou de girofle (T et T de l’essence de clou de girofle) | bêta-Caryophyllène (87‑44-5) | 204,36 | 5,01 × 10-2(M) | 4,16(M) | 6,30(M) |
| Terpènes et terpénoïdes de l’essence de clou de girofle (T et T de l’essence de clou de girofle) | Eugénol (97-53-0) | 164,20 | 754(M) | 1,26(M) | 2,27(M) |
| Guaiène | N/A | 204,35 | 1,92 × 10-2(M) | 1,73(M) | 6,79(M) |
| alpha-Guaiène | N/A | 204,35 | 3,36 × 10-2(M) | 3,27(M) | 6,51(M) |
| Valencène | N/A | 204,35 | 5,01 × 10-2(M) | 4,41(M) | 6,30(M) |
Abréviations : N/A = non applicable; Koe = coefficient de partage octanol-eau
(M) = modélisé
a EPA 2012a
| Substance | Structure représentative, nom commun (NR CAS) | Masse moléculaire (g/mol)a | Solubilité dans l’eau (mg/L)a | Pression de vapeur (Pa)a | log Koea |
|---|---|---|---|---|---|
| Guaiol | N/A | 222,37 | 3,61(M) | 4,86 × 10-3(M) | 5,24(M) |
| Bulnésol | N/A | 222,37 | 7,07(M) | 6,80 × 10-3(M) | 4,90(M) |
| Élémol | N/A | 222,37 | 1,99(M) | 5,14 × 10-2(M) | 5,54(M) |
Abréviations : N/A = non applicable; Koe = coefficient de partage octanol-eau
(M) = modélisé
a EPA 2012a
| Substance | Structure représentative, nom commun (NR CAS) | Masse moléculaire (g/mol)a | Solubilité dans l’eau (mg/L)a | Masse volumiquea | Pression de vapeur (Pa)a | log Koea |
|---|---|---|---|---|---|---|
| Essence de santal | alpha-Santalol (115‑71‑9) | 220,35 | 6,41(M) | 1,00(M) | 4,51 × 10-3(M) | 4,96(M) |
| Essence de santal | bêta-Santalol (77‑42‑9) | 220,35 | 4,19(M) | 1,00(M) | 9,83 × 10-3(M) | 5,18(M) |
| Guaiazulène | N/A | 198,30 | 1,12 × 10-1(M) | 1,00 | 1,41(M) | 5,93(M) |
Abréviations : N/A = non applicable; Koe = coefficient de partage octanol-eau
(M) = modélisé
a EPA 2012a
4. Sources et utilisations
À l’exception de l’alpha-guaiène, toutes les substances du groupe des sesquiterpènes monocycliques et bicycliques ont été visées par une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012). Nous résumons au tableau 4-1 les renseignements déclarés sur les quantités totales produites et importées pour les substances de ce groupe. D’après ces renseignements, il n’y a eu, en 2011, aucune production ou importation au-dessus du seuil de déclaration de 100 kg d’essence de gingembre, de bisabolène, d’alpha-bisabolène, de copaïba, des T et T de l’essence de clou de girofle, de valencène, de guaiol, de bulnésol, d’élémol, d’essence de santal et de guaiazulène (Environnement Canada 2013). On n’a pas divulgué de production de santol-penténol et de sandalore, au-dessus du seuil de déclaration de 100 kg en 2011, mais pendant cette même année, on en a importé au Canada entre 100 et 1000 kg (Environnement Canada 2013). On n’a pas divulgué de production de bêta‑caryophyllène, au-dessus du seuil de déclaration de 100 kg en 2011, mais pendant cette même année, on en a importé au Canada entre 1000 et 10 000 kg (Environnement Canada 2013).
| Nom commun | Production totale (kg)a | Importations totales (kg)a | Année de déclaration |
|---|---|---|---|
| Essence de gingembre | PD | PD | 2011 |
| Bisabolène | PD | PD | 2011 |
| alpha-Bisabolène | PD | PD | 2011 |
| Santol-penténol | PD | 100 à 1000 | 2011 |
| Sandalore | PD | 100 à 1000 | 2011 |
| Copaïba | PD | NR | 2011 |
| bêta-Caryophyllène | PD | 1000 à 10 000 | 2011 |
| T et T de l’essence de clou de girofle | PD | PD | 2011 |
| Guaiène | PD | PD | 2011 |
| alpha-Guaiène | PD | N/A | N/A |
| Valencène | PD | PD | 2011 |
| Guaiol | PD | PD | 2011 |
| Bulnésol | PD | PD | 2011 |
| Élémol | PD | PD | 2011 |
| Essence de santal | PD | PD | 2011 |
| Guaiazulène | PD | PD | 2011 |
Abréviations : PD = pas de déclaration au-dessus du seuil de déclaration de 100 kg; N/A = non applicable, cette substance n’était pas visée par l’enquête menée en 2011.
a Les valeurs reflètent les quantités déclarées en réponse à l’enquête menée en vertu de l’article 71 de la LCPE (Canada 2012). Consulter l’enquête pour les inclusions et exclusions spécifiques (annexes 2 et 3).
Les renseignements obtenus en vertu de l’article 71 de la LCPE indiquent que le bisabolène, l’alpha-bisabolène, le santol-penténol, le sandalore et le copaïba sont utilisés dans des produits de soins personnels (Environnement Canada 2013).
D’autres utilisations des substances du sous-groupe 1, du sous-groupe 2 et de l’essence de santal sont rapportées dans les tableaux 4-2, 4-3 et 4-4.
| Utilisation | Essence de gingembre | Bisabolène | alpha-Bisabolène | Santol-penténol | Sandalore | Copaïba |
|---|---|---|---|---|---|---|
| Aromatisant alimentairea | O | O | O | N | N | O |
| Emballage alimentairea | N | N | N | N | N | O (composant d’encres d’imprimerie, pas de contact direct avec les aliments) |
| Base de données d’ingrédients de produits de santé naturelsb | O (en tant qu’huile essentielle de gingembre, IM, INM) | N | N | N | N | O (IM, INM) |
| Base de données des produits de santé naturels homologués, ingrédient médicinal ou non médicinal dans des produits de santé naturels au Canadab | O (IM, INM) | N | N | N | N | O (IM, INM) |
| Déclaré présent dans des cosmétiques, d’après des déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiquesc | O | N | N | N | O | O |
| Formulant de produits antiparasitaires homologués au Canadad | N | O | O | O | O | O |
Abréviations : O = oui, cette utilisation a été rapportée pour cette substance; N = non, cette utilisation n’a pas été rapportée pour cette substance; IM = ingrédient; INM = ingrédient non médicinal
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2015 et 2017; sans référence.
b Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2015; sans référence.
c Communication personnelle, courriel de la Direction de la sécurité des produits dangereux et des consommateurs de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2015; sans référence.
d Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2015; sans référence.
| Utilisation | bêta-Caryophyllène | T et T de l’essence de clou de girofle | Guaiène | alpha-Guaiène | Valencène |
|---|---|---|---|---|---|
| Aromatisant alimentairea | O | N | O | N | O |
| Base de données d’ingrédients de produits de santé naturelsb | O | N | N | N | O |
| Base de données des produits de santé naturels homologués, présent en tant qu’ingrédient médicinal ou non médicinal dans des produits de santé naturels au Canadab | O (IM; INM) | N | N | N | N |
| Déclaré présent dans des cosmétiques, basé sur les déclarations faites à santé Canada en vertu du Règlement sur les cosmétiquesc | O | O | N | N | N |
| Formulant de produits antiparasitaires homologués au Canadad | O | O | O | O | N |
Abréviations : O = oui, cette utilisation a été rapportée pour cette substance; N = non, cette utilisation n’a pas été rapportée pour cette substance; IM = ingrédient; INM = ingrédient non médicinal
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2017; sans référence.
b Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2015 et 2017; sans référence.
c Communication personnelle, courriel de la Direction de la sécurité des produits dangereux et des consommateurs de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2017 et octobre 2019; sans référence.
d Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2015 et 2016; sans référence.
| Utilisation | Détails |
|---|---|
| Aromatisant alimentairea | Utilisations rapportées au niveau international dans des boissons alcooliques ou non alcooliques, des produits de boulangerie et pâtisserie, des gommes à mâcher, des produits laitiers congelés et des confiseries |
| Base de données d’ingrédients de produits de santé naturelsb | IM (essence de santal), INM (essence de santal) (exhausteur de goût, ingrédient de fragrance) |
| Base de données de produits de santé naturels homologués, présent en tant qu’ingrédient médicinal ou non médicinal dans des produits de santé naturels au Canadab | IM (essence de santal), INM (essence de santal) |
| Déclaré présent dans des cosmétiques, d’après des déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiquesc | Lotions pour les corps, fragrances, nettoyants, produits de massage et produits pour soins capillaires |
| Formulant dans des produits antiparasitaires homologués au Canadad | Formulant |
Abréviations : IM = ingrédient; INM = ingrédient non médicinal.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2015; sans référence, Burdock 2010.
b Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2017; sans référence.
c Communication personnelle, courriel de la Direction de la sécurité des produits dangereux et des consommateurs de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, octobre 2019; sans référence.
d Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2015; sans référence.
Sous-groupe 1 (essence de gingembre, bisabolène, alpha-bisabolène, santol-penténol, sandalore, copaïba)
Le sous-groupe 1 comporte quatre substances discrètes (bisabolène, alpha‑bisabolène, santol-penténol, sandalore) et deux UVCB (essence de gingembre et copaïba). L’essence de gingembre est obtenue par distillation à la vapeur de rhizomes de gingembre moulus, secs. Le gingembre est cultivé principalement dans des pays tropicaux et subtropicaux (Jamaïque, Inde, pays d’Afrique, sud de la Chine et Australie) à partir d’une plante herbacée originaire d’Asie, le Zingiber officinale Roscoe (Burdock 2010). Le copaïba est obtenu à partir de l’oléorésine des espèces de Copaifera (Leguminoseae), qui poussent principalement dans le nord et le nord-est du Brésil. L’oléorésine tirée du tronc de ces espèces est un liquide transparent dont la couleur va du jaune au brun clair (Santiago et coll. 2015). Dans le cas du copaïba, cette substance peut être présente dans des produits disponibles pour les consommateurs sous forme de résine, d’oléorésine ou d’huile essentielle, toutes ayant une composition similaire. Le nom copaïba couvre toutes les sous-espèces de copaïba (Copaifera langsdorffii, Copaifera multijuga, Copaifera officinalis et Copaifera duckei).
L’essence de gingembre est utilisée dans un certain nombre de produits disponibles pour les consommateurs, tels que des lotions pour le corps, des parfums, des nettoyants, des produits pour le bain, des produits de massage, des désodorisants et déodorants, des produits de soins capillaires et des produits de soins oraux. D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, le Zingiber officinale (gingembre), l’essence de gingembre ou l’essence essentielle de gingembre sont utilisés dans plus de 250 produits au Canada, à une concentration inférieure ou égale à 3 % pour une majorité de ceux-ci (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada 2017; sans référence). L’essence essentielle de gingembre est également inscrite dans la Base de données d’ingrédients de produits de santé naturels, en tant qu’ingrédient médicinal ou non médicinal comme exhausteur de goût, ingrédient de parfum, agent masquant, agent de conditionnement de la peau ou agent tonique (BDIPSN 2019). Il existe des produits de santé naturels homologués, comme un analgésique topique, un antiseptique oral, qui contiennent de l’essence essentielle de gingembre comme ingrédient non médicinal (BDPSNH 2018). De plus, selon l’American Cleaning Institute (ACI), l’essence de gingembre est utilisée comme fragrance dans des nettoyants tout‑usage, des produits pour la vaisselle et de produits pour la lessive (ACI 2018).
Le copaïba est utilisé dans un certain nombre de produits disponibles pour les consommateurs, comme des lotions pour le corps ou le visage, des produits de massage, des nettoyants et des produits de soins capillaires. D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, le copaïba, la résine de copaïba et la résine de Copaifera officinalis (copaïba) sont utilisés dans plus de 60 produits, à une concentration inférieure ou égale à 3 % pour une majorité (plus de 85 %) de ceux-ci (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada 2015; sans référence). On a aussi signalé l’utilisation du copaïba dans des cosmétiques à cause de ses fonctions filmogène, masquante et parfumante (COSING 2018). Le Copaifera officinalis est inscrit dans la Base de données d’ingrédients de produits de santé naturels en tant qu’ingrédient homéopathique et ingrédient médicinal. La résine de Copaifera officinalis (copaïba) est inscrite en tant qu’ingrédient non médicinal utilisé comme agent filmogène ou parfum dans des produits à usage topique (BDIPSN 2019). Le Copaifera officinalis, l’essence essentielle de copaïba et le copaïba sont présents en tant qu’ingrédient médicinal et homéopathique dans des produits de santé naturels. La résine de Copaifera officinalis (copaïba) est présente en tant qu’ingrédient non médicinal dans des produits homologués tels que des analgésiques à usage topique, des médicaments contre l’acné, des écrans solaires et des produits capillaires (BDPSNH 2018). De plus, le site Web de l’ACI indique une utilisation potentielle du copaïba dans des produits de nettoyage domestiques (ACI 2017).
D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, le sandalore a été rapporté dans un nombre limité de produits à des concentrations allant jusqu’à 1 %, et aucune déclaration n’a été faite pour le bisabolène, l’alpha-bisabolène et le santol-penténol (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada 2017; sans référence). L’International Fragrance Association a rapporté que le bisabolène, l’alpha-bisabolène, le santol-penténol et le sandalore sont des ingrédients de parfums utilisés dans des produits de consommation (IFRA 2016).
Au Canada, on a signalé l’utilisation de bisabolène, d’alpha-bisabolène, de santol-penténol, de sandalore et de copaïba comme formulants des produits antiparasitaires.
Au niveau international, l’utilisation de l’essence de gingembre et du bisabolène a été rapportée en tant qu’aromatisant dans des aliments dont des boissons alcooliques et non alcooliques, des produits laitiers congelés, des gélatines et des puddings et des confiseries molles (Burdock 2010). L’essence de gingembre, le bisabolène et le copaïba sont inscrits en tant qu’agents aromatisants dans le Substances Added to Food Inventory de la Food and Drug Administration (FDA) des États-Unis (FDA 2018, FCC 2018). Le bisabolène y est aussi inscrit comme agent antimicrobien, exhausteur de goût ou adjuvant, et le copaïba comme adjuvant (FDA 2018). De plus, le bisabolène et l’alpha‑bisabolène sont inscrits sur la liste des aromatisants de l’Union européenne (UE), et l’essence de gingembre, le bisabolène et le copaïba sont inscrits dans le Food Chemicals Codex comme agent aromatisant (FCC 2018). Aucun renseignement définitif n’est disponible sur l’utilisation potentielle d’essence de gingembre, de bisabolène, d’alpha-bisabolène ou de copaïba comme agents aromatisants au Canada. Toutefois, puisque ces substances sont connues pour être utilisées comme agents aromatisants aux États-Unis ou en Europe, il est possible qu’elles soient présentes dans des aliments vendus au Canada (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2019; sans référence).
Sous-groupe 2 (bêta-caryophyllène, T et T de l’essence de clou de girofle, guaiène, alpha-guaiène et valencène)
Le sous-groupe 2 comporte quatre substances discrètes (bêta-caryophyllène, guaiène, alpha-guaiène et valencène) et un UVCB (T et T de l’essence de clou de girofle). Le bêta-caryophyllène est un sesquiterpène bicyclique naturel et un constituant commun de nombreuses huiles essentielles, en particulier des essences de clou de girofle, de Cannabis sativa, de romarin et de houblon (da Silva Oliveira 2018).
Les T et T de l’essence de clou de girofle sont un sous-produit du procédé de production de différentes essences de clous de girofle. Ils contiennent du bêta‑caryophyllène (minimum de 70 %) et de l’eugénol (maximum de 5 %). L’essence brute extraite des feuilles, des pousses et des tiges des plantes de la famille des Myrtaceae est distillée à la vapeur, puis retraitée pour produire diverses qualités d’essence de girofle et de dérivés (Ultra International B.V. 2018, FDT 2018, FS 2009). Le terme « terpènes et terpénoïdes » fait référence aux résultats de l’isolement de certaines fractions de terpènes et de terpénoïdes de l’essence brute. Arctander (1960) indique que « terpeneless, terpene, fractionated, rectified, or redistilled » peuvent être d’autres synonymes de terpènes et terpénoïdes.
Le bêta-caryophyllène est utilisé dans un certain nombre de produits disponibles pour les consommateurs, tels que des lotions pour le corps ou le visage et des produits pour soins capillaires. D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, le bêta-caryophyllène est utilisé dans un nombre limité de produits au Canada, à des concentrations allant jusqu’à 0,1 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, janvier 2017; sans référence). Le bêta-caryophyllène est aussi présent dans plusieurs produits de santé naturels, tels que des nettoyants pour le visage pour traiter l’acné et un produit topique utilisé pour traiter l’herpès buccal. Selon l’ACI, le bêta-caryophyllène est également utilisé comme parfum dans du détergent liquide pour lessive et des renforçateurs pour détergents (ACI 2018).
Les T et T de l’essence de clou de girofle sont utilisés dans un certain nombre de produits disponibles pour les consommateurs, tels que des lotions pour le corps, des parfums, des nettoyants, des produits pour le bain, des produits de massage, des désodorisants ou déodorants, des produits de soins capillaires et des produits de soins oraux. D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, les T et T de l’essence de clou de girofleNote de bas de page 4 sont utilisés dans plus de 600 produits au Canada, à une concentration inférieure ou égale à 3 % pour la majorité (94 %) de ceux-ci (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, octobre 2019; sans référence). Étant donné qu’il n’existe pas de nom spécifique pour les T et T de l’essence de clou de girofle dans l’International Nomenclature of Cosmetic Ingredients, il existe un certain degré d’incertitude quant aux déclarations faites en vertu du Règlement sur les cosmétiques pour les produits susmentionnés contenant des T et T de l’essence de clou de girofle ou simplement de l’essence de clou de girofle. En l’absence de tout renseignement additionnel, aux fins de la présente évaluation, nous présumons que les produits susmentionnés contiennent des T et T de l’essence de clou de girofle. Ceci constitue une approche prudente, puisque la quantité de bêta‑caryophyllène dans l’essence de clou de girofle classique est bien inférieure à celle des T et T de l’essence de clou de girofle (17 % par rapport à plus de 70 %) et que le danger associé à l’eugénol, le principal composant de l’essence de clou de girofle classique, est faible (ECCC et SC 2018c).
Le guaiène, les T et T de l’essence de clou de girofle, l’alpha-guaiène et le valencène sont aussi mentionnés comme ingrédients de parfum utilisés dans des biens de consommation par l’International Fragrance Association (IFRA 2017).
Au Canada, on a signalé l’emploi de bêta-caryophyllène, des T et T de l’essence de clou de girofle, du guaiène et de l’alpha-guaiène comme formulant dans des produits antiparasitaires.
Au plan international, l’utilisation de bêta-caryophyllène et de valencène a été signalée dans une large variété d’aliments préparés, dont des produits de boulangerie et de pâtisserie, des produits laitiers congelés, de la gomme à mâcher et des boissons (Burdock 2010). Le guaiène est présent naturellement en petite quantité dans l’essence de patchouli et d’autres essences essentielles. Il a été rapporté présent dans l’essence de pelure de lime, l’essence de menthe poivrée, du calamus, les racines, les graines et les feuilles de livèche et dans le mangoustan (Garcinia mangostana L.) (Burdock 2010). Le guaiène et le valencène sont des substances aromatisantes autorisées dans l’Union européenne (EFSA 2015b). Le bêta-caryophyllène, le guaiène et le valencène sont inscrits dans le Substances Added to Food Inventory de la FDA des États‑Unis en tant qu’agents aromatisants ou adjuvants (FDA 2018). Le bêta‑caryophyllène est aussi inscrit dans le Food Chemicals Codex en tant qu’agent aromatisant (FCC 2015). Aucun renseignement définitif n’est disponible sur l’utilisation potentielle du bêta-caryophyllène, du guaiène ou du valencène comme aromatisant alimentaire au Canada. Néanmoins, puisque ces substances sont connues pour être utilisées comme agents aromatisants aux États-Unis, il est possible qu’elles soient présentes en tant qu’aromatisant alimentaire dans des aliments vendus au Canada (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2019; sans référence).
De plus, on a signalé la présence de bêta-caryophyllène et de valencène dans des produits de vapotage aux États-Unis (EPA 2019).
Sous-groupe 3 (guaiol, bulnésol, élémol)
Le sous-groupe 3 comporte trois substances discrètes, le guaiol, le bulnésol et l’élémol. Ce sont des alcools sesquiterpénoïdes présents dans un certain nombre d’essences essentielles dont celles du bois de guaiac, de cyprès et dans l’essence de guaiac (Bledsoe 2000, Petrov 2019).
Au Canada, aucune déclaration de la présence de guaiol, de bulnésol ou d’élémol dans des produits cosmétiques n’a pas été faite à Santé Canada en vertu du Règlement sur les cosmétiques. En Europe, la présence de guaiol ou d’élémol a été signalée dans des cosmétiques avec une fonction de parfum (COSING 2018). Ils ont aussi été décrits par l’International Fragrance Association comme ingrédients de parfum utilisés dans des produits de consommation (IFRA 2017).
L’élémol est utilisé comme agent odorant ou parfumant dans une large gamme de produits, dont des produits de soins personnels, des produits de nettoyage et des assainisseurs d’air, à une concentration de 50 ppm ou moins (suivi de renseignements obtenus lors d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012).
L’utilisation d’élémol comme formulant a aussi été rapportée dans des produits antiparasitaires (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, janvier 2016; sans référence).
L’élémol est une substance aromatisante autorisée dans l’Union européenne (EFSA 2015c). Aucun renseignement définitif n’est disponible sur l’utilisation potentielle d’élémol comme aromatisant alimentaire au Canada. Néanmoins, étant donné qu’au niveau international cette substance est connue pour être utilisée comme aromatisant alimentaire, il est possible qu’elle soit présente dans des aliments vendus au Canada (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2019; sans référence).
Essence de santal
L’essence de santal est utilisée dans un certain nombre de produits disponibles pour les consommateurs, tels que des lotions pour le corps, des parfums, des nettoyants, des produits de massage et des produits pour soins capillaires. D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l’essence de santalNote de bas de page 5 est utilisée dans plus de 650 produits au Canada, à une concentration de 3 % ou moins pour la majorité (90 %) de ceux-ci (communication personnelle, courriel de la Direction de la sécurité des produits dangereux et des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, octobre 2019; sans référence).
L’essence de santal est inscrite dans la Base de données d’ingrédients de produits de santé naturels en tant qu’ingrédient homéopathique, ingrédient médicinal (essence essentielle de santal) et ingrédient non médicinal à des fins d’exhausteur de flaveur ou d’ingrédient de parfum (BDIPSN 2019). L’essence de Santalum album (bois de santal) est présente en tant qu’ingrédient non médicinal dans certains produits de santé naturels homologués, comme des médicaments contre l’acné et des écrans solaires (BDPSNH 2018).
Selon l’ACI, l’essence de santal est utilisée comme parfum dans des nettoyants liquides tout-usage, des produits pour la vaisselle et des produits pour la lessive (ACI 2018). L’essence de santal est aussi utilisée comme formulant dans des produits antiparasitaires (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada 2015; sans référence).
Au niveau international, l’utilisation d’essence de santal a été signalée dans des aliments, dont des boissons alcooliques ou non alcooliques, des produits de boulangerie et de pâtisserie, de la gomme à mâcher, des produits laitiers congelés et des confiseries (Burdock 2010). L’essence de santal est inscrite en tant qu’agent aromatisant ou adjuvant dans le Substances Added to Food Inventory de la FDA des États-Unis (FDA 2018). Aucun renseignement définitif n’est disponible sur l’utilisation potentielle de l’essence de santal comme aromatisant alimentaire au Canada. Néanmoins, étant donné que cette substance est connue pour être utilisée comme aromatisant alimentaire aux États-Unis, il est possible qu’elle soit présente dans des aliments vendus au Canada (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2019; sans référence).
Guaiazulène
Le guaiazulène est un sesquiterpène bicyclique présent naturellement dans diverses essences essentielles, comme l’essence de bois de gaïac ou de camomille (Matricaria chamomilla) [Kourounakis et coll. 1997].
Le guaiazulène donne une couleur bleue aux cosmétiques (Andersen 1999) et est utilisé dans un certain nombre de produits disponibles pour les consommateurs, comme des hydratants pour le corps ou le visage, des shampooings, des revitalisants, des produits pour le bain, des produits capillaires d’élimination après soins, des huiles pour massage, des déodorants, des exfoliants et des produits de maquillage. D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, le guaiazulène est présent dans plus de 90 cosmétiques, à une concentration de moins de 0,1 % dans la majorité (70 %) de ces produits (communication personnelle, courriel de la Direction de la sécurité des produits dangereux et des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, octobre 2019; sans référence).
Le guaiazulène est inscrit dans la Base de données d’ingrédients de produits de santé naturels comme ingrédient non médicinal à des fins de parfum et d’additif de couleur (BDIPSN 2019). Toutefois, aucun produit de santé naturel homologué en contenant n’a été recensé (BDPSNH 2018).
Aucun renseignement n’est disponible sur une utilisation alimentaire directe ou indirecte du guaiazulène au Canada ou au niveau international (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2017; sans référence).
5. Devenir et comportement dans l’environnement
5.1 Persistance dans l’environnement et potentiel de bioaccumulation
Les modèles utilisés pour la CRE (ECCC 2016b) prédisent que l’essence de gingembre, le bisabolène, l’alpha-bisabolène, le santol-penténol, le sandalore, le copaïba, le valencène et l’essence de santal ne devraient pas être persistants dans l’eau, l’air, les sédiments ni dans les sols. Étant donné leur demi-vie, le bêta‑caryophyllène, le T et T de l’essence de clou de girofle, le guaiène, l’alpha-guaiène, le guaiol, le bulnésol, l’élémol et le guaiazulène devraient persister dans l’eau, les sédiments et les sols, mais pas dans l’air.
Étant donné leur faible log Koe, leur faible facteur de bioconcentration et leur faible facteur de bioaccumulation (ECCC 2016b), l’essence de gingembre, le bulnésol, le santol-penténol, le sandalore, le guaiol, l’élémol et l’essence de santal ne devraient pas beaucoup se bioaccumuler dans les organismes. Étant donné sa valeur modérée à élevée de leur log Koe (> 4,2) et leur fort facteur de bioaccumulation (> 5000) (ECCC 2016b), le bisabolène, l’alpha‑bisabolène, le copaïba, le bêta-caryophyllène, les T et T de l’essence de clou de girofle, le guaiène, l’alpha-guaiène, le valencène et le guaiazulène devraient être bioaccumulés de manière significative dans les organismes.
En conséquence, les T et T de l’essence de clou de girofle, le guaiène, l’alpha‑guaiène et le guaiazulène devraient persister dans l’environnement et se bioaccumuler dans les organismes. Le bêta-caryophyllène, le principal composant des T et T de l’essence de clou de girofle, qui représente de 73 à 80 % de sa composition, devrait aussi persister dans l’environnement et présenter un potentiel élevé de bioaccumulation.
6. Potentiel d’effets nocifs sur l’environnement
6.1 Caractérisation des risques pour l’environnement
Les risques posés à l’environnement par les substances du groupe des sesquiterpènes monocycliques et bicycliques ont été caractérisés au moyen de la démarche de classification du risque écologique des substances organiques (CRE) [ECCC 2016a]. La CRE est une démarche basée sur le risque qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des divers éléments de preuve pour déterminer la classification. Nous combinons les divers éléments de preuve pour distinguer entre des substances de puissance faible ou élevée et celles dont le potentiel d’exposition est plus faible ou plus élevé dans divers milieux. Cette démarche réduit l’incertitude globale de la caractérisation comparativement à une approche qui reposerait sur un unique paramètre dans un seul milieu (p. ex. la concentration létale moyenne). Nous résumons cette démarche dans ce qui suit. La démarche est décrite en détail dans le document d’ECCC (2016a).
Nous avons collecté des données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les quantités produites et importées au Canada dans les écrits scientifiques, dans des bases de données empiriques (p. ex. Boîte à outils QSAR de l’OCDE 2014) et dans les réponses à des enquêtes menées en vertu de l’article 71 de la LCPE. Nous en avons généré aussi en utilisant des modèles choisis de type (Q)SAR (relation (quantitative) structure-activité) ou de devenir du bilan massique et de bioaccumulation. Ces données ont été utilisées comme données d’entrée d’autres modèles de bilan massique ou pour compléter les profils d’exposition ou de danger des substances.
Les profils de danger sont basés principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition sont aussi basés sur plusieurs paramètres, dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport sur de grandes distances. Les profils de danger et d’exposition sont comparés à des critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance organique comme faible, modéré ou élevé. D’autres règles ont été appliquées (p. ex. constance de la classification, marge d’exposition) afin de préciser les classifications préliminaires du danger et de l’exposition.
Nous avons utilisé une matrice de risque pour assigner à chaque substance une classification du potentiel de risque faible, modérée ou élevée en se basant sur les classifications du danger et de l’exposition. Les classifications du risque potentiel au moyen de la CRE ont été vérifiées en suivant une approche en deux étapes. La première étape sert à ajuster le résultat de la classification du risque de modérée ou élevée à faible dans le cas des substances qui ont une faible vitesse d’émission estimée dans l’eau suite au traitement des eaux usées, représentant un faible potentiel d’exposition. La deuxième étape sert à réexaminer la classification du potentiel de risque comme étant faible en utilisant des scénarios de risque relativement prudents à une échelle locale (c.-à-d. à proximité immédiate d’un point de rejet), conçus pour être protecteurs de l’environnement, afin de déterminer si la classification du potentiel de risque devrait être accrue.
La CRE est basée sur une approche pondérée afin de réduire au minimum le potentiel de surclassification ou de sous-classification du danger et de l’exposition et, donc, du risque subséquent. Les approches équilibrées pour traiter des incertitudes sont décrites en plus grands détails dans le document d’ECCC (2016a). Voici deux des domaines d’incertitudes les plus importants. Des erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient conduire à des modifications de la classification du danger, particulièrement dans le cas des paramètres reposant sur des valeurs de résidus dans les tissus (c.-à-d. le mode d’action toxique), dont de nombreux sont prédits au moyen de modèles (Q)SAR (Boîte à outils QSAR de l’OCDE 2014). Toutefois, l’impact d’une telle erreur est réduit par le fait qu’une surestimation de la létalité moyenne conduira une valeur prudente (protectrice) pour les résidus dans les tissus utilisée pour l’analyse des résidus corporels critiques (RCC). Une erreur de sous-estimation de la toxicité aiguë sera amortie grâce à l’utilisation d’autres paramètres de danger comme le profilage structural du mode d’action, la réactivité ou l’affinité de liaison à l’estrogène. Des modifications ou des erreurs de quantité chimique pourraient conduire à une classification différente de l’exposition, cette dernière étant hautement sensible à la vitesse d’émission et à la quantité utilisée. Les classifications de la CRE reflètent donc l’exposition et le risque au Canada sur la base de la quantité estimée actuellement utilisée. Elles pourraient ne pas refléter des tendances futures.
Les données et les éléments critiques utilisés pour produire les profils spécifiques des substances du groupe des sesquiterpènes monocycliques et bicycliques, et les résultats de la classification du danger, de l’exposition et du risque sont présentés dans un document d’ECCC (2016b).
Nous avons résumé dans le tableau 6-1 les classifications du danger, de l’exposition et du risque subséquent pour les substances du groupe des sesquiterpènes monocycliques et bicycliques.
| Substance | CRE du danger | CRE de l’exposition | CRE du risque |
|---|---|---|---|
| Essence de gingembre | faible | faible | faible |
| Bisabolène | faible | faible | faible |
| alpha-Bisabolène | faible | faible | faible |
| Santol-penténol | modéré | faible | faible |
| Sandalore | faible | faible | faible |
| Copaïba | faible | modérée | faible |
| bêta-Caryophyllène | faible | faible | faible |
| T et T de l’essence de clou de girofle | élevée | faible | faible |
| Guaiène | faible | faible | faible |
| alpha-Guaiène | élevé | faible | faible |
| Valencène | élevé | faible | faible |
| Guaiol | faible | faible | faible |
| Bulnésol | faible | faible | faible |
| Élémol | faible | faible | faible |
| Essence de santal | faible | faible | faible |
| Guaiazulène | faible | faible | faible |
Les caractérisations de faible danger et de faible exposition données par la CRE, l’essence de gingembre, le bisabolène, l’alpha‑bisabolène, le sandalore, le bêta-caryophyllène, le guaiène, le guaiol, le bulnésol, l’élémol, l’essence de santal et le guaiazulène se traduisent par un faible potentiel de risque pour l’environnement. Il est improbable que ces substances soient préoccupantes pour l’environnement au Canada.
D’après les renseignements pris en compte pour la CRE, le santol-penténol a été classé comme ayant un faible potentiel d’exposition. Le santol-penténol a été classé comme ayant un potentiel de danger modéré, basé sur un potentiel modéré d’effets nocifs sur des réseaux trophiques aquatiques en raison de son potentiel de bioaccumulation. Le santol-penténol a été classé comme présentant un faible potentiel de risque pour l’environnement. Les effets potentiels sur l’environnement et la manière avec laquelle ils pourraient se manifester n’ont pas été étudiés davantage en raison de la faible exposition à cette substance. En se basant sur les profils d’utilisation actuels, il est improbable que cette substance soit préoccupante pour l’environnement au Canada.
D’après les renseignements pris en compte pour la CRE, le copaïba a été classé comme présentant un potentiel d’exposition modéré en raison de sa longue persistance globale (la somme des demi-vies chimiques dans tous les milieux, pondérée par la fraction massique de la substance tel que déterminé en utilisant un modèle de devenir dans plusieurs milieux) et de la quantité utilisée modérée rapportée basée sur la quantité utilisée moyenne rapportée lors de l’inscription de la substance sur la LIS. Le copaïba a été classé comme présentant un faible potentiel de danger et subséquemment un faible potentiel de risque pour l’environnement. Étant donné que les profils d’utilisation actuels do copaïba se traduisent par un potentiel d’exposition modéré et étant donné son faible potentiel de poser un danger, il est improbable que cette substance soit préoccupante pour l’environnement au Canada.
D’après les renseignements pris en compte pour la CRE, les T et T de l’essence de clou de girofle, l’alpha-guaiène et le valencène ont été classés comme ayant un faible potentiel d’exposition. Ces trois substances ont été classées comme ayant un potentiel de danger élevé, basé sur un potentiel élevé à causer des effets nocifs sur des réseaux trophiques aquatiques en raison de leur potentiel de bioaccumulation. Ces substances ont été classées comme ayant un potentiel modéré de risque pour l’environnement. Toutefois, cette classification du risque a été abaissée à faible, en raison des quantités utilisées actuellement (voir la section 7.1.1 du document sur l’approche de CRE (ECCC 2016a).Les effets potentiels et la manière avec laquelle ils peuvent se manifester dans l’environnement n’ont pas fait l’objet d’une étude plus poussée en raison de la faible exposition à ces substances. En se basant sur les profils d’utilisation actuels, il est improbable que ces substances soient préoccupantes pour l’environnement au Canada.
7. Potentiel d’effets nocifs sur la santé humaine
Pour la caractérisation des effets sur la santé humaine des substances du groupe des sesquiterpènes monocycliques et bicycliques, nous avons donné la préférence aux données sur le danger posé par la substance entière. En l’absence de données sur les effets sur la santé de la substance complète, des renseignements sur les effets sur la santé des principaux composants ont été pris en compte afin d’éclairer l’évaluation des risques. Dans l’absence de donnée sur la substance ou ses principaux composants, nous avons réalisé une lecture croisée.
7.1 Évaluation du sous-groupe 1 (essence de gingembre, bisabolène, alpha-bisabolène, santol-penténol, sandalore, copaïba)
7.1.1 Évaluation de l’exposition
En tenant compte des faibles quantités des substances du sous-groupe 1 déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013), il ne devrait pas y avoir d’exposition à ces substances à partir les milieux de l’environnement.
Une exposition par voie alimentaire à l’essence de gingembre, au bisabolène, à l’alpha-bisabolène ou au copaïba est possible en raison de leur utilisation possible comme aromatisant alimentaire. L’administration par voie orale ou cutanée de produits de santé naturels contenant de l’essence de gingembre et du copaïba pourra entraîner une exposition à ces substances par ces mêmes voies. De plus, une exposition par voie cutanée peut être due à l’utilisation de certains cosmétiques contenant ces substances (p. ex. lotions pour le corps, nettoyants et produits de soins capillaires). Puisque l’on considère que les substances du sous-groupe 1 présentent un faible potentiel de danger, nous n’avons pas réalisé d’estimation quantitative de ces expositions potentielles.
7.1.2 Évaluation des effets sur la santé des substances du sous-groupe 1
Essence de gingembre
Au niveau international, nous n’avons trouvé aucune évaluation des risques dus à l’essence de gingembre.
Lors d’une étude de la toxicité subchronique, des rats Wistar mâles et femelles (5/dose/sexe) ont reçu 0, 100, 250 ou 500 mg/kg p.c./j d’essence de gingembre par gavage oral pendant 13 semaines (Jeena et coll. 2011). Aucun effet nocif n’a été rapporté à aucune des doses. Une dose sans effet nocif observé (DSENO) de 500 mg/kg p.c./j a été inférée par les auteurs de l’étude.
Lors d’une étude de la toxicité subchronique, des rats Wistar mâles et femelles (8/dose/sexe) ont reçu 0, 600, 1000, 1400 ou 1800 mg/kg p.c./j d’essence de gingembre par gavage oral pendant 30 jours. Les rats traités avec 1000 mg/kg p.c./j ou plus exhibaient des diminutions importantes du poids corporel et de la consommation d’aliments par rapport au groupe témoin. L’examen histologique des foies indiquait une clarification diffuse des hépatocytes, une congestion et une nécrose à 1400 et 1800 mg/kg p.c./j (Biapa Nya et coll. 2010). En se basant sur ces résultats, les auteurs de l’étude ont déduit une DSENO de 1000 mg/kg p.c./j et une dose minimale avec effet nocif observé (DMENO) de 1400 mg/kg p.c./j.
Lors d’une épreuve Ames l’essence de gingembre ne s’est pas avérée mutagène à 3 à 5 mg/plaque chez les souches TA 98, TA 100, TA 102 et TA 1535 de Salmonella typhimurium. Une seule administration d’un extrait aqueux de gingembre par gavage à des doses de 500, 1000, 2000, 5000 ou 10 000 mg/kg p.c./j d’essence de gingembre chez des souris a provoqué une fréquence significativement plus élevée d’aberrations chromosomiques dans les cellules de moelle osseuse aux doses supérieures à 1000 mg/kg p.c./j (Mukhopadhyay et Mukherjee 2000).
En se basant sur les renseignements disponibles, aucun effet préoccupant sur la santé de l’essence de gingembre n’a été trouvé.
Bisabolène et alpha-bisabolène
Le JECFA (comité mixte d’expert de la FAO et de l’OMS sur les additifs alimentaires) a évalué le bisabolène et a conclu qu’il n’est pas préoccupant en tant qu’aromatisant alimentaire, en se basant sur les niveaux d’absorption estimés pour l’Europe et les États-Unis (0,2 μg/kg p.c./j pour les deux) (OMS 2005).
En l’absence de données empiriques sur les effets sur la santé du bisabolène et de l’alpha-bisabolène, l’Autorité européenne pour la sécurité alimentaire (EFSA) a basé son évaluation sur une approche par lecture croisée avec le limonène, qui est considéré être un analogue de ces deux substances d’après les renseignements disponibles sur leur structure et leur métabolisme (EFSA 2015b). Le bisabolène, l’alpha-bisabolène et le limonène ont été classés comme hydrocarbures de type cyclohexène, et le comité de l’EFSA a conclu qu’ils sont métabolisés en substances inoffensives (EFSA 2015b). Le bisabolène, l’alpha‑bisabolène et le limonène appartiennent à la classe I de la classification de Cramer. Selon cette dernière les substances de classe 1 ont une structure chimique simple dont les voies métaboliques et produits finaux connus suggèrent une toxicité orale faible. En plus de similitudes de leur structure chimique et de leurs propriétés physico-chimiques, l’applicabilité des données sur le limonène pour la caractérisation du potentiel de risque pour la santé du bisabolène et de l’alpha-bisabolène était soutenue par des similitudes de leurs profils chimiques et biologiques dans les prédictions des modèles (Q)SAR (Boîte à outils QSAR de l’OCDE 2016).
Dans le cadre du Plan de gestion des produits chimiques, le limonène a été visé par une évaluation préalable des monoterpènes acycliques, monocycliques et bicycliques du groupe des terpènes et terpénoïdes (ECCC, SC 2020) qui n’a signalé aucun effet préoccupant sur la santé. En conséquence, il ne devrait y avoir aucun effet préoccupant du bisabolène et de l’alpha-bisabolène sur la santé.
Santol-penténol
Nous n’avons trouvé aucune évaluation du santol‑penténol faite au palier international. Il existe peu de données empiriques sur les effets sur la santé.
Lors d’une étude réalisée en suivant la ligne directrice 408 de l’OCDE, aucun effet n’a été rapporté chez des rats mâles et femelles auxquels on avait administré des doses allant jusqu’à 1000 mg/kg p.c./j par gavage oral pendant 90 jours. Une DSENO supérieure à 1000 mg/kg p.c./j a été rapportée par les auteurs (Dossier d’enregistrement de l’ECHA 2015).
De même, lors d’une deuxième étude réalisée en suivant la ligne directrice 421 de l’OCDE, aucun effet sur la reproduction ou le développement n’a été rapporté chez des rats mâles et femelles ou leurs petits, auxquels on avait administré des doses allant jusqu’à 1000 mg/kg p.c./j par gavage oral pendant 90 jours. Une DSENO supérieure à 1000 mg/kg p.c./j a été rapportée par les auteurs (Dossier d’enregistrement de l’ECHA 2015).
En se basant sur les renseignements disponibles, aucun effet préoccupant pour la santé n’a été trouvé pour le santol-penténol.
Sandalore
Nous n’avons trouvé aucune évaluation du sandalore réalisée au palier international. De plus, nous n’avons trouvé aucune étude sur la mutagénicité ou la génotoxicité ni sur la toxicité par inhalation pour cette substance.
Lors d’une étude à dose répétée de 28 jours sur la toxicité subchronique, des rats ont reçu de l’essence de sandalore par gavage oral à des doses de 0, 35, 325 ou 1000 mg/kg p.c./j. Aucun effet nocif n’a été rapporté, hormis une augmentation de la salivation chez les mâles et les femelles ayant reçu 325 ou 1000 mg/kg p.c./j (Dossier d’enregistrement de l’ECHA 2010). On a signalé que les rats des deux sexes traités avec 325 ou 1000 mg/kg p.c./j exhibaient une augmentation significative des masses absolue ou relative de leur foie même après une période de récupération de 14 jours. Les examens microscopiques des foies ont mis évidence une hypertrophie hépatocellulaire chez les femelles et les mâles ayant reçu 325 ou 1000 mg/kg p.c./j, ainsi que chez les mâles ayant reçu 35 mg/kg p.c./j. L’hypertrophie de la glande thyroïde était évidente, accompagnée d’une augmentation des poids absolu et relatif de la thyroïde chez les femelles traitées avec 1000 mg/kg p.c./j. Toutefois, les auteurs ont conclu qu’en l’absence de modifications dégénératives ou inflammatoires associées, l’hypertrophie du foie et de la thyroïde était une réponse adaptative. Une augmentation significative des poids absolu et relatif des reins en présence de gouttelettes hyalines dans les tubules chez les mâles ayant reçu 1000 mg/kg p.c./j uniquement a été considérée par les auteurs comme étant spécifique aux rats mâles et non reliée à des effets sur la santé humaine. Lors de cette étude, les effets se sont avérés réversibles pendant la période de récupération de 14 jours. Les auteurs ont rapporté une DSENO de 1000 mg/kg p.c./j pour la toxicité (Dossier d’enregistrement de l’ECHA 2010). Ces conclusions sont en accord avec celles de notre évaluation précédente des monoterpènes acycliques, monocycliques et bicycliques (ECCC, SC 2020) et de l’approche d’évaluation des risques pour la santé humaine de l’EPA (EPA 1991).
Lors d’une étude sur la toxicité pour la reproduction et le développement, dans le cadre de laquelle des rats mâles et femelles ont reçu de l’essence de sandalore par gavage à raison de 0, 100, 300 ou 1000 mg/kg p.c./j pendant 28 jours, aucune mortalité, aucune modification du poids corporel, de la masse des organes ni de la consommation d’aliments et aucun effet sur le système reproducteur n’ont été rapportés (Dossier d’enregistrement de l’ECHA 2010). Une augmentation de la salivation et un pelage abdominal taché d’urine ont été observés chez les mâles et les femelles ayant reçu 1000 mg/kg p.c./j (Dossier d’enregistrement de l’ECHA 2010). Toutefois, les auteurs n’ont pas considéré que ces effets étaient liés au traitement. De même, aucune modification des paramètres d’accouplement ou de fertilité, y compris de l’indice de fertilité et de gestation, du cycle œstral, des paramètres du sperme, de la masse des testicules et de la spermatogénèse, n’a été rapportée. Aucune modification des paramètres de mise bas ou de la portée n’a été rapportée, la taille de la portée et la survie des petits n’étaient pas affectées par le traitement. Aucun signe clinique ni aucune lésion macroscopique pouvant être attribué à une exposition maternelle au sandalore n’a pas non plus été rapporté chez les petits. Les auteurs ont rapporté une DSENO de 1000 mg/kg p.c./j pour la toxicité pour la reproduction ou le développement (Dossier d’enregistrement de l’ECHA 2010).
En se basant sur les renseignements disponibles, aucun effet préoccupant du sandalore sur la santé humaine n’a été identifié.
Copaïba
Nous n’avons trouvé aucune évaluation du copaïba faite au palier international. En ce qui concerne ses effets sur la santé humaine, le copaïba n’a été classé par aucune agence de réglementation nationale ou internationale.
Peu de renseignements sur les effets du copaïba sur la santé ont été retrouvés dans les publications scientifiques.
Sachetti et coll. (2011) ont réalisé une étude sur la toxicité pour le développement en suivant la ligne directrice 414 de l’OCDE. Dans le cadre de cette étude, des rates gravides (25 par dose) ont reçu par gavage oral 0, 500, 1000 ou 1250 mg/kg p.c./j d’oléorésine de copaïba du sixième au dix-neuvième jour de gestation (JG) Sachetti et coll. (2011) ont considéré l’oléorésine de copaïba toxique pour la mère, car elle provoquait une réduction de l’absorption d’aliments et du gain de poids corporel chez les femelles ayant reçu 1000 ou 1250 mg/kg p.c./j. Toutefois, ils ont rapporté que les femelles n’exhibaient aucun signe clinique de toxicité. Un poids corporel fœtal inférieur et une occurrence accrue de variations du squelette fœtal telles qu’une ossification frontale et thoracique incomplète et des membres non ossifiés, à 1000 et 1250 mg/kg p.c./j ont été observés au vingtième jour de gestation. Aucune mortalité ni aucune malformation du fœtus n’a été observée à aucune des doses. En se basant sur ces résultats, les auteurs de l’étude ont déduit une DSENO de 500 mg/kg p.c./j et une DMENO de 1000 mg/kg p.c./j pour la toxicité maternelle et la toxicité pour le développement (Sachetti et coll. 2011). En ce qui concerne l’absence de signe clinique de toxicologie chez les mères, la diminution de la consommation d’aliments pendant la période du traitement à 1000 ou 1250 mg/kg p.c./j peut être causée par la faible sapidité de la substance chimique et peut causer la diminution du poids corporel. Selon De Sesso et Scialli (2018), l’ossification chez les rongeurs se produit pendant la période périnatale (près de la naissance) et est fortement dépendante de l’absorption alimentaire maternelle. Ces auteurs considèrent que les observations d’ossification réduite sont des manifestations mineures de la toxicité pour le développement, car elles sont transitoires et typiquement réversibles pendant la période de lactation. La diminution du poids des mères et des fœtus et le retard de l’ossification chez les fœtus ne sont pas considérés comme étant nocifs dans ce rapport et une DMENO de 1250 mg/kg p.c./j a été établie.
Pendant 8 semaines, des rats mâles Wistar (5/dose) ont reçu par voie orale 200, 500 ou 2500 mg/kg p.c./j de baume du Copaifera multijuga, une sous-espèce du copaïer, puis ont été accouplés avec des femelles non traitées (2 femelles par mâle) (Gonçalves et coll. 2014). Aucun effet nocif n’a été rapporté chez les mâles ou leurs descendants. Gonçalves et coll. (2014) ont conclu qu’une exposition par voie orale à 200, 500 ou 2500 mg/kg p.c./j de baume du C. multijuga pendant 8 semaines n’était pas toxique toxicité pour la reproduction. Ils proposent une DSENO orale de 2500 mg/kg p.c./j ou plus pour la toxicité pour les mâles.
Lors d’une étude sur la toxicité pour la reproduction et le développement, Lima et coll. (2011) ont administré intravaginalement à des rates (2,5 % dans une crème vaginale) une dose simple quotidienne de 28,6 mg/kg p.c./j de baume du Copaifera duckei, une sous-espèce du copaïer, pendant 30 jours avant d’être gravides, 20 jours pendant la période d’accouplement et pendant les 20 jours de gestation (exposition totale de 70 jours). Aucun effet nocif n’a été rapporté chez les mères ou leurs petits.
Une simple dose de résine d’essence de copaïba, volatile ou fraction de résine (500, 1000 ou 2000 mg/kg p.c.), administrée par gavage à des souris n’a pas mené à une hausse des dommages à l’ADN dans les cellules de la moelle osseuse et du sang (Almeida et coll. 012). Lors d’une étude sur la génotoxicité réalisée selon la ligne directrice 474 de l’OCDE, diverses résines de copaïba administrées par gavage à des souris mâles Swiss n’ont pas mené à une hausse de micronoyaux dans la moelle osseuse (Furtado et coll. 2018). La fréquence des micronoyaux n’a pas changé après une exposition de fibroblastes pulmonaires de hamster chinois (cellules V79) à différentes résines de copaïba (Furtado et coll. 2018).
Les renseignements disponibles n’indiquent aucun effet préoccupant du copaïba sur la santé.
7.1.3 Caractérisation des risques pour le sous-groupe 1
En se basant sur les renseignements disponibles, aucun effet sur la santé préoccupant n’a été retrouvé pour les substances du sous-groupe 1. Pour cette raison, aucun point de départ n’a été défini et nous avons suivi une approche pour caractériser les risques. Nous considérons que l’exposition de la population générale aux substances du sous-groupe 1 constitue un faible risque pour la santé humaine.
7.2 Évaluation du sous-groupe 2 (bêta-caryophyllène, T et T de l’essence de clou de girofle, guaiène, alpha-guaiène et valencène)
7.2.1 Évaluation de l’exposition
Milieux naturels et aliments
Étant donné les faibles quantités des substances ont on a déclaré l’utilisation au Canada (Environnement Canada 2013) et le faible risque d’exposition environnementale selon la CRE, il ne devrait pas y avoir d’exposition aux T et T de l’essence de clou de girofle, au guaiène, à l’alpha-guaiène et au valencène depuis les milieux naturels, y compris l’eau potable.
Le modèle de fugacité de niveau III appelé ChemCAN (2003) a été utilisé pour dériver les concentrations prévues de bêta-caryophyllène dans l’environnement au Canada à partir de la limite supérieure de la plage de volumes déclarée de 10 000 kg. Les concentrations estimées dans l’air, l’eau et le sol étaient respectivement de 1,01 × 10‑2 ng/m3, 8,65 × 10-1 ng/L et 4,71 × 10-3 ng/g. Ces concentrations estimées entraînent une exposition négligeable (moins de 1 ng/kg p.c./j) à partir des milieux naturels de la population générale au bêta-caryophyllène.
La présence de bêta-caryophyllène a aussi été mesurée dans l’air intérieur au Canada dans 36 maisons avec garages attenants à Ottawa (janvier à février 2014, étude sur les garages) et dans 54 maisons au Nunavik (janvier à avril 2018, étude sur le Nunavik) en hiver (Won 2019). L’air intérieur a été prélevé passivement pendant 2 ou 7 jours au moyen de tubes de désorption thermique (Tenax TA). À Ottawa, la présence de bêta-caryophyllène a été détectée dans 17 % des maisons (6 maisons). Toutefois, la concentration de tous les échantillons était inférieure à la limite de quantification de la méthode, soit 1,4 ng (ce qui équivaut à environ 0,45 ng/m3). Au Nunavik, la présence de bêta-caryophyllène a été détectée dans 9 % des maisons (5 maisons), avec une concentration moyenne de 0,9 μg/m3 et une plage de concentrations allant de 0,5 à 1,5 μg/m3. Tous les autres échantillons présentaient une concentration inférieure à la limite de quantification (Won 2019).
L’exposition au bêta-caryophyllène à partir de sa présence dans l’air intérieur a été estimée au moyen de la concentration maximale dans l’air de 1,5 μg/m3 mesurée lors de l’étude sur le Nunavik décrite ci-dessus (Won 2019). Elle variait entre 1,09 × 10‑3 et 3,06 × 10-4 mg/kg p.c./j pour tous les groupes d’âge (annexe C, tableau C-1).
On ne dispose d’aucune donnée précise sur l’utilisation potentielle du bêta-caryophyllène, du guaiène et du valencène dans des aliments vendus au Canada. Toutefois, comme ces substances sont utilisées en tant qu’aromatisants alimentaires ailleurs dans le monde, il se peut qu’elles soient présentes au même titre dans des aliments vendus au Canada. On a aussi déclaré la présence de bêta-caryophyllène, de guaiène et de valencène dans diverses huiles essentielles ou extraits de plantes reconnus comme des aromatisants alimentaires à l’échelle internationale (Burdock 2010).
Le JECFA a évalué le bêta-caryophyllène, le guaiène et le valencène aux fins d’utilisation en tant qu’aromatisants alimentaires (OMS 2005) et conclu que ces substances ne présentaient « aucune préoccupation en matière d’innocuité aux niveaux actuels d’absorption lorsqu’elles sont utilisées comme aromatisants ». L’EFSA a également évalué le bêta-caryophyllène, le guaiène et le valencène en tant qu’aromatisants alimentaires et a aussi conclu que ces aromatisants ne présentaient pas de préoccupation en matière d’innocuité aux niveaux d’absorption estimés (EFSA 2015a; EFSA 2015b). Dans le cadre de leurs évaluations, le JECFA et l’EFSA ont estimé les quantités des substances absorbées par une personne à l’aide d’une méthode de l’absorption quotidienne maximisée calculée à partir de données d’enquête et fondée sur les volumes de production annuelle déclarés par l’industrie alimentaire dans les enquêtes sur les quantités (NAS 1989; IOFI 1995; Lucas 1999 cité dans OMS 2005; EFSA 2015a; EFSA 2015b).
En l’absence de données sur l’utilisation réelle, le cas échéant, du bêta-caryophyllène, du guaiène et du valencène en tant qu’aromatisants alimentaires dans des aliments vendus au Canada, les estimations de quantités absorbées par personne pour la population américaine de 8 × 10-3 mg/kg p.c./j, 5 × 10‑5 mg/kg p.c./j et 4 × 10‑4 mg/kg p.c./j calculées par le JECFA constituent des estimations acceptables de l’exposition alimentaire possible de la population générale canadienne (personnes d’un an et plus) au bêta-caryophyllène, au guaiène et au valencène, respectivement, à partir de leur utilisation comme aromatisants alimentaires. (OMS 2005; communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, mai 2019, sans référence.)
Le bêta-caryophyllène, le guaiène et le valencène sont naturellement présents dans certains aliments (OMS 2005; Nijssen 2018) et présents dans une gamme d’huiles essentielles, comme l’essence d’écorce de citron, l’huile essentielle d’orange amère et l’huile de feuilles de kaloupilé. L’exposition par l’alimentation à ces huiles découlant de leur présence naturelle dans les écorces de fruits et d’autres matières végétales utilisées pour obtenir les huiles essentielles devrait être faible.
Les estimations d’exposition alimentaire de la population générale canadienne au bêta-caryophyllène, au guaiène et au valencène à partir de leur présence naturelle dans certains aliments ont été calculées par la Direction des aliments de Santé Canada au moyen des données sur la présence tirées de la base de données sur les composants volatils dans les aliments (Nijssen 2018). Pour chaque catégorie d’aliments et de boissons de la base de données, on a prudemment utilisé la concentration la plus élevée déclarée pour chaque substance afin de représenter la catégorie alimentaire. Dans les cas où les concentrations étaient d’importance semblable dans plusieurs catégories alimentaires liées, les aliments ont été regroupés dans une même catégorie et la concentration la plus élevée déclarée de tous les aliments visés a été appliquée à l’ensemble de la catégorie (p. ex., tous les légumes, sauf les pommes de terre).
Les concentrations maximales de bêta-caryophyllène dans les aliments utilisées pour l’évaluation se situaient entre 0,001 ppm pour le poulet et 33 000 ppm pour la cannelle (concentration utilisée pour représenter toutes les épices). Le guaiène est présent à une concentration allant jusqu’à 4000 ppm dans la baie de piment de la Jamaïque (quatre épices) et de moins de 1000 ppm dans le gingembre. La concentration maximale de guaiène dans le piment de la Jamaïque a été utilisée pour représenter l’ensemble des herbes et épices. Les concentrations maximales de valencène allaient de 0,09 ppm dans les noix (concentration déclarée dans la noix de macadamia) à 15,3 ppm dans le jus de fruits (concentration déclarée dans le jus d’orange).
L’exposition alimentaire de la population canadienne au bêta-caryophyllène, au guaiène et au valencène à partir de leur présence naturelle dans certains aliments a été estimée en multipliant la quantité d’aliments consommés par la quantité de chaque substance dans ces aliments. Les estimations de la moyenne et du 90e centile de la consommation alimentaire sont fondées sur l’absorption alimentaire individuelle quotidienne de toute la population déclarée par les répondants à l’Enquête sur la santé dans les collectivités canadiennes (ESCC) de 2004 pour les nourrissons d’au plus 12 moisNote de bas de page 6 et à l’ESCC de 2015 pour tous les autres groupes d’âge (Statistique Canada 2004 et 2015). La moyenne et le 90e centile de l’exposition alimentaire estimés de cette manière pour divers groupes d’âge sont présentés à l’annexe B.
Les expositions alimentaires moyennes au bêta-caryophyllène, au guaiène et au valencène à partir de leur présence naturelle dans certains aliments se situaient respectivement entre 1,65 × 10-1 mg/kg p.c./j (nourrissons de 6 à 12 mois) et 1,52 mg/kg p.c./j (enfants de 4 à 8 ans), entre 8,1 × 10-2 mg/kg p.c./j (adultes de 19 ans et plus) et 1,52 × 10-1 mg/kg p.c./j (enfants de 4 à 8 ans), et entre 1,4 × 10‑2 mg/kg p.c./j (adultes de 19 ans et plus) et 9,9 × 10-2 mg/kg p.c./j (enfants de 1 à 3 ans).
Produits offerts aux consommateurs
Le bêta-caryophyllène et les T et T de l’essence de clou de girofle sont présents dans des produits offerts aux consommateurs. Pour évaluer le risque d’exposition au bêta-caryophyllène et aux T et T de l’essence de clou de girofle à partir de cosmétiques et de produits de santé naturels (bêta-caryophyllène seulement) appliqués localement, on a choisi des scénarios sentinelles en fonction des fréquences d’utilisation et des concentrations déclarées de bêta-caryophyllène et de T et T de l’essence de clou de girofle dans ces produits. Ces scénarios représentaient la plus forte exposition par rapport aux autres cosmétiques et produits de santé naturels topiques contenant les substances. Les expositions aux T et T de l’essence de clou de girofle à partir de l’utilisation d’un hydratant corporel, d’une huile de massage et d’une huile essentielle employée comme parfum ont été choisies comme scénarios sentinelles pour les utilisations topiques. Bien que le bêta-caryophyllène soit également présent dans des hydratants corporels, l’exposition à partir d’un hydratant corporel contenant des T et T de l’essence de clou de girofle est plus élevée que l’exposition au bêta-caryophyllène, étant donné la concentration maximale dans le produit et le fait que le bêta-caryophyllène est le principal composant des T et T de l’essence de clou de girofle. Par conséquent, on considère que la valeur d’exposition potentielle aux T et T de l’essence de clou de girofle est protectrice des possibles expositions au bêta-caryophyllène contenu dans les hydratants corporels. Ces données sont résumées à l’annexe C (tableaux C-2 à C-4).
Les plus fortes expositions quotidiennes devraient donc provenir de l’utilisation d’un hydratant corporel ayant une concentration maximale déclarée de 3 % et de l’utilisation de T et T de l’essence de clou de girofle en tant qu’huile essentielle dans un parfum pour le corps ou une huile de massage ayant une concentration maximale de 100 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, octobre 2019, sans référence). Bien que la concentration maximale déclarée pour l’huile de massage contenant des T et T de l’essence de clou de girofle soit de 100 %, les huiles de massage sont habituellement diluées avant l’utilisation. Par conséquent, on a présumé que la concentration maximale de T et T de l’essence de clou de girofle dans l’huile de massage était de 3 % (RIVM 2006).
Nous n’avons pas trouvé de produit contenant de l’alpha-guaiène, bien que l’IFRA (2017) le mentionne comme ingrédient parfumants dans des biens offerts aux consommateurs. L’exposition cutanée possible à la substance à partir de son utilisation comme ingrédient parfumant a été évaluée au moyen d’un scénario représentatif pour le produit avec des estimations d’exposition cutanée élevées (hydratant corporel). Nous avons présumé une concentration maximale de 0,1 % pour calculer les estimations d’exposition cutanée. Nous avons présumé qu’une substance individuelle dans un mélange de parfums serait présente en une concentration maximale de 10 % et que la quantité maximale de parfum dans un produit cosmétique serait de 1 % (SC 2016) [tableau C-5].
Selon des renseignements figurant sur le site Web de l’ACI, le bêta-caryophyllène pourrait être utilisé comme fragrance dans les détergents (liquides) et les activateurs de détergent à une concentration maximale de 5 % (ACI 2018). Pour évaluer l’exposition potentielle au bêta-caryophyllène à partir de son utilisation dans des produits d’entretien ménager, nous avons évalué son utilisation dans les détergents liquides. Nous avons présumé que le bêta-caryophyllène serait présent en une concentration maximale de 5 %, comme indiqué sur le site Web de l’ACI (ACI 2018).
Le bêta-caryophyllène est aussi présent dans les médicaments contre l’herpès buccal. L’exposition par voie orale à partir de l’utilisation d’un traitement contre l’herpès buccal a été quantifiée à une concentration de 20 % (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, juillet et août 2019, sans référence). De plus, les T et T de l’essence de clou de girofle sont présents dans les rince-bouches à une concentration maximale de 3 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, octobre 2019, sans référence).
Le bêta-caryophyllène est également présent en tant que parfum dans les assainisseurs d’air. Pour évaluer l’exposition potentielle au bêta-caryophyllène par inhalation, nous avons présumé que la quantité de la substance dans un assainisseur d’air serait équivalente à la quantité de parfum, soit au plus 10 % (FS 2015).
Les expositions systémiques à partir de produits offerts aux consommateurs sont présentées au tableau 7-1.
Absorption cutanée
Pour estimer l’exposition systémique d’éventuels contacts cutanés aux substances du sous-groupe 2, nous avons utilisé une valeur d’absorption cutanée de 20 % pour toutes les substances du sous-groupe 2, à partir des renseignements disponibles et des facteurs suivants.
- Une valeur d’absorption cutanée de 20 % pour une peau recouverte a été utilisée pour le groupe des monoterpènes acycliques, monocycliques et bicycliques (ECCC, SC 2020) à partir d’études in vitro sur l’absorption cutanée chez l’humain pour le géraniol, le citronellol et le linalol (Gilpin et coll. 2010; ECHA 2018). L’absorption cutanée trouvée par ces études se situait entre 4,3 % et 19,5 % (valeur moyenne de l’absorption cutanée + 1 ou 2 écarts-types, en fonction de la variabilité [SCCS 2010], selon le recouvrement du site, y compris les résidus collés à la peau). Le bêta-caryophyllène, une substance représentative du sous-groupe 2, a une masse moléculaire semblable à celle du géraniol, du citronellol et du linalol, et possède aussi une pression de vapeur modérée. Le géraniol, le citronellol et le linalol ont des valeurs moyennes à élevées de solubilité dans l’eau (10 à 10 000 mg/L) et de log Koe (3-6), tandis que le bêta-caryophyllène a une faible solubilité dans l’eau (0,01 à 10 mg/L) et un log Koe élevé (6 à 8), ce qui laisse à penser que l’absorption cutanée potentielle du bêta-caryophyllène serait inférieure à celle du géraniol, du citronellol et du linalol.
- Une étude in vitro limitée sur l’absorption cutanée de l’essence de baume de copaïba contenant 42 % de bêta-caryophyllène, une substance du sous-groupe 2, par la peau d’oreille de porcs suggère une faible absorption cutanée du bêta-caryophyllène, soit moins de 1 %, y compris les résidus collés à la peau (Lucca et coll. 2015).
Exposition par inhalation
Les substances du sous-groupe 2 possèdent des pressions de vapeur entre 1,26 et 4,41 Pa et sont considérées comme volatiles. Par conséquent, l’exposition par inhalation a aussi été quantifiée pour les scénarios sentinelles d’exposition cutanée. La quantité de produit pouvant être inhalée a été ajustée de 80 % pour tenir compte de la quantité absorbée par la peau. Dans le cas des lotions pour le corps, comme la quantité de produit pouvant être inhalée a été ajustée en fonction de la surface exposée et que cette valeur était inférieure à 80 % de la quantité de produit, aucune autre modification n’a été apportée à la quantité de produit.
L’exposition systémique totale a été calculée en additionnant l’exposition systémique par inhalation et par voie cutanée.
| Substance | Scénario pour le produit | Concentration en pourcentage dans le produit | Exposition systémique quotidienne (mg/kg p.c./j)a |
|---|---|---|---|
| Bêta-caryophyllène | INM dans une crème contre l’herpès buccal (voie orale) | 20 % | 2,70×10-1 (adultes) à 1,33 (enfants de 2 à 3 ans) |
| Bêta-caryophyllène | Lavage et séchage à l’air de vêtements lavés à la main (voie cutanée et inhalation) | 5 % | 1,54×10-1 (adultes) |
| Bêta-caryophyllène | Assainisseur d’air (inhalation) | 10 % | 4,08×10-2 (adultes) à 1,17×10-1 (nourrissons) |
| T et T de l’essence de clou de girofle | Lotion pour le corps (voie cutanée et inhalation) | 3 % | 8,54×10-1 (adultes) à 1,93 (nourrissons de 0 à 5 mois) |
| T et T de l’essence de clou de girofle | Huile de massage (voie cutanée et inhalation) | 3 % | 2,80×10-1 (adultes) à 1,74 (nourrissons de 0 à 5 mois) |
| T et T de l’essence de clou de girofle | Rince-bouche (voie orale) | 3 % | 6,89×10-1 (adultes) à 1,30 (enfants de 4 à 8 ans) |
| T et T de l’essence de clou de girofle | Huile essentielle utilisée comme parfum pour le corps (voie cutanée et inhalation) | 100 % | 1,31 (adultes) à 3,81 (enfants de 2 à 3 ans) |
| Alpha-guaiène | Lotion pour le corps (voie cutanée et inhalation) | 0,1 % | 2,70×10-2 (adultes) à 6,35×10-2 (nourrissons de 0 à 5 mois) |
Abréviations : INM, ingrédient non médicinal
a Un facteur d’absorption cutanée de 20 % a été utilisé pour extrapoler l’exposition cutanée afin d’obtenir l’exposition systémique. Les calculs sont détaillés à l’annexe C.
7.2.2 Évaluation des effets sur la santé du sous-groupe 2
Le sous-groupe 2 contient cinq substances. Le bêta-caryophyllène est une substance distincte au sein de ce sous-groupe et aussi le principal composant des T et T de l’essence de clou de girofle.
Les T et T de l’essence de clou de girofle se distinguent de l’essence de girofle, car ils contiennent de fortes concentrations de bêta-caryophyllène (de 73 % à 80 %) et de faibles concentrations d’eugénol (de 0,5 % à 5 %) [FDT 2018; FS 2009]. En comparaison, l’essence de girofle (NR CAS 8000-34-8) contient de 76 % à 97 % d’eugénol (NR CAS 97-53-0), de 0,6 % à 17 % de bêta-caryophyllène ainsi que des quantités allant de traces à 11 % d’acétate d’eugényle (NR CAS 93-28-7) [Tisserand et Young 2014; Jirovetz 2006]. Environnement et Changement climatique Canada et Santé Canada ont évalué l’essence de girofle dans le cadre de l’évaluation de l’eugénol, car il peut être présent dans l’essence de girofle en une concentration allant jusqu’à 97 %. L’eugénol a été considéré comme présentant un faible potentiel de danger et, par conséquent, le risque pour la santé humaine associé à une exposition à l’eugénol ou à l’essence de girofle a été jugé faible (ECCC, SC 2018c).
Il n’y a pas d’information disponible sur les dangers associés aux T et T de l’essence de clou de girofle, à l’alpha-guaiène ou au valencène. Il existe peu de renseignements sur les dangers associés au guaiène, et ceux-ci se limitent à des essais de sensibilisation de la peau et de mutagénicité. Il existe trois isomères très similaires : l’alpha-guaiène, le bêta-guaiène et le gamma-guaiène.
Le bêta-guaiène n’est pas considéré comme un sensibilisant de la peau selon les conclusions d’un test épicutané de maximalisation et d’applications répétées lors duquel les sujets humains n’ont pas montré de réaction à la suite d’une exposition à de la gelée de pétrole à 2 % de bêta-guaiène ni à une solution à 10 % de guaiène composée d’une part d’éthanol et de trois parts de phtalate de diéthyle, respectivement. De plus, le bêta-guaiène n’est pas jugé mutagène ni clastogène selon les conclusions d’un essai de mutation inverse sur bactéries et d’un test du micronoyau in vitro réalisés conformément aux lignes directrices 471 et 487 de l’OCDE, respectivement (RIFM 2017).
En l’absence de données sur les dangers associés au guaiène, à l’alpha-guaiène et au valencène, l’EFSA a désigné le bêta-caryophyllène comme substance représentative du guaiène et du valencène, ainsi que le guaiène comme substance représentative de l’alpha-guaiène (EFSA 2015b). Par conséquent, le bêta-caryophyllène a été utilisé pour éclairer l’évaluation des effets de ces trois substances sur la santé. Puisque le bêta-caryophyllène est le principal composant des T et T de l’essence de clou de girofle, il a servi à éclairer l’évaluation de leurs effets sur la santé.
Bêta-caryophyllène
Lors d’une étude réalisée par Schmitt et coll. (2016) conformément à la ligne directrice 408 de l’OCDE, on a administré par gavage des doses de 0, 150, 450 ou 700 mg/kg p.c./j de substance d’essai (équivalant à 0, 115,5, 346,5 ou 539 mg/kg p.c./j de bêta-caryophyllène) à des rats Wistar mâles et femelles pendant 90 jours, suivis d’une période de rétablissement de 21 jours. Les auteurs ont ajouté une période d’observation intermédiaire de 28 jours pour le groupe témoin et ceux ayant reçu une dose élevée. La substance d’essai contenait environ 77 % (% p/p) de bêta-caryophyllène, 1,28 % (% p/p) d’eugénol et de dérivés de l’eugénol, et 21,72 % (% p/p) d’autres huiles essentielles. Aucun changement au gain de poids corporel ni à la consommation alimentaire, ni aucun effet nocif n’a été observé chez les deux sexes à aucune dose. L’écoulement nasal a été jugé accessoire et non lié au traitement au bêta-caryophyllène, car il a aussi été observé chez les animaux du groupe témoin, mais pas après la période de rétablissement. Une hausse de la phosphatase alcaline a été observée dans le sang des femelles ayant reçu une forte dose. Comme la phosphatase alcaline est un biomarqueur de maladies hépatiques, il pourrait s’agir d’un signe de dommage au foie à la plus forte dose. Les auteurs ont observé une infiltration de lymphocytes et de monocytes chez les femelles témoins et celles ayant reçu une dose élevée ainsi que des changements vacuolaires dans le cytoplasme des hépatocytes des mâles témoins et de ceux ayant reçu une dose élevée, tous de fréquence et de gravité semblables. Ces effets n’ont toutefois pu être confirmés, car les auteurs n’ont pas fourni d’images aux fins d’observation. Les hausses de la masse du foie chez les femelles ayant reçu une dose élevée et de la masse de la rate chez les mâles ayant reçu des doses faibles et moyennes semblent adaptatives, car elles n’ont pas été observées chez le groupe en rétablissement. Les auteurs ont prélevé des ganglions lymphatiques, mais n’ont présenté aucun résultat. Aucun effet nocif n’a été observé après l’administration du bêta-caryophyllène ni après la période de rétablissement. Les auteurs ont déterminé une DSENO de 700 mg/kg p.c./j de substance d’essai (soit 539 mg/kg p.c./j de bêta-caryophyllène) pour les rats mâles et femelles (Schmitt et coll. 2016). D’après la présence d’écoulement nasal, qui est un symptôme courant d’infection virale, et les changements vacuolaires dans le foie des rats témoins observés par les auteurs de l’étude, il semble que certains animaux des groupes témoins (mâles et femelles) puissent avoir été malades pendant l’étude, ce qui aurait modifié les résultats.
Dans une étude réalisée conformément à la ligne directrice 407 de l’OCDE, des souris Swiss femelles ont reçu par gavage des doses de 0, 300 ou 2000 mg/kg p.c./j de bêta-caryophyllène (pureté supérieure à 98,5 %) pendant 28 jours (da Silva Oliveira et coll. 2018). Aucun effet nocif n’a été observé. Les auteurs ont conclu que la DSENO pour la toxicité est supérieure à 2000 mg/kg p.c./j, la dose d’essai la plus élevée (da Silva Oliveira et coll. 2018).
L’administration sous-chronique de bêta-caryophyllène par l’alimentation en doses de 0, 222, 456 et 1367 mg/kg p.c./j pour les rats mâles et de 0, 263, 1033 ou 4278 mg/kg p.c./j pour les rats femelles pendant 90 jours n’a pas entraîné de mortalité, de signes cliniques de toxicité ni de changements ophtalmologiques (EFSA 2015b). La pureté de la substance pouvait atteindre 95 %. Chez les rats mâles et femelles des groupes ayant reçu des doses moyennes et élevées, on a observé des baisses significatives, dépendant la dose, du gain de poids corporel, de la consommation alimentaire et de l’efficacité alimentaire (EFSA 2015b). Une hausse de la numération plaquettaire n’a été observée que chez les femelles, tandis qu’une hausse liée à la dose du nombre de globules blancs et de plusieurs autres paramètres hématologiques a été observée chez les rats mâles du groupe ayant reçu une forte dose. On n’a pas signalé de corrélation entre histopathologie et ces variations. Les constatations histopathologiques comprenaient une hausse des masses absolues et relatives du foie ainsi qu’une hypertrophie des hépatocytes centrolobulaires à médiolobulaires chez les rats mâles et femelles des groupes ayant reçu des doses moyennes et élevées. On a aussi signalé une importante hausse des masses absolues et relatives des reins des mâles du groupe ayant reçu une dose élevée et les femelles des groupes ayant reçu des doses moyennes et élevées. Les rats mâles ont présenté une hausse de l’accumulation des gouttelettes hyalines ou des cas de néphropathie induite par l’alpha-2-globuline, ce qui est considéré comme un effet propre aux rats mâles et donc peu pertinent pour les humains (EFSA 2015b). Ces conclusions concordent avec l’évaluation antérieure des monoterpènes acycliques, monocycliques et bicycliques (SC, ECCC 2020) et la démarche d’évaluation des risques pour la santé humaine de l’EPA des États-Unis (USEPA 1991). L’examen des ganglions lymphatiques mésentériques a révélé la présence d’érythrocytes dans les sinus des rats mâles et femelles des groupes ayant reçu des doses moyennes et élevées. On a jugé que le poids réduit de la rate chez les mâles ayant reçu une dose élevée était lié à la baisse générale de la masse des composants du système lymphatique. En se fondant sur les changements au système lymphatique chez les rats mâles et les changements pathologiques dans le foie et les ganglions lymphatiques mésentériques chez les rats mâles et femelles, les auteurs ont déterminé une DSENO de 222 mg/kg p.c./j pour le bêta-caryophyllène (EFSA 2015b).
Lors d’une étude in vivo, l’exposition à 20, 200 et 2000 mg/kg de la substance n’a pas entraîné d’effet cytotoxique ou génotoxique dans les cellules sanguines de souris (Molina-Jasso et coll. 2009). Dans une étude in vitro, l’exposition à 100 μg/ml de bêta-caryophyllène n’a entraîné aucun effet cytotoxique ou génotoxique dans des lymphocytes humains en culture (Di Sotto et coll. 2010).
7.2.3 Caractérisation des risques pour la santé humaine
On a trouvé une DSENO de 222 mg/kg p.c./j pour le bêta-caryophyllène pour toutes les voies d’exposition, en fonction des changements au système lymphatique chez les rats mâles, des changements pathologiques dans le foie et les ganglions lymphatiques mésentériques chez les rats mâles et femelles, et des effets sur les reins des femelles observés dans l’une des études sur la toxicité par voie orale menées sur 90 jours (EFSA 2015b). Aucune donnée sur les dangers associés à l’exposition au bêta-caryophyllène par inhalation ou par voie cutanée n’a été recensée. Par conséquent, nous avons utilisé la DSENO orale de 222 mg/kg p.c./j ainsi que l’extrapolation de voie à voie pour caractériser les risques.
Les estimations d’exposition quotidienne et les marges d’exposition qui en découlent sont résumées au tableau 7-2.
| Substance | Scénario d’expositiona | Exposition systémique (mg/kg p.c./j) | Marge d’expositionb |
|---|---|---|---|
| Bêta-caryophyllène | Milieu naturel (air intérieur) et aromatisant alimentaire (1 an et plus) | 8,31 × 10-3 (adultes) à 9,09 × 10-3 (bébés de 1 an) | > 24 000 (toutes les sous-populations) |
| Bêta-caryophyllène | Exposition systémique par voie orale à partir d’une crème contre l’herpès buccal (20 %) | 2,70 × 10-1 (adultes) à 1,33 (enfants de 2 à 3 ans) | 167 (enfants de 2 à 3 ans) à 821 (adultes) |
| Bêta-caryophyllène | Exposition systémique par inhalation et par voie cutanée en mélangeant, chargeant, lavant et suspendant des vêtements lavés à la main (5 %) | 1,54 × 10-1(adultes) | 1439 (adultes) |
| Bêta-caryophyllène | Exposition systémique par inhalation à partir d’un assainisseur d’air (10 %) | 4,08 × 10-2 (adultes) à 1,23 × 10-1 (enfants de 2 à 3 ans) | 1810 (enfants de 2 à 3 ans) à 5440 (adultes) |
| T et T de l’essence de clou de girofle | Exposition systémique par inhalation et par voie cutanée à partir d’une lotion pour le corps (3 %) | 8,54 × 10-1 (adultes) à 1,93 (nourrissons de 0 à 5 mois) | 115 (nourrissons de 0 à 5 mois) à 260 (adultes) |
| T et T de l’essence de clou de girofle | Exposition systémique par inhalation et par voie cutanée à partir d’une huile de massage (3 %) | 2,80 × 10-1 (adultes) à 1,74 (nourrissons de 0 à 5 mois) | 127 (nourrissons de 0 à 5 mois) à 793 (adultes) |
| T et T de l’essence de clou de girofle | Exposition systémique par voie orale à partir d’un rince-bouche (3 %) | 6,89 × 10-1 (adultes) à 1,30 (enfants de 4 à 8 ans) | 170 (enfants de 4 à 8 ans) à 322 (adultes) |
| T et T de l’essence de clou de girofle | Exposition systémique par inhalation et par voie cutanée à partir de l’utilisation d’une huile essentielle comme parfum pour le corps (100 %) | 1,31 (adultes) à 3,81 (enfants de 2 à 3 ans) | 58 (enfants de 2 à 3 ans) à 169 (adultes) |
| Alpha-guaiène (parfum) | Exposition systémique par inhalation et par voie cutanée à partir d’une lotion pour le corps (0,1 %) | 2,70 × 10-2 (adultes) à 6,35 × 10-2 (nourrissons de 0 à 5 mois) | 3495 (nourrissons de 0 à 5 mois) à 8209 (adultes) |
| Guaiène | Aromatisant alimentaire (absorption alimentaire) [1 an et plus] | 5 × 10-5 | 4 440 000 (1 an et plus) |
| Valencène | Aromatisant alimentaire (absorption alimentaire) [1 an et plus] | 4 × 10-4 | 555 000 (1 an et plus) |
a Les paramètres des scénarios d’exposition et les calculs pour le sous-groupe 2 sont présentés à l’annexe C.
b La marge d’exposition est calculée en utilisant la dose d’effet critique (DSENO) de 222 mg/kg p.c./j), basée sur les changements au système lymphatique chez les rats mâles, les changements pathologiques dans le foie et les ganglions lymphatiques mésentériques chez les rats mâles et femelles, et les effets non expliqués sur les reins des femelles observés lors d’une étude sur la toxicité par voie orale du bêta-caryophyllène menée sur 90 jours.
Les marges d’exposition calculées pour l’exposition au bêta-caryophyllène, au guaiène et au valencène à partir d’aliments (en fonction de leur utilisation potentielle comme aromatisants alimentaires) sont jugées adéquates pour compenser les incertitudes sur les effets sur la santé et les données d’exposition. L’absorption supplémentaire de bêta-caryophyllène, de guaiène et de valencène à partir de leur présence naturelle dans certains aliments n’est pas jugée préoccupante pour la santé humaine. En ce qui concerne l’exposition au bêta-caryophyllène à partir du milieu naturel, de produits nettoyants, d’assainisseurs d’air et de crèmes contre l’herpès buccal ainsi que l’exposition aux T et T de l’essence de clou de girofle à partir de lotions pour le corps, d’huiles de massage, de rince-bouche et de leur utilisation à titre d’huile essentielle comme parfum pour le corps (9 ans et plus), on considère que la marge d’exposition entre la dose d’effet critique et l’estimation d’exposition présentée au tableau 8-3 est adéquate pour compenser les incertitudes sur les effets sur la santé et sur les données d’exposition. De plus, on considère que la marge d’exposition calculée pour l’exposition à l’alpha-guaiène à partir de son utilisation potentielle comme parfum est adéquate pour compenser les incertitudes sur les effets sur la santé et sur les données d’exposition.
On considère que la marge entre la dose d’effet critique et l’estimation d’exposition quotidienne aux T et T de l’essence de clou de girofle à partir de leur utilisation à titre d’huile essentielle comme parfum pour le corps destiné aux enfants de 2 à 8 ans est potentiellement inadéquate pour compenser les incertitudes sur les effets sur la santé et sur les données d’exposition.
7.2.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Incidence |
|---|---|
| Exposition | N/A |
| Il existe un degré d’incertitude lié au facteur d’absorption cutanée utilisé pour les substances du sous-groupe 2, car il est fondé sur l’examen des données disponibles. Toutefois, l’utilisation d’un facteur d’absorption cutanée de 20 % ne devrait pas entraîner une sous-estimation des expositions systémiques par voie cutanée, puisqu’il s’agit d’une estimation supérieure tirée des données disponibles sur l’absorption cutanée pour le groupe des monoterpènes acycliques, monocycliques et bicycliques et le groupe des sesquiterpènes monocycliques et bicycliques. | +/- |
| Comme l’assainisseur d’air contient plusieurs substances parfumantes (environ 25), l’hypothèse selon laquelle la concentration de parfum dans l’assainisseur d’air équivaut à la concentration de bêta-caryophyllène constitue une estimation prudente. | + |
| On ne sait pas avec certitude si les produits offerts aux consommateurs contiennent des T et T de l’essence de clou de girofle ou de l’essence de girofle classique. En l’absence d’autres données, il a été présumé que les produits contiennent des T et T de l’essence de clou de girofle. Cette hypothèse constitue une démarche prudente puisque la quantité de bêta-caryophyllène dans l’essence de girofle classique est bien moindre que celle dans les T et T de l’essence de clou de girofle (17 % contre plus de 70 %) et que le danger associé à l’eugénol, le principal composant de l’essence de girofle classique, est faible (ECCC, SC 2018c). | + |
| Danger | N/A |
| Il existe peu d’information sur les effets de l’exposition à doses répétées au bêta-caryophyllène par les voies d’exposition pertinentes et pour différentes durées. De plus, il y a peu d’études sur les animaux portant sur la toxicité à doses répétées des T et T de l’essence de clou de girofle, du guaiène et du valencène pour les voies d’exposition pertinentes (voies cutanée et orale et inhalation). Les données sur les dangers associés au principal composant, le bêta-caryophyllène, ont servi à éclairer l’évaluation des effets sur la santé, le cas échéant. | +/- |
+ = incertitude quant au potentiel de surestimation de l’exposition ou du risque; - = incertitude quant au potentiel de sous-estimation de l’exposition ou du risque; +/- = potentiel inconnu de surestimation ou de sous-estimation du risque.
7.3 Évaluation du sous-groupe 3 (guaiol, bulnésol, élémol)
7.3.1 Évaluation de l’exposition au sous-groupe 3
Milieux naturels et aliments
Étant donné les faibles quantités (moins de 100 kg) de guaiol, de bulnésol et d’élémol dont on a déclaré l’utilisation au Canada (Environnement Canada 2013), on ne prévoit pas d’exposition à ces substances depuis les milieux naturels, y compris l’eau potable.
Nous n’avons pas relevé d’utilisation du bulnésol comme aromatisant alimentaire au Canada ou ailleurs dans le monde. On a toutefois signalé la présence d’élémol dans plusieurs huiles essentielles ou extraits de plantes qui sont aussi reconnus à titre d’aromatisants alimentaires à l’échelle internationale (Burdock 2010).
En utilisant une méthode de l’absorption quotidienne maximisée calculée à partir de données d’enquête et fondée sur les volumes de production annuelle déclarés par l’industrie alimentaire dans les enquêtes sur les quantités (IOFI 1995, cité dans EFSA 2015c), l’EFSA a estimé que l’absorption par personne d’élémol à partir de son utilisation à titre d’aromatisant alimentaire en Europe est de 1,6 μg par jour (0,027 μg/kg p.c. pour une personne de 60 kg). En l’absence de données sur l’utilisation réelle (si elles existent) de l’élémol en tant qu’aromatisant alimentaire dans des aliments vendus au Canada, nous avons utilisé les quantités absorbées par personne, calculées par l’EFSA pour représenter l’exposition alimentaire possible de la population générale canadienne (personnes d’un an et plus) à cette substance à partir de son utilisation potentielle à titre d’aromatisant alimentaire.
Le bulnésol et l’élémol sont naturellement présents dans certains aliments (OMS 2006; EFSA 2015c; Nijssen 2018) et également présents dans une gamme d’huiles essentielles, comme l’essence d’écorce de citron, l’essence d’écorce de mandarine, l’huile essentielle d’orange amère et l’huile de feuille de kaloupilé. L’exposition alimentaire à ces huiles découlant de leur présence naturelle dans les écorces de fruits et d’autres matières végétales sources d’huiles essentielles devrait être faible.
Les estimations d’exposition alimentaire de la population générale canadienne au bulnésol et à l’élémol à partir de leur présence naturelle dans certains aliments ont été calculées par la Direction des aliments de Santé Canada à partir des données sur leur concentration tirées de la base de données sur les composants volatils dans les aliments (Nijssen 2018). Pour chaque catégorie d’aliments et de boissons de la base de données, nous avons utilisé de manière prudente la concentration la plus élevée déclarée pour chaque substance afin de représenter la catégorie alimentaire. Dans les cas où les concentrations étaient similaires dans plusieurs catégories alimentaires liées, les aliments ont été regroupés dans une même catégorie et la concentration la plus élevée déclarée de tous les aliments visés a été appliquée à l’ensemble de la catégorie (p. ex., tous les légumes, sauf les pommes de terre; tous les jus de fruits).
Le bulnésol est présent dans les épices et fines herbes, à une concentration maximale déclarée de 4500 ppm dans le basilic, lequel a été choisi pour représenter l’ensemble des épices et fines herbes. Les concentrations maximales d’élémol dans les aliments utilisés pour l’évaluation se situaient entre 0,37 ppm pour le jus de pamplemousse (concentration utilisée pour représenter tous les jus de fruits) et 301 ppm pour le gingembre (concentration utilisée pour représenter toutes les épices).
L’exposition alimentaire de la population canadienne au bulnésol et à l’élémol à partir de leur présence naturelle dans certains aliments a été estimée en multipliant la quantité d’aliments consommés par la quantité de chaque substance dans ces aliments. Les estimations de la moyenne et du 90e centile de la consommation alimentaire sont fondées sur l’absorption alimentaire individuelle en une journée par « toute la population » déclarée par les répondants à l’Enquête sur la santé dans les collectivités canadiennes (ESCC) de 2004 pour les nourrissons d’au plus 12 moisNote de bas de page 7 et à l’ESCC de 2015 pour tous les autres groupes d’âge (Statistique Canada 2004 et 2015). Les expositions alimentaires moyennes estimées de cette manière se situaient entre 8,2 × 10-2 mg/kg p.c./j (personnes de 14 à 18 ans) et 1,71 × 10-1 mg/kg p.c./j (enfants de 4 à 8 ans) pour le bulnésol, et entre 6 × 10-3 mg/kg p.c./j (nourrissons de 6 à 12 mois) et 2,7 × 10-2 mg/kg p.c./j (enfants de 4 à 8 ans) pour l’élémol (annexe B).
Produits offerts aux consommateurs
L’élémol est utilisé comme ingrédient odorant ou parfumant dans une gamme de produits, notamment les produits de soins personnels, les produits nettoyants et les assainisseurs d’air, à une concentration de 50 ppm ou moins (suivi des renseignements déclarés en réponse à l’avis émis en 2012 par le Canada en vertu de l’article 71). Pour évaluer l’exposition potentielle à l’élémol à partir de son utilisation comme ingrédient parfumant, nous avons utilisé un scénario de produit représentatif avec des estimations d’exposition cutanée élevées (hydratant corporel) et une concentration maximale de 50 ppm (0,005 %) pour dériver les estimations d’exposition cutanée. En présumant d’une absorption complète par voie cutanée (absorption cutanée de 100 %), les estimations d’exposition systémique par voie cutanée vont de 6,76 × 10-3 pour les adultes à 1,59 × 10-2 pour les nourrissons de 0 à 5 mois.
7.3.2 Évaluation des effets sur la santé du sous-groupe 3
Il n’existe aucune donnée empirique sur les effets du guaiol, du bulnésol et de l’élémol sur la santé. Aucune évaluation internationale du guaiol, du bulnésol ou de l’élémol n’est disponible.
En l’absence de données sur les dangers associés à ces substances, nous avons utilisé une méthode de lecture croisée. Les données sur les dangers associés à l’alpha-terpinéol (un analogue) ont été utilisées pour éclairer l’évaluation des dangers.
L’alpha-terpinéol est caractérisé par un noyau à six atomes de carbone, comprenant une double liaison (cyclohexène), possédant de multiples groupements méthyles et un groupement alcool comme l’élémol du sous-groupe 3, à la différence que l’alpha-terpinéol est monocyclique, alors que le guaiol et le bulnésol sont des sesquiterpènes bicycliques et ont un noyau à sept atomes de carbone à double liaison (Dolejš et coll. 1960). L’analogue et les substances cibles ont aussi des propriétés physiques et chimiques semblables et sont présents naturellement dans les huiles essentielles extraites du Duguetia lanceolata ou du Cinnamomum illicioides (Isman 2000). L’action métabolique sur l’alpha-terpinéol et l’élémol produit des métabolites inoffensifs (OCDE 2019). Les données toxicocinétiques sur le guaiol et le bulnésol ne sont pas disponibles, mais elles devraient très probablement suivre des voies métaboliques semblables à celle de l’alpha-terpinéol, car la conjugaison représente la principale voie métabolique pour ces alcools (Belsito et coll. 2008). Le bulnésol, le guaiol, l’élémol et l’alpha-terpinéol sont des substances de classe I selon la classification de Cramer. Les substances de classe I sont des substances de structure chimique simple dont les voies métaboliques sont connues et dont le métabolisme génère des produits finaux inoffensifs, ce qui suggère une faible toxicité par voie orale.
Dans une étude réalisée conformément à la ligne directrice 422 de l’OCDE, trois groupes de dix rats mâles et dix rats femelles ont reçu par gavage des doses de 0, 60, 250 ou 750 mg/kg p.c./j d’alpha-terpinéol pendant au moins 35 jours (deux semaines avant l’accouplement, tout au long des périodes d’accouplement et de gestation, et jusqu’au jour 6 de lactation) [dossier d’enregistrement de l’ECHA 2019b]. Le troisième groupe a eu une période de rétablissement de deux semaines. Aucun signe clinique ou de toxicité n’a été consigné pour les mâles et les femelles. On a observé une baisse de la consommation alimentaire et du poids corporel chez les mâles et les femelles, mais seulement à la dose de 750 mg/kg p.c./j. À la même dose, les taux d’urée sanguine et de créatinine ainsi que la glycémie étaient considérablement plus élevés. Après deux semaines toutefois, tous les paramètres sanguins étaient revenus à la normale. Une hypertrophie adaptative des hépatocytes centrolobulaires dans le foie des femelles du groupe ayant reçu la dose de 750 mg/kg p.c./j n’était plus présente après deux semaines de rétablissement, et des anomalies histopathologiques observées dans les reins des mâles ayant reçu les doses de 250 et 750 mg/kg p.c./j s’étaient également résorbées après la fin de l’administration. À la dose de 750 mg/kg p.c./j, on a observé dans les épididymes un nombre réduit ou une absence totale de spermatozoïdes ainsi que la présence de cellules spermatogènes dégénérées dans les canaux. Une atrophie ou une dégénération des tubes séminifères, accompagnée de spermatides géantes et d’une vacuolisation des tubes séminifères, a été observée dans les testicules de tous les animaux du groupe ayant reçu la dose de 750 mg/kg p.c./j. À la même dose, aucune des femelles s’étant accouplées avec des mâles n’est devenue enceinte. Les effets sur l’appareil reproducteur masculin auraient été suffisants pour empêcher la fécondation et rendre les mâles complètement infertiles. Des anomalies semblables étaient toujours présentes après la période de rétablissement de deux semaines. Il n’y a eu aucun effet sur les paramètres reproducteurs des femelles, comme les cycles œstraux, l’intervalle précoïtal ou l’accouplement dans tous les groupes, et aucun effet sur le nombre d’implantations, l’indice de survie post-implantation ou l’indice de naissances vivantes chez les femelles ayant reçu les doses moyennes et faibles. Selon les effets sur la reproduction des mâles, les auteurs de l’étude ont déterminé une DSENO de 250 mg/kg p.c./j pour la toxicologie de la reproduction (dossier d’enregistrement de l’ECHA 2019b).
Dans le cadre d’une étude comparative de deux semaines, on a administré oralement de l’alpha-terpinéol à des rats mâles par gavage ou par leur régime alimentaire. Pendant deux semaines, deux groupes de cinq rats mâles ont reçu par gavage des doses de 500 ou 750 mg/kg p.c./j de terpinéol et deux autres ont reçu par leur régime alimentaire des concentrations de 8000 ou 12 000 ppm d’alpha-terpinéol (dossier d’enregistrement de l’ECHA 2019b). On a signalé une baisse de la consommation alimentaire dans les deux groupes gavés durant le traitement et à la fin de la période de traitement de deux semaines. Dans les groupes soumis au traitement, la consommation alimentaire était très faible durant les premiers jours de l’étude, mais a augmenté rapidement, et l’absorption totale de la substance dans le groupe ayant reçu la dose élevée est demeurée d’un peu plus de 750 mg/kg p.c./j pendant toute la deuxième semaine. Une baisse nette du gain de poids corporel a été observée dans les deux groupes. Des effets sur la mobilité des spermatozoïdes ont été signalés dans les groupes gavés, tandis qu’aucun effet n’a été détecté dans les groupes suivant le régime alimentaire. Les auteurs ont conclu que les effets sur l’appareil reproducteur masculin dépendent du mode d’administration de la dose (dossier d’enregistrement de l’ECHA 2019b). Cependant, l’exposition à l’alpha-terpinéol était de plus courte durée dans cette étude (14 jours) par rapport à l’étude précédente (35 jours), et pourrait ne pas être représentative de l’effet sur la spermatogenèse observé après 35 jours d’exposition dans l’étude précédente.
Aucun effet nocif sur l’appareil reproducteur masculin ou le foie n’a été signalé durant une étude à doses répétées chez les rats mâles (dix animaux/dose), lors de laquelle des doses d’alpha-terpinéol de 0 ou 622,65 mg/kg p.c./j (12 000 ppm) ont été administrées par le régime alimentaire pendant 90 jours (soit un processus complet de spermatogenèse) [dossier d’enregistrement de l’ECHA 2019b]. Les auteurs de l’étude ont conclu que les effets sur l’appareil reproducteur masculin pouvaient uniquement être observés en raison du pic de concentration dû à l’administration par gavage (dossier d’enregistrement de l’ECHA 2019b). Ils ont expliqué que dans certains cas, l’administration par gavage crée des circonstances pharmacocinétiques ne pouvant être rencontrées dans des conditions réelles d’exposition, comme le régime alimentaire, et peut donc être considérée comme une voie d’exposition non pertinente (dossier d’enregistrement de l’ECHA 2019b). Toutefois, les auteurs n’ont fourni aucune mesure de la substance chimique dans le sang ou l’urée des animaux pour appuyer cette hypothèse.
Dans une étude réalisée conformément à la ligne directrice 414 de l’OCDE, on a administré par gavage un mélange de terpinéol à des doses de 0, 60, 200 ou 600 mg/kg p.c./j à des rattes enceintes (20/dose) du JG 6 au JG 19 (dossier d’enregistrement de l’ECHA 2019b). L’alpha-terpinéol était le composant principal (de 62 % à 80 %) du mélange de terpinéol. Le poids moyen ajusté du foie des femelles ayant reçu une dose de 600 mg/kg p.c./j était considérablement plus élevé, mais aucune anomalie macroscopique n’a été détectée. Aucun signe clinique ni signe de réaction au traitement n’a été relevé chez les femelles traitées. La consommation alimentaire était plus faible tout au long du traitement chez le groupe ayant reçu une dose de 600 mg/kg p.c./j, tandis qu’elle est demeurée inchangée chez les groupes ayant reçu les doses de 60 et 200 mg/kg p.c./j. Aucun effet du traitement maternel sur les données relatives aux portées n’a été signalé pour l’ensemble des doses, à l’exception d’une croissance embryofœtale légèrement réduite à la dose de 600 mg/kg p.c./j. De plus, on a noté un poids placentaire moyen plus bas à la dose de 600 mg/kg p.c./j. Les masses du placenta, des portées et des fœtus sont demeurées inchangées aux doses de 60 et 200 mg/kg p.c./j. Dans le groupe ayant reçu une dose de 600 mg/kg p.c./j, on a relevé une légère augmentation du nombre de cas d’ossification absente ou incomplète de la 5e ou de la 6e sternèbre, mais cela pourrait être lié à la baisse de la consommation alimentaire chez les mères et n’a donc pas été considéré comme un effet nocif sur le développement. En se fondant sur les résultats de l’étude, les auteurs ont jugé que la dose de 600 mg/kg p.c./j du mélange de terpinéol (équivalant à 480 mg/kg p.c./j d’alpha-terpinéol), soit la dose d’essai la plus élevée, constituait la DSENO pour la toxicité pour les mères et le développement (dossier d’enregistrement de l’ECHA 2019b).
Lors d’une étude réalisée conformément à la ligne directrice 413 de l’OCDE, on a administré par inhalation d’aérosol un mélange de terpinéol en concentrations de 0, 0,202, 0,572 ou 2,23 mg/L (équivalant à 0, 202, 572 ou 2230 mg/m3, respectivement) à des rats mâles et femelles (10/sexe/dose) pendant six heures par jour, cinq jours par semaine pour treize semaines (dossier d’enregistrement de l’ECHA 2019b). Certains animaux du groupe témoin et du groupe ayant reçu une dose élevée ont eu une période de rétablissement de quatre semaines. Les auteurs de l’étude n’ont signalé aucun effet nocif. En se fondant sur ces résultats, ils ont établi une concentration sans effet nocif observable (CSENO) de 2,23 mg/L (équivalant à 2230 mg/m3), soit la dose d’essai la plus élevée (dossier d’enregistrement de l’ECHA 2019b).
Un mélange complexe de terpinéol ne s’est pas révélé mutagène lors d’essais de mutation inverse sur bactéries réalisés avec les souches TA 98, TA 100, TA 102, TA 1535 et TA 1537 de S. typhimurium, avec et sans activation métabolique (dossier d’enregistrement de l’ECHA 2019b).
L’alpha-terpinéol ne s’est pas révélé mutagène lors d’essais sur bactéries et n’a pas entraîné de mutation génique chez des cellules de mammifères, avec ou sans activation métabolique exogène (Belsito et coll. 2008; Bhatia et coll. 2008a). Lors d’une étude à doses répétées de 14 jours chez 3 ou 4 rats mâles, l’administration d’une alimentation enrichie de 1 % d’alpha-terpinéol a entraîné une réduction de la consommation alimentaire, du poids corporel et des taux d’ApoA-1 (un composant de la lipoprotéine de haute densité). On a aussi observé une hausse des taux de cholestérol et de triacylglycérol ainsi que de la masse du foie (Imaizumi et coll. 1985).
Stoner et coll. (1973) ont évalué le potentiel de l’alpha-terpinéol de causer des tumeurs pulmonaires chez les souris A/He femelles. Les souris ont reçu de l’alpha-terpinéol par injection intrapéritonéale trois fois par semaine pendant huit semaines, ce qui correspond à des doses cumulatives totales de 1,9 et 9,6 g/kg (80 et 400 mg/kg p.c./dose ou 35 et 170 mg/kg p.c./j). Les souris ont été euthanasiées 12 semaines après la dernière injection. À la dose de 1,9 g/kg, 2 souris étaient mortes et 3 des 18 survivantes présentaient des tumeurs. À la dose de 9,6 g/kg, 5 souris étaient mortes et l’une des 15 survivantes présentait des tumeurs. Stoner et coll. (1973) n’ont pas observé de variation importante du nombre de tumeurs entre les animaux traités et les animaux témoins. Par conséquent, dans le cadre de cette étude, les auteurs ont déterminé que l’alpha-terpinéol n’était pas cancérigène (Stoner et coll. 1973).
7.3.3 Caractérisation des risques pour la santé humaine
La dose d’effet critique déterminée pour l’alpha-terpinéol à partir d’une étude par gavage de 35 jours sur la toxicité pour la reproduction correspond à une DSENO de 250 mg/kg p.c./j. La dose d’effet est basée sur l’infertilité totale causée par un nombre réduit ou une absence complète de spermatozoïdes en présence de cellules spermatogènes dégénérées dans les épididymes et de l’atrophie ou de la dégénération des tubes séminifères observées dans les testicules des rats mâles ayant reçu une dose de 750 mg/kg p.c./j (ECHA 2019b).
Le tableau 7-4 résume les estimations d’exposition quotidienne et les marges d’exposition qui en découlent.
| Substancea | Scénario d’exposition | Exposition systémique quotidienne (mg/kg p.c./j) | Marge d’expositionb |
|---|---|---|---|
| Élémol | Aromatisant alimentaire (absorption alimentaire) [enfants d’un an et plus] | 2,70 × 10-5 | 9 259 259 |
| Élémol | Exposition cutanée à partir de lotion pour le corps (0,005 %) [toutes les sous-populations] | 6,76 × 10-3 (adultes) à 1,59 × 10-2 (nourrissons) | 15 750 (nourrissons) à 37 000 (adultes) |
a L’annexe D donne les paramètres des scénarios d’exposition et les calculs pour l’élémol. On suppose une absorption cutanée de 100 %.
b La marge d’exposition est calculée en utilisant la dose d’effet critique (DSENO = 250 mg/kg p.c./j), basée sur le nombre réduit ou l’absence complète de spermatozoïdes en présence de cellules spermatogènes dégénérées dans les épididymes et d’une atrophie ou d’une dégénération des tubes séminifères observées dans les testicules des rats mâles dans le cadre d’une étude par gavage de 35 jours sur la toxicité du terpinéol pour la reproduction.
La marge d’exposition calculée pour l’exposition à l’élémol à partir d’aliments, en raison de son utilisation potentielle au Canada comme aromatisant alimentaire, est jugée adéquate pour compenser les incertitudes sur les effets sur la santé et sur les données d’exposition. L’absorption supplémentaire d’élémol à partir de sa présence naturelle et de celle du bulnésol dans certains aliments n’est pas jugée préoccupante pour la santé humaine. De plus, la marge d’exposition calculée pour l’exposition à l’élémol à partir de son utilisation potentielle comme ingrédient parfumant est jugée adéquate pour compenser les incertitudes sur les effets sur la santé et sur les données d’exposition.
Puisqu’il n’y a aucune source déterminée d’exposition de la population générale au guaiol, une méthode qualitative de caractérisation des risques a été adoptée et le risque pour la santé humaine associé au guaiol a été jugé faible.
7.3.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Incidence |
|---|---|
| Danger | N/A |
| Il n’existe aucune donnée sur les dangers associés au guaiol, au bulnésol et à l’élémol. Les données de lecture croisée de l’analogue, l’alpha-terpinéol, ont servi à éclairer l’évaluation des risques. | +/- |
+ = incertitude quant au potentiel de surestimation de l’exposition ou du risque; - = incertitude quant au potentiel de sous-estimation de l’exposition ou du risque; +/- = potentiel inconnu de surestimation ou de sous-estimation du risque. Les marges d’exposition obtenues sont jugées adéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les dangers.
7.4 Essence de santal
7.4.1 Évaluation de l’exposition à l’essence de santal
Milieux naturels et aliments
Compte tenu des faibles quantités de la substance déclarées être utilisées au Canada (Environnement Canada 2013), on ne prévoit pas d’exposition à l’essence de santal à partir des milieux naturels.
Il n’existe aucune information précise sur l’utilisation potentielle de l’essence de santal comme aromatisant alimentaire dans des aliments vendus au Canada. Toutefois, puisque l’essence de santal est employée comme aromatisant alimentaire ailleurs dans le monde, il se peut qu’elle soit présente au même titre dans des aliments vendus au Canada.
Le JECFA et l’EFSA n’ont pas publié d’estimations de l’exposition à l’essence de santal lorsqu’elle est utilisée comme aromatisant, mais le Fenaroli’s Handbook of Flavour Ingredients (Burdock 2010) fait état d’une consommation « individuelle » de cette substance à partir de son utilisation comme aromatisant alimentaire. La consommation individuelle est une estimation de l’absorption par personne fondée sur une méthode de l’absorption quotidienne maximisée calculée à partir de données d’enquête pour la population américaine, analogue à celle employée par le JECFA.
En l’absence de données sur l’utilisation réelle, le cas échéant, de l’essence de santal en tant qu’aromatisant alimentaire dans des aliments vendus au Canada, l’estimation des quantités absorbées par personne pour la population américaine de 1,20 × 10‑4 mg/kg p.c./j, indiquée dans le Fenaroli’s Handbook of Flavour Ingredients constitue une estimation acceptable de l’exposition alimentaire possible de la population générale canadienne (personnes d’un an et plus) à la substance à partir de son utilisation comme aromatisant alimentaire (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, mai 2019, sans référence; Burdock 2010).
Produits offerts aux consommateurs
L’exposition cutanée devrait être la principale voie d’exposition à partir de produits offerts aux consommateurs. En fonction de la faible pression de vapeur des deux principaux composants de l’essence de santal, l’alpha-santalol (4,51 × 10‑3 Pa) et le bêta-santalol (9,83 × 10‑3 Pa), et des utilisations relevées, l’inhalation ne devrait pas constituer une importante voie d’exposition.
Pour évaluer le risque d’exposition à l’essence de santal à partir de cosmétiques appliqués de manière topique, nous avons choisi des scénarios sentinelles à partir des fréquences d’utilisation et des concentrations déclarées d’essence de santal dans ces produits. Les expositions à l’essence de santal à partir de l’utilisation d’un hydratant corporel, d’une huile de massage, d’un hydratant pour le visage, d’un shampooing et de l’utilisation d’une huile essentielle comme parfum ont été choisies comme scénarios sentinelles pour les utilisations topiques. Ces données sont résumées à l’annexe E (tableaux E-1 à E-5).
Ainsi, l’exposition quotidienne la plus élevée à l’essence de santal devrait provenir de l’utilisation d’un hydratant corporel ayant une concentration maximale déclarée de 30 % d’essence de santal. Bien que la concentration maximale déclarée pour l’huile de massage soit de 100 %, les huiles de massage sont normalement diluées avant leur utilisation. Par conséquent, on présume que la concentration maximale d’essence de santal dans l’huile de massage est de 3 % (RIVM 2006). De plus, on a estimé les expositions cutanées causées par l’utilisation d’un hydratant pour le visage d’une concentration maximale de 3 %, l’utilisation d’une huile essentielle d’une concentration maximale de 100 % comme parfum pour le corps et l’utilisation d’un shampooing d’une concentration maximale de 10 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, octobre 2019, sans référence).
On a également signalé l’utilisation de l’essence de santal comme ingrédient non médicinal dans un système de nettoyage facial pour traiter l’acné et dans un écran solaire, en des concentrations d’au plus 2 % et 0,04 %, respectivement (mai 2012; communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, janvier 2019, sans référence). Comme les trois composants du système de nettoyage facial doivent être utilisés ensemble, les expositions quotidiennes à partir d’un nettoyant pour le visage, d’un hydratant pour le visage et d’un soin intensif antitache ont été additionnées. On a également quantifié l’exposition cutanée à partir de l’utilisation d’un écran solaire (annexe E, tableaux E-6 et E-7).
On peut aussi acheter l’essence de santal sous forme d’huile essentielle et on peut l’utiliser en aromathérapie. Les estimations de l’exposition par inhalation à partir de produits d’aromathérapie se situaient entre 2,24 × 10-1 mg/kg p.c./j pour les adultes et 8 × 10‑1 mg/kg p.c./j pour les nourrissons de 0 à 5 mois (annexe E, tableaux E-8 et E-9). Nous avons considéré le scénario d’exposition à partir de produits d’aromathérapie comme le scénario sentinelle pour une exposition potentielle par inhalation découlant de l’utilisation de l’essence de santal dans des assainisseurs d’air, des chandelles et de l’encens.
Selon des renseignements figurant sur le site Web de l’ACI, l’essence de santal pourrait être utilisée comme parfum dans des nettoyants tout usage et des détergents à lessive, à des concentrations maximales de 1 % et 5 %, respectivement (ACI 2018). Pour évaluer l’exposition potentielle à l’essence de santal à partir de son utilisation dans des produits d’entretien ménager, nous avons évalué l’utilisation de l’essence de santal dans des nettoyants tout usage et des détergents liquides. Il a été présumé que l’essence de santal serait présente en des concentrations maximales de 1 % et 5 % dans les nettoyants tout usage et les détergents liquides, respectivement, comme indiqué sur le site Web de l’ACI (ACI 2018) (annexe E, tableaux E-8 et E-9).
Le tableau 7‑6 résume les expositions à partir de produits offerts aux consommateurs.
| Scénario | Concentration dans le produit (%) | Exposition quotidienne (mg/kg p.c./j)a |
|---|---|---|
| Lotion pour le corps (voie cutanée) | 30 % | 40,5 (adultes) à 95,2 (nourrissons de 0 à 5 mois) |
| Huile de massage (voie cutanée) | 3 % | 1,30 (adultes) à 8,57 (nourrissons de 0 à 5 mois) |
| Hydratant pour le visage (voie cutanée) | 3 % | 7,23 × 10-1 (personnes de 14 à 18 ans) à 1,22 (adultes) |
| Huile essentielle utilisée comme parfum pour le corps (voie cutanée) | 100 % | 7,58 (adultes) à 22,0 (bébés de 2 à 3 ans) |
| Shampooing (voie cutanée) | 10 % | 1,75 × 10-1 (adultes) à 6,19 × 10-1 (nourrissons de 0 à 5 mois) |
| Système de nettoyage facial (voie cutanée) | 2 % | 7,39 × 10-1 (personnes de 14 à 18 ans) à 1,23 (adultes) |
| Écran solaire (voie cutanée) | 0,04 % | 8,40 × 10-2 (jeunes de 9 à 13 ans) à 3,80 × 10-1 (nourrissons de 6 à 11 mois) |
| Aromathérapie (exposition systémique par inhalation) | 100 % | 2,24 × 10-1 (adultes) à 6,46 × 10-1 (nourrissons de 0 à 5 mois) |
| Mélange, chargement et application d’un nettoyant tout usage (voie cutanée) | 1 % | 5,00 × 10-2 (adultes) |
| Exposition par contact avec des planchers nettoyés (voie cutanée) | 1 % | 1,83 × 10-2 (bébés de 1 à 2 ans) |
| Exposition par contact avec des planchers nettoyés (voie orale non alimentaire) | 1 % | 1,38 × 10-3 (bébés de 1 à 2 ans) |
| Mélange, chargement, lavage et suspension de vêtements lavés à la main (voie cutanée) | 5 % | 5,43 × 10-1 (adultes) |
7.4.2 Évaluation des effets sur la santé de l’essence de santal
Évaluation des dangers associés à l’essence de santal
L’essence de santal a été approuvée et reconnue comme généralement inoffensive aux fins d’utilisation comme aromatisant par la Flavor and Extract Manufacturers Association (FEMA) [Hall et Oser 1965]. La FDA des États-Unis a approuvé l’utilisation de l’essence de santal comme aromatisant naturel et comme substance naturelle utilisée en conjonction avec des saveurs (21CFR172.510). Il existe peu de données empiriques sur les effets de l’essence de santal sur la santé.
Chaabra et Rao (1993) ont administré par gavage 5 et 10 μl/animal/j d’essence de santal pure (138,9 et 277,7 mg/kg p.c./j respectivement) à des souris Swiss albinos allaitantes pendant 14 ou 21 jours, à partir du premier jour de lactation. On a relevé une importante baisse de la concentration en cytochromes hépatiques P-450 chez les petits et les mères ayant reçu 10 μl d’essence de santal pendant 21 jours. Une baisse du nombre de cytochromes hépatiques P-450 peut indiquer un effet inhibitoire de l’essence de santal sur les enzymes des cytochromes dans le foie. Ces résultats ne nous permettent pas de déterminer précisément quelle enzyme est modifiée par l’essence de santal. Selon ces résultats, l’essence de santal semble se retrouver dans le lait maternel et pourrait inhiber le métabolisme des xénobiotiques hépatiques chez les mères et les petits (Chaabra et Rao 1993).
Aucune réaction de sensibilisation n’a été observée après l’application topique d’une gelée de pétrole contenant 10 % d’essence de santal sur 25 volontaires (Opdyke 1974).
On a observé des réactions photoallergiques chez 3 des 138 patients ayant subi un photo-épidermotest réalisé avec de l’essence de santal à 2 % (Fotiades et coll. 1995). Au Japon, l’essence de santal est considérée comme un sensibilisant de la peau à risque élevé et une cause potentielle de dermatite de contact pigmentée (Nakayama 1998). En raison du risque de réactions photoallergiques chez la population japonaise, on recommande l’utilisation d’une concentration maximale de 2 % (Tisserand et Young 2014).
L’essence de santal a donné un résultat négatif lors d’un test de recombinaison sur spores utilisant les souches H17 (Rec+) et M45 (Rec-), réalisé avec ou sans activation métabolique (S9) [Burdock et Carabin 2008]. L’essence de santal n’est pas cytotoxique ni génotoxique pour les cellules épithéliales mammaires (Ortiz et coll. 2016). De plus, l’essence de santal ne contient aucune substance cancérigène connue (Burdock et Carabin 2008).
Afin d’éclairer l’évaluation des risques associés à l’essence de santal, nous avons examiné les données sur les dangers liés à ses principaux composants, soit l’alpha-santalol (41 % à 55 %) et le bêta-santalol (24 % à 27 %).
Évaluation des dangers posés par l’alpha-santalol et le bêta-santalol
Le JECFA a évalué le santalol (alpha et bêta) et conclu à l’absence de préoccupation en matière d’innocuité aux niveaux actuels d’utilisation dans les aliments (OMS 2002). Aux États-Unis, l’alpha-santalol et le bêta-santalol sont autorisés comme aromatisants synthétiques ou adjuvants que l’on peut ajouter aux aliments conformément à tous les principes des bonnes pratiques de fabrication (21CFR172.515).
Le Research Institute for Fragrance Materials (RIFM) a évalué comme ingrédients parfumants un groupe des alcools terpéniques cycliques et non cycliques qui comportait quelque trente substances classées comme alcools monoterpéniques, sesquiterpéniques et diterpéniques (Belsito et coll. 2008). Il a déterminé que toutes les substances avaient d’étroites relations structurales ainsi que des profils biochimiques et de toxicité semblables et suivaient les mêmes voies de désintoxication métabolique. Il y avait assez de données sur le farnésol, le bisabolol, le linalol, le menthol et l’alpha-terpinéol (des composés comprenant tous les principaux éléments structuraux et sites potentiels pour le métabolisme présents chez tous les autres membres du groupe) pour démontrer que les terpènes cycliques et non cycliques suivent des voies métaboliques communes. Pour quantifier les risques pour la santé humaine associés à l’utilisation d’alcools terpéniques, le RIFM a déterminé une DSENO systémique de 50 mg/kg p.c./j, basée sur la plus faible DSENO de toutes les études disponibles et calculée à partir d’une étude sur la toxicité du linalol et du citronellol à doses répétées par voie orale (Belsito et coll. 2008). La DSENO systémique utilisée par le RIFM est fondée sur une dose sans effet observable (DSEO) de 50 mg/kg p.c./j tirée d’une étude à doses répétées sur le linalol examinée en 2020 par ECCC et SC (ECCC, SC 2020). Lors de cette étude, on a administré à des rats un régime alimentaire contenant des parts égales de citronellol et de linalol (50 mg de chaque substance) pendant 12 semaines (ECCC, SC 2020). Comme l’étude est fondée sur une seule dose d’un mélange de citronellol et de linalol, nous ne considérerons pas que cette dose constitue une DSENO fiable pour évaluer les risques de l’alpha-santalol et du bêta-santalol pour la santé humaine.
En l’absence de données sur les dangers associés à ces substances, une méthode de lecture croisée a été appliquée, et les données sur les dangers associés au bisabolol (l’analogue de lecture croisée) ont été utilisées pour éclairer l’évaluation des dangers.
L’alpha-santalol et le bêta-santalol sont des composés organiques classés comme des alcools alcènes sesquiterpéniques bicycliques et des isomères (97,4 % de similitude structurale selon la Boîte à outils QSAR de l’OCDE [2019]). Aussi connu sous le nom de lévoménol, le bisabolol est un alcool alcène sesquiterpénique monocyclique naturel. Les substances cibles et l’analogue sont de structure similaire, constituée d’un squelette cyclique doté d’une chaîne latérale comprenant une double liaison et un groupement hydroxyle. Selon la Boîte à outils QSAR de l’OCDE (2019), le bisabolol présente une similitude structurale de 75,5 % avec l’alpha-santalol et de 77 % avec le bêta-santalol. L’essence de santal et le bisabolol se sont révélés non mutagènes lors d’un test de recombinaison sur spores utilisant les souches H17 (Rec+) et M45 (Rec-) ainsi que leurs spores, et lors d’un test d’Ames, respectivement. Ils ont aussi donné des résultats négatifs lors d’un essai de génotoxicité pour les cellules épithéliales mammaires (essence de santal) et d’essais d’aberration chromosomique réalisés sur des cellules V79 de hamster chinois (bisabolol). L’alpha-santalol, le bêta-santalol et le bisabolol sont des substances de classe I selon la classification de Cramer. Les substances de classe I sont des substances de structure chimique simple dont les voies métaboliques sont connues et dont le métabolisme génère des produits finaux inoffensifs, ce qui suggère une faible toxicité par voie orale.
Lors d’une évaluation de l’innocuité du bisabolol réalisée en 1999, le groupe d’experts du Cosmetic Ingredient Review (CIR) a conclu que le bisabolol est bien absorbé à la suite d’une application topique et peut agir comme rehausseur de pénétration (CIR 2017). L’OMS a publié une évaluation de l’innocuité des alcools tertiaires terpénoïdes alicycliques et acycliques aliphatiques, qui visait notamment le bisabolol (OMS 2011). L’OMS a passé en revue toutes les études disponibles sur le bisabolol et déterminé une DSENO de 980 mg/kg p.c./j pour les mères et le développement (OMS 2011). L’OMS a reconnu l’effet inhibiteur du bisabolol sur quatre enzymes des cytochromes hépatiques P450 (CYP) chez l’humain (OMS 2011).
Dans le cadre d’une étude de 28 jours sur la toxicité par voie cutanée, on a appliqué directement sur la peau rasée de 10 rats Wistar (5 de chaque sexe) des pansements semi-occlusifs imbibés de bisabolol dans un véhicule d’huile d’olive à des doses de 50 (1 %), 200 (4 %) et 1000 (20 %) mg/kg p.c./j. Les rats ont été exposés à la substance pendant 6 heures par jour, 7 jours par semaine pour 4 semaines (28 jours). Aucun effet lié au traitement n’a été relevé chez les rats ayant reçu les doses de 50 et 200 mg/kg p.c./j. Un érythème modéré transitoire et la formation de squames diffuses ont été relevés chez certaines femelles du groupe ayant reçu la dose élevée. On a observé une importante hausse de la glycémie chez les deux sexes du groupe ayant reçu la dose élevée et du taux de calcium sérique chez les mâles ayant reçu la dose élevée. On a également relevé une importante baisse du poids absolu moyen du foie chez les femelles ayant reçu la dose élevée ainsi qu’une hausse du poids relatif moyen des testicules chez les mâles ayant reçu la dose élevée. Les auteurs ont attribué ces changements à l’importante baisse du poids moyen final des femelles et des mâles ayant reçu la dose élevée. Une masse réduite pour le foie réduit peut aussi indiquer une inhibition de l’activité des enzymes hépatiques. En se fondant sur ces résultats, les auteurs ont déterminé une DSENO de 200 mg/kg p.c./j ou de 4 % pour les effets cutanés (Bhatia et coll. 2008b).
Lors d’une étude sur la toxicité pour le développement, on a quotidiennement administré par gavage du bisabolol (98 %) à des rattes enceintes du JG 6 au JG 15 à des doses de 0, 0,250, 0,500, 1,0 ou 3,0 ml/kg p.c./j (équivalant à 0, 245, 490, 980 ou 2940 mg/kg p.c./j) [OMS 2011; Bhatia et coll. 2008b]. Aucun effet sur le développement prénatal n’a été observé à des doses allant jusqu’à 1,0 ml/kg (960 mg/kg p.c./j). Une importante réduction du nombre de fœtus ainsi qu’une hausse subséquente du taux de résorption fœtale ont été observées dans le groupe ayant reçu la dose de 3,0 ml/kg (2940 mg/kg p.c./j). Aucune malformation n’a été relevée. On a observé une légère sédation, une ataxie, une consommation alimentaire réduite et une réduction du gain de poids corporel chez les femelles ayant reçu cette dose (2940 mg/kg p.c./j). Aucune donnée sur le foie n’a été fournie. Selon ces résultats, les auteurs de l’étude ont déterminé une DSENO de 980 mg/kg p.c./j pour la toxicité pour les mères et le développement (OMS 2011; Bhatia et coll. 2008b).
Dans le cadre d’une étude semblable, on a administré du bisabolol par gavage à des lapines enceintes du JG 6 au JG 18 à des doses de 0, 0,3, 1,0 ou 3,0 ml/kg p.c./j (équivalant à 0, 294, 980 ou 2940 mg/kg p.c./j) [OMS 2011; Bhatia et coll. 2008b]. Les fœtus ont été prélevés au jour 30 et examinés. Aucun effet nocif sur le développement prénatal ou les petits n’a été relevé à des doses allant jusqu’à 1,0 ml/kg (980 mg/kg p.c./j). On a noté une réduction du nombre de fœtus dans le groupe ayant reçu la dose de 3,0 ml/kg (2940 mg/kg p.c./j), mais aucun fœtus mort ni malformation. Les mères de ce groupe présentaient une légère sédation et une réduction du gain de poids corporel. Aucune information sur le foie n’a été consignée. Selon ces résultats, les auteurs de l’étude ont déterminé une DSENO de 980 mg/kg p.c./j pour la toxicité pour les mères et le développement (OMS 2011; Bhatia et coll. 2008b).
L’effet inhibiteur du bisabolol sur des cytochromes P-450 comme les CYP2D6, CYP1A2, CYP2C9 ou CYP3A4 a été constaté (Tisserand et Young 2014; OMS 2011). Les cytochromes sont les principales enzymes participant au métabolisme des médicaments, qui compte pour environ 75 % du métabolisme total. La plupart des médicaments sont désactivés par les cytochromes, directement ou en facilitant l’excrétion par le corps. De plus, de nombreuses substances sont bioactivées par les cytochromes pour former leurs composés actifs (Guengerich 2008). En inhibant les cytochromes CYP2D6, CYP1A2, CYP2C9 ou CYP3A4, le bisabolol peut entraîner un risque d’interaction avec des médicaments métabolisés par ces enzymes, comme les antidépresseurs tricycliques, les antiarythmiques, les analgésiques, les antidiabétiques, les antiépileptiques, les antipsychotiques ou les médicaments chimiothérapeutiques (Tisserand et Young 2014). D’après la baisse des cytochromes hépatiques P-450 causée par l’essence de santal et observée précédemment par Chaabra et Rao (1993), l’essence de santal et son analogue, le bisabolol, pourraient accroître la probabilité d’effets nocifs chez les populations vulnérables, comme les personnes ayant des problèmes de santé préexistants.
On n’a observé aucune mutagénicité lors d’un test d’Ames sur les souches TA97a, TA98, TA100 et TA1535 de Salmonella typhimurium avec et sans activation S9 réalisé avec du bisabolol (dans l’éthanol) à des doses de 1,5 à 5000 μg/plaque (Bhatia et coll. 2008b). On a réalisé un essai d’aberration chromosomique avec bisabolol sur des cellules V79 de hamster chinois. Les cellules ont d’abord été incubées avec 7,81, 15,63 ou 31,25 μg de bisabolol/ml avec activation métabolique (S9), ou avec 0,78, 1,56 ou 3,13 μg de bisabolol/ml sans activation. Lors d’une deuxième expérience, les cellules ont été incubées avec 10, 20, 30 ou 40 μg de bisabolol/ml avec activation, ou avec 2, 3 ou 4 μg de bisabolol/ml sans activation. Les résultats de l’essai sur le bisabolol ont été négatifs (OMS 2011; Bhatia et coll. 2008b).
7.4.3 Caractérisation des risques pour la santé humaine
En l’absence de données sur les dangers posés par l’essence de santal et ses principaux composants, l’alpha-santalol et le bêta-santalol, nous avons utilisé les données sur les effets de l’analogue bisabolol sur la santé pour caractériser les risques associés à l’essence de santal.
Pour la caractérisation des risques, on a choisi une DSENO de 200 mg/kg p.c./j tirée d’une étude à court terme sur la toxicité cutanée du bisabolol en raison non seulement des effets critiques sur la santé observés à une dose de 1000 mg/kg p.c./j, comme la réduction du gain de poids corporel, la réduction de l’efficacité alimentaire, la formation d’un érythème modéré transitoire et de squames diffuses chez certaines femelles, la réduction de la masse absolue du foie chez les femelles et la hausse de la masse relative des testicules chez les mâles lors de l’étude réalisée par Bhatia et coll. (2008b), mais aussi de la diminution du nombre de cytochromes hépatiques P-450 observée à une dose de 277,7 mg/kg p.c./j d’essence de santal, mais non à une dose de 138,9 mg/kg p.c./j lors de l’étude de Chaabra et Rao (1993).
Pour caractériser les risques associés à une exposition par voie orale et par inhalation, nous avons utilisé une DSENO de 980 mg/kg p.c./j tirée de deux études par voie orale sur la toxicité pour le développement en se fondant sur les effets critiques pour la santé consistant en une légère sédation, une ataxie, une réduction de la consommation alimentaire et du gain de poids corporel chez les femelles ainsi qu’une réduction significative du nombre de fœtus et une hausse du taux de résorption fœtale (Bhatia et coll. 2008b).
Le tableau 7‑7 résume les estimations d’exposition quotidienne et les marges d’exposition qui en découlent.
| Scénario d’expositiona | Exposition (mg/kg p.c./j) | Marge d’expositionb |
|---|---|---|
| Aromatisant alimentaire (absorption alimentaire) [1 an et plus] | 1,20 × 10-4 | 416 667 |
| Exposition cutanée à partir d’une lotion pour le corps (30 %) [toutes les sous-populations] | 40,5 (adultes) à 95,2 (nourrissons) | 2 (nourrissons) à 5 (adultes) |
| Exposition cutanée à partir d’une huile de massage (3 %) [toutes les sous-populations] | 1,30 (adultes) à 8,57 (nourrissons) | 23 (nourrissons) à 154 (adultes) |
| Exposition cutanée à partir d’un hydratant pour le visage (3 %) [personnes de 14 à 18 ans; adultes] | 7,26 × 10-1 (personnes de 14 à 18 ans) à 1,22 (adultes) | 164 (adultes) à 276 (personnes de 14 à 18 ans) |
| Exposition cutanée à partir d’une huile essentielle utilisée comme parfum pour le corps (100 %) [personnes de 14 à 18 ans; bébés de 2 à 3 ans] | 7,45 (personnes de 14 à 18 ans) à 22 (bébés de 2 à 3 ans) | 9 (bébés de 2 à 3 ans) à 27 (personnes de 14 à 18 ans) |
| Exposition cutanée à partir d’un shampooing (10 %) [toutes les sous-populations] | 1,75 × 10-1 (adultes) à 6,19 × 10-1 (nourrissons de 0 à 5 mois) | 323 (nourrissons de 0 à 5 mois) à 1140 (adultes) |
| Exposition cutanée à partir d’un traitement contre l’acné (système de nettoyage facial) [2 %] (personnes de 9 à 13 ans; adultes) | 7,39 × 10-1 (personnes de 9 à 13 ans) à 1,23 (adultes) | 163 (adultes) à 271 (personnes de 9 à 13 ans) |
| Exposition cutanée à partir d’un écran solaire (0,04 %) [toutes les sous-populations] | 8,40 × 10-2 (personnes de 9 à 13 ans) à 3,80 × 10-1 (nourrissons de 6 à 11 mois) | 527 (nourrissons de 6 à 11 mois) à 2381 (personnes de 9 à 13 ans) |
| Exposition cutanée à partir du mélange, du chargement et de l’application d’un nettoyant tout usage pour le plancher (1 %) [adultes] | 5,00 × 10-2 (adultes) | 4000 (adultes) |
| Exposition cutanée à partir du contact avec des planchers nettoyés (1 %) [bébés de 1 à 2 ans] | 1,83 × 10-2 (bébés de 1 à 2 ans) | 10 900 (bébés de 1 à 2 ans) |
| Exposition systémique par voie orale non alimentaire à partir du contact avec des planchers nettoyés (1 %) [bébés de 1 à 2 ans] | 1,38 × 10-3 (bébés de 1 à 2 ans) | > 700 000 (bébés de 1 à 2 ans) |
| Exposition cutanée à partir du mélange, du chargement, du lavage et de la suspension de vêtements lavés à la main (5 %) [adultes] | 5,43 × 10-1 (adultes) | 369 (adultes) |
| Exposition systémique par inhalation à partir de produits d’aromathérapie (100 %) [toutes les sous-populations] | 2,24 × 10-1 (adultes) à 8,00 × 10-1 (bébés d’un an) | 1225 (bébés d’un an) à 4366 (adultes) |
a Les paramètres des scénarios d’exposition et les calculs pour l’essence de santal sont présentés à l’annexe D. Nous présumons une absorption cutanée de 100 %.
b Pour les scénarios d’exposition cutanée, la dose d’effet critique (200 mg/kg p.c./j) tirée d’une étude à court terme sur la toxicité cutanée est basée sur une réduction du gain de poids corporel, une réduction de l’efficacité alimentaire, la formation d’un érythème modéré transitoire et de squames diffuses chez certaines femelles, une réduction du poids absolu du foie chez les femelles et une hausse du poids relatif des testicules chez les mâles (Bhatia et coll. 2008b). Pour les scénarios d’exposition par inhalation et par voie orale, la dose d’effet critique (980 mg/kg p.c./j) tirée de deux études par voie orale sur la toxicité pour le développement est basée sur une légère sédation, une ataxie, une réduction de la consommation alimentaire et du gain de poids corporel chez les femelles ainsi qu’une importante réduction du nombre de fœtus et une hausse du taux de résorption fœtale (Bhatia et coll. 2008b).
Nous considérons que les marges d’exposition entre la dose d’effet critique et l’estimation d’exposition quotidienne à l’essence de santal à partir d’une lotion pour le corps, d’une huile de massage (nourrissons et enfants jusqu’à 8 ans) et de l’utilisation de l’huile essentielle comme parfum pour le corps sont potentiellement inadéquates pour compenser les incertitudes sur les effets sur la santé et les données d’exposition.
Pour tous les autres scénarios, les marges d’exposition entre la dose d’effet critique et l’estimation d’exposition variaient entre 154 et 10 667 et sont jugées adéquates pour compenser les incertitudes sur les effets sur la santé et sur les données d’exposition.
7.2.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Incidence |
|---|---|
| Danger | N/A |
| Il n’existe aucune étude réalisée sur des animaux couvrant toutes les voies d’exposition et portant sur la toxicité chronique, la toxicité pour la reproduction et le développement, la génotoxicité ou la cancérogénicité de l’essence de santal et de ses principaux composants (alpha-santalol et bêta-santalol). | +/- |
| En l’absence de données sur les dangers associés à l’essence de santal et à ses principaux composants (alpha-santalol et le bêta-santalol), on a utilisé l’analogue de lecture croisée, le bisabolol, pour éclairer la caractérisation des risques. | +/- |
+ = incertitude quant au potentiel de surestimation de l’exposition ou du risque; - = incertitude quant au potentiel de sous-estimation de l’exposition ou du risque; +/- = potentiel inconnu de surestimation ou de sous-estimation du risque.
7.5 Guaiazulène
7.5.1 Évaluation de l’exposition au guaiazulène
Milieux environnementaux
Puisque l’on n’a pas signalé au Canada l’importation ou la fabrication de guaiazulène en quantité supérieure à 100 kg et étant donné les faibles quantités de guaiazulène dont l’utilisation est déclarée (Environnement Canada 2013), il ne devrait y avoir aucune exposition à cette substance dans les milieux environnementaux, notamment dans l’eau potable.
Au Nunavik, on a prélevé des échantillons d’air dans 54 maisons durant l’hiver (de janvier à avril 2018). Aucun des échantillons analysés ne contenait de guaiazulène. La limite de quantification du guaiazulène était de 1,5 ng.
Produits offerts aux consommateurs
Le guaiazulène est présent dans des produits offerts aux consommateurs. L’exposition au guaiazulène résultant de l’utilisation d’une lotion pour le corps, d’un hydratant pour le visage, d’un produit capillaire pour permanente ou lissant ou d’un après-rasage était considérée comme un scénario sentinelle pour les applications sur la peau. Les données sur le guaiazulène sont résumées à l’annexe F (tableau F-1 à F-5).
Les expositions quotidiennes les plus élevées au guaiazulène devraient survenir en raison de l’utilisation d’une lotion pour le corps (concentration maximale de 0,1 %), d’un hydratant pour le visage (concentration maximale de 0,3 %), d’un revitalisant (concentration maximale de 1 %), d’un produit capillaire pour permanente ou lissant (concentration maximale de 1 %) ou d’un après-rasage (concentration maximale de 1 %). (Communication personnelle, échange de courriels entre la Direction de la sécurité des produits de consommation de Santé Canada et le Bureau d’évaluation des risques des substances existantes de Santé Canada, octobre 2019; non référencé.)
La voie cutanée devrait être le principal mode d’exposition, mais nous avons aussi quantifié l’exposition par inhalation, car le guaiazulène est volatil.
Les estimations d’exposition par les produits offerts aux consommateurs sont résumées dans le tableau 7-9.
| Scénario | Pourcentage de concentration dans le produit | Exposition cutanée (mg/kg p.c./j)a | Exposition par inhalation (mg/m3)a |
|---|---|---|---|
| Lotion pour le corps | 0,1 % | 1,35 × 10-1 (adultes) – 3,17 × 10-1 (bébés de 0 à 5 mois) | 3,70 × 10-2 (adultes) – 6,80 × 10-3 (bébés de 0 à 5 mois) |
| Hydratant pour le visage | 0,3 % | 1,22 × 10-1 (adultes) – 7,86 × 10-2 (enfants de 9 à 13 ans) | 2,70 × 10-2 (enfants de 9 à 13 ans) – 4,30 × 10-2 (adultes) |
| Revitalisant | 1 % | 1,95 × 10-2 (adultes) – 3,47 × 10-2 (enfants de 2 à 3 ans) | 1,10 × 10-2 (enfants de 2 à 3 ans) – 4,10 × 10-2 (adultes) |
| Produit capillaire lissant ou pour permanente | 1 % | 2,16 (adultes) – 5,74 (enfants de 4 à 8 ans) | 7,50 × 10-2 (enfants de 4 à 8 ans) – 1,40 × 10-1 (adultes) |
| Lotion après-rasage | 1 % | 3,24 × 10-1 (adultes) – 5,48 × 10-1 (enfants de 9 à 13 ans) | 7,70 × 10-3 (enfants de 9 à 13 ans) – 1,20 × 10-2 (adultes) |
a Les détails des calculs figurent à l’annexe F.
7.5.2 Évaluation des effets du guaiazulène sur la santé
La seule étude des effets du guaiazulène sur la santé a mis en évidence une activité cytotoxique et antiproliférative, mais aucun effet génotoxique sur des cellules neuronales saines de rats (Togar et coll. 2014).
En l’absence d’effet du guaiazulène sur la santé, nous avons suivi une approche par lecture croisée et utilisé les données sur les dangers d’une substance analogue, le naphtalène, pour éclairer l’évaluation des risques.
Le guaiazulène est un dérivé alkylé de l’azulène, sa couleur bleu intense est presque identique à celle de l’azulène. Ces deux composés organiques ont des structures très proches (CIR 1999). L’azulène est un composé organique et un isomère du naphtalène (CIR 1999). En déplaçant une liaison du cycle cycloheptatriène au cycle cyclopentadiène à très haute température, ce qui est possible par un procédé à haute température, l’azulène se réarrange naturellement pour former du naphtalène, qui consiste en deux cycles de benzène fusionnés (CIR 1999). Le naphtalène et le guaiazulène présentent des structures similaires à 87,1 % selon la boîte à outils QSAR de l’OCDE (2019). Tous ces composés ont des propriétés physicochimiques et des profils de toxicologie mécanistique comparables et ont tendance à former quelques métabolites communs (simulateur métabolique sur la fraction S9 du foie de rat) ayant des caractéristiques structurelles associées à un potentiel de les rendre toxiques pour le développement et la reproduction. Le guaiazulène et le naphtalène appartiennent à la classe III de la classification de Cramer. Les substances de cette classe sont définies comme ayant des structures chimiques qui permettent de les considérer comme non sûres de prime abord et qui indiquent une toxicité élevée.
EC et SC ont conclu que le naphtalène n’était ni génotoxique ni cancérigène et ont trouvé que leurs DSENO et DMENO étaient identiques (EC et SC 2008; USEPA 2008).
Pour l’exposition par voie orale, une DSENO de 100 mg/kg p.c./j a été déterminée à partir de l’observation de baisses de poids ou de diminution de gain de poids corporel à une dose de 200 mg/kg p.c./j (DMENO) lors d’une étude de 13 semaines menée chez le rat (EC et SC 2008; USEPA 2008). Dans cette étude, 10 mâles et 10 femelles rats ont reçu du naphtalène par gavage à des doses de 0, 25, 50, 100, 200 ou 400 mg/kg. Des baisses du gain de poids corporel dépassant 10 %, sans modification de l’apport alimentaire chez les mâles et les femelles ayant reçu 200 ou 400 mg/kg p.c./j, et des lésions sur les reins des mâles exposés et les thymus des femelles exposées ont été observées.
Pour l’exposition par voie cutanée, une DSENO de 300 mg/kg p.c./j a été déterminée à partir des données d’une étude de toxicité par voie cutanée de 90 jours chez le rat, au cours de laquelle des effets ont été constatés seulement à la dose maximale testée de 1000 mg/kg p.c./j (EC et SC 2008; USEPA 2008). Ces effets étaient notamment une peau et des papules excoriées chez les deux sexes et une atrophie des tubules séminifères chez les mâles (SC 2008; USEPA 2008). D’autres effets ont été observés, en particulier des lésions non néoplasiques dans le ganglion cervical (hyperplasie), le foie (hémosidérose), la thyroïde (kystes du tractus thyréoglosse), les reins (pyélonéphrite), la vessie (hyperplasie) et la peau (acanthose et hyperkératose) chez les femelles. Vu que les effets n’ont été observés qu’à la dose limite, l’EPA des États-Unis a conclu que la toxicité par voie cutanée n’était probablement pas préoccupante (EC et SC 2008; USEPA 2008).
Dans une étude de 13 semaines de l’EPA des États-Unis portant sur tout l’organisme des rats, on a trouvé une CMEO de 10 mg/m3 pour l’exposition par inhalation, à partir de l’observation le l’augmentation de la prévalence et de la gravité des lésions nasales (dégénérescence, atrophie et hyperplasie des cellules basales de l’épithélium olfactif; formation de rosettes dans l’épithélium olfactif; perte des glandes de Bowman; hypertrophie de l’épithélium respiratoire) (EC et SC 2008; USEPA 2008).
Environnement Canada et Santé Canada ont publié en 2008 une évaluation préalable visant le naphtalène qui concluait que cette substance pouvait présenter un risque pour la santé humaine (EC et SC 2008). L’EPA des États-Unis a classé le naphtalène dans le groupe C (« cancérogène possible pour l’humain ») en se fondant sur des données inadéquates pour la cancérogénicité chez l’humain et des preuves limitées de la cancérogénicité chez l’humain après exposition d’animaux de laboratoire par voie orale et par inhalation (USEPA 2008). Le Centre international de recherche sur le cancer (CIRC) a classé le naphtalène comme « possiblement cancérogène pour les humains » (groupe 2B), en se basant sur des « données inadéquates chez les humains » et des « données probantes suffisantes chez les animaux de laboratoire » concernant la cancérogénicité (CIRC 2002). En outre, il a été considéré que le risque de cancérogénicité par inhalation était inférieur au risque de toxicité pour le naphtalène en raison du manque de fiabilité des données prouvant qu’il pouvait être cancérigène pour les humains (tumeurs bénignes des voies respiratoires observées chez les rongeurs à la dose maximale de 157 mg/m3 en comparaison de lésions nasales observées constatées à la CMEO de 10 mg/m3, selon EC et SC 2008).
(Dodd et coll. 2012) ont réalisé une étude de 90 jours sur l’inhalation de vapeur de naphtalène (6 h/j et 5 j/sem) à des doses de 0, 0,1, 1, 10 et 30 ppm (respectivement 0, 0,52, 5,2, 52 et 156 mg/m3) chez des rats Fisher 344 (10/groupe/sexe) en suivant les directives de l’EPA des États-Unis, suivi d’une période de récupération de 4 semaines pour les rats exposés à 10 ppm 2012. Les concentrations d’exposition au naphtalène ont été mesurées par spectrométrie de masse couplée à la chromatographie en phase gazeuse et des essais sur les aérosols ont permis de vérifier l’absence de particule solide. Une baisse du poids corporel et de la consommation de nourriture et d’eau n’a été observée que pour les rats exposés 30 ppm de naphtalène. Les poids moyens absolus de la rate, du testicule gauche et de la région thymique chez les rats mâles exposés à 10 ou 30 ppm étaient très inférieurs aux valeurs moyennes du groupe témoin, mais aucune différence n’a été observée pour les poids relatifs des organes. Chez les rats femelles, les poids moyens absolus du cœur, du foie et de la région thymique étaient statistiquement très inférieurs pour tous les groupes, mais l’amplitude des diminutions ne dépendait pas de la concentration. Par rapport au poids corporel, ils étaient similaires aux valeurs du groupe témoin. Toutes les différences significatives d’un point de vue statistique entre les valeurs du poids des organes (absolues ou par rapport au poids corporel ou au cerveau) observées immédiatement après une exposition de 90 jours à 10 ppm ont diminué en amplitude. Ces valeurs n’étaient plus statistiquement très différentes des valeurs des témoins après une période de récupération de 4 semaines. Une hyperplasie légère et une métaplasie pavimenteuse ont été observées dans l’épithélium respiratoire de rats exposés à 10 ou 30 ppm. Des lésions de l’épithélium olfactif ont été constatées seulement chez les rates des groupes exposés à 10 ou 30 ppm et consistaient en des dégénérescences, des nécroses, des zones de réépithélialisation et une hyperplasie des cellules basales. Une dégénérescence de l’épithélium olfactif et une hyperplasie des cellules basales étaient toujours latentes après la période de récupération de 4 semaines à 10 ppm. Aucun effet lié au naphtalène n’a été observé à 0,1 ppm ou 1 ppm. Une CSENO de 5,2 mg/m3 (1 ppm) a été déterminée à partir de l’observation d’une atrophie ou désorganisation de l’épithélium olfactif et d’une hyperplasie de l’épithélium respiratoire et de transition à 52 mg/m3 (10 ppm) par les auteurs de l’étude (Dodd et coll. 2012; dossier d’inscription de l’ECHA 2019a).
Bien que le mécanisme ne soit pas encore complètement élucidé, EC et SC (2008), et l’EPA des États-Unis (2008) ont indiqué que l’on avait proposé des mécanismes non génotoxiques pour expliquer la possible cancérogénicité du naphtalène. EC et SC (2008) ont mentionné que l’effet cancérigène n’avait été observé que chez des souris exposées à une dose pouvant atteindre 157 mg/m3 et chez des rats exposés à 314 mg/m3 pendant 2 ans dans une étude sur la toxicité par inhalation menée dans le cadre du National Toxicology Program (NTP). Aucune différence d’effet néoplasique n’a été observée entre les groupes de contrôle et la dose minimale de 52 mg/m3 chez les souris et les rats (EC et SC 2008). Pour l’exposition par inhalation, la CMEO était égale à 10 mg/m3 (Dodd et coll. 2012), soit une dose très inférieure à celle à laquelle les effets cancérigènes ont été observés.
7.5.3 Caractérisation des risques pour la santé humaine
L’exposition de la population générale au guaiazulène peut résulter de l’utilisation de produits offerts aux consommateurs (des lotions, des crèmes dépilatoires, des revitalisants et des après-rasages). On prévoit que le mode d’exposition prédominant sera la voie cutanée et possiblement l’inhalation.
Nous avons choisi une DSENO de 300 mg/kg p.c. pour l’exposition par voie cutanée (EC et SC 2008; USEPA 2008).,
Pour l’exposition par inhalation, une CSENO de 5,2 mg/m3 a été déterminée à partir de l’observation d’une augmentation de la prévalence et de la gravité des lésions nasales (dégénérescence, atrophie et hyperplasie des cellules basales de l’épithélium olfactif; formation de rosettes dans l’épithélium olfactif; perte des glandes de Bowman; hypertrophie de l’épithélium respiratoire) à une concentration de 10 mg/m3 (Dodd et coll. 2012). Comme les effets toxiques du guaiazulène ont été observés dans les voies respiratoires, il a été jugé pertinent de comparer directement les concentrations maximales dans l’air issues du scénario d’exposition à la CSENO de 5,2 mg/m3. La CSENO non cancérigène de 5,2 mg/m3 de naphtalène ayant servi à caractériser le risque associé au guaiazulène est considérée comme très prudente. Il n’est donc pas nécessaire de caractériser la possible cancérogénicité du guaiazulène.
Le tableau 7‑10 fournit les estimations des expositions pertinentes au guaiazulène et les ME qui en découlent.
| Scénario d’exposition a | Exposition | ME b |
|---|---|---|
| Exposition par voie cutanée due à l’utilisation de lotion pour le corps (0,1 %) (toutes les sous-populations) | 1,35 × 10-1 (adultes) – 3,17 × 10-1 mg/kg p.c./j (bébés de 0 à 5 mois) | 950 (bébés de 0 à 5 mois) – 2220 (adultes) |
| Exposition par inhalation due à l’utilisation de lotion pour le corps (0,1 %) (toutes les sous-populations) | 6,80 × 10⁻3 (bébés de 0 à 5 mois) – 3,70 × 10⁻2 (adultes) mg/m3 | 141 (adultes) – 765 (bébés de 0 à 5 mois) |
| Exposition par voie cutanée due à l’utilisation d’hydratant pour le visage (0,3 %) (enfants de 9 à 13 ans; adultes) | 7,26 × 10-2 (jeunes de 14 à 18 ans) – 1,22 × 10-1 (adultes) mg/kg p.c./j | 2467 (adultes) – 4133 (jeunes de 14 à 18 ans) |
| Exposition par inhalation due à l’utilisation d’hydratant pour le visage (0,3 %) (enfants de 9 à 13 ans; adultes) | 2,70 × 10-2 (enfants de 9 à 13 ans) – 4,30 × 10-2 (adultes) mg/m3 | 121 (adultes) – 193 (enfants de 9 à 13 ans) |
| Exposition par voie cutanée due à l’utilisation de revitalisant (1 %) (enfants de 2 à 3 ans; adultes) | 1,95 × 10-2 (adultes) – 3,47 × 10-2 (enfants de 2 à 3 ans) mg/kg p.c./j | 8654 (enfants de 2 à 3 ans) – 15 406 (adultes) |
| Exposition par inhalation due à l’utilisation de revitalisant (1 %) | 1,10 × 10-2 (enfants de 2 à 3 ans) – 4,10 × 10-2 (adultes) mg/m3 | 127 (adultes) – 473 (enfants de 2 à 3 ans) |
| Exposition par voie cutanée due à l’utilisation d’un produit capillaire pour permanente ou lissant (1 %) (enfants de 4 à 8 ans; adultes) | 2,16 (adultes) – 5,74 (enfants de 4 à 8 ans) mg/kg p.c./j | 52 (enfants de 4 à 8 ans) – 139 (adultes) |
| Exposition par inhalation due à l’utilisation d’un produit capillaire pour permanente ou lissant (1 %) | 7,50 × 10-2 (enfants de 4 à 8 ans) – 1,40 × 10-1 (adultes) mg/m3 | 37 (adultes) – 69 (enfants de 4 à 8 ans) |
| Exposition par voie cutanée due à l’utilisation d’un après-rasage (1 %) (enfants de 9 à 13 ans; adultes) | 3,24 × 10-1 (adultes) – 5,48 × 10-1 (enfants de 9 à 13 ans) | 548 (enfants de 9 à 13 ans) – 925 (adultes) |
| Exposition par inhalation due à l’utilisation d’un après-rasage (1 %) (enfants de 9 à 13 ans; adultes) | 7,70 × 10-3 (enfants de 9 à 13 ans) – 1,20 × 10-2 (adultes) | 433 (adultes) – 675 (enfants de 9 à 13 ans) |
a Les paramètres et calculs liés au scénario d’exposition au guaiazulène figurent à l’annexe F.
b Pour les scénarios d’exposition par voie cutanée, le niveau d’effet critique de 300 mg/kg p.c./j (DSENO) déterminé lors d’une étude de toxicité du naphtalène par voie cutanée se base sur l’observation d’une atrophie des tubules séminifères chez les mâles et de lésions non néoplasiques dans le ganglion cervical (hyperplasie), le foie (hémosidérose), la thyroïde (kystes du tractus thyréoglosse), les reins (pyélonéphrite), la vessie (hyperplasie) et la peau (acanthose et hyperkératose) chez les femelles. Pour les scénarios d’exposition par inhalation, le niveau d’effet critique de 5,2 mg/m3 (CSENO) déterminé lors d’une étude de neurotoxicité subchronique (au museau seulement) chez le rat se base sur l’observation d’une atrophie ou désorganisation de l’épithélium olfactif et une hyperplasie de l’épithélium respiratoire et de transition.
La ME entre le niveau d’effet critique et l’estimation de l’exposition quotidienne au guaiazulène par voie cutanée ou inhalation due à l’utilisation d’un produit capillaire pour permanente ou lissant est considérée comme possiblement inadéquate pour compenser les incertitudes des données sur les effets sur la santé et l’exposition.
Pour tous les autres scénarios, les ME entre le niveau d’effet critique et l’estimation d’exposition étaient comprises entre 121 et 4133 et sont considérées comme inadéquate, car elles ne compensent pas les incertitudes des données sur les effets sur la santé et l’exposition.
7.5.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Répercussions |
|---|---|
| Risques | N/A |
| Aucune donnée concernant les risques liés au guaiazulène n’est disponible. La lecture croisée des données de l’analogue, le naphtalène, a servi à réaliser l’évaluation des risques. | +/- |
8. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, le risque que les substances du groupe des sesquiterpènes monocycliques et bicycliques puissent avoir des effets nocifs sur l’environnement est faible. Il est proposé de conclure que les 16 substances du groupe des sesquiterpènes monocycliques et bicycliques ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le bisabolène, le copaïba, les essences de gingembre, l’alpha-bisabolène, le sandalore, le santol-penténol, le bêta-caryophyllène, le guaiène, l’alpha-guaiène, le valencène, le guaiol, l’élémol et le bulnésol ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaines.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que les terpènes et terpénoïdes de l’essence de clou de girofle, l’essence de santal et le guaiazulène satisfont aux critères énoncés à l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que les terpènes et terpénoïdes de l’essence de clou de girofle, l’essence de santal et le guaiazulène satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE et que les 13 autres substances du groupe des sesquiterpènes monocycliques et bicycliques ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Il est également proposé de conclure que l’essence de clou de girofle et le guaiazulène répondent aux critères de persistance et de bioaccumulation et que l’essence de santal ne répond pas aux critères de persistance ou de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
[21CFR172.510] Code of Federal Regulations, « Title 21 – Food and Drugs, Part 172 Food Additives Permitted for Direct Addition to Food for Human Consumption, Section 172.510 Synthetic flavoring substances and adjuvants ». Révisé le 1er avril 2019 (disponible en anglais seulement).
[21CFR172.515] Code of Federal Regulations, « Title 21 – Food and Drugs, Part 172 Food Additives Permitted for Direct Addition to Food for Human Consumption, Section 172.515 Synthetic flavoring substances and adjuvants ». Révisé le 1er avril 2019 (disponible en anglais seulement).
[ACI] American Cleaning Institute [base de données]. 2017. Washington (E.-U.) : ACI [consulté en décembre 2017] (disponible en anglais seulement).
[ACI] American Cleaning Institute [base de données]. 2018. Washington (E.-U.): ACI [consulté en décembre 2018] (disponible en anglais seulement).
[AFSSAPS] Agence française de sécurité sanitaire des produits de santé. 2008. Recommandations relatives aux critères de qualité des huiles essentielles : contribution pour l’évaluation de la sécurité des produits cosmétiques contenant des huiles essentielles [PDF]. Saint-Denis : AFSSAPS (éditeur), collection Recommandations, 17 p., FRA.
Almeida MR, D’Arc Castania Darin J, Hernandes LC, Freiman de Souza Ramos M, Greggi Antunes LM et de Freitas O. 2012. !Genotoxicity assessment of copaiba oil and its fractions in Swiss mice ». Genet Mol Biol. 35(3):664-672 (disponible en anglais seulement).
Andersen FA 1999. « Final report on the safety assessment of azulene ». Int J Toxicol. 18(3 suppl):27-3. (Disponible en anglais seulement).
Api AM, Belsito D, Bhatia S, Botelho D, Browne D, Bruze M, Burton Jr GA, Buschmann J, Calow P, Dagli ML, et coll. 2016. « RIFM fragrance ingredient safety assessment, elemol, CAS Registry Number 639-99-6 ». Food Chem Toxicol. 110:S16-S21 (disponible en anglais seulement).
[ARLA] Agence de règlementation de la lutte antiparasitaire. 2010. Décision de réévaluation : Naphthalène, Ottawa (Ontario), gouvernement du Canada.
Arctander S. 1960. Perfume and flavour material of natural origin. Elizabeth (NJ) (disponible en anglais seulement).
[BDIPSN] Base de données sur les ingrédients de produits de santé naturels. [Modifié le 26 septembre 2019]. Ottawa (Ontario), gouvernement du Canada. [Consulté en octobre 2019].
[BDPSNH] Base de données des produits de santé naturels homologués. [Modifié le 6 février 2018]. Ottawa (Ontario), gouvernement du Canada. [Consulté en avril 2019].
Belsito D, Bickers D, Bruze M, Calow P, Greim P, Hanifin JM, Rogers AE, Saurat JH, Sipes IG et Tagami H. 2008. « A toxicologic and dermatologic assessment of cyclic and non-cyclic terpene alcohols when used as fragrance ingredients ». Food Chem Toxicol. 46:S1-S71 (disponible en anglais seulement).
Bhatia SP, Letizia CS et Api AM. 2008a. « Fragrance material review on alpha-terpineol ». Food Chem Toxicol. 46:S280-S285 (disponible en anglais seulement).
Bhatia SP, McGinty D, Letizia CS et Api AM. 2008b. « Fragrance material review on alpha-bisabolol ». Food Chem Toxicol. 46:S72-S76 (disponible en anglais seulement).
Biapa Nya PC, Kuiate JR, Wankeu M et Ntiokam D. 2010. « Acute and subacute toxicity studies of Zingiber officinale Roscoe essential oil on mice (Swiss) and rats (Wistar) ». Afr J Pharm Pharmacol. 1:39-49 (disponible en anglais seulement).
Bledsoe JO. 2000. « Terpenoids ». Dans : Kirk‐Othmer, éditeur. Encyclopedia of Chemical Technology. 5e éd. Hoboken (NJ): Wiley (disponible en anglais seulement).
Brand JE, Fox JED, Pronk G et Cornwell C. 2007. « Comparison of oil concentration and oil quality from Santalum spicatum and S. album plantations, 8–25 years old, with those from mature S. spicatum natural stands ». Aust For. 70(4):235-41 (disponible en anglais seulement).
Burdock GA et Carabin IG. 2008. « Safety assessment of sandalwood oil (Santalum album L.) ». Food Chem Toxicol. 46:421-432 (disponible en anglais seulement).
Burdock GA. 2010. Fenaroli’s handbook of flavor ingredients. 6e éd. Boca Raton (FL): CRC Press (disponible en anglais seulement).
Canada, ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF]. Gazette du Canada, Partie 1, vol. 146, no 48, Supplément.
Canada. [1978]. Règlement sur les aliments et drogues. C.R.C., ch. 870.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch.33. Gazette du Canada, Partie III, vol. 22, no 3.
Caputi L, Aprea E. 2011. Use of terpenoids as natural flavouring compounds in food industry. Recent Pat Food Nutr Agric. 3:9-16 (disponible en anglais seulement).
Chaabra SK, Rao AR. 1993. Postnatal modulation of xenobiotic metabolizing enzymes in liver of mouse pups following transactional exposure to sandalwood oil. Nutr Res. 13,1191–1202 (disponible en anglais seulement).
ChemCAN [level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (Ontario): Trent University, Canadian Centre for Environmental Modelling and Chemistry (disponible en anglais seulement).
[CIR] Cosmetic Ingredient Review. 1999. Final report on the safety assessment of azulene. Int J of Toxicol. 18(suppl.3):27-32 (disponible en anglais seulement).
[CIR] Cosmetic Ingredient Review. 2017. Bisabolol. Int J Toxicol. 36:24S-25S (disponible en anglais seulement).
[COSING] European Commission Database for Information on Cosmetic Substances and Ingredients. 2018. European Cosmetic ingredient inventory [database]. Bruxelles (BE) : European Commission Cosmetics Directive [consulté en décembre 2018] (disponible en anglais seulement).
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1983. Summary for the results of surveys of the amount and frequency of use of cosmetic products by women. Technical report. Washington (E.-U.): CTFA (disponible en anglais seulement).
Da Silva Oliveira GL, Conceiçao Machado K, Conceiçao Machado K, Paula dos Santos C.L. da Silva A, Mendes Feitosa C, de Castro Almeida FR. 2018. Non-clinical toxicity of β-caryophyllene, a dietary cannabinoid: Absence of adverse effects in female Swiss mice. Regul Toxicol Pharmacol. 92:338-346 (disponible en anglais seulement).
DeSesso JM, Scialli AR. 2018. Bone development in laboratory mammals used in developmental toxicity studies. Birth Defects Res. 110:1157-1187 (disponible en anglais seulement).
Di Sotto A, Mazzanti G, Carbone G, Hreila P, Maffei F. 2010. Inhibition by β-caryophyllene of ethyl methanesulfonate-induced clastogenicity in cultured human lymphocytes. Mutat Res. 699:23-28 (disponible en anglais seulement).
Dodd DE, Wong BA, Gross EA, Miller RA. 2012. Nasal epithelial lesions in F344 rats following a 90-day inhalation exposure to naphthalene. Inhal Toxicol 24:70-79 (disponible en anglais seulement).
Dolejš L, Mironov A, Šorm F. 1960. Structure of bulnesol stereochemistry of guaiol, nepetalinic acids and iridomyrmecins. Tetrahedron Letters 1(132):18-21 (disponible en anglais seulement).
[EC et SC] Environnement Canada, Santé Canada. 2008. Rapport d’évaluation préalable pour le Défi : Naphtalène - Numéro de registre du Chemical Abstracts Service 91-20-3, Ottawa (Ontario), Canada, gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2014. Approche d’identification des substances chimiques et des polymères jugés prioritaires pour l’évaluation des risques en vertu de la Partie 5 de la Loi canadienne sur la protection de l’environnement de 1999 [LCPE (1999)], Ottawa (Ontario), Canada, gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2015. Identification des priorités d’évaluation des risques : résultats de l’examen de 2015, Ottawa (Ontario), Canada, gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [Modifié le 12 mars 2017]. Catégorisation de substances chimiques, Ottawa (Ontario), Canada, gouvernement du Canada. [Consulté en mars 2018].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018a. Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée [PDF], Ottawa (Ontario), Canada, gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018b. Évaluation préalable – Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT) [PDF], Ottawa (Ontario), Canada, gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018c. Évaluation préalable – 2-Méthoxy-4-(prop-2-ènyl)phénol (eugénol) et Rose, extrait de Rosa canina [PDF], Ottawa (Ontario), Canada, gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2020. Ébauche d’évaluation préalable - Terpènes et terpénoïdes - Groupe des monoterpènes acycliques, monocycliques et bicycliques, Ottawa (Ontario), Canada, gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques, Ottawa (Ontario), Canada, gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (Québec): ECCC. Information in support of the science approach document: ecological risk classification of organic substances. Accessible sur demande : substances@ec.gc.ca (disponible en anglais seulement).
[ECHA Registration dossier] Registration dossier of European Chemicals Agency. 2010. Registration dossier for sandalore. Helsinki (FI) : ECHA (disponible en anglais seulement).
[ECHA Registration dossier] Registration dossier of European Chemicals Agency. 2015. Registration dossier for santol pentenol. Helsinki (FI) : ECHA (disponible en anglais seulement).
[ECHA Registration dossier] Registration dossier of European Chemicals Agency. 2018. Registration dossier for linalool. Helsinki (FI) : ECHA (disponible en anglais seulement).
[ECHA Registration dossier] Registration dossier of European Chemicals Agency. 2019a. Registration dossier for naphthalene. Helsinki (FI) : ECHA (disponible en anglais seulement).
[ECHA Registration dossier] Registration dossier of European Chemicals Agency. 2019b. Registration dossier for terpineol. Helsinki (FI) : ECHA (disponible en anglais seulement).
[EFSA] Autorité européenne pour la sécurité alimentaire. 2008. Flavouring Group Evaluation 25, (FGE.25): Aliphatic and aromatic hydrocarbons from chemical group 31. Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food. EFSA Journal. 918:1-109 (disponible en anglais seulement).
[EFSA] Autorité européenne pour la sécurité alimentaire. 2011a. Consideration of aliphatic and alicyclic and aromatic hydrocarbons evaluated by JECFA (63rd meeting) structurally related to aliphatic and aromatic hydrocarbons evaluated by EFSA in FGE.25Rev2. EFSA Journal. 13:4067 (disponible en anglais seulement).
[EFSA] Autorité européenne pour la sécurité alimentaire. 2011b. Aliphatic and aromatic hydrocarbons from chemical group 31. EFSA Journal. 9:2177 (disponible en anglais seulement).
[EFSA] Autorité européenne pour la sécurité alimentaire. 2011c. Scientific Opinion on Flavouring Group Evaluation 18, Revision 2 (FGE.18Rev2): Aliphatic, alicyclic and aromatic saturated and unsaturated tertiary alcohols, aromatic tertiary alcohols and their esters from chemical groups 6 and 8. EFSA Journal. 9:1847 (disponible en anglais seulement).
[EFSA] Autorité européenne pour la sécurité alimentaire. 2015a. Consideration of aliphatic and alicyclic and aromatic hydrocarbons evaluated by JECFA (63rd meeting) structurally related to aliphatic and aromatic hydrocarbons evaluated by EFSA in FGE.25Rev2. EFSA Journal. 9:2178 (disponible en anglais seulement).
[EFSA] Autorité européenne pour la sécurité alimentaire. 2015b. Scientific Opinion on Flavouring Group Evaluation 78, Revision 2 (FGE.78Rev2): Consideration of aliphatic and alicyclic and aromatic hydrocarbons evaluated by JECFA (63rd meeting) structurally related to aliphatic and aromatic hydrocarbons evaluated by EFSA in FGE.25Rev2. EFSA Journal. 13:4067 (disponible en anglais seulement).
[EFSA] Autorité européenne pour la sécurité alimentaire. 2015c. Scientific Opinion on Flavouring Group Evaluation 18, revision 3 (FGE.18Rev3): Aliphatic, alicyclic and aromatic saturated and unsaturated tertiary alcohols, aromatic tertiary alcohols and their esters from chemical groups 6 and 8. EFSA Journal. 13(5):4118 (disponible en anglais seulement).
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS 2012 recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada et Santé Canada; Programme des substances existantes.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [estimation model]. c2000-2012. Ver. 4.11. Washington (E.-U.): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation (disponible en anglais seulement).
[FCC] Food Chemicals Codex. 2018. Food Chemicals Codex, 11e édition. Washington (E.-U.), DC National Academy Press (disponible en anglais seulement).
[FDS] Fiche de données de sécurité. 2015. Glade Wax Melts (Pumpkin Spice). Racine (WI), S.C. Johnson & Son. [Consulté le 1er mars 2018] (disponible en anglais seulement).
[FDT] Fiche de données techniques. 2018. Clove Terpenes. Barcelone (ES): Lluch Essence (disponible en anglais seulement).
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, et coll. 2016. Consumption of cosmetic products by the French population. Second part: Amount data. Food Chem Toxicol. 90:130-141 (disponible en anglais seulement).
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC. 2015. Consumption of cosmetic products by the French population. First part: Frequency data. Food Chem Toxicol. 78:159-169 (disponible en anglais seulement).
Florin I, Rutberg L, Curvall M, Enzell CR. 1980. Screening of tobacco smoke constituents for mutagenicity using the Ames’ test. Toxicology. 15(3):219-232 (disponible en anglais seulement).
Fotiades J, Soter NA, Lim HW. 1995. Results of evaluation of 203 patients for photosensitivity in a 7.3-year period. J Am Acad Dermatol. 33(4):597-602 (disponible en anglais seulement).
[FS] Fiche de spécification. 2009. Clove Terpenes 920 Indesso. Barcelone (Espagne) : Ventós (disponible en anglais seulement).
Furtado RA, de Oliveira PF, Senedese JM, Ozelin SD, Ribeirao de Souza LD, Leandro LF, de Oliveira WL, Mangabeira da Silva JJ, Oliveira LC, Rogez H, et coll. 2018. Assessment of genotoxic activity of oleoresins and leaves extracts of six Copaifera species for prediction of potential human risks. J Ethnopharmacol. 221:119-125 (disponible en anglais seulement).
Garcia-Hidalgo E, von Goetz N, Siegrist M, Hungerbühler K. 2017. Use-patterns of personal care and household cleaning products in Switzerland. Food Chem Toxicol. 99:24-39 (disponible en anglais seulement).
Gilpin S, Hui X, Maibach H. 2010. In vitro human skin penetration of geraniol and citronellol. Dermatitis 21:41-48 (disponible en anglais seulement).
GlaxoSmithKline Consumer Healthcare Inc. [modifié en 2017]. Foire aux questions Abreva, Mississauga (Ontario), GlaxoSmithKline Consumer Healthcare Inc. [Consulté le 4 septembre 2019].
Gomes-Carneiro MR, Felzenszwalb I, Paumgartten FJ. 1998. Mutagenicity testing of (±)-camphor, 1, 8-cineole, citral, citronellal,(−)-menthol and terpineol with the Salmonella/microsome assay. Mutat Res. 416(1-2):129-136 (disponible en anglais seulement).
Gomez-Berrada MP, Gautier F, Parent-Massin D, Ferret PJ. 2013. Retrospective exposure data for baby and children care products: An analysis of 48 clinical studies. Food Chem Toxicol. 57:185–194 (disponible en anglais seulement).
Gonçalves ES, Silva JR, Gomes CL, Nery MBL, Navarro DMAF, Santos GKN, Silva-Neto JC, Costa-Silva JH, Araùjo AV et Wanderley AG. 2014. « Effects of the oral treatment with Copaifera multijuga oil on reproductive performance of male Wistar rats ». Revista Brasileira de Farmacognosia. 24:355-62 (disponible en anglais seulement).
Guengerish PF. 2008. « Cytochrome P450 and Chemical Toxicology ». Chem Res Toxicol. 21:70-83 (disponible en anglais seulement).
Hall RL et Oser BL. 1965. « Recent progress in the consideration of flavoring ingredients under the Food Additives Amendment. III. GRAS (generally recognized as safe) substances ». Food Technol. 19:151-197 (disponible en anglais seulement).
Heck JD, Vollmuth TA, Cifone MA, Jagannath DR, Myhr B et Curren RD. 1989. « An evaluation of food flavoring ingredients in a genetic toxicity screening battery ». Toxicologist. 9:257-272 (disponible en anglais seulement).
Husnu Can Baser K, Buchbauer G. 2010. Handbook of essential oils. Science, technology, and applications. 1re éd. Londres (R.-U.): CRC Press and Taylor & Francis Group (disponible en anglais seulement).
[ICIRC] Centre international de recherche sur le cancer. 2002. IARC monographs on the evaluation of carcinogenic risks to human. Some traditional herbal medicines, some mycotoxins, naphthalene and styrene [PDF]. Volume 82. Lyon (France) : CIRC (disponible en anglais seulement).
[IFRA] International Fragrance Association. Volume of Use Survey 2017: Transparency List. 2017. Geneva (CH): International Fragrance Association. [Consulté en décembre 2018] (disponible en anglais seulement).
Imaizumi K, Hanada K, Mawatari K et Sugano M. 1985. « Effect of essential oils on the concentration of serum lipids and apolipoproteins in rats ». Agri Biol Chem. 49:2795-2796 (disponible en anglais seulement).
[IOFI] International Organization of the Flavour Industry 1995. European Inquiry on Volume of Use. Soumis à l’OMS par la Flavor and Extract Manufacturers’ Association of the United States, Washington (E.-U.). États-Unis (disponible en anglais seulement).
Isman MB. 2000. « Plant essential oils for pest and disease management ». J Crop Protec. 19:603-608 (disponible en anglais seulement).
Jeena K, Liju VB et Kuttan R. 2011. « A preliminary 13-week oral toxicity study of ginger oil in male and female Wistar rats ». Int J Toxicol. 30:662-670 (disponible en anglais seulement).
Jeena K, Liju VB et Kuttan R. 2014. « Antimutagenic potential and modulation of carcinogen-metabolizing enzymes by ginger essential oil ». Phytother Res. 28:849-855 (disponible en anglais seulement).
Jirovetz L, Buchbauer G, Stoilova I, Stoyanova A, Krastanov A et Schmidt E. 2006. « Chemical composition and antioxidant properties of clove leaf essential oil ». J Agric Food Chem 23: 6303-7 (disponible en anglais seulement).
Kourounakis AP, Rekka EA et Kourounakis PN. 1997. « Antioxidant activity of guaiazulene and protection against paracetamol hepatotoxicity in rats ». J Pharm Pharmacol. 49:938-942 (disponible en anglais seulement).
Lima CS, de Medeiros BJL, Favacho HAS, dos Santo KC, de Oliveira BR, Taglialegna JC, da Costa EVM, de Campos KJ et Carvalho JCT. 2011. « Pre-clinic validation of vaginal cream containing copaiba oil (reproductive toxicology study) ». Phytomedecine. 18(12):1013-23 (disponible en anglais seulement).
Loretz L, Api AM, Barraj L, Burdick J, Davis DA, Dressler W, Gilberti E, Jarrett G, Mann S, Pan YHL et coll. 2006. « Exposure data for personal care products: Hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant ». Food Chem Toxicol. 44:2008-2018. (Disponible en anglais seulement).
Loretz LG, Api AM, Babcock L, Barraj LM, Burdick J, Cater KC, Jarrett G, Mann S, Pan YHL, Re TA et coll. 2008. « Exposure data for cosmetic products: Facial cleaner, hair conditioner, and eye shadow ». Food Chem Toxicol. 46(5):1516-1524 (disponible en anglais seulement).
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ et coll. 2005. « Exposure data for cosmetic products: lipstick, body lotion, and face cream ». Food Chem Toxicol. 43:279-291 (disponible en anglais seulement).
Lorillard Tobacco Company. 1982. Mutagenicity evaluation of alpha-terpineol in the mouse lymphoma mutation assay. Projet no 20989 du LBI. Rapport non publié déposé par l’EFFA au secrétariat du FLAVIS (disponible en anglais seulement).
Lorillard Tobacco Company. 1983. Mutagenicity evaluation of alpha-terpineol in the Ames Salmonella/microsome plate test. projet no 20988 du LBI. Rapport non publié déposé par l’EFFA au secrétariat du FLAVIS (disponible en anglais seulement).
Lucas CD, Putnam JM et Hallagan JB. 1999. 1995 Poundage and technical effects update survey. Washington (E.-U.): Flavor and Extract Manufacturers’ Association of the United States (disponible en anglais seulement).
Lucca LG, de Matos SP, Borille BT, Dias DDO, Teixeira HF, Veiga Jr VF, Limberger RP et Koester LS. 2015. « Determination of β-caryophyllene skin permeation/retention from crude copaiba oil (Copaifera multijuga Hayne) and respective oil-based nanoemulsion using a novel HS-GC/MS method ». J Pharma Biomed Anal. 104:144-148 (disponible en anglais seulement).
Madyastha KM et Srivatsan V. 1988. « Biotransformations of α-terpineol in the rat: its effects on the liver microsomal cytochrome P-450 system ». Bull Environ Contam Toxicol. 41:17-25 (disponible en anglais seulement).
May RL, Levenson C, So JJ et Rock JA. 2012. « Single-centre, open-label study of a proprietary topical 0.5% salicylic acid-based treatment regimen containing sandalwood oil in adolescents and adults with mild to moderate acne ». J Drugs Dermatol. 11(2):1403-1408 (disponible en anglais seulement).
Molina-Jasso D, Alvarez-Gonzalez I et Madrigal-Bujaidar E. 2009. « Clastogenicity of beta-caryophyllene in mouse ». Biol Pharm Bull. 32(3):520-522 (disponible en anglais seulement).
Mukhopadhyay MJ et Mukherjee A. 2000. « Clastogenic effect of ginger rhizome in mice ». Phytother Res. 14(7):555-557 (disponible en anglais seulement).
Nakayama H. 1998. « Fragrance hypersensitivity and its control ». Dans : Frosch PJ, Johansen JD et White IR, éditeurs. Fragrances: beneficial and adverse effects. Berlin (Allemagne) : Springer (disponible en anglais seulement).
[NAS] National Academy of Sciences. 1989. 1987 Poundage and technical effects update of substances added to food. Washington (É.U.): Committee on Food Additives Survey Data, Food and Nutrition Board, Institute of Medicine, National Academy of Sciences (disponible en anglais seulement).
Nijssen LM, Ingen-Visscher CA van et Donders JJH [éditeurs]. 1963-2018. VCF (Volatile Compounds in Food): database, version 16.6.1, 2018. Triskelion B.V. Zeist, Pays-Bas (disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques. 2009. Emission scenario document on coating industry (paints, lacquers and varnishes) [PDF]. Paris (FR), OCDE, Direction de l’environnement. (Series on Emission Scenario Documents no 22; Rapport no ENV/JM/MONO(2009)24, JT03267833). [Consulté le 1er mars 2018] (disponible en anglais seulement).
OECD QSAR Toolbox [Outil de lecture croisée]. 2014. Version 3.3. Paris (France), Organisation de coopération et de développement économiques, Laboratoire de chimie mathématique.
OECD QSAR Toolbox [Outil de lecture croisée]. 2016. Paris (France), Organisation de coopération et de développement économiques, Laboratoire de chimie mathématique.
OECD QSAR Toolbox [Outil de lecture croisée]. 2019. Version 4.2. Paris (France), Organisation de coopération et de développement économiques, Laboratoire de chimie mathématique.
[OMS] Comité mixte FAO/OMS d’experts des additifs alimentaires. 2002. Evaluation of certain food additives (#913). Fifty-ninth report of the Joint FAO/WHO Expert Committee on Food Additives [PDF]. Genève (CH), Organisation mondiale de la Santé (disponible en anglais seulement).
[OMS] Comité mixte FAO/OMS d’experts des additifs alimentaires. 2005. Evaluation of certain food additives and certain contaminants (series 54). Sixty-third meeting of the Joint FAO/WHO Expert Committee on Food Additives [PDF]. Genève (CH), Organisation mondiale de la Santé (disponible en anglais seulement).
[OMS] Comité mixte FAO/OMS d’experts des additifs alimentaires. 2011. Safety evaluation of certain food additives and contaminants (series 64). Seventy-third meeting of the Joint FAO/WHO Expert Committee on Food Additives [PDF]. Genève (CH), Organisation mondiale de la Santé (disponible en anglais seulement).
Onyenekwe PC et Hashimoto S. 1999. « The composition of the essential oil of dried Nigerian ginger (Zingiber officinale Roscoe) ». Eur Food Res Technol. 209(6):407-10 (disponible en anglais seulement).
Opdyke DLJ. 1974. « Fragrance raw materials monographs: Sandalwood oil, East Indian ». Food Chem Toxicol. 12:989-990 (disponible en anglais seulement).
Ortiz C, Morales L, Saster M, Haskins WE et Matta J. 2016. « Cytotoxicity and genotoxicity assessment of sandalwood essential oil in human breast cell lines MCF-7 and MCF-10A ». Evid Based Complement Alternat Med. 3696232 (disponible en anglais seulement).
Perveen S. 2018. « Introductory Chapter: Terpenes and Terpenoids ». Dans : IntechOpen. [Consulté le 18 décembre 2019] (disponible en anglais seulement).
Petrov P. 2019. « Guaiol ». Terpenes and Testing Magazine. [Consulté le 15 mars 2019] (disponible en anglais seulement).
Pino JA, Marbot R, Rosado A et Batista A. 2004. « Chemical composition of the essential oil of Zingiber officinale Roscoe L. from Cuba ». J Essent Oil Res. 16(3):186-88 (disponible en anglais seulement).
Rania VK, Kumar A et Aggarwal KK. 2005. « Essential oil composition of ginger (Zingiber officinale Roscoe) rhizomes from different places in India ». J Essent. 8(2):187-191 (disponible en anglais seulement).
[RIFM] Research Institute for fragrance Materials, Inc. 2017. « RIFM fragrance ingredient safety assessment, β-Guaiene, CAS Registry Number 88-84-6 ». Food Chem Toxicol. 110(Supplement 1):S9-S15 (disponible en anglais seulement).
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [institut national de santé publique et de l’environnement]. 2006. Cosmetics fact sheet: to assess the risks for the consumer: updated version for ConsExpo 4. Bilthoven (P.B.): RIVM. Rapport no 320104001/2006 (disponible en anglais seulement).
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [institut national de santé publique et de l’environnement]. 2014. General fact sheet: general default parameters for estimating consumer exposure–updated version 2014. Bilthoven (P.B.): RIVM. Rapport no 090013003/2014 (disponible en anglais seulement).
Sachetti CG, de Carvalho RR, Paumgartten FJR, Lameira OA et Caldas ED. 2011. « Developmental toxicity of copaiba tree (Copaifera reticulate Ducke, Fabaceae) oleoresin in rat ». Food Chem Toxicol. 49:1080-1085 (disponible en anglais seulement).
[SC] Santé Canada. [Modifié le 14 juillet 2020]. Règlementation des produits de vapotage, Ottawa (Ontario), gouvernement du Canada. [Consulté le 4 décembre 2020].
[SC] Santé Canada. 2013. Supporting documentation: summary tables of health effects information for methylenediphenyl diisocyanates and diamines. Ottawa (Ontario), Santé Canada. Information in support of the screening assessment for the MDI/MDA Substance Grouping. Disponible sur demande : substances@ec.gc.ca (disponible en anglais seulement).
[SC] Santé Canada. 2016. Document sur l’approche scientifique – Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances, Ottawa (Ontario), gouvernement du Canada.
[SC] Santé Canada. 2019. Canadian exposure factors used in human health risk assessment. Unpublished report. Ottawa (Ontario), gouvernement du Canada (disponible en anglais seulement).
Santiago KB, Conti BJ, Andrade BFMT, Da Silva JJM, Rogez HLG, Crevelin EJ, De Moraes LAB, Veneziani R, Ambrosio SR, Bastos JK, et coll. 2015. « Immunomodulatory action of Copaifera spp oleoresins on cytokine production by human monocytes ». Biomed Pharmacother. 70:12-18 (disponible en anglais seulement).
Schmitt D, Levy R et Carrol B. 2016. « Toxicological evaluation of β-caryophyllene oil: subchronic toxicity in rats ». Int J. Toxicol. 35(5):558-567 (disponible en anglais seulement).
[SCCS] Scientific Committee on Consumer Safety. 2010. Basic criteria for the in vitro assessment of dermal absorption of cosmetic ingredients adopted by the SCCS at its 7th plenary meeting of 22 June 2010 [PDF]. Bruxelles (B): Commission européenne, Health & Consumers (disponible en anglais seulement).
[SCCS] Scientific Committee on Consumer Safety. 2015. The SCCS’s Notes of Guidance for the Testing of Cosmetic Ingredients and their Safety Evaluation [PDF]. 9e révision. Commission européenne. Rapport no SCCS/1564/15, version révisée du 25 avril 2016. (Disponible en anglais seulement).
Sharma M, Levenson C, Bell RH, Anderson, SA, Hudson JB, Collins CC et Cox ME. 2014. « Suppression of Lipopolysaccharide‐stimulated Cytokine/Chemokine Production in Skin Cells by Sandalwood oil and Purified α‐santalol and β‐santalol ». Phytother Res. 28(6):925-932 (disponible en anglais seulement).
Statistique Canada. 2004. Enquête sur la santé dans les collectivités canadiennes (ESCC) – Cycle 2.2 : Nutrition. Fichier partagé. Ottawa (Ontario), gouvernement du Canada. Valeurs estimatives obtenues à l’aide de SAS 9.3 [GRID] jusqu’à SAS EG 5.1.
Statistique Canada. 2015. Enquête sur la santé dans les collectivités canadiennes (ESCC). Fichier partagé. Ottawa (Ontario), gouvernement du Canada. Valeurs estimatives obtenues à l’aide de SAS 9.3 [GRID] jusqu’à SAS EG 5.1.
Statistique Canada. 2017. Custom tabulation of grooming products data from the Canadian Health Measures Survey Cycle 2 (2010–2011). Préparé pour le Bureau d’évaluation des risques des substances existantes de Santé Canada par Statistique Canada; non publié. Ottawa (Ontario), gouvernement du Canada (disponible en anglais seulement).
Stoner GD, Shimkin MB, Kniazeff AJ, Weisburger JH, Weisburger EK et Gori GB. 1973. « Test for carcinogenicity of food additives and chemotherapeutic agents by the pulmonary tumor response in strain A mice ». Cancer Res. 33:3069-3085 (disponible en anglais seulement).
Swift KAD. 2005. Flavours and Fragrances. Cambridge (R.U.): Woodhead Publishing Limited (disponible en anglais seulement).
Tisserand R et Young R. 2014. Essential Oil Safety. 2e éd. London (R.U.): Churchill Livingstone (disponible en anglais seulement).
Togar B, Turkez H, Hacimuftuoglu A, Tatar A et Geyikoglu F. 2014. « Guaiazulene biochemical activity and cytotoxic and genotoxic effects on rat neuron and N2a neuroblastom cells ». J Intercult Ethnopharmacol. 4 : 29-33 (disponible en anglais seulement).
Ultra International B.V. 2018. Product: Clove terpenes. Spijkenisse (P.-B.): Ultra International B.V. [Consulté en décembre 2018] (disponible en anglais seulement).
[USFDA] US Food and Drug Administration. 2018. Substances Added to Food (formerly EAFUS). Silver Spring (MD): US FDA (disponible en anglais seulement).
[USEPA] United States Environmental Protection Agency. 2008. Naphthalene: Phase 4 amendment: Response to comments in reference to “naphthalene: HED Chapter for the registration eligibility document (RED)”. Washington (E.-U.): USEPA, Office of Research and Development (disponible en anglais seulement).
[USEPA] United States Environmental Protection Agency. 2011. Exposure Factors Handbook 2011 Edition (Final). Washington (E.-U.) : USEPA. EPA/600/R-09/052F (disponible en anglais seulement).
[USEPA] United States Environmental Protection Agency. 2012a. EPI Suite- Estimation Program Interface Suite for Microsoft Windows [modèle d’estimation]. C2000-2012. Version 4.11. Washington (E.-U.): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation (disponible en anglais seulement).
[USEPA] United States Environmental Protection Agency. 2019. The Chemistry Dashboard. LIST: Terpenes in vape. Research Triangle Park (NC): USEPA, Chemical Safety for Sustainability Research Program (disponible en anglais seulement).
Verghese J, Sunny TP et Balakrishnan V. 1990. « (+)-α-Santalol and (-)-β-Santalol (Z) Concentration, a New Quality Determinant of East Indian Sandalwood Oil ». Flavour Frag J. 5:223-226 (disponible en anglais seulement).
Wilson AS, Davis CD, Williams DP, Buckpitt AR, Pirmohamed M et Park BK. 1996. « Characterisation of the toxic metabolite(s) of naphthalene ». Toxicology. 114:233-242 (disponible en anglais seulement).
Won D, Yang W, So S et Aubin D. 2019. Investigation of Sources and Indoor Air Levels of CMP3 Chemicals. Phase 1 – Analysis of Indoor Air Samples from Two Field Studies. Rapport final. Ottawa (Ontario) : Conseil national de recherches du Canada. 53 p. rapport no A1-014282.1 (disponible en anglais seulement).
Wu X, Bennett DH, Ritz B, Cassady DL, Lee K et Hertz-Picciotto I. 2010. « Usage pattern of personal care products in California households ». Food Chem Toxicol. 48:3109-3119 (disponible en anglais seulement).
Xin-Hua Z, Teixeira da Silva JA, Yong-Xia J, Jian Y et Guo-Hua M. 2012. « Essential Oils Composition from Roots of Santalum album L ». J Essent. 15(1):1-6 (disponible en anglais seulement).
Annexes
Annexe A. Données croisées pour le sous-groupe 3, l’essence de santal et le guaiazulène
| Nom chimique | Guaiol | Bulnésol | Élémol | Alpha-terpinéol |
|---|---|---|---|---|
| Rôle | Objectif | Objectif | Objectif | Analogue |
| NR CAS | 489-86-1 | 22451-73-6 | 639-99-6 | 98-55-5 |
| Structure chimique | ![C[C@H]1CC[C@H](CC2=C1CC[C@@H]2C)C(C)(C)O](/content/dam/eccc/images/pded/terpenes-group-2/20210203-TableA-1-1.jpg) |
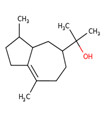 |
![CC(=C)[C@@H]1C[C@@H](CC[C@@]1(C)C=C)C(C)(C)O](/content/dam/eccc/images/pded/terpenes-group-2/20210203-TableA-1-3.jpg) |
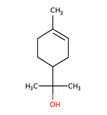 |
| Masse moléculaire (g/mol) | 222,37 | 222,37 | 222,37 | 154,25 |
| Solubilité dans l’eau (mg/L) | 3,61(M) | 7,07(M) | 1,99(M) | 710(E) |
| Pression de vapeur (Pa) | 4,86 × 10-3(M) | 6,80 × 10-3(M) | 5,14 × 10-2(M) | 5,64 à 24 °C(E) |
| log Koe | 5,24(M) | 4,90(M) | 5,54(M) | 2,98(E) |
| Toxicocinétique et métabolisme | AD | AD | Métabolites urinaires : (-)-15-hydroxyélémol. Métabolisme par conjugaison avec l’acide glucuronique et le sulfate. La formation d’époxydes intermédiaires n’est pas prévue.b | Oxydation allylique du groupe méthyle d’un 2 -(4-méthyl-1-cyclohex-3-ényl) propan-2-ol, oxydé ensuite en un groupe carboxylique. Dans une voie mineure, époxydation et hydrolyse produisent le métabolite triol 1,2,8-trihydroxy-p-menthane.c |
| Toxicité par doses répétées (voie orale)a | AD | AD | AD | DSENO = 250 mg/kg p.c./j (étude par gavage de rats de 5 semaines, toxicité pour les testicules et l’épididyme entraînant une infertilité à 750 mg/kg p.c./j chez les mâles). |
| Toxicité par doses répétées (inhalation) | AD | AD | AD | CSENO > 2,23 mg/L dans l’air (dose maximale, études de 13 semaines chez les rats au museau seulement) |
| Toxicité pour la reproduction ou le développement (gavage) | AD | AD | AD |
DSENO pour la reproduction chez les parents mâles = 250 mg/kg p.c./j; preuve de toxicité pour les testicules et l’épididyme entraînant une infertilité à la dose maximale testée de 750 mg/kg p.c./j. Cela a empêché d’évaluer les effets sur la reproduction des femelles à 750 mg/kg p.c./j de sorte que la DSENO pour la reproduction des femelles est supérieure à 250 mg/kg p.c./j. DSENO pour le développement > 250 mg/kg p.c./j chez les rats exposés quotidiennement tout au long de la gestation et jusqu’au 6e jour de lactation; les petits mâles et femelles n’ont pas été affectés à 250 mg/kg p.c./j. |
| Toxicité pour le développement (gavage) | AD | AD | AD | DSENO > 600 mg/kg p.c./j chez les rats exposés aux jours de gestation 6 à 19 (14 jours). |
| Toxicité génétique | AD | AD | Mutagénicité et génotoxicité négatives lors du test d’Ames chez les souches TA98, TA100, TA1535, TA1537 et E. coli.d | Mutagénicité in vitro négative lors de 3 tests d’Ames et 2 essais sur cellules de lymphome de souris.e |
Abréviations : AD : aucune donnée Koe : coefficient de partage octanol-eau
E : expérimental
M : modélisé
Une ou plusieurs références sont citées si l’information n’était pas déjà mentionnée dans le texte du rapport.
a La DSENO observée pour le terpinéol dans cette étude sert de PDD dans la caractérisation des risques pour les données croisées sur le guaiol, le bulnésol et l’élémol.
b EFSA 2015
c Madyastha et Srivatsan 1988
d Api et coll. 2016
e Florin et coll. 1980; Heck et coll. 1989; Lorillard Tobacco Company 1982 et 1983
f Gomez-Carneiro et coll. 1998
| Nom chimique | Alpha-santalol | Bêta-santalol | Bisabolol |
|---|---|---|---|
| Rôle | Objectif | Objectif | Analogue |
| NR CAS | 115-71-9 | 77-42-9 | 515-69-5 |
| Structure chimique | ![C\C(=C\CC[C@]1(C)C2C[C@@H]3[C@H](C2)C13C)\CO (C)(C)O](/content/dam/eccc/images/pded/terpenes-group-2/20210203-TableA-2-1.jpg) |
![C\C(=C\CC[C@]1(C)C2C[C@@H]3[C@H](C2)C13C)\CO (C)(C)O](/content/dam/eccc/images/pded/terpenes-group-2/20210203-TableA-2-2.jpg) |
![C\C(=C\CC[C@]1(C)C2C[C@@H]3[C@H](C2)C13C)\CO (C)(C)O](/content/dam/eccc/images/pded/terpenes-group-2/20210203-TableA-2-1.jpg) |
| Masse moléculaire (g/mol) | 220,35 | 220,35 | 222,37 |
| Solubilité dans l’eau (mg/L) | 6,41(M) | 4,19(M) | 1,69(E) |
| Pression de vapeur (Pa) | 4,51 × 10-3 (M) | 9,83 × 10-3 (M) | 0,018(M) |
| log Koe | 4,96(M) | 5,18(M) | 5,63(E) |
| Toxicocinétique et métabolisme | AD | AD | AD |
| Toxicité par doses répétées (voie orale) | AD | AD | AD |
| Toxicité par doses répétées (inhalation) | AD | AD | AD |
| Toxicité par doses répétées (voie cutanée)* | AD | AD |
Exposition semi-occluse de 28 jours à 0, 50, 200 ou 1000 mg/kg p.c./j chez les rats mâles et femelles. 50, 200 mg/kg p.c./j : aucun effet 1000 mg/kg p.c./j : baisse du gain de poids corporel, diminution de l’efficacité alimentaire, érythème modéré transitoire et formation diffuse de croûte chez certaines femelles, diminution du poids absolu du foie chez les femelles et augmentation du poids relatif des testicules chez les mâles (DSENO : 200 mg/kg p.c./j)a,b |
| Toxicité pour le développement (gavage)a | AD | AD |
Des rates gravides ont reçu 0,250, 0,500, 1,0 ou 3,0 mL/kg p.c./j de bisabolol (équivalent à 0, 245, 490, 980 ou 2940 mg/kg p.c./j) du 6e au 15e jour de gestation. DSENO déterminé à 980 mg/kg p.c./j à partir de l’observation d’une légère sédation, d’une ataxie, d’une diminution de la prise alimentaire et d’une réduction du gain de poids corporel chez les femelles ainsi que d’une importante diminution de nombre de fœtus et d’une augmentation du taux de résorption à 2550 mg/kg p.c./j.a,b Des lapines gravides ont reçu 0,250, 0,500, 1,0 ou 3,0 mL/kg p.c./j de bisabolol (équivalent à 0, 294, 980 ou 2940 mg/kg p.c./j) du 6e au 18e jour de gestation. DSENO déterminé à 980 mg/kg p.c./j à partir de l’observation d’une légère sédation, d’une ataxie, d’une diminution de la prise alimentaire et d’une réduction du gain de poids corporel chez les femelles ainsi que d’une importante diminution de nombre de fœtus et d’une augmentation du taux de résorption à 2550 mg/kg p.c./j.b |
| Toxicité génétique | L’essence de santal a donné des résultats négatifs lors de tests de recombinaison avec des spores de souches H17 Rec+ et M45 Rec- en présence ou en l’absence d’activation métabolique (S9).c L’essence de santal n’était pas cytotoxique ou génotoxique pour les cellules épithéliales de sein.d | L’essence de santal a donné des résultats négatifs lors de tests de recombinaison avec des spores de souches H17 Rec+ et M45 Rec- en présence ou en l’absence d’activation métabolique (S9).c L’essence de santal n’était pas cytotoxique ou génotoxique pour les cellules épithéliales de sein.d | Mutagénicité négative lors du test d’Ames chez les souches TA98, TA100 et TA1535 et Salmonella typhimurium et génotoxicité négative lors du test d’aberration chromosomique avec des cellules V79 de hamster chinois.b |
Abréviations : AD : aucune donnée, Koe : coefficient de partage octanol-eau
E : expérimental
M : modélisé
a La DSENO observée pour le bisabolol dans cette étude sert de PDD dans la caractérisation des risques pour les données croisées sur l’essence de santal
b Bhatia et coll. 2008b
c Burdock et Carabin 2008
d Ortiz et coll. 2016
| Nom chimique | Guaiazulène | Naphtalène |
|---|---|---|
| Rôle | Objectif | Analogue |
| NR CAS | 489-84-9 | 91-20-3 |
| Structure chimique | 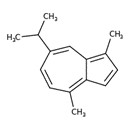 |
 |
| Masse moléculaire (g/mol) | 198,3 | 128,2 |
| Solubilité dans l’eau (mg/L) | 1,12 × 10-1 (M) | 31(E) |
| Pression de vapeur (Pa) | 1,41(M) | 11,3(E) |
| log Koe | 5,93(M) | 3,3(E) |
| Toxicocinétique et métabolisme | AD | La bioactivation du naphtalène varie considérablement selon les espèces, les genres et les différentes régions anatomiques de l’appareil respiratoire. Chez les humains, il est facilement absorbé et métabolisé par plusieurs cytochromes P450. Le naphtalène et ses métabolites peuvent franchir la barrière placentaire et peuvent donc affecter les tissus fœtaux. Le naphtalène peut subir un métabolisme oxydatif et être excrété sous la forme de conjugués naphtoliques et thioéthers, qui proviennent du produit initial d’oxydation chez les rongeurs. Le processus chez les humains est inconnu.b |
| Toxicité par doses répétées (voie orale) | AD | DSENO de 100 mg/kg p.c./j à partir de l’observation de diminutions importantes du poids corporel des gains de poids corporel à 200 mg/kg p.c./j lors d’une étude de 13 semaines (DMENO).c |
| Toxicité par doses répétées (inhalation) | AD |
Dans une étude de 13 semaines sur museau seulement chez les rats, une CMEO de 10 mg/m3 a été constatée à partir de l’observation d’une augmentation de la prévalence et de la gravité des lésions nasales (dégénérescence, atrophie et hyperplasie des cellules basales de l’épithélium olfactif; perte des glandes de Bowman; hypertrophie de l’épithélium respiratoire).c Une CSENO de 5,2 mg/m3 a été déterminée dans une étude similaire de toxicité par inhalation servant à calculer un CSENO pour les lésions nasales à la suite d’expositions au museau seulement.c |
| Toxicité par doses répétées (voie cutanée)a | AD | DSENO de 300 mg/kg p.c./j à partir de l’observation d’une étude de toxicité par voie cutanée de 90 jours chez le rat, où des effets ont été constatés seulement à la dose maximale testée de 1000 mg/kg p.c./j (USEPA 2008). Ces effets étaient notamment une peau et des papules excoriées chez les deux sexes et une atrophie des tubules séminifères chez les mâles. D’autres effets ont été observés, en particulier des lésions non néoplasiques dans le ganglion cervical (hyperplasie), le foie (hémosidérose), la thyroïde (kystes du tractus thyréoglosse), les reins (pyélonéphrite), la vessie (hyperplasie) et la peau (acanthose et hyperkératose) chez les femelles.c |
| Toxicité génétique | AD | Le naphtalène a donné des résultats négatifs lors de tests in vitro et in vivo. Il n’est donc pas considéré génotoxique.c |
Annexe B. Exposition alimentaire estimée aux sesquiterpènes monocycliques et bicycliques naturels
| Sous-population | Substance | Exposition alimentaire moyenne (µg/kg p.c./j) | Exposition alimentaire au 90e centile (µg/kg p.c./j) |
|---|---|---|---|
| 0 à 6 mois | Guaiène | 0 | 0 |
| 6 à 12 mois | Guaiène | 0 | 0 |
| 1 à 3 ans | Guaiène | 90 | 287 |
| 4 à 8 ans | Guaiène | 152 | 361 |
| 9 à 13 ans | Guaiène | 108 | 277 |
| 14 à 18 ans | Guaiène | 73 | 165 |
| 19 ans et plus | Guaiène | 81 | 137 |
| 0 à 6 mois | bêta-caryophyllène | 0 | 0 |
| 6 à 12 mois | bêta-caryophyllène | 165 | 519 |
| 1 à 3 ans | bêta-caryophyllène | 1037 | 3242 |
| 4 à 8 ans | bêta-caryophyllène | 1522 | 3733 |
| 9 à 13 ans | bêta-caryophyllène | 1028 | 2691 |
| 14 à 18 ans | bêta-caryophyllène | 694 | 1638 |
| 19 ans et plus | bêta-caryophyllène | 735 | 1340 |
| 0 à 6 mois | Valencène | 0 | 0 |
| 6 à 12 mois | Valencène | 57 | 190 |
| 1 à 3 ans | Valencène | 99 | 298 |
| 4 à 8 ans | Valencène | 95 | 266 |
| 9 à 13 ans | Valencène | 45 | 139 |
| 14 à 18 ans | Valencène | 30 | 98 |
| 19 ans et plus | Valencène | 14 | 54 |
| 0 à 6 mois | Bulnésol | 0 | 0 |
| 6 à 12 mois | Bulnésol | 0 | 0 |
| 1 à 3 ans | Bulnésol | 101 | 322 |
| 4 à 8 ans | Bulnésol | 171 | 406 |
| 9 à 13 ans | Bulnésol | 122 | 311 |
| 14 à 18 ans | Bulnésol | 82 | 185 |
| 19 ans et plus | Bulnésol | 91 | 155 |
| 0 à 6 mois | Élémol | 0 | 0 |
| 6 à 12 mois | Élémol | 6 | 27 |
| 1 à 3 ans | Élémol | 23 | 61 |
| 4 à 8 ans | Élémol | 27 | 65 |
| 9 à 13 ans | Élémol | 20 | 49 |
| 14 à 18 ans | Élémol | 15 | 33 |
| 19 ans et plus | Élémol | 14 | 26 |
Annexe C. Paramètres d’exposition servant à estimer l’exposition aux substances du sous-groupe 2
| Groupe d’âge | Concentration dans l’air (µg/m3) (24 heures)a | Taux d’inhalation (m3/j)b | Poids corporel (kg)b | Exposition par inhalation (mg/kg p.c./j)c |
|---|---|---|---|---|
| 0 à 5 mois | 1,5 | 3,7 | 6,3 | 8,81 × 10-4 |
| 6 à 11 mois | 1,5 | 5,4 | 9,1 | 8,9 × 10-4 |
| 1 an | 1,5 | 8 | 11 | 1,09 × 10-3 |
| 2 à 3 ans | 1,5 | 9,2 | 15 | 9,2 × 10-4 |
| 4 à 8 ans | 1,5 | 11,1 | 23 | 7,24 × 10-4 |
| 9 à 13 ans | 1,5 | 13,9 | 42 | 4,96 × 10-4 |
| 14 à 18 ans | 1,5 | 15,9 | 62 | 3,85 × 10-4 |
| (19 ans et plus) | 1,5 | 15,1 | 74 | 3,06 × 10-4 |
a Valeur maximale détectée dans l’air intérieur surveillé dans des maisons du Nunavik (Won 2019).
b Comme mentionné dans Santé Canada 2019.
c Calculé à l’aide de la formule suivante : Exposition par inhalation (mg/kg p.c./j) = (concentration dans l’air (1,5 µg/m3) × Taux d’inhalation (m3/j) × Facteur de conversion 1 mg/1000 µg)) / poids corporel (kg)
| Groupe d’âge | Quantité moyenne de produit (g/app)a | Concentration dans l’air (mg/m3) (24 heures)b | Exposition cutanée (mg/kg p.c./j)c | Exposition par inhalation (mg/kg p.c./j)d | Exposition combinée (mg/kg p.c./j)e |
|---|---|---|---|---|---|
| 0 à 5 mois | 2 | 3,90 × 10-2 | 1,90 | 2,29 × 10-2 | 1,93 |
| 6 à 11 mois | 2,5 | 4,90 × 10-2 | 1,65 | 2,91 × 10-2 | 1,68 |
| 1 an | 3,1 | 6,20 × 10-2 | 1,69 | 4,51 × 10-2 | 1,74 |
| 2 à 3 ans | 4,1 | 7,90 × 10-2 | 1,64 | 4,85 × 10-2 | 1,69 |
| 4 à 8 ans | 5 | 9,80 × 10-2 | 1,30 | 4,73 × 10-2 | 1,35 |
| 9 à 13 ans | 7,7 | 1,50 × 10-1 | 1,10 | 4,96 × 10-2 | 1,15 |
| 14 à 18 ans | 10 | 2,00 × 10-1 | 9,68 × 10-1 | 5,13 × 10-2 | 1,02 |
| (19 ans et plus) | 10 | 2,10 × 10-1 | 8,11 × 10-1 | 4,29 × 10-2 | 8,54 × 10-1 |
a Selon Ficheux et coll. 2016. La fréquence présumée était égale à 1 pour tous les groupes d’âge. Pour la modélisation de l’inhalation, la quantité de produit a été ajustée en fonction de la surface exposée; voir les explications ci-dessous.
b Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’exposition à la vapeur, d’évaporation et de rejet constant et à partir des paramètres suivants : durée d’exposition de 24 h, durée d’émission de 24 h, volume de la pièce de 58 m3, taux de ventilation de 0,5/h, surface égale à la surface de peau exposée (présumée égale à la surface des bras, à ¾ de la surface des jambes, à la surface des mains et à la ½ de la surface des pieds) (soit 1325 cm2 pour un bébé de 0 à 5 mois, 1703 cm2 pour un bébé de 6 à 11 mois, 2070 cm2 pour un bébé de 1 an, 2685 cm2 pour un enfant 2 à 3 ans, 3813 cm2 pour un enfant de 4 à 8 ans, 5953 cm2 pour un enfant de 9 à 13 ans, 7655 cm2 pour jeune de 14 à 18 ans et 8543 cm2 pour un adulte (de 19 ans et plus) [SC 2019]), quantité de produit ajustée en fonction de la surface exposée (0,93 g pour un bébé de 0 à 5 mois, 1,16 g pour un bébé de 6 à 11 mois, 1,45 g pour un bébé de 1 an, 1,85 g pour un enfant de 2 à 3 ans, 2,30 pour un enfant de 4 à 8 ans, 3,61 g pour un enfant de 9 à 13 ans, 4,65 g pour un jeune de 14 à 18 ans et 4,87 g pour un adulte), matrice de masse moléculaire de 1000 g/mol et température d’application de 32 °C.
c Exposition cutanée (mg/kg p.c./j) calculée à l’aide de la formule suivante : [quantité moyenne de produit (g/application) × fréquence quotidienne moyenne (nombre d’applications/j) × concentration de produit (3 %) × absorption cutanée (20 %) × facteur de conversion (1000 mg/g)] ÷ poids corporel (6,3 kg pour un bébé de 0 à 5 mois, 9,1 kg pour un bébé 6 de 11 mois, 11 kg pour un bébé de 1 an, 15 kg pour un enfant de 2 à 3 ans, 23 kg pour un enfant de 4 à 8 ans, 42 kg pour un enfant de 9 à 13 ans, 62 kg pour un jeune de 14 à 18 ans et 74 kg pour un adulte (19 ans et plus) [SC 2019]).
d Exposition par inhalation (mg/kg p.c./j) calculée à l’aide de la formule suivante : [Concentration dans l’air (mg/m3) (moyenne pondérée sur 24 heures) × Taux d’inhalation (m3/j) (3,7 m3/j pour un bébé de 0 à 5 mois, 5,4 m3/j pour un bébé de 6 à 11 mois, 8 m3/j pour un bébé de 1 an, 9,2 m3/j pour un enfant de 2 à 3 ans, 11,1 m3/j pour un enfant de 4 à 8 ans, 13,9 m3/j pour un enfant de 9 de 13 ans, 15,9 m3/j pour un jeune de 14 à 18 ans et 15,1 m3/j pour un adulte (19 ans et plus) [SC 2019])] ÷ poids corporel (6,3 kg pour un bébé de 0 à 5 mois, 9,1 kg pour un bébé de 6 à 11 mois, 11 kg pour un bébé de 1 an, 15 kg pour un enfant de 2 à 3 ans, 23 kg pour un enfant de 4 à 8 ans, 42 kg pour un enfant de 9 à 13 ans, 62 kg pour un enfant de 14 à 18 ans et 74 kg pour un adulte (19 ans et plus) (SC)).
e Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j)
| Groupe d’âge | Quantité moyenne de produit (g/j)a | Concentration dans l’air (mg/m3) (24 heures)b | Exposition cutanée (mg/kg p.c./j)c | Exposition par inhalation (mg/kg p.c./j)d | Exposition combinée (mg/kg p.c./j)e |
|---|---|---|---|---|---|
| 0 à 5 mois | 1,8 | 5,00 × 10-2 | 1,71 | 2,94 × 10-2 | 1,74 |
| 6 à 11 mois | 1,8 | 5,30 × 10-2 | 1,19 | 3,15 × 10-2 | 1,22 |
| 1 an | 1,8 | 5,50 × 10-2 | 9,82 × 10-1 | 4,00 × 10-2 | 1,02 |
| 2 à 3 ans | 1,8 | 5,80 × 10-2 | 7,20 × 10-1 | 3,56 × 10-2 | 7,56 × 10-1 |
| 4 à 8 ans | 1,9 | 6,30 × 10-2 | 4,96 × 10-1 | 3,04 × 10-2 | 5,26 × 10-1 |
| 9 à 13 ans | 2,3 | 7,50 × 10-2 | 3,29 × 10-1 | 2,48 × 10-2 | 3,53 × 10-1 |
| 14 à 18 ans | 2,9 | 9,40 × 10-2 | 2,81 × 10-1 | 2,41 × 10-2 | 3,05 × 10-1 |
| Adultes (19 ans et plus) | 3,2 | 1,00 × 10-1 | 2,59 × 10-1 | 2,04 × 10-2 | 2,80 × 10-1 |
a Selon Ficheux et coll. 2016. Fréquence présumée de 1/j.
b Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’exposition à la vapeur, d’évaporation et de rejet constant, à supposer que 80 % de la dose appliquée était disponible pour l’évaporation (quantité restante à la surface de la peau après absorption cutanée de la substance) (80 % × quantité de produit × 3 %), et à partir des paramètres suivants : durée d’exposition de 1 heure, durée d’émission e 1 heure, volume de la pièce de 20 m3, taux de ventilation de 0,6/h, surface de rejet égale à la surface exposée (surface totale moins la surface de la tête pour un enfant de 0 à 11 ans et surface totale moins la moitié de la surface de la tête et du tronc pour un adulte ou un adolescent) (3180 cm2 pour un bébé de 0 à 5 mois, 4090 cm2 pour un bébé de 6 à 11 mois, 4865 cm2 pour un bébé de 1 an, 6225 cm2 pour un enfant de 2 à 3 ans, 8595 cm2 pour un enfant 4 à 8 ans, 10 395 cm2 pour un enfant de 9 à 13 ans, 13 385 cm2 pour un jeune de 14 à 18 ans et 14 670 cm2 pour un adulte (19 ans et plus) [SC 2019], masse moléculaire de 1000 g/mol et température d’application de 32 °C.
c Exposition cutanée calculée à l’aide de la formule suivante : (quantité moyenne de produit (g/application) × fréquence quotidienne moyenne × concentration de produit (3 %) × absorption cutanée (20 %) × facteur de conversion (1000 mg/g)) ÷ poids corporel (kg) (6,3 kg pour un bébé de 0 à 5 mois, 9,1 kg pour un bébé de 6 à 11 mois, 11 kg pour un bébé de 1 an, 15 kg pour un enfant de 2 à 3 ans, 23 kg pour un enfant de 4 à 8 ans, 42 kg pour un enfant de 9 à 13 ans, 62 kg pour un jeune de 14 à 18 ans et 74 kg pour un adulte (19 ans et plus) [SC 2019]).
d Exposition par inhalation (mg/kg p.c./j) calculée à l’aide de la formule suivante : [Concentration dans l’air (mg/m3) (moyenne pondérée sur 24 heures) × Taux d’inhalation (m3/j) (3,7 m3/j pour un bébé de 0 à 5 mois, 5,4 m3/j pour un bébé de 6 à 11 mois, 8 m3/j pour un bébé de 1 an, 9,2 m3/j pour un enfant de 2 à 3 ans, 11,1 m3/j pour un enfant de 4 à 8 ans, 13,9 m3/j pour un enfant de 9 de 13 ans, 15,9 m3/j pour un jeune de 14 à 18 ans et 15,1 m3/j pour un adulte (19 ans et plus) [SC 2019])] ÷ poids corporel (6,3 kg pour un bébé de 0 à 5 mois, 9,1 kg pour un bébé de 6 à 11 mois, 11 kg pour un bébé de 1 an, 15 kg pour un enfant de 2 à 3 ans, 23 kg pour un enfant de 4 à 8 ans, 42 kg pour un enfant de 9 à 13 ans, 62 kg pour un enfant de 14 à 18 ans et 74 kg pour un adulte (19 ans et plus) [SC 2019]).
e Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j)
| Groupe d’âge | Quantité moyenne de produit (g/app) a | Fréquence quotidienne moyenne b | Exposition cutanée (mg/kg p.c./j) c | Exposition par inhalation (mg/kg p.c./j) d | Exposition systémique (mg/kg p.c./j) e |
|---|---|---|---|---|---|
| 2 à 3 ans | 0,33 | 1,0 | 3,74 | 6,75 × 10-2 | 3,81 |
| 4 à 8 ans | 0,33 | 1,0 | 2,44 | 5,31 × 10-2 | 2,49 |
| 9 à 13 ans | 0,33 | 1,4 | 1,87 | 3,64 × 10-2 | 1,91 |
| 14 à 18 ans | 0,33 | 1,4 | 1,27 | 2,82 × 10-2 | 1,29 |
| Adultes (19 ans et plus) | 0,33 | 1,7 | 1,29 | 2,24 × 10-2 | 1,31 |
a Selon Loretz et coll. 2006
b Selon Loretz et coll. 2006; Statistique Canada 2017; la fréquence quotidienne minimale a été fixée à 1.
c L’exposition cutanée (mg/kg p.c./j) a été calculée à l’aide de la formule suivante : (quantité moyenne de produit (g/application) × fréquence quotidienne moyenne × concentration de produit (100 %) × facteur de rétention (0,85) × facteur de conversion (1000 mg/g) × absorption cutanée (20 %)) ÷ poids corporel (kg) [15 kg pour un enfant de 2 à 3 ans, 23 kg pour un enfant de 4 à 8 ans, 42 kg pour un enfant de 9 à 13 ans, 62 kg pour un jeune de 14 à 18 ans et 74 kg pour un adulte (19 ans et plus) [SC 2019]].
d L’exposition par inhalation (mg/kg p.c./j) a été calculée à l’aide de la formule suivante : (Concentration dans l’air (moyenne sur 24 heures) (mg/m3) × taux d’inhalation (m3/j) [9,2 m3/j pour un enfant de 2 à 3 ans, 11,1 m3/j pour un enfant de 4 à 8 ans, 13,9 m3/j pour un enfant de 9 de 13 ans, 15,9 m3/j pour un jeune de 14 à 18 ans et 15,1 m3/j pour un adulte (19 ans et plus)] ÷ poids corporel (kg) [15 kg pour un enfant de 2 à 3 ans, 23 kg pour un enfant de 4 à 8 ans, 42 kg pour un enfant de 9 à 13 ans, 62 kg pour un enfant de 14 à 18 ans et 74 kg pour un adulte (19 ans et plus) [SC 2019]]. Les concentrations dans l’air ont été modélisées à l’aide du modèle de rejet instantané de ConsExpo, à supposer que la durée d’exposition, le volume de la pièce et le taux de ventilation soient respectivement de 5 min, 10 m3 et 0/h.
e L’exposition systémique (mg/kg p.c./j) a été calculée à l’aide de la formule suivante : Exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j).
| Groupe d’âge | Quantité moyenne de produit (g/app)a | Concentration dans l’air (mg/m3) (24 h)b | Exposition cutanée (mg/kg p.c./j)c | Exposition par inhalation (mg/kg p.c./j)d | Exposition combinée (mg/kg p.c./j)e |
|---|---|---|---|---|---|
| 0 à 5 mois | 2 | 6,00 × 10-5 | 6,35 × 10-2 | 3,52 × 10-5 | 6,35 × 10-2 |
| 6 à 11 mois | 2,5 | 8,60 × 10-5 | 5,49 × 10-2 | 5,10 × 10-5 | 5,50 × 10-2 |
| 1 an | 3,1 | 1,10 × 10-4 | 5,64 × 10-2 | 8,00 × 10-5 | 5,64 × 10-2 |
| 2 à 3 ans | 4,1 | 1,00 × 10-4 | 5,47 × 10-2 | 6,13 × 10-5 | 5,47 × 10-2 |
| 4 à 8 ans | 5 | 1,60 × 10-3 | 4,35 × 10-2 | 7,72 × 10-4 | 4,43 × 10-2 |
| 9 à 13 ans | 7,7 | 3,90 × 10-4 | 3,67 × 10-2 | 1,29 × 10-4 | 3,68 × 10-2 |
| 14 à 18 ans | 10 | 7,40 × 10-5 | 3,23 × 10-2 | 1,90 × 10-5 | 3,23 × 10-2 |
| Adultes (19 ans et plus) | 10 | 7,60 × 10-5 | 2,70 × 10-2 | 1,55 × 10-5 | 2,70 × 10-2 |
a Selon Ficheux et coll. 2016. La fréquence présumée était égale à 1 pour tous les groupes d’âge. Pour la modélisation de l’inhalation, la quantité de produit a été ajustée en fonction de la surface exposée; voir les explications ci-dessous.
b Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’exposition à la vapeur, d’évaporation et de rejet constant et à partir des paramètres suivants : durée d’exposition de 24 h, durée d’émission de 24 h, volume de la pièce de 58 m3, taux de ventilation de 0,5/h, surface égale à la surface de peau exposée (présumée égale à la surface des bras, à ¾ de la surface des jambes, à la surface des mains et à la ½ de la surface des pieds) (soit 1325 cm2 pour un bébé de 0 à 5 mois, 1703 cm2 pour un bébé de 6 à 11 mois, 2070 cm2 pour un bébé de 1 an, 2685 cm2 pour un enfant 2 à 3 ans, 3813 cm2 pour un enfant de 4 à 8 ans, 5953 cm2 pour un enfant de 9 à 13 ans, 7655 cm2 pour jeune de 14 à 18 ans et 8543 cm2 pour un adulte (de 19 ans et plus) [SC 2019]), quantité de produit ajustée en fonction de la surface exposée (0,93 g pour un bébé de 0 à 5 mois, 1,16 g pour un bébé de 6 à 11 mois, 1,45 g pour un bébé de 1 an, 1,85 g pour un enfant de 2 à 3 ans, 2,30 pour un enfant de 4 à 8 ans, 3,61 g pour un enfant de 9 à 13 ans, 4,65 g pour un jeune de 14 à 18 ans et 4,87 g pour un adulte), matrice de masse moléculaire de 1000 g/mol et température d’application de 32 °C.
c Exposition cutanée (mg/kg p.c./j) calculée à l’aide de la formule suivante : [quantité moyenne de produit (g/application) × fréquence quotidienne moyenne (nombre d’applications/j) × concentration de produit (0,1 %) × absorption cutanée (20 %) × facteur de conversion (1000 mg/g)] ÷ poids corporel (6,3 kg pour un bébé de 0 à 5 mois, 9,1 kg pour un bébé 6 de 11 mois, 11 kg pour un bébé de 1 an, 15 kg pour un enfant de 2 à 3 ans, 23 kg pour un enfant de 4 à 8 ans, 42 kg pour un enfant de 9 à 13 ans, 62 kg pour un jeune de 14 à 18 ans et 74 kg pour un adulte (19 ans et plus) [SC 2019]).
d Exposition par inhalation (mg/kg p.c./j) calculée à l’aide de la formule suivante : [Concentration dans l’air (mg/m3) (moyenne pondérée sur 24 heures) × taux d’inhalation (m3/j) (3,7 m3/j pour un bébé de 0 à 5 mois, 5,4 m3/j pour un bébé de 6 à 11 mois, 8 m3/j pour un bébé de 1 an, 9,2 m3/j pour un enfant de 2 à 3 ans, 11,1 m3/j pour un enfant de 4 à 8 ans, 13,9 m3/j pour un enfant de 9 de 13 ans, 15,9 m3/j pour un jeune de 14 à 18 ans et 15,1 m3/j pour un adulte (19 ans et plus) [SC 2019])] ÷ poids corporel (6,3 kg pour un bébé de 0 à 5 mois, 9,1 kg pour un bébé de 6 à 11 mois, 11 kg pour un bébé de 1 an, 15 kg pour un enfant de 2 à 3 ans, 23 kg pour un enfant de 4 à 8 ans, 42 kg pour un enfant de 9 à 13 ans, 62 kg pour un enfant de 14 à 18 ans et 74 kg pour un adulte (19 ans et plus) [SC 2019]).
e Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j)
| Groupe d’âge | Quantité moyenne de produit ingérée (g/application)a | Fréquence quotidienne moyenneb | Poids corporel (kg)c | Exposition systémique (mg/kg p.c./j)d |
|---|---|---|---|---|
| 4 à 8 ans | 1,7 | 1 | 23 | 1,30 |
| 9 à 13 ans | 1,7 | 1 | 42 | 7,14 × 10-1 |
| 14 à 18 ans | 1,0 | 1 | 62 | 8,23 × 10-1 |
| Adultes (19 ans et plus) | 1,0 | 1 | 74 | 6,89 × 10-1 |
a Selon Ficheux et coll. 2016; CSSC 2015.
b Selon Ficheux et coll. 2015. La fréquence quotidienne minimale a été fixée à 1.
c Comme mentionné dans Canadian exposure factors used in human health risk assessment (SC 2019).
d Exposition systémique calculée à l’aide de la formule suivante : (Quantité moyenne de produit ingérée (g/application) × fréquence quotidienne moyenne × concentration de produit (3 %) × facteur de conversion (1000 mg/g)) ÷ poids corporel (kg)
| Scénario d’expositiona | Groupe d’âge | Concentration | Exposition cutanée (mg/kg p.c./j) | Exposition par inhalation (mg/kg p.c./j) | Exposition combinée (mg/kg p.c./j) |
|---|---|---|---|---|---|
| Mélange et ajout d’un détersif et étendange du linge lavé à la main | Adultes | 5 % | 1,54 × 10-1 | 3,88 × 10-4 | 1,54 × 10-1 |
| Désodorisant | Petits enfants à Adultes | 10 % | S. O. | 1,23 × 10-1 à 4,08 × 10-2 | 1,23 × 10-1 à 4,08 × 10-2 |
| INM dans une crème contre l’herpès buccal | Adultes à Enfants de 2 à 3 ans | 20 % | 2,70 × 10-1 à 1,33 | S.O. | 2,70 × 10-1 à 1,33 |
Abréviations : S. O. : sans objet
a Les explications sur la méthode et les paramètres servant à estimer l’exposition par voie cutanée et par inhalation au bêta-caryophyllène contenu dans les produits sont fournies dans le tableau A-4.
| Scénario d’exposition | Hypothèsesa |
|---|---|
| Mélange et ajout d’un détersif pour lavage à la main et étendage du linge lavé à la main (adultes) |
Concentration de bêta-caryophyllène : 5 % (ACI 2018) Mélange et ajout d’un détersif (voie cutanée) : Mélange et ajout d’un détersif (modèle d’inhalation, d’exposition à la vapeur, d’évaporation et de rejet constant) : Lavage à la main (voie cutanée) : Lavage à la main (inhalation, exposition à la vapeur, évaporation et rejet constant) : Étendage de linge lavé à la main (voie cutanée) : Étendage de linge lavé à la main (inhalation, exposition à la vapeur, évaporation et augmentation de la surface de rejet) : Exposition combinée : Voie cutanée (mélange ou ajout + lavage à la main + étendage de linge lavé à la machine) + inhalation (mélange ou ajout + lavage à la main + étendage de linge lavé à la machine) |
|
Désodorisant (bloc de cire) (inhalation) (toutes les sous-populations) |
Concentration de bêta-caryophyllène : 5 à 10 % (FDS 2015) Inhalation – exposition à la vapeur, scénario à taux constant Exposition par inhalation (mg/kg p.c./j) = (concentration dans l’air (mg/m3 – 24 heures) × taux d’inhalation quotidien (m3/j)) ÷ poids corporel (kg) |
|
Ingrédient non médicinal dans une crème contre l’herpès buccal |
Concentration de bêta-caryophyllène : 20 % Quantité : 100 mg/j pour une taille de produit de 2000 mg destinés à traiter trois poussées d’herpès, durant chacune 10 jours (2000 mg/produit ÷ 3 poussées/produit ÷ 10 jours/poussée = 100 mg/j) (Soins de santé aux consommateurs de GSK 2017). Exposition par voie orale (mg/kg p.c./j) = (100 mg/j × concentration de produit (20 %)) ÷ poids corporel (kg) |
a L’exposition aux produits a été estimée à l’aide de ConsExpo Web (2016). Les estimations d’exposition ont été calculées à partir des poids corporels et taux d’inhalation par défaut de 74 kg et 15,1 m3/j pour les adultes (de 19 ans et plus), 62 kg et 15,9 m3/j pour les jeunes de 14 à 18 ans, 42 kg et 13,9 m3/j pour les enfants de 9 à 13 ans, 23 kg et 11,1 m3/j pour les enfants de 4 à 8 ans, 15 kg et 9,2 m3/j pour les enfants de 2 à 3 ans, 11 kg et 8,0 m3/j pour les bébés de 1 an, 9,1 kg et 5,4 m3/j pour les bébés de 6 à 11 mois et 6,3 kg et 3,7 m3/j pour les bébés de 0 à 5 mois (SC 2019).
Annexe D. Paramètres pour l’estimation de l’exposition aux substances du sous-groupe 3
| Groupe d’âge | Quantité moyenne de produit (g/application)a | Poids corporel (kg)b | Exposition cutanée (mg/kg p.c./j)c |
|---|---|---|---|
| 0 à 5 mois | 2 | 6,3 | 1,59 × 10-2 |
| 6 à 11 mois | 2,5 | 9,1 | 1,37 × 10-2 |
| 1 an | 3,1 | 11 | 1,41 × 10-2 |
| 2 à 3 ans | 4,1 | 15 | 1,37 × 10-2 |
| 4 à 8 ans | 5 | 23 | 1,09 × 10-2 |
| 9 à 13 ans | 7,7 | 42 | 9,17 × 10-3 |
| 14 à 18 ans | 10 | 62 | 8,06 × 10-3 |
| Adultes (19 ans et plus) | 10 | 74 | 6,76 × 10-3 |
a Selon Ficheux et coll. 2016. La fréquence présumée était égale à 1 pour tous les groupes d’âge.
b Comme mentionné dans Canadian exposure factors used in human health risk assessment (SC 2019).
c Exposition cutanée calculée à l’aide de la formule suivante : (Quantité moyenne de produit (g/application) × fréquence quotidienne moyenne × concentration de produit (0,005 %) × facteur de conversion (1000 mg/g)) ÷ poids corporel (kg)
Annexe E. Paramètres d’exposition servant à estimer l’exposition à l’essence de santal
| Groupe d’âge | Quantité moyenne de produit (g/application)a | Poids corporel (kg)b | Exposition cutanée (mg/kg p.c./j)c |
|---|---|---|---|
| 0 à 5 mois | 2 | 6,3 | 95,2 |
| 6 à 11 mois | 2,5 | 9,1 | 82,4 |
| 1 an | 3,1 | 11 | 84,5 |
| 2 à 3 ans | 4,1 | 15 | 82,0 |
| 4 à 8 ans | 5 | 23 | 65,2 |
| 9 à 13 ans | 7,7 | 42 | 55,0 |
| 14 à 18 ans | 10 | 62 | 48,4 |
| Adultes (19 ans et plus) | 10 | 74 | 40,5 |
a Selon Ficheux et coll. 2016. La fréquence présumée était égale à 1 pour tous les groupes d’âge.
b Comme mentionné dans Canadian exposure factors used in human health risk assessment (SC 2019).
c Exposition cutanée calculée à l’aide de la formule suivante : (Quantité moyenne de produit (g/application) × fréquence quotidienne moyenne × concentration de produit (30 %) × facteur de conversion (1000 mg/g)) ÷ poids corporel (kg)
| Groupe d’âge | Quantité moyenne de produit (g/application)a | Poids corporel (kg)b | Exposition cutanée (mg/kg p.c./j)c |
|---|---|---|---|
| 0 à 5 mois | 1,8 | 6,3 | 8,57 |
| 6 à 11 mois | 1,8 | 9,1 | 5,93 |
| 1 an | 1,8 | 11 | 4,91 |
| 2 à 3 ans | 1,8 | 15 | 3,60 |
| 4 à 8 ans | 1,9 | 23 | 2,48 |
| 9 à 13 ans | 2,3 | 42 | 1,64 |
| 14 à 18 ans | 2,9 | 62 | 1,40 |
| Adultes (19 ans et plus) | 3,2 | 74 | 1,30 |
a Selon Ficheux et coll. 2016. Fréquence présumée de 1/j.
b Comme mentionné dans Canadian exposure factors used in human health risk assessment (SC 2019).
c Exposition cutanée calculée à l’aide de la formule suivante : (Quantité moyenne de produit (g/application) × fréquence quotidienne moyenne × concentration de produit (3 %) × facteur de conversion (1000 mg/g)) ÷ poids corporel (kg)
| Groupe d’âge | Quantité moyenne de produit (g/application) a | Fréquence quotidienne moyenne b | Poids corporel (kg) c | Exposition cutanée (mg/kg p.c./j) d |
|---|---|---|---|---|
| 9 à 13 ans | 1,1 | 1,0 | 42 | 7,86 × 10-1 |
| 14 à 18 ans | 1,5 | 1,0 | 62 | 7,26 × 10-1 |
| Adultes (19 ans et plus) | 1,5 | 2,0 | 74 | 1,22 |
a Selon Ficheux et coll. 2016
b Selon Loretz et coll. 2005; Ficheux et coll. 2015
c Comme mentionné dans Canadian exposure factors used in human health risk assessment (SC 2019).
d Exposition systémique calculée à l’aide de la formule suivante : (Quantité moyenne de produit (g/application) × fréquence quotidienne moyenne × concentration de produit (100 %) × facteur de conversion (1000 mg/g)) ÷ poids corporel (kg)
| Groupe d’âge | Quantité moyenne de produit (g/app)a | Fréquence quotidienne moyenneb | Exposition cutanée (mg/kg p.c./j)c |
|---|---|---|---|
| 2 à 3 ans | 0,33 | 1,0 | 22,0 |
| 4 à 8 ans | 0,33 | 1,0 | 14,3 |
| 9 à 13 ans | 0,33 | 1,4 | 11,0 |
| 14 à 18 ans | 0,33 | 1,4 | 7,45 |
| Adultes (19 ans et plus) | 0,33 | 1,7 | 7,58 |
a Selon Loretz et coll. 2006
b Selon Loretz et coll. 2006; Statistique Canada 2017; la fréquence quotidienne minimale a été fixée à 1.
c L’exposition cutanée (mg/kg p.c./j) a été calculée à l’aide de la formule suivante : (quantité moyenne de produit (g/application) × fréquence quotidienne moyenne × concentration de produit (100 %) × facteur de rétention (0,85) × facteur de conversion (1000 mg/g) × absorption cutanée (20 %)) ÷ poids corporel (kg) [15 kg (enfant de 2 à 3 ans), 23 kg (enfant de 4 à 8 ans), 42 kg (enfant de 9 à 13 ans), 62 kg (jeune de 14 à 18 ans) et 74 kg (adulte de 19 ans et plus) [SC 2019]].
| Groupe d’âge | Quantité moyenne de produit (g/application)a | Fréquence quotidienne moyenneb | Facteur de rétention | Poids corporel (kg)c | Exposition cutanée (mg/kg p.c./j)d |
|---|---|---|---|---|---|
| 0 à 5 mois | 3,9 | 1,1 | 0,01 | 6,3 | 6,19 × 10-1 |
| 6 à 11 mois | 5,6 | 1,0 | 0,01 | 9,1 | 6,15 × 10-1 |
| 1 an | 6,1 | 1,0 | 0,01 | 11 | 5,55 × 10-1 |
| 2 à 3 ans | 7,9 | 1,0 | 0,01 | 15 | 5,27 × 10-1 |
| 4 à 8 ans | 9,7 | 1,0 | 0,01 | 23 | 4,22 × 10-1 |
| 9 à 13 ans | 7,5 | 1,0 | 0,01 | 42 | 1,79 × 10-1 |
| 14 à 18 ans | 10,4 | 1,0 | 0,01 | 62 | 1,68 × 10-1 |
| Adultes (19 ans et plus) | 11,8 | 1,0 | 0,01 | 74 | 1,75 × 10-1 |
a Selon Loretz et coll. 2008; Ficheux et coll. 2016; Gomez-Berrada et coll. 2013.
b Selon Loretz et coll. 2008; Ficheux et coll. 2015; Wu et coll. 2010; Gomez-Berrada et coll. 2013. La fréquence quotidienne minimale a été fixée à 1.
c Comme mentionné dans Canadian exposure factors used in human health risk assessment (SC 2019).
d Exposition cutanée calculée à l’aide de la formule suivante : (Quantité moyenne de produit (g/application) × fréquence quotidienne moyenne × concentration de produit (10 %) × facteur de rétention (0,01) × facteur de conversion (1000 mg/g)) ÷ poids corporel (kg)
| Groupe d’âge | Exposition cutanée au nettoyant (mg/kg p.c./j) a | Exposition cutanée à l’hydratant (mg/kg p.c./j) b | Exposition cutanée au traitement contre les boutons (mg/kg p.c./j) c | Exposition cutanée totale (mg/kg p.c./j) d |
|---|---|---|---|---|
| 9 à 13 ans | 1,77 × 10-2 | 5,24 × 10-1 | 2,62 × 10-1 | 8,03 × 10-1 |
| 14 à 18 ans | 1,28 × 10-2 | 4,84 × 10-1 | 2,42 × 10-1 | 7,39 × 10-1 |
| Adultes, (19 ans et plus) | 1,43 × 10-2 | 8,11 × 10-1 | 4,05 × 10-1 | 1,23 |
a L’exposition quotidienne pour un produit nettoyant pour visage a été calculée à l’aide de la formule suivante : [Quantité moyenne de produit (g/application (3,1 g pour les enfants de 9 à 13 ans et 3,3 g pour les jeunes de 14 à 18 ans et les adultes (19 ans et plus) selon Ficheux et coll. 2016) × fréquence moyenne/j (1,2 pour les 9 à 13 ans et les 14 à 18 ans et 1,6 pour les adultes (19 ans) selon Ficheux et coll. 2015 et Loretz et coll. 2008) × concentration de produit (2 %) × facteur de rétention (0,01) × facteur de conversion (1000 mg/g)] / poids corporel (42 kg pour les enfants de 9 à 13 ans, 62 kg pour les jeunes 14 à 18 ans et 74 kg pour les adultes (19 ans et plus) [SC 2019].
b L’exposition quotidienne pour un hydratant médicamenteux a été calculée à l’aide de la formule suivante : [(Quantité moyenne de produit (g/application) (1,1 g pour les enfants de 9 à 13 ans, 1,5 g pour les jeunes de 14 à 18 ans et les adultes (19 ans et plus) selon Ficheux et coll. 2016) × (fréquence quotidienne moyenne) (1 pour les 9 à 13 ans et les 14 à 18 ans, 2 pour les adultes (19 ans et plus) selon Loretz et coll. 2005 et Ficheux et coll. 2015) × concentration de produit (2 %) × facteur de conversion (1000 mg/g)] / poids corporel (42 kg pour les enfants de 9 à 13 ans, 62 kg pour les jeunes de 14 à 18 ans et 74 kg pour les adultes (19 ans et plus) [SC 2019].
c L’exposition quotidienne résultant d’un traitement intensif contre les boutons est présumée être égale à 50 % d’exposition à l’hydratant médicamenteux selon les quantités relatives de produit. La quantité de produit totale dans le traitement intensif contre les boutons était la moitié de celle dans l’hydratant médicamenteux. L’exposition quotidienne résultant d’un traitement intensif contre les boutons a été calculée à l’aide de la formule suivante : exposition quotidienne à l’hydratant médicamenteux (2 %) × 50 %
d Exposition systémique totale calculée à l’aide de la formule suivante : Exposition quotidienne provenant du nettoyant pour le visage (mg/kg p.c./j) + exposition quotidienne provenant de l’hydratant médicamenteux (mg/kg p.c./j) + exposition quotidienne résultant d’un traitement intensif contre les boutons (mg/kg p.c./j)
| Groupe d’âge | Quantité moyenne de produit (g/application)a | Fréquence quotidienne moyenneb | Poids corporel (kg)c | Exposition cutanée (mg/kg p.c./j)d |
|---|---|---|---|---|
| 6 à 11 mois | 5,4 | 1,6 | 9,1 | 3,80 × 10-1 |
| 1 an | 5,4 | 1,6 | 11 | 3,14 × 10-1 |
| 2 à 3 ans | 5,4 | 1,6 | 15 | 2,30 × 10-1 |
| 4 à 8 ans | 6,3 | 1,4 | 23 | 1,53 × 10-1 |
| 9 à 13 ans | 6,3 | 1,4 | 42 | 8,40 × 10-2 |
| 14 à 18 ans | 18,2 | 1,4 | 62 | 1,64 × 10-1 |
| Adultes (19 ans et plus) | 18,2 | 1,4 | 74 | 1,38 × 10-1 |
a Selon Ficheux et coll. 2016
b Selon Ficheux et coll. 2015
c Comme mentionné dans Canadian exposure factors used in human health risk assessment (SC 2019).
d Exposition cutanée calculée à l’aide de la formule suivante : (Quantité moyenne de produit (g/application) × fréquence quotidienne moyenne × concentration de produit (10 %) × facteur de conversion (1000 mg/g)) ÷ poids corporel (kg)
| Scénario d’expositiona | Groupe d’âge | Concentration | Exposition cutanée (mg/kg p.c./j) | Exposition par inhalation (mg/kg p.c./j) | Exposition par voie orale (mg/kg p.c./j) |
|---|---|---|---|---|---|
| Aromathérapie | Adultes | 100 % | S.O. | 2,24 × 10-1 (1,1 mg/m3) | S.O. |
| Aromathérapie | 0 à 5 mois | 100 % | S.O. | 6,46 × 10-1 (1,1 mg/m3) | S.O. |
| Mélange et ajout d’un détersif et étendange du linge lavé à la main | Adultes | 5 % | 5,43 × 10-1 | S.O. | S.O. |
| Mélange, ajout et application d’un nettoyant universel pour le sol | Adultes | 1 % | 5,00 × 10-2 | S.O. | S.O. |
| Exposition provenant de contacts avec le sol | 1 à 2 ans | 1 % | 1,83 × 10-2 | S.O. | 1,38 × 10-3 |
a Les explications sur la méthode et les paramètres servant à estimer l’exposition par voie cutanée et par inhalation à l’essence de santal contenue dans des produits sont fournies dans le tableau C-5.
S.O. : sans objet
| Scénario d’exposition | Hypothèsesa |
|---|---|
| Aromathérapie |
Désodorisant contenant de l’huile essentielle dans ConsExpo. Modélise l’évaporation d’une huile essentielle à partir d’une lampe aromatique. Les valeurs par défaut ont été extraites de la fiche de données de produit cosmétique du RIVM (RIVM 2006). Modèle d’inhalation, évaporation et taux constant : Exposition par inhalation (mg/kg p.c./j) : (concentration dans l’air (24 heures; mg/m3) × taux d’inhalation quotidienne (m3/j)) ÷ poids corporel (kg) |
| Mélange et ajout d’un détersif pour le lavage à la main et étendage du linge lavé à la main (adultes) |
Concentration d’essence de santal : 5 % (ACI 2018) Mélange et ajout d’un détersif (voie cutanée) : Lavage à la main (voie cutanée) : Étendage de linge lavé à la main (voie cutanée) : Exposition combinée : mélange/ajout + lavage à la main _ étendage de linge lavé à la machine |
| Mélange, ajout et application d’un nettoyant universel pour le sol (liquide) (adultes) |
Concentration d’essence de santal : 1 % (ACI 2018). Mélange et ajout d’un détersif (voie cutanée) : Application (voie cutanée) : Exposition combinée : mélange/ajout + application |
| Exposition provenant de contacts avec des sols nettoyés (petits enfants) |
Concentration d’essence de santal : 1 % (ACI 2018). Calculs basés selon les procédures opérationnelles normalisées de l’EPA des États-Unis (2012), section 7. Voie cutanée : Dépôt résiduel (mg/cm2) : Calculé en supposant qu’il y ait 14,4 g de produit pour 22 m2 de sol (fiche de données de produit nettoyant de ConsExpo 2018) × 1000 mg/g × 1 m2/10 000 cm2 Exposition orale accidentelle (c.-à-d. l’exposition par contact de la bouche par les mains) : RM : charge de résidu sur les mains (mg/cm2); calculée à l’aide de l’algorithme suivant : RM = [Fiamains × exposition cutanée (mg) (calculée ci-dessus)] / (SM × 2) Fiamains : 0,15 (sans unité); fraction d’ingrédient actif sur les mains par rapport au résidu de surface total issu de l’étude de Jazzercise SM : 150 cm2; surface type d’une main |
a L’exposition aux produits a été estimée à l’aide de ConsExpo Web (2016). Les estimations d’exposition ont été calculées à partir des poids corporels et taux d’inhalation par défaut de 74 kg et 15,1 m3/j pour les adultes (de 19 ans et plus), 62 kg et 15,9 m3/j pour les jeunes de 14 à 18 ans, 42 kg et 13,9 m3/j pour les enfants de 9 à 13 ans, 23 kg et 11,1 m3/j pour les enfants de 4 à 8 ans, 15 kg et 9,2 m3/j pour les enfants de 2 à 3 ans, 11 kg et 8,0 m3/j pour les bébés de 1 an, 9,1 kg et 5,4 m3/j pour les bébés de 6 à 11 mois et 6,3 kg et 3,7 m3/j pour les bébés de 0 à 5 mois (SC 2019).
Annexe F. Paramètres d’exposition servant à estimer l’exposition au guaiazulène
| Groupe d’âge | Quantité moyenne de produit (g/application)a | Poids corporel (kg)b | Exposition cutanée (mg/kg p.c./j)c | Pic d’exposition par inhalation (mg/m3)d |
|---|---|---|---|---|
| 0 à 5 mois | 2 | 6,3 | 3,17 × 10-1 | 6,80 × 10-3 |
| 6 à 11 mois | 2,5 | 9,1 | 2,75 × 10-1 | 8,50 × 10-3 |
| 1 an | 3,1 | 11 | 2,82 × 10-1 | 1,10 × 10-2 |
| 2 à 3 ans | 4,1 | 15 | 2,73 × 10-1 | 1,30 × 10-2 |
| 4 à 8 ans | 5 | 23 | 2,17 × 10-1 | 2,20 × 10-2 |
| 9 à 13 ans | 7,7 | 42 | 1,83 × 10-1 | 2,70 × 10-2 |
| 14 à 18 ans | 10 | 62 | 1,61 × 10-1 | 3,50 × 10-2 |
| Adultes (19 ans et plus) | 10 | 74 | 1,35 × 10-1 | 3,70 × 10-2 |
a Quantité moyenne de produit pour l’exposition cutanée selon Ficheux et coll. 2016. La fréquence présumée était égale à 1 pour tous les groupes d’âge.
b Comme mentionné dans Canadian exposure factors used in human health risk assessment (SC 2019).
c Exposition cutanée calculée à l’aide de la formule suivante : (Quantité moyenne de produit (g/application) × fréquence quotidienne moyenne × concentration de produit (0,1 %) × facteur de conversion (1000 mg/g)) ÷ poids corporel (kg)
d Les pics de concentration dans l’air ont été modélisées à l’aide du modèle ConsExpo d’exposition à la vapeur, d’évaporation et de rejet constant et à partir des paramètres suivants : durée d’exposition de 24 h, durée d’émission de 24 h, volume de la pièce de 58 m3, surface de rejet égale à la surface d’application non couverte par des vêtements (présumée égale à la surface de la tête, des bras et des mains et à ¾ de la surface des jambes (soit 8543 cm2 pour un adulte, 7655 cm2 pour un jeune de 14 à 18 ans, 5953 cm2 pour un enfant de 9 à 13 ans, 3813 cm2 pour un enfant 4 à 8 ans, 2685 cm2 pour un enfant de 2 à 3 ans, 2070 cm2 pour un bébé de 1 an, 1703 cm2 pour bébé de 6 à 11 mois et 1325 cm2 pour un bébé de 0 à 5 mois), quantité de produit ajustée en fonction de la surface exposée (4,87 g pour les adultes, 4,65 g pour les 14 à 18 ans, 3,61 g pour les 9 à 13 ans, 2,3 g pour les 4 à 8 ans, 1,85 g pour les 2-3 ans, 1,45 g pour les bébés de 1 an, 1,16 g pour les 6 à 11 mois et 0,93 g pour les 0 à 5 mois), taux de ventilation de 0,5/h, matrice de masse moléculaire de 1000 g/mol et température d’application de 32 °C.
| Groupe d’âge | Quantité moyenne de produit (g/application)a < | Fréquenceb | Poids corporel (kg)c | Exposition cutanée (mg/kg p.c./j)d | Pic de concentration dans l’air (mg/m3)e |
|---|---|---|---|---|---|
| 9 à 13 ans | 1,1 | 1 | 42 | 7,86 × 10-2 | 2,70 × 10-2 |
| 14 à 18 ans | 1,5 | 1 | 62 | 7,26 × 10-2 | 3,10 × 10-2 |
| Adultes (19 ans et plus) | 1,5 | 2 | 74 | 1,22 × 10-1 | 4,30 × 10-2 |
a Selon Ficheux et coll. 2016 pour la quantité de produit.
b Comme mentionné par Ficheux et coll. 2015 et Loretz et coll. 2005
c Comme mentionné dans Canadian exposure factors used in human health risk assessment (SC 2019).
d Exposition cutanée calculée à l’aide de la formule suivante : (Quantité moyenne de produit (g/application) × fréquence quotidienne moyenne × concentration de produit (0,3 %) × facteur de conversion (1000 mg/g)) ÷ poids corporel (kg)
e Les pics de concentration dans l’air ont été modélisées à l’aide du modèle ConsExpo d’exposition à la vapeur, d’évaporation et de rejet constant et à partir des paramètres suivants : durée d’exposition de 24 h pour les jeunes de 9 à 18 ans et de 12 h pour les adultes (fréquence de 2 fois par jour), durée d’émission de 24 h pour les 9 à 18 ans et de 12 h pour les adultes, volume de la pièce de 20 m3, surface de rejet égale à la surface d’application (présumée égale à la surface de la tête (soit 585 cm2 pour un adulte, 370 cm2 pour un jeune de 14 à 18 ans et 350 cm2 pour un enfant de 9 à 13 ans), taux de ventilation de 0,6/h, matrice de masse moléculaire de 1000 g/mol et température d’application de 32 °C.
| Groupe d’âge | Quantité moyenne de produit (g/application)a | Facteur de rétention | Exposition cutanée (mg/kg p.c./j)b | Pic de concentration dans l’air (mg/m3)c |
|---|---|---|---|---|
| 2 à 3 ans | 5,2 | 0,1 | 3,47 × 10-2 | 1,10 × 10-2 |
| 4 à 8 ans | 7,8 | 0,1 | 3,39 × 10-2 | 2,10 × 10-2 |
| 9 à 13 ans | 7,8 | 0,1 | 1,86 × 10-2 | 2,60 × 10-2 |
| 14 à 18 ans | 10 | 0,1 | 1,61 × 10-2 | 3,00 × 10-2 |
| Adultes (19 ans et plus) | 13,1 | 0,1 | 1,95 × 10-2 | 4,10 × 10-2 |
a Selon Loretz et coll. 2008, pour les adultes, Ficheux et coll. 2016 pour les 14 à 18 ans, 9 à 13 ans et 4 à 8 ans, et Garcia-Hidalgo et coll. 2017 pour les 2 à 3 ans; fréquence présumée de 1 pour toutes les sous-populations hormis les adultes, pour lesquels une fréquence de 1,1 a été présumée, selon Loretz et coll. 2008.
b Exposition cutanée calculée à l’aide de la formule suivante : (quantité moyenne de produit (g/application) × fréquence quotidienne moyenne × concentration de produit (1 %) × facteur de conversion (1000 mg/g)) ÷ poids corporel (kg)(15 kg pour les 2 à 3 ans, 23 kg pour les 4 à 8 ans, 42 kg pour les 9 à 13 ans, 62 kg pour les 14 à 18 ans et 74 kg pour les adultes) [SC 2019].
c Les pics de concentration dans l’air ont été modélisés à l’aide du modèle ConsExpo d’exposition à la vapeur, d’évaporation et de rejet constant, à supposer que 100 % de la dose appliquée fût disponible pour l’évaporation et à partir des paramètres suivants : durée d’exposition de 10 min, durée d’émission de 10 min (selon l’étiquette du produit, qui mentionne qu’il faut laisser sécher les cheveux pendant 10 min avant de les rincer), volume de la pièce de 10 m3 (salle de bain), surface de rejet égale à la surface d’application (présumée équivalente à la moitié de surface des mains et de la surface de la tête pour toutes les sous-populations, hormis les bébés de 2 à 3 ans, chez lesquels la surface d’application a été présumée égale à la moitié de la surface de la tête (1040 cm2 pour les adultes, 755 cm2 pour les 14 à 18 ans, 655 cm2 pour les 9 à 13 ans, 520 cm2 pour les 4 à 8 ans et 275 cm2 pour les 2 à 3 ans), taux de ventilation de 2/h (salle de bain), matrice de masse moléculaire de 1000 g/mol et température d’application de 32 °C.
| Groupe d’âge | Quantité moyenne de produit (g/application)a | Facteur de rétention | Exposition cutanée (mg/kg p.c./j)b | Pic de concentration dans l’air (mg/m3)c |
|---|---|---|---|---|
| 4 à 8 ans | 132 | 0,1 | 5,74 | 7,50 × 10-2 |
| 9 à 13 ans | 152 | 0,1 | 3,62 | 8,60 × 10-2 |
| 14 à 18 ans | 160 | 0,1 | 2,58 | 9,10 × 10-2 |
| Adultes (19 ans et plus) | 160 | 0,1 | 2,16 | 1,40 × 10-1 |
a Selon le RIVM 2006, pour les adultes et les 14 à 18 ans, pour les 4 à 13 ans, la quantité de produit a été calculée à l’aide d’un ajustement de la surface.
b Exposition cutanée calculée à l’aide de la formule suivante : (quantité moyenne de produit (g/application) × concentration de produit (1 %) × facteur de rétention (0,1) × facteur de conversion (1000 mg/g)) ÷ poids corporel (kg) (23 kg pour un enfant de 4 à 8 ans, 42 kg pour un enfant de 9 à 13 ans, 62 kg pour un jeune de 14 à 18 ans et 74 kg pour un adulte) [SC 2019].
c Les pics de concentration dans l’air ont été modélisés à l’aide du modèle ConsExpo d’exposition à la vapeur, d’évaporation et de rejet constant, à supposer que 100 % de la dose appliquée était disponible pour l’évaporation (quantité de produit/j × concentration de 1 %) et à partir des paramètres suivants : durée d’exposition de 1,5 heure (la lotion permanente est laissée sur les cheveux pendant un maximum de 40 minutes avant le rinçage et la lotion fixante pendant un maximum de 15 minutes avant le rinçage; la durée d’exposition de 1,5 heure sert à estimer le temps de contact des lotions permanentes et fixant avec les cheveux, y compris le temps de rinçage), durée d’émission de 1,5 heure, surface de rejet égale à la surface d’application (présumée équivalente à la moitié de la surface de la tête pour toutes les sous-populations (585 cm2 pour les adultes, 370 cm2 pour les 14 à 18 ans, 350 cm2 pour les 9 à 13 ans et 305 cm2 pour les 4 à 8 ans)), taux de ventilation de 0,5/h, matrice de masse moléculaire de 1000 g/mol et température d’application de 32 °C.
| Groupe d’âge | Quantité moyenne de produit (g/application)a | Poids corporel (kg)b | Exposition cutanée (mg/kg p.c./j)c | Concentration dans l’air (mg/m3)d |
|---|---|---|---|---|
| 9 à 13 ans | 2,3 | 42 | 5,48 × 10-1 | 7,70 × 10-3 |
| 14 à 18 ans | 2,4 | 62 | 3,87 × 10-1 | 8,10 × 10-3 |
| Adultes (19 ans et plus) | 2,4 | 74 | 3,24 × 10-1 | 1,20 × 10-2 |
a Selon Ficheux et coll. 2016 pour la quantité de produit. La fréquence présumée était égale à 1 pour tous les groupes d’âge.
b Comme mentionné dans Canadian exposure factors used in human health risk assessment (SC 2019).
c Exposition cutanée calculée à l’aide de la formule suivante : (quantité moyenne de produit (g/application) × concentration de produit (1 %) × facteur de conversion (1000 mg/g)) ÷ poids corporel (kg)
d Les pics de concentration dans l’air ont été modélisés à l’aide du modèle ConsExpo d’exposition à la vapeur, d’évaporation et de rejet constant, à supposer que 100 % de la dose appliquée était disponible pour l’évaporation (quantité de produit/j × concentration de 1 %) et à partir des paramètres suivants : durée d’exposition de 24 heures, durée d’émission de 24 heures, volume de la pièce de 20 m3, surface de rejet égale à la surface d’application (présumée équivalente à un quart de la surface de la tête et à environ la moitié de la surface du visage (292,5 cm2 pour les adultes, 185 cm2 pour les 14 à 18 ans et 175 cm2 pour les 9 à 13 ans), taux de ventilation de 0,6/h, matrice de masse moléculaire de 100 g/mol (matrice de masse moléculaire pour un après-rasage contenant 42 % d’eau et 55 % d’éthanol (RIVM 2006) et température d’application de 32 °C.

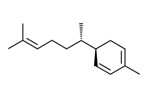
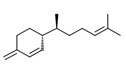
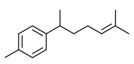
![[C(CC(C1C(C2)C(C)C)C3(C2)C)=C(C)C31]](/content/dam/eccc/images/pded/terpenes-group-2/20210203-Table2-1-9.jpg)
![CC1=CC[C@H]2C[C@@H]1[C@]2(C)CCC=C(C)C](/content/dam/eccc/images/pded/terpenes-group-2/20210203-Table2-1-10.jpg)