Évaluation préalable - Groupe de certaines substances ignifuges organiques - Phosphate de tri(méthylphényle)
Titre officiel : Évaluation préalable - Groupe de certaines substances ignifuges organiques - Phosphate de tri(méthylphényle)
Numéro de registre du Chemical Abstracts Service 1330-78-5
Environnement et Changement climatique Canada Santé Canada
Mai 2019
No de cat. : En14-366/2019F-PDF
ISBN 978-0-660-29859-7
Sommaire
En vertu de l’article 74 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)], les ministres de l'Environnement et de la Santé ont réalisé l’évaluation préalable du phosphate de tri(méthylphényle) (TCP) (no CAS 1330-78-5), communément appelé phosphate de tricrésyle. Le TCP appartient au groupe de certaines substances ignifuges organiques (SIO), groupe constitué de substances organiques ayant une fonction similaire, à savoir l’application à des maétriaux afin de ralentir l’ignition ou la propagation d’un incendie. Cette substance a été identifiée d’intérêt prioritaire pour une évaluation, car elle satisfait aux critères de catégorisation du paragraphe 73(1) de la LCPE (1999).
Le TCP n'est pas présent naturellement dans l'environnement. Au Canada, les résultats d'une enquête sur l'industrie ont indiqué qu’en 2011, pas de TCP n'a été produit au Canada, mais que de 1 000 à 10 000 kg de TCP pur et entre 100 et 1000 kg de TCP présent dans des mélanges, des produits commerciaux ou des produits disponibles pour les consommateurs y ont été importés. Au Canada, les utilisations confirmées du TCP incluent : adhésifs et produits d'étanchéité, pièces pour automobile, additif de lubrifiants et graisses résistant au feu, applications électroniques et électriques. À l’échelle internationale, le TCP est utilisé comme substance ignifuge et plastifiant pour des applications domestiques comme l’enduction d’envers de meubles, des adhésives et composés d’étanchéité, des pièces pour automobile, des applications aéronautiques, des applications électroniques et électriques, dans divers articles manufacturés extrudés tels que du poly(chlorure de vinyle) (PVC) souple et des bâches en PVC, dans des additifs extrême-pression pour lubrifiants et dans des fluides hydrauliques résistants au feu.
Les produits commerciaux mis en marché actuellement en tant que TCP sont constitués principalement d’un mélange des isomères m-TCP et p-TCP, la teneur de l’isomère o-TCP étant environ de 0,05 %. Aux fins de la présente évaluation, les trois isomères sont considérés avoir des propriétés chimiques et physiques identiques. Ils sont caractérisés par une solubilité dans l’eau modérée, un coefficient de partage octanol-eau modéré, une faible pression de vapeur et un faible point de fusion.
D’après des données expérimentales limitées et des données modélisées, le TCP n'est pas persistant dans l'eau, les sédiments, le sol ou l'air. Des données empiriques et modélisées sur son hydrolyse suggèrent une dégradation rapide qui augmente quand le pH de l'environnement augmente. D’après la faible volatilité modélisée et la courte demi‑vie dans l'air (18,74 h) et la distance de transport caractéristique estimée de 363 km, le TCP ne devrait pas séjourner dans l'air assez longtemps pour être transporté dans l'atmosphère sur une distance significative à partir de sa source de rejet.
D’après des données modélisées et des données tirées d’études empiriques sur la bioconcentration chez les poissons, le TCP est considéré avoir des potentiels de bioaccumulation et de bioconcentration faibles à modérés. Le TCP devrait être métabolisé rapidement par les poissons.
Selon des données modélisées et des études empiriques sur son écotoxicité, le TCP est considéré avoir un niveau de toxicité pour les organismes aquatiques allant de modéré à élevé, avec des effets chroniques et aigus démontrés d’environ 0,001 à 1 mg/L. Il n’existe pas de données sur la toxicité du TCP dans les sédiments, le sol ou pour la faune.
Les eaux usées résultant d’activités de traitement industriel devraient conduire au rejet de TCP dans l'environnement au Canada. Bien que TCP puisse être présent dans des produits commerciaux et des produits disponibles pour les consommateurs, les renseignements sur les rejets dans l'environnement par cette voie sont limités et devraient être minimaux et diffus, en particulier si on tient compte du faible niveau d'utilisation identifié de cette substance au Canada. Des scénarios d'exposition ont été élaborés pour les rejets industriels, de tels rejets dans l'eau entraînant une faible répartition du TCP dans les sédiments. Bien qu’il n’existe pas de données sur la toxicité dans le sol, l'exposition des mammifères vivant dans le sol due à l'application de biosolides contenant du TCP a été estimée. Pour traiter des expositions potentielles des prédateurs fauniques qui consomment des poissons ayant accumulé du TCP, une modélisation de l'apport quotidien total a été effectuée pour le vison et la loutre de rivière en tant qu'espèces représentatives de la faune. Des analyses du quotient de risque, intégrant des estimations prudentes de l'exposition et les renseignements sur la toxicité ont été faites. Elles indiquaient un faible potentiel de risque pour les organismes aquatiques, les mammifères vivant dans le sol et les mammifères piscivores.
Compte tenu de tous les éléments de preuve avancés dans la présente évaluation préalable, le risque d’effet nocif sur l’environnement dû au TCP est faible. Nous concluons que le TCP ne satisfait à aucun des critères de l’alinéa 64a) ou 64b) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l'environnement ou sa diversité biologique, ou qui constituent ou peuvent constituer un danger pour l’environnement nécessaire à la vie.
Aucune classification des effets sur la santé du TCP (contenant moins de 0,1 % de o-TCP) par des organismes de réglementation nationaux ou internationaux n’a été trouvée. D'après les renseignements disponibles, le TCP n'est ni cancérogène ni génotoxique. En se basant sur des études réalisées avec des animaux, les effets critiques sur la santé dus à une exposition au TCP sont des effets sur les ovaires et le cortex surrénalien. Les principales sources d’exposition de la population générale au Canada devraient être les milieux de l’environnement (air, poussière, sol, eau), les aliments dont le lait maternel et l’utilisation de produits disponibles pour les consommateurs comme des meubles (avec garniture ou mousse traitée) et des lubrifiants.
Les marges d’exposition entre les estimations d’absorption due aux milieux de l’environnement, aux aliments et au contact avec des produits disponibles pour les consommateurs et les niveaux d'effet sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l'exposition. Par conséquent, nous concluons que le TCP ne satisfait à aucun des critères de l'alinéa 64c) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Conclusion globale
Nous concluons que le TCP ne satisfait à aucun des critères de l'article 64 de la LCPE.
1. Introduction
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)] (Canada 1999), les ministres de l'Environnement et de la Santé ont procédé à l’évaluation préalable de substances afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
L'Initiative des groupes de substances constitue un élément clé du Plan de gestion des produits chimiques du gouvernement du Canada. Le groupe de certaines substances ignifuges organiques comprend dix substances qui ont été déclarées priorités d'action, car elles satisfaisaient aux critères de catégorisation en vertu de l'article 73 de la LCPE (1999) ou étaient considérées comme prioritaires en raison de préoccupations relatives à l’environnement et/ou la santé humaine (Environnement Canada, Santé Canada 2007). Toutes ces substances ont une fonction similaire, l'application sur des matériaux en vue de ralentir l'ignition et la propagation du feu. En outre, ces substances sont des substituts potentiels à d'autres produits ignifuges qui sont actuellement soumis à des contrôles règlementaires ou à un retrait progressif au Canada et/ou à l'échelle mondiale.
La présente évaluation préalable porte sur la substance phosphate de tri(méthylphényle), ci-après appelée TCP, autrefois appelée phosphate de tricrésyle (no CAS 1330-78-5). Cette substance a été identifiée lors de la catégorisation des substances de la Liste intérieure des substances (LIS) réalisée en vertu du paragraphe 73(1) de la LCPE (1999) comme satisfaisant aux critères des substances présentant le plus fort risque d'exposition des personnes au Canada. Bien que cette substance ne réponde pas aux critères de catégorisation relatifs à la persistance et à la bioaccumulation, elle satisfait à ceux de toxicité intrinsèque pour des organismes non humains.
La présente évaluation préalable tient compte de renseignements sur les propriétés chimiques, les dangers, les utilisations et l'exposition au TCP. Les données pertinentes pour l'évaluation préalable de cette substance sont tirées de publications originales, de documents de synthèse et d'évaluation, de rapports de recherche de parties intéressées et de résultats de recherches bibliographiques récentes couvrant la période allant jusqu'en janvier 2017 pour les sections ayant trait à l’environnement et à la santé humaine. Une recherche bibliographique ciblée a été réalisée jusqu’en juillet 2018 pour des éléments de la partie portant sur les effets sur la santé. Des données empiriques tirées d'études clés, ainsi que certains résultats provenant de modélisation, nous ont servi à tirer nos conclusions. Lorsqu'ils étaient disponibles et pertinents, les renseignements contenus dans des évaluations effectuées par d'autres juridictions ont été utilisés.
La présente évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE travaillant à Santé Canada et d'Environnement et Changement climatique Canada. Elle intègre des intrants d'autres programmes exécutés au sein de ces ministères. Les parties de la présente évaluation préalable portant sur la santé humaine et l'environnement ont fait l'objet d'un examen externe écrit par des pairs et/ou de consultations. Des commentaires portant sur les parties techniques relatives à l'environnement ont été faits par le Dr Jon Arnot (Arnot Research and Consulting) et M. John A. Biesemeier (Chemtura Corporation). Des commentaires sur les parties techniques concernant la santé humaine ont été faits par Raymond York (R.G. York & Associates), Donna Vorhees (The Science Collaborative) et Bernard Gadagbui (Toxicology Excellence for Risk Assessment (TERA)). De plus, l’ébauche de la présente évaluation préalable a fait l’objet d’une période de commentaires du public de 60 jours. Certaines parties ayant trait à la santé humaine ont fait l’objet d’une consultation externe ciblée écrite par des pairs. Des commentaires ont été reçus de Richard Manderville de l’Université de Guelph, de Mohamed Abou-Elwafa Abdallah de l’Université de Birmingham et de Kebede K. Kefeni de l’Université de technologie de Tshwane. Bien que des commentaires externes aient été pris en considération, le contenu final et les conclusions de la présente évaluation préalable sont la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
La présente évaluation préalable est centrée sur des renseignements jugés critiques afin de déterminer si cette substance satisfait aux critères de l'article 64 de la LCPE (1999), en étudiant ces renseignements et en suivant une approche basée sur le poids de la preuve et le principe de précautionNote de bas de page 1 . Nous présentons dans la présente évaluation préalable les renseignements critiques et les éléments pris en compte à partir desquels nous avons tiré nos conclusions.
2. Identité de la substance
La présente évaluation préalable porte sur la substance dénommée phosphate de tri(méthylphényle) (no CAS 1330-78-5), qui fait partie du groupe de certaines substances ignifuges organiques. Le phosphate de tri(méthylphényle) était autrefois connu sous le nom de phosphate de tricrésyle. Une liste des autres noms chimiques (des noms commerciaux) est disponible dans le National Chemical Inventory (NCI 2013). Aux fins de la présente évaluation, cette substance sera appelée TCP. L'identité de la substance pour le TCP est donnée dans le tableau 2-1, où elle est décrite au moyen d’une structure comportant le groupe méthyle à des positions indéfinies.
Il existe trois isomères du TCP différenciés par la position du groupe méthyle : phosphate de tri(2-méthylphényle), phosphate de tri(3-méthylphényle) et phosphate de tri(4-méthylphényle), appelés ci-après o-TCP (no CAS 78-30-8), m-TCP (no CAS 563-04-2) et p-TCP (no CAS 78-32-0). L'identité du TCP et de ses isomères est présentée dans le tableau 2-1. D’autres noms du TCP et de ses isomères sont disponibles (ECCC 2018a).
| No CAS (acronyme) | Structure chimique | Masse moléculaire | Formule chimique |
|---|---|---|---|
| 1330-78-5 (TCP) | 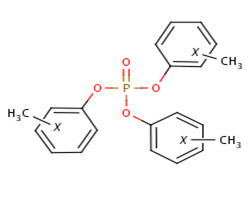 |
368,37 g/mol | C21H21O4P |
| 78-30-8 (o-TCP) | 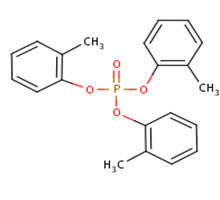 |
368,37 g/mol | C21H21O4P |
| 563-04-2 (m-TCP) | 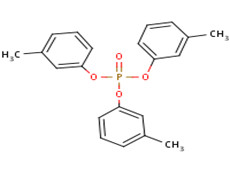 |
368,37 g/mol | C21H21O4P |
| 78-32-0 (p-TCP) | 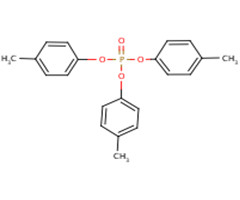 |
368,37 g/mol | C21H21O4P |
La plupart des études sur le TCP ont été faites avec des produits commerciaux. Les mélanges commerciaux de TCP peuvent contenir de 65 à 70 % de phosphate de tri(méthylphényle) (mélange de m-TCP et de p-TCP avec 0,05 % de o-TCP), 0,5 % de phosphate de triphényle et moins de 0,05 % de phénol et de méthylphénol libres (Bayer 2002). Habituellement, le TCP est produit par la réaction d'un mélange synthétique de 3-méthylphénol et de 4-méthylphénol avec de l'oxychlorure de phosphore (Ashford 1994, UK EA 2009) afin de limiter la formation d'isomères indésirables (p. ex. du o-TCP) et de contaminants (Sjögren et al. 2010). En général, pour les premières pratiques de production, des crésols (méthylphénols) dérivés du pétrole ou du goudron de houille étaient utilisés [crésols naturels] (Sjögren et al. 2010). Bien que la production de TCP au moyen de crésols naturels ait été rapportée de nos jours (p. ex., Grands Lacs 2010, Chemnet 2014), les activités de production ont changé au fil du temps et la quantité de o-TCP présente a été réduite à son minimum (UK EA 2009, Sjögren et al. 2010). Il est toutefois difficile d'obtenir des données sur la quantité de o-TCP et d'autres isomères du 2-méthylphényle dans des matériaux contenant du TCP commercialisés à l'échelle internationale (Sjögren et al. 2010). Des estimations prudentes allant de 0,1 à 1 % de o-TCP ont été rapportées (Sjögren et al. 2010, ACGIH 2012 cité dans HSDB 2014). Toutefois, il a été rapporté que la concentration est habituellement inférieure à 0,1 % (Sjögren et al. 2010). De plus, il est typiquement revendiqué que les matériaux de « nouvelle génération » ont une teneur en o-TCP envore plus faible (Sjögren et al. 2010). En se basant sur ces divers renseigements, il est raisonnable de penser que les mélanges de TCP contiennent moins de 0,1 % de o-TCP.
3. Propriétés physiques et chimiques
Les données clés sur les propriétés physiques et chimiques du TCP et de ses isomères sont données dans le tableau 3-1. Les données tirées d'études empiriques ont fait l'objet d'un examen critique quant à leur qualité.
Des modèles de type QSAR (relations quantitatives structure-activité) ont été utilisés pour générer des données dans le cas de certaines des propriétés physiques et chimiques du TCP. Ces modèles sont baés principalement sur des méthodes d'addition de fragments, c'est-à-dire qu'ils additionnent les contributions des fragments sous-structuraux d'une molécule pour effectuer des prédictions sur une propriété ou un paramètre. La plupart de ces modèles reposent sur la notation SMILES (Simplified Molecular-Input Line-Entry System) (ECCC 2018a).
Bien que la méthode de compensation des moindres carrés ait été appliquée pour harmoniser les propriétés physiques et chimiques du TCP (Schenker et al. 2005), les données empiriques originales ont été utilisées de préférence comme propriétés physiques et chimiques clés pour la présente évaluation. Le TCP (le mélange d'isomères) est un liquide transparent, incolore ayant une très légère odeur aromatique (PISSC 1990). Le TCP commercialisé est un liquide transparent allant d'incolore à légèrement jaune (UK EA 2009, Ashford 1994, Bayer 2002, Wildlife International Ltd. 2002, OMS 1990). Le TCP a un bas point de fusion de -33 oC, tandis que celui de ses trois isomères est plus élevé, allant de 11 à 78 oC (UK EA 2009, OMS 1990). Le point d'ébullition du TCP est de 476,06oC à une pression atmosphérique standard, tandis que celui de ses isomères est plus faible à diverses pressions mesurées. La masse moléculaire du TCP est de 1160 kg/m3 à 20 oC, comparable à celle de ses trois isomères.
Le TCP se caractérise par une solubilité dans l’eau modérée à la température ambiante et une très faible volatilité due à sa faible pression de vapeur et à sa faible constante de Henry. Cette substance a également un coefficient de partage octane/eau allant de modéré à élevé (voir le tableau 3-1). En milieu alcalin, le TCP peut facilement être hydrolysé en phosphate di(méthylpropyle) et en méthylphénol, mais il est stable dans des milieux neutres ou acides (PISSC 1990, van der Veen et de Boer 2012, OMS 1990). Environnement Canada a évalué le méthylphénol et, en mai 2016, a conclu qu'il ne satisfaisait à aucun des critères de l’alinéa 64(a), 64(b) ou 64(c) de la LCPE (Environnement Canada 2016). Par conséquent, nous ne discuterons pas du méthylphénol dans la présente évaluation.
| Propriété | Valeur | Température (°C) | Référence |
|---|---|---|---|
| Point de fusion (°C) | -33 | S.O. | EPA 2010 (Midwest Research Institute 1977) UK EA 2009 (OMS 1990) |
| Point d'ébullition (°C) | 476,06 (pression atmosphérique standard de 101 325 Pa) | S.O. | MPBPVP, v.1.43 |
| Masse volumique (kg/m3) | 1160 | 20 | UK EA 2009 (Ashford 1994) |
| Pression de vapeur (Pa) | 6,6 x 10-5 | 25 | UK EA 2009 (extrapolé) |
| Constante de Henry (Pa.m3/mol) | 6,75 x 10-2 (6,843 x 10-7 atm.m3/mol) | 25 | Calculé à partir de la masse moléculaire, de la pression de vapeur et de la solubilité dans l’eau données dans le présent tableau |
| log Koe (sans dimension) | 5,11 | 25 (température ambiante) | Saeger et al. 1979 |
| log Kco (sans dimension) | 3,52 | S.O. | KOCWIN v.2.00 |
| log Koa (sans dimension) | 9,59 | S.O. | KOAWIN v.1.10 |
| log Kae (sans dimension) | -4,564 | 25 | Calculé à partir de la constante de Henry donnée dans le présent tableau |
| Solubilité dans l’eau (mg/L) | 0,36 | 25b | Saeger et al. 1979 |
| pKa (sans dimension) | NA | NA | NA |
Abréviations : Koe = coefficient de partage octanol-eau; Kco = coefficient de partage carbone organique-eau; Koa = coefficient de partage octanol-air; pKa, constante de dissociation acide; s.o. = sans objet; NA = non applicable
a Les valeurs entre parenthèses représentent les valeurs originales rapportées par les auteurs ou estimées au moyen de modèles.
4. Sources
Le TCP est une substance synthétique. Elle n'est pas présente naturellement dans l'environnement. En se basant sur les réponses à une enquête récente menée pour l’année civile 2011en vertu de l'article 71 de la LCPE, le TCP n'a pas été produit au Canada, mais de 1000 à 10 000 kg y ont été importés soit sous forme de substance pure (1000-10 000kg) soit dans des produits commerfiaux ou des produits disponibles pour les consommateurs (100-1000 kg) (EC 2013-2014). Bien que cette enquête visait des produits, il est possible que les importations de produits commerciaux ou de produits disponibles pour les consommateurs aient été sous-estimées.
Le TCP est une substance chimique produite en grande quantité aux États-Unis, où sa production est estimée de 1 à 10 millions de livres (EPA 2010). En 1998, 2002 et 2006, de 412 à 4082 tonnes (454 à 4500 tons) de TCP ont été produites aux États‑Unis (van der Veen et de Boer 2012) et, en 2008, 0,73 tonne, 0,54 tonne, 3,3 tonnes et 4,5 tonnes ont respectivement été produites/utilisées en Norvège, au Danemark, en Finlande et en Suède (van der Veen et de Boer 2012). Il y a deux sites de production connus en Europe. Toutefois, les renseignements sur les quantités produites et la taille du marché sont confidentiels (UK EA 2009).
5. Utilisations
Selon les déclarations faites en vertu de l'article 71 de la LCPE, au Canada le TCP a des applications dans des adhésifs et produits d'étanchéité, dans pièces pour automobile, des aéronefs, des produits électriques ou électroniques et comme lubrifiants et additifs pour graisse résistant au feu (EC 2013-2014). Dans le cadre de tests préliminaires réalisés par Santé Canada sur des articlesmanufacturés pour enfants achetés au Canada en 2014, du TCP a été détecté dans une chaise en mousse à un niveau supérieur à la limite de dosage rapportée de 0,7 %. Toutefois, aucun TCP n'a été détecté dans les 23 autres articles manufacturés pour enfants (p. ex., coussins d'allaitement, jouets) (Santé Canada 2014). Selon la documentation du fabricant (ICL 2013c), le TCP est commercialisé pour servir dans de la mousse de rembourrage de meubles.
Le TCP est inscrit sur la Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques de Santé Canada (plus couramment appelée Liste critique des ingrédients de cosmétiques), un outil administratif utilisé par Santé Canada pour avertir les fabricants et d’autres que certaines substances qui seraient présentes dans un cosmétique pourraient contrevenir à : a) l'interdiction générale mentionnée à l'article 16 de la Loi sur les aliments et drogues; ou b) une disposition du Règlement sur les cosmétiques. La Liste critique interdit l'utilisation de TCP (synonyme : phosphate de tricrésyle) (Santé Canada [modofié en 2015]).
Le TCP n'est pas inscrit comme additif alimentaire approuvé sur les Listes des additifs alimentaires autorisés, qui ont été incorporées comme référence dans les autorisations respectives de commercialisation émises en vertu de la Loi sur les aliments et drogues (Santé Canada, [modifié en 2017]). Le TCP n'a pas été identifié comme étant utilisé/présent dans des formulations pour matériaux d'emballage alimentaire, mais il est présent dans des additifs indirects utilisés comme lubrifiant pour des pièces d'équipement ou de machine qui n'entrent pas en contact avec les aliments (courriel de 2013 de la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada; source non référencé). Le TCP n'est inscrit ni dans la Base de données sur les produits pharmaceutiques, ni dans la Base de données interne sur les ingrédients non médicinaux de la Direction des produits thérapeutiques, ni dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN), ni dans la Base de données sur les produits de santé naturels homologués (BDPSNH) en tant qu'ingrédient médicinal ou non dans les produits pharmaceutiques finaux, des produits de santé naturels ou des médicaments vétérinaires au Canada (BDPP [modifiée en 2017], BDIPSN [modifiée en 2017], BDPSNH [modifiée en 2016], courriel de la Direction des produits thérapeutiques de Santé Canada adressé au Bureau de gestion du risque de Santé Canada en 2013; source non référencée).
La Commission for Environmental Cooperation (CEC) a mené un projet pour lequel la présence de substances ignifuges émergentes a été recherchée dans des produits d’ameublement du Canada, des États-Unis et du Mexique au moyen d’un criblage par fluorescence X (XRF) suivi d’une analyse par CG-SM (CEC 2015). Le TCP était l’un des seize composés ignifuges évalués lors de cette étude, mais il n’a été identifié dans aucun des échantillons prélevés dans les 132 produits achetés entre décembre 2014 et avril 2015.
À l'échelle internationale, les applications du TCP comprennent également plusieurs articles manufacturés, comme des meubles et des appareils électroniques. Il a été rapporté que le TCP était appliqué comme enduction d'envers de rembourrage pour meubles aux États-Unis (CPSC 1998, Piccirillo 1999, NRC 2000). Du TCP est utilisé dans le rembourrage des meubles en cuir synthétique d’après un rapport de la Commission européenne (2011) et dans des housses de sièges en PVC (SinoHarvest 2011). Au Japon, il a été rapporté que du TCP avait été détecté dans des rideaux, du papier peint, des revêtements de sol et des appareils électroniques (Kajiwara et al. 2011). Du TCP est utilisé comme produit ignifuge dans le polystyrène couramment utilisé dans des ordinateurs, des présentoirs et des réfrigérateurs. En outre, du TCP utilisé comme produit ignifuge a été identifié dans des cartes à circuits imprimés (AFEA 2001). Le TCP peut aussi être utilisé dans divers articles utilitaires, dont des chaussures, des imperméables et des sacs à main (SinoHarvest 2011), ainsi que dans des gants en PVC (Siret-Alatrista et al. 2010) ou des vêtements en cuir synthétique (PISSC 1990, Ash et Ash 2000, Ash et Ash 2003). Plusieurs autres applications du TCP concernent l'intérieur des automobiles (PISSC 1990, ATSDR 1997). Des utilisations mineures ont aussi été rapportées dans des montures de lunettes (Siret‑Alatrista et al. 2010) et une jambe artificielle (Grimalt et al. 2009). Du TCP est également utilisé dans divers produits extrudés, comme des films et isolants de câbles en poly(chlorure de vinyle) (PVC) souple, des tuyaux, des courroies de convoyeur pour les mines, des gaines de ventilation et des bâches en polystyrène ou en PVC (Weil 2001, Ash et Ash 2003, UK EA 2009, SinoHarvest 2011).
À l'échelle internationale, le TCP est utilisé comme additif ignifuge et plastifiant dans une gamme de produits. Il est utilisé avec le nitrate de cellulose, l'éthylcellulose, des laques, des adhésifs, pour la dispersion de pigments, dans des films photographiques et comme clarifiant pour la production de polymères de caséine (PISSC 1990, Weil 1993, Ashford 1994, UK EA 2009). En raison de ses propriétés antiusure, anticorrosion, antimousse, lubrifiantes et ignifuges, le TCP est utilisé comme additif dans les huiles à moteur et pour turbines et des fluides hydrauliques de systèmes hydrauliques d’aéronefs (PISSC 1990, Okazaki et al. 2003).
6. Rejets dans l'environnement
Les rejets anthropiques dans l'environnement dépendent de différentes pertes qui surviennent lors de la production, de l'utilisation industrielle, de l'utilisation commerciale ou par les consommateurs, de la durée de vie utile et de l'élimination de la substance. En raison de l'utilisation du TCP comme substance ignifuge, les rejets de cette substance dans l'environnement au Canada devraient être diffus, avec quelques sources ponctuelles (p. ex., à partir des installations de traitement). Les rejets dus aux produits commerciaux et aux produits disponibles pour les consommateurs peuvent se produire tant à l'intérieur qu'à l'extérieur.
Selon des déclarations faites en vertu de l'article 71 de la LCPE, du TCP est importé au Canada sous forme pure et dans des produits commerciaux et des produits disponibles pour les consommateurs (EC 2013-2014). Au Canada, le TCP est utilisé comme produit ignifuge dans plusieurs secteurs. Au Canada, les activités dans le cadre desquelles on utilise du TCP et qui sont susceptibles d'entraîner des rejets ponctuels dans l'environnement comprennent le mélange dans des produits et potentiellement le nettoyage de contenants.
Il est probable que le rejet de TPC dans l'environnement surviendra lors d'activités industrielles. Ces rejets devraient principalement avoir lieu dans le milieu aquatique suite au traitement d’eaux usées. Des rejets dans le sol pourraient aussi se produire lors de l'épandage de biosolides sur des terres agricoles et des pâturages. Le TPC n'est pas une substance à déclaration obligatoire à l'Inventaire national des rejets de polluants (INRP 2011, données de 1994 à 2009).
7. Concentrations environnementales mesurées
À l'échelle internationale, les niveaux de TCP dans l'air et dans l'eau semblent être faibles, avec des niveaux sensiblement plus élevés dans les sédiments et les poissons (Boethling et Cooper 1985). Une liste détaillée des concentrations disponibles de TCP et de ses isomères, provenant de la littérature accessible à tous, dans l'air, l'eau, les sédiments, le sol, le biote et d'autres milieux est disponible dan des documents d'appui (ECCC 2018b). Toutefois, les données sur les concentrations de TCP et de ses isomères dans l'environnement au Canada sont limitées, mais elles sont disponibles pour l'eau et certains biotes.
7.1 Air
Au Canada, aucune donnée sur les concentrations de TCP dans l’air n’est disponible (ECCC 2018b).
Des concentrations de TCP allant de 0,01 et 2 ng/m3 ont été mesurées dans des échantillons d'air prélevés près des installations ayant produit des phosphates d'aryle à Nitro et à Gallipolis Ferry, en Virginie-Occidentale, aux États-Unis (Boethling et Cooper 1985).
Au Japon, trois études réalisées entre 1974 et 2000 ont fait état de concentrations de TCP dans l'air. Des concentrations allant d’une non-détection à 70,3 ng/m3 ont été mesurées dans 3 des 19 échantillons d'air collectés dans des villes très industrialisées de l'île de Shikoku (PISSC 1990). Toutefois, des concentrations moins élevées allant de la non-détection à 21,4 ng/m3 ont été rapportées lors de deux autres études (PISSC 1990, Kishi et Sekine 2003, Takimoto et al. 1999). Takimoto et al., (1999) ont conclu que dans le bassin de la rivière Kurose au Japon, la principale source de TCP dans l'air, probablement adsorbé sur la matière particulaire, provenait des gaz d'échappement des motocyclettes et des automobiles.
Dans une étude plus récente menée en Finlande, du TCP n’a pas été détecté à un niveau supérieur à la limite de détection de 0,0007 ng/m3 (une valeur semi-quantitative déterminée par rapport à un autre produit ignifuge de type organophosphate) dans un échantillon d'air prélevé en juillet 2004 dans une région rurale du nord de la Finlande — un endroit choisi pour vérifier le potentiel de transport atmosphérique à longue distance (Marklund et al. 2005).
7.2 Eau
Il existe des études limitées sur la caractérisation des concentrations de TCP dans l'eau (ECCC 2018b). Au Canada, le TCP n’a pas été détecté dans les eaux libres des Grands Lacs, mais dans les affluents du lac Ontario et du lac Érié des concentrations de TCP allant respectivement de 11 à 22 ng/L et de 2,5 à 10 ng/L ont été mesurées en 2010 et 2011 (Lee et al. 2011).
Aux États-Unis, diverses études ont cherché à déterminer les niveaux de TCP dans les eaux de surface (Boethling et Cooper 1985). Cependant, étant donné que les limites de détection d'un grand nombre de ces études étaient élevées (p. ex. ≥100 ng/L), un seul échantillon d'eau de surface avec une concentration mesurée de 20 ng/L a été rapporté en aval d'une installation de production de phosphates d'aryle (Boethling et Cooper 1985).
En Europe, trois études indépendantes menées dans des rivières du Danemark, de Rome et d'Autriche (Bacaloni et al. 2007, Martinez-Carballo et al. 2007, UK EA 2009) ont rapporté des concentrations de TCP inférieure à la limite de détection.
Au Japon, au cours des années 1970 et 1990, des mesures de TCP ont été faites dans les eaux de rivières et de lacs. Toutefois, seules quelques études ont rapporté des des concentrations mesurées de TCP supérieures à la limite de détection. Des concentrations de o-TCP, de p-TCP et de m-TCP inférieures à 500 ng/L [les limites de détection allaient de 5 à 2500 ng/L (UK EA 2009, Cho et al. 1994, 1996)] ont été rapportées. Les auteurs de ces études ont également indiqué que les concentrations de TCP supérieures à la limite de détection ont été généralement mesurées dans des régions très polluées et souvent dans des échantillons d'eau contenant des sédiments en suspension et des sédiments (UK EA 2009). En Chine, des échantillons d'eau ont été prélevés sur 17 sites le long de la rivière Songhua, des concentrations de m-TCP allant de 5,2 à 45 ng/L ont été détectées (Wang et al. 2011).
7.3 Sédiments
Au Canada, un projet de recherche a été mené en 2012 et 2013, respectivement dans le bassin de la rivière Niagara et le bassin de la rivière Mississauga du lac Ontario (De Silva et Muir 2016). Une carotte de sédiments a été prélevée sur chaque site. Les concentrations moyennes mesurées de TCP (total de tous les isomères) étaient de 0,011 mg/kg (poids sec) pour le bassin de la Niagara et de 0,0082 mg/kg pour le bassin de la Mississauga.
Des études réalisées ailleurs avant 2005, principalement dans les années 1980 et 1990, ont fait état de la détection de TCP dans des sédiments près de zones industrialisées (ECCC 2018b).
Aux États-Unis, la présence de TCP dans les sédiments de lacs et de rivières d'eau douce fait l’objet d’une surveillance. Au début des années 1980, les concentrations de TCP dans les sédiments des zones industrialisées du fleuve Delaware, de la rivière Kanawha, de la rivière Saginaw, du port de Baltimore et de la rivière Detroit allaient de la non-détection à (limite de détection de 0,2 mg/kg) à 1,3 mg/kg (Boethling et Cooper 1985). De 1988 à 1990, des concentrations de TCP dans les sédiments allant 0,05 à 3,40 mg/kg (ps) (le niveau moyen était de 1,1 mg/kg ps) ont été mesurées dans les 10 échantillons prélevés dans la rivière Grand Calumet en Indiana (Hoke et al. 1993).
En Europe, du TCP a été détecté dans les sédiments de sources d'eau douce à des concentrations allant de la non-détection à 0,39 mg/kg (PS) au Danemark, en Norvège, en Autriche et en Allemagne (Ricking et al. 2003, Martinez-Carballo et al. 2007, UK EA 2009, van der Veen et de Boer 2012). Les concentrations dans des sédiments marins allaient de la non-détection à 0,37 mg/kg (ps) au Danemark (UK EA 2009).
Kawagoshi et al. (1999) ont rapporté des concentrations de TCP allant de la non‑détection à 2,558 mg/kg (ps) sur une période de 7 ans (1991 à 1997) sur le site d'enfouissement de déchets solides au Japon. En 1992, des concentrations des isomères du TCP dans les sédiments allant de de la non-détection à 0,08 mg/kg ont été mesurées dans le bassin de la rivière Kurose (Cho et al. 1994). Du TCP a également été mesuré dans un échantillon de sédiments marins, à une concentration de 0,004 mg/kg (ps), à Tokyo (Wakabayashi 1980).
7.4 Sol
La littérature existante renferme peu de références sur les concentrations de TCP dans les sols (ECCC 2018b), et celles identifiées sont plus anciennes (avant 1996). Aucune donnée sur les concentrations de TCP dans les sols au Canada n'est disponible.
Aux États-Unis, des concentrations de TCP ont été mesurées dans les sols de bases de l'armée de l'air contaminés par des fluides hydrauliques, allant de 0,02 à 130 mg/kg (David et Seiber 1999b). En outre, du TCP a été détecté dans les sols près d'installations de production de phosphates d'aryle à Gallipolis Ferry, en Virginie‑Occidentale, les concentrations allant de 1,0 à 4,0 mg/kg (Boethling et Cooper 1985).
Au Japon, les concentrations d'isomères du TCP mesurées dans les sols près d'une autoroute et dans une forêt allaient de la non-détection à 1,52 mg/kg (Takimoto et al. 1999). Les concentrations du m-TCP étaient supérieures à celles de o-TCP et de p-TCP (Takimoto et al. 1999).
7.5 Biote
Quelques études font état de concentrations de TCP dans le biote (ECCC 2018b). Au Canada, 0,12 ng/g poids humide (ph) de TCP a été mesuré dans un homogénat d'œuf du goéland argenté prélevé dans la région des Grands Lacs (Chen et al. 2012). Aucune autre donnée sur les concentrations de TCP dans le biote au Canada n’a été trouvée.
Aux États-Unis, les concentrations de TCP dans la végétation près d'installations de production de phosphates d'aryle à Gallipolis Ferry, en Virginie-Occidentale, allaient de 1 à 20 mg/kg ph (Boethling et Cooper 1985). Du TCP a aussi été mesuré dans des poissons près d'une usine de production de phosphate de triaryle, à une concentration de 2-5 g/kg ph (Muir 1984). Une concentration de TCP de 40 µg/kg ph a été mesurée dans un esturgeon de la rivière Columbia, dans une région en aval de plusieurs usines de traitement de métaux (Lombardo et Egry 1979, cité dans UK EA 2009).
En Suède, du TCP a été mesuré dans les muscles de divers poissons de lacs et de zones côtières (2003-2007), à des concentrations allant de 1,8 à 10 ng/g lipides (pl) (Sundkvist et al. 2010).
Du TCP a été mesuré à une concentration de 45,4 ng/g pl dans Epinephelus corallicola collecté dans la baie de Manille, aux Philippines (UK EA 2009, Kim et al. 2011).
7.6 Autres milieux
Quelques données sur la concentration de TCP dans des effluents, des boues ou des biosolides sont disponibles (ECCC 2018b). Du TCP a été mesuré dans l'effluent d'usines de traitement des eaux usées au Canada, à une concentration de 1,14 ng/L (Woudneh et al. 2015) et de <0,50 à 24,1 ng/L (médiane de 4,01 ng/L) (De Silva et al. 2017), et en Autriche et au Danemark, à des concentrations allant respectivement de la non-détection à 55 ng/L en 2005 (Martinez-Carballo et al. 2007) et de la non-détection à 530 ng/L (limite de détection de 20 ng/L) (UK EA 2009). Du TCP a aussi été mesuré dans 3 des 15 échantillons de biosolides d'eaux usées collectés au Danemark, à une concentration moyenne de 613 ng/kg ps (UK EA 2009).
Au Japon, TCP a été mesuré dans l'effluent de cinq complexes industriels de machinerie, à des concentrations allant de la non-détection à 560 ng/L (Cho et al. 1994), ainsi que dans l’effluent de cinq usines de traitement des eaux usées de la ville de Kitakyushu, à des concentrations allant de 400 à 580 ng/L (LD = 60 µg/L) (Ishikawa et al. 1985c, cité dans UK EA 2009).
8. Devenir et comportement dans l'environnement
8.1 Distribution dans l'environnement
Le TCP devrait être rejeté principalement dans les eaux usées d'installations industrielles qui en utilisent comme additif ignifuge. Le TCP est partiellement éliminé par adsorption sur les biosolides dans les systèmes de traitement des eaux usées, biosolides qui peuvent ensuite être épandus sur des sols agricoles. Une modélisation de fugacité de niveau III (tableau 8-1) à l'aide du modèle EQC (2012) a été réalisée pour décrire la distribution dans l'environnement du TCP suite à son rejet dans l'air, l'eau ou le sol.
Les résultats obtenus avec le modèle HYDROWIN suggèrent que la vitesse d'hydrolyse du TCP augmente avec le pH de l'eau (demi-vie de 192,6 ans à pH 5, 11,58 ans à pH 6, 1,17 an à pH 7, 42,87 jours à pH 8, 4,287 jours à pH 9, et 10,29 heures à pH 10). La demi-vie de 42,87 jours (1029 heures) pour le pH de 8 le plus pertinent pour l’environnement, [pH de 8,2 pour l'eau naturelle du lac Ontario (Howard et Deo 1979)] a été utilisée pour la présente évaluation afin de prédire le devenir du TCP dans l'eau. Des demi-vies de 1,5 et de 2 ans pour un milieu acide de pH inférieur à 7 ont également été prises en compte. Toutefois, les résultats indiquent un devenir semblable du TCP dans l'eau pour la demi-vie de 42,87 jours à pH 8.
| TCP rejeté dans | Pourcentage du TCP dans l'air | Pourcentage du TCP dans l'eau | Pourcentage du TCP dans le sol | Pourcentage du TCP dans les sédiments |
|---|---|---|---|---|
| Air (100 %) | 3,32 | 4,54 | 91,6 | 0,6 |
| Eau (100 %) | négligeable | 88,7 | 0,1 | 11,1 |
| Sol (100 %) | négligeable | 0,2 | 99,8 | négligeable |
a Les propriétés physiques et chimiques et les demi-vies dans l'environnement (t1/2) du TCP dans les milieux naturels sont requis pour la modélisation et sont données à l'annexe A
Lorsque du TCP est rejeté dans l'air, environ 3 % devraient demeurer dans la phase gazeuse tandis que la plus grande partie devrait se retrouver dans la phase particulaire de l'air étant donné son log Koa modéré. Cette substance a une demi-vie prédite très faible (≤ 1 à un jour) en raison de sa réaction avec les radicaux hydroxyles et, par conséquent, le TCP en phase gazeuse ne devrait pas avoir un potentiel de transport atmosphérique à longue distance vers des régions éloignées. La phase particulaire se dépose sur le sol et l'eau sous forme de dépôts humides et secs. De la quantité transférée de l'air vers le sol, la majorité (environ 92 %) restera dans le sol, tandis qu'une plus petite partie peut être transportée dans les ruissellements de surface vers les systèmes aqueux. Une fois combinée aux intrants atmosphériques, environ 0,6 % de la fraction massique se retrouvera dans les sédiments.
Une modélisation plus approfondie a été réalisée afin de clarifier le potentiel de transport atmosphérique à longue distance du TCP. Les estimations de la distance de transport caractéristique (DTC) de 222 et de 363 km dans l'air obtenues respectivement à l'aide du modèle de niveau III de persistance et de transport (TaPL3) (TaPL3 2003) et du modèle de dépistage des POP de l'OCDE (outil QSAR de l'OCDE 2012, Scheringer et al. 2009) montrent également que le TCP a un faible potentiel de transport dans l'air. De plus, la persistance estimée du TCP dans l'air au moyen de TaPL3 et des POP de l'OCDE sont respectivement de 38,3 et 71 jours. Les résultats obtenus avec AEROWIN suggèrent qu'environ 47 % du TCP rejeté dans l'air se retrouvera dans la la phase particulaire en raison de son log Koa plus élevé de 9,59 (AEROWIN 2010). Bien que le pourcentage de la substance adsorbée sur des aérosols prédit par le modèle de dépistage des POP de l'OCDE soit inférieur (4 %), ces deux modèles indiquent que le transport à grande distance associé à des particules peut constituer un facteur pour le TCP.
L'efficacité de transfert (ET) est le pourcentage du flux des émissions vers l'atmosphère déposé à la surface (eau et sol) dans une région éloignée (% ET = D/E × 100, E étant le flux des émissions vers l'atmosphère et D le flux du dépôt sur les milieux en surface dans une région cible). L'ET estimée pour le TCP de 0,0167 % est nettement inférieure à la limite de 2,248 % établie en se basant sur la substance de référence du modèle (BPC 28), signifiant qu'il est improbable que le TCP se dépose sur la surface terrestre dans une région éloignée.
Lorsque du TCP est rejeté dans des eaux de surface, une très grande majorité (88,7 %) devrait demeurer dans l'eau. Étant donné sa solubilité dans l’eau faible à modérée (0,36 mg/L), une petite fraction (11,1 %) du TCP devrait être adsorbée sur des solides en suspension et/ou des sédiments. La volatilisation à partir des eaux de surface est très faible. La perte de TCP par les systèmes aqueux résulte donc principalement de l'enfouissement des sédiments (provenant du processus naturel de sédimentation) et de la dégradation (ECCC 20185c, tableau 8-2).
Lorsque du TCP est rejeté dans le sol suite à l'épandage de biosolides sur des terres agricoles, il devrait s'adsorber sur le sol (à environ 100 %) en raison de sa nature très hydrophobe. L'évaporation à partir du sol ne devrait pas avoir lieu, en raison de sa pression de vapeur extrêmement faible.
8.2 Persistance dans l'environnement
En se basant sur les rejets probables et les caractéristiques de répartition du TCP, la persistance dans l'environnement est la plus pertinente pour l'eau, les sédiments et le sol, où la plus grande partie de la substance devrait se retrouver. Des données empiriques et des données modélisées ont été prises en compte pour le poids de la preuve ayant trait à la persistance du TCP.
Des prévisions modélisées pour la présence de TCP dans l'air suggèrent une demi‑vie inférieure à 1 jour (phase gazeuse) et/ou une persistance globale (Pglob) de 108 jours (modèle de l'OCDE pour les POP). Des tests sur le TCP dans des conditions à long terme pertinentes sur le plan environnemental afin de déterminer les voies de dégradation et les produits de transformation font défaut.
Des données empiriques et des données modélisées sur la dégradation du TCP sont données dans le tableau le 8-2.
8.2.1 Données empiriques sur la persistance
Le TCP peut facilement être hydrolysé pour produire du phosphate di(méthylphényle) et du méthylphénol en milieu alcalin, mais il est stable dans des milieux neutres ou acides (PISSC 1990, van der Veen et de Boer 2012, OMS 1990). Le méthylphénol a été évalué par Environnement Canada, qui a conclu, en mai 2016, qu’il ne satisfaisait pas aux critères de l’alinéa 64a) ou 64b) de la LCPE (Environnement Canada 2016). Par conséquent, nous ne discuterons pas du méthylphénol dans la présente évaluation.
L'hydrolyse du TCP, du o-TCP et du p-TCP à un pH de 10,3 a conduit à calculer des demi-vies respectives de 70, 70 et 27 minutes (David et Seiber 1999a). L'hydrolyse du TCP, du o-TCP et du p-TCP à un pH de 10,7 a conduit à calculer des demi-vies respectives de 200, 280 et 670 minutes (David et Seiber 1999a). À ces pH basiques, le TCP n'est pas stable dans l'eau. Bien que la température expérimentale n’ait pas été rapportée pour cette étude, le chauffage des boues liquides entraînera une augmentation quasi-certaine de l'hydrolyse (David et Seiber 1999a).
Une étude sur l'hydrolyse réalisée avec de l'eau provenant du lac Ontario a permis de constater qu'à 21 oC le TCP était dégradé à 100 % en 5 à 6 jours, et qu'un mélange de m-TCP et de p-TCP était dégradé rapidement (< 4 jours) après une période de latence de deux jours (Howard et Deo 1979). En raison de la phase initiale de latence avant la dégradation, une dégradation microbienne plutôt que l'hydrolyse a probablement été le processus de dégradation dominant dans ces échantillons (UK EA 2009).
Plusieurs études (Saeger et al. 1979, Ku et Alvarez 1982, Cho et al. 1996, David et Seiber 1999a, NITE 2002) ont documenté la biodégradation aérobie du TCP à l'aide de tests de « biodégradabilité intrinsèque » et de « biodégradation immédiate » plus rigoureuse. Bien que ces tests n’ont pas pu mettre en évidence une biodégradation immédiate, ils ont montré que le TCP était intrinsèquement biodégradable (Saeger et al. 1979, EPA 2010).
Muir et al. (1985) ont étudié la dégradation du TCP dans l'eau et les sédiments d'un système d'étangs artificiels et dans des sédiments naturels. La demi-vie du m-TCP dans des sédiments naturels de rivière était de 10,1 jours à 25 °C. L'utilisation des rapports de dégradation dans l’eau, le sol et les sédiments (1/1/4) de Boethling et al. (1995) a conduit à calculer une demi-vie de 2,5 jours pour l'eau et le sol. De façon générale, ces données correspondent à la demi-vie rapportée dans d'autres études empiriques, à savoir que le TCP a une courte demi-vie dans l'eau, le sol et les sédiments.
8.2.2 Modélisation de la persistance
Une approche de QSAR basée sur le poids de la preuve a aussi été suivie en utiliant les modèles de dégradation mentionnés dans le tableau 8-2. Étant donné l'importance environnementale de l'eau, du sol et des sédiments, et le fait que le TCP devrait se retrouver principalement dans ces milieux, il est raisonnable et pertinent d'en étudier la dégradation dans l'eau, le sol et les sédiments.
La probabilité de biodégradation selon le modèle TOPKAT (2004) suggère que le TCP est biodégradable à 100 % en 28 jours. Les résultats correspondent à la région de prédiction optimale (OPS), le domaine structurel du modèle. Le modèle CATALOGIC (2012) prédit que 72 % du TCP sera biodégradé dans des conditions aérobies en 28 jours, conduisant à demi-vie ultime de 15,4 jours. Les deux modèles, TOPKAT et CATALOGIC, suggèrent des vitesses de minéralisation due à la biodégradation modérées à élevées, correspondant aux données empiriques. La biodégradation a été prédite au moyen des modèles BIOWIN 3 et BIOWIN 4. Ces modèles suggèrent également que le TCP n'est pas persistant dans l'eau, même si la probabilité linéaire MITI de BIOWIN 5 et la probabilité non linéaire MITI de BIOWIN 6 suggèrent autrement. De plus, les résultats obtenus avec le modèle HYDROWIN suggèrent que la vitesse d'hydrolyse du TCP augmente avec le pH de l'eau [11,58 ans à pH 6, 1,17 an à pH 7, 42,87 jours à pH 8 et 10,29 heures à pH 10] (tableau 8-2).
En résumé, les données empiriques et les données modélisées sur la biodégradation suggèrent que la demi-vie dans l'eau est probablement de l’ordre de plusieurs heures à moins de 40 jours. En appliquant une procédure d'extrapolation de la demi-vie en utilisant un rapport de 1/1/4 pour l'eau, le sol et les sédiments, il est prévu que le TCP se dégrade rapidement dans le sol et les sédiments et ne conduise pas à une exposition à long terme dans ces milieux (Boething et al. 1995). De plus, les données empiriques et les données modélisées sur l’hydrolyse suggèrent une vitesse de dégradation plus rapide qui augmente quand le pH de l'eau, du sol et des sédiments augmente.
Milieu |
Processus du devenir | Modèle et base du modèle | Résultat et prédiction du modèle | Demi-vie extrapolée (jour) |
|---|---|---|---|---|
| Air | Oxydation atmosphérique | AOPWIN 2010a,b | t½ = 0,78 jour | ≤ 2 |
| Air | Réaction avec l'ozone | AOPWIN, 2010b | S.O.c | S.O. |
| Eau | Hydrolyse | HYDROWIN, 2010b | 11,58 ans (pH 6) 1,17 an (pH 7) 42,87 jours (pH 8) | S.O. |
| Biodégradation primaire | Biodégradation (aérobie) | BIOWIN, 4.10b Sous-modèle 4 | Valeur de classification de 3,58 « se biodégrade rapidement » | < 182 |
| Biodégradation ultime | Biodégradation (aérobie) | BIOWIN, 4.10b Sous-modèle 3 | Valeur de classification de 2,31 « se biodégrade rapidement » | < 182 |
| Biodégradation ultime | Biodégradation (aérobie) | BIOWIN, 4.10b Sous-modèle 5 : probabilité linéaire du MITI | Valeur de probabilité de ‑0,0061; « se biodégrade très lentement » | > 182 |
| Biodégradation ultime | Biodégradation (aérobie) | BIOWIN, 4.10b Sous-modèle 6 : probabilité non linéaire du MITI | Valeur de probabilité de 0,0098; « se biodégrade très lentement » | > 182 |
| Biodégradation ultime | Biodégradation (aérobie) | TOPKAT, 2004 (v. 6.1) Probabilité | 1,000 « se biodégrade rapidement » | < 182 |
| Biodégradation ultime | Biodégradation (aérobie) | CATALOGIC, 2012 Pourcentage de la DBO (demande biochimique en oxygène) | % DBO = 72 « se biodégrade rapidement » Demi-vie primaire : 11,613 jours Demi-vie ultime : 15,434 jours | < 182 |
Abréviations : S.O. = sans objet; t1/2 = demi-vie; % = pourcentage.
a Sur la base d'une journée d'une durée de 12 heures, d'une concentration en radicaux hydroxyles de 1,5×106 molécules/cm3 (moyenne annuelle sur 12 heures) et d'une température du système de 25 °C.
b EPI Suite (2012)
8.3 Bioaccumulation
Lors de la discussion sur le potentiel de bioaccumulation, nous avons examiné plusieurs paramètres potentiels, dont les propriétés de la substance (c.-à-d. log Koe, log Koa, taille moléculaire et diamètres), le facteur de bioconcentration (FBC), le facteur de bioamplification (FBAm), le facteur d'amplification trophique (FAT) et le facteur de bioaccumulation (FBA). Nous avons aussi examiné le calcul potentiel et le rôle des constantes de vitesse de biotransformation métabolique afin de déterminer le potentiel de bioaccumulation.
La valeur empirique de log Koe de 5,11 pour le TCP suggère un certain potentiel de bioaccumulation ou de bioamplification dans le biote. Une forte sorption aux solides, tel qu’indiquée par un log Kco modéré, suggère un potentiel de résidus liés dans l'environnement réduisant la fraction de TCP biodisponible. Il subsiste une incertitude quant aux estimations des coefficients de partage mais, en se basant seulement sur la structure chimique du TCP, il est raisonnable d’assumer que ces valeurs seront élevées.
La bioconcentration du TCP a fait l’objet de plusieurs études avec des poissons (ECCC 2018c). Ces études ont fait état de FBC faibles à modérés. Aucune étude empirique sur les FBAm, FAT ou FBA n’a été trouvée dans la littérature au moment de la présente évaluation. Étant donné que les modèles de FAT accessibles au public sont limités, ce paramètre ne peut pas à l'heure actuelle être modélisé de façon fiable. Par conséquent, les données modélisées sur la bioconcentration et la bioaccumulation sont considérées constituer le meilleur poids de la preuve possible pour le potentiel de bioaccumulation du TCP.
8.3.1 Bioaccumulation déterminée empiriquement
8.3.1.1 Facteur de bioconcentration (FBC)
Nous avons discuté de quelques études sur la bioconcentration du TCP chez les poissons dans la présente section, et les avons mentionnées dans le tableau 8-3. Une liste détaillée des données sur la bioconcentration du TCP chez les poissons disponibles dans la littérature accessible à tous se trouve dans le document de soutien (ECCC 2018c).
Dans la première, un produit commercial contenant du TCP a fait l'objet de test d’absorption par l'ablette commune (Alburnus alburnus) dans des eaux saumâtres naturelles (7 % de salinité) à 10 °C pendant 14 jours (Bengtsson et al. 1986). Le FBC à l'équilibre était de 800 L/kg. Le TCP a été rapidement éliminé du poisson, avec une demi-vie d'épuration de quatre jours ou moins, et une élimination presque complète en 14 jours (Bengtsson et al. 1986). Dans la deuxième étude, la bioconcentration du TCP par la tête-de-boule (Pimephales promelas) a été étudiée à 25 °C pendant 32 jours (Veith et al. 1979). Un FBC de 165 L/kg a été établi en se basant sur la radioactivité totale.
Des FBC ont également été mesurés chez la truite arc-en-ciel (Oncorhynchus mykiss) et la tête-de-boule (Pimephales promelas) pour les isomères p-TCP et m-TCP (Muir et al. 1983) (ECCC 2018c). En raison de la brève durée des tests (24 heures), l’état d’équilibre n’était pas atteint dans le cas de la truite arc-en-ciel. Les FBC estimatés basés sur la mesure de la radioactivité totale allaient de 165 à 2768 L/kg selon la méthode utilisée pour calculer ou modéliser la valeur (ECCC 2018c). Une étude de quatre semaines du FBC chez le crapet harlequin (Lepomis macrochirus) du p-TCP a permis de déterminer un FBC de 1589 L/kg, basés sur la mesure de la radioactivité totale (Sitthichaikasem 1978). Cependant, en raison de l'absorption possible du TCP provenant des aliments ainsi que de l'eau, cette valeur peut être plus pertinente pour la bioaccumulation (UK EA 2009).
| No CAS | Organisme testé | FBC | Valeur cinétique et/ou à l'équilibre (L/kg)a | Référence |
|---|---|---|---|---|
| 1330-78-5 | Ablette, Alburnus alburnus |
FBC | 800 (14 j, 50 µg/L de phosphate de triaryle) | Bengtsson et al. 1986 |
| 1330-78-5 | Tête-de-boule, Pimephales promelas | FBC | 165 (32 j; concentration moyenne de 31,6 μg/L) | Veith et al. 1979 |
| 78-32-0 | Tête-de-boule, Pimephales promelas | FBC | 2199 ± 227 (méthode de la vitesse initiale); 928 ± 8 (méthode de test statique); 588 ± 129 (modèle BIOFAC) (24 h, 5 µg/L nominal) |
Muir et al. 1983 |
| 78-32-0 | Truite arc-en-ciel, Oncorhynchus mykiss |
FBC | 2768 ± 641 (méthode de la vitesse initiale); 1420 ± 42 (méthode de test statique); 1466 ± 138 (modèle BIOFAC) (24 h, 5 µg/L nominal) *La concentration à l'équilibre n'était pas atteinte en 24 heures. |
Muir et al. 1983 |
| 563-04-2 | Tête-de-boule, Pimephales promelas | FBC | 1653 ± 232 (méthode de la vitesse initiale); 596 ± 103 (méthode de test statique); 385 ± 92 (modèle BIOFAC) (24 h, 5 µg/L nominal) |
Muir et al. 1983 |
| 563-04-2 | Truite arc-en-ciel, Oncorhynchus mykiss |
FBC | 1162 ± 313 (méthode de la vitesse initiale); 784 ± 82; (méthode de test statique); 1102 ± 137 (modèle BIOFAC); (24 h, 5 µg/L nominal) *La concentration à l'équilibre n'était pas atteinte en 24 heures. |
Muir et al. 1983 |
| 78-32-0 | Crapet arlequin, Lepomis macrochirus | FBC | 1589 (4 semaines, NP) | UK EA 2009 (Sitthichaikasem, 1978) |
Abréviations : FBA = facteur de bioaccumulation; FBC = facteur de bioconcentration; SO = sans objet, NP = non précisé.
a Les valeurs entre parenthèses représentent la durée ou les concentrations d'essai auxquelles les FBA ou les FBC ont été obtenus.
8.3.1.2 Facteur de bioamplification (FBAm) et facteur d'amplification trophique (FAT)
La bioamplification est le processus faisant que la concentration d'un produit chimique dans un organisme atteint un niveau supérieur à celui dans l'alimentation de cet organisme, en raison de l'absorption alimentaire (Gobas et Morrison 2000). Un facteur de bioamplification (FBAm) supérieur à 1 indique qu'une bioamplification potentielle a lieu. Les données sur la FBAm peuvent être considérées comme des indicateurs du potentiel d'absorption et d'accumulation dans le biote et sont prises en compte pour le poids de la preuve global. Le facteur d'amplification trophique (FAT) est une mesure du potentiel de bioamplification d'une substance au sein d'un réseau trophique étudié dans des conditions de terrain. Ce facteur est estimé en mettant en corrélation les concentrations de la substance normalisées dans le biote à différents niveaux trophiques.
Aucune étude expérimentale sur le FBAm et le BAT n'a été trouvée pour le TCP.
8.3.1.3 Facteur de bioaccumulation (FBA)
Les facteurs de bioaccumulation sont mesurés dans des conditions de terrain en tant que rapport entre les charges de substance chimique absorbées dans le corps entier dues à toutes les expositions et les concentrations dans l'eau ambiante. Les mesures du FBA sont un paramètre priviligié pour évaluer le potentiel de bioaccumulation des substances, car ce facteur intègre toutes les expositions à la substance chimique, y compris celle due aux aliments qui prédomine pour les substances ayant un log Koe supérieur à environ 4 (Arnot et Gobas 2003a).
Une étude empirique a fait état d'une estimation approximative du facteur d'accumulation maximal de 0,08 à 0,13 % p/p, dû à l'alimentation chez le vairon (Phoxinus phoxinus) dans le cas du TCP (Bengtsson et al. 1986, ECCC 2018c). Aucune valeur empirique acceptable du FBA n'était disponible pour le TCP au moment de la présente évaluation. Une modélisation cinétique du bilan massique corrigée pour la biotransformation métabolique a donc été utilisée pour combler cette lacune dans les données.
8.3.2 Modélisation de la bioconcentration et de la bioaccumulation
Environnement et Changement climatique Canada a fait une estimation du FBC et du FBA du TCP au moyen de deux modèles basés sur la structure, des modèles de type QSAR, et d’un modèle cinétique de bilan massique à trois niveaux trophiques (Arnot et Gobas 2003b). Toutes les estimations du FBC et du FBA, à l'exception du sous-modèle 1 du modèle BCFBAF de la version 4.0 de EPIWIN, ont été corrigées pour le métabolisme, car ce dernier représente une voie d'élimination fondamentale de nombreux produits chimiques comme le TCP. Cette correction a été effectuée en calculant les constantes de vitesse de biotransformation (kM) à l'aide de renseignements tirés d’études empiriques sur le FBC ou le FBA ou d'une méthode de type QRSA basée sur la structure.
La constante de vitesse du métabolisme constitue un intrant très sensible pour la modélisation de la bioaccumulation et peut être hautement variable (Arnot et al. 2008a, Arnot et al. 2008b). Une kM empirique de 0,20/j a été estimée pour le TCP dans la cas d'un poisson de 10 g à 15 oC (Arnot et al. 2008a, Arnot et al. 2008b), à partir d'une étude de qualité fiable sur le FBC pour l'ablette commune (Alburnus alburnus) (Bengtsson et al. 1986). La constante de vitesse du métabolisme pour le TCP a également été estimée à 0,015/j à l'aide du sous-modèle QRSA de kM de la version 3.10 2010 du modèle BCFBAF de la version 4.0 2012 d’EPIWIN (d’après Arnot et al. 2009), et la kM RDSA pour un poisson de 10 g à 15 oC. Les estimations empiriques et QSAR concordent bien et ces vitesses sont jugées relativement « rapides » (supérieurs à 0,1) (Arnot et Gobas 2006, Nichols et al. 2007). La valeur de kM de 0,15/j a ensuite été normalisée pour modéliser le FBC et le FBA d'un poisson de niveau trophique intermédiaire en utilisant une modification à trois niveaux trophiques du modèle de bilan massique de bioaccumulation d'Arnot et Gobas (2003a). Les résultats de la modélisation du FBC et du FBA pour le TCP sont respectivement de 1 589 et 2 043 L/kg poids humide.
Le modèle de FBCmax avec facteurs d'atténuation (Dimitrov et al. 2005) a également été appliqué et a prédit un FBC corrigé de 1 251 (log FBC de 3,0974), corrigeant pour les effets atténuateurs des acides, de la biotransformation métabolique, des phénols, de la taille et de la solubilité dans l’eau. Ce modèle prédit une constante de vitesse de biotransformation métabolique de 0,05/jour. Cependant, ces résultats sont pris en compte avec prudence étant donné que la substance est considérée être hors du domaine structurel du modèle.
Avec un log Koe empirique de 5,11, la fraction biodisponible prédite du TCP dans la colonne d'eau est, selon les modèles de bilan massique pour les poissons (BAF-QSAR v.1.2), de 97 %. Ceci suggère que presque toute la substance chimique présente dans des eaux de surface typiques est biodisponible pour une absorption chimique à la surface des branchies.
En résumé, étant donné les FBC empiriques allant de 165 à 800 L/kg pour des concentrations respectives de TCP de 0,0316 et 0,050 mg/L (les deux étant inférieures à la valeur de solubilité empirique dans l'eau de 0,36 mg/L), les études empiriques sur la bioaccumulation dans les poissons indiquent collectivement un faible potentiel de bioconcentration. Le FBC (1589 L/kg) et le FBA (2043 L/kg) modélisés indiquent aussi que le TCP n’a pas un potentiel élevé de bioaccumulation.
8.3.3 Bioaccumulation dans les plantes
L'absorption du p-TCP (no CAS 78-32-0) par les plantes à partir du sol a été calculée uniquement pour le soya (Casterline et al. 1985). Les semences ont été plantées dans un sol non traité de 2 cm recouvrant le sol traité au TCP (10 mg/kg). Le FBA pour le poids frais (pousse de la plante) était de 0,17, alors que les concentrations de p-TCP étaient respectivement de 1,72 et 10,14 µg/g dans les pousses et le sol (rapport pousse/sol d'environ 1/6). Les résultats de cette étude sont incertains, car il ne s'agissait pas d'une étude des BPL pour laquelle du sol stérilisé a été utilisé et les concentrations nominales n'ont pas été vérifiées.
8.4 Résumé du devenir dans l'environnement
Le TCP devrait principalement être rejeté par des sources industrielles, suite au traitement des eaux usées. Une fois rejeté dans l'eau, une grande proportion (88,7 %) du TCP devrait y rester. Une forte tendance à se sorber sur la phase solide dans divers milieux (y compris la matières particulaire en suspension dans l'air) signifie que ce produit chimique se retrouvera dans des biosolides, les sols et les particules en suspension dans l'air, et qu'il sera transféré dans le sol à partir de dépôts secs et de l'épandage de biosolides sur des terres agricoles. En résumé, ses caractéristiques de sorption élevées indiquent que le TCP se retrouvera dans l'eau, les biosolides, les sédiments et le sol.
9. Potentiel d'effets nocifs sur l'environnement
9.1 Évaluation des effets sur l'environnement
Des données d’écotoxicité empiriques pour le TCP ont été prises en compte pour l'évaluation de ses effets sur l'environnement. Le TCP devrait principalement être rejeté par des sources industrielles, suite au traitement des des eaux usées. Une exposition des organismes aquatiques peut avoir lieu car, une fois rejeté dans l’eau, une grande proportion (88,7 %) du TCP devrait y rester. Une forte tendance de sorption sur la phase solide dans divers milieux (y compris les particules en suspension dans l'air) indique que le TCP se retrouvera dans l'eau, les biosolides, les sédiments et le sol. Il existe un certain nombre de données empiriques sur la toxicité aquatique du TCP. Nous avons utilisé des données modélisées pour appuyer les données empiriques. Il n'existe aucune donnée sur la toxicité du TCP pour les sédiments au moment de la présente évaluation. La présente évaluation a donc été centrée sur les espèces aquatiques. Toutefois, des données disponibles sur la toxicité terrestre du TCP ont également été prises en compte pour la présente évaluation, car elles sont pertinentes pour les expositions pour les mammifères piscivores et vivant dans le sol.
Tel que détaillé ci-après, une étude chronique empirique de 35 jours sur les premiers stades de la vie de l'épinoche à trois épines (Gasterosteus aculeatus) a été retenue pour le calcul de la concentration estimée sans effet (CESE) pour l'eau. En les comparant avec les résultats d’études empiriques, les résultats obtenus avec des modèles QSAR de toxicité sont du même ordre de grandeur. Un scénario d'exposition dans le sol a également été élaboré afin de refléter les concentrations potentielles de TCP dans le sol agricole suite à un épandage possible de biosolides provenant d'un système d'un système traitement des eaux usées recevant l’effluent d’activités industrielles. Les concentrations dans le sol, les vitesses potentielles d’absorption et les concentrations chez un petit mammifère (c.-à-d. la musaraigne) ont été estimées au moyen d'un modèle basé sur la fugacité et faisant intervenir des principes de partage à l'équilibre pour estimer le devenir global de la substance dans le sol et l'exposition du biote du sol (BASL4 2001). Une étude de deux ans sur l'exposition par voie alimentaire orale avec des rats mâles a été utilisée pour la valeur critique de toxicité (VCT) pour la faune.
9.1.1 Études empiriques dans l'eau
Lors de plusieurs études, la toxicité du TCP pour les algues a été caractérisée. Une étude sur Scenedesmus pannonicus a conduit à établir unne CE50 chronique à 96 h et une concentration sans effet observé (CSEO) pour la croissance respectivement de 1,5 et 0,32 mg/L (UK EA 2009). D'autres données sur la toxicité chronique à 72 heures du TCP pour l'algue verte Pseudokirchneriella subcapitata étaient disponibles auprès de NITE (2008) et de l'ECHA (c2007-2013). La CSEO la plus faible pour la vitesse de croissance était de 0,088 mg/L. D’autres CSEO tirées de ces études relatives à la vitesse de croissance, à la biomasse et au nombre de cellules étaient respectivement de 4,7, > 2,5 et 2,4 mg/L.
Des données sur la toxicité aquatique du TCP pour des invertébrés sont également disponibles. Une étude non publiée sur la toxicité aiguë à 48 h avec Daphnia magna a fait état d'une CE50 pour la mortalité/immobilité de 0,27 mg/L et d’une CSEO de 0,1 mg/L. Deux autres CE50 à 48 heures (Adema et al. 1983, ECHA c2007-2013) étaient beaucoup plus élevées (5,6 et 146 mg/L).
Deux études sur la toxicité chronique pour Daphnia magna ont été identifiées dans la littérature accessible à tous (Adema et al. 1981, 1983). Une CE50 à 21 jours entre 0,1 et 0,3 mg/L (Adema et al. 1981) et une CSEO (mortalité, reproduction) à 21 jours de 0,1 mg/L (Adema et al. 1983) ont été rapportées.
Van den Dikkenberg et al. ont fait état d'études sur l'embryon et l'alevin de quatre espèces de poissons : l'épinoche à trois épines (Gasterosteus aculeatus), le poisson zèbre (Brachydanio rerio), le medaka (Oryzias latipes), et la jordanelle de Floride (Jordanella floridae). Parmi ces espèces, la CSEO et la CE50 [mortalité aux premiers stades de la vie (au stade d'un poisson de 4 semaines), effets sublétaux excluant la croissance] étaient respectivement de 0,001 et 0,0013 mg/L, et la CL50 pour l'épinoche à trois épines exposée pendant 35 jours était de 0,0017 mg/L (Van den Dikkenberg et al. 1989). Les CSEO pour la croissance et les effets sublétaux au stade de l'embryon étaient inférieures, soit 0,00032 et 0,0032 mg/L respectivement (Van den Dikkenberg et al. 1989).
Les CSEO obtenues lors d'une étude de six semaines sur l'embryon et l'alevin du poisson zèbre, du medaka et de la jordanelle de Floride étaient plus élevées (0,0056, 0,01 et 0,01 mg/L respectivement) que celles obtenues pour l'épinoche à trois épines (Adema et al. 1983). La CSEO obtenue lors d'une étude de quatre semaines sur la toxicité chronique pour le guppy était nettement plus élevée à 1 mg/L (Adema et al. 1983).
Les résultats du modèle ECOSAR (v.1.00) sont disponibles dans le document d’ECCC (2018d). De façon générale, ils correspondent aux données empiriques et étayent la CESE calculée utilisée pour l'analyse des risques (voir ci-dessous). Bien que le log Koe du TCP (5,11) soit supérieur au seuil du modèle pour l'estimation de la toxicité aiguë (environ 5), il en est proche et, par conséquent, les valeurs de CL50 chez Daphnia et de CL50 à 96 heures chez les poissons prédite par le modèle ECOSAR (0,057-0,165 mg/L) ont été prises en compte, mais n’ont pas été utilisées pour estimer une CESE aux fins de l'analyse de risques. Toutefois, les prévisions sur la toxicité chronique étaient inférieures au seuil du modèle (log Koe d'environ 8). Ces résultats allaient de 0,005 à 0,04 mg/L.
La CE50 la plus faible obtenue lors des études les plus fiables est une CE50 à 35 jours de 0,0013 mg/L pour la mortalité aux premiers stades de la vie (au stade d'un poisson de 4 semaines) et pour les effets sublétaux de l'étude sur l'embryon et l'alevin chez Gasterosteus aculeatus (épinoche à trois épines) (Van den Dikkenberg et al. 1989). Cette valeur a été retenue comme valeur critique de la toxicité (VCT) pour les organismes pélagiques. Le choix de cette VCT est jugé raisonnable comparativement aux résultats modélisé de l'ECOSAR (toxicité létale chronique de 0,005 mg/L; ECCC 2018d).
Globalement, nous avons une grande confiance dans l'ensemble de données sur la toxicité aquatique, avec ses données sur plusieurs paramètres et organismes. Pour calculer la CESE, nous avons retenu un facteur d'application de 3 afin de tenir compte des différences de sensibilité des espèces. Bien qu'il existe de nombreuses données, celles qui portent sur la toxicité chronique ne concernent que trois taxons : les algues, les vertébrés et les invertébrés. La CESE ainsi obtenue est de 0,00043 mg/L.
9.1.2 Études empiriques dans les sédiments
Il n’existe aucune donnée sur la toxicité du TCP pour les organismes benthiques.
9.1.3 Études empiriques pour les organismes vivant dans le sol et la faune terrestre
Il existe une étude réalisée avec un produit commercial (Durad 310M) contenant du TCP à moins de 5 % p/p. Cette étude a conduit à calculer une CL50 (émergence des semis) de plus de 100 mg/kg. Elle ne peut pas être interprétée pour caractériser la toxicité du TCP pour les plantes étant donné la faible pureté de la substance testée.
Il existe également quelques études sur les effets sur les insectes dus à un contact avec du TCP (OMS 1990). Toutefois, ces données ne sont pas pertinentes pour le calcul d’une CESE pour les organismes terrestres.
Une CESE pour les petits mammifères vivant dans le sol a été calculée à partir d’une revue sur la toxicité pour les mammifères. Une revue approfondie de la toxicité pour les mammifères est présenté dans la partie ayant trait à la santé humaine de la présente évaluation et seules les études clés prises en compte pour le calcul de la valeur toxicologique de référence (VTR, jugée équivalente à une CESE) sont résumées ci‑dessous.
Des tests de toxicité du TCP ont été réalisées avec 95 rates (F344/N; jusqu'à 15 rates par groupe) lors d'une étude de deux ans sur l'exposition dans l'alimentation par voie orale, aussi décrite à la section 10.2.3 (NTP 1994). Pour cette étude, des concentrations alimentaires de 0, 75, 150 et 300 mg/kg de TCP ont été estimés correspondre à des doses quotidiennes moyennes de 0, 4, 7 ou 15 mg/kg chez ces femelles. Au cours de cette étude de deux ans, le poids corporel des rates était au cours de la première semaine en moyenne de 91 g, (91, 91, 92 et 90 g respectivement pour quatre concentrations différentes de TCP dans l'alimentation) et, à la 104e et dernière semaine de l'étude, de 320 g (315, 320, 332 et 313 g respectivement pour quatre concentrations différentes de TCP). Les paramètres de la DSENO et de la DMENO pour la vacuolisation cytoplasmique du cortex surrénal étaient respectivement de 4 et de 7 mg/kg par jour. Nous avons retenu cette étude pour le calcul de la valeur toxicologique de référence (VTR). La VCT de 5,3 mg/kg pc par jour a donc été calculée à l'aide d'une moyenne géométrique des valeurs de la DSENO et de la DMENO.
Les paramètres de toxicité chez le rat (DSENO de 4 mg/kg par jour et DMENO de 7 mg/kg par jour) tirés de cette étude et un poids corporel de 10 grammes, obtenu au moyen de BASL 4, ont été utilisés comme intrants pour estimer la VTR du TCP pour la musaraigne. Un facteur d'évaluation de 10 a été appliqué pour tenir compte de l'extrapolation des conditions de laboratoire à celles de terrain. La VTR ainsi obtenue pour le TCP pour la musaraigne est de 1,259 mg/kg pc/jour (Annexe B).
Les mêmes paramètres de toxicité chez le rat utilisés pour calculer la VTR pour la musaraigne ont été utilisés pour calculer les VTR du TCP pour le vison et la loutre de rivière. Des poids corporels de 1,08 et 7,98 kg ont été utilisés pour obtenir les VTR correspondantes. Un facteur d'évaluation de 10 a été appliqué pour tenir compte de l'extrapolation des conditions de laboratoire à celles de terrain. Les VTR prédites ainsi obtenues pour le TCP chez le vison et la loutre de rivière sont respectivement de 0,390 et 0,237 mg/kg pc/ jour (Annexe B).
9.2 Évaluation de l'exposition dans l'environnement
9.2.1 Rejets industriels
Des données limitées sur les concentrations de TCP dans les eaux au Canada ont été relevées. Par conséquent, des concentrations environnementales ont donc été évaluées en se basant sur les renseignements disponibles, y compris sur les quantités estimées de la substance, les vitesses de rejet estimées et les caractéristiques du milieu récepteur. Des concentrations environnementales ont été estimées pour des scénarios de rejets industriels, tel que décrit dans les sections suivantes.
9.2.1.1 Scénarios d'exposition et concentrations environnementales estimées
Exposition en milieu aquatique
Une exposition en milieu aquatique au TCP devrait avoir lieu si la substance est rejetée suite à des activités industrielles, soit vers un système de traitement des eaux usées soit directement dans un plan d'eau de surface récepteur. La concentration de cette substance dans les eaux réceptrices près du point de rejet du système de traitement des eaux usées est utilisée comme concentration environnementale estimée (CEE) pour l'évaluation du risque posé par la substance en milieu aquatique. Elle peut être calculée à l'aide de l'équation suivante :
Ceau-ind = (1000 x Q x P x (1-R)) / (N x F x D)
avec :
Ceau-ind = concentration en milieu aquatique due aux rejets industriels, en mg/L
Q = quantité de substance totale utilisée chaque année sur un site industriel, en kg/an
P = pertes dans les eaux usées, fraction
R = taux d'élimination du système de traitement des eaux usées, fraction
N = nombre de jours de rejets annuels, en jour/an
F = flux de l'effluent du système d'assainissement des eaux usées, en m3/jour
D = facteur de dilution dans l'eau réceptrice, sans dimension
Ces paramètres sont décrits en détail de document d’Environnement Canada (2018e).
Étant donné que le TCP est utilisé par des installations industrielles et qu'il devrait être rejeté dans l'eau, des scénarios prudents de rejets industriels en milieu aquatique ont été élaborés pour couvrir une gamme d'activités industrielles potentielles diverses au Canada. Dans le cas du TCP, le scénario pertinent comprend le mélange de la substance dans des installations industrielles. Des rejets de TCP ont été estimés pour ce scénario avec du TCP en mélange pour diverses applications.
Le TCP étant importé en vrac sous forme de liquide pur ou de composant d'un mélange liquide qui peuvent produire des résidus dans les contenants de transport, les activités de nettoyage de ces contenants peuvent entraîner des rejets de ces substances dans l'environnement. Bien que les concentrations environnementales de TCP attribuables à ces rejets puissent être élevées, de tels rejets seraient probablement épisodiques et de courte durée. Compte tenu de ces préoccupations et des lacunes actuelles dans les données sur les opérations et pratiques de nettoyage des contenants, une caractérisation quantitative de l'exposition n'a pas été faite pour de tels rejets.
Nous donnons dans le tableau 9-1 la gamme des intrants utilisés pour estimer les concentrations dans le milieu aquatique près des points de rejet industriel. En se basant sur ces hypothèses, ces scénarios industriels conduisent à des CEE totales de7,3 x 10‑8 à 2,7 x 10-6 mg/L (tableau 9-2). Ces valeurs de CEE pour les organismes aquatiques représentent les concentrations totales de TCP (dissout et associé à des particules) dans l'eau réceptrice près du point de rejet sur chaque site. Il est bon de noter que ces CEE calculées sont semblables aux concentrations de 2,5x10-6 à 2,2 x 10-5 mg/L (11 à 22 ng/L et 2,5 à 10 ng/L) mesurées dans le lac Ontario, le fleuve Saint-Laurent et le lac Érié au Canada dans le cadre d'études réalisées en 2010 et en 2011.
| Intrant | Valeur | Justification et référence |
|---|---|---|
| Quantité annuelle utilisée sur le site (kg/an) | < 10 000 | Tel que déclaré à ECCC (2013-2014) |
| Perte dans les eaux usées (%) | 0,25 à 1,0 | Hypothèse standard basée sur l'OCDE (2009) |
| Efficacité d'élimination du système de traitement des eaux usées (%) | 74,3 à 85,8 | Prévision du modèle ASTreat 1.0 pour le traitement de niveau primaire hors site, le traitement de niveau secondaire |
| Nombre de jours de rejets annuels (jours) | 250 à 350 | Basé sur les données de l'INRP, renseignements spécifiques au site ou jugement professionnel (INRP 2011 et base de données interne d'Environnement et Changement climatique Canada) |
| Débit de l'effluent du système de traitement des eaux usées, en m3/j | 15 000 à 22 400 000 |
Données spécifiques au site pour le système de traitement des eaux usées |
| Facteur de dilution (-) | 10 et plus | Débit du système de traitement des eaux usées spécifique du site/ débit dans l'environnement récepteur. Lorsque le facteur de dilution était supérieur à 10, une valeur maximale par défaut de 10 a été utilisée. |
| Utilisation/secteur | CEE dans l'eau (mg/L) | CEE dans les sédiments (4 % de CO) (mg/kg ps) | CEE dans le sol (2 % de CO) (mg/kg ps) |
|---|---|---|---|
| Mélange | 7,27 x 10-8 à 2,70 x 10-6 | 0,00001 à 0,00036 | 0,00001 à 0,00030 |
Pour estimer la concentration de TCP dans les sédiments de fond, nous avons suivi une approche de partage eau-sédiments à l'équilibre (ECHA 2010). Ceci fait intervenir une estimation de la concentration de la substance dans la phase aqueuse (dissoute) de l'eau sus-jacente à partir de sa concentration totale, selon des études menées par Gobas et al. (2003) et Gobas (2010). La concentration de la substance dans les sédiments de fond est estimée à partir de sa concentration dans la phase aqueuse de l'eau sus-jacente, basée sur une hypothèse de partage à l'équilibre entre les sédiments de fond et l'eau sus-jacente décrite par le National Center for Environmental Assessment de l'Environmental Protection Agency des États-Unis (EPA 2003). À l’équilibre, la CEE dans les sédiments de fond peut être corrélée de manière linéaire avec la concentration dans la phase aqueuse de l'eau sus-jacente. Des scénarios d'exposition dans les sédiments ont été élaborés en tant qu'extension des scénarios de rejets industriels dans le milieu aquatique décrits ci-dessus pour déterminer les CEE dans les sédiments à l’équilibre, normalisées pour une teneur en carbone organique de 4 % (une teneur en carbone organique typique dans les sédiments de fond des rivières et des lacs). Pour le TCP, la CEE obtenue dans les sédiments va de 0,00001 à 0,00036 mg/kg ps.
Exposition dans le sol
En l'absence de données pertinentes, un scénario d'exposition dans le sol a été élaboré pour refléter les concentrations potentielles dans des sols agricoles résultant de l'épandage possible de biosolides provenant d’un système de traitement des eaux usées.
Les concentrations dans le sol et l'exposition d’un petit mammifère (c.-à-d. musaraigne ou campagnol) ont été estimées au moyen d'un modèle basé sur la fugacité qui fait intervenir les principes de partage à l'équilibre pour estimer le devenir global de la substance (BASL 4, 2001). Pour cette analyse, la concentration maximale de TCP de 1,15 mg/kg, mesurée dans des échantillons de biosolides prelévés dans une usine de traitement des eaux usées au Canada, a été utilisée (ECCC 2016).
Une dose journalière totale (DJT) de TCP de 0,1185 mg/kg pc/j (normalisée pour 2 % de CO) est ainsi estimé pour la musaraigne, en se basant sur une voie de chaîne alimentaire dans le sol. Cette valeur est jugée prudente étant donné que le modèle BASL4 ne tient pas compte du métabolisme dans son estimation.
Exposition de la faune
Une DJT pour la faune a été calculée pour le vison (Mustela vison) et la loutre de rivière (Lontra canadensis) qui consomment du poisson, en suivant l'approche de l'EPA des États-Unis (1993). Pour calculer la DJT, un FBA de 2043 (log FBA de 3,31) [voir la section 9.1.4 Études empiriques pour le milieu terrestre (faune)] a été utilisé de concert avec la valeur de la CEE maximale dans l'eau de 0,0000027 mg/L, conduisant à des DJT estimées respectives de 0,0010 et de 0,0008 mg/kg pc/j pour le vison et la loutre de rivière.
9.2.2 Rejets commerciaux ou par les consommateurs
Bien que du TCP puisse être présent dans des produits commerciaux ou dans des produits disponibles pour les consommateurs, de tels produits devraient conduire à des rejets minimes. L'utilisation de TCP comme additif dans ces produits peut entraîner des émissions diffuses et, bien qu’il existe des incertitudes, la vitesse de tels rejets devrait être très faible par rapport à celle des sources industrielles ponctuelles où cette substance est incorporée dans des produits. Les émissions résultant des scénarios industriels présentés dans la présente évaluation conduiraient à des concentrations dans l'environnement beaucoup plus élevées. Étant donné que les produits fabriqués avec du TCP n’entreront généralement pas en contact avec l'eau sur une base régulière, la lixiviation de cette substance dans l'eau sera probablement minime.
En l'absence de renseignements sur la lixiviation du TCP à partir de produits, il a été estimé (UK EA 2009) que le potentiel de rejet pendant la durée de vie du produit contenant du TCP serait de 0,25 % pour un produit destiné à une utilisation à l'intérieur, et de 7,25 % pour un produit destiné à une utilisation à l'extérieur. Le rejet potentiel de produits ignifuges organiques dans l'eau par des matières plastiques au cours de leur durée de vie utile est estimé à 0,05 % si la substance est destinée à une utilisation à l'intérieur et à 0,16% si la substance est destinée à une utilisation à l'extérieur (OCDE 2009). La grande majorité des produits devrait être confinés ou utilisés à l'intérieur et, par conséquent, le taux de rejet de 0,05 % s'applique très bien et est probablement une surestimation puisque aucun contact avec l'eau ne devrait avoir lieu.
Par conséquent, le scénario de la pire éventualité de rejet diffus de TCP à travers le Canada (par les usines de traitement des eaux usées et le rejet diffus direct dans l'environnement) conduit, en utilisant le taux de rejet à l'intérieur de 0,05 % pendant la durée de vie utile de l'OCDE (2009), à un rejet estimé à 10,5 kg. Ce scénario comprend plusieurs hypothèses : valeurs maximales de la gamme associée à chaque type d'importation (1000 kg pour les produits commerciaux ou les produits disponibles pour les consommateurs, 10 000 kg pour la formulation et 10 000 kg pour la substance pure); utilisation complète du TCP dans les produits; faible exposition dans l'eau pendant la durée de vie utile et utilisation à l'intérieur. Ce résultat suggère qu'un rejet important de TCP par des produits en contenant est improbable. Le résultat de ce scénario est jugé très incertain.
Les évaluations du TCP dans la poussière domestique et dans la poussière provenant d'autres microenvironnements au Canada et à l'étranger sont abordées dans la section sur l'évaluation de l'exposition pour la santé humaine de la présente évaluation (10.1.1 Milieux de l’environnement et aliments). L'exposition au TCP due à des produits disponibles pour les consommateurs est décrite dans la section sur l'évaluation de l'exposition pour la santé humaine de la présente évaluation (10.1.2 Produits disponibles pour les consommateurs).
9.3 Caractérisation des risques pour l'environnement
L’approche suivie pour la partie ayant trait à l’environnement de la présente évaluation préalable était d’examiner diverses sources de renseignements et de tirer des conclusions basées sur le principe du poids de la preuve (Annexe C) et le principe de précaution, conformément aux dispositions de la LCPE. Les éléments de preuve pris en compte comprennent les résultats d'un calcul prudent du quotient de risque ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité intrinsèque ou l'écotoxicité, les sources et le devenir de la substance et sa présence et répartition dans l'environnement.
9.3.1 Analyse du quotient de risque
Une analyse du quotient de risque a été réalisée pour les scénarios portant sur le milieu aquatique, le sol et la faune (tableau 9-3; Annexe B) afin de déterminer s'il existe un risque potentiel d'effets nocifs aux environs de rejets industriels au Canada.
9.3.1.1 Eau
Les scénarios de rejet industriel spécifique du site présentés ci-dessus ont conduit à calculer des CEE pour les organismes aquatiques de 7,27 x 10-8 à 2,70 x 10-6 mg/L. Ces CEE représentent le niveau d'exposition dans les eaux réceptrices près du point de rejet du système de traitement des eaux usées sur chaque site. Une CESE de 0,00043 mg/L a été calculée à partir de la CE50 à 35 jours de 0,013 mg/L (mortalité aux premiers stades de la vie) dans le cas de Gasterosteus aculeatus (épinoche à trois épines) (van den Dikkenberg et al. 1989) (voir la section 9.1.1 Études empiriques dans l'eau à la section Évaluation des effets sur l'environnement). Les quotients de risque résultants (CEE/CESE) vont de 0,0002 à 0,006 (Annexe B). Par conséquent, il est improbable que cette substance ait des effets nocifs chez les organismes pélagiques sur de tels sites.
9.3.1.2 Sol
Nous avons utilisé BASL4 pour estimer l'exposition (DJT) de la musaraigne due à la chaîne trophique dans le sol. La DJT de 0,1185 mg/kg pc/jour (voir la section 9.2.1.1) a été comparée à la VTR de 1,259 mg/kg pc/jour (voir la section 9.1.3). Sur la base de ces valeurs, un quotient de risque de 0,094 a été calculé pour le TCP, suggérant que l’exposition à cette substance due à la chaîne trophique sera peu préoccupante pour les organismes vivant dans le sol.
9.3.1.3 Faune
Des DJT pour la faune piscivore ont été estimées en suivant l’approche de l'EPA (1993). Pour calculer la DJT, le FBA de 2043 (voir la section 8.3.2) a été utilisé de concert avec la CEE maximale dans l'eau de 0,0000027 mg/L, conduisant à des DJT estimatées respectives de 0,0010 et de 0,0008 mg/kg pc/jour pour le vison et la loutre de rivière. Les VTR calculées pour le vison et la loutre de rivière à la section 9.1.3 sont respectivement de 0,390 et de 0,237 mg/kg pc/jour, conduisant à des quotients de risque (DJT/VRT) de 0,0026 (vison) et de 0,0032 (loutre de rivière) (Annexe B). Par conséquent, même en faisant des hypothèses prudentes, il est improbable que l'utilisation actuelle du TCP au Canada conduise à des niveaux seuils avec effets dans le cas du vison et de la loutre de rivière.
| Milieu | Scénario | CESE/VTR | CEE/DJT | QR |
|---|---|---|---|---|
| Eau | Rejets industriels dans l'eau | 0,00043 mg/L | 7,27 x 10-8 à 2,70 x 10‑6 mg/L | 0,0002 à 0,006 |
| Sol | Épandage de biosolides sur le sol | 1,259 mg/kg pc/jour (VTR) | 0,045 mg/kg pc/jour (DJT) | 0,094 |
| Faune | DJT piscivores (vison/poisson) | 0,39 (vison) et 0,237 (loutre) mg/kg pc/jour | 0,0010 (vison) et 0,0008 (loutre) mg/kg pc/jour | 0,0026 (vison) 0,0032 (loutre) |
Abréviations : CESE = concentration estimée sans effet; VTR = valeur de toxicité de référence; CEE = concentration environnementale estimée; DJT = dose journalière totale; QR = quotient de risque
9.3.2 Examen des éléments de preuve et conclusion
Les faibles quantités de TCP importées au Canada et les renseignements sur ses utilisations indiquent un faible potentiel de rejet généralisé dans l'environnement au Canada. Le TCP a été mesuré à de faibles niveaux dans des échantillons d'air, d'eau, de sédiments, de sols et de biote prélevés près de sources. Par conséquent, la principale préoccupation concernant le TCP est l'exposition à proximité de ces sources.
La valeur empirique de log Koe de 5,11, la vitesse rapide de biotransformation métabolique (kM) et le FBC et le FBA faibles à modérés du TCP indiquent un potentiel limité de bioaccumulation ou de bioamplification dans le biote. La faible sorption sur les solides, indiquée par un log Kco relativement faible et une solubilité dans l’eau modérée (0,36 mg/L), suggère un potentiel limité de résidus liés dans l'environnement faisant augmenter la fraction biodisponible de TCP dans l'eau. Le TCP devrait avoir un faible potentiel de persistance dans l'air, l'eau, les sédiments ou le sol, et il est improbable qu’il conduise à des expositions à long terme dans ces milieux (section 8.2 Persistance dans l'environnement). Le TCP ne devrait pas avoir de potentiel de transport à longue distance dans l'air, et il est improbable qu'il se dépose sur la surface terrestre en quantités significatives dans des régions éloignées.
Les scénarios industriels spécifiques du site représentaient un niveau d'exposition dans les eaux réceptrices près du point de rejet du système de traitement des eaux usées sur chaque site. Les quotients de risque ont indiqué que des effets nocifs sur les organismes pélagiques sont improbables sur de tels sites. L'importance de rejets provenant de produits constitue une incertitude en raison de l'absence de données pour étayer une analyse quantitative précise de l'exposition dans l'environnement due à la lixiviation d'additifs ignifuges par des articles manufacturés. Toutefois, les rejets dans l'environnement par cette voie devraient être minimes et diffus.
Le temps de résidence prédit du TCP dans le sol est court, cette substance ne devrait donc pas s'accumuler avec le temps. Par conséquent, aux niveaux actuels potentiels d'utilisation et en se basant sur une faible persistance et une bioconcentration et une bioaccumulation limitées, le TCP ne devrait pas avoir d'effets sur la chaîne alimentaire et ne devrait pas entraîner d'effets nocifs sur les petits mammifères vivant dans le sol. Même avec des hypothèses prudentes, il est improbable que l'utilisation actuelle du TCP au Canada entraîne des effets nocifs sur les poissons consommant des espèces sauvages.
Compte tenu de tous les éléments de preuve avancés dans la présente évaluation préalable, il est conclu que le TCP n'a pas le potentiel d'entraîner d'effets nocifs sur l'environnement au Canada.
9.3.3 Incertitudes de l'évaluation des risques pour l'environnement
Nous reconnaissons qu'il existe des renseignements pour caractériser les rejets potentiels dus à l’utilisation de produits commerciaux ou de produits disponibles pour les consommateurs, ainsi qu’au désassemblage ou à l’élimination de tels produits à la fin de leur vie utile. Bien que la plupart des sites d’enfouissement au Canada devrait collecter et traiter leur lixiviat, aucune donnée sur les lixiviats de TCP, qui pourrait être utile pour interpréter les rejets en fin de vie utile, n'a été rapportée à ce jour. Toutefois, en se basant sur les renseignements sur la faible pression de vapeur du TCP, ces rejets sont jugés minimes. Le rejet dans l'environnement de cette substance par des matières plastiques par lixiviation est jugé possible, quoique faible. En outre, de nombreux produits contenant du TCP n’entreront pas en contact avec l'eau sur une base régulière, p. ex. les produits électroniques. Pour la présente évaluation, le faible rejet estimé de TCP pour le scénatio de pire cas extrême suggère qu’il est improbable que les produits contenant du TCP constituent une part importante des rejets. En se basant sur les renseignements disponibles, il est assumé que les principales voies de rejet de TCP dû à des produits utilisés sont couvertes par les scénarios actuels de rejets industriels. Globalement, le niveau de confiance dans les scénarios d'exposition au TCP est modéré.
Enfin, nous reconnaissons que la présente évaluation souffre de lacunes dans les données sur la toxicité du TCP dans les sédiments et le sol. Toutefois, le TCP n’est pas utilisé en grande quantité au Canada, et les rejets sont probablement faibles. De plus, en se basant sur l'analyse effectuée pour la présente évaluation, la plus grande partie de l'exposition concernerait les organismes pélagiques et, par conséquent, l'évaluation du risque pour l'eau est plus pertinente que les risques potentiels posés aux organismes vivant dans les sédiments. Le TCP devrait aussi avoir un faible potentiel de persistance dans l'air, l'eau, les sédiments ou le sol, et il est improbable qu’il conduise à des expositions à long terme pour les organismes dans ces milieux (section 8.2 Persistance dans l'environnement).
10. Potentiel d'effets nocifs sur la santé humaine
10.1 Évaluation de l'exposition
10.1.1 Milieux de l’environnement et aliments
Le TCP a fait l'objet d'une surveillance dans divers milieux de l’environnement au Canada et ailleurs (voir la section 7). Lorsqu'il est rejeté dans l'air, le TCP devrait se dégrader rapidement (t1/2 ≤ 1 jour) ou se retrouver dans la phase particulaire de l'air. En raison de sa solubilité dans l’eau modérée, lorsqu'il est rejeté dans les eaux de surface, la majorité de la substance devrait demeurer dans l'eau et une petite fraction devrait s'adsorber sur les solides en suspension et se retrouver dans les sédiments. La volatilisation à partir de l'eau de surface est très faible. Lorsque le TCP est rejeté dans le sol suite à l'épandage de biosolides sur des terres agricoles, il devrait s'adsorber sur sol (environ 100 %) en raison de sa nature hydrophobe. Il devrait être stable dans le sol et résister à la dégradation et, par conséquent, le processus de perte dans le sol sera principalement attribuable à l'enfouissement ou au ruissellement en surface.
Les estimations limites supérieures de la dose journalière de TCP provenant des milieux de l’environnement pour la population canadienne sont données à l'Annexe D. Pour la plupart des groupes d'âge, la principale contribution à la dose journalière estimée provenait de l'ingestion de poussière, suivie des aliments. Les absorptions par exposition à l'air et à l'eau étaient très faibles et jugées négligeables. La plus forte dose journalière estimée a été claculée pour les nourrissons allaités (0 à 6 mois), la dose estimée étant de 0,10 µg/kg pc/jour, provenant principalement de la poussière et du lait maternel.
10.1.1.1 Air ambiant
Au Canada, aucun rapport de concentrations de TCP dans l'air ambiant n’a été trouvé (voir la section 7.1). Le TCP a fait l’objet d’une sruveillance dans des échantillons d'air extérieur prélevés aux États-Unis, à la fin des années 1970, sur un site de production de TCP en Virginie-Occidentale, où les concentrations allaient de 0,01 à 2 ng/m3 (Boethling et Cooper 1985, MRI 1979). Dans le cadre d'une étude récente menée en Finlande, le TCP n'a pas été détecté (rapporté comme < 0,0007 ng/m3, une valeur semi-quantitative baséesur un autre organophosphate ignifuge) dans un échantillon d'air prélevé en juillet 2004 dans une région rurale du nord de la Finlande (Marklund et al. 2005). Au Japon, le TCP a déjà fait l'objet d'une surveillance dans le cadre d'études sur l'air extérieur, le TCP ayant été détecté dans un nombre limité d'échantillons (3 sur 19) prélevés en 1974, jusqu'à 70,3 ng/m3 dans des villes très industrialisées (PISSC 1990). En raison des gaz d'échappement des véhicules, du TCP peut être présent dans les villes industrialisées. Du o-TCP et du m-TCP ont été détectés dans les gaz d'échappement de motocyclettes et de voitures, avec des concentrations sensiblement les mêmes pour les deux isomères dans les gaz d'échappement des motocyclettes (150-300 ng/m3), et le rapport (o-TCP/m-TCP) était le même avant et après la combustion. Les niveaux étaient légèrement moins élevés dans les gaz d'échappement des voitures (140 ng/m3) (Takimoto et al. 1999). Deux études plus récentes ont toutefois fait état de concentrations de TCP plus faibles, allant de la non-détection à 21,4 ng/m3 (Takimoto et al. 1999, Kishi et Sekine 2003).
10.1.1.2 Air intérieur
Nous avons trouvé deux études canadiennes pour lesquelles le TCP a été mesuré dans l'air intérieur. Vykoukalová et al. (2017) ont mesuré deux isomères du TCP, le o-TCP et le p-TCP dans l’air intérieur de 23 habitations à Toronto lors d’une campagne d’échantillonnage de 28 jours de mai à août 2013. Une non-détection a été rapportée dans cette étude pour les échantillons quand le niveau du blanc était > 35 % du niveau mesuré. Le o-TCP a été mesuré dans la gamme allant de la non-détection à 0,05 ng/m3, avec une concentration médiane de 0,005 ng/m3 et une fréquence de détection de 77 %. Le p-TCP a été mesuré dans la gamme allant de la non-détection à 0,023 ng/m3, avec une concentration médiane de 0,002 ng/m3 et une fréquence de détection de 71 %. Les trois isomères du TCP ont aussi fait l’objet d’une surveillance dans l’air intérieur de 32 habitations du Grand Toronto et de 19 habitations à Ottawa lors d’une campagne d’échantillonnage de 3 semaines de la fin février à la fin juillet 2015 (Yang et al. 2018). L’air a été échantillonné dans les chambres de toutes ces habitations (n = 51) et, de plus, dans la pièce la plus utiliusée de 26 des 51 habitations. Le TCPP (rapporté en tant que somme de ses isomères) a été détecté dans l’air des chambres à des niveaux allant de 0,00102 à 0,244 ng/m3, avec une moyenne géometrique de 0,00114 ng/m3 et une fréquence de détection de 2 % (la limite de détection de la méthode utilisée était de 0,00034 ng/m3). Le TCP n’a pas été détecté dans l’air de la pièce la plus utilisée (n = 26) lors de cette étude.
Le TCP a aussi fait l'objet d’une surveillance dans plusieurs milieux intérieurs aux États-Unis, en Europe et en Chine (Appendix E, tableau E-1).
Aux États-Unis, le o-TCP et le p-TCP ont été mesurés dans des échantillons d’air intérieur prélevés dans 20 habitations à Bloomington (Indiana) lors d’une campagne d’échantillonnage de 28 jours en mai à août 2013. Une non-détection a été rapportée pour les échantillons quand le niveau du blanc était > 35 % du niveau mesuré. Le o-TCP a été mesuré dans la gamme allant de la non-détection à 0,142 ng/m3, avec une concentration médiane de 0,142 ng/m3 et une fréquence de détection de 3 %. Le p-TCP a été mesuré dans la gamme allant de la non-détection à 0,256 ng/m3, avec une concentration médiane de 0,256 ng/m3 et une fréquence de détection de 7 % (Vykoukalová et al. 2017).
Lors d’études en Europe, le TCP n’a pas été détecté de manière ubiquiste dans des environnements intérieurs. Lors d’une étude récente réalisée dans 63 garderies en Allemagne, le TCP n’a été détecté ni dans l’air intérieur ni dans la poussière, les limites de détection n’ayant toutefois pas été rapportées (Fromme et al. 2014). Lors d’une étude réalisée par Tollbäck et al. (2006), des échantillons d'air ont été prélevés dans une maternelle et une salle de cours en Suède. La concentration de TCP mesurée dans la salle de cours était de 0,4 ng/m3, mais le TCP n'a pas été détecté dans les classes de la maternelle. Cequier et al. (2014) ont étudié la présence de TCP dans des habitations en Norvège (n = 48) et des classes de deux écoles primaires (n = 6). Le TCP n’a pas été détecté dans les classes et la concentration médiane de TCP dans les habitations était inférieure à la limite de détection de la méthode utilisée (limite de 18 à 44 ng/m3 pour les organophosphates ignifuges), avec un maximum de 0,644 ng/m3. Le TCP n’a été détecté à un niveau supérieur à la limite de détection (1 ng/m3) dans aucun des échantillons prélevés dans des habitations (n=50) et des environnements non résidentiels (p. ex., boulangerie, magasin de tapis, garages) (n=55) (année non précisée) (Staaf et Östman 2005). Dans le cadre d'une étude distincte, le o-TCP n'a pas été mesuré à un niveau supérieur à la limite de dosage (4,1 ng/m3) dans aucun des échantillons (n=12) prélevés dans divers environnements non résidentiels (p. ex., magasins d'appareils électroniques et d'ameublement) à Zurich en Suisse (Hartmann et al. 2004). Cependant, dans le cadre de cette même étude, le o-TCP a été détecté à un niveau supérieur à la limite de détection de 0,41 ng/m3 dans un échantillon prélevé dans un théâtre (2,1 ng/m3) (année non précisée) (Hartmann et al. 2004).
Une étude récente a fait état de concentrations de TCP spécifiques à la taille de particules allant de 0,03 à 0,2 ng/m3 dans des bureaux chinois équipés de mobilier de bureau et de produits électroniques courants, loin de zones industrielles ou à forte circulation (Yang et al. 2014). Les concentrations de TCP étaient les plus importantes pour la fraction de particules de 0,7 à 1,1-µm, c.-à-d. la fraction ultrafine (≤ 1 µm) (Yang et al. 2014).
Le temps passé dans les automobiles peut également représenter des sources potentielles d'exposition au TCP. Les niveaux de TCP dans l'air des véhicules ont fait l'objet d’une surveillance lors de quelques études mentionnées dans la littérature internationale. En Allemagne, une étude sur l'émission d'organophosphates dans l'air intérieur des véhicules a permis de déterminer que le TCP n’a pas été détecté à un niveau supérieur à la limite de détection de 10 à < 50 ng/m3 dans huit véhicules neufs, que ce soit à la température ambiante ou à 65 °C (Wensing et al. 2005). Le TCP n'a pas été détecté dans aucun des échantillons d'air prélevés dans trois voitures à Zurich (Suisse), une voiture neuve, une voiture d'un an et une voiture de neuf ans (Hartmann et al. 2004). Le TCP n'a pas été détecté dans des échantillons d'air (n = 5 pour chaque véhicule) prélevés dans une voiture (près de la zone respiratoire du conducteur), deux autobus et un wagon de métro en Suède, il n’a pas non plus été détecté dans aucun des échantillons prélevés en même temps à l'extérieur des véhicules dans les garages de stationnement (Staaf et Östman 2005).
Le temps passé dans les avions peut également représenter des sources potentielles d'exposition au TCP. Lors de plusieurs études, le potentiel d'exposition dans les cabines d'avion a été examiné en raison de l'utilisation de TCP dans les huiles des turbines de moteur et les fluides hydrauliques du système hydraulique des avions. van Netten (2008) a rapporté que du TCP avait été détecté dans l'air de la cabine pendant le vol dans le cadre d'un suivi de l'air pour les personnes. Deux échantillons d'air ont été prélevés lors de deux vols distincts. La société aérienne, le pays de départ et d'arrivée et l'année de l'échantillonnage n'ont pas été précisés. Les concentrations de TCP ajustées en fonction de l'efficacité de l'échantillonneur étaient de 108 ng/m3 et de 36 ng/m3 pour les vols A et B. Les auteurs ont fait remarquer que pour le vol A, la génératrice auxiliaire avait été utilisé, ce qui a par la suite été associé à une défaillance d'un joint étanche à l'huile (van Netten 2008). Une autre étude a montré que du TCP, présent dans toutes les huiles à moteur ou pour turbine en usage dans les tous avions de la présente étude, a été détecté dans quatre échantillons sur 95 (4,2 %) (Solbu et al. 2011). Les concentrations de TCP allaient de la limite de dosage à 0,29 µg/m3. Du TCP avait toutefois été détecté dans 39 % des frottis (n = 56; représentant un échantillonnage à plus long terme) et dans tous les filtres HEPA (n = 6; échantillons ponctuels), bien que dans ce dernier cas le o-TCP n’ait pas été détecté. Il a aussi été montré que la concentration de TCP lors d’un test au sol dans un avion, qui avait souffert d’une fuite d'huile pour turbine avec contamination subséquente de l'air de la cabine et du cockpit, était un ordre de grandeur plus importante que la concentration mesurée après le remplacement du moteur. Une étude sur des aéronefs militaires a montré que les concentrations de TCP dans l’air du cockpit étaient inférieures à 5 μg/m3, à deux exceptions près (22 et 51 μg/m3). Les démarrages des moteurs au sol à forte puissance conduisent aux concentrations les plus élevées. Tous les échantillons ont été collectés dans des conditions de vol normales (De Nola et al. 2011).
Pour la population canadienne, les estimations d'absorption quotidienne due à l'exposition au TCP dans l'air (tant intérieur qu'extérieur pendant une période de 24 heures) étaient la concentration maximale de 0,244 ng/m3 mesurée dans les chambres dce 51 habitations de la région du Grand Toronto et d’Ottawa (Yang et al. 2018). Bien que des études sur la présence de TCP dans l’air extérieur aient été identifiées, elles n’ont pas été jugées assez fiables pour être utilisées pour la caractérisation de l’exposition.
10.1.1.3 Poussière
La présence de TCP a été surveillée dans la poussière domestique ainsi que dans la poussière provenant d'autres environnements au Canada et ailleurs (Annexe E, tableau E-1 et E-2).
Le TCP a été inclus dans l'étude de référence canadienne des organophosphates ignifuges dans des échantillons de poussière domestique archivés (n = 818) collectés en 2007 et 2008 dans diverses villes canadiennes dans le cadre de l'Enquête sur la poussière domestique au Canada (EPDC) (données préliminaires de l'EPDC, Kubwabo et al. manuscrits en cours de rédaction, Bureau de la science de la santé environnementale et de la recherche de Santé Canada, non référencée, 13 décembre 2013). La technique d'échantillonnage de la poussière de l'EPDC a été jugée adéquate pour déterminer des concentrations représentatives d’organophosphates ignifuges, en se basant sur une comparaison des techniques d'échantillonnage de la poussière (Fan et al. 2014). Le TCP a été détecté dans 99,9 % des échantillons de l'étude de référence, et les concentrations allaient d’une non-détection (limite de détection de 30 ng/g) à 295 000 ng/g. La concentration médiane et le 95e percentile étaient de 4860 et de 17 700 ng/g, respectivement. La concentration maximale de TCP était la plus importante parmi celles de tous les organophosphates ignifuges mesurées lors de cette étude.
Du TCP a aussi été mesuré lors d’autres études canadiennes. Vykoukalová et al. (2017) ont mesuré deux isomères du TCP, le o-TCP et le p-TCP, dans 23 habitations à Toronto pendant une campagne d’échantillonnage de 28 jours de mai à aout 2013. Pour cette étude, une non-détection a été rapportée quand le niveau du blanc éait > 35 % du niveau mesuré. Les concentrations de o-TCP allaient de la non‑détection à 7,02 ng/g, avec une concentration médiane de 0,712 ng/g et une fréquence de détection de 71 %. Les concentrations de p-TCP dans la poussière allaient de 0,871 à 116 ng/g, avec une concentration médiane de 6,18 ng/g et une fréquence de détection de 100 %. La poussière a été collectée dans 32 habitations de la région du Grand Toronto et dans 19 habitations à Ottawa pendant une campagne d’échantillonnage de 3 semaines en 2015. La poussière a été échantillonnée dans les chambres de toutes les habitations (n = 51) et dans la pièce la plus utilisée de 26 des 51 habitations. Le TCP (rapporté comme somme des isomères du TCP) a été détecté dans 74 % des échantillons de poussière prélevés dans les chambres (n = 51) à des concentrations allant de 0,75 à 1120 ng/g, moyenne géométrique de 23,2 ng/g, et 95ème percentile de 554 ng/g. Le TCP a été détecté dans 81 % des échantillons de poussière prélevés dans les pièces les plus utilisées (n = 26) à des concentrations allant de 0,75 ào 699 ng/g, moyenne géométrique de 28,8 ng/g, 95ème percentile de 217 ng/g (Yang et al. 2018).
Une étude de surveillance de la poussière domestique aux États-Unis, réalisée en Californie en 2011 et précédemment en 2006, a mis en évidence des concentrations relativement moindres (Dodson et al. 2012). Les concentrations médianes de TCP dans les échantillons prélevés sur les surfaces des pièces habitées de 16 résidences en 2011 et 2006 étaient respectivement de 680 et 1000 ng/g, les concentrations allant respectivement de 180 à 10 000 ng/g et de 330 à 4400 ng/g (Dodson et al. 2012). Les concentrations de TCP rapportées lors d’études sur la poussière domestique réalisées en Europe et ailleurs étaient généralement inférieures à celles mesurées lors de l'étude de référence canadienne (Kersten et Reich 2003, Brommer et al. 2012, Dirtu et al. 2012, Van den Eede et al. 2011). Lors d’une étude récente réalisée aux Pays-Bas, l'équipement électronique (appareils électroniques) a été examiné comme source de TCP dans la poussière domestique. Les niveaux de TCP dans la poussière domestique présente sur les appareils électroniques (médiane de 330 ng/g) étaient nettement supérieurs à ceux de la poussière prélevés près de ces appareils (110 ng/g) (Brandsma et al. 2014). Ces résultats sont en accord avec ceux de Kajiwara et al. (2011), qui ont fait remarquer que le TCP était un organophosphate ignifuge majeur détecté dans le matériel électronique (téléviseurs ACL) du marché japonais en 2008. En Nouvelle-Zélande, des échantillons de poussière ont été prélevés sur les tapis, les planchers et les matelas dans des milieux ruraux et urbains en 2008 (Ali et al. 2012). La concentration médiane (120 ng/g, n = 34) des échantillons prélevés sur les tapis et les planchers était inférieure à celle des échantillons prélevés sur les matelas (157 ng/g, n = 16).
Lors d’une étude récente en Allemagne, des organophosphates ont été mesurés dans des échantillons appariés d’air intérieur et de poussière prélevés dans 63 garderies (Fromme et al. 2014). Le TCP n’a été détecté ni dans l’air intérieur ni dans la poussière de ces garderies, les limite de détection n’ont toutefois pas été spécifiées (Fromme et al. 2014). En 2008, lors d’une autre étude en Belgique, des échantillons de poussière (n = 15) ont été collectés dans divers magasins de détail, dont un magasin d’électronique, un magasin de matelas, des pharmacies, une boutique d’aubaines et un magasin de meubles, et plusieurs composés ignifuges, dont le TCP, ont été analysés (Van den Eede et al. 2011). Les concentrations de TCP allaient de la non-détection (LD = 0,04) à 12,5 ng/g, avec une moyenne de 1,53 ng/g (Van den Eede et al. 2011).
En Allemagne, Brommer et al. (2012) ont mesuré le TCP dans la poussière de l’intérieur de 12 automobiles. Les échantillons ont été prélevés entre décembre 2010 et janvier 2011 à l'aide d'un aspirateur typique utilisé par le propriétaire pour nettoyer son véhicule. Les concentrations de TCP étaient beaucoup plus grandes que celles mesurées dans la poussière domestique lors de même étude, allant de la non-détection (LD = 40 ng/ng) à 150 000 ng/g, la moyenne étant de 24 000 ng/g (Brommer et al. 2012). Brandsma et al. (2014) ont récemment rapporté des concentrations de TCP dans des voitures aux Pays-Bas. Huit voitures faisaient partie de l'étude : deux voitures plus anciennes (2003 et 2004) et quatre autres voitures construites entre 2008 et 2012. Les échantillons prélevés sur le tableau de bord (n = 8) et sur les sièges (n = 8) avaient des concentrations médianes de TCP de 750 ng/g (47 [limite de détection] à 9 500 ng/g) et de 1400 ng/g (250 à 380 000 ng/g), respectivement. La concentration élevée (en particulier le maximum dans les échantillons des sièges) est conforme à l'utilisation de TCP comme plastifiant dans les automobiles. Les niveaux de TCP dans la poussière des sièges d'automobile étaient également nettement plus élevés que ceux mesurés dans la poussière domestique prélevée sur des appareils électroniques lors de la même étude (Brandsma et al. 2014).
Les estimations d'absorption quotidienne due à une exposition au TCP relativement à l'ingestion de poussière pour la population canadienne ont été basées sur la concentration au 95ème percentile de 17 700 ng/g tirée de l'Enquête sur la poussière domestique au Canada (données de référence préliminaires de l'Enquête sur la poussière domestique au Canada) (communication personnelle du Bureau de la science et de la recherche en santé environnementale de Santé Canada, datée du 13 décembre 2013). Les éléments de preuve tirés d’un nombre limité d'études réalisées en Europe indiquent que le temps passé dans une voiture peut représenter une source d'exposition au TCP présent dans la poussière. Cependant, les expositions calculées à partir de l'étude sur la poussière domestique au Canada étaient jugées, avec raison, prudentes pour estimer l'exposition due à la poussière de la population générale au Canada.
10.1.1.4 Sol et sédiments
Aucune donnée de surveillance du TCP dans le sol ou les sédiments n’a été trouvée pour le Canada (voir la section 7.4). Aux États-Unis, les données disponibles sur les sols (p. ex., Boethling et Cooper 1985, David et Seiber 1999b) sont anciennes et n’ont pas été jugées appropriées ni pertinentes pour un calcul prudent des absorptions de la population générale dues à l’exposition actuelle. Une CEE maximale pour le TCP dans le sol de 300 ng/g ps (0,0003 mg/kg ps) a été estimée pour l'épandage de biosolides sur des terres agricoles en suivant des approches prudentes, tel que détaillé dans la section « Évaluation de l'exposition dans l'environnement » (voir la section 9.2.1.1).
Lors d’une étude canadienne récente, une carotte de sédiments provenant du bassin de la rivière Niagara et une autre provenant du bassin de la rivière Mississauga, en Ontario, prélevées respectivement en 2012 et 2013 (De Silva et Muir 2016, voir la section 7.3) ont été étudiées. Le TCP (total des isomères) a été analysé et des niveaux moyens de 0,011 mg/kg ps (Niagara) et de 0,0082 mg/kg ps (Mississauga) ont été déterminés.
En Europe, des concentrations de TCP allant d’une non-détection à 390 µg/kg ont été mesurées dans des sédiments de sources d'eau douce au Danemark, en Norvège, en Autriche et en Allemagne (Ricking et al. 2003, Martinez-Carballo et al. 2007, UK EA 2009, Van der Veen et de Boer 2012), la surveillance la plus récente de ces concentrations dans les sédiments d'eau douce (2005) mettant en évidence des valeurs allant de 1,5 à 39 ng/g ps (rapportées comme < LQ - 39 ng/g ps) (Martinez-Carballo et al. 2007). Au Danemark, les concentrations dans les sédiments marins allaient de de la non-détection à 370 µg/kg (UK EA 2009).
Étant donné qu'aucune étude appropriée ou pertinente de surveillance du TCP n'a été identifiée, la CEE maximale dans le sol (0,0003 mg/kg ps) a été retenue pour estimer les absorptions dues à l'ingestion de sol pour la population générale du Canada.
10.1.1.5 Eau potable
La surveillance du TCP dans l’eau potable au Canada a fait l’objet de plusieurs études (Annexe E, tableau E-3). De 2000 à 2003, les isomères du TCP ont été ciblés dans le cadre du programme de surveillance de l'eau potable municipale de la ville de Toronto, et aucun n'a été détecté à un niveau supérieur à la limite de détection de 60 ng/L (Ville de Toronto 2003a, 2003b, 2003c).
Le TCP a également fait l'objet d'une surveillance lors de plusieurs études plus anciennes sur l'eau potable au Canada. Le TCP n’a pas été détecté dans la majorité des échantillons d'eau potable prélevés dans diverses municipalités (environ 35) au Canada à la fin des années 1970. Toutefois, quand il était détecté, sa concentration allait de 0,7 à 4,3 ng/L (Lebel et al. 1981, Wiliams et Lebel 1981). Le TCP a aussi été détecté dans l'eau potable de 5 des 12 municipalités canadiennes de la région des Grands Lacs (Thunder Bay, Owen Sound, Union-Leamington, St Catherines et Toronto), à des concentrations allant de 0,6 à 1,8 ng/L dans le cadre d'une étude de surveillance réalisée en 1980 (Williams et al. 1982).
La présence de TCP dans des eaux de surface a également fait l'objet d'une surveillance (voir la section 7.2). Au Canada, le TCP n’a pas été détecté dans les eaux libres des Grands Lacs, mais l’a été dans les affluents du lac Ontario et du lac Érié en 2010-2011, à des concentrations allant de 2,5 à 22 ng/L (Lee et al. 2011). En Europe, dans le cadre d'une surveillance récente d’eaux de surface, le TCP n’a pas été détecté lors de trois études indépendantes menées dans des rivières du Danemark, de Rome et de l'Autriche (Bacaloni et al. 2007, Martinez-Carballo et al. 2007, UK EA 2009).
Les doses journalières limites supérieures de TCP dues à l'exposition à l'eau potable de la population générale du Canada ont été calculées en utilisant la limite de détection de 60 ng/L du programme de surveillance de l'eau potable de la ville de Toronto des années de 2000 à 2003 (Ville de Toronto 2003a, 2003b, 2003c).
10.1.1.6 Aliments
Aucune étude faisant état de la présence de TCP dans des aliments commercialisés au Canada n’a été trouvée. Cependant, le TCP avait auparavant été ciblé lors de la Total Diet Study de la Food and Drug Administration des États-Unis (FDA) (Annexe E, tableau E-4). La Total Diet Study est un programme en cours de la FDA visant à analyser les contaminants dans 357 types d'aliments (allant des produits laitiers aux aliments pour bébés) vendus à travers les États-Unis (FDA 2014). Les résultats de l'étude sur le panier de provisions publiés sur le site Web de la FDA (FDA 2014) ont montré que TCP avait été détecté dans un des 44 échantillons de pain de blé concassé à une concentration de 90 ng/g (0,09 ppm) (moyenne de 2,05 ng/g) dans un panier de provisions collecté en 2003 (FDA 2006). Cependant, le TCP n'a été détecté dans aucun autre aliment de tous les paniers de provisions collectés de 1991 à la fin de 2003, représentant environ 15 000 produits alimentaires (FDA 2006). À ce titre, la détection de TCP dans un seul échantillon a été jugée non représentative et, par conséquent, cette donnée n'a pas été utilisée pour l'évaluation de l'exposition.
La présence de TCP dans le biote a aussi fait l'objet d'une surveillance aux États‑Unis, en Europe et au Japon (Annexe E, tableau E-5). Le TCP a fait l'objet d'une surveillance aux États-Unis lors de plusieurs études plus a anciennes sur des poissons près d'installations industrielles (Lombardo et Egry 1979, Muir 1984). Toutefois, les résultats de ces études ne sont pas jugés appropriés pour la caractérisation de l'exposition aujourd'hui. Le TCP a fait l'objet d'une surveillance dans une large gamme de poissons, de mollusques et de crustacés d'eau douce et d'eau de mer collectés en 2005 ou 2007 à travers la Suède, avec une gamme de concentrations rapportée allant de 1,8 à 110 ng/g pl (ou un maximum de 1,32 ng/g ph, Sundkvist et al. 2010). La concentration maximale de TCP était celle d’un échantillon provenant d’un cours d'eau recevant l'eau d'un aéroport international situé à Marstaan, une banlieue de Stockholm, ce qui peut expliquer cette concentration plus élevée (Sundkvist et al. 2010). Ce même échantillon était le seul dans lequel un niveau détectable de o-TCP de 2,5 ng/g pl a été mesuré. Dans le cadre d'une surveillance environnementale par le ministère de l'Environnement du Japon ([ME Japon] 2003), le TCP n’a pas été détecté dans des échantillons archivés de poissons collectés à divers endroits en 1975 (n = 96) et 1978 (n = 93). Toutefois, du TCP a été détecté dans des échantillons collectés plus récemment en 1993 (n = 75), à des concentrations allant de 63 à 82 ng/g pl.
En se basant sur les renseignements disponibles, les estimations des doses journalières de TCP dues à la consommation de poissons pour la population générale du Canada ont été calculées à l'aide de la concentration maximale (1,32 ng/g ph) dans les mollusques mesurée en Europe (Sundkvist et al. 2010). En l'absence d'une surveillance récente en Amérique du Nord, cette concentration est jugée appropriée pour calculer les doses limites supérieures chroniques pour la population générale du Canada. En outre, l'hypothèse selon laquelle le TCP est présent à cette concentration dans tout le groupe d'aliments aquacoles (poissons, mollusques, crustacés et aliments connexes) consommés par la population générale est jugée prudente. Bien que certaines populations du nord du Canada puissent consommer de façon saisonnière de plus grandes quantités de produits de la mer, cette estimation est jugée prudente pour tenir compte de cette variabilité.
10.1.1.7 Lait maternel
Aucune étude faisant état d'une surveillance du TCP dans le lait maternel au Canada n’a été trouvée. Toutefois, deux études internationales l’ont été. Sundkvist et al. (2010) ont fait état de concentrations de TCP dans des échantillons de lait maternel provenant de femmes vivant dans quatre villes de la Suède entre 1997 et 2007 (Annexe E, tableau E-6). Ces échantillons de lait avaient été prélevés deux à trois semaines après l'accouchement de leur premier enfant. La plupart des échantillons de chaque cohorte (une seule ville pour une année donnée) ont été regroupés, et une seule valeur a été rapportée. Les concentrations de TCP allaient d'une non-détection (limite de détection de 0,1 ng/g lipides) en 2006 (50 échantillons regroupés) à 3,7 ng/g lipides en 1997 (69 échantillons regroupés), les deux cohortes provenant de la ville d'Uppsala (Sundkvist et al. 2010). Les auteurs ont remarqué une tendance semblable (c.-à-d. des concentrations plus élevées dans des échantillons plus anciens) pour un autre organophosphate ignifuge, et ont fait remarquer que les échantillons plus anciens pouvaient avoir été contaminés, par exemple, par l'équipement d'échantillonnage, comme les tire-lait.
Le TCP a été mesuré dans le lait maternel humain collecté au Japon (n = 20) entre 2009 et 2011, aux Philippines (n = 41) en 2008 et au Vietnam (n = 26) en 2008 (Kim et al. 2014). Bien que la fréquence de détection globale ait été de 59 % pour cette étude (limite de détection non précisée), le TCP n’a pas été détecté dans les échantillons provenant du Japon. Aux Philippines, la concentration médiane (2,3 ng/g pl, gamme allant de la non-détection à 11 ng/g pl) était supérieure à celle mesurée au Vietnam (0,28 ng/g pl, gamme allant de la non-détection à 7,9 ng/g pl). La même tendance a été observée pour les concentrations totales de composés organophosphorés. Au Vietnam et aux Philippines, les concentrations maximales étaient associées respectivement à des échantillons collectés auprès de mères résidant près de zones urbaines et de sites de recyclage de déchets électroniques.
Les estimations des doses journalières de TCP pour les enfants allaités de la population générale du Canada ont été calculées en se basant sur la concentration de 3,7 ng/g lipides (donnant une concentration de 0,26 ng/g ph pour une teneur rapportée en lipides de 3,4 %) tirée de l'étude réalisée en Suède (Sundkvist et al. 2010).
10.1.2 Produits disponibles pour les consommateurs
Le TCP est un additif ignifuge ayant diverses utilisations et applications (consulter la section 5), qui peuvent entraîner une exposition de la population générale. Les estimations de l'exposition par voie dermique ont été calculées en suivant des approches prudentes dans le cadre de scénarios jugés pertinents pour la population générale. Le TCP est une substance très peu volatile en raison de sa faible pression de vapeur et de sa faible constante de Henry (voir la section 3). En tant que tel, les rejets dans l'air provenant de produits disponibles pour les consommateurs devraient être couverts par les estimations de l'exposition due à l'air intérieur et à la poussière (voir les sections 9.1.1.1 et 9.1.1.3).
10.1.2.1 Articles manufacturés
Des produits ignifuges peuvent être présents dans des revêtements appliqués sur le côté intérieur de tissus de couverture en tant qu'« enduction d'envers ». L'utilisation de TCP dans de l’enduction d'envers de rembourrage de meubles n'a pas été rapportée au Canada, mais elle a été documentée aux États-Unis. Il est donc raisonnable d’assumer que la population générale du Canada puisse être exposée à du TCP présent dans des meubles. D’après un rapport de 2000 du National Research Council des États-Unis (NRC 2000), du TCP a été appliqué comme enduction d'envers de rembourrage de meubles (Piccirillo 1999, NRC 2000). Dans le cadre d'une enquête réalisée aux États-Unis par la Fire Retardant Chemicals Association avant 1998, des « phosphates aromatiques » (comme le TCP) auraient été utilisés dans des meubles résidentiels selon les renseignements provenant des industries des produits ignifuges aux États-Unis ayant des activités commerciales avec l'industrie des textiles (cité dans CPSC 1998). L'Upholstered Furniture Action Council (UFAC), un regroupement volontaire de fabricants de meubles, avait souligné le potentiel d'exposition dermique due à la couche d'enduction d'envers, soit par contact direct avec la substance dû à la contamination de la surface extérieure du tissu (à partir de la couche d'enduction d'envers humide lorsque le textile est mis en rouleau après sa production), soit par migration et dégradation de l'enduction d'envers au travers de l’armure du textile (cité dans CPSC 1998).
D'autres rapports ont aussi documenté l'utilisation du TCP dans des meubles, y compris son utilisation comme plastifiant dans le cuir synthétique en Europe (Commission européenne 2011) et dans les housses de siège en PVC (SinoHarvest 2011). En outre, d’après la documentation des producteurs, le TCP est commercialisé pour de la mousse souple utilsisée pour la fabrication de meubles (ICL 3013c). Du TCP a été détecté dans une chaise en mousse lors de tests préliminaire réalisés par Sant Canada sur des articles manufacturés pour enfants achetés des des de ≥ 0,7 % supérieure à la limite de dosage. Toutefois, le TCP n’a pas été détecté dans les 23 autres articles manufacturés pour enfants testés (p. ex., coussins d'allaitement, jouets). (Santé Canada 2014). Lors d’une étude entreprise par le CEC, la présence of 16 produits ignifuges a été recherchée dans des produits d’ameublement (p. ex. chaises de bureau, sofas avec rembourrage et/ou chaises) provenant du Canada, des États-Unis et du Mexique (criblage par fluorescence X (XRF) suivi d’une analyse par CG/SM). Le TCP n’a été détecté dans aucun des 132 produits achetés pour cette étude en décembre 2014 et avril 2015 (CEC 2015).
Bien que le TCP n’ait pas été identifié dans la plupart des produits disponibles pour les consommateurs restés lors d’études récentes (CEC 2015, Santé Canada 2014), les meubles traités sont toujours considérés comme la source la plus probable d’exposition au TCP pour les Canadiens en raison de son utilisation rapportée dans de tels produits au niveau international. En tant que telles, les absorptions par voie dermique due à une exposition ont été estimées pour les jeunes enfants et les adultes dans le cas du scénario sentinelle de contact direct avec l'enduction d'envers de matériaux de rembourrage de meubles pour adultes (tableau 10-1). Aucune donnée sur une migration spécifique au TCP n’a été identifiée. À ce titre, une gamme de valeurs de migration pour d'autres organophosphates ignifuges a été utilisée pour tenir compte de la migration à partir du rembourrage et de la mousse traités et de la variabilité des vitesses de migration. Ces valeurs ont été jugées prudentes en raison de la solubilité plus grande de ces composés par rapport à celle du TCP, les expériences sur la migration consistant à mesurer le transfert de la substance à partir du textile ou de la mousse en solution aqueuse (c.-à-d. imitant une migration médiée par la sueur). Le TCP a une solubilité dans l’eau de 0,36 mg/L (Saeger et al. 1979), alors que le PTCE (phosphate de tri(2-chloroéthyle)) et le PTDCP (phosphate de tri(1,3-dichlorpropane-2-yle)) ont respectivement des solubilités dans l’eau de 7820 mg/L (UE RAR 2009) et de 18,1 mg/L (SafePharm Laboratories 2002). Les vitesses de migration allaient de 5,6 × 10-5 mg/cm2/h pour le PTDCP à 2,17 x 10-4 mg/cm2/h pour le (PTCE). La migration du PTCE était basée sur celle dans l'enduction d'envers textile décrite dans le rapport européeen d’évaluation des risques du PTCE (UE RAR 2009), tandis que la vitesse pour le PTDCP était basée sur la migration dans la mousse de rembourrage traitée, décrite par la Consumer Product Safety Commission des États-Unis (CPSC 2005). Les estimations de l'exposition par voie dermique due au contact avec des meubles pour adultes allaient de 1,29 ×10-3 à 4,99 ×10-3 mg/kg pc/j pour les jeunes enfants et de 6,61×10-3 à 2,56 ×10-2 mg/kg pc/j pour les adultes. Ces plages reflètent les différentes vitesses de migration. Ces estimations ont été faites à l'aide d'hypothèses prudentes décrites à l'Annexe F.
D'autres juridictions ont effectué des évaluations du TCP en rapport avec les meubles (NRC 2000, Commission européenne 2011). Cependant, les approches suivies variaient considérablement, tout comme les absorptions et les conclusions spécifiques à la voie en raison de différences entre les paramètres pris en compte, les valeurs par défaut, la prudence observée, etc. Le rapport d'évaluation sur les produits ignifuges dans les produits de consommation publié par la Commission européenne comportait plusieurs recommandations pour une amélioration des scénarios (Commission européenne 2011), dont la plupart ont été prises en compte pour la présente évaluation.
| Voie d'exposition | Source | Produit | Groupe d'âge | Absorption |
|---|---|---|---|---|
| Dermique | Rembourrage d’enduction d'envers ou mousse | Meubles | Tout-petit (15,5 kg) | 3 × 10-3 à 5,0 × 10-3 mg/kg pc/j |
| Voie cutanée | Rembourrage d’enduction d'envers ou mousse | Meubles | Adulte (70,9 kg) | 6,6 × 10-3 à 2,6 × 10-2 mg/kg pc/j |
Les autres utilisations du TCP dans des articles manufacturés au Canada comprennent les pièces pour automobile, comme le coffre et la garniture de toit (ECCC 2013-2014). Le TCP a été associé à la poussière de l’intérieur de véhicules (Brommer et al. 2012, Brandsma et al. 2014, voir la section 10.1.1.3). En tant que tel, il est raisonnable d’assumer que la population générale du Canafa puisse être exposée au TCP à l’intérieur de véhicules. Les utilisations de TCP dans d'autres articles manufacturés rapportées dans la littérature internationale comprennent l'ameublement domestique, les appareils électroniques et d'autres articles utilitaires (p. ex. chaussures, imperméables, cuir synthétique et sacs à main) (Kajiwara et al. 2011, SinoHarvest 2011, Siret-Alatrista et al. 2010, PISSC 1990, Ash et Ash 2003) (Annexe F). Bien qu’une exposition au TCP puisse être due à ces articles manufacturés, le potentiel global d'exposition (fréquence, durée et ampleur) de tels scénarios ne devrait pas entraîner d'expositions supérieures à celles quantitatives prévues par les scénarios de meubles.
10.1.2.2 Produits
Les produits contenant du TCP disponibles pour la population générale du domaine des fluides hydrauliques, des huiles et des lubrifiants peuvent comprendre les fluides pour transmission automatique et les huiles pour moteur d’automobile ou de motocyclettes (Chemtura 2007, Takimoto et al. 1999, Solbu et al. 2011, ATSDR 1997, OMS 1990). Les concentrations de TCP dans divers produits à base d'huile sont données à l'annexe G. Selon l’enquête réalisée auprès de l'industrie canadienne, un produit pour la population générale a été identifié comme pouvant conduire à un contact direct, à savoir un fluide pour servodirection (ECCC 2013-2014). La voie dermique a été considérée comme la seule voie d’exposition en raison de la faible pression de vapeur du TCP. En suivant une approche de couche mince (Westat 1987), l’exposition par voie dermique à court terme la plus importante (bouts des doigts) au TCP due à l’utilisation du fluide pour servodirection a été estimée à 2,4 µg/kg pb (Annexe G).
10.1.3 Biosurveillance
Nous avons identifié une étude canadienne pour laquelle neuf métabolites urinaires d’organophosphates ignifuges ont été mesurés dans des échantillons d’urine (n = 24) collectés en 2010-2012 chez des femmes enceintes de la région de Hamilton (Ontario) (Kosarac et al. 2016). Deux métabolites du TCP ont été mesurés lors de cette étude, le phosphate de di(2-méthylphényle) (PD2MP) et le phosphate de di(4-méthylphényle) (PD4MP). Les concentrations de ces deux métabolites urinaires, détectés avec une fréquence combinée de 75 %, se situaient dans une gamme allant de < 0,13 à 4,38 ng/mL, avec une médiane de 0,69 ng/mL (LD de 0,13 ng/mL) (Kosarac et al. 2016). Le TCP a aussi été mesuré dans le tissu adipeux, dans 6 municipalités de l’Ontario en 1989, mais le TCP n’a été détecté dans aucun des 82 échantillons analysés, avec une limite de détection de 1 ng/g (LeBel et al. 1989).
Aux États-Unis, le PD2MP et le PD4MP ont été analysés dans des échantillons d’urine ponctuels provenant de la National Health and Nutrition Examination Survey (NHANES) de 2013-2014 (Ospina et al. 2018). Le PD2MP n’a été détecté que dans 0,1 % et le PD4MP dans 13% des 2666 échantillons analysés (LD = 0,05 µg/L pour les deux substances). Les concentrations de PD2MP ont donc toutes été considérées inférieures à la LD, alors que pour le PD4MP la valeur au 95ème percentile allait de 0,090 µg/L pour les adultes de 60 ans et plus à 0,240 µg/L pour les enfants de 6 à 11 ans (il n’était pas possible de calculer les moyennes géométriques et les valeurs au 50ème percentile étaient inférieures à la LD) (Ospina et al. 2018). Pour une étude de moindre ampleur réalisée aux États-Unis, neuf métabolites urimaires de produits ignifuges ciblés ont été mesurés. Le PD2MP, qui n’a été détecté dans aucun des échantillons, et le PD4MP faisaient partie de cette étude. Le PD4MP n’a pas été détecté à un niveau supérieur à la limite de détection de 0,05 ng/mL dans aucun des échantillons collectés chez des adultes à Atlanta (Géorgie) (n = 76) en 2015. Il a cependant été détecté dans 34 % des échantillons collectés chez des pompiers en 2010-2011 pour une étude du National Institute for Occupational Safety and Health (NIOSH) des Éatst-Unis, avec une concentration médiane inférieure à la LD de 0,05 ng/mL couvrant la gamme allant de < 0,05 à 0,21 ng/mL (Jayatilaka et al. 2017).
Pour une étude réalisée en Allemagne, la présence de huit métabolites d’organophosphates, dont les trois isomères du TCP, dans l’urine de 312 enfants âgés de 22 à 80 mois fréquentant des garderies a été étudiée. Aucun des trois isomères du TCP n’a été détecté à un niveau supérieur à la limite de détection de 0,1 μg/L (Fromme et al. 2014).
Un marqueur de l’exposition au o-TCP (adduit de butyrylcholinestérase ou butyrylcholinestérase phosphorylée) a été détecté dans 6 des 12 échantillons sanguins provenant de douge passagers d’un avion de ligne choisi au hasard, probablement le résultat de joints d’étanchéité des moteurs usés ou défectueux qui peuvent libérer de l’huile dans l’approvisionnement en air de la cabine (Liyasova et al. 2011). Les échantillons de sang ont été prélevés de 24 à 48 heures après la fin du vol. Les auteurs ont décrit les niveaux d'exposition comme très faibles, en moyenne de 0,05 à 1 % de butyrylcholinestérase phosphorylée. Quatre des sujets qui avaient présenté des résultats positifs ont fait l'objet d'une nouvelle analyse de 3 à 7 mois après leur dernier voyage en avion et ne présentaient plus de butyrylcholinestérase phosphorylée (Liyasova et al. 2011).
10.2 Évaluation des effets sur la santé
Un résumé des renseignements disponibles sur les effets sur la santé du TCP est présenté à l’Annexe H.
Aucune classification des effets sur la santé du TCP (contenant < 0,1 % de o-TCP) par des organismes de réglementation nationaux ou internationaux n’a été trouvée.
10.2.1 Cancérogénicité et génotoxicité
Le NTP des États-Unis a réalisé une étude de 2 ans par voie orale avec des rats et des souris afin de déterminer la cancérogénicité du TCP. Des rats Fischer 344/N (95 par sexe par groupe) ont reçu du TCP dans leur alimentation à des doses de 0, 75, 150 ou 300 ppm (environ 0, 3, 6 ou 13 mg/kg pc/j dans le cas des mâles et de 0, 4, 7 ou 15 mg/kg pc/j dans le cas des femelles) pendant deux ans. Un autre groupe de rats a reçu 600 ppm de TCP dans son alimentation pendant 22 semaines, puis a reçu une alimentation témoin. De même, des souris B6C3F1 (95 par sexe par dose) ont reçu du TCP dans leur alimentation à des doses de 0, 60, 125 ou 250 ppm (environ 0, 7, 13 ou 27 mg/kg pc/j pour les mâles et 0, 8, 18 ou 37 mg/kg pc/j jour pour les femelles) pendant deux ans. Les rats et les souris ont été examinés à 3, 9 et 15 mois, puis au bout des deux ans. Aucune preuve d’une activité cancérogène du TCP n’a été mise en évidence chez les rats et les souris exposés. Les effets non néoplasiques observés durant l'étude de deux ans comprenaient une vacuolisation cytoplasmique du cortex surrénal chez les rats mâles et femelles, une hyperplasie des cellules interstitielles de l'ovaire chez les rates, une pigmentation céroïde du cortex surrénal chez les souris mâles et femelles, ainsi qu'une fréquence accrue de foyers cellulaires clairs, un changement des tissus adipeux et une pigmentation céroïde dans le foie des souris mâles (NTP 1994). Ces effets sont discutés plus en détail à la section 9.2.3.
Des études sur la génotoxicité du TCP ont été réalisées in vitro et in vivo. Des résultats négatifs ont été obtenus lors de deux épreuves bactériologiques de mutation (Salmonella typhimurium TA 98, TA100, TA1535, TA1537, TA1538) avec ou sans activation métabolique. Le TCP n'a induit aucun échange de chromatides sœurs dans les cellules des ovaires de hamsters chinois (OHC), avec ou sans activation métabolique. Pour les épreuves d'aberration chromosomique, les résultats ont été négatifs pour les cellules OHC et la lignée cellulaire de lymphomes murins, mais étaient ambigus pour les cellules L5178Y de lymphome murin et positifs pour la lignée cellulaire BALB/3T3, avec ou sans activation métabolique. Lors d’une épreuve in vivo, le TCP n'a pas induit de synthèse imprévue d'ADN chez les rats exposés. Par conséquent, d’après les renseignements disponibles, il est improbable que le TCP soit génotoxique.
10.2.2 Effets sur la reproduction et le développement
Les effets du TCP sur la reproduction chez des rats et des souris des deux sexes ont été étudiés. Lors d’une étude suivant un protocole de reproduction continue, des souris mâles et femelles Swiss (CD-1) (20 par sexe par dose pour le groupe testé, 40 par sexe pour le groupe témoin) ont reçu des doses de 0, 0,05, 0,1 ou 0,2 % de TCP (environ 0, 63, 124 ou 250 mg/kg pc/j) dans leur alimentation pendant 7 jours avant la reproduction et 98 jours durant la reproduction. Une diminution importante (p < 0,01) du nombre de portées par paire liée à la dose a été observée. La proportion de petits nés vivants et leur poids ont diminué de façon significative à la dose de 250 mg/kg pc/j. Lors de la phase d'accouplement croisé, une infertilité perturbée a été observée chez les mâles et les femelles ayant reçu une dose de 250 mg/kg pc/j, l'effet étant plus important chez les femelles. Des modifications des glandes surrénales liées à la dose ont été observées chez les deux sexes. À la dose élevée, le poids corporel des mâles et des femelles a diminué. Une diminution importante (p < 0,05) de la motilité des spermatozoïdes a été observée à 63 et 124 mg/kg pc/j (les mâles du groupe ayant reçu 250 mg/kg pc/j jour n'ont pas été examinés). Une atrophie des tubules séminifères et une diminution du poids des testicules et de l'épididyme ont été observées chez les mâles F0 à la dose élevée, alors qu’aucune modification histopathologique de l'appareil reproducteur féminin n’a été mis en évidence. Une DMENO de 63 mg/kg pc/j a été retenue, en se basant sur la diminution du nombre de portées par paire. Aucne DSENO n’a été établie (Chapin et al. 1988).
Lors d’une étude sur une génération avec des rats Long Evans, les effets du TCP sur la reproduction ont aussi fait l’objet d’un examen. Du TCP a été administré par gavage dans de l'huile de maïs à des rats mâles (12 par dose), à raison de 0, 100 ou 200 mg/kg pc/j, et à des rats femelles (24 par dose), à raison de 0, 200 ou 400 mg/kg pc/j. Les mâles ont reçu ces doses pendant 56 jours, et les femelles pendant 14 jours avant la reproduction et tout au long de la période de reproduction de 10 jours. Les mâles ayant reçu la faible dose (100 mg/kg pc/j) ont été accouplés avec les femelles ayant reçu la faible dose (200 mg/kg pc/j), et les mâles ayant reçu la dose élevée (200 mg/kg pc/j) ont été accouplés avec les femelles ayant reçu la dose élevée (400 mg/kg pc/j). Une morphologie anormale des spermatozoïdes liée à la dose a été observée à toutes les doses. La concentration, la motilité et la progression des spermatozoïdes ont diminué à la dose de 200 mg/kg pc/j. Le nombre de femelles accouchant de petits vivants a diminué à toutes les doses. Une diminution de la taille des portées et de la viabilité des petits a été observée à la dose de 400 mg/kg pc/j. Des modifications histopathologiques au niveau des testicules et des épididymes ont été observées chez les rats mâles et des ovaires chez les rates. Une DMENO de 100 mg/kg pc/j a été retenue, correspondant à la plus faible dose des tests, en se basant sur une fœtotoxicité, une morphologie anormale des spermatozoïdes, des modifications histopathologiques au niveau des testicules et des épididymes (Carlton et al. 1987).
Lors d’une étude sur la toxicité pour le développement prénatal, des rates SD enceintes ont reçu du TCP par gavage à raison de 0, 20, 100, 400 ou 750 mg/kg pc/j pendant les jours 0 à 19 de la gestation. Les observations cliniques comprenaient une salivation accrue aux doses de 100 mg/kg pc/j et plus, et une alopécie et une apparence négligée aux doses de 400 mg/kg pc/j et plus. À toutes les doses, le poids corporel des fœtus était moindre comparativement à celui des fœtus du groupe témoin. Une ossification incomplète a été observée à la dose de 750 mg/kg pc/j. Une DMENO de 20 mg/kg pc/j a été retenue, correspondant à la plus faible dose des tests, en se basanr sur le poids corporel réduit des fœtus, tandis qu’une DMNEO de 100 mg/kg pc/j pour la toxicité maternelle a été retenue en se basant sur une salivation accrue. En outre, une DSENO pour la toxicité maternelle a été établie à 20 mg/kg pc/j. Aucune DSENO pour la toxicité pour le développement n’a été identifiée (MPI Research Inc. 2004).
10.2.3 Toxicité à dose répétée
Plusieurs études à dose répétée ont été trouvées, elles sont résumées l'Annexe H. Certaines sont présentées ci-dessous.
Une étude par voie dermique à court terme a été identifiée. Des rates Sprague-Dawley (5 par dose) ont reçu du TCP (3 % dans de l'huile pour moteur à réaction) par application sur la peau rasée à raison de 0, 500 ou 1 000 mg/kg pc/j, pour un total de 20 expositions pendant une période de quatre semaines. Le niveau de cholinestérase sérique était significativement (p < 0,05) réduit chez toutes les rates exposées. Des signes cliniques d'hypersensibilité, telle qu’une activité motrice accrue, ont été observés à la dose de 1 000 mg/kg pc/j (Mobil 1990).
Le NTP des États-Unis a réalisé une étude de 13 semaines par voie orale avec des rats Fischer 344/N et des souris B6C3F1. Les animaux (10 par sexe par dose) ont reçu jusqu'à 800 mg/kg pc/j de TCP dans de l'huile de maïs par gavage. Aucune mortalité n'a été observée chez l'une ou l'autre des espèces. Le poids corporel moyen final des rats et des souris mâles était nettement moindre que celui des témoins après une exposition à des doses de 200 mg/kg pc/j et plus, tandis que celui des souris femelles, était nettement moindre après avoir reçu des doses de 400 mg/kg pc/j et plus. Aucune modification significative du poids corporel moyen n'a été observée chez les rates. Une vacuolisation cytoplasmique du cortex surrénal liée à la dose a été observée chez les rats et les souris des deux sexes à toutes doses. Une hyperplasie des cellules interstitielles de l'ovaire a été observée chez les souris femelles et les rates. De plus, une atrophie des tubules séminifères a été observée chez les rats mâles à des doses de 400 mg/kg pc/j et plus. Il n'y a eu aucune modification biologique significative des paramètres neurocomportementaux chez les rats exposés. Toutefois, chez les souris, une dégénérescence multifocale de la moelle épinière a été observée chez les deux sexes aux doses de 100 mg/kg pc/j et plus, et une dégénérescence multifocale du nerf sciatique a été observée aux doses de 200 mg/kg pc/j et plus chez les mâles et aux doses de 100 mg/kg pc/j et plus chez les femelles. Une diminution significative de la force de préhension des pattes avant a été observée chez les mâles ayant reçu une dose de 200 mg/kg pc/j ou plus et chez les femelles ayant reçu une dose de 400 mg/kg pc/j ou plus. De même, une diminution significative de la force de préhension des pattes arrière a été observée chez les deux sexes à des doses de 200 mg/kg pc/j et plus. Une DMENO 50 mg/kg pc/j, la dose la plus faible dose des tests, a été retenue pour les rats et les souris en se basant sur la vacuolisation cytoplasmique du cortex surrénal et l’hypertrophie des cellules interstitielles de l'ovaire (NTP 1994).
Une étude semblable de 13 semaines a été réalisée avec des rats et des souris. Des rats Fischer 344/N (10 par sexe par dose) ont reçu une ration alimentaire contenant 0, 900, 1700, 3300, 6600 ou 13 000 ppm de PTPC (environ 0, 55, 120, 220, 430 ou 750 mg/kg pc/j pour les mâles et 65, 120, 230, 430 ou 770 mg/kg pc/j pour les femelles), tandis que des souris B6C3F1 (10 par sexe par dose) ont reçu un e ration alimentaire contenant 0, 250, 500, 1000, 2100 ou 4200 ppm de TCP (environ 0, 45, 110, 180, 380 ou 900 mg/kg pc/j pour les mâles et 0, 65, 130, 230, 530 ou 1050 mg/kg pc/j pour les femelles). Aucune mortalité n'a été observée chez les rats ni chez les souris de l'un ou l'autre sexe. Le poids corporel moyen final était significativement moindre chez les rats mâles aux doses de 430 mg/kg pc/j et chez les rates aux doses de 230 mg/kg pc/j et plus. Pour les souris, le poids corporel moyen avait diminué (importance non rapportée) à la dose de 900 mg/kg pc/j chez les mâles et aux doses de 530 mg/kg pc/j ou plus chez les femelles. Une vacuolisation cytoplasmique du cortex surrénal a été observée chez tous les rats et souris exposés, sauf chez les souris mâles ayant reçu 45 mg/kg pc/j. De plus, une hypertrophie des cellules interstitielles de l'ovaire et une inflammation l'interstitium de l'ovaire ont été observées chez toutes les rates. Une nécrose papillaire rénale et un œdème papillaire rénal ont été observés à la dose de 750 mg/kg pc/j chez les rats mâles et aux doses de 430 mg/kg pc/j ou plus chez les rates. Une hypertrophie basophile du lobe antérieur de la glande pituitaire et une atrophie des tubules séminifères ont été observée aux doses de 430 mg/kg pc/j et plus chez les rats mâles. Aucune modification biologique significative des paramètres neurocomportementaux n’a été observée chez les rats exposés. Chez les souris, une hyperplasie papillaire des muqueuses de la vésicule biliaire a été observée chez les mâles ayant reçu des doses de 110 mg/kg pc/j ou plus et chez les femelles ayant reçu des doses de 230 mg/kg pc/j ou plus. Une dégénérescence du tubule rénal a été observée chez toutes les souris mâles ayant reçu une dose de 900 mg/kg pc/j. Une dégénérescence axonale a été observée chez les souris mâles ayant reçu des doses de 380 mg/kg pc/j ou plus et chez les femelles ayant reçu des doses de 230 mg/kg pc/j ou plus. Des diminutions significatives de la force de préhension des pattes avant ont été observées chez les mâles et les femelles ayant respectivement reçu des doses de 380 et 530 mg/kg pc/j (p ≤ 0,05) et chez les mâles et les femelles ayant reçu respectivement des doses de 900 et 1050 mg/kg pc/j (p ≤ 0,01). Des diminutions significatives de la force de préhension des pattes arrière ont été observées chez les mâles ayant reçu une dose de 900 mg/kg pc/j et chez les femelles ayant reçu 530 mg/kg pc/j ou plus (p ≤ 0,01).
Une DMENO de 55 mg/kg pc/j pour les rats mâles a été identifiée en se basant sur la vacuolisation cytoplasmique du cortex surrénal, et une de 65 mg/kg pc/j pour les rates en se basant sur l’hyperplasie des cellules interstitielles de l'ovaire. Aucune DSENO n’a été identifiée pour l'étude sur les rats. Pour les souris, DMENO de 110 mg/kg pc/j pour les mâles et de 65 mg/kg pc/j, la plus faible dose des tests, pour les femelles ont été retenues en se basant sur la vacuolisation cytoplasmique du cortex surrénal. Une DSENO de 45 mg/kg pc/j a été retenue pour les mâles (NTP 1994).
Le TCP a fait l’objet d’autres tests lors d’une étude de deux ans sur l'exposition par l'alimentation chez des rats et des souris. Des rats Fischer 344/N (95 par sexe par dose) ont reçu des rations alimentaires contenant 0, 75, 150 ou 300 ppm de TCP (environ 0, 3, 6 ou 13 mg/kg pc/j pour les mâles et 0, 4, 7 ou 15 mg/kg pc/j pour les femelles). Un autre groupe de rats (95 par sexe par dose) a reçu des rations alimentaires contenant 600 ppm de TCP (environ 26 mg/kg pc/j pour les mâles et 30 mg/kg pc/j pour les femelles) pendant 22 semaines, puis a reçu une alimentation témoin. Aucune mortalité n'a été observée. Aucun effet sur le poids corporel moyen final n’a été observé. Une vacuolisation cytoplasmique du cortex surrénal a été observée chez les rats mâles ayant reçu une doise de 26 mg/kg pc/j et chez les femelles ayant reçu une dose de 7 mg/kg pc/j ou plus à 3 mois. À 9 et 15 mois, une vacuolisation cytoplasmique a été observée principalement chez les femelles ayant reçu une dose de 15 mg/kg pc/j, la fréquence et la gravité augmentant significativement à la fin de l'étude. Une hyperplasie des cellules interstitielles de l'ovaire a été observée chez les rates à la dose de 7 mg/kg pc/j, la fréquence et la gravité augmentant à la fin de l'étude. Une DMENO de 7 ou de 15 mg/kg pc/j a été retenue en se basant respectivement sur l’hyperplasie des cellules interstitielles de l’ovaire observée chez les femelles et sur la vacuolisation cytoplasmique du cortex surrénal observée chez les mâles. Une DSENO de 4 ou de 13 mg/kg pc/j a été retenue respectivement pour les femelles et les mâles.
Des souris B6C3F1 (95 par sexe par dose) ont reçu des rations alimentaires contenant 0, 60, 125 ou 250 ppm de TCP (environ 0, 7, 13 ou 27 mg/kg pc/j pour les mâles et 0, 8, 18 ou 37 mg/kg pc/j pour les femelles). Après 3, 9 et 15 mois d'exposition, jusqu'à 15 souris/sexe/dose ont subi une autopsie afin d’évaluer des lésions histopathologiques. Le poids corporel, la survie et la consommation de nourriture des groupes exposés étaient semblables à ceux des témoins. Une pigmentation céroïde du cortex surrénal a été observée dans tous les groupes exposés, y compris les témoins (avec une fréquence de ou proche de 100 % à 9, 15 et 24 mois) pendant pratiquement toute la durée de l'étude de 2 ans, sauf chez les femelles ayant reçu une dose 8 ou 18 mg/kg pc/j et subi une autopsie à 3 mois. La gravité était nettement accrue chez les femelles ayant reçu la dose de 37 mg/kg pc/j. Une fréquence accrue de foyers cellulaires clairs, un changement des tissus adipeux et une pigmentation céroïde dans le foie ont été observés chez les mâles ayant reçu une dose de 13 mg/kg pc/j ou plus. Une DMENO de 7 ou 37 mg/kg pc/j pour les mâles ou les femelles a été retenue en se basant sur la pigmentation céroïde du cortex surrénal. Une DSENO de 18 mg/kg pc/j a été retenue pour les souris femelles, mais aucune DSENO n'a été identifiée pour les souris mâles (NTP 1994).
Étant donné que des lésions surrénales ont été observées dans tous les groupes de souris mâles et femelles, y compris les témoins, des lésions surrénales surviennent spontanément chez les souris et le TCP en a accéléré l’apparition (ATSDR 2012). Par conséquent, la DSENO de 4 mg/kg pc/j basée sur la vacuolisation cytoplasmique du cortex surrénal observée chez les rates est retenue comme la plus faible DSENO pour les lésions surrénales.
Les renseignements tirés d'études à dose répétée par voie orale indiquent que les organes cibles pour le TCP sont la glande surrénale et les ovaires chez les rats. Les mécanismes par lesquels ces effets se produisent n'ont pas été élucidés, mais certaines études ont fourni quelques éclaircissements. Parmi les mécanismes possibles, un mécanisme potentiel sous-jacent de ces effets semble être une altération dans la voie de stockage résultant de l'inhibition par le TCP de l'hydrolase d'ester cholestérylique neutre, une enzyme qui catalyse la conversion de l'ester cholestérylique stocké en cholestérol libre. Une telle action entraînerait une accumulation d'esters cholestéryliques dans les cellules corticosurrénales et les cellules interstitielles de l'ovaire. Le TCP inhibait aussi l'A:cholestérol acyltransférase (ACAT) dans les glandes surrénales. L'ACAT intervient dans l'estérification du cholestérol pour former des gouttelettes de lipides cytoplasmiques d'ester cholestérylique, un mécanisme par lequel les cellules emmagasinent et conservent le cholestérol en excès de ce qui est exigé pour la stéroïdogénèse. Les souris mâles B6C3F1 ont exhibé des fréquences accrues de modifications des lipides, des foyers cellulaires clairs et de pigmentation céroïde dans les cellules hépatiques après exposition au TCP pendant deux ans, ce qui pourrait indiquer une perturbation du métabolisme des lipides. Cependant, étant donné que de tels effets n'ont pas été rapportés chez les femelles, d’autres mécanismes interviennent probablement (ATSDR 2012).
10.2.4 Neurotoxicité
L'exposition au TCP a également induit une neurotoxicité chez les souris et les rats. Lors d'une étude de 16 jours par gavage avec des rats F344/N, une réduction significative de la force de préhension des pattes avant a été observée chez les femelles ayant reçu des doses de 1450 mg/kg pc/j et plus et chez les mâles ayant reçu une dose de 2900 ou 5800 mg/kg pc/j. Une réduction significative de la force de préhension des pattes arrière a été observée chez les mâles ayant reçu une dose de 2900 ou 5800 mg/kg pc/j et chez les femelles ayant reçu une dose de 5800 mg/kg pc/j (NTP 1994). Lors d’une étude semblable de 16 jours par gavage avec des souris B6C3F1, une réduction significative de la force de préhension des pattes avant a été observée chez les mâles ayant reçu une dose de 1450 mg/kg pc/j par jour et chez les femelles ayant reçu une dose de 5800 mg/kg pc/j. Une réduction significative de la force de préhension des pattes arrière a aussi été observée à une dose de 360 mg/kg pc/j chez les mâles, à une dose de 730 mg/kg pc/j chez les mâles et les femelles, à une dose de 1450 mg/kg pc/j chez les mâles et à une dose de 5800 mg/kg pc/j chez les mâles et les femelles, au 14e jour de l'étude (NTP 1994).
Des effets neurologiques du TCP ont aussi été observés chez des souris lors d’études subchroniques par voie orale. Lors d’une étude de 13 semaines par gavage avec des souris B6C3F1, il a été observé une dégénérescence multifocale de la moelle épinière à des doses de 100 mg/kg pc/j et plus chez les deux sexes, ainsi qu’une dégénérescence multifocale du nerf sciatique à des doses de 200 mg/kg pc/j et plus chez les mâles et à des doses de 100 mg/kg pc/j et plus chez les femelles. Une réduction de la force de préhension des pattes arrière a été observée à des doses de 200 mg/kg pc/j et plus chez les deux sexes. Une réduction de la force de préhension des pattes avant a été observée à des doses de 400 mg/kg pc/j et plus chez les mâles et à des doses de 200 mg/kg pc/j et plus chez les femelles (NTP 1994).
Lors d’une étude semblable de 13 semaines d'exposition par l'alimentation avec des souris B6C3F1, une dégénérescence axonale a été observée chez les mâles ayant reçu des doses de 380 mg/kg pc/j et plus et chez les femelles ayant reçu des doses de 230 mg/kg pc/j et plus. Une réduction significative de la force de préhension des pattes avant a été observée respectivement à des doses de 380 mg/kg pc/j et plus chez les mâles et à des doses de 530 mg/kg pc/j et plus chez les femelles. Une réduction significative de la force de préhension des pattes arrière a été observée respectivement à des doses de 900 et 1050 mg/kg pc/j chez les mâles et les femelles (NTP 1994).
Le TCP peut aussi induire des effets neurologiques lors d’une exposition dermique. Lors d'étude de quatre semaines par voie dermique avec des rates Sprague-Dawley, la teneur en cholinestérase sérique était significativement réduite (p < 0,05) aux deux doses testées de 500 et 1000 mg/kg pc/j. Des signes cliniques d'hypersensibilité, comme une activité motrice accrue, ont été observés à la dose de 1000 mg/kg pc/j (Mobil 1990). Cette étude a été réalisée en 1990, et la composition de la formulation de TCP utilisée pour l'étude est inconnue et pourrait être différente des formulations de TCP utilisées commercialement de nos jours.
10.2.5 Sensibilisation
Lors d'une épreuve des ganglions lymphatiques locaux, vingt souris femelles CBA/J Rj ont été réparties en cinq groupes de quatre. Du TCP a été appliqué à la surface des oreilles des souris à des concentrations de 100 % (non diluées), de 50 % et de 25 % (p/v). Le groupe témoin négatif a reçu une mélange d'huile d'olive et d’acétone (HOA) tandis que le groupe témoin positif recevait de l'α-hexylcinnamaldéhyde (HCA) à 25 % dans l'HOA. Aucune mortalité, aucune toxicité systémique ni aucune irritation locale n’a été observée pendant l'étude. Aucun effet lié au traitement sur le poids corporel des animaux n’a été observé dans aucun des groupes traités. Les indices de stimulation de l'article testé étaient de 3,7, 3,4 et 5,7 aux concentrations de traitement respectives de 100 (non diluées), 50 et 25 % (p/v). Une réponse lymphoproliférative significative (indice de stimulation de 17,2) a été constatée dans le cas de la substance chimique témoin positive et ce résultat a confirmé la validité de l'épreuve. En conclusion, dans les conditions de la présente épreuve, le TCP Kronitex, testé dans un vecteur convenable, a présenté un potentiel de sensibilisation (sensibilisant) dans le cadre de l'épreuve des ganglions lymphatiques locaux (LAB Research Ltd. 2010).
10.2.6 Études avec des humains
Il existe plusieurs rapports de cas, généralement mal documentées, sur les effets toxiques dus à une ingestion accidentelle de TCP ou à une exposition professionnelle à cette substance dont la concentration des isomères est inconnue. Une éclosion de polyneuropathie aiguë a été rapportée chez plus de 20 jeunes femmes au Sri Lanka en 1977 et 1978. La cause de la neuropathie était le TCP en tant que contaminant dans une huile de cuisson spéciale (huile de sésame). La contamination s'était probablement produite pendant le transport de l'huile dans des contenants utilisés auparavant pour stocker des huiles minérales (Senanayake et Jeyaratnam 1981). En 1944, trois cas de polyneuropathie toxique ont été rapportés chez des personnes ayant travaillé de six à huit mois dans une usine de production de TCP en Angleterre. La pénétration dans la peau et l'inhalation ont été jugées les principales causes de cette intoxication professionnelle (Hunter et al. 1944). Un cas de grave intoxication d’un enfant de quatre ans ayant ingéré un lubrifiant contenant du TCP a été rapporté. Les constatations cliniques étaient les suivantes : vomissement, diarrhée, faiblesse, somnolence, crise cholinergique différée et vélocité nerveuse déprimée. Le rétablissement complet a pris quatre semaines (Goldstein et al. 1988). On pense que la concentration de l'isomère o-TCP, un agent neurotoxique puissant (PISSC 1990), dans les mélanges à base de TCP produits au moment où ces cas humains ont été rapportés était plus élevée que celle présente dans les formulations de TCP actuelles.
Un cas de dermite par contact allergique induite par un contact avec des pansements adhésifs de la marque Band-Aid qui contenaient du TCP comme ingrédient (Norris et Storrs 1990) a été rapporté. De plus, un test de maximalisation effectué par voie dermique sur des hommes a montré que le TCP était un sensibilisant modérément fort (Dupont 1992).
10.2.7 Toxicocinétique
Aucun renseignement sur la toxicocinétique de mélanges de TCP n’a été trouvé. Kurebayashi et al. (1985) ont réalisé une étude sur l'isomère p-TCP, un composant du TCP, avec des rats mâles Wistar. Les rats ont reçu une seule dose de 7,8 mg/kg de 14C-p-TCP par gavage, dans de l'huile de maïs. 41 % de la dose administrée a été excrétée dans l'urine en sept jours, indiquant qu'au moins cette quantité avait été absorbée.
La distribution de la radioactivité liée au 14C-p-TCP a été étudiée chez des rats jusqu'à 168 heures après l'administration par gavage d'une dose unique de 89,6 mg/kg de 14C‑p-TCP dans de l'huile de maïs. Après 24 heures, la radioactivité s'était largement répartie dans les tissus. Des concentrations relativement élevées de la substance radiomarquée ont été trouvées dans les tissus adipeux, le foie et les reins, en plus de l'intestin et de l'estomac, tandis que les poumons, les testicules, la rate, le thymus et le sang en renfermaient des quantités intermédiaires. Les plus faibles concentrations de radioactivité se trouvaient dans le cœur, les muscles et le cerveau. Après 72 heures, la radioactivité dans les tissus avait diminué pour s'établir à environ 25 % de la valeur après 24 heures. Après 168 heures, la radioactivité dans les tissus avait encore diminué pour s'établir à environ 10 % des valeurs rapportées à 24 heures.
Kurebayashi et al. (1985) ont aussi étudié le métabolisme du p-TCP chez des rats mâles Wistar. Des métabolites ont été identidiés dans le sang, l'urine, les fèces et les tissus des rats à divers moments (jusqu'à 72 heures) après l'administration par gavage de 7,8 ou 89,6 mg/kg de 14C-p-TCP dans de l'huile de maïs. Le métabolisme faisait intervenir une série d'oxydations successives (dans le foie) et d'hydrolyse (dans l'intestin) qui ont conduit à la présence d'acide 4-hydroxybenzoïque, de phosphate di(4-méthylphényle) et de phosphate de 4-méthylphényle et de 4-carboxyphényle comme principaux métabolites urinaires. Dans la bile, les principaux métabolites étaient le phosphate di(4-méthylphényle), le phosphate de 4-méthyphényle et de 4‑carboxyphényle, ainsi que le phosphate de di(4-méthylphényle) et de 4‑carboxyphényle et le phosphate de 4-méthylphényle et de 4-carboxyphényle oxydés. L'analyse des fèces a mise en évidence des métabolites très semblables à ceux de la bile. À la dose élevée, le principal métabolite fécal était le p-TCP inchangé, probablement en raison d'une absorption incomplète. L'analyse de l'air expiré a mise en évidence du 14CO2, qui semblait avoir été produit par décarboxylation de l'acide 4‑hydroxybenzoïque par des microbes intestinaux.
Du 14C-p-TCP a été excrété dans l'urine et les fèces de rats mâles Wistar ayant reçu par gavage une dose unique de 7,8 ou 89,6 mg/kg de la substance dans de l'huile de maïs. Pour les deux doses, la majeure partie de la radioactivité a été excrétée dans les 24 heures. À la faible dose, 41 % de la radioactivité a été excrétée dans l'urine et 44 % dans les fèces dans les 7 jours. La radioactivité de l'air expiré représentait 19 % de la dose administrée. Chez les rats avec canule en place dans les voies biliaires, environ 28 % de la radioactivité administrée a été excrétée dans la bile pendant 24 heures. À la dose élevée, 12 % de la radioactivité a été excrétée dans l'urine, 77 % dans les fèces et 6 % dans l'air expiré dans les 7 jours. Les auteurs ont suggéré que la circulation enterohépatique et la microflore intestinale jouent un rôle important dans la dégradation des métabolites biliaires du p-TCP (Kurebayashi et al. 1985). L'élimination par la bile a aussi été établie après une injection intraveineuse chez des lapins (Gross et Grosse 1932) et une injection intrapéritonéale chez des rats (Myers et al. 1955).
10.3 Caractérisation des risques pour la santé humaine
Aucune classification des effets du TCP (contenant < 0,1 % de o-TCP) sur la santé par des organismes de réglementation nationaux ou internationaux n’a été identifiée. Lors d’une étude de deux ans avec des souris et des rats ayant reçu du TCP dans leur alimentation, aucune preuve de cancérogénicité n’a été mise en écidence. D’après les renseignements disponibles, il est improbable que le TCP soit génotoxique.
En se basant principalement sur le poids de la preuve des renseignements disponibles, les effets critiques dus à une exposition au TCP sont la vacuolisation cytoplasmique du cortex surrénal et l'hyperplasie des cellules interstitielles de l'ovaire observées chez les rats et les souris. La plus faible DMENO a été établie à 7 mg/kg pc/j en se basant sur la vacuolisation cytoplasmique du cortex surrénal observée chez des rates lors d’une étude de deux ans par voie alimentaire. La DSENO correspondante était de 4 mg/kg pc/j. La comparaison de cette DSENO avec les estimations les plus élevées de la dose journalière totale due aux milieux de l’environnement (0,10 µg/kg pc/j; nourrissons de 0 à 6 mois allaités) a conduit à calculer une marge d'exposition d'environ 39 000. Cette marge est jugée adéquate pour rendre compte des incertitudes des bases de données sur les effets et l'exposition. La sélection de la plus faible DSENO comme point de départ est aussi jugée protectrice pour les effets développementaux et neurotoxicologiques observés chez des animaux à des doses plus élevées.
Pour ce qui a trait à l'exposition au TCP présent dans certains articles manufacturés, le contact avec le matériau de rembourrage ou la mousse présent dans des meubles a été identifié comme source possible d'exposition (tableau 10-2). La comparaison de la DSENO de 4 mg/kg pc/jtirée de l'étude de deux ans par voie orale avec la valeur la plus élevée des estimations d'exposition quotidienne chronique par voie dermique (2,6 × 10‑3 mg/kg pc/j) pour des adultes qui s'assoient sur des meubles a conduit à calculer une marge d'exposition de 1156. Cette approche est jugée prudente étant donné que les estimations d'exposition sont basées sur les taux de migration d’organophosphates ignifuges plus solubles dans l'eau, c.-à-d. plus enclins à la migration que le TCP. De plus, ces estimations prudentes d'exposition sont comparées à un niveau auquel aucun effet n'a été observé chez des animaux traités pendant deux ans. En se basant sur ces renseignements, la marge d'exposition calculée est jugée adéquate pour tenir compte des incertitudes des bases de données sur les effets et l'exposition.
La comparaison de la DMENO de 20 mg/kg pc/j tirée de l'étude sur le développement (à court terme) avec l'estimation la plus élevée due à la manipulation de produits contenant du TCP (fluide de servodirection) (0,002 mg/kg pc par événement, peu fréquent) a conduit à calculer une marge d'exposition d'environ 10 000. Cette marge est jugée adéquate pour tenir compte des incertitudes des bases de données sur les effets et l'exposition.
| Voie et durée d'exposition | Source | Groupe d'âge (poids) | Absorption (mg/kg pc/j) | Dose avec effet critique (mg/kg p.c. par jour) | Marge d'exposition |
|---|---|---|---|---|---|
| Orale (voie principale) | Milieux de l’environnement et aliments | Nourrissons allaités (7,5 kg) | 1,0 × 10-4 | 4 (DSENO) | 39 000 |
| Dermique (quotidienne) | Meubles | Tout-petit (15,5 kg) | 1,3 × 10-3 à 5,0 × 10-3 | 4 (DSENO) | 801 à 3104 |
| Voie cutanée (quotidienne) | Meubles | Adulte (70,9 kg) | 6,6 × 10-3 à 2,6 × 10-2 | 4 (DSENO) | 156 à 605 |
| Dermique (peu fréquent, par événement) | Fluide de servodirection | Adulte (70,9 kg) | 0,002 | 20 (DMENO) | 10 000 |
10.4 Incertitudes de l'évaluation des risques pour la santé humaine
Nous reconnaissons que la présente évaluation préalable souffre d’incertitudes liées aux bases de données sur l’exposition et les effets sur la santé.
Les estimations d'absorption dans le cas de l’air, de l'eau potable ou de la poussière domestique étaient basées sur des données empiriques canadiennes. En l'absence de données canadiennes, des données européennes ont été utilisées pour estimer les absorptions de TCP dues aux poissons et au lait maternel. Aucune donnée sur les aliments mis en marché en Amérique du Nord et en Europe n’était disponible dans la littérature de base. Toutefois, des données environnementales sur les poissons en Europe étaient disponibles. L'hypothèse selon laquelle le poisson est la seule source d'exposition alimentaire (à l'exception du lait maternel dans le cas des bébés allaités), basée sur les niveaux mesurés en Europe, constitue une incertitude. Pour tenir compte de cette incertitude, l'évaluation alimentaire pour la population générale ssume de manière prudnte que tous les produits du groupe des aliments aquacoles (c.-à-d. les poissons, les mollusques et crustacés et les aliments connexes) contiennent la substance à des niveaux limites supérieurs. Les données de surveillance retenues pour plusieurs milieux n’étaient pas récentes, ce qui constitue une autre incertitude de la présente évaluation.
Aucune donnée sur la migration spécifique au TCP n’a été identifiée. Cependant, cette migration a été estimée de manière prudente en se basant sur des études sur la migration d'autres substances organophosphatées pour lesquelles la migration devrait être plus élevée, en raison de leur plus grande solubilité. Bien que le scénario sir les meubles (avec rembourrage ou mousse traité) ait été jugé approprié pour évaluer la l’exposition limite supérieure due aux produits disponibles pour les consommateurs, il existe une incertitude quant à la présence de TCP dans d'autres articles manufacturés ou produits disponibles sur le marché au Canada.
Il existe une incertitude quant à la concentration du o-TCP, qui peut entraîner une neuropathie différée induite par des organophosphates (NDIOP) chez les humains et des animaux de laboratoire. Toutefois, des études sur le TCP contenant moins de 0,1 % de o-TCP n'ont pas mis en évidende de NPIOP chez des animaux de laboratoire. La présente évaluation est basée sur l'hypothèse selon laquelle tous les produits commerciaux actuels contiennent moins de 0,1 % de o-TCP (voir la section 2). Bien que cette hypothèse soit jugée appropriée en se basant sur les renseignements disponibles, elle ne peut pas exclure le fait qu'il pourrait y avoir des produits contenant des concentrations plus élevées de o-TCP sur le marché canadien.
Il existe une incertitude associée aux résultats d'une étude sur la toxicité pour le développement prénatal, au cours de laquelle un poids corporel fœtal moindre a été observé après une exposition in utero à une dose de 20 mg/kg pc/j, la plus faible dose testée, une dose inférieure à celle pour laquelle des effets sur la mère ont été observés (MPI Research Inc. 2004). Toutefois, une ossification fœtale différée s'est produite à une dose beaucoup plus élevée que celle associée à la toxicité pour la mère. Le point de départ (4 mg/kg pc/j) retenu pour la caractérisation des risques pour la santé humaine est inférieur à 20 mg/kg pc/j. Les renseignements sur les effets d’une exposition par voie dermique sont limités. Les marges d'exposition claculées pour les scénarios d'exposition par voie dermiqueétaient basés sur le niveau d'effet critique identifié lors d’une une étude par voie orale. En ce qui concerne la caractérisation des risques associés à une exposition à du TCP due au fait de s'asseoir sur des meubles rembourrés, il subsiste une incertitude quant à l'hypothèse que l'utilisation d'une vitesse de migration plus réaliste et d'une absorption par voie cutanée spécifique au TCP conduirait à calculer une marge d'exposition plus élevée. Toutefois, cette hypothèse est jugée raisonnable étant donné que l'exposition a été estimée en se basant sur : a) des vitesses de migration à partir de la mousse ou du textile d’organophosphates ignifuges beaucoup plus solubles dans l’eau que le TCP; b) un rapport d’équivalence voie dermique/voie orale qui est probablement surestimé étant donné le pourcentage d'absorption par voie dermique plus faible d'autres substances organophosphatées dont les propriétés physico-chimiques (comme un Koe et/ou une masse moléculaire inférieur) les rendent plus aptes à une absorption par voie dermique.
11. Conclusion
Compte tenu de tous les éléments de preuve avancés dans la présente ébauche d'évaluation préalable, le risque d’effets nocifs du TCP sur des organismes ou l'intégrité plus large de l'environnement est faible. Nous concluons que le TCP ne satisfait à aucun des critères de l’alinéa 64a) ou 64b) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l'environnement ou sa diversité biologique ou qui constituent ou peuvent constiturer un danger pour l'environnement nécessaire à la vie.
En se basant sur l'adéquation des marges entre les estimations limites supérieures de l'exposition due aux milieux de l’environnement ou à des produits disponibles pour les consommateurs et les niveaux d'effet dus à une exposition chronique ou subchronique, nous concluons que le TCP ne satisfait à aucun des critères de l'alinéa 64c) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Nous concluons donc que le TCP ne satisfait à aucun des critères de l’article 64 de la LCPE.
Références
Abou-Donia M.B., Varga P.A., Graham D.G. et Kinnes C.G.; 1980; Delayed neurotoxicity of a single dermal administration of o-ethyl o-4-nitro-phenyl phenylphosphonothioate and tri-o-cresyl phosphate to cats; Toxicol. Lett., 1 (Édition spéciale), p. 141.
Adema D.M.M., Canton J.H., Slooff W. et Hanstveit A.O.; 1981; Onderzoek naar een geshikte combinatie toetsmethoden ter bepaling van de aquatische toxiciteit van milieugevaarlijke stiffen; Rapport nr RIV 627905001, Rijksinstituut Voor Volksgezondheid en Milieuhygiene, Biltoven, Pays-Bas, 112 [cité dans UK EA 2009].
Adema D.M.M., Kuiper J., Hanstveit A.O. et Canton H.H.; 1983; Consecutive system of tests for assessment of the effects of chemical agents in the aquatic environment; Pesticide Chemistry: Human Welfare Environmental Protection; Congrès international sur la chimie des pesticides (5ème, 1982, Kyoto, Japon) 3, p. 537-544 [cité dans UK EA 2009].
Adipose Autopsy Samples from Six Ontario Municipalities; Bull. Environ. Contam. Toxicol., 43, p. 225-230.
[AFEA] Agence fédérale de l’environnement de l’Allemagne; 2001; Substituting Environmental Relevant Flame Retardants: Assessment Fundamentals–Results and summary overview [PDF]; rapport de recherché 204 08 542 (ancien) et 297 44 542 (nouveau) UBA-FB 000171/1e; André Leisewitz, Hermann Kruse, Engelbert Schramm; à la demande de l’Agende fédérale de l’environnement de l’Allemagne (Umweltbundesamt, UBA). (disponible en anglais seulement)
Agence de l’environnement du Japon; 1996; Chemicals in the environment. Report on environmental survey and wildlife monitoring of chemicals in F.Y. 1994; Agence de l’environnement du Japon, Division de la sécurité et de la santé de l’environnement [cité dans UK EA 2009].
[AEROWIN] AEROWIN Program for Windows [modèle d’estimation]; 2010; version 1.00; Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014]. (disponible en anglais seulement)
Ali N., Dirtu A.C., Van den Eede N., Goosey E., Harrad S., Neels H., Mannetje A., Coakley J., Douwes J. et Covaci A.; 2012; Occurrence of alternative flame retardants in indoor dust from New Zealand: Indoor sources and human exposure assessment; Chemosphere, 88, p. 1276-1282.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d’estimation]; 2010; version 1.92a; Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014]. (disponible en anglais seulement)
Arnot J.A. et Gobas F.A.P.C.; 2003a; A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs; QSAR Comb. Sci., 22(3), p. 337-345.
Arnot J.A. et Gobas F.A.P.C.; 2003b; Categorization of organic substances on the Domestic Substances List for bioaccumulation potential; Rapport présenté à Environnement Canada, Division des substances existantes, juin 2003; Gatineau (QC) : Environnement Canada.
Arnot J.A. et Gobas F.A.P.C.; 2006; A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms; Environ. Rev., 14, p. 257-297.
Arnot J.A., Mackay D. et Bonnell M.; 2008b; Estimating metabolic biotransformation rates in fish from laboratory data; Environ. Toxicol. Chem., 27(2), p. 341-351.
Arnot J.A., Mackay D., Parkerton T.F. et Bonnell M.; 2008a; Database of fish biotransformation rate for organic chemicals; Environ. Toxicol. Chem., 27(11), p. 2263‑2270.
Arnot J.A., Meylan W., Tunkel J., Howard P.H., Mackay D., Bonnell M. et Boethling R.S.; 2009; A quantitative structure-activity relationship for predicting metabolic biotransformation rates for organic chemicals in fish; Environ. Toxicol. Chem., 28(6), p. 1168-1177.
Ash M. et Ash I.; 2000; Handbook of Industrial Chemical Additives; Synapse Information Resources Inc., Endicott (NY).
Ash M. et Ash I.; 2003; Handbook of Paint and Raw Coating Materials; Synapse Information Resources Inc., Endicott (NY).
Ashford R.D.; 1994; Ashford's Dictionary of Industrial Chemicals; Wavelength Publications Ltd, Londres (Royaume-Uni). p. 908 [cité dans EPA 2010 et UK EA 2009].
ASTreat Model [modèle sur l'élimination dans les usines de traitement des eaux usées]; 2006; version 1.0; Cincinnati (OH) : Procter & Gamble Company; disponible auprès de Procter & Gamble Company, Cincinnati (OH), États-Unis.
[ATSDR] Agency for Toxic Substances and Disease Registry; 1997; Toxicological profile for hydraulic fluid [PDF]; Atlanta (GA) : US Department of Health and Human Services, Public Health Service [consulté en juin 2013].
[ATSDR] Agency for Toxic Substances and Disease Registry; 2012; Toxicological profile for phosphate ester flame retardants [PDF]. Atlanta (GA): US Department of Health and Human Services, Public Health Service[consulté en juin 2013]. [D[1]
Bacaloni A., Cavaliere C., Foglia P., Nazzari M., Samperi R. et Lagana A.; 2007; Liquid chromatography/tandem mass spectrometry determination of organophosphorus flame retardants and plasticizers in drinking and surface waters; Rapid. Commun. Mass Spectrom., 21, p. 1123-1130.
Banjeree B.D., Saha S., Ghosh K.K. et Nandy P.; 1992; Effect of tricresyl phosphate on humoral and cell-mediated immune responses in albino rats; Bull. Environ. Contam. Toxicol., 49, p. 312-317.
[BASL4] Biosolids-Amended Soil Level 4 Model; 2011; version 2.00; Peterborough (ON) : Université Trent, Canadian Environmental Modelling Centre [consulté le 1er novembre 2013]. (disponible en anglais seulement)
Bayer; 2002; Technical information and safety data sheet for Disflamoll TKP; Bayer AG [cité dans UK EA 2009].
[BCFBAF] Bioaccumulation Program for Windows [modèle d’estimation]; 2010; version 3.10; Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014]. (disponible en anglais seulement)
[BDIPSN] Base de données d’ingrédients de produits de santé naturels; [modifié le 21 juin 2017]; Ottawa (ON) : gouvernement du Canada [consultée le 24 avril 2014].
[BDPP] Base de données sur les produits pharmaceutiques;[modifiée le 17 février 2017]; Ottawa (ON) : gouvernement du Canada [consultée le 24 avril 2014].
[BDPSNH] Base de données des produits de santé naturels homologués; [modifié le 10 août 2016]; Ottawa (ON) : gouvernement du Canada [consulté le 24 avril 2014].
Bengtsson B.E., Tarkpea M., Sletten T., Carlberg G.E., Kringstad A. et Renberg L.; 1986; Bioaccumulation and effects of some technical triaryl phosphate products in fish and Nitocra spinipes; Environ. Toxicol. Chem., 5, p. 853-861.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’estimation]; 2010; version 4.10; Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014]. (disponible en anglas seulement)
Boethling G.R.S. et Cooper J.C.; 1985; Environmental fate and effects of triaryl and trialkyl/aryl phosphate esters; Residue Reviews, 94, p. 49-99.
Boethling R.S., Howard P.H., Beauman J.A. et Larosche M.E.; 1995; Factors for intermedia extrapolation in biodegradability assessment; Chemosphere, 30, p.741-752.
Boîte à outils QSAR de l’OCDE [outil de lecture croisée]; 2012; version 3.0; Paris (France) : Organisation de coopération et de développement économiques, Direction de l'environnement.
Brandsma S.H., de Boer J., van Velzen M.J.M. et Leonards P.E.G.; 2014; Organophosphorus flame retardants (PFRs) and plasticizers in house and car dust and the influence of electronic equipment; Chemosphere, 116, p. 3-9.
Brommer S., Harrad S., Van den Eede N. et Covaci A.; 2012; Concentrations of organophosphate esters and brominated flame retardants in German indoor dust samples; J. Environ. Monit., 14(9), p. 2482-2487.
Canada; 1999; Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33; Gazette du Canada, Partie III, vol. 22, no 3.
Canada; ministère de l’Environnement; 2013; Canadian Environmental Protection Act, 1999: Avis concernant certaines substances ignifuges organiques [PDF]; Gazette du Canada, Partie I, vol. 147, no 13, p. 613–633 [consultée le 17 août 2017].
Carlton B.D., Hasaran A.H., Mezza L.E. et Smith M.K.; 1987; Examination of the reproductive effects of tricresyl phosphate administered to Long- Evans rats; Toxicology, 46, p. 321-328 [cité dans UK EA 2009, PISSC 1990 et GLCC 2001].
Casterline J.L. Jr, Ku Y. et Barnett N.M.; 1985; Uptake of tri-p-cresyl phosphate in soybean plants; Bulletin of Environ. Contam. Toxicol., 35, p. 209-212.
CATALOGIC [modèle numérique]; 2012; version 5.11.13; Bourgas (Bulgarie) : Université Prof. Assen Zlatarov, Laboratoire de chimie mathématique. (disponible en anglais seulement)
Cavalleri A. et Cosi V.; 1978; Polyneuritis incidence in shoe factory workers: Case report and etiological considerations; Arch. Environ. Health, 33, p. 192-197.
CCE; 2015; Amélioration des connaissances trilatérales sur les ignifugeants et leur utilisation dans les produits manufacturés : Analyse de certains ignifugeants contenus dans les meubles de bureau et de maison; Montréal, Canada : Commission de coopération environnementale, 16 p.
Cequier E., Ionas A.C., Covaci A., Marcé R.M., Becher G. et Thomsen C.; 2014; Occurrence of a broad range of legacy and emerging flame retardants in indoor environments in Norway; Environ Sci Technol., 48, p. 6827-6835.
Chapin R.E., George J.D. et Lamb J.C.; 1988; Reproductive toxicity of tricresyl phosphate in a continuous breeding protocol in Swiss CD-1 mice; Fund. Appl. Toxicol., 10, p. 344-354 [cité dans PISSC 1990 et UK EA 2009].
[ChemFate] Interactive ChemFate Database [base de données sur Internet]; 2012; Syracuse (NY) : Syracuse Research Corporation [consulté le 11 juin 2014]. (disponible en anglais seulement)
Chemtura Corporation; 2007; Chemtura Petroleum Additives: Components and Solutions [PDF]; West Lafayette (IN) : Chemtura Corporation. (disponible en anglais seulement)
Chen D., Chu S.G. et Letcher R.J.; 2012; Determination of non-halogenated, chlorinated and brominated organophosphate flame retardants in herring gull eggs based on liquid chromatography-tandem quadrupole mass spectrometry; Journal of Chromatography A, 1220, p. 169-174.
Cho K.J., Kirakawa T., Mukai T., Takimoto K. et Okada M.; 1996; Origin and stormwater runoff of TCP (tricresyl phosphate) isomers; Water Research, 30(6), p. 1431-1438.
Cho K.J., Takimoto K. et Okada M.; 1994; Fate of tricresyl phosphate isomers in Kurose River (Japan); Water Science and Technology, 30(10), p. 189-197.
City of Toronto; 2003a; Water quality quarterly report (January-March 2003); Works and Emergency Services, Toronto.
City of Toronto; 2003b; Water quality quarterly report (April-June 2003); Works and Emergency Services, Toronto.
City of Toronto; 2003c; Water quality quarterly report (July-September 2003); Works and Emergency Services, Toronto.
Commission européenne; 2011; Identification and evaluation of data on flame retardants in consumer products. Final Report [PDF]; Bruxelles (Belgique) : préparé pour la Commission européenne, Direction générale de la Santé et sécurité alimentaire, par ARCADIS Belgium, contrat no 17.020200/09/549040. (disponible en anglais seulement)
[CPSC] Consumer Product Safety Commission des États-Unis; 1998; Post-hearing comments of the Upholstered Furniture Action Council on the toxicity of flame retardants chemical treatments for upholstery fabrics [PDF]. Washington (DC). (disponible en anglais seulement)
[CPSC] Consumer Product Safety Commission des États-Unis; 2005; Migration of Flame Retardant Chemicals in Upholstered Furniture Foam [PDF]; Washington (DC): Division of Chemistry, US CPSC.
[CPSC] Consumer Product Safety Commission des États-Unis; 2006; CPSC Staff Preliminary risk assessment of flame retardant chemicals in upholstered furniture foam [PDF]; US Consumer Product Safety Commission. (disponible en anglais seulement)
Crockett A.B.; 1978a; US EPA: Letter to M.P. Halper; EPA des États-Unis, 26 octobre [cité dans Boethling et Cooper 1985].
Crockett A.B.; 1978b; US EPA: Letter to P. Hilgard; EPA des États-Unis [cité dans Boethling et Cooper 1985].
Crockett A.B.; 1978c; US EPA: Letter to G. B. Wiersma; EPA des États-Unis, 2 juin [cité dans Boethling et Cooper 1985].
Crockett A.B. 1979; US EPA: Letter to P. Hilgard; EPA des États-Unis, 6 mars [cité dans Boethling et Cooper 1985].
Daughtrey W., Biles R., Jortner B. et Ehrich M.; 1996; Subchronic delayed neurotoxicity evaluation of jet engine lubricants containing phosphorus additives; Fundam. Appl. Toxicol., 32, p. 244-249
David M.D. et Seiber J.N.; 1999a; Accelerated hydrolysis of industrial organophosphates in water and soil using sodium perborate; Environmental Pollution, 105, p. 121-128.
David M.D. et Seiber J.N.; 1999b; Analysis of organophosphate hydraulic fluids in U.S. Air force base soils; Arch. Environ. Contam. Toxicol., 36, p. 235-241.
DeNola G., Hanhela P.J. et Mazurek W.; 2011; Determination of tricresyl phosphate air contamination in aircraft; Ann. Occup. Hyg., 55, p. 710-722.
De Nola G., Kibby J. et Mazurek W.; 2008; Determination of ortho-cresyl phosphate isomers of tricresyl phosphate used in aircraft turbine engine oils by gas chromatography and mass spectrometry; J. Chromatogr. A., 1200, p. 211-216.
De Silva A. et Muir D.; 2016; Using remote environments to detect new persistent and bioaccumulative chemicals in commerce; rapport non publié; Gatineau (QC) : Environnement et Changement climatique Canada.
De Silva A., Smyth S.A. et Derek M.; 2017; Occurrence and fate of certain organic flame retardants in municipal wastewater treatment systems: organophosphorus; rapport non publié; Gatineau (QC) : Environnement et Changement climatique Canada.
Dimitrov S., Dimitrova N., Parkerton T., Comber M., Bonnell M. et Mekenyan O.; 2005; Base-line model for identifying the bioaccumulation potential of chemicals; SAR QSAR Environ. Res., 16(6), p. 531-554.
Dirtu A., Ali N., Van den Eede N., Neels H. et Covaci A.; 2012; Country specific comparison for profile of chlorinated, brominated and phosphate organic contaminants in indoor dust. Case study for Eastern Romania, 2010; Environment International, 49, p. 1-8.
Dodson R.E., Perovich L.J., Covaci A., Van den Eede N., Ionas A.C., Dirtu A.C., Brody J.G. et Rudel R.A.; 2012; After the PBDE Phase-Out: A Broad Suite of Flame Retardants in Repeat House Dust Samples from California; Environ. Sci. Technol., 46(24), p. 13056-13066.
Dupont Chemical; 1992; Initial submission: study synopsis regarding tricresyl phosphate and 2,3-dibromopropyl phosphate with cover letter dated 101592; NTIS/OTS Fiche # 0571488.
[ECCC 2016] Environment et Changement climatique Canada; 2016; Évaluation préalable : Groupe de substances classifiées internationalement : substances de crésol (méthylphénol), mai 2016; Environnement et Changement climatique Canada and Santé Canada.
[ECCC 2018a] Environnement et Changement climatique Canada; 2018a; Supporting documentation: Summary tables of substance identity and physical chemical property information for Tricresyl phosphate; Gatineau (QC) : Environnement et Changement climatique Canada; Information in support of the Screening Assessment for Phosphoric acid, tris(methylphenyl) ester; disponible sur demande auprès de : ec.substances.ec@canada.ca
[ECCC 2018b] Environnement et Changement climatique Canada; 2018b; Supporting documentation: Summary tables of environmental concentrations information for Tricresyl phosphate; Gatineau (QC) : Environnement et Change climatique Canada; Information in support of the Screening Assessment for Phosphoric acid, tris(methylphenyl) ester; disponible sur demande auprès de : ec.substances.ec@canada.ca
[ECCC 2018c] Environnement et Changement climatique Canada; 2018c; Supporting documentation: Summary tables of environmental fate and behaviour information for Tricresyl phosphate; Gatineau (QC) : Environnement et Changement climatique Canada; Information in support of the Screening Assessment for Phosphoric acid, tris(methylphenyl) ester; disponible sur demande auprès de : ec.substances.ec@canada.ca
[ECCC 2018d] Environnement et Changement climatique Canada; 2018d; Supporting documentation: Summary tables of ecotoxicity data information for Tricresyl phosphate; Gatineau (QC) : Environnement et Change climatique Canada; Information in support of the Screening Assessment for Phosphoric acid, tris(methylphenyl) ester; disponible sur demande auprès de : ec.substances.ec@canada.ca
[ECCC 2018e] Environnement et Changement climatique Canada; 2018e; Supporting documentation: Summary tables of ecological exposure information for Tricresyl phosphate; Gatineau (QC) : Environnement et Changement climatique Canada; Information in support of the Screening Assessment for Phosphoric acid, tris(methylphenyl) ester; disponible sur demande auprès de : ec.substances.ec@canada.ca
[ECHA] Agence européenne des produits chimiques; 2010; Guidance on information requirements and chemical safety assessment. Chap. R.16: Environmental exposure estimation. May 2010. Guidance for the implementation of REACH; Helsinki (Finlande) : Agence européenne des produits chimiques.
[ECHA] Agence européenne des produits chimiques; c2007-2013; Substances enregistrées;Résultats de recherche portant sur le no CAS 1330-78-5; Helsinki (Finlande) : Agence européenne des produits chimiques [mis à jour le 26 juillet 2013; consulté le 17 juillet 2013].
[ECOSAR] Ecological Structure Activity Relationships Class Program [modèle d’estimation]; 2012; version 1.11; Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (disponible en anglais seulement)
Environnement Canada; 2001; Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances inscrites sur la Liste intérieure des substances (LIS) [PDF]; Gazette du Canada, Partie I, vol. 135, no 46, p. 4194-4211.
Environnement Canada; 2013-2014; Data for certain organic flame retardants substance grouping collected under the Canadian Environmental Protection Act, 1999, section 71: Notice with respect to certain organic flame retardant substances; données préparées par Environnement Canada, Santé Canada : Programme des substances existantes.
Environnement Canada, Santé Canada; 2007; Substances chimiques : Catégorisation de substances chimiques; Ottawa (ON) : gouvernement du Canada [mis à jour le 20 avril 2007; consulté le 10 juin 2014].
[EPA] Environmental Protection Agency des États-Unis; 1993; Wildlife Exposure Factors Handbook; Washington (DC) : US EPA, Office of Research and Development.
[EPA] Environmental Protection Agency des États-Unis; 2010; HPV Chemical Hazard Characterizations, Screening-level hazard characterization, Phosphoric acid, trismethylphenyl ester; Washington (DC) : US EPA, Office of Pollution Prevention and Toxics [consulté le 6 juin 2013]. (disponible en anglais seulement)
[EPI Suite] Ecological Structure Activity Relationships Class Program [Estimation Model]; 2012; version 4.11; Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (disponible en anglais seulement)
[EQC] Equilibrium Criterion Model; 2012; version 1.00; Peterborough (ON) : Université Trent, Canadian Environmental Modelling Centre.
Evenset A., Leknes H., Christensen G.N., Warner N., Remberger M. et Gabrielsen G.W.; 2009; Screening of New Contaminants in Samples from Norwegian Arctic; NIVA Report 4351-1, SPFO-Report 1049/2009. TA-2510/2009; ISBN:978-82- 449-0065-2 [cité dans Van der Veen et de Boer 2012].
Fan X., Kubwabo C., Rasmussen P. E. et Wu F.; 2014; Simultaneous determination of thirteen organophosphate esters in settled indoor house dust and a comparison between two sampling techniques; Sci. Tot. Environ., 491-492, p. 80-86.
[FDA] Food and Drug Administration des États-Unis; 2006; Total Diet Study Market Baskets 1991-3 through 2003-4 [PDF]; College Park (MD) : Center for Food Safety and Applied Nutrition. (disponible en anglais seulement)
[FDA] Food and Drug Administration des États-Unis; 2014; Total Diet Study; Silver Spring (MD): US Food and Drug Administration. (disponible en anglais seulement)
FMC Corporation; 1995; Tricresyl phosphate/Durad 125L Acute delayed neurotoxicity study in hens (study # I94-1925); NTIS/OTS #0572164.
Food and Drug Research Laboratories Inc.; 1975a; Acute Dermal Toxicity Study in Rabbits; réalisée pour FMC Corporation [cité dans IUCLID 2001].
Food and Drug Research Laboratories Inc.; 1975b; Eye Irritation Test in Rabbits; réalisée pour FMC Corporation [cité dans IUCLID 2001].
Foster D. Snell Inc.; 1976; 28-Day Oral Administration in Rats; réalisée pour FMC Corporation [cité dans IUCLID 2001].
Freeman G.B., Irwin R., Trejo R., Hejtmancik M., Ryan M. et Peters A.C.; 1988; Reversibility and tolerance to tricresyl phosphate-induced neurotoxic effects in F344 rats; Toxicologist, 8, p. 76 [cité dans PISSC 1990].
Freudenthal R.I., Rausch L., Gerhart J.M., Barth M.L., Mackerer C.R. et Bisinger E.C.; 1993; Subchronic neurotoxicity of oil formulations containing either tricresyl phosphate or tri-orthocresyl phosphate; J. Am. Coll. Toxicol., 12, p. 409-416.
Fromme H., Lahrz T., Kraft M., Fembacher L., Mach C., Dietrich S., Burkardt R., Völkel W. et Göen T.; 2014; Organophosphate flame retardants and plasticizers in the air and dust in German daycare centers and human biomonitoring in visiting children (LUPE 3); Environ. Int., 71, p. 158-163.
Fukushima M., Kawai S. et Yamaguchi Y.; 1992; Behavior of organophosphoric acid triesters in Japanese riverine and coastal environment; Water Science and Technology, 25, p. 271-278 [cité dans UK EA 2009].
Glob E.; 1998; Miljøfremmde stoffer i havbunden; Lillebætsamarbejdet [cité dans UK EA 2009].
Gobas F.A.P.C.; 2010; Comments on approach to sediment exposure; Burnaby (C.-B.) : Université Simon Fraser, School of Resource & Environmental Management, 25 mars.
Gobas F.A.P.C., Kelly B.C. et Arnot J.A.; 2003; Quantitative structure activity relationships for predicting the bioaccumulation of POPs in terrestrial food-webs; QSAR Comb. Sci., 22, p. 329-336.
Gobas F.A.C.P. et Morrison H.A.; 2000; Bioconcentration and biomagnification in the aquatic environment; dans Boethling R.S. et Mackay D. (éditurs.), Handbook of property estimation methods for chemicals, environmental and health sciences; Boca Raton (Floride) : CRC Press, p. 189C.
Goldstein D.A., Mcguigan M.A. et Ripley B.D.; 1988; Acute tricresyl phosphate intoxication in childhood; Hum. Toxicol., 7, p. 179-182 [cité dans PISSC 1990].
Grimalt R., Romaquera C. et Vilaplana J.; 2009; Allergic Contact Dermatitis from Tricresyl Phosphate; Dermatitis, 20(5), p. 297-298
Gross E. et Grosse A.; 1932; A contribution to the toxicology of ortho-tricresylphosphates; Naunyn-Shmiedeberg's Archives of Pharmacology, 168, p. 473‑514 (en allemand) [cité dans PISSC 1990].
Haggerty G.J., Hejtmancik M., Deskin R., Ryan M.J., Peters A.C. et Irwin R.; 1986; Effects of subchronic exposure to tricresyl phosphate in F344 rats and B6C3F1 mice: behavioural and morphological correlates; Toxicologist, 6, p. 218 [cité dans PISSC 1990].
Hann R.W. Jr et Jensen P.A.; 1977; Water quality characteristics of hazardous materials [DOC]; NTIS-PB-285946; Université du Texas A&M, College Station Environmental Engineering Div.;1751 p. [cité dans ChemFate 2012];
Hartmann P.C., Burgi D. et Giger W.; 2004; Organophosphate flame retardants and plasticizers in indoor air; Chemosphere, 57, p. 781-787.
Haworth S., Lawlor T., Mortelmans K., Speck N. et Zeiger E.; 1983; Salmonella mutagenicity test results for 250 chemicals; Environ. Mutagen. (Suppl. 1), 3, p. 142 [cité dans PISSC 1990].
Hine C., Rowe V.K., White E.R., Darmer K.I. Jr et Youngblood G.T.; 1981; dans Clayton G.D. et Clayton F.E. éditeurs; Patty's industrial hygiene and toxicology, 3ème edition révisée, vol. 2A; New York, Wiley-Interscience, p. 2362-2363 [cité dans PISSC 1990].
Hoke R.A., Giesy J.P., Zabik M. et Unger M.; 1993; Toxicity of sediments and sediment pore waters from the Grand Calumet River-Indiana Harbor area of concern; Ecotoxicity and Environmental Safety, 26(1), p. 86-112 [cité dans UK EA 2009].
Hollifield H.C.; 1979; Rapid nephelometric estimate of water solubility of highly insoluble organic chemicals of environmental interest; Bulletin of Environmental Contamination and Toxicology, 23, p. 579-586.
Houde M., Berryman D., de Lafontaine Y. et Verrault J.; 2014; Novel brominated flame retardants and dechloranes in three fish species from the St. Lawrence River, Canada; Sci. Total Environ., 479-480, p. 48-56.
Howard P.H. et Deo P.G.; 1979; Degradation of aryl phosphates in aquatic environments; Bulletin of Environmental Contamination and Toxicology, 22, p. 337-344.
[HSDB] Hazardous Substances Data Bank [base de données sur Internet]; 2012; Bethesda (MD) : National Library of Medicine (États-Unis) [révisé le 8 mars 2013; consulté le 15 juin 2013]. (disponible en anglais seulement)
[HSDB] Hazardous Substances Data Bank [base de données]; 2014; Bethesda (MD) : National Library of Medicine (États-Unis) [consultée le 29 octobre 2018]. (disponible en anglais seulement)
Hunter D., Perry K.M.A. et Evans R.B.; 1944; Toxic polyneuritis arising during the manufacture of tricresyl phosphate; Br. J. Ind. Med., 1, p. 227-231 [cité dans PISSC 1990].
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d'évaluation]; 2010; version 2.00; Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014]. (disponible en anglais seulement)
[ICL] Israel Chemicals Ltd Industrial Products; 2012; Flame Retardants [PDF]; Beer Sheva, Israël [consulté en juin 2013]. (disponible en anglais seulement)
[ICL] Israel Chemicals Ltd. Industrial Products; 2013a; Application–Phenolic Resins; Tel Aviv, Israël [consulté en juin 2013]. (disponible en anglais seulement)
[ICL] Israel Chemicals Ltd. Industrial Products; 2013b; Application–PVC; Tel Aviv, Israël [consulté en juin 2013]. (disponible en anglais seulement)
[ICL] Israel Chemicals Ltd. Industrial Products; 2013c; Segment–Bedding and Seating [Internet]; Tel Aviv, Israël [consulté en juin 2013]. (disponible en anglais seulement)
Imperial Oil; 1991; Male reproductive toxicity assessment following a fourteen-day oral exposure to phosphate esters in F344 rats. Study # 64412; obtenu d’Environnement Canada 2001.
[INRP] Inventaire national des rejets de polluants. 2011.
Irwin R., Freeman G.B., Trejo R., Hehtmancik M. et Peters A.; 1987; Effects of chronic exposure to tricresyl phosphate I F344 rats and B6C3F1 mice: behavioural and biochemical correlates; Soc. Neurosci. Abstr., 13, p. 90 [cité dans PISSC 1990].
Ishikawa S. et al.; 1985a; Suishitsu Odaku Kenkyu, 8, p. 799-807 [cité dans HSDB 2012].
Ishikawa S., Taketomi M. et Shinohara R.; 1985b; Determination of trialkyl and triaryl phosphates in environmental samples; Water Research, 19, p. 119-125 [cité dans UK EA 2009].
Ishikawa S., Taketomi M. et Shinohara R.; 1985c; Determination of organic phosphate esters in factory effluent and domestic effluent; Japanese Journal of Water Pollution Research, 8, p. 529-535 [cité dans UK EA 2009].
[IUCLID]; 2001; IUCLID Data set for tris(methylphenyl) phosphate; Great Lakes Chemical Corporation [cité dans UK EA 2009].
Izmerov N.F., Sanotsky I.V., et Sidorov K.K.; 1982; Toxicometric parameters of industrial toxic chemicals under single exposure; Moscou, Centre des projets internationaux, GKNT, p. 14 [cité dans PISSC 1990].
Jayatilaka N.K., Restrepo P., Williams L., Ospina M., Valentin-Blasini L. et Calafat A.M.; 2017; Quantification of three chlorinated dialkyl phosphates, diphenyl phosphate, 2,3,4,5-tetrabromobenzoic acid, and four other organophosphates in human urine by solid phase extraction-high performance liquid chromatography-tandem mass spectrometry; Anal. Bioanal. Chem., 409, p. 1323-1332.
Johanssen F.R., Wright P.L., Gordon D.E., Levinskas G.J., Radue R.W. et Graham P.R.; 1977; Evaluation of delayed neurotoxicity and dose-response relationships of phosphate esters in the adult hen; Toxicol. Appl. Pharmacol., 41, p. 291-304 [cité dans PISSC 1990].
Kajiwara N., Noma Y. et Takigami H.; 2011; Brominated and organophosphate flame retardants in selected consumer products on the Japanese market in 2008; J. Hazardous Materials, 192, p. 1250-1259.
Kawagoshi Y., Fukunaga I. et Itoh H.; 1999; Distribution of organophosphoric acid triesters between water and sediment at a sea-based solid waste disposal site; J. Mater. Cycles Waste Manage; 1, p. 53-61.
Kenmotsu K., Matsunaga K. et Ishida T.; 1980;[Studies on the mechanisms of biological activities of various environmental pollutants. V. Environmental fate of organic phosphoric acid triesters.] Okayama-ken Kankyo Hoken Senta Nempo, 4, p. 103-110 (en japonais) [cité dans PISSC 1990].
Kersten W. et Reich T.; 2003; [Non-volatile organic substances in Hamburg indoor dust] Reinhalt Luft, 63, p. 85-91 [article en allemand avec un résumé en anglais].
Kim J.W., Ramaswamy B.R., Chang K.H., Isobe T. et Tanabe S.; 2011; Multiresidue analytical method for the determination of antimicrobials, preservatives, benzotriazole UV stabilizers, flame retardants and plasticizers in fish using ultra high performance liquid chromatography coupled with tandem mass spectrometry; J. Chromatogr. A., 1218, p. 3511-3520.
Kim J.W., Isobe T., Sudaryanto A., Malarvannan G., Chang K.W., Muto M., Prudent M. et Tanabe S.; 2013; Organophosphorus flame retardants in house dust from the Philippines: occurrence and assessment of human exposure; Environ. Sci. Pollut. Res., 20, p. 812-822.
Kinkead E.R., Bunger S.R., Wolfe R.E. et Wall H.G.; 1990; The acute delayed neurotoxicity evaluation of two jet engine oil formulations; NTIS/OTS, fiche numéro 0516607-3.
Kinkead E.R., Wolfe R.E., Salins S.A., Godin C.S. et Flemming C.D.; 1992; Acute delayed neurotoxicity evaluation of two jet engine oils using a modified navy and EPA protocol; Govt Reports Announcements & Index, no 14, 1993; NTIS/AD-A262 580/4.
Kishi H. et Sekine Y.; 2003; Simple prediction of atmospheric concentration of hydrophilic compounds based on the classification of industrial uses; QSAR & Combinatorial Science, 22, p. 396-398.
Klimisch H.J., Andreae M. et Tillmann U.; 1997; A systematic approach for evaluating the quality of experimental toxicological and ecotoxicological data; Regulatory Toxicology and Pharmacology, 25, p. 1-5.
[KOAWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [modèle d’estimation]; 2010; version 1.10; Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014]. (disponible en anglais seulement)
[KOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d’estimation]; 2010; version 2.00; Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014]. (disponible en anglais seulement)
Kosarac I., Kubwabo C. et Foster W.G.; 2016; Quantitative determination of nine urinary metabolites of organophosphate flame retardants using solid phase extraction and ultra performance liquid chromatography coupled to tandem mass sepectrometry (UPLC-MS/MS); J. Chromatogr. B, 1014, p. 24-30.
Ku Y. et Alvarez G.H.; 1982; Biodegradation of 14C-tri-p-cresyl phosphate in a laboratory activated sludge system; Appl. Environ. Microbiol., 43, p. 619-622.
Kurebayashi H., Tanaka A. et Yamaha T.; 1985; Metabolism and disposition of the flame retardant plasticizer, tri-p-cresyl phosphate, in the rat; Toxicol. Appl. Pharmacol., 77, p. 395-404.
LAB Research Ltd; 2010; Final report: Skin sensitization: Local Lymph Node Assay with Kronitex TCP. Study code :10/160-037E; date du rapport final : 1er octobre 2010 (déclaration de 2014 en vertu de l'article 71).
Latendresse J., Brooks C. et Capen C.; 1994a; Pathologic effects of butylated triphenyl phosphate-based hydraulic fluid and tricresyl phosphate on the adrenal gland, ovary, and testes in the Fischer 344 rat; Toxicol. Pathol., 22, p. 341-352 [cité dans UK EA 2009 et IUCLID 2001].
Latendresse J.R., Brooks C.L., Flemming C.D. et Capen C.C.; 1994b; Reproductive Toxicity of Butylated Triphenyl Phosphate and Tricresyl Phosphate Fluids in F344 Rats; Fundam. Appl. Toxicol., 22, p. 392-399.
Latendresse J.R., Brooks C.L. et Capen C.C.; 1995; Toxic effects of butylated triphenyl phosphate-based hydraulic fluid and tricresyl phosphate in female F344 rats; Vet. Pathol., 32(4), p. 394-402.
Latourette H.K.; 1978; FMC Corp.: Letter to U.S. Environmental Protection Agency, attn. 1. Urquhart [cité dans Boethling et Cooper 1985].
Latourette H.K.; 1980; FMC Corp.: Letter to D. W. Smith, U.S. EPA, July II [cité dans Boethling et Cooper 1985].
LeBel G.L., Williams D.T. et Benoit F.M.; 1981; Gas Chromatographic Determination of Trialkyl/Aryl Phosphates in Drinking Water, Following Isolation Using Macroreticular Resin; J. Assoc. Off. Anal. Chem., 64(4), p. 991-998.
LeBel G.L., Williams D.T. et Berard D.; 1989; Triaryl/Alkyl Phosphate Residues in Human : Adipose Autopsy Samples from Six Ontario Municipalities; Bull. Environ. Contam. Toxicol., 43, p. 225 – 230.
Lee H.B., Peart T., Muir D., Teixeria C., Sett A., Struger J. et Backus S.; 2011; Organophosphorus flame retardants and benzotriazoles in open waters and tributaries of the Great Lakes; préparé par Environnement Canada (affiche).
Lefaux R.; 1972; Industrial toxicology. Phosphoric esters; dans Practical toxicology of plastics; Londres (Royaume-Uni), Iliffe Books Ltd, p. 121-127 [cité dans PISSC 1990].
Leonards P., Steindal E.H., van der Veen I., Berg V., Bustnes J.O. et van Leeuwen S.; 2011; Screening of Organophosphorus Flame Retardants 2010; SPFO-Report 1091/ 2011, TA-2786/2011 [cité dans Van der Veen et de Boer 2012].
Litton Bionetics Inc.; 1979a; Evaluation of Phosflex 31 P in the in vitro transformation of BALB3T3 cells; réakisé pour la Stauffer Chemical Company [cité dans IUCLID 2001]
Litton Bionetics Inc.; 1979b; Mutagenicity evaluation of Phosflex 31 P in an in vitro cytogenetic assay measuring sister chromatid exchange and chromosomal aberrations; réakisé pour la Stauffer Chemical Company [cité dans IUCLID 2001]
Litton Bionetics Inc. 1979c. Mutagenicity evaluation of phosflex 31 P in the Ames Salmonella microsome plate test. Pour Stauffer Chemical Company. [cité dans IUCLID, 2001]
Litton Bionetics Inc. 1979d. Mutagenicity evaluation of Phosflex 31 P in the mouse lymphoma forward mutation assay. Pour Stauffer Chemical Company. [cité dans IUCLID, 2001]
Liu X., Ji K. et Chio K.; 2012; Endocrine disruption potentials of organophosphate flame retardants and related mechanisms in H295R and MVLN cell lines and in zebrafish; Aquatic Toxicology, 114-115, p. 173-181.
Liyasova M., Li B., Schopfer L.M. et al.; 2011; Exposure to tri-o-cresyl phosphate detected in jet airplane passengers; Toxicol. Appl. Pharmacol., 256, p. 337-347
Lombardo P. et Egry I.J.; 1979; Identification and gas-liquid chromatographic determination of aryl phosphate residues in environmental samples; J. AOAC Int., 62, p. 47-51 [cité dans OMS 1990 et UK EA 2009].
Mackerer C.R., Barth M.L., Kreuger A.J., Chawla B. et Roy T.A.; 1999; Comparison of neurotoxic effects and potential risks from oral administration of ingestion of jet engine lubricants; J. Toxicol. Environ. Health, 57, p. 293-328.
Marhold J.V.; 1972; Collection of results of toxicological assessments of compounds and formulations tested at the Department of Toxicology, Research Institute for Organic Synthesis, Prague, Institute for Management Training in the Chemical industry [cité dans PISSC 1990].
Marklund A., Andersson B. et Haglund P.; 2005; Traffic as a source of organophosphorus flame retardants in snow; Environ. Sci. Technol., 39, p. 3555-3562.
Martinez-Carballo E., Gonzalez-Barreiro C., Sitka A., Scharf S. et Gans O.; 2007; Determination of selected organophosphate esters in the aquatic environment of Austria; Science of Total Environment, 388, p. 290-299.
Marzulli F.N., Callahan J.F. et Brown D.W.; 1965; Chemical structure and skin penetrating capacity of a short series of organic phosphates and phosphoric acid; J. Invest. Dermatol., 44, p. 339-344 [cité dans Sjögren et al. 2010].
[ME Japon] Ministère de l'Environnement du Japon; 2003; Surveyed chemical substances and their detected levels in the environment (a cumulative list for fiscal year 1974-1998) [PDF] [consulté le 14 juin 2013]. (diponible en anglais seulement)
Mele J.M. et Jensh R.P.; 1977; Teratogenic effects of orally administered tri-ocresyl phosphate on Wistar albino rats; Teratology, 15, p. 32A [cité dans PISSC 1990 et UK EA 2009].
Michaelis S.; 2002; Aircraft cabin fumes: an aviation safety issue; J. Occup. Health Safety - AU NZ, 18(4), p. 291-294.
Midwest Research Institute; 1977; Assessment of the Need for the Character of and the Impact Resulting from Limitations on Aryl Phosphates, MRI 4309-L; Midwest Research Institute, Kansas City (MO), 279 p. [cité dans ChemFate 2012 et EPA 2010].
Ministère de l'Environnement du Canada; 2013; Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances ignifuges organiques [PDF]; Gazette du Canada, Partie I, vol. 147, no 13, p. 613-633.
Mirsalis J. et al.; 1985; Environmental Mutagenesis, 5, p. 482 [cité dans EA 2009]
Mobil Oil Corporation; 1987; Determination of the effects of tritolyl phosphate (tricresyl phosphate, Stock 955) on rat serum, erythrocyte and brain cholinesterase activities. Study # 61739; obtenu de EC 2001.
Mobil Oil Corporation; 1990; Final Report: The Effect of a Generic Jet Engine Oil Formulation on Serum Cholinesterase (ChE) Activity in Female Sprague Dawley Rats Following Two Weeks of Dermal Administration: Range-Finding Study prepared by Mobil Environmental and Health Science Laboratory. Study # 63114; obtenu de EC 2001.
Mobil Oil Corporation; 1991e; Male reproductive toxicity assessment following a fourteen-day oral exposure to Stock 955 in F344 and Long Evans Rats-Range Finding Study. Study # 64240; obtenu de EC 2001.
Mobil Oil Corporation; 1992b; Reproductive toxicity assessment in male F344 rats following a 10-week oral exposure to generic jet engine oil formulations. Study # 64972; obtenu de EC 2001.
Modern Plastics Encyclopedia; 1975; International Advertising Supplement 52(10A); New York, McGraw-Hill Inc., p. 697 [cité dans PISSC 1990].
Morrissey R.E., Schwetz B.A., Lamb J.C. IV, Ross M.D., Teague J.L. et Morris R.W.; 1988a; Evaluation of rodent sperm, vaginal cytology, and reproductive organ weight data from National Toxicology Program 13-week study; Fundam. Appl. Toxicol., 11, p. 343-358 [cité dans PISSC 1990].
[MPBPVP] Melting Point Boiling Point Program for Microsoft Windows [modèle d’estimation]; 2010; version 1.43; Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014].
MPI Research Inc.; 2004; An oral prenatal developmental toxicity study of tricresyl phosphate in rats. Study# 1038-003; obtenu de EC 2013-2014.
Muir D.C.G.; 1984; Phosphate esters; dans Hutzinger O. éditeur, The handbook of environmental chemistry; Berlin, Heidelberg, New York, Tokyo, Springer-Verlag, vol. 3, partie C, p. 41-66 [cité dans UK EA 2009 et OMS 1990].
Muir D.C.G., Lint D. et Grift N.P.; 1985; Fate of three phosphate ester flame retardants in small ponds; Environ. Toxicol. Chem., 4, p. 663-675.
Muir D.C.G., Yarechewski A.L., Grift N.P.; 1983; Environmental dynamics of phosphate esters. III. Comparison of the bioconcentration of four triaryl phosphates by fish; Chemosphere, 12, p. 155-166
Myers D.K., Rebel J.B.J., Veeger D., Kemp A. et Simons E.G.L.; 1955; Metabolism of triaryl phosphates in rodents; Nature (London), 176, p. 259-260 [cité dans PISSC 1990].]
[NCI] National Chemical Inventories [base de données sur CD-ROM]; 2013; Issue 1; Columbus (OH) : American Chemical Society.(disponible en anglais seulement)
New York University; 1951; Bellevue Medical Centre, April 10, 1951; Data from Exxon Research and Engineering Company, NTIS OTS 206104 [cité dans EA 2009].
[NITE] National Institute of Technology and Evaluation database [base de données sur Internet]. 2002. Biodegradation and Bioaccumulation of the Existing Chemical Substances under the Chemical Substances Control Law. [cité dans US EPA, 2010]. Accès : http://www.safe.nite.go.jp/english/kizon/KIZON_start_hazkizon.html (depuis le 5 mai 2010)
[NITE] National Institute of Technology and Evaluation database [base de données sur Internet]; 2008; GHS Classification Guidance by the Japanese Government [consulté le 18 mai 2017]. (disponible en anglais seulement)
NOMO5; 1987; Programs to Enhance PC-Gems Estimates of Physical Properties for Organic Compounds; The Mitre Corp. [cité dans EPA 2010].
Norris P. et Storrs F.J.; 1990; Allergic contact dermatitis to adhesive bandages; Dermatologic Clinics, 8, p. 147-152 [cité dans IUCLID 2001].
[NRC] National Research Council (États-Unis); 2000; Toxicological Risks of Selected Flame-Retardant Chemicals. Washington, DC: National Academy Press. (disponible en anglais seulement)
[NTP] National Toxicology Program; 1994; Toxicology and carcinogenesis studies of tricresyl phosphate (CAS No. 1330-78-5) in F344/N rats and B6C3F1 mice (gavage and feel studies); Research Triangle Park (NC) : National Toxicology Program (Technical Report Series No. 433, PB 95-227377).
[OCDE] Organisation de coopération et de développement économiques; 2009; Emission scenario document on plastics additives [PDF]; Paris (France) : Organisation de coopération et de développement économiques, Direction de l'environnement (Series on Emission Scenario Documents No. 3); rapport no ENV/JM/MONO(2004)8/REV1. JT03267870 [consulté en octobre 2014].
Oishi H., Oishi S. et Hiraga K.; 1982; Toxicity of several phosphoric acid esters in rats; Toxicol. Lett., 13, p. 29-34 [cité dans PISSC 1990].(disponible en anglais seulement)
Okazaki M.E., D'Souza A. et Antika S.; 2003; United States Patent No. 6,649,080 B2; Phosphate ester base stocks and aircraft hydraulic fluids comprising the same; [cité dans Schindler et al. 2014]. (disponible en anglais seulement)
OMS; 1990; Flame retardants: Tricresyl phosphate. Environmental Health Criteria 110; Organisation mondiale de la santé, Genève (Suisse).
OMS; 1998; EHC 209: Flame Retardants: Tris-(Chloropropyl)Phosphate and Tris-(2- Chloroethyl)phosphate; Genève, Suisse [cité dans van der Veen et de Boer 2012].
[PISSC] Programme international sur la sécurité des substances chimiques; 1990; Tricresyl Phosphate; Genève, Suisse : Organisation mondiale de la santé (Critère d'hygiène de l'environnement no 110); financé conjointement par le Programme des Nations Unies pour l'environnement, l'Organisation internationale du travail et l'Organisation mondiale de la santé.
Piccirillo V.J.; 1999; Flame-retardant product chemistries, toxicology and hazard evaluations; NPC Inc., Sterling (VA) [cité dans NRC 2000]
Repke V.L. et Shepherd R.C.; 1980; United States Patent 4193404; Stretchable and Comfortable pad; Johnson & Johnson (New Brunswick, NJ), Appl. No 05/896,841, Déposé le 17 avril 1978. (disponible en anglais seulement)
Ricking M., Schwarzbauer J. et Franke S.; 2003; Molecular markers of anthropogenic activity in sediments of the Havel and Spree Rivers (Germany); Water Research, 37, p. 2607-2617.
Saeger V.W., Hicks O., Kaley R.G., Michael P.R., Mieure J.P. et Tucker E.S.; 1979; Environmental fate of selected phosphate esters; Environ. Sci. Technol., 13(7), p. 840‑844.
SafePharm Laboratories; 2002; TDCP: Determination of general physicochemical properties, Report 1613/004; SafePharm Laboratories, PO Box 45, Derby (R.-U.).
Saito C., Kato T., Taniguchi H., Fujita T., Wada H. et Mori Y.; 1974; Subacute toxicity of tricresylphosphate (TCP) in rats; Pharmacometrics, 8, p. 107-118 [cité dans PISSC 1990].
Sample B.E., Opresko D.M. et Suter G.W. II; 1996; Toxicological Benchmarks for Wildlife: 1996 Revision; Oak Ridge (TN) : Health Sciences Research Division, soumis au Department of Energy des États-Unis, contrat no DE-AC05-84OR21400.
Santé Canada; 1994; Loi canadienne sur la protection de l'environnement : L'évaluation du risque à la santé humaine des substances d'intérêt prioritaire; Ottawa (ON).
Santé Canada; 1998; Exposure factors for assessing total daily intake of priority substances by the general population of Canada; rapport non publié; Ottawa (ON) : gouvernement du Canada.
Santé Canada; 2014; CMP Survey 2014-2015: Determination of flame retardants in consumer products; non publié; Santé Canada, Ottawa, Ontario.
Santé Canada; [modifié le 14 décembre 2015]; Liste des ingrédients dont l’usage est interdit dans les cosmétiques [base de données]; Ottawa (ON) : gouvernement du Canada [consultée le 24 avril 2014].
Santé Canada; [modifié le 3 mai 2017]; Listes des additifs alimentaires autorisés; Ottawa (ON) : Santé Canada, Direction des aliments [consulté le 24 avril 2014].
Sax N.I., Lewis R.J. Sr (éditeurs); 1987; Hawley's Condensed Chemical Dictionary, 11e edition, New York : Van Nostrand Reinhold Co., p. 1178 [cité dans HSDB 2012].
Schenker U., Macleod M., Scheringer M. et Hungerbühler K.; 2005; Improving data quality for environmental fate models: a least-squares adjustment procedure for harmonizing physicochemical properties of organic compounds; Environ. Sci. Technol., 39, p. 8434-8441.
Scheringer M., MacLeod M. et Wegmann F.; 2009; The OECD Pov and LRTP Screening Tool, version 2.2; A manual for the OECD Pov and LRTP Screening Tool 2.2 that is a follow-up version of the software POPorNot 1.0 distributed at the OECD/UNEP Workshop on Application of Multimedia Models for Identification of Persistent Organic Pollutants; ETH Zurich (Suisse), avril 2009. La version 2.2 répare un bogue dû à des modifications apportées à Excel 2007.
Schindler B.K., Koslitz S., Weiss T., Broding H.C., Brüning T. et Bünger J.; 2014; Exposure of aircraft maintenance technicians to organophosphates from hydraulic fluids and turbine oils: a pilot study; Int. J. Hyg. Environ. Health, 217(1), p. 34-37.
Schindler B.K., Weiss T., Schütze A., Koslitz S., Broding H.C., Bünger J. et Brüning T.; 2013; Occupational exposure of air crews to tricresyl phosphate isomers and organophosphate flame retardants after fume events; Arch. Toxicol., 87(4), p. 645-648.
Senanayake N. et Jeyaratnam J.; 1981; Toxic polyneuropathy due to gingili oil contaminated with tri-cresyl phosphate affecting adolescent girls in Sri Lanka; Lancet, 10, p. 88-89 [cité dans PISSC 1990].
SinoHarvest; 2011; Tricresyl phosphate (TCP) [Internet]; Shanghai, Chine [consulté en juin 2013]. (disponible en anglais seulement)
Siret-Alatrista A., Zimerson E., Guillot B. et Raison-Peyron N.; 2010; Allergic contact dermatitis to tricresyl phosphate from safety goggles [abstract]; Contact Dermatitis, 63 (Suppl. 1), p. 58-107.
Sitthichaikasem S.; 1978; Some toxicological effects of phosphate esters on rainbow trout and bluegill; these de l’Université de l'Iowa; University Microfilms 7813246 [cité dans Zitko 1980 et dans UK EA 2009].
Sjögren B., Iregren A. et Järnberg J.; 2010; The Nordic Expert Group for Criteria Documentation of Health Risks from Chemicals; 143. Phosphate triesters with flame retardant properties; Arbete och Hälsa, 44(6), p. 1-220.
Solbu K., Daae H.L., Thorud S., Ellingsen D.G., Lundanes E. et Molander P.; 2010; Exposure to airborne organophosphates originating from hydraulic and turbine oils among aviation technicians and loaders; J. Environ. Monit., 12, p. 2259-2268.
Somkuti S.C., Lapadula D.M., Chapin R.E., Lamb J.C. IV et Aboudonia M.B.; 1987a; Reproductive tract lesions resulting from subchronic administration (63 days) of tri-o-cresyl phosphate in male rats; Toxicol. Appl. Pharmacol., 89, p. 49-63 [cité dans UK EA 2009 et PISSC 1990].
Somkuti S.C., Lapadula D.M., Chapin R.E., Lamb J.C. IV et Aboudonia M.B.; 1987a; Time course of the tri-o-cresyl phosphate-induced testicular lesion in F-344 rats: enzymatic, hormonal, and sperm parameter studies; Toxicol. Appl. Pharmacol., 89, p. 64-72 [cité dans UK EA 2009 et PISSC 1990].
Staaf T. et Östman C.; 2005; Organophosphate triesters in indoor environments; J. Environ. Monit., 7, p. 883-887.
Stauffer Chemical Company; 1979; Acute inhalation toxicity of Phosflex 31 P in albino rats. Study No. T-6682 [cité dans IUCLID 2001].
Stauffer Chemical Company; 1988; Test procedures and data summaries for t-butyl phenyl phosphate, tricresyl phosphate, trixylenyl phosphate, mixed triaryl phosphate and isopropyl phenyl diphenyl; [Communication personnelle citée dans PISSC 1990].
Sumitomo Chemical Company; 1974; Pharmaceuticals Division Report, Tests of the subacute toxicity of tricresylphosphate in rats [cité dans IUCLID 2001].
Sundkvist A.M., Olofsoon U. et Haglund P.; 2010; Organophosphorus flame retardants and plasticizers in marine and fresh water biota and in human milk; J. Environ. Monitor., 12, p. 943-951.
Takimoto K., Hirakawa T., Ito K., Mukai T. et Okada M.; 1999; Source and transport of tricresyl phosphate (TCP) isomers in Kurose river basin; Atmos. Environ., 33, p. 3191‑3200.
[TaPL3] Long Range Transport and Persistence Level III model; 2003; version 3.00; Peterborough (ON) : Université Trent, Canadian Environmental Modelling Centre. (disponible en anglais seulement)
Tocco D.R., Randall J.L., York R.G. et Smith M.K.; 1987; Evaluation of the teratogenic effects of tri-ortho-cresyl phosphate in the Long-Evans hooded rat; Fund. Appl. Toxicol., 8(3), p. 291-297 [cité dans UK EA 2009 et PISSC 1990].
Tollbäck J., Tamburro D., Crescenzi C. et Carlsson H.; 2006; Air sampling with Empore solid phase extraction membranes and online single-channel desorption/liquid chromatography/mass spectrometry analysis: determination of volatile and semi-volatile organophosphate esters; J. Chromatogr. A, 1129, p. 1-8 [cité dans van der Veen et de Boer 2012].
[TOPKAT] Toxicity Prediction by Komputer Assisted Technology [Internet]; 2004; version 6.2; San Diego (CA) : Accelrys Software Inc.
[UE RAR]; Union européenne; 2009; European Union Risk Assessment Report. Tris(2-chloroethyl)phosphate (TCEP) [pdf]; juillet 2009. (disponible en anglais seulement)
[UK EA] Agence de l’environnement du Royaume-Uni; 2009; Environmental risk evaluation report: Tricresyl phosphate (CAS no. 1330-785) [PDF]; Bristol (R.-U.) : UK Environmental Agency [consulté le 6 juin 2013]. (disponible en anglais seulement)
UNEP Publications; 1998; Triethyl Phosphate Case No.: 78-40-0; SIDS Initial Assessment Report; Pour le SIAM 5, Organisation de coopération et de développement économiques (OCDE), Genève, Suisse, p. 1-18 (octobre) [cité dans van der Veen et de Boer 2012].
Université de New York; 1951; Bellevue Medical Centre, 10 avril 1951, Data from Exxon Research and Engineering Company; NTIS OTS 206104 [cité dans EA 2009].
van den Dikkenberg R.P., Canton H.H., Mathijssen-Spiekman L.A.M. et Roghair C.J.; 1989; Usefulness of Gasterosteus aculeatus - the three-spined stickleback - as a test organism in routine toxicity tests; Report 718625003, Rijksinstituut Voor Volksgezondheid en Milieuhygiene, Biltoven, Pays-Bas, 28.
Van den Eede N., Dirtu A.C., Ali N., Neels H. et Covaci A.; 2012; Multi-residue method for the determination of brominated and organophosphate flame retardants in indoor dust; Talanta, 89, p. 292-300.
Van den Eede N., Dirtu A.C., Neels H. et Covaci A.; 2011; Analytical developments and preliminary assessment of human exposure to organophosphate flame retardants from indoor dust; Environ. Int., 37(2), p. 454-461.
Van der Veen I. et de Boer J.; 2012; Phosphorus flame retardants: Properties, production, environmental occurrence, toxicity and analysis; Chemosphere, 88, p. 1119‑1153.
van Netten C.; 2008; Design of a small personal air monitor and its application in aircraft; Sci. Total Environ., 407, p. 1206-1210.
Veith G.D., DeFoe D.L. et Bergstedt B.V.; 1979; Measuring and estimating the bioconcentration factor of chemicals in fish; J. Off. Rech. Pêch. Can., 36, p. 1040-1048.
Vykoukalová M., Venier M., Vojta Š., Melymuk L., Bečanová J., Romanak K., Prokeš R., Okeme J.O., Saini A., Diamond M.L. et Klánová J.; 2017; Organophosphate esters flame retardants in the indoor environment; Environment International, 106, p. 97-104.
Wakabayashi A.; 1980; Environmental pollution caused by organophosphoric fireproofing plasticizers; Annual Report Tokyo Metropolitan Research Institute of Environmental Protection, 11, p. 110-113 (en japonais) [cité dans PISSC 1990].
Wang X.-W., Liu J.-F. et Yin Y.-G.; 2011; Development of an ultra-high-performance liquid chromatography-tandem mass spectrometry method for high throughput determination of organophosphorus flame retardants in environmental water; J. Chromatogr. A., 1218, p. 6705-6711.
Weil E.D.; 1993; Flame retardants (Phosphorus); Kirk-Othmer Encyclopedia of Chemical Technology, volume 10, 4e édition, p. 976-998; John Wiley and Sons Inc. [cite dans UK EA 2009].
Wensing M., Uhde E. et Salthammer T.; 2005; Plastics additives in the indoor environment - flame retardants and plasticizers; Sci. Total Environ., 339, p. 19-40.
Westat Inc.; 1987; National Usage Survey of Household Cleaning Products; préparé pour l’EPA des États-Unis, Office of Toxic Substances; EPA Contract No. 68-02-42431987.
Wildlife International Ltd; 2002; Technical information and safety data sheet for Kronitex TCP [cité dans UK EA 2009].
Williams D.T. et LeBel G.L.; 1981; A National Survey of Tri(haloalkyl)-, Trialkyl-, and Triarylphosphates in Canadian Drinking Water; Bull. Environ. Contam. Toxicol., 27, p. 450-457.
Williams D.T., Nestmann E.R., LeBel G.L., Benoit F.M. et Otson R.; 1982; Determination of mutagenic potential and organic contaminants of Great Lakes Drinking Water; Chemosphere, 11(3), p. 263 – 276.
Wilson R., Jones-Otazo H., Petrovic S., Mitchell I., Bonvalot Y., Williams D. et Richardson G.M.; 2013; Revisiting dust and soil ingestion rates based on hand-to-mouth transfer; Human and Ecological Risk Assessment, 19(1), p. 158-188.
Winder C. et Balouet J.-C.; 2002; The toxicity of commercial jet oils; Environ. Res., 89, p. 146-164.
Wong P.T.S. et Chau Y.K.; 1984; Structure-toxicity of triaryl phosphates in freshwater algae; Sci. Total Environ., 32, p. 157-165.
Woudneh M.B., Benskin J.P., Wang G., Grace R., Hamilton M.C. et Cosgrove J.R.; 2015; Quantitative determination of 13 organophosphorous flame retardants and plasticizers in a wastewater treatment system by high performance liquid chromatography tandem mass spectrometry; J. Chromatography A, 1400, p. 149-155.
Yang F., Ding J., Huang W., Xie W. et Liu W.; 2014; Particle size-specific distributions and preliminary exposure assessments of organophosphate flame retardants in office air pariculate matter; Environ. Sci. Technol., 48, p. 63-70.
Yang C., Harris S.A., Jantunen L.M., Sidiqque S., Kubwabo C., Tsirlin D., Latifovic L., Fraser B., St-Jean M., De La Campa R., You H., Kulka R. et Diamond M.L.; 2018; Are cell phones an indicator of personal exposure to organophosphate flame retardants and plasticizers? (soumis pour publication).
Yasuda H.; 1980; Concentration of organic phosphorus pesticides in the atmosphere above the Dogo plain and Ozu basin; J. Chem. Soc. Jpn, 1980(4), p. 645-653 (en japonais) [cité dans OMS 1990].
Annexes
Annexe A. Intrants pour la modélisation de la fugacité de niveau III
| Milieux de l’environnement | Demi-vie (heure) | Référence |
|---|---|---|
| Air | 18,74 | EPI Suite 4.10 2012 |
| Eaua | 1029 | EPI Suite 4.10 2012 |
| Sola | 1029 | EPI Suite 4.10 2012 |
| Sédiments | 4116 | EPI Suite 4.10 2012 |
| Masse molaire | 368,37 g/mol | - |
| Température | 25 oC | - |
| Solubilité dans l’eau | 0,36 mg/L | Saeger et al. 1979 |
| Pression de vapeur | 6,6 x 10-5 Pa (à 25 oC) | EA UK 2009 (extrapolé) |
| log Koe | 5,11 | Saeger et al. 1979 |
| Point de fusion | -33 oC | EPA 2010 (Midwest Research Institute 1977) |
| log Kae | -4,564 | Calculé à partir de la conversion de la constante de Henry en Kae et de Scale.xlsb |
| Kae | 2,729 x 10-5 | - |
| Constante de Henry | 0,0675 Pa-m3/mol | Calculé à partir de la conversion de la constante de Henry en Kae et de Scale.xlsc |
| log Kco | 3,5253 | KOCWIN v2.00 2010d |
| Kco | 3351,97 | - |
| log Koa | 9,591 | KOAWIN v. 1.10 2010e |
| Koa | 3,90 x 109 | - |
a Les valeurs de demi-vie pour l'eau, le sol, et les sédiments sont mises à l'échelle 1/1/4 (c.-à-d. que la demi-vie dans les sédiments est quatre fois celle dans l'eau) en se basant sur l’approche d’extrapolation de Boethling (Boethling et al. 1995).
b en utilisant une solubilité dans l’eau empirique de 0,36 mg/L et une PV de 6,6E-05 Pa à 25 oC comme intrants
c en utilisant une solubilité dans l’eau empirique de 0,36 mg/L et une PV de 6,6E-05 Pa à 25 oC comme intrants
d en utilisant un log Koe de 5,11, un PF de -33 oC et une solubilité dans l’eau de 0,36 mg/L comme intrants
e log Koe = 5,11, PF= -33 oC, PV = 3,5E+05 Pa, solubilité dans l’eau = 0,3 mg/L
Annexe B. Analyse du quotient de risque écologique du TCP
Paramètres |
Organisme pélagique | Organisme du sol | Espèce qui consomme du poisson (vison)h | Espèce qui consomme du poisson (loutre de rivière)h |
|---|---|---|---|---|
| Concentration environne-mentale estimée (CEE) | 7,27 x 10-8 à 2,70 x 10-6 mg/L | 0,1185 mg/kg pc/jc (DJT normalisée pour 2 % CO) | 0,0010 mg/kg pc/j (DJT) | 0,0008 mg/kg pc/j (DJT) |
| Valeur critique de toxicité (VCT) | 0,0013 mg/La | 5,3 mg/kg pc/jd | 5,3 mg/kg pc/jd | 5,3 mg/kg pc/jd |
| Facteur d'application | 3b | 10e | 10e | 10e |
| Concentration estimée sans effet (CESE) | 0,00043 mg/L | 1,259 mg/kg pc/jf (VTR) | 0,39 mg/kg pc/jf (VTR) | 0,37 mg/kg pc/jf (VTR) |
| Quotient de risque (CEE/CESE) | 0,0002 à 0,006 | 0,094g | 0,0026g | 0,0032g |
a Van den Dikkenberg et al. (1989) (également cité dans UK EA 2009), 0,0013 mg/L pour CE50 à 35 jours pour la mortalité aux premiers stades de la vie (après le stade d'un poisson de 4 semaines).
b Facteur d'application de 3 pour la sensibilité des espèces car, même s’il existe beaucoup de données, les données chroniques ne couvrent que deux catégories : vertébrés et invertébrés (pas des producteurs primaires). Par conséquent, FA = 1 x 3 = 3.
c BASL4
En raison de l'absence de données mesurées, la CEE a été calculée à l'aide du modèle BASL4 (BASL4 2011). Afin d'étudier les impacts potentiels d'une application à long terme, une période d'application de 10 années consécutives a été prise en compte. Pour le calcul, une vitesse d'application maximale de 8300 kg poids sec/hectare/an (basée sur la limite réglementaire provinciale existante la plus élevée) a été prise en compte, avec une profondeur de mélange de 0,1 m (valeur par défaut pour le modèle BASL4) et une masse volumique du sol de 1487 kg/m3 (valeur par défaut pour le modèle BASL4). Au Canada, d'après une analyse de l'exposition, la concentration maximale de TCP dans des biosolides était de 1,15 mg/kg ps. Cette valeur a été utilisée pour le calcul. Demi-vie dans le sol = 42,87 jours.
Cela conduit à une vitesse d'absorption maximale chez les mammifères de 0,16 mg/kg pc/j pour une CO de 2,7 %, qui peut être comparée la valeur de l’absorption toxique de référence. Après normalisation à 2 % CO, la DJT est de 0,1185 mg/kg pc/j.
d Moyenne géométrique des valeurs de la DSENO et de la DMENO (moyenne géométrique de4 mg/kg pc/j et de 7 mg/kg pc/j), tirée du NTP (1994).
e Pour calculer la CESE chez les espèces fauniques pour le TCP, un facteur de 10 a été appliqué à la VTR pour tenir compte de l'extrapolation de conditions de laboratoire à celles sur le terrain.
f VTR – valeur totale de référence
En raison du manque de données sur la faune, la VCT est basée sur la valeur de toxicité de référence pour la faune (Sample et al., 1996), établie à l'aide du modèle d'exposition de la faune, dans lequel les effets potentiels du TCP sur les rongeurs (NTP 1994) sont normalisés pour un poids corporel type du vison, Mustela vison, une espèce faunique servant de substitut :
VRT = s CMATee x (PCet/PCef)
avec :
VTR = valeur totale de référence (mg/kg pc/j)
CMATts = concentration maximale autorisée de substances toxiques pour les espèces testées (mg/kg pc/j), CMAT= moyenne géométrique de la DSENO et de la DMENO pour les espèces testées. Une DMENO de 7 mg/kg pc/j et une DSENO de 4 mg/kg pc/j (NTP 1994) ont été retenues pour déterminer la VTR pour l'évaluation des effets potentiels sur la faune. Ce paramètre a été jugé pertinent, en se basant sur une étude de 2 ans sur l'exposition par voie alimentaire avec des rates (voir la section sur l'évaluation ayant trait à la santé (NTP 1994).
PCet = poids corporel moyen des espèces testées (kg); PCet = 0,32 kg [moyenne du poids des rats pour la DSENO et la DMENO (NTP 1994)].
(Le poids corporel des rates était en moyenne de 91 g, (91, 91, 92, 90 g pour les quatre concentrations de TCP dans l'alimentation) au cours de la première semaine de l'étude, et était en moyenne de 320 g (315, 320, 332, 313 g pour les quatre concentrations de TCP dans l'alimentation) lors de la 104ème et dernière semaine de l'étude.)
PCef = poids corporel des espèces focales (kg) = poids = masse volumique/volume = (1 g/cm3) x (10 cm3) = 10 g = 0,01 kg; = 0,01 (musaraigne) (EPA 1993).
g Quotient de risque = DJT/VTR
h Modèle d'exposition de la faune et équations de toxicité
L'exposition de la faune est basée sur la dose journalière totale (DJT) du vison (Mustela vison) et de la loutre de rivière (Lontra canadensis) qui consomment du poisson, et elle est déterminée au moyen du modèle d'exposition de la faune (EPA 1993), avec
DJT = [TML (Ci × DE × Pi / EBi × EAi) + (Cs × TAs) + (Ce × VAe)] × Pt
avec :
- DJT = dose journalière totale (mg/kg pc/j)
- TML = taux métabolique libre du récepteur faunique d'intérêt; dans la présente évaluation, un TML de 235 kcal/kg pc/j est assumé pour le vison et de 179 kcal/kg pc/j pour loutre de rivière.
- Ci = concentration de contaminant dans la énième espèce de proie (mg/kg) = Ce x FBC; une Ci de 0,0056 mg/kg pc a été retenue (valeur par défaut), représentant la concentration de TCP la plus élevée publiée dans un échantillon de poisson canadien (foie d'un grand brochet) (Houde et al. 2014)
- Pi = pourcentage de la énième espèce de proie dans le régime alimentaire (sans unité); 0,85 pour le vison et 0,84 pour la loutre de rivière
- Par prudence, il a été supposé qu'à peu près la totalité du régime alimentaire du vison et de la loutre de rivière se compose de poisson : Pi = 1,0
- EBi = énergie brute de la énième espèce de proie (850 kcal/kg de proie); le 5e centile est utilisé comme valeur prudente; EBi = 1177
- EAi = efficacité d'assimilation de la énième espèce de proie par le récepteur faunique; EAi=0,94 (vison et loutre de rivière). Valeur par défaut.
- Cs = concentration de contaminant dans les sédiments (mg/kg ps); il a été assumé que l'exposition au TCP due aux sédiments est négligeable; Cs = 0
- TAs = taux d'absorption de sédiments (kg ps/kg pc/j); il a été calculé que l'ingestion accidentelle de sédiments est nulle; TAs = 0,006 (vison), 0,001 (loutre de rivière)
- Ce = concentration de contaminant dans l'eau (mg/L); 2,7 ng/L, qui est la concentration totale de TCP mesurée la plus élevée provenant de l'analyse de l'exposition, a été retenue pour représenter une concentration régionale possible dans l'eau (section de l'exposition); Ce = 2,7 x 10-6 mg/L pour le vison et la loutre de rivière.
- VAe = vitesse d’absorption d’eau (L/jour); il est supposé que l’absorption est de 10 %; VAe = 0,1064 (vison), 0,642 (loutre de rivière)
- Pt = pourcentage de temps passé par le récepteur dans la zone contaminée. Pt=1 (vison et loutre de rivière)
Une description et une définition de chacune des variables de l'équation ci-dessus sont présentées dans le document de l’EPA (1993).
En raison du manque de données sur la faune, la VCT a été basée sur la valeur de toxicité de référence (VTR) pour la faune (Sample et al. 1996), établie à l'aide du modèle d'exposition de la faune, dans lequel les effets potentiels du TCP sur les rongeurs (NTP 1994) sont normalisés pour un poids corporel type du vison, Mustela vison, une espèce faunique servant de substitut :
VRT = s CMATee x (PCet/PCef)
avec :
VTR = valeur de référence totale (mg/kg pc/j)
CMATts = concentration maximale autorisée de substances toxiques pour les espèces testées (mg/kg pc/j), CMAT= moyenne géométrique de la DSENO et de la DMENO pour les espèces testées. Une DMENO de 7 mg/kg pc/j et une DSENO de 4 mg/kg pc/j (NTP 1994) ont été retenues pour déterminer une VTR pour l'évaluation des effets potentiels sur la faune. Ce paramètre a été jugé pertinent, en se basant sur une étude de 2 ans sur l'exposition par voie alimentaire avec des rates (voir la section sur l'évaluation ayant trait à la santé (NTP 1994).
PCet = poids corporel moyen des espèces testées (kg); PCet = 0,32 kg [moyenne du poids des rats pour la DSENO et la DMENO (NTP 1994)].
(Le poids corporel des rates était en moyenne de 91 g, (91, 91, 92, 90 g pour les quatre concentrations de TCP dans l'alimentation) au cours de la première semaine de l'étude, et était en moyenne de 320 g (315, 320, 332, 313 g pour les quatre concentrations de TCP dans l'alimentation) lors de la 104ème et dernière semaine de l'étude.)
PCef = poids corporel des espèces focales (kg); =1,08 (vison); 7,98 (loutre de rivière) (EPA 1993)
Quotient de risque = DJT/VTR
Annexe C. Poids de la preuve pour l'évaluation des risques pour l’environnement
| Élément de preuve | Niveau de confiancea | Pertinence pour l’évaluationb | Poids attribuéc |
|---|---|---|---|
| Propriétés physiques et chimiques | Modéré | Modérée à élevée | Modéré |
| Persistance | Élevée | Faible | Faible |
| Bioaccumulation | Élevée | Modérée | Modéré |
| Effets (CESE, VTR) | Modéré | Élevée | Modéré à élevé |
| Analyse de l'exposition (CEE, DJT) | Modéré | Élevée | Modéré à élevé |
| Risque | Modéré | Élevée | Modéré à élevé |
a Le niveau de confiance est déterminé en fonction de la qualité des données, de leur variabilité, des lacunes dans les données et du fait que les données sont pertinente pour l’objet.
b La pertinence fait référence à l’impact de la preuve sur l’évaluation.
c Un poids est attribué à chaque élément de preuve en fonction du niveau de confiance et de la pertinence pour l’évaluation.
Annexe D. Estimations de l'absorption quotidienne de TCP par divers groupes d'âge au sein de la population générale du Canada
| Voie d'exposition | De 0 à 6 moisa allaitésb | De 0 à 6 mois nourris à la préparationc | De 0 à 6 mois non nourris à la préparationd | 0,5 à 4 anse | 5 à 11 ansf | de 12 à 19 ansg | 20 à 59 ansh | ≥ 60 ansi |
|---|---|---|---|---|---|---|---|---|
| Air ambiantj | 8,5E-06 | 8,5E-06 | 8,5E-06 | 1,8E-05 | 1,4E-06 | 8,1E-06 | 7,0E-06 | 6,1E-06 |
| Air intérieurk | 6,0E-05 | 6,0E-05 | 6,0E-05 | 1,3E-04 | 1,0E-04 | 5,7E-05 | 4,9E-05 | 4,2E-05 |
| Eau potablel | S.O. | 6,4E-03 | 2,4E-03 | 2,7E-03 | 2,1E-03 | 1,2E-03 | 1,3E-03 | 1,3E-03 |
| Alimentsm | 1,3E-02 | NI | NI | 4,7E-03 | 3,8E-03 | 2,2E-03 | 2,1E-03 | 1,3E-03 |
| Poussièren | 9,0E-02 | 9,0E-02 | 9,0E-02 | 4,7E-02 | 1,8E-02 | 6,6E-04 | 6,2E-04 | 6,1E-04 |
| Solo | 0 | 0 | 0 | 2,7E-07 | 2,0E-07 | 7,1E-09 | 6,8E-09 | 6,3E-09 |
| Absorption totale | 1,0E-01 | 9,6E-02 | 9,2E-02 | 5,4E-02 | 2,4E-02 | 4,1E-03 | 4,0E-03 | 3,3E-03 |
Abréviations : S.O. = sans objet; NI = données non identifiées dans la littérature.
a Il est assumé que les nourrissons pèsent 7,5 kg, respirent 2,1 m3 d'air par jour (Santé Canada 1998) et ingèrent respectivement 38 et 0 mg de poussière et de sol par jour (Wilson et al. 2013).
b Il est assumé que les nourrissons allaités exclusivement consomment 0,742 L de lait maternel par jour, et que le lait maternel constitue la seule source alimentaire. Aucune surveillance du TCP dans le lait n’a été identifiée au Canada. La concentration de 0,13 µg/L dans le lait maternel entier était basée sur une mesure rapportée de 3,7 ng/g lipides x 3,4 % (teneur en lipides du lait maternel) x 1,03 g/mL (masse volumique du lait maternel) provenant de 69 échantillons de lait maternel humain prélevés en Suède en 1997 (Sundkvist et al. 2010).
c Il est assumé que les nourrissons nourris exclusivement avec une préparation consomment 0,8 L d'eau par jour (Santé Canada 1998), utilisée pour reconstituer la préparation. Aucune donnée de surveillance du TBB et du TBPH dans les préparations n’a été identifiée. Par conséquence, l'absorption par voie alimentaire ne reflète que celle provenant de l'eau. Pour plus de détails, veuillez consulter la note de bas de page sur l'eau potable.
d Il est assumé que les nourrissons exclusivement non nourris avec une préparation consomment 0,7 L d'eau par jour (Santé Canada 1998) et qu'environ 50 % de ces nourrissons commencent à manger des aliments solides à 4 mois et 90 % à 6 mois (NHW 1990).
e Il est assumé que l'enfant pèse 15,5 kg, qu'il respire 9,3 m3 d'air par jour, qu'il boit 0,7 L d'eau par jour, qu'il consomme 54,7 g de poisson par jour (Santé Canada 1998) et qu'il ingère respectivement 41 et 14 mg de poussière et de sol par jour (Wilson et al. 2013).
f Il est assumé que l'enfant pèse 31,0 kg, qu'il respire 14,5 m3 d'air par jour, qu'il boit 1,1 L d'eau par jour, qu'il consomme 89,8 g de poisson par jour (Santé Canada 1998) et qu'il ingère respectivement 31 et 21 mg de poussière et de sol par jour (Wilson et al. 2013).
g Il est assumé que la personne pèse 59,4 kg, qu'il respire 15,8 m3 d'air par jour, qu'il boit 1,2 L d'eau par jour, qu'il consomme 97,3 g de poisson par jour (Santé Canada 1998) et qu'il ingère respectivement 2,2 et 1,4 mg de poussière et de sol par jour (Wilson et al. 2013).
h Il est assumé que la personne pèse 70,9 kg, qu'elle respire 16,2 m3 d'air par jour, qu'elle boit 1,5 L d'eau par jour, qu'elle consomme 111,7 g de poisson par jour (Santé Canada 1998) et qu'elle ingère respectivement 2,5 et 1,6 mg de poussière et de sol par jour (Wilson et al. 2013).
i Il est assumé que la personne pèse 72,0 kg, qu'elle respire 14,3 m3 d'air par jour, qu'elle boit 1,6 L d'eau par jour, qu'elle consomme 72,9 g de poisson par jour (Santé Canada 1998) et qu'elle ingère respectivement 2,5 et 1,5 mg de poussière et de sol par jour (Wilson et al. 2013).
j Aucune donnée de surveillance de l'air intérieur ay Canada n’a été identifiée. La concentration maximale dans l’air intérieur de 0,244 ng/m3 pour les chambres de 51 habitations de la région du Grand Toronto et d’Ottawa (Yang et al. 2018) a été retenue pour calculer les estimations limites supérieures de l’absorption journalière due à l’air ambiant. Il est assumé que les Canadiens passent 3 heures à l’extérieur chaque jour (Santé Canada 1998).
k La concentration maximale dans l’air intérieur de 0,244 ng/m3 pour les chambres de 51 habitations de la région du Grand Toronto et d’Ottawa (Yang et al. 2018) a été retenue pour calculer les estimations limites supérieures de l’absorption journalière due à l’air intérieur. Il est assumé que les Canadiens passent 21 heures à l’intérieur chaque jour (Santé Canada 1998).
l La limite de détection de 60 ng/L du programme de surveillance de l'eau potable municipale de la ville de Toronto (2003) a été retenue pour les estimations limites supérieures de la dose journalière due à l'eau potable.
m Aucune donnée de surveillance des aliments commercialisés au Canada n’a été idebtifiée. Toutefois, des données environnementales sur les poissons, mollusques et crustacés étaient disponibles. La concentration de TCP de 1,32 µg/kg poids humide (basée sur une concentration maximale rapportée de 110 µg/kg lipides x 1,2 % de teneur en lipides) dans des moules collectées en 2007 en Suède (Sundkvist et al. 2010) a été retenue pour les estimations limites supérieures de la dose journalière pour tous les produits alimentaires liés aux poissons du groupe des aliments aquacoles. Les quantités d'aliments de plus de 12 groupes alimentaires consommées quotidiennement par chaque groupe d'âge ont été tirées de l'Enquête Nutrition Canada de 1970-1972 (Santé Canada 1988).
n La concentration au 95ème percentile du TCP (17 700 ng/g) tirée de l’étude basée sur les échantillons prélevés lors de l'Enquête sur la poussière domestique au Canada (Kubwabo et al. 2014) a été retenue pour les estimations limites supérieures de la dose journalière due à la poussière.
o Aucune étude appropriée ou pertinente sur la surveillance du TCP dans le sol en Amérique du Nord n’a été identifiée. La concentration environnementale estimée (CEE) maximale dans le sol de 300 ng/g ps (0,0003 mg/kg ps) a été retenue pour les estimations limites supérieures de l'absorption quotidienne due à l’exposition au sol.
Annexe E. Données de surveillance environnementale
| Emplacement | Pays | n | LD (ng/m3) | Concentration (ng/m3) | Référence |
|---|---|---|---|---|---|
| Habitations | Canada | 34 | ND rapporté pour les échantillons quand le niveau de blanc était > 35 % du niveau mesuré | ND – 0,050 (o-TCP) | Vykoukalová et al. 2017 |
| Habitations | Canada | 34 | ND rapporté pour les échantillons quand le niveau de blanc était > 35 % du niveau mesuré | ND-0,023 (p-TCP) | Vykoukalová et al. 2017 |
| Habitations (chambres) | Canada | 51 | 0,00034 | 0,00102 – 0,244 | Yang et al. 2018 |
| Habitations (pièce la plus utilisée) | Canada | 26 | 0,00034 | ND | Yang et al. 2018 |
| Habitations | États-Unis | 30 | ND rapporté pour les échantillons quand le niveau de blanc était > 35 % du niveau mesuré | ND-0,142 (o-TCP) | Vykoukalová et al. 2017 |
| Habitations | États-Unis | 30 | ND rapporté pour les échantillons quand le niveau de blanc était > 35 % du niveau mesuré | ND-0,256 (p-TCP) | Vykoukalová et al. 2017 |
| Magasins d'électronique | Suisse | 5 | 0,41 | ND à 0,21 | Hartmann et al. 2004 |
| Magasins de meubles | Suisse | 2 | 0,41 | ND | Hartmann et al. 2004 |
| Bureaux | Suisse | 4 | 0,41 | ND à 0,37 | Hartmann et al. 2004 |
| Théâtre | Suisse | 1 | 0,41 | 2,1 | Hartmann et al. 2004 |
| Maisons | Suède | 50 | 1 | < LD | Staaf et Östman 2005 |
| Divers milieux intérieurs (p. ex., magasin de bicyclettes, magasin de tapis, magasin de vêtements, installations de soins de santé, boulangerie, magasin de tapis) | Suède | 50 | 1 | < LD | Staaf et Östman 2005 |
| Voiture | Suède | 5 | 1 | < LD | Staaf et Östman 2005 |
| Autobus | Suède | 10 | 1 | < LD | Staaf et Östman 2005 |
| Voiture de métro | Suède | 5 | 1 | < LD | Staaf et Östman 2005 |
| Garage pour voitures | Suède | 5 | 1 | < LD | Staaf et Östman 2005 |
| Garage pour autobus | Suède | 5 | 1 | < LD | Staaf et Östman 2005 |
| Garage pour voitures de métro | Suède | 5 | 1 | < LD | Staaf et Östman 2005 |
| Aéronefs | - | - | 4,5 | Vol A : 108 Vol B : 36 | Van Nette 2009 |
Abréviations : ND = non détecté; LD = limite de détection
| Emplacement | Type d'échantillon | Année d'échan-tillonnage | n | Médiane (gamme) (ng/g) | Référence |
|---|---|---|---|---|---|
| Divers emplacements, Canada | Aspirateur | 2007-2008 | 818 | 4860 (< 30 à 295 0000) | Kubwabo et al. 2004 |
| Divers emplacements, Canada | Aspirateur — poussière fraîchea | 2007-2010 | 134 | 2600 (80 à 62 000) | Fan et al. 2010 |
| Divers emplacements, Canada | Aspirateur — poussière domestiqueb | 2007-2010 | 134 | 990 (50 à 75 000) | Fan et al. 2010 |
| Toronto, Canada | Aspirateur, planchers | 2013 | 35 | 0,712 (ND–7,02) (o-TCP) | Vykoukalová et al. 2017 |
| Toronto, Canada | Aspirateur, planchers | 2013 | 35 | 6,18 (0,871–116) (p-TCP) | Vykoukalová et al. 2017 |
| Toronto et Ottawa, Canada | Habitations (chambres) | 2015 | 51 | 23,2 (moyenne) (0,75–1120) | Yang et al. 2018 |
| Toronto et Ottawa, Canada | Habitations (pièce la plus utilisée) | 2015 | 26 | 28,8 (moyenne) (0,75–699) | Yang et al. 2018 |
| Californie, États-Unis | Surfaces des aires de vie | 2006 | 16 | 1000 (330 à 400) | Dodson et al. 2012 |
| Californie, États-Unis | Surfaces des aires de vie | 2011 | 16 | 680 (180 à 10 000) | Dodson et al. 2012 |
| NP, Allemagne | Aspirateur | NS | 65 | 2200 (NP à 36 000) | Kersten et Reich 2003c |
| Zone urbaine, Allemagne | Tapis et planchers | 2010-2011 | 10 | 94 (moyenne) (< 40 à 240) | Brommer et al. 2012 |
| Iasi, Roumanie | Tapis | 2010 | 47 | 500 (< 50 à 5500) | Dirtu et al. 2012 |
| Zone urbaine, Belgique | Tapis et planchers | 2008 | 33 | 240 | Van den Eede et al. 2011 |
| NP, Belgique | Aspirateur | 2006-2010 | 6 | 106 (29 à 1110) | Van den Eede et al., 2012d |
| NP, Espagne | Aspirateur | 2006 | 1 | 89 (seule valeur) | Van den Eede et al. 2012d |
| NP, Roumanie | Aspirateur | 2007 | 3 | 430 (86 à 2350) | Van den Eede et al., 2012d |
| Divers emplacements, Nouvelle-Zélande | Tapis et planchers | 2008 | 34 | 120 (< 50 à 3760) | Ali et al. 2012 |
| Divers emplacements, Nouvelle-Zélande | Matelas | 2008 | 16 | 157 (< 50 à 2155) | Ali et al. 2012 |
| Malate, Philippines | Aspirateur | 2008 | 17 | 18 (< 0,27 à 25) | Kim et al. 2013 |
| Payatas, Philippines | Aspirateur | 2008 | 20 | 7,7 (< 0,27 à 140) | Kim et al. 2013 |
Abréviations : NP = non précisé; LD = limite de détection
a La poussière fraîche fait référence à des échantillons pre=élevés pas des techniciens formés dans des sones de vie au moyen d’un échantillonneur sous vide. Ceci exclut la poussière domestique ancienne qui s’est déposée au cours du temps dans des zones qui n’étaient nettoyées sur une base régulière.
b La poussière domestique fait référence à des échantillons prélevés au moyen de systèmes à vide utilisés par les participants à l’étude.
c Cité dans Wensing et al. 2005.
b. Seules des données brutes disponibles. Valeurs calculées.
| Emplacement | Type d'échantillon | Année d'échan-tillonnage | Taille d'échantillon | Moyenne [gamme] (ng/L) | Référence |
|---|---|---|---|---|---|
| Toronto (Ontario), Canada | Eau potable | 2000 | 10 | [ND] | Ville de Toronto 2000 |
| m-TCP : [ND] | |||||
| p-TCP : [ND] | |||||
| Toronto (Ontario), Canada | Eau potable | 2001 | 19 | : [ND] | Ville de Toronto 2001 |
| m-TCP : [ND] | |||||
| p-TCP : [ND] | |||||
| Toronto (Ontario), Canada | Eau potable | 2002 | 19 | : [ND] | Ville de Toronto 2002 |
| m-TCP : [ND] | |||||
| p-TCP : [ND] | |||||
| Toronto (Ontario), Canada | Eau potable | 2003 | 14 | : [ND] | Ville de Toronto 2003 |
| m-TCP : [ND] | |||||
| p-TCP : [ND] | |||||
| UTEP en Ontario, Canada | Eau potable | 1978 | 12 | [ND à 0,3] | Lebel et al. 1981 |
| Divers emplacements, Canada | Eau potable | 1979 | 60 | [ND à 4,3] | Williams et Lebel 1981 |
| Divers emplacements, Canada | Eau potable | 1980 | 12 | [0,4 à 1,8] | Williams et al. 1980 |
| Rome, Italie | Eau potable | 2006 | 6 | [ND] | Bacaloni et al. 2007 |
Abréviation : ND, non décelé
| Type d'aliment | Emplacement | Pays | Année d'échan-tillonnage | n | Concentration (ng/g) | Référence |
|---|---|---|---|---|---|---|
| Tous les autres types d'aliments | Divers emplacements | États-Unis | 1991-2002 | > 15 000 | ND | [FDA (2006)] |
| Pain | Divers emplacements | États-Unis | 2003 | 44 | 2,05 (moyenne) (ND à 90) DF= 2 % | [FDA (2013c)] |
| Tous les autres types d'aliments | Divers emplacements | États-Unis | de 2004 à 2005 | - |
ND | [FDA (2013b)] |
| Type d'aliment | Emplacement | Année d'échan-tillonnage | n | Concentration (gamme) (ng/g lipides) | Concentration (fourchette) (ng/g poids humide) | Référence |
|---|---|---|---|---|---|---|
| Esturgeon | Fleuve Columbia, États-Unis | NR | NR | 40 | - | Lombardo et Egry 1979 |
| NS | près du lieu de production de PTA, aux États‑Unis | NS | NS | (2-5) | - | Muir 1984 |
| Hareng (marin) | Mer Baltique, Suède | 2007 | 4 (72 P) | < 0,4 | < 0,010 | Sundkvist et al., 2010 |
| Perche (eau de mer) | Holmon et Kvadofjarden, Suède | 2007 | 2 (10 P) | 22 (20-23) | 0,095 (0,082-0,1) | Sundkvist et al. 2010 |
| Moules (eau de mer) | Suède | 2007 | 30 | 110 | 1,32 | Sundkvist et al. 2010 |
| Moules (eau de mer) | Suède | 2007 | 11 | 11 | 0,13 | Sundkvist et al. 2010 |
| Lotte (eau de mer) | Fjallbacka, Suède | 2007 | 5 | 19 | 0,11 | Sundkvist et al. 2010 |
| Saumon (eau de mer) | Baie de Botnie, Suède | 2005 | 5 | 1,8 | 0,16 | Sundkvist et al. 2010 |
| Perche (eau douce) | Emplacements de niveau de fond, Suède | 2007 | 7 (60 combinés) | 18 (< 2,1 à 43) | 0,07 (0,01-0,13) | Sundkvist et al. 2010 |
| Perche (eau douce) | Près de sources, Suède | 2007 | 3 (27 P) | 24 (22-137) | 0,10 (0,10-0,20) | Sundkvist et al. 2010 |
| NS | Divers emplacements, Japon | 1993 | 75 | (63-82) | NR | Ministère de l'Environnement du Japon 2003 |
| NS | Divers emplacements, Japon | 1978 | 93 | ND | NR | Ministère de l'Environnement du Japon 2003 |
| NS | Divers emplacements, Japon | 1975 | 96 | ND | NR | Ministère de l'Environnement du Japon 2003 |
| Poissons, mollusques et crustacés | Mer intérieure de Seto, Japon | 1980 | 41 | (1-19) | NR | Kenmotsu et al. 1981 |
Abréviations : n = taille de l’échantillonnage; ND = non détecté; NR = non rapporté
| Type d'aliment | Emplacement | Année d’échan-tillonnage | n | Concentration (gamme) (ng/g lipides) | Concentration (gamme) (ng/g poids humide) | Référence |
|---|---|---|---|---|---|---|
| Lait maternel | Uppsala | 1997 | 69 (C) | 3,7 | 0,126 | Sundkvist et al. 2010 |
| Lait maternel | Uppsala | 1998 | 90 (C) | 3,0 | 0,102 | Sundkvist et al. 2010 |
| Lait maternel | Uppsala | 2006 | 50 (C) | < 0,1 | < 0,003 | Sundkvist et al. 2010 |
| Lait maternel | Lycksele | 2003 | 39 (C) | < 0,2 | < 0,008 | Sundkvist et al. 2010 |
| Lait maternel | Lund | 2003 | 37 (C) | < 0,2 | < 0,008 | Sundkvist et al. 2010 |
| Lait maternel | Umeå | 2007 | 1 | 1,7 | 0,019 | Sundkvist et al. 2010 |
Abréviations : n = taille de l’échantillonnage; C = combiné
Annexe F. Estimations d'exposition au TCP due aux articles manufacturés
En se basant sur les renseignements disponibles, des absorptions par voie dermique ont été estimées pour le contact direct des jeunes enfants et des adultes avec le rembourrage de meubles avec enduction d'envers contenant du TCP (tableau F-1). Les estimations d'exposition présentées ci-dessous sont considérées être la limite supérieure basée sur des hypothèses prudentes. À remarquer que ces produits sont inclus en fonction de l'hypothèse de leur utilisation au Canada étant donné que de telles utilisations n'ont été identifiées recensées que dans des sources de renseignements américaines ou internationales.
Absorption = (SC × FCP × M × DE) / PC
| Symbole | Description | Valeur |
|---|---|---|
| SCa | Surface de contact avec la peau | 357 cm2 (tout-petit) 1 395 cm2 (adulte) |
| FCPb | Facteur de contact avec la peau | 1 |
| Mc | Vitesse de migration | 2,17 x 10-4 mg/cm2/h (PTCE) 5,6 × 10-5 mg/cm2/h (PTDCP) |
| DEd | Durée de l'exposition | 1 h (tout-petit) 6 h (adulte) |
| PCe | Poids corporel | 15,5 kg (tout-petit) 70,9 kg (adulte) |
| Absorption | Estimation de l'absorption | 1,3 × 10-3 – 5,0 × 10-3 mg/kg pc/j (tout-petit) 6,6 × 10-3 – 2,6 × 10-2 mg/kg pc/j (adulte) |
a Pour ce scénario, il est présumé qu'une personne porte un short et un t-shirt. La surface d’exposition est basée sur l'exposition d’une partie de la moitié inférieure des membres (bras et jambes). La superficie des membres (Santé Canada 1995) a été multipliée par un demi afin de tenir compte de la couverture par les vêtements, puis multipliée par un tiers pour tenir compte de la forme triangulaire des membres, quand un seul côté est directement en contact avec le meuble remborré (CPSC 2006b).
b Aucun facteur de contact avec la peau spécifique au TCP, c.-à-d. la fraction de la substance présente sur une surface adhérant à la peau, n’a été ideintifié dans la littérature. Par conséquent, une valeur de 1 a été retenue afin d’assumer que tout le composé chimique en contact avec la peau est disponible pour l’absorption.
c Aucune vitesse de migration spécifique au TCP n’a été identifiée dans la littérature. Par conséquent, une gamme de vitesses migration basées sur celles d'autres produits ignifuges organophosphatés a été retenue. Le vitesse de migration de 2,17 x 10-4 mg/cm2/h pour le PTCE pour des textiles pour meubles est tirée d’une étude non publiée de Bruckert et al. (1990) mentionnée dans le document UE RAR sur le PTCE (2009). La vitesse de migration de 5,6 × 10-5 mg/cm2/h pour le PTDCP a été utilisé pour estimer les expositions dermiques, en se basant sur des études de migration portant sur la mousse traitée pour meubles menées par la CPSC des États-Unis (CPSC 2005). La CPSC a construit une maquette de chaise miniature comprenant un bloc de mousse recouvert d’un tissu en coton, attaché à du contreplaqué. La chaise miniature a été humidifiée à l'aide d'une solution saline imitant la sueur, et une pression a été appliquée pour imiter l'action de s'asseoir. La vitesse de migration de 5,6 × 10-5 mg/cm2/h pour le PTDCP a été déterminé en se basant sur la quantité maximale rapportée (8 µg) extraite quotidiennement du filtre (diamètre de 5,5 cm) pendant la période du test de migration (6 heures) (CPSC 2005).
d La durée d'exposition en position assise a été ajustée par rapport aux durées rapportées dans le document de la CPSC (2006) pour une position assise en toute tranquillité.
e Santé Canada (1998).
Annexe G. TCP dans des huiles à moteur, des lubrifiants et des fluides
| Produit | TCP total | o-TCP | m-TCP | p-TCP | Référence | Remarques |
|---|---|---|---|---|---|---|
| Fluide de servodirection | 0,2 % | NR | NR | NR | Environnement Canada 2013 | NA |
| Huile pour moteur d’automobile | NR | 2,2-2,9 mg/g | 1,9-2,3 mg/g | ND | Takimoto et al. 1999 | Mesuré au Japon |
| Huile pour moteur de motocyclette | NR | 1,7-7,3 mg/g | 1,5-6,8 mg/g | ND | Takimoto et al. 1999 | Mesuré au Japon |
| Huile pour turbine d'avion | NR | 13-150 mg/L | NR | NR | De Nola et al. 2008 | NA |
| Huile pour turbine d'avion | 2-3 % | NR | NR | NR | De Nola et al. 2008 | De la FS du produit |
| Huile pour turbine d'avion | NR | < 50 mg/kg | NR | NR | De Nola et al. 2008 | NA |
| Huile pour turbine d'avion | NR | < limite de dosage | ~ 2,5 % | NR | De Nola et al. 2011 | NA |
| Huile pour turbine d'avion | NR | 20-40 μg/L | NR | NR | De Nola et al. 2011 | produit après 2001 |
| Huile pour turbine d'avion | 1-5 % | NR | NR | NR | Solbu et al. 2007 | Tiré de la FS |
| Huile pour turbine d'avion | 32 mg/g | NR | NR | NR | Solbu et al. 2010 | Huile neuve |
| Huile pour turbine d'avion | 21,8 mg/g | NR | NR | NR | Solbu et al. 2010 | Huile de 10 ans |
| Huile pour turbine d'avion | 3 % | NR | NR | NR | van Netten 2008 | NA |
| Huile pour turbine d'avion | 3 % | NR | NR | NR | Winder et Balouet 2002, Michaelis 2002 | Quantité dans l'huile Mobil Jet Oil II |
| Fluide hydraulique | NR | 0,5 % en poids | NR | NR | ATSDR 1997 | NA |
| Huile lubrifiante | NR | 2 % | 42 % | 31 % | OMS 1990 | Mesuré en 1975 |
| Lubrifiant de réfrigération | NR | 1-2 % | NR | NR | HPD 2011 | Frigorigène pour climatisation automobile |
Abréviations : NR = non rapporté; ND = non détecté; NA = non applicable
Exposition aux huiles par voie dermique
Un contact cutané direct avec des huiles peut conduire à une exposition par voie dermique au TCP utilisé dans diverses huiles et autres fluides. Parmi toutes les utilisations potentielles de TCP dans des huiles et d'autres fluides, le produit retenu était un fluide de servodirection, en raison de la confirmation de son utilisation au Canada (Environnement Canada 2013). L'événement d'exposition d'un adulte qui remplit le réservoir de fluide de servodirection d'un véhicule ne devrait pas se produire souvent (probablement de 2 à 4 fois par année) et, par conséquent, il a été estimé sur une base par événement et sur une base aigüe ou à court terme. L’estimation d'exposition présentée ci-dessous est basée sur des hypothèses prudentes.
Absorption = (S × EC × MV × FM) / PC
| Symbole | Description | Valeur | Référence |
|---|---|---|---|
| S | Surface de contact avec le bout des doigts (cm2) | 6 | Couche mince selon le manuel de de Versar, scénario de l'application instantanée (Westat 1987) |
| EC | Épaisseur de la couche d'huile sur la main (cm) | 1,59 × 10-2 | Couche mince selon le manuel de de Versar, scénario de l'application instantanée (Westat 1987) |
| MV | Masse volumique du produit (g/cm3) | 0,88 | Couche mince selon le manuel de de Versar, scénario de l'application instantanée (Westat 1987) |
| FM | Fraction massique de TCP | 0,002 | Environnement Canada (2013‑2014) |
| PC | Poids corporel | 70,9 kg (adulte) | Santé Canada (1998) |
| Absorption | Absorption (µg/kg pc) | 2,4 | - |
Annexe H. Résumé des renseignements sur les effets du TCP sur la santé
Paramètre |
Niveaux minimaux avec effeta/Résultats |
|---|---|
Toxicité aiguë |
Plus faible DL50 par voie orale (souris) = 3900 mg/kg pc (Izmerov 1982 cité dans PISSC 1990) Plus faible CL50 par voie dermique (chat) = 1500 mg/kg (Abou-Donia et al. 1980 cité dans PISSC 1990) Plus faible CL50 par inhalation (rat) > 5,2 mg/L (Stauffer Chemical Co. 1979 cité dans ECB 2001) DMENO par voie orale (rat) = 2000 mg/kg pc, basée sur une inhibition significative de l'activité sérique, érythrocyte et cholinestérasique cérébrale observée chez des rates Sprague Dawley ayant reçu du TCP (un mélange contenant au moins 20 organophosphates, y compris 0,4 %, 19,5 % de m-TCP et 2,4 % de p-TCP), par gavage, à une dose unique de 2000 mg/kg pc (Mobil 1987). [Autres études : FMC Corporation 1975 cité dans IUCLID 2001; Johanssen et al. 1977; Marhold 1972 cité dans PISSC 1990; Stauffer Chemical Co. 1988 cité dans PISSC 1990; EPA 2010. |
Irritation/ sensibilisation |
Résultats négatifs lors du test de Draize sur la peau (ligne directrice de l'EPA) : du TCP (100 %) a été appliqué sur le côté gauche intact abrasé du dos et sur le côté droit abrasé de six lapins albinos. Les sites d'application ont été recouverts d'une gaze chirurgicale pendant 24 heures, après quoi la gaze a été enlevée et la peau a été examinée pour rechercher des signes d'irritation. Un érythème a été observé sur la peau abrasée d'un animal après 24 heures. L'érythème avait disparu lors de l'observation après 72 heures. Aucun des animaux n'a présenté d'œdème sur les sites abrasés ou non (sites intacts). Par conséquent, le TCP n'a pas provoqué d'irritation de la peau lors de ce test (Food and Drug Research Lab. Inc. 1975a cité dans ECB 2001). Résultats négatifs lors du test oculaire de Draize (ligne directrice de l'EPA) : neuf lapins ont reçu 0,1 mL de TCP non dilué dans l’œil droit. Les yeux de six lapins n'ont pas été nettoyés au cours de la période d'observation, tandis que ceux des trois autres lapins l'ont été, 4 secondes après l'application. Tous les yeux ont été examinés après 24, 48 et 72 heures, puis après 7 jours. Les yeux ont été évalués en suivant la méthode de Draize. Des effets conjonctivaux ont été observés après 24 heures chez deux des six lapins dont les yeux n'avaient pas été nettoyés, mais tout avait disparu après 48 heures. Aucun effet oculaire n'a été observé dans le cas des lapins dont les yeux avaient été nettoyés 4 secondes après l'application. Le laboratoire a rapporté que, en se basant sur ces résultats, le TCP n'est pas un irritant oculaire (Food and Drug Research Lab. Inc. 1975b cité dans EBC 2001). Résultats positifs lors d'une épreuve des ganglions lymphatiques locaux (ligne directrice de l'OCDE) : vingt souris femelles CBA/J Rj ont été réparties en cinq groupes de quatre : trois groupes ont reçu la formulation appropriée de TCP Kronitex à des concentrations de 100 (non dilué), 50 et 25 % (p/v), le groupe témoin négatif a reçu un mélange huile d'olive/acétone (HOA) et le groupe témoin positif a reçu de l'α‑hexylcinnamaldéhyde (HCA) à 25 % dans du HOA. Les solutions du produit testé ont été appliquées sur la surface dorsale des oreilles des animaux de laboratoire (25 μL/oreille), trois jours de suite (jours 1, 2 et 3). Aucun traitement n'a été fait les jours 4, 5 et 6. Le jour 6, la prolifération cellulaire des ganglions lymphatiques locaux a été mesurée par incorporation de méthylthymidine tritiée (3HTdR), et les valeurs obtenues ont été utilisées pour calculer les indices de stimulation (IS). Aucune mortalité, aucune toxicité systémique ni aucune irritation n’a été observée pendant l'étude. Aucun effet lié au traitement n’a été observé sur le poids corporel des animaux des groupes traités. Les indices de stimulation de l'article testé étaient respectivement de 3,7, 3,4 et 5,7 aux concentrations de traitement de 100 (non dilué), 50 % et 25 % (p/v). De l'α-hexylcinnamaldéhyde (25 % (p/v) dissout dans HOA a servi de témoin positif pour démontrer la performance appropriée de l'épreuve. Une réponse lymphoproliférative significative (indice de stimulation de 17,2) a été constatée dans le cas de la substance chimique témoin positive, et ce résultat a confirmé la validité de l'épreuve. En conclusion, dans les conditions de la présente épreuve, le Kronitex TCP testé dans un vecteur approprié a présenté un potentiel de sensibilisation (sensibilisant) dans le cadre de l'épreuve des ganglions lymphatiques locaux (LAB Research Ltd. 2010). |
Toxicité à court terme |
Plus faible DMENO par voie orale (souris) = 360 mg/kg pc/j, basée sur une force de préhension moindre des pattes arrière observée chez des souris mâles. Des souris B6C3F1 (10 par sexe par dose) ont reçu du TCP (contenant 79 % de phosphate de tri(méthylphényle), dont 21 % de phosphate de tri(3-méthylphényle), 4 % de phosphate de tri(4-méthylphényle, < 0,1 % de phosphate de tri(2-méthylphényle), d'autres phosphates de tri(méthylphényle) non déterminés et 18 % de phosphate de di(méthylphényle, par gavage dans de l'huile de maïs, à raison de 0, 360, 730, 1450, 2900 mg/kg pc/j ou 5800 mg/kg pc/j (pur) pendant 13 ou 14 jours d'une période de 16 jours. Une réduction significative de la force de préhension des pattes arrière a été observée à la dose de 730 mg/kg pc/j chez les mâles et les femelles, à la dose de 1450 mg/kg pc/j chez les mâles et à la dose de 5800 mg/kg pc/j chez les mâles et les femelles. Une réduction significative de la force de préhension des pattes avant a aussi été observée à la dose de 1450 mg/kg pc/j chez les mâles et à la dose de 5800 mg/kg pc/j chez les femelles au 14ème jour de l'étude. Cinq mâles et toutes les femelles ayant reçu 1450 mg/kg pc/j, toutes les souris ayant reçu 2900 mg/kg pc/j et quatre mâles et une femelle ayant reçu 5800 mg/kg pc/j sont morts avant la fin de l'étude. Le poids corporel moyen final des souris mâles ayant reçu 1450 ou 5800 mg/kg pc/j jour était significativement moindre que celui des souris témoins. Le poids corporel moyen final des souris femelles ayant reçu 360, 730 ou 5800 mg/kg pc/j était significativement supérieur à celui des souris témoins. Une nécrose multifocale du ganglion lymphatique mandibulaire, de la rate et du thymus a été observée principalement chez les souris ayant reçu 2900 ou 5800 mg/kg pc/j (NTP 1994). DMENO par voie orale (rat) = 1450 mg/kg pc/j, basée sur une diminution du poids corporel liée à la dose chez des rats F344/N mâles et femelles (10 par sexe par dose) ayant reçu 13 ou 14 doses de TCP (contenant 79 % de phosphate de tri(méthylphényle), dont 21 % de phosphate de tri(3-méthylphényle), 4 % de phosphate de tri(4-méthylphényle, < 0,1 % de phosphate de tri(2-méthylphényle), d'autres phosphates de tri(méthylphényle) non déterminés et 18 % de phosphate de di(méthylphényle)), par gavage à raison de 0, 360, 730, 1450, 2900 ou 5800 mg/kg pc/j au cours d'une période de 16 jours. Une femelle ayant reçu 1450 mg/kg pc/j et cinq mâles et huit femelles ayant reçu 2900 mg/kg pc/j sont morts avant la fin de l'étude. Le poids corporel moyen final des rats ayant reçu des doses de 1450 mg/kg pc/j et plus était nettement moindre que celui des témoins. Une nécrose multifocale du ganglion lymphatique mandibulaire, de la rate et du thymus a été observée principalement chez les mâles et les femelles ayant reçu 2900 et 5800 mg/kg pc/j. Une aspermatogenèse diffuse a été observée chez les mâles ayant reçu 2900 et 5800 mg/kg pc/j. Une réduction significative de la force de préhension des pattes avant a été observée chez les femelles ayant reçu des doses de 1450 mg/kg pc/j et plus et chez les mâles ayant reçu des doses de 2900 et 5800 mg/kg pc/j. Une réduction significative de la force de préhension des pattes arrière a été observée chez les mâles ayant reçu des doses de 2900 et 5800 mg/kg pc/j et chez les femelles ayant reçu des doses de 5800 mg/kg pc/j (NTP 1994). Plus faible DMENO par voie dermique (rat) = 500 mg/kg pc/j, basée sur une cholinestérase sérique réduite observée chez les rates Sprague‑Dawley (5/dose) ayant reçu du TCP (3 % dans de l'huile de moteur d'avion à réaction) par application sur la peau rasée à raison de 0, 500 ou 1000 mg/kg pc/j, pour un total de 20 expositions pendant quatre semaines. Des signes cliniques d'hypersensibilité, notamment une activité motrice accrue, ont été observés à la dose de 1000 mg/kg pc/j. La cholinestérase sérique était significativement (p < 0,05) réduite chez tous les rats exposés (Mobil 1990a). [Autres études : Foster D. Snell Inc. 1976 cité dans ECB 2001, Oishi et al. 1982, Chapin et al. 1988, Kinkead et al. 1990, 1993, Banerjee et al. 1992, Freudenthal et al. 1993, NTP 1994, Mackerer et al. 1999]. Aucune étude sur l'exposition par inhalation n'a été identifiée. |
Toxicité subchronique |
Plus faible DMENO par voie orale (rat) = 50 mg/kg pc/j, basée sur une vacuolisation cytoplasmique du cortex surrénal observée chez des rats F344/N (10 par sexe par dose) ayant reçu du TCP dans une préparation de mélanges d'isomères (contenant 79 % de phosphate de tri(méthylphényle), dont 21 % de phosphate de tri(3-méthylphényle), 4 % de phosphate de tri(4-méthylphényle, < 0,1 % de phosphate de tri(2-méthylphényle), d'autres phosphates de tri(méthylphényle) non déterminés et 18 % de phosphate de di(méthylphényle)), par gavage à raison de 0, 50, 100, 200, 400 ou 800 mg/kg pc/j dans de l'huile de maïs, 5 jours par semaine pendant 13 semaines. Aucune mortalité n’a été observée. Le poids corporel moyen final des mâles ayant reçu des doses de 200 mg/kg pc/j et plus était significativement moindre que celui des témoins. Une vacuolisation cytoplasmique du cortex surrénal a été observée chez les deux sexes dans tous les groupes, la gravité augmentant avec la dose. Une hypertrophie des cellules interstitielles de l'ovaire a été observée chez toutes les femelles traitées. Une atrophie des tubules séminifères a ét observée chez les mâles ayant reçu des doses de 400 mg/kg pc/j et plus. Il n'y a eu aucune modification biologique significative des paramètres neurocomportementaux (NTP 1994). Plus faible DMENO par voie orale (souris) = 50 mg/kg pc/j, basée sur une vacuolisation cytoplasmique du cortex surrénal observée chez des souris B6C3F1 (10 par sexe par dose) ayant reçu du TCP dans une préparation de mélange d'isomères (contenant 79 % de phosphate de tri(méthylphényle), dont 21 % de phosphate de tri(3-méthylphényle), 4 % de phosphate de tri(4-méthylphényle, < 0,1 % de phosphate de tri(2-méthylphényle), d'autres phosphates de tri(méthylphényle) non déterminés et 18 % de phosphate de di(méthylphényle)), par gavage à raison de 0, 50, 100, 200, 400 ou 800 mg/kg pc/j jour dans de l'huile de maïs, 5 jours par semaine pendant 13 semaines. Aucune mortalité n’a été observée. Le poids corporel moyen final des rats mâles était significativement moindre aux doses de 200 mg/kg pc/j et plus et chez les femelles aux doses de 400 mg/kg pc/j et plus. Une vacuolisation cytoplasmique du cortex surrénal liée à la dose a été observée chez les deux sexes dans tous les groupes. Une hypertrophie des cellules interstitielles de l'ovaire a été observée chez toutes les femelles traitées. Chez les deux sexes, une dégénérescence multifocale de la moelle épinière a été observée aux doses de 100 mg/kg pc/j et plus et une dégénérescence multifocale du nerf sciatique a été observée à la dose de 200 mg/kg pc/j chez les mâles et à la dose de 100 mg/kg pc/j chez les femelles. Une réduction significative de la force de préhension des pattes avant a été obserée chez les mâles ayant reçu une dose de 200 mg/kg pc/j ou plus ainsi que chez les femelles ayant reçu une dose de 400 mg/kg pc/j. Une diminution significative de la force de préhension des pattes arrière a été observée aux doses de 200 mg/kg pc/j et plus chez les deux sexes (NTP 1994). Autres études : DMENO par voie orale (rat) = 55 ou 65 mg/kg pc/j (mâles ou femelles respectivement), basée sur une vacuolisation cytoplasmique du cortex surrénal observée chez les mâles et sur une hyperplasie des cellules interstitielles de l'ovaire observée chez les femelles. Des rats 344/N (10 par sexe par dose) ont reçu du TCP ((contenant 79 % de phosphate de tri(méthylphényle), dont 21 % de phosphate de tri(3-méthylphényle), 4 % de phosphate de tri(4-méthylphényle, < 0,1 % de phosphate de tri(2-méthylphényle), d'autres phosphates de tri(méthylphényle) non déterminés et 18 % de phosphate de di(méthylphényle)) dans leur alimentation à raison de 0, 900, 1700, 3300, 6600 ou 13 000 ppm (environ 0, 55, 120, 220, 430 ou 750 mg/kg pc/jr pour les mâles et 0, 65, 120, 230, 430 ou 770 mg/kg pc/j pour les femelles), 7 jours par semaine pendant 13 semaines. Aucune mortalité n’a été observée. Le poids corporel moyen final des rats mâles était nettement moindre aux doses de 430 mg/kg pc/j et plus, et celui des femelles aux doses de 230 mg/kg pc/j et plus. Il n'y a eu aucune modification biologique significative des paramètres neurocomportementaux. Une vacuolisation cytoplasmique du cortex surrénal a été observée chez tous les groupes exposés. Une hypertrophie des cellules interstitielles de l'ovaire et une inflammation de l'interstitium de l'ovaire ont été observées chez toutes femelles exposées. Une nécrose papillaire rénale et un œdème papillaire rénal ont été observée à la dose de 750 mg/kg pc/j chez les mâles et de 430 mg/kg pc/j ou plus chez les femelles. Une hypertrophie basophile du lobe antérieur de la glande pituitaire et une atrophie des tubules séminifères ont été observées aux doses de 430 mg/kg pc/j et plus chez les mâles (NTP 1994). |
Autres études sur la toxicité sub-chronique |
DMENO par voie orale (souris) = 65 ou 110 mg/kg pc/j (mâles ou femelles respectivement) en fonction d'une vacuolisation cytoplasmique du cortex surrénal observée chez des souris B6C3F1 ayant reçu du TCP (contenant 79 % de phosphate de tri(méthylphényle), dont 21 % de phosphate de tri(3-méthylphényle), 4 % de phosphate de tri(4-méthylphényle, < 0,1 % de phosphate de tri(2-méthylphényle), d'autres phosphates de tri(méthylphényle) non déterminés et 18 % de phosphate de di(méthylphényle)) dans leur alimentation à raison de 0, 250, 500, 1000, 2100 ou 4200 ppm (environ 45, 110, 180, 380 ou 900 mg/kg pc/j pour les mâles et 65, 130, 230, 530 ou 1050 mg/kg pc/j pour les femelles), 7 jours par semaine pendant 13 semaines. Aucune mortalité n'est survenue. Le poids corporel moyen avait diminué (importance non rapportée) à la dose de 900 mg/kg pc/j chez les mâles et aux doses de 530 mg/kg pc/j et plus chez les femelles. Une vacuolisation cytoplasmique du cortex surrénal a été observée chez tous les groupes exposés, sauf les mâles ayant reçu 45 mg/kg pc/j. Une hyperplasie papillaire des muqueuses de la vésicule biliaire a été observée chez les mâles ayant reçu des doses de 110 mg/kg pc/j et plus et chez les femelles ayant reçu des doses de 230 mg/kg pc/j et plus. Une dégénérescence du tubule rénal a été observée chez tous les mâles ayant reçu la dose de 900 mg/kg pc/j. Une dégénérescence axonale a été observée chez les mâles ayant reçu des doses de 380 mg/kg pc/j et plus et chez les femelles ayant reçu des doses de 230 mg/kg pc/j et plus. Des diminutions significatives de la force de préhension des pattes avant ont été observées chez les mâles et les femelles ayant reçu respectivement des doses de 380 et 530 mg/kg pc/j (p ≤ 0,05) et chez les mâles et les femelles ayant reçu respectivement des doses de 900 et 1050 mg/kg pc/j (p ≤ 0,01). Une réduction significative de la force de préhension des pattes arrière a été observée à la dose de 900 mg/kg pc/j chez les mâles et aux doses de 530 mg/kg pc/j et plus chez les femelles (p ≤ 0,01). Une DSENO de 45 mg/kg pc/j a été retenue pour les mâles (NTP 1994). DMENO par voie orale (rat) = 1000 mg/kg pc/j, basée sur une hypertrophie du cortex surrénal observée chez des rats Sprague-Dawley (5 par sexe par dose) ayant reçu du TCP dans une solution de gomme arabique à 5 % par gavage, à raison de 30, 100, 300 ou 1000 mg/kg pc/j 6 jours par semaine pendant 3 mois. Le groupe témoin a reçu une solution de gomme arabique à 5 %. Une salivation excessive a été observée à toutes les doses immédiatement après le gavage. Tous les groupes traités ont présenté une légère augmentation du poids du foie. Les autres observations à 1000 mg/kg pc/j comprenaient une diminution significative du gain de poids corporel et une légère diminution du poids de la rate, du cœur et des poumons chez les mâles, et une augmentation du poids de la glande surrénale chez les femelles (Sumitomo Chemical Company 1974 cité dans EBC 2001). [Autres études : Saito et al. 1974, Haggerty et al. 1986 (résumé seulement), Irwin et al. 1987 (résumé seulement), Freeman et al. 1988 (résumé seulement), Daughtrey et al. 1996, tous cités dans PISSC 1990. Aucune étude d'exposition par inhalation et par voie cutanée n'a été observée. |
Toxicité chronique/ cancérogénicité |
Cancérogénicité par voie orale chez les rats : des rats Fischer 344/N (95 par sexe par dose) ont reçu du TCP (contenant 79 % de phosphate de tri(méthylphényle), dont 21 % de phosphate de tri(3-méthylphényle), 4 % de phosphate de tri(4-méthylphényle, < 0,1 % de phosphate de tri(2-méthylphényle), d'autres phosphates de tri(méthylphényle) non déterminés et 18 % de phosphate de di(méthylphényle)) dans leur alimentation à raison de 0, 75, 150 ou 300 ppm (environ 0, 3, 6 ou 13 mg/kg pc/j pour les mâles et 0, 4, 7 ou 15 mg/kg pc/j pour les femelles) pendant 2 ans. Un autre groupe de rats a reçu 600 ppm de TCP dans son alimentation pendant 22 semaines, puis a reçu l'alimentation témoin. Les rats ont été examinés à 3, 9 et 15 mois, puis à deux ans pendant l'étude. Aucune activité cancérogène du TCP n’a été mise en évidence chez les rats mâles et femelles exposés (NTP 1994). Cancérogénicité par voie orale chez les souris : des souris B6C3F1 (95 par sexe par dose) ont reçu du TCP (contenant 79 % de phosphate de tri(méthylphényle), dont 21 % de phosphate de tri(3-méthylphényle), 4 % de phosphate de tri(4-méthylphényle, < 0,1 % de phosphate de tri(2-méthylphényle), d'autres phosphates de tri(méthylphényle) non déterminés et 18 % de phosphate de di(méthylphényle)) dans leur alimentation, à raison de 0, 60, 125 ou 250 ppm (environ 0, 7, 13 ou 27 mg/kg pc/j pour les mâles et 0, 8, 18 ou 37 mg/kg pc/j pour les femelles) pendant 2 ans. Les souris ont été examinées à 3, 9 et 15 mois, puis à deux ans pendant l'étude. Aucune activité cancérogène du TCP n’a été mise en évidence chez les souris mâles et femelles exposées (NTP 1994). Effet non néoplasique Plus faible DMENO par voie orale (rat) = 7 ou 26 mg/kg pc/j (femelles ou mâles respectivement), basée sur une vacuolisation cytoplasmique du cortex surrénal observée chez les rates. Des rats Fischer 344/N (95 par sexe par dose) ont reçu du TCP (contenant 79 % de phosphate de tri(méthylphényle), dont 21 % de phosphate de tri(3-méthylphényle), 4 % de phosphate de tri(4-méthylphényle, < 0,1 % de phosphate de tri(2-méthylphényle), d'autres phosphates de tri(méthylphényle) non déterminés et 18 % de phosphate de di(méthylphényle)) dans leur alimentation, à raison de 0, 75, 150 ou 300 ppm (environ 0, 3, 6 ou 13 mg/kg pc/j pour les mâles et 0, 4, 7 ou 15 mg/kg p/j pour les femelles) pendant 2 ans. Un autre groupe de rats (95 par sexe par dose) a reçu une alimentation contenant 600 ppm de TCP pendant 22 semaines, puis a reçu l'alimentation témoin (environ 26 mg/kg pc/j pour les mâles et 30 mg/kg pc/j pour les femelles). À 3, 9 et 15 mois d'exposition, jusqu'à 15 rats/sexe/dose ont subi une autopsie et des lésions histopathologiques ont été recherchées. Aucune mortalité n'est survenue. Aucun effet sur le poids corporel moyen final n’a été observé. Une vacuolisation cytoplasmique du cortex surrénal a été observée chez les mâles ayant reçu 26 mg/kg pc/j et chez les femelles ayant reçu 7 mg/kg pc/j et plus à 3 mois. À 9 et 15 mois, une vacuolisation cytoplasmique a été observée principalement chez les femelles ayant reçu 15 mg/kg pc/j, la fréquence et la gravité augmentant de façon significative à la fin de l'étude. Chez les rates, une hyperplasie des cellules interstitielles de l'ovaire a été observée à la dose de 15 mg/kg pc/j, dont la fréquence et la gravité ont augmenté à la fin de l'étude. Une DSENO de 4 ou 13 mg/kg pc/j a été retenue respectivement pour les femelles ou les mâles (NTP 1994). DMENO par voie orale (souris) = 7 ou 37 mg/kg pc/j (mâles ou femelles respectivement), basée sur une pigmentation céroïde du cortex surrénal observée chez les souris mâles. Des souris B6C3F1 (95 par sexe par dose) ont reçu du TCP (21 % de m-TCP, 4 % de p-TCP, < 0,1 % d'autres phosphates de tri(méthylphényle) non identifiés) dans leur alimentation, à raison de 0, 60, 125 ou 250 ppm (environ 0, 7, 13 ou 27 mg/kg pc/j chez les mâles et 0, 8, 18 ou 37 mg/kg pc/j chez les femelles) pendant deux ans. Les souris ont été examinées à 3, 9 et 15 mois, puis à deux ans pendant l'étude. À 3, 9 et 15 mois d'exposition, jusqu'à 15 souris/sexe/concentration ont subi une autopsie et des lésions histopathologiques ont été recherchées. Le poids corporel, la survie et la consommation de nourriture des groupes exposés étaient semblables à ceux des témoins. Une pigmentation céroïde du cortex surrénal a été observée chez tous les groupes exposés pendant pratiquement toute la durée de l'étude de deux ans, sauf chez les femelles ayant été autopsiées à 3 mois et ayant reçu 8 ou 18 mg/kg pc/j. La gravité était nettement accrue chez les femelles ayant reçu 37 mg/kg pc/j. Une fréquence accrue de foyers cellulaires clairs, un changement des tissus adipeux et une pigmentation céroïde du foie ont été observés chez les mâles ayant reçu une dose de 13 mg/kg p/j ou plus. Une DSENO de 18 mg/kg pc/j par jour a été retenue pour les femelles (NTP 1994). Aucune étude d'exposition par inhalation ou par voie dermique n'a été identifiée. |
Toxicité pour la reproduction
|
Plus faible DMENO par voie orale (souris) = 63 mg/kg pc/j, basée sur une diminution du nombre de portées par paire de souris. Des souris Swiss CD-1 (20 par sexe par dose pour le groupe test, 40 par sexe pour le groupe témoin) ont reçu 0, 0,05, 0,1 ou 0,2 % de TCP (avec moins de 0,1 %) en poids (environ 0, 63, 124, ou 250 mg/kg pc/j) dans leur alimentation, pendant 7 jours avant la reproduction et 98 jours durant la reproduction. Le protocole de l'étude comprenait une phase de reproduction continue de la génération F0, un accouplement croisé afin de déterminer le sexe touché chez les animaux F0 et une évaluation de la fertilité et de la performance de la dernière portée (F1) de la reproduction continue. Une diminution significative liée à la dose (p < 0,01) a été observée dans le nombre de portées par paire. La proportion de petits nés vivants a diminué de façon significative à la dose de 250 mg/kg par jour. Lors de la phase d'accouplement croisé, les mâles témoins ont été accouplés avec les femelles traitées, et les femelles témoins ont été accouplées avec les mâles traités. Une infertilité a été observée chez les mâles et les femelles ayant reçu une dose de 250 mg/kg pc/j, l'effet étant plus grand chez les femelles. Des modifications liées à la dose ont été observées au niveau des glandes surrénales chez les deux sexes, et le poids corporel a diminué chez les mâles et les femelles ayant reçu la dose élevée. Une diminution significative (p < 0,05) de la motilité des spermatozoïdes a été observée à 62,5 et 124 mg/kg pc/j (le groupe ayant reçu la dose de 250 mg/kg pc/j n'a pas été examiné). Une atrophie des tubules séminifères et une diminution du poids des testicules et de l'épididyme ont été observées chez les mâles F0 à la dose de 250 mg/kg pc/j. Des modifications significatives au niveau des glandes surrénales, liées à la dose, ont été observées chez les F0 des deux sexes à la dose de 250 mg/kg pc/j. La dernière portée de la phase reproduction de 98 jours a été élevée jusqu'à l'âge de 74 jours, puis accouplée au sein du groupe témoin et de deux groupes soumis au traitement (0, 0,05 et 0,1 % de TCP, il y avait trop peu de rejetons dans le groupe de 0,2 %). Une diminution de l'indice de fertilité a été observée dans le groupe ayant reçu 0,1 % de TCP, ainsi qu’une diminution de la proportion de naissances vivantes et du nombre de nouveau-nés vivants par portée. Chez les mâles F1 à l'autopsie, la concentration et la morphologie des spermatozoïdes étaient normales à la fin de l'essai, quoique la motilité ait diminué dans les deux groupes de 0,05 % et de 0,1 % comparativement à celle des animaux du groupe témoin. Ces données indiquent que le TCP a provoqué une infertilité chez les souris des deux sexes de la génération F0 et a eu une incidence sur la motilité des spermatozoïdes, même à la dose la plus faible chez les mâles F1 (Chapin et al. 1988). Autres études : DMENO = 100 mg/kg pc/j, basée sur une fœtotoxicité, une morphologie des spermatozoïdes anormale, des changements histopathologiques au niveau des testicules et des épididymes. Du TCP (contenant moins de 9 %) a été administré par gavage dans de l'huile de maïs à des rats Long Evans mâles (12 par dose) à raison de 0, 100 ou 200 mg/kg pc/j, et à des femelles (24 par dose) à raison de 0, 200 ou 400 mg/kg pc/j. Les mâles ont reçu leur dose pendant 56 jours, et les femelles pendant 14 jours avant la reproduction et tout au long de la période de reproduction de 10 jours. Les mâles ayant reçu la dose de 100 mg/kg pc/j ont été accouplés avec les femelles ayant reçu la dose de 200 mg/kg pc/j, et les mâles ayant reçu la dose de 200 mg/kg pc/j ont été accouplés avec les femelles ayant recu la dose de 400 mg/kg pc/j. Une morphologie anormale des spermatozoïdes liée à la dose a été observée à toutes les doses. La concentration, la motilité et la progression des spermatozoïdes ont diminué à la dose de 200 mg/kg pc/j. Une diminution du poids de l'épididyme, une nécrose et une dégénérescence des tubules séminifères, une hypospermie dans l'épididyme et une augmentation dans la dégénérescence et des spermatides immatures ont aussi été observées chez les mâles à la dose de 200 mg/kg pc/j. Chez les femelles, une altération des cellules interstitielles de l'ovaire, une augmentation du nombre de follicules et des corps jaunes ont été observés aux 200 mg/kg pc/j et plus. Le nombre de nouveau-nés vivants était réduit à toutes les doses. Une taille réduite des portées, liée à la dose, a été observée aux doses de 200 mg/kg pc/j et plus (Carlton et al. 1987). [Autres études : Morrissey et al. 1988b cité dans PISSC 1990, Mobil 1991e, 1992b, Imperial Oil 1991, Latendresse et al. 1994a, 1994b. Aucune étude d'exposition par inhalation ou par voie dermique n'a été identifiée. |
Toxicité pour le développement |
Plus faible DMENO par voie orale (rat) = 20 mg/kg pc/j, basée sur une diminution significative du poids corporel moyen du fœtus. Des rates Sprague Dawley ont reçu du TCP (composition inconnue) par gavage, à raison de 0, 20, 100, 400 ou 750 mg/kg pc/j à partir du jour 0 jusqu'au jour 19 de gestation. Les observations cliniques comprenaient une salivation accrue à une dose de 100 mg/kg pc/j ou plus et une alopécie et une apparence négligée à une dose de 400 mg/kg pc/j ou plus. Le poids corporel des fœtus avait diminué (importance non rapportée) comparativement à celui des groupes témoins à toutes les doses. Une ossification incomplète a été observée à la dose de 750 mg/kg pc/j (EPA 2010). [Autres études : Tocco et al., 1987 cité dans PISSC, 1990 et ÉE, 2009; Mele et Jensh, 1977 cité dans PISSC, 1990 et ÉE, 2009] Aucune étude d'exposition par inhalation ou par voie dermique n'a été identifiée. |
Génotoxicité et paramètres connexes : in vivo |
Synthèse d'ADN non programmée Résultats négatifs : chez les rats mâles ayant reçu du TCP par gavage (Mirsalis 1985 cité dans ÉE 2009). |
Génotoxicité et paramètres connexes : in vitro |
Mutagénicité chez des bactéries Résultats négatifs : chez Salmonella typhimurium TA 98, TA100, TA1535, TA1537, TA1538 avec ou sans activation métabolique (Haworth et al. 1983 cité dans NTP 1994 et ÉE 2009, Litto Bionetics Inc. 1979a cité dans ECB 2001 et ÉE 2009). Aberrations chromosomiques Résultats négatifs : dans des cellules ovariennes de hamster chinois (CHO), avec ou sans activation métabolique (NTP 1994). Résultats négatifs : dans une lignée cellulaire de lymphomes murins avec ou sans activation métabolique (Litto Bionetics Inc. 1979b cité dans ECB 2001 et ÉE 2009). Résultats ambigus : dans des cellules de lymphomes murins L5178Y avec ou sans activation métabolique (Litto Bionetics Inc. 1979c cité dans ECB 2001 et ÉE 2009). Résultats positifs : dans la lignée cellulaire BALB/3T3 avec ou sans activation métabolique (Litto Bionetics Inc. 1979d cité dans ECB 2001 et ÉE 2009). Échange de chromatides sœurs Résultats négatifs : dans CHO avec ou sans activation métabolique (NTP 1994 et ÉE 2010). |
1 CL50, concentration létale médiane; DL50, dose létale médiane; CMENO, concentration minimale avec effet nocif observé; DMENO, dose minimale avec effet nocif observé; DMEO, dose minimale avec effet observé.
Études épidémiologiques |
Résultats |
|---|---|
Polyneuropathie |
Plusieurs études sur les humains ont été recensées. Une éclosion de polyneuropathie aiguë a été signlée chez plus de 20 jeunes femmes au Sri Lanka en 1977-1978. La cause de la neuropathie a été attribuée au TCP présent en tant que contaminant dans une huile de cuisson spéciale (huile de sésame). La contamination s'est probablement produite pendant le transport de l'huile dans des contenants utilisés auparavant pour stocker des huiles minérales (Senanayake et Jeyaratnam 1981, cité dans PISSC 1990). En 1944, trois cas de polyneuropathie toxique ont été rapportés chez des travailleurs ayant travaillé de six à huit mois dans une usine de production de TCP en Angleterre. Le degré de pénétration dans la peau et l'exposition par inhalation ont été retenus comme principales causes de l'intoxication professionnelle (Hunter et al. 1944). Une forte prévalence de polyneuropathie chez des travailleurs d'une fabrique de chaussures a été rapportée en Italie depuis 1958. La cause peut être attribuée au TCP (Cavalleri et Cosi 1978). Toutefois, la relation de cause à effet n'a pas été établie Cette polyneuropathie peut dépendre de divers facteurs étiologiques (dont le n-hexane) ou résulter d'une combinaison de ces derniers (Leveque 1983 cité dans PISSC 1990). |
Irritation/ sensibilisation |
Une grave intoxication a été rapportée chez un enfant de 4 ans suite à l'ingestion d'un lubrifiant contenant du TCP (profil de substitution inconnu). Les constatations cliniques étaient les suivantes : vomissements, diarrhée, faiblesse, somnolence, crise cholinergique différée et vélocité nerveuse déprimée. Par contre, un rétablissement complet s'est fait en quatre semaines (Goldstein et al. 1988). Un essai épicutané à applications répétées chez des humains a mis en évidence des signes d'irritation (New York Université 1951 cité dans ÉE 2009). Dans le cadre d'une étude sur 230 patients de l'industrie métallurgique présentant une possible dermatite professionnelle, 2,6 % d'entre eux présentaient des résultats positifs à l'essai épicutané avec du TCP (ÉE 2009). Un cas de dermite de contact allergique induite par un contact avec des pansements adhésifs de la marque Band-Aid contenant du TCP comme ingrédient a été rapporté (Norris et Storrs 1990, cité dans IUCLID 2001, ÉE 2009). Un test de maximalisation effectué par voie cutanée sur des hommes indiquant que le TCP est un sensibilisant modérément fort (Dupont 1992) (indice de stimulation de 17,2) a été constatée dans le cas de la substance chimique témoin positive, et ce résultat a confirmé la validité du test. En conclusion, dans les conditions du présent test, le Kronitex TCP testé avec un vecteur convenable a présenté un potentiel de sensibilisation (sensibilisant) lors du test des ganglions lymphatiques locaux [LAB Research Ltd 2010). |
