4. Effets sur l’habitat du poisson : étude de la communauté d’invertébrés benthiques
- 4.2.1 Première phase et phases subséquentes des ESEE
- 4.2.2 Ampleur et portée géographique
- 4.2.3 Recherche des causes
4.3 Considérations relatives au plan d’étude de la communauté d’invertébrés benthiques
- 4.3.1 Analyse de puissance et taille des échantillons
- 4.3.2 Facteurs de confusion
- 4.3.3 Uniformisation de la terminologie
- 4.3.4 Indication de l’emplacement des stations d’échantillonnage
- 4.3.5 Plans d’échantillonnage recommandés
- 4.3.6 Répartition des zones de référence et des zones exposées selon les phases de l’ESEE
- 4.3.7 Sélection d’habitats pertinents sur le plan écologique
- 4.3.8 Sélection des saisons d’échantillonnage pertinentes sur le plan écologique
4.4 Aspects statistiques pour les plans d’étude
- 4.4.1 Détermination de l’effort d’échantillonnage pour l’ACR
- 4.4.2 Détermination de l’effort d’échantillonnage pour le sous-échantillonnage sur le terrain
- 4.4.3 Utilisation d’ellipses de probabilité pour les plans ACR
4.5 Méthodes de terrain pour le suivi de la communauté d’invertébrés benthiques
- 4.5.1 Maillage des dispositifs d’échantillonnage
- 4.5.2 Équipement d’échantillonnage
- 4.5.3 Substrats artificiels
- 4.5.4 Équipement d’échantillonnage dans les habitats marins et estuariens
- 4.5.5 Récipients à échantillons
- 4.5.6 Fixation et conservation des spécimens
- 4.5.7 Assurance et contrôle de la qualité des travaux de terrain
- 4.6.1 Programme de certification de la NABS
- 4.6.2 Niveau d’identification taxinomique
- 4.6.3 Collections de référence
- 4.6.4 AQ/CQ pour le traitement des échantillons d’invertébrés benthiques en laboratoire
4.7 Évaluation et interprétation des données
4.8 Exigences relatives à la présentation des données
4.9 Critères d’effet et critères d’appui de la communauté d’invertébrés benthiques
- 4.11.1 Application des approches fondées sur le poids de la preuve à la recherche des causes des effets
- 4.11.2 Essais de toxicité létale et sublétale
- 4.11.3 Analyse de carottes de sédiments pour l’étude des tendances historiques
- 4.11.4 Autres paramètres associés aux invertébrés benthiques et autres organismes
Liste des tableaux
- Tableau 4-1 : Plans d’études recommandés pour l’échantillonnage
- Tableau 4-2 : Clés taxinomiques - Invertébrés benthiques dulcicoles
- Tableau 4-3 : Niveaux de résolution taxinomique recommandés pour les invertébrés benthiques marins (approche « niveau taxinomique le plus bas »)
- Tableau 4-4 : Clés taxinomiques – Invertébrés benthiques marins et estuariens du Canada
Liste des figures
- Figure 4-1 : Exemples de l’échelle spatiale d’une zone, d’une station répétée et d’un sous-échantillon de terrain pour un plan d’étude de type contrôle-impact
- Figure 4-2 : Plans d’étude contrôle-impact
- Figure 4-3 : Plans d’étude par gradients
- Figure 4-4 : Approche des conditions de référence
- Figure 4-5 : Niveaux de stress entraînant une perturbation déduits à partir de la position des sites de référence dans un espace d’ordination hybride multidimensionnel
4. Effets sur l’habitat du poisson : étude de la communauté d’invertébrés benthiques
4.1 Aperçu
L’étude de la communauté d’invertébrés benthiques réalisée aux fins des études de suivi des effets sur l’environnement (ESEE) a pour objet de déterminer l’ampleur et la portée géographique de la dégradation de l’habitat attribuable au rejet de l’effluent, et de fournir une évaluation des ressources alimentaires disponibles pour les poissons choisis dans l’étude des poissons (chapitre 3). Toutefois, puisqu’elle ne comprend pas une comparaison directe du régime alimentaire des poissons et des invertébrés benthiques, l’étude de la communauté d’invertébrés benthiques sert principalement à étudier la dégradation de l’habitat. Par conséquent, l’objectif de l’étude de la communauté benthique est de déterminer s’il y a des différences structurales (p. ex., densité totale des invertébrés, nombre de taxons, changements de la structure de dominance des taxons) entre les communautés d’invertébrés situées près du point de rejet final de l’effluent de la mine de métaux et les communautés de référence. Le plan d’étude sera différent selon que la mine de métaux rejette son effluent en eaux douces, estuariennes ou marines (voir la section 4.3). Par ailleurs, le plan d’étude des invertébrés benthiques ne correspond pas nécessairement à celui utilisé pour l’étude des poissons adultes ou l’évaluation de la qualité de l’eau, en raison des différents critères et difficultés inhérents à chaque protocole d’échantillonnage.
Si l’étude sur la communauté des invertébrés benthiques est effectuée dans une zone qui le permet, des échantillons de sédiments sont prélevés et la distribution granulométrique et la teneur en carbone organique total des sédiments de ceux –ci sont déterminées (Règlement sur les effluents des mines de métaux [REMM], annexe 5, sous-alinéa 16a)(iii)). Des échantillons d’eau doivent aussi être prélevés lorsque des études sur les invertébrés benthiques sont réalisées (REMM, annexe 5, sous-alinéa 7a)(ii)). Pour en savoir plus sur l’échantillonnage de l’eau et des sédiments, veuillez consulter les chapitres 5 et 7.
Le présent chapitre a pour objet de fournir des directives sur le plan d’étude et sur l’interprétation des résultats d’une étude de la communauté d’invertébrés benthiques, compte tenu des exigences des ESEE. Plus particulièrement, le présent document aborde 1) les divers plans d’étude; 2) la normalisation des méthodes; 3) les méthodes d’analyse des données appropriées au plan d’étude. Le Règlement sur les effluents des mines de métaux (REMM, annexe 5) établit les exigences et les échéanciers pour les études des communautés d’invertébrés benthiques. Le cadre général du Programme d’ESEE est présenté dans le chapitre 1 du présent guide technique.
Parmi les descripteurs des communautés d’invertébrés benthiques utilisés pour déterminer les effets (critères d’effet), figurent la densité totale des invertébrés benthiques, la richesse des taxons, l’indice de régularité (de Simpson) et l’indice de similarité (de Bray-Curtis) [REMM, annexe 5, sous-alinéa 16a)(iii)]. D’autres descripteurs des communautés (critères d’appui) susceptibles de faciliter l’interprétation des résultats pourraient être mesurés et présentés, mais ne sont pas des critères requis aux fins de la détermination des effets. Parmi ces critères d’appui figurent l’indice de diversité de Simpson, la densité des taxons (familles), la proportion des taxons (familles) et la présence/absence de taxons (familles). Pour en savoir plus sur les critères d’effet et les critères d’appui des communautés d’invertébrés benthiques, veuillez consulter la section 4.9.
4.2 Phases des ESEE
4.2.1 Première phase et phases subséquentes des ESEE
La première phase de l’ESEE doit servir à caractériser les communautés benthiques des principaux habitats susceptibles d’être touchés par l’effluent d’une mine de métaux et à établir les conditions de référence requises aux fins de la comparaison des données obtenues au cours des phases suivantes. Il permet également de faire une évaluation critique de la nécessité de raffiner le plan d’étude des phases ultérieures ou d’ajouter d’autres méthodes de suivi. Nous énumérons ci-après les exigences relatives au plan d’étude à respecter pour atteindre les objectifs de l’étude de la communauté d’invertébrés benthiques s’appliquant aux mines de métaux de la phase 1.
L’étude de la phase 1 vise notamment à définir des zones qui sont relativement homogènes quant à la classe d’habitat et qui présentent une gamme particulière de degrés d’exposition à l’effluent de la mine de métaux.
Le plan d’étude de la première étude de la communauté d’invertébrés benthiques devrait comprendre :
- l’échantillonnage pendant une saison représentative sur le plan écologique;
- l’échantillonnage dans une zone de référence et dans une zone fortement exposée (p. ex., zone la plus proche du point de rejet de l’effluent);
- l’échantillonnage dans des habitats écologiquement représentatifs;
- un des sept plans d’échantillonnage sélectionné selon les caractéristiques des sites (tableau 4-1);
- les variables environnementales propres à chaque site qui seront mesurées;
- l’uniformisation des méthodes de terrain et de laboratoire.
Les phases subséquentes de l’ESEE servent à confirmer les résultats des phases précédentes, à raffiner au besoin les méthodes de suivi et à déterminer les facteurs responsables des effets détectés.
4.2.2 Ampleur et portée géographique
Les études sur l’ampleur et la portée géographique visent à déterminer l’étendue spatiale des effets sur la communauté d’invertébrés benthiques qui sont causés par l’effluent d’une mine de métaux. Le chapitre 1 présente des renseignements sur les mines de métaux menant de telles études et sur les seuils critiques d’effets (SCE) établis par Environnement Canada afin de cibler les activités de suivi additionnelles.
Les plans d’étude sur l’ampleur et la portée géographique devraient comprendre :
- les mêmes éléments des plans d’étude et d’échantillonnage que ceux du suivi précédent, mais une couverture géographique plus grande (zones d’échantillonnage additionnelles);
- une évaluation de la pertinence des zones échantillonnées antérieurement. La nouvelle couverture géographique peut comprendre des types d’habitat et de substrat additionnels (par ex., cours d’eau ou lacs d’un ordre supérieur, ou zones marines ou estuariennes allant des zones intertidales aux zones infralittorales). Si ces nouveaux habitats n’étaient pas représentés dans les zones de référence utilisées dans le cadre du suivi précédent, il convient de réévaluer la pertinence de ces zones de référence;
- l’échantillonnage d’autres habitats, saisons ou stades du cycle vital des invertébrés présentant un intérêt écologique, si cela est approprié pour l’évaluation de l’ampleur des effets détectés;
- la possibilité de considérer d’autres indicateurs biotiques comme outils d’évaluation de l’ampleur des effets, si l’utilisation de tels indicateurs paraît appropriée et utile. Parmi les indicateurs susceptibles d’être utilisés à cette fin, mentionnons la biomasse et la composition taxinomique des communautés de périphyton, de phytoplancton, de macrophytes ou de zooplancton, l’échantillonnage des invertébrés à d’autres stades du cycle vital, l’identification plus fine des invertébrés, la biomasse des invertébrés, la production secondaire, d’autres habitats vulnérables ou saisons, et les essais de toxicité des sédiments et de l’eau.
Lors d’études sur l’ampleur et la portée géographique, les questions suivantes pourraient être abordées :
Ampleur :
- Combien de groupes taxinomiques sont touchés?
- Quelle est l’ampleur des effets (p. ex., importance de la variation de la densité) sur les groupes taxinomiques touchés?
- Les effets sont-ils observés chez d’autres organismes benthiques, comme le périphyton ou les macrophytes, présents dans la zone de référence et vraisemblablement présents dans la zone exposée? Il est à noter que cette question n’a pas à être abordée dans le cadre du Programme d’ESEE, mais pourrait faire partie d’une étude de recherche des causes.
Portée géographique :
- Quelle est la superficie du territoire touché?
- Les communautés d’invertébrés benthiques se trouvant aux stations d’échantillonnage les plus éloignées du point de rejet de l’effluent sont-elles similaires à celles des stations de référence?
4.2.3 Recherche des causes
Pour en savoir plus sur la recherche des causes, veuillez consulter le chapitre 12 du présent guide.
4.3 Considérations relatives au plan d’étude de la communauté d’invertébrés benthiques
Diverses considérations et recommandations devant être examinées au cours du processus d’élaboration du plan d’étude sont analysées ci-dessous. Les plans pour les études sur la communauté d’invertébrés benthiques doivent être appropriés au site visé. Les sept plans recommandés sont décrits à la section 4.3.5. Ils cherchent tous à prendre en compte les contraintes possibles et les facteurs liés à la disponibilité et la distribution spatiale des zones de référence convenables ainsi que sur l’étendue et l’hétérogénéité des zones exposées potentielles. Il faut souligner que, bien que ces plans d’étude soient considérés comme les plans existants, d’application générale, les plus faciles à suivre, il ne s’agit pas d’une liste exhaustive des moyens possibles de réaliser une étude de la communauté d’invertébrés benthiques. Il est présumé que chaque responsable d’étude possède suffisamment de connaissances scientifiques pour appliquer les présentes recommandations avec toute la rigueur voulue et déterminer si certaines conditions particulières justifient l’apport de modifications aux plans d’étude.
4.3.1 Analyse de puissance et taille des échantillons
Pour une description détaillée de l’analyse de puissance, veuillez consulter le chapitre 8 du présent guide technique.
Dans le cadre de la première phase de l’ESEE, il est recommendé que l’étude comporte ce qui suit :
- au moins deux zones d’étude : la zone de référence et une zone fortement exposée à l’effluent;
- au moins cinq station répétées dans chacune des deux zones d’étude;
- au moins trois sous-échantillons de terrain à prélever dans chacune des stations.
En l’absence d’information a priori sur la densité et la variabilité des populations d’invertébrés à l’intérieur d’une station, on fixe arbitrairement à trois le nombre de sous-échantillons requis pour refléter avec exactitude la densité réelle à chacune des stations. Le nombre total d’échantillons d’invertébrés benthiques recommandé s’élève donc à 30 pour les mines de métaux qui mènent leur première étude de suivi (phase 1). Lorsque des plans d’étude autre que le plan contrôle-impact sont requis, il est essentiel de conserver le même effort d’échantillonnage minimal, bien que la répartition des zones, des stations et des échantillons puisse différer.
En outre, il est important que les stations soient réparties de manière que seule la classe dominante d’habitat soit échantillonnée (voir la section 4.3.7). Le fait de limiter l’échantillonnage à l’habitat dominant réduit la variation des données. Les zones d’étude caractérisées par des habitats extrêmement hétérogènes ou qui présentent deux habitats d’importance égale pourraient exiger un effort d’échantillonnage supérieur à l’effort minimal recommandé ci-dessus. Il est souhaitable de dépasser les exigences minimales liées à l’effort d’échantillonnage. Dans ce cas, l’une ou l’autre des mesures suivantes pourraient être mises en œuvre : ajout d’une ou de plusieurs zones de référence, ajout d’une zone peu exposée à l’effluent ou très peu exposée à l’effluent, augmentation du nombre de stations par zone ou augmentation du nombre de sous-échantillons de terrain par station. La décision d’accroître l’effort d’échantillonnage devrait être prise en consultation avec le coordonnateur régional.
4.3.2 Facteurs de confusion
Il convient de noter que le Programme d’ESEE des mines de métaux ne charge pas l’industrie des mines de métaux de déterminer les effets des rejets d’autres industries ou sources de pollution sur les communautés d’invertébrés benthiques lorsqu’en présence de rejets multiples.
Est-il possible d’éliminer les effets de certains facteurs de confusion en modifiant le plan d’étude?
L’interprétation des effets sur la communauté d’invertébrés benthiques peut être difficile si des facteurs de confusion sont présents dans la zone à l’étude. Un examen minutieux des données historiques ou existantes et des informations amassées durant la caractérisation du site afin de mieux éclairer le choix des composantes des plans d’étude et d’échantillonnage peut souvent aider à résoudre les problèmes posés par les facteurs de confusion. Pour en savoir plus sur les facteurs de confusion, veuillez consulter Hauer et Lamberti (1996), Culp et al. (2000) et Lowell et al. (2000).
Ces facteurs peuvent être regroupés dans quatre catégories :
Variables environnementales : les variables environnementales peuvent fausser l’interprétation des effets sur la communauté d’invertébrés benthiques lorsqu’il n’est pas possible de distinguer les effets de l’effluent d’une mine de métaux des effets engendrés par les différences de certains paramètres de l’habitat naturel. Pour tenter de résoudre ce problème, le plan peut être modifié de manière à mieux caractériser les conditions de référence et à inclure tous les types d’habitat. À cette fin, des zones de référence peuvent être choisies dans des bassins hydrographiques adjacents ou plus éloignés ou l’échantillonnage de zones de référence additionnelles peut être effectué (c.-à-d. en délaissant l’approche contrôle-impact simple pour un plan plus approprié – voir les figures 4-3, 4-4 et le tableau 4-1). Parmi les facteurs de confusion potentiels dont les effets peuvent être éliminés par l’adoption de plans d’étude et d’échantillonnage plus appropriés, mentionnons les gradients de profondeur, la granulométrie du substrat, la dilution rapide de l’effluent, les événements interannuels ou rares et les fluctuations saisonnières ou à long terme de paramètres physiques comme la température ou les régimes d’écoulement. Il peut être possible d’évaluer l’influence des variations des paramètres environnementaux ou d’habitat en examinant les corrélations entre les mesures de ces paramètres et celles des indicateurs benthiques.
Rejets multiples ou effets historiques : l’interprétation des résultats peut également se révéler difficile lorsque les zones exposées à divers degrés à l’effluent d’une mine de métaux sont également exposées à d’autres effluents ou facteurs de stress à des degrés divers ou encore lorsque les habitats ont été perturbés dans le passé par la construction d’ouvrages tels que des digues ou des bassins de retenue. Lorsque c’est possible, le changement de l’emplacement des stations d’échantillonnage pourrait remédier au problème. Dans les zones sédimentaires, la collecte de carottes de sédiments peut également aider à résoudre les problèmes posés par les facteurs de confusion résultant d’effets historiques (pour de plus amples renseignements sur le suivi des sédiments, voir le chapitre 7).
Moment de l’échantillonnage : la période de l’année ou l’année durant laquelle l’échantillonnage est réalisé peut compliquer l’interprétation des effets de l’effluent sur la communauté d’invertébrés benthiques. Une bonne connaissance de la phénologie des diverses espèces d’invertébrés formant la communauté benthique (c.-à-d. la relation entre le climat et les caractéristiques du cycle vital des invertébrés) et un examen minutieux des données recueillies au cours des années antérieures dans les zones de référence permettent normalement de tenir compte de ces facteurs.
Méthodes d’échantillonnage : si les méthodes d’échantillonnage courantes (types de dispositif d’échantillonnage, dimensions des mailles ou identification réalisée selon des niveaux de résolution taxinomique différents) n’ont pas été utilisées de manière systématique dans une même étude ou dans plusieurs études consécutives, les effets de l’effluent sur les communautés d’invertébrés benthiques pourraient être masqués. Il peut être possible de procéder à un examen plus approfondi des données et d’utiliser un niveau de résolution taxinomique comparable en ramenant toutes les identifications à un niveau commun plus élevé. Toutefois, dans bien des cas, une révision complète du plan d’étude afin de permettre une utilisation cohérente des méthodes d’échantillonnage courantes peut être nécessaire afin de résoudre ces problèmes. Enfin, si des conditions environnementales ou divers aspects logistiques ne permettent pas de mener à bien l’échantillonnage correctement et en toute sécurité, l’utilisation d’autres méthodes peut être envisagée.
À l’heure actuelle, la seule autre méthode recommandée pour le volet des invertébrés benthiques est l’utilisation de mésocosmes afin de mener sur le terrain des bioessais à l’échelle des communautés. La mine de métaux peut toutefois proposer d’autres méthodes de suivi, justifiables sur le plan scientifique, permettant de déterminer si l’effluent a des effets sur la communauté d’invertébrés benthiques. Les mésocosmes sont également utiles comme outil de recherche des causes (voir le chapitre 12). Leur applicabilité et les diverses méthodologies sont décrites en détail au chapitre 9. D’autres méthodes sont également décrites au chapitre 9.
4.3.3 Uniformisation de la terminologie
Aux fins du Programme d’ESEE, il est essentiel d’adopter des définitions standardisées pour désigner les lieux d’échantillonnage, afin de faciliter les évaluations régionales et nationales. La terminologie uniformisée suivante s’appliquant aux lieux d’échantillonnage devrait être adoptée et appliquée de manière cohérente et rigoureuse, et ce, pour toutes les ESEE comportant une étude de la communauté d’invertébrés benthiques. Une représentation schématique de ces termes est présentée à la figure 4-1.
La présente section définit les termes station répétée et sous-échantillon de terrain. Les zones de référence et d’exposition sont définies au chapitre 2. Pour les plans d’étude de base convenant à l’analyse de variance (ANOVA) (contrôle-impact, contrôle-impact multiple), dont les objectifs consistent à déterminer les différences entre les zones et au sein de chaque zone, chaque zone exposée et chaque zone de référence comporte un certain nombre de stations répétées (c.-à-d. les répétitions pour l’ANOVA), et chaque station répétée, un certain nombre de sous-échantillons de terrain regroupés. De la même façon, les plans d’étude par gradient ou fondés sur les conditions de référence (c.-à-d. approche fondée sur les conditions de référence [ACR]) utilisent les stations répétées comme échelle spatiale de répétition, des sous-échantillons de terrain étant recueillis au besoin (voir la section 4.3.5 pour la description de ces approches).
Le concept de zone ne s’applique pas directement au plan d’étude par gradient ou à l’approche fondée sur les conditions de référence (ACR). Lorsqu’un plan d’étude par gradient ou de l’ACR est élaboré ou utilisé, les comparaisons ne sont pas fondées sur un plan équilibré avec un nombre similaire de stations répétées dans les zones d’exposition et de référence. Par exemple, pour l’ACR, les stations exposées sont comparées individuellement à une distribution de stations de référence représentant les conditions de référence appropriées. Dans le cas des études par gradient, le manque de zones de référence ou exposées appropriées pourrait justifier le choix de ce type d’étude. Par conséquent, la terminologie propre à l’ANOVA ne s’applique pas directement à cette méthode. La section 4.3.5 présente ces plans d’études de manière plus détaillée.
De plus amples informations concernant le nombre requis de stations répétées et leur répartition en fonction de l’échelle spatiale et du plan d’étude sont fournies aux sections 4.3.5 et 4.4.2.
Sous-échantillons de terrain
Les sous-échantillons de terrain sont constitués d’invertébrés benthiques récoltés dans une superficie déterminée ou pendant une période de temps fixe (p. ex., échantillon prélevé à l’aide d’une benne, d’un carottier, d’un cylindre, d’un quadrat, d’un filet troubleau ou d’un filet en U). Afin d’assurer la répartition spatiale adéquate des sous-échantillons à l’intérieur d’une station d’échantillonnage, ils devraient être prélevés selon un plan d’échantillonnage aléatoire ou aléatoire stratifié. Aux fins des nombreuses analyses statistiques utilisées pour évaluer les effets en eau douce ou en milieu marin (section 4.9), les données de tous les sous-échantillons de terrain provenant d’une même station sont regroupées afin de fournir une seule valeur pour chaque descripteur à chaque station.
Regroupement des sous-échantillons de terrain
Le regroupement des données des sous-échantillons de terrain peut être effectué à divers moments du programme de suivi. Le moment précis où ce regroupement peut être effectué dépend de divers facteurs, dont :
- l’efficacité du traitement et de l’entreposage des échantillons de terrain (les récipients d’entreposage des échantillons de terrain ont-ils la taille requise pour recevoir des échantillons regroupés?)
- l’efficacité du tri en laboratoire (le tri d’échantillons plus petits est-il plus efficient?)
- la capacité de répondre aux questions soulevées dans le plan d’étude.
Les deux premiers facteurs, qui ont pour résultat le regroupement physique des sous-échantillons, sont essentiellement de nature logistique. Leur applicabilité devrait être établie en fonction des caractéristiques propres à chaque site et des méthodes utilisées. Il convient de noter que le regroupement physique entraîne la perte des informations se rapportant à chacun des sous-échantillons. En ce qui a trait au troisième facteur s’il s’avère nécessaire d’obtenir des informations additionnelles pour résoudre certaines questions soulevées dans le plan d’étude (p. ex., examen des aires de répartition des espèces ou évaluation de la précision des sous-échantillons de terrain), les sous-échantillons peuvent être conservés et traités individuellement. Les données non regroupées peuvent alors être utilisées pour examiner les questions posées par le plan d’étude, puis regroupées électroniquement aux fins des analyses statistiques appropriées. Pour les divers paramètres, le regroupement électronique doit être fait de façon à donner des résultats équivalents à ceux qui auraient été obtenus avec le regroupement physique des sous-échantillons de terrain. Cet aspect est particulièrement important pour le critère de la richesse des taxons. Des exemples de calcul de la densité et de la richesse des taxons à une station avec les données regroupées sont présentés ci-dessous.
Pour la densité, le calcul doit être effectué comme ceci :
Densité calculée en regroupant les sous-échantillons = (nombre dans le sous-échantillon a + nombre dans le sous-échantillon b + nombre dans le sous-échantillon c) / superficie totale des sous-échantillons a, b et c.
Il faut noter que le nombre obtenu est le même que si la densité était calculée pour chaque sous-échantillon et qu’une moyenne était effectuée.
Toutefois, le calcul de la richesse des taxons pour une station n’est pas équivalent à la moyenne de la richesse des taxons dans les trois sous-échantillons. La richesse des taxons d’une station doit être calculée comme suit :
Richesse des taxons de la station = tous les taxons observés à une station, dans tous les sous-échantillons (et non pas le nombre moyen de taxons des trois sous-échantillons).
Station répétée
Une station répétée est un site d’échantillonnage précis et fixe à l’intérieur d’une zone à l’étude. C’est une entité reconnaissable qui peut faire l’objet d’échantillonnages répétés et qui peut être définie quantitativement (p. ex., latitude et longitude, description écrite). Dans chaque type d’habitat, un certain nombre de stations répétées sont échantillonnées. L’échantillonnage de chaque station produit un échantillon composite constitué préférablement d’au moins trois sous-échantillons d’invertébrés benthiques. Les stations situées dans la zone exposée doivent être exposées au panache de l’effluent. En outre, les stations répétées doivent être suffisamment éloignées les unes des autres pour être considérées comme des répétitions au sens statistique du terme.
La superficie des stations répétées varie selon qu’elles sont situées dans des lacs, des cours d’eau ou des milieux marins côtiers. Les superficies recommandées pour les lacs et les cours d’eau sont les suivantes :
Lacs : chaque station répétée devrait mesurer au moins 10 m × 10 m et se trouver à au moins 20 m de la station la plus rapprochée.
Cours d’eau : chaque station répétée devrait comprendre un tronçon longitudinal comportant une séquence d’une fosse et un seuil et s’étalant sur une longueur équivalente à six fois la largeur à pleins bords du chenal (Leopold et al., 1964; Newbury, 1984; Leopold, 1994). La distance entre les stations situées dans un habitat similaire devrait être égale à au moins trois fois la largeur à pleins bords. Pour faire en sorte que l’échantillonnage prévu dans le cadre du Programme d’ESEE s’effectue de façon cohérente, il est recommandé d’utiliser la définition de la largeur à pleins bords proposée par Newbury et Gaboury (1993) et dans le chapitre 5 du présent guide technique. S’il est n’est pas faisable d’échantillonner une telle longueur de cours d’eau (p.ex., grands cours d’eau ou ruisseaux d’amont dont les gradients changent rapidement), on pourra alors retenir la définition de superficie d’une station répétée proposée pour les lacs (c.-à-d., site revisitable mesurant au moins 10 m × 10 m et suffisamment éloignée des stations voisines).
Milieux côtiers marins : chaque station répétée devrait être un lieu défini où il est possible, par ses dimensions, d’y revenir (c.-à-d. 10 m × 10 m). Les stations répétées doivent être espacées les unes des autres d’au moins 50 m, cette distance variant selon la superficie de la zone. Dans certains estuaires, une station répétée devrait comprendre un tronçon longitudinal qui inclut le principal habitat à échantillonner (p. ex., distance équivalente à six fois la largeur à pleins bords). Si cette longueur de tronçon n’est pas réalisable dans de grands estuaires, une définition similaire à celle proposée pour les zones côtières peut être adoptée.
Zone
Les renseignements généraux et les définitions des zones de référence et des zones exposées sont présentés au chapitre 2.
La superficie recommandée pour une zone d’étude des invertébrés benthiques diffère selon que celle-ci est située dans un lac, un cours d’eau et un estuaire. Les superficies recommandées pour les lacs et les cours d’eau sont les suivantes :
Lacs : la zone d’étude devrait mesurer au moins 100 m × 100 m et être suffisamment grande pour contenir le nombre nécessaire de stations répétées suffisamment éloignées les unes des autres.
Cours d’eau : la superficie de la zone d’étude dépend de la morphologie du cours d’eau. Cette zone devrait correspondre à un tronçon de cours d’eau suffisamment grand pour contenir le nombre nécessaire de stations répétées suffisamment éloignées les unes des autres. La longueur totale du cours d’eau contenant la zone est donc équivalente au produit du nombre de stations répétées par six fois la largeur à pleins bords. Cette longueur de tronçon devrait permettre normalement de contenir une séquence d’un seuil et une fosse (Newbury, 1984).
Estuaires : pour les estuaires relativement homogènes et de faible salinité, les exigences régissant la délimitation de la zone sont les mêmes que pour les cours d’eau. Pour les régions marines longues et étroites se prêtant à un plan de type contrôle-impact, comme certaines baies et les fjords, la zone devrait être suffisamment grande (au moins 100 × 100 m) pour inclure l’habitat homogène à échantillonner, la gamme d’exposition recherchée et le nombre nécessaire de stations répétées (suffisamment éloignées les unes des autres).
4.3.4 Indication de l’emplacement des stations d’échantillonnage
Veuillez consulter la section 2.2.3 du chapitre 2 pour obtenir des renseignements généraux sur la façon d’indiquer l’emplacement des stations d’échantillonnage.
4.3.5 Plans d’échantillonnage recommandés
Les caractéristiques propres au site doivent être prises en compte dans la sélection d’un plan pour l’étude de la communauté d’invertébrés benthiques. L’un des sept plans d’échantillonnage suivants est recommandé.
- contrôle-impact (C-I);
- contrôle-impact multiple (C-IM);
- avant-après–contrôle-impact (BACI; de l’anglais before/after-control/impact);
- gradient linéaire (GL)
- gradient radial (GR);
- gradients multiples (GM);
- approche des conditions de référence (ACR).
Des exemples de ces plans se trouvent aux figures 4-2, 4-3 et 4-4.
Ces plans se subdivisent en trois catégories fondamentales qui relèvent chacune d’une approche conceptuelle différente. Ces catégories sont les suivantes :
- les plans d’échantillonnage contrôle-impact et contrôle-impact multiple (ainsi que BACI) satisfont aux conditions d’application de l’analyse de variance et permettent de détecter d’éventuelles différences entre la zone exposée et la zone de référence.
- les plans d’échantillonnage par gradient(s) (linéaire, radial ou multiples) permettent d’examiner les changements qui surviennent dans la structure de la communauté tout au long d’un gradient physique ou d’un gradient de concentration de l’effluent. Ces plans se prêtent mieux aux analyses de régression ou de covariance (ANCOVA).
- l’approche multivariable fondée sur les conditions de référence permet de comparer des stations potentiellement « perturbées » ou exposées à des stations de référence pertinentes choisies.
Il convient de noter que les plans des deux dernières catégories se prêtent dans certaines circonstances aux analyses de variance. D’autres méthodes de suivi (p. ex., mésocosmes) sont également recommandées, mais leur utilisation doit se justifier scientifiquement. Les caractéristiques, l’applicabilité et les limites des plans d’échantillonnage susmentionnés sont brièvement présentées au tableau 4-1 et décrites de façon plus détaillée ci-dessous.
Les descriptions qui suivent s’appliquent principalement à la conception de la première phase et des phases subséquentes. Des applications spéciales permettant de déterminer l’ampleur et la portée géographique d’un effet sont présentées, le cas échéant.
Plan d’étude contrôle-impact
Le plan d’étude le plus simple à utiliser pour l’ESEE est le plan contrôle-impact (ou référence-exposition) (Green, 1979). Dans les cours d’eau et les estuaires, ce système prévoit la sélection d’au moins une zone de référence et d’une série de zones exposées en aval. Pour le suivi régulier, il devrait y avoir au moins une zone fortement exposée à l’effluent. Les degrés d’exposition à l’effluent diffèrent entre les zones exposées et les zones de référence, mais ils devraient être comparables d’une station à l’autre dans une zone donnée. Les classes d’habitat échantillonnées devraient être uniformes d’une zone à l’autre et, exception faite du degré d’exposition, être le plus similaires possible relativement à des caractéristiques comme le substrat, la profondeur, la vitesse du courant, les propriétés de l’eau, les gradients environnementaux, l’utilisation des terres, etc. Dans le premier plan d’étude, l’analyse de variance est utilisée pour comparer les zones, et ce plan est recommandé pour les cours d’eau simples et homogènes qui ne comportent pas de rejets en amont ou provenant d’autres sources près du site pouvant masquer les effets.
La mine de métaux peut proposer des modifications à ce plan d’ANOVA de base, à condition que la version modifiée soit scientifiquement justifiable et permette d’examiner les questions de suivi appropriées. Par exemple, des modifications du plan contrôle-impact peuvent être appropriées si la présence d’un facteur de confusion ne permet pas de trouver une zone de référence en amont ou dans un bassin hydrographique adjacent, mais qu’un tel plan pourrait s’appliquer. Dans ce cas particulier, la zone de référence peut être choisie en aval du point de rejet plutôt qu’en amont. Cette zone de référence devrait cependant se trouver hors de la zone exposée et satisfaire aux mêmes critères applicables aux zones de référence que les autres plans.
Ce premier plan est également recommandé pour les estuaires simples et homogènes ou les baies ou bras étroits ne comportant pas d’effluents en amont ou provenant d’autres sources près du site pouvant masquer les effets, ou encore lorsque les habitats pertinents sur le plan écologique sont répartis en îlots isolés mais homogènes (par ex., affleurements rocheux épars).
Ampleur et portée géographique
Le plan C-I peut également être utilisé pour évaluer la portée géographique d’un effet en faisant d’abord appel à des protocoles de bioévaluation rapide (Plafkin et al., 1989) ou à d’autres informations existantes pour évaluer approximativement la distance jusqu’à laquelle se fait sentir l’effet. Cette étape peut être suivie d’un programme de suivi de type C-I englobant la zone fortement exposée et ciblant des zones exposées additionnelles situées dans des endroits où les effets détectés semblent se dissiper. Ces zones additionnelles devraient être réparties de manière à englober le point le plus éloigné où l’on soupçonne que les effets de l’effluent demeurent perceptibles. L’échantillonnage devrait comprendre également les zones de référence et les zones exposées déjà suivies. À l’aide d’une analyse de variance, des comparaisons entre les zones peuvent dès lors être effectuées afin de déterminer la portée géographique d’un effet à un niveau de signification donné.
Plan d’étude contrôle-impact multiple
L’utilisation d’une zone de référence unique soulève deux difficultés importantes : 1) la possibilité élevée de la présence d’autres facteurs de confusion et 2) le manque d’indépendance entre les stations d’une même zone de référence (pseudorépétition) (Hurlbert, 1984). Dans les systèmes où il est impossible de trouver une zone de référence appropriée en raison de la présence de facteurs de confusion ou dans les cas où il y a constat, après examen des données historiques, qu’il est préférable d’utiliser plus d’une zone de référence, le plan d’étude contrôle-impact multiple devrait être utilisé. Un schéma illustrant l’application de ce plan d’étude aux mines de métaux rejetant leur effluent dans les cours d’eau importants, les lacs ou les eaux côtières est présenté à la figure 4-2d, e, f. Le plan d’échantillonnage devrait être conçu de manière à ce que les zones de référence additionnelles soient situées dans des bassins hydrographiques adjacents ou dans des baies voisines et comportent un assemblage de classes d’habitats comparable à la gamme d’habitats trouvés dans la zone exposée.
De par leur conception, les plans C-I et C-IM visent à étudier une différence particulière d’ampleur de l’effet entre les zones à l’étude. Ces plans satisfont aux conditions d’application des analyses de variance et des analyses de puissance qui s’y rattachent. Ces méthodes s’appliquent avec souplesse et peuvent fournir des indicateurs permettant de déterminer si l’effluent de la mine de métaux a un effet biologique ou non sur la communauté d’invertébrés benthiques. Ces plans supposent au départ que l’exposition à l’effluent et les conditions de l’habitat sont relativement homogènes dans toutes les stations comprises à l’intérieur d’une zone d’échantillonnage, ou encore que l’exposition à l’effluent varie à l’intérieur de limites acceptables dans une zone donnée.
Plan d’étude avant-après–contrôle-impact (BACI)
Les plans C-I et C-IM peuvent être améliorés lorsque des données sont recueillies avant et après le début du rejet de l’effluent dans le plan d’eau récepteur. Les mêmes aspects décrits précédemment s’appliquent au choix des zones de référence (contrôle) et des zones exposées (impact). Le plan est toutefois amélioré grâce à la collecte de données à la fois avant et après que l’installation devient fonctionnelle. Ce type de plan de suivi a été nommé « avant-après–contrôle-impact » (BACI, de before/after-control/impact) (Schmitt et Osenberg, 1996). Son utilisation aide à distinguer les effets de l’effluent par rapport aux différences naturelles entre les zones de référence et les zones exposées qui existaient déjà avant le rejet de l’effluent.
Green (1979), Schmitt et Osenberg (1996), Underwood (1997), de même que les références qu’ils contiennent, présentent des descriptions détaillées de plusieurs types de plans BACI et des analyses statistiques effectuées. Dans sa forme la plus simple, un plan BACI nécessite la collecte de données de suivi au moins une fois avant et une fois après le début du rejet de l’effluent dans une zone de référence et dans une zone exposée, puis les données sont analysées par ANOVA factorielle superfie-temps (Green, 1979). Dans cette situation, l’existence d’un effet de l’effluent est inférée quand le terme d’interaction superficie-temps de l’ANOVA est significatif. Quand les zones de référence et exposée ont été échantillonnées de manière répétée pendant la période avant et la période après, il est possible de recourir à une analyse BACI pour séries appariées; dans ce cas, les effets potentiels sont étudiés en recherchant un changement dans la valeur de delta (différence entre les zones de référence et les zones exposées), de la période avant à la période après le rejet (Schmitt et Osenberg, 1996). Il est possible d’améliorer ce plan en intégrant plusieurs zones de référence (Schmitt et Osenberg, 1996; Underwood, 1997). Veuillez consulter la section 2.2.2.2.2 du chapitre 2 pour en savoir plus sur les données de base.
Plan d’étude par gradient linéaire ou gradient radial
Les plans d’étude par gradient linéaire ou radial (figure 4-3a, b, c) conviennent dans le cas où la dilution rapide de l’effluent empêche la sélection d’une zone exposée présentant des concentrations d’effluent relativement homogènes. Comme le plan C-I, les plans par gradient peuvent être utilisés lorsqu’il est impossible de trouver une zone de référence appropriée en amont du point de rejet de l’effluent ou dans une baie ou un bassin hydrographique adjacent. Ces plans permettent également de déterminer la distance à laquelle les effets demeurent perceptibles le long du panache de l’effluent (soit l’objectif de la détermination de l’ampleur et de la portée géographique).
L’approche par gradient permet d’examiner les écarts par rapport à un « modèle » attendu (non perturbé) de corrélations entre des facteurs biotiques et environnementaux le long de gradients spatiaux. Elle se prête davantage à l’analyse de régression (ou à une méthode équivalente), pour laquelle il est plus approprié d’obtenir des mesures exactes des variables biotiques et d’habitat pour une gamme suffisamment grande de conditions que de consacrer des efforts équivalents à des répétitions (p. ex., cinq stations à l’intérieur d’une zone). Dans le cas le plus simple, on conclura à la présence d’un effet statistiquement significatif si la pente de la droite de régression d’une variable réponse (variable dépendante) en fonction de la distance du point de rejet de l’effluent est significativement différente de 0. Cette méthode est fondée sur la présence d’un gradient d’effet s’amenuisant en fonction de la distance à partir de la source ponctuelle de rejet, et il n’est pas toujours possible de confirmer la présence ou l’absence d’un effet dans une station donnée. Il convient alors de déterminer à quel endroit précis le long du gradient les effets étudiés ne sont plus détectables ou cessent d’être importants. Par conséquent, avec les plans par gradient, les données de référence proviennent des stations les plus éloignées de la source de l’effluent.
Un gradient n’est pas nécessairement rectiligne, et les stations d’une zone donnée ne sont pas nécessairement équidistantes le long de ce dernier. L’intervalle entre les stations peut être plus ou moins continu le long du gradient à mesure qu’on s’éloigne de la source de l’effluent. Comparativement au plan C-I, l’effort d’échantillonnage porte moins sur des zones de dilution nettement différentes que sur une couverture spatiale adéquate. Il n’existe souvent pas d’espaces « vides » entre les zones d’échantillonnage distinctes, mais plutôt un continuum de stations d’échantillonnage réparties le long du gradient. Toutefois, si la dilution de l’effluent change brusquement dans le milieu récepteur, il convient d’accroître l’effort d’échantillonnage dans cette portion particulière du gradient afin de détecter avec exactitude les changements soudains des effets de l’effluent de la mine de métaux.
Un plan par gradient linéaire est particulièrement indiqué pour les plans d’eau étroits tels que les cours d’eau. Le plan par gradient radial peut mieux convenir aux plans d’eau plus larges comme les lacs et les zones côtières ouvertes. L’échantillonnage s’effectue en divers points s’éloignant de la source de l’effluent, le long de plusieurs transects suivant des gradients. Comme le plan d’étude C-IM, le plan d’étude par gradient radial permet d’accroître le nombre de sites de référence. Il offre en outre une meilleure couverture spatiale, ce qui est un atout dans le cas des zones lacustres ou marines ouvertes et non homogènes, où la circulation de l’eau et les courants sont souvent assujettis à des régimes complexes et où l’on peut trouver une variété de classes d’habitats ou de gradients d’importance égale.
Pour le plan par gradient radial, la comparaison des résultats des régressions pour chaque gradient (p. ex., abondance des invertébrés benthiques en fonction de la distance du point de rejet) peut aider à déterminer l’orientation et l’étendue des effets. Il est également possible de soumettre les données de tous les gradients à une analyse de régression, si la comparaison s’effectue entre des facteurs biotiques et des facteurs physiques non liés à des facteurs géographiques ou de l’habitat naturel. Si l’effort d’échantillonnage est suffisamment intense (p. ex., gradient radial), il peut être possible de choisir des stations répétées sans facteurs de confusion (habitats homogènes) en vue d’effectuer une analyse de régression entre une variable biotique et une variable liée à l’effluent.
Dans la mesure du possible, le gradient d’exposition devrait être dissocié de tout gradient environnemental. En présence d’un gradient d’exposition décroissant le long de zones de profondeurs différentes, l’application d’un plan par gradient linéaire ou radial peut encore être envisagée si les gradients d’exposition et de profondeur ne sont pas corrélés et si les différences de profondeur ne sont pas importantes au point de masquer les effets de l’effluent. Dans les cas où une corrélation peut être établie entre le gradient d’exposition et un gradient environnemental, il peut être préférable d’appliquer un plan d’étude à gradients multiples (voir la prochaine section). Autrement, il peut être nécessaire d’utiliser une approche multivariable pour éliminer l’effet des variations de profondeur.
Plans d’étude par gradients, et ampleur et portée géographique
En raison de la répartition des stations d’échantillonnage, l’utilisation de plans d’étude par gradient est particulièrement appropriée pour déterminer la portée géographique d’un effet. Le plan le plus simple pour étudier l’ampleur et la portée géographique consiste à répartir les stations d’échantillonnage le long d’un gradient d’exposition décroissant, en veillant à ce que les stations les plus éloignées soient situées à bonne distance de la zone d’influence de l’effluent. Il est alors possible de déterminer la portée géographique des effets en reportant sur un graphique les variables réponse en fonction de la distance à partir de la mine de métaux et en examinant les données afin de trouver le point d’inflexion où les variables réponse convergent asymptotiquement vers les conditions de référence. Il est également possible d’inclure les données des stations ainsi réparties, avec les paramètres physicochimiques mesurés, dans une analyse multivariable (ordination ou groupement) en vue d’établir quelles stations distantes sont groupées avec les stations de référence et lesquelles sont associées aux stations distinctement soumises aux effets de l’effluent. Ces deux approches (représentation graphique et analyse multivariable) visent à relever des tendances parmi l’ensemble des données en vue de déterminer de façon approximative la portée géographique des effets. Comme ces approches ne comportent pas de vérification d’hypothèses, une analyse de puissance ne s’appliquerait pas (contrairement à l’application de l’approche C-I à l’étude de l’ampleur et de la portée géographique; voir ci-dessus).
Il est également possible de concevoir un plan d’étude par gradient prévoyant la vérification d’hypothèses pour examiner la portée géographique d’un effet. Il faut alors utiliser les sous-échantillons de terrain comme répétitions (et traiter les stations comme des zones) et effectuer des comparaisons station par station à l’aide d’une analyse de variance le long d’un gradient en vue de déterminer à quel endroit les effets s’estompent, à un niveau de signification donné. Cette approche peut cependant nécessiter un effort d’échantillonnage considérable, selon le nombre de stations réparties le long du gradient et le nombre de sous-échantillons de terrain requis (par l’analyse de puissance) par station.
Plan d’étude par gradients multiples
Dans certains cas, il peut également être utile de comparer les gradients de référence à ceux qui sont exposés à l’effluent de la mine de métaux, en particulier lorsqu’un gradient environnemental concomitant masque un gradient d’exposition à l’effluent dans la zone exposée. En utilisant un plan par gradients multiples (voir diagrammes d et e de la figure 4-3), il devient possible d’effectuer une comparaison statistique entre le gradient d’une zone exposée et un gradient environnemental similaire dans la zone de référence. Les gradients de référence devraient être aussi similaires que possible au gradient de la zone exposée pour ce qui est de la profondeur et de l’habitat. Une analyse de covariance permet de vérifier la présence éventuelle d’effets liés à l’effluent et d’éliminer l’influence du gradient environnemental concomitant.
Approche des conditions de référence
Le concept de base de l’approche des conditions de référence (ACR) consiste à établir une base de données biologiques et environnementales mesurées dans des sites présentant des conditions non perturbées (stations de référence). Cette base de données est utilisée pour élaborer des modèles prédictifs associant une série de variables environnementales à des conditions biologiques. Le modèle analyse ensuite un ensemble de variables environnementales mesurées dans une nouvelle station pour prévoir les conditions biologiques attendues dans cette station (c.-à-d. les conditions biologiques du groupe de stations de référence présentant des attributs environnementaux similaires). Une comparaison des conditions biologiques réelles à la nouvelle station avec les conditions prévues permet d’évaluer l’état de la nouvelle station.
L’application de l’ACR à l’étude d’un système perturbé réduit le besoin de trouver des stations de référence comparables à proximité, ce qui peut poser un problème avec certaines approches courantes. Avec l’ACR, au lieu d’avoir à trouver et à échantillonner des stations de référence situées en amont (système fluvial) ou dans une baie voisine (lac), il est possible d’utiliser un ensemble de stations de référence biologiquement comparables choisies dans une base de données existantes pour évaluer une station exposée. Dans la mesure où elle est mise à jour régulièrement, cette base de données peut être utilisée dans le cadre de plusieurs étapes de l’ESEE.
La base de données sur les conditions de référence est établie au moyen d’un programme d’échantillonnage normalisé effectué à des échelles géographiques très diverses. Le même protocole d’échantillonnage de la communauté d’invertébrés benthiques est utilisé dans le plus grand nombre d’écorégions et d’ordres de cours d’eau ou de lacs possible à l’échelle d’un bassin hydrographique. Un certain nombre de variables environnementales sont mesurées durant l’échantillonnage des invertébrés. Les données recueillies sont soumises à une analyse multivariable à trois étapes dans le cadre de laquelle :
- un certain nombre de groupes d’invertébrés sont formés d’après la similarité de la structure des communautés;
- les données biologiques sont corrélées avec les variables environnementales, et un ensemble optimal de variables environnementales permettant de prédire la répartition dans les divers groupes est établi;
- la condition biologique des stations exposées est évaluée en utilisant l’ensemble optimal de variables environnementales pour prédire la répartition dans les divers groupes. La qualité de l’ajustement de la station exposée au groupe dans lequel elle a été assignée par le modèle détermine si elle diffère du groupe de référence et, le cas échéant, l’ampleur de cet écart. L’évaluation peut se faire soit en utilisant les variables décrivant la communauté, en déterminant si le site se trouve dans l’étendue de variation observée aux sites de référence (deux écarts-types [ET]), ou encore en utilisant des méthodes d’ordination pour déterminer si le site exposé se retrouve dans l’ellipse de probabilité à 95 % des sites de références jumelés.
Selon le moment et l’endroit où se déroule l’échantillonnage, la base de données ainsi constituée pourra également être utilisée pour effectuer des comparaisons par analyse de variance entre les zones de référence et les zones exposées.
Une fois la base de données établie, l’ACR peut être utilisée comme méthode d’évaluation biologique rapide et pour examiner des enjeux d’envergure nationale et locale à l’aide de la même base de données et du même logiciel. En raison de l’ampleur de l’effort d’échantillonnage requis au départ, l’application de cette approche à une seule mine de métaux située dans une région éloignée est peu possible, à moins qu’une base de données de référence existe déjà. Toutefois, son application peut être envisagée dans les régions comportant plusieurs industries (dont des secteurs industriels faisant l’objet d’une ESEE). Dans ces conditions, il peut être utile et rentable pour plusieurs usagers de collaborer à la constitution de la base de données de référence. Pour de plus amples renseignements sur l’ACR, voir Bailey et al. (2003).
Pour aider l’industrie à localiser des sites de référence propices au Programme d’ESEE, l’Unité conjointe d’écologie d’eau douce de l’Université Laurentienne a dirigé le réseau de biosurveillance par l’ACR des invertébrés benthiques du nord de l’Ontario (Northern Ontario RCA Network). Pour en savoir plus sur ce réseau, veuillez consulter le site Web suivant (en anglais seulement).
Le Réseau canadien de biosurveillance aquatique (RCBA) est un programme de collaboration mis sur pied et maintenu par Environnement Canada qui vise à établir un réseau de sites de référence en utilisant l’approche des conditions de référence. Tous les utilisateurs intéressés à évaluer la santé biologique des eaux douces du Canada peuvent accéder à cette information. Pour en savoir plus sur le RCBA, veuillez consulter son site Web.
| Type de plan | Milieu récepteur | Zone de référence (contrôle) | Zone exposée (impact) |
Méthode statistique |
|---|---|---|---|---|
| Contrôle-impact (C-I) Figure 4-2 |
Cours d’eau ou lacs homogènes ou estuaires de faible salinité. | Une seule zone de référence en amont du point de rejet final de l’effluent de la mine de métaux. | Zone fortement exposée (des zones exposées sont ajoutées pour l’étude de l’ampleur et de la portée géographique). | ANOVA |
| Contrôle-impact multiple (C-IM) Figure 4-2d, e, f |
Cours d’eau ou lacs à rives homogènes, estuaires et zones côtières homogènes. | Zones de référence multiples dans un même bassin hydrologique ou une même baie, ou dans un bassin ou une baie adjacents similaires. | Zone fortement exposée (des zones exposées sont ajoutées pour l’étude de l’ampleur et de la portée géographique). | ANOVA |
| Avant-après-contrôle-impact (BACI) | Les mêmes que ceux des plans contrôle-impact et contrôle-impact multiple | Les mêmes que celles des plans contrôle-impact et contrôle-impact multiple, mais des données sont recueillies avant et après le rejet de l’effluent | Les mêmes que celles des plans contrôle-impact et contrôle-impact multiple, mais des données sont recueillies avant et après le rejet de l’effluent | ANOVA |
| Gradient linéaire (GL) Figure 4-3a, b |
Cours d’eau ou lacs présentant des contraintes géographiques, estuaires étroits, non homogènes ou baies marines, bras de mer ou fjords présentant des contraintes géographiques. | Série de stations de référence non exposées ou faiblement exposées à l’effluent et situées vers la fin d’un gradient décroissant d’exposition à l’effluent de la mine de métaux. |
Gradient unique décroissant de la concentration de l’effluent dans le milieu récepteur. | Régression/ ANCOVA |
| Gradient radial (GR) Figure 4-3c |
Lacs, baies marines ouvertes non homogènes et zones côtières. | Comme ci-dessus, mais les stations sont situées vers l’extrémité de plusieurs gradients radiaux. | Comme ci-dessus, mais les gradients sont répétés de façon radiale. | Comme ci-dessus |
| Gradients multiples (GM) Figure 4-3d, e |
Lacs ou cours d’eau, Baies marines ouvertes non homogènes ou zones côtières. |
Série de stations de référence non exposées à l’effluent, réparties le long d’un transect suivant un gradient environnemental comparable à celui observé dans la zone exposée. | Gradient de concentrations d’effluent de plus en plus faibles et gradient environnemental concomitant dans le milieu récepteur. | ANCOVA, les transects de référence et exposés considérés comme groupes de traitement. |
| Approche des conditions de référence (ACR) Figure 4-4 |
Cours d’eau ou lacs, en particulier pour les projets d’études conjoints ou lorsqu’une base de données sur les conditions de référence existe. | Séries multiples de stations de référence non exposées ou faiblement exposées à l’effluent situées dans des bassins hydrographiques similaires, à l’intérieur d’une même écorégion. | Série de stations situées dans la zone exposée, comparées individuellement à la distribution des stations de référence. | Analyse multivaria-ble/ANOVA (si possible) |
Note : les données recueillies suivant l’un ou l’autre des plans ci-dessus peuvent être soumises à des analyses multivariables afin de distinguer des tendances (c.-à-d. sans tests d’hypothèses) qui peuvent être utiles pour déterminer des zones potentiellement préoccupantes.
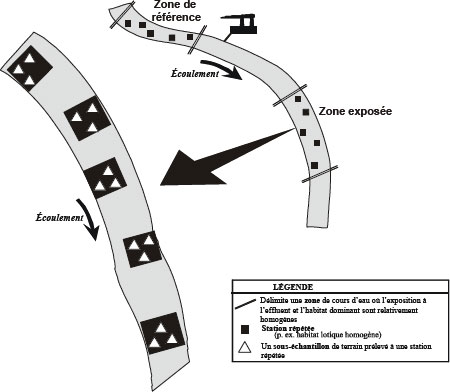
Figure 4-1 : Exemples de l’échelle spatiale d’une zone, d’une station répétée et d’un sous-échantillon de terrain pour un plan d’étude de type contrôle-impact (description longue)
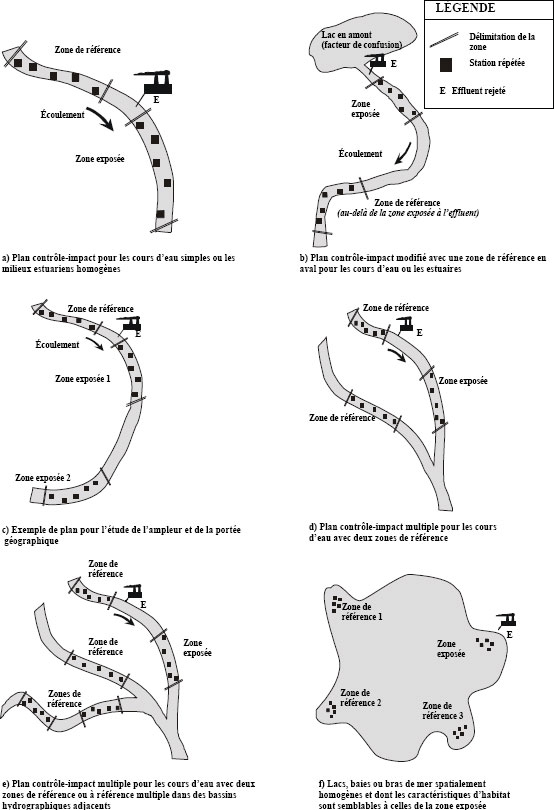
Figure 4-2 : Plans d’étude contrôle-impact (description longue)
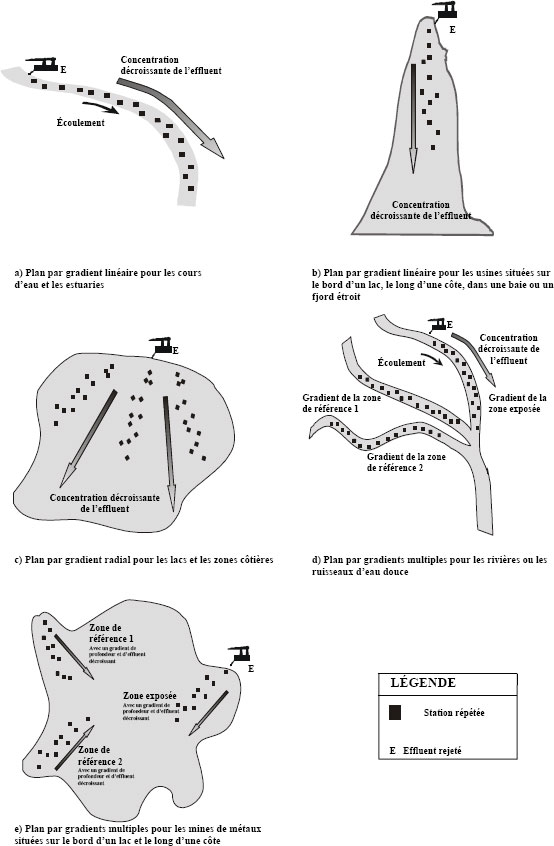
Figure 4-3 : Plans d’étude par gradients (description longue)
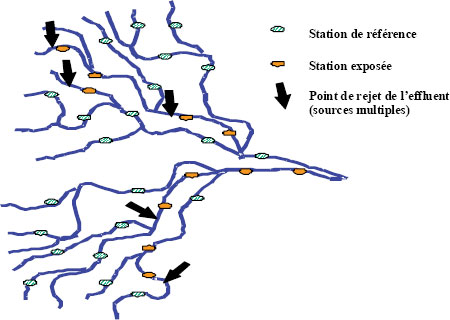
Figure 4-4 : Approche des conditions de référence (description longue)
4.3.6 Répartition des zones de référence et des zones exposées selon les phases de l’ESEE
La répartition des zones de référence et des zones exposées dépend du plan d’étude choisi et de la phase du Programme d’ESEE.
Lors de la phase 1, l’objectif consiste à déterminer si l’effluent d’une mine de métaux a des effets sur la communauté d’invertébrés benthiques de la zone fortement exposée à l’effluent, où la présence d’un effet est le plus vraisemblable. Cette restriction spatiale de l’examen a pour objectif de concentrer l’effort d’échantillonnage dans une perspective de rentabilité. Cet objectif devrait sous-tendre le choix du plan d’étude et la répartition des zones de référence et des zones exposées.
Pour les phases subséquentes, les objectifs sont de confirmer les résultats, de détecter les changements et de recueillir des données de suivi des tendances. Comme ces objectifs visent une échelle géographique semblable à celle de la phase 1, les critères de sélection des zones de référence et exposées devraient être les mêmes. Toutefois, comme pour tout programme de surveillance continue, le caractère adéquat de la sélection des zones de référence et exposées doit être réévalué au fur et à mesure que de nouvelles données sont acquises.
En ce qui concerne l’ampleur et la portée géographique, l’objectif consiste à déterminer l’étendue spatiale des effets détectés antérieurement. L’échantillonnage devrait donc être mené dans des zones exposées plus éloignées du point de rejet de l’effluent, jusqu’à ce que les conditions redeviennent similaires à celles des zones de référence. La répartition spatiale des multiples zones et stations exposées dépend du plan d’échantillonnage choisi. Si un facteur de confusion est détecté dans la zone peu exposée à l’effluent avant que les conditions redeviennent similaires à celles observées dans les zones de référence et si ce facteur ne peut être éliminé par une modification du plan d’étude (tableau 4-1), alors la zone exposée ne devrait pas s’étendre au-delà du point où le facteur de confusion a été détecté. D’autres plans d’étude ou méthodes efficientes peuvent également être appliqués (voir le chapitre 9 et le tableau 4-1).
En outre, durant l’examen des données de suivi, l’acceptabilité des zones de référence échantillonnées au cours des suivis précédents doit être réévaluée aux fins de l’étude de l’ampleur et de la portée géographique. La nouvelle portée géographique pourrait couvrir de nouveaux habitats, tels que des cours d’eau ou des lacs d’un ordre plus élevé. Si ces nouveaux habitats n’étaient pas représentés dans les zones de référence utilisées durant les suivis précédents, une réévaluation de l’acceptabilité de ces dernières sera nécessaire. L’ajout de zones de référence devrait également être envisagé si cette mesure permet d’établir un meilleur équilibre entre le nombre de zones de référence et le nombre de zones exposées.
Si les suivis antérieurs ont été menés avec l’ACR, il peut ne pas être nécessaire d’accroître le nombre de zones de référence (dans la mesure où elles représentent adéquatement les types d’habitat), mais il est recommandé d’en rééchantillonner un certain nombre afin de déterminer les effets de la variation temporelle naturelle.
4.3.7 Sélection d’habitats pertinents sur le plan écologique
4.3.7.1 Directives générales pour la sélection des habitats
Les habitats les plus représentatifs au plan écologique devraient être échantillonnés dans les zones exposées, et des habitats similaires doivent être repérés et échantillonnés dans les zones de référence. Les questions suivantes doivent orienter la sélection des types d’habitat appropriés :
- Quel type d’habitat est proportionnellement le plus important dans la zone exposée?
- Quel habitat, en l’absence de toute influence anthropique, abrite les plus riches assemblages d’invertébrés (diversité des invertébrés benthiques) à l’intérieur de la zone d’étude?
- Dans quel habitat les invertébrés sont-ils plus susceptibles d’être exposés de façon prolongée aux contaminants présents dans les sédiments ou dans l’eau?
- Existe-t-il des données historiques pour un habitat donné?
Il faut d’abord échantillonner l’habitat qui couvre la plus grande superficie de la zone exposée. Toutefois, d’autres facteurs peuvent justifier la sélection d’un autre habitat plus circonscrit. Ainsi, il peut être plus important, au plan écologique, d’échantillonner des habitats très sensibles et plus diversifiés, même s’ils couvrent une plus faible superficie de la zone à l’étude. Par exemple, dans les cours d’eau, les rapides peuvent abriter un assemblage diversifié d’espèces présentant des sensibilités fort diverses aux changements de la qualité de l’eau. En conséquence, la communauté de cet habitat risque de présenter des changements de plus forte amplitude que les communautés moins riches en espèces. En revanche, la faune des zones de sédimentation, bien qu’elle soit généralement moins riche au plan taxinomique, présente un intérêt pour les études de suivi biologique, car elle pourrait être directement exposée pendant des périodes plus longues aux contaminants dans les sédiments. La réaction des communautés des zones de sédimentation à la présence de contaminants pourrait donc être différente de celle des communautés plus sensibles, mais moins exposées, vivant dans les rapides. Pour de plus amples informations sur la sélection des habitats dans les cours d’eau, veuillez consulter Cuffney et al. (1993), Plafkin et al. (1989) et Meador et al. (1993).
4.3.7.2 Sélection des habitats pour le Programme d’ESEE
Le choix des habitats en vue de l’échantillonnage dépend des caractéristiques propres àchaque site. La décision d’échantillonner plus d’un habitat important au plan écologique au cours d’une même étude dépend de la phase du Programme d’ESEE.
Pour la phase 1 ainsi que les phases subséquentes, l’objectif est d’établir si l’effluent a des effets sur la communauté d’invertébrés benthiques; par conséquent, l’habitat où ces effets sont les plus susceptibles de se manifester devrait être échantillonné. S’il est établi que plus d’un habitat est important au plan écologique, l’effort devrait être accru pour échantillonner tous ces habitats durant l’évaluation de l’ampleur et de la portée géographique. Cette façon de faire permet de réduire le risque de ne pas détecter d’effets dans un habitat sensible ou la nécessité d’étendre l’étude à de nouveaux habitats durant les études subséquentes. Il peut être rentable d’accroître l’effort d’échantillonnage durant la même visite sur le terrain afin d’examiner certaines questions à propos de l’ampleur et la portée géographique des effets.
L’ajout de types d’habitat écologiquement importants ne devrait pas entraîner une réduction de l’effort d’échantillonnage dans l’habitat dominant. Pour la plupart des études de suivi biologique, la décision de restreindre l’échantillonnage à un seul habitat vise à réduire la variabilité inhérente à l’échantillonnage de substrats naturels. Cette variabilité ne ferait qu’augmenter si le même effort d’échantillonnage était étendu à plusieurs habitats différents.
En ce qui concerne la détermination de l’ampleur et de la portée géographique, les habitats les plus importants sur le plan écologique dans les zones exposées doivent être échantillonnés, et des habitats similaires doivent être repérés et échantillonnés dans les zones de référence. La détermination du nombre et des types d’habitat à échantillonner est fondée sur les résultats des suivis précédents, les caractéristiques particulières de chaque site et les objectifs de l’étude de l’ampleur et de la portée géographique. Par exemple, pour déterminer la portée géographique d’un effet observé, il peut être important d’échantillonner des habitats additionnels comme des cours d’eau ou des lacs d’un ordre supérieur. En revanche, si une réponse à l’effluent n’a été observée que dans un seul des types d’habitats échantillonnés lors des suivis précédents, l’échantillonnage durant l’étude de détermination de l’ampleur et de la portée géographique pourrait cibler ce type d’habitat.
4.3.7.3 Sélection des habitats marins et estuariens
En milieu marin ou estuarien, l’échantillonnage peut se dérouler soit dans des habitats de sédimentation, soit dans des habitats d’érosion. De plus, la décision d’échantillonner des substrats intertidaux plutôt que des substrats infralittoraux dépendra du milieu récepteur qui est approprié et de la possibilité d’obtenir des échantillons utiles. Les questions suivantes orientent la sélection des types d’habitat en milieu marin ou estuarien :
- Quels habitats est-il possible d’échantillonner?
L’habitat qui occupe la plus vaste superficie et qui risque le plus de subir les effets de l’effluent devrait être sélectionné. Toutefois, la sélection des habitats principaux est faite, en partie, en fonction de la faisabilité de l’échantillonnage. Par exemple, l’échantillonnage des invertébrés benthiques risque d’exiger des moyens techniques très lourds si l’habitat principal est un escarpement rocheux vertical qui plonge à une profondeur de 300 m immédiatement sous l’émissaire de l’effluent. L’échantillonnage serait également difficilement faisable si l’habitat principal est situé dans la zone intertidale et consiste en une falaise rocheuse escarpée balayée par de fortes vagues et exposée aux vents ou aux accumulations de glace. Par ailleurs, lorsque plusieurs habitats appropriés sont disponibles, un choix doit être fait. Dans certains cas, on pourra décider d’échantillonner plus d’un habitat (plan par gradient radial ou plan similaire). Les habitats à substrats mous devraient être choisis de préférence, puisqu’on peut généralement y utiliser des méthodes plus quantitatives.
- Quel est l’habitat le plus actif ou « important » au plan biologique?
Lorsque le milieu infralittoral le plus exposé à l’effluent est constitué à la fois de sédiments consolidés et non consolidés, il est possible d’échantillonner les deux types de sédiments ou de se limiter à un seul. Tout bien considéré, les sédiments non consolidés se prêtent plus facilement à un échantillonnage quantitatif. Toutefois, s’il apparaît évident que la couche superficielle (10 premiers centimètres; ou la profondeur de pénétration de l’appareil d’échantillonnage) d’un substrat composé de sable grossier n’abrite pratiquement aucun macro-organisme alors que le récif rocheux voisin est extrêmement riche et abrite un grand nombre d’espèces de poissons, c’est ce dernier habitat qui est le plus « actif » et qui devrait être choisi. De la même façon, si un des principaux types d’habitats directement exposés à l’effluent de la mine de métaux abrite une importante ressource halieutique, il pourra être jugé comme étant le plus important au plan biologique.
- L’habitat pertinent sur le plan écologique peut-il être « classifié » en fonction d’un type physique reconnu et d’espèces caractéristiques?
Les systèmes de classification des habitats ont été décrits et étudiés par de nombreux chercheurs et peuvent être utiles pour comparer les facteurs biotiques « attendus » aux facteurs biotiques réels observés au voisinage de la mine de métaux. Parmi les travaux applicables au milieu marin, mentionnons un document détaillé préparé à l’intention du ministère des Pêches et des Océans pour la délimitation du détroit de Georgia, le long de la côte ouest du Canada et du nord ouest des États-Unis (Watson, 1997). Des informations utiles sur la classification des habitats littoraux marins et des zones côtières profondes du monde sont fournies par Frith et al. (1993), Booth et al. (1996), Robinson et Levings (1995), Hay et al. (1996) et Robinson et al. (1996). La classification des milieux estuariens a été plus particulièrement étudiée par Matthews (1993), Scott et Jones (1995), Finlayson et van der Valk (1995) et Levings et Thom (1994). Aux États-Unis, le système le plus couramment utilisé est celui de Cowardin et al. (1979) et de Cowardin et Golet (1995), avec des améliorations proposées par divers autres auteurs.
- Du fait de la profondeur à laquelle il est rejeté ou de sa flottabilité, l’effluent risque-t-il d’influer davantage sur les zones intertidales ou infralittorales?
Si l’effluent est rejeté dans une zone intertidale et demeure principalement dans cette zone, c’est cette dernière qui devrait être retenue aux fins de l’échantillonnage. Toutefois, si l’effluent touche à la fois des habitats de la zone intertidale et de la zone infralittorale, on retiendra de préférence l’habitat infralittoral puisque les incidences sur les poissons y seront vraisemblablement plus importantes. Lorsque la situation s’y prête, les deux types d’habitats peuvent être échantillonnés. Il faudrait également prendre en compte les fluctuations saisonnières de la colonne d’eau, car celles-ci peuvent avoir des effets sur les zones intertidales.
- Quel type d’habitat occupe la plus grande superficie de la zone à l’étude?
Dans bien des cas, les substrats des habitats côtiers sont constitués d’un mélange de limon, de sable, de gravier et de roches. Dans les baies situées près de l’embouchure d’un cours d’eau, une accumulation de sédiments sablonneux ou limoneux est généralement observée. Les sédiments des zones d’étude estuariennes sont généralement constitués en large partie de substrats meubles provenant des rivières. Si les proportions d’habitats de sédimentation et d’érosion s’équivalent, il serait préférable d’effectuer l’échantillonnage dans les habitats de sédimentation, puisque c’est là que les substances rejetées dans l’effluent de la mine de métaux s’accumulent habituellement et que les effets néfastes risquent le plus de se manifester. Les substrats des zones d’érosion ont tendance à être « nettoyés » ou « récurés » par l’action du courant ou des vagues ou par l’érosion par la glace.
Cependant, si la proportion des milieux à substrats consolidés est largement supérieure à celle des substrats non consolidés, ou si les sédiments charriés par l’effluent de la mine de métaux ont commencé à se déposer le long d’une côte rocheuse autrefois non contaminée, il pourrait être préférable de choisir ce type d’habitat aux fins de l’échantillonnage.
- Existe-t-il des facteurs de confusion susceptibles d’influer sur les communautés d’invertébrés benthiques?
L’utilisation des communautés d’invertébrés benthiques présentes dans les zones d’échantillonnage soumises à des facteurs de confusion d’origine naturelle ou anthropique pour interpréter les effets d’une mine de métaux pose des problèmes et devrait, de toute évidence, être évitée. Par exemple, si des substrats consolidés et non consolidés sont présents, un seul de ces types de substrat peut se trouver hors de la zone d’influence des facteurs de confusion. Les effets saisonniers ou continus du gel ou de l’érosion par la glace constituent une source de facteur de confusion particulièrement importante dans les régions arctiques, en particulier dans les zones intertidales et infralittorales. Ces facteurs peuvent perturber considérablement les communautés de surface.
- Quel est le milieu touché par les rejets en zone infralittorale?
De toute évidence, c’est le milieu le plus exposé à l’effluent qui devrait être retenu aux fins de l’échantillonnage et qui déterminera le plan d’échantillonnage retenu. Dans un estuaire, si le rejet s’effectue à la surface et si la surface est composée d’une couche importante et permanente d’eau douce avec un faible apport d’eau salée en profondeur à marée haute, l’habitat dominant à échantillonner devrait se trouver en aval de la mine de métaux. Toutefois, si l’apport d’eau salée résultant de l’action des marées est important, l’échantillonnage devrait être effectué en amont et en aval de la mine de métaux. Un grand nombre d’autres facteurs de ce type doivent être pris en compte, et dans ces cas, il faut recueillir des informations détaillées en vue de mieux caractériser les habitats et la dispersion de l’effluent.
En résumé, lorsque plusieurs habitats se prêtent à l’échantillonnage, il est premièrement recommandé d’échantillonner les habitats infralittoraux, car ceux-ci présentent habituellement une diversité faunique plus élevée et les organismes y sont moins répartis par îlots que dans les habitats intertidaux, les conditions y étant moins extrêmes ou rigoureuses. Ces caractéristiques sont particulièrement évidentes dans l’Arctique, où les conditions hivernales extrêmement rigoureuses peuvent entraîner l’élimination de la plupart des organismes à espérance de vie plus longue qui intègrent habituellement les effets des contaminants de façon plus évidente. Deuxièmement, la préséance devrait être accordée aux zones de sédimentation, particulièrement dans les zones infralittorales, car l’échantillonnage y présente moins de difficultés et permet l’utilisation de méthodes plus quantitatives. De plus, les contaminants s’accumulent habituellement dans les zones de sédimentation, alors qu’ils ne le font généralement pas dans les zones d’érosion.
4.3.8 Sélection des saisons d’échantillonnage pertinentes sur le plan écologique
4.3.8.1 Directives générales pour la sélection des saisons d’échantillonnage
Toutes les études des communautés d’invertébrés benthiques devraient se dérouler durant les saisons les plus pertinentes sur le plan écologique. L’échantillonnage devrait se tenir durant une période de rejet de l’effluent et après que le milieu récepteur a été exposé à l’effluent pendant une période suffisante, durant laquelle on peut raisonnablement s’attendre à ce que des effets se produisent (en général de trois à six mois).
La période de l’année à choisir de préférence devrait être celle durant laquelle la diversité biologique est maximale, car cette période correspond aux cycles saisonniers de recrutement des organismes benthiques (généralement liés au climat et à l’abondance de nourriture). De nombreux insectes dont le cycle biologique comporte un stade aquatique se reproduisent au printemps et à l’automne. D’autres, cependant, produisent plusieurs cohortes durant la période de l’année où les plans d’eau sont libres de glace. Dans de nombreux habitats lotiques, l’échantillonnage est effectué en automne (septembre-octobre), alors que la plupart des taxons sont présents ou ont atteint une taille suffisante pour être récoltés à l’aide de l’équipement d’échantillonnage et que les régimes d’écoulement sont favorables. Dans les grands lacs où les communautés benthiques sont souvent dominées par les annélides, les crustacés et les mollusques, les périodes d’émergence des insectes et les régimes hydrologiques jouent un rôle moins important dans la détermination du calendrier d’échantillonnage (Rosenberg et Resh, 1993).
Si des données historiques sur la communauté d’invertébrés benthiques existent pour le système à l’étude, il peut être utile d’examiner ces données et, le cas échéant, de procéder à des échantillonnages pendant les mêmes périodes à des fins de comparaisons. Parmi les autres facteurs qui sont susceptibles d’influer sur le choix de la période d’échantillonnage, mentionnons les fluctuations saisonnières du débit (en particulier les débits d’étiage et de crue), le gel et l’érosion par la glace, les cycles de rejets de la mine de métaux, le type d’équipement d’échantillonnage choisi, la faisabilité de l’échantillonnage et la sécurité du personnel sur le terrain. Il faut éviter les périodes où il n’y a pas de rejet d’effluent. La détermination du calendrier d’échantillonnage exige une bonne connaissance des fluctuations saisonnières et du cycle vital des organismes benthiques ainsi que de l’évolution du régime hydrologique du système étudié. Rosenberg et Resh (1993), Johnson et al. (1993), Rees (1984), Malley et Reynolds (1979), Barber et Kevern (1974) et Jonasson (1955) fournissent des indications utiles pour le choix de la période d’échantillonnage.
4.3.8.2 Sélection de la saison d’échantillonnage pour les phases du Programme d’ESEE
Il est recommandé de restreindre l’échantillonnage à une seule saison, à moins que les données existantes révèlent l’existence de plus d’une période critique pour la communauté d’invertébrés benthiques du bassin à l’étude. Comme cette saison d’échantillonnage sera retenue au cours des études subséquentes, il est important de prendre cette décision après avoir examiné toutes les données existantes propres au site concernant les cycles vitaux des taxons présents et les régimes hydrologiques.
De même, la saison d’échantillonnage adoptée aux fins de la détermination de l’ampleur et de la portée géographique devrait être la même que celle choisie pour les suivis antérieurs, à moins que l’examen des données existantes justifie la modification du calendrier d’échantillonnage pour des raisons scientifiques ou logistiques. En outre, l’ajout de saisons peut être indiqué pour évaluer l’ampleur de la réponse de la communauté d’invertébrés benthiques. Par exemple, si l’échantillonnage se fait lorsqu’un stade du cycle vital d’un invertébré donné est absent, il peut être nécessaire d’ajouter une saison d’échantillonnage pour évaluer si des effets sont présents chez cet invertébré. Les bivalves, par exemple, ne sont pas facilement échantillonnés en automne. Or, l’automne est une période critique pour de nombreux autres invertébrés. Dans ce cas, une saison pourrait être ajoutée au programme de suivi, et le plan d’échantillonnage adapté pour résoudre ce problème propre au site (activité additionnelle d’échantillonnage en été à l’aide de méthodes spécialement conçues pour les bivalves).
Pour la plupart des zones estuariennes et marines, l’échantillonnage peut se dérouler n’importe quand entre le printemps et le milieu de l’automne. Pour les milieux marins situés en zones tempérées, l’échantillonnage des invertébrés benthiques est habituellement réalisé à la fin de l’été ou à l’automne, car de nombreux organismes benthiques comportent un stade larvaire planctonique qui n’atteint pas le fond avant cette période. En outre, les populations dont le recrutement se produit au printemps se sont alors stabilisées. Dans l’Arctique, l’échantillonnage est normalement réalisé à la fin de l’été ou le début de l’automne, lorsque la longue durée d’éclairement et les températures plus chaudes ont permis à la flore et à la faune de croître et de se développer, et que la surface de la mer est encore libre de glace. En général, la période de reproduction et les fluctuations de l’abondance des organismes benthiques sont liées au cycle des marées, aux saisons et à l’abondance de la nourriture.
4.4 Aspects statistiques pour les plans d’étude
Des directives générales relatives aux aspects statistiques (p. ex., sélection des valeurs de a et de b et détermination de l’effort d’échantillonnage) sont présentées au chapitre 8. La présente section fournit des directives précises sur les statistiques appliquées aux invertébrés benthiques, notamment l’effort d’échantillonnage et l’utilisation d’ellipses de probabilité dans l’espace d’ordination pour l’ACR. En outre, on indique comment déterminer le nombre de sous-échantillons de terrain à prendre à une station donnée et comment utiliser les données tirées de ces sous-échantillons pour améliorer les futurs plans d’étude.
Il convient ici de rappeler que, bien que l’ACR puisse être utilisée pour présenter les résultats de l’étude de la communauté d’invertébrés benthiques, les mines de métaux doivent aussi soumettre l’information relative aux critères d’effets qui sont prescrits par le REMM (voir section 4.9).
4.4.1 Détermination de l’effort d’échantillonnage pour l’ACR
Lorsque l’approche des conditions de référence est utilisée, la question de la répétition est différente. La répétition est appliquée à l’échelle de la station et, puisque que la variation à l’intérieur d’une station est souvent nettement inférieure à la variation entre les stations, des échantillons individuels sont prélevés à chaque station, et la variation entre les stations est utilisée pour décrire les conditions de référence. Le nombre de réplicats de référence est déterminé par le nombre de stations dans le groupe auquel la station exposée appartient selon la prévision de l’ACR. Ce nombre est déterminé au moment de la formation des groupes de stations de référence, lors de la classification initiale (voir la section 4.3.5), mais il a été établi à au moins 10 stations. La variation entre les stations de référence formant le groupe de référence détermine l’erreur de type I, fixée à 0,1 à l’aide d’une ellipse de probabilité de 90 %. Comme cette approche prévoit la comparaison de stations exposées individuelles à des stations de référence multiples (minimum de 10), il est impossible d’établir la valeur de l’erreur de type II, qui nécessite une estimation de la variance associée à une station unique. Une autre façon de faire consiste à prélever plus d’un échantillon à la station exposée, mais ce procédé renseigne sur la variation à l’intérieur de chaque station, et non pas sur celle qui existe entre les stations. Il est clair que l’erreur de type II associée à la station ne peut être déterminée avec une seule station exposée. Les analyses de puissance décrites ci-dessus ne conviennent donc pas au plan ACR. Par conséquent, les études menées selon ce plan doivent être conçues de manière à permettre une détermination exacte et précise des conditions de référence et à ainsi accroître la probabilité de détecter les éventuels écarts par rapport aux conditions de référence dans les stations exposées.
4.4.2 Détermination de l’effort d’échantillonnage pour le sous-échantillonnage sur le terrain
Le prélèvement de sous-échantillons multiples à chaque station répétée vise à faire en sorte que l’effort d’échantillonnage permette d’obtenir une estimation juste des différentes variables à l’étude (p. ex., nombre de taxons, densité, etc.) pour chacune des stations échantillonnées. Cette approche est nécessaire parce que la répartition des espèces peut ne pas être homogène à l’intérieur d’une station (dont les dimensions sont largement supérieures à celles du dispositif d’échantillonnage utilisé). Un sous-échantillonnage inadéquat : 1) fournit une estimation peu précise de la vraie moyenne à chaque station et 2) peut contribuer à gonfler l’estimation de la vraie variance entre les stations et, par le fait même, à réduire la puissance des analyses.
Par conséquent, la répartition des sous-échantillons de terrain à l’intérieur de chaque station répétée dépend des deux facteurs interdépendants suivants (voir ci-dessous), qui doivent être pris en considération dans tout exercice de conception d’un plan d’échantillonnage des invertébrés benthiques. Toutefois, en l’absence d’informations existantes, il est recommandé de prélever au moins trois sous-échantillons à chaque station.
1. Relation entre l’abondance (ou la densité) et le degré d’agrégation des organismes et le niveau de précision souhaitée pour les estimations à chaque station.
Pour une station donnée, le nombre de sous-échantillons de terrain doit être suffisant pour fournir une moyenne et une variance attestant de la capture d’un nombre représentatif d’organismes (voir la synthèse de Burd et al., 1990). Plus le degré d’agrégation d’une communauté s’élève, plus la variance de l’abondance moyenne augmente dans chaque station répétée. Elliott (1977) et Holme et McIntyre (1984) ont proposé la même méthode simple de détermination du nombre de sous-échantillons requis pour obtenir un niveau prédéfini de précision. Selon Elliott (1977), un indice de précision (D) de 20 % (erreur type égale à 20 % de la moyenne) est acceptable pour la plupart des échantillons de benthos. Le nombre de sous-échantillons de terrain peut alors être déterminé à l’aide de l’équation suivante :
n = s2/D2 X̄2
où
X̄ = moyenne de l’échantillon
n = nombre de sous-échantillons de terrain
s2 = variance de l’échantillon
D = indice de précision (c.-à-d. 0,20)
Donc, pour déterminer le nombre de sous-échantillons de terrain (c.-à-d. nombre de coups de benne) qu’il faut prélever dans chaque station répétée pour obtenir une estimation avec un degré de précision de 20 %, il est possible d’utiliser les données disponibles pour calculer la moyenne et la variance et, ainsi, le nombre approprié de sous-échantillons de terrain. Ce nombre peut varier d’un site à l’autre, en réponse aux changements du rapport de la moyenne à la variance. Il est donc recommandé de calculer le nombre de sous-échantillons pour les sites qui présentent la plus grande variabilité et d’appliquer les valeurs obtenues à toutes les zones, de manière à uniformiser l’effort d’échantillonnage. Cette recommandation prudente fournit des estimations plus précises dans les habitats plus homogènes, mais elle permet d’uniformiser l’effort d’échantillonnage entre les zones et les stations répétées. Il faut en outre noter que dans le cas des populations agrégées, bien que la moyenne globale ne devrait pas varier, selon l’échelle d’agrégation par rapport à la taille de l’échantillonneur, la variance varie en fonction de la taille de l’échantillonneur. Par conséquent, les estimations de la taille de l’échantillon fondées sur des données préliminaires ne sont pertinentes que pour un programme qui utilise un échantillonneur du même type et de la même taille que celui qui a servi à la collecte des données préliminaires. Lorsqu’il est impossible de déterminer l’effort d’échantillonnage à partir des données d’une phase antérieure de l’étude, le dénombrement des organismes dans les sous-échantillons prélevés dans le cadre de l’étude en cours au moment de leur traitement et le calcul des moyennes et des variances permettent de déterminer le nombre d’échantillons qui doivent être traités en laboratoire. Toutefois, cette approche a posteriori suppose qu’un nombre suffisant d’échantillons ont été prélevés sur le terrain, ainsi, l’effort consacré au calcul de la taille de l’échantillon a priori à l’intérieur d’une station répétée devrait minimiser les problèmes causés par un effort d’échantillonnage insuffisant.
Une autre approche utilise l’abondance et la variance pour déterminer l’effort de sous-échantillonnage et la précision et peut être utilisée pour déterminer le nombre de sous-échantillons de terrain à prélever à chacune des stations répétées. Cette méthode est fondée sur la relation qui existe entre l’abondance moyenne à une station donnée et la variance entre toutes les stations répétées dans la zone ou le long du gradient à l’étude. Downing (1979, 1986) a utilisé la loi de puissance de Taylor (1961) pour estimer le degré d’agrégation dans une communauté d’invertébrés benthiques dulcicoles et ainsi déterminer l’effort d’échantillonnage requis pour réduire la variance à un niveau acceptable. Il faut en effet un nombre donné d’organismes dans chaque station répétée pour estimer avec la précision requise l’abondance moyenne à partir de l’échantillon. Vézina (1988) a utilisé la même méthode pour déterminer empiriquement le degré d’agrégation de communautés benthiques marines. L’équation de régression de la puissance décrivant la relation entre le logarithme de l’abondance moyenne à une station donnée et le logarithme de la variance entre toutes les stations donne une formule qui est ensuite utilisée pour déterminer la variance estimée attendue pour une abondance donnée d’organismes dans la région visée par l’étude. Avec cette formule, la variance estimée pour chaque valeur d’abondance moyenne à chaque station répétée est calculée et est ensuite utilisée, comme l’a fait Elliott (1977), pour estimer le nombre de sous-échantillons à prélever à cette station répétée. Les méthodes d’Elliott (1977) et de Downing (1979) se distinguent par le fait que la variance utilisée dans l’équation pour déterminer le nombre de sous-échantillons de terrain est fondée, dans le premier cas, sur la variance de l’échantillon et, dans le deuxième cas, sur la variance calculée pour la moyenne de l’échantillon à partir de l’équation de régression de la puissance pour tous les échantillons de la région étudiée. En outre, l’indice d’agrégation (pente) de l’équation de régression de la puissance peut ensuite être utilisé pour déterminer la transformation de données la plus appropriée aux fins des analyses statistiques paramétriques. Malheureusement, cette méthode présume que l’agrégation est uniforme dans toute la région d’étude, ce qui n’est pas nécessairement le cas lorsqu’un agent de stress environnemental externe intervient. Toutefois, la qualité de l’ajustement des données de moyenne et de variance à l’équation de régression logarithmique fournit une bonne indication du degré de validité de l’hypothèse d’agrégation homogène. Le cas échéant, les valeurs aberrantes doivent être exclues de l’analyse afin d’éviter une distorsion des résultats. Comme le degré d’agrégation des communautés benthiques peut varier sous l’influence de changements des conditions environnementales d’origine naturelle ou anthropique, il est conseillé d’examiner la relation qui existe entre la moyenne et la variance chaque fois qu’on procède à un échantillonnage du benthos. Enfin, il convient de noter que « l’équation de régression de puissance » utilisée ici pour le calcul du nombre de sous-échantillons de terrain ne présente aucun lien avec les analyses de puissance servant à déterminer le nombre de stations répétées (voir les sections précédentes).
2. Relation entre le nombre et la distribution des différentes espèces et la représentativité des échantillons.
Pour vérifier si le nombre d’espèces échantillonnées est suffisant, il est possible d’utiliser des méthodes simples de raréfaction comme la « courbe de l’abondance des espèces » ou la courbe des espèces en fonction de la superficie d’échantillonnage (voir Burd et al., 1990), lesquelles comparent le nombre d’espèces obtenu au nombre de spécimens pour différents nombres de répétitions groupées. Cette analyse est particulièrement importante dans les régions arctiques, où la diversité peut être élevée, mais seulement à une échelle spatiale dépassant largement la portée de l’échantillonnage. En d’autres mots, le nombre d’espèces par rapport à l’abondance est élevé, mais l’abondance est passablement faible. La même situation peut également se présenter en haute mer. En raison des hypothèses inhérentes à la distribution des organismes sous-entendues dans le cas des courbes logarithmiques d’abondance des espèces, la méthode fondée sur la courbe de la similarité en fonction de la superficie échantillonnée, qui utilise des indices de similarité calculés avec des données de présence/absence afin de déterminer l’effort d’échantillonnage requis pour obtenir un degré de similarité globale acceptable de la faune entre les stations répétées, apparaît mieux adaptée à la situation (Weinberg, 1978; Kronberg, 1987).
Si les données préliminaires font défaut ou ne permettent pas de déterminer le nombre de sous-échantillons de terrain requis pour obtenir une collection représentative d’espèces, une vérification très simple de l’effort d’échantillonnage peut être effectuée. S’il est estimé qu’un nombre X d’échantillons par station répétée suffit pour atteindre l’objectif de qualité des données visant à récupérer 95 % des espèces benthiques présentes à n’importe quelle des stations répétées, des échantillons supplémentaires peuvent être recueillis et analysés dans quelques stations choisies. La détermination de la diversité maximale obtenue à l’aide de ces échantillons supplémentaires permettra d’établir si le nombre initial d’échantillons suffisait pour atteindre l’objectif de 95 % (à l’aide d’une courbe espèces/superficie).
4.4.3 Utilisation d’ellipses de probabilité pour les plans ACR
Dans le cadre d’une vaste étude sur la qualité de l’eau des cours d’eau réalisée au Royaume-Uni en 1990, un certain nombre de méthodes permettant de circonscrire le continuum de réponses en une série de bandes représentant les niveaux de qualité biologique ont été élaborées (Clarke et al., 1992). Cette étude a fourni une représentation simplifiée du continuum de réponses dans des sites présentant une qualité biologique allant d’élevée à faible. Cette approche était considérée comme un mécanisme approprié pour obtenir un constat de la qualité biologique et établir des comparaisons générales dans le temps et l’espace utiles à des fins de gestion. Du point de vue de la gestion, il est souhaitable de pouvoir assigner un niveau de perturbation. À cette fin, il faut établir des catégories de réponse allant de faible à grave. Dans l’étude précitée (Clarke et al., 1992), un certain nombre de systèmes de classification des réponses ont été considérés et évalués. Le seuil entre les sites non stressés et stressés (bande A) a été fixé au seuil de probabilité de 90 % (écart-type [ET] = 1,64) pour le nombre de taxons et le score BMWP (Biological Monitoring Working Party) et à 95% pour le score moyen par taxon (« Average score per taxon », ou ASPT). En Australie, le seuil est fixé à 2 ET pour le nombre moyen de taxons au site de référence. Enfin, la valeur de 95 % est souvent retenue comme limite pour la détermination d’un effet biologique pour les données univariables et les descripteurs simples des communautés (Lowell, 1997). Au Royaume-Uni, Wright (1995) a distingué les différents niveaux de perturbation en quantifiant les seuils pour les sites stressés et non stressés à l’aide de trois bandes de dimensions égales. Selon Wright (1995), il n’y a aucune raison logique de choisir un autre système pour diviser le continuum de sites.
Une approche similaire peut être utilisée pour établir des niveaux d’impact à l’aide de méthodes d’ordination multidimensionnelle. L’assemblage d’invertébrés de référence peut être décrit d’après sa distribution dans un espace réduit, et l’assemblage de tout site donné peut être caractérisé par sa position dans cet espace bidimensionnel (X et Y) (figure 4-5). Plus la similarité entre les sites est grande, plus ils seront rapprochés l’un de l’autre dans cet espace XY. Si cette approche est utilisée pour déterminer la taille de l’effet pour un assemblage d’invertébrés, il faut positionner tous les sites de référence dans cet espace avec le site à l’étude. La probabilité que le site étudié soit comparable aux sites de référence est déterminée en traçant des ellipses de probabilité pour les sites de référence seulement. Reynoldson et al. (1995) ont choisi l’ellipse de probabilité de 90 % comme représentant la première bande, soit le seuil à partir duquel un site peut être considéré comme équivalent aux sites de référence. La justification du choix de cette ellipse plutôt que de l’ellipse de 95 %, plus courante, est fondée sur le fait que l’approche multivariable est plus bruyante que les mesures univariables; par conséquent, il a été jugé approprié d’adopter un seuil plus conservateur. Les sites dans l’espace réduit compris dans l’ellipse la plus petite (probabilité de 90 %) seraient considérés comme équivalents aux sites de référence et, de ce fait, non perturbés. Deux autres ellipses de probabilité (figure 4-5), de même largeur, sont utilisées pour raffiner l’examen des écarts par rapport aux sites de référence, en accord avec les arguments de Wright et ses collaborateurs (Clarke et al., 1992; Wright, 1995). Les sites compris entre l’ellipse la plus petite (90 %) et l’ellipse suivante (99 %) peuvent être considérés comme potentiellement différents, la probabilité que la variabilité naturelle soit en cause s’élevant à 10 %. Les sites compris entre l’ellipse de 99 % et la plus grande ellipse (99,9 %) sont considérés comme différents, la probabilité qu’il en soit autrement s’élevant à seulement 1 %. Enfin, les sites se trouvant à l’extérieur de l’ellipse de 99,9 % sont déclarés très différents.
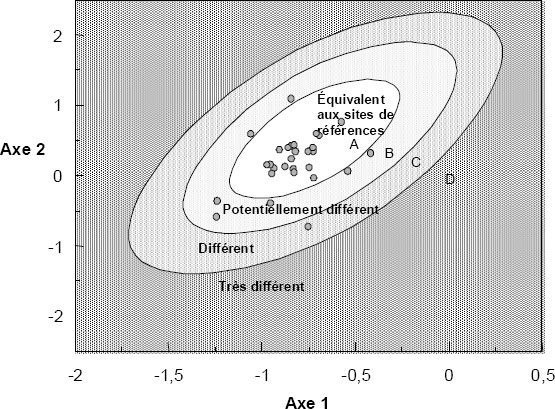
Note : Les bandes, fondées sur des ellipses de probabilité de 90 %, 99 % et 99,9 %, sont identifiées respectivement par les lettres A (non perturbé), B (potentiellement perturbé), C (perturbé) et D (fortement perturbé).
Figure 4-5 : Niveaux de stress entraînant une perturbation déduits à partir de la position des sites de référence dans un espace d’ordination hybride multidimensionnel (« hybrid multidimensional scaling ordination space ») (description longue)
4.5 Méthodes de terrain pour le suivi de la communauté d’invertébrés benthiques
4.5.1 Maillage des dispositifs d’échantillonnage
Les échantillons d’invertébrés benthiques renferment habituellement diverses quantités de sédiments fins et de débris. Pour accélérer le transfert des échantillons dans les récipients à échantillon, ainsi que leur entreposage et leur expédition, le volume de ces échantillons est réduit sur le terrain par tamisage. Ce tamisage devrait être réalisé le plus rapidement possible, de préférence immédiatement après la récupération des échantillons et avant leur conservation, car de nombreux organismes deviennent fragiles et cassants après la conservation. Diverses techniques de tamisage existent, mais la plupart prévoient le lavage des échantillons avec un tamis ou un ensemble de tamis.
Pour les études en eau douce, la taille recommandée pour les mailles des filets et tamis est de 500 µm.
En eau douce, les macroinvertébrés sont définis comme étant tous les organismes retenus par des mailles de 200 à 500 µm (Slack et al., 1973; Weber, 1973; Wiederholm, 1980; Suess, 1982). Les stades immatures de certains taxons peuvent être plus petits, et les adultes de certains autres, plus grands.
Il faut noter que les maillages recommandés s’appliquent à tous les équipements utilisés sur le terrain et en laboratoire, qu’il s’agisse des filets en Nitex des échantillonneurs de benthos ou du dispositif de tamisage.
Dans certaines circonstances propres à un site, il peut être souhaitable de récupérer les organismes plus petits en utilisant un tamis à mailles plus fines (moins de 500 µm). Ceci peut être justifié dans les cas suivants :
- pour des fins de comparaison si des tamis à mailles plus fines avaient été utilisés lors d’études du benthos effectuées antérieurement dans l’écosystème considéré;
- pour des raisons pratiques, si l’échantillonnage doit être effectué durant des périodes où les organismes sont très petits. Rees (1984), Barber et Kevern (1974) et Jonasson (1955) ont examiné les variations saisonnières de l’efficacité du tamisage.
Dans tous les cas susmentionnés, il est fortement recommandé d’utiliser une série de tamis comprenant au moins les mailles recommandées et, le cas échéant, des mailles plus fines. Cette façon de procéder tient compte des enjeux particuliers au site tout en satisfaisant aux objectifs du Programme d’ESEE, car elles permettent la tenue de comparaisons aux échelles nationale et régionale des échantillons recueillis à l’aide de tamis standardisés. Un tamisage fin peut être effectué sur le terrain, à condition de procéder en laboratoire au fractionnement approprié des échantillons à l’aide d’une série de tamis avant d’entreprendre le traitement.
Pour les invertébrés marins, le tamisage des échantillons est effectué avec de l’eau de mer et non de l’eau douce, car le choc osmotique causé par l’eau douce peut provoquer l’éclatement des cellules et une distorsion importante des organismes. Par ailleurs, le cas échéant, l’eau utilisée pour le tamisage devrait être débarrassée au préalable des organismes qu’elle peut contenir à l’aide d’un tamis à mailles plus petites que les mailles les plus fines utilisées aux fins de l’étude. En outre, il importe d’apporter un soin particulier au lavage des échantillons afin d’éviter d’endommager les spécimens et ainsi de réduire sérieusement la fiabilité des déterminations taxinomiques ainsi que la rentabilité globale de l’opération. Des méthodes visant à protéger les spécimens, en particulier dans les échantillons marins, ont été proposées (Gray et al., 1990).
Pour les études en milieu marin, il est recommandé d’utiliser sur le terrain une paire de tamis à mailles de 1 000 et de 500 mm et de conserver et de traiter les échantillons retenus par le tamis à mailles de 500 mm uniquement si cela s’avère approprié. Le macrobenthos marin englobe typiquement les organismes retenus par les mailles de 500 à 1 000 µm (Reish, 1959; Thiel, 1975; Pearson, 1975; Holme et McIntyre, 1984; Gray et al., 1990). Il a été estimé qu’un tamis à mailles de 1 000 mm retient environ 95 % de la biomasse de la macrofaune marine (Reish, 1959), tout en réduisant la proportion, dans les échantillons obtenus, des formes juvéniles ou des spécimens appartenant à la méiofaune, lesquelles présentent une réaction fonctionnelle aux perturbations de l’environnement différente de celle des adultes des espèces composant la macrofaune (Schwinghamer, 1981, 1983; Warwick, 1986).
L’étude des plus petits organismes benthiques pour la détermination de l’ampleur et de la portée géographique dans les écosystèmes marins peut inclure l’évaluation de la méiofaune, en particulier les nématodes, les copépodes et les plus petits oligochètes, ou encore celle des foraminifères vivants et morts (Schwinghamr, 1981, 1983) ou celle des formes juvéniles de la macrofaune. Toutes ces approches nécessitent l’utilisation de mailles plus fines ou d’échantillonneurs différents de ceux qui sont actuellement recommandés (les carottiers peuvent convenir davantage à de telles études que les bennes – voir Holme et McIntyre, 1984). Toutefois, s’il est important d’amasser des données sur les formes de plus petite taille, le simple ajout d’un tamis supplémentaire risque de ne pas donner les résultats escomptés. Il convient d’évaluer l’efficacité des techniques d’échantillonnage pour les organismes de petite taille. En milieu marin, Gray et al. (1990) ont indiqué que le carottier est l’instrument le plus approprié pour la récolte du méiobenthos. Or, ce type d’appareil n’est pas recommandé pour le Programme d’ESEE. Par conséquent, avant d’entreprendre un tamisage plus fin, il convient d’élaborer des protocoles d’échantillonnage appropriés.
4.5.2 Équipement d’échantillonnage
Les études sur le benthos comportent deux aspects importants qui doivent être pris en compte : le maillage (voir section précédente) et l’équipement d’échantillonnage quantitatif. L’échantillonnage quantitatif des communautés benthiques s’effectue à l’aide de dispositifs qui couvrent une superficie préétablie ou qui prélèvent un volume connu de l’habitat, comme les bennes ou les filets. Les dispositifs choisis doivent être non sélectifs et convenir à la nature particulière du substrat. Les échantillons de benthos prélevés dans les substrats naturels fournissent des indications sur les facteurs de stress historiques et actuels. Il est donc recommandé d’utiliser des échantillonneurs qui permettent de récolter les organismes présents dans les sédiments, à moins que des obstacles d’ordre physique rendent cette opération impossible. L’échantillonneur utilisé pour une classe d’habitat donnée devrait être le même pour toutes les stations et pour toutes les zones. Toutefois, l’utilisation d’échantillonneurs différents est permise au cours d’une même étude, mais uniquement pour l’échantillonnage de classes d’habitat différentes. Par exemple, si des habitats d’érosion et de sédimentation doivent être échantillonnés dans des zones de références et des zones exposées, une des bennes recommandées pourrait être utilisée pour les habitats de sédimentation, alors qu’un échantillonneur Hess conviendrait mieux pour les habitats d’érosion. Il est également recommandé d’utiliser des bennes munies d’un grillage et de portes s’ouvrant par le haut afin de limiter le phénomène d’onde de choc pouvant entraîner la perte d’une partie du substrat et de faciliter l’examen (et, au besoin, la caractérisation chimique) de la surface non perturbée des échantillons de sédiments.
L’uniformisation des échantillonneurs benthiques facilite la comparaison des données des études des invertébrés benthiques à l’échelle régionale ou nationale. Des recommandations sont fournies ci-dessous quant aux dispositifs appropriés à utiliser pour les diverses classes d’habitat rencontrées durant les études d’invertébrés benthiques dans le cadre de l’ESEE. Eleftheriou et Holme (1984), Klemm et al. (1990) et Scrimgeour et al. (1993) présentent les options appropriées pour divers milieux récepteurs potentiels et résument les avantages et les inconvénients des appareils recommandés. Le choix d’un échantillonneur peut également être dicté par le type d’appareil qui a été utilisé au cours des études antérieures effectuées dans le même milieu. Pour assurer la comparabilité des études avec les études précédentes, il est recommandé d’utiliser des échantillonneurs similaires. Le lecteur est invité à consulter les références traitant des échantillonneurs quantitatifs et des méthodes appropriées citées par Klemm et al. (1990), Eleftheriou et Holme (1984), Elliott et Tullett (1978, 1983), Rosenberg (1978), Downing (1984) et Mason (1991). Voir également Rabeni et Gibbs (1978) et alberta Environment (1990).
L’uniformisation des techniques ne vise pas uniquement les échantillonneurs utilisés, mais également le niveau d’expérience requis pour les employer correctement. Les personnes qui manipulent ces appareils doivent avoir reçu une formation appropriée pour réduire le plus possible les variations due aux erreurs de manipulation. Par exemple, lorsqu’on procède à l’échantillonnage d’une zone d’érosion dans un cours d’eau, il est important d’uniformiser la profondeur à laquelle le substrat est remué, car certaines personnes pourraient faire preuve à cet égard d’un zèle excessif en brassant le substrat plus profondément et vigoureusement que d’autres. Il est essentiel que le chef d’équipe connaisse bien les méthodes d’échantillonnage des invertébrés benthiques et organise des séances de formation efficaces à l’intention des employés chargés de l’échantillonnage sur le terrain. Une bonne formation prévient normalement les erreurs liées à l’utilisateur (Reynoldson et Rosenberg, 1996).
Habitats de sédimentation - eau douce
Les bennes sont des appareils à mâchoires actionnées par des ressorts ou par gravité qui « mordent » dans les substrats meubles (sable, limon, vase, etc.) et prélèvent des sédiments sur une superficie déterminée du fond. Ces appareils sont généralement descendus au fond au bout d’une ligne ou d’un câble à partir d’une embarcation, parfois à l’aide d’un treuil. Si le dispositif choisi n’est pas adapté au type de substrat à échantillonner, l’efficacité de l’échantillonnage peut être compromise. Parmi les facteurs qui peuvent influer sur l’efficacité de l’échantillonnage, mentionnons la profondeur de pénétration, le degré de fermeture des mâchoires et la perte de matériel pendant la remontée. Dans les zones de sédimentation des cours d’eau ou des lacs, les bennes Ponar ou Ekman sont recommandées pour l’échantillonnage des invertébrés aux fins des ESEE. Veuillez consulter Eleftheriou et Holme (1984), Klemm et al. (1990) et Scrimgeour et al. (1993) pour en savoir plus sur les échantillonneurs.
Habitats d’érosion - eau douce
Les échantillonneurs à filet pour les cours d’eau sont des dispositifs qui permettent de capturer les organismes benthiques dans les cours d’eau exposés à l’érosion. Ces dispositifs comportent des mailles de différentes tailles (voir la section 4.5.1) qui permettent de tamiser les organismes qui sont délogés du substrat sur une superficie connue et emportés par le courant. Pour les habitats d’érosion en eau douce, il est recommandé d’utiliser un échantillonneur cylindrique de type Neill-Hess, car ce dernier permet d’estimer la superficie échantillonnée (généralement, 0,1 m2). Un des inconvénients de l’utilisation d’échantillonneurs cylindriques dans les cours d’eau est leur incompatibilité possible avec la granulométrie du substrat. En effet, dans certains systèmes, la taille moyenne des particules pourrait être trop grande pour que l’échantillonneur cylindrique Neill-Hess puisse échantillonner efficacement les invertébrés benthiques. Dans ce cas, un filet en U (Scrimgeour et al., 1993) peut fournir des échantillons sur une superficie délimitée et peut être modifié selon la granulométrie du substrat. Ce dispositif a été utilisé avec succès dans des substrats de granulométrie diverse (Glozier, 1989) et permet l’échantillonnage tant de roches individuelles que de superficies délimitées. Le filet troubleau, même s’il ne fournit pas d’estimation pour une superficie connue, a été largement utilisé au Royaume-Uni, aux États-Unis, en Australie et au Canada dans le cadre de programmes de suivi à grande échelle (Reynoldson et al., 1995). L’échantillonnage au filet troubleau convient particulièrement à l’approche des conditions de référence (ACR), qui prévoit l’échantillonnage de nombreuses stations. Un échantillon est prélevé pendant un temps prédéterminé à chaque station aux fins de l’estimation des descripteurs de la communauté benthique. La normalisation des méthodes d’échantillonnage au filet troubleau est essentielle pour préserver le pouvoir de comparaison et exige une formation minimale (Reynoldson et Rosenberg, 1996). L’échantillonnage au filet troubleau prévoit le prélèvement d’un seul échantillon composite à chaque station en déplaçant le filet pour une période de trois minutes pendant que le substrat est perturbé (Reynoldson et al., 1997). Il convient de noter qu’il n’est pas nécessaire de conserver séparément les sous-échantillons de terrain pour la méthode d’échantillonnage au filet troubleau recommandée pour l’ACR.
Pour l’échantillonnage d’habitats plus difficiles (p. ex., zones très profondes, à faible courant ou zones à substrat dur), d’autres types d’échantillonneurs comme les quadrats en métal ou les systèmes d’extraction à l’air peuvent se révéler utiles. Toutefois, pour les besoins des comparaisons aux échelles nationale ou régionale, les dispositifs d’échantillonnage recommandés devraient convenir dans la majorité des habitats présentant un intérêt particulier au plan écologique. Pour les habitats où l’échantillonnage se révèle très difficile, d’autres méthodes peuvent être utilisées.
4.5.3 Substrats artificiels
L’utilisation de substrats artificiels pour l’échantillonnage des invertébrés benthiques n’est généralement pas recommandée comme protocole d’échantillonnage dans le cadre d’un Programme d’ESEE.
Il n’y a aucun avantage à utiliser des substrats artificiels, quand les méthodes courantes fournissent des données au moins aussi fiables que les substrats artificiels, sans leurs nombreux inconvénients et problèmes (AETE, 1995). Les substrats artificiels ne permettent pas d’obtenir des échantillons représentatifs de la communauté benthique indigène du site où ils sont placés. Il s’agit d’engins sélectifs qui favorisent les espèces mobiles, sujettes à la dérive, des substrats durs. En outre, les substrats artificiels ne permettent pas de surveiller adéquatement les effets des contaminants présents dans les sédiments ou liés à ces derniers sur les organismes aquatiques, car les taxons associés aux sédiments sont généralement sous-représentés dans les échantillons prélevés à l’aide de substrats artificiels. Les communautés d’invertébrés sur les substrats artificiels reflètent uniquement les conditions qui prévalaient durant la période d’exposition et n’intègrent pas les effets à plus long terme. L’utilisation de substrats artificiels pour l’échantillonnage des invertébrés benthiques peut donc se révéler inefficace pour détecter les effets des effluents, particulièrement lorsque les espèces non mobiles, les contaminants liés aux sédiments et l’intégration à long terme des effets sont importants. Toutefois, il convient de noter que dans certaines circonstances particulières, notamment lorsque des substrats artificiels sont utilisés depuis longtemps dans un écosystème ou en présence de conditions extrêmes (plans d’eau très profonds à courant très fort), l’utilisation de substrats artificiels peut s’avérer la seule méthode de terrain possible et peut être envisagée conjointement à d’autres solutions de rechange, si elle permet de déterminer d’éventuels effets sur la communauté d’invertébrés benthiques d’une manière scientifiquement défendable.
4.5.4 Équipement d’échantillonnage dans les habitats marins et estuariens
Habitats de sédimentation – milieux marins et estuariens
Les habitats de sédimentation marins peuvent être échantillonnés à l’aide d’une benne Smith-McIntyre (benne Van Veen modifiée), qui est un appareil approprié et disponible au Canada. Eleftheriou et Holme (1984) passent en revue les méthodes d’échantillonnage utilisées en milieu marin. Toutefois, dans les zones infralittorales peu profondes où l’utilisation des plus grandes bennes est impossible, une petite benne Ponar peut être utilisée. Ce modèle peut être manipulé à partir d’un petit canot pneumatique et remonté à la main.
Les sédiments meubles intertidaux peuvent être échantillonnés au moyen de tout appareil couvrant une superficie d’au moins 0,1 m2. À l’aide d’un dispositif approprié, une profondeur de substrat meuble fixée à 10 cm est prélevée. Soulignons qu’on choisira de préférence la partie la plus profonde possible de la zone intertidale, puisque les conditions physiques moins rudes y favorisent une richesse et une abondance des espèces plus grande.
Habitats d’érosion - milieux marins et estuariens
Dans les milieux marins ou estuariens, une benne peut être utilisée pour échantillonner les sédiments meubles constitués de grosses particules (p. ex., gravier). Pour l’échantillonnage des substrats compacts des habitats d’érosion (intertidal et infralittoral), il est préférable d’utiliser des quadrats délimitant une superficie minimale de 0,1 m2. Toutefois, le recours à d’autres techniques quantitatives pourrait s’avérer nécessaire pour la collecte des mollusques et crustacés et d’autres espèces de plus grande taille. Parmi ces méthodes, mentionnons la récolte à la main par des plongeurs, la télédétection sur des surfaces définies (Eleftheriou et Holme, 1984; Gray et al., 1990), et les récoltes effectuées à l’intérieur de limites définies le long de transects. La description d’un protocole d’échantillonnage pour le milieu marin se trouve dans une série de rapports du Puget Sound Estuary Program (Tetra Tech, 1986a, 1986b, 1987). Lorsqu’ils sont effectués correctement, les relevés photographiques peuvent fournir des informations quantitatives, au moins pour les organismes épibenthiques de plus grande taille (voir Burd et al., 1990). Les coûts de traitement sont habituellement beaucoup plus bas que pour les relevés des matériaux meubles à l’aide d’une benne ou d’un carottier.
La zone intertidale devrait être échantillonnée si elle est fortement envahie par le panache de l’effluent. La détermination du niveau de marée présentant le plus d’intérêt pour l’étude des impacts de la mine de métaux devrait tenir compte de certaines considérations logistiques. Essentiellement, il est préférable d’échantillonner dans les portions les plus profondes de la zone intertidale puisque les conditions moins rudes qui les caractérisent favorisent une plus grande uniformité et diversité de la flore et de la faune (variabilité inter-échantillon). La répartition verticale des plantes et des animaux de cet habitat côtier reflète habituellement les gradients de divers paramètres environnementaux comme l’exposition à l’air, la température (y compris le gel), la salinité, l’intensité lumineuse et la photopériode, l’abrasion due aux troncs d’arbre ou à la glace et l’action des vagues. Il faut tenir compte de ces gradients lors de la planification et de la réalisation des études biologiques dans le milieu intertidal. Les protocoles d’échantillonnage adaptés à ces milieux diffèrent à certains égards de ceux décrits dans les sections précédentes (voir Gray et al., 1990). Lorsque c’est possible, il faut effectuer des relevés semi-quantitatifs à l’aide de quadrats de 0,1 m2. La détermination du substrat ou du type d’habitat à échantillonner dépend des limites des méthodes d’échantillonnage et de l’habitat dominant présent (pour en savoir plus sur la sélection de l’habitat dominant, voir la section 4.3.7). Toutefois, si la récolte d’échantillons s’avère impossible pour des considérations écologiques ou autres, on peut recourir à des relevés visuels, après consultation de l’agent d’autorisation local. Les relevés par examen visuel font appel à des techniques d’enregistrement et de cartographie (échelle approximative de 1/5 000) des principales caractéristiques biologiques, aux fins de l’évaluation des changements globaux de la communauté biologique.
4.5.5 Récipients à échantillons
D’après les directives d’Environnement Canada pour le suivi du benthos en eau douce (Guidelines for Monitoring Benthos in Freshwater Environments; EVS Environment Consultants, 1993), les récipients à échantillons doivent :
- être assez gros pour que l’échantillon n’occupe pas plus de 50 % du volume, le reste étant réservé à l’agent de conservation;
- être assez solides pour leur manipulation et leur transport réguliers;
- être étanches;
- posséder des propriétés physiques et chimiques qui ne sont pas modifiées par l’agent de fixation ou de conservation;
- être conformes au règlement sur le transport des marchandises dangereuses.
4.5.6 Fixation et conservation des spécimens
Il faut procéder sur le terrain à la fixation de tous les échantillons dans une solution tamponnée de formol à 10 % afin d’éviter que les vers marins et dulcicoles ne soient endommagés. Le formol est également couramment utilisé pour la conservation de la plupart des insectes aquatiques. La conservation directement dans l’éthanol entraîne souvent le ramollissement des spécimens, qui deviennent difficiles à manipuler. Après l’ajout de l’agent de conservation sur le terrain, il faut brasser doucement les récipients à échantillon à plusieurs reprises pour faire pénétrer l’agent dans tout matériel fin présent dans l’échantillon. Comme le formol est une substance cancérogène et irritante, les personnes qui l’utilisent doivent porter des gants et des verres, et le port de cet équipement de protection devrait être obligatoire. De plus, les récipients à échantillons incassables doivent être scellés à l’aide d’une pellicule de paraffine, placés dans un sac double pour le transport jusqu’au laboratoire et étiquetés convenablement. Les échantillons doivent être fixés aussitôt que possible après leur prélèvement pour éviter que les invertébrés prédateurs ne se nourrissent des autres invertébrés.
4.5.7 Assurance et contrôle de la qualité des travaux de terrain
Un survol des recommandations en matière d’assurance et de contrôle de la qualité (AQ/CQ) pour le volet terrain de l’étude des communautés d’invertébrés benthiques est présenté ci-dessous.
L’échantillonnage sur le terrain est la première étape de la collecte des données. Les procédures d’AQ/CQ pour l’étude des communautés d’invertébrés benthiques sont énoncées dans le plan d’étude et doivent être respectées à la lettre, de manière à garantir la haute qualité des données. Les modes opératoires normalisés de terrain devraient spécifier les équipements et les protocoles d’échantillonnage appropriés pour l’étude. Un plan d’AQ/CQ pour l’échantillonnage sur le terrain comporte de nombreux éléments, dont les principaux sont :
- tout le personnel participant à l’échantillonnage sur le terrain devrait avoir une formation appropriée et une bonne expérience de l’équipement et des objectifs de l’étude;
- toutes les consignes de sécurité doivent être connues, comprises et respectées;
- l’équipement d’échantillonnage devrait être adapté au type de plan d’eau et au groupe d’invertébrés étudiés et devrait être inspecté et entretenu régulièrement;
- il convient d’établir a priori des critères d’acceptabilité des échantillons obtenus et des consignes précises en cas de non-respect de ces critères (c.-à-d., circonstances justifiant le prélèvement d’un nouvel échantillon; pour un échantillon prélevé à l’aide d’une benne, une pénétration de 10 cm serait jugée acceptable [Gray et al., 1990]). De plus, les méthodes doivent être uniformes tout au long de l’étude;
- une description de l’examen visuel des échantillons prélevés à l’aide d’une benne devrait être consignée (couleur, odeur et texture des sédiments, présence de débris);
- la contamination pendant l’échantillonnage des paramètres chimiques devrait être vérifiée à l’aide de blancs de transport et d’analyse de l’eau utilisée pour le rinçage de l’équipement;
- le tamisage sur le terrain, s’il est nécessaire, devrait être effectué le plus rapidement possible après la récolte des échantillons;
- les échantillons doivent être entreposés dans des récipients adéquats, avec un agent de conservation approprié pour éviter leur détérioration;
- tous les récipients à échantillons doivent être convenablement étiquetés;
- un carnet de terrain détaillé devrait être tenu;
- des formulaires de chaîne de possession et des méthodes appropriées d’expédition et d’entreposage doivent être utilisés.
On trouvera de plus amples renseignements sur tous les aspects des procédures d’AQ/CQ applicables à l’étude des invertébrés benthiques dans le rapport de 1999 du programme ETIMA (Programme d'évaluation des techniques de mesure d'impacts en milieu aquatique = Aquatic Effects Technology Evaluation Program [AETE]) (Beak, 1999).
4.6 Méthodes de laboratoire
Pour en savoir plus sur le tri des échantillons et le sous-échantillonnage, veuillez consulter le document Protocoles de tri des échantillons et de sous- échantillonnage dans les études de suivi des effets sur l’environnement portant sur les communautés d’invertébrés benthiques, accessible sur le site de l’ESEE (https://www.canada.ca/fr/environnement-changement-climatique/services/gestion-pollution/publications/guide-mines-metaux-tri-echantillons.html).
4.6.1 Programme de certification de la NABS
L’identification exacte des invertébrés benthiques aquatiques est cruciale pour les programmes de suivi tels que le Programme d’ESEE des mines de métaux. La North American Benthological Society (NABS) a mis en œuvre un programme de certification pour l’identification des invertébrés benthiques. Ce programme évalue les connaissances et compétences des candidats en matière de taxinomie des invertébrés aquatiques et vérifie que ces derniers fournissent des identifications de haute qualité. Il est recommandé que l’identification des invertébrés benthiques soit effectuée par une personne qui a suivi et réussi le programme de certification de la NABS.
4.6.2 Niveau d’identification taxinomique
L’identification des invertébrés benthiques devrait satisfaire aux exigences du programme d’évaluation. Des recherches récentes indiquent qu’une identification jusqu’à la famille fournit un niveau de résolution taxinomique suffisant pour détecter les réponses des communautés aux perturbations anthropiques (Warwick, 1988a, 1988b; Bowman et Bailey, 1997). Comme il a été mentionné précédemment, le niveau de résolution taxinomique utilisé pour les études de suivi peut varier d’une étape à l’autre, des niveaux plus fins étant requis pour détecter des effets environnementaux plus subtils.
Aux fins du premier suivi et des suivis subséquents en eau douce, la famille est le niveau d’identification recommandé. Toutes les statistiques sommaires et les mesures descriptives doivent être calculées et présentées à ce niveau de résolution dans les rapports d’interprétation des résultats du premier suivi et des suivis subséquents. Les organismes qui ne peuvent être identifiés avec la précision taxinomique requise doivent être regroupés dans une catégorie distincte dans l’ensemble de données de base. L’utilisation de clés couvrant la région géographique étudiée est recommandée. Le tableau 4-2 présente les références taxinomiques généralement utilisées pour divers groupes d’organismes dulcicoles.
Pour certaines étapes, il peut être nécessaire de pousser plus loin l’identification selon les questions et les objectifs de l’étude. Le genre a été défini comme le plus bas niveau pratique pour la majorité des insectes, alors que pour les autres groupes, le plus bas niveau pratique est le plus bas niveau pouvant être atteint sans avoir recours à des méthodes spéciales (dissection, microscope) ou à des spécialistes (Taylor, 1997). Cette définition peut servir de guide si une identification plus fine s’avère souhaitable pour la détermination de l’ampleur et de la portée géographique ou la recherche des causes.
Certaines conditions propres aux sites peuvent justifier une identification plus fine pour une partie ou l’ensemble des familles taxinomiques. Par exemple, si dans les études historiques disponibles les invertébrés benthiques ont été identifiés à un niveau plus bas, il peut être souhaitable de poursuivre les travaux à ce même niveau à des fins de comparaison. Dans ce cas, les statistiques sommaires et les mesures descriptives peuvent être présentées pour ce niveau, à condition de fournir également un ensemble de données sommaires à l’échelle de la famille.
Les deux objectifs visés par la détermination de l’ampleur et de la portée géographique des effets peuvent nécessiter des niveaux de résolution taxinomique différents. L’identification jusqu’à la famille convient pour la détermination de la portée géographique des effets. Ce niveau d’identification fournit les données nécessaires pour calculer et présenter les statistiques sommaires et descriptives requises relatives à la portée géographique des effets. Ce premier objectif est similaire à ceux de la phase 1 et des suivis subséquents par sa portée, la principale différence étant l’ajout de zones exposées plus éloignées du point de rejet de l’effluent.
Lors du deuxième objectif, soit la détermination del’ampleur des effets, l’identification peut être faite à la famille, mais il peut aussi être nécessaire de mener une identification plus fine. La question suivante peut orienter le choix du niveau d’identification requis aux fins de l’évaluation de l’ampleur des effets :
- Quelle est l’ampleur de l’effet sur des groupes taxinomiques potentiellement sensibles aux caractéristiques de l’effluent rejeté au site en question (en d’autres mots, combien de groupes sont touchés parmi les familles sensibles)?
L’une ou l’autre des options suivantes peut être utilisée pour évaluer l’ampleur des effets durant la détermination de l’ampleur et de l’étendue géographique :
- Identifier jusqu’au plus bas niveau pratique tous les organismes échantillonnés. Cette façon d’établir l’ampleur des effets fournit des renseignements additionnels potentiellement utiles pour la conception de l’étude, au début de la recherche des causes.
- Analyser à nouveau les données des familles significativement touchées durant le premier suivi afin de déterminer des taxons indicateurs pouvant être utilisés pour évaluer l’ampleur des effets dans les stations plus éloignées. Par exemple, si un effet a été observé parmi la famille des Baetidés (ordre des Éphéméroptères) durant le premier suivi, il convient de pousser plus loin (p. ex., jusqu’au genre) l’identification de tous les Baetidés échantillonnés durant la détermination de l’ampleur et de la portée géographique des effets. Cette approche permet de répertorier les taxons sensibles dans la famille et d’évaluer l’ampleur des effets après examen des réponses observées à l’intérieur de ce sous-ensemble de taxons sensibles.
- D’autres approches scientifiquement défendables peuvent être utilisées pour évaluer l’ampleur des effets.
Pour tous les invertébrés benthiques provenant du milieu marin ou estuarien, il est recommandé de pousser l’identification jusqu’au niveau de lafamille. Dans les rapports d’interprétation, les statistiques sommaires doivent être calculées et présentées à ce même niveau. Divers auteurs ont examiné l’utilité de recourir aux taxons plus élevés pour le suivi environnemental de sites exposés à divers degrés de pollution organique en Europe (voir Warwick et Clarke [1993] et les références citées par ces auteurs). Dans le cas du benthos marin, les spécimens juvéniles et immatures devraient être identifiés et dénombrés séparément des adultes, car ils réagissent différemment aux effets environnementaux.
Bien que la famille soit le niveau d’identification recommandé pour la présentation des données et la détermination des effets, les mines de métaux peuvent opter pour une identification plus fine. Certaines conditions propres aux sites peuvent justifier ce niveau d’identification pour une partie ou l’ensemble des groupes familiaux. Par exemple, si dans les études historiques disponibles les invertébrés benthiques ont été identifiés à un niveau plus bas, il peut être souhaitable de poursuivre les travaux à ce même niveau à des fins de comparaison. Dans ce cas, les statistiques sommaires et les mesures descriptives peuvent être présentées pour ce niveau, à condition de fournir également un ensemble de données sommaires à l’échelle de la famille.
Dans le cas des échantillons marins, il est suggéré d’utiliser les collections de référence, si celles-ci contiennent un nombre suffisant de spécimens représentatifs, non seulement aux fins précitées, mais aussi pour élaborer pour chaque mine de métaux une base de données sur la taille et la biomasse, comme un autre indicateur ou outil (voir la section 4.11.4). À cette fin, il est recommandé de conserver 5 à 10 spécimens représentatifs de chaque taxon, en notant pour chacun d’eux les valeurs moyennes de la largeur, de la longueur et du poids frais égoutté.
4.6.3 Collections de référence
Pour obtenir des informations utiles pour le suivi des effets environnementaux, il faut s’assurer que l’identification des invertébrés est effectuée de façon uniforme durant toute la durée d’une étude ainsi que d’une étude à l’autre. Par conséquent, il est recommandé de constituer des collections d’organismes de référence à des fins de comparaison et de contrôle de la qualité des identifications taxinomiques. L’identité de chaque taxon versé dans la collection de référence devrait en outre être confirmée par un taxinomiste professionnel indépendant. Les musées sont parfois en mesure d’offrir ce service lorsque l’étude porte sur des régions éloignées et qu’il est probable que de nouvelles mentions de spécimens soient faites ou que des aires de répartition soient étendues. Les collections de référence peuvent être utilisées pour confirmer des identifications, assurer l’uniformité des déterminations taxinomiques entre les études et la formation du personnel. Des protocoles pour la préparation et l’entretien de collections de référence d’invertébrés benthiques sont présentés dans un rapport préparé pour le Plan d’action du Fraser d’Environnement Canada (Green, 1994). Selon les recommandations formulées dans ce rapport, chaque mine de métaux (ou groupe de mines de métaux) devrait constituer, entretenir et tenir à jour une collection de référence exhaustive contenant plusieurs spécimens représentatifs de chaque taxon et de chaque zone étudiée. Chaque spécimen devrait être identifié à l’aide d’une étiquette indiquant l’endroit et la date de capture. Ce genre de collection occupe peu de place et loge normalement dans une seule armoire. Cette collection devrait être sous la garde de la mine de métaux. Si cette dernière ne dispose pas des installations ou du personnel requis pour constituer, maintenir et entretenir sa propre collection de référence, il se peut qu’une université ou un musée soit en mesure de le faire à sa place. Toutefois, comme l’entretien à long terme du matériel biologique préservé nécessite un effort considérable, la quantité de matériel soumise doit être minimisée.
| Taxon | Références taxinomiques couramment utilisées |
|---|---|
| Clés générales | Merritt et Cummins, 1984, 1996; Peckarsky et al., 1990; Pennak, 1978; Thorp et Covich, 1991 |
| Clés régionales | Clifford, 1991 (Alberta) Lehmkuhl, 1975a, 1975b, 1976, 1979 (Saskatchewan) Laplante et al., 1991 (Québec) |
| Clés pour taxons particuliers | |
| ANNÉLIDES Oligochètes Hirudinés |
Brinkhurst, 1986 Klemm, 1972, 1985, 1991 |
| CRUSTACÉS Amphipodes Décapodes Cladocères Copépodes |
Bousfield, 1958 Brandlova et al., 1972 Dussart, 1969 Crocker et Barr, 1968 Fitzpatrick, 1983 |
| INSECTES | Chu et Cutkomp, 1992; Hilsenhoff, 1995 |
| PLÉCOPTÈRES (perles) |
Fullington et Steward, 1980; Harper et Stewart, 1984; Hitchcock, 1974; Stewart et Stark, 1993 |
| ÉPHÉMÉROPTÈRES (éphémères) | Bednarik et McCafferty, 1979; Edmunds et al., 1976; Lewis, 1974; Morihara et McCafferty, 1979; McCafferty et Waltz, 1990; Waltz, 1994 |
| ODONATES (libellules et demoiselles) | Hilsenhoff 1995; Westfall and May 1996; Walker 1933, 1953, 1958; Walker and Corbet 1978 |
| TRICHOPTÈRES (phryganes) | Schefter et Wiggins, 1986; Schuster et Etnier, 1978; Wiggins, 1996 |
| COLÉOPTÈRES | Hilsenhoff et Schmude, 1992 |
| DIPTÈRES (mouches) | Hilsenhoff, 1995; Johannsen, 1977; Oliver et al., 1978; Saether, 1975, 1977; Simpson et Bode, 1980; Wiederhom, 1983, 1986; Wood et al., 1963 |
| GASTÉROPODES (escargots) | Burch, 1989; Clarke, 1981 |
| PÉLÉCYPODES (Bivalves; moules) | Mackie et al., 1980; Clarke, 1981; Burch, 1975a, 1975b; Mackie et Huggins, 1983 |
Le tableau 4-3 précise les niveaux de résolution taxinomique recommandés pour les principaux groupes d’invertébrés benthiques marins. Habituellement, le niveau de résolution taxinomique devrait être uniforme à l’intérieur de chaque groupe principal pour tous les échantillons prélevés durant une étude ainsi que d’une étude à l’autre. Les organismes qui ne peuvent être identifiés au niveau taxinomique requis doivent être regroupés dans une catégorie distincte dans l’ensemble de données de base, au niveau de résolution taxinomique le plus précis possible. Comme l’exactitude du travail taxinomique repose sur la disponibilité d’une documentation à jour, il est important d’avoir accès aux ouvrages taxinomiques de base. L’utilisation de clés couvrant la région géographique étudiée est fortement recommandée. Une liste détaillée des ouvrages taxinomiques pour les milieux marins et estuariens est présentée au tableau 4-4. Pour les taxons dont l’identification exige un examen microscopique détaillé, un montage sous lame de microscope peut s’imposer. La préparation de tels montages peut comporter plusieurs étapes, notamment la dissection, le lavage et la coloration des spécimens. Les techniques de montage sous lame de microscope sont décrites par Klemm et al. (1990). Dans le cas du benthos marins, les formes juvéniles ou immatures doivent être identifiées et dénombrées séparément des adultes, car elles présentent des réactions différentes aux effets environnementaux. Toutes les identifications doivent être effectuées ou vérifiées par un taxinomiste qualifié et expérimenté. Les collections de référence déjà établies peuvent également se révéler fort utiles. Le Centre de référence de l’Atlantique au Centre des sciences de la mer Huntsman, à St. Andrews (Nouveau-Brunswick), possède une excellente collection de référence. Des iconographies ont également été utilisées avec succès (Camburn et al., 1984-1986).
Tableau 4-3 : Niveaux de résolution taxinomique recommandés pour les invertébrés benthiques marins (approche du plus bas niveau taxinomique pratique) (description longue)
| Taxon | Niveau |
| Porifères | Classe |
| Cnidaires | Genre |
| Turbellariés | Genre |
| Némertéens | Genre |
| Nématodes | (à exclure des analyses*) |
| Sipunculiens | Espèce |
| Priapulides | Espèce |
| Brachiopodes | Genre |
| Bryozoaires | Family |
| Mollusques | |
| • Aplacophores • Gastéropodes • Bivalvia • Polyplacophores • Scaphopodes |
Genre Espèce Espèce Genre Espèce |
| Annélides | |
| • Polychètes • Oligochètes |
Espèce (sauf quelques immatures) Genre |
| Arthropodes | |
| • Pycnogonides • Céphalocarides • Malacostracés • Copépodes • Cirripèdes |
Famille Sous-classe Espèce (à exclure des analyses*) Espèce |
| Ascidiacés | Famille |
| Échinodermes | Espèce |
* Les Nématodes et les Copépodes (p. ex. les Harpacticoïdes) appartiennent à la méiofaune, et seule une fraction des spécimens sera retenue dans un tamis à mailles de 500 ou 1 000 mm. Par conséquent, les données ne sont pas représentatives et doivent être exclues des analyses (Holme et McIntyre, 1984).
Tableau 4-4 : Clés taxinomiques – Invertébrés benthiques marins et estuariens du Canada (description longue)
Abbot 1974 (seashells)
Abbott, R.T., 1974 (Coquillages)
Abbott, R.T., Zim, H.S., Sandström, G.F., 2001 (Mollusques)
Appy et al., 1980 (Polychètes de la baie de Fundy)
Austin, W.C., 1985 (Invertébrés du Pacifique)
Baker, H.R., 1980 (Espèces de Tubificidés)
Banse, K., 1972; Banse, K., et Hobson, K.D., 1974 (Polychètes)
Berkeley, C., et Berkeley, E., 1952a, 1952b (Annélides du Pacifique)
Blake, J.A., 1971 (Polydora, Côte Est)
Blake, J.A., 1991 (Polychètes, Atlantique Nord)
Blake, J.A., 1988 (Phyllodocidés [Polychètes], Atlantique)
Bousfield, E.L., 1960 (Coquillages de l’Atlantique)
Bousfield, E.L., et Hendryks, E.A., 1994, 1995a, 1995b (Amphipodes du Pacifique)
Bousfield, E.L., et Hoover, P.M., 1995 (Amphipodes du Pacifique)
Bousfield, E.L., et Kendall, J.A., 1994 (Amphipodes du Pacifique)
Bousfield, E.L., 1973 (Amphipodes de l’Atlantique)
Brinkhurst, R.O., 1982 (Oligochètes)
Brinkhurst, R.O., et Baker, H.R., 1979 (Tubificidés marins [Oligochètes])
Brunel, P., Bossé, L. et Lamarche, G., 1998
(Catalogue des invertébrés du golfe du Saint-Laurent)
Butler, T.H., 1983 (Crevettes du Pacifique)
Clark, H.L., 1924 (Holothuroïdes)
Clark, H.L., 1915 (Ophiuroïdes)
Coates, K.A., 1980 (Enchytraeides de la Colombie-Britannique)
Coe, W.R., 1912 (Échinodermes, Atlantique)
Coe, W.R., 1943 (Némertes, Atlantique)
Cutler, E.B., 1973 (Sipunculiens)
Fauchald, K., 1977 (Polychètes)
Fournier, J.A., et Petersen, M.E., 1991 (Polychètes)
Gibson, R., 1994 (Némertéens)
Gosner, K.J., 1971
Graham, A., 1988 (Gastéropodes)
Hart, J.F.L., 1982 (Crabes de la Colombie-Britannique)
Hobson, K.D., et Banse, K., 1981 (Polychètes de la Colombie-Britannique)
Hyman, L.H., 1940 (Polycladidés (Turbellariés), Atlantique)
Hyman, L.H., 1944 (Turbellariés, Atlantique)
Keen, A.M., et Coan, E., 1974 (Mollusques)
Knight-Jones, P., 1978 (Spirorbidés [Polychètes], Pacifique et Atlantique)
Knight-Jones, P., 1983 (Sabellidés [Polychètes])
Kozloff, E.N., 1987 (Invertébrés du Nord-Ouest du Pacifique)
Lambert, P., 1981 (Étoiles de mer de la Colombie-Britannique)
Laubitz, D.R., 1972 (Caprellidés)
Light, W.J., 1977 (Spionidés [Polychètes], Pacifique)
Morris, P.A., 1951 (Mollusques, Atlantique)
Pettibone, M.H., 1963 (Polychètes, Atlantique)
Pettibone, M.H., 1992 (Pholoïdes [Polychètes])
Pettibone, M.H., 1993 (Polynoïdes [Polychètes])
Pohle, G.W., 1990 (Décapodes, Atlantique)
Sars, G.O., 1895 (Amphipodes)
Sars, G.O., 1899 (Isopodes)
Sars, G.O., 1900 (Cumacés)
SBMNH, 1994a,b,c, 1995a,b,c, 1996a,b,c, 1997a,b
Schultz, G.A., 1969 (Crustacés isopodes)
Smith, R.I., 1964 (Clés des invertébrés marins, Atlantique)
Squires, H.J., 1990 (Décapodes, Atlantique)
Steele, D.H., et Brunel, P., 1968 (Amphipodes)
Tattersall, W.M., et Tattersall, O.S., 1951 (Mysidacés)
Thorp, J.H., et Covich, A.P., 1991 (Clés des invertébrés dulcicoles)
Ushakov, P.V., 1955 (Polychètes)
Wallace, N.A., 1919 (Isopodes de la baie de Fundy)
Watling, L., 1979 (Cumacés, Atlantique)
Weiss, H.M., 1995 (Macrofaune marine)
4.6.4 AQ/CQ pour le traitement des échantillons d’invertébrés benthiques en laboratoire
Le traitement des échantillons et le dénombrement des divers taxons d’invertébrés s’effectuent en laboratoire. Une fois triés, les échantillons prélevés dans le cadre de chaque étude devraient être conservés en lieu sûr pendant au moins six ans, ou jusqu’à ce qu’on détermine qu’aucune information supplémentaire ne sera requise à leur sujet. Tous les échantillons doivent être traités de façon uniforme afin de réduire le plus possible les risques d’erreurs expérimentales lors des dénombrements. Pour limiter les erreurs de traitement, les éléments suivants devraient être intégrés au programme d’AQ/CQ :
- toutes les personnes qui participent au traitement et aux analyses des échantillons doivent avoir suivi une formation appropriée. À cet égard, la NABS a implanté un programme de certification pour les taxinomistes des invertébrés aquatiques.
- les effets du sous-échantillonnage (le cas échéant) sur les estimations de l’abondance doivent être évalués sur au moins 10 % des échantillons et documentés;
- une série d’échantillons choisis au hasard devrait être soumise à un nouveau tri aux fins de l’évaluation de l’efficacité du tri initial (voir ci-après);
- les références taxinomiques appropriées doivent être consultées, selon le type et l’emplacement géographique de l’habitat étudié;
- une collection de référence complète devrait être constituée pour chaque mine de métaux, vérifiée par un taxinomiste reconnu de l’extérieur et mise à jour au besoin (p. ex., lorsque de nouveaux taxons sont récoltés);
- le système utilisé pour l’archivage des échantillons devrait être décrit;
- des notes détaillées sur le traitement et l’analyse des échantillons en laboratoire doivent être consignées.
La première étape du traitement des échantillons consiste à séparer les organismes des débris et, au besoin, à sous-échantillonner les organismes triés en vue de pratiquer une identification plus poussée. Le taux d’erreur résultant inévitablement de ces activités devrait être estimé (voir par exemple Kreis, 1986, 1989).
4.6.4.1 Efficacité du tri
L’efficacité du tri peut être facilement vérifiée de façon ponctuelle si les débris résiduels d’un échantillon sont conservés. Il est recommandé de soumettre au moins 10 % des échantillons à un nouveau tri, et le critère de tri acceptable veut qu’au plus 10 % du nombre total d’organismes aient été manqués. Cette estimation doit être consignée dans le rapport d’interprétation. Si les organismes manqués constituent plus de 10 % du nombre total d’organismes pendant le nouveau tri, alors tous les échantillons du groupe d’échantillons doivent être triés de nouveau.
Il en ira de même lorsqu’un groupe entier d’invertébrés benthiques aura échappé à l’attention de la personne chargée du tri (c.-à-d. qu’il n’aura pas été reconnu comme un organisme), et ce, même si ces organismes représentent moins de 10 % du nombre total. Les facteurs suivants doivent être pris en compte dans la détermination de groupes d’échantillons semblables : 1) zone d’échantillonnage; 2) classe d’habitat; 3) personne effectuant le tri. Les directives d’AQ/CQ s’appliquent indépendamment à chaque groupe d’échantillons triés. Les fractions triées et non triées doivent être conservées tant et aussi longtemps que l’efficacité du tri et l’exactitude des identifications n’auront pas été confirmées.
4.6.4.2 Sous-échantillonnage
Le sous-échantillonnage des échantillons d’invertébrés en laboratoire est acceptable si la méthode utilisée est quantitative. Les gros échantillons ou ceux qui contiennent de grandes quantités de débris sédimentaires peuvent nécessiter un sous-échantillonnage avant le tri. Veuillez consulter la version révisée du document technique Protocoles de tri des échantillons et de sous-échantillonnage dans les études de suivi des effets sur l’environnement portant sur les communautés d’invertébrés benthiques (Environnement Canada, 2002), accessible sur le site Web du Bureau national des études de suivi des effets sur l’environnement (https://www.canada.ca/fr/environnement-changement-climatique/services/gestion-pollution/publications/guide-mines-metaux-tri-echantillons.html). Le rapport détaillé de l’exactitude et de la précision du sous-échantillonnage, pour toutes les méthodes utilisées, est essentiel à l’AQ/CQ des études des invertébrés benthiques pour l’ESEE. Le critère d’un protocole de sous-échantillonnage acceptable est le suivant : les estimations de chaque groupe d’échantillons ne doivent pas différer par plus de 20 % des dénombrements réels. Lorsque l’erreur est supérieure à 20 % pour une technique de sous-échantillonnage donnée ou un type d’échantillon donné (type et quantité de matière organique), il faut modifier la technique pour atteindre le niveau de précision exigé ou faire le tri complet de tous les échantillons du groupe de sorte que le processus de sous-échantillonnage ne compromette pas l’intégrité des données. Les estimations sont ensuite comparées aux dénombrements réels, et l’exactitude des estimations ainsi que la précision entre les sous-échantillons peuvent être calculées au moyen de l’équation suivante :
% d’erreur de l’estimation = [1 – (nombre estimé dans l’échantillon/nombre réel)] × 100
L’exactitude devrait être mentionnée dans le rapport d’interprétation.
Il est recommandé qu’au moins 300 organismes soient prélevés d’un échantillon dans tout programme de sous-échantillonnage pour assurer une normalisation additionnelle. Dans le cas des stations d’échantillonnage où il a été impossible d’obtenir le nombre minimum d’organismes (300) recommandé ou pour lesquelles l’exactitude était faible, l’échantillon devrait être signalé lorsqu’il en est fait mention.
On trouvera de plus amples renseignements sur tous les aspects des procédures d’AQ/CQ applicables à l’étude des invertébrés benthiques dans le rapport de 1999 de l’ETIMA (Beak, 1999).
4.7 Évaluation et interprétation des données
4.7.1 Méthodes de traitement des données
4.7.1.1 AQ/CQ pour la saisie et la vérification des données
Une fois la saisie des données achevée, la première étape de l’analyse des données consiste à vérifier les erreurs de transcription. L’omission de cette étape invalide les analyses subséquentes. Il importe de vérifier toutes les données saisies en comparant un exemplaire imprimé du fichier aux feuilles de données brutes. Idéalement, cette vérification ne devrait pas être confiée à la personne qui a effectué la saisie originale. Les systèmes à double entrée et les vérifications de transcription à partir des registres de données originales sont des techniques de contrôle de la qualité utiles. Il faut clairement distinguer les données manquantes de l’absence d’un taxon en utilisant des codes uniques différents de 0 pour identifier les valeurs manquantes, avec les définitions des codes intégrées dans chaque fichier. L’utilisation de fichiers de données en mode lecture seulement permet d’assurer l’intégrité des données. Les préoccupations relatives à l’AQ/CQ en matière d’analyse des données sont la vérification et la validité des données, la répétitivité et la robustesse des analyses statistiques et la rigueur et la pertinence des analyses. Selon EVS Environment Consultants (1993), les résultats de l’analyse des données devraient être reproductibles. En d’autres mots, un chercheur analysant les données présentées en annexe d’un rapport particulier et utilisant les méthodes décrites dans ce rapport devrait parvenir aux mêmes conclusions que l’auteur du rapport. Les précautions additionnelles suivantes s’imposent durant la vérification et l’analyse des données :
- recourir à un personnel ayant reçu une formation appropriée et possédant l’expérience requise;
- utiliser diverses techniques de représentation graphique des données en vue de repérer les erreurs de transcription, les valeurs aberrantes et toutes autres données douteuses;
- présenter les données brutes sous forme de base de données électronique et, sous forme de tableaux, en annexe des rapports;
- décrire les méthodes (tests statistiques particuliers) et les logiciels (le cas échéant) utilisés aux fins des analyses;
- prendre des notes détaillées sur les analyses des données.
Pour de plus amples renseignements sur tous les aspects des méthodes d’AQ/CQ applicables aux programmes de suivi des invertébrés benthiques, veuillez consulter le rapport de 1999 de l’ETIMA 1999 (Beak, 1999).
4.7.1.2 Traitement des valeurs aberrantes
En posant l’hypothèse que la saisie a été effectuée correctement, les données devraient être synthétisées, épurées des valeurs erronées et aberrantes, évaluées quant à leur normalité et, le cas échéant, transformées (EVS Environment Consultants, 1993). Diverses techniques de représentation graphique comme les diagrammes en rectangles et moustaches, les courbes de distribution normale et les diagrammes arborescents peuvent être utilisés pour repérer les valeurs extrêmes (valeurs aberrantes véritables ou erreurs de saisie) (voir Tukey, 1977). Norris et Georges (1993) recommandent d’examiner les estimations de l’abondance de chaque taxon afin de déterminer si les valeurs enregistrées sont plausibles. Ils recommandent également de calculer les moyennes et les écarts-types, les valeurs excessivement élevées ou faibles pouvant indiquer des erreurs. Les valeurs extrêmes ou aberrantes qui ne sont pas dues à des erreurs doivent être conservées, car leur élimination entraînerait la perte d’observations et, de là, une baisse de la puissance statistique associée à l’étude de la communauté d’invertébrés benthiques. Il convient plutôt de souligner l’existence de ces valeurs dans le rapport et d’en préciser l’incidence sur les résultats en procédant à une nouvelle analyse après exclusion de ces valeurs.
4.7.1.3 Organismes inconnus, immatures et non benthiques
Dans plusieurs cas, des organismes non benthiques ont été inclus dans les études réalisées dans le cadre du Programme d’ESEE des effluents de mines de métaux. S’il est documenté qu’un groupe d’organismes donné peut, à un moment de son développement, s’établir sur le fond (tels que les Simocephalus), alors il est acceptable de l’inclure dans la communauté d’invertébrés benthiques étudiée. Toutefois, certaines espèces, comme celles appartenant au genre Daphnia qui sont planctoniques, doivent être retirées de l’ensemble de données.
Certains échantillons peuvent contenir des spécimens immatures impossibles à identifier jusqu’au niveau de résolution taxinomique recommandé. Une telle situation peut également survenir lorsque des caractéristiques essentielles à l’identification sont perdues à cause d’une conservation inadéquate des échantillons (p. ex., dissolution des coquilles des mollusques par le formol non tamponné). Pour rendre compte correctement des données brutes, les taxons non identifiés et leur abondance doivent être fournis dans les fichiers électroniques de données brutes et dans les annexes aux rapports. Toutefois, aux fins de l’analyse, les chercheurs et consultants devraient décider s’il convient ou non de répartir les spécimens inconnus selon l’abondance relative des taxons correctement identifiés. Il faut pour cela présumer que la répartition des spécimens inconnus correspond à celle des spécimens identifiés, ce qui n’est pas nécessairement le cas. Les solutions suivantes peuvent être considérées :
- exclure tous les spécimens immatures ou endommagés;
- regrouper tous les spécimens (matures et immatures, identifiés ou non) en une seule catégorie au niveau taxinomique supérieur suivant;
- traiter les taxons non identifiés comme des catégories distinctes au cours de l’analyse.
La première option n’est pas la meilleure solution si le taxon « problématique » représente une grande proportion de la communauté benthique totale. Quant à la deuxième option, elle présume que tous les taxons appartenant à un niveau taxinomique supérieur réagissent de la même façon aux éventuels effets nocifs de l’effluent, ce qui n’est pas nécessairement le cas. Enfin, la troisième option aura des effets variables sur l’interprétation des données, selon l’abondance du taxon en cause. La solution retenue dépend de l’expertise et de l’expérience du chercheur, mais elle devrait être décrite en détail dans le rapport d’interprétation à la section traitant des méthodes utilisées.
Pour les études en milieux marins, il est exigé que les individus immatures et juvéniles soient dénombrés séparément des adultes, qu’il soit possible ou non de les identifier à l’espèce, de manière à ce que l’analyse de la communauté d’adultes soit soustraite à l’influence confondante des formes juvéniles transitoires. Ainsi, les analyses devraient présenter les résultats avec et sans la présence des immatures. Cette précaution est nécessaire puisque les formes benthiques récemment fixées présentent des caractéristiques de survie différentes de celles des adultes, lesquels sont présents dans les sédiments depuis beaucoup plus longtemps et intègrent les effets des perturbations de l’habitat dans le temps. Selon la chronologie de l’échantillonnage, les juvéniles récemment fixés peuvent être abondants dans les échantillons, mais ils peuvent également tous périr en quelques jours sous l’influence des facteurs de stress, de la prédation ou de la compétition. Il faut toutefois se garder de conclure que les données sur les immatures ne sont pas importantes. Toute variation importante du taux de fixation des immatures entre deux échantillons voisins prélevés dans des habitats physiquement homogènes peut trahir l’existence de niveaux de stress différents. En ne combinant pas les groupes pour les analyses, on évite de fausser les résultats.
4.7.1.4 Réduction et transformation des données
La transformation des données est souvent effectuée sans prendre en considération les effets sur l’interprétation des résultats. Pour obtenir des renseignements généraux sur la transformation des données, veuillez consulter le chapitre 8. La transformation ne devrait être envisagée que s’il y a une connaissance parfaite des effets sur les données et leur interprétation, et uniquement si elle est nécessaire pour permettre les analyses statistiques. Les transformations devraient :
- homogénéiser les variances hétérogènes ou rendre la variance indépendante de la moyenne pour les analyses paramétriques;
- normaliser les distributions;
- linéariser les relations entre les variables;
- réduire les effets sur l’analyse multivariable (ou l’ordination) des taxons extrêmement dominants dans un ensemble de données;
- atténuer le problème que pose pour l’analyse la présence d’un trop grand nombre de zéros dans la matrice de données (voir Clarke et Green, 1988).
La réduction des données devrait servir uniquement à faciliter les analyses statistiques paramétriques ou multivariables, et ce, pour les mêmes raisons que celles invoquées pour la transformation des données. La réduction des données peut entraîner l’élimination ou le regroupement de taxons plus rares, ou la réduction des sous-échantillons par regroupement ou calcul de moyennes. Il existe divers protocoles de réduction des données pour les communautés marines, mais l’interprétation subséquente des résultats des analyses de données doit tenir compte des réductions effectuées. Par exemple, l’élimination des taxons rares pourrait conduire à l’exclusion d’au moins 90 % de la biomasse dans une station donnée si les organismes considérés sont de grande taille. Dans certains cas, les taxons rares peuvent être regroupés dans un niveau taxinomique supérieur, ce qui limite la perte d’informations, mais suppose qu’on considère comme uniforme le comportement des groupes taxinomiques mixtes ainsi formés. Stephenson et Cook (1980) passent en revue les principales méthodes de réduction des données et Burd et al. (1990) examinent certaines considérations écologiques associées à ces méthodes.
Des transformations logarithmiques ont souvent été appliquées aux données d’invertébrés benthiques, parce que l’abondance de ces organismes varie généralement de façon exponentielle (Green, 1979). La transformation logarithmique réduit l’importance des membres numériquement dominants et accroît la probabilité de déterminer la structure lorsque les différences observées sont dues à des taxons d’abondance moyenne ou rare. Toutefois, la transformation logarithmique est passablement radicale. D’autres chercheurs ont préconisé le recours à d’autres formes de conversion géométrique comme la racine carrée, la racine cubique, la racine quatrième, le logarithme naturel, etc. (voir Hoyle, 1973; Tukey, 1977; Hoaglin et al., 1983; Downing, 1981). Downing (1979) a démontré empiriquement que la meilleure transformation générale pour stabiliser la variance pour le benthos dulcicole était la racine quatrième (x0,25), puisque cette méthode améliore grandement la performance des méthodes multivariables paramétriques comme les ordinations. Après avoir répété l’exercice avec des communautés marines infralittorales, Vézina (1988) a conclu que ces communautés étaient empiriquement moins agrégées que les communautés dulcicoles et qu’elles nécessitaient donc une transformation moins radicale (p. ex., x0,4). Toutefois, les deux chercheurs insistent sur l’importance d’analyser les rapports entre la moyenne et la variance en vue de trouver la méthode de transformation la plus appropriée pour une communauté donnée. Cette étape permet de vérifier si la transformation choisie a bel et bien permis de stabiliser la variance.
4.8 Exigences relatives à la présentation des données
Les données sont présentées sous la forme d’une base de données électronique et sur support papier (rapport d’interprétation), conformément aux spécifications d’Environnement Canada (voir le chapitre 10 pour en savoir plus sur la présentation électronique). L’ensemble complet des données de base, incluant les données concernant les taxons rares ou d’abondance très variable et les identifications douteuses, devrait être conservé sous cette forme, même si une filtration des données a été réalisée avant le calcul des descripteurs de la communauté. Il est ainsi possible de recourir à d’autres méthodes de filtration, de calcul des descripteurs ou d’analyse lors d’analyses ou de méta-analyses ultérieures. La liste suivante présente les aspects des travaux sur le terrain et en laboratoire et des analyses des données de l’étude des invertébrés de l’ESEE qui doivent être décrits dans le rapport d’interprétation.
Travaux sur le terrain
- conserver les feuilles de terrain pendant six ans;
- préciser l’emplacement des stations répétées (coordonnées de quadrillage);
- préciser la date et l’heure de l’échantillonnage;
- indiquer la composition de l’équipe d’échantillonnage;
- décrire l’habitat, y compris les variables environnementales connexes;
- décrire les méthodes d’échantillonnage utilisées, y compris le type et la taille du dispositif d’échantillonnage ainsi que le maillage des filets et tamis.
Travaux en laboratoire
- conserver les feuilles de rapport d’analyse pendant six ans;
- consigner les données brutes pour chaque sous-échantillon de terrain individuel ou regroupé, en précisant les taxons présents et le nombre de spécimens;
- décrire les méthodes et le niveau de sous-échantillonnage utilisés lors du tri en laboratoire;
- présenter l’efficacité du tri atteinte;
- indiquer les références taxinomiques consultées;
- préciser le lieu où sont conservées les collections de référence et décrire les vérifications taxinomiques effectuées.
Analyse des données
- fournir en annexe des tableaux de l’abondance de chaque taxon répertorié dans chaque échantillon;
- fournir des tableaux synoptiques des descripteurs calculés avec les estimations de la variance;
- fournir des estimations de la puissance atteinte durant l’étude;
- décrire les effets des valeurs aberrantes ou extrêmes sur les résultats (le cas échéant);
- préciser dans quelle mesure les objectifs de qualité des données, les modes opératoires normalisés et les protocoles d’échantillonnage ont été respectés, et signaler tout problème éventuel décelé au cours de l’AQ/CQ.
4.9 Critères d’effet et critères d’appui de la communauté d’invertébrés benthiques
Densité totale des invertébrés : nombre total de spécimens récoltés par station, toutes catégories taxinomiques confondues, exprimé par unité de surface (p. ex., nombre d’invertébrés/m2). Les valeurs de densité devraient être indiquées pour chaque station. Ces valeurs doivent être accompagnées de la moyenne arithmétique (± erreur type, ± ET [écart-type]), de la médiane et des valeurs maximale et minimale pour la zone.
Richesse des taxons (familles) : nombre total de catégories taxinomiques différentes récoltées à chaque station. Ces valeurs doivent être accompagnées de la moyenne arithmétique (± erreur type, ± ET), de la médiane et des valeurs maximale et minimale pour la zone.
Indice de régularité (indice de régularité de Simpson) (équitabilité) : La régularité (R) peut être quantifiée pour chaque station. La moyenne (R moyen ± erreur type, ± ET), la médiane, les valeurs minimale et maximale pour la zone doivent être présentées. La régularité est calculée selon la méthode de Smith et Wilson (1996):
![]()
où :
R = régularité
pi = proportion du ie taxon à la station
S = nombre total de taxons à la station
Indice de similarité (indice de Bray-Curtis [B-C])* : L’indice de Bray-Curtis est un coefficient de distance qui varie de 0 pour deux sites possédant des descripteurs identiques à 1 pour deux sites totalement différents. La valeur du coefficient rend donc compte du degré d’association entre les sites. L’indice de B-C fait partie de la classe des coefficients de distance qualifiés de semimétriques, que certains appellent coefficients de dissimilarité. L’indice de B-C mesure le pourcentage de différence entre les sites (Legendre et Legendre, 1983), et la mesure de distance (D) se calcule selon l’équation suivante :
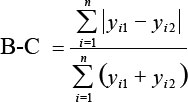
où :
B-C = distance de Bray-Curtis entre les sites 1 et 2
yi1 = nombre d’invertébrés de taxon i au site 1
yi2 = nombre d’invertébrés de taxon i au site 2
n = nombre total de taxa présent dans les deux sites
La distance de Bray-Curtis (B-C) calculée à partir de la médiane des stations de référence devra être indiquée pour chaque station, et la moyenne arithmétique (± erreur type, ± ET) et les valeurs maximale et minimale pour chaque zone. Comme l’application de cet indice à la détermination des effets peut être nouvelle pour certains, nous présentons ci-dessous un certain nombre de références traitant de la question ainsi qu’un exemple détaillé illustrant l’utilisation de cet indice dans le cadre d’une étude de la communauté d’invertébrés benthiques.
La plupart des descripteurs des communautés d’invertébrés dont il est question ci-dessus constituent des mesures de la densité totale et de la richesse des taxons et ne fournissent aucune information quantitative sur les types d’organismes présents. L’utilisation d’un indice de similarité est donc également recommandée, car il résume en un seul chiffre la différence globale de la structure des communautés entre les sites de référence et les sites exposés. En outre, il ne repose sur aucune prémisse concernant la nature de la communauté et varie dans une seule direction (Taylor et Bailey, 1997). Parmi les divers indices disponibles, le coefficient de Bray-Curtis (Bray et Curtis, 1957) est le plus fiable selon de nombreux auteurs (Bloom, 1981; Pontasch et al., 1989; Jackson, 1993). Il est également peu affecté par la nature des communautés comparées (Bloom, 1981), et les différences ont la même contribution au calcul du coefficient, sans égard à l’abondance du taxon. Après avoir examiné quatre indices, Bloom (1981) a conclu que seul l’indice de Bray-Curtis rendait fidèlement la vraie ressemblance entre les sites.
Exemple de l’utilisation de l’indice de Bray-Curtis dans le cadre du Programme d’ESEE
Cet exemple vise à illustrer comment il convient d’utiliser cet indice pour évaluer les effets dans le cadre d’un Programme d’ESEE. La base de données utilisée pour les besoins de la présente démonstration comporte cinq stations échantillonnées dans la zone de référence et cinq stations dans la zone exposée, chacune présentant cinq taxons.
- la densité de chaque taxon est inscrite dans un tableau;
- une densité médiane est calculée pour chaque taxon pour les stations de référence (voir tableau ci-dessous).
Tableau montrant la densité des taxons médian des stations de référence Densité des taxons Stations de référence Taxon 1 Taxon 2 Taxon 3 Taxon 4 Taxon 5 Réf. 1 2 3 2 3 1 Réf. 2 3 5 2 4 3 Réf. 3 9 1 1 1 1 Réf. 4 4 6 3 4 1 Réf. 5 5 4 2 3 2 Médiane de référence 4 4 2 3 1 - Un tableau similaire est élaboré pour les stations exposées. Aucune médiane n’est calculée.
Tableau montrant la densité des taxons médians pour les stations exposition. Densité des taxons Stations exposées Taxon 1 Taxon 2 Taxon 3 Taxon 4 Taxon 5 Exp. 1 23 4 2 10 1 Exp. 2 12 2 2 8 3 Exp. 3 14 6 1 6 2 Exp. 4 13 1 3 12 2 Exp. 5 15 3 2 4 1 - La distance entre chaque station (référence et exposée) et la médiane de référence est calculée selon la séquence exposée ci-dessous pour la station 1.
Pour cette approche, la médiane de référence pour un taxon donné devient yi2, soit le nombre d’invertébrés du taxon i au site 2 dans l’équation présentée précédemment.La distance entre chaque station (référence et exposée) et la médiane de référence Taxa 1 Taxa 2 Taxa 3 Taxa 4 Taxa 5 Réf. 1 (yi1) 2 3 2 3 1 Médiane de référence (yi2) 4 4 2 3 1 | yi1-yi2 | ou
Réf. 1 - médiane de référence2 1 0 0 0 (yi1+yi2) 6 7 4 6 2
En remplaçant les éléments de l’équation de l’indice de B-C par leur valeur, on obtient :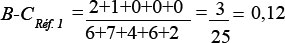
- La distance de Bray-Curtis par rapport à la médiane de référence est calculée de la même façon pour chaque station.
- Les résultats sont présentés pour chaque station, avec la moyenne (± erreur type) pour la zone.
Le calcul des distances de Bray-Curtis avec la base de données fictive donnerait les résultats suivants :Le calcul des distances de Bray-Curtis Station Σ | yi1-yi2 | Σ (yi1+yi2) Distance de B-C
par rapport à la médianeMoyenne
± erreur typeRéf. 1 3 25 0,12 0,18 ± 0,06 Réf. 2 5 31 0,16 Réf. 3 11 27 0,41 Réf. 4 4 32 0,13 Réf. 5 2 30 0,07 Exp. 1 26 54 0,48 0,43 ± 0,03 Exp. 2 17 41 0,41 Exp. 3 17 43 0,40 Exp. 4 23 45 0,51 Exp. 5 13 39 0,33 - Enfin, pour vérifier la présence éventuelle d’un effet dans la zone exposée, la distance de Bray-Curtis moyenne entre les stations de référence et la médiane de référence (0,18 ± 0,06) peut être comparée statistiquement à la distance moyenne entre les stations exposées et la médiane de référence (0,43 ± 0,03).
Indice de diversité de Simpson (D) : l’indice de diversité de Simpson tient compte tant de l’abondance et que de la richesse taxinomique de la communauté d’invertébrés. Il est calculé en déterminant la contribution relative (ou proportionnelle) de chaque catégorie taxinomique au total observé à chaque station. La valeur de D calculée pour chaque station devrait être indiquée, avec la moyenne (± erreur type, ± ET), la médiane et les valeurs maximale et minimale de D pour la zone. Le calcul de l’indice de diversité de Simpson s’effectue selon l’équation suivante (Krebs, 1985) :
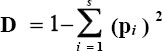
où :
D = indice de diversité de Simpson
S = nombre total de taxons à la station
pi = proportion du ie taxon à la station
Densité de chaque taxon (famille) : nombre d’individus de chaque taxon (famille), exprimé par unité de surface (p. ex., nombre d’invertébrés/m2). Les valeurs de densité doivent être indiquées pour chacun des taxons à chaque station. Ces valeurs doivent être accompagnées de la moyenne (± erreur type) de chaque taxon pour la zone.
Abondance relative de chaque taxon (familles) : abondance relative (exprimée en pourcentage) de chaque taxon à chaque station. Ces valeurs doivent être accompagnées du pourcentage moyen (± erreur type) pour chaque taxon pour la zone.
Présence/absence de chaque taxon (familles) : présentée sous la forme d’une matrice indiquant la présence ou l’absence de chaque taxon à chaque station d’échantillonnage. Les colonnes correspondent aux stations, et les lignes, aux taxons.
Outre les descripteurs des invertébrés benthiques, les variables de suivi des sédiments sont également présentées (voir le chapitre 7).
4.10 Évaluation des résultats
4.10.1 Effets sur la communauté d’invertébrés benthiques
L’objectif de l’étude de la communauté des invertébrés benthiques réalisée dans le cadre du Programme d’ESEE est de répondre à la question suivante :
« L’effluent a-t-il des effets sur la communauté d’invertébrés benthiques? »
La définition du terme « effet » est donnée à l’article 1 de l’annexe 5 du Règlement sur les effluents des mines de métaux.
Pendant les premières phases du programme de suivi et lors de la détermination de l’ampleur et de la portée géographique, les critères d’effet suivants sont calculés et rapportés. Ils servent à déterminer s’il y a des effets sur la communauté d’invertébrés benthiques :
- la densité totale des invertébrés benthiques;
- la richesse des taxons (familles);
- l’indice de régularité (de Simpson);
- l’indice de similarité (de Bray-Curtis).
Pour le volet des invertébrés benthiques, il est recommandé de calculer et de présenter également les critères d’appui suivants :
- Indice de diversité de Simpson
- Densité de chaque taxon (familles)
- Abondance relative de chaque taxon (familles)
- Présence/absence de chaque taxon (familles)
Tous ces critères, décrits en détail à la section précédente (4.9), sont essentiellement des paramètres sommaires choisis pour englober toute l’étendue des effets éventuels de l’effluent d’une mine de métaux.
De nombreux autres descripteurs des invertébrés benthiques sont proposés dans la documentation scientifique. Si on le souhaite, d’autres descripteurs propres au site peuvent être calculés et servir à étayer l’interprétation des effets. Resh et al. (1995) énumèrent les divers critères qui orientent la sélection de ces descripteurs et évaluent leur applicabilité à l’étude des invertébrés benthiques.
Pour les analyses statistiques et la détermination du niveau de puissance approprié, les recommandations relatives à l’établissement de la taille de l’effet et des valeurs de a et de b formulées à la section 8.6.1 demeurent valides. Il était recommandé dans cette section d’utiliser des valeurs de a et b égales ne dépassant pas 0,10. La méthode d’analyse convenant à chacun des types de plans d’étude (c.-à-d., ANOVA, ANCOVA, régression, analyse multivariable) est indiquée au tableau 4-1.
Une dernière mise en garde concernant l’étude des effets sur la communauté d’invertébrés benthiques s’impose. Il est essentiel que l’exploitant de la mine de métaux choisisse un plan d’étude propre au site afin de mener une évaluation appropriée. Il est donc vital de bien choisir la ou les zones de référence (voir la section 4.3.5). L’exemple assez courant qui suit illustre l’importance de sélectionner judicieusement la ou les zones de référence. Si une mine de métaux opte pour un plan contrôle-impact simple comportant une zone de référence en amont, ce sont les différences relevées entre la communauté en amont et la communauté en aval qui, selon leur importance, indiqueront la présence ou l’absence d’effets. Toutefois, si les communautés se trouvant en aval sont perturbées par un facteur tel que le rétablissement du débit original qui était obstrué en amont (p. ex., par une digue), ces communautés, bien que différentes de celles se trouvant en amont, pourraient ressembler davantage, mais sans nécessairement être similaires, à celles d’une zone de référence choisie dans un bassin hydrographique adjacent (ou plus éloignée du point de rejet). En pareilles circonstances, la sélection d’une zone de référence additionnelle (voir l’exemple fourni à la figure 4-2d) pourrait bien être justifiée en dépit des coûts supplémentaires découlant d’une telle décision, l’interprétation et l’évaluation des effets à chaque site pouvant alors être réalisées de façon appropriée. Dans cet exemple, les différences significatives relevées entre les zones en amont et en aval ne seront pas nécessairement considérées comme un effet si un nombre suffisant de données additionnelles tendent à démontrer le contraire.
4.10.2 Prochaine étape
Une fois les données de suivi analysées, il faut décider de la prochaine étape du Programme d’ESEE. Cette étape dépend de la relation entre plusieurs facteurs clés, qui sont brièvement examinés ci-dessous.
La conclusion statistique de l’étude des invertébrés benthiques précédente
L’étude de la communauté d’invertébrés benthiques peut conduire à l’une des trois conclusions statistiques suivantes :
- aucun effet n’est détecté, mais la puissance est insuffisante (puissance < 0,90);
- aucun effet n’est détecté et la puissance est suffisante (puissance ≥ 0,90);
- un effet est détecté.
Si l’un des critères d’effet (densité totale des invertébrés, richesse des taxons, indice de régularité [de Simpson] et indice de similarité [de Bray-Curtis]) révèle la présence d’une différence statistiquement significative entre les zones exposées et les zones de référence (ou le long d’un gradient), il faut conclure à la présence d’un effet sur la communauté d’invertébrés benthiques. Diverses méthodes statistiques peuvent conduire à ce résultat. Le choix des méthodes dépend du plan d’étude du programme de suivi.
Si la puissance est insuffisante, la mine de métaux peut réévaluer le nombre de stations d’échantillonnage retenues ou le plan d’échantillonnage choisi de manière à ce que la prochaine étude ait la puissance requise.
Options du Programme d’ESEE lorsque des effets ont été décelés
Si des effets sur la communauté d’invertébrés benthiques sont détectés, il faudra répondre à la question suivante :
Les effets sont-ils liés à l’exploitation de la mine de métaux?
Les questions suivantes peuvent aider à déterminer si les effets observés sont effectivement liés à l’exploitation de la mine de métaux :
- La cause des effets est-elle connue ou soupçonnée?
- Les effets peuvent-ils être imputés à un changement naturel des conditions dans l’environnement aquatique récepteur?
- Les effets peuvent-ils être raisonnablement corrélés à un facteur anthropique autre que l’effluent de la mine de métaux?
- L’approche fondée sur le poids de la preuve indique-t-elle une relation de cause à effet (voir la section 4.11)?
Cette série de questions peut être utilisée comme approche pour permettre de déterminer si les effets observés sont liés à la mine de métaux. Si la présence de facteurs de confusion rend difficile la détermination des effets de l’effluent de la mine de métaux sur la communauté d’invertébrés benthiques, la mine de métaux devrait réexaminer le plan d’étude pour la phase suivante. Si les effets observés sont confirmés et que leur cause est inconnue, la mine de métaux passe à l’étape suivante de l’évaluation et de l’interprétation des données : la détermination de l’ampleur et de la portée géographique des effets.
L’ampleur et la portée géographique des effets sont-elles connues?
Si les effets observés sont confirmés (voir le chapitre 1 pour plus de détails sur les effets confirmés) et que leur cause est inconnue, la mine de métaux passe à l’étape suivante et détermine l’ampleur et la portée géographique des effets. Pour en savoir plus, veuillez consulter la section 4.2.2.
4.11 Autres outils pour le suivi ciblé, les approches fondées sur le poids de la preuve ou la recherche des causes
Un certain nombre d’autres outils et approches peuvent être utilisés pour la recherche des causes dans le cadre du Programme d’ESEE. Les méthodes décrites dans le présent guide ne se veulent pas exhaustives et les mines de métaux peuvent proposer d’autres approches scientifiquement défendables. Les outils doivent être rentables, reconnus dans les publications scientifiques et offerts par les laboratoires consultants, universitaires et gouvernementaux, et ils doivent satisfaire aux exigences du Programme d’ESEE.
Des renseignements complémentaires se trouvent dans les chapitres 9 et 12 du présent guide.
4.11.1 Application des approches fondées sur le poids de la preuve à la recherche des causes des effets
Pour distinguer parmi les impacts cumulatifs d’agents de stress multiples, dont les effets peuvent parfois se confondre, il faut établir clairement un lien de cause à effet avec l’effluent étudié. Cette situation s’impose particulièrement dans le cadre des évaluations environnementales des écosystèmes aquatiques, car ces derniers reçoivent souvent plus d’un effluent présentant des effets interdépendants. L’évaluation des résultats d’un suivi est souvent fondée, dans une large mesure, sur les données de suivi sur le terrain. Or, si ces données permettent d’établir des corrélations entre l’effluent d’une mine de métaux et son effet présumé, elles ne révèlent pas l’existence d’une relation claire de cause à effet. L’utilisation d’une approche fondée sur le poids de la preuve alliant des informations de provenances diverses peut cependant faciliter l’établissement d’un tel lien. Pour en savoir plus sur l’utilisation des approches fondées sur le poids de la preuve, veuillez consulter les chapitres 9 et 12 du présent guide technique.
4.11.2 Essais de toxicité létale et sublétale
Les essais de toxicité létale et sublétale peuvent être utilisés durant les études de l’ampleur et de la portée géographique des effets et de la recherche des causes lorsqu’un effet a été détecté ou lorsque des travaux antérieurs n’ont pas permis d’élucider de façon satisfaisante les causes. Ces méthodes permettent de déterminer directement la toxicité létale ou sublétale et de confirmer que les perturbations du benthos sont attribuables à la toxicité de l’effluent plutôt qu’à des facteurs de confusion. Par exemple, les effets néfastes sur la structure de la communauté d’invertébrés benthiques peuvent être dus à d’autres facteurs que la toxicité de l’effluent, dont des différences de conditions environnementales. Mais lorsque l’altération de la structure de la communauté s’accompagne d’une toxicité, l’effluent devrait être la cause des changements observés chez les invertébrés benthiques. Ces méthodes fournissent également des renseignements importants pour l’interprétation des effets notés sur le terrain lorsque les données sur la communauté d’invertébrés benthiques sont peu concluantes ou lorsque seulement des espèces tolérant la pollution sont présentes dans les sites exposés et les sites de référence.
4.11.3 Analyse de carottes de sédiments pour l’étude des tendances historiques
Le profil sédimentaire des zones de sédimentation des plans d’eau peut refléter les conditions limnologiques récentes et anciennes (Frey, 1988). La détermination précise de l’âge des sédiments combinée à un inventaire des restes de certains organismes et végétaux (p. ex., diatomées, zooplancton, insectes) permet de retracer la chronologie des changements, lesquels sont souvent liés à la période d’influence anthropique. Cette façon de faire permet de reconstituer non seulement l’histoire du plan d’eau, mais aussi celle des bassins hydrographique et atmosphérique, et de distinguer les effets des événements naturels de ceux des perturbations anthropiques. De nombreux ouvrages ont été rédigés sur le sujet. Frey (1988) présente une synthèse des connaissances dans ce domaine. Malheureusement, ce type d’analyse exige une grande expertise, et les services paléolimnologiques demeurent peu disponibles. En outre, les analyses ne révèlent que les tendances qui se sont maintenues sur de longues périodes (plusieurs années à plusieurs décennies) du fait de la nature des processus de sédimentation comme la bioturbation. Le coût de ces analyses varie selon les caractéristiques des sites étudiés.
4.11.4 Autres paramètres associés aux invertébrés benthiques et autres organismes
Les invertébrés benthiques sont les principaux organismes indicateurs dont l’utilisation est recommandée dans le cadre d’un Programme d’ESEE pour le suivi des effets sur les habitats du poisson. Toutefois, les niveaux d’identification et les mesures recommandés dans le présent guide ne constituent pas la liste des seules mesures permettant d’évaluer les communautés d’invertébrés benthiques. D’autres mesures comme la biomasse, un niveau d’identification taxinomique plus poussé, la production secondaire et divers paramètres rendant compte du degré d’adaptation des communautés d’invertébrés peuvent également se révéler utiles pour les programmes de suivi.
En milieu marin, la biomasse des invertébrés benthiquespeut livrer des informations additionnelles utiles parce qu’elle renseigne sur la quantité d’énergie disponible pour les autres niveaux trophiques (p. ex., poissons). Pour les communautés marines, certains chercheurs affirment qu’une analyse de l’abondance et de la biomasse des organismes benthiques fournit un indicateur sensible des changements de la composition de la communauté benthique (p. ex., Warwick, 1986; Warwick et al., 1987; Clarke, 1990; Burd et al., 1990). Ainsi, dans les échantillons marins, la distribution de la biomasse permet de séparer les trois principaux groupes fonctionnels d’organismes benthiques, soit la microfaune (organismes vivant à la surface des particules de sédiments), la méiofaune (organismes occupant les espaces interstitiels) et la macrofaune (organismes fouisseurs et épifaune) (Schwinghamer, 1981, 1983). Comme ces trois groupes d’organismes présentent des modes de reproduction, des rythmes métaboliques, des adaptations environnementales et des cycles vitaux différents, ils réagissent différemment aux perturbations de l’habitat. Cette particularité peut devenir fort importante dans les habitats infralittoraux arctiques, où l’abondance peut être faible mais les individus de grande taille. Toutefois, la mesure précise de la biomasse peut être fastidieuse et difficile (Crisp, 1984), à moins qu’elle soit effectuée selon un niveau de précision et une fréquence excédant la portée d’un Programme d’ESEE. Ainsi, l’analyse des échantillons prélevés dans le cadre d’un tel programme permet seulement de révéler les changements relatifs de biomasse. La méthode consiste à mesurer le poids humide égoutté de spécimens adultes de taille représentative de chacune des espèces répertoriées au cours de chaque étude. Comme cette méthode est non destructrice, la collection de référence peut être utilisée à cette fin avant la vérification externe ou l’archivage. Le poids moyen d’une espèce donnée peut alors être utilisé pour transformer les données d’abondance en biomasse relative aux fins de la réalisation d’analyses statistiques additionelles. Ces données n’indiquent que les changements relatifs importants et ne peuvent être utilisées pour déduire la production ou le flux trophique au sein des communautés benthiques.
Outre les invertébrés benthiques, plusieurs autres types de biote aquatique ont été envisagés en vue du Programme d’ESEE. Parmi les plus pertinents figuraient : 1) le phytoplancton; 2) les macrophytes; 3) le périphyton.
4.12 Références
Abbott, R.T. 1974. American Seashells. 2nd Edition. New York (NY), Van Nostrand Reinhold Co. 633 pages.
Abbott, R.T., H.S. Zim et G.F. Sandström. 2001. Seashells of North America. A Guide to Field Identification. Golden Field Guides from St. Martin’s Press. New York (NY), St. Martin’s Press. 280 pages.
AETE – Aquatic Effects Technology Evaluation Program. 1995. Field Evaluation of Aquatic Effects Monitoring Methods-Pilot Study. Volume 1. AETE Project 4.1.1. Ottawa (Ont.), Centre canadien de la technologie des minéraux et de l'énergie.
Alberta Environment. 1990. Selected Methods for the Monitoring of Benthic Invertebrates in Alberta Rivers. Environmental Quality Monitoring Branch, Alberta Environment.
Appy, T.D., I.F. Linkletter et M.J. Dadswell. 1980. A Guide to the Marine Flora and Fauna of the Bay of Fundy: Annelida: Polychaeta. Biological Station, St. Andrews (NB), Fisheries and Marine Service Technical Report No. 920. 124 pages.
Austin, W.C. 1985. An Annotated Checklist of Marine Invertebrates in the Cold Temperate Northeast Pacific, Vol. 1, 2 and 3. Cowichan Bay (C.-B.), Khoyatan Marine Laboratory, Rapport pour Pêches et Océans Canada.
Bailey, R.C., R.H. Norris et T.B. Reynoldson. 2003. Bioassessment of Freshwater Ecosystems. Boston (MA), Kluwer.
Baker, H.R. 1980. Key to the Common Tubificid Species of the Northeast Pacific. Manuscript from Oligochaeta Workshop.
Banse, K. 1972. « Redescription of some species of Chone Kröyer and Euchone Malmgren, and three new species (Sabellidae, Polychaeta) », Fishery Bulletin, 70 (2) : 459-495.
Banse, K, et K.D. Hobson. 1974. Benthic Errantiate Polychaetes of British Columbia and Washington. Ottawa (Ont.), Bulletin of the Fisheries Research Board of Canada 185. 111 pages.
Barber, W.E., et N.R. Kevern. 1974. « Seasonal variation of sieving efficiency in a lotic habitat », Freshwater Biology, 4 : 293-300.
Beak. 1999. Quality Assurance Program for Assessing Mine-Related Effects Using Benthic Invertebrate Communities. Aquatic Effects Technology Evaluation (AETE) project 2.1.4. Ottawa (Ont.), Ressources Naturelles Canada, Centre canadien de la technologie des minéraux et de l'énergie (CANMET). 33 pages.
Bednarik, A.F., et W.P. McCafferty. 1979. Biosystematic Revision of the Genus Stenonema (Ephemeroptera: Heptageniidae). Bulletin canadien des sciences halieutiques et aquatiques, no 201. 73 pages.
Berkeley, C., et E. Berkeley. 1952a. Canadian Pacific Fauna, 9. Annelida 9b (1) Polychaeta Errantia. Toronto (Ont.), University of Toronto Press, Fisheries Research Board of Canada.
Berkeley, C., et E. Berkeley. 1952b. Canadian Pacific Fauna 9. Annelida 9b (2) Polychaeta Sedentaria. Toronto (Ont.), University of Toronto Press, Fisheries Research Board of Canada.
Blake, J.A. 1971. « Revision of the genus Polydora from the east coast of North America (Polychaeta: Spionidae) », Smithsonian Contributions to Zoology, 75 : 1-32.
Blake, J.A. 1988. « New species and records of Phyllodocidae (Polychaeta) from Georges Bank and other areas of the western North Atlantic », Sarsia, 73 : 245-257. Bergen ISSN 0036-4827.
Blake, J.A. 1991. « Revision of some genera and species of Cirratulidae (Polychaeta) from the western North Atlantic », dans M.E. Petersen et J.B. Kirkegaard (éd.), Systematics, Biology and Morphology of World Polychaeta. Proceedings of the Second International Polychaete Conference, Copenhagen, August 18-23, 1986. Ophelia Supplement 5. Pp. 17-30.
Bloom, S.A. 1981. « Similarity indices in community studies: Potential pitfalls », Marine Ecology Progress Series, 5 : 125-128.
Booth, J., D.E. Hay et J. Truscott. 1996. Standard Methods for Sampling Resources and Habitats in Coastal Subtidal Regions of British Columbia: Part 1: Review of Mapping with Preliminary Recommendations. Rapport technique canadien des sciences halieutiques et aquatiques, no 2118 : viii + 53 pages.
Bousfield, E.L. 1958. « Fresh-water amphipod crustaceans of glaciated North America », Canadian Field-Naturalist, 72 (2) : 55-113.
Bousfield, E.L. 1973. Shallow-Water Gammaridean Amphipoda of New England. Ithaca (NY), Cornell University Press.
Bousfield, E.L. 1960. Canadian Atlantic seashells. Ottawa (Ont.), Ministère du Nord canadien et des Ressources nationales, Musée national du Canada. 72 pages.
Bousfield, E.L., et E.A. Hendryks. 1994. « The amphipod superfamily Leucothoidea on the Pacific coast of North America. Family Pleustidae: subfamily Pleustinae. Systematics and Biogeography », Amphipacifica, 1 (2) : 3-69.
Bousfield, E.L., et E.A. Hendryks. 1995a. « The amphipod Family Pleustidae on the Pacific coast of North America. Part III. Subfamilies Parapleustinae, Dactylopleustinae, and Pleusirinae: systematics and distributional ecology », Amphipacifica, 2 (1) : 65-133.
Bousfield, E.L., et E.A. Hendryks. 1995b. « The amphipod superfamily Eusiroidea in the North American Pacific region. I. Family Eusiridae: systematics and distributional ecology », Amphipacifica, 1 (4) : 3-60.
Bousfield, E.L., et P.M. Hoover. 1995. « The amphipod superfamily Pontoporeioidea on the Pacific coast of North America. II. Family Haustoriidae. Genus Eohaustorius J.L. Barnard: systematics and distributional ecology », Amphipacifica, 2 (1) : 35-63.
Bousfield, E.L., et J.A. Kendall. 1994. « The amphipod superfamily Dexaminoidea of the North American Pacific coast; families Atylidae and Dexaminidae: systematics and distributional ecology », Amphipacifica, 1 (3) : 3-66.
Bowman, M.F., et R.C. Bailey. 1997. « Does taxonomic resolution affect the multivariate description of the structure of freshwater benthic macroinvertebrate communities? », Canadian Journal of Fisheries and Aquatic Sciences, 54 : 1802-1807.
Brandlova, J., Brandl Z. et C. H. Fernando. 1972. « The Cladocera of Ontario with remarks on some species and distribution », Canadian Journal of Zoology, 50 : 1373-1403.
Bray, J.R., et J.T. Curtis. 1957. « An ordination of the upland forest communities of southern Wisconsin », Ecological Monographs, 27 : 325-349.
Brinkhurst, R.O. 1982. British and Other Marine and Estuarine Oligochaetes. Synopses of the British Fauna (N.S.) 21. Cambridge (Royaume-Uni), Cambridge University Press. 127 pages.
Brinkhurst, R.O. 1986. Guide to the Freshwater Aquatic Microdrile Oligochaetes of North America. Publication spéciale canadienne des sciences halieutiques et aquatiques no 84. Ottawa (Ont.), Pêches et Océans Canada, Direction de l’information et des publications scientifiques. 259 pages.
Brinkhurst, R.O., et H.R. Baker. 1979. « A review of the marine Tubificidae (Oligochaeta) of North America », Canadian Journal of Zoology, 57 : 1553-1569.
Brunel, P., L. Bossé et G. Lamarche. 1998. Catalogue des Invertébrés marins de l’estuaire et du golfe du Saint-Laurent / Catalogue of the Marine Invertebrates of the Estuary and Gulf of Saint Lawrence. Publication spéciale canadienne des sciences halieutiques et aquatiques no 126. Ottawa (Ont.), Conseil national de recherches du Canada. 405 pages.
Burch, J.B. 1975a. Freshwater Sphaeriacean clams (Mollusca: Pelecypoda) of North America. Hamburg (MI), Malacological Publications.
Burch, J.B. 1975b. Freshwater Unionacean Clams (Mollusca: Pelecypoda) of North America. Hamburg (MI), Malacological Publications.
Burch, J.B. 1989. North American Freshwater Snails. Ann Arbor, (MI), Malacological Publications. 365 pages.
Burd, B.J., A. Nemec et R.O. Brinkhurst. 1990. « The development and application of analytical methods in benthic marine infaunal studies », Advances in Marine Biology, 26 : 169-247.
Butler, T.H. 1983. Shrimps of the PacificCoast of Canada. Bulletin canadien des sciences halieutiques et aquatiques, no 202. Ottawa (Ont.), Ministère des Pêches et des Océans.
Camburn, K.E., J.C. Kingston et D.F. Charles (éd.). 1984-1986. PIRLA Diatom Iconograph. Contient 53 planches photographiques et 1059 figures avec légendes. PIRLA unpublished Report Series, Report No. 3. Bloomington (IN), Indiana University.
Chu, H.F., et L.K. Cutkomp. 1992. How to Know the Immature Insects. 2nd edition. Dubuque (IA), Wm. C. Brown Publishers.
Clark, H.L. 1915. « Catalogue of recent ophiurans », Mem. Mus. Comp. Zool. Harv., 25: 165-376 + 20 plates.
Clark, H.L. 1924. « Some holothurians from British Columbia », Canadian Field-Naturalist, 38 : 54-57.
Clarke, A.H. 1981. Les Mollusques d’Eau Eouce du Canada. Ottawa (Ont.), Musée national des sciences naturelles, Musées nationaux du Canada. 447 pages.
Clarke, K.R. 1990. « Comparisons of dominance curves », Journal of Experimental Marine Biology and Ecology, 138 : 143-157.
Clarke, K.R., et R.H. Green. 1988. « Statistical design and analysis for a ‘biological effects’ study », Marine Ecology Progress Series, 46 : 213-226.
Clarke, R.T., M.T. Furse et J.F. Wright. 1992. A Comparison of Single, Paired and Three Season Combined Macro-Invertebrate Samples for the Biological Banding of River Quality. Bristol (R.-U.), National Rivers Authority.
Clifford, H.F. 1991. Aquatic Invertebrates of Alberta. Edmonton (Alb.), University of Alberta Press. 538 pages.
Coates, K.A. 1980. Keys to Intertidal Genera and Species of Enchytraeidae found in British Columbia. Manuscript from Oligochaeta Workshop. Victoria (C.-B.), University of Victoria.
Coe, W.R. 1912. « Echinoderms of Connecticut », Connecticut State Geological and Natural History Survey, 19 :1-147.
Coe, W.R. 1943. « Biology of the nemerteans of the west coast of North America », Transactions of the Connecticut Acadademy of Arts and Sciences, 35 : 129-328 + plates 1-4.
Cowardin, L.M., V. Carter, F.C. Golet et E.T. LaRoe. 1979. Classification of wetlands and deepwater habitats of the United States. Washington (DC), U.S. Fish and Wildlife Service. FWS/OBS-79/31.
Cowardin, L.M., et F.C. Golet. 1995. « US Fish and Wildlife Service 1979 wetland classification: A review », Vegetatio, 118 : 139-152.
Crisp, D.J. 1984. « Energy flow measurements», dans N.A. Holme et A.D. McIntyre (éd.), Methods for the Study of Marine Benthos. IBP Handbook 16. Oxford (Royaume-Uni), Blackwell Scientific Publications. Pp. 284-370.
Crocker, D.W., et D.W. Barr. 1968. Handbook of the Crayfishes of Ontario. Toronto (Ont.), University of Toronto Press. 158 pages.
Cuffney, T.F., M.E. Gurtz et M.R. Meador. 1993. Guidelines for the Processing and Quality Assurance of Benthic Invertebrate Samples Collected as part of the National Water-Quality Assessment Program. U.S. Geological Survey Open-File Report 93-407.
Culp, J.M., R.B. Lowell et K.J. Cash. 2000. « Integrating mesocosm experiments with field and laboratory studies to generate weight-of-evidence risk assessments for large rivers », Environmental Toxicology and Chemistry, 19 : 1167-1173.
Cutler, E.B. 1973. « Sipuncula of the western North Atlantic », Bulletin of the American Museum of Natural History, 152 (3) : 1-204.
Downing, J.A. 1979. « Aggregation, transformation and the design of benthos sampling programs », Journal of the Fisheries Research Board of Canada, 36 : 1454-1463.
Downing, J.A. 1981. « How well does the fourth-root transformation work? », Canadian Journal of Fisheries and Aquatic Sciences, 38 : 127-129.
Downing, J.A. 1984. « Sampling the benthos of standing waters », dans J.A. Downing et F.H. Rigler (éd.), A Manual on Methods for the Assessment of Secondary Productivity in Fresh Waters. Second Edition. IBP Handbook 17. Oxford (Royaume-Uni), Blackwell Scientific Publications. Pp. 87-130.
Downing, J.A. 1986. « Spatial heterogeneity: Evolved behaviour or mathematical artefact? », Nature, 323 : 255-257.
Dussart, B. 1969. Les copépodes des eaux continentales. Paris (FR), Éditions N. Boubée & Cie. 292 pages.
Edmunds Jr., G.F., S.L. Jensen et L. Berner. 1976. The Mayflies of North and Central America. Minneapolis (MN), University of Minnesota Press. 330 pages.
Eleftheriou, A., et N.A. Holme. 1984. « Macrofauna techniques », dans N.A. Holme et A.D. McIntyre (éd.), Methods for the Study of Marine Benthos. IBP Handbook 16. Oxford (Royaume-Uni), Blackwell Scientific Publications. Pp. 140-216.
Elliott, J.M. 1977. Some Methods for the Statistical Analysis of Samples of Benthic Invertebrates. Freshwater Biological Association Scientific Publication No. 25. Ambleside (Royaume-Uni), Freshwater Biological Association. 160 pages.
Elliott, J.M., et P.A. Tullett. 1978. A Bibliography of Samplers for Benthic Invertebrates. Freshwater Biological Association Occasional Publication No. 4. Ambleside (Royaume-Uni), Freshwater Biological Association. 61 pages.
Elliott, J.M., et P.A. Tullett. 1983. A Supplement to a Bibliography of Samplers for Benthic Macroinvertebrates. Freshwater Biological Association Occasional Publication No. 20. Ambleside (Royaume-Uni), Freshwater Biological Association. 27 pages.
Environnement Canada. 2002. Le Guide révisé pour les protocoles de tri des échantillons et de sous-échantillonnage pour les ESEE portant sur les communautés d’invertébrés benthiques. Ottawa (Ont.). Bureau national des ESEE, Environnement Canada.
EVS Environment Consultants. 1993. Guidelines for Monitoring Benthos in Freshwater Environments. Prepared for: Environment Canada, 224 West Esplanade, North Vancouver, B.C.
Fauchald, K. 1977. The Polychaeta Worms. Definitions and Keys to Orders, Family and Genera. Science Series 28. Los Angeles (CA), Natural History Museum of Los Angeles County,. 188 pages.
Finlayson, C.M., et A.G. van der Valk. 1995. « Wetland classification and inventory: A summary », Vegetatio, 118 (1-2) : 185-192.
Fitzpatrick Jr., J.F. 1983. How to Know the Freshwater Crustacea. Dubuque (IA), Wm. C. Brown Publishers.
Fournier, J.A., et M.E. Petersen. 1991. « Cossura longocirrata: Redescription and distribution, with notes on reproductive biology and a comparison of described species of Cossura (Polychaeta: Cossuridae) », Ophelia Supplement, 5 : 63-80.
Frey, D.G. 1988. « What is paleolimnology? », Journal of Paleolimnology, 1 : 5-8.
Frith, H.R., G. Seraring, P. Wainwright, H. Harper et B. Emmett. 1993. Review of Habitat Classification Systems and an Assessment of their Suitability to Coastal B.C. Rapport inédit. Sidney (C.-B.), L.G.L. Ltd pour Environnement Canada, Direction des services des urgences environnementales.
Fullington, K.E., et K.W. Stewart. 1980. « Nymphs of the stonefly genus Taeniopteryx (Plecoptera: Taeniopterygidae) of North America », Journal of the Kansas Entomological Society, 53 : 237-259.
Gibson, R. 1994. Nemerteans. 2nd edition. Synopses of the British Fauna (New Series) No. 24. Shrewsbury (Royaume-Uni), Field Studies Council. 224 pages.
Glozier, N. 1989. The Effects of Biotic and Abiotic Factors on the Foraging Success of a Lotic Minnow, Rhinichthys cataractae. Mémoire de maîtrise. Calgary (AB), University of Calgary. 151 p.
Gosner, K.I. 1971. Guide to the Identification of Marine and Estuarine Invertebrates. New York (NY), J. Wiley and Sons. 693 pages.
Graham, A. 1988. Molluscs: Prosobranchs and Pyramellid Gastropods. 2nd edition. D.M. Kermack & R.S.K. Barnes (éd.), Synopses of the British Fauna (New Series) No. 2. The Linnean Society of London.
Gray, J.S., K.R. Clarke, R.M. Warwick et G. Hobbs. 1990. « Detection of initial effects of pollution on marine benthos: An example from the Ekofisk and Eldfisk oilfields, North Sea », Marine Ecology Progress Series, 66 : 285-299.
Green, R.H. 1979. Sampling Design and Statistical Methods for Environmental Biologists. Toronto (Ont.), John Wiley and Sons. 257 pages.
Green, G. 1994. Protocols for Reference and Voucher Collections of Aquatic Invertebrates Stored at the Royal British Columbia Museum. DOE-FRAP 1994-15.
Harper, P.P., et K.W. Stewart. 1984. « 13. Plecoptera », dans R.W. Merritt et K.W. Cummins (éd.), An Introduction to the Aquatic Insects of North America. 2nd edition. Dubuque (IA), Kendall/Hunt Publ. Co. Pp. 182-230.
Hart, J.F.L. 1982. Crabs and Their Relatives of British Columbia. Handbook No. 40. Victoria (C.-B.), British Columbia Provincial Museum.
Hauer, F.R., et G.A. Lamberti (éd.). 1996. Methods in Stream Ecology. San Diego (CA), Academic Press Inc. 674 pages.
Hay, D.E., R.D. Waters et T.A. Boxwell (éd.). 1996. Proceedings, Marine Ecosystem Monitoring Network Workshop, Nanaimo, B.C. March 28-30. 1995. Rapport technique canadien des sciences halieutiques et aquatiques, no 2108. 160 pages.
Hilsenhoff, W.L. 1995. Aquatic Insects of Wisconsin. Keys to Wisconsin Genera and Notes on Biology, Habitat, Distribution and Species. Madison (WI), Publication Number 3 of the Natural History Museams Council, University of Wiconsin-Madison. 79 pages.
Hilsenhoff, W.L., et K.L. Schmude. 1992. « Riffle beetles of Wisconsin (Coleoptera: Dryopidae, Elmidae, Lutrochidae, Psephenidae) with notes on distribution, habitat, and identification », Great Lakes Entomologist, 25 (3) : 191-213.
Hitchcock, S.W. 1974. Guide to the Insects of Connecticut. Part VII. The Plecoptera or Stoneflies of Connecticut. Bulletin of the State Geological and Natural History Survey of Connecticut 107. vi + 262 pages.
Hoaglin, D.C., F. Mosteller et J.W. Tukey. 1983. Understanding Robust and Exporatory Data Analysis. New York (NY), John Wiley.
Hobson, K.D., et K. Banse. 1981. Sedentariate and Archiannelid Polychaetes of British Columbia and Washington. Bulletin 209. Ottawa (Ont.), Ministère des Pêches et des Océans.
Holme, N.A., et A.D. McIntyre (éd). 1984. Methods for the Study of Marine Benthos. IBP Handbook 16. Oxford (Royaume-Uni), Blackwell Scientific Publications. 387 pages.
Hoyle, M.H. 1973. « Transformations – An introduction and a bibliography », International Statistical Review, 41 : 203-223.
Hurlbert, S.H. 1984. « Pseudoreplication and the design of ecological field experiments », Ecological Monographs, 54 : 187-211.
Hyman, L.H. 1940. « The polyclad flatworms of the Atlantic coast of the United States and Canada », Proc. U.S. Nat. Mus., 89 : 449-495.
Hyman, L.H. 1944. Marine Turbellaria from the Atlantic coast of North America. American Museum Novitates, No. 1266. 15 pages.
Jackson, D.A. 1993. « Multivariate analysis of benthic invertebrate communities: The implication of choosing particular data standardizations, measures of association, and ordination measures », Hydrobiologia, 268 : 9-26.
Johannsen, O.A. 1977. Aquatic Diptera. Los Angeles (CA), Entomological Reprint Specialists. Fourth reprinting.
Johnson, R.K., T. Wiederholm et D.M. Rosenberg. 1993. « Freshwater biomonitoring using individual organisms, populations, and species assemblages of benthic macroinvertebrates », dans D.M. Rosenberg et V.H. Resh (éd.), Freshwater Biomonitoring and Benthic Macroinvertebrates. New York (NY), Chapman and Hall. Pp. 40-125.
Jónasson, P.M. 1955. « The efficiency of sieving techniques for sampling freshwater bottom fauna », Oikos, 6 : 183-207.
Keen, A.M., et E. Coan. 1974. Marine Molluscan Genera of Western North America. Palo Alto (CA), Stanford University Press.
Klemm, D.J. 1972. Freshwater Leeches (Annelida: Hirudinea) of North America. U.S. Environmental Protection Agency, Identification Manual No. 8. Washington (DC), U.S. Environmental Protection Agency. 53 p.
Klemm, D.J. 1985. A Guide to the Freshwater Annelida (Polychaeta, Naidid and Tubificid Oligochaeta, and Hirudinea) of North America. Dubuque (IA), Kendall/Hunt Publ. Co. 198 pages.
Klemm, D.J. 1991. « Taxonomy and pollution ecology of the Great Lakes region leeches (Annelida: Hirudinea) », Michigan Academician, 24 : 37-103.
Klemm, D.J., P.A. Lewis, F. Fulk et J.M. Lazorchak. 1990. Macroinvertebrate Field and Laboratory Methods for Evaluating the Biological Integrity of Surface Waters. EPA 600/4-90/030. Cincinnati, (OH), U.S. Environmental Protection Agency, Environmental Monitoring Laboratory.
Knight-Jones, P. 1978. « New Spirorbidae (Polychaeta: Sedentaria) from the East Pacific, Atlantic, Indian and southern oceans », Zoological Journal of the Linnean Society, 64 : 201-240.
Knight-Jones, P. 1983. « Contributions to the taxonomy of Sabellidae (Polychaeta) », Zoological Journal of the Linnean Society, 79 : 245-295.
Kozloff, E.N. 1987. Marine Invertebrates of the Pacific Northwest. Seattle (WA), University of Washington Press.
Krebs, C.J. 1985. Ecology. The Experimental Analysis of Distribution and Abundance. Third edition. New York (NY), Harper and Row. 800 pages.
Kreis Jr., R.G. 1986. « Variability study. Section 17 », dans D.F. Charles et D.R. Whitehead (éd.), Paleoecological Investigation of Recent Lake Acidification (PIRLA): Methods and Project Description. Palo Alto (CA), Electric Power Research Institute.
Kreis Jr., R.G. 1989. « Variability Study - Interim Results. Section 4 », dans D.F. Charles et D.R. Whitehead (éd.), Paleoecological Investigation of Recent LakeAcidification (PIRLA): 1983-1985: Interim Report. October 1989. Palo Alto (CA), Electric Power Research Institute.
Kronberg, I. 1987. « Accuracy of species and abundance minimal areas determined by similarity area curves », Marine Biology, 96 : 555-561.
Lambert, P. 1981. The Sea Stars of British Columbia. B.C. Provincial Museum Handbook No. 39. Victoria (C.-B.), British Columbia Provincial Museum.
Laplante, S., Y. Bousquet, P. Bélanger et C. Chantal. 1991. Liste des espèces de coléoptères du Québec. Fabreries, Supplément no 6. Sillery (QC), Association des entomologistes amateurs du Québec. 136 pages.
Laubitz, D.R. 1972. The Caprellidae (Crustacea, Amphipoda) of Atlantic and Arctic Canada. Publication en océanographie biologique no 4. Ottawa (Ont.), Musée national des sciences naturelles, Musées nationaux du Canada. 82 pages.
Legendre, L., et P. Legendre. 1983. Numerical Ecology. Amsterdam (NL), Elsevier.
Lehmkuhl, D.M. 1975a. « Field guide to aquatic insect families », Blue Jay, 33 : 199-219.
Lehmkuhl, D.M. 1975b. « Saskatchewan damselflies and dragonflies », Blue Jay, 33 : 18-27.
Lehmkuhl, D.M. 1976. « Mayflies », Blue Jay, 34 : 70-81.
Lehmkuhl, D.M. 1979. How to Know the Aquatic Insects. Dubuque (IA), Wm. C. Brown Company Publishers.168 pages.
Leopold, L.B., G.M. Wolman et J.P. Miller. 1964. Fluvial Processes in Geomorphology. San Francisco (CA), W.H. Freeman and Co. 522 pages.
Leopold, L.B. 1994. A View of the River. Cambridge (MA), Harvard University Press. 297 pages.
Lewis, P.A. 1974. Taxonomy and Ecology of Stenonema Mayflies (Heptageniidae: Ephemeroptera). EPA-670/4-74-006. Cincinnati (OH), U.S. Environmental Protection Agency. 81 pages.
Levings, C.D., et R.M. Thom. 1994. « Habitat changes in the Georgia Basin: Implications for resource management and restoration », dans R.C.H. Wilson, R.J. Beamish, F. Aitkens et J. Bell (éd.), Review of the Marine Environment and Biota of Strait of Georgia, Puget Sound and Juan de Fuca Strait. Proceedings of the BC/Washington Symposium on the Marine Environment, Jan. 13-14, 1994. Rapport technique canadien des sciences halieutiques et aquatiques, no 1948. Pp. 330-351.
Light, W.J. 1977. « Spionidae (Annelida: Polychaeta) from San Francisco Bay, California: A revised list with nomenclatural changes, new records, and comments on related species from the northeastern Pacific Ocean », Proceedings of the Biological Society of Washington, 90 (1) : 66-88.
Lowell, R.B. 1997. Discussion Paper on Critical Effect Size Guidelines for EEM using Benthic Invertebrate Communities. Report to the Environmental Effects Monitoring Program. EEM/1997/9.
Lowell, R.B., J.M. Culp et M.G. Dubé. 2000. « A weight-of-evidence approach for northern river risk assessment: Integrating the effects of multiple stressors », Environmental Toxicology and Chemistry, 19 : 1182-1190.
Mackie, G.L., D.S. White et T.W. Zdeba. 1980. A Guide to Freshwater Molluscs of the Laurentian Great Lakes with Special Emphasis on the Genus Pisidium. EPA-600/3-80-068. Duluth (MN), U.S. Environmental Protection Agency, Office of Research and Development, Environmental Research Laboratory. 143 pages.
Mackie, G.L., et D.G. Huggins. 1983. Sphaeriacean Clams of Kansas. Technical Publications of the State Biological Survey of Kansas. Lawrence (KS), University of Kansas. 92 pages.
Malley, D.F., et J.B. Reynolds. 1979. « Sampling strategies and life history of non-insectan freshwater invertebrates », Journal of the Fisheries Research Board of Canada, 36 : 311-318.
Mason, C.F. 1991. Biology of Freshwater Pollution. Second Edition. New York (NY), Longman Scientific & Technical. 351 pages.
Matthews, G.W.T. 1993. The Ramsar Convention: Its History and Development. Gland, Suisse, Ramsar Convention Bureau.
McCafferty, W.P., et R.D. Waltz. 1990. « Revisionary synopsis of the Baetidae (Ephemeroptera) of North and Middle America », Transactions of the American Entomological Society, 116 : 769-800.
Meador, M.R., C.R. Hupp, T.F. Cuffney et M.E. Gurtz. 1993. Methods for Characterizing Stream Habitat as Part of the National Water-Quality Assessment Program. Raleigh (NC), U.S. Geological Survey. Open-File Report 93-408.
Merritt, R.W., et K.W. Cummins. 1984. An Introduction to the Aquatic Insects of North America. Second Edition. Dubuque (IA), Kendall/Hunt. 722 pages.
Merritt, R.W., et K.W. Cummins. 1996. An Introduction to the Aquatic Insects of North America. Third Edition. Dubuque (IA), Kendall/Hunt.
Morihara, D.K., et W.P. McCafferty. 1979. « The Baetis larvae of North America (Ephemeroptera: Baetidae) », Transactions of the American Entomological Society, 105 : 139-221.
Morris, P.A. 1951. A Field Guide to the Shells of our Atlantic and GulfCoasts. The Peterson Field Guide Series. Boston (MA), Houghton Mifflin Company. 236 pages.
Newbury, R.W. 1984. « Hydrolic determinants of aquatic insect habitats », dans V.H. Resh et D.M. Rosenberg (éd.), The Ecology of Aquatic Invertebrates. New York (NY), Praeger Publishers, New York.
Newbury, R.W., et M. Gaboury. 1993. Stream Analysis: Fish Habitat and Design. A field Manual. Gibsons (C.-B.), Newbury Hydraulics.
Norris, R.H., et A. Georges. 1993. « Analysis and interpretation of benthic macroinvertebrate surveys », dans D.M. Rosenberg et V.H. Resh (éd.), Freshwater Biomonitoring and Benthic Invertebrates. New York (NY), Chapman & Hall. Pp. 234-286.
Oliver, D.R., D. McClymont et M.E. Roussel. 1978. A Key to some Larvae of the Chironomidae (Diptera) from the Mackenzie and Porcupine River Watersheds. Fisheries and Marine ServiceTechnical Report No. 791. Ottawa (Ont.), Agriculture Canada.
Pearson, T.H. 1975. « The benthic ecology of Loch Linnhe and Loch Eil, a sea-loch system on the west coast of Scotland. IV. Changes in the benthic fauna attributable to organic enrichment », Journal of Experimental Marine Biology and Ecology, 20 : 1-41.
Peckarsky, B.L., P.R. Fraissinet, M.A. Penton et D.J. Conklin (éd.). 1990. Freshwater Macroinvertebrates of Northeastern North America. Ithaca (NY), Cornell University Press. 442 pages.
Pennak, R.W. 1978. Freshwater Invertebrates of the United States: Protozoa to Mollusca. Third edition. New York (NY), John Wiley & Sons Inc. 803 pages.
Pettibone, M.H. 1963. « Marine polychaete worms of the New England Region. 1. Aphroditidae through Trochochaetidae », U.S. Natl. Mus. Bull. 227:1. Washington (DC), Smithsonian Institute. Pp. 1-356.
Pettibone, M.H. 1992. « Contribution to the polychaete family Pholoidae Kinberg », Smithsonian Contributions to Zoology, 532 : 1-22.
Pettibone, M.H. 1993. « Scaled polychaetes (Polynoidae) associated with ophiuroids and other invertebrates and review of species referred to Malmgrenia McIntosh and replaced by Malmgreniella Hartman, with descriptions of new taxa », Smithsonian Contributions to Zoology, 538: 1-92.
Plafkin, J.L., M.T. Barbour et K.D. Porter. 1989. Rapid Bioassessment Protocols for use in Streams and Rivers: Benthic Macroinvertebrates and Fish. EPA/444/4-89-001. Washington (DC), U.S. Environmental Protection Agency, Office of Water Assessment and Watershed Protection Division. 162 pages.
Pohle, G.W. 1990. A Guide to Decapod Crustacea from the Canadian Atlantic: Anomura and Brachyura. Rapport technique canadien des sciences halieutiques et aquatiques, no 1771. 29 pages.
Pontasch, K.W., E.P. Smith et J. Cairns Jr. 1989. « Diversity indices, community comparison indices and canonical discriminant analysis: Interpreting the results of multispecies toxicity tests », Water Research, 23 : 1229-1238.
Rabeni, C.F., et K.E. Gibbs. 1978. « Comparison of two methods used by divers for sampling benthic invertebrates in deep rivers », Journal of the Fisheries Research Board of Canada, 35 : 332-336.
Rees, H.L. 1984. « A note on mesh selection and sampling efficiency in benthic studies », Marine Pollution Bulletin, 15 : 225-229.
Reish, D.J. 1959. « A discussion of the importance of the screen size in washing quantitative marine bottom samples », Ecology, 40 : 307-309.
Resh, V.H., R.H. Norris et M.T. Barbour. 1995. « Design and implementation of rapid assessment approaches for water resource monitoring using benthic macroinvertebrates », Australian Journal of Ecology, 20 : 108-121.
Reynoldson, T.B., R.C. Bailey, K.E. Day et R.H. Norris. 1995. « Biological guidelines for freshwater sediment based on BEnthic Assessment of SedimenT (the BEAST) using a multivariate approach for predicting biological state », Australian Journal of Ecology, 20 : 198-219.
Reynoldson, T.B., et D.M. Rosenberg. 1996. « Sampling strategies and practical considerations in building reference data bases for the prediction of invertebrate community structure », dans R.C. Bailey, R.H. Norris et T.B. Reynoldson (éd.), Study Design and Data Analysis in Benthic Macroinvertebrate Assessments of Freshwater Ecosystems using a Reference Site Approach. Technical Information Workshop, North American Benthological Society, 44th Annual Meeting, Kalispell, Montana. Pp. 1-31.
Reynoldson, T.B., R.H. Norris, V.H. Resh et D.M. Rosenberg. 1997. « The reference condition: A comparison of multimetric and multivariate approaches to assess water-quality impairment using benthic macroinvertebrates », Journal of the North American Benthological Society, 16 : 833-852.
Robinson, C.L.K., et C.D. Levings. 1995. An Overview of Habitat Classification Systems, Ecological Models, and Geographic Information Systems Applied to Shallow Foreshore Marine Habitats. Rapport manuscrit canadien des sciences halieutiques et aquatiques, no 2322. 65 pages.
Robinson, C.L.K., D.E. Hay, J. Booth et J. Truscott. 1996. Standard Methods for Sampling Resources and Habitats in Coastal Subtidal Regions of British Columbia: Part 2 - Review of Sampling with Preliminary Recommendations. Rapport technique canadien des sciences halieutiques et aquatiques, no 2119. xii + 119 pages.
Rosenberg, D.M. 1978. Practical Sampling of Freshwater Macrozoobenthos: A Bibliography of Useful Texts, Reviews, and Recent Papers. Canadian Fisheries and Marine Service Technical Report No. 790. 15 pages.
Rosenberg, D.M., et V.H. Resh (éd.). 1993. Freshwater Biomonitoring and Benthic Macroinvertebrates. New York (NY), Chapman & Hall. 488 pages.
Saether, O.A. 1975. Nearctic and Palaearctic Heterotrissocladius (Diptera: Chironomidae). Ottawa (Ont.), Bulletin of the Fisheries Research Board of Canada No. 193. 67 pages.
Saether, O.A. 1977. Taxonomic studies on Chironomidae: Nanocladius, Pseudochironomus and the Harnischia complex. Ottawa (Ont.), Bulletin of the Fisheries Research Board of Canada No. 196. 143 pages.
Sars, G.O. 1895. An Account of the Crustacea of Norway with Short Descriptions and Figures of all the Species. Vol. 1. Amphipoda. Christiana and Copenhagen, Danemark, A.L.B. Cammermeyers Forlag.. viii + 711 pages, 248 planches.
Sars, G.O. 1899. An Account of the Crustacea of Norway with Short Descriptions and Figures of all the Species. Vol. II. Isopoda. Bergen, Norvège, Bergen Museum. x + 270 pages, 104 planches. (Texte sur les Cryptoniscidae et les planches publiés en 1899).
Sars, G.O. 1900. An Account of the Crustacea of Norway with Short Descriptions and Figures of all the Species. Vol. III. Cumacea. Bergen, Norvège, Bergen Museum.
SBMNH – Santa Barbara Museum of Natural History. 1994a. Taxonomic Atlas, Vol. 1, Platyhelminthes, and Nemertea. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1994b. Taxonomic Atlas, Vol. 2, Porifera. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1994c. Taxonomic Atlas, Vol. 4, Oligochaeta and Polychaeta: Phyllodocidae to Paralacydoniidae. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1995a. Taxonomic Atlas, Vol. 5, The Annelida, Part 2, Polychaeta: Phyllodocida (Syllidae and Scale-Bearing Families), Amphinomida and Eunicida. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1995b. Taxonomic Atlas, Vol. 12, The Crustacea, Part 3, The Amphipoda. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1995c. Taxonomic Atlas, Vol. 13, The Bryozoa. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1996a. Taxonomic Atlas, Vol. 6, The Annelida, Part 3, Polychaeta: Orbiniidae to Cossuridae. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1996b. Taxonomic Atlas, Vol. 9, The Mollusca, Part 2, The Gastropoda. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1996c. Taxonomic Atlas, Vol. 14, Miscellaneous Taxa. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1997a. Taxonomic Atlas, Vol 10, The Pycnogonida, The Crustacea, Part 1, The Decapoda and Mysidacea. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1997b. Taxonomic Atlas, Vol. 11, The Crustacea, Part 2, The Isopoda, Cumacea and Tanaidacea. Santa Barbara (CA), Santa Barbara Museum of Natural History.
Schefter P., et G.B. Wiggins. 1986. A Systematic Study of the Nearctic Larvae of the Hydropsyche morosa Group (Trichoptera: Hydropsychidae). Toronto (Ont.), Royal Ontario Museum,.
Schmitt, R.J., et C.W. Osenberg. 1996. Detecting Ecological Impacts: Concepts and Applications in Coastal Habitats. San Diego (CA), Academic Press. 401 pages.
Schultz, G.A. 1969. The Marine Isopod Crustaceans. Dubuque (IA), Wm. C. Brown Co.
Schuster, G.A., et D.A. Etnier. 1978. A Manual for the Identification of the larvae of the Caddisfly Genera Hydropsyche Pictet and Symphitopsyche Ulmer in Eastern and Central North America. Cincinnati (OH), U.S. Environmental Protection Agency.
Schwinghamer, P. 1981. « Characteristic size distributions of integral benthic communities », Canadian Journal of Fisheries and Aquatic Sciences, 38 : 1255-1263.
Schwinghamer, P. 1983. « Generating ecological hypotheses from biomass spectra using causal analysis: A benthic example », Marine Ecology Progress Series, 13 : 151-166.
Scott, D.A., et T.A. Jones. 1995. « Classification and inventory of wetlands », Vegetatio, 118 : 1-16.
Scrimgeour, G.J., J.M. Culp et N.E. Glozier. 1993. « An improved technique for sampling lotic invertebrates », Hydrobiologia, 254 : 65-71
Simpson, K., et R. Bode. 1980. Common Larvae of Chironomidae (Diptera) from New York State Streams and Rivers, with Particular Reference to the Fauna of Artificial Substrates. New York State Museum Bulletin No. 439. 105 pages.
Slack, K.V., R.C. Averett, P.E. Geeson et R.G. Lipscomb. 1973. Methods for collection and analysis of aquatic biological and microbiological samples. U.S. Geological Survey Techniques of Water-Resources Investigations, Book 5, Chapter 4A. Washington, (D.C.), U.S. Department of the Interior, Geological Survey. 165 pages.
Smith, R.I. 1964. Keys to Marine Invertebrates of the Woods Hole Region: A Manual for the Identification of the More Common Marine Invertebrates. Contribution No. 11. Woods Hole (MA), Systematics-Ecology Program, Marine Biological Laboratory.
Smith, B., et J.B.Wilson. 1996. « A consumer’s guide to evenness indices », Oikos,76 : 70-82.
Squires, H.J. 1990. Decapod Crustacea of the AtlanticCoast of Canada. Ottawa (Ont.), Ministères des Pêches et des Océans. 532 pages.
Steele, D.H., et P. Brunel. 1968. « Amphipoda of the Atlantic and Arctic coasts of North America: Anonyx (Lysianassidae) », Journal of the Fisheries Research Board of Canada, 25 (5) : 943-1060.
Stephenson, W., et S.D. Cook. 1980. « Skewness of data in the analysis of species-in-sites-in-times », Proceedings of the Royal Society of Queensland, 91 : 37-52.
Stewart, K.W., et B.P. Stark. 1993. Nymphs of North American Stonefly Genera (Plecoptera). Denton (TX), University of North Texas Press. 460 pages.
Suess, M.J. (éd.) 1982 Examination of Water For Pollution Control. A Reference Handbook. Vol. 3. Biological, Bacteriological and Virological Examination. Oxford (Angleterre), Permagon Press.
Tattersall, W.M., et O.S. Tattersall. 1951. The British Mysidacea. Londres (Angleterre), Ray Society. 460 pages.
Taylor, L.R. 1961. « Aggregation, variance and the mean », Nature, 189 : 732-735.
Taylor, B.R. 1997. Optimization of Field and Laboratory Methods for Benthic Invertebrate Monitoring. Final Report. Aquatic Effects Technology Evaluation (AETE) project 2.1.2. Ottawa (Ont.), Ressources naturelles Canada, Centre canadien de la technologie des minéraux et de l’énergie (CANMET). 100 pages.
Taylor, B.R, et R.C. Bailey. 1997. Technical Evaluation on Methods for Benthic Invertebrate Data Analysis and Interpretation. Final Report. Aquatic Effects Technology Evaluation (AETE) project 2.1.3. Ottawa (Ont.), Ressources naturelles Canada, Centre canadien de la technologie des minéraux et de l’énergie (CANMET). 26 pages.
Tetra Tech, Inc. 1986a. General QA/QC Considerations for Collecting Environmental Samples in Puget Sound. Seattle (WA), Rapport préparé pour le U.S. Environmental Protection Agency, Region 10. Final Report TC-3991-04.
Tetra Tech, Inc. 1986b. Recommended Protocols for Station Positioning in Puget Sound. Seattle (WA), Rapport préparé pour le U.S. Environmental Protection Agency, Region 10. Final Report TC-3090-05.
Tetra Tech, Inc. 1987. Recommended Protocols for Sampling and Analyzing Subtidal Benthic Macroinvertebrate Assemblages in Puget Sound. Seattle (WA), Rapport préparé pour le U.S. Environmental Protection Agency, Region 10. Final Report TC-3991-04.
Thiel, T.H. 1975. « The size structure of the deep-sea benthos », Internationale Revue der gesamten Hydrobiologie, 60 : 575-606.
Thorp, J.H., et A.P. Covich. 1991. Ecology and Classification of North American Freshwater Invertebrates. New York (NY), Academic Press.
Tukey, J. 1977. Exploratory Data Analysis. Reading (MA), Addison-Wesley. 688 pages.
Underwood, A.J. 1997. Experiments in Ecology: Their Logical Design and Interpretation Using Analysis of Variance. Cambridge (Royaume-Uni), Cambridge University Press. 504 pages.
Ushakov, P.V. 1955. Polychaeta of the Far Eastern Seas of the USSR. Acad. Sci. USSR. Jerusalem (Israël), Israel Program for Scientific Translation (traduit en anglais, 1965). 419 pages
Vézina, A.F. 1988. « Sampling variance and the design of quantitative surveys of the marine benthos », Marine Biology, 97 : 151-155.
Walker, E.M. 1933. « The nymphs of the Canadian species of Ophiogomphus Odonata, Gomphidae », The Canadian Entomologist, 65 : 217-229.
Walker, E.M. 1953. The Odonata of Canada and Alaska. Volume 1, Part I: General. Part II: The Zygoptera - Damselflies. Toronto (Ont.), University of Toronto Press. 292 pages.
Walker, E.M. 1958. The Odonata of Canada and Alaska. Volume 2, The Anisoptera. Toronto (Ont.), University of Toronto Press. 318 pages.
Walker, E.M., et P.S. Corbet. 1978. The Odonata of Canada and Alaska. Volume 3, The Anisoptera - Macromiidae, Corduliidae, Libellulidae. Toronto (Ont.), University of Toronto Press. 307 pages.
Wallace, N.A. 1919. The Isopoda of the Bay of Fundy. University of Toronto Studies, Biological Series No. 18. 42 pages.
Waltz, R.D. 1994. Field recognition of adult Acentrella and Heterocloeon (Ephemeroptera: Baetidae). Great Lakes Entomologist 26 : 321-323.
Warwick, R.M. 1986. « A new method for detecting pollution effects on marine benthic communities », Marine Biology, 92 : 557-562.
Warwick, R.M. 1988a. « Analysis of community attributes of the macrobenthos of Frierfjord/Langesundfjord at taxonomic levels higher than species », Marine Ecology Progress Series, 46 : 167-170.
Warwick, R.M. 1988b. « The level of taxonomic discrimination required to detect pollution effects on marine benthic communities », Marine Pollution Bulletin, 19 : 259-568.
Warwick, R.M., et K.R. Clarke. 1993. « Increased variability as a symptom of stress in marine communities », Journal of Experimental Marine Biology and Ecology, 172 : 215-226.
Warwick, R.M., T.H. Pearson et Ruswahyuni. 1987. « Detection of pollution effects on marine macrobenthos: Further evaluation of the species abundance/biomass method », Marine Biology, 95 : 193-200.
Watling, L. 1979. Marine Flora and Fauna of the Northeastern United States. Crustacea: Cumacea. NOAA Technical Report NMFS Circular 423 : 1-22.
Watson, J. 1997. A Review of Ecosystem Classification: Delineating the Strait of Georgia. Vancouver (C.-B.), Pêches et Océans Canada, Région du Pacifique, Direction des sciences.
Weber, C.I. (éd.) 1973. Biological Field and Laboratory Methods for Measuring the Quality of Surface Waters and Effluents. EPA-670/4-73-001. Cincinnati (OH), U.S. Environmental Protection Agency.
Weinberg, S. 1978. « The minimal area problem in invertebrate communities of Mediterranean rocky substrata », Marine Biology, 49 : 33-40.
Weiss, H.M. 1995. Marine Animals of Southern New England and New York: Identification Keys to Common Nearshore and Shallow Water Macrofauna. Bulletin 115 of the State Geological and Natural History Survey of Connecticut. Hartford (CT), Department of Environmental Protection.
Westfall Jr., M.J., et M.L. May. 1996. Damselflies of North America. Gainesville (FL), Scientific Publishers. 650 pages.
Wiederholm, T. 1980. « Use of benthos in lake monitoring », Journal Water Pollution Control Federation, 52 : 537-547.
Wiederholm, T. (éd.). 1983. Chironomidae of the Holarctic region. Keys and diagnosis. Part 1. Larvae. Entomologica Scandinavica Supplement No. 19. 457 pages.
Wiederholm, T. (éd.). 1986. Chironomidae of the Holarctic region. Keys and diagnosis. Part 2. Pupae. Entomologica Scandinavica Supplement No. 28. 482 pages.
Wiggins, G.B. 1996. Larve of the North American Caddisfly Genera (Trichoptera), 2nd Edition. Toronto (Ont.), University of Toronto Press. 457 pages.
Wood, D.M., B.V. Peterson, D.M. Davies et H. Gyorkos. 1963. « The black flies (Diptera: Simuliidae) of Ontario. Part II. Larval identification with descriptions and illustrations », Proceedings of the Entomological Society of Ontario 93 : 99-129.
Wright, J.F. 1995. « Development and use of a system for predicting the macroinvertebrate fauna in flowing waters », Australian Journal of Ecology, 20 : 181-197.
Figures et tableaux
Le tableau 4-1 présente les plans d’études recommandés pour l’échantillonnage. Pour chacun des types de plans, le milieu récepteur, la zone de référence (ou zone de contrôle), la zone exposée (impact) et la méthode statistique sont indiqués.
La figure 4-1 est une représentation schématique des échelles spatiales d’une zone de référence et d’une zone exposée, de stations répétées et de sous-échantillons de terrain pour un plan d’étude de type contrôle-impact.
La figure 4-2 illustre six exemples de plans d’étude contrôle-impact. L’image (a) présente un plan contrôle-impact pour les cours d’eau simples ou les milieux estuariens homogènes. L’image (b) illustre un plan contrôle-impact modifié avec une zone de référence en aval pour les cours d’eau ou les estuaires. L’image (c) présente un exemple de plan pour l’étude de l’ampleur et de la portée géographique. L’image (d) illustre un plan contrôle-impact multiple pour les cours d’eau avec deux zones de référence. L’image (e) présente un plan contrôle-impact multiple pour les cours d’eau avec deux zones de référence ou à référence multiple dans des bassins hydrographiques adjacents. Enfin, l’image (f) illustre des lacs, des baies ou des bras de mer spatialement homogènes dont les caractéristiques d’habitat sont semblables à celles de la zone exposée.
La figure 4-3 est une illustration de cinq exemples de plans d’étude par gradients. L’image (a) présente un plan par gradient linéaire pour les cours d’eau et les estuaires. L’image (b) illustre un plan par gradient linéaire pour les mines situées sur le bord d’un lac, le long d’une côte, dans une baie ou un fjord étroit. L’image (c) présente un plan par gradient radial pour les lacs ou les zones côtières. L’image (d) présente un plan par gradients multiples pour les rivières ou les ruisseaux d’eau douce. Enfin, l’image (e) présente un plan par gradients multiples pour les mines de métaux situées sur le bord d’un lac ou le long d’une côte.
La figure 4-4 est une représentation schématique qui illustre l’emplacement des stations de référence et des stations exposées par rapport au point de rejet de l’effluent (sources multiples) dans une approche des conditions de référence.
La figure 4-5 est un graphique qui illustre les niveaux de stress entraînant une perturbation déduits à partir de la position des sites de référence dans un espace d’ordination hybride multidimensionnel. Les bandes, basées sur des ellipses de probabilité de 90 %, 99 % et 99,9 %, sont désignées par les lettres A (non perturbé), B (potentiellement perturbé), C (perturbé) et D (fortement perturbé).
Le tableau 4-2 présente les clés taxinomiques applicables à l’identification taxinomique des invertébrés benthiques. Chaque taxon est présenté avec les références taxinomiques normalement utilisées.
Le tableau 4-3 illustre le niveau recommandé de résolution taxinomique pour les invertébrés benthiques dans un milieu marin, selon l’approche du plus bas niveau taxinomique pratique. Chaque taxon correspond à un niveau. Ces niveaux comprennent la famille, la classe, la sous-classe, le genre et l’espèce.
Le tableau 4-4 établit une liste des clés taxinomiques correspondant aux invertébrés benthiques marins et estuariens du Canada. Les références sont énumérées en ordre alphabétique.