12. Recherche des causes
12.2 Objectif et attentes relatifs à la recherche des causes
12.3 Élaboration d'hypothèses et d'une étude de recherche des causes
12.4 Utilisation des profils de réponse et de la dynamique des populations
- 12.4.1 Aperçu des résultats du Programme d'études de suivi des effets sur l’environnement des mines de métaux
- 12.4.2 Profils de réponse des poissons
- 12.4.3 Profils des effets possibles sur les poissons
- 12.4.4 Profils de réponse de la communauté benthique
- 12.4.5 Profils des effets possibles sur le benthos
12.5 Approche progressive (élimination)
- 12.5.1 Évaluation des données sur la réduction de la toxicité et évaluation des données sur la toxicité
- 12.5.2 Exemple d'un cadre de recherche des causes pour l'évaluation des données sur la réduction de la toxicité et l'évaluation des données sur la toxicité
12.6 Méthode intégrée (poids de la preuve)
- 12.6.1 Utilisation de la méthode du poids de la preuve
- 12.6.2 La triade de la qualité des sédiments à titre d'exemple du poids de la preuve
12.7 Toxicologie des métaux et bioaccumulation
- 12.7.1 Écotoxicité des métaux
- 12.7.2 Toxicité du sélénium
- 12.7.3 Biomarqueurs (métallothionéine)
- 12.7.4 Utilisation de méthodes de bioaccumulation
- 12.7.5 Méthodes pour mettre la bioaccumulation et la toxicité en corrélation
12.8 Approches pour les études sur le terrain portant sur les poissons et le benthos
- 12.8.1 Plan d'étude sur le terrain
- 12.8.2 Organismes en captivité
- 12.8.3 Mésocosmes (poissons et invertébrés)
- 12.8.4 Dispositifs pour la transplantation de communautés benthiques
- 12.8.5 Macrophytes, périphyton, phytoplancton et chlorophylle
12.9 Méthodes de laboratoire et essais de toxicité
- 12.9.1 Paramètres histologiques et physiologiques
- 12.9.2 Essais de toxicité
- 12.9.3 Essai de toxicité sur les poissons : cycle de vie du méné à grosse tête
- 12.9.4 Essai de toxicité sur les sédiments entiers
- 12.9.5 Métaux dans l'eau sus-jacente dans le cadre d'essais de toxicité sur les sédiments entiers
- 12.9.6 Essais de toxicité de l'eau interstitielle des sédiments
12.10 Outils pour l'analyse des effluents et de la qualité de l'eau
- 12.10.1 Mesure des métaux dissous pendant la recherche des causes
- 12.10.2 Spéciation des métaux pour les métaux d'intérêt
- 12.10.3 Mesure des réactifs et des sous-produits réactifs utilisés dans le traitement
- 12.10.4 Surveillance du débit et des charges dans la zone exposée
12.11 Outils à prendre en compte pour l'analyse des sédiments
- 12.11.1 La surveillance des sédiments en tant qu'outil de recherche des causes
- 12.11.2 Transport des matières en suspension
- 12.11.3 Taux de sédimentation des matières en suspension et datation des sédiments pour obtenir les tendances historiques
- 12.11.4 Carottage de sédiments
- 12.11.5 Composition chimique des sédiments
- 12.11.5.1 Concentrations partielles des métaux dans les sédiments (extraction partielle), extraction séquentielle des métaux, rapports entre les métaux simultanément extractibles et les sulfures volatils en milieu acide (MTA/SVMA)
- 12.11.5.2 Rapport carbone-azote (rapport C/N) pour les sédiments marins
12.12 Analyse de l'eau interstitielle des sédiments
Liste des tableaux
- Tableau 12-1: Exemples de méthodes qui peuvent être utilisées pour déterminer les causes possibles pendant la recherche des causes
- Tableau 12-2 : Ensemble officialisé de critères de causalité formant une partie de la méthode du poids de la preuve pour l'évaluation des effets des effluents des mines
Liste des figures
12. Recherche des causes
12.1 Introduction
Le présent chapitre est une compilation de toutes les sections portant sur la recherche des causes qui étaient incluses dans les différents chapitres de la version de 2002 du Document d'orientation pour l'étude de suivi des effets sur l'environnement (ESEE) des mines de métaux. Plusieurs méthodes et concepts ont été mis à jour avec de nouveaux renseignements.
Un atelier sur la recherche des causes du Programme d'ESEE des mines de métaux a été organisé conjointement par l'Association minière du Canada et Environnement Canada en décembre 2009. L'objectif de cet atelier était d'explorer différents aspects et enjeux liés à la phase de recherche des causes du Programme d'ESEE des mines de métaux. Des renseignements généraux sur la recherche des causes, les études environnementales, les causes potentielles des effets, les études de cas ainsi que les outils et les méthodes utilisés pour la recherche des causes ont été présentés. L'atelier a fourni une occasion de discuter et de développer la recherche des causes des mines de métaux, et a permis l'identification des besoins en matière de recherche. Le compte rendu de l'atelier a été utilisé pour étoffer le présent chapitre qui porte sur la recherche des causes dans le cadre du Programme d'ESEE des mines de métaux, et d'autres détails sont inclus dans le compte rendu publié en 2012 et accessible sur le site Web du Programme d'études de suivi des effets sur l’environnement, au http://www.ec.gc.ca/esee-eem.
12.2 Objectif et attentes relatifs à la recherche des causes
L'objectif d'une étude de recherche des causes est de déterminer la cause des effets confirmés, c’est-à-dire ce qui est responsable des effets (se référer au chapitre 1, section 1.3.2.1 pour obtenir de l'information au sujet des effets confirmés). Les directives présentées dans le présent chapitre visent à permettre plus de flexibilité dans la conception des études de recherche des causes afin de répondre aux besoins propres à un site, et elles devraient être complétées par tous les renseignements disponibles, notamment des publications scientifiques accessibles au public. Comme dans le cas de toutes les ESEE, des études sur la recherche des causes doivent utiliser les méthodes validées et de bonnes pratiques scientifiques.
Les méthodes validées acceptables comprennent celles dont la rigueur a été établie sur un fondement crédible, comme les méthodes ou procédures normalisées préparées par des organismes reconnus à l'échelle internationale (à titre d'exemple, Environnement Canada, l'Organisation de coopération et de développement économiques (OCDE), l'Environmental Protection Agency (EPA) des États-Unis, l'American Society for Testing and Materials (ASTM), l'Organisation internationale de normalisation (ISO), l'Union européenne (UE) et l'Organisation mondiale de la santé (OMS) de même que celles publiées dans des revues scientifiques évaluées par des pairs et acceptées à titre de protocoles scientifiquement valables. De plus, des méthodes qui ne font pas autorité et qui n'ont pas été évaluées par des pairs peuvent être utilisées si la preuve de leur bien-fondé est faite.
Les éléments d'une pratique scientifique saine incluent l'intégrité scientifique, le concept expérimental, la sécurité en laboratoire, l'analyse des erreurs, l'assurance et le contrôle de la qualité, l'interprétation de données essentielles et la tenue précise de dossiers (c.-à-d., documentation de la méthode et de la collecte de données, documentation, conservation et accès) (OCDE, 2007; CIRC, 2008; Deutsch Forschungsgemeinshaft, 1998). Il est attendu que les ESEE soient fondées sur des principes scientifiques éprouvés, c.-à-d. « des enquêtes et des observations organisées effectuées par du personnel qualifié au moyen de méthodes documentées donnant des résultats et des conclusions vérifiables » (SETAC, 1999). Des principes scientifiques éprouvés signifient que les données et les conclusions sont appuyées par les normes élevées de la méthode scientifique, laquelle comprend la formulation d'une ou de plusieurs hypothèses facilement vérifiables, l'utilisation de méthodes expérimentales ou analytiques bien documentées (tailles d'échantillonnage appropriées, témoins appropriés), l'utilisation d'outils d'analyse des données pertinents (statistiques ou modèles) et la formulation de conclusions qui tiennent compte d'une ou de plusieurs hypothèses et qui sont fondées sur les résultats (SETAC, 1999). La Society of Environmental Toxicology and Chemistry (SETAC, 1999) soulève d'importantes mises en garde en ce qui a trait à l'interprétation des données, notamment en ce qui concerne les déclarations de certitude par rapport aux déclarations d'incertitude, la causalité par rapport à la corrélation, l'absence de preuve par rapport à la preuve d'absence et l'interprétation erronée possible (ne pas tenir compte de certaines variables, utiliser des tailles d'échantillons inadéquates, le manque de témoins appropriés, les biais, les anecdotes). De plus, Bosker et Munkittrick (2009) émettent une mise en garde au sujet de l'assurance de la qualité/contrôle de la qualité générique et des enjeux statistiques des ESEE suivants : taille insuffisante de l'échantillon, omission de supprimer les valeurs aberrantes, exposition incertaine, mauvais choix du site de référence, rapports incomplets ou mauvais, erreur de saisie des données et mauvaises données déclarées.
12.3 Élaboration d'hypothèses et d'une étude de recherche des causes
Pendant l'élaboration du plan d'étude de recherche des causes (se reporter au chapitre 2, 2.2 et au chapitre 1, 1.4.2.2), les mines sont encouragées à mentionner plusieurs hypothèses possibles qui pourraient expliquer les causes des effets confirmés, en tenant compte de tout schéma de réponse identifiable. Plusieurs effets peuvent avoir une même cause et peuvent être identifiés par la formulation d'une hypothèse principale. Dans d'autres cas, plusieurs hypothèses peuvent être formulées pour examiner plusieurs effets confirmés. Des outils pertinents pour examiner les hypothèses établies peuvent alors être proposés. La portée des travaux peut varier. Il peut s'avérer suffisant d'examiner et de présenter des preuves solides à l'aide des données existantes, seules ou jumelées à de nouvelles données (méthode du poids de la preuve) ou d'un examen de la documentation scientifique. Par ailleurs, il peut s'avérer nécessaire d'effectuer des études complètes sur le terrain ou en laboratoire.
Le tableau ci-dessous présente des exemples de méthodes différentes de recherche des causes visant à examiner différentes hypothèses de causes possibles. Les sections suivantes du présent document suggèrent différentes façons de déterminer la cause des effets.
| Hypothèses (Cause possible) |
Approche | Exemple |
|---|---|---|
| Habitat, éléments nutritifs | Collecte de données biologiques avec les mesures à l'appui pour caractériser l'habitat, la qualité de l'eau et la chimie des sédiments qui permettrait d'élargir les analyses statistiques (p. ex. approches corrélatives et à plusieurs variables). Des échantillons pour l'étude de la chimie de l'effluent (plusieurs échantillons si cela est nécessaire) recueillis simultanément peuvent permettre d'établir des liens entre les conditions dans le milieu récepteur et les composants possibles de causalité dans l'effluent des mines. La caractérisation de conditions ou d'événements inhabituels peut fournir d'autres connaissances. | 1) Étude normalisée des invertébrés benthiques portant sur l'eau, les sédiments et la chimie de l'effluent pour explorer les relations avec l'habitat, les éléments nutritifs et les mesures des contaminants.2) Collecte de données sur la température, les éléments nutritifs et la productivité primaire (chlorophylle a, périphyton) dans le milieu récepteur avec les mesures correspondantes des éléments nutritifs dans l'effluent afin d'examiner la cause des effets liée aux éléments nutritifs, comme l'eutrophisation, et peut inclure la modélisation ou le bilan massique. |
| Variabilité naturelle | Voir les chapitres 2, 3, 4, 6, 7, 8 et 9. | |
| Contaminants | Analyse de la charge corporelle de métaux, seule ou jumelée à d'autres mesures (p. ex. gonades des poissons ou histologie du foie) à la recherche de signes d'un développement anormal (gonades) ou de signes de pathologie (p. ex. lésions hépatiques). | 1) Analyse des éléments traces dans les amphipodes recueillis dans la zone de référence et la zone exposée, et comparaison des niveaux avec les « concentrations corporelles critiques » publiées.2) Approche fondée sur les biomarqueurs pour les poissons, p. ex. mesure de la concentration de métallothionéine ou d'autres protéines à faible masse moléculaire qui sont connues pour être induites par une exposition aux métaux.3) Analyse des éléments traces dans les tissus (p. ex. foie, viscères, corps entier et muscle, selon ce qui est approprié pour l'effet identifié ou le contaminant préoccupant) des poissons recueillis dans la zone de référence et la zone d'exposition; cela permet de déterminer si les contaminants sont biodisponibles et accumulés.4) Utilisation d'une approche progressive (évaluation des données sur la réduction de la toxicité/évaluation des données sur la toxicité) pour déterminer la source des contaminants dans les flux de déchets. |
| Quantité limitée de nourriture | Examen de la documentation scientifique sur le régime alimentaire des poissons afin de comprendre les préférences et examen des données existantes sur les invertébrés benthiques pour évaluer la disponibilité de nourriture, seule ou de pair avec d'autres renseignements, dont les isotopes stables. | Mesures du contenu de l'estomac, des types de proies pertinentes (p. ex. invertébrés benthiques, proies planctoniques) ou de paramètres de la qualité de l'eau, comme la turbidité ou la température. |
12.4 Utilisation des profils de réponse et de la dynamique des populations
12.4.1 Aperçu des résultats du Programme d'études de suivi des effets sur l’environnement des mines de métaux
Les analyses nationales des données du Programme d'ESEE des mines de métaux (Lowell, 2007; Environnement Canada, 2012) laissent entendre que les profils de réponse des poissons (les poissons étaient plus âgés, plus maigres [condition réduite] et leurs foies et leurs gonades étaient plus petits) peuvent être liés à la toxicité ou à l'altération de l'habitat. Les données laissent entendre également que les profils de réponse (diminution significative de la richesse taxonomique, changements dans la structure de la communauté dans les zones exposées mesurés à l'aide des valeurs plus élevées de l'indice de Bray-Curtis et de l'indice de régularité de Simpson, et une densité accrue) peuvent être liés à la toxicité ou à l’altération de l'habitat ou à l'eutrophisation de certaines mines. À ce jour, les effets signalés des effluents des mines sur le potentiel d'utilisation des poissons (mesuré par la teneur en mercure dans les tissus des poissons) semblent être minimes.
12.4.2 Profils de réponse des poissons
Il est important de comprendre que la réponse de la population de poissons échantillonnée est un aperçu ponctuel, et il ne devrait pas être supposé que cette réponse représente une étape dans une série de réponses qui peuvent mener d'un état d'équilibre à un nouveau (Environnement Canada, 2010). La réponse est également un reflet de la manière dont les poissons se portent et non une indication du mécanisme d'impact. Par exemple, une augmentation de la quantité ou de la qualité de la nourriture ou de l'habitat devrait se traduire par une augmentation de la croissance, de la taille, de l'investissement dans la reproduction (taille des gonades) et de la condition. Un taux de croissance plus rapide se traduit généralement par une reproduction des poissons à un plus jeune âge et par conséquent, l'âge de la maturité (âge auquel les poissons commencent à se reproduire) est abaissé. Une fois regroupés, ces changements dans la population contribuent normalement à abaisser l'âge moyen de la population. Lorsque la population s'adapte à sa nouvelle capacité de charge, les paramètres devraient revenir aux niveaux de référence, mais pour une densité plus importante de poissons. De même, un déversement accidentel à létalité aiguë peut se traduire plus tard dans le temps par une augmentation des ressources alimentaires étant donné qu'il y a une densité de poissons plus faible pour la même quantité de nourriture disponible. Par conséquent, les effets peuvent ne pas entraîner de changements à long terme dans la communauté piscicole puisque la population maintient son équilibre et que des mesures correctives peuvent ne pas être efficaces sur le plan écologique ou des coûts.
Ce ne sont pas toutes les espèces qui répondront directement au stress, mais certaines peuvent répondre indirectement en raison de changements observés dans la pression exercée par la prédation ou dans la disponibilité de la nourriture. Le profil de réponse observé peut toutefois servir à interpréter les résultats et à concevoir les études pour la prochaine phase. Il est important de consulter les données de soutien pour aider à l'interprétation et à la conception de l'étude. Gibbons et Munkittrick (1994) et Munkittrick et al. (2000) ont regroupé les caractéristiques des poissons en fonction de la structure d'âge (âge moyen ou répartition par âge), de la dépense énergétique (taux de croissance et taux de reproduction) et de l'emmagasinage d'énergie (condition, poids du foie). Ils ont attribué la mention « augmentation », « diminution » ou « aucun changement » à chaque caractéristique afin d'obtenir un profil de réponse général qui pourrait être utilisé pour fournir une orientation à la recherche des facteurs de causalité. De plus, la nature du profil de réponse au cours des phases de surveillance permet la caractérisation de l’état du système en question, et permet par la suite la prise de décisions en matière de gestion au sujet de l'efficacité des règlements actuels (Environnement Canada, 2010). Le chapitre du Guide pour l'ESEE pour le secteur des pâtes et papiers portant sur la recherche des causes et la recherche de solutions (Environnement Canada, 2010) et Munkittrick et al. (2000) fournit des renseignements détaillés sur les profils des effets et les profils de réponse interprétables. Les profils de réponse interprétables possibles dont les mines pourraient tenir compte sont, par exemple, la limitation des éléments nutritifs, la toxicité, l'eutrophisation et la perturbation du métabolisme. D'autres profils de réponse existent et peuvent s'appliquer.
12.4.3 Profils des effets possibles sur les poissons
Trois profils d'effets sont décrits ci-dessous; d'autres existent et peuvent s'appliquer.
12.4.3.1 Limitation des éléments nutritifs/toxicité
Les limitations d'éléments nutritifs qui ont une incidence sur la santé des poissons (laquelle peut être caractérisée par une diminution du coefficient de condition, de la taille du foie ou de la taille des gonades) peuvent initialement se traduire par une diminution de la croissance et de la reproduction des poissons. Au fil du temps, cela peut mener à une augmentation de l'âge de la population étant donné que le nombre de jeunes produits est moins grand (Gibbons et Munkittrick, 1994). Un problème de longue durée de disponibilité de nourriture et de rendement mènera en définitive à une diminution de la taille de la population sous la capacité de charge du système, et les paramètres de rendement des poissons (croissance, condition) pourront alors commencer à récupérer à mesure que l'âge de la population augmente, mais que le nombre d'individus diminue.
La toxicité chimique peut causer une augmentation du poids du foie, de même qu'une détérioration de la condition et une diminution du poids des gonades. Il a été suggéré que l'augmentation de la taille du foie est associée à une augmentation de l'activité des processus de détoxification. Toutefois, il est important de noter que la toxicité chimique peut causer une augmentation des enzymes de détoxification du foie sans que la taille du foie augmente, et inversement. L'augmentation du volume du foie peut être un indicateur de l'emmagasinage modifié de l'énergie en fonction de la toxicité, mais cette augmentation peut ne pas être directement liée à une augmentation des enzymes de détoxification (Munkittrick et al., 1994, 2000).
12.4.3.2 Perturbation du métabolisme
Tel qu'il a été mentionné dans Hewitt et Servos (2001), le gouvernement du Canada (dans le cadre de la Loi canadienne sur la protection de l'environnement (1999)) a défini les substances perturbatrices du système endocrinien comme étant des substances qui ont la capacité de nuire à la synthèse, à la sécrétion, au transport, à la fixation, à l'action ou à l'élimination des hormones, et qui peuvent avoir des effets sur le maintien de l'homéostasie, la reproduction, le développement ou le comportement d'un organisme. Les effets sur la reproduction peuvent être caractérisés par une taille réduite des gonades et des indicateurs plus élevés de l'utilisation d'énergie (croissance, taille du foie et condition), lesquels indiquent que de l'énergie est disponible, mais que les poissons n'utilisent pas cette énergie aux fins de reproduction (Munkittrick et al., 1991). Les métaux lourds sont particulièrement reconnus pour être des substances perturbatrices du métabolisme et du système endocrinien, y compris le cadmium, le cuivre, le plomb, le fer, le mercure et le sélénium (Hewitt et Servos, 2001; Fajreaus-Van Ree, 2004). Ces métaux lourds ont été associés à des réactions de stress et à une fonction des surrénales des poissons altérées en laboratoire et à l'état sauvage (Brodeur et al., 1998; Brodeur et al., 1997). Hontela et al. (1992) ont démontré que les poissons présentent une diminution liée à l’exposition du coefficient de condition et de l'efficacité de la croissance de même qu'une capacité réduite d'élever le cortisol sanguin.
12.4.3.3 Eutrophisation
L'eutrophisation (caractérisée par une augmentation du poids des gonades et du foie, et par une amélioration de la condition) peut découler d'une diminution de la taille de la population ou d'une augmentation de l'habitat et des ressources alimentaires. La diminution de la taille de la population peut être liée à l'augmentation de la prédation en raison d'une plus grande abondance de prédateurs, ou encore, à l'augmentation de la mortalité en raison du vieillissement de la population. Toutefois, une augmentation du taux de reproduction pourrait se traduire à long terme par une augmentation de jeunes poissons, ce qui pourrait tôt ou tard mener à la limitation des ressources alimentaires (Gibbons et Munkittrick, 1994) si la population de jeunes poissons n'est pas contrôlée par la prédation.
12.4.4 Profils de réponse de la communauté benthique
Les indicateurs d'effet (et les critères d'effet) du Programme d'ESEE de la communauté benthique sont la densité (le nombre d'animaux par unité de surface), la richesse taxonomique (nombre de taxons), l'indice de similarité (indice de Bray-Curtis) (mesure des différences dans la structure de la communauté entre deux assemblages) et l'indice de régularité (indice de régularité de Simpson) (régularité avec laquelle les individus sont répartis entre les taxons). En comparant ces critères d'effet entre une zone exposée et une zone de référence, ou le long d'un gradient, il est possible de déceler des différences structurelles dans la communauté benthique. Cette information peut servir à déterminer la quantité d'énergie disponible pour les poissons, et de ce fait, elle constitue une mesure de la santé de l'habitat des poissons. Le chapitre du Guide pour l'ESEE pour le secteur des pâtes et papiers portant sur la recherche des causes et la recherche de solutions (Environnement Canada, 2010) et Munkittrick et al. (2000) fournit certains renseignements détaillés sur les profils des effets et quelques profils de réponse interprétables. Les profils de réponse interprétables possibles dont les mines pourraient tenir compte sont, par exemple, la limitation des éléments nutritifs, la toxicité et l'eutrophisation. D'autres profils de réponse existent et peuvent s'appliquer.
12.4.5 Profils des effets possibles sur le benthos
Deux profils d'effets sont décrits ci-dessous; d'autres existent et peuvent également s'appliquer.
12.4.5.1 Eutrophisation/étouffement
L'eutrophisation, ou l'enrichissement en éléments nutritifs, est un processus de surfertilisation d'un plan d'eau par des éléments nutritifs qui se traduit par la production d'une quantité de matière organique plus importante que ce que les réactions d'auto-épuration peuvent traiter (Chambers et al., 2001). Le degré d'eutrophisation qui a une incidence sur les invertébrés benthiques peut varier de léger à modéré ou prononcé. Dans le cas d'une eutrophisation légère à modérée, la réponse type est une augmentation de l'abondance et du nombre de taxons d'invertébrés benthiques (richesse taxonomique) relativement aux conditions de référence. Une eutrophisation prononcée (richesse taxonomique réduite, densité accrue) commencera à modifier la composition de la communauté benthique. L'hypereutrophisation ou l'eutrophisation prononcée peut être observée lorsque l'abondance1 et la richesse taxonomique des organismes benthiques déclinent; à cette étape, les répercussions négatives sur les stocks de poissons et les végétaux sont généralement observées lorsque l'oxygène est consommé par la matière organique en décomposition (Environnement Canada, 2007; Lowell et al., 2000).
Certaines études dans la documentation scientifique laissent entendre que le phosphore forme des complexes avec les métaux dans la colonne d'eau (solides en suspension); ces complexes se déposent ensuite dans les sédiments (Ledo et al., 2004; Pereira et al., 2008). Dans certaines conditions (milieu réducteur, saisonnalité (automne/hiver), lumière du jour), le phosphore est libéré, ce qui cause l'eutrophisation (Ledo et al., 2004; Pereira et al., 2008). L'ammoniac et les nitrates sont généralement élevés en raison des matériaux de dynamitage, de la décomposition du cyanure ou de l'apport en eaux usées (CCME, 2009); ces deux produits peuvent agir comme substances toxiques, mais elles peuvent également contribuer à l'enrichissement.
L'eutrophisation prononcée est généralement associée à l'augmentation du nombre et du type de taxons (benthiques) qui résistent aux polluants (p. ex. oligochètes, chironomidés ou nématodes) et à la diminution du nombre et du type d'espèces sensibles (p. ex. les éphéméroptères, les plécoptères ou les trichoptères). L'eutrophisation sévère masque fréquemment les effets toxiques qui auraient pu être mesurés (Lowell et al., 2000).
12.4.5.2 Toxicité/étouffement
Les métaux-traces sont potentiellement toxiques pour les organismes et peuvent avoir une incidence sur le rendement individuel et de la population. Des diminutions de la richesse taxonomique et de l'abondance constituent généralement un signe d'effets inhibiteurs globaux, comme la toxicité ou l'étouffement (Lowell et al., 2000). De tels changements au niveau de la population sont observés dans la structure de la communauté benthique, avec des variations vers une composition des espèces de plus en plus simple et souvent prévisible puisque les taxons sensibles se raréfient ou disparaissent et que les taxons qui tolèrent mieux les métaux dominent (Clements, 2004; Pollard et Yuan, 2006; Courtney et Clements, 2002; Canfield et al., 1994).
Des conditions aquatiques anoxiques ou hypoxiques peuvent être observées lorsque l'oxygène est consommé par la matière organique en décomposition. Si les courants sont faibles et ne parviennent pas à entraîner les matières organiques, ces conditions peuvent donner lieu à la formation de composés réduits potentiellement toxiques, comme le méthane, l'ammoniac et le sulfure d'hydrogène (Pearson et Rosenberg, 1978). Les conditions toxiques et anoxiques peuvent abaisser les taux d'alimentation des invertébrés, ce qui pourrait réduire la croissance et la biomasse des invertébrés (ce qui, à son tour, a une incidence sur la communauté de poissons) (Lowell et al., 2000).
12.4.5.3 Conditions méromictiques/hypoxiques
L'effluent des mines peut produire une stratification dans certains lacs profonds, ce qui donne lieu à des conditions méromictiques dans ces lacs. Le mélange saisonnier généralement observé n'a pas lieu, ce qui donne lieu à des différences verticales et temporelles des métaux dissous, et au cycle méromictique de certains métaux. L'oxygène dissous à des profondeurs sous la chemocline du lac n'est pas renouvelé, ce qui se traduit par un appauvrissement en oxygène (Sánchez et al., 2008; Szarek-Gwiazda et Żurek, 2006; Campbell et Torgersen, 1980). Ceci mène ultimement à des conditions toxiques et à la perte de l'habitat.
12.5 Approche progressive (élimination)
12.5.1 Évaluation des données sur la réduction de la toxicité et évaluation des données sur la toxicité
12.5.1.1 Évaluation des données sur la réduction de la toxicité
Une évaluation des données sur la réduction de la toxicité est une méthode de diagnostic par étape propre à un site visant à régler les problèmes de toxicité (Novak et Holtze, 2012). Des protocoles visant à étudier les causes probables de la toxicité ont été mis au point par l'EPA des États-Unis (1989) et sont connus en tant qu'études d'évaluation des données sur la réduction de la toxicité et d'évaluation des données sur la toxicité.
Les objectifs généraux des processus d'évaluation des données sur la réduction de la toxicité et d'évaluation des données sur la toxicité (EPA des États-Unis, 1989) doivent dicter les interventions nécessaires pour réduire la toxicité de l'effluent à des niveaux acceptables. Une approche en six étapes fondée sur l'EPA des États-Unis (1989), (1991a), (1991b), (1993a) et (1993b) et Novak et Holtze (2012) a été mise au point et est axée sur la réduction de la toxicité de l'ensemble de l'effluent au lieu d'éléments précis de l'effluent. Les six étapes sont les suivantes :
- Information et acquisition de données
- Évaluation des mesures correctives utilisées pour réduire la toxicité de l'effluent
- Évaluation des données sur la toxicité de l'effluent :
- Phase I : Caractérisation de la toxicité au moyen de traitements variés
- Phase II : Identification des substances toxiques soupçonnées
- Phase III : Confirmation des substances toxiques
- Recherche et identification des sources de toxicité dans l'installation
- Évaluation de la traitabilité de la toxicité aux fins de réduction de la toxicité dans l'effluent terminal
- Confirmation et élimination de la toxicité
12.5.1.2 Évaluation des données sur la toxicité
L'approche relative à l'évaluation des données sur la toxicité utilise les réponses des organismes qui ont été obtenues dans le cadre d'un essai biologique approprié pour déceler la présence d'agents actifs. Cette approche permet de caractériser les substances actives d'intérêt dans une matrice complexe qui comprend trois phases : la caractérisation, l'identification et la confirmation des substances toxiques.
- Les méthodes d'évaluation des données sur la toxicité aquatique de la phase 1 ont initialement été mises au point pour être utilisées conjointement avec les essais de toxicité aiguë chez les ménés à grosse tête ou Ceriodaphnia dubia (EPA des É.‑U., 1991a), mais elles ont été adaptées aux essais de toxicité sublétale (EPA des É.‑U., 1991b).
- L'identification de la toxicité aquatique à la phase II est décrite dans le document de l'EPA des États-Unis (1993a).
- La confirmation de la toxicité aquatique à la phase III est décrite dans le document de l'EPA des États-Unis (1993b).
Des protocoles d'évaluation des données sur la toxicité existent également pour la toxicité des sédiments et de l'eau interstitielle (EPA des É.‑U., 1991c et 1997) et la toxicité marine (phase I uniquement) (EPA des É.‑U., 1996).
Dans le cadre de traitements normalisés de caractérisation de l'effluent de la phase I de l'EPA des États-Unis, l'effluent ou l'eau est soumis à différents traitements qui séparent les catégories chimiques précises (par exemple, filtration, aération, extraction, chélation). Ce processus d'élimination sert à déterminer la façon dont sa chimie et sa toxicité sont modifiées après un tel traitement. Une part importante de la toxicité observée dans les effluents industriels est souvent attribuable aux effets du pH. Par conséquent, l'ajustement de pH est utilisé tout au long de la phase I afin de fournir de plus amples renseignements sur la nature des substances toxiques. Dans tous les cas, la toxicité d'échantillons traités est comparée à celle d'échantillons non traités pour déterminer quelle approche, s'il y a lieu, réduit la toxicité.
L'un des principaux avantages du processus d'évaluation des données sur la réduction de la toxicité et d'évaluation des données sur la toxicité est qu'il intègre les réponses des organismes dans l'évaluation de mélanges complexes afin de déterminer l'identité d'une ou plusieurs substances responsables de la toxicité. Les tentatives d'utilisation du dépistage chimique seul pour identifier les substances responsables de la toxicité sont généralement infructueuses.
L'identification de la cause de la toxicité transitoire ou non persistante peut être difficile et nécessiter le traitement et l'analyse d'un grand nombre d'échantillons.
Des études de cas utilisant l'évaluation des données sur la réduction de la toxicité et l'évaluation des données sur la toxicité ont été présentées par Novak et Holtze (2012) lors de l'atelier de 2009 sur la recherche des causes.
12.5.2 Exemple d'un cadre de recherche des causes pour l'évaluation des données sur la réduction de la toxicité et l'évaluation des données sur la toxicité
Le cadre de recherche des causes est une application de l'approche d'évaluation des données sur la réduction de la toxicité et d'évaluation des données sur la toxicité dans le contexte de la recherche des causes. Ce cadre a été mis au point par Hewitt et al. (2003) et il est décrit plus en détail dans le chapitre du Guide pour l'ESEE pour le secteur des pâtes et papiers portant sur la recherche des causes (Environnement Canada, 2010). Le cadre comprend des questions étape par étape qui suivent une approche progressive (figure 12-1). Les questions sont définies par un continuum de phases d'enquête, chacune fournissant plus de renseignements au sujet de la cause de l'effet avec des investissements concomitants de temps et de ressources. Un examen des renseignements pertinents au sujet de l'histoire de la mine, du type de processus, des modifications du processus ou du fonctionnement, de l'étendue et de l'ampleur des effets, de même que des profils de réponse observés dans les phases de suivi des effets sur l'environnement est essentiel avant de prendre des décisions au sujet des étapes initiales et de l'orientation de la recherche des causes. Les lignes directrices pour répondre à ces questions ont évolué en réponse à l'examen de la documentation publiée et des résultats en cours du programme de suivi des effets sur l'environnement pour le secteur des pâtes et papiers (Hewitt et al., 2003).
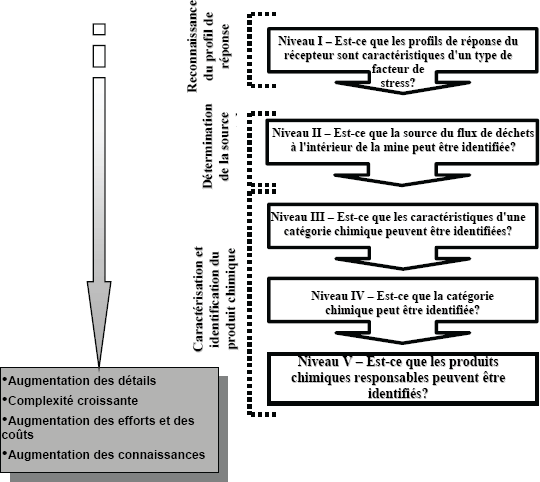
Figure 12-1: Cadre de travail par niveau pour la recherche des causes dans le suivi des effets sur l'environnement (Hewitt et al., 2003) (description longue).
12.5.2.1 Définition des profils de réponse
La première étape consiste à définir les profils de réponse. La caractérisation d'un ou de plusieurs types de facteur de stress fondée sur les profils de réponse sera très avantageuse pour toute recherche des causes dès le début, en précisant où porter attention et en permettant la meilleure utilisation des ressources possiblement limitées. Une fois que le profil de réponse a été défini, le cadre de travail (figure 12-1) est divisé par niveau pour identifier le facteur de stress pour ce type de profil.
12.5.2.2 Identification de la source et fonctionnement sélectif des processus en usine
L'objet de l'identification de la source est de tenter de préciser ou d'isoler des flux de déchets spécifiques dans le processus de fabrication ou de traitement qui sont responsables des effets observés mesurés dans le milieu récepteur. Les études devraient commencer par un examen systématique de chaque flux à traiter lors de la recherche de la source des effets dans la mine.
La détermination d'une ou plusieurs sources de l'effet a plusieurs résultats potentiellement importants, dont 1) concentrer les enquêtes supplémentaires dans un secteur donné de la mine pour effectuer un inventaire plus détaillé des sources du flux à traiter, des quantités, et des qualités et toxicités du flux de déchets; 2) identifier un secteur de la mine où les opérations peuvent être examinées pour assurer que les « activités normales » se déroulent et pour éliminer les anomalies; 3) évaluer la possibilité de traitement de la source et des conséquences en ce qui a trait à la qualité de l'effluent terminal; 4) concentrer les enquêtes détaillées subséquentes sur une ou plusieurs sources du flux de déchets, y compris l'identification des produits chimiques.
En général, des essais de toxicité aiguë sont effectués sur différents flux de déchets de l'usine. À l'aide de données sur la toxicité aiguë, il est possible d'isoler les flux de déchets qui pourraient servir à effectuer des essais de toxicité sublétale à plus long terme. L'attention devrait être portée sur les constituants de l'effluent qui seraient transportés par le traitement primaire et qui auraient une incidence sur la qualité de l'effluent terminal. De plus amples renseignements sont disponibles dans Environnement Canada (2010), Rickwood et al. (2006) and Martel et al. (1997). Des essais à plus long terme peuvent être effectués à l'aide d'une variété d'approches, incluant des mésocosmes, des essais biologiques en laboratoire, des essais du cycle de vie partiel ou complet, etc.
12.5.2.3 Isolation et caractérisation du produit chimique
Cette étape représente une évaluation des données sur la toxicité. Si l'identification des flux de déchets n'a pas fourni suffisamment de renseignements pour caractériser l'effet, les procédures ci-dessous peuvent être utilisées pour isoler et identifier les substances responsables.
La caractérisation et l'identification du produit chimique peuvent être très complexes. Les caractéristiques du composé, les catégories de composé ou les composés eux-mêmes peuvent être déterminés; cependant, chaque étape devient plus coûteuse et plus complexe. Les approches décrites dans cette section sont conçues pour déterminer les caractéristiques particulières des produits chimiques qui sont responsables des effets faisant l'objet d'une enquête. Les renseignements provenant d'études sur le terrain, de l'identification de la source, d'études de laboratoire et du profil d'exposition peuvent fournir des indications sur la catégorie chimique.
La phase I de l'évaluation des données sur la toxicité comprend la caractérisation de la catégorie chimique : 1) déterminer les caractéristiques des agents actifs et 2) déterminer si l'effet est causé par les mêmes substances. Cette étape utilise des méthodes spécifiques pour isoler les produits chimiques actifs et proposer des structures aux fins d'identification. Les propriétés physicochimiques des substances actives peuvent être décrites à l'aide de manipulations de l'effluent couplées à un essai biologique qui reproduit les effets sur le terrain ou qui est mécaniquement lié à ces effets (voir la section 1.2.6.2.6 du chapitre portant sur la recherche des causes du Guide pour l'ESEE) (Environnement Canada, 2010). Chaque essai est conçu pour modifier les substances ou leur biodisponibilité afin que l'information sur la nature des substances puisse être obtenue.
La phase II de l'évaluation des données sur la toxicité comprend l'identification de la catégorie chimique. Les composants actifs sont isolés ou séparés davantage des substances inactives aux fins d'identification et de confirmation. Ces méthodes sont propres aux catégories de produits chimiques et elles utilisent les réponses à l'essai biologique (voir la section 1.2.6.2.6 du chapitre portant sur la recherche des causes du Guide pour l'ESEE) (Environnement Canada, 2010) pour évaluer la réussite ou d'échec de l'extraction, de la séparation et de la concentration des substances bioactives. Les étapes de l'isolation du produit chimique s'effectuent de manière itérative, en fonction des réponses à l'essai biologique, jusqu'à ce que d'autres isolations ne soient plus possibles ou que les produits chimiques potentiels soient identifiés. Une fois qu'il existe des preuves solides indiquant qu'un ou plusieurs produits chimiques potentiels sont associés à la réponse, la troisième phase de l'évaluation des données sur la toxicité (ci-dessous) peut être entreprise.
La phase III de l'évaluation des données sur la toxicité comprend l'identification du produit chimique responsable. Cette étape comprend les techniques pour confirmer que les substances proposées sont réellement responsables de la toxicité observée. Ceci est généralement accompli par un regroupement des renseignements obtenus à l'aide de la méthode du poids de la preuve qui établit collectivement l'identité des composés actifs et la cause de l'effet de façon continue au fil du temps afin que les efforts d'amélioration puissent traiter adéquatement l'effet. Les approches de confirmation comprennent les éléments suivants :
- Approche de corrélation : une relation solide et cohérente entre les concentrations des agents soupçonnés et la réponse à l'essai biologique peut être établie.
- Approche fondée sur les symptômes : différentes substances actives produisent souvent des symptômes différents en réponse à un essai. En comparant les expositions de l'échantillon d'effluent à ceux des substances actives pures soupçonnées, une personne peut obtenir des preuves supplémentaires à savoir si les agents soupçonnés sont responsables. Des exemples de symptômes incluent la sensibilité des espèces, les formes des courbes dose-réponse et le temps nécessaire pour que l'effet se produise.
- Approche par ajout connu : les agents soupçonnés sont ajoutés à l'effluent afin de déterminer si une réponse proportionnelle est obtenue pendant l'essai biologique.
12.6 Méthode intégrée (poids de la preuve)
12.6.1 Utilisation de la méthode du poids de la preuve
Faire la distinction entre les effets cumulatifs de plusieurs facteurs de stress (qui parfois ont des effets confusionnels) nécessite d'établir un lien de causalité définitif avec l'effluent de la mine qui est évalué. La surveillance environnementale des écosystèmes aquatiques est particulièrement susceptible à ces obstacles puisque ces écosystèmes reçoivent souvent plusieurs rejets d'effluents agissant ensemble. Les évaluations des résultats de surveillance dépendent souvent, en grande partie, de données de surveillance sur le terrain qui ne peuvent montrer que la corrélation (au lieu d'un lien cause à effet clair) entre l'effluent de la mine et l'effet observé. L’établissement d’un lien de causalité fort peut, toutefois, être avantagé par l'utilisation de la méthode du poids de la preuve, laquelle consiste à regrouper l'information provenant de plusieurs sources différentes, c.‑à-d. plusieurs éléments de preuve. La force du lien de causalité peut être évaluée en utilisant un ensemble officialisé de critères initialement mis au point dans le domaine de l'épidémiologie. Ces critères sont présentés dans le tableau 12-2, lequel est fondé sur les travaux de Fox (1991), Suter (1993), Gilbertson (1997), Beyers (1998), Culp (1999), Culp et al. (2000) et Lowell et al. (2000). Dans plusieurs cas, tous les critères ne peuvent pas être satisfaits ou les résultats de certains critères peuvent être incompatibles avec ceux d'autres critères. Dans ces cas, il peut s'avérer utile d'attribuer un poids à chaque critère en fonction de son importance relative pour une évaluation donnée. En particulier, les évaluations qui comprennent des preuves provenant d'expériences sur le terrain et en laboratoire seront plus robustes que celles uniquement fondées sur la surveillance sur le terrain. Souvent, il n'est pas nécessaire de satisfaire à tous les critères pour fournir un argument de causalité fort (p. ex. voir Beyers, 1998). Les avantages d'appliquer des critères officialisés aux évaluations de données générées par un programme de suivi des effets sur l'environnement comprennent, notamment : 1) aider à lier les différents regroupements de données sur les effets de facteurs de stress multiples; 2) attribuer plus précisément la causalité et 3) identifier les importantes lacunes en matière d'information (c.-à-d., critères qui n'ont pas encore été abordés). Ce type d'approche peut contribuer à rendre les évaluations des effets de l'effluent d'une mine plus rigoureux et robuste en regroupant des approches de rechange et des méthodes de recherche des causes.
Tableau 12-2 : Ensemble officialisé de critères de causalité formant une partie de la méthode du poids de la preuve pour l'évaluation des effets des effluents des mines. (description longue)
Critères de causalité pour la méthode du poids de la preuve
Corrélation spatiale du facteur de stress et effet le long d'un gradient allant des zones les plus exposées vers les zones les moins exposées
Corrélation temporelle d'un facteur de stress et effet en fonction de la durée d'exposition
Mécanisme plausible liant le facteur de stress à l'effet
Vérification expérimentale des effets d'un facteur de stress dans des conditions contrôlées et concordance des résultats expérimentaux avec les données de terrain
Force : courbe de l'exposition prononcée par réponse
Spécificité : diagnostic de l'effet de l'exposition à un facteur de stress particulier
Preuve d'exposition (contaminants ou autres indicateurs) dans le corps des organismes touchés
Uniformité de l'association facteur de stress/effet dans différentes études au sein de la région à l'étude
Cohérence avec les connaissances existantes d'autres régions où les mêmes facteurs de stress et effets ont été étudiés, de même que ceux qui sont analogues
12.6.2 La triade de la qualité des sédiments à titre d'exemple du poids de la preuve
L'utilisation de l'approche de la triade de la qualité des sédiments est recommandée pendant la recherche des causes des effets sur les communautés d'invertébrés benthiques (Parker et Dumaresq, 2002). Le Programme d'évaluation des techniques de mesure d'impact en milieu aquatique appuie l'utilisation de la triade de la qualité des sédiments à chaque site, mais non pour la surveillance de « routine » (ESG, 1999).
Initialement, la triade de la qualité des sédiments intégrait trois composants (éléments de preuve) : la chimie des sédiments pour déterminer la contamination chimique, les essais biologiques de toxicité des sédiments et la structure de la communauté benthique afin de déterminer l'état des biotes résidents (Chapman, 1992). À l'aide des différents éléments de preuve, des corrélations statistiques peuvent être formulées et intégrées dans une analyse du poids de la preuve (qualitative et quantitative), rendant les données plus puissantes que si chaque composant était interprété individuellement (voir Alden, 1992; Chapman, 1992; Warwick et Clarke, 1991).
La triade classique de la qualité des sédiments, qui est fondée sur la corrélation, peut permettre de tirer des conclusions définitives au sujet de l'état de pollution des sédiments contaminés (p. ex. l'exposition et les effets). Elle fournit le niveau minimal de renseignements nécessaires, c.-à-d., une évaluation préalable des risques en fonction de laquelle des hypothèses relatives à la cause peuvent être proposées. Dans le paradigme d'évaluation des risques fourni par Chapman et Hollert (2006), la causalité est abordée après la triade de la qualité des sédiments, dans laquelle les études initiales sont relativement simples et servent à fournir des conclusions définitives ou à indiquer des lacunes où d'autres renseignements sont nécessaires. Des conclusions définitives au sujet de la causalité ne peuvent pas être tirées sans effectuer d'autres études. La recherche des causes est examinée à un niveau plus élevé, c.-à-d., une évaluation plus détaillée. Chapman et Hollert suggèrent d'ajouter quatre catégories supplémentaires d'éléments de preuve à la triade de la qualité des sédiments :
- Remplacements directs ou ajouts à la modification existante des éléments de preuve : histopathologie des poissons de fond, exposition du crabe et santé.
- Variations des éléments de preuve existants : essais de toxicité in situ ou par contact des sédiments (éléments de preuve de la toxicité); expériences de colonisation (modification des éléments de preuve).
- Éléments de preuve supplémentaires : exposition du crabe et santé; eau de surface; communauté de bactéries; bioamplification/empoisonnement secondaire; biomarqueurs.
- Éléments de preuve pour déterminer la causalité : morphologie de l'habitat (évaluations des données sur la toxicité); analyses guidées par les effets; résidus corporels critiques; essais in situ par contact des sédiments et essais de toxicité en laboratoire; biomarqueurs et paramètres propres au mécanisme.
Aperçu de la méthode d'étude à l'aide de la triade de la qualité des sédiments
- collecte d'échantillons;
- chimie des sédiments;
- essai en laboratoire de la toxicité des sédiments;
- identification et dénombrement des invertébrés benthiques dans les échantillons de sédiments;
- collecte de poissons pour l'analyse des tissus;
- analyse supplémentaire;
- analyse des données et préparation du rapport.
1) Prélèvement d'échantillons
Des échantillons sont prélevés dans les zones de référence et dans les zones d'exposition ou le long d'un gradient d'exposition afin d'aider à délimiter l'étendue géographique de l'effet. Le nombre total de sites d'échantillonnage devrait être d'au moins dix, ce qui devrait fournir suffisamment de données pour effectuer une analyse statistique rigoureuse. Les échantillons recueillis à chaque emplacement devraient servir à l'analyse de la composition chimique, du benthos et de la toxicité des sédiments.
2) Composition chimique des sédiments
L'analyse de la composition chimique des sédiments devrait inclure les caractéristiques physiques (taille des particules et contenu organique total), les éléments nutritifs (p. ex. nitrate, nitrite, phosphore, ammoniac, azote total Kjehldahl (TKN)), la composition chimique générale (p. ex. potassium, chlore, sulfate) et les métaux (extractibles en totalité ou en partie) (ESG, 1999). Les paramètres chimiques pertinents au site devraient être analysés en fonction des renseignements obtenus préalablement du site, dont notamment la composition chimique de l'eau et de l'effluent. Des analyses du potentiel d'oxydoréduction devraient également être envisagées.
3) Essai en laboratoire de la toxicité des sédiments
Un ensemble de trois essais est idéal pour l'approche de la triade et nécessite l'utilisation de trois espèces différentes soumises à des essais (MEEO, 1997; ESG, 1999) (anciennement le ministère de l'Environnement et de l'Énergie de l'Ontario [MEEO], maintenant le ministère de l'Environnement de l'Ontario [MEO]). Ceci fournit une mesure de protection pour s'assurer qu'un effet biologique n'est pas manqué parce que l'espèce soumise à l'essai est insensible aux produits chimiques présents dans les sédiments. Il fournit également des organismes d'essai de différents niveaux trophiques de l'écosystème de sorte que les principaux groupes trophique pertinents (et leurs niveaux respectifs de complexité avec des capacités divergentes de métabolisation et de dépuration des produits chimiques) soient représentés. Les essais recommandés utilisent des invertébrés benthiques et des poissons et ils intègrent différents paramètres biologiques (p. ex. survie et croissance). Tout essai avec des organismes qui peut intégrer la reproduction devrait également être envisagé (p. ex. Ceriodaphnia dubia).
Les trois essais recommandés sont les suivants :
- Hyalella azteca, un essai de survie et de croissance de cet amphipode après 14 jours (Environnement Canada, 1997a)
- C. dilutus (anciennement Chironomus tentans (Shobanov et al., 1999)), un essai de survie et de croissance de cet organisme après 14 jours (Environnement Canada, 1997b)
- un essai de toxicité (Bedard, 1992; Van Geest et al., 2011a, 2011b) et de bioaccumulation (Van Geest et al., 2011a et 2011b) chez le méné à grosse tête après 28 jours
4) Identification et dénombrement des invertébrés benthiques dans les échantillons de sédiments
L'identification et le dénombrement des invertébrés benthiques devraient être effectués de la façon décrite au chapitre 4 du présent document d'orientation.
5) Prélèvements sur les poissons aux fins d'analyse des tissus
Cette étape est facultative et utile, surtout dans les zones où il existe un doute au sujet de la possibilité d'utiliser les poissons pour la consommation humaine. Le prélèvement de tissus sur les poissons pour effectuer des analyses des métaux fournirait de l'information à savoir si les produits chimiques présents dans les biotes résidents ont une incidence sur la possibilité d'utiliser les poissons pour la consommation humaine. Les tissus peuvent être congelés aux fins d'analyses futures (MEEO, 1997).
6) Analyse supplémentaire
Afin d'obtenir suffisamment d'éléments de preuve pour déterminer la causalité, Chapman et Hollert (2006) recommandent d'autres études provenant de leurs quatre catégories (ayant fait l'objet d'une discussion dans la section 12.6.2 ci-dessus). Le choix des espèces à utiliser dans les essais de toxicité et des éléments de preuve à examiner devrait être fait en fonction des contaminants, des récepteurs et des facteurs de stress potentiellement préoccupants.
Dans le modèle proposé par Chapman et Hollert (2006), la causalité peut être déterminée à l'aide des éléments de preuve suivants : la composition chimique des sédiments in situ, la colonisation benthique, l'évaluation des données sur la toxicité, l'analyse guidée par les effets ou le fractionnement guidé par les essais biologiques (pour identifier les contaminants organométalliques), la bioaccumulation/résidus corporels critiques, la morphologie de l'habitat et la dynamique sédimentaire. Les choix relatifs à ces éléments de preuve dépendront des résultats de la triade de la qualité des sédiments de l'évaluation préalable standard (analyse chimique, de la toxicité et des invertébrés benthiques).
7) Analyse des données et préparation du rapport
Cette dernière étape dans l'approche de la triade de la qualité des sédiments consiste à analyser statistiquement les données obtenues de l'étude des invertébrés benthiques, de l'analyse chimique et des essais de toxicité, de même que d'intégrer les résultats de cette analyse dans une méthode du poids de la preuve.
12.7 Toxicologie des métaux et bioaccumulation
Lors de l'atelier de recherche des causes associées aux mines de métaux de 2009, deux publications particulières sur la toxicité des métaux (EPA des É.-U., 2007 et Adams et al., 2011, et les références qu'elles contiennent) ont fait l'objet de discussions et elles devraient être consultées pour obtenir de plus amples renseignements. Le cadre de travail pour l'évaluation des risques associés aux métaux (EPA des É.-U, 2007) fournit des lignes directrices concernant les propriétés des métaux, comme la chimie de l'environnement, la biodisponibilité et la bioaccumulation. Dans le contexte de ce cadre de travail, divers articles liés aux métaux ont été rédigés, dont un par McGeer et al. (2004) qui traite de la biodisponibilité et de la bioaccumulation des métaux. La définition de la bioaccumulation, telle qu'elle est définie dans McGeer et al. (2004) et l'EPA des États-Unis (2007), est l'accumulation nette d'un métal dans un tissu ou dans un organisme entier qui résulte de l'exposition environnementale dans un milieu comme l'air, l'eau, le sol et les sédiments, de même que l'alimentation. La biodisponibilité est définie comme la mesure dans laquelle les métaux bioaccessibles sont absorbés sur, dans ou au travers des membranes biologiques des organismes (McGeer et al., 2004; EPA des É.-U, 2007). Les mesures de la bioaccumulation sont habituellement un indicateur efficace de la biodisponibilité des métaux. Une accumulation excessive de certaines formes dissoutes (espèces) de métaux est potentiellement toxique pour les organismes. Toutefois, il est important de noter que différents types d'organismes accumuleront les métaux à des degrés différents (Adams et al., 2011).
12.7.1 Écotoxicité des métaux
Dans la version de 2002 du Document d'orientation sur le Programme d'études de suivi des effets sur l’environnement des mines de métaux, il était présumé que la bioaccumulation pourrait servir à déduire directement la cause de la toxicité en fonction de la recherche sur les invertébrés (Borgmann et Norwood 1997, 1997a, 1997b) et des modèles de produits chimiques organiques (Campbell, 2012). Plusieurs progrès ont été réalisés sur le sujet de la bioaccumulation des métaux relativement à la toxicité et l'état actuel des connaissances scientifiques indique que la relation entre la bioaccumulation et la toxicité est confondue par la physiologie (Adams et al., 2011; EPA des É.-U, 2007). Il est maintenant reconnu que ce ne sont pas tous les métaux qui s'accumulent dans un organisme qui interagissent aux sites (p. ex. récepteurs biochimiques, organites, cellules, organes et tissus) de l'action toxique (McGeer et al., 2010). Les corrélations entre la toxicité et la bioaccumulation de métaux n'indiquent pas toujours une relation de cause à effet, notamment lorsque la relation subit une influence, comme cela est le cas pour la bioaccumulation de métaux et la toxicité. De plus, l'extrapolation des corrélations déduites des expositions en laboratoire à un seul métal aux effluents complexes où il peut y avoir un mélange de contaminants nécessiterait une validation complète. Une corrélation directe entre l'accumulation et la toxicité a été observée uniquement chez les invertébrés pour quelques métaux (des métaux non essentiels et non réglementés, comme le cadmium et le thallium) et formes organométalliques (McGeer et al., 2012; Borgmann et Norwood 1997a, 1997b, 1999; Borgmann, 2000). La bioaccumulation de cuivre et de zinc dans les tissus des invertébrés est moins utile, car ces éléments sont réglementés à différents degrés, bien que leurs concentrations naturelles peuvent être élevées (McGeer et al., 2012).
Pour obtenir une réaction biologique ou s'accumuler dans un organisme, les métaux doivent d'abord interagir avec une membrane cellulaire. Contrairement aux contaminants organiques, les métaux se trouvant dans le milieu aquatique (à l'exception des complexes organométalliques et métalliques neutres) sont incapables de traverser la membrane cellulaire par simple diffusion; au contraire, ils sont transportés (transport facilité) à travers la membrane cellulaire (Campbell, 1995, 2012). La physiologie des organismes séquestre ou détoxique des quantités importantes de métaux toxiques. La portion active des métaux du point de biologique ou métabolique qui est disponible pour contribuer à la toxicité doit le faire au site d'action et, de plus, les métaux totaux sont au mieux un substitut pour la fraction de métaux actifs sur le plan métabolique au site d'action (McGeer et al., 2010).
Puisque les métaux sont détoxiqués une fois qu'ils entrent dans l'environnement intracellulaire (Vijver et al., 2004; Luoma et Rainbow 2008), les prévisions simples de la toxicité associée aux métaux sur la base de quotas ou de charges de métaux (approche portant sur les résidus dans les tissus), comme c'est souvent fait dans le cas des contaminants organiques, sont rarement applicables (Campbell, 2012). Les métaux qui se lient à des protéines inductibles capables de liaison avec les métaux comme les métallothionéines, ou qui sont précipités dans des concrétions insolubles composés de granules riches en métaux, peuvent être considérés comme étant des métaux détoxiqués biologiquement, comparativement aux métaux dans des fractions sensibles aux métaux comme les organites et les protéines thermosensibles (Campbell, 2012). Un corollaire de ce modèle d’accumulation des métaux est le suivant : la tolérance ou la résistance des métaux se rattachera à la capacité d’un organisme de prévenir la liaison de métaux « inappropriés » à des sites sensibles. La liaison d’un métal « inapproprié » à un site sensible aux métaux, souvent appelée « débordement » ou détoxification incomplète, pourrait annoncer le début du stress induit par les métaux (Campbell et Hare, 2009).
12.7.2 Toxicité du sélénium
Le sélénium est un métal-trace qui présente un risque potentiel élevé en tant que substance toxique. Le sélénium, un nutriment essentiel, peut s'accumuler dans les tissus des poissons ovipares à la suite d'une exposition alimentaire (Palace, 2012). Bien que cet élément ne soit pas toxique pour les poissons adultes, à des concentrations légèrement élevées, il se dépose dans les œufs et peut provoquer la tératogénicité (Holm et al., 2005). Puisque la biogéochimie du sélénium est complexe, les critères basés sur les tissus (par opposition à la concentration aqueuse) sont généralement acceptés comme étant les indicateurs les plus fiables de toxicité potentielle du sélénium chez les poissons (EPA des É.‑U, 2004). L'indicateur le plus fiable de toxicité potentielle du sélénium est la mesure de la concentration dans les œufs ou les ovaires, bien que des courbes de toxicité propres aux espèces soient nécessaires pour obtenir une évaluation exacte du risque (Holm et al., 2005). Les muscles peuvent être utilisés comme substitut aux œufs et aux ovaires; toutefois, les corrélations entre ces tissus dépendent du partage du sélénium entre les muscles et les œufs, lequel varie en fonction du cycle reproducteur et entre les espèces (NAMC, 2008). En raison de l'incertitude liée au séjour des poissons très mobiles dans la zone étudiée et en raison du cycle reproducteur plus court de certaines espèces de poissons, la toxicité pour la reproduction peut ne pas être détectée adéquatement entre les phases de suivi des effets sur l'environnement (Palace, 2012). Par conséquent, la toxicité du sélénium peut être un important facteur à étudier en tant que source de toxicité lors de la recherche des causes. Beaucoup de renseignements sur la toxicité du sélénium ont été présentés dans les volets Toxicité des métaux et Toxicité aquatique générale de l'Atelier sur la toxicité aquatique de 2011.
12.7.3 Biomarqueurs (métallothionéine)
Les biomarqueurs sont des outils utilisés pour évaluer l'exposition propre à un métal. Des augmentations importantes des réponses du biomarqueur (soit au fil du temps ou relativement aux sites de référence) pourraient indiquer que des métaux sont biodisponibles dans le milieu récepteur. La métallothionéine, une protéine à faible masse moléculaire capable de se lier aux métaux (EPA des É.‑U, 2007), est considérée comme un biomarqueur de la pollution par des métaux lourds dans les environnements aquatiques et elle a reçu beaucoup d'attention. Dans le domaine des biomarqueurs pour les métaux, cette protéine se conforme à la majorité des critères définis pour de tels outils. Par exemple, la métallothionéine répond spécifiquement de façon proportionnelle à la dose aux modifications des niveaux ambiants d'un métal-trace ou d'un groupe de métaux-traces (Cd, Cu, Zn et Ag). De plus, des niveaux élevés de métallothionéine pourraient être associés aux effets nocifs sur les organismes et les populations puisque ces concentrations élevées indiquent l'échec de la détoxification des métaux, cependant lorsque cette capacité est dépassée, cela peut se traduire par la liaison non spécifique des métaux aux cibles cellulaires de la toxicité.
À ce jour, il n'y a pas de preuves recueillies sur le terrain à l'effet que les concentrations de métallothionéine répondent aux métaux comme As, Ni, Pb et Hg. De plus, le biomarqueur métallothionéine n'assurera pas le suivi de l'exposition à des produits chimiques non métalliques, comme l'ammoniac et le cyanure. La métallothionéine constitue un excellent biomarqueur des effets induits par les métaux; toutefois, l'extrapolation des données de laboratoire est déconseillée (EPA des É.‑U, 2007).
Des renseignements supplémentaires sur le métallothionéine se trouvent dans Couillard, 1997; Couillard et al., 1999; Giguère et al., 1999; Gillis et al., 1999; Laflamme et al., 1998; Perceval et al., 1999; Pinel-Alloul et al., 1999; Wang et al., 1999 et EPA des É.‑U, 2007.
12.7.4 Utilisation de méthodes de bioaccumulation
Pour évaluer la toxicité du métal, le cadre de travail pour l'évaluation des risques associés aux métaux (EPA des É.‑U, 2007) devrait être consulté puisqu'il traite de questions liées aux méthodes ou aux outils utilisés pour indiquer la biodisponibilité du métal, de même que des approches scientifiques pour déterminer la bioaccumulation des métaux (EPA des É.‑U, 2007). De plus, Adams et al. (2011) résume les travaux du sous-groupe d'experts de la Society of Environmental Toxicology and Chemistry (SETAC) sur la bioaccumulation des contaminants métalliques. Ce sous-groupe a évalué l'utilisation potentielle des résidus métalliques dans les tissus pour prévoir les effets dans les organismes aquatiques (Adams et al., 2011).
L'approche hiérarchique suivante pour évaluer si les métaux sont responsables des effets confirmés dans les milieux récepteurs des mines de métaux a été présentée par Peter Campbell lors de l'atelier de recherche des causes associées aux mines de métaux de 2009 (Campbell, 2012) (l'approche tient compte des interactions entre le métal et l'organisme qui ont été présentées précédemment et elle peut s'appliquer aux métaux non essentiels) :
- Déterminer les organismes bioindicateurs appropriés qui vivent dans les zones d'exposition et les zones de référence. Les critères pour la sélection des organismes bioindicateurs sont bien établis (Phillips et Rainbow, 1993). Si des organismes indigènes ne sont pas disponibles, des organismes en cage peuvent être envisagés.
- Pour chaque espèce de bioindicateur, choisir l'organe cible approprié (p. ex. les branchies ou le foie, ou pour certaines petites espèces, les concentrations dans l'ensemble de l'organisme) (approche du fractionnement cellulaire).
- Comparer les concentrations de métaux bioaccumulés dans les spécimens prélevés dans la zone de référence et la zone d'exposition. L'observation de concentrations de métaux considérablement plus élevées chez les spécimens exposés représente une preuve suffisante qu'au moins un de ces métaux est responsable des effets confirmés. Il faut noter qu'en se fiant à la bioaccumulation des métaux (plutôt qu'à la détermination des concentrations de métaux et à la spéciation des métaux dans le milieu récepteur), cela pourrait permettre d'éviter de devoir estimer la biodisponibilité des métaux observés dans le plan d'eau recevant l'effluent minier.
- Pour améliorer l'interprétation des concentrations de métaux bioaccumulés, déterminer le partage cellulaire (fractionnement cellulaire) des métaux dans les organismes cibles (Campbell et Hare, 2009). Cependant, cette distinction entre les métaux détoxiqués du point de vue biologique et les métaux ayant « débordé » sur des sites sensibles aux métaux serait uniquement justifiée pour les espèces de bioindicateurs qui démontrent une réponse-seuil claire à une exposition accrue aux métaux (voir la discussion dans Campbell et al. (2008) et Campbell et Hare (2009)).
Campbell (2012) a également décrit une méthode pour départager l'importance relative des différents métaux dans un mélange. Cette méthode compare la transcription génétique entre les organismes exposés et les organismes de référence. Cette méthode semble prometteuse en tant qu'outil discriminateur de biosurveillance pour détecter et différencier les contaminants métalliques (Pierron et al., 2009; Walker et al., 2008).
12.7.5 Méthodes pour mettre la bioaccumulation et la toxicité en corrélation
Trois méthodes pour mettre la bioaccumulation et la toxicité en corrélation sont présentées brièvement ci-dessous.
12.7.5.1 Approche portant sur les résidus dans les tissus
L'utilisation de la bioaccumulation en tant qu'indicateur de la toxicité est connue comme étant l'approche portant sur les résidus dans les tissus, et cette approche mise sur l'établissement d'une relation dose-réponse afin de faire le lien entre les résidus présents dans les tissus et les effets toxiques. Le principe est que les concentrations dans les tissus sont un meilleur substitut que les concentrations d'exposition externe (eau, sédiment/sol ou régime alimentaire) pour caractériser la toxicité. Meador et al. (2011) indiquent que cinq mesures fondées sur l'exposition peuvent être utilisées dans l'approche portant sur les résidus dans les tissus, et qu'elles ont toutes des relations proportionnelles entre elles : concentration d'exposition externe, concentration dans l'organisme entier, concentration dans les organes, concentration cible et concentration dans le milieu récepteur. Les approches portant sur les résidus dans les tissus, établissant un lien entre l'accumulation et la toxicité, ont été mises au point pour certains métaux (p. ex. sélénium, cuivre, méthylmercure, cadmium, zinc, arsenic, cobalt, chrome et manganèse) dans certains poissons et invertébrés (Borgmann 2000; Tessier et al., 1993), y compris Hyalella (Adams et al., 2011; Borgmann et al., 2001; Norwood et al., 2007; Borgmann et al., 1991; Borgmann et Norwood, 1997a, 1997b; Borgmann et Norwood, 1999; Holm et al., 2005; Hodson, 1990; Ridal et al., 2010; Meador et al., 2011). L'utilisation de l'approche portant sur les résidus dans les tissus pour les métaux peut toutefois s'avérer problématique (Meador et al., 2011). Des études ont démontré que les relations avec la bioaccumulation pour Hyalella peuvent être uniques (Adams et al., 2011) et l'interprétation des données obtenues à partir des études sur Hyalella peut ne pas être claire (Wang et al., 2004). Adams et al. (2011) ont conclu que les approches portant sur les résidus dans les tissus pour les métaux autres que les organométaux ne sont pas prises en charge puisqu'elles n'ont pas permis de développer une approche généralisée pour estimer les effets, et dans les circonstances, la détermination de l'applicabilité peut nécessiter une validation sur le terrain. Sappington et al. (2011) discutent des avantages et des limites de l'intégration d'une approche portant sur les résidus dans les tissus dans une évaluation écologique. Par conséquent, une certaine prudence est de rigueur lorsque l'utilisation des approches portant sur les résidus dans les tissus pour la recherche des causes est envisagées, et l’Environmental Protection Agency des États-Unis (2007), Adams et al. (2011), Sappington et al. (2011) et les références citées dans le présent document devraient être consultés pour obtenir des renseignements supplémentaires. Bien que les approches portant sur les résidus dans les tissus sont un moyen complexe pour déterminer les relations relatives à la toxicité, il est toujours possible de les utiliser pour comprendre les causes des effets nocifs dans certains scénarios (p. ex. indication de l'exposition aux métaux pour déterminer quels métaux sont assimilés par les organismes).
12.7.5.2 Modèle du ligand biotique
Les métaux dans le milieu aquatique (à l'exception des espèces comme les complexes organométalliques et métalliques neutres) sont transportés à travers les membranes respiratoires ou digestives par transport facilité, à l'aide de systèmes de transport précis ou de canaux à l'intérieur des membranes (une liaison ionique aux ligands cellulaires ou un ligand assimilable comme le thiosulfate). Un tel déplacement est habituellement une fonction non pas des métaux dissous totaux mais plutôt de la concentration de fer métallique libre. Il s'agit du fondement du modèle du ligand biotique (Campbell, 2005, 2012). Le modèle du ligand biotique est un outil qui peut être utilisé pour évaluer quantitativement la façon dont plusieurs paramètres de la composition chimique de l'eau influencent la spéciation et la biodisponibilité des métaux dans le milieu aquatique (Niyogi et Wood, 2004; CCME 2007). Le modèle du ligand biotique fournit un exemple sur le moment où la bioaccumulation des métaux peut être appliquée avec succès en tant qu'indicateur d'un effet. Le modèle du ligand biotique est fondé sur des prédictions relatives à la liaison d'un métal au site d'action toxique, et cette approche intègre les interactions métalliques tout au long de la voie de toxicité exposition-absorption-accumulation (Di Toro et al., 2000, 2001; McGeer et al., 2010; McGeer et al., 2012). L'absorption de métaux dans le modèle du ligand biotique est fondée sur des estimations de la biodisponibilité relative de différentes formes dissoutes (espèces) de métaux. Ces interactions entre les espèces de métaux et le ligand biotique sont intégrées dans le cadre de modélisation en équilibre. La force des modèles du ligand biotique réside dans le fait qu'ils tiennent compte simultanément de la spéciation géochimique et de la liaison relative des espèces de métaux (ou de l'absence de liaison) au site de toxicité. D'autres renseignements sur le modèle du ligand biotique se trouvent dans Paquin et al. (1999, 2002a, 2002b), CCME (2007), USEPA (2003), Santore et al. (2001, 2002), Niyogi et Wood (2004) et McGeer et al. (2010).
12.7.5.3 Fractionnement cellulaire
Les méthodes de fractionnement cellulaire caractérisent la bioaccumulation dans un tissu ou un organisme entier. À l'aide des processus suivants, soit l'homogénéisation, la centrifugation et le traitement thermique, il est possible de faire une distinction entre les formes détoxiquées et les formes actives sur le plan métabolique à l'intérieur d'une cellule (Campbell et al., 2008; Campbell et Hare, 2009). Le fractionnement cellulaire de métaux bioaccumulés a le potentiel de fournir de l'information utile sur la toxicité des métaux. Les fractions comprennent des granules riches en métaux, des débris cellulaires, des organites (p. ex. mitochondries, microsomes et lysosomes), des protéines thermosensibles et des protéines non thermosensibles.
Les études ont groupé les parcelles cellulaires en groupes sensibles aux métaux, comme les mitochondries, et les protéines thermosensibles (où la toxicité du métal peut survenir), et en groupe inactif sur le plan métabolique, comme les granules et les protéines non thermosensibles (où l'accumulation de métaux est bénigne).
12.8 Approches pour les études sur le terrain portant sur les poissons et le benthos
Plusieurs outils peuvent être utilisés pour réaliser les études de recherche des causes à l'aide des poissons et du benthos. La rentabilité et la disponibilité des laboratoires indépendants, universitaires ou gouvernementaux devraient être prises en compte.
12.8.1 Plan d'étude sur le terrain
Les plans par gradient peuvent être utilisés pour associer le niveau d'un facteur de stress à la distance géographique entre les exutoires. La cooccurrence de la contamination avec les effets des métaux est un élément de preuve pour la détermination des effets des métaux. Les gradients de contamination offrent la possibilité de déterminer la cooccurrence des métaux avec des profils de réponse prévus (Luoma et Rainbow, 2008). Les plans d'étude sur le terrain, comme les plans par gradient et les plans de contrôle-impact sont traités dans d'autres chapitres. Les plans par gradient sont traités plus en détail dans les chapitres 2, 3, 4 et 9. D'autres plans d'étude sur le terrain, comme les plans de contrôle-impact sont traités aux chapitres 2 et 4.
12.8.2 Organismes en captivité
Les bivalves en cage sont traités au chapitre 9 (Autres méthodes) du présent document d'orientation technique.
Les études de recherche des causes peuvent avoir recours à des poissons ou des invertébrés sédentaires, ou à des techniques relatives à la captivité. Les essais biologiques à l'aide de cages sont souvent utilisés avec des individus plus vieux (taille plus grande) et moins sensibles puisque la taille des mailles de la cage doit être suffisamment grande pour permettre un échange d'eau adéquat afin d'empêcher des effets de cage, comme le salissage, la sédimentation et une faible concentration d'oxygène dissous.
Les poissons ont été utilisés en captivité in situ (Muir et al., 1991). Des discussions ont eu lieu au sujet de l'utilisation de poissons en cage en raison des préoccupations relatives aux effets interactifs du stress sur les poissons en cage (Courtenay, 2002). Il a été suggéré que les poissons de petite taille dont le domaine vital est plus restreint pouvaient être moins susceptibles de ressentir le stress et qu'ils conviendraient donc mieux à des études en captivité (Palace et al., 2005; Bandler et al., 2012). Cette méthode peut s'avérer utile dans la recherche des causes, notamment lorsque les effets des déversements doivent être résolus à une petite échelle spatiale, si cette méthode est optimisée pour réduire le stress (vérification de l'effet de la captivité sur le poids des poissons).
La mise en cage d'amphipodes pour des évaluations in situ des réponses biologiques aux conditions environnementales est une méthode établie (Grapentine 2012; Borgmann et al., 2007; Couillard et al., 2008; Mulliss et al., 1996; Muir et al., 1991; VanWingaarden et al., 1996; Henry et al., 1994). Les expériences peuvent être conçues a) pour évaluer les effets directs d'effluents ou de sédiments contaminés, b) pour faire le lien entre certains métaux et une toxicité ou une anomalie de la communauté benthique, c) pour établie les voies importantes d'exposition et d'absorption pour les contaminants, d) pour quantifier la relation entre les facteurs de stress et la réponse, et e) pour examiner les effets des facteurs naturels et autres facteurs de stress anthropiques.
La méthodologie est bien développée, elle n'est pas compliquée du point de vue technique, elle examine plusieurs voies d'exposition aux contaminants, elle se prête à une grande répétition expérimentale, elle incorpore de multiples facteurs biologiques, et son coût est faible à modéré. Les amphipodes sont maintenus dans des cages grillagées en plastique à des endroits sélectionnés à l'avance dans le milieu récepteur, cette étape étant suivie par la récupération et l'analyse en vue de déterminer la survie, la croissance ou les concentrations de métaux dans les tissus. Les cages peuvent être conçues pour une exposition à une colonne d'eau, à des sédiments et à une colonne d'eau, ainsi qu'à de l'eau interstitielle et elles sont déployées sur la majorité des substrats. Chaque cage peut contenir au moins 15 amphipodes sans entraîner un taux de mortalité significatif après le déploiement. La nourriture peut être ajoutée au départ ou au cours de l'expérience si elle ne constitue pas un facteur expérimental. Les amphipodes placés dans les cages peuvent être maintenus dans des seaux pendant plusieurs heures ou plusieurs jours sans qu'il y ait de décès associé à la manipulation ou au transport. Les paramètres suivants peuvent être mesurés : le nombre de survivants, la croissance individuelle moyenne durant la période d'exposition, l'estimation de la reproduction et des concentrations des éléments pertinents dans le corps entier. Une analyse de ces paramètres peut déterminer : les effets de l'emplacement ou du degré d'agression sur la santé des amphipodes et les populations; la bioaccumulation et la biodisponibilité des métaux; et si les concentrations de métaux dans les tissus sont associées à des effets nocifs pour l'organisme d'essai ou les espèces qui se nourrissent des amphipodes. La force de cette méthode est qu'elle peut faire la différence entre les effets des sédiments et de l'eau. La normalisation peut être nécessaire pour les essais sur des amphipodes autres que Hyalella azteca.
D'autres invertébrés aquatiques qui ont été utilisés dans des cages sur le terrain incluent les moucherons, les sangsues, les escargots (Henry et al., 1994) et la puce d'eau (Daphnia magna) (van Wingaarden et al., 1996).
12.8.3 Mésocosmes (poissons et invertébrés)
Les mésocosmes sont utiles pour déterminer les facteurs contributifs propres à l'effluent et ils sont traités en détail au chapitre 9.
12.8.4 Dispositifs pour la transplantation de communautés benthiques
Le dispositif pour la transplantation d'organismes benthiques découle de méthodes par gradient spatial utilisées dans le cadre de nombreuses ESEE dans les secteurs des mines et des pâtes et papiers menées sur des rivières, des ruisseaux, des réservoirs et des milieux marins complexes (Thomas, 2012). L'approche mise sur l'utilisation et la relocalisation (transplantation) de populations indigènes d'organismes benthiques et du substrat ou de l'habitat connexe, et elle a permis d'établir avec succès des tendances comparatives pour les communautés benthiques et la qualité du substrat sur les plans spatial et temporel (Thomas, 2012). Une caractéristique clé de cette approche est la capacité de faire ressortir de petites différences entre les sites (différences biophysiques, chimiques ou sur le plan des organismes benthiques), notamment : les changements liés à la distance mesurée par rapport à la zone d'exposition; l'abondance et la diversité de la communauté benthique; la qualité des sédiments (mesures chimiques et physiques, apparence); les changements touchant la biomasse; la présence et la compositions bactériennes; ainsi que les malformations et la symétrie liées aux organismes benthiques. De plus, cette méthode peut contribuer à séparer les effets historiques et liés à l'effluent actuel des autres sources de confusion et de variabilité d'origine naturelle et anthropique, de même qu'à déterminer le scénario d'exposition de l'effluent.
12.8.5 Macrophytes, périphyton, phytoplancton et chlorophylle
En plus des invertébrés benthiques, le phytoplancton, les macrophytes et le périphyton peuvent être évalués dans le cadre de la recherche des causes. AETE (1997) a évalué chacune de ces catégories biotiques en fonction de la sensibilité, la pertinence sur le plan écologique, la validité et la reproductibilité, la spécificité du site, et l'applicabilité.
12.8.5.1 Macrophytes
AETE (1997) a examiné plusieurs études qui ont montré une diminution de la diversité des espèces et l'abondance de macrophytes exposés à des eaux polluées par les métaux. L'absence de macrophytes des régions touchées où il devrait normalement y en avoir peut être perçue comme une indication de pollution (AETE, 1997). Les répercussions sur la densité et la biomasse des macrophytes pourraient toucher grandement les autres membres de la communauté d'eau douce puisqu'ils peuvent fournir un habitat aux organismes des niveaux trophiques plus élevés de la communauté. Les macrophytes sont sédentaires et fournissent une mesure de l'impact de la fraction biodisponible des métaux à l'aide d'une image intégrée dans le temps (Whitton et al., 1981). La composition de la communauté de macrophytes semble être plus un indicateur de stress environnemental à long terme qu'un outil de détection précoce des effets possibles. Kelly (1988), Haslam (1982), Small et al. (1996) et Sortkjaer (1984) ont élaboré des méthodes de surveillance des macrophytes pour l'évaluation de la pollution. Il y a plusieurs espèces de macrophytes fréquemment rencontrés dans les environnements canadiens qui sont recommandés en tant que candidats possibles pour la biosurveillance : Leptodictyum riparium, Potomogeton epihydrus v. nuttallii, Potomogeton sp., Fontinalis spp., Potomogeton richardsonii, Ericaulon esotangulare, Elocharis acicularis (AETE, 1997; Whitton et al., 1981; Crawford et Luoma, 1993). En même temps, il ne faut pas oublier que les populations de macrophytes varient de façon saisonnière dans la majorité des rivières et des lacs, des variations marquées de la biomasse, et qu'elles ne sont disponibles en tant qu'espèces pour la biosurveillance que pendant une saison de croissance relativement courte (Hellawell, 1986). L'utilisation de macrophytes dans le milieu marin n'est possible que dans les régions intertidales à substrat dur. Si cela est considéré être un habitat important qui est potentiellement touché par les effluents des mines, des études de quadrats du littoral pour examiner le pourcentage de couverture et la biomasse par unité de surface, les espèces majeures et l'épifaune connexe, comme les amphipodes, peuvent être des indicateurs complémentaires appropriés (AETE, 1997).
12.8.5.2 Périphyton
Le périphyton est généralement sédentaire et il intègre les effets des variables environnementales dans un délai assez court. Les microalgues faisant partie du périphyton sont importantes en tant que producteurs primaires dans les rivières et les zones littorales des lacs (Cattaneo et Kalff, 1980) et en tant que source de nourriture disponible pour les invertébrés (Whitton, 1984). En tant que source alimentaire pour les niveaux trophiques supérieurs, le périphyton joue potentiellement un rôle important dans le transfert de contaminants entre les niveaux trophiques. De plus, en raison de sa nature sédentaire, le périphyton est un bon indicateur des conditions locales et il joue un rôle clé à l'interface entre le substrat et les eaux environnantes, peut-être en exerçant une influence sur les voies biogéochimiques et la dynamique. Les organismes du tapis de périphyton peuvent avoir des taux de roulement relativement élevés. Par conséquent, ils sont parmi les premiers organismes à réagir au stress environnemental et parmi les premiers à se rétablir. Les espèces sensibles sont souvent remplacées par des espèces plus tolérantes (Austin 1983; Austin et al., 1985). Par conséquent, le périphyton reflète souvent les conditions environnementales actuelles (Lowe et Pan, 1996) et pourrait servir d'indicateur d'alerte rapide.
Le périphyton a été utilisé en tant qu'indicateur dans les évaluations de la qualité de l'eau de différents systèmes par un grand nombre de chercheurs (Chessman, 1985; Clements et Kiffney, 1994). Différentes méthodes d'échantillonnage ont été utilisées, incluant le grattage, le brossage ou l'aspiration. Les mesures structurelles du périphyton comprennent généralement le dénombrement des organismes, ce qui fournit des renseignements sur l'abondance, la diversité des espèces et la structure de la communauté, alors que les mesures fonctionnelles étudient les modifications dans la production primaire, la respiration et le traitement des déchets (Clements, 1991). Les communautés de périphyton comprennent souvent plusieurs espèces et elles occupent un petit espace géographique comparativement aux autres groupes aquatiques; des échantillons représentatifs peuvent être prélevés d'une surface de quelques centimètres carrés de substrat (Lowe et Pan, 1996). Toutefois, certains auteurs ont mentionné qu'il est difficile d'obtenir des échantillons représentatifs et uniformes en raison de l'hétérogénéité spatiale et de la difficulté à échantillonner les organismes (Weitzel et al., 1979; Kutka et Richards, 1986; St-Cyr, 2000). Peu importe les problèmes d'échantillonnage possible, plusieurs études ont caractérisé des communautés d'algues dans des cours d'eau et elles ont établi un lien entre l'abondance de taxons spécifiques et la présence de métaux (Clements, 1991; Whitton, 1984). Des études dans les lacs ont identifié des changements semblables dans la composition des espèces avec des pertes d'espèces sensibles aux métaux (Austin et Deniseger, 1985; Austin et al., 1985; Roch et al., 1985). Lowe et Pan (1996) ont conclu que les données de surveillance des algues benthiques seraient très intéressantes si elles étaient jumelées avec un ensemble de données de surveillance supplémentaires, y compris des mesures physiques et chimiques et l'analyse d'autres biotes de communautés aquatiques, comme les invertébrés.
12.8.5.3 Phytoplancton
La structure des communautés de phytoplancton peut être modifiée en réponse aux facteurs de stress environnementaux qui ont une incidence sur certaines espèces sensibles et pas sur d'autres. Cette approche a été largement utilisée pour étudier les effets de la pollution par les métaux et elle a été appliquée à la surveillance à long terme de la progression de la pollution aux sites des mines. La récolte sur pied et la biomasse (habituellement mesurées à l'aide de la chlorophylle a) des communautés de phytoplancton sont habituellement évaluées dans toute étude où les producteurs primaires sont pris en compte, et ces mesures ont été utilisées à titre d'indicateurs dans les programmes environnementaux à long terme aux sites des mines (AETE, 1997). Des tendances constantes de tolérance ou d'intolérance à la pollution par les métaux sont identifiées chez certaines espèces et elles peuvent servir d'avertissement précoce de la pollution par les métaux (AETE, 1997). À long terme, la biomasse ne semble pas être une mesure utile des effets de la contamination par des métaux sur les producteurs primaires, étant donné que les changements à long terme dans la composition des espèces ou la réduction de la pression exercée par le broutage peuvent contrebalancer toute réduction à court terme de la biomasse des algues (Yan, 1979). De plus, la biomasse se disperse, et la densité et la biomasse ont tendance à être semblables entre les zones d'impact et les zones de référence (AETE, 1997).
12.8.5.4 Indicateurs pour le phytoplancton et le périphyton
La mesure de la chlorophylle a, de la chlorophylle b et de la biomasse du phytoplancton et du périphyton peut s'avérer utile dans les cas où les rejets d'éléments nutritifs en amont représentent des influences confusionnelles, ou lorsqu'un enrichissement en éléments nutritifs provenant des effluents des mines est soupçonné. La concentration des pigments photosynthétiques est souvent utilisée pour estimer la biomasse du phytoplancton.
La biomasse du phytoplancton et du périphyton tend à avoir une distribution irrégulière et elle varie au fil du temps alors que les fleurs d'eau se développent et que l'eau se stratifie. Cette méthode est plus appropriée pour les lacs que les rivières, bien que les preuves d'une importante biomasse phytoplanctonique dans les échantillons riverains soit néanmoins un indicateur que les éléments nutritifs reflètent l'état trophique en amont et peuvent être, et sont probablement, pertinents dans l'évaluation des influences des éléments nutritifs (par opposition aux contaminants) sur la structure en aval des communautés benthiques, du zooplancton et probablement des poissons. Des critères ont été établis afin de classer l'eutrophisation en fonction du périphyton et du phytoplancton (Dodds et Welch, 2000; Dodds, 2006). Les éléments nutritifs et plusieurs autres facteurs dont la lumière, la température, la vitesse, les solides en suspension et les perturbations physiques peuvent avoir une incidence sur la composition et la biomasse de la communauté de périphyton (Culp et al., 1996; Chambers et al., 2006; Azim et Asaeda, 2005; Biggs et Kilroy, 2000). Les relations entre les éléments nutritifs et la biomasse du périphyton ont fait l'objet d'études (Dodds et Welch, 2000; Chambers et al., 2001).
Souvent, deux mesures courantes de la biomasse sont utilisées : la chlorophylle a, qui est utilisée comme indicateur de la quantité totale des organismes autotrophes dans l'échantillon, et la masse sèche sans cendre, laquelle est une mesure de la quantité totale de matières organiques dans l'échantillon. La masse sèche sans cendre comprend les microorganismes autotrophes et hétérotrophes vivants, le périphyton et les micro-invertébrés morts, et possiblement les débris terrestres. Il est recommandé d'analyser ces deux paramètres, car ils fournissent des renseignements complémentaires et qu'ils peuvent être jumelés afin de former un indice appelé « indice d'autotrophie » (Weber, 1973). D'autres renseignements sur l'utilisation de la chlorophylle a à titre d'indicateur de la biomasse se trouvent dans Weitzel (1979). Des méthodes pour déterminer la masse sèche sans cendre sont décrites dans Ridley Thomas et al. (1989) et dans Aloi (1990).
La chlorophylle a peut être mesurée à l'aide de la spectrophotométrie, de la fluorométrie ou de la chromatographie liquide, et en tenant compte de la chlorophylle b et c, des produits de dégradation de la chlorophylle (p. ex. chlorophyllides, phaéophorbides et phéophytines) et de la turbidité. De plus amples renseignements peuvent être obtenus sur les méthodes analytiques dans la Standard Methods for the Examination of Water and Wastewater (méthode 10200 H) (American Public Health Association (APHA), American Water Works Association (AWWA) et Water Environment Federation (WEF), 2001).
12.9 Méthodes de laboratoire et essais de toxicité
12.9.1 Paramètres histologiques et physiologiques
Les effets de la contamination peuvent être constatés non seulement à l'échelle de l'écosystème, de la communauté, de la population et de l'individu, mais également à l'échelle cellulaire, infracellulaire et moléculaire (Peplow et Edwards, 2005). Lors de l'atelier de recherche des causes associées aux mines de métaux (2009) (Environnement Canada, 2012), des travaux ont été présentés relativement à l'étude des paramètres et histologiques et physiologiques pour déterminer la cause de l'augmentation de la taille et du poids du foie et des gonades chez les poissons (Sharpe et al., 2012). L'histologie des gonades a été utilisée pour identifier le sexe et le niveau de maturité des poissons (en raison de la petite taille des poissons) de même que pour observer le développement asynchrone ou anormal. L'histologie du foie a été utilisée pour évaluer la pathologie clinique (difformités, anomalies et parasites), l'index mitotique du foie (indicateur de la prolifération cellulaire en réponse à des tumeurs ou à l'arsenic, par exemple), la vacuolisation lipidique et le contenu en glycogène. De plus, les paramètres physiologiques comme la teneur en glycogène et en triglycérides du foie ont été mesurés. Ces indices regroupés fournissent une indication de la fonction des gonades et du foie. Certains indicateurs et méthodes incluent : des méthodes de diagnostic de la toxicité hépatique (Wolf et Wolfe, 2005), des méthodes histopathologiques (Hinton et al., 1990, 2005; Costa et al., 2009; Werner et al., 2003) et des indicateurs physiologiques et biochimiques (Taylor, 2004; Weber et al., 2003; Werner et al., 2003).
12.9.2 Essais de toxicité
Des essais de toxicité létale et sublétale en laboratoire à l'aide de poissons et d'espèces benthiques à titre d'organismes d'essai, et de sédiments entiers, d'eau interstitielle des sédiments, d'effluents et d'eau à titre de milieu d'essai, peuvent permettre une détermination directe de la toxicité. Des essais de toxicité peuvent être utilisés conjointement avec plusieurs outils de surveillance et d'autres essais sur le terrain décrits ailleurs dans le présent chapitre pour aider à interpréter les résultats dans des situations où il y a des facteurs confusionnels, des rejets multiples ou des modifications de l'habitat découlant de rejets d'effluents de longue date. Ces méthodes d'essai de toxicité peuvent également être utiles pour identifier la cause de l'absence de taxons aux sites d'exposition.
Il y a un ensemble de méthodes d'essai en laboratoire; ce chapitre fait référence à certaines méthodes pertinentes, mais de nombreuses autres sont disponibles au Canada et dans d'autres organismes internationaux, tels que la Division des méthodes biologiques d'Environnement Canada de même que l'Environmental Protection Agency des États‑Unis, l'Organisation de coopération et de développement économiques, l'Union européenne, l'Organisation mondiale de la santé, etc. Il est recommandé que les essais de toxicité soient effectués par des laboratoires accrédités qui respectent les protocoles normalisés reconnus.
Les essais de toxicité létale et sublétale ont plusieurs limites qui doivent être prises en considération. Étant donné que les méthodes d'essai de toxicité en laboratoire ne permettent pas de déterminer la toxicité in situ, elles pourraient ne pas tenir compte de la toxicité liée aux eaux sus-jacentes, ou des effets de la composition chimique des eaux sus-jacentes sur la toxicité des contaminants lors de l'essai des sédiments ou de l'eau interstitielle des sédiments. Ces problèmes seront plus marqués lorsque la composition chimique de l'eau sus-jacente utilisée dans l’essai de toxicité diffère considérablement de l'eau in situ, ou lorsque les conditions sur le terrain ou pendant les essais de toxicité sont telles que les concentrations de contaminants dans l'eau sus-jacente sont loin d'être en équilibre avec les sédiments (Parker et Dumaresq, 2002).
12.9.3 Essai de toxicité sur les poissons : cycle de vie du méné à grosse tête
L'essai en laboratoire sur l'ensemble du cycle de vie du méné à grosse tête peut être utilisé pour évaluer les effets sur les poissons de l'exposition à long terme aux effluents (Parrott et al., 2012; Parrott, 2005; Parrott et Bennie, 2009). Cet essai sur l'ensemble du cycle de vie couvre toutes les « phases critiques » d'exposition pendant le cycle de vie des poissons, soit les œufs, le stade larvaire, le développement au stade juvénile, la période de reproduction des poissons adultes et le taux de survie de la première génération.
Les essais sur l'ensemble du cycle de vie sont longs et coûteux. Toutefois, ces essais permettent de simuler les effets d'expositions environnementales réelles et ils offrent des données qu'il serait impossible à obtenir en utilisant l'exposition des poissons en laboratoire sur de plus courtes durées. La méthode pourrait fournir des données utiles dans les cas où la capture de poissons sauvages est difficile (Parrott et al., 2012).
12.9.4 Essai de toxicité sur les sédiments entiers
Des essais de toxicité des sédiments peuvent servir à évaluer la contamination potentielle dans les milieux aquatiques (Parker et Dumaresq, 2002). Ces essais fournissent une méthode directe pour déterminer la disponibilité chimique des contaminants dans les sédiments, et ils peuvent être utilisés comme outil d'évaluation conjointement avec des données chimiques et l'analyse d'autres contaminants, l'analyse de la communauté benthique et d'autres outils de surveillance des sédiments, comme l'analyse en triade de la qualité des sédiments (voir la section 12.6.2). Les essais de toxicité sur les sédiments entiers fournissent une mesure directe de la toxicité en évaluant les effets des sédiments sur les organismes d'essai dans la zone d'exposition relativement aux effets associés aux sédiments du site de contrôle ou de référence. Les résultats des essais sont exprimés en termes de survie, de croissance et de reproduction comparativement à un site de référence. Les effets peuvent également être exprimés en tant que différence (en pourcentage) de la réponse dans les sédiments de contrôle ou de référence.
Les essais de toxicité sur les sédiments entiers peuvent être utilisés pour confirmer que les modifications dans les communautés d'invertébrés benthiques sont liées à la toxicité des sédiments et non à d'autres facteurs physiques ou biologiques. Les effets nocifs sur la structure de la communauté d'invertébrés benthiques pourraient être dus à la toxicité des sédiments, mais ils pourraient également être attribuables à d'autres facteurs (la prédation, les différences d'habitat, etc.). L'altération simultanée de la structure de la communauté d'invertébrés benthiques et de la toxicité des sédiments met les sédiments en cause en tant que responsables des effets sur la communauté d'invertébrés benthiques. Ces essais fournissent également des renseignements importants pour l'interprétation des effets sur le terrain dans des situations où les données sur la communauté d'invertébrés benthiques ne sont pas concluantes, ou lorsque seules les espèces tolérantes à la pollution sont présentes dans la zone d'exposition et dans la zone de référence.
Une série d'essais peut être effectuée pour démontrer la toxicité des sédiments pour plus d'une espèce. L'utilisation d'une batterie de tests aide à démontrer l'importance et le caractère universel de la réponse d'organismes de complexité variable (c.-à-d., nombre d'espèces réagissant) à la toxicité des sédiments. Les réponses relatives observées lors d'essais sur les sédiments avec différentes espèces peuvent contribuer à la détermination de la cause de la toxicité des sédiments si l'information sur la sensibilité relative des différentes espèces aux différents métaux est disponible dans la documentation. Les essais visant plusieurs espèces peuvent également aider à expliquer le lien entre la structure de la communauté d'invertébrés benthiques et la toxicité des sédiments. L'utilisation de plusieurs espèces lors d'essais de la toxicité permet de faire des comparaisons plus directes entre l'abondance/absence d'espèces d'invertébrés benthiques et les résultats des essais de toxicité avec les mêmes espèces, ou des espèces étroitement liées. Des procédures d'essai normalisées sont disponibles (Bedard et al., 1992; ASTM, 1997, 2010; Environnement Canada, 1997a, 1997b).
La limite des essais de toxicité sur les sédiments entiers est qu'il s'agit d'essais en laboratoire qui ne permettent pas de déterminer la toxicité in situ directement. De plus, si de l'eau sus-jacente régulière est utilisée (ce qui est généralement le cas), au lieu d'eau recueillie du site d'étude, les effets des différences de qualité de l'eau sus-jacente sur la toxicité des sédiments, s'il y a lieu, ne sont pas pris en compte.
12.9.4.1 Survie et croissance de Hyalella azteca
Hyalella azteca est un amphipode habitant dans les sédimentsqui estutilisé régulièrement dans les études menées sur le terrain et en laboratoire pour recherche la source et la cause de la toxicité des sédiments (Shuhaimi-Othman et al., 2006; Borgmann et al., 2004; Borgmann et al., 2005a, 2005b; Couillard et al., 2008; Ingersoll et al., 2000; Borgmann et Norwood 2002; Nowierski et al., 2005). Environnement Canada possède une méthode normalisée (SPE 1/RM/33 : Essai de survie et de croissance de l'amphipode dulcicole H. azteca dans les sédiments) (Environnement Canada, 1997a). Les paramètres de la méthode SPE 1/RM/33 sont la survie (toxicité létale) et la croissance (par masse sèche) après un essai de toxicité de 14 jours pour les sédiments dans l'effluent et dans l'eau. L'essai peut être exécuté à l'aide d'une ou de plusieurs concentrations (Environnement Canada, 1997a).
Taylor et al. (2012) ont modifié la méthode SPE 1/RM/33 afin de pouvoir utiliser un essai de toxicité dans les sédiments et un essai de toxicité dans l'eau seulement afin de distinguer les effets des rejets actuels de l'effluent de ceux de l'accumulation historique de métaux et d'autres substances toxiques dans les sédiments. L'essai de toxicité des sédiments comprend la préparation de différentes combinaisons de mélange sédiments/eau : trois types de sédiments (site d'exposition, référence sur le terrain et référence en laboratoire) sont chacun combinés à l'un des trois types d'eau (eau de dilution de laboratoire, eau de référence et eau du milieu récepteur) (maximum de neuf combinaisons possibles). En utilisant les combinaisons ci-dessus, il est possible de déterminer la toxicité de l'effluent ou dans les sédiments de façon indépendante. En utilisant une combinaison d'échantillons de sédiments et d'eau prélevés sur le terrain et en laboratoire, le plan d'étude tient également compte de l'influence que la composition chimique de l'eau propre à un site (p. ex. carbone organique dissous dans le milieu récepteur) peut avoir sur la toxicité (Taylor et al., 2012) (Borgmann et al., 2005c; Borgmann, 2002; Environnement Canada, 1997a; Ingersoll et al., 2000). L'essai avec l'eau seulement est fondé sur la méthode SPE 1/RM/33 et une méthode provisoire mise au point par Borgmann et al. (2005) pour une méthode à l'eau seulement. La conception de l'essai est fondée sur une exposition statique d'une durée de 14 jours avec renouvellement de l'eau pour examiner la survie et la croissance des organismes d'essai. Les essais effectués sur un échantillon d'eau du site de référence sur le terrain, un échantillon prélevé sur le terrain et un échantillon d'eau de dilution de laboratoire en l'absence de sédiments, mais en présence d'un substrat artificiel pour les organismes d'essai.
Les résultats combinés de l'étude présentée lors de l'atelier de recherche des causes associées aux mines de métaux (Taylor et al., 2012) indiquent que la méthode d'essai portant sur H. azteca (SPE 1/RM/33) est un outil rapide, rentable et facilement accessible lorsqu'il est combiné à des relevés sur les communautés benthiques et à des analyses chimiques (approche de la triade de la qualité des sédiments). Cette méthode peut être utilisée pour distinguer les effets biologiques de la contamination historique des sédiments de la qualité actuelle de l'effluent, en tant compte de la variabilité temporelle et de la toxicité des métaux dans l'eau et les sédiments. Cependant, la variabilité temporelle sur le plan des constituants de l'effluent doit être prise en considération au moment de décider si la qualité actuelle de l'effluent peut avoir une incidence sur la communauté d'invertébrés benthiques.
12.9.4.2 Survie et croissance des larves dulcicoles de chironomes Chironomus dilutus ou Chironomus riparius
Les chironomes ont été grandement utilisés dans les essais de toxicité des sédiments aux États-Unis et au Canada. La méthode d'essai normalisée par Environnement Canada est décrite dans SPE 1/RM/32 (Environnement Canada 1997b) : Essai de survie et de croissance des larves dulcicoles de chironomes (Chironomus tentans ou Chironomus riparius) dans les sédiments. Un sommaire et des références supplémentaires se rapportant aux procédures d'essai sur les chironomidés sont disponibles dans Environnement Canada (1997b). La méthode SPE 1/RM/32 expose dix organismes du deuxième stade larvaire de (C. dilutus anciennement C. tentans) ou du premier stade larvaire de (C. riparius) à un échantillon contenant des sédiments et de l'eau dans le cadre d'un essai biologique. À la fin de l'essai, les sédiments sont tamisés et les organismes (morts et vivants) sont récupérés. Les animaux survivants sont dénombrés, séchés et pesés. Les deux paramètres calculés sont le pourcentage moyen d'organismes qui ont survécu à l'exposition et le poids sec moyen par animal ayant survécu (Environnement Canada, 1997b).
12.9.4.3 Survie et reproduction de l'oligochète Tubifex tubifex
Cet essai est décrit dans ASTM (2010).
Les spécimens de Tubifex sont exposés à des quantités égales de sédiments et d'eau dans le cadre de l'essai biologique. Les individus matures sexuellement (âgés de huit semaines) sont introduits et incubés pendant 28 jours. La production de cocons indique la reproduction des organismes. À la fin de l'essai, l'échantillon est tamisé et nombre d'adultes survivants, le nombre de cocons pleins et vides, le nombre de jeunes de taille inférieure à 500 mm et le nombre de jeunes dont la taille est supérieure à 500 mm sont dénombrés à titre de mesures de la survie et de la reproduction.
12.9.4.4 Survie et croissance de l'éphémère Hexagenia limbata
Cet essai est décrit dans le « Laboratory Sediment Biological Testing Protocol » du ministère de l'Environnement de l'Ontario (Bedard et al., 1992) et dans ASTM (2010).
L'essai utilise de jeunes nymphes d'éphémère Hexagenia limbata qui ont de trois à quatre mois et qui sont élevées en laboratoire à partir d'œufs recueillis sur le terrain. De 10 à 15 spécimens de H. limbata sont exposés pendant 21 jours à de l'eau et des sédiments dans le cadre d'un essai biologique. Les animaux ne sont pas nourris au cours de cette période. À la fin de l'essai, le nombre d'animaux survivants est dénombré et les animaux sont séchés et pesés pour déterminer leur poids sec et ainsi obtenir une indication de leur croissance. La survie et la croissance dans les sédiments à l'étude sont comparées statistiquement à la survie et à la croissance dans le groupe témoin.
12.9.5 Métaux dans l'eau sus-jacente dans le cadre d'essais de toxicité sur les sédiments entiers
La mesure des métaux dans l'eau sus-jacente dans le cadre d'essais de toxicité sur les sédiments entiers peut être utilisée pour la quantification des métaux biodisponibles ou l'identification de la cause de la toxicité des sédiments. La mesure des métaux dissous dans l'eau sus-jacente peut fournir des renseignements sur la biodisponibilité relative des métaux dans les sédiments et, par conséquent, de leur la toxicité potentielle. Toutefois, la toxicité des métaux dans les sédiments n'est pas proportionnelle aux concentrations totales en métaux dans les sédiments, et la biodisponibilité peut varier grandement d'un sédiment à l'autre. La biodisponibilité des métaux, notamment pour H. azteca, semble souvent être principalement due aux métaux dissous dans l'eau sus-jacente (Deaver et Rodgers, 1996; Warren et al., 1998; Borgmann, 2000; Borgmann et Norwood, 1999a). Si des données sur la toxicité des métaux dans l'eau sont disponibles, et s'il est reconnu que la toxicité est principalement due aux métaux dissous pour les espèces d'invertébrés benthiques en question, les concentrations dans l'eau peuvent parfois être utilisées pour déduire la cause de la toxicité. L'utilisation des concentrations de métaux dans l'eau sus-jacente est limitée à des essais de toxicité statique pour lesquels l'eau sus-jacente n’est pas renouvelée.
La principale limite de ce type de mesure est que la toxicité des métaux peut être réduite considérablement par la complexation avec le carbone organique dissous qui s'écoule des sédiments par lixiviation. Les concentrations dans l'eau résultant d'un niveau donné de toxicité peuvent, par conséquent, être plus élevées dans les essais de toxicité des sédiments que dans les essais avec de l'eau seulement (Borgmann, 2000). Cet effet peut être réduit en utilisant un grand rapport eau/sédiment dans l'essai de toxicité (Borgmann et Norwood, 1999b). La composition chimique de l’eau peut également avoir une incidence sur la toxicité des métaux, et les concentrations de métaux dans l'eau sus-jacente doivent être comparées aux concentrations de métaux causant de la toxicité dans les essais avec de l'eau seulement si la composition en ions principaux de l'eau utilisée pour ces essais est semblable. Cette technique ne permettra pas de déterminer la cause de la toxicité si la phase solide du sédiment contribue considérablement à la toxicité.
12.9.6 Essais de toxicité de l'eau interstitielle des sédiments
Les concentrations de contaminants dans l'eau interstitielle peuvent être plus fortement corrélées à la toxicité pour les organismes aquatiques (Liber et al., 2011; Cairns et al., 1984; Nebeker et al., 1984; Schuytema et al., 1984; Knezovich et Harrison, 1988; Giesy et Hoke, 1990) que celles dans les sédiments en vrac (Patrick et al., 1977; Adams et al., 1985; Shaner et Knight, 1985; van de Guchte et Mass-Diepeveen, 1988; Di Toro, 1989; Ankley et al., 1991; Carr et Chapman, 1992). Par conséquent, les essais de toxicité au moyen de l'eau interstitielle des sédiments peuvent être un complément important aux essais de toxicité sur les sédiments entiers. L'importance relative de l'eau interstitielle et des sédiments entiers en tant que sources de contaminants toxiques pour les organismes aquatiques semble dépendre de l'espèce de l'organisme d'essai et du type de contaminant (Knezovich et Harrison, 1987; Giesy et Hoke, 1990; Harkey et al., 1994).
Il y a une quantité relativement importante de documents qui décrivent les essais de toxicité avec l'eau interstitielle (Burton 1992, 1998). Toutefois, il n'y en a pas autant que pour les essais sur les sédiments entiers, et il existe peu de méthodes normalisées pour les essais de toxicité avec l'eau interstitielle pour les organismes d'eau douce. Environnement Canada (1992) offre deux méthodes normalisées utilisant l'eau interstitielle pour étudier les échinides (oursins verts et oursins plats) et les bactéries luminescentes.
Les essais qui peuvent être utilisés pour les essais de toxicité de l'eau interstitielle sont décrits brièvement ci-dessous. Il est à noter qu'il s'agit d'essais normalisés pour l'essai de toxicité de l'eau et des effluents et qu'ils ne sont pas réservés aux essais avec l'eau interstitielle.
12.9.6.1 Essai biologique sur la fécondation chez les oursins verts
L'essai sur la fécondation des oursins verts est décrit dans le chapitre portant sur la toxicité sublétale (chapitre 6, tableau 6.2).
12.9.6.2 Essai de toxicité aiguë Microtox
L'essai de toxicité aiguë Microtox est utilisé pour évaluer l'effet de l'exposition aux effluents sur la production de lumière par les bactéries marines naturellement luminescentes Vibrio fischeri. Le résultat est exprimé comme la concentration où la production de lumière est réduite de 25 % ou 50 % (CI25, CI50).
L'essai Microtox est fréquemment utilisé sur place par plusieurs industries. L'essai est décrit dans le manuel du fabricant Microtox Manual: A Toxicity Testing Handbook (Microbics Corp.). L'essai Microtox est une trousse d'essai biologique de dépistage rapide qui mesure les effets toxiques sur la production de lumière d'une culture normalisée de bactéries luminescentes. La principale limite de cette méthode est que le diluant (eau de dilution) est une solution saline, alors que l'organisme d'essai est une bactérie marine ayant peu de pertinence avec les milieux miniers canadiens, étant donné que la majorité des effluents miniers se déversent dans des milieux dulcicoles.
12.9.6.3 Létalité aiguë avec Daphnia magna
Cet essai vise à déterminer la concentration d'eau d'essai qui cause une mortalité de 50 % pour Daphnia magna pendant une période d'exposition de 48 heures. Cet essai normalisé utilise des groupes de nouveau-nés de D. magna âgés de moins de 24 heures dans une gamme de concentrations d'eau d'essai. L'essai de létalité de D. magna est décrit en détail dans SPE 1/RM/11 (Environnement Canada 1990, 1996).
12.9.6.4 Reproduction et survie de Ceriodaphnia dubia
Cet essai est décrit dans le chapitre portant sur la toxicité sublétale (chapitre 6, tableau 6.2).
12.9.6.5 Inhibition de la croissance de l'algue Pseudokirchneriella subcapitata
Cet essai est décrit dans le chapitre portant sur la toxicité sublétale (chapitre 6, tableau 6.2).
12.9.6.6 Essai de toxicité de l'eau interstitielle des sédiments à l'aide de Hyalella azteca et Chironomus dilutus
Les essais normalisés pour Hyalella azteca (Environnement Canada, 1997) et Chironomus dilutus (Environnement Canada, 1997a), décrits dans les sections 12.9.4.1 et 12.9.4.2, respectivement, ont récemment été utilisés pour l'essai de l'eau interstitielle des sédiments. Liber et al. (2011) ont évalué l'hypothèse voulant que les concentrations de métaux dans l'eau interstitielle soient mieux corrélées avec la toxicité des sédiments dans les organismes benthiques qu'avec les concentrations de métaux dans les sédiments entiers. À l'aide de H. azteca et C. dilutus, ils ont découvert que, dans certains cas pour les métaux spécifiques examinés, leur approche permet de prédire la toxicité des sédiments à l'aide des données sur les métaux dans l'eau interstitielle des sédiments (Liber et al., 2011).
12.10 Outils pour l'analyse des effluents et de la qualité de l'eau
Aux sites où il y a des effets sur les poissons ou la communauté d'invertébrés benthiques, il existe plusieurs techniques de caractérisation des effluents et de surveillance de la qualité de l'eau qui peuvent aider à comprendre la nature et la cause des effets. De plus, la caractérisation des effluents comprenant d'autres contaminants des mines provenant d'autres sources, notamment les sources non ponctuelles, peut s'avérer appropriée à certains sites dans le cadre de la recherche des causes. Dans certains cas, ces techniques pourraient également fournir de précieux renseignements pendant la surveillance de la recherche des causes, dont des données environnementales complémentaires, lors de la détermination de l'étendue et de l'ampleur des effets observés sur les poissons ou la communauté d'invertébrés benthiques. Les techniques décrites ci-dessous sont recommandées, et les mines peuvent utiliser des techniques individuelles ou des combinaisons de techniques, le cas échéant, pour répondre aux questions propres à un site. De plus amples renseignements sur la caractérisation des effluents et la surveillance de la qualité de l'eau peuvent être consultés au chapitre 5.
12.10.1 Mesure des métaux dissous pendant la recherche des causes
La mesure des métaux totaux et dissous dans les échantillons de qualité de l'eau de l'effluent et de la zone d'exposition pendant la recherche des causes aiderait à déterminer quels métaux causent ou contribuent aux effets observés (Parker et Dumaresq, 2002). La justification pour mesurer les métaux dissous pendant la recherche des causes est fondée sur la théorie que ce sont les métaux dans la fraction dissoute, notamment les ions métalliques libres, qui sont les plus biodisponibles pour les organismes aquatiques. Il existe des preuves qualitatives à l'appui de cette théorie, notamment pour les milieux synthétiques définis (c.-à-d., essais biologiques en laboratoire). Toutefois, cette relation semble se détériorer dans les eaux naturelles, notamment en présence de matières organiques dissoutes naturelles (ESG, 1999).
La procédure normale pour mesurer les concentrations de métaux dissous comprend la filtration immédiate de l'échantillon d'eau brute à l'aide d'un filtre de 0,45 micron et ensuite de conserver l'échantillon filtré avec de l'acide nitrique à un pH inférieur à 2,0 afin de conserver les métaux dissous en solution jusqu'au moment de l'analyse. Il existe des différences de la taille du filtre utilisé, mais le filtre de 0,45 micron est le plus couramment utilisé. Des préoccupations sont soulevées selon lesquelles certains métaux liés aux colloïdes, qui ne sont pas réellement dissous, peuvent passer à travers cette taille de membrane de filtration, et certains chercheurs recommandent des tailles de filtre aussi petites que 0,1 micron pour réduire cette préoccupation (EVS, 1997).
Dans un rapport par Hall (1998), trois systèmes de filtre ont été évalués (filtres à seringue, intégrés et à vide). Les recommandations de cette étude sont fondées sur la contamination recueillie par ces filtres et leur facilité d'utilisation. Avant de choisir un système, il est important d'évaluer sa propension à être bouché par l'échantillon d'eau. Toute personne qui prévoit effectuer des analyses des métaux dissous est fortement encouragée à consulter Hall (1998) avant le prélèvement de l'échantillon.
Un « peeper », un échantillonneur à membrane de dialyse, et un gradient de diffusion en couches minces peuvent être utilisés pour mesurer les métaux biodisponibles dans l'eau sus-jacente (Liber et Doig, 2000). Les métaux biodisponibles peuvent être comparés aux concentrations de métaux dissous, ce qui permet une meilleure prédiction de la toxicité.
12.10.2 Spéciation des métaux pour les métaux d'intérêt
Les métaux ne sont ni créés ni détruits par les processus biologiques ou chimiques. Cependant, ces processus sont capables de transformer les métaux d'une espèce à l'autre (USEPA, 2007). La forme dans laquelle le métal (ou métalloïde) se produit (c.-à-d., la spéciation du métal) peut avoir un effet important sur la biodisponibilité, la bioaccessibilité et la toxicité de ce métal pour les organismes aquatiques (Tessier et Turner, 1995; Stumm et Morgan, 1996; EPA des É.-U., 2007). Par conséquent, la compréhension de la spéciation des contaminants d'intérêt peut être importante pour comprendre la nature et les causes des effets sur les écosystèmes aquatiques (Parker et Dumaresq, 2002). Langmuir et al. (2004) discutent de la chimie de l'environnement des métaux et fournissent des exemples de la façon dont la spéciation influence le comportement et les effets.
La spéciation des métaux peut être mesurée par une analyse directe ou être estimée à l'aide d'outils de modélisation. Deux des plus importants facteurs ayant une incidence sur la spéciation des métaux sont le pH et l'état d'oxydation. Par conséquent, peu importe la méthode utilisée pour évaluer la spéciation des métaux, il est important de prendre des mesures précises sur le terrain du pH et de l'oxygène dissous. De plus, si des échantillons doivent être analysés pour la spéciation des métaux, il est important de veiller à ce que les procédures appropriées de prélèvement, de préservation et d'entreposage des échantillons soient respectées.
La spéciation, ou du moins la détermination de la valence, de certains métaux dans l'eau peut être déterminée de façon analytique, bien qu'un tel service puisse être limité. Des méthodes analytiques comprennent des méthodes utilisant l'échange d'ions, l'électrochimie, la chromatographie d'exclusion stérique, la voltampérométrie, la spectrométrie d'absorption des rayons X (pour structure fine), la spectrométrie de masse à source à plasma inductif, le gradient de diffusion en couche mince, la chromatographie liquide à haute performance en phase inverse par formation de paires d'ions, les mini-électrodes intégrées dans le gel, la perméabilité liquide par membrane à fibres creuses, de même que plusieurs méthodes présentées dans la section 12.11.5.1 (concentrations partielles de métaux dans les sédiments). Les techniques de mesure de la spéciation des métaux dans les solutions aqueuses ont été minutieusement examinées par Tessier et Turner (1995), Unsworth et al. (2006) et Ekberg et al. (2011). Si des échantillons sont acheminés aux fins d'analyse de la spéciation, il faut faire preuve d'une grande prudence lors de la collecte, de la manipulation et de l'entreposage des échantillons. Il faut être très prudent, car des changements dans des facteurs tels que la teneur en oxygène dissous de l'échantillon pourraient se traduire par la spéciation de l'échantillon qui changerait considérablement entre le moment de sa collecte et celui de son analyse. Il est fortement recommandé de communiquer avec le laboratoire qui effectuera les analyses avant d'effectuer la collecte d'échantillons afin de déterminer les procédures appropriées.
Un certain nombre de programmes informatiques sont disponibles pour la modélisation de la spéciation chimique des métaux dans l'eau, comme les suivants :
- MINTEQA2 (Allison et al., 1991)
- MINEQL+ (Schecher et McAvoy, 1992, 1994)
- Windermere Humic Aqueous Model (WHAM) (Tipping, 1994, 1998)
- VMINTEQ (Gustafson, 2004)
- Modèle Chemical Equilibria in Soils and Solutions (CHESS) (Santore et al., 1998; Meyer et al., 1999)
- MINEQL+ dans le modèle du ligand biotique par McGeer et al. (2000) (Paquin et al., 2002a, 2002b)
- BIOCHEM ORCHESTRA (Vink et Meeussen, 2007)
- TRANSPEC (Bhavsar et al., 2008)
- PHREEQCI (Parkhurst et Appelo, 2000)
- FITEQL (Herbelin et Westall, 1999)
- TICKET (Farley et al., 2008)
Étant donné que la spéciation des métaux dépend de plusieurs facteurs, tous ces programmes ont besoin de données sur les éléments suivants : pH, alcalinité, dureté, cations et anions principaux, force ionique, matières dissoutes totales, carbone organique dissous, métaux totaux dissous, sulfure, apports d'origine anthropique uniques, comme l'EDTA, et concentration d'aluminium et de fer (III) (EVS, 1997). Ces programmes peuvent être utilisés pour prédire les formes et les concentrations de métaux dans l'effluent ou l'eau, et pour prévoir la toxicité (EVS, 1997). Les sources possibles d'erreur sont décrites dans EVS (1997).
12.10.3 Mesure des réactifs et des sous-produits réactifs utilisés dans le traitement
Une vaste gamme de réactifs chimiques est utilisée dans le traitement du minerai, et ces réactifs, ou les sous-produits de la décomposition de ces réactifs, peuvent être présents dans les effluents des mines. Par conséquent, les réactifs et les sous-produits des réactifs peuvent être présents dans les milieux récepteurs. Les analyses des réactifs et des sous-produits des réactifs peuvent s'avérer utiles dans les cas où les effets observés ne peuvent pas être attribués aux métaux et aux autres paramètres contrôlés régulièrement dans le cadre du programme d'ESEE à un site. Plusieurs réactifs et sous-produits particuliers qui ont fait été abordés au cours de l'atelier de recherche des causes des mines de métaux de 2009 (Environnement Canada, 2012) sont présentés brièvement ci-dessous.
Des espèces de cyanure peuvent être présentes dans les effluents ou sous forme de résidus solides contaminés. La toxicité du cyanure est liée à sa spéciation. Le cyanure libre (HCN, CN-) est classé comme étant la forme la plus toxique en raison de son potentiel d'inhibition métabolique élevé, alors que les complexes métal-cyanure (p. ex. [Fe(CN)6]3-, [Fe(CN)6]4-) sont considérés être moins toxiques (Shifrin et al., 1996). Zagury (2012) a démontré que les espèces plus réactives de cyanure qui sont initialement associées à des résidus solides se dégradent principalement en raison de la volatilisation, de la lixiviation et de la dégradation bactérienne. La plus grande proportion d'espèces stables de cyanure observées dans les résidus vieillis découle probablement de la dissociation précoce de complexes faibles à modérément forts, probablement lors de l'altération atmosphérique (p. ex. décomposition en présence de lumière ultraviolette).
Les xanthates sont souvent utilisés comme collecteurs durant le traitement des minerais sulfurés par flottation. La présence de xanthates a été observée dans les effluents et les eaux réceptrices à des concentrations pouvant atteindre 4,0 mg/L. Ces concentrations sont suffisantes pour causer une toxicité potentielle, étant donné que les xanthates présentent une toxicité (selon des mesures à la CI25) à des concentrations allant de 0,5 mg/L à 3 mg/L (Vigneault et al., 2012).
Les sulfosels (thiosulfate, trithionate, tétrathionate et d'autres polythionates) sont produits par la flottation de minerais sulfurés. Vigneault et al. (2012) ont déclaré que le thiosulphate était généralement plus toxique que le tétrathionate. La sensibilité aux sulfosels variait d'aucune réponse pour la Truite arc-en-ciel à une CI25 de 59,4 mg S2O3/L pour C. dubia (reproduction). La toxicité aiguë du thiosulphate pour D. magna (létalité) était également supérieure à celle du tétrathionate (CE50 à environ 300 et 750 mg/L, respectivement) (Vigneault et al., 2012). Des concentrations de thiosulphate de 700 mg/L ont été signalées dans des effluents miniers, donc en quantité suffisante pour causer de la toxicité (Vigneault et al., 2012).
Le sélénium est libéré dans les bassins versants avoisinants pendant l'extraction et la fonte des minerais de cuivre, de plomb, de mercure, d'argent, d'uranium et de zinc. Le sélénium est tératogène à des teneurs élevées. La détermination de la concentration aqueuse de sélénium dans les effluents, les eaux usées et les eaux réceptrices peut permettre de déterminer si le sélénium est présent à des concentrations élevées. La biogéochimie du sélénium est complexe et des études plus approfondies de la toxicité du sélénium dans les tissus des poissons pourraient donner des résultats plus utiles (Palace, 2012).
D'autres réactifs de procédé et de traitement des eaux usées susceptibles d'être rejetés en concentrations suffisantes pour causer la toxicité incluent le Magnafloc, le Nalmet et la chaux (Vigneault et al., 2012).
12.10.4 Surveillance du débit et des charges dans la zone exposée
Pendant l'étude de recherche des causes, la mesure du débit d'eau dans la zone exposée pourrait aider à interpréter les données et à comprendre le taux de dilution, le mélange, le bilan massique, le devenir et les effets des contaminants ainsi que les relations de cause à effet. Il peut être utile d'évaluer le degré d'exposition des communautés aux effluents des mines et à leurs contaminants sur une période plus longue et dans une variété de conditions.
Les évaluations des taux de charge sont essentielles aux calculs du bilan massique. En supposant un mélange complet, le principal énoncé pour le bilan massique à un point de rejet est :
Masse ou taux de charge de la substance en amont + taux massique ajouté par le point de rejet = Taux massique de la substance immédiatement en aval du point de rejet
Étant donné que le taux de charge est le produit du débit et de la concentration, le bilan massique est obtenu par :
Q0s0 + Qese = Qs
où Q0 , Qe et Q = le débit en aval, le taux de rejet de l'effluent et le taux en amont, respectivement;
s0 , se et s = concentration en amont, dans l'effluent et en aval, respectivement.
Un énoncé semblable peut être formulé pour la modulation des débits :
Q0 + Qe = Q
Le débit et les concentrations en amont sont souvent connus ou peuvent être mesurés aisément. Les caractéristiques de l'effluent sont généralement connues plus en détail. La résolution de l'équation pour trouver la concentration en aval, s, donne ce qui suit :
![]()
Par conséquent, la concentration en aval dépend des débits en amont et en aval, de même que de la concentration en amont et des intrants chimiques dans l'effluent. Si la concentration en amont est de zéro, la concentration en aval, s, sera égale à la concentration de l'effluent réduite par le taux du débit de l'effluent sur le débit total de la rivière. Ceci est communément appelé l'effet de dilution.
Les équations ci-dessus s'appliquent au scénario le plus simple, soit immédiatement en aval du point de rejet. Les calculs du bilan massique deviennent plus complexes à mesure que l'on s'éloigne en aval du point de rejet et que les facteurs contributifs des affluents, les sources ponctuelles multiples, les sources distribuées, de même que la dispersion, la décantation chimique et les effets de la décomposition chimique sont pris en compte. Des références utiles pour la formulation appropriée d'équations du bilan massique incluent Thomann et Mueller (1987), McCutcheon et French (1989) et Henderson-Sellers et French (1991).
12.11 Outils à prendre en compte pour l'analyse des sédiments
12.11.1 La surveillance des sédiments en tant qu'outil de recherche des causes
Dans les sites où l'on observe des effets au sein de la communauté d'invertébrés benthiques, il existe un certain nombre de techniques de surveillance des sédiments pouvant aider à comprendre la nature et la cause des effets (Parker et Dumaresq, 2002). Les techniques décrites ci-dessous sont recommandées. Il n'est pas nécessaire d'utiliser toutes ces techniques. Il est possible qu'une ou quelques-unes soient suffisantes pour rechercher la cause d'un effet.
12.11.2 Transport des matières en suspension
Dans certains réseaux hydrographiques, une compréhension des caractéristiques du transport des matières en suspension peut être importante, notamment pour comprendre l'origine et le devenir des sédiments. La morphologie des cours d'eau alluviaux et des chenaux de rivière mobiles est probablement déterminée par les événements pluvio-hydrologiques. Par conséquent, la séquence de nappes d'eau dormante et de rapides qui est caractéristique de ces lits de rivière, et les distributions granulométriques correspondantes de sédiments dans les canaux, peuvent avoir des durées de résidence qui sont courtes par rapport au programme d'études de suivi des effets sur l'environnement. Dans ces circonstances, la caractérisation appropriée de la morphologie du chenal du cours d'eau, et notamment de ses éléments plus dynamiques, peut être une source d'information importante pour déterminer la cause des effets sur les communautés d'invertébrés benthiques. Par exemple, il peut être important de savoir si les dépôts annuels et le retrait subséquent des matières à grains fins est une caractéristique régulière de la zone d'étude, et si des mouvements importants sur le plan écologique de matières à grains grossiers (gravier et galets) se déroulent sur des échelles de temps de quelques années ou moins.
La majorité des preuves liant la morphologie du chenal au transport des sédiments et à l'hydrologie du bassin ont été recueillies dans des bassins fluviaux aux États-Unis qui contenaient des quantités importantes de matières en suspension. Dans les régions englacées qui sont typiques d'une grande partie du Canada, les sédiments alluviaux dans les cours d'eau comprenant beaucoup de matières d'origine glaciaire peuvent être plus stables lors d'événements pluvio-hydrologiques. De plus, dans le Bouclier canadien en particulier, l'abondance de lacs et de terres humides, en particulier dans les bassins versants de premier et de second ordre, peut aider à compenser les effets des événements pluvio-hydrologiques. Donc, une comparaison des résultats avec les résultats des études menées aux États-Unis n'est peut-être pas très utile.
Les observations directes du transport de sédiments en suspension et du mouvement de la charge de fond sont difficiles à effectuer puisque ces événements clés sont de courte durée et surviennent à des moments où le débit du cours d'eau empêche la mesure directe à cause des conditions dangereuses. Toutefois, il existe un certain nombre d'indicateurs qualitatifs de la nature dynamique des chenaux de rivière qui peuvent être utilisés. Des archives photographiques d'écoulements maximaux qui comprennent un débordement (p. ex. avec une période de retour d'un an ou plus) peuvent être utilisées pour fournir des preuves qualitatives de l'importance du transport et du dépôt des sédiments en suspension. Une autre méthode consiste à identifier les rochers ou les galets à l'aide d'un code de couleur et d'observer régulièrement l'étendue de leur déplacement. Il est suggéré que l'exploitant d'une mine utilise une combinaison de méthodes pour décrire l'emplacement physique de tels réseaux hydrographiques dynamiques
12.11.3 Taux de sédimentation des matières en suspension et datation des sédiments pour obtenir les tendances historiques
Une compréhension des taux de sédimentation des matières en suspension peut être importante pour comprendre les influences sur la chimie des sédiments et, en particulier, l'influence relative d'une exploitation minière.
Les taux de sédimentation peuvent être estimés quantitativement à l'aide de pièges à sédiments, mais il peut s'avérer difficile d'effectuer un échantillonnage représentatif et il peut même être impossible, à l'aide de cette méthode, de tenir compte de l'effet des tempêtes ou d'autres événements hydrologiques importants. En raison de ces difficultés, on considère que la mesure directe des taux de sédimentation des matières en suspension devrait être réservée à des circonstances exceptionnelles. Les taux de sédimentation à long terme peuvent également être estimés quantitativement à l'aide du carottage de sédiments.
L'influence relative de l'exploitation minière peut également être estimée de façon plus qualitative dans les cours d'eau au lit de graviers ou dans les sédiments des lacs dominés par de la matière organique molle. Dans de tels cas, la présence de sédiments minéraux fins indiquerait une certaine influence de la mine. Dans d'autres types d'environnement, cette méthode peut ne pas être efficace, étant donné que le dépôt de sédiments minéraux naturels fins masquerait toute influence de la mine. Voir Håkanson et Jansson (1983) pour de plus amples renseignements sur la sédimentologie des lacs.
La datation précise des sédiments, jumelée à un inventaire des restes de certains organismes et matériel végétal (p. ex. diatomées, zooplancton, insectes), fournit une chronologie des changements qui peuvent souvent être liés à la période d'influence anthropique (Frey, 1998). La datation de carottes de sédiments à l'aide d'isotopes a été utilisée pour évaluer la géochronologie du taux de dépôt de sédiments année après année (Weech et al., 2012) (et de plusieurs années à plusieurs décennies) pour éliminer les facteurs de confusion, comme les effets historiques. Les isotopes comme le carbone 14, l'uranium 234/238, le plomb 210, le césium 137 et le béryllium 10 peuvent être évalués (Cohen, 2003; Ritchie et McHenry, 1990; Zapata, 2003; Bierman et Nicols, 2004; Mabit et al., 2008). Consulter Frey (1998) et Cohen (2003) pour des renseignements détaillés sur la paléolimnologie.
12.11.4 Carottage de sédiments
Les carottiers prélèvent souvent des échantillons verticaux pour la détermination de la répartition verticale des caractéristiques des sédiments (Parker et Dumaresq, 2002). On préfère généralement les carottiers lorsqu'il est essentiel de maintenir l'intégrité du profil des sédiments, parce qu'il s'agit des dispositifs les moins perturbateurs. Favorisant le moins l'oxydation, les carottiers devraient être privilégiés lorsqu'il importe de maintenir un milieu exempt d'oxygène sous les couches sédimentaires superficielles (SPE 1/RM/29 : Environnement Canada, 1994). Plusieurs types de dispositifs de carottage de sédiments sont disponibles. Même si les carottiers possèdent l'avantage de prélever des échantillons de sédiments de surface (les 15 à 30 cm supérieurs) et de sédiments profonds (> 30 cm) qui sont intacts et ont subi une perturbation minimale, peu d'entre eux sont efficaces dans les substrats où se trouvent du sable, du gravier, de l'argile ou du till. Il est à noter que le document d'Environnement Canada intitulé Document d'orientation sur le prélèvement et la préparation de sédiments en vue de leur caractérisation physicochimique et d'essais biologiques (SPE 1/RM/29 : Environnement Canada, 1994) et ASTM (1992) contiennent des directives complètes sur le carottage de sédiments, y compris les procédures de carottage des sédiments, les avantages et les désavantages des carottiers de même que le transport et la manipulation des échantillons prélevés.
12.11.5 Composition chimique des sédiments
12.11.5.1 Concentrations partielles des métaux dans les sédiments (extraction partielle), extraction séquentielle des métaux, rapports entre les métaux simultanément extractibles et les sulfures volatils en milieu acide (MTA/SVMA)
Bien que les concentrations totales des métaux puissent ne pas être directement liées à la disponibilité biologique et à la toxicité, plusieurs recommandations pour la qualité des sédiments sont actuellement basées sur les concentrations totales de métaux (Parker et Dumaresq, 2002). Une variété de méthodes a été utilisée pour prédire les effets biologiques des métaux dans des sédiments contaminés par des métaux. Ces méthodes comprennent la normalisation des sédiments pour la granulométrie, le contenu organique ou la fraction extractible de métaux à l'aide des sulfures volatils en milieu acide (sulfures volatiles en milieu acide) et des métaux simultanément extractible (métaux simultanément extractibles) (Parker et Dumaresq, 2002).
On pense généralement que la forme chimique particulière d'un élément détermine son comportement, sa disponibilité biologique et sa toxicité potentielle, au lieu de la concentration totale dans les sédiments. Des formes chimiques particulières peuvent être mesurées des façons ci-dessous :
- à l'aide de techniques de mesure directe;
- directement par la digestion séquentielle des sédiments;
- en prédisant les niveaux par la modélisation thermodynamique.
Les techniques de mesure directe incluent : spectrométrie photoélectronique à rayons X; microscopie à balayage électronique/microanalyse aux rayons X, spectrométrie de masse à émission ionique secondaire et spectrométrie à électrons Auger (Parker et Dumaresq, 2002). Ces méthodes ont été appliquées aux études géochimiques et à l'exploration minérale.
La force relative de l'association entre les métaux et les particules peut être évaluée à l'aide d'une extraction unique ou séquentielle ou à l'aide de méthodes de digestion des sédiments. Les acides faibles ou chélateurs (p. ex. EDTA) et les agents réducteurs peuvent être utilisés pour établir les différences entre les différentes formes chimiques. Les fractions de sédiments peuvent être définies du point de vue opérationnel (p. ex. oxyhydrides de ferromanganèse) selon la méthode de digestion utilisée. Le récent concept des sulfures volatils en milieu acide suppose que les concentrations de métaux dans l'eau interstitielle des sédiments anoxiques sont contrôlées par les sulfures. Les sulfures volatils en milieu acide sont extraits à l'aide de la technique de purge et de piégeage à l'acide froid. Les métaux simultanément extractibles représentent la portion des métaux totaux libérés pendant la dissolution des sulfures volatils en milieu acide. Le ratio métaux simultanément extractible/sulfures volatils en milieu acide est parfois utilisé pour caractériser la disponibilité des métaux. Lorsque la fraction de métaux simultanément extractibles dépasse la fraction de sulfures volatils en milieu acide (p. ex. le rapport métaux simultanément extractibles/sulfures volatils en milieu acide est supérieur à 1), les métaux libres peuvent être présents dans l'eau interstitielle à des niveaux adéquats pour causer une toxicité aiguë. Toutefois, la toxicité ne peut pas être prédite, seulement la non-toxicité peut l'être (Parker et Dumaresq, 2002).
La limite de ces analyses est que les échantillons de sédiments anoxiques doivent être prélevés et entreposés soigneusement pour empêcher l'oxydation. Une description des méthodes de collecte des sédiments se trouve dans Warren et al. (1998).
12.11.5.2 Rapport carbone-azote (rapport C/N) pour les sédiments marins
Les effets sur la communauté d'invertébrés benthiques peuvent se produire en réponse à un enrichissement organique dans des sédiments. Afin de déterminer si un enrichissement organique contribue aux effets, une combinaison de techniques de mesure devrait être utilisée dans l'environnement marin. La mesure du carbone organique total fournit une indication de l'enrichissement organique. La mesure du potentiel d'oxydo-réduction (Eh) fournit une indication des teneurs en oxygène dans les sédiments marins. La mesure des sulfures dans les sédiments fournit une indication à savoir si la décomposition de matières organiques dans les sédiments se produit (Environnement Canada, 1994).
La mesure du rapport carbone-azote (rapport C/N) dans les sédiments marins devrait fournir une indication de la source de l'enrichissement organique. Si l'enrichissement organique est attribuable à des sources terrestres (p. ex. eaux usées municipales et des effluents des fabriques de pâtes et papiers), le rapport C/N sera plus élevé (Hargrave et al., 1995). Si l'enrichissement organique est attribuable à des sources naturelles, telles que la décomposition de plantes aquatiques marins, le rapport C/N sera beaucoup plus faible. Par conséquent, si une étude sur la communauté d'invertébrés benthiques indique un effet sur la communauté d'invertébrés benthiques, et il existe des preuves selon lesquelles l'effet pourrait être dû à un enrichissement organique (carbone organique total élevé, Eh élevé), la détermination des rapports C/N des sédiments marins peut aider à identifier la source de la charge organique de cet écosystème.
12.12 Analyse de l'eau interstitielle des sédiments
Les sédiments lacustres fins de surface renferment ordinairement de 90 à 95 % d'eau (Adams, 1991). Une partie de cette eau est liée aux réseaux cristallins de minéraux présents dans les sédiments, mais la plus grande partie ne fait qu'occuper les interstices entre les particules sédimentaires. Cette eau est appelée eau de porosité ou eau interstitielle. L'association intime de cette eau avec les particules à la surface des sédiments aboutit à des réactions qui tendent vers l'équilibre. Le partage des contaminants entre les particules sédimentaires et la phase aqueuse dépend dans une grande mesure de la quantité de carbone organique, de la granulométrie des sédiments, de la forme chimique des contaminants et des propriétés physicochimiques du milieu (p. ex. pH, température, potentiel d'oxydoréduction, capacité de sorption et de désorption des sédiments ou équilibre entre les phases solide et liquide (Parker et Dumaresq, 2002). On ne connaît pas très bien la dynamique de ces processus; toutefois, on pense généralement que les concentrations de la plupart des substances dans l'eau de porosité tendent vers l'équilibre avec la phase solide et ses contaminants connexes, et que les métaux dans l'eau de porosité représentent en grande partie la fraction biologiquement disponible dans les sédiments (Parker et Dumaresq, 2002). C'est pourquoi on prélève de l'eau de porosité en vue d'essai de toxicité, pour se faire une idée de la toxicité relative des sédiments contaminés ou pour évaluer les concentrations des contaminants.
La nature des sédiments au site de l'étude peut influencer grandement l'utilité des mesures de l'eau interstitielle. Les sédiments d'argile compactée à grains très grossiers ou durs n'auront probablement pas d'eau interstitielle fortement contaminée (Burton et Pitt, 2002). Par conséquent, l'échantillonnage des eaux interstitielles devraient se limiter aux sédiments allant d'argile sablonneux à non compacté.
Si les sédiments sont anoxiques (la majorité des sédiments déposés se trouvent à une profondeur supérieure à 2 cm), toutes les étapes de la collecte et du traitement des échantillons devraient se dérouler dans une atmosphère inerte ou à exposition limitée afin de prévenir l'oxydation et la sorption/précipitation subséquente des espèces de métaux réduits si la spéciation des métaux est d'intérêt. Lorsque des sédiments anoxiques sont exposés à l'air, les sulfures volatiles peuvent être perdus, ce qui peut augmenter la disponibilité (et la toxicité) des métaux liés aux sulfures. Finalement, les échantillons d'eau interstitielle subissent des changements chimiques rapides, se traduisant par une durée d'entreposage variant de quelques heures à quelques jours. Un dispositif commun pour l'échantillonnage de l'eau interstitielle des sédiments est la cellule de dialyse, également connu sous le nom de « dialysis cell », également connue sous le nom de « peeper » (Doig et Liber, 2000). Les prélèvements sur le terrain à l'aide de « peepers » ou de dispositifs d'aspiration sont les méthodes les plus précises pour obtenir des échantillons représentatifs, puisqu'elles sont moins susceptibles de modifier la chimie in situ de l'eau interstitielle et elles sont recommandées pour les études géochimiques (Burton et Pitt, 2002; EPA des États-Unis, 2001). Les méthodes de laboratoire qui permettent l'extraction de plus grands volumes d'eau sont privilégiées lorsque les échantillons sont prélevés aux fins d'essais de toxicité, y compris la centrifugation, la pressurisation ou l'aspiration. L'utilisation et les avantages de « minipeepers » pour les essais en laboratoire de toxicité des sédiments sont discutés dans Doig et Liber (2002).
Pour de plus amples renseignements sur les méthodes de collecte d'eau interstitielle sur le terrain (in situ) et en laboratoire, veuillez consulter la publication d'Environnement Canada intitulé Document d'orientation sur le prélèvement et la préparation de sédiments en vue de leur caractérisation physicochimique et d'essais biologiques (SPE 1/RM/29), Environnement Canada (1994), EPA des États-Unis (2001), Doig et Liber (2002) et Burton et Pitt (2002).
Pour les essais de toxicité sur l'eau interstitielle, veuillez consulter la section 12.9.6.
>12.13 Références
Adams, D.D. 1991. Sampling Sediment Pore Water. In: Mudroch, A., MacKnight, S.D. (éd.) CRC Handbook of Techniques for Aquatic Sediments Sampling, p. 202-203. Boca Raton (FL) : CRC Press, Inc. 210 p.
Adams, W.U., Kimerle, R.A., Mosher, R.G. 1985. Aquatic Safety Assessment of Chemicals Sorbed to Sediments. In: Cardwell, R.D., Purdy, R., Bahner, R.C. (éd.) Aquatic Toxicology and Hazard Assessment. Philadelphia (PA) : American Society for Testing and Materials. p. 429-453.
Adams, W.J., Blust, R., Borgmann, U., Brix, K.V., DeForest, D.K., Green, A.S., Meyer, J.S., McGeer, J.C., Paquin, P.R., Rainbow, P.S., et al. 2011. Utility of tissue residues for predicting effects of metals on aquatic organisms. Integr. Environ. Assess. Manag. 7(1):75-98.
Alden, R.W. III. 1992. Uncertainty and Sediment Quality Assessments: I. Confidence limits for the triad. Env. Tox. Chem. 11:637-644.
Allison, J.D., Brown, D.S., Novo-Gradac, K.J. 1991. MINTEQA2/PRODEFA2, A geochemical assessment model for environmental systems: version 3.0 user’s manual. Athens (GA) : Environmental Protection Agency des États-Unis. EPA/600/3-91/021.
Aloi, J.E. 1990. A critical review of freshwater periphyton field methods. Journal canadien des sciences halieutiques et aquatiques 47(3):656-670.
Ankley, G.T., Schubauer-Berigan, M.K., Dierkes, J.R. 1991. Predicting the Toxicity of Bulk Sediments to Aquatic Organisms with Aqueous Test Fractions: Pore Water Versus Elutriate. Environ. Toxicol. Chem. 10:1359-1366.
[APHA/AWWA/WEF] American Public Health Association, American Water Works Association, Water Environment Federation. 2001. Standard Methods for the Examination of Water and Wastewater, Method 10200H (Chlorophyll).
[ASTM] American Society for Testing and Materials. 1992. E 1391-90, Standard Guide for Collection, Storage, Characterization and Manipulation of Sediments for Toxicological Testing. In: 1992 Annual Book of ASTM Standards, Vol. II.04, Section 11. Philadelphie (PA). p. 1134-1153.
[ASTM] American Society for Testing and Materials. 1997. Standard test methods for measuring the toxicity of sediment-associated contaminants with fresh water invertebrates (Annex 3, Hexagenia spp., and Annex 4, Tubifex tubifex). Vol. 11.05, Standard E1706-95b.
[ASTM] American Society for Testing and Materials. 2010. Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates. ASTM Method E 1706-05(2010).
[ATA] Atelier sur la toxicité aquatique, du 2 au 5 octobre 2011, Winnipeg (Man.), Canada.
Austin, A. 1983. Evaluation of changes in a large oligotrophic wilderness park lake exposed to mine tailings effluent for 14 years: The periphyton. Natur. Can. 110:119-134.
Austin, A. 1993. Evaluation of changes in a large oligotrophic wilderness park lake exposed to mine tailing effluent for 14 years: The periphyton. Natur. Can. 110:119-134.
Austin, A., Deniseger, J. 1985. Periphyton community changes along a heavy metal gradient in a long narrow lake. Environ. Exp. Bot. 25:41-52.
Austin, A., Deniseger, J., Clark, M.J.R. 1985. Lake algal populations and physico-chemical changes after 14 years input of metallic mining wastes. Water Res. 19:299-308.
Azim, M.E., Verdegem, M.C.J., van Dam, A.A., Beveridge, M.C.M. 2005. Periphyton. Ecology, Exploitation and Management. Cambridge (MA) : CABI Publishing.
Bandler, C., Baron, C.L., Palace, V.P. 2012. An update on the use of caged fish for Environmental Effects Monitoring. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Bedard, D., Hayton, A., Persaud, D. 1992. Ontario Ministry of Environment laboratory sediment biological testing protocol. Toronto (Ont.) : Direction des ressources en eau, Ministère de l'Environnement de l'Ontario. 26 p.
Beyers, D.W. 1998. Causal inference in environmental impact studies. J. N. Am. Benthol. Soc. 17:367-373.
Bhavsar, S.P., Gandhi, N., Diamond, M.L. 2008. Extension of coupled multispecies metal transport and speciation (TRANSPEC) model to soil. Chemosphere 70(5):914-924.
Bierman, P.R., Nichols, K.K. 2004. Rock to sediment – slope to sea with 10Be – rates of landscape change. Annual Review of Earth and Planetary Sciences 32:215-255. Palo Alto (CA) : Annual Reviews Inc.
Biggs, B.J.F., Kilroy, C. 2000. Stream Periphyton Monitoring Manual. Préparé pour le ministère de l'Environnement de la Nouvelle-Zélande par le National Institute of Water and Atmospheric Research, Christchurch (Nouvelle-Zélande).
Borgmann, U., Norwood, W.P., Babirad, I.M. 1991. Relationship between chronic toxicity and bioaccumulation of cadmium in Hyalella azteca. J. Can. Sci. Halieut. Aquat. 48:1055-1060.
Borgmann, U., Norwood, W.P. 1997a. Toxicity and accumulation of zinc and copper in Hyalella azteca exposed to metal-spiked sediments. J. Can. Sci. Halieut. Aquat. 54:1046-1054.
Borgmann, U., Norwood, W.P. 1997b. Identification of the toxic agent in metal-contaminated sediments from Manitouwadge Lake, Ontario, using toxicity-accumulation relationships in Hyalella azteca. J. Can. Sci. Halieut. Aquat. 54:1055-1063.
Borgmann, U., Norwood, W.P. 1999. Assessing the toxicity of lead in sediments to Hyalella azteca: the significance of bioaccumulation and dissolved metal. J. Can. Sci. Halieut. Aquat. 56:1494-1503.
Borgmann, U. 2000. Methods for assessing the toxicological significance of metals in aquatic ecosystems: Bioaccumulation-toxicity relationships, water concentrations, and sediment spiking approaches. Aquat. Ecosyst. Health Management 3(3):277-289.
Borgmann, U., Norwood, W.P. 1999a. Predicting the toxicity of lead in sediments to Hyalella azteca: the significance of bioaccumulation and dissolved metal. J. Can. Sci. Halieut. Aquat. 56:1494-1503.
Borgmann, U., Norwood, W.P. 1999b. Sediment toxicity testing using large water-sediment ratios: an alternative to water renewal. Environ. Poll. 106:333-339.
Borgmann, U. 2002. Toxicity test methods and observations using the freshwater amphipod, Hyalella. Burlington (Ont.), Saskatoon (Sask.) : Environnement Canada, Institut national de recherche sur les eaux (INRE). Collection de l'INRE no 02-332.
Borgmann, U., Norwood, W.P., Reynoldson, T.B., Rosa, F. 2001. Identifying cause in sediment assessments: Bioavailability and the sediment quality triad. J. Can. Sci. Halieut. Aquat. 58:950-960.
Borgmann, U., Norwood, W.P., Dixon, D.G. 2004. Re-evaluation of metal bioaccumulation and chronic toxicity in Hyalella azteca using saturation curves and the biotic ligand model. Environ. Pollut. 131(3):469-484.
Borgmann, U., Grapentine, L., Norwood, W.P., Bird, G., Dixon, D.G., Lindeman, D. 2005a. Sediment toxicity testing with the freshwater amphipod Hyalella azteca: relevance and application. Chemosphere 61(11):1740-1743.
Borgmann, U., Ingersoll, C.G., Mathyk, S., Lennie-Misgeld, P. 2005b. Draft biological test method: Test for survival in 10-day water-only exposures using the freshwater amphipod, H. azteca, with emphasis on detection of toxicity due to ammonia.
Borgmann, U., Ingersoll, C.G., Mathyk, S., Lennie-Misgeld, P. 2005c. Draft biological test method: Test for survival in 10-day water-only exposures using the freshwater amphipod, H. azteca, with emphasis on detection of toxicity due to ammonia.
Borgmann, U., Couillard, Y., Grapentine, L.C. 2007. Relative contribution of food and water to 27 metals and metalloids accumulated by caged Hyalella azteca in two rivers affected by metal mining. Environmental Pollution 145:753-765.
Bosker, T., Munkittrick, K. 2009. Often overlooked: Biological QA/QC. Integrated Environmental Assessment and Management 5(3):489-91.
Brodeur, J.C., Sherwood, G., Hontela, A. 1997. Impaired cortisol secretion in yellow perch (Perca flavescens) from lakes contaminated by heavy metals: in vivo and in vitro assessment. J. Can. Sci. Halieut. Aquat. 54:2752-2758.
Brodeur, J.C., Daniel, C., Ricard, A.C., Hontela, A.1998. In vitro response to ACTH of the interrenal tissue of rainbow trout (Oncorhynchus mykiss) exposed to cadmium. Aquat. Toxicol. 42:103-113.
Burton, G.A. Jr. (éd.) 1992. Sediment Toxicity Assessment. Chelsea (MI) : Lewis Publishers Inc. 457 p.
Burton, G.A. 1998. Assessing aquatic ecosystems using pore water and sediment chemistry. Rapport préparé pour le Programme d'évaluation des techniques de mesure d'impacts en milieu aquatique (ÉTIMA), Centre canadien de la technologie des minéraux et de l'énergie (CANMET), Ressources naturelles Canada, Ottawa (Ont.)
Burton, G.A., Pitt, R.E. 2002. Stormwater Effects Handbook. A Toolbox for Watershed Managers, Scientists, and Engineers. Boca Raton (FL) : CRC Press. 875 p.
Cairns, M.A., Nebeker, A.V., Gakstatter, J.H., Griffis, W.L. 1984. Toxicity of Copper-spiked Sediments to Freshwater Invertebrates. Environ. Toxicol. Chem. 3:435-445.
Campbell, P., Torgerson, T. 1980. Maintenance of iron meromixis by iron redeposition in a rapidly flushed monimolimnion. J. Can. Sci. Halieut. Aquat. 37(8):1303-1313.
Campbell, P.G.C. 1995. Interactions between trace metals and organisms: a critique of the free-ion activity model. In: Tessier, A., Turner, D.J. (éd.) Metal Speciation and Bioavailability in Aquatic Systems. Chichester (Royaume-Uni) : Wiley & Sons p. 45-102.
Campbell, P.G.C. 2012. Ecotoxicology of trace metals in the aquatic environment. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Campbell, P.G.C., Kraemer, L.D., Giguère, A., Hare, L., Hontela, A. 2008. Subcellular distribution of cadmium and nickel in chronically exposed wild fish: inferences regarding metal detoxification strategies and implications for setting water quality guidelines for dissolved metals. Human Ecol. Risk Assess. 14:290-316.
Campbell, P.G.C., Hare, L. 2009. Metal detoxification in freshwater animals. Roles of metallothioneins. In: Sigel, A., Sigel, H., Sigel, R.K.O. (éd.) Metallothioneins and Related Chelators. Cambridge (Royaume-Uni) : Royal Society of Chemistry. p. 239-277.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C., 1999, ch. 33.
Canfield, T.J., Kemble, N.E., Brumbaugh, W.G., Dwyer, F.J., Ingersoll, C.G., Fairchild, J.F. 1994. Use of Benthic Invertebrate Community Structure and the Sediment Quality Triad to Evaluate Metal-Contaminated Sediment in the Upper Clark Fork River, Montana. Environmental Toxicology and Chemistry 13(12):1999-2012.
Carr, R.S., Chapman, D.C. 1992. Comparison of Solid-phase and Pore-water Approaches for Assessing the Quality of Marine and Estuarine Sediments. Chem. Ecol. 7:19-30.
Cattaneo, A., Kalff, J. 1980. The relative contribution of aquatic macrophytes and their epiphytes to the production of macrophyte beds. Limnol. Oceanogr. 25:280-289.
[CCME] Conseil canadien des ministres de l'environnement. 1999. Recommandations canadiennes pour la qualité de l'environnement. Chapitre 4 : Recommandations canadiennes pour la qualité des eaux : protection de la vie aquatique. Hull (Qc) : Conseil canadien des ministres de l'environnement. Accès : http://ceqg-rcqe.ccme.ca/?lang=fr
[CCME] Conseil canadien des ministres de l'environnement. 2007. Protocole d'élaboration des recommandations pour la qualité des eaux en vue de protéger la vie aquatique. Winnipeg (Man.) : Conseil canadien des ministres de l'environnement.
Chambers, P.A., Guy, M.A., Roberts, E.S., Charlton, M.N., Kent, R., Gagnon, C., Grove, G., Foster, N. 2001. Les éléments nutritifs et leurs effets sur l'environnement au Canada. Ottawa (Ont.) : Agriculture et Agroalimentaire Canada, Environnement Canada, Pêches et Océans Canada, Santé Canada, Ressources naturelles Canada. 271 p.
Chambers, P.A., Culp, J.M., Glozier, N.E., Cash, K.J., Wrona, F.J., Norton, L. 2006. Northern Rivers Ecosystem Initiative: Nutrients and Dissolved Oxygen – issues and impacts. Environmental Monitoring and Assessment 113(1-3):117-142.
Chapman, P.M. 1992. Sediment Quality Triad Approach. US EPA Sediment Classification Methods Compendium. Washington (DC) : Office of Science and Technology. 10-1-10-18.
Chapman, P.M., Hollert, H. 2006. Should the Sediment Quality Triad become a tetrad, a pentad, or possibly even a hexad? Journal of Soils and Sediments 6(1):4-8.
Chessman, B.C. 1985. Artificial-substratum periphyton and water quality in the lower La Trobe River, Victoria. Aust. J. Mar. Freshwater. Res. 36:855-871.
Clements, W.H. 1991. Community responses of stream organisms to heavy metals: a review of observational and experimental approaches. In: Newman, M.C., McIntosh, A.W. (éd.) Metal Ecotoxicology. Concepts and applications. Chelsea (MI) : Lewis Publ. p. 363-391.
Clements, W.H. 2004. Small-scale experiments support causal relationships between metal contamination and macroinvertebrate community responses. Ecological Applications 14:954-957.
Clements, W.H., Kiffney, D.M. 1994. Integrated laboratory and field approach for assessing impacts of heavy metals at the Arkansas River, Colorado. Environ. Toxicol. Chem. 13:397-404.
Cohen, A.S. 2003. Paleolimnology: The history and Evolution of Lake Systems. New York (NY) : Oxford University Press. 509 p.
Costa, P.M., Diniz, M.S., Caeiro, S., Lobo, J., Martins, M., Ferreira, A.M., Caetano, M., Vale, C., DelValls, T.A., Costa, M.H. 2009. Histological biomarkers in liver and gills of juvenile Solea senegalensis exposed to contaminated estuarine sediments: a weighted indices approach. Aquatic Toxicology 92(3):202-212.
Couillard, Y., St-Cyr, L. 1997. Technical evaluation of metallothionein as a biomarker for the mining industry. Rapport technique préparé dans le cadre du Programme d'évaluation des techniques de mesure d'impacts en milieu aquatique (ÉTIMA). Projet de l'ÉTIMA no 2.2.1. Préparé pour Ressources naturelles Canada, Centre canadien de la technologie des minéraux et de l'énergie (CANMET). 191 p.
Couillard, Y., Giguère, A., Campbell, P.G.C., Perceval, O., Pinel-Alloul, B., Hare, L. 1999. Field evaluation of the use of metallothionein as a biomarker for metal contamination and toxic effects in the freshwater bivalve Pyganodon grandis: Subcellular metal partitioning. 20e réunion annuelle de la Society of Environmental Toxicology and Chemistry, du 14 au 18 novembre 1999, Philadelphie (PA).
Couillard, Y., Grapentine, L.C., Borgmann, U., Doyle, P., Masson, S. 2008. The amphipod Hyalella azteca as a biomonitor in field deployment studies for metal mining. Environmental Pollution 156:1314-1324.
Courtenay, L.A. 2002. Quantifying impacts of pulp mill effluent on fish in Canadian marine and estuarine environments: problems and progress. Water Qual. Res. J. Can. 37:79-99.
Courtney, L.A., Clements, W.H. 2002. Assessing the influence of water and substratum quality on benthic macroinvertebrate communities in a metal-polluted stream: an experimental approach. Freshwater Biology 47(9):1766-1779.
Crawford, J.K., Luoma, S.N. 1993. Guidelines for studies of contaminants in biological tissues for the National Water Quality Assessment Program. Denver (CO) : U.S. Geological Service. Open-File Rep. No. 92-494.
Culp, J.M. 1999. Weight-of-Evidence Assessments for Large Rivers: Linking Community Bioassays with Field and Laboratory Studies. Workshop on Integrated Approaches for Interpreting Environmental Effects Monitoring Data. DOE EEM/1999/1.
Culp, J.M., Podemski, C.L., Cash, K.J., Lowell, R.L. 1996. Utility of field-based artificial streams for assessing effluent effects on riverine ecosystems. J. Aquat. Ecosystem Health 5:117-124.
Culp, J.M., Lowell, R.B., Cash, K.J. 2000. Integrating in situ community experiments with field studies to generate weight-of-evidence risk assessments for large rivers. Environ. Toxicol. Chem. 19(4):1167-1173.
Deaver, E., Rodgers, J.H. Jr. 1996. Measuring bioavailable copper using anodic stripping voltammetry. Environ. Toxicol. Chem. 15:1925-1996.
Deutsch Forschungsgemeinshaft (German Research Council). 1998. Proposals for Safeguarding Good Scientific Practice. D-69469 Weinheim (République fédérale d'Allemagne) : Wiley-VCH Verlag GmbH. 85 p.
Di Toro, D.M. 1989. A Review of the Data Supporting the Equilibrium Partitioning Approach to Establishing Sediment Quality Criteria. Rapport présenté au National Research Council. [cité dans Baudo, 1990].
Di Toro, D.M., Allen, H.E., Bergman, H.L., Meyer, J.S., Paquin, P.R., Santore, R.C. 2000. The Biotic Ligand Model: A Computational Approach for Assessing the Ecological Effects of Metals in Aquatic Systems. Publié par l'Environmental Program de l'Association internationale pour le cuivre, dans le cadre de sa série « Copper in the Environment and Health ».
Di Toro, D.M., Allen, H.E., Bergman, H.L., Meyer, J.S., Paquin, P.R., Santore, R.C. 2001. A Biotic Ligand Model of the Acute Toxicity of Metals. I. Technical Basis. Environmental Toxicology and Chemistry 20(10):2383-2396.
Dodds, W.K. 2006. Eutrophication and trophic state in rivers and streams. Limnology and Oceanography 51(1, partie 2):671-680.
Dodds, W.K., Welch, E.B. 2000. Establishing nutrient criteria in streams. J. N. Am. Benthol. Soc. 19(1):186-196.
Doig, L., Liber, K. 2000. Dialysis minipeeper for measuring pore-water metal concentrations in laboratory sediment toxicity and bioavailability tests. Environmental Toxicology and Chemistry 19(12):2882-2889.
Ekberg, C., Ödegaard-Jensen, A. 2011. Uncertainties in chemical modelling of solubility, speciation and sorption. Accreditation and Quality Assurance 16(4/5):207-214. Heidelberg (Allemagne) : Springer Berlin.
Environnement Canada. 1990 [modifié en 1996]. Méthode d’essai biologique : essai de létalité aiguë sur Daphnia spp. Série de la Protection de l'environnement, Rapport SPE 1/RM/11. Ottawa (Ont.) 59 p.
Environnement Canada. 1992. Méthode d'essai biologique : Essai sur la fécondation chez les échinides (oursins globuleux et oursins plats). Série de la Protection de l'environnement, Rapport SPE
1/RM/27. Ottawa (Ont.) 124 p.
Environnement Canada. 1994. LINK MISSINGDocument d'orientation sur le prélèvement et la préparation de sédiments en vue de leur caractérisation physicochimique et d'essais biologiques. Série de la Protection de l'environnement, Rapport SPE 1/RM/29. Ottawa (Ont.)
Environnement Canada. 1996. Méthode d'essai biologique : essai de létalité aiguë sur Daphnia spp. Série de la Protection de l'environnement, Rapport SPE 1/RM/11 (avec les modifications de mai 1996). Ottawa (Ont.) 78 p.
Environnement Canada. 1997a. Méthode d’essai biologique : essai de survie et de croissance de l'amphipode dulcicole Hyalella azteca. Série de la Protection de l'environnement, Rapport SPE 1/RM/33. Ottawa (Ont.) 122 p.
Environnement Canada. 1997b. Méthode d'essai biologique. Essai de survie et de croissance des larves dulcicoles chironomes (Chironomus tentans ou Chironomus riparius) dans les sédiments. Série de la Protection de l'environnement, Rapport SPE 1/RM/32. Ottawa (Ont.) 133 p.
Environnement Canada. 2007. Critères et directives pour la détermination de l'eutrophisation prononcée. Bureau national des études de suivi des effets sur l'environnement, Environnement Canada.
Environnement Canada. 2010. Guide technique pour l'Étude de suivi des effets sur l'environnement (ESEE) des pâtes et papiers – Chapitre 11 : Recherche des causes et des solutions. Environnement Canada. 40 p.
Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc), Canada. ISBN: 978-1-100-19968-9.
Environnement Canada. 2012. Second National Assessment of Environmental Effects Monitoring Data From Metal Mines subjected to the Metal Mining Effluent Regulations. Environnement Canada. 66 p.
[ESG] ESG International Inc. 1999. AETE Synthesis Report of Selected Technologies for Cost-Effective Environmental Monitoring of Mine Effluent Impacts in Canada. Projet de l'ÉTIMA no 4.1.4. Mars 1999. Ottawa (Ont.) : Centre canadien de la technologie des minéraux et de l'énergie (CANMET), Ressources naturelles Canada.
[ÉTIMA] Programme d'évaluation des techniques de mesure d'impacts en milieu aquatique. 1997. Technical Evaluation of Monitoring Methods using Macrophytes, Phytoplankton, and Periphyton to Assess the Impacts of Mine Effluents on the Aquatic Environment. Projet de l'ÉTIMA no 2.3.2.
EVS Environmental Consultants. 1997. Technical evaluation: water quality and biological effects. Rapport préparé pour le Programme d'évaluation des techniques de mesure d'impacts en milieu aquatique (ÉTIMA), Centre canadien de la technologie des minéraux et de l'énergie (CANMET), Ressources naturelles Canada, Ottawa (Ont.)
Fåhræus-van Ree, G.E., Payne, J.F. 2005. Endocrine disruption in the pituitary of white sucker (Catostomus commersoni) caged in a lake contaminated with iron-ore mine tailings. Hydrobiologia 532:221-224.
Farley, K.J., Rader, K.J., Miller, B.E. 2008. Tableau Input Coupled Kinetic Equilibrium Transport (TICKET) Model. Environmental Science & Technology 42(3):838-847.
Fox, G.A. 1991. Practical causal inference for ecoepidemiologists. J. Toxicol. Environ. Health 33:359-379.
Frey, D.G. 1998. What is paleolimnology? J. Paleolimnology 1:5-8.
Gibbons, W.N., Munkittrick, K.R. 1994. A sentinel monitoring framework for identifying fish population responses to industrial discharges. J. Aquat. Eco. Health 3:227-237.
Giesy, J.P., Hoke, R.A. 1990. Freshwater Sediment Quality Criteria: Toxicity Bioassessment. In: Baudo, R., Giesy, J.P., Muntau, H. (éd.) Sediments: Chemistry and Toxicity of In-place Pollutants, p. 265-348. Chelsea (MI) : Lewis Publishers, Inc. 405 p.
Giguère, A., Couillard, Y., Perceval, O., Campbell, P.G.C., Pellerin-Massicotte, J., Pinel-Alloul, B. 1999. Field evaluation of the use of metallothionein as a biomarker for metal contamination and toxic effects in the freshwater bivalve Pyganodon grandis: Responses at the organism level. 20e réunion annuelle de la Society of Environmental Toxicology and Chemistry, du 14 au 18 novembre 1999, Philadelphie (PA).
Gilbertson, M. 1997. Advances in forensic toxicology for establishing causality between Great Lakes epizootics and specific persistent toxic chemicals. Environ. Toxicol. Chem. 16:1771-1778.
Gillis, P.L., Dixon, D.G., Reynoldson, T.B., Diener, L.C. 1999. Metallothionein as a biomarker for trace metal exposure and effects in Tubifex tubifex and Chironomus riparius. 20e réunion annuelle de la Society of Environmental Toxicology and Chemistry, du 14 au 18 novembre 1999, Philadelphie (PA).
Grapentine, L.C. 2012. In situ measurements of toxicity and contaminant bioaccumulation with caged amphipods exposed to water and sediment for Investigation of Cause in metal mining Environmental Effects Monitoring studies. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Gustafson, J.P. 2004. Visual MINTEQ, version 2.30 [version Windows de MINTEQA2, version 4.0].
Håkanson, L., Jansson, M. 1983. Principles of Lake Sedimentology. Berlin (Allemagne) : Springer-Verlag. 316 p.
Hall, G.E.M. 1998. Cost-effective protocols for the collection, filtration and preservation of surface waters for detection of metals and metalloids at ppb ad ppt levels. Rapport préparé pour le Programme d'évaluation des techniques de mesure d'impacts en milieu aquatique (ÉTIMA), Centre canadien de la technologie des minéraux et de l'énergie (CANMET), Ressources naturelles Canada, Ottawa (Ont.)
Hargrave, B.T., Phillips, G.A., Doucette, L.I., White, M.J., Milligan, T.G., Wildish, D.J., Cranston, R.E. 1995. Biogeochemical observations to assess benthic impacts of organic enrichment from marine aquaculture in the Western Isles region of the Bay of Fundy. Rapp. tech. can. sci. halieut. aquat. 2062. 159 p.
Harkey, G.A., Landrum, P.F., Kaine, S.J. 1994. Comparison of Whole-sediment, Elutriate and Pore-water Exposures for Use in Assessing Sediment-associated Organic Contaminants in Bioassays. Environ. Toxicol. Chem. 13(8):1315-1329.
Haslam, S.M. 1982. A proposed method for monitoring river pollution using macrophytes. Environ. Technol. Letters 3:19-34.
Hellawell, J.M. 1986. Biological indicators of freshwater pollution and environmental management. Londres (Royaume-Uni) : Elsevier Applied Science Publishers. 546 p.
Henderson-Sellers, B., French, R.H. 1991. Water Quality Modelling Volume IV:
Decision Support Techniques for Lakes and Reservoirs. Boca Raton (FL) : CRC Press.
Henry, C.J., Higgins, K.F., Buhl, K.J. 1994. Acute toxicity and hazard assessment of Rodeo®, X-77 Spreader®, and Chem-Trol® to aquatic invertebrates. Arch. Environ. Contam. Toxicol. 27:392-399.
Herbelin, A.L., Westall, J.C. 1999. FITEQL, A Computer Program for Determination of Chemical Equilibrium Constants from Experimental Data. Report 99-01, version 4.0. Corvallis (OR) : Oregon State University.
Hewitt, M.L., Servos, M.R. 2001. An Overview of Substances Present in Canadian Aquatic Environments Associated with Endocrine Disruption. Water Qual. Res. J. Canada 36(2):191-213.
Hewitt, M.L., Dube, M.G., Culp, J.M., MacLatchy, D.L., Munkittrick, K.R. 2003. A proposed framework for investigation of cause for environmental effects monitoring. Human and Ecological Risk Assessment 9(1):195-211.
Hinton, D.E., David, E., Darrel, J.L., Adams, S.M. 1990. Integrative histopathological approaches to detecting effects of environmental stressors on fishes. American Fisheries Society Symposium: Biological indicators of stress in fish 8:51-66. FR 36(1).
Hinton, D.E., Kullman, S.W., Bencic, D.C., Hardman, R.C., Chen, P.J., Carney, M., Volz, D.C. 2005. Resolving mechanisms of toxicity while pursuing ecotoxicological relevance. Marine Pollution Bull. 51:635-648.
Hodson, P.V. 1990. Indicators of ecosystem health at the species level and the example of selenium affects on fish. Environmental Monitoring and Assessment 15(3):241-255.
Holm, J., Palace, V.P., Siwik, P., Sterling, G., Evans, R.E., Baron, C.L., Werner, J., Wautier, K. 2005. Developmental effects of bioaccumulated selenium in eggs and larvae of two salmonid species. Environ. Toxicol. Chem. 24:2373-2381.
Hontela, A., Ramussen, J.B., Audet, C., Chevalier, G. 1992. Impaired cortisol stress response in fish from environments polluted by PAHs, PCB, and mercury. Arch. Environ. Contam. Toxicol. 22:278-283.
Ingersoll, C.G., Ivey, C.D., Brunson, E.L., Hardesty, D.K., Kemble, N.E. 2000. Evaluation of toxicity: Whole-sediment versus overlying-water exposures with amphipod H. azteca. Environmental Toxicology and Chemistry 19:2906-2910.
Centre international de recherche sur le cancer. 2008. Code of Good Scientific Practice. Genève (Suisse) : Organisation mondiale de la santé. 11 p.
Kelly, M. 1988. Mining and the freshwater environment. Londres (Royaume-Uni) : Elsevier Applied Science. 231 p.
Knezovich, J.P., Harrison, F.L. 1987. The Bioavailability of Sediment-sorbed Organic Chemicals: A Review. Water Air Soil Pollut. 32:233-245.
Knezovich, J.P., Harrison, F.L. 1988. The Bioavailability of Sediment-sorbed Chlorobenzenes to Larvae of the Midge, Chironomous decorus. Ecotoxicol. Environ. Safety 15:226-241.
Kutka, F.J., Richards, C. 1996. Relating diatom assemblage structure to stream habitat quality. J. N. Am. Benthol. Soc. 15:469-480.
Laflamme, J.S., Couillard, Y., Campbell, P.G.C., Hontela, A. 1998. Impaired physiological response to stress and high levels of metallothionein in perch (Perca flavescens) from lakes contaminated by heavy metals. 25e atelier annuel sur la toxicité aquatique, du 18 au 21 octobre 1998, à Québec (Qc).
Langmuir, D., Chrostowski, P., Vigneault, B., Chaney, R. Issue Paper on the Environmental Chemistry of Metals. Présenté au Risk Assessment Forum de l'Environmental Protection Agency des États-Unis. Présenté par ERG, 110, Hartwell Avenue, Lexington (MA).
Ledo, H., Rivas, Z., Gutierrez, J., Gutierrez, E., Ojeda, J., Avila, H. 2004. Baseline of Ca, Mg, Fe, Mn, and Al concentrations in Catatumbo River Surficial sediments. Water, Air, and Soil Pollution 155:117-135.
Liber, D., Liber, K. 2000. Dialysis minipeeper for measuring pore-water metal concentrations in laboratory sediment toxicity and bioavailability tests. Environ. Toxicol. Chem. 19(1):2882-2889.
Liber, K., Doig, L.E., White-Sobey, S.L. 2011. Toxicity of uranium, molybdenum, nickel, and arsenic to Hyalella azteca and Chrionomus dilutus in water-only and spiked-sediment toxicity tests. Ecotox. Environ. Saf. 74:1171-1179.
Lowe, R.L., Pank, Y. 1996. Benthic algal communities as biological monitors. In: Stevenson, R.J., Bothwell, M.L., Lowe, R.L. (éd.) Algal ecology. Freshwater benthic ecosystem. San Diego (CA) : Academic Press.
Lowell, R.B., Culp, J.M., Dube, M.G. 2000. A weight-of evidence approach for northern river risk assessment: integrating the effects of multiple stressors. Environ. Toxicol. Chem. 19(4):1182-1190.
Lowell, R.B., Tessier, C., Walker, S.L., Willsie, A., Bowerman, M., Gautron, D. 2007. Évaluation nationale des données de la phase 1 du Programme d'étude de suivi des effets sur l'environnement des mines de métaux. Gatineau (Qc) : Bureau national des études de suivi des effets sur l'environnement, Environnement Canada. 45 p.
Luoma, S.N., Rainbow, P.S. 2008. Metal contamination in aquatic environments: science and lateral management. Cambridge (Royaume-Uni) : Cambridge University Press.
Mabit, L., Benmansour, M., Walling, D.E. 2008. Comparative advantages and limitations of the fallout radionuclides 137Cs, 210Pbex and 7Be for assessing soil erosion and sedimentation. Journal of Environmental Radioactivity 99(12):1799-1807.
Martel, P.H., Kovacs, T.G., O’Connor, B.L., Voss, R.H. 1997. Source and identity of compounds in a thermomechanical pulp mill effluent inducing hepatic mixed-function oxidase activity in fish. Environ Toxicol. Chem. 16:2375-2383.
McCutcheon, S.C., French, R.H. 1989. Water Quality Modelling Volume I: Transport
and Surface Exchange in Rivers. Boca Raton (FL) : CRC Press.
McGeer, J.C., Playle, R.C., Wood, C.M., Galvez, F. 2000. A Physiologically Based Biotic Ligand Model for Predicting the Acute Toxicity of Waterborne Silver to Rainbow Trout in Freshwaters. Environmental Science and Technology 34:4199-4207.
McGeer, J., Henningsen, G., Lanno, R., Fisher, N., Sappington, K., Drexler, J. 2004. Issue paper on the bioavailability and bioaccumulation of metals.
McGeer, J.C., Clifford, M., Janssen, C.R., De Schamphelaere, K.A.C. 2010. Modeling the toxicity of metals to aquatic biota using the biotic ligand approach. In: Bury, N.R., Handy, R.D. (éd.) Essential Reviews in Experimental Biology Vol. 2. Surface Chemistry, Bioavailability and Metal Homeostasis in Aquatic Organisms: an Integrated Approach. Londres (Royaume-Uni) : SEB Press. p. 205-231.
McGeer, J., Clifford, M., Ng, T., Wood, C. 2012. Using bioaccumulation models for predicting dissolved metal toxicity. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Meador, J., Parkerton, T., McElroy, A. 2011. Tissue residue approach to toxicity assessment: A step forward. Society of Environmental Toxicology and Chemistry.
Meyer, J.S., Santore, R.C., Bobbitt, J.P., DeBrey, L.D., Boese, C.J., Paquin, P.R., Allen, H.E., Bergman, H.L., Di Toro, D.M. 1999. Binding of nickel and copper to fish gills predicts toxicity but free ion activity does not. Environ. Sci. Tech. 33:913-916.
Muir, D.C.G., Kenny, D.F., Grift, N., Robinson, R.D., Titman, R.D., Murkin, H.R. 1991. Fate and acute toxicity of bromoxynil esters in an experimental prairie wetland. Environ. Toxicol. Chem. 10:395-406.
Mulliss, R.M., Revitt, D.M., Shutes, R.B.E. 1996. A statistical approach for the assessment of the toxic influences on Gammarus pulex (Amphipoda) and Asellus aquaticus (Isopoda) exposed to urban discharges. Wat. Res. 30:1237-1243.
Munkittrick, K.R., Portt, C.B., Van Der Kraak, G.J., Smith, I.R., Rokosh, D.A. 1991. Impact of bleached kraft mill effluent on population characteristics, liver MFO activity, and serum steroid levels of a Lake Superior white sucker (Catostomus commersoni) population. J. Can. Sci. Halieut. Aquat. 48:1371-1380.
Munkittrick, K.R., Van Der Kraak, G.J., McMaster, M.E., Portt, C.B., van den Heuvel, M.R., Servos, M.R. 1994. Survey of receiving-water environmental impacts associated with discharges from pulp mills. 2. Gonad size, liver size, hepatic EROD activity and plasma sex steroid levels in white sucker. Environ. Toxicol. Chem. 13:1089-1101.
Munkittrick, K.R., McMaster, M.E., Van Der Kraak, G., Portt, C., Gibbons, W.N., Farwell, A., Gray, M. 2000. Development of Methods for Effects-Driven Cumulative Effects Assessment Using Fish Populations: Moose River Project. Pensacola (FL) : The Society of Environmental Toxicology and Chemistry. 236 p.
Nebeker, A.V., Cairns, M.A., Gakstatter, J.H., Malueg, K.W., Schuytema, G.S., Krawczyk, D.R. 1984. Biological Methods for Determining Toxicity of Contaminated Freshwater Sediments to Invertebrates. Environ. Toxicol. Chem. 3:617-630.
Niyogi, S., Wood, C.M. 2004. The Biotic Ligand Model, a flexible tool for developing site-specific water quality guidelines for metals. Environ. Sci. Technol. 38(23):6177-6192.
North American Metals Council. 2008. Selenium Tissue Thresholds: Tissue Selection Criteria, Threshold Development Endpoints, and Potential to Predict Population or Community Effects in the Field. 178 p.
Norwood, W.P., Borgmann, U., Dixon, D.G. 2007. Chronic toxicity of arsenic, cobalt, chromium and manganese to Hyalella azteca in relation to exposure and bioaccumulation. Environmental Pollution 147:262-272.
Novak, L.J., Holtze, L.E. 2012. Toxicity Reduction Evaluations (TREs) as a Tool for Investigation of Cause – Mining Case Studies. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Nowierski, M., Dixon, D.G., Borgmann, U. 2005. Effects of water chemistry on the bioavailability of metals in sediment to Hyalella azteca: Implications for sediment quality guidelines. Arch. Environ. Contam. Toxicol. 49:322-332.
[OCDE] Organisation de coopération et de développement économiques, Forum mondial de la science. 2007. Best Practices for Ensuring Scientific Integrity and Preventing Misconduct. Paris (FR) : Organisation de coopération et de développement économiques. 13 p.
Ontario. Ministère de l'Environnement et de l'Énergie. 1997. Sediment and biological assessment of Canagaigue Creek at the Uniroyal Chemical Ltd. Plant, Elmira, Ontario. 1995-1996. Ministère de l'Environnement et de l'Énergie. 37 p. + annexes.
Palace, V.P., Doebel, C., Baron, C.L., Evans, R.E., Wauiter, K.G., Klaverkamp, J.F., Werner, J., Kollar, S. 2005. Caging small bodied fish as an alternative method for environmental effects monitoring (EEM). Can. Wat. Qual. Res. J. 40:328-333.
Palace, V.P. 2012. Investigating Selenium Toxicity Using an Environmental Effects Monitoring Approach. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Paquin, P.R., Di Toro, D.M., Santore, R.C., Trivedi, D., Wu, K.B. 1999. A Biotic Ligand Model of the Acute Toxicity of Metals. III. Application to Fish and Daphnia Exposure to Silver. Section 3, in: Integrated Approach to Assessing the Bioavailability and Toxicity of Metals in Surface Waters and Sediments, a submission to the EPA Science Advisory Board. Washington (DC) : Office of Water, Office of Research and Development. US EPA-822-E-99-001. p. 3-59 à 3-102.
Paquin, P.R., Gorsuch, J.W., Apte, S., Batley, G.E., Bowles, K.C., Campbell, P.G.C., Delos, C.G., Di Toro, D.M., Dwyer, R.L., Galvez, F., et al. 2002a. The Biotic Ligand Model: A Historical Overview, Special Issue: The Biotic Ligand Model for Metals – Current Research, Future Directions, Regulatory Implications. Comparative Biochemistry and Physiology C 133(1-2):3-35.
Paquin, P.R., Zoltay, V., Winfield, R.P., Wu, K.B., Mathew, R., Santore, R., Di Toro, D.M. 2002b. Extension of the Biotic Ligand Model of Acute Toxicity to a Physiologically-based Model of the Survival Time of Rainbow Trout (Oncorhynchus mykiss) Exposed to Silver, Special Issue: The Biotic Ligand Model for Metals – Current Research, Future Directions, Regulatory Implications. Comparative Biochemistry and Physiology C 133(1-2):305-343.
Parker, R., Dumaresq, C. 2002. Effluent characterization, water quality monitoring, and sediment monitoring in the metal mining EEM program. Water Qual. Res. J. Canada 37(1):219-228.
Parkhurst, D.L., Appelo, C.A. 2000. User's guide to PHREEQC (Version 2) – A computer program for speciation, hatch-reaction, one-dimensional transport, and inverse geochemical calculations. U.S. Geological Survey, Water-Resources Investigations Report 99-4259. 112 p.
Parrott, J.L. 2005. Overview of methodology and endpoints in fathead minnow lifecycle tests assessing pulp mill effluents. Water Qual. Res. J. Can. 40(3):334-346.
Parrott, J.L., Bennie, D.T. 2009. Lifecycle exposure of Fathead minnows to a mixture of six common pharmaceuticals and triclosan. J. Toxicol. Environ. Health B 9:297-317.
Parrott, J.P., Hewitt, L.M., McMaster, M.E. 2012. Fathead Minnow Lifecycle Assays for Assessment of Complex Effluents. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Patrick, W.H. Jr, Gambrell, R.P., Khalid, R.A. 1977. Physicochemical Factors Regulating Solubility and Bioavailability of Toxic Heavy Metals in Contaminated Dredged Sediment. J. Environ. Sci. Health A 12:475-492.
Pearson, T.H., Rosenberg, R. 1978. Macrobenthic succession in relation to organic enrichment and pollution of the marine environment. Oceanography and Marine Biology Annual Review 163:229-311.
Peplow, D., Edmonds, R. 2005. The effects of mine waste contamination at multiple levels of biological organization. Ecological Engineering 24(1/2):101-119.
Perceval, O., Couillard, Y., Giguère, A., Pinel-Alloul, B., Campbell, P.G.C. 1999. Field evaluation of the use of metallothionein as a biomarker for metal contamination and toxic effects in the freshwater bivalve Pyganodon grandis: Responses at the population level. 20e réunion annuelle de la Society of Environmental Toxicology and Chemistry, du 14 au 18 novembre 1999, Philadelphie (PA).
Pereira, P., de Pablo, H., Vale, C., Rosa-Santos, F., Cesário, R. 2009. Metal and nutrient dynamics in a eutrophic coastal lagoon (Óbidos, Portugal): the importance of observations at different time scales. Environ. Monit. Assess. 158:405-418.
Phillips, D.J.H., Rainbow, P.S. 1993. Biomonitoring of trace aquatic contaminants. Londres (Royaume-Uni) : Elsevier Applied Science Publishers.
Pierron, F., Bourret, V., St-Cyr, J., Campbell, P.G.C., Bernatchez, L., Couture, P. 2009. Transcriptional responses to environmental metal exposure in wild yellow perch (Perca flavescens) collected in lakes with differing environmental metal concentrations (Cd, Cu, Ni). Ecotoxicol. 18:620-631.
Pinel-Alloul, B., Campbell, P.G.C., Hare, L., Couillard, Y., Giguère, A., Perceval, O. 1999. Field evaluation of the use of metallothionein as a biomarker for metal contamination and toxic effects in the freshwater bivalve Pyganodon grandis: Overview. 20e réunion annuelle de la Society of Environmental Toxicology and Chemistry, du 14 au 18 novembre 1999, Philadelphie (PA).
Pollard, A.I., Yuan, L. 2006. Community response patterns: evaluating benthic invertebrate composition in metal-polluted streams. Ecological Applications 16(2):645-655.
Rickwood, C.J., Dubé, M.G., Hewitt, M., Kovacs, T.G., MacLatchy, D.L. 2006. Use of paired fathead minnow (Pimephales promelas) reproductive test. Part 2: Source identification of biological effects at a bleached kraft pulp mill. Env. Toxicol. Chem. 25:1847-1856.
Ridal, J.J., Yanch, L.E., Fowlie, A.R., Razavi, N.R., Delongchamp, T.M., Choy, E.S., Fathi, M., Hodson, P.V., Campbell, L., Blais, J.M., et al. 2010. Potential causes of enhanced transfer of mercury to St. Lawrence River Biota: implications for sediment management strategies at Cornwall, Ontario, Canada. Hydrobiologia 2010:81-98.
Ridley-Thomas, C.I., Austin, A., Lucey, W.P., Clark, M.J.R. 1989. Variability in the determination of ash free dry weight for periphyton communities: a call for a standard method. Water Research 23(6):667-670.
Ritchie, J.C., McHenry, J.R. 1990. Application of radioactive fallout cesium-137 for measuring soil erosion and sediment accumulation rates and patterns: a review. Journal of Environmental Quality 19(2):215-233.
Roch, M., Nordin, R.N., Austin, A., McKean, C.J.P., Deniseger, J., Kathman, R.D., McCarter, J.A., Clark, M.J.R. 1985. The effects of heavy metal contamination on the aquatic biota of Buttle Lake and the Cambpell River drainage (Canada). Arch. Environ. Contam. Toxicol. 14:347-362.
Sánchez España, J., López Pamo, E., Santofimia Pastor, E., Diez Ercilla, M. 2008. The acidic mine pit lakes of the Iberian Pyrite Belt: an approach to their physical limnology and hydrogeochemistry. Applied Geochemistry 23(5):1260-1287.
Santore, R.C., McGrath, J., Brix, K., Paquin, P.R., Di Toro, D.M. 1998. Use of a biotic ligand model to calculate site-specific water effect ratios for metals. Conférence annuelle de 1998 de la Society of Environmental Toxicology and Chemistry, Charlotte (NC).
Santore, R.C., Di Toro, D.M., Paquin, P.R., Allen, H.E., Meyer, J.S. 2001. A Biotic Ligand Model of the Acute Toxicity of Metals. II. Application to Acute Copper Toxicity in Freshwater Fish and Daphnia. Environmental Toxicology and Chemistry 20(10):2397-2402.
Santore, R.C., Mathew, R., Paquin, P.R., Di Toro, D.M. 2002. Development of a Biotic Ligand Model of Acute Toxicity for Zinc, Special Issue: The Biotic Ligand Model for Metals – Current Research, Future Directions, Regulatory Implications. Comparative Biochemistry and Physiology C 133(1-2):271-285.
Sappington, K.G., Bridges, T.S., Bradbury, S.P., Erickson, R.J., Hendriks, A.J., Lanno, R.P., Meador, J.P., Mount, D.R., Salazar, M.H., Spry, D.J. 2011. Application of the tissue residue approach in ecological risk assessment. Integrated Environmental Assessment and Management 7(1):116-140 (Special Issue: Tissue Residue Approach Special Series).
Schecher, W.D., McAvoy, D.C. 1992. MINEQL+: a software environment for chemical equilibrium modelling. Comput. Environ. Urban Systems 16:65-76.
Schecher, W.D., McAvoy, D.C. 1994. MINEQL+: A Chemical Equilibrium Program for Personal Computers (Version 3.01). Hallowell (ME) : Environmental Research Software. 107 p.
Schuytema, G.S., Nelson, P.O., Malueg, K.W., Nebeker, A.V., Krawczyk, D.F., Ratcliff, A.K., Gakstatter, J.H. 1984. Toxicity of Cadmium in Water and Sediment to Daphnia magna. Environ. Toxicol. Chem. 3:293-308.
[SETAC] Society of Environmental Toxicology and Chemistry. 1999. SETAC Technical Issue Paper. Sound Science. Pensacola (FL) : Society of Environmental Toxicology and Chemistry.
Shaner, S.W., Knight, A.W. 1985. The Role of Alkalinity in the Mortality of Daphnia magna in Bioassays of Sediment-bound Copper. Comp. Biochem. Physiol. 82C:273-277.
Sharpe, R.L., Machtans, H., Crowe, J., Smith, P., Patrick, H., Chapman, P.M., Connell, R., Daniels, E. 2012. Con Mine: Investigation of Cause Study on fish livers – Challenges to designing a new Investigation of Cause study. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Shifrin, N.S., Beck, B.D., Gauthier, T.D., Chapnick, S.D., Goodman, G. 1996. Chemistry, toxicology and human health risk of cyanide compounds in soils at former manufactured gas plant sites. Regul. Toxicol. Pharmacol. 23:106-116.
Shobanov, N.A., Kiknadze, I.I., Butler, M.G. 1999. Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera, Chironomidae). Ent. Scand. 30:311-322.
Shuhaimi-Othman, M., Pascoe, D., Borgmann, U., Norwood, W.P. 2006. Reduced metals concentrations of water, sediment and Hyalella azteca from lakes in the vicinity of the Sudbury metal smelters, Ontario, Canada. Environmental Monitoring and Assessment 117(1/3):27-44.
Small, A.M., Adey, W.H., Lutz, S.M., Reese, E.G., Roberts, D.L. 1996. A macrophyte-based rapid biosurvey of stream water quality: restoration at the watershed scale. Restoration Ecol. 4:124-145.
Sortkjaer, O. 1984. Macrophytes and macrophyte communities as test systems in ecotoxicological studies of aquatic systems. Ecol. Bull. 36:75-80.
St. Cyr, L., Campbell, P.G.C. 2000. Bioavailability of sediment-bound metals for Vallisneria americana Michx, a submerged aquatic plant, in the St. Lawrence River. Journal canadien des sciences halieutiques et aquatiques 57:1330-1341.
Stumm, W., Morgan, J.J. 1996. Aquatic chemistry: chemical equilibria and rates in natural waters. 3e éd. New York (NY) : Wiley Interscience.
Suter, G.W. II. 1993. Ecological Risk Assessment. Boca Raton (FL) : Lewis Publishers.
Szarek-Gwiazda, E., Zurik, R. 2006. Distribution of Trace Elements in Meromictic Pit Lake. Water, Air & Soil Pollution 174(1-4):181-196.
Taylor, L.N., McFarlane, W.J., Pyle, G.G., Couture, P., McDonald, D.G. 2004. Use of performance indicators in evaluating chronic metal exposure in wild yellow perch (Perca flavescens). Aquatic Toxicology 67:371-385.
Taylor, L.N., Novak, K., Holtze, K., Ali, N., Scroggins, R. 2012. Separating current effluent quality from historical contamination using a laboratory based monitoring tool for investigation of cause. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Tessier, A., Couillard, Y., Cambpell, P.G.C., Auclair, J.C.A. 1993. Modeling of Cd partitioning in oxic lake sediments and Cd concentrations in the freshwater bivalve Anodonta grandis. Limnol. Oceanogr. 38:1-17.
Tessier, A., Turner, D.R (éd.) 1995. Metal speciation and bioavailability in aquatic systems. Chichester (Royaume-Uni) : John Wiley and Sons Ltd.
Thomann, R.T., Mueller, J.A. 1987. Principles of Surface Water Quality Modelling and
Control. New York (NY) : Harper Collins Publishers Inc.
Thomas, G.P. 2012. Use and application of Benthic Transplant Devices (BTDs). In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Tipping, E. 1998. Humic ion-binding Model VI: an improved description of the interactions of protons and metal ions with humic substances. Aq. Geochem. 4:3-48.
Unsworth, E.R., Warnken, K.W., Zhang, H., Davison, W., Black, F., Buffle, J., Cao, J., Cleven, R., Galceran, J., Gunkel, P., et al. 2006. Model predictions of metal speciation in freshwaters compared to measurements by in situ techniques. Environmental Science & Technology 40(6):1942-1949.
[USEPA] Environmental Protection Agency des États-Unis. 1989. Generalized methodology for conducting industrial toxicity reduction evaluations. EPA-600/2-88/070.
[USEPA] Environmental Protection Agency des États-Unis. 1991a. Methods for aquatic toxicity identification evaluations: Phase I toxicity characterization procedures. EPA-600/6-91/003.
[USEPA] Environmental Protection Agency des États-Unis. 1991b. Toxicity identification evaluation: characterization of chronically toxic effluents, Phase I. EPA-600/6-91/005.
[USEPA] Environmental Protection Agency des États-Unis. 1991c. Sediment toxicity identification evaluation: Phase I (Characterization), Phase II (Identification) and Phase III (Confirmation) modifications of effluent procedures. EPA-600/6-91/007.
[USEPA] Environmental Protection Agency des États-Unis. 1993a. Methods for aquatic toxicity identification evaluations: Phase II toxicity identification procedures for samples exhibiting acute and chronic toxicity. EPA-600/R-92/080.
[USEPA] Environmental Protection Agency des États-Unis. 1993b. Methods for aquatic toxicity identification evaluations: Phase III toxicity confirmation procedures for samples exhibiting acute and chronic toxicity. EPA-600/R-92/081.
[USEPA] Environmental Protection Agency des États-Unis. 1996. Marine toxicity identification evaluation (TIE): Phase I guidance document. Duluth (MN) : Environmental Research Laboratory. EPA/600/R-96/054.
[USEPA] Environmental Protection Agency des États-Unis. 1997. Sediment Toxicity Evaluation (TIE) Phases I, II, and III, Guidance Document. EPA/600/R-07/080.
[USEPA] Environmental Protection Agency des États-Unis. 2001. Methods for Collection, Storage and Manipulation of Sediments for Chemical and Toxicological Analyses: Technical Manual. EPA-823-B-01-002.
[USEPA] Environmental Protection Agency des États-Unis. 2003. Biotic Ligand Model: Technical Support Document for its Application to the Evaluation of Water Quality Criteria for Copper. Washington (DC) : Office of Science and Technology, Health and Ecological Criteria Division. EPA Number 822R03027.
[USEPA] Environmental Protection Agency des États-Unis. 2004. Draft Aquatic Life Water Quality Criteria for Selenium – 2004. EPA-822-D-04-001. Washington (DC) : Office of Water.
[USEPA] Environmental Protection Agency des États-Unis. 2007. Framework for Metals Risk Assessment. Washington (DC) : Office of the Science Advisor, Risk Assessment Forum. EPA/120/R-07/001.
van de Guchte, C., Maas-Diepeveen, J.L. 1988. Screening Sediments for Toxicity: A Water-concentration Related Problem. In: Proceedings of the 14th Annual Aquatic Toxicity Workshop, du 1er au 4 novembre 1987, Toronto (Ont.) Rapp. tech. can. sci. halieut. aquat. 1607:81-91.
Van Geest, J.L., Poirier, D.G., Solomon, K.R., Sibley, P.K. 2011. A comparison of the bioaccumulation potential of three freshwater organisms exposed to sediment-associated contaminants under laboratory conditions. Environ. Toxicol. Chem. 30:939-949.
Van Geest, J.L., Poirier, D.G., Sibley, P.K., Solomon, K.R. 2011. Validation of Ontario's new laboratory-based bioaccumulation methods with in situ field data. Environ. Toxicol. Chem. 30:950-958.
van Wijngaarden, R.P.A., van den Brink, P.J., Crum, S.J.H., Voshaar, J.H.O., Brock, T.C.M., Leeuwangh, P. 1996. Effects of the insecticide Dursban® 4E (active ingredient chlorpyrifos) in outdoor experimental ditches: I. Comparison of short-term toxicity between the laboratory and the field. Environ. Toxicol. Chem. 15:1133-1142.
Vigneault, B., Desforges, M., McGeer, J. 2012. Mining Reagents and By-Products (e.g. Thiosalts) As Potential Toxicants in Mine Effluents. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Vijver, M.G., Van Gestel, C.A.M., Lanno, R.P., Van Straalen, N.M., Peijnenburg, W.J.G.M. 2004. Internal metal sequestration and its ecotoxicological relevance: a review. Environ. Sci. Technol. 38:4705-4712.
Vink, J.P.M., Meeussen, J.C.L. 2007. BIOCHEM-ORCHESTRA: a tool for evaluating chemical speciation and ecotoxicological impacts of heavy metals on river flood plain systems. Environmental Pollution 148(3):833-841.
Walker, P.A., Kille, P., Hurley, A., Bury, N.R., Hogstrand, C. 2008. An in vitro method to assess toxicity of waterborne metals to fish. Toxicol. Appl. Pharmacol. 230:67-77.
Wang, D., Couillard, Y., Campbell, P.G.C., Jolicoeur, P. 1999. Changes in subcellular metal partitioning in the gills of freshwater bivalves (Pyganodon grandis) living along an environmental cadmium gradient. J. Can. Sci. Halieut. Aquat. 56:774-784.
Wang, F., Goulet, R.R., Chapman, P.M. 2004. Testing sediment biological effects with the freshwater amphipod Hyalella azteca: the gap between laboratory and nature. Chemosphere 57:1713-1724.
Warren, L.A., Tessier, A., Hare, L. 1998. Modelling cadmium accumulation by benthic invertebrates in situ: The relative contributions of sediment and overlying water reservoirs to organism cadmium concentrations. Limnol. Oceanogr. 43:1442-1454.
Warwick, R.M., Clarke, K.R. 1991. A Comparison of Some Methods for Analysing Changes in Benthic Community. J. Mar. Biol. Ass. U.K. 71:225-244.
Weber, C.I. 1973. Biological field and laboratory methods for measuring the quality of surface waters and effluents. U.S. Environmental Protection Agency Report 670/4/73/001.
Weber, L.P., Higgins, P.S., Carlson, R.I., Janz, D.M. 2003. Development and validation of methods for measuring multiple biochemical indices of condition in juvenile fishes. Journal of Fish Biology 63:637-658.
Weech, S., Orr, P., Russel, C., Fedat, L., Yaschyshyn, D. 2012. Investigation of Cause of Effects on Benthic Invertebrates at the Kidd Metallurgical Site. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Weitzel, R.L., Sanocki, S.L., Holecek, H. 1979. Sample replication of periphyton collected from artificial substrates. In: Weitzel, R.L. (éd.) Methods and Measurements of Periphyton Communities: a Review. Philadelphie (PA) : ASTM STP 690. p. 90-115.
Werner, I., Clar, S.L., Hinton, D.E. 2003. Biomarkers aid understanding of aquatic organism responses to environmental stressors. California Agriculture 57(4):110-115.
Whitton, B.A. 1984. Algae as monitors of heavy metals in freshwaters. In: Shubert, L.E. (éd.) Algae as Ecological Indicators. Londres (Royaume-Uni) : Academic Press. p. 257-280.
Whitton, B.A., Say, P.J., Wher, J.D. 1981. Use of plants to monitor heavy metals in rivers. In: Say, P.J., Whitton, B.A. (éd.) Heavy metals in Northern England: environmental and biological aspects. Département de botanique, Université de Durham, Durham (Royaume-Uni). p. 135-145.
Wolf, J.C., Wolfe, M.J. 2005. A Brief Overview of nonneoplastic hepatic toxicity in fish. Toxicologic Pathology 33:75-85.
Yan, N.D. 1979. Phytoplankton community of an acidified, heavy metal contaminated lake near Sudbury, Ontario: 1973-1977. Water, Air, and Soil Poll. 11:43-45.
Zagury, G.J. 2012. Cyanide speciation and fate in gold mine tailings: A case study. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Zapata, F. 2003. The use of environmental radionuclides as tracers in soil erosion and sedimentation investigations: recent advances and future developments. Soil & Tillage Research 69(1/2):3-13.
Tableaux et figures
Le tableau 12-1 décrit les causes possibles susceptibles d’être envisagées au cours de la recherche des causes pour les effets confirmés dont la valeur est inférieure au seuil critique d’effet. Les causes possibles sont notamment les différences d’habitat, les concentrations élevées de nutriants, la réponse causée par la contamination de l’effluent, la variation naturelle, la contamination historique des sédiments et la rareté de la nourriture. Une approche est proposée pour l’étude de chacune des causes. De plus, des exemples illustrent chaque approche proposée.
Le tableau 12-2 définit un ensemble formalisé de critères de causalité faisant partie d’une approche fondée sur le poids de la preuve pour évaluer les effets des effluents des mines. Les principaux critères de causalité comprennent la corrélation spatiale, la corrélation temporelle, le mécanisme plausible, la vérification expérimentale, la force, la spécificité, la preuve d’exposition, l’uniformité et la cohérence.
La figure 12-1 est un diagramme conceptuel qui présente un cadre par étapes pour la recherche des causes dans les études de suivi des effets sur l’environnement. Les niveaux 1 à 5 sont divisés en trois catégories : détermination du profil de réponse, identification de la source dans la mine et caractérisation et identification des substances chimiques. Le passage d’une étape à une autre implique que les résultats augmentent en précision, en complexité, en efforts et en coûts.
Footnotes
- Footnote 1
L'abondance est définie comme le nombre d'invertébrés benthiques. Le terme « densité » est utilisé lorsque l'abondance est exprimée par unité de surface.