Examen scientifique
Table des matières
But
Le but de l'examen scientifique est de déterminer les médicaments qui appartiennent à la même classe thérapeutique que le médicament à soumis à un examen approfondi, les doses comparables de ces médicaments et le degré de comparabilité au médicament breveté à l’étude. Ce processus s’appelle la comparaison selon la catégorie thérapeutique (CCT).
Méthode

Description de la figure
Cette image présente le processus général de l’examen scientifique. Le chef de l’équipe scientifique analyse le médicament à l’étude et toutes les indications approuvées. Un agent scientifique (AS) peut demander un rapport d’un centre d’information sur les médicaments (CIM), qui sera ensuite analysé par l’AS avec d’autres références. L’AS produit un rapport pour le groupe consultatif de l’équipe scientifique (GCEP), qui sera utilisé pour définir des comparateurs et un degré de similitude, et pour déterminer s’il y a un besoin de consulter le GCMUH. L’AS produit ensuite une feuille de résumé du contexte scientifique (FRCS) et une feuille de comparaison selon la catégorie thérapeutique (CCT) pour les comparateurs possibles. La FRCS et la feuille de CCT remplies sont ensuite envoyées au personnel du Conseil qui réalise l’analyse sur les prix et au titulaire de droits.
Le Groupe consultatif sur les médicaments pour usage humain (GCMUH) peut être consulté à la discrétion du personnel, au cas par cas.
Des comparateurs sont déterminés au début de l’examen approfondi pour chaque indication ou utilisation approuvée du médicament breveté visé. D'autres indications ou utilisations pourraient potentiellement être prises en compte dans le contexte d'une audience.
Les évaluations de la CCT sont effectuées pour chaque indication en fonction de l’ensemble de la population traitée, plutôt qu’en fonction des besoins de patients particuliers. Les évaluations de la CCT sont confidentielles et seront communiquées seulement au titulaire de droits, sauf si la loi l'exige.
Chaque médicament de comparaison se voit attribuer un degré de similitude avec le médicament breveté, conformément à la procédure en deux étapes. Un degré de comparabilité est attribué à chaque comparateur trouvé par indication. Les formes posologiques comparables sont également établies à cette étape. La concentration du produit pharmaceutique est déterminée en fonction du schéma posologique à l’étude. En règle générale, le schéma posologique correspond à une période de traitement pour les indications aiguës, tandis qu’un schéma quotidien (correspondant à la dose d’entretien) est utilisé pour les indications chroniques.
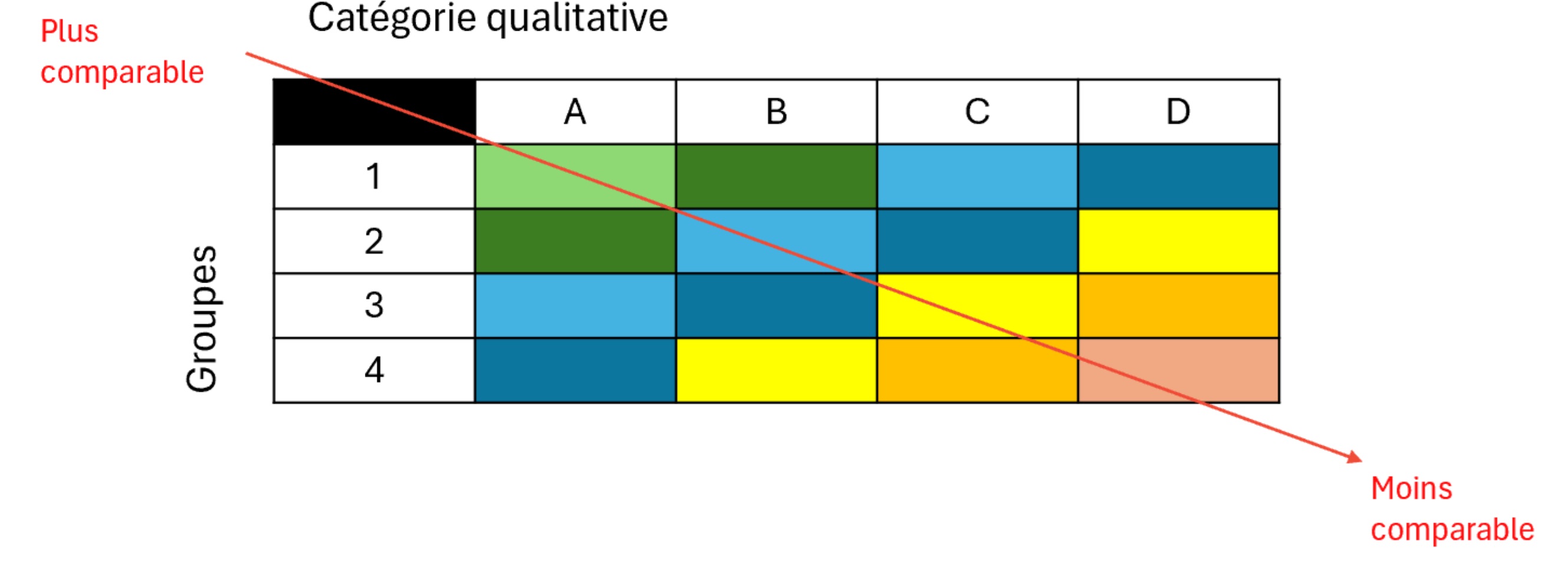
Description de la figure
Ce tableau illustre le spectre de la comparabilité, qui varie de « plus comparable » (en haut à gauche) à « moins comparable » (en bas à droite). L’axe horizontal représente la catégorie qualitative (A, B, C, D), tandis que l’axe vertical indique les groupes (1, 2, 3, 4). La figure montre efficacement comment la comparabilité diminue progressivement d’une catégorie qualitative à l’autre (de gauche à droite) et d’un groupe à l’autre (de haut en bas).
La comparabilité se distingue visuellement par la couleur :
- Vert : comparabilité élevée (p. ex. : A1, A2 et B1)
- Bleu : comparabilité moyenne (p. ex. : A3, A4, B2, B3, C1, C2, D1)
- Jaune, orange et rose : comparabilité basse (p. ex. : B4, C3, C4, D2, D3 et D4)
Selon la situation, le personnel peut décider de consulter de manière ponctuelle le Groupe consultatif sur les médicaments pour usage humain (GCMUH) ou d'autres experts. Le GCMUH ni les autres experts ne peuvent exécuter des fonctions décisionnelles. Ils sont une ressource à laquelle le personnel peut éventuellement faire appel, dans certaines situations, pour qu’ils donnent leur avis sur l’analyse qu’elle effectue. De même, les titulaires de droits ne peuvent pas demander une révision de leur médicament breveté par le GCMUH (ou par tout autre expert que le personnel peut avoir consulté).
- Plus d’information sur le Groupe consultatif sur les médicaments pour usage humain (GCMUH)
Sources d’information
Lors de l'attribution d'une cote de comparabilité aux médicaments dans la CCT, le personnel de l’équipe scientifique consulte les sources suivantes :
- Classification ATC;
- Indications ou utilisations approuvées, ou indications proposées, le cas échéant;
- Littérature médicale disponible;
- Évaluations cliniques réalisées par des organismes nationaux et internationaux d’évaluation des technologies de la santé (p. ex. Agence des médicaments du Canada, INESSS, EMA, NICE, etc.);
- Renseignements fournis par écrit par le titulaire de droits (le cas échéant);
- Recherches menées par un centre d’information sur les médicaments (CIM). Le personnel peut faire appel aux services de divers CIM pour obtenir des renseignements scientifiques, notamment des renseignements sur les essais cliniques et les directives de pratique clinique;
- Recherches menées par le personnel;
- Groupe consultatif sur les médicaments pour usage humain (GCMUH) du CEPMB. Le personnel peut, de façon ponctuelle, décider de consulter le GCMUH dans certaines situations lorsqu’il le juge nécessaire;
- Lignes directrices ou déclarations consensuelles de groupes cliniques canadiens ou étrangers concernant le traitement à l’aide du médicament breveté à l’étude pour l’indication approuvée par Santé Canada.
Renseignements fournis par les titulaires de droits
Les titulaires de droits peuvent à soumettre toute information pertinente dans les plus brefs délais après la réception d’un avis d’examen approfondi. Ces informations peuvent être déposées via notre outil de dépôt en ligne sous l’onglet « Rapports scientifiques ». Le titulaire de droits doit envoyer la notification du dépôt d'une soumission scientifique en ligne par courriel à PMPRB.Filing-Depot.CEPMB@pmprb-cepmb.gc.ca.
Il serait particulièrement utile pour le personnel de l’équipe scientifique que le titulaire de droits expose clairement, dans les documents transmis, la raison d’être de ses propositions concernant le degré de comparabilité, les médicaments pouvant faire l’objet de comparaisons et les schémas posologiques comparables.
Pour plus d'informations sur les détails à inclure dans la soumission scientifique, veuillez consulter la section Renseignements fournis par le titulaire de droits dans le cadre du processus d’examen scientifique.
Délais
Les titulaires de droits sont généralement informés de la sélection des médicaments de comparaison pour chaque indication ou utilisation approuvée dans les huit mois suivant le début de l’examen approfondi.
Résultats
Les titulaires de droits peuvent s'attendre à recevoir les documents suivants à la suite d'une révision scientifique :
- Évaluations CCTn (et CCTi le cas échéant) qui comprennent des schémas posologiques comparables
- Cote de comparabilité de chaque comparateur
- Feuille de résumé du contexte scientifique (FRCS) comprenant un résumé des justifications par comparateur évalué et des références pertinentes