Concordance des listes de médicaments des régimes publics au Canada, Partie 3 : Médicaments évalués par le Programme commun d’évaluation des médicaments
Table des matières
- Sommaire
- Introduction
- Méthodologie
- Limitations
- 1. Aperçu de la couverture des médicaments évalués par le PCEM dans les régimes publics d’assurance-médicaments du Canada
- 2. Couverture des médicaments sélectionnés évalués par le PCEM par segment de marché
- Références
- Annexe A : Taux d’inscription et de concordance des médicaments évalués par le PCER ayant reçu une recommandation positive
- Annexe B : Médicaments inclus dans l’étude
Remerciements
Le présent rapport a été rédigé par le CEPMB dans le cadre du SNIUMP.
Le CEPMB tient à remercier les membres du Comité consultatif du SNIUMP pour leur supervision et leurs conseils d’experts au cours de la rédaction du présent rapport. Il convient de noter que les déclarations et les constatations se rapportant au présent rapport ne reflètent pas nécessairement ceux des membres ou de l’organisme qu’ils représentent.
Nous remercions Nevzeta Bosnic d’avoir dirigé le projet, ainsi que Jeffrey Menzies, Caroline Peterson, Elena Lungu et Tanya Potashnik d’avoir supervisé l’élaboration du rapport. Le CEPMB tient également à souligner la contribution de Brian O’Shea, de l’analyste Jun Yu et de l’équipe de rédaction formée de Sarah Parker, Shirin Paynter et Laura Fortune.
Avertissement
Le SNIUMP est une initiative de recherche indépendante des activités réglementaires du Conseil du CEPMB. Les priorités de recherche, les données, les déclarations et les opinions présentées ou reproduites dans les rapports du SNIUMP ne représentent pas la position du CEPMB au sujet des questions réglementaires. Les rapports du SNIUMP ne contiennent pas d’information confidentielle ou protégée en vertu des articles 87 et 88 de la Loi sur les brevets, et la mention d’un médicament dans un rapport du SNIUMP ne revient pas à reconnaître ou à nier que le médicament fait l’objet d’une demande de brevet en vertu des articles 80, 81 ou 82 de la Loi sur les brevets ou que son prix est ou n’est pas excessif au sens de l’article 85 de la Loi sur les brevets.
Bien qu’ils soient en partie fondés sur les données tirées de la base de données du SNIUMP de l’ICIS et sur les données obtenues sous licence de la base de données de vérification des achats des hôpitaux et des pharmacies du Canada et de la base de données des régimes privés d’assurance‑médicaments à paiement direct, lesquelles appartiennent à IQVIA Solutions Canada Inc. et/ou à ses sociétés affiliées (« IQVIA »), les déclarations, les constatations, les conclusions, les points de vue et les opinions exprimés dans le présent rapport sont exclusivement ceux du CEPMB et ne sont pas attribuables à l’ICIS ou à IQVIA.
Sommaire
La mise en œuvre d’un régime universel d’assurance pour les médicaments sur ordonnance, en complément d’un système de soins de santé universel, est une question qui fait l’objet de débats depuis des décennies au Canada. Récemment, le Conseil consultatif sur la mise en œuvre d’un régime national d’assurance-médicaments a publié un rapport dans lequel il recommande que le Canada mette en place un régime universel d’assurance-médicaments et dresse une liste nationale de médicaments assurés qui jetterait les bases de l’initiativeNote de bas de page i. Afin d’éclairer le dialogue sur la composition éventuelle d’une telle liste de médicaments, le CEPMB a effectué plusieurs analyses sur l’état actuel de la couverture des médicaments par les régimes publics d’assurance-médicaments au Canada.
Le présent rapport est le dernier d’une série de trois rapports du CEPMB qui examinent les lacunes et les chevauchements actuels dans les listes de médicaments assurés des régimes publics d’assurance-médicaments canadiens. Le premier rapport de cette série donnait un aperçu du degré de concordance entre les listes générales de médicaments assurés des différents régimes publics d’assurance‑médicaments au Canada à partir des données de 2015. Le deuxième rapport analysait la couverture par les régimes publics des médicaments oncologiques évalués par le Processus conjoint intérimaire d’évaluation des médicaments oncologiques (interim Joint Oncology Drug Review, ou iJODR) ou par le Programme pancanadien d’évaluation des anticancéreux (PPEA) de l'Agence canadienne des médicaments et des technologies de la santé (ACMTS), en date de la fin mars 2020.
Ce troisième et dernier rapport analyse les médicaments évalués par le Programme commun d’évaluation des médicaments (PCEM) de l’ACMTS. L’analyse s’intéresse à une sélection de 307 médicaments évalués par le PCEM entre le 16 décembre 2003 et le 30 juin 2019. Le rapport rend compte du pourcentage de ces médicaments qui étaient inscrits sur la liste de médicaments assurés de chacun des régimes d’assurance-médicaments participant au PCEM à l’échelle fédérale, provinciale et territoriale au 30 juin 2020 et sur les listes de médicaments assurés des régimes privés d’assurance-médicaments au 31 décembre 2019. Les 307 médicaments choisis l’ont été parce qu’ils représentent la majorité des médicaments mis en marché au Canada au cours des deux dernières décennies. En 2019, ces médicaments représentaient plus de 13,0 milliards de dollars de ventes au Canada, soit 43 % du total des dépenses pharmaceutiques au Canada.
Bien que le rapport évalue les lacunes et les chevauchements généraux qui existent dans l’inscription des médicaments évalués par le PCEM aux listes de médicaments assurés de certains régimes d’assurance-médicaments participants de l’ACMTS à l’échelle fédérale, provinciale et territoriale, son objectif n’est pas d’évaluer la pertinence de ces listes.
Principales constatations
Les médicaments évalués par le PCEM qui sont inscrits sur les listes de médicaments assurés sont relativement les mêmes dans la plupart des régimes publics d’assurance-médicaments au Canada.
- Bon nombre des médicaments évalués par le PCEM qui ont été sélectionnés pour la présente étude étaient inscrits sur la liste de médicaments assurés de la plupart des régimes publics; en effet, les régimes d’assurance-médicaments comptaient en moyenne 65 % des médicaments sélectionnés sur leur liste de médicaments assurés.
- Le taux d’inscription moyen passait à 88 % lorsqu’il était pondéré en fonction des ventes, ce qui indique que les médicaments non couverts par les régimes d’assurance-médicaments ne représentaient qu’un faible pourcentage des dépenses nationales.
- Parmi les 307 médicaments sélectionnés, 207 (67 %) étaient inscrits sur la liste de médicaments assurés d’au moins six provinces et représentaient 90 % des ventes.
- Les taux de concordance des médicaments inscrits dans les différents régimes publics étaient élevés, le taux moyen étant de 81 %, et ils passaient à 91 % lorsque les ventes étaient prises en compte.
Les taux d’inscription sur les listes de médicaments assurés des régimes publics ne montrent que de très légères variations entre les segments de marché analysés.
- Le taux d’inscription moyen des médicaments biologiques était légèrement plus élevé que celui des médicaments à petites molécules, mais le taux de concordance moyen entre les provinces était légèrement inférieur.
- Les taux d’inscription des médicaments de sources multiples, qui incluent les médicaments génériques et les médicaments biologiques pour lesquels il existe des médicaments biosimilaires, dépassaient ceux des médicaments de source unique dans la plupart des régimes publics d’assurance-médicaments, tandis que leurs taux de concordance interprovinciale étaient presque identiques.
- À l’exception des régimes d’assurance-médicaments plus petits, les médicaments onéreux pour maladies rares (MOMR) affichaient des taux d’inscription nettement plus élevés que d’autres médicaments évalués par le PCEM. En 2019, la Colombie-Britannique, l’Ontario et l’Alberta avaient inscrit sur leur liste de médicaments assurés 93 %, 90 % et 80 % de ces médicaments, respectivement.
Introduction
Depuis plus de 50 ans au Canada, la mise en œuvre d’un régime d’assurance-médicaments universel bénéficie de l’appui des principales commissions nationalesNote de bas de page 1. Dans le rapport final qu’il a publié en 2019, le Conseil consultatif sur la mise en œuvre d’un régime national d’assurance-médicaments a recommandé que le Canada mette en place un régime universel d’assurance-médicaments à payeur unique. Il serait ainsi possible de jeter les bases d’une approche uniforme à l’égard de l’inscription des médicaments sur les listes de médicaments assurés et de l’accès des patients aux médicaments d’un bout à l’autre du paysNote de bas de page 2.
Après qu’un médicament sur ordonnance a été autorisé par Santé Canada, il revient aux régimes publics d’assurance-médicaments et aux organismes de lutte contre le cancer au Canada de décider si le médicament sera remboursé. Les processus d’examen de l’ACMTS en vue du remboursement du médicament jouent un rôle important dans ces décisions.
Dans le cadre de ces processus, l’ACMTS évalue les données cliniques et économiques sur le médicament, ainsi que les données probantes tirées de l’expérience des patients et des cliniciens, dans le but de formuler des recommandations et des conseils sur le remboursement à l’intention des régimes publics fédéral, provinciaux et territoriaux d’assurance-médicaments et des organismes provinciaux de lutte contre le cancer (à l’exception du Québec), ainsi que de la Société canadienne du sangNote de bas de page 3.
Le PCEM, l’un des processus d’examen en vue du remboursement des médicaments utilisés par l’ACTMS, évalue les médicaments non oncologiques.
Le Groupe consultatif pancanadien sur un cadre en vue d’une liste de médicaments d’ordonnance est en train de créer un cadre recommandé concernant l’élaboration d’une éventuelle liste pancanadienne de médicaments assurés. Les recommandations seront prêtes d’ici la fin du printemps 2022.
Outre les discussions nationales sur un régime d’assurance-médicaments et une liste de médicaments assurés à l’échelle nationale, et dans le cadre de son travail pour l’initiative de recherche du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP), le Conseil d’examen du prix des médicaments brevetés (CEPMB) a élaboré une série de trois rapports qui portent sur la couverture des médicaments sur ordonnance au Canada.
Le premier rapport de la série comparait les listes générales de médicaments assurés des différents régimes publics en résumant la concordance entre les listes des provinces en 2015, tandis que le deuxième rapport s’intéressait à la couverture des médicaments oncologiques. Le présent rapport, troisième de la série, analyse la couverture des médicaments évalués par le Programme commun d’évaluation des médicaments (PCEM) de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS).
La première section du rapport contient un aperçu des médicaments évalués par le PCEM qui sont inscrits sur les listes de médicaments assurés des différents régimes publics, dont les taux d’inscription. On y compare le pourcentage de médicaments sélectionnés qui sont inscrits sur la liste de médicaments assurés de chacun des régimes provinciaux d’assurance-médicaments et leur part respective des ventes, le nombre de médicaments sélectionnés qui sont inscrits sur les listes de médicaments assurés des différents régimes provinciaux et les taux de concordance entre les régimes provinciaux d’assurance-médicaments. La deuxième section examine la couverture et la concordance des listes de médicaments assurés selon des segments particuliers du marché (médicaments biologiques et médicaments à petites molécules; médicaments de source unique et médicaments de sources multiples) ainsi que la couverture des médicaments onéreux pour maladies rares (MOMR).
Méthodologie
L’analyse porte sur une sélection de 307 médicaments évalués par le PCEM de l’ACMTS entre le 16 décembre 2003 et le 30 juin 2019. Le rapport rend compte du pourcentage de ces médicaments qui étaient inscrits sur la liste de médicaments assurés de chacun des régimes d’assurance-médicaments participant au PCEM au 30 juin 2020 et sur les listes de médicaments assurés des régimes privés d’assurance-médicaments au 31 décembre 2019. Les médicaments sélectionnés comprennent à la fois des médicaments pour lesquels l’ACMTS a formulé une recommandation positive en vue de leur remboursement (78 %) et des médicaments pour lesquels l’ACMTS a formulé une recommandation négative (22 %)Note de bas de page ii. Ces 307 médicaments représentaient plus de 13,0 milliards de dollars de ventes en 2019, soit 43 % des dépenses pharmaceutiques totales au CanadaNote de bas de page iii. Aux fins de la présente analyse, un « médicament » inclut toutes les formulations et toutes les concentrations d’un principe actif donné.
Une « liste de médicaments assurés » désigne une liste de médicaments couverts pour les bénéficiaires admissibles, qui est déterminée par chaque régime d’assurance-médicaments. Les « régimes publics d’assurance-médicaments » comprennent tous les régimes d’assurance-médicaments financés par les fonds publics, dont les listes générales de médicaments assurés, les listes spécialisées de médicaments assurés et les autres programmes spéciaux d’accès aux médicaments, dans chacune des provinces participantes de l’ACMTS – Colombie-Britannique, Alberta, Saskatchewan, Manitoba, Ontario, Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard et Terre-Neuve-et-Labrador – ainsi que le régime public d’assurance-médicaments du Yukon et les Services de santé non assurés (SSNA). Chaque administration dispose de son propre ensemble de programmes, de critères d’admissibilité et de structures de partage des coûts. Pour avoir un aperçu des régimes publics d’assurance-médicaments du SNIUMP, consulter le document de référence Conception des régimes publics d’assurance-médicaments sur le site Web du CEPMB.
Le régime public d’assurance-médicaments du Québec a été exclu de l’analyse en raison du manque de données disponibles.
Sources de données
Tous les médicaments évalués par le PCEM pour lesquels une recommandation finale avait été émise et affichée pendant la période d’étude ont été extraits du site Web de l’ACMTS. Les demandes initiales et les demandes présentées une nouvelle fois pour les mêmes médicaments ont été examinées soigneusement afin que les recommandations les plus récentes soient prises en compte. Les médicaments dont l’homologation a été annulée par Santé Canada après la commercialisation ont été exclus de l’étude, tout comme les médicaments oncologiques plus anciens évalués par le PCEM.
Le statut d’inscription des médicaments sur les listes de médicaments assurés des différents régimes publics a été extrait de la base de données du SNIUMP de l’ICIS. Lorsque l’information n’était pas disponible, le statut d’inscription a été confirmé par l’examen des listes de médicaments assurés disponibles ou par des représentants des régimes publics d’assurance-médicaments. Le statut d’inscription a été obtenu au niveau du principe actif. Un médicament était jugé inscrit si au moins une indication évaluée par le PCEM était couverte.
La base de données des régimes privés d’assurance-médicaments d’IQVIA a été utilisée pour obtenir une liste des médicaments remboursés par les régimes privés d’assurance-médicaments en 2019.
Les données sur les ventes provinciales et nationales ont été extraites de la base de données de vérification des achats des hôpitaux et des pharmacies du Canada (base de données CDH) 2019 d’IQVIA, qui englobe toutes les ventes, peu importe le payeur (public, privé et patient).
Analyse
Toutes les analyses ont été réalisées en fonction des principes actifs, quelle que soit l’indication. Si un médicament existait en version générique ou biosimilaire, il était considéré comme inscrit si l’une de ses versions se trouvait sur la liste de médicaments assurés (que ce soit le médicament d’origine, la version générique ou la version biosimilaire).
L’analyse des segments de marché inclut des comparaisons entre les médicaments biologiques et les médicaments à petites molécules, et entre les médicaments de source unique et les médicaments de sources multiples; les médicaments onéreux pour maladies rares (MOMR) font l’objet d’une analyse en tant que sous-catégorie de médicaments évalués par le PCEM.
- Les médicaments biologiques correspondent aux médicaments de l’annexe D selon la Base de données sur les produits pharmaceutiques (BDPP) de Santé Canada. Tous les autres médicaments étaient considérés comme des médicaments à petites molécules.
- Les médicaments de source unique sont les médicaments d’origine produits par un seul fabricant, pour lesquels il n’existe aucune version générique ou biosimilaire sur le marché. Les médicaments de sources multiples sont produits par au moins deux fabricants et comprennent le médicament d’origine ou son ou ses équivalents génériques et biosimilaires.
- Les MOMR correspondent aux médicaments qui ont été désignés comme médicaments orphelins par la Food and Drug Administration (FDA) ou par l’Agence européenne des médicaments (EMA) et dont le coût de traitement annuel est supérieur à 100 000 $.
Les taux d’inscription sur les listes de médicaments assurés sont déclarés pour chacun des régimes d’assurance-médicaments analysés en fonction du nombre de médicaments et des ventes correspondantes, le cas échéant.
- Pour calculer le taux d’inscription en fonction du nombre de médicaments, on a divisé le nombre de médicaments inscrits sur la liste de médicaments assurés d’une administration donnée par le nombre total de médicaments sélectionnés à des fins d’analyse.
- Pour calculer le taux d’inscription pondéré, on a eu recours aux ventes nationales au détail et dans les hôpitaux au Canada en 2019, et on a accordé une pondération plus importante aux médicaments représentant une part plus élevée du marché.
Les taux de concordance mesurent l’harmonisation des décisions d’inscription entre des paires de régimes publics d’assurance-médicaments pour les 307 médicaments sélectionnés. Au total, 55 combinaisons d’administrations ont fait l’objet d’une comparaison quant au nombre de médicaments et aux ventes correspondantes. Les régimes d’assurance-médicaments étaient jugés concordants si les deux régimes avaient pris la même décision d’inscription concernant un médicament, soit de l’inscrire ou de ne pas l’inscrire.
Pour obtenir une liste de définitions pertinentes, consulter le glossaire fourni à la page Études analytiques du SNIUMP du site Web du CEPMB.
Limites
Le présent rapport a pour but d’évaluer les lacunes et les chevauchements généraux qui existent dans l’inscription des médicaments évalués par le PCEM aux listes de médicaments assurés de certains régimes d’assurance-médicaments participants de l’ACMTS à l’échelle fédérale, provinciale et territoriale; l’objectif n’est pas d’évaluer la pertinence de ces listes.
Afin de fournir un point de comparaison équitable, le rapport vise exclusivement les médicaments évalués par le PCEM et leur statut d’inscription sur les listes de médicaments assurés des différents régimes publics d’assurance-médicaments au 30 juin 2020, ou ceux compris dans les données des régimes privés d’assurance-médicaments en 2019. L’aperçu proposé ne tient pas compte des médicaments qui ont par la suite été ajoutés aux listes de médicaments assurés ou remboursés par les régimes privés d’assurance-médicaments.
Une comparaison directe du nombre de médicaments inscrits peut fournir un portrait incomplet de la couverture dans les administrations, car ce nombre peut dépendre des besoins thérapeutiques de la population admissible.
Les taux d’inscription pondérés sont fondés sur les ventes globales déclarées dans la base de données CDH, qui inclut des données nationales sur tous les payeurs. Certains médicaments, dont plusieurs ayant réalisé des ventes importantes, n’étaient pas compris dans les données au moment de l’analyse, ce qui peut avoir influencé les résultats pondérés.
1. Aperçu de la couverture des médicaments évalués par le PCEM dans les régimes publics d’assurance-médicaments du Canada
Les médicaments évalués par le PCEM qui sont inscrits sur les listes de médicaments assurés sont relativement les mêmes dans la plupart des régimes publics d’assurance-médicaments au Canada. Individuellement, les régimes publics d’assurance-médicaments plus importants avaient inscrit une proportion plus élevée des médicaments sélectionnés. Lorsque les ventes nationales de ces médicaments sont prises en compte, les taux d’inscription sur les listes de médicaments assurés sont plus élevés dans toutes les administrations, ce qui donne à penser que les médicaments non couverts par les régimes d’assurance-médicaments ne représentent qu’une petite part de l’ensemble du marché canadien. Une comparaison directe des décisions d’inscription entre paires d’administrations confirme des taux de concordance relativement élevés; ainsi, les décisions d’inscription des médicaments évalués par le PCEM semblent faire consensus au sein des régimes publics d’assurance-médicaments.
L’analyse des médicaments en fonction des principes actifs, quelles que soient les indications qui y sont associées, a révélé qu’un grand nombre des médicaments sélectionnés pour la présente étude étaient inscrits sur la liste de médicaments assurés de la plupart des régimes publics d’assurance-médicaments au 30 juin 2020. Les taux d’inscription allaient de 53 % à l’Île-du-Prince-Édouard à 79 % en Ontario, avec une moyenne de 65 % dans toutes les listes analysées. Lorsque les données étaient pondérées en fonction des ventes nationales, les taux d’inscription étaient beaucoup plus élevés et plus uniformes d’une administration à l’autre, pour une moyenne de 88 % dans l’ensemble des provinces. Par exemple, les médicaments inscrits en Ontario représentaient 94 % des ventes nationales totales (marchés public et privé compris), ce qui signifie que les médicaments non inscrits ne représentaient qu’une petite part du marché canadien. Des variations dans la part des médicaments inscrits dans les régimes publics d’assurance-médicaments peuvent découler de différents facteurs, tels que la conception des régimes et les besoins thérapeutiques de la population admissible.
Sur les 307 médicaments sélectionnés, 98 % étaient remboursés par au moins un régime privé en 2019.
Lorsque seuls les médicaments ayant reçu une recommandation positive du PCEM étaient pris en compte, le taux d’inscription moyen passait à 77 %, l’Ontario et le Nouveau-Brunswick ayant inscrit 90 % et 86 % de ces médicaments sur leur liste, respectivement. Pour obtenir les résultats complets pour les médicaments ayant reçu une recommandation positive, consulter l’annexe A.
La figure 1.1 présente les taux d’inscription par administration au 30 juin 2020 en fonction du nombre de médicaments inscrits et des ventes correspondantes, ainsi que le pourcentage de médicaments accessibles par l’entremise des régimes privés d’assurance-médicaments en 2019.
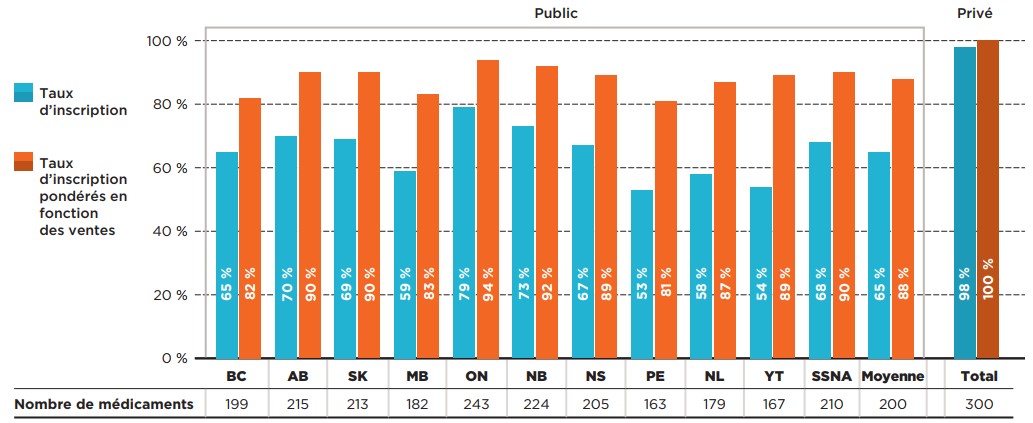
Description de la figure
Ce graphique à barres montre le pourcentage de médicaments sélectionnés évalués par le PCEM qui sont inscrits sur les listes de médicaments assurés des régimes publics d’assurance-médicaments pour chacune des administrations participant au PCEM et sur les listes de médicaments assurés des régimes privés d’assurance-médicaments canadiens. Les taux d’inscription sont présentés sous forme de pourcentage du nombre total de médicaments, quelle que soit leur indication, et sous forme de pourcentage pondéré en fonction des ventes. Le nombre de médicaments inscrits dans chaque administration est indiqué dans un tableau figurant sous le graphique. La couverture des régimes publics a été évaluée en date du 30 juin 2020, et celle des régimes privés, en date de 2019. Les taux d’inscription pondérés sont fondés sur les ventes réalisées en 2019.
| Nombre de médicaments | Taux d’inscription | Taux d’inscription pondérés en fonction des ventes | |
|---|---|---|---|
Colombie-Britannique |
199 |
65 % |
82 % |
Alberta |
215 |
70 % |
90 % |
Saskatchewan |
213 |
69 % |
90 % |
Manitoba |
182 |
59 % |
83 % |
Ontario |
243 |
79 % |
94 % |
Nouveau-Brunswick |
224 |
73 % |
92 % |
Nouvelle-Écosse |
205 |
67 % |
89 % |
Île-du-Prince-Édouard |
163 |
53 % |
81 % |
Terre-Neuve-et-Labrador |
179 |
58 % |
87 % |
Yukon |
167 |
54 % |
89 % |
Services de santé non assurés |
210 |
68 % |
90 % |
Moyenne pour tous les régimes publics |
200† |
65 % |
88 % |
Régimes privés |
199 |
98 % |
100 % |
Remarque : Les taux d’inscription ont été calculés en fonction du nombre total de médicaments, sans égard à leurs indications.
* Pour 307 médicaments évalués par le PCEM de l’ACMTS entre le 16 décembre 2003 et le 30 juin 2019.
† Veuillez noter que cette valeur a été corrigée le 24 février 2022.
Sources des données : Statut de couverture – données du SNIUMP de l’ICIS et autres données accessibles au public, 30 juin 2020; Ventes nationales et provinciales – base de données de vérification des achats des hôpitaux et des pharmacies du Canada (CDH) d’IQVIA, 2019; Régimes privés – base de données des régimes privés d’assurance-médicaments (PDP) d’IQVIA, 2019.
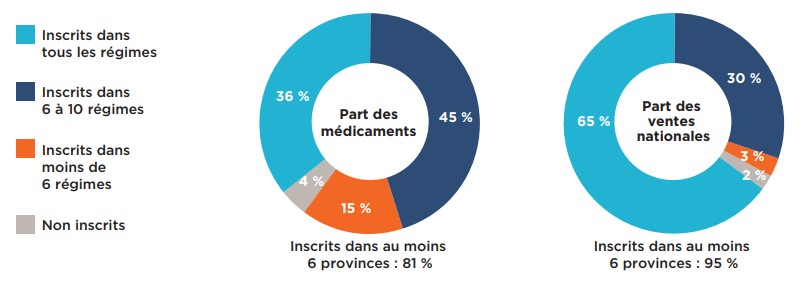
Une analyse du nombre d’inscriptions aux listes de médicaments assurés des régimes publics a révélé que plus des deux tiers (67 %) des 307 médicaments sélectionnés étaient inscrits dans au moins six des onze régimes publics d’assurance-médicaments étudiés; 29 % étaient inscrits dans toutes les listes de médicaments assumés des régimes publics, tandis que 38 % étaient inscrits dans six à dix de ces listes (figure 1.2). Les médicaments inscrits dans au moins six listes de médicaments assurés représentaient 90 % des ventes nationales de tous les médicaments analysés. Une faible proportion des médicaments (20 %) étaient inscrits dans moins de six régimes. Ces médicaments représentaient une proportion encore plus faible des ventes totales, soit à peine 6 %. Parmi les médicaments analysés, 12 % ne se trouvaient sur la liste de médicaments assurés d’aucun régime public, représentant 4 % des ventes nationales. Parmi les médicaments non inscrits, plus des trois quarts avaient reçu une recommandation négative du PCEM.
Lorsque seuls les médicaments ayant reçu une recommandation positive du PCEM étaient pris en compte, le pourcentage de médicaments inscrits dans au moins six régimes passait à 81 %, représentant 95 % des ventes.
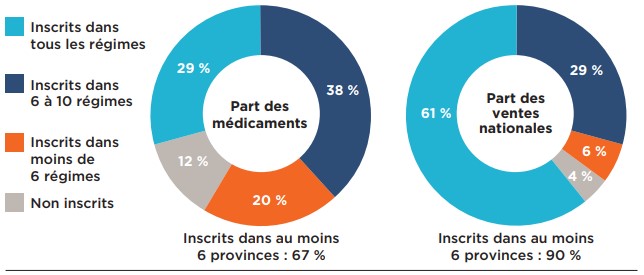
Description de la figure
Cette figure se compose de deux diagrammes en anneau. Le diagramme de gauche montre la part de médicaments sélectionnés évalués par le PCEM qui étaient inscrits dans tous les régimes publics; dans six à dix régimes; dans moins de six régimes; et ceux qui n’étaient inscrits dans aucun des régimes publics, au 30 juin 2020. Le diagramme de droite montre la part correspondante des ventes nationales pour ces catégories de médicaments. Au total, 67 % des médicaments sélectionnés étaient inscrits dans au moins six régimes publics et représentaient 90 % des ventes.
| Part des médicaments | Part des ventes nationales | |
|---|---|---|
Inscrits dans tous les régimes |
29 % |
61 % |
Inscrits dans 6 à 10 régimes |
38 % |
29 % |
Inscrits dans moins de 6 régimes |
20 % |
6 % |
Non inscrits |
12 % |
4 % |
Remarque : Les régimes publics d’assurance-médicaments des administrations suivantes ont été inclus : Colombie-Britannique, Alberta, Saskatchewan, Manitoba, Ontario, Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard, Terre-Neuve-et-Labrador, Yukon et SSNA.
* Pour 307 médicaments évalués par le PCEM de l’ACMTS entre le 16 décembre 2003 et le 30 juin 2019.
Sources des données : Statut de couverture – données du SNIUMP de l’ICIS et autres données accessibles au public, 30 juin 2020; Ventes nationales et provinciales – base de données de vérification des achats des hôpitaux et des pharmacies du Canada (CDH) d’IQVIA, 2019.
L’Ontario, dont le régime public d’assurance-médicaments est le plus important au Canada, est l’administration qui comptait sur sa liste le plus grand nombre de médicaments sélectionnés évalués par le PCEM, soit 243 médicaments. Le Nouveau-Brunswick comptait sur sa liste 221 (88 %) des médicaments inscrits en Ontario, ainsi que trois autres médicaments. Les autres régimes publics d’assurance-médicaments comptaient sur leur liste entre 67 % et 87 % des médicaments inscrits sur la liste de médicaments assurés en Ontario.
La figure 1.3 montre les chevauchements et les lacunes dans les médicaments inscrits sur la liste de médicaments assurés en Ontario et celle des autres régimes publics d’assurance-médicaments.
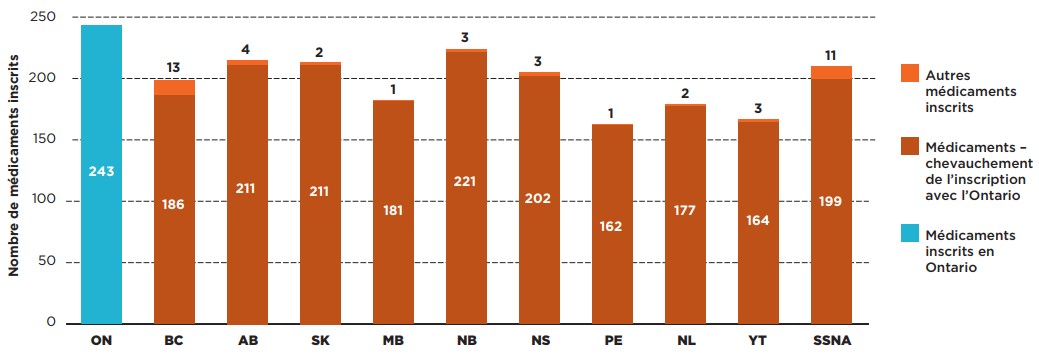
Description de la figure
Ce graphique à barres compare le nombre de médicaments sélectionnés évalués par le PCEM qui sont inscrits sur la liste de médicaments assurés du régime de l’Ontario avec le nombre de ces médicaments qui sont inscrits sur la liste de médicaments assurés de chacun des régimes publics d’assurance-médicaments. Le chevauchement entre les régimes est indiqué, de même que le nombre de médicaments additionnels évalués par le PCEM qui sont inscrits sur la liste de médicaments assurés du régime de chacune des administrations.
| Nombre de médicaments inscrits (chevauchement de l’inscription avec l’Ontario) | Nombre de médicaments additionnels inscrits | |
|---|---|---|
Ontario |
243 |
S.O. |
Colombie-Britannique |
186 |
13 |
Alberta |
211 |
4 |
Saskatchewan |
211 |
2 |
Manitoba |
181 |
1 |
Nouveau-Brunswick |
221 |
3 |
Nouvelle-Écosse |
202 |
3 |
Île-du-Prince-Édouard |
162 |
1 |
Terre-Neuve-et-Labrador |
177 |
2 |
Yukon |
164 |
3 |
Services de santé non assurés |
199 |
11 |
* Pour 307 médicaments évalués par le PCEM de l’ACMTS entre le 16 décembre 2003 et le 30 juin 2019.
Sources des données : Statut de couverture – données du SNIUMP de l’ICIS et autres données accessibles au public, 30 juin 2020; Ventes nationales et provinciales – base de données de vérification des achats des hôpitaux et des pharmacies du Canada (CDH) d’IQVIA, 2019.
Pour évaluer la mesure dans laquelle les décisions d’inscription sont harmonisées entre les régimes publics d’assurance-médicaments, on a mesuré les taux de concordance en comparant les décisions d’inscription des 307 médicaments sélectionnés entre paires de régimes. Au total, 55 comparaisons bilatérales ont été faites entre les 11 régimes publics. Les décisions d’inscription des deux régimes étaient jugées concordantes lorsqu’elles étaient soit toutes deux « oui », soit toutes deux « non ».
Le tableau 1.1 présente les différents taux de concordance bilatérale entre régimes, tant du point de vue du nombre de médicaments (taux non pondéré) que du point de vue des ventes nationales correspondantes (taux pondéré).
En ce qui concerne le nombre de médicaments, les taux de concordance variaient de 69 % (SSNA et Yukon) à 93 % (Nouvelle-Écosse et Nouveau-Brunswick), avec un taux de concordance moyen et médian de 81 % et de 80 %, respectivement. Si on tenait uniquement compte des médicaments ayant reçu une recommandation positive du PCEM, les taux de concordance moyen et médian demeuraient inchangés. Cette forte cohérence rejoint l’approche harmonisée d’évaluation des médicaments envisagée par l’ACMTS et témoigne de l’harmonisation des intérêts gouvernementaux à l’échelle fédérale et provinciale.
Lorsque les ventes étaient prises en compte, les taux de concordance moyens augmentaient, allant de 77 % (Colombie-Britannique et Île-du-Prince-Édouard) à 98 % (Ontario et Nouveau-Brunswick), avec des taux de concordance moyen et médian de 91 % et 92 %, respectivement. Ces résultats confirment que les médicaments qui ne sont pas inscrits uniformément par les régimes publics d’assurance-médicaments ne représentent qu’une part moyenne relativement faible des ventes totales.
Tableau 1.1 Taux de concordance des listes de médicaments assurés entre les régimes publics d’assurance-médicaments, médicaments sélectionnés*
| Tous les médicaments sélectionnés* | Taux d’inscription | Moyenne | Médiane | Minimum | Maximum | Écart-type |
|---|---|---|---|---|---|---|
Non pondéré |
81 % |
80 % |
69 % |
93 % |
6 % |
|
Pondéré en fonction des ventes |
91 % |
92 % |
77 % |
98 % |
5 % |
Remarque : Les régimes publics d’assurance-médicaments des administrations suivantes ont été inclus : Colombie-Britannique, Alberta, Saskatchewan, Manitoba, Ontario, Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard, Terre-Neuve-et-Labrador, Yukon et SSNA.
* Pour 307 médicaments évalués par le PCEM de l’ACMTS entre le 16 décembre 2003 et le 30 juin 2019.
Sources des données : Statut de couverture – données du SNIUMP de l’ICIS et autres données accessibles au public, 30 juin 2020; Ventes nationales et provinciales – base de données de vérification des achats des hôpitaux et des pharmacies du Canada (CDH) d’IQVIA, 2019.
2. Couverture des médicaments sélectionnés évalués par le PCEM par segment de marché
Les taux d’inscription sur les listes de médicaments assurés des régimes publics ne montrent que de très légères variations entre les segments de marché analysés. Les médicaments biologiques évalués par le PCEM affichent des taux d’inscription légèrement supérieurs à ceux des médicaments à petites molécules, mais leur taux de concordance moyen est plus faible. Les taux d’inscription des médicaments de sources multiples sont supérieurs à ceux des médicaments de source unique dans presque tous les régimes publics d’assurance-médicaments, tandis que leurs taux de concordance interprovinciale sont presque identiques.
Médicaments biologiques et médicaments à petites molécules
Les médicaments biologiques ne représentaient que 21 % des médicaments sélectionnés évalués par le PCEM, mais ils représentaient 48 % de leurs ventes totales en 2019. Malgré les coûts relativement élevés des médicaments biologiques, leurs taux d’inscription dépassaient ceux des médicaments à petites molécules dans la plupart des provinces.
En moyenne, 70 % des médicaments biologiques étaient couverts par les régimes publics d’assurance-médicaments, avec certaines variations importantes d’un régime à l’autre, tandis que la couverture moyenne des médicaments à petites molécules atteignait 64 %. Les taux d’inscription des médicaments biologiques étaient supérieurs à la moyenne dans la plupart des provinces, avec des taux considérablement plus bas observés à l’Île-du-Prince-Édouard, à Terre-Neuve-et-Labrador et au Yukon. Aucune différence n’a été constatée chez les payeurs privés, qui remboursaient en moyenne 98 % des médicaments biologiques et non biologiques.
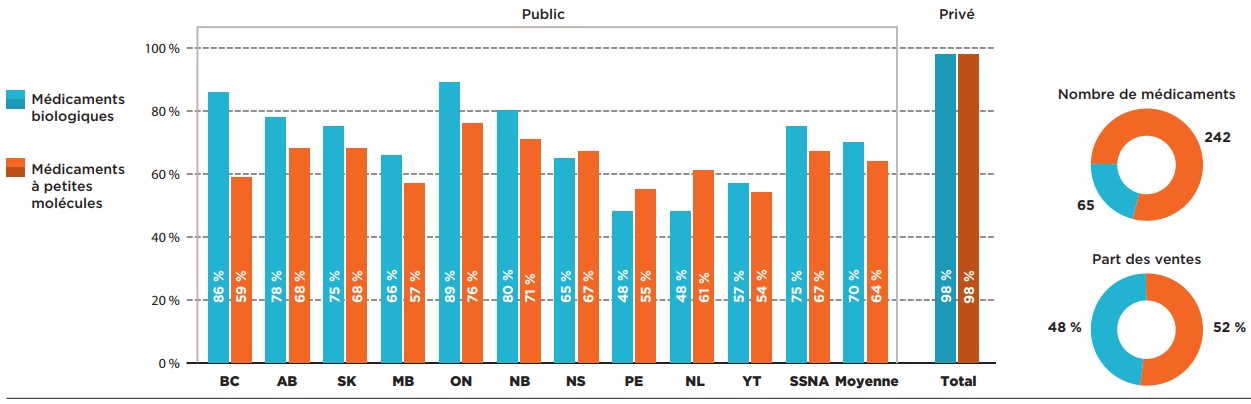
Description de la figure
Ce graphique à barres compare les taux d’inscription des médicaments biologiques et des médicaments à petites molécules dans chacun des régimes publics d’assurance-médicaments. Une moyenne est fournie pour tous les régimes publics ainsi que pour les régimes privés. Au total, les médicaments biologiques représentaient 65 des 307 médicaments et 48 % des ventes de ces médicaments, tandis que les médicaments à petites molécules représentaient les 242 autres médicaments et 52 % des ventes.
| Taux d’inscription des médicaments biologiques | Taux d’inscription des médicaments à petites molécules | |
|---|---|---|
Colombie-Britannique |
86 % |
59 % |
Alberta |
78 % |
68 % |
Saskatchewan |
75 % |
68 % |
Manitoba |
66 % |
57 % |
Ontario |
89 % |
76 % |
Nouveau-Brunswick |
80 % |
71 % |
Nouvelle-Écosse |
65 % |
67 % |
Île-du-Prince-Édouard |
48 % |
55 % |
Terre-Neuve-et-Labrador |
48 % |
61 % |
Yukon |
57 % |
54 % |
Services de santé non assurés |
75 % |
67 % |
Moyenne pour tous les régimes publics |
70 % |
64 % |
Régimes privés |
98 % |
98 % |
* Pour 307 médicaments évalués par le PCEM de l’ACMTS entre le 16 décembre 2003 et le 30 juin 2019.
Sources des données : Statut de couverture – données du SNIUMP de l’ICIS et autres données accessibles au public, 30 juin 2020; Ventes nationales et provinciales – base de données de vérification des achats des hôpitaux et des pharmacies du Canada (CDH) d’IQVIA, 2019.
Médicaments de source unique et médicaments de sources multiples
La grande majorité (242) des médicaments évalués par le PCEM sélectionnés pour l’analyse étaient des produits d’origine de source unique; ces médicaments représentaient près des trois quarts des ventes des médicaments sélectionnés et avaient des taux de couverture légèrement inférieurs à ceux des médicaments de sources multiples dans presque tous les régimes publics.
L’Ontario a enregistré le taux d’inscription le plus élevé (78 %) pour les médicaments de sources multiples, suivi de l’Alberta (70 %) et du Nouveau-Brunswick (70 %). Les autres provinces affichaient des taux allant de 50 % à 69 %. Collectivement, les médicaments de source unique avaient un taux d’inscription moyen de 64 %. Une analyse du marché des médicaments de sources multiples, comprenant 65 médicaments génériques, biosimilaires et d’origine, a révélé que les médicaments de sources multiples présentaient des taux d’inscription variant de 60 % (en Colombie-Britannique) à 85 % (en Ontario), avec un taux d’inscription moyen de 70 %.
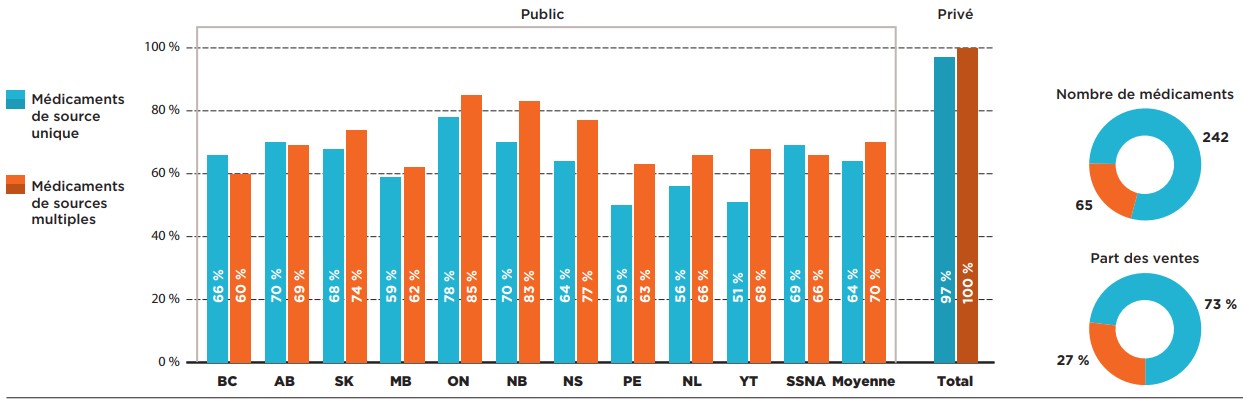
Description de la figure
Ce graphique à barres compare les taux d’inscription des médicaments de source unique et des médicaments de sources multiples dans chacun des régimes publics d’assurance-médicaments. Une moyenne est fournie pour tous les régimes publics ainsi que pour les régimes privés. Au total, les médicaments de source unique représentaient 242 des 307 médicaments et 73 % des ventes de ces médicaments, tandis que les médicaments de sources multiples représentaient les 65 autres médicaments et 27 % des ventes.
| Taux d’inscription des médicaments de source unique | Taux d’inscription des médicaments de sources multiples | |
|---|---|---|
Colombie-Britannique |
66 % |
60 % |
Alberta |
70 % |
69 % |
Saskatchewan |
68 % |
74 % |
Manitoba |
59 % |
62 % |
Ontario |
78 % |
85 % |
Nouveau-Brunswick |
70 % |
83 % |
Nouvelle-Écosse |
64 % |
77 % |
Île-du-Prince-Édouard |
50 % |
63 % |
Terre-Neuve-et-Labrador |
56 % |
66 % |
Yukon |
51 % |
68 % |
Services de santé non assurés |
69 % |
66 % |
Moyenne pour tous les régimes publics |
64 % |
70 % |
Régimes privés |
97 % |
100 % |
* Pour 307 médicaments évalués par le PCEM de l’ACMTS entre le 16 décembre 2003 et le 30 juin 2019.
Sources des données : Statut de couverture – données du SNIUMP de l’ICIS et autres données accessibles au public, 30 juin 2020; Ventes nationales et provinciales – base de données de vérification des achats des hôpitaux et des pharmacies du Canada (CDH) d’IQVIA, 2019.
La figure 2.3 offre un aperçu de l’harmonisation des décisions d’inscription entre les provinces par segment de marché. Globalement, il semble que les taux de concordance moyens des médicaments biologiques et des médicaments non biologiques varient légèrement, tandis que les taux de concordance des médicaments de source unique et des médicaments de sources multiples sont comparables.
Le taux de concordance moyen des médicaments biologiques était légèrement inférieur à celui des médicaments à petites molécules, soit 75 % et 86 %, respectivement. Les taux de concordance entre provinces appariées couvraient en outre un large intervalle dans le cas des médicaments biologiques, avec un taux de concordance maximum de 92 % enregistré pour l’Alberta et la Nouvelle-Écosse.
Les taux de concordance moyens des médicaments de source unique et des médicaments de sources multiples étaient de 81 % et de 80 %, respectivement. La Nouvelle-Écosse concordait avec l’Alberta et le Nouveau-Brunswick dans 92 % de leurs décisions d’inscription des médicaments de source unique, tandis que l’Ontario et le Nouveau-Brunswick affichaient le taux de concordance le plus élevé pour les décisions d’inscription des médicaments de sources multiples, soit 95 %.
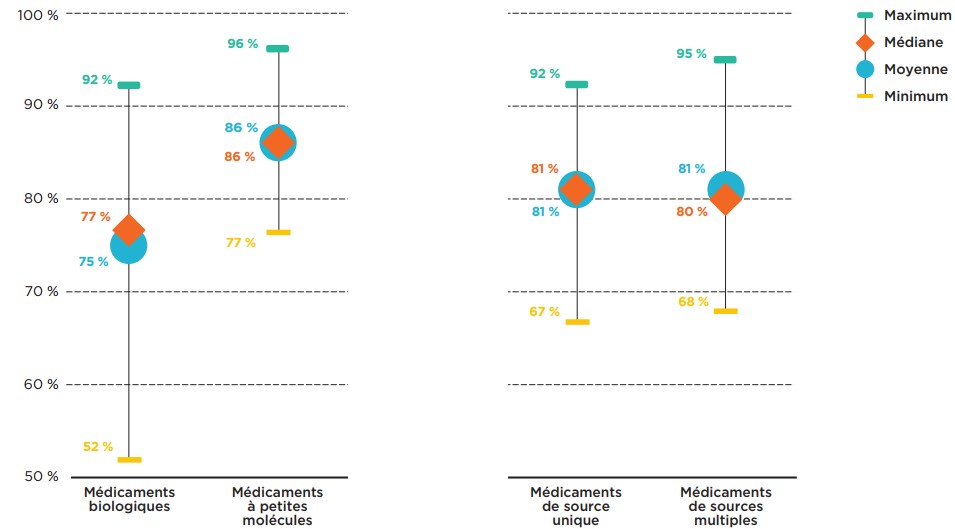
Description de la figure
Ce graphique présente l’éventail des taux de concordance des listes de médicaments assurés sélectionnés par segment de marché pour toutes les paires de régimes provinciaux d’assurance-médicaments. Les taux d’inscription minimum, maximum, moyen et médian sont indiqués pour chaque segment analysé : médicaments biologiques, médicaments à petites molécules, médicaments de source unique et médicaments de sources multiples.
| Segment de marché | Taux de concordance maximum | Taux de concordance moyen | Taux de concordance médian | Taux de concordance minimum |
|---|---|---|---|---|
Médicaments biologiques |
92 % |
75 % |
77 % |
52 % |
Médicaments à petites molécules |
96 % |
86 % |
86 % |
77 % |
Médicaments de source unique |
92 % |
81 % |
81 % |
67 % |
Médicaments de sources multiples |
95 % |
81 % |
80 % |
68 % |
Remarque : Les régimes publics d’assurance-médicaments des administrations suivantes ont été inclus : Colombie-Britannique, Alberta, Saskatchewan, Manitoba, Ontario, Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard, Terre-Neuve-et-Labrador, Yukon et SSNA.
* Pour 307 médicaments évalués par le PCEM de l’ACMTS entre le 16 décembre 2003 et le 30 juin 2019.
Sources des données : Statut de couverture – données du SNIUMP de l’ICIS et autres données accessibles au public, 30 juin 2020; Ventes nationales et provinciales – base de données de vérification des achats des hôpitaux et des pharmacies du Canada (CDH) d’IQVIA, 2019.
Médicaments onéreux pour maladies rares (MOMR)
Par rapport à l’ensemble des médicaments évalués par le PCEM, les MOMR avaient des taux de couverture beaucoup plus élevés dans la plupart des grands régimes publics d’assurance-médicaments, dont celui de la Colombie-Britannique (93 %), de l’Ontario (90 %) et de l’Alberta (80 %). À l’inverse, certains des régimes d’assurance-médicaments plus petits, soit celui de l’Île-du-Prince-Édouard, de Terre-Neuve-et-Labrador et du Yukon, ne comptaient sur leur liste de médicaments assurés que quelques-uns des 30 MOMR analysés.
Afin d’aider les Canadiens atteints d’une maladie rare à accéder aux médicaments dont ils ont besoin, le gouvernement du Canada s’est engagé à investir jusqu’à un milliard de dollars sur deux ans, à compter de 2022-2023, et jusqu’à 500 millions de dollars par année par la suite. Introduite dans le budget fédéral de 2019, cette initiative comprend une collaboration avec les provinces, les territoires et les intervenants disposés à participer à l’élaboration d’une stratégie nationale relative aux médicaments pour le traitement des maladies raresNote de bas de page 5.
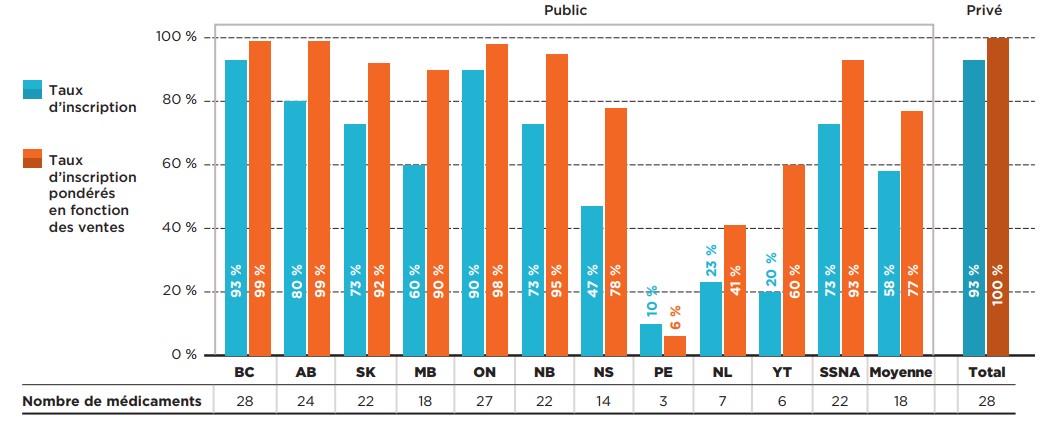
Description de la figure
Ce graphique à barres montre le pourcentage de médicaments onéreux pour maladies rares (MOMR) sélectionnés qui sont inscrits sur les listes de médicaments assurés des régimes publics d’assurance‑médicaments pour chacune des administrations participant au PCEM et sur les listes de médicaments assurés des régimes privés d’assurance-médicaments canadiens. Les taux d’inscription sont présentés sous forme de pourcentage du nombre total de MOMR, quelle que soit leur indication, et sous forme de pourcentage pondéré en fonction des ventes. Le nombre de MOMR inscrits dans chaque administration est indiqué dans un tableau figurant sous le graphique. La couverture des régimes publics d’assurance-médicaments a été évaluée en date du 30 juin 2020, et celle des régimes privés, en date de 2019. Les taux d’inscription pondérés sont fondés sur les ventes réalisées en 2019.
| Nombre de médicaments | Taux d’inscription | Taux d’inscription pondérés en fonction des ventes | |
|---|---|---|---|
Colombie-Britannique |
28 |
93 % |
99 % |
Alberta |
24 |
80 % |
99 % |
Saskatchewan |
22 |
73 % |
92 % |
Manitoba |
18 |
60 % |
90 % |
Ontario |
27 |
90 % |
98 % |
Nouveau-Brunswick |
22 |
73 % |
95 % |
Nouvelle-Écosse |
14 |
47 % |
78 % |
Île-du-Prince-Édouard |
3 |
10 % |
6 % |
Terre-Neuve-et-Labrador |
7 |
23 % |
41 % |
Yukon |
6 |
20 % |
60 % |
Services de santé non assurés |
22 |
73 % |
93 % |
Moyenne pour tous les régimes publics |
18† |
58 % |
77 % |
Régimes privés |
28 |
93 % |
100 % |
* Pour 30 MOMR évalués par le PCEM de l’ACMTS entre le 16 décembre 2003 et le 30 juin 2019.
† Veuillez noter que cette valeur a été corrigée le 25 février 2022.
Sources des données : Statut de couverture – données du SNIUMP de l’ICIS et autres données accessibles au public, 30 juin 2020; Ventes nationales et provinciales – base de données de vérification des achats des hôpitaux et des pharmacies du Canada (CDH) d’IQVIA, 2019.
Annexe A : Taux d’inscription et de concordance des médicaments évalués par le PCER ayant reçu une recommandation positive
Parmi les 307 médicaments analysés, 240 (77 %) avaient reçu au moins une recommandation positive en vue de leur remboursement dans le cadre du processus d’examen de l’ACMTS. Les taux d’inscription de ces médicaments étaient plus élevés dans tous les régimes publics d’assurance‑médicaments; en effet, 81 % des 240 médicaments analysés étaient inscrits dans au moins six régimes d’assurance-médicaments. Les taux de concordance des médicaments ayant reçu une recommandation positive étaient pratiquement identiques aux taux de concordance de l’ensemble des médicaments.
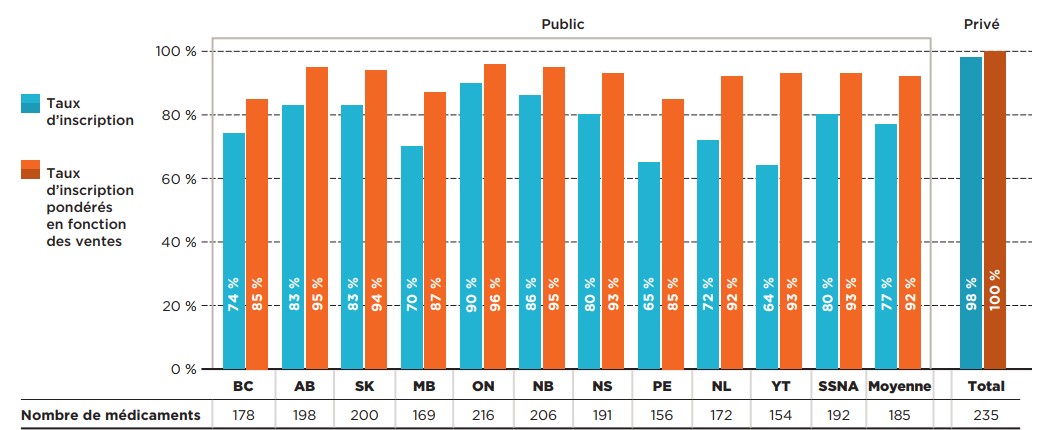
Description de la figure
Ce graphique à barres montre le pourcentage de médicaments évalués par le PCER ayant reçu une recommandation positive qui sont inscrits sur les listes de médicaments assurés des régimes publics d’assurance-médicaments pour chacune des administrations participant au PCEM et sur les listes de médicaments assurés des régimes privés d’assurance-médicaments canadiens. Les taux d’inscription sont présentés sous forme de pourcentage du nombre total de médicaments, quelle que soit leur indication, et sous forme de pourcentage pondéré en fonction des ventes. Le nombre de médicaments inscrits dans chaque administration est indiqué dans un tableau figurant sous le graphique. La couverture des régimes publics d’assurance-médicaments a été évaluée en date du 30 juin 2020, et celle des régimes privés, en date de 2019. Les taux d’inscription pondérés sont fondés sur les ventes réalisées en 2019.
| Nombre de médicaments | Taux d’inscription | Taux d’inscription pondérés en fonction des ventes | |
|---|---|---|---|
Colombie-Britannique |
178 |
74 % |
85 % |
Alberta |
198 |
83 % |
95 % |
Saskatchewan |
200 |
83 % |
94 % |
Manitoba |
169 |
70 % |
87 % |
Ontario |
216 |
90 % |
96 % |
Nouveau-Brunswick |
206 |
86 % |
95 % |
Nouvelle-Écosse |
191 |
80 % |
93 % |
Île-du-Prince-Édouard |
156 |
65 % |
85 % |
Terre-Neuve-et-Labrador |
172 |
72 % |
92 % |
Yukon |
154 |
64 % |
93 % |
Services de santé non assurés |
192 |
80 % |
93 % |
Moyenne pour tous les régimes publics |
185† |
77 % |
92 % |
Régimes privés |
235 |
98 % |
100 % |
Remarque : Les taux d’inscription ont été calculés en fonction du nombre total de médicaments, sans égard à leurs indications.
* Pour 240 médicaments évalués entre le 16 décembre 2003 et le 30 juin 2019 qui ont reçu une recommandation positive dans le cadre du PCER de l’ACMTS. Les recommandations négatives sont les recommandations de type « Ne pas rembourser » et « Ne pas ajouter à la liste de médicaments couverts »; toutes les autres recommandations en matière d’inscription sont considérées comme des recommandations positives.
† Veuillez noter que cette valeur a été corrigée le 24 février 2022.
Sources des données : Statut de couverture – données du SNIUMP de l’ICIS et autres données accessibles au public, 30 juin 2020; Ventes nationales et provinciales – base de données de vérification des achats des hôpitaux et des pharmacies du Canada (CDH) d’IQVIA, 2019; Régimes privés – base de données des régimes privés d’assurance-médicaments (PDP) d’IQVIA, 2019.
Description de la figure
Cette figure se compose de deux diagrammes en anneau. Le diagramme de gauche montre la part de médicaments évalués par le PCEM ayant reçu une recommandation positive qui étaient inscrits dans tous les régimes publics; dans six à dix régimes; dans moins de six régimes; et ceux qui n’étaient inscrits dans aucun des régimes publics, au 30 juin 2020. Le diagramme de droite montre la part correspondante des ventes nationales pour ces catégories de médicaments. Au total, 81 % des médicaments sélectionnés étaient inscrits dans au moins six régimes publics et représentaient 95 % des ventes.
| Part des médicaments | Part des ventes nationales | |
|---|---|---|
Inscrits dans tous les régimes |
35 % |
64 % |
Inscrits dans 6 à 10 régimes |
47 % |
31 % |
Inscrits dans moins de 6 régimes |
15 % |
3 % |
Non inscrits |
4 % |
2 % |
Remarque : Les régimes publics d’assurance-médicaments des administrations suivantes ont été inclus : Colombie-Britannique, Alberta, Saskatchewan, Manitoba, Ontario, Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard, Terre-Neuve-et-Labrador, Yukon et SSNA.
* Pour 240 médicaments évalués entre le 16 décembre 2003 et le 30 juin 2019 qui ont reçu une recommandation positive dans le cadre du PCER de l’ACMTS. Les recommandations négatives sont les recommandations de type « Ne pas rembourser » et « Ne pas ajouter à la liste de médicaments couverts »; toutes les autres recommandations en matière d’inscription sont considérées comme des recommandations positives.
Sources des données : Statut de couverture – données du SNIUMP de l’ICIS et autres données accessibles au public, 30 juin 2020; Ventes nationales et provinciales – base de données de vérification des achats des hôpitaux et des pharmacies du Canada (CDH) d’IQVIA, 2019.
Tableau A1. Taux de concordance des listes de médicaments assurés entre les régimes publics d’assurance-médicaments, médicaments ayant reçu une recommandation positive*
| Tous les médicaments sélectionnés* | Taux d’inscription | Moyenne | Médiane | Minimum | Maximum | Écart-type |
|---|---|---|---|---|---|---|
Non pondéré |
81 % |
80 % |
66 % |
94 % |
7 % |
|
Pondéré en fonction des ventes |
92 % |
92 % |
78 % |
99 % |
5 % |
Remarque : Les régimes publics d’assurance-médicaments des administrations suivantes ont été inclus : Colombie-Britannique, Alberta, Saskatchewan, Manitoba, Ontario, Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard, Terre-Neuve-et-Labrador, Yukon et SSNA.
* Pour 240 médicaments évalués entre le 16 décembre 2003 et le 30 juin 2019 qui ont reçu une recommandation positive dans le cadre du PCER de l’ACMTS. Les recommandations négatives sont les recommandations de type « Ne pas rembourser » et « Ne pas ajouter à la liste de médicaments couverts »; toutes les autres recommandations en matière d’inscription sont considérées comme des recommandations positives.
Sources des données : Statut de couverture – données du SNIUMP de l’ICIS et autres données accessibles au public, 30 juin 2020; Ventes nationales et provinciales – base de données de vérification des achats des hôpitaux et des pharmacies du Canada (CDH) d’IQVIA, 2019.
Annexe B : Médicaments inclus dans l’étude
Les médicaments indiqués ci-dessous ont été inclus dans l’analyse du présent rapport. Toutes les analyses ont été réalisées en fonction des principes actifs, quelle que soit l’indication. Si un médicament existait en version générique ou biosimilaire, il était considéré comme inscrit si l’une de ses versions se trouvait sur la liste de médicaments assurés (que ce soit le médicament d’origine, la version générique ou la version biosimilaire).
| Principe(s) actif(s) | Nom commercial | Principe(s) actif(s) | Nom commercial |
|---|---|---|---|
Abacavir/lamivudine |
Kivexa |
Infliximab |
Remicade |
Abatacept |
Orencia |
Insuline asparte/protamine d’insuline asparte |
Novomix 30 |
Abobotulinumtoxine |
Dysport Therapeutic |
Insuline dégludec |
Tresiba |
Acamprosate calcique |
Campral |
Insuline détémir |
Levemir |
Bromure d’aclidinium |
Tudorza Genuair |
Insuline glargine |
Lantus |
Bromure d’aclidinium/ fumarate de formotérol dihydraté |
Duaklir Genuair |
Insuline glulisine |
Apidra |
Adalimumab |
Humira |
Interféron bêta-1a |
Rebif |
Adéfovir dipivoxil |
Hepsera |
Isavuconazole |
Cresemba |
Aflibercept |
Eylea |
Ivabradine |
Lancora |
Agalsidase alfa |
Replagal |
Ivacaftor |
Kalydeco |
Agalsidase bêta |
Fabrazyme |
Ivermectine |
Rosiver |
Alemtuzumab |
Lemtrada |
Ixékizumab |
Taltz |
Alendronate monosodique/ cholécalciférol |
Fosavance |
Lacosamide |
Vimpat |
Alglucosidase |
Myozyme |
Acétate de lanréotide |
Somatuline Autogel |
Alirocumab |
Praluent |
Carbonate de lanthane hydraté |
Fosrenol |
Aliskiren |
Rasilez |
Laronidase |
Aldurazyme |
Alitrétinoïne |
Toctino |
Latanoprost |
Monoprost |
Almotriptan |
Axert |
Latanoprostène bunod |
Vyzulta |
Alogliptine |
Nesina |
Lédipasvir/sofosbuvir |
Harvoni |
Alogliptine/metformine |
Kazano |
Létermovir |
Prevymis |
Ambrisentan |
Volibris |
Lévodopa/carbidopa |
Duodopa |
Bésylate d’amlodipine/ atorvastatine calcique |
Caduet |
Lévofloxacine |
Quinsair |
Apixaban |
Eliquis |
Linaclotide |
Constella |
Chlorhydrate d’apomorphine |
Movapo |
Linagliptine |
Trajenta |
Aprémilast |
Otezla |
Linagliptine/metformine |
Jentadueto |
Aprépitant |
Emend |
Liraglutide |
Victoza |
Aripiprazole |
Abilify |
Dimésylate de lisdexamfétamine |
Vyvanse |
Asénapine |
Saphris |
Lixisénatide |
Adlyxine |
Asfotase alfa |
Strensiq |
Lixisénatide/insuline glargine |
Soliqua |
Atazanavir |
Reyataz |
Lomitapide |
Juxtapid |
Chlorhydrate d’atomoxétine |
Strattera |
Étabonate de lotéprednol |
Lotemax |
Acide azélaïque |
Finacea |
Lumacaftor/ivacaftor |
Orkambi |
Chlorhydrate d’azélastine/ propionate de fluticasone |
Dymista |
Lurasidone |
Latuda |
Azilsartan médoxomil |
Edarbi |
Macitentan |
Opsumit |
Azilsartan médoxomil/ chlorthalidone |
Edarbyclor |
Maraviroc |
Celsentri |
Solution d’aztréonam pour inhalation |
Cayston |
Chlorhydrate de mémantine |
Ebixa |
Bélimumab |
Benlysta |
Mépolizumab |
Nucala |
Benralizumab |
Fasenra |
Bromure de méthylnaltrexone |
Relistor |
Bictégravir/emtricitabine/ ténofovir alafénamide |
Biktarvy |
Mifépristone/misoprostol |
Mifegymiso |
Brexpiprazole |
Rexulti |
Migalastat |
Galafold |
Tartrate de brimonidine/ maléate de timolol |
Solution ophtalmique Combigan |
Miglustat |
Zavesca |
Brinzolamide/brimonidine |
Simbrinza |
Mirabegron |
Myrbetriq |
Suspension de brinzolamide/maléate de timolol |
Azarga |
Sels mixtes d’amphétamine |
Adderall XR |
Brivaracétam |
Brivlera |
Furoate de mométasone |
Asmanex |
Brodalumab |
Siliq |
Mométasone/formotérol |
Zenhale |
Budésonide |
Cortiment |
Mycophénolate sodique |
Myfortic |
Buprénorphine |
Sublocade |
Natalizumab |
Tysabri |
Chlorhydrate de buprénorphine |
Probuphine |
Nébivolol |
Bystolic |
Timbre transdermique de buprénorphine |
Butrans |
Nétupitant/palonosétron |
Akynzeo |
Buprénorphine/naloxone |
Suboxone |
Nintedanib |
Ofev |
Calcitriol |
Silkis |
Nitisinone |
Nitisinone |
Canagliflozine |
Invokana |
Norgelestromine/ éthinylestradiol |
Evra |
Canagliflozine/ chlorhydrate de metformine |
Invokamet |
Nusinersen |
Spinraza |
Canakinumab |
Ilaris |
Acide obéticholique |
Ocaliva |
Carbidopa/lévodopa/ entacapone |
Stalevo |
Ocrélizumab |
Ocrevus |
Cerliponase alfa |
Brineura |
Ocriplasmine |
Jetrea |
Certolizumab pegol |
Cimzia |
Olmésartan médoxomil |
Olmetec |
Ciclésonide |
Alvesco |
Olmésartan médoxomil/ hydrochlorothiazide |
Olmetec Plus |
Ciclésonide en vaporisateur nasal |
Omnaris |
Omalizumab |
Xolair |
Chlorhydrate de cinacalcet |
Sensipar |
OnabotulinumtoxinA |
Botox |
Suspension otique de chlorhydrate de ciprofloxacine/ dexaméthasone |
Ciprodex |
Chlorhydrate d’oxycodone/ chlorhydrate de naloxone |
Targin |
Cladribine |
Mavenclad |
Ozénoxacine |
Ozanex |
Neurotoxine de Clostridium botulinum de type A sans protéines complexantes |
Xeomin |
Palipéridone |
Invega |
Chlorhydrate de colésévélam |
Lodalis |
Palmitate de palipéridone |
Invega Sustenna |
Crisaborole |
Eucrisa |
Chlorhydrate de palonosétron |
Aloxi |
Cyclosporine |
Émulsion ophtalmique Restasis |
Diaspartate de pasiréotide |
Signifor |
Cystéamine |
Cystadrops |
Pegfilgrastim |
Neulasta |
Bitartrate de cystéamine |
Procysbi |
Peginterféron bêta-1a |
Plegridy |
Dabigatran étexilate |
Pradaxa |
Pegvisomant |
Somavert |
Dapagliflozine |
Forxiga |
Pérampanel |
Fycompa |
Dapagliflozine/chlorhydrate de metformine |
Xigduo |
Périndopril arginine/ amlodipine |
Viacoram |
Daptomycine |
Cubicin |
Phleum pratense |
Grastek |
Bromhydrate de darifénacine |
Enablex |
Pirfénidone |
Esbriet |
Darunavir |
Prezista |
Plerixafor |
Mozobil |
Darunavir/cobicistat |
Prezcobix |
Prasugrel |
Effient |
Darunavir/cobicistat/ emtricitabine/ténofovir alafénamide |
Symtuza |
Prégabaline |
Lyrica |
Déférasirox |
Exjade |
Chlorhydrate de propivérine |
Mictoryl |
Défériprone |
Ferriprox |
Solution orale de propranolol |
Hemangiol |
Delta-9-tétrahydrocannabinol/ cannabidiol |
Sativex |
Prucalopride |
Resotran |
Dénosumab |
Prolia |
Chlorhydrate de quinagolide |
Norprolac |
Dénosumab |
Xgeva |
Raltégravir |
Isentress |
Succinate de desvenlafaxine |
Pristiq |
Ramipril/ hydrochlorothiazide |
Altace HCT |
Dexaméthasone |
Ozurdex |
Ranibizumab |
Lucentis |
Diénogest |
Visanne |
Mésylate de rasagiline |
Azilect |
Fumarate de diméthyle |
Tecfidera |
Reslizumab |
Cinqair |
Dolutégravir |
Tivicay |
Rifaximine |
Zaxine |
Dolutégravir/abacavir/ lamivudine |
Triumeq |
Rilpivirine |
Edurant |
Dolutégravir/rilpivirine |
Juluca |
Riociguat |
Adempas |
Doravirine |
Pifeltro |
Risankizumab |
Skyrizi |
Doravirine/lamuvidine/ fumarate de ténofovir disoproxil |
Delstrigo |
Rituximab |
Rituxan |
Doxycycline monohydratée |
Apprilon |
Rivaroxaban |
Xarelto |
Chlorhydrate de dronédarone |
Multaq |
Rivastigmine |
Exelon Patch |
Drospirénone/ éthinylestradiol |
Yasmin |
Roflumilast |
Daxas |
Dulaglutide |
Trulicity |
Romiplostim |
Nplate |
Chlorhydrate de duloxétine |
Cymbalta |
Rotigotine |
Neupro |
Dupilumab |
Dupixent |
Rufinamide |
Banzel |
Dutastéride |
Avodart |
Sacubitril/valsartan |
Entresto |
Éculizumab |
Soliris |
Dichlorhydrate de saproptérine |
Kuvan |
Édaravone |
Radicava |
Sarilumab |
Kevzara |
Édoxaban |
Lixiana |
Saxagliptine |
Onglyza |
Éfavirenz/emtricitabine/ fumarate de ténofovir disoproxil |
Atripla |
Saxagliptine/metformine |
Komboglyze |
Éfinaconazole |
Jublia |
Sébélipase alfa |
Kanuma |
Elbasvir/grazoprévir |
Zepatier |
Sécukinumab |
Cosentyx |
Bromhydrate d’élétriptan |
Relpax |
Sélexipag |
Uptravi |
Éliglustat |
Cerdelga |
Sémaglutide |
Ozempic |
Élosulfase alfa |
Vimizim |
Citrate de sildénafil |
Revatio |
Eltrombopag |
Revolade |
Silodosine |
Rapaflo |
Éluxadoline |
Viberzi |
Phosphate de sitagliptine |
Januvia |
Elvitégravir/cobicistat/ emtricitabine/fumarate de ténofovir disoproxil |
Stribild |
Phosphate de sitagliptine monohydraté/chlorhydrate de metformine |
Janumet |
Elvitégravir/cobicistat/ emtricitabine/ténofovir alafénamide |
Genvoya |
Oxybate de sodium |
Xyrem |
Empagliflozine |
Jardiance |
Phénylbutyrate de sodium |
Pheburane |
Empagliflozine et metformine |
Synjardy |
Sofosbuvir |
Sovaldi |
Emtricitabine/ténofovir alafénamide |
Descovy |
Sofosbuvir/velpatasvir/ voxilaprévir |
Vosevi |
Emtricitabine/rilpivirine/ fumarate de ténofovir disoproxil |
Complera |
Sofosbuvir/velpatasvir |
Epclusa |
Emtricitabine/rilpivirine/ ténofovir alafénamide |
Odefsey |
Succinate de solifénacine |
Vesicare |
Emtricitabine/fumarate de ténofovir disoproxil |
Truvada |
Somatropine |
Genotropin |
Entécavir |
Baraclude |
Stiripentol |
Diacomit |
Éplérénone |
Inspra |
Oxyhydroxyde sucro-ferrique |
Velphoro |
Mésylate d’éprosartan/ hydrochlorothiazide |
Teveten Plus |
Tadalafil |
Adcirca |
Ertugliflozine |
Steglatro |
Taliglucérase alfa |
Elelyso |
Ertugliflozine/chlorhydrate de metformine |
Segluromet |
Chlorhydrate de tapentadol |
Nucynta |
Oxalate d’escitalopram |
Cipralex |
Téduglutide |
Revestive |
Acétate d’eslicarbazépine |
Aptiom |
Telmisartan/amlodipine |
Twynsta |
Étonogestrel/ éthinylestradiol |
Nuvaring |
Télotristat |
Xermelo |
Étravirine |
Intelence |
Ténofovir alafénamide |
Vemlidy |
Évérolimus |
Afinitor |
Fumarate de ténofovir disoproxil |
Viread |
Évolocumab |
Repatha |
Tériflunomide |
Aubagio |
Exénatide |
Byetta |
Tériparatide injectable (source ADNr) |
Forteo |
Fampridine |
Fampyra |
Tésamoréline |
Egrifta |
Fébuxostat |
Uloric |
Ticagrélor |
Brilinta |
Fentanyl buccal |
Fentora |
Tiotropium/olodatérol |
Inspiolto Respimat |
Fumarate de fésotérodine |
Toviaz |
Bromure de tiotropium |
Spiriva Respimat |
Fidaxomicine |
Dificid |
Tipranavir |
Aptivus |
Fingolimod |
Gilenya |
Tocilizumab |
Actemra |
Fluorouracile/acide salicylique |
Actikerall |
Tofacitinib |
Xeljanz |
Furoate de fluticasone |
Arnuity Ellipta |
Tolvaptan |
Jinarc |
Furoate de fluticasone/ vilantérol |
Breo Ellipta |
Chlorhydrate de tramadol |
Zytram XL |
Furoate de fluticasone/ uméclidinium/vilantérol |
Trelegy Ellipta |
Travoprost/maléate de timolol |
Duotrav |
Propionate de fluticasone |
Aermony Respiclick |
Solution ophtalmique de travoprost |
Izba |
Propionate de fluticasone/ xinafoate de salmétérol |
Arbesda Respiclick |
Tréprostinil sodique |
Remodulin |
Fosamprénavir calcique |
Telzir |
Pamoate de triptoréline |
Trelstar |
Galsulfase |
Naglazyme |
Chlorure de tropsium |
Trosec |
Acétate de glatiramère |
Copaxone |
Acétate d’ulipristal |
Fibristal |
Glécaprévir/pibrentasvir |
Maviret |
Uméclidinium |
Incruse Ellipta |
Phénylbutyrate de glycérol |
Ravicti |
Uméclidinium/vilantérol |
Anoro Ellipta |
Bromure de glycopyrronium |
Seebri |
Ustékinumab |
Stelara |
Golimumab |
Simponi |
Tartrate de varénicline |
Champix |
Extrait allergénique de pollens de graminées |
Oralair |
Védolizumab |
Entyvio |
Chlorhydrate de guanfacine |
Intuniv XR |
Vélaglucérase alfa |
Vpriv |
Guselkumab |
Tremfya |
Voriconazole |
Vfend |
Icatibant |
Firazyr |
Chlorhydrate de ziprasidone |
Zeldox |
Idursulfase |
Elaprase |
Acide zolédronique |
Aclasta |
Indacatérol |
Onbrez |
Tartrate de zolpidem |
Sublinox |
Indacatérol/ glycopyrronium |
Ultibro Breezhaler |
|
