Ligne directrice : Exigences réglementaires associées à une identification numérique attribuée à une drogue (DIN)

Télécharger le format de rechange
(Format PDF, 940 Ko, 37 pages)
Organisation Santé Canada
Publiée : May 2019
Date d'adoption : 2019/05/03
Date d'entrée en vigueur : 2019/05/03
Date des changement de nature administrative : 2025-02-18
Avant-propos
Les lignes directrices sont destinées à guider l'industrie et les professionnels de la santé sur la façon de se conformer aux lois en vigueur et au Règlement sur les aliments et drogues. Les lignes directrices fournissent également aux membres du personnel des renseignements concernant la façon de mettre en œuvre le mandat et les objectifs de Santé Canada de manière juste, uniforme et efficace.
Les lignes directrices sont des outils administratifs n'ayant pas force de loi, ce qui permet une certaine souplesse d'approche. Les principes et les pratiques énoncés dans le présent document pourraient être remplacés par d'autres approches, à condition que celles-ci s'appuient sur une justification adéquate. Il faut tout d'abord discuter d'autres approches avec le programme concerné pour s'assurer qu'elles respectent les exigences des lois et des règlements applicables.
Corollairement à ce qui précède, il importe également de mentionner que Santé Canada se réserve le droit de demander des renseignements ou du matériel supplémentaire, ou de définir des conditions dont il n'est pas explicitement question dans la ligne directrice afin que le Ministère puisse être en mesure d'évaluer adéquatement l'innocuité, l'efficacité ou la qualité d'un produit thérapeutique donné. Santé Canada s'engage à justifier de telles demandes et à documenter clairement ses décisions.
| Date | Changement | Emplacement (section, paragraphe) |
Nature du changement et justification |
|---|---|---|---|
| 3 mai 2019 | La présente ligne directrice regroupe et remplace les politiques et les lignes directrices suivantes :
|
Changement global | Faciliter la recherche d'information en lien avec les DIN en regroupant plusieurs documents d'orientation et sur les politiques en un seul document. |
| 3 mai 2019 | Ajout de contenu : « (disponible pour usage immédiat dans les pharmacies d'hôpital et d'officine [c.-à-d. le médicament se retrouve physiquement sur les tablettes des pharmacies]) » | 6.4, paragraphe 4 | Clarification du concept de disponibilité d'un médicament sur le marché canadien |
| 19 juin 2019 | De plus amples renseignements sur les exigences concernant la présentation d'un avis de cessation de vente à la section 6.5 du document d'orientation. | 6.5 | Les instructions concernant l'avis de cessation de vente du fabricant. |
| Correction à la liste de type de présentation de l'article 6.8 Réémission d'un DIN par Santé Canada. | 6.8 | Enlèvement de type de présentation CPA. | |
| 14 janvier 2022 | Mises à jour générales du document en fonction des changements de processus et des commentaires des intervenants internes et externes | Toutes les sections | |
| Ajout mineur concernant l'émission de plusieurs DIN pour régler des questions de sécurité | 6.1.3, paragraphe 1 | Fournir des éclaircissements sur les pratiques existantes | |
| Ajout d'un nouveau paragraphe | 6.2, paragraphe 2 | Rappel : des exigences supplémentaires en matière de déclaration publique de pénuries et de cessation de vente de médicaments peuvent s'appliquer à certains produits | |
| Mise à jour des descriptions des statuts et ajout de la définition du statut « accès restreint » | 6.2 | Adapter et clarifier les descriptions des statuts | |
| Mises à jour mineures dans les sections 6.3 à 6.8 | 6.3 à 6.8 | Fournir des éclaircissements sur les pratiques existantes et sur le changement de processus (les courriels de confirmation ne sont plus envoyés après le traitement des notifications) | |
| Changements majeurs dans l'ensemble de la section 6.10 | 6.10 | Fournir des éclaircissements supplémentaires sur les exigences en lien avec la soumission (y compris le processus d'inscription réglementaire (PIR)) | |
| Modification mineure de la formulation | Annexe A | ||
| Modification mineure de la formulation | 5 | Aligner la formulation à une autres section du document | |
| Modification mineur au paragraphe | 6.1.1.1 | Fournir des éclaircissements supplémentaires concernant les nouveaux DIN | |
| 1 mai 2024 | Révisions mineures pour améliorer la clarté | Tout au long du document | Révisions visant à clarifier l'interprétation des exigences réglementaires associées à un DIN et aux obligations du fabricant de faire rapport à Santé Canada |
| Mises à jour des types de notification | 2 | Pour harmoniser avec les types d'activités réglementaires et les descriptions des transactions de réglementation mis à jour | |
| Révisions mineures pour améliorer la clarté | 6.4.1 | Fournir des précisions supplémentaires concernant la loi à laquelle il est fait référence. | |
| Révisions mineures pour améliorer la clarté | 6.5 | Clarifier davantage les informations à soumettre (numéro de lot) | |
| Révision mineures au texte | 6.7 | Aligner le texte avec une autre section du document | |
| Mises à jour du type d'activité réglementaire et de la description de la transaction de réglementation | Tableau 5 | Pour harmoniser avec les types d'activités réglementaires et les descriptions des transactions de réglementation mis à jour | |
| 15 juillet 2024 | Révision mineures au texte | Tout au long du document | Aligner le texte avec le Règlement sur les aliments et drogues |
| Mises à jour du type d'activité réglementaire et de la description de la transaction de réglementation | Tableau 5 | Pour harmoniser avec les types d'activités réglementaires et les numéros de contrôle utilisés lors de la soumission des notifications | |
| 18 février, 2025 | Révision mineure pour améliorer la clarté | 5 | Afin de guider le lecteur pour consulter la section 6.6.4.1 pour plus de clarifications sur la désignation « DIN » sur l'étiquette d'un biocide |
| Ajout d'une nouveau section | 6.6.4 | Fournir des précisions supplémentaires concernant l'annulation après la transition vers le Règlement sur les biocides | |
| Ajout d'une nouveau section | 6.6.4.1 | Fournir des précisions supplémentaires pour souligner la différence entre le numéro d'identification du biocide et la désignation « DIN » sur l'étiquette d'un biocide | |
| Révision mineure au texte | Tout au long du document | Aligner le texte avec le Règlement sur les aliments et drogues |
Sur cette page
- 1. Introduction
- 2. Objectif
- 3. Portée
- 4. Objectifs stratégiques
- 5. Définitions
- 6. Directives sur la mise en œuvre
- 6.1 Attribution d'un DIN
- 6.2 État des médicaments dans la Base de données sur les produits pharmaceutiques
- 6.3 Avis de mise en marché
- 6.4 Avis de 12 mois sans vente - état dormant
- 6.5 Avis de cessation de vente
- 6.6 Annulation d'un DIN
- 6.6.1 Annulation en raison de problèmes d'innocuité
- 6.6.2 Annulation à défaut de fournir une déclaration annuelle des médicaments en vertu de C.01.014.6 (2) (a) du Règlement sur les aliments et drogues
- 6.6.3 Annulation : produit n'est pas ou n'est plus considéré comme étant une drogue (ou médicament) en vertu de C.01.014.6 (1) (c) du Règlement sur les aliments et drogues
- 6.6.4 Annulation en raison d'une transition dans le cadre du Règlement sur les biocides
- 6.7 Activités requises suivant l'annulation d'un DIN
- 6.8 Réattribution d'un DIN par Santé Canada
- 6.9 Exportation commerciale
- 6.10 Soumission des avis à Santé Canada
- 6.11 Communiquez avec nous
- Annexe A Modèle : Demande de réattribution de DIN
1. Introduction
Lorsque Santé Canada autorise la mise en marché d'un médicament au Canada, une identification numérique de drogue (DIN) est attribuée au fabricant et imprimée sur les étiquettes des emballages. Un DIN indique que l'évaluation du médicament a satisfait les exigences de la Loi sur les aliments et drogues et de ses règlements et que les bénéfices liés au médicament l'emportent sur les préjudices à la santé. Les fabricants de médicaments d'ordonnance et sans ordonnance doivent obtenir un DIN avant de pouvoir les commercialiser au Canada. En plus d'une autorisation de mise en marché, l'émission d'un avis de conformité (AC) peut être nécessaire pour ces médicaments.
Le DIN attribué à un médicament est unique et peut servir d'outil facilitant les activités effectuées après la commercialisation des produits, telles que l'identification et la vérification des produits par des professionnels de la santé, les rappels de produits, les inspections et le contrôle de la qualité. Bien que l'attribution d'un DIN fasse partie intégrante de l'autorisation de mise en marché d'un médicament, le DIN est la propriété de Santé Canada.
2. Objectif
La présente ligne directrice vise à :
- 1. prêter assistance aux fabricants dans l'interprétation des exigences réglementaires associées à un DIN
- 2. fournir aux fabricants les directives en lien avec leurs obligations de soumettre à Santé Canada les avis de changement d'état de médicaments et ce, dans les délais prescrits :
- Avis de mise en marché
- Avis de 12 mois sans vente
- Avis de cessation de vente
3. Portée
La présente ligne directrice s'applique à tous les médicaments pour lesquels un DIN a été attribué c'est-à-dire, les médicaments pour usage humain et animal, les produits biologiques et radiopharmaceutiques et les désinfectants. La présente ligne directrice se limite aux changements affectant l'état d'un DIN. Celle-ci vise à fournir des directives en lien avec les activités suivantes :
- l'attribution d'un DIN au fabricant par Santé Canada
- l'émission d'un formulaire de déclaration de médicament révisé au fabricant par Santé Canada
- la soumission par le fabricant d'avis de mise en marché auprès de Santé Canada
- la soumission par le fabricant d'avis de 12 mois sans vente auprès de Santé Canada
- la soumission par le fabricant d'avis de cessation de vente auprès de Santé Canada
La présente ligne directrice ne vise pas à renseigner sur les activités suivantes :
- les exigences en lien avec la soumission et la gestion des présentations de drogue et des demandes d'autorisation de médicaments
- la déclaration des effets indésirables d'un médicament
- la déclaration de pénuries possibles ou réelles de médicaments sur le site Web de signalement de pénuries de médicaments géré par une tierce partie
- les frais d'utilisation et les frais à payer pour le droit de vente d'un médicament
- les licences d'établissement
- les produits qui ne sont pas attribué un DIN c'est-à-dire, les instruments médicaux, les produits de santé naturels, les produits de santé vétérinaire, les produits antiparasitaires, les cosmétiques, les traitements expérimentaux pour les humains et les animaux et le cannabis à des fins médicales en vertu de la partie 14 du Règlement sur le cannabis
- le processus de déclaration annuelle des médicaments
4. Objectifs stratégiques
Les objectifs stratégiques qui orientent l'autorité réglementaire des activités relatives à l'attribution d'un DIN et la soumission d'informations en lien avec DIN sont les suivants :
- protéger la santé et la sécurité des Canadiens contre la vente de médicaments non sécuritaires ou interdits
- offrir aux Canadiens de l'information exacte et fiable et ce, en temps opportun sur la disponibilité des médicaments au Canada
5. Définitions
- Formulaire annuel de déclaration de médicament (FADM)
- Formulaire visant à assister les fabricants à se conformer à l'article C.01.014.5 du Règlement sur les aliments et drogues, qui exige que chaque fabricant de médicaments confirme, avant le 1er octobre de chaque année, que tous les renseignements fournis antérieurement concernant ce médicament sont exacts.
- Pour obtenir de plus amples renseignements sur le FDAM, consultez la Ligne directrice - Frais à payer pour le droit de vendre une drogue.
- Dossier
- Ensemble de toutes les activités réglementaires durant le cycle de vie d'un produit pour un intervenant.
- Numéro d'identification de dossier
- Code unique créé par Santé Canada pour identifier un dossier. Le numéro d'identification de dossier est également appelé nom du dossier de premier niveau. Il est composé d'une lettre minuscule suivie de six (6) ou sept (7) chiffres uniques selon le type d'activité réglementaire.
- Cesser
- Lorsque le fabricant cesse de façon permanente la vente d'un médicament.
- Date de cessation
-
Lorsqu'un fabricant qui vend un médicament et qui décide d'en cesser la vente de façon permanente, la date de cessation de la vente correspond à la date de la dernière vente effectuée par le fabricant.
Lorsqu'un fabricant qui a cessé la vente d'un médicament de façon temporaire et qui, par la suite, décide d'en cesser la vente de façon permanente, la date de cessation de la vente correspond à la date à laquelle la décision de cesser la vente de façon permanente a été prise.
- Drogue
- Au sens de l'article 2 de la Loi sur les aliments et drogues. Sont compris parmi les drogues les substances ou mélanges fabriqués, vendus ou présentés comme pouvant servir :
- au diagnostic, au traitement, à l'atténuation ou à la prévention d'une maladie, d'un désordre, d'un état physique anormal ou de leurs symptômes, chez l'être humain ou les animaux;
- à la restauration, à la correction ou à la modification des fonctions organiques chez l'être humain ou les animaux; ou
- à la désinfection des locaux où des aliments sont gardés.
- Identification numérique de drogue (DIN)
-
Un numéro à huit chiffres généré par ordinateur qui est attribué par Santé Canada à une drogue (ou un médicament) avant sa commercialisation selon le paragraphe C.01.014.2 (1) du Règlement sur les aliments et drogues.
En vertu du Règlement sur les aliments et drogues, ce numéro identifie de façon unique chaque drogue (ou médicament) vendue sous forme posologique au Canada. Il est situé sur l'étiquette de l'emballage des médicaments d'ordonnance et sans ordonnance qui ont été évalués et dont la vente est autorisée au Canada.
Un DIN identifie de manière univoque les caractéristiques suivantes :
- nom du produit
- nom du fabricant
- les ingrédients médicinaux
- concentration du ou des ingrédients médicinaux
- forme posologique
- les voies d'administration
- espèces, seulement pour les médicaments destinés aux animaux
Veuillez voir la section 6.6.4.1 pour la distinction entre un DIN et la désignation « DIN » sur l'étiquette d’un biocide.
- Formulaire de déclaration de médicament (FDM)
-
Formulaire émis par Santé Canada en vertu de l'article C.01.014.2 (1) du Règlement sur les aliments et drogues qui contient le DIN attribué à une drogue (ou à un médicament) ainsi que des informations spécifiques au médicament tel qu'il a été autorisé par Santé Canada.
Conformément à l'article C.01.014.3 du Règlement sur les aliments et drogues, le fabricant doit, dans les 30 jours suivant la date de la première vente de la drogue (ou du médicament), dater et signer le FDM dûment rempli déclarant l'exactitude des renseignements fournis et la date de la première vente de ce médicament et le retourner à Santé Canada.
- Date limite d'une drogue (ou médicament) sous forme posologique
-
La date la plus antérieure parmi les suivantes :
- la date jusqu'à laquelle la drogue (ou le médicament) conserve son activité, sa pureté et ses propriétés physiques tels qu'indiqués sur l'étiquette, ou
- la date après laquelle le fabricant recommande de ne plus utiliser la drogue (ou le médicament)
La date limite d'utilisation devrait être indiquée, au minimum, par l'année et le mois.
- Étiquette
-
Comprend ce qui suit :
- étiquettes apposées au contenant ou à l'emballage du médicament
- toutes notices distinctes
- renseignements d'ordonnance
- fiches techniques
- renseignements sur le médicament pour le consommateur et pour le patient (c.-à-d., dépliants pour le patient)
- carnets de suivi du patient
- monographies de produit ou
- autre matériel contenant des renseignements concernant ce produit pharmaceutique en particulier
Les étiquettes des emballages créées par le fabricant peuvent être incluses dans l'emballage ou fournies au consommateur au moment de la délivrance du médicament.
- Numéro de lot
- Toute combinaison de lettres, de chiffres ou de lettres et de chiffres qui peut être utilisée pour retracer un médicament lors de sa fabrication et de sa distribution.
- Fabricant
- Toute personne, y compris une association ou une société de personnes, qui, sous son propre nom ou sous une marque de commerce, un dessin, une marque nominale, un nom commercial ou un autre nom, un dessin ou une marque soumise à son contrôle, vend un médicament. Il s'agit de la personne ou de l'entreprise à laquelle le DIN est attribué. Aux fins du présent document, un fabricant peut inclure un agent autorisé à agir en son nom.
- Avis de mise en marché
- Avis soumis par le fabricant auprès de Santé Canada pour rapporter la date de la première vente d'un médicament particulier, en vertu de l'article C.01.014.3 du Règlement sur les aliments et drogues.
- Drogue nouvelle
- Conformément à la partie C, titre 8, du Règlement sur les aliments et drogues, s'entend d'une drogue, à l'exception d'un produit de santé animale :
- qui est constituée d'une substance ou renferme une substance, sous forme d'ingrédient actif ou inerte, de véhicule, d'enrobage, d'excipient, de solvant ou de tout autre constituant, laquelle substance n'a pas été vendue comme drogue au Canada pendant assez longtemps et en quantité suffisante pour établir, au Canada, l'innocuité et l'efficacité de cette substance employée comme drogue;
- qui entre dans une association de deux drogues ou plus, avec ou sans d'autres ingrédients, qui n'a pas été vendue dans cette association particulière ou dans les proportions de ladite association pour ces drogues particulières, pendant assez longtemps et en quantité suffisante pour établir, au Canada, l'innocuité et l'efficacité de cette association ou de ces proportions employées comme drogue; ou
- pour laquelle le fabricant prescrit, recommande, propose ou déclare un usage comme drogue ou un mode d'emploi comme drogue, y compris la posologie, le mode d'administration et la durée d'action, et qui n'a pas été vendue pour cet usage ou selon ce mode d'emploi au Canada pendant assez longtemps et en quantité suffisante pour établir, au Canada, l'innocuité et l'efficacité de cet usage ou de ce mode d'emploi pour cette drogue.
- Avis de conformité
- Avis émis à un fabricant suivant l'évaluation satisfaisante d'une présentation de drogue pour un nouveau médicament en vertu de l'article C.08.004 ou C.08.004.01 du Règlement sur les aliments et drogues.
- Étiquette portant une marque maison
- Étiquette d'un médicament sans ordonnance autorisé par Santé Canada et vendu sous le nom d'un détaillant qui n'est ni le fabricant du médicament, ni la personne ou l'entreprise à laquelle le DIN a été attribué.
6. Directives sur la mise en œuvre
6.1 Attribution d'un DIN
Une fois qu'un médicament a été autorisé pour la vente au Canada, Santé Canada lui attribue un DIN conformément à la partie C, titre 1 du Règlement sur les aliments et drogues, qui permet au fabricant de commercialiser son produit au Canada. En ce qui concerne les drogues nouvelles, commercialisées sous la Partie C, titre 8 du Règlement, le fabricant doit obtenir un avis de conformité (AC) et un DIN pour être autorisé à les vendre au Canada.
Avant le 13 juin 2018, seul un AC était émis pour les drogues de l'annexe C, ou produits radiopharmaceutiques, autorisées par Santé Canada. Un DIN n'était pas attribué pour ces produits. Les modifications apportées au Règlement sur les aliments et drogues, entrées en vigueur le 13 juin 2018, requièrent maintenant que les fabricants de drogues de l'annexe C soumettent une demande de DIN pour obtenir un DIN pour ces produits.
- Pour obtenir de plus amples renseignements sur l'attribution des DIN pour les drogues de l'annexe C, consultez la Ligne directrice : Identification numérique pour les drogues de l'annexe C (radiopharmaceutiques et trousses).
Le DIN est attribué par le biais d'un formulaire de déclaration de médicament (FDM). En plus de citer le DIN, le FDM contient de l'information qui est propre au médicament et ce, tel qu'autorisé par Santé Canada. Santé Canada envoie les FDM par courriel directement au fabricant.
6.1.1 Le moment de l'attribution d'un DIN
6.1.1.1 Nouveaux DIN
Lorsque les fabricants demandent une autorisation pour un médicament à usage humain en vertu de la Partie C, titre 8 du Règlement, le DIN est attribué au fabricant avant l'émission de l'AC afin qu'il puisse commencer à préparer le matériel d'étiquetage à l'avance. Cependant, le DIN n'est pas attribué avant que toutes les composantes de la présentation aient été évaluées et autorisées par Santé Canada.
Lorsque les fabricants demandent une autorisation pour un médicament destiné aux animaux en vertu de la Partie C, titre 8 du Règlement, le DIN est attribué au fabricant au même moment que l'AC.
Pour les fabricants demandant une autorisation en vertu de la partie C, titre 1 du Règlement sur les aliments et drogues pour les médicaments destinés à usage humain ou destinés aux animaux, un AC n'est pas émis. Le DIN, attribué par le biais d'un FDM, représente l'autorisation pour la vente du médicament au Canada.
6.1.1.2 Formulaire de déclaration de médicament révisé
Le changement d'une ou plusieurs caractéristiques d'un médicament, tel qu'indiqué dans la définition d'un DIN à la section 5, doit être autorisé avant que le FDM puisse être révisé. Les changements proposés doivent être soumis à Santé Canada par le biais d'une présentation de drogue ou d'une demande d'autorisation.
Par conséquent, pour tout changement ultérieur à un médicament à usage humain ou destiné aux animaux autorisé en vertu de la partie C, titre 1, la révision du FDM, portant la même séquence de chiffres que le DIN ayant été attribué au fabricant auparavant, est émis après que l'AC est émis.
Pour tout changement ultérieur à un médicament à usage humain ou animal autorisé en vertu de la partie C, titre 1, un FDM révisé, portant la même séquence de chiffres que le DIN ayant été attribué au fabricant, peut être émis. Le FDM représente l'autorisation de mise en marché; un AC n'est émis pas pour ces médicaments.
Le tableau 1 ci-dessous indique les changements pouvant être apportés aux caractéristiques d'un médicament qui nécessiteraient soit l'émission d'un nouveau DIN ou l'attribution d'un FDM révisé.
| Changement dans les caractéristiques |
Nouveau DIN | FDM révisé portant la même séquence de chiffres que celle du DIN ayant été attribué au fabricant |
|---|---|---|
| Nom du produit | S.O. | ✓ |
| Nom du fabricant | S.O. | ✓ |
| Ingrédients médicinaux | ✓ | S.O. |
| Concentration des ingrédients médicinaux | ✓ | S.O. |
| Forme posologique | ✓ | S.O. |
| Voie d'administration | ✓ | ✓Note de bas de page * |
| Espèce, seulement pour les médicaments destinés aux animaux |
S.O. | ✓ |
|
||
6.1.2 Attribution d'un DIN en fonction du nom du produit
Le nom de produit est proposé par un fabricant afin qu'il puisse en faire la commercialisation et la publicité, lorsqu'applicable. Avant leur autorisation, Santé Canada évalue le nom de chaque produit inclus dans une présentation de drogue ou une demande d'autorisation pour un médicament.
- Pour obtenir de l'information sur l'évaluation des noms de produits de médicaments pour usage humain, consultez les documents suivants :
- Ligne directrice à intention de l'industrie - Examen des marques nominatives de médicament
- Foire aux questions - Ligne directrice à intention de l'industrie - Examen des marques nominatives de médicament
- Ligne directrice : Questions et réponses : Le règlement sur l'étiquetage en langage clair pour les médicaments vendus sans ordonnance
- Ligne directrices sur les désinfectants : Résumé
Si un fabricant désire commercialiser un médicament autorisé, c'est-à-dire pour lequel un DIN a déjà été attribué et ce, sous des noms différents, un nouveau DIN sera attribué pour chaque nouveau nom.
- Pour plus d'information sur la soumission d'une présentation de drogue pour l'ajout d'un nouveau nom de produit pour un médicament à usage humain, consultez la Foire aux questions - Ligne directrice à l'intention de l'industrie - Examen des marques nominatives de médicament
- Pour toutes questions concernant les noms de produit pour les médicaments destinés aux animaux, communiquez avec la Direction des médicaments vétérinaires à vdd.skmd.so-dgps.dmv.cp@hc-sc.gc.ca.
Un nouveau DIN ne sera pas attribué à un fabricant désirant commercialiser un médicament sans ordonnance et portant une étiquette de marque maison, telle que définie dans la section 5, si le nom de produit demeure inchangé.
Le tableau 2 ci-dessous fournit un exemple de deux produits avec le même DIN.
| Informations sur les produits | Produit 1 | Produit 2 |
|---|---|---|
| DIN | ZZZZZZZZ | ZZZZZZZZ |
| Nom du produit | Oméprazole | Oméprazole |
| Nom du fabricant | Compagnie pharmaceutique | Compagnie pharmaceutique |
| Détaillant | Pharmacie1 | Pharmacie2 |
L'ajout ou la modification d'éléments spécifiques à une étiquette portant une marque maison (p. ex. éléments graphiques, couleurs, police, etc.) doivent être évalués et autorisés avant d'être introduite sur le marché. Par conséquent, un avis au Bureau des présentations et de la propriété intellectuelle (BPPI) ne sera plus accepté pour les étiquettes portant une marque privée.
- Pour plus d'information sur la soumission d'étiquettes supplémentaires pour un médicament vendu sans ordonnance et autorisé pour un usage humain, consultez la section 5.9 du Ligne directrice : Questions et réponses : Le règlement sur l'étiquetage en langage clair pour les médicaments vendus sans ordonnance
Santé Canada attribuera un seul DIN pour les produits dont la saveur, la couleur et/ou le parfum varient, à condition que toutes les autres caractéristiques du produit (y compris la formulation, la voie d'administration, la forme posologique, le nom du produit, le nom du fabricant et l'étiquetage - sauf l'identification de la saveur, de la couleur et/ou du parfum) soient identiques. Comme discuté à la section 6.1.3 du présent document, des DIN distincts seraient attribué pour les formulations avec et sans sucre, ainsi que les formulations avec et sans agent de conservation, et dans d'autres cas où les différences de formulations peuvent entraîner des problèmes de sécurité.
L'introduction d'une nouvelle saveur, d'une nouvelle couleur ou d'une nouvelle fragrance pour un produit déjà existant peut nécessiter une évaluation. Ligne directrice - Changements effectués après l'émission d'une identification numérique de drogue (DIN) doit être consultée pour déterminer ce qui doit être soumis à Santé Canada avant de procéder à tout changement.
6.1.3 Attribution de plusieurs DIN pour adresser les problèmes d'innocuité
Dans le but de prévenir des erreurs de médication potentiellement graves, Santé Canada peut, dans certaines circonstances, attribuer plusieurs DINs pour un médicament dont différents formats sont autorisés pour une même concentration, tels que des formats à dose unique. Cela peut s'appliquer, sans s'y limiter, aux différents volumes de doses de stylos préremplis, de seringues préremplies et d'auto-injecteurs, ainsi qu'aux produits grand format pour les pharmacies.
Lorsqu'une présentation de drogue nouvelle (PDN) ou une demande d'identification numérique de drogue (DDIN) est soumise et autorisée pour une seringue préremplie à dose unitaire dont la concentration est la même, mais dont les formats diffèrent, un DIN sera attribué pour chacun des formats. Par exemple, 2 DIN seront attribués pour une seringue préremplie de 10 mg/ml offerte en dose unitaire de 1 ml et de 2 ml. Pour les produits qui sont présentement disponibles sur le marché, Santé Canada adressera ces cas de façon individuelle.
Le développement de cette politique se poursuivra lorsque Santé Canada aura acquis davantage d'expérience quant à son application.
6.2 État des médicaments dans la Base de données sur les produits pharmaceutiques
Une fois que le DIN a été attribué ou que le DIN a été attribué et que l'AC a été émis au fabricant, Santé Canada publie les renseignements associés à ce médicament, y compris le DIN et son état, dans la Base de données sur les produits pharmaceutiques (BDPP). L'état d'un médicament dans la BDPP indique sa disponibilité sur le marché canadien. En vertu du Règlement sur les aliments et drogues, le fabricant est tenu d'informer Santé Canada de tout changement concernant l'état d'un médicament.
En vertu des articles C.01.014.9 à C.01.014.10 du Règlement modifiant le Règlement sur les aliments et drogues (pénuries de drogues et cessation de la vente de drogues), certains titulaires d'autorisation de médicaments sont tenus de signaler publiquement les pénuries et les cessations de la vente de médicaments sur le site Web suivant : Penuriesdemedicamentscanada.ca. Pour de plus amples renseignements sur la manière de signaler les pénuries et les cessations de la vente de médicaments sur le site Web, veuillez consulter le Guide pour la déclaration de pénuries et de cessations de la vente de drogues.
La figure 1 illustre les différents états pouvant être attribués à un produit dans la BDPP. Elle indique de gauche à droite la manière dont l'état d'un produit peut changer au fil du temps.
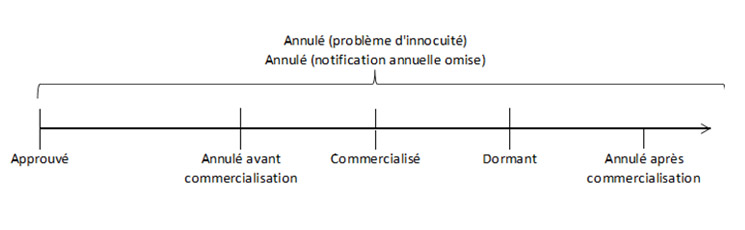
Figure 1 - Équivalent textuel
Description de la figure 1 : Ordre chronologique des états pouvant possiblement être associés à un médicament et apparaissant dans la BDPP
La figure 1 illustre l'ordre chronologique de cinq états pouvant possiblement être associés à un médicament. De gauche à droite : approuvé, annulé avant commercialisation, commercialisé, dormant et annulé après commercialisation. Les états annulé (problème d'innocuité) et annulé (notification annuelle omise) apparaissent en haut de la ligne chronologique pour illustrer que l'un ou l'autre de ces événements peut se produire en tout temps suivant l'émission d'un DIN.
Chacun des états est décrit ci-après :
- Approuvé : désigne un DIN actif dont la vente a été autorisée au Canada, mais qui n'a pas encore été commercialisé au Canada.
- Annulé (avant commercialisation) : désigne un DIN qui a été annulé avant sa commercialisation au Canada. Le DIN est considéré comme étant inactif.
- Commercialisé : désigne un DIN actif actuellement vendu au Canada.
- Accès restreint : désigne un DIN actif dont la vente du produit pharmaceutique correspondant est restreinte aux gouvernements fédéral, provinciaux et territoriaux et aux administrations municipales, conformément à l'article C.08.002.02 du Règlement.
- Dormant : désigne un DIN actif qui était auparavant commercialisé au Canada, mais qui n'a pas fait l'objet de vente pendant au moins 12 mois consécutifs. Le médicament demeure autorisé pour la vente au Canada et peut être commercialisé à nouveau.
- Annulé après commercialisation : désigne un DIN qui a été annulé suite à la cessation de la vente du médicament par le fabricant, conformément à l'article C.01.014.6 (1) (a) du Règlement. Le DIN est considéré comme étant inactif.
- Annulé (problème d'innocuité) : fait référence à un DIN annulé en vertu des alinéas du Règlement sur les aliments et drogues mentionnés ci-dessous. Dans tous ces cas, le DIN est considéré comme étant inactif.
- en vertu de l'alinéa C.01.014.6 (2) (b) du Règlement sur les aliments et drogues et à défaut d'avoir fourni les données probantes relatives à l'innocuité et à l'efficacité du médicament, conformément à l'article C.01.013 du Règlement sur les aliments et drogues
- en vertu de l'alinéa C.01.014.6 (2) (c) du Règlement sur les aliments et drogues et suivant de la suspension d'un avis de conformité, conformément à l'article C.08.006
- en vertu de l'alinéa C.01.014.6 (3) (a) du Règlement sur les aliments et drogues et à défaut de s'être conformé à l'ordre émis conformément à l'article 21.31 de la Loi sur les aliments et drogues demandant d'effectuer une évaluation et d'en fournir les résultats
- en vertu de l'alinéa C.01.014.6 (3) (b) du Règlement sur les aliments et drogues et suivant l'évaluation des résultats fournis en réponse à l'ordre émis conformément à l'article 21.31 de la Loi sur les aliments et drogues.
- Annulé (notification annuelle omise) : fait référence à un DIN qui a été annulé, à défaut d'avoir soumis le formulaire de déclaration annuelle des médicaments, conformément à l'alinéa C.01.014.6 (2) (a) du Règlement sur les aliments et drogues. Dans ce cas-ci, le DIN est considéré comme étant inactif.
6.3 Avis de mise en marché
Conformément à l'article C.01.014.3 du Règlement sur les aliments et drogues, le fabricant se doit d'informer Santé Canada lorsqu'il commercialise, pour la première fois au Canada, un médicament pour lequel un DIN a été attribué. Le fabricant doit retourner à Santé Canada le FDM dûment rempli dans les 30 jours suivant la première vente du médicament. Le FDM doit être rempli, signé et daté. Toutes les pages du FDM doivent être soumises à Santé Canada.
Si un fabricant s'est vu délivrer un FDM révisé (voir la section 6.1.1.2 pour plus d'information sur les FDM révisés), le fabricant se doit d'informer Santé Canada lorsque le médicament est vendu pour la première fois sous le changement autorisé. Le fabricant doit retourner le FDM dûment rempli à Santé Canada dans les 30 jours suivant la première vente du médicament ayant fait l'objet du changement. Le FDM doit être rempli, signé et daté. Toutes les pages du FDM doivent être retournées à Santé Canada. Il est à noter qu'un avis de mise en marché ne doit pas être soumis pour l'introduction d'une nouvelle taille d'emballage ou d'un nouveau modèle d'étiquette à moins qu'un nouveau FDM n'ait été émis pour ce changement (voir le tableau 1 de la section 6.1.1.2.).
6.3.1 Complétion de l'avis de mise en marché
Un avis de mise en marché inclus les documents ci-dessous :
- une lettre d'accompagnement
- un FDM dûment rempli et signé
- le matériel d'étiquetage, lorsqu'applicable (voir le tableau 3)
Ce n'est que lorsqu'un avis de mise en marché complet et dûment rempli est reçu et traité que l'état du médicament dans la BDPP peut être modifié à Commercialisé ou Accès restreint.
Les sections ci-dessous visent à informer le fabricant sur :
- la façon de remplir correctement le FDM
- les circonstances dans lesquelles le matériel d'étiquetage doit être soumis
6.3.1.1 Partie I du Formulaire de déclaration de médicament
La partie I du FDM présente les renseignements inclus dans la BDPP. Il incombe au fabricant de vérifier les renseignements sur le FDM au moment de sa réception. En cas d'erreurs dans les coordonnées de l'entreprise ou du fabricant à qui le DIN a été attribué, de l'agent ou du ou des importateurs soient, l'adresse postale, le nom de la personne à contacter, le numéro de téléphone, le numéro de télécopieur et l'adresse électronique, le fabricant doit contacter l'Unité de la gestion de l'information sur le client à client.information@hc-sc.gc.ca pour obtenir des instructions sur la façon de soumettre des mises à jours des informations de contact de l'entreprise.
Aucune modification ne peut être apportée au nom de l'entreprise ou du fabricant à qui le DIN a été attribué, le nom du produit, la forme posologique, la voie d'administration, les ingrédients médicinaux, la concentration et les espèces, pour les médicaments destinés aux animaux, inscrits sur le FDM. Le fabricant doit soumettre une présentation de drogue ou une demande d'autorisation du médicament pour que ces changements soient effectués.
6.3.1.2 Partie II du Formulaire de déclaration de médicament
La partie II du FDM contient les renseignements fournis par le fabricant dans le cadre de l'avis de mise en marché.
Les renseignements ci-après doivent être fournis dans la partie II.
- La date à laquelle le médicament a été vendu pour la première fois au Canada suivant :
- son autorisation par Santé Canada; ou
- l'autorisation d'un changement pour lequel un FDM révisé a été émis; ou
- sa réintroduction sur le marché (également connu sous date de réintroduction) après une période d'au moins 12 mois consécutifs pendant laquelle il n'y a eu aucune vente et pour laquelle un avis de 12 mois sans vente a été soumis à Santé Canada
- Le représentant autorisé (titre, signature) :
- Toute personne désignée par le fabricant pour agir en son nom
- La date à laquelle le FDM a été rempli et signé
6.3.1.3 Soumission des étiquettes avec un avis de mise en marché
Dans certaines circonstances, le matériel d'étiquetage doit être soumis avec l'avis de mise en marché.
En 2014, la publication du Règlement modifiant le Règlement sur les aliments et drogues (étiquetage, emballage et marques nominatives des drogues pour usage humain) (Règlement sur l'étiquetage en langage clair) a abrogé l'exigence de soumettre les étiquettes commercialisées une fois que le médicament a été mis en marché, tel qu'indiqué dans le Règlement sur les aliments et drogues.
Par conséquent, pour déterminer si une copie des étiquettes commercialisées doit être soumise avec un avis de mise en marché pour un médicament, conformément au Règlement sur l'étiquetage en langage clair, consultez le tableau 3.
| Médicament | Date à laquelle l'activité de réglementation (p. ex., PDN, DDIN) contenant des étiquettes a été soumise et autorisée par Santé Canada | ||
|---|---|---|---|
| Avant le 13 juin 2015 |
Entre le 13 juin 2015et le 13 juin 2017 |
Après le 13 juin 2017 |
|
| D'ordonnance | Oui | Non | Non |
| Administré ou délivré par un professionnel de la santé (inclut les produits éthiques) | Oui | Non | Non |
| Sans ordonnance | Oui | Oui | Non |
| Désinfectant | Oui | Oui | Oui |
| D'ordonnance et sans ordonnance destinés aux animaux |
Oui | Non | Non |
| Notez que lors du dépôt d'un avis de mise en marché suite à la réattribution d'un DIN, les étiquettes commercialisées ne sont pas requises. | |||
6.4 Avis de 12 mois sans vente - état dormant
Il est possible que le fabricant n'ait pas vendu un médicament, à certains moments, lors de sa commercialisation. Si l'une ou l'autre de ces périodes dure au moins 12 mois consécutifs, le fabricant se doit, en vertu de l'article C.01.014.71 et du sous-alinéa C.01.014.5 (1) (a) (ii) du Règlement sur les aliments et drogues, d'en informer Santé Canada. Les sections 6.4.1 et 6.4.2 décrivent en détail quand soumettre un avis de 12 mois sans vente.
Après avoir reçu un avis complet et traité l'information, Santé Canada modifie l'état dans la BDPP pour indiquer de ce médicament est Dormant. Aucun courriel de confirmation n'est envoyé après le traitement de l'avis. Le fabricant peut confirmer le changement d'état en consultant la BDPP. Un produit considéré comme étant Dormant demeure autorisé par Santé Canada et peut être commercialisé à nouveau.
Lorsque 12 mois se sont écoulés depuis la dernière vente du médicament au Canada, le fabricant se doit d'informer Santé Canada. Les trois conditions suivantes doivent être remplies :
- Le médicament a été attribué un DIN ou a été attribué un DIN et un AC a été émis;
- le médicament a été commercialisée au Canada; et
- le médicament n'a pas été vendu sur le marché canadien pendant une période de 12 mois consécutifs.
Dans le cas d'un médicament qui n'a connu aucune vente en raison d'une faible demande causée, par exemple, par une faible population de patients visée par ce traitement, le fabricant se doit d'informer Santé Canada que le médicament est considéré comme étant Dormant, conformément à l'article C.01.014.71 et au sous-alinéa C.01.014.5 (1) (a) (ii) du Règlement sur les aliments et drogues. Si le fabricant souhaite que l'état de son produit dormant reste inscrit comme commercialisé dans la BDPP, il peut fournir une justification indiquant que les conditions suivantes sont remplies :
- un inventaire de ce médicament est maintenu par le fabricant et
- le médicament est disponible sur le marché canadien. Un médicament qui est disponible sur le marché canadien signifie qui peut être dispensé immédiatement par les d'hôpitaux et les pharmacies d'officine. En d'autres mots, le médicament se trouve sur les tablettes des pharmacies.
Cependant, dans une telle situation, Santé Canada peut choisir de conserver l'état du médicament dans la BDPP comme étant Commercialisé afin d'éviter des répercussions sur les plans de traitement des patients. Si le fabricant ne satisfait plus une des deux conditions susmentionnées, cela doit être signalé à Santé Canada. Si le médicament est vendu sur le marché, l'obligation d'en informer Santé Canada, conformément à l'article C.01.014.71 ou au sous-alinéa C.01.014.5 (1) (a) (ii) du Règlement sur les aliments et drogues, ne s'applique plus.
6.4.1 Avis de 12 mois sans vente dans les 30 jours civils
Les fabricants sont encouragés à informer Santé Canada lorsqu'un médicament n'a pas été vendu pendant au moins 12 mois consécutifs et ce, dans les 30 jours suivant cette période. Cela permet à Santé Canada ainsi qu'aux patients, aux professionnels de la santé et à d'autres intervenants du système de santé d'avoir des renseignements à jour sur tous les médicaments disponibles sur le marché canadien.
Toutefois, en vertu de l'article C.01.014.71 du Règlement sur les aliments et drogues, les fabricants de médicaments pour usage humain, listés ici-bas, qui n'ont pas vendus pour une période de 12 mois consécutifs sont dans l'obligation d'en d'informer Santé Canada dans les 30 jours civils. Ces médicaments sont ceux :
- inclus aux annexes I, II, III, IV ou V de la Loi réglementant certaines drogues et autres substances
- qui requièrent une ordonnance
- inclus aux annexes C et D de la Loi sur les aliments et drogues
- pouvant être vendus sans ordonnance, mais qui sont administrés uniquement sous la supervision d'un praticien (p. ex. les solutions d'hémodialyse, l'épinéphrine pour les réactions allergiques graves, les produits de contraste pour imagerie par résonance magnétique (IRM), l'insuline et les vaccins).
Le fabricant doit envoyer l'avis de 12 mois sans vente par l'entremise d'une lettre, portant l'en-tête de l'entreprise. Il doit clairement indiquer la date à laquelle le produit a été vendu pour la dernière fois ou le dernier jour de la période de 12 mois sans vente. L'avis doit être envoyé par voie électronique, tel qu'indiqué dans la section 6.10.
Ce n'est que lorsqu'un avis de 12 mois sans vente complet et dûment rempli est reçu et traité que l'état du médicament dans la BDPP peut être modifié à Dormant.
6.4.2 Soumission de l'avis de 12 mois sans vente pour tous les médicaments par le biais du formulaire de déclaration annuelle de médicament
Les fabricants de médicaments ayant obtenu un DIN, en vertu du sous-alinéa C.01.014.2 (1) du Règlement sur les aliments et drogues, et qui sont commercialisés, doivent informer Santé Canada si l'état de ces médicaments est Dormant au moment de la soumission du formulaire de déclaration annuelle des médicaments (FDAM).
Les directives pour compléter et retourner le FDAM sont incluses dans la trousse de la Déclaration annuelle des médicaments envoyée au fabricants chaque année au mois de juin par Santé Canada.
Ce n'est que lorsqu'un FDAM complet et dûment rempli est reçu et traité que l'état peut être modifié dans la BDPP pour indiquer que le médicament est Dormant. La date de signature du FDAM sera utilisée pour déterminer la date de l'état Dormant, si aucune autre date n'a été fournie.
6.4.3 Reprise de la vente après l'état de dormance
Si le fabricant reprend la vente d'un médicament dont l'état était Dormant, celui-ci doit soumettre, dans les 30 jours suivant la reprise de la vente de ce médicament, un FDM signé et daté. La date de reprise de la vente doit être indiquée sur le FDM. Le fabricant ne doit pas utiliser la date à laquelle le médicament a été commercialisé pour la première fois. La soumission des étiquettes commercialisées n'est pas requise lorsqu'un médicament est vendu à nouveau après un état de dormance.
6.5 Avis de cessation de vente
Le fabricant doit soumettre un avis de cessation de vente dans les 30 jours suivant la cessation de la vente du médicament, conformément à l'article C.01.014.7 du Règlement sur les aliments et drogues. La date de la cessation de la vente du médicament est celle où le fabricant a procédé à leur dernière vente et non celle où il a été vendu pour la dernière fois dans un commerce de détail. Santé Canada annule le DIN après la réception et le traitement d'un avis complet, conformément à l'alinéa C.01.014.6 (1) (a) du Règlement sur les aliments et drogues. Le fabricant doit se conformer aux obligations associées à ce médicament avant l'annulation du DIN et ce, jusqu'à l'échéance du dernier lot distribué ou de la plus longue période précisée dans le Règlement sur les aliments et drogues. Veuillez consulter la section 6.7 pour plus d'information sur les activités requises suivant l'annulation d'un DIN.
L'avis de cessation de vente du fabricant doit être envoyé par l'entremise d'une lettre portant l'en-tête de l'entreprise et doit contenir les renseignements suivants : le DIN du produit, la date de cessation de vente, ainsi que le numéro de lot et la date d'expiration du dernier lot distribué au Canada si le produit était déjà commercialisé. Ce n'est que lorsqu'un avis de cessation de vente complet et dûment rempli est reçu et traité que l'état est modifié dans la BDPP pour indiquer que le médicament a été Annulé. La date associée à la cessation de la vente du médicament incluse dans la lettre sera ajoutée à la BDPP. Si la date de cessation n'est pas incluse dans la lettre, la date de la lettre sera plutôt utilisée.
- si le médicament n'a jamais été commercialisé, c'est-à-dire que son état est Approuvé dans la BDPP, l'état sera modifié pour indiquer que le médicament est Annulé après commercialisation.
- si le médicament est commercialisé ou a déjà été commercialisé, c'est-à-dire que son état est Commercialisé ou Dormant dans la BDPP, l'état sera modifié pour indiquer que le médicament est Annulé après commercialisation. La date limite d'utilisation du dernier lot distribué au Canada, le numéro de lot et la date de la cessation de la vente du produit doivent être fournis par le fabricant pour être affichés dans la BDPP. Le cas échéant, les fabricants devraient expliquer pourquoi la date d'expiration et le numéro de lot ne sont pas inclus dans la notification. Aucun courriel de confirmation n'est envoyé après le traitement de l'avis. Le fabricant peut confirmer le changement d'état en consultant la BDPP.
Seuls les médicaments peuvent faire renvoi à d'autres médicaments déjà autorisés si leur DIN n'est pas Annulé. De plus, les titulaires de licence doivent consulter la section 2.5.4.1 de la Ligne directrice : Traitement administratif des présentations et des demandes concernant les médicaments destinés aux humains ou les désinfectants suivant l'annulation d'un DIN par leur concédant afin de se familiariser avec les répercussions sur leurs médicaments qui font l'objet d'un contrat de licence qui a été traité de façon administrative par Santé Canada.
6.5.1 Cessation de la vente après l'état de dormance
Après avoir informé Santé Canada de la période de 12 mois sans vente, un fabricant peut décider de cesser la vente de ce médicament sur le marché canadien. Lorsque le fabricant a cessé de vendre activement son médicament (c.-à-d. qu'il a cessé de le vendre, mais n'a pas encore pris la décision d'arrêter définitivement) la vente et qu'il décide ensuite d'en cesser la vente, la date de cessation est la date à laquelle il prend la décision de cesser sa vente sur le marché Canadian. La date de cessation doit être après la date où le médicament a été déclaré comme étant Dormant.
6.6 Annulation d'un DIN
Plusieurs raisons peuvent mener à l'annulation d'un DIN par Santé Canada. Ces raisons sont décrites dans l'article C.01.014.6 du Règlement sur les aliments et drogues.
6.6.1 Annulation en raison de problèmes d'innocuité
6.6.1.1 Annulation en raison de problèmes d'innocuité et d'efficacité en vertu de C.01.014.6 (2) (b) du Règlement sur les aliments et drogues
Santé Canada peut annuler le DIN lorsqu'un fabricant ne fournit pas suffisamment de données probantes concernant l'innocuité et l'efficacité liées à une utilisation recommandée pour un médicament.
Lorsqu'il est déterminé qu'une annulation de DIN est justifiée, Santé Canada changera l'état à Annulé (problème d'innocuité) dans la BDPP.
6.6.1.2 Annulation suivant la suspension d'un avis de conformité en vertu de C.01.014.6 (2) (c) du Règlement sur les aliments et drogues
Tel que décrit à l'alinéa C.08.002 (1) (c) du Règlement sur les aliments et drogues, nul ne peut vendre un médicament si l'AC est suspendu. L'interdiction de vendre entre en vigueur dès que l'AC a été suspendu et s'applique aux fabricants ainsi qu'à toutes autres tierces parties telles que les grossistes, les détaillants, les pharmaciens et les praticiens.
Suivant la suspension d'un AC, Santé Canada peut annuler le DIN conformément à l'alinéa C.01.014.6 (2) (c) du Règlement sur les aliments et drogues.
Suivant la décision d'annuler le DIN, Santé Canada changera l'état à Annulé (problème d'innocuité) dans la BDPP. La base de données des AC sera également mise à jour pour indiquer que l'AC a été suspendu.
6.6.1.3 Annulation à défaut de se conformer à un ordre d'effectuer une évaluation et d'en fournir les résultats en vertu de C.01.014.6 (3) (a) du Règlement sur les aliments et drogues
Pour permettre à Santé Canada de réglementer un médicament de façon plus efficace et plus effective, Santé Canada a le pouvoir d'ordonner au fabricant d'effectuer des évaluations, de compiler des renseignements, de faire des essais ou des études ou de surveiller l'expérience acquise sur le médicament et de lui fournir les résultats en vertu de l'article 21.31 de la Loi sur les aliments et drogues.
- Pour plus d'information sur le pouvoir de Santé Canada d'exiger une évaluation en vertu de l'article 21.31 de la Loi sur les aliments et drogues ainsi que sur le pouvoir de demander un essai, des études, etc., consultez le document Lignes directrices provisoires pour l'application des pouvoirs en vertu de la Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi de Vanessa) (Pouvoir d'exiger et de communiquer des renseignements, pouvoir d'exiger la modification d'une étiquette, pouvoir d'ordonner un rappel).
En vertu de l'article 21.31 de la Loi sur les aliments et drogues, si le fabricant ne se conforme pas à l'ordre de fournir l'information demandée, Santé Canada peut annuler le DIN conformément à l'alinéa C.01.014.6 (3) (a) du Règlement sur les aliments et drogues.
Suivant la décision d'annuler le DIN, Santé Canada changera l'état à Annulé (problème d'innocuité) dans la BDPP.
6.6.1.4 Annulation suivant l'examen des résultats d'une évaluation en vertu de C.01.014.6 (3) (b) du Règlement sur les aliments et drogues
Si, suivant l'évaluation de renseignements fournis en réponse à un ordre, en vertu de l'article 21.31 de la Loi sur les aliments et drogues tel que décrit à la section 6.6.1.3, il a été déterminé que les risques de préjudices à la santé l'emportent sur les bénéfices du médicament, Santé Canada peut annuler le DIN conformément à l'alinéa C.01.014.6 (3) (b) du Règlement sur les aliments et drogues.
Suivant la décision d'annuler le DIN, Santé Canada changera l'état à Annulé (problème d'innocuité) dans la BDPP.
6.6.2 Annulation à défaut de fournir une déclaration annuelle des médicaments en vertu de C.01.014.6 (2) (a) du Règlement sur les aliments et drogues
Chaque année, les fabricants doivent fournir à Santé Canada une copie signée de leur formulaire de déclaration annuelle des médicaments (FDAM). Le FDAM permet aux fabricants d'attester que les renseignements concernant leurs médicaments sont exacts et de fournir des mises à jour à Santé Canada.
Avant le 1er octobre de chaque année, Santé Canada communique avec tous les fabricants qui n'ont pas retourné une copie signée du FDAM afin de leur rappeler de se remplir leurs obligations réglementaires.
Si Santé Canada n'a pas reçu le FDAM au plus tard le 1er octobre, conformément à l'article C.01.014.5 du Règlement sur les aliments et drogues, Santé Canada peut annuler les DIN. Un dernier avis écrit sera émis au fabricant pour l'informer que ses DIN seront annulés, conformément à l'alinéa C.01.014.6 (2) (a) du Règlement sur les aliments et drogues, et qu'il ne peut plus vendre ces médicaments, conformément à l'alinéa C.01.014 (1) du Règlement sur les aliments et drogues.
Par la suite, Santé Canada changera l'état du médicament à Annulé (notification annuelle omise) dans la BDPP.
6.6.3 Annulation : produit n'est pas ou n'est plus considéré comme étant une drogue (ou médicament) en vertu de C.01.014.6 (1) (c) du Règlement sur les aliments et drogues
Santé Canada peut annuler un DIN lorsqu'il a déterminé que le produit n'est pas ou n'est plus considéré comme étant une drogue en vertu du Règlement sur les aliments et drogues.
Dans une telle situation, Santé Canada expliquera par écrit au fabricant que le produit est reclassé et qu'il n'est plus réglementé en tant que drogue en vertu du Règlement sur les aliments et drogues.
Santé Canada fournira au fabricant la date à laquelle l'état du médicament sera modifié et la date à laquelle le DIN sera annulé. Le cas échéant, des renseignements sur le ou les règlements auxquels le produit sera assujetti seront fournis au fabricant pour lui pour permettre de commercialiser le produit sur le marché canadien.
Après le changement de classification du produit, Santé Canada annulera le DIN et celui-ci sera retiré de la BDPP.
6.6.4 Annulation en raison d'une transition dans le cadre du Règlement sur les biocides
Les désinfectants dont la vente est autorisée en vertu du Règlement sur les aliments et drogues bénéficieront d'une période de transition de quatre (4) ans à compter de la date d'entrée en vigueur du 31 Mai, 2024, pour obtenir une autorisation de mise en marché en vertu du Règlement sur les biocides . Au moment de la délivrance de l'autorisation de mise en marché du biocide, Santé Canada changera l'état du ou des produits ayant fait l'objet d'une transition à Annulé (transition aux biocides) dans la BDPP.
Le 1er juin, 2029, le jour suivant la fin de la période de transition de quatre (4) ans, tous les DIN restants attribués aux désinfectants ne seront plus valides. Santé Canada changera l'état de ces DIN s à Annulé.
- Pour plus d'informations sur les biocides, consultez les Lignes directrices sur les biocides
- Pour plus d'informations sur la période de transition, consultez les Lignes directrices sur la transition des désinfectants et des assainisseurs de surface vers le Règlement sur les biocides
6.6.4.1 Le numéro d'identification du biocide et la désignation « DIN » sur l'étiquette d'un biocide
L'alinéa 31 (1) (d) du Règlement sur les biocides permet d'utiliser la désignation « DIN » avant le numéro d'identification du biocide à 8 chiffres sur l'étiquette d'un biocide. Ces numéros ne sont pas les mêmes que les numéros d'identification des médicaments (DIN), car les biocides ne sont pas réglementés en tant que drogue en vertu du Règlement sur les aliments et drogues.
Toute question concernant ces produits, y compris les numéros d'identifications des biocides, doit être adressée à la Direction des produits de santé naturels et sans ordonnance (DPSNS) à l'adresse suivante : nnhpd-dpsnso@hc-sc.gc.ca.
6.7 Activités requises suivant l'annulation d'un DIN
Lorsqu'un DIN est annulé en vertu de l'article C.01.014.6 du Règlement sur les aliments et drogues, aucune autre vente ne peut être effectuée par le fabricant puisque l'alinéa C.01.014 (1) du Règlement sur les aliments et drogues interdit à un fabricant de commercialiser une drogue ou médicament qui n'a pas de DIN.
Afin de ne pas imposer un fardeau excessif à l'industrie, Santé Canada peut permettre aux grossistes, aux détaillants, aux pharmaciens et aux praticiens de continuer à vendre ou à distribuer les inventaires restants du médicament après l'annulation de son DIN, si :
- la date limite d'utilisation du ou des lots n'est pas dépassée : et
- l'annulation du DIN n'est pas reliée à un problème de santé ou d'innocuité
Si le DIN est annulé, le médicament ne peut plus être importé au Canada à des fins commerciales.
Si Santé Canada est informé de tout risque ou de toute activité non conforme liée à un médicament dont le DIN a été annulé, les mesures appropriées seront mises en place pour atténuer le risque, conformément à la Politique de conformité et d'application (POL-0001).
Les scénarios ci-dessous illustrent quelques-unes des activités qu'un fabricant doit poursuivre après l'annulation d'un DIN. Les fabricants doivent consulter les règlements pour obtenir tout détail sur leurs obligations.
Scénario no 1 : Mises à jour des renseignements sur l'innocuité du médicament dans la monographie de produit
Même si le DIN a été annulé, le fabricant doit continuer de soumettre les présentations de drogue ou les demandes d'autorisation appropriées pour ajouter ou changer toute information dans la monographie de produit relative à l'innocuité, précisément l'information reliée aux contre-indications, aux mises en garde et aux précautions ou aux effets indésirables, nécessaires lorsque de nouveaux renseignements sont disponibles à cet effet et ce, jusqu'à ce que tous les lots du médicament sur le marché soient expirés.
Scénario no 2 : Déclaration des effets indésirables
L'obligation pour les fabricants de tenir un registre des effets indésirables des médicaments conformément à l'article C.01.020 du Règlement sur les aliments et drogues et pour les grossistes et les distributeurs de tenir un registre conformément à l'article C.02.022 du Règlement sur les aliments et drogues continue de s'appliquer après que le DIN ait annulé. Bien que le fabricant ne soit pas tenu de déclarer les nouveaux cas d'effets indésirables reçus après la cessation de la vente d'un médicament, Santé Canada encourage fortement la déclaration de tous effets indésirables graves et peut demander au fabricant de fournir ces renseignements. D'autres renseignements sur les exigences en matière de déclaration pour les médicaments à usage humain sont disponibles dans le document : Déclaration des effets indésirables des produits de santé commercialisés - Document d'orientation à l'intention de l'industrie.
Scénario no 3 : Vente, tenue de dossiers et déclaration
Un fabricant cesse la vente d'un médicament le 28 février et informe Santé Canada le même jour. Santé Canada annule le DIN. Toutefois, le médicament est disponible sur le marché et la date limite d'utilisation du dernier lot est le 30 décembre.
Les grossistes, les détaillants, les pharmaciens et les praticiens peuvent continuer à vendre ou à distribuer le médicament jusqu'au 30 décembre s'ils avaient des lots en leur possession avant l'annulation du DIN. Toutefois, un importateur ne peut continuer à importer un médicament dont le DIN a été annulé à des fins commerciales.
Les grossistes, les distributeurs et les importateurs sont toujours responsable de la tenue des dossiers en vertu du Règlement sur les aliments et drogues, y compris l'article C.02.022 du Règlement sur les aliments et drogues, et ce, pour tous les lots de médicament existant sur le marché, incluant ceux sur le marché après l'annulation du DIN, soit entre le 28 février et le 30 décembre. En vertu de l'article C.02.022 du Règlement sur les aliments et drogues, les dossiers doivent être conservés pendant un 1 an après la date limite d'utilisation du dernier lot, à moins que la licence d'établissement ne précise une autre période.
Scénario no 4 : Mise à jour de l'étiquetage
Dans le cas où un fabricant annule un DIN associé à une concentration d'un médicament (p. ex. médicament X, 10 mg) alors que les DIN associés aux autres concentrations de ce même médicament (p. ex. médicament X, 20 mg, 40 mg, 80 mg) continuent d'être commercialisés, le fabricant doit soumettre une présentation de drogue ou un demande d'autorisation pour retirer de l'étiquetage les renseignements ayant trait au DIN annulé (c'est-à-dire, la monographie du produit, l'encart, les renseignements d'ordonnance, etc.), et ce, après la date limite d'utilisation de tous les lots du médicament disponible sur le marché.
6.8 Réattribution d'un DIN par Santé Canada
Dans certaines circonstances, Santé Canada peut réattribuer la même séquence de chiffres que celle du DIN originellement attribué pour le même médicament, après que celui-ci ait été annulé.
Le fabricant doit communiquer avec l'unité d'émission des DIN au sein du BPPI pour connaître les exigences applicables à une présentation de drogue ou une demande d'autorisation d'un médicament avant de réintroduire ce médicament sur le marché. Les demandes doivent être envoyées à l'unité d'émission des DIN au sein du BPPI en utilisant le modèle figurant à l'annexe A.
Les renseignements obtenus par le fabricant seront envoyés au bureau d'évaluation approprié pour déterminer quel type de présentation de drogue ou de demande d'autorisation devra être soumise (p. ex. (S)P(A)DN, DDIN(PB)(PD)) pour réattribuer la même séquence de chiffres que celle du DIN originellement attribué pour le même médicament, le cas échéant. Les frais associés à la présentation de drogue ou à la demande d'autorisation de même que les délais d'évaluation vont s'appliquer.
À la discrétion de Santé Canada, le dépôt d'une demande peut être exigé pour la réattribution d'un DIN.
Le médicament pour lequel le fabricant souhaite obtenir la réattribution du DIN est assujetti à toutes les exigences réglementaires existantes, y compris le dépôt de mises à jour de sécurité et d'étiquetage ainsi qu'une évaluation de nom de produit à présentation et à consonance semblables. Si un problème potentiel lié aux présentations et aux consonances semblables est identifié, le médicament pour lequel le fabricant demande la réattribution d'un DIN peut nécessiter un changement de son nom de produit. Consultez la Ligne directrice à intention de l'industrie - Examen des marques nominatives de médicament pour obtenir de plus amples renseignements sur les évaluations de nom de produits.
Si les renseignements fournis par le fabricant sont acceptables, le FDM portant la même séquence de chiffres que celle du DIN annulé sera émis au fabricant. L'état du DIN dans la BDPP sera modifié pour indiquer que le médicament est Approuvé. Le fabricant se devra d'informer Santé Canada lorsque le produit sera commercialisé, conformément à l'article C.01.014.3 du Règlement sur les aliments et drogues. Consultez la section 6.3 ci-dessus pour obtenir des renseignements supplémentaires sur les avis de mise en marché.
6.9 Exportation commerciale
Lorsqu'un fabricant cesse la vente d'un médicament destiné à la consommation au Canada, mais continue de le commercialiser et de l'exporter, l'exportation avec ou sans l'invocation de l'article 37 de la Loi sur les aliments et drogues déterminera si la vente du médicament est considérée comme ayant cessé au Canada.
- Pour obtenir un complément d'information sur l'article 37 de la Loi sur les aliments et drogues, consultez le document : L'intention d'invoquer l'article 37 de la Loi des aliments et drogues pour les produits destinés à l'exportation.
6.9.1 Exportation sans l'invocation de l'article 37
Pour exporter un médicament sans l'invocation de l'article 37 de la Loi sur les aliments et drogues, le fabricant doit détenir, entre autres, un DIN ou un DIN et un AC, étant donné que ces types d'exportation commerciale sont généralement considérés comme des ventes au Canada.
Dans ce cas, la vente du médicament exporté n'est pas considérée comme ayant cessé et le fabricant n'est pas tenu de soumettre un avis de cessation de vente à Santé Canada. L'état dans la BDPP continuera d'indiquer que ce médicament est Commercialisé et le fabricant se doit de continuer à remplir ses obligations après la commercialisation.
6.9.2 Exportation en vertu de l'article 37
Lorsque la vente d'un médicament destiné à la consommation au Canada a cessé, mais que le fabricant continue de l'exporter en vertu de l'article 37 de la Loi sur les aliments et drogues, la vente du médicament est considérée comme ayant cessé au Canada.
Dans ce cas, les fabricants devront envoyer un avis de cessation de vente à Santé Canada. Ce n'est que lorsqu'un avis de cessation de vente complet et dûment rempli reçu et traité que l'état du médicament changera à est Annulé (après commercialisation) dans la BDPP.
6.10 Soumission des avis à Santé Canada
Pour que Santé Canada puisse traiter les avis reçus du fabricant de façon rapide et efficace, tous les documents requis doivent être fournis, dûment remplis et soumis dans le format approprié.
6.10.1 Documents requis
| Activité | FDM | Étiquette | Lettre d'accompagnement |
|---|---|---|---|
| Avis de mise en marché | Requis | Consulter le tableau 3 |
Requis |
| Reprise de la vente après l'état de dormance |
Requis | Non requise | Requis |
| Avis de 12 mois sans vente | Non requis | Non requis | Requis |
| Avis de cessation de la vente | Non requis | Non requise | Requis |
| Demande de réattribution de DIN | Non requis | Non requise | Non requise - envoyer par courriel (voir annexe A) |
Lorsqu'un fabricant présente un avis ou une demande de réattribution de DIN à Santé Canada, celui-ci doit fournir tous les documents et tous les renseignements requis (consultez le tableau 4). Si les documents fournis ne sont pas dûment remplis ou si des renseignements requis sont manquants ou inexacts, l'avis ne pourra pas être traité. Ce n'est lorsque Santé Canada recevra tous les documents et tous les renseignements requis que l'avis pourra être traité.
6.10.2 Format et directives relatives à la soumission des avis
Les avis de mise en marché, les avis de 12 mois sans vente, les avis de cessation de la vente et les demandes de réattribution de DIN doivent tous être envoyés par voie électronique. Veuillez vous référer au tableau 5 ci-après pour de l'information sur les méthodes de transmission.
Médicaments à usage humain et désinfectants
Les avis de mise en marché, de 12 mois sans vente et de cessation de vente doivent être soumis au Bureau des présentations et de la propriété intellectuelle (BPPI) par le Portail commun des demandes électroniques (PCDE), en utilisant le Processus d'inscription réglementaire (PIR).
1. Pour les transactions en format eCTD, se référer à:
- La Ligne directrice : Préparation des activités réglementation de drogues en format eCTD, disponsible sur la page d'information sur le dépôt des présentations par voie électronique, et
- La Ligne directrice sur le Processus d'inscription réglementaire (PIR), disponible sur la page d'information sur le PIR
2. Pour les transactions en format électronique autre que le format eCTD, se référer à:
- La Ligne directrice : Préparation des activités de réglementation en format non-eCTD, et
- La ligne directrice sur le Processus d'inscription réglementaire (PIR), disponible sur la page d'information sur le PIR.
Médicaments à usage vétérinaire
Les avis de commercialisation, de 12 mois sans vente et de cessation de vente peuvent être soumis par courriel.
Pour les dossiers précédemment déposés au moyen du PIR, ces avis doivent être soumis via le PCDE, en format électronique autre que le format eCTD, en utilisant le PIR, tel qu'indiqué dans :
- La Ligne directrice : Préparation des activités de réglementation en format non-eCTD, et
- La Ligne directrice sur le Processus d'inscription réglementaire (PIR), disponible sur la page d'information du PIR.
Pour tous les médicaments à usage humain ou vétérinaire et les désinfectants : les demandes de réattribution de DIN doivent être soumises par courrier électronique. Veuillez vous référer à l'annexe A pour le modèle.
Type d'avis |
Type d'activité réglementaire |
Description de la transaction réglementaire |
Méthode de transmission |
|---|---|---|---|
Avis de mise en marché |
Faire correspondre le type d'activité réglementaire au numéro de contrôle sous lequel le FDM a été émis |
Formulaire de déclaration de médicaments |
Médicaments à usage humain et désinfectants : obligatoire par l'entremise du PCDE (en utilisant le PIR et le format eCTD). Médicaments à usage vétérinaire : acceptés par courriel, ou par voie du PCDE si un numéro d'identification de dossier a été attribué au produit et si le PIR est utilisé. |
Avis de 12 mois sans vente |
Toujours utiliser le dernier type d'activité réglementaire P(A)DN(UE)(CV) ou (D)DIN(B)(D)(F) approuvé le plus récent. Si le DIN a été attribué en vertu de S(A)PDN, utilise le type d'activité réglementaire du P(A)DN(UE)(CV) auquel il est un supplément. |
Avis de douze mois sans vente (État de DIN dormant) |
Médicaments à usage humain et désinfectants : doivent être envoyés par le PCDE si un numéro d'identification de dossier a été attribué au produit. Sinon, un courriel sera accepté. Médicaments à usage vétérinaire : acceptés par courriel, ou par le PCDE si un numéro d'identification de dossier a été attribué au produit et si le PIR est utilisé. Toujours soumettre sous le numéro de contrôle du dernier type d'activité réglementaire P(A)DN(UE)(CV) ou (D)DIN(B)(D)(F) approuvé le plus récent. Si le DIN a été attribué en vertu de S(A)PDN, utilise le numéro de contrôle de l'activité réglementaire du P(A)DN(UE)(CV) auquel il est un supplément. Pour les produits plus âgées avec des numéros de contrôle au format « #HN######## » ou s'il n'y a pas de numéro de contrôle associé à l'activité réglementaire P(A)DN(UE)(CV) ou (D)DIN(B)(D)(F) approuvé le plus récent, soumettre sous le numéro de contrôle « 000000 ». |
Avis de cessation de vente |
Toujours utiliser le dernier type d'activité réglementaire P(A)DN(UE)(CV) ou (D)DIN(B)(D)(F) approuvé le plus récent. Si le DIN a été attribué en vertu de S(A)PDN, utilise le type d'activité réglementaire du P(A)DN(UE)(CV) auquel il est un supplément. |
Avis de cessation de vente |
Médicaments à usage humain et désinfectants : doivent être envoyés par le PCDE si un numéro d'identification de dossier a été attribué au produit. Sinon, un courriel sera accepté. Médicaments à usage vétérinaire : acceptés par courriel ou par le PCDE, si un numéro d'identification de dossier a été attribué au produit et si le PIR est utilisé. Toujours soumettre sous le numéro de contrôle du dernier type d'activité réglementaire P(A)DN(UE)(CV) ou (D)DIN(B)(D)(F) approuvé le plus récent. Si le DIN a été attribué en vertu de S(A)PDN, utilise le numéro de contrôle de l'activité réglementaire du P(A)DN(UE)(CV) auquel il est un supplément. Pour les produits plus âgées avec des numéros de contrôle au format « #HN######## » ou s'il n'y a pas de numéro de contrôle associé à l'activité réglementaire P(A)DN(UE)(CV) ou (D)DIN(B)(D)(F) approuvé le plus récent, soumettre sous le numéro de contrôle « 000000 ». |
Demande de réattribution de DIN |
S.O | S.O | Envoyer par courriel (voir annexe A) |
6.11 Communiquez avec nous
Toute question concernant les renseignements ou les exigences contenus dans la présente ligne directrice doit être adressée à l'unité d'émission des DIN du BPPI à l'adresse din@hc-sc.gc.ca
Annexe A Modèle : Demande de réattribution de DIN
À : din@hc-sc.gc.ca
Objet : Demande de réattribution de DIN pour [nom du produit – DIN XXXXXXXX]
Bonjour,
Le présent courriel vise à faire une demande de réattribution de DIN XXXXXXXX pour [nom du produit].
Les renseignements ci-après sont fournis pour aider Santé Canada à déterminer si la soumission d'une présentation de drogue ou d'une demande d'autorisation est requise pour la réattribution du DIN.
- Y a-t-il eu des changements dans la formulation depuis l'approbation de la dernière présentation et/ou depuis la cessation de la vente du médicament? O/N
- Y a-t-il eu des changements dans la fabrication depuis l'approbation de la dernière présentation et/ou depuis la cessation de la vente du médicament? O/N
- Est-ce que le produit est disponible dans d'autres juridictions (p. ex. la Food and Drug Administration des États-Unis)? O/N
- Y a-t-il eu des changements dans l'étiquetage depuis l'approbation de la dernière présentation et/ou depuis la cessation de la vente du médicament? O/N
- Y a-t-il eu des réactions indésirables inattendues déclarées à l'échelle nationale ou internationale pour ce médicament? O/N
- Quelles sont les raisons ayant menées à l'annulation de ce DIN?
J'atteste que les renseignements fournis sont justes et exacts.
Cordialement,
[Signature autorisée]