Comprendre la corrosion galvanique
Lyndsie Selwyn
Liste des abréviations
- μL
- microlitre
- ECS
- électrode au calomel saturée
- ESH
- électrode standard à hydrogène
- M
- molarité
- ppm
- partie par million
- p/v
- poids sur volume
La présente ressource d'apprentissage s'adresse aux professionnels du patrimoine qui souhaitent se renseigner sur la corrosion galvanique. Elle s'inscrit dans le cadre de l'atelier « Le soin des métaux dans les collections » de l'Institut canadien de conservation (ICC). La présente ressource a pour but d'expliquer la corrosion galvanique, de présenter les situations dans lesquelles elle peut survenir dans le domaine de la conservation et de décrire des solutions visant à atténuer les problèmes qu'elle peut causer. Elle contient en outre une démonstration illustrant la corrosion galvanique de manière impressionnante et colorée.
Objectifs d'apprentissage
Grâce à une bonne compréhension de la corrosion galvanique, les professionnels du patrimoine seront en mesure :
- de reconnaître les dommages possibles lorsqu'il y a contact direct entre deux métaux;
- d'utiliser une série galvanique et d'en comprendre la signification;
- de trouver des moyens d'atténuer les problèmes liés à la corrosion.
Généralités : les aspects de la corrosion galvanique
La plupart des métaux se corrodent lorsqu'ils sont humides. Lorsque deux métaux humides sont en contact, l'un des deux se corrode plus rapide que si les métaux étaient séparés. Cette augmentation de la vitesse de corrosion s'appelle la corrosion galvanique.
La série galvanique
Il est possible de classer les métaux selon une séquence pour déterminer plus facilement les métaux qui se corroderont de manière accélérée au contact d'un autre métal. Cette séquence s'appelle la série galvanique. Le tableau 1 montre une série galvanique établie pour différents métaux dans l'eau de mer. Bien que le graphite ne soit pas un métal, sa conductivité est néanmoins assez grande pour provoquer la corrosion galvanique; c'est pourquoi il est inclus dans le tableau 1. Les métaux y sont classés du plus réactif – au bas du tableau – au moins réactif – au haut du tableau. Dans toute paire de métaux, le métal ayant un classement inférieur dans la série est le métal le plus actif, alors que celui ayant un classement supérieur est le métal le plus noble. Lorsque deux métaux sont en contact, c'est le métal le plus actif qui est le plus sujet à la corrosion galvanique. À titre d'exemple, si du zinc est en contact avec de l'acier doux, le zinc peut être touché par la corrosion galvanique, car c'est le métal le plus actif.
| Série établie du métal le plus noble (au haut) au plus actif (au bas) |
|---|
| Graphite (carbone) |
| Platine |
| Or |
| Acier inoxydable (alliage 316) |
| Argent |
| Nickel |
| Cuivre-nickel (70:30 % en poids) |
| Plomb |
| Bronze d'étain |
| Brasure d'étain au plomb (50:50 % en poids) |
| Étain |
| Cuivre |
| Laiton jaune |
| Chrome (plaqué sur de l'acier) |
| Acier doux, fonte |
| Cadmium |
| Alliages d'aluminium |
| Zinc |
| Magnésium |
Pour que la corrosion galvanique se produise, les métaux doivent être en contact de deux façons. Premièrement, il doit y avoir un contact électrique, soit par un contact physique direct ou par l'intermédiaire d'un autre corps conducteur, pour que le courant électrique puisse circuler d'un métal à l'autre. Deuxièmement, il doit y avoir un contact ionique permettant un courant ionique entre les deux métaux. Pour ce faire, on a besoin d'un électrolyte, c'est-à-dire une solution contenant des ions provenant, par exemple, d'un sel dissous, d'une base ou d'un acide. Pour qu'un contact ionique survienne, les métaux doivent être entièrement immergés dans l'électrolyte ou être complètement recouverts d'une couche d'électrolyte qui humidifie les deux métaux, ce qui peut être le cas lorsque le taux d'humidité est élevé.
La corrosion galvanique peut comporter certains avantages. En effet, si le métal plus actif se corrode de manière accélérée, la corrosion du métal plus noble s'en trouve alors ralentie. Ainsi, la corrosion galvanique peut servir à protéger un métal de la corrosion en sacrifiant un métal plus actif. Dans un tel cas, le métal plus actif est appelé « anode sacrificielle ». À titre d'exemple, le zinc, l'aluminium et le magnésium, qui ont tous les trois un classement inférieur à celui du fer et de l'acier dans la série galvanique, ont déjà servi d'anodes sacrificielles pour protéger l'acier dans l'eau de mer. Des anodes sacrificielles ont servi à protéger une machine à vapeur en fonte et en fer forgé avant qu'elle soit extraite d'une épave dans l'eau de mer (MacLeod, 1990). De même, des anodes sacrificielles en magnésium ont été enterrées dans le sol autour d'une sculpture en acier exposée à l'extérieur pour en protéger la partie enfouie (Benson, 2014). Cette technique de protection du métal au moyen d'une anode sacrificielle est un exemple qui s'inscrit dans une approche plus générale appelée « protection cathodique », laquelle est également réalisable au moyen d'une électrode métallique et d'une alimentation électrique (Davis, 2000).
Problèmes causés par la corrosion galvanique
Il est important que les restaurateurs connaissent les dangers liés à la corrosion galvanique lorsque deux métaux différents sont en contact. Le danger est parfois évident, par exemple lorsque deux métaux sont utilisés sur une sculpture pour des raisons artistiques. Prenons le cas d'une statue en bronze à d'étain, installée à l'extérieur, dont le personnage tient un objet en acier doux. L'acier peut rouiller en raison de la corrosion galvanique chaque fois que la pluie ou un taux d'humidité élevé dissout des sels ou des polluants pour former un électrolyte, étant donné que l'acier est plus actif que le bronze à l'étain d'après la série galvanique. Les produits de corrosion provenant de l'acier forment des taches de couleur rouille sur le bronze. Notons que l'acier est un alliage de fer contenant une petite quantité de carbone, généralement moins de 1 % en poids (Selwyn, 2004), mais que souvent, on l'appelle simplement « fer ».
La corrosion galvanique peut également toucher des métaux présents dans les éléments de structure; parfois, ces métaux sont dissimulés. À titre d'exemple, des armatures en acier ont autrefois servi à soutenir les sculptures de bronze de l'intérieur. Ainsi, si l'humidité pénètre à l'intérieur d'une telle sculpture, que ce soit directement ou par condensation, il est possible qu'elle forme un électrolyte. Lorsque le bronze et l'acier sont liés par un contact direct et par un électrolyte, l'acier est touché par la corrosion galvanique. Les produits de corrosion du fer provenant de l'acier corrodé peuvent s'échapper, entrer en contact avec la surface de la sculpture et la tacher (Lins, 1985). La corrosion de l'acier peut également causer une « levée de rouille », laquelle se produit lorsque les produits de corrosion du fer s'accumulent et fissurent le bronze. Au fil du temps, si l'acier perd trop de résistance, toute la structure de soutien peut être compromise.
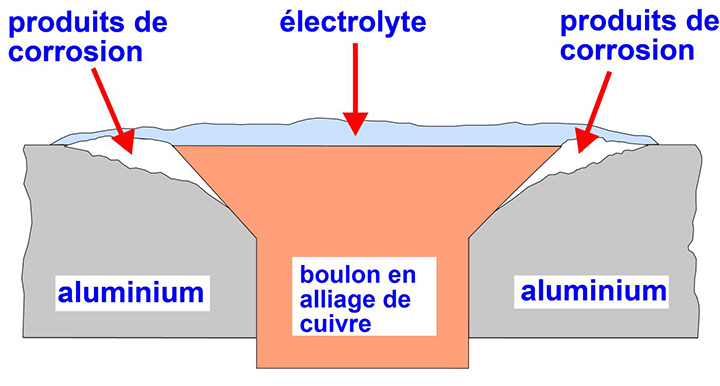
La corrosion galvanique est souvent associée à un mauvais choix de boulons. Si de l'aluminium est maintenu en place à l'aide de boulons faits d'un alliage de cuivre, le cuivre peut provoquer la corrosion galvanique de l'aluminium. La figure 1 montre une partie blanche entourant un boulon central fabriqué avec un alliage de cuivre : il s'agit d'un cas de corrosion de l'aluminium. La corrosion de l'aluminium est pire à proximité de l'alliage de cuivre, comme l'illustre le schéma de la figure 2. De même, lorsque des boulons en acier sont utilisés sur des plaques en bronze, l'acier peut être touché par la corrosion galvanique et former des taches de rouille sur les plaques.

© Gouvernement du Canada, Institut canadien de conservation. ICC 87306-0016
Figure 1. Corrosion galvanique de l'aluminium autour d'un boulon fait d'un alliage de cuivre sur une sculpture extérieure en aluminium. Les produits de corrosion ont formé un anneau blanc autour de la tête foncée du boulon.
© Gouvernement du Canada, Institut canadien de conservation. ICC 129916-0024
Figure 2. Schéma de la corrosion galvanique survenue autour d'un boulon fait d'un alliage de cuivre posé sur une plaque en aluminium.
Composées à base de graphite, les fibres de carbone sont de plus en plus utilisées pour apporter un soutien à la fois léger, inerte et robuste, peu importe si elles sont utilisées seules, sous la forme de tissu ou de tiges, ou si elles sont incorporées à du polymère ou à d'autres matériaux (Mallick, 2008). Il faut néanmoins faire preuve de prudence au moment de les utiliser avec les métaux. Puisque le carbone figure en tête de liste de la série galvanique du tableau 1, il peut provoquer la corrosion galvanique de la plupart des métaux avec lesquels il est en contact. Même les fibres de carbone qui sont entièrement incorporées à du polymère peuvent causer des problèmes si le polymère se dégrade et que le carbone entre en contact avec un métal. Par ailleurs, étant donné que des fibres de carbone sont parfois incorporées à des métaux pour former des composites à matrice métallique, ceux-ci sont sujets à la corrosion galvanique.
Métaux plaqués à l'aide d'un métal de placage plus actif
Bien souvent, la corrosion galvanique s'observe lorsqu'un métal est plaqué sur un autre. Afin de déterminer dans quelle mesure l'objet se corrodera, il faut savoir si le métal appliqué pour en recouvrir l'autre, appelé « métal de placage », est le plus actif ou le plus noble. Un exemple courant où le métal de placage est plus actif que le métal recouvert est l'acier galvanisé, qui est le résultat de l'application d'un revêtement de zinc sur de l'acier.
Le revêtement de zinc protège l'acier de deux façons : grâce à la corrosion galvanique d'une part et parce que le revêtement agit comme barrière physique d'autre part. Si la couche de zinc demeure intacte, le zinc sert de barrière physique contre l'humidité, et l'acier ne subira donc pas de corrosion. Bien que le zinc soit plus actif que l'acier, il est protégé par ses produits de corrosion, généralement le carbonate de zinc, et il se corrode plus lentement à l'extérieur que l'acier non protégé. Si la couche de zinc est rayée ou endommagée de telle sorte que l'acier est exposé, le zinc se corrode en premier et protège ainsi l'acier exposé par corrosion galvanique.
La protection par corrosion galvanique du zinc est l'un des avantages qu'offre l'acier galvanisé. Par contre, puisque le zinc se trouve plus bas que la plupart des autres métaux dans la série galvanique, le zinc sur l'acier galvanisé peut se corroder rapidement si l'acier galvanisé est utilisé avec d'autres métaux. L'acier sera ainsi laissé sans protection une fois que la majeure partie du zinc aura disparu. Maltby (2003) donne un exemple de ce phénomène pour l'acier galvanisé en contact avec de l'acier.
L'aluminium et le cadmium se trouvent également plus bas que l'acier dans la série galvanique, et tous deux ont déjà été utilisés pour protéger l'acier. On se sert également d'alliages d'aluminium et de zinc pour appliquer un revêtement sur l'acier; ces alliages ont des noms commerciaux comme Aluzinc, Galfan, Galvalume et Zincalume. Par le passé, le cadmium a servi à plaquer la quincaillerie en acier des meubles, mais il l'est moins de nos jours en raison de sa toxicité.
Métaux plaqués à l'aide d'un métal de placage plus noble
Le placage d'un métal plus noble sur un métal plus actif est souvent fait pour produire un objet qui a toutes les apparences du métal plus noble. À titre d'exemple, on peut penser aux sculptures de zinc plaquées de cuivre, aux rampes d'escalier en laiton chromé, aux plateaux de cuivre plaqués argent ou aux objets religieux dorés où l'or est plaqué sur de l'argent ou des alliages de cuivre. De nombreux métaux peuvent être plaqués sur de l'acier : les alliages de cuivre, comme sur les structures de lit en laiton; l'argent, sur les ustensiles de cuisine; le chrome, sur les pièces automobiles; l'étain, sur les boîtes de conserve étamées; et le nickel, souvent plaqué sur de l'acier avant que l'on ne plaque du chrome par-dessus. Tant que le revêtement est continu et sans porosité, seul le métal le plus noble est exposé, et ce dernier agit comme une barrière pour protéger de la corrosion le métal qui se trouve en dessous. Si le métal le plus noble se corrode lentement, il est possible que la protection qu'il offre dure longtemps.
Si le métal de placage présente des imperfections ou est endommagé, le métal sous-jacent ainsi exposé peut se corroder. Dans un tel cas, la corrosion galvanique n'offre aucune protection; au contraire, la corrosion galvanique augmente le taux de corrosion du métal sous-jacent. À titre d'exemple, les sculptures de zinc plaquées de cuivre peuvent être endommagées gravement par la corrosion par piqûres aux endroits où se trouvent des imperfections du cuivrage en raison de la corrosion galvanique du zinc, en particulier à l'extérieur (Grissom, 1994). La boîte de conserve qui, en réalité, est faite d'acier étamé, en est un autre exemple. L'étain est plus noble que l'acier, de sorte que l'acier sous-jacent sera touché par la corrosion galvanique si l'étain est endommagé.
La corrosion du métal sous-jacent, si elle est concentrée sur une petite surface, peut fragiliser la couche de placage et entraîner le soulèvement de cette dernière. La figure 3 montre le soulèvement du placage d'argent d'un casse-noisettes en acier plaqué argent; la figure 4 montre le soulèvement du placage de chrome se produisant sur le pourtour en acier chromé d'un phare.

© Gouvernement du Canada, Institut canadien de conservation. ICC 129916-0017
Figure 3. Un casse-noisettes en acier plaqué argent endommagé par la corrosion galvanique de l'acier. La formation de produits de corrosion du fer provenant de l'acier corrodé a provoqué l'apparition de bulles et le soulèvement du placage.

© Gouvernement du Canada, Institut canadien de conservation. ICC 129916-0019
Figure 4. Pourtour en acier chromé d'un phare. L'acier a été touché par la corrosion galvanique. La formation de produits de corrosion du fer provenant de l'acier corrodé a provoqué le soulèvement du placage et la formation de taches à la surface du chrome.
Il existe des cas où le placage se produit involontairement, ce qui conduit à la corrosion galvanique. Si l'eau d'une fontaine ornée d'une sculpture d'aluminium contient des ions de cuivre provenant de tuyaux en cuivre, le cuivre se déposera sur l'aluminium par placage électrochimique de remplacement; consulter la Note de l'ICC 9/12 Comment plaquer une couche d'argent sur des alliages de cuivre à l'aide de produits chimiques. Les zones où le cuivre s'est plaqué causeront alors la corrosion galvanique de l'aluminium dans les zones non plaquées, produisant ainsi des piqûres. Le même problème survient lorsque du cuivre se plaque sur du zinc; en fait, aussi peu que 0,1 ppm d'ions de cuivre dans l'eau suffit pour augmenter le taux de corrosion du zinc (Zhang, 2006).
Prévention et traitement de la corrosion galvanique
Il est important de connaître les combinaisons de matériaux qui peuvent conduire à la corrosion galvanique. Cela est particulièrement vrai lors de la commande de nouvelles œuvres d'art, car il est plus facile d'éviter un problème au moment de la conception que de le régler plus tard, une fois l'œuvre terminée. Lorsqu'on entend mettre en contact deux métaux différents, il faut voir à ce que les métaux utilisés soient aussi près que possible l'un de l'autre dans la série galvanique. À titre d'exemple, si l'on propose d'utiliser de l'acier pour l'armature à l'intérieur d'une sculpture de bronze, il serait préférable d'utiliser de l'acier inoxydable, lequel se trouve plus haut dans la série galvanique apparaissant dans le tableau 1.
Une autre approche pour prévenir la corrosion galvanique consiste à séparer les différents métaux à l'aide d'un isolant, comme le Téflon ou un autre plastique. Pour ce faire, il est possible d'utiliser, par exemple, une armature faite d'un métal plus actif dans une sculpture composée d'un métal plus noble. Malheureusement, s'il y a beaucoup de zones de contact, la défaillance d'une seule de ces zones mettra les deux métaux en contact électrique. De plus, si l'isolant devient poreux en vieillissant, il peut agir comme une éponge et piéger les électrolytes. Ce problème a été observé sur la statue de la Liberté, où les séparateurs faits d'amiante enduit de gomme laque sont devenus poreux au fil du temps (Baboian et Cliver, 1990). Les isolants placés entre les métaux pour prévenir la corrosion galvanique devraient être inspectés régulièrement dans le cadre d'un programme d'entretien.
Rien ne peut être fait pour séparer les deux métaux dans un objet plaqué. Un objet plaqué où le métal le plus noble est sur le dessus est un exemple de vice inhérent, car le problème de corrosion galvanique est inhérent à l'objet. La seule chose à faire est de garder l'objet dans un environnement qui n'est pas propice à la corrosion galvanique. Puisque les métaux sont irréversiblement reliés par une connexion électrique, il faut éviter d'établir une connexion par l'intermédiaire d'un électrolyte. L'objet doit être entreposé dans un environnement sec ou être protégé à l'aide d'un cirage régulier ou d'autres revêtements. Si une statue est destinée à être exposée à l'extérieur, mais que l'on sait qu'elle sera vraisemblablement détruite par la corrosion galvanique, on peut alors envisager, en dernier recours, de créer une réplique faite de matériaux différents et de la placer à l'extérieur, pendant que l'on entrepose la statue originale à l'intérieur, dans un environnement contrôlé.
Si la corrosion galvanique menace l'intégrité structurelle d'un objet, les pièces corrodées devraient être remplacées. Une telle tâche peut s'avérer difficile, surtout lorsqu'il est question de sculptures de grande taille. À titre d'exemple, dans les années 1980, il a fallu remplacer environ 1 800 barres en fer forgé de l'armature de la statue de la Liberté (Statue of Liberty) par des barres en acier inoxydable (Einbinder, 1990; Baboian et Cliver, 1990). Dans le cas de la statue en bronze d'un peu plus de 11 mètres et de 27 tonnes de William Penn sur le toit de l'hôtel de ville de Philadelphie, des boulons en fer forgé ont servi, au moment de son installation en 1894, à ancrer le socle de la statue. Les boulons ont dû être remplacés dans les années 1970, car ils risquaient de se briser en raison de la détérioration par corrosion galvanique (Lins, 1985).
Activité : démonstration de la corrosion galvanique
Dans la démonstration suivante de la corrosion galvanique, on utilise du laiton, un alliage de cuivre et de zinc, pour accélérer la corrosion d'un clou en fer. La feuille de laiton utilisée dans cette démonstration est une feuille de calage composée de 70 % de cuivre et de 30 % de zinc d'une épaisseur de 0,025 mm (0,001 po). Une feuille si mince peut être pliée facilement. Aux fins de la démonstration, on a utilisé des indicateurs dans l'électrolyte pour que les résultats des réactions anodique et cathodique soient apparents. On mélange l'électrolyte avec de la gélose pour produire un gel qui empêche les couleurs des indicateurs de se disperser. La gélose (aussi appelée « agar-agar ») est une poudre beige duveteuse insoluble dans l'eau à température ambiante; toutefois, elle se dissout facilement dans de l'eau bouillante et se transforme en un gel translucide ferme lorsqu'elle refroidit sous la barre des 40 °C (Scott, 2012). Pour les besoins de la présente démonstration, une gélose bon marché servant habituellement à des travaux de microbiologie convient bien, mais une autre gélose, quelle qu'en soit la qualité, devrait tout aussi bien fonctionner.
Avant d'effectuer cette démonstration ou de préparer les solutions, consulter la fiche de données de sécurité de chaque produit chimique utilisé. Il faut porter l'équipement de protection individuelle recommandé, comme une protection pour les yeux, des gants jetables (par exemple, de nitrile) et des vêtements de protection. La phénolphtaléine est une substance réputée cancérigène. Il faut faire sécher les échantillons produits dans le cadre de la démonstration avant de les éliminer en tant que déchets dangereux.
Équipement et matériel requis pour faire la démonstration de la corrosion galvanique d'un clou en fer
- Deux clous en fer de 25,4 mm (1 po); utiliser des clous communs non galvanisés
- Feuille de laiton d'une taille de 51 mm × 13 mm × 0,025 mm (2 po × 0,5 po × 0,001 po)
- Papier abrasif, par exemple du papier abrasif régulier (granulométrie : 600 à 1 500), ou des abrasifs coussinés, comme ceux de la marque Micro-Mesh (grades réguliers 1 800 à 6 000)
- Acétone
- Cylindre gradué de 50 mL
- Eau (distillée ou déionisée; ne pas utiliser de l'eau du robinet), environ 40 mL
- Bécher en verre de 100 mL
- Balance précise à 0,01 g près
- Spatule
- 1,20 g de chlorure de sodium (NaCl; ne pas utiliser du sel de table)
- 1,20 g de gélose
- Plaque chauffante
- Tige de verre pour agiter
- Chronomètre
- Pipette réglable (aussi appelée « micropipette ») dans une fourchette de 200 μL à 1 000 μL ou seringue graduée de 1 mL pour le transfert de volumes de 400 μL ou 800 μL
- Solution mère de phénolphtaléine à 1 % (p/v) dans l'éthanol; consulter Préparation de la solution mère pour l'indicateur : phénolphtaléine à 1 % (p/v) dans de l'éthanol
- Solution mère de ferricyanure de potassium à 1 % (p/v) dans l'eau; consulter Préparation de la solution mère pour l'indicateur : ferricyanure de potassium à 1 % (p/v) dans de l'eau
- Deux petites boîtes de Petri jetables en polystyrène (60 mm × 15 mm)
- Thermomètre (pouvant mesurer de la température ambiante jusqu'à 100 °C)
- Petite lime en métal
Procédure pour faire la démonstration de la corrosion galvanique
- Dégraisser les clous en les frottant avec de l'acétone, au cas où ils seraient recouverts d'une couche d'huile, puis les sécher.
- Limer le rebord de la tête de chaque clou afin que les clous puissent être déposés à l'horizontale (sur la longueur) (figure 5).
- Poncer les clous avec le papier abrasif légèrement plus grossier, comme l'abrasif coussiné Micro-Mesh 1 800.
- Utiliser de l'acétone pour essuyer les limailles de fer et la poussière produites par l'abrasion.
- Dégraisser la feuille de laiton en l'essuyant avec de l'acétone, puis la sécher.
- Poncer le laiton avec le papier abrasif légèrement plus fin, comme l'abrasif coussiné Micro-Mesh 6 000.
- Retirer toute particule de la feuille de laiton à l'aide de l'acétone.
- Envelopper doucement la tige de l'un des deux clous avec le laiton en laissant environ 20 mm non enveloppés; il n'est pas nécessaire que le laiton soit serré autour du clou (figure 6).
- Placer le clou et le laiton dans le fond d'une boîte de Petri afin que le clou soit à l'horizontale (c'est-à-dire le rebord limé vers le bas) et que le laiton se plie par-dessus plutôt que par-dessous le clou.
- Placer l'autre clou dans le fond de l'autre boîte de Petri afin que le clou soit à l'horizontale.
- Préparer une solution contenant de la gélose et du chlorure de sodium.
- Mesurer 40 mL d'eau distillée à l'aide d'un cylindre gradué et verser l'eau dans un bécher de verre de 100 mL.
- Peser 1,20 g de NaCl à l'aide de la spatule et de la balance, transférer le tout dans l'eau et agiter pour dissoudre, ce qui donne une solution à 3 % (p/v) ou 0,51 M de NaCl.
- Peser 1,20 g de gélose à l'aide de la spatule et de la balance, puis transférer le tout dans le mélange d'eau et de sel, ce qui donne une solution à 3 % (p/v).
- Utiliser la plaque chauffante pour porter la solution à ébullition. Remuer doucement pendant que la solution chauffe afin d'éviter que la gélose ne colle au fond du bécher et ne brunisse.
- Une fois que la solution commence à bouillir, poursuivre l'ébullition pendant trois minutes (chronométrées). Continuer à remuer doucement pendant que la solution bout.
- Retirer du feu et continuer à remuer doucement pendant que la solution refroidit. À température ambiante, il faut environ 15 minutes pour que la solution cesse de bouillir et qu'elle atteigne 50 °C.
- Surveiller la température de la solution pendant qu'elle refroidit. Lorsque la solution atteint environ 65 °C, y ajouter les indicateurs.
- Ajouter 800 μL de la solution de ferricyanure de potassium à l'aide de la pipette réglable. La solution de gélose deviendra jaune pâle. Bien mélanger afin que la couleur soit homogène.
- Ajouter 400 μL de la solution de phénolphtaléine à l'aide de la pipette réglable. La solution devrait demeurer jaune. Bien mélanger.
- Continuer à surveiller la température de la solution et à remuer doucement. (Éviter de remuer vigoureusement, puisque cela peut créer des bulles. Remuer continuellement permet d'éviter la gélification de la gélose et empêche cette dernière de coller à la surface plus froide du bécher en verre.)
- Lorsque la température de la solution atteint 50 °C, la verser doucement dans les deux boîtes de Petri. Verser assez de solution pour recouvrir les échantillons métalliques, sans plus, soit environ 10 mL. Si la partie plate de la feuille de laiton est trop près du fond de la boîte de Petri, une bulle d'air pourrait rester emprisonnée sous le laiton. Cependant, le laiton a aussi tendance à flotter; on pourra éviter ce phénomène en versant un peu de la solution sur le dessus du laiton pendant que la boîte se remplit.
- Prendre note de l'heure. La gélose devrait être complètement gélifiée après environ cinq minutes. Une fois que la gélose s'est gélifiée, il devrait être possible de mettre la boîte de Petri à l'envers sans que son contenu ne tombe.
- Noter la couleur de la solution au début de l'expérience.
- Surveiller la couleur pendant plusieurs heures ou jusqu'au lendemain.
Résultats de la démonstration de la corrosion galvanique d'un clou de fer
La figure 5 montre un clou dont une partie de la tête a été limée à plat en comparaison avec un clou non limé. Limer le clou de cette façon permet de l'étendre à plat dans la boîte de Petri. La figure 6 montre un clou de fer qui a été enveloppé dans une feuille de laiton, placé avec le côté limé vers le bas et la feuille de laiton passant par-dessus.

© Gouvernement du Canada, Institut canadien de conservation. ICC 129916-0003
Figure 5. Deux clous de fer. La tête du clou apparaissant à droite a été limée afin que le rebord soit au ras de la tige du clou.

© Gouvernement du Canada, Institut canadien de conservation. ICC 129916-0004
Figure 6. Clou de fer enveloppé dans une feuille de laiton dans une boîte de Petri.
Les figures 7, 8 et 9 montrent la corrosion de deux clous, l'un étant en contact avec une feuille de laiton et l'autre, non. La couleur jaune pâle de la gélose est causée par le ferricyanure de potassium. La photo de la figure 7 a été prise environ deux minutes après que la solution de gélose eut été versée dans les boîtes de Petri. De légères zones rosées et bleutées sont visibles. Sur la photo de la figure 8, prise après une heure, les régions bleues et roses sont bien définies, et sur la photo de la figure 9, après huit heures, ces régions de couleur sont encore plus grandes. La corrosion du clou produit des ions de fer(II) (Fe2+), qui réagissent avec le ferricyanure de potassium pour créer une teinte bleue. Là où l'oxygène est réduit, des ions OH− sont produits; ceux-ci réagissent avec la phénolphtaléine pour créer une teinte rose. La croissance des régions colorées à mesure que le clou se corrode est montrée dans une vidéo en accéléré de la corrosion galvanique.

© Gouvernement du Canada, Institut canadien de conservation. ICC 129916-0006
Figure 7. Clou de fer et feuille de laiton dans une boîte de Petri (à gauche) et clou de fer dans une boîte de Petri (à droite), deux minutes après que la solution de gélose eut été versée dans les boîtes de Petri. De petites régions rosées et bleutées commencent à apparaître.
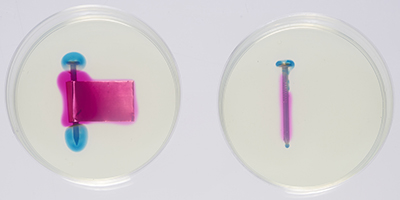
© Gouvernement du Canada, Institut canadien de conservation. ICC 129916-0007
Figure 8. Clou de fer et feuille de laiton dans une boîte de Petri (à gauche) et clou de fer dans une boîte de Petri (à droite), après une heure. Les régions rosées et bleutées sont maintenant clairement définies.

© Gouvernement du Canada, Institut canadien de conservation. ICC 129916-0014
Figure 9. Clou de fer et feuille de laiton dans une boîte de Petri (à gauche) et clou de fer dans une boîte de Petri (à droite), après huit heures. Les régions rosées et bleutées ont pris de l'ampleur.
Dans chaque cas, les régions bleutées et rosées sont nettement plus grandes pour les clous enveloppés dans une feuille de laiton, ce qui indique que le laiton a fait augmenter le taux de corrosion. La corrosion accrue est le résultat de la corrosion galvanique du fer due au contact avec le laiton. Pour ce qui est du clou sans laiton, le fer se corrode généralement là où le processus de fabrication a exercé une pression sur le clou. Dans le présent exemple, seule la tête est corrodée; souvent, par contre, les deux extrémités du clou se corrodent et, dès lors, du bleu apparaît aux deux extrémités de celui-ci et la gélose autour du milieu du clou devient rose.
La couleur bleue provient de l'indicateur de ferricyanure de potassium, qui réagit avec les ions Fe2+ produits par la corrosion du clou. Le ferricyanure de potassium (K3[FeIII(CN)6]) se dissout dans la solution pour produire des ions ferricyanure ([FeIII(CN)6]3−), lesquels réagissent avec les ions Fe2+ pour produire du bleu de Prusse (Ware, 2008). À la figure 9, après huit heures, il y a des traces de brun dans les régions bleues. Le brun provient de composés de Fe(III), qui sont formés à partir d'ions Fe2+ ayant réagi avec l'oxygène dans la solution pour former de la rouille brune au lieu de réagir avec le ferricyanure de potassium.
La couleur rose provient de la phénolphtaléine, un indicateur de pH courant. La phénolphtaléine est incolore dans les solutions neutres et légèrement acides; elle devient rose dans les solutions basiques dont le pH est de 8 et plus (Skoog et coll., 2014). Aux figures 8 et 9, les ions hydroxyde sont produits lors de la réaction cathodique de l'oxygène sur la surface du laiton dans la boîte de Petri de gauche et sur les parties du clou qui ne se corrodent pas de la boîte de Pétri de droite. Les ions hydroxyde rendent la solution plus basique, ce qui crée la couleur rose. La séparation de la région rose de la région bleue montre que la réaction de l'oxygène et la corrosion du clou se produisent à des endroits différents.
Procédures supplémentaires
Préparation de la solution mère pour l'indicateur : phénolphtaléine à 1 % (p/v) dans de l'éthanol
La procédure suivante peut servir à préparer 100 mL de solution de phénolphtaléine à 1 % (p/v) dans de l'éthanol.
Équipement et matériel requis pour préparer la solution mère de phénolphtaléine
- Phénolphtaléine (poudre blanche)
- Balance précise à 0,01 g près
- Éthanol anhydre
- Fiole jaugée de 100 mL
- Spatule
- Pipette Pasteur
- Entonnoir
- Bouteille brune pour contenir 100 mL
- Étiquette
Procédure pour préparer la solution mère de phénolphtaléine
- Remplir environ la moitié de la fiole jaugée de 100 mL avec de l'éthanol.
- Peser 1,00 g de phénolphtaléine à l'aide de la spatule et de la balance.
- Ajouter la phénolphtaléine à l'éthanol dans la fiole jaugée.
- Remuer pour dissoudre le tout le plus possible.
- Remplir la fiole jaugée jusqu'à un peu moins de 100 mL avec de l'éthanol. Bien mélanger.
- Ajuster le bas du ménisque à la ligne de 100 mL avec de l'éthanol en utilisant la pipette Pasteur. Remarque : la solution devrait être incolore.
- Transférer le liquide dans la bouteille à l'aide de l'entonnoir.
- Étiqueter la bouteille.
Préparation de la solution mère pour l'indicateur : ferricyanure de potassium à 1 % (p/v) dans de l'eau
La procédure suivante peut servir à préparer 100 mL d'une solution aqueuse de ferricyanure de potassium à 1 % (p/v).
Équipement et matériel requis pour préparer la solution mère de ferricyanure de potassium
- Ferricyanure de potassium (sel rouge-orange)
- Balance précise à 0,01 g près
- Eau (distillée ou déionisée)
- Fiole jaugée de 100 mL
- Spatule
- Pipette Pasteur
- Entonnoir
- Bouteille brune pour contenir 100 mL
- Étiquette
Procédure pour préparer la solution mère de ferricyanure de potassium
- Remplir environ la moitié de la fiole jaugée de 100 mL avec de l'eau.
- Peser 1,00 g de ferricyanure de potassium à l'aide de la spatule et de la balance.
- Ajouter le ferricyanure de potassium à l'eau dans la fiole jaugée.
- Remuer pour dissoudre le tout le plus possible.
- Remplir la fiole jaugée jusqu'à un peu moins de 100 mL avec de l'eau. Bien mélanger.
- Ajuster le bas du ménisque à la ligne de 100 mL avec de l'eau en utilisant la pipette Pasteur. Remarque : la solution devrait être jaune-vert.
- Transférer le liquide dans la bouteille brune à l'aide de l'entonnoir.
- Étiqueter la bouteille.
Aspects scientifiques de la corrosion galvanique
Potentiel de corrosion et série galvanique
Lorsqu'un métal se corrode dans un électrolyte, les atomes du métal se séparent en ions et en électrons (e-), les ions se dissolvant dans l'électrolyte. À titre d'exemple, voici la réaction pour le fer (Fe) :
Fe → Fe2+ + 2e−
C'est ce que l'on appelle une réaction anodique, laquelle se traduit par la formation d'ions Fe2+. D'autres réactions éliminent les électrons; par exemple, l'oxygène (O2) dissous dans un électrolyte peut réagir pour former des ions hydroxydes (OH−), à savoir la réaction suivante :
O2 + 2H2O + 4e− → 4OH−
C'est ce que l'on appelle une réaction cathodique. Les électrons sont déposés dans le métal lors de la réaction anodique et en sont retirés lors de la réaction cathodique. L'équilibre est atteint lorsque les électrons sont déposés et retirés au même rythme.
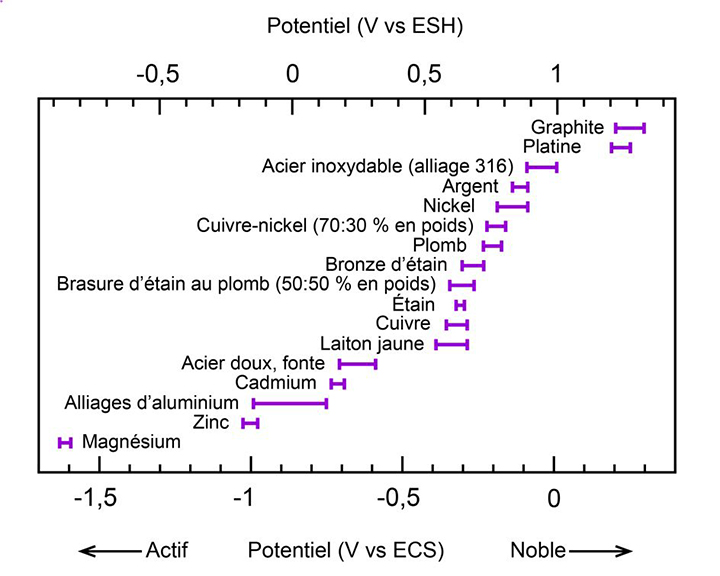
Les charges électriques des ions et des électrons font en sorte que le métal acquiert un potentiel électrique. Pour un métal qui se corrode, alors que deux réactions ou plus se produisent simultanément, ce potentiel est appelé « potentiel mixte » ou « potentiel de corrosion ». La série galvanique présentée dans le tableau 1 est fondée sur des valeurs de potentiel de corrosion. La figure 10 montre les potentiels de corrosion (tirés de LaQue, 1975) pour différents métaux et alliages mesurés dans l'eau de mer. Le potentiel de corrosion dépend de la réactivité du métal concerné.
Par exemple, le zinc acquiert un potentiel de corrosion plus faible (plus négatif) que le fer, ce qui le place sous le fer dans la série galvanique.
© Gouvernement du Canada, Institut canadien de conservation. ICC 129916-0025
Figure 10. Série galvanique pour certains métaux dans l'eau de mer. Les barres horizontales montrent la plage du potentiel de corrosion pour chaque métal, mesuré en volts (V) à l'aide d'une électrode au calomel saturée (ECS, valeur inférieure) ou à l'aide d'une électrode standard à hydrogène (ESH, valeur supérieure). Les valeurs sont tirées de LaQue (1975).
Description de la figure 10
Les métaux énumérés ci-dessous sont présentés du plus noble au plus actif.
Graphite
Platine
Acier inoxydable (alliage 316)
Argent
Nickel
Cuivre-nickel (70:30 % en poids)
Plomb
Bronze d'étain
Brasure d'étain au plomb (50:50 % en poids)
Étain
Cuivre
Laiton jaune
Acier doux, fonte
Cadmium
Alliages d'aluminium
Zinc
Magnésium
Le potentiel de corrosion dépend de l'ensemble des réactions qui se produisent à la surface du métal; il dépend donc de divers facteurs, comme la composition de l'électrolyte et la quantité d'oxygène dissous. À la figure 10, le potentiel de corrosion de chaque métal est représenté par une plage de valeurs, plutôt que par une seule valeur, et ce, en raison des variations qui touchent les facteurs en cause. De plus, en raison de ces variations, le classement des métaux dans la série galvanique peut être différent d'un ouvrage de référence à un autre. La position du plomb, par exemple, à la figure 10 et dans le tableau 1, est plus élevée que dans la série galvanique qu'a établie le département de la Défense américain (département de la Défense des É.-U., 2016).
Dans les tableaux ou graphiques publiés qui présentent des séries galvaniques, il est possible que l'on montre l'acier inoxydable et d'autres alliages à deux positions différentes. L'une de ces deux positions, généralement appelée « passive », correspond à l'alliage dans des conditions dites normales. Il s'agit de la position de l'acier inoxydable dans le tableau 1 et à la figure 101. L'autre position, soit la position « active », est plus basse dans la série galvanique et s'applique en cas de rupture du film passif protégeant l'alliage, comme cela peut se produire dans les piqûres et les fissures (LaQue, 1975).
Corrosion de métaux en contact
Lorsque deux métaux, comme l'argent et le fer, sont mis en contact dans un électrolyte, le potentiel des deux métaux est contraint de s'équilibrer et, pour ce faire, il se stabilise à une nouvelle valeur entre le potentiel de corrosion respectif des deux métaux. Par conséquent, les taux de corrosion des deux métaux changent. Le métal le plus actif, le fer, se corrode plus rapidement qu'il ne le ferait seul, tandis que le métal le plus noble, l'argent, se corrode plus lentement. Parallèlement, les taux associés aux réactions cathodiques, comme la réaction de l'oxygène, changent dans la direction opposée, c'est-à-dire que la réaction cathodique s'accélère sur le métal le plus noble et ralentit sur le métal le plus actif. Le taux de corrosion accru du métal le plus actif, le fer dans cet exemple, est la corrosion galvanique. La série galvanique en soi ne révèle pas à quel point le taux de corrosion changera; néanmoins, la corrosion galvanique est généralement plus importante pour les métaux qui sont très éloignés les uns des autres dans la série galvanique.
La figure 11 montre un exemple de ces réactions dans une zone où une couche d'argent plaquée a été endommagée, exposant le fer sous-jacent. Dans ce cas, la corrosion est accentuée par les surfaces relatives des deux métaux; la couche d'argent sur le dessus offre une grande surface sur laquelle l'oxygène peut réagir.

© Gouvernement du Canada, Institut canadien de conservation. ICC 129916-0023
Figure 11. Schéma de la corrosion à l'endroit où se trouve une rayure ou un défaut sur du fer plaqué argent.
Remerciements
Merci tout spécialement à Jacqueline Riddle d'avoir contribué à l'élaboration de cette ressource d'apprentissage. Merci également à Jean-Bernard Memet d'avoir fourni la recette pour la préparation de la démonstration.
Fournisseurs
Remarque : les renseignements qui suivent visent uniquement à informer le lecteur. Le fait qu'une entreprise figure dans la présente liste ne signifie pas pour autant qu'elle est approuvée par l'ICC.
Produits chimiques et matériel de laboratoire
Les produits chimiques, dont la gélose, la phénolphtaléine et le ferricyanure de potassium, sont vendus par des fournisseurs de substances chimiques, comme :
- Fisher Scientific
- Sigma-Aldrich (en anglais seulement)
Alliages de cuivre
Les feuilles de laiton sont vendues sous la forme de feuilles de laiton pour cales minces par Lee Valley Tools.
Feuilles abrasives de marque Micro-Mesh
Les feuilles abrasives de marque Micro-Mesh sont vendues par Micro-Surface Finishing Products (en anglais seulement).
Bibliographie
Baboian, R., et E. B. Cliver. « Corrosion on the Statue of Liberty: An Overview », dans The Statue of Liberty Restoration (sous la direction de R. Baboian, E. B. Cliver et E. L. Bellante), Houston (Texas), National Association of Corrosion Engineers, 1990, p. 75-83.
Benson, P. L. « Some Considerations in Determining New Paint Systems for Use in the Treatment of Painted Fiberglass and Steel Outdoor Sculptures », dans Conserving Outdoor Painted Sculpture: Proceedings from the Interim Meeting of the Modern Materials and Contemporary Art Working Group of ICOM-CC, Kröller-Müller Museum, Otterlo, the Netherlands, 4-5 June 2013 (sous la direction de L. Beerkens et T. Learner), Los Angeles (Californie), Getty Conservation Institute, 2014, p. 87-94.
Davis, J. R. (directeur de publication). Corrosion: Understanding the Basics, Materials Park (Ohio), ASM International, 2000, p. 407-421.
Département de la Défense des États-Unis. MIL-STD-889C. Department of Defense Standard Practice: Dissimilar Metals (en anglais seulement), s. l., département de la Défense, États-Unis d'Amérique, 2016.
Einbinder, M. « Armature Replacement on the Statue », dans The Statue of Liberty Restoration (sous la direction de R. Baboian, E. B. Cliver et E. L. Bellante), Houston (Texas), National Association of Corrosion Engineers, 1990, p. 129-130.
Fontana, M. G. Corrosion Engineering, troisième édition, New York (New York), McGraw-Hill, 1986, p. 43.
Grissom, C. A. « The Conservation of Outdoor Zinc Sculpture », dans Ancient and Historic Metals: Conservation and Scientific Research (sous la direction de D. A. Scott, J. Podany et B. B. Considine), Marina del Rey (Californie), Getty Conservation Institute, 1994, p. 279-304.
LaQue, F. L. Marine Corrosion: Causes and Prevention, New York (New York), Wiley, 1975, p. 179.
Lins, A. « Outdoor Bronzes: Some Basic Metallurgical Considerations », dans Sculptural Monuments in an Outdoor Environment (sous la direction de V. Naudé), Philadelphia (Pennsylvanie), Pennsylvania Academy of the Fine Arts, 1985, p. 8-20.
MacLeod, I.D. « Conservation Management of Iron Steamships—the S.S. Xantho (1872) », dans Fifth National Conference on Engineering Heritage 1990: Interpreting Engineering Heritage, Perth, 3–5 December 1990: Preprints (sous la direction de A. Moulds, B. W. S. James, J. F. Moynihan et C. Keith), Perth (Australie), Institution of Engineers, 1990, p. 75-80.
Maltby, S. L. « The Conservation and Preservation of Architectural Sheet Metal Work », National Association of Corrosion Engineers Northern Area Eastern Conference, Ottawa, 15–17 September 2003, Ottawa (Ontario), NACE, 2003. Offert sur CD.
Mallick, P. K. Fiber-Reinforced Composites: Materials, Manufacturing, and Design, troisième édition, Boca Raton (Floride), CRC Press, 2008, p. 6-23.
Scott, C. L. « The Use of Agar as a Solvent Gel in Objects Conservation », American Institute for Conservation of Historic and Artistic Works Objects Specialty Group Postprints, no 19 (2012), p. 71-83.
Selwyn, L. Métaux et corrosion : Un manuel pour le professionnel de la conservation, Ottawa (Ontario), Institut canadien de conservation, 2004, p. 96-97.
Skoog, D. A., D. M. West, F. J. Holler et S. R. Crouch. Fundamentals of Analytical Chemistry, neuvième édition, Belmont (Californie), Brooks/Cole, 2014, p. 323-326.
Ware, M. « Prussian Blue: Artists' Pigment and Chemists' Sponge », Journal of Chemical Education, vol. 85, no 5 (2008), p. 612-621.
Zhang, X. G. « Zinc », dans Uhlig's Corrosion Handbook (sous la direction de R. W. Revie), deuxième édition, Hoboken (New Jersey), Wiley, 2006, p. 887-904.
Détails de la page
- Date de modification :