Ce que nous avons entendu
Réponses à la consultation publique sur le livre blanc Diffusion publique de renseignements cliniques dans les présentations de médicaments et les demandes d'homologation d'instruments médicaux
Qui a donné des commentaires?
Du 10 mars au 26 mai 2017, Santé Canada a reçu 45 commentaires individuels en réponse au livre blanc de Santé Canada intitulé Diffusion publique de renseignements cliniques dans les présentations de médicaments et les demandes d'homologation d'instruments médicaux.
La ventilation des réponses par groupes d'intervenants figure au Diagramme Circulaire 1 ci-dessous.
*Veuillez noter : les chiffres ci-dessous reflètent le nombre de soumissions individuelles provenant de chaque groupe d'intervenants.
Certaines soumissions ont été soumises au nom de plusieurs personnes ou organisations.
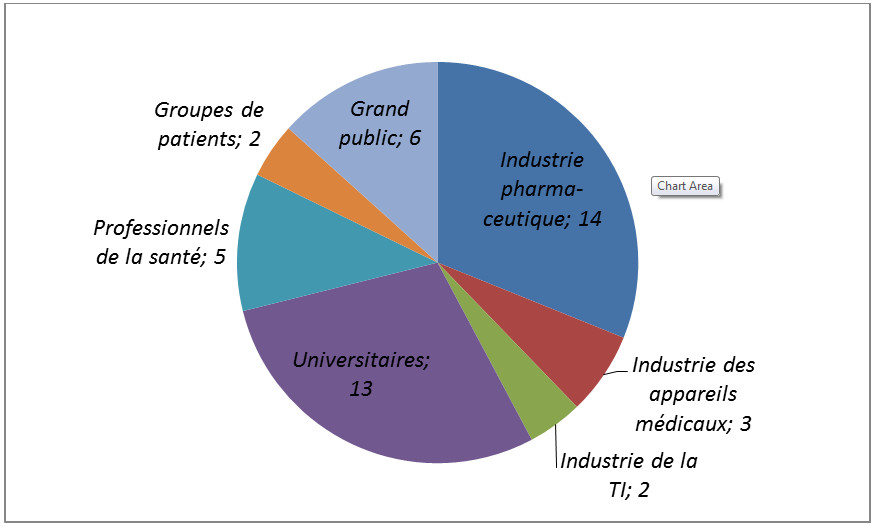
Diagramme Circulaire 1 - Équivalent textuel
Diagramme Circulaire: Tableau 1: réponses, par groupe d'intervenants.
Ce graphique illustre la répartition des réponses par groupe d'intervenants en réponse à la consultation publique sur le livre blanc, Diffusion publique de renseignements cliniques dans les présentations de médicaments et les demandes d'homologation d'instruments médicaux. Quarante-cinq réponses sont montrées, dont 14 de l'industrie pharmaceutique, 3 de l'industrie d'instruments médicaux, 2 de l'industrie des TI, 13 des universitaires, 5 des professionnels de la santé, 2 des groupes de patients, et 6 du grand public.
Que disent les intervenants?
Universitaires et chercheurs :
Les répondants de ce groupe appuient la proposition et préconisent une transparence accrue. En résumé :
- La majorité des répondants appuient la diffusion publique de renseignements cliniques et affirment qu'aucune restriction ne doit entraver l'accès à l'information clinique diffusée.
- Plusieurs ont suggéré que les dispositions proposées visant la protection de l'information constituant des paramètres exploratoires, des indications secondaires, des programmes de développement continu, des résultats provisoires et des méthodologies peuvent empêcher la diffusion complète de renseignements cliniques.
- La consultation sur la portée du caviardage et le temps accordé à l'industrie devrait être clairement décrite afin de ne pas prolonger le processus.
- Tous les médicaments en vente libre et les produits de santé naturels, ainsi que les rapports de l'examinateur devraient être inclus dans la portée de la proposition.
Professionnels de la santé :
À l'instar des universitaires et des chercheurs, les répondants de ce groupe appuient la proposition. En résumé :
- Les répondants estiment qu'une plus grande disponibilité de renseignements cliniques sera bénéfique pour les interactions entre le médecin et le patient et éclairera la prise de décisions sur les traitements disponibles.
- De même, l'harmonisation avec les initiatives internationales de transparence des essais cliniques profiterait aux professionnels de la santé et à la recherche au Canada.
- Les répondants ont soulevé des préoccupations concernant les risques de retard dans la mise en œuvre et l'apport de ressources suffisantes pour cette initiative.
Industries des produits pharmaceutiques, des appareils médicaux, et de la TI :
De nombreux membres de l'industrie appuient la proposition et les initiatives de transparence dans leur ensemble, et plusieurs ont également formulé des commentaires. En résumé :
- L'industrie pharmaceutique a favorisé l'harmonisation de cette proposition à l'échelle internationale, et plus particulièrement avec l'initiative de publication proactive de données cliniques de l'Agence européenne des médicaments (AEM). De nombreux répondants ont déclaré que la portée des documents à diffuser devrait être exactement la même que celle de la Politique 0070 de l'AEM.
- Plusieurs répondants ont demandé que la proposition s'applique de façon prospective uniquement à compter de la date d'entrée en vigueur, certains mentionnent des difficultés techniques avec les présentations non fournies dans le format Common Technical Document (CTD) avant 2001.
- L'industrie pharmaceutique suggère que la diffusion des données individuelles sur les patients concorde avec la phase 2 de la politique 070 de l'AEM, et qu'il y ait suffisamment de temps et de réflexion pour l'examen des complexités associées à la divulgation des données individuelles des patients.
- Les mesures de protection contre l'utilisation commerciale des renseignements cliniques divulgués doivent être semblables à celles utilisées dans le portail de l'AEM.
- Plusieurs répondants ont soulevé des préoccupations à l'égard du fardeau sur l'industrie et les ressources de Santé Canada.
- Un certain nombre de répondants ont demandé que les présentations de drogue nouvelle en vente libre ainsi que les décisions en matière de réglementation retirées ou négatives soient exclues de la portée de la proposition.
- Plusieurs répondants estiment que les cadres existants d'accès aux renseignements cliniques (c.-à-d. les publications des fabricants, les demandes d'accès à l'information et les demandes de renseignements commerciaux confidentiels (RCC) en vertu de l'alinéa 21.1(3)c) de la Loi sur les aliments et drogues sont suffisants pour atteindre les objectifs de transparence.
- Les sociétés membres et les associations de l'industrie des appareils médicaux ont fait remarquer que, même si les sociétés pharmaceutiques peuvent tirer parti de leurs présentations faites aux termes de la politique 070 sur la transparence des produits de l'AEM, il n'existe aucune mesure équivalente pour les appareils médicaux. Les répondants ont noté que l'approche globale des principales administrations (c.-à-d. les États-Unis et l'Union européenne) sur la transparence des données cliniques pour les appareils médicaux n'est pas identique et que son adoption ne suit pas la même cadence. Les membres proposent que la mise en œuvre de la divulgation des données cliniques sur les appareils médicaux soit repoussée et harmonisée avec les règlements de l'Union européenne récemment publiés (Règlement de 2017/745 et Règlement relatif aux dispositifs médicaux de diagnostic in vitro 2017/746) dont la mise en œuvre est prévue après 2020.
Groupes de patients et grand public :
Les répondants des groupes de patients et du grand public sont favorables à la proposition et appuient les positions adoptées par les universitaires, les chercheurs et les professionnels de la santé. En résumé :
- La plupart ont réitéré les avantages prévus d'une plus grande disponibilité de renseignements cliniques pour le système de soins de santé.
- Les groupes de patients estiment que leurs efforts de défense des droits et d'éducation procureraient d'autres avantages, et les répondants du grand public affirment que les interactions entre le médecin et le patient y gagneraient également.
- Certains répondants s'inquiétaient des limites de la portée clinique proposée de la diffusion de l'information. D'autres préoccupations portent sur les données probantes que Santé Canada s'est engagé à mettre en œuvre rapidement et sur le processus pour éviter les retards constatés avec les demandes d'accès à l'information.
Prochaines étapes - poursuite de la mobilisation et de l'élaboration de la réglementation
Nous tenons à remercier tous les répondants de leurs commentaires sur la proposition. Les commentaires reçus éclaireront l'élaboration de la version provisoire des règlements, des processus opérationnels internes et des documents d'orientation pertinents.
Santé Canada va également de l'avant avec ses plans visant la poursuite à l'été et à l'automne 2017 de la mobilisation externe continue auprès des intervenants et des experts en la matière.
Santé Canada prévoit proposer à l'automne 2017 un projet de règlement à l'appui de la diffusion publique de renseignements cliniques dans les présentations de médicaments et les demandes d'appareils médicaux. Il y aura d'autres consultations publiques après la publication du projet de règlement.
Pour communiquer avec nous :
Adresse postale :
Bureau de la gestion de l'information
Direction de la gestion des ressources et des opérations
Direction générale des produits de santé et des aliments
Santé Canada
Immeuble Graham-Spry
250, avenue Lanark
Ottawa (Ontario)
K1A 0K9
Téléphone : 613-793-4180
Courriel : hc.rmod_stakeholders-intervenants_dgro@hc-sc.gc.ca
Consultez notre page pour des mises à jour sur notre travail.