Consultation : Projet de Lignes directrices sur la qualité de l’air intérieur résidentiel pour l’acroléine
État actuel : Fermé
Fermé aux nouvelles entrées le 11 août 2020.
Télécharger le rapport complet (Format PDF, 1.5 mo, 78 pages)
Organisation : Santé Canada
Publiée : 2020-06-12
Objet de la consultation
Le présent document passe en revue les études épidémiologiques, toxicologiques et d'exposition portant sur l'acroléine ainsi que les conclusions découlant d'examens complets effectués par des organisations reconnues à l'échelle internationale se consacrant à la santé et à la protection de l'environnement. Il vise à proposer de nouvelles limites d'exposition dans l'air intérieur de courte et de longue durées qui réduiraient au minimum les risques pour la santé humaine et à recommander diverses mesures d'atténuation des risques afin de réduire l'exposition à l'acroléine. La présente consultation vise à solliciter des commentaires sur les Lignes directrices sur la qualité de l'air intérieur résidentiel (LDQAIR) pour l'acroléine proposées.
Santé Canada a entrepris une évaluation des risques pour la santé liés à l'acroléine car les concentrations d'acroléine dans les habitations du Canada sont généralement plus élevées que le niveau de référence dans l'air intérieur (NRAI) pour l'acroléine fixé par Santé Canada en 2017, et pour caractériser de manière plus complète les sources de l'acroléine dans le milieu intérieur.
Le document propose (1) une limite d'exposition de courte durée (une heure) de 38 µg/m3 pour protéger contre l'irritation oculaire et (2) une limite d'exposition de longue durée (basée sur une moyenne de 24 heures) de 0.44 µg/m3 pour protéger contre les effets respiratoires nocifs. Comme la concentration d'acroléine présente dans une habitation canadienne typique serait inférieure à la limite d'exposition de courte durée, mais supérieure à celle de longue durée, elle pourrait représenter un risque pour la santé, et plus particulièrement pour la fonction respiratoire.
Ce document est disponible pour une période de consultation publique de 60 jours.
Les commentaires (avec justification pertinente, au besoin) peuvent être transmis à Santé Canada :
hc.air.sc@canada.ca
ou
Bureau de la qualité de l'eau et de l'air, Santé Canada
269, avenue Laurier Ouest, localisateur d'adresse 4903B
Ottawa (Ontario) K1A 0K9
Les commentaires doivent nous parvenir avant le 11 août 2020.
Il est à noter que le présent document pourrait être révisé après l'analyse des commentaires reçus et que, s'il y a lieu, des LDQAIR pour l'acroléine seront formulées. Le présent document devrait donc être considéré strictement comme une ébauche pour commentaires.
Préambule
Santé Canada évalue les risques pour la santé que posent certains polluants dans l'air intérieur résidentiel et formule des recommandations sur les façons de réduire ces risques. Les Lignes directrices sur la qualité de l'air intérieur résidentiel (LDQAIR) résument les effets connus sur la santé, les sources de polluants et les niveaux d'exposition dans les habitations canadiennes, et caractérisent les risques pour la santé à partir des meilleures données scientifiques disponibles. Des limites d'exposition proposées (également appelées valeurs guides) de courte et/ou de longue durées au polluant, qui représentent les concentrations dans l'air intérieur en dessous desquelles des effets sur la santé sont peu probables, sont aussi élaborées. Les limites d'exposition proposées prennent en compte les concentrations de référence (CRf) de ce polluant et la possibilité d'atteindre un tel niveau à partir du contrôle des sources intérieures, et peuvent être établies pour l'exposition de courte durée, pour l'exposition de longue durée ou les deux. Les LDQAIR comprennent aussi des recommandations pour le contrôle des sources ou d'autres mesures de réduction de l'exposition à ce polluant.
Une limite d'exposition proposée peut ne pas être établie pour certains polluants, bien que les preuves scientifiques disponibles justifient la nécessité d'en réduire l'exposition. C'est alors qu'un document d'orientation axé sur les mesures de contrôle des sources et de réduction de l'exposition est élaboré.
Les LDQAIR et les documents d'orientation servent de base scientifique aux mesures visant à évaluer et à réduire les risques des polluants de l'air intérieur, notamment :
- les évaluations de risques pour la santé liés aux polluants de l'air intérieur effectuées par les responsables de la santé publique dans les habitations ou des milieux similaires;
- les normes de performance pouvant s'appliquer aux matériaux, aux produits et aux appareils qui émettent des polluants pour éviter que leur utilisation normale ne conduise à des concentrations de polluants dans l'air dépassant les limites d'exposition proposées;
- les produits de communication visant à informer les Canadiens des mesures à prendre pour réduire leur exposition aux polluants de l'air intérieur et aider à protéger leur santé.
Les LDQAIR et les documents d'orientation remplacent une série de valeurs limites d'exposition aux polluants de l'air intérieur publiées dans un rapport intitulé Directives d'exposition concernant la qualité de l'air des résidences (Santé Canada, 1987). En plus des mises à jour relatives aux substances apparaissant dans le rapport de 1987, des lignes directrices ou des documents d'orientation seront élaborés pour d'autres substances ayant le potentiel d'influer sur la santé humaine dans l'air intérieur.
Ce document porte sur l'acroléine qui a été désignée comme prioritaire pour l'élaboration de LDQAIR. En effet, les concentrations d'acroléine mesurées dans les habitations canadiennes dépassent le niveau de référence dans l'air intérieur (NRAI) fixé à 0,35 µg/m3 (Santé Canada, 2017). Ce NRAI repose sur les lésions de l'épithélium respiratoire survenues chez le rat dans une évaluation publiée par la California Environmental Protection Agency (CalEPA, 2008).
En plus de mettre à profit la littérature pertinente, le présent document s'appuie sur des examens complets des effets sur la santé de l'acroléine, dont :
- Proposition de valeurs guides de qualité d'air intérieur : L'acroléine, publiée par l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (Anses; France) en 2013;
- Acrolein Reference Exposure Levels, publiés par la California Environmental Protection Agency en 2008 (ci-après désignés par CalEPA, 2008);
- Toxicological Profile for Acrolein, publié par l'Agency for Toxic Substances and Disease Registry en 2007 (ci-après désigné par ATSDR, 2007);
- Toxicological Review of Acrolein, publié par l'US Environmental Protection Agency en 2003 (ci-après désigné par US EPA, 2003);
- Concise International Chemical Assessment Document 43: Acrolein, publié par l'Organisation mondiale de la Santé en 2002 (ci-après désigné par OMS, 2002);
- Liste des substances d'intérêt prioritaire, rapport d'évaluation : acroléine, publiée par Environnement Canada et Santé Canada en 2000 (ci-après désigné par Environnement Canada et Santé Canada, 2000).
Les examens complets susmentionnés ainsi qu'une recherche sur Internet allant jusqu'en octobre 2018, en portant une attention particulière sur les recherches publiées après l'examen complet le plus récent (c'est-à-dire Anses, 2013), ont permis de repérer la documentation pertinente. Les articles originaux directement liés à l'évaluation de l'exposition à l'acroléine dans l'air intérieur et de ses effets sur la santé ont été passés en revue. La portée de ce document se limite à l'exposition par inhalation à l'acroléine et ne prend pas en compte les sources alimentaires ni l'exposition par voie orale. Les études clés retenues pour la construction des limites d'exposition proposées sont présentées et, le cas échéant, les données justificatives résumées. Des études de recherche menées par Santé Canada ont également permis d'obtenir des données sur les concentrations d'acroléine présentes dans les habitations canadiennes ainsi que sur les différents facteurs les influençant.
Table des matières
- Liste des tableaux
- Liste des figures
- Résumé
- 1.0 Caractéristiques physiques et chimiques
- 2.0 Sources dans l'air
- 3.0 Concentrations dans l'air intérieur et extérieur
- 4.0 Toxicocinétique
- 5.0 Effets sur la santé
- 6.0 Établissement des concentrations de référence pour les expositions de courte et de longue durées
- 6.1 Concentration de référence pour l'exposition de courte durée
- 6.2 Concentration de référence pour l'exposition de longue durée
- 6.3 Comparaison entre l'exposition dans les habitations canadiennes et la concentration de référence, et établissement des limites d'exposition proposées
- 6.4 Incertitudes et futurs travaux de recherche
- 7.0 Lignes directrices proposées
- 8.0 Références
- Annexe A : Liste des acronymes et des abréviations
- Annexe B : Études d'exposition humaine
- Annexe C : Études toxicologiques
- Annexe D : Autres lignes directrices
Liste des tableaux
- Tableau 1. Propriétés physiques et chimiques de l'acroléine
- Tableau 2. Concentrations (µg/m3) intérieures et extérieures d'acroléine au Canada
- Tableau 3. Limites d'exposition à l'acroléine proposées dans le milieu intérieur
- Tableau B1. Exposition de courte durée
- Tableau B2. Études épidémiologiques
- Tableau C1. Études d'exposition aiguë (unique)
- Tableau C2. Études d'exposition répétée (3 jours à 6 semaines)
- Tableau C3. Études d'exposition répétée (6 semaines à 18 mois)
- Tableau D1. Autres lignes directrices pour l'exposition de courte durée
- Tableau D2. Autres lignes directrices pour l'exposition produisant des effets non néoplasiques
Liste des figures
- Figure 1. Distribution des concentrations d'acroléine dans l'air intérieur par saison dans les études de Santé Canada
- Figure 2. Distribution des ratios I/E par saison dans les études de Santé Canada
- Figure 3. Voie proposée du métabolisme de l'acroléine (adaptation de l'OMS, 2002 et de Burcham, 2016)
Résumé
| Limite d'exposition | Concentration | Effets critiques | |
|---|---|---|---|
| µg/m3 | ppb | ||
| Courte durée
(1 heure) |
38 | 17 | Irritation oculaire chez les volontaires sains |
| Longue durée
(24 heures) |
0,44 | 0,19 | Lésions de l'épithélium respiratoire de la cavité nasale du rat |
La limite d'exposition de courte durée (une heure) à l'acroléine proposée est de 38 µg/m3 et celle de longue durée est de 0,44 µg/m3 (basée sur une moyenne de 24 heures).
Comme la concentration d'acroléine présente dans une habitation canadienne typique serait inférieure à la limite d'exposition de courte durée, mais supérieure à celle de longue durée, elle pourrait représenter un risque pour la santé, et plus particulièrement pour la fonction respiratoire. Il est donc recommandé de réduire l'exposition à l'acroléine par une ventilation adéquate et le contrôle des sources intérieures.
Contexte
L'acroléine est un aldéhyde α,β-insaturé hautement réactif et volatil, présent dans l'air intérieur et extérieur. Dans la Liste des substances d'intérêt prioritaire, rapport d'évaluation : acroléine publiée en 2000, Environnement Canada et Santé Canada ont établi une concentration tolérable d'acroléine reposant sur des modifications au niveau des cellules de l'épithélium respiratoire nasal mises en évidence chez le rat après une exposition par inhalation à l'acroléine. Plusieurs études clés ont été publiées depuis la parution de la Liste des substances d'intérêt prioritaire, rapport d'évaluation, en plus d'évaluations des risques pour la santé réalisées par des organisations internationales. Santé Canada a fixé un niveau de référence dans l'air intérieur (NRAI) pour l'acroléine en 2017. Les NRAI représentent les concentrations associées à des niveaux de risques acceptables liés à une exposition de longue durée à un composé organique volatil (COV) spécifique, établis par les organisations ou autorités ayant réalisé les évaluations de risques. Les concentrations d'acroléine dans les habitations du Canada sont généralement plus élevées que le NRAI recommandé. Pour cette raison, et pour caractériser de manière plus complète ses sources dans le milieu intérieur et passer en revue la littérature récente portant sur ses effets sur la santé, l'acroléine a été priorisée pour une évaluation complète des risques pour la santé et l'élaboration de LDQAIR.
Les LDQAIR proposées passent en revue les études épidémiologiques, toxicologiques et d'exposition portant sur l'acroléine ainsi que les conclusions découlant d'examens complets effectués par des organisations reconnues à l'échelle internationale se consacrant à la santé et à la protection de l'environnement. Elles visent à fournir des limites d'exposition de courte et de longue durées à l'acroléine dans l'air intérieur proposées, qui réduiraient au minimum les risques pour la santé humaine, ainsi qu'à appuyer l'élaboration de mesures visant à limiter les émissions d'acroléine. Les LDQAIR proposées indiquent également que, comparativement aux limites d'exposition proposées, les concentrations mesurées dans les habitations du Canada pourraient présenter un risque pour la santé et recommandent donc plusieurs mesures d'atténuation des risques visant à en réduire l'exposition.
Sources et exposition
L'acroléine est omniprésente dans l'environnement. Sa principale source naturelle est la combustion incomplète de matières organiques au cours d'incendies de forêt. Sa principale source anthropique est la combustion de matières organiques et de combustibles, les véhicules à moteur (incluant les aéronefs) produisant la majeure partie des émissions d'acroléine. Certains procédés industriels comme l'incinération, la fabrication de pâtes et papiers et de panneaux de copeaux orientés et la production d'électricité à partir du charbon contribuent également aux émissions d'acroléine, mais dans une moindre mesure que les sources mobiles.
Les concentrations d'acroléine sont généralement plus élevées dans l'air intérieur résidentiel que dans le milieu extérieur. Le tabagisme, les cuisinières à gaz, les foyers au bois, l'encens, la cuisson à l'huile et la formation secondaire découlant de l'oxydation d'autres COV provenant de certains produits et matériaux de construction sont des sources d'acroléine dans l'air intérieur. Il n'existe toutefois aucune information concernant la contribution relative de chacune de ces sources à la concentration totale d'acroléine dans l'air intérieur.
L'acroléine est l'une des substances chimiques les plus difficiles à mesurer dans l'air en raison de sa réactivité. Les études réalisées par Santé Canada ont eu recours aux deux méthodes suivantes les plus utilisées pour mesurer les concentrations d'acroléine dans l'air : prélèvement sur cartouches de 2,4-dinitrophénylhydrazine associé à une analyse par chromatographie liquide à haute performance et prélèvement par canisters passivés associé à une analyse par chromatographie en phase gazeuse couplée à la spectrométrie de masse. Chacune de ces deux méthodes a ses propres limites, mais la littérature scientifique et les recherches menées par Environnement et Changement climatique Canada et Santé Canada semblent indiquer que les canisters passivés aboutissent à l'heure actuelle à l'estimation la plus précise des concentrations d'acroléine dans l'air intérieur.
Les concentrations médianes d'acroléine mesurées entre 2005 et 2010 à Edmonton, Halifax, Regina et Windsor, en hiver et en été à l'aide de canisters passivés, se situent entre 1,3 et 8,1 µg/m3 à l'intérieur et entre 0,2 et 2,2 µg/m3 à l'extérieur (Santé Canada, 2010a, 2010b, 2012, 2013). À Windsor, des mesures de l'exposition personnelle ont également été relevées, la médiane variant entre 1,1 et 4,3 µg/m3. Dans ces études, le ratio intérieur/extérieur des concentrations d'acroléine est en général systématiquement supérieur à 2,5, ce qui indique une prédominance des sources intérieures d'acroléine.
Effets sur la santé
Des études toxicologiques et d'exposition humaine contrôlée ont examiné les effets sur la santé de l'exposition à l'acroléine, les données épidémiologiques probantes relatives à son exposition dans l'air intérieur étant insuffisantes. Ces études ont permis d'établir que les effets de l'exposition de courte et de longue durées à l'acroléine par inhalation surviennent au site de contact. Les principaux effets sur la santé comprennent l'irritation oculaire et respiratoire ainsi que des lésions tissulaires au niveau des voies respiratoires.
Dans la présente évaluation, la limite d'exposition de courte durée est établie à partir des résultats d'une étude d'exposition humaine contrôlée, alors que la limite d'exposition de longue durée repose sur les données toxicologiques issues d'une étude portant sur un modèle de rongeur. Les résultats d'autres études toxicologiques et d'exposition humaine contrôlée ont engendré des données probantes.
Études chez l'homme
Les études avec des participants humains ont indiqué que l'exposition aiguë à l'acroléine provoque une irritation oculaire à des concentrations aussi faibles que 0,21 mg/m3 (210 µg/m3), une irritation nasale à partir de 0,35 mg/m3 (350 µg/m3) et une irritation respiratoire (mesurée par une diminution de la fréquence respiratoire) à partir de 0,69 mg/m3 (690 µg/m3) (Darley et al., 1960; Weber-Tschopp et al., 1977; Dwivedi et al., 2015; Claeson et Lind, 2016). Les données épidémiologiques relatives aux effets à long terme chez l'homme proviennent uniquement de deux études françaises : l'une a montré une association positive entre les concentrations d'acroléine à l'école et l'asthme allergique au cours de l'année précédente ainsi qu'entre les concentrations d'acroléine et l'asthme d'effort, association non retrouvée avec l'asthme non allergique (Annesi-Maesano et al., 2012); et l'autre n'a relevé aucun lien significatif entre les concentrations d'acroléine mesurées dans l'air intérieur résidentiel et l'asthme au cours de l'année précédente (Billionnet et al., 2011). Aucune de ces deux études n'a relevé de lien entre les concentrations d'acroléine et la rhinite.
Études toxicologiques
Chez les animaux de laboratoire, l'exposition aiguë à des concentrations d'acroléine aussi faibles que 0,7 mg/m3 (700 µg/m3) provoque des effets irritants comme une baisse de la fréquence respiratoire, une bronchoconstriction ou une résistance accrue à l'écoulement et une hypersécrétion de mucus chez de nombreuses espèces. Des modifications au niveau de la composition des cellules des voies respiratoires chez le cobaye, le hamster et le rat ont été observées à partir de concentrations plus élevées de 2,1 mg/m3 (2100 µg/m3) (Leikauf, 1991; Roemer et al., 1993; Cassee et al., 1996; Cassee, Groten et Feron, 1996; Arumugan et al., 1999; US EPA, 2003; CalEPA, 2008).
Les effets de l'exposition répétée à l'acroléine par inhalation sont similaires à ceux de l'exposition unique. Des études chez la souris et le rat ont indiqué qu'une exposition de 3 jours à 13 semaines à l'acroléine provoque une hypersécrétion de mucus, et une inflammation et une prolifération cellulaire au niveau de l'épithélium respiratoire accompagnées d'une hyperplasie des cellules basales et d'une métaplasie squameuse (Lyon et al., 1970; Feron et al., 1978; Kutzman et al., 1981, 1985; Costa, 1986; Roemer et al., 1993; Cassee, Groten et Feron, 1996; Dorman et al., 2008). La sévérité des effets semble être proportionnelle au niveau mais pas à la durée d'exposition. Chez les animaux de laboratoire, l'acroléine réagit principalement dans la région nasale et les voies respiratoires supérieures, mais à des concentrations plus élevées elle peut pénétrer plus profondément dans les voies respiratoires inférieures où elle y induira des lésions. Dans la plupart des études, des effets ont été observés à la concentration expérimentale la plus faible de 0,9 mg/m3 (900 µg/m3); une étude chez le rat a toutefois signalé une dose sans effet nocif observé (DSENO) de 0,46 mg/m3 (460 µg/m3) pour les pathologies de l'épithélium respiratoire nasal, y compris l'inflammation, l'hyperplasie et la métaplasie squameuse (Dorman et al., 2008).
L'acroléine s'est révélée mutagène et génotoxique in vitro, mais aucune génotoxicité ne s'est manifestée dans les quelques études in vivo (Kutzman, 1981; Lam et al., 1985; Environnement Canada et Santé Canada, 2000; US EPA, 2003; ATSDR, 2007; Wang et al., 2012; Lee et al., 2014). Aucune conclusion au sujet de son potentiel cancérogène ne peut être tirée des quelques études disponibles.
Populations sensibles
Certaines personnes comme les asthmatiques et celles souffrant de maladie pulmonaire ou de bronchite chronique pourraient être plus sensibles aux effets de l'acroléine sur les voies respiratoires. Les enfants, et plus particulièrement ceux atteints d'asthme, souffriraient davantage des effets respiratoires découlant d'une exposition à l'acroléine du fait de la prévalence accrue de l'asthme chez les enfants, de la petite taille et de l'immaturité de leurs voies respiratoires, et de l'exacerbation de l'asthme chez les enfants causée par les contaminants atmosphériques toxiques. En général, les allergies nasales préexistantes peuvent également aggraver la réaction aux irritants nasaux. Une synthèse diminuée de glutathion ou une baisse de l'activité de la glutathion-S-transférase pourrait accroître la sensibilité individuelle aux effets de l'acroléine.
Mécanisme de la toxicité
L'acroléine est un irritant sensoriel qui active les mécanismes de défense de l'organisme pour éviter qu'elle ne pénètre plus profondément dans les voies respiratoires, comme une diminution de la fréquence respiratoire, une hypersécrétion de mucus et une bronchoconstriction. En raison de sa forte réactivité, l'acroléine se lie rapidement et de façon irréversible aux groupes sulfhydryles au site de contact initial, ce qui entraîne une déplétion en glutathion et en d'autres agents de réduction ainsi que des changements d'activités enzymatiques provoquant une réduction de l'activité protectrice dans l'épithélium respiratoire nasal. Ces changements peuvent également induire une réponse inflammatoire par le recrutement de cellules immunitaires et une stimulation de la production ou libération de cytokines pro-inflammatoires.
Établissement des limites d'exposition proposées
L'établissement d'une limite d'exposition proposée se fait en deux étapes. Une concentration de référence (CRf) dans l'air intérieur est d'abord déterminée en appliquant des facteurs d'incertitude aux concentrations auxquelles l'effet nocif le plus sensible a été observé. Grâce à cette approche, une limite d'exposition proposée permettant de réduire les effets potentiels sur la santé comme ceux observés dans les principales études toxicologiques, d'exposition humaine contrôlée et épidémiologiques liées à la qualité de l'air intérieur peut être établie.
En ce qui concerne la CRf pour l'exposition de courte durée, la période d'exposition est précisée, soit une heure dans ce cas-ci. Quant à la CRf pour l'exposition de longue durée, l'exposition peut durer des mois, des années, voire toute la vie.
Les CRf pour les expositions de courte et de longue durées sont ensuite comparées aux mesures de l'exposition dans l'air intérieur résidentiel, puis évaluées en fonction de leur faisabilité technique. En général, si la CRf peut être atteinte par la mise en œuvre de mesures de contrôle raisonnables, la limite d'exposition proposée est alors égale à la CRf. Si la CRf ne peut être atteinte par le recours à des technologies ou à des pratiques de gestion du risque existantes, la limite d'exposition proposée peut alors être égale à une concentration plus élevée, produisant ainsi une marge d'exposition plus faible entre la limite d'exposition proposée et la concentration à laquelle des effets sur la santé ont été observés dans les études sanitaires. Cette limite d'exposition proposée représente néanmoins une mesure de protection de la santé, tout en demeurant un objectif réalisable pour l'amélioration de la qualité de l'air intérieur lors de l'évaluation des mesures de gestion du risque.
Limite d'exposition de courte durée proposée pour la qualité de l'air intérieur résidentiel
Pour l'exposition de courte durée à l'acroléine, l'irritation oculaire constitue l'effet le plus sensible chez les volontaires sains. Une DSENO de 115 µg/m3 a été retenue comme point de départ (Dwivedi et al., 2015) et un facteur d'incertitude de 3 a été appliqué pour prendre en compte les personnes sensibles. La CRf pour l'exposition aiguë est donc égale à 38 µg/m3.
Les études de la qualité de l'air intérieur résidentiel de Santé Canada fournissent des échantillons de mesures de l'acroléine relevées sur une période de 24 heures, qui ne représentent pas une exposition aiguë ni maximale (Santé Canada, 2010a, 2010b, 2012, 2013). Ces mesures indiquent que le niveau d'exposition de référence pour l'exposition de courte durée est plus élevé que la plage des concentrations médianes dans l'air intérieur. Comme cette limite d'exposition est réalisable dans les habitations canadiennes, la limite d'exposition proposée pour l'exposition de courte durée à l'acroléine est donc de 38 µg/m3.
Il est recommandé de comparer la limite d'exposition de courte durée à un échantillon d'air d'une heure.
Limite d'exposition de longue durée proposée pour la qualité de l'air intérieur résidentiel
Pour l'exposition de longue durée à l'acroléine, les lésions dégénératives de l'épithélium respiratoire de la cavité nasale du rat constituent l'effet le plus sensible. Une DSENO de 460 µg/m3 reposant sur l'inflammation, l'hyperplasie et la métaplasie squameuse à des concentrations expérimentales plus élevées a été retenue comme point de départ (Dorman et al., 2008). Cette concentration a été corrigée en fonction d'une exposition continue et les différences toxicocinétiques entre le rat et l'homme ont été prises en compte par l'application d'un rapport de dépôt, de sorte que la DSENO équivalente chez l'homme est de 11 µg/m3. Des facteurs d'incertitude de 2,5 et de 10 ont été appliqués pour tenir compte respectivement des différences toxicodynamiques entre le rat et l'homme et de la sensibilité au sein de la population humaine. La CRf pour l'exposition de longue durée est donc égale à 0,44 µg/m3.
Les concentrations médianes d'acroléine mesurées dans les habitations canadiennes au cours d'une période de 24 heures dans le cadre des études de la qualité de l'air intérieur résidentiel de Santé Canada varient entre 1,3 et 8,1 µg/m3, la valeur du 95e centile se situant entre 3,5 et 21,0 µg/m3 (Santé Canada, 2010a, 2010b, 2012, 2013). Ceci indique que la concentration d'acroléine présente dans certaines habitations canadiennes dépasserait la CRf, malgré la prise en compte des incertitudes liées aux mesures de l'acroléine. La CRf a toutefois été établie à l'aide des données scientifiques les plus récentes et est comparable au NRAI de 0,35 µg/m3 fixé par Santé Canada et à des valeurs d'autres instances (Environnement Canada et Santé Canada, 2000, US EPA, 2003, CalEPA, 2008, Anses, 2013). En outre, il est possible de réduire la concentration d'acroléine dans l'air intérieur par la ventilation et le contrôle des sources. La limite d'exposition proposée pour l'exposition de longue durée à l'acroléine est donc de 0,44 µg/m3.
La durée d'échantillonnage utilisée lors de la comparaison de la concentration mesurée d'acroléine avec la limite d'exposition de longue durée devrait être d'au moins 24 heures.
Recommandations pour la gestion des risques
Les stratégies de réduction de l'exposition à l'acroléine dans l'air intérieur sont les suivantes :
- Augmenter la ventilation en ouvrant les fenêtres quand cela est possible ou au moyen de stratégies de ventilation mécanique.
- Se servir d'une hotte avec évacuation à l'extérieur réglée de préférence à la plus haute intensité en cuisinant, surtout avec des huiles.
- En cuisinant, en plus d'une hotte (ou en l'absence de hotte), se servir des brûleurs arrière de la cuisinière, ouvrir les fenêtres ou faire fonctionner le ventilateur de l'appareil de chauffage ou du système de ventilation.
- S'abstenir de fumer ou de faire brûler des bougies ou de l'encens dans l'habitation, et s'assurer que les appareils de combustion (p. ex., les cuisinières à gaz, les poêles à bois et les cheminées) s'évacuent correctement à l'extérieur.
- Diminuer les concentrations de COV dans l'air intérieur pour réduire la formation secondaire d'acroléine. Pour ce faire, employer dans la mesure du possible des produits à faible taux d'émission, ouvrir les fenêtres pour veiller à une ventilation adéquate lors de l'utilisation de produits comme les colles, les peintures, les vernis et les produits de nettoyage et réduire au minimum l'utilisation de produits parfumés comme les désodorisants à brancher ou en aérosol (assainisseurs d'air).
1.0 Caractéristiques physiques et chimiques
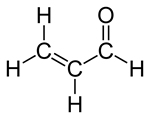
L'acroléine est un liquide inflammable transparent ou jaunâtre, d'odeur douceâtre et âcre. L'acroléine est un aldéhyde α,β-insaturé volatil dont la solubilité dans l'eau et la pression de vapeur sont faibles. Le Tableau 1 résume les propriétés physiques et chimiques de l'acroléine (US EPA, 2003; CalEPA, 2008).
|
2.0 Sources dans l'air
Cette section se concentre sur les sources d'acroléine dans l'air extérieur et intérieur. Bien qu'elles contribuent à l'exposition à l'acroléine, les sources présentes dans les milieux autres que l'air comme les aliments (Environnement Canada et Santé Canada, 2000) dépassent la portée du présent document.
2.1 Sources extérieures
L'acroléine est omniprésente dans le milieu ambiant, libérée par des sources naturelles et anthropiques. Sa principale source naturelle est la combustion incomplète de matières organiques au cours d'incendies de forêt. L'acroléine est également un produit de la photooxydation de nombreux polluants d'hydrocarbure dans l'air, dont le propylène et le 1,3-butadiène (ATSDR, 2007; CalEPA, 2008). Les processus de fermentation et de mûrissement produisent aussi de faibles quantités d'acroléine (Environnement Canada et Santé Canada, 2000).
La principale source anthropique d'acroléine atmosphérique est la combustion de matières organiques et les combustibles. Les rejets estimés des véhicules routiers pourraient atteindre jusqu'à 3 000 000 kg/an, mais ceux des véhicules à moteur autres que routiers (y compris les aéronefs) pourraient être encore plus élevés (Environnement Canada et Santé Canada, 2000). L'utilisation de biodiesel (mélange de soya et d'huile animale) produit plus d'acroléine que celle du diesel dérivé du pétrole (diesel à très faible teneur en soufre) (Karavalakis et al., 2010; Cahill et Okamoto, 2012). Certains procédés industriels comme l'incinération, la fabrication de pâtes et papiers et de panneaux de copeaux orientés et la production d'électricité à partir du charbon contribuent également aux émissions d'acroléine, mais dans une moindre mesure que les sources mobiles (Santé Canada et Environnement Canada, 2000). Selon l'Inventaire national des rejets de polluants (2017), les émissions industrielles d'acroléine dans l'atmosphère se situaient entre 102 et 111 tonnes entre 2013 et 2015.
Il n'existe toutefois aucune information concernant la contribution relative de chacune de ces sources à la concentration totale d'acroléine dans l'air ambiant.
2.2 Sources intérieures
Les concentrations d'acroléine sont généralement 2 à 20 fois plus élevées dans l'air intérieur résidentiel que dans l'air extérieur (Environnement Canada et Santé Canada, 2000; OMS, 2002; ATSDR, 2007; Santé Canada, 2010a, 2010b, 2012, 2013). Les activités comme le tabagisme et la cuisson à l'huile seraient d'importantes sources d'acroléine dans l'air intérieur (Environnement Canada et Santé Canada, 2000; OMS, 2002). Il n'existe toutefois aucune information concernant la contribution relative de chacune de ces sources à la concentration totale d'acroléine dans l'air intérieur.
Il a été démontré expérimentalement que la fumée du tabac produit entre 3 et 220 µg d'acroléine par cigarette fumée, dont une grande partie peut être inhalée dans la fumée principale ou faire augmenter de 0,4 à 2 ppb (0,9 - 4,6 µg/m3) la concentration d'acroléine dans une pièce (OMS, 2002; ATSDR, 2007). Au Canada, des études menées à l'Île-du-Prince-Édouard et à Regina, en Saskatchewan, ont relevé un lien entre les concentrations accrues d'acroléine et la présence de fumée de tabac secondaire à la maison; ces différences ne sont toutefois pas statistiquement significatives en raison de la petite taille des échantillons et de certaines incertitudes associées aux méthodes de mesure utilisées dans ces études (voir la section 3) (Gilbert et al., 2005; Héroux et al., 2010). D'autres études ont rapporté des concentrations plus élevées d'acroléine dans les milieux intérieurs où sont consommés des produits du tabac (ATSDR, 2007). Les concentrations urinaires des métabolites de l'acroléine sont d'ailleurs beaucoup plus élevées chez les fumeurs que chez les non-fumeurs au sein de la population générale américaine (Alwis et al., 2015).
De récentes études ont démontré que les cigarettes électroniques (e-cigarettes, vapotage) libèrent entre moins de 0,02 et 21 µg d'acroléine par bouffée dans la vapeur de fumée principale (Herrington et Myers, 2015; McRobbie et al., 2015; Gillman et al., 2016; Farsalinos et Gillman, 2018; Farsalinos et al., 2018). Selon un modèle de prévision, la contribution de la forte utilisation de cigarette électronique à la concentration d'acroléine dans l'air intérieur s'élève à plus de 0,88 ppb (2 µg/m3) (Logue et al., 2017). Dans certains cas, il a été démontré que les rejets de cigarettes électroniques étaient plus élevés que ceux de l'usage du tabac, plus particulièrement en conditions de bouffées sèches (ou dry puffs) qui résultent d'une surchauffe du liquide de la cigarette électronique (Farsalinos et Gillman, 2018).
L'acroléine peut être produite durant la cuisson lors du chauffage à haute température des graisses ou des huiles animales ou végétales (ATSDR, 2007). Seaman et al. (2009) ont démontré que la cuisson ou la friture de divers types d'aliments dans différentes huiles de cuisson émettait considérablement plus d'acroléine que la friture sans huile. La concentration d'acroléine dans l'air intérieur se situait entre 26,4 et 64,5 µg/m3 5 minutes après avoir fait frire des aliments dans ces différentes huiles de cuisson dans un petit appartement (188 m3) bien aéré (prélèvements à 6 mètres de la source d'émissions). Dans une étude portant sur des cuisines commerciales à Hong Kong, la présence d'acroléine dans l'air expulsé a été associée à la cuisson à l'huile (Ho et al., 2006). D'ailleurs, une étude menée dans des habitations de la Californie a établi une corrélation entre les concentrations d'acroléine et les activités de cuisson (Seaman et al., 2007). Le renouvellement de l'air est considéré comme le moyen le plus efficace d'éliminer l'acroléine produite par la cuisson à l'huile (Seaman et al., 2009).
La présence d'une cuisinière à gaz dans l'habitation a été reconnue comme étant un prédicteur de concentrations accrues d'acroléine. L'exposition personnelle moyenne à l'acroléine est significativement plus élevée (p < 0,05) dans les habitations munies d'une cuisinière à gaz (2,68 µg/m3) que dans celles munies d'une cuisinière électrique (2,03 µg/m3) (Stocco et al., 2008). Comme l'acroléine se trouve également dans la fumée de bois, l'utilisation de poêles ou de foyers au bois pourrait en faire augmenter la concentration (CIRC, 1995; Seaman et al., 2009). Il a été démontré expérimentalement que le taux d'émission d'acroléine issue de la combustion d'une bougie en paraffine est de 0,18 µg/kg de bougie consumée (Lau et al., 1997), soit un taux d'émission plus de 1000 fois plus faible que celui de la cigarette. La combustion de l'encens accroît également la concentration d'acroléine dans l'air intérieur (Ho et Yu, 2002).
Le dégazement des matériaux de construction et la formation secondaire (l'oxydation d'autres composés organiques volatils émis) peuvent également contribuer à la concentration d'acroléine dans l'air intérieur. Des essais d'émission en chambre effectués en Californie ont trouvé de l'acroléine dans les émissions de certains matériaux de construction (des peintures et des panneaux de particules) et dans celles du bois de charpente utilisé en construction résidentielle ainsi que dans des maisons inoccupées nouvellement construites (Seaman et al., 2007). Une étude canadienne a d'ailleurs détecté de l'acroléine dans certains types de bois, de matériaux isolants et de produits de peinture (Won et al., 2014). Les auteurs de cette étude ont toutefois indiqué qu'il faut interpréter la présence d'acroléine avec prudence en raison des limites de la méthode d'échantillonnage (soit un prélèvement sur tubes pour désorption thermique contenant un support imprégné de pentafluorophenylhydrazine), qui ont donné lieu à de fortes concentrations de fond et à une faible efficacité de piégeage (voir la section 3 pour en savoir davantage sur les méthodes de mesure).
La demi-vie de 14,4 heures de l'acroléine dans le milieu intérieur est similaire à celle présente dans le milieu ambiant (15 - 20 h) (ASTDR, 2007; Seaman et al., 2009).
3.0 Concentrations dans l'air intérieur et extérieur
L'acroléine est l'une des substances chimiques les plus difficiles à mesurer dans l'air en raison de sa forte volatilité et de sa réactivité. Les études réalisées par Santé Canada (Santé Canada, 2010a, 2010b, 2012, 2013) ont eu recours aux deux méthodes suivantes les plus utilisées pour mesurer la concentration d'acroléine dans l'air intérieur : prélèvement sur cartouches de 2,4-dinitrophénylhydrazine (DNPH) associé à une analyse par chromatographie liquide à haute performance et prélèvement par canisters passivés associé à une analyse par chromatographie en phase gazeuse couplée à la spectrométrie de masse. Chacune de ces deux méthodes a ses propres limites qui sont décrites ci-dessous.
De nombreux problèmes ont été signalés avec la méthode faisant appel à la 2,4-DNPH, dont l'instabilité de la réaction de l'hydrazone-acroléine avec la DNPH au cours du prélèvement et du stockage, les réactions avec d'autres substances chimiques (p. ex., l'ozone) qui perturbent la précision des mesures d'acroléine et une mauvaise séparation chromatographique des composés carbonylés généralement présents dans l'air (Tejada, 1986; Possanzini et Di Palo, 1996; Schulte-Ladbeck et al., 2001; Seaman et al., 2006; Knighton et al., 2007; Wang et al., 2009; Uchiyama et al., 2010; Ho et al., 2011; Herrington et Hays, 2012). Les données recueillies par Santé Canada concordent avec les conclusions formulées dans la littérature puisqu'environ 80 % des échantillons prélevés se situent sous la limite de détection (communication personnelle, Santé Canada, 2018, source non citée). Le manque de fiabilité de cette méthode de quantification de l'acroléine est bien connu, l'US EPA ayant même émis un addenda en 1999 pour retirer l'acroléine de la liste des analytes couverts par la méthode TO-11A. Par conséquent, le présent document ne fait état d'aucune donnée d'exposition de Santé Canada obtenue à partir de cartouches imprégnées de 2,4-DNPH.
Des problèmes liés à la méthode faisant appel aux canisters passivés ont également été signalés, un accroissement (Swift et al., 2007; US EPA, 2010) et une diminution (ERG, 2005) des concentrations d'acroléine au fil du temps ayant été relevés dans les canisters. Des recherches ont d'ailleurs établi que la concentration de fond d'acroléine dans les canisters nettoyés peut être élevée, ce qui pourrait donner lieu à une surestimation (US EPA, 2010). La méthode de nettoyage des canisters peut également influer sur la concentration de fond d'acroléine et l'accroissement de la concentration d'acroléine au fil du temps (Dann et Wang, 2007; Shelow et al., 2009). Malgré ces problèmes, l'US EPA considère que la méthode reposant sur un système de prélèvement par canisters passivés est supérieure à celle sur cartouches imprégnées de 2,4-DNPH et l'utilise dans ses réseaux d'échantillonnage de l'air ambiant comme l'Urban Air Toxics Monitoring Program et le National Air Toxics Trends Stations.
Des recherches ont été menées pour s'assurer que les données recueillies par Santé Canada par la méthode reposant sur un système de prélèvement par canisters passivés peuvent servir d'estimation raisonnable de la concentration réelle d'acroléine dans l'air intérieur. La première a examiné l'effet du délai d'analyse (soit le nombre de jours écoulés entre le prélèvement par canisters et l'analyse des canisters par le laboratoire d'analyse) dans les données antérieures. Les résultats de cette recherche ont révélé que l'effet du délai d'analyse est faible, mais statistiquement significatif (une augmentation de 0,66 % par jour). La prise en compte du taux de renouvellement de l'air, de la température et du taux d'humidité intérieure régnant sur le site de prélèvement produit une augmentation plus élevée, mais toujours relativement faible (augmentation de 1,22 % par jour). Pour ce qui est de la seconde recherche, Santé Canada et Environnement Canada ont testé la stabilité de l'acroléine dans les canisters passivés. Les résultats démontrent que, dans l'ensemble, les concentrations mesurées au jour 21 sont légèrement plus élevées que les concentrations connues au jour 0, qu'il s'agisse de canisters SummaMC ou SiloniteMC. L'écart médian entre le jour 0 et le jour 21 est de 0,34 µg/m3 (0,11 à 5,8 µg/m3) pour les canisters SummaMC et de 0,44 µg/m3 (0,02 à 6,6 µg/m3) pour les canisters SiloniteMC. Pour ces deux types de canisters, les écarts de concentrations d'acroléine les plus importants surviennent à la plus forte concentration (12 μg/m3).
Ces résultats laissent supposer que la méthode reposant sur un système de prélèvement par canisters passivés aboutit à l'heure actuelle à l'estimation la plus précise des concentrations d'acroléine dans l'air intérieur malgré certaines erreurs de mesure. Les niveaux d'exposition à l'acroléine dans l'air intérieur et extérieur du Canada établis par les études de Santé Canada sont présentés au Tableau 2. Ces études, qui ont recueilli des données en été et en hiver auprès de plus de 200 ménages de quatre villes canadiennes, constituent les plus récentes données représentatives permettant de quantifier les niveaux d'exposition de longue durée dans les maisons individuelles canadiennes.
Les concentrations médianes d'acroléine mesurées par Santé Canada en hiver et en été, entre 2005 et 2010, à Edmonton, Halifax, Regina et Windsor se situent entre 1,3 et 8,1 µg/m3 à l'intérieur et entre 0,2 et 2,2 µg/m3 à l'extérieur. Les valeurs du 95e centile varient entre 3,5 et 21 µg/m3 à l'intérieur et entre 0,5 et 7,4 µg/m3 à l'extérieur (Santé Canada, 2010a, 2010b, 2012, 2013). En 2005, des mesures d'exposition personnelle ont également été recueillies à Windsor où la médiane se situe entre 1,1 et 4,3 µg/m3 et le 95e centile entre 3,1 et 8,2 µg/m3 (Santé Canada, 2010b).
| Lieu | Période d'échantillonnage | Méthode d'échantillonnageNote de bas de page a | Saison | Nbre d'habitations | Usage du tabac | Nbre d'échantillonsNote de bas de page b | Concentration (μg/m3) | Référence | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Min | Médiane | 95e centile | Max | ||||||||
| INTÉRIEURES | |||||||||||
| Edmonton,
Alberta |
2010 | Canisters passivés
(7 jours × 24 heures) |
Été
Hiver |
50
50 |
Non-fumeurs | 328
337 |
< LD
< LD |
8,1
6,2 |
21,0
15,6 |
26,4
39,1 |
Santé Canada (2013) |
| Halifax,
Nouvelle-Écosse |
2009 | Canisters passivés
(7 jours × 24 heures) |
Été
Hiver |
50
50 |
Non-fumeurs | 331
312 |
< LD
< LD |
4,1
2,8 |
11,4
9,7 |
21,4
334,0 |
Santé Canada (2012) |
| Regina,
Saskatchewan |
2007 | Canisters passivés
(24 heures) |
Été
Hiver |
111
106 |
Non-fumeurs
Fumeurs Non-fumeurs Fumeurs |
91
13 83 21 |
0,01
1,8 0,17 0,3 |
4,3
7,0 1,8 2,5 |
11,3
16,0 3,5 10,1 |
13,8
16,0 6,8 12,7 |
Santé Canada (2010a) |
| Windsor,
Ontario |
2006 | Canisters passivés
(5 jours × 24 heures) |
Été
Hiver |
46
47 |
Non-fumeurs | 211
224 |
1,1
0,4 |
6,2
1,6 |
10,3
3,5 |
12,6
13,3 |
Santé Canada (2010b) |
| Windsor,
Ontario |
2005 | Canisters passivés
(5 jours × 24 heures) |
Été
Hiver |
45
48 |
Non-fumeurs | 217
232 |
0,01
0,01 |
5,9
1,3 |
10,2
3,5 |
20,2
7,5 |
Santé Canada (2010b) |
| Plage provenant de toutes les études | < LD-1,8 | 1,3-8,1 | 3,5-21,0 | 6,8-334,0 | |||||||
| EXTÉRIEURES | |||||||||||
| Edmonton,
Alberta |
2010 | Canisters passivés
(7 jours × 24 heures) |
Été
Hiver |
50
50 |
- | 324
332 |
0,5
0,2 |
2,2
1,0 |
7,4
2,5 |
30,7
5,0 |
Santé Canada (2013) |
| Halifax,
Nouvelle-Écosse |
2009 | Canisters passivés
(7 jours × 24 heures) |
Été
Hiver |
50
50 |
- | 324
286 |
0,2
0,1 |
0,6
0,6 |
1,6
1,4 |
6,9
3,6 |
Santé Canada (2012) |
| Regina,
Saskatchewan |
2007 | Canisters passivés
(24 heures) |
Été
Hiver |
111
106 |
- | 108
94 |
0,07
0,02 |
1,0
0,2 |
1,9
0,9 |
2,8
2,4 |
Santé Canada (2010a) |
| Windsor,
Ontario |
2006 | Canisters passivés
(5 jours × 24 heures) |
Été
Hiver |
46
47 |
- | 214
215 |
0,1
0,1 |
0,6
0,3 |
1,1
0,5 |
3,2
0,9 |
Santé Canada (2010b) |
| Windsor,
Ontario |
2005 | Canisters passivés
(5 jours × 24 heures) |
Été
Hiver |
45
48 |
- | 216
200 |
0,16
0,01 |
0,6
0,2 |
1,2
0,5 |
2,2
1,0 |
Santé Canada (2010b) |
| Plage provenant de toutes les études | 0,01-0,5 | 0,2-2,2 | 0,5-7,4 | 0,9-30,7 | |||||||
| PERSONNELLES | |||||||||||
| Windsor,
Ontario |
2005 | Canisters passivés
(5 jours × 24 heures) |
Été
Hiver |
45
48 |
- | 206
225 |
1,1
0,3 |
4,3
1,1 |
8,2
3,1 |
19,1
10,1 |
Santé Canada (2010b) |
Notes : LD = limite de détection Notes de bas de page
|
|||||||||||
La Figure 1 présente la distribution des concentrations d'acroléine dans l'air intérieur apparaissant dans les études de Santé Canada. Il convient de noter que plusieurs mesures ont été relevées dans chacune des habitations des études d'Edmonton, de Halifax et de Windsor, et qu'une moyenne de ces mesures a été établie pour chacune d'entre elles. Une seule mesure a été prise pour chacune des habitations de l'étude de Regina. Les concentrations d'acroléine sont plus élevées en été qu'en hiver dans chacune de ces quatre villes (Santé Canada, 2010a, 2010b, 2012, 2013), probablement à cause de la hausse des températures en été. Ceci est conforté par les données recueillies par l'Enquête canadienne sur les mesures de la santé révélant que la concentration des aldéhydes, des cétones et des alcools est généralement plus élevée durant les mois chauds et plus faible durant les mois froids (Li et al., 2019).
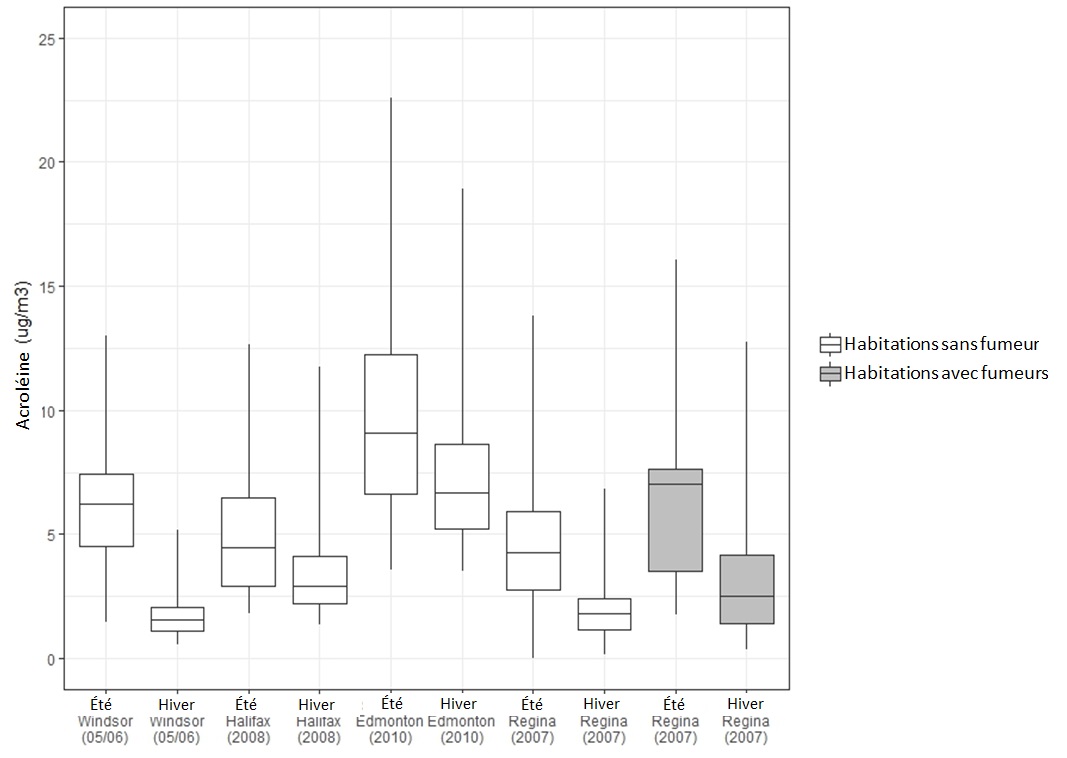
Figure 1 - Équivalent textuel
La Figure 1 présente la distribution des concentrations d'acroléine dans l'air intérieur dans les études de Santé Canada sous forme de diagramme de quartiles. L'axe vertical indique la concentration d'acroléine en µg/m3 se situant entre 0 et 25, et l'axe horizontal indique la ville, l'année et la saison de l'étude. Pour chaque étude, les 75e, 50e et 25e centiles sont représentés par le haut, le centre et le bas des boîtes, alors que les moustaches représentent les 90e et 10e centiles. Les concentrations mesurées en été et en hiver dans les habitations sans fumeur sont indiquées pour Windsor en 2005-2006, Halifax en 2008, Edmonton en 2010 et Regina en 2007. Les concentrations mesurées en été et en hiver dans les habitations avec fumeurs sont indiquées pour Regina en 2007. Les valeurs minimales, maximales, médianes et les 95e centiles de chaque étude sont présentés dans le Tableau 2.
Source des données : Santé Canada (2010a, 2010b, 2012, 2013)
Les 75e, 50e et 25e centiles sont représentés par le haut, le centre et le bas des boîtes, alors que les moustaches représentent les 90e et 10e centiles. Les valeurs aberrantes provenant de Halifax n'ont pas été intégrées à ce graphique.
La présente la distribution des ratios intérieur/extérieur (I/E) pour chaque habitation. Le ratio I/E compare les concentrations d'acroléine mesurées dans une habitation donnée à celles mesurées immédiatement à l'extérieur de cette même habitation. Dans ces études, Figure 2 les ratios I/E sont généralement beaucoup plus grands que 2,5, quelle que soit la ville ou la saison, ce qui indique une prédominance des sources intérieures d'acroléine.
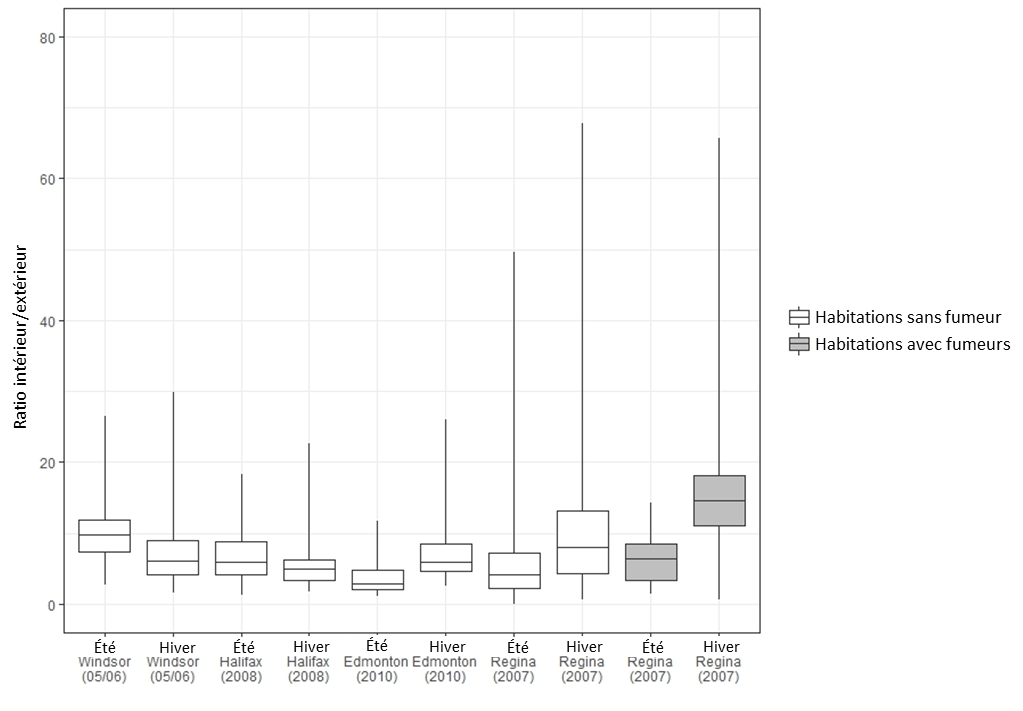
Figure 2 - Équivalent textuel
La Figure 2 présente la distribution des ratios intérieur/extérieur des concentrations d'acroléine apparaissant dans les études de Santé Canada sous forme de diagramme de quartiles. L'axe vertical indique le ratio intérieur/extérieur (sans unité) se situant entre 0 et 80, et l'axe horizontal indique la ville, l'année et la saison de l'étude. Pour chaque étude, les 75e, 50e et 25e centiles sont représentés par le haut, le centre et le bas des boîtes, alors que les moustaches représentent les 90e et 10e centiles. Les concentrations mesurées en été et en hiver dans les habitations sans fumeur sont indiquées pour Windsor en 2005-2006, Halifax en 2008, Edmonton en 2010 et Regina en 2007. Les concentrations mesurées en été et en hiver dans les habitations avec fumeurs sont indiquées pour Regina en 2007. Les valeurs minimales, maximales, médianes et les 95e centiles de chaque étude sont présentés dans le Tableau 2. La figure indique que les ratios intérieur/extérieur sont supérieurs à 2,5 pour toutes les villes et toutes les saisons.
Source des données : Santé Canada (2010a, 2010b, 2012, 2013)
Les 75e, 50e et 25e centiles sont représentés par le haut, le centre et le bas des boîtes, alors que les moustaches représentent les 90e et 10e centiles. Les valeurs aberrantes provenant de Halifax n'ont pas été intégrées à ce graphique.
4.0 Toxicocinétique
4.1 Absorption, distribution, métabolisme et excrétion
Il a été démontré que les voies respiratoires de certaines espèces animales éliminent efficacement l'acroléine de l'air inhalé (ATSDR, 2007). Chez des chiens anesthésiés par exemple, environ 80 à 85 % de la dose inhalée d'acroléine est retenue dans les voies respiratoires, et approximativement 20 % atteignent les voies respiratoires inférieures (Egle, 1972, cité par ATSDR, 2007; US EPA, 2003). D'ailleurs, chez la souris et le rat, l'acroléine inhalée est retenue presque entièrement au niveau des voies respiratoires supérieures (Morris, 1996, cité par ATSDR, 2007; Morris et al., 2003; Struve et al., 2008).
Chez le rat, l'absorption d'acroléine dans les voies respiratoires supérieures diminue avec l'augmentation de la concentration ou du débit, et son efficacité baisse également en fonction du temps au cours de périodes d'exposition de 40 ou 80 minutes (Morris, 1996; Struve et al., 2008), ce qui laisse supposer qu'il s'agit d'un processus saturable. Des données recueillies auprès de plusieurs espèces animales de laboratoire démontrent que l'acroléine réagit principalement dans la région nasale. Elle peut toutefois pénétrer dans les voies respiratoires inférieures à des concentrations plus élevées (examinées par US EPA, 2003), probablement en raison d'une perte de l'efficacité d'élimination des voies respiratoires supérieures au fur et à mesure que la concentration augmente. L'acroléine devrait également se déposer différemment d'une espèce à l'autre dans les voies respiratoires supérieures et inférieures : elle devrait se déposer principalement dans les voies nasales chez le rongeur, une espèce à respiration nasale obligatoire dont les voies nasales ont une grande superficie, alors qu'elle pourrait pénétrer dans les voies respiratoires inférieures chez l'homme au cours de la respiration buccale (Kimbell et al., 2001; Overton et al., 2001; Corley et al., 2012).
Chez le rat, la quasi-totalité de la fraction radioactive d'acroléine administrée par voie intraveineuse ou par gavage est détectée dans l'excreta dans les 24 heures, entre 54 et 59 % de la radioactivité étant détectée dans l'urine, entre 22 et 27 % dans le dioxyde de carbone expiré et entre 1 et 12 % dans les matières fécales. Les concentrations tissulaires sont très faibles (< 1,2 %), indiquant l'absence de distribution systémique (Parent et al., 1996, 1998, cités par US EPA, 2003). Par inhalation, l'acroléine n'induit pas de déplétion en glutathion (GSH) dans le foie, ce qui laisse de nouveau croire à une absence de distribution systémique (McNulty et al., 1984, cités par CalEPA, 2008; Lam et al., 1985). Aucune autre donnée relative à la distribution après une exposition par inhalation n'a été relevée.
Du fait de la forte réactivité de l'acroléine, les effets observés après inhalation se limitent généralement au site de contact initial (c.-à-d. les voies respiratoires). L'acroléine inhalée est retenue au site d'exposition où elle se lie rapidement et de façon irréversible aux groupes sulfhydryles protéiques et non protéiques ainsi qu'aux amines primaires et secondaires des protéines et des acides nucléiques (OMS, 2002; US EPA, 2003). Plus particulièrement, il a été suggéré que l'acroléine se lie aux résidus de cystéine des protéines et au GSH pour former un adduit GSH-acroléine (ATSDR, 2007; CalEPA, 2008).
Il a été proposé que la voie métabolique majeure de l'acroléine fait d'abord intervenir la conjugaison de la GSH avec la double liaison activée de l'acroléine en présence de glutathion-S-transférase (GST). Cette conjugaison est suivie d'une dégradation des adduits acroléine-GSH en dérivés de l'acide mercapturique par l'alcool et l'aldéhyde déshydrogénases (examinée par OMS, 2002 et US EPA, 2003). L'acide S-(3-hydroxypropyl)mercapturique (3-HPMA, voir la Figure 3) est le principal métabolite et il a été détecté dans l'urine de rats auxquels de l'acroléine a été administrée par inhalation ou par injection intrapéritonéale (IP) ou sous-cutanée (Linhart et al., 1996, cités par US EPA, 2003). Le 3-HPMA a d'ailleurs été retrouvé dans l'urine de souris exposées à l'acroléine par inhalation (Tully, 2014; Conklin et al., 2017). Linhart et al. (1996) ont également détecté un métabolite secondaire dans l'urine du rat, soit l'acide S-(2-carboxyéthyl)mercapturique (CEMA, voir la Figure 3), qui représente environ 10 % de ces deux acides mercapturiques.
L'époxydation de l'acroléine et la conjugaison du GSH avec l'époxyde, ou la conjugaison de l'eau avec l'acroléine conduisant à la formation de 3-hydroxypropionaldéhyde qui est ensuite oxydé en acide malonique et en acide oxalique constitueraient deux autres voies métaboliques secondaires (Parent et al., 1998).
L'acroléine est présente de façon endogène à cause de la peroxydation lipidique et du métabolisme des acides α-hydroxyaminés et des polyamines. La peroxydation lipidique survient au cours de l'inflammation qui caractérise certaines maladies respiratoires comme la maladie pulmonaire obstructive chronique et l'asthme (examinée par ATSDR, 2007; Bein et Leikauf, 2011; Burcham, 2016). L'acroléine a été détectée dans le condensat d'air exhalé et les crachats induits, les concentrations d'acroléine étant plus élevées chez les sujets souffrant de maladie pulmonaire obstructive chronique ou d'asthme que chez ceux en bonne santé (Deshmukh et al., 2008, cités par Bein et Leikauf, 2011). Les métabolites de l'acroléine 3-HPMA et CEMA ont été détectés dans l'urine de plus de 98 % de la population générale américaine, leur concentration étant considérablement plus élevée chez les fumeurs (Alwis et al., 2015).
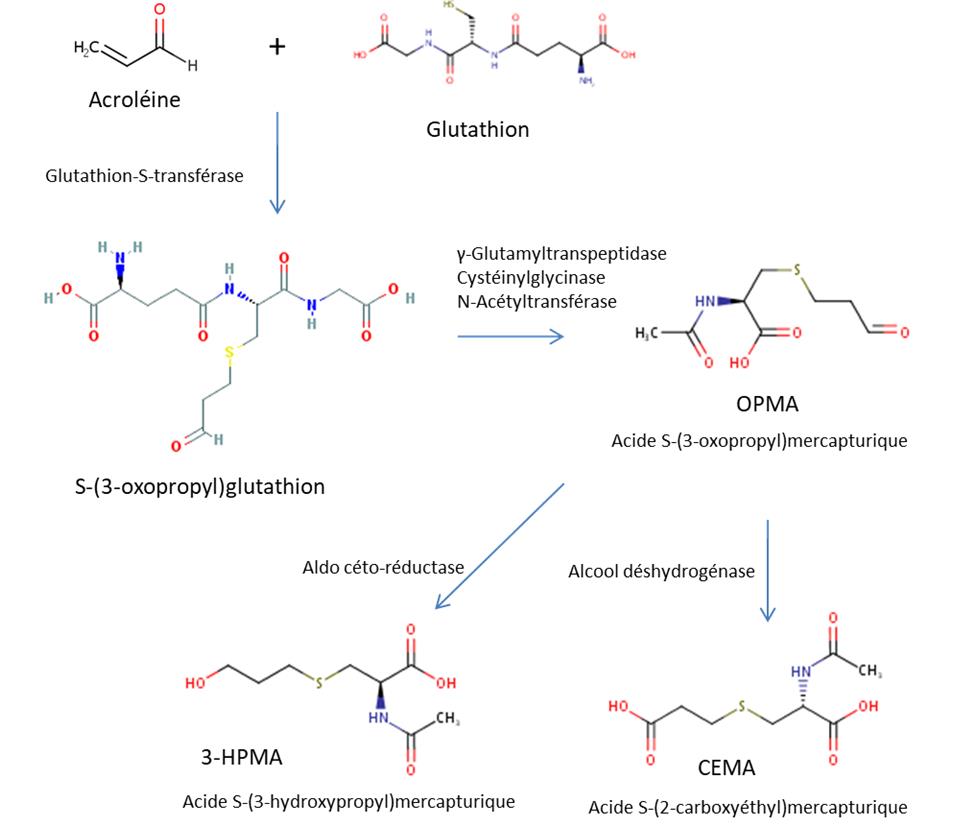
Figure 3 - Équivalent textuel
La Figure 3 présente la principale voie du métabolisme de l'acroléine. L'acroléine apparait comme point de départ dans le coin supérieur gauche. Le signe d'addition apparait à droite de l'acroléine, suivi du glutathion. En-dessous du signe d'addition apparait une flèche pointant vers le bas, avec les termes « Glutathion-S-transférase » sur le côté. La flèche pointe vers S-(3-oxopropyl)glutathion, suivi d'une autre flèche pointant vers la droite avec les termes γ-Glutamyltranspeptidase, Cystéinylglycinase et N-Acétyltransférase au-dessus et menant à Acide S-(3-oxopropyl)mercapturique (OPMA). À partir de OPMA, deux flèches pointent vers le bas, une à gauche indiquant Aldo céto-réductase et menant à Acide S-(3-hydroxypropyl)mercapturique (3-HPMA) et une à droite indiquant Alcool déshydrogénase et menant à Acide S-(2-carboxyéthyl)mercapturique (CEMA).
4.2 Modélisation pharmacocinétique à base physiologique
Schroeter et al. (2008) ont développé un modèle CFD-PBPK pour l'acroléine prenant en compte à la fois la mécanique des fluides et des éléments physiologiques. Un modèle CFD reposant sur des modèles tridimensionnels des voies nasales du rat et de l'homme a été associé à un modèle PBPK à deux compartiments (mucus et épithélium, et sous-épithélium perfusé). Le modèle de rat a été optimisé à l'aide de données pharmacocinétiques (PK) provenant des études de Struve et al. (2008) et de Morris (1996) (c.-à-d. les paramètres PK ont été ajustés en fonction des données empiriques issues de ces études), sans toutefois être pleinement validé (c.-à-d. les résultats produits par le modèle n'ont été comparés qu'aux études PK menées chez le rat servant à calibrer le modèle). Comme le modèle n'a été ni calibré ni validé chez l'homme, les auteurs ont fait preuve de prudence en se servant des résultats du 99e centile. Une saturation ou une cinétique non linéaire semble se manifester aux concentrations pertinentes.
Corley et al. (2012) ont élargi le modèle CFD de Schroeter et al. (2008) pour y inclure les voies respiratoires supérieures et inférieures. Le modèle PBPK à deux compartiments a été conservé, mais une nouvelle vitesse maximale de métabolisme (Vmax) a été établie pour prendre en compte la saturation des aldéhydes déshydrogénases. L'absorption relative d'acroléine chez le rat, le singe et l'homme n'est présentée que pour une concentration atmosphérique de 0,6 ppm (1,38 mg/m3), les tissus nasaux et l'ensemble des voies respiratoires (prenant en compte les modèles d'exposition par inhalation et par voie orale chez l'homme). L'absorption d'acroléine au niveau des tissus nasaux est moins élevée chez l'homme que chez l'animal (69,5 %, 54,7 % et 24 %, respectivement chez le rat, le singe et l'homme pour une concentration de 0,6 ppm [1,38 mg/m3]). L'absorption d'acroléine est toujours relativement plus faible chez l'homme lorsque l'ensemble des voies respiratoires est pris en compte (98,5 %, 95,8 %, 45,2 % et 34,8 %, respectivement chez le rat, chez le singe, au niveau nasal chez l'homme et au niveau buccal chez l'homme, pour une concentration de 0,6 ppm [1,38 mg/m3]). Le modèle a été calibré à l'aide de données PK provenant d'études chez le rat (Morris, 1996; Struve et al., 2008), sans toutefois être pleinement validé chez le rat, ni calibré ou validé chez l'homme.
Comme le formaldéhyde est un gaz analogue, le flux du formaldéhyde a également été modélisé chez le rat et l'homme par Kimbell et al. (2001), qui se sont servis de modèles CFD tridimensionnels anatomiquement corrects pour estimer le flux dans différents compartiments ou régions des vois nasales. Le flux moyen dans 20 compartiments est environ deux fois plus élevé chez l'homme que chez le rat; le flux maximal est environ 25 % plus élevé chez le rat que chez l'homme (voir la section 6.2).
5.0 Effets sur la santé
Cette section examine les effets de l'acroléine chez l'homme (voir la section 5.1) ainsi que les études toxicologiques pertinentes menées chez l'animal de laboratoire, en plus de données justificatives provenant de systèmes de test in vitro (voir la section 5.2). Un résumé des effets sur la santé de l'exposition par inhalation à l'acroléine est présenté à la section 5.3, en plus d'une analyse du mécanisme d'action. De plus amples détails portant sur les études d'exposition humaine et toxicologiques présentées ci-dessous se trouvent également dans les annexes B et C.
Les études pertinentes portant sur les effets sur la santé de l'acroléine publiées jusqu'en octobre 2018 ont été passées en revue. Bien que l'acroléine soit un composant de la fumée du tabac, toutes celles traitant de la fumée du tabac n'ont pas été prises en compte, la fumée du tabac étant un mélange complexe de nombreux cancérogènes et toxines connus et ses effets sur la santé n'étant pas abordés dans ce document. Les autres voies d'exposition, soit l'ingestion et la voie cutanée, n'ont pas été considérées comme pertinentes du point de vue physiologique. Santé Canada a évalué les études originales considérées comme essentielles à l'établissement des limites d'exposition proposées relatives à l'acroléine (voir la section 6). Des examens des effets sur la santé de l'acroléine faisant autorité ont également permis de recueillir d'autres données pertinentes : a) Proposition de valeurs guides de qualité d'air intérieur : L'acroléine de l'Anses (2013); b) Acrolein Reference Exposure Levels de la CalEPA (2008); c) Toxicological Profile for Acrolein de l'ATSDR (2007); d) Toxicological Review of Acrolein de l'US EPA (2003); e) Concise International Chemical Assessment Document 43: Acrolein de l'OMS (2002); f) Liste des substances d'intérêt prioritaire, rapport d'évaluation : acroléine d'Environnement Canada et de Santé Canada (2000).
5.1 Effets chez l'homme
5.1.1 Exposition de courte durée
De nombreuses études décrivent les effets aigus de l'acroléine sur des volontaires. L'irritation oculaire y est l'effet le plus sensible, survenant à des expositions aussi courtes que 5 minutes à des concentrations d'acroléine comprises entre 0,06 et 0,1 ppm (0,14 - 0,23 mg/m3) (Darley et al., 1960; Weber-Tschopp et al., 1977; Dwivedi et al., 2015; Claeson et Lind, 2016). L'irritation nasale, de la gorge et respiratoire survient à des concentrations plus élevées (Weber-Tschopp et al., 1977).
Darley et al. (1960) ont exposé les yeux seulement de 36 volontaires à 0,06, 1,3 à 1,6 ou 2,0 à 2,3 ppm (0,14, 2,99 - 3,68 ou 4,60 - 5,29 mg/m3, respectivement) d'acroléine pendant 5 minutes. Certains sujets ont rapporté une irritation oculaire dès la plus faible concentration (0,14 mg/m3), bien que dans l'ensemble le score d'irritation associé à cette concentration ait été considéré comme nul.
Dans un premier test, Weber-Tschopp et al. (1977; publication en allemand) ont exposé 53 volontaires de manière continue à des concentrations croissantes d'acroléine pendant 40 minutes (maximum de 0,6 ppm [1,4 mg/m3]); une incidence beaucoup plus élevée d'irritation oculaire subjective a été observée à 0,09 ppm (0,21 mg/m3). Une irritation oculaire, mesurée par la fréquence de clignement des yeux, a été observée à partir de 0,26 ppm (0,60 mg/m3). Les auteurs de l'étude ont également constaté une augmentation significative de cas signalés d'irritation nasale entre 0,15 et 0,26 ppm (0,35 et 0,60 mg/m3), une irritation de la gorge à partir de 0,43 ppm (1,0 mg/m3) et une baisse de la fréquence respiratoire à 0,6 ppm (1,4 mg/m3). Dans un second test, Weber-Tschopp et al. (1977) ont exposé 42 sujets à des concentrations d'acroléine comprises entre 0,15 et 0,6 ppm (0,35 et 1,4 mg/m3) pendant 1,5 minute, avec une pause entre les expositions. L'incidence d'irritation oculaire subjective a augmenté de façon significative à 0,3 ppm (0,69 mg/m3) et celle d'irritation nasale à 0,6 ppm (1,4 mg/m3). Enfin, dans le dernier test, Weber-Tschopp et al. (1977) ont exposé 46 volontaires à 0,3 ppm (0,69 mg/m3) d'acroléine pendant 60 minutes. L'intensité de l'irritation oculaire, nasale et de la gorge a augmenté au cours des 10 à 20 premières minutes et une diminution significative de la fréquence respiratoire a été mesurée (Weber-Tschopp et al., 1977, cités par US EPA, 2003).
D'autres études ont signalé des effets similaires. Sim et Pattle (1957) ont constaté que les expositions à 0,8 ppm (1,84 mg/m3) pendant 10 minutes ou à 1,2 ppm (2,76 mg/m3) pendant 5 minutes étaient « extrêmement irritantes » et provoquaient des larmoiements (Sim et Pattle, 1957, cités par US EPA, 2003). Claeson et Lind (2016) ont indiqué qu'une irritation oculaire a été rapportée par des volontaires dès les 7 premières minutes d'une exposition de 15 minutes des yeux seulement à une concentration d'acroléine de 0,36 mg/m3. L'irritation a persisté 10 minutes après l'arrêt de l'exposition. Aucune différence du point de vue de l'irritation oculaire n'a été relevée entre l'exposition des témoins et une exposition de 45 minutes à 0,16 mg/m3 ou de 60 minutes à 0,07 mg/m3. Dwivedi et al. (2015) ont examiné l'irritation chez 18 sujets exposés à une concentration d'acroléine de 0,05 ou de 0,1 ppm (0,12 ou 0,23 mg/m3) pendant 2 heures. Une légère augmentation de l'irritation oculaire subjective et de la fréquence de clignement des yeux a été mise en évidence à 0,1 ppm (0,23 mg/m3), mais pas à 0,05 ppm (0,12 mg/m3) d'acroléine. Aucune différence n'a été observée entre les témoins et les sujets exposés pour ce qui est de la fréquence respiratoire, de la fonction pulmonaire ou des marqueurs de l'inflammation dans le sang ou le crachat.
Toutes ces études ont été menées auprès d'un faible nombre de volontaires, en plus d'avoir eu recours à une autodéclaration des symptômes de l'irritation.
Plusieurs études de cas décrivent les effets de l'exposition aiguë à l'acroléine, bien qu'il s'agisse souvent d'expositions à de nombreuses substances où la concentration d'acroléine n'est généralement pas connue. Un garçon de deux ans a été hospitalisé pour insuffisance respiratoire aiguë après une exposition d'environ une heure à une fumée âcre provenant de la combustion d'huile végétale. Les effets pulmonaires ont subsisté 18 mois après l'exposition (Mahut et al., 1993, cités par CalEPA, 2008). Un travailleur d'une usine chimique exposé à un dégagement accidentel de vapeurs d'acroléine sur son lieu de travail présentait une pneumonie chimique et une irritation oculaire qui ont pu être traitées (Champeix et al., 1966, cités par US EPA, 2003). Aux États-Unis, les CDC (2013) ont passé en revue les cas d'intoxication aiguë à l'acroléine causée par l'usage professionnel de pesticides et en ont dénombré huit entre 1993 et 2009. Les symptômes observés comprennent la détresse respiratoire, l'irritation oculaire, les céphalées, la dyspnée et l'irritation de la peau ou des brûlures.
5.1.2 Exposition de longue durée
Les récentes études examinant le lien entre les concentrations atmosphériques d'acroléine et les effets sur la santé humaine sont nombreuses. Il convient de noter qu'aucun lien de causalité n'a pu être établi, ces études étant toutes transversales. Deux d'entre elles se sont penchées sur les concentrations d'acroléine en milieu scolaire ou résidentiel en France, mesurées à l'aide d'échantillonneurs passifs imprégnés de DNPH; les sujets ont toutefois été exposés à de nombreux polluants et les effets sur la santé (asthme et rhinite) reposent sur des questionnaires au lieu de diagnostics médicaux (Billionnet et al., 2011; Annesi-Maesano et al., 2012). Une autre étude a modélisé les concentrations ambiantes d'acroléine à partir de données d'émissions et comparé ces concentrations à la prévalence de l'asthme dans différentes régions des États-Unis (deCastro, 2014). Les expositions n'y sont pas mesurées, et il n'y a aucun cas individuel d'asthme ni aucun témoin. Les limites des méthodes de mesure de l'acroléine ont été abordées à la section 3. Ces études sont examinées plus en détail ci-dessous.
Annesi-Maesano et al. (2012) ont mesuré les concentrations d'acroléine et d'autres contaminants de l'air dans 401 classes de 108 écoles primaires de 6 villes françaises. Les concentrations d'acroléine ont été réparties en trois groupes : faible (< LD - non précisée), moyenne (> LD mais < 1,55 µg/m3) et forte (> 1,55 µg/m3). Les effets sur la santé examinés étaient l'asthme et la rhinite évalués au moyen d'un questionnaire de santé rempli par les parents et d'une visite médicale comprenant un test de la piqûre pour le dépistage des allergies et un test pour détecter l'asthme d'effort. Après ajustement sur les facteurs de confusion possibles (y compris le tabagisme passif et les antécédents familiaux), les rapports de cotes (RC) pour le développement de l'asthme au cours de l'année précédente étaient de 1,23 (intervalle de confiance [IC] à 95 % se situant entre 1,02 et 1,45) pour la concentration moyenne et de 1,22 (IC à 95 % se situant entre 1,09 et 1,38) pour la concentration forte par rapport à la concentration faible. Après stratification des sujets sur la réactivité cutanée, une association positive entre l'acroléine et l'asthme allergique (atopique) a été mise en évidence (RC de 1,22 pour le groupe d'exposition moyenne et de 1,28 pour celui d'exposition forte), association non retrouvée avec l'asthme non allergique (non atopique). L'acroléine a également été significativement corrélée avec l'asthme d'effort (p < 0,025). Il n'y avait aucun lien entre la concentration d'acroléine et le développement de rhinoconjonctivite au cours de l'année précédente. Les limites de cette étude sont nombreuses, y compris l'étroite plage de concentrations mesurées, l'absence d'informations sur la répartition des concentrations d'acroléine par classe, une surveillance de courte durée (5 jours) sans prendre en compte les niveaux d'exposition à l'acroléine à la maison et un asthme diagnostiqué par les parents au cours de l'année précédente plutôt que par un médecin. Étant donné la faible association non significative entre l'acroléine et l'asthme dans le groupe expérimental, la relation inverse entre l'acroléine et l'asthme chez les enfants non atopiques et l'absence de relation concentration-réponse, l'affirmation des auteurs selon laquelle l'acroléine joue un rôle dans le développement de l'asthme doit être considérée avec prudence.
Billionnet et al. (2011) ont prélevé l'air de 490 habitations en France et mesuré les concentrations d'acroléine et d'autres contaminants de l'air intérieur pendant une semaine. Les concentrations d'acroléine ont été réparties en quartiles; les concentrations étaient comprises entre < LD (0,1) et 12,9 µg/m3, avec une médiane de 1,0 µg/m3. Les concentrations supérieures au troisième quartile ont été considérées comme élevées (1,51 µg/m3). Les effets sur la santé (le développement de l'asthme au cours de l'année précédente et celui d'une rhinite le mois précédent) ont été évalués au moyen d'un questionnaire. Après ajustement sur les facteurs de confusion possibles (y compris le tabagisme et les caractéristiques de l'habitation), aucune association significative n'a été mise en évidence entre les concentrations élevées d'acroléine et l'asthme ou la rhinite. L'article portait essentiellement sur les effets de concentrations combinées de polluants.
Une étude plus récente qui s'est penchée sur les concentrations ambiantes modélisées d'acroléine et la prévalence de l'asthme au sein de la population américaine a été relevée. deCastro (2014) a estimé les niveaux d'exposition à l'acroléine dans chaque secteur de recensement à partir de données du National Emissions Inventory et de surveillance de l'air de l'US EPA ainsi que de modèles incorporant la densité de la population, la topographie et le climat. Les concentrations modélisées ont été réparties en quintiles, le quintile inférieur se situant entre 0,000 14 et 0,011 µg/m3 et le quintile supérieur entre 0,055 et 0,457 µg/m3. Les auteurs les ont ensuite comparées aux résultats du National Health Interview Survey, qui produit des estimations de la prévalence des maladies aux États-Unis par année et par groupe d'âge. Le RC de la prévalence de crise d'asthme dans les 12 mois précédents était plus élevé dans le quintile supérieur que dans le quintile inférieur pour tous les sujets (n = 271 348), les personnes qui n'avaient jamais fumé, et les personnes qui n'avaient jamais fumé plus les anciens fumeurs; les auteurs ont qualifié ces augmentations de marginalement significatives, les valeurs de p étant comprises entre 0,05 et 0,15. Aucune tendance n'a été observée dans les quatre quintiles inférieurs. La principale limite de cette étude est que les concentrations d'acroléine n'ont pas été réellement mesurées.
Deux récentes études de biosurveillance ont examiné les concentrations urinaires de 3-HPMA (le métabolite majeur de l'acroléine) et le risque de maladie. L'absence de mesures d'exposition à l'acroléine ou d'attribution des sources (comprend l'exposition à l'acroléine issue de toutes les sources, y compris la production endogène) constitue une limite de ces études; de plus, aucun effet sur la santé n'a été examiné. DeJarnett et al. (2014) ont examiné la concentration urinaire de 3-HPMA et le risque de maladie cardio-vasculaire chez 211 sujets présentant un risque modéré à élevé de maladie cardio-vasculaire. Après ajustement sur les facteurs de confusion, une association significative entre la concentration urinaire de 3-HPMA et le risque de maladie cardio-vasculaire a été mise en évidence (un score de risque de Framingham plus élevé). Ce lien est encore plus marqué chez les non-fumeurs. Park et al. (2015) ont mesuré la concentration urinaire de 3-HPMA auprès d'environ 2200 adultes fumeurs provenant de cinq différents groupes ethniques. Après ajustement sur les facteurs de confusion possibles, la concentration de 3-HPMA était la plus élevée chez les natifs d'Hawaii et la plus faible chez les Latinos. Les auteurs ont constaté que les natifs d'Hawaii ont un risque plus élevé de développer un cancer du poumon que les Blancs et les Latinos un risque plus faible; selon eux, les différences de métabolisme de l'acroléine expliqueraient en partie les différences de risque.
5.1.3 Cancérogénicité
Le Centre international de Recherche sur le Cancer (CIRC) considère que l'acroléine est « inclassable quant à sa cancérogénicité pour l'homme » (Groupe 3; CIRC, 1995) en raison de preuves insuffisantes chez l'homme ou l'animal de laboratoire. L'US EPA (2003) a également conclu que la base de données sur l'acroléine ne permet pas d'évaluer son potentiel cancérogène.
Une étude cas témoins menée en milieu professionnel a été relevée, dans laquelle l'exposition de travailleurs à plusieurs substances chimiques a été classée « toujours » ou « jamais » par catégorie d'emplois (Ott et al., 1989, cités par CIRC, 1995 et US EPA, 2003). Deux hommes morts des suites d'un lymphome non hodgkinien, un autre d'un myélome multiple et trois autres de leucémie non lymphocytaire avaient tous été exposés à l'acroléine. Il n'y avait aucune augmentation statistiquement significative des cas de cancer chez les travailleurs exposés à l'acroléine et les travailleurs avaient probablement tous été exposés simultanément à d'autres substances chimiques. Les résultats de cette étude ne permettent donc pas d'évaluer le potentiel cancérogène de l'acroléine.
Aucune autre étude sur le potentiel cancérogène de l'acroléine n'a été recensée dans la littérature.
5.2 Études toxicologiques
5.2.1 Effets respiratoires
5.2.1.1 Exposition (unique) aiguë
L'acroléine présente une toxicité aiguë élevée par inhalation, provoquant des réactions inflammatoires aiguës, des lésions pulmonaires et la mort chez le rat, la souris, le cobaye et le lapin (examinées par US EPA, 2003). La CL50 est comprise entre 8 et 66 ppm (18,4 et 151,8 mg/m3) pour des expositions de 4 ou 6 heures chez le rat, la souris et le hamster (Environnement Canada et Santé Canada, 2000). À des concentrations plus faibles, l'acroléine est un irritant respiratoire, induisant des effets comme une décroissance de la fréquence respiratoire, une bronchoconstriction et une hypersécrétion de mucus.
La concentration d'acroléine qui entraîne une diminution de 50 % de la fréquence respiratoire (RD50) (une indication du potentiel irritant, voir Shusterman, 2011) est déterminée entre 1,0 et 2,9 ppm (2,3 et 6,7 mg/m3) chez la souris et entre 4,6 et 9,2 ppm (10,6 et 21,2 mg/m3) chez le rat (US EPA, 2003; CalEPA, 2008), ce qui indique que la souris est plus sensible que le rat à l'irritation. Une exposition concomitante à l'acroléine et à l'acétaldéhyde ou au formaldéhyde provoque une diminution plus marquée de la fréquence respiratoire (Cassee et al., 1996).
Chez le cobaye, une exposition par inhalation de 0,35 à 17 ppm (0,8 et 39,1 mg/m3) d'acroléine entraîne une diminution de la fréquence respiratoire et une augmentation de la résistance à l'écoulement et du volume courant (Murphy et al., 1963, cités par US EPA, 2003; Davis et al., 1967, cités par US EPA, 2003). La résistance accrue des voies respiratoires est transitoire à 0,3 ppm (0,7 mg/m3); l'hyperréactivité bronchique persiste toutefois plus de 24 heures après l'arrêt d'une exposition à 0,9 ppm (2,1 mg/m3) d'acroléine (Leikauf, 1991). Chez la souris, une exposition unique de 1,1 à 1,6 ppm (2,5 et 3,7 mg/m3) d'acroléine provoque une décroissance de la fréquence respiratoire et une augmentation de la résistance des voies respiratoires, qui sont plus marquées chez les animaux déjà sensibilisés par injection IP d'ovalbumine (un modèle de maladie allergique des voies respiratoires), ce qui semble indiquer que les animaux sensibilisés seraient plus susceptibles aux effets respiratoires de l'acroléine (Morris et al., 2003).
Chez le cobaye, une exposition à une concentration d'acroléine de 0,9 ppm (2,1 mg/m3) pendant 2 heures provoque des changements au niveau de la composition des cellules trachéales. Ces changements sont toutefois transitoires, ces cellules revenant à la normale dans les 24 heures (Leikauf, 1991). Chez le hamster, une exfoliation des bronches, une prolifération des cellules basales, des zones irrégulières au niveau de l'épithélium et une hyperplasie sont observées 4 jours après une exposition à 6 ppm (13,8 mg/m3) d'acroléine pendant 4 heures (Kilburn et McKenzie, 1978, cités par US EPA, 2003; Environnement Canada et Santé Canada, 2000). Chez le rat, Arumugan et al. (1999) ont observé la présence de cellules desquamées et mononucléaires dans les bronchioles, une hyperémie et un emphysème après une exposition à 2 ppm (4,6 mg/m3) d'acroléine pendant 4 heures. Roemer et al. (1993) ont observé une prolifération accrue des cellules nasales, trachéales et pulmonaires après une exposition de 0,2 à 0,6 ppm (0,46 à 1,38 mg/m3) d'acroléine pendant 6 heures. Ces effets n'ont pu être reproduits par Cassee, Groten et Feron (1996), qui n'ont pas observé de lésion nasale ni de prolifération cellulaire chez des rats exposés à 0,67 ou 1,4 ppm (1,54 ou 3,22 mg/m3) d'acroléine pendant 6 heures.
5.2.1.2 Exposition répétée
L'exposition répétée par inhalation à l'acroléine produit des effets similaires à ceux de l'exposition unique. Des études chez la souris et le rat ont démontré que l'exposition de 3 jours à 13 semaines à l'acroléine provoque une hypersécrétion de mucus ainsi qu'une inflammation et une prolifération cellulaire au niveau de l'épithélium respiratoire accompagnées d'une hyperplasie cellulaire basale et d'une métaplasie squameuse. La sévérité des effets semble croître avec le niveau d'exposition et non avec la durée d'exposition.
De nombreuses études d'exposition de courte durée (3 jours à 4 semaines) ont été relevées chez la souris et le rat. Les effets observés s'apparentent à ceux d'une exposition par contact direct avec un irritant. Chez la souris, une exposition à 0,5 ou 1,7 ppm (1,2 ou 3,9 mg/m3) d'acroléine pendant 4 jours (3 heures par jour) conduit à une réduction plus importante de la fréquence respiratoire que l'exposition unique (Kane et Alarie, 1977, cités par US EPA, 2003). Buckley (1984) n'a observé de lésions (exfoliation, érosion, ulcération, nécrose, inflammation et métaplasie squameuse de l'épithélium respiratoire) que dans les voies respiratoires supérieures de souris exposées à 1,7 ppm (3,9 mg/m3) d'acroléine pendant 5 jours (6 heures par jour). Des effets similaires ont été observés chez le rat au cours d'une étude d'exposition de 3 semaines (5 jours par semaine à 3 ppm [6,9 mg/m3]) (Leach et al., 1987). Chez la souris et le rat, une exposition de 2 à 3 ppm (4,6 à 6,9 mg/m3) d'acroléine pendant 2 à 4 semaines conduit à une hypersécrétion de mucus et à une métaplasie des cellules caliciformes dans les poumons (Borchers et al., 1998, cités par US EPA, 2003; Borchers, Carty et Leikauf, 1999, cités par US EPA, 2003; Borchers et al., 1999, cités par US EPA, 2003; Borchers et al., 2008; Chen et al., 2010, 2013). Chez le rat, Roemer et al. (1993) ont observé une prolifération cellulaire accrue au niveau de l'épithélium nasal, trachéal et pulmonaire après une exposition à 0,2 ou 0,6 ppm (0,46 ou 1,38 mg/m3) d'acroléine pendant 3 jours (6 heures par jour); les effets étaient moins prononcés que ceux de l'exposition unique. Chez le rat, Cassee, Groten et Feron (1996) ont également mis en évidence une prolifération cellulaire accrue au niveau du nez après une exposition du nez seulement à 0,25 ou 0,67 ppm (0,57 ou 1,54 mg/m3) pendant 3 jours (6 heures par jour). Les auteurs ont aussi observé des lésions de l'épithélium nasal dont l'incidence et la sévérité augmentent avec la concentration (dose minimale avec effet nocif observé [DMENO] = 0,25 ppm [0,57 mg/m3], mais aucune DSENO). Le gouvernement du Canada (Environnement Canada et Santé Canada, 2000) a déjà établi une concentration repère (CR05) de 0,14 mg/m3 pour « la désagrégration, la nécrose, l'épaississement et la desquamation de l'épithélium respiratoire/transitionnel », et de 0,68 mg/m3 pour l'hyperplasie cellulaire basale. La CR05 représente « la concentration associée à une augmentation de 5 % de l'incidence des lésions de l'épithélium respiratoire nasal ». La concentration tolérable repose sur la CR05 associée à l'effet le plus sensible.
Les nombreuses études de toxicité subchronique (6 à 13 semaines) par inhalation de l'acroléine relevées confirment les effets observés dans les études d'expositions de courte durée et aiguë. Chez la souris, le rat, le cobaye, le lapin, le hamster, le singe et le chien, l'exposition à l'acroléine induit des effets irritants sur l'appareil respiratoire, allant de l'inflammation légère aux concentrations faibles à la métaplasie et à l'hyperplasie aux concentrations plus élevées. Selon les espèces et le protocole d'exposition, les tissus cibles comprennent les voies respiratoires supérieures et inférieures. La cavité nasale apparaît comme la région la plus sensible étant le site de premier contact.
Lyon et al. (1970) ont exposé des rats, des cobayes, des singes (mâles seulement) et des chiens (mâles seulement) à une concentration d'acroléine sous forme de vapeur de 0,7 ou 3,7 ppm (1,6 ou 8,5 mg/m3) pendant 6 semaines (8 heures par jour, 5 jours par semaine). Toutes les espèces du groupe faiblement exposé ont présenté des irritations et des écoulements oculaires et nasaux ainsi qu'une légère inflammation chronique du tissu pulmonaire. Ces effets sont plus prononcés chez le chien que chez le singe. Les chiens et les singes du groupe fortement exposé ont développé une métaplasie squameuse et une hyperplasie cellulaire basale dans la trachée; les singes ont également présenté une nécrose et une métaplasie squameuse dans les bronches. Dans cette même étude, les chercheurs ont exposé de façon continue les animaux à une concentration d'acroléine sous forme de vapeur de 0,22, 1,0 ou 1,8 ppm (0,5, 2,3 ou 4,1 mg/m3) pendant 90 jours. À la plus faible concentration, deux des quatre chiens ont présenté un emphysème modéré, une congestion pulmonaire aiguë, une vacuolisation focale dans les cellules épithéliales bronchiolaires et une certaine constriction des bronchioles. Une inflammation pulmonaire a été observée chez le cobaye et le rat à partir de 1 ppm. Les singes exposés à 1,8 ppm d'acroléine ont développé une métaplasie squameuse et une hyperplasie cellulaire basale dans la trachée. Selon l'US EPA (2003), aucune analyse histopathologique des voies nasales n'a été effectuée dans cette étude et il n'y avait aucun groupe témoin concomitant.
Dans une autre étude sur plusieurs espèces, Feron et al. (1978) ont exposé des hamsters, des rats et des lapins à une concentration d'acroléine sous forme de vapeur de 0, 0,4, 1,4 ou 4,9 ppm (0, 0,9, 3,2 ou 11,3 mg/m3) pendant 13 semaines (6 heures par jour, 5 jours par semaine). Six rats du groupe fortement exposé sont morts au cours des quatre premières semaines d'exposition. Les autopsies ont révélé la présence de lésions au niveau des poumons (hémorragie et œdème). De ce groupe, les rats qui ont survécu présentaient des lésions sévères au niveau des poumons, y compris une hémorragie, un œdème, une bronchopneumonie, une bronchite, une hyperplasie et une métaplasie de l'épithélium bronchique. Les lapins exposés à la plus forte concentration d'acroléine présentaient des lésions similaires au niveau des poumons, mais moins sévères que chez le rat (les auteurs les ont qualifiées de « modérées »). Les poumons du hamster n'ont pas été touchés. Les trois espèces présentaient des lésions de la trachée à la plus forte concentration, dont la sévérité allait de l'hyperplasie légère chez le lapin à l'hyperplasie et à la métaplasie modérées chez le hamster, en passant par des lésions sévères chez le rat. Cette étude comprenait également une analyse histopathologique nasale (trois sections). Seul un rat a été affecté à la plus faible concentration, des modifications métaplasiques et inflammatoires ayant été observées. À la concentration moyenne, les lésions du rat ont été considérées comme modérées (données d'incidence non présentées) et de légères modifications ont été observées chez le hamster. À la concentration la plus élevée, des modifications sévères ont été observées chez le rat et le hamster, alors qu'elles étaient modérées chez le lapin. La plus faible DMENO a été fixée à 0,4 ppm par l'US EPA (2003) chez le rat, l'espèce la plus sensible. Cette étude a été retenue comme étude clé par l'US EPA pour la construction d'une CRf par inhalation. Elle a été préférée à l'étude de trois jours de Cassee, Groten et Feron (1996) en raison du plus grand nombre d'animaux d'espèces différentes et des deux sexes par test, de la plus longue durée d'exposition, de l'utilisation de trois différentes concentrations couvrant une vaste plage et de l'évaluation de nombreux effets.
Plusieurs études sur l'exposition à l'acroléine ont été menées chez le rat F344 (Kutzman, 1981; Kutzman et al., 1985; Costa et al., 1986). Des rats mâles et femelles ont été exposés à 0, 0,4, 1,4 ou 4,0 ppm (0, 0,9, 3,2 ou 9,2 mg/m3) d'acroléine pendant 62 jours (6 heures par jour, 5 jours par semaine). Un fort taux de mortalité (56 %) a été observé chez les mâles à la concentration la plus élevée, alors que toutes les femelles ont survécu. Plusieurs animaux morts présentaient une bronchopneumonie sévère aiguë. Les animaux qui ont survécu présentaient des lésions du poumon et de la trachée de sévérité très variable, dont un œdème alvéolaire focal avec desquamation cellulaire au niveau des bronches et des bronchioles, une nécrose de l'épithélium bronchiolaire et un œdème trachéal avec érosion de l'épithélium muqueux. Les auteurs ont qualifié ces effets de maladie pulmonaire obstructive, ces lésions ayant été mises en évidence dans les grandes et petites voies respiratoires. L'examen fonctionnel des poumons a révélé une dépression de la fonction pulmonaire. À la concentration moyenne, les poumons présentaient une nécrose et une hyperplasie encore une fois fortement variables; ce groupe fonctionnait toutefois tout aussi bien que le groupe témoin. Aucune lésion n'a été observée au niveau des poumons chez le groupe faiblement exposé; ces animaux présentaient toutefois des déficits fonctionnels s'apparentant à un syndrome respiratoire restrictif. Les auteurs ont constaté que les examens fonctionnels semblent constituer l'indicateur de changement le plus sensible et que les tests de constitution des poumons confortent les observations fonctionnelles. Cette étude a permis à Santé Canada d'établir une CR05 de 0,76 mg/m3 pour les lésions du cornet nasal chez le rat dans son évaluation antérieure des risques de l'acroléine (Environnement Canada et Santé Canada, 2000).
Dorman et al. (2008) ont exposé des rats mâles F344 à une concentration d'acroléine de 0, 0,02, 0,06, 0,2, 0,6 ou 1,8 ppm (0, 0,05, 0,14, 0,46, 1,4 ou 4,1 mg/m3) pendant 13 semaines (6 heures par jour, 5 jours par semaine). Une analyse histopathologique a été réalisée aux jours d'exposition 4, 14, 30 et 65, puis après une période de repos de 60 jours sur six sections de la cavité nasale. Les lésions ont été classées en fonction de leur sévérité et le nombre d'animaux touchés de chaque groupe a été consigné. Les pathologies de l'épithélium respiratoire nasal comprenaient l'inflammation, l'hyperplasie et la métaplasie squameuse, avec des effets légers à la concentration de 0,6 ppm (1,4 mg/m3) et des effets plus graves à la concentration plus élevée. Des effets ont été observés dès les premiers jours d'exposition à la concentration la plus élevée. L'inflammation et l'hyperplasie étaient transitoires au niveau de certains sites, avant d'être remplacées par une métaplasie persistante malgré l'arrêt de l'exposition. Les auteurs ont établi une DSENO de 0,2 ppm (0,46 mg/m3) pour la pathologie nasale. Une prolifération cellulaire accrue a également été observée aux concentrations de 0,6 et de 1,8 ppm (1,4 et 4,1 mg/m3), mais pas à celle de 0,2 ppm (0,46 mg/m3). Des pathologies de l'épithélium olfactif nasal ont été mises en évidence à la concentration de 1,8 ppm (4,1 mg/m3), dont l'inflammation, la dégénérescence et l'atrophie. Le larynx et la trachée ont présenté une métaplasie squameuse, qui était toutefois légère et réversible. Aucune pathologie liée au traitement n'a été mise en évidence dans les poumons. Il s'agit de la seule étude d'exposition par inhalation à l'acroléine qui a pu établir à la fois une DSENO et une DMENO. Dans leur évaluation des risques de l'acroléine, la CalEPA (2008) et l'Anses (2013) ont retenu la DSENO de 0,2 ppm (0,46 mg/m3) comme dose critique pour l'exposition de longue durée.
Le modèle CFD-PBPK développé par Schroeter et al. (2008) a servi à l'analyse dosimétrique de l'étude de toxicité par inhalation menée pendant 13 semaines chez le rat par Dorman et al. (2008). Une très forte incidence de lésions a été relevée dans les voies nasales antérieures (I et II), mais aucune corrélation n'a pu être mise en évidence entre les doses prévues et l'incidence de lésions; une forte corrélation a toutefois pu être observée dans les régions III et IV (à la concentration de 1,8 ppm [4,14 mg/m3]), ce qui a amené les auteurs à en déduire que la concentration de 0,6 ppm (1,38 mg/m3) constituait une DSENO et celle de 1,8 ppm (4,14 mg/m3) une DMENO. Le seuil du flux associé à la DSENO était de 72 pg/cm2-s; chez l'homme, il a été associé à une concentration de 45 ppb (DSENOceh = 0,1 mg/m3).
Deux autres études examinant l'exposition à l'acroléine pendant au moins un an ont été relevées. Feron et Kruysse (1977) ont exposé des hamsters à 4 ppm (9,2 mg/m3) d'acroléine pendant 52 semaines (7 heures par jour, 5 jours par semaine), suivies d'une période de repos de 29 semaines. Aucune tumeur n'a été détectée dans les voies respiratoires ni dans d'autres organes. Toutefois, 20 % des animaux présentaient une inflammation et une métaplasie épithéliale au niveau des voies respiratoires (CIRC, 1995). Quant à eux, Le Bouffant et al. (1980) ont exposé des rats à l'acroléine pendant 18 mois (1 heure par jour à 8 ppm [18,4 mg/m3]) sans détecter de tumeurs. Ces deux études sont toutefois d'un intérêt limité en raison de l'exposition à une concentration unique, du faible nombre d'animaux par groupe et du peu d'effets examinés.
5.2.2 Effets immunologiques
La réponse inflammatoire induite par l'acroléine a été mise en évidence dans plusieurs études d'exposition de courte durée et comprend le recrutement de cellules immunitaires et une stimulation de la production ou libération de cytokines pro-inflammatoires. Chez la souris, une exposition à 3 ppm (6,9 mg/m3) d'acroléine pendant 3 heures (mais pas à 0,3 ppm; 0,69 mg/m3) conduit à une augmentation des lymphocytes dans le liquide de lavage broncho-alvéolaire (LLBA) (Thompson et al., 2017). Le nombre total de cellules et le nombre de neutrophiles et d'éosinophiles demeurent toutefois inchangés dans le LLBA. Chez la souris, une exposition à 3 ppm (6,9 mg/m3) d'acroléine pendant 3 semaines induit une accumulation de macrophages dans le LLBA (Borchers, Carty et Leikauf, 1999, cités par US EPA, 2003; Borchers et al., 1999, cités par US EPA, 2003).
L'acroléine favorise la sensibilisation in vitro et in vivo. Roux et al. (1999, cités par CalEPA, 2008) ont montré que la préincubation avec de l'acroléine de tissus pulmonaires déjà sensibilisés augmente considérablement la réponse contractile des bronchioles à de nombreux antigènes, y compris les acariens de la poussière et l'histamine. O'Brien et al. (2016) ont exposé des souris à 5 ppm (11,5 mg/m3) d'acroléine et à de l'ovalbumine (OVA) inhalée pendant 2 semaines avant de les soumettre à une provocation à l'OVA pendant 3 jours, ce qui a provoqué une augmentation des IgG spécifiques de l'OVA et des neutrophiles (par rapport à l'exposition à l'OVA seule). L'inflammation pulmonaire était également plus prononcée chez les animaux exposés à l'acroléine et à l'OVA que chez ceux exposés à l'OVA seule. Selon les auteurs, l'acroléine semble favoriser la sensibilisation à l'OVA inhalée, comme le montre l'augmentation des IgG, mais les résultats pourraient tout aussi bien indiquer une tolérance respiratoire en raison du protocole d'exposition (expositions répétées à deux antigènes). Il a également été démontré qu'une préexposition à l'acroléine provoque une désensibilisation (une tolérance). Chez la souris, une préexposition par inhalation à l'acroléine (3 heures par jour à 0,5 ou 1,7 ppm [1,2 ou 3,9 mg/m3] pendant 3 jours), suivie d'une provocation à l'acroléine (0,4 à 11,2 ppm [0,9 à 25,8 mg/m3]) pendant 10 minutes, fait passer la RD50 de 1,7 à 3 ppm (3,9 à 6,9 mg/m3) (Kane et Alarie, 1977, cités par US EPA, 2003). D'ailleurs chez le rat, la RD50 est cinq fois plus élevée après une préexposition par inhalation à 15 ppm de formaldéhyde, un autre aldéhyde, pendant 9 jours (Babiuk et al., 1985, cités par US EPA, 2003). Chez la souris, une exposition à 5 ppm (11,5 mg/m3) d'acroléine pendant 4 heures engendre une réaction moins prononcée des voies respiratoires après une provocation à d'autres allergènes, mise en évidence par une diminution de la libération de certaines cytokines (IL-33, IL-25 et IL-1a) dans le LLBA (Danyal, 2016). Une diminution de la libération de cytokines a également été observée in vitro chez l'homme et la souris dans des cellules épithéliales prétraitées à l'acroléine après une provocation à des allergènes.
L'acroléine peut également réduire l'inflammation allergique chez les animaux sensibilisés. Chez la souris, une exposition à 5 ppm d'acroléine pendant 4 jours réduit l'inflammation allergique des voies respiratoires (inhibition de la production de mucus, de l'infiltration de leucocytes et de la sécrétion de cytokines) des animaux déjà sensibilisés par injection IP d'OVA (un modèle de l'asthme allergique). Une diminution de l'hyperplasie des cellules caliciformes est également signalée (Spiess et al., 2013).
O'Brien et al. (2016) fournissent l'explication suivante en réponse aux observations contradictoires : « l'incidence de l'exposition à l'acroléine sur la maladie allergique des voies respiratoires dépend du moment de survenue de cette exposition au cours de la pathogenèse », ce qui semble indiquer que l'exposition peut soit favoriser la sensibilisation allergique (comme dans le développement de l'asthme) et l'inflammation neutrophilique, soit bloquer l'inflammation allergique (comme pour l'asthme chronique).
5.2.3 Effets cardio-vasculaires
La pression artérielle et la fréquence cardiaque de rats anesthésiés exposés à l'acroléine pendant une minute augmentent à partir de 22 ppm (50 mg/m3); la fréquence cardiaque diminue toutefois à la concentration plus élevée de 1100 ou 2200 ppm (2530 ou 5060 mg/m3) (Egle et Hudgins, 1974, cités par US EPA, 2003).
Chez le rat, une augmentation de l'incidence d'arythmie a été observée pendant une exposition de 3 heures à 3 ppm (6,9 mg/m3) d'acroléine et une heure après. L'acroléine a également provoqué une diminution de la sensibilité du baroréflexe à la fois chez les rats normotendus et les rats spontanément hypertendus (Hazari et al., 2014). Au cours d'une autre étude menée chez le rat par ces mêmes chercheurs, la pression artérielle était plus élevée après une exposition à 3 ppm (6,9 mg/m3) d'acroléine pendant 3 heures qu'après une exposition à l'air (absence de groupe témoin simultané) (Perez et al., 2013). Dans ces études, les rats hypertendus sont plus sensibles à l'exposition à l'acroléine. Dans une étude plus récente menée chez la souris, Kurhanewicz et al. (2017) ont démontré qu'une exposition à 3 ppm (6,9 mg/m3) d'acroléine pendant 3 à 4 heures entraîne une augmentation de la variabilité de la fréquence cardiaque et celle de l'incidence d'arythmie.
Thompson et al. (2017) ont signalé une baisse de la performance du myocarde chez la souris après une exposition à 0,3 ppm (0,69 mg/m3) d'acroléine pendant 3 heures. Cet effet n'a pas été observé à la concentration d'acroléine de 3 ppm (6,9 mg/m3). Cette concentration plus élevée a toutefois provoqué une augmentation du volume d'éjection systolique et du débit cardiaque, en plus de celle du délai régional de l'étirement des fibres musculaires indiquant un asynchronisme myocardique intraventriculaire.
5.2.4 Effets sur la reproduction et le développement
Les études de Kutzman (1981) et de Kutzman et al. (1985) comprennent un volet toxicité sur la reproduction. Six jours avant leur accouplement à des rats non traités, des rats (mâles et femelles) ont été soumis à un protocole d'exposition pendant 62 jours (voir la section 5.2.1.2 pour de plus amples détails). Le taux de gestation ainsi que le nombre de corps jaunes, d'embryons viables, de morts fœtales ou de pertes préimplantation sont demeurés inchangés. Aucune anomalie morphologique des spermatozoïdes n'a été détectée. Bouley et al. (1976) ont exposé des rats (3 mâles et 21 femelles) de façon continue à 0 ou 0,55 ppm (1,3 mg/m3) d'acroléine pendant 4 jours avant leur accouplement et 22 jours après. Il n'y avait aucune différence dans le nombre de femelles gravides ainsi que dans le nombre et le poids des fœtus entre les animaux exposés et les témoins. Ces études sont limitées par le peu d'animaux et d'effets examinés. De plus, l'étude de Bouley et al. (1976) ne s'est servie que d'une seule concentration.
5.2.5 Génotoxicité
In vitro, il a été démontré que l'acroléine induit des mutations de l'ADN chez les bactéries ainsi que des mutations et des lésions de l'ADN, y compris des aberrations chromosomiques (AC), des échanges de chromatides sœurs (ECS), des ruptures de brins d'ADN et des liaisons croisées, chez les cellules de mammifères (examinées par Environnement Canada et Santé Canada, 2000; US EPA, 2003; ATSDR, 2007; Wang et al., 2011, 2012; Mohammad et al., 2012; Luo et al., 2013; Lee et al., 2014). Souvent, la génotoxicité n'est observée que dans des conditions qui limitent la cytotoxicité.
Les cellules déficientes en réparation sont plus sensibles à la génotoxicité induite par l'acroléine; l'acroléine semble également inhiber la réparation de l'ADN. Chez l'homme, l'acroléine augmente les mutations dans les fibroblastes déficients en réparation, mais non dans ceux contribuant à la réparation (Curren et al., 1988, cités par US EPA, 2003). Elle provoque également des mutations dans les cellules V79 déficientes en réparation (dans le poumon du hamster chinois), bien que les cellules V79 normales n'aient pas été testées (US EPA, 2003). Wang et al. (2012) ont montré que l'acroléine réduit la réparation de l'ADN dans les cellules épithéliales bronchiques et les fibroblastes pulmonaires humains en culture. Lee et al. (2014) ont constaté que l'acroléine inhibe à la fois la réparation par excision de nucléotides et la réparation par excision de base, en plus d'induire une dégradation des protéines de réparation dans les cellules urothéliales.
Il existe peu de données relatives à la génotoxicité in vivo de l'acroléine. D'ailleurs, seulement deux études examinant les effets génotoxiques de l'acroléine suite à une exposition par inhalation ont été relevées. Chez le rat, aucun ECS ni aucun AC n'ont été mis en évidence dans le sang périphérique après une exposition à 4 ppm (9,2 mg/m3) d'acroléine pendant 62 jours. Il n'y avait également aucun ECS dans la moelle osseuse (Kutzman, 1981). Aucune liaison croisée ADN-protéines n'a été mise en évidence dans la muqueuse nasale du rat après une exposition à 2 ppm (4,6 mg/m3) d'acroléine pendant 6 heures (Lam et al., 1985). L'acroléine ne provoque pas de létalité dominante chez la souris (exposition par injection IP) ni de létalité récessive liée au sexe chez la drosophile (ATSDR, 2007).
L'acroléine forme des adduits avec l'ADN; des adduits avec la désoxyguanosine (dG), la désoxyadénosine et la désoxycytidine ont été observés dans les cellules de mammifères en culture après une incubation avec de l'acroléine (US EPA, 2003; Moghe et al., 2015; Randall et al., 2016). Certaines études semblent indiquer que les adduits se forment préférentiellement au niveau des sites CpG et que la méthylation de ces sites favorise la liaison avec l'acroléine (Wang et al., 2013). Des adduits acroléine-ADN ont été mis en évidence dans les poumons de fumeurs et d'anciens fumeurs (Zhang, 2007, cité par Burcham, 2016), et un nombre accru d'adduits acroléine-dG ont également été observés chez la souris dans le LLBA, les poumons et la vessie après une exposition à la fumée de cigarette (Lee et al., 2015). Feng et al. (2006) ont constaté que les emplacements des adduits acroléine-ADN au niveau du gène suppresseur de tumeur p53 correspondent aux points chauds observés dans les tumeurs du poumon chez les fumeurs. Dans une étude récente comparant les tumeurs de la vessie au tissu sain du même organe, Lee et al. (2014) ont détecté plus d'adduits acroléine-dG dans les tumeurs que dans le tissu sain; la majorité des tumeurs provenaient de fumeurs ou d'anciens fumeurs. Dans une autre étude, Zhang et al. (2011) ont toutefois constaté que la concentration totale acroléine-dG dans les leucocytes était la même chez les fumeurs et les non-fumeurs. Des adduits acroléine-ADN ont également été observés dans l'ADN hépatique de personnes et de rats non exposés, ce qui indique la présence d'une certaine concentration de fond ou une production endogène d'acroléine (Nath et al., 1996, cités par US EPA, 2003). Chez la poule, des adduits à l'ADN ont été observés dans l'aorte après une exposition à 1 ppm (2,3 mg/m3) d'acroléine pendant 6 heures; toutefois, la concentration d'adduits à l'ADN était comparable à celle du groupe témoin 10 jours après l'exposition, ce qui semble indiquer la présence d'un mécanisme de réparation (Penn et al., 2001, cités par CalEPA, 2008).
5.2.6 Cancérogénicité
Très peu d'études se sont penchées sur des durées d'exposition à l'acroléine supérieures à 13 semaines. Feron et Kruysse (1977) ont exposé des hamsters à 4 ppm (9,2 mg/m3) d'acroléine pendant 52 semaines (7 heures par jour, 5 jours par semaine). Il n'y avait pas de tumeur dans les voies respiratoires ni dans d'autres organes après une période de rétablissement de 29 semaines. Les auteurs ont constaté que ce protocole d'exposition à l'acroléine par inhalation, suivi d'une période de rétablissement de 29 semaines, n'a pas fait croître l'incidence de tumeurs dans les voies respiratoires des animaux exposés simultanément au benzo[a]pyrène par instillation intratrachéale ou à la N-nitrosodiéthylamine par injection sous-cutanée (Feron et Kruysse, 1977, cités par CIRC, 1995). Le Bouffant et al. (1980) ont exposé des rats à 8 ppm (18,4 mg/m3) d'acroléine pendant 18 mois (1 heure par jour) et n'ont détecté aucune tumeur. Aucune conclusion au sujet du potentiel cancérogène de l'acroléine ne peut être tirée de ces études en raison de leur courte durée et de leur concentration unique.
La cancérogénicité de l'acroléine n'a été mise en évidence dans aucune étude d'exposition par voie orale menée sur différentes espèces (examinée par ATSDR, 2007; CIRC, 1995). Des études par gavage chez la souris (18 mois) ou le rat (24 mois) (Parent et al., 1991, 1992, cités par CIRC, 1995) et une étude d'exposition par l'eau potable de 24 à 28 mois chez le rat (Lijinski et Reuber,1987 et Lijinski, 1988, tous deux cités par CIRC, 1995) n'ont détecté aucune augmentation de l'incidence de tumeurs liées au traitement.
L'injection IP d'acroléine seule pendant 21 semaines n'a provoqué aucune tumeur de la vessie dans une étude d'initiation et de promotion chez le rat. Toutefois, l'injection bihebdomadaire d'acroléine pendant 6 semaines, suivie d'une administration d'uracile dans la nourriture pendant 20 semaines, a provoqué une augmentation statistiquement significative de l'incidence de papillomes de la vessie chez le rat en comparaison de l'injection bihebdomadaire d'eau pendant 6 semaines, suivie d'une administration d'uracile dans la nourriture pendant 20 semaines (incidence de 18/30 et de 8/30 respectivement, p < 0,05) (Cohen et al., 1992, cités par CIRC, 1995).
In vitro, Lee et al. (2015) ont constaté que l'acroléine induit la croissance ancrage-dépendante des cellules épithéliales bronchiques et urothéliales chez l'homme, indiquant une transformation néoplasique.
5.3 Résumé des effets sur la santé et mécanisme d'action
Les études toxicologiques chez l'homme et l'animal ont permis d'établir que les effets de l'exposition unique ou répétée par inhalation à l'acroléine surviennent au site de contact. L'irritation des yeux, du nez et des voies respiratoires constitue le principal effet sur la santé. Les irritants sensoriels comme les aldéhydes stimulent directement les terminaisons du nerf trijumeau dans la muqueuse nasale. Les mécanismes de défense tels que la diminution de la fréquence respiratoire, l'hypersécrétion de mucus et la bronchoconstriction sont alors activés pour éviter que l'acroléine ne pénètre plus profondément dans les voies respiratoires. La sévérité des lésions des voies respiratoires augmente avec le niveau d'exposition.
Chez l'animal de laboratoire, l'acroléine réagit principalement dans la région nasale et les voies respiratoires supérieures, mais elle peut pénétrer dans les voies respiratoires inférieures à des concentrations plus élevées. Chez l'homme, l'acroléine peut atteindre les voies respiratoires inférieures au cours de la respiration buccale. L'absorption de l'acroléine semble être un processus saturable.
Du fait de sa forte réactivité (électrophile), l'acroléine se lie rapidement et de façon irréversible avec les groupes sulfhydryles protéiques et non protéiques ainsi qu'avec les amines primaires et secondaires des protéines et des acides nucléiques (OMS, 2002; US EPA, 2003). L'acroléine induit une déplétion en GSH réduit et en d'autres agents de réduction ainsi que des changements d'activités enzymatiques, provoquant ainsi une réduction de l'activité protectrice dans l'épithélium respiratoire nasal (US EPA, 2003; CalEPA, 2008).
L'exposition unique à l'acroléine provoque une irritation des yeux, du nez et de la gorge dans les études avec des volontaires. L'effet le plus sensible est l'irritation oculaire, rapportée par certains sujets après une exposition à une concentration comprise entre 0,14 et 0,36 mg/m3 pendant 5 à 60 minutes (Darley et al., 1960 et Weber-Tschopp et al., 1977, cités tous deux par US EPA, 2003 et CalEPA, 2008; Dwivedi et al., 2015; Claeson et Lind, 2016). L'irritation nasale subjective commence entre 0,35 et 0,60 mg/m3, l'irritation de la gorge à partir de 0,69 mg/m3 et l'irritation respiratoire, mesurée par une diminution de la fréquence respiratoire, à 0,69 mg/m3 (chute de 10 à 15 %) et 1,4 mg/m3 (chute de 25 %) (Weber-Tschopp et al., 1977, cités par CalEPA, 2008 et US EPA, 2003).
Les données épidémiologiques relatives aux effets à long terme de l'acroléine chez l'homme proviennent uniquement de deux études transversales françaises sur la qualité de l'air intérieur et l'asthme et la rhinite. Annesi-Maesano et al. (2012) ont mesuré les concentrations d'acroléine dans des salles de classe et mis en évidence un lien entre les concentrations élevées d'acroléine (> LD) et l'incidence accrue d'asthme, mais pas de rhinoconjonctivite, au cours de l'année précédente (évaluée par un questionnaire rempli par les parents) par rapport aux concentrations d'acroléine plus faibles (< LD). La LD n'a pas été précisée et la plupart des étudiants (72 %) ont été exposés à des concentrations < LD. Les auteurs ont également signalé une corrélation entre l'exposition à l'acroléine et l'asthme d'effort. Billionnet et al. (2011) n'ont relevé aucune association significative entre les concentrations d'acroléine présentes dans les habitations et l'asthme au cours de l'année précédente ou la rhinite au cours du mois précédent (évaluée par un questionnaire). Les limites de ces deux études sont nombreuses et elles sont abordées à la section 5.1.2.
Chez l'animal de laboratoire, des signes d'irritation ainsi qu'une inflammation et des lésions dans les voies respiratoires apparaissent suite à une exposition par inhalation à l'acroléine. Chez la souris, le rat, le cobaye, le lapin, le hamster, le singe et le chien, l'exposition à l'acroléine induit des effets irritants sur l'appareil respiratoire, allant de l'inflammation légère aux concentrations faibles à la métaplasie et à l'hyperplasie aux concentrations plus élevées. Une diminution de la fréquence respiratoire, soit une indication de l'irritation sensorielle, est observée chez toutes les espèces testées; la plus faible RD50 relevée pour une exposition unique est de 2,3 mg/m3 chez la souris (US EPA, 2003; CalEPA, 2008). D'autres effets irritants sur les voies respiratoires sont la résistance accrue des voies respiratoires et l'hyperréactivité bronchique chez le cobaye et l'hypersécrétion de mucus chez la souris et le rat (Murphy, 1963, cité par US EPA, 2003; Leikauf, 1991; Borchers et al., 1998; Borchers et al., 1999, cités par US EPA, 2003).
En ce qui a trait à l'histopathologie, l'épithélium respiratoire nasal du rat est l'organe cible le plus sensible, des lésions ayant été observées dans plusieurs études d'exposition unique ou répétée à des concentrations comprises entre 0,46 et 1,38 mg/m3 pendant un maximum de 13 semaines (Feron et al., 1978; Roemer et al., 1993; Cassee, Groten et Feron, 1996; Dorman et al., 2008). Les lésions inflammatoires, dégénératives et métaplasiques apparaissant dans l'épithélium nasal du rat ont été qualifiées de désagrégration, de nécrose, d'épaississement, de desquamation, d'hyperplasie cellulaire basale et de métaplasie squameuse; leur sévérité augmente avec le niveau d'exposition et non avec la durée d'exposition (Feron et al., 1978; Cassee, Groten et Feron, 1996; Dorman et al., 2008). Les effets surviennent généralement dans la cavité nasale aux concentrations faibles. Toutefois, des lésions des voies respiratoires inférieures se produisent aux concentrations plus élevées, plus particulièrement dans la trachée et les poumons du rat à partir de 1,6 mg/m3 (Lyon et al., 1970; Feron et al., 1978; Kutzman, 1981; Arumugan et al., 1999; Dorman et al., 2008; Chen et al., 2010, 2013). Dorman et al. (2008) ont également observé une inflammation, une dégénérescence et une atrophie de l'épithélium olfactif nasal chez le rat ainsi qu'une perte de neurones olfactifs après une exposition à une concentration d'acroléine de 4,1 mg/m3 pendant 13 semaines. Les auteurs ont déterminé que l'épithélium respiratoire est le tissu le plus sensible en se fondant sur la DSENO et la DMENO relevées; toutefois, selon le modèle dosimétrique développé par Schroeter et al. (2008), la dose délivrée à l'épithélium olfactif est plus faible.
Une inflammation et des modifications histopathologiques ont également été relevées dans les voies respiratoires inférieures (la trachée et les poumons) chez le cobaye, le hamster, le lapin, le chien et le singe à partir d'une concentration d'acroléine de 1,61 mg/m3, et comme chez le rat, la sévérité des lésions augmente avec la concentration (Lyon et al, 1970; Feron et al., 1978; Kilburn et McKenzie, 1978, cités par US EPA, 2003; Leikauf, 1991). Chez la souris, des lésions similaires à celles du rat (exfoliation, érosion, ulcération, nécrose, inflammation et métaplasie squameuse de l'épithélium respiratoire) n'ont été observées que dans les voies respiratoires supérieures après une exposition à 3,9 mg/m3 d'acroléine pendant 5 jours (Buckley, 1984); des signes de métaplasie ont été observés dans les poumons après une exposition à 4,6 mg/m3 d'acroléine pendant 4 semaines (Borchers et al., 2008). Aucune étude portant sur des concentrations plus faibles n'a été relevée chez la souris.
In vitro, l'acroléine s'est révélée mutagène, inhibant la réparation de l'ADN et provoquant des lésions de l'ADN, dont des adduits à l'ADN, des ruptures de brins et des liaisons croisées. Toutefois, les données concernant la formation et la mutagénicité des adduits à l'ADN in vivo sont limitées. Chez le rat, l'inhalation d'acroléine n'a provoqué de lésion de l'ADN (ECS ou AC) ni dans le sang ni dans la moelle osseuse après une exposition de 62 jours (Kutzman, 1981), et aucune liaison croisée ADN-protéines n'a été mise en évidence dans la muqueuse nasale après une exposition unique par inhalation (Lam et al., 1985).
Les études limitées de cancérogénicité avec des animaux de laboratoire ne mettent pas en évidence de tumeur induite par l'acroléine. Toutefois, les aldéhydes apparentés, le formaldéhyde et l'acétaldéhyde, induisent des tumeurs nasales chez le rat. Les analyses du mécanisme d'action ont déterminé que les réponses tumorigènes associées à ces aldéhydes ne sont pas linéaires et qu'elles découlent principalement de la cytotoxicité et de la prolifération plutôt que de la mutagénicité (Environnement Canada et Santé Canada, 2000; Santé Canada, 2017). Le type de lésion tissulaire et de prolifération cellulaire induit par d'autres aldéhydes est également observé avec l'exposition à l'acroléine dans des modèles animaux. La cytotoxicité (dégénérescence), la prolifération et la métaplasie au niveau de l'épithélium respiratoire ont été systématiquement observées chez les animaux de laboratoire exposés, parfois même une seule fois, à l'acroléine par inhalation. Bien qu'il n'existe pas d'association positive entre l'inhalation d'acroléine et l'induction de tumeurs dans l'appareil respiratoire et que l'acroléine ne soit pas considérée comme un agent cancérogène dans cette évaluation, le potentiel cancérogène de l'acroléine exige des recherches plus poussées.
5.4 Populations sensibles
Les personnes sensibilisées comme les asthmatiques et celles souffrant de maladie pulmonaire ou de bronchite chronique pourraient être plus sensibles aux effets de l'acroléine sur les voies respiratoires. Bien qu'aucune étude menée auprès de populations sensibles n'ait pu le démontrer pour l'acroléine, ceci a été confirmé pour d'autres aldéhydes comme l'acétaldéhyde (Santé Canada, 2017) et le formaldéhyde (Santé Canada, 2006). En général, les allergies nasales préexistantes peuvent également aggraver la réaction aux irritants nasaux (Shusterman, 2011).
Les études animales montrant une hyperréactivité et une inflammation bronchiques après une exposition par inhalation à l'acroléine ainsi que les études in vitro indiquant que l'acroléine augmente la production de mucines et de médiateurs pro-inflammatoires démontrent que l'acroléine peut exacerber l'asthme et que les personnes sensibilisées pourraient être plus sensibles à ses effets nocifs. Les effets de l'exposition par inhalation à l'acroléine, dont une décroissance de la fréquence respiratoire, une hypersécrétion de mucus et une bronchoconstriction, sont plus prononcés chez les souris déjà sensibilisées par une injection IP d'OVA (un modèle de maladie allergique des voies respiratoires) (Morris et al., 2003). Roux et al. (1999, cités par CalEPA, 2008) ont montré que la préincubation avec de l'acroléine de tissus pulmonaires déjà sensibilisés augmente considérablement la réponse contractile des bronchioles à de nombreux antigènes, y compris les acariens de la poussière et l'histamine.
Les enfants, et plus particulièrement ceux atteints d'asthme, souffriraient davantage des effets respiratoires découlant d'une exposition à l'acroléine du fait de la prévalence accrue de l'asthme chez les enfants, de la petite taille et de l'immaturité de leurs voies respiratoires, et de l'exacerbation de l'asthme chez les enfants causée par les contaminants atmosphériques toxiques (Delfino et al., 2003; CalEPA, 2008).
Les personnes hypertendues pourraient également être plus sensibles aux effets de l'acroléine. Perez et al. (2013) ont constaté une augmentation de la fréquence respiratoire et du débit-volume chez les rats hypertendus après une exposition à une concentration qui n'a eu aucune incidence sur les rats normotendus. Les rats hypertendus sont également plus sensibles aux effets cardio-vasculaires, y compris une augmentation de la fréquence cardiaque, de la pression artérielle et de la variabilité de la fréquence cardiaque. Dans une étude avec des rats Dahl sélectionnés pour leur résistance ou leur sensibilité à l'hypertension, les rats sensibles étaient plus sensibles à la mortalité et aux lésions pulmonaires causées par l'acroléine que les rats résistants (Kutzman et al., 1984).
Les porteurs de verres de contact pourraient être plus sensibles à l'exposition oculaire et à l'irritation due à l'acroléine, les verres de contact ayant la capacité de piéger et de concentrer les composés volatils ainsi que de prolonger la durée d'exposition en limitant la capacité normale autonettoyante des yeux (Cal EPA, 2008).
Comme le GSH joue un rôle clé dans la détoxification de l'acroléine, les personnes présentant une synthèse réduite de GSH pourraient être plus sensibles aux effets de l'acroléine. Certaines personnes pourraient également être plus sensibles à la toxicité de l'acroléine en raison d'une faible activité de la GST. Par exemple, l'un des quatre variants alléliques de l'isoenzyme GSTP1-1 présente une efficacité catalytique nettement inférieure pour la conjugaison de l'acroléine avec le GSH (Pal et al., 2000, cités par Stevens et Maier, 2008).
6.0 Établissement des concentrations de référence pour les expositions de courte et de longue durées
6.1 Concentration de référence pour l'exposition de courte durée
Pour l'exposition de courte durée à l'acroléine, plusieurs études examinant l'irritation oculaire et respiratoire chez des volontaires ont été prises en compte pour établir le point de départ à la construction de la CRf pour l'exposition de courte durée (voir la section 5.1). Les DMENO pour l'irritation oculaire relevées dans de nombreuses études sont similaires, se situant entre 0,21 et 0,36 mg/m3 (Weber-Tschopp et al., 1977; Dwivedi et al., 2015; Claeson et Lind, 2016). L'étude de Weber-Tschopp et al. (1977) a employé différents protocoles d'exposition, dont une exposition à des concentrations croissantes d'acroléine (≤1,4 mg/m3) pendant 40 minutes et une autre à une concentration constante d'acroléine (0,69 mg/m3) pendant 60 minutes. Comme l'article original a été rédigé en allemand, c'est le rapport de l'US EPA qui a été cité. Cette étude n'a pu établir de DSENO pour l'irritation oculaire, les sujets ayant rapporté une irritation oculaire à la plus faible concentration testée de 0,21 mg/m3 (DMENO). Dans une étude plus récente, Dwivedi et al. (2015) ont exposé des volontaires sains à de l'acroléine pendant 2 heures. Une légère augmentation de l'irritation oculaire a été mise en évidence à 0,23 mg/m3 (DMENO), mais pas à 0,12 mg/m3 (DSENO). La DSENO provenant de cette étude est similaire à celles issues de deux autres études d'exposition des yeux seulement (celle de Darley et al. [1960] où la DSENO = 0,14 mg/m3; celle de Claeson et Lind [2016] où la DSENO = 0,16 mg/m3).
La plus faible DMENO pour l'irritation respiratoire provient de l'étude de Weber-Tschopp et al. (1977). Suite à une exposition à 0,69 mg/m3 d'acroléine pendant 60 minutes, les sujets ont rapporté une irritation des yeux, du nez et de la gorge, et la fréquence respiratoire a été réduite de 10 à 15 %, ce qui indique une légère irritation respiratoire. Aucune DSENO n'a été relevée pour l'irritation respiratoire dans cette étude. Dwivedi et al. (2015) ont constaté que la fréquence respiratoire, la fonction pulmonaire, l'inflammation nasale ou les marqueurs d'inflammation dans le sang ou le crachat étaient demeurés inchangés après une exposition à 0,23 mg/m3 (DSENO) d'acroléine pendant 2 heures. Aucune DMENO n'a été relevée pour ces effets.
L'irritation oculaire est donc l'effet le plus sensible, et les plus faibles DMENO pour cet effet sont de 0,21 mg/m3 (Weber-Tschopp et al., 1977) et de 0,23 mg/m3 (Dwivedi et al., 2015). Weber-Tschopp et al. (1977) n'ayant relevé aucune DSENO, la DSENO de 0,12 mg/m3 (115 µg/m3) établie par Dwivedi et al. (2015) pour l'irritation oculaire a été retenue comme point de départ à la construction de la CRf pour l'exposition aiguë. Ce point de départ est également inférieur à la DMENO et à la DSENO pour les effets respiratoires observés respectivement dans les études de Weber-Tschopp et al. (1977) et de Dwivedi et al. (2015). Un facteur d'incertitude (FI) de 3 a ensuite été appliqué pour prendre en compte les personnes sensibles; ce facteur est considéré comme suffisant, l'irritation oculaire par contact ne devant pas varier considérablement au sein de la population (NRC, 2001; US EPA, 2008). Aucun FI pour les lacunes dans la base de données n'a été appliqué, l'étude clé et la base de données sur la toxicité aiguë étant adéquates. La CRf pour l'exposition aiguë est donc de 38 µg/m3.
6.2 Concentration de référence pour l'exposition de longue durée
Peu d'études épidémiologiques se sont penchées sur l'acroléine et ses effets sur la santé; aucune d'entre elles n'a pu servir d'étude clé pour établir une valeur de référence à long terme en raison de ses limites et plus particulièrement de l'absence de causalité.
Chez de nombreuses espèces d'animaux de laboratoire, les études d'exposition par inhalation ont systématiquement mis en évidence des effets sur les voies respiratoires après une exposition à des concentrations d'acroléine comprises entre 0,46 et 1,38 mg/m3 pendant 3 jours à 13 semaines. Ces effets ont été observés à la concentration la plus faible dans la majorité des études; une seule étude de 13 semaines a pu relever à la fois une DSENO et une DMENO. Dorman et al. (2008) ont relevé une DSENO de 0,46 mg/m3 et une DMENO de 1,38 mg/m3 pour les lésions dégénératives dans l'épithélium respiratoire de la cavité nasale chez le rat. Une DSENO de 1,38 mg/m3 et une DMENO de 4,14 mg/m3 ont également été établies pour la perte de neurones olfactifs.
Chez le rat, Dorman et al. (2008) ont constaté que la dose modélisée délivrée aux tissus (provenant de Schroeter et al. [2008]) et agissant sur l'épithélium olfactif est plus faible que celle associée aux lésions de l'épithélium respiratoire. Toutefois, la DSENO de 0,46 mg/m3 (460 µg/m3) pour les lésions de l'épithélium respiratoire a été retenue comme point de départ, car il s'agit de la plus faible concentration associée à un effet nocif. Cette concentration a été corrigée pour l'adaptation d'une exposition provenant d'une étude animale (6 heures par jour, 5 jours par semaine) à une exposition continue (24 heures sur 24, tous les jours), de sorte que la DSENO corrigée est égale à 82 µg/m3.
Les différences toxicocinétiques entre le rat et l'homme ont été prises en compte par l'application d'un rapport de dépôt de 0,13 pour un gaz de catégorie 1 qui entraîne des effets sur les voies respiratoires extrathoraciques (US EPA, 1994), de sorte que la DSENO équivalente chez l'homme est égale à 11 µg/m3. L'US EPA (2003) et l'Anses (2013) se sont également servies de cette approche pour établir la CRf de l'acroléine, qui est considérée comme appropriée en l'absence de données propres à cette substance chimique. Bien qu'il ait montré que la rétention de l'acroléine par les voies respiratoires était moins élevée chez l'homme que chez le rat, le modèle CFD-PBPK développé par Corley et al. (2012) n'a pas servi à l'extrapolation interspécifique dans cette évaluation, n'ayant pas été calibré ni validé chez l'homme. La CalEPA (2008) a utilisé le facteur d'ajustement dosimétrique (DAF) du formaldéhyde pour construire la CRf de l'acroléine. Ce DAF est un rapport entre la moyenne du flux moyen et du flux maximal du formaldéhyde dans les voies respiratoires supérieures du rat et celle de l'homme (Kimbell et al., 2001). Cette approche de la CalEPA ajoute de l'incertitude en raison de l'utilisation d'un analogue (c.-à-d. le formaldéhyde) et de l'établissement d'une moyenne du flux moyen et du flux maximal.
Des FI de 2,5 et de 10 ont été appliqués au point de départ (DSENO équivalente chez l'homme de 11 µg/m3) pour tenir compte respectivement des différences toxicocinétiques entre le rat et l'homme et de la sensibilité au sein de la population humaine. Bien que Dorman et al. (2008) ont réalisé une étude subchronique, aucun FI supplémentaire n'a été appliqué, rien n'indiquant que la sévérité ou l'incidence des lésions augmente avec la durée d'exposition; le niveau d'exposition semble être le facteur déterminant. Aucun FI n'a également été appliqué pour les lacunes dans la base de données, l'étude clé et la base de données sur les effets sanitaires étant considérées comme adéquates. Ritter et al. (2007) ont expliqué en détail le choix des FI utilisés pour établir la CRf pour l'exposition de longue durée. La CRf pour l'exposition de longue durée est donc égale à 0,44 µg/m3.
6.3 Comparaison entre l'exposition dans les habitations canadiennes et la concentration de référence, et établissement des limites d'exposition proposées
Santé Canada a mené plusieurs études d'exposition dans de nombreuses villes canadiennes au cours des dix dernières années (Santé Canada, 2010a, 2010b, 2012, 2013). Ce sont là les plus récentes données représentatives permettant de quantifier les niveaux d'exposition de longue durée dans les habitations canadiennes (voir la section 3.0).
Les CRf de courte et de longue durées reposent sur la caractérisation de la relation concentration-réponse et l'application de FI pour tenir compte de certaines variabilités et de données manquantes. Bien que le contexte d'application des CRf, la faisabilité technique et la possibilité de mettre en œuvre des mesures d'atténuation du risque n'entrent pas dans la détermination des CRf, ils sont pris en compte lors de l'établissement des limites d'exposition de courte et de longue durées proposées.
Pour établir les limites d'exposition proposées, les CRf pour les expositions de courte et de longue durées sont d'abord comparées aux données d'exposition disponibles relatives aux habitations canadiennes, puis évaluées en fonction de leur faisabilité par la mise en œuvre de mesures de contrôle des sources intérieures. Si la CRf peut être atteinte, la limite d'exposition proposée sera alors égale à la CRf. Sinon, une concentration plus élevée pourra être choisie en fonction des données actuelles, tout en gardant à l'esprit que la limite d'exposition doit protéger la santé.
Les critères de la présente évaluation servant à établir les limites d'exposition de courte et de longue durées à l'acroléine proposées sont les suivants :
- une valeur généralement réalisable dans les habitations canadiennes en l'absence d'une importante source d'acroléine dans l'air intérieur;
- une valeur qui n'est pas associée à d'importants effets sur la santé, étant donné les niveaux d'exposition établis et les données probantes disponibles.
6.3.1 Concentration de référence et limite d'exposition proposée pour l'exposition de courte durée
La base de données documentaire a fourni des données sur les effets chez l'homme permettant d'établir une CRf pour l'exposition de courte durée à l'acroléine de 38 µg/m3. La plage des concentrations médianes de l'acroléine mesurées au cours d'une période de 24 heures dans les habitations canadiennes dans le cadre des études de la qualité de l'air intérieur résidentiel de Santé Canada varie entre 1,3 et 8,1 µg/m3, la valeur du 95e centile se situant entre 3,5 et 21,0 µg/m3 (voir le Tableau 2) (Santé Canada, 2010a, 2010b, 2012, 2013). Les échantillons intégrés sur 24 heures prélevés dans le cadre de ces études ne représentent pas une exposition aiguë ou maximale. Toutefois, des pointes d'acroléine peuvent survenir lors de la consommation de tabac ou la cuisson des aliments ainsi que lors de l'utilisation de foyers ou de poêles à bois. Selon les données d'échantillonnage recueillies au cours d'une période de 24 heures et les sources présumées, la CRf pour l'exposition de courte durée devrait être réalisable dans les habitations canadiennes. La limite d'exposition de courte durée à l'acroléine proposée est donc de 38 µg/m3.
6.3.2 Concentration de référence et limite d'exposition proposée pour l'exposition de longue durée
La base de données documentaire a permis d'établir une CRf pour l'exposition chronique de 0,44 µg/m3, les lésions de l'épithélium respiratoire constituant l'effet critique. Les études de la qualité de l'air intérieur résidentiel de Santé Canada (Santé Canada, 2010a, 2010b, 2012, 2013) fournissent la meilleure mesure de l'exposition chronique dans les habitations canadiennes, bien qu'une certaine incertitude demeure quant à l'exactitude des données d'exposition en raison des difficultés d'ordre méthodologique rencontrées dans la mesure de l'acroléine dans l'air intérieur. La plage des concentrations médianes de l'acroléine mesurées au cours d'une période de 24 heures dans les habitations canadiennes dans le cadre des études de la qualité de l'air intérieur résidentiel de Santé Canada varie entre 1,3 et 8,1 µg/m3, la valeur du 95e centile se situant entre 3,5 et 21,0 µg/m3 (voir le Tableau 2) (Santé Canada, 2010a, 2010b, 2012, 2013). Ceci indique que la concentration d'acroléine présente dans certaines habitations canadiennes dépasserait la CRf, malgré la prise en compte des incertitudes liées aux mesures de l'acroléine. La CRf a toutefois été établie à l'aide des données scientifiques les plus récentes et est comparable au NRAI de 0,35 µg/m3 fixé par Santé Canada et à des valeurs de référence d'autres instances (voir l'annexe D). Les sources d'acroléine dans les habitations canadiennes comprennent le tabagisme, la cuisson à l'huile et la formation secondaire découlant de réactions avec d'autres COV. Selon les informations limitées sur les sources, il est possible de réduire la concentration d'acroléine dans l'air intérieur par la ventilation et le contrôle des sources. La limite d'exposition de longue durée à l'acroléine proposée est donc de 0,44 µg/m3.
6.4 Incertitudes et futurs travaux de recherche
Les données relatives à l'exposition répétée par inhalation à l'acroléine chez l'homme étant limitées, les données animales ont servi à établir le point de départ à la construction de la CRf. Il a été clairement démontré chez de nombreuses espèces que l'acroléine est une substance réactive qui exerce ses effets au site de premier contact (c.-à-d. la cavité nasale chez le rat). Plusieurs méthodes de comparaison de la physiologie des voies respiratoires ont été examinées pour tenir compte des différences toxicocinétiques entre le rat et l'homme. Chacune a ses propres hypothèses et incertitudes. Il pourrait être utile d'en savoir davantage sur la cinétique du dépôt d'acroléine chez l'homme. En outre, des données qui permettraient de calibrer et de valider un modèle CFD-PBPK chez l'homme faciliteraient l'extrapolation intra-espèce pour une substance chimique particulière ainsi que celle de l'exposition intermittente à une exposition continue.
Bien que la nature des effets (l'irritation) soit probablement la même pour toutes les espèces, les différences quantitatives de sensibilité ont été prises en compte en se servant de FI par défaut pour les différences toxicodynamiques (entre le rat et l'homme) et d'un FI pour la variabilité intraspécifique (pour les individus sensibles). Aucune étude n'a été relevée sur les effets de l'acroléine chez les individus sensibles comme les asthmatiques - de telles études réduiraient l'incertitude liée à la CRf.
Les études sur les effets de l'exposition de longue durée par inhalation à l'acroléine sont peu nombreuses. Les quelques études épidémiologiques examinant le lien entre l'exposition à l'acroléine et l'asthme ou la rhinite comportent également d'importantes limites décrites à la section 5.1.2. La plupart des études avec des animaux de laboratoire se limitent à une durée subchronique et les quelques études d'exposition chronique disponibles ne permettent de formuler aucune conclusion quant à la cancérogénicité de l'acroléine.
Les études d'exposition existantes ont évalué l'exposition quotidienne moyenne à partir de temps d'échantillonnage de 24 heures. Les expositions de courte durée aux concentrations maximales n'ont pas été évaluées. Comme indiqué à la section 3, l'acroléine est difficile à quantifier avec précision et les méthodes disponibles ont chacune leurs limites. Il existe donc de l'incertitude à l'égard de la concentration réelle d'acroléine dans l'air intérieur. Les données recueillies par Santé Canada par la méthode faisant appel aux canisters passivés aboutiraient toutefois à une estimation réaliste des concentrations d'acroléine dans l'air intérieur résidentiel du Canada.
Il existe peu d'estimations quantitatives des sources intérieures d'acroléine. Des données supplémentaires sur l'attribution des sources permettraient de mettre en œuvre une stratégie plus complète de réduction des concentrations d'acroléine dans l'air intérieur et de déterminer si les limites d'exposition proposées peuvent être réalisables dans une habitation typique du Canada.
7.0 Lignes directrices proposées
7.1 Limites d'exposition proposées
| Limite d'exposition | Concentration | Effets critiques | |
|---|---|---|---|
| µg/m3 | ppb | ||
| Courte durée
(1 h) |
38 | 17 | Irritation oculaire chez les volontaires sains |
| Longue durée
(24 h) |
0,44 | 0,19 | Lésions de l'épithélium respiratoire de la cavité nasale du rat |
Il est recommandé de comparer la limite d'exposition de courte durée (aiguë) à un échantillon d'air d'une heure.
Lors de la comparaison de la concentration d'acroléine mesurée avec la limite d'exposition de longue durée, le temps d'échantillonnage devrait être d'au moins 24 heures dans des conditions normales. Par ailleurs, la moyenne des résultats obtenus à partir d'échantillons successifs prélevés à différents moments de l'année permettra d'obtenir une estimation plus représentative de l'exposition de longue durée.
7.2 Recommandations pour la gestion des risques
La concentration d'acroléine d'un certain nombre d'habitations du Canada pourrait être supérieure à la limite d'exposition de longue durée offrant une protection contre l'irritation respiratoire et la dégénérescence de l'épithélium respiratoire. Les sources d'acroléine devraient donc être contrôlées dans les habitations pour limiter autant que possible l'exposition, étant donné qu'il n'est ni pratique ni recommandé dans la plupart des cas d'y effectuer des analyses de la qualité de l'air. En outre, plusieurs mesures énumérées ci-dessous permettront également de réduire les concentrations d'autres contaminants de l'air intérieur, améliorant ainsi la qualité de l'air intérieur.
L'exposition à l'acroléine dans l'air intérieur peut être réduite par une ventilation adéquate et le contrôle des sources intérieures. Les stratégies de réduction de l'exposition à l'acroléine dans l'air intérieur sont les suivantes :
- Augmenter la ventilation en ouvrant les fenêtres quand cela est possible ou au moyen de stratégies de ventilation mécanique. Pour en savoir davantage, se référer à la Fiche de renseignements : La ventilation et le milieu intérieur (Santé Canada, 2018a).
- Se servir d'une hotte avec évacuation à l'extérieur réglée de préférence à la plus haute intensité en cuisinant, surtout avec des huiles.
- En cuisinant, en plus d'une hotte (ou en l'absence de hotte), se servir des brûleurs arrière de la cuisinière, ouvrir les fenêtres ou faire fonctionner le ventilateur de l'appareil de chauffage ou du système de ventilation. Pour en savoir davantage, se référer à la Fiche de renseignements : La cuisson et la qualité de l'air intérieur (Santé Canada, 2018b).
- S'abstenir de fumer ou de faire brûler des bougies ou de l'encens dans l'habitation, et s'assurer que les appareils de combustion (p. ex., les cuisinières à gaz, les poêles à bois et les cheminées) s'évacuent correctement à l'extérieur.
- Diminuer les concentrations de COV dans l'air intérieur pour réduire la formation secondaire d'acroléine. Pour ce faire, employer dans la mesure du possible des produits à faible taux d'émission, ouvrir les fenêtres pour veiller à une ventilation adéquate lors de l'utilisation de produits comme les colles, les peintures, les vernis et les produits de nettoyage et réduire au minimum l'utilisation de produits parfumés comme les désodorisants à brancher ou en aérosol (assainisseurs d'air).
8.0 Références
Alwis, K.U., deCastro, B.R., Morrow, J.C. et Blount, B.C. (2015) Acrolein Exposure in U.S. Tobacco Smokers and Non-Tobacco Users: NHANES 2005-2006. Environmental Health Perspectives, 123(12): 1302-1308.
Annesi-Maesano, I., Hulin, M., Lavaud, F., Raherison, C., Kopferschmitt, C., De Blay, F., Charpin, D.A. et Denis, C. (2012) Poor air quality in classrooms related to asthma and rhinitis in primary schoolchildren of the French 6 Cities Study. Thorax, 67(8): 682-688.
Anses (2013) Proposition de valeurs guides de qualité d'air intérieur. L'acroléine. Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail. [En ligne], http://www.anses.fr/en/documents/AIR2011sa0354Ra.pdf.
Arumugam, N., Sivakumar, V., Thanislass, J., Pillai, K.S., Devaraj, S.N. et Devaraj, H. (1999) Acute pulmonary toxicity of acrolein in rats--underlying mechanism. Toxicology Letters, 104(3): 189-194.
ATSDR (2007) Toxicological Profile for Acrolein. Agency for Toxic Substances and Disease Registry, Public Health Service, US Department of Health and Human Services, Atlanta, GA.
Babiuk, C., Steinhagen, W.H. et Barrow, C.S. (1985) Sensory irritation response to inhaled aldehydes after formaldehyde pretreatment. Toxicology and Applied Pharmacology, 79(1): 143-149.
Bein, K. et Leikauf, G.D. (2011) Acrolein - a pulmonary hazard. Molecular Nutrition and Food Research, 55(9): 1342-1360.
Billionnet, C., Gay, E., Kirchner, S., Leynaert, B. et Annesi-Maesano, I. (2011) Quantitative assessments of indoor air pollution and respiratory health in a population-based sample of French dwellings. Environmental Research, 111(3): 425-434.
Borchers, M.T., Carty, M.P. et Leikauf, G.D. (1999) Regulation of human airway mucins by acrolein and inflammatory mediators. The American Journal of Physiology, 276(4 Pt 1): L549-55.
Borchers, M.T., Wert, S.E. et Leikauf, G.D. (1998) Acrolein-induced MUC5ac expression in rat airways. The American Journal of Physiology, 274(4 Pt 1): L573-81.
Borchers, M.T., Wesselkamper, S.C., Eppert, B.L., Motz, G.T., Sartor, M.A., Tomlinson, C.R., Medvedovic, M. et Tichelaar, J.W. (2008) Nonredundant functions of alphabeta and gammadelta T cells in acrolein-induced pulmonary pathology. Toxicological Sciences: An Official Journal of the Society of Toxicology, 105(1): 188-199.
Borchers, M.T., Wesselkamper, S., Wert, S.E., Shapiro, S.D. et Leikauf, G.D. (1999) Monocyte inflammation augments acrolein-induced Muc5ac expression in mouse lung. The American Journal of Physiology, 277(3): L489-97.
Bouley, G., Dubreuil, A., Godin, J., Boisset, M. et Boudene, C. (1976) Phenomena of adaptation in rats continuously exposed to low concentrations of acrolein. The Annals of Occupational Hygiene, 19(1): 27-32.
Buckley, L.A., Jiang, X.Z., James, R.A., Morgan, K.T. et Barrow, C.S. (1984) Respiratory tract lesions induced by sensory irritants at the RD50 concentration. Toxicology and Applied Pharmacology, 74(3): 417-429.
Burcham, P.C. (2016) Acrolein and Human Disease: Untangling the Knotty Exposure Scenarios Accompanying Several Diverse Disorders. Chemical Research in Toxicology, 30(1): 145-161.
Cahill, T.M. et Okamoto, R.A. (2012) Emissions of Acrolein and Other Aldehydes from Biodiesel-Fueled Heavy-Duty Vehicles. Environmental Science & Technology, 46(15): 8382-8388.
CalEPA (2008) TSD [Technical Support Document] for Noncancer RELs: Appendix D. Individual Acute, 8-Hour and Chronic Reference Exposure Level Summaries. D.1 Summaries using this version of the Hot Spots Risk Assessment Guidelines. California Environmental Protection Agency, Office of Environmental Health Hazard Assessment. [En ligne], http://www.oehha.ca.gov/air/hot_spots/2008/AppendixD1_final.pdf#page=42.
Cassee, F.R., Arts, J.H.E., Groten, J.P. et Feron, V.J. (1996) Sensory irritation to mixtures of formaldehyde, acrolein, and acetaldehyde in rats. Archives of Toxicology, 70(6): 329-337.
Cassee, F.R., Groten, J.P. et Feron, V.J. (1996) Changes in the nasal epithelium of rats exposed by inhalation to mixtures of formaldehyde, acetaldehyde, and acrolein. Fundamental and Applied Toxicology, 29(2): 208-218.
CDC (2013) Acute pesticide-related illness resulting from occupational exposure to acrolein - Washington and California, 1993-2009. Centers for Disease Control and Prevention - Morbidity and Mortality weekly report, 26(16).
Champeix, J., Courtial, L., Perche, E. et Catalina, P. (1966) Acute broncho-pneumopathy from acrolein vapors. Archives des maladies professionnelles de médecine du travail et de sécurité sociale, 27(10): 794-796.
Chen, P., Deng, Z., Wang, T., Chen, L., Li, J., Feng, Y., Zhang, S., Nin, Y., Liu, D., Chen, Y., Ou, X. et Wen, F. (2013) The potential interaction of MARCKS-related peptide and diltiazem on acrolin-induced airway mucus hypersecretion in rats. International Immunopharmacology, 17(3): 625-632.
Chen, Y.J., Chen, P., Wang, H.X., Wang, T., Chen, L., Wang, X., Sun, B.B., Liu, D.S., Xu, D., An, J. et Wen, F.Q. (2010) Simvastatin attenuates acrolein-induced mucin production in rats: Involvement of the Ras/extracellular signal-regulated kinase pathway. International Immunopharmacology, 10(6): 685-693.
CIRC (1995) IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Volume 63 Drycleaning, Some Chlorinated Solvents and Other Industrial Chemicals. IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans, 63: 75.
Claeson, A.S. et Lind, N. (2016) Human exposure to acrolein: Time-dependence and individual variation in eye irritation. Environmental Toxicology and Pharmacology, 45: 20-27.
Cohen, S.M., Garland, E.M., St John, M., Okamura, T. et Smith, R.A. (1992) Acrolein initiates rat urinary bladder carcinogenesis. Cancer Research, 52(13): 3577-3581.
Conklin D.J., Malovichko M.V., Zeller I., Das T.P., Krivokhizhina T.V., Lynch B.H., Lorkiewicz P., Agarwal A., Wickramasinghe N., Haberzettl P., Sithu S.D., Shah J., O'Toole T.E., Rai S.N., Bhatnagar A., Srivastava S. (2017) Biomarkers of Chronic Acrolein Inhalation Exposure in Mice: Implications for Tobacco Product-Induced Toxicity. Toxicological Sciences. 158(2):263-274.
Corley, R.A., Kabilan, S., Kuprat, A.P., Carson, J.P., Minard, K.R., Jacob, R.E., Timchalk, C., Glenny, R., Pipavath, S., Cox, T., Wallis, C.D., Larson, R.F., Fanucchi, M.V., Postlethwait, E.M. et Einstein, D.R. (2012) Comparative computational modeling of airflows and vapor dosimetry in the respiratory tracts of rat, monkey, and human. Toxicological Sciences: An Official Journal of the Society of Toxicology, 128(2): 500-516.
Costa, D.L., Kutzman, R.S., Lehmann, J.R. et Drew, R.T. (1986) Altered lung function and structure in the rat after subchronic exposure to acrolein. The American Review of Respiratory Disease, 133(2): 286-291.
Curren, R.D., Yang, L.L., Conklin, P.M., Grafstrom, R.C. et Harris, C.C. (1988) Mutagenesis of xeroderma pigmentosum fibroblasts by acrolein. Mutation Research, 209(1-2): 17-22.
Dann & Wang (2007) Canada's Experience with Acrolein Measurements Using Canisters - Preliminary Results. NESCAUM Monitoring and Assessment Committee Meeting.
Danyal, K., de Jong, W., O'Brien, E., Bauer, R.A., Heppner, D.E., Little, A.C., Hristova, M., Habibovic, A. et van der Vliet, A. (2016) Acrolein and thiol-reactive electrophiles suppress allergen-induced innate airway epithelial responses by inhibition of DUOX1 and EGFR. American Journal of Physiology. Lung Cellular and Molecular Physiology, 311(5): L913-L923.
Darley, E.F., Middleton, J.T. et Garber, M.J. (1960) Plant damage and eye irritation from ozone-hydrocarbon reactions. Agricultural and Food Chemistry, 8(6): 483-485.
Davis, T.R., Battista, S.P. et Kensler, C.J. (1967) Mechanism of respiratory effects during exposure of guinea pigs to irritants. Archives of Environmental Health, 15(4): 412-419.
deCastro, B.R. (2014) Acrolein and asthma attack prevalence in a representative sample of the United States adult population 2000-2009. PloS One, 9(5): e96926.
DeJarnett, N., Conklin, D.J., Riggs, D.W., Myers, J.A., O'Toole, T.E., Hamzeh, I., Wagner, S., Chugh, A., Ramos, K.S., Srivastava, S., Higdon, D., Tollerud, D.J., DeFilippis, A., Becher, C., Wyatt, B., McCracken, J., Abplanalp, W., Rai, S.N., Ciszewski, T., Xie, Z., Yeager, R., Prabhu, S.D. et Bhatnagar, A. (2014) Acrolein exposure is associated with increased cardiovascular disease risk. Journal of the American Heart Association, 3(4): 10.1161/JAHA.114.000934.
Delfino, R.J., Gong, H., Linn, W.S., Hu, Y. et Pellizzari, E.D. (2003) Respiratory symptoms and peak expiratory flow in children with asthma in relation to volatile organic compounds in exhaled breath and ambient air. Journal of Exposure Analysis and Environmental Epidemiology, 13(5): 348-363.
Deshmukh, H.S., Shaver, C., Case, L.M., Dietsch, M., Wesselkamper, S.C., Hardie, W.D., Korfhagen, T.R., Corradi, M., Nadel, J.A., Borchers, M.T. et Leikauf, G.D. (2008) Acrolein-activated matrix metalloproteinase 9 contributes to persistent mucin production. American Journal of Respiratory Cell and Molecular Biology, 38(4): 446-454.
Dorman, D.C., Struve, M.F., Wong, B.A., Marshall, M.W., Gross, E.A. et Willson, G.A. (2008) Respiratory tract responses in male rats following subchronic acrolein inhalation. Inhalation Toxicology, 20(3): 205-216.
Dwivedi, A.M., Johanson, G., Lorentzen, J.C., Palmberg, L., Sjogren, B. et Ernstgard, L. (2015) Acute effects of acrolein in human volunteers during controlled exposure. Inhalation Toxicology, 27(14): 810-821.
Egle, J.L.,Jr (1972) Retention of inhaled formaldehyde, propionaldehyde, and acrolein in the dog. Archives of Environmental Health, 25(2): 119-124.
Egle, J.L.,Jr et Hudgins, P.M. (1974) Dose-dependent sympathomimetic and cardioinhibitory effects of acrolein and formaldehyde in the anesthetized rat. Toxicology and Applied Pharmacology, 28(3): 358-366.
Environnement Canada et Santé Canada (2000) Liste des substances d'intérêt prioritaire, rapport d'évaluation: acroléine. Gouvernement du Canada, Ottawa, ON, Canada.
ERG (2005) Carbonyl recovery and stability in canisters. Eastern Research Group. EPA 68-D-00-264.
Farsalinos, K.E. et Gillman, G. (2018) Carbonyl emissions in e-cigarette aerosol: A systematic review and methodological considerations. Frontiers in Physiology, 8(JAN).
Farsalinos, K.E., Yannovits, N., Sarri, T., Voudris, V., Poulas, K. et Leischow, S.J. (2018) Carbonyl emissions from a novel heated tobacco product (IQOS): comparison with an e-cigarette and a tobacco cigarette. Addiction, 113(11): 2099-2106.
Feng, Z., Hu, W., Hu, Y. et Tang, M.S. (2006) Acrolein is a major cigarette-related lung cancer agent: Preferential binding at p53 mutational hotspots and inhibition of DNA repair. Proceedings of the National Academy of Sciences of the United States of America, 103(42): 15404-15409.
Feron, V.J. et Kruysse, A. (1977) Effects of exposure to acrolein vapor in hamsters simultaneously treated with benzo[a]pyrene or diethylnitrosamine. Journal of Toxicology and Environmental Health, 3(3): 379-394.
Feron, V.J., Kruysse, A., Til, H.P. et Immel, H.R. (1978) Repeated exposure to acrolein vapour: Subacute studies in hamsters, rats and rabbits. Toxicology, 9(1-2): 47-57.
Gilbert, N.L., Guay, M., Miller, J.D., Judek, S., Chan, C.C. et Dales, R.E. (2005) Levels and determinants of formaldehyde, acetaldehyde, and acrolein in residential indoor air in Prince Edward Island, Canada. Environmental Research, 99(1): 11-17.
Gillman, I.G., Kistler, K.A., Stewart, E.W. et Paolantonio, A.R. (2016) Effect of variable power levels on the yield of total aerosol mass and formation of aldehydes in e-cigarette aerosols. Regulatory Toxicology and Pharmacology, 75: 58-65.
Hazari, M.S., Griggs, J., Winsett, D.W., Haykal-Coates, N., Ledbetter, A., Costa, D.L. et Farraj, A.K. (2014) A single exposure to acrolein desensitizes baroreflex responsiveness and increases cardiac arrhythmias in normotensive and hypertensive rats. Cardiovascular Toxicology, 14(1): 52-63.
Héroux, M.E., Clark, N., van Ryswyk, K., Mallick, R., Gilbert, N.L., Harrison, I., Rispler, K., Wang, D., Anastassopoulos, A., Guay, M., Macneill, M. et Wheeler, A.J. (2010) Predictors of indoor air concentrations in smoking and non-smoking residences. International Journal of Environmental Research and Public Health, 7(8): 3080-3099.
Herrington, J.S. et Hays, M.D. (2012) Concerns regarding 24-h sampling for formaldehyde, acetaldehyde, and acrolein using 2,4-dinitrophenylhydrazine (DNPH)-coated solid sorbents. Atmospheric Environment, 55: 179-184.
Herrington, J.S. et Myers, C. (2015) Electronic cigarette solutions and resultant aerosol profiles. Journal of Chromatography A, 1418: 192-199.
Ho, S.S.H., Ho, K.F., Liu, W.D., Lee, S.C., Dai, W.T., Cao, J.J. et Ip, H.S.S. (2011) Unsuitability of using the DNPH-coated solid sorbent cartridge for determination of airborne unsaturated carbonyls. Atmospheric Environment, 45(1): 261-265.
Ho, S.S.H., Yu, J.Z., Chu, K.W. et Yeung, L.L. (2006) Carbonyl emissions from commercial cooking sources in Hong Kong Journal of the Air & Waste Management Association, 56(8): 1091-1098.
Ho, S.S.H. et Yu, J.Z. (2002) Concentrations of formaldehyde and other carbonyls in environments affected by incense burning. Journal of Environmental Monitoring, 4(5): 728-733.
[INRP] Inventaire national des rejets de polluants. 2017.Ottawa (ON) : Gouvernement du Canada. Résultats de recherche sur l'acroléine. [Consulté le 18 décembre 2018]. https://pollution-dechets.canada.ca/inventaire-national-rejets/archives/index.cfm?do=query&lang=Fr.
Kane, L.E. et Alarie, Y. (1977) Sensory irritation to formaldehyde and acrolein during single and repeated exposures in mice. American Industrial Hygiene Association Journal, 38(10): 509-522.
Karavalakis, G., Bakeas, E., et Stournas, S. (2010) Influence of Oxidized Biodiesel Blends on Regulated and Unregulated Emissions from a Diesel Passenger Car. Environmental Science & Technology, 44(13): 5306-5312.
Kilburn, K.H. et McKenzie, W.N. (1978) Leukocyte recruitment to airways by aldehyde-carbon combinations that mimic cigarette smoke. Laboratory Investigation; a Journal of Technical Methods and Pathology, 38(2): 134-142.
Kimbell, J.S., Overton, J.H., Subramaniam, R.P., Schlosser, P.M., Morgan, K.T., Conolly, R.B. et Miller, F.J. (2001) Dosimetry modeling of inhaled formaldehyde: binning nasal flux predictions for quantitative risk assessment. Toxicological Sciences: An Official Journal of the Society of Toxicology, 64(1): 111-121.
Kimbell, J.S., Subramaniam, R.P., Gross, E.A., Schlosser, P.M. et Morgan, K.T. (2001) Dosimetry modeling of inhaled formaldehyde: comparisons of local flux predictions in the rat, monkey, and human nasal passages. Toxicological Sciences: An Official Journal of the Society of Toxicology, 64(1): 100-110.
Knighton, W.B., Herndon, S.C., Shorter, J.H., Miake-Lye, R.C., Zahniser, M.S., Akiyama, K., Shimono, A., Kitasaka, K., Shimajiri, H. et Sugihara, K. (2007) Laboratory evaluation of an aldehyde scrubber system specifically for the detection of acrolein. Journal of the Air and Waste Management Association, 57(11): 1370-1378.
Kurhanewicz, N., McIntosh-Kastrinsky, R., Tong, H., Ledbetter, A., Walsh, L., Farraj, A. et Hazari, M. (2017) TRPA1 mediates changes in heart rate variability and cardiac mechanical function in mice exposed to acrolein. Toxicology and Applied Pharmacology, 324: 51-60.
Kutzman, R.S. (1981) A subchronic inhalation study of Fischer 344 rats exposed to 0, 0.4, 1.4 or 4.0 ppm acrolein. BNL 30222, Brookhaven National Laboratory for the National Toxicology Program, Upton, NY, 11973.
Kutzman, R.S., Popenoe, E.A., Schmaeler, M. et Drew, R.T. (1985) Changes in rat lung structure and composition as a result of subchronic exposure to acrolein. Toxicology, 34(2): 139-151.
Kutzman, R.S., Wehner, R.W. et Haber, S.B. (1984) Selected responses of hypertension-sensitive and resistant rats to inhaled acrolein. Toxicology, 31(1): 53-65.
Lam, C.W., Casanova, M. et Heck, H.D. (1985) Depletion of nasal mucosal glutathione by acrolein and enhancement of formaldehyde-induced DNA-protein cross-linking by simultaneous exposure to acrolein. Archives of Toxicology, 58(2): 67-71.
Lau, C., Fiedler, H., Hutzinger, O., Schwind, K.H. et Hosseinpour, J. (1997) Levels of selected organic compounds in materials for candle production and human exposure to candle emissions. Chemosphere, 34(5-7): 1623-1630.
Le Bouffant, L., Martin, J.C., Daniel, H., Henin, J.P. et Normand, C. (1980) Action of intensive cigarette smoke inhalations on the rat lung. Role of particulate and gaseous cofactors. Journal of the National Cancer Institute, 64(2): 273-284.
Leach, C.L., Hatoum, N.S., Ratajczak, H.V. et Gerhart, J.M. (1987) The pathologic and immunologic effects of inhaled acrolein in rats. Toxicology Letters, 39(2-3): 189-198.
Lee, H.W., Wang, H.T., Weng, M.W., Chin, C., Huang, W., Lepor, H., Wu, X.R., Rom, W.N., Chen, L.C. et Tang, M.S. (2015) Cigarette side-stream smoke lung and bladder carcinogenesis: inducing mutagenic acrolein-DNA adducts, inhibiting DNA repair and enhancing anchorage-independent-growth cell transformation. Oncotarget, 6(32): 33226-33236.
Lee, H.-., Wang, H.-., Weng, M.-., Hu, Y., Chen, W.-., Chou, D., Liu, Y., Donin, N., Huang, W.C., Lepor, H., Wu, X.-., Wang, H., Beland, F.A. et Tang, M.S. (2014) Acrolein- and 4-Aminobiphenyl-DNA adducts in human bladder mucosa and tumor tissue and their mutagenicity in human urothelial cells. Oncotarget, 5(11): 3526-3540.
Leikauf, G.D. (1991) Mechanisms of aldehyde-induced bronchial reactivity: role of airway epithelium. Research Report (Health Effects Institute), 49: 1-35.
Li, Y., Cakmak, S., et Zhu, J. (2019) Profiles and monthly variations of selected volatile organic compounds in indoor air in Canadian homes: Results of Canadian national indoor air survey 2012-2013. Environment International, 126: 134-144.
Lijinsky, W. (1988) Chronic studies in rodents of vinyl acetate and compounds related to acrolein. Annals of the New York Academy of Sciences, 534: 246-254.
Lijinsky, W. et Reuber, M.D. (1987) Chronic carcinogenesis studies of acrolein and related compounds. Toxicology and Industrial Health, 3(3): 337-345.
Linhart, I., Frantik, E., Vodickova, L., Vosmanska, M., Smejkal, J. et Mitera, J. (1996) Biotransformation of acrolein in rat: excretion of mercapturic acids after inhalation and intraperitoneal injection. Toxicology and Applied Pharmacology, 136(1): 155-160.
Logue, J.M., Sleiman, M., Montesinos, V.N., Russell, M.L., Litter, M.I., Benowitz, N.L., Gundel, L.A. et Destaillats, H. (2017) Emissions from Electronic Cigarettes: Assessing Vapers' Intake of Toxic Compounds, Secondhand Exposures, and the Associated Health Impacts. Environmental Science & Technology, 51(16): 9271-9279.
Luo, C., Yang, L., Feng, Z., Li, Y., Long, J. et Liu, J. (2013) A cigarette component acrolein induces accelerated senescence in human diploid fibroblast IMR-90 cells. Biogerontology, 14(5): 503-511.
Lyon, J.P., Jenkins, L.J.,Jr, Jones, R.A., Coon, R.A. et Siegel, J. (1970) Repeated and continuous exposure of laboratory animals to acrolein. Toxicology and Applied Pharmacology, 17(3): 726-732.
Mahut, B., Delacourt, C., de Blic, J., Mani, T.M. et Scheinmann, P. (1993) Bronchiectasis in a child after acrolein inhalation. Chest, 104(4): 1286-1287.
McNulty, M., Heck, H.D. et Casanova-Schmitz, M. (1984) Depletion of glutathione in rat respiratory mucosa by inhaled acrolein. Fed Proc, 43: 575.
McRobbie, H., Phillips, A., Goniewicz, M.L., Smith, K.M., Knight-West, O., Przulj, D. et Hajek, P. (2015) Effects of switching to electronic cigarettes with and without concurrent smoking on exposure to nicotine, carbon monoxide, and acrolein. Cancer Prevention Research, 8(9): 873-878.
Moghe, A., Ghare, S., Lamoreau, B., Mohammad, M., Barve, S., McClain, C. et Joshi-Barve, S. (2015) Molecular mechanisms of acrolein toxicity: relevance to human disease. Toxicological Sciences: An Official Journal of the Society of Toxicology, 143(2): 242-255.
Mohammad, M.K., Avila, D., Zhang, J., Barve, S., Arteel, G., McClain, C. et Joshi-Barve, S. (2012) Acrolein cytotoxicity in hepatocytes involves endoplasmic reticulum stress, mitochondrial dysfunction and oxidative stress. Toxicology and Applied Pharmacology, 265(1): 73-82.
Morris, J.B. (1996) Uptake of Acrolein in the Upper Respiratory Tract of the F344 Rat. Inhalation Toxicology, 8(4): 387-403.
Morris, J.B., Symanowicz, P.T., Olsen, J.E., Thrall, R.S., Cloutier, M.M. et Hubbard, A.K. (2003) Immediate sensory nerve-mediated respiratory responses to irritants in healthy and allergic airway-diseased mice. Journal of Applied Physiology (Bethesda, Md.: 1985), 94(4): 1563-1571.
Murphy, S.D., Klingshirn, D.A. et Ulrich, C.E. (1963) Respiratory response of guinea pigs during acrolein inhalation and its modification by drugs. The Journal of Pharmacology and Experimental Therapeutics, 141: 79-83.
Nath, R.G., Ocando, J.E. et Chung, F.L. (1996) Detection of 1, N2-propanodeoxyguanosine adducts as potential endogenous DNA lesions in rodent and human tissues. Cancer Research, 56(3): 452-456.
NRC (National Research Council) (2001) Standing Operating Procedures for Developing Acute Exposure Guideline Levels for Hazardous Chemicals. Washington, DC: National Academy Press.
O'Brien, E., Spiess, P.C., Habibovic, A., Hristova, M., Bauer, R.A., Randall, M.J., Poynter, M.E. et van der Vliet, A. (2016) Inhalation of the reactive aldehyde acrolein promotes antigen sensitization to ovalbumin and enhances neutrophilic inflammation. Journal of Immunotoxicology, 13(2): 191-197.
OMS (2002) Acrolein - Concise International Chemical Assessment Document 43. Organisation mondiale de la Santé, Genève.
Ott, M.G., Teta, M.J. et Greenberg, H.L. (1989) Lymphatic and hematopoietic tissue cancer in a chemical manufacturing environment. American Journal of Industrial Medicine, 16(6): 631-643.
Overton, J.H., Kimbell, J.S. et Miller, F.J. (2001) Dosimetry modeling of inhaled formaldehyde: the human respiratory tract. Toxicological Sciences: An Official Journal of the Society of Toxicology, 64(1): 122-134.
Pal, A., Hu, X., Zimniak, P. et Singh, S.V. (2000) Catalytic efficiencies of allelic variants of human glutathione S-transferase Pi in the glutathione conjugation of alpha, beta-unsaturated aldehydes. Cancer Letters, 154(1): 39-43.
Parent, R.A., Caravello, H.E. et Long, J.E. (1992) Two-year toxicity and carcinogenicity study of acrolein in rats. Journal of Applied Toxicology: JAT, 12(2): 131-139.
Parent, R.A., Caravello, H.E. et Long, J.E. (1991) Oncogenecity study of acrolein in mice. Journal of the American College of Toxicology, 10(6): 647-659.
Parent, R.A., Caravello, H.E. et Sharp, D.E. (1996) Metabolism and distribution of [2,3-14C]acrolein in Sprague-Dawley rats. Journal of Applied Toxicology: JAT, 16(5): 449-457.
Parent, R.A., Paust, D.E., Schrimpf, M.K., Talaat, R.E., Doane, R.A., Caravello, H.E., Lee, S.J. et Sharp, D.E. (1998) Metabolism and distribution of [2,3-14C]acrolein in Sprague-Dawley rats. II. Identification of urinary and fecal metabolites. Toxicological Sciences: An Official Journal of the Society of Toxicology, 43(2): 110-120.
Park, S.L., Carmella, S.G., Chen, M., Patel, Y., Stram, D.O., Haiman, C.A., Le Marchand, L. et Hecht, S.S. (2015) Mercapturic Acids Derived from the Toxicants Acrolein and Crotonaldehyde in the Urine of Cigarette Smokers from Five Ethnic Groups with Differing Risks for Lung Cancer. PloS One, 10(6): e0124841.
Penn, A., Nath, R., Pan, J., Chen, L., Widmer, K., Henk, W. et Chung, F.L. (2001) 1,N(2)-propanodeoxyguanosine adduct formation in aortic DNA following inhalation of acrolein. Environmental Health Perspectives, 109(3): 219-224.
Perez, C.M., Ledbetter, A.D., Hazari, M.S., Haykal-coates, N., Carll, A.P., Winsett, D.W., Costa, D.L. et Farraj, A.K. (2013) Hypoxia stress test reveals exaggerated cardiovascular effects in hypertensive rats after exposure to the air pollutant acrolein. Toxicological Sciences, 132(2): 467-477.
Possanzini, M. et Di Palo, V. (1996) Short-term measurements of acrolein in ambient air. Chromatographia, 43(7-8): 433-435.
Randall, M.J., Haenen, G.R., Bouwman, F.G., van der Vliet, A. et Bast, A. (2016) The tobacco smoke component acrolein induces glucocorticoid resistant gene expression via inhibition of histone deacetylase. Toxicology Letters, 240(1): 43-49.
Ritter, L., Totman, C., Krishnan, K., Carrier, R., Vézina, A. et Morisset, V. (2007) Deriving uncertainty factors for threshold chemical contaminants in drinking water. Journal of Toxicology and Environmental Health - Part B: Critical Reviews, 10(7): 527-557.
Roemer, E., Anton, H.J. et Kindt, R. (1993) Cell proliferation in the respiratory tract of the rat after acute inhalation of formaldehyde or acrolein. Journal of Applied Toxicology: JAT, 13(2): 103-107.
Roux, E., Hyvelin, J.M., Savineau, J.P. et Marthan, R. (1999) Human isolated airway contraction: interaction between air pollutants and passive sensitization. American Journal of Respiratory and Critical Care Medicine, 160(2): 439-445.
Santé Canada (2018a) Fiche de renseignements : La ventilation et le milieu intérieur. [En ligne], https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/fiche-de-renseignements-ventilation-milieu-interieur.html.
Santé Canada (2018b) Fiche de renseignements : La cuisson et la qualité de l'air intérieur. [En ligne], https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/fiche-de-renseignements-cuisson-et-qualite-lair-interieur.html.
Santé Canada (2017) Document de synthèse : Niveaux de référence dans l'air intérieur liés à l'exposition chronique aux composés organiques volatils. Cat. : H144-48/2017F-PDF, ISBN : 978-0-660-23533-2, Gouvernement du Canada, Ottawa, Canada.
Santé Canada (2016) Projet de décision de réévaluation PRVD2016-16, Acroléine. PRVD2016-16. Santé Canada, Agence de réglementation de la lutte antiparasitaire. Ottawa, Ontario.
Santé Canada (2013) Étude de la qualité de l'air intérieur à Edmonton (2010) : Sommaire des données des composés organiques volatils (COV). Santé Canada, Ottawa, Ontario.
Santé Canada (2012) Étude de la qualité de l'air intérieur à Halifax (2009) : Sommaire des données d'échantillonnage des composés organiques volatils. Santé Canada, Ottawa, Ontario.
Santé Canada (2010a) Étude de la qualité de l'air intérieur à Regina (2007) : Sommaire des données d'échantillonnage des composés organiques volatils. Santé Canada, Ottawa, Ontario.
Santé Canada (2010b) Étude d'évaluation de l'exposition à Windsor (2005-2006) : Sommaire des données d'échantillonnage des composés organiques volatils. Santé Canada, Ottawa, Ontario.
Santé Canada (2006) Lignes directrices sur la qualité de l'air intérieur résidentiel : Formaldéhyde. [En ligne], https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/lignes-directrices-qualite-air-interieur-residentiel-formaldehyde.html.
Santé Canada (1987) Directives d'exposition concernant la qualité de l'air des résidences. Cat. : H46-2/90-156F.
Schroeter, J.D., Kimbell, J.S., Gross, E.A., Willson, G.A., Dorman, D.C., Tan, Y.M. et Clewell III, H.J. (2008) Application of physiological computational fluid dynamics models to predict interspecies nasal dosimetry of inhaled acrolein. Inhalation Toxicology, 20(3): 227-243.
Schulte-Ladbeck, R., Lindahl, R., Levin, J.-. et Karst, U. (2001) Characterization of chemical interferences in the determination of unsaturated aldehydes using aromatic hydrazine reagents and liquid chromatographkky. Journal of Environmental Monitoring, 3(3): 306-310.
Seaman, V.Y., Bennett, D.H., et Cahill, T.M. (2007) Origin, occurrence, and source emission rate of acrolein in residential indoor air. Environmental Science &Technology, 41(20): 6940-6946.
Seaman, V.Y., Charles, M.J. et Cahill, T.M. (2006) A Sensitive Method for the Quantification of Acrolein and Other Volatile Carbonyls in Ambient Air. Analytical Chemistry, 78(7): 2405-2412.
Seaman, V.Y., Bennett, D.H. et Cahill, T.M. (2009) Indoor acrolein emission and decay rates resulting from domestic cooking events. Atmospheric Environment, 43(39): 6199-6204.
Shelow, D., Rice, J, Jones, M., Camalier, L, et Swift, J. (2009) Acrolein Measurements. Presentation at 2009 National Ambient Air Monitoring Conference, Nashville, TN.
Shusterman, D. (2011) The effects of air pollutants and irritants on the upper airway. Proceedings of the American Thoracic Society, 8(1): 101-105.
Sim, V.M. et Pattle, R.E. (1957) Effect of possible smog irritants on human subjects. Journal of the American Medical Association, 165(15): 1908-1913.
Spiess, P.C., Kasahara, D., Habibovic, A., Hristova, M., Randall, M.J., Poynter, M.E. et van der Vliet, A. (2013) Acrolein exposure suppresses antigen-induced pulmonary inflammation. Respiratory Research, 14: 107-9921-14-107.
Stevens, J.F. et Maier, C.S. (2008) Acrolein: Sources, metabolism, and biomolecular interactions relevant to human health and disease. Molecular Nutrition and Food Research, 52(1): 7-25.
Stocco, C., MacNeill, M., Wang, D., Xu, X., Guay, M., Brook, J. et Wheeler, A.J. (2008) Predicting personal exposure of Windsor, Ontario residents to volatile organic compounds using indoor measurements and survey data. Atmospheric Environment, 42(23): 5905-5912.
Struve, M.F., Wong, V.A., Marshall, M.W., Kimbell, J.S., Schroeter, J.D. et Dorman, D.C. (2008) Nasal uptake of inhaled acrolein in rats. Inhalation Toxicology, 20(3): 217-225.
Swift, J.L., Howell, M., Tedder, D. et Merrill, R. (2007) Collection and Analysis of Acrolein using Compendium Method TO-15. Presented at the QA Region 6 Conference, Dallas TX, October 2006.
Tejada, S.B. (1986) Evaluation of Silica Gel Cartridges Coated In Situ With Acidified 2, 4-Dinitrophenylhydrazine for Sampling Aldehydes and Ketones in Air. International Journal of Environmental Analytical Chemistry, 26(2): 167-185.
Thompson, L.C., Ledbetter, A.D., Haykal-Coates, N., Cascio, W.E., Hazari, M.S. et Farraj, A.K. (2017) Acrolein Inhalation Alters Myocardial Synchrony and Performance at and Below Exposure Concentrations that Cause Ventilatory Responses. Cardiovascular Toxicology, 17(2): 97-108.
Tully, M., Zheng, L., Acosta, G., Tian, R. et Shi, R. (2014) Acute systemic accumulation of acrolein in mice by inhalation at a concentration similar to that in cigarette smoke. Neuroscience Bulletin, 30(6): 1017-1024.
Uchiyama, S., Inaba, Y. et Kunugita, N. (2010) Determination of acrolein and other carbonyls in cigarette smoke using coupled silica cartridges impregnated with hydroquinone and 2,4-dinitrophenylhydrazine. Journal of Chromatography A, 1217(26): 4383-4388.
US EPA (1994) Methods for derivation of inhalation reference concentrations and application of inhalation dosimetry. EPA/600/8-90/066F.
US EPA (2003) Toxicological Review of Acrolein (107-02-8). In Support of Summary Information on the Integrated Risk Information System (IRIS). EPA/635/R-03/003, United States Environmental Protection Agency, Washington, D.C. [En ligne], http://cfpub.epa.gov/ncea/iris/iris_documents/documents/toxreviews/0364tr.pdf.
US EPA (2008) Reregistration Eligibility Decision: Acrolein. [En ligne], https://archive.epa.gov/pesticides/reregistration/web/pdf/acrolein_red.pdf.
US EPA (2010) Data Quality Evaluation Guidelines for Ambient Air Acrolein Measurements. [En ligne], https://www3.epa.gov/ttnamti1/files/ambient/airtox/20101217acroleindataqualityeval.pdf.
Wang, H.T., Hu, Y., Tong, D., Huang, J., Gu, L., Wu, X.R., Chung, F.L., Li, G.M. et Tang, M.S. (2012) Effect of carcinogenic acrolein on DNA repair and mutagenic susceptibility. Journal of Biological Chemistry, 287(15): 12379-12386.
Wang, H.T., Weng, M.W., Chen, W.C., Yobin, M., Pan, J., Chung, F.L., Wu, X.R., Rom, W. et Tang, M.S. (2013) Effect of CpG methylation at different sequence context on acrolein- and BPDE-DNA binding and mutagenesis. Carcinogenesis, 34(1): 220-227.
Wang, H., Zhang, X. et Chen, Z. (2009) Development of DNPH/HPLC method for the measurement of carbonyl compounds in the aqueous phase: Applications to laboratory simulation and field measurement. Environmental Chemistry, 6(5): 389-397.
Wang, L., Sun, Y., Asahi, M. et Otsu, K. (2011) Acrolein, an Environmental Toxin, Induces Cardiomyocyte Apoptosis via Elevated Intracellular Calcium and Free Radicals. Cell Biochemistry and Biophysics, 61(1): 131-136.
Weber-Tschopp, A., Fischer, T., Gierer, R. et Grandjean, E. (1977) Experimentally induced irritating effects of acrolein on men (author's transl). International Archives of Occupational and Environmental Health, 40(2): 117-130.
Won, D., Nong, G., Yang, W. et Collins, P. (2014) Material Emissions Testing: VOCs from Wood, Paint, and Insulation Materials. A1-000342.2, NRC Institute for Research in Construction, Ottawa, ON.
Zhang, S., Balbo, S., Wang, M. et Hecht, S.S. (2011) Analysis of acrolein-derived 1,N2-propanodeoxyguanosine adducts in human leukocyte DNA from smokers and nonsmokers. Chemical Research in Toxicology, 24(1): 119-124.
Zhang, S., Villalta, P.W., Wang, M. et Hecht, S.S. (2007) Detection and quantitation of acrolein-derived 1,N2-propanodeoxyguanosine adducts in human lung by liquid chromatography-electrospray ionization-tandem mass spectrometry. Chemical Research in Toxicology, 20(4): 565-571.
Annexe A : Liste des acronymes et des abréviations
- AC
- Aberration chromosomique
- ADN
- Acide désoxyribonucléique
- Anses
- Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail
- ATSDR
- Agency for Toxic Substances and Disease Registry
- CalEPA
- California Environmental Protection Agency
- CDC
- Centers for Disease Control and Prevention
- CEH
- Concentration équivalente chez l'homme
- CEMA
- Acide S-(2-carboxyéthyl)mercapturique
- CFD
- Mécanique des fluides numérique (computational fluid dynamics)
- CIRC
- Centre international de Recherche sur le Cancer
- CL50
- Concentration qui cause la mort de 50 % de la population faisant l'objet d'un essai
- COV
- Composé organique volatil
- CR05
- Concentration repère associée à une augmentation de 5 % d'un effet
- CRf
- Concentration de référence
- DAF
- Facteur d'ajustement dosimétrique (dosimetric adjustment factor)
- dG
- Désoxyguanosine
- DMENO
- Dose minimale avec effet nocif observé
- DNPH
- Dinitrophénylhydrazine
- DSENO
- Dose sans effet nocif observé
- ECS
- Échange de chromatides sœurs
- FI
- Facteur d'incertitude
- GSH
- Glutathion (libre ou réduit)
- GST
- Glutathion-S-transférase
- 3-HPMA
- Acide S-(3-hydroxypropyl)mercapturique
- IC
- Intervalle de confiance
- I/E
- Intérieur/extérieur
- IP
- Intrapéritonéal
- LD
- Limite de détection
- LDQAIR
- Lignes directrices sur la qualité de l'air intérieur résidentiel
- LLBA
- Liquide de lavage broncho-alvéolaire
- NRAI
- Niveau de référence dans l'air intérieur
- OMS
- Organisation mondiale de la Santé
- OVA
- Ovalbumine
- PBPK
- Pharmacocinétique à base physiologique
- PK
- Pharmacocinétique
- ppb
- Partie par milliard
- ppm
- Partie par million
- RC
- Rapport de cotes
- RD50
- Concentration induisant une diminution de 50 % de la fréquence respiratoire (50% respiratory rate decrease)
- US EPA
- United States Environmental Protection Agency
Annexe B : Études d'exposition humaine
| Étude | Participants | Exposition | Résultats | DSENO/DMENO |
|---|---|---|---|---|
| Claeson et Lind (2016) | 26 volontaires (18 femmes, 8 hommes) | Exposition de 15, 45 ou 60 min des yeux seulement à 0,07, 0,16 et 0,36 mg/m3 d'acroléine | Irritation oculaire chez plus de la moitié des sujets rapportée à 0,36 mg/m3 pendant 15 min (à partir de 6,8 min)
Aucune différence par rapport aux témoins à 0,16 mg/m3 pendant 45 min ou à 0,07 mg/m3 pendant 60 min |
DSENO = 0,16 mg/m3
DMENO = 0,36 mg/m3 (irritation oculaire) |
| Darley et al. (1960) | 36 volontaires (26 hommes, 10 femmes) | Exposition de 5 min des yeux seulement à 0, 0,06, 1,3 - 1,6 ou 2,0 - 2,3 ppm (0,14, 2,99 - 3,68 ou 4,60 - 5,29 mg/m3) d'acroléine | Mesure subjective de l'irritation (nul = 0, moyen = 1, sévère = 2)
Scores moyens de l'irritation maximale : air = 0,361; 0,06 ppm = 0,471; 1,3 - 1,6 ppm = 1,182; 2,0 - 2,3 ppm = 1,476 |
DMENO = 0,14 mg/m3 (légère irritation oculaire à la plus faible concentration)
Retenue par la CalEPA (2008) pour établir un niveau d'exposition de référence pour l'exposition aiguë |
| Dwivedi et al. (2015) | 18 volontaires (9 femmes, 9 hommes) | Exposition corps entier de 2 heures à 0,05 ou 0,1 ppm (0,12 ou 0,23 mg/m3) d'acroléine | Légère augmentation de la fréquence de clignement des yeux et de l'irritation oculaire mise en évidence à la concentration élevée, mais pas à la concentration faible
Aucune différence par rapport aux témoins pour ce qui est de la fréquence respiratoire, de la fonction pulmonaire, de l'inflammation nasale et des marqueurs de l'inflammation dans le sang ou le crachat |
DSENO = 0,12 mg/m3
DMENO = 0,23 mg/m3 (légère irritation oculaire) |
| Weber-Tschopp et al. (1977) | a) 53 volontaires (31 hommes, 22 femmes)
b) 42 volontaires (17 hommes, 25 femmes) c) 46 volontaires (21 hommes, 25 femmes) |
Expositions corps entier :
a) 40 min à des concentrations croissantes d'acroléine, de 0,09 à 0,6 ppm (0,21 à 1,4 mg/m3) b) 1,5 min à des concentrations d'acroléine comprises entre 0,15 et 0,6 ppm (0,35 et 1,4 mg/m3) avec 8 min entre chaque exposition c) 60 min à 0,3 ppm (0,69 mg/m3) d'acroléine |
a) Plus grande incidence d'irritation oculaire subjective à 0,09 ppm, d'irritation nasale à 0,26 ppm et d'irritation de la gorge à 0,43 ppm; augmentation de la fréquence de clignement des yeux à 0,26 ppm; baisse de 25 % de la fréquence respiratoire à 0,6 ppm b) Augmentation significative de l'incidence d'irritation oculaire subjective à 0,3 ppm et de l'incidence d'irritation nasale à 0,6 ppm c) Irritation des yeux, du nez et de la gorge et diminution de la fréquence respiratoire (10 - 15 %) |
DMENO = 0,21 mg/m3 (légère irritation oculaire à la plus faible concentration) Retenue par l'US EPA (2010) pour établir une valeur limite AEGL (acute exposure guideline limit) pour l'exposition aiguë DMENO = 0,69 mg/m3 (baisse de la fréquence respiratoire/irritation) Retenue par l'ATSDR (2007) pour établir un MRL (minimal risk level) pour l'exposition aiguë |
| Étude | Participants | Exposition | Résultats | DSENO/DMENO |
|---|---|---|---|---|
| Annesi-Maesano et al. (2012) | 6590 enfants de 6 villes françaises (401 classes de 108 écoles primaires) | Concentrations mesurées « pendant les heures de classe » (durée non précisée bien qu'une « concentration moyenne sur 5 jours » soit mentionnée ailleurs dans l'article)
Concentrations réparties en 3 groupes : faible < LD, moyenne = LD - 1,55 µg/m3, forte > 1,55 µg/m3 (LD non précisée) |
La visite médicale comprenait un test de la piqûre pour le dépistage des allergies et un test de détection de l'asthme d'effort.
Questionnaire de santé rempli par les parents (rhinite et asthme au cours de l'année précédente). Les facteurs de confusion comprenaient le tabagisme passif et les antécédents familiaux (ajustement). RC < 1 pour le développement de rhinoconjonctivite au cours de l'année précédente à la concentration moyenne ou forte; RC = 1,23 et RC = 1,22 pour le développement de l'asthme au cours de l'année précédente respectivement aux concentrations moyenne et forte. Après stratification des sujets sur la réactivité cutanée, une association positive a été mise en évidence entre l'acroléine et l'asthme allergique (atopique) (RC de 1,22 pour le groupe d'exposition moyenne et de 1,28 pour celui d'exposition forte, p = 0,1665), association non retrouvée avec l'asthme non allergique (non atopique) (RC de 0,94 et de 0,60, p = 0,0741). Cette association avec l'asthme était plus marquée au printemps et en été (RC de 1,37). L'acroléine a été significativement corrélée avec l'asthme d'effort (p < 0,025). |
Aucune Les auteurs affirment que l'acroléine joue un rôle dans le développement de l'asthme chez les enfants atopiques. |
| Billionnet et al. (2011) | 1012 personnes âgées de 15 ans et plus demeurant dans 490 habitations françaises | Échantillonnage effectué dans la chambre des parents pendant une semaine; moyenne utilisée pour l'analyse
LD égale à 0,1, limite de quantification (LQ) égale à 0,3 µg/m3 0,8 % des habitations < LD, 3,5% entre la LD et la LQ Concentrations comprises entre < LD et 12,9 µg/m3 Médiane = 1,0 µg/m3 3e quartile = 1,51 µg/m3 Concentrations supérieures au troisième quartile considérées comme élevées |
Questionnaire sur les caractéristiques de l'habitation et le niveau d'activité à la maison ainsi que les heures consacrées à ces activités
Questionnaire sur l'asthme (l'année précédente) et la rhinite (le mois précédent) - diagnostic non confirmé par un médecin Ajustement sur les facteurs de confusion (y compris le tabagisme, la pollution extérieure et la présence d'animaux) Aucune association entre l'acroléine et l'asthme (RC de 0,83, IC à 95 % se situant entre 0,5 et 1,5) Aucune association entre l'acroléine et la rhinite (RC de 1,08, IC à 95 % se situant entre 0,8 et 1,7) |
Aucune Selon les résultats, il n'existerait pas de lien entre l'exposition à une concentration d'acroléine supérieure à 1,5 µg/m3 et le développement de l'asthme au cours de l'année précédente. |
| deCastro (2014) | ~270 000 sujets aux États-Unis
National Health Interview Survey (CDC) |
Examen des concentrations ambiantes d'acroléine (concentrations du 2005 National Air Toxics Assessment ou NATA)
NATA : données du National Emissions Inventory et de surveillance de l'air de l'EPA; estimation des concentrations extérieures à partir de modèles (prenant en compte la densité de la population et la topographie des secteurs de recensement), puis celle des niveaux d'exposition (prenant en compte les caractéristiques sociodémographiques, les activités et le climat) entre le quintile 0,000 138 - 0,010 900 µg/m3 et le quintile 0,055 510 1 - 0,457 000 µg/m3 |
Interview menée auprès d'un échantillon représentatif sur le plan national de ménages, qui produit des estimations de la prévalence des maladies aux États-Unis (c.-à-d. une estimation de la prévalence de l'asthme aux États-Unis par année et par groupe d'âge) Prise en compte des facteurs de confusion (urbain/rural, tabagisme) Crises d'asthme auto-déclarées au cours de l'année précédente (définition standard des CDC pour l'évaluation de la prévalence de crise d'asthme) Expositions géographiquement liées aux habitations des participants pour chaque secteur de recensement Les auteurs ont qualifié l'augmentation de la prévalence de crise d'asthme dans le quintile supérieur de « marginalement significative » (p = 0,1), le RC étant de 1,08 (IC à 95 % se situant entre 0,98 et 1,19) pour tous les sujets, les personnes qui n'avaient jamais fumé (RC de 1,13), et les personnes qui n'avaient jamais fumé plus les anciens fumeurs (RC de 1,09). Aucune tendance n'a été observée pour les quatre autres quintiles. |
Aucune L'EPA estime que la concentration ambiante d'acroléine est à l'origine de 75 % des effets non cancérogènes sur l'appareil respiratoire attribuables aux polluants atmosphériques toxiques aux États-Unis. |
Annexe C : Études toxicologiques
| Étude | Espèce, sexe et nombre | Exposition | Résultats | DSENO/DMENO |
|---|---|---|---|---|
| Arumugan et al. (1999) | Rats mâles Wistar, 5 par groupe | 4 heures (tête seulement) à 0, 1 ou 2 ppm (2,3 ou 4,6 mg/m3) d'acroléine | Dans les poumons : diminution des niveaux de GSH, d'acide ascorbique et d'alpha-tocophérol; activité réduite de la catalase et de la glutathion peroxydase; présence de cellules desquamées et mononucléaires dans les bronchioles; hyperémie; emphysème | DMENO = 2,3 mg/m3
(changements enzymatiques et cellulaires dans l'épithélium respiratoire à la plus faible concentration) |
| Cassee, Groten et Feron (1996) | Rats mâles Wistar, 5-6 par groupe | 6 heures (nez seulement) à 0, 0,25, 0,67 ou 1,4 ppm (0,57, 1,54 ou 3,22 mg/m3) d'acroléine | Activité réduite de la glutathion réductase dans l'épithélium respiratoire nasal
Aucune lésion nasale ni aucune prolifération cellulaire |
DMENO = 0,57 mg/m3
(changements enzymatiques dans l'épithélium respiratoire à la plus faible concentration) |
| Lam et al. (1985) | Rat mâles Fischer 344, 4 par groupe | 3 heures (nez seulement) à 0, 0,1, 0,5, 1,0, 2,5, 5 ppm (0,23, 1,2, 2,3, 5,8, 11,5 mg/m3) d'acroléine | Déplétion dose-dépendante des groupes sulfhydryles non protéiques dans la muqueuse respiratoire (significative à partir de 1,2 mg/m3)
Aucune liaison croisée ADN-protéines dans la muqueuse nasale |
DMENO = 1,2 mg/m3
(déplétion des groupes sulfhydryles dans la muqueuse respiratoire) |
| Leikauf (1991) | Cobayes mâles Hartley, 5-7 par groupe | 2 heures (corps entier) à 0, 0,31, 0,67, 0,91, 1,26 ppm (0,7, 1,54, 2,1, 2,9 mg/m3) d'acroléine | Hyperréactivité bronchique/résistance accrue des voies respiratoires transitoires à 0,7 mg/m3, mais persistantes plus de 24 heures après l'arrêt de l'exposition à 2,1 mg/m3
Changements au niveau de la composition des cellules trachéales à 2,1 mg/m3, avec un retour à la normale dans les 24 heures |
DMENO = 0,7 mg/m3
(hyperréactivité bronchique et résistance accrue des voies respiratoires à la plus faible concentration) |
| Morris et al. (2003) | Souris C57Bl/6J, 3 -8 par groupe
Naïves et sensibilisées (OVA) (nombre de mâles et de femelles par groupe non précisé) |
10 min (nez seulement) à 0,3, 1,6, 3,9 ppm (0,69, 3,7, 9,0 mg/m3) d'acroléine
(aucun groupe témoin) |
Décroissance de la fréquence respiratoire; résistance accrue des voies respiratoires
Effets plus marqués chez les animaux déjà sensibilisés par une injection IP d'OVA |
Aucune
Aucun groupe témoin Effets observés à 0,69 mg/m3 (la plus faible concentration) |
| Perez et al. (2013) | Rats mâles spontanément hypertendus (SH) et Wistar Kyoto normotendus (NT), 6 par groupe | 3 heures (corps entier) à 3 ppm (6,9 mg/m3) d'acroléine
(aucun groupe témoin; 5 jours entre le test de référence et l'exposition des animaux) |
Augmentation de la fréquence cardiaque, de la pression artérielle, de la variabilité de la fréquence cardiaque (seulement après 3 heures), de la fréquence respiratoire (seulement après 3 heures) et du débit-volume (seulement après 3 heures) chez les rats SH; augmentation seulement de la pression artérielle chez les rats NT au cours de l'exposition à l'acroléine - augmentation moindre que celle chez les rat SH | Aucune
Aucun groupe témoin Effets observés à 6,9 mg/m3 (la plus faible concentration) |
| Roemer et al. (1993) | Rats mâles Sprague Dawley, 3-5 par groupe | 6 heures (tête seulement) à 0, 0,2 ou 0,6 ppm (0,46 ou 1,4 mg/m3) d'acroléine | Synthèse accrue de l'ADN et prolifération accrue des cellules nasales, trachéales et pulmonaires | DMENO = 0,46 mg/m3
(prolifération au niveau de l'épithélium respiratoire à la plus faible concentration) |
| Thompson et al. (2017) | Souris mâles C57Bl/6J, 6 par groupe | 3 heures (corps entier) à 0,3 ou 3 ppm (0,7 ou 6,9 mg/m3) d'acroléine
(aucun groupe témoin; période d'acclimatement de 30 min retenue comme base de référence pour les animaux) |
À la concentration la plus élevée seulement, baisse de la fréquence respiratoire, et augmentation du volume courant et du nombre de lymphocytes dans les poumons (nombre total de cellules et nombre de neutrophiles et d'éosinophiles inchangés); augmentation du volume d'éjection systolique (20 %) et du débit cardiaque (10 %) 24 heures après l'exposition; haut degré d'asynchronisme cardiaque (c.-à-d. pertes de synchronisation des contractions) 1 heure et 24 heures après l'exposition À la concentration la plus faible seulement, réduction de la fréquence cardiaque (5 % 1 heure après l'exposition, mais non 24 heures après) et baisse de la performance du myocarde (1 heure et 24 heures après l'exposition) |
Aucune
Aucun groupe témoin Effets observés à 0,7 mg/m3 (la plus faible concentration) |
| Étude | Espèce, sexe et nombre | Exposition | Résultats | DSENO/DMENO |
|---|---|---|---|---|
| Borchers et al. (2008) | Souris femelles C57Bl/6J, 8 par groupe | 6 heures par jour (corps entier) à 0, 0,5 ou 2 ppm (1,2 ou 4,6 mg/m3) d'acroléine pendant 1, 2 ou 4 semaines | Augmentation de l'indice de mucus (à la concentration élevée pendant 2 et 4 semaines) - métaplasie des cellules à mucus dans les poumons
Augmentation du nombre de cellules épithéliales dans le LLBA (lésions des voies respiratoires) (à la concentration élevée pendant 1, 2 et 4 semaines) Accumulation de macrophages (aux concentrations faible et élevée pendant 2 et 4 semaines) |
DMENO = 1,2 mg/m3
(changements au niveau du LLBA à la plus faible concentration) |
| Bouley et al. (1976) | Rats SPF OFA (3 mâles et 21 femelles) | Exposition continue à 0 ou 0,55 ppm (1,3 mg/m3) d'acroléine pendant 4 jours avant leur accouplement et 22 jours après | Aucune différence dans le nombre de femelles gravides ainsi que dans le nombre et le poids des fœtus entre les animaux exposés et ceux du groupe témoin | DSENO (toxicité sur la reproduction et le développement) = 1,3 mg/m3 (concentration unique; peu d'effets examinés) |
| Buckley (1984) | Souris mâles Swiss-Webster, 16-24 par groupe (8 - 10 témoins) | 6 heures par jour (corps entier) à 0 ou 1,7 ppm (3,9 mg/m3) d'acroléine pendant 5 jours | Exfoliation et métaplasie squameuse de l'épithélium respiratoire, et ulcération modérée de l'épithélium olfactif; aucune lésion au niveau des voies respiratoires inférieures | DMENO = 3,9 mg/m3
(lésions de l'épithélium respiratoire et olfactif à la plus faible concentration) |
| Cassee, Groten et Feron (1996) | Rats mâles Wistar, 5-6 par groupe | 6 heures par jour (nez seulement) à 0, 0,25, 0,67 ou 1,4 ppm (0,57, 1,54 ou 3,22 mg/m3) d'acroléine pendant 3 jours | Modifications histopathologiques liées à la concentration (y compris la désagrégration, la nécrose, l'épaississement, la desquamation et l'hyperplasie cellulaire basale) au niveau de l'épithélium respiratoire nasal/transitionnel, mais pas de l'épithélium olfactif; sévérité des lésions proportionnelle à la concentration
Réduction de l'activité de la glutathion réductase aux concentration faible et moyenne; réduction de l'activité de la GST et des aldéhydes déshydrogénases à la concentration moyenne Prolifération cellulaire accrue aux concentrations faible et moyenne |
DMENO = 0,57 mg/m3
(lésions de l'épithélium respiratoire nasal à la plus faible concentration) Santé Canada a déjà établi une CR05 de 0,14 mg/m3 sur laquelle repose la concentration tolérable. |
| Leach et al. (1987) | Rats mâles SD, 40 par groupe | 6 heures par jour, 5 jours par semaine à 0, 0,1, 1,0 ou 3,0 ppm (0,23, 2,3 ou 6,9 mg/m3) d'acroléine pendant 3 semaines | Exfoliation, érosion et nécrose de l'épithélium respiratoire du cornet nasal et métaplasie des cellules squameuses dans le groupe fortement exposé, sans aucune modification histopathologique au niveau des poumons | Aucune
Seuls 12 rats du groupe témoin et 12 rats du groupe fortement exposé ont été soumis à une analyse histopathologique. |
| O'Brien et al. (2016) | Souris mâles C57BL/6 | 4 heures par jour, 4 jours par semaine à 0 ou 5 ppm (11,5 mg/m3) d'acroléine pendant 2 semaines
(+OVA, également OVA seule par inhalation) Provocation à l'OVA inhalée pendant 3 jours après une semaine de repos |
Augmentation des IgG spécifiques de l'OVA après une exposition à l'acroléine par rapport à une exposition à l'OVA seule (l'acroléine favorise la sensibilisation) Inflammation pulmonaire plus prononcée après une exposition à l'acroléine par rapport à une exposition à l'OVA seule Aucune différence entre les groupes dans le nombre de leucocytes dans les poumons, le nombre de macrophages ou d'IL et de TNFα dans le LLBA; aucune différence également dans l'expression de l'ARNm des cytokines dans les tissus pulmonaires Augmentation de l'expression de l'ARNm de l'IL-17F dans les poumons chez les animaux exposés (± OVA). Les auteurs indiquent que ces IL ont été associées à l'asthme. |
Aucune
Effets observés à 11,5 mg/m3 (concentration unique) |
| Roemer et al. (1993) | Rats mâles Sprague Dawley, 3-5 par groupe | 6 heures par jour (tête seulement) à 0, 0,2 ou 0,6 ppm (0,46 ou 1,38 mg/m3) d'acroléine pendant 3 jours | Prolifération cellulaire accrue dans l'épithélium nasal, trachéal et pulmonaire; effets moins prononcés que ceux de l'exposition unique | DMENO = 0,46 mg/m3
(prolifération cellulaire dans l'épithélium respiratoire à la plus faible concentration) |
| Spiess et al. (2013) | Souris mâles C57BL/6 sensibilisées à l'OVA par injection IP, 3-4 par groupe | 6 heures par jour (corps entier) à 0 ou 5 ppm (11,5 mg/m3) d'acroléine pendant 4 jours (de plus, exposition par inhalation des animaux à l'OVA pendant 30 min au cours de la provocation bronchique) | Réduction de l'inflammation allergique des voies respiratoires (inhibition de la production de mucus, de l'infiltration de leucocytes et de la sécrétion de cytokines) et diminution de l'hyperplasie des cellules caliciformes suite à l'exposition à l'acroléine | Aucune
Effets observés à 11,5 mg/m3 (concentration unique) |
| Étude | Espèce, sexe et nombre | Exposition | Résultats | DSENO/DMENO |
|---|---|---|---|---|
| Dorman et al. (2008) | Rats mâles Fischer 344, 12 par groupe | 6 heures par jour, 5 jours par semaine (corps entier) à 0, 0,02, 0,06, 0,2, 0,6 ou 1,8 ppm (0, 0,05, 0,14, 0,46, 1,4 or 4,1 mg/m3) d'acroléine pendant 13 semaines Analyse histopathologique des voies respiratoires réalisée aux jours 4, 14, 30 et 65, puis après une période de repos de 60 jours; classement des lésions de 1 à 5 en fonction de leur gravité et division de la cavité nasale en 6 sections |
Réduction du poids corporel - importante (20 %) chez le groupe fortement exposé; réduction moindre, mais significative, et persistante au cours de l'exposition chez tous les autres animaux; retour partiel à la normale après l'exposition Pathologies de l'épithélium respiratoire nasal : inflammation, hyperplasie et métaplasie squameuse; effets légers à 1,4 mg/m3 à partir du jour 4; effets plus graves à la concentration plus élevée; effets observés dès les premiers jours de l'exposition à 4,1 mg/m3; inflammation et hyperplasie transitoires au niveau de certains sites, puis remplacées par une métaplasie persistante malgré l'arrêt de l'exposition Prolifération cellulaire accrue à 1,4 ou 4,1 mg/m3, mais pas à 0,46 mg/m3 Réponse inflammatoire de l'épithélium olfactif, dégénérescence et atrophie à 4,1 mg/m3 à partir du jour 4 |
DSENO = 0,46 mg/m3 DMENO = 1,4 mg/m3 (lésions de l'épithélium respiratoire dans la cavité nasale) La DSENO de 0,46 mg/m3 est considérée comme la dose critique pour l'exposition de longue durée dans les évaluations des risques de l'acroléine menées par la CalEPA (2008) et l'Anses (2013). DSENO = 1,4 mg/m3 DMENO = 4,1 mg/m3 (inflammation de l'épithélium olfactif) |
| Feron et Kruysse (1977) | Hamsters dorés (syriens), 18 par sexe par groupe d'exposition Instillation trachéale hebdomadaire de NaCl et de benzo[a]pyrène ou injection sous-cutanée toutes les 3 semaines de N-nitrosodiéthylamine chez certains animaux |
7 heures par jour, 5 jours par semaine (corps entier) à 0 ou 4 ppm (9,2 mg/m3) d'acroléine pendant 52 semaines ± période de rétablissement de 29 semaines |
Réduction du poids corporel qui commence à disparaître après l'exposition Inflammation et métaplasie de l'épithélium de la cavité nasale (légère à modérée); lésions toujours présentes après la période de rétablissement chez 20 % des animaux Aucune tumeur dans les voies respiratoires Aucune augmentation de l'incidence des tumeurs induites par le B[a]P; aucun effet sur les tumeurs induites par la DENA |
Aucune
Aucun signe de cancérogénicité à 9,2 mg/m3 |
| Feron et al. (1978) | Hamsters dorés (20 par groupe), rats Wistar (12 par groupe), lapins Dutch (4 par groupe), mâles et femelles | 6 heures par jour, 5 jours par semaine (corps entier) à 0, 0,4, 1,4 ou 4,9 ppm (0,9, 3,2, 11,3 mg/m3) d'acroléine pendant 13 semaines Analyse histopathologique de l'appareil respiratoire de tous les animaux; lésions classées comme faibles, modérées ou sévères |
Réduction importante du gain de poids à la concentration élevée chez le hamster et le lapin, et aux concentrations moyenne et élevée chez le rat Analyse histopathologique du nez : à la concentration faible, modifications métaplasiques et inflammatoires chez 1 rat; à la concentration moyenne, modifications chez le rat (modérées; incidence non précisée) et le hamster (légères), mais pas chez le lapin; à la concentration élevée, modifications chez le lapin (modérées) et chez le rat et le hamster (sévères) Analyse histopathologique de l'épithélium trachéal : à la concentration élevée, légère hyperplasie chez le lapin, hyperplasie et métaplasie modérées chez le hamster et lésions sévères chez le rat Analyse histopathologique des poumons : à la concentration élevée, hémorragie sévère, œdème, bronchopneumonie, bronchite, hyperplasie et métaplasie des bronches, et lésions de tout type et de toute gravité chez le rat; effets similaires chez le lapin, mais moins sévères (modérés) que chez le rat |
DMENO = 0,9 mg/m3 (la plus faible concentration) Cette valeur est considérée comme la plus faible DMENO par l'US EPA qui s'en est servie pour établir une CRf. |
| Kutzman (1981); Kutzman et al. (1985); Costa et al. (1986) | Rats Fischer 344 : 24 mâles par groupe utilisés pour l'exploration fonctionnelle pulmonaire et la pathologie des poumons; 8 mâles par groupe utilisés pour la pathologie seulement; 10 mâles par groupe utilisés pour la cytologie; 8 mâles et 8 femelles par groupe pour les essais relatifs à la reproduction | 6 heures par jour, 5 jours par semaine (corps entier) à 0, 0,4, 1,4 ou 4,0 ppm (0,9, 3,2 ou 9,2 mg/m3) d'acroléine pendant 62 jours, avec période de rétablissement de 1 semaine Analyse histopathologique des poumons, de la trachée et du cornet nasal (aucune section); lésions classées sur une échelle de 0 à 5 |
Baisse du poids corporel plus importante chez les animaux exposés à la concentration élevée que chez les témoins; aucune différence entre les animaux exposés et les témoins aux autres concentrations À la concentration élevée, mortalité (bronchopneumonie), nécrose de l'épithélium bronchiolaire et desquamation, et œdème bronchiolaire et pulmonaire; œdème trachéal de sévérité très variable; dépression de la fonction pulmonaire, même chez les animaux ne présentant aucune lésion histologique Aucune lésion pulmonaire à la concentration moyenne; nécrose et hyperplasie bronchiques chez certains rats qui fonctionnaient tout aussi bien que les témoins Déficits fonctionnels sans aucune lésion pulmonaire à la concentration faible Aucune anomalie morphologique des spermatozoïdes, et aucun changement au niveau du taux de gestation et du nombre de corps jaunes, d'embryons viables, de morts fœtales ou de pertes préimplantation |
DMENO = 0,9 mg/m3 (dépression de la fonction pulmonaire à la plus faible concentration) Cette valeur conforte la plus faible DMENO dont s'est servie l'US EPA pour établir une CRf. DSENO = 9,2 mg/m3 (toxicité sur la reproduction à la plus forte concentration; peu d'effets examinés) |
| Kutzman et al. (1984) | Rats femelles Dahl sélectionnés pour leur sensibilité (DS) ou leur résistance à l'hypertension (DR), 10 par groupe | 6 heures par jour, 5 jours par semaine (corps entier) à 0, 0,4, 1,4 ou 4,0 ppm (0,9, 3,2 ou 9,2 mg/m3) d'acroléine pendant 62 jours, avec période de rétablissement de 1 semaine | À la concentration élevée, mortalité en moins de 11 jours de tous les rats DS due à une nécrose sévère de l'épithélium des voies respiratoires, avec œdème et hémorragie; mortalité de 4 rats DR sur 10 en moins de 62 jours; perte de poids et développement de lésions prolifératives dans les poumons chez les survivants Aux concentrations moyenne et faible, légère hyperplasie de l'épithélium bronchique et métaplasie squameuse ainsi qu'inflammation aiguë du cornet nasal chez les deux souches |
DMENO = 0,9 mg/m3 (lésions prolifératives dans les voies respiratoires et inflammation nasale à la plus faible concentration) Plus grande sensibilité de la souche DS aux concentrations élevées |
| Le Bouffant et al. (1980) | Rats femelles SD, 20 par groupe | 1 heure par jour, 5 jours par semaine (corps entier) à 8 ppm (18,4 mg/m3) d'acroléine pendant 10 ou 18 mois | Aucune tumeur ni aucun changement de poids corporel | Aucune (l'étude concernait surtout l'inhalation de fumée de cigarette) |
| Lyon et al. (1970) | Rats mâles et femelles SD (15 par groupe), cobayes mâles et femelles (15 par groupe), singes mâles (9 par groupe), chiens mâles (2 par groupe) | 8 heures par jour, 5 jours par semaine à 0,7 ou 3,7 ppm (1,6 ou 8,5 mg/m3) d'acroléine pendant 6 semaines De façon continue à 0,22, 1,0 ou 1,8 ppm (0,5, 2,3 ou 4,1 mg/m3) d'acroléine pendant 90 jours Aucun groupe témoin concomitant Aucune analyse histopathologique des voies nasales Résultats de nature descriptive, aucun classement des lésions |
Étude de 6 semaines : À 0,7 ppm, inflammation chronique (légère, focale à diffuse, aucune modification de l'épithélium respiratoire) et emphysème occasionnel (modéré et irrégulier) chez toutes les espèces, mais plus prononcés chez le chien et le singe; importantes modifications morphologiques au niveau de la trachée (métaplasie squameuse et hyperplasie cellulaire basale) chez le chien et le singe; nécrose et métaplasie squameuse des bronches, et réparation et régénération de l'épithélium bronchique chez le singe; mortalité de 2 singes (aux jours 6 et 9), mais cause à déterminer Étude de 90 jours : À 0,22 ppm, emphysème modéré, congestion pulmonaire aiguë, vacuolisation focale dans les cellules épithéliales bronchiolaires et une certaine constriction des bronchioles chez le chien; modifications inflammatoires non spécifiques au niveau des poumons chez le singe, le cobaye et le chien, et modifications histopathologiques non spécifiques chez le rat (les poumons et la trachée, mais pas la cavité nasale, de seulement la moitié des rats ont été examinés) À 1 ppm, inflammation pulmonaire chez le cobaye, et bronchiolite et début de bronchopneumonie chez 1 chien À 1,8 ppm, métaplasie squameuse et hyperplasie cellulaire basale dans la trachée chez le singe, et bronchopneumonie chez le chien |
Aucune (aucun groupe témoin concomitant) Effets observés à 0,5 mg/m3 (la plus faible concentration) |
Annexe D : Autres lignes directrices
D1. Lignes directrices pour l'exposition de courte durée
Dans la Liste des substances d'intérêt prioritaire, rapport d'évaluation : acroléine publiée par Environnement Canada et Santé Canada, aucune ligne directrice n'a été établie pour l'exposition de courte durée à l'acroléine (Environnement Canada et Santé Canada, 2000).
La CalEPA (2008) a établi un niveau d'exposition de référence de 2,5 µg/m3 pour l'exposition aiguë (une heure). Ce niveau de référence repose sur la moyenne géométrique des concentrations causant une irritation oculaire chez l'homme provenant des deux études suivantes : une DMENO de 138 µg/m3 issue d'une étude menée auprès de 36 volontaires exposés (les yeux seulement) à l'acroléine pendant 5 minutes (Darley et al., 1960), et une DMENO de 210 µg/m3 issue d'une étude menée auprès de 53 volontaires exposés à des concentrations croissantes d'acroléine pendant 40 minutes (Weber-Tshopp et al., 1977). Un FI de 60, soit 6 pour l'utilisation d'une DMENO et 10 pour la variabilité intraspécifique, a ensuite été appliqué à cette valeur.
L'US EPA (2010) a établi une valeur limite AEGL-1 ( acute exposure guideline limit) de 70 µg/m3 pour des effets non invalidants et une durée d'exposition de 10 minutes à 8 heures, qui repose sur l'irritation oculaire à 210 µg/m3 chez l'homme après une exposition à des concentrations croissantes d'acroléine pendant 40 minutes (Weber-Tschopp et al., 1977). Un FI de 3 a ensuite été appliqué pour prendre en compte la variabilité intraspécifique.
Au cours de leurs évaluations de pesticides, l'US EPA (2008) et l'Agence de réglementation de la lutte antiparasitaire (2016) de Santé Canada ont établi un niveau préoccupant de 7 µg/m3 pour l'exposition de courte durée à partir d'une DMENO de 210 µg/m3 pour l'irritation oculaire et des FI de 10 pour la sensibilité intraspécifique et de 3 pour l'absence de DSENO, et d'une DMENO de 700 µg/m3 pour l'irritation nasale et oculaire et des FI de 10 pour la sensibilité intraspécifique et de 10 pour l'absence de DSENO.
L'Anses (2013) a établi une valeur guide court terme de 6,9 µg/m3 pour une durée d'exposition de 1 heure, qui repose sur une DMENO de 0,7 mg/m3 pour l'irritation des yeux, du nez et de la gorge chez des volontaires exposés à l'acroléine pendant 60 minutes (Weber-Tschopp et al., 1977). Un FI de 100 a ensuite été appliqué, soit 10 pour l'utilisation d'une DMENO et 10 pour la variabilité intraspécifique.
L'ATSDR (2007) a établi un MRL (minimal risk level) de 3 ppb (6,9 µg/m3) pour l'exposition aiguë (14 jours maximum), qui repose sur une DMENO de 0,3 ppm (0,7 mg/m3) pour l'irritation des yeux, du nez et de la gorge et une diminution de la fréquence respiratoire chez 46 volontaires exposés à l'acroléine pendant 60 minutes (Weber-Tschopp et al., 1977). Un FI de 100 a ensuite été appliqué, soit 10 pour l'utilisation d'une DMENO et 10 pour la variabilité intraspécifique.
| Organisation | Limite d'exposition | Effet sur la santé |
|---|---|---|
| California EPA (2008) | 2,5 µg/m3 (1 h) | Irritation oculaire |
| US EPA (2010) | 70 µg/m3 (10 min à 8 h) | Irritation oculaire |
| US EPA (2008), Santé Canada (2016) | 7 µg/m3 | Irritation des yeux, du nez et de la gorge |
| Anses (2013) | 6,9 µg/m3 (1 h) | Irritation des yeux, du nez et de la gorge |
| ATSDR (2007) | 6,9 µg/m3 (3 ppb) (1 à 14 jours) | Irritation des yeux, du nez et de la gorge et respiratoire |
D2. Lignes directrices pour l'exposition chronique produisant des effets non néoplasiques
Des évaluations antérieures ont établi des limites d'exposition relatives à l'exposition chronique ou de longue durée à l'acroléine reposant sur les lésions de l'épithélium respiratoire nasal chez le rat.
Le gouvernement du Canada (Santé Canada et Environnement Canada, 2000) a établi une concentration tolérable de 0,4 µg/m3, reposant sur une CR05 de 0,14 mg/m3 issue d'une étude de 3 jours (Cassee, Groten et Feron, 1996) qui a été ajustée à une exposition continue (6 heures/24 heures). Un FI de 100 a ensuite été appliqué, soit 10 pour l'extrapolation interspécifique et 10 pour les populations humaines sensibles.
L'US EPA (2003) a établi une CRf de 0,2 µg/m3 pour l'exposition par inhalation, qui repose sur une DMENO de 0,9 mg/m3 tirée d'une étude de 13 semaines chez le rat (Feron et al., 1978). Cette DMENO a été ajustée à une exposition continue (6 heures/14 heures et 5 jours/7 jours), et une concentration équivalente chez l'homme (CEH) a été calculée à l'aide d'un rapport de dépôt de 0,13 (CEH = 0,02 mg/m3). Ce rapport tient compte des différences pharmacocinétiques et non pharmacodynamiques entre l'animal et l'homme. Un FI de 1000 a ensuite été appliqué, soit 3 pour tenir compte des différences pharmacocinétiques entre les espèces, 10 pour les populations humaines sensibles, 10 pour l'utilisation d'une étude subchronique et 3 pour l'utilisation d'une DMENO.
La CalEPA (2008) a établi un niveau d'exposition de référence de 0,35 µg/m3 pour l'exposition chronique, qui repose sur une DSENO de 0,46 mg/m3 tirée d'une étude de 13 semaines (Dorman et al., 2008). Cette DSENO a été ajustée à une exposition continue (6 heures/14 heures et 5 jours/7 jours), et une CEH a été calculée à l'aide d'un DAF de 0,85 reposant sur un modèle développé pour un analogue, le formaldéhyde (CEH = 0,07 mg/m3). Un FI de 200 a ensuite été appliqué, soit 2 pour la pharmacocinétique (utilisation du DAF d'un analogue), 3 pour la pharmacodynamique, 10 pour les populations humaines sensibles et 3 pour l'utilisation d'une étude subchronique.
L'Anses (2013) s'est également servie de la DSENO de 0,46 mg/m3 établie par Dorman et al (2008) pour construire une valeur guide long terme de 0,8 µg/m3. Aucun ajustement n'a été apporté pour la durée, et une CEH a été calculée à l'aide d'un rapport de dépôt de 0,13 (CEH = 60 µg/m3). Ce rapport tient compte des différences pharmacocinétiques et non pharmacodynamiques entre l'animal et l'homme. Un FI de 75 a ensuite été appliqué, soit 2,5 pour les différences pharmacocinétiques, 10 pour les populations humaines sensibles et 3 pour l'utilisation d'une étude subchronique.
| Organisation | Limite d'exposition | Effet sur la santé |
|---|---|---|
| Santé Canada et Environnement Canada (2000) | 0,4 µg/m3 | Lésions de l'épithélium respiratoire nasal |
| US EPA (2003) | 0,2 µg/m3 | Lésions de l'épithélium respiratoire nasal |
| California EPA (2008) | 0,35 µg/m3 | Lésions de l'épithélium respiratoire nasal |
| Anses (2013) | 0,8 µg/m3 | Lésions de l'épithélium respiratoire nasal |