Archivée Le manganèse dans l'eau potable
Document de consultation publique
Préparé par le Comité fédéral-provincial-territorial sur l'eau potable
La période de consultation se termine le 5 août 2016
Table des matières
- But de la consultation
- Partie I. Vue d'ensemble et application
- Partie II. Science et considérations techniques
- 4.0 Propriétés, utilisation et sources dans l’environnement
- 5.0 Exposition
- 6.0 Méthodes d'analyse
- 7.0 Considérations relatives aux techniques de traitement et aux réseaux de distribution
- 7.1 Chimie et traitement du manganèse
- 7.2 Traitement dans les installations municipales
- 7.3 Réseau de distribution
- 7.4 Traitement dans les systèmes résidentiels
- 8.0 Cinétique et métabolisme
- 9.0 Effets sur la santé humaine
- 10.0 Effets sur la santé chez les animaux de laboratoire
- 11.0 Mode d’action
- 12.0 Classement et évaluation
- 13.0 Justification
- 14.0 Références
- Annexe A : Liste des acronymes
- Annexe B : Répercussions prévues par province et territoire

Télécharger le rapport complet
(Format PDF, 1 016 Mo, 127 pages)
Sujets connexes
But de la consultation
Le Comité fédéral-provincial-territorial sur l’eau potable (CEP) a évalué l’information disponible sur le manganèse dans le but de mettre à jour la recommandation pour la qualité de l’eau potable actuelle et le document technique concernant le manganèse dans l’eau potable. La consultation vise à solliciter des commentaires sur la recommandation proposée, la démarche suivie pour l’élaborer et les coûts possibles de sa mise en œuvre, ainsi que pour déterminer la disponibilité d’autres données d’exposition.
La recommandation actuelle pour le manganèse, dont la dernière version remonte à 1987, établissait un objectif d’ordre esthétique (OE) de 0,05 mg/L (50 µg/L) en fonction des limites du traitement, ainsi que du goût et des taches sur la lessive et les appareils de plomberie. Le présent document augmenté et mis à jour propose une concentration maximale acceptable (CMA) et un objectif d’ordre esthétiques pour le manganèse total dans l’eau potable. La CMA proposée de 0,1 mg/L (100 µg/L) est fondée sur les effets neurologiques observés chez les rongeurs. Des études épidémiologiques ont observé des effets similaires chez les enfants. Quant à l’OE proposé, qui est de 0,02 mg/L (20 µg/L), il réduirait au minimum le nombre de plaintes liées à la couleur de l’eau et augmenterait la confiance des consommateurs à l’égard de la qualité de l’eau potable. Le document fournit des données et des renseignements à jour sur l’exposition au manganèse au Canada, et sur les méthodes d’analyse et les technologies de traitement existantes aux échelles municipale et résidentielle.
Le CEP a demandé que le document soit rendu public aux fins de consultation. Les commentaires, avec justification pertinente le cas échéant, sont les bienvenus. Ils peuvent être envoyés au Secrétariat du CEP par courrier électronique (water_eau@hc-sc.gc.ca) ou au besoin par la poste au Secrétariat du CEP, Bureau de la qualité de l’eau et de l’air, Santé Canada, 3e étage, 269, avenue Laurier Ouest, localisateur d’adresse 4903D, Ottawa (Ontario) K1A 0K9. Les commentaires doivent nous parvenir avant le 5 août 2016.
Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l’affiliation de leurs auteurs, aux membres concernés du CEP. Les personnes qui ne veulent pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent fournir une déclaration à cet effet avec leurs commentaires.
Il est à noter que le présent document technique sur le manganèse dans l’eau potable sera révisé après l’analyse des commentaires reçus et qu’une recommandation pour l’eau potable sera établie s’il y a lieu. Ce document devrait donc être considéré strictement comme une ébauche pour commentaires.
Partie I. Vue d’ensemble et application
1.0 Recommandation proposée
Une concentration maximale acceptable (CMA) de 0,1 mg/L (100 µg/L) est proposée pour le manganèse total dans l’eau potable. Un objectif d’ordre esthétique (OE) de 0,02 mg/L (20 µg/L) est aussi proposé pour le manganèse total dans l’eau potable.
2.0 Sommaire
Le manganèse est présent naturellement dans l’environnement et il est très répandu dans l’air, l’eau et le sol. On ne le retrouve pas sous sa forme élémentaire dans l’environnement, mais il peut exister sous plusieurs états d’oxydation. Dans l’environnement, la présence de manganèse dans l’eau peut être de source naturelle (météorisation du sol et des roches) ou anthropique (exploitation minière, rejets industriels, lixiviation à partir de sites d’enfouissement, etc.). Le manganèse est utilisé dans diverses industries, notamment dans l’industrie de l’acier, et pour la fabrication de différents produits (par exemple les feux d’artifice, les piles sèches, les fertilisants, les fongicides, les cosmétiques et la peinture). Sous forme de permanganate, il est également utilisé comme agent oxydant pour le traitement de l’eau potable.
Ce document technique passe en revue et évalue tous les risques connus pour la santé qui sont associés à la présence de manganèse dans l’eau potable. Il tient compte des nouvelles études et approches, ainsi que de la disponibilité de techniques de traitement appropriées. D’après cet examen, la recommandation proposée pour le manganèse dans l’eau potable est une CMA de 0,1 mg/L (100 μg/L), calculée en fonction des nourrissons, qui constituent la population la plus sensible.
À sa réunion de l’automne 2015, le Comité fédéral-provincial-territorial sur l’eau potable a examiné le présent document technique sur le manganèse et en a autorisé la diffusion à des fins de consultation publique.
2.1 Effets sur la santé
Le manganèse est un élément essentiel pour les humains. Le risque de carence en manganèse est jugé faible au Canada, parce qu’il est présent en quantité suffisante dans les aliments. Puisque les études dont on dispose ne permettent pas d’établir un lien entre le manganèse et le cancer, un effet autre que le cancer a été retenu pour cette évaluation. Des études menées chez l’humain semblent établir un lien entre le manganèse présent dans l’eau potable et certains effets neurologiques chez les enfants. Toutefois, ces études ne peuvent être utilisées que pour appuyer le choix du principal effet sur la santé. Les effets observés chez les enfants concordent avec les effets neurologiques constatés dans les études clés sur les animaux qui ont servi à établir la CMA proposée.
2.2 Considérations d’ordre esthétique
Les préoccupations relatives à la présence de manganèse dans l’eau potable sont souvent liées à des plaintes de consommateurs au sujet de la couleur de l’eau. L’OE proposé, soit 0,02 mg/L (20 µg/L), réduirait au minimum le nombre de plaintes liées à la couleur de l’eau et permettrait d’accroître la confiance des consommateurs à l’égard de qualité de l’eau potable.
2.3 Exposition
Le manganèse est présent naturellement et très répendu dans l’environnement. Les Canadiens peuvent être exposés au manganèse par sa présence dans l’air, les aliments, les produits de consommation, le sol et l’eau potable. Bien que les aliments constituent la principale source d’exposition au manganèse, ce dernier est plus facilement absorbé de l’eau potable que lorsqu’il est consommé avec des aliments. Au Canada, les concentrations de manganèse dans l’eau douce sont généralement inférieures à 0.1 mg/L, et atteignent parfois des pics de quelques milligrammes par litre. Les eaux souterraines acides ou affectées par des décharges industrielles peuvent contenir des taux plus élevés. En général, on retrouve davantage de manganèse dans les eaux souterraines que dans les eaux de surface. L’absorption par contact cutané ou par inhalation du manganèse présent dans l’eau potable est jugée improbable.
2.4 Analyse et traitement
Il existe plusieurs méthodes d’analyse qui permettent de mesurer le manganèse total dans l’eau potable à des concentrations bien inférieures à la CMA et à l’OE proposés. Le manganèse total comprend les formes particulaires et dissoutes de manganèse présentes dans un échantillon d’eau. Par conséquent, si les deux formes sont mesurées séparément, les deux concentrations doivent être additionnées avant d’être comparées à la CMA et à l’OE.
On dispose de différentes méthodes pour ramener le taux de manganèse dans l’eau potable en deçà de la CMA proposée. Le choix de la méthode qui convient le mieux dépend de la forme de manganèse présente dans la source d’eau. Des faibles niveaux de manganèse dans l’eau brute ou l’eau traitée peuvent s’accumuler dans le réseau de distribution et causer périodiquement des taux élevés de manganèse dans l’eau du robinet. L’accumulation d’oxydes de manganèse dans le réseau de distribution peut également entraîner la libération d’autres contaminants dans l’eau qui y circule. Les usines de traitement de l’eau bien exploitées et optimizées peuvent atteindre un taux de manganèse de 0,015 mg/L ou moins dans l’eau traitée, réduisant ainsi au minimum l’accumulation de manganèse et le rejet potentiel de manganèse et d’autres contaminants dans l’eau distribuée. Cela permettrait d’éviter la présence de manganèse dans l’eau du robinet des consommateurs à des niveaux dépassant l’OE, et de réduire à la fois le nombre de plaintes liées à la couleur de l’eau et la possibilité que des concentrations plus élevées de manganèse (qui pourraient excéder la CMA proposée) se retrouvent dans l’eau du robinet.
Plusieurs techniques de traitement peuvent permettre d’éliminer efficacement le manganèse à l’échelle résidentielle. Cependant, il n’existe à l’heure actuelle aucun dispositif de traitement certifié pour cet usage précis.
3.0 Application de la recommandation
Remarque : des conseils spécifiques concernant l’application des recommandations pour l’eau potable devraient être obtenus auprès de l’autorité appropriée en matière d’eau potable dans le secteur de compétence concerné.
3.1 Surveillance
3.1.1 Caractérisation de l’eau à la source
Il faut caractériser les sources d’eau afin de déterminer si elles contiennent du manganèse. Pour cette analyse, des échantillons devraient être prélevés pendant les périodes où le taux de manganèse est le plus susceptible d’être élevé dans les eaux de surface, par exemple lors de la stratification thermique en été et du renouvellement de l’eau des lacs à l’automne. Bien qu’il soit moins probable que la concentration de manganèse dans les eaux souterraines varie d’une saison à l’autre, des variations importantes ont été observées entre des puits situés à proximité les uns des autres. Par conséquent, tous les puits d’un champ de captage doivent être caractérisés. La surveillance des eaux de surface devrait être effectuée tous les trois mois, ainsi que chaque semaine pendant l’été et l’automne dans les lacs et les réservoirs qui subissent une stratification et/ou des variations importantes de la concentration en manganèse. Les sources d’eau souterraine doivent faire l’objet d’une surveillance semestrielle. Les autorités peuvent envisager de réduire l’échantillonnage lorsqu’il a été démontré que la concentration de manganèse dans l’eau d’une source est inférieure à 0,02 mg/L, ou que des mesures de traitement appropriées sont en place.
3.1.2 Usine de traitement
Les services publics qui traitent l’eau pour en éliminer le manganèse devraient effectuer des vérifications fréquentes de l’eau brute et de l’eau traitée, afin d’ajuster les procédés au besoin et de s’assurer que les procédés de traitement utilisés permettent de maintenir les concentrations de manganèse en deçà de la CMA et de l’OE. La fréquence de surveillance de l’eau traitée dépendra des données historiques sur les fluctuations du manganèse dans l’eau brute et des procédés de traitement en place. Par exemple, les usines de traitement de l’eau où les concentrations de manganèse varient et où l’oxydation et la filtration sont utilisées pour traiter l’eau peuvent exiger une surveillance quotidienne. Si les services publics ont de la difficulté à contrôler les concentrations de manganèse dans l’eau traitée, il peut être nécessaire d’effectuer une surveillance à chaque étape clé du traitement à l’usine. Une partie des échantillons prélevés doit faire l’objet d’une filtration qui permettra d’en déterminer le contenu en manganèse particulaire et dissous. Cette étape est importante pour déterminer le type de traitement requis et pour évaluer le rendement de l’usine de traitement. Les services publics qui ont de la difficulté à contrôler le manganèse dans l’eau traitée et qui oxydent directement le manganèse avec du permanganate de potassium, du dioxyde de chlore ou de l’ozone, peuvent également envisager de quantifier la fraction colloïdale du manganèse d’échantillons recueillis dans la chaîne de traitement. Dans de nombreux cas, la surveillance des procédés d’une usine de traitement peut se faire par colorimétrie afin de réduire les coûts d’analyse.
3.1.3 Réseau de distribution
Puisque le manganèse peut s’accumuler et être libéré dans les réseaux de distribution, une surveillance de l’eau dans le système de distribution et l’eau du robinet des consommateurs devrait être effectuée si du manganèse est présent ou a déjà été présent dans la source d’eau. Cette procédure permet de s’assurer que les opérations et l’entretien effectués suffisent à maintenir les concentrations de manganèse dans le système de distribution sous l’OE. La libération de manganèse étant généralement sporadique, il est difficile d’établir un programme de surveillance régulier qui puisse permettre de détecter efficacement la présence, dans l’eau du robinet, de rejets de manganèse dans le système de distribution. Toutefois, les facteurs de risques associés à l’accumulation et à la libération de manganèse dans le réseau de distribution peuvent servir d’indicateurs pour déterminer à quel moment (selon les occurrences) et à quel endroit surveiller les rejets de manganèse. Une surveillance fondée sur les événements peut être requise lorsque les risques de libération sont accrus, notamment après toute perturbation hydraulique du système (p. ex., bris de canalisation ou purge des bornes d’incendie) ou tout changement dans les propriétés chimiques de l’eau (p. ex., changement de pH, de température ou de type de source d’eau, mélange de l’eau non contrôlé, concentration résiduelle de chlore ou mélange non contrôlé de désinfectant). Le prélèvement d’échantillons dans le système de distribution devrait idéalement être effectué aux endroits comportant d’importants facteurs de risque favorisant l’accumulation de manganèse (p. ex., proximité de l’usine de traitement, matériaux de tuyauterie, biofilm) et le rejet découlant d’un événement. Une surveillance devrait également être effectuée en cas de changement de couleur de l’eau, bien que l’absence d’un tel changement ne signifie pas nécessairement qu’il n’y a pas de libération de manganèse. La surveillance du manganèse doit être effectuée conjointement avec celle d’autres métaux susceptibles d’apparaître simultanément dans le réseau de distribution, et dont le relargage a déjà été observé concomitamment à celui du manganèse (p. ex., fer, arsenic, plomb). Les services publics qui ont mis en place des mesures préventives, qui possèdent des données de base démontrant l’absence de manganèse dans le réseau de distribution, et dont la qualité de l’eau et les conditions hydrauliques et physiques sont stables peuvent effectuer une surveillance moins fréquente.
3.1.4 Conformité
La surveillance du manganèse devrait être effectuée principalement au robinet chez les consommateurs, et une partie des échantillons prélevés à des endroits situés à proximité de l’usine de traitement. Il est recommandé d’effectuer une surveillance au minimum tous les trois mois. On devrait également procéder à une surveillance fondée sur les événements pendant les périodes où le risque de libération de manganèse est accru, ou lorsqu’une coloration de l’eau est signalée.
3.1.5 Surveillance résidentielle
Les particuliers qui possèdent un puits privé sont encouragés à faire analyser leur eau chaque année pour s’assurer que la concentration de manganèse y est inférieure à la CMA. Ceux qui utilisent un dispositif de traitement au point d’entrée ou au point d’utilisation devraient en outre analyser l’eau qui entre dans le dispositif de traitement ainsi que de l’eau traitée, pour s’assurer de l’efficacité de l’appareil.
Partie II. Science et considérations techniques
4.0 Propriétés, utilisation et sources dans l’environnement
Le manganèse (numéro du CAS 7439-96-5) est un métal de transition du groupe VIIB qui coexiste souvent naturellement avec le fer dans les dépôts géologiques et les sols, et qui est corrodé par les conditions atmosphériques. Le point d’ébullition du manganèse est de 1 962 °C et son point de fusion de 1 244 °C. Sa pression de vapeur est de 1 mm Hg à 1 292 °C (U.S. EPA, 2004; ATSDR, 2012). Le manganèse existe sous des formes organiques et inorganiques qui présentent des caractéristiques physico-chimiques différentes. Le manganèse est un élément essentiel pour un grand nombre d’organismes, y compris les humains, et il est présent dans de nombreux aliments (IOM, 2001).
Le manganèse est présent à l’état naturel dans l’environnement (il est largement répandu dans l’air, l’eau et le sol), et il forme 0,1 % de la croûte terrestre. On ne le retrouve toutefois pas sous sa forme élémentaire (Barceloux, 1999; Kohl et Medlar, 2006; OMS, 2011). La concentration de manganèse dans les différents milieux varie beaucoup selon les conditions de l’environnement et la proximité de sources anthropiques telles que des installations industrielles de ferro-alliage (U.S. EPA, 2004). Le manganèse peut présenter différents états d’oxydation (les plus courants étant +2, +4, et +7) et il peut former une grande variété de complexes en se combinant avec d’autres éléments tels que l’oxygène, le soufre et le chlore, ainsi qu’avec des carbonates et des silicates (Stokes et coll., 1988; ATSDR, 2012). Les minéraux que l’on retrouve le plus abondamment dans le sol sont la pyrolusite (dioxyde de manganèse), la rhodochrosite (carbonate de manganèse [MnCO3] et la rhodonite [silicate de manganèse]) (Stokes et coll., 1988; PISSC, 1999; Kohl et Medlar, 2006). L’oxyde de Mn(IV) est la forme la plus abondante retrouvée dans les minerais de manganèse (Kohl et Medlar, 2006). Seulement une douzaine des quelque 300 minéraux contenant du manganèse sont considérés comme des gisements de minerai suffisamment importants pour appuyer l’extraction minière du manganèse (International Manganese Institute, 2014).
Des études portant sur les seuils relatifs au goût et à l’aspect du manganèse dans l’eau potable ont été menées (Cohen et coll., 1960; Sain et coll., 2014). Sain et coll. (2014) ont examiné les seuils d’apparence et de goût pour le Mn(II) dissous et le Mn(IV) particulaire, en effectuant des tests un sur cinq, un sur trois et triangulaires avec des concentrations variant entre 0,005 et 506 mg/L. Selon les résultats, la meilleure estimation du seuil relatif au goût, chez la population, est de 101 mg/L pour le Mn(II) provenant du sulfate de manganèse, bien que ce résultat dépende sans doute à la fois du sulfate et du Mn(II). La régression logistique des données a indiqué que le seuil de goût du Mn(II) était de 75,4 mg/L pour 50 % de la population. Bien que les tests associés au seuil de goût du Mn(IV) étaient été limités par la coloration de l’eau, les résultats ont révélé qu’une eau contenant 0,05 mg/L de Mn(IV) ne pouvait être distinguée de l’eau distillée. Les études sur le seuil relatif à l’aspect ont quant à elles révélé que le Mn(II) était incolore et qu’il ne pouvait être détecté à l’œil nu à des concentrations aussi élevées que 506 mg/L. En revanche, le Mn(IV) particulaire a été détecté visuellement par 100 % des participants à une concentration de 0,005 mg/L. Les auteurs ont conclu qu’une concentration de manganèse de 0,01 à 0,02 mg/L est une limite acceptable pour protéger contre la coloration de l’eau. Cette conclusion est appuyée par de nombreuses études menées sur les systèmes d’approvisionnement en eau potable, selon lesquelles les consommateurs se plaignent d’une coloration de l’eau et/ou de taches sur la lessive lorsque la concentration de manganèse est supérieure à 0,02 mg/L (Sly et coll., 1990; Casale et coll., 2002; Kohl et Medlar, 2006). À la lumière de ces renseignements, il a été suggéré d’abaisser à 0,02 mg/L la limite de 0,05 mg/L indiquée dans les recommandations pour la qualité de l’eau potable, afin de réduire le nombre de plaintes relatives à la couleur de l’eau et d’accroître la confiance des consommateurs à l’égard de la qualité de l’eau potable (Dietrich et Burlingame, 2015).
La présence de manganèse dans les eaux souterraines et de surface peut être de source naturelle (météorisation du sol et des roches) ou anthropique (déversements industriels, activités minières et lixiviation à partir de sites d’enfouissement) (Stokes et coll., 1988; Kohl et Medlar, 2006; Ljung et Vahter, 2007). Les propriétés physico-chimiques du milieu environnant (p. ex., teneur en carbone organique, capacité d’échange cationique, pH, Eh, teneur en particules et en minéraux) ont une incidence sur la spéciation et la solubilité dans l’eau du manganèse, qui ont à leur tour un effet sur la concentration dans les eaux souterraines et les eaux de surface (Stokes et coll., 1988; Kohl et Medlar, 2006). Dans les eaux de surface, on retrouve le manganèse sous forme particulaire, colloïdale, organique et dissoute. La plupart des sels de manganèse organiques sont, dans une certaine mesure, solubles dans l’eau. Le carbonate de manganèse est moins soluble (0,065 g/L) que le sel haloïde, mais il constitue la majeure partie du manganèse dissous présent dans l’eau (PISSC, 1999; Luo et Millero, 2003). Parmi les autres formes solubles, citons le chlorure de manganèse (MnCl2), le permanganate de potassium (KMnO4) et le sulfate de manganèse (MnSO4), qui ont une solubilité de 72,3 g/L, 6,38 g/L et 52 g/L respectivement (CRC, 1983). Dans l’eau, les états d’oxydation les plus courants sont le Mn(II), le Mn(IV) et le Mn(VII) (Stokes et coll., 1988; ATSDR, 2012; Rumsby et coll., 2014). Le Mn(III), le Mn(V) et le Mn(VI) ne sont pas stables dans les solutions neutres. Les milieux acides et très réducteurs, ainsi que la présence de nitrates, de sulfates et de chlorures, favorisent la réduction des composés minéraux de Mn(III) et de Mn(IV) en Mn(II), une forme plus stable et plus soluble, de même que la formation de sulfate de manganèse et de chlorure de manganèse (Stokes et coll., 1988; OMS, 2004; Kohl et Medlar, 2006; ATSDR, 2012). Dans des conditions alcalines (pH > 8 à 9) et d’oxydation (en présence de chlore, d’ozone, etc.), le Mn(II) sera converti en Mn(IV), et le manganèse précipitera et formera des minéraux insolubles de composés de Mn(IV) (OMS, 2004). Le Mn(IV) est donc insoluble, mais il peut se retrouver dans l’eau à l’état particulaire (Kohl et Medlar, 2006). Le cycle oxydation-réduction peut être réalisé de façon abiotique ou biotique (PISSC, 1999; OMS, 2004).
Dans le sol, le manganèse est surtout présent dans les roches métamorphiques et sédimentaires, et sa concentration varie (Stokes et coll., 1988). La forme des composés de manganèse dans le sol dépend surtout du pH et du potentiel réducteur du sol et de l’eau, mais la minéralogie du sol, l’activité microbienne oxydative et le contenu en matière organique sont aussi des facteurs importants (OMS, 2004, 2011). Par exemple, la formation de manganèse soluble est favorisée par des conditions de réduction et de pH acide, comme celles causées par les pluies acides ou la décomposition de matières organiques (Kohl et Medlar, 2006). La rétention du manganèse dans le sol résulte de la capacité d’échange cationique du sol, qui forme des oxydes et des hydroxydes de manganèse insoluble, et de l’adsorption aux oxydes et aux hydroxydes (OMS, 2004).
Les principales sources de manganèse particulaire dans l’atmosphère sont de nature industrielle : usines de production de fer et d’acier, centrales électriques, fours à cokerie et poussières produites par l’extraction minière. Les sources naturelles de manganèse, comme les éruptions volcaniques, les incendies de forêt, les embruns océaniques et l’érosion du sol, peuvent aussi faire augmenter les taux de manganèse dans l’atmosphère (Stokes et coll., 1988; PISSC, 1999; U.S. EPA, 2004). Les particules de manganèse rejetées dans l’atmosphère, notamment sous forme de dioxyde de manganèse (MnO2) et de tétraoxyde de manganèse (Mn3O4), sont de petite taille et peuvent être transportées sur de longues distances avant de se déposer sur le sol ou les eaux de surface.
Le manganèse est utilisé dans diverses industries en raison de ses propriétés de réduction-oxydation (Kohl et Medlar, 2006). Il est surtout employé en sidérurgie, principalement pour améliorer les propriétés mécaniques de l’acier inoxydable et des alliages d’aluminium et de ferromanganèse (Barceloux, 1999; U.S. EPA, 2004; ATSDR, 2012). Le dioxyde et le chlorure de manganèse sont utilisés par les industries pour les piles sèches, les feux d’artifice, l’essence, l’agriculture, le cuir et les tissus, et comme agent de contraste en imagerie par résonnance magnétique (PISSC, 1999; International Manganese Institute, 2014). Le sulfate de manganèse est employé dans les fertilisants et dans certains fongicides. On l’utilise également dans les cosmétiques et les peintures en raison de ses propriétés colorantes. Les usines de traitement de l’eau potable utilisent l’ion permanganate (MnO4–) comme agent oxydant pour éliminer le fer et d’autres contaminants. En 2004, l’utilisation du méthylcyclopentadiényl manganèse tricarbonyle comme additif pour essence a diminué radicalement au Canada à la suite de mesures volontaires prises par les raffineries de pétrole du pays (Walsh, 2007).
5.0 Exposition
Les Canadiens peuvent être exposés au manganèse par l’air, les aliments, les produits de consommation, le sol et l’eau potable. Toutefois, la principale source d’exposition au manganèse demeure l’alimentation (Barceloux, 1999). Le manganèse est un élément essentiel car il agit comme cofacteur pour les enzymes participant aux mécanismes de défense antioxydants, à la croissance et au métabolisme. À ce titre, il fait l’objet d’un apport quotidien recommandé fixé par les organismes internationaux pertinents (PISSC, 1999; IOM, 2001). Il est reconnu, dans diverses publications et évaluations des risques, que la biodisponibilité du manganèse dans l’eau potable (prise à jeun) est plus élevée que dans les aliments (Ruoff et coll., 1995; IRIS, 2002; U.S. EPA, 2004; Bouchard et coll., 2011).
5.1 Eau
La concentration de manganèse dans l’eau douce se situe habituellement entre 1 et 200 μg/L, sous forme de Mn(II) dissous ou sous forme de particules d’oxyde, d’hydroxyde et de carbonate de manganèse. Les concentrations de manganèse peuvent être plus élevées dans les eaux souterraines ou de surface qui sont acides, qui présentent un faible potentiel d’oxydoréduction (Eh), ou qui sont touchées par des rejets industriels. C’est d’ailleurs ce qui ressort des données canadiennes, selon lesquelles l’eau potable contient en général moins de 100 μg/L de manganèse, sauf dans quelques cas où la concentration peut atteindre des milliers de microgrammes par litre. Les sources d’eau souterraine contiennent généralement plus de manganèse que les sources d’eau de surface, car les premières présentent davantage de conditions réductrices (OMS, 2011). L’Étude nationale sur l’eau potable a relevé la concentration de manganèse dans l’eau potable à divers endroits au Canada (Santé Canada, 2014a). Dans toutes les provinces et tous les territoires, des échantillons ont été recueillis à divers points d’alimentation en eau potable des réseaux de distribution pour en mesurer le manganèse dissous (n = 65). En 2009, 39 % des échantillons se sont révélés en deçà de la limite de détection (2 μg/L). En 2010, ce pourcentage a atteint 63,2 %. Les moyennes étaient de 16,1 μg/L en 2009 et de 10,8 μg/L en 2010. 75 % des résultats étaient inférieurs à 11 μg/L en 2009, et inférieurs à 8 μg/L en 2010. Seulement deux lectures ont dépassé 100 μg/L les deux années (la valeur maximale observée étant de 440 μg/L en 2009 et de 160,0 μg/L en 2010).
En Colombie-Britannique, le ministère de l’Environnement a indiqué qu’une surveillance du manganèse avait été effectuée à divers endroits, autant dans les eaux souterraines que dans les eaux de surface, entre 1991 et 2014 (British Columbia Ministry of Health, 2014). La concentration en manganèse total (extraction chimique) était égale ou inférieure à 5 μg/L dans 288 échantillons sur 3 593 (8 %), la moyenne était de 96,1 μg/L et la médiane de 8 μg/L. La concentration était supérieure à 200 μg/L dans 417 échantillons (12 %). La concentration en manganèse dissous était égale ou inférieure à 5 μg/L dans 4 échantillons sur 155 (3 %), la moyenne était de 311 μg/L et la médiane de 8 μg/L. La concentration était supérieure à 200 μg/L dans 20 échantillons (13 %), et supérieure à 10 000 μg/L dans 6 échantillons (4 %).
En Alberta, les concentrations de manganèse ont été mesurées entre 2003 et 2013 dans deux usines de traitement de l’eau recevant de l’eau des rivières Elbow et Bow à Calgary, et dans quatre de leurs réseaux de distribution (extrémités nord et sud de Calgary) (Alberta Environment, 2014). Dans l'eau brute non traitée (n = 2 810), aucun manganèse dissous ou total n’a été détecté dans 17 échantillons (moins de 1 %, limite de détection : 0,4 à 0,5 μg/L). La moyenne s’élevait à 8,7 μg/l, la médiane à 0,60 μg/L et le maximum à 434,3 μg/L. 31 échantillons affichaient une concentration supérieure à 50 μg/L (1 %). Dans l’eau traitée sortant des usines de traitement (n = 2 175), aucun manganèse dissous ou total n’a été détecté dans 1 578 échantillons (72 %, limite de détection : 0,4 à 0,5 μg/L). La moyenne était de 0,61 μg/L, la médiane de 0,5 μg/L et le maximum de 16,3 μg/L. Dans le réseau de distribution (n = 1 925), aucun manganèse dissous ou total n’a été détecté dans 1 169 échantillons (59 %). La moyenne était de 0,74 μg/L, la médiane de 0,5 μg/L et le maximum de 12,6 μg/L.
En Saskatchewan, des échantillons d’eau potable traitée ont été prélevés dans le réseau de distribution (95 % des échantillons) et dans des usines de traitement entre 2003 et 2014 (n = 2 239 dans 640 sites, limite de détection : 0,5 à 10 μg/L) (Saskatchewan Water Security Agency, 2014). Dans le réseau de distribution, une moyenne de 143 μg/L, une médiane de 10 μg/L et un maximum de 8 440 μg/L de manganèse dissous et total ont été relevés. Dans l’eau traitée, la moyenne était de 229 μg/L, la médiane de 10 μg/L et le maximum de 3 510 μg/L.
Au Manitoba, des échantillons d’eau brute (n = 1 648) et d’eau traitée (n = 1 586) ont été prélevés entre 2002 et 2012 (Conservation et Gestion des ressources hydriques Manitoba, 2015). Dans l’eau brute, la moyenne de manganèse total était de 201 μg/L, la médiane de 25 μg/L et le maximum de 9 870 μg/L. 70 % des concentrations mesurées étaient inférieures à 100 μg/L et 23 % étaient supérieures à 200 μg/L. Dans l’eau traitée, la moyenne était de 71 μg/L, la médiane de 8 μg/L et le maximum de 5 150 μg/L. 91 % des concentrations mesurées étaient inférieures à 100 μg/L et 6 % étaient supérieures à 200 μg/L. Les limites de détection n’étaient pas fournies.
En Ontario, la concentration de manganèse dans l’eau potable a été mesurée dans des échantillons recueillis entre 2009 et 2014 (Ontario Ministry of the Environment, 2014). L’eau provenant des réseaux de distribution (prélevée aux usines de traitement) affichait des concentrations de manganèse égales ou inférieures à 0,1 μg/L dans 153 échantillons sur 1 330 (limite de détection de 0,05 à 0,1). La moyenne était de 4,4 μg/L, la médiane de 1,5 μg/L et le maximum de 187 μg/L. Quatre résultats étaient supérieurs à 100 μg/L et aucun ne dépassait 200 μg/L. Dans l’eau traitée, les concentrations de manganèse (mesurées au robinet) étaient égales ou inférieures à 0,1 μg/L dans 222 échantillons sur 1 700, la moyenne était de 5,8 μg/L, la médiane de 1,2 μg/L et le maximum 442 μg/L. Douze résultats étaient supérieurs à 100 μg/L et deux étaient supérieurs à 200 μg/L. Dans l’eau brute, les concentrations de manganèse étaient égales ou inférieures à 0,1 μg/L dans 98 échantillons sur 2 105, la moyenne était de 23,5 μg/L, la médiane de 6,8 μg/L, et le maximum de 838 μg/L. 109 résultats étaient supérieurs à 100 μg/L, et 51 étaient supérieurs à 200 μg/L.
Au Québec, la concentration en manganèse d’échantillons d’eau prélevés dans des usines de traitement et le réseau de distribution ayant des sources souterraines a été mesurée entre 2010 et 2014 (ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques, 2014). Dans l’eau brute (n = 283), la concentration moyenne était de 86,6 μg/L, la médiane de 4,3 μg/L, et le maximum des 4 100 μg/L (limite de détection : 0,2 μg/L). 36 échantillons (13 %) présentaient une concentration égale ou supérieure à 200 μg/L. La concentration moyenne de manganèse dans l’eau traitée (n = 126) était de 35,4 μg/L, la médiane de 2,9 μg/L, et le maximum de 470,0 μg/L. 22 résultats (17 %) étaient supérieurs à 50 μg/L et 7 étaient supérieurs à 200 μg/L. La seule concentration de manganèse mesurée dans le réseau de distribution était de 68 μg/L. Une étude menée dans le sud-ouest du Québec a révélé des concentrations de 0,5 à 71,1 μg/L (moyenne de 4,11 μg/L) dans des sources municipales (n = 262) (Baldwin et coll., 1999). Dans les puits, les concentrations mesurées étaient de 0,2 à 158,9 μg/L (n = 16; moyenne de 2,78 μg/L).
Au Nouveau-Brunswick, les niveaux de manganèse dans l’eau potable ont été mesurés dans des systèmes d’approvisionnement d’eau de la Couronne (de puits d’eau souterraine) et municipaux (eaux souterraines et de surface) (ministère de la Santé du Nouveau-Brunswick, 2014). Dans l’eau potable provenant des syst’emes sur les terres de la Couronne, la concentration en manganèse était égale ou inférieure à 5 μg/L dans 957 échantillons sur 1 817 (53 %), et 310 échantillons avaient une concentration en manganèse supérieure à 200 μg/L (17 %). La moyenne était de 88 μg/L, la médiane de 5 μg/L et le maximum de 4 000 μg/L. Dans le réseau de distribution municipal, la concentration de manganèse était égale ou inférieure à 5 μg/L dans 1 186 échantillons sur 2 115 (56 %), et 139 échantillons (7 %) avaient une concentration supérieure à 200 μg/L. La moyenne était de 75 μg/L, la médiane de 5 μg/L, et le maximum de 2 560 μg/L. Dans les systèmes alimentés par des sources souterraines, 563 échantillons sur 2 081 affichaient une concentration en manganèse égale ou inférieure à 5 μg/L (27 %), et 694 (33 %) une concentration supérieure à 200 μg/L. La moyenne était de 306 μg/L, la médiane de 53 μg/L, et le maximum de 4 400 μg/L. Dans le cas de réseaux alimentés par des sources d’eau de surface, 154 échantillons sur 490 (31 %) avaient une concentration en manganèse égale ou inférieure à 5 μg/L, et 60 (12 %) avaient une concentration supérieure à 200 μg/L. La moyenne était de 172 μg/L, la médiane de 28 μg/L, et le maximum de 3 130 μg/L. Des renseignements sur la teneur en manganèse d’échantillons d’eau géoréférencés prélevés dans des puits privés (n = 10 571) ont également été publiés dans l’Atlas de la composition chimique de l’eau souterraine au Nouveau-Brunswick 1994-2007 (Ministre de l’Environnement et des Gouvernements locaux du Nouveau-Brunswick, 2008). Parmi les échantillons, analysés, 7 811 échantillons affichaient une concentration supérieure à 5 μg/L (74 %) et 4 207 échantillons une concentration supérieure à 50 μg/L (40 %). La valeur maximale observée était de 33 600 μg/L. L’usine de traitement de Sackville a déclaré une concentration habituelle de manganèse total de 1 500 à 2 500 μg/L dans l’eau brute, et inférieure à 50 μg/L dans l’eau traite sortant de l’usine de traitement.
À Terre-Neuve-et-Labrador, la concentration en manganèse a été mesurée dans des échantillons d’eau potable recueillis entre 2011 et 2014 (Newfoundland and Labrador Department of Environment and Conservation, 2014). Toutes les valeurs obtenues se situaient au-dessus de la limite de détection (10 μg/L). L’eau du robinet (n = 253) affichait une concentration moyenne de 170,9 μg/L, une concentration médiane de 120 μg/L et une concentration maximale de 980 μg/L. Dans l’eau de la source d’approvisionnement (n = 96), la concentration moyenne était de 224,6 μg/L, la concentration médiane de 115 μg/L et la concentration maximale de 2 400 μg/L.
Au Yukon, on a mesuré la concentration en manganèse dans des échantillons d’eau potable provenant de 21 sources d’eau souterraine en 2012, 2013 et 2014 (limite de détection : 1 à 50 μg/L) (Yukon Environmental Health Services, 2014). La concentration moyenne de manganèse dans l’eau brute (n = 33) et l’eau traitée (n = 13) étaient respectivement de 60,3 μg/L et 13,3 μg/L, et les valeurs médianes de 20 μg/L et 6 μg/L. Onze échantillons avaient une concentration supérieure à 100 μg/L (23,9 %, tous des échantillons d’eau brute), et la concentration maximale obtenue était de 209 μg/L.
5.2 Aliments
Les aliments constituent la principale source d’exposition au manganèse, la majeure partie de l’apport provenant des céréales, des noix et des légumes. Dans le cadre de l’Étude canadienne sur l’alimentation totale (ECAT), on a estimé la concentration moyenne de manganèse dans divers aliments (Santé Canada, 2009). De fortes concentrations de manganèse (supérieures à 1,0 μg/g) ont été observées dans les céréales (pain [3,5 à 19,1 μg/g], farine blanche [3,5 à 7,5 μg/g], riz [3,0 à 4,9 μg/g], céréales [1,0 à 25,9 μg/g], maïs à éclater [7,2 à 10,6 μg/g]), les noix (28,5 μg/g), le beurre d’arachide (13,1 à 16,8 μg/g), les abats (3,1 à 4,0 μg/g), certains fruits (bleuets [8,3 à 10,0 μg/g], ananas en boîte [12,0 à 20,4 μg/g], bananes [1,7 à 4,6 μg/g]), les légumes (0,8 à 3,0 μg/g pour les betteraves, le brocoli, le chou, le chou-fleur, les carottes, le céleri, la laitue, le maïs, les concombres, les oignons et les pommes de terre, et 3,0 à 7,5 μg/g pour les épinards), le thé (2,3 à 5,1 μg/g) et les herbes et épices (71,0 à 123,6 μg/g). Des concentrations intermédiaires (0,5 à 1,0 μg/g) de manganèse ont été relevées dans le fromage (0,05 à 1,0 μg/g), les poivrons (0,6 à 0,8 μg/g), les raisins (0,5 à 0,8 μg/g) et la saucisse (0,4 à 1,0 μg/g). De faibles concentrations (0,02 à 0,5 μg/g) de manganèse ont été relevées dans la viande (0,02 à 0,2 μg/g pour le boeuf, l’agneau, le poulet, le poisson et le veau), les champignons (0,4 à 0,6 μg/g), les pommes (0,2 à 0,3 μg/g), le café (0,2 à 0,3 μg/g), les oeufs (0,3 à 0,4 μg/g) et le lait (0,01 à 0,04 μg/g).
L’ECAT a également mesuré l’absorption de différents éléments par l’alimentation chez la population canadienne, selon l’âge et le sexe (Santé Canada, 2009). L’apport quotidien moyen de manganèse a été estimé pour les groupes d’âge suivants : 0 à 1 mois, 2 à 3 mois, 4 à 6 mois, 7 à 9 mois, 10 à 12 mois, 1 à 4 ans, 5 à 11 ans, 12 à 19 ans, 20 à 39 ans, 40 à 64 ans et 65 ans et plus. L’apport alimentaire quotidien moyen de manganèse, pour l’ensemble des groupes d’âge, a été estimé à 61,3 μg/kg poids corporel (p.c.) par jour entre 1993 et 1999 (Montréal), 59,0 μg/kg p.c. par jour en 2000 (Ottawa), 51 μg/kg p.c. par jour en 2001 (St. John’s), 56,0 μg/kg p.c. par jour en 2002 (Vancouver), 52 μg/kg p.c. par jour en 2003 (Montréal), 50 μg/kg p.c. par jour en 2004 (Winnipeg), 44 μg/kg p.c. par jour en 2005 (Toronto), 53 μg/kg p.c. par jour en 2006 (Halifax) et 54,0 μg/kg p.c. par jour en 2007 (Vancouver). Ces valeurs d’apport en manganèse appuient les estimations antérieures de 2 à 9 mg/jour pour les adultes (apport plus élevé chez les végétariens) (Schroeder et coll., 1966; Barceloux, 1999; IOM, 2001).
Les concentrations de manganèse dans le lait maternel ont été estimées à 3,7 μg/L (2,7 à 5,4 μg/L; n = 11 mères en santé) pendant le premier mois, les concentrations les plus élevées ayant été mesurées au jour 1 (Casey et coll., 1985). Ces concentrations diminuaient ensuite pour s’établir à 1,9 μg/L trois mois après la naissance (Casey et coll., 1985; IOM, 2001). En se fondant sur des données préliminaires, Santé Canada a estimé à 2,2 ng Mn/g la teneur médiane en manganèse du lait maternel d’après les mesures de l’ECAT (Santé Canada, 2014b). En utilisant cette estimation de la concentration médiane de manganèse et en supposant une consommation moyenne de 780 mL de lait maternel par jour, on peut estimer à 0,2 µg/L l’apport quotidien de manganèse des nourrissons de 0 à 6 mois par l’intermédiaire du lait maternel (Santé Canada, 2014b). L’OMS a estimé un apport quotidien de manganèse variant entre 2,6 et 11,1 μg/jour pour les nourrissons allaités (OMS, 2011).
Aux États-Unis, l’apport quotidien provenant des aliments a été estimé à 2,7 et 2,2 mg chez les hommes et les femmes, respectivement (NRC, 1989). Les apports ont été estimés à 1,1 mg/jour chez les nourrissons de 6 à 11 mois et à 1,5 mg/jour chez les enfants de 2 ans. Au Royaume-Uni, l’apport moyen par les adultes est estimée à 4,9 mg/jour, dont la moitié provient du thé (EVM, 2002).
En ce qui concerne le manganèse dans les préparations pour nourrissons, le Règlement sur les aliments et drogues du Canada prescrit un minimum de 5 μg de manganèse/100 kcal (3,33 μg/100 mL de préparation prête à l’emploi) (ministre de la Justice, 2014). Le règlement n’établit pas de quantité maximale de manganèse dans les préparations pour nourrissons. Le groupe d’experts du LSRO (Life Science Research Office) et le comité du Codex de l’OMS et de la FAO ont fixé un minimum de 1 μg manganèse/100 kcal et un maximum (concentration supérieure recommandée par l’OMS et la FAO) de 100 μg manganèse/100 kcal (67 μg/100 mL) pour la concentration de manganèse recommandée dans les préparations pour nourrissons (en poudre ou en liquide) vendues sur le marché comme substitut au lait maternel, afin qu’il réponde aux besoins nutritionnels (Raiten et coll., 1998; OMS, 2007).
5.3 Air
L’air ambiant contient généralement de faibles taux de manganèse, les composés de manganèse ayant une faible pression de vapeur (Stokes et coll., 1988). Des faibles concentrations ont aussi été mesurées dans les matières particulaires (MP) au Canada, où le taux de manganèse dans l’air ambiant est surveillé dans les aérosols atmosphériques (fins/grossiers) par le Réseau national de surveillance de la pollution atmosphérique (RNSPA). En 2013, les concentrations de manganèse mesurées étaient de 0,050 à 51,4 ng/m3 pour les MP2.5 (grande majorité des échantillons < 10 ng/m3) et de 1 à 43 ng/m3 (0,001 à 0,043 μg/m3) pour les MP10 (grande majorité des échantillons < 0,010 μg/m3) (Environnement Canada, 2014). Ces résultats sont similaires à ceux obtenus en 2003 et 2005, alors que les taux de manganèse mesurés se situaient entre 0,002 et 0,025 μg/m3 (Santé Canada 2010). Les concentrations oscillaient entre 0,06 et 0,22 μg/m3 dans certaines parties des villes abritant d’importantes sources industrielles de manganèse (2003 et 2005). Les concentrations de manganèse (MP2.5 et MP10 ) ont chuté de 13 à 77 % entre la fin des années 1980 et le début des années 2000 (Santé Canada, 2010).
Des études portant sur l’exposition de la population dans différentes villes du Canada et des États-Unis (Toronto, Riverside et Indianapolis) ont également été menées à Toronto en 1995 et 1996, deux années pendant lesquelles l’utilisation de MMT dans l’essence était largement répandue (Wallace et Slonecker, 1997). Des échantillons provenant de points de surveillance personnels (population générale) et fixes ont révélé des valeurs médianes respectives de 0,015 μg/m3 et 0,024 μg/m3 (limite de détection : 2 à 9 ng/m3). Aux États-Unis, la valeur médiane de l’exposition personnelle mesurée était de 0,003 μg/m3 à Indianapolis (où aucun MMT n’était ajouté à l’essence) et de 0,020 à 0,049 μg/m3 à Riverside, en Californie. Des concentrations estimatives de 1 à 2 ng/m3 ont été établies comme concentrations de référence dans les milieux non contaminés au Canada et aux États-Unis.
5.4 Produits de consommation
Il est possible de se procurer du manganèse comme supplément nutritif au Canada (Santé Canada, 2007a). Les doses recommandées par Santé Canada sont de 0,13 à 9 mg/jour pour les adultes (aucune pour les moins de 19 ans) pour les produits de santé naturels provenant de sources multiples comme le chlorure, le citrate et l’oxyde de manganèse.
5.5 Sol
Le manganèse est présent naturellement dans le sol à des concentrations estimatives de 40 à 900 mg/kg. Selon le type de roche, les concentrations peuvent parfois se situer en dehors de cette plage (plus élevées dans les minerais de fer et les roches mafiques et sédimentaires, moins élevées dans le grès) (Barceloux, 1999; PISSC, 1999; Michaelke et coll., 2007). Les enfants peuvent ingérer le manganèse présent dans le sol par leur tendance à porter les objets à la bouche (PISSC, 1999).
Dans le cadre d’une étude exhaustive menée à l’échelle nationale et régionale, la concentration moyenne de référence (sans l’influence de l’activité humaine), pour les différents profils de sol de cinq principales régions géologiques (n = 173) du Canada, a été établie à 520 mg/kg avec une plage allant de 100 à 1 200 mg/kg (McKeague et Wolynetz, 1980).
5.6 Concentrations de biomarqueurs chez la population canadienne
Statistique Canada, Santé Canada et l’Agence de la santé publique du Canada ont mis en œuvre le cycle 1 de l’Enquête canadienne sur les mesures de la santé, une étude transversale menée entre 2007 et 2009 dans 15 sites différents et qui a permis de recueillir des données sur la santé et de prélever des spécimens biologiques chez environ 5 600 Canadiens âgés de 6 à 79 ans, répartis en cinq groupes d’âge (6 à 11 ans, 12 à 19 ans, 20 à 39 ans, 40 à 59 ans et 60 à 79 ans) (Santé Canada, 2010). Le cycle 2 de l’Enquête, réalisé entre 2009 et 2011 selon un protocole similaire, portait sur les Canadiens âgés de 3 à 79 ans. La moyenne géométrique des concentrations de manganèse dans le sang complet, pour tous les âges, était de 9,2 μg/L (intervalle de confidence [IC] à 95 % = 9,0 à 9,5 μg/L; n = 5 309) lors du cycle 1 et de 9,8 μg/L (IC à 95 % = 9,5 à 10,0 μg/L; n = 5 575) lors du cycle 2. La concentration de manganèse dans le sang complet était de 11,0 μg/L (IC à 95 % = 11,0 à 12,0 μg/L) chez les 3 à 5 ans (cycle 1 seulement; aucune donnée pour le cycle 2). Pour les autres groupes d’âge de plus de 6 ans, la concentration variait de 8,8 à 10 μg/L au cycle 1 et de 9,4 à 11 μg/L au cycle 2. Les concentrations de manganèse dans le sang complet, pour tous les groupes d’âge, variaient de 8,6 à 9,5 μg/L au cycle 1 et de 9 à 10 μg/L au cycle 2 chez les hommes, et de 9,2 à 11 μg/L au cycle 1 et de 9,5 à 11 μg/L au cycle 2 chez les femmes. Les plus forts taux de manganèse dans le sang ont été relevés chez les 6 à 11 ans (10 à 12µg/L). La moyenne géométrique des concentrations de manganèse dans l’urine s’élevait à 0,081 μg/L (IC à 95 % = 0,072 à 0,092 μg/L; n = 5 431) pour la population canadienne totale âgée de 6 à 79 ans au cycle 1 (aucune donnée n’est présentée pour le cycle 2, la plupart des mesures se situant en deçà de la limite de détection). Les concentrations de manganèse dans le sang complet variaient entre 6,3 μg/L (10e percentile) et 15,0 μg/L (95e percentile). Aucune donnée n’a été fournie pour les enfants de moins de 3 ans.
L’étude MIREC de Santé Canada (n = 1 415 à 1 938) a mesuré la moyenne géométrique des concentrations de manganèse dans le sang des mères durant le premier trimestre (8,8 μg/l, IC à 95 % = 8,7 à 8,9 μg/L, maximum de 29,1 μg/L) et le troisième trimestre (12,0 μg/l, IC à 95 % = 12,0 à 12,4 μg/L, maximum de 33,5 μg/L), dans le sang ombilical (30,9 μg/l, IC à 95 % = 30,9 à 32,0 μg/L, maximum de 98,9 μg/L) et dans le méconium (4,5 μg/l, IC à 95 % = 4,3 à 4,7 μg/L, maximum de 40,0 μg/L) (Santé Canada, 2015).
Dans une étude de cohortes menée en France (n = 247 femmes enceintes et leurs bébés) les moyennes géométriques des concentrations de manganèse mesurées dans le sang, les cheveux et le placenta des mères étaient respectivement de 20,4 μg/L, 0,36 μg/g, et 0,10 μg/g (5e et 95e percentiles de 11,1 à 40,4 μg/L, 0,16 à 0,87 μg/L et 0,06 à 0,16 μg/L) (Takser et coll., 2003). Des moyennes géométriques de 38,5 et 0,75 μg/L (5e et 95e percentiles de 19,1 à 71,2 μg/L et 0,22 à 4,25 μg/L) ont été mesurées dans le cordon ombilical et le sang des nouveau-nés, respectivement. Les taux de manganèse dans le sang mesurés lors du suivi effectué chez les enfants à l’âge de 6 ans étaient très similaires à ceux mesurés à la naissance.
Au Québec, des données sur les métaux traces ont été colligées dans le cadre d’une enquête transversale menée en 2001 chez des hommes et des femmes de 18 à 65 ans habitant dans la région de la ville de Québec (n = 500) (Leblanc et coll., 2004). Les taux de manganèse dans le sang complet (moyenne géométrique de 169,8 nmol/L (IC à 95 % = 164,9 à 174,8 nmol/L); n = 427) et dans le sérum (moyenne géométrique de 12,0 nmol/L (IC à 95 % = 11,8 à 12,3 nmol/L); n = 403) ont été présentés. Une autre étude sur l’exposition au manganèse, menée dans le sud-ouest du Québec (Baldwin et coll., 1999), a notamment mesuré le taux de manganèse dans le sang (n = 306, âgés de 20 à 69 ans). La moyenne géométrique du taux de manganèse dans le sang était de 7,1 μg/L (plage de 2,5 à 15,9). Dans une autre étude, la moyenne géométrique des concentrations de manganèse mesurées chez des ostréiculteurs (âgés de 33 à 64 ans; n = 61) de la Colombie-Britannique, était de 176,8 nmol/L chez les hommes et de 217,8 nmol/L chez les femmes dans le sang complet, et de 16,5 nmol/L chez les hommes et de 12,9 nmol/L chez les femmes dans le sérum (Clark et coll., 2007). Alors que les concentrations de manganèse dans le sang étaient considérablement plus élevées chez les femmes que chez les hommes, elles étaient relativement les mêmes pour les deux sexes dans le sérum.
5.7 Exposition/apport quotidien total
L’estimation de l’apport quotidien provenant de l’eau potable peut varier considérablement selon les concentrations de manganèse dans l’eau (voir la section 5.1 sur l’exposition), et il faut tenir compte de plusieurs facteurs pour obtenir une estimation juste de l’exposition de la population canadienne. En outre, il faut faire preuve de prudence en extrapolant les apports provenant de différentes sources à l’absorption relative provenant de chaque source individuelle, puisque d’autres facteurs (dont la biodisponibilité et la forme/l’espèce de manganèse) ont une incidence sur l’importance toxicologique de la dose estimée.
5.8 Exposition multi-voies par l’eau potable
Vu les propriétés physico-chimiques du manganèse élémentaire, l’exposition au manganèse dans l’eau potable par voie cutanée et par inhalation est probablement négligeable (Karim, 2011).
6.0 Méthodes d’analyse
L’U.S. Environmental Protection Agency (EPA) recommande actuellement quatre méthodes d’analyse (méthode 200.5 révision 4.2, méthode 200.7 révision 4.4, méthode 200.8 révision 5.4 et méthode 200.9 révision 2.2) pour le dosage du manganèse total dans l’eau potable (U.S. EPA, 2014). Elle recommande également plusieurs méthodes (SM 3111B, SM 3113B et SM 3120B) mises au point par un organisme d’élaboration de normes volontaires consensuelles.
Le manganèse total est défini comme étant la somme des concentrations des fractions dissoute et particulaire (en suspension) d’un échantillon d’eau. On le mesure à l’aide de méthodes qui permettent de déterminer le manganèse total récupérable. L’analyse du manganèse total est nécessaire pour effectuer une comparaison avec la CMA. Il est toutefois essentiel de connaître la concentration de chaque fraction (c.-à-d. dissoute et particulaire) pour pouvoir déterminer la méthode de traitement appropriée et vérifier si le traitement élimine efficacement le manganèse. Cette question est abordée en détail aux sections 6.2 et 7.2.
La limite de détection de la méthode (LDM) associée à chaque méthode recommandée est indiquée ci-dessous. Il importe toutefois de préciser que les LDM dépendent de la matrice de l’échantillon, des instruments utilisés et des conditions d’utilisation choisies, et qu’elles varient d’un laboratoire à l’autre.
- La méthode EPA 200.5 Rév. 4.2 fait appel à la spectrométrie d’émission atomique par torche à plasma (ICP-AES), et sa LDM est de 0,06 µg/L (U.S. EPA, 2003).
- La méthode EPA 200.7 Rév. 4.4 fait appel à l’ICP-AES, et sa LDM est de 1,4 µg/L (U.S. EPA, 1994a).
- La méthode EPA 200.8 Rév. 5.4 fait appel à la spectrométrie de masse par torche à plasma (ICP-MS), et sa LDM est de 0,02 µg/L pour le manganèse total récupérable et de 0,04 µg/L pour une injection aqueuse directe (U.S. EPA, 1994b).
- La méthode EPA 200.9 Rév. 2.2 fait appel à la spectrométrie d’absorption atomique en four au graphite (GFAA) et sa LDM est de 0,3 µg/L (U.S. EPA, 1994c).
- La méthode SM (standard method) 3111B fait appel à la spectrométrie d’absorption atomique directe avec flamme air-acétylène, et sa LDM est de 0,01 mg/L (10 µg/L) (APHA et coll., 1992, 1995, 2005, 2012).
- La méthode SM 3113B fait appel à la spectrométrie d’absorption atomique électrothermique, et sa LDM est de 0,2 µg/L (APHA et coll., 1992, 1995, 2005, 2012).
- La méthode SM 3120B fait appel à l’ICP-AES, et sa LDM est de 2 µg/L (APHA et coll., 1992, 1995, 1998, 2005, 2012).
- Les versions en ligne des méthodes SM 3113B-04, 99 et SM 3120B-99 sont aussi des méthodes recommandées.
Il existe une autre méthode d’analyse normalisée qui ne fait pas partie des méthodes recommandées par l’U.S. EPA. Il s’agit de la méthode SM 3125, une méthode bien établie qui est jugée acceptable pour l’analyse du manganèse dans l’eau potable.
- La méthode SM 3125B fait appel à l’ICP-MS, et sa LDM est de 0,002 µg/L (APHA et coll., 1992, 1995, 2005, 2012).
6.1 Méthodes
Les méthodes EPA 200.5 révision 4.2, EPA 200.7 révision 4.4 et SM 3120B sont fondées sur des analyses multi-élémentaires réalisées par signaux d’émission atomique par torche à plasma (ICP-AES), à l’aide d’instruments séquentiels ou simultanés. Les instruments mesurent les spectres linéaires d’émission atomique par spectrométrie optique. Les spectres d’émission propres aux éléments sont produits à l’aide d’une torche à plasma radiofréquence. Les spectres sont dispersés par un spectromètre à grille de réflexion et l’intensité des spectres linéaires est vérifiée à des longueurs d’onde précises par un appareil photosensible. La méthode EPA 200.5 se distingue notamment par le fait que des signaux d’émission atomique à plasma vus en direction axiale sont utilisés pour analyser tous les analytes. Des effets de matrice peuvent se produire avec la méthode EPA 200.5 lorsque les concentrations totales de calcium, de magnésium et de sodium dépassent 125 mg/L et que la concentration en silice dépasse 250 mg/L. Dans le cas des méthodes EPA 200.7 et SM 3120B, des interférences peuvent survenir lorsque la concentration de matières dissoutes totales est supérieure à 0,2 % (p/v) et 1 500 mg/L, respectivement.
Dans les méthodes EPA 200.8 rév. 5.4 et SM 3125 B, les échantillons sont atomisés et ionisés dans un plasma induit par radiofréquence. Les ions sont extraits du plasma par une interface à pression négative et séparés par un spectromètre de masse en fonction de leur rapport masse/charge. Les ions séparés sont détectés par un multiplicateur d’électrons ou un détecteur de Faraday. Des effets de matrice peuvent se produire avec les méthodes EPA 200.8 et SM 3125B lorsque la concentration de matières dissoutes totales est supérieure à 0,2 % et 0,5 % (p/v), respectivement.
Les méthodes EPA 200.9 rév. 2.2 et SM 3113B font appel à la spectrométrie d’absorption atomique en four au graphite avec une plateforme maintenue à température constante. Cette technique comprend une série de trois étapes de chauffage visant à sécher, carboniser (afin de réduire les interférences causées par d’autres ions) et atomiser les analytes sur la surface en graphite pyrolytique. L’atomisation élève les analytes dans une atmosphère d’argon de grande pureté, et on fait passer une lumière d’une longueur d’onde donnée à travers le nuage atomique, en mesurant la diminution de l’intensité de la lumière. Aucune interférence de matrice liée au manganèse n’a été relevée dans ces méthodes.
La méthode SM 3111B est une méthode d’absorption atomique directe par flamme air-acétylène, dans laquelle l’échantillon est aspiré dans la flamme et atomisé. Elle consiste à envoyer un faisceau de lumière vers un détecteur en le faisant passer d’abord à travers une flamme et dans un monochromateur. Le détecteur mesure alors la quantité de lumière absorbée par l’élément atomisé dans la flamme. Comme chaque métal possède une longueur d’onde d’absorption qui lui est propre, une lampe source composée de l’élément concerné est utilisée.
L’U.S. EPA n’a pas fixé de niveau pratique d’évaluation quantitative (NPEQ) pour le manganèse. Un rapport publié par cet organisme en 2010 indique que l’utilisation de NPEQ pour la détermination des capacités d’analyse peut être problématique en raison des différentes méthodes utilisées pour établir ces NPEQ. Le rapport souligne que le seuil minimal de niveau à rapporter (SMNR) peut être utile pour remplacer le NPEQ. Le SMNR d’un analyte est mesuré à l’aide d’une méthode analytique particulière et on le définit comme une estimation du seuil minimal de niveau à rapporter de la plus faible concentration qu’il est possible d’obtenir avec un degré de confiance de 95 % dans au moins 75 % des cas (U.S. EPA, 2010). Aucun SMNR n’a été fourni pour les méthodes citées plus haut, à l’exception de la méthode EPA 200.5, pour laquelle un SMNR de 0,2 µg/L a été fixé. À l’exception de la méthode EPA 3111B, les SMNR et/ou les LDM des méthodes précitées sont bien inférieures aux concentrations nécessaires pour effectuer une analyse quantitative précise du manganèse en deçà de la CMA et de l’OE.
6.2 Conservation et préparation des échantillons
Pour effectuer une évaluation quantitative du manganèse dissous, particulaire et total, certaines étapes de préparation et de conservation des échantillons doivent être suivies. La méthode SM 3030B fournit des directives sur les procédures de filtration et de préparation à effectuer pour le dosage des métaux dissous ou particulaires (APHA et coll., 2012). Pour le dosage des métaux dissous, les échantillons doivent être filtrés au moment du prélèvement à l’aide d’un dispositif de filtration en plastique prétraité, sous vide ou sous pression. Il est recommandé d’utiliser des membranes filtrantes dont le diamètre des pores est de 0,22 à 0,45 µm pour fractionner le manganèse dissous et le manganèse particulaire (Kohl et Medlar, 2006; Brandhuber et coll., 2013). Le filtrat doit être acidifié à un pH < 2 avec de l’acide nitrique concentré. Pour la détermination du manganèse particulaire, le filtre doit être conservé et les particules qu’il contient doivent être digérées en laboratoire par une méthode appropriée (APHA et coll., 2012).
Actuellement, pour les méthodes EPA 200.7, EPA 200.8 et EPA 200.9 ainsi que les méthodes SM 3111B, SM 3113B, SM 3120B et SM 3125B, la digestion acide des échantillons n’est nécessaire que si la turbidité d’un échantillon préservé dans l’acide est supérieure à une (1) unité de turbidité néphélémétrique (uTN). Dans le cas des méthodes EPA, la digestion est réalisée en transférant une aliquote de l’échantillon dans une solution d’acide nitrique et d’acide chlorhydrique, puis en chauffant doucement la solution à une température d’environ 85 °C (digestion thermique) (EPA, 1994, a, b, c). Il est recommandé d’effectuer une digestion par micro-ondes (SM 3030 K) lorsque l’analyse du manganèse total récupérable est effectuée à l’aide d’une méthode SM qui fait appel à l’ICP-MS. Bien que les méthodes énoncées ci-dessus ne requièrent pas de digestion thermique en milieu acide pour l’analyse du manganèse total à moins que la turbidité dépasse 1 uTN, des recherches menées sur d’autres métaux comme le plomb et le chrome ont indiqué que cela ne permettait pas de quantifier avec précision la concentration totale d’un métal dans un échantillon. Par exemple, les exigences en matière d’analyse de l’UCMR3 prescrivent de solubiliser l’échantillon préservé dans l’acide par chauffage léger à l’aide d’acide nitrique, peu importe la turbidité de l’échantillon ou la méthode utilisée (U.S. EPA, 2012). De même, APHA et coll. (2012) recommandent de vérifier si les métaux ont été récupérés de manière adéquate dans les différentes matrices d’échantillon, en comparant les résultats obtenus avec et sans la digestion.
Dans certains cas, les services publics peuvent choisir de mesurer la fraction de manganèse colloïdal présente dans l’usine de traitement ou dans l’eau traite. Cette mesure peut se révéler particulièrement importante lorsqu’on tente de déterminer la cause d’un problème touchant le fonctionnement d’une usine de traitement. Du manganèse colloïdal peut être présent dans les échantillons d’eau prélevés après l’application d’un oxydant fort comme de l’ozone, du permanganate ou du dioxyde de chlore, avant la coagulation, ou dans les usines de traitement ayant recours à l’ozonisation intermédiaire (c.-à-d. les usines de biofiltration). Il est plus probable de trouver ces solides colloïdaux dans les eaux douces puisque les ions calcium et magnésium contribuent à déstabiliser et à agréger les particules d’oxyde de manganèse. En règle générale, « manganèse colloïdal » s’entend des particules d’oxyde de manganèse qui sont < 0,20 µm et > 30 000 daltons. Si du manganèse colloïdal est présent, il traversera les filtres de 0,20 µm et sera faussement quantifié en tant que manganèse dissous. Par conséquent, après la filtration initiale (0,20 µm), l’échantillon devra être filtré une fois de plus avec un filtre possédant un seuil de coupure de 30 000 daltons si un dosage du manganèse colloïdal est nécessaire.
6.3 Méthodes colorimétriques
Il existe diverses méthodes colorimétriques pour le dosage du manganèse dissous dans l’eau potable. Ces méthodes sont fondées sur une réaction entre le manganèse dissous et d’autres composés. Cette réaction produit du permanganate, qui est alors mesuré par colorimétrie. Les réactions peuvent être soumises à des interférences produites par d’autres métaux ou des composés organiques en solution, ce qui peut avoir une incidence sur l’exactitude des résultats. Ces méthodes conviennent donc le mieux à la surveillance de l’efficacité du traitement dans les usines de traitement et non pas à la surveillance de la conformité. Les méthodes colorimétriques ont pour avantage que des trousses permettant de détecter rapidement les changements dans la concentration de manganèse sont offertes sur le marché, ce qui peut faciliter la surveillance des procédés dans une usine de traitement (Brandhuber et coll., 2013).
La méthode SM 3500 Mn B est une méthode colorimétrique basée sur l’oxydation par persulfate du manganèse dissous en présence de nitrate d’argent. Les échantillons contenant des oxydes de manganèse particulaire doivent être traités avec une série de composés réducteurs pour dissoudre ces oxydes. On peut effectuer des mesures photométriques en préparant des solutions étalons et en comparant l’absorbance de l’échantillon à celle des étalons. La concentration minimale détectable associée à cette méthode est de 42 µg/L (APHA et coll., 2012). Il existe également une méthode colorimétrique brevetée réalisée à l’aide d’acide ascorbique, de cyanure alcalin et d’une solution indicatrice. L’intervalle de détection de cette méthode est de 0,01 à 0,7 mg/L (Brandhuber et coll., 2013).
7.0 Considérations relatives aux techniques de traitement et aux réseaux de distribution
7.1 Chimie et traitement du manganèse
Il est important de connaître la chimie et la microbiologie du manganèse dans les systèmes d’approvisionnement en eau potable pour déterminer le système de traitement le plus approprié ou pour évaluer et optimiser les systèmes déjà utilisés pour l’élimination du manganèse. Comme il en a été question à la section 4.0, le manganèse existe sous différents états d’oxydation dans les systèmes d’approvisionnement en eau. Les quatre plus importants états d’oxydation, dans le contexte du traitement de l’eau potable, sont les suivants : le Mn(II), un cation métallique divalent libre transparent dans l’eau; le Mn(III), un état transitoire qui existe sous la forme d’oxyde de manganèse (Mn2O3), lequel est un solide brun foncé/noir; le Mn(IV), un solide noir sous forme de MnO2(S); et le Mn(VII), sous forme de MnO4–, un ion permanganate dissous qui est violet dans l’eau et qu’on ajoute à l’eau comme agent oxydant lors du traitement de l’eau potable. Un bref aperçu de la chimie du manganèse liée au traitement de l’eau potable est présenté ci-dessous. Pour obtenir des renseignements plus détaillés, consulter Sommerfield (1999), Kohl et Medlar (2006), et Brandhuber et coll. (2013).
Les réactions chimiques qui déterminent quelles espèces de manganèse sont présentes dans le cadre d’un traitement de l’eau potable sont les réactions d’oxydation/réduction, de précipitation/dissolution et de sorption/désorption. Dans une usine de traitement de l’eau potable, les trois réactions peuvent se produire au cours d’un même traitement. La présence des différentes espèces de manganèse dépend du potentiel d’oxydation/réduction et du pH de l’eau, ainsi que d’autres paramètres présents dans l’eau qui peuvent se combiner au manganèse pour former des composés de manganèse. Dans des conditions de pH élevé ou de forte oxydation, le Mn(II) dissous, à l’équilibre, forme des oxydes, des hydroxydes ou des carbonates solides insolubles.
Les procédés de traitement du manganèse sont conçus de façon à tirer parti des différences entre les espèces de manganèse sur le plan de la solubilité. La solubilité du Mn(II) réduit est de plusieurs fois supérieure à celle du Mn(IV). Par conséquent, l’oxydation du Mn(II) en Mn(IV) entraîne la formation d’un précipité d’oxydes de manganèse solides. Parce que ces solides peuvent exister dans plusieurs états d’oxydation (p. ex. le Mn(III) et le Mn(IV)), on utilise souvent l’appellation MnOx(s) pour les désigner (Brandhuber et coll., 2013). La tendance du manganèse à précipiter ou à se dissoudre peut être contrôlée par la modification des conditions d’oxydation/réduction et de pH dans une usine de traitement de l’eau potable.
L’adsorption/désorption est le troisième procédé utilisé pour contrôler le manganèse dans les usines de traitement de l’eau potable. Les particules de MnOx(s) ont une charge électrique qui varie avec le pH, mais dans la plupart des cas ces particules sont chargées négativement et elles ont la capacité d’adsorber les ions Mn(II) des solutions. Une fois le Mn(II) adsorbé sur les particules de MnOx(s), la surface catalyse l’oxydation du Mn(II) adsorbé en Mn(IV), ce qui accroît la vitesse d’oxydation du Mn(II) en Mn(IV).
Dans la pratique, le manganèse peut passer de la forme soluble à la forme particulaire et il peut être difficile à réduire à des concentrations faibles (c.-à-d. < 0,015 mg/L) dans les usines de traitement et les réseaux de distribution (Brandhuber et coll., 2013). Il importe également de souligner que le MnOx(s) peut exister sous forme particulaire et colloïdale. La forme particulaire est composée de gros solides oxydés (> 0,20 à 0,45 µm) et la forme colloïdale de particules oxydées plus petites (< 0,20 µm et > 30 000 daltons). Dans certaines conditions, de grandes quantités de manganèse colloïdal peuvent se former lorsque du Mn(II) est oxydé directement avec un oxydant fort tel que l’ozone. Les particules colloïdales peuvent être difficiles à déstabiliser et l’ajout d’un coagulant doit être optimisé pour éliminer efficacement ces particules lors de la sédimentation et de la filtration (Casale et coll., 2002; Brandhuber et coll., 2013).
7.2 Traitement dans les installations municipales
Choisir le système de traitement approprié pour éliminer le manganèse ou pour optimiser un système existant nécessite de bien connaître les formes de manganèse (dissous, colloïdal ou particulaire) présentes dans l’eau de la source d’approvisionnement. Lorsque l’eau d’une source d’approvisionnement doit être traitée pour en éliminer le manganèse, le Mn(II) sous forme dissoute est généralement la principale espèce présente (c.-à-d. dans les lacs ou les eaux souterraines anoxiques). Toutefois, selon le pH et la teneur en oxygène dissous (OD) de l’eau, une combinaison de manganèse dissous et particulaire peut être présente. Les méthodes de traitement utilisées font généralement appel à une combinaison de procédés permettant d’éliminer à la fois le manganèse dissous et particulaire (p. ex. oxydation, adsorption et/ou filtration). Si le manganèse n’est présent que sous forme colloïdale ou particulaire (Mn(IV), il peut être éliminé par des procédés courants d’élimination des particules tels que la filtration conventionnelle ou la filtration membranaire à basse pression (microfiltration ou ultrafiltration).
Le Mn(II) dissous peut être éliminé ou contrôlé de différentes façons : pratiques relatives à l’eau de la source d’approvisionnement, oxydation/séparation physique, adsorption/oxydation, filtration biologique et adoucissement par précipitation. L’une des techniques les plus couramment utilisées pour réduire efficacement les concentrations de manganèse dans l’eau potable consiste à effectuer une oxydation directe du Mn(II) dissous pour former du MnOx(s) particulaire, puis à éliminer ce dernier par un procédé physique comme la clarification et la filtration sur milieu granulaire ou la filtration membranaire à basse pression. Ces méthodes permettent habituellement d’éliminer 80 à 99 % du manganèse et d’atteindre une concentration inférieure à 0,04 mg/L. Une autre technique de traitement courante est l’utilisation d’un milieu filtrant enrobé de MnOx(s) qui adsorbe le Mn(II) dissous pour l’oxyder ensuite à la surface en présence d’un oxydant approprié tel que du chlore libre ou du permanganate de potassium. Cette technique de traitement permet généralement d’obtenir un taux d’élimination très élevé et d’atteindre des concentrations inférieures à 0,020 mg/L dans l’eau traitée. La filtration biologique et l’adoucissement se sont également révélés efficaces pour éliminer le manganèse, en permettant d’atteindre des concentrations inférieures à 0,03 mg/L dans l’eau traitée (Casale et coll., 2002; Kohl et Medlar, 2006; Tobiason et coll., 2008; Kohl et Dixon, 2012; Brandhuber et coll., 2013). Beaucoup de ces technologies, en particulier le milieu filtrant enrobé de MnOx(s), peuvent être utilisées pour éliminer le manganèse de l’eau potable dans les systèmes à petite échelle. Les services publics peuvent réussir à atteindre des concentrations encore plus faibles que celles mentionnées plus haut, selon le fonctionnement et la conception des installations de l’usine de traitement. En particulier, il a été démontré que l’optimisation d’usines de traitement existantes pouvait permettre de réduire les concentrations de manganèse en deçà de 0,02 mg/L (Brandhuber et coll., 2013).
Le type de traitement qui sera le plus efficace pour éliminer le manganèse dépend du type et du taux de manganèse présent dans l’eau de la source d’approvisionnement, de la chimie générale de l’eau, du procédé de traitement choisi, et des objectifs relatifs à la qualité de l’eau. Les services publics devraient effectuer des activités de surveillance dans les usines de traitement, notamment un dosage périodique des différentes formes de manganèse (p. ex. dissous et particulaire), pour s’assurer que les procédés de traitement utilisés éliminent adéquatement le manganèse. Des directives détaillées sur le traitement du manganèse dans l’eau potable sont données par Brandhuber et coll. (2013).
Par le passé, les limites fixées pour le manganèse dans l’eau potable étaient fondées sur des considérations esthétiques et sur la faisabilité des traitements (U.S. EPA, 1979). Récemment, des études ont révélé que les particules de MnOx(s) présentes dans l’eau potable entraînaient une coloration de l’eau et qu’elles étaient visibles à l’œil nu à des concentrations aussi faibles que 0,005 à 0,02 mg/L (Sly et coll., 1990; Sain et coll., 2014). En outre, des enquêtes approfondies ont démontré qu’une concentration de 0,05 mg/L dans l’eau traitée n’était pas assez faible pour maintenir au minimum le nombre de plaintes de consommateurs (Sly et coll., 1990; Casale et coll., 2002; Kohl et Medlar, 2006). Selon Kohl et Medlar (2006), les résultats d’études détaillées concernant les services publics indiquent qu’une majorité de consommateurs a régulièrement des problèmes de coloration de l’eau lorsque les concentrations de manganèse sont de 0,05 mg/L au robinet. De nombreuses études ont aussi révélé que les usines de traitement existantes étaient capables de réduire la concentration de manganèse dans l’eau traitée à moins de 0,02 mg/L en optimisant la conception et le fonctionnement d’une usine nouvelle ou existante (Kohl et Medlar, 2006; Tobiason et coll., 2008; Brandhuber et coll., 2013). Kohl et Medlar (2006) ont publié des données tirées d’une enquête effectuée dans 189 usines de traitement éliminant le manganèse des sources d’eau souterraine et de surface à l’aide de diverses technologies de traitement. La moyenne géométrique des concentrations relevées dans l’eau traitée par ces usines était de 0,010 mg/L. De même, Casale et coll. (2002) ont indiqué qu’environ 80 % des usines de traitement des eaux souterraines et 70 % des usines de traitement des eaux de surface (193 usines de traitement) obtenaient des concentrations de 0,01 mg/L dans l’eau traitée. Ces données montrent que les services publics peuvent obtenir des concentrations plus faibles dans l’eau traitée que celles indiquées précédemment et que la plupart des usines de traitement sont capables d’atteindre, dans l’eau traitée, une concentration de manganèse inférieure à 0,02 mg/L (Casale et coll., 2002; Kohl et Medlar; 2006; Tobiason et coll., 2008; Brandhuber et coll., 2013).
Les répercussions de l’accumulation et de la libération de manganèse et de métaux concomitants dans les réseaux de distribution ont aussi fait l’objet de recherches approfondies au cours des dernières années (U.S. EPA, 2006; Friedman et coll., 2010; Ginige et coll., 2011; Brandhuber et coll., 2015). Des concentrations élevées de manganèse au robinet peuvent être liées à l’accumulation et à la libération de manganèse dans le réseau de distribution plutôt qu’à une concentration élevée de manganèse dans l’eau à la source ou l’eau traitée (Brandhuber et coll., 2015).
À la lumière de ce qui précède, il est recommandé que les usines de traitement établissent un objectif de ≤ 0,015 mg/L de manganèse total dans l’eau traitée (Brandhuber et coll., 2013), un objectif atteignable pour la plupart des usines de traitement optimisées et exploitées de façon adéquate. L’établissement d’un tel objectif permettra de minimiser l’accumulation de manganèse dans le réseau de distribution et la libération subséquente de manganèse dans l’eau distribuée, et de prévenir ainsi les plaintes de clients à l’égard de la couleur de l’eau et l’augmentation des concentrations de manganèse dans l’eau du robinet (qui pourraient être au-dessus de la CMA).
7.2.1 Élimination dans les sources d’eau
Dans certains cas, il peut être possible de réduire les concentrations de manganèse dans l’eau qui entre dans une usine de traitement en gérant le taux manganèse présent dans l’eau de la source d’approvisionnement. Les concentrations de manganèse, dans les eaux souterraines d’un puits individuel, varient généralement moins dans le temps (d’une journée ou d’une saison à l’autre) que dans les eaux de surface (Barbeau et coll., 2011). Des variations importantes de la concentration de manganèse ont toutefois été observées entre différents puits d’un même champ de captage situés à proximité les uns des autres. Les services publics qui disposent de plusieurs puits peuvent donc pomper de façon sélective une combinaison de puits à différents débits pour diminuer la concentration de manganèse dans l’eau qui entre dans l’usine de traitement (Brandhuber et coll., 2013). Une autre solution pour éliminer le manganèse dans l’eau souterraine consiste à oxyder le Mn(II) in situ en augmentant le potentiel redox dans l’aquifère entourant les puits. Pour ce faire, on injecte de l’eau aérée dans l’aquifère par des puits de recharge. Cette technologie est rarement utilisée en raison des préoccupations liées à l’altération de la géochimie de l’aquifère et du risque de colmatage des puits d’extraction (Mettler et coll., 2001). En dépit de ces préoccupations, cette technologie est utilisée à grande échelle avec succès en Suisse et aux États-Unis (AWWA, 1984; Mettler et coll., 2001).
Des techniques d’aération peuvent aussi être employées comme solution pour réduire la concentration de manganèse dans les eaux de surface. L’oxygène dissous (OD) présent dans l’hypolimnion des réservoirs et des lacs peut disparaître entièrement lors de la stratification thermique. Il peut en résulter une augmentation de la concentration de Mn(II) dissous dans la colonne d’eau, causée par les rejets provenant des sédiments dans des conditions anoxiques. L’oxygénation et l’aération hypolimnique peuvent être utilisées pour ajouter de l’OD dans les réservoirs tout en maintenant la stratification (Brandhuber et coll., 2013). Il existe plusieurs types d’aérateurs qui génèrent un flux de gaz au contact de l’eau. L'eau reçoit ainsi de l’oxygène qui est ensuite transporté dans l’hypolimnion. La quantité d’oxygène requise pour aérer adéquatement une partie ou la totalité de l’hypolimnion dépend du volume d’eau, du profil d’OD dans le lac et de la demande en oxygène des sédiments. L’aération doit être soigneusement contrôlée pour éviter la déstratification du réservoir, car celle-ci pourrait causer d’autres problèmes liés à la qualité de l’eau (Kohl et Medlar, 2006). Brandhuber et coll. (2013) ont présenté de données tirées d’une étude de cas portant sur un système d’aération hypolimnique à grande échelle installé dans un réservoir en période de stratification thermique. La concentration de Mn(II) mesurée à l’entrée d’eau de l’usine était de 1,7 mg/L. Après avoir considéré plusieurs options, on a décidé d’installer un système d’oxygène liquide constitué de deux conduits de diffusion d’oxygène gazeux placés au fond du réservoir. On a fait fonctionner le système d’avril à octobre en réglant le flux d’oxygène de façon à maintenir la concentration d’OD au-dessus de 5 mg/L. Ce système a permis de réduire au minimum la quantité de Mn(II) libéré par les sédiments et de diminuer la concentration de manganèse dans l’eau de la source d’approvisionnement à une moyenne annuelle inférieure à 0,05 mg/L (la valeur maximale était de moins de 0,2 mg/L).
Prendre l’eau à des profondeurs variables est une autre solution qui s’offre aux usines de traitement des eaux de surface qui possèdent des réservoirs profonds et un système de prise d’eau à plusieurs niveaux. Ces systèmes permettent de prendre l’eau à la profondeur choisie du réservoir en fonction de la qualité de l’eau aux différentes profondeurs. Lorsque l’élimination du manganèse est le principal objectif, les usines de traitement peuvent surveiller la concentration d’OD et de Mn(II) dissous à chaque prise d’eau, et tirer l’eau là où la concentration est la moins élevée (généralement à de faibles profondeurs lorsque l’hypolimnion devient anoxique dans le réservoir). Habituellement, dans la pratique, on détermine à quel niveau prendre l’eau en tenant compte de divers facteurs liés à la qualité de l’eau, puisque tirer l’eau à de faibles profondeurs risque de provoquer d’autres problèmes comme une quantité accrue des cellules algales ou des problèmes liés au goût et à l’odeur (Benskin et coll., 2004; Brandhuber et coll., 2013).
7.2.2 Oxydation chimique / séparation physique
Lorsque la principale forme de manganèse présente dans l’eau d’une source d’approvisionnement est le Mn(II) dissous, effectuer une oxydation directe pour convertir le Mn(II) en précipité de MnOx(s) et ensuite le séparer physiquement peut être un moyen efficace d’éliminer le manganèse dans l’eau potable. L’efficacité de ces procédés repose en grande partie sur la capacité de l’agent oxydant (ou des agents oxydants) à convertir entièrement le Mn(II) dissous en MnOx(s). L’efficacité de l’oxydation du manganèse dépend de plusieurs facteurs, dont le pH, l’Eh, la température, le temps de réaction, l’alcalinité et la demande totale en oxydant dans l’eau (p. ex., présence de fer, de sulfure, de nitrate, d’ammoniac et de composés organiques) (Casale et coll., 2002; Brandhuber et coll., 2013). Une fois que le Mn(II) dissous est converti en particules de MnOx(s), il peut être retiré par coagulation/floculation, par sédimentation, ou par flottation à l’air dissous et filtration sur milieu granulaire. La filtration membranaire à basse pression (ultra et microfiltration) peut aussi être utilisée. Pour que les procédés d’élimination physiques soient efficaces, il faut s’assurer que le manganèse qui entre dans le filtre est particulaire (Tobiason et coll., 2008). En outre, selon Brandhuber et coll. (2013), la taille des particules et l’endroit où elles sont générées dans la chaîne de traitement sont des facteurs clés pour une élimination efficace du manganèse. Par exemple, les particules colloïdales doivent être déstabilisées par coagulation/floculation avant d’être filtrées.
L’oxydation du manganèse dans l’eau est une réaction autocatalytique en trois étapes, auxquelles sont associées différentes réactions cinétiques, ce qui a d’importantes répercussions sur le traitement de l’eau potable. La première étape est l’oxydation du Mn(II) en solution par l’oxydant (réaction relativement lente), la deuxième est l’adsorption du Mn(II) sur les solides de MnOx(s) (réaction rapide), et la troisième est l’oxydation catalysée en surface de l’ion Mn(II) sorbé par l’ajout d’un oxydant (réaction moyennement rapide). Il convient de noter que la deuxième étape est également importante dans les processus de filtration parce que les couches de MnOx(s) présentes sur le matériau filtrant adsorbent rapidement le Mn(II) dissous, qui peut alors être oxydé. Cette question est abordée plus en détail à la section 7.2.3.
Les agents oxydants généralement utilisés pour convertir le Mn(II) dissous en précipités de MnOx(s) sont notamment le permanganate (MnO4–), le dioxyde de chlore (ClO2) et l’ozone (O3). Dans des conditions de pH élevé, le chlore et l’oxygène peuvent aussi être efficaces. Des études menées par Knocke et coll. (1990a) et Gregory et Carlson (2003) ont indiqué que la cinétique des réactions de ces oxydants avec le Mn(II) est suffisamment rapide, dans la plupart des conditions de pH et de température, des quantités de carbone organique dissous (COD) et des concentrations de Mn(II), pour être utilisée dans les procédés de traitement de l’eau potable. L’oxydation au chlore et l’oxydation à l’oxygène ne sont efficaces que si le pH est supérieur à 9 et 9,5, respectivement (Knocke et coll., 1990a; Brandhuber et coll., 2013). Des renseignements détaillés sur l’efficacité de différents oxydants pour l’élimination du manganèse dans l’eau potable sont donnés dans Knocke et coll. (1990a), Casale et coll. (2002), Gregory et Carlson (2003), Kohl et Medlar (2006), Tobiason et coll. (2008), et Brandhuber et coll. (2013).
Brandhuber et coll. (2013) se sont penchés sur les principaux facteurs ayant un effet sur l’efficience de l’oxydation chimique du Mn(II), à savoir le choix de l’oxydant, la dose appliquée, la cinétique de réaction, le temps de réaction, le lieu d’injection de l’oxydant, et la surveillance. Sur le plan opérationnel, le point le plus important est de laisser suffisamment de temps de réaction, dans l’usine de traitement, pour obtenir une oxydation complète et efficace du Mn(II). En général, pour pouvoir obtenir une réaction d’oxydation suffisamment rapide pour être efficace dans une usine de traitement, on doit utiliser un oxydant fort ayant un pH approprié (Brandhuber et coll., 2013). De plus, les doses d’oxydant doivent être supérieures aux rapports stœchiométriques pour répondre à la demande en oxydant de la source d’eau et obtenir une oxydation adéquate du manganèse (Kohl et Medlar, 2006). La présence de fer, qui accompagne souvent celle du manganèse dans les sources d’eau, peut particulièrement avoir un effet sur l’efficacité de l’oxydation du manganèse. Comme le fer s’oxyde plus facilement que le manganèse à n’importe quel pH, la demande en oxydant du fer doit être comblée avant qu’une oxydation significative du manganèse puisse se produire (Brandhuber et coll., 2013). Avant de choisir un agent oxydant, les services publics devraient effectuer des essais de floculation afin de déterminer quels oxydants seraient efficaces dans leur source d’eau et leur usine de traitement.
L'utilisation de permanganate, de dioxyde de chlore et d’ozone pour oxyder le Mn(II) peut entraîner la formation de particules de MnOx(s) d’une taille inférieure à un (1) µm (Knocke et coll., 1990a; Brandhuber et coll., 2013). La formation de ce MnOx(s) colloïdal se produit plus souvent dans une eau de faible dureté puisque la présence d’ions calcium et magnésium dissous aide à la déstabilisation et au regroupement de ces colloïdes. On recommande généralement d’ajouter ces oxydants avant la coagulation/floculation afin que les particules colloïdales puissent être déstabilisées et retirées au moyen de procédés de sédimentation et de filtration conventionnels (Brandhuber et coll., 2013).
Plusieurs combinaisons différentes d’oxydation et de séparation physique sont utilisées pour traiter l’eau contre le manganèse : emploi de multiples oxydants, variation dans le site d’injection de l’oxydant, recours à diverses méthodes de séparation physique, etc. Les considérations relatives à chaque agent oxydant et chaque technologie de filtration sont abordées dans les sections qui suivent. On y fait état des capacités d’élimination du manganèse dissous de ces technologies, en présentant des exemples d’usines de traitement qui les ont utilisées à grande échelle ou dans le cadre d’essais-pilotes, tout en reconnaissant que l’efficacité de tout procédé de traitement est propre à chaque site, et qu’elle varie en fonction de la qualité de l’eau à la source et selon la conception et le fonctionnement de chaque installation de traitement.
7.2.2.1 Permanganate
L’oxydation du Mn(II) dissous peut être réalisée avec du permanganate (MnO4–) obtenu sous forme de permanganate de sodium (NaKMnO4) ou de permanganate de potassium (KMnO4). Par le passé, le KMnO4 était la forme de permanganate la plus utilisée pour l’oxydation du Mn(II). Brandhuber et coll. (2013) ont toutefois noté que de plus en plus de services publics ont recours au NaKMnO4, parce que celui-ci peut être acheté sous forme de solution très concentrée et que cela leur évite d’avoir à se procurer le matériel nécessaire pour dissoudre le produit sec à l’usine de traitement.
Les données sur l’oxydation du Mn(II) au permanganate indiquent que celle-ci se produit très rapidement dans toute une gamme de pH et de température de l’eau, lorsque l’eau a une faible teneur en COD (< 3 mg/L) (Knocke et coll., 1987 et 1990). La dose stœchiométrique de permanganate requise pour oxyder le Mn(II) en Mn(IV) est de 1,9 mg KMnO4 par mg Mn(II). Cependant, comme c’est le cas pour toutes les réactions d’oxydation, la demande provenant des autres éléments présents dans l’eau de la source d’approvisionnement peut faire augmenter la dose totale nécessaire. Knocke et coll. (1990a) ont démontré que pour un pH entre 5,5 et 9,0, l’oxydation de 0,25 mg/L de Mn(II) avec du permanganate en une quantité équivalente à 105 % de la valeur stœchiométrique se produisait en 60 secondes (T = 25 °C, COD < 1 mg/L). L'augmentation de la teneur en COD à 10 mg/L a fait grimper le temps d’oxydation du Mn(II) à 1 à 2 minutes (T = 25 °C, pH = 7,0). Les conditions auxquelles l’oxydation n’a pas permis de réduire efficacement la concentration de résidus finaux de Mn(II) en deçà de 0,05 mg/L sont une température de 5 °C et un pH de 5,5. Les auteurs ont fait observer que l’utilisation du permanganate pour oxyder le Mn(II) constitue une solution peu pratique lorsqu’il y a beaucoup de matière organique dans l’eau de la source d’approvisionnement, en raison de son coût élevé en produits chimiques (Knocke et coll., 1987). Les résultats des travaux de Gregory et Carlson (2003) indiquent que le temps de réaction, pour l’oxydation du Mn(II) au permanganate, augmentait lorsque la concentration initiale de Mn(II) était plus faible. Pour une concentration initiale de Mn(II) de 60 µg/L et une dose de KMnO4 correspondant à 300 % de la valeur stœchiométrique, il a fallu 1 200 secondes pour atteindre une concentration résiduelle de Mn(II) inférieure à 20 µg/L (objectif de l’étude pour l’eau traitée). En comparaison, l’oxydation initiée à 1 000 µg/L s’est fait beaucoup plus rapidement et a permis d’atteindre une concentration de Mn(II) inférieure à 10 µg/L en moins de 200 secondes. Pour ces tests, les paramètres de qualité de l’eau étaient les suivants : pH = 7,0, COT = 3,4 mg/L et T = 9 °C.
Dans la pratique, le dosage du permanganate pour oxyder le Mn(II) doit être optimisé avec précision de façon à oxyder complètement le Mn(II) sans laisser d’excédent de permanganate dans l’eau traitée. Un excédent de permanganate pourrait colorer en rose l’eau qui sort de l’usine de traitement, ou produire un précipité de MnOx(s) dans le réseau de distribution et accroître le nombre de plaintes de consommateurs à propos de la couleur de l’eau. Il est donc important de porter une attention particulière au temps de contact et à la dose de permanganate utilisée. Brandhuber et coll. (2013) ont indiqué que dans la plupart des usines de traitement, un temps de réaction de 2 à 4 minutes est suffisant avec une faible concentration initiale de Mn(II) et/ou un faible pH (p ex., pH 6 à 6,5), mais que le temps de réaction peut souvent être plus court dans des conditions de pH élevé.
Un grand nombre d’études ont démontré qu’il est possible d’éliminer efficacement le Mn(II) dissous dans des usines de traitement de l’eau potable à grande échelle en utilisant l’oxydation au permanganate suivie d’une séparation physique (Carlson et coll., 1997; Kohl et Medlar, 2006; Brandhuber et coll., 2013). Kohl et Medlar (2006) ont publié des données provenant de sept usines de traitement à grande échelle qui éliminaient le manganèse par l’ajout de KMnO4 suivi d’une filtration. Dans tous les cas, ces usines ont réussi à éliminer plus de 80 % du manganèse et à atteindre une concentration moyenne de manganèse inférieure à 0,045 mg/L dans l’eau traitée. Deux de ces usines ont réussi à éliminer entre 80 et 86 % du manganèse présent dans l’influent en effectuant une oxydation au KMnO4 suivie d’une filtration conventionnelle (mélange, floculation, décantation et filtration sur média granulaire) : les concentrations moyennes de manganèse, qui étaient de 0,090 et 0,111 mg/L à l’entrée de l’usine, étaient respectivement de 0,019 mg/L et 0,021 mg/L à la sortie. Les installations qui ont couplé l’ajout de KMnO4 à une autre méthode d’oxydation ont obtenu un taux d’élimination plus élevé. Deux usines ayant combiné l’aération à l’ajout de KMnO4 et à la filtration conventionnelle ont réussi à éliminer 92 et 97 % du manganèse et à atteindre des concentrations moyennes de 0,019 et 0,045 mg/L dans l’eau traitée. La méthode de flottation à l’air dissous a également été utilisée pour éliminer le manganèse oxydé. En Australie, une usine de traitement a réussi à éliminer avec succès le manganèse en utilisant un prétraitement combiné avec du permanganate de potassium, suivi de l’ajout de chlorhydrate de polyaluminium, d’une floculation et d’une flottation à l’air dissous (Kohl et Medlar, 2006). La concentration de manganèse a été réduite de 0,08 mg/L dans l’eau brute à moins de 0,02 mg/L dans l’eau traitée. Aucune donnée opérationnelle n’était disponible pour les usines de traitement mentionnées ci-dessus.
La documentation consultée contient plusieurs études de cas portant sur des techniques visant l’optimisation des systèmes d’oxydation par KMnO4 utilisés en combinaison avec une filtration conventionnelle (Brandhuber et coll., 2013). Une installation municipale qui traitait l’eau brute d’un lac dont la concentration en Mn(II) variait considérablement (fluctuations horaires de 0,2 à 1,0 mg/L) a été optimisée en utilisant la mesure du potentiel d’oxydoréduction pour contrôler la dose de permanganate ajoutée. L’usine est passée de l’ajout de substances chimiques par débit contrôlé à un dosage déterminé par le potentiel d’oxydoréduction. Avec cette méthode, la concentration de manganèse dans l’eau traitée était inférieure à 0,01 mg/L 90 % du temps et inférieure à 0,02 mg/L 95 % du temps.
Une méthode combinant la filtration membranaire à basse pression et l’oxydation du Mn(II) par KMnO4 a aussi été utilisée pour l’élimination du manganèse dans des usines de traitement de l’eau potable à grande échelle. Le permanganate est l’oxydant de choix pour les installations qui utilisent des membranes résistant aux oxydants. Dans ces cas, il est important que les réactions d’oxydation soient terminées avant que l’eau atteigne les membranes, car la formation d’un précipité dans les pores de la membrane pourrait endommager la structure de la membrane. Une usine à grande échelle utilisant l’ultrafiltration/le permanganate de potassium a traité avec succès de l’eau brute contenant 0,62 mg/L de manganèse et 0,4 mg/L de fer, et réussi à atteindre des concentrations inférieures à la limite de détection (non précisée) (AWWA, 2005). L’usine, qui fonctionne à un flux net de 25 gfd, ajoute d’abord du KMnO4 à l’eau, laquelle est ensuite soumise à un mélange statique et envoyée dans une chambre d’oxydation, puis dans trois réservoirs à membrane immergés placés parallèlement. Un réservoir de récupération reçoit les eaux rejetées et le surnageant est recyclé et réacheminé au début du procédé, ce qui permet un taux de récupération total du système de 99 %. Kohl et Medlar (2006) mentionnent également une usine de traitement de l’eau potable à grande échelle qui obtient un taux élevé d’élimination du manganèse en utilisant le KMnO4 suivi d’une microfiltration. L’usine a déclaré avoir atteint un taux d’élimination du manganèse de 99 %, en obtenant une concentration de 0,005 mg/L à partir d’une concentration initiale moyenne de 0,811 mg/L dans l’influent. On ne dispose d’aucune donnée opérationnelle sur cette usine de traitement (AWWA, 2005).
7.2.2.2 Dioxyde de chlore
Le dioxyde de chlore peut oxyder efficacement le Mn(II) dissous en Mn(IV), mais il convient davantage pour les sources d’eau où la demande en oxydant des matières organiques n’est pas très élevée (Tobiason et coll., 2008). La réaction entre le ClO2 et le Mn(II) dissous est rapide, habituellement 1 à 2 minutes ou moins, selon la dose de ClO2 et la concentration initiale de Mn(II) dissous (Brandhuber et coll., 2013). Comme pour le permanganate, l’efficacité de l’oxydant est fortement réduite à basse température (5 °C) et à pH faible (5,5) (Knocke et coll., 1990a). La dose stœchiométrique de ClO2 pour l’oxydation du Mn(II) est de 2,45 mg ClO2 par mg de Mn(II). Toutefois, en présence de Mn(II), le dioxyde de chlore n’est pas complètement réduit en ion chloride (Cl-), mais seulement en chlorite (ClO2-) (Knocke et coll., 1990a). Il est également important de souligner que si le dioxyde de chlore et l’ion chlorite ne sont pas éliminés avant la deuxième désinfection au chlore, ils réagiront avec le chlore libre pour former un ion chlorate. Lorsqu’un ion chlorate est présent dans l’eau, il est très persistant et difficile à éliminer. Au Canada, la recommandation basée sur la santé pour l’eau potable est de 1 mg/L pour le chlorite et le chlorate. Toutefois, pour être en mesure de respecter cette recommandation, on conseille aux usines de traitement qui utilisent le dioxyde de chlore comme désinfectant principal de ne pas en ajouter plus de 1,2 mg/L (Santé Canada, 2008).
Knocke et coll. (1987) ont démontré qu’une dose de 1 à 1,5 mg/L oxydait efficacement des concentrations initiales de Mn(II) d’environ 0,25 mg/L sur une large gamme de pH lorsque le COD était inférieur à 2,5 mg/L. Par opposition, l’eau contenant entre 8 et 10 mg/L nécessitait plus de 3 mg/L de ClO2. Gregory et Carlson (2003) ont comparé l’oxydation du Mn(II) au dioxyde de chlore, au permanganate de potassium et à l’ozone en utilisant des concentrations initiales de Mn(II) plus faibles (60 µg/L). Ils ont découvert que le dioxyde de chlore était le plus efficace pour obtenir des concentrations < 10 µg/L dans l’eau traitée. À la dose ClO2 stœchiométrique relative de 200 %, l’oxydation a fait passer la concentration de 60 µg/L à moins de 10 µg/L en 300 secondes dans l’eau présentant les conditions suivantes : T = 9°C, pH = 7,0 et COT = 3,4 mg/L. À une concentration initiale de Mn(II) de 200 µg/L, le processus a pris moins de 75 secondes.
Étant donné que la dose de dioxyde de chlore ne doit pas dépasser 1,2 mg/L, plusieurs auteurs ont indiqué que l’utilisation du dioxyde de chlore seul pour l’oxydation du Mn(II) se limite à l’eau qui présente une faible teneur en COD et en Mn(II) dissous, et pour laquelle un traitement par oxydation est nécessaire. Dans certains cas, ajouter du permanganate en plus du dioxyde de chlore peut se révéler efficace pour l’eau présentant une teneur en COD particulièrement élevée (Knocke et coll., 1987; Casale et coll., 2002; Brandhuber et coll., 2013). Il faut également tenir compte du fait que le dioxyde de chlore doit être produit sur place en raison de son haut degré de réactivité.
Malgré ces restrictions, plusieurs usines de traitement à grande échelle ont déclaré avoir recours au dioxyde de chlore et à la séparation physique pour éliminer le manganèse. Kohl et Medlar (2006) ont présenté des données provenant de plusieurs usines qui réussissaient à éliminer 81 à 95 % du manganèse et à atteindre des concentrations aussi faibles que 0,001 mg/L dans l’eau traitée en utilisant le dioxyde de chlore et la filtration conventionnelle. Dans une étude de cas présentée par Brandhuber et coll. 013), une usine de traitement à grande échelle qui recevait des plaintes au sujet de la couleur de l’eau a obtenu des résultats concluants en remplaçant le permanganate de potassium par le dioxyde de chlore pour l’oxydation du Mn(II) dans l’eau brute, dont la concentration variait entre 0,07 à 0,2 mg/L. On y a découvert que le ClO2 était plus efficace pour abaisser les concentrations à moins de 0,02 mg/L. De même, des études visant à déterminer l’oxydant le plus efficace pour l’élimination du Mn(II) ont permis de déterminer que le ClO2 était plus efficace que le permanganate de potassium et l’ozone pour obtenir des concentrations faibles de Mn(II). Des doses de dioxyde de chlore allant de 0,44 à 1,5 mg/L ont permis d’oxyder efficacement le Mn(II) et d’en réduire la concentration à 0,005 mg/L sans produire des taux inacceptables de chlorite (Carlson et Gregory, 2003).
La méthode combinant l’oxydation au dioxyde de chlore et la microfiltration est également efficace pour éliminer le manganèse dans l’eau potable. Tobiason et coll. (2008) ont fait état d’un système pilote capable de faire passer de 0,094 mg/L à 0,001 mg/L la concentration de manganèse dans l’influent en utilisant 0,5 mg/L de dioxyde de chlore comme oxydant de préfiltration, suivi d’une microfiltration.
7.2.2.3 Ozone
L’ozone est un puissant oxydant qui peut oxyder efficacement le Mn(II), mais il est considéré comme moins efficace que les autres oxydants pour obtenir des concentrations de manganèse inférieures à 0,02 mg/L dans l’eau potable (Brandhuber et coll., 2013). L’oxydation à l’ozone, dans les procédés de traitement de l’eau potable, met habituellement en jeu de l’O3 moléculaire et le radical hydroxyle HO neutre. Dans le cas de l’oxydation du Mn(II) dissous, des études ont démontré que c’est l’O3 moléculaire qui réagit directement avec le Mn(II) et que les radicaux hydroxyles n’ont pas beaucoup d’effet (Nowell et Hoigne, 1987). La dose stœchiométrique, pour l’oxydation du Mn(II), est de 0,87 mg O3 par mg Mn(II) (Knocke et coll., 1990a). La dose requise est généralement 2 à 5 fois supérieure, selon l’alcalinité et la teneur en COD de l’eau de la source d’approvisionnement. La présence de COD dans l’eau de la source d’approvisionnement inhibe considérablement l’oxydation du Mn(II) par l’ozone en raison de la demande en oxydant concurrentielle provenant du COD (Knocke et coll., 1990a). Cet effet peut être atténué par l’augmentation de l’alcalinité, qui favorise l’oxydation directe du Mn(II) par l’O3 en diminuant la formation de radicaux hydroxyles (Paillard et coll., 1989). La cinétique de l’oxydation du Mn(II) par l’ozone est similaire à celle observée avec le permanganate et le dioxyde de chlore à un pH et une température similaires, bien que le taux de manganèse résiduel soit habituellement plus élevé. Selon Knocke et coll. (1990a) et Carlson et Gregory (2003), l’oxydation du Mn(II) avec l’ozone se produit rapidement (30 à 60 secondes) avec diverses doses d’ozone (0,5 à 2,0 mg/L) à des pH (5,63 à 7,0), des teneurs en COD (1 et 3,4 mg/L) et des températures (9 et 25 °C) variées, mais ces expériences n’ont pas révélé de faibles concentrations de manganèse résiduel (< 0,02 mg/L).
De nombreux auteurs ont souligné qu’il peut être difficile d’obtenir un dosage optimal de l’ozone en raison des demandes concurrentes en oxydant (Kohl et Medlar, 2006; Tobiason et coll., 2008; Brandhuber et coll., 2013). L’ozone oxyde le Mn(II) dissous, mais à des doses suffisamment élevées, il peut également oxyder des particules d’oxyde de Mn(III) et de Mn(IV) à l’état d’oxydation du Mn(VII) et produire du permanganate, ce qui peut causer une coloration rose de l’eau. Gregory et Carlson (2003) ont indiqué que pour éliminer efficacement le Mn(II) avec l’ozone, la demande provenant des matières organiques naturelles (MON) nécessitait l’utilisation de doses d’ozone assez élevées pour entraîner la production de Mn(VII) et une coloration de l’eau traitée.
Quelques études pilotes ont été menées pour évaluer une méthode d’élimination du manganèse consistant à effectuer une ozonation suivie d’une filtration (McKnight et coll., 1993; Wilczak et coll., 1993). McKnight et coll. (1993) ont réalisé des études pilotes visant à déterminer s’il était possible de remplacer le chlore par l’ozone pour oxyder le manganèse dans une usine de filtration conventionnelle. L’eau brute, à cet endroit, avait une teneur en COT de 6 à 8 mg/L, un pH de 6,5 à 7,2 et une alcalinité de 30 à 40 mg/L sous forme de CaCO3. Les auteurs ont découvert qu’il fallait des doses élevées d’ozone pour oxyder le Mn(II) dans l’eau brute et que les particules oxydées formaient de petits flocs à tête d’épingle difficiles à sédimenter et à filtrer. L’ozone était alors utilisé sur l’eau décantée. L’application d’une dose d’ozone de 2,5 mg/L à l’eau décantée suivie d’une filtration a permis d’éliminer 95 % du Mn(II) dissous, dont les concentrations initiales se situaient entre 0,6 et 1,0 mg/L. D’autres auteurs ont indiqué que l’oxydation du Mn(II) produisait des particules de MnOx(s) colloïdales difficiles à retirer après la sédimentation, et que des adjuvants de filtration étaient nécessaires pour capter les solides à l’étape de la filtration (O’Brien et coll., 1996; Tobiason et coll., 2008). En outre, on ajoute rarement du chlore avant la filtration lorsqu’une ozonation est effectuée à cette étape, ce qui élimine la possibilité de réactions d’adsorption/oxydation dans le filtre. Ces facteurs font en sorte qu’il est difficile d’obtenir des concentrations de Mn(II) dissous résiduel inférieures à 0,025 mg/L par un traitement à l’ozone (Tobiason et coll., 2008).
7.2.2.4 Chlore et oxygène
L’oxydation chimique directe du Mn(II) avec du chlore et de l’oxygène est rarement utilisée dans les usines de traitement de l’eau potable, parce que la cinétique réactionnelle est lente et le temps de contact insuffisant, sauf dans des conditions de pH alcalin (pH > 8 à 9) (Kohl et Medlar, 2006; Brandhuber et coll., 2013). Knocke et coll. (1990a) ont indiqué que des doses 4 fois plus élevées que la dose stœchiométrique pour le chlore libre et un temps de contact minimal de 3 heures avaient été nécessaires pour abaisser une concentration initiale de Mn(II) de 1,0 mg/L à 0,7 mg/L à un pH de 7,0 et une température de 25 °C. Lorsque le pH a été augmenté à 9,0, le Mn(II) a été oxydé à moins de 0,05 mg/L en une heure. Des températures moins élevées (14°C), de même que la présence de COD, ont aussi réduit de façon importante le temps de réaction. Avec le chlore, il faut également tenir compte du fait que si l’eau sortant de l’usine de traitement contient un taux élevé de Mn(II) dissous, celui-ci peut être oxydé par les résidus de chlore libre présents dans le réseau de distribution en raison des temps de contact et produire du MnOx(s). Ce phénomène pourrait donner lieu à des plaintes de consommateurs à l’égard de la couleur de l’eau (Kohl et Medlar, 2006; Brandhuber et coll., 2013). Comme il en a été mentionné précédemment, même si le chlore n’est pas efficace pour oxyder directement le Mn(II) dissous dans les conditions normales d’exploitation des usines de traitement, il est fondamental pour l’efficacité de certains procédés d’adsorption/oxydation abordés à la section 7.2.3 (Brandhuber et coll., 2013).
L’OD peut oxyder le Mn(II) dissous. Toutefois, comme dans le cas du chlore, la cinétique des réactions est lente à moins que le pH soit d’au moins 9,0 à 9,5. Ces conditions alcalines sont absentes de la plupart des procédés de traitement de l’eau potable, sauf dans les usines de traitement qui utilisent un procédé d’adoucissement chaux-soude ou à la chaux.
7.2.3 Adsorption/oxydation
Le traitement du Mn(II) dissous par adsorption et oxydation est fondé sur la présence des MnOx(s) recouvrant le matériau filtrant, qui ont la capacité d’adsorber le Mn(II) dissous dans l’eau d’alimentation et de le retenir dans le lit filtrant. La surface de ces oxydes agit alors comme catalyseur pour l’oxydation du Mn(II) adsorbé par les oxydants (p. ex., chlore ou permanganate) ajoutés à l’eau, pour produire encore plus d’oxydes. Il existe plusieurs types de matériaux filtrants qui peuvent adsorber le Mn(II) dissous. Citons notamment le sable vert de manganèse, la pyrolusite, et les matériaux filtrants conventionnels recouverts d’un enrobage de MnOx(s) appliqué commercialement par le fournisseur du matériau filtrant. L’ajout continu ou intermittent d’oxydant à l’eau brute avant son contact avec le matériau filtrant est nécessaire au maintien des sites d’adsorption des MnOx(s) (Knocke et coll., 1990b; Tobiason et coll., 2008; Islam et coll., 2010). Le lieu où est effectuée cette procédure dans l’usine de traitement peut varier. Dans les usines de traitement des eaux de surface qui effectuent une chloration avant la filtration, cette étape fait souvent partie du procédé de filtration utilisé pour éliminer les particules. Si aucune chloration de préfiltration n’est effectuée, un contacteur d’adsorption peut être placé après la filtration (Knocke et coll., 2010). Dans les usines de traitement des eaux souterraines, le procédé d’adsorption/filtration est souvent utilisé expressément pour l’élimination du manganèse et/ou du fer. L’un des principaux avantages de la présence d’un milieu de filtration enrobé de MnOx(s) dans la chaîne de traitement est qu’elle permet d’obtenir des concentrations uniformément faibles (< 0,015 mg/L) de manganèse dans l’eau traitée (Brandhuber et coll., 2013).
7.2.3.1 Sable vert de manganèse
Le sable vert de manganèse conventionnel est un matériau filtrant granulaire constitué de sable glauconieux. La glauconite est enrobée artificiellement d’une fine couche de matière à base de manganèse (ions manganeux), qui est ensuite transformée en une couche de MnOx(s) par le traitement du sable vert à l’aide d’une solution de permanganate de potassium ou de chlore (Knocke et coll., 1990b; Sommerfield, 1999). Ce matériau possède une grande capacité d’adsorption pour éliminer le Mn(II) dissous (1,5 kg/m3). Le matériau filtrant en sable vert est généralement plus petit (taille effective de 0,30 à 0,35 mm) que celui en sable siliceux; par conséquent il capte bien les petites particules. Puisque la perte de charge générée est supérieure à celle d’un lit filtrant de même profondeur en sable siliceux, le sable vert est le plus souvent utilisé avec la filtration sous pression (Brandhuber et coll., 2013). De plus, les filtres au sable vert conviennent davantage pour les réseaux d’eaux souterraines où la concentration en fer et en manganèse est inférieure à 5 mg/L (Kohl et Medlar, 2006).
Deux méthodes normalisées peuvent être utilisées pour éliminer le manganèse par filtration au sable vert : la régénération continue et la régénération intermittente. La régénération continue nécessite d’ajouter un oxydant (permanganate de potassium ou chlore) ou une combinaison de deux oxydants à l’eau brute avant qu’elle entre en contact avec le sable vert. Lorsque l’oxydant utilisé est le permanganate de potassium, la majorité du Mn(II) dissous dans l’eau de la source d’approvisionnement sera directement oxydée en MnOx(s) et le sable vert agira essentiellement comme un système d’élimination physique. Si toutefois du Mn(II) atteint le sable vert, il peut être éliminé par adsorption sur l’enrobage de MnOx(s). Dans ces cas, la capacité d’adsorption du sable vert diminue plus lentement puisque le manganèse qui entre dans le filtre est déjà oxydé. Lorsque la perte de charge a atteint un niveau donné, on effectue un lavage à contre-courant pour retirer les particules de MnOx (Knocke et coll., 1990). Un excès d’oxydant est nécessaire pour assurer la régénération des sites d’adsorption du MnOx(s). Il est important de savoir que l’ajout continu de permanganate de potassium au sable vert peut entraîner une coloration de l’eau traitée, car ce procédé crée un excédent de permanganate (Brandhuber et coll., 2013). Du chlore, ou de faibles doses de permanganate de potassium combinées à du chlore, peuvent aussi être utilisés pour la régénération continue du milieu filtrant en sable vert. Maintenir une concentration de chlore libre de 0,5 à 1,0 mg/L dans l’ensemble du milieu filtrant permet la régénération de son enrobage de MnOx(s) en oxydant le Mn(II) adsorbé. Selon Brandhuber et coll. (2013), l’utilisation de chlore libre constitue une solution convenable pour la régénération du milieu filtrant de sable vert, en raison de son coût peu élevé en produits chimiques, de la plus faible quantité de solides qui se retrouve dans le filtre, et de l’absence de risque de coloration de l’eau attribuable à un excès de permanganate. Le chlore libre peut régénérer l’enrobage de MnOx(s) du milieu filtrant en oxydant le Mn(II) absorbé. Dans les cas où la concentration de Mn(II) dépasse 1 mg/L dans l’eau de la source d’approvisionnement, ou s’il faut diminuer la formation de sous-produits de désinfection (SPD), le permanganate de potassium peut alors être l’oxydant de choix ou à privilégier, en utilisant des concentrations moins élevées de chlore libre.
Dans un procédé de régénération intermittente, le Mn(II) est éliminé par le milieu filtrant en étant adsorbé sur l’enrobage de MnOx(s) du sable vert. À mesure que les sites d’adsorption se remplissent, le milieu filtrant commence à perdre sa capacité à éliminer le Mn(II) dissous. Le milieu filtrant doit alors être retiré de la chaîne afin qu’un oxydant puisse être appliqué pour oxyder le Mn(II) adsorbé et créer de nouveaux sites d’adsorption. Cette méthode exige une surveillance minutieuse du Mn(II) dans l’eau traitée, car le milieu filtrant de sable vert doit être retiré et régénéré avant qu’une quantité importante de Mn(II) dissous traverse le filtre et se retrouve dans l’eau traitée.
Kohl et Medlar (2006) ont présenté des données provenant d’usines de traitement des eaux souterraines ayant recours à la filtration au sable vert de manganèse. Ces usines ont atteint un taux d’élimination du manganèse de 86 % à 100 %, en obtenant une concentration moyenne inférieure à 0,020 mg/L dans l’eau traitée alors qu’elle se situait entre 0,35 mg/L et 0,52 mg/L dans l’influent.
Outre les milieux filtrants granulaires faits avec de la glauconite, plusieurs fabricants produisent des milieux filtrants en charbon anthraciteux et en sable siliceux recouverts d’une couche de MnOx(s) appliquée par traitement chimique. Ces milieux filtrants éliminent le Mn(II) par le même mécanisme que le sable vert. Récemment, l’offre en glauconite a été limitée et ces matériaux de rechange constituent une solution viable pour les usines de traitement de l’eau qui utilisent une technique de traitement fondée sur l’adsorption/l’oxydation.
7.2.3.2 Couches de MnOx(s) sur un milieu filtrant conventionnel
Une méthode d’élimination du Mn(II) importante, mais souvent oubliée, est l’adsorption de Mn(II) sur une couche de MnOx(s) qui se crée sur les milieux filtrants en charbon anthraciteux et en sable siliceux dans une usine de traitement, en raison de la présence de Mn(II) et de chlore libre dans le lit filtrant (Knocke et coll., 1988, 1990 b). Dans ce procédé, le Mn(II) adsorbé est par la suite oxydé par la présence de chlore libre dans tout le filtre, de façon à créer de nouveaux sites d’adsorption sur les MnOx(s) (régénération continue). En outre, seule une partie des MnOx(s) est éliminée lors du lavage à contre-courant, ce qui permet une augmentation nette du nombre de sites pendant la durée d’opération (Hargette et Knocke, 2001). Ce processus est appelé effet naturel du sable vert par Knocke et coll. (1988) et effet du milieu filtrant artificiellement enrobé d’oxydes par Kohl et Medlar (2006). Dans beaucoup d’usines de traitement, ce processus s’amorce et se maintient de lui-même sans que les ingénieurs de procédé et les opérateurs s’en aperçoivent (Kohl et Melar, 2006; Brandhuber et coll., 2013).
Plusieurs recherches ont été menées dans le but de mieux comprendre les facteurs qui contribuent à l’élimination efficace du Mn(II) dans les usines de traitement qui utilisent un milieu filtrant enrobé de MnOx(s). L’efficacité de la filtration par milieu filtrant enrobé de MnOx(s) dépend du nombre de sites d’adsorption et de l’état d’oxydation du milieu filtrant, du pH de l’eau, et de la concentration de chlore libre dans le filtre (Knocke et coll., 1988, 1990 b, 1991; Hargette et Knocke, 2001; Tobiason et coll., 2008). Brandhuber et coll. (2013) ont résumé les principales conditions opérationnelles propices au bon fonctionnement de ce procédé. Ces conditions comprennent une concentration en chlore libre de 0,5 à 1,0 mg/L dans l’eau filtrée (pour assurer une régénération efficace du revêtement de MnOx(s)), ainsi que l’application au filtre d’un pH de 6,0 ou plus, parce qu’un pH plus faible créerait une concurrence entre le Mn(II) et les ions H+ pour les sites d’adsorption. Enfin, le manganèse doit entrer dans le filtre sous forme de Mn(II) dissous, puisque les particules de Mn(IV) ne sont pas adsorbées sur le milieu filtrant. Brandhuber et coll. (2013) ont noté que dans ces conditions, les usines de production d’eau potable réussissent régulièrement à obtenir des concentrations en manganèse très faibles dans l’eau traitée (< 0,015 mg/L), même avec des concentrations aussi élevées que 0,5 mg/L avant la filtration.
Tobiason et coll. (2008) ont réalisé des recherches sur des milieux filtrants en charbon anthraciteux et en sable siliceux enrobés de MnOx(s) obtenus dans des installations de traitement de l’eau à grande échelle. Les résultats de leurs recherches indiquent que le niveau d’enrobage est plus élevé sur les milieux filtrants qui sont exposés en premier au chlore libre et au Mn(II) lorsque l’eau traverse le filtre (p. ex. la couche supérieure d’un filtre à deux couches), peu importe le type de matériau (anthracite et sable). L’adsorption du Mn(II) se produit donc dans la partie supérieure du lit filtrant. Cette étude a également révélé que même si les résidus normaux de chlore libre utilisés dans une usine de traitement peuvent régénérer partiellement les sites d’adsorption de MnOx(s), la capacité d’élimination du manganèse diminue avec le temps. Il a été suggéré que les installations aient occasionnellement recours à la régénération intermittente hors ligne du milieu filtrant, en utilisant des solutions de chlore ou de permanganate de potassium pour en améliorer la capacité d’adsorption.
Le potentiel de formation de SPD est l’un des principaux points dont il faut tenir compte avec la filtration sur milieu filtrant enrobé de MnOx(s). Tobiason et coll. (2008) ont démontré que le recours à la chloration de préfiltration avec un milieu filtrant enrobé de MnOx(s) pour l’élimination du manganèse peut faire augmenter de 10 à 50 % les concentrations de SPD (THM et HAA) dans le réseau de distribution, comparativement à une chloration après la filtration.
Au cours des dix dernières années, beaucoup de gouvernements ont modifié les règlements relatifs aux SPD dans l’eau potable, ce qui a poussé les usines de traitement à déplacer le point d’application du chlore en aval des filtres. Ce changement fait en sorte qu’il n’y a pas de résidus de chlore libre dans le filtre et exclut ainsi la possibilité d’utiliser la filtration sur milieu enrobé de MnOx(s) pour éliminer le manganèse. Plusieurs auteurs ont démontré que la libération du manganèse accumulé sur un milieu filtrant enrobé de MnOx(s) entraînait des concentrations élevées de manganèse dans l’eau traitée pendant la transition vers la filtration biologique (Gabelich et coll., 2006; Tobiason et coll., 2008; Kohl et Dixon, 2012). Les installations qui songent à déplacer le point d’application du chlore après le filtre devraient évaluer le potentiel de rejet de manganèse du milieu filtrant. La libération de manganèse provenant du milieu filtrant a été observée dans divers systèmes possédant différentes concentrations et sources de manganèse (et non seulement dans des systèmes où l’eau de la source d’approvisionnement contient une concentration élevée de manganèse). Citons, par exemple, les systèmes dont l’eau de la source d’approvisionnement présente une concentration en manganèse faible mais constante, et les systèmes où sont utilisés des coagulants (p. ex. le chlorure de fer(III)) contenant des impuretés de manganèse. Kohl et Dixon (2012) ont réalisé des essais pilotes avec un système de filtration conventionnel de 23 L/min en utilisant un milieu filtrant provenant d’une usine de traitement à grande échelle et recouvert d’un enrobage uniforme et bien établi de MnOx(s). Lorsque les filtres ont été utilisés sans chlore, ils ont commencé à relâcher du manganèse, ce qui a provoqué une augmentation allant jusqu’à 0,03 mg/L de la concentration de manganèse dans l’eau filtrée, pendant une période allant jusqu’à 30 jours. De même, Gabelich et coll. (2006) ont fait état d’un milieu filtrant, dans une usine à grande échelle, qui a commencé à relâcher du manganèse dans les heures suivant l’élimination du chlore dans les filtres (conversion à la filtration biologique). Il a été établi que le manganèse était attribuable aux impuretés présentes dans le coagulant en chlorure de fer(III) utilisé à l’usine et à la présence de chlore libre dans les filtres, qui ont causé une accumulation de MnOx(s) dans le milieu filtrant. L’installation en question a signalé une augmentation allant de 70 à 110 µg/L du manganèse total à la sortie de l’usine après que le chlore ait été éliminé dans les filtres. Des essais plus approfondis ont révélé que la dissolution du manganèse provenant du milieu filtrant est un processus complexe au cours duquel se produisent des échanges entre trois formes chimiques de manganèse dans la partie supérieure du milieu filtrant (premier mètre). Il semble également que le choix du coagulant et le pH de la solution aient une grande incidence sur la mobilité du manganèse dans le milieu filtrant.
Dans les cas où il faut limiter la quantité de chlore ajoutée avant la filtration pour prévenir la formation de SPD, l’utilisation de contacteurs sur milieu filtrant de MnOx(s) après la filtration peut constituer un traitement approprié contre le manganèse (Tobiason et coll., 2008; Knocke et coll., 2010; Bierlein et coll., 2015). Knocke et coll. (2010) ont fait la preuve qu’un contacteur d’adsorption sur milieu enrobé de MnOx(s) constitue un moyen efficace d’éliminer le Mn(II) dissous pour toute une gamme de pH (6,3 à 8,0), de doses de chlore libre (> 1,0 mg/L), de concentrations initiales de Mn(II) (0,03 à 0,3 mg/L) et de taux de charge hydraulique (jusqu’à 24 gpm/pi2).
Comme il est mentionné plus haut, l’efficacité de la filtration sur milieu filtrant enrobé de MnOx(s) dans les usines à grande échelle a été démontrée dans plusieurs études (Charlton et coll., 2002; Kohl et coll., 2002; Herzner et coll., 2003; Angara et coll., 2004; Kohl et Medlar, 2006, Tobiason et coll., 2007, 2008). Les résultats d’une enquête menée auprès de plusieurs usines utilisant la filtration sur milieu filtrant enrobé de MnOx(s) donnent une concentration moyenne de 0,007 mg/L dans l’eau traitée pour l’ensemble des usines. Le taux d’élimination dans ces usines allait de 98 à 99 %, chaque usine présentant une concentration moyenne de manganèse variant entre 0,001 mg/L et 0,014 mg/L dans l’eau traitée (Kohl et Medlar, 2006). Selon Jeffcoat et coll. (2007), déplacer le point d’injection du chlore du mélangeur rapide à l’influent du filtre (où se crée le milieu filtrant enrobé de MnOx(s)) dans une usine conventionnelle à grande échelle est une méthode efficace pour éliminer le manganèse. Des concentrations de manganèse d’environ 0,05 mg/L dans l’influent ont été abaissées à moins de 0,01 mg/L à l’aide de ce procédé.
Tobiason et coll. (2008) et Brandhuber et coll. (2013) ont publié des données tirées d’études de cas portant sur des installations utilisant la filtration sur milieu filtrant enrobé de MnOx(s) pour éliminer le Mn(II) dissous. Tobiason et coll. (2008) ont démontré qu’une usine d’un débit de 25 mgd utilisant la coagulation à l’alun, la floculation, la décantation, la filtration sur milieu filtrant double et la désinfection au chlore libre avait pu diminuer la concentration de chlore avant la filtration sans nuire à l’élimination du Mg(II). Après que la dose de chlore préfiltration a été diminuée de 2,8 à 1,6 mg/L, les résidus de chlore après la filtration sont passés de 0,9 à 0,2 mg/L. Les concentrations de Mg(II) dans l’eau traitée sont demeurées inférieures à 0,020 mg/L pendant toute la transition, malgré des concentrations dans l’eau brute de 0,1 à 0,7 mg/L.
7.2.3.3 Pyrolusite
Il est possible d’éliminer le manganèse d’une solution par adsorption sur une tour de filtration composée de pyrolusite granulaire, qui est la forme minérale du MnO2(s) (aucun enrobage nécessaire). Les filtres de pyrolusite utilisés pour le traitement de l’eau potable sont généralement constitués d’un mélange de sable et de pyrolusite. Le rapport sable/pyrolusite dépend de la concentration de manganèse dans l’eau de la source d’approvisionnement. Il arrive souvent que du chlore soit ajouté à l’eau en amont du filtre pour assurer la régénération continue du milieu filtrant en pyrolusite. Cependant, une régénération intermittente effectuée avec de l’eau de lavage à contre-courant chlorée peut aussi être efficace. L’un des avantages du milieu filtrant en pyrolusite est qu’il peut permettre d’obtenir des taux de filtration plus élevés qu’avec le sable vert, et réduire ainsi la grosseur des filtres et les coûts de construction (Sommerfield, 1999, Casale et coll., 2002). Toutefois, comme les milieux en pyrolusite possèdent une très forte densité (> 4,0), ils nécessitent des taux de charge hydraulique plus élevés pour fluidiser le lit filtrant lors des lavages à contre-courant.
Peu de données sont disponibles sur l’efficacité de la pyrolusite pour l’élimination du manganèse. Les données publiées par Kohl et Medlar (2006) indiquent que la pyrolusite a permis d’éliminer de 81 à 99 % du manganèse dans trois usines de traitement des eaux souterraines. Ces usines ont réussi à obtenir, dans l’eau traitée, des concentrations de manganèse de 0,001 mg/L à 0,024 mg/L.
Kenari et Barbeau (2014) ont présenté une utilisation différente de la pyrolusite pour l’élimination du Mn(II) dissous. Ils ont utilisé un réacteur à lit fluidisé comme moyen de contact entre l’eau et le milieu filtrant en pyrusite. Les résultats de leurs essais indiquent qu’après une minute ou moins de temps de contact, presque 100 % du Mn(II) dissous avait été éliminé (avec des concentrations initiales de manganèse allant jusqu’à 0,3 mg/L). Du chlore libre a été utilisé comme oxydant pour régénérer la surface du milieu filtrant en pyrolusite dans le lit fluidisé. Des charges hydrauliques de 24 à 63 m/h appliquées au lit filtrant ont permis d’éliminer le Mn(II) dissous de façon extrêmement efficace (pH entre 6,2 et 7,8).
7.2.4 Filtration biologique
L’élimination du manganèse par filtration biologique repose sur la capacité de bactéries oxydant le manganèse (BOM) présentes naturellement dans les films biologiques recouvrant les milieux filtrants à adsorber et oxyder le Mn(II) dissous et à former du Mn(IV) particulaire, qui peut être ensuite éliminé par lavage à contre-courant. De nombreuses souches de bactéries ayant la capacité d’oxyder le Mn(II) ont été recensées dans la documentation. Leptothrix, Sphaerotilus, Crenothrix et Metallogenium en sont des exemples (Mouchet, 1992). Les recherches ont révélé que les mécanismes d’élimination du Mn(II) par les BOM sont notamment l’oxydation intercellulaire par action enzymatique, l’adsorption à la surface de la membrane cytoplasmique, et l’oxydation extracellulaire par l’action catalytique des polymères excrétés. L’adsorption sur les particules de MnOx(s) qui s’accumulent dans le filtre pendant le processus d’oxydation contribue également de façon importante à l’élimination du Mn(II) dans les procédés de biofiltration (Casale et coll., 2002; Burger et coll., 2008a, Sahabi et coll., 2009; Kohl et Dixon, 2012; Brandhuber et coll., 2013; Bruins et coll., 2015).
Plusieurs facteurs biologiques et physicochimiques influent sur l’efficacité des filtres biologiques pour l’élimination du manganèse. Les facteurs biologiques sont notamment la présence et la diversité des BOM dans l’eau de la source d’approvisionnement, la capacité des BOM à former un biofilm actif dans les conditions d’utilisation du filtre, la période d’acclimatation de la population de BOM, et le maintien de l’activité biologique après un lavage à contre-courant ou d’autres contraintes exercées sur le filtre. La période d’acclimatation des BOM varie de 14 à 100 jours, les périodes les plus courtes étant observées après l’ensemencement des filtres et lorsque la température se situe entre 20 et 30 oC (Mouchet et coll., 1992; Holst, 2004).
Les facteurs physicochimiques importants sont le pH, le potentiel redox, la concentration initiale de Mn(II) et le taux de charge du filtre (Kohl et Dixon, 2012). Les conditions opérationnelles requises pour établir une population adéquate de BOM dans les filtres consistent notamment à maintenir des conditions aérobies avec une concentration en oxygène dissous (OD) minimale de 5 mg/L, un potentiel redox de 300 à 400 mV, et un pH égal ou supérieur à 6,3 (Mouchet coll., 1992; Burger et coll., 2008a; Hoyland et coll., 2014). La présence d’ammoniac, de nitrite et de sulfure dans l’eau de la source d’approvisionnement a des effets négatifs sur la capacité des BOM à oxyder le manganèse. On a également constaté que l’élimination du manganèse par biofiltration convenait généralement mieux aux eaux souterraines, car la concentration en manganèse, la température et le pH de ces eaux sont relativement stables. À l'inverse, dans les eaux de surface, la concentration de manganèse et la température varient beaucoup et il n’est pas certain que les BOM puissent survivre dans un biofiltre pendant une longue période dans ces conditions (Brandhuber et coll., 2013).
La documentation sur le sujet fait état de nombreuses usines de traitement par biofiltration qui ont réussi à éliminer le manganèse dans les eaux souterraines (Mouchet et coll., 1992; Li et coll., 2005; Burger et coll., 2008 b; Kohl et Dixon, 2012). Kohl et Dixon (2012) ont publié des données provenant de huit usines de traitement du Canada, de l’Europe et de la Chine qui utilisent des biofiltres à sable monocouches. Ces usines de traitement sont capables d’éliminer plus de 93 % du manganèse et d’atteindre des concentrations inférieures à la limite de détection de la méthode, établie à 0,03 mg/L. Plusieurs de ces usines sont situées au Nouveau-Brunswick et figurent dans les travaux de Burger et coll. (2008b). Dans la chaîne de traitement de ces usines, l’eau est pompée d’un aquifère vers un filtre à courant descendant ayant une capacité nominale de 1 325 L/min, une unité de filtration de 2,1 m de diamètre, un lit filtrant de 1,8 m de profondeur et une surface de 3,4 m2. De l’air comprimé est pompé dans les filtres pour assurer un potentiel d’oxydoréduction élevé. Les filtres sont soumis à un lavage à contre-courant d’une vitesse de 20 m/h après chaque tranche d’environ 300 heures d’exploitation. Après le lavage à contre-courant, on laisse maturer les filtres pendant 5 minutes avant de les remettre en service. Dans ces usines, les concentrations de manganèse variaient de 0,86 à 1,39 mg/L dans l’influent et on a réussi à éliminer > 99 % du manganèse (< 0,03 mg/L dans l’eau traitée). Dans l’eau de la source d’approvisionnement, le pH variait de 6,46 à 7,63 et la température de 9 à 10 °C.
Jusqu’à maintenant, la majorité des usines de filtration biologique du manganèse ont été mises en place pour traiter les eaux souterraines. Récemment, des recherches ont été menées afin d’examiner la possibilité d’utiliser la biofiltration pour éliminer le manganèse dans les eaux de surface (Kohl et Dixon, 2012; Granger et coll., 2014; Hoyland et coll., 2014). Hoyland et coll. (2014) ont mené des études à l’échelle de banc d’essai visant à évaluer s’il était possible d’éliminer à la fois les MON et le Mn(II) par biofiltration dans des conditions représentatives des usines de traitement de l’eau de surface utilisant la coagulation et l’ozonation avant la filtration. L’étude a révélé que les BOM pouvaient éliminer plus de 98 % du Mn(II) dans un biofiltre avec un pH aussi faible que 6,3. Des essais marginaux ont de plus révélé que des BOM bien acclimatés (50 jours) pouvaient éliminer efficacement le Mn(II) avec toute une gamme de concentrations dans l’influent (0,1 à 0,2 mg/L), de charge hydraulique (1,3 × 10-3 à 2,72 × 10-3 m/s), et de températures (7 à 22 °C) pendant une période de 1 à 2 jours. Kohl et Dixon (2012) ont publié des données sur l’élimination du manganèse dans une usine de traitement des eaux de surface d’un débit de 454 ML/jour utilisant l’ozonation intermédiaire et 14 filtres à double couche composés de 180 cm de charbon actif en grains (CAG) sur 25 cm de sable. L’ozone était appliqué après la sédimentation et avant la filtration, à une dose de 1,5 à 2,0 mg/l, et le pH à l’entrée des filtres était de 7,2 à 7,6. La concentration de manganèse total, dans l’influent, variait de 0,032 à 0,089 mg/L. Dans l’eau traitée, la concentration de manganèse était inférieure à 0,002 mg/L (LDM) dans tous les échantillons, ce qui signifie que 94 % du manganèse a pu être éliminé. En revanche, un taux d’élimination beaucoup moins élevé a été constaté dans une usine de traitement de 190 ML/jour utilisant l’ozonation intermédiaire et des filtres à CAG de 6 pieds (1,83 m) de profondeur. La concentration de manganèse total, dans l’influent, était cette fois de 0,018 à 0,071 mg/L. Les filtres ont éliminé en moyenne 40 % du manganèse total, mais de grandes variations (21 à 76 %) ont été observées pour différentes dates d’échantillonnage. Les auteurs n’ont pas cherché à déterminer l’origine de cette différence de rendement entre les deux usines.
Comme il a été mentionné à la section 7.2.3.2, il est important que les services publics qui envisagent de passer de la filtration sur milieu enrobé de MnOx(s) à la filtration biologique tiennent compte du manganèse accumulé sur le milieu filtrant, qui pourrait être libéré dans l’eau une fois le chlore libre résiduel épuisé (Gabelich et coll., 2006; Kohl et Dixon, 2012). On recommande aux installations qui ont l’intention de convertir un filtre existant contenant un milieu filtrant enrobé de MnOx(s) de retirer ce dernier et de le nettoyer ou le remplacer avant d’entreprendre la filtration biologique (Kohl et Dixon, 2012).
7.2.5 Adoucissement et échange d’ions
Les usines de traitement qui utilisent l’adoucissement à la chaux ou à la soude peuvent aussi éliminer le manganèse en augmentant le pH de l’eau (p. ex., > 9,5 à 10) au-dessus de la valeur de solubilité de diverses phases solides d’hydroxyde et de carbonate de manganèse. De même, le pH élevé associé à l’adoucissement à la chaux ou chaux-soude augmentera considérablement la vitesse d’oxydation du Mn(II) dissous en présence d’OD. La présence d’OD entraînera la formation de solides de MnOx(s). L’augmentation du pH de l’eau de la source d’approvisionnement ne constitue pas en elle-même un moyen rentable d’éliminer le Mn(II) dissous. Il s’agit plutôt d’une méthode que l’on utilise habituellement quand l’eau de la source d’approvisionnement doit être adoucie. Dans beaucoup d’installations faisant appel à l’adoucissement à la chaux ou à la soude, le taux élevé d’élimination du manganèse (ou du fer) obtenu découle des réactions chimiques liées à l’adoucissement. De plus, bien souvent, le personnel de l’usine n’utilise pas le système de traitement dans le but d’éliminer le manganèse. Dans les usines qui adoucissent l’eau, il peut arriver que le manganèse soit éliminé à l’insu de l’opérateur du système de traitement, en particulier si le manganèse ne fait pas l’objet d’une surveillance régulière dans l’eau de la source d’approvisionnement et dans l’eau traitée. Une usine d’adoucissement à la chaux à grande échelle a déclaré avoir obtenu une concentration moyenne de manganèse de 0,001 mg/L dans l’eau traitée à partir d’une concentration moyenne, dans l’eau de la source d’approvisionnement, de 0,520 mg/L (Kohl et Medlar, 2006).
Le Mn(II) dissous peut également être éliminé par échange de cations dans les procédés d’adoucissement à la zéolite. Comme c’est le cas pour d’autres procédés reposant sur l’échange de cations, le lavage à contre-courant de la zéolite, généralement effectué avec une solution hypersaline, permet d’éliminer le manganèse (tout comme le fer, le calcium et le magnésium) accumulé sur la résine. L’adoucissement à la zéolite comme moyen d’élimination du Mn(II) pose toutefois des préoccupations, notamment celle associée à la présence d’oxygène ou d’autres oxydants. Ces conditions peuvent entraîner l’oxydation des ions Mn(II) échangés en MnOx(s) à la surface de la zéolite, ce qui fera diminuer la capacité globale d’échange cationique de la résine de zéolite avec le temps (Sommerfield, 1999).
7.2.6 Séquestration
La séquestration est une mesure de contrôle qui vise à limiter les problèmes d’ordre esthétique de la qualité de l’eau causés par l’oxydation du Mn(II) dissous, qui forme des particules de MnOx(s) dans le réseau de distribution. La séquestration est généralement considérée comme une mesure de contrôle temporaire, parce que l’effet de l’agent séquestrant est d’une durée limitée (Kohl et Medlar, 2006). Puisque la séquestration n’élimine pas le manganèse de l’eau, elle ne réduit pas l’exposition au manganèse liée à l’eau potable. C’est pourquoi cette solution ne devrait être envisagée, comme mesure de contrôle visant à réduire le risque de coloration de l’eau, que pour les systèmes d’approvisionnement dont l’eau à la source ou l’eau traitée contient une concentration de manganèse inférieure à la CMA. Il convient toutefois de noter qu’une dose constante doit être maintenue à long terme. Dans la plupart des cas, la méthode la plus appropriée pour réduire les concentrations de Mn(II) dissous au robinet consiste à installer ou à optimiser un système de traitement du manganèse qui permettra de maintenir la concentration bien en deçà de la CMA et de l’OE, de façon à limiter la quantité de manganèse qui s’accumule dans le réseau de distribution. L’utilisation d’un agent séquestrant peut constituer la solution la plus pratique pour éviter la coloration de l’eau dans les très petits systèmes alimentés en eau souterraine qui présentent de faibles concentrations en Mn(II) à la source et dont les ressources sont limitées (AWWA, 1993). Une attention particulière devra toutefois être portée au risque d’accumulation et de libération subséquente de manganèse dans le réseau de distribution.
Lors d’une séquestration chimique, on utilise un agent chimique qui se liera au manganèse dissous afin de créer un complexe en solution dans lequel le manganèse ne peut être oxydé ou précipité. L’ajout de polyphosphates seuls ou en conjonction avec du chlore est la méthode la plus couramment utilisée pour la séquestration du manganèse (Sommerfield, 1999; Kohl et Medlar, 2006). La dose adéquate d’agent chimique séquestrant à utiliser dépend des caractéristiques de la qualité de l’eau et des recommandations du fabricant. Il est souvent difficile de déterminer la combinaison chimique à appliquer en raison de la variabilité de la qualité de l’eau (c.-à-d., variation des concentrations de manganèse et d’autres cations) et des conditions dans le réseau de distribution (c.-à-d., variation du temps de rétention et de la température) (Kohl et Medlar, 2006). De plus, les polyphosphates s’hydrolysent avec le temps et peuvent entraîner la libération de Mn(II) dissous séquestré antérieurement. La vitesse d’hydrolyse augmente à pH faible ou élevé, et avec la température de l’eau (Brandhuber et coll., 2013). Si la séquestration est utilisée comme mesure de contrôle, des échantillons doivent être prélevés périodiquement dans le réseau de distribution pour mesurer la concentration de manganèse total et s’assurer qu’elle demeure sous la CMA.
7.2.7 Autres facteurs à prendre en compte
Outre le manganèse présent dans l’eau de la source d’approvisionnement, l’ajout de produits chimiques et les procédés utilisés dans l’usine de traitement peuvent également influer sur la quantité de manganèse qu’une usine de traitement doit gérer. Les trois principales sources de manganèse résultant des opérations d’une usine de traitement sont :
- la présence d’impuretés de manganèse dans les coagulants (principalement des coagulants ferriques) utilisés pour la déstabilisation des particules;
- la resolubilisation du Mn(II) par la réduction de solides de MnOx(s) stockés dans les bassins de sédimentation, en raison des conditions anoxiques de ces bassins;
- la présence de manganèse dissous dans les flux de recyclage qui découle des opérations de traitement des solides (Tobiason et coll., 2008).
Kohl et Medlar (2006) ont résumé les études publiées sur les risques de contamination de l’eau potable par les sels ferriques susceptibles de contenir du manganèse. Certaines études ont révélé que dans les usines qui utilisent la coagulation améliorée, la contamination au manganèse du chlorure de fer(III) peut faire augmenter la concentration de manganèse soluble jusqu’à 0,5 mg/L. Les taux de manganèse attribuables à l’ajout d’un coagulant dans l’eau de surface varient généralement entre 0,025 et 0,055 mg/L. Les rejets provenant des solides présents dans les bassins de sédimentation contiennent habituellement des concentrations de 0,01 à 0,10 mg/l, avec quelques variations saisonnières, et le taux de manganèse provenant des flux de recyclage se situe entre 0,01 et 1 mg/L (Tobiason et coll., 2008). Par conséquent, bien que le débit total des flux secondaires découlant du traitement des résidus soit relativement faible en comparaison à celui de l’eau qui entre dans l’usine de traitement, la charge totale de Mn(II) provenant de ces flux secondaires peut être considérable. Il est fortement recommandé d’effectuer un échantillonnage rigoureux des flux secondaires pour y mesurer la concentration en Mn(II) dissous. Le traitement de ces flux secondaires pour en éliminer le Mn(II) dissous devrait également être envisagé. Brandhuber et coll. (2013) ont fait état d’un cas où une usine a fabriqué un milieu filtre à grande échelle enrobé de MnOx(s) pour traiter les flux secondaires provenant des installations de traitement des résidus avant qu’ils atteignent le réservoir terminal de l’usine (c.-à-d. la source d’eau d’alimentation de l’installation). La concentration de Mn(II) dissous dans l’eau non traitée des flux secondaires variait de 0,02 mg/L à plus de 1 mg/L. En faisant passer ces flux secondaires à travers le lit filtrant enrobé de MnOx(s), on a réussi à éliminer plus de 90 % du Mn(II) dissous. Avec le temps, cette usine a pu démontrer que le fait de traiter les flux secondaires provenant du traitement des résidus avant qu’ils atteignent le réservoir terminal permettait de diminuer considérablement la concentration de Mn(II) dissous dans l’influent de l’usine de traitement. Cette approche a permis de faciliter la gestion des problèmes de manganèse sur le plan opérationnel, et de faire des économies en réduisant la quantité d’oxydants chimiques nécessaire (p. ex. le permanganate) pour traiter l’eau de la source d’approvisionnement.
7.3 Réseau de distribution
Les concentrations de manganèse supérieures à 0,02 mg/L peuvent donner lieu à des plaintes relatives à la coloration de l’eau et à l’apparition de taches sur la plomberie et la lessive, et causer de l’insatisfaction envers la qualité de l’eau (Sommerfield, 1999; Casale et coll., 2002; Kohl et Medlar, 2006; Tobiason et coll., 2008). Dans certains cas, les problèmes de manganèse dans l’eau du robinet ne sont pas causés par de trop fortes concentrations de manganèse dans l’eau de la source d’approvisionnement, mais résultent plutôt de la libération de manganèse accumulé dans le réseau de distribution en raison de la présence constante de manganèse, même en faible concentration, dans l’eau de la source ou l’eau traitée. De temps à autre, une chimie de l’eau instable ou des perturbations physiques ou hydrauliques peuvent libérer des dépôts de manganèse dans le réseau de distribution, et entraîner des plaintes sur la coloration de l’eau.
En plus de ces préoccupations d’ordre esthétique, le manganèse peut agir comme capteur et servir de puits pour les métaux indésirables, et inhiber la formation d’incrustations de Pb(IV) stable dans les tuyaux en plomb (Schock et coll., 2014). Il crée donc d’autres risques pour la santé, car d’autres contaminants organiques concomitants peuvent être ainsi libérés dans le réseau (Schock et Holm, 2003; Shock, 2005). Un examen exhaustif de la documentation sur le sujet, effectué par Kohl et Medlar (2006), a révélé que des dépôts de manganèse peuvent se créer dans les réseaux de distribution même lorsque la concentration de manganèse dans l’eau qui sort de l’usine de traitement est aussi faible que 0,02 mg/L. Par conséquent, un objectif de ≤ 0,015 mg/L de manganèse est recommandé pour l’eau traitée (Brandhuber et coll., 2013).
Les services publics doivent veiller à ce que les mesures de contrôle et de traitement du manganèse mises en œuvre tiennent compte des dépôts et des éventuels rejets de manganèse dans le réseau de distribution. Dans bon nombre de cas, diminuer le plus possible la concentration de manganèse avant la distribution constitue la stratégie la plus efficace.
7.3.1 Accumulation et rejet de manganèse dans les réseaux de distribution
Les dépôts de manganèse peuvent être le fait d’un processus physique résultant de la sédimentation de particules (U.S. EPA, 2006), d’une sorption physico-chimique (Friedman et coll., 2010) ou d’une accumulation biologique (Sly et coll., 1990; Cerrato et coll., 2010; Ginige et coll., 2011). Le manganèse s’accumule dans les dépôts meubles de matériaux qui composent les tuyaux des réseaux de distribution, par exemple le fer (Zacheus et coll., 2001; Cerrato et coll., 2006; Peng et Korshin, 2011), le polyéthylène (Zacheus et coll., 2001), le polychlorure de vinyle (Cerrato et coll., 2006) et le plomb (Schock et coll., 2014). Cerrato et coll. (2006) ont découvert que le manganèse s’accumulait moins dans les tuyaux en fer (3,48 % en poids) que dans les tuyaux en PVC (6 % en poids). Ils ont aussi découvert que dans les tuyaux en fer, le manganèse était associé à des dépôts sous forme de pustules, alors que dans les tuyaux en PVC, il s’agissait de dépôts de surface facilement éliminés/libérés. La concentration en manganèse de l’eau, dans les réseaux de distribution, diminue à mesure que l’eau s’éloigne de l’usine de traitement (Kohl et Medlar, 2006). Par ailleurs, Barbeau et coll. (2011) ont constaté que la concentration de manganèse dans l’eau était inversement proportionnelle à son âge, une diminution de 37 % ayant été observée après un temps de rétention de 24 heures. Notamment, Brandhuber et coll. (2015) ont estimé le manganèse emmagasiné dans les conduites d’un système de distribution d’après les données de Friedman et coll. (2010). Les dépôts de manganèse variaient de 0,1 mg/pi2 à 10 000 mg/pi2, avec une médiane estimée à 210 mg/pi2, ce qui équivaut à environ 3,8 lb Mn/mille (pour un tuyau de 6 pouces de diamètre) ou 7,7 lb Mn/mille (pour un tuyau de 12 po de diamètre). Brandhuber et coll. (2015) ont également noté que la libération de seulement 1,5 % des dépôts de manganèse suffisait pour que les valeurs des recommandations sur la santé de l’U.S. EPA, soit 1 mg Mn/L pour 1 jour et 10 jours, soient dépassées. Peng et Korshin (2011) ont découvert que le manganèse était fortement lié aux fractions organiques et mobiles des incrustations de corrosion, et que la majorité du manganèse se trouvait sous forme dissoute. Les auteurs ont également découvert que 9 % du manganèse faisait partie de la fraction échangeable, laquelle est susceptible d’être remplacée par des ions concurrents, ce qui rend les dépôts de manganèse vulnérables aux variations dans la qualité de l’eau.
Les perturbations physiques qui touchent le réseau de distribution peuvent également causer la libération d’incrustations contenant du manganèse. Par exemple, Del Toral et coll. (2003) ont fait état d’un lien entre la libération accrue de plomb et divers événements perturbateurs tels que l’installation/le remplacement d’un compteur, l’installation d’un compteur automatisé, la réparation d’une fuite, la réparation ou le remplacement du robinet d’arrêt de la conduite externe, ou d’importants travaux d’excavation dans la rue.
Le manganèse peut aussi s’accumuler dans les biofilms du réseau de distribution (Ginige et coll., 2011; Cerrato et coll., 2010; Sly et coll., 1990). Des bactéries oxydant (Cerrato et coll., 2010; Sly et coll., 1990) et réduisant (Cerrato et coll., 2010) le manganèse ont été identifiées. Il a été démontré que le manganèse emprisonné et accumulé dans les biofilms de l’eau potable pouvait être libéré lors de l’inactivation de ces biofilms (Ginige et coll., 2011). Dans le cadre d’études à l’échelle du banc d’essai réalisées par Ginige et coll. (2011), des réacteurs à biofilm exposés à des influents contenant une concentration faible (0,02 mg/L) et élevée (0,04 mg/L) de manganèse ont été soumis pendant 14 jours à un traitement de désactivation du biofilm correspondant à 3 mg/L de chlore. Dans les deux réacteurs (concentration faible et élevée), la concentration d’ATP a diminué d’un facteur de 10 en 2 jours. Pendant l’inactivation, la turbidité et le taux de manganèse ont tous les deux augmenté dans les deux réacteurs. Dans le réacteur exposé à l’influent contenant une faible concentration, la libération de manganèse a atteint son apogée au jour 4, soit 0,07 mg/L, puis a diminué pour atteindre le niveau de référence, soit 0,01 mg/l, au jour 8. Dans le réacteur exposé à une concentration élevée, la libération de manganèse a culminé au jour 4 à 0,08 mg/L (0,06 mg/L à l’origine), et le taux de manganèse dans l’effluent a diminué graduellement pour tomber à 0,03 mg/L au jour 12. Les auteurs avancent que les substances exopolymériques et la couche d’oxyde/hydroxyde métallique pourraient jouer un rôle dans le rythme auquel le manganèse se détache des biofilms.
7.3.2 Répercussions de l’accumulation de manganèse sur les autres sources de préoccupation dans les réseaux de distribution
La présence de manganèse dans les réseaux de distribution a également des répercussions sur d’autres métaux préoccupants. L’accumulation de manganèse dans les tuyaux de plomb peut entraver la formation d’incrustations de Pb (IV) plus stables, ce qui accroît le risque de libération de plomb par le biais d’incrustations plus solubles (Schock et coll., 2014). Les MnOx(s) se sont révélés très efficaces pour capter toute une variété de métaux, y compris le plomb (Dong et coll., 2003) et l’arsenic (Ouvrard et coll., 2002). Freidman et coll. (2010) ont établi un lien entre les dépôts de MnOx(s) dans les matériaux de la tuyauterie et des éléments comme le baryum, le plomb, le nickel, le vanadium, l’arsenic, le radium, le chrome et l’uranium. Les dépôts de manganèse constituent des puits potentiels pour l’accumulation et la libération subséquente de ces métaux. Schock et coll. (2014) ont découvert que dans les réseaux de distribution où le manganèse était contrôlé au moyen d’un programme de rinçage unidirectionnel, les taux de plomb étaient eux aussi inférieurs, la quantité de plomb accumulée étant moins importante en l’absence de manganèse.
De plus, un lien a pu être établi entre la présence de particules dans le réseau de distribution et une teneur accrue en matières organiques (Vreeburg, 2010). Lors d’une étude où un traitement supplémentaire avait permis d’éliminer la totalité des particules (> 0,1 µm) entrant dans le réseau de distribution, la teneur en matières organiques s’est révélée six fois moins élevée que dans les réseaux de distribution conventionnels contenant des particules. Selon Vreeburg (2010), il se pourrait que les particules fassent augmenter la surface disponible pour la régénération biologique.
7.3.3 Gestion du manganèse dans les réseaux de distribution
Dans un article de synthèse portant sur la coloration de l’eau dans les réseaux de distribution, Vreeburg et Boxall (2007) mentionnent deux méthodes pour gérer les risques de coloration :
- adopter un seuil de nettoyage pour éviter l’accumulation de matière;
- limiter ou empêcher la pénétration ou la génération de particules dans le réseau de distribution.
De même, Brandhuber et coll. (2015) ont recommandé une méthode de gestion qui réduit au minimum la quantité de manganèse entrant dans le réseau de distribution, qui réduit au minimum la quantité de manganèse emmagasinée dans le réseau de distribution par des pratiques exemplaires de nettoyage des conduites principales, qui réduit au minimum les perturbations physiques/hydrauliques, et qui maintient la chimie de l’eau stable.
Des réseaux à grande vitesse d’écoulement peuvent être utilisés comme méthode d’autonettoyage afin de minimiser l’accumulation de sédiments (Vreeburg, 2010). Les particules qui s’accumulent pendant les périodes où le niveau de l’eau est bas peuvent être remises en suspension en augmentant suffisamment la vitesse d’écoulement de l’eau, prévenant ainsi les problèmes d’accumulation à long terme. La valeur pratique de cette technique peut être limitée, car la conception des réseaux de distribution doit s’y prêter (système ramifié par rapport à système en boucle).
Les sédiments peuvent également être enlevés par raclage, mais cette technique doit être utilisée avec précaution, car elle ne convient pas à tous les types de tuyaux et de qualités d’eau (FCM, 2003). Par exemple, le raclage de canalisations en fonte sans revêtement a été associé à une quantité accrue de fer et de rejets de plomb en aval, comparativement aux canalisations en fonte dotées d’un revêtement et ayant été raclées, et aux canalisations dépourvues de revêtement et n’ayant pas été raclées (Camara et coll., 2013).
Le rinçage unidirectionnel est considéré comme une pratique exemplaire pour gérer les particules en suspension dans un système de distribution (FCM, 2003; Brandhuber et coll., 2015). Zacheus et coll. (2001) ont constaté que dans la pratique, avant le rinçage, le manganèse constituait 3,7 % (en poids) des vieux dépôts mous présents dans les tuyaux du réseau de distribution, alors qu’un an après le rinçage, ils n’en constituaient que 0,58 % (en poids). De même, Barbeau et coll. (2005) ont découvert que les dépôts meubles retrouvés dans les canalisations de réseaux de distribution en fonte ductile recouverte de ciment, ainsi que dans celles en fonte grise sans revêtement, étaient constitués à 5,9 % (en poids) de manganèse. Un an après le rinçage, le contenu en manganèse avait diminué à 0,35 %. Dans une étude sur le terrain réalisée par Carrière et coll. (2005), le rinçage unidirectionnel s’est révélé efficace, dans certains cas, pour l’enlèvement des dépôts meubles dans le réseau de distribution. Les auteurs ont tenu à souligner que cette méthode devait être appliquée selon les particularités de chaque site. Vreeburg (2010) a également recommandé l’approche du « réservoir d’eau propre », qui nécessite que l’eau en amont utilisée pour le rinçage des canalisations provienne de tuyaux ne contenant aucune matière pouvant être remise en suspension, afin d’empêcher l’introduction de sédiments dans les canalisations rincées. Dans les cas extrêmes, le remplacement des tuyaux pourrait constituer une solution de dernier recours contre le manganèse accumulé dans les réseaux (Brandhuber et coll., 2015).
La stabilité des conditions de la qualité de l’eau est un facteur important pour réduire au minimum la libération de manganèse accumulé dans les réseaux de distribution. Friedman et coll. (2010) ont relevé plusieurs paramètres liés à la qualité de l’eau qui doivent être contrôlés afin de maintenir la stabilité de l’eau pour les dépôts de matière inorganique, dont le pH, le potentiel d’oxydoréduction et la corrosion. Le mélange non contrôlé des eaux de surface et des eaux souterraines ainsi que le mélange non contrôlé d’eau chlorée et chloraminée sont à éviter.
La gestion de l’accumulation et de la libération de manganèse peut représenter un défi de taille pour les usines de traitement, car même si une installation réussit à atteindre les OE, il se peut que les canalisations du réseau de distribution contiennent une quantité de manganèse accumulée avec le temps. Pour déterminer les zones du réseau de distribution qui présentent un risque élevé, il faut d’abord connaître les facteurs qui ont une incidence sur le risque d’accumulation (p. ex., présence de manganèse dans l’eau de la source d’approvisionnement et l’eau traitée, proximité de l’usine de traitement, matériau de fabrication des tuyaux, biofilm) et sur le risque de libération (p. ex., instabilité des conditions liées à la qualité de l’eau, perturbations hydrauliques/physiques). Les zones du réseau de distribution où le risque d’accumulation et de rejet est le plus élevé peuvent constituer des emplacements de choix pour effectuer une surveillance accrue fondée sur les événements.
7.4 Traitement dans les systèmes résidentiels
Dans les cas où l’on souhaite éliminer le manganèse à l’échelle résidentielle, par exemple lorsque l’eau potable d’une résidence provient d’un puits privé, un dispositif de traitement résidentiel peut être employé pour réduire les concentrations de manganèse dans l’eau potable. Avant d’installer un appareil de traitement, il faut faire analyser l’eau pour en établir la chimie générale et vérifier la présence de manganèse dans l’eau non traitée, ainsi que sa concentration. L’eau qui entre dans le dispositif de traitement et l’eau traitée doivent être analysées régulièrement par un laboratoire accrédité pour vérifier l’efficacité du dispositif. Comme les dispositifs de traitement perdent leur capacité d’élimination avec l’usage et avec le temps, ils doivent faire l’objet d’un entretien et/ou être remplacés à l’occasion. Les consommateurs doivent vérifier la durée de vie prévue des composantes de leur dispositif de traitement selon les recommandations du fabricant, et veiller à leur entretien au besoin.
Santé Canada ne recommande aucune marque particulière de dispositif de traitement de l’eau potable, mais conseille fortement aux consommateurs d’utiliser des dispositifs dont la conformité aux normes pertinentes de NSF International (NSF) et de l’American National Standards Institute (ANSI) est certifiée par un organisme de certification agréé. Ces normes visent à préserver la qualité de l’eau potable en assurant la sûreté des matériaux et l’efficacité des produits qui entrent en contact avec l’eau potable. La norme NSF/ANSI 42 Drinking Water Treatment Units – Aesthetic Effects contient des exigences relatives à la réduction du manganèse. Pour qu’un dispositif puisse être certifié pour la réduction du manganèse en vertu de la norme 42, il doit pouvoir réduire une concentration allant de 1 à 2 mg/L de manganèse dissous (Mn(II)) à une concentration maximale de 0,05 mg/L dans l’eau traitée (NSF/ANSI, 2014a).
Les organismes de certification, qui doivent être accrédités par le Conseil canadien des normes (CCN), garantissent qu’un produit ou un service est conforme aux normes en vigueur. Au Canada, les organismes suivants sont accrédités par le CCN pour la certification de la conformité aux normes de la NSF/ANSI des dispositifs de traitement de l’eau potable et des produits qui entrent en contact avec l’eau potable (CCN, 2014) :
- Groupe CSA;
- NSF International;
- Water Quality Association;
- UL LLC;
- Bureau de Normalisation du Québec;
- International Association of Plumbing and Mechanical Officials.
- La liste à jour des organismes de certification accrédités peut être obtenue auprès du CCN.
Bien qu’il n’existe actuellement aucune unité de traitement certifiée expressément pour la réduction du manganèse, plusieurs technologies de traitement peuvent être efficaces pour éliminer le manganèse à l’échelle résidentielle. Les systèmes de traitement du manganèse sont habituellement installés au point d’entrée (PE) dans la maison pour réduire la possibilité de coloration de l’eau et de taches sur la lessive (considérations d’ordre esthétique). Ces systèmes sont généralement conçus et fabriqués pour un usage résidentiel par des fournisseurs ou des détaillants de systèmes de traitement de l’eau potable. Les technologies de traitement qui peuvent être employées au point d’entrée dans la maison pour réduire le risque de coloration de l’eau et de taches sont l’échange d’ion (c.-à-d. un adoucisseur d’eau) et la filtration sur sable vert. Il existe également des dispositifs de traitement de l’eau potable qui réduisent les concentrations de manganèse au point d’utilisation (PU) dans la maison (p. ex. au robinet de l’évier de cuisine), ainsi que des filtres de type déversoir (p. ex. une carafe munie d’un filtre). Les technologies appropriées pour un traitement résidentiel sont l’osmose inverse, l’échange d’ions (adoucisseurs d’eau et autres systèmes d’échange cationique), et les filtres oxydants (p. ex. les filtres au sable vert).
Santé Canada recommande fortement que tous les composants et les produits chimiques utilisés pour ces traitements soient certifiés conformes aux normes pertinentes de la NSF/ANSI, soit la norme 60 (Drinking Water Treatment Chemicals Health Effects) (NSF/ANSI, 2014b), la norme 61 (Drinking Water System Components Health Effects) (NSF/ANSI, 2014c) et la norme 372 (Drinking Water System Components Lead Content) (NSF/ANSI, 2011). Les systèmes d’osmose inverse sont visés par la norme 58 (Reverse Osmosis Drinking Water Treatment Systems) (NSF/ANSI, 2014d) et les adoucisseurs d’eau par la norme 44 (Cation exchange water softeners) (NSF/ANSI, 2014e).
Le choix du système de traitement le plus efficace pour un foyer dépendra de divers facteurs, dont la concentration et la forme (dissoute ou particulaire) de manganèse, ainsi que d’autres paramètres de l’eau de la source d’approvisionnement comme la dureté, le fer, l’alcalinité, le sulfure, l’ammoniac et le carbone organique dissous.
Il a été démontré que le système de traitement par osmose inverse est la technique de traitement au PU la plus efficace et la plus fiable pour éliminer le manganèse de l’eau potable dans les habitations dont l’alimentation en eau contient des concentrations élevées de manganèse (Barbeau et coll., 2011; Brodeur et Barbeau, 2015; Santé Canada, 2015). Barbeau et coll. (2011) ont constaté que huit systèmes d’osmose inverse installés dans des habitations alimentées par un puits éliminaient 100 % du manganèse, malgré une concentration initiale élevée (> 1 mg/L). Dans un rapport plus détaillé produit à partir des mêmes données, Brodeur et Barbeau (2015) ont indiqué que les systèmes d’osmose inverse installés au PU pouvaient abaisser la concentration en manganèse à moins de 1,0 µg/L dans l’eau traitée lorsque la concentration de manganèse dans l’eau du puits se situait entre 141 et 3,9 µg/L (taux d’élimination de 86 à 100 %). Les systèmes d’osmose inverse au PU ont également fait l’objet d’essais contrôlés en laboratoire afin d’évaluer leur capacité à réduire les concentrations de manganèse au robinet (Santé Canada, 2015). Trois différents systèmes de ce type, certifiés selon la norme 58 de la NSF/ANSI pour ce qui touche l’élimination des métaux (c.-à-d. l’arsenic, le baryum, le chrome, le cuivre et le plomb), ont été testés dans le cadre de cette étude. Les essais ont été effectués conformément aux exigences énoncées dans la norme 58 de la NSF/ANSI concernant les allégations liées à la réduction des produits chimiques inorganiques. Deux séries d’essais ont été menées avec différentes concentrations de manganèse. Dans la première série, la concentration médiane de manganèse dans l’influent était de 100 µg/L pour les deux systèmes d’osmose inverse (une valeur représentative de la concentration moyenne de manganèse dans les puits). Deux des systèmes ont obtenu un taux d’élimination moyen supérieur à 95 %, avec des concentrations inférieures à 4 µg/L dans l’eau traitée. Le troisième système, qui a été mis à l’essai sans réservoir de stockage, a obtenu un taux d’élimination médian de 88 %, avec des concentrations inférieures à 24 µg/L dans l’eau traitée. Dans la deuxième série d’essais, les concentrations dans l’influent se situaient entre 1,5 et 3,5 mg/L (une valeur représentative des concentrations maximales de manganèse présentes dans l’eau de puits). Les résultats obtenus avec les deux systèmes étaient similaires à ceux de la première série, avec des taux d’élimination médians de 95 à 97 % et des concentrations de 63 à 100 µg/L dans l’eau traitée. Le système sans réservoir de stockage a obtenu un taux d’élimination plus faible, soit une médiane de 91 %, et une concentration de 140 µg/L dans l’eau traitée. Dans l’ensemble, dans la plupart des conditions, les systèmes d’osmose inverse installés au PU peuvent permettre d’abaisser la concentration de manganèse sous la CMA. Les propriétaires de puits dont l’eau contient une concentration élevée en manganèse (> 2 mg/L) devront peut-être utiliser une combinaison de deux technologies de traitement, comme l’échange d’ions au PE suivi de l’osmose inverse au PU, pour obtenir des concentrations inférieures à 100 µg/L dans l’eau traitée.
Il existe également des dispositifs au PU pourvus d’un milieu d’échange cationique qui sont efficaces pour éliminer le manganèse. Carrière et coll. (2011) ont découvert que les filtres de type déversoir contenant un milieu d’échange cationique (et de CAG) pouvaient réduire le taux de manganèse, dans l’eau d’un influent dont la concentration en manganèse était de 1 mg/l, avec une efficacité allant de plus de 60 % à 100 % de leur capacité estimée. Ces filtres ont même souvent atteint un taux d’élimination de 100 % lors de leurs premières utilisations. Les dispositifs d’échange cationique conçus pour être installés sous l’évier se sont également révélés efficaces pour éliminer le manganèse dissous (jusqu’à 100 %), mais dans certains cas leur efficacité a diminué après avoir atteint seulement 50 % de leur capacité de traitement prévue. Il est également important de noter que les concentrations de manganèse dans l’eau traitée augmentaient lorsque les dispositifs étaient utilisés au-delà de leur capacité estimée. Puisque les milieux d’échange cationique utilisés dans les dispositifs de traitement de l’eau potable ont une faible affinité au manganèse comparativement au calcium, au magnésium et à d’autres métaux comme le fer, les ions manganèse sont plus facilement séparés de la résine, ce qui réduit la capacité d’élimination et peut entraîner une quantité plus importante de manganèse dans l’eau traitée (Carrière et coll., 2011). Par conséquent, ces dispositifs doivent être utilisés avec beaucoup de précautions et faire l’objet d’une étroite surveillance.
Les adoucisseurs d’eau classiques utilisés pour traiter l’eau à l’entrée des habitations font également appel à l’échange d’ions et peuvent permettre d’éliminer de faibles concentrations de manganèse. Si l’eau de la source d’approvisionnement contient du manganèse particulaire, ce dernier peut endommager la résine et réduire l’efficacité du système. Comme il a été mentionné précédemment, le taux d’élimination des systèmes fondés sur l’échange d’ions peut varier en raison de la sélectivité de la résine envers les cations qui causent la dureté de l’eau (calcium et magnésium). Par conséquent, un adoucisseur d’eau sera moins efficace pour éliminer le manganèse si l’eau de la source d’approvisionnement est très dure ou si le système est utilisé pour traiter le fer. Brodeur et Barbeau (2015) et Barbeau et coll. (2011) ont constaté que l’efficacité des systèmes à échange d’ions utilisés pour traiter les eaux souterraines à l’échelle résidentielle variait beaucoup (-48 % à 99 %). Malgré l’écart important entre les différents taux d’élimination du manganèse observés dans cette étude, les systèmes se sont révélés efficaces dans l’ensemble. Soixante-quinze pour cent des systèmes ont réussi à éliminer 99 % du manganèse (concentrations dans l’influent allant jusqu’à 211 µg/L) et à atteindre une concentration inférieure à 19 µg/L dans l’eau traitée.
Les filtres oxydants au PE comme les filtres au sable vert peuvent être utilisés pour l’élimination du manganèse à l’échelle résidentielle. Ces systèmes contiennent un milieu filtrant traité avec du permanganate de potassium pour produire un enrobage qui absorbe et oxyde le manganèse dissous. Ces filtres sont souvent appelés filtres au sable vert de manganèse. Les filtres au sable vert demandent beaucoup d’entretien, y compris une régénération fréquente avec un oxydant et des lavages à contre-courant réguliers pour retirer les particules de manganèse oxydées. L’oxydant de choix est le chlore, bien que le permanganate de potassium puisse aussi être efficace. Une utilisation et un entretien déficients des filtres au sable vert ont été associés à une augmentation des concentrations de manganèse dans l’eau du robinet où l’eau de puits était traitée (Barbeau et coll., 2011). Brodeur et Barbeau (2015) ont publié des données sur trois filtres au sable vert installés dans des résidences pour l’élimination du manganèse. Aucun de ces systèmes n’a pu réduire la concentration de manganèse en deçà de 100 µg/L. On a de plus constaté que dans deux des systèmes, les filtres libéraient du manganèse, ce qui a fait augmenter de 17 à 199 % la concentration de manganèse dans l’eau traitée. Pour cette raison, les propriétaires qui veulent utiliser ce type de système de traitement pour l’élimination du manganèse doivent porter une attention particulière au choix du système et à son fonctionnement. De plus, il est important de vérifier régulièrement la concentration de manganèse dans l’eau traitée par filtration sur sable vert afin de s’assurer que le système élimine efficacement le manganèse et que le filtre ne libère pas de manganèse.
Selon la concentration de manganèse dans l’eau de la source d’approvisionnement et le type de traitement choisi, les propriétaires qui possèdent un puits pourraient décider de traiter l’eau au PE afin de réduire le risque de coloration de l’eau et de taches sur la lessive, en plus de traiter au PU pour s’assurer que la concentration de manganèse dans l’eau potable de la résidence est systématiquement en deçà de la CMA.
8.0 Cinétique et métabolisme
La section qui suit résume les données présentées dans plusieurs recherches récentes (Aschner et coll., 2005; Dorman et coll., 2006; Santé Canada, 2010) et dans des articles scientifiques publiés plus récemment. Le lecteur est invité à consulter ces documents pour obtenir des renseignements plus détaillés.
8.1 Absorption
Le manganèse est un nutriment essentiel qui est soumis à un contrôle homéostatique par la régulation de son absorption dans le tube digestif et de son excrétion hépatobiliaire (effet de premier passage) après son ingestion. En revanche, le manganèse inhalé lors d’une exposition en milieu professionnel peut être transporté au cerveau par l’appareil olfactif ou les voies respiratoires sans être soumis à ce contrôle homéostatique de l’absorption intestinale et au premier passage hépatique (Aschner et coll., 2005; Roth, 2006). L’absorption de manganèse par inhalation diffère donc considérablement de l’absorption par ingestion d’eau potable.
L’ingestion par voie alimentaire est la plus importante source d’exposition au manganèse par voie orale chez l’humain. Outre le contrôle homéostatique, l’absorption dépend de divers facteurs tels que la biodisponibilité et/ou la bioaccessibilité du manganèse dans le tube digestif, sa forme chimique, la quantité de manganèse ingérée, le bilan en fer, le sexe et l’âge. Chez les adultes, une plus petite partie du manganèse provenant des aliments et de l’eau est habituellement absorbée dans le tube digestif que chez les nourrissons (Davidsson et coll., 1988; Johnson et coll., 1991; Finley et coll., 1994; Institute of Medicine, 2000; Santé Canada, 2010). Des études menées sur l’exposition par voie orale chez les animaux ont donné des résultats similaires sur le plan de l’absorption (Pollack et coll., 1965; Davis et coll., 1993; Finley et coll., 1997; Zheng et coll., 2000). Le taux d’absorption du manganèse ingéré est plus élevé pendant la période néonatale, et il semblerait que la biodisponibilité du manganèse soit également plus élevée pendant cette période (Dorothy Klimis-Zacas, 1993). Le taux de rétention du manganèse serait particulièrement élevé chez les nouveau-nés, au taux de rétention de 20 % de l’apport oral ayant été mesuré chez des nourrissons nourris avec de la préparation pour nourrissons (Aschner and Aschner, 2005).
Un examen de 13 études publiées fondées sur une large gamme de scénarios d’exposition chez l’humain (sans égard à l’état de jeûne) n’a révélé aucune différence statistiquement significative sur le plan de la biodisponibilité (définie dans l’examen comme étant la fraction qui pénètre dans la circulation générale, c.à-d. excluant la partie excrétée dans la bile après l’effet de premier passage hépatique) du manganèse lorsque celui-ci est ingéré avec l’eau, comparativement aux aliments (le rapport aliment/eau était de 0,7) (Ruoff, 1995). Dans le cas des aliments, la disponibilité dans le tube digestif était la même que le manganèse ait été présent naturellement dans les aliments ou qu’il y ait été ajouté. Cependant, lorsque les données ont été réévaluées en tenant compte des personnes à jeun, la biodisponibilité du manganèse provenant de l’eau était environ deux fois plus élevée que celui provenant des aliments (le rapport aliment : eau était de 0,5) (Ruoff, 1995). Dans l’ensemble, ces données indiquent que la biodisponibilité du manganèse chez l’humain pourrait dépendre en partie des interactions entre le manganèse et les matières présentes dans le tube digestif (fibres, protéines et autres substances inorganiques), plutôt que de sa biodisponibilité dans chaque matière ingérée. Les recherches ont révélé que l’absorption nette du manganèse par la voie alimentaire était influencée par la présence de métaux traces, de cellulose, de pectine, de phytate, d’acide ascorbique et d’autres composants alimentaires (Aschner et coll., 2005), et par la bioaccessibilité du manganèse dans les matrices solides (c.-à-d. la proportion de manganèse, dans une matrice solide, qui est potentiellement biologiquement disponible pour absorption). La bioaccessibilité a été estimée entre 55 et 95 % dans une variété d’aliments d’origine animale (Lei et coll., 2013) et entre 12 et 41 % dans 20 sols en milieu urbain (Sialelli et coll., 2010). La biodisponibilité s’est révélée similaire chez des rats adultes ayant été soumis pendant 61 jours à des expositions équivalentes au manganèse dans l’eau potable et dans les aliments (Foster et coll., 2015). Il convient toutefois de noter que les changements adaptatifs qui se produisent chez les adultes pour contrôler le taux de manganèse après une forte exposition (notamment la diminution de l’absorption gastro-intestinale et l’augmentation de l’excrétion) ne sont pas établis chez les nourrissons, qui ne possèdent pas encore ces mécanismes de contrôle homéostatique (Aschner et coll., 2005; Foster et coll., 2015).
La forme chimique (c.-à-d. l’espèce) et l’état de valence du manganèse ont une incidence sur son absorption. Le manganèse soluble (p. ex. le chlorure de manganèse) est plus facilement absorbé (Roels et coll., 1997), tout comme l’état d’oxydation trivalent associé au complexe du manganèse présent dans le lait maternel humain. Cette forme trivalente se lie à la lactoferrine est elle est régulée, à travers le tube digestif, par les récepteurs de la lactoferrine dans les membranes de la bordure en brosse des cellules épithéliales sur toute la longueur de l’intestin grêle. Les préparations pour nourrissons contiennent l’état d’oxydation divalent, et comme celui-ci ne se lie pas à la lactoferrine, l’absorption dans l’intestin de peut pas être régulée par les récepteurs de la lactoferrine (Erikson et coll., 2007b). Dans certaines des études consultées, un apport élevé en manganèse dans l’alimentation chez des adultes en santé était accompagné d’une diminution du pourcentage d’absorption ainsi que d’une augmentation de la métabolisation hépatique et de l’élimination biliaire et pancréatique du manganèse (Finley et coll., 2003; Aschner et coll., 2005).
Autant chez les humains que chez les animaux, un faible bilan en fer augmenterait l’absorption du manganèse, peu importe les réserves en manganèse de l’organisme (Mena et coll., 1969; Chandra et Shukla, 1976; Shukla et coll., 1976; Finley et Davis, 1999; Arnich et coll., 2004). L’absorption du fer et l’absorption du manganèse dans le tube digestif font appel au même système de transport, ce qui crée une compétition entre le manganèse et le fer non-héminique pour ce qui touche le transporteur de métaux divalent 1 (DMT-1, aussi appelé DCT-1 ou nramp-2) (Davis et coll., 1992a), l’expression du DMT-1 (taux d’ARNm) augmentant considérablement dans le duodénum lorsqu’il y a une déficience en fer (Gunshin et coll., 2001).
L’absorption gastro-intestinale est aussi influencée par des facteurs liés à la personne, comme le sexe et l’âge. Chez l’humain, le manganèse est davantage absorbé dans le tube digestif chez les femmes que chez les hommes (Finley et coll., 1994), probablement en raison du bilan en fer moins élevé des femmes et de leur besoin accru en fer. Une augmentation de l’absorption et de la rétention a été observée chez les nouveau-nés et les nourrissons, jusqu’à un âge non déterminé chez les humains et jusqu’à 17 à 18 jours chez les rongeurs (Gruden, 1977; Keen et coll., 1986; Dörner et coll., 1989; Kostial et coll., 1989; Zlotkin et coll., 1995; Aschner et coll., 2005). Les nourrissons peuvent absorber jusqu’à 40 % du manganèse ingéré (comparativement à 3 % chez les adultes), ce qui les rend particulièrement vulnérables aux effets d’une forte exposition au manganèse (Neal et Guilarte, 2013). La rétention biliaire accrue du manganèse chez les nouveau-nés peut s’expliquer par l’immaturité de leur système hépatobiliaire (excrétion réduite) (Miller et coll., 1975; Cotzias et coll., 1976) et par une absorption accrue dans le tube digestif (Cahill et coll., 1980). L’absorption accrue observée chez les très jeunes enfants pourrait également être un mécanisme compensatoire résultant des besoins métaboliques des nourrissons, qui sont plus élevés que ceux des adultes parce que le manganèse est essentiel à une minéralisation des os adéquate et à la synthèse des tissus conjonctifs (Santamaria, 2008). La rétention du manganèse semble varier considérablement entre les individus : chez des adultes humains ayant reçu une dose de manganèse radiomarqué dans de la préparation pour nourrissons, l’absorption moyenne mesurée était de 5,9 ± 4,8 %, et l’écart de 0,8 à 16 %, ce qui représente une différence d’un facteur de vingt. Le taux de rétention mesuré au jour 10 (0,6 à 9,2 %) montrait également des différences considérables entre les individus (Davidsson et coll., 1989a).
On en connaît peu sur l’absorption du manganèse par voie cutanée, mais elle devrait être extrêmement limitée (Aschner et coll., 2005). Aucune donnée expérimentale concernant l’absorption du manganèse par cette voie n’a été recensée.
8.2 Distribution
De l’information relative à la distribution du manganèse a été résumée en détail dans deux évaluations (Aschner et coll., 2005; 2007) et dans un rapport de Santé Canada (2010).
8.2.1 Distribution dans les tissus
Le manganèse est distribué dans tout le corps par la circulation générale. Dans le sang, le manganèse est présent dans le plasma, où le Mn(II) se lie à l’albumine, dans les globules rouges, où il se lie principalement à l’hémoglobine (Gibbons et coll., 1976; Saric, 1986; Davidsson et coll., 1989b), et dans les globules blancs.
La distribution du manganèse dépend de sa forme chimique (valence et solubilité). Dans une étude de toxicité par voie alimentaire, les taux de manganèse dans le foie et les reins se sont révélés beaucoup plus élevés chez les souris mâles exposées à l’acétate de manganèse ou au carbonate de manganèse que chez celles exposées au chlorure de manganèse ou au dioxyde de manganèse (Komura et Sakamoto, 1991).
Dans la plupart des tissus humains, la concentration de manganèse varie entre 0,1 et 1 µg/g poids humide, mais des valeurs plus élevées ont été recensées dans le foie, le bulbe olfactif, les reins et certaines parties du cerveau chez des adultes présumés normaux (Aschner et coll., 2005). On trouve généralement les concentrations de manganèse les plus élevées dans les tissus riches en mitochondries, tels que le foie, le pancréas, les reins, l’hypophyse et les intestins. Les concentrations les plus faibles sont observées dans les muscles, les os et la graisse (Merian et coll., 2004; Santé Canada, 2010). C’est dans l’os qu’est stockée la plus grande quantité de manganèse, ces tissus contenant 25 à 40 % de la charge totale de manganèse dans le corps en raison de la concentration nette dans la masse osseuse (Aschner et coll., 2005; Roth, 2006). La gestation a été associée à des concentrations élevées de manganèse dans le foie des rats (Jarvinen et Ahlström, 1975).
Dans le lait humain, les concentrations sont généralement inférieures à 30 µg/L, mais des valeurs atteignant 60 µg/L ont été signalées (Santé Canada, 2010). Les concentrations de manganèse mesurées dans le lait diminuaient à partir de la naissance jusqu’à plus de sept jours post-partum (Arnaud et Favier, 1995). Les ratios des concentrations de manganèse dans le sang complet par rapport au lait maternel ont été estimés chez des femmes soumises à une exposition professionnelle ou environnementale à différents métaux dans une région de l’Inde fortement touchée par l’industrie sidérurgique, et chez des femmes (témoins) vivant à une distance de 100 km (Sharma et Pervez, 2005). Les ratios moyens variaient de 2,8 à 4,1 chez les femmes exposées, et de 1,7 à 2,5 chez les femmes du groupe témoin. Chez les deux groupes exposés, une corrélation a été établie entre la concentration de manganèse dans le sang et dans le lait maternel. Une étude menée au Bangladesh sur des mères exposées à des concentrations élevées de manganèse et d’autres métaux dans l’eau potable a révélé des taux élevés de manganèse dans l’urine, mais aucune corrélation n’a été établie entre une forte concentration de manganèse dans l’eau potable et des taux élevés dans le lait maternel ou le sang (Ljung et coll., 2009).
Les fœtus, les nouveau-nés et les petits sont exposés au manganèse (maternel) parce que celui-ci traverse la barrière placentaire et parce qu’il est présent dans le lait. Après que des rates mères aient été exposées par voie orale à du chlorure de manganèse dans l’eau potable (2 000 ppm) pendant la période de gestation (272 mg Mn/kg p.c. par jour) et de lactation (480 mg Mn/kg p.c. par jour), la charge totale de manganèse (mesurée par spectrométrie d’absorption atomique) dans le corps des nouveau-nés et des petits âgés de 11 jours a augmenté d’un facteur de six à huit. Cette augmentation était indépendante de l’âge et de la durée d’exposition; la même hausse a été observée que l’exposition ait eu lieu pendant la gestation seulement, l’allaitement seulement, ou la gestation et l’allaitement (Kostial et coll., 2005). Des concentrations accrues de manganèse ont également été observées dans le prosencéphale et le rhombencéphale de rats nouveau-nés après une exposition in utero (Kontur et Fechter, 1985).
8.2.2 Distribution dans le cerveau
Le cerveau absorbe facilement le manganèse de la circulation, et les niveaux peuvent augmenter dans le cerveau à la suite de fortes expositions. La demi-vie estimative du manganèse dans le cerveau est de 51 à 74 jours chez le rat, de 53 jours chez le macaque et de 53 jours chez l’humain (Cotzias et coll., 1968; Newland et coll., 1987; Takeda et coll., 1995).
Des recherches récentes portant sur l’absorption du manganèse dans le cerveau ont mené à la conclusion que le manganèse peut pénétrer dans le cerveau par différentes voies, notamment à partir du sang en traversant les cellules endothéliales capillaires de la barrière hématoencéphalique (BHE), en passant du sang au liquide céphalo-rachidien (LCR) par l’intermédiaire des plexus choroïdes, et lors d’une exposition par inhalation, en passant de la muqueuse nasale au bulbe olfactif par l’entremise des connexions neuronales du système olfactif. Toutefois, dans le dernier cas, l’absorption ne serait importante que si le sujet est soumis à une forte exposition respiratoire par voie nasale (Aschner et coll., 2005; Crossgrove et Yokel, 2005; Bock et coll., 2008). On ne sait pas avec certitude si l’une de ces voies en particulier prédomine dans les cas graves de manganisme ou dans les cas de troubles neurologiques légers chez l’humain, ni quels sont les principaux mécanismes de transport moléculaire de ces voies (Aschner et coll., 2005).
De nombreuses études menées chez les animaux font état d’une augmentation des concentrations de manganèse dans le cerveau après une exposition aiguë ou chronique par voie orale (Holbrook et coll., 1975; Rehnberg et coll., 1982; Kristensson et coll., 1986; Newland et coll., 1989; Chan et coll., 1992; Davis et coll., 1992b; Malecki et coll., 1996; Lai et coll., 1999). Dans l’une de ces études, une augmentation du taux de manganèse a été constatée dans certaines parties du cerveau de rats exposés au manganèse dans l’eau potable (10 mg MnCl2•4H2O/mL) pendant cinq jours, les concentrations les plus élevées ayant été observées dans le striatum et les concentrations les plus faibles dans le cortex cérébral. Après dix jours, les concentrations les plus élevées ont été relevées dans la protubérance et le bulbe rachidien, et les concentrations les plus faibles dans l’hypothalamus. Les variations du taux de manganèse entre les différentes parties du cerveau étaient plus marquées chez les nouveau-nés que chez les rats sevrés et les rats adultes (Chan et coll., 1992). Chez des petits femelles matures (JPN 120) de rats Wistar ayant été exposés directement au manganèse dans l’eau potable (280, 2800 ou 5 600 mg Mn/L) pendant toute la période de gestation et de lactation ainsi qu’à partir du sevrage, une augmentation de la concentration de manganèse liée à la dose a été observée dans toutes les parties du cerveau (soit le mésencéphale, la protubérance, le bulbe rachidien, le cervelet, le cortex cérébral et, de façon plus importante, l’hypothalamus, le striatum et l’hippocampe), sauf dans le cortex cérébral et l’hippocampe des rats ayant reçu la dose la plus faible (Lai et coll., 1999).
Une étude de Dorman et coll. (2000) a mis en évidence une différence, dans la distribution du manganèse dans le cerveau, entre des rats nouveau-nés et des rats adultes exposés à des doses similaires de chlorure de manganèse par voie orale (25 ou 50 mg/kg p.c. par jour). Une augmentation de la concentration de manganèse a été observée seulement dans le striatum et le cervelet chez les rats adultes du groupe ayant reçu la dose la plus élevée, alors que l’exposition des nouveau-nés a donné lieu à une augmentation de la concentration de manganèse dans le striatum, l’hippocampe, le rhombencéphale et le cortex cérébral chez tous les groupes exposés. Ces résultats indiquent que les risques de neurotoxicité seraient plus élevés chez les nouveau-nés que chez les adultes après une exposition à de fortes concentrations de manganèse par voie orale.
La toxicité induite par le manganèse est associée à des taux élevés de manganèse dans le cerveau après une forte exposition, et les régions du cerveau les plus particulièrement sensibles seraient le striatum (noyau caudé et putamen), le globus pallidus et le noyau sous-thalamique (appelés collectivement « ganglions de la base »), ainsi que les zones frontales du cortex (Dobson et coll., 2004). Chez l’humain, le noyau caudé/putamen et le globus pallidus ont été identifiés comme étant les principaux organes cibles de neurotoxicité après une exposition au manganèse (Pal et coll., 1999; Aschner et coll., 2005).
8.2.3 Absorption et efflux cellulaires
Le Mn(II) et le Mn(III) peuvent tous les deux traverser la BHE (Aschner et coll., 1999). Le Mn(II) utilise divers transporteurs de cations divalents, alors que le Mn(III) associé à la transferrine est absorbé par le biais du récepteur de la transferrine (TfR) (Santé Canada, 2010). L’absorption du Mn(II) non lié aux protéines semble se faire beaucoup plus rapidement que celle du complexe Mn(III)-transferrine (Tf); le Mn(II) serait donc l’espèce prédominante de manganèse qui pénètre dans le cerveau à partir du plasma, tandis que l’absorption du complexe Mn(III)-Tf jouerait un rôle moins important dans l’absorption du manganèse dans le cerveau (Yokel et coll., 2006). On en sait très peu sur les mécanismes de transport du manganèse dans le cerveau pendant le développement. Les DMT-1 et les TfR sont présents dans le cerveau en développement, comme en témoigne l’expression des protéines DMT-1 et TfR chez les ratons Sprague-Dawley dès le JPN5, avec des concentrations augmentant jusqu’au JPN15 dans toutes les parties du cerveau examinées (cortex, hippocampe, striatum) (Siddappa et coll., 2002; Garcia et coll., 2006).
Il a été établi récemment que le SLC30A10, un transporteur présent à la surface des cellules, joue un rôle important dans la sortie du manganèse hors du cerveau (Leyva-Illades et coll., 2014). Ce transporteur réduit le taux de Mn dans les cellules, alors que ses mutations provoquent la toxicité du manganèse. D’autres transporteurs contribuent également à maintenir l’homéostasie du manganèse dans la cellule (Chen et coll., 2015).
8.3 Métabolisme
Dans sa forme élémentaire, le manganèse n’est pas métabolisé et il est absorbé et excrété sans modification. Le manganèse est généralement ingéré sous forme de sels ionisés, et son état de valence peut changer pendant ou après son absorption. Bien que la forme divalente du manganèse prédomine dans les systèmes biologiques, le manganèse peut aussi être présent à l’état trivalent dans la plupart des enzymes, lié à la transferrine (Tf), et dans le lait humain, lié à la lactoferrine (Aschner et coll., 2005).
Dans le foie et la circulation, une partie du manganèse divalent est oxydée en manganèse trivalent et stabilisée en se liant à des ligands protéiques tels que la Tf (Aschner et coll., 2005). La Tf se lie au Mn(III) (ou au Fe(III)), mais pas au Mn(II) (Aisen et coll., 1969; Critchfield et Keen, 1992; Ueda et coll., 1993). Le Mn(II) peut également s’oxyder en Mn(III) à l’intérieur des cellules, en réagissant avec des espèces de radicaux libres tels que des anions superoxydes (Archibald et Tyree, 1987). Il a été avancé que la céruléoplasmine présente dans le plasma sanguin catalyserait l’oxydation du Mn(II) en Mn(III), provoquant un changement in vitro où le manganèse se lie alors davantage à la Tf qu’à l’α2-macroglobuline (Gibbons et coll., 1976). Cependant, des études récentes menées chez des souris n’exprimant pas la céruloplasmine ont clairement démontré que cette dernière n’était pas nécessaire à l’oxydation du manganèse dans le plasma ni à sa liaison à la transferrine plasmatique (Jursa et Smith, 2009). De plus, il est possible que de petites quantités de Mn(II) soient spontanément oxydées et forment de petites quantités de Mn(III) qui, même à l’état de traces, peuvent entraîner la formation de radicaux libres réactifs (HaMai et coll., 2001). Certaines études laissent entendre que la majorité du manganèse présent dans les cellules de mammifère existerait sous forme de Mn(II) (Reaney et coll., 2002). Toutefois, la détection précise de l’état de valence du manganèse in vivo est limitée par diverses contraintes d’ordre technologique.
Les données semblent indiquer que l’état de valence du manganèse joue un rôle important dans sa rétention et sa toxicité (Yokel et coll., 2006). Chez les vaches, le Mn(II)-α2-macroglobuline a été éliminé plus rapidement que le Mn(III)-Tf (Gibbons et coll., 1976). Des études in vitro ont révélé que le Mn(III) présentait un potentiel de cytotoxicité et de neurotoxicité plus élevé que le Mn(II), vraisemblablement en raison du potentiel de réduction plus élevé du Mn(III), et de sa capacité à produire un stress oxydatif (Ali et coll., 1985; Archibald et Tyree, 1987; Chen et coll., 2001; Reaney et coll., 2002; Reaney et Smith, 2005). Chez des rats ayant reçu des doses identiques de Mn(II) ou de Mn(III) par voie intrapéritonéale, les concentrations dans le cerveau et dans le sang se sont révélées plus élevées chez les rats ayant reçu du Mn(III) (Reaney et coll., 2006).
8.4 Excrétion
Le manganèse est essentiellement éliminé du sang par le foie et excrété dans l’intestin par la bile (Miller et coll., 1967). Une grande partie du manganèse biliaire présente dans l’intestin est excrétée dans les selles, et une petite partie est réabsorbée (Schroeder et coll., 1966; Davis et coll., 1993).
La demi-vie, pour la clairance du manganèse du corps entier, est d’environ 4 jours durant la phase rapide et de 39 jours durant la phase lente, pendant laquelle s’effectuent environ les deux tiers de l’élimination (OMS, 1981). Les demi-vies estimatives, pour la rétention dans le corps entier, ont été estimées de 13 à 37 jours chez des humains ayant ingéré du manganèse radiomarqué (sous forme de chlorure de manganèse) (Mena et coll., 1969; Sandstrom et coll., 1986; Davidsson et coll., 1989a). Dans le cerveau, les demi-vies étaient de 50 à 220 jours chez les rats et les primates non humains (Takeda et coll., 1995; Santé Canada, 2010). L’absorption du manganèse dans le cerveau s’effectue par transport facilité. Il en sortirait toutefois plus lentement et par diffusion, ce qui pourrait causer une accumulation avec le temps (Yokel et Crossgrove, 2004).
Le transport direct du manganèse présent dans le sérum à travers la paroi intestinale peut contribuer à l’excrétion dans les selles (Bertinchamps et coll., 1965; Garcia-Aranda et coll., 1984). De petites quantités de manganèse sont excrétées dans l’urine, la sueur, le lait maternel, les cheveux et les ongles (Merian et coll., 2004; Santé Canada, 2010). La concentration de manganèse dans l’urine est généralement faible (Alessio et coll., 1989; Minoia et coll., 1990; Park et coll., 2003), et l’excrétion urinaire est considérée comme un mauvais biomarqueur de la charge corporelle suivant une exposition par voie orale ou par inhalation (Andersen et coll., 1999). Les cheveux ont aussi été utilisés dans plusieurs études comme biomarqueur de la charge corporelle et de l’exposition au manganèse dans l’environnement, bien qu’ils nécessitent un nettoyage approprié pour éliminer toute contamination au manganèse de nature exogène, de façon à pouvoir examiner seulement le manganèse incorporé par le métabolisme (Eastman et coll., 2013).
Les nourrissons, en particulier les nouveau-nés, possèdent une moins grande capacité d’excrétion biliaire que les adultes (Cotzias et coll., 1976). Il en résulte que la charge corporelle de manganèse sera plus élevée chez les nouveau-nés et les jeunes enfants après une exposition donnée, ce qui, de pair avec les importants processus neurodéveloppementaux qui se produisent chez les nouveau-nés, rend ces derniers particulièrement sensibles aux effets toxiques du manganèse (Neal et Guilarte, 2013).
8.5 Modèles PBPK
Des modèles pharmacocinétiques à base physiologique (PBPK) ont été élaborés pour le manganèse chez les rats (Teeguarden et coll., 2007a; 2007 b; 2007c; Na et coll., 2008; Nong et coll., 2008; 2009; Yoon et coll., 2009a; 2009b), les singes (Nong et coll., 2009; Schroeter et coll., 2011; 2012) et les humains (Schroeter et coll., 2011; Yoon et coll., 2011). Les modèles PBPK publiés depuis 2008 comprennent la voie orale et l’inhalation. Diverses voies d’injection (intrapéritonéale, sous-cutanée et intraveineuse) sont également utilisées dans les modèles visant les humains et les singes (Schroeter et coll., 2011), pour permettre l’évaluation des données expérimentales obtenues avec du manganèse radiomarqué (54Mn). Le transfert dans le lait maternel chez le rat (Yoon et coll., 2009a), ainsi que la dose au fœtus et le devenir du manganèse chez le rat (Yoon et coll., 2009b) et l’humain (Yoon et coll., 2011) (mère et foetus), peuvent être estimés. Un modèle PBPK a également été élaboré pour le transport du manganèse inhalé de la muqueuse olfactive au striatum chez le rat (Leavens et coll., 2007). Un aperçu de ces modèles est présenté dans Taylor et coll. (2012).
Les plus récents modèles créés pour les singes et les humains (Schroeter et coll., 2011; 2012) permettent d’estimer les concentrations de manganèse dans les tissus cibles du cerveau (globus pallidus). Ces modèles peuvent estimer la concentration de manganèse dans les tissus après une exposition par ingestion, par inhalation ou par injection (intraveineuse, intrapéritonéale, sous-cutanée). En bref, ils comportent des compartiments pour le foie, les poumons, la cavité nasale, les os, le sang, le bulbe olfactifNote de bas de page1, le cerveletNote de bas de page2, le globus pallidusNote de bas de page2, l’hypophyseNote de bas de page2, et d’autres tissus de l’organisme. Ces modèles tiennent compte des capacités de liaison aux tissus du manganèse saturable, des flux préférentiels du manganèse dans des tissus précis (du cerveau), et des processus de contrôle homéostatique (c.-à-d. la diminution de l’absorption intestinale et l’induction de la sécrétion biliaire lors d’une exposition à de fortes concentrations).
Les modèles pour les singes et les humains ont tous les deux été validés par comparaison avec des données sur le manganèse obtenues à l’aide d’un traceur. La validation du modèle élaboré pour les singes comprenait l’excrétion fécale (après injection sous-cutanée ou inhalation), la rétention dans tout le corps (après injection intrapéritonéale, injection intraveineuse ou exposition par voie orale) et la concentration dans le tissu cérébral (après une exposition par inhalation). Dans le modèle élaboré pour les humains, on a réussi à intégrer les caractéristiques liées à la dose relatives à l’élimination du manganèse (rétention dans tout le corps, rétention dans le plasma) pour diverses voies d’exposition. Selon les auteurs, les modèles utilisés pour estimer les concentrations d’exposition susceptibles d’accroître les concentrations de manganèse dans les tissus pourraient également servir dans le cadre d’une évaluation des risques fondée sur la dosimétrie (Shroeter et coll., 2011). Bien que le modèle puisse être utilisé pour estimer la concentration de manganèse dans le tissu cérébral, ces types de simulations n’ont pas été validées chez l’humain.
9.0 Effets sur la santé humaine
Les effets d’une exposition au manganèse sur la santé humaine ont été étudiés dans un grand nombre d’études épidémiologiques. Une forte exposition au manganèse, notamment en milieu de travail, peut causer une maladie neurologique clinique appelée « manganisme ». Cette affection est caractérisée par des troubles cognitifs et moteurs généralisés tels que la bradykinésie, la rigidité généralisée, l’altération de la démarche, les chutes, la dystonie, la difficulté à marcher à reculons et les troubles d’élocution. En outre, de nombreuses études ont démontré qu’une faible exposition au manganèse, en particulier par inhalation, pouvait entraîner des déficits sur le plan des paramètres neurofonctionnels, dont une détérioration de la motricité fine, de la coordination œil-main et du temps de réaction. De récentes études épidémiologiques semblent également indiquer un lien entre l’exposition au manganèse dans l’eau potable et certains effets neurologiques observés chez les enfants (Bouchard et coll., 2011; Khan et coll., 2011; Roehls et coll., 2012; Oulhote et coll., 2014).
9.1 Caractère essentiel
Le manganèse est considéré comme un élément essentiel par Santé Canada et par d’autres organismes internationaux (NRC, 1989; IOM, 2001; Expert Group on Vitamins and Minerals, 2002; National Institutes of Health, 2011; OMS, 2011). Le manganèse est un cofacteur essentiel pour certains enzymes (pyruvate carboxylase, Mn-superoxyde dismutase) (NRC, 1989; IOM, 2001). Il peut également agir comme cofacteur pour des enzymes (décarboxylases, hydrolases, kinases, etc.) qui sont aussi activées par d’autres cations divalents similaires, et qui ne sont pas altérées par une carence en manganèse (EVM, 2002). Les enzymes nécessitant du manganèse assurent plusieurs fonctions, dont la défense antioxydante, la formation des os, la métabolisation des hydrates de carbone, du cholestérol et des protéines, et l’utilisation d’autres nutriments comme les vitamines biotine et acide ascorbique (Saudin et coll., 1988; IOM, 2001).
Les carences en manganèse sont extrêmement rares et leurs symptômes ne sont pas clairement définis (Dupont et Tanaka, 1985; IOM, 2001). Chez les animaux, on observe des malformations des os et des cartilages, des retards de croissance, des perturbations neurologiques, des anomalies de la fonction reproductrice ainsi que des troubles de métabolisation du glucose, des hydrates de carbone (symptômes s’apparentant à ceux du diabète) et des lipides (EVM, 2002). En ce qui concerne les humains, des anomalies de la peau telles qu’un rash érythémateux, une croissance lente des ongles, une diminution de la densité osseuse, une dépigmentation des cheveux et une hypocholestérolémie sont observées chez les personnes ayant une alimentation pauvre en manganèse (environ 0,01 à 0,34 mg/jour).
La Direction générale des produits de santé et des aliments de Santé Canada a adopté des les apports nutritionnels de référence fixés par l’IOM pour le manganèse. Faute de données suffisantes sur la dose et la réponse, aucun besoin moyen estimatif (BME) n’a été établi. Des apports suffisants (AS) ont été calculés d’après les données sur l’apport alimentaire moyen de personnes en santé. Les AS ont été établis à 0,003 mg/jour pour les nourrissons de 0 à 6 mois, 0,6 mg/jour pour les nourrissons de 6 à 12 mois, 1,2 mg/jour pour les enfants de 1 à 3 ans, 1,5 mg/jour pour les enfants de 4 à 8 ans, 2,3 mg/jour pour les hommes adultes, 1,8 mg/jour pour les femmes adultes, 2,0 mg/jour pour les femmes enceintes et 2,6 mg/jour pour les femmes qui allaitent. Ils ont été calculés à partir des données sur l’apport médian de l’étude de la Food and Drug Administration sur l’alimentation totale des enfants, des adolescents et des adultes, et d’après la concentration de manganèse dans le lait maternel pour les nourrissons (IOM 2001; Santé Canada 2007b).
L’apport maximal tolérable (AMT) a été fixé à 2 à 6 mg/jour pour les enfants de 1 à 18 ans, 11 mg/jour pour les adultes, et 9 à 11 mg/jour pour les femmes enceintes ou allaitantes (IOM, 2001). Comme les données sur la toxicité sont insuffisantes et que l’on ne sait pas exactement à quel âge les nourrissons acquièrent les mécanismes nécessaires pour maintenir l’homéostasie du manganèse, aucun AMT n’a été fixé pour les nourrissons (IOM, 2001). La cinquième édition du manuel Pediatric Nutrition Handbook de l’American Academy of Pediatrics ainsi que le rapport American Society for Parenteral and Enteral Nutrition recommandent tous les deux 1 µg Mn/kg p.c. par jour pour les nouveau-nés nourris par voie parentérale (3 à 10 kg), même si le taux de rétention du manganèse administré par voie intraveineuse atteint presque 100 % (comparativement à 8 % pour l’ingestion de lait maternel) (Committee on Nutrition, 2003; Mirtallo et coll., 2004; Aschner et Aschner, 2005).
L’AMT pour les adultes est fondée sur l’absence d’effets observés chez les adultes en santé ayant un régime alimentaire occidental contenant jusqu’à 10,9 mg/jour de manganèse (NOAEL de 11 mg/jour dans Greger, 1999), et dans une étude portant sur une alimentation végétarienne riche en manganèse, contenant possiblement 13 à 20 mg/jour de manganèse (Schroeder et coll., 1966). Davis et Greger (1992), pour leur part, donnent une LOAEL de 15 mg/jour. Une augmentation de l’activité du superoxyde dismutase-manganèse dans les lymphocytes a été observée après l’application de cette dose en supplément pendant 90 jours. Aucune étude de toxicité par l’alimentation visant à évaluer les effets neurologiques du manganèse au niveau correspondant à l’AMT chez l’humain n’a été trouvée.
Le Comité scientifique de l’alimentation humaine de la Commission européenne a fixé une concentration maximale de manganèse de 100 μg/100 kcal pour le lait maternisé (SCF 2003). Le calcul de cette valeur n’est pas clairement expliqué, mais la Commission a indiqué que la neurotoxicité du manganèse était une source de préoccupation grandissante.
Les carences en manganèse sont peu probables au Canada, l’alimentation étant la principale source de manganèse. En outre, selon l’ECAT (Santé Canada, 2009), la population atteint les valeurs d’AS établies par l’IOM. Les produits de santé naturels (c.-à-d. les suppléments contenant du manganèse) peuvent aussi contribuer de façon importante à l’apport quotidien, soit jusqu’à 9 mg/jour au Canada.
9.2 Toxicité aiguë
Une faiblesse musculaire et des perturbations neurologiques telles qu’une altération des capacités mentales ont été observées chez un homme de 66 ans ayant ingéré accidentellement de faibles doses de permanganate de potassium (environ 1,8 mg Mn/kg p.c./jour) pendant quatre semaines (Holzgraefe et coll., 1986). Toutefois, parce qu’il a été exposé à d’autres substances, il n’est pas possible d’affirmer avec certitude que les effets observés chez cet homme ont été causés par le manganèse. Dans une autre étude de cas, les symptômes suivants ont été observés chez un homme de 50 ans ayant ingéré du sulfate de manganèse hydraté (trois cuillérées à table par jour, pendant une durée indéterminée) : léthargie, vomissements, douleurs abdominales diffuses, diarrhée abondante, insuffisance hépatique, atteinte rénale aiguë, détresse respiratoire aiguë, dysfonction du myocarde, et choc avec acidose lactique. Le patient est décédé en 72 heures. Il est important de souligner que celui-ci suivait un régime sans protéines et qu’il consommait beaucoup de tisanes dans le cadre d’un nettoyage hépatique (Sanchez et coll., 2012).
9.3 Epidémiologie
L’exposition chronique au manganèse en suspension dans l’air a été associée à plusieurs reprises à des effets neurologiques (Santé Canada, 2010). Des études de cohortes, des études transversales et des études de rapports de cas portant sur les effets de l’exposition au manganèse en suspension dans l’air ont été menées auprès de soudeurs, de travailleurs et de populations vivant à proximité d’usines de ferro-alliage (Roels et coll., 1992; Lucchini et coll., 1999; Mergler et coll., 1999; Bowler et coll., 2006; Bouchard et coll., 2007b; Lees-Haley et coll., 2007; Myers et coll., 2009; Riojas-Rodríguez et coll., 2010; Criswell et coll., 2011; Menezes-Filho et coll., 2011; Meyer-Baron et coll., 2013; Michalke et Fernsebner, 2014; Yoon et Ahn, 2015).
Le lien entre l’exposition professionnelle au manganèse et les tests neuropsychologiques subcliniques est équivoque, mais des changements dans le temps de réaction visuelle, la coordination œil-main, la stabilité des mains et les résultats aux tests de performance motrice ont été observés. Des cas de manganisme ont été relevés chez les groupes les plus exposés, avec des symptômes tels que la bradykinésie, des troubles d’élocution, l’altération de la démarche, la rigidité généralisée, la dystonie, la tendance à tomber vers l’arrière, et une démarche caractéristique consistant à marcher sur les orteils avec la colonne droite et les coudes fléchis. On ne sait pas exactement si les effets associés à l’exposition par inhalation peuvent être induits par voie orale. Il est difficile d’extrapoler d’une voie d’exposition à une autre en raison des différences observées, sur le plan de la toxicocinétique, entre les diverses voies d’exposition et les divers états d’oxydation (Aschner et coll., 2005; Roels et coll., 2012).
De nombreuses études épidémiologiques transversales ont observé une association entre d’une part l’exposition accrue au manganèse, et d’autre part des effets neurologiques chez les nourrissons et les enfants, notamment la désinhibition comportementale, et de faibles résultats aux tests portant sur les fonctions exécutives et aux tests de lecture et d’aptitude numérique (Kawamura et coll., 1941; Kondakis et coll., 1989; He et coll., 1994; Woolf et coll., 2002; Wright et coll., 2006; Ericson et coll., 2007; Wasserman et coll., 2011; Khan et coll., 2012; Bhang et coll., 2013; Chen et coll., 2014; Yu et coll., 2014; Haynes et coll., 2015).
Dans le cadre d’une récente étude épidémiologique transversale réalisée au Québec, on s’est penché sur le lien entre le manganèse présent dans l’approvisionnement en eau potable et la déficience intellectuelle chez les enfants d’âge scolaire (Bouchard et coll., 2011). Cette étude portait sur 362 enfants âgés de 6 à 13 ans vivant dans des collectivités alimentées par des eaux souterraines contenant des concentrations variées de manganèse (plage de 1 µg/L à 2 700 µg/L, avec une valeur médiane de 34 µg/L). Les concentrations de manganèse dans l’eau (MnW) ont été mesurées au robinet dans les résidences. Les auteurs de l’étude ont mesuré la concentration de manganèse dans les cheveux des enfants (MnH), ainsi que le rendement de ces derniers sur l’Échelle abrégée d’intelligence de Wechsler (QI). Une différence de 6,2 points a été observée entre le QI des enfants des quintiles inférieur (concentration médiane de 1 µg/L) et supérieur (concentration médiane de 216 µg/L) d’exposition au manganèse dans l’eau Les fortes MnW ont été associées à des résultats globaux de rendement et de QI plus faibles, après la neutralisation des covariables (c.-à-d. scolarité et intelligence non verbale de la mère, revenu familial, niveau de stimulation à la maison et structure familiale). Les fortes MnH ont été associées à des résultats globaux de QI plus faibles, après la neutralisation des mêmes covariables. La MnH augmentait avec la consommation de manganèse dans l’eau, mais pas avec la consommation de manganèse dans les aliments (questionnaire semi-quantitatif sur la fréquence de consommation des aliments), ce qui laisse croire que la biodisponibilité du manganèse dans l’eau et dans les aliments serait différente.
Dans une deuxième publication de ce groupe, un rapport inverse a également été observé entre les fonctions neurocomportementales (mémoire, attention, fonction motrice, hyperactivité) et l’exposition au manganèse chez les mêmes enfants (n = 375) (Oulhote et coll., 2014). Les auteurs ont fait état d’une association inverse entre la MnW ou la MnH normalisées (transformées en log10) et la mémoire, l’attention ou la fonction motrice, après la neutralisation des facteurs de confusion (c.-à-d., sexe et âge de l’enfant, scolarité de la mère, intelligence non verbale de la mère, revenu familial, dépression maternelle, concentrations de plomb dans l’eau). En ce qui concerne le Mn présent dans les cheveux, une augmentation d’un écart-type de la MnH en log10 a été associée à une baisse de 24 % de l’écart-type des résultats relatifs à la mémoire (IC à 95 % : -36, -12 %) et à une baisse de 25 % de l’écart-type des résultats relatifs à l’attention (IC à 95 % : -41, -9 %), après la neutralisation des facteurs de confusion. Aucune association importante n’a été observée entre la MnH et la fonction motrice. Pour ce que touche le Mn dans l’eau, l’augmentation d’un écart-type de la MnW en log10 (plage non précisée par les auteurs) a été associée à une baisse de 14 % de l’écart-type des résultats relatifs à la mémoire (IC à 95 % : -24, -4 %). Une faible association négative avec la fonction motrice a été observée (baisse de 11 % de l’écart-type, IC à 95 % : -21, -0,4 %). Une détérioration importante de la mémoire et de la fonction motrice a été observée à des MnW supérieures à 100 et 180 µg/L, respectivement. L’étude n’a révélé aucune association importante entre la MnW et l’hyperactivité ou l’attention.
Les contaminants non métalliques dans l’eau potable n’étaient pas évalués dans le cadre de ces études, mais celles-ci tenaient compte de plusieurs covariables présentes dans l’eau (p. ex. le plomb et l’arsenic), du statut socioéconomique, et de divers facteurs liés à la mère susceptibles d’influer sur l’association entre le manganèse et les capacités cognitives. Le risque de biais dans ces études ne peut toutefois pas être écarté. Peu de renseignements ont été fournis sur les critères d’admissibilité des sujets et sur les caractéristiques des sujets « perdus de vue ». Une classification erronée de l’exposition est possible, pour diverses raisons : la MnW n’a été mesurée qu’une seule fois, les sujets n’avaient pas besoin d’avoir habité la maison plus de trois mois pour participer à l’étude (les expositions antérieures au manganèse n’étaient pas prises en compte), l’utilisation de cheveux comme biomarqueur pouvait fausser les données d’exposition, aucune information sur l’alimentation ou la concentration dans le sol n’a été fournie, et le moment ainsi que la durée associés aux niveaux d’exposition pendant les périodes cruciales du développement ne sont pas indiqués. Il n’est pas indiqué si le niveau d’exposition des participants était connu ou non des chercheurs. Finalement, les intervalles de confiance étaient grands et bon nombre des effets observés se situaient à la limite de la signification.
En Ohio, une étude transversale (Communities Actively Researching Exposure Study) a été menée avec des enfants âgés de 7 à 9 ans (n = 404) entre octobre 2008 et mars 2013 (Haynes et coll., 2015). Dans cette étude, les variables dépendantes (développement cognitif évalué avec le WISC-IV) et les covariables comme le taux de manganèse dans le sang et les cheveux ont été mesurés lors de la première visite. Des concentrations élevées dans le sang (> 11,2 μg/L) et dans les cheveux (> 747 ng/g) ont été associées de façon significative à un QI global plus faible que chez les témoins (sang : 8,2 à 11,2 μg/L; cheveux : 207 à 747 ng/g), après la neutralisation des facteurs de confusion (les plus importants étant la créatinine, la plombémie, la communauté, le sexe, ainsi que le QI et la scolarité des parents). Les auteurs ne se sont penchés que sur l’association entre les variables prédictives et les effets, sans interpréter leurs résultats du point de vue des risques. Les associations mesurées peuvent être biaisées, les renseignements sur les participants et l’exposition étant peu détaillés. Par exemple, les auteurs ont exclu les participants pour lesquels il manquait des données pour n’importe quel modèle de covariables, ainsi que ceux qui présentaient des concentrations de manganèse plus élevées, ce qui peut créer un biais dans la relation observée (p. ex., si des participants pour lesquels il manquait des données présentaient une faible concentration de manganèse et avaient un QI peu élevé, ou si des participants ayant un QI élevé présentaient une concentration élevée de manganèse, l’exclusion de ces participants aurait pour effet de biaiser les résultats par rapport à la valeur nulle dans les deux scénarios, et de causer une surévaluation des effets). Comme les caractéristiques des participants exclus n’étaient pas présentées, on ne sait pas dans quelle mesure les sujets pris en compte dans l’étude sont représentatifs de la population. L’exposition peut avoir fait l’objet d’une classification erronée, puisque les expositions antérieures et les variations dans le temps ont été mal évaluées (les cheveux et le sang sont des bioindicateurs limités; il n’y a aucune estimation de l’apport total de manganèse ou de la part provenant de l’eau potable; les bioindicateurs du manganèse et les autres covariables n’ont été mesurés qu’une seule fois). Il existe également un risque de confusion, car les caractéristiques de base n’ont pas été réparties selon les groupes d’exposition (impossible d’évaluer les différences autres que celles touchant le manganèse par rapport aux valeurs de référence) et les modèles statistiques n’ont pas été construits de façon à inclure tous les facteurs de confusion importants (le choix des covariables devrait être fondé sur les changements touchant les variables dépendantes, et non sur les variables d’exposition). De plus, le manganèse a été corrélé avec d’autres covariables considérées, ce qui réduit la confiance à l’égard du modèle. Aussi, les participants pourraient être classés dans différents quintiles d’exposition, en fonction du bioindicateur choisi comme principale variable indépendante (Mn dans les cheveux ou dans le sang). Il existe également un risque de coïncidence, et comme les résultats n’étaient pas précis (large IC à 95 % incluant presque la valeur nulle), il aurait été utile d’indiquer la signification (valeurs P) des modèles à multiples variables.
Plusieurs études transversales réalisées au Bangladesh ont établi des liens entre les concentrations de manganèse dans l’eau potable et le rendement cognitif chez les enfants d’âge scolaire. Wasserman et coll. (2011) ont étudié l’association entre l’exposition au manganèse et à l’arsenic et la fonction intellectuelle chez 304 enfants âgés de 8 à 11 ans, en utilisant des sous-tests adaptés du WISC-IV. Les auteurs ont classé les enfants en fonction des concentrations de manganèse (inférieures ou supérieures à 500 µg/L) et d’arsenic (inférieures ou supérieures à 10 µg/L) présentes dans l’eau de puits. Après voir fait les ajustements nécessaires (scolarité et intelligence de la mère, type de logement, fait que la famille possède une télévision, taille et circonférence de la tête de l’enfant), l’augmentation du taux de manganèse dans le sang (MnB) a été associée à des indices de mémoire de travail et de raisonnement perceptif plus faibles. Cette étude présente certaines faiblesses, notamment le fait qu’elle visait à l’origine un autre objectif et que d’autres contaminants présents dans l’eau pourraient être la cause des effets observés. Ensuite, aucune autre source de manganèse n’a été prise en compte, et aucune tentative n’a été faite pour vérifier s’il y avait un lien entre la MnW et la MnB. En outre, les résultats neurologiques ont été mesurés à l’aide d’une échelle modifiée qui n’est pas validée, ni normalisée. De plus, les quartiles d’exposition utilisés dans l’étude n’ayant pas été quantifiés, les données ne peuvent pas être utilisées pour une évaluation quantitative des risques. Enfin, seules les erreurs types des coefficients de régression ont été présentées.
Les limites de l’étude de Wasserman et coll. (2011) s’appliquent également à une publication antérieure des mêmes auteurs (Wasserman et coll., 2006). Dans cette étude antérieure, une diminution liée à la dose des résultats bruts obtenus pour l’échelle globale, le rendement et les compétences verbales en tenant compte des facteurs de confusion (les mêmes que ceux de l’étude de 2011) a été observée. Contrairement à l’étude de 2011 (dans laquelle l’association avec la MnB était significative), seule l’association avec la MnW était significative dans l’étude de 2006.
Khan et coll. (2012) ont examiné les associations entre l’exposition au manganèse et à l’arsenic dans l’eau potable et le rendement scolaire de 840 enfants au Bangladesh. La fonction intellectuelle a été évaluée sur deux plans, soit les langues et les mathématiques. L’étude a révélé une association marquée entre une MnW > 400 µg/L et la diminution des résultats au test de mathématiques ajustés en fonction des facteurs de confusion (arsenic, année scolaire, scolarité de la mère, scolarité du père, circonférence de la tête, corrélation dans les façons dont les enfants sont notés par les enseignants). Dans une étude précédente menée par les mêmes auteurs avec un protocole similaire, l’augmentation de la MnW a été associée à des comportements négatifs en classe après un ajustement en fonction des facteurs confusionnels (arsenic, sexe, IMC, scolarité de la mère, circonférence des bras) (Khan et coll., 2011). Les conclusions de ces deux études peuvent être nuancées par le fait que la possibilité d’une exposition à d’autres substances neurotoxiques n’a pas été prise en compte (p. ex. l’ajustement pour l’exposition à l’arsenic et au plomb est incomplet) et que la caractérisation de l’exposition n’est pas exhaustive (ainsi que l’examen des autres sources de manganèse comme l’air et les poussières), ainsi que par la forte variabilité des résultats (large IC à 95 %) et par le risque lié à la partialité de l’enseignant.
L’association entre les concentrations de manganèse dans le sang ombilical et les sous-échelles de psychomotricité a été évaluée dans le cadre d’une étude de cohortes réalisée à Paris avec des personnes favorisées sur le plan social (n = 247 femmes enceintes et leur enfant) (Takser et coll., 2003). Les enfants ont été évalués au moyen de trois tests psychologiques (à 9 mois, 3 ans et 6 ans). L’attention, la mémoire non verbale et les aptitudes manuelles ont été associées négativement à l’exposition, après ajustement pour tenir compte des facteurs de confusion (sexe de l’enfant, niveau de scolarité de la mère). L’étude n’a toutefois révélé aucun lien entre l’exposition au manganèse à la naissance et les indices psychomoteurs généraux, le quotient de développement sur l’échelle de Brunet–Lézine à 9 mois, ou l’indice de cognition générale (ICG) de McCarthy à 3 et 6 ans. La contribution de l’exposition au manganèse par l’eau potable n’était pas claire. Les auteurs n’ont fait mention d’aucune méthode pour factoriser la corrélation intra-individuelle (mesures prises plusieurs fois sur la même personne au fil du temps) dans l’analyse statistique, augmentant le risque d’erreurs de type I. Bien que les auteurs aient précisé que tous les modèles de régression avaient été ajustés pour tenir compte des concentrations de plomb dans le sang maternel et ombilical, des ensembles de covariables différents ont été utilisés et il n’est pas indiqué clairement lesquels ont été choisis pour chaque modèle.
Une étude longitudinale de cohortes multicentres réalisée à Shanghaï, en Chine, a examiné les effets d’une exposition prénatale aux taux de manganèse présent dans l’environnement, en étudiant les concentrations de manganèse dans le sérum ombilical (MnUmbi) et en effectuant des tests NBNA, c’est-à-dire des évaluations comportementales et neurologiques des nouveau-nés (Yu et coll., 2014). Les auteurs ont examiné 933 couples mère-enfant en mesurant la MnUmbi et en évaluant le développement comportemental des nouveau-nés (réflexes, capacités fonctionnelles et état comportemental) à l’aide du test NBNA. On a associé le fait d’être dans le quartile supérieur de MnUmbi à un résultat faible au test NBNA (signification statistique du coefficient de régression) après ajustement en fonction des facteurs de confusion (âge, scolarité, revenu, emploi et tabagisme des parents, âge gestationnel, sexe, poids à la naissance, plomb et mercure). Toutefois, le faible taux de participation (70 % des sujets recrutés) pourrait avoir entraîné un biais de sélection. Aucune analyse du sérum maternel n’a été effectuée pendant la grossesse pour déterminer s’il pourrait y avoir une relation avec le développement intra-utérin. Aucun suivi à long terme n’a été effectué pour évaluer les effets sur le développement des enfants. Aucun ajustement n’a été effectué pour tenir compte de facteurs confusionnels importants tels que d’autres sources d’exposition, des facteurs de risques environnementaux et une exposition aux métaux. De plus, le risque d’effet de confusion résiduel est grand en raison des importantes différences entre les groupes d’exposition sur le plan du statut socioéconomique. Les auteurs n’ont pas expliqué la signification clinique des changements (l’importance d’une diminution de 1,1 du coefficient de régression), et on ne sait pas exactement pourquoi la relation a été décrite comme étant non linéaire, aucun effet dose-réponse clair n’ayant été indiqué. Les covariables considérées étaient plus probablement colinéaires (scolarité et emploi de la mère), mais les auteurs n’ont pas justifié l’inclusion de ces covariables dans le modèle.
L’association entre l’exposition aux contaminants environnementaux et le neurodéveloppement à l’âge de 2 ans a été examinée dans le cadre de l’étude intitulée Taiwan Birth Panel Study (n = 230 couples formés de mères non fumeuses et de leurs enfants) (Lin et coll., 2013). L’exposition in utero à des concentrations de manganèse supérieures au 75e percentile (c.-à-d. 59,3 µg/L) dans le sang ombilical a été associée aux faibles quotients cognitifs et langagiers obtenus à l’inventaire CDIIT (Comprehensive Developmental Inventory for Infants and Toddlers)comparativement aux concentrations inférieures au 75e percentile (signification statistique du coefficient de régression) après ajustement en fonction de l’âge maternel, du sexe, du tabagisme, du soutien et de la stimulation offerts à la maison, et des taux d’arsenic et de mercure dans le sang ombilical. Les quotients globaux, moteurs, sociaux et d’autonomie n’ont pas été associés au modèle. Aucune explication n’a été donnée pour justifier l’inclusion de moins de 50 % des participants sélectionnés, qui se distinguaient de la population générale par un niveau de scolarité de la mère plus élevé, des taux de mercure et de plomb plus élevés dans le sang ombilical, et un poids plus élevé à la naissance. De plus, une seule mesure des contaminants (plomb, mercure, manganèse) a été effectuée. Finalement, l’étude était axée sur les effets d’une co-exposition, et les auteurs n’ont pas indiqué s’ils avaient fait des ajustements en fonction du plomb dans le modèle pour le manganèse.
Des études de cas portant sur deux fillettes (6 et 10 ans) qui buvaient de l’eau de puits contenant des concentrations élevées de manganèse (jusqu’à 2,4 mg/L dans les deux cas) ont été présentées par Sahni et coll. (2007) et Brna et coll. (2011). Des taux sériques élevés de manganèse et des symptômes neurologiques tels que le pica, des changements de comportement, des troubles de langage, un manque de coordination, des difficultés à marcher et le retrait social ont été observés chez les deux fillettes. Dans les deux cas, les autres membres de la famille ne présentaient aucun symptôme. Les auteurs ont avancé qu’un trouble métabolique lié aux métaux divalents pourrait être associé à l’apparition des symptômes.
Une étude de cas portant sur un garçon de 10 ans du Massachusetts ayant bu pendant 5 ans de l’eau de puits turbide contenant du manganèse à une concentration de 1 210 µg/L a été exposée par Woolf et coll. (2002). L’enfant ne présentait aucun trouble cognitif ou neurologique, et sa motricité fine, son équilibre, son rendement scolaire, son QI et les résultats de l’examen d’imagerie par résonance magnétique étaient normaux. Toutefois, son rendement se situait sous la moyenne pour l’indice de mémoire général (17e percentile), la mémoire verbale (19e percentile), la mémoire visuelle (14e percentile), et l’indice d’apprentissage (19e percentile). Ses enseignants ont remarqué qu’il manquait de concentration en classe. La causalité est incertaine, parce que l’eau bue par le garçon avait une forte teneur en fer (1 570 µg/L) et que les déchets toxiques constituaient une source de préoccupation pour les résidents du quartier industrialisé où il habitait. Un seul échantillon d’eau a été recueilli à la fin de la période d’exposition de 5 ans.
Plusieurs études transversales (Zota et coll., 2009; Chen et coll., 2014; Eum et coll., 2014; Guan et coll., 2014) ainsi qu’une étude de cohortes (Yu et coll., 2013) ont examiné l’association entre l’exposition au manganèse et le poids corporel à la naissance. Seules quelques-unes de ces études ont établi un lien entre le manganèse et un faible poids corporel (les études transversales menées en Asie). Toutes les études ayant mis en lumière une association positive présentaient plusieurs limites, notamment une conception ne permettant pas de déterminer la temporalité (direction de l’effet), un biais de sélection, et l’absence d’ajustement pour tenir compte des covariables importantes, ce qui limite l’établissement d’un lien causal entre le manganèse et les effets observés sur la santé.
Les autres études, en revanche, n’ont relevé aucune association entre une forte exposition environnementale au manganèse et de quelconques effets neurologiques (Vieregge et coll., 1995; Torrente et coll., 2005a; Hernandez-Bonilla et coll., 2011). L’étude exploratoire de Torrente et coll. (2005a) n’a révélé aucune corrélation entre la concentration de différents éléments dans les cheveux (taux moyen de manganèse 0,18 à 0,26 µg/g) et l’état cognitif d’enfants âgés de 12 à 14 ans (n ± 100) habitant à proximité de zones industrielles de la Catalogne, en Espagne. L’étude de Vieregge et coll. (1995) n’a relevé aucune différence, dans les résultats relatifs aux affections neurologiques et à la maladie de Parkinson, entre deux cohortes composées d’adultes de plus de 40 ans (homogènes sur le plan de l’âge [âge moyen de 57 ans], du sexe, de la nutrition et des médicaments) exposés pendant au moins 10 ans à différents taux de manganèse dans l’eau potable provenant d’un puits dans une région rurale de l’Allemagne (n du groupe A, manganèse < 50 µg/L = 74; n du groupe B, manganèse > 300 µg/L = 41). Les taux de manganèse dans le sang n’étaient pas statistiquement différents entre les deux groupes. Dans l’étude transversale de Hernandez-Bonilla et coll. (2011), aucune différence significative n’a été observée dans les résultats neuromoteurs entre des enfants de 7 et 11 ans habitant dans des collectivités rurales et présentant des résultats faibles ou élevés pour les biomarqueurs de l’exposition au manganèse (sang : 9,7 contre 8,2 µg/L; cheveux : 12 contre 0,57 µg/g) après la neutralisation des covariables (Pb et Hg dans le sang, sexe, âge, scolarité de la mère), à l’exception d’une faible association entre le test de tapotement des doigts et le manganèse dans le sang seulement. Dans l’ensemble, les résultats ont révélé une absence d’association et n’ont pas été interprétés du point de vue des risques par les auteurs. L’association marginale avec la capacité de tapoter des doigts n’est pas concluante, car les auteurs n’ont pas neutralisé les autres covariables (tabagisme des parents, différences du point de vue de la nutrition et présence de 13 enfants ayant un surplus de poids dans le groupe de faible exposition comparativement à un seul dans le groupe de forte exposition, possiblement un indicateur d’autres facteurs socioéconomiques). En outre, les expositions antérieures n’ont pas été évaluées. Les conclusions tirées de ces trois études n’indiquant aucun effet sont limitées en raison du modèle d’étude utilisé (étude transversale), de la possibilité que seuls les sujets en santé sont demeurés dans les zones où la concentration était élevée (effet du malade survivant), de la possibilité d’autres sources d’exposition ou de variations antérieures non répertoriées, et du fait que des covariables importantes n’ont pas été neutralisées (p. ex. l’état nutritionnel).
Bien que le manganèse soit essentiel à la santé humaine, plusieurs rapports de cas, études transversales et études de cohortes corroborent l’existence d’une association entre l’exposition à des taux élevés de manganèse dans l’eau potable et divers problèmes neuropsychologiques observés chez les nourrissons et les enfants, tels qu’un changement de comportement, un QI inférieur, des troubles du langage et de la mémoire, ainsi qu’un manque de coordination et de contrôle des mouvements. Des études transversales et des études de rapports de cas ont fait état de liens entre divers effets neuropsychologiques et des concentrations élevées de manganèse (centaines de µg/L) dans l’eau potable, tandis que des études de cohortes ont démontré ces associations avec les taux prénataux, révélés par les concentrations de manganèse dans le sang ombilical. La plupart des études n’ont pas permis de déterminer la temporalité (c.-à-d. que l’effet survient après la cause) de l’association. Le risque d’établir de fausses associations a été jugé élevé, et les mesures de l’exposition étaient généralement rudimentaires et reposaient sur une seule mesure prise sur un seul échantillon. Une meilleure compréhension du mode d’action neurotoxique du manganèse permettrait d’identifier des biomarqueurs neurologiques précis des effets et de mesurer les premiers signes de toxicité.
Des cas de manganisme subséquents à l’inhalation de manganèse en milieu de travail ont été observés. Toutefois, on ne sait pas si cet effet peut être extrapolé à l’exposition par voie orale, car il existe des différences toxicocinétiques majeures entre l’absorption par inhalation et l’absorption par voie orale, et entre la sensibilité chez les adultes et la sensibilité pendant le développement. Afin de pouvoir effectuer une analyse dose-réponse pour les effets examinés, il faudrait disposer de mesures d’exposition plus fiables qui permettraient d’établir un point de départ précis, sur le plan toxicologique, pour les effets neurologiques. Il convient toutefois de noter que les études épidémiologiques appuient, sur le plan qualitatif, l’utilisation des effets neurotoxiques comme critère d’effet critique.
10.0 Effets sur la santé chez les animaux de laboratoire
Le manganèse est facilement absorbé dans le système nerveux central, mais son absorption dans de nombreux autres tissus comme les poumons, les reins et les testicules a aussi été décrite. Plusieurs études réalisées sur des modèles animaux ont démontré que le système nerveux central est la principale cible de la toxicité résultant d’une exposition au manganèse par voie orale, suivi par l’appareil reproducteur. Les sections qui suivent présentent des données toxicologiques relatives à une exposition à des sels de manganèse solubles par voie orale.
Il est important de noter que dans beaucoup des études menées chez les animaux de laboratoire avec des sels de manganèse, il n’est pas précisé clairement si la dose indiquée fait référence à du manganèse ou à un complexe du manganèse (p. ex. MnCl2, MnCl2·4H2O). Santé Canada a donc exprimé la dose dans les mêmes mots que ceux utilisés par les auteurs de ces études. Lorsque cela était possible, Santé Canada a communiqué avec les auteurs des études considérées comme étant possiblement essentielles à l’évaluation, afin de confirmer que les doses avaient été correctement interprétées. Dans l’ensemble, les doses indiquées dans la majorité des études faisaient référence au Mn élémentaire.
10.1 Toxicité aiguë
La létalité aiguë du manganèse par voie orale varie selon l’espèce chimique et la voie d’exposition (gavage ou voie alimentaire). Les composés de manganèse semblent présenter une plus faible toxicité aiguë lorsqu’ils sont donnés dans les aliments que lorsqu’ils sont administrés par gavage (Finley et Johnson, 1996; U.S. EPA, 2003; Santé Canada, 2010). Les doses létales moyennes (DL50), pour la voie orale, étaient approximativement de 250 mg Mn/kg p.c. (sous forme de chlorure de manganèse) à 1 082 mg Mn/kg p.c. (sous forme d’acétate de manganèse) chez des rats adultes exposés par gavage (Hazaradze, 1961; Smyth et coll., 1969; Kostial et coll., 1989; OMS, 2011). En comparaison, une exposition répétée à une dose similaire de manganèse (50 000 ppm) sous forme de sulfate de manganèse ajoutée aux aliments n’a entraîné aucune mortalité chez des rats exposés pendant 14 jours (NTP, 1993).
Un certain nombre d’effets neurologiques ont été constatés chez des rats ayant été exposés par gavage à une seule dose de MnCl2 (50 mg/kg MnCl2·H2O) aqueux. Ces effets étaient notamment une diminution importante et réversible de l’activité générale, un retard dans l’acquisition de réactions d’évitement en réponse à des stimulus conditionnés et non conditionnés, une augmentation de la période de latence des réflexes conditionnés, et une dégradation temporaire du processus d’apprentissage (Shukakidze et coll., 2003).
10.2 Exposition à court terme et exposition chronique
10.2.1 Neurotoxicité
La neurotoxicité est considérée dans plusieurs études comme un effet particulièrement sensible après une exposition au manganèse. Les effets neurotoxiques causés par une exposition au manganèse peuvent être classés selon qu’ils touchent des paramètres comportementaux (altération des réflexes, de l’activité motrice, de l’apprentissage, de la mémoire ou des sens), des paramètres structuraux (gliose, neuroinflammation, altérations neurostructurales), ou des paramètres neurochimiques (altération des systèmes de neurotransmetteurs). La présente section traite des effets neurotoxiques résultant d’une exposition au manganèse pendant le développement et à l’âge adulte.
10.2.1.1 Effets neurocomportementaux chez les nouveau-nés et les jeunes
Des effets neurocomportementaux ont été observés chez des rats et des souris (petits ou nouveau-nés) ayant été exposés au manganèse pendant les périodes de gestation et de lactation, et/ou de façon directe après le sevrage (alimentation, eau potable ou gavage). Des effets neurocomportementaux ont aussi été observés chez des primates non humains exposés au manganèse par l’intermédiaire de préparations pour nourrissons.
Une augmentation passagère de l’activité motrice a été observée chez des souris exposées au manganèse par le lait maternel du JPN2 au JPN24 (mères exposées à 5 mg Mn/mL [dose équivalant à 5 000 ppm Mn] dans l’eau potable) et du JPN25 au JPN180 (3 µg/mL ou 3 ppm de manganèse dans l’eau potable). La dose d’exposition réelle (donnée aux mères en mg/kg p.c.) n’a pas été précisée, et celle des petits pendant la période de lactation n’est pas connue. L’activité locomotrice (mesurée à des intervalles de 30 jours) était accrue aux JPN60 et 90 seulement, et non aux JPN30, 120, 150 ou 180 (Chandra et coll., 1979a). Des effets du manganèse sur les mouvements ont été observés aux doses élevées dans une étude sur trois générations chez la souris : des mouvements anormaux ont été relevés dans la démarche de deux nouveau-nés de la portée de la troisième génération exposée à 25 mg Mn/kg p.c. par jour (Ishizuka et coll., 1991). De même, une augmentation de l’activité motrice spontanée a été observée chez des rats nouveau-nés exposés par voie orale (per os) pendant 50 jours (du JPN1 au JPN49) à la dose d’essai la plus élevée (50 mg MnCl2/kg p.c. par jour) d’une solution aqueuse de chlorure de manganèse (Brenneman et coll., 1999). Aucun effet n’a été signalé à 25 mg MnCl2/kg p.c.
Des altérations ont été observées lors de tests en espace ouvert (évaluation du comportement et locomotion) chez des rats mâles exposés par gavage, durant deux semaines, à 10 ou 30 mg Mn/kg p.c. par jour de chlorure de manganèse dans une solution saline, pendant la période juvénile seulement ou pendant la période juvénile (JPN20 à JPN34) et la période adulte (SPN12 à SPN20). L’étude a révélé que les souris en développement étaient plus sensibles aux effets du Mn, et qu’une exposition en début de vie augmentait la sensibilité à l’âge adulte. Aucun effet n’a été observé chez les souris femelles (Moreno et coll., 2009b). Une NOAEL de 250 µg Mn/jour a été établie après l’administration de manganèse dans une solution de sucrose à 10 % par micropipette (LOAEL : 750 µg Mn/jour), pour les effets neurocomportementaux (résultats aux épreuves de géotaxie négative et de distance parcourue chez des rats provoqués avec de la cocaïne). Les rats étaient exposés pendant 21 jours (du JPN1 au JPN21; Reichel et coll., 2006).
L’exposition au manganèse est associée à divers effets sensoriels chez les jeunes animaux. Les effets sur l’orientation ont été évalués par le réflexe de redressement en situation de chute chez des rats ayant été exposés in utero et par le lait maternel (du JG10 au JPN21), et dont la mère avait reçu une dose de 32, 160 ou 800 ppm MnCl2•4H2O par voie alimentaire. Une importante diminution du réflexe de redressement en situation de chute a été observée chez les petits mâles exposés à une dose maternelle ≥ 160 ppm et chez les petits femelles exposés à une dose maternelle de 800 ppm (Ohishi et coll., 2012).
Une diminution de la perception des odeurs a été constatée chez des rats exposés par voie orale, du JPN1 au JPN20, à 500 µg Mn par jour sous forme de MnCl2 dans une solution de sucrose à 10 %. Les résultats aux tests du fouisseur et aux tests d’évitement passif semblent également indiquer une diminution de la mémoire et de la capacité d’apprentissage (Tran et coll., 2002a; Tran et coll., 2002b). Des rats nouveau-nés exposés par voie orale pendant 21 jours (du JPN1 au JPN21) à 25 ou 50 mg MnCl2/kg p.c. par jour administré par micropipette sous forme de MnCl2.4H2O, ont présenté une réaction de sursaut prononcée à des stimulus acoustiques sous forme d’impulsions (Dorman et coll., 2000) (on présume que la dose indiquée par les auteurs fait référence au Mn).
Les effets neurocomportementaux résultant d’un excès de manganèse dans les préparations pour nourrissons à base de soja ont été évalués dans le cadre d’une étude effectuée avec des bébés singes rhésus nourris avec une préparation commerciale à base de lait de vache (50 μg Mn/L), une préparation commerciale à base de protéines de soja (300 μg Mn/L) ou une préparation à base de soja enrichie de manganèse (1 000 μg Mn/L) pendant quatre mois après leur naissance (Golub et coll.,2005). Les doses correspondantes indiquées par les auteurs étaient de 0,018, 0,106 et 0,323 mg Mn/kg p.c. par jour, respectivement (noté dans un erratum :Golub, 2012). Un ensemble complet de tests comportementaux (dimensions motrice, cognitive et sociale, et tests visant spécialement le système de dopamine)Note de bas de page 3 ont été effectués sur une période de 18 mois (ce qui équivaut à 6 ans d’âge chez les humains). Il est important de noter qu’en plus de ne pas contenir la même quantité de manganèse, les préparations à base de lait de vache et celles à base de soja différaient à plus égards sur le plan nutritionnel, notamment en ce qui concerne les protéines, les glucides, les matières grasses, et d’autres composants susceptibles de créer des différences entre les réponses comportementales observées (Golub et coll., 2005). Ainsi, le groupe nourri avec la préparation à base de lait de vache ne constitue pas un témoin adéquat pour évaluer l’effet du manganèse chez le groupe nourri avec la préparation à base de soja et le groupe nourri avec la préparation de soja enrichie de manganèse, dans le cadre d’une évaluation des risques quantitative. On pourrait mieux évaluer l’effet du manganèse en comparant le groupe nourri avec la préparation à base de soja enrichie de manganèse avec le groupe nourri avec la préparation à base de soja seulement; toutefois, aucune analyse statistique permettant de comparer ces deux groupes n’a pas été fournie. Néanmoins, des changements dans le cycle activité/sommeil et les interactions sociales (moins de jeu et tendance accrue à s’accrocher à l’autre dans les interactions sociales dyadiques) ont été observés chez les singes des deux groupes nourris avec une préparation à base de soja, comparativement à celui nourri avec la préparation à base de lait de vache. Les deux groupes nourris avec une préparation à base de soja ont présenté également des cycles de veille plus courts et des périodes d’inactivité plus courtes, pendant le jour, que le groupe nourri avec une préparation à base de lait de vache. Toutefois, aucune différence apparente n’a été relevée entre les deux groupes nourris avec une préparation à base de soja (analyse statistique non disponible). Aucune différence importante n’a été observée entre les trois groupes pour ce qui touche la concentration des métabolites de la dopamine et de la sérotonine (HVA et 5HIAA) dans le liquide céphalorachidien (LCR), la stéréotypie et les tests de rendement continu. Cette étude pourrait indiquer une sensibilité des comportements sociaux et des systèmes de la dopamine à une exposition au manganèse par voie alimentaire en début de la vie. Il faut toutefois souligner que les différences nutritionnelles entre les préparations à base de lait de vache et les préparations à base de soja pourraient contribuer aux écarts entre les réactions comportementales. Dans l’ensemble, les résultats n’ont révélé aucune différence entre les groupes dans les situations d’essai les plus structuréesNote de bas de page 4 utilisées pour évaluer des fonctions cognitives précises telles que l’apprentissage, la mémoire et l’attention. Cependant, les nourrissons participaient peu aux tests formels visant les fonctions cognitives, et la réalisation d’autres tests à un âge plus avancé pourrait permettre d’en apprendre davantage (Golub et coll.,2005; Golub, 2012).
McDougall et coll. (2008) ont étudié les effets d’une exposition postnatale au manganèse sur les comportements associatifs et non associatifs chez des rats nouveau-nés auxquels on a donné des suppléments de manganèse (750 μg/jour) du JPN1 au JPN21 (voir la section sur les effets neurochimiques pour connaître les résultats relatifs à la fonction présynaptique de la dopamine). Les effets d’une exposition postnatale au manganèse sur le fonctionnement du système nigro-strié ont été évalués au moyen d’un test de la tige tournante et par l’induction d’une stéréotypie par amphétamine à l’âge adulte. Le manganèse n’a eu aucun effet sur la performance au test de la tige tournante, mais les stéréotypies induites par amphétamine observées chez les rats exposés au manganèse étaient beaucoup plus importantes que chez les témoins. Au chapitre des processus associatifs, l’exposition au manganèse n’a altéré la performance des rats dans aucun des aspects de l’épreuve de préférence de place conditionnée induite par la cocaïne (préférence, extinction ou réinstallation), et n’a eu aucun effet sur les réponses lors des séances de ratio progressif (réponse opérante renforcée avec du sucrose, une mesure de la motivation). Dans le régime de ratio fixe, toutefois, l’acquisition du comportement s’est révélée déficiente, ce qui indique un possible déficit dans l’apprentissage procédural.
D’autres effets sur le comportement, dont une diminution des perceptions olfactives, ont été observés chez des rats nouveau-nés ayant reçu de fortes doses par voie orale (dose minimale estimée à 8,8 mg Mn/kg p.c. par jour [à partir de 500 µg/jour]) (Tran et coll., 2002a). En outre, à des doses ≥ 25 mg/kg p.c. par jour, on a observé des effets neurocomportementaux reflétant une anxiété accrue et une altération d’autres comportements émotionnels, une diminution des capacités d’apprentissage et de mémorisation, une augmentation des signes d’hypo/hyperactivité, et une baisse de l’activité motrice (Kristensson et coll., 1986; Pappas et coll., 1997; Brenneman et coll., 1999; Liu et coll., 2006; McDougall et coll., 2008; Kern et coll., 2010; Kern et Smith, 2011; Molina et coll., 2011; Nowak et coll., 2011; Peneder et coll., 2011; Betharia et Maher, 2012; Ohishi et coll., 2012; Beaudin et coll., 2013).
Une évaluation détaillée des effets neurodéveloppementaux liés à une exposition au manganèse chez les rats a été présentée par Kern et coll. (2010), qui ont exposé des rats Sprague-Dawley nouveau-nés à des doses de 25 ou 50 mg Mn/kg p.c. par jour dans une solution de sucrose administrée par voie orale à l’aide d’une micropipette, pendant 21 jours après leur naissance. Dans cette étude, les rats (n = 15 à 20 mâles/traitement) ont été soumis à une batterie de tests neurologiques (espace ouvert, labyrinthe en croix surélevé, labyrinthe radial à huit branches) afin d’évaluer les effets d’une exposition au manganèse par voie orale pendant une période correspondant au développement des voies dopaminergiques dans les parties du cerveau qui sont importantes pour la régulation des comportements liés aux fonctions exécutives (qui font appel à l’attention, à l’apprentissage et à la mémoire). En plus des tests comportementaux, on a mesuré le taux de récepteurs et de transporteurs de la dopamine dans le cerveau (décrits dans la présente section sous « effets neurochimiques »). Bien qu’aucune NOAEL n’ait été relevée, une LOAEL de 25 mg Mn/kg p.c. par jour peut être établie pour cette étude, d’après l’ampleur des stéréotypies observées pendant un nombre accru de jours de séances lors des tests du labyrinthe radial à huit branches (modification du comportement orienté vers un but, indicatrice d’une mémoire spatiale déficiente) et le taux réduit de récepteurs de type D1 dans le striatum dorsal. À la dose d’essai la plus forte (50 mg Mn/kg p.c. par jour), les auteurs ont également observé une altération de l’activité locomotrice et une désinhibition des comportements lors du test en espace ouvert au JPN23, une altération de l’apprentissage et un nombre accru d’erreurs dans le labyrinthe radial au JPN23, et des difficultés d’apprentissage et de mémorisation (retard/échec dans l’atteinte du critère relatif à l’apprentissage et nombre accru d’erreurs dans le test du labyrinthe radial à huit branches) du JPN33 au JPN46. D’après les résultats au test du labyrinthe en croix surélevé, l’exposition au manganèse (jusqu’à une dose de 50 mg Mn/kg p.c. par jour) n’a pas eu d’effet apparent sur la peur ou l’anxiété (Kern et coll., 2010).
Dans une étude subséquente visant à établir si une exposition au manganèse tôt dans la vie entraîne des effets neurocomportementaux et neurochimiques qui persistent jusqu’à l’âge adulte, des rats exposés par voie orale à des doses de manganèse identiques à celles de l’étude précédente, pendant les 21 jours suivant leur naissance et sans autre exposition, ont été examinés plus tard au cours de leur vie. Les résultats ont révélé que l’exposition au manganèse provoquait une modification des taux de récepteurs de la dopamine ainsi qu’une astrogliose (indiquée par les protéines fibrillaires acides gliales, ou GFAP) à l’âge adulte. Bien que l’on n’ait observé aucune désinhibition comportementale ni diminution de l’activité motrice chez les adultes, une évaluation du rendement comportemental (mesuré par l’activité dans la zone centrale de l’espace ouvert) réalisée sans (JPN97) et avec (JPN98) provocation par D-amphétamine a révélé que les animaux exposés présentaient une réponse locomotrice accrue avec la provocation par D-amphétamine (Kern et Smith, 2011). L’ensemble de ces résultats indique qu’une exposition au manganèse en début de vie pourrait avoir des effets de longue durée sur le système dopaminergique.
Le même modèle (nouveau-nés) et le même régime d’administration des doses ont été utilisés par Beaudin et coll. (2013) pour explorer davantage les effets chroniques de l’exposition au manganèse sur le développement sensori-moteur. Dans cette étude, on a comparé les effets d’une exposition au manganèse en début de vie et ceux d’une exposition pendant la vie entière sur la fonction sensori-motrice fine chez des rats Long-Evans mâles. Le test de l’escalier a été utilisé pour mesurer objectivement les effets sur la motricité qui sont étudiés en recherche pédiatrique. Les auteurs ont exposé les animaux (n = 11/groupe), par voie orale, à 25 mg Mn/kg p.c. par jour ou 50 mg Mn/kg p.c. par jour pendant une courte période postnatale de 21 jours, ou pendant toute la vie (jusqu’à l’âge adulte). Les tests menés à l’âge adulte ont révélé un déficit de rendement (test de l’escalier, capacité à saisir et manger les granules) à la dose de 25 mg Mn/kg p.c. par jour, et le rendement était pire chez les rats exposés à cette dose pendant toute leur vie que chez les rats exposés pendant une courte période de 21 jours après leur naissance. Ces résultats corroborent ceux des études épidémiologiques ayant fait état d’un déficit de la fonction sensori-motrice fine chez des enfants exposés au manganèse (Beaudin et coll., 2013; Zoni et Lucchini, 2013).
10.2.1.2 Effets neurocomportementaux observés chez les adultes
Plusieurs études font état d’altérations neurocomportementales consécutives à une exposition au manganèse à l’âge adulte. Des rats exposés au manganèse par l’eau potable (1 mg MnCl2•4H2O/mL) ont montré des signes d’hyperactivité et d’hypoactivité, tels qu’une augmentation/réduction de l’activité motrice spontanée, une altération de la réponse au test de D-amphétamine, une diminution de la distance parcourue, et une baisse de l’activité dans l’espace ouvert (Nachtman et coll., 1986).
Chez des rats femelles albinos matures ayant reçu du chlorure de manganèse par gavage (0,357 et 0,714 mg Mn/kg p.c. par jour, dans l’eau distillée) pendant 15 ou 30 jours, on a observé une augmentation des taux de manganèse et de cholestérol dans le cerveau (hippocampe, cervelet et cortex) accompagnée de difficultés d’apprentissage (après une période d’entraînement au jour 29, les rats exposés prenaient 3,7 fois plus de temps que les témoins pour atteindre la sortie d’un labyrinthe en T). Le retard, chez les rats exposés, a été entièrement corrigé par une administration simultanée de mevinolin (un inhibiteur de la biosynthèse du cholestérol) avec le manganèse ou par la suppression du manganèse (Öner et Sentürk, 1995; Sentürk et Öner, 1996).
L’acquisition de réactions d’évitement conditionnées et non conditionnées, ainsi que la dynamique des difficultés d’apprentissage et de mémorisation, ont été étudiées chez des rats adultes exposés à du manganèse avant ou après l’apprentissage d’un labyrinthe à voies multiples. Les rats ont été exposés à du chlorure de manganèse (doses de 20 ou 50 mg MnCl2•4H2O/kg) dans les aliments pendant 30 jours. Des tests ont été effectués immédiatement après l’apprentissage ou 90 jours après celui-ci. Les animaux exposés aux doses les plus fortes étaient plus agressifs, tombaient souvent de la plateforme et ont échoué aux tests en labyrinthe. Une dégradation irréversible du processus d’apprentissage a été observée après une exposition au manganèse. Toutefois, le manganèse n’a pas modifié de façon importante la capacité des animaux à reproduire un comportement acquis antérieurement (réussir à traverser le labyrinthe) (Shukakidze et coll., 2003).
Des jeunes rats Wistar adultes (16/dose) ont été exposés à du chlorure de manganèse par gavage (14,84 ou 59,36 mg MnCl2•4H2O/kg p.c. par jour, 5 jours/semaine, dans l’eau distillée) pendant 10 semaines, puis soumis à une période de récupération de 12 semaines. Une diminution statistiquement significative du rendement relatif à la mémoire spatiale à court et à long terme au test du labyrinthe à huit branches, ainsi que du rendement relatif à l’activité locomotrice au test en espace ouvert, a été observée aux deux doses. Sept semaines après la fin de l’exposition, l’activité motrice est redevenue normale. Une diminution du nombre de réactions de sursaut aux stimuli acoustiques et de l’inhibition avant l’impulsion qui y est associée a été observée. Une augmentation du temps de latence des potentiels évoqués sensoriels, accompagnée par une diminution de leur durée ont été observées aux deux doses après les 10 semaines d’exposition, et ont persisté pendant la période de récupération uniquement chez les rats ayant reçu la dose élevée. Une densité accrue de la protéine fibrillaire acide gliale immunoréactive (GFAP-IR) a été observée aux deux doses dans le gyrus denté de l’hippocampe, mais pas dans la couche radiée ni le stratum oriens (Vezeret coll., 2005). Dans une étude antérieure portant sur les effets du manganèse sur l’activité motrice, des rats exposés au manganèse de façon chronique par l’eau potable (1 mg MnCl2•4H2O/mL) ont présenté des signes d’hyperactivité et d’hypoactivité tels qu’une augmentation (à partir des semaines 5 à 7) et une baisse (à partir de la semaine 8) de l’activité motrice spontanée, une modification de la réponse au test de D-amphétamine (réponse accrue après 14 à 29 semaines, disparaissant aux semaines 41 et 65), une diminution de la distance parcourue, et une diminution de l’activité lors des tests en espace ouvert (Nachtman et coll., 1986).
Des troubles de l’apprentissage spatial ont été observés chez des rats femelles Sprague-Dawley gravides soumises au test de la piscine de Morris après avoir reçu pendant 43 semaines une alimentation pauvre en fer (3 mg Fe/kg) enrichie de 100 mg Mn/kg, comparativement à des rats femelles gravides soumises à un régime témoin (35 mg Fe/kg, 10 mg Mn/kg) (Fitsanakis et coll., 2009). Dans cette étude, l’exposition au manganèse par la voie alimentaire a révélé qu’une carence en fer (laquelle touche particulièrement les femelles gestantes) peut accroître les effets du manganèse sur le système cognitif (Fitsanakis et coll., 2009).
Chez des rats mâles adultes exposés pendant 8 mois à 0,1 ou 5,0 mg Mn/mL sous forme de chlorure de manganèse dans l’eau potable, une augmentation de l’activité motrice spontanée (mesurée de façon hebdomadaire pendant 60 sessions durant une minute chacune) a été observée aux deux doses pendant le premier mois (Bonilla, 1984a). Une exposition supplémentaire allant jusqu’à six mois n’a pas eu d’incidence sur cet effet, mais une diminution importante de l’activité motrice a été observée après 7 et 8 mois chez les animaux exposés comparativement aux témoins. Le développement de la motricité fine chez des rats exposés de la naissance à 21 jours ou sur toute la durée de vie a été étudié à l’aide du test de l’escalier (Beaudin et coll., 2013). Une altération de la motricité fine a été observée chez les adultes ayant été exposés à 50 mg Mn/kg p.c. par jour par gavage au début de leur vie seulement. De plus, les adultes exposés pendant toute la vie ont présenté des difficultés généralisées à atteindre et saisir des objets (Beaudin et coll., 2013).
Des signes de faiblesse musculaire et de rigidité des membres inférieurs ont été observés chez quatre singes rhésus (Macaca mulatta) mâles adultes ayant reçu une dose de 25 mg MnCl2•4H2O/kg p.c. par jour (correspondant à 6,94 mg Mn/kg p.c. par jourNote de bas de page5) par voie orale pendant 18 mois (Gupta et coll., 1980).
Des effets neurocomportementaux ont été relevés chez des rats et des souris (petits, jeunes et/ou adultes) exposés au manganèse par voie orale (doses estimatives de 43,7 à 910 mg Mn/kg p.c. par jour, sous forme de chlorure de manganèse) soit dans les aliments, dans l’eau potable ou par gavage, pendant des périodes d’une durée variable (allant de 14 jours à 21 semaines) (Gray et Laskey, 1980; Ali et coll., 1983; Chandra, 1983; Kristensson et coll., 1986; Pappas et coll., 1997; Calabresi et coll., 2001; Torrente et coll., 2005b; Liu et coll., 2006; Vezer et coll. 2007; Avila et coll., 2008; Molina et coll., 2011; Nowak et coll., 2011; Betharia and Maher, 2012; Fordahl et coll., 2012; Shi et coll., 2012; Takacs et coll., 2012; Krishna et coll., 2014). Les chercheurs ont noté les effets suivants : retard du réflexe de redressement, ataxie, déficits de l’apprentissage, de la mémoire et de l’activité motrice (faibles résultats au test de la piscine de Morris et au test de descente), signes d’hypoactivité ou d’hyperactivité, anxiété, mauvaise humeur, agressivité et impulsivité (lors du test en milieu ouvert, du test du nouvel objet, du test de nage forcée et du test du labyrinthe en croix surélevé).
Développement moteur, interaction sociale dyactique, surveillance automatisée de l’activité, études d’absorption du fer, prélèvement d’échantillons de LCR (pour l’analyse des catécholamines dans le LCR), tests WGTA (reconnaissance d’objet [apprentissage et inversion], entraînement pour le test de non-appariement retardé, test de non-appariement retardé, apprentissage de l’emplacement [et inversion], score de tempérament après la séance, récompense retardée) et tests CANTAB (entraînement à intervalle fixe, provocation à la dopamine, test de performance continue, observation de stéréotypies).
10.2.1.3 Évaluation structurelle des tissus neuronaux
Plusieurs études ont décrit les effets délétères de l’exposition au manganèse sur l’ultrastructure des tissus cérébraux, comme la dégénérescence neuronale, la gliose (astrogliose)Note de bas de page6 ou la neuroinflammation, chez les rongeurs jeunes et adultes.
Une altération des tissus cérébraux a été observée à de très faibles doses chez des rats mâles juvéniles (JPN21) exposés quotidiennement par gavage à du MnCl2•4H2O dans l’eau (une seule dose de 50 µg MnCl2•4H2O par rat par jour) pendant une période d’une durée variée (15, 30, 45 ou 60 jours, c.-à-d. jusqu’au JPN80; 6 rats/groupe). Même si les données indiquent une seule dose par jour, les doses réelles en mg/kg pourraient varier considérablement, car le poids des jeunes en croissance change tout au long de l’étude. Les modifications observées comprennent une dégénérescence neuronale dans le cortex cérébral (région frontale) et dans le cortex cérébelleux après 30, 45 et 60 jours (aucun effet à 15 jours), une dégénérescence neuronale et une prolifération neurogliale dans le noyau caudé après 60 jours d’exposition, et la présence de déformations astrocytaires du type II d’Alzheimer (changement morphologique) dans la zone de dégénérescence neuronale (cortex cérébral) (Chandra et Shukla, 1978).
Une dégénérescence neuronale marquée (gliose, perte neuronale et dépigmentation dans la région de la substance noire) a été observée chez quatre singes rhésus (Macaca mulatta) mâles adultes ayant reçu pendant 18 mois une dose de 25 mg MnCl2•4H2O/kg p.c. par jour par voie orale (les détails relatifs à l’administration de la dose n’ont pas été fournis), comparativement à quatre singes témoins (Gupta et coll., 1980). Les autres régions du cerveau n’ont pas été examinées.
Dans une autre étude, des petits mâles et femelles ont été exposés à du chlorure de manganèse in utero et par le lait maternel, pendant 70 jours (soit 15 à 20 jours avant la gestation, pendant toute la gestation, et pendant un mois après la mise bas). Les mères recevaient une solution aqueuse de chlorure de manganèse dans leur première portion de nourriture, ce qui donne une dose estimative de 10 ou 20 mg MnCl2•4H2O/kg p.c. par jour. Une gliose marquée et proportionnelle à la dose a été observée aux deux doses dans le noyau caudé, les noyaux septaux dorsal et ventral, le noyau accumbens et le cortex cérébral (Lazrishvili et coll., 2009).
Dans deux études où de jeunes rats adultes ont été exposés par gavage à une dose quotidienne de manganèse (20 ou 50 mg MnCl2H2O/kg) pendant 30 jours, des changements dans l’ultrastructure des neurones, les contacts inter-neuronaux et les cellules gliales ont été observés dans le noyau caudé, la substance noire et la région fronto-pariétale du cortex. Ces changements se sont accentués après trois mois (c.-à-d. après l’arrêt de l’exposition) et ont entraîné une dégénérescence cellulaire. Dans les deux études, on note également que la majorité des mitochondries des neurones et des astrocytes ont été détruites (Bikashvili et coll., 2001; Shukakidze et coll., 2002). Les doses d’essai quotidiennes étaient de 50 mg MnCl2•4H2O/kg (Bikashvili et coll., 2001) et de 20 ou 50 mg MnCl2•4H2O MnCl2/kg p.c. par jour (Shukakidze et coll., 2002).
Les effets différentiels d’une exposition par gavage à du chlorure de manganèse dans une solution saline (10 ou 30 mg Mn/kg p.c. par jour) chez la souris ont été examinés sur trois périodes de vie : juvénile (JPN 20 à 34); adulte (SPN 12 à 20); juvénile et adulte (Moreno et coll., 2009a). À une dose ≥ 10 mg Mn/kg p.c. par jour, le manganèse a augmenté l’expression de l’oxyde nitrique synthase 2 (NOS2)Note de bas de page7 dans les cellules microgliales, et causé une légère activation des astrocytes (non statistiquement significative) chez les souris juvéniles. Une augmentation de l’astrogliose a été constatée chez les souris adultes. Les mêmes changements ont été observés chez les souris ayant été exposées pendant les deux périodes (juvénile et adulte), mais ils étaient de plus grande ampleur, et l’expression du NOS2 était également accrue dans les astrocytes (Moreno et coll., 2009a).
Une activation des astrocytes (indiquée par un taux élevé de GFAP) et/ou une baisse de la neurogénèse (indiquée par un nombre accru de cellules exprimant le doublecortin et de cellules exprimant la reelin, et par une diminution de la concentration des hormones associées à la thyroïde) ont été observées chez des rats exposés à du chlorure de manganèse par micropipette du JPN1 au JPN21 (25 ou 50 mg Mn/kg p.c. par jour, dans une solution de sucrose à 25 %; Kern et coll., 2011), ou in uteroet dans le lait maternel du JG10 au JPN21 (concentrations dans l’alimentation de la mère : 32, 160, 800 ou 1 600 ppm de MnCl2•4H2O) (Ohishi et coll., 2012). Une augmentation du taux de GFAP (dans le gyrus denté) a également été observée chez des rats mâles adultes ayant été exposés au manganèse par gavage pendant 10 semaines (15 et 59 mg MnCl2•4H2O/kg p.c. par jour dans l’eau distillée) (Vezer et coll., 2005; Vezer et coll., 2007). Une exposition au manganèse avant le sevrage a entraîné une expression accrue de la GFAP dans le cortex préfrontal chez des rats exposés à 25 ou 50 mg Mn/kg p.c. par jour (JPN24), et a mené avec le temps à une activation accrue des astrocytes dans d’autres régions du cerveau qui contrôlent la fonction exécutive, soit le striatum médial et le noyau accumbens, à la dose de 50 mgMn/kg p.c. par jour (JPN107). Ces résultats indiquent un effet de l’exposition au manganèse sur l’astrogliose qui a persisté et/ou progressé dans d’autres régions du cerveau chez les animaux adultes après que le taux de manganèse dans le sang est revenu à la normale (Kern et Smith, 2011).
Une expression accrue de la GFAP, de l’ARNm de la GFAP, de l’oxygénase hémique-1 (un marqueur de stress oxydatif) et des NOS inductibles a été observée dans la substance noire de souris adultes mâles ayant été exposées pendant 8 semaines à 0,4 g Mn/L dans l’eau potable (Krishna et coll., 2014).
Après que des souris ont été exposées in uteroet par le lait maternel (du JG10 au JPN21) à du manganèse dans les aliments (32, 160 ou 800 ppm Mn provenant de chlorure de manganèse), une augmentation du nombre de cellules exprimant la reelin a été constatée au JPN21 chez les animaux ayant reçu 160 ppm manganèse ou plus. D’autres altérations neuronales ont aussi été observées à la dose la plus élevée. Selon les auteurs, le manganèse pourrait cibler les cellules granulaires immatures et empêcher leur différentiation en cellules granulaires matures, entraînant une apoptose et une migration neuronale anormale (Wang et coll., 2012).
Dans une étude multigénérationnelle menée avec des souris exposées à 25 mg Mn/kg p.c. par jour (sous forme de chlorure de manganèse) dans l’eau potable, une toxicité cellulaire révélée par une démarche anormale a été observée chez 2 nouveau-nés (310.2.1.4 Effets neurochimiques
Une augmentation de l’activité de la monoamine oxydase (MAO) a été observée chez des jeunes rats mâles exposés à du manganèse de façon quotidienne au début de la période postnatale. Les rats ont été exposés par gavage à du chlorure de manganèse tétrahydrate dans l’eau distillée (50 µg MnCl2•4H2O par jour par rat; une seule dose d’essai) pendant des périodes d’une durée variée (15, 30, 45 ou 60 jours). Une augmentation de l’activité de la MAO a été observée dans le cerveau des animaux de tous les groupes exposés (Chandra et Shukla, 1978). Puisque la MAO sert à métaboliser (inactiver) les neurotransmetteurs monoaminergiques (noradrénaline, dopamine, épinéphrine et sérotonine), cette observation concorde avec les résultats d’autres études faisant état d’une modification des taux de neurotransmetteurs comme la dopamine (DA) ou la sérotonine. Une diminution des taux de DA a été relevée dans le striatum et la région hypothalamique des jeunes rats et des jeunes souris ayant été exposés par gavage à une dose ≥ 10 mg Mn/kg p.c. par jour du JPN1 au JPN21 ou du JPN 1 au JPN24Note de bas de page8 (Deskin et coll., 1980; Moreno et coll., 2009b). Une diminution dose-réponse des taux de DA dans le striatum a également été observée chez des jeunes rats exposés par gavage à 0, 50, 250 ou 500 µg Mn/jour entre le JPN1 et le JPN20) (Tran et coll., 2002b). Cette baisse de la DA était accompagnée d’effets fonctionnels négatifs sur le développement moteur et le comportement, évalués selon le test de redressement (réflexe), le test de retour au gîte et le test d’évitement passif (Tran et coll., 2002b).
Une diminution du taux de DA dans le striatum a été observée chez des souris mâles et femelles exposées par gavage à des doses de 10 et 30 mg Mn/kg p.c. par jour sous forme de chlorure de manganèse dans une solution saline, sur deux périodes (période juvénile du JPN20 au JPN34 et période adulte de la SPN12 à la SPN20) (Moreno et coll., 2009b). Une diminution des taux de DA a également été observée dans le tronc cérébral de rats adultes (âgés de 3 mois) ayant été exposés par gavage à une dose de 20 mg MnCl2/kg p.c. par jour de chlorure de manganèse pendant 6,5 jours (Desole et coll., 1997). Une diminution à long terme de la libération de dopamine striatale induite par cocaïne, mesurée par microdialyse in vivo au JPN90, a également été notée chez des rats exposés (750 µg Mn/jour) pendant la période néonatale (du JPN1 au JPN21) (McDougall et coll., 2008).
À de fortes doses (environ 20 mg Mn/kg p.c. par jour et plus), des changements dans les taux d’autres neurotransmetteurs (p. ex., GABA, sérotonine, aspartate, Gln, Glu, taurine) ou dans l’activité des enzymes neurotransmetteurs (AChE) (Deskin et coll., 1981; Lipe et coll., 1999; Garcia et coll., 2006), ainsi qu’une réduction des sites de fixation des transporteurs de la DA, des récepteurs de la DA de type D1 (Dorman et coll., 2000; Liu et coll., 2006; Reichel et coll., 2006; McDougall et coll., 2008; Kern et coll., 2010; Kern et Smith, 2011) et des aberrations touchant la neurogénèse (Wang et coll., 2012), ont été observés dans le striatum de souris et de rats juvéniles.
Chez les rats, on a découvert que les effets sur la cognition et le comportement d’une exposition au manganèse tôt dans la vie étaient associés à d’importantes modifications de la quantité de transporteurs de la dopamine (DAT) et des récepteurs D1 et D2 dans le striatum dorsal, le cortex préfrontal et le noyau accumbens (Kern et coll., 2010). Dans cette étude, des rats nouveau-nés ont été exposés à des doses de 25 et 50 mg Mn/kg p.c. par jour (sous forme de MnCl2), administrées par micropipette, du JPN1 au JPN21. Les animaux ont été soumis à une série de tests conçus pour évaluer divers comportements relevant de la fonction exécutive (n = 15 à 20 mâles/traitement) (les détails de cette expérience sont présentés dans la sous-section « effets comportementaux » ci-dessous), et une analyse immunohistochimique a été effectuée sur une cohorte d’animaux distincte afin de mesurer les taux de D1, D2 et DAT dans le cerveau (n = 4–7 rats/traitement). Le nombre de récepteurs D1 était significativement moins élevé dans le striatum dorsal des animaux exposés (chez les deux groupes), tout comme le nombre DAT dans le groupe ayant reçu la dose élevée. Aucun changement n’a été observé en ce qui concerne le nombre de D2 dans le striatum. Une diminution des récepteurs D1 dans le noyau accumbens a été observée à la dose forte. Bien que le taux de récepteurs D2 n’ait pas changé de façon mesurable dans le striatum et le noyau accumbens, une augmentation importante a été observée dans le cortex préfrontal des animaux ayant reçu la dose forte. Ces résultats indiquent que l’exposition au manganèse pendant le développement pourrait altérer l’environnement synaptique dopaminergique dans les cellules du cerveau (Kern et coll., 2010).
Des changements neurochimiques ont aussi été décrits dans une étude subséquente qui visait à déterminer si une exposition au manganèse en début de vie entraîne des effets neurocomportementaux et neurochimiques persistant jusqu’à l’âge adulte (Kern et Smith, 2011). Dans cette étude, des rats nouveau-nés (JPN 1 à 21) ont été exposés à du MnCl2 (25 ou 50 mg Mn/kg p.c. par jour, dans une solution de sucrose à 25 %) par micropipette. Des analyses ont été effectuées au JPN24 (rats sevrés) et au JPN107 (âge adulte) afin de mesurer la densité de DAT et de récepteurs de la dopamine de type D1 et D2 dans le cortex préfrontal, le striatum, et le noyau accumbens. Les résultats ont révélé que les rats exposés avant le sevrage à 25 mg Mn/kg p.c. par jour présentaient un nombre accru de récepteurs D1 dans le noyau accumbens au JPN107. Toutefois, au JPN 24, le nombre de récepteurs D1 avait diminué dans ce tissu chez les rats ayant reçu la dose élevée, et avait diminué dans le striatum dorsal pour les deux doses. Une augmentation significative des récepteurs D2 (à environ 800 % de la valeur des témoins) a été observée au JPN24 et au JPN107 dans le cortex préfrontal des animaux ayant reçu la dose la plus forte. Le nombre de DAT était accru au JPN24 dans le striatum dorsal et le noyau accumbens à la dose la plus forte, mais les changements relatifs au nombre de transporteurs avaient disparu au JPN107. Il est intéressant de noter que les concentrations de manganèse relevées dans le sang et le cerveau au JPN107 (après l’exposition ayant eu lieu avant sevrage, du JPN1 au JP21) n’étaient pas statistiquement différentes de celles des témoins (malgré l’augmentation observée au JPN24) (Kern et Smith, 2011), ce qui laisse à penser qu’une exposition au manganèse en début de vie entraînerait des effets sur le système dopaminergique qui persisteraient même après que les concentrations de manganèse soient revenues à ce qu’elles étaient avant l’exposition. Dans le cadre d’une étude antérieure réalisée par un autre groupe de chercheurs, des souris nouveau-nés mâles ont été exposées à du manganèse dans l’eau potable (5 mg MnCl2/L) pendant une période allant jusqu’à 180 jours. Une augmentation passagère de la teneur en DA, NE, HVA et tyrosine a été notée dans les corps striés (Chandra et coll., 1979a). Les auteurs ont suggéré que cette augmentation temporaire des taux de DA et NE striataux pourrait être en lien avec l’hyperactivité observée après 60 et 90 jours d’exposition (Chandra et coll., 1979a).
Une diminution des taux de DA dans le sérum, le cervelet, l’hypothalamus, le cortex, l’hippocampe, le mésencéphale et/ou le striatum a été observée chez des rats adultes exposés à une dose ≥ 22,5 mg Mn/kg p.c. par jour (sous forme de chlorure ou de sulfate de manganèse) dans l’eau potable. Une modification des quantités de neurotransmetteurs ou de métabolites de neurotransmetteurs (GABA, sérotonine, norépinéphrine (NE), DA, Glu, taurine), des transporteurs de neurotransmetteurs, et de l’activité enzymatique (TH) a également été notée chez des rats et des souris adultes ayant été exposés à des doses estimatives allant de 22,5 à 2 943,3 mg Mn/kg p.c. par jour (sous forme de chlorure ou de sulfate de manganèse) dans l’eau potable ou par gavage pendant une période variant de 7 jours à 8 mois (Bonilla, 1978, 1980; Chandra, 1983; Eriksson et coll., 1987a; Subhash et Padmashree, 1991; Miele et coll., 2000; Ranasinghe et coll., 2000; Spadoni et coll., 2000; Calabresi et coll., 2001; Centonze et coll., 2001; Montes et coll., 2001; Anderson et coll., 2007; 2008; 2009; Fordahl et coll., 2010; Krishna et coll., 2014). Une augmentation des concentrations de manganèse dans les tissus a été constatée chez 4 singes rhésus mâles exposés pendant 18 mois à du chlorure de manganèse tétrahydrate (20 mg/kg p.c. par jour, dans de l’eau distillée) par gavage. Une diminution des taux de DA et de NE a été observée dans le diencéphale, le corps strié, le mésencéphale et la protubérance. Le taux de 5-hydroxytryptamine (5-HT) était réduit dans le mésencéphale. Une diminution des taux de DA et de 5-HT a été observée dans la moelle allongée, bien que la teneur en manganèse dans le cerveau des singes exposés ait été similaire à celle mesurée chez les témoins (Chandra et coll., 1979b).
Une modification des taux de GABA et d’autres neurotransmetteurs a également été notée chez des rats sevrés âgés de 30 jours et des rats adultes âgés de 90 jours ayant été exposés pendant 30 jours à 10 ou 20 mg Mn/kg p.c. par jour (sous forme de chlorure de manganèse dans l’eau) par gavage. À la dose de 20 mg Mn/kg p.c. par jour, on a observé une augmentation des taux de GABA dans le noyau caudé chez les rats juvéniles, et une augmentation des taux d’aspartate, de glutamate (Glu), de glutamine (Gln), de taurine et de GABA dans le cervelet des adultes. Aucun effet dose-réponse n’a été relevé dans les autres parties du cerveau examinées (cortex frontal et hippocampe) (Lipe et coll., 1999). Une modification des taux de GABA et d’autres neurotransmetteurs (c.-à-d. une augmentation des taux de sérotonine et de GABA et une diminution du taux d’acétylcholinestérase [AChE]) a été observée dans le striatum, l’hypothalamus et le cerveau en général des rats juvéniles des deux sexes exposés par gavage à ≥ 20 mg Mn/kg p.c. par jour (sous forme de chlorure de manganèse dans une solution de sucrose à 5 %; doses d’essai : 10, 15 et 20 µg Mn/kg p.c. par jour) (Deskin et coll., 1981), ou par le lait maternel (petits exposés du JPN 4 au JPN21, alors que leur mère recevait un supplément de manganèse de 100 ppm Mn par voie alimentaire) et dans leurs aliments, lorsqu’ils en ont été capables (c.-à-d. au JPN 11) (Garcia et coll., 2006).
Une diminution du taux d’acide 3,4-dihydroxyphénylacétique (DOPAC) a été observée dans le striatum et l’hypothalamus de rats mâles exposés à du chlorure de manganèse dans l’eau potable pendant 8 mois. On a également relevé une augmentation du taux d’acide 5-hydroxy-indolacétique dans l’hippocampe, et du taux de noradrénaline dans la protubérance (ces effets ont été observés aux deux doses d’essai (0,1 et 1,0 mg Mn/mL) (Bonilla, 1984b).
Il a été suggéré que les changements touchant les systèmes de neurotransmetteurs variaient en fonction de la durée d’exposition lors d’une intoxication au manganèse. De tels changements ont été observés dans des études menées par un groupe de chercheurs ayant exposé des souris nouveau-nés mâles à du chlorure de manganèse par le lait maternelNote de bas de page9 puis dans de l’eau potable contenant 3 µg Mn/mL (3 mg/L) pendant une période allant jusqu’à 180 jours (Chandra et coll., 1979a), et ayant exposé des souris mâles à du chlorure de manganèse dans de l’eau potable contenant 1 mg/mL (1 000 mg/L) pour une durée allant jusqu’à 360 jours (Chandra et Shukla, 1981). L’exposition au manganèse a fait augmenter les taux de DA, NE, HVA et tyrosine dans le corps strié (Chandra et coll., 1979a; Chandra et Shukla, 1981). Il convient toutefois de noter que cette augmentation était passagère (les concentrations sont descendues sous les valeurs des témoins après 300 et/ou 360 jours d’exposition) (Chandra et Shukla, 1981). Ces changements n’ont pas été corrélés avec le taux de manganèse dans le corps strié, qui a augmenté progressivement jusqu’au jour 120 chez les souris et jusqu’au jour 240 chez les rats avant de se stabiliser (Chandra et coll., 1979a; Chandra et Shukla, 1981). Cependant, les changements notés dans les taux de neurotransmetteurs ont été associés à une activité accrue de la MAO dans le striatum des rats pendant les premières périodes d’exposition au manganèse (du 15e au 120e jour d’exposition). Selon les auteurs, l’augmentation initiale des taux de NE et DA striatale chez les souris pourrait être reliée à l’hyperactivité observée après 60 et 90 jours d’exposition (Chandra et coll., 1979a). Des résultats similaires (augmentation temporaire des taux de DA dans le noyau caudé/le putamen) ont été constatés chez des rats ayant été exposés à une plus forte dose de manganèse (2,8 mg/L) sous forme de chlorure de manganèse tétrahydrate dans l’eau potable (Eriksson et coll., 1987a).
On a émis l’hypothèse que les changements qui touchent l’absorbtion synaptosomale des amines dans le cerveau des rats et qui sont provoqués par le manganèse varient avec l’âge. Dans des études de Lai et coll. (1982; 1984), des rats ont été exposés in utero et durant toute leur vie à 1 mg MnCl2•4H2O/mL de chlorure de manganèse dans l’eau potable, ce qui correspond à une dose estimative de 33 mg Mn/kg p.c. par jour (Lai et coll., 1982Note de bas de page10), ou à 36,1 mg Mn/kg p.c. par jour (Lai et coll., 1984Note de bas de page11). Chez les rats âgés de 70 à 90 jours, les auteurs ont constaté une diminution passagère de l’absorption de DA par les synaptosomes isolés de l’hypothalamus, du striatum et du mésencéphale, ainsi qu’une diminution de l’absorption synaptosomale de la choline dans l’hypothalamus. Chez les rats plus vieux (âgés de 90 à 120 jours), l’absorption synaptosomale de la choline était accrue dans le striatum et l’hypothalamus, mais aucun changement n’a été noté dans l’absorption de la DA.
10.2.2 Toxicité pour la reproduction
10.2.2.1 Appareil reproducteur des mâles adultes
Des études ont révélé que le manganèse altérait les fonctions testiculaires et causait des lésions aux testicules après une exposition de courte ou longue durée.
Chez des souris CD-1 mâles exposées pendant 43 jours à de l’acétate de manganèse (7,5, 15,0 et 30,0 mg/kg p.c. par jour), une diminution du nombre de spermatozoïdes dans les testicules (doses ≥ 7,5 mg/kg p.c. par jour) et une diminution de la motilité des spermatozoïdes (doses ≥ 15,0 mg/kg p.c. par jour) ont été observées. La capacité des mâles exposés à féconder les femelles n’a toutefois pas diminué (Ponnapakkam et coll., 2003a). Une augmentation des anomalies de la tête des spermatozoïdes et du pourcentage de spermatozoïdes anormaux a également été notée chez des souris ayant reçu du permanganate de potassium (65 à 380 mg/kg p.c. par jour) ou du sulfate de manganèse (102,5 à 610 mg/kg p.c. par jour) pendant 21 jours par gavage (Joardar et Sharma, 1990).
Des lésions testiculaires ont été observées chez le singe et le rat. Chez des singes rhésus adultes exposés par voie oraleNote de bas de page12 à du chlorure de manganèse à raison de 25 mg MnCl2•4H2O/kg p.c. par jour pendant 18 mois, les auteurs ont observé une congestion et une enflure des testicules, une augmentation marquée du poids des testicules, un œdème interstitiel et une dégénérescence des tubes séminifères. Aucune anomalie n’a été détectée dans les cellules de Leydig. L’activité de plusieurs enzymes (déshydrogénase succinique, glucose-6-phosphate déshydrogénase et phosphatase acide) a été fortement inhibée dans les tubes séminifères. Les auteurs de cette étude ont conclu qu’une exposition chronique au manganèse ne causait pas d’importants changements dégénératifs dans les testicules plus tôt que n’apparaissent les encéphalopathies causées par les métaux chez les primates (Murthy et coll., 1980).
Chez des rats Sprague-Dawley exposés à de l’acétate de manganèse pendant 63 jours, une dégénérescence légère à modérée de l’épithélium germinal dans les tubes séminifères s’est produite à la dose de 612 mg Mn/kg p.c. par jour (aucun effet à 306 mg Mn/kg p.c. par jour). Il semble que ces changements sont réversibles et disparaissent après l’arrêt de l’exposition (Ponnapakkam et coll., 2003c).
Une baisse de fertilité a été observée chez des souris mâles ayant été exposées à du chlorure de manganèse dans l’eau potable (8 000 mg MnCl2/L, correspondant à des doses de 706 mg MnCl2/kg p.c. par jour ou 309 mg Mn/kg p.c. par jour si la dose indiquée par les auteurs fait référence au MnCl2 et non au Mn élémentaire) pendant 12 semaines avant leur accouplement avec des femelles non exposées (aucun effet observé à 1 000, 2 000 et 4 000 mg MnCl2/L) (Elbetieha et coll., 2001).
10.2.2.2 Appareil reproducteur des femelles adultes
Plusieurs études ont été menées chez le rat, la souris et le lapin afin d’évaluer la toxicité du manganèse sur l’appareil reproducteur des femelles. Certaines de ces études ont révélé une diminution de la fertilité, une augmentation des pertes après l’implantation et une baisse de la viabilité des fœtus à des doses d’exposition élevées.
Une diminution du nombre d’implantations et de fœtus viables a été observée chez des souris suisses femelles exposées à du chlorure de manganèse tétrahydrate dans l’eau potable (8000 mg MnCl2/L) pendant 12 semaines avant d’être accouplées à des mâles non exposés (aucun effet à 1 000, 2 000 ou 4 000 mg MnCl2/L) (Elbetieha et coll., 2001). Une augmentation des pertes après l’implantation a été notée chez les femelles gravides ayant reçu de l’eau potable contenant 8 000 mg Mn/L (Elbetieha et coll., 2001). En revanche, aucun effet sur la reproduction n’a été observé chez les lapines gravides ayant reçu des doses similaires de chlorure de manganèse entre le JG6 et le JG20 (Szakmáry et coll., 1995).
Le manganèse n’a pas eu d’effets négatifs sur la santé des mères, la taille des portées ou la proportion mâles/femelles chez les petits lorsque des mères ont été exposées à du chlorure de manganèse dans l’eau potable (2 ou 10 mg MnCl2/mL) pendant la gestation, et aucune analyse plus poussée des organes reproducteurs des femelles n’a été effectuée (Pappas et coll., 1997). Dans une autre étude, une diminution du poids des portées a été constatée chez des rats femelles ayant reçu du chlorure de manganèse dans l’eau potable (20 mg MnCl2/mL) (Kontur et Fechter, 1985). À cette dose, la consommation d’eau et le gain de poids corporel ont diminué de façon très importante.
Le manganèse n’a eu aucun effet sur le gain de poids maternel, le nombre d’implantations, les résorptions, ou le pourcentage de morts fœtales chez des femelles Sprague-Dawley ayant reçu des doses variées de sulfate de manganèse par voie alimentaire (4, 24, 54, 154, 504 et 1 004 mg Mn/kg aliments secs) du sevrage à l’accouplement, et jusqu’au GD21 (Jarvinen et Ahlström, 1975).
10.2.3 Toxicité pour le développement
Plusieurs études portant sur la toxicité pour le développement résultant de l’exposition au manganèse chez le rat, la souris ou le lapin ont été réalisées avec des périodes d’exposition comparables pendant la gestation et la période postnatale. Le manganèse traverse facilement la barrière placentaire et est libéré dans le lait maternel (Saric, 1986). Les nouveau-nés sont particulièrement sensibles à l’exposition au manganèse pendant le développement, car tout indique qu’ils absorbent et accumulent davantage le manganèse et qu’ils en excrètent moins, parce que leur capacité d’excrétion biliaire n’est pas encore développée (Deskin et coll., 1980; Dorman et coll., 2000; Keen et coll., 1986).
Des études ont révélé qu’une exposition au manganèse par voie orale ou par inhalation pendant la gestation, la lactation et la période postnatale a un effet sur la croissance et/ou la survie, altère le rendement reproducteur et entraîne des effets neurotoxiques. L’exposition au manganèse pendant la gestation a aussi été associée à un gain de poids réduit chez les petits. Cette évaluation est principalement axée sur la toxicité pour le développement résultant d’une exposition au manganèse par voie orale. Un compte rendu détaillé de la toxicité résultant d’une exposition par inhalation est présenté dans Santé Canada (2010).
10.2.3.1 Effets sur la croissance et la survie
Dans deux études portant sur les effets de formes solubles du manganèse sur le développement, aucun effet évident sur l’implantation ou sur la survie maternelle ou fœtale n’a été relevé chez des rats, des souris, des hamsters et des lapins exposés à du sulfate de manganèse monohydrate par gavage pendant 5 à 13 jours de gestation consécutifs (souris et rats : JG6 à 15, hamsters : JG6 à 10, lapins : JG6 à 18). Les doses variaient entre 0,783 à 1,36 (faible dose) et 78,3 à 136,0 (dose élevée) mg/kg p.c. par jour, selon l’espèce visée (NTIS, 1973).
Chez des souris exposées à du chlorure de manganèse par la voie alimentaire (0, 32, 160 ou 800 ppm de Mn) du JG10 au JPN21, une diminution du poids corporel a été constatée chez les petits mâles à 160 ppm (du JPN21 au JPN70) et à 800 ppm (du JPN17 au JPN63). En revanche, aucune altération du poids corporel n’a été observée chez les femelles entre le JPN2 et le JPN77 (Wang et coll., 2012).
10.2.3.2 Altération du développement de l’appareil reproducteur
Un développement pubertaire précoce induit par le manganèse a été constaté chez des rats mâles et femelles exposés par gavage à des doses de 10 à 25 mg/kg MnCl2 au début de la période de développement postnatal (Pine et coll., 2005; Lee et coll., 2006; Hiney et coll., 2011).
Une étude fait état de mauvais résultats sur le plan du rendement reproducteur et de la croissance et la survie des nouveau-nés chez des rats ayant été exposés au manganèseNote de bas de page13 par voie alimentaire (aliments contenant à la base une dose de manganèse de 50 mg/kg p.c. par jour, plus 0, 500 ou 1 000 mg/kg p.c. par jour, sous forme sèche) pendant une période allant jusqu’à 7,5 mois. Des études histologiques décrites dans Gerber et coll. (2002) ont révélé une diminution de la spermatogénèse, une altération de l’épithélium, une atrésie (dégénérescence) des follicules ovariens ainsi qu’une persistance du corps jaune, un signe de dysfonctionnement ovarien.
Une diminution du développement sexuel, révélée par une diminution du poids des testicules, des vésicules séminales et du prépuce, a été observée chez des souris mâles exposées par voie alimentaire à 1 050 ppm de manganèse sous forme de Mn3O4, tout en étant soumises à un régime alimentaire pauvre en fer (Gray et Laskey, 1980).
10.2.3.3 Tératogénicité
La tératogénicité des formes solubles du manganèse après une exposition par voie orale n’a été examinée que dans deux études, et aucune d’elles n’a fait état d’un nombre accru d’anomalies dans les tissus mous ou squelettiques (NTIS, 1973; Grant et coll., 1997). Dans la première étude, des rats, des souris, des hamsters et des lapins ont été exposés à du sulfate de manganèse monohydrate par gavage, pendant 5 à 13 jours de gestation consécutifs (souris et rats : JG6 à 15, hamsters : JG6 à 10, lapins : JG6 à 18; les doses variaient entre 0,783 à 1,36 [faible dose] et 78,3 à 136,0 [dose élevée] mg/kg p.c. par jour, selon l’espèce; NTIS, 1973). Dans la deuxième étude, des rats ont été exposés à du chlorure de manganèse par gavage, du JG6 au JG17 (400 µmol/kg p.c. par jour; Grant et coll., 1997).
10.2.3.4 Neurotoxicité au stade de développement
L’exposition au manganèse pendant la gestation, la lactation et/ou la période postnatale peut causer plusieurs types d’effets neurotoxiques, y compris des effets sur le comportement qui sont révélés par une altération neurochimique et neurostructurale chez les animaux, comme il a été mentionné à la section 9.2.2. Les effets notés comprennent une altération des fonctions cognitives et comportementales, qui concorde avec les effets sur le développement observés dans les études épidémiologiques.
Les nouveau-nés sont particulièrement sensibles à l’exposition au manganèse pendant le développement postnatal, et de nombreuses données probantes indiquent que les nouveau-nés absorbent et retiennent davantage le manganèse que les adultes, ce qui fait augmenter la taux de manganèse dans le cerveau et la neurotoxicité durant cette période (Deskin et coll., 1980; Kontur et Fechter, 1985; Keen et coll., 1986; Kristensson et coll., 1986; Brenneman et coll., 1999; Dorman et coll., 2000; Weber et coll., 2002; Tran et coll., 2002a). Cette sensibilité accrue peut être attribuable à plusieurs facteurs, dont une plus grande absorption du manganèse depuis le tube digestif, une barrière hémato-encéphalique incomplètement formée, l’absence d’excrétion biliaire du manganèse jusqu’au sevrage, et une plus grande susceptibilité aux perturbations de l’activité de divers enzymes et à une déficience des systèmes de neurotransmetteurs (Kostial et coll., 1978; Shukla et coll., 1980; Kristensson et coll., 1986; Brenneman et coll., 1999; Dorman et coll., 2000; Moreno et coll., 2009b; Santé Canada, 2010). Cette dernière différence entre les animaux en développement et les animaux adultes a été observée dans des études ayant comparé les effets d’une exposition au manganèse chez des animaux nouveau-nés et adultes (Kostial et coll., 1978; Shukla et coll., 1980; Dorman et coll., 2000; Moreno et coll., 2009b).
Les effets du manganèse sur les mouvements à de fortes doses ont été observés dans une étude sur trois générations chez la souris : des mouvements anormaux ont été notés dans la démarche de deux nouveau-nés de la portée de la troisième génération exposée à 25 mg Mn/kg p.c. par jour (Ishizuka et coll., 1991).
10.2.4 Autres effets
Les effets d’une exposition au manganèse par la voie alimentaire (sauf les effets neurotoxiques) sont décrits dans une étude menée par le NTP (1993) chez des rats et des souris ayant ingéré de sulfate de manganèse monohydrate dans les aliments pendant 14 jours, 13 semaines, ou 2 ans. Dans l’étude de 2 ans, les souris ont été exposées à des doses de 1 500 à 15 000 ppm par voie alimentaire. Les doses correspondant au niveau d’exposition le plus élevé n’ont pas été ajustées en fonction du poids corporel; par conséquent elles variaient avec la croissance (gain de poids) des animaux. Les doses estimées, sur la durée de l’étude, variaient entre 1 171 mg/kg p.c. par jour (semaine 4) et 505 mg/kg p.c. par jour (semaine 104) pour les rats mâles (1 249 à 561 mg/kg p.c. par jour pour les rats femelles). Les doses correspondant au niveau d’exposition le plus élevé, chez les souris, variaient entre 2 263 à 1 916 mg/kg p.c. par jour pour les mâles et entre 3 449 et 1 983 mg/kg p.c. par jour pour les femelles. Dans cette étude, aucun effet important n’a été observé dans l’appareil respiratoire, le système cardiovasculaire, le foie, les yeux, les muscles ou les os (lésions pathologiques), chez l’une ou l’autre des espèces (NTP, 1993). Il est utile de mentionner que dans cette étude, l’exposition se faisait par les aliments et non par l’eau potable. Comme il est mentionné dans la section traitant de la cinétique, la biodisponibilité du manganèse devrait être plus importante lors d’une exposition dans l’eau potable (si elle est prise à jeun) que dans les aliments.
10.2.4.1 Effets sur le poids corporel
Plusieurs études menées avec des conditions variées ont fait état d’une diminution du poids corporel après une exposition au manganèse par voie orale chez les rongeurs. Un poids largement inférieur a été observé au JPN21 chez des rats nouveau-nés ayant reçu 250 ou 750 µg Mn/jour (sous forme de chlorure de manganèse dans une solution de sucrose à 10 %) du JPN1 au JPN21 (Reichel et coll., 2006). Une diminution de la croissance et du gain de poids a aussi été observée chez des rats nouveau-nés ayant été exposés par voie oraleNote de bas de page14 à 25 ou 50 mg/kg p.c. par jour de chlorure de manganèse, du JPN1 au JPN49 et du JPN21 au JPN49 (Brenneman et coll., 1999; Dorman et coll., 2000). Chez des rats âgés de 90 jours exposés par gavage à 10 ou 20 mg Mn/kg p.c. par jour (sous forme de chlorure de manganèse dans l’eau distillée) pendant 30 jours, une diminution du poids corporel a été observée dans les deux groupes (Lipe et coll., 1999). Les plus fortes doses (≥ 120 mg Mn/kg p.c. par jour) de manganèse dans les aliments ou dans l’eau potable ont également provoqué une diminution du gain de poids corporel chez des rats et des souris (Komura et Sakamoto, 1991; NTP, 1993; Torrente et coll., 2005b; Avila et coll., 2008).
Dans l’étude du NTP (1993), le poids corporel moyen a diminué chez les souris femelles exposées à une dose ≥ 1 500 ppm de manganèse par voie alimentaire et chez les rats mâles exposés à une dose de 15 000 ppm. Aucun effet n’a été observé sur le poids corporel des souris mâles ou des rats femelles (NTP, 1993).
10.2.4.2 Effets respiratoires
Il a été démontré que le manganèse avait des effets sur les voies respiratoires après une exposition par voie orale (réduction du poids des poumons) et par inhalation (inflammation nasale et pulmonaire). Une évaluation détaillée des effets toxicologiques associés à l’inhalation de manganèse est présentée dans le rapport Évaluation du risque pour la santé humaine du manganèse inhalé de Santé Canada (Santé Canada, 2010).
10.2.4.3 Effets gastrointestinaux
Des cobayes ayant été exposés par gavage à 10 mg/kg de chlorure de manganèse pendant 30 jours ont présenté des foyers de nécrose dans l’estomac et l’intestin grêle, ainsi qu’une diminution de l’activité de l’adénosine triphosphatase et de la glucose 6-phosphatase dans les cellules (Chandra et Imam, 1973). Toutefois, dans cette étude, il est possible que les effets nuisibles observés dans l’estomac et dans l’intestin grêle des animaux aient été entièrement ou en partie causés par le gavage lui-même. Une hyperplasie de l’estomac antérieur associée à des ulcères et une inflammation (principalement chez les mâles) a été observée chez des souris (mais pas chez les rats) ayant reçu 15 000 ppm de sulfate de manganèse par voie alimentaire pendant 2 ans (NTP, 1993).
Chez des souris mâles exposées à du sulfate de manganèse monohydrate (jusqu’à 50 000 ppm) par voie alimentaire pendant 13 semaines, une hyperplasie et une hyperkératose légères de l’estomac antérieure ont été observées chez 3/10 animaux à la dose d’essai la plus élevée (1 950 mg Mn/kg p.c. par jour). Par contre, aucun effet gastrointestinal n’a été observé chez les souris femelles exposées selon les mêmes conditions, ni chez les rats ayant reçu 25 000 ppm ou moins (NTP, 1993).
10.2.4.4 Effets cardiovasculaires
Dans deux études menées sur des rats mâles Sprague-Dawley sevrés, une exposition au manganèse par voie alimentaire (45 à 50 ppm dans les aliments) pendant 15 semaines a entraîné une réduction de la contraction maximale des vaisseaux (Kalea et coll., 2005). Elle a également provoqué des altérations structurelles aortiques (augmentation du taux d’acide uronique et de la concentration de glycosaminoglycanes totaux, et diminution de la concentration d’acide hyaluronique et de sulfate d’héparane dans les aortes) (Kalea et coll., 2006).
10.2.4.5 Effets hématologiques
Chez les rats (en particulier chez les mâles), on a observé une augmentation des numérations de leucocytes et de neutrophiles après une exposition par voie alimentaire à 50 000 ppm de sulfate de manganèse monohydrate pendant 14 jours. Des effets hématologiques ont également été signalés chez les rats après 13 semaines d’exposition (augmentation de la numération de neutrophiles à partir de 1 600 ppm chez les mâles et de 6 250 ppmNote de bas de page15 chez les femelles) et les souris (diminution des taux d’hématocrite et d’hémoglobine à 50 000 ppm chez les mâles et les femelles, respectivement) (NTP, 1993).
On n’a observé aucune différence notable dans l’hématologie des rats et des souris exposés à du manganèse dans leur alimentation pendant deux ans; l’augmentation des taux d’hématocrite et d’hémoglobine et celle du nombre d’érythrocytes (Er) sont les seuls effets hématologiques observés à l’évaluation intermédiaire des 15 mois chez les souris mâles recevant 15 000 ppm, mais leur signification est incertaine (NTP, 1993). Ces résultats contrastent avec ceux obtenus chez des souris ayant reçu une alimentation contenant 2 g de Mn/kg pendant 100 jours : les taux d’Er ont diminué après l’exposition à l’acétate et au chlorure de manganèse; et la numération leucocytaire a baissé sous l’effet de l’acétate, du chlorure et du dioxyde de manganèse (Komura et Sakamoto, 1991). Une baisse de l’hématocrite a été observée après l’exposition au carbonate de manganèse (Komura et Sakamoto, 1991).
10.2.4.6 Effets hépatiques
Chez des rats exposés à 16 mg de MnCl2•4H2O/kg pc/jour (dans une solution buvable de sucrose à 10 %) pendant 30 jours, on a observé des modifications de plusieurs niveaux d’enzymes hépatiques et sériques (dans le foie : diminution de l’activité de la déshydrogénase succinique et de l’alcool déshydrogénase et augmentation de l’activité de la monoamine oxydase (MAO), de l’adénosine triphosphatase, de l’arginase, de l’alanine aminotransférase, de la ribonucléase et de la glucose-6-phosphatase; dans le sérum : augmentation de l’activité de l’α-amylase et diminution de l’activité de la β-amylase) (Shukla et coll., 1978). Dans une autre étude, les rats femelles exposés de la conception à l’âge de 60 jours à des doses plus élevées de manganèse dans l’eau potable, sous forme de chlorure de manganèse tétrahydraté (1 000, 10 000 ou 20 000 mg MnCl2/L), présentaient une nécrose hépatique et des modifications ultrastructurales (Leung et coll., 1982). Dans l’étude du NTP (1993), on signale un poids relatif du foie réduit chez les rats mâles qui ont reçu du sulfate de manganèse monohydrate en doses supérieures ou égales à 12 500 ppm pendant 14 jours. Après 13 semaines d’exposition, on signale également une baisse du poids du foie chez les rats mâles à des doses supérieures ou égales à 35,8 mg de Mn/kg pc/jour (supérieures ou égales à 1 600 ppm) et chez les rats femelles à des doses de 650 mg de Mn/kg pc/jour (25 000 ppm). Chez les souris, seuls les mâles présentaient une baisse relative et absolue du poids du foie aux doses de 2 410 mg de Mn/kg pc/jour (50 000 ppm) (NTP, 1993).
10.2.4.7 Effets rénaux
Les rats Sprague-Dawley mâles qui ont reçu par voie orale (gavage) des doses élevées de manganèse (de 306 à 1 838 mg de Mn/kg pc/jour sous forme d’acétate de manganèse) pendant 63 jours ont développé des maladies rénales graves (glomérulosclérose, néphrite et urolithiase [calculs rénaux]; Ponnapakkam et coll., 2003b). Les femelles ne présentaient pas de différences significatives avec les groupes témoins pour ce qui est des effets sur les tissus, ce qui donne à penser que les mâles sont plus sensibles à cet effet induit par le manganèse. Contrairement à ces constatations, aucun changement histopathologique rénal significatif n’a été observé chez les souris et les rats recevant des doses élevées de sulfate de manganèse (jusqu’à 2 410 et 650 mg de Mn/kg pc/jour, respectivement) pendant 13 semaines (NTP, 1993), ni chez les souris et les rats recevant du sulfate de manganèse (jusqu’à 50 000 ppm par voie alimentaire) pendant 14 jours (NTP, 1993). On n’a pas détecté d’augmentation du stress oxydatif dans les reins des rats exposés par l’eau potable à des doses allant jusqu’à 25 000 ppm de MnCl2 (soit environ 861 mg de Mn/kg pc/jour) pendant 30 jours (Avila et coll., 2008)Note de bas de page16.
Une augmentation marginale de la gravité moyenne de la néphropathie (en comparaison du groupe témoin) a été relevée chez les rats mâles recevant du sulfate de manganèse monohydraté (15 000 ppm) pendant deux ans, alors qu’aucun changement histopathologique rénal significatif n’a été observé chez les rats femelles ou chez les souris des deux sexes exposées dans des conditions similaires (NTP, 1993).
10.2.4.8 Effets endocriniens et neuroendocriniens
Un groupe de chercheurs a mené plusieurs études suivant des méthodologies semblables sur l’effet du manganèse (chlorure de manganèse) sur l’état hormonal. Les effets signalés comprennent une augmentation de la gonadolibérine (GnRHNote de bas de page17), de l’hormone lutéinisante (LH), de l’hormone folliculo-stimulante (FSH) et des taux estradiol ou de testostérone chez des rats Sprague-Dawley immatures exposés à du MnCl2 par gavage avant la puberté : des effets ont été signalés chez les femelles exposées à 10 mg de MnCl2/kg pc/jour du 12e au 29e jour après la naissance et les mâles exposés à 25 mg de MnCl2/kg pc/jour du 15e au 48e jour après la naissance ou du 15e au 55e jour après la naissance (Pine et coll., 2005; Lee et coll., 2006). À ces doses, l’exposition continue au manganèse a également induit, chez les femelles, un avancement modéré mais significatif de l’âge de l’ouverture vaginale (1,5 jour) et, chez les mâles, une augmentation de la production quotidienne de sperme et de l’efficacité de la spermatogénèse (Pine et coll., 2005; Lee et coll., 2006).
Dans une autre étude, le même groupe de chercheurs a étudié les effets de l’exposition au manganèse dans la période prépubère par gavage (solution saline; 10 mg de MnCl2/kg pc) des femelles (du 12e au 22e jour après la naissance ou du 12e au 29e jour après la naissance) sur des gènes spécifiques liés à la puberté dérivés des cellules gliales connus pour influer sur la libération neuronale de l’hormone de libération de l’hormone lutéinisante (LH-RH) dans le segment basal médian de l’hypothalamus et dans les régions préoptique et antéro-ventrale péri-ventriculaire. Les auteurs ont noté une augmentation de l’expression du facteur de croissance analogue à l’insuline 1 (IGF-1) et des gènes de la cyclooxygénase-2 (COX-2) dans le segment basal médian de l’hypothalamus au 22e et au 29e jour après la naissance, ainsi que du gène de la LH-RH dans les régions préoptique et antéro-ventrale péri-ventriculaire au 29e jour après la naissance (Hiney et coll.., 2011).
La sensibilité des femelles au manganèse pendant la puberté est prouvée par les résultats d’études in vitro sur l’hypothalamus basal sectionné de rats mâles adultes et de rats mâles et femelles immatures (Pine et coll., 2005; Lee et coll., 2006; Prestifilippo et coll., 2007). Le chlorure de manganèse stimule la libération de LH-RH chez les mâles adultes à une plus forte concentration (500 µM) que celle nécessaire chez les femelles (50 µM) et les mâles (250 µM) immatures, respectivement. Donc, les femelles immatures sont plus sensibles que les mâles matures et immatures à cet effet induit par le manganèse (Pine et coll., 2005; Lee et coll., 2006; Prestifilippoet coll., 2007).
Dans une étude du NTP de 1993, on a trouvé des effets endocriniens sans lien avec le manganèse (lésions histopathologiques) chez les souris et les rats recevant du sulfate de manganèse monohydraté (jusqu’à 25 000 ppm chez les rats et jusqu’à 50 000 ppm chez les souris) pendant 13 semaines. Chez les souris recevant du sulfate de manganèse monohydraté (15 000 ppm) pendant deux ans, on a observé une augmentation de l’incidence de l’hyperplasie du follicule thyroïdien et de la dilatation folliculaire de la thyroïde chez les mâles et les femelles; aucun effet endocrinien n’a été relevé chez les rats exposés dans des conditions similaires (NTP, 1993).
10.2.4.9 Cancérogénicité
En 1996, l’U.S. EPA a déclaré que le manganèse était « non classable parmi les agents cancérigènes pour l’humain » (Groupe D) parce que les études existantes étaient considérées comme inadéquates pour évaluer sa cancérogénicité (U.S. EPA, 1996; 2014). Le Centre international de recherche sur le cancer (CIRC) n’a pas encore évalué la cancérogénicité du manganèse.
Aucune donnée ne démontre clairement la cancérogénicité (Assem et coll., 2011). Dans une étude du NTP, on a administré du sulfate de manganèse monohydrate à des souris et à des rats par voie alimentaire (0, 1 500, 5 000 ou 15 000 ppm) pendant deux ans (NTP, 1993). Chez les rats des deux sexes (doses allant jusqu’à 615 et 715 mg/kg pc/jour pour les mâles et les femelles, respectivement), on n’a relevé aucun signe d’activité cancérogène. Chez les souris des deux sexes (doses allant jusqu’à 1 800 et 2 250 mg/kg pc/jour pour les mâles et les femelles, respectivement), on a relevé des signes équivoques de cancérogénicité reposant sur une augmentation marginale de l’incidence de l’adénome folliculaire de la thyroïde et une augmentation statistiquement significative de l’incidence de l’hyperplasie des cellules folliculaires.
10.3 Génotoxicité
On ne connaît pas très bien le potentiel génotoxique du manganèse, et les résultats des tests de génotoxicité semblent dépendre du système d’essai et du protocole utilisés. Des études in vitro ont révélé qu’au moins quelques-unes des formes chimiques du manganèse (telles que le sulfate de manganèse) présentent un potentiel mutagène/génotoxique. Cependant, aucune conclusion générale ne peut être tirée quant à la possibilité que les composés de manganèse posent un danger génotoxique pour les humains, parce que les résultats des études in vivo menées chez l’humain ne sont pas uniformes (Commission européenne, 2000; Santé Canada, 2010; Assem et coll., 2011).
10.3.1 Observations in vitro
10.3.1.1 Mutag énicité et transformation cellulaire
Lors d’essais de mutagénicité sur Salmonella (test d’Ames) effectués avec et sans activation métabolique, le sulfate de manganèse s’est révélé non mutagène pour les souches de S. typhimurium TA97, TA98, TA100, TA1535, et TA1537 (Mortelmans et coll., 1986), mais il était mutagène pour la souche TA97 dans une autre étude (Pagano et Zeiger, 1992). Dans d’autres études, le chlorure de manganèse n’était pas mutagène pour les souches de S.typhimurium TA98, TA100 et TA1535, mais il était mutagène pour la souche TA1537 (Wong, 1988; de Méo et coll., 1991). Le sulfate et le chlorure de manganèse ont tous les deux donné un résultat positif lorsqu’ils ont été testés avec la souche TA102 sans activation métabolique (de Méo et coll., 1991). L’absence de mutagénicité du manganèse, dans certains des tests d’Ames, peut être causée par une faible biodisponibilité de l’ion métallique attribuable aux composants du milieu de culture, qui inhibent l’activité mutagénique des ions métalliques en les chélatant ou en leur faisant concurrence pour les sites de transport actif (NTP, 1993).
Le chlorure de manganèse a donné des résultats positifs, sans activation métabolique, lors d’essais sur des cellules de lymphome de souris (80, 60 et 40 µg/mL) (Oberly et coll., 1982) et lors d’un test des comètes (essai sur gel d’une cellule unique) réalisé sur des lymphocytes humains en culture (pouvoir mutagène de 2,4 révertants/nmole MnCl2) (de Méo et coll., 1991). Il a également provoqué des transformations cellulaires dans des cellules d’embryons de hamster de Syrie (0,13 mM MnCl2) (Casto et coll., 1979).
Le sulfate de manganèse a présenté une faible capacité de mutation et de conversion lors des essais de conversion génique et de mutation réverse chez la souche D7 de Saccharomyces cerevisiae (Singh, 1984). Il a donné des résultats négatifs aux essais de conversion génique en levure dans les deux autres études (Baranowska et coll., 1977; Parry, 1977).
10.3.1.2 Échange de chromatides sœurs et aberrations chromosomiques
Le sulfate de manganèse (12 500 ppm) a induit un échange de chromatides sœurs sans activation métabolique dans des fibroblastes de souris (Andersen, 1983), des cellules ovariennes de hamster chinois (Galloway et coll., 1987) et des lymphocytes humains (Andersen, 1983), et avec activation métabolique dans des cellules ovariennes de hamster chinois (NTP, 1993). Le manganèse a également provoqué des aberrations chromosomiques sans activation métabolique dans des cellules ovariennes de hamster chinois (Galloway et coll., 1987; NTP 1993).
En revanche, le permanganate de potassium n’a causé aucune aberration chromosomique dans une culture primaire de cellules provenant d’embryons de hamster de Syrie, lors des tests sans activation métabolique (Tsuda et Kato, 1977).
10.3.2 Observations in vivo
10.3.2.1 Mutagénicité
Le sulfate de manganèse n’a pas provoqué de mutations létales récessives liées au sexe chez Drosophila melanogaster (Valencia et coll., 1985; NTP, 1993). Le chlorure de manganèse n’a pas provoqué de mutations somatiques chez D. melanogaster (Rasmuson, 1985).
Aucune translocation héréditaire (chez la souris) ni mutation létale dominante (chez le rat) n’ont été détectées chez des souris ayant été exposées à du sulfate de manganèse par voie alimentaire pendant 7 semaines et chez des rats ayant été exposées par gavage une fois par jour pendant 1 à 5 jours (Newell et coll., 1974 cités dans NTP, 1993).
10.3.2.2 Aberrations chromosomiques
Des souris albinos suisses exposées par voie orale à du sulfate de manganèse (doses allant de 33 à 132 mg Mn/kg p.c. par jour) pendant 3 semaines ont présenté une augmentation du nombre d’anomalies de la tête des spermatozoïdes et une fréquence accrue d’aberrations chromosomiques et de miconoyaux dans les cellules de la moelle osseuse (Joardar et Sharma, 1990). Dans une étude similaire, des souris albinos suisses exposées par voie orale à 22,6, 45,2 et 132,1 mg Mn/kg p.c. par jour (sous forme de permanganate de potassium) pendant trois semaines ont présenté une augmentation du nombre d’anomalies de la tête des spermatozoïdes et une fréquence accrue d’aberrations chromosomiques dans la moelle osseuse (Joardar et Sharma, 1990).
Aucune altération chromosomique importante n’a été relevée dans la moelle osseuse ou les spermatogonies de rats mâles exposés à 0,014 mg Mn/kg p.c. par jour (sous forme de chlorure de manganèse) pendant 180 jours (Dikshith et Chandra, 1978).
10.3.3 Épigénétique
De plus en plus de données probantes indiquent que l’exposition à des substances toxiques telles que des métaux en début de vie pourrait influer sur l’expression des gènes plus tard dans la vie, possiblement par des mécanismes épigénétiques (Wright et Baccarelli, 2007). Il semblerait que les changements dans l’expression des gènes qui se produisent sans modification de la séquence d’ADN finissent par altérer les produits de protéines de ces gènes. On ne possède pas encore toutes les connaissances nécessaires pour établir si une forte exposition au manganèse provoque des modifications épigénétiques dans l’ADN qui sont susceptibles d’altérer l’expression des gènes et d’entraîner les effets sur la santé qui ont été décrits. L’exposition au manganèse pendant le développement provoque des changements durables dans l’expression de plusieurs protéines du système dopaminergique (D2, DAT et catécholamine méthyltransférase). Ces protéines sont régulées épigénétiquement par la méthylation des îlots CpG par la protéine méthyltransférase de l’ADN (DNMT) (Kern et coll. 2010, 2011; Shumay et coll., 2010; Day et coll., 2013). Le manganèse a un effet pro-oxydant aux fortes doses d’exposition, et il a été démontré que le stress oxydatif inhibait la DNMT ou entraînait une diminution des taux de DNMT (Han et coll., 2011). En outre, l’altération de la fonction du système dopaminergique a été associée aux déficits comportementaux et cognitifs découlant d’une exposition au manganèse pendant le développement (Kern et coll., 2010, 2011; Beaudin et coll., 2013, 2015; Reichel et coll., 2006; McDougall et coll., 2008).
11.0 Mode d’action
Le système nerveux central est une cible critique de la toxicité du manganèse chez les humains, les primates non humains et les rongeurs. Comme il en a été question aux sections 9 et 10 du présent document, des études toxicologiques ont révélé que l’exposition au manganèse par voie orale (et/ou par inhalation) avait divers effets nocifs sur le comportement (p. ex. une réduction des capacités d’apprentissage et de mémorisation), sur la fonction motrice (p. ex. altération des réflexes et de l’activité) et sur l’ultrastructure du tissu cérébral.
Divers mécanismes ont été proposés pour expliquer la neurotoxicité du manganèse, mais les données indiquent qu’elle fait intervenir plusieurs processus interreliés, tels qu’un dysfonctionnement mitochondrial (Gavin et coll., 1992; Zheng et coll., 1998), la formation de radicaux libres (Desole et coll., 1994; 1995; Hussain et coll., 1997; Taylor et coll., 2006) et une déficience des neurotransmetteurs (Chandra et coll., 1979a; Deskin et coll., 1980; Chandra et Shukla, 1981; Lai et coll., 1982; 1984; Subhash et Padmashree, 1991; Komura et Sakamoto, 1994; Ranasinghe et coll., 2000; Calabresi et coll., 2001; Montes et coll., 2001; Tran et coll., 2002a; 2002b; Fitsanakis et coll., 2006; McDougall et coll., 2008; Peneder et coll., 2011). Ces processus génèrent des radicaux, perturbent la phosphorylation oxydative et la synthèse de l’ATP, et entraînent un dysfonctionnement cellulaire, une apoptose/nécrose et la mort cellulaire. L’exposition au manganèse perturbe également la régulation du Fe, ce qui pourrait contribuer au mécanisme de neurotoxicité du manganèse (Kwik-Uribe et coll., 2003; Kwik-Uribe et Smith, 2006; Reaney et coll., 2006; Crooks et coll., 2007).
Un taux élevé de manganèse peut perturber la régulation et l’interaction des neurotransmetteurs (DA, Glu et GABA) dans les noyaux gris centraux (Chandra et coll., 1979a; Deskin et coll.,1980; Chandra et Shukla, 1981; Lai et coll., 1982; 1984; Subhash et Padmashree, 1991; Komura et Sakamoto, 1994; Ranasinghe et coll., 2000; Calabresi et coll., 2001; Montes et coll., 2001; Tran et coll., 2002a; 2002b; Fitsanakis et coll., 2006; McDougall et coll., 2008; Burton et Guilarte, 2009; Peneder et coll., 2011).
La DA joue un rôle dans la régulation de la cognition, du comportement, de l’activité motrice et de la sécrétion des hormones du système nerveux (Fitsanakis et coll., 2006; Farina et coll., 2013; Guilarte, 2013), tandis que les voies dopaminergiques participent à la régulation des comportements liés aux fonctions exécutives (p. ex. la mémoire, l’apprentissage, l’attention) (Kern et coll., 2010). Environ 80 % de la DA extracellulaire est recyclée dans les neurones présynaptiques en étant recaptée par les transporteurs de dopamine (DAT et NET dépendants du Na+/Cl-) qui se trouvent principalement dans le noyau caudé, le putamen et le noyau accumbens. L’activité des DAT est essentielle à l’homéostasie dans le cerveau car elle contribue à l’efflux cellulaire de la DA (Roth et coll., 2013) et aide à contrôler la durée et la dimension de la signalisation dopaminergique dans le cerveau.
Les déficits neurologiques relevés dans les études chez les animaux, notamment les rongeurs et les primates non humains, étaient accompagnés d’une altération du nombre de récepteurs DAT et DA, et d’une altération de la réponse des antagonistes de la DA. Puisque le nombre de DAT augmente tout au long du développement pour culminer à l’âge adulte (Roth et coll., 2013), il a été avancé que les effets cognitifs et neurocomportementaux observés chez les enfants après une exposition au manganèse pourraient être liés à des effets sur le système dopaminergique pendant le développement (Neal et Guilarte, 2013).
Le glutamate (Glu) est le plus abondant neurotransmetteur excitatoire dans le cerveau et il pourrait jouer un rôle dans le développement du SNC et dans diverses fonctions de ce dernier, telles que la cognition, l’apprentissage et la mémoire (Fitsanakis et coll., 2006). Un taux élevé de manganèse dans les astrocytes semble agir sur la toxicité principalement par stress oxydatif et dysfonction mitochondriale, mais il semble également nuire au cycle de couplage métabolique Gln-Glu entre les astrocytes et les neurones (c.-à-d. le cycle Gln/Glu-GABA), lequel joue un rôle crucial dans les fonctions normales du cerveau (Erikson et Aschner, 2003; Aschner et coll., 2009; Sidoryk-Wegrzynowicz et coll., 2009; Farina et coll., 2013; Karki et coll., 2013; Sidoryk-Wegrzynowicz et Aschner, 2013a; Sidoryk-Wegrzynowicz et Aschner, 2013b). Le cycle Gln/Glu-GABA est essentiel pour un fonctionnement optimal du SNC, parce qu’il produit le neurotransmetteur d’acides aminés Glu (excitatoire) et le GABA (inhibitoire) par des interactions dynamiques entre les astrocytes et les neurones (Sidoryk-Wegrzynowicz et Aschner, 2013b). L’interruption de ce cycle provoque des changements dans les transmissions Glu-ergiques et/ou GABA-ergiques et dans la métabolisation du Gln (Zwingmann et coll., 2003; Sidoryk-Wegrzynowicz et coll., 2009; Sidoryk-Wegrzynowicz et Aschner, 2013a; Sidoryk-Wegrzynowicz et Aschner, 2013b). De plus, la perturbation de la métabolisation et de la fonction astrocytique peut empêcher les astrocytes de fournir les substrats utilisés par les neurones pour la métabolisation des neurotransmetteurs, menant ainsi à une diminution de l’oxydation du glucose dans les neurones, à une détérioration du métabolisme énergétique des neurones et à une perturbation des processus de neurotransmission (Zwingmann et coll., 2003; Sidoryk-Wegrzynowicz et Aschner, 2013b).
L’exposition au manganèse peut accroître la fréquence et l’amplitude des potentiels postsynaptiques excitateurs dans le striatum, en raison de l’hyperactivité des neurones corticostriataux (Centonze et coll., 2001; Fitsanakis et coll., 2006), et/ou favoriser l’excitotoxicité par une suractivation des récepteurs postsynatiques du glutamate (Fitsanakis et coll., 2006). L’hyperactivité du récepteur du glutamate N-méthyl-D-aspartate peut provoquer une augmentation de la consommation d’énergie, en raison de l’entrée d’ions Na+ et Ca2+ qui doivent être activement expulsés de la cellule. Les cellules affaiblies en énergie peuvent permettre une libération passive du glutamate, causant ainsi une élévation de la concentration extracellulaire de glutamate et, en conséquence, une excitation anormale des neurones striataux (excitotoxicité) (Erikson et Aschner, 2003; Fitsanakis et Aschner, 2005; Fitsanakis et coll., 2006).
Des données contradictoires ont été publiées au sujet du GABA, certains groupes de chercheurs faisant état d’une augmentation des taux de GABA striatal causée par le manganèse, alors que d’autres groupes n’ont constaté aucun effet ou signalé une diminution des taux de GABA dans le striatum ou le cortex frontal (Fitsanakis et coll., 2006; Racette et coll., 2012; Martinez-Finley et coll., 2013; Michalke et Fernsebner, 2014). Ces conclusions divergentes peuvent s’expliquer par des différences méthodologiques (p. ex., voie ou durée de l’exposition, âge au moment de l’exposition) et/ou par la contribution et l’altération d’autres systèmes de neurotransmetteurs (Martinez-Finley et coll., 2013).
12.0 Classement et évaluation
Bien que le manganèse soit un élément essentiel, les carences en manganèse sont très rares puisque les besoins nutritionnels sont facilement comblés par l’alimentation. Les préoccupations relatives aux effets toxiques du manganèse sont principalement associées à des expositions excessives, en particulier chez les nourrissons, qui ne possèdent pas les mécanismes homéostatiques nécessaires à la stabilisation des taux de manganèse dans les tissus (Costa et Aschner, 2014).
Les études existantes chez les humains et les animaux de laboratoire ne permettent pas d’identifier la cancérogénicité comme effet préoccupant dans l’évaluation des risques du manganèse. L’U.S. EPA (1999) juge que les données sont insuffisantes pour évaluer le potentiel cancérogène du manganèse chez les humains. Le manganèse n’a pas été classé par le Centre international de recherche sur le cancer. Un effet autre que le cancer a donc été choisi pour l’évaluation des risques du manganèse dans l’eau potable.
Le système nerveux central semble être la principale cible de toxicité du manganèse chez les mammifères, suivi de l’appareil reproducteur. Il a été établi que le manganèse était facilement absorbé dans le système nerveux central après une exposition par voie orale, mais des concentrations élevées peuvent également se retrouver dans d’autres tissus comme les poumons, les reins et les testicules (Aschner et coll., 2005; Bock et coll., 2008).
Plusieurs études épidémiologiques indiquent une possible association entre l’exposition au manganèse dans l’eau potable et des effets neurologiques chez les enfants (Bouchard et coll., 2011; Khan et coll., 2011; Roels et coll., 2012; Oulhote et coll., 2014). Ces effets comprennent une déficience intellectuelle et des fonctions neurocomportementales réduites (mémoire, attention, fonction motrice, hyperactivité) entre les quintiles inférieur et supérieur d’exposition au manganèse dans l’eau potable qui ont été observés, où les concentrations médianes variaient de 1 à 216 µg/L (Bouchard et coll., 2011; Oulhote et coll., 2014).
Ces études ne peuvent être utilisées pour effectuer une évaluation quantitative des risques en raison des limites qu’elles comportent, à savoir les facteurs de confusion potentiels, des estimations inadéquates de l’exposition, le risque de biais et l’absence de détermination des effets temporaires, et le fait qu’on ne dispose pas d’un point de départ clairement établi, lequel est nécessaire pour une analyse dose-réponse. Cependant, les résultats de ces études peuvent être utilisées pour appuyer qualitativement le choix du principal effet utilisé dans l’évaluation quantitative chez les animaux, puisque des paramètres similaires représentant des comportements liés à la fonction exécutive ont été étudiés chez les rongeurs (p. ex. l’hyperactivité [mesurée par un test en espace ouvert] et des déficits d’apprentissage [mesurés à l’aide d’un labyrinthe radial à huit branches]; Kern et coll., 2010). En outre, d’après certaines études, les effets cognitifs et neurocomportementaux observés chez les enfants après une exposition au manganèse pourraient être reliés aux effets sur le système dopaminergique pendant le développement (Neal et Guilarte, 2013), et les données mécanistiques semblent révéler l’existence d’éléments communs entre les rongeurs et les primates non humains quant au rôle du système dopaminergique dans la neurotoxicité induite par le manganèse (Neal et Guilarte, 2013). L’OCDE (2007) recommande le rat comme modèle de choix à utiliser pour l’extrapolation de la neurotoxicité développementale aux humains.
Plusieurs études ont établi des LOAEL après une exposition au manganèse par voie orale. La documentation publiée soulève des préoccupations quant à la pertinence de certains des effets étudiés chez l’humain, et bon nombre d’études portent uniquement sur les effets après une exposition de courte durée, sans qu’il y ait de suivi à long terme. Toutefois, trois études sur les animaux se démarquent par le fait qu’elles évaluent de près et quantifient les effets neurologiques qui concordent avec ceux relevés dans les études épidémiologiques, en tenant compte des effets observés à long terme (Kern et coll., 2010; 2011; Beaudin et coll., 2013).
Les études de Kern et Beaudin ont été choisies comme fondement pour la présente évaluation des risques en raison de leur rigueur dans l’évaluation des effets neurodéveloppementaux en début de vie (les effets neurocomportementaux sont appuyés par les résultats neurochimiques correspondants) qui concordent avec les constatations des études épidémiologiques (Bouchard et coll., 2011; Khan et coll., 2011; Roehls et coll., 2012; Oulhote et coll., 2014). Ces études ont établi une LOAEL de 25 mg Mn/kg p.c. par jour pour différents effets neurologiques chez le rat. En plus de faire la preuve que l’exposition au manganèse en début de vie peut entraîner des effets comportementaux et sensorimoteurs, ces études ont fourni un appui mécanistique en démontrant les changements neurostructuraux et neurochimiques correspondants. Further, Kern et coll. (2011) et Beaudin et coll. (2013) ont démontré que l’exposition au manganèse pendant l’enfance cause des effets qui persistent tout au long de la vie adulte, après que les concentrations de manganèse dans le cerveau sont revenues à la normale.
Malgré les forces citées ci-dessus, il importe de préciser que les études clés choisies ne reflètent pas la LOAEL la plus faible pour les effets neurologiques liés à une exposition au manganèse par voie orale relevés dans la documentation, et qu’une analyse de la dose de référence n’a pas été possible parce que seulement deux doses ont été mises à l’essai. D’autres études ont fait état d’une neurotoxicité résultant de l’exposition au manganèse par voie orale chez des rats, des souris et des primates non humains, à des concentrations allant de 0,106 mg/kg p.c. par jour chez les primates non humains (Golub et coll., 2005) à 6,5 mg/kg p.c. par jour chez les jeunes rats adultes (Vezer et coll., 2005, 2007). Toutefois, on juge que ces études à elles seules ne suffisent pas pour effectuer une évaluation des risques (Chandra et Shukla, 1978; Chandra et coll., 1979a, 1979b; Deskin et coll., 1980; Gupta et coll., 1980; Oner et Senturk, 1995, 1996; Shukakidze et coll. 2002, 2003; Tran et coll., 2002b; Larishvili et coll., 2009; Moreno et coll., 2009a, 2009b). Ces études comportent de nombreuses limites, telles que des lacunes dans les données concernant les effets à long terme et des facteurs de confusion qui nuisent à l’interprétation des résultats. Néanmoins, ces études appuient le choix de la neurotoxicité comme principal effet préoccupant pour cette évaluation des risques.
Il faut garder à l’esprit que plusieurs facteurs peuvent avoir une incidence sur l’ampleur des effets toxiques associés à l’exposition par l’eau potable chez les nourrissons, notamment la biodisponibilité accrue du manganèse ingéré à jeun, la variabilité de la forme chimique et de l’état de valence dans l’eau potable, et le fait que l’absorption et la rétention du manganèse sont plus importantes chez les nourrissons que chez les adultes (Dorothy Klimis-Zacas, 1993; Costa et coll., 2014; Aschner et Aschner, 2005; Keen et coll., 1986). Il convient également de noter que la présente évaluation des risques tient compte des études les plus appropriées dans le contexte de l’élaboration d’une recommandation pour le manganèse dans l’eau potable. La différence entre la biodisponibilité du manganèse dans les aliments et l’eau potable est reconnue dans la documentation et dans les évaluations des risques antérieures (Ruoff, 1995; IRIS, 2002; U.S. EPA, 2004; Bouchard et coll., 2011), et on ne dispose d’aucune donnée quantitative sur la biodisponibilité du manganèse selon la source d’exposition chez les nourrissons. Les concentrations de manganèse dans les cheveux des enfants (un biomarqueur de l’exposition au manganèse) ont été corrélées à l’exposition au manganèse par l’eau potable, mais non à l’exposition par les aliments (Bouchard et coll., 2011). Compte tenu des différences de biodisponibilité entre les diverses voies et sources d’exposition, et de la capacité limitée de la population vulnérable à maintenir l’homéostasie du manganèse, on a choisi avec soin les études ayant les voies et les sources d’exposition au manganèse les plus appropriées pour obtenir une valeur basée sur la santé pour l’eau potable.
Vu les défis posés par l’utilisation d’études épidémiologiques chez l’humain déjà existantes pour l’évaluation quantitative des risques, des études chez les animaux qui étaient représentatives des effets constatés chez l’humain ont été utilisées pour quantifier les risques dans la présente évaluation. Les études de Kern et coll. (2010, 2011) et de Beaudin et coll. (2013) ont été menées chez des rats nouveau-nés afin de refléter les risques pour les nourrissons (la sous-population la plus sensible) sur le plan du développement. Les nourrissons (et les nouveau-nés) sont particulièrement sensibles aux effets du manganèse en raison de leur capacité d’absorption accrue et de leur faible capacité d’excrétion biliaire. Des éléments probants indiquent également qu’une exposition au manganèse en début de vie, pendant une période cruciale du développement du système dopaminergique, peut entraîner des effets neurotoxiques persistant à l’âge adulte.
D’après la LOAEL la plus appropriée décrite ci-dessus, l’apport quotidien tolérable (AQT) pour le manganèse se calcule comme suit :
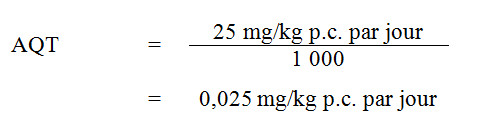
Figure 1 - Equivalent Textuel
L'AQT pour le manganèse est de 0,025 mg/kg de poids corporel par jour. Cet AQT est obtenu en divisant la LOAEL de 25 mg/kg poids corporel par jour par le facteur d'incertitude de 1000.
où :
- AQT est l’apport quotidien tolérable, c’est-à-dire la dose de manganèse provenant de l’eau potable qui ne devrait pas poser de risques pour la santé humaine. Il convient de noter que la biodisponibilité varie de façon importante entre les différentes voies et sources d’exposition au manganèse (aliments, air et eau);
- 25 mg/kg p.c. par jour est la LOAEL tirée des études de Kern et coll. (2010, 2011) et de Beaudin et coll. (2013). Elle est fondée sur les effets neurologiques observés après une exposition postnatale au manganèse chez le rat;
- 1 000 représente le facteur d’incertitude, choisi pour tenir compte de l’extrapolation interspécifique (×10), de la variabilité intraspécifique (×10), et de l’utilisation d’une LOAEL plutôt que d’une NOAEL (×10).
En utilisant cet AQT, on calcule la VBS du manganèse total dans l’eau potable comme suit :
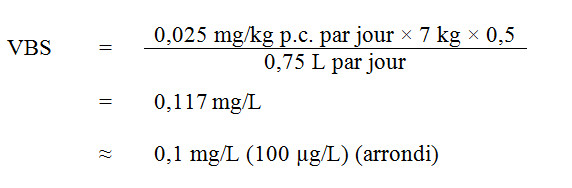
Figure 2 - Equivalent Textuel
La VBS pour le manganèse dans l'eau potable est de 0,1 mg/L (arrondie). Cette valeur est calculée en multipliant l'AQT de 0,025 mg/kg de poids corporel par jour par 7 kg, le poids corporel moyen d'un nourrisson puis par le facteur d'attribution de 0,5, qui tient compte de la contribution de l'eau potable à l'apport quotidien tolérable, et en divisant le résultat par 0,75 L, soit le volume moyen d'eau potable ingéré quotidiennement par un nourrisson (0 – 6 mois).
où :
- 0,025 mg/kg p.c. par jour est l’AQT calculé ci-dessus;
- 7 kg est le poids corporel moyen d’un nourrisson (0 – 6 mois) (Santé Canada, 1999);
- 0,5 est le facteur d’attribution estimatif pour l’eau potable. Étant donné que la formule représente l’alimentation totale des nourrissons non allaités au cours des premiers mois de vie, les concentrations potentiellement élevées de manganèse présentes dans le lait maternisé et dans l’eau utilisée pour sa préparation sont considérées comme les principales sources d’exposition. Comme la quantité de manganèse contenue dans l’eau potable et le lait maternisé varie grandement, on suppose une attribution équivalant à la moitié de l’exposition potentielle pour l’eau potable, et le reste pour le lait maternisé lui-même. On s’attend à ce que la quantité de manganèse provenant d’autres sources soit négligeable pour ce groupe d’âge;
- 0,75 L par jour est la quantité estimative d'eau du robinet consommée quotidiennement par un nourrisson de 0 à 6 mois nourri au biberon (Santé Canada, 1999).
12.1 Considérations internationales
D’autres organismes ont fixé des limites pour la concentration de manganèse dans l’eau potable. En général, deux valeurs différentes sont établies : une pour les limites d’ordre esthétique ou opérationnel, et une axée sur la santé humaine.
Le Minnesota Department of Health (Département de la santé du Minnesota) a élaboré un document d’orientation par paliers fondé sur le même effet et la même étude clé (Kern et coll., 2010) utilisés par Santé Canada pour dériver sa VBS proposée. Une concentration de 0,1 mg/L a été établie pour les enfants de moins d’un an, et de 0,3 mg/L pour les enfants d’un an et plus et les adultes (MDH, 2012).
L’U.S. EPA a établi un niveau maximal secondaire de contaminant (secondary maximum contaminant level) de 0,05 mg/pour le manganèse dans l’eau potable, en se fondant sur des considérations d’ordre esthétique. Elle a en outre publié un avis sanitaire non réglementaire de 0,3 mg/L, en se fondant sur l’absence d’effets dans des études de toxicité par la voie alimentaire (U.S. EPA, 2004).
L’Organisation mondiale de la santé a établi une valeur basée sur la santé de 0,4 mg/L, en se fondant sur l’absence d’effets dans un ensemble d’études de toxicité par la voie alimentaire (OMS, 2011). L’OMS a déterminé qu’il n’était pas nécessaire d’établir une ligne directrice officielle, puisque la valeur basée sur la santé se situe bien en deçà des concentrations habituellement présentes dans l’eau potable.
Les recommandations australiennes (Australian Drinking Water Guidelines) donnent une valeur guide basée sur la santé de 0,5 mg/L, calculée d’après un niveau d’exposition au manganèse jugé sécuritaire par l’OMS pour toutes les sources, et une recommandation d’ordre esthétique de 0,1 mg/L pour le manganèse dans l’eau potable, calculée d’après les données des usines de traitement sur l’acceptation par les consommateurs (NHMRC, 2011).
13.0 Justification
Le manganèse est présent naturellement dans l’environnement sous plusieurs états d’oxydation. Le manganèse, qui est largement répandu dans l’air, l’eau et le sol, peut se retrouver dans l’eau en provenant de sources naturelles comme la météorisation des sols et des roches, ou du fait de l’activité humaine. En général, on retrouve davantage de manganèse dans les eaux souterraines que dans les eaux de surface.
Le manganèse est un élément essentiel pour les humains. Le risque de carence en manganèse est jugé faible au Canada parce qu’on le retrouve en quantité suffisante dans les aliments. Les études dont on dispose actuellement ne permettent pas de déterminer si le manganèse pourrait être cancérogène, et il n’a pas été classé par le Centre international de recherche sur le cancer, ni par l’U.S. EPA pour ce qui a trait à la cancérogénicité. La biodisponibilité du manganèse est plus élevée lorsqu’il est consommé dans l’eau potable que lorsqu’il est ingéré avec les aliments. Les concentrations de manganèse observées dans les cheveux des enfants sont en corrélation avec l’exposition au manganèse par l’eau potable, mais pas avec l’exposition au manganèse par les aliments.
Le système nerveux central semble être la principale cible des effets toxiques du manganèse chez l’être humain et chez les animaux. Plusieurs études épidémiologiques indiquent un possible lien entre l’exposition au manganèse par l’eau potable et certains effets neurologiques chez les enfants, tels qu’une capacité intellectuelle et une fonction neurocomportementale réduites. Bien que leurs limites nous empêchent de s’en servir pour établir une CMA, ces études peuvent être utilisées pour appuyer qualitativement le choix des principaux effets dans les études menées avec des animaux. Les effets neurologiques relevés chez les enfants correspondent aux effets neurologiques observés dans les études clés chez les animaux qui ont servi de fondement au calcul de la valeur basée sur la santé.
Les nourrissons constituent la sous-population la plus sensible aux effets du manganèse sur la santé, car ils absorbent et retiennent davantage le manganèse que les adultes. Bien qu’elle soit établie pour la sous-population la plus sensible, la VBS procure également une protection contre les effets d’une exposition chronique chez les enfants et les adultes. En outre, l’exposition au manganèse dans l’eau potable à des concentrations égales ou inférieures à la VBS ne devrait entraîner aucun autre type d’effet toxique associé à l’exposition au manganèse. Une valeur basée sur la santé de 0,1 mg/L a été calculée pour le manganèse dans l’eau potable.
Une CMA de 0,1 mg/L (100 µg/L) et un OE de 0,02 mg/L (20 µg/L) sont proposés pour le manganèse total dans l’eau potable. La CMA proposée a été établie de façon à protéger la population la plus sensible, à savoir les nourrissons, contre les effets neurologiques. L’OE proposé permettra de réduire le nombre de plaintes formulées par les consommateurs concernant la couleur de l’eau et les taches sur la lessive. La CMA et l’OE proposés pour le manganèse peuvent être mesurés à l’aide des méthodes analytiques existantes et peuvent être atteints avec les techniques de traitement utilisées aux échelles municipale et résidentielle. Dans le cadre de son processus continu de révision des recommandations, Santé Canada continuera de suivre les nouvelles recherches à ce sujet et recommandera au besoin toute modification jugée appropriée.
14.0 Références
Aisen, P., Aasa, R. et Redfield, A.G. (1969). The chromium, manganese, and cobalt complexes of transferrin. J. Biol. Chem., 244(17): 4628–4633. [Cité dans Santé Canada, 2010]
Alberta Environment (2014). Communication personnelle de H. Li, J. Gawor, D. Reid et J. Benjamin.
Alessio, L., Apostoli, P., Ferioli, A. et Lombardi, S. (1989). Interference of manganese on neuroendocrinal system in exposed workers. Biol. Trace Elem. Res., 21: 249–253. [Cité dans Santé Canada, 2010]
Ali, M.M., Murthy, R.C., Mandal, S.K. et Chandra, S.V. (1985). Effect of low protein diet on manganese neurotoxicity: III. Brain neurotransmitter levels. Neurobehav. Toxicol.Teratol., 7: 427–431. [Cité dans Santé Canada, 2010]
Ali, M.M., Murthy, R.C., Saxena DK, Srivastava, R.S. et Chandra, S.V. (1983). Effect of low protein diet on manganese neurotoxicity: I. Developmental and biochemical changes. Neurobehav. Toxicol.Teratol., 5(3): 377–383. [Cité dans Santé Canada, 2010]
Allen, J., Kligerman, A., Campbell, J., Westbrook Collins, B., Erexson, G., Kari, F. et Zeiger, E. (1990). Cytogenetic analyses of mice exposed to dichloromethane. Environ. Mol. Mutagen., 15: 221–228.
Andersen, O. (1983). Effects of coal combustion products and metal compounds on sister chromatid exchange (SCE) in a macrophage-like cell line. Environ. Health Perspect., 47: 239–253. [Cité dans NTP, 1993.]
Andersen, M.E., Gearhart, J.M. et Clewell, H.J. 3rd (1999). Pharmacokinetic data needs to support risk assessments for inhaled and ingested manganese. Neurotoxicology, 20(2): 161–171. [Cité dans Santé Canada, 2010.]
Anderson, J.G., Cooney, P.T. et Erikson, K.M. (2007). Brain manganese accumulation is inversely related to gamma-amino butyric acid uptake in male and female rats. Toxicol. Sci., 95(1): 188–95.
Anderson, J.G., Fordahl, S.C., Cooney, P.T., Weaver, T.L., Colyer, C.L. et Erikson, K.M. (2008). Manganese exposure alters extracellular GABA, GABA receptor and transporter protein and mRNA levels in the developing rat brain. Neurotoxicology, 29(6): 1044–1053.
Anderson, J.G., Fordahl, S.C., Cooney, P.T., Weaver, T.L., Colyer, C.L. et Erikson, K.M. (2009). Extracellular norepinephrine, norepinephrine receptor and transporter protein and mRNA levels are differentially altered in the developing rat brain due to dietary iron deficiency and manganese exposure. Brain Res., 1281: 1–14.
Angara, G., Cummings, L., Knocke, W.R. et Budd, G.C. (2004). Intermediate and long-term manganese control strategies during the upgrade of the Little Falls Water Treatment Plants. Proceedings of the American Water Works Association Water Quality Technology Conference.
APHA, American Water Works Association et Water Environment Federation (1992). standard methods for the examination of water and wastewater, 18e édition. American Public Health Association, Washington, DC.
APHA, American Water Works Association et Water Environment Federation (1995). Standard methods for the examination of water and wastewater 19e édition. American Public Health Association, Washington, DC.
APHA, American Water Works Association et Water Environment Federation (1998). Standard methods for the examination of water and wastewater 20e édition American Public Health Association, Washington, DC.
APHA, American Water Works Association et Water Environment Federation (2005). Standard methods for the examination of water and wastewater, 21e édition. American Public Health Association, Washington, DC.APHA,
APHA, American Water Works Association et Water Environment Federation (2012). Standard methods for the examination of water and wastewater 22e édition. American Public Health Association, Washington, DC.
Archibald, F.S. et Tyree, C. (1987). Manganese poisoning and the attack of trivalent manganese upon catecholamines. Arch. Biochem. Biophys., 256(2): 638–650. [Cité dans Santé Canada, 2010.]
Arnaud, J. et Favier, A. (1995). Copper, iron, manganese and zinc contents in human colostrum and transitory milk of French women. Sci. Total Environ., 159(1): 9–15. [Cité dans Santé Canada, 2010.]
Arnich, N., Cunat, L., Lanhers, M.C. et Burnel, D. (2004). Comparative in situ study of the intestinal absorption of aluminum, manganese, nickel, and lead in rats. Biol. Trace Elem. Res., 99:(1–3): 157–171. [Cité dans Santé Canada, 2010.]
Aschner, J.L. et Aschner, M. (2005). Nutritional aspects of manganese homeostasis. Mol. Aspects Med. 26(4–5): 353–362. Review.
Aschner, M., Vrana, K.E. et Zheng, W. (1999). Manganese uptake and distribution in the central nervous system (CNS). Neurotoxicology, 20(2–3): 173–180. [Cité dans Santé Canada, 2010.]
Aschner, M., Erikson, K.M. et Dorman, D.C. (2005). Manganese dosimetry: Species differences and implications for neurotoxicity. Crit. Rev. Toxicol., 35(1): 1–32.
Aschner, M., Guilarte, T.R., Schneider, J.S. et Zheng, W. (2007). Manganese: recent advances in understanding its transport and neurotoxicity. Toxicol. Appl. Pharmacol., 221(2): 131–147.
Aschner, M., Erikson, K.M., Herrero Hernandez, E., Hernandez, E.H. et Tjalkens, R. (2009). Manganese and its role in Parkinson’s disease: from transport to neuropathology. Neuromolecular Med., 11(4): 252–266.
Assem, F.L., Holmes, P. et Levy, L.S. (2011). The mutagenicity and carcinogenicity of inorganic manganese compounds: a synthesis of the evidence. J. Toxicol. Env. Heal. B, 14(8): 537–570.
ATSDR (2012). Toxicological profile for manganese. U.S. Department of Health and Human Services. Public Health Service. ATSDR, Atlanta, Georgia.
Au, C., Benedetto, A. et Aschner, M. (2008). Manganese transport in eukaryotes: the role of DMT1. Neurotoxicology, 29(4): 569–576.
Avila, D.S., Gubert, P., Fachinetto, R., Wagner, C., Aschner, M., Rocha, J.B. et coll. (2008). Involvement of striatal lipid peroxidation and inhibition of calcium influx into brain slices in neurobehavioral alterations in a rat model of short–term oral exposure to manganese. Neurotoxicology, 29(6): 1062–1068.
AWWA (1984). Removing iron and manganese from groundwater. Confluence, 76(11): 67–69.
AWWA (1993). Committee Report: Research needs for inorganic contaminants. J. Am. Water Works Assoc., 5: 106 –113.
AWWA (2005). Microfiltration and ultrafiltration membranes for drinking water. M53 Manual of Water Supply Practices. American Water Works Association, Denver, Colorado.
Baldwin, M., Mergler, D., Larribe, F., Belanger, S., Tardif, R., Bilodeau, L. et Hudnell, K. (1999). Bioindicator and exposure data for a population based study of manganese. Neurotoxicology, 20(2–3): 343–353.
Baranowska, H., Ejchart, A. et Putrament, A. (1977). Manganese mutagenesis in yeast. V. On mutation and conversion induction in nuclear DNA. Mutat. Res., 42: 343–348. [Cité dans NTP, 1993.]
Barbeau, B., Carriere, A. et Bouchard, M. (2011). Spatial and temporal variations in manganese concentrations in drinking water. J. Environ. Sci. Health A Tox. Hazard. Subst. Environ. Eng.,. 46(6): 608–616.
Barbeau, B., Gauthier, V., Julienne, K. et Carrière, A. (2005). Dead-end flushing of a distribution system : Short and long-term effects on water quality. J. Water Supply Res. T., 54(6), 371–383.
Barceloux, D.G. (1999). Manganese. J. Toxicol. Clin. Toxicol., 37(2): 293–307.
Beaudin, S.A., Nisam, S. et Smith, D.R. (2013). Early life versus lifelong oral manganese exposure differently impairs skilled forelimb performance in adult rats. Neurotoxicol. Teratol., 38: 36–45.
Benskin, P. et Linder, K. (2004). Hypoliminion withdrawal renews reservoir. Opflow, 5: 12–15.
Berghem, L., Hansson, M., Lundborg, M. et Camner, P. (1987). Fibronectin concentrations in lung lavage fluid after inhalation exposure to low levels of metals. Environ. Res., 43(1): 179–185. [Cité dans Santé Canada, 2010.]
Bertinchamps, A.J., Miller, S.T. et Cotzias, G.C. (1965). Interdependence of routes excreting manganese. Am. J. Physiol., 211: 217–224.
Betharia, S. et Maher, T.J. (2012). Neurobehavioral effects of lead and manganese individually and in combination in developmentally exposed rats. Neurotoxicology, 33(5): 1117–27.
Bhang, S., Cho, S., Kim, J., Hong, Y., Shin, M., Yoo, H.J., Cho, I.H., Kim, Y. et Kim, B. (2013). Relationship between blood manganese levels and children’s attention, cognition, behavior, and academic performance: A nationwide cross-sectional study. Environ. Res., 126(0): 9–16.
Bierlein, K.A., Knocke, W.R., Tobiason, J.E., Subramaniam, Pham, M. et Little, J.C. (2015). Modeling manganese removal in a pilot-scale postfiltration contractor. J. Am. Water Works Assoc., 107(2): 109–119.
Bikashvili, T.Z., Shukakidze, A.A. et Kiknadze, G.I. (2001). Changes in the ultrastructure of the rat cerebral cortex after oral doses of manganese chloride. Neurosci. Behav. Physiol., 31(4): 385–389.
Blecharz-Klin, K., Piechal, A., Joniec-Maciejak, I., Pyrzanowska, J. et Widy-Tyszkiewicz, E. (2012). Effect of intranasal manganese administration on neurotransmission and spatial learning in rats. Toxicol. Appl. Pharmacol., 265(1): 1–9.
Bock, N.A., Paiva, F.F., Nascimento, G.C., Newman, J.D. et Silva, A.C. (2008). Cerebrospinal fluid to brain transport of manganese in a non-human primate revealed by MRI. Brain Res., 1198: 160–170.
Bonilla, E. (1978). Increased GABA content in caudate nucleus of rats after chronic manganese chloride administration. J. Neurochem., 31(2): 551–552.
Bonilla, E. (1980). L-tyrosine hydroxylase activity in the rat brain after chronic oral administration of manganese chloride. Neurobehav. Toxicol., 2: 37–41. [Cité dans Newland, 1999.]
Bonilla, E. (1984a). Chronic manganese intake induces changes in the motor activity of rats. Exp. Neurol., 84(3): 696–700.
Bonilla, E. (1984b). Effects of chronic manganese intake on the levels of biogenic amines in rat brain regions. Neurobeh. Toxicol. Teratol., 6: 341–344.
Bornhorst, J., Ebert, F., Hartwig, A., Michalke, B. et Schwerdtle, T. (2010). Manganese inhibits poly(ADP-ribosyl)ation in human cells: a possible mechanism behind manganese-induced toxicity? J. Environ. Monit., 12(11): 2062–2069.
Bornhorst, J., Meyer, S., Weber, T., Böker, C., Marschall, T., Mangerich, A. et coll. (2013). Molecular mechanisms of Mn induced neurotoxicity: RONS generation, genotoxicity, and DNA-damage response. Mol. Nutr. Food Res., 57(7): 1255–1269.
Bouchard, M.F., Sauve, S., Barbeau, B., Legrand, M., Brodeur, M.E., Bouffard, T., Limoges, E., Bellinger, D.C. et Mergler, D. (2011). Intellectual impairment in school-age children exposed to manganese from drinking water. Environ. Health Perspect., 119(1): 138–143.
Bowler, R.M., Gysens, S., Diamond, E., Nakagawa, S., Drezgic, M. et Roels, H.A. (2006). Manganese exposure: Neuropsychological and neurological symptoms and effects in welders. Neurotoxicology, 27(3): 315–326.
Bowman, A.B., Kwakye, G.F., Hernandez, E.H. et Aschner, M. (2011). Role of manganese in neurodegenerative diseases. J. Trace Elem. Med. Biol., 25(4): 191–203.
Brandhuber, P, Clark, S., Knocke, W. et Tobiason, J. (2013). Guidance for the treatment of manganese. Water Research Foundation, Denver, Colorado.
Brandhuber, P., Craig, S., Friedman, M.J., Hill, A., Booth, S. et Hanson, A. (2015). Legacy of manganese accumulation in water systems. Water Research Foundation, Denver, Colorado.
Brenneman, K.A., Cattley, R.C., Ali, S.F. et Dorman, D.C. (1999). Manganese-induced developmental neurotoxicity in the CD rat: Is oxidative damage a mechanism of action? Neurotoxicology, 20(2–3): 477–488. [Cité dans Santé Canada, 2010.]
British Columbia Ministry of Health (2014). Communication personnelle de D. Fishwick.
Brna, P., Gordon, K., Dooley, J.M. et Price, V. (2011). Manganese toxicity in a child with iron deficiency and polycythemia. J. Child Neurol., 26(7): 891–894.
Brodeur, M.E. et Barbeau, B. (2015). Performance of point-of-use and point-of-entry technologies for the removal of manganese in drinking water: Summary of the EDU-MANGO Epidemiological Study. Report prepared for Santé Canada.
Bruins, J. H., Petrusevski, B., Slokar, Y.M., Huysman, K., Koen, J., Kruithof, J.C. et Kennedy, M.D. (2015). Biological and physico-chemical formation of Birnessite during the ripening of manganese removal filters. Water Res., 69: 154–161.
Burger, M.S, Krentz, C.A., Mercer, S.S. et Gagnon, G.A. (2008b). Manganese removal and occurrence of manganese-oxidizing bacteria in full-scale biofilters. J. Water Supply Res. T., 57(5): 351–359.
Burger, M.S., Mercer, S.S., Shupe, G.D. et Gagnon, G.A. (2008a). Manganese removal during bench-scale biofiltration. Water Res., 42: 4733–4742.
Burton, N.C. et Guilarte, T.R. (2009). Manganese neurotoxicity: Lessons learned from longitudinal studies in nonhuman primates. Environ. Health Perspect., 117(3): 325–332.
Burton, N.C., Schneider, J.S., Syversen, T. et Guilarte, T.R. (2009). Effects of chronic manganese exposure on glutamatergic and GABAergic neurotransmitter markers in the nonhuman primate brain. Toxicol. Sci., 111(1): 131–139.
Cahill, D.F., Bercegeay, M.S., Haggerty, R.C., Gerding, J.E. et Gray, L.E. (1980). Age-related retention and distribution of ingested Mn3O4 in the rat. Toxicol. Appl. Pharmacol., 53(1): 83–91. [Cité dans Santé Canada, 2010.]
Calabresi, P., Ammassari-Teule, M., Gubellini, P., Sancesario, G., Morello, M., Centonze, D. et coll. (2001). A synaptic mechanism underlying the behavioral abnormalities induced by manganese intoxication. Neurobiol. Dis., 9: 419–432.
Camara, E., Montreuil, K.R., Knowles, A.D. et Gagnon, G.A. (2013). Role of the water main in lead service line replacement: A case study. . J. Am. Water Works Assoc., E423–E431.
Camner, P., Curstedt, T. et Jarstrand, C. (1985). Rabbit lung after inhalation of manganese chloride: A comparison with the effects of chlorides of nickel, cadmium, cobalt, and copper. Environ. Res, 38: 301–309. [Cité dans Santé Canada, 2010]
Carlson, K.H., Knocke, W.R. et Gertig, K.R. (1997). Optimizing treatment through Fe and Mn fractionations. J. Am. Water Works Assoc., 89(4): 162–171.
Carrière, A., Gauthier, V., Desjardins, R., et Barbeau, B. (2005). Evaluation of loose deposits in distribution systems through unidirectional flushing. J. Am. Water Works Assoc., 97(9): 82–92.
Carrière, A., Brouillon, M., Sauvé, S., Bouchard, M. et Barbeau, B. (2011). Performance of point-of-use devices to remove manganese from drinking water. J. Environ. Sci. Health A Tox. Hazard Subst. Environ. Eng., 46(6): 601–607.
Casale, R.J., LeChevallier, M.W. et Pontius, F.W. (2002). Manganese control and related issues. American Water Works Research Foundation et American Water Works Association. Denver, Colorado.
Casey, C.E., Hambidge, K.M. et Neville, M.C. (1985). Studies in human lactation: Zinc, copper, manganese and chromium in human milk in the first month of lactation. Am. J. Clin. Nutr., 41(6): 1193–1200.
Casto, B.C., Meyers, J. et DiPaolo, J.A. (1979). Enhancement of viral transformation for evaluation of the carcinogenic or mutagenic potential of inorganic metal salts. Cancer Res., 39: 193–198.
Centonze, D., Gubellini, P., Bernardi, G. et Calabresi, P. (2001). Impaired excitatory transmission in the striatum of rats chronically intoxicated with manganese. Exp. Neurol., 172(2): 469–476.
Cerrato, J.M., Reyes, L.P., Alvarado, C.N. et Dietrich, A.M. (2006). Effect of PVC and iron materials on Mn(II) deposition in drinking water distribution systems, Water Res., 40, 2720–2726.
Chan, A.W., Minski, M.J., Lim, L. et Lai, J.C. (1992). Changes in brain regional manganese and magnesium levels during postnatal development: modulations by chronic manganese administration. Abstract. Metab. Brain Dis., 7(1): 21–33.
Chandra, S.V. (1983). Psychiatric illness due to manganese poisoning. Acta Psychiat. Scand., 67(Suppl 303): 49–54.
Chandra, S.V. et Imam, Z. (1973). Manganese induced histochemical and histological alterations in gastrointestinal mucosa of guinea pigs. Abstract. Acta pharmacol. Toxicol., 33: 449–458.
Chandra, S.V. et Shukla, G.S. (1976). Role of iron deficiency in inducing susceptibility to manganese toxicity. Arch. Toxicol., 35(4): 319–323. [Cité dans Santé Canada, 2010]
Chandra, S.V. et Shukla, G.S. (1978). Manganese encephalopathy in growing rats. Environ. Res., 15: 28–37.
Chandra, S.V. et Shukla, G.S. (1981). Concentrations of striatal catecholamines in rats given manganese chloride through drinking water. J. Neurochem., 36: 683–687.
Chandra, S.V., Shukla, G.S. et Saxena, D.K. (1979a). Manganese-induced behavioral dysfunction and its neurochemical mechanism in growing mice. J. Neurochem., 33: 1217–1221.
Chandra, S.V., Srivastava, R.S. et Shukla, G.S. (1979b). Regional distribution of metals and biogenic amines in the brain of monkeys exposed to manganese. Toxicol. Lett., 4(3): 189–192.
Charlton, N., Tikos, E., Gaffney, L. et Kohl, P. (2002). Breakpoint breakdown: optimization of manganese removal to very low levels with oxide-coated filter media. Proceedings of the American Water Works Association Water Quality Technology Conference.
Chen, P., Chakraborty, S., Mukhopadhyay, S., Lee, E., Paoliello, M.M., Bowman, A.B. et Aschner, M. (2015). Manganese homeostasis in the nervous system. J. Neurochem., 134(4): 601–610.
Chen, J.Y., Tsao, G.C., Zhao, Q. et Zheng, H.S. (2001). Differential cytotoxicity of Mn(II) and Mn(III): Special reference to mitochondrial [Fe-S] containing enzymes. Toxicol. Appl. Pharmacol., 175(2): 160–168. [Cité dans Santé Canada, 2010]
Chen, L., Ding, G., Gao, Y., Wang, P., Shi, R., Huang, H. et Tian, Y. (2014). Manganese concentrations in maternal-infant blood and birth weight. Environ. Sci. Pollut. Res. Int., 21(9): 6170–6175.
Clark, N.A., Teschke, K., Rideout, K. et Copes, R. (2007). Trace element levels in adults from the west coast of Canada and associations with age, gender, diet, activities, and levels of other trace elements. Chemosphere, 70(1): 155–164.
Cohen, J.M., Kamphake, L.J., Harris, E.K. et Woodward, R.L. (1960). Taste threshold concentrations of metals in drinking water. J. Am. Water Works Assoc., 52: 660.
Committee on Nutrition, American Academy of Pediatrics (2003). Dans : Kleinman, R.E. (éditeur), Pediatric Nutrition Handbook, 5e édition.
Corella-Vargas, R. (1984). [High levels of manganese in the diet of rats (Rattus norvegicus albinicus). I. Effect on reproduction] (Spanish). Arch. Latinoam. Nutr., 34: 457–65. [Cité dans Gerber et coll., 2002.]
Corkal, D.R., Braul, L., Poon, D., Hicks, W. et Germin, G. (2005). Piloting small rural systems for Fe, Mn and TDS removal. Proceedings of the 57th Annual Conference of the Western Canada Water and Wastewater Association, Saskatoon, Saskatchewan.
Costa, L. et Aschner, M., éditeurs (2014). Manganese in health and disease. RSC Publishing.
Cotzias, G.C., Horiuchi, K., Fuenzalida, S. et Mena, I. (1968). Chronic manganese poisoning. Clearance of tissue manganese concentrations with persistence of the neurological picture. Neurology, 18(4): 376–382. [Cité dans Santé Canada, 2010]
Cotzias, G.C., Miller, S.T., Papavasiliou, P.S. et Tang, L.C. (1976). Interactions between manganese and brain dopamine. Med. Clin. North Am., 60(4): 729–738. [Cité dans Santé Canada, 2010]
Covy, J.P. et Giasson, B.I. (2011). Alpha-Synuclein, leucine-rich repeat kinase-2, and manganese in the pathogenesis of Parkinson disease. Neurotoxicology, 32(5): 622–9.
CRC Handbook of Chemistry and Physics (1983). 64e édition. CRC Press.
Criswell, S.R., Perlmutter, J.S., Videen, T.O., Moerlein, S.M., Flores, H.P., Birke, A.M. et Racette, B.A. (2011). Reduced uptake of [18F]FDOPA PET in asymptomatic welders with occupational manganese exposure. Neurology, 76(15): 1296–1301.
Critchfield, J.W. et Keen, C.L. (1992). Manganese+2 exhibits dynamic binding to multiple ligands in human plasma. Metabolism 41(10): 1087–1092. [Cité dans Santé Canada, 2010]
Crooks, D.R., Ghosh, M.C., Braun-Sommargren, M., Rouault, T.A. et Smith, D.R. (2007). Manganese targets m-aconitase and activates iron regulatory protein 2 in AF5 GABAergic cells. J. Neurosci. Res., 85(8): 1797–809.
Crossgrove, J.S. et Yokel, R.A. (2004). Manganese distribution across the blood-brain barrier. III. The divalent metal transporter-1 is not the major mechanism mediating brain manganese uptake. Neurotoxicology, 25(3): 451–460. [Cité dans Santé Canada, 2010]
Crossgrove, J.S. et Yokel, R.A. (2005). Manganese distribution across the blood-brain barrier. IV. Evidence for brain influx through store-operated calcium channels. Neurotoxicology, 26(3): 297–307. [Cité dans Santé Canada, 2010]
Crossgrove, J.S., Allen, D.D., Bukaveckas, B.L., Rhineheimer, S.S. et Yokel, R.A. (2003). Manganese distribution across the blood-brain barrier I. Evidence for carrier-mediated influx of manganese citrate as well as manganese and manganese transferrin. Neurotoxicology, 24(1): 3–13. [Cité dans Michalke et coll., 2007.]
Davidsson, L., Cederblad, A., Hagebo, E., Lonnerdal, B. et Sandstrom, B. (1988). Intrinsic and extrinsic labeling for studies of manganese absorption in humans. J. Nutr., 118(12): 1517–1521.
Davidsson, L., Cederblad, A., Lönnerdal, B. et Sandström, B. (1989a). Manganese retention in man: A method for estimating manganese absorption in man. Am. J. Clin. Nutr., 49(1): 170–179.
Davidsson, L., Lönnerdal, B., Sandström, B., Kunz, C. et Keen, C.L. (1989b). Identification of transferrin as the major plasma carrier protein for manganese introduced orally or intravenously of after in vitro addition in the rat. J. Nutr., 119(10): 1461–1464.
Davis, C.D., Malecki, E.A. et Greger, J.L. (1992a). Interactions among dietary manganese, heme iron and non-heme iron in women. Am. J. Clin. Nutr., 56: 926–932. [Cité dans Santé Canada, 2010]
Davis, C.D., Wolf, T.L. et Greger, J.L. (1992b). Varying levels of manganese and iron affect absorption and gut endogenous losses of manganese by rats. J. Nutr., 122: 1300–1308.
Davis, C.D., Zech, L. et Greger, J.L. (1993). Manganese metabolism in rats: An improved methodology for assessing gut endogenous losses. Proceedings of the Society for Experimental Biology and Medicine, 202(1): 103–108. [Cité dans Santé Canada, 2010]
Day, J.J., Childs, D., Guzman-Karlsson, M.C., Kibe, M., Moulden, J., Song, E., Tahir, A. et Sweatt, J.D. (2013). DNA methylation regulates associative reward learning. Nat. Neurosci., 16(10): 1445–1452.
Del Toral, M.A., Porter, A. et Schock, M.R. (2013). Detection and evaluation of elevated lead release from service lines: a field study. Environ. Sci. Tech., 47(16): 9300–9307.
De Méo, M., Laget, M., Castegnaro, M. et Duménil, G. (1991). Genotoxic activity of potassium permanganate in acidic solutions. Mutat. Res., 260(3): 295–306. [Cité dans ATSDR 2008.]
Deskin, R., Bursian, S.J. et Edens, F.W. (1980). Neurochemical alterations induced by manganese chloride in neonatal rats. Neurotoxicology, 2: 65–73.
Deskin, R., Bursian, S.J. et Edens, F.W. (1981). The effect of chronic manganese administration on some neurochemical and physiological variables in neonatal rats. Gen. Pharmacol., 12: 279–280.
Desole, M.S., Miele, M., Esposito, G., Migheli, R., Fresu, L., De Natale, G. et coll. (1994). Dopaminergic system activity and cellular defense mechanisms in the striatum and striatal synaptosomes of the rat subchronically exposed to manganese. Abstract. Arch. Toxicol., 68(9): 566–570.
Desole, M.S., Esposito, G., Migheli, R., Fresu, L., Sircana, S., Miele, M. et coll. (1995). Allopurinol protects against manganese-induced oxidative stress in the striatum and in the brainstem of the rat. Neurosci. Lett., 192(2): 73–76.
Desole, M.S., Esposito, G., Migheli, R., Sircana, S., Delogu, M.R., Fresu, L. et coll. (1997). Glutathione deficiency potentiates manganese toxicity in rat striatum and brainstem and in PC12 cells. Pharmacol. Res, 36(4): 285–92.
Dietrich, A.M. et Burlingame, G.A. (2015). Critical review and rethinking of USEPA Secondary Standards for maintaining organoleptic quality of drinking water. Environ. Sci. Technol., 49: 708–720.
Dikshith, T.S. et Chandra, S.V. (1978). Cytological studies in albino rats after oral administration of manganese chloride. Bull. Environ. Contam. Toxicol., 19: 741–746. [Cité dans Santé Canada, 2010]
Dobson, A.W., Weber, S., Dorman, D.C., Lash, L.K., Erikson, K.M. et Aschner, M. (2003). Oxidative stress is induced in the rat brain following repeated inhalation exposure to manganese sulfate. Biol. Trace Elem. Res., 93(1–3): 113–126.
Dong, D., Derry, L.A., Lion, L.W. (2003). Pb scavenging from a freshwater lake by Mn oxides in heterogeneous surface coating materials. Water Res., 37: 1662–1666.
Dorman, D.C., Struve, M.F., Vitarella, D., Byerly, F.L., Goetz, J. et Miller, R. (2000). Neurotoxicity of manganese chloride in neonatal and adult CD rats following subchronic (21-day) high-dose oral exposure. J. Appl. Toxicol., 20(3): 179–187.
Dorman, D.C., Struve, M.F., Clewell, H.J., 3rd et Andersen, M.E. (2006). Application of pharmacokinetic data to the risk assessment of inhaled manganese. Neurotoxicology, 27(5): 752–764.
Dörner, K., Dziadzka, S., Höhn, A., Sievers, E., Oldigs, H.D., Schulz-Lell, G. et coll. (1989). Longitudinal manganese and copper balances in young infants and preterm infants fed on breast-milk and adapted cow’s milk formulas. British Journal of Nutrition, 61: 559–572. [Cité dans Santé Canada, 2010]
Dupont, C.L. et Tanaka, Y. (1985). Blood manganese levels in children with convulsive disorder. Biochem. Med., 33(2): 246–255.
Eastman, R. R., Jursa, T. P., Benedetti, C., Lucchini, R. G. et Smith, D. R. (2013). Hair as a biomarker of environmental manganese exposure. Environmental Science & Technology, 47(3), 1629–1637.
Elbetieha, A., Bataineh, H., Darmani, H. et Al-Hamood, M.H. (2001). Effects of long-term exposure to manganese chloride on fertility of male and female mice. Toxicol. Lett., 119(3): 193–201.
Environment Canada (2014). Quality assured data, national air pollution surveillance (NAPS). Ottawa. http://maps-cartes.ec.gc.ca/rnspa-naps/data.aspx?lang=en.
Erikson, K.M. et Aschner, M. (2003). Manganese neurotoxicity and glutamate-GABA interaction. Neurochem. Int., 43: 475–480.
Erikson, K.M., Dorman, D.C., Lash, L.H. et Aschner, M. (2007a). Manganese inhalation by rhesus monkeys is associated with brain regional changes in biomarkers of neurotoxicity. Toxicol. Sci., 97(2): 459–466.
Ericson, J.E., Crinella, F.M., Clarke-Stewart, K.A., Allhusen, V.D., Chan, T. et Robertson, R.T. (2007b). Prenatal manganese levels linked to childhood behavioral disinhibition. Neurotoxicol. Teratol., 29(2): 181–187.
Eum, J.H., Cheong, H.K., Ha, E.H., Ha, M., Kim, Y., Hong, Y.C., Park, H. et Chang, N. (2014). Maternal blood manganese level and birth weight: A MOCEH birth cohort study. Environ. Health, 13(1): 31-069X-13-31.
European Commission (2000). Opinion of the Scientific Committee on Food on the tolerable upper intake level of manganese. Report No. SCF/CS/NUT/UPPLEV/21.
Expert Group on Vitamins and Minerals Secretariat (EVM) (2002). Review of manganese – revised version. EVM/99/22.REVISEDAUG2002, United Kingdom.
Farina, M., Avila, D.S., da Rocha, J.B.T. et Aschner, M. (2013). Metals, oxidative stress and neurodegeneration: A focus on iron, manganese and mercury. Neurochem. Int., 62: 575–94.
FCM (2003). Qualité de l’eau dans les réseaux de distribution. Fédération canadienne des municipalités Disponible à : www.fcm.ca/Documents/reports/Infraguide/Water_Quality_in %C2 %A0Distribution_System_FR.pdf
Finley, J.W. et Davis, C.D. (1999). Manganese deficiency and toxicity: Are high or low dietary amounts of manganese cause for concern? Biofactors, 10(1): 15–24. [Cité dans Santé Canada, 2010]
Finley, J.W. et Johnson, P.E. (1996). Manganese deficiency and excess in rodents. Dans :Watson, R.R. (eds.). Trace elements in laboratory rodents. Florida, CRC Press: p. 85–102.
Finley, J.W., Johnson, P.E. et Johnson, L.K. (1994). Sex affects manganese absorption and retention by humans from a diet adequate in manganese. Am. J. Clin. Nutr., 60(6): 949–955.
Finley, J.W., Caton, J.S., Zhou, Z. et Davison, K.L. (1997). A surgical model for determination of true adsorption and biliary excretion of manganese in conscious swine fed commercial diets. J. Nutr., 127(12): 2334–2341.
Finley, J.W., Penland, J.G., Pettit, R.E. et Davis, C.D. (2003). Dietary manganese intake and type of lipid do not affect clinical or neuropsychological measures in healthy young women. J. Nutr., 133(9): 2849–2856. [Cité dans Santé Canada 2007.]
Fitsanakis, V.A. et Aschner, M. (2005). The importance of glutamate, glycine, and gamma-aminobutyric acid transport and regulation in manganese, mercury and lead neurotoxicity. Toxicol. Appl. Pharmacol., 204(3): 343–354.
Fitsanakis, V.A., Au, C., Erikson, K.M. et Aschner, M. (2006). The effects of manganese on glutamate, dopamine and gamma-aminobutyric acid regulation. Neurochem. Int, 48(6–7): 426–433.
Fitsanakis, V.A., Piccola, G., Marreilha dos Santos, A.P., Aschner, J.L. et Aschner, M. (2007). Putative proteins involved in manganese transport across the blood-brain barrier. Hum. Exp. Toxicol., 26(4): 295–302.
Fitsanakis, V.A., Thompson, K.N., Deery, S.E., Milatovic, D., Shihabi, Z.K., Erikson, K.M. et coll. (2009). A chronic iron-deficient/high-manganese diet in rodents results in increased brain oxidative stress and behavioral deficits in the Morris water maze. Neurotox. Res., 15(2): 167–178.
Fordahl, S.C., Anderson, J.G., Cooney, P.T., Weaver, T.L., Colyer, C.L. et Erikson, K.M. (2010). Manganese exposure inhibits the clearance of extracellular GABA and influences taurine homeostasis in the striatum of developing rats. Neurotoxicology, 31(6): 639–646.
Fordahl, S., Cooney, P., Qiu, Y., Xie, G., Jia, W. et Erikson, K.M. (2012). Waterborne manganese exposure alters plasma, brain, and liver metabolites accompanied by changes in stereotypic behaviors. Neurotoxicol. Teratol., 34(1): 27–36.
Foster, M.L., Bartnikas, T.B., Johnson, L.C., Herrera, C., Pettiglio, M.A., Keene, A.M., Taylor, M.D. et Dorman, D.C. (2015). Pharmacokinetic evaluation of the equivalency of gavage, dietary, and drinking water exposure to manganese in f344 rats. Toxicol. Sci., 145(2): 244–251.
Friedman, M.J., Hill, A.S., Reiber, S.H., Valentine, R.L., Larsen, G., Young, A., Korshin, G.V. et Peng, C-Y. (2010). Assessment of Inorganics Accumulation in Drinking Water system scales and sediments. Water Research Foundation and United States Environmental Protection Agency, Denver, CO.
Furst, A. (1978). Tumorigenic effect of an organomanganese compound on F344 rats and Swiss albino mice: Brief communication. J. Natl. Cancer Inst., 60: 1171–1173. [Cité dans U.S. EPA, 2008; Santé Canada, 2010]
Gabelich, C.J., Gerringer, F.W., Lee, C.C. et Knocke, W.R. (2006). Sequential manganese desorption and sequestration in anthracite coal and silica sand filter media. . J. Am. Water Works Assoc., 98(5): 116–127.
Galloway, S.M., Armstrong, M.J., Reuben, C., Colman, S., Brown, B., Cannon, C. et coll. (1987). Chromosome aberrations and sister chromatid exchanges in Chinese hamster ovary cells: Evaluations of 108 chemicals. Environ. Mol. Mutagen., 10(Suppl. 10): 1–175.
Garcia, S.J., Gellein, K., Syversen, T. et Aschner, M. (2006). A manganese-enhanced diet alters brain metals and transporters in the developing rat. Toxicol. Sci., 92(2): 516–525.
Garcia-Aranda, J.A., Lifshitz, F. et Wapnir, R.A. (1984). Intestinal absorption of manganese in experimental malnutrition. J. Pediatr. Gastroenterol. Nutr., 3: 602–607.
Garrick, M.D., Dolan, K.G., Horbinski, C., Ghio, A.J., Higgins, D., Porubcin, M. et coll. (2003). DMT1: a mammalian transporter for multiple metals. BioMetals, 16: 41– 54. [Cité dans Reany and Smith 2005.]
Gavin, C.E., Gunter, K.K. et Gunter, T.E. (1992). Mn2+ sequestration by mitochondria and inhibition of oxidative phosphorylation. Toxicol. Appl. Pharmacol., 115: 1–5. [Cité dans Santé Canada, 2010]
Gerber, G.B., Léonard, A. et Hantson, P. (2002). Carcinogenicity, mutagenicity and teratogenicity of manganese compounds. Crit. Rev. Oncol. Hematol., 42: 25–34.
Gibbons, R.A., Dixon, S.N., Hallis, K., Russell, A.M., Sansom, B.F. et Symonds, H.W. (1976). Manganese metabolism in cows and goats. Biochim. Biophys. Acta, 444(1): 1–10. [Cité dans Davidsson et coll., 1989b; Santé Canada, 2010]
Gilani, S.H. et Alibhai, Y. (1990). Teratogenicity of metals to chick embryos. J. Toxicol. Environ. Health, 30: 23–31. [Cité dans Gerber et coll. 2002.]
Ginige, M.P., Wylie, J. et Plumb, J. (2011). Influence of biofilms on iron and manganese deposition in drinking water distribution systems. Biofouling, 27(2), 151–163.
Golub, M.S. (2012). Erratum. Neurotoxicol. Teratol., 34(1): 220.
Golub, M.S., Hogrefe, C.E., Germann, S.L., Tran, T.T., Beard, J.L., Crinella, F.M. et coll. (2005). Neurobehavioral evaluation of rhesus monkey infants fed cow’s milk formula, soy formula, or soy formula with added manganese. Neurotoxicol. Teratol., 27(4): 615–627.
Gonzalez, L.E., Juknat, A.A., Venosa, A.J., Verrengia, N. et Kotler, M.L. (2008). Manganese activates the mitochondrial apoptotic pathway in rat astrocytes by modulating the expression of proteins of the Bcl-2 family. Neurochem. Int., 53(6–8): 408–415.
Gouvernement du Canada (2014). Règlement sur les aliments et drogues. Dernière modification le 2014-01-29. C.R.C., c. 870. Disponible à : http://laws.justice.gc.ca/fra/reglements/C.R.C.%2C_ch._870/
Grant, D., Blazak, W.F. et Brown, G.L. (1997). The reproductive toxicology of intravenously administered MnDPDP in the rat and rabbit. Acta Radiologica, 38: 759–769. [Cité dans Santé Canada, 2010]
Gray, E.L. et Laskey, J.W. (1980). Multivariate analysis of the effects of manganese on the reproductive physiology and behavior of the male house mouse. J. Toxicol. Environ. Health , 6: 861–867. [Cité dans Santé Canada, 2010]
Greger, J.L. (1999). Nutrition versus toxicology of manganese in humans: Evaluation of potential biomarkers. Neurotoxicology, 20(2-3): 205–212.
Gregory, D. et Carlson, K. (2003). Effect of soluble Mn concentration on oxidation kinetics. J. Am. Water Works Assoc., 95(1): 98–108.
Gruden, N. (1977). Suppression of transduodenal manganese transport by milk diet supplemented with iron. Nutr. Metab. 21(5): 305–309. [Cité dans Santé Canada, 2010]
Guan, H., Wang, M., Li, X., Piao, F., Li, Q., Xu, L., Kitamura, F. et Yokoyama, K. (2014). Manganese concentrations in maternal and umbilical cord blood: Related to birth size and environmental factors. Eur. J. Public Health, 24(1): 150–157.
Guilarte, T.R. (2013). Manganese neurotoxicity: new perspectives from behavioral, neuroimaging, and neuropathological studies in humans and non-human primates. Front. Aging Neurosci., 5(23): 1–10.
Gunshin, H., Allerson, C.R., Polycarpou-Schwarz, M., Rofts, A., Rogers, J.T., Kishi, F. et coll. (2001). Iron-dependent regulation of the divalent metal ion transporter. FEBS Letters 509(2): 309–316. [Cité dans Santé Canada, 2010]
Gupta, S.K., Murthy, R.C. et Chandra, S.V. (1980). Neuromelanin in manganese-exposed primates. Toxicol. Lett., 6: 17–20.
HaMai, D. et Bondy, S.C. (2004). Oxidative basis of manganese neurotoxicity. Ann. N. Y. Acad. Sci., 1012: 129–141.
HaMai, D., Campbell, A. et Bondy, S.C. (2001). Modulation of oxidative events by multivalent manganese complexes in brain tissue. Free Radic. Biol. Med., 31(6): 763–768. [Cité dans Santé Canada, 2010]
HaMai, D., Rinderknecht, A.L., Guo-Sharman, K., Kleinman, M.T. et Bondy, S.C. (2006). Decreased expression of inflammation-related genes following inhalation exposure to manganese. Neurotoxicology, 27(3): 395–401.
Han, Z.J., Song, G., Cui, Y., Xia, H.F., Ma, X. (2011). Oxidative stress is implicated in arsenic-induced neural tube defects in chick embryos. Int. J. Dev. Neurosci., 29(7): 673–680.
Hargette, A. et Knocke, W.R. (2001). Assessement of fate of manganese in oxide-coated filtration systems. J. Environ. Eng., 127(2): 1132–1138.
Hauser, R.A., Zesiewicz, T.A., Rosemurgy, A.S., Martinez, C. et Olanow, C.W. (1994). Manganese intoxication and chronic liver failure. Ann. Neurol., 36(6): 871–875. [Cité dans IOM, 2004, Santé Canada, 2010]
Haynes, E.H., Sucharew, H., Kuhnell, P., Alden, J., Barnas, M., Wright, R.O., Parsons, P.J., Aldous, K.M., Praamsma, M.L., Beidler, C. et Dietrich, K.N. (2015). Manganese exposure and neurocognitive outcomes in rural school-age children: The Communities Actively Researching Exposure Study (Ohio, USA). Environ. Health Perspect., 123(10): 1066–1071.
Hazaradze, R.E. (1961). Hygienic background for determining the maximum permissible concentration of manganese in water basins. Gig. Sanit., 26(12): 8–14. [Cité dans OMS, 1981.]
He, P., Liu, D.H. et Zhang, G.Q. (1994). Effects of high-level-manganese sewage irrigation on children’s neurobehavior. Zhonghua Yu Fang Yi Xue Za Zhi, 28(4): 216–218.
Hejtmancik, M., Peters, A.C., Toft, J.D., Basaran, A., Sheridan, A. et Athey, P. (1987a). The chronic study of manganese sulfate monohydrate (CAS No. 10034-96-5) in F344 rats. Battelle’s Columbus Laboratories, Columbus, Ohio. [Cité dans Santé Canada, 2010]
Hejtmancik, M., Peters, A.C., Toft, J.D., Dersing, R., Basaran, A., Sheridan, A. et coll. (1987b). The chronic study of manganese sulfate monohydrate (CAS No. 10034-96-5) in B6C3F1 mice. Battelle’s Columbus Laboratories, Columbus, Ohio. [Cité dans Santé Canada, 2010]
Hernandez-Bonilla, D., Schilmann, A., Montes, S., Rodriguez-Agudelo, Y., Rodriguez-Dozal, S., Solis-Vivanco, R., Rios, C. et Riojas-Rodriguez, H. (2011). Environmental exposure to manganese and motor function of children in mexico. Neurotoxicology, 32(5): 615–621.
Herzner, J.A., Parmenter, W., Page, J. et Heupler, S. (2003). Manganese control: a back to basics approach to stop customer complaints and works with unconventional processes. Proceedings of the American Water Works Association Water Quality and Technology Conference.
Hiney, J.K., Srivastava, V.K. et Dees, W.L. (2011). Manganese induces IGF-1 and cyclooxygenase-2 gene expressions in the basal hypothalamus during prepubertal female development. Toxicol. Sci., 121(2): 389–96.
Holbrook, D.J.J., Washington, M.E., Leake, H.B. et Brubaker, P.E. (1975). Studies on the evaluation of the toxicity of various salts of lead, manganese, platinum, and palladium. Environ. Health Perspect., 10: 95–101.
Holst, T.C. (2004). Large-scale biological manganese removal: from pilot study to implementation. Proceedings of the American Water Works Association Water Quality and Technology Conference.
Holzgraefe, M., Poser, W., Kijewski, H. et Beuche, W. (1986). Chronic enteral poisoning caused by potassium permanganate: A case report. J. Toxicol. Clin. Toxicol., 24(3): 235–244.
Hoyland, V.W., Knocke, W.R., Falkinham III, J.O., Pruden, A. et Singh, G. (2014). Effect of drinking water treatment process parameters on biological removal of manganese from surface water. Water Res., 66: 31–39. Disponible à : www.epa.gov/waterscience/criteria/drinking/dwstandards2009.pdf
Hussain, S., Lipe, G.W., Slikker, W. et et coll. (1997). The effects of chronic exposure of manganese on antioxidant enzymes in different regions of rat brain. Neurosci. Res. Commun., 21: 135–144.
International Manganese Institute (2014). Paris, France. Disponible à : www.manganese. org/index.php.
IOM (2000). Dietary reference intakes for vitamin A, vitamin K, arsenic, boron, chromium, copper, iodine, iron, manganese, molybdenum, nickel, silicon, vanadium, and zinc. Institute of Medicine, National Academy of Sciences, National Academies Press, Washington, D.C.: p. 394–419.
IOM (2001). Dietary reference intakes for vitamin A, vitamin K, arsenic, boron, chromium, copper, iodine, iron, manganese, molybdenum, nickel, silicon, vanadium, and zinc. Institute of Medicine, National Academy of Sciences, National Academies Press. Washington, D.C.: p. 285–324. Disponible à : www.nap.edu/catalog.php?record_id=10026.
IOM (2005). Dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein and amino acids. Panel on Macronutrients, Panel on the Definition of Dietary Fiber, Subcommittee on Upper Reference Levels of Nutrients, Subcommittee on Interpretation and Uses of Dietary Reference Intakes, and the Standing Committee on the Scientific Evaluation of Dietary Reference Intakes Food and Nutrition Board (ed.). Institute of Medicine, National Academies Press, Washington, D.C. Disponible à : www.nal.usda.gov/fnic/DRI/DRI_Energy/energy_full_report.pdf.
Ishihara, N., Koizumi, M. et Yoshida, A. (1987). Metal concentrations in human pancreatic juice. Archives of Environmental Health, 42(6): 356–360.
Ishizuka, H., Nishida, M. et Kawada, J. (1991). Changes in stainability observed by light microscopy in the brains of ataxial mice subjected to three generations of manganese administration. Biochem. Int., 25: 677–687.
Islam, A.A., Goodwill, J.E., Bouchard, R., Tobiason, J.E. et Knocke, W.R. (2010). Characterization of filter media Mn)x(s) surfaces and Mn removal capability. J. Am. Water Works Assoc., 102(9): 71–83.
Itoh, K., Sakata, M., Watanabe, M., Aikawa, Y. et Fujii, H. (2008). The entry of manganese ions into the brain is accelerated by the activation of N-methyl-D-aspartate receptors. Abstract. Neuroscience, 154(2): 732–740.
Jarvinen, R. et Ahlström, A. (1975). Effect of the dietary manganese level on tissue manganese, iron, copper and zinc concentrations in female rats and their fetuses. Med. Biol., 53: 93–99. [Cité dans ATSDR, 2012.]
Jeffcoat, S.B., Lavinder, S.R., Dye, D. et Sosebee, R. (2007). Techniques for simultaneous control of manganese and disinfection by-products at conventional water treatment facilities. Proceedings of the American Water Works Association Water Quality and Technology Conference.
Joardar, M. et Sharma, A. (1990). Comparison of clastogenicity of inorganic manganese administered in cationic and anionic forms in vivo. Mutat. Res., 240: 159–163. [Cité dans Santé Canada, 2010]
Johnson, P.E., Lykken, G.I. et Korynta, E.D. (1991). Absorption and biological half-life in humans of intrinsic and extrinsic 54Mn tracers from foods of plant origin. Mn. J. Nutr., 121: 711–717.
Jursa, T. et Smith, D.R. (2009). Ceruloplasmin alters the tissue disposition and neurotoxicity of manganese, but not its loading onto transferrin. Toxicol. Sci., 107(1): 182–193.
Kalea, A.Z., Harris, P.D. et Klimis-Zacas, D.J. (2005). Dietary manganese suppresses alpha1 adrenergic receptor-mediated vascular contraction. J. Nutr. Biochem., 16(1): 44–49.
Kalea, A.Z., Lamari, F.N., Theocharis, A.D., Schuschke, D.A., Karamanos, N.K. et Klimis-Zacas, D.J. (2006). Dietary manganese affects the concentration, composition and sulfation pattern of heparan sulfate glycosaminoglycans in Sprague-Dawley rat aorta. BioMetals, 19(5): 535–546.
Karim, Z. (2011). Risk assessment of dissolved trace metals in drinking water of Karachi, Pakistan. Bull. Environ. Contam. Toxicol. 86: 676–678
Karki, P., Lee, E. et Aschner, M. (2013). Manganese neurotoxicity: a focus on glutamate transporters. Ann. Occup. Environ. Med., 25(4).
Kawamura, C.L., Ikuta, H., Fukuzimi, S., Yamada, R., Tsubaki, S., Kodama, T. et Kurata S.. (1941). Intoxication by manganese in well water. Kitasato Arch. Exp. Med. 18: 145–169.
Keen, C.L., Bell, J.G. et Lönnerdal, B. (1986). The effect of age on manganese uptake and retention from milk and infant formulas in rats. J. Nutr., 116: 395–402.
Kenari, S.L.D. et Barbeau, B. (2014). Pyrolusite fluidized-bed reactor: A robust and compact process for removing manganese from groundwater. Water Res., 49: 475–483.
Kern, C. et Smith, D.R. (2011). Pre-weaning Mn exposure leads to prolonged astrocyte activation and lasting effects on the dopaminergic system in adult male rats. Synapse, 65(6): 532–544.
Kern, C.H., Stanwood, G.D. et Smith, D.R. (2010). Preweaning manganese exposure causes hyperactivity, disinhibition, and spatial learning and memory deficits associated with altered dopamine receptor and transporter levels. Synapse, 64(5): 363–378.
Khan, K., Factor-Litvak, P., Wasserman, G.A., Liu, X., Ahmed, E., Parvez, F., Slavkovich, V., Levy, D., Mey, J., van Geen, A. et Graziano, J.H. (2011). Manganese exposure from drinking water and children’s classroom behavior in Bangladesh. Environ. Health Perspect., 119(10): 1501–1506.
Khan, K., Wasserman, G.A., Liu, X., Ahmed, E., Parvez, F., Slavkovich, V., Levy, D., Mey, J., van Geen, A., Graziano, J.H. et Factor-Litvak, P. (2012). Manganese exposure from drinking water and children’s academic achievement. Neurotoxicology, 33(1): 91–97.
Klimis-Zacas, D. (1993). Manganese in health and disease. CRC Press: p. 54–55.
Knocke, W.R., Hoehn, R.C. et Sinsabaugh, R.L. (1987). Using alternative oxidants to remove dissolved manganese from water laden with organices. . J. Am. Water Works Assoc., 79(3): 75–79.
Knocke, W.R., Hamon, J.R. et Thompson, C.P. (1988). Soluble manganese removal on oxide-coated filter media. . J. Am. Water Works Assoc., 74(12): 65–70.
Knocke, W.R., Van Benschoten, J.E., Kearney, M., Soborski, A. et Reckhow, D.A. (1990a). Alternative oxidants for the removal of soluble manganese. American Water Works Research Foundation and American Water Works Association, Denver, Colorado.
Knocke, W.R., Occiano, S. et Hungate, R. (1990b). Removal of soluble manganese from water by oxide-coated filter media. American Water Works Research Foundation and American Water Works Association, Denver, Colorado.
Knocke, W.R., Occiano, S.C. et Hungate, R. (1991). Removal of soluble manganese by oxide-coated filter media: sorption rate and removal mechanism issues. . J. Am. Water Works Assoc., 83(8): 64–69.
Knocke, W.R., Zuransky, L., Little, J.C. et Tobiason, J.E. (2010). Adsorptive contactors for removal of soluble manganese during drinking water treatment. . J. Am. Water Works Assoc., 102(8): 64–75.
Kohl, P., Kim, A. et Charlton, N. (2002). Limitations of ozone for removal of manganese to very low levels, a comparative study. Proceedings of the American Water Works Association Water Quality and Technology Conference.
Kohl, P.M et Dixon, D. (2012). Occurrence, impacts and removal of manganese in biofiltration processes. Water Research Foundation, Denver, Colorado.
Kohl, P.M. et Medlar, S.J. (2006). Occurrence of manganese in drinking water and manganese control. American Water Research Foundation, American Water Works Association and IWA Publishing. Denver, Colorado.
Komura, J. et Sakamoto, M. (1991). Short-term oral administration of several manganese compounds in mice: Physiological and behavioral alterations caused by different forms of manganese. Bull. Environ. Contam. Toxicol., 46: 921–928. [Cité dans Santé Canada, 2010]
Komura, J. et Sakamoto, M. (1994). Chronic oral administration of methylcyclopentadienyl manganese tricarbonyl altered brain biogenic amines in the mouse: comparison with inorganic manganese. Toxicol. Lett., 73: 65–73.
Kondakis, X.G., Makris, N., Leotsinidis, M., Prinou, M. et Papapetropoulos, T. (1989). Possible health effects of high manganese concentration in drinking water. Arch. Environ. Health, 44(3): 175–178.
Kontur, P. et Fechter, L.D. (1985). Brain manganese, catecholamine turnover, and the development of startle in rats prenatally exposed to manganese. Teratology, 32: 1–11.
Kostial, K., Kello, D., Jugo, S., Rabar, I. et Maljković, T. (1978). Influence of age on metal metabolism and toxicity. Environ. Health Perspect., 25: 81–86.
Kostial, K., Blanusa, M., Maljković, T., Kello, D., Rabar, I. et Stara, J.F. (1989). Effect of a metal mixture in diet on the toxicokinetics and toxicity of cadmium, mercury and manganese in rats. Toxicol. Ind. Health, 5(5): 685–698. [Cité dans U.S. EPA, 2004.]
Kostial, K., Blanusa, M. et Piasek, M. (2005). Regulation of manganese accumulation in perinatally exposed rat pups. J. Appl. Toxicol. 25(2): 89–93.
Koudinov, A.R. et Koudinova, N.V. (2005). Cholesterol homeostatis failure as a unifying cause of synaptic degeneration. J. Neurol. Sci., 229–230: 233–240.
Krishna, S., Dodd, C.A., Hekmatyar, S.K. et Filipov, N.M. (2014). Brain deposition and neurotoxicity of manganese in adult mice exposed via the drinking water. Arch. Toxicol., 88(1): 47–64.
Kristensson, K., Eriksson, H., Lundh, B., Plantin, O., Wachmeister, L., el Azazi, M. et coll. (1986). Effects of manganese chloride on the rat developing nervous system. Acta Pharmacol. Toxicol., 59(5): 345–348. [Cité dans Santé Canada, 2010]
Kwik-Uribe, C. et Smith, D.R. (2006). Temporal responses in the disruption of iron regulation by manganese. J. Neurosci. Res., 83(8): 1601–1610.
Kwik-Uribe, C.L., Reaney, S., Zhu, Z. et Smith, D. (2003). Alterations in cellular IRP-dependentiron regulation by in vitro manganese exposure in undifferentiated PC12 cells. Brain Res., 973(1): 1–15.
Lai, J.C., Leung, T.K., Guest, J.F., Davison, A.N. et Lim, L. (1982). The effects of chronic manganese chloride treatment expressed as age-dependent, transient changes in rat brain synaptosomal uptake of amines. Journal of Neurochemistry, 38(3): 844–847.
Lai, J.C., Leung, T.K. et Lim, L. (1984). Differences in the neurotoxic effects of manganese during development and aging: Some observations on brain regional neurotransmitter and non-neurotransmitter metabolism in a developmental rat model of chronic manganese encephalopathy. Neurotoxicology, 5(1): 37–47.
Lai, J.C., Minski, M.J., Chan, A.W., Leung, T.K. et Lim, L. (1999). Manganese mineral interactions in brain. Neurotoxicology, 20(2–3): 433–444. [Cité dans Santé Canada, 2010]
Laitung, J.K. et Mercer, D.M. (1983). Manganese absorption through a burn. Burns Incl. Therm. Inj., 10(2): 145–146.
Laskey, J.W., Rehnberg, G.L., Hein, J.F. et Carter, S.D. (1982). Effects of chronic manganese (Mn3O4) exposure on selected reproductive parameters in rats. J. Toxicol. Environ. Health, 9(4): 677–687. [Cité dans Santé Canada, 2007b;ATSDR, 2008.]
Lauwerys, R., Roels, H., Genet, P., Toussaint, G., Bouckaert, A. et de Cooman, S. (1985). Fertility of male workers exposed to mercury vapor or to manganese dust: A questionnaire study. Am. J. Ind. Med., 7(2): 171–176. [Cité dans Santé Canada, 2007b; ATSDR, 2008.]
Lazrishvili, I.L., Shukakidze, A.A., Chkhartishvili, N.N. et Bikashvili, T.Z. (2009). Morphological changes and manganese content in the brains of rat pups subjected to subchronic poisoning with manganese chloride. Neurosci. Behav. Physiol., 39(1): 7–12.
Leavens, T.L., Rao, D., Andersen, M.E. et Dorman, D.C. (2007). Evaluating transport of manganese from olfactory mucosa to striatum by pharmacokinetic modeling. Toxicol. Sci., 97(2): 265–278.
Leblanc, A., Lapointe, S., Beaudet, A., Côté, I., Dumas, P., Labrecque, F., Lamy, C., Larochelle, J., Lepage, L., Pelletier, F. et Weber, J. (2004). Étude sur l’établissement de valeurs de référence d’éléments traces et de métaux dans le sang, le sérum et l’urine de la population de la grande région de québec. Direction toxicologie humaine, Direction risques biologiques, environnementaux et occupationnels, Institut national de santé publique du Québec. Disponible à : www.inspq.qc.ca/pdf/publications/289-ValeursReferenceMetaux.pdf.
Lee, B., Pine, M., Johnson, L., Rettori, V., Hiney, J.K. et Dees, W.L. (2006). Manganese acts centrally to activate reproductive hormone secretion and pubertal development in male rats. Reprod. Toxicol., 22(4): 580–585.
Lee, B., Hiney, J.K., Pine, M.D., Srivastava, V.K. et Dees, W.L. (2007). Manganese stimulates luteinizing hormone releasing hormone secretion in prepubertal female rats: hypothalamic site and mechanism of action J. Physiol., 578(3): 765–772.
Lees-Haley, P.R., Rohling, M.L. et Langhinrichsen-Rohling, J. (2006). A meta-analysis of the neuropsychological effects of occupational exposure to manganese. Clin. Neuropsychol., 20(1): 90–107.
Lei, B., Chen, L., Hao, Y., Cao, T., Zhang, X., Yu, Y. et coll. (2013). Trace elements in animal-based food from Shanghai markets and associated human daily intake and uptake estimation considering bioaccessibility. Ecotoxicol. Environ. Saf., 96: 160–7.
Leung, T.K., Lai, J.C. et Lim, L. (1982). The effects of chronic manganese feeding on the ctivity of monoamine oxidase in various organs of the developing rat. Comp. Biochem. Physiol. C, 71(2): 223–228. [Cité dans U.S. EPA, 2004]
Leyva-Illades, D., Chen, P., Zogzas, C.E., Hutchens, S., Mercado, J.M., Swaim, C.D., Morrisett, R.A., Bowman, A.B., Aschner, M. et Mukhopadhyay, S. (2014). SLC30A10 is a cell surface-localized manganese efflux transporter, and parkinsonism-causing mutations block its intracellular trafficking and efflux activity. J. Neurosci., 34(42): 14079–14095.
Lin, C.C., Chen, Y.C., Su, F.C., Lin, C.M., Liao, H.F., Hwang, Y.H., Hsieh, W.S., Jeng, S.F., Su, Y.N. et Chen, P.C. (2013). In utero exposure to environmental lead and manganese and neurodevelopment at 2 years of age. Environ. Res., 123: 52–57.
Lipe, G.W., Duhart, H., Newport, G.D., Slikker, W.J. et Ali, S.F. (1999). Effect of manganese on the concentration of amino acids in different regions of the rat brain. J. Environ. Sci. Health B, 34(1): 119–132.
Liu, X., Sullivan, K.A., Madl, J.E., Legare, M. et Tjalkens, R.B. (2006). Manganese-induced neurotoxicity: the role of astroglial-derived nitric oxide in striatal interneuron degeneration. Toxicol. Sci., 91(2): 521–531.
Liu, J., Jin, L., Zhang, L., Li, Z., Wang, L., Ye, R., Zhang, Y. et Ren, A. (2013). Placental concentrations of manganese and the risk of fetal neural tube defects. J. Trace Elem. Med. Biol., 27(4): 322–325.
Ljung, K. et Vahter, M. (2007). Time to re-evaluate the guideline value for manganese in drinking water? Environ. Health Perspect., 115(11): 1533–1538.
Ljung, K.S., Kippler, M.J., Goessler, W., Grandér, G.M., Nermell, B.M. et Vahter, M.E. (2009). Maternal and early life exposure to manganese in rural Bangladesh. Environ. Sci. Technol., 43(7): 2595–2601.
Lucchini, R., Apostoli, P., Perrone, C., Placidi, D., Albini, E., Migliorati, P., Mergler, D., Sassine, M.P., Palmi, S. et Alessio, L. (1999). Long-term exposure to "low levels" of manganese oxides and neurofunctional changes in ferroalloy workers. Neurotoxicology, 20(2–3): 287–297.
Luo, Y. et Millero, F.J. (2003). Solubility of rhodochrosite (MnCO3) in NaCl solutions. J. Solution Chem., 32(5).
Malecki, E.A., Radzanowski, G.M., Radzanowski, T.J., Gallaher, D.D. et Greger, J.L. (1996). Biliary manganese excretion in conscious rats is affected by acute and chronic manganese intake but not by dietary fat. J. Nutr., 126(2): 489–498. [Cité dans Santé Canada, 2010]
Manitoba Conservation and Water Stewardship. (2015). Communication personnelle de J. Muenster.
Mann, M.A., Thomson, D., Jabari, E. et Rohe, D. (2002). Microfiltration and ultrafiltration: novel pre-treatments for iron and manganese removal from a reverse osmosis feedwater. Proceedings of the Water Quality and Technology Conference. American Water Works Association.
Martinez-Finley, E.J., Gavin, C.E., Aschner, M. et Gunter, T.E. (2013). Manganese neurotoxicity and the role of reactive oxygen species. Free Radic. Biol. Med., 62: 65–75.
McDougall, S.A., Reichel, C.M., Farley, C.M., Flesher, M.M., Der-Ghazarian, T., Cortez, A.M. et coll. (2008). Postnatal manganese exposure alters dopamine transporter function in adult rats: Potential impact on nonassociative and associative processes. Neuroscience, 154(2): 848–860.
McKnight, K.F., Carlson, M., Fortin, P. et Ziesmer, C. (1993). Comparison of ozone efficiency for manganese oxidation between raw and settled water. Ozone. Sci. Eng., 15(4): 331–341
MDH (2012). Health based guidance for groundwater. Manganese. Minnesota Department of Health.
Mena, I., Horiuchi, K., Burke, K. et Cotzias, G.C. (1969). Chronic manganese poisoning: Individual susceptibility and absorption of iron. Neurology, 19(10): 1000–1006. [Cité dans Santé Canada, 2010]
Menezes-Filho, J.A., Novaes, C.O., Moreira, J.C., Sarcinelli, P.N. et Mergler, D. (2011). Elevated manganese and cognitive performance in school-aged children and their mothers. Environ. Res., 111(1): 156–163.
Mergler, D., Baldwin, M., Belanger, S., Larribe, F., Beuter, A., Bowler, R., Panisset, M., Edwards, R., de Geoffroy, A., Sassine, M.P. et Hudnell, K. (1999). Manganese neurotoxicity, a continuum of dysfunction: Results from a community based study. Neurotoxicology, 20(2–3): 327–342.
Merian, E., Anke, M., Ihnat, M. et Stoeppler, M. (2004). Elements and their compounds in the environment – occurence, analysis and biological relevance. 2nd ed., Weinheim, Wiley – VCH Verlag
Mettler, S., Abdelmoula, M., Hoehn, E., Schoenenberger, R., Weidler, P. et von Gunten, U. (2001). Characterization of iron and manganese precipitates from an in-situ ground water treatment plant. Groundwater, 39(6): 921–930.
Meyer-Baron, M., Schaper, M., Knapp, G., Lucchini, R., Zoni, S., Bast-Pettersen, R., Ellingsen, D.G., Thomassen, Y., He, S., Yuan, H., Niu, Q., Wang, X.L., Yang, Y.J., Iregren, A., Sjogren, B., Blond, M., Laursen, P., Netterstrom, B., Mergler, D., Bowler, R. et van Thriel, C. (2013). The neurobehavioral impact of manganese: Results and challenges obtained by a meta-analysis of individual participant data. Neurotoxicology, 36: 1–9.
Michalke, B. et Fernsebner, K. (2014). New insights into manganese toxicity and speciation. J. Trace Elem. Med. Bio., 28(2): 106–116.
Michalke, B., Halbach, S. et Nischwitz, V. (2007). Speciation and toxicological relevance of manganese in humans. J. Environ. Monit., 9(7): 650–656.
Miele, M., Serra, P.A., Esposito, G., Delogu, M.R., Migheli, R., Rocchitta, G. et coll. (2000). Glutamate and catabolites of high-energy phosphates in the striatum and brainstem of young and aged rats subchronically exposed to manganese. Aging (Milano), 12(5): 393–397. [Cité dans Santé Canada, 2010]
Miller, E.B., Kanabrocki, E., Case, L., Graham, L., Fields, T., Oester, Y.T. et coll. (1967). Non-dialyzable manganese, copper and sodium in human bile. J. Nucl. Med., 8: 891–895. [Cité dans Santé Canada, 2010]
Miller, S.T., Cotzias, G.C. et Evert, H.A. (1975). Control of tissue manganese: Initial absence and sudden emergence of excretion in the neonatal mouse. Am. J. Physiol., 229: 1080–1084.
Ministère du Développement durable, de l’Environnement et des Parcs du Québec (2011). Communication personnelle de C. Robert.
Ministère du Développement durable, de l’Environnement et des Parcs du Québec (2014). Communication personnelle de C. Robert.
Minoia, C., Sabbioni, E., Apostoli, P., Pietra, R., Pozzoli, L., Gallorini, M. et coll. (1990). Trace element reference values in tissues from inhabitants of the European community. I. A study of 46 elements in urine, blood and serum of Italian subjects. Sci. Tot. Environ., 95: 89–105. [Cité dans Santé Canada, 2010]
Mirtallo, J., Canada, T., Johnson, D., Kumpf, V., Petersen, C., Sacks, G., Seres, D. et Guenter, P. (2004). Task Force for the Revision of Safe Practices for Parenteral Nutrition. Safe Practices for Parenteral. J. Parenter. Enteral. Nutr. 28, S39–S70.
Moberly, A.H., Czarnecki, L.A., Pottackal, J., Rubinstein, T., Turkel, D.J., Kass, M.D. et coll. (2012). Intranasal exposure to manganese disrupts neurotransmitter release from glutamatergic synapses in the central nervous system in vivo. Neurotoxicology, 33(5): 996–1004.
Molina, R.M., Phattanarudee, S., Kim, J., Thompson, K., Wessling-Resnick, M., Maher, T.J. et coll. (2011). Ingestion of Mn and Pb by rats during and after pregnancy alters iron metabolism and behavior in offspring. Neurotoxicology, 32(4): 413–422.
Montes, S., Alcaraz-Zubeldia, M., Muriel, P. et coll. (2001). Striatal manganese accumulation induces changes in dopamine metabolism in the cirrhotic rat. Brain Res., 891: 123–129.
Moreno, J.A., Streifel, K.M., Sullivan, K.A., Legare, M.E. et Tjalkens, R.B. (2009a). Developmental exposure to manganese increases adult susceptibility to inflammatory activation of glia and neuronal protein nitration. Toxicol. Sci., 112(2): 405–415.
Moreno, J.A., Yeomans, E.C., Streifel, K.M., Brattin, B.L., Taylor, R.J. et Tjalkens, R.B. (2009b). Age-dependent susceptibility to manganese-induced neurological dysfunction. Toxicol. Sci., 112(2): 394–404.
Mortelmans, K., Haworth, S., Lawlor, T., Speck, W., Tainer, B. et Zeiger, E. (1986). Salmonella mutagenicity tests: II. Results from testing of 270 chemicals. Environmental Mutagenesis, 8(Suppl. 7): 1–119.
Mouchet, P. (1992). From conventional to biological of iron and manganese in France. . J. Am. Water Works Assoc., 84(4): 158–167,
Murthy, R.C., Srivastava, R.S., Gupta, S.K. et Chandra, S.V. (1980). Manganese induced testicular changes in monkeys. Exp. Pathol., 18(4): 240–244. [Cité dans Santé Canada, 2010]
Myers, J.E., Fine, J., Ormond-Brown, D., Fry, J., Thomson, A. et Thompson, M.L. (2009). Estimating the prevalence of clinical manganism using a cascaded screening process in a South African manganese smelter. 10th International Symposium on Neurobehavioral Methods and Effects in Environmental and Occupational Health. Neurotoxicology, 30(6): 934–940.
Na, H.K., Kim, E.H., Jung, J.H., Lee, H.H., Hyun, J.W. et Surh, Y.J. (2008). (-)-Epigallocatechin gallate induces Nrf2-mediated antioxidant enzyme expression via activation of PI3K and ERK in human mammary epithelial cells. Arch. Biochem. Biophys., 476(2): 171–177.
Nachtman, J.P., Tubben, R.E. et Commissaris, R.L. (1986). Behavioral effects of chronic manganese administration in rats: Locomotor activity studies. Neurobehav. Toxicol.Teratol., 8(6): 711–715.
Nam, J. et Kim, K. (2008). Abnormal motor function and the expression of striatal dopamine D2 receptors in manganese-treated mice. Biol. Pharm. Bull., 31(10): 1894–7.
Neal, A.P. et Guilarte, T.R. (2013). Mechanisms of lead and manganese neurotoxicity. Toxicol. Res. (Camb.), 2(2): 99–114.
New Brunswick Department of Environment (2008). New Brunswick groundwater chemistry atlas: 1994–2007. Sciences and Reporting Branch, Sciences and Planning Division, Environmental Reporting Series T2008-01.
New Brunswick Department of Health (2014). Communication personnelle de K. Gould et T. L. Arsenault.
Newell, G.W., Jorgenson, T.A. et Simmon, V.F. (1974). Study of mutagenic effects of manganese sulfate (FDA No. 71-71). Compound Report No. 3. U.S. Food and Drug Administration, Rockville, MD. [Cité dans NTP, 1993.]
Newfoundland and Labrador Department of Environment and Conservation (2014). Communication personnelle de H. Khan et A. Tobin.
Newland, M.C., Cox, C, Hamada, R., Oberdorster, G. et Weiss, B. (1987). The clearance of manganese chloride in the primate. Fundam.Appl. Toxicol., 9(2): 314–328. [Cité dans Santé Canada, 2010]
Newland, M.C., Ceckler, T.L., Kordower, J.H. et Weiss, B. (1989). Visualizing manganese in the primate basal ganglia with magnetic resonance imaging. Experimental Neurology, 106(3): 251–258. [Cité dans Santé Canada, 2010]
NHMRC (2011). Australian Drinking Water Guidelines. National Health and Medical Research Council: 780–782. Disponible à : www.nhmrc.gov.au/guidelines/publications/eh52
Nieminski, E. et Evans, D. (1995). Pilot testing of trace metals removal with ozone at Snowbird Ski Resort. Ozone. Sci. Eng., 17: 297–309.
Nong, A., Taylor, M.D., Clewell, H.J., 3rd, Dorman, D.C. et Andersen, M.E. (2009). Manganese tissue dosimetry in rats and monkeys: accounting for dietary and inhaled Mn with physiologically based pharmacokinetic modeling. Toxicol. Sci., 108(1): 22–34.
Nong, A., Teeguarden, J.G., Clewell, H.J., 3rd, Dorman, D.C. et Andersen, M.E. (2008). Pharmacokinetic modeling of manganese in the rat IV: Assessing factors that contribute to brain accumulation during inhalation exposure. J. Toxicol. Environ. Health A, 71(7): 413–26.
Nowak, P., Bojanek, K., Szkilnik, R., Josko, J., Boron, D., Adwent, M. et coll. (2011). Ontogenetic exposure of rats to pre- and post-natal manganese enhances behavioral impairments produced by perinatal 6-hydroxydopamine. Neurotox. Res., 19(4): 536–43.
Nowell, L.H. et Hoigne, J. (1987). Interaction of iron (II) and other transition metals with aqueous ozone. Dans : Proceedings from 8th Ozone World Congress, International Ozone Association, Norwalk, CT.
NRC (1989). Recommended dietary allowances. National Research Council (ed.). 10th edition. National Academies Press, Washington, D.C.
NSF/ANSI (2011).. Standard 372: Drinking water system components – lead content. NSF International/American National Standards Institute. NSF International, Ann Arbor, Michigan.
NSF/ANSI (2014a). Standard 42: Drinking water treatment units – aesthetic effects. NSF International/American National Standards Institute. NSF International, Ann Arbor, Michigan.
NSF/ANSI (2014b). Standard 60: Drinking water treatment chemicals – health effects. NSF International/American National Standards Institute. NSF International, Ann Arbor, Michigan.
NSF/ANSI (2014c). Standard 61: Drinking water system components – health effects. NSF International/American National Standards Institute. NSF International, Ann Arbor, Michigan.
NSF/ANSI (2014d). Standard 58: Reverse osmosis drinking water treatment systems. NSF International/American National Standards Institute. NSF International, Ann Arbor, Michigan.
NSF/ANSI (2014e). Standard 44: Cation exchange water softeners. NSF International/American National Standards Institute. NSF International, Ann Arbor, Michigan.
NTIS (1973). Teratologic evaluation of FDA 71-71 (manganese sulfate, monohydrate). PB 223-813. U.S. Department of Commerce, Springfield, VA. [Cité dans NTP, 1993.]
NTP (1993). Toxicology and carcinogenesis studies of manganese (II) sulfate monohydrate (CAS No. 10034-96-5) in F344/N rats and B6C3F1 mice (feed studies). National Toxicology Program. Report No. TR-428. Disponible à : http://ntp.niehs.nih.gov/?objectid=0709D83B-9FDB-28AC-789C940D7855e09C.
O’Brien, W.J., Lee, E., Freeman, S., Shorney, H., Long, B. et Elder, D. (1996). Manganese oxidation and removal by ozone and polymer-assisted filtration. Proceedings 1996 AWWA Water Quality Technology Conference. Boston, MA.
Oberly, T.J., Piper, C.E. et McDonald, D.S. (1982). Mutagenicity of metal salts in the L5178Y mouse lymphoma assay. J. Toxicol. Environ. Health, 9: 367–376. [Cité dans Santé Canada, 2010]
OECD (2007). OECD Guideline for the testing of chemicals. developmental neurotoxicity study (TG 426). Disponible à : www.oecd-ilibrary.org/environment/test-no-426-developmental-neurotoxicity-study_9789264067394-en;jsessionid=8a0ycpkew639.x-oecd-live-02.
Ohishi, T., Wang, L., Akane, H., Shiraki, A., Goto, K., Ikarashi, Y. et coll. (2012). Reversible aberration of neurogenesis affecting late-stage differentiation in the hippocampal dentate gyrus of rat offspring after maternal exposure to manganese chloride. Reprod. Toxicol., 34(3): 408–419.
OMS (2004). Concise international chemical assessment document 63: Manganese and its compounds: Environmental aspects. Organisation mondiale de la Santé, ISBN 92 4 153063 4.
OMS (2007). Standard for infant formula and formulas for special medical purposes intended for infants. CODEX STAN 72-1981. Organisation mondiale de la Santé (OMS) et Organisation des Nations Unies pour l’alimentation et l’agriculture (FAO) (ed.). Codex Alimentarius (publié in 1981 et révisé en 2007). Disponible à : www.codexalimentarius.org.
OMS (2011). Manganese in drinking water. Background document for development of WHO Guidelines for Drinking-water Quality. Organisation mondiale de la Santé. Disponible à : www.who.int/water_sanitation_health/dwq/chemicals/manganese.pdf
Öner, G. et Sentürk, U.K. (1995). Reversibility of manganese-induced learning defect in rats. Food Chemistry and Toxicology, 33(7): 559–563.
Ontario Ministry of the Environment (2014). Communication personnelle de S. Deshpande.
Oszlanczi, G., Vezer, T., Sarközi, L., Horvath, E., Szabo, A., Konya, Z. et coll. (2010). Metal deposition and functional neurotoxicity in rats after 3-6 weeks nasal exposure by two physicochemical forms of manganese. Environ. Toxicol. Pharmacol., 30(2): 121–126.
Oulhote, Y., Mergler, D., Barbeau, B., Bellinger, D.C., Bouffard, T., Brodeur, M.E., Saint-Amour, D., Legrand, M., Sauve, S. et Bouchard, M.F. (2014). Neurobehavioral function in school-age children exposed to manganese in drinking water. Environ. Health Perspect., 122(12): 1343–1350.
Ouvrard, S., Simonnot, M-O. et Sardin, M. (2002). Reactive behavior of natural manganese oxides toward the adsorption of phosphate and arsenate. Ind. Eng. Chem. Res., 41, 2785–2791.
Pagano, D.A. et Zeiger, E. (1992). Conditions for detecting the mutagenicity of divalent metals in Salmonella typhimurium. Environ. Mol. Mutagen., 19(2): 139–146. [Cité dans Santé Canada, 2010]
Paillard, H., Legube, B., Bourbigot, M.M. et Lefebvre, E. (1989). Iron and manganese removal with ozonation in the presence of humic substances. Ozone-Sci. Eng., 11(1): 93–99.
Pal, P.K., Samii, A. et Calne, D.B. (1999). Manganese neurotoxicity: A review of clinical features, imaging and pathology. Neurotoxicology, 20(2–3): 227–238. [Cité dans Santé Canada, 2010]
Pappas, B.A., Zhang, D., Davidson, C.M., Crowder, T., Park, G.A. et Fortin, T. (1997). Perinatal manganese exposure: Behavioral, neurochemical, and histopathological effects in the rat. Neurotoxicol. Teratol., 19(1): 17–25.
Park, N.H., Park, J.K., Choi, Y., Yoo, C.I., Lee, C.R., Lee, H. et coll. (2003). Whole blood manganese correlates with high signal intensities on T1-weighted MRI in patients with liver cirrhosis. Neurotoxicology, 24(6): 909–915. [Cité dans Santé Canada, 2010]
Park, J.D., Chung, Y.H., Kim, C.Y., Ha, C.S., Yang, S.O., Khang, H.S. et coll. (2007). Comparison of high MRI T1 signals with manganese concentration in brains of cynomolgus monkeys after 8 months of stainless steel welding-fume exposure. Inhal. Toxicol., 19(11): 965–971.
Parry, J.M. (1977). The use of yeast cultures for the detection of environmental mutagens using a fluctuation test. Mutat. Res., 46: 165–176. [Cité dans NTP, 1993.]
Peneder, T.M., Scholze, P., Berger, M.L., Reither, H., Heinze, G., Bertl, J. et coll. (2011). Chronic exposure to manganese decreases striatal dopamine turnover in human alpha-synuclein transgenic mice. Neuroscience, 180: 280–92.
Peng, C-Y. et Korshin, G.V. (2011). Speciation of trace inorganic contaminants in corrosion scales and deposits formed in drinking water distribution systems. Water Res., 45: 5553–5563.
Pine, M., Lee, B., Dearth, R., Hiney, J.K. et Dees, W.L. (2005). Manganese acts centrally to stimulate luteinizing hormone secretion: a potential influence on female pubertal development. Toxicol. Sci., 85: 880–885.
PISSC (1999). Concise international chemical assessment document 12: Manganese and its compounds. Programme international sur la sécurité des substances chimiques, Organisation mondiale de la Santé.
Pollack, S., George, J.N. et Reba, R.C. (1965). The absorption of nonferrous metals in iron deficiency. J. Clin. Invest., 44: 1470–1473.
Ponnapakkam, T.P., Bailey, K.S., Graves, K.A. et Iszard, M.B. (2003a). Assessment of male reproductive system in the CD-1 mice following oral manganese exposure. Reprod. Toxicol., 17(5): 547–551. [Cité dans Santé Canada, 2010]
Ponnapakkam, T., Iszard, M. et Henry-Sam, G. (2003b). Effects of oral administration of manganese on the kidneys and urinary bladder of Sprague-Dawley rats. Int. J. Toxicol., 22(3): 227–232. [Cité dans Santé Canada, 2010]
Ponnapakkam, T.P., Sam, G.H. et Iszard, M.B. (2003c). Histopathological changes in the testis of the Sprague Dawley rat following orally administered manganese. Bull. Environ. Contam. Toxicol., 71(6): 1151–1157. [Cité dans Santé Canada, 2010]
Prestifilippo, J.P., Fernandez-Solari, J., Mohn, C., De Laurentiis, A., McCann, S.M., Dees, W. et coll. (2007). Effect of manganese on luteinizing hormone-releasing hormone secretion in adult male rats. Toxicol. Sci., 97(1): 75–80.
Prestifilippo, J.P., Fernandez-Solari, J., De Laurentiis, A., Mohn, C.E., de la Cal, C., Reynoso, R. et coll. (2008). Acute effect of manganese on hypothalamic luteinizing hormone releasing hormone secretion in adult male rats: involvement of specific neurotransmitter systems. Toxicol. Sci., 105(2): 295–302.
Racette, B.A., Aschner, M., Guilarte, T.R., Dydak, U., Criswell, S.R. et Zheng, W. (2012). Pathophysiology of manganese-associated neurotoxicity. Neurotoxicology, 33(4): 881–886.
Raiten, D.J., Talbot, J.M. et Waters, J.H. (1998). Assessment of nutrient requirements for infant formulas. Life Sciences Research Office, American Society for Nutritional Sciences (ed.). Volume 128 (No. 11S): 2059S–2294S, Bethesda, Maryland, http://jn.nutrition.org/content/128/11/suppl/DC1.
Ranasinghe, J.G.S., Liu, M., Sakakibara, Y. et coll. (2000). Manganese administration induces the increased production of dopamine sulfate and depletion of dopamine in Sprague-Dawley rats. J. Biochem. (Tokyo), 128: 477–480.
Rasmuson, A. (1985). Mutagenic effects of some water-soluble metal compounds in a somatic eye-color test system in Drosophila melanogaster. Mutat. Res., 157: 157–162. [Cité dans Assem et al., 2011].
Reaney, S.H. et Smith, D.R. (2005). Manganese oxidation state mediates toxicity in PC12 cells. Toxicol. Appl. Pharmacol., 205(3): 271–281.
Reaney, S.H., Bench, G. et Smith, D.R. (2006). Brain accumulation and toxicity of Mn(II) and Mn(III) exposures. Toxicol. Sci., 93(1): 114–124.
Reaney, S.H., Kwik-Uribe, C.L. et Smith, D.R. (2002). Manganese oxidation state and its implications for toxicity. Chemical Research in Toxicology, 15(9): 1119–1126.
Rehnberg, G.L., Hein, J.F., Carter, S.D., Linko, R.S. et Laskey, J.W. (1982). Chronic ingestion of Mn3O4 by young rats: Tissue accumulation and distribution of manganese in two generations:. J. Toxicol. Environ. Health, 9(2): 175–188. [Cité dans Santé Canada, 2010]
Reichel, C.M., Wacan, J.J., Farley, C.M., Stanley, B.J., Crawford, C.A. et McDougall, S.A. (2006). Postnatal manganese exposure attenuates cocaine-induced locomotor activity and reduces dopamine transporters in adult male rats. Neurotoxicol. Teratol., 28(3): 323–332.
Rink, S.M., Ardoino, G., Queirolo, E.I., Cicariello, D., Manay, N. et Kordas, K. (2014). Associations between hair manganese levels and cognitive, language, and motor development in preschool children from Montevideo, Uruguay. Arch. Environ. Occup. Health, 69(1): 46–54.
Riojas-Rodriguez, H., Solis-Vivanco, R., Schilmann, A., Montes, S., Rodriguez, S., Rios, C. et Rodriguez-Agudelo, Y. (2010). Intellectual function in Mexican children living in a mining area and environmentally exposed to manganese. Environ. Health Perspect., 118(10): 1465–1470.
Roels, H.A., Ghyselen, P., Buchet, J.P., Ceulemans, E. et Lauwerys, R.R. (1992). Assessment of the permissible exposure level to manganese in workers exposed to manganese dioxide dust. Br. J. Ind. Med., 49(1): 25–34.
Roels, H.A., Meiers, G., Delos, M., Ortega, I., Lauwerys, R.R., Buchet, J.P. et coll. (1997). Influence of the route of administration and the chemical form (MnCl2, MnO2) on the absorption and cerebral distribution of manganese in rats. Arch. Toxicol., 71(4): 223–230.
Roels, H.A., Bowler, R.M., Kim, Y., Claus Henn, B., Mergler, D., Hoet, P., Gocheva, V.V., Bellinger, D.C., Wright, R.O., Harris, M.G., Chang, Y., Bouchard, M.F., Riojas-Rodriguez, H., Menezes-Filho, J.A. et Tellez-Rojo, M.M. (2012). Manganese exposure and cognitive deficits: A growing concern for manganese neurotoxicity. Neurotoxicology, 33(4): 872–880.
Roth, J.A. (2006). Homeostatic and toxic mechanisms regulating manganese uptake, retention, and elimination. Biol. Res., 39(1): 45–57.
Roth, J.A., Li, Z., Sridhar, S. et Khoshbouei, H. (2013). The effect of manganese on dopamine toxicity and dopamine tranposter (DAT) in control and DAT transfected HEK cells. Neurotoxicology, 35: 121–8.
Rumsby, P., Clegg, H., Jonsson, J., Benson, V., Harman, M., Doyle, T., Rushton, L., Warwick, P. et Wilkinson, D. (2014). Speciation of manganese in drinking water. National Centre for Environmental Toxicology, UC9780. Prepared for the Drinking Water Inspectorate.
Ruoff, W.L. (1995). Relative bioavailability of manganese ingested in food or water. Dans :Proceedings of the Workshop on the Bioavailability and Oral Toxicity of Manganese. Sponsored by the U.S. Environmental Protection Agency, Cincinnati, OH, August 30-31, 1994. [Cité dans U.S. EPA, 2002]
Sahabi, D. M., Takeda, M., Suzuki, I. et Koizumi, J. (2009). Removal of Mn2+ from water by “aged” biofilter media: The role of catalytic oxides layers. J. Biosci. Bioeng., 107(2): 151–157,
Sahni, V., Léger, Y., Panaro, L., Allen, M., Giffin, S., Fury, D. et Hamm N. (2007). Case report: a metabolic disorder presenting as pediatric manganism. Environ. Health Perspect., 115(12): 1776–1779.
Sain, A.E, Griffin, A. et Dietrich, A.M (2014). Assessing taste and visual perception of Mn(II) and Mn(IV). J. Am. Water Works Assoc., 106(1): 32–40.
Salehi, F., Krewski, D., Mergler, D., Normandin, L., Kennedy, G., Philippe, S. et coll. (2003). Bioaccumulation and locomotor effects of manganese phosphate/sulfate mixture in Sprague-Dawley rats following subchronic (90 day) inhalation exposure. Toxicol. Appl. Pharmacol., 191(3): 264–271.
Salehi, F., Normandin, L., Krewski, D., Kennedy, G., Philippe, S. et Zayed, J. (2006). Neuropathology, tremor and electromyogram in rats exposed to manganese phosphate/sulfate mixture. J. Appl. Toxicol., 26(5): 419–426.
Sanchez, B., Casalots-Casado, J., Quintana, S., Arroyo, A., Martin-Fumado, C. et Galtes, I. (2012). Fatal manganese intoxication due to an error in the elaboration of epsom salts for a liver cleansing diet. Forensic Sci. Int., 223(1–3): e1–4.
Sánchez, D.J., Domingo, J.L., Llobet, J.M. et Keen, C.L. (1993). Maternal and developmental toxicity of manganese in the mouse. Toxicology Letters, 69(1): 45–52. [Cité dans Santé Canada, 2010]
Sandstrom, B., Davidsson, L., Cederblad, A., Eriksson, R. et Lonnerdal, B. (1986). Manganese absorption and metabolism in man. Acta Pharmacol. Toxicol., 59(Suppl 7): 60–62. [Cité dans Santé Canada, 2010]
Santamaria, A.B. (2008). Manganese exposure, essentiality & toxicity. Indian J. Med. Res., 128(4): 484–500.
Santé Canada (2007a). Suppléments de multivitamines/minéraux. Base de données d'ingrédients de produits de santé naturels, Direction des produits de santé naturels, Santé Canada, Ottawa, Ontario. Disponible à : http://webprod.hc-sc.gc.ca/nhpid-bdipsn/atReq.do?atid=multi_vitmin_suppl&lang=fra.
Santé Canada (2007b). Average dietary intakes (µg/kg bw/day) of trace elements for Canadians in different age/sex groups for Total Diet Study. Bureau d'innocuité des produits chimiques, Direction générale des produits de santé et des aliments, Santé Canada, Ottawa, Ontario.
Santé Canada (2009). Étude canadienne sur l’alimentation totale. Disponible à : www.hc-sc.gc.ca/fn-an/surveill/total-diet/index-fra.php.
Santé Canada (2010). Évaluation du risque pour la santé humaine du manganèse inhalé. Bureau de l’eau, de l’air et des changements climatiques, Programme de la sécurité des milieux, Santé Canada. Disponible de : http://canadiensensante.gc.ca/publications/healthy-living-vie-saine/manganese/index-fra.php
Santé Canada (2014a). Communication personnelle de A.-M. Tugulea.
Santé Canada (2014b). Communication personnelle de R. Dabeka.
Santé Canada (2015). Drinking water treatment system testing for manganese removal. Réalisé par NSF International sous contrat avec Santé Canada.
Saric, M. (1986). Manganese. Dans : Frieberg, L., Nordberg, G.F. and Vouk, V.B. (eds.). Handbook on the Toxicology of Metals. Volume II: Specific Metals. 2nd ed. Amsterdam, Elsevier Science Publishers BV (354–386). [Cité dans Geber et coll., 2002, Merian et coll., 2004.]
Saskatchewan Water Security Agency (2014). Communication personnelle de S. Ferris.
Saudin, F., Gelas, P. et Bouletreau, P. (1988). Trace elements in artificial nutrition. art and practice. Ann. Fr. Anesth. Reanim., 7(4): 320–332.
Schneider, C., Johns, P. et Huehmer, R. (2001). Microfiltration for removal of manganese from surface water. AWWA 2001 Annual Conference Proceedings, Washington, D.C.
Schock, M.R. (2005). Distribution systems as reservoirs and reactors for inorganic contaminants. Chapitre 6 dans : Distribution system water quality challenges in the 21st century – a strategic guide. M.J. Macphee (éditeur.). American Water Works Association, Denver, Colorado.
Schock, M.R. et Holm, T.R. (2003). Are we monitoring in the right places for metals and radionuclides? Journal of the New England Water Works Association, 141(2): 102.
Schock, M.R., Cantor, A.F., Triantafyllidou, S., Desantis, M.K. et Scheckel, K.G. (2014). Importance of pipe deposits to Lead and Copper Rule compliance. J. Am. Water Works Assoc., 106(7), E336–E349.
Schroeder, H.A., Balassa, J.J. et Tipton, I.H. (1966). Essential trace metals in man: Manganese. A study in homeostasis. J. Chronic Dis., 19(5): 545–571. [Cité dans Santé Canada, 2010]
Schroeter, J.D., Nong, A., Yoon, M., Taylor, M.D., Dorman, D.C., Andersen, M.E. et coll. (2011). Analysis of manganese tracer kinetics and target tissue dosimetry in monkeys and humans with multi-route physiologically based pharmacokinetic models. Toxicol. Sci., 120(2): 481–498.
Schroeter, J.D., Dorman, D.C., Yoon, M., Nong, A., Taylor, M.D., Andersen, M.E. et coll. (2012). Application of a multi-route physiologically based pharmacokinetic model for manganese to evaluate dose-dependent neurological effects in monkeys. Toxicol. Sci., 129(2): 432–446.
SCF (2003). Report of the scientific committee on food on the revision of essential requirements of infant formulae and follow-on formulae. Scientific Committee on Food, Health and Consumers Directorate-General, European Commission, SCF/CS/NUT/IF/65 Final, Brusselles, Belgique.
Seel, N.M. (2012). Basal Ganglia. Dans :Seel, N.M. (Ed.) Encyclopedia of the Sciences of Learning. Springer US. Disponible à :http://dx.doi.org/10.1007/978-1-4419-1428-6_2043.
Sentürk, U.K. and Öner, G. (1996). The effect of manganese-induced hypercholesterolemia on learning in rats. Biol. Trace Elem. Res., 51( 3): 249–257.
Sharma, R. and Pervez, S. (2005). Toxic metals status in human blood and breast milk samples in an integrated steel plant environment in Central India. Environ. Geochem. Health, 27(1): 39–45.
Shi, X.Q., Yan, W., Wang, K.Y., Fan, Q.Y. and Zou, Y. (2012). Protective effects of dietary fibre against manganese-induced neurobehavioral aberrations in rats. Arh. Hig. Rada. Toksikol., 63(3): 263–270.
Shukakidze, A.A., Lazriev, I.L. and Mitagvariya, N. (2003). Behavioral impairments in acute and chronic manganese poisoning in white rats. Neurosci. Behav. Physiol., 33(3): 263–267.
Shukakidze, A.A., Lazriev, I.L., Khetsuriani, R.G. and Bikashvili, T.Z. (2002). Changes in neuroglial ultrastructure in various parts of the rat brain during manganese chloride poisoning. Neurosci. Behav. Physiol., 32(6): 561–566.
Shukla, G.S., Singh, S. and Chandra, S.V. (1978). The interaction between manganese and ethanol in rats. Acta Pharmacol. Toxicol., 43(5): 354–362.
Shukla, G.S., Chandra, S.V. and Seth, P.K. (1976). Effect of manganese on the levels of DNA, RNA, DNase and RNase in cerebrum, cerebellum and rest of brain regions of rat. Acta Pharmacol. Toxicol., 39(5): 562–569. [Cité dans Santé Canada, 2010]
Shukla, G.S., Dubey, M.P. and Chandra, S.V. (1980). Manganese-induced biochemical changes in growing versus adult rats. Arch. Environ. Contam. Toxicol., 9(4): 383–391. [Cité dans Santé Canada, 2010]
Shumay, E., Fowler, J.S. and Volkow, N.D. (2010). Genomic features of the human dopamine transporter gene and its potential epigenetic states: Implications for phenotypic diversity. PLOS ONE, 5(6): e11067.
Sialelli, J., Urquhart, G.J., Davidson, C.M. and Hursthouse, A.S. (2010). Use of a physiologically based extraction test to estimate the human bioaccessibility of potentially toxic elements in urban soils from the city of Glasgow, UK. Environ. Geochem. Health, 32(6): 517–527.
Siddappa, A.J., Rao, R.B., Wobken, J.D., Leibold, E.A., Connor, J.R. and Georgieff, M.K. (2002). Developmental changes in the expression of iron regulatory proteins and iron transport proteins in the perinatal rat brain. J. Neurosci. Res., 68(6): 761–775.
Sidoryk-Wegrzynowicz, M., Lee, E., Albrecht, J. and Aschner, M. (2009). Manganese disrupts astrocyte glutamine transporter expression and function. J. Neurochem., 110(3): 822–830.
Sidoryk-Wegrzynowicz, M. and Aschner, M. (2013a). Role of astrocytes in manganese mediated neurotoxicity. BMC Pharmacol. Toxicol., 14(23).
Sidoryk-Wegrzynowicz, M. and Aschner, M. (2013b). Manganese toxicity in the central nervous system: the glutamine/glutamate-gamma-aminobutyric acid cycle. J. Intern. Med., 273: 466–477.
Singh, I. (1984). Induction of gene conversion and reverse mutation by manganese sulphate and nickel sulphate in Saccharomyces cerevisiae. Mutat. Res. 137(1): 47–49. [Cité dans Santé Canada, 2010]
Sly, L.I., Hodgkinson, M.C., Arunpairojana, V. 1990. Deposition of manganese in drinking water distribution systems. Appl. Environ. Microbiol., 56(3), 628–639.
Smyth, H.F., Carpenter, C.P., Weil, C.S., Pozzani, U.C., Striegal, J.A. and Nycum, J.S. (1969). Range-finding toxicity data: List VII. AIHA, 30: 470–476. [Cité dans U.S. EPA, 2004, OMS, 2011.]
Sommerfield, E.O. (1999). Iron and manganese removal handbook. American Water Works Association. Denver, Colorado.
Spadoni, F., Stefani, A., Morello, M., Giacomini, P. and Sancesario, G. (2000). Selective vulnerability of pallidal neurons in the early phases of manganese intoxication. Exp. Brain Res., 135(4): 544–551.
Stokes, P.M., Campbell, P.G.C., Schroeder, W.H., Trick, C., France, R.L., Puckett, K.J., LaZerte, B., Speyer, M., Hanna, J.E. et Donaldson, J. (1988). Manganese in the Canadian environment. NRCC (éditeur).
Subhash, M.N. et Padmashree, T.S. (1991). Effect of manganese on biogenic amine metabolism in regions of the rat brain. Food Chem. Toxicol., 29: 579–82.
Szakmáry, E., Ungváry, G., Hudák, A., Naray, M., Tatrai, E., Szeberenyi, S. et coll. (1995). Developmental effect of manganese in rat and rabbit. Central European Journal of Occupational and Environmental Medicine, 1(2): 149–159. [Cité dans OMS, 1999.]
Takacs, S., Szabo, A., Oszlanczi, G., Paulik, E. et Papp, A. (2012). A pilot study with simultaneous recording of changes in motility and cortical electrical activity of rats during four weeks of oral manganese exposure. Int. J. Environ. Health Res., 22(4): 331–9.
Takeda, A., Sawashita, J. et Okada, S. (1995). Biological half-lives of zinc and manganese in rat brain. Brain Research, 695(1): 53–58. [Cité dans Santé Canada, 2010]
Tapin, D., Kennedy, G., Lambert, J. et Zayed, J. (2006). Bioaccumulation and locomotor effects of manganese sulfate in Sprague-Dawley rats following subchronic (90 days) inhalation exposure. Toxicol. Appl. Pharmacol., 211(2): 166–174.
Taylor, M.D., Clewell, H.J. 3rd, Andersen, M.E., Schroeter, J.D., Yoon, M., Keene, A.M. et Dorman, D.C. (2012). Update on a pharmacokinetic-centric alternative tier II program for MMT-Part II: Physiologically based pharmacokinetic modeling and manganese risk assessment. J. Toxicol., Article ID 791431.
Taylor, M.D., Erikson, K.M., Dobson, A.W., Fitsanakis, V.A., Dorman, D.C. et Aschner, M. (2006). Effects of inhaled manganese on biomarkers of oxidative stress in the rat brain. Neurotoxicology, 27(5): 788–797.
Teeguarden, J.G., Dorman, D.C., Covington, T.R., Clewell, H.J. 3rd et Andersen, M.E. (2007a). Pharmacokinetic modeling of manganese. I. Dose dependencies of uptake and elimination. J. Toxicol. Environ. Health A., 70(18): 1493–1504.
Teeguarden, J.G., Dorman, D.C., Nong, A., Covington, T.R., Clewell, H.J. 3rd et Andersen, M.E. (2010). Pharmacokinetic modeling of manganese. II. Hepatic processing after ingestion and inhalation. J. Toxicol. Environ. Health A, 70(18): 1505–1514.
Teeguarden, J.G., Gearhart, J., Clewell, H.J. 3rd, Covington, T.R., Nong, A. et Andersen, M.E. (2007c). Pharmacokinetic modeling of manganese. III. Physiological approaches accounting for background and tracer kinetics. J. Toxicol. Environ. Health A., 70(18): 1515–1526.
Thompson, K.J., Molina, R.M. et Donaghey, T.E.A. (2011). Manganese uptake and distribution in the brain after methyl bromide-induced lesions in the olfactory epithelia. Toxicol. Sci., 120(1): 163–72.
Tjalkens, R.B., Zoran, M.J., Mohl, B. et Barhoumi, R. (2006). Manganese suppresses ATP-dependent intercellular calcium waves in astrocyte networks through alteration of mitochondrial and endoplasmic reticulum calcium dynamics. Brain Res., 1113(1): 210–219.
Tobiason, J.E., Knocke, W.R., Islam, A.A., et Goodwill, J.E. (2007). Control of periodically elevated raw water manganese with oxide coated media. Proceedings of the American Water Works Association Water Quality Technology Conference.
Tobiason, J.E., Islam, A.A., Knocke, W.R., Goodwill, J., Hargette, P., Bouchard, R. et Zuravnsky, L. (2008). Characterization and performance of filter media for manganese control. American Water Works Research Foundation, Denver, Colorado.
Torrente, M., Colomina, M.T. et Domingo, J.L. (2005a). Metal concentrations in hair and cognitive assessment in an adolescent population. Biol. Trace Elem. Res., 104(3): 215–221.
Torrente, M., Colomina, M.T. et Domingo, J.L. (2005b). Behavioral effects of adult rats concurrently exposed to high doses of oral manganese and restraint stress. Toxicology, 211(1–2): 59–69.
Torres-Agustin, R., Rodriguez-Agudelo, Y., Schilmann, A., Solis-Vivanco, R., Montes, S., Riojas-Rodriguez, H. et coll. (2013). Effect of environmental manganese exposure on verbal learning and memory in Mexican children. Environ. Res., 121: 39–44.
Tran, T.T., Chowanadisai, W., Crinella, F.M., Chicz-Demet, A. et Lonnerdal, B. (2002a). Effect of high dietary manganese intake of neonatal rats on tissue mineral accumulation, striatal dopamine levels, and neurodevelopmental status. Neurotoxicology 23(4–5): 635–643.
Tran, T.T., Chowanadisai, W., Lonnerdal, B., Le, L., Parker, M., Chicz-Demet, A. et coll. (2002b). Effects of neonatal dietary manganese exposure on brain dopamine levels and neurocognitive functions. Neurotoxicology 23(4–5): 645–651.
Treinen, K.A., Gray, T.J.B. et Blazak, W.F. (1995). Developmental toxicity of mangafodipir trisodium and manganese chloride in Sprague-Dawley rats. Teratology, 52: 109–115. [Cité dans Santé Canada, 2010]
Tsuda, H. et Kato, K. (1977). Chromosomal aberrations and morphological transformation in hamster embryonic cells treated with potassium dichromate in vitro. Mutat. Res., 46: 87–94. [Cité dans ATSDR, 2008.]
Tuschl, K., Mills, P.B. et Clayton, P.T. (2013). Manganese and the brain. Int. Rev. Neurobiol., 110: 277–312.
Ueda, F., Raja, K.B., Simpson, R.J., Trowbridge, I.S. et Bradbury, M.W. (1993). Rate of 59Fe uptake into brain and cerebrospinal fluid and the influence thereon of antibodies against the transferrin receptor. J. Neurochem., 60(1): 106–113. [Cité dans Santé Canada, 2010]
U.S. EPA (1979). National Secondary Drinking Water Regulations; Final Rule. Federal Register 44(140): 42195–42202.
U.S. EPA (1986). Guidelines for the health risk assessment of chemical mixtures. U. S. Environmental Protection Agency. Federal Register 51(185): 34014–34025.
U.S. EPA (1988). Recommendations for and documentation of biological values for use in risk assessment. U.S. Environmental Protection Agency. Office of Health and Environmental Assessment, Environmental Criteria and Assessment Office, Cincinnati, Ohio.
U.S. EPA (1994a). Method 200.7: Determination of metals and trace elements in water and wastes by inductively coupled plasma-atomic emission spectrometry. Rev 4.4. Environment Monitoring Systems Laboratories. Office of Research and Development, Cincinnati, Ohio 45268.
U.S. EPA (1994b). Method 200.8, Revision 5.4: Determination of trace elements in waters and wastes by Inductively Coupled Plasma-Mass Spectrometry. Environment Monitoring Systems Laboratories. Office of Research and Development, Cincinnati, Ohio 45268
U.S. EPA (1994c). Method 200.9, Revision 2.2: Determination of trace elements by stabilized temperature graphite furnace atomic adsorption. Environment Monitoring Systems Laboratories. Office of Research and Development, Cincinnati, Ohio 45268
U.S. EPA (1994d). Method 218.6, Revision 3.3: Determination of dissolved hexavalent chromium in drinking water, groundwater and industrial wastewater effluents by ion chromatography. Environment Monitoring Systems Laboratories. Office of Research and Development, Cincinnati, OH.
U.S. EPA (1999). Guidelines for carcinogen risk assessment. National Center for Environmental Assessment, Risk Assessment Forum, U.S. Environmental Protection Agency. Washington, D.C. NCEA-F-0644. July 1999. Disponible à : www.epa.gov/ncea/raf/car2sab.htm
U.S. EPA (2002). Manganese (CASRN 7439-96-5). Integrated Risk Information System (IRIS). Last revision: 1996 ed., National Center for Environmental Assessment (NCEA), U.S. Environmental Protection Agency. Disponible à : www.epa.gov/ncea/iris/subst/0373.htm. Last revision: 2002.
U.S. EPA (2003). Method 200.5. Determination of trace elements in drinking water by axially viewed inductively coupled plasma – atomic emission spectrometry. National exposure research laboratory. Office of research and development. Ohio 45268. EPA 600/R-06/115
U.S. EPA (2004). Drinking water health advisory for manganese. Office of Water, Health and Ecological Criteria Division, EPA-822-R-04-003, Washington. Disponible à : www.epa.gov/safewater/ccl/pdfs/reg_determine1/support_cc1_magnese_dwreport.pdf
U.S. EPA (2006). Inorganic contaminant accumulation in potable water distribution systems. Office of Water, U.S. Environmental Protection Agency, Washington, D.C. Disponible à : www.epa.gov/ogwdw/disinfection/tcr/pdfs/issuepaper_tcr_inorganiccontaminantaccumulation.pdf
U.S. EPA (2009). 2009 edition of the drinking water standards and health advisories. United States EPA 822-R-09-011, Office of Water, U.S .Environmental Protection Agency, Washington, D.C. Disponible à : www.epa.gov/waterscience/criteria/drinking/dwstandards2009.pdf
U.S. EPA (2010). Technical basis for the lowest concentration minimum reporting level (LCMRL) calculation. Office of Water (MLK 140) EPA 815-R-11-001 December 2010 http://water.epa.gov/drink
U.S. EPA (2012). Federal Registry Part II. Revisions of the Unregulated Contaminant Monitoring Regulation (UCMR 3) for public water systems; Final Rule. Vol 77, No 85. May 2, 2012. U.S.Environmental Protection Agency, Washington, D.C.
Valencia, R., Mason, J.M., Woodruff, R.C. et Zimmering, S. (1985). Chemical mutagenesis testing in Drosophila. III. Results of 48 coded compounds tested for the National Toxicology Program. Environ. Mutagen., 7(3): 325–348.
Vezer, T., Kurunczi, A., Naray, M., Papp, A. et Nagymajtényi, L. (2007). Behavioral effects of subchronic inorganic manganese exposure in rats. Am. J. Ind. Med., 50(11): 841–852.
Vezer, T., Papp, A., Z, H., Varga, M., Naray, M. et Nagymajtényi, L. (2005). Behavioral and neurotoxicological effects of subchronic manganese exposure in rats. Environ. Toxicol. Pharmacol, 19: 797–810.
Vieregge, P., Heinzow, B., Korf, G., Teichert, H.M., Schleifenbaum, P. et Mosinger, H.U. (1995). Long term exposure to manganese in rural well water has no neurological effects. Can. J. Neurol. Sci., 22: 286–289.
Vreeburg, J. (2010). Discolouration in Drinking Water Systems: The Role of Particles Clarified. London: IWA Publishing.Vreeburg, J.H.G. et Boxall, J.B. (2007). Discolouration in potable water distribution systems: A review. Water Res., 41: 519–529.
Vreeburg, J.H.G., Schippers, D., Verberk, J.Q.J.C. et van Dijk, J.C. (2008). Impact of particles on sediment accumulation in a drinking water distribution system. Water Res., 42, 4233–4242.
Wallace, L. et Slonecker, T. (1997). Ambient air concentrations of fine (PM25) manganese in U.S. national parks and in California and Canadian cities: The possible impact of adding MMT to unleaded gasoline. J.Air Waste Manage. Assoc., 47(6): 642–652.
Walsh, M.P. (2007). The global experience with lead in gasoline and the lessons we should apply to the use of MMT. Am. J. Ind. Med., 50(11): 853–860.
Wang, L., Ohishi, T., Shiraki, A., Morita, R., Akane, H., Ikarashi, Y. et coll. (2012). Developmental exposure to manganese chloride induces sustained aberration of neurogenesis in the hippocampal dentate gyrus of mice. Toxicol. Sci., 127(2): 508–21.
Ward, J.M. (1980). The carcinogenicity of ethylene dichloride in Osborne-Mendel rats and B6C3F1 mice. Dans : Ames, B., Infante, P. et Reitz, R. (éditeurs). Ethylene dichloride: A potential health risk? Banbury Report No. 5. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, New York. p. 35–53.
Wasserman, G.A., Liu, X., Parvez, F., Ahsan, H., Levy, D., Factor-Litvak, P., Kline, J., van Geen, A., Slavkovich, V., LoIacono, N.J., Cheng, Z., Zheng, Y. et Graziano, J.H. (2006). Water manganese exposure and children’s intellectual function in Araihazar, Bangladesh. Environ. Health Perspect., 114(1): 124–129.
Wasserman, G.A., Liu, X., Parvez, F., Factor-Litvak, P., Ahsan, H., Levy, D., Kline, J., van Geen, A., Mey, J., Slavkovich, V., Siddique, A.B., Islam, T. et Graziano, J.H. (2011). Arsenic and manganese exposure and children’s intellectual function. Neurotoxicology, 32(4): 450–457.
Weber, S., Dorman, D.C., Lash, L.H., Erikson, K., Vrana, K.E. et Aschner, M. (2002). Effects of manganese (Mn) on the developing rat brain: Oxidative-stress related endpoints. Neurotoxicology, 23(2): 169–175.
Wong, P.K. (1988). Mutagenicity of heavy metals. Bull. Environ. Contam. Toxicol., 40: 597–603.
Woolf, A., Wright, R., Amarasiriwardena, C. et Bellinger, D. (2002). A child with chronic manganese exposure from drinking water. Environ. Health Perspect., 110(6): 613–616.
Wright, R.O. et Baccarelli, A. (2007). Metals and neurotoxicology. J. Nutr. 137(12): 2809–2813. Review.
Wright, R.O., Amarasiriwardena, C., Woolf, A.D., Jim, R. et Bellinger, D.C. (2006). Neuropsychological correlates of hair arsenic, manganese, and cadmium levels in school-age children residing near a hazardous waste site. Neurotoxicology, 27(2): 210–216.
Yokel, R.A., Lasley, S.M. et Dorman, D.C. (2006). The speciation of metals in mammals influences their toxicokinetics and toxicodynamics and therefore human health risk assessment. J. Toxicol. Environ. Health B, 9(1): 63–85.
Yoon, J.H. et Ahn, Y.S. (2015). A large, nationwide, longitudinal study of central nervous system diseases among Korean workers exposed to manganese. Parkinsonism Relat. Disord., 21(3): 194–198.
Yoon, M., Nong, A., Clewell, H.J., 3rd, Taylor, M.D., Dorman, D.C. et Andersen, M.E. (2009a). Lactational transfer of manganese in rats: predicting manganese tissue concentration in the dam and pups from inhalation exposure with a pharmacokinetic model. Toxicol. Sci., 112(1): 23–43.
Yoon, M., Nong, A., Clewell, H.J., 3rd, Taylor, M.D., Dorman, D.C. et Andersen, M.E. (2009b). Evaluating placental transfer and tissue concentrations of manganese in the pregnant rat and fetuses after inhalation exposures with a PBPK model. Toxicol. Sci., 112(1): 44–58.
Yoon, M., Schroeter, J.D., Nong, A., Taylor, M.D., Dorman, D.C., Andersen, M.E. et coll. (2011). Physiologically based pharmacokinetic modeling of fetal and neonatal manganese exposure in humans: describing manganese homeostasis during development. Toxicol. Sci., 122(2): 297–316.
Yu, X., Cao, L. et Yu, X. (2013). Elevated cord serum manganese level is associated with a neonatal high ponderal index. Environ. Res., 121(0): 79–83.
Yu, X., Zhang, J., Yan, C. et Shen, X. (2014). Prenatal exposure to manganese at environment relevant level and neonatal neurobehavioral development. Environ. Res., 133(0): 232–238.
Yukon Environmental Health Services (2014). Communication personnelle de P. Brooks.
Zacheus, O.M., Lehtola, M.J., Korhonen, L.K. et Martikainen, P.J. (2001). Soft deposits, the key site for microbial growth in drinking water distribution networks, Water Res., 35(7): 1751–1765.
Zhao, F., Cai, T., Liu, M., Zheng, G., Luo, W. et Chen, J. (2009). Manganese induces dopaminergic neurodegeneration via microglial activation in a rat model of manganism. Toxicol. Sci., 107(1): 156–64.
Zheng, W., Kim, H. et Zhao, Q. (2000). Comparative toxicokinetics of manganese chloride and methylcyclopentadienyl manganese tricarbonyl (MMT) in Sprague-Dawley rats. Toxicol. Sci., 54: 295–301.
Zheng, W., Ren, S. et Graziano, J.H. (1998). Manganese inhibits mitochondrial aconitase: A mechanism of manganese neurotoxicity. Brain Res., 799: 334–342. [Cité dans Santé Canada, 2010]
Zlotkin, S.H., Atkinson, S. et Lockitch, G. (1995). Trace elements in nutrition for premature infants. Clin. Perinatol., 22(1): 223–240. [Cité dans Santé Canada, 2010]
Zota, A.R. ettinger, A.S., Bouchard, M., Amarasiriwardena, C.J., Schwartz, J., Hu, H. et Wright, R.O. (2009). Maternal blood manganese levels and infant birth weight. Epidemiology, 20(3): 367–373.
Zwingmann, C., Leibfritz, D. et Hazell, A.S. (2003). Energy metabolism in astrocytes and neurons treated with manganese: relation among cell-specific energy failure, glucose metabolism, and intercellular trafficking using multinuclear NMR-spectroscopic analysis. J. Cereb. Blood Flow Metab., 23: 756–771.
Annexe A : Liste des acronymes
- 5-HIAA
- acide 5-hydroxy-indolacétique
- AChE
- acétylcholinestérase
- ANSI
- American National Standards Institute
- AQT
- apport quotidien tolérable
- AS
- apport suffisant
- ATP
- adénosine triphosphate
- BHE
- barrière hématoencéphalique
- BOM
- bactérie oxydant le manganèse
- CAG
- charbon actif en grains
- CAS
- Chemical Abstracts Service
- CCN
- Conseil canadien des normes
- CEP
- Comité fédéral-provincial-territorial sur l’eau potable
- CICR
- Centre international de recherche sur le cancer
- CMA
- concentration maximale acceptable
- COD
- carbone organique dissous
- COX-2
- cyclooxygénase-2
- CpG
- cytosine phosphate–guanine
- DA
- dopamine
- DAT
- transporteur de dopamine
- DCT
- transporteur de cations divalent
- DL 50
- dose létale moyenne
- DMT
- transporteur de métaux divalent
- DNMT
- protéine méthyltransférase de l’ADN
- DOPAC
- acide 3,4-dihydroxyphénylacétique
- Er
- érythrocyte
- FSH
- hormone folliculo-stimulante
- GABA
- acide 4-aminobutanoïque
- GFAP
- protéine fibrillaire acide gliale
- Gln
- glutamine
- Glu
- glutamate
- GnRH
- gonadolibérine
- HAA
- acide haloacétique
- HVA
- acide homovanillique
- IC
- intervalle de confiance
- ICG
- indice de cognition générale de McCarthy
- ICP-AES
- spectrométrie d’émission atomique par torche à plasma
- ICP-MS
- spectrométrie de masse par torche à plasma
- IGF-1
- facteur de croissance analogue à l’insuline 1
- JG
- jour de gestation
- JPN
- jour postnatal
- LCR
- liquide céphalo-rachidien
- LDM
- limite de détection de la méthode
- LH
- hormone lutéinisante
- LOAEL
- dose minimale avec effet nocif observé
- LSRO
- Life Science Research Office
- MAO
- monoamine oxydase
- MIREC
- Maternal-Infant Research on Environmental Chemicals
- MMT
- méthylcyclopentadiényl manganèse tricarbonyle
- Mn
- manganèse
- MnB
- concentration de manganèse dans le sang
- MnH
- concentration de manganèse dans les cheveux
- MnUmbi
- concentration de manganèse dans le sérum ombilical
- MnW
- concentration de manganèse dans l’eau
- MON
- matières organiques naturelles
- MP
- matières particulaires
- NBNA
- évaluation comportementale et neurologique des nouveaux-nés
- NE
- norépinéphrine
- NOAEL
- dose sans effet nocif observé
- NOS2
- oxyde nitrique synthase 2
- NPEQ
- niveau pratique d’évaluation quantitative
- NSF
- NSF International
- OD
- oxygène dissous
- OE
- objectif esthétique
- OMS
- Organisation mondiale de la santé
- p.c.
- poids corporel
- PBPK
- pharmacocinétique physiologique
- PE
- point d’entrée
- PU
- point d’utilisation
- PVC
- polychlorure de vinyle
- QI
- quotient intellectuel
- RNSPA
- Réseau national de surveillance de la pollution atmosphérique
- SM
- méthode normalisée (standard method)
- SMNR
- seuil minimal de niveau à rapporter
- SNC
- système nerveux central
- SPD
- sous-produit de désinfection
- SPN
- semaine postnatale
- Tf
- transferrine
- TfR
- récepteur de la transferrine
- THM
- trihalométhanes
- U.S.
- EPA United States Environmental Protection Agency
- UCMR3
- Third Unregulated Contaminant Monitoring Rule
- uTN
- unité de turbidité néphélémétrique
- VBS
- valeur basée sur la santé
Annexe B : Répercussions prévues par province et territoire
Veuillez noter que l'information suivante n'est pas dans les deux langues officielles puisque la source de l'information n'est pas assujettie à la Loi sur les langues officielles.
Île-du-Prince-Édouard
Manganese in concentrations in Prince Edward Island drinking water are generally low, and the proposed guidelines would have a relatively small impact in the Province. It is not expected that any municipal water supply system will need to take action to meet the proposed health based guideline or aesthetic objective. The health based guideline of 0.1 mg/L is expected to have a minimal impact on private well owners, as it is likely they would be taking action to reduce manganese levels at this concentration on an aesthetic basis in any case. Assuming that acceptance by homeowners of elevated manganese concentrations is based on actual adverse effects rather than guideline levels, the potential effect on private well owners may be primarily in relation to the revised aesthetic objective and it's influence on real estate transactions, with a slight increase (up from ~3% to ~5%) in private wells exceeding the proposed aesthetic guideline.
Terre-Neuve-et-Labrador
The Province of Newfoundland and Labrador is responsible for extensive monitoring for inorganic parameters including manganese in the province. Manganese monitoring is conducted semi-annually for all public water supplies in the province, and quarterly for populations larger than 5,000.
Of the 305 surface water sources in the province, 258 (85%) are protected under the Water Resources Act. Of the 198 groundwater sources in the province, 59 (30%) are protected under the Water Resources Act. This provides for an extensive source water protection program that reduces the risk of contamination for drinking water sources. A total of 76 public drinking water supplies (both surface water and groundwater) will exceed the proposed MAC of 0.1 mg/L.
A total of 232 public drinking water supplies (both surface water and groundwater) may exceed the proposed AO of 0.02 mg/L periodically. Of these, 92 may be systems that have never had manganese exceedances in the past. In the 2013-14 fiscal year, there were 102 manganese exceedances in the province. Additionally, an unknown number of private wells may exceed the proposed guidelines.
The majority of Newfoundland and Labrador’s drinking water systems do not have any treatment other than disinfection as 68% of the systems service very small populations (less than 500 people). Due to this fact, the cost of implementing this guideline to remove manganese from systems where exceedances are expected will be extremely expensive, especially as most of the systems that will require treatment are located in very small communities that lack resources.
Treatment for manganese is currently used in only 6 distribution systems in the province with marginal effectiveness.
The province will continue to monitor for manganese at the current frequency, and to encourage source water protection for all public water supplies. It will also introduce manganese/iron removal treatment systems as necessary for public water supplies at risk of exceeding the guidelines.
Nouvelle-Écosse
The revised guideline proposes a maximum acceptable concentration (MAC) for manganese of 100 µg/L and a reduction to the current aesthetic objective (AO) from 50 µg/L to 20 µg/L. The proposed development of a health-based guideline for manganese and a reduction to the current aesthetic objective will likely result in moderate to significant impact for Nova Scotia.
Nova Scotia's drinking water program consists of public and private supplies. Public drinking water supplies include municipal (approved) and registered facilities. 64.7% (613,784 persons) of the population are serviced by a municipal system; 1.3% (12,200 persons) are serviced by a registered facility; and the remaining 34% (322,754 persons) rely on the use of a private drinking water supply.
Nova Scotia Environment (NSE) regulates water quality at municipal and registered public drinking water facilities. There are currently 1545 registered facilities. As part of our evaluation, NSE analyzed available data from 53% of these facilities. The data identified that 43% exceed an AO of 20 µg/L with 22% exceeding a MAC of 100 µg/L. Existing data included as part of our evaluation for registered facilities prevents an accurate determination of true impact as treatment information maintained by NSE is not current and we do not have data for all of our registered facilities. NSE regulates 83 municipal drinking water facilities. Recent data identifies three facilities exceeding a MAC of 100 µg/L for manganese with 14 facilities exceeding an AO of 20 µg/L in treated water.
NSE does not regulate water quality at private residences; however, we wanted to include them in our impact analysis as 34% of our population relies on the use of a private drinking water supply. Analysis of available data from various sources coupled with knowledge of local geology and unserviced areas suggests that up to 70,000 private drinking water supplies may be impacted. As NSE does not maintain water quality data for private drinking water supplies, it is not possible to provide a determination of true impact with any certainty.
For Nova Scotia, the proposed establishment of a MAC for manganese will require: the development of a communication strategy to encourage homeowners on private supplies to have their water tested for manganese; the development of risk communication messages in consultation with our Medical Officers of Health ( MOH); the development of educational materials; and the development of a compliance/ enforcement strategy for our public systems.
The proposed revisions will likely result in challenges for our public drinking water supplies, particularly registered facilities; homeowners relying on the use of private drinking water supplies; and the Compliance Division of NSE. Specific challenges are likely to include: increased rates of non-compliance as an estimated 22 % of registered facilities will be out of compliance with the new health-based guideline; increased staff resources to address increased rates of non-compliance; increased sampling costs; and costs associated with the purchase, installation, operation and maintenance of treatment devices.
Nouveau-Brunswick
New Brunswick is supportive of minimizing exposure of manganese from drinking water, now that it has been determined that a health based value is necessary to be protective.
The impact to New Brunswick may be substantial. Manganese is a very common element in New Brunswick drinking water. When reviewing drinking water quality results, we can estimate approximately 1/3 of regulated municipal raw water sources may not be compliant with the new MAC. Proper source water characterization will likely have to be undertaken for many regulated systems. Some systems already have manganese treatment in place to address aesthetic concerns, but for those that don’t, there may be a need to construct new water treatment plants. Associated costs could be significant. Improvements to water distribution systems may be required. Those municipal systems with existing water treatment plants may need to be optimized and additional post-treatment monitoring will be required as well as additional distribution system monitoring.
There are numerous Crown Systems with historical values that exceeded the new MAC. Further investigation here will be needed to determine next steps.
Approximately 30% of all private wells in NB will not be compliant with the new MAC. A rough estimate implicates approximately 30,000 wells.
Additional discussion will be required with stakeholders to discuss how to proceed with implementation of the proposed Guideline and how to manage monitoring and source-water characterization.
Québec
Au Québec, étant donné que le manganèse ne fait pas l'objet d'une norme au Règlement sur la qualité de l'eau potable, les résultats de manganèse disponibles découlent des campagnes d'échantillonnage réalisées par le ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques dans le cadre du Programme de surveillance de la qualité de l’eau potable. Ainsi, de novembre 2010 à mars 2014, 410 analyses du manganèse ont été réalisées dans 107 d’installations de production d’eau potable alimentées en eau souterraine.
Parmi ces résultats d’analyse, 31 (7,6 %) ont montré un résultat supérieur à la CMA proposée de 0,1 mg/L (100 μg/L), ce qui concerne 18 (16,8 %) des installations de production d’eau potable ayant fait l’objet d’une analyse. Par ailleurs, 52 (12,7 %) résultats de manganèse dépassant l’objectif esthétique proposé de 0,02 mg/L (20 μg/L) ont été observés pour 29 (27 %) des installations visitées. Considérant les résultats d'analyse disponibles et le très grand nombre d’installations de production d’eau potable qui s’approvisionnent en eau souterraine au Québec, les impacts attendus de l’ajout d’une norme pour le manganèse à la réglementation, en fonction de la révision de la recommandation publiée par Santé Canada, seraient relativement importants.
Ontario
The proposed guideline value will have minimal impact in Ontario. Ontario currently has an aesthetic objective for manganese that is lower than the proposed guideline.
The aesthetic objective being proposed in the consultation is lower than the current aesthetic objective and may impact small drinking water systems.
Manitoba
A review of the available manganese data shows that the proposed change to the aesthetic objective (from 0.05 to 0.02 mg/L) and, more importantly, establishment of a health-based guideline of 0.1 mg/L would have a significant impact on Manitoba’s public and semi-public water systems. Approximately 30% of public water systems and 20% of semi-public water systems licenced to date show manganese levels at the treatment plant at or above 0.02 mg/L. About 10% of public water systems and a similar proportion of licenced semi-public water systems show manganese levels at the proposed 0.1 mg/L MAC or above. Data from the water treatment plant does not take into consideration potential ‘legacy manganese’ that may have accumulated within distribution lines or consumers’ service lines over the years as part of sediment or pipe scale.
Saskatchewan
The Water Security Agency (WSA) has reviewed the proposed guideline technical document for manganese in drinking water and agrees with the proposed MAC of 100 µg/L and an aesthetic objective of 20 µg/L for total manganese in drinking water. Drinking water analytical results for 3643 samples collected over the last 5 years (2010 to present) from the distribution systems of municipal waterworks regulated by the WSA showed that total manganese levels exceeded the proposed MAC in 108 sampling locations or distribution systems of communities in the province.
Nearly 50% of the ground water treatment systems in Saskatchewan contain significant amounts of iron and manganese in their raw water, and most of these systems have manganese greensand filters to remove manganese from their treated water. These systems adopt a combination of processes (e.g., oxidation using potassium permanganate followed by adsorption/and or filtration in manganese greensand filters) to remove manganese from drinking water. The affected communities continue to monitor manganese levels in treated water as per monitoring requirements specified in the provincial document “Municipal Drinking Water Quality Monitoring Guidelines - EPB 202” and in accordance with operational permit conditions. The proposed MAC for manganese may pose a significant compliance challenge for affected communities as WSA will be compelled to require upgrading once revised standards are adopted in the province. The Water Security Agency will work closely with the affected communities to ensure compliance in the future. Cost estimation for treatment upgrade for these affected communities is not possible at this time.
Alberta
In Alberta it is estimated that around 3% of municipal drinking-water systems will not meet the proposed MAC with a further 15% not being able to meet the proposed revised AO. No estimate of costs are available at this time as the range of potential solutions will be unique to each individual system and may range from changes in operational practice (such as blending for groundwater systems) through to capital expenditure to provide additional process capacity.
Colombie-Britannique
It is anticipated that the proposed change to the manganese guidelines to make the aesthetic objective (AO) more stringent as well as the addition of a maximum acceptable concentration (MAC) will have significant impact on many British Columbia water supply systems.
The change in AO from 0.05 mg/L to 0.02 mg/L would double the number of systems exceeding the objective (200-400 in IHA alone), however this is a minor concern as there is no health impact associated with this change. As manganese concentrations at levels near the AO cause unsightly water, this is often motivation to address this issue even though there is no health concern.
More significant is the proposed addition of a maximum acceptable concentration (0.1 mg/L) based on studies citing an association between exposure to manganese in drinking water and neurological effects in children. This will mean significantly different messaging from what health officials have historically given regarding manganese. It will also require the need for clear and meaningful advice to those that have been consuming water sources that exceed the proposed MAC, who have previously been told that elevated manganese is merely an aesthetic concern.
It is estimated that well over 400 existing water supply systems in BC would exceed the proposed MAC, most of which would be smaller sized systems. Health Canada asserts that the new MAC and AO for manganese should be achievable for most treatment plants. Water suppliers with manganese concentrations consistently above the MAC will arguably need to plan, finance and install such treatment. This will particularly challenge small water systems, as a high proportion of these are on groundwater, and they have limited resources to pay for installation and operation of treatment.
The proposed MAC may also limit options for new sources of water when expanding systems in high manganese regions of the province. Given that manganese is more prevalent in groundwater than surface water, the new proposed manganese guidelines may further pose a challenge for private well owners in BC, which are not captured in the numbers reported above. In summary, these would have significant resource implications on health authorities, water suppliers and ultimately users.
The overall financial, social and health impacts of adopting this guideline are difficult to quantify, however it is reasonable to anticipate that for communities with elevated manganese in drinking water, short term costs of treatment will be balanced against long term diminished potential lifetime earnings as well as long term cost of increased social services and education associated with potential neurological effects.
Yukon
It is not anticipated that the guideline technical document for manganese will have a significant impact on Yukon large public drinking water systems.
Territoires du Nord-Ouest
Aucun paragraphe n’a été soumis par le territoire.
Nunavut
Aucun paragraphe n’a été soumis par le territoire.