Recommandations pour la qualité de l’eau potable au Canada – Antimoine : Considérations relatives à la santé, calcul de la valeur
- Aperçu
- Considérations relatives à la exposition
- Considérations relatives à la santé, calcul de la valeur
- Considérations relatives à l’analyse et au traitement
- Stratégies de gestion, considérations internationales
- Justification de la concentration maximale acceptable
- Références, liste des abréviations
- Données sur la qualité des eaux au Canada
Sur cette page
- Cinétique
- Effets sur la santé
- Mode d'action
- Étude principale sélectionnée
- Calcul de la valeur basée sur la santé (VBS)
Cinétique
Absorption:
On a démontré l'existence d'une absorption gastro-intestinale (GI) de l'antimoine chez les humains et plusieurs espèces animales (Environnement Canada et Santé Canada, 2010; Borborema et coll., 2013). La littérature scientifique actuelle indique que l'absorption GI de l'antimoine est faible et dépend de la solubilité et de la forme chimique (état d'oxydation) (OMS, 2003; OEHHA 2016; ATSDR, 2019). L'absorption GI du trioxyde d'antimoine (TOA) relativement insoluble était d'environ 1 % chez l'humain (UE, 2008). D'après les données sur l'intoxication aiguë (empoisonnement) de quatre personnes exposées au tartrate d'antimoine et de potassium (TAP), une forme d'antimoine très soluble dans l'eau, l'absorption serait de 5 % (Iffland et Bösche 1987; Lauwers et coll., 1990). La Commission internationale de protection radiologique recommande l'utilisation d'un facteur d'absorption de 10 % pour l'absorption d'antimoine par voie alimentaire et, en raison de la variabilité des données d'absorption disponibles, une absorption de 5 % est recommandée pour les situations où des données précises ne sont pas disponibles (ICIRP, 1981, 1995, 2017). Les données sur l'absorption cutanée de l'antimoine sont limitées. La faible solubilité dans l'eau et les lipides de l'antimoine et de ses composés laisse croire que l'exposition cutanée n'est pas une voie d'exposition importante (OEHHA, 2016). Dans une étude de Roper et Stupart (2006), des échantillons de peau de l'abdomen (1 échantillon) et du sein (5 échantillons) de femmes ont été exposés in vitro à 100 μg/cm2 et 300 μg/cm2 de trioxyde de diantimoine, ce qui a entraîné des absorptions cutanées totales estimées à 0,26 % et 0,14 % respectivement, après une période d'exposition de 24 heures.
Distribution
Une fois absorbé, l'antimoine ingéré se distribue principalement dans le foie, la rate et les os et, dans une moindre mesure, dans la vésicule biliaire, les reins, les ongles, les ovaires, les testicules, la thyroïde et les cheveux (DFG, 2007; Tylenda et coll., 2015; Kip et coll., 2017; Sztajnkrycer, 2017). Des études menées chez l'humain (Gerhardsson et coll., 1982, 1988; Kip et coll., 2017), chez le singe rhésus (Friedrich et coll., 2012) et chez le rat (Poon et coll., 1998; Coelho et coll., 2014a) à l'aide de mercapto-succinate d'antimoine de sodium, d'antimoniate de méglumine et de TAP, respectivement, marqués par radioactivité (Sb124), indiquent que l'accumulation dépend de la dose. Une étude menée par Sunagawa (1981) sur des rats a révélé que l'exposition à l'antimoine métallique entraînait des concentrations d'antimoine similaires dans le foie et le sang, mais que l'exposition au trioxyde d'antimoine entraînait une concentration d'antimoine 10 fois plus élevée dans le sang que dans le foie. La distribution des différents états d'oxydation (par exemple, +3, +5) après une exposition orale à l'antimoine n'est pas connue (ECCC et Santé Canada, 2020). Dans le sang, l'antimoine pentavalent se trouve principalement dans le sérum (Felicetti et coll., 1974; Edel et coll., 1983; Ribeiro et coll., 2010) et l'antimoine trivalent est principalement présent dans la fraction hémoglobine des globules rouges (Lippincott et coll., 1947; Edel et coll., 1983; Newton et coll. 1994; Poon et coll. 1998; Kobayashi et Ogra, 2009). Cependant, il a été démontré que l'antimoine trivalent et pentavalent pénètre dans les globules rouges (Quiroz et coll. 2013; Lopez et coll. 2015; Barrera et coll. 2016). Des études in vitro ont montré que l'antimoine pentavalent peut pénétrer dans les érythrocytes par des canaux protéiques (Quiroz et coll. 2013; Barrera et coll. 2016).
Des transferts d'antimoine par le placenta et les glandes mammaires (lait maternel) ont été observés chez les humains et les animaux (Miranda et coll., 2006; Coelho et coll., 2014a; NTP, 2018; Li et coll., 2019).
Métabolisme
Les preuves in vitro du métabolisme de l'antimoine ingéré chez les mammifères montrent une interconversion intracellulaire entre les deux états de valence Sb(III) et Sb(V) (NTP, 2018). En cas d'ingestion d'antimoine, il se produit une réduction du Sb(V) en Sb(III) qui dépend de la dose et qui est favorisée par un pH acide et une température élevée (de 25 °C à 37 °C) (Frezard et coll., 2001; DFG, 2007; NTP, 2018). Cette réduction est suivie de la conjugaison du Sb(III) avec le glutathion (GSH) réduit, puis du recyclage entéro-hépatique du complexe Sb(III)-GSH (Bailly et coll., 1991; DFG, 2007).
Il n'existe aucune preuve convaincante de la méthylation de l'antimoine chez les mammifères, bien que des formes méthylées d'antimoine aient été constatées dans l'environnement (Filella et Williams, 2010; Herath et coll., 2017; Sztajnkrycer, 2017).
Élimination
L'antimoine ingéré est principalement excrété dans les selles et, dans une moindre mesure, dans l'urine (Environnement Canada et Santé Canada, 2010; Borborema et coll., 2013; OEHHA, 2016). Le Sb(V) est principalement excrété dans l'urine, tandis que le Sb(III) est excrété dans les selles (Friedrich et coll., 2012; Sztajnkrycer, 2017). Les études sur la pharmacocinétique humaine indiquent que la pharmacocinétique de l'antimoine dépend de l'âge; les jeunes enfants éliminent une plus grande quantité de produit chimique que les adultes (Cruz et coll., 2007). Chez les patients traités par l'antimoniate de méglumine (5 mg de Sb/kg p.c. par jour, par injection intramusculaire) pendant 30 jours, on a obtenu des demi-vies d'élimination allant de 24 à 72 heures pour la phase d'excrétion rapide et une demi-vie supérieure à 50 jours pour la phase d'élimination lente (Miekeley et coll., 2002).
Effets sur la santé
Les données sur la toxicité de l'antimoine et de ses composés ingérés ont été décrites ailleurs de manière plus détaillée (OEHHA, 2016; NTP, 2018; ATSDR, 2019). La présente évaluation se concentre sur les données d'exposition orale qui sont les plus pertinentes pour l'exposition à l'eau potable. Selon les données disponibles, l'exposition orale à l'antimoine peut induire des effets indésirables principalement sur le tractus GI (par exemple, douleurs abdominales, nausées, vomissements et diarrhée) et le foie. Des effets nocifs sur les reins, le système cardiovasculaire, le métabolisme (par exemple, diminution du taux de glucose sérique) et le développement ont également été observés (Lauwers et coll., 1990; Hepburn et coll., 1993; OMS, 2003; Alvarez et coll., 2005; OEHHA, 2016; Scinicariello et Buser, 2016; Sztajnkrycer, 2017; NTP, 2018; ATSDR, 2019).
Effets sur la santé humaine
Il y a peu de données sur les effets toxicologiques de l'antimoine chez l'humain. La majorité des données chez l'humain provenant de publications sont des effets indésirables observés lors d'utilisations thérapeutiques de médicaments à base d'antimoine (antimoniés). Les effets indésirables observés après l'administration de doses thérapeutiques comprennent des troubles du tractus GI, une cardiotoxicité, une pancréatite, une hépatotoxicité et une néphrotoxicité (Hepburn et coll., 1994; Oliveira et coll., 2009, 2011; Mlika et coll., 2012; Wise et coll., 2012). Bien que ces études fournissent un aperçu utile des effets potentiels à la suite d'une exposition à l'antimoine, la pertinence de ces effets après une exposition environnementale est incertaine en raison de la faible absorption des composés d'antimoine.
Hépatotoxicité
Chez les humains exposés à l'antimoine pour le traitement de la leishmaniose (une maladie parasitaire), des dommages hépatocellulaires et une altération du métabolisme hépatique ont été notés (OEHHA, 2016). Il a été montré que les patients traités pour une leishmaniose cutanée présentaient une altération des enzymes hépatiques touchant notamment l'alanine aminotransférase et la glutathion S-transférase B1, ce qui indique des lésions hépatiques potentielles et une altération du métabolisme hépatique (Hepburn et coll., 1993, 1994; Andersen et coll., 2005; Oliveira et coll., 2011). Dans le traitement de la leishmaniose viscérale, une altération de la fonction peroxysomale, une hépatite et une insuffisance hépatique ont été observées chez les patients (Gupta et coll., 2009; Oliveira et coll., 2009). Les patients traités pour une leishmaniose muqueuse ont également présenté une augmentation des enzymes hépatiques (Franke et coll., 1990; Saenz et coll., 1991).
Effets gastro-intestinaux
L'antimoine est connu depuis longtemps pour ses propriétés émétiques (ATSDR, 2019). Bien que rarement déclarés, certains cas d'empoisonnement sont survenus après l'ingestion accidentelle de boissons ou d'aliments contaminés par l'antimoine. Les effets les plus fréquemment déclarés à la suite d'un empoisonnement à l'antimoine ingéré comprennent des troubles gastro-intestinaux (par exemple, douleurs abdominales, nausées, vomissements et diarrhée). L'exposition à des concentrations entre 0,4 et 0,9 mg Sb/kg p.c. provoquerait des vomissements chez les adultes (Lauwers et coll., 1990; Santé Canada, 1997; Cooper et Harrison, 2009; Sundar et Chakravarty, 2010; Tylenda et coll., 2015; Sztajnkrycer, 2017; NTP, 2018).
Effets sur la reproduction et le développement
Des données provenant d'études rétrospectives et prospectives chez des femmes enceintes traitées pour une leishmaniose viscérale avec des doses thérapeutiques d'antimoine (c.-à-d. 20 mg/kg de stibogluconate de sodium, par voie intramusculaire, une fois par jour pendant 30 jours) semblent indiquer une association entre l'antimoine et la toxicité pour le développement (c.-à-d. des avortements spontanés) (Mueller et coll., 2006; Adam et coll., 2009). De plus, cet effet semble être propre au premier (Mueller et coll., 2006; Adam et coll., 2009; Forns et coll., 2014) et peut-être au deuxième trimestre de la grossesse (Mueller et coll., 2006). Comme il a été mentionné précédemment, étant donné la faible absorption des composés d'antimoine, la pertinence de tels effets à la suite d'une exposition environnementale est incertaine. Une étude récente a examiné les effets d'un mélange de métaux sur la taille du fœtus au milieu de la grossesse dans une cohorte essentiellement hispanique de Los Angeles (Howe et coll., 2021). Les auteurs ont trouvé une association entre l'antimoine urinaire (en tant que composant d'un mélange de métaux urinaires comprenant l'arsenic total, le baryum, le cadmium, le mercure, le molybdène, l'étain, le cobalt, le nickel et le thallium) et un poids fœtal réduit. L'analyse a permis de conclure que l'antimoine était un élément possiblement préoccupant en raison de son association inverse avec la taille du fœtus et qu'une étude plus approfondie de l'exposition à l'antimoine au sein de cette population est nécessaire.
Pour évaluer la relation entre les concentrations sanguines prénatales de métaux et le risque d'avortement spontané, Vigeh et coll. (2021) ont comparé les concentrations sanguines de certains métaux lourds dans des échantillons prélevés chez des mères apparemment en bonne santé, recrutées dans le cadre de l'étude TEND (Tehran Environment and Neurodevelopmental Defects), qui ont ensuite subi un avortement spontané, avec des mères dont la grossesse s'est terminée par une naissance vivante. Au début de la grossesse, 206 femmes ont été recrutées et suivies jusqu'à l'avortement du fœtus ou l'accouchement réussi. Les concentrations moyennes de plomb, d'antimoine et de nickel dans le sang étaient plus élevées chez les mères ayant subi un avortement spontané que chez les mères dont la grossesse s'est poursuivie. Toutefois, la différence n'était pas statistiquement significative. Après l'ajustement des covariables, une association significative entre l'âge maternel et le risque d'avortement spontané a été observée dans tous les modèles de régression. Seul l'antimoine présentait une relation positive notable avec le risque d'avortement spontané (rapport de cotes : 1,65; intervalle de confiance à 95 % : de 1,08 à 2,52; valeur de P : 0,02) par rapport aux autres métaux. Le coefficient de corrélation de Pearson a montré des corrélations positives significatives (P < 0,05) entre les concentrations prénatales de métaux dans le sang, sauf pour le nickel. Les auteurs ont conclu que, bien que l'étude n'ait pas fourni de preuves solides des effets induits par les métaux sur la fréquence d'un avortement spontané à des concentrations relativement faibles, ces métaux devraient être évités chez les femmes qui prévoient tomber enceintes ou pendant les premiers stades de la grossesse afin de prévenir le risque d'effets indésirables.
Autres effets
Des données sur le traitement par des antimoniés chez les humains et l'inhalation à long terme de poussières contenant de l'antimoine sur le lieu de travail indiquent que l'antimoine peut également induire une néphrotoxicité, une cardiotoxicité ainsi que des effets sur le système musculo-squelettique, le pancréas et le système nerveux (Hepburn et coll., 1993; Hepburn et coll., 1994; Santé Canada, 1997; OMS, 2003; OEHHA, 2016; ATSDR, 2019).
Effets sur la santé des animaux de laboratoire
L'antimoine présente une toxicité aiguë pour les animaux de laboratoire, comme l'indiquent les valeurs de la dose létale médiane (DL50) par voie orale dans la littérature, notamment 115 et 600 mg/kg p.c. pour le TAP chez les lapins/rats et les souris, respectivement (Omura et coll., 2002; OMS, 2003). Des valeurs de DL50 orale supérieures à 2 000 mg/kg p.c. ont été observées pour l'hexahydroxoantimonate de sodium (ECHA, 2014) et supérieures à 20 000 mg/kg p.c. pour le TOA (OMS, 2003).
Comme pour les humains, il existe peu de données sur les effets toxiques de l'antimoine après une exposition par voie orale chez les animaux de laboratoire, mais elles indiquent que l'exposition peut entraîner plusieurs effets nocifs pour la santé. Il a été montré que l'exposition orale aiguë au Sb(III) et au Sb(V) a des effets sur le tractus GI (NTP, 1992; Tylenda et coll., 2015). Il est reconnu que les expositions orales subchroniques et chroniques (principalement au TOA, au TAP et au trichlorure d'antimoine) ont des effets sur le foie, la thyroïde et les reins (Sunagawa, 1981; NTP, 1992; Poon et coll., 1998; Hext et coll., 1999; NTP, 2018), en plus d'induire possiblement des effets indésirables sur le développement (Imai et Nakamura, 2006; Chen et coll., 2010; ECHA, 2014, Khosravi et coll., 2018). Ces effets ont également été observés dans des études d'injection sur des animaux (Paumgartten et Chahoud, 2001; Omura et coll., 2002; Grimaldi et coll., 2010; Coelho et coll., 2014b; Kato et coll., 2014). Cependant, cette voie d'exposition n'étant pas applicable au contexte d'exposition à l'eau potable, ces études ne feront pas l'objet d'une discussion approfondie dans la présente évaluation des risques. Parmi les autres effets déclarés, mentionnons une modification de la glycémie (Schroeder et coll., 1970; Poon et coll., 1998) et des taux de lipides (Schroeder et coll., 1970; Poon et coll., 1998; Hext et coll., 1999) à la suite d'expositions subchroniques et chroniques de rats au Sb(III) (c.-à-d. TAP ou TOA) dans l'eau potable ou des aliments. Les résultats des études sur les antimoniés laissent croire aussi à un potentiel de cardiotoxicité et de néphrotoxicité de l'antimoine (NTP, 1992; Tirmenstein et coll., 1995; Poon et coll., 1998; Tylenda et coll., 2015) ainsi qu'à un potentiel œstrogénique (Choe et coll., 2003; Darbre, 2006). Le tableau 4 présente un résumé des études pertinentes sur la toxicité de l'antimoine chez les animaux.
| Espèce et nombre | Durée de l'exposition | Composé et doses (en mg Sb/kg p.c. par jour) | PD (mg Sb/kg p.c. par jour) | Effets critiques | Réf. |
|---|---|---|---|---|---|
| Souris B6C3F1 (10/sexe/dose) | 14 jours (ad libitum) | TAP dans l'eau potable : 0, 21, 36, 63, 99, 150 | NOAEL NOAEL= 99 | Lésions de l'estomac dans le groupe ayant reçu une forte dose. Augmentation du poids relatif du foie liée à la dose; lésions dans le foie chez la plupart des souris du groupe ayant reçu la forte dose. | NTP (1992) |
| Rats F344/N (10/sexe/dose) | 14 jours (ad libitum) | TAP dans l'eau potable : 0, 5,8, 10, 21, 34, 61 | NOAELNOAEL = 61 | Augmentation du poids relatif du foie dans le groupe ayant reçu une forte dose. | NTP (1992) |
| Rats Sprague-Dawley (15/sexe/dose) | 13 semaines (et 4 semaines de récupération pour les animaux ayant reçu une forte dose) | TAP dans l'eau potable : mâles : 0,06; 0,56; 5,58 et 42,17; femelles : 0,06; 0,64; 6,13 et 45,69 | NOAEL NOAEL= 0,06 | Augmentation liée à la dose de l'anisocaryose hépatique atteignant une gravité modérée dans le groupe ayant reçu une forte dose. Baisse du taux de glucose sérique en fonction de la dose chez les femelles, statistiquement significative dans les trois groupes ayant reçu les doses les plus élevées. Accumulation d'antimoine liée à la dose dans les globules rouges et la rate, avec une accumulation marquée commençant dans le groupe ayant reçu la deuxième plus faible dose et une persistance de l'antimoine dans la rate au-delà de la récupération. | Poon et coll. (1998) |
| Rats Wistar (souche Alpk:APSD; 12/sexe/dose) | 90 jours | TOA par le régime alimentaire : hommes : 0, 70, 353 et 1 408; femmes : 0, 81, 413 et 1 570 | NOAEL NOAEL= 1 408 | Petite augmentation du poids du foie, légère diminution de l'activité de la phosphatase alcaline plasmatique et faible augmentation des taux d'aspartate et d'alanine aminotransférase plasmatiques dans le groupe ayant reçu la dose élevée. Aucun effet histologique sur le foie. | Hext et coll. (1999) |
| Rats Wistar (mâles; 5/dose) | 24 semaines | TOA par le régime alimentaire : 0, 418 et 836 | LOEL = 418 | Modifications histopathologiques du foie et augmentation de l'activité de l'aspartate transaminase (AST). | Sunagawa (1981) |
| Rats SD (femelles; 20/dose) | JG 6 à 19 | Hexahydroxoantimonate de sodium par gavage : 0, 49, 148 et 493 | NOAEL NOAEL= 49 | Fréquence accrue (non significative) des retards de développement du squelette dans les groupes recevant des doses moyennes et élevées. La plupart des valeurs n'étaient que légèrement supérieures aux données historiques des témoins. Si l'on considère l'ensemble des malformations squelettiques, leur fréquence a été observée chez 99,3 % à 100 % des fœtus et 100 % des portées, y compris les témoins. Pas de toxicité pour la reproduction, d'embryotoxicité ni de fœtotoxicité. | ECHA (2014) |
| Rats Long-Evans (50–60/sexe/dose) | À vie | TAP : 0 et 0,43 dans l'eau potable; dose estimée par l'U.S. EPA (1992) | LOAEL = 0,43 | Taux de survie réduit chez les mâles et les femelles; aux espérances de vie médianes, la survie était réduite de 106 et 107 jours pour les mâles et les femelles, respectivement, par rapport aux témoins. Le taux de glucose sérique non à jeun a été réduit de 28 % à 30 % chez les animaux traités. | Schroeder et coll. (1970) |
JG – jour de gestation; LOEAL – dose minimale avec effet nocif observé; LOEL – dose minimale avec effet observé; NOAELNOAEL – dose sans effet nocif observé; PD – point de départ; SD – Sprague Dawley.; TAP – tartrate d'antimoine et de potassium; TOA – trioxyde d'antimoine
Génotoxicité et cancérogénicité
La génotoxicité et la cancérogénicité de l'antimoine et de ses composés ont été examinées précédemment (OMS, 2003; Porquet et Filella, 2007; NTP, 2018; ATSDR, 2019). Pour la génotoxicité, dans l'ensemble, les études in vivo sur le trioxyde d'antimoine ont été négatives pour la clastogénicité et les aberrations de la moelle osseuse, et les essais in vivo ont été négatifs pour les aberrations chromosomiques et la formation de micronoyaux. Des études sur l'exposition professionnelle ont aussi donné des résultats négatifs en ce qui a trait à la formation de micronoyaux et d'échange de chromatides sœurs. Les essais in vitro ont donné généralement des résultats négatifs pour la mutation de gènes. Toutefois, quelques réponses positives ont été observées avec le trichlorure et le pentachlorure d'antimoine (substance hautement soluble) lors d'essais sur la formation de micronoyaux et les aberrations chromosomiques. Globalement, la génotoxicité de ces substances faisant partie du groupe de substances contenant de l'antimoine est peu inquiétante (ECCC et Santé Canada, 2020).
Le CIRC a classé le trioxyde d'antimoine comme étant un cancérogène du groupe 2B (CIRC 1989, 2014) lorsqu'il est inhalé. La Commission européenne a classé le trioxyde d'antimoine comme étant un cancérogène de catégorie 2 (cancérogène présumé chez les humains) en vertu du règlement relatif à la classification, à l'étiquetage et à l'emballage (CLP) ([CE] nº 1272/2008) (UE, 2008a). Selon un rapport d'évaluation des risques de l'Union européenne, le trioxyde d'antimoine est classé comme étant un cancérogène de catégorie 3 (annexe 1, directive 67/548/EEC) compte tenu des rares preuves d'un effet cancérogène (UE, 2008). L'UE (2008) indique en outre qu'il n'existe aucune preuve de l'apparition de tumeurs après une exposition orale à l'antimoine. L'incidence du cancer n'a pas augmenté dans les études chroniques où des souris et des rats ont été exposés par voie orale au TAP (ATSDR, 2019).
Mode d'action
Le mode d'action de la toxicité induite par l'antimoine chez les mammifères n'a pas été totalement éclairci. Cependant, les données actuelles indiquent que l'hépatotoxicité liée au traitement fait probablement intervenir un stress oxydatif (NTP, 2018) qui est précédé par la réduction du Sb(V) (la forme la plus répandue dans l'eau potable) en sa forme Sb(III). Tant la réduction in vitro du Sb(V) en Sb(III) (qui dépend de la dose et qui est favorisée par un pH acide et une température élevée) que le rôle du Sb(III) dans l'hépatotoxicité ont été démontrés (Frezard et coll., 2001; DFG, 2007; Kato et coll., 2014). Le déséquilibre de l'homéostasie des thiols a également été montré par l'épuisement du glutathion intracellulaire et l'inhibition des systèmes enzymatiques contenant des thiols par le Sb(III) (par exemple, TAP) (Lauwers et coll., 1990; DFG, 2007; Kato et coll., 2014). Ces processus entraînent une production accrue de dérivés réactifs de l'oxygène (DRO), un stress oxydatif ainsi que l'induction de l'activité de la peroxydase et de l'apoptose (Lecureur et coll., 2002b; Kato et coll., 2014).
Hashemzaei et coll. (2015) ont observé que la lyse des hépatocytes isolés de rat induite par l'antimoine était médiée par la formation de DRO, la peroxydation lipidique et une baisse du potentiel de la membrane des mitochondries. Un stress oxydatif accru a également été observé dans le foie de souris et de rats traités avec des antimoniés Sb(V) (par exemple, l'antimoniate de méglumine) (Dzamitika et coll., 2006; Frezard et coll., 2009; Bento et coll., 2013). Le traitement à court terme des souris par l'antimoniate de méglumine a également induit un stress oxydatif, comme en témoigne l'augmentation de la peroxydation lipidique et de l'activité de la superoxyde dismutase dans le foie. On a aussi fait état d'un déséquilibre entre les activités de la superoxyde dismutase et de la catalase dans les tissus du cœur, du foie, de la rate et du cerveau (Bento et coll., 2013).
Enfin, la cytotoxicité du TAP, mise en évidence par l'apoptose induite par le TAP, a été observée dans diverses lignées cellulaires lymphoïdes, notamment les lignées cellulaires de leucémie myéloïde aiguë HL60. Il existe également un lien entre l'apoptose sous-jacente et l'augmentation de la production cellulaire de DRO, ainsi que la perte de potentiel dans la membrane mitochondriale (Lecureur et coll., 2002a, 2002b). Une augmentation des concentrations de DRO et des effets délétères sur les mitochondries par le TOA ont également été notés (NTP, 2018).
Wan et coll. (2021) ont étudié la néphrotoxicité induite par une exposition à l'arsenic ou à l'antimoine qui se manifeste par de l'autophagie et de la pyroptose in vivo et in vitro. In vivo, des souris ont reçu des doses de 4 mg/kg de trioxyde d'arsenic ou de 15 mg/kg de trichlorure d'antimoine par intubation intragastrique pendant 60 jours. In vitro, des cellules épithéliales tubulaires rénales (TCMK-1) ont été traitées au trioxyde d'arsenic (12,5 μM) ou au trichlorure d'antimoine (25 μM) pendant 24 heures. Les résultats in vivo ont montré que l'exposition à l'arsenic ou à l'antimoine pouvait induire des modifications histopathologiques dans les reins, comme l'indiquent les taux élevés de créatinine et d'isocyanure (qui servent d'indicateurs de néphrotoxicité). De plus, l'exposition à l'arsenic ou à l'antimoine a induit un stress oxydatif activant les processus d'autophagie et de pyroptose (deux types de mort cellulaire programmée) par l'augmentation ou la diminution de l'expression génique anti-autophagie ou anti-pyroptose. In vitro, l'arsenic ou l'antimoine ont augmenté la production de DRO et diminué le potentiel de la membrane mitochondriale dans les cellules TCMK.
Étude principale sélectionnée
Les effets nocifs de l'antimoine sur la santé ont été évalués dans plusieurs études subchroniques sur des rats et des souris. Les données disponibles sur l'humain ne permettent pas de calculer une valeur basée sur la santé (VBS) en raison des faiblesses de l'étude, notamment la voie d'administration de l'antimoine (c.-à-d. l'injection intraveineuse et intramusculaire) ainsi que l'exposition à des doses élevées par empoisonnements ou applications thérapeutiques de médicaments à base d'antimoine. Les données animales sont donc considérées comme étant les plus pertinentes pour l'évaluation des risques.
Pour le calcul d'une VBS pour l'eau potable, l'étude de Poon et coll. (1998) est choisie comme étude clé parce qu'elle a utilisé un nombre adéquat d'animaux, reposait sur l'administration d'antimoine par l'eau potable à des doses multiples, a évalué de nombreux effets sur la santé et a indiqué la NOAELNOAEL la plus basse dans la base de données sur la toxicité chez les animaux. Des rats Sprague-Dawley (15/sexe/dose) ont reçu 0, 0,5, 5, 50 et 500 ppm de TAP (0,06, 0,56, 5,58 et 42,17 mg Sb/kg p.c. par jour pour les mâles; 0,06, 0,64, 6,13 et 45,69 mg Sb/kg p.c. par jour pour les femelles) dans l'eau potable pendant 13 semaines. Dix animaux supplémentaires par sexe ont été inclus dans chacun des groupes de contrôle et de la dose la plus élevée, et ont reçu de l'eau du robinet pendant une autre période de récupération de quatre semaines.
Les auteurs n'ont observé aucune mortalité ni aucun signe clinique de toxicité, et plusieurs des changements histologiques notés dans les organes internes évalués ont été considérés comme étant adaptatifs. Les changements histologiques observés dans le foie étaient l'anisocaryose (c.-à-d. la variation de la taille et de la forme) et l'hyperchromicité (augmentation de la densité optique) des noyaux hépatiques, ainsi que l'augmentation de la densité splénique et l'homogénéité périveineuse du cytoplasme des hépatocytes. L'anisocaryose est apparue avec une fréquence et une gravité accrues, liées à la dose, chez les deux sexes, avec une persistance observée pendant la période de récupération chez les animaux ayant reçu la dose élevée, ce qui indique que ces effets ne sont pas facilement réversibles. Selon les auteurs, tous les animaux du groupe ayant reçu une forte dose présentaient une anisocaryose de gravité modérée et la plupart des animaux des groupes ayant reçu une faible dose présentaient une anisocaryose de gravité faible ou minimale. Une hyperchromicité a été constatée chez les mâles ayant reçu la forte dose, qui a également persisté pendant la période de récupération. Une augmentation de la densité des hépatocytes et de l'homogénéité périveineuse dans la rate a été observée chez tous les rats traités (qui a persisté jusqu'à la guérison), mais elle a été considérée comme étant adaptative et était moins importante chez les femelles. Les autres effets déclarés sont : de légères modifications histologiques de la thyroïde observées chez tous les animaux traités, progressant en gravité avec l'augmentation de la dose; une diminution du glucose sérique liée à la dose chez les femelles à partir de la deuxième dose la plus faible, la signification statistique étant atteinte dans le groupe de la dose la plus élevée; une diminution du nombre de globules rouges et de plaquettes avec une augmentation du volume corpusculaire moyen chez les mâles ayant reçu la dose la plus élevée; une accumulation d'antimoine dans les globules rouges liée à la dose, commençant dans le groupe d'animaux ayant reçu la deuxième dose la plus faible et une accumulation accrue d'antimoine dans la rate liée à la dose, commençant dans le groupe ayant reçu la dose la plus faible et persistant chez les animaux ayant reçu la dose la plus élevée jusqu'à la guérison. Poon et ses collaborateurs ont déterminé une NOAELNOAEL de 0,06 mg/kg p.c. par jour basée sur des changements histologiques dans le foie et la thyroïde, des changements biochimiques (à savoir une diminution de la concentration du glucose sérique chez les femelles), et l'accumulation d'antimoine dans les globules rouges et la rate.
Dans un examen de l'étude de Poon et coll. (1998) par Lynch et coll. (1999), Lynch et ses collaborateurs ont conclu que les effets histologiques observés dans le foie n'étaient pas nécessairement indicatifs d'une toxicité manifeste et ont donc proposé une autre NOAEL de 6 mg Sb/kg p.c. par jour. Poon et ses collaborateurs ont toutefois réagi dans une publication ultérieure en indiquant que si les modifications histologiques du foie étaient considérées comme étant adaptatives, ces effets devaient être pris en compte avec les modifications de la biochimie sérique, qui indiquent ensemble une modification de la fonction hépatique (Valli et coll., 2000). En conclusion, Poon et ses collaborateurs maintiennent que la NOAEL de 0,06 mg Sb/kg p.c. par jour est appropriée.
D'autres évaluations récentes de l'OEHHA (2016) et de l'ATSDR (2019) ont également utilisé les données de Poon et coll. (1998) pour formuler leur avis sanitaire sur l'antimoine. Lors de l'élaboration de l'objectif de santé publique pour l'antimoine dans l'eau potable, l'OEHHA (2016) a indiqué que l'anisocaryose hépatique chez les mâles était le principal paramètre de santé pour l'évaluation des risques et a calculé un point de départ (PD) de 0,14 mg Sb/kg p.c. par jour (10 % de dose repère [BMD10]) sur lequel repose l'objectif de santé. Selon l'OEHHA, le choix du critère d'évaluation clé pour la santé est étayé par des preuves de lésions hépatiques chez les humains exposés à l'antimoine pour le traitement de la leishmaniose et chez les animaux dans des études à doses répétées, et par le fait que l'anisocaryose hépatique a été documentée comme étant une réponse toxique après l'exposition à d'autres composés xénobiotiques tels que l'hydroquinone et le toxaphène. L'ATSDR (2019), en développant son niveau de risque minimal intermédiaire pour l'antimoine, a également utilisé la NOAEL de 0,06 mg/kg p.c. par jour comme établi par Poon et coll. (1998), mais en se basant sur les changements dans les taux de glucose sérique que l'ATSDR a établi comme l'un des paramètres de santé les plus sensibles dans la base de données de toxicité chez les animaux.
Dans le cadre du Plan de gestion des produits chimiques, les risques pour la santé humaine et l'environnement posés par un groupe de onze substances contenant de l'antimoine ont été évalués précédemment (ECCC et Santé Canada, 2020). En utilisant l'approche de l'évaluation préalable, un PD de 49 mg Sb/kg p.c. par jour pour les effets sur le squelette fœtal établi par l'ECHA (2014) a été utilisé pour caractériser les risques associés à l'exposition aux substances contenant de l'antimoine présent dans les milieux naturels, les aliments, l'eau potable et les produits de consommation. Dans le cadre de l'étude de l'ECHA (2014), on a administré une forme moins soluble d'antimoine (hexahydroxyantimonate de sodium) par gavage, ce qui a donné un PD plus élevé que celui indiqué par Poon et coll. (1988), qui ont administré du TAP dans de l'eau potable. ECCC et Santé Canada (2020) n'ont pas pris en compte les études administrant du TAP ou du trichlorure d'antimoine pour caractériser les risques, car on a jugé que l'exposition à ces formes d'antimoine dans les milieux naturels, les aliments, l'eau potable et les produits de consommation n'était pas prévue.
Pour le calcul d'une VBS pour l'antimoine dans l'eau potable, le PD de 0,06 mg Sb/kg p.c. par jour de Poon et coll. (1998) associé à des changements dans l'histologie du foie (anisocaryose) ainsi que des changements dans la biochimie sérique (qui, ensemble, sont indicatifs d'un changement dans la fonction du foie) a été choisi. Le choix des effets sur le foie comme effet principale sur la santé s'appuie sur les preuves de lésions hépatiques chez les humains exposés à l'antimoine pendant le traitement de la leishmaniose, ainsi que dans les études à doses répétées chez les animaux. Étant donné que la forme d'antimoine (TAP) utilisée dans l'étude de Poon et coll. (1998) est plus soluble que les autres formes d'antimoine qui peuvent être présentes dans l'eau potable, la VBS devrait protéger contre toutes les formes d'antimoine présentes dans l'eau potable.
Calcul de la valeur basée sur la santé (VBS)
Une LOEL de 0,06 mg Sb/kg p.c. par jour basée sur des changements histopathologiques (anisocaryose) dans le foie et des changements dans la biochimie sérique qui sont indicatifs d'effets sur le foie, d'après Poon et coll. (1998), est choisie comme PD pour calculer la VBS pour l'antimoine dans l'eau potable.
En utilisant la LOEL de 0,06 mg Sb/kg p.c. par jour, un apport quotidien acceptable (AQA) pour l'antimoine total est calculé comme suit :
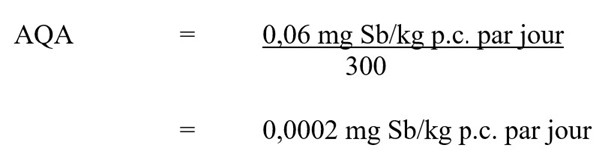
Figure 1 - Équivalent textuel
L'apport quotidien acceptable (AQA) pour l'antimoine total est 0,0002 mg Sb/kg de poids corporel par jour. Cet AQA est obtenu en divisant la LOEL de 0,06 mg Sb/kg de poids corporel par jour par le facteur d'incertitude de 300.
où :
- 0,06 mg Sb/kg p.c. par jour est la LOEL établie à partir de Poon et coll. (1998), en fonction des changements histopathologiques (anisocaryose) dans le foie et de changements dans la biochimie sérique indiquant des effets sur le foie;
- 300 est le facteur d'incertitude, qui tient compte de la variation interspécifique (×10), de la variation intraspécifique (×10) et de l'utilisation d'une étude subchronique (×3).
À partir de cette AQA, on peut calculer la VBS pour l'antimoine dans l'eau potable :
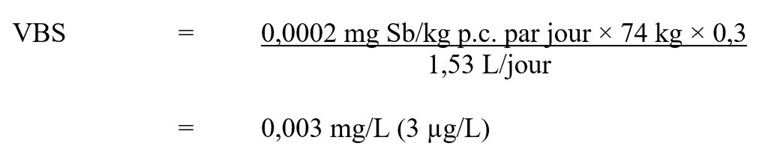
Figure 2 - Équivalent textuel
La valeur basée sur la santé (VBS) pour l'antimoine dans l'eau potable est de 0,003 mg/L. Cette valeur est calculée en multipliant l'AQA de 0,0002 mg Sb/kg de poids corporel par jour par le poids corporel moyen d'un adulte de 74 kg par le facteur d'attribution pour l'eau potable de 0,3. Le résultat est divisé par 1,53 L/jour, soit le volume d'eau potable moyen ingéré quotidiennement par un adulte.
où :
- 0,0002 mg Sb/kg p.c. par jour est la AQA calculée précédemment;
- 74 kg est le poids corporel moyen d'un adulte (Santé Canada, en préparation);
- 0,3 est le facteur d'attribution pour l'eau potable basé sur la limite supérieure de l'apport estimé par l'eau potable (voir la section sur l’exposition);
- 1,53 L par jour est le volume quotidien d'eau consommé par un adulte canadien (Santé Canada, en préparation). En raison de la faible volatilité et de la faible absorption cutanée de l'antimoine (OEHHA, 2016), il est peu probable que l'exposition à ce métal lors de la douche ou du bain soit importante. Par conséquent, une évaluation de l'exposition par plusieurs voies, telle que décrite par Krishnan et Carrier (2008), n'a pas été réalisée.