Impuretés décelées dans certains antagonistes des récepteurs de l’angiotensine II (ARA), aussi appelés sartans
Table des matières
Aperçu
Au cours de l'été 2018, plusieurs produits contenant du valsartan ont fait l'objet d'un rappel au Canada et à l'étranger en raison de la présence d'une impureté, soit la N-nitrosodiméthylamine (NDMA), dans l'ingrédient actif fabriqué par Zhejiang Huahai Pharmaceuticals en Chine.
Depuis, la présence de NDMA et d'autres impuretés similaires, soit la N-nitrosodiethylamine (NDEA), N-Nitrosodiisopropylamine (NDiPA), N-Nitrosométhyl-n-butylamine (NMBA) ont été détectées dans le valsartan ou dans d'autres médicaments de la même classe que le valsartan (désignés comme des antagonistes des récepteurs de l'angiotensine II, ou ARA) fabriqués par différents fabricants dans divers pays et qui ont amené d'autres rappels au Canada et à l'étranger.
Les ARA sont utilisés dans le traitement des patients atteints d'hypertension afin de prévenir les crises cardiaques et les accidents vasculaires cérébraux. La NDEA et la NDMA, NDiPA et NMBA sont des nitrosamines qui sont classées comme des agents potentiellement cancérogènes pour les humains, ce qui signifie qu'une exposition à long terme à ces substances pourrait augmenter le risque de cancer. Puisque le risque de cancer découle d'une exposition à long terme, aucun risque immédiat pour la santé n'est associé à l'utilisation d'ARA contenant ces impuretés.
Santé Canada est conscient que cette situation inquiète des Canadiennes et Canadiens qui comptent sur ces médicaments pour conserver leur santé. De ce fait, le ministère travaille en étroite collaboration avec les entreprises et les partenaires réglementaires étrangers pour déterminer la cause fondamentale du problème et assurer la mise en place de mesures appropriées pour empêcher que la situation ne se reproduise dans le futur.
Ainsi, voici quelques exemples des diverses mesures prises par Santé Canada pour diminuer les conséquences possibles pour les Canadiennes et les Canadiens et de tenir les manufacturiers responsables de l'innocuité et de l'efficacité de leurs produits vendus au Canada.
- Exiger le retrait des médicaments concernés, puis confirmer et surveiller l'efficacité des démarches de retrait. Plus bas se trouve la liste des produits concernés. Celle-ci sera mise à jour selon le besoin.
- Informer le public à plusieurs reprises concernant les retraits, l'évaluation des risques par rapport à la NDMA et les mesures prises par le ministère quant à la situation.
- Communiquer avec tous les détenteurs d'autorisations de mise en marché des ARA concernés et évaluer les processus de fabrication qu'ils utilisent pour les produits qui sont vendus au Canada.
- Établir la non-conformité aux exigences des bonnes pratiques de fabrication du site de Zhejiang Huahai Pharmaceuticals à Chuannan et Hetero Laboratories Limited, Unit 1. Selon ce qui précède, aucun produit ne peut être importé depuis ces sites, sauf les produits considérés comme médicalement nécessaires.
- Analyser des échantillons d'ARA actuellement offerts sur le marché canadien. Les résultats des analyses se trouvent plus bas. Ces informations seront mises à jour dès qu'il y aura de nouveaux résultats.
- Demander aux détenteurs d'autorisations de mise en marché des ARA concernés d'analyser tous leurs produits actuellement en vente ou prévus pour une future mise envente pour vérifier la présence possible de NDEA ou de NDMA.Il a aussi été suggéré aux compagnies d'utiliser des pratiques de fabrication qui pourrait éviter la création et présence d'impuretés de nitrosamines. Cette mesure préventive supplémentaire vise à mieux garantir l'innocuité des ARA vendus au Canada.
Santé Canada continue de travailler en étroite collaboration avec des organismes de réglementation internationaux, y compris la Food and Drug Administration des États-Unis et l'Agence européenne des médicaments, qui sont ses partenaires pour échanger de l'information et coordonner les efforts en matière d'inspection, d'évaluation des risques et de communications publiques. De plus, le ministère poursuivra son travail en informant le public et en prenant les mesures nécessaires si des médicaments actuellement en vente au Canada sont reconnus comme dangereux pour la santé.
Retraits
Santé Canada publie la liste complète des antagonistes des récepteurs de l'angiotensine II (ARA) qui font l'objet d'un retrait au Canada en raison de la présence ou de la possibilité d'impuretés de nitrosamines. Cette liste sera mise à jour si de nouveaux produits feront l'objet de retrait. Les produits qui ne figurent pas sur cette liste n'ont pas fait l'objet d'un retrait au Canada pour ce problème. Il convient de noter que les retraits effectués dans d'autres pays pourraient ne pas toucher les produits canadiens.
Si vous prenez un médicament faisant l'objet d'un retrait, vous devez :
- continuer de prendre votre médicament sauf si votre fournisseur de soins de santé vous a indiqué que vous devez cesser de le prendre;
- communiquer avec votre fournisseur de soins de santé pour discuter des options de traitement;
- consulter votre pharmacien si vous n'êtes pas certain que vous prenez un produit ayant fait l'objet d'un retrait;
- communiquer avec votre fournisseur de soins de santé si vous avez des préoccupations au sujet de votre santé.
| Nom du produit ou ingrédient pharmaceutique actif (IPA) | DIN | Concentration | No de lot | Date de rappelé | Fabricant d'IPA |
|---|---|---|---|---|---|
| AURO-IRBESARTAN/HCT | 02447878 | 150/12.5 mg | IN1518001-A | 17 avril 2019 | Aurobindo Pharma Limited, Unit-I |
| PRO DOC LIMITEE - IRBESARTAN | 02365200 | 150 mg | 604292 | 11 mars 2019 | TEVA API India Ltd. |
| PRO DOC LIMITEE - IRBESARTAN | 02365219 | 300 mg | 601795 | 11 mars 2019 | TEVA API India Ltd. |
| APO-LOSARTAN | 02379058 | 25 mg | NL1453 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN | 02379058 | 25 mg | NL1452 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN | 02353504 | 50 mg | NK1254 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN | 02353504 | 50 mg | NK1253 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN | 02353512 | 100 mg | NL1461 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN | 02353512 | 100 mg | NG2092 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN | 02353512 | 100 mg | NH5932 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN | 02353512 | 100 mg | NH5933 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN | 02353512 | 100 mg | NL1460 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN | 02353512 | 100 mg | NH5934 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN/HCTZ | 02371235 | 50/12.5 mg | NL1441 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN/HCTZ | 02371235 | 50/12.5 mg | NZ8848 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN/HCTZ | 02371235 | 50/12.5 mg | NL1445 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN/HCTZ | 02371235 | 50/12.5 mg | NZ8849 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN/HCTZ | 02371235 | 50/12.5 mg | NZ8860 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN/HCTZ | 02371243 | 100/12.5 mg | NG2087 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN/HCTZ | 02371243 | 100/12.5 mg | NL1421 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN/HCTZ | 02371243 | 100/12.5 mg | NG2086 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN/HCTZ | 02371243 | 100/12.5 mg | NL1422 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN/HCTZ | 02371251 | 100/25 mg | NL1429 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN/HCTZ | 02371251 | 100/25 mg | NZ8846 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN/HCTZ | 02371251 | 100/25 mg | NZ8847 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| APO-LOSARTAN/HCTZ | 02371251 | 100/25 mg | NZ8845 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309750 | 25 mg | 498294 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309750 | 25 mg | 605342 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309750 | 25 mg | 611944 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309769 | 50 mg | 498285 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309769 | 50 mg | 600047 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309769 | 50 mg | 600091 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309769 | 50 mg | 603894 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309769 | 50 mg | 612025 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309769 | 50 mg | 612031 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309769 | 50 mg | 612679 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309769 | 50 mg | 616743 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309777 | 100 mg | 498864 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309777 | 100 mg | 602668 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309777 | 100 mg | 603816 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309777 | 100 mg | 605298 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309777 | 100 mg | 605300 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309777 | 100 mg | 613935 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| PMS-LOSARTAN | 02309777 | 100 mg | 613936 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| LOSARTAN (PRO DOC LIMITEE) | 02394367 | 25 mg | 498292 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| LOSARTAN (PRO DOC LIMITEE) | 02394367 | 25 mg | 605344 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| LOSARTAN (PRO DOC LIMITEE) | 02394375 | 50 mg | 498779 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| LOSARTAN (PRO DOC LIMITEE) | 02394375 | 50 mg | 600046 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| LOSARTAN (PRO DOC LIMITEE) | 02394375 | 50 mg | 603903 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| LOSARTAN (PRO DOC LIMITEE) | 02394375 | 50 mg | 498284 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| LOSARTAN (PRO DOC LIMITEE) | 02394375 | 50 mg | 603895 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| LOSARTAN (PRO DOC LIMITEE) | 02394383 | 100 mg | 499008 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| LOSARTAN (PRO DOC LIMITEE) | 02394383 | 100 mg | 605299 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| LOSARTAN (PRO DOC LIMITEE) | 02394383 | 100 mg | 605297 | 8 mars 2019 | Hereto Laboratories Limited Unit 1 |
| TEVA-LOSARTAN/HCTZ | 02358263 | 50/12.5 mg | 35344801A | 6 mars 2019 | Hereto Laboratories Limited Unit 1 |
| TEVA-LOSARTAN/HCTZ | 02358263 | 50/12.5 mg | 35349397A | 6 mars 2019 | Hereto Laboratories Limited Unit 1 |
| MYLAN-VALSARTAN | 02383527 | 40 mg | Tous les lots | 28 novembre 2018 | Mylan Laboratories Limited |
| MYLAN-VALSARTAN | 02383535 | 80 mg | Tous les lots | 28 novembre 2018 | Mylan Laboratories Limited |
| MYLAN-VALSARTAN | 02383543 | 160 mg | Tous les lots | 28 novembre 2018 | Mylan Laboratories Limited |
| MYLAN-VALSARTAN | 02383551 | 320 mg | Tous les lots | 28 novembre 2018 | Mylan Laboratories Limited |
| COMPRIMÉS TEVA-VALSARTAN/HCTZ | 02356996 | 80/12,5 mg | 35211136A | 17 août 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS TEVA-VALSARTAN/HCTZ | 02357003 | 160/12,5 mg | 35211335A | 17 août 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS TEVA-VALSARTAN/HCTZ | 02357003 | 160/12,5 mg | 35211844R | 17 août 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS TEVA-VALSARTAN/HCTZ | 02357011 | 160/25 mg | 35210937R | 17 août 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS TEVA-VALSARTAN/HCTZ | 02357011 | 160/25 mg | 35210938R | 17 août 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS TEVA-VALSARTAN/HCTZ | 02357011 | 160/25 mg | 35210939R | 17 août 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS TEVA-VALSARTAN/HCTZ | 02357011 | 160/25 mg | 35210940R | 17 août 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS TEVA-VALSARTAN/HCTZ | 02357038 | 320/12,5 mg | 35211546R | 17 août 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS TEVA-VALSARTAN/HCTZ PP 30s | 02357046 | 320/25 mg | 35212731R | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS ACT-VALSARTAN 40MG FC | 02337487 | 40 mg | K47338 | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS ACT-VALSARTAN 80MG FC | 02337495 | 80 mg | K45370 | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS ACT-VALSARTAN 80MG FC | 02337495 | 80 mg | K47652 | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS ACT-VALSARTAN 80MG FC | 02337495 | 80 mg | K47653 | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS ACT-VALSARTAN 80MG FC | 02337495 | 80mg | K47654 | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS ACT-VALSARTAN 160MG FC | 02337509 | 160 mg | K39691 | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS ACT-VALSARTAN 160MG FC | 02337509 | 160 mg | K44167 | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS ACT-VALSARTAN 160MG FC | 02337509 | 160 mg | K47657 | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS ACT-VALSARTAN 160MG FC | 02337509 | 160 mg | K47658 | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS ACT-VALSARTAN 320MG FC | 02337517 | 320 mg | K44166 | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| COMPRIMÉS ACT-VALSARTAN 320MG FC | 02337517 | 320 mg | K45371 | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| SANDOZ VALSARTAN 40 MG | 02356740 | 40 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| SANDOZ VALSARTAN 80 MG | 02356759 | 80 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| SANDOZ VALSARTAN 160 MG | 02356767 | 160 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| SANDOZ VALSARTAN 320 MG | 02356775 | 320 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| VALSARTAN de SANIS 40 MG | 02366940 | 40 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| VALSARTAN de SANIS 80 MG | 02366959 | 80 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| VALSARTAN de SANIS 160 MG | 02366967 | 160 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| VALSARTAN de SANIS 320 MG | 02366975 | 320 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| VALSARTAN de PRO DOC LIMITÉE de 40 MG | 02367726 | 40 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| VALSARTAN de PRO DOC LIMITÉE de 80 MG | 02367734 | 80 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| VALSARTAN de PRO DOC LIMITÉE de 160 MG | 02367742 | 160 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| VALSARTAN de PRO DOC LIMITÉE de 320 MG | 02367750 | 320 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| VALSARTAN de SIVEM PRODUITS PHARMACEUTIQUES ULC de 40 MG | 02384523 | 40 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| VALSARTAN de SIVEM PRODUITS PHARMACEUTIQUES ULC de 80 MG | 02384531 | 80 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| VALSARTAN de SIVEM PRODUITS PHARMACEUTIQUES ULC de 160 MG | 02384558 | 160 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
| VALSARTAN de SIVEM PRODUITS PHARMACEUTIQUES ULC de 320 MG | 02384566 | 320 mg | Tous les lots | 9 juillet 2018 | Zhejiang Huahai Pharmaceuticals |
Résultats des analyses
Santé Canada a analysé des échantillons d'ARA offerts sur le marché canadien pour vérifier la présence de NDMA ou de NDEA. Les résultats sont présentés ci-dessous. Santé Canada continuera d'évaluer les nouveaux développements afin de déterminer si des analyses additionnelles sont nécessaires.
Les résultats montrent le taux d'impuretés de NDMA et de NDEA décelé dans les produits, si oui ou non ce taux correspond aux limites acceptables pour une exposition à vie, et si le produit a été assujetti à un rappel.
| Nom de la compagnie détenteur de l'autorisation de mise en marché | Nom du produit | DIN | Force (mg) |
Numéro du lot | Fabricant de l'ingrédient pharmaceutique active | Date d'expiration | Résultats de NDMA ng / comprimé |
Résultats de NDEA ng / comprimé |
Limite de NDMA (96 ng/jour) dépassé?Note de bas de page * |
Limite de NDEA (26.5 ng/jour) dépassé?Note de bas de page * |
Rappelé au Canada | Date Ajoutée |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Accel Pharma Inc. | ACCEL-CANDESARTAN | 02463784 | 32 | 1805003937 | Alembic Pharmaceuticals Limited (API Division - II) | 2020-02-29 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| Actavis Pharma Company | ACT VALSARTAN | 02337517 | 320 | K44166 | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2018-07-31 | 15242.72 | 12.78 | Oui | Non | Oui | 20 decembre 2018 |
| ACT VALSARTAN | 02337517 | 320 | K45371 | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2018-10-31 | 10770.86 | 186.67 | Oui | Oui | Oui | 20 decembre 2018 | |
| ACT- OLMESARTAN | 02442205 | 40 | F83746 | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2020-03-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| Angita Pharma Inc. | AG-IRBESARTAN | 02474417 | 300 | IE317017AR | Jubilant Generics Limited | 2019-10-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| Apotex Inc. | APO-OLMESARTAN/HCTZ | 02453614 | 40/12.5 | NF7704 | Apotex Pharmachem India Pvt. Ltd. | 2019-02-28 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| APO-OLMESARTAN/HCTZ | 02453614 | 40/12.5 | NN7635 | Signa S.A. de C.V. | 2019-12-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| APO-LOSARTAN/HCTZ | 02371235 | 50/12.5 | NL1445 | Hetero Labs Limited | 2019-08-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| APO-LOSARTAN | 02353512 | 100 | NL1461 | Hetero Labs Limited | 2019-08-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| Astrazeneca Inc. | ATACAND - CANDESARTAN | 02311658 | 32 | KL0275 | Takeda Pharmaceutical Company Limited | 2021-04-30 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| Auro Pharma Inc. | AURO-CANDESARTAN HCT | 02421046 | 32/12.5 | WKSA18004-A | Aurobindo Pharma Limited & Chromo Laboratories Limited | 2020-07-29 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| AURO-IRBESARTAN | 02406098 | 75 | IA7517001-A | Aurobindo Pharma Limited- Unit 1 | 2020-06-30 | non- détecté | 4.7 | Non | Non | Non | 29 avril 2019 | |
| AURO-IRBESARTAN | 02406098 | 75 | IA7517002-A | Aurobindo Pharma Limited- Unit 1 | 2020-11-05 | non- détecté | 4.44 | Non | Non | Non | 29 avril 2019 | |
| AURO-IRBESARTAN | 02406098 | 75 | IA7517003-A | Aurobindo Pharma Limited- Unit 1 | 2020-11-05 | non- détecté | 4.61 | Non | Non | Non | 29 avril 2019 | |
| AURO-IRBESARTAN | 02406101 | 150 | IA1517002-A | Aurobindo Pharma Limited- Unit 1 | 2020-10-31 | non- détecté | 9.77 | Non | Non | Non | 29 avril 2019 | |
| AURO-IRBESARTAN | 02406101 | 150 | IA1517001-A | Aurobindo Pharma Limited- Unit 1 | 2020-06-30 | non- détecté | 13.63 | Non | Oui2 | Non2 | 29 avril 2019 | |
| AURO-IRBESARTAN | 02406101 | 150 | IA1517003-A | Aurobindo Pharma Limited- Unit 1 | 2020-10-31 | non-détecté | 8.97 | Non | Non | Non | 29 avril 2019 | |
| AURO-IRBESARTAN | 02406128 | 300 | IA3017001-A | Aurobindo Pharma Limited- Unit 1 | 2020-06-30 | non-détecté | 27.81 | Non | Oui2 | Non2 | 29 avril 2019 | |
| AURO-IRBESARTAN | 02406128 | 300 | IA3017003-A | Aurobindo Pharma Limited- Unit 1 | 2020-10-31 | non-détecté | 17.47 | Non | Non | Non | 29 avril 2019 | |
| AURO-IRBESARTAN | 02406128 | 300 | IA3017002-A | Aurobindo Pharma Limited- Unit 1 | 2020-10-31 | non-détecté | 19.6 | Non | Non | Non | 29 avril 2019 | |
| AURO-IRBESARTAN HCT | 02447894 | 300/25 | IN3018001-A | Aurobindo Pharma Limited- Unit 1 | 2020-04-06 | non-détecté | 26.78 | Non | Oui2 | Non2 | 29 avril 2019 | |
| AURO-IRBESARTAN HCT | 02447886 | 300/12.5 | IR3018001-A | Aurobindo Pharma Limited- Unit 1 | 2020-04-06 | non-détecté | 30.29 | Non | Non | le lot n'a jamais été distribué | 29 avril 2019 | |
| AURO-IRBESARTAN HCT | 02447878 | 150/12.5 | IN1518001-A | Aurobindo Pharma Limited- Unit 1 | 2020-04-06 | non-détecté | 15.82 | Non | Oui | Oui | 29 avril 2019 | |
| AURO-OLMESARTAN | 02443872 | 40 | WOSB18004-A | Aurobindo Pharma Unit-I | 2020-01-12 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| AURO-LOSARTAN | 02403358 | 100 | WB1018003-A | Aurobindo Pharma Unit-I | 2021-03-15 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| AURO-VALSARTAN | 02414201 | 40 | VWSA17003-A | Aurobindo Pharma Limited, Unit-XI | 2019-10-31 | non- détecté | 1.41 | Non | Non | Non | 16 janvier 2019 | |
| AURO-VALSARTAN | 02414201 | 40 | VWSA18007-A | Aurobindo Pharma Limited, Unit-XI | 2020-08-24 | non- détecté | 1.07 | Non | Non | Non | 16 janvier 2019 | |
| AURO-VALSARTAN | 02414201 | 40 | VWSA18003-A | Aurobindo Pharma Limited, Unit-XI | 2020-08-23 | non- détecté | 1.04 | Non | Non | Non | 16 janvier 2019 | |
| AURO-VALSARTAN | 02414228 | 80 | VWSB17010-A | Aurobindo Pharma Limited, Unit-XI | 2019-07-31 | non- détecté | non- détecté | Non | Non | Non | 16 janvier 2019 | |
| AURO-VALSARTAN | 02414228 | 80 | VWSB17011-A | Aurobindo Pharma Limited, Unit-XI | 2019-07-31 | non- détecté | non- détecté | Non | Non | Non | 16 janvier 2019 | |
| AURO-VALSARTAN | 02414236 | 160 | VWSC17001-A | Aurobindo Pharma Limited, Unit-XI | 2018-12-31 | non- détecté | < 3.20 | Non | Non | Non | 16 janvier 2019 | |
| AURO-VALSARTAN | 02414236 | 160 | VWSC17005-A | Aurobindo Pharma Limited, Unit-XI | 2019-05-31 | non- détecté | < 3.20 | Non | Non | Non | 16 janvier 2019 | |
| AURO-VALSARTAN | 02414236 | 160 | VWSC18002-A | Aurobindo Pharma Limited, Unit-XI | 2020-01-19 | non- détecté | 4.58 | Non | Non | Non | 16 janvier 2019 | |
| AURO-VALSARTAN | 02414236 | 160 | VWSC18001-A | Aurobindo Pharma Limited, Unit-XI | 2020-01-19 | < 6.40 | 4.39 | Non | Non | Non | 16 janvier 2019 | |
| AURO-VALSARTAN | 02414236 | 160 | VWSC18016-A | Aurobindo Pharma Limited, Unit-XI | 2020-08-24 | non- détecté | 4.7 | Non | Non | Non | 16 janvier 2019 | |
| AURO-VALSARTAN | 02414244 | 320 | VWSD17001-B | Aurobindo Pharma Limited, Unit-XI | 2019-05-31 | non- détecté | non- détecté | Non | Non | Non | 16 janvier 2019 | |
| AURO-VALSARTAN | 02414244 | 320 | VWSD18005-A | Aurobindo Pharma Limited, Unit-XI | 2020-08-25 | non- détecté | 12.14 | Non | Non | Non | 16 janvier 2019 | |
| AURO-VALSARTAN | 02414244 | 320 | VWSD18001-A | Aurobindo Pharma Limited, Unit-XI | 2020-04-15 | non- détecté | 8.56 | Non | Non | Non | 16 janvier 2019 | |
| AURO-VALSARTAN | 02414244 | 320 | VWSD18001-A | Aurobindo Pharma Limited | 2020-04-15 | non- détecté | 8.61 | Non | Non | Non | 20 decembre 2018 | |
| AURO-VALSARTAN HCT | 02408112 | 80/12.5 | HHSA18001-A | Aurobindo Pharma Limited, Unit-XI | 2021-08-02 | non- détecté | 1.88 | Non | Non | Non | 16 janvier 16 2019 | |
| Jamp Pharma Corp | JAMP-OLMESARTAN | 02461668 | 40 | MC218002A | Glenmark Pharmaceuticals Limited | 2020-04-30 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| JAMP-LOSARTAN-HCTZ | 02408252 | 100/25 | LY218001A | Jubilant Generics Limited | 2019-06-30 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| JAMP-IRBESARTAN | 02418215 | 300 | IE318005A | Jubilant Generics Limited | 2020-03-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| Merck Canada Inc. | OLMETEC - OLMESARTAN | 02318679 | 40 | N021852 | Daiichi Sankyo Chemical Pharma Co., Ltd. Hiratsuka Plant | 2020-04-30 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| Mint Pharmaceuticals Inc. | MINT-LOSARTAN/HCTZ DS | 02389673 | 100/25 | 1805009844 | Alembic Pharmaceuticals Limited (API Division - II) | 2021-07-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| Mylan Pharmaceuticals ULC | MYLAN-VALSARTAN | 02383527 | 40 | 3048813 | Mylan Laboratories Limited, Unit 8, in Hyderabad, India | 2017-11-30 | < 1.60 | 8.32 | Non | Oui | Oui | 16 janvier 2019 |
| MYLAN-VALSARTAN | 02383535 | 80 | 3056368 | Mylan Laboratories Limited, Unit 8, in Hyderabad, India | 2019-06-30 | < 3.20 | 22.43 | Non | Oui | Oui | 16 janvier 2019 | |
| MYLAN-VALSARTAN | 02383543 | 160 | 3056371 | Mylan Laboratories Limited, Unit 8, in Hyderabad, India | 2019-06-30 | non- détecté | 62.76 | Non | Oui | Oui | 16 janvier 2019 | |
| MYLAN-VALSARTAN | 02383551 | 320 | 3048815 | Mylan Laboratories Limited, Unit 8, in Hyderabad, India | 2017-11-30 | non- détecté | 132.77 | Non | Oui | Oui | 16 janvier 2019 | |
| Novartis Pharmaceuticals Canada Inc. | DIOVAN | 02289504 | 320 | BEK32 | Novartis Pharma Schweizerhalle | 2021-07-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| Pharmascience Inc. | PMS-CANDESARTAN HCTZ | 02391295 | 16 | 615170 | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2020-04-30 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| PMS-LOSARTAN | 02309777 | 100 | 613936 | Hetero Labs Limited | 2021-03-31 | non- détecté | 10.41 | Non | Non | Non | 20 decembre 2018 | |
| PMS-LOSARTAN-HCTZ | 02392232 | 100/12.5 | 0803847 | Dr. Reddy's Laboratories Limited | 2020-06-30 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| PMS-IRBESARTAN | 02317087 | 300 | 615908 | Zhejiang Tianyu Pharmaceutical Co., Ltd. | 2021-03-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| PMS-IRBESARTAN-HCTZ | 02328526 | 300/12.5 | 606524 | Zhejiang Tianyu Pharmaceutical Co., Ltd., | 2018-11-30 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| PMS-IRBESARTAN-HCTZ | 02328526 | 300/12.5 | 611016 | USV Private Limited | 2019-11-30 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| Ranbaxy Pharmaceuticals Canada Inc. | RAN-VALSARTAN | 02363119 | 160 | 2884804 | Sun Pharmaceutical Industries Limited | 2019-05-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| Sandoz Canada Inc. | SANDOZ CANDESARTAN | 02417340 | 32 | JC3223 | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2020-06-30 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| SANDOZ CANDESARTAN PLUS | 02420732 | 32 | HY8217 | Zhejiang Tianyu Pharmaceutical Co., Ltd. | 2020-04-30 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| SANDOZ OLMESARTAN | 02443422 | 40 | HX2039 | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2020-02-28 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| SANDOZ LOSARTAN | 02313359 | 100 | JD6746 | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2020-04-30 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| SANDOZ VALSARTAN | 02356775 | 320 | HW4965 | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2020-12-31 | 2703.76 | non- détecté | Oui | Non | Oui | 20 decembre 2018 | |
| SANDOZ IRBESARTAN | 02328496 | 300 | HX4282 | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2020-01-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| SANDOZ IRBESARTAN | 02328496 | 300 | JD1818 | Zhejiang Tianyu Pharmaceutical Co., Ltd. | 2020-05-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| Sanis Health Inc. | IRBESARTAN | 02372398 | 300 | 35213058A | TEVA API INDIA PVT. LTD. | 2019-12-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| Sanofi-Aventis Canada Inc. | AVAPRO - IRBESARTAN | 02237925 | 300 | KC001 | CHINOIN Pharmaceutical and Chemical Works Private Co. Ltd. | 2020-01-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| Septa Pharmaceuticals Inc. | SEPTA-LOSARTAN | 02424983 | 100 | LR318004A | Jubilant Generics Limited | 2020-03-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| Sivem Pharmaceuticals Inc. | LOSARTAN HCT | 02388987 | 100/25 | QX1018005-B | Zhejiang Tianyu Pharmaceutical Co., Ltd. | 2021-06-08 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| IRBESARTAN | 02385309 | 300 | HX7687 | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2019-12-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| IRBESARTAN HCT | 02385325 | 300/12.5 | HY7380 | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2020-11-30 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| Teva Canada Limited | TEVA-CANDESARTAN | 02366339 | 32 | 2537058 | Pliva Croatia Ltd. | 2020-05-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 |
| TEVA-LOSARTAN | 02357976 | 100 | 2070318 | Teva API India Private Ltd | 2021-03-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| TEVA-LOSARTAN/HCTZ | 02358263 | 50/12.5 | 35349397A | Hetero Labs Limited | 2020-09-30 | non- détecté | 10.3 | Non | Non | Non | 20 decembre 2018 | |
| TEVA-IRBESARTAN | 02316412 | 300 | 35213086A | TEVA API INDIA LTD | 2019-12-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| TEVA-VALSARTAN | 02356686 | 320 | 35211729R | Jubilant Generics Limited | 2019-03-31 | non- détecté | non- détecté | Non | Non | Non | 20 decembre 2018 | |
| TEVA-VALSARTAN/HCTZ | 02357038 | 320/12.5 | 35212732 | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2019-10-31 | 14538.35 | non- détecté | Oui | Non | le lot n'a jamais été distribué | 20 decembre 2018 | |
| TEVA-VALSARTAN/HCTZ | 02357038 | 320/12.5 | 35211546R | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2019-01-31 | 258.19 | 1770.87 | Oui | Oui | Oui | 20 decembre 2018 | |
| TEVA-VALSARTAN/HCTZ | 02357046 | 320/25 | 35212731R | Zhejiang Huahai Pharmaceutical Co., Ltd. | 2019-11-30 | 13367.64 | non- détecté | Oui | Non | Oui | 20 decembre 2018 | |
|
||||||||||||
Méthode d'analyse
Santé Canada a fournie une méthode qui a été développée pour détecter et quantifier les impuretés nitrosamines, à savoir la N-nitrosodiméthylamine (NDMA) et la N-nitrosodiéthylamine (NDEA), dans les antagonistes des récepteurs de l'angiotensine II (ARA).
Détection de la N-Nitrosodiméthylamine (NDMA) et de la N-Nitrosodiéthylamine (NDEA) par CG-SM-SM (injection directe) dans les produits finis et les substances médicamenteuses de sartans
1. Principe et portée
La présente méthode a été conçue afin de détecter et quantifier les impuretés nitrosamine N-nitrosodiméthylamine (NDMA) et N-nitrosodiéthylamine (NDEA) dans les produits finis de valsartan, irbésartan et losartan. Cette méthode est effectuée par un chromatographe en phase gazeuse couplé à un spectromètre de masse en tandem (CG-SM-SM) à injection directe.
La méthode peut également être utilisée pour détecter et quantifier la NDMA et la NDEA dans les produits finis de candersartan et olmersartan et les substances médicamenteuses de sartans (par ex. valsartan, ibersartan, losartan, candesartan et olmesartan). Par contre, s'il y a des interférences d'observer, une validation supplémentaire serait requise.
2. Sécurité
Les mesures de sécurité en laboratoire servent à s'assurer que l'environnement de travail est sain et sécuritaire, ce qui comprend le recours à un équipement de protection individuelle (incluant, mais sans s'y limiter, un sarrau de laboratoire, des lunettes de protection et des gants de nitrile ou en caoutchouc de butyle) ainsi qu'aux équipements de contrôle de laboratoire appropriés (p. ex. dispositifs de ventilation des zones de confinement).
Les produits chimiques utilisés dans cette méthode sont dangereux. Les analystes devraient lire attentivement la fiche de données de sécurité (FDS) de chaque produit chimique. En raison de la nature toxique des nitrosamines, on recommande l'achat de solutions étalons de référence diluées afin de réduire la portée de l'exposition éventuelle.
3. Réactifs et étalons de référence
- Méthanol grade CLHP MeOH (no du CAS : 67-56-1)
- NDMA : Solution de N-Nitrosodiméthylamine (5000 μg/mL dans du méthanol; no du CAS : 62-75-9)
- NDEA : Solution de N-Nitrosodiéthylamine, (100 μg/mL dans du méthanol; no du CAS : 55-18-5)
- Solution de NDMA-d6 : Solution de N-nitrosodiméthylamine-d6 (1000 μg/mL dans du méthanol; no du CAS : 17829-05-9)
4. Instruments et équipements
- Agilent GC 7890A avec MSMS 7000 avec source EI source ou l'équivalent
- Agilent DB-624 25 m x 0.32 μm 1.8 μm ou l'équivalent
- Vials pour CG ambrés de 2 mL à bouchon fileté et membrane de PTFE/silicone
- 20 x tubes filetés à fond rond de 125 mm avec bouchons
- Pipettes automatiques, volumes variés
- Balance à chargement supérieur d'une précision de ± 0,01 g et balance analytique permettant une lecture à ± 0,0001 g
- Ballons volumétriques (classe A), volumes variés
- Pipettes Pasteur et poires à pipette
- Spatule
- Vials ambrés en verre de 15 mL avec bouchon
- Vials ambrés en verre de 40 mL avec bouchon
- Mélangeur Vortex, à un et à plusieurs tubes
- Supports pour vials et supports de rangement
- Chiffons Kimwipe
- Mortier et pilon
- Bain-marie ultrasonique
- Centrifugeuse, Beckmann-Coulter Allegra X-15R ou équivalente
5. Préparation des solutions
Solutions étalons
- Solutions étalons de référence (telles qu'achetées)
-
- Solution étalon de NDMA dans du méthanol (5000 ppm)
- Solution étalon de NDEA dans du méthanol (100 ppm)
- Solution étalon interne (telle qu'achetée)
-
- Solution étalon de NDMA-d6 dans du méthanol (1000 ppm)
Solutions étalons diluées
- Solution étalon de NDMA (200 ppm) :
- Transférer 800 μL de solution étalon de référence de NDMA (5000 ppm) dans un ballon volumétrique de 20 mL, diluer jusqu'à la jauge avec du méthanol.
- Solution étalon diluée (NDMA : 40 ppm, NDEA : 20 ppm) :
- Transférer 800 μL de solution étalon de NDMA (200 ppm) et 800 μl de solution étalon de NDEA (100 ppm) dans un ballon volumétrique de 4 mL, diluer jusqu'à la jauge avec du méthanol.
- Solution-étalon interne-1 (20 ppm) :
- Transférer 500 μL de solution étalon de NDMA-d6 (1000 ppm) dans un ballon volumétrique de 25 mL, diluer jusqu'à la jauge avec du méthanol.
- Solution-étalon interne-2 (0,2 ppm) :
- Transférer 5 μL de solution étalon de NDMA-d6 (20 ppm) dans un ballon volumétrique de 500 mL, diluer jusqu'à la jauge avec du méthanol.
Solutions d'étalonnage
- STD-12 :
- Transférer 500 μL de solution étalon diluée (NDMA : 40 ppm, NDEA : 20 ppm) et 50 μl de solution étalon interne-1 (20 ppm) dans un ballon volumétrique de 5 mL, diluer au volume avec du méthanol. Bien mélanger.
- STD-7 :
- Transférer 1000 μL de STD-12 dans un ballon volumétrique de 20 mL, diluer au volume avec la solution étalon interne-2 (0,2 ppm). Bien mélanger. Cette solution servira à effectuer l'évaluation de la performance du système et la vérification de la dérive du système.
- STD-11 :
- Dilution 1:1 de STD-12 avec la solution étalon interne-2.
- STD-10 :
- Dilution 1:1 de STD-11 avec la solution étalon interne-2.
- STD-9 :
- Dilution 1:1 de STD-10 avec la solution étalon interne-2.
- STD-8 :
- Dilution 3:2 de STD-9 avec la solution étalon interne-2.
- STD-6 :
- Dilution 1:1 de STD-7 avec la solution étalon interne-2.
- STD-5 :
- Dilution 1:1 de STD-6 avec la solution étalon interne-2.
- STD-4 :
- Dilution 2:3 de STD-5 avec la solution étalon interne-2.
- STD-3 :
- Dilution 1:1 de STD-4 avec la solution étalon interne-2.
- STD-2 :
- Dilution 1:1 de STD-3 avec la solution étalon interne-2.
- STD-1 :
- Dilution 2:3 de STD-2 avec la solution étalon interne-2.
| Description | Concentration de NDMA (µg/mL) | Concentration de NDEA (µg/mL) | Concentration de NDMA-d6 (µg/mL) |
|---|---|---|---|
| STD-1 | 0,002 | 0,001 | 0,2 |
| STD-2 | 0,005 | 0,0025 | 0,2 |
| STD-3 | 0,01 | 0,005 | 0,2 |
| STD-4 | 0,02 | 0,01 | 0,2 |
| STD-5 | 0,05 | 0,025 | 0,2 |
| STD-6 | 0,1 | 0,05 | 0,2 |
| STD-7 | 0,2 | 0,1 | 0,2 |
| STD-8 | 0,3 | 0,15 | 0,2 |
| STD-9 | 0,5 | 0,25 | 0,2 |
| STD-10 | 1 | 0,5 | 0,2 |
| STD-11 | 2 | 1 | 0,2 |
| STD-12 | 4 | 2 | 0,2 |
Pour la NDMA, les solutions STD-1 à STD-6 sont utilisées pour la plage de travail allant de 0,002 à 0,1 µg/mL; les solutions STD-6 à STD-12 sont utilisées pour la plage de travail allant de 0,1 à 4,0 µg/mL.
Pour la NDEA, les solutions STD-1 à STD-5 sont utilisées pour la plage de travail allant de 0,001 à 0,025 µg/mL; les solutions STD-5 à STD-11 sont utilisées pour la plage de travail allant de 0,025 à 1,0 µg/mL.
Les plages de travail de la NDMA et de la NDEA peuvent être ajustées au besoin.
Préparation des échantillons
Pour les produits finis :
Peser au minimum 20 comprimés et calculer le poids moyen d'un comprimé. Moudre au minimum 20 comprimés en une poudre fine à l'aide du mortier et du pilon.
Préparer trois échantillons de chaque produit. Peser exactement l'équivalent de 250 mg de substance médicamenteuse de la poudre d'échantillon homogénéisée dans un tube fileté à fond rond.
À l'aide d'une pipette automatique, ajouter 5 mL de solution étalon interne-2 de NDMA-6 à chaque tube d'échantillon. Bien refermer les tubes, soumettre à l'ultrason pendant 5 minutes, puis déposer le support de tubes dans l'agitateur vortex à tubes multiples et agiter à 2000 rpm pendant 5 minutes. Centrifuger les tubes pendant au moins 5 minutes à 1500 rpm. Délicatement, retirer les tubes de la centrifugeuse. À l'aide d'une pipette Pasteur, transférer un aliquot de chaque tube dans un vial CG en verre de 2 mL.
Remarque : La précision de la méthode a été évaluée par des études de récupération. Les valsartan, irbesartan et losartan dans les produits finis ont été ensemencés avec une solution d'étalon de référence de la façon suivante :
- Pour les échantillons contenant de la NDMA à un taux supérieur à 0,3 ppm ou de la NDEA à un taux supérieur à 0,08 ppm :
- Ensemencer la solution d'échantillon avec la solution étalon qui correspond le mieux à celle de l'échantillon et calculer la récupération.
- Pour les échantillons contenant de la NDMA à un taux inférieur à 0,3 ppm ou de la NDEA à un taux inférieur à 0,08 ppm :
- Ensemencer la solution de l'échantillon avec la solution STD-3 (1:1) afin d'obtenir une solution contenant 0,05 ppm de la NDMA et 0,025 ppm de la NDEA. Vérifier le ratio signal/bruit et calculer la limite de détection (LOD) et la limite de quantification (LOQ).
Pour les substances médicamenteuses :
Préparer trois échantillons de chaque substance. Peser précisément 250 mg de la poudre homogénéisée de l'échantillon dans un tube fileté à fond rond en verre.
Continuer la préparation selon les instructions pour les produits finis ci-dessus. Il est recommandé d'ensemencer l'échantillon pour déterminer la précision de la méthode.
6. Paramètres de fonctionnement des instruments :
Paramètres suggérés pour le CG :
Paramètres de l'injecteur :
- Mode d'injection :
- Injecteur « pulsed splitless »
- Température d'injection :
- 240 °C
- Débit :
- 1,8 mL/min
- Débit de vidange de la membrane (septum) :
- 3 mL/min
- Débit de vidange :
- 50 mL/min après 0,75 minute
- Volume d'injection :
- 2,0 µL
Programmation du four :
Température initiale : 60 °C
Attente : 2 min
| No de rail (ramp #) |
Débit (°C/min) (Rate) |
Température finale (°C) | Durée d'attente (minutes) |
|---|---|---|---|
| 1 | 5 | 130 | 0 |
| 2 | 40 | 240 | 5 |
| Durée totale : 24 min | |||
Paramètres suggérés pour le détecteur SM
- Ligne de transfert de la SM (température auxiliaire) :
- 250 °C
- Source d'ions :
- EI
- Température de la source :
- 250 °C
- Délai du solvant :
- 6 min
- Temps d'arrêt :
- 15 min
- Gaz d'injection (quench gas):
- Hélium à 2,25 mL/min
- Gaz de collision :
- Azote à 1,5 mL/min
| Analyte | Temps de rétention (minutes) | Segment | Fenêtre du temps de rétention (minutes) | Ion précurseur (m/z) | Ion produit (m/z) | CE (V) |
Résolution | Temporisation (ms) (dwell) |
|---|---|---|---|---|---|---|---|---|
| NDMA-d6 (étalon interne) | 7,8 | 1 | 7,5-8,1 | 80 | 50 | 5 | Étendue / étendue | 100 |
| NDMA | 7,8 | 1 | 7,5-8,1 | 74 | 42 | 15 | Étendue / étendue | 100 |
| 74 | 44 | 4 | 100 | |||||
| NDEA | 12,7 | 2 | 12,4-13,0 | 102 | 44 | 12 | Étendue / étendue | 150 |
| 102 | 85 | 2 | 150 |
7. Performance du système
Le coefficient de détermination (R2) de chaque courbe d'étalonnage est d'au moins 0,995.
Le ratio signal/bruit de la solution STD-1 (NDMA = 0,002 µg/mL; NDEA = 0,001 µg/mL) devrait être au moins 10.
8. Calculs
Établir les courbes d'étalonnage pour la NDMA et la NDEA en utilisant le ratio de facteur de réponse (surface du pic de NDMA ou NDEA divisée par la surface du pic de l'étalon interne) par rapport à la concentration étalon (µg/mL). À l'aide des pentes et de l'ordonnées à l'origine des courbes d'étalonnage, déterminer la teneur en NDMA et en NDEA de chaque échantillon en fonction de l'équation suivante.
Pour les produits finis :
Les résultats, en ppm relatif à la quantité déclarée de la substance médicamenteuse sartan dans le produit, sont calculés comme suit :
Où,
- y =
- rapport de la surface du pic de NDMA ou de NDEA à la surface du pic de NDMA-d6
- b =
- ordonnée à l'origine de la courbe linéaire
- m =
- pente de la courbe linéaire
- Wtspl =
- poids de l'échantillon (g)
- AVGwt=
- poids moyen d'un comprimé (g)
- LC =
- quantité déclarée sur l'étiquette (g) de l'échantillon
- V =
- 5 mL (volume)
Équation 1 - Description textuel
Parties par million est égale à y moins b sur m, qui représente la différence entre le rapport de la surface du pic d'impureté à la surface du pic de l'étalon interne moins l'ordonnée à l'origine de la courbe linéaire sur la pente de la courbe linéaire. Cette valeur est multipliée par le poids moyen d'un comprimé, ensuite multipliée par le volume, divisée par le poids de l'échantillon et ensuite divisée par la quantité déclarée sur l'étiquette de l'échantillon.
Pour les substances médicamenteuses :
Les résultats, en ppm relatif à la substance médicamenteuse testée, sont calculés comme suit :
Où,
- y =
- rapport de la surface du pic de NDMA ou de NDEA à la surface du pic de NDMA-d6
- b =
- ordonnée à l'origine de la courbe linéaire
- m =
- pente de la courbe linéaire
- Wtspl =
- poids de l'échantillon (g)
- V =
- 5 mL (volume)
Équation 2 - Description textuel
Parties par million est égale à y moins b sur m, qui représente la différence entre le rapport de la surface du pic d'impureté à la surface du pic de l'étalon interne moins l'ordonnée à l'origine de la courbe linéaire sur la pente de la courbe linéaire. Cette valeur est multipliée par le volume et ensuite divisée par le poids de l'échantillon.
9. Résultats de la LOD et de la LOQ
Les limites de détection (LOD) et les limites de quantification (LOQ) peuvent être calculées en utilisant le ratio signal/bruit de la solution d'échantillon ensemencé (ensemencé avec la solution STD-3 à 1 :1).
LOD et LOQ théoriques :
Si aucun résultat de solution ensemencée n'est disponible, les LOD et LOQ théoriques peuvent être calculées en utilisant le signal/bruit de la STD-1 (NDMA : 0,002 µg/mL; NDEA 0,001 µg/mL).
À des fins de référence, les résultats des LOD et LOQ théoriques de Santé Canada sont les suivants :
| NDMA | NDEA | |||||||
|---|---|---|---|---|---|---|---|---|
| Concentration substance médicamenteuse µg/mL | µg/mL | Signal/bruit | LOD (calc.) ppm | LOQ (calc.) ppm | µg/mL | Signal/bruit | LOD (calc.) ppm | LOQ (calc.) ppm |
| 50 | 0,002 | 74 | 0,002 | 0,0054 | 0,001 | 55 | 0,002 | 0,0073 |
10. Chromatogrammes des échantillons
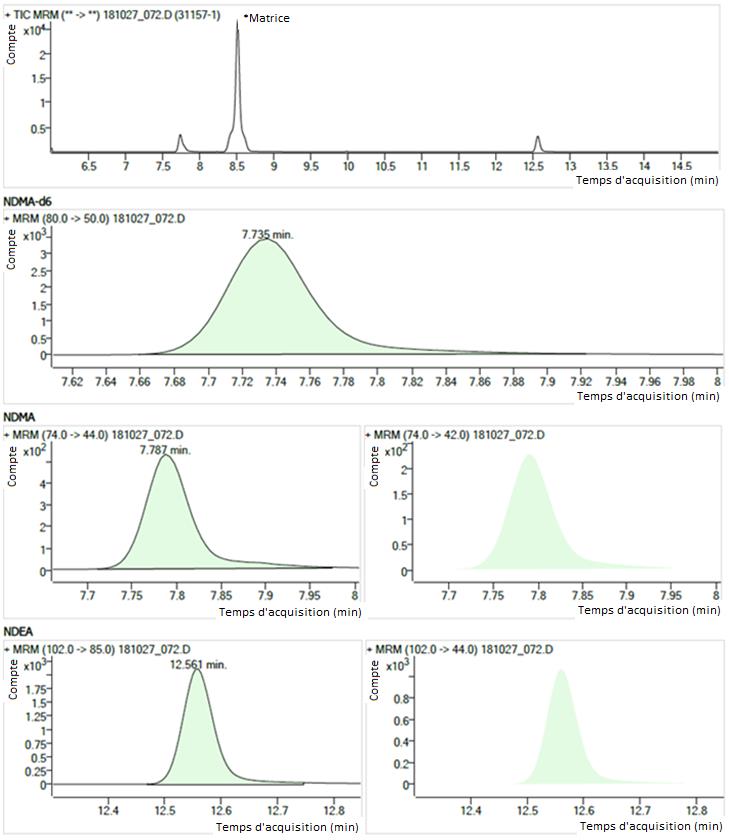
Figure 1 - Description textuel
La figure montre des chromatogrammes d'un échantillon montrant des pics typiques de la NDMA et de la NDEA. Les chromatogrammes sont organisés en quatre rangées.
- La première rangée montre un chromatogramme du courant total ionique de 6,0 à 15,0 minutes. Il y a un large pic à 8,5 minutes (étiqueté « matrice ») et des pics plus petits à 7,7 minutes (NDMA, NDMA-d6) et à 12,6 minutes (NDEA).
- La deuxième rangée montre des chromatogrammes de surveillance de réactions multiples (m/z 80,0 → 50,0) avec un seul pic pour l'étalon interne de la NDMA-d6 à 7,735 minutes.
- La troisième rangée montre deux chromatogrammes de surveillance de réactions multiples (m/z 74,0 → 44,0 and m/z 74,0 → 42,0), chacun avec un seul pic pour la NDMA à 7,787 minutes.
- La quatrième rangée montre deux chromatogrammes de surveillance de réactions multiples (m/z 102,0 → 85,0 and m/z 102,0 → 44,0) avec un seul pic pour la NDEA à 12,561 minutes.
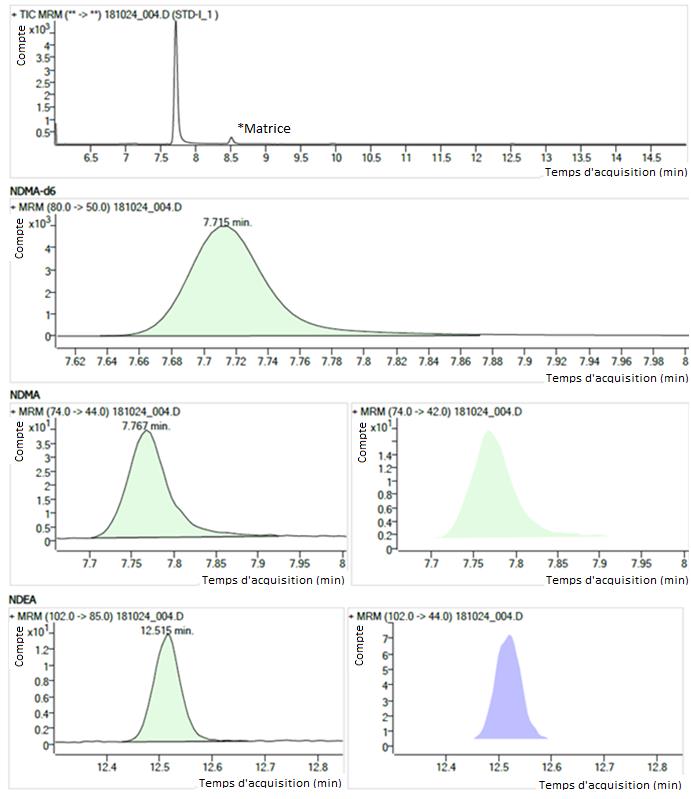
Figure 2 - Description textuel
La figure montre des chromatogrammes de la solution étalon STD-1. Les chromatogrammes sont organisés en quatre rangées.
- La première rangée montre des chromatogrammes du courant total ionique de 6,0 à 15,0 minutes. Il y a un large pic à 7,7 minutes (NDMA, NDMA-d6) et un petit pic à 8,5 minutes (étiqueté « matrice »).
- La deuxième rangée montre deux chromatogrammes de surveillance de réactions multiples (m/z 80.0 → 50.0) avec un seul pic pour la solution d'étalon interne NDMA-d6 à 7,715 minutes.
- La troisième rangée montre deux chromatogrammes de surveillance de réactions multiples (m/z 74.0 → 44.0 and m/z 74.0 → 42.0) avec un seul pic pour la NDMA à 7,767 minutes.
- La quatrième rangée montre deux chromatogrammes de surveillance de réactions multiples (m/z 102.0 → 85.0 and m/z 102.0 → 44.0) avec un seul pic pour la NDEA à 12,515.
La Food and Drug Administration (FDA) des Étas-Unis et la Direction européenne de la qualité des médicaments (DEQM) ont également publié des méthodes pour détecter la NDMA et la NDEA. Les voici :
Communications de Santé Canada
- Mise à jour de Santé Canada (2019-04-18) : Auro Pharma inc. procède au rappel volontaire d'un lot de comprimés d'Auro-irbésartan hydrochlorothiazide contaminé par une impureté de nitrosamine
- Mise à jour de Santé Canada (2019-03-14) : Pro Doc Limitée rappelle volontairement deux lots du médicament irbésartan en raison de la présence d'une impureté de nitrosamine
- Mise à jour de Santé Canada (2019-03-09) : Rappel volontaire de nombreux médicaments contenant du Losartan en raison de la présence possible d'une impureté de nitrosamine
- Mise à jour de Santé Canada (2018-12-20) : Publication par Santé Canada des résultats de l'analyse de certains médicaments à base de sartan
- Mise à jour de Santé Canada (2018-11-28) : Rappel volontaire de médicaments Mylan-Valsartan par mesure de précaution en raison de la présence d'une impureté
- Mise à jour de Santé Canada (2018-10-02) : Santé Canada constate que le site de Zhejiang Huahai Pharmaceuticals ne respecte pas les exigences relatives à la fabrication d'ingrédients médicamenteux
- Mise à jour de Santé Canada (2018-09-13) : Santé Canada informe d'une seconde impureté liée aux médicaments renfermant du Valsartan déjà rappelés
- Mise à jour de Santé Canada (2018-09-10) : Évaluation des risques pour la santé associés au Valsartan contaminé par la NDMA
- Mise à jour de Santé Canada (2018-08-18) : Teva Canada élargit le rappel de médicaments contenant du Valsartan pour inclure des lots supplémentaires, par mesure de précaution
- Avis de Santé Canada (2018-07-09) : Rappel de plusieurs médicaments contenant du Valsartan en raison d'une contamination potentiellement cancérogène
Détails de la page
- Date de modification :