Ligne directrice : Identification numérique pour les drogues de l'annexe C (radiopharmaceutiques et trousses)
Ligne directrice
Date d'approbation : 2017-12-13
Date de mise en vigueur : 2017-12-13
Avant-propos
Les lignes directrices sont des documents destinés à guider l'industrie et les professionnels de la santé sur la façon de se conformer aux lois et aux règlements qui régissent leurs activités. Elles indiquent par ailleurs aux membres du personnel comment s'acquitter des mandats de Santé Canada et atteindre ses objectifs d'une manière juste, uniforme et efficace.
Les lignes directrices sont des outils administratifs n'ayant pas force de loi, ce qui permet une certaine souplesse d'approche. Les principes et les pratiques énoncés dans le présent document pourraient être remplacés par d'autres approches si celles-ci sont bien fondées. Il convient d'en discuter au préalable avec le programme concerné pour s'assurer qu'elles respectent les exigences des lois et des règlements applicables.
Parallèlement, il est tout aussi important de mentionner que Santé Canada se réserve le droit de demander des renseignements ou du matériel supplémentaire, ou de définir des conditions dont il n'est pas explicitement question dans la ligne directrice, afin de permettre au Ministère d'évaluer de façon adéquate l'innocuité, l'efficacité ou la qualité d'un produit thérapeutique donné. Santé Canada s'engage à justifier de telles demandes et à documenter clairement ses décisions.
Il faut lire ce document en parallèle avec l'avis qui l'accompagne et les sections pertinentes des autres lignes directrices qui s'appliquent.
Table des matières
- 1. Introduction
- 2. Conseils de mise en œuvre
- 2.1 Demande d'une identification numérique de drogue
- 2.2 Formulaire de déclaration de médicament et avis de mise en marché
- 2.3 Déclaration de 12 mois sans vente (DIN dormant)
- 2.4 Annulation d'une DIN
- 2.5 Déclaration annuelle de médicament
- 2.6 Frais à payer pour le droit de vendre une drogue
- 2.7 Frais pour l'examen d'une présentation de drogue
- 3. Période de transition
1. Introduction
1.1 Objectif et aperçu
Le 13 décembre 2017, Santé Canada a publié le Règlement modifiant le Règlement sur les aliments et drogues (exigences de DIN pour les drogues sous forme posologique figurant à l'annexe C de la Loi sur les aliments et drogues) dans la Partie II de la Gazette du Canada. L'objectif de cette modification réglementaire est d'exiger que les drogues de l'annexe C (radiopharmaceutiques et trousses) portent une identification numérique de drogue (DIN) pour qu'elles puissent être vendues au Canada. En plus de la nouvelle exigence d'avoir une DIN pour toutes les drogues de l'annexe C, les conditions d'étiquetage ont également été mises à jour pour refléter la nouvelle exigence. Ainsi, au lieu d'exiger que le numéro de licence d'établissement figure sur l'étiquette, dorénavant c'est la DIN qui doit y figurer.
1.2 Portée et application
Cette ligne directrice s'applique à toutes les drogues de l'annexe C.
1.3 Objectif stratégique
Voici en quoi consistent les objectifs stratégiques qui guident l'autorité de réglementation quant à l'attribution de la DIN et l'exigence qu'elle figure sur l'étiquette d'un produit pharmaceutique :
- fournir à la population canadienne, aux partenaires et aux intervenants des renseignements à jour, fiables et exacts sur la disponibilité des médicaments au Canada; et
- aider à protéger la santé et la sécurité des Canadiens contre la vente de médicaments dangereux.
Ces objectifs doivent être gardés à l'esprit lorsqu'on se conforme au règlement, et notamment lorsqu'on interprète les exigences réglementaires dans des cas particuliers.
1.4 Énoncés de politique
Avant ces modifications, tous les médicaments sous forme posologique (autres que les drogues de l'annexe C) régis par le Règlement sur les aliments et drogues (RAD) recevaient une DIN après autorisation de Santé Canada, laquelle devait figurer sur l'étiquette du produit. Un certain nombre d'incohérences réglementaires se manifestent lorsqu'on n'exige pas qu'une DIN soit attribuée aux drogues de l'annexe C. Plus précisément, il n'est pas nécessaire d'aviser Santé Canada une fois qu'une drogue de l'annexe C est lancée sur le marché canadien ou lorsqu'un produit radiopharmaceutique est retiré du marché. Par ailleurs, puisqu'il n'existe aucun mécanisme pour annuler un avis de conformité (le type d'autorisation de mise en marché que reçoivent les drogues de l'annexe C), Santé Canada n'a pas le pouvoir d'annuler l'état sur le marché de ces médicaments.
Grâce à ces modifications, les drogues de l'annexe C seront soumises aux mêmes exigences que tous les autres produits auxquels une DIN est attribuée, comme l'avis de mise en marché, l'avis de cessation de la vente et l'avis lorsqu'une drogue n'est pas vendue au cours d'une période de 12 mois. Ces changements assureront l'harmonisation de la surveillance réglementaire de ces produits par rapport aux autres produits auxquels une DIN a été attribuée.
Même si les drogues de l'annexe C ont été ajoutées à la base de données en ligne sur les produits pharmaceutiques (BDPP) en 2015, l'information qui y figure reste incomplète. Les intervenants pourraient être dans l'impossibilité de trouver des renseignements adéquats sur les solutions de rechange disponibles en cas de pénurie éventuelle d'une drogue. Comme la BDPP est publique, grâce à ces modifications, les médecins et autres intervenants du domaine de la santé pourront consulter l'information concernant l'état sur le marché des drogues de l'annexe C. Il s'agit d'une mesure importante d'atténuation en période de pénurie et de cessation de vente d'une drogue. En outre, l'attribution d'une DIN aux drogues de l'annexe C facilitera l'identification, la surveillance et le rappel de ces produits. Par exemple, l'Agence des services frontaliers du Canada (ASFC) pourra consulter la BDPP pour obtenir de l'information complète et fiable sur les médicaments importés pour mener ses activités de conformité et d'application de la loi. Les établissements de soins de santé (hôpitaux et cliniques) pourront aussi identifier facilement les drogues visées par des rappels.
1.5 Contexte
Avant 1998, des licences en vertu de l'annexe C étaient délivrées tous les ans aux fabricants de drogues de l'annexe C. Chaque licence délivrée en vertu de l'annexe C énumérait tous les produits du fabricant qui se trouvaient sur le marché à ce moment, et ces licences étaient renouvelées tous les ans. Ces licences ont été remplacées par des licences d'établissement en 1998. Depuis, le numéro de la licence d'établissement doit apparaître sur les étiquettes des drogues de l'annexe C.
En ce qui concerne les autres catégories de médicaments, une DIN était attribuée à chaque drogue dont la vente est autorisée au Canada. Il sert d'identifiant unique qui, historiquement, a été utilisé essentiellement aux fins de remboursement par les compagnies d'assurance. Comme la plupart des produits radiopharmaceutiques sont administrés par voie parentérale (c.-à-d. par injection intraveineuse ou intramusculaire) et qu'ils sont généralement préparés et administrés par des professionnels de la santé dans une clinique ou un hôpital, les DIN n'étaient pas jugées nécessaires aux fins de remboursement. Les drogues de l'annexe C n'étaient donc pas soumises à l'exigence d'avoir une DIN.
Au fil du temps, le but de la DIN a évolué. Aujourd'hui, Santé Canada utilise les DIN dans le cadre de différentes activités réglementaires, notamment pour assurer le suivi de l'état sur le marché d'un médicament et afficher des renseignements connexes dans la BDPP. L'ASFC utilise les DIN dans le cadre de ses activités de conformité et d'application de la loi pour les médicaments importés. La DIN est une preuve de l'autorisation accordée au fabricant de vendre un produit sur le marché canadien. Santé Canada peut également révoquer l'autorisation de vendre un produit lorsque, à la suite de sa mise en marché, le produit s'est révélé dangereux ou pour d'autres raisons, telles que le non-respect des règlements. Dans ces cas, la DIN est annulée.
Actuellement, une fois que la DIN a été attribuée, le fabricant de la drogue doit fournir à Santé Canada un avis dans les 30 jours suivant la vente de la drogue au Canada, un avis lorsque la drogue n'est pas vendue pendant une période de 12 mois consécutifs ou un avis si le produit est retiré du marché canadien. Un formulaire de déclaration de médicament permet au fabricant de confirmer chaque année que tous les renseignements fournis dans le passé concernant la drogue sont exacts. Santé Canada utilise cette information dans le cadre de différentes activités réglementaires, notamment pour assurer le suivi de l'état sur le marché d'un médicament dans la BDPP.
Comme les drogues de l'annexe C ne sont pas soumises à l'exigence d'avoir une DIN, les fabricants ne sont pas tenus de fournir un avis de mise en marché ou le formulaire de déclaration annuelle de médicament. En l'absence de ces renseignements sur les drogues de l'annexe C dans la BDPP, la détermination des produits radiopharmaceutiques offerts sur le marché canadien s'est avérée difficile. Ce problème a été mis en évidence lors de la pénurie d'isotopes ayant suivi la fermeture de l'installation du réacteur national de recherche universel de Chalk River en 2007-2008 et 2009-2010. Sans une liste à jour des drogues de l'annexe C sur le marché, Santé Canada a eu de la difficulté à trouver d'autres sources de radio-isotopes pendant la période de pénurie.
2. Conseils de mise en œuvre
2.1 Demande d'une identification numérique de drogue
2.1.1 Produits dont l'autorisation de mise en marché est délivrée avant le 13 juin 2018
Les produits ayant reçu une autorisation de mise en marché avant le 13 juin 2018 n'ont pas de DIN attribuée. Pour recevoir une DIN, vous devez présenter une demande de DIN pour les drogues de l'annexe C (DIN-SC) en remplissant un formulaire de demande d'identification numérique de drogue pour un produit de l'annexe C avec une autorisation de mise en marché.
Pour remplir et soumettre le formulaire, qui est disponible sur demande, il suffit de suivre les directives qui y figurent. Pour obtenir une copie du formulaire, vous pouvez communiquer avec la Direction des produits biologiques et des thérapies génétiques (DPBTG) par courriel à l'adresse suivante : BGTD_ORA@hc-sc.gc.ca.
Ce processus de demande d'une DIN-SC est unique aux produits de l'annexe C pour lesquels Santé Canada a déjà accordé une autorisation de mise en marché et ne s'appliquera qu'aux médicaments qui sont actuellement vendus ou qui seront vendus au Canada. Les formulaires de demande de DIN pour les produits de l'annexe C qui ne sont plus vendus au Canada (et qui ne seront plus vendus à l'avenir) ne doivent pas être soumis. Si, à l'avenir, la mise en marché du produit est de nouveau envisagée, avant de pouvoir vendre le médicament au Canada, il faut présenter une nouvelle demande de DIN-SC et obtenir une DIN, avec étiquettes mises à jour.
2.1.2 Drogues sans autorisation de mise en marché
En vertu de l'article C.01.014.1(3) du Règlement sur les aliments et drogues, la présentation de drogue nouvelle, la présentation de drogue nouvelle pour usage exceptionnel, la présentation abrégée de drogue nouvelle ou la présentation abrégée de drogue nouvelle pour usage exceptionnel tient lieu de demande d'identification numérique.
2.2 Formulaire de déclaration de médicament et avis de mise en marché
Lorsque l'examen de votre demande de DIN-SC ou de la présentation de drogue nouvelle sera terminé et que les modifications réglementaires entreront en vigueur, Santé Canada vous enverra un formulaire de déclaration de médicament (FDM) et le nouveau DIN.
Les FDM sont délivrés par Santé Canada conformément à l'article C.01.014.2 du Règlement sur les aliments et drogues. Ils contiennent la DIN attribuée à une drogue ainsi que certaines des informations incluses dans la présentation de drogue. Conformément à l'article C.01.014.3 du RAD, le promoteur doit, dans les 30 jours suivant le début de la vente d'un médicament, remplir le FDM et le retourner à Santé Canada avec le matériel d'étiquetage (le cas échéant).
Vous pouvez trouver des instructions détaillées pour la présentation de l'avis de mise en marché dans Avis : Directives concernant la présentation en format électronique du formulaire de déclaration de médicament (FDM) et des documents d'appui disponibles sur notre site Web à l'adresse suivante :
2.3 Déclaration de 12 mois sans vente (DIN dormant)
Conformément à l'article C.01.014.71 du Règlement sur les aliments et drogues, si un produit n'a pas été vendu sur le marché canadien pendant 12 mois consécutifs, le fabricant de drogues de l'annexe C est tenu d'en aviser Santé Canada dans les 30 jours civils suivant ce délai.
Vous pouvez trouver des instructions détaillées pour la présentation de l'avis de 12 mois sans vente dans Ligne directrice : Annulation d'une identification numérique de drogue (DIN) et avis de cessation de la vente d'une drogue.
2.4 Annulation d'une DIN
Conformément à l'article C.01.014.7 du Règlement sur les aliments et drogues, le fabricant est tenu d'aviser Santé Canada dans les 30 jours suivant la cessation de la vente du médicament.
Vous pouvez trouver des instructions détaillées pour la présentation de l'avis de cessation de la vente dans Ligne directrice : Annulation d'une identification numérique de drogue (DIN) et avis de cessation de la vente d'une drogue disponible sur notre site Web à l'adresse fournie à la section 2.3.
2.5 Déclaration annuelle de médicament
Le Formulaire de déclaration annuelle de médicament (FDAM) vise à aider les promoteurs à se conformer à l'article C.01.014.5 du Règlement sur les aliments et drogues qui exige qu'un fabricant de drogue confirme chaque année, avant le mois d'octobre, que les renseignements précis fournis dans le passé sur le produit sont exacts. Le non-respect de cet article peut entraîner l'annulation par Santé Canada des DIN existantes.
Les promoteurs de produits de l'annexe C devront remplir le FDAM fourni et le retourner avant le mois d'octobre de chaque année.
Santé Canada prépare et, durant la première semaine de juin, envoie à tous les fabricants le document de déclaration annuelle de médicament qui comprend des directives sur les marches à suivre.
2.6 Frais à payer pour le droit de vendre une drogue
Le Règlement sur les prix à payer à l'égard des drogues et instruments médicaux accorde à Santé Canada le pouvoir d'imposer des frais annuels pour le droit ou le privilège de vendre un médicament au Canada. En vertu de l'article C.01.014.2 du Règlement sur les aliments et drogues, des frais sont exigés pour chaque produit auquel une identification numérique de drogue (DIN) a été attribuée, lequel a été déclaré par la suite comme mis en marché.
Toutefois, pour les produits de l'annexe C, une disposition de non-application a été ajoutée au Règlement sur les prix à payer à l'égard des drogues et instruments médicaux. Santé Canada envisage de consulter les intervenants au cours des prochains mois afin de discuter d'une mise à jour du cadre des frais d'utilisation, après quoi le Ministère entend commencer l'application des frais.
Vous trouverez des renseignements supplémentaires sur les frais relatifs au droit de vendre des médicaments dans Ligne directrice - Frais à payer pour le droit de vendre une drogue disponible.
2.7 Frais pour l'examen d'une présentation de drogue
Tous les frais actuellement payés par les fabricants de produits radiopharmaceutiques en vertu du Règlement sur les prix à payer à l'égard des drogues et instruments médicaux, comme les frais d'examen d'une présentation de drogue nouvelle, de présentation abrégée de drogue nouvelle et de supplément de présentation de drogue (p. ex., site de fabrication d'un nouveau médicament) ou les frais de licence d'établissement continueront de s'appliquer.
Pour les demandes de DIN-SC, une disposition de non-application a été ajoutée au Règlement sur les prix à payer à l'égard des drogues et instruments médicaux. Par conséquent, il n'y aura pas de frais pour l'examen de ces demandes.
3. Période de transition
Santé Canada veut que toutes les demandes de DIN soient soumises avant le 13 décembre 2018.
Afin d'atténuer l'impact de ces règlements modifiés, il y aura une période de transition pour permettre aux détenteurs d'une autorisation de présenter des demandes de DIN et de mettre à jour les étiquettes des produits. Cette disposition transitoire ne s'applique qu'aux détenteurs d'une autorisation de mise en marché de drogues de l'annexe C qui ont déjà reçu une autorisation de mise sur le marché.
3.1 Demande reçue au plus tard le 13 décembre 2018 et acceptée pour examen
Le détenteur de l'autorisation aura 12 mois après l'attribution de la DIN pour mettre à jour l'étiquette des produits radiopharmaceutiques (et les générateurs) ou 24 mois après l'attribution de la DIN pour mettre à jour l'étiquette du produit pour les trousses.
3.2 Demande non reçue jusqu'au 13 décembre 2018
Le détenteur de l'autorisation aura jusqu'au 13 décembre 2019 pour les produits radiopharmaceutiques (et les générateurs) ou le 13 décembre 2020 (pour les trousses) pour se conformer pleinement au Règlement sur les aliments et drogues jusqu'à l'expiration de la période de transition.
3.3 Diagramme de la période de transition
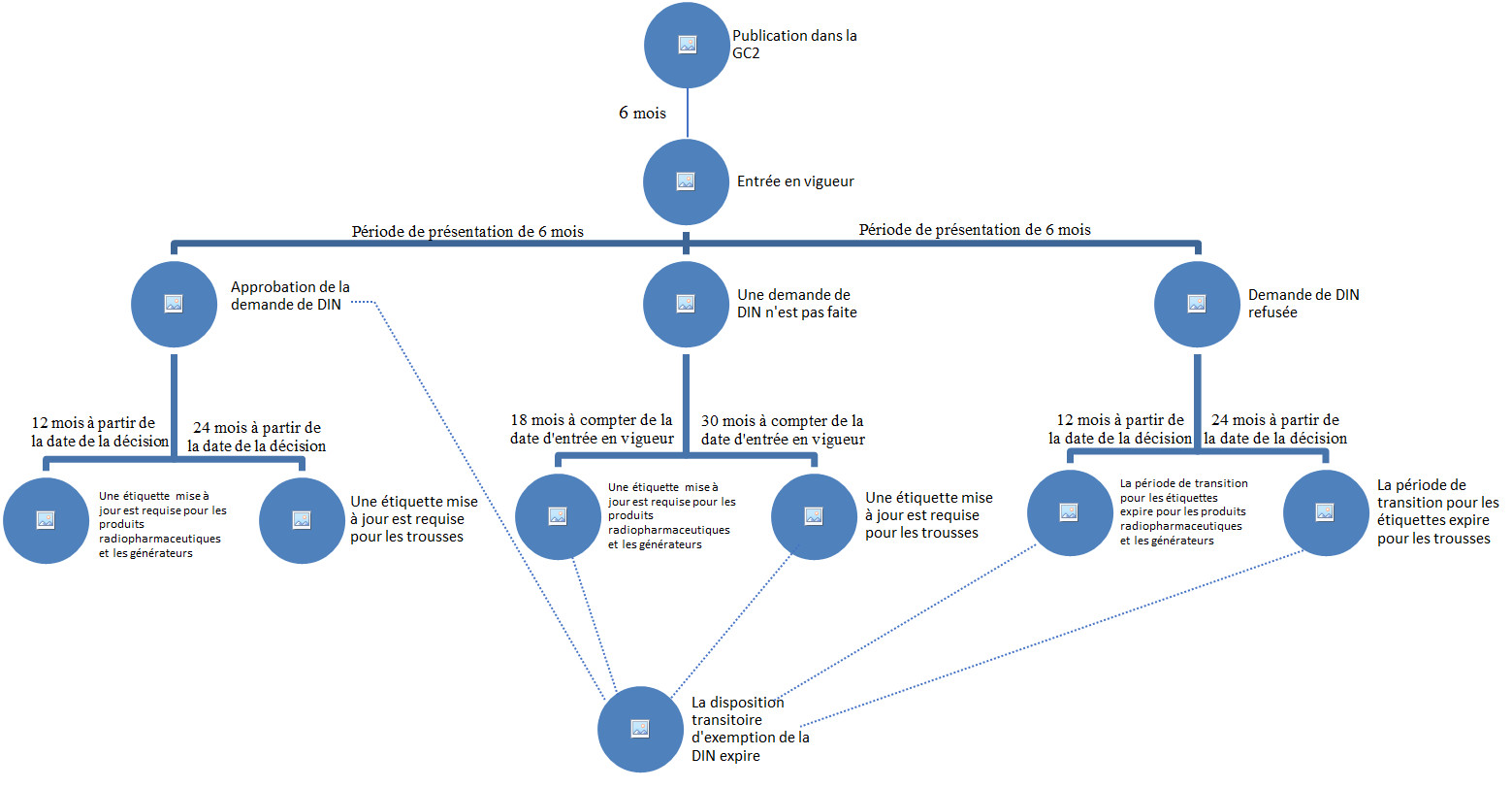
Figure 1 - Équivalent textuel
Cette image est un diagramme de la période de transition:
- Il commence en haut avec la publication dans la GCII.
- Il y a ensuite une période de six mois avant l'entrée en vigueur du règlement.
- Après l'entrée en vigueur, il y a une période de présentation de 6 mois.
Le diagramme se divise ensuite en trois (3) avenues possibles:
- La demande de DIN est approuvée.
- La demande de DIN n'est pas faite dans la période de présentation de 6 mois.
- La demande de DIN est refusée.
Si la demande de DIN est approuvée, la période de transition pour le produit possédant un DIN est terminée.
Le diagramme se divise en deux avenues:
- Si le produit est un produit radiopharmaceutique ou un générateur, la période de transition pour le changement d'étiquette expirera 12 mois après la date de la décision.
- Si le produit est une trousse, la période de transition pour le changement d'étiquette expirera 24 mois après la date de la décision.
Si la demande de DIN n'est pas faire:
- La période de transition pour le produit possédant un DIN expirera 30 mois après la date d'entrée en vigueur de la réglementation.
Le diagramme se divise en deux avenues:
- Si le produit est un produit radiopharmaceutique ou un générateur, la période de transition pour le changement d'étiquette expirera 18 mois après la date d'entrée en vigueur.
- Si le produit est une trousse, la période de transition pour le changement d'étiquette expirera 30 mois après la date d'entrée en vigueur.
Si la demande de DIN est refusée:
- La période de transition pour le produit possédant un DIN expirera 24 mois après la date de la décision.
L'organigramme se divise en deux avenues:
- Si le produit est un produit radiopharmaceutique ou un générateur, la période de transition pour le changement d'étiquette expirera 12 mois après la date de la décision.
- Si le produit est une trousse, la période de transition pour le changement d'étiquette expire 24 mois après la date de la décision.