ARCHIVÉE Ligne Directrice - Frais à payer pour le droit de vendre une drogue
Avis au lecteur
Ceci s'agit d’un document qui a été archivée. Veuillez consulter la version la plus récente de ce document.
Date d’adoption : 1998/05
Date de révision : 2018/06/13
Date d’entrée en vigueur : 2018/06/13
| Date | Révision | Emplacement (section, paragraphe) | Nature du changement et justification |
|---|---|---|---|
| 2018/06/13 | Modification de la section Portée et application | S1.3 | Règlement modifiant le Règlement sur les aliments et drogues (exigences d’identification numérique pour les drogues sous forme posologique visées à l’annexe C de la Loi sur les aliments et drogues) et le Règlement modifiant le Règlement sur les prix à payer à l’égard des drogues et instruments médicaux (exigences d’identification numérique pour les drogues sous forme posologique visées à l’annexe C de la Loi sur les aliments et drogues). |
| 2018/06/13 | Modification des renseignements concernant les DINs dormants et suppression des notes explicatives au bas de page | S.2.2.4, notes de bas de page | Règlement modifiant le Règlement sur les aliments et drogues (exigences d’identification numérique pour les drogues sous forme posologique visées à l’annexe C de la Loi sur les aliments et drogues) |
| 2017/03/14 | Modification à la définition de Formulaire de notification annuelle de drogue | S1.5 | Pour améliorer la clarté |
| 2017/03/14 | Modification pour ajouter des détails supplémentaires à l’égard du processus de notification annuelle | S2.2.3, S2.2.4 |
Pour préciser les exigences supplémentaires à ce processus pour tenir compte du Règlement modifiant le Règlement sur les aliments et drogues (pénuries de drogues et cessation de la vente de drogues) |
| 2017/03/14 | Modification de l’adresse postale aux fins de paiement de factures | S2.3.2 | Pour refléter le changement d'adresse pour les comptes recevables |
| 2017/03/14 | Modification du premier point de la section Quand payer les frais | S2.3.4 | Pour améliorer la clarté |
| 2017/03/14 | Ajout de précisions concernant les DIN dormants et le processus de remise des frais pour ces produits | S2.2.4, S2.5.2, S2.5.4 |
Pour préciser les exigences supplémentaires relatives à ce processus pour tenir compte du Règlement modifiant le Règlement sur les aliments et drogues (pénuries de drogues et cessation de la vente de drogues) |
| 2013/06/10 | La portée a été changée pour exclure les présentations de drogues nouvelles pour usage exceptionnel (DNUE) de cette ligne directrice | S.1.3 | Révision au Règlement sur les prix à payer à l'égard des drogues et instruments médicaux (le Règlement) pour exclure les présentations de DNUEs (PDN et PADN) |
| 2013/06/10 | La Division des politiques sur les présentations et renseignements a été remplacée par le Bureau des présentations et de la propriété intellectuelle. | S.2.1 | Pour tenir compte du changement de nom du bureau |
| 2013/03/02 | Une phrase qui prêtait à confusion a été enlevée | Le dernier paragraphe de la S.2.3.4 | Pour améliorer la clarté |
| 2013/03/02 | Le nom complet du Formulaire d’attestation et de demande de remise des frais pour le droit de vendre une drogue a été inséré | Divers endroits dans le document | Pour améliorer la clarté |
| 2011/04/01 | Les révisions importantes apportées à ce document comprennent la modification du barème des frais et les processus de remise des frais et des frais différés | le document au complet | La ligne directrice a été réécrite pour tenir compte du nouveau Règlement sur les frais à payer |
Avant-propos
Les lignes directrices sont des documents destinés à guider l’industrie et les professionnels de la santé sur la façon de se conformer aux politiques et aux lois et règlements qui régissent leurs activités. Elles servent également de guide au personnel lors de l’évaluation et de la vérification de la conformité et permettent ainsi d’appliquer les mandats d’une façon équitable, uniforme et efficace.
Les lignes directrices sont des outils administratifs n’ayant pas force de loi, ce qui permet une certaine souplesse d’approche. Les principes et les pratiques énoncés dans le présent document pourraient être remplacés par d’autres approches, à condition que celles-ci s’appuient sur une justification. Ces autres approches devraient être examinées préalablement en consultation avec le programme concerné pour s’assurer qu’elles respectent les exigences des lois et des règlements applicables.
Corollairement à ce qui précède, il importe également de mentionner que Santé Canada se réserve le droit de demander des renseignements ou du matériel supplémentaire, ou de définir des conditions dont il n’est pas explicitement question dans la ligne directrice, et ce, afin que le ministère puisse être en mesure d’évaluer adéquatement l’innocuité, l’efficacité ou la qualité d’un produit thérapeutique donné. Santé Canada s’engage à justifier de telles demandes et à documenter clairement ses décisions.
Table des matières
- 1. Introduction
- 2. Directives pour la mise en œuvre
1. Introduction
Le présent document contient l’orientation et l’interprétation du Règlement sur les prix à payer à l’égard des drogues et instruments médicaux (Règlement sur les prix) et fait ressortir la manière dont seront administrés les frais à payer pour le droit de vendre une drogue, énoncés à la Partie 2, Section 4, de ce règlement.
1.1 Objectifs de la politique
Assurer que le système de recouvrement des frais défraie au gouvernement les coûts pour l’application des principes de l’évaluation et de la gestion des risques prévus dans le règlement sur les drogues. Ces coûts reflètent les coûts actuels associés à la mise en marché de drogues, à l’exception des produits de santé naturels et de drogues à usage vétérinaire seulement.
1.2 Énoncés de politique
Le fabricant qui est titulaire d’une identification numérique de drogue (DIN) assignée à une drogue aux termes de l’article C.01.014.2 du Règlement sur les aliments et drogues se verra exiger des frais pour le droit de vendre la drogue en question, chaque année où la drogue est sur le marché au Canada.
Des frais sont exigés pour le droit de vendre une drogue au cours de l’année suivante débutant le 1er octobre et prenant fin le 30 septembre de l’année subséquente.
Les titulaires de DIN qui n’ont pas terminé leur première année civile de ventes d’une drogue au Canada verront leurs frais différés jusqu’à la fin de leur première année civile terminée.
Les titulaires de DIN sont admissibles à une remise d’une partie des frais exigés pour le droit de vendre lorsque ces frais excèdent 1,5 % des recettes brutes réelles (RBR) générées par cette drogue au cours l’année civile antérieure.
Ces frais sont majorés annuellement de 2 % et arrondis au dollar supérieur, à compter du 1er avril 2012.
1.3 Portée et application
La présente ligne directrice s’applique à toutes les drogues auxquelles un DIN est assigné et dont la vente a commencé au Canada, à l’exception :
- des drogues nouvelles pour usage exceptionnel (DNUE) autorisées suite au dépôt d’une présentation de drogue nouvelle (PDN) ou d’une présentation abrégée de drogue nouvelle (PADN) conformément à l’article C.08.002.01 ou C.08.002.1 du Règlement des aliments et des drogues
- des produits de santé naturels (PSN)
- des drogues à usage vétérinaire seulement. Les drogues ne servant qu’à un usage vétérinaire, doivent se conformer au Règlement sur les prix à payer pour vendre une drogue vétérinaire.
- des drogues inscrites à l'annexe C. Note : L’exemption pour ces drogues est une mesure temporaire étant donné que Santé Canada travaille à consulter et à réviser ses frais pour élargir la portée des frais liés à la possession d’un DIN, incluant ainsi les drogues inscrites à l’annexe C.
1.4 Contexte
Au début des années 1990, Santé Canada a reçu l'autorisation, en vertu de la Loi sur la gestion des finances publiques, d'exiger des frais d'utilisation aux fabricants en vue de récupérer une partie des coûts liés à la prestation des services touchant les drogues, y compris les coûts liés à la surveillance de l’innocuité après approbation. Cependant, les coûts de la prestation de ces services se sont toutefois accrus considérablement en raison de l’augmentation du volume des demandes, de même que de l’augmentation des coûts de l’inflation et d’autres coûts liés à l’exploitation d’activités commerciales.
Les frais à payer pour le droit de vendre une drogue prévus dans le Règlement sur les prix visent à fournir suffisamment de financement permettant à Santé Canada de rencontrer les normes de service, se tenir au courant de l’évaluation des signaux et des tendances en matière d’innocuité, et produire des communications sur les risques concernant tous les produits de santé commercialisés réglementés. La question des coûts associés à l’inflation a aussi été prévue.
1.5 Définitions
- Année civile
- Période de douze mois consécutifs débutant le 1er janvier.
- Fabricant
- Aux fins du présent document, fabricant s’entend d’un titulaire d’un DIN.
- Formulaire de notification annuelle de drogue
- Ce formulaire est une version imprimée des renseignements figurant dans la Base de données sur les produits pharmaceutiques, et fait état de tous les produits pharmaceutiques appartenant au fabricant nommé sur le formulaire, à compter de la date imprimée sur le formulaire. Ce dernier est utilisé pour faciliter le processus de renouvellement annuel.
- Formulaire de déclaration de médicament
- Ce formulaire est fourni au fabricant lors de la délivrance d’un DIN par Santé Canada. Le fabricant doit l’utiliser pour s’acquitter de son obligation d’aviser Santé Canada dans les 30 jours suivant le début de la vente du produit pharmaceutique sur le marché canadien.
- Première année civile terminée
- Achèvement d’une période de douze mois consécutifs commençant au 1er janvier, suivant la date à laquelle la drogue a été offert sur le marché au Canada pour la première fois.
- Recettes brutes réelles
- S’entend des sommes perçues par le titulaire du DIN pour les ventes au Canada de tous les drogues visées par le même DIN au cours de l’année civile antérieure.
1.6 Acronymes
- BPPI
- Bureau des présentations et de la propriété intellectuelle
- DIN
- Identification numérique de drogue
- DNUE
- Drogues nouvelles pour usage exceptionnel
- FDM
- Formulaire de déclaration de médicament
- FNAD
- Formulaire de notification annuelle de drogue
- RBR
- Recettes brutes réelles
2. Directives pour la mise en œuvre
2.1 Renseignements généraux sur les personnes-ressources
Pour toute question concernant le paiement de votre facture ou le solde de votre compte, communiquez avec les Comptes recevables, par téléphone, au 613-957-1052, ou au 1-800-815-0506, par télécopieur, au 613-957-3495 ou par courriel au AR-CR@hc-sc.gc.ca Veuillez avoir à portée de la main votre numéro de compte ou le numéro de la facture.
Pour toute question portant sur l’interprétation du barème des frais pour le droit de vendre une drogue, communiquez avec le Bureau des présentations et de la propriété intellectuelle (BPPI) anciennement le DPPR) par téléphone au 613-946-1151, par télécopieur au 613-954-3067, ou par courriel hc.annual-annuelle.sc@canada.ca
2.2 Exigences réglementaires liées aux frais à payer pour le droit de vendre une drogue
2.2.1 Émission d’identification numérique de drogue (DIN)
Avant que la vente d’une drogue soit autorisée au Canada, un DIN doit lui être assigné conformément à l’article C.014.2 ou C.08.002 du Règlement sur les aliments et drogues.
2.2.2 Formulaire de déclaration de médicament (FDM)
Lors de l’émission d’un DIN, un FDM est fourni au fabricant qui doit le remplir et le retourner conformément à l’article C.01.014.3 du Règlement sur les aliments et drogues, dans les trente (30) jours suivant le début de la vente de la drogue au Canada.
2.2.3 Notification annuelle
Conformément à l’article C.01.014.5 du Règlement sur les aliments et drogues, le fabricant d’une drogue est tenu, avant le 1er octobre de chaque année, de faire parvenir à Santé Canada une notification signée confirmant que tous les renseignements fournis antérieurement par le fabricant à l'égard de cette drogue sont toujours exacts.
2.2.4 DIN dormant
Pour tous les produits commercialisés auxquels une identification numérique de drogue a été attribuée conformément à l’article C.01.014.2(1) du Règlement, le fabricant doit indiquer sur le FNAD lorsque la drogue n’a pas été vendue pendant une période de douze mois consécutifs. Le DIN de ce produit sera alors considéré comme étant dormant. Dépendamment du type de produit, d’autres exigences qui ne sont pas reliées au FNAD pourraient s’appliquer. Veuillez consulter la section 6.3.2 de la ligne directrice Annulation d’une identification numérique de drogue (DIN) et avis de cessation de la vente d’une drogue pour de plus amples informations.
2.2.5 Avis de cessation de la vente
En vertu de l’article C.01.014.7 du Règlement modifiant le Règlement sur les aliments et drogues (pénuries de drogues et cessation de la vente de drogues), si la vente d’une drogue au Canada a cessé, le fabricant doit envoyer un avis à Santé Canada dans les trente (30) jours suivant la date de cessation de la vente de cette drogue. L'avis doit présenter les renseignements suivants :
- l’identification numérique de drogue (DIN) attribuée à cette drogue aux termes du paragraphe C.01.014.2 (1);
- la date à laquelle le fabricant a cessé la vente de la drogue; et
- la date limite d’utilisation la plus tardive attribuée à la drogue que le fabricant a vendue et le numéro de lot de celle-ci.
Omission d’informer Santé Canada de la cessation de la vente
Si la vente d’un produit a cessé mais qu’aucun avis écrit n’a été reçu par Santé Canada avant le 1er octobre, le fabricant reste responsable du paiement des frais liés au droit de vendre.
Si la propriété d’un produit a été transférée à une autre société, et que le nouveau propriétaire a mis le produit sur le marché sous un autre DIN ; le titulaire du DIN antérieur doit aviser Santé Canada si la vente de son produit a cessée, à défaut de quoi, les frais annuels à payer pour le droit de vendre seront appliqués à la fois à l’ancien et au nouveau DIN puisque, selon les dossiers de Santé Canada, les deux DINs sont sur le marché.
2.3 Paiement des frais
Des instructions sur le paiement des frais figurent dans le document intitulé Comment acquitter les frais exigés.
2.3.1 Qui est responsable du paiement?
La personne nommée au dossier en qualité de titulaire du DIN à la date à laquelle la facture est établie est responsable du paiement. La facture et tout relevé mensuel subséquent sont préparés au nom du titulaire du DIN, et sont envoyés au service des affaires réglementaires de la société ou à l’adresse indiquée à titre d’adresse de facturation du titulaire du DIN, sur le Formulaire de notification annuelle de drogue (FNAD).
2.3.2 Où soumettre le paiement de la facture
Santé Canada
Comptes recevables, Indice de l’adresse : 1918B
18ième Pièce, 1804B, Édifice Jeanne-Mance
161, promenade Goldenrod, Pré Tunney
Ottawa, Ontario
KIA OK9
Canada
2.3.3 Frais annuels
En 2011, les frais annuels exigés pour le droit de vendre une drogue à laquelle un DIN a été assigné sont établis à 1 020 $. Notez qu'il y a une augmentation annuelle des frais (voir Rajustements des frais ci-dessous pour plus d'informations).
Les frais doivent être acquittés avant l’année à laquelle ils s’appliquent. Par exemple, les frais acquittés le 1er octobre 2011 s’appliquent au droit de vendre du 1er octobre 2011 au 30 septembre 2012. La seule exception entre en jeu lorsqu’il y a un différé de frais pour une drogue qui n’a pas terminé sa première année civile sur le marché (pour de plus amples renseignements, voir la section 2.4).
Rajustement des frais
Les frais à payer pour le droit de vendre sont majorés annuellement de 2 % et arrondis au dollar supérieur, à compter du 1er avril 2012. Un facteur de rajustement annuel est nécessaire pour assurer le maintien du respect des normes de service. Chaque année, un avis d’intention faisant état des frais modifiés sera publié dans la Gazette du Canada, Partie I. En outre, tous les trois ans, Santé Canada examinera les coûts liés à la prestation des services et proposera de nouveaux frais ou des frais modifiés, pour tenir compte des résultats de ces examens, au besoin.
2.3.4 Quand payer les frais
Des frais sont exigés pour le droit de vendre un produit au cours de l’année suivante débutant le 1er octobre et prenant fin le 30 septembre de l’année subséquente. Les factures pour les frais annuels à payer pour le droit de vendre sont envoyées le 1er octobre de chaque année et doivent être acquittées dans un délai de trente (30) jours.
Ne joignez pas le paiement au FNAD rempli en août.
Afin de rappeler aux fabricants le processus de renouvellement annuel, Santé Canada fait parvenir à chacun d’eux, en juin, une trousse de renouvellement annuel, contenant les documents suivants :
- le FNAD, qui contient une liste des drogues auxquels un DIN a été assigné et qui, à la date d’impression, avaient fait l’objet d’un avis indiquant qu’ils étaient offerts en vente au Canada, sont approuvés pour la vente au Canada ou sont en état de dormance (n'ont pas été sur le marché canadien pour la vente pendant au moins 12 mois consécutifs) et au sujet desquels Santé Canada n’a pas reçu d’avis de cessation de vente;
- des instructions sur la façon de remplir le FNAD;
- le Formulaire d’attestation et de demande de remise des frais pour le droit de vendre une drogue;
- le Formulaire pour la cessation de la vente de médicaments;
- tout autre renseignement jugé nécessaire.
Le FNAD rempli et, s’il y a lieu, un Formulaire d’attestation et de demande de remise des frais pour le droit de vendre une drogue doivent être soumis à Santé Canada au plus tard à la mi-août (voir la section 2.5 pour de plus amples renseignements sur les remises de frais). Ce processus donne le temps de valider les demandes de remise des frais et de les appliquer à la facture.
2.4 Différé de frais et exigibilité du paiement différé
Le paragraphe 35. (4) du Règlement sur les prix à payer stipule que dans le cas où le fabricant n’a pas terminé sa première année civile de ventes d’une drogue, le paiement des frais est différé jusqu’à la fin de la première année civile terminée au cours de laquelle la drogue était offerte sur le marché (c’est-à-dire, est exigible le 1er janvier suivant l’achèvement de la première année civile). Ce différé permet aux fabricants d’accumuler des données sur les recettes réelles générées par la vente du nouveau produit au cours de sa première année civile de ventes, en vue de déterminer si le fabricant est admissible à une remise des frais (pour de plus amples renseignements sur la remise des frais différés, voir la section 2.5.3 ci-dessous).
Le total des frais exigibles le 1er janvier comprend les frais pour chaque période allant du 1er octobre au 30 septembre qui a commencé. Bien que les frais soient exigibles le 1er janvier, Santé Canada n’émet pas de facture avant le mois de février. Les frais à payer sont exigible dans les trente (30) jours suivant émission de la facture.
La figure 1 montre un exemple du moment où un paiement serait exigible pour un produit dont la vente commence en mai 2011. Le paiement des frais pour la période A est différé jusqu’à la fin de la première année civile. Ce paiement est exigible le 1er janvier 2013. Le paiement des frais pour la période B est également différé jusqu’au 1er janvier 2013. En février 2013, le fabricant sera facturé ainsi :
1 020 $ (période A) + 1 020 $ (période B) + 2 % x 1 020 $ (augmentation annuelle) = 2 061 $
Figure 1
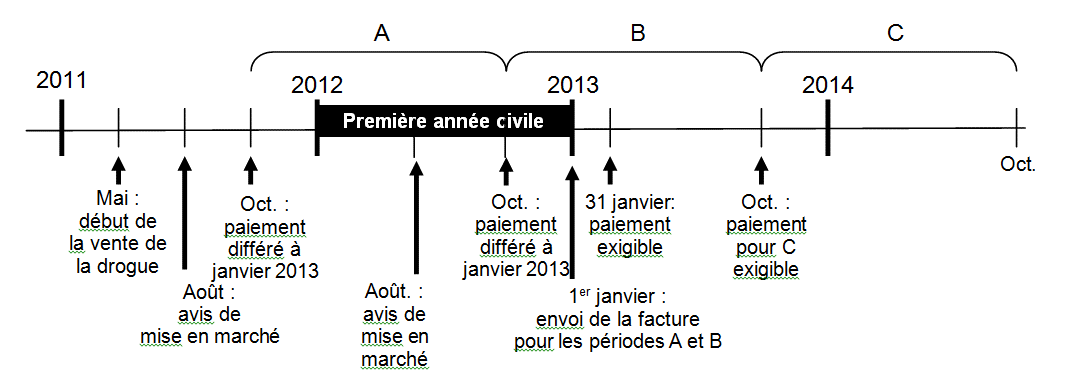
Figure 1 - Description
Le présent diagramme montre le schéma chronologique relatif au report dans le cas d'un médicament dont la vente a débuté en mai 2011. L'acquittement des frais à payer pour le droit de vendre en 2011-2012 et 2012-2013 est reporté à la fin de la première civile pendant laquelle le médicament a été vendu (2012) ou, comme indiqué, en janvier 2013. Le diagramme montre que l'acquittement des frais à payer pour le droit de vendre en 2013-2014 n'est pas reporté et est exigé au moment de l'avis en octobre. Il montre également que le formulaire annuel d'avis de mise sur le marché doit être renvoyé en août.
2.5 Remise des frais
2.5.1 Admissibilité à une remise des frais
Pour que le fabricant soit admissible à une remise des frais aux termes du paragraphe 35. (2) du Règlement sur les prix à payer, les frais à payer doivent excéder 1,5 % des RBR du fabricant provenant de la vente de la drogue au Canada au cours de l’année civile antérieure.
Fabricants à l’extérieur du Canada
Les fabricants qui sont propriétaires de produits pharmaceutiques et qui sont à l’extérieur du Canada doivent déterminer leur admissibilité à une remise des frais en utilisant leurs RBR provenant du total des ventes de tous les produits pharmaceutiques ayant le même DIN au Canada. Ainsi, si le fabricant vend les produits pharmaceutiques avec le même DIN par l’intermédiaire de plus qu’un importateur au Canada, la remise des frais est fondée sur les RBR que le fabricant tire des ventes de tous les importateurs de la drogue avec le même DIN.
2.5.2 Documentation (Formulaire d’attestation et de demande de remise des frais pour le droit de vendre une drogue)
Conformément au paragraphe 35.(2) du Règlement sur les prix, pour qu’une remise des frais soit accordée, le fabricant doit joindre au FNAD rempli une déclaration certifiée par la personne responsable de ses affaires financières, faisant état des RBR provenant de la vente de la drogue au cours de l’année civile antérieure, c’est-à-dire le Formulaire d’attestation et de demande de remise des frais pour le droit de vendre une drogue.
Il convient de noter qu’une remise des frais sera automatiquement appliquée à tous les DIN dormants, étant donné que ces produits n’ont pas été vendus sur le marché canadien pendant une période de 12 mois consécutifs. Les fabricants ne sont pas tenus de remplir le Formulaire d'attestation et de demande de remise des frais pour le droit de vendre des drogues pour ces produits. Ces produits ne seront pas inclus dans le calcul des frais annuels habituels facturés en octobre.
Veuillez consulter l'article 2.5.4 pour l’information au sujet des DIN dormants pour lesquels les frais pour le droit de vendre ont été différés.
Personne financièrement responsable pour plusieurs fabricants
Les personnes responsables des affaires financières de plusieurs fabricants doivent soumettre un formulaire d’attestation distinct à des fins de remise des frais pour chacun des fabricants à qui un code de compagnie particulier a été attribué. Le code de compagnie est constitué d’un numéro de quatre ou cinq chiffres assigné par la Base de données sur les produits pharmaceutiques. Il est utilisé comme numéro de compte et figure au-dessus du nom du titulaire du DIN, sur le FNAD.
RBR remises en question par Santé Canada avant l’envoi de la facture
Si, selon quelque renseignement dont Santé Canada dispose, il est déterminé que la déclaration soumise par le fabricant ou par la personne responsable de ses affaires financières est inexacte ou insuffisante pour déterminer les RBR du fabricant au cours de l’année civile antérieure, Santé Canada pourra exiger que le fabricant présente un ou des registres des ventes qui ont été vérifiés par un vérificateur financier indépendant. Ces registres des ventes serviront à déterminer les frais exigibles. Une facture faisant état des frais exigibles confirmés ou corrigés sera envoyée. Si le fabricant ne fournit pas les registres des ventes vérifiés demandés par Santé Canada, dans un délai de soixante (60) jours suivant la date de la demande, une facture établie pour le total des frais applicables sera envoyée.
RBR remises en question par Santé Canada après l’envoi de la facture
Si, selon quelque renseignement dont Santé Canada dispose, il est déterminé que la déclaration soumise par le fabricant ou par la personne responsable de ses affaires financières est inexacte, ou insuffisante pour déterminer les RBR du fabricant au cours de l’année civile antérieure, Santé Canada pourra exiger que le fabricant présent des registres des ventes qui ont été vérifiés par un vérificateur financier indépendant. Si les registres des ventes soumis par le fabricant établissent que la remise des frais calculée et soumise par le fabricant est exacte, aucune autre mesure ne sera prise. Si les registres des ventes établissent que les frais calculés et soumis par le fabricant sont inférieurs au montant exigible aux termes de l’article 35 du Règlement sur les prix, la différence est exigible immédiatement. Si les registres des ventes présentés établissent que les frais exigibles sont inférieurs au montant soumis par le fabricant, le montant excédentaire sera remboursé au fabricant.
2.5.3 Calcul des frais à des fins de remise
Si le fabricant satisfait les conditions d’admissibilité à la remise des frais, les frais sont calculés ainsi : (à supposer que les frais se chiffrent à plus de 1,5 % des RBR)
RBR x 1,5 % = frais exigibles
Par exemple : En se basant sur des RBR de 58 000 $ et des frais à payer de 1 020 $ pour le droit de vente, les frais avec remise exigibles seraient de 58 000 $ x 1,5 % = 870 $. Le fabricant recevrait une facture de 870 $.
2.5.4 Calcul et demande de remise des frais lorsque le paiement a été différé
Admissibilité à une remise des frais, et calcul des frais
Pour que le fabricant soit admissible à une remise des frais aux termes du paragraphe 35. (2) du Règlement sur les prix, les frais à payer pour le droit de vendre doivent être supérieurs à 1,5 % des RBR du fabricant provenant de la vente de la drogue au Canada au cours de sa première année civile.
Par exemple, à la figure 1 (à supposer que le fabricant soit admissible à une remise), les frais exigibles au 1er janvier 2013 seraient calculés ainsi :
1,5 % x RBR (première année civile) x 2 (pour les périodes A et B) = frais exigibles
Demande de remise des frais différés
Si le fabricant est admissible à une remise des frais différés, il doit remplir un Formulaire d’attestation et de demande de remise des frais pour le droit de vendre une drogue et le soumettre à Santé Canada avant le 20 janvier suivant l’achèvement de la première année civile complète durant laquelle le produit a été offert sur le marché. Si le 20 janvier est un samedi ou un dimanche, alors la date limite est remise au premier lundi suivant le 20 janvier. Ce formulaire est accompagné d’une déclaration certifiée par la personne responsable des affaires financières du fabricant, établissant les RBR provenant de la vente de la drogue au cours de la première année civile. Santé Canada examinera la documentation et émettra une facture en février avec les frais appropriés à payer dans les trente (30) jours.
Le fabricant doit être prêt à soumettre, sur demande, des renseignements supplémentaires concernant la détermination des RBR, comme il est expliqué à la section 2.5.2.
Demande de remise des frais différés pour les DIN dormants
Les fabricants sont tenus de présenter le Formulaire d'attestation et de demande de remise des frais pour le droit de vendre des drogues pour les DIN dormants dont le paiement a été différé si des ventes de ces produits ont été réalisées au cours de la première année civile terminée. Toutefois, si les ventes ont cessé avant le début de la première année civile complète, la remise des frais sera automatiquement appliquée à ces DIN dormants. Vous trouverez ci-dessous deux exemples illustrant ces deux scénarios.
Scénario 1 – Ventes réalisées au cours de la première année civile terminée
La figure 2 donne un exemple d’un DIN dormant dont le paiement a été différé, pour lequel le Formulaire d'attestation et de demande de remise des frais pour le droit de vendre des drogues devrait être présenté si les frais pour le droit de vendre excèdent 1,5 % des recettes brutes réelles (RBR) perçus par le fabricant et provenant de la vente de cette drogue au Canada.
Figure 2
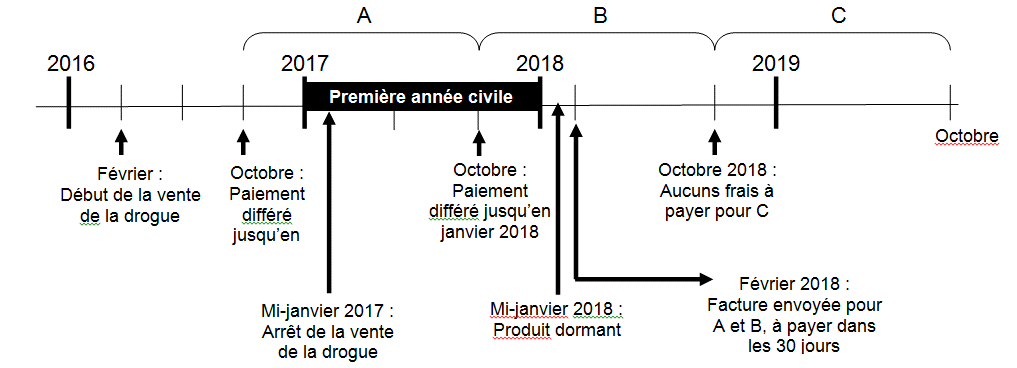
Figure 2 - Description
La figure 2 donne un exemple dun DIN dormant dont le paiement a été différé, pour lequel le Formulaire d'attestation et de demande de remise des frais pour le droit de vendre des drogues devrait être présenté si les frais pour le droit de vendre excèdent 1,5 % des recettes brutes réelles (RBR) perçus par le fabricant et provenant de la vente de cette drogue au Canada.
Dans cet exemple, le produit est déclaré comme commercialisé en février 2016; sa vente est arrêtée à la mi-janvier 2017; puis, à la mi-janvier 2018, ce DIN devient dormant après un arrêt de vente de 12 mois consécutifs.
Les frais différés pour le droit de vendre ce produit seront facturés en février 2018 pour la période de facturation A (octobre 2016) ainsi que la période de facturation B (octobre 2017). Pour être admissible à une remise des frais, le fabricant doit présenter le Formulaire d'attestation et de demande de remise des frais pour le droit de vendre des drogues en fonction des ventes réalisées de janvier 2017 à décembre 2017 (la première année civile terminée), avant l’émission de la facture.
Scénario 2 - Aucune vente réalisée au cours de la première année civile terminée
La figure 3 donne un exemple d’un DIN dormant dont le paiement a été différé et pour lequel il n’est pas requis de présenter le Formulaire d'attestation et de demande de remise des frais pour le droit de vendre des drogues.
Figure 3
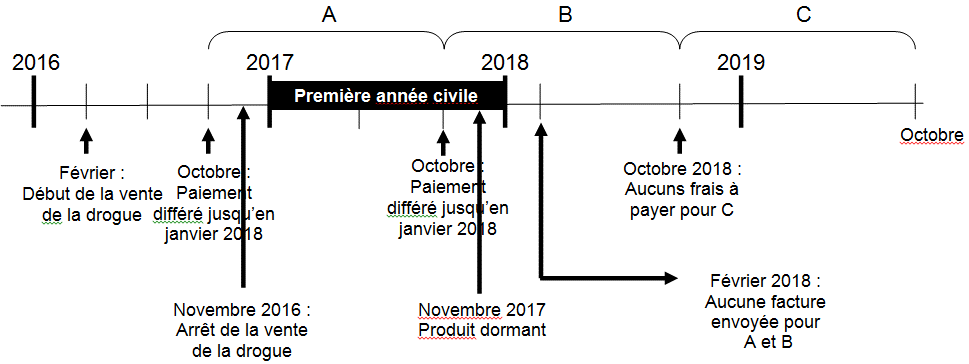
Figure 3 - Description
La figure 3 donne un exemple d’un DIN dormant dont le paiement a été différé et pour lequel il nest pas requis de présenter le Formulaire d'attestation et de demande de remise des frais pour le droit de vendre des drogues.
Dans cet exemple, le produit est déclaré comme commercialisé en février 2016; sa vente est arrêtée en novembre 2016; puis, en novembre 2017, ce DIN devient dormant après un arrêt de vente de 12 mois consécutifs.
Dans ce scénario, puisqu’aucune vente n’a été réalisée au cours de la première année civile terminée (de janvier à décembre 2017), une remise des frais sera automatiquement appliquée à ce produit. Les fabricants ne sont pas tenus de remplir le Formulaire d'attestation et de demande de remise des frais pour le droit de vendre des drogues, et le coût pour ce produit ne sera pas inclus dans les frais différés en février.