Foire aux questions - Portail commun de demandes électroniques
Foire aux questions
1. Comment fonctionne le Portail commun de demandes électroniques (PCDE)?
Le PCDE permet aux partenaires commerciaux d'envoyer des transactions réglementaires à Santé Canada par voie électronique, c'est-à-dire un service de messagerie « électronique ». Depuis janvier 2017, le PCDE est la méthode de transmission obligatoire pour les transactions réglementaires en format eCTD (Electronique Common Technical Document). Toutefois, les transactions dont la taille dépasse 10 Go doivent continuer d'être envoyées au moyen de supports électroniques.
Voir la figure 1 qui illustre l'architecture de haut niveau du PCDE :
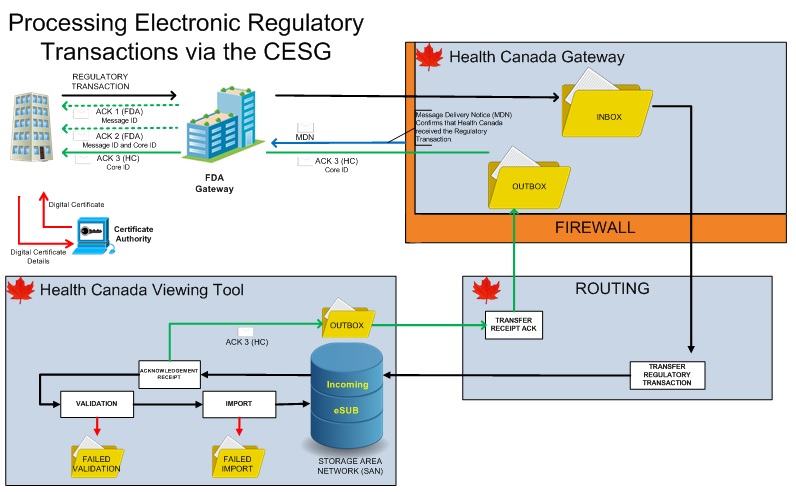
Figure - Description textuelle
Le partenaire commercial (PC) demande un certificat numérique à l'autorité de certification (AC). L'AC attribue un certificat numérique au PC.
Le PC transmet une transaction électronique réglementaire qui est d'abord reçue par le volet de la Food & Drug Administration (FDA) du portail. Le PC reçoit deux accusés de réception de la FDA lorsque la transmission est achevée.
Après avoir traversé le pare-feu, la transaction réglementaire est acheminée dans la boîte de réception du volet de Santé Canada du portail. La transaction réglementaire est transmise au réseau de stockage de l'outil de visualisation de Santé Canada.
Un accusé de réception est créé et enregistré dans la boîte d'envoi. Cet accusé de réception est ensuite réacheminé par l'entremise des volets de Santé Canada et de la FDA du portail, puis envoyé au partenaire commercial. Un avis de livraison de message (MDN, de l'anglais Message Delivery Notification) est également envoyé au portail de la FDA pour confirmer que Santé Canada a reçu la transaction réglementaire.
La transaction réglementaire est validée et importée. Si la validation échoue, la transaction réglementaire est placée dans le dossier des échecs de validation. Si l'importation échoue, la transaction réglementaire est placée dans le dossier des échecs d'importation. Si le contrôle est réussi, la transaction réglementaire est enregistrée dans la section du réseau de stockage réservée aux présentations électroniques reçues.
2. Comment puis-je devenir un partenaire commercial afin d'utiliser le PCDE?
Veuillez consulter le Guide de l'utilisateur de la FDA pour obtenir des renseignements sur le processus d'inscription.
3. Est-il nécessaire d'envoyer également une lettre d'autorisation à Santé Canada (Annexe E du guide de l'utilisateur de la FDA) lors de la création d'un compte ESG ?
Il n'est pas nécessaire d'envoyer la lettre d'autorisation à Santé Canada lors de la création d'un compte ESG, mais uniquement à la FDA, conformément au guide de l'utilisateur.
4. Je suis déjà inscrit à titre de partenaire commercial auprès de la FDA. Dois-je posséder un compte de Santé Canada?
Si vous êtes déjà inscrit à titre de partenaire commercial auprès de la FDA et que vous souhaitez interagir avec Santé Canada par l'intermédiaire du PCDE, vous n'avez pas besoin de créer un nouveau compte. Vous pouvez utiliser votre compte existant et sélectionner « SC » comme centre d'examen.
5. Que signifient les différents avis reçus par le PCDE?
Lorsque vous utiliserez le PCDE pour envoyer une transaction au centre « HC », vous recevrez 3 messages. Le premier message, Message Disposition Notifications (MDN), sera envoyé par la FDA et indiquera que la partie FDA du portail a bien reçu votre transaction réglementaire et comprendra votre numéro d'identification du message (MessageID). Le second message sera un nouvel accusé de réception de la FDA, qui contient à la fois le numéro d'identification du message (MessageID) et le numéro d'identification principal (CoreID). Le troisième message (accusé de réception de Santé Canada, voir la figure 4) sera envoyé par Santé Canada et indiquera que votre transaction réglementaire a bien été reçue par la partie Santé Canada du PCDE, et contiendra l'ID général
La figure 2 illustre la façon dont le MDN et les accusés de réception de la FDA et de Santé Canada apparaissent dans les messages du WebTrader :
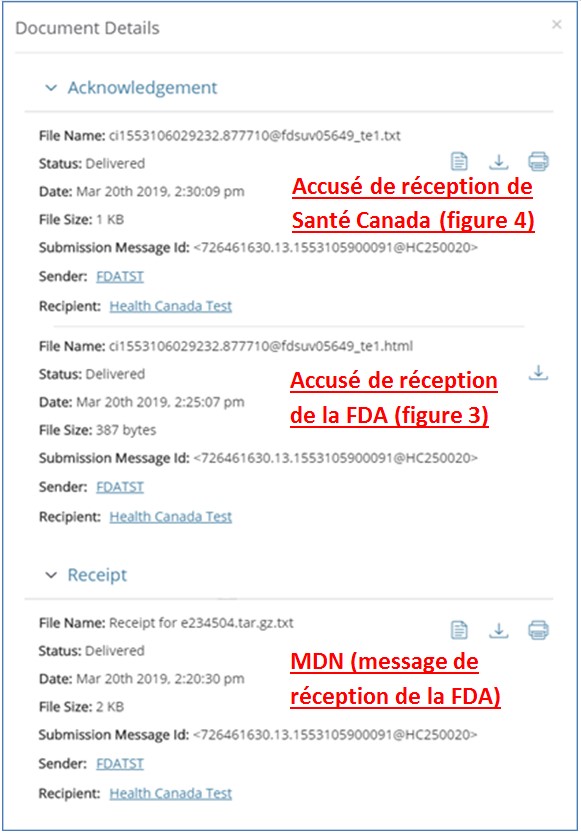
Figure - Description textuelle
Illustre la façon dont le Message Disposition Notification (MDN) et les accusés de réception de la FDA et de Santé Canada apparaissent dans les messages du WebTrader.
La figure 3 illustre le nouvel accusé de réception de la FDA, qui contient à la fois le numéro d'identification du message (MessageID) et le numéro d'identification principal (CoreID).

Figure - Description textuelle
Image d'un accusé de réception de la FDA qui contient à la fois le numéro d'identification du message (MessageID) et le numéro d'identification principal (CoreID).
6. Où se trouve le timbre horodateur indiquant que Santé Canada a reçu la transaction réglementaire?
Le timbre horodateur que Santé Canada utilise pour indiquer la date et l'heure de réception figure dans l'accusé de réception de Santé Canada et est surligné dans la figure 4.

Figure - Description textuelle
Image d'un accusé de réception de Santé Canada où le timbre horodateur a été surligné. Dans cet exemple, la date et l'heure qui est surligné est 03202019142628, qui peut être lu comme le 20 mars 2019 à14:26:28.
Le timbre horodateur « 03202019142628 » doit être lu de la façon suivante « Mois/Jour/Année/Heure/Minute/Seconde » ou « 20 mars 2019 à 14 h 26 m 28 sec ».
7. Comment les transactions sont-elles gérées par Santé Canada lorsqu'elles sont reçues après la fermeture des bureaux, les fins de semaine, ou lors des jours fériés?
Ces transactions sont traitées en conformité avec les pratiques actuelles. Toutes les transactions réglementaires reçues après 17 h, heure normale de l'Est, les fins de semaine ou les jours fériés sont considérées reçues le jour ouvrable suivant par Santé Canada.
8. Quelles transactions réglementaires doivent être envoyées par l'intermédiaire du PCDE?
À l'heure actuelle, les transactions réglementaires suivantes doivent obligatoirement être envoyées par l'intermédiaire du PCDE.
- Transactions en format eCTD
- Transactions pour les fichiers XML du processus d'inscription réglementaire (PIR) (en format eCTD et non eCTD)
9. Quelle structure de dossier doit être utilisée pour envoyer les transactions réglementaires par l'intermédiaire du PCDE?
Santé Canada exige que les partenaires commerciaux incluent le dossier principal lorsqu'ils envoient une transaction par l'intermédiaire du PCDE. La figure 5 illustre la structure de dossier acceptable.

Figure - Description textuelle
Illustre la structure de dossier acceptable pour l'envoi de transactions réglementaires par l'intermédiaire du PCDE incluant le Dossier de premier niveau et le Dossier du numéro de séquence. Dans cet exemple, le dossier de premier niveau est e004567 et le numéro de dossier séquence est 0000.
10. La transaction réglementaire révisée qui a échouée la validation peut-elle être renvoyée par l'intermédiaire du PCDE?
Oui.
11. Que dois-je faire si je ne reçois pas l'accusé de réception de Santé Canada?
Le partenaire commercial devra en aviser Santé Canada par courriel à hc.cesg-pcde.sc@canada.ca.
12. Que doit-on faire s'il manque des renseignements dans l'accusé de réception de Santé Canada?
Le partenaire commercial doit vérifier que le dossier principal a été joint lorsqu'il a envoyé la transaction réglementaire. S'il n'a pas été joint, veuillez soumettre de nouveau la transaction avec le dossier principal. S'il a été joint, veuillez fournir l'accusé de réception à Santé Canada par courriel à hc.cesg-pcde.sc@canada.ca.
13. Si l'accusé de réception de Santé Canada n'a pas été reçu, la transaction doit-elle être envoyée de nouveau?
Veuillez ne pas renvoyer une transaction si vous ne recevez pas tout de suite l'accusé de réception de Santé Canada. En fonction de la taille du fichier, l'envoi de l'accusé de réception pourrait prendre une heure ou plus. Les partenaires commerciaux ne doivent pas renvoyer de transactions à moins que Santé Canada le leur demande. Si vous souhaitez vérifier que votre transaction a bien été reçue, veuillez communiquer avec hc.cesg-pcde.sc@canada.ca.
14. Les signatures électroniques sont-elles acceptées par la Direction générale des produits de santé et aliments (DGPSA) et peuvent-elles être utilisées pour la présentation par l'intermédiaire du PCDE?
Oui, les signatures électroniques sont acceptées par la DGPSA conformément à la Politique de signature électronique de la DGPSA. Elles sont coordonnées avec les directions et traitées au cas par cas. La politique, qui a été corédigée avec l'industrie, est fournie sur demande par courriel à hc.cesg-pcde.sc@canada.ca.
15. Quelles sont quelques-unes des différences terminologiques entre la FDA et Santé Canada?
Lorsque vous utiliserez le PCDE, vous remarquerez des différences dans la terminologie utilisée par la FDA et Santé Canada. Le Tableau 1 compare les termes semblables utilisés par la FDA et Santé Canada
| Terme de la FDA | Terme de Santé Canada |
| ESG de la FDA (Electronic Submissions Gateway de la FDA) | PCDE (Portail commun de demandes électroniques) |
| Partenaire de transaction | Partenaire commercial |
| Soumission | Transactions réglementaires |
Veuillez noter que dans certains cas, ces termes sont interchangeables lorsque l'on correspond avec Santé Canada et la FDA.
16. Avec qui dois-je communiquer pour obtenir des renseignements complémentaires sur le PCDE?
Veuillez consulter la section des Demandes de renseignements et soutien pour déterminer à qui vous devez adresser vos questions.
17. Quelle est la longueur maximale du chemin d'accès, incluant le nom de fichier, pour les transactions réglementaires envoyées par l'intermédiaire du PCDE?
La longueur maximale du chemin d'accès pour les transactions réglementaires envoyées par l'intermédiaire du PCDE est de 200 caractères.
18. Est-il possible d'envoyer plusieurs transactions simultanément pour un même
dossier?
Non. Les transactions réglementaires (séquences) pour un dossier doivent être envoyées séparément. Les promoteurs doivent avoir obtenu l'accusé de réception de Santé Canada pour une transaction avant d'envoyer la transaction suivante. Si les transactions en format eCTD ne sont pas reçues dans le bon ordre, cela entrainera une transaction manquante et une erreur d'eCTD (« Numérotation » (A07)) sera générée au moment de la validation.
19. Est-il recommandé d'envoyer les transactions réglementaires à un moment particulier de la journée?
Conformément à la foire aux questions de la FDA concernant le processus et les politiques liés au Portail commun de demandes électroniques (PCDE), Santé Canada recommande d'envoyer les transactions réglementaires qui sont volumineuses (5 Go à 10 Go) après 16 h 30 HNE. De cette manière, votre transaction peut être traitée et livrée à Santé Canada au cours de la nuit. Pour de plus amples renseignements au sujet des transactions volumineuses, consultez la foire aux questions de la FDA et la section 5.7 du guide de l'utilisateur de la FDA concernant le PCDE. Pour déposer des fichiers dont la taille dépasse 10 Go, il faudra continuer d'utiliser des supports électroniques. Pour obtenir des détails sur le dépôt de fichiers à l'aide d'un support électronique, veuillez consulter l'alinéa 3.2 ii) de la Ligne directrice : Préparation des activités de réglementation en format eCTD.