Guide des bonnes pratiques d’étiquetage et d’emballage pour les médicaments sur ordonnance

Télécharger le format de rechange
(Format PDF, 1.32 MB, 77 pages)
Organisation: Santé Canada
Publié: 2019-06-21
Préambule
Toutes les mesures possibles ont été prises pour assurer l'exactitude de l'information fournie dans le Guide. Le Guide repose sur les renseignements qui étaient disponibles durant sa rédaction, et il a pour but de décrire les points initiaux à considérer lorsque l'on décide du contenu et de la conception des étiquettes et des emballages. Il est à prévoir que d'autres études sur les divers sujets abordés dans le Guide seront publiées ultérieurement, auquel cas des modifications seront apportées au document afin d'y intégrer ces nouvelles informations, s'il y a lieu.
Le présent document doit être lu en parallèle avec les sections pertinentes des règlements et des autres politiques et documents d'orientation applicables de Santé Canada.
Structure du Guide
Le Guide est divisé en trois parties.
La partie 1 contient l'objectif, l'introduction et la portée. Elle donne aussi un aperçu du processus de rédaction du Guide.
La partie 2 souligne l'importance du point de vue de l'utilisateur. Elle met l'accent sur la nécessité de prendre en considération l'environnement dans lequel les produits de santé sont choisis et utilisés. Cette perspective est destinée à servir de point de référence à toutes les autres sections du Guide.
La partie 3 aborde les éléments précis de la conception des étiquettes et des emballages du point de vue de la sécurité. La section sur chaque composante fournit des renseignements contextuels, suivis de recommandations.
Les annexes contiennent les renseignements supplémentaires présentés ci-après.
Annexe 1 : Glossaire
Annexe 2 : Principes liés aux facteurs humains et méthodes d'évaluation applicables à l'étiquetage et à l'emballage
Annexe 3 : Schémas d'utilisation des produits
Annexe 4 : Remerciements
Toutes les parties du Guide et ses sections sont interreliées et devraient être considérées comme un tout - aucun sujet ne devrait être examiné isolément.
Table des matières
- 1 Aperçu du guide
- 2 Tenir compte des utilisateurs et de leurs environnements
- 3 Concevoir des étiquettes et des emballages à des fins de sécurité
- 3.1 Introduction
- 3.2 Planifier la conception des étiquettes et des emballages
- 3.3 Conception et disposition
- 3.3.1 Style et taille des caractères
- 3.3.2 Recours aux lettres majuscules (lettrage « TALLman »)
- 3.3.3 Proximité et compatibilité de l'information figurant sur la partie principale
- 3.3.4 Espace blanc
- 3.3.5 Couleur et contraste
- 3.3.6 Utilisation d'abréviations, de symboles et d'indications de dose
- 3.3.7 Étiquettes bilingues
- 3.3.8 Logo, image de marque et présentation commerciale
- 3.3.9 Permanence
- 3.4 Information sur l'étiquette
- 3.5 Emballage
- Annexe 1 - Glossaire
- Annexe 2 - Principes liés aux facteurs humains et méthodes d'évaluation applicables à l'étiquetage et à l'emballage
- Annexe 3 - Schémas d'utilisation des produits
- Annexe 4 - Remerciements
- Références
1 Aperçu du guide
1.1 Objectif
Le Guide des bonnes pratiques d'étiquetage et d'emballage pour les médicaments sur ordonnance a pour but de fournir des orientations aux promoteurs, aux fabricants et aux titulaires d'une licence (dénommés les « promoteurs » dans le Guide) pour la conception des étiquettes et des emballages sécuritaires et clairs.
Il est essentiel que toutes les exigences réglementaires soient respectées en ce qui a trait à l'étiquetage et à l'emballage.
Les recommandations contenues dans ce Guide aideront le promoteur à structurer (a) l'information requise par la réglementation et (b) toute autre information complémentaire importante propre à l'identification, à la sélection et à l'utilisation du produit. L'information est présentée à l'appui de la conception des étiquettes et des emballages clairs et efficaces afin de minimiser le risque d'erreur pouvant causer un préjudice.
1.2 Introduction
L'étiquette et l'emballage constituent les premiers points d'interaction entre un produit de santé et un professionnel de la santé ou un patient. Ils permettent de communiquer de l'information clé à propos de l'utilisation sûre et appropriée de produits de santé, et ils jouent un rôle important dans l'identification, la sélection et l'administration des produits. La capacité de procéder de façon sécuritaire à l'identification, à la sélection et à l'administration d'un produit dépend de la capacité de l'utilisateur à lire et à comprendre l'information qui apparaît sur l'étiquette.
Par l'entremise de l'Initiative sur l'étiquetage en langage clair, un nouveau règlement modifiant le Règlement sur les aliments et drogues (étiquetage, emballage et marques nominatives des drogues pour usage humain)Note de bas de page 1 a été adopté dans le but d'améliorer l'utilisation sûre de médicaments en rendant l'information sur les étiquettes de médicaments plus faciles à lire et à comprendre. Ces modifications comprennent une exigence pour l'ajout des coordonnées sur l'étiquette et la présentation des maquettes d'étiquettes et d'emballages. Le contenu du Guide fournira de l'information qui respecte les objectifs de l'Initiative sur l'étiquetage en langage clair.
1.3 Portée
Le Guide porte essentiellement sur les étiquettes et les emballages intérieur et extérieur des produits de santé suivants pour usage humain :
- produits pharmaceutiques sur ordonnance;
- produits biologiques et radiopharmaceutiques;
- médicaments qui peuvent être vendus sans ordonnance, mais qui sont obtenus ou administrés uniquement sous la direction d'un professionnel de la santé (p. ex. nitroglycérine, insuline, épinéphrine injectable en cas de réaction allergique).
Ils sont désignés par les termes « produits » ou « produits de santé » dans le Guide.
Le Guide ne s'applique pas au sang entier et à ses composants relevant du Règlement sur le sangNote de bas de page 2; aux cellules, tissus et organes visés par le Règlement sur la sécurité des cellules, tissus et organes humains destinés à la transplantationNote de bas de page 3; aux produits de santé en vente libre, aux désinfectants assimilés à une drogue, aux produits médicamenteux utilisés dans le cadre d'essais cliniques, aux ingrédients pharmaceutiques actifs et aux médicaments à usage vétérinaire.
Le Guide se veut un complément du document de Santé Canada Ligne directrice - Étiquetage des médicaments pharmaceutiques destinés à l'usage des humainsNote de bas de page 4 et est conforme au Règlement sur les aliments et drogues de la Loi sur les aliments et droguesNote de bas de page 5.
Les aspects de l'étiquetage qui ne sont pas visés sont le nom du produit de santé (voir le document Ligne directrice à intention de l'industrie - Examen des marques nominatives de médicamentsNote de bas de page 6), les étiquettes apposées par l'utilisateur, les monographies de produit, les dépliants d'accompagnement (p. ex. les renseignements posologiques) et les renseignements pour les patients sur les médicaments.
1.4 Documents consultés pour la rédaction du guide
De nombreux documents offrant des orientations pour optimaliser la conception et le contenu des étiquettes et des emballages des produits de santé ont été publiés afin de favoriser l'utilisation sécuritaire des produits de santé. Nous avons examiné toutes ces publications et d'autres études et consultations sur le sujet, notamment les suivantes, et les avons adaptées pour rédiger le Guide :
- règlements, normes, politiques et lignes directrices applicables du Canada;
- communications des risques diffusées par Santé Canada visant les étiquettes et les emballages intérieur et extérieur;
- modifications des emballages et des étiquettes et enseignements pertinents tirés des rapports publiés sur des incidents de sécurité où les étiquettes et emballages étaient des facteurs contributifs;
- analyse d'agrégation des erreurs signalées volontairement à l'Institut pour l'utilisation sécuritaire des médicaments Canada (ISMP) dans lesquelles des étiquettes et des emballages sont clairement définis comme des sujets de préoccupation ou des facteurs contributifsNote de bas de page 7Note de bas de page 8;
- prise en considération des questions et principes liés aux facteurs humains (voir l'annexe 2, Principes liés aux facteurs humains et méthodes d'évaluation applicables à l'étiquetage et à l'emballage);
- règlements, normes, politiques et lignes directrices internationaux applicables;
- concepts appliqués à l'étiquetage et à l'emballage des produits de santé par les organisations vouées à la sécurité (National Patient Safety Agency du Royaume-Uni, qui fait maintenant partie du National Health Service du Royaume-Uni, par exemple);
- participation d'un groupe consultatif d'experts internationaux et multidisciplinaires et d'autres intervenants et spécialistes compétents (voir l'annexe 4, Remerciements).
2 Tenir compte des utilisateurs et de leurs environnements
Il faut concevoir un produit de santé qui répond aux besoins des utilisateurs dans l'environnement d'utilisation, plutôt que d'espérer que l'utilisateur ou l'environnement changera pour s'adapter à l'utilisation prévue du produit de santéNote de bas de page 9. Il faut concevoir un gant qui s'adapte à la main, au lieu de choisir une main qui convient à un gant en particulier.
Puisque l'environnement d'utilisation influe sur la façon dont les utilisateurs interagissent avec un produit de santé, il faut en tenir compte quand on conçoit et évalue les étiquettes et les emballages d'un produitNote de bas de page 9. Pour ce qui est d'un médicament sur ordonnance, l'environnement d'utilisation peut comprendre l'endroit où le produit sera utilisé (p. ex. les hôpitaux, les établissements de soins de longue durée, les cabinets des professionnels de la santé et les services de transport d'urgence), l'endroit où le produit sera entreposé, les outils et technologies d'appui (p. ex. les piluliers et distributeurs de pilules, dossiers d'administration de médicaments et technologies de codes à barres) et le niveau d'éclairage.
Il est important que la conception des étiquettes et de l'emballage d'un produit tienne compte des utilisateurs ainsi que de l'environnement et des processus dans lesquels il sera utilisé (entreposé, sélectionné et administré). Une récente analyse d'agrégation des déclarations d'incidents relatifs aux étiquettes ou emballages de produits de santé donne un aperçu des problèmes vécus par des utilisateursNote de bas de page 8. Voici quelques facteurs relevés dans cette analyse qui ont pu contribuer aux erreurs :
- étiquettes et emballages à présentation semblable;
- proéminence de la présentation et de la marque nominative;
- nom propre ou usuel (dénomination commune) du produit pas assez en évidence;
- expression de la concentration pas assez en évidence et pas assez claire;
- lisibilité de l'information (p. ex. taille des caractères, contraste entre le fond et le texte);
- présentation de l'étiquette portant à confusion;
- décalage entre l'affichage de l'information et les perforations sur les plaquettes alvéolaires;
- emploi d'abréviations dangereuses ou trompeuses.
3 Concevoir des étiquettes et des emballages à des fins de sécurité
3.1 Introduction
La partie 3 du Guide fournit de l'information sur les pratiques exemplaires actuelles en ce qui concerne la conception et la présentation de l'étiquette d'un produit de santé, l'information fournie sur l'étiquette et la conception ou le choix d'un emballage et d'un contenant immédiat. Les sujets et les principes englobent divers facteurs qui ont contribué aux incidents liés aux médicaments et divers problèmes répertoriés lors des analyses environnementales réalisées auprès des promoteurs et des utilisateurs.
Même si les divers sujets sont présentés séparément dans la partie 3, ils doivent néanmoins être considérés comme un tout pour favoriser un juste équilibre entre l'uniformisation et la différenciation (p. ex. au sein de la gamme de produits du promoteur). L'uniformisation des étiquettes et du choix des emballages peut réduire les erreurs en renforçant la reconnaissance des formes sur lesquelles s'appuient les humains pour traiter l'informationNote de bas de page 10. Toutefois, plus les étiquettes ou les emballages de produits ont des caractéristiques en commun (p. ex. style des caractères, taille et couleur des caractères, taille et forme du contenant ou de l'emballage, disposition de l'information), plus les produits risquent de se ressembler. L'effet cumulatif des caractéristiques des étiquettes et des emballages peut causer des problèmes de similarité qui font que les utilisateurs ont de la difficulté à différencier les produits. Il faut tenir compte du risque de problèmes de similarité pendant la conception de l'étiquette et de l'emballage du produit. De même, un équilibre est nécessaire lors de la modification des étiquettes et des emballages existants pour empêcher la création de nouveaux problèmes de similarité. Il est tout particulièrement important de concilier l'uniformisation et la différenciation pour prévenir (ou résoudre) les problèmes de similarité des médicaments de niveau d'alerte ou de risque élevé du promoteur.
En plus des sujets abordés dans le Guide, il est vivement recommandé aux promoteurs de tenir compte des facteurs humains lors de la sélection, de l'utilisation et de la manipulation du produit, ainsi que d'envisager des essais par les utilisateurs en misant sur une approche fondée sur le risque (voir l'annexe 2, Principes liés aux facteurs humains et méthodes d'évaluation applicables à l'étiquetage et à l'emballage) pour la conception de l'étiquette et de l'emballage.
3.2 Planifier la conception des étiquettes et des emballages
Au moment de concevoir l'étiquette et l'emballage d'un produit, on recommande vivement aux promoteurs de prendre une série de mesures préparatoires. On présente ci-après un aperçu des mesures que les promoteurs peuvent inclure dans leurs processus de développement et de mise en marché du produit.
- Penser à concevoir l'étiquette et l'emballage du produit dès que possible dans le processus de développement.
- La création de l'emballage devrait commencer tôt. Les facteurs influant sur le choix d'un emballage devraient aller au-delà du maintien de la stabilité, de la facilité de fabrication ou des considérations commerciales. La conception de l'emballage aura aussi une incidence sur la taille des étiquettes intérieure et extérieure.
- Dans le cas des produits à faire approuver au Canada, le promoteur a peut-être déjà de l'expérience sur d'autres marchés. Examiner attentivement les plaintes et les données incidentes pour déterminer s'il convient de modifier l'étiquette ou l'emballage prévu du produit de santé pour le marché canadien.
- Définir les utilisateurs du produit et les environnements d'utilisation.
- Pour concevoir une étiquette et un emballage en vue d'une utilisation sécuritaire, il faut penser aux utilisateurs et aux environnements d'utilisation du produit tout au long du développement du produit.
- À tout le moins, il faut passer en revue les questions énoncées à l'annexe 2, Principes liés aux facteurs humains et méthodes d'évaluation applicables à l'étiquetage et à l'emballage, pour définir les utilisateurs et les environnements d'utilisation. Ces questions visent à recueillir un large éventail de renseignements, et les réponses peuvent inciter à comprendre les facteurs importants liés à une conception sécuritaire.
- Les schémas d'utilisation du produit peuvent être utiles si l'on prévoit de mener des essais par les utilisateurs fondés sur les facteurs humains. En effet, ces schémas aideront à déterminer la portée de l'utilisation et les principaux utilisateurs. (Pour obtenir un exemple, voir l'annexe 3, Schémas d'utilisation des produits.)
- Il faut penser aux autres produits qui pourraient être utilisés avec le produit concerné, car les produits sont rarement utilisés seuls.
- Envisager des essais par les utilisateurs. Une variété d'essais par les utilisateurs et d'autres méthodes ont été utilisés pour concevoir ou modifier des étiquettes. (Voir l'annexe 2, Principes liés aux facteurs humains et méthodes d'évaluation applicables à l'étiquetage et à l'emballage.)
- Préparer des maquettes de l'étiquette et de l'emballage, y compris l'emballage externe. Les maquettes ont plusieurs utilités (p. ex. essais par les utilisateurs, groupes de discussion).
- Privilégier l'amélioration continue. Étudier les plaintes et les données incidentes pour déceler toute difficulté et tout problème imprévus liés à l'étiquette ou à l'emballage au début du processus de conception et après la mise en marché. Les fabricants doivent suivre les tendances et mettre en œuvre des mesures d'atténuation des risques en vue d'améliorer les étiquettes et les emballages. La collecte de renseignements tout au long du cycle de vie du produit est une approche proactive qui peut faciliter la conception de l'emballage et de l'étiquette.
3.3 Conception et disposition
3.3.1 Style et taille des caractères
Contexte
L'illisibilité de l'information imprimée contribue aux erreurs relatives aux produits de santéNote de bas de page 8Note de bas de page 11. Les interactions entre les éléments typographiques d'une étiquette ou les changements y étant apportés (p. ex. style de caractère, taille, espacement, emploi de caractères gras ou italiques, couleur, contraste) peuvent nuire à la lisibilité et à la compréhension du texteNote de bas de page 12. Les utilisateurs doivent pouvoir lire l'information sur l'étiquette dans des environnements réalistes ou dans les situations où les produits seront utilisés.
Recommandations
Les recommandations suivantes ne s'appliquent pas aux marques de commerce, au texte sur les droits d'auteur et aux logos.
Style de caractère
- Pour choisir un style de caractère, il faut se rappeler que différents styles ayant la même force de corps ne paraissent pas de même tailleNote de bas de page 12.
(insert image fig1-fra.jpg)
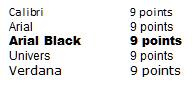
Figure 1 - Text description
Cette image montre le nom de la police dans la taille de caractère précisée; les polices sont Calibri, 9 points; Arial, 9 points; Arial Black, 9 points; Univers, 9 points; et Verdana, 9 points.
- Privilégier les styles de type linéal (sans empattement), tels Univers ou Helvetica, qui ne sont ni resserrés, ni élargis, ni décoratifs, pour l'information cléNote de bas de page 13. Ces caractères sont moins ornementés, se détachent mieux du fond et paraissent habituellement plus gros que les caractères avec empattement de même pointNote de bas de page 14. Les polices resserrées ou condensées peuvent être plus difficiles à lire, même lorsque leur force de corps est plus grandeNote de bas de page 12.
- Choisir un style de caractère ayant suffisamment d'espace entre les lettres (pour accroître la lisibilité des caractères) et entre les mots (pour accroître la lisibilité du texte)Note de bas de page 12. Des lettres étroites et un faible espacement peuvent donner l'impression que les mots se télescopent, tandis qu'un grand espacement peut nuire à la lectureNote de bas de page 12. L'espacement adéquat réduit aussi le risque d'illisibilité en cas de bavure de l'encre.
- Éviter d'utiliser uniquement des majusculesNote de bas de page 12Note de bas de page 13Note de bas de page 15Note de bas de page 16 (à l'exception des marques nominatives, des titres et des avertissements courts). (Voir la section 3.4.3, Avertissements critiques.) L'emploi de mots tout en majuscules réduit la lisibilité des caractères et la compréhension dans une plus grande mesure que tout autre facteur. Les minuscules offrent plus de variations au chapitre des caractéristiques (p. ex. forme des lettres), ce qui améliore la lisibilitéNote de bas de page 12.
- Il faut éviter l'italique, sauf pour souligner une partie du texteNote de bas de page 12.
Taille de caractère
- Utiliser une taille de caractère facilement lisible par une variété d'utilisateurs (p. ex. personnes âgées, personnes ayant une déficience visuelle) dans les environnements d'utilisation des produits (p. ex. une chambre d'hôpital faiblement éclairée). Les exemples suivants présentent un style de caractère à différentes tailles de caractère pour illustrer que de petits changements sur le plan de la taille du caractère peuvent avoir une incidence sur la lisibilité.

Figure 2 - Text description
Cette image montre la phrase « Voici Verdana 4, 5 points » dans laquelle est utilisée la police Verdana à la taille de caractère réelle de 4, 5 points; on retrouve cinq autres représentations de la même phrase avec différentes tailles de caractère pour la police Verdana : 6 points, 8 points, 9 points, 10 points et 12 points
- Il est recommandé d'utiliser la plus grande taille de caractère possible. Cependant, une taille inférieure à 6 points ne devrait pas être utilisée pour l'information cléNote de bas de page 13Note de bas de page 17. L'information clé inclut les éléments clés (voir la section 3.4.1, Principaux éléments figurant sur la partie principale pour obtenir plus de détails) ainsi que l'information sur l'étiquette exigée par la réglementation.
- Pour les très petits produits vendus sur ordonnance, comme les ampoules et les fioles de 2 mL ou moins, la taille des caractères doit être d'au moins 1,5 mmNote de bas de page 15.
- Pour améliorer la lisibilité des caractères lorsque l'on utilise des tailles plus petites (p. ex. petits contenants), il est recommandé d'utiliser une couleur d'arrière-plan très différente de la couleur des caractèresNote de bas de page 12. (Voir la section 3.3.5, Couleur et contraste, pour obtenir plus d'information.)
- Un caractère de très petite taille peut être plus facile à lire en association avec d'autres caractéristiques (p. ex. police, couleur, espace blanc, caractères gras, etc.).
- Le Règlement sur les aliments et drogues exige que le nom propre ou usuel soit inscrit en caractères d'une taille égale à au moins la moitié de celle des caractères de la marque nominativeNote de bas de page 18.
Mise en page
- Pour accroître la lisibilité, utiliser l'alignement à gauche seulement en laissant la marge de droite inégale du texte (comme dans le présent document). Cette forme d'alignement fournit des points de référence visuels qui guident doucement l'œil du lecteur d'une ligne à l'autre. Puisque chaque ligne est plus courte ou plus longue que la suivante, l'œil est guidé de l'une à l'autreNote de bas de page 12.
- Pour accroître la lisibilité de l'information sur les panneaux latéraux, utiliser des listes à puces et du texte de style télégraphique, plutôt que des phrases complètes, dans la mesure du possibleNote de bas de page 13.
- Pour indiquer l'ordre des étapes à suivre, utiliser des listes numérotées et limiter le texte de chaque étape à une seule ligne dans la mesure du possible. Il est ainsi plus facile pour les utilisateurs de suivre les instructions et de reprendre là où ils étaient si leur lecture a été interrompueNote de bas de page 13.
- Utiliser des caractéristiques contrastantes (p. ex. force de corps, caractères gras, couleur et espacement) pour aider les lecteurs à distinguer un produit d'un autre et pour faire ressortir les renseignements importants (p. ex. mises en garde dans le mode d'emploi) afin de favoriser l'utilisation sécuritaire du produit et de permettre à l'utilisateur de trouver rapidement l'information voulueNote de bas de page 13. Par exemple, s'il faut présenter l'information dans un paragraphe, utiliser des caractères gras pour faire ressortir les mots ou les phrases clés, ou utiliser des sous-titres qui permettent aux lecteurs de repérer facilement et rapidement l'information dont ils ont besoinNote de bas de page 13. L'exemple présenté ci-après illustre l'utilisation de caractères gras ou de sous-titres sur l'étiquette d'un produit.
- Dose habituelle pour adulte : 75 mg (1 comprimé), une fois par jour.
Monographie du produit disponible sur demande. Conserver les comprimés entre 15 et 30o C. Conserver à l'abri de l'humidité.
Pharmacien : Distribuer avec le feuillet d'accompagnement destiné au patient. - Il faut tenir compte de l'information fournie dans la norme de l'Association canadienne de normalisation (CSA), Étiquetage des ampoules, des fioles et des seringues à cartouches utilisées pour les médicamentsNote de bas de page 15, laquelle peut faciliter le choix de certains éléments tels que le style de caractères (notamment leur largeur et leur hauteur), le rapport-trait et l'espace entre les caractères, les mots et les lignes.
3.3.2 Recours aux lettres majuscules (lettrage « TALLman »)
Contexte
Le recours aux lettres majuscules est une méthode utilisée pour mieux différencier les dénominations communes de médicaments (nom propre ou usuel) qui se ressemblent sur le plan graphique ou phonétique en utilisant des MAJUSCULES pour écrire certaines syllabes ou certains groupes de lettres composant ces nomsNote de bas de page 9Note de bas de page 19. Cette technique est généralement utilisée pour attirer l'attention sur les différences entre des noms prêtant à confusionNote de bas de page 19. Cette technique peut être efficace parce qu'elle attire l'attention sur les noms de médicaments comportant des lettres majuscules et elle peut servir de mise en gardeNote de bas de page 20; toutefois, l'utilisation excessive de cette technique peut réduire son efficacité, puisque les noms ne paraissent plus si nouveauxNote de bas de page 21.
Le recours aux majuscules est l'une des nombreuses méthodes d'atténuation des risques qui peuvent être utilisées pour réduire au minimum le risque d'erreur entre des noms qui se ressemblent. Cette technique n'utilise pas un style, une taille ou une couleur en particulier, et elle peut être utilisée dans les systèmes électroniques. C'est pourquoi elle est devenue une méthode largement acceptée pour différencier les noms de médicaments dans le milieu de la santéNote de bas de page 22.
L'Institut pour la sécurité des médicaments aux patients du Canada (ISMP Canada)Note de bas de page 23, l'Institute for Safe Medication Practices (ISMP-US)Note de bas de page 24, la Food and Drug Administration (FDA) des États-UnisNote de bas de page 9Note de bas de page 24 et diverses autres organisations mondiales appuient le recours aux majuscules pour les noms de médicaments pouvant être confondus avec d'autresNote de bas de page 22Note de bas de page 25-30.
Recommandations
- Utiliser des majuscules sur les étiquettes de produit uniquement comme stratégie d'atténuation d'un risque connu pour la sécurité, c.-à-d. s'il y a un risque de confusion entre deux noms de médicaments ou plus pouvant avoir des conséquences graves.
- Utiliser des majuscules comme stratégie de sécurité, pas de commercialisation.
- Pour ne pas réduire l'efficacité des lettres majuscules et pour s'assurer qu'elles ont l'impact le plus fort qui soit, limiter leur utilisation aux noms associés à un risque élevé pour les patients. Ces noms devraient être déterminés dans le cadre d'un processus officiel d'évaluation du risqueNote de bas de page 29Note de bas de page 30.
- Les causes potentielles de confusion entre des noms de médicaments doivent être comprises avant d'envisager l'utilisation de lettres majuscules en tant que solution potentielle. Si la confusion est associée à des étiquettes ou à des emballages d'apparence similaire, d'autres stratégies de différenciation doivent être utilisées.
- S'assurer que l'utilisation des lettres majuscules est conforme à ce que l'on retrouve dans la liste des noms de médicaments utilisés au Canada qui se ressemblent sur le plan graphique ou phonétiqueNote de bas de page 23.
- Si des majuscules sont utilisées, elles doivent seulement servir pour la dénomination commune ou une partie de la dénomination commune de la marque nominative sur l'étiquette du produit.
- Si l'on a recours à des majuscules, les utiliser sur les étiquettes intérieures et extérieures, par souci d'uniformité.
3.3.3 Proximité et compatibilité de l'information figurant sur la partie principale
Contexte
Selon le principe de la proximité, tous les renseignements pertinents pour une tâche ou une opération mentale commune doivent être affichés à proximité les uns des autresNote de bas de page 31Note de bas de page 32. Par exemple, le nom, la concentration et la forme posologique sont des éléments distincts, mais ce sont des éléments étroitement liés qui sont utilisés pour l'identification et l'administration d'un produit de santé, et ils doivent être affichés à proximité les uns des autres sur l'étiquette.
Toutefois, la quantité nette du produit dans l'emballage n'est pas liée à cette information et n'est pas nécessaire pour l'identification et l'administration du produit, et elle devrait donc être affichée à un autre endroit. On a signalé des erreurs (confusion) lorsque la concentration du produit (une valeur numérique) et la taille unitaire ou le nombre d'unités (une autre valeur numérique) étaient placés à proximité l'une de l'autre.
La proximité et la compatibilité peuvent être affectées par d'autres attributs de l'étiquette et des caractères, notamment la couleur, le style et l'épaisseur des caractères et la force de corps. L'utilisation de couleurs, ou de styles ou tailles de caractères similaires ou encore des mêmes signes ou éléments graphiques, peut relier des informations par inadvertance (p. ex. des valeurs numériques), même si elles ne sont pas placées à proximité l'une de l'autre sur l'étiquette.
Recommandations
- Les informations concernant une tâche ou une opération mentale commune (p. ex. nom du produit de santé, concentration, forme posologique, voie d'administration) devraient être placées à proximité les unes des autres sur l'étiquetteNote de bas de page 32Note de bas de page 33.
- La présentation des divers éléments de l'étiquette doit être considérée dans son ensemble. En plus de regrouper les informations dans l'espace principal, on doit se demander comment la couleur ainsi que le style, la taille et l'épaisseur des caractères séparent ou relient visuellement les différentes informations. Par exemple, si le nombre de comprimés dans un emballage est de la même couleur que la concentration, mais est proéminent (en gras ou en caractères plus grands, par exemple), il pourrait être confondu avec la concentration ou la dose.
- Si plus d'une concentration figure sur un même espace, s'assurer que la concentration par unité est placée à proximité de la concentration par volume totalNote de bas de page 16Note de bas de page 33. Si la quantité totale par volume total est présentée dans l'espace principal, veiller à ce que cette information soit proéminente par rapport à toute autre expression de la concentrationNote de bas de page 26Note de bas de page 34.
- Indiquer la quantité nette dans l'emballage séparément de la concentration du produit, et s'assurer que cette dernière est proéminente. L'affichage de ces deux éléments d'information à proximité l'un de l'autre (p. ex. 10 mg / 7 comprimés) a contribué à des erreurs relatives aux médicamentsNote de bas de page 8. Le nombre d'unités peut apparaître sur l'espace principal, mais il doit être séparé physiquement ou par des caractéristiques graphiques afin de réduire le risque de confusion avec la concentration du produit.
- Éviter de séparer des informations non connexes au moyen de signes qui pourraient être mal interprétés. Par exemple, si un point ou un tiret est placé entre la dose et le volume total dans le contenant, le volume pourrait être interprété comme faisant partie de la dose (p. ex. « 1 000 unités • 25 mL », où « 25 mL » désigne le volume total dans le contenant et non la concentration par volume total, pourrait être interprété comme « 1 000 unités par 25 mL »).
- Lorsque possible, éviter de placer des informations non connexes (y compris des éléments graphiques) entre le nom du produit de santé et sa concentrationNote de bas de page 9Note de bas de page 26.
- Pour que l'information clé soit lisible et non susceptible d'être mal interprétée, il ne faut pas superposer du texte ou des images (ou logos)Note de bas de page 35.
- La norme de fabrication, s'il y a lieu (United States Pharmacopeia (USP), British Pharamacopoeia [BP], par exemple), doit être indiquée à proximité du nom propre du produitNote de bas de page 4.
3.3.4 Espace blanc
Contexte
L'espace blanc est un aspect important de la conception et on doit lui porter une grande attention à l'étape de la conception. L'espace blanc doit être utilisé aussi généreusement que possible pour accroître la lisibilité des étiquettes des produits de santéNote de bas de page 36, et ce, afin que les professionnels de la santé et les patients puissent trouver rapidement l'information nécessaire pour utiliser le produit de façon sécuritaireNote de bas de page 13.
Le terme « espace blanc » ne désigne pas nécessairement un espace de couleur blanche sur l'étiquette. Selon la couleur d'arrière-plan, il peut être plus approprié d'utiliser un autre terme, par exemple « l'espace vide ». L'espace blanc sur l'étiquette ou l'emballage d'un produit de santé désigne tout espace non imprimé et dénué de signes, d'éléments graphiques en couleurs, de filigranes ou d'autres éléments visuels.
L'espace blanc entourant le texte offre une sensation d'ouverture et d'espaceNote de bas de page 37. Il peut aussi aider le lecteur à se concentrer sur le messageNote de bas de page 14. Mais surtout, il peut améliorer la disposition du lecteur à lire le message et sa capacité à traiter l'information présentée, parce qu'il réduit la concentration et l'effort mental exigésNote de bas de page 37Note de bas de page 38.
Recommandations
- Intégrer des espaces blancs dans la conception et la disposition de l'information sur les étiquettes des produits de santé dès que possible dans le processus de conception. Les espaces blancs doivent être utilisés aux fins suivantes :
- encadrer du texte (p. ex. listes à puces) et séparer l'information non connexe;
- séparer les phrases les unes des autres;
- séparer les paragraphes (pour distinguer une idée de l'idée suivante);
- autour des titres et des informations importantes (p. ex. les mises en garde) pour faire ressortir leur importance.
- Maximiser l'utilisation de l'espace blanc pour ne pas encombrer l'information sur l'étiquette si on utilise de plus petits caractères. L'augmentation de l'interlignage peut être particulièrement utile aux personnes âgéesNote de bas de page 14.
- Éviter les styles de caractères condensés, qui réduisent l'espace blanc entre les lettres et les mots et peuvent nuire à la lisibilité en faisant en sorte que les mots se fusionnent lorsqu'on les litNote de bas de page 12.
- Pour obtenir de l'information sur l'étiquette des ampoules, des fioles et des seringues préremplies, et plus particulièrement sur l'espace entre les caractères, les mots et les lignes, consulter la norme de la CSA « Étiquetage des ampoules, des fioles et des seringues à cartouches utilisées pour les médicaments »Note de bas de page 15.
3.3.5 Couleur et contraste
Contexte
Il faut utiliser soigneusement la couleur sur les étiquettes intérieures et extérieures des produits de santé pour faciliter et non entraver la sélection des bons produits par les utilisateurs. La couleur est l'un des nombreux facteurs dont il faut tenir compte dans la conception des étiquettes des produits de santé, et elle ne doit pas être considérée isolément.
Les gens qui voient bien les couleurs ne peuvent détecter les différences entre des couleurs similaires que si elles sont placées côte à côte. Autrement, les couleurs similaires ne sont pas faciles à distinguer, et des erreurs peuvent se produire si la couleur est la seule variable utilisée sur l'étiquette d'un produit de santé. Par exemple, des problèmes peuvent survenir si les diverses concentrations d'un produit sont différenciées par des variations d'une certaine couleurNote de bas de page 12.
Par ailleurs, dans des conditions non optimales, la capacité de discerner les couleurs peut être réduite - par exemple si le texte est imprimé sur de petits contenants ou de petites étiquettes, si le temps de visualisation est court (p. ex. urgences, distractions), si l'éclairage est faible (p. ex. chambre d'hôpital la nuitNote de bas de page 39), ou si les couleurs de produits similaires sont séparées les unes des autres (pas vues ensemble)Note de bas de page 40.
L'effet de la couleur dans la conception de l'étiquette peut aussi être atténué par le daltonismeNote de bas de page 41-44. Certains types de daltonisme sont plus fréquents que d'autres. Les daltoniens peuvent avoir de la difficulté à percevoir certaines couleursNote de bas de page 35Note de bas de page 39 (p. ex. rouge et vert) ou à lire du texte dans certaines combinaisons de couleurs ou sur des fonds de d'une couleur en particuliereNote de bas de page 40.
Contraste
Le contraste est un principe de conception fondamental qui aide l'utilisateur à capter les différences dans ce qu'il voitNote de bas de page 45. Il s'agit d'un facteur important pour la lisibilité du texte, surtout sur les emballages dont le fond est en couleurNote de bas de page 1Note de bas de page 9Note de bas de page 10Note de bas de page 16Note de bas de page 33Note de bas de page 35Note de bas de page 42-44Note de bas de page 46-49. Par exemple, il est recommandé d'utiliser du texte de couleur foncée sur un fond pâle pour assurer un contraste suffisant et une visibilité optimaleNote de bas de page 9Note de bas de page 10Note de bas de page 15Note de bas de page 16Note de bas de page 35Note de bas de page 48Note de bas de page 50.
Différenciation par couleur et codage par couleur
La différenciation par couleur est généralement utilisée pour mettre en évidence certaines caractéristiques sur une étiquette de produit ou pour aider à faire la distinction entre un produit et un autreNote de bas de page 10Note de bas de page 34. Toutefois, l'utilisation répétée de cette technique risque de produire des étiquettes à présentation semblableNote de bas de page 10Note de bas de page 35Note de bas de page 46Note de bas de page 50 ce qui prédispose les utilisateurs au biais de confirmation (lorsqu'une personne voit ce qu'elle s'attend à voir). La différenciation par couleur peut également réduire la proéminence de l'information clé si elle est mal utiliséeNote de bas de page 15Note de bas de page 46.
« Le codage par couleur est l'application systématique de la couleur pour faciliter la classification et l'identification. Un système de codage par couleur permet aux utilisateurs d'associer une couleur à une fonctionNote de bas de page 10. » Le codage par couleur renvoie à l'utilisation de couleurs constantes pour certains produits ou certaines concentrations de produit par tous les fabricants. Pour diverses raisons, dont les suivantes, de nombreux spécialistes de la sécurité ne sont pas favorables à l'utilisation du codage par couleurNote de bas de page 9Note de bas de page 10Note de bas de page 16Note de bas de page 35Note de bas de page 42Note de bas de page 51Note de bas de page 52 :
- l'efficacité de cette technique pour prévenir les erreurs n'a pas été confirméeNote de bas de page 16Note de bas de page 51;
- des problèmes sont survenus en raison du codage par couleurNote de bas de page 9Note de bas de page 10Note de bas de page 51Note de bas de page 52;
- la sélection de couleurs identifiables comporte des limitesNote de bas de page 35Note de bas de page 39Note de bas de page 40Note de bas de page 51-53;
- la mémoire humaine a ses limitesNote de bas de page 10Note de bas de page 39Note de bas de page 51.
Le codage par couleur procure certains avantages pour les étiquettes apposées par l'utilisateur et dans certains domaines de pratique, par exemple chez les anesthésistes en salle d'opérationNote de bas de page 54, mais ces avantages ne sont pas nécessairement applicables aux autres utilisateurs ou environnements. On ne peut pas s'attendre à ce que les utilisateurs se souviennent de certaines couleurs et leur attribuent un sens compte tenu du nombre élevé de différentes concentrations, des milliers de classes de médicaments et de produits et du nombre limité de couleurs visuellement distinctes.
Par convention, on reconnaît à certaines couleurs des significations précises (p. ex. le rouge peut dénoter un danger, l'orange, un avertissement, le jaune, la nécessité de faire attention)Note de bas de page 40. Ces conventions sont souvent utilisées pour la signalisation dans des environnements dangereux ou à risque, notamment pour les panneaux de circulation ou les contenants de produits chimiques dangereuxNote de bas de page 55. Outre ces exemples, les couleurs peuvent avoir des significations subjectives pour certaines populations d'utilisateursNote de bas de page 56.
Recommandations
Utilisation de la couleur
- La couleur est l'un des nombreux facteurs dont il faut tenir compte dans la conception des étiquettes des produits de santé, et elle ne doit pas être considérée isolément.
- Il faut penser aux environnements d'utilisation, parce qu'une couleur peut paraître différente dans des conditions d'éclairage différentesNote de bas de page 9Note de bas de page 35Note de bas de page 39Note de bas de page 42Note de bas de page 43.
- Le choix des couleurs doit tenir compte des principes généraux présentés ci-après.
- Teinte : Les couleurs qui s'opposent sur le cercle chromatique (couleurs complémentaires) [p. ex. bleu et orange, jaune et violet] sont plus contrastantes que les couleurs qui sont plus proches (p. ex. violet et bleu, orange et rouge) et offrent une plus grande différenciation de teinteNote de bas de page 53Note de bas de page 57-59.
- Saturation : Les couleurs entièrement saturées (vives) combinées à des couleurs faiblement saturées (ternes) offrent un meilleur contraste que les combinaisons de couleurs ayant un niveau de saturation semblableNote de bas de page 57.
- Valeur : Les couleurs à faible valeur (couleurs foncées) placées à côté ou en opposition des couleurs à haute valeur (couleurs pâles) offrent un meilleur contraste que les couleurs de valeur similaireNote de bas de page 53.
- Utiliser la couleur aux fins suivantes :
- pour attirer l'attention sur les renseignements importants de l'étiquetteNote de bas de page 10, comme le nom du produit de santé et sa concentrationNote de bas de page 33;
- pour attirer l'attention sur les mises en garde ou augmenter leur proéminenceNote de bas de page 9Note de bas de page 10Note de bas de page 59;
- pour différencier un produit d'un autreNote de bas de page 42 ou les différentes concentrations d'une gamme de produitsNote de bas de page 42Note de bas de page 46Note de bas de page 51Note de bas de page 60.
- Tandis que les éléments de présentation et les logos peuvent favoriser le processus de sélection, il faut s'assurer de distinguer correctement les produits au sein d'une gamme de produits afin de réduire le risque de confusionNote de bas de page 8.
- Pour mieux distinguer les différentes concentrations d'un produit, utiliser une couleur de teinte différente plutôt qu'une intensité ou une valeur différente de la même couleurNote de bas de page 16. Par exemple, éviter les différentes teintes de bleu pour exprimer les différentes concentrations; utiliser plutôt des couleurs nettement différentes.
- En général, le codage par couleur des produits de santé n'est pas recommandéNote de bas de page 9Note de bas de page 10Note de bas de page 16Note de bas de page 35Note de bas de page 42Note de bas de page 51Note de bas de page 52.
- On peut envisager d'utiliser d'autres éléments, pas seulement des couleurs, pour faciliter la distinction entre les produitsNote de bas de page 9 : bandes de couleur, encadrés ou bordures (autour du texte)Note de bas de page 33.
- Lors du choix des couleurs des étiquettes et des emballages, il faut penser aux conséquences possibles du daltonisme. Par exemple, il faut éviter d'utiliser le rouge et le vert ensembleNote de bas de page 41, car il est possible que les personnes atteintes de daltonisme rouge-vert ne soient pas en mesure de distinguer ces couleurs. Les programmes de simulation par ordinateur, notamment VischeckNote de bas de page 61, peuvent aider à déterminer comment les couleurs seront perçues par les personnes atteintes des différentes formes de daltonisme.
- Apparier les styles des étiquettes et des emballages intérieur et extérieur afin que l'apparence, dont les couleurs, soit identique ou semblableNote de bas de page 35Note de bas de page 46. Les utilisateurs peuvent ainsi mettre ou remettre plus facilement le contenant dans le bon emballage, au besoin. Ils peuvent aussi trouver plus facilement l'emballage secondaire (extérieur) correspondant lorsqu'ils ont besoin de l'information imprimée seulement sur cet emballage (p. ex. mode d'emploi d'un produit de santé fourni dans un petit contenant). Cette correspondance entre l'étiquette du contenant et l'étiquette de son emballage ou de sa boîte réduit le nombre de renseignements que l'utilisateur doit traiter simultanémentNote de bas de page 62.
Contraste
- On peut maximaliser la lisibilité du texte à l'aide d'un contraste élevé entre le texte et l'arrière planNote de bas de page 9Note de bas de page 10Note de bas de page 33Note de bas de page 43Note de bas de page 46Note de bas de page 63 (p. ex. lettrage foncé sur fond clairNote de bas de page 16Note de bas de page 42Note de bas de page 48Note de bas de page 49). Éviter les combinaisons de couleurs de caractères et de fonds qui sont difficiles à lire (p. ex. lettrage noir ou jaune sur fond rougeNote de bas de page 48).
- Utiliser des étiquettes opaques sur des contenants clairs ou translucides pour s'assurer que le texte est lisible et qu'on ne le voit pas au travers du contenantNote de bas de page 35. S'assurer qu'il reste assez d'espace clair après l'application de l'étiquette sur le contenant pour permettre à l'utilisateur de voir le contenuNote de bas de page 35.
- S'il est impossible d'utiliser une étiquette en papier, utiliser sur le contenant translucide de l'encre contrastante sur un fond opaque pour maintenir la lisibilitéNote de bas de page 35.
- La gravure (gaufrage en relief et en creux) des caractères sur le contenant pourrait ne pas offrir suffisamment de contraste à elle seule. Si l'on a recours à cette méthode, il faut surligner les caractères avec de l'encreNote de bas de page 16.
- S'assurer qu'il y a un contraste suffisant entre les symboles exigés par la réglementation et la couleur de l'arrière-planNote de bas de page 18.
Contenants
- Les échelles graduées sur les seringues préremplies (contenants clairs « prêts à utiliser ») ou les dispositifs doseurs par voie orale (p. ex. seringues orales) devraient être facilement lisibles. Par exemple, utiliser de l'encre noire sur un champ blancNote de bas de page 15.
- Pour les plaquettes alvéolaires, utiliser un matériel non réfléchissant au verso pour que l'information imprimée soit bien lisibleNote de bas de page 9Note de bas de page 26Note de bas de page 46.
- Pour les liquides dans des contenants clairs, apposer les étiquettes avec de la colle incolore pour éviter de donner l'impression que le contenu a changé de couleurNote de bas de page 15.
3.3.6 Utilisation d'abréviations, de symboles et d'indications de dose
Contexte
L'utilisation de certaines abréviations (p. ex. OD), de certains symboles (p. ex. µ) et de certaines indications de dose (p. ex. 1,0 mg) pour transmettre de l'information sur des produits de santé a été reconnue comme la cause sous-jacente d'accidents graves, voire mortelsNote de bas de page 64. Une abréviation peut avoir plus d'une signification et elle risque donc d'être mal interprétéeNote de bas de page 9, surtout si les utilisateurs ne connaissent pas bien le sens prévu. Les pratiques et la terminologie peuvent varier entre les différents professionnels et groupes de santé (p. ex. pharmaciens, infirmières, médecins), entre les spécialités cliniques et même entre les patients et les professionnels de la santé.
Recommandations
Généralités
- Utiliser le moins possible d'abréviations, de symboles et d'indications de dose (numériques) sur l'étiquette et l'emballage des produits de santéNote de bas de page 9Note de bas de page 64.
- Éviter les abréviations, symboles et indications de dose qui peuvent facilement entraîner des erreursNote de bas de page 9Note de bas de page 64. Consulter la liste « Ne pas utiliser » de l'ISMP Canada pour obtenir des précisionsNote de bas de page 64. Cette liste, adaptée d'une liste dressée par l'ISMP-USNote de bas de page 65, tient compte des erreurs relatives aux médicaments déclarées volontairement à l'ISMP Canada dans lesquelles des personnes avaient précisé qu'une abréviation, un symbole ou une indication de dose (inscription numérique) était à l'origine d'incidents ayant causé un préjudice ou susceptibles de causer un préjudice.
- S'assurer que les abréviations utilisées fournissent de l'information utile et facile à identifier par les utilisateurs (p. ex. professionnels de la santé, patients)Note de bas de page 6.
- Une abréviation ne devrait pas être ambiguë ou susceptible d'être mal interprétée par l'utilisateur. En particulier, éviter les abréviations qui indiquent la posologie. (Par exemple, l'abréviation « QD » peut être lue ou interprétée à tort comme « QID », et « OD » peut être interprétée comme « oculus dexter » [« œil droit » en latin] ou « une fois par jour »)Note de bas de page 6.
- Utiliser les normes nationales ou internationales relatives aux abréviations (p. ex. utiliser l'abréviation « mL » pour « millilitre »)Note de bas de page 64.
Remarque : Le symbole « µg » (« microgramme ») est conforme au Système international (SI) et est souvent utilisé dans la littérature scientifique. Cependant, sur les étiquettes, il est recommandé d'utiliser plutôt « mcg »Note de bas de page 4. La lettre grecque « µ » peut être difficile à voir dans certains caractères et certaines tailles et elle risque d'être confondue avec la lettre « m » (« mg » pour « milligramme », au lieu du symbole voulu « µg » pour « microgramme »).
- Les noms propres et les noms usuels des produits de santé et des ingrédients médicinaux du produit ne devraient pas être abrégésNote de bas de page 4Note de bas de page 15Note de bas de page 16Note de bas de page 64. Des erreurs de confusion de produits sont possibles lorsque des abréviations similaires sont utilisées pour de multiples produits (p. ex. MS [sulfate de morphine] et MgSO4 [sulfate de magnésium]).
- Dans la mesure du possible, éviter d'utiliser des abréviations de noms de vaccins (p. ex. dcaT et DCaT). Les abréviations sont des facteurs qui ont contribué à des erreurs de sélection de vaccinsNote de bas de page 66.
- Définir les abréviations utilisées sur les dispositifs doseurs qui sont fournis. S'assurer que ces abréviations correspondent aux abréviations utilisées sur l'étiquette et sur l'emballage du produit, notamment le mode d'emploi, l'emballage extérieur (carton), les contenants et tout document écrit fourni.
- Il est fortement recommandé de procéder à un test de compréhension pour toute nouvelle abréviation. (Voir l'annexe 2, Principes liés aux facteurs humains et méthodes d'évaluation applicables à l'étiquetage et à l'emballage.)
Voie d'administration
- Inscrire au complet toute voie d'administration inhabituelle (p. ex. intrathécale) parce que l'utilisateur ne la connaît peut-être pas et que l'abréviation risque de créer de la confusionNote de bas de page 26. Les autres voies d'administration désignées par des abréviations doivent être expliquées au long au moins une fois ailleurs sur l'étiquetteNote de bas de page 4.
3.3.7 Étiquettes bilingues
Contexte
L'étiquetage bilingue peut poser des problèmes de lisibilité des étiquettes intérieure et extérieure en raison du risque d'encombrement de l'information. Les commentaires formulés par les professionnels de la santé, les patients et les consommateurs au cours de la rédaction du Guide ont fait ressortir les préoccupations présentées ci-après.
- Il faut avoir assez d'espace pour le français et l'anglais, tout en conservant l'espace blanc, surtout si l'espace est restreint (sur les petits contenants, par exemple). Le texte français est généralement un peu plus long que le texte anglais correspondant.
- Vérifier l'exactitude et le sens de l'information sur le produit de santé dans les deux langues.
- Veiller à l'uniformisation et à la cohérence de la disposition des textes bilingues sur les étiquettes de produits de santé (p. ex. nom du produit, forme de sel du médicament, emplacement de certains renseignements, proéminence de renseignements précis).
- Reconnaître les différences subtiles entre la présentation et l'interprétation de l'information en français et en anglais (p. ex. pour exprimer la décimale, on utilise un point en anglais et une virgule en français).
Recommandations
Principes généraux
- L'étiquetage bilingue doit être envisagé au début du processus de création de l'étiquette et de l'emballage afin de déterminer avec précision l'espace requis sur l'étiquette pour inscrire les renseignements nécessaires.
- Il est préférable d'inclure les deux langues sur l'étiquette (et dans la technologie, p. ex. instructions vocales automatisées).
- Au moment d'inclure les versions française et anglaise sur un même panneau où l'espace est limité, penser à la meilleure façon d'afficher l'information clé d'une façon uniforme, dans une même gamme de produits et d'une gamme à l'autre. (Voir l'annexe 1, Glossaire, pour obtenir la définition de « information clé ».)
Organisation de l'information
- Dans le cas des emballages ou des contenants ayant plusieurs panneaux ou côtés (p. ex. une boîte), il est préférable de consacrer un panneau complet à l'information en anglais, et un autre à l'information en français.
- Si les emballages ont seulement un ou deux panneaux utilisables ou s'ils ont un espace limité, il faut songer à utiliser différents types d'étiquettes ou des étiquettes innovantes (p. ex. étiquettes pelables) pour inscrire l'information dans les deux langues. Les nouveaux types d'étiquettes devraient être conformes aux règlements et aux lignes directrices applicablesNote de bas de page 1Note de bas de page 4. (Voir la section 3.5.2, Petits contenants et contenants de petit volume.)
- Il faut trouver les éléments communs en français et en anglais des renseignements clés et déterminer si cette information peut être combinée pour utiliser moins d'espace. Quand l'information (p. ex. le nom du médicament) est la même en anglais et en français, on peut la combiner plutôt que répéter tous les détails dans les deux langues.
Expression de la concentration
- Pour les grands nombres (plus que 9 999), il faut utiliser une espace fine, plutôt que la virgule, pour séparer les chiffres en groupes de trois (p. ex. 10 000). (Voir la section 3.4.2, Expression de la concentration.)
- En français, on utilise la virgule comme séparateur décimal, tandis qu'en anglais on utilise souvent une virgule pour séparer les tranches de chiffres dans les nombres (10,000, par exemple). La virgule peut donc être une source de confusion pour certains utilisateursNote de bas de page 67.
- Selon le SI, « le symbole du séparateur décimal pourra être le point sur la ligne ou la virgule sur la ligne » et « les nombres comportant un grand nombre de chiffres peuvent être partagés en tranches de trois chiffres, séparés par une espace, afin de faciliter la lecture. Ces tranches ne sont jamais séparées par des points ou des virgulesNote de bas de page 67. »
- On doit s'assurer que l'espace entre les nombres est assez large pour indiquer que les nombres sont partagés en tranches de trois chiffres, mais qu'il n'est pas large au point que chaque tranche soit interprétée comme représentant un nombre.
- Penser à une façon d'uniformiser l'affichage de la concentration du produit lorsque l'unité de mesure est différente dans les deux langues (p. ex. « unités » en français, « units » en anglais). L'examen des éléments communs des renseignements clés peut aider à combiner l'information.
- Si les emballages des produits n'ont pas de panneaux ou de côtés distincts (p. ex. ampoules et fioles), tenir compte du champ visuel disponible pour l'information clé. (Voir la section 3.4.2, Expressions de la concentration, pour obtenir de plus amples renseignements sur les cas où plusieurs expressions de la concentration figurent sur l'étiquette.)
- La norme de la CSA intitulée « Étiquetage des ampoules, des fioles et des seringues à cartouches utilisées pour les médicaments » offre également des lignes directrices sur l'utilisation du français et de l'anglais sur les ampoules, les fioles et les seringues à cartouches (préremplies)Note de bas de page 15.
3.3.8 Logo, image de marque et présentation commerciale
Contexte
Alors que les logos, les images de marque ou d'autres formes de présentation commerciale peuvent aider à distinguer des produits provenant de différents fabricants, des déclarations d'incidents montrent qu'ils peuvent contribuer aux erreurs et nuire à l'utilisation sécuritaire des produits de santéNote de bas de page 8. Les problèmes présentés ci-après ont notamment été observés.
- La présentation commerciale peut contribuer à la similarité des étiquettes et des emballages, surtout dans les situations suivantes :
- produits du même promoteur;
- articles d'une gamme de produitsNote de bas de page 8;
- produits génériques, où l'on observe une tendance à créer ou à uniformiser l'apparence dans toutes les gammes de produitsNote de bas de page 8Note de bas de page 68-70.
- La marque nominative (marque déposée) peut être proéminente par rapport au nom propre ou usuel sur l'étiquette d'un médicamentNote de bas de page 42 (au-delà de ce qui est stipulé dans le Règlement sur les aliments et drogues [C.01.004]Note de bas de page 18).
- La présence d'éléments graphiques et de texte associé à l'image de la marque peut nuire à la présentation claire de l'information importante pour l'utilisateurNote de bas de page 71. En particulier, ces éléments de l'étiquette peuvent faire en sorte que les différences dans l'information importante (p. ex. concentrations, ingrédients, indications) n'apparaissent pas clairement et ne soient pas remarquées au moment de la sélection ou de l'administration.
Des problèmes peuvent également survenir après modification de l'étiquette d'un produit bien connu. Des raisons pour une modification peuvent inclure l'harmonisation sur le plan national ou international de l'apparence des produitsNote de bas de page 72, l'atteinte des objectifs de la mise en marché ou la modification de certains aspects de l'étiquette pour éviter que des erreurs ne se reproduisent. La modification de l'étiquette doit être équilibrée; il faut notamment s'assurer de conserver les aspects positifs du concept existant au bénéfice des utilisateurs. On a fait remarquer que [TRADUCTION] « même si cela n'est pas toujours possible, il est important de mettre à nouveau à l'essai les étiquettes modifiées pour diverses raisons, pour s'assurer que les changements ne perturbent pas le système ni le rendement des utilisateursNote de bas de page 73 ».
Recommandations
- Les logos et les éléments de la présentation commerciale sur les étiquettes de produit ne devraient pas distraire l'utilisateur ou nuire à la communication efficace des renseignements clés qui lui sont destinésNote de bas de page 4Note de bas de page 8Note de bas de page 17Note de bas de page 42.
- Il faut viser l'équilibre entre l'utilisation des éléments de la présentation commerciale et la présentation de l'information clé sur les étiquettes. Bien que la proéminence de la présentation commerciale et de l'image de marque puissent aider à repérer un produit précis dans un environnement de vente au détail, elle peut aussi empêcher les utilisateurs de bien distinguer les différents produits ou les différentes concentrations d'un même produitNote de bas de page 8.
- Penser à l'espace requis pour un logo et à l'espace qui restera sur l'étiquette pour inscrire les renseignements concernant le produit.
- S'assurer que l'information clé dans une gamme de produits est clairement différenciée d'un produit à l'autre pour éviter la confusion et le risque d'erreur de sélection.
- Établir une distinction claire entre les différentes concentrations d'un même produit de santé et la présentation des produits différents du même fabricant. Songer à utiliser des couleurs, en association avec d'autres éléments de l'étiquette et l'emballage, comme la taille, la forme ou des caractéristiques du dispositif de fermetureNote de bas de page 8Note de bas de page 74.
- En cas de modification de l'étiquette ou de l'emballage, envisager un essai par les utilisateurs avant la mise sur le marché pour réduire le risque de conséquences imprévues (p. ex. lorsqu'on donne une nouvelle image à la marque ou qu'on ajoute un produit à une gamme de produits)Note de bas de page 33.
3.3.9 Permanence
Contexte
L'étiquetage sécuritaire des produits de santé garantit que tous les renseignements demeurent lisibles pendant toute la durée de vie du produitNote de bas de page 41. Il peut arriver que des renseignements importants sur les étiquettes soient effacés involontairement en raison de la manipulation et de l'utilisationNote de bas de page 75.
Recommandations
- S'assurer que le texte imprimé sur les produits demeure lisible pendant toute la durée de vie du produit, en tenant compte des conditions de transport et d'entreposage et des environnements où le produit est utiliséNote de bas de page 41.
- Envisager l'emploi de technologies spéciales, comme le papier résistant aux bavuresNote de bas de page 76 et les encres contenant des adhésifs, lesquels colleront à une variété de surfaces, y compris le plastique.
- Utiliser des encres résistantes à l'alcool isopropylique ou éthylique et qui sont assez durables pour résister à une manipulation normale, particulièrement dans le cas des produits injectables (p. ex. ampoules, fioles, seringues préremplies)Note de bas de page 15Note de bas de page 16Note de bas de page 35.
3.4 Information sur l'étiquette
3.4.1 Éléments clés sur l'espace principal
L'espace principal d'une étiquette est la première interface entre l'utilisateur et le produit de santé. Il représente un facteur important dans l'identification et la sélection du produit. La réglementation de Santé Canada précise l'information qui doit figurer sur l'espace principal (Règlement sur les aliments et drogues [C.01.004])Note de bas de page 18.
On s'attend à ce que les promoteurs connaissent les exigences réglementaires qui s'appliquent à leurs produits.
En plus de l'information exigée aux fins de la réglementation, huit éléments clés ont été établis par le groupe consultatif d'experts composé de professionnels de la santé, de consommateurs et d'organismes de réglementation qui ont fourni leurs commentaires pendant l'élaboration de ce Guide. Ces éléments aident l'utilisateur à choisir correctement un produit et à l'utiliser de façon appropriée. Il a été noté que ces éléments constituaient les principaux renseignements à inclure dans l'espace principal des étiquettes intérieure et extérieure des produits de santé (voir la note ci-dessous). Ces éléments clés sont conformes aux normes nationales et internationales et à la littérature scientifique sur la sécurité, mais ils n'englobent pas toute l'information exigée par la réglementation ou les directives visant les divers types de produits de santé. Par exemple, l'identification numérique de la drogue (DIN) est exigée par la réglementation, mais elle ne figure pas parmi les huit éléments.
Les huit éléments clés sont les suivants :
- marque nominative du produit de santé;
- dénomination commune (nom propre ou usuel) du produit de santé;
- concentration, avec ou sans la quantité totale par volume total;
- forme posologique;
- voie d'administration (s'il ne s'agit pas de produits solides administrés par voie orale, comme des comprimés);
- avertissements critiques, s'il y a lieu;
- population, s'il y a lieu (enfants, par exemple);
- instructions d'entreposage, s'il y a lieu.
Remarque : Il faut absolument considérer chaque produit, ses utilisateurs, les environnements d'utilisation et les exigences réglementaires pour déterminer quels éléments clés parmi les huit peuvent être nécessaires pour assurer une utilisation sécuritaire. (Voir la section 3.5.2, Petits contenants et contenants de petit volume). Par exemple, les produits buvables peuvent être utilisés dans les hôpitaux et même dans des résidences où un accès intraveineux peut être installé sur une personne. Puisqu'il est possible d'injecter tout produit liquideNote de bas de page 77, et puisqu'un suppositoire peut être ingéré, il faut absolument indiquer la voie d'administration (orale pour le liquide, rectale ou vaginale pour le suppositoire) sur l'espace principal de l'étiquette de tels produits.
Pour les très petits contenants, il est possible que l'étiquette intérieure n'ait pas suffisamment d'espace pour inclure tous les éléments clés déterminés. La nature du produit suggérera donc quels éléments sont les plus importants pour assurer une sélection et une utilisation sécuritaires et doivent donc être inclus sur l'étiquette intérieure, en tenant compte des exigences réglementaires.
Les instructions d'entreposage constituent un des éléments clés qui ne sont pas abordés dans une section distincte du présent guide. Toutefois, il peut être bon d'inclure ces instructions sur l'espace principal lorsqu'il faut conserver le produit à une température autre que la température ambiante. Par exemple, les produits à réfrigérer sont moins courants, et alors les instructions sur la réfrigération des produits qui doivent être conservés à basse température devraient figurer sur l'espace principal pour alerter les consommateurs. Cela est particulièrement important pour les vaccins à conserver au réfrigérateur.
3.4.2 Expression de la concentration
Contexte
L'expression de la concentration est un élément clé de l'information sur l'étiquette d'un produit de santé. Si cette information n'est pas claire ou est absente, cela peut nuire à la sélection des bons produits et à leur utilisation adéquate. Des produits peuvent être offerts en plusieurs concentrations, et la concentration peut être exprimée dans plusieurs unités différentes. En conséquence, la concentration d'un produit peut facilement être mal interprétéeNote de bas de page 10.
La liste suivante fournit des exemples de pratiques d'étiquetage qui peuvent créer de la confusion en raison de la méthode utilisée pour exprimer la concentration d'un produit de santé :
- présenter la concentration sous plus d'une formeNote de bas de page 10 (p. ex. sous forme de concentration et de pourcentage);
- utiliser des unités de mesure différentes sur la même étiquette ou le même emballageNote de bas de page 9 (p. ex. millimoles [mmol] et milligrammes [mg]);
- utiliser différentes unités de volumeNote de bas de page 78 (p. ex. « par mL », « par mm3 », « par cc »);
- présenter divers nombres dans l'espace principal, par exemple la concentration (une expression ou plus) et le nombre total d'unités dans l'emballageNote de bas de page 8;
- placer la concentration (une valeur numérique) et la taille unitaire ou le nombre d'unités (une autre valeur numérique) à proximité l'une de l'autreNote de bas de page 9 (voir la section 3.3.3, Proximité et compatibilité de l'information figurant sur la partie principale);
- ne pas faire concorder le volume du produit de santé dans le contenant avec l'expression de la concentration (p. ex. le contenu total d'une fiole est de moins de 1 mL, mais la concentration sur l'étiquette fournit la quantité de produits par millilitre)Note de bas de page 8;
- ajouter dans le contenant plus de solution que la quantité nécessaire pour reconstituer le produitNote de bas de page 10 ou plus que ce qu'il faut pour administrer la dose requise du produitNote de bas de page 79 (trop remplir le contenant, de sorte qu'il est nécessaire de le manipuler pour en extraire une plus petite quantité du produit ou pour éliminer l'excès de produit afin de préparer la dose à administrer);
- utiliser des zéros à droite (p. ex. « 2,0 », « 2,50 ») ou ne pas utiliser de zéros à gauche (p. ex. « ,2 ») - si le séparateur décimal n'est pas perçu correctement, une erreur de dose, multipliée ou divisée par 10, pourrait survenirNote de bas de page 8Note de bas de page 64;
- utiliser certaines abréviations d'unités du SI qui peuvent être à l'origine d'erreurs de lecture (p. ex. pour « microgramme », le symbole « μg » utilisé au lieu de « mcg » peut être difficile à lire dans certains caractères et formats et pourrait être confondu avec « mg »Note de bas de page 4);
- ne pas indiquer la même concentration sur l'étiquette du produit et dans la section « Posologie et administration » de la monographie de produit ou dans l'information posologique.
D'autres problèmes importants liés à l'expression de la concentration d'un produit peuvent accroître le risque de confusion et d'erreur. Dans le cas des produits de santé sous forme de sel, l'activité et la quantité de l'ingrédient actif peuvent être très différentes d'une forme de sel à l'autre. Il peut donc y avoir un manque d'uniformité dans la présentation de l'information et dans la façon dont les utilisateurs désignent (ou comprennent) la concentration. Les utilisateurs peuvent avoir de la difficulté à faire la différence entre la dose de la forme de sel d'un ingrédient actif et la dose de l'ingrédient actif proprement ditNote de bas de page 80. Par exemple, le flupenthixol est disponible en trois formes de sel, soit chlorhydrate, acétate et décanoate. Les comprimés oraux sont disponibles sous forme de sel de chlorhydrate. Les produits injectables sont disponibles sous forme de sel d'acétate, où 50 mg fournissent 42,25 mg de flupenthixol, et sous forme de sel de décanoate, où 200 mg fournissent 144,4 mg de flupenthixol. Ainsi, confondre une dose de 100 mg entre les deux sels entraînerait l'administration de 72,2 mg ou de 95,5 mg de médicament actif, et cela représenterait une différence importante sur le plan de la vitesse d'absorption. Il est aussi important de faire une distinction entre deux préparations ou plus du même ingrédient actif, surtout si les doses diffèrent considérablement. Une erreur de posologie résultant d'une confusion quant à la préparation utilisée (p. ex. l'amphotéricine B liposomique par rapport à l'amphotéricine B classique) a donné lieu à des événements indésirables graves, dont le décèsNote de bas de page 81.
Dans le cas des produits de santé à diluer pour obtenir la concentration finale à utiliser, la concentration indiquée sur l'étiquette peut être différente de celle exigée pour le produit final. Des instructions de dilution imprécises ont causé des incidentsNote de bas de page 82. Les problèmes suivants ont été relevés :
- La concentration du produit par rapport à la quantité de diluant requise pour la reconstitution peut créer de la confusion, car le volume final à administrer au patient peut être différent du volume de diluant utilisé.
- On peut ajouter à la complexité en exigeant l'utilisation d'un diluant précis ou exclusif ou encore plusieurs étapes - par exemple la reconstitution suivie de la dilution - avant que le produit ne puisse être administré.
- Les dilutions requises pour l'usage d'un produit chez les enfants peuvent être différentes de celles requises pour les adultes. Il est donc important que l'expression de la concentration aide l'utilisateur à faire les bons calculs pour les populations pédiatriques plus vulnérables. Idéalement, des préparations et concentrations commerciales pour enfants seront offertesNote de bas de page 83.
Les concentrations fractionnelles peuvent prêter davantage à l'erreur et à la confusion - une situation qui doit être prise en compte quand de nouvelles concentrations sont ajoutées à une gamme de produits existante. Prenons par exemple les timbres transdermiques de fentanyl, qui sont offerts à des concentrations de 12,5 mcg / h et de 125 mcg / h; des erreurs de 10 fois la dose se sont produites parce que le séparateur décimal n'a pas été perçuNote de bas de page 84. Ce problème a été réglé en indiquant sur l'étiquette une concentration de 12 mcg / h plutôt que de 12,5 mcg / h. Dans ce genre de cas, le séparateur décimal et les chiffres correspondants peuvent causer de la confusion. Si le médicament concerné est un médicament de niveau d'alerte élevé, comme un opioïde, les conséquences peuvent être très graves.
Les formes posologiques qui libèrent ou délivrent une quantité de produits différente de la quantité totale dans le contenant devraient être examinées attentivement. L'inhalateur de nicotine est un bon exemple : il contient 10 mg par cartouche, mais délivre seulement 4 mg. Cet écart peut créer de la confusion pour celui qui rédige l'ordonnance et l'utilisateur, en raison de la non concordance entre la façon dont la dose prescrite est communiquée et la présentation de la concentration sur l'étiquette. De plus, si le médicament disponible est interprété comme correspondant à 10 mg de nicotine par cartouche, cela pourrait aussi entraîner l'administration d'une dose plus élevée et une augmentation inutile du traitement par la nicotine lorsqu'on passe de l'inhalateur au timbre transdermique de nicotine à libération prolongée.
Recommandations
Principes généraux
- Exprimer la concentration par dose d'un produit de santé dans une unité appropriée du système métrique (SI)Note de bas de page 15Note de bas de page 16, sauf dans les situations où d'autres unités de mesure sont acceptées et requises, comme les unités d'activité des médicaments biologiquesNote de bas de page 33 et les concentrations en pourcentage des préparations topiques. Toutes les données numériques devraient être accompagnées d'une unité de mesure pour exprimer la concentration d'un produit.
- Utiliser « mcg » plutôt que « μg » pour « microgramme »Note de bas de page 64.
- Santé Canada recommande l'utilisation de l'abréviation « mcg »Note de bas de page 4. La lettre grecque « µ » peut être difficile à voir dans certains caractères et certaines tailles et elle risque d'être confondue avec la lettre « m »Note de bas de page 4, ce qui peut contribuer à des erreurs de dose. (Voir la section 3.3.6, Utilisation d'abréviations, de symboles et d'indications de dose.)
- Partager les nombres comportant cinq chiffres ou plus en tranches de trois chiffres, séparées par une espace pour éviter les erreurs de lecture (p. ex. 1000 mg, mais 10 000 mg)Note de bas de page 67. Ce format est compatible avec les deux langues officielles (contrairement à l'utilisation du point ou de la virgule) et il est recommandé par le système SINote de bas de page 67 et par Travaux publics et Services gouvernementaux CanadaNote de bas de page 85.
- Songer à mettre un espace entre les caractères pour accroître la clarté. Par exemple, laisser assez d'espace autour de la barre oblique (« / ») pour optimiser la lisibilité de ce caractère, étant donné qu'il pourrait être interprété par erreur comme le chiffre « 1 » (un) ou la lettre « l » (L).
- Ne pas utiliser la barre oblique (« / ») au lieu du mot « ou », et éviter de l'utiliser pour séparer différents éléments d'information. On a signalé des erreurs d'interprétation ayant donné lieu à des incidents en raison de ce caractèreNote de bas de page 86.
- Éviter les zéros à droite (p. ex. « 2,0 », « 2,50 »), mais toujours inscrire un zéro à gauche (p. ex. « 0,2 »)Note de bas de page 64.
- Dans la mesure du possible, uniformiser les unités exprimant la concentration du produit et les unités exprimant la posologie du produitNote de bas de page 9.
- Éviter d'inscrire l'expression de la concentration près d'autres données numériques, par exemple le nombre d'unités dans l'emballageNote de bas de page 8. (Voir la section 3.3.3, Proximité et compatibilité de l'information figurant sur la partie principale.)
- Tenir compte des expressions de la concentration existantes quand on prépare des produits comparables ou des produits de même classe pour la mise en marché.
- Les modifications de l'expression de la concentration, en particulier pour les produits critiques ou de spécialité, peuvent causer des problèmes. Avant de modifier l'expression de la concentration en utilisant des unités différentes ou un format différent, il est recommandé de soumettre à un essai par les utilisateurs la nouvelle étiquette et le nouvel emballage. (Voir l'annexe 2, Principes liés aux facteurs humains et méthodes d'évaluation applicables à l'étiquetage et à l'emballage.)
Expression de la concentration
- Éviter d'utiliser à la fois des unités métriques (SI) et d'autres unités (p. ex. milligrammes combinés à des unités internationales)Note de bas de page 87 pour exprimer la concentration d'un ingrédient en particulier sur l'espace principal. Il vaut mieux présenter les équivalences sur un panneau latéral ou au verso.
- Dans le cas de formes posologiques telles que les timbres transdermiques, les implants et les inhalateurs, indiquer la quantité totale des ingrédients médicinaux (par timbre, implant ou inhalateur) et la dose délivrée par unité de temps et la durée d'utilisation sur l'étiquette intérieure et l'étiquette extérieureNote de bas de page 4.
- Inscrire sur le dispositif lui-même (p. ex. timbre, implant, cartouche) le taux de délivrance du médicament (p. ex. « x mg / jour »)Note de bas de page 4.
- Si la quantité totale dans l'unité ne correspond pas à la dose délivrée, la quantité totale de médicaments dans l'unité peut être indiquée sur un panneau latéral ou au verso de l'emballage, plutôt que sur l'espace principal. Cela a pour but de réduire la confusion au sujet de la posologie et de fournir de l'information rapidement en cas de mauvaise utilisation. (Voir la section 3.5.5, Timbres transdermiques.)
Expression de la concentration par volume
- Dans le cas des liquides pour administration orale, indiquer la quantité de chaque ingrédient médicinal par millilitre (p. ex. 5 mg / mL)Note de bas de page 4Note de bas de page 33 ou par volume habituellement administréNote de bas de page 4Note de bas de page 88 (p. ex. 25 mg / 5 mL). Il vaut mieux indiquer la quantité d'ingrédients médicinaux par millilitre sur l'étiquette des produits destinés à des patients de différents groupes d'âge. Ainsi, l'utilisateur peut calculer la dose nécessaire selon l'âge. Des instructions précises seront fournies dans la monographie de produit. Les dispositifs doseurs par voie orale sont des outils importants pour assurer une posologie appropriée. (Voir la sous section « Dispositifs doseurs » dans la section 3.5.1, Emballage - Considérations générales.)
- Pour les produits pour usage parentéral en petit volume (100 mL ou moins)Note de bas de page 89, indiquer la quantité de chaque ingrédient médicinal par millilitre (p. ex. 5 mg / mL), de même que la quantité totale par volume total (p. ex. 20 mg / 4 mL)Note de bas de page 4.
- Si le volume d'unité est 1 mL, il ne devrait y avoir qu'une seule expression de la concentrationNote de bas de page 89 (p. ex. 5 mg / mL ou 5 mg par mL).
- Lorsque la quantité totale par volume total est indiquée dans l'espace principal, s'assurer que cette information est proéminente par rapport à toute autre expression de la concentrationNote de bas de page 26Note de bas de page 89. La quantité totale par volume total devrait être l'expression principale suivie de la concentration par mL indiquée à proximitéNote de bas de page 34Note de bas de page 89.
- Utiliser une ou plusieurs techniques décrites dans les sections du Guide 3.3.1 Style et taille des caractères et 3.3.5 Couleur et contraste du Guide (p. ex. afficher l'information en premier, utiliser des caractères plus gros ou gras, accroître le contraste). Par exemple, on peut indiquer « 400 mg / 4 mL » de façon proéminente par rapport à « 100 mg / mL », en présentant l'expression non proéminente entre parenthèses ou en caractères plus petits.
- Pour les produits à dose unique sous une forme prête à l'utilisation (seringues préremplies), exprimer la concentration comme la quantité d'ingrédients actifs dans le volume fourni (p. ex. 6 mg / 1,2 mL, 4 mg / 0,8 mL). La concentration par mL peut être indiquée dans l'information posologique du produit.
- Pour les contenants ayant un volume total de moins de 1 mL, exprimer la concentration comme la quantité d'ingrédients actifs dans le volume fourni (p. ex. 3 mg / 0,5 mL)Note de bas de page 89.
- Il faut éviter les pourcentages pour exprimer la concentration lorsque la dose usuelle repose sur le calcul du poids ou du volume de la quantité de produits à administrerNote de bas de page 9Note de bas de page 33. L'expression de la concentration du produit devrait correspondre aux unités de mesure décrites dans l'information posologique pour éviter une erreurNote de bas de page 9.
- Éviter d'indiquer la concentration sous forme de pourcentage ou de ratio (p. ex. 1:1000)Note de bas de page 10Note de bas de page 90 afin de réduire au minimum les calculs additionnels exigés des consommateurs. Des exceptions sont possibles pour les produits de santé dont la concentration de l'ingrédient fait partie du nom (p. ex. anesthésiques locaux)Note de bas de page 33.
- L'épinéphrine est un produit de santé pour lequel de multiples expressions de la concentration ont souvent été utilisées avec une concentration présentée en milligrammes par millilitre (mg / mL) ou en ratio (p. ex.1:100 000). Pour les anesthésiques locaux dans lesquels l'épinéphrine est un ingrédient secondaire, la composante épinéphrine peut être exprimée en ratio (p. ex. lidocaïne à 1 % et épinéphrine 1:100 000). Si l'épinéphrine est le seul ingrédient, la concentration devrait être exprimée en « mg / mL »Note de bas de page 91 (p. ex. 1 mg / mL) et en tant que quantité totale dans le volume total (p. ex. 10 mg / 10 mL), tel qu'indiqué au point précédent.
- Pour les produits en grand volume administrés par voie parentérale, dont les solutions de dialyse, les indications en pourcentage ou en poids par 100 mL (p. ex. 1 % p / v ou 1 g / 100 mL) sont jugées acceptables, tout comme l'est la quantité totale par volume total (p. ex. 2,5 g / 250 mL)Note de bas de page 4. Le volume total dans le contenant devrait également être indiqué dans l'espace principal.
Reconstitution et dilution
- Pour les produits de santé sous forme liquide qui doivent être dilués avec l'utilisation, inclure un avertissement pertinent (tel que « Diluer avant l'emploi ») dans l'espace principal des étiquettes intérieure et extérieure. Le concentré de chlorure de potassium pour usage parentéral est l'un des produits exigeant cet avertissement sur le dispositif de fermeture du contenant. (Voir la section 3.4.3, Avertissements critiques.)
- Pour les produits qu'il faut reconstituer ou qui exigent une autre manipulation (p. ex. les poudres à reconstituer pour administration orale ou parentérale), indiquer la quantité totale de poudre ou de produit sec dans le contenant primaire sur l'espace principal des étiquettes intérieure et extérieure. S'assurer que ce nombre est proéminent et qu'il n'est pas placé à proximité de l'expression de la concentration finale. (Voir la section 3.3.3, Proximité et compatibilité de l'information figurant sur la partie principale.)
- Pour les produits de santé sous forme de poudre qui doivent être reconstitués et ensuite dilués avant l'emploi, inclure un avertissement pertinent (p. ex. « Acétazolamide pour injection - Diluer avant l'emploi ») dans l'espace principal des étiquettes intérieure et extérieure.
Expressions de la concentration des produits pour enfants
- Pour les produits destinés aux adultes ou aux enfants, présenter l'expression de la concentration dans l'espace principal sous une forme qui simplifie le calcul des doses pour enfants. Se rappeler que les expressions de la concentration peuvent devoir s'appliquer aux deux populations. Par exemple, un produit normalement administré à un adulte en dose de 1 g peut être administré à un enfant en dose basée sur le poids (p. ex. milligrammes par kilogramme [mg / kg]). Donc, si la fiole contient 1000 mg dans 10 mL (100 mg / mL), il peut être préférable d'utiliser comme expression principale de la concentration « 1 g / 10 mL » pour faciliter le calcul de la dose pour les adultes, et comme expression secondaire, « 100 mg / mL », pour faciliter le calcul des doses inférieures à 1 g.
- Pour les produits qui exigent des dilutions différentes pour les adultes et les enfants, il peut être nécessaire d'inscrire un avertissement sur un panneau latéral pour indiquer les dilutions requises pour produire une dose prête à l'emploi pour la population de patients visée.
Autre
- Si des préparations, des sels, des systèmes de délivrance ou des conjugués spéciaux (p. ex. conjugués anticorps médicament) différents du même médicament ont des posologies très différentes, indiquer clairement le type de produit sur l'étiquette, à proximité de la concentration du produit (p. ex. amphotéricine B, amphotéricine B liposomique ou amphotéricine B en complexe lipidique; trastuzumab ou trastuzumab emtansineNote de bas de page 92.)
3.4.3 Avertissements critiques
Contexte
Un avertissement critique est un avertissement qui doit être mis en évidence et transmis à chaque utilisateur avant l'administration du produit afin de faciliter que ce produit sera utilisé correctement et de prévenir une erreur qui pourrait entraîner de graves préjudices ou le décès. Les avertissements critiques doivent attirer l'attention des utilisateurs et être à la fois explicites et concisNote de bas de page 55Note de bas de page 93. On veut que les utilisateurs remarquent, lisent, comprennent et suivent les messages d'avertissementNote de bas de page 94. Les avertissements critiques sont souvent encadrés dans la monographie de produit et le dépliant d'accompagnement destiné au patient, et ils figurent souvent dans l'espace principal des étiquettes intérieure et extérieure.
La conception de l'étiquette et de l'emballage ne devrait pas envoyer de message contradictoire aux utilisateurs. Par exemple, si un médicament topique est fourni dans une fiole similaire à celle des produits injectables ou si un médicament à inhaler est fourni sous forme de capsule, il est possible que la présence d'un avertissement sur l'étiquette ne soit pas suffisante pour modifier l'expérience de l'utilisateur et la manipulation habituelle des produits fournis dans des emballages ou formats similairesNote de bas de page 95-98. Il faudra intégrer d'autres mesures de protection qui tiennent compte des limites humaines, des interactions entre les utilisateurs et le produit et de l'environnement où cette interaction a lieu lors de la conception du produit pour réduire au minimum l'erreur humaineNote de bas de page 99Note de bas de page 100. La présence de l'avertissement sur l'étiquette ne sera peut être pas suffisante pour alerter l'utilisateur d'une situation critiqueNote de bas de page 101. Idéalement, l'étiquette et l'emballage seront harmonisés et transmettront ensemble le message sur l'usage prévu du produitNote de bas de page 100. (Voir aussi la section 3.5.1, Emballage - Considérations générales.)
Recommandations
Principes généraux
- Consulter les règlements et les politiques applicables de Santé Canada pour obtenir d'autres renseignements sur les exigences relatives aux énoncés et aux symboles d'avertissement pour des produits précis.
- Idéalement, un avertissement critique a les caractéristiques suivantes :
- Il figure dans l'espace principalNote de bas de page 26Note de bas de page 46 des étiquettes intérieure et extérieure. Tous les autres avertissements devraient être inscrits sur un panneau latéral ou au verso, ou un renvoi devrait être fait au dépliant d'accompagnement ou au feuillet d'information à l'intention du patient remis avec le produit.
- Il est situé sur une partie que les utilisateurs devront manipuler pour utiliser le produit. Par exemple, pour les produits à usages multiples, les avertissements ne devraient pas être placés sur des parties de l'emballage qui seront jetées après la première utilisationNote de bas de page 94Note de bas de page 102. Les avertissements les plus remarqués et les plus efficaces sont placés de façon que la tâche soit temporairement interrompue et que les utilisateurs doivent lire l'avertissement avant de continuerNote de bas de page 55Note de bas de page 59.
- Il est adapté au public cible, c'est à dire qu'il tient compte des connaissances, de la formation et de l'expérience des personnes qui pourraient voir cet avertissementNote de bas de page 55Note de bas de page 59.
- Les avertissements critiques ne devraient pas :
- être scindés ou obscurcis par d'autres renseignements (p. ex. logos, textes ou éléments graphiques en arrière plan)Note de bas de page 37;
- être placés uniquement sur le panneau intérieur de l'emballage extérieur (p. ex. imprimés sur la paroi intérieure de la boîte).
Énoncés d'avertissements critiques
- Employer des énoncés concis composés de mots aussi explicites que possibleNote de bas de page 4Note de bas de page 93Note de bas de page 102-104. Les avertissements critiques transmis de cette façon attirent l'attention des utilisateurs, respectent les principes du langage clair, répondent aux exigences d'étiquetage bilingue et contribuent à réduire l'encombrement sur l'étiquette.
- L'utilisation d'un mot indicateur (p. ex. MISE EN GARDE ou ALERTE) est un élément d'un avertissement efficace qui peut aider à attirer l'attention sur l'information importanteNote de bas de page 55Note de bas de page 59Note de bas de page 102Note de bas de page 104.
- S'il y a assez d'espace (p. ex. sur l'étiquette extérieure), envisager l'utilisation des éléments supplémentaires suivants pour communiquer efficacement le message d'avertissement :
- description du danger (p. ex. « agent paralysant »);
- conséquence du non respect (p. ex. « provoque un arrêt respiratoire »);
- comportement requis ou souhaité (p. ex. « le patient doit être ventilé »)Note de bas de page 105.
- Utiliser des énoncés affirmatifs,Note de bas de page 33Note de bas de page 94 comme « Pour usage intraveineux seulement - Fatal si administré par d'autres voies ». Les énoncés affirmatifs portent moins à confusion que les énoncés non affirmatifs (p. ex. « Non destiné à l'administration intrathécale »), dans lequel le terme « non » risque de ne pas être vuNote de bas de page 9.
Proéminence
- Éviter les phrases entièrement en majuscules ou en italique, car ces formats sont difficiles à lireNote de bas de page 42Note de bas de page 46Note de bas de page 59Note de bas de page 106.
- Utiliser l'espace blanc autour d'un avertissement critique pour faire ressortir l'informationNote de bas de page 42Note de bas de page 59Note de bas de page 93Note de bas de page 102.
- On peut envisager une combinaison des caractéristiques suivantes pour attirer l'attention sur un avertissement, car la combinaison peut être plus efficace que les attributs individuelsNote de bas de page 55Note de bas de page 94 :
- majuscules pour faire ressortir les mots indicateursNote de bas de page 42Note de bas de page 46Note de bas de page 106
- impression en gros caractères grasNote de bas de page 9Note de bas de page 10Note de bas de page 20Note de bas de page 106Note de bas de page 107
- contraste élevé
- couleurNote de bas de page 9Note de bas de page 10Note de bas de page 106
- borduresNote de bas de page 102
- encadrésNote de bas de page 10Note de bas de page 103
- symboles picturauxNote de bas de page 108
- On peut utiliser la couleur (avec prudence) pour attirer l'attention sur l'avertissement et le différencier du reste du texteNote de bas de page 9Note de bas de page 42.
- Des combinaisons de couleurs particulières pour le texte et le fond sont associées à chacun des trois mots indicateurs : fond rouge et lettrage blanc pour « DANGER »; fond orange et lettrage noir pour « MISE EN GARDE »; fond jaune et lettrage noir pour « ATTENTION »Note de bas de page 94Note de bas de page 109. Le rouge est généralement utilisé pour le niveau de danger le plus élevé, suivi de l'orange et du jaune.
- Envisager le rouge ou l'orange, car ces couleurs sont associées à un plus grand danger et elles peuvent donner lieu à une meilleure conformité des utilisateursNote de bas de page 102. Cela dit, il y a une certaine controverse à propos de la signification du rouge, et on craint que la fréquence accrue de son utilisation ne dilue son impact (p. ex. du texte rouge est utilisé sur des sacs de solution pour mettre l'accent sur la voie d'administration ou d'autres aspects de l'utilisation du produit, pour mettre en évidence le contenu de médicaments et pour souligner la teneur en électrolytes de liquides de maintien et de remplacement intraveineux)Note de bas de page 8.
Symboles
- Limiter l'emploi des symboles aux mises en garde exigées par Santé Canada et n'employer que des symboles reconnus pour améliorer la compréhension des utilisateurs et l'utilisation du produitNote de bas de page 65Note de bas de page 104Note de bas de page 110. Les avertissements peuvent être repérés plus rapidement s'ils sont accompagnés de symboles ou d'image en gras, à fort contraste, de forme simple et placés à proximité du messageNote de bas de page 59Note de bas de page 105.
- Pour s'assurer que ces critères sont remplis, procéder à des essais par des utilisateurs des symboles nouveaux ou inconnus, surtout si l'étiquette et l'emballage du produit sont destinés à plusieurs groupes culturels différentsNote de bas de page 55.
Étiquettes, capsules et bagues métalliques
- Les avertissements critiques devraient être la seule information inscrite sur la surface supérieure (cercle) de la bague métallique ou de la capsule de protection d'une fiole contenant un produit injectableNote de bas de page 89. Si des informations sont inscrites sur le côté de la bague métallique (p. ex. nombres ou lettres représentant le numéro de lot ou un code), elles ne doivent pas détourner l'attention de l'avertissement sur la bagueNote de bas de page 111.
- Aucune information autre qu'un avertissement critique ne devrait figurer sur la surface supérieure de la bague métallique ou sur la capsule de protection d'une fiole de produit injectableNote de bas de page 111.
Avertissements critiques propres aux produits
Idéalement, les stratégies de prévention des erreurs telles que l'emploi d'avertissements critiques sur les étiquettes et les emballages de certains produits sont définies lors des essais par les utilisateurs avant la mise en marché. Les recommandations suivantes sont fondées sur les leçons tirées des déclarations d'erreurs relatives à des médicaments et des analyses réalisées par diverses administrations et organisations. Elles représentent des améliorations supplémentaires qui ont été proposées par des organismes de réglementation, des organisations de sécurité, des experts en sécurité et d'autres intervenants et qui devraient être incluses dans l'espace principal (étiquettes intérieure et extérieure) et sur le contenant, s'il y a lieu.
Médicaments injectables concentrés qui doivent toujours être dilués avant l'administration
- S'assurer que toutes les étiquettes portent l'avertissement suivant dans un encadré : « Concentré : Doit être dilué avant l'emploi »Note de bas de page 89.
- Les avertissements doivent apparaître sur les étiquettes du produit, mais ils peuvent aussi être [TRADUCTION] « inscrits sur la surface supérieure (cercle) de la bague métallique (embout) ou de la capsule de protection d'une fiole contenant un produit injectable »Note de bas de page 89.
- Concentré de chlorure de potassium pour usage parentéral
- L'utilisation d'une capsule ou d'une bague noire sur les fioles de chlorure de potassium et l'utilisation d'une ou de plusieurs bandes noires au-dessus de la constriction d'une ampoule sont limitées exclusivement aux contenants de chlorure de potassium concentré pour injectionNote de bas de page 89.
- [TRADUCTION] « La bague du contenant et la capsule de protection doivent être noirs, et les deux doivent présenter les mots "Doit être dilué" en caractères facilement lisibles, avec une couleur qui se distingue bien du fond OU la capsule de protection peut être en plastique transparent à travers lequel la bague noir est visible et le texte imprimé est facilement visibleNote de bas de page 112. »
Inhibiteurs neuromusculaires
- Inclure l'avertissement suivant sur les étiquettes, la capsule de protection et la bague métallique de tous les inhibiteurs neuromusculaires : « Mise en garde : Agent paralysant » ou « Agent paralysant »Note de bas de page 89Note de bas de page 113Note de bas de page 114. L'avertissement sur l'étiquette devrait être proéminent dans tous les espaces principaux.
- Au minimum, s'assurer que la couleur de la capsule de protection et de la bague métallique et la couleur du lettrage de l'avertissement respectent les exigences de l'USP :
- [TRADUCTION] « Les mots suivants doivent être inscrits sur la bague métallique et la capsule de protection du contenant, en noir ou blanc (selon la couleur qui se détache le mieux de celle de la capsule ou de la bague) : "Mise en garde : Agent paralysant" ou "Agent paralysant" (selon la taille du dispositif de fermeture)Note de bas de page 89. »
- Envisager l'utilisation d'une bague métallique rouge avec lettrage blanc : « Mise en garde : Agent paralysant » ou « Agent paralysant »Note de bas de page 113.
- Envisager l'utilisation d'une capsule rouge avec lettrage blanc : « Mise en garde : Agent paralysant » ou « Agent paralysant »Note de bas de page 113. On peut aussi utiliser une capsule de protection transparente qui permet de voir la bague métallique et sa mise en gardeNote de bas de page 89Note de bas de page 113.
- Limiter l'utilisation d'un avertissement en lettres blanches sur une capsule de protection et/ou une bague métallique rouges aux inhibiteurs neuromusculairesNote de bas de page 113. Une bague métallique et une capsule de protection rouges avec un avertissement en lettres blanches (ou une capsule de protection transparente) sont couramment utilisées pour les inhibiteurs neuromusculaires au CanadaNote de bas de page 113.
- L'utilisation de combinaisons de couleurs différentes de celles qui sont actuellement employées pour les inhibiteurs neuromusculaires au Canada (ou tout autre changement dans les mises en garde les concernant) peut nécessiter d'autres essais par les utilisateurs pour prévenir les conséquences imprévuesNote de bas de page 113.
- Consulter le bulletin de l'Institut pour l'utilisation sécuritaire des médicaments du Canada sur ce sujet pour obtenir de plus amples renseignements sur ces recommandations et d'autres considérations, notamment l'utilisation d'étiquettes pelables apposées par l'utilisateur sur les seringuesNote de bas de page 113.
Vincristine et autres alcaloïdes de la pervenche
- Les étiquettes de ces produits doivent porter l'avertissement suivant : « Pour usage intraveineux seulement - Fatal si administré par d'autres voies »Note de bas de page 33Note de bas de page 115Note de bas de page 116.
- L'avertissement doit être bien en vue sur l'étiquetteNote de bas de page 33Note de bas de page 116.
Méthotrexate pour administration par voie orale
- S'assurer que les étiquettes de méthotrexate administré par voie orale portent l'avertissement suivant : « Vérifier la dose et la fréquence - Le méthotrexate est généralement administré une fois par semaine »Note de bas de page 26Note de bas de page 33Note de bas de page 117.
- L'avertissement doit être bien en vue sur l'étiquetteNote de bas de page 33.
Système d'information sur les matières dangereuses utilisées au travail (SIMDUT)
Le SIMDUT est une « norme nationale canadienne en matière de communication des renseignements sur les dangers » qui précise la classification des matières dangereuses et les exigences pour l'étiquetage des contenantsNote de bas de page 118. Certains produits de santé peuvent être assujettis à la réglementation du SIMDUT, et les fournisseurs sont tenus d'identifier et d'étiqueter correctement ces produits.
3.4.4 Date limite d'utilisation
Contexte
Il existe de nombreux moyens d'exprimer la date limite d'utilisation, notamment selon le format de la date, l'ordre des divers détails et le regroupement de l'information. Ces variations peuvent poser des problèmes aux utilisateurs. L'examen des incidents a révélé des préoccupations dans deux principaux domaines : la compréhension et la lisibilité.
Problèmes de compréhension
- La représentation de l'année dans le format à deux chiffres crée une certaine confusion entre l'année et le mois (p. ex. on peut croire que « 03 04 » signifie « mars 2004 » ou « avril 2003 »)Note de bas de page 9Note de bas de page 10Note de bas de page 26.
- Si l'on montre seulement le mois et l'année de la date limite d'utilisation (p. ex. « 02/2014 » pour « février 2014 »), les utilisateurs, y compris les patients, pourraient ne pas savoir que la date limite d'utilisation est en fait le dernier jour du mois.
- L'utilisation d'un format à deux chiffres pour le mois et le jour peut créer de la confusion entre ces deux éléments de la date lorsque le jour du mois est le 12 ou moins (p. ex. « 2015-01-09 » peut être interprété comme le « 9 janvier 2015 » ou le « 1er septembre 2015 »).
- Si l'on n'utilise pas de mot d'introduction ou de descripteur (p. ex. EXP) pour distinguer la date limite d'utilisation du numéro de lot, les utilisateurs risquent de les confondre, surtout s'ils sont placés à proximité l'un de l'autre ou côte à côte sur l'étiquette du produitNote de bas de page 10.
Problèmes de lisibilité
- Les utilisateurs peuvent être incapables de voir la date en raison d'un faible contraste (p. ex. encre noire sur fond foncé). L'impression en relief (surtout quand il n'y a que peu ou pas de contraste de couleur) est un problème connexe qui peut nuire considérablement à la capacité de trouver et de lire l'information sur une étiquetteNote de bas de page 10Note de bas de page 26.
- Si l'encre pâlit avec le temps, cela peut créer des problèmes.
- Les arrière plans qui brillent et reflètent la lumière peuvent nuire à la lisibilitéNote de bas de page 10.
Recommandations
Améliorer la compréhension
- Inclure les trois éléments de la date (année, mois, jour) s'il y a lieu et si l'espace le permetNote de bas de page 4. Lorsque la date limite d'utilisation doit comprendre le jour du mois, utiliser le format à quatre chiffres pour l'année et indiquer le mois en lettres (voir ci dessous).
- Utiliser des tirets entre les trois éléments (p. ex. AAAA MM JJ pour l'année, le mois et le jour) pour plus de clarté.
- Pour le mois, utiliser les abréviations suivantes (qui sont acceptables en français et en anglais) : JA, FE, MR, AV, MA, JN, JL, AU, SE, OC, NO, DENote de bas de page 4Note de bas de page 15Note de bas de page 16Note de bas de page 41.
Remarque : Il est possible que JN soit interprété par erreur comme le mois de janvier, au lieu du mois de juin, auquel cas, le produit serait jeté prématurément au lieu d'être utilisé au delà de sa date limite d'utilisation. Il n'y a donc aucun risque pour la santé. La même règle s'appliquerait si l'on pensait que MA signifie « mars » au lieu de « mai ». - Si l'espace disponible sur un petit contenant ne permet pas d'inclure les trois éléments de la date, présenter l'année avec quatre chiffres et le mois avec deux lettres, comme dans les exemples ci-dessousNote de bas de page 4.
- Ajouter un descripteur avant la date pour avertir l'utilisateur de la signification de l'information, p. ex. : « EXPNote de bas de page 10 », « EXPIRATION », « EXPIRATION DATE », « DATE D'EXPIRATIONNote de bas de page 4 », « DATE D'EXP. », « EXPIRY », « EXPIRY DATE » ou « EXPIRENote de bas de page 88 ».
Par exemple :
Quand tous les éléments de la date s'appliquent :
AAAA MM JJ : 2024-OC-31
Pour les petits contenants, s'il n'y a de l'espace que pour le mois et l'année :
AAAA MM : 2024-OC
Améliorer la lisibilité
- Laisser un espace suffisant entre la date limite d'utilisation et le numéro de lot pour éviter la confusion et pour empêcher qu'ils soient lus ensemble comme un seul élément d'information. Dans la mesure du possible, présenter la date limite d'utilisation et le numéro de lot sur des lignes séparées.
- Utiliser des encres qui s'endommageront ou s'effaceront difficilement sur le produit ou son emballage au cours d'une utilisation normale (p. ex. résistantes à l'alcool de désinfection)Note de bas de page 15Note de bas de page 16Note de bas de page 35. (Voir la section 3.3.9, Permanence.)
- Éviter d'imprimer l'information en relief ou en creux, car cela ne crée que peu ou pas de contrasteNote de bas de page 10Note de bas de page 35Note de bas de page 119. La gravure (gaufrage en relief et en creux) du texte sur le contenant pourrait ne pas offrir suffisamment de contraste à elle seule. Si on a recours à cette méthode, il faut surligner le texte avec de l'encreNote de bas de page 16.
Emplacement
- Indiquer la date limite d'utilisation sur les étiquettes intérieure et extérieure de chaque produitNote de bas de page 18, à un endroit facile à trouverNote de bas de page 35. Cela peut permettre d'éviter que cette information ne soit pas vue. Par exemple, envisager d'indiquer la date limite d'utilisation sur un côté ou au dos de l'emballage du produitNote de bas de page 33.
- Inscrire la date limite d'utilisation sur une section qui ne sera pas retirée ou détruite lors de l'ouverture du contenantNote de bas de page 4Note de bas de page 35.
- (Voir la section 3.5.4, Plaquettes alvéolaires.)
Autres considérations
- Quand on étiquette un produit qui contient plusieurs éléments ayant des dates limites d'utilisation différentes, on doit inscrire la date la plus proche dans le temps sur l'étiquette extérieure du produit.
3.4.5 Numéro de lot
Contexte
Certains utilisateurs s'inquiètent de la confusion créée quand un numéro de lot est confondu avec la date limite d'utilisation, ou lorsqu'il est combiné à celle ciNote de bas de page 10. Des utilisateurs ont également dit avoir de la difficulté à lire le numéro de lot sur certaines étiquettes. La lisibilité est altérée quand le texte est en relief, quand il n'y a pas assez de contraste entre le texte et l'arrière plan, et quand le texte imprimé manque de permanenceNote de bas de page 10Note de bas de page 35. Pour certains produits (p. ex. les vaccins), le numéro de lot est un élément du processus de vérification ou de documentation par les utilisateurs. En pareilles circonstances, il faut que le numéro soit lisible pour assurer une documentation complète de l'administration du produit.
Recommandations
Réduction de l'ambiguïté
- Utiliser un terme ou un indicateur comme « numéro de lot », « N° de lot » ou « Lot » avant l'information sur le lot, pour que l'utilisateur sache où trouver cette information en cas de rappelNote de bas de page 4Note de bas de page 88.
- Laisser un espace suffisant entre le numéro de lot et la date limite d'utilisation pour éviter la confusion et pour empêcher qu'ils soient lus ensemble comme un seul élément d'information. Dans la mesure du possible, présenter le numéro de lot et la date limite d'utilisation sur des lignes séparées.
Améliorer la lisibilité
- Utiliser des encres qui s'endommageront ou s'effaceront difficilement sur le produit ou son emballage (p. ex. résistantes à l'alcool de désinfection)Note de bas de page 15Note de bas de page 16Note de bas de page 35. (Voir la section 3.3.9, Permanence.)
- Éviter d'imprimer l'information en relief ou en creux, car cela ne crée que peu ou pas de contrasteNote de bas de page 10Note de bas de page 15Note de bas de page 16Note de bas de page 35. La gravure (gaufrage en relief et en creux) du texte sur le contenant pourrait ne pas offrir suffisamment de contraste à elle seule. Si on a recours à cette méthode, il faut surligner le texte avec de l'encreNote de bas de page 16.
Emplacement
- Indiquer le numéro de lot sur les étiquettes intérieure et extérieure de chaque produitNote de bas de page 18, à un endroit facile à trouverNote de bas de page 35. Cela peut permettre d'éviter que cette information ne soit pas vue. Par exemple, envisager d'indiquer le numéro de lot sur un côté ou au dos de l'emballage du produitNote de bas de page 33.
- Éviter de placer le numéro de lot sur la surface supérieure (cercle) de la bague métallique des fioles, conformément aux normes USP (pharmacopée des États Unis)Note de bas de page 120.
- Inscrire le numéro de lot sur une section qui ne sera pas retirée ou détruite à l'ouverture du contenant (p. ex. pas sur des languettes détachables ou sur le dessus ou le col d'une ampoule)Note de bas de page 9Note de bas de page 35.
- Voir la section 3.5.4, Plaquettes alvéolaires.
Autres considérations
- Quand on étiquette un produit qui contient plusieurs éléments ayant chacun leur numéro de lot, on peut utiliser un nouveau numéro de lot pour représenter le produit combiné.
3.4.6 Identification automatisée (p. ex. codes à barres)
Contexte
L'identification automatisée est définie comme [TRADUCTION] « l'utilisation de codes à barres, de l'identification par radiofréquence (IRF) et d'autres codes lisibles par machine afin d'identifier un article ou un processus rapidement et avec exactitudeNote de bas de page 121 ». Même s'ils ne sont pas obligatoires au Canada, les systèmes automatisés d'identification offrent la possibilité d'utiliser les produits de santé de façon plus sûre et plus efficace aux divers stades de l'utilisation : achat, gestion des stocks, entreposage, préparation, délivrance et administrationNote de bas de page 122. Ces systèmes peuvent également faciliter la traçabilité des produits (p. ex. lors d'un rappel) et la vérification de l'authenticité des produits de santé durant leurs déplacements au sein de la chaîne d'utilisation des médicamentsNote de bas de page 122.
Recommandations
- Intégrer aux identificateurs automatisés l'information clé qui assurera une sélection et une utilisation appropriées du produitNote de bas de page 16. Il ne faut pas considérer que l'information contenue dans l'identificateur automatisé fait en sorte qu'il n'est plus obligatoire d'inscrire toute l'information qui doit figurer directement sur les étiquettes intérieure et extérieure.
- La lisibilité de l'information clé figurant sur l'étiquette ne doit pas être altérée par la présence d'identificateurs automatisés.
- L'information intégrée à l'identificateur automatisé ne devrait comprendre rien d'autre que les renseignements approuvés sur le produit. Elle devrait aussi être axée sur les besoins des utilisateurs et ne devrait pas être de nature promotionnelleNote de bas de page 26. La présente recommandation vise tout type d'identificateur automatisé figurant sur l'étiquette ou l'emballage d'un produit de santé, dont les codes QR (réponse rapide) ou les micropuces qu'on peut lire avec un appareil portatif.
- L'information intégrée à l'identificateur automatisé doit être conforme aux exigences réglementaires visant l'étiquetage des produits de santé. De plus, les promoteurs doivent s'assurer qu'il existe des processus d'assurance de la qualité, notamment de vérification de l'exactitude (p. ex. le bon code à barres sur la bonne étiquette) et de la lisibilité des identificateurs automatisés sur les étiquettes des produits de santé. Pour l'identification automatisée des produits pharmaceutiques au Canada, il faut tenir compte de l'information et des normes approuvées par le Projet canadien de codage à barres des produits pharmaceutiquesNote de bas de page 123.
3.5 Emballage
3.5.1 Emballage - Considérations générales
Contexte
L'emballage d'un produit de santé est un facteur important pour promouvoir l'utilisation prévue et appropriée de ce produit. Le type ou le format du contenant donne souvent aux utilisateurs une idée de la voie et de la méthode d'administration prévuesNote de bas de page 8. Si le contenant d'un produit de santé, son format ou son apparence sont similaires à ceux d'autres produits censés être manipulés différemment, des erreurs peuvent être commises et entraîner de graves préjudices, comme l'illustrent les exemples ci-après.
- Si l'on fournit un médicament topique dans un flacon du même format que celui utilisé pour un médicament injectable, l'utilisateur risque d'extraire le produit à l'aide d'une seringue pour injection, puis de se l'injecter par inadvertanceNote de bas de page 95Note de bas de page 124.
- Si l'on fournit de l'eau stérile pour irrigation dans un sac en plastique flexible, l'utilisateur pourrait l'administrer par voie intraveineuse par inadvertance. Dans pareille situation, le problème de ressemblance tient à la présence d'un port d'injection sur le sac d'eau stérile à la possibilité d'y fixer une tubulure pour perfusion intraveineuse (IV)Note de bas de page 8.
- Il peut arriver que des capsules pour inhalation soient ingérées par inadvertanceNote de bas de page 96. Inversement, des capsules censées être ingérées peuvent être prises pour des capsules pour inhalationNote de bas de page 96.
- La vincristine destinée à être administrée par voie intraveineuse pourrait être administrée par voie intrathécale par inadvertanceNote de bas de page 125. De même, du chlorure de potassium concentré destiné à être dilué puis administré en perfusion pourrait être injecté par inadvertance sans avoir été diluéNote de bas de page 126.
- Un produit destiné à traiter les symptômes de la ménopause peut être confondu avec un contraceptif oral, en partie à cause des similitudes de conception des emballagesNote de bas de page 97.
Emballage extérieur ou suremballage
L'emballage extérieur, ou le suremballage, offre un bon moyen d'afficher des renseignements importants sur le produit. Parfois, il permet aussi de réunir les divers éléments du produit (p. ex. le médicament, le dispositif doseur et le feuillet d'information à l'intention du patient)Note de bas de page 75. Toutefois, il faut être prudent avec ce type d'emballage, car les suremballages, les emballages extérieurs et les cartons d'expédition peuvent aussi nuire à une identification et à une utilisation appropriées du produit, comme l'illustrent les exemples suivants :
- L'utilisation d'une matière réfléchissante sur l'étiquette extérieure ou le suremballage peut réduire la visibilité de l'information clé se trouvant sur l'étiquetteNote de bas de page 35.
- Il arrive que des produits soient placés dans des boîtes d'expédition mal étiquetées, ce qui peut entraîner des erreurs d'identification et de sélectionNote de bas de page 35Note de bas de page 126.
Produits en plusieurs parties
Les produits de santé comprenant plusieurs éléments (p. ex. un vaccin et son diluant) destinés à être utilisés ensemble peuvent être conditionnés de sorte que tous ces éléments soient offerts dans le même emballage; mais ils peuvent aussi être emballés séparément. Des erreurs peuvent se produire lorsque l'étiquetage ou l'emballage ne permet pas d'utiliser correctement les divers éléments, comme l'illustrent les exemples suivants :
- L'étiquetage est insuffisant et n'indique pas clairement que le produit comprend plusieurs éléments qui doivent tous être utilisés ensembleNote de bas de page 127Note de bas de page 128.
- Un des éléments ne se voit pas bien (p. ex. caché, peu visible ou peu accessible) dans l'emballage combiné, ce qui donne à croire à l'utilisateur que seul l'élément visible est requis (p. ex. le diluant d'un produit devant être reconstitué a été fourni dans une seringue préremplie et a été confondu avec un produit prêt à utiliser; le médicament actif n'a donc pas été reconstitué et l'on a administré uniquement le diluantNote de bas de page 127).
- L'information clé relative aux diluants du produit n'est pas assez en évidenceNote de bas de page 127.
Dispositifs doseurs
Les produits de santé destinés aux enfants sont souvent offerts sous forme de liquides pris par voie orale afin d'en faciliter l'administrationNote de bas de page 129. L'emballage de certains de ces produits contient un dispositif de mesure ou de délivrance de la dose destiné à faciliter l'administration d'une dose ou d'un volume précis par le patient. Cette présentation du dispositif doseur par voie orale est destinée à aider l'utilisateur à préparer et à administrer adéquatement la doseNote de bas de page 33.
Recommandations
Généralités
- Un certain nombre de facteurs peuvent être considérés au moment de choisir un emballage. Ces facteurs comprennent le maintien de la stabilité du produit, la facilité de fabrication, le choix du système de distribution, la sécurité du produit, la facilité d'utilisation et même la conformité des utilisateursNote de bas de page 130.
- Offrir les produits de santé dans un contenant qui permet de les choisir et de les utiliser correctement, au lieu de faire appel uniquement à des éléments sur l'étiquette tels que les avertissements. Un emballage bien conçu peut réduire le risque d'erreurs relatives aux médicamentsNote de bas de page 130.
- Déterminer comment le produit sera utilisé au point d'administration. Par exemple, s'il doit être administré par voie intraveineuse, il faut concevoir l'emballage et l'étiquette de sorte que l'information soit très facile à lire quand le contenant est suspendu à une potence pour IVNote de bas de page 130.
- Quand on envisage d'opter pour un tout nouveau type de contenant pour un produit de santé sans pouvoir s'inspirer des pratiques antérieures sur le marché, il faut intégrer des essais par les utilisateurs au processus d'élaboration du produitNote de bas de page 74. C'est particulièrement important quand un nouveau type de contenant est utilisé pour un produit existant.
- Si l'espace le permet, envisager d'inclure d'autres indices qui aideront l'utilisateur à identifier, choisir et utiliser le produit (p. ex. apposer le symbole chimique universel « H2O » sur les sacs d'eau stérile, ou choisir un contenant de taille et de forme uniques pour un produit particulier)Note de bas de page 10Note de bas de page 100.
Emballage extérieur ou suremballage
- Pour améliorer la visibilité de l'information clé, éviter d'utiliser des matières réfléchissantes pour le suremballage (p. ex. pour l'emballage des solutions intraveineuses); utiliser des matières mates dans la mesure du possibleNote de bas de page 35.
- Envisager d'imprimer et de mettre en surbrillance l'information essentielle relative au produit sur les cartons d'expédition des produits susceptibles d'être stockés dans ce carton d'origine. Dans pareil cas, l'information devrait être imprimée sur au moins trois faces non opposées du cartonNote de bas de page 4Note de bas de page 35.
Produits en plusieurs parties
- Dans la mesure du possible, éviter d'emballer séparément les différents éléments d'un produit en plusieurs parties. Fournir et emballer plutôt ensemble tous les éléments composant le produit qu'il faudra utiliser pour préparer et administrer la doseNote de bas de page 127.
- Créer un emballage qui, une fois ouvert, permet de voir clairement 1) tous les produits inclus destinés à être utilisés en même temps et 2) les directives pour combiner ces produits. S'assurer que les étiquettes indiquent clairement le nombre de parties et la façon dont il faut les combiner et les utiliserNote de bas de page 4Note de bas de page 74.
- Pour éviter les erreurs de dilution lorsqu'un diluant est inclus dans l'emballage, n'en fournir que le volume exact nécessaire à la reconstitutionNote de bas de page 131Note de bas de page 132.
- Chaque élément des produits emballés ensemble qui sont destinés à être utilisés séparément (p. ex. les vitamines prénatales pour le jour et pour la nuit) devrait être emballé dans un contenant immédiat distinct, par exemple, une alvéole.
Dispositifs doseurs
- Inclure un dispositif doseur avec tous les produits de santé liquides destinés à être avalés, et exprimer l'information sur la dose en unités de mesure correspondant à l'étalonnage du dispositifNote de bas de page 133-135 (voir la section 3.5.3, Produits pour enfants).
- Le dispositif doseur devrait comporter une marque permettant de mesurer la plus petite dose recommandéeNote de bas de page 133Note de bas de page 134.
- Le volume des dispositifs doseurs ne devrait pas dépasser de beaucoup la plus forte dose individuelle recommandée sur l'étiquette du produitNote de bas de page 134.
- Le dispositif doseur devrait être réétalonné si l'on modifie la concentration du produit avec lequel il est censé être utilisé.
- Fournir des instructions claires et précises sur la façon de mesurer et d'administrer une dose donnée. L'ajout de dessins montrant l'heure, la méthode et la voie d'administration peut être utile à certains utilisateursNote de bas de page 136. Mettre à l'essai les dessins auprès des utilisateurs dans le cadre du test de compréhension.
- Utiliser des unités SI et métriques pour les mesures sur les dispositifs doseurs et d'autres renseignements figurant sur l'étiquetteNote de bas de page 9Note de bas de page 64Note de bas de page 137.
- Utiliser un contraste de couleurs suffisant pour les graduations ou les marques des dispositifs doseurs afin d'éviter que ces marques ne soient obscurcies lorsqu'on ajoute le produit liquide au dispositifNote de bas de page 134. Par exemple, utiliser de l'encre noire sur un champ blancNote de bas de page 15.
- Éviter les zéros après la décimale (« 2 », pas « 2,0 ») afin d'éviter les doses dix fois trop élevéesNote de bas de page 64Note de bas de page 132.
- Utiliser le zéro avant la décimale (« 0,2 », pas « ,2 ») afin d'éviter les doses dix fois trop élevéesNote de bas de page 64Note de bas de page 132.
- Afin d'éviter toute administration parentérale par inadvertance de liquides destinés à être avalés, l'applicateur oral (p. ex. seringue) fourni comme dispositif doseur ne devrait pas pouvoir accepter d'aiguilleNote de bas de page 138.
- Veiller à ce que les bouchons utilisés comme dispositifs doseurs pour les liquides oraux soient d'une taille et d'une conception adéquates pour éviter le risque de suffocation chez les enfantsNote de bas de page 138.
- Pour les préparations buvables dont la marge thérapeutique est étroite ou dont la dose est inférieure à 5 mL, les cuillers et les gobelets ne sont pas acceptablesNote de bas de page 138.
3.5.2 Petits contenants et contenants de petit volume
Contexte
Le terme « petit contenant » ou « contenant de petit volume » est réservé aux contenants imposant des restrictions évidentes à la quantité d'information qui peut figurer sur l'étiquette ou l'emballage du produitNote de bas de page 47Note de bas de page 139. Cela comprend les contenants spéciaux qui sont trop petits pour porter une étiquette complèteNote de bas de page 4.
L'utilisation de petits contenants peut causer des erreurs en raison de la difficulté à lire ou à comprendre les étiquettes sur le produit, comme l'illustrent les exemples suivants :
- Il n'y a pas assez d'information sur le produit (p. ex. absence de la dose totale ou de la concentration de l'ingrédient actif, absence d'instructions de reconstitution)Note de bas de page 8.
- Il est impossible d'identifier facilement les fioles et les ampoules contenant des solutions concentrées de médicaments qui doivent être diluées avant l'administration parentéraleNote de bas de page 140.
- En raison de l'orientation du texte, le champ de vision est limité par la courbure du petit contenant (p. ex. on peut confondre plus facilement des produits au nom similaire fournis dans des ampoules si ce nom est imprimé horizontalement sur la circonférence de l'ampoule, plutôt que sur sa longueur, surtout dans le cas des petites ampoules de 1, 2 ou 5 mLNote de bas de page 35).
Recommandations
- Tenir compte de la taille du contenant et de la conception de l'étiquette dès les premières étapes de développement du produit.
- Considérer tout contenant qui n'est pas assez grand pour porter une étiquette intérieure conforme au paragraphe C.01.004(1) du Règlement sur les aliments et droguesNote de bas de page 18 comme un petit contenant ou un contenant de petit volume auquel les présentes recommandations devraient s'appliquer.
- Déterminer avec Santé Canada quels petits contenants ou contenants de petit volume sont acceptables avant de soumettre une demande relative au produit et le plus tôt possible au cours du développement du produit.
- Réserver les petits contenants et les contenants de petit volume aux cas où leur utilisation n'a pas d'incidence négative sur le profil d'innocuité du produit. Par exemple, les avantages d'offrir des médicaments injectables en petit volume (pour limiter à une seule dose la quantité totale dans chaque contenant) pour assurer la sécurité peuvent contrebalancer les éventuels problèmes liés à la plus petite étiquette intérieure.
- Pour améliorer la lisibilité de l'information clé pour les utilisateurs, tenir compte de la taille et de l'orientation du texte sur les petits contenantsNote de bas de page 35. L'orientation du texte devrait être la même que celle du champ de vision, de sorte que la vision ne soit pas limitée par les caractéristiques physiques du petit contenant, comme sa courbure.
- Envisager l'utilisation d'un plus grand contenant, de plus grandes étiquettes ou d'un emballage et d'une étiquette au concept innovateur lorsque l'espace est limité (p. ex. employer des contenants plus grands que ce qui est requis pour le volume total de gouttes pour les yeux ou de comprimés, ou utiliser une étiquette mobile, une étiquette dépliante ou une étiquette pelable). Les nouveaux types d'étiquettes devraient être conformes aux règlements et aux lignes directrices applicablesNote de bas de page 1Note de bas de page 4. En ce qui concerne l'étiquetage des ampoules, des fioles et des seringues préremplies, se reporter à l'information fournie dans la norme CSA intitulée Étiquetage des ampoules, des fioles et des seringues à cartouches utilisées pour les médicamentsNote de bas de page 15.
3.5.3 Produits pour enfants
Contexte
Les enfants présentent naturellement un haut risque de préjudice par suite d'une erreur relative à un médicamentNote de bas de page 133. Le nombre d'erreurs évitables dans cette population est trois fois plus élevé que parmi les adultes traités à l'hôpitalNote de bas de page 141. Quand une erreur se produit, les nourrissons et les enfants courent plus de risques de préjudice ou de décès que les adultes en raison de cette erreurNote de bas de page 142. Les facteurs d'étiquetage et d'emballage suivants peuvent multiplier les risques chez les enfants :
- obligation de calculer des doses individuelles en fonction de l'âge, du poids (p. ex. mg/kg) ou de la surface corporelleNote de bas de page 133;
- mauvaise interprétation de l'étiquette ou des marques sur les dispositifs doseurs se soldant par des doses insuffisantes ou trop élevéesNote de bas de page 135.
Recommandations
- Si un produit pour enfants est très différent d'un produit similaire pour adultes, créer une étiquette et un emballage très différents pour les deux produitsNote de bas de page 136.
- Concevoir l'emballage du produit et le dispositif de fermeture du contenant de façon que les enfants n'aient pas accès au produit ou n'y aient qu'un accès limitéNote de bas de page 130.
- S'il y a lieu, séparer l'information bilingue afin d'éviter toute mauvaise interprétation des détails relatifs aux produits qui sont destinés aux enfants, mais pas aux nourrissons. Par exemple, en français, le mot « enfants » signifie « children » en anglais, mais il diffère du mot anglais « infants » par une seule lettre.
- Fournir des instructions claires et précises sur la façon de mesurer et d'administrer une dose donnée. L'ajout de dessins montrant l'heure, la méthode et la voie d'administration peut être utile à certains utilisateurs. Mettre à l'essai les dessins et les graphiques auprès des utilisateurs dans le cadre du test de compréhension. (Voir l'annexe 2, Principes liés aux facteurs humains et méthodes d'évaluation applicables à l'étiquetage et à l'emballage.)
- Si un dispositif de mesure ou de dosage est fourni avec les formes liquides de produits destinés à un usage chez des enfants, les instructions fournies doivent être conformes au dispositif de mesureNote de bas de page 143.
3.5.4 Plaquettes alvéolaires
Contexte
Il existe plusieurs types de plaquettes alvéolaires, par exemple des alvéoles individuelles sur une bande perforée permettant de séparer les doses unitaires ou des plaquettes fermées par une feuille et renfermant plusieurs doses à utiliser selon les besoins, ou pendant une durée de traitement donnée (p. ex. 3 jours, 2 semaines, 1 mois)Note de bas de page 9. La plaquette alvéolaire peut être sortie de son emballage extérieur, coupée en plus petites unités ou déchirée le long des perforations. Toutes ces manipulations peuvent faire en sorte que l'information sur le produit ne sera plus claire ou sera inexistante, ce qui nuira à l'utilisation sécuritaire du produit. Les préoccupations suivantes ont été soulevées à propos de la conception des plaquettes alvéolaires :
- illisibilité du nom du médicament ou de sa concentration, notamment à cause d'une pellicule brillante et du manque de contraste entre les caractères et l'arrière-planNote de bas de page 8Note de bas de page 9Note de bas de page 26Note de bas de page 42Note de bas de page 47;
- incapacité à trouver le nom du médicament ou la concentration sur les comprimés, les capsules ou les pastilles restantes une fois que certaines ont été retirées de leur alvéoleNote de bas de page 8Note de bas de page 42;
- nom du produit et concentration imprimés à travers deux alvéoles, ce qui en fait sorte qu'il est difficile de savoir si la concentration indiquée est celle de deux alvéoles ou d'une seuleNote de bas de page 8Note de bas de page 71;
- décalage entre l'information affichée et les perforations sur une plaquette alvéolaireNote de bas de page 8;
- difficulté à identifier le produit une fois que la plaquette alvéolaire a été retirée de sa boîte (difficulté à associer la plaquette à sa boîteNote de bas de page 42), problème touchant particulièrement les consommateurs qui prennent plusieurs produits de santé emballés de cette façon;
- difficulté à retirer le produit des alvéolesNote de bas de page 144;
- présentation et séquençage des doses ne correspondant pas à la posologie habituelle approuvée du produitNote de bas de page 9Note de bas de page 145 :
- étiquetage des doses avec les jours de la semaine, quand cet étiquetage n'est pas requisNote de bas de page 9;
- alvéoles numérotées en séquenceNote de bas de page 9;
- plus de doses fournies que ce qui est nécessaire pour un seul traitementNote de bas de page 9.
Recommandations
Généralités
- Choisir pour la plaquette alvéolaire une matière qui ne nuira pas à la lisibilité de l'information clé. Par exemple, les films argentés peuvent ne pas convenir, car ils sont brillants, ce qui peut réduire la lisibilité de l'information impriméeNote de bas de page 26Note de bas de page 42.
- Inscrire l'information suivante sur chaque alvéole :
- marque déposée, marque nominative (ou nom du produit, s'il n'a pas de marque nominative);
- nom établi (usuel ou propre) ou, dans le cas d'un médicament renfermant plus d'un ingrédient médicinal, marque nominative du médicament ou du produit de santé;
- concentration du produit de santé, sauf si le nom est utilisé uniquement pour une concentration donnée du produit (p. ex. pour un produit contenant plus d'un ingrédient médicinal);
- voie d'administration (sauf dans le cas des produits solides administrés par voie orale, notamment les comprimés);
- numéro de lot;
- date limite d'utilisation.
- Si l'on ne peut pas inscrire l'information sur chaque plaquette sans qu'elle devienne illisible, la présenter de façon à éviter que le nom du médicament ou du produit (au moins la marque nominative) et la concentration soient détachés ou détruits quand on retire une unité posologique. Par exemple, envisager l'affichage répétitif en diagonaleNote de bas de page 26 ou aléatoireNote de bas de page 9. Il peut être acceptable d'indiquer le numéro de lot et la date limite d'utilisation à l'une ou aux deux extrémités de la plaquetteNote de bas de page 26.
- Éviter les perforations si la séparation des alvéoles le long de ces perforations sectionne de façon inappropriée certains renseignements (p. ex. la marque nominative ou la concentration).
- Concevoir la plaquette alvéolaire de sorte qu'elle soit adaptée à l'information relative au produit et aux instructions d'utilisationNote de bas de page 9 :
- Éviter d'inscrire des renseignements relatifs au produit directement sur deux alvéoles, afin que l'utilisateur ne pense pas que deux comprimés ou capsules correspondent à la dose en fait contenue dans un comprimé ou une capsuleNote de bas de page 8Note de bas de page 145.
- Ne placer qu'une dose unitaire (p. ex. un comprimé, une capsule ou une pastille) dans chaque alvéoleNote de bas de page 9. Si de multiples doses unitaires doivent être prises en tant que dose unique, cela doit être précisé dans les instructions sur la posologie.
- S'il y a des perforations entre les alvéoles, elles devraient permettre la séparation de chaque alvéole de la plaquetteNote de bas de page 8. Les perforations qui incluent plusieurs alvéoles peuvent laisser croire à une posologie différente de la réalité (p. ex. si deux alvéoles au lieu d'une seule sont dans la même unité perforée, on pourrait croire que le contenu des deux alvéoles correspond à une dose).
- Envisager l'utilisation de nouvelles technologies dans lesquelles l'étiquette intérieure adhère à la plaquette alvéolaire, de sorte que l'information clé est préservée tout au long de l'utilisation du produit.
- Si l'étiquette risque de se détacher durant l'utilisation, imprimer l'information clé sur chaque alvéole.
Produits de santé destinés à une utilisation séquentielle (p. ex. contraceptifs oraux)
- Éviter les perforations sur ce type de plaquette, car le médicament ou le produit doit être pris dans un ordre bien précis, et chaque plaquette peut contenir différents produits ou différentes doses de produit.
- Veiller à ce que l'information requise sur la plaquette alvéolaire demeure lisible quand on retire les dosesNote de bas de page 4. Par exemple, on peut inscrire cette information sur une seule section qui ne sera pas retirée ou détruite pendant la période d'utilisation du produit.
- Date limite d'utilisation et numéro de lot :
- Idéalement, imprimer la date limite d'utilisation et le numéro de lot sur chaque alvéole, de sorte qu'ils soient toujours lisibles quand il ne reste plus qu'une dose, surtout si chaque alvéole est détachable.
- Inscrire la date limite d'utilisation et le numéro de lot à un seul endroit sur les plaquettes alvéolaires à aspect de « piste de course » (p. ex. celles des contraceptifs oraux), afin qu'ils ne se déchirent pas pendant l'utilisation (p. ex. sur l'extrémité de l'emballage scellée à chaud).
- Inscrire la date limite d'utilisation et le numéro de lot de sorte qu'ils soient alignés entre les perforations, le cas échéant (c.a.d. imprimé sur des sections entre les perforations, de sorte que l'information ne soit pas perdue quand on déchire les alvéoles).
3.5.5 Timbres transdermiques
Contexte
L'utilisation de médicaments transdermiques et les caractéristiques de ce système de délivrance ont causé des erreurs et des problèmes de santé à certains patientsNote de bas de page 146. Les problèmes suivants (de nature générale) ont été signalés lors de l'utilisation de timbres transdermiques :
- Les timbres transdermiques faits d'une matière translucide ou de la couleur de la peau (pour que leur utilisation soit discrèteNote de bas de page 146) sont parfois difficiles à voir sur la peau. Il y a donc une possibilité de surdose si le patient ou son soignant ne peut pas percevoir un timbre existant et en applique un deuxième sans retirer le premier. Si le timbre ne se voit pas bien, il peut y avoir exposition non intentionnelle au médicament si le soignant, un enfant ou un animal de compagnie entre en contact avec un timbre qui est tombé ou n'a pas été éliminé de façon appropriéeNote de bas de page 74. Ce risque pour la sécurité est particulièrement préoccupant pour les médicaments de niveau d'alerte élevé (p. ex. le fentanyl)Note de bas de page 147.
- L'information clé, comme le nom du médicament et la concentration, devrait être clairement affichée sur le timbre lui-même. C'est particulièrement important pour les patients qui ne peuvent pas expliquer à d'autres personnes le mode d'emploi de leur médicament, ainsi que pour les soignants et les professionnels de la santé qui connaissent mal le patient ou ne l'ont pas rencontré auparavant (p. ex. le personnel des services d'urgence des hôpitaux ou des équipes médicales d'urgence). Il faut que les professionnels de la santé puissent identifier le contenu d'un timbre afin de pouvoir prendre les mesures appropriées relativement à ce traitement (p. ex. soulagement de la douleur, maîtrise de la pression artérielle, abandon du tabac) ou éviter un traitement contre-indiquéNote de bas de page 148.
Recommandations
Les recommandations présentées ici sont importantes quel que soit le type de timbre et sont particulièrement critiques pour les médicaments qui pourraient entraîner de graves préjudices si le timbre ne se voyait pas après avoir été appliqué ou se décollait. Des timbres invisibles ou trop discrets peuvent présenter de graves risques pour la sécurité.
- S'assurer que l'information requise à propos des timbres transdermiques est visible et lisible, et que l'encre est durableNote de bas de page 149.
- Pour tout texte figurant sur un timbre transdermique, utiliser une couleur qui assurera la visibilité du timbre une fois celui-ci appliqué sur la peauNote de bas de page 147Note de bas de page 149.
- Envisager pour les timbres transdermiques l'utilisation d'une couleur qui les rendra encore plus visibles une fois appliquésNote de bas de page 147, peu importe la couleur de la peau du patient. Un timbre clair ou transparent peut aussi être difficile à trouver s'il se détache prématurément du patient, ce qui augmente le risque d'exposition secondaire ou accidentelle au médicamentNote de bas de page 74.
- D'après l'examen des rapports d'incident, l'information suivante devrait figurer sur un timbre transdermique :
- marque nominative;
- nom propre ou nom usuel;
- taux de délivrance du médicament (p. ex. « X mg/heure »).
Annexe 1 - Glossaire
À proximité : Appliqué au nom usuel, signifie adjacent au nom usuel sans qu'aucun texte imprimé ou écrit, ni aucun signe graphique, ne soit intercalé entre les deux. (Règlement sur les aliments et drogues, article B.01.001Note de bas de page 18)
Affichage principal : Voir « Espace principal ».
Analyse d'agrégation : Voir « analyse d'incidents multiples ».
Analyse des causes souches : Outil qui peut être utilisé pour effectuer une analyse complète et systémique des événements sentinelles. Cela inclut l'identification des causes profondes ou causes souches et des facteurs contributifs, des stratégies visant la réduction des risques et l'élaboration des plans d'action de même que des outils et des méthodes pouvant évaluer l'efficacité desdits plans. (Institut canadien pour la sécurité des patients. Cadre canadien de l'analyse des causes souches, 2006Note de bas de page 150)
Analyse d'incidents multiples : Analyse d'un groupe d'incidents composé de plusieurs incidents similaires par leur nature ou leur origine […]. Cette méthode d'analyse peut produire un important apprentissage à l'échelle de l'établissement ou du système qui ne peut pas être obtenu par d'autres moyens. (Cadre canadien d'analyse des incidents. 2012Note de bas de page 151)
Avertissement critique : Un avertissement critique est un avertissement qui doit être mis en évidence et transmis à chaque utilisateur avant l'administration du produit afin de faciliter que ce produit sera utilisé correctement et de prévenir une erreur qui pourrait entraîner de graves préjudices ou le décès.
Biais de confirmation : Phénomène qui pousse une personne à « voir » l'information qu'elle s'attend à voir plutôt que de l'information qui va à l'encontre de ses attentes. (Human factors and substitution errors. ISMP Can Saf Bull. 2003;3(5):1-2.Note de bas de page 152)
Date limite d'utilisation : La première des dates suivantes à survenir :
- la date, indiquée au moins par l'année et le mois, jusqu'à laquelle une drogue conserve son activité, sa pureté et ses propriétés physiques précisées sur l'étiquette;
- la date, indiquée au moins par l'année et le mois, après laquelle le fabricant recommande de ne plus utiliser la drogue. (Règlement sur les aliments et drogues, article C.01.001Note de bas de page 18)
Dénomination commune : Décrit la substance médicamenteuse. Les dénominations communes internationales sont uniques, applicables de façon universelle et acceptées dans le monde entier. La dénomination commune est le nom propre d'un ingrédient (ou son nom usuel si cet ingrédient n'a pas de nom propre). (Règlement sur les aliments et drogues, article C.01.001Note de bas de page 18)
Drogue : Sont compris parmi les drogues les substances ou mélanges de substances fabriqués, vendus ou présentés comme pouvant servir :
- au diagnostic, au traitement, à l'atténuation ou à la prévention d'une maladie, d'un désordre, d'un état physique anormal ou de leurs symptômes, chez l'être humain ou les animaux;
- à la restauration, à la correction ou à la modification des fonctions organiques chez l'être humain ou les animaux;
- à la désinfection des locaux où des aliments sont gardés. (Loi sur les aliments et drogues, article 2Note de bas de page 5)
Drogue sous sa forme posologique : S'entend d'une drogue prête pour la consommation sans autre transformation. (Règlement sur les aliments et drogues, paragraphe C.01.005(3)Note de bas de page 18)
Élément clé : Aux fins du présent Guide, huit éléments ont été déterminés par le groupe consultatif d'experts comme étant des renseignements clés qui doivent être inclus sur l'espace principal de l'étiquette d'un produit de santé. Ces éléments aident l'utilisateur à choisir correctement un produit et à l'utiliser de façon appropriée. Ils visent également à compléter les recommandations réglementaires internationales et l'harmonisation avec les normes nationales et internationales et la littérature sur la sécurité. Cependant, ils n'englobent pas tous les éléments exigés par la réglementation ou les directives visant les divers types de produits de santé. Par exemple, l'identification numérique de la drogue (DIN) est exigée par la réglementation, mais elle ne figure pas parmi les huit éléments.
Emballage : Notamment récipient, empaquetage ou autre conditionnement contenant, en tout ou en partie, un aliment, une drogue, un cosmétique ou un instrument. (Loi sur les aliments et drogues, article 2Note de bas de page 5)
Emballage de sécurité : Désigne un emballage doté d'un dispositif de sûreté qui offre au consommateur une assurance raisonnable que l'emballage n'a pas été ouvert avant l'achat. (Règlement sur les aliments et drogues, article A.01.010Note de bas de page 18)
Erreur de substitution : Erreur qui se produit quand on choisit le mauvais produit plutôt que le produit prévu.
Erreur relative aux médicaments : Voir « Incident lié aux médicaments ».
Espace blanc : Zone « négative » entourant le lettrage. (Carter R, et coll. Typographic design: Form and communication, fifth edition. 2012Note de bas de page 12). L'espace blanc sur l'étiquette ou l'emballage d'un produit désigne tout espace non imprimé et dénué de signes, d'éléments graphiques en couleurs, de filigranes ou d'autres éléments visuels.
Espace principal (aussi nommé « affichage principal ») : Désigne :
- dans le cas d'un emballage qui comprend une carte réclame, la partie de l'étiquette apposée entièrement ou en partie sur la principale surface exposée de l'emballage ou entièrement ou en partie sur le côté de la carte réclame qui est exposé ou visible dans les conditions normales ou habituelles de vente ou d'utilisation ou sur ces deux parties de l'emballage et de la carte réclame;
- dans le cas d'un emballage décoratif, la partie de l'étiquette apposée, entièrement ou en partie sur le dessous de l'emballage, sur la principale surface exposée, ou sur une étiquette mobile fixée à l'emballage;
- dans le cas de tous les autres emballages, la partie de l'étiquette apposée entièrement ou en partie sur la principale surface exposée. (Règlement sur l'emballage et l'étiquetage des produits de consommation, article 2Note de bas de page 153)
Étiquette : Sont assimilés aux étiquettes les inscriptions, mots ou marques accompagnant les aliments, drogues, cosmétiques, instruments ou emballages ou s'y rapportant. (Loi sur les aliments et drogues, article 2Note de bas de page 5)
Étiquette intérieure : Désigne l'étiquette sur le récipient immédiat d'un aliment ou d'une drogue, ou y apposée. (Règlement sur les aliments et drogues, article A.01.010Note de bas de page 18)
Étiquette extérieure (drogue) : Désigne l'étiquette sur l'extérieur d'un emballage d'aliment ou de drogue, ou y apposée. (Règlement sur les aliments et drogues, article A.01.010Note de bas de page 18)
Fabricant ou distributeur : Toute personne, y compris une association ou une société de personnes, qui, sous son propre nom ou sous une marque de commerce, un dessin-marque, un logo, un nom commercial ou un autre nom, dessin ou marque soumis à son contrôle, vend un aliment ou une drogue. (Règlement sur les aliments et drogues, article A.01.010Note de bas de page 18)
Force de corps : [TRADUCTION] « Distance approximative entre le haut d'une lettre majuscule et le bas d'une lettre minuscule avec un jambage descendant (par exemple, le bas d'un "j"). » (Singer JP, et coll. Manufacturer's guide to developing consumer product instructions. 2003Note de bas de page 154)
Incident critique : [TRADUCTION] « Incident entraînant un grave préjudice pour le patient (perte de la vie, d'un membre ou d'un organe vital) ou risque élevé d'un tel incident. Les incidents sont jugés critiques quand une enquête et une intervention immédiates sont requises. L'enquête vise à déterminer les facteurs contributifs, et l'intervention comprend des mesures visant à réduire la probabilité de récurrence. » (Davies J, et coll. Canadian Patient Safety Dictionary. 2003Note de bas de page 155)
Incident lié aux médicaments : [TRADUCTION] « Tout événement évitable qui peut causer ou entraîner l'utilisation inappropriée d'un médicament ou des préjudices pour un patient pendant que ce médicament est sous le contrôle d'un professionnel de la santé, d'un patient ou d'un consommateur. Les incidents liés aux médicaments peuvent être liés à la pratique professionnelle, aux produits médicamenteux, aux procédures ou aux systèmes, incluant la prescription, la communication d'ordres, l'étiquetage, l'emballage ou la nomenclature des produits, la préparation magistrale, la délivrance, la distribution, l'administration, l'éducation, la surveillance et l'utilisation. » (ISMP Canada. Definitions of termsNote de bas de page 156.)
Information clé : Aux fins du présent Guide, l'information clé comprend les éléments clés (voir la section 3.4.1, Éléments clés sur l'espace principal, pour obtenir plus d'information) ainsi que l'information sur l'étiquette exigée par la réglementation.
Ingénierie des facteurs humains : [TRADUCTION] « Discipline visant à comprendre comment les êtres humains interagissent avec le monde qui les entoure. Elle s'inspire de la recherche appliquée entreprise dans de nombreux domaines comme la biomécanique, la kinésiologie, la physiologie et la science cognitive et cherche à définir les paramètres et les contraintes qui influent sur le rendement humain. Les connaissances acquises peuvent être utilisées pour la conception de systèmes compatibles avec les caractéristiques humaines. Inversement, si les systèmes ne sont pas compatibles avec les caractéristiques humaines, cela peut nuire au rendement. » (ISMP Canada. Failure mode and effects analysis (FMEA): A framework for proactively identifying risk healthcare. Version 1. 2006Note de bas de page 157)
Ingrédient actif : Comprend toute drogue qui, lorsqu'elle est utilisée comme matière première dans la manufacture d'une drogue sous forme posologique, lui confère les effets recherchés. (Règlement sur les aliments et drogues, article C.01A.001Note de bas de page 18)
Langage clair : Style de rédaction clair conçu pour que le public cible soit capable de le lire et de le comprendre facilement. Cela comprend la façon dont l'information est organisée et présentée dans un espace, comme l'utilisation de l'espace blanc, de polices, d'une voix active plutôt que passive, d'éléments de conception et de couleurs. (Lignes directrices questions-réponses : Le règlement sur l'étiquetage en langage clairNote de bas de page 158)
Lisibilité : Facilité avec laquelle on peut lire et comprendre un texte écrit. (Plain Language Commission. Readability ReportsNote de bas de page 159)
Lisibilité des caractères : Facilité à identifier chaque lettre ou caractère; elle a une incidence sur la capacité de lire des mots et des phrases.
Maquette : Dans le contexte de l'étiquetage et de l'emballage des médicaments, la maquette est une copie grandeur nature en couleurs des étiquettes et une représentation en couleurs(p. ex. une photographie) des emballages qui serviront à la vente du médicament, y compris les éléments de présentation et de conception, les éléments graphiques, les polices, les couleurs et le texte proposés (avec une section pour la date limite d'utilisation, le DIN et le numéro de lot).
Marque déposée : Voir « Marque nominative ».
Marque nominative (drogue) : Dans le cas d'une drogue, le nom en français ou en anglais, avec ou sans le nom d'un fabricant, d'une personne morale, d'une société de personnes ou d'un particulier :
- qui lui a été attribué par le fabricant;
- sous lequel elle est vendue ou fait l'objet de publicité;
- qui sert à l'identifier. (Règlement sur les aliments et drogues, article C.01.001Note de bas de page 18)
Médicament de niveau d'alerte élevé : [TRADUCTION] « Médicament qui risque d'entraîner de graves préjudices pour le patient s'il est utilisé de façon erronée. » (Institute for Safe Medication Practices. c2015.Note de bas de page 160)
Microgramme : Un millionième de gramme, 1 x 10-6 gramme.
Nom propre (drogue) : Désigne, à l'égard d'une drogue, le nom en anglais ou en français
- attribué à ladite drogue à l'article C.01.002,
- figurant en caractères gras dans le présent règlement lorsqu'il est question de ladite drogue et, lorsque la drogue est distribuée sous une forme autre que celle qui est décrite dans la présente partie, le nom de la forme sous laquelle ladite drogue est distribuée,
- spécifié dans la licence canadienne, dans le cas des drogues comprises à l'annexe C ou à l'annexe D de la Loi, ou
- attribué, dans l'une des publications mentionnées à l'annexe B de la Loi, dans le cas des drogues non comprises aux alinéas a), b) ou c). (Règlement sur les aliments et drogues, article C.01.001Note de bas de page 18)
Nom usuel : Dans le cas d'une drogue, le nom en français ou en anglais sous lequel elle est :
- généralement connue;
- désignée dans des revues scientifiques ou techniques autres que les publications dont le nom figure à l'annexe B de la Loi. (Règlement sur les aliments et drogues, article C.01.001Note de bas de page 18)
Numéro de lot : Désigne toute combinaison de lettres, de chiffres ou de lettres et de chiffres au moyen de laquelle tout aliment ou une drogue peut être retracé au cours de la fabrication et identifié au cours de la distribution. (Règlement sur les aliments et drogues, article A.01.010Note de bas de page 18)
Point : [TRADUCTION] « Mesure de la taille utilisée principalement en typographie. […] On l'utilise le plus souvent pour indiquer la force de corps ou l'espacement ajouté entre les lignes. » (Carter R, et coll. Typographic design: Form and communication, fifth edition. 2012Note de bas de page 12)
Police : [TRADUCTION] « Ensemble complet de caractères d'une forme, d'une taille et d'un style identiques. À l'époque des caractères en plomb traditionnels, la police désignait une taille et un style particuliers; en typographie numérique, une police peut compter plusieurs tailles et même divers styles de caractères. » (Carter R, et coll. Typographic design: Form and communication, fifth edition. 2012Note de bas de page 12)
Présentation commerciale: [TRADUCTION] « Qualité matérielle de l'emballage d'un produit ou apparence physique qui sert à distinguer la marque »Note de bas de page 161. Cela comprend [TRADUCTION] « la façon dont une entreprise emballe, enveloppe et étiquette un médicament ou un produit biologique, notamment l'utilisation de thèmes de couleurs, de tailles, de dessins et de formes et la disposition des mots ou éléments graphiques sur l'étiquette d'un contenant ou d'un carton »Note de bas de page 9.
Récipient immédiat : Récipient qui est en contact direct avec la drogue. (Règlement sur les aliments et drogues, article C.01.001Note de bas de page 18)
Recours aux lettres majuscules (lettrage « TALLman ») : Utilisation de majuscules pour certaines syllabes ou certains groupes de lettres composant des noms qui se ressemblent ou ont la même sonorité afin de mieux les différencierNote de bas de page 22. Cette technique est appliquée en particulier aux dénominations communes (noms propres ou usuels).
Système international d'unités (SI) : Il consiste en un ensemble de base de préfixes et d'unités dérivées […] :
- Le SI est fondé sur un choix de sept unités de base bien définies et considérées par convention comme indépendantes du point de vue dimensionnel : le mètre, le kilogramme, la seconde, l'ampère, le kelvin, la mole et la candela.
- Les unités dérivées sont formées en combinant les unités de base d'après les relations algébriques qui lient les grandeurs correspondantes. Les noms et les symboles de certaines de ces unités peuvent être remplacés par des noms et des symboles spéciaux qui peuvent être utilisés pour exprimer les noms et symboles d'autres unités dérivées.
- Le SI n'est pas statique : c'est un système évolutif qui reflète les besoins de plus en plus croissants des utilisateurs en matière de mesures. (Bureau international des poids et mesures. Le Système international d'unités [SI], 8e édition. 2006Note de bas de page 67)
Taille de caractère : Se mesure habituellement en « points ». Voir « Point » et « Force de corps ».
Usage parentéral : Signifie l'administration d'une drogue au moyen d'une seringue hypodermique, d'une aiguille ou de quelque autre instrument, à travers ou dans la peau ou une muqueuse. (Règlement sur les aliments et drogues, article C.01.001Note de bas de page 18)
Utilisateur : Groupe ou individu qui va utiliser un produit de santé dans le contenant d'origine du promoteur avec son étiquette d'origine. Les utilisateurs peuvent être identifiés grâce à une schématisation de l'utilisation du produit. Peuvent figurer parmi eux le personnel interne du promoteur et des personnes faisant partie de la chaîne d'approvisionnement, y compris le lieu d'administration d'un produit de santé.
Annexe 2 - Principes liés aux facteurs humains et méthodes d'évaluation applicables à l'étiquetage et à l'emballage
Facteurs humains : Aperçu
L'ingénierie des facteurs humains est la discipline qui tente de comprendre les caractéristiques des humains et la façon dont ces derniers interagissent avec le monde qui les entoureNote de bas de page 156. Ces caractéristiques et interactions constituent les « facteurs humains ». L'ingénierie des facteurs humains s'inspire de la recherche appliquée menée dans de nombreux domaines comme la biomécanique, la kinésiologie, la physiologie et la science cognitive afin de définir les éléments qui influent sur le rendement humain. On peut ensuite se servir de ces éléments pour concevoir des processus, des systèmes ou des objets que les humains utilisent ou avec lesquels ils interagissent afin d'améliorer le rendement et de minimiser les erreurs.
Il est important que la conception des étiquettes et de l'emballage d'un produit tienne compte des utilisateurs ainsi que de l'environnement et des processus dans lesquels il sera utilisé (entreposé, sélectionné et administré). Les utilisateurs ne sont pas des concepteurs et les concepteurs ne sont pas des utilisateursNote de bas de page 162. Même si, par définition, ce sont les concepteurs qui sont les principaux responsables de la conception, il faut envisager de faire participer les utilisateurs à tous les aspects de la conception du produit, dès le départ. En particulier, les concepteurs ne doivent pas se contenter de demander aux utilisateurs ce dont ils ont besoin ou ce qu'ils veulent.
La conception de l'étiquette et de l'emballage peut aussi tirer profit d'un examen continu, que l'on nomme aussi la conception par itérationNote de bas de page 163. Le fait d'apporter des changements progressifs à la conception d'une étiquette ou d'un emballage et de pouvoir justifier chaque changement peut aider à optimiser le processus de conception. Une partie de ce processus peut comprendre le fait de poser les questions suivantes : l'information figurant sur l'étiquette est-elle structurée de manière à être comprise par l'utilisateur? Quelle est l'information la plus proéminente? Que dit le contenant à l'utilisateur à propos de la façon d'utiliser le produit? Est-ce que l'apparence du produit et la façon dont l'information est présentée permettent à l'utilisateur de bien comprendre l'information?
Les sous-sections suivantes présentent des exemples de questions qui peuvent servir à définir les utilisateurs et les environnements d'utilisation.
Utilisateurs
La majorité des produits sera associée à plusieurs types d'utilisateurs présentant différents niveaux d'acuité visuelle et diverses maladies sous-jacentes et utilisant déjà un certain nombre de produits de santé. Chaque catégorie d'utilisateur aura des exigences particulières. Pour optimiser la sécurité, on peut devoir adapter les caractéristiques de l'étiquette et de l'emballage à ces différentes exigences. Idéalement, les essais devraient viser divers types d'utilisateurs : utilisateurs novices (personnes ayant peu d'expérience, voire aucune expérience du produit, ou qui le connaissent peu ou ne le connaissent pas); utilisateurs occasionnels (personnes qui ont peu d'expérience et ont peut-être oublié les détails relatifs à l'utilisation); nouveaux utilisateurs (personnes dont l'expérience porte seulement sur des produits de santé similaires, pas sur le produit en question); utilisateurs avertis (personnes qui possèdent une longue expérience du produit à l'étude et le connaissent très bien)Note de bas de page 164.
- Est-ce que les patients utiliseront le produit avec ou sans l'aide d'un professionnel de la santé?
- Quels professionnels de la santé (le cas échéant) joueront un rôle dans l'utilisation du produit (p. ex. naturopathe, infirmière, pharmacien, médecin, inhalothérapeute)?
- À quels groupes d'âge appartiennent les groupes de patients susceptibles d'interagir avec le produit de santé?
- Est-ce que les problèmes de vision (p. ex. vision partielle ou difficulté à percevoir les couleurs) devraient être pris en compte lors de la conception d'un produit? La capacité visuelle peut être particulièrement pertinente dans le cas des produits destinés au traitement des problèmes oculaires ou aux soins des yeux, ainsi que des produits utilisés dans le traitement d'affections susceptibles d'altérer la vision (p. ex. le diabète sucré). On peut utiliser des logiciels pour traiter les images numériques des étiquettes et emballages de produits de santé, afin de simuler les effets de la difficulté à percevoir les couleurs.
- Quel est le niveau de connaissance de l'utilisateur type (p. ex. médecin, infirmière, technicien, soignant, patient)?
- Quelles caractéristiques propres aux utilisateurs pourraient les empêcher d'utiliser le produit correctement (p. ex. force physique, dextérité, coordination, vision, audition, mémoire, état pathologique, degré de lucidité, capacité de déglutition, tolérance aux médicaments qui ont un mauvais goût ou qui sont difficiles à avaler ou à ingérer)?
- Dans quelle mesure le produit est-il facile ou compliqué à utiliser, c.-à-d., est-ce que de multiples étapes ou une manipulation excessive sont nécessaires pour utiliser le produit?
- Quelles sont les tâches critiques censés être exécutées simultanément par les utilisateurs?
Environnements d'utilisation
On peut utiliser des produits de santé dans les hôpitaux, les établissements de soins de longue durée, les cabinets des professionnels de la santé, les centres de dialyse, les autres centres de soins indépendants, les pharmacies privées, les cliniques de naturopathie, les pharmacies spécialisées, les services de transport d'urgence, et au domicile du patient. Même si toutes les interactions avec les étiquettes et les emballages des produits de santé devraient se faire idéalement dans des conditions idéales, les produits de santé sont souvent utilisés et conservés dans des salles mal éclairées, et de multiples variables associées à un niveau de stress élevé contribuent à la complexité du choix et de l'utilisation d'un produit.
- Quels sont tous les environnements dans lesquels les utilisateurs sont susceptibles d'interagir avec le produit de santé?
- Est-ce que des produits similaires sont déjà utilisés dans ces environnements? Si c'est le cas, leur mode d'utilisation est-il similaire à celui du produit proposé?
- A-t-on commis des erreurs relatives à des produits similaires dans ce même environnement?
- Quel est le niveau d'éclairage prévu dans les endroits où le produit est susceptible d'être choisi et utilisé?
- Le choix des couleurs et des contrastes pourrait-il nuire à la capacité de choisir et d'utiliser un produit dans un environnement mal éclairé?
- Où le produit est-il entreposé?
- Le produit est-il généralement entreposé à divers endroits?
- Quels autres types de produits peuvent être entreposés à proximité?
- Comment le produit est-il entreposé? Est-ce que le mode d'entreposage a une incidence sur l'orientation de l'étiquette?
- Y a-t-il des restrictions d'entreposage (p. ex. stabilité de la température, photosensibilité)? Si c'est le cas, pourraient-elles influer sur le mode d'entreposage du produit?
- Dans quelle mesure l'environnement est-il actif ou est-il une source de distraction?
- S'attend-on à ce que l'utilisateur exécute d'autres tâches pendant qu'il interagit avec le produit?
- Quelles technologies et quels outils (p. ex. armoires de distribution automatisée, dossiers d'administration de médicaments et codes à barres) sont actuellement utilisés dans l'environnement, et leur utilisation sera-t-elle appropriée avec la conception du produit proposé?
Pour toute forme d'évaluation, qu'elle soit interne ou externe, il faut savoir qui sont les utilisateurs et il faut comprendre comment le produit sera utilisé, les environnements dans lesquels il sera utilisé et la façon dont les utilisateurs interagiront avec ses divers éléments, comme son contenant, les étiquettes intérieure et extérieure, l'emballage lui-même et les dispositifs doseurs.
Essais par les utilisateurs
En quoi consistent les essais par les utilisateurs?
Les essais par les utilisateurs englobent un large éventail de méthodes qui permettent d'évaluer l'utilisabilité d'un produit, d'observer les difficultés que rencontrent les utilisateurs du produit et de trouver des solutions pour éliminer ou atténuer les conséquences de ces problèmes. Dans le cadre de ces essais, on simule ou on reproduit les conditions d'utilisation du produit pour donner une idée réaliste du fonctionnement de l'étiquette et de l'emballage dans les environnements visés. Ce ne sont pas des essais d'assurance qualité ni des études de marché. Les essais par les utilisateurs ont lieu dans des conditions contrôlées pour déterminer si les gens peuvent atteindre des objectifs précis avec un produit ou un système donné.
Quelle est l'utilité des essais par les utilisateurs?
Les essais par les utilisateurs permettent de déterminer si les utilisateurs prévus pourront effectuer de façon sécuritaire et efficace les tâches essentielles associées à la sélection et à l'utilisation du produit de santé ou s'ils feront des erreurs, s'ils auront de la difficulté à utiliser le produit ou s'ils en seront incapables. C'est particulièrement important pour les produits associés à un niveau d'alerte élevé.
Les essais par les utilisateurs permettent d'obtenir des renseignements plus précis sur les expériences vécues par les utilisateurs d'un produit et de détecter les problèmes au-delà des principes généraux exposés dans le Guide.
Quand devrait-on envisager des essais par les utilisateurs?
Bien que ce ne soit pas obligatoire, les promoteurs sont encouragés à considérer d'entreprendre des essais par les utilisateurs pour la conception des étiquettes et des emballages dans les cas suivants :
- conception d'une nouvelle étiquette ou d'un nouvel emballage (p. ex. conception novatrice ou habituellement pas associée au produit);
- ajouts à une gamme de produits (p. ex. ajout d'une forme à libération prolongée);
- modification d'un produit actuellement sur le marché (p. ex. nouvelle configuration de l'emballage, nouvelle indication, nouveau système d'administration, nouvelle population cible);
- modifications importantes apportées à la disposition ou aux couleurs d'une étiquette (p. ex. changements qui peuvent avoir une incidence sur la lisibilité ou la reconnaissance de l'information clé);
- changement de statut du médicament (p. ex. de médicament d'ordonnance à médicament en vente libre); problèmes de sécurité critiques (p. ex. mortel si administré par la mauvaise voie d'administration);
- problèmes de sécurité après la commercialisation en lien avec l'étiquette ou l'emballage du produit.
Les essais par les utilisateurs entraînent certains coûts, mais ces coûts initiaux sont souvent beaucoup moins élevés que les coûts associés aux corrections des emballages ou des étiquettes mal conçus qui augmentent le risque de préjudices graves après la commercialisation des produits. Des emballages et des étiquettes conçus intelligemment améliorent la satisfaction de l'utilisateur et peuvent éventuellement être moins coûteux, pour une variété de raisons.
Méthodes d'essai par les utilisateurs
De l'information et des liens sont fournis ci-dessous pour un certain nombre de méthodes pouvant être utilisées pour évaluer les étiquettes et les emballages. On recommande habituellement d'utiliser des méthodes d'essai supplémentaires et plus rigoureuses si les niveaux de risque sont plus élevés. L'élaboration de schémas d'utilisation du produit représente une composante importante de ces méthodes.
Analyse des modes de défaillance et de leurs effetsNote de bas de page 74Note de bas de page 157
L'analyse des modes de défaillance et de leurs effets (AMDE) est un type d'évaluation proactive des risques sur lequel on peut se baser pour évaluer systématiquement les dangers liés au produit et les points de risque au sein du système dans lequel un produit sera utilisé (utilisateurs, environnements). Cela représente une façon d'établir et de classer par ordre de priorité ces risques, de déterminer les stratégies permettant d'atténuer ou de corriger les erreurs potentielles et les problèmes (p. ex. pour réduire la probabilité de survenue de l'erreur, pour réduire la gravité des conséquences de l'erreur ou pour augmenter la probabilité que l'erreur soit détectée), et d'évaluer les stratégies d'atténuation.
Test de compréhensionNote de bas de page 75Note de bas de page 165-169
Un test de compréhension évalue la compréhension de l'utilisateur en ce qui concerne des éléments de communication d'une étiquette en se basant sur la langue, la présentation et les graphiquesNote de bas de page 170. Idéalement, le test de compréhension s'applique à tous les messages clés figurant sur l'étiquette d'un produitNote de bas de page 75. Dans le cadre du test de compréhension, un intervieweur montre le produit de santé ou une maquette aux participants et leur demande d'expliquer le contenu de l'étiquette (p. ex. une abréviation). L'intervieweur pose ensuite d'autres questions afin d'évaluer tout écart entre la signification réelle et l'interprétation du participant et afin de trouver d'éventuelles solutions à ces écarts.
Inspection cognitiveNote de bas de page 157Note de bas de page 171-173
L'inspection cognitive consiste à guider un petit nombre d'utilisateurs dans le cadre d'un processus ou d'une tâche, souvent au début du processus de conception, en vue d'examiner l'activité mentale et les problèmes qui surviennentNote de bas de page 171Note de bas de page 172. On peut utiliser l'inspection cognitive dans le cadre de l'AMDE et l'appliquer à n'importe quel contexteNote de bas de page 157. On peut utiliser l'inspection cognitive pour évaluer les produits de santé dont la marge thérapeutique est étroite ou qui sont contre-indiqués chez certaines populations, et pour évaluer les messages d'avertissement critiques.
Les utilisateurs examinent les tâches qui leur ont été assignées, en « pensant à voix haute », afin que l'examinateur puisse bien comprendre leurs attentes et leurs problèmes. Les éventuelles solutions de conception découlant de l'inspection cognitive devraient ensuite être appliquées à l'amélioration de la conception des étiquettes et des emballages du produit de santé.
Si l'on comprend clairement la situation, en plaçant les utilisateurs dans leur propre environnement (que ce soit la vraie vie ou des « simulations de haut niveau »), on améliorera la valeur et les avantages des observations issues de l'inspection cognitive.
Évaluation de l'utilisabilité
L'évaluation de l'utilisabilité (qu'on appelle aussi test d'utilisation simulée ou essai par l'utilisateur) constitue un moyen systématique de recueillir des données auprès de participants représentatifs dans des situations réalistes. Les utilisateurs exécutent des tâches précises dans le cadre d'un scénario pendant que des données sont recueillies afin de déceler les erreurs ou les problèmes potentiels. Comme le font les scénarios de l'inspection cognitive, ces scénarios créent un contexte. Diverses tâches sont ensuite assignées aux participants. Les scénarios sont élaborés après consultation des utilisateurs et en fonction du schéma d'utilisation du produit et d'une observation directe.
Les essais par les utilisateurs peuvent comprendre des inspections cognitives avec mise en œuvre de scénarios reproduisant le plus fidèlement possible le véritable processus d'utilisation du produit, ou certains éléments de ce processus. On peut recourir à une analyse des protocoles verbaux, qui consiste à demander aux participants de penser à voix haute durant les scénarios et de verbaliser toutes leurs pensées et leurs difficultésNote de bas de page 174. L'information recueillie peut comprendre une rétroaction des utilisateurs (p. ex. sondages de satisfaction, entrevues), l'analyse des tâches (p. ex. le nombre d'étapes dans le processus) et la mesure du rendement à l'exécution des tâches (p. ex. durée de la formation, temps d'exécution, nombre d'étapes créant de la confusion, nombre d'erreurs commises par les utilisateurs et nature de ces erreurs).
Expérience : tâches de mémorisationNote de bas de page 175-177
On peut prévoir des tâches de mémorisation de l'information afin de déterminer comment la conception de l'étiquette influence l'habilité du participant à mémoriser l'information présentée sur l'étiquette. On peut utiliser l'exercice de mémorisation pour évaluer les étiquettes et les emballages de produits présentant un risque de lésions graves ou de décès s'ils sont administrés de façon erronée ou par une voie inappropriée, ce qui peut arriver dans le cas des médicaments de niveau d'alerte élevé.
Expérience : tâches de sélection
On peut utiliser les tâches de sélection d'un produit de santé pour évaluer ou comparer l'incidence de la conception de l'étiquette ou de l'emballage sur le rendement. On a utilisé cette méthode pour comparer des étiquettes existantes à des étiquettes de médicaments repenséesNote de bas de page 178, pour évaluer la compréhension des abréviations courantesNote de bas de page 179 et pour déterminer si l'inclusion du logo d'un promoteur additionnel avait une incidence sur le choix du médicamentNote de bas de page 73.
Annexe 3 - Schémas d'utilisation des produits
Le schéma d'utilisation d'un produit décrit où et comment un produit va être utilisé, selon ses indications, et qui est susceptible d'entrer en contact avec celui-ci. Ces schémas visent à faire comprendre de façon exhaustive et exacte comment le produit sera utilisé et dans quels environnements, et comment les utilisateurs interagiront avec lui (p. ex. avec le dispositif de fermeture ou l'étiquette du contenant, l'emballage et ses étiquettes ou le dispositif doseur) afin de l'identifier et de prendre des décisions concernant son utilisation.
Un schéma d'utilisation de produit peut être utile lorsqu'un essai par des utilisateurs basé sur des facteurs humains est prévu, car il aide à définir l'ampleur de l'utilisation et les principaux utilisateurs.
Un exemple de schéma d'utilisation de produits est présenté ci-dessous. La sélection et l'administration sont les points clés du processus : c'est là que l'utilisateur interagit avec le produit (plus précisément, avec l'étiquette et l'emballage). Dans l'exemple ci-dessous, ces points d'interaction sont présentés en italique et en rouge.
Figure 3 - Text description
Modèle d'organigramme d'utilisation des médicaments pour un médicament antinéoplasique intraveineux
Cet exemple est un modèle d'organigramme d'utilisation des médicaments pour un médicament antinéoplasique intraveineux. Le modèle a 3 colonnes. La colonne de gauche est une liste des étapes du processus : la prescription, la transcription/documentation, distribution, l'administration et la surveillance. La colonne du milieu présente les événements qui se déroulent durant chaque étape d'un premier scénario du processus d'utilisation d'un médicament. La colonne de droite présente les événements qui se déroulent durant un deuxième scénario.
Prescription
Oncologue à l'hôpital
- Deux scénarios :
- Scénario 1 - Écrit l'ordonnance au dossier du patient ou
- Scénario 2 - Entre l'ordonnance dans le dossier électronique du patient.
- Ces scénarios seront décrits séparément.
Scenario 1
Transcription/ Documentation
Deux voies sont envisageables :
- Le commis d'unité ou l'infirmier consigne l'ordonnance dans le Registre d'administration des médicaments (RAM) ou
- Une copie de l'ordonnance est envoyée à la pharmacie et le technicien en pharmacie entre l'ordonnance dans le profil informatisé du patient à la pharmacie.
Distribution
À partir du profil informatisé du patient, le pharmacien examine l'ordonnance et confirme la transcription.
- Le texte des 3 étapes suivantes est écrit en caractères gras et rouges.
- Ensuite, l'assistant ou le technicien en pharmacie choisit et prépare le médicament.
- Le pharmacien ou le technicien en pharmacie vérifie le médicament.
- Le médicament est envoyé au secteur réservé aux soins des patients.
Administration
- L'infirmier examine l'ordonnance et confirme sa transcription dans le RAM.
- L'infirmier administre le médicament au patient. Le texte de cette étape est écrit en caractères gras et rouges.
Surveillance
Les cliniciens évaluent la réaction du patient au médicament; les résultats sont consignés dans un rapport.
Scenario 2
Transcription/ Documentation
Deux voies sont possibles :
- L'ordonnance est transmise par voie électronique à la pharmacie, ou
- L'ordonnance est transmise par voie électronique au Registre électronique d'administration des médicaments (RAMe).
Distribution
- Le pharmacien examine l'ordonnance.
- Le texte des 3 étapes suivantes est écrit en caractères gras et rouges.
- L'assistant ou le technicien en pharmacie choisit et prépare le médicament.
- Le pharmacien ou le technicien en pharmacie vérifie le médicament.
- Le médicament est envoyé au secteur réservé aux soins des patients.
Administration
- L'infirmier examine l'ordonnance et confirme son entrée dans le RAMe.
- L'infirmier administre le médicament au patient. Le texte de cette étape est écrit en caractères gras et rouges.
Surveillance
Les cliniciens évaluent la réaction du patient au médicament; les résultats sont consignés dans un rapport.
Remarque : L'information en rouge et italique désigne les processus de sélection et d'administration, éléments clés de l'interaction entre les utilisateurs et le produit.
Annexe 4 - Remerciements
Membres du groupe consultatif d'experts
Ce Guide a été préparé en collaboration avec l'ISMP Canada. Santé Canada et l'ISMP Canada tiennent à remercier tout particulièrement les autres membres du groupe consultatif d'experts pour leurs orientations, leurs commentaires et leur soutien :
- Agence européenne des médicaments, Londres, Royaume-Uni
- Association canadienne des docteurs en naturopathie
- Association des infirmières et infirmiers du Canada
- Association des pharmaciens du Canada
- Food and Drug Administration (FDA) des États-Unis
- Groupe CSA
- Healthcare Human Factors, Centre for Global eHealth Innovation, University Health Network, Toronto (Ont.)
- Institute for Safe Medication Practices (États-Unis)
- Medicines and Healthcare Products Regulatory Agency, Royaume-Uni
- Medicines Evaluation Board, Pays-Bas
- Patients pour la sécurité des patients du Canada
- Société canadienne des anesthésiologistes
- Société canadienne des pharmaciens d'hôpitaux
- Therapeutic Goods Administration, Australie
Références
Dans la mesure du possible, les références ont été tirées de sites Web accessibles au public.
- Note de bas de page 1
-
Gouvernement du Canada. Loi sur les aliments et drogues. Règlement modifiant le Règlement sur les aliments et drogues (étiquetage, emballage et marques nominatives des drogues pour usage humain). Gazette du Canada [Internet]. Ottawa (ON) : Travaux publics et Services gouvernementaux Canada; 13 juin 2014 [archivée le 2 juil. 2014; mise à jour le 3 juil. 2014; cité le 22 nov.].
- Note de bas de page 2
-
Gouvernement du Canada. Règlement sur le sang [Internet]. Ottawa (ON) : ministère de la Justice, Canada; 9 oct. 2013 [mise à jour le 23 oct. 2014; cité le 19 nov. 2014].
- Note de bas de page 3
-
Gouvernement du Canada. Règlement sur la sécurité des cellules, tissus et organes humains destinés à la transplantation, Interpretation [Internet]. Ottawa (ON) : Santé Canada; 2004 [cité le 23 oct. 2014].
- Note de bas de page 4
-
Gouvernement du Canada. Ligne directrice - Étiquetage des médicaments pharmaceutiques destinés à l'usage des humains [Internet]. Ottawa (ON): Santé Canada; 13 juin 2015 [cité le 14 mai 2016].
- Note de bas de page 5
-
Gouvernement du Canada. Loi sur les aliments et drogues (L.R.C. (1985), ch. F-27) [Internet]. Ottawa (ON) : ministère de la Justice, Canada; 6 nov. 2014 [cité le 6 mars 2016].
- Note de bas de page 6
-
Gouvernement du Canada. Ligne directrice à l'intention de l'industrie - Examen des marques nominatives de médicament [Internet]. Ottawa (ON) : Santé Canada; 2 juil. 2014 [cité le 27 août 2014].
- Note de bas de page 7
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Étiquetage et emballage : analyse par agrégat des déclarations d'incidents et accidents liés à la médication. Bulletin de l'ISMP Canada [Internet]. 2013 [cité le 1 juil. 2014];13(9).
- Note de bas de page 8
-
Institute for Safe Medication Practices Canada. Labelling and packaging: an aggregate analysis of medication incident reports. Project report [Internet]. Toronto (ON): The Institute; 14 sept. 2013 [cité le 18 août 2014].
- Note de bas de page 9
-
U.S. Department of Health and Human Services, Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Guidance for industry: Safety considerations for container labels and carton labeling design to minimize medication errors (draft guidance) [Internet]. Rockville (MD): The Administration; avr. 2013 [cité le 20 janv. 2014].
- Note de bas de page 10
-
Cohen MR, editor. Medication Errors. 2nd ed. Washington (DC): American Pharmaceutical Association; 2007.
- Note de bas de page 11
-
Institute for Safe Medication Practices. Acute Care - ISMP Medication Safety Alert. Administering just the diluent or one of two vaccine components leaves patients unprotected [Internet]. Horsham (PA): The Institute; 22 mai 2014 [cité le 18 août 2014].
- Note de bas de page 12
-
Carter R, Day B, Megs P. Typographic design: Form and communication, Fifth Edition. Hoboken (NJ): John Wiley & Sons, Inc.; 2012.
- Note de bas de page 13
-
Gouvernement du Canada. Lignes directrices pour la conception d'étiquettes de marché pour les produits antiparasitaires à usage domestique [Internet]. Ottawa (ON) : Santé Canada; 16 juin 2011 [cité le 8 janv. 2015].
- Note de bas de page 14
-
Association canadienne de santé publique et Programme national sur l'alphabétisation et la santé. De bons remèdes pour les aînés : lignes directrices sur la rédaction des documents et la conception des emballages des médicaments sur ordonnance [Internet]. Ottawa (ON) : L'Association; 2002 [cité le 8 janv. 2015].
- Note de bas de page 15
-
Groupe CSA. CAN/CSA-Z264.2-F99 - Étiquetage des ampoules, des fioles et des seringues à cartouches utilisées pour les médicaments. Norme nationale du Canada. Etobicoke (ON) : Le Groupe; Oct. 1999 [confirmé en 2004].
- Note de bas de page 16
-
Société canadienne des pharmaciens d'hôpitaux. Lignes directrices sur l'emballage et l'étiquetage des médicaments à l'intention des fabricants. Ottawa (ON) : La Société; 2001.
- Note de bas de page 17
-
U.S. Department of Health and Human Services. CFR - Code of Federal Regulations Title 21, Volume 4, Part 201 [Internet]. Silver Spring (MD): U.S. Food and Drug Administration; 1er avr. 2014 [cité le 8 janv. 2015].
- Note de bas de page 18
-
Gouvernement du Canada. Règlement sur les aliments et drogues [Internet]. Ottawa (ON) : ministère de la Justice; 3 juin 2015 [cité le 6 mars 2016].
- Note de bas de page 19
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Recours aux lettres majuscules pour l'écriture des noms de médicaments utilisés en oncologie. Bulletin de l'ISMP Canada [Internet]. 11 nov. 2010 [cité le 10 janv. 2015];10(8):1.
- Note de bas de page 20
-
Filik R, Purdy K, Gale A, et al. Labeling of medicines and patient safety: Evaluating methods of reducing drug name confusion. Hum Factors. 2006;48(1):39‐47.
- Note de bas de page 21
-
Emmerton L, Rizk MF. Bedford G, et al. Systematic derivation of an Australian standard for Tall Man lettering to distinguish similar drug names. J Eval Clin Pract. 2015 [cité le 31 oct. 2015];21(1):85-90.
- Note de bas de page 22
-
Institute for Safe Medication Practices Canada and Canadian Association of Provincial Cancer Agencies. Medication safety for drugs used in oncology. Drug labelling and the application of TALLman lettering. Project report [Internet]. Toronto (ON): The Institute; 8 nov. 2010 [cité le 10 janv. 2015].
- Note de bas de page 23
-
Institute for Safe Medication Practices Canada. Application of TALLman lettering for selected high-alert drugs in Canada. Bulletin de l'ISMP Canada [Internet]. 2015 [cité le 6 nov. 2015];15(10).
- Note de bas de page 24
-
Institute for Safe Medication Practices. FDA and ISMP lists of look-alike drug names with recommended tall man letters [Internet]. Horsham (PA): The Institute; c2011 [cité le 22 fév. 2014].
- Note de bas de page 25
-
National Patient Safety Agency and the Helen Hamlyn Research Centre. Design for patient safety. A guide to the design of electronic infusion devices [Internet]. London (UK): National Health Service; mars 2010 [cité le 22 févr. 2014].
- Note de bas de page 26
-
Medicines and Healthcare products Regulatory Agency. Best practice guidance on the labelling and packaging of medicines [Internet]. London (UK): The Agency; nov. 2015 [cité le 9 mars 2016].
- Note de bas de page 27
-
Metules T, Bauer J. JCAHO's Patient Safety Goals, Part 2: Preventing med errors. Mod Med [Internet]. 1er janv. 2007 [cité le 22 févr. 2014].
- Note de bas de page 28
-
Joint Commission. Sentinel event alert: Safe use of opioids in hospitals [Internet]. Oakbrook Terrace (IL): The Commission; 8 août 2012 [cité le 6 mars 2016].
- Note de bas de page 29
-
Health Quality & Safety Commission New Zealand. Tall man lettering list. Report [Internet]. Auckland (NZ): The Commission; déc. 2013 [cité le 22 févr. 2014].
- Note de bas de page 30
-
Australian Commission on Safety and Quality in Health Care. National tall man lettering list [Internet]. Sydney (AU): The Commission; 2011 [cité le 22 févr. 2014].
- Note de bas de page 31
-
Rothrock L, Barron K, Simpson TW, et al. Applying the proximity compatibility and the control-display compatibility principles to engineering design interfaces. Hum Factors Ergonomics Manuf. 2006;16(1):61-81
- Note de bas de page 32
-
Wickens CD, Carswell CM. The proximity compatibility principle: its psychological foundation and relevance to display design. Hum Factors. 1995;37(3):473-494.
- Note de bas de page 33
-
International Medication Safety Network. Position Statement: Making medicines naming, labelling and packaging safer [Internet]. Horsham (PA): The Network; 2013 [cité le 25 mai 2014].
- Note de bas de page 34
-
Pennsylvania Patient Safety Authority. Drug labeling and packaging - looking beyond what meets the eye. Patient Safety Advisory [Internet]. 2007;4(3):1-6 [cité le 6 mars 2016].
- Note de bas de page 35
-
National Patient Safety Agency and the Helen Hamlyn Research Centre. Design for patient safety. A guide to labelling and packaging of injectable medicines [Internet]. London (UK): National Health Service; mai 2008 [cité le 10 déc. 2013].
- Note de bas de page 36
-
U.S. Department of Health and Human Services. Food and Drug Administration. Center for Drug Evaluation and Research. Guidance for industry: Labeling OTC human drug products using a column format [Internet]. Silver Spring (MD): The Administration; déc. 2000 [cité le 25 févr. 2014].
- Note de bas de page 37
-
Medicines and Healthcare products Regulatory Agency [Internet]. Best practice guidance on patient information leaflets. London (UK): The Agency; 29 déc. 2014 [cité le 28 avril 2016].
- Note de bas de page 38
-
Frase LT, Schwartz BJ. Typographical cues that facilitate comprehension. J Educ Psychol. 1979;71(2):197-206.
- Note de bas de page 39
-
Institute for Safe Medication Practices. Acute Care - ISMP Medication Safety Alert. How colorful is too colorful when it comes to patient safety? Will color-tinted IV tubing help? [Internet]. Horsham (PA): The Institute; 30 juil. 2009 [cité le 22 févr. 2014].
- Note de bas de page 40
-
Green M. Human Factors. SBFAQ Part 2: Color Discrimination [Internet]. Toronto (ON): Visual Expert; c2004 [cité le 22 févr. 2014].
- Note de bas de page 41
-
Gouvernement du Canada. Document de référence concernant l'étiquetage - Direction des produits de santé naturels. Version 2 [Internet]. Ottawa (ON) : Santé Canada; août 2006 [archivé le 24 juin 2013; cité le 24 nov. 2013].
- Note de bas de page 42
-
National Patient Safety Agency and the Helen Hamlyn Research Centre. Design for patient safety. A guide to the graphic design of medication packaging. 2nd ed. [Internet]. London (UK): National Health Service; 2007 [cité le 8 janv. 2014].
- Note de bas de page 43
-
Australian Government, Department of Health, Therapeutic Goods Administration. A guide to labelling drugs and poisons in accordance with the Standard for the Uniform Scheduling of Drugs and Poisons [Internet]. Symonston (Australia): The Administration; oct. 2007 [cité le 28 avril 2016].
- Note de bas de page 44
-
Cole B, Harris R. Caution: coloured medication and the colour blind. Lancet [Internet]. 29 août 2009 [cité le 6 mars 2016];374(9691):720.
- Note de bas de page 45
-
Dair C. Design with type. Toronto (ON): University of Toronto Press; 1967.
- Note de bas de page 46
-
Quality Review of Documents Group, European Medicines Agency. QRD recommendations on pack design and labelling for centrally authorised non-prescription human medicinal products. Draft [Internet]. London (UK): The Agency; 10 mars 2011 [cité le 25 févr. 2014]. EMA/275297/2010.
- Note de bas de page 47
-
Australian Government. Department of Health, Therapeutic Goods Administration. TGA medicine labelling and packaging review. Consultation paper. Version 1 [Internet]. Symonston (Australia): The Administration; mai 2012 [cité le 6 mars 2016].
- Note de bas de page 48
-
Bix L, Lockhart H, Cardoso F, et al. The effect of color contrast on message legibility. Journal of Design Communication [Internet]. 2003 [cité le 22 mai 2014];5.
- Note de bas de page 49
-
Institut national canadien pour les aveugles. Pour une meilleure lisibilité : lignes directrices d'accessibilité [Internet]. Toronto (ON) : L'Institut; 2006 [cité le 12 fév. 2014].
- Note de bas de page 50
-
Equipment and Facilities Committee, American Society of Anesthesiologists. Statement on the labeling of pharmaceuticals for use in anesthesiology [Internet]. Schaumburg (IL): The Society; 27 oct. 2004 [modifié le 28 oct.2009; cité le 6 mars 2016].
- Note de bas de page 51
-
Filiatrault P, Hyland S. Does colour-coded labelling reduce the risk of medication errors? Can J Hosp Pharm [Internet]. Ottawa: Canadian Society of Hospital Pharmacists; 2009 [cité le 22 févr. 2014]; 62(2):154-156.
- Note de bas de page 52
-
Institute for Safe Medication Practices. Acute Care - ISMP Medication Safety Alert. A spectrum of problems with using color [Internet]. Horsham (PA): The Institute; 13 nov. 2003 [cité le 22 févr. 2014].
- Note de bas de page 53
-
Zwimpfer M. Colour, Light, Sight, Sense. West Chester (NY): Schiffer Publishing Ltd.; 1988.
- Note de bas de page 54
-
Groupe CSA. CAN/CSA-ISO 26825-F10 - Matériel d'anesthésie et de réanimation respiratoire - Étiquettes apposées par l'utilisateur sur les seringues contenant des médicaments utilisés pendant l'anesthésie - Couleurs, aspect et propriétés. Etobicoke (ON) : L'Association; 2010 [norme ISO 26825:2008 adoptée, première édition, 15 août 2008].
- Note de bas de page 55
-
Wogalter MS, Conzola V, Smith-Jackson T. Research-based guidelines for warning design and evaluation. Appl Ergon [Internet]. 2002 [cité le 20 mars 2014];33. 219-230.
- Note de bas de page 56
-
Green M. Human Factors. SBFAQ Part 5: Using Color Effectively [Internet]. Toronto (ON): Visual Expert; c2004 [cité le 6 mars 2016].
- Note de bas de page 57
-
Itten J. The Elements of Colour. New York (NY): Van Nostrand Reinhold; 1970.
- Note de bas de page 58
-
Edwards B. Colour: A course in mastering the art of mixing colors. New York (NY): Jeremy P. Tarcher/Penguin a member of Penguin Group (USA) Inc.; 2004.
- Note de bas de page 59
-
Institute for Safe Medication Practices. Acute Care - ISMP Medication Safety Alert. Your attention please… Designing effective warnings [Internet]. Horsham (PA): The Institute; 24 août 2006 [cité le 22 févr. 2014].
- Note de bas de page 60
-
Hellier E, Tucker M, Kenny N, et al. Merits of using color and shape differentiation to improve the speed and accuracy of drug strength identification on over-the-counter medicines by laypeople. J Patient Saf. 2010;6(3):158-164.
- Note de bas de page 61
-
Department of Psychology, Stanford University. Vischeck [Internet]. Stanford (CA): Stanford University [modifié le 21 avr. 2009; cité le 22 févr. 2014].
- Note de bas de page 62
-
Sweller J. Cognitive load during problem solving: effects on learning. Cognitive Sci. 1988 [cité le 6 sept. 2014];12: 257-285.
- Note de bas de page 63
-
Russell-Minda E, Jutai J, Strong G, et al. Clear Print: An evidence-based review of the research on typeface legibility for readers with low vision [Internet].Toronto (ON): Canadian National Institute for the Blind; avril 2006 [cité le 12 févr. 2014].
- Note de bas de page 64
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Éliminer l'utilisation dangereuse d'abréviations, de symboles et de certaines inscriptions numériques. Bulletin de l'ISMP Canada [Internet]. 2006 [cité le 18 juil. 2014];6(4):1-3.
- Note de bas de page 65
-
Institute for Safe Medication Practices. ISMP's list of error-prone abbreviations, symbols and dose designations [Internet]. Huntingdon (PA): The Institute [cité le 11 mars 2015].
- Note de bas de page 66
-
Institute for Safe Medication Practices. Acute Care - ISMP Medication Safety Alert. Adacel (Tdap) and Daptacel (DTaP) confusion [Internet]. Horsham (PA): The Institute; 24 août 2006 [cité le 14 janv. 2014].
- Note de bas de page 67
-
Organisation intergouvernementale de la Convention du Mètre, Bureau international des poids et mesures. Le Système international d'unités (SI), 8e édition [Internet]. Sèvres (FR) : Le Bureau; 2006 [cité le 24 avr. 2014].
- Note de bas de page 68
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Les vulnérabilités du système à travers le continuum de soins : une autre inversion entre l'hydrate de chloral et le chlorure de potassium. Bulletin de l'ISMP Canada [Internet]. 2005 [cité le 23 août 2014];5(7):1-2.
- Note de bas de page 69
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Vos déclarations ont suscité une réponse favorable des fabricants. Bulletin de l'ISMP Canada [Internet]. 2007 [cité le 23 août 2014];7(7):2.
- Note de bas de page 70
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Un patient partage et déclare une confusion liée à l'insuline. Bulletin de l'ISMP Canada [Internet]. 2007 [cité le 23 août 2014];7(6):1-2.
- Note de bas de page 71
-
Bilan 2010 des conditionnements : savoir reconnaître les pièges pour éviter les erreurs. Prescrire [Internet]. 2011 [cité le 15 janv. 2015];20(117):162-165.
- Note de bas de page 72
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Alerte : Un récent changement apporté à l'étiquetage du rituximab (Rituxan®) a mené à la déclaration d'incidents causés par une confusion entre deux produits. Bulletin de l'ISMP Canada [Internet]. 2008 [cité le 23 août 2014];8(1):4.
- Note de bas de page 73
-
Bojko A, Buffardi K, Lew G. Eye tracking study on the impact of the manufacturer's logo and multilingual description on drug selection performance. Proc Hum Factors Ergonomics Soc Annual Meeting. 2006;50(1):1112-1116.
- Note de bas de page 74
-
U.S. Department of Health and Human Services, Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Guidance for industry: Safety considerations for product design to minimize medication errors. Draft guidance [Internet]. Rockville (MD): U.S. Food and Drug Administration; déc. 2012 [cité le 1er mars 2014].
- Note de bas de page 75
-
Bilan 2011 des conditionnements : trop de dangers et trop de patients oubliés. Prescrire [Internet]. 2012;21(127):133-138.
- Note de bas de page 76
-
Prescription bottle labeling simplified. Adhesives & Sealants Industry. 2006;13(12):19.
- Note de bas de page 77
-
Shah-Mohammadi A-R, Gaunt MJ. Oral medications inadvertently given via the intravenous route. Pa Patient Saf Advis. 2013 [cité le 1er févr. 2015];10(3):85-91.
- Note de bas de page 78
-
Kenagy JW, Stein GC. Naming, labeling, and packaging of pharmaceuticals. Am J Health Syst Pharm. 2001;58:2033-2041.
- Note de bas de page 79
-
U.S. Department of Health and Human Services, Food and Drug Administration. Center for Drug Evaluation and Research (CDER), Center for Biologics Evaluation and Research (CBER). Draft Guidance for Industry - Allowable excess volume and labeled vial fill size in injectable drug and biological products. Silver Spring (MD): Center for Drug Evaluation and Research, Food and Drug Administration; juin 2015 [cité le 6 mars 2016].
- Note de bas de page 80
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Étiquetage des produits à base de fer. Bulletin de l'ISMP Canada [Internet]. 21 avr. 2009 [cité le 27 août 2013];9(3):1.
- Note de bas de page 81
-
Institute for Safe Medication Practices. Acute care - ISMP Medication Safety Alert. Urgent drug safety message. Medication errors with certain lipid-based drug products [Internet]. Horsham (PA): The Institute; 18 août 1998 [cité le 11 janv. 2015].
- Note de bas de page 82
-
Programme Canada Vigilance. Canadiens en santé. Rappels et avis. Jevtana (cabazitaxel) - Potentiel d'erreurs de médication dans la préparation menant à une surdose - Pour les professionnels de la santé [Internet]. Ottawa (ON) : Santé Canada; 10 janv. 2014 [cité le 26 févr. 2014].
- Note de bas de page 83
-
Joint Commission. Preventing pediatric medication errors. Sentinel Event Alert [Internet]. 2008 [cité le 24 juil. 2014];39.
- Note de bas de page 84
-
International Medication Safety Network. Medication incidents related to the use of fentanyl transdermal systems: An international aggregate analysis [Internet]. Horsham (PA): The Network; oct. 2009 [cité le 21 août 2014].
- Note de bas de page 85
-
Bureau de la traduction, Travaux publics et Services gouvernementaux Canada. Termium Plus®. Le guide du rédacteur. 2 Les nombres [Internet]. Ottawa (ON) : Travaux publics et Services gouvernementaux Canada; 15 oct. 2015, c2016 [cité le 6 mars 2016].
- Note de bas de page 86
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Déclaration sur la confusion de l'étiquetage sur une seringue d'insuline. Bulletin de l'ISMP Canada [Internet]. 2014 [cité le 11 janv. 2015];14(5):3-4.
- Note de bas de page 87
-
Adapté de : International Medication Safety Network. Position statement - Making medicines naming, labelling and packaging safer [Internet]. Horsham (PA): The Network; 2013 [cité le 22 févr. 2014].
- Note de bas de page 88
-
Australian Government, Department of Health, Therapeutic Goods Administration. Therapeutic Goods Order No. 69 General requirements for labels for medicines [Internet]. Symonston (ACT): The Administration; 14 juil. 2014 [cité le 28 avril 2016].
- Note de bas de page 89
-
United States Pharmacopeial Convention. USP 38. General Chapters: <1> Injections. Labels and Labeling. Rockville (MD): The Convention; 2015.
- Note de bas de page 90
-
Wheeler DW, Carter JJ, Murray LJ, et al. The effect of drug concentration expression on epinephrine dosing errors. Ann Intern Med. 2008;148:11-14.
- Note de bas de page 91
-
Pending United States Pharmacopeia and National Formulary (USP39-NF34), tel que présenté dans : Update on Proposed General Chapter <7> Labeling; 2013, Generic Pharmaceutical Association [Internet] [cité le 5 janv. 2016].
- Note de bas de page 92
-
Programme Canada Vigilance. Canadiens en santé. Rappels et avis. Kadcyla (trastuzumab emtansine) et Herceptin (trastuzumab) - Risque potentiel d'erreur de médication en raison de la similarité entre les dénominations communes - Pour les professionnels de la santé [Internet]. Ottawa (ON) : Santé Canada; 9 oct. 2013 [cité le 15 janv. 2015].
- Note de bas de page 93
-
Wogalter MS, ed. Handbook of warnings. Chapter 11, Purposes and scope of warnings [Internet]. Mahwah (NJ): Lawrence Erlbaum Associates; 2006 [cité le 15 janv. 2015]; p. 3-9.
- Note de bas de page 94
-
Rogers WA, Lawson N, Rousseau GK. Warning research: an integrative perspective. Hum Factors. 2000;42(1):102-139.
- Note de bas de page 95
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Alerte : Décès attribuable à l'injection par inadvertance d'épinéphrine pour usage topique. Bull ISMP Can [Internet]; 2009 [cité le 19 févr. 2014];9(2):2.
- Note de bas de page 96
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Déclaration d'incidents liés aux capsules et au dispositif d'inhalation Spiriva. Bull ISMP Can [Internet]. 2009[cité le 2 mars 2014];9(10):3-4.
- Note de bas de page 97
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Alerte : Échantillons d'Angeliq (drospirénone et estradiol-17β) offerts par erreur comme contraceptifs. Bulletin de l'ISMP Canada [Internet]. 2010 [cité le 21 août 2014];10(10);1-2.
- Note de bas de page 98
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Mise en garde concernant la solution nettoyante et désinfectante pour lentilles cornéennes Clear Care®. ISMP Canada - Médicamentssécuritaires.ca - Alerte [Internet]. 2010 [cité le 19 févr. 2014];1(2):1-2.
- Note de bas de page 99
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Des médicaments conçus pour la voie épidurale et administrés par voie intraveineuse peuvent résulter en un décès. Bulletin de l'ISMP Canada [Internet]. 2006 [cité le 12 janv. 2014];6(7):1-2.
- Note de bas de page 100
-
Institute for Safe Medication Practices Canada. Enhanced sterile water label paves way for national standard. Bulletin de l'ISMP Canada [Internet]. 2003 [cité le 12 janv. 2014];3(6):1-2.
- Note de bas de page 101
-
U D, Hyland S. Pharmacists' role in preventing medication errors with potassium chloride. Can J Hosp Pharm [Internet]. 2002 [cité le 15 janv. 2015];55(4):278-280.
- Note de bas de page 102
-
Hellier E, Edworthy J, Derbyshire N, et al. Considering the impact of medicine label design characteristics on patient safety. Ergonomics. 2006;49(5-6):617-630.
- Note de bas de page 103
-
Callan J, Gwynne J. Human factors principles for medical device labelling [Internet]. Rockville (MD): Center for Devices and Radiological Health, Food and Drug Administration; sept. 1993 [cité le 17 févr. 2014]. FDA Contract No.: 223;-89-6022.
- Note de bas de page 104
-
Steward DW, Martin IM. Intended and unintended consequences of warning messages: A review and synthesis of empirical research. Journal of Public Policy & Marketing. 1994;13(1):1-19.
- Note de bas de page 105
-
Wickens CD, Lee JD, Liu Y, et al. An introduction to human factors engineering. New York (NY): Addison-Wesley Educational Publishers Inc.; 2004.
- Note de bas de page 106
-
Enterprise and Industry Directorate, European Commission. Guideline on the readability of the labelling and package leaflet of medicinal products for human use. Revision 1 [Internet]. Brussels (Belgium): The Commission; 12 janv. 2009 [cité le 25 févr. 2014].
- Note de bas de page 107
-
U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), Center for Biologics Evaluation and Research (CBER). Guidance for industry: Warnings and precautions, contraindications, and boxed warning sections of labeling for human prescription drug and biological products - Content and format [Internet]. Silver Spring (MD): The Administration; oct. 2011 [cité le 15 janv. 2015].
- Note de bas de page 108
-
United States Pharmacopeial Convention. USP Pictograms, 2015 [Internet]. Rockville (MD): The Convention; 2015 [cité le 26 juillet 2015].
- Note de bas de page 109
-
Peckham G. Product safety labelling: Harmonization of U.S. international standards is on the horizon [Internet]. William Mitchell law review. 2000 [cité le 6 mars 2016];27(1):article 6.
- Note de bas de page 110
-
United States Pharmacopeial Convention. Recommendations to the Safe Medication Use Expert Committee by the Health Literacy and Prescription Container Labeling Advisory Panel, May and November 2009 [Internet]. Rockville (MD): The Convention; 2010 [cité le 15 janv. 2015].
- Note de bas de page 111
-
United States Pharmacopeial Convention. General Chapter <1> Injections. Section on Labeling and Cap Overseals. To be printed in USP 34-NF 29 (November 1, 2010). Official on December 1, 2013 [Internet]. Rockville (MD): The Convention; nov. 2010 [cité le 15 janv. 2015].
- Note de bas de page 112
-
United States Pharmacopeial Convention. USP 38.USP Monographs: Potassium Chloride for Injection Concentrate. Labeling. Rockville (MD): The Convention; 2015.
- Note de bas de page 113
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Les inhibiteurs neuromusculaires : maintenir, au fil du temps, les améliorations au niveau de l'emballage. Bulletin de l'ISMP Canada [Internet]. 2014 [cité le 17 août 2014];14(7):1-5.
- Note de bas de page 114
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Initiative en matière d'emballage et d'étiquetage des inhibiteurs neuromusculaires. Bulletin de l'ISMP Canada [Internet]. 2006 [cité le 20 mai 2014]; 6(2):2.
- Note de bas de page 115
-
World Health Organization. Information Exchange System. Alert No. 115 [Internet]. Genève (Suisse): The Organization; 18 juil. 2007 [cité le 20 juil. 2014]. Document No : QSM/MC/IEA.
- Note de bas de page 116
-
United States Pharmacopeial Convention. White Paper. USP's role in patient safety [Internet]. Rockville (MD): The Convention; 23 sept. 2009 [cité le 20 févr. 2014].
- Note de bas de page 117
-
Medicines and Healthcare products Regulatory Agency. Additional warning statements for inclusion on the label and/or in the leaflet of certain medicines [Internet]. London (UK): The Agency; juil. 2012 [cité le 6 mars 2016].
- Note de bas de page 118
-
Gouvernement du Canada. Système d'information sur les matières dangereuses utilisées au travail (SIMDUT) [Internet]. Ottawa (ON): Santé Canada; 2015 [cité le 9 sept. 2014].
- Note de bas de page 119
-
Lohiya S. The variable location, content, and legibility of expiration dates on medicine containers [Letter]. J Am Board Fam Practice [Internet]. 2004 [cité le 27 août 2014];17(4):395-397.
- Note de bas de page 120
-
United States Pharmacopeial Convention. Proposed revisions to the Labeling on Ferrules and Cap Overseals of general chapter <1> injections [Internet]. Pharmacopeial Forum. 2010 [cité le 23 avril 2016];36(1).
- Note de bas de page 121
-
Healthcare Quality Directorate, Department of Health, National Health Service. Coding for success - Simple technology for safer patient care [Internet]. London (UK): The Service; 16 févr. 2007 [cité le 15 mai 2014].
- Note de bas de page 122
-
Expert Group on Safe Medication Practices, Council of Europe. Creation of a better medication safety culture in Europe: building up safe medication practices [Internet]. Strasbourg (France): The Council; 2006 [cité le 15 mai 2014].
- Note de bas de page 123
-
Institut pour la sécurité des médicaments aux patients du Canada. Le Projet canadien de codage à barres des produits pharmaceutiques. À propos du projet. [Internet]. Toronto (ON) : L'Institut; c2000-2015 [cité le 6 mars 2016].
- Note de bas de page 124
-
Santé Canada. Canadiens en santé. Rappels et avis. Adrenalin (chlorure d'épinéphrine 1:1000) destiné à un usage topique - Risque d'injection par inadvertance - Pour les professionnels de la santé [Internet]. Ottawa (ON) : Santé Canada; 17 août 2010 [modifié le 7 mars 2013; cité le 26 août 2014].
- Note de bas de page 125
-
Institute for Safe Medication Practices Canada. Published data supports dispensing vincristine in minibags as a system safeguard. Bulletin de l'ISMP Canada [Internet]. 2001 [cité le 25 août 2014];1(1):1.
- Note de bas de page 126
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Un danger qui se reproduit : les solutions de chlorure de potassium concentrées. Bulletin de l'ISMP Canada [Internet]. 2004 [cité le 19 févr. 2014];4(3):1-2.
- Note de bas de page 127
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Administration d'un diluant sans le médicament auquel il doit être associé. Bulletin de l'ISMP Canada [Internet]. 2010 [cité le 12 janv. 2014];10(7):1-3.
- Note de bas de page 128
-
Institute for Safe Medication Practices. Acute Care - ISMP Medication Safety Alert. Safety Brief: Diluent vial looks like drug vial [Internet]. 23 août 2012 [cité le 15 janv. 2015].
- Note de bas de page 129
-
Yin SH, Wolf MS, Dreyer BP, et al. Evaluation of consistency in dosing directions and measuring devices for pediatric nonprescription liquid medications. JAMA [Internet]. 2010 [cité le 25 juil. 2014];304(23):2595-2602.
- Note de bas de page 130
-
WHO expert committee on specifications for pharmaceutical preparations. WHO technical report series 902. Thirty-sixth report. Annex 9. Guidelines on packaging for pharmaceutical products [Internet]. Genève (Suisse): World Health Organization; 2002 [cité le 20 déc. 2013].
- Note de bas de page 131
-
Lee M. Manufacturer's packaging. Safe use from a medication error perspective. Panel 3 [Internet]. Horsham (PA): Med-Errs; 24 juin 2010 [cité le 18 déc. 2014]. Accessible à l'adresse :
- Note de bas de page 132
-
Institute for Safe Medication Practices. Acute Care - ISMP Medication Safety Alert. ISMP action agenda: January-March 1999 [Internet]. 21 avr. 1999 [cité le 15 janv. 2015].
- Note de bas de page 133
-
Levine SR, Cohen MR, Blanchard NR, et al. Guidelines for preventing medication errors in pediatrics. J Pediatr Pharmacol Ther [Internet]. 2001 [cité le 28 avril 2016];6:427-443.
- Note de bas de page 134
-
U.S. Department of Health and Human Services. Food and Drug Administration. Center for Drug Evaluation and Research. Guidance for industry: Dosage delivery devices for orally ingested OTC liquid drug products [Internet]. Silver Spring (MD): The Administration; mai 2011 [cité le 20 févr. 2014].
- Note de bas de page 135
-
Millonig MK. Pharmacist CE Lesson. Reducing OTC pediatric dosing errors: What the pharmacist needs to know. CE Drug Store News [Internet]. Nov./déc. 2012 [cité le 6 mars 2016].
- Note de bas de page 136
-
World Health Organization. WHO Expert Committee on Specifications for Pharmaceutical Preparations. WHO Technical Report Series 970. Forty-sixth Report. [Internet]. Geneva (Switzerland); 2012 [cité le 6 juin 2016].
- Note de bas de page 137
-
Institute for Safe Medication Practices. 2016-2017 Targeted medication safety best practices for hospitals [Internet]. Horsham (PA): The Institute; c2016 [cité le 6 mars 2016].
- Note de bas de page 138
-
European Medicines Agency. Draft guideline on pharmaceutical development of medicines for pediatric use. Report No.: EMA/CHMP/QWP/180157/2011 [Internet]. London (UK): The Agency; mai 2011 [cité le 20 févr. 2014].
- Note de bas de page 139
-
Agence de réglementation de la lutte antiparasitaire, Santé Canada. Lignes directrices pour la conception d'étiquettes dépliants et d'étiquettes multi-éléments pour les produits antiparasitaires à usage domestique [Internet]. Ottawa (ON) : Santé Canada; 16 juin 2011 [cité le 21 janv. 2015].
- Note de bas de page 140
-
ASTM D4267-07, Standard specification for labels for small-volume (100 mL or less) parenteral drug containers. West Conshohocken (PA): ASTM International; 2007 [cité le 12 déc. 2013].
- Note de bas de page 141
-
Cohen MR, Blanchard N, Frederico F, Magelli M, et al. Draft guidelines for preventing medication errors in pediatrics. J Pediatr Pharm Pract. 1998;189-202; en référence dans : Levine SR, Cohen MR, Blanchard NR, et al. Guidelines for preventing medication errors in pediatrics. J Pediatr Pharmacol Ther [Internet]. 2001 [cité le 28 avril 2016];6:426-442.
- Note de bas de page 142
-
Hughes RD, editor. Patient safety and quality: An evidence-based handbook for nurses. Chapter 15, Pediatric safety and quality [Internet]. Rockville (MD): Agency for Healthcare Research and Quality; 2008 Mar. Chapter 15, Pediatric safety and quality; [cité le 21 janv. 2015]; [30 pages].
- Note de bas de page 143
-
Bureau de la gastroentérologie et des maladies infectieuses et virales. Direction des produits thérapeutiques. Direction générale des produits de santé et des aliments, Santé Canada. Ligne directrice. Norme d'étiquetage des médicaments pédiatriques en vente libre contre la toux et le rhume, administrés par voie orale [Internet]. Ottawa (ON) : Santé Canada; 6 févr. 2009 [cité le 6 mars 2016].
- Note de bas de page 144
-
van Geffen EC, Meuwese E, Philbert D, et al. Problems with Medicine Packages: Experiences reported to a Dutch reporting system. Ann Pharmacother. 2010;44(6):1104-1109.
- Note de bas de page 145
-
Institute for Safe Medication Practices. Unsafe Tylenol packaging. ISMP Medication Safety Alert! 7 avr. 2005 [cité le 12 déc. 2013];10(7):1-2.
- Note de bas de page 146
-
Lee M, Philips J. Transdermal patches: high risk for error? Drug Topics. 2002:54-55 [cité le 21 janv. 2015].
- Note de bas de page 147
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Analyse de données internationales sur des incidents liés aux timbres transdermiques de fentanyl. Bulletin de l'ISMP Canada. 2009 [cité le 2 janv. 2014];9(10):1-2.
- Note de bas de page 148
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Alerte : Les timbres génériques de fentanyl. Bulletin de l'ISMP Canada. 2006 [cité le 9 janv. 2014];9(10):13.
- Note de bas de page 149
-
U.S. Food and Drug Administration. FDA requiring color changes to Duragesic (fentanyl) pain patches to aid safety-emphasizing that accidental exposure to used patches can cause death. Drug Safety Communications. 23 sept. 2013 [cité le 21 janv. 2015].
- Note de bas de page 150
-
Institut canadien pour la sécurité des patients. L'Institut pour l'utilisation sécuritaire des médicaments du Canada. Saskatchewan Health. Cadre canadien de l'analyse des causes souches. Edmonton AB: Institut canadien pour la sécurité des patients. Mars 2006. Édition française 2008.
- Note de bas de page 151
-
Collaborateurs à l'analyse des incidents. Cadre canadien d'analyse des incidents [Internet]. Edmonton (AB) : Institut canadien pour la sécurité des patients; 2012 [cité le 21 janv. 2015]
- Note de bas de page 152
-
Institute for Safe Medication Practices Canada. Human factors and substitution errors. ISMP Can Saf Bull [Internet]. 2003 [cité le 13 nov. 2013];3(5):1-2.
- Note de bas de page 153
-
Gouvernement du Canada. Règlement sur l'emballage et l'étiquetage des produits de consommation [Internet. Ottawa (ON) : ministère de la Justice, Canada; 29 janv. 2014 [cité le 17 mai 2016].
- Note de bas de page 154
-
Singer JP, Balliro GM, Lerner ND. Smith TP, editor. Manufacturer's guide to developing consumer product instructions. Washington (DC): Consumer Product Safety Commission; oct. 2003 [cité le 21 janv. 2015].
- Note de bas de page 155
-
Davies J, Hebert P, Hoffman C. Un dictionnaire canadien sur la sécurité des patients. Ottawa (ON) : Collège royal des médecins et chirurgiens du Canada; 2003 [cité le 27 nov. 2014].
- Note de bas de page 156
-
Institute for Safe Medication Practices Canada. Definitions of terms [Internet]. Toronto (ON): The Institute; c2000-2015 [cité le 21 janv. 2015].
- Note de bas de page 157
-
Institut pour l'utilisation sécuritaire des médicaments du Canada. Failure mode and effects analysis (FMEA): A framework for proactively identifying risk healthcare. Version 1. Toronto (ON) : L'Institut; 2006
- Note de bas de page 158
-
Gouvernement du Canada. Ligne directrice - Questions-réponses : Le règlement sur l'étiquetage en langage clair pour les médicaments sur ordonnance [Internet]. Ottawa (ON) : Santé Canada; 30 avril 2015 [cité le 6 nov. 2015].
- Note de bas de page 159
-
Plain Language Commission. Readability reports [Internet]. London (UK): The Commission [cité le 28 sept. 2014]
- Note de bas de page 160
-
Institute for Safe Medication Practices. ISMP High-alert medications [Internet]. Horsham (PA): The Institute; c2016 [cité le 6 mars 2016].
- Note de bas de page 161
-
Lanham Act §43(a), 15 U.S.C. §1125 (2010); as quoted in Greene JA, Kesselheim AS. Why do the same drugs look different? Pills, trade dress, and public health. N Engl J Med. 2011;365(1):83-89.
- Note de bas de page 162
-
Nielsen J. Usability Engineering. San Diego (CA): Academic Press; 1993.
- Note de bas de page 163
-
Nielsen J. The usability engineering life cycle. Comput. 1992;25:12-22.
- Note de bas de page 164
-
Horton W. Designing and writing online documentation: hypermedia for self-supporting products, 2nd ed. New York (NY): Wiley; 1994.
- Note de bas de page 165
-
Brass EP, Weintraub W. Label development and the label comprehension study for over-the-counter drugs. Clin Pharmacol Ther. 2003;74(5):406-412.
- Note de bas de page 166
-
American National Standards Institute. American national standard for criteria for safety symbols. ANSI Z535.3. New York (NY): The Institute; 2002.
- Note de bas de page 167
-
Enterprise and Industry Directorate General. European Commission. Guideline on the readability of the label and package leaflet of medicinal products for human use [Internet]. Brussels (BE): The Commission; 12 janv. 2009 [cité le 6 mars 2016].
- Note de bas de page 168
-
Medicines and Healthcare products Regulatory Agency. Guidance on the user testing of patient information leaflets [Internet]. London (UK): The Agency; juin 2005 [cité le 28 avril 2016].
- Note de bas de page 169
-
Shaver ERF, Wogalter MS. A comparison of older vs. newer over-the-counter (OTC) nonprescription drug labels on search time accuracy. Proc Hum Fact Ergon Soc Annu Meet. 2003;47(5):826-830.
- Note de bas de page 170
-
Gouvernement du Canada. Exigences en matière de données pour que des ingrédients médicinaux passent de « sur ordonnance » à « sans « ordonnance » [Internet]. Ottawa (ON) : Santé Canada; 1er mai 2014 [cité le 29 nov. 2015].
- Note de bas de page 171
-
Lewis C, Polson P, Wharton C, et al. Testing a walkthrough methodology for theory-based design of walk-up-and-use interfaces. Proceedings of the ACM CHI 90 Human Factors in Computing Systems Conference. 1990;235-242.
- Note de bas de page 172
-
Polson P, Lewis C, Rieman J, et al. Cognitive walkthroughs: a method for theory-based evaluation of user interfaces. Int J Hum Comput Stud. 1992;36:741-773.
- Note de bas de page 173
-
Nielsen J, Mack RL, editors. Usability inspection methods. New York (NY): John Wiley and Sons; 1994. Chapter 2, Heuristic evaluation. Chapter 5, The cognitive walkthrough method: A practitioner's guide.
- Note de bas de page 174
-
Ericsson A, Simon H. Protocol analysis: verbal reports as data. Cambridge (MA): The MIT Press; 1993.
- Note de bas de page 175
-
Wogalter MS, Vigilante WJ. Effects of label format on knowledge acquisition and perceived readability by younger and older adults. Ergonomics. 2003;46(4):327-344.
- Note de bas de page 176
-
Estes WK, Taylor HA. A detection method and probabilistic models for assessing information processing from brief visual displays. Proc Natl Acad Sci U S A. 1964;52(2):446-454.
- Note de bas de page 177
-
Buffardi K, Bojko A, Israelski E. Tachistoscopic study on the impact of net quantity and dosage strength proximity on dosage strength recognition in prescription drug labels. Proc Hum Fact Ergon Soc Annu Meet. 2007;51(11):730-734.
- Note de bas de page 178
-
Bojko A, Gaddy C, Lew G, et al. Evaluation of drug label designs using eye tracking. Proc Hum Fact Ergon Soc Annu Meet. 2005;49(11):1033-1037.
- Note de bas de page 179
-
Shultz J, Strosher L, Nenshi Nathoo S, et al. Avoiding potential medication errors associated with non-intuitive medication abbreviations [Internet]. Can J Hosp Pharm. 2011 [cité le 21 janv. 2015];64(4):246-251.