Page 4 : Document de conseils sur le contrôle de la corrosion dans les réseaux de distribution d'eau potable
Partie B. Renseignements à l'appui
Le relargage de contaminants dans les réseaux de distribution d'eau potable peut être dû à la corrosion interne des éléments de ces réseaux ou de la plomberie. L'efficacité des mesures destinées à contrôler la corrosion et le relargage de contaminants dans un réseau donné peut être évaluée en mesurant les concentrations des contaminants dans l'eau du robinet au fil du temps et en établissant une corrélation entre ces concentrations et les activités de contrôle.
La corrosion est définie comme étant la détérioration d'un matériau, habituellement un métal, due à une réaction de celui-ci avec son environnement (NACE International, 2000). Dans les réseaux de distribution d'eau potable, le matériau peut être un tuyau ou un raccord métallique, le revêtement intérieur en ciment d'une conduite ou un tuyau en PVC.
Le présent document met principalement l'accent sur la corrosion de matériaux à base de plomb, de cuivre et de fer et le relargage en résultant. Il aborde aussi brièvement le relargage à partir des conduites en PVC et en ciment, mais n'inclut pas la biocorrosion.
La corrosion des matériaux métalliques est électrochimique par nature; elle se définit comme la destruction d'un métal par le biais de réactions de transfert d'électrons (Snoeyink et Wagner, 1996). Ce type de corrosion se produit uniquement en présence des quatre composantes typiques d'une cellule électrochimique, c'est-à-dire : 1) une anode, 2) une cathode, 3) une connexion entre l'anode et la cathode permettant le transfert des électrons, et 4) une solution électrolytique qui conduira les ions entre l'anode et la cathode. Dans le cas de la corrosion interne des réseaux de distribution d'eau potable, l'anode et la cathode sont des sites à la surface du métal qui présentent un potentiel électrochimique différent; la connexion électrique est assurée par le métal, et l'eau sert d'électrolyte.
La réaction principale de la corrosion est l'oxydation ou dissolution anodique du métal pour produire des ions métalliques et des électrons :
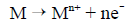
Figure 4 - Document de conseils sur le contrôle de la corrosion dans les réseaux de distribution d'eau potable - Description textuel
où :
- M est le métal;
- e- est un électron;
- n est la valence et le nombre correspondant d'électrons.
Pour que cette réaction anodique se poursuive, il faut une seconde réaction utilisant les électrons produits. Les accepteurs d'électrons les plus communs dans l'eau potable sont l'oxygène dissous et les espèces chlorées en solution aqueuse.
Les ions issus de la réaction ci-dessus peuvent être libérés dans l'eau potable en tant que produits de corrosion, ou réagir avec les substances présentes dans l'eau pour former à la surface de la conduite une incrustation dont la nature peut varier de très soluble et friable à adhérente et protectrice. Les incrustations protectrices se forment habituellement lorsque le cation métallique se combine avec un hydroxyde, un oxyde, un carbonate, un phosphate ou un silicate pour former un précipité.
La concentration d'un métal donné dans l'eau potable dépend du taux de corrosion et des propriétés de dissolution et de précipitation des incrustations formées. Au départ, lorsque le métal est nu, le taux de corrosion dépasse de loin le taux de dissolution. À mesure que les produits de corrosion s'accumulent à la surface, le taux de corrosion diminue et se rapproche graduellement du taux de dissolution (Snoeyink et Wagner, 1996).
B.1.1 Principaux contaminants découlant de la corrosion dans les réseaux de distribution d'eau potable
Les matériaux présents dans le réseau de distribution déterminent la nature des contaminants qui aboutiront le plus vraisemblablement dans l'eau du robinet. Les contaminants les plus inquiétants issus du relargage des matériaux des réseaux de distribution d'eau potable sont l'aluminium, l'antimoine, l'arsenic, le bismuth, le cadmium, le chlorure de vinyle, le cuivre, l'étain, le fer, le nickel, les composés organoplombiques, l'organoétain, le plomb, le sélénium et le zinc. Il est important de déterminer si ces contaminants sont présents à des concentrations supérieures à celles jugées sécuritaires pour la consommation humaine.
Au Canada, les tuyauteries en cuivre avec soudures plomb-étain (d'utilisation courante jusqu'en 1989) et les robinets et raccords en laiton sont prédominants dans les systèmes de plomberie résidentiels (Churchill et coll., 2000). Les tuyaux en fonte ou en fonte ductile représentent plus des deux tiers des conduites maîtresses installées d'un bout à l'autre du Canada (InfraGuide, 2001). Dans les nouvelles installations, les tuyaux en PVC remplacent souvent les tuyaux en cuivre et les entrées de service et de distribution en plomb. Les matériaux à base de ciment sont également couramment utilisés pour la fabrication des tuyaux de diamètre plus grand.
L'eau potable peut être contaminée par le relargage du plomb présent dans les vieilles conduites maîtresses, les entrées de service, la pâte à joints et les soudures, les raccords en laiton et en bronze, ainsi que dans les cols-de-cygne et les éléments de soupape ou les joints d'étanchéité utilisés dans les usines de traitement ou les conduites maîtresses. Pendant de nombreuses années, le plomb a été une composante courante des réseaux de distribution d'eau. La réglementation de la plomberie de l'ensemble des provinces et des territoires se fonde sur le Code national de la plomberie -Canada (CNP). Le CNP a accepté jusqu'en 1975 l'utilisation du plomb dans la fabrication des tuyaux (entrées de service). En vertu du CNP, tous les raccords doivent être conformes à la norme ASME 112.18.1/CSA B125.1 (autrefois CSA B125.1) de l'American Society of Mechanical Engineers (ASME) et de l'Association canadienne de normalisation (CSA) visant les robinets. En 1986, cette norme limitait la teneur en plomb des soudures à 0,2 %. La version de 1990 du CNP interdit officiellement l'utilisation des soudures à base de plomb pour réaliser ou réparer des systèmes de plomberie servant à distribuer l'eau potable (CNRC, 2005). Les produits de rechange les plus communément utilisés sont les soudures étain-antimoine, étain-cuivre et étain-argent.
Une nouvelle génération d'alliages de laiton à prix abordable sert désormais à la fabrication des raccords et des éléments de plomberie en ligne. Ces alliages à très faible teneur en plomb contiennent moins de 0,25 % de plomb (sous forme d'impuretés), le plomb étant remplacé par du bismuth ou par une combinaison de bismuth et de sélénium (AwwaRF, 2007).
Le cuivre est utilisé dans les tuyaux et les alliages des systèmes de plomberie résidentiels. Les alliages en cuivre utilisés dans les réseaux de distribution d'eau potable sont le laiton (pour les raccords) et le bronze (pour les robinets). Le laiton est essentiellement composé de cuivre et de zinc, auxquels s'ajoutent d'autres composants mineurs comme le plomb. Les raccords en laiton sont aussi souvent enduits d'un mélange de chrome et de nickel. Le bronze (appelé également laiton rouge) est un alliage de cuivre, d'étain et de zinc, avec ou sans plomb. La plupart des laitons contiennent entre 2 % et 8 % de plomb.
En plus d'être présent dans les raccords en laiton et en bronze comme les robinets, le plomb peut aussi se retrouver dans des appareils comme les refroidisseurs d'eau et les fontaines à jet vertical couramment utilisés dans les écoles et les autres bâtiments non résidentiels. Certains composants des refroidisseurs d'eau, comme les joints soudés se trouvant dans les appareils ou le revêtement du réservoir, peuvent contenir des alliages à base de plomb (U.S. EPA, 2006b).
Les matériaux suivants constituent les principales sources de fer dans les réseaux de distribution d'eau potable : fonte, fonte ductile, fer et acier galvanisés. Les éléments qui risquent d'être en contact avec l'eau pendant son transport de l'usine de traitement au consommateur comprennent les parois et les parties mobiles des cuvelages de puits, les pompes, les équipements de mélange, les compteurs, les conduites, les vannes et les raccords. Le fer peut être libéré directement à partir des matériaux à base de fer, ou indirectement, par les sous-produits de la corrosion du fer, ou tubercules de rouille, qui se forment pendant le processus de corrosion.
Les tuyaux galvanisés libèrent du zinc puisqu'ils sont fabriqués par trempage de tuyaux d'acier dans un bain de zinc en fusion. Ils peuvent aussi libérer du cadmium et du plomb, présents sous forme d'impuretés (Leroy et coll., 1996). Jusqu'en 1980, le CNP a accepté l'utilisation d'acier galvanisé dans la fabrication des tuyaux pour les systèmes de plomberie (CNRC, 2005).
Les matériaux à base de ciment utilisés pour la distribution de l'eau potable comprennent les tuyaux en béton armé, les revêtements en mortier de ciment et les tuyaux en amiante-ciment. Outre les agrégats (sable, gravier ou amiante) qui forment la structure de base du ciment, le liant, qui assure la cohésion du matériau et lui confère ses propriétés mécaniques, est constitué principalement de silicates de calcium et d'aluminates de calcium utilisés en diverses proportions (Leroy et coll., 1996). La dégradation des matériaux à base de ciment peut libérer de l'hydroxyde de calcium dans l'eau distribuée, ce qui risque d'augmenter le pH et l'alcalinité. Cette dégradation peut également libérer de l'aluminium et de l'amiante.
Selon la documentation scientifique, il est rare que les matériaux à base de ciment causent de graves problèmes de qualité de l'eau. Toutefois, on signale des cas où des revêtements en mortier de ciment nouvellement réalisés in situ auraient causé des problèmes de qualité de l'eau dans des conditions de débit d'eau faible ou des culs-de-sac, lorsque l'alcalinité est faible (Douglas et Merrill, 1991).
Les tuyaux en PVC, en polyéthylène ou en PVC chloré utilisés dans les réseaux de distribution peuvent libérer des substances chimiques organiques dans l'eau potable. Les conduites maîtresses fabriquées avant 1977 contiennent des concentrations élevées de chlorure de vinyle et sont sujettes au relargage de ce composé (Flournoy et coll., 1999). On utilise des stabilisants pour protéger le PVC contre la décomposition lorsqu'il est exposé à une chaleur extrême pendant la production. Au Canada, les composés d'organoétain sont les stabilisants les plus couramment employés dans la production de tuyaux en PVC utilisés pour la distribution d'eau potable, et on a détecté leur présence dans l'eau distribuée par ce type de tuyaux. Les tuyaux en PVC chloré sont fabriqués au moyen de stabilisants contenant du plomb, ce dernier pouvant alors être relargué dans l'eau distribuée. Il est à noter que les raccords conçus pour les tuyaux en PVC peuvent être faits de laiton, qui contient du plomb et en constitue une source potentielle en cas d'utilisation de tuyaux en PVC. En vertu du CNP, tous les tuyaux en plastique doivent être conformes à la série de normes CSA B137 sur les tuyaux en plastique, ces normes exigeant que les tuyaux et leurs raccords soient conformes aux exigences de la norme 61 de NSF International (NSF) et de l'American National Standards Institute (ANSI) concernant le relargage des contaminants.
Il n'existe pas de méthode ou d'indice universel fiable pour mesurer la corrosivité de l'eau et évaluer ainsi le degré d'exposition des populations aux contaminants relargués dans les réseaux de distribution. Comme la corrosion des éléments des réseaux de distribution et des systèmes de plomberie constitue une source importante de la présence de métaux dans l'eau potable, la mesure des contaminants dans l'eau du robinet constitue le meilleur moyen d'évaluer la corrosion et, par là, l'exposition des consommateurs.
La documentation scientifique indique que le plomb, le cuivre et le fer sont les contaminants dont les concentrations risquent le plus de dépasser les valeurs recommandées à cause de la corrosion des matériaux des réseaux de distribution d'eau potable. La CMA pour le plomb dans l'eau potable est fondée sur les effets de cet élément sur la santé de la population la plus sensible (c'est-à-dire les enfants). Les recommandations pour le cuivre et le fer sont fondées sur des considérations d'ordre esthétique (organoleptiques), comme la couleur et le goût. L'objectif esthétique du cuivre dans l'eau potable a été fixé à ≤ 1,0 mg/L; le cuivre est un élément essentiel à la santé des humains et il est généralement jugé non toxique, sauf lorsqu'il atteint des doses supérieures à 15 mg/jour. L'objectif esthétique du fer, qui est lui aussi un élément essentiel pour les humains, a été fixé à ≤ 0,3 mg/L. Étant donné ce qui précède, on a retenu la concentration de plomb au robinet comme déclencheur des programmes de contrôle de la corrosion (Santé Canada, 1978, 1992).
Un examen récent de la documentation (Schock, 2005) indique qu'un certain nombre de contaminants peuvent s'accumuler dans les réseaux de distribution d'eau ou s'en libérer. Les incrustations qui se sont formées dans les tuyaux des réseaux de distribution et ont atteint un équilibre dynamique peuvent ensuite libérer des contaminants tels que l'aluminium, l'arsenic, d'autres métaux-traces et des radionucléides. Les effets des changements apportés aux processus de traitement, en particulier ceux qui ont une influence sur les paramètres de la qualité de l'eau, comme le pH, l'alcalinité et le potentiel d'oxydoréduction, doivent être surveillés de près dans l'eau distribuée.
Une étude a été réalisée en 1981 afin d'évaluer les concentrations de cadmium, de calcium, de chrome, de cobalt, de cuivre, de plomb, de magnésium, de nickel et de zinc dans l'eau potable distribuée au Canada (Méranger et coll., 1981). En s'appuyant sur des échantillons représentatifs prélevés d'un robinet qui a coulé pendant 5 minutes au débit maximal, l'étude a conclu que seules les concentrations de cuivre augmentaient de façon importante dans l'eau potable du robinet, comparativement à l'eau brute et à l'eau traitée.
Par ailleurs, diverses autres études ont montré que les concentrations de métaux-traces mesurées dans des échantillons d'eau du robinet prélevés après une période de stagnation pouvaient atteindre des valeurs supérieures à celles recommandées (Wong et Berrang, 1976; Lyon et Lenihan, 1977; Nielsen, 1983; Samuels et Méranger, 1984; Birden et coll., 1985; Neff et coll., 1987; Schock et Neff, 1988; Gardels et Sorg, 1989; Schock, 1990a; Singh et Mavinic, 1991; Lytle et coll., 1993; Viraraghavan et coll., 1996).
Singh et Mavinic (1991) ont étudié le relargage du cuivre, du fer, du plomb et du zinc dans la plomberie de cuivre avec soudures à base de plomb de tours d'habitation et de maisons unifamiliales. Ils ont observé que dans le district régional de Vancouver, où l'eau est généralement corrosive (pH : 5,5-6,3; alcalinité : 0,6-3,7 mg/L de carbonate de calcium), le premier litre d'eau prélevé au robinet après une période de stagnation de 8 heures dépassait les valeurs fixées par les Recommandations pour la qualité de l'eau potable au Canada concernant le plomb et le cuivre dans 43 % (plomb) et 62 % (cuivre) des échantillons prélevés dans les tours d'habitation, et dans 47 % (plomb) et 73 % (cuivre) des échantillons prélevés dans les maisons unifamiliales. Les échantillons prélevés dans les tours d'habitation après une période de purge prolongée de l'eau du robinet présentaient toujours des concentrations supérieures aux valeurs des recommandations dans 6 % des cas pour le plomb et dans 9 % des cas pour le cuivre. En ce qui concerne les maisons unifamiliales, il a été possible dans tous les cas de ramener les teneurs en plomb et en cuivre de l'eau du robinet à un niveau inférieur aux valeurs des recommandations en faisant couler l'eau froide pendant 5 minutes.
Subramanian et coll. (1991) ont étudié le relargage de l'antimoine, de l'argent, du cadmium, du cuivre, de l'étain, du plomb et du zinc à partir de tuyaux de cuivre neufs à soudures sans plomb exposés à l'eau du robinet. Les concentrations mesurées d'antimoine, d'argent, de cadmium, d'étain, de plomb et de zinc étaient inférieures aux limites de détection, même dans les échantillons d'eau qui avaient reposé dans les tuyaux pendant 90 jours. Toutefois, les concentrations de cuivre étaient dans certains cas supérieures à 1 mg/L. Les chercheurs ont conclu que les soudures étain-antimoine, étain-argent et étain-cuivre-argent utilisées dans ces systèmes de plomberie ne libéraient pas d'antimoine, d'argent, de cadmium, d'étain, de plomb ou de zinc dans l'eau potable.
Samuels et Méranger (1984) ont étudié le relargage des métaux-traces à partir des robinets de cuisine en contact avec l'eau de la Ville d'Ottawa. L'eau a été prélevée après une période de stagnation de 24 heures à des robinets neufs non rincés. Les chercheurs ont mesuré des concentrations variées de cadmium, de chrome, de cuivre, de plomb et de zinc, selon le type de robinet et les solutions utilisées. En règle générale, les concentrations de cadmium, de chrome, de cuivre et de zinc relargués ne dépassaient pas les valeurs fixées à l'époque par les Recommandations pour la qualité de l'eau potable au Canada. Toutefois, les concentrations de plomb relarguées à partir des robinets contenant des joints en cuivre soudés au plomb étaient très supérieures à la valeur recommandée.
Une étude similaire de Schock et Neff (1988) a révélé que les robinets neufs en laiton chromé pouvaient libérer dans l'eau potable des quantités importantes de cuivre, de plomb et de zinc, notamment après une période de stagnation. Les chercheurs ont également conclu que les robinets et les raccords en laiton des plomberies résidentielles constituaient une source continue de plomb, même lorsque les tuyaux de cuivre étaient raccordés avec de la soudure et du flux sans plomb.
D'autres études ont porté sur les concentrations de plomb dans l'eau potable dans les bâtiments non résidentiels, notamment dans des lieux de travail et des écoles. Maas et coll. (1994) ont procédé à une analyse statistique des échantillons d'eau prélevés après une période de stagnation nocturne à plus de 12 000 fontaines, fontaines à jet vertical, refroidisseurs, robinets et machines à glaçons. L'analyse a révélé que plus de 17 % des échantillons avaient des concentrations de plomb supérieures à 15 µg/L. Une analyse approfondie a indiqué que plus de 25 % des échantillons d'eau potable provenant des fontaines à jet vertical, des refroidisseurs et des robinets avaient des concentrations de plomb supérieures à 15 µg/L. D'autres études ont révélé qu'entre 5 % et 21 % des fontaines ou des robinets d'eau potable présentaient des concentrations de plomb supérieures à 20 µg/L après une période de stagnation de plus de 8 heures (Gnaedinger, 1993; Bryant, 2004; Sathyanarayana et coll., 2006; Boyd et coll., 2008a).
Des études réalisées à Copenhague (Danemark) ont décelé un relargage de nickel à partir du laiton nickelé et chromé après une période de stagnation de l'eau (Anderson, 1983). Les concentrations de nickel mesurées dans les premiers 250 mL variaient de 8 à 115 µg/L, et n'étaient plus que de 9 à 19 µg/L après une purge de 5 minutes. D'autres études ont révélé la présence de concentrations élevées de nickel (jusqu'à 8 700 µg/L dans un cas) dans l'eau provenant d'installations nouvelles nickelées, en laiton nickelé et chromé ou en bronze industriel contenant du nickel au bout d'une période de stagnation de 12 heures (Nielsen et Andersen, 2001). Des expériences réalisées dans le cadre de l'application de la réglementation de la U.S. EPA régissant la teneur en plomb et en cuivre de l'eau (Lead and Copper Rule) ont également révélé que le laiton constitue une source possible de nickel dans l'eau du robinet (Kimbrough, 2001). On a trouvé du nickel dans le premier litre d'eau prélevé après une période de stagnation (concentrations moyennes variant entre 4,5 et 9,2 µg/L, et concentrations maximales variant entre 48 et 102 µg/L). Les résultats ont aussi montré que le nickel se trouvait presque entièrement dans les 100 premiers millilitres prélevés.
Comme plus des deux tiers des réseaux canadiens de distribution d'eau potable sont en fonte et en fonte ductile, il n'est pas surprenant de constater que l'eau rouge soit le problème de corrosion le plus souvent signalé par les consommateurs. Lorsque la concentration en fer dépasse l'objectif esthétique de ≤ 0,3 mg/L établi par les Recommandations pour la qualité de l'eau potable au Canada, elle peut tacher la lessive et les raccords de plomberie, conférer un goût désagréable aux boissons et donner à l'eau une couleur qui va du jaune au rouge brunâtre.
Outre les problèmes esthétiques qu'ils posent, les tubercules de rouille peuvent abriter divers types de microorganismes. Tuovinen et coll. (1980) en ont isolé des réducteurs de sulfate et de nitrate, des oxydants du nitrate, de l'ammoniac et du soufre, ainsi que des microorganismes hétérotrophes non identifiés. Emde et coll. (1992) ont pour leur part isolé des coliformes, dont Escherichia coli, Enterobacter aerogenes et des espèces du genre Klebsiella à partir de tubercules de rouille dans le réseau de distribution de Yellowknife. On a également détecté des concentrations élevées de coliformes (> 160 bactéries par gramme de tubercules) dans les tubercules de rouille d'un réseau de distribution d'eau du New Jersey aux prises depuis longtemps avec des problèmes bactériologiques, alors qu'aucun coliforme n'était détecté dans l'eau traitée des usines de traitement. Les coliformes identifiés étaient E. Coli, Citrobacter freundii et Enterobacter agglomerans (LeChevallier et coll., 1988). La plupart des surfaces des conduites des réseaux de distribution sont colonisées par des microorganismes, mais les tubercules de rouille sont particulièrement propices à leur multiplication. Les zones nodulaires des incrustations offrent aux bactéries une protection physique contre la désinfection en formant des interstices dans lesquels elles peuvent se réfugier (LeChevallier et coll., 1987).
Les hydroxydes de fer peuvent également adsorber et concentrer les substances chimiques. L'adoption de la chloration de l'eau par un réseau de distribution d'eau du Midwest des États-Unis a provoqué une hausse marquée des concentrations en arsenic de l'eau du robinet. La chloration de l'eau souterraine (dont les teneurs en arsenic n'avaient jamais dépassé 10 µg/L) a induit la formation d'hydroxyde ferrique solide qui a adsorbé et concentré l'arsenic présent dans l'eau. La chloration a également modifié les incrustations formées dans les tuyaux de cuivre, entraînant la libération d'oxydes de cuivre ayant eux aussi la propriété d'adsorber et de concentrer l'arsenic. Les concentrations d'arsenic mesurées dans l'eau ont atteint jusqu'à 5 mg/L (Reiber et Dostal, 2000). Par ailleurs, les incrustations risquent également d'adsorber des substances chimiques comme l'arsenic qui seront libérées plus tard si la qualité de l'eau distribuée change (Reiber et Dostal, 2000; Lytle et coll., 2004). Après avoir mesuré des concentrations d'arsenic variant entre 10 et 13 650 µg/L dans les incrustations des tuyaux de fer de 15 réseaux de distribution d'eau potable, Lytle et coll. (2004) ont conclu que même les réseaux dont l'eau contient des concentrations d'arsenic inférieures à 10 µg/L peuvent présenter des teneurs dangereuses d'arsenic dans l'eau du robinet. L'arsenic qui s'accumule avec le temps dans les sous-produits de la corrosion des réseaux de distribution d'eau potable risque d'être libéré plus tard, en particulier quand le régime hydraulique ou la qualité de l'eau changent.
Des concentrations élevées d'aluminium ont été détectées dans l'eau potable de Willemstad, à Curaçao (Antilles néerlandaises) après l'installation de 2,2 km de nouveaux tuyaux à revêtement de mortier de ciment (Berend et Trouwborst, 1999). Les concentrations en aluminium de l'eau distribuée sont passées de 5 à 690 µg/L dans les deux mois qui ont suivi cette installation. Plus de deux ans après, le relargage de l'aluminium produisait toujours des concentrations de cette substance supérieures à 100 µg/L. Ces concentrations anormales ont été attribuées à la concentration élevée d'aluminium dans le revêtement de mortier de ciment (18,7 % d'oxyde d'aluminium) ainsi qu'à la faible dureté de l'eau (15 à 20 mg/L de carbonate de calcium), à sa faible alcalinité (18 à 32 mg/L de carbonate de calcium), à son pH élevé (8,5 à 9,5), au temps de contact prolongé (2,3 jours) de l'eau distribuée et à l'utilisation de polyphosphate en guise d'inhibiteur de la corrosion.
Une série de tests effectués sur le terrain dans diverses régions du Royaume-Uni où l'eau présentait des caractéristiques différentes (Conroy, 1991) a permis d'observer le relargage d'aluminium à partir de tuyaux à revêtement de ciment portland appliqué in situ. On a mesuré des concentrations en aluminium supérieures à celle prévue par la norme de la Communauté européenne (CE) de 0,2 mg/L pendant les deux mois qui ont suivi l'installation des tuyaux dans une zone où l'eau présentait une très faible alcalinité (environ 10 mg/L de carbonate de calcium) et un pH élevé (> 9,5), avec un temps de contact de 6 heures. Après deux mois d'utilisation, les concentrations d'aluminium étaient redevenues inférieures à la valeur prévue par la norme de la CE. Par ailleurs, dans les zones où l'eau était légèrement plus alcaline (environ 50 mg/L de carbonate de calcium), les concentrations d'aluminium n'ont jamais dépassé la valeur prévue par la norme de la CE. La recommandation canadienne sur l'aluminium dans l'eau potable établit une valeur opérationnelle guide qui s'applique aux usines de traitement de l'eau utilisant des coagulants à base d'aluminium. « Comme il n'existe aucune preuve convaincante et solide indiquant que l'aluminium dans l'eau potable peut être la cause d'effets nocifs chez l'être humain », on n'a pas établi de recommandation fondée sur des critères de santé pour l'aluminium dans l'eau potable (Santé Canada, 1998).
On a observé la présence de fibres d'amiante dans l'eau distribuée par des tuyaux en amiante-ciment (Leroy et coll., 1996). Cependant, selon le document technique de la Recommandation pour la qualité de l'eau potable au Canada concernant l'amiante, « il n'existe pas d'ensemble cohérent de données convaincantes indiquant que l'ingestion d'amiante est dangereuse. Par conséquent, il n'est pas nécessaire de fixer une concentration maximale acceptable (CMA) pour l'amiante dans l'eau potable ». (Santé Canada, 1989).
Sadiki et Williams (1999) ont réalisé une étude sur les concentrations d'organoétain présentes au Canada dans l'eau potable distribuée par de nouvelles conduites en PVC à l'hiver et au printemps (28 sites), puis à l'automne (21 sites) en 1996. Environ 29 % des échantillons d'eau prélevés durant les périodes hiver/printemps et 40 % des échantillons prélevés en automne contenaient des composés d'organoétain. Parmi ces derniers, les composés les plus souvent détectés étaient le monométhylétain et le diméthyltétain, dont les concentrations variaient de 0,5 à 257 ng d'étain par litre. Une étude supplémentaire réalisée à l'été de 1996 aux endroits où les teneurs en organoétain mesurées au cours de l'hiver et du printemps avaient été les plus élevées a permis de constater une baisse des concentrations d'organoétain dans 89 % des échantillons d'eau prélevés (concentrations d'étain variant de 0,5 à 21,5 ng/L). Il n'existe pas de recommandation pour la qualité de l'eau potable au Canada concernant les organoétains.
De nombreux facteurs contribuent à la corrosion et au relargage de contaminants dans les réseaux de distribution d'eau potable, mais les principaux sont le type de matériau utilisé, l'âge de la plomberie, la période de stagnation de l'eau et la qualité de l'eau dans le réseau. Les concentrations de toutes les matières corrosives ou solubles présentes dans le réseau de distribution dépendront de certains ou de l'ensemble des facteurs. Toutefois, l'incidence de ces facteurs sur chacun des contaminants variera d'un contaminant à l'autre.
Les facteurs qui influent sur la corrosion et le relargage du plomb, du cuivre, du fer et du ciment sont examinés ci-après, puisque ces matériaux sont ceux qui risquent le plus de produire des contaminants en concentrations supérieures aux Recommandations pour la qualité de l'eau potable au Canada, de poser des risques pour la santé publique et d'être à l'origine de plaintes des consommateurs. Une liste des facteurs clés et de leurs principaux effets se trouve à la section C.3.
Les concentrations de plomb mesurées au robinet et provenant des soudures au plomb et des raccords en laiton diminuent avec le temps (Sharrett et coll., 1982; Birden et coll., 1985; Boffardi, 1988, 1990; Schock et Neff, 1988; Neuman, 1995). Les chercheurs ont conclu que les concentrations de plomb les plus élevées s'observent au cours de la première année qui suit l'installation des plomberies et qu'elles diminuent ensuite pour marquer un palier au bout d'un certain nombre d'années (Sharrett et coll., 1982; Boffardi, 1988). Toutefois, contrairement aux joints soudés au plomb et aux raccords en laiton, les tuyaux en plomb demeurent une source constante et importante de plomb même après plusieurs années d'utilisation (Britton et Richards, 1981; Schock et coll., 1996). L'analyse d'échantillons d'eau du robinet prélevés dans le cadre d'une étude sur le terrain (Maas et coll., 1991) a montré que les habitations de tous âges présentaient des risques importants de contamination par le plomb.
La libération du cuivre dans l'eau potable dépend en grande partie du type d'incrustations formées par la corrosion dans le système de plomberie. On peut supposer qu'à un âge donné, un sous-produit de la corrosion déterminera les concentrations de cuivre libérées dans l'eau potable. La solubilité dépend de la nature des incrustations prédominantes et peut être classée par ordre décroissant comme suit : hydroxyde cuivreux [Cu(OH)2] > brochantite [Cu4(SO4)(OH)6] >> phosphate cuivrique [Cu3(PO4)2] > ténorite [CuO] et malachite [Cu2(OH)2CO3] (Schock et coll., 1995). Les concentrations de cuivre continuent de diminuer avec l'âge des matériaux de plomberie même après 10 ou 20 ans d'utilisation, lorsque les incrustations de ténorite ou de malachite tendent à prédominer (Sharrett et coll., 1982; Neuman, 1995; Edwards et McNeill, 2002). Dans certains cas, les sulfates et les phosphates peuvent d'abord réduire les concentrations de cuivre en formant de la brochantite et du phosphate cuivrique, mais ils risquent à plus long terme d'empêcher la formation d'incrustations de ténorite et de malachite plus stables (Edwards et coll., 2002).
L'âge des tuyaux en fer influe sur leur corrosion. En règle générale, la concentration de fer dans l'eau et le taux de corrosion augmentent avec le temps à partir de la première exposition à l'eau, et diminuent ensuite graduellement à mesure que les incrustations s'accumulent (McNeill et Edwards, 2001). Toutefois, la plupart des problèmes d'eau rouge actuels sont causés par de vieux tuyaux en fonte, à la surface recouverte de très nombreux tubercules, qui présentent une stagnation de l'eau dans les culs-de-sac. Sarin et coll. (2003) ont récupéré des tuyaux en fonte sans revêtement vieux de 90 à 100 ans dans des réseaux de distribution. L'accumulation d'incrustations de corrosion dans ces tuyaux était telle qu'elle réduisait le diamètre interne dans une proportion qui pouvait atteindre 76 %. Les tuyaux dans cet état sont sujets à l'abrasion et présentent de grandes surfaces de contact qui favorisent la libération du fer.
Un matériau à base de ciment nouvellement installé libère d'ordinaire de l'hydroxyde de calcium qui contribue à augmenter le pH, l'alcalinité et la teneur en calcium de l'eau (Holtschulte et Schock, 1985; Douglas et Merrill, 1991; Conroy et coll., 1994; Douglas et coll., 1996; Leroy et coll., 1996). Les expériences de Douglas et Merrill (1991) ont montré qu'après 1, 6 et 12 années d'exposition à un débit peu élevé d'eau faiblement alcaline, le relargage d'hydroxyde de calcium à partir du revêtement de mortier de ciment persistait, mais qu'il diminuait toutefois de façon importante dans les tuyaux de 6 et de 12 ans comparativement aux tuyaux d'un an. Ces observations s'expliquent par le fait que le relargage d'hydroxyde de calcium diminue naturellement avec l'épuisement du calcium de la surface des tuyaux. De plus, les dépôts formés après une exposition prolongée protègent le mortier contre le relargage.
Les concentrations de plomb et de cuivre mesurées dans l'eau potable provenant de diverses sources de plomb, notamment les entrées de service en plomb, les soudures au plomb et les raccords en laiton, peuvent augmenter de façon importante après quelques heures de stagnation de l'eau dans les réseaux de distribution. De nombreux facteurs, comme la qualité de l'eau et l'âge, la composition, le diamètre et la longueur des tuyaux de plomb, ont des répercussions sur la forme des courbes de stagnation et sur le temps requis pour atteindre un état d'équilibre (Lytle et Schock, 2000).
À l'examen des courbes de stagnation établies par divers auteurs, Schock et coll. (1996) ont conclu que les concentrations de plomb augmentaient de façon exponentielle lorsqu'il y avait stagnation, mais qu'elles atteignaient une valeur d'équilibre assez constante au bout d'une nuit de stagnation. Lytle et Schock (2000) ont montré que les concentrations de plomb augmentaient rapidement avec la stagnation de l'eau, et que les 20 à 24 premières heures constituaient une période critique pour les tuyaux de plomb et les raccords en laiton. Ils ont constaté que l'augmentation de la concentration de plomb était plus rapide au cours des 10 premières heures, atteignant environ 50 % à 70 % de la valeur maximale observée. La concentration du plomb continuait ensuite d'augmenter légèrement, au bout d'une période allant jusqu'à 90 heures de stagnation même.
Kuch et Wagner (1983) ont représenté graphiquement les concentrations de plomb par rapport à la durée de stagnation pour deux qualités d'eau et deux diamètres de tuyaux en plomb. Les concentrations de plomb dans un tuyau de 1/2 po (1,3 cm), dont l'eau présentait un pH de 6,8 et une alcalinité de 10 mg/L (carbonate de calcium [CaCO3]), étaient sensiblement plus élevées que celles mesurées dans un tuyau de 3/8 po (1,0 cm), dont l'eau présentait un pH de 7,2 et une alcalinité de 213 mg/L (CaCO3). D'autres données produites par Kuch et Wagner (1983) indiquent que les concentrations de plomb atteignent un niveau presque maximal ou d'équilibre après une période de stagnation de plus de 300 minutes (5 heures) dans un tuyau de 1/2 po (entrée de service en plomb de 1,3 cm) et de plus de 400 minutes (6,7 heures) dans un tuyau de 3/8 po (1,0 cm). Le diamètre des tuyaux ou des entrées de service en plomb au Canada varie de 1/2 po (1,3 cm) à 3/4 po (1,9 cm), mais se situe le plus souvent entre 5/8 po (1,6 cm) et 3/4 po (1,9 cm). En outre, on a démontré que les concentrations de plomb sont très sensibles à la durée de stagnation durant les trois premières heures de repos de l'eau dans des tuyaux dont le diamètre se situe entre 1/2 po (1,3 cm) et 3/4 po (1,9 cm). Selon les caractéristiques de la qualité de l'eau et le diamètre des tuyaux, des différences dans la durée de stagnation aussi peu importantes que 30 ou 60 minutes ont permis d'observer des écarts dans les concentrations de plomb allant de 10 % à 30 % (Kuch et Wagner, 1983; Schock, 1990a). Les tuyaux de plomb et les tuyaux de cuivre longs et de faible diamètre produisent respectivement les plus fortes concentrations de plomb et de cuivre sous l'effet de la stagnation (Kuch et Wagner, 1983; Ferguson et coll., 1996).
Le plomb est également relargué pendant les périodes de stagnation à partir des joints soudés et des raccords en laiton (Birden et coll., 1985; Neff et coll., 1987; Schock et Neff, 1988). Wong et Berrang (1976) ont conclu que les concentrations de plomb de l'eau prélevée dans un système de plomberie résidentiel installé depuis un an et constitué de tuyaux de cuivre avec soudures étain-plomb pouvait dépasser 0,05 mg/L après une période de stagnation de 4 à 20 heures, et que l'eau en contact avec des tuyaux de plomb pouvait dépasser cette valeur en 10 à 100 minutes. Dans une étude sur les effets de la durée de stagnation sur la libération de plomb à partir de coupons en laiton, Schock et coll. (1995) ont observé que les concentrations de plomb issues de coupons en laiton contenant 6 % de plomb ont augmenté lentement pendant la première heure pour atteindre finalement une concentration maximale de 0,08 mg/L après 15 heures de stagnation. Après 6 heures de stagnation, la concentration de plomb était supérieure à 0,04 mg/L. De plus, les auteurs de l'étude ont observé que la quantité de plomb libérée des raccords en laiton variait selon la composition de l'alliage et la durée de stagnation.
Le cuivre affiche un comportement plus complexe que le plomb en eau stagnante. Les concentrations de cet élément augmentent au début de la stagnation, mais elles peuvent ensuite diminuer ou continuer d'augmenter selon les teneurs de l'eau en oxydant. Lytle et Schock (2000) ont montré que les concentrations de cuivre augmentent rapidement avec la stagnation de l'eau dans les tuyaux, mais qu'elles retombent rapidement dès que la concentration d'oxygène dissous passe sous le seuil de 1 mg/L. Sorg et coll. (1999) ont également observé que lorsque l'eau est adoucie, les concentrations de cuivre augmentent jusqu'à atteindre des valeurs maximales de 4,4 et 6,8 mg/L après environ 20 à 25 heures de stagnation, et qu'elles retombent ensuite à 0,5 mg/L après 72 à 92 heures. Les concentrations maximales correspondent au moment où la teneur en oxygène dissous est réduite à 1 mg/L ou moins. Dans l'eau non adoucie, la concentration maximale est atteinte en moins de 8 heures, puisque la concentration d'oxygène dissous diminue plus rapidement dans les tuyaux en boucle exposés à ces conditions.
On a indiqué que les périodes cycliques d'écoulement et de stagnation de l'eau constituaient la principale cause des problèmes d'eau rouge découlant de la corrosion du fer dans les réseaux de distribution (Benjamin et coll., 1996). On a également montré que la concentration du fer augmentait pendant les périodes plus longues de stagnation qui caractérisent les culs-de-sac (Beckett et coll., 1998; Sarin et coll., 2000).
On a établi une corrélation entre la période de contact de l'eau distribuée avec les matériaux en ciment et la détérioration de la qualité de l'eau, qui augmente avec un contact prolongé (Holtschulte et Schock, 1985; Conroy, 1991; Douglas et Merrill, 1991; Conroy et coll., 1994; Douglas et coll., 1996; Berend et Trouwborst, 1999). À l'issue d'une étude effectuée aux États-Unis sur 33 réseaux de distribution dotés de nouveaux tuyaux à revêtement de mortier de ciment in situ et qui transportaient de l'eau de faible alcalinité, Douglas et Merrill (1991) ont conclu que la dégradation de la qualité de l'eau était plus évidente dans les culs-de-sac ou dans les sections à débit faible ou intermittent. Le Water Research Centre du Royaume-Uni est parvenu à des conclusions similaires, relevant que plus la période de contact entre l'eau et le revêtement de mortier est longue, plus les hydroxydes relargués s'accumulent, entraînant une augmentation du pH de l'eau (Conroy, 1991; Conroy et coll., 1994). On a également établi un lien entre la durée de la période de stagnation de l'eau dans les nouveaux tuyaux de mortier de ciment installés à Curaçao et les concentrations élevées d'aluminium mesurées dans l'eau potable (Berend et Trouwborst, 1999), mais ces résultats étaient dus à la teneur élevée en aluminium du mortier (18,7 % d'oxyde d'aluminium).
L'effet du pH sur la solubilité des sous-produits de la corrosion est souvent un facteur clé permettant de comprendre la concentration des métaux dans l'eau du robinet. Il est important de souligner à cet égard que la solubilité des sous-produits de la corrosion formés dans les réseaux de distribution diminue habituellement lorsque le pH de l'eau augmente.
La solubilité des principaux sous-produits de la corrosion du plomb (solides du plomb bivalent : cérusite [PbCO3], hydrocérusite [Pb3(CO3)2(OH)2] et hydroxyde de plomb [Pb(OH)2]) a un effet déterminant sur les concentrations de plomb dans l'eau du robinet (Schock, 1980, 1990b; Sheiham et Jackson, 1981; De Mora et Harrison, 1984; Boffardi, 1988, 1990; U.S. EPA, 1992; Leroy, 1993; Peters et coll., 1999). Pour des raisons ayant trait à la thermodynamique, la solubilité des sous-produits de la corrosion du plomb dans les réseaux de distribution diminue à mesure que le pH augmente (Britton et Richards, 1981; Schock et Gardels, 1983; De Mora et Harrison, 1984; Boffardi, 1988; Schock, 1989; U.S. EPA, 1992; Singley, 1994; Schock et coll., 1996). Les modèles de solubilité montrent que les concentrations de plomb sont au plus bas lorsque le pH se situe autour de 9,8 (Schock et Gardels, 1983; Schock, 1989; U.S. EPA, 1992; Schock et coll., 1996). Toutefois, ces relations avec le pH de l'eau risquent de ne pas se vérifier pour le dioxyde de plomb tétravalent insoluble (PbO2) solide, découvert dans les dépôts de tuyaux en plomb de plusieurs réseaux de distribution (Schock et coll., 1996, 2001). Selon une compilation de données thermodynamiques, la relation observée entre le pH et le dioxyde de plomb pourrait être l'inverse de celle observée avec les solides du plomb bivalent (par ex. cérusite, hydrocérusite) (Schock et coll., 2001; Schock et Giani, 2004). Lytle et Schock (2005) ont démontré que le dioxyde de plomb se formait facilement à un pH de 6 à 6,5 dans de l'eau contenant une concentration résiduelle de chlore libre persistant, en quelques semaines à quelques mois.
Contrairement à la contamination par les tuyaux de plomb et les alliages de cuivre et de plomb, qui dépend principalement de la solubilité des produits de la corrosion, la contamination par les soudures au plomb dépend surtout de la corrosion galvanique (Oliphant, 1983b; Schock, 1990b; Reiber, 1991; Singley, 1994). L'augmentation du pH est associée à une baisse de la corrosion galvanique des soudures au plomb (Oliphant, 1983b; Gregory, 1990; Reiber, 1991; Singley, 1994).
On a constaté par expérience dans les services publics que les concentrations les plus faibles de plomb dans l'eau du robinet étaient associées à un pH supérieur à 8 (Karalekas et coll., 1983; Lee et coll., 1989; Dodrill et Edwards, 1995; Douglas et coll., 2004). De 1999 à 2003, la Ville d'Ottawa a évalué un certain nombre de méthodes chimiques de contrôle de la corrosion pour son réseau de distribution d'eau (Douglas et coll., 2004). Les résultats d'expériences effectuées en laboratoire et d'expériences pilotes et l'analyse des incidences sur un certain nombre de critères ont permis d'établir une stratégie de contrôle de la corrosion fondée sur l'utilisation d'hydroxyde de sodium et de dioxyde de carbone pour obtenir un pH de 9,2 et une alcalinité minimale cible de 35 mg/L de carbonate de calcium. Pendant la phase initiale de mise en oeuvre, le passage à l'hydroxyde de sodium a été effectué pendant que le pH était maintenu à 8,5. Toutefois, à la suite de la demande d'un client de mesurer la concentration de plomb, les chercheurs ont découvert une zone de la ville où les teneurs en plomb de l'eau du robinet étaient élevées (10 à 15 µg/L dans les échantillons prélevés après une période de purge). Le problème a été attribué à un phénomène de nitrification à l'intérieur du réseau de distribution qui a réduit le pH de 8,5 à une plage de 7,8-8,2, et entraîné le relargage du plomb à partir des entrées de service en plomb. On a augmenté le pH de l'eau de 8,5 à 9,2 pour régler le problème de nitrification et réduire la dissolution du plomb. Cette hausse du pH a presque immédiatement ramené les concentrations de plomb dans l'eau du robinet entre 6 et 8 µg/L (après purge) dans la zone affectée. Une surveillance continue a montré que les concentrations de plomb dans l'eau du robinet se situaient constamment dans une plage de 1,3 à 6,8 µg/L après l'augmentation du pH, et restaient donc nettement inférieures à la norme de 10 µg/L prescrite par l'Ontario (Normes de qualité de l'eau potable de l'Ontario) (Douglas et coll., 2007).
L'étude de données fournies par 365 services publics visés par la Lead and Copper Rule (LCR) de la U.S. EPA a révélé que les teneurs moyennes en plomb de l'eau du robinet au 90e centile dépendaient à la fois du pH et de l'alcalinité de l'eau (Dodrill et Edwards, 1995). Dans la catégorie du niveau le plus bas de pH (pH < 7,4) et d'alcalinité (< 30 mg/L de carbonate de calcium), la probabilité pour les services publics de dépasser le niveau d'intervention prescrit par la LCR de la U.S. EPA pour le plomb, soit 0,015 mg/L, s'établissait à 80 %. Dans cette catégorie de faible alcalinité, seul un pH supérieur à 8,4 semblait capable de réduire les concentrations de plomb dans l'eau du robinet. Toutefois, lorsqu'on combine une alcalinité supérieure à 30 mg/L de carbonate de calcium et un pH supérieur à 7,4, l'eau distribuée peut dans certains cas satisfaire au seuil de la U.S. EPA relatif à la concentration de plomb.
Une étude réalisée en 1988 auprès de 94 services d'eau afin de déterminer les concentrations de plomb dans l'eau du robinet et d'évaluer les facteurs influant sur ces concentrations a donné des résultats analogues (Lee et coll., 1989). Au total, 1 484 sites incluant des entrées de service en plomb ou sans plomb ont été échantillonnés après une période nocturne de stagnation d'au moins 6 heures. Les résultats ont clairement démontré que le maintien du pH de l'eau à un minimum de 8,0 permettait de garder la teneur en plomb du premier litre d'eau prélevé au robinet sous le seuil recommandé (< 10 µg/L). La région métropolitaine de Boston (Massachusetts) a réalisé une étude de cinq ans visant à réduire les concentrations de plomb dans son réseau de distribution d'eau potable (Karalekas et coll., 1983). Entre 1976 et 1981, les chercheurs ont surveillé les concentrations de plomb dans l'eau du robinet, dans les entrées de service en plomb et dans le réseau de distribution connexe de quatorze ménages. Les concentrations moyennes ont été calculées en combinant des échantillons prélevés au robinet 1) après une nuit de stagnation; 2) après avoir laissé couler l'eau jusqu'à ce qu'elle devienne froide; 3) après une purge du réseau pendant trois minutes supplémentaires. Même si l'alcalinité est toujours restée très faible (12 mg/L de carbonate de calcium en moyenne), l'élévation du pH de 6,7 à 8,5 a réduit les concentrations moyennes de plomb de 0,128 à 0,035 mg/L.
Même si l'ion hydrogène ne joue pas un rôle de réduction direct sur les surfaces de cuivre, le pH peut influer sur la corrosion du cuivre en modifiant le potentiel d'équilibre de la demi-réaction de réduction de l'oxygène, ainsi que l'espèce de cuivre en solution (Reiber, 1989). La corrosion du cuivre augmente rapidement lorsque le pH est inférieur à 6, et les taux de corrosion uniformes peuvent être élevés lorsque le pH est faible (inférieur à 7 environ), ce qui provoque un amincissement du métal. À des valeurs de pH plus élevées (supérieures à 8 environ), les problèmes de corrosion du cuivre se manifestent presque toujours par des piqûres de corrosion ou par une corrosion inégale (Edwards et coll., 1994a; Ferguson et coll., 1996). Edwards et coll. (1994b) ont observé que dans le cas de surfaces de cuivre neuves exposées à des solutions simples contenant du bicarbonate, du chlorure, du nitrate, du perchlorate ou du sulfate, l'augmentation du pH de 5,5 à 7,0 réduisait de moitié environ les taux de corrosion, mais que des hausses additionnelles du pH n'entraînaient que des changements mineurs.
Pour prévoir les concentrations de cuivre dans l'eau potable, on s'appuie sur la solubilité et les propriétés physiques de l'oxyde et de l'hydroxyde cuivriques ainsi que des carbonates solides dont sont constituées les incrustations dans la plupart des réseaux de distribution d'eau faits de cuivre (Schock et coll., 1995). Le modèle à l'hydroxyde cuivrique de Schock et coll. (1995) montre clairement qu'une augmentation du pH entraîne une réduction de la solubilité du cuivre. Lorsque le pH atteint une valeur supérieure à 9,5 environ, le modèle prédit une augmentation de la solubilité de l'hydroxyde cuivrique causée par les complexes de carbonates et d'hydroxydes. L'examen des données sur les concentrations de cuivre dans l'eau potable communiquées par 361 services publics visés par la LCR de la U.S. EPA révèle que les valeurs moyennes du 90e centile sont plus élevées dans l'eau dont le pH est inférieur à 7,4, et qu'aucun des services dont l'eau présentait un pH supérieur à 7,8 n'a dépassé le niveau d'intervention de 1,3 mg de cuivre par litre d'eau prescrit par la U.S. EPA (Dodrill et Edwards, 1995). On a toutefois signalé que les problèmes liés à la solubilité du cuivre persistaient jusqu'à un pH de 7,9 environ lorsqu'on utilise de l'eau souterraine froide, très alcaline et riche en sulfates (Edwards et coll., 1994a).
À l'intérieur de la plage de pH de 7 à 9, le taux de corrosion et le degré de formation de tubercules dans les réseaux de distribution en fer augmentent généralement avec la valeur du pH (Larson et Skold, 1958; Stumm, 1960; Hatch, 1969; Pisigan et Singley, 1987). Toutefois, on observe habituellement une baisse des concentrations de fer à mesure que le pH de l'eau augmente (Karalekas et coll., 1983; Kashinkunti et coll., 1999; Broo et coll., 2001; Sarin et coll., 2003). Dans un banc d'essai de tuyaux en boucle fabriqué à l'aide de tuyaux en fonte sans revêtement vieux de 90 à 100 ans récupérés d'un réseau de distribution d'eau de Boston, les concentrations de fer ont diminué de façon constante lorsqu'on a augmenté le pH de 7,6 à 9,5 (Sarin et coll., 2003). De même, on a constaté une nette tendance à la baisse des concentrations de fer mesurées sur deux ans dans un réseau de distribution où le pH de l'eau avait été augmenté de 6,7 à 8,5 (Karalekas et coll., 1983). Ces observations s'accordent avec le fait que la solubilité des sous-produits de la corrosion du fer diminue à mesure que le pH augmente.
L'eau acide, faiblement alcaline et à faible teneur en calcium est particulièrement corrosive pour les matériaux en ciment. Les problèmes de qualité de l'eau qui peuvent se présenter sont liés à la chimie du ciment. La chaux du ciment libère dans l'eau potable des ions calcium et hydroxyles qui peuvent entraîner une hausse importante du pH, selon le pouvoir tampon de l'eau (Leroy et coll., 1996). Des tests à l'échelle pilote ont été réalisés pour simuler des conditions de faible débit dans des tuyaux récemment revêtus de mortier de ciment distribuant une eau de faible alcalinité (Douglas et coll., 1996). Dans une eau dont le pH initial était de 7,2, l'alcalinité de 14 mg/L (carbonate de calcium) et la teneur en calcium de 13 mg/L (carbonate de calcium) ont donné des niveaux de pH allant jusqu'à 12,5. De même, dans une eau dont le pH initial était de 7,8, l'alcalinité de 71 mg/L (carbonate de calcium) et la teneur en calcium de 39 mg/L (carbonate de calcium) ont donné des pH allant jusqu'à 12. Les augmentations les plus importantes du pH ont été observées pendant la première semaine de l'expérience, et le pH a ensuite diminué lentement avec le vieillissement du revêtement. Dans une série de tests sur le terrain et sur banc d'essai visant à déterminer l'incidence du revêtement de mortier de ciment in situ sur la qualité de l'eau, Conroy et coll. (1994) ont observé que dans des conditions de faible débit et de faible alcalinité de l'eau (environ 10 mg/L de carbonate de calcium), le pH pouvait rester supérieur à 9,5 plus de deux ans après la pose du revêtement.
Une série d'expériences réalisées sur le terrain dans des régions du Royaume-Uni ayant diverses qualités d'eau a permis de conclure qu'un pH élevé de l'eau dans les tuyaux en ciment pouvait rendre le plomb soluble. On a observé une hausse importante des concentrations de plomb avec l'augmentation du pH, lorsque celui-ci était supérieur à 10,5. Les concentrations de plomb variaient d'un peu moins de 100 µg/L à un pH de 11 à plus de 1 000 µg/L à un pH supérieur à 12 (Conroy, 1991). Ce résultat nous incite à nous interroger sur l'exactitude des modèles de solubilité dans des conditions de pH élevé et sur le niveau à partir duquel un ajustement du pH risque de devenir préjudiciable.
Les valeurs de pH élevées provoquées par le relargage du ciment risquent aussi de favoriser le relargage d'aluminium à partir des matériaux en ciment, puisque le pH élevé risque d'augmenter la solubilité de l'aluminium (Berend et Trouwborst, 1999).
L'alcalinité sert à contrôler l'intensité du pouvoir tampon dans la plupart des réseaux de distribution d'eau. Il convient donc de maintenir une valeur minimale d'alcalinité pour stabiliser le pH afin de contrôler la corrosion du plomb, du cuivre et du fer et d'assurer la stabilité des revêtements et des tuyaux à base de ciment.
Le recours à des processus d'osmose inverse et de nanofiltration influe sur l'alcalinité de l'eau traitée. En effet, ces processus éliminent les ions sodium, sulfate, chlorure, calcium et bicarbonate et produisent une eau corrosive (Taylor et Wiesner, 1999). Ce constat souligne l'importance d'ajuster ces processus, notamment en ajoutant une base et en aérant le débit du perméat afin de rétablir l'alcalinité de l'eau avant sa distribution.
Selon les modèles thermodynamiques, la solubilité minimale du plomb s'observe à un pH relativement élevé (9,8) et à une alcalinité faible (30 à 50 mg/L de carbonate de calcium) (Schock, 1980, 1989; Schock et Gardels, 1983; U.S. EPA, 1992; Leroy, 1993; Schock et coll., 1996). Ces modèles montrent que le niveau à partir duquel l'alcalinité influe sur la solubilité du plomb dépend de la forme de carbonate de plomb présente à la surface du tuyau. Lorsque la cérusite est stable, une augmentation de l'alcalinité réduit la solubilité du plomb; lorsque l'hydrocérusite est stable, une augmentation de l'alcalinité augmente la solubilité du plomb (Sheiham et Jackson, 1981; Boffardi, 1988, 1990). La cérusite est moins stable aux valeurs du pH auxquelles l'hydrocérusite est stable et peut se former. L'hydrocérusite est au final convertie en cérusite, substance qu'on trouve dans beaucoup de dépôts des tuyaux de plomb. On a observé une libération élevée du plomb dans des tuyaux où la cérusite était censée être stable compte tenu des conditions de pH et d'alcalinité. Toutefois, lorsque ces conditions sont ajustées pour permettre la stabilité thermodynamique de l'hydrocérusite, la libération du plomb devient moins élevée que dans tous les endroits où la cérusite est stable (Schock, 1990a).
Des expériences en laboratoire ont également révélé qu'à un pH variant de 7 à 9,5, l'alcalinité optimale pour le contrôle de la corrosion du plomb se situait entre 30 et 45 mg/L de carbonate de calcium, et que des ajustements visant à augmenter l'alcalinité au-delà de cette plage de valeurs ne procurait que peu d'avantages supplémentaires (Schock, 1980; Sheiham et Jackson, 1981; Schock et Gardels, 1983; Edwards et McNeill, 2002) et pouvait même être nuisible dans certains cas (Sheiham et Jackson, 1981).
Schock et coll. (1996) ont fait état de l'existence de quantités importantes de dioxyde de plomb tétravalent insoluble dans les dépôts de tuyaux de plomb de plusieurs réseaux de distribution d'eau. Toutefois, on ignore s'il existe un rapport entre l'alcalinité de l'eau et la solubilité du dioxyde de plomb, puisqu'on n'a signalé la présence d'aucun complexe ni d'aucun carbonate solide. L'existence de quantités importantes de dioxyde de plomb insoluble dans les dépôts des tuyaux en plomb pourrait expliquer la variabilité de la libération du plomb dans l'eau des entrées de service en plomb et le rapport médiocre entre la concentration totale de plomb et l'alcalinité (Lytle et Schock, 2005).
L'alcalinité ne devrait pas influer sur la libération du plomb à partir des soudures au plomb, puisque cette libération dépend surtout de la corrosion galvanique des soudures, par opposition à la solubilité des sous-produits de la corrosion qui sont formés (Oliphant, 1983a). Toutefois, Dudi et Edwards (2004) ont avancé que l'alcalinité pourrait jouer un rôle dans le relargage du plomb à partir des connexions galvaniques entre les éléments de plomberie contenant du plomb et ceux contenant du cuivre. Aucun lien net n'a encore été établi, d'après l'expérience des services publics, entre l'alcalinité de l'eau et la solubilité du plomb. Des données recueillies dans 47 municipalités des États-Unis ont donné à penser que les cibles les plus prometteuses en matière de chimie de l'eau pour le contrôle de la corrosion du plomb étaient un pH variant entre 8 et 10, et une alcalinité de 30 à 150 mg/L de carbonate de calcium (Schock et coll.,1996). Une étude ultérieure réalisée aux États-Unis auprès de 94 sociétés et districts d'approvisionnement en eau n'a révélé aucun lien entre la solubilité du plomb et l'alcalinité (Lee et coll., 1989). Une étude menée auprès de 365 services publics visés par la LCR de la U.S. EPA a permis de constater que la libération du plomb était beaucoup moins élevée lorsque l'alcalinité était maintenue entre 30 et 74 mg/L de carbonate de calcium que lorsqu'elle était inférieure à 30 mg/L de carbonate de calcium. On a également relevé des teneurs en plomb inférieures dans les réseaux des services dont l'eau présentait une alcalinité située entre 74 et 174 mg/L, ou supérieure à 174 mg/L, lorsque le pH était de 8,4 ou moins (Dodrill et Edwards, 1995).
Des expériences effectuées en laboratoire et sur le terrain ont démontré que le relargage du cuivre est plus important lorsque l'alcalinité est plus élevée (Edwards et coll., 1994b, 1996; Schock et coll., 1995; Ferguson et coll., 1996; Broo et coll., 1998) et que cette hausse est vraisemblablement due à la formation de complexes de bicarbonates et de carbonates de cuivre solubles (Schock et coll., 1995; Edwards et coll., 1996).
L'examen des données recueillies auprès de 361 services publics visés par la LCR de la U.S. EPA a également montré les effets nuisibles de l'alcalinité; on a observé que ces effets évoluaient d'une manière à peu près linéaire, et qu'ils étaient plus importants à un pH peu élevé : la combinaison d'un pH faible (< 7,8) et d'une alcalinité élevée (> 74 mg/L de carbonate de calcium) a donné les concentrations de cuivre les plus élevées du 90e centile (Edwards et coll., 1999).
Toutefois, une faible alcalinité (< 25 mg/L de carbonate de calcium) peut elle aussi causer des problèmes selon l'expérience des services publics (Schock et coll., 1995). Dans le cas d'eaux fortement alcalines, la seule solution pratique pour réduire la solubilité du cuivre consiste à adoucir l'eau à la chaux, à éliminer le bicarbonate ou à ajouter des quantités relativement élevées d'orthophosphate (U.S. EPA, 2003).
Des concentrations de cuivre peu élevées peuvent cependant être observées avec une alcalinité élevée lorsque les conditions favorisent la formation de malachite et de ténorite moins solubles (Schock et coll., 1995). Une expérience réalisée en laboratoire par Edwards et coll. (2002) a permis d'observer le double effet possible d'une alcalinité élevée. Pour des tuyaux relativement neufs, à un pH de 7,2, on a observé un rapport pratiquement linéaire entre la concentration maximale du cuivre libéré et l'alcalinité. Toutefois, à mesure que les tuyaux vieillissaient, la concentration de cuivre libéré dans l'eau était moins élevée à une alcalinité de 300 mg/L de carbonate de calcium, favorisant la formation de malachite, qu'à une alcalinité de 15 et 45 mg/L de carbonate de calcium, qui favorisait plutôt la formation d'hydroxyde cuivrique relativement soluble.
On a attribué des taux de corrosion du fer (Stumm, 1960; Pisigan et Singley, 1987; Hedberg et Johansson, 1987; Kashinkunti et coll., 1999) et des concentrations de fer plus faibles (Horsley et coll., 1998; Sarin et coll., 2003) à une alcalinité élevée de l'eau dans les réseaux de distribution.
Des expériences réalisées sur un banc d'essai de tuyaux en boucle fabriqué à l'aide de tuyaux en fonte sans revêtement vieux de 90 à 100 ans récupérés d'un réseau de distribution d'eau de Boston ont démontré qu'une réduction de l'alcalinité de 30-35 mg/L à 10-15 mg/L de carbonate de calcium à un pH constant provoquait une augmentation immédiate de 50 à 250 % de la libération du fer dans l'eau. En augmentant l'alcalinité de l'eau de 30-35 mg/L à 58-60 mg/L de carbonate de calcium et en la ramenant ensuite à 30-35 mg/L, on a aussi démontré que l'augmentation de l'alcalinité réduisait la libération de fer, mais que le changement n'était pas aussi important que ceux observés dans la plage inférieure des valeurs de l'alcalinité (Sarin et coll., 2003). On a par ailleurs réalisé dans la ville de Topeka (Kansas) une analyse des paramètres de la qualité de l'eau traitée (pH, alcalinité, dureté, température et teneurs en chlorures et en sulfates) et des plaintes des consommateurs ayant trait à l'eau rouge (Horsley et coll., 1998). Les données analysées correspondaient à la période 1989-1998. La plupart des problèmes d'eau rouge étaient liés à l'utilisation de tuyaux en fonte sans revêtement âgés de 50 à 70 ans. De 1989 à 1998, le pH annuel moyen de l'eau distribuée a varié entre 9,1 et 9,7; son alcalinité a varié de 47 à 76 mg/L de carbonate de calcium, et sa dureté totale a varié de 118 à 158 mg/L de carbonate de calcium. Les chercheurs ont conclu que le rapport entre l'alcalinité de l'eau et sa coloration rouge était le plus net et le plus utile, et qu'on pouvait réduire de façon importante le nombre de plaintes des consommateurs en maintenant l'alcalinité de l'eau prête au débit à un niveau supérieur à 60 mg/L de carbonate de calcium.
L'alcalinité est un des principaux paramètres influant sur la détérioration de la qualité de l'eau due aux matériaux à base de ciment. Lorsque de l'eau faiblement tamponnée entre en contact avec du ciment, les substances alcalines solubles du ciment passent rapidement dans l'eau potable. Conroy et coll. (1994) ont observé que l'alcalinité jouait un rôle important dans la détérioration de la qualité de l'eau prélevée dans les culs-de-sac de conduites maîtresses à revêtement de mortier in situ où le débit d'eau est faible. Lorsque l'alcalinité se maintient aux alentours de 10 mg/L de carbonate de calcium, les valeurs du pH restent au-dessus de 9,5 pendant une période pouvant aller jusqu'à deux ans et les concentrations d'aluminium demeurent supérieures à 0,2 mg/L pendant un mois ou deux après l'installation du revêtement. Par contre, lorsque l'alcalinité atteint environ 35 mg/L de carbonate de calcium, les problèmes de qualité de l'eau se limitent à une hausse du pH à un niveau supérieur à 9,5 pendant un mois ou deux après l'installation du revêtement. Lorsque l'alcalinité est supérieure à 55 mg/L de carbonate de calcium, on ne relève aucun problème de qualité de l'eau.
Il n'existe pas de rapport simple entre la température et les processus de corrosion. puisque la température influe sur plusieurs paramètres de la qualité de l'eau, comme la solubilité de l'oxygène dissous, la viscosité, les taux de diffusion, les coefficients d'activité, l'enthalpie des réactions, la solubilité des composés, les taux d'oxydation et l'activité biologique (McNeill et Edwards, 2002).
Ces paramètres influent à leur tour sur le taux de corrosion, les propriétés des incrustations formées et le relargage des substances dans les réseaux de distribution. On s'attend à ce que le taux de corrosion du plomb, du cuivre et du fer augmente en fonction de la température. Toutefois, la solubilité de plusieurs sous-produits de la corrosion diminue à mesure que la température augmente (Schock, 1990a; Edwards et coll., 1996; McNeill et Edwards, 2001, 2002).
On a établi une corrélation entre les variations saisonnières (été-hiver) de la température et les concentrations de plomb dans l'eau, ces dernières étant plus élevées en été (Britton et Richards, 1981; Karalekas et coll., 1983; Colling et coll., 1987, 1992; Douglas et coll., 2004). De 1999 à 2003, la Ville d'Ottawa a examiné un certain nombre d'options de contrôle de la corrosion pour son réseau de distribution d'eau potable (Douglas et coll., 2004). Les chercheurs ont fait état d'une importante variation saisonnière des concentrations de plomb, les valeurs les plus élevées s'observant de mai à novembre.
De même, dans une étude portant sur la concentration de sous-produits de la corrosion du cuivre dans l'eau potable de tours d'habitation et de maisons unifamiliales du district régional de Vancouver, Singh et Mavinic (1991) ont observé que les concentrations de cuivre mesurées au robinet d'eau froide n'atteignaient généralement que le tiers de celles mesurées au robinet d'eau chaude. On a comparé en laboratoire la teneur en cuivre d'une eau douce et de faible alcalinité à des températures de 4, 20, 24 et 60 °C. L'eau à 60 °C contenait plus de cuivre, mais la différence observée entre 4 et 24 °C était minime (Boulay et Edwards, 2001). On a toutefois indiqué que la solubilité de l'hydroxyde de cuivre diminuait à mesure que la température augmentait (Edwards et coll., 1996; Hidmi et Edwards, 1999).
Une étude réalisée auprès de 365 services publics visés par la LCR de la U.S. EPA n'a laissé constater aucune tendance significative entre la température et les concentrations mesurées de plomb et de cuivre (Dodrill et Edwards, 1995).
Horsley et coll. (1998) ont analysé le nombre de plaintes relatives à l'eau rouge en fonction de la température de l'eau. Ils n'ont observé aucune corrélation directe entre la température et le nombre de plaintes enregistrées, mais ils ont constaté que ce nombre était plus élevé en été. Par ailleurs, une corrélation très étroite a été relevée entre les taux de corrosion mesurés dans des réacteurs annulaires faits de tuyaux de fonte neufs et les variations saisonnières de la température (Volk et coll., 2000). Les taux de corrosion mesurés au début de l'étude (mars) s'établissaient à environ 2,5 millièmes de pouce par an [mpa] (0,064 mm par an) à une température inférieure à 13 °C. Ils ont commencé à augmenter en mai et ont enregistré leurs valeurs les plus élevées de juillet à septembre (5 à 7 mpa [0,13 à 0,18 mm par an] et > 20 °C).
On croyait par le passé que le calcium entravait la corrosion des métaux en formant à leur surface un film de carbonate de calcium (également appelé couche de passivation). Toutefois, de nombreux auteurs ont réfuté cette idée (Stumm, 1960; Nielsen, 1983; Lee et coll., 1989; Schock, 1989, 1990b; Leroy, 1993; Dodrill et Edwards, 1995; Lyons et coll., 1995; Neuman, 1995; Reda et Alhajji, 1996; Rezania et Anderl, 1997; Sorg et coll., 1999). Aucune étude publiée n'a réussi à démontrer, en utilisant des techniques d'analyse propres au composé, la formation d'une couche protectrice de carbonate de calcium dans les tuyaux de plomb, de cuivre ou de fer (Schock, 1989). Leroy (1993) a même démontré que dans certains cas, le calcium pouvait augmenter légèrement la solubilité du plomb. Enfin, des études réalisées auprès de sociétés et districts d'approvisionnement en eau aux États-Unis n'ont laissé constater aucun lien entre les concentrations de plomb ou de cuivre et les concentrations de calcium (Lee et coll., 1989; Dodrill et Edwards, 1995).
S'agissant du fer, de nombreux auteurs ont fait état de l'importance du calcium dans diverses situations, y compris la formation d'incrustations de carbonate de calcium ou de mélanges solides de carbonate de fer et de carbonate de calcium, et la formation d'une couche de passivation sur les sites cathodiques (Larson et Skold, 1958; Stumm, 1960; Merill et Sanks, 1978; Benjamin et coll., 1996; Schock et Fox, 2001). Toutefois, le carbonate de calcium ne forme pas en soi d'incrustations protectrices sur les matériaux en fer (Benjamin et coll., 1996).
Le calcium constitue le principal composé chimique des matériaux en ciment. Les types primaires de ciment utilisés pour la distribution d'eau potable renferment de 38 à 65 % d'oxyde de calcium (Leroy et coll., 1996). Tant que l'état d'équilibre n'est pas atteint entre la teneur en calcium du ciment et celle de l'eau distribuée, on présume qu'il y aura relargage du ciment dans l'eau, ou précipitation du calcium de l'eau dans les pores du ciment, selon le potentiel de précipitation du carbonate de calcium présent dans l'eau.
L'acide hypochloreux est un agent oxydant fort utilisé pour la désinfection de l'eau potable; il s'agit de la forme prédominante de chlore libre à un pH inférieur à 7,5. Les espèces de chlore libre (acide hypochloreux et ion hypochlorite) peuvent également servir d'oxydants primaires du plomb et donc en augmenter la corrosion (Boffardi, 1988, 1990; Schock et coll., 1996; Lin et coll., 1997). Toutefois, une étude des effets du chlore sur la corrosion réalisée sur un banc d'essai de tuyaux en boucle a démontré que l'ajout de chlore libre (0,2 mg/L) n'augmentait pas les concentrations de plomb (Cantor et coll., 2003). Une étude réalisée auprès de 94 sociétés et districts d'approvisionnement en eau aux États-Unis n'a pas non plus décelé de lien entre les concentrations de plomb et les concentrations résiduelles de chlore libre (entre 0 et 0,5 mg/L) (Lee et coll., 1989).
La présence de dépôts importants de dioxyde de plomb dans les incrustations de corrosion a été signalée pour la première fois par Schock et coll. (1996) dans les tuyaux de différents réseaux de distribution d'eau potable. Les chercheurs ont formulé des suggestions concernant les conditions chimiques qui favoriseraient les dépôts de plomb tétravalent ainsi que les modifications des conditions de traitement (notamment de la désinfection) qui pourraient rendre les incrustations de plomb tétravalent plus vulnérables à une déstabilisation. Schock et coll. (2001) ont trouvé dans les tuyaux en plomb du réseau de distribution de Cincinnati (Ohio) des dépôts dont la phase solide protectrice principale était constituée de dioxyde de plomb. À la suite de ces résultats, ils ont également examiné diverses caractéristiques de la solubilité du dioxyde de plomb en chimie théorique, notamment son association avec une concentration résiduelle de chlore libre et la faible demande en oxydants.
À la suite de la découverte de concentrations élevées de plomb après la conversion de sections du réseau de distribution d'eau de Washington (DC) à la chloramination, Renner (2004) a décrit le lien entre le changement de désinfectant et les résultats de la recherche antérieure de la U.S. EPA sur la formation d'incrustations de plomb tétravalent (Schock et coll., 2001). Schock et Giani (2004) ont décrit les résultats des activités de surveillance de la qualité de l'eau du robinet et des analyses des incrustations du réseau de distribution de la Water and Sewer Authority de Washington (DC), confirmant que le dioxyde de plomb était le principal produit de départ et validant ainsi l'hypothèse selon laquelle la diminution du potentiel d'oxydo-réduction (POR) découlant du remplacement de fortes doses de chlore libre par la chloramination avait entraîné des taux élevés de dissolution du plomb. Les expériences effectuées en laboratoire par Edwards et Dudi (2004) et par Lytle et Schock (2005) ont confirmé que les dépôts de dioxyde de plomb pouvaient se former facilement et être par la suite déstabilisés en quelques semaines ou en quelques mois dans des conditions réalistes de pH, de POR et d'alcalinité du réseau de distribution. Une étude réalisée récemment en laboratoire par Switzer et coll. (2006) a démontré que l'eau contenant du chlore libre oxydait le plomb pour donner des dépôts insolubles de dioxyde de plomb, et que le plomb était presque entièrement dissous dans une solution de chloramine. Les résultats de l'étude confirment l'hypothèse selon laquelle le remplacement du traitement au chlore libre par la chloramination peut provoquer la dissolution du plomb.
Lorsqu'on ajoute de l'acide hypochloreux dans un approvisionnement en eau, il devient l'oxydant dominant des surfaces en cuivre (Atlas et coll., 1982; Reiber, 1987, 1989; Hong et Macauley, 1998). On a démontré qu'une concentration résiduelle de chlore libre favorisait la corrosion du cuivre à un pH peu élevé (Atlas et coll., 1982; Reiber, 1989). Par contre, il réduisait le taux de corrosion du cuivre à un pH de 9,3 (Edwards et Ferguson, 1993; Edwards et coll., 1999). Toutefois, Schock et coll. (1995) ont conclu que les espèces de chlore libre influeront sur la solubilité à l'équilibre du cuivre en stabilisant les phases solides de cuivre(II), ce qui entraînera une libération beaucoup plus importante du cuivre. Les auteurs n'ont observé aucun effet direct du chlore libre sur la solubilité du cuivre(II), si ce n'est le changement de valence et son effet indirect sur le potentiel de solubilité du cuivre.
Plusieurs auteurs ont fait état d'une augmentation du taux de corrosion du fer en présence de chlore libre (Pisigan et Singley, 1987; Cantor et coll., 2003). Toutefois, la consommation rapide du chlore libre résiduel par les sous-produits de la corrosion du fer est plus inquiétante pour la santé humaine (Frateur et coll., 1999). De plus, lorsque la corrosion du fer subit l'effet de micro-organismes, la présence d'une concentration plus élevée de chlore libre résiduel peut en fait réduire les problèmes de corrosion (LeChevallier et coll., 1993). Aucune information établissant une corrélation entre les concentrations de fer et la présence de chlore libre résiduel n'a été retrouvée dans la littérature scientifique.
La documentation scientifique consultée n'établit aucune corrélation non plus entre la présence de chlore libre résiduel et la dégradation des tuyaux en ciment.
Des rapports ont fait état de l'incidence des chloramines sur les concentrations de plomb dans les réseaux de distribution d'eau potable. Comme mentionné plus tôt, la Water and Sewer Authority de Washington (DC) a modifié en 2000 son traitement de désinfection pour se conformer au règlement sur les sous-produits de la désinfection (Disinfection Byproducts Rule) de l'U.S. EPA, et a choisi d'utiliser les chloramines au lieu du chlore pour la désinfection secondaire. Or, à la suite de ce changement, on a détecté dans plus de 1 000 foyers de Washington des concentrations de plomb supérieures au niveau d'intervention de 0,015 mg/L prescrit par l'U.S. EPA, et mesuré dans plus de 157 foyers des concentrations de plomb supérieures à 300 µg/L dans l'eau du robinet (Renner, 2004; U.S. EPA, 2007). Comme le chlore est un oxydant puissant, les incrustations d'oxyde de plomb qui s'étaient formées dans les tuyaux au fil des années étaient parvenues à un état d'équilibre dynamique dans le réseau de distribution. Le passage du chlore aux chloramines a réduit le potentiel d'oxydation de l'eau distribuée et déstabilisé les incrustations d'oxyde de plomb, augmentant ainsi le relargage du plomb (Schock et Giani, 2004; Lytle et Schock, 2005). Les travaux de Edwards et Dudi (2004) ont également montré que les chloramines ne formaient pas de solides de faible solubilité sur les surfaces de plomb, d'où une probabilité accrue de relargage du plomb dans l'eau potable. Le POR de l'eau traitée par chloramination favorise la formation de solides du plomb bivalent. En règle générale, la solubilité et la libération du plomb dépendent du pH, de l'alcalinité et de la concentration d'inhibiteurs de la corrosion (orthophosphates) (Schock et coll., 2005b). Il ressort des modèles thermodynamiques que le dioxyde de plomb est relativement insensible à la concentration d'orthophosphates et à l'alcalinité. Pour que les chloramines influent sur la libération du plomb liée au POR, il faut d'abord qu'il y ait formation et stabilisation de dioxyde de plomb. Une étude de Treweek et coll. (1985) indique également que, dans certaines conditions, l'eau chloraminée a un pouvoir de solubilisation plus grand que l'eau chlorée, même si la corrosion apparente du plomb est plus lente.
La documentation scientifique renseigne peu sur les effets des chloramines sur le cuivre ou sur le fer. Certains auteurs indiquent que les chloramines sont moins corrosives pour le fer que le chlore libre (Treweek et coll., 1985; Cantor et coll., 2003). Hoyt et coll. (1979) font par ailleurs état d'une hausse des plaintes concernant l'eau rouge à la suite du remplacement des chloramines par du chlore libre résiduel pour le traitement de l'eau.
Aucune information n'a été trouvée dans la documentation scientifique examinée sur l'existence d'un lien possible entre l'utilisation des chloramines et la dégradation des tuyaux en ciment.
Des études ont montré que les effets du chlorure sur la corrosion du plomb dans les réseaux de distribution d'eau potable étaient négligeables (Schock, 1990b). Le chlorure ne devrait pas non plus avoir d'effet appréciable sur la solubilité du plomb (Schock et coll., 1996). Toutefois, Oliphant (1993) a constaté que cette substance augmentait la corrosion galvanique des soudures à base de plomb dans les systèmes de plomberie en cuivre.
On a traditionnellement rapporté que le chlorure était corrosif pour le cuivre (Edwards et coll., 1994b). Toutefois, des chercheurs ont démontré que des concentrations élevées de chlorure (71 mg/L) réduisaient en fait le taux de corrosion du cuivre à un pH de 7 à 8 (Edwards et coll., 1994a, b, 1996; Broo et coll., 1997, 1999). Edwards et McNeill (2002) avancent que cette dichotomie peut s'expliquer si on prend en compte les effets à long terme au lieu des effets à court terme : le chlorure augmente le taux de corrosion du cuivre à court terme, mais les sousproduits de cette corrosion protègent la surface de cuivre à plus long terme.
Des études ont démontré que les effets du sulfate sur la corrosion du plomb dans l'eau potable sont généralement négligeables (Boffardi, 1988; Schock, 1990b; Schock et coll., 1996). Le sulfate réduirait en fait la corrosion galvanique des soudures à base de plomb (Oliphant, 1993). En effet, il modifie la forme physique du produit normal de la corrosion, qui se transforme en plaques cristallines plus protectrices.
Le sulfate est un puissant catalyseur de la corrosion qui participe à la piqûration du cuivre (Schock, 1990b; Edwards et coll., 1994b; Ferguson et coll., 1996; Berghult et coll., 1999). On a montré qu'il réduisait les concentrations de cuivre dans les matériaux de cuivre neufs. Toutefois, lorsque ces matériaux vieillissent, des concentrations élevées de sulfate font augmenter les concentrations de cuivre dans l'eau (Edwards et coll., 2002). Les auteurs ont conclu que ce phénomène était dû à la propriété du sulfate de prévenir la formation d'incrustations de malachite et de ténorite plus stables et moins solubles. Toutefois, Schock et coll. (1995) signalent que les complexes de sulfate aqueux n'auront vraisemblablement pas d'effet significatif sur la solubilité du cuivre dans l'eau potable.
Une étude des concentrations de plomb signalées par 365 services publics à la suite de la mise en application de la LCR de la U.S. EPA a révélé que des ratios chlorure/sulfate plus élevés entraînaient des valeurs plus élevées des concentrations de plomb dans l'eau du robinet au 90e centile. Cette étude a montré que 100 % des services publics qui fournissent une eau potable dont le ratio chlorure/sulfate est inférieur à 0,58 satisfont au niveau d'intervention de 0,015 mg/L prescrit par la U.S. EPA pour le plomb. Toutefois, seuls 36 % des services publics fournissant une eau dont le ratio chlorure/sulfate est supérieur à 0,58 satisfont à ce critère (Edwards et coll., 1999). Dudi et Edwards (2004) démontrent également d'une manière concluante que des ratios chlorure/sulfate plus élevés augmentent le relargage du plomb à partir du laiton à cause des connexions galvaniques. On a constaté que les concentrations élevées de plomb dans l'eau potable de Durham (Caroline du Nord) étaient la cause principale des concentrations élevées de plomb mesurées dans le sang d'un enfant. On avait au départ lié ce phénomène au remplacement du chlore par de la chloramine pour la désinfection secondaire de l'eau. Toutefois, des études plus approfondies ont permis de déterminer qu'un changement concurrent du coagulant (remplacement du sulfate d'aluminium par du chlorure ferrique) avait augmenté le ratio chlorure/sulfate, entraînant ainsi le relargage du plomb à partir de la plomberie (Renner, 2006; Edwards et Triantafyllidou, 2007).
Un examen de la documentation scientifique n'a permis d'établir aucun rapport clair entre les teneurs en chlorure ou en sulfate et la corrosion du fer. Les études de Larson et Skold (1958) ont démontré que le ratio de la somme du chlorure et du sulfate sur le bicarbonate (plus tard appelé l'indice de Larson) jouait un rôle important (un ratio élevé indiquant une eau plus corrosive). D'autres chercheurs ont signalé que le chlorure (Hedberg et Johansson, 1987; Velveva, 1998) et le sulfate (Velveva, 1998) favorisaient la corrosion du fer. L'exposition en laboratoire de sections de tuyaux de fonte de 90 ans à de l'eau contenant 100 mg de chlorure par litre a provoqué une augmentation immédiate des concentrations de fer dans l'eau (de 1,8 à 2,5 mg/L). Par contre, on a constaté que le sulfate inhibait la dissolution des oxydes de fer et réduisait ainsi les concentrations de fer dans l'eau (Bondietti et coll., 1993). La présence de sulfate ou de chlorure conduit par ailleurs à la formation d'incrustations protectrices (Feigenbaum et coll., 1978; Lytle et coll., 2003). Toutefois, ni le sulfate ni le chlorure ne semblent avoir d'effet sur la corrosion du fer (Van Der Merwe, 1988).
Des concentrations élevées de sulfate peuvent dans certains cas provoquer une dégradation rapide des matériaux à base de ciment. Il est possible que le sulfate réagisse avec les aluminates de calcium présents dans le ciment hydraté, produisant ainsi des sulfoaluminates de calcium fortement hydratés. Ces composés ont un volume beaucoup plus grand que les aluminates initiaux, ce qui peut provoquer l'apparition de fissures et réduire la résistance mécanique des matériaux. Cet effet du sulfate pourrait être atténué en présence de concentrations élevées de chlorure (Leroy et coll., 1996).
Il semble que la matière organique naturelle (MON) ait pour effet d'augmenter la solubilité du plomb. On a également démontré la formation de complexes de plomb dissous par des ligands organiques. Par contre, on a constaté que certaines matières organiques recouvraient la paroi intérieure des tuyaux et réduisaient ainsi la corrosion. Il n'est donc pas possible de formuler une prévision raisonnable des effets des diverses MON sur la solubilité du plomb (Schock, 1990b).
Des études portant sur la piqûration de la plomberie de cuivre ont donné à conclure que certaines MON pourraient réduire la tendance de l'eau à causer ce type de corrosion (Campbell, 1954a, b, 1971; Campbell et Turner, 1983; Edwards et coll., 1994a; Korshin et coll., 1996; Edwards et Sprague, 2001). Toutefois, les MON contiennent des groupes complexants puissants, et on a démontré qu'elles pouvaient augmenter la solubilité des produits de la corrosion du cuivre (Korshin et coll., 1996; Rehring et Edwards, 1996; Broo et coll., 1998, 1999; Berghult et coll., 1999, 2001; Edwards et coll., 1999; Boulay et Edwards, 2001; Edwards et Sprague, 2001). Néanmoins, on n'a pas démontré de façon concluante l'importance des MON dans la solubilité du cuivre par rapport à celle des ligands concurrents (Schock et coll., 1995; Ferguson et coll., 1996).
Plusieurs auteurs ont démontré que les MON diminuaient le taux de corrosion du fer (Larson, 1966; Sontheimer et coll., 1981; Broo et coll., 1999). Toutefois, des expériences réalisées par Broo et coll. (2001) ont révélé que les MON favorisaient la corrosion à un pH faible, mais la réduisaient à un pH élevé. Les chercheurs ont conclu que cet effet opposé était dû aux différents complexes qui se forment à la surface sous différentes conditions de pH. On a également constaté que les MON stimulaient la formation d'incrustations protectrices (Campbell et Turner, 1983). Toutefois, elles ont la faculté de complexer les ions métalliques (Benjamin et coll., 1996), ce qui pourrait conduire à une augmentation des concentrations de fer dans l'eau.
La documentation scientifique examinée contenait peu d'information sur le lien entre les MON et la dégradation des tuyaux en ciment.
Comme nous l'avons indiqué plus haut, il n'existe pas de méthode de mesure simple et directe de la corrosion interne des réseaux de distribution d'eau potable. Au fil des ans, diverses méthodes ont été proposées pour évaluer indirectement cette corrosion. L'indice de Langelier a servi par le passé à déterminer la corrosivité de l'eau distribuée pour les métaux. Des méthodes utilisant des bancs d'essai de tuyaux et des coupons ont été mises au point pour comparer diverses méthodes de contrôle de la corrosion. Lorsque les effets de la corrosion sur la santé des consommateurs ont commencé à susciter des préoccupations (par ex. relargage de métaux dans les réseaux de distribution), mesurer la concentration des métaux dans l'eau du robinet est devenue la méthode la plus appropriée pour évaluer l'exposition des populations aux métaux et les résultats du contrôle de la corrosion.
Les indices de corrosion ne devraient pas être utilisés pour évaluer l'efficacité des programmes de contrôle de la corrosion puisqu'ils ne donnent qu'un aperçu de la tendance du carbonate de calcium à se dissoudre ou à précipiter. Ces indices ont servi historiquement à évaluer la corrosivité de l'eau distribuée pour les métaux et à contrôler la corrosion. Ils étaient fondés sur l'hypothèse selon laquelle la formation d'une mince couche de carbonate de calcium à la surface d'un tuyau métallique protégeait contre la corrosion. Un certain nombre de ratios semi-empiriques et empiriques comme l'indice de Langelier, l'indice de Ryzner, l'indice d'agressivité, l'excès momentané et le potentiel de précipitation du carbonate de calcium ont été élaborés pour évaluer l'équilibre carbonate-bicarbonate de calcium. Toutefois, un dépôt de carbonate de calcium ne forme pas un film protecteur adhérent à la surface du métal. Les travaux d'Edwards et coll. (1996) ont même démontré que, dans certaines conditions, l'utilisation des indices de corrosion pouvait conduire à la prise de mesures susceptibles d'augmenter la libération de sous-produits de la corrosion. À la lumière des preuves empiriques importantes qui viennent contredire l'existence présumée d'un lien entre la corrosion et le plus commun des indices de corrosion, l'indice de Langelier, l'American Water Works Association Research Foundation a recommandé de cesser d'utiliser les indices de corrosion à des fins de contrôle de la corrosion (Benjamin et coll., 1996).
Les coupons et les bancs d'essai de tuyaux constituent des outils utiles pour comparer les diverses techniques de contrôle de la corrosion avant de mettre en place des programmes de contrôle à l'échelle du réseau. Ils permettent de simuler efficacement les conditions des réseaux de distribution sans modifier l'intégrité de ceux-ci à l'échelle réelle. Toutefois, même lorsqu'on a recours à de longues périodes d'exposition des matériaux à l'eau des réseaux à l'étude, les coupons testés sur le terrain ou en laboratoire et les bancs d'essai de tuyaux ne fournissent pas une évaluation exacte de la corrosion qui peut survenir à plus grande échelle. Ces tests ne reflètent pas d'une manière fiable l'exposition des populations aux contaminants présents dans les réseaux de distribution, vu le nombre considérable de facteurs pouvant influer sur la concentration des contaminants dans l'eau du robinet.
Pour obtenir une approximation raisonnablement fiable des conditions réelles étudiées, il est primordial de porter la plus grande attention au choix des matériaux des essais. L'utilisation de matériaux neufs dans les simulateurs (par ex. bancs d'essai de tuyaux) doit convenir à l'étude du problème de corrosion en question. Ainsi, le recours à des tuyaux neufs en cuivre sera approprié si le réseau à l'étude approvisionne des bâtiments neufs qui utilisent ce type de tuyaux. Les robinets en laiton au plomb conviennent lorsque leur utilisation est autorisée par la réglementation en vigueur et qu'ils sont disponibles sur le marché. Par contre, l'utilisation de tuyaux en plomb neufs ne convient pas lorsqu'il s'agit de reproduire les conditions d'un réseau comportant de vieilles entrées de service en plomb ou des cols-de-cygne ou siphons dont l'intérieur est recouvert d'incrustations contenant ou non du plomb. En fait, la prédiction de la réaction de ces matériaux à divers traitements ou changements de la qualité de l'eau risque d'être erronée si le choix des matériaux utilisés pour la simulation n'est pas approprié. Même s'il n'existe aucune norme concernant la conception des simulateurs, diverses publications peuvent renseigner les chercheurs sur les concepts et les facteurs opérationnels à prendre en compte lorsqu'ils entreprennent ce type d'études (AwwaRF, 1990, 1994).
On utilise habituellement des coupons insérés dans les réseaux de distribution pour déterminer le taux de corrosion correspondant à un métal particulier. Ces coupons fournissent une bonne estimation du taux de corrosion ainsi que des informations visuelles sur la morphologie des incrustations. Il n'existe actuellement aucune norme universelle régissant la géométrie des coupons, les matériaux les composant ou les protocoles d'exposition dans les réseaux de distribution d'eau potable (Reiber et coll., 1996). Les coupons utilisés doivent être représentatifs des matériaux dont sont faits les tuyaux à l'étude. Ils sont généralement insérés dans le réseau de distribution pour une période de temps donnée, et le taux de corrosion est déterminé par une mesure de la perte de masse par unité de surface. La durée du test doit permettre la formation d'incrustations de corrosion, et peut donc varier de 3 à 24 mois selon le type de métal testé (Reiber et coll., 1996).
La piètre reproductibilité des résultats (haut degré de variation entre les mesures effectuées sur différents coupons) constitue le principal inconvénient de la méthode. Ce manque de précision est dû à la fois à la séquence complexe des procédures de manipulation, de préparation et de restauration de la surface, qui comporte un risque d'erreurs induites par l'analyse, et au haut degré de variabilité qui caractérise les propriétés métallurgiques ou les conditions chimiques de la surface du coupon pendant la période d'exposition (Reiber et coll., 1996).
Les bancs d'essai de tuyaux sont plus complexes que les coupons et peuvent être conçus de manière à reproduire diverses conditions de qualité de l'eau. Ils peuvent également servir à évaluer la corrosion des métaux en laboratoire. En plus de servir à mesurer la perte de masse par unité de surface, les techniques électrochimiques permettent de mesurer le taux de corrosion. Les bancs d'essai peuvent enfin simuler un réseau de distribution ou un système de plomberie et permettre ainsi de mesurer le relargage des contaminants en fonction de la stratégie de contrôle de la corrosion utilisée.
Les bancs d'essai de tuyaux, qui peuvent être faits de matériaux neufs ou de sections de tuyaux usagés, sont exposés à des conditions propices à la formation d'incrustations de corrosion ou de couches de passivation qui influeront à la fois sur le taux de corrosion et sur la libération du métal sous-jacent. La période de préparation doit permettre la formation d'incrustations de corrosion et peut donc durer de 3 à 24 mois selon le type de métal étudié. Étant donné cette variabilité, on recommande de prévoir au moins six mois pour la réalisation de ce type d'études (Eisnor et Gagnon, 2003).
Comme dans le cas des tests sur coupons, il n'existe actuellement aucune norme universelle régissant l'utilisation des bancs d'essai de tuyaux pour évaluer la corrosion dans les réseaux de distribution d'eau potable. Eisnor et Gagnon (2003) ont élaboré un cadre pour concevoir et utiliser des réseaux pilotes de distribution d'eau afin de combler cette lacune. Ce cadre définit huit facteurs importants à prendre en considération pour la conception des bancs d'essai de tuyaux : (1) catégorie de la section d'essai (installation permanente ou amovible), (2) matériau de la section d'essai, (3) diamètre de la section d'essai, (4) longueur de la section d'essai, (5) configuration de l'écoulement, (6) temps de rétention, (7) vitesse d'écoulement et (8) période de stagnation.
L'exposition des consommateurs à des contaminants provenant de la corrosion interne des réseaux d'eau potable peut provenir de la corrosion du réseau de distribution aussi bien que de la plomberie. La mesure des contaminants au robinet demeure le meilleur moyen de déterminer l'exposition de la population à ces contaminants. On peut également évaluer l'efficacité du programme de contrôle de la corrosion en mesurant les concentrations du contaminant étudié dans l'eau du robinet au fil du temps et en établissant une corrélation entre ces concentrations et les activités de contrôle de corrosion.
La U.S. EPA reconnaît et approuve les quatre méthodes suivantes pour mesurer les concentrations de plomb dans l'eau potable : 1) la méthode 200.8 (U.S. EPA, 1994b), 2) la méthode 200.9 (U.S. EPA, 1994b), 3) la méthode normalisée 3113B (APHA et coll., 2005) et 4) la méthode de l'American Society for Testing and Materials (ASTM) 3559-96D (ASTM, 1996). Une étude récente de Triantafyllidou et coll. (2007) a révélé que les particules de plomb peuvent ne pas être suffisamment dissoutes à des fins d'analyse si elles ne sont pas acidifiées pendant une période assez longue. Un délai d'attente d'au moins 16 heures après l'acidification est requis avant de pouvoir procéder à une analyse du plomb. De plus, une digestion thermique peut s'avérer nécessaire en présence de plomb particulaire.
L'absorption atomique est la méthode la plus communément utilisée pour mesurer les concentrations de plomb dans l'eau; ses limites de détection varient d'environ 0,0006 à 0,001 mg/L (0,6 à 1 µg/L). Le seuil pratique d'évaluation quantitative (SPEQ) de ces méthodes est fixée à 0,005 mg/L (U.S. EPA, 2000, 2006a).
Une méthode exclusive de voltamétrie impulsionnelle différentielle avec strippage anodique du cuivre, la méthode 1001 (aucune limite de détection indiquée) de la société Palintest Inc. du Kentucky (U.S. EPA, 2006a), est également approuvée pour l'analyse du plomb dans l'eau potable.
Dans le cadre du présent document, les concentrations de plomb dans l'eau du robinet constituent la seule mesure pour mettre en place ou optimiser un programme de contrôle de la corrosion. Des mesures de contrôle de la corrosion du cuivre et du fer sont cependant examinées dans ce qui suit, vu que la corrosion et les concentrations de ces métaux dépendent étroitement des méthodes de contrôle de la corrosion choisies.
La corrosion des réseaux d'eau potable et la libération de contaminants dans l'eau distribuée dépendent à la fois des matériaux exposés à la corrosion et de l'eau qui entre en contact avec ces derniers. La durée du contact de l'eau avec les matériaux a une incidence considérable sur les concentrations de métaux dans l'eau potable. En conséquence, la première méthode de réduction de l'exposition aux contaminants de l'eau potable consiste à purger la plomberie avant de consommer l'eau.
On peut également réduire la corrosivité de l'eau potable en ajustant son pH ou son alcalinité ou en y ajoutant des inhibiteurs de corrosion. Ces méthodes doivent cependant être utilisées avec prudence. Des études pilotes devraient être effectuées pour déterminer l'efficacité de la méthode de contrôle de la corrosion retenue, compte tenu des conditions particulières prévalant dans le réseau de distribution. Par ailleurs, une méthode permettant de réduire efficacement les concentrations de plomb, de cuivre ou de fer lors d'essais pilotes ne donnera pas nécessairement les mêmes résultats en conditions réelles. Il convient donc de procéder à une surveillance rigoureuse à l'échelle réelle avant, pendant et après la mise en oeuvre ou l'optimisation d'un programme de contrôle de la corrosion.
On peut également réduire l'exposition des consommateurs aux métaux lourds en utilisant, comme mesure provisoire, des dispositifs de traitement de l'eau potable certifiés.
Un choix judicieux des matériaux (contenant peu de plomb, comme les soudures sans plomb, les raccords et éléments de plomberie en ligne à faible teneur en plomb) constitue un des moyens possibles de réduire l'exposition des consommateurs aux contaminants inquiétants. Par exemple, l'utilisation de soudures sans plomb réduit la concentration de plomb dans l'eau potable causée par la corrosion des soudures. Depuis 1990, le CNP interdit l'utilisation des soudures au plomb dans les nouvelles installations ou les travaux de réparation des systèmes de plomberie destinés à l'approvisionnement en eau potable. Le CNP autorise toujours une concentration maximale de 0,2 % de plomb dans les soudures dites sans plomb (CNRC, 2005).
Le remplacement complet des entrées de service en plomb peut entraîner une réduction importante des concentrations de plomb dans l'eau du robinet des consommateurs. Le remplacement partiel de ces conduites (de la portion des services publics ou des consommateurs, par exemple) peut également réduire les concentrations de plomb, mais généralement de façon moins importante qu'un remplacement complet (U.S. EPA, 2004a). Par contre, qu'il soit complet ou partiel, le remplacement des entrées de service peut perturber ou déloger les incrustations de plomb existantes et entraîner une augmentation provisoire importante du plomb au robinet (U.S. EPA, 2004a; Renner, 2007). Cette augmentation peut durer trois mois ou plus. Le remplacement partiel peut également provoquer de la corrosion galvanique à l'endroit où la nouvelle tuyauterie en cuivre est rattachée à la tuyauterie restante en plomb. En règle générale, les services publics ne devraient ménager aucun effort pour encourager les consommateurs à remplacer leur portion des entrées de service. Les mesures de contrôle de la corrosion qui comprennent le remplacement partiel ou complet des entrées de service doivent prévoir une purge appropriée après le remplacement et un nettoyage des grilles ou des aérateurs des sorties d'eau afin d'en déloger les débris. On recommande fortement de consigner avec précision tout remplacement partiel aux fins de référence ultérieure (U.S. EPA, 2004a). La qualité de l'eau au robinet des consommateurs doit être étroitement surveillée à la suite d'un remplacement complet ou partiel, particulièrement pendant le premier mois suivant les travaux. Une purge appropriée doit être effectuée après le remplacement des entrées de service et lorsque des concentrations élevées de plomb sont observées. Il est également possible de réduire provisoirement l'exposition au plomb en utilisant des dispositifs de traitement de l'eau potable. Il importe cependant de signaler que dans les situations où le remplacement d'entrées de service peut entraîner des teneurs élevées en plomb, la capacité des dispositifs de traitement est susceptible de diminuer, et il est parfois nécessaire de remplacer ces dispositifs plus fréquemment.
Santé Canada recommande aux consommateurs et aux services d'eau d'utiliser, autant que possible, des produits certifiés conformes aux normes sanitaires appropriées de NSF et de l'ANSI (la norme NSF/ANSI 61 s'applique aux éléments des réseaux de distribution d'eau potable) (NSF International, 2007). Ces normes ont été conçues pour préserver la qualité de l'eau potable, en assurant l'innocuité et l'efficacité de tous les produits qui entrent en contact avec elle.
Dans une étude récente, Dudi et coll. (2004) ont utilisé le protocole d'essai de la section 8 de la norme NSF/ANSI 61 pour mesurer le relargage du plomb à partir d'éléments de plomberie en ligne comme des compteurs et des robinets d'arrêt. Cette étude a démontré que les éléments de plomberie exposés à de l'eau de robinet non corrosive relarguent moins de plomb que ceux exposés à l'eau de pH 5 utilisée par le protocole. Les éléments de plomberie ont relargué au minimum 4 fois moins de plomb que les robinets d'arrosage en laiton, et 3,5 fois moins que les tuyaux en plomb pur avec l'eau de pH 5. Ces résultats s'expliquent par le fait que l'eau de pH 5 du protocole contient de 20 à 100 fois plus de phosphate (un inhibiteur de la corrosion) que la quantité habituellement utilisée par les services publics pour contrôler le relargage du plomb dans l'eau potable. Les chercheurs ont conclu qu'il n'est pas certain que le protocole actuellement utilisé par la norme NSF/ANSI 61 pour mesurer le relargage du plomb à partir des éléments de plomberie en ligne reproduise adéquatement les conditions réelles d'exposition, en particulier à long terme.
En réponse aux questions soulevées par l'étude de Dudi et coll. (2004), des clarifications sont actuellement ajoutées au protocole de la norme NSF/ANSI 61, pour indiquer que ce protocole vise à évaluer les risques de relargage d'un groupe de métaux, dont le plomb. Ce protocole d'essai utilise deux valeurs de pH (5 et 10) pour prendre en compte la gamme des métaux à tester : les normes prescrites doivent être respectées aux deux valeurs du pH pour qu'un dispositif ou un élément puisse être certifié en vertu de cette norme. Dans le cas du plomb, un pH de 10 est considéré comme étant agressif.
L'ajustement du pH à l'usine de traitement de l'eau est la méthode la plus communément employée pour réduire la corrosion et le relargage des contaminants dans les réseaux de distribution d'eau potable. L'augmentation du pH demeure une des méthodes les plus efficaces pour réduire la corrosion du plomb et du cuivre et limiter les concentrations de plomb, de cuivre et de fer dans l'eau potable. L'expérience a montré que le pH optimal pour le plomb et le cuivre se situe entre 7,5 et 9,5. Les valeurs les plus élevées de cette plage peuvent permettre de réduire les concentrations en fer, mais elles pourraient également favoriser la corrosion de ce métal et la formation de tubercules. Même si on a eu tendance par le passé à recommander d'augmenter l'alcalinité de l'eau pour lutter contre la corrosion, il n'est pas certain que cette méthode soit la meilleure pour réduire les concentrations de plomb et de cuivre dans l'eau potable. La documentation scientifique semble indiquer que l'alcalinité optimale pour limiter le relargage du plomb et du cuivre se situe entre 30 et 75 mg/L de carbonate de calcium. Une alcalinité plus élevée (> 60 mg/L de carbonate de calcium) est également préférable pour réduire la corrosion et le relargage du fer et limiter les problèmes d'eau rouge. De plus, l'alcalinité sert à réguler l'intensité du pouvoir tampon de la plupart des réseaux de distribution d'eau et il est donc nécessaire de maintenir une alcalinité suffisante pour assurer la stabilité du pH dans l'ensemble du réseau de distribution afin de contrôler la corrosion du plomb, du cuivre et du fer et stabiliser les revêtements et tuyaux à base de ciment.
Il existe deux principaux types d'inhibiteurs de la corrosion pour le traitement de l'eau potable : les composés à base de phosphate et ceux à base de silicate. Les produits les plus communément utilisés sont des orthophosphates, des polyphosphates (généralement, des polyphosphates mélangés) et le silicate de sodium, tous disponibles avec ou sans zinc.
L'utilisation des inhibiteurs de corrosion est un processus par essais successifs et son efficacité dépend à la fois de la qualité de l'eau et des conditions qui caractérisent le réseau de distribution. L'efficacité dépend aussi largement du maintien d'une concentration résiduelle de ces produits dans l'ensemble du réseau de distribution, ainsi que du pH et de l'alcalinité de l'eau.
La mesure de la concentration d'inhibiteurs présents dans le réseau de distribution fait partie des bonnes pratiques de contrôle de la corrosion. D'une manière générale, il est impossible d'établir une corrélation directe entre la concentration résiduelle d'inhibiteurs présente dans le réseau de distribution et les concentrations de plomb, de cuivre ou de fer dans l'eau du robinet.
Santé Canada recommande aux consommateurs et aux services d'eau d'utiliser dans la mesure du possible des additifs, tels que les inhibiteurs de corrosion, certifiés comme étant conformes à la norme de santé NSF/ANSI appropriée ou à une norme équivalente. Les inhibiteurs à base de phosphate et de silicate sont inclus dans la norme NSF/ANSI 60 intitulée Drinking Water Treatment Chemicals - Health Effects (NSF International, 2005). Ces normes ont été conçues pour préserver la qualité de l'eau potable en garantissant que les additifs respectent les exigences minimales quant à leurs effets sur la santé et que leur présence dans l'eau potable ne pose pas de danger pour la santé des consommateurs.
Récemment, l'utilisation du chlorure d'étain en guise d'inhibiteur de la corrosion dans les réseaux de distribution d'eau potable a été ajoutée à la norme NSF/ANSI 60. Toutefois, il n'existe encore que très peu de données expérimentales sur ce produit. Sous certaines conditions, cet inhibiteur réagit avec le métal à la surface du tuyau ou avec les sous-produits de la corrosion déjà présents pour former un dépôt moins soluble sur la paroi interne des tuyaux. Cette réduction de la solubilité des dépôts conduit à une diminution de la concentration des métaux dans l'eau du robinet.
L'orthophosphate et l'orthophosphate de zinc sont les inhibiteurs dont on signale le plus souvent l'efficacité dans la documentation scientifique pour la réduction des concentrations de plomb et de cuivre dans l'eau potable (Bancroft, 1988; Reiber, 1989; Boffardi, 1993; Johnson et coll., 1993; Dodrill et Edwards, 1995; Rezania et Anderl, 1995, 1997; Schock et coll., 1995; Boireau et coll., 1997; MacQuarrie et coll., 1997; Churchill et coll., 2000; Schock et Fox, 2001; Becker, 2002; Dudi et Edwards, 2004; Kirmeyer et coll., 2004). Selon certains auteurs, l'utilisation de l'orthophosphate entraînerait à court terme une réduction des concentrations de cuivre, mais à plus long terme, elle préviendrait la formation d'incrustations plus stables comme la malachite et la ténorite (Schock et Clement, 1998; Edwards et coll., 2001; Cantor et coll., 2003). Il semble par ailleurs qu'un traitement au phosphate d'abord jugé inefficace pour la réduction de la corrosion du plomb et du cuivre ait donné de bons résultats après une augmentation des concentrations de phosphate utilisées ou après une optimisation du pH et des concentrations d'orthophosphate (Schock et coll., 1996; Schock et Fox, 2001). Schock et Fox (2001) ont obtenu une réduction concluante de la corrosion du cuivre dans de l'eau très alcaline en utilisant de l'orthophosphate dans des conditions où les ajustements du pH et de l'alcalinité ne donnaient pas de bons résultats. Les teneurs résiduelles typiques d'orthophosphate varient entre 0,5 et 3,0 mg/L (équivalent d'acide phosphorique) (Vik et coll., 1996).
Les modèles de solubilité du plomb et du cuivre indiquent que le pH optimal pour la formation d'un film d'orthophosphate se situe entre 6,5 et 7,5 sur les surfaces de cuivre (Schock et coll., 1995) et entre 7 et 8 sur les surfaces de plomb (Schock, 1989). Une étude portant sur 365 services publics visés par la LCR d e la U.S. EPA a également révélé que les services utilisant de l'orthophosphate avaient des concentrations de cuivre sensiblement réduites seulement lorsque le pH était inférieur à 7,8, et des concentrations réduites de plomb seulement lorsque le pH était inférieur à 7,4 et l'alcalinité inférieure à 74 mg/L de carbonate de calcium (Dodrill et Edwards, 1995).
Plusieurs auteurs ont signalé que l'orthophosphate réduisait les concentrations de fer (Benjamin et coll., 1996; Lytle et Snoeyink, 2002; Sarin et coll., 2003), les taux de corrosion du fer (Benjamin et coll., 1996; Cordonnier, 1997) et la fréquence des épisodes d'eau rouge (Shull, 1980; Cordonnier, 1997). Les inhibiteurs à base de phosphate, en particulier l'orthophosphate, peuvent également réduire les populations de bactéries hétérotrophes évaluées par numération sur plaque ainsi que le nombre de coliformes dans les réseaux de distribution en fonte en réduisant la corrosion. Dans le cadre d'une étude de 18 mois réalisée sur 31 réseaux de distribution d'eau en Amérique du Nord, on a observé que les réseaux de distribution utilisant des inhibiteurs à base de phosphate contenaient moins de coliformes que ceux qui n'utilisaient aucune méthode de contrôle de la corrosion (LeChevallier et coll., 1996). De même, l'ajout d'orthophosphate à raison de 1 mg/L dans un réacteur de fonte très corrodé a immédiatement réduit la libération d'oxyde de fer et le nombre de bactéries présentes dans l'eau du réacteur (Appenzeller et coll., 2001).
Les sels de zinc (chlorure, sulfate et orthophosphate) protègent efficacement les tuyaux en amiante-ciment lorsque les concentrations et la plage de pH appropriées sont maintenues dans l'ensemble du réseau de distribution (Leroy et coll., 1996). Le zinc recouvre la paroi intérieure des tuyaux et empêche ainsi la libération de fibres et l'attaque de l'eau. On suppose que le zinc réagit dans un premier temps avec l'eau pour former un précipité d'hydroxycarbonate de zinc comme l'hydrozincite [Zn5(CO3)2(OH)6]. Le solide de zinc peut ensuite réagir avec la surface du tuyau. Une étude réalisée sur les tuyaux en plomb et les tuyaux en amiante-ciment d'un circuit de recirculation a montré que l'orthophosphate contenant du zinc inhibait la corrosion dans ces deux types de tuyaux à un pH de 8,2 (Leroy et coll., 1996).
Plusieurs auteurs ont indiqué que l'utilisation du polyphosphate pouvait prévenir la corrosion du fer et réduire les concentrations de fer dans l'eau (McCauley, 1960; Williams, 1990; Facey et Smith, 1995; Cordonnier, 1997; Maddison et Gagnon, 1999). Toutefois, le polyphosphate n'agit pas comme un inhibiteur de la corrosion du fer mais plutôt comme un agent séquestrant, réduisant ainsi la coloration rouge de l'eau (Lytle et Snoeyink, 2002). Selon McNeill et Edwards (2001), un tel effet a conduit de nombreux chercheurs à conclure à une réduction des concentrations de sous-produits du fer alors qu'en fait, les concentrations de fer et les taux de corrosion du fer pourraient avoir augmenté.
Certaines études ont conclu à l'utilité du polyphosphate pour réduire les concentrations de plomb dans l'eau (Boffardi, 1988, 1990, 1993; Lee et coll., 1989; Hulsmann, 1990; Boffardi et Sherbondy, 1991). Par contre, d'autres ont conclu qu'il était inefficace et pouvait même dans certains cas aggraver le problème du plomb (Holm et coll., 1989; Schock, 1989; Holm et Schock, 1991; Maas et coll., 1991; Boireau et coll., 1997; Cantor et coll., 2000; Edwards et McNeill, 2002). McNeill et Edwards (2002) ont montré que le polyphosphate pouvait conduire à une augmentation importante de la concentration de plomb dans des tuyaux de trois ans après une période de stagnation de 8 et de 72 heures. Ils ont mesuré des augmentations des concentrations de plomb atteignant jusqu'à 591 %, comparativement à celles mesurées dans les mêmes conditions sans inhibiteur. Ils ont donc déconseillé l'utilisation du polyphosphate pour le contrôle de la corrosion du plomb. Les données concernant l'incidence du polyphosphate sur la solubilité du cuivre sont limitées. Une étude de cas réalisée dans trois services d'eau (Cantor et coll., 2000) indique que l'utilisation du polyphosphate augmente la concentration de cuivre dans l'eau du robinet. Une autre étude réalisée sur banc d'essai de tuyaux de cuivre (Edwards et coll., 2002) montre par ailleurs que même si le polyphosphate réduit généralement les concentrations de cuivre soluble, les concentrations de cuivre augmentent de façon importante à un pH de 7,2 et à une alcalinité de 300 mg/L de carbonate de calcium, puisque le polyphosphate nuit à la formation d'incrustations de malachite plus stables.
Les données disponibles concernant l'effet du silicate de sodium sur la solubilité du plomb et du cuivre sont limitées. Comme il s'agit d'un composé basique, sa présence est toujours associée à une augmentation du pH, et il est donc difficile de mesurer l'effet qu'il produit à lui seul en matière de réduction des concentrations de plomb et de cuivre puisque l'augmentation du pH pourrait donner le même résultat.
Une étude de Schock et coll. (2005a) portant sur un service public de taille moyenne a permis de résoudre simultanément un problème de fer dans la source d'approvisionnement en eau ainsi qu'un problème de relargage du plomb et du cuivre dans le système de plomberie grâce à l'ajout de silicate de sodium et à la chloration. Le silicate de sodium a été ajouté dans les trois puits qui présentaient des concentrations élevées de fer et de manganèse et qui approvisionnaient des habitations équipées d'entrées de service en plomb. Un quatrième puits n'avait besoin que d'une chloration et d'un ajustement du pH à l'aide d'hydroxyde de sodium. Dans les trois premiers puits, une dose initiale de silicate de 25 à 30 mg/L a causé l'augmentation du pH de 6,3 à 7,5 et entraîné une réduction immédiate de 55 et de 87 % des concentrations de plomb et de cuivre, respectivement. L'augmentation de la dose de silicate à 45-55 mg/L a fait monter le pH à 7,5 et donné une nouvelle réduction des concentrations de plomb et de cuivre (0,002 mg/L et 0,27 mg/L, respectivement). Il convient aussi de noter que la qualité de l'eau traitée sur le plan de la couleur et de la teneur en fer était égale ou supérieure à celle mesurée avant le traitement. Toutefois, selon la littérature scientifique, l'utilisation du silicate de sodium ne réduit pas à elle seule de manière concluante les concentrations de plomb et de cuivre.
Entre 1920 et 1960, plusieurs auteurs ont indiqué que l'utilisation de silicate de sodium permettait de réduire les épisodes de coloration rouge de l'eau (Tresh, 1922; Texter, 1923; Stericker, 1938, 1945; Loschiavo, 1948; Lehrman et Shuldener, 1951; Shuldener et Sussman, 1960). Toutefois, dans une étude réalisée sur le terrain dans la ville de Laval (Québec) au cours de l'été 1997, l'utilisation de faibles concentrations de silicate de sodium (4 à 8 mg/L; pH de 7,5 à 8,8) pour réduire les concentrations de fer dans de vieux tuyaux de fonte ou de fonte ductile n'a eu aucun effet bénéfique. L'emploi d'une caméra insérée dans un tuyau de fonte 1) avant l'injection du silicate de sodium, 2) avant l'injection du silicate de sodium, mais immédiatement après l'élimination mécanique des tubercules et 3) après 5 mois de traitement au silicate de sodium a permis de conclure que le silicate de sodium ne permettait pas de réduire la formation de tubercules ni d'en prévenir la formation aux concentrations testées (Benard, 1998). Même si peu d'études ont prouvé l'efficacité du silicate de sodium dans l'inhibition de la corrosion ou réussi à en élucider le véritable mode d'action, les fabricants recommandent d'injecter d'emblée une forte dose de silicate de sodium pour former une couche de passivation sur la paroi des tuyaux. Ils recommandent d'utiliser au départ des concentrations de 20 à 30 mg/L et de réduire ensuite ces concentrations à une plage de 4 à 10 mg/L pour maintenir la couche protectrice dans les tuyaux (Katsanis et coll., 1986).
Les expériences qui ont porté sur les effets de concentrations élevées de silice à différentes valeurs de pH ont révélé qu'à un pH de 8, cette substance pouvait jouer un rôle dans le processus de stabilisation de la matrice de ciment des tuyaux, en intervenant dans la formation de couches protectrices de fer ferrique qui ralentissent le relargage du calcium (Holtschulte et Schock, 1985).
Comme les concentrations des métaux-traces augmentent avec la stagnation de l'eau, la purge de la plomberie peut réduire de façon importante les concentrations de plomb et de cuivre dans l'eau potable. Cette pratique peut être assimilée à une mesure de contrôle de l'exposition. Gardels et Sorg (1989) ont démontré que 60 à 75 % du plomb relargué des robinets de cuisine se trouvait dans les 125 premiers millilitres recueillis au robinet. Ils ont en outre conclu qu'en laissant couler 200 à 250 mL d'eau, on évacuait 95 % ou plus du plomb relargué dans l'eau (en supposant l'absence d'autres sources de plomb en amont du robinet). Dans une étude sur la contamination de l'eau potable par les soudures au plomb, Wong et Berrang (1976) ont conclu que les deux premiers litres d'eau des robinets d'eau froide ne devraient pas servir à la consommation humaine si l'eau a reposé dans les tuyaux pendant une journée. Dans des études canadiennes au cours desquelles les robinets d'eau froide étaient purgés pendant 5 minutes, aucune des concentrations mesurées des métaux-traces ne dépassait les recommandations correspondantes pour la qualité de l'eau potable à ce moment (Méranger et coll., 1981; Singh et Mavinic, 1991). Toutefois, la purge des robinets d'eau froide dans les immeubles risque de ne pas suffire pour abaisser les teneurs de l'eau en plomb et en cuivre sous les seuils prescrits (Singh et Mavinic, 1991; Murphy, 1993). Murphy (1993) a démontré que la concentration moyenne de plomb contenue dans des échantillons prélevés aux fontaines et aux robinets d'eau potable dans des écoles avait augmenté sensiblement à l'heure du dîner après une purge de 10 minutes le matin. Les auteurs en ont conclu à la nécessité de procéder à des purges périodiques durant la journée afin de réduire les concentrations de plomb.
Lorsque le plomb relargué dans l'eau provient des entrées de service en plomb, il ne suffit pas de laisser couler l'eau jusqu'à ce qu'elle devienne froide, puisque c'est généralement à ce point que l'eau qui reposait dans l'entrée de service atteint le robinet. L'établissement du profil des concentrations de plomb pour des sites représentatifs, en procédant à l'échantillonnage séquentiel de plusieurs litres, peut donner des renseignements utiles sur le relargage du plomb. Il peut également permettre de déterminer si la purge suffira à elle seule à réduire les concentrations de plomb, ainsi que la durée de purge requise.
Comme il a été mentionné précédemment, en 2000, les services publics de Washington (DC) ont cessé d'utiliser le chlore comme désinfectant résiduel du réseau de distribution pour adopter les chloramines. Ce changement a provoqué le relargage de quantités considérables de plomb, principalement à partir des entrées de service. Les données recueillies pendant cet épisode de corrosion ont révélé que dans certains foyers, les concentrations les plus élevées de plomb ne s'observaient pas dans les échantillons de premier jet prélevés, mais parfois après une minute de purge (Edwards et Dudi, 2004). Certains échantillons recueillis après une purge contenaient jusqu'à 48 mg/L de plomb. Dans certains cas, les concentrations restaient supérieures aux niveaux prescrits même après 10 minutes de purge. Les services de distribution d'eau ont finalement décidé de conseiller aux consommateurs de laisser couler l'eau pendant 10 minutes avant de la consommer et de leur fournir des filtres pour éliminer le plomb (Edwards et Dudi, 2004). La douche, la lessive, la chasse d'eau des toilettes et le lave-vaisselle constituent tous des moyens possibles de purger le système de plomberie avant de consommer l'eau le matin. Il convient de noter que dans certains cas, la purge ne peut suffire à réduire les concentrations de plomb dans l'eau du robinet. Par conséquent, les services d'eau doivent procéder à une surveillance appropriée pour s'assurer que la purge constitue une mesure adéquate avant de la recommander aux consommateurs.
On recommande aussi de procéder régulièrement à la purge des réseaux de distribution plus grands, et notamment des culs-de-sac, pour évacuer les sous-produits de la corrosion qui se détachent des parois et les microorganismes qu'ils pourraient contenir.
Des activités d'entretien, comme un nettoyage régulier des aérateurs et des grilles des robinets pour en déloger les débris, peuvent également jouer un rôle important dans la réduction des concentrations de plomb dans l'eau du robinet. Parmi les débris des aérateurs ou des grilles, on trouve parfois des particules de plomb, qui peuvent être abrasées et franchir les grilles pendant les périodes de consommation d'eau. Ceci peut entraîner une augmentation notable, de façon variable et sporadique, du plomb particulaire dans l'eau du robinet. Selon le type de particules de plomb présent et le mode de préparation utilisé pour l'analyse des échantillons, il peut s'avérer difficile de mesurer avec précision des concentrations élevées de plomb (Triantafyllidou et coll., 2007). C'est pourquoi il est important de veiller à ce que l'échantillonnage soit réalisé avec l'aérateur ou la grille en place afin de détecter toute contribution possible du plomb particulaire.
On peut installer des dispositifs de traitement de l'eau potable au point d'entrée ou au robinet dans les bâtiments résidentiels ou non résidentiels pour réduire davantage les concentrations de contaminants. Comme les concentrations de plomb, de cuivre et de fer risquent d'augmenter dans le système de plomberie et comme l'exposition à ces contaminants par l'eau potable ne devient inquiétante qu'en cas d'ingestion des contaminants (l'inhalation et l'absorption cutanée ne constituent pas des voies importantes d'exposition), on juge que l'installation de dispositifs de traitement aux robinets constitue le meilleur moyen de réduire les concentrations de contaminants à des niveaux sûrs et esthétiquement acceptables immédiatement avant la consommation.
Santé Canada ne recommande pas de marques particulières de dispositifs de traitement de l'eau potable, mais conseille vivement aux consommateurs de n'acheter que des dispositifs certifiés par un organisme de certification accrédité comme étant conformes aux normes appropriées de NSF International (NSF) et de l'American National Standards Institute (ANSI). Ces normes visent à préserver la qualité de l'eau potable en aidant à assurer l'innocuité des matériaux et l'efficacité des produits qui entrent en contact avec elle. Les organismes de certification, qui doivent être accrédités par le Conseil canadien des normes (CCN), garantissent qu'un produit est conforme aux normes en vigueur. Au Canada, les organismes suivants ont été accrédités par le CCN pour la certification de la conformité aux normes NSF/ANSI des dispositifs de traitement de l'eau potable et des produits liés à l'eau potable (CCN, 2003) :
- CSA International (www.csa-international.org);
- NSF International (www.nsf.org);
- Water Quality Association (www.wqa.org);
- Underwriters Laboratories Inc. (www.ul.com);
- Quality Auditing Institute (www.qai.org);
- International Association of Plumbing & Mechanical Officials (www.iapmo.org).
On trouve sur le site Web du CCN SCC (www.scc.ca) une liste à jour des organismes de certification accrédités.
Le tableau 2 énumère les techniques de traitement de l'eau utilisées dans les dispositifs de traitement qui peuvent réduire les concentrations de plomb, de cuivre et de fer dans l'eau potable.
| Contaminant | Technique de traitement |
Norme NSF/ANSI Standard |
Réduction
|
|
|---|---|---|---|---|
| Influent (mg/L) |
Eau traitée (mg/L) |
|||
| Plomb | Adsorption (sur charbon) | 53 | 0,15 | 0,010 |
| Osmose inverse | 58 | 0,15 | 0,010 | |
| Distillation | 62 | 0,15 | 0,010 | |
| Cuivre | Adsorption (sur charbon) | 53 | 3 | 1,3 |
| Osmose inverse | 58 | 3 | 1,3 | |
| Distillation | 62 | 4 | 1,3 | |
| Fer | Filtration | 42 (esthétique) |
3-5 | 0,3 |
Les protocoles d'échantillonnage et les niveaux d'intervention liés aux protocoles de surveillance ci-dessous tiennent compte de la variabilité des concentrations de plomb mesurées au robinet, qui dépendent de la période de stagnation, de l'âge et de la source du plomb, ainsi que d'autres facteurs, comme les limites de l'analyse.
Des programmes de surveillance résidentielle mis en oeuvre dans le passé aux États-Unis et en Europe ont permis de démontrer que les concentrations de plomb au robinet varient de façon importante au sein d'un même réseau et d'un même site d'échantillonnage (Karalekas et coll., 1978; Bailey et Russell, 1981; AwwaRF, 1990; Schock, 1990a, b; U.S. EPA, 1991a). Comme nous l'avons indiqué à la section B.2.2, la concentration de plomb dans l'eau du robinet dépend d'un éventail de facteurs physiques et chimiques, notamment la qualité de l'eau (le pH, l'alcalinité, la température, le chlore résiduel, etc.), la durée de stagnation ainsi que l'âge, le type, la taille et l'étendue des matériaux à base de plomb. Le mode d'utilisation de l'eau et le volume prélevé sont également des facteurs ayant une importante influence sur la concentration de plomb au robinet. Sur le plan statistique, plus le degré de variation est important, plus le nombre de sites d'échantillonnage doit être grand pour que les résultats soient représentatifs du réseau de distribution. En outre, lorsqu'on effectue un échantillonnage dans le but d'évaluer l'efficacité de modifications apportées à une méthode de traitement de la corrosion, il est important de réduire le degré de variabilité des concentrations de plomb mesurées dans l'eau du robinet (AwwaRF, 1990). Pour obtenir des résultats représentatifs et reproductibles, il est donc essentiel d'intégrer à tout programme de surveillance des mesures destinées à contrôler les facteurs qui causent la variation (Schock, 1990a; AwwaRF, 2004; Commission européenne, 1999).
En ce qui concerne les programmes de surveillance résidentielle, il faut veiller à ce que les échantillons soient prélevés à partir du robinet de la cuisine, en gardant l'aérateur ou la grille en place, et en respectant un débit correspondant à celui normalement utilisé (environ de 4 à 5 L/min) par les consommateurs (van den Hoven et Slaats, 2006). Ces précautions contribuent à garantir que les échantillons prélevés sont représentatifs des concentrations de plomb habituelles dans l'eau du robinet. Il est également conseillé de répartir les échantillons de quatre litres en aliquotes d'un litre, car ce type de profil des concentrations de plomb permet d'obtenir des informations plus précises sur la source du plomb.
B.5.2 Détermination des protocoles d'échantillonnage et du niveau d'intervention pour le programme de surveillance résidentielle : option 1 (protocole en deux volets)
L'option 1 du programme de surveillance résidentielle (protocole en deux volets) a pour objectifs : d'identifier les réseaux de distribution présentant un problème de corrosion du plomb provenant de divers matériaux et d'établir la cause du problème; d'estimer le risque d'une exposition des consommateurs à des concentrations élevées de plomb; et d'évaluer la qualité et l'efficacité des programmes de contrôle de la corrosion. Le choix de l'option 1 du programme de surveillance résidentielle a tenu compte des protocoles d'échantillonnage utilisés dans différentes études sur les concentrations de plomb au robinet et sur les facteurs de variation de ces concentrations. Une approche en deux volets constitue une méthode efficace pour évaluer la corrosion dans l'ensemble d'un réseau de distribution et pour déterminer les concentrations de plomb potentiellement les plus élevées. Elle permet également de recueillir de façon efficace les renseignements nécessaires pour décider des meilleures mesures correctives à prendre et pour évaluer l'efficacité du contrôle de la corrosion dans les réseaux résidentiels au Canada.
Dans certains cas, l'autorité responsable peut juger souhaitable de prélever les échantillons pour les deux volets à l'occasion d'une même visite sur un site. Elle élimine ainsi le besoin de retourner dans une résidence au cas où les concentrations mesurées dépassent le niveau d'intervention fixé pour le volet 1. Les analyses à faire dans le cadre du volet 2 se limiteront aux échantillons appropriés, déterminés d'après les résultats du volet 1.
L'échantillonnage effectué lors du volet 1 sert à déterminer la contribution de la plomberie interne à la concentration de plomb au robinet, à la suite d'une période de stagnation et du contact transitoire de l'eau avec l'entrée de service en plomb. On prélève un échantillon de premier jet de 1 L au robinet d'eau froide du consommateur (sans retirer l'aérateur ou la grille), après au moins 6 heures de stagnation. Lorsque plus de 10 % des sites (90e centile) présentent une concentration de plomb supérieure à 0,015 mg/L (niveau d'intervention pour le plomb), il est recommandé que les services publics prennent des mesures correctives, y compris le prélèvement d'échantillons supplémentaires selon les indications du protocole d'échantillonnage établi pour le volet 2.
Largement utilisé pour évaluer les concentrations de plomb à l'échelle de l'ensemble d'un réseau de distribution, le protocole d'échantillonnage du volet 1 s'est révélé être une méthode efficace pour identifier les réseaux munis ou non d'entrées de service en plomb qui nécessitent un contrôle de la corrosion (AwwaRF, 1990; U.S. EPA, 1990, 1991a). À la suite d'une analyse des résultats d'évaluations exhaustives effectuées à l'échelle de réseaux, la U.S. EPA est arrivée à la conclusion que, si un nombre suffisant de sites est échantillonné, le protocole d'échantillonnage du volet 1 peut donner des résultats représentant avec précision les concentrations de plomb dans l'ensemble d'un réseau et constituer au besoin l'élément déclencheur de mesures correctives (U.S. EPA, 1991a).
Chaque élément du protocole d'échantillonnage, comme la période de stagnation, le volume d'eau prélevé et le niveau d'intervention, a une incidence importante sur l'évaluation d'ensemble de la corrosion interne d'un réseau. On a retenu une période de stagnation de 6 heures, car une telle période permet de réduire la variabilité des concentrations de plomb dans l'eau du robinet et d'assurer la détection des concentrations élevées de plomb dans un réseau, si celui-ci en présente. Il est important de déceler avec précision les concentrations élevées de plomb présentes dans un réseau afin de pouvoir mettre en oeuvre les mesures correctives appropriées et de démontrer que le contrôle de la corrosion a été optimisé.
Un examen récent de la variation des concentrations de plomb au robinet a permis d'établir que la période de stagnation constitue le facteur physique le plus important à prendre en considération dans le cadre d'un programme de surveillance (AwwaRF, 2004). L'écart-type des concentrations de plomb dans l'eau du robinet se situe habituellement entre 50 % et 75 % (Schock et coll., 1990a). On a démontré que le prélèvement d'échantillons d'eau du robinet après des périodes de stagnation se rapprochant du temps nécessaire pour atteindre un état d'équilibre permettait de réduire la variabilité des concentrations de plomb (Bailey et coll., 1986; U.S. EPA, 1991a). Des expériences de la U.S. EPA ont également montré que parmi les échantillons prélevés après diverses périodes de stagnation dans des tuyaux de plomb, ceux dont les concentrations présentaient l'écart-type le moins élevé correspondaient aux échantillons associés à des périodes de stagnation supérieures à 6 heures (AwwaRF, 1990).
Il est particulièrement important de réduire le degré de variation des concentrations de plomb au robinet dans les réseaux qui présentent des teneurs en plomb se rapprochant du niveau d'intervention (0,015 mg/L), ainsi que dans les réseaux pour lesquels il faut démontrer que le contrôle de la corrosion a été optimisé. Pour établir qu'une réduction des concentrations de plomb est attribuable à des modifications de la méthode de traitement (ou à d'autres mesures correctives) et non aux autres facteurs influant sur la variabilité des concentrations en question, il est important de choisir la période de stagnation la plus susceptible de permettre une mesure des concentrations les plus élevées. Démontrer qu'une diminution notable des concentrations élevées de plomb dans un réseau est due aux mesures de contrôle de la corrosion est ensuite essentiel lorsqu'on cherche à déterminer si le contrôle de la corrosion interne de ce réseau a été optimisé. En particulier, lorsque les concentrations de plomb dans un réseau diminuent, leur variabilité doit également être réduite pour qu'on puisse attribuer avec suffisamment de certitude la baisse des concentrations aux modifications apportées à la méthode de traitement (AwwaRF, 2004).
On a également observé que pendant les périodes de stagnation, il y a relargage de plomb à partir des joints soudés et des raccords en laiton (Neff et coll., 1987; Schock et Neff, 1988). Des études portant sur les sources du plomb présent dans l'eau du robinet ont en effet montré que les soudures au plomb et les raccords en laiton contribuent de façon importante à la présence de concentrations élevées de plomb après une période de stagnation (Lee et coll., 1989; Singh et Mavinic, 1991; AwwaRF, 2004; U.S. EPA, 2007). On a constaté que les concentrations de plomb provenant des raccords en laiton augmentent de façon considérable après une période de stagnation de 4 à 20 heures, selon l'âge et le type du matériau (Lytle et Shock, 2000). Pour accroître les chances de détecter les concentrations élevées de plomb attribuables à la corrosion des matériaux à base de plomb (soudures au plomb, raccords en laiton et éléments de plomberie en ligne) dans un réseau, il est important de prélever des échantillons après une période de stagnation s'approchant du temps requis pour atteindre une valeur d'équilibre, à savoir plus de 6 heures.
La période de stagnation nocturne peut varier considérablement d'un site à l'autre. Des chercheurs ont cependant indiqué que la période moyenne de stagnation durant la nuit est de 7,3 heures (Bailey et Russell, 1981). La période de stagnation la plus prudente avant la prise d'échantillons se situe entre 8 et 18 heures, puisqu'une telle période correspond aux concentrations maximales de plomb dans l'eau. Toutefois, elle pourrait être difficile à respecter d'un point de vue opérationnel. On a démontré que les différences entre les concentrations de plomb mesurées après 8 heures et celles mesurées après 6 heures étaient négligeables (Lytle et Schock, 2000). La période minimale de stagnation recommandée avant la prise d'un échantillon au robinet pour le dosage du plomb a donc été fixée à 6 heures pour l'option 1 du programme de surveillance résidentielle. Il est important de signaler que la période de stagnation de 6 heures ne doit pas nécessairement avoir lieu durant la nuit. Pour faciliter le prélèvement d'échantillons pour le volet 1 dans de multiples résidences au cours d'une même journée, les services publics peuvent envisager d'effectuer des prélèvements dans des résidences qui sont inoccupées pendant 6 heures durant d'autres périodes de la journée.
Le volume d'échantillon est également considéré comme un facteur important pour déterminer les concentrations de plomb dans l'eau du robinet des consommateurs (AwwaRF, 1990, 2004). On a mesuré des concentrations élevées de plomb dans les échantillons qui se situent entre le premier et le douzième litre d'eau prélevés au robinet, selon la source de la contamination et le lieu, dans le réseau de distribution, où se trouve le matériau ayant causé cette dernière. D'après certaines études récentes (Campbell et Douglas, 2007; Huggins, 2007; Kwan, 2007; Sandvig, 2007; U.S. EPA, 2007; Craik et coll., 2008), c'est généralement dans les échantillons d'une eau ayant reposé dans une entrée de service en plomb qu'on observe les concentrations de plomb les plus élevées. On considère cependant qu'il est trop exigeant de prélever de nombreux litres d'eau à chacun des sites d'échantillonnage, c'est pourquoi on prélève habituellement un volume d'eau moindre lorsqu'on fait l'évaluation de la corrosion à l'échelle d'un réseau. De nombreuses études indiquent que le prélèvement d'un échantillon de 1 L après une période de stagnation de 6 heures permet d'effectuer une évaluation efficace du niveau de corrosion à l'échelle d'un réseau (Frey, 1989; Lee et coll., 1989; U.S. EPA, 1991a). Le prélèvement d'un échantillon de 1 L permet en effet de déterminer la concentration de plomb qui, après une période de stagnation, est attribuable au contact de l'eau avec les éléments de plomberie pouvant contenir du plomb, comme les raccords en laiton et les soudures au plomb, de même que celle résultant du contact transitoire de l'eau avec l'entrée de service en plomb, le cas échéant. Les données obtenues de nombreux services publics aux États-Unis indiquent que les concentrations de plomb dans le premier litre d'eau peuvent être élevées en raison de l'apport en plomb provenant de la plomberie interne et de l'entrée de service en plomb. Ces données signalent également que la concentration de plomb dans le premier litre d'eau est beaucoup plus élevée pour les résidences équipées d'une entrée de service en plomb que pour celles n'en ayant pas, et qu'elle dépend de la qualité de l'eau (Karalekas et coll., 1978; U.S. EPA, 1990, 1991a). De même, les résultats d'une étude récente réalisée par un service public canadien indique que les concentrations de plomb dans le premier litre d'eau sont beaucoup plus élevées pour les résidences équipées d'une entrée de service en plomb que pour celles dont l'entrée de service n'est pas en plomb (Craik et coll., 2008). On a donc retenu un volume d'échantillon de 1 L pour le protocole d'échantillonnage du volet 1, puisque cette quantité fournit des renseignements suffisants pour évaluer la corrosion et qu'elle facilite le prélèvement et l'analyse des échantillons.
On a établi le niveau d'intervention pour le protocole d'échantillonnage du volet 1 en fonction de la concentration de plomb dans le site correspondant à la valeur du 90e centile, telle que mesurée lors de l'échantillonnage de surveillance. Des renseignements supplémentaires sur la façon de déterminer le 90e centile sont présentés à la section C.2. Le choix de la valeur de 0,015 mg/L pour le 90e centile tient compte d'une analyse de la U.S. EPA relative aux concentrations de plomb mesurées dans de nombreux réseaux (1990, 1991a). Dans le cadre de la promulgation de la version définitive de la LCR, la U.S. EPA a analysé les données sur les concentrations de plomb d'échantillons d'eau du robinet prélevés dans plus de 100 000 sites d'échantillonnage rattachés à 39 réseaux de taille moyenne présentant différentes qualités d'eau. Selon les données analysées, la concentration de plomb de l'eau de plus de 80 % des réseaux ne comportant pas d'entrées de service en plomb pouvait être ramenée à une valeur correspondant au 90e centile, soit 0,015 mg/L, en effectuant un ajustement du pH ou en ajoutant à l'eau des inhibiteurs de corrosion. Les réseaux comportant des entrées de service en plomb présentaient quant à eux des concentrations de plomb beaucoup plus élevées, et seuls 25 % d'entre eux ont pu respecter le niveau d'intervention de 0,015 mg/L. On a cependant jugé approprié de prendre des mesures correctives supplémentaires dans ces cas-là, comme le remplacement des entrées de service en plomb.
Le choix de la concentration de plomb du 90e centile, soit 0,015 mg/L, pour le niveau d'intervention du volet 1 est également fondé sur les limites de l'analyse. On a en effet retenu la valeur de 0,015 mg/L car celle-ci évite d'avoir à formuler des hypothèses concernant les valeurs inférieures au SPEQ des méthodes analytiques, lequel se situe à 0,005 mg/L. Étant donné que la distribution des concentrations de plomb dans l'eau potable est généralement log-normale, on devrait s'attendre à observer un grand nombre de valeurs inférieures au SPEQ fixé pour le plomb. Si on utilisait une valeur moyenne, l'incertitude analytique et les hypothèses associées à des valeurs inférieures au SPEQ pourraient influer sur les résultats. La teneur en plomb du 90e centile, 0,015 mg/L, est également jugée la plus prudente, puisqu'elle correspond approximativement à la concentration de plomb moyenne de 0,005 mg/L (U.S. EPA, 1991a). On considère que le niveau de fond maximal du plomb dans l'eau potable à la sortie de l'usine de traitement est de 0,005 mg/L. Ainsi, des concentrations supérieures à 0,005 mg/L constituent une indication qu'il y a dans le réseau de distribution ou la plomberie interne un apport de plomb provenant des compteurs ou des raccords en laiton, des soudures au plomb ou des entrées de service en plomb.
Le niveau d'intervention du volet 1 a pour objet de déclencher des mesures correctives, notamment le prélèvement d'échantillons supplémentaires. Si les concentrations de plomb dépassent 0,015 mg/L (niveau d'intervention pour le plomb) dans moins de 10 % des sites (correspondant au 90e centile), les services publics doivent fournir aux occupants des résidences présentant des concentrations supérieures à 0,010 mg/L des renseignements sur les moyens de réduire leur exposition au plomb. Ces moyens peuvent comprendre la purge d'un volume donné d'eau avant la consommation après une période de stagnation, la vérification des grilles et des aérateurs afin de déterminer s'il s'y trouve des débris pouvant contenir du plomb, comme des soudures au plomb, et le remplacement de leur portion des entrées de service en plomb. On recommande également aux services publics d'effectuer un échantillonnage de suivi dans ces sites afin d'évaluer l'efficacité des mesures correctives prises par les consommateurs.
Ce protocole d'échantillonnage permettra aux services publics d'obtenir l'information nécessaire sur la qualité de l'eau pour déterminer s'il faut inciter les consommateurs à purger leur réseau d'eau potable après des périodes de stagnation, afin de protéger les populations les plus sensibles contre les concentrations dangereuses de plomb. Les échantillons prélevés servent également, sur le plan opérationnel, à déterminer si l'eau distribuée a tendance ou non à être corrosive pour le plomb et, dans l'affirmative, à établir les prochaines étapes à entreprendre pour mettre en oeuvre un programme de contrôle de la corrosion. On estime que la méthode d'échantillonnage préconisée pour le volet 1 renseigne davantage sur les concentrations de plomb que les autres méthodes d'échantillonnage courantes. Elle devrait par conséquent être utilisée afin d'accroître les chances de déceler correctement les problèmes de contamination par le plomb à l'échelle d'un réseau de distribution, notamment la présence de concentrations élevées de plomb attribuables au contact de l'eau avec divers matériaux contenant du plomb durant la période de stagnation nocturne.
L'échantillonnage du volet 2 est nécessaire uniquement si le volet 1 révèle la présence, dans plus de 10 % des sites (90e centile), de concentrations de plomb supérieures à 0,015 mg/L (niveau d'intervention pour le plomb). Les prélèvements sont effectués dans 10 % des sites échantillonnés dans le cadre du volet 1, plus précisément dans les sites où on a observé les concentrations les plus élevées. Dans le cas d'un réseau de petite taille (desservant 500 personnes ou moins), il faut prélever des échantillons dans au moins deux sites afin d'obtenir des données suffisantes pour dresser le profil des concentrations de plomb de l'eau de ce réseau.
On prélève consécutivement quatre échantillons de 1 L d'eau potable au robinet d'eau froide du consommateur (sans retirer l'aérateur ou la grille) après au moins 6 heures de stagnation. Chaque échantillon est ensuite analysé séparément afin d'obtenir un profil des contributions du robinet, de la plomberie (plomb présent dans les soudures, les raccords en laiton ou en bronze, les compteurs d'eau en laiton, etc.) et d'une portion ou de l'ensemble de l'entrée de service en plomb. Les services publics qui auront choisi de prélever quatre échantillons de 1 L lors du volet 1 peuvent procéder à l'analyse des trois échantillons restants de 1 L après que les analyses effectuées dans le cadre du volet 1 ont permis de déterminer les résidences à retenir.
L'échantillonnage du volet 2 a pour objectif de fournir des renseignements sur la source de la contamination au plomb et sur les concentrations de plomb potentiellement les plus élevées, afin d'aider les services publics à déterminer les meilleures mesures correctives à prendre. Il permet également d'obtenir les meilleures informations pour évaluer l'efficacité et l'optimisation du programme de contrôle de la corrosion.
Pour obtenir des renseignements sur les concentrations potentiellement les plus élevées, il est important de réaliser l'échantillonnage après une période de stagnation. Le protocole d'échantillonnage du volet 2 vise notamment à prélever des échantillons de l'eau qui a reposé non seulement dans la plomberie de la résidence, mais également dans une portion ou dans l'ensemble de l'entrée de service en plomb, s'il y a présence d'une telle conduite. Les concentrations de plomb dans l'eau ayant reposé dans des tuyaux de plomb augmentent de façon considérable avec le temps, durant une période pouvant aller jusqu'à 8 heures, semblables aux concentrations provenant d'autres matériaux à base de plomb (soudures au plomb et raccords en laiton). Plusieurs facteurs influent sur la pente des courbes de stagnation de l'eau potable dans un tuyau de plomb. Généralement, la concentration de plomb augmente rapidement durant les 300 premières minutes. La pente de la courbe de stagnation pour un tuyau de plomb est habituellement très abrupte pour les périodes de stagnation inférieures à 6 heures. Par conséquent, de petites différences dans la durée de stagnation de l'eau peuvent entraîner des variations importantes dans les concentrations de plomb mesurées (Kuch et Wagner, 1983; AwwaRF, 1990, 2004; Schock, 1990a).
Le volume d'eau qui a été en contact avec l'entrée de service en plomb après une période de stagnation constitue un autre facteur important qui influe sur les concentrations de plomb au robinet. Des études établissant les profils des concentrations de plomb de réseaux de distribution au Canada et aux États-Unis ont indiqué que parmi les échantillons prélevés au robinet de résidences équipées d'une entrée de service en plomb, ce sont les échantillons correspondant à l'eau ayant reposé dans une telle conduite qui présentent la concentration de plomb la plus élevée (Campbell et Douglas, 2007; Huggins, 2007; Kwan, 2007; U.S. EPA, 2007; Craik et coll., 2008). Selon les résultats de ces études, lorsque l'eau a reposé dans une entrée de service en plomb durant 6 heures, la concentration maximale de plomb peut être mesurée dans les échantillons se situant entre le quatrième et le douzième litre du volume d'eau recueilli. Dans de nombreuses études, on a souvent mesuré des concentrations de plomb très élevées dans le quatrième, le cinquième ou le sixième litre du volume d'échantillon (Campbell et Douglas, 2007; Douglas et coll., 2007; Sandvig, 2007; Craik et coll., 2008). L'établissement de profils complets des concentrations de plomb dans l'eau de résidences de Washington (DC) équipées d'une entrée de service en plomb, effectué après le remplacement de l'ancienne méthode de traitement par un traitement aux chloramines, a montré que la quantité moyenne de plomb libéré dans l'eau (concentration ajustée au volume réel) attribuée à l'entrée de service était de 470 µg (73 µg/L), comparativement à 26 µg (26 µg/L) dans le premier litre d'échantillon et à 72 µg (31 µg/L) dans les échantillons provenant des autres éléments de tuyauterie des résidences et des composantes en amont de l'entrée de service en plomb (U.S. EPA, 2007).
Déterminer la possibilité de concentrations élevées de plomb dans l'eau ayant reposé dans une entrée de service en plomb constitue donc un élément essentiel de tout protocole d'échantillonnage servant à évaluer la corrosion interne des réseaux de distribution résidentiels et l'optimisation consécutive du contrôle de la corrosion. Une comparaison des échantillons présentant les concentrations de plomb les plus élevées avant et après la mise en oeuvre de mesures de contrôle de la corrosion permettra aux services publics d'obtenir les données nécessaires pour déterminer si la méthode de traitement utilisée a été optimisée. Cette comparaison contribuera en dernier ressort à démontrer que les concentrations les plus élevées ont été réduites le plus possible. Au Canada, on estime que le prélèvement d'au moins quatre échantillons de 1 L après une période de stagnation de 6 heures accroîtra les chances de détection des concentrations de plomb les plus élevées. Étant donné que le volume d'échantillon requis pour recueillir de l'eau ayant reposé dans l'entrée de service en plomb dépendra de la configuration propre à la plomberie de chaque site, les services publics devraient effectuer une caractérisation générale des différents types de sites à haut risque dans le but de déterminer si le prélèvement de quatre échantillons de 1 L sera suffisant.
On préconise le prélèvement de quatre échantillons de 1 L à analyser séparément, car une telle démarche permettra d'établir le profil des contributions du robinet, de la plomberie du foyer et, dans de nombreux cas, d'une portion ou de l'ensemble de l'entrée de service en plomb, aux concentrations de plomb. Des études antérieures ont montré que 95 % du plomb provenant du robinet est évacué avec les premiers 200 à 250 mL d'eau. En outre, le plomb provenant des soudures au plomb se trouve généralement dans les deux premiers litres d'eau évacués des tuyaux de plomberie. Le prélèvement de quatre échantillons de 1 L à analyser séparément permettra donc aux fournisseurs d'eau d'obtenir des renseignements à la fois sur les concentrations de plomb au robinet potentiellement les plus élevées ainsi que sur la source de la contamination par le plomb. Ces renseignements pourront ensuite servir à déterminer les meilleures mesures correctives à prendre pour le réseau et fourniront des données qui faciliteront l'évaluation visant à déterminer si le contrôle de la corrosion a été optimisé.
B.5.3 Détermination des protocoles d'échantillonnage et des niveaux d'intervention pour le programme de surveillance résidentielle : option 2 (résidences équipées d'une entrée de service en plomb)
Ce protocole consiste en une méthode de rechange destinée aux secteurs de compétence au sein desquels le prélèvement d'échantillons après une période de stagnation de 6 heures est difficilement réalisable ou pour lesquels des obligations réglementaires restreignent le recours à l'approche en deux volets exposée ci-dessus. L'option 2 du programme de surveillance résidentielle vise à mesurer la concentration de plomb de l'eau qui a été en contact avec l'entrée de service en plomb et la plomberie interne (par ex. les soudures au plomb, les raccords en laiton au plomb) durant une courte période transitoire (30 min). On prélève consécutivement quatre échantillons de 1 L d'eau potable au robinet d'eau froide du consommateur (sans retirer l'aérateur ou la grille) après une purge de 5 minutes suivie de 30 minutes de stagnation. Chaque échantillon est ensuite analysé séparément afin d'obtenir un profil des contributions du robinet, de la plomberie (plomb présent dans les soudures, les raccords en laiton ou en bronze, les compteurs d'eau en laiton, etc.) et d'une portion ou de l'ensemble de l'entrée de service en plomb. Si, lors d'un échantillonnage, la concentration moyenne de plomb des quatre échantillons prélevés sur un même site est supérieure à 0,010 mg/L dans plus de 10 % des sites de prélèvement (90e centile), on recommande aux services publics de prendre des mesures correctives.
Le choix de ce protocole en tant que méthode de rechange pour la surveillance résidentielle s'appuie sur une adaptation d'un protocole d'échantillonnage utilisé par diverses études européennes dans le but d'estimer l'exposition hebdomadaire moyenne au plomb des consommateurs par l'eau du robinet (Baron, 1997, 2001; Commission européenne, 1999). Bien qu'il ait servi dans ces études à évaluer l'exposition hebdomadaire moyenne, ce protocole peut se révéler utile pour obtenir de l'information sur la corrosivité de l'eau pour les tuyaux en plomb. Il peut donc être utilisé afin d'identifier les sites résidentiels équipés d'une entrée de service en plomb qui pourraient présenter des concentrations élevées de plomb. Comme il est précisé cidessous, ce protocole a été adapté de manière à ce qu'il puisse constituer une méthode d'évaluation de la corrosion. Toutefois, en raison de ses limites inhérentes, il ne peut s'appliquer qu'aux résidences munies d'une entrée de service en plomb.
Dans le cadre des études européennes susmentionnées, on a évalué différents protocoles d'échantillonnage afin de cerner les méthodes à utiliser pour estimer la concentration hebdomadaire moyenne de plomb au robinet des consommateurs (Baron, 1997, 2001; Commission européenne, 1999). L'étude de la Commission européenne (1999) a comparé les méthodes d'échantillonnage communément utilisées (échantillonnage aléatoire le jour, après une purge complète et une période de stagnation déterminée) à la méthode proportionnelle composite pour déterminer laquelle était la plus représentative de la quantité hebdomadaire moyenne de plomb ingérée par les consommateurs. Selon ces études, mesurer la concentration moyenne de plomb dans deux échantillons de 1 L prélevés après une purge complète de 5 minutes suivie d'une période de stagnation de 30 minutes constitue une méthode efficace pour estimer la concentration moyenne de plomb au robinet des consommateurs. On considère également qu'une période de stagnation de 30 minutes est représentative du temps moyen de repos de l'eau entre les utilisations dans un cadre résidentiel (Commission européenne, 1999; Baron, 2001; van den Hoven et Slaats, 2006).
Dans les études européennes dont ce protocole s'inspire, on a également analysé les données recueillies dans le but de déterminer si un protocole comportant une période de stagnation de 30 minutes pourrait servir à la détection des zones d'un réseau pouvant présenter des concentrations élevées de plomb. Les auteurs de ces études ont conclu que si le nombre d'échantillons prélevés est suffisant pour produire des données valables sur le plan statistique, le prélèvement de deux échantillons consécutifs de 1 L après une période de stagnation de 30 minutes pourrait alors permettre d'évaluer les réseaux ou les parties d'un réseau nécessitant la mise en oeuvre de mesures de contrôle de la corrosion (Commission européenne, 1999; van den Hoven et Slaats, 2006).
Un aspect important de ces études est qu'une large proportion des sites surveillés étaient équipés d'un système de plomberie en plomb ou d'une entrée de service en plomb. Les chercheurs ont conclu que 80 % des propriétés qui posaient problème mais n'avaient pas été détectées correctement, présentaient une entrée de service en plomb et plus de 5 m de tuyaux de plomberie faits d'un matériau autre que le plomb (cuivre, acier galvanisé ou plastique). Ces études ont ainsi permis de constater que le prélèvement de deux échantillons consécutifs de 1 L d'eau dans ce type de sites entraînerait une sous-estimation de l'exposition hebdomadaire moyenne des consommateurs et que le prélèvement d'un volume plus important d'eau était nécessaire pour identifier les propriétés posant problème. Le volume d'eau requis n'est cependant pas précisé dans les études. En outre, étant donné que 60 % des sites échantillonnés dans le cadre des études européennes étaient équipés d'une entrée de service ou de tuyaux de plomberie en plomb, on a établi que le prélèvement d'échantillons d'eau ayant reposé dans des tuyaux de plomb durant 30 minutes constituait un élément essentiel du protocole afin d'identifier avec précision les propriétés susceptibles de présenter des concentrations élevées de plomb.
Les résultats d'un travail d'établissement de profils des concentrations de plomb effectué par deux services publics canadiens indiquent que les concentrations de plomb mesurées dans le quatrième, le cinquième ou le sixième litre d'un volume d'échantillon (entrée de service en plomb) prélevé après une période de stagnation de 30 minutes sont plus élevées que les concentrations mesurées dans le premier et le deuxième litre (Campbell et Douglas, 2007; Douglas et coll., 2007; Craik et coll., 2008). Accroître le volume d'eau utilisé par les études européennes en le faisant passer à quatre échantillons consécutifs de 1 L devrait permettre aux services publics de mieux comprendre l'état des réseaux dans lesquels la corrosion des entrées de service en plomb risque de poser un problème.
Des données provenant de deux villes canadiennes sur les concentrations de plomb au robinet, mesurées à l'aide de différents protocoles d'échantillonnage, confirment l'efficacité d'un protocole prescrivant le prélèvement de quatre échantillons consécutifs de 1 L d'eau après une période de stagnation de 30 minutes pour identifier les résidences dont l'eau peut présenter des concentrations élevées de plomb en raison de la corrosion des entrées de service en plomb (Douglas et coll., 2007; Craik et coll., 2008). Les études menées dans ces deux villes ont montré qu'en général l'apport de plomb provenant d'une entrée de service en plomb peut être mesuré après une période de stagnation de 30 minutes dans le troisième, le quatrième, le cinquième ou le sixième litre d'échantillon. Ce protocole représente donc une option envisageable pour les services publics qui souhaitent mettre en place un programme de surveillance résidentielle dans les sites équipés d'une entrée de service en plomb. L'efficacité de la méthode pour évaluer la corrosion des composantes d'un réseau de distribution autres que les entrées de service et les systèmes de plomberie internes en plomb n'a cependant fait l'objet d'aucune vérification. Il n'existe aucune donnée indiquant que cette méthode pourrait être efficace pour évaluer les problèmes de corrosion dans les systèmes de plomberie dont certains éléments seulement, tels que les soudures, les raccords en laiton, les tuyaux ou autres, comportent du plomb.
Le niveau d'intervention fixé dans le cadre de la deuxième option du programme de surveillance résidentielle correspond à la valeur recommandée pour le plomb, soit une CMA de 0,010 mg/L. Si la concentration moyenne de plomb dans les quatre échantillons d'un même site est supérieure à 0,010 mg/L dans plus de 10 % des sites (90e centile), les autorités responsables doivent mettre en place des mesures correctives. On compare la concentration moyenne de plomb à la CMA de 0,010 mg/L, car on suppose que ceci permettra une détection plus précise des réseaux nécessitant la mise en oeuvre de mesures de contrôle de la corrosion. L'analyse d'un ensemble restreint de données provenant d'un service public canadien (Campbell et Douglas, 2007) qui a mis en place des mesures de contrôle de la corrosion pousse en effet à croire que le fait de comparer séparément chaque échantillon à la CMA de 0,010 mg/L peut mener à des conclusions inadéquates quant aux besoins en matière de traitement. Il vaut mieux comparer une valeur moyenne à la valeur fixée pour le niveau d'intervention. On recommande cependant d'effectuer une analyse de chaque litre d'eau prélevé afin de déterminer avec plus de précision la source du plomb et les concentrations de plomb potentiellement plus élevées, analyse qui pourra ensuite servir à déterminer les mesures correctives appropriées pour le réseau.
Si moins de 10 % des sites présentent une concentration moyenne de plomb dépassant 0,010 mg/L, les services publics doivent fournir aux consommateurs occupant les résidences où les échantillons révèlent une concentration supérieure à 0,010 mg/L des renseignements sur les moyens de réduire leur exposition au plomb. On recommande également aux services publics d'effectuer un échantillonnage de suivi dans ces sites afin d'évaluer l'efficacité des mesures correctives prises par les consommateurs.
Étant donné que ce protocole sert à l'évaluation de la corrosion après une courte période de stagnation, il est essentiel que l'eau prélevée lors de l'échantillonnage ait été en contact avec l'entrée de service en plomb afin d'accroître les chances de détecter les concentrations élevées de plomb, le cas échéant. Dans les situations où le service public sait que la concentration de plomb attribuable à l'entrée de service ne peut être mesurée qu'à partir d'un volume d'échantillon plus important, le prélèvement de quatre échantillons de 1 L devrait être considéré comme étant le volume d'échantillon minimal requis. Les autorités responsables doivent connaître les limites inhérentes à ce protocole et intégrer à celui-ci une évaluation des concentrations potentiellement plus élevées en prélevant des échantillons après une période de stagnation de 6 heures. Un sous-ensemble d'échantillons d'eau ayant reposé durant 6 heures doit être prélevé avant et après la mise en oeuvre des mesures de contrôle de la corrosion afin d'évaluer avec précision la corrosion interne du réseau et de s'assurer que le contrôle de la corrosion a été optimisé.
En général, un programme de surveillance résidentielle a pour objectifs d'identifier les réseaux de distribution dans lesquels la corrosion du plomb provenant de divers matériaux constitue un problème et de déterminer la cause du problème; d'estimer la possibilité d'une exposition des consommateurs à des concentrations élevées de plomb; et d'évaluer la qualité et l'efficacité des programmes de contrôle de la corrosion. Destinée aux résidences équipées d'une entrée de service en plomb, la deuxième option du programme de surveillance résidentielle n'a pas été évaluée en fonction de ces objectifs. Elle est plutôt destinée à déceler les concentrations élevées de plomb dans l'eau des résidences équipées d'une entrée de service en plomb. Il est également important de signaler que ce protocole n'a fait l'objet d'aucune évaluation visant à déterminer s'il est efficace pour déceler la corrosion d'autres matériaux utilisés en plomberie, et qu'il ne permet pas de mesurer les concentrations potentiellement plus élevées qui pourraient être présentes dans l'eau ayant reposé durant une période prolongée dans les entrées de service en plomb et les systèmes de plomberie des résidences.
Selon une étude de Kuch et Wagner (1983), les concentrations de plomb atteignent une valeur d'équilibre assez constante après 5 à 7 heures de stagnation, selon le diamètre des tuyaux (correspondant à 1/2 po et 3/8 po [13 mm et 10 mm]). De plus, la concentration de plomb augmente de façon exponentielle durant les 300 premières minutes de stagnation dans un tuyau en plomb. On a également constaté que la contribution à la concentration de plomb des autres matériaux, comme les raccords en laiton au plomb et les soudures à base de plomb, augmente de façon considérable après 4 à 20 heures de stagnation. Il existe peu de données de terrain comparant les différentes concentrations de plomb dans l'eau du robinet après diverses périodes de stagnation. Il est par conséquent difficile de déterminer si une période de stagnation de 30 minutes est suffisante pour évaluer la corrosion. Un petit nombre d'études avancent que, pour des volumes d'échantillon équivalents prélevés à un même robinet, les concentrations de plomb mesurées après une période de stagnation de 30 minutes sont beaucoup moins importantes que celles mesurées après une période de stagnation de 6 heures (AwwaRF, 1990; Douglas et coll., 2007; Craik et coll., 2008). Il semble donc y avoir un risque notable de sous-estimer la concentration maximale de plomb au robinet lorsqu'on utilise une période de stagnation de 30 minutes.
La U.S. EPA a réalisé en 1990 une analyse de diverses études approfondies sur les concentrations de plomb au robinet mesurées d'un bout à l'autre de réseaux donnés à l'aide d'échantillons de 1 L prélevés après une période de stagnation de 6 heures (premier jet) (U.S. EPA, 1990, 1991a). Cette analyse indique que les échantillons de premier jet de 1 L ont permis avec efficacité de déceler les concentrations élevées de plomb provenant de matériaux autres que les entrées de service en plomb dans les réseaux des services publics qui maintiennent un pH inférieur à 8 ou qui n'ajoutent à l'eau aucun inhibiteur de corrosion. L'analyse des données présentées dans le document de la U.S. EPA (U.S. EPA, 1991a) permet également de constater qu'une période de stagnation de 6 heures est essentielle au protocole d'échantillonnage. Un nombre important des réseaux évalués présentaient des concentrations de plomb se situant entre 15 et 30 µg/L; ce niveau est si bas qu'une période de stagnation plus courte aurait pu rendre impossible la détection des problèmes que posaient ces réseaux. On arrive à la même constatation en examinant les concentrations d'échantillons de 1 L prélevés après une période de stagnation minimale de 6 heures dans les entrées de service en plomb de 11 réseaux de distribution différents. Selon l'analyse de ces données effectuée par l'U.S. EPA, les concentrations de plomb au 90e centile étaient pour 48 % de ces réseaux inférieures à 30 µg/L, et 25 % des réseaux présentaient des concentrations se situant entre 10 et 30 µg/L (U.S. EPA, 1991a). Ces données laissent ainsi croire que, lorsque les concentrations de plomb se situent à un niveau moins élevé, une période de stagnation plus longue est nécessaire afin de pouvoir déceler avec précision les réseaux qui auraient avantage à mettre en place des mesures de contrôle de la corrosion.
De nombreuses études récentes ont signalé l'importance que peut avoir la contribution des matériaux à base de plomb autres que les entrées de service en plomb aux concentrations mesurées au robinet (Kimbrough, 2001; U.S. EPA, 2004a). Les études effectuées à Washington (DC) pour établir le profil des concentrations de plomb après le passage d'un traitement par chloration à un traitement aux chloramines ont permis de constater que des changements dans la qualité de l'eau peuvent entraîner l'apparition de concentrations élevées de plomb provenant des raccords en laiton et des soudures plomb-étain. Dans les profils établis, on constate que la concentration moyenne de plomb des échantillons de premier jet était de 26 µg/L pour le premier litre prélevé et de 31 µg/L pour l'eau provenant de la plomberie des bâtiments (U.S. EPA, 2007). Si l'échantillonnage avait été réalisé après une période de stagnation plus courte, il est probable dans de telles conditions que la corrosion n'aurait pas pu être évaluée avec précision.
L'évaluation de la qualité et de l'efficacité des méthodes de traitement au moment de leur mise en oeuvre constitue l'un des aspects importants de tout programme de contrôle de la corrosion. Dans le cadre de nombreuses études, on a évalué l'efficacité des méthodes de traitement du contrôle de la corrosion en mesurant les concentrations de plomb présentes dans les échantillons de premier jet avant et après le début du traitement. On peut évaluer l'efficacité d'un traitement en établissant des corrélations entre les concentrations de plomb des échantillons de premier jet et la valeur des différents paramètres de la qualité de l'eau, comme le pH, l'alcalinité et la concentration d'inhibiteurs (Karalekas et coll., 1983; U.S. EPA, 1991a). On considère qu'il est essentiel d'effectuer les comparaisons à partir des concentrations de plomb qui sont le plus près des valeurs maximales pour déterminer si les méthodes de traitement ont été optimisées. Il peut notamment être difficile de démontrer qu'une méthode de traitement a été optimisée lorsque les concentrations de plomb dans un réseau ne dépassent que légèrement le niveau d'intervention (0,010 mg/L), à moins que leur degré de variation soit minime. Le prélèvement d'échantillons après une période de stagnation plus longue, lorsque les concentrations sont susceptibles d'être plus élevées, peut ainsi fournir des données statistiquement plus valables pour démontrer que le contrôle de la corrosion a été optimisé.
Les auteurs de l'étude européenne dont s'inspire le protocole comportant une période de stagnation de 30 minutes recommandent le recours à divers protocoles d'échantillonnage pour évaluer l'efficacité du traitement pour le contrôle de la corrosion comparativement à celle des mesures prises dans chaque propriété, comme le remplacement des entrées de service en plomb. On a montré qu'il convient d'utiliser un protocole d'échantillonnage comportant une période de stagnation de 30 minutes pour mesurer l'efficacité du remplacement de tuyaux en plomb. Il n'a cependant pas été démontré qu'un tel protocole est convenable pour évaluer l'efficacité du traitement pour le contrôle de la corrosion (Commission européenne, 1999).
Le nombre de sites d'échantillonnage suggéré au tableau 2 selon la taille du réseau à évaluer est tiré de la LCR d e la U.S. EPA (U.S. EPA, 1991a). Lors de l'élaboration de cette réglementation, la U.S. EPA a réalisé une estimation du nombre minimal de sites d'échantillonnage requis pour caractériser de façon adéquate la distribution des concentrations de plomb au robinet dans l'ensemble d'un réseau. Dans le cadre de cette analyse, la U.S. EPA a jugé nécessaire de veiller à ce que le nombre de sites d'échantillonnage soit à la fois raisonnable pour les services publics et représentatif des concentrations de plomb au robinet dans l'ensemble du réseau. On a utilisé les résultats d'études sur les concentrations de plomb au robinet réalisées par de nombreux services publics des États-Unis afin d'effectuer une analyse statistique des concentrations à l'échelle d'un réseau. Les données utilisées dans cette analyse correspondaient aux concentrations mesurées dans les échantillons de premier jet de 1 L prélevés après une période de stagnation d'au moins 6 heures (AwwaRF, 1990).
Les études effectuées à l'échelle de réseaux entiers ont montré que les concentrations de plomb au robinet présentaient une distribution log-normale et que les concentrations de plomb de 25 % à 40 % des endroits échantillonnés étaient supérieures à 0,015 mg/L. Les données ont été analysées à l'aide de méthodes d'échantillonnage statistique telles celles utilisées dans le cadre des applications de contrôle de la qualité. Les résultats de l'analyse ont permis de constater que le nombre de sites d'échantillonnage suggéré au tableau 2 permettra efficacement d'identifier, avec un niveau de confiance d'environ 90 %, les réseaux desservant plus de 100 personnes dont les concentrations de plomb au 90e centile dépassent 0,015 mg/L (U.S. EPA, 1991b). Il est à signaler que l'évaluation de la U.S. EPA a été réalisée à partir de données recueillies au moyen d'un protocole de prélèvement d'échantillons après une période de stagnation de 6 heures et avec un niveau d'intervention de 0,015 mg/L. Les données obtenues après une période de stagnation de 30 minutes et avec un niveau d'intervention de 0,010 mg/L n'ont pas été évaluées dans le présent contexte. On ne peut donc pas déterminer le niveau de confiance avec lequel ce protocole permettra de détecter les réseaux ayant des concentrations de plomb supérieures à 0,010 mg/L, ni l'estimer de manière fiable sans refaire une analyse similaire avec un ensemble de données beaucoup plus grand que celui dont on dispose.
Compte tenu de la variabilité des concentrations de plomb dans l'eau du robinet, on juge qu'il est indiqué de prendre des mesures supplémentaires pour accroître le niveau de confiance avec lequel le nombre de sites d'échantillonnage suggéré permettra de déceler les concentrations élevées de plomb au robinet. Retenir dans le nombre de sites d'échantillonnage suggéré les endroits à haut risque, comme les résidences équipées d'une entrée de service en plomb, et prélever les échantillons durant des périodes où la température de l'eau est plus élevée devrait accroître le degré d'assurance que l'échantillonnage représentera adéquatement la totalité du réseau. La U.S. EPA a indiqué qu'il est nécessaire de prélever des échantillons deux fois par an et de cibler les résidences à haut risque pour accroître le niveau de confiance. On a également souligné que ces deux mesures sont particulièrement importantes dans le cas des réseaux desservant 100 personnes ou moins.
L'analyse statistique réalisée par la U.S. EPA a permis de constater qu'il est impossible d'atteindre un niveau de confiance de 90 % avec le nombre de sites d'échantillonnage suggéré pour les réseaux desservant moins de 100 personnes. On juge cependant que le prélèvement d'un nombre plus important d'échantillons est difficilement réalisable pour ce type de réseau. La U.S. EPA a toutefois déterminé que si le nombre de sites d'échantillonnage suggéré est composé de lieux à haut risque, l'échantillonnage sera alors suffisant pour dresser un tableau représentatif des concentrations de plomb dans le réseau (U.S. EPA, 1991b).
B.5.5 Détermination des protocoles d'échantillonnage et des niveaux d'intervention pour les programmes de surveillance non résidentielle
Les objectifs des protocoles d'échantillonnage et des niveaux d'intervention pour les sites non résidentiels, comme les services de garde, les écoles et les immeubles à bureaux, sont de localiser les problèmes particuliers de relargage de plomb dans les bâtiments et de déterminer les endroits où il doit intervenir ainsi que les mesures correctives à prendre. Ils visent à réduire le plus possible les concentrations de plomb aux sorties d'eau potable froide (c'est-à-dire les raccords et les appareils de plomberie comme les robinets et les fontaines) utilisées pour la boisson et la cuisine afin de protéger les occupants contre une exposition au plomb. Les protocoles d'échantillonnage et les niveaux d'intervention se fondent sur les variations observées dans les concentrations de plomb aux sorties d'eau des immeubles non résidentiels, variations qui dépendent des sources de plomb dans la plomberie ainsi que des modes d'utilisation de l'eau.
Dans certains cas, les autorités responsables peuvent juger souhaitable de prélever les échantillons pour les volets 1 et 2 en même temps afin de ne pas avoir à retourner sur un site. Il faut cependant savoir que le niveau de confiance dans les résultats de l'analyse de certains échantillons sera moindre, puisque le fait de purger une sortie d'eau peut influer sur les échantillons prélevés après la purge à d'autres sorties situées à proximité.
On prélève un échantillon de premier jet de 250 mL aux endroits désignés dans le plan d'échantillonnage, après stagnation de l'eau pendant au moins 8 heures, mais généralement pas plus de 24 heures. Pour que les échantillons recueillis soient représentatifs, l'aérateur ou la grille de la sortie d'eau ne doivent pas être retirés avant le prélèvement. Si la concentration de plomb est supérieure à 0,020 mg/L (niveau d'intervention pour le plomb) à l'un des endroits surveillés, des mesures correctives doivent alors être prises.
Le protocole d'échantillonnage du volet 1 a été utilisé dans des cadres non résidentiels pour localiser les problèmes particuliers de relargage de plomb, pour déterminer les méthodes d'intervention requises et pour démontrer l'efficacité de mesures correctives. Il existe de nombreuses études publiées portant sur la mise en oeuvre de programmes complets d'échantillonnage visant à mesurer les concentrations de plomb au robinet dans des écoles et d'autres immeubles non résidentiels. Ces études démontrent que le prélèvement d'échantillons de 250 mL après une période de stagnation d'au moins 8 heures, mais généralement pas plus de 24 heures, constitue un moyen efficace pour identifier les sorties d'eau qui présentent des concentrations élevées de plomb (Gnaedinger, 1993; Murphy, 1993; Maas et coll., 1994; Bryant, 2004; Boyd et coll., 2008a, b). Les auteurs de nombreuses études sont arrivés à déterminer au moyen de cette méthode d'échantillonnage la source du plomb dans les écoles et à élaborer des plans d'intervention (Boyd et coll., 2008a, b; U.S. EPA, 2008).
Tout comme dans le cadre d'un programme de surveillance résidentielle, chacun des éléments d'un protocole d'échantillonnage en milieu non résidentiel, comme la période de stagnation, le volume d'eau prélevé et le niveau d'intervention, a une incidence importante sur l'utilité des données recueillies. Étant donné que les objectifs du prélèvement d'échantillons dans des immeubles non résidentiels sont distincts de ceux du prélèvement d'échantillons dans un cadre résidentiel, le volume d'eau prélevé et les niveaux d'intervention sont également différents.
Les protocoles d'échantillonnage en milieu non résidentiel des volets 1 et 2 prescrivent le prélèvement d'un volume d'échantillon de 250 mL. Des études ont démontré que lors de l'évaluation de la quantité de plomb relarguée à partir de sorties d'eau comme les robinets de cuisine, plus de 95 % du plomb présent peut être mesuré dans les premiers 200 à 250 mL d'eau provenant d'un robinet (Gardels et Sorg, 1989). On a également constaté que les concentrations de plomb dans les immeubles non résidentiels diminuent généralement de façon importante après une purge de 30 secondes. Cette diminution laisse supposer que les fontaines et les robinets d'un immeuble non résidentiel, de même que les éléments de plomberie qui y sont raccordés, peuvent contribuer de façon importante aux concentrations élevées de plomb observées (Bryant, 2004; Boyd et coll., 2008a, b). Le prélèvement d'un volume plus important d'eau, un litre par exemple, toucherait ainsi une portion plus grande des éléments de plomberie en amont des sorties d'eau. Ces éléments de plomberie peuvent comprendre des vannes, des raccords en T et des joints soudés pouvant contribuer à la concentration de plomb de l'échantillon de 1 L. Il ne serait cependant pas possible de déterminer le matériau responsable de la libération du plomb. En outre, on suppose que le prélèvement d'une telle quantité d'eau à partir d'une fontaine d'eau potable pourrait diluer la concentration initialement mesurée à la sortie d'eau. Cette situation n'est pas souhaitable, car l'eau prélevée des sections de la plomberie situées plus loin de la sortie d'eau présente généralement des concentrations moins élevées (U.S. EPA, 2004b). On considère donc qu'il est important lors de la prise d'échantillons dans un immeuble non résidentiel de prélever des volumes d'eau moins grands (250 mL) que ceux normalement utilisés pour évaluer la corrosion interne des réseaux résidentiels (un litre ou plus). On préconise ainsi pour l'échantillonnage dans les immeubles non résidentiels un volume d'échantillon de 250 mL, puisqu'un tel volume correspond à l'eau provenant à la fois de l'appareil de plomberie (la fontaine ou le robinet) et d'une section plus courte de la plomberie, et qu'il permet par conséquent d'identifier avec une plus grande efficacité la source du plomb présent à la sortie d'eau (U.S. EPA, 1994a, 2006b).
Comme mentionné à la section B.5.2.1, des études cherchant à déterminer les sources du plomb dans l'eau du robinet ont montré que les soudures au plomb et les raccords en laiton contribuent de façon notable aux concentrations élevées de plomb mesurées après une période de stagnation (Lee et coll., 1989; Singh et Mavinic, 1991; AwwaRF, 2004; U.S. EPA, 2007). Ces études indiquent que selon l'âge et le type des matériaux, les concentrations de plomb augmentent de façon importante après des périodes de stagnation de 4 à 20 heures (Lytle et Schock, 2000). Le mode d'utilisation de l'eau dans un immeuble constitue donc un facteur important dans la détermination des concentrations de plomb au robinet. Étant donné que l'utilisation de l'eau est généralement intermittente dans les bâtiments non résidentiels, comme les services de garde, les écoles et les immeubles à bureaux, il est par conséquent important d'effectuer un prélèvement d'échantillons après une période de stagnation. La période de stagnation la plus prudente avant la prise d'échantillons se situe entre 8 et 18 heures, puisqu'il s'agit de la période la plus susceptible de permettre la mesure des concentrations maximales de plomb dans l'eau. Les échantillons précédés d'une première purge devraient donc être prélevés à la suite d'une période de stagnation de 8 heures au moins, et de 24 heures au plus, pour qu'ils soient représentatifs des périodes les plus longues durant lesquelles, au cours de la plupart des jours de la semaine, les robinets et les fontaines d'un immeuble non résidentiel ne sont pas utilisés pour boire.
Le niveau d'intervention de 0,020 mg/L est fondé sur le principe selon lequel le volume de l'échantillon de premier jet prélevé (250 mL) est moins important que les volumes d'eau normalement prélevés pour évaluer la corrosion dans les sites résidentiels, ces volumes étant généralement de 1 L ou plus. Il est impossible d'effectuer une comparaison directe entre les niveaux d'intervention pour les protocoles en milieu résidentiel et les niveaux d'intervention pour les protocoles en milieu non résidentiel. Toutefois, si des volumes d'eau supplémentaires sont prélevés après la prise du premier échantillon de 250 mL (des volumes de 250 à 1000 mL, par exemple), l'analyse de cette quantité plus importante d'eau risque, si le calcul est effectué en fonction d'un échantillon de 1 L, d'indiquer une concentration moindre. Ceci s'explique par le fait que les volumes prélevés consécutivement au premier échantillon de 250 mL seront susceptibles de contenir des concentrations de plomb inférieures à celui-ci et, par conséquent, d'avoir un effet de dilution (U.S. EPA, 2004b).
L'échantillonnage du volet 1 sert à déterminer les robinets et les fontaines d'un bâtiment qui sont susceptibles de contribuer aux concentrations élevées de plomb dans l'eau. Lorsqu'on observe des concentrations supérieures au niveau d'intervention de 0,020 mg/L, des mesures correctives provisoires doivent être prises afin de protéger la santé des populations qui sont sensibles dans des conditions d'exposition comme celles qu'on retrouve dans les immeubles non résidentiels. Les occupants du bâtiment ainsi que toute autre partie intéressée, comme les parents, devraient être informés des résultats des échantillonnages effectués dans ce bâtiment.
Afin de faciliter l'identification de la source du plomb aux sorties d'eau qui présentent des concentrations de plomb supérieures au niveau d'intervention fixé pour le volet 1, on prélève des échantillons de suivi de l'eau qui a reposé dans la plomberie en amont et non de l'eau présente dans la sortie d'eau elle-même. Les résultats peuvent ensuite être comparés afin d'évaluer les sources des concentrations élevées de plomb et de déterminer les mesures correctives qui s'imposent. Dans le but d'effectuer une comparaison des résultats, un deuxième échantillon de 250 mL est prélevé après une période de stagnation équivalente. L'eau qui a reposé dans la plomberie en amont d'une sortie d'eau peut être recueillie en prenant un échantillon de 250 mL après une période de stagnation minimale de 8 heures, mais ne dépassant généralement pas 24 heures, suivie d'une purge de 30 secondes. Les fontaines d'eau et les robinets d'eau froide qui présentent des concentrations dépassant le niveau d'intervention fixé pour le volet 1 sont échantillonnés de nouveau à la même saison durant la même année. Le niveau d'intervention fixé pour le volet 2 est également de 0,020 mg/L, car le volume d'échantillon retenu est aussi de 250 mL. On préconise une purge de 30 secondes, puisqu'une telle purge devrait normalement permettre l'évacuation de l'eau présente dans la sortie d'eau.
Si la concentration de plomb du deuxième échantillon de 250 mL est inférieure à 0,020 mg/L (niveau d'intervention pour le plomb), on pourra alors conclure que le plomb provient de la fontaine d'eau, du robinet d'eau potable froide ou de la plomberie à proximité. Si des concentrations de plomb supérieures à 0,020 mg/L (niveau d'intervention pour le plomb) sont mesurées dans les échantillons prélevés dans le cadre du volet 2, les sources du plomb peuvent alors inclure la plomberie qui se trouve derrière le mur, la sortie d'eau et la plomberie de l'immeuble combinées, ou l'entrée de service. Lorsque les concentrations de plomb dépassent le niveau d'intervention fixé pour le volet 2, il faut prendre des mesures correctives immédiates, déterminer les sources du plomb et mettre en oeuvre les mesures visant à remédier au problème.
Les résultats de l'échantillonnage effectué dans le cadre des volets 1 et 2 doivent être interprétés en fonction du profil de la plomberie, de manière à ce qu'il soit possible de déterminer les sources du plomb et de prendre les mesures correctives provisoires et à long terme qui s'imposent. Les autorités compétentes peuvent dresser le profil de la plomberie d'un immeuble à l'aide des questions présentées à la section C.6. Il est possible de consulter une autre source de référence (U.S. EPA, 2006b) pour obtenir de l'information sur un type différent d'échantillonnage permettant d'établir la source du plomb, si elle n'a pas été déterminée, ainsi que des renseignements détaillés sur la façon d'interpréter les résultats de l'échantillonnage réalisé dans le cadre des volets 1 et 2.
La teneur en plomb de l'eau potable acheminée aux immeubles non résidentiels par un réseau de distribution est généralement faible. On recommande de prélever lors de chaque visite de surveillance des échantillons à une sortie d'eau située près du point d'entrée de l'eau dans le bâtiment non résidentiel. Ces échantillons permettront de déterminer la concentration de plomb attribuable à l'entrée de service ou au réseau de distribution (conduite maîtresse). Idéalement, les échantillons devraient être prélevés après un temps de purge suffisant pour qu'ils soient représentatifs de l'eau provenant de l'entrée de service et de la conduite maîtresse. Le volume d'eau purgé dépendra des caractéristiques du système de plomberie du bâtiment, à savoir la distance entre l'entrée de service et la conduite maîtresse. Dans certains cas, par exemple lorsque le bâtiment est équipé d'une entrée de service en plomb, il peut être difficile d'obtenir un échantillon représentatif de l'eau arrivant de la conduite maîtresse en raison de l'apport de plomb provenant de l'entrée de service. Dans une telle situation, il faut choisir un emplacement de rechange pour effectuer l'échantillonnage.
La présence de concentrations élevées de plomb dans l'eau de bâtiments comme les écoles est habituellement attribuable à un relargage du plomb à partir des matériaux et des raccords de plomberie ainsi qu'aux modes d'utilisation de l'eau (U.S. EPA, 2006b; Boyd et coll., 2007; Pinney et coll., 2007). Diverses études évaluant les concentrations de plomb dans l'eau potable des fontaines et des robinets d'écoles au Canada et aux États-Unis ont démontré que les concentrations mesurées dans un même bâtiment peuvent varier de façon importante et présenter une distribution aléatoire (Boyd et coll., 2007; Pinney et coll., 2007). Une évaluation des concentrations de plomb dans l'eau d'écoles de Seattle (Washington) a montré que les échantillons de premier jet de 250 mL de 19 % des fontaines d'eau potable présentaient des concentrations supérieures à 0,020 mg/L (niveau d'intervention pour le plomb) (Boyd et coll., 2008a). La contamination au plomb était attribuable à la présence de tuyaux en acier galvanisé, de soudures plomb-étain (50/50) et de pièces en laiton comme des têtes de fontaine, des vannes, des bagues d'extrémité et des raccords flexibles. Il est donc important de mesurer les concentrations de plomb de l'eau des fontaines et des autres sorties d'eau destinée à la consommation dans les immeubles non résidentiels afin de déterminer s'il y a des concentrations élevées et de localiser les endroits où des mesures correctives s'imposent pour protéger la santé des occupants.
Bien qu'il existe peu de données sur la variabilité des teneurs en plomb dans l'eau des fontaines et des robinets des immeubles non résidentiels, des études ont montré qu'il est impossible de prédire la présence de concentrations élevées. Le nombre de sites à échantillonner dans un immeuble non résidentiel doit être établi dans le cadre de l'élaboration d'un plan d'échantillonnage. Un profil de la plomberie du bâtiment doit également être effectué afin d'estimer le potentiel de contamination par le plomb pour chaque fontaine et robinet d'eau potable froide, ainsi que chaque robinet utilisé pour la cuisine. Les autorités compétentes peuvent dresser le profil de la plomberie d'un bâtiment à l'aide des questions présentées à la section C.6. Les renseignements sur le profil de la plomberie d'un bâtiment pourront ensuite servir à l'élaboration d'un plan d'échantillonnage approprié pour le type de bâtiment évalué (par exemple, un service de garde, une école ou un immeuble à bureaux).
Les autorités responsables du maintien de la qualité de l'eau d'un immeuble non résidentiel devront effectuer un échantillonnage plus approfondi à chacune des sorties d'eau ciblées dans le plan d'échantillonnage élaboré pour l'immeuble en question. Le plan d'échantillonnage doit accorder la priorité aux fontaines d'eau potable et aux robinets d'eau froide destinée à la consommation ou utilisée pour la cuisine, en tenant compte des renseignements sur le profil de la plomberie concernant notamment, entre autres, les zones comprenant des tuyaux de plomb, les soudures, les raccords et les appareils de plomberie en laiton, les zones de stagnation de l'eau et les zones qui constituent des sources d'alimentation en eau pour les consommateurs, y compris les bébés, les enfants et les femmes enceintes.
Quand on prélève des échantillons aux robinets d'une cuisine d'un immeuble non résidentiel, il faut laisser les aérateurs et les grilles en place, et le débit de l'eau doit correspondre à celui normalement utilisé (environ 4 à 5 L/min). Toutefois, dans le cas des autres sorties d'eau telles les fontaines, le débit est habituellement moins grand et doit par conséquent être également moins grand durant l'échantillonnage. Ces précautions contribuent à garantir que chaque échantillon est représentatif de la qualité moyenne de l'eau provenant de la fontaine ou du robinet où il a été prélevé. Il est également important de signaler qu'une étude a permis de montrer que l'ouverture et la fermeture des robinets d'arrêt associés aux raccords et aux appareils de plomberie (robinets et fontaines) avant le prélèvement des échantillons contribuent à accroître les concentrations de plomb de façon notable (Seattle Public Schools, 2005). Après l'ouverture d'un robinet d'arrêt, les sorties d'eau doivent être complètement purgées avant qu'on puisse laisser reposer l'eau dans les tuyaux pour la période de stagnation requise.