Page 4 : Recommandations pour la qualité de l'eau potable au Canada : document technique – acide (4-chloro-2-méthylphénoxy) acétique (MCPA)
9.0 Effets sur la santé
9.1 Effets chez les humains
La dose orale létale la plus faible à avoir été publiée pour le MCPA chez les humains est de 814 mg/kg p.c. (RTECS, 2005). Des symptômes d'exposition aiguë à de fortes doses de MCPA ont été signalés à la suite de l'intoxication causée par une ingestion accidentelle et une exposition accidentelle durant la fabrication ou l'application du produit sur le terrain. Au nombre des symptômes figuraient la fatigue, la faiblesse, l'anoxie, les nausées, les vomissements, la diarrhée, la baisse de la pression artérielle, les troubles de la régulation de la température corporelle, l'hypotension progressive, l'ataxie, l'irritabilité neuromusculaire et les convulsions (Popham et Davis, 1964; Johnson et Koumides, 1965; Jones et coll., 1967; Palva et coll., 1975; Bovey, 1980b; Timonen et Palva, 1980; U.S. EPA, 1984).
Diverses études épidémiologiques ont été effectuées sur les herbicides de type phénoxy au Canada, aux États-Unis, en Australie, en Nouvelle-Zélande et dans plusieurs pays européens. La plupart des études épidémiologiques menées jusqu'à présent ont porté sur des expositions multiples à divers herbicides chlorophénoxy, principalement le 2,4-D et l'acide trichloro-2,4,5 phénoxyacétique (2,4,5-T), ainsi qu'à d'autres pesticides, à des matières premières, à des intermédiaires et à des produits chimiques pour la transformation. On a signalé que certains herbicides phénoxy, tels que le 2,4,5-T, avaient été contaminés par des dioxines et des furannes durant la production, mais il a été établi que le MCPA n'avait pas été contaminé par la dioxine (Wiklund et coll., 1988; Eriksson et coll., 1990; Mannetje et coll., 2005). La controverse perdure quant à savoir si la présence de dioxine a accru le risque de certains cancers. Des cas de sarcome des tissus mous (STM), de lymphome non hodgkinien (LNH) et de maladie de Hodgkin ont été associés à des herbicides phénoxy, y compris à certains qui avaient été contaminés par de la dioxine; mais les résultats étaient contradictoires (Mannetje et coll., 2005).
Certaines de ces études épidémiologiques ont examiné entre autres herbicides le MCPA (Hardell et Sandström, 1979; Eriksson et coll., 1981; Hardell et coll., 1981; Vineis et coll., 1986, 1991; Wiklund et coll., 1987, 1988, 1989; Eriksson et coll., 1990; Saracci et coll., 1991; Bueno de Mesquito et coll., 1993; Becher et coll., 1996; Lynge, 1998); toutefois, rares sont les études qui ont fait état d'effets propres au MCPA (et aux composés apparentés). Il est par conséquent difficile de déterminer l'exposition au MCPA pris isolément. Ces études, comme indiqué plus bas, sont limitées, vu que les échantillons prélevés étaient de petite taille, qu'il s'est probablement produit une co-exposition à d'autres pesticides, et qu'on ne dispose pas d'informations détaillées sur la dose utilisée ou la durée d'application des pesticides. Des études plus déterminantes avec une évaluation exacte de l'exposition au MCPA sont nécessaires.
Une étude cas-témoins en population effectuée dans le nord et le centre de la Suède a examiné l'association potentielle entre l'exposition à un groupe de plusieurs classes de pesticides, y compris le MCPA, et le risque de LNH. 404 cas de LNH chez les hommes ont été sélectionnés entre 1987 et 1990, de même qu'un nombre deux fois plus élevé de témoins. Les auteurs ont constaté que parmi les pesticides examinés, les herbicides étaient associés de façon marginale au LNH, le rapport de cotes (RC) étant de 1,6 % et l'intervalle de confiance à 95 % (IC) de 1,0 à 2,5; toutefois, l'échantillon était de petite taille (61 cas et 81 témoins). Une analyse plus approfondie portant sur des sujets exposés à des classes particulières d'herbicides a révélé que le groupe des acides phénoxyacétiques prédominait, le RC étant de 1,5 (IC = 0,9-2,4), ce qui n'était pas significatif. Dans le groupe des acides phénoxyacétiques, le MCPA présentait un RC de 2,7 (IC = 1,0-6,9). Vu le petit nombre de cas exposés au MCPA et de témoins (12 cas et 11 témoins), les résultats obtenus ne sont pas très fiables (Hardell et Eriksson, 1999).
Deux études cas-témoins emboîtées et portant sur les STM et les LNH ont été effectuées chez une cohorte internationale de travailleurs exposés aux herbicides phénoxy, aux chlorophénols et à la dioxine de même qu'à d'autres pesticides dans leur milieu de travail (Kogevinas et coll., 1995). Ces études ont révélé un excès de risque de STM chez les travailleurs exposés à tout herbicide phénoxy (RC = 10,3; IC = 1,2-90,6; 10 cas de STM chez les personnes exposées c. 30 témoins) et à chacune des trois principales classes d'herbicides phénoxy, y compris la classe du MCPA, MCPP [acide (±)-2-(4-chloro-2-méthylphénoxy)propanoïque ou mecoprop] et du MCPB; RC = 11,3; IC = 1,3-98; 10 cas chez les personnes exposées c. 29 témoins). L'association pour les LNH était plus faible que pour les STM; aucun risque excédentaire n'était étroitement associé à l'une des expositions. Selon les auteurs, il est compliqué d'évaluer l'effet indépendant de chaque herbicide ou contaminant sur le risque de cancer, vu que les travailleurs sont rarement exposés à un seul herbicide. Ces chercheurs n'ont relevé aucune association spécifique entre le risque et les herbicides contaminés par la dioxine.
Une étude de cohorte a été effectuée au Danemark sur les effets sur la santé liés à une exposition potentielle à des herbicides de 4 461 sujets (3 390 hommes et 1 071 femmes) ayant travaillé entre 1947 et 1993 dans deux usines de production d'herbicides phénoxy. Le MCPA, l'acide 2-(2,4-dichlorophénoxy)propanoïque (2,4-DP ou dichlorprop) et le MCPP étaient les principaux herbicides produits dans ces usines, mais d'autres composés, notamment des colorants et des pigments, y étaient également fabriqués (Lynge, 1993, 1998). Une augmentation non significative par un facteur de deux du risque de STM a été observée chez les personnes potentiellement exposées aux herbicides phénoxy par rapport à la population danoise; quatre cas ont été observés alors qu'on en attendait 1,68 (rapport standardisé d'incidence = 2,38; IC = 0,7-6,1). Aucune surincidence de LNH n'a été observée chez les travailleurs potentiellement exposés aux herbicides phénoxy par rapport à la population danoise générale. Le risque global de cancer était similaire dans la population danoise générale et chez les travailleurs. Toutefois, il n'a pas été possible de déterminer la contribution du MCPA, en raison de l'exposition à de multiples herbicides. Selon les auteurs, les observations relevées (bien que fondées sur des nombres peu élevés) continuent d'indiquer une association possible entre l'exposition au MCPA et l'exposition à d'autres herbicides phénoxy apparentés, tels que le MCPP et le 2,4-DP, et le risque de STM. Des études cas-témoins antérieures sur les herbicides phénoxy effectuées en Suède par Eriksson et coll. (1981) et Hardell et coll. (1981) évoquaient une association possible (c.-à-d. une augmentation du risque) entre les STM et l'exposition aux herbicides phénoxy de même qu'aux chlorophénols et à leurs contaminants.
Dans une autre étude de cohorte (1947-1975), la mortalité et l'incidence du cancer ont été examinées chez 5 754 travailleurs d'une usine britannique qui fabriquait, formulait et pulvérisait surtout du MCPA, mais aussi d'autres produits chimiques à usage agricole durant la même période (Coggon et coll., 1986). La mortalité générale de même que la mortalité par cancer étaient inférieures aux prévisions basées sur les taux nationaux; lorsqu'un facteur de correction pour les milieux ruraux a été appliqué, la sous-mortalité par cancer a été remplacée par une légère surmortalité, qui n'était cependant pas significative sur le plan statistique. Seul un décès dû à un STM a été observé dans cette étude, comparativement au nombre prévu de 0,9 dans la cohorte complète et à 0,6 chez les travailleurs potentiellement exposés aux acides phénoxy. Les taux de mortalité par maladie de Hodgkin et LNH étaient inférieurs à ce que laissaient prévoir les taux nationaux. Les auteurs ont conclu que s'il existe un risque de STM associé au MCPA, il est inférieur à ce que suggéraient les études antérieures sur le 2,4,5-T et le 2,4,5-trichlorophénol, et est faible en termes absolus.
En raison de la petite taille de la plupart des cohortes, on ne peut pas trop se fier aux résultats obtenus, tant positifs que négatifs.
Bien que plusieurs études épidémiologiques aient été effectuées sur les effets d'une exposition aux pesticides sur la reproduction et le développement, seules quelques-unes ont porté sur le MCPA et sont décrites ci-dessous.
Une étude a tenté d'analyser l'effet de l'exposition aux pesticides sur le risque d'avortement spontané dans la population agricole de l'Ontario (Arbuckle et coll., 1999). Un questionnaire a été utilisé pour recueillir de l'information auprès de 2 110 femmes concernant 3 936 grossesses, dont 395 s'étaient soldées par un avortement spontané. Les périodes d'exposition avant la conception (période de quatre mois allant du troisième mois avant la conception au mois civil de la conception) et après la conception (période de quatre mois à partir du mois civil de la conception jusqu'à la fin du premier trimestre) ont été examinées séparément, et les avortements spontanés précoces (< 12 semaines) et tardifs (12-19 semaines) ont été distingués pour les mêmes périodes d'exposition. Les résultats ont mis en évidence un faible lien entre le risque d'avortement précoce et une exposition avant la conception à tout type d'herbicide phénoxy (RC ajusté = 1,1; IC = 0,6-1,9). Toutefois, lorsque l'analyse était limitée aux avortements précoces, le RC ajusté passait à 2,5 (IC = 1,0-6,4), alors que le RC ajusté pour les avortements tardifs tombait à 0,4 (IC = 0,2-1,0). Lorsqu'on tenait compte dans l'analyse de l'utilisation d'équipement ou de vêtements de protection chez les opérateurs antiparasitaires de sexe masculin exposés à un herbicide phénoxy, le RC (pour tous les avortements spontanés ou pour le sous-groupe des avortements précoces) était inférieur à 1 chez les hommes qui disaient utiliser ces formes de protection. En revanche, le RC était beaucoup plus élevé dans le sous-groupe des avortements spontanés précoces lorsque les hommes n'avaient pas utilisé d'équipement ou de vêtements protecteurs durant leur exposition. Lorsque l'analyse se limitait à une exposition au MCPA, on n'a observé aucune élévation du risque d'avortement spontané dû à une exposition avant la conception quel que soit l'âge gestationnel; le RC ajusté était de 0,8 (IC = 0,4-1,7). Par contre, le RC ajusté pour le MCPA dans le cas des avortements précoces a augmenté à 2,3 (IC = 0,8-6,5), alors que le RC ajusté pour les avortements tardifs a baissé à 0,4 (IC = 0,1-1,2). Une analyse plus approfondie a fait ressortir que si l'exposition avant la conception au MCPA durait un mois ou plus, le RC ajusté atteignait 5,4 (IC = 1,7-17,3) pour les avortements précoces; le RC était inférieur à 1 pour les avortements tardifs après une exposition au MCPA ainsi qu'à tous les autres herbicides phénoxy analysés.
L'étude (Arbuckle et coll., 1999) comporte un certain nombre de limites, notamment les suivantes : échantillon de petite taille (p. ex. groupe non exposé, sous-groupe exposé au MCPA), rappel du passé (qualité de l'information limitée par la mémoire des répondants et par la longue période de rappel pour l'usage des pesticides, en général plus de 10 ans) et aucune information détaillée sur la dose utilisée et le temps passé à appliquer des pesticides. Selon les auteurs, les résultats de l'étude indiquent que l'exposition avant la conception au MCPA et aux herbicides phénoxy peut avoir un effet indésirable sur la grossesse, entraînant en particulier des avortements spontanés précoces (pouvant évoquer un effet médié par l'homme en raison du risque plus élevé associé à la non-utilisation d'équipement ou de vêtements protecteurs). Compte tenu des limites de l'étude, cependant, d'autres études s'imposent pour confirmer ces résultats.
Afin d'évaluer si les enfants d'opérateurs antiparasitaires agricoles courent un plus grand risque d'anomalies congénitales, Garry et coll. (1996) ont comparé les naissances (n = 4 935) chez les opérateurs antiparasitaires privés titulaires d'un permis délivré par l'État (n = 34 772) au Minnesota entre 1989 et 1992 avec celles figurant dans le registre de naissances de l'État (contenant 210 723 naissances vivantes pour la même période). Le taux de malformations pour tous les types d'anomalies congénitales était significativement plus élevé chez les enfants des opérateurs antiparasitaires privés. La tendance relative à la surincidence des anomalies congénitales a été analysée selon la région, l'utilisation de pesticides, la saison et le ratio hommes/femmes. Les analyses portant sur les diverses régions ont montré que l'ouest du Minnesota, une importante région productrice de blé, de betteraves à sucre et de pommes de terre, affichait le taux le plus élevé d'anomalies congénitales pour 1 000 naissances vivantes. Les données pour le MCPA et le 2,4-D ont été regroupées en raison de leurs similarités pour ce qui est de leur structure chimique, de leur spectre d'activité biocide et de leur utilisation dans les cultures, bien que le 2,4-D soit davantage employé que le MCPA. Dans le cas du 2,4-D et du MCPA, la fréquence des anomalies dans les régions où ces produits étaient abondamment utilisés n'était pas significativement plus grande (RC = 1,86; IC = 0,69-2,05) pour les anomalies congénitales combinées du système nerveux central, de l'appareil circulatoire/respiratoire et les anomalies urogénitales et musculaires. Cependant, une augmentation significative a été signalée lorsque toutes les anomalies sont combinées (RC = 1,51; IC = 1,40-1,62). Aucune donnée individuelle n'était disponible pour le MCPA dans cette étude de cohorte (Garry et coll., 1996).
Rares sont les études épidémiologiques qui ont été effectuées sur les effets du MCPA sur la reproduction et le développement, et celles qui ont été menées ont une portée limitée à cause de la petite taille de leur échantillon. Comme les travailleurs peuvent être exposés à plusieurs herbicides phénoxy, à d'autres composés et peut-être à des contaminants comme la dioxine, il est difficile d'isoler l'exposition au seul MCPA.
Une autre des limites importantes des études susmentionnées tenait au fait qu'il existait uniquement une possibilité d'exposition; dans aucune d'entre elles on n'a mesuré directement l'exposition des sujets étudiés.
9.2 Effets sur les animaux de laboratoire et les systèmes d'essai in vitro
9.2.1 Toxicité aiguë
On trouvera au tableau 3 des détails sur les études disponibles sur la toxicité orale aiguë.
| Formes de MCPA | DL50 orale (mg/kg p.c.)Note de bas de page 1 | ||
|---|---|---|---|
| Rats | Souris | Cobayes | |
| MCPA, forme acide | 700-1 383Note de bas de page 2Note de bas de page 3Note de bas de page 4Note de bas de page 5 | 439-800Note de bas de page 6Note de bas de page 7 | 700Note de bas de page 8 |
| MCPA-EHE | 2 235Note de bas de page 4 | ||
| MCPA-DMAS | 1 200-1 867Note de bas de page 3Note de bas de page 4 | 550Note de bas de page 8 | |
| Sel de sodium de MCPA | 3 500Note de bas de page 4 | 560Note de bas de page 8 | |
Notes de bas de page
|
|||
9.2.2 Études sur l'exposition de courte durée
Des études de courte durée ont été effectuées sur les effets du MCPA, du MCPA-DMAS et du MCPA-EHE chez les souris, les rats et les chiens. Des effets indésirables ont été relevés au niveau du foie et du rein. De façon générale, les chiens semblent être plus sensibles que les rats aux effets indésirables du MCPA après une exposition répétée. Selon la U.S. EPA (2003, 2004e), cette sensibilité accrue semble résulter de la diminution de la capacité d'élimination du MCPA chez les chiens par rapport aux rats.
Dans une étude de toxicité orale de 28 jours visant à établir les doses, du MCPA (94,8 %) a été administré à des souris (4-6 souris par sexe par dose) dans leur ration à raison de 0, 100, 300, 900 ou 2 700 ppm (équivalant à des doses de 0, 19,1-22,0, 56,3-67,7, 173,4-184,8 ou 453,7-820,1 mg/kg p.c. par jour chez les mâles et 0, 20,7-26,2, 69,2-73,9, 193,4-223,9 ou 442,3-956,3 mg/kg p.c. par jour chez les femelles). Des effets ont été observés à la plus forte dose chez les deux sexes, notamment les suivants : troubles moteurs, perte de poids cumulative importante, hépatotoxicité (augmentation de l'activité alanine aminotransférase [ALT] et de l'activité phosphatase alcaline [PA] dans le sérum, augmentation du poids du foie et signes histopathologiques connexes), effets sur la rate (diminution du poids moyen des rates, signes macroscopiques d'involution, nombre accru de polynucléaires neutrophiles et baisse du nombre de lymphocytes) et diminution du poids des reins. Chez les mâles qui avaient reçu une forte dose, on observait une baisse du poids moyen des testicules accompagnée de signes histopathologiques d'atrophie testiculaire, alors que chez les femelles, on relevait une atrophie des ovaires et des glandes utérines. L'autopsie a révélé que les animaux ayant reçu une forte dose souffraient de cachexie (état de mauvaise santé générale caractérisée par la malnutrition, la faiblesse et l'émaciation). Des effets au niveau du foie (dégénérescence albumineuse) ont été observés chez une femelle ayant reçu une dose moyenne. Chez les souris femelles, la dose minimale avec effet nocif observé (LOAEL) a été établie à 900 ppm (193,4-223,9 mg/kg p.c. par jour) d'après la dégénérescence albumineuse dans le foie, et la dose sans effet nocif observé (NOAEL) était de 300 ppm (69,2-73,9 mg/kg p.c. par jour). Chez les souris mâles, la LOAEL était de 2 700 mg/kg (453,7-820,1 mg/kg p.c. par jour) et la NOAEL de 900 ppm (173,4-184,8 mg/kg p.c. par jour) (Kirsch, 1985a). La plus forte dose utilisée dans cette étude se situait dans les limites de la DL50 pour les souris, ce qui peut expliquer les effets importants enregistrés à cette dose.
Des effets sur le rein ont également été signalés dans des études de 90 jours portant sur des rats. Du MCPA de qualité technique (94,8 %) a été administré à des rats (15 rats par sexe par dose) dans leur ration à raison de 0, 50, 150 ou 450 ppm (équivalant à des doses de 0, 3,6, 10,9 ou 32,6 mg/kg p.c. par jour pour les mâles et de 0, 4,0, 12,1 ou 35,8 mg/kg p.c. par jour pour les femelles). À 450 ppm, les taux de créatinine étaient augmentés dans le plasma des femelles. Au même niveau de dose, les taux de cholestérol et de calcium accusaient une baisse chez les mâles. Les auteurs ont mentionné que ces effets étaient difficiles à évaluer vu qu'ils n'étaient survenus que chez les mâles. Ils ont également observé une augmentation du poids absolu et relatif des reins chez les mâles. À 150 ppm, le poids absolu des reins était accru (108 % par rapport aux témoins) (p < 0,05). Aucun changement n'a été observé au niveau le plus faible (50 ppm). Selon les auteurs, la NOAEL se situe entre 50 et 150 ppm et se fonde sur l'atteinte rénale liée au calcium et aux changements dans le poids des reins, mais aucune altération histopathologique n'a été détectée en corrélation avec cette augmentation du poids des reins (Kirsch, 1985b). Dans cette même étude, l'ARLA (2007) a établi une NOAEL de 3,6 mg/kg p.c. par jour et une LOAEL de 10,9 mg/kg p.c. par jour en fonction des effets du MCPA sur le rein (augmentation du poids relatif et absolu, bilirubine, cristaux et pH urinaires).
Dans une étude combinée de la toxicité subchronique et de la neurotoxicité, du MCPA (94,2 %) a été administré à des groupes de 15 rats Wistar mâles et 15 rats Wistar femelles pendant trois mois à des concentrations alimentaires de 0, 50, 500 ou 2 500 ppm (équivalant à des doses de 0, 3, 34 ou 177 mg/kg p.c. par jour pour les mâles et de 0, 4, 42 ou 188 mg/kg p.c. par jour pour les femelles) (Mellert et coll., 1994). À la dose la plus forte, une diminution significative du poids corporel a été observée chez les rats des deux sexes à partir du 7e jour suivant l'administration et jusqu'à la fin de l'étude. À la dose la plus forte, on a relevé chez les deux sexes une diminution significative des paramètres hématologiques (hématies, hémoglobine et hématocrite), une augmentation significative des enzymes hépatiques (ALT, PA et aspartate aminotransférase [AST]) et une altération des hépatocytes, caractérisée par une éosinophilie cytoplasmique et un cytoplasme granulaire dans le foie. De plus, on a observé une augmentation du nombre ou un changement du type de cellules spumeuses dans le poumon et une atrophie myéloïde de la moelle hématopoïétique chez les deux sexes. Chez les mâles ayant reçu une forte dose, l'étude a mis en évidence une diminution du poids des testicules, une atrophie testiculaire, une atrophie des vésicules séminales et de la prostate, ainsi qu'une aspermie ou une oligospermie dans l'épididyme. Dans le cadre de l'évaluation de la neurotoxicité, une batterie d'essais d'observation fonctionnelle et des évaluations de l'activité motrice ont été effectuées sur 10 animaux par groupe et par sexe avant le traitement et les jours 22, 50 et 85 du traitement. Les effets suivants ont été observés à 2 500 ppm : diminution de la force des pattes arrière chez les femelles le jour 85; diminution de l'étalement du pied posé sur le sol (p < 0,02) chez les mâles le jour 22; baisse (p < 0,02) de la force de préhension des pattes avant chez les mâles le jour 50. Aucun changement significatif lié au traitement n'a été observé aux deux doses les plus faibles. La U.S. EPA a établi la NOAEL à 500 ppm (34 et 42 mg/kg p.c. par jour pour les mâles et les femelles, respectivement) et la LOAEL à 2 500 ppm (177 et 188 mg/kg p.c. par jour chez les mâles et les femelles, respectivement), d'après la réduction du poids corporel et les gains de poids corporel, la pathologie du foie, les changements dans les paramètres biochimiques et hématologiques, l'atrophie testiculaire et les changements dans l'activité motrice.
La U.S. EPA (2004e) a jugé que le MCPA était neurotoxique à la lumière des signes cliniques de neurotoxicité relevés dans l'étude de Mellert et coll. (1994) et dans une étude de neurotoxicité aiguë menée chez des rats (U.S. EPA, 2003). D'autres études (études de toxicité orale aiguë et subchronique) portant sur le MCPA-DMAS et le MCPA-EHE chez les rats ont également mis en évidence des effets neurotoxiques indésirables, le MCPA-EHE étant la plus toxique des trois formes de MCPA (U.S. EPA, 2004e). Au nombre des effets neurotoxiques observés dans ces études figuraient des troubles de la coordination et de la démarche, une réduction de l'activité motrice, une ataxie (manque de coordination musculaire), une diminution du niveau de vigilance et une réduction de la force de préhension des pattes arrière.
Du MCPA a été administré dans la ration alimentaire de rats Charles River (10 par sexe par dose) à raison de 0, 4, 8 ou 16 mg/kg p.c. par jour pendant 90 jours. Aucun effet lié au traitement n'a été relevé, à part une augmentation significative du poids relatif et absolu des reins chez les mâles à la dose la plus forte, les augmentations étant modérées aux deux autres doses chez les mâles. On n'a observé aucune altération histopathologique liée au traitement chez les rats des deux sexes, peu importe la dose. La dose sans effet observé (NOEL) sur l'augmentation du poids des reins chez les rats était de 8 mg/kg p.c. par jour (Holsing et Kundzin, 1970).
Dans deux études indépendantes d'une durée de 90 jours, on a ajouté à la ration alimentaire de chiens beagle (quatre par sexe par dose) du MCPA de qualité technique (94,8 %) à des doses de 0, 3, 12 ou 48 mg/kg p.c. par jour et de 0, 0,3, 1 ou 12 mg/kg p.c. par jour, respectivement. Une toxicité grave et des décès ont été observés à la dose la plus élevée (48 mg/kg p.c. par jour) : une femelle est morte durant la semaine 5, et les trois autres femelles et trois des quatre mâles ont été sacrifiés à l'état moribond durant les semaines 7 et 8. Une diminution de la fonction rénale et hépatique, caractérisée par une augmentation des taux d'urée et de créatinine et de l'activité ALT dans le sang, a été notée aux doses égales et supérieures à 3 mg/kg p.c. par jour. Dans cette étude, on a établi la NOAEL à 1 mg/kg p.c. par jour, et la LOAEL à 3 mg/kg p.c. par jour, d'après la perturbation de la fonction rénale non accompagnée de changements histopathologiques. Cette absence de changements histopathologiques indique probablement que les effets sont réversibles (Reuzel et Hendriksen, 1980).
Dans une étude d'une durée d'un an, on a ajouté à la ration alimentaire de chiens beagle mâles et femelles (six par sexe par dose) du MCPA de qualité technique (94,8 %) à des concentrations de 0, 6, 30 ou 150 ppm (équivalant à des doses de 0, 0,22, 1,02 ou 5,32 mg/kg p.c. par jour chez les mâles et de 0, 0,21, 1,02 ou 5,12 mg/kg p.c. par jour chez les femelles) (Hellwig, 1986). Aucun signe clinique ni décès liés au traitement n'ont été observés durant l'étude. Chez les mâles ayant reçu la dose élevée, le gain de poids cumulatif moyen observé entre le jour 1 et le jour 364 était de 77 % par rapport aux témoins. À la dose élevée (chez les deux sexes), on a observé des hausses statistiquement significatives du taux sérique de créatinine (aux semaines 13, 26 et 52 ) et de l'activité ALT et AST dans le sérum à la plupart des intervalles d'échantillonnage. À la nécropsie, l'examen macroscopique a révélé une coloration brun foncé du rein chez quatre des six femelles ayant reçu la dose moyenne, chez quatre des six mâles ayant reçu la dose élevée et chez toutes les femelles ayant reçu la dose élevée. Des changements histopathologiques du rein ont été notés, notamment une augmentation liée à la dose du dépôt d'un pigment dans l'épithélium des tubes proximaux du rein chez toutes les femelles et trois des six mâles ayant reçu la dose élevée et chez quatre des femelles ayant reçu la dose moyenne. Aucun effet lié au traitement n'a été observé à la faible dose (Hellwig, 1986). En s'appuyant sur cette étude, la U.S. EPA (2003) a fixé la NOAEL à 6 ppm (0,22 et 0,21 mg/kg p.c. par jour, respectivement, pour les mâles et les femelles) et la LOAEL à 30 ppm (1,02 mg/kg p.c. par jour chez les deux sexes), d'après la néphrotoxicité (changements macroscopiques à la nécropsie et changements histopathologiques).
Deux études de toxicité subchronique ont aussi été menées avec les autres formes de MCPA. Du MCPA-DMAS (99,9 % d'ingrédient actif) a été administré à des chiens beagle à des concentrations alimentaires de 0, 20, 80 ou 360 ppm (équivalant à des doses de 0, 0,6, 2,4 et 10,9 mg/kg p.c. par jour chez les mâles et de 0, 0,7, 2,9 et 12,8 mg/kg p.c. par jour chez les femelles) pendant une période de 110 à 118 jours (Hellwig et coll., 1995a). À la dose la plus forte, on a noté chez les deux sexes une hausse des taux de créatinine, d'urée et d'ALT et, chez les mâles, un allongement du temps de thromboplastine partielle. À 80 ppm, les taux de créatinine et d'urée étaient plus élevés chez les deux sexes, alors que la hausse du taux d'ALT et l'allongement du temps de thromboplastine partielle n'ont été observés que chez les femelles. L'augmentation du taux d'ALT était reliée à une inflammation interstitielle subaiguë à chronique du foie. Aucun changement significatif n'a été observé aux faibles doses chez les deux sexes. La U.S. EPA (2003) a fixé la LOAEL à 80 ppm (2,4 mg/kg p.c. par jour chez les mâles et 2,9 mg/kg p.c. par jour chez les femelles), d'après les changements histopathologiques (accrus en cas d'inflammation interstitielle subaiguë à chronique du foie), hématologiques et biochimiques, et la NOAEL à 20 ppm (0,6 mg/kg p.c. par jour chez les mâles et 0,7 mg/kg p.c. par jour chez les femelles). Aucun détail statistique n'était fourni dans la revue.
Des chiens beagle ont reçu du MCPA-EHE (93,5 % d'ingrédient actif) à des concentrations alimentaires de 0, 20, 80 ou 360 ppm (l'équivalent de 0, 0,6, 2,5 ou 11,1 mg/kg p.c. par jour chez les mâles et de 0, 0,7, 2,8 ou 12,7 mg/kg p.c. par jour chez les femelles) pendant une période de 110 à 118 jours. Les doses administrées représentaient l'équivalent de 0, 0,4, 1,6 ou 7,1 mg/kg p.c. par jour et 0, 0,4, 1,8 ou 8,1 mg/kg p.c. par jour de MCPA sous forme d'acide respectivement chez les mâles et les femelles. À la dose de 360 ppm, on a relevé chez les deux sexes une hausse des paramètres biochimiques (créatinine, urée et ALT), un allongement du temps de thromboplastine partielle ainsi qu'une augmentation du poids relatif et absolu de la thyroïde et du poids relatif des ovaires (femelles). La hausse du taux d'ALT était reliée à une inflammation interstitielle subaiguë à chronique du foie. À la dose de 80 mg/kg, les deux sexes présentaient une augmentation des taux de créatinine et d'urée et, chez les femelles, le taux d'ALT était également augmenté. Aucune modification associée au traitement n'a été observée à la faible dose chez les deux sexes. La U.S. EPA (2003) a fixé la LOAEL associée à la toxicité générale chez les beagles à 80 ppm (1,6 mg/kg p.c. par jour de MCPA sous forme d'acide chez les mâles et 1,8 mg/kg p.c. par jour chez les femelles), d'après les modifications des paramètres biochimiques (hausse des taux de créatinine, d'urée et d'ALT). La NOAEL est de 20 ppm (0,4 mg/kg p.c. par jour de MCPA sous forme d'acide chez les deux sexes) (Hellwig et coll., 1995b). Aucun détail statistique n'a été fourni durant l'examen.
9.2.3 Exposition de longue durée (toxicité chronique) et cancérogénicité
Des études d'exposition de longue durée et de cancérogénicité ont été menées chez le rat et la souris concernant le MCPA. Aucun signe de cancérogénicité n'a été observé chez ces deux espèces; toutefois, chez le rat et la souris, des effets indésirables sur le foie et le rein semblables à ceux observés dans les études de toxicité subchronique ont été notés avec des doses comparables. Aucune étude de longue durée chez le chien n'a été recensée.
On a ajouté pendant deux ans à la ration alimentaire de rats Wistar (50 par sexe par dose) du MCPA (94,8 %) à raison de 0, 20, 80 ou 320 ppm (équivalant à des doses de 0, 1,1, 4,4 ou 17,6 mg/kg p.c. par jour chez les mâles et de 0, 1,4, 5,7 ou 23 mg/kg p.c. par jour chez les femelles) (Kirsch, 1988; Bellet et coll., 1999). Deux groupes satellites (n = 10-15 par sexe par dose et par groupe) ont aussi été étudiés. Aucun effet lié au traitement n'a été noté à la dose de 20 ppm. Des modifications biochimiques ont été observées chez les deux sexes à la dose de 80 ppm, mais sans aucun changement histopathologique. Les effets associés à la dose élevée comprenaient une diminution minime du poids corporel chez les mâles (au jour 14 et après; p < 0,05) et une augmentation légère mais sporadique du poids corporel chez les femelles (p < 0,05). Le taux de triglycérides était significativement réduit chez les mâles aux semaines 78 et 104, et le taux d'ALT était élevé chez les femelles aux semaines 52, 78 et 104. À la dose élevée, chez les rats mâles, des changements macroscopiques et microscopiques à l'examen pathologique témoignaient d'une néphropathie chronique progressive se manifestant par une augmentation de la rétraction et de la surface glandulaire du rein. Aux doses administrées, on n'a observé aucune hausse liée au traitement de l'incidence des tumeurs, comparativement aux témoins. Les auteurs ont indiqué que la NOEL générale était de 20 ppm (1,1 mg/kg p.c. par jour chez les mâles et 1,4 mg/kg p.c. par jour chez les femelles). Cependant, la U.S. EPA (2003) a fixé la NOAEL relative à la toxicité générale à 80 ppm (4,4 mg/kg p.c. par jour chez les mâles et 5,7 mg/kg p.c. par jour chez les femelles) et la LOAEL à 320 ppm (17,6 mg/kg p.c. par jour chez les mâles et 23 mg/kg p.c. par jour chez les femelles), d'après l'hépatotoxicité (hausse du taux d'ALT) chez les femelles et les effets rénaux chez les mâles. Cependant, l'ARLA (2005b, 2006) a estimé que cette étude n'avait pas utilisé des doses suffisamment élevées pour atteindre la dose maximale tolérée (DMT) et que, par conséquent, elle ne permettait pas d'évaluer pleinement le pouvoir oncogène global du MCPA.
Des souris B6C3F1 (50 par sexe par dose) ont reçu pendant deux ans dans leurs rations alimentaires du MCPA (94,6 %) à raison de 0, 20, 100 ou 500 ppm, soit l'équivalent de doses de 0, 3,2, 15,7 ou 79,5 mg/kg p.c. par jour chez les mâles et de 0, 3,9, 19,5 ou 97,2 mg/kg p.c. par jour chez les femelles (Kuhborth et coll.,1988; Bellet et coll., 1999). Un groupe satellite (n = 10 par sexe par dose) a été utilisé pour les analyses hématologiques. Des modifications du poids corporel ont été observées chez les deux sexes durant l'étude; toutefois, le poids corporel final des mâles et des femelles n'était pas statistiquement différent de celui des témoins. Le rein était le seul organe qui présentait des lésions associées au traitement. On a noté une hausse statistiquement significative du poids des reins chez les femelles ayant reçu la dose élevée. Pour ce qui est des lésions rénales, on a notamment observé une incidence accrue de la calcification intratubulaire et la présence de cylindres hyalins tubulaires chez les mâles et les femelles ayant reçu la dose élevée. Chez les femelles ayant reçu la dose moyenne ou la dose élevée, on a noté une hausse non reliée à la dose de l'incidence de l'hyperplasie rénale légère (7/50 et 4/50, respectivement) comparativement aux témoins et aux femelles ayant reçu la faible dose, à laquelle aucune hyperplasie n'a été observée. De plus, chez les mâles ayant reçu la dose élevée, on a noté une incidence accrue de l'hyperplasie focale de l'épithélium tubulaire rénal (signification statistique non précisée). L'auteur a indiqué que la NOEL générale était de 100 ppm (15,7 mg/kg p.c. par jour chez les mâles et 19,5 mg/kg p.c. par jour chez les femelles) (Kuhborth et coll., 1988; Bellet et coll., 1999). Cependant, la U.S. EPA (2003) a fixé la NOAEL générale pour les mâles à 100 ppm (15,7 mg/kg p.c. par jour) et la LOAEL, toujours chez les mâles, à 500 ppm (79,5 mg/kg p.c. par jour), d'après les changements histopathologiques du rein. Pour les souris femelles, l'EPA (2003) a fixé la NOAEL générale à 20 ppm (3,9 mg/kg p.c. par jour) et la LOAEL à 100 ppm (19,5 mg/kg p.c. par jour), d'après l'hyperplasie rénale, qui a été jugée significative sur le plan toxicologique à cette dose.
9.2.4 Mutagénicité et génotoxicité
D'après les données connues, le MCPA sous sa forme acide et ses autres formes ne sont pas considérés comme génotoxiques in vivo. Comme il est mentionné plus loin, le MCPA n'était pas mutagène dans la majorité des essais signalés de mutation des gènes sur des bactéries et des cellules de mammifères, pas plus qu'il ne provoquait de lésions de l'ADN dans le SOS chromotest. Par ailleurs, aucune donnée in vivo ne laisse supposer une clastogénicité dans la moelle osseuse, et les essais d'échange de chromatides soeurs ont donné des résultats négatifs ou faiblement positifs.
À l'exception d'un résultat positif et de deux résultats faiblement positifs (examinés dans Elliott, 2005), le MCPA sous forme d'acide a donné des résultats négatifs aux essais bactériens in vitro réalisés avec Salmonella typhimurium (plusieurs souches) (Räsänen et coll., 1977; Nishimura et coll., 1982; Moriya et coll., 1983; Kappas, 1988; Jones et coll., 1993a). Le MCPA-DMAS et le MCPA-EHE ont eux aussi donné des résultats négatifs (Jones et coll., 1992, 1993b; Elliott, 2005).
Des résultats négatifs ont également été obtenus avec le MCPA sous forme d'acide, le MCPA-DMAS et le MCPA-EHE dans des essais de mutation sur des cellules de mammifères (Ovaire de hamster chinois, HPRT avec et sans S9) (Adams et coll., 1993a,b,c; Elliott, 2005).
On a obtenu un résultat positif avec le MCPA sous forme d'acide dans un essai de recombinaison mitotique avec Aspergillus nidulans (Kappas, 1988), et un résultat faiblement positif dans un test de mutagénicité sur levure (Saccharomyces cerevisiae) (Zetterberg, 1978, 1979).
Le MCPA a donné des résultats négatifs au SOS chromotest (Escherichia coli PQ37 avec et sans S9) (Mersch-Sundermann et coll., 1989).
Des aberrations chromosomiques in vitro ont été décelées dans des lymphocytes périphériques humains (avec et sans S9) avec des concentrations cytotoxiques élevées de MCPA sous forme d'acide et de MCPA-DMAS, mais pas avec le MCPA-EHE (Akhurst et coll., 1993a,b,c; Elliott, 2005).
Des essais d'aberrations chromosomiques in vivo avec le MCPA sous forme d'acide étaient négatifs chez le hamster chinois à des doses égales ou inférieures à 1 200 mg/kg p.c. administrées par gavage oral (Gelbke et Engelhardt, 1985a,d), alors que des essais d'échange de chromatides soeurs ont donné des résultats négatifs ou faiblement positifs à la même dose et avec la même voie d'administration (Linnainmaa, 1984; Gelbke et Engelhardt, 1985b,c; Mustonen et coll., 1989). Le MCPA, le MCPA-DMAS et le MCPA-EHE ont tous donné des résultats négatifs au test in vivo du micronoyau sur moelle osseuse chez des souris auxquelles on avait administré une dose de 384 mg/kg p.c. par gavage oral (Proudlock et coll., 1993a,b,c).
Cette absence générale de génotoxicité après l'exposition au MCPA concorde avec l'absence de cancérogénicité chez les animaux (Elliott, 2005).
9.2.5 Toxicité pour la reproduction et le développement
Des effets sur le développement ont été observés en présence de toxicité maternelle chez des rats ayant reçu du MCPA, du MCPA-DMAS ou du MCPA-EHE. Aucun effet semblable ne s'est toutefois manifesté chez le lapin. Une étude sur deux générations menée chez les rats n'a permis de constater aucun effet sur la reproduction.
On a administré des doses de 0, 15, 60 ou 120 mg/kg p.c. par jour de MCPA (94,22 %) par gavage à des rates Wistar gravides aux jours 6 à 15 de la gestation (Hellwig et Hildebrand, 1993a). La LOAEL associée à la toxicité maternelle était de 120 mg/kg p.c. par jour, d'après la diminution du poids corporel associée au traitement, le gain de poids corporel et la consommation alimentaire durant le traitement et pendant le reste de la période de gestation. La LOAEL associée à la toxicité pour le développement était de 120 mg/kg p.c. par jour, d'après la baisse du poids du placenta et du foetus et l'augmentation du nombre de foetus présentant un retard de développement du squelette. La NOAEL relative à la toxicité maternelle et à la toxicité pour le développement était de 60 mg/kg p.c. par jour.
On a administré des doses de 0, 15, 30 ou 60 mg/kg p.c. par jour de MCPA (94,22 %) une fois par jour par gavage à des lapines himalayennes aux jours 7 à 19 de la gestation (Hellwig et Hildebrand, 1993b). À la dose de 60 mg/kg p.c. par jour, on a observé une baisse liée au traitement du poids corporel, du gain de poids et de la consommation d'aliments. La LOAEL associée à la toxicité maternelle était de 60 mg/kg p.c. par jour, d'après la baisse significative du poids corporel, du gain de poids et de la consommation d'aliments durant la période de traitement. La NOAEL relative à la toxicité maternelle était de 30 mg/kg p.c. par jour. La NOAEL relative à la toxicité pour le développement était égale ou supérieure à la plus forte dose testée, soit 60 mg/kg p.c. par jour. Aucune LOAEL associée à la toxicité pour le développement n'a été déterminée.
On a administré par gavage à des groupes de 17 à 25 rates CD gravides du MCPA-DMAS (78,2 %) dans du méthylcellulose à 0,5 % à des doses de 0, 18,5, 62 ou 185 mg/kg p.c. par jour (l'équivalent de 0, 15, 50 ou 150 mg de MCPA sous forme d'acide libre/kg p.c. par jour) aux jours 6 à 19, inclusivement, de la gestation (Cappon, 1999b). Une toxicité maternelle (signes cliniques et décès d'un sujet) a été observée chez les femelles ayant reçu la dose élevée. Après rajustement pour tenir compte du poids de l'utérus gravide, le poids corporel des femelles ayant reçu la dose élevée était comparable à celui des témoins. Le poids des utérus gravides était significativement plus bas dans le groupe ayant reçu la dose élevée que chez les témoins. Une résorption complète de la portée s'est produite chez cinq mères; cette perte post-implantation était significativement plus élevée que chez les témoins (41,8 %, comparativement à 3,8 % chez les témoins). Le poids foetal moyen dans le groupe ayant reçu la dose élevée était significativement plus bas que chez les témoins (2,1 g, comparativement à 3,5 g chez les témoins). Une hausse de l'incidence des malformations externes et/ou squelettiques majeures a été relevée chez les foetus des groupes ayant reçu 150 mg/kg p.c. par jour (11 portées sur 17), comparativement aux témoins (3 portées sur 25). De plus, l'incidence des variations squelettiques était plus élevée chez les groupes ayant reçu la forte dose, comparativement aux témoins. La LOAEL associée à la toxicité maternelle était de 150 mg/kg p.c. par jour de MCPA sous forme d'acide, d'après la mortalité et les signes cliniques, et la NOAEL était de 50 mg/kg p.c. par jour de MCPA sous forme d'acide. La U.S. EPA (2003) a fixé la LOAEL associée à la toxicité pour le développement à 150 mg/kg p.c. par jour de MCPA sous forme d'acide, d'après l'incidence accrue des résorptions, la diminution du poids foetal et les malformations ou variations externes et squelettiques. La NOAEL relative à la toxicité pour le développement a été fixée à 50 mg/kg p.c. par jour de MCPA sous forme d'acide (U.S. EPA, 2003).
On a administré par gavage à des groupes de 25 rates CD gravides des doses de 0, 23,5, 62,7 ou 188 mg/kg p.c. de MCPA-EHE (99,9 %) par jour (l'équivalent de 0, 15, 40 et 120 mg/kg p.c. par jour de MCPA sous forme d'acide) dans du méthylcellulose à 0,5 % aux jours 6 à 19, inclusivement, de la gestation (Cappon, 1999a). La consommation d'aliments était significativement réduite pendant le traitement chez les femelles recevant la forte dose (83 à 91 % des valeurs enregistrées chez les témoins). Par conséquent, le poids corporel moyen net et le gain de poids corporel moyen net (après ajustement pour tenir compte du poids de l'utérus gravide) était statistiquement réduit de 5 % et 28 % respectivement par rapport aux témoins. Une résorption complète de la portée a été observée chez deux mères ayant reçu la dose élevée, en plus d'une légère augmentation parallèle (mais non significative) de la perte post-implantation, de la résorption complète et de la résorption précoce. À la plus forte dose, le poids foetal moyen était significativement plus bas que celui des témoins (2,5 c. 3,7 g pour les témoins). Une hausse significative de l'incidence de plusieurs variations squelettiques, notamment des sternèbres non ossifiées et des côtes courbées, a été observée à cette dose. L'incidence de l'ossification du corps vertébral de la première cervicale était statistiquement plus basse aux doses de 62,7 et 188 mg/kg p.c. par jour (13,7, 12,2, 4,6 et 0,6 % par portée, respectivement, pour les groupes témoins, à faible dose, à dose moyenne et à dose élevée). La U.S. EPA (2003) a fixé la LOAEL associée à la toxicité pour le développement à 188 mg/kg p.c. par jour de MCPA-EHE (120 mg/kg p.c. par jour de MCPA sous forme d'acide), d'après le nombre total de résorptions de la portée, la diminution du poids foetal et les perturbations de la croissance, et la NOAEL relative à la toxicité pour le développement à 62,7 mg/kg p.c. par jour de MCPA-EHE (40 mg/kg p.c. par jour de MCPA sous forme d'acide). La LOAEL associée à la toxicité maternelle était de 188 mg/kg p.c. par jour de MCPA-EHE (120 mg/kg p.c. par jour de MCPA sous forme d'acide), d'après le gain plus faible de poids corporel et la réduction de la consommation d'aliments (U.S. EPA, 2003). La NOAEL relative à la toxicité maternelle était de 62,7 mg/kg p.c. par jour de MCPA-EHE (40 mg/kg p.c. par jour de MCPA sous forme d'acide).
Aucun effet sur la reproduction n'a été observé chez des rats albinos mâles et femelles (n = 25 par sexe par dose et par génération) ayant reçu dans leurs rations alimentaires du MCPA (94,8 %) à raison de 0, 50, 150 ou 450 ppm (équivalant à des doses de 0, 2,5, 7,5 ou 22,5 mg/kg p.c. par jour) sur deux générations (MacKenzie, 1986; Bellet et coll., 2001). Aucun effet lié au traitement n'a été noté quant au nombre moyen de naissances vivantes, le ratio du sexe à la naissance ni la survie des petits dans toutes les portées des groupes traités des deux générations. À la concentration alimentaire élevée (450 ppm), des différences statistiquement significatives ont été observées concernant le gain de poids corporel chez les petits mâles (F1a) et femelles (F1a et F1b), ainsi que le poids corporel et le gain de poids chez les petits mâles et femelles des générations F2a et F2b. Aucun effet significatif sur la fonction reproductrice n'a été observé chez les deux générations des deux sexes (MacKenzie, 1986; Bellet et coll., 2001).
Dans cette étude, la NOEL relative à la fonction reproductrice des rats ayant reçu du MCPA a été estimée à 450 ppm (environ 22,5 mg/kg p.c. par jour). La NOEL relative à la toxicité générale était de 150 ppm (environ 7,5 mg/kg p.c. par jour), d'après le poids corporel des animaux adultes de la génération F1b et les effets sur les petits de la génération F1b (réduction du poids et gain de poids plus faible). D'après les résultats de l'étude, le MCPA n'a pas d'effet toxique sur la reproduction chez les rats, ce qu'a confirmé la U.S. EPA (2003). Cependant, l'ARLA (2006) a déterminé que la DMT n'avait pas été atteinte dans cette étude. Toujours selon l'ARLA (2006), le MCPA pourrait accroître la sensibilité des jeunes en l'absence de toxicité maternelle, et ce, en raison de la diminution du poids corporel et du gain de poids moindre chez les petits des deux générations durant la lactation. Après l'évaluation de cette étude sur deux générations, le troisième groupe de travail sur le MCPA a soumis à l'ARLA (2007) deux études supplémentaires confidentielles portant sur une génération, dans lesquelles on a administré aux sujets des doses de MCPA acide ou de MCPA-EHE plus élevées que dans l'étude sur deux générations susmentionnée. Aucun effet nocif n'a été constaté sur le poids corporel des petits jusqu'au moment du sevrage, ce qui indique que les petits ne présentaient pas une sensibilité accrue par rapport aux mères.
En raison de ses préoccupations concernant la neurotoxicité des diverses formes de MCPA observée dans les études sur la toxicité aiguë et subchronique, la U.S. EPA (2004e) a déclaré, dans le cadre du rapport de l'Hazard Identification Assessment Review Committee, qu'il était nécessaire d'après les données actuelles de procéder à une étude de la neurotoxicité pour le développement.
10.0 Classification et évaluation
En raison de l'insuffisance des données issues des études épidémiologiques et du manque d'études adéquates chez l'animal, Santé Canada classe le MCPA dans le groupe VIA (inclassable en ce qui concerne la cancérogénicité chez l'être humain), selon sa définition (1994). Le CIRC (1983) a évalué le MCPA et conclu qu'« aucune donnée adéquate n'était disponible pour évaluer la cancérogénicité du MCPA chez les animaux de laboratoire. Les données chez l'humain sont également inadéquates. Les données dont on dispose sont insuffisantes pour évaluer la cancérogénicité du MCPA seul chez l'humain. »
Le CIRC (1986) a aussi évalué la famille des herbicides chlorophénoxy et conclu qu'« un nombre limité de données indique que l'exposition professionnelle aux herbicides chlorophénoxy peut entraîner le cancer chez l'humain. »
La U.S. EPA (2003, 2004c,e) a classé le MCPA parmi les substances « qui ne sont probablement pas cancérogènes pour l'humain »
, en raison du manque de données relatives à sa cancérogénicité chez les souris et les rats.
Un nombre limité d'études épidémiologiques a été mené sur les effets du MCPA et des composés chlorophénoxy apparentés, mais ces études ne permettent pas de conclure que ces produits sont cancérogènes et ont des effets sur la reproduction. Dans le cadre de ces études, on a évalué des expositions multiples à des mélanges d'herbicides chlorophénoxy, d'autres pesticides et des composés organiques. Les résultats étaient difficiles à interpréter, et les études ont été jugées limitées pour plusieurs raisons, comme l'absence de prise en compte des facteurs de confusion et la faible taille de l'échantillon.
Aucun signe de cancérogénicité n'a été observé dans les études d'exposition de longue durée au MCPA sous forme d'acide menées chez la souris ou le rat. Toutefois, l'ARLA (2005b, 2006, 2007) a indiqué que durant l'étude de l'exposition de longue durée chez le rat, la dose maximale tolérée n'avait pas été atteinte et que cette étude n'était donc pas considérée comme adéquate pour l'évaluation du potentiel global de cancérogénicité. Les tests visant à mesurer la génotoxicité et la mutagénicité étaient en grande partie négatifs.
Des études de la toxicité subchronique ont montré que le chien était plus sensible que le rat et la souris aux effets du MCPA et des composés apparentés : le niveau des effets observés était au moins 10 fois plus bas chez le chien que chez le rat et la souris dans les études de toxicité chronique et subchronique. L'étude allométrique des données sur le rat, le chien et l'être humain indique que la clairance rénale du MCPA chez le chien est 10 fois plus lente que chez l'être humain (Timchalk, 2004). La sensibilité particulière du chiens aux effets du MCPA soulignée dans la littérature peut donc être attribuée à la clairance rénale réduite des acides organiques (p.ex.: le MCPA), qui entraîne des concentrations sanguines plus élevées que chez l'humain et les autres espèces. Ce fait suggère que le chien n'est pas une espèce indicatrice appropriée pour l'évaluation de la toxicité du MCPA chez l'humain (Timchalk, 2004). En se basant sur les résultats de l'ajustement allométrique entre les espèces raporté par Timchalk (2004), et les données disponibles chez les animaux, l'ARLA (2007) a déterminé que le rat est le modèle le plus approprié pour effectuer une évaluation des risques à la santé chez l'humain pour les utilisations du MCPA en agriculture et autres usages non-reliés aux pelouse. Aucune étude à long-terme chez les chiens n'a été trouvée dans la litérature scientifique.
L'ARLA (2006, 2007, 2008) a dérivé une dose de référence alimentaire chronique (pendant la durée de la vie), ou dose journalière admissible (DJA), de 0,012 mg/kg p.c. par jour pour le MCPA sur la base d'une NOAEL de 3,6 mg/kg p.c. par jour établie par une étude de 90 jours sur le rat effectuée par Kirsch (1985b). La NOAEL était fondée sur les effets sur le rein (augmentation du poids relatif et absolu, concentration urinaire de bilirubine et crystaux et pH urinaires).
La DJT est calculée en utilisant le NOAEL et les facteurs d'incertitude identifiés par l'ARLA dans leur dérivation de la DJA :
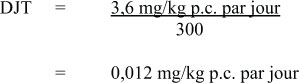
Figure 1 - Text Description
La dose journalière tolérable du MCPA est égale à 0,012 milligrammes par kilogramme de poids corporel par jour. Cette valeur a été calculée en divisant 3,6 milligrammes par kilogramme de poids corporel par jour par 300.
où :
- 3,6 mg/kg p.c. par jour est la NOAEL de l'étude de 90 jours sur le rat effectuée par Kirsch (1985b);
- 300 est le facteur d'incertitude : × 10 pour tenir compte de la variation à l'intérieur de l'espèce; × 10 pour tenir compte de la variation entre les espèces; × 3 pour tenir compte d'une base de données incomplète - caractère inadéquat de l'évaluation de la cancérogénicité, la DMT n'ayant pas été atteinte lors de l'étude de deux ans sur le rat (Bellet, 1999).
Bien que la NOAEL provienne d'une étude sous-chronique, l'emploi d'un facteur d'incertitude de × 10 pour tenir compte d'une base de données incomplète (utilisation d'une étude de toxicité sous-chronique au lieu d'une étude de toxicité chronique) n'est pas justifié, car les effets sur le rein observés après 90 jours d'administration de doses plus élevées de MCPA n'étaient pas apparents dans l'étude de deux ans, ce qui laisse penser que le rat pourrait être capable de s'adapter à ces effets. Cependant, l'étude de deux ans sur les rats (Bellet, 1999) n'a pas atteint la DMT, et on a considéré les effets observés au bout de 90 jours comme étant indicatifs d'une atteinte toxique initiale du rein, celui-ci étant l'organe cible dans toutes les espèces étudiées. Comme la NOAEL sur les reins tirée de l'étude de 90 jours sur le rat était la NOAEL la plus faible rapportée dans la base de données sur la toxicité du MCPA chez les animaux(à l'exception du chien), la DJT du MCPA assure également une protection contre tous les effets nocifs mentionnés dans les études de toxicité subchronique et chronique chez le rat (effets généraux et effets sur les reins, le foie, les testicules, la reproduction, le développement et le système nerveux).
En utilisant la DJT de 0,012 mg/kg p.c. par jour, la concentration maximale acceptable (CMA) pour le MCPA est derivée comme suit :

Figure 2 - Text Description
La concentration maximale acceptable pour le MCPA est égale à 0,1 milligramme par litre (valeur arrondie). Cette valeur a été calculée en multipliant la dose journalière tolérable (précédemment calculée) de 0,012 milligrammes par kilogramme de poids corporel par jour par 70 kilogrammes et par 0,2. La valeur obtenue a par la suite été divisée par 1,5 litres par jour pour avoir la concentration maximale acceptable.
où :
- DJT = dose journalière tolérabledérivée ci-dessus;
- PC = poids corporel; le poids corporel moyen d'un adulte au Canada est estimé à 70 kg;
- CE = consommation d'eau; 1,5 L est le volume quotidien moyen d'eau potable consommée par un adulte;
- FA = facteur d'attribution : proportion de la dose journalière totale de MCPA estimée comme provenant d'une exposition par l'eau potable, comparativement aux autres sources (aliments, sol, air et produits de consommation). En l'absence de données complètes ou appropriées sur l'exposition aux autres sources environnementales pertinentes, on utilise un facteur d'attribution par défaut de 20 %.
10.1 Considérations internationales
La U.S. EPA n'a pas établi de concentration maximale de contaminants (CMC) dans le cas du MCPA dans l'eau potable. Elle a établi un avis sanitaire pour la durée de vie en 1988, afin de fournir des conseils techniques informels pour aider les autorités fédérales, étatiques et locales responsables de la protection de la santé publique en cas de déversements ou de contamination (U.S. EPA, 1987, 2006).
L'OMS (1996) a établi une ligne directrice de 0,002 mg/L pour le MCPA dans l'eau potable d'après l'étude d'un an sur l'alimentation du chien qui indiquait une NOAEL de 0,15 mg/kg p.c. par jour pour la toxicité rénale et hépatique publiée par Hellwig (1986). La dérivation de cette ligne directrice utilisait un facteur d'incertitude de 300 pour tenir compte de la variation à l'intérieur de l'espèce (× 10), de la variation entre les espèces (× 10) et du caractère inadéquat de la base de données (× 3) ainsi qu'en attribuant un pourcentage de 10 % de la DJT pour l'exposition par l'eau potable (OMS, 1996, 2003).
11.0 Justification
Le MCPA est couramment utilisé comme herbicide au Canada. Le MCPA est homologué au Canada pour utilisation dans des sites agricoles, sur le gazon fin, la pelouse et le gazon de placage, ainsi qu'en foresterie et dans des sites industriels. Le MCPA est employé partout au Canada, particulièrement dans les Prairies, et compte parmi les 10 pesticides les plus vendus dans le pays. Bien que le MCPA soit couramment employé au Canada, les données d'exposition ne démontrent pas de niveaux importants dans l'eau potable.
Santé Canada classe le MCPA comme étant inclassable en ce qui concerne la cancérogénicité chez l'être humain, en raison de l'insuffisance des données issues des études épidémiologiques et du manque de données adéquates chez l'animal. Cette classification est similaire aux classifications établies par le CIRC et par l'U.S. EPA. La concentration maximale acceptable pour le MCPA dans l'eau potable a été établie d'après les effets de ce composé sur le rein chez le rat.
Cette CMA est atteignable par les technologies de traitement disponibles, et mesurable par les méthodes d'analyse disponibles.
Santé Canada continuera, dans le cadre de son processus continu de révision des recommandations, à suivre les nouvelles recherches à ce sujet, et recommandera au besoin toute modification jugée nécessaire.