Rapport du comité - Le 18 et 19 juillet 2018
Comité scientifique sur le Plan de gestion des produits chimiques
Progression de l'examen des substances chimiques perturbatrices du système endocrinien effectué en vertu de la Loi canadienne sur la protection de l'environnement (1999)
L'introduction du rapport a été fournie par les ministères dans la documentation préparatoire à la réunion.
Sur cette page
- Contexte
- Contexte et objectif de la réunion
- Approche actuelle du Canada relative aux substances chimiques perturbatrices du système endocrinien
- Aperçu du processus de délibération du Comité scientifique
- Question à l'étude 1
- Question à l'étude 2
- Question à l'étude 3
- Résumé
- Remerciements
- Annexe 1
- Appendice A
- Appendice B
Contexte
Établi en 2006, le Plan de gestion des produits chimiques (PGPC) est une initiative du gouvernement du Canada qui établit des priorités claires pour l'évaluation et la gestion des substances chimiques utilisées au Canada, y compris le programme des substances nouvelles et existantes de la Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)]. En 2013, Santé Canada (SC) et Environnement et Changement climatique Canada (ECCC) [les ministères], ont formé le Comité scientifique sur le PGPC pour recevoir une expertise sur des considérations scientifiques relatives à l'exécution du Plan de gestion.
Lors de la réunion de Comité scientifique tenue en juillet 2018, les ministères lui ont demandé un avis sur les considérations scientifiques relatives à la façon dont le gouvernement du Canada pourrait faire évoluer l'approche actuelle liée à la reconnaissance et à l'évaluation des perturbateurs du système endocrinien (PSE).
Le présent rapport du Comité scientifique contient des extraits de documents préparatoires à la réunion fournis par les ministères pour décrire le contexte et l'objectif de la réunion, ainsi que des renseignements généraux sur l'approche actuelle adoptée au Canada en matière de PSE, et comprend les annexes et les appendices. Ces extraits sont signalés dans le texte.
Contexte et objectif de la réunion
(fournis par les ministères dans les documents préparatoires à la réunion)
En 2017, le Comité permanent de l'environnement et du développement durable de la Chambre des communes a publié un rapport contenant des recommandations sur le renforcement de la LCPE (1999) dans le cadre de son cycle quinquennal d'examen (article 343), notamment des recommandations concernant les PSE (Parlement du Canada, 2017). De plus, la reconnaissance et l'évaluation des PSE sont un sujet sur lequel certaines parties prenantes ont fait aux ministères des recommandations sur les mesures à prendre (ACDE, 2017).
Un PSE est une substance chimique exogène qui interagit ou interfère avec la fonction du système endocrinien. Ses effets peuvent comprendre le contrôle de la croissance et de la maturation, la reproduction et le développement, le comportement et la réaction aux stimuli, la production, l'utilisation et le stockage de l'énergie, l'équilibre et le maintien de l'eau et des électrolytes dans le corps. Selon la définition de l'Organisation mondiale de la santé (OMS) adoptée par l'Organisation de coopération et de développement économiques (OCDE), « un perturbateur endocrinien est une substance ou un mélange exogène altérant les fonctions du système endocrinien et induisant donc des effets nocifs sur la santé d'un organisme intact, de ses descendants ou populations (ou sous-population) », tandis qu'« un perturbateur endocrinien potentiel est une substance ou un mélange exogène possédant des propriétés susceptibles d'induire une perturbation endocrinienne dans un organisme intact, chez ses descendants ou ses populations (ou sous-population) » (OCDE, 2018d). Ainsi, l'exposition à un PSE peut modifier la production, le transport, le métabolisme, l'activation des récepteurs ou l'action en aval d'une hormone, ce qui peut perturber les messages reçus par un tissu cible. Durant les périodes critiques du développement (par exemple, développement ou différenciation du cerveau, du tractus reproducteur ou des organes reproducteurs), l’exposition aux PSE peut entraîner des effets néfastes (c’est-à-dire des changements fonctionnels à long terme et possiblement multigénérationnels).
Lors de cette réunion, les membres du comité ont discuté des considérations scientifiques nécessaires pour guider les progrès d'un éventuel programme de travail sur les PSE au Canada qui s'appuierait sur les pratiques exemplaires de plusieurs pays et les avantages des méthodologies et des données nouvelles et émergentes. Pour atteindre cet objectif, on a demandé au Comité scientifique de répondre à des questions posées par les ministères. Puisque les ministères mènent diverses activités liées à la gestion des produits chimiques (la collecte de renseignements, l'établissement des priorités, l'évaluation et la gestion des risques, la recherche, le contrôle et la surveillance), on a demandé au Comité scientifique d'utiliser une optique « adaptée » et de déterminer les incertitudes pertinentes pour le contexte de la décision.
Approche actuelle du Canada relative aux substances chimiques perturbatrices du système endocrinien
(fournie par les ministères dans les documents préparatoires à la réunion)
La LCPE (1999) définit une substance hormonoperturbante comme une substance ayant la capacité de perturber la synthèse, la sécrétion, le transport, la fixation, l'action ou l'élimination des hormones naturelles dans un organisme ou sa descendance, qui assurent le maintien de l'homéostasie, de la reproduction, du développement ou du comportement de l'organisme (Canada, 1999). La LCPE (1999) n'exige pas explicitement la désignation comme PSE de substances chimiques. Toutefois, l'approche fondée sur le risque adoptée par les ministères pour évaluer les substances nouvelles et existantes comporte une étude de la documentation scientifique, notamment les études épidémiologiques humaines et les renseignements disponibles sur les effets des essais de toxicité aiguë et de toxicité à doses répétées, lesquelles incluent la perturbation du système endocrinien affectant la reproduction et le développement. L'évaluation tient compte, dans la mesure du possible, du potentiel de perturbation du système endocrinien par une substance compte tenu des renseignements sur la structure et des données disponibles sur les dangers. Dans le cadre du PGPC, les évaluations effectuées pour caractériser le risque, y compris celui posé par des PSE et des PSE potentiels, tiennent compte des sources et des voies d'exposition prévues et potentielles. Lorsque les ensembles de données sont réduits, l'évaluation du potentiel de perturbation endocrine pourra également tenir compte d'autres sources de données comme les modèles in silico, les essais in vitro, les analyses croisées et les renseignements provenant d'autres organismes de réglementation.
Outre les sources d'information décrites au paragraphe précédent, le Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères) (Le Règlement) (Canada, 2005) exige, en fonction de quantités seuils séquentielles, le dépôt de renseignements sur les caractéristiques physiques et chimiques, les dangers et l'exposition avant de pouvoir importer ou fabriquer une substance nouvelle (l'appendice A présente un tableau sommaire des exigences en matière de données). Si les quantités dépassent 10 000 kg par an, selon les annexes 5 et 6, les renseignements exigés sur la toxicité comprennent les essais de toxicité à doses répétées chez les mammifères (appendice A; tableau A-1). Bien que ces derniers ne soient pas spécifiquement conçus pour la détection du potentiel de perturbation endocrinienne, on peut les utiliser, dans une certaine mesure, pour déterminer les effets indésirables potentiels liés aux troubles endocriniens. Les essais d'écotoxicité (appendice A; tableau A-2) ne sont pas conçus pour donner un éclairage sur les effets sur le système endocrinien, car il s'agit d'essais à court terme (toxicité aiguë). Le Règlement sur les renseignements concernant les substances nouvelles (RRSN) exige également que les déclarants soumettent toutes les autres données en leur possession qui sont pertinentes dans le cadre de l'évaluation d'un danger, ce qui pourrait comprendre la soumission d'essais endocriniens spécifiques, s'ils sont disponibles.
Outre les stratégies susmentionnées, les ministères peuvent directement demander des renseignements aux parties prenantes. Le Programme des substances nouvelles peut faire un suivi direct auprès des déclarants pour obtenir plus de renseignements, soit sur une base volontaire, soit par la mise en œuvre de mesures de gestion des risques. Par exemple, le Programme des substances nouvelles peut exiger des données d'essai supplémentaires au moyen de mesures prévues par la LCPE (1999), comme les Avis de nouvelle activité (article 81), les Requêtes ministérielles visant à obtenir des renseignements supplémentaires [alinéa 84(1)c] et les Avis écrits [alinéa 71(1)c]. De même, pour les substances existantes, des renseignements peuvent être obtenus en vertu des activités de collecte de données prévues à l'article 71 ou au moyen d'autres déclarations volontaires (Canada, 2017b). De plus, en vertu de l'article 70, il incombe à l'industrie de fournir les renseignements qu'elle possède qui lui permettrait de conclure qu'une substance serait effectivement ou potentiellement toxique au sens de l'article 64 de la LCPE (1999). En raison de ces exigences, l'industrie peut déclarer les renseignements sur le potentiel de perturbation endocrinienne, s'ils sont disponibles.
De plus, les ministères mènent ou surveillent des recherches sur les produits chimiques (y compris les PSE). Ces recherches permettent de déterminer les nouvelles priorités en matière d'évaluation des risques ou, s'il y a lieu, de prendre des mesures supplémentaires. Le document Collecte de renseignements (Canada 2017c) présente l'approche de désignation des substances chimiques et des polymères jugés prioritaires pour l'évaluation des risques en vertu de la partie 5 de la LCPE (1999). La réponse donnée par le gouvernement fédéral, conformément à la Loi canadienne sur la protection de l'environnement (1999) (Canada, 2012), à la pétition no 340 de l'Association canadienne du droit de l'environnement et Ecojustice, « Recherche fédérale sur les substances hormonopertubantes », contient un aperçu des activités relatives aux PSE des ministères jusqu'en 2012. L'appendice B énumère également les activités de recherche internes plus récentes et plus actives, qui comprennent la biosurveillance et l'exposition à divers produits chimiques, y compris les PSE potentiels (tableau B-1), les effets dus à l'exposition aux PSE potentiels (tableau B-2) et les activités de recherche et l'expertise pertinentes aux PSE (tableau B-3). Les scientifiques de SC et d'ECCC continuent de contribuer aux initiatives et aux programmes internationaux, y compris ceux de l'OCDE, pour l'élaboration, la normalisation et la validation de méthodes d'essai de toxicité reconnues à l'échelle internationale (in vitro et in vivo) pour évaluer les substances liées à la perturbation endocrinienne et les effets toxiques associés à ces mécanismes.
En ce qui concerne le contexte international, l'annexe 1 donne un aperçu de certaines approches, de certains cadres et de certaines orientations à l'échelle internationale que l'on devrait prendre en considération pour la détermination et l'évaluation des PSE.
Aperçu du processus de délibération du Comité scientifique
On a demandé au Comité scientifique du PGPC de délibérer sur les démarches scientifiques visant à distinguer et à évaluer les perturbateurs du système endocrinien (PSE) dans le contexte du PGPC. Comme nous le mentionnions plus haut, cette demande a été formulée à la suite des recommandations du Comité scientifique de l'environnement et du développement durable de la Chambre des communes et des positions de certaines parties prenantes concernant les PSE. Dans ce contexte, le Comité scientifique a d’abord discuté de la charge globale des ministères en séance plénière, puis s’est divisé en 3 petits groupes pour examiner séparément les 3 questions. Chacun des 3 groupes a abordé toutes les questions à l’étude et a tenu de brèves séances plénières pour encourager le débat. Enfin, une séance plénière plus longue a été organisée pour partager les dernières réflexions et suggestions. Le rapport a ensuite été rédigé et peaufiné après la réunion.
Au début, le Comité scientifique a cherché à savoir si les PSE présentent un défi particulier pour l'évaluation des risques ou si les PSE peuvent être facilement traités avec les méthodes et le cadre existants du PGPC canadien. La plupart des membres, mais pas tous, sont d'avis que les PSE ne présentent pas un défi particulier d'un point de vue scientifique, car les difficultés rencontrées dans l'évaluation des PSE affectent également l'évaluation des produits chimiques qui affectent les processus biologiques non endocriniens. Plusieurs exemples ont été donnés à titre d'illustration, y compris la difficulté de distinguer la relation dose-réponse à de faibles expositions chimiques et les effets transgénérationnels potentiels qui ont été reconnus comme des préoccupations causées par les PSE, mais qui constituent également des difficultés permanentes pour les paramètres non endocriniens. Tous les membres s'entendent pour dire que les PSE ont joué un rôle déterminant dans les efforts visant à mieux comprendre un certain nombre de questions applicables dans le domaine de la toxicologie, et que ces questions ont souvent été évaluées de manière plus explicite pour les PSE que pour les produits chimiques ayant d'autres modes d'action. Parmi les exemples présentés ici, mentionnons la relation dose-réponse aux doses « faibles » (définies comme étant dans la gamme des expositions environnementales), la complexité des interactions des récepteurs et la difficulté de déterminer un point de départ significatif à partir des effets « précoces » ou « en amont » qui ne sont généralement pas considérés comme des paramètres « apicaux » (c'est-à-dire indiquant un état pathologique). Ainsi, la plupart des membres, mais pas tous, ont estimé que les approches scientifiques d'évaluation des dangers et des risques présentés par les PSE sont globalement compatibles avec les méthodes et les approches actuellement en usage ou en cours d'élaboration, y compris les approches visant à tenir compte du potentiel des effets transgénérationnels. Toutefois, certains membres ont estimé que cette dernière préoccupation constituait un défi distinct et potentiellement unique. Certains membres du Comité scientifique ont également fait remarquer que les questions relatives aux PSE ont suscité et suscitent encore des préoccupations au sein de la société et qu'elles posent des défis immédiats au processus réglementaire visant la gestion des PSE.
Plusieurs des réponses aux questions à l'étude ne se limitent pas uniquement aux PSE, mais s'appliquent plutôt à l'évolution des méthodes d'évaluation des risques qui pourraient être utilisées à l'avenir dans le cadre du PGPC pour toutes les substances. Il s'agit là d'un autre cas où les PSE font avancer la science de l'évaluation des risques pour la santé et l'environnement.
Question à l'étude 1
De quelle façon les considérations présentées ci-dessus (et toute autre considération supplémentaire discernée par le Comité) pourraient-elles influer sur les pratiques actuelles d'établissement des priorités et d'évaluation alors que les ministères s'emploient à promouvoir et à élargir les approches pour les PSE et les PSE potentiels?
Cette étude pourrait inclure les domaines suivants :
- la relation dose-réponse et le seuil d'adversité
- le rôle des données sur les modalités de perturbation endocrinienne moins étudiées (récepteurs non œstrogéniques, récepteurs non androgéniques, signalisation des hormones non-thyroïdienne et pas de stéroïdogénèse, « non‑EATS »)
- l'applicabilité des données axées sur la santé humaine pour éclairer les évaluations écologiques et vice versa.
1.1 Commentaires généraux sur les principaux facteurs à considérer
En se fondant sur les commentaires fournis par les ministères et sur ses discussions ultérieures, le Comité scientifique a dressé une liste de sujets se rapportant à la question de l'établissement des priorités et des pratiques d'évaluation des PSE et des PSE potentiels, comme suit :
- la relation dose-réponse, y compris la relation dose-réponse non monotone et la toxicologie à faible dose*
- les modalités de perturbation endocrinienne y compris, non seulement les récepteurs d'œstrogènes, les récepteurs d'androgènes, la signalisation des hormones thyroïdiennes et la stéroïdogenèse (« EATS »), mais aussi les modalités des récepteurs non œstrogéniques, des récepteurs non androgéniques, la signalisation des hormones non thyroïdiennes et pas de stéroïdogenèse (« non-EATS »)
- les périodes de sensibilité
- les effets multigénérationnels, y compris l'épigénétiques
- l'extrapolation interspécifique, y compris chez les humains, les modèles de mammifères et les espèces écologiques (vertébrés et invertébrés)
- les expositions pertinentes pour l'environnement
- la variabilité, la sensibilité et la vulnérabilité des populations (au-delà des périodes de susceptibilité susmentionnées)*
- les risques cumulatifs posés par les mélanges, les coexpositions et les facteurs de stress non chimiques*
- la complexité liée de l'interprétation des résultats donnés par des systèmes d'essai de substitution.
Les commentaires émis sur ces neuf sujets sont intégrés dans les réponses du Comité scientifique à la première question. En outre, le comité a formulé quelques observations générales supplémentaires sur les trois thèmes signalés par un astérisque (*), qui sont examinés dans les sous-sections suivantes.
1.1.1 Courbes de dose-réponse non monotone
Pour l'évaluation des risques, le point de départ est généralement calculé à partir de l'effet critique défini comme le premier effet apical néfaste qui se produit au niveau d'exposition le plus bas de la courbe dose-réponse toxicologique chez les espèces les plus sensibles. Lors de l'élaboration de lignes directrices sur l'exposition fondées sur une évaluation des risques, on utilise un niveau d'exposition protecteur pour cet effet critique et, ce faisant, les populations exposées devraient être protégées contre tous les autres effets apicaux préoccupants, car il faudrait des doses plus élevées pour que ces effets se manifestent. Toutefois, l'une des principales préoccupations des parties prenantes est que la possibilité de courbes de dose-effet non monotone pour les PSE peut révéler que les pratiques actuelles d'évaluation des risques ne protègent pas suffisamment. Bien que l'on n'eût pas demandé au comité son avis sur cette question précise, il estime que les points suivants peuvent être pertinents pour répondre à cette préoccupation :
- Il existe de nombreux processus qui expliquent pourquoi les courbes de dose-effet sont non monotones, par exemple :
- Une dose-réponse non monotone « apparente » due à l'activation de différents récepteurs pour différentes plages de doses. Un exemple classique est celui des nutriments essentiels où, à faible apport, la courbe dose-réponse est inclinée vers le bas en raison de la réduction des effets de carence, et, à apport élevé, la courbe dose-réponse s'incline vers le haut en raison d'une toxicité accrue. Dans de tels cas, les effets néfastes en aval de la carence et de la toxicité diffèrent sur le plan qualitatif.
- Une courbe dose-réponse non monotone « intégrée » décrivant à un effet indésirable modulé par de multiples voies avec une directionnalité différente. Par exemple, la prolifération à médiation œstrogénique pourra être modulée vers le haut ou le bas, selon l'interaction moléculaire ou la cible du récepteur. Par conséquent, si une substance vise des cibles multiples, mais avec des puissances différentes, la réponse peut d'abord pointer vers une direction puis la direction opposée à mesure que la dose augmente. Pour cette raison, des essais plus intégrés (par exemple, à rendement moyen, tel qu’il est indiqué ci-dessous) pourraient mieux réussir à discerner de tels cas par rapport aux essais axés uniquement sur des cibles initiatrices (par exemple, fixation aux ligands du récepteur).
- Le problème des courbes dose-réponse non monotones peut s'appliquer à tous les types de substances toxiques, pas seulement aux PSE (par exemple, toxicité à dose élevée perturbe la relation dose-réponse pour les effets observés pour la première fois à de faibles doses). Pensons par exemple, à la célèbre courbe en forme de U inversé de l’activité de l’amphétamine sur le comportement. Dans le cas des PSE qui affectent spécifiquement les niveaux d’hormones (par exemple, synthèse, transport ou dégradation modifiés), des concentrations faibles ou élevées peuvent provoquer des effets différents.
- Le rapport de l'Environmental Protection Agency (EPA) des États-Unis, « State of the Science Evaluation: Nonmonotonic Dose Responses As They Apply to Estrogen, Androgen, and Thyroid Pathways and EPA Testing and Assessment Procedures », (EPA, 2013), le rapport des National Academies of Science des États-Unis, « Review of the Environmental Protection Agency's State-of-the-Science Evaluation of Nonmonotonic Dose-Response Relationships As They Apply to Endocrine Disruptors » (NASEM, 2014) et le rapport des National Academies of Science des États-Unis, « Application of Systematic Review Methods in an Overall Strategy for Evaluating Low-Dose Toxicity from Endocrine Active Chemicals » (NASEM, 2017), contiennent des discussions plus détaillées sur les problèmes de courbes dose-réponse non monotones.
La section 1.7 présente d'autres commentaires sur les courbes doses-réponses non monotones des PSE.
1.1.2 Variabilité et sensibilité de la population (au-delà des périodes de sensibilité)
Une composante essentielle de la gestion des produits chimiques est la caractérisation de la variabilité de la réaction des organismes aux facteurs de stress (Zeise et coll., 2013). Malgré les nombreux progrès dans la caractérisation de la variabilité de l'exposition (NASEM, 2012), la caractérisation de la variabilité humaine dans le danger et la relation dose-réponse demeure difficile, notamment parce que l'on effectue la plupart des essais avec des systèmes génétiquement homogènes qui ne reproduisent pas les variations interspécifiques ou intraspécifiques. Cette difficulté persiste également dans les évaluations des risques écologiques où seuls quelques modèles sont actuellement testés et utilisés pour représenter des milliers d'espèces potentiellement sensibles. Chiu et coll. (2018) et Harrill et McAllister (2017) donnent un aperçu des modèles de mammifères, ainsi que certains des outils informatiques disponibles, pour aider à caractériser la variabilité du danger et de la relation dose-réponse. Dans de nombreux cas, le passage des estimations ponctuelles aux analyses probabilistes permettra une caractérisation plus riche du risque individuel, de l'incidence sur la population et de la confiance statistique.
Le commentaire ci-dessus s'applique à toutes les substances dont on envisage l'évaluation des risques et, au besoin, la gestion subséquente des risques. Cependant, l'une des principales difficultés posées par les PSE est qu'il peut y avoir une variabilité fondamentale importante, tant au niveau des « valeurs de réglage » hormonales que de la réserve fonctionnelle pour le contrôle homéostatique. Par exemple, à un moment donné, une fraction de la population peut déjà se trouver « hors de la fourchette prévue » (par exemple, en raison des effets de multiples facteurs de stress) et courir un risque plus élevé d'être touchée si une exposition survient. Un autre exemple est l'organisme en développement, qui peut avoir une capacité de compensation beaucoup moins grande que celle d'un adulte. Ainsi, l'exposition environnementale aux PSE à un stade précoce de la vie peut amener plus de sujets au-delà du seuil d'adversité par rapport aux adultes (p. ex., Woodruff et coll., 2008). Le rapport sur les faibles doses des NSA (2017) indique que les méthodes actuelles d'essai de toxicité utilisées pour déterminer les dangers peuvent considérablement sous-estimer l'exposition à laquelle des effets nocifs se produisent en raison de la variabilité, de la sensibilité, de l'exposition à plusieurs facteurs de stress, entre autres, qui caractérisent les populations humaines « naturelles ». Pour tenir compte des incertitudes, on a intégré des facteurs de sécurité ou d'incertitude dans les évaluations des risques. Le Comité scientifique s'est demandé si d'autres facteurs de sécurité ou d'incertitude seraient nécessaires pour tenir pleinement compte de l'éventail des facteurs examinés. Le rapport du groupe d'experts des NSA recommandait également une stratégie visant à « faciliter un examen plus régulier de la pertinence des essais de toxicité » (2017, p. 29-34). Il a toutefois noté que les questions sur la quantité de preuves nécessaires pour évaluer les changements potentiels aux méthodes d'essai existantes (p. ex., établir la sensibilité, la spécificité et la reproductibilité des nouveaux paramètres) pourraient être importantes et a conclu que ces questions pourraient être plus adéquatement traitées par l'intermédiaire de décisions politiques.
Les difficultés et questions suivantes ont été soulevées :
- Comment définir au mieux la vulnérabilité et la sensibilité, puisque les évaluations des risques doivent protéger les individus, les populations et les espèces?
- Peut-on utiliser des méthodes de toxicologie computationnelle, in silico, pour discerner des sentinelles, soit des individus ou des populations plus sensibles ou vulnérables?
- Peut-on définir la variabilité biologique d'après le contexte génomique d'une population qui peut ensuite être comparée à des cellules ou tissus primaires (essai in vitro) pour définir l'espace biologique pertinent et discerner les sentinelles en fonction du contexte génomique? (On pourrait utiliser par exemple le tissu pulmonaire pour prédire la réponse intestinale.)
- Comment tenir compte de la variabilité phénotypique? L'argument a été présenté en faveur de la nécessité de tenir compte des niveaux actuels d'exposition naturelle, en particulier dans les zones où les récepteurs écologiques peuvent s'être acclimatés à des concentrations de polluants. Lors des essais de recherche sur les « effets des PSE » à faible dose, la réaction à un produit toxique ou à un mélange de produits toxiques peut varier selon que les sujets (ou une population) se sont habitués ou non à une substance.
- Afin de tenir compte des expositions pertinentes pour l'environnement, les conditions des essais pourraient être améliorées par rapport à la pratique actuelle. Il s'agit par exemple ici de se rapprocher de doses ou de concentrations plausibles sur le plan biologique qui permettent de mieux modéliser les expositions chez les humains et dans l'environnement, d'utiliser des espèces d'essais plus pertinentes et de tenir compte des différentes étapes spécifiques de la vie.
- On a indiqué que les modèles de cellules souches pluripotentes induites (CSPi) constituent un moyen d'évaluer la sensibilité génétique, et que des études de cas démontrant la relation dans les modèles in vitro, in vivo et entre eux pourraient accroître la confiance dans la prédiction des niveaux sécuritaires d'exposition des populations sensibles.
1.1.3 Risque cumulatif dû aux mélanges, aux coexpositions et aux facteurs de stress non chimiques
Le risque cumulatif présente un ensemble de problèmes semblables à ceux dont il a été question plus haut pour la variabilité de la population. Le rapport de l'EPA des États-Unis, Guidance on Cumulative Risk Assessment of Pesticide Chemicals that Have a Common Mechanism of Toxicity (2002), traite du recours à la puissance relative pour évaluer l'exposition cumulative à des substances agissant par un mécanisme d'action commun qui pourrait s'appliquer à certaines catégories de PSE. Les mélanges chimiques ont traditionnellement posé des défis pour l'évaluation des risques en raison de la difficulté pour caractériser les expositions mixtes et de concevoir des études qui peuvent traiter adéquatement les scénarios d'exposition, les résultats potentiels et les diverses courbes dose-réponse possibles. La prise en compte des courbes dose-réponse complexes possibles et la définition de la nature de l'interaction chimique (p. ex. additive, synergique et antagoniste) nécessitent des plans d'étude complexes et des études in vivo qui impliquent un très grand nombre d'animaux. Si les études in vitro présentent un certain potentiel pour caractériser la toxicité des mélanges (p. ex. Abdo et coll., 2015b; Neal et coll., 2015), la caractérisation des mélanges pose encore des défis analytiques et d'autres difficultés surviendront lors de la traduction des conditions d'essai in vitro en expositions in vivo (extrapolation in vitro-in vivo [EIVIV]). Bien que les approches EIVIV à débit élevé aient démontré leur utilité pour traduire la bioactivité in vitro en points de départ in vivo, en particulier pour l'évaluation des risques pour la santé humaine, ces efforts ont surtout porté sur des substances individuelles.
Récemment, Zeise et ses collègues (2013) ont inclus les coexpositions, les mélanges et les facteurs de stress non chimiques comme composantes de la variabilité. L'interdépendance des voies d'entrée de la plupart des systèmes biologiques, y compris le système endocrinien, signifie qu'il existe de nombreux domaines potentiels d'interaction entre de multiples produits chimiques et autres facteurs de stress. Les domaines potentiels d'interaction avec les facteurs de risque physiques, génétiques et sociaux ne sont pas propres aux mélanges ou aux PSE individuels, mais ils sont toutefois particulièrement importants ici. Il est encore difficile de s'attaquer aux facteurs de stress non chimiques dans les systèmes d'essais in vitro et in vivo en laboratoire.
Comme on le verra plus loin, les études in vitro sont actuellement limitées dans leur capacité de saisir de multiples voies interconnectées, bien que l’élaboration de modèles organotypiques promette d’améliorer ces capacités. En ce qui concerne les facteurs de stress non chimiques ou d’autres facteurs touchant l’homéostasie endocrinienne, il est bien connu que le système endocrinien répond à une variété de stimuli non chimiques, y compris le stress et l’anxiété généralisés, et le caractère saisonnier. Par exemple, mentionnons les effets du stress sur les concentrations d’hormones toroïdales chez les humains et des changements saisonniers (par exemple, température, durée du jour) sur la signalisation de la reproduction chez de nombreux animaux (par exemple, Helmreich et Tylee, 2011). Toutefois, des recherches plus poussées sont nécessaires pour intégrer ces facteurs dans l’évaluation des risques. En reconnaissant que le développement de la maladie est un processus multifactoriel, ces connaissances pourraient être appliquées pour améliorer l’évaluation des risques liés aux PSE à mesure que la recherche avance pour déterminer les contributions relatives des déterminants physiques, chimiques, sociaux et génétiques de la maladie. Entre-temps, les approches qui reposent sur l’utilisation de facteurs d’incertitude pour tenir compte des incertitudes dans les évaluations des risques, y compris l’exposition aux mélanges, devraient être appliquées sur la base d’une justification scientifique appropriée, et d’autres recherches sont nécessaires pour évaluer le caractère suffisant de ces facteurs.
1.2 Portée et approche du comité concernant la question à l'étude 1
Le Comité scientifique aborde le contexte qu'exigent les définitions de « PSE » et de « PSE potentiel ». Le Comité scientifique indique que la définition d'un PSE exige d'établir à la fois qu'une substance « ait des effets nocifs pour la santé » et qu'elle « altère les fonctions du système endocrinien ». Le Comité scientifique a conclu que du point de vue des « pratiques actuelles d'attribution des priorités et des évaluations », le fait d'établir qu'une substance « a des effets nocifs pour la santé » est suffisant en soi pour justifier l'attribution de priorités et une évaluation précoce. Plus précisément, le Comité scientifique a estimé qu'après avoir déterminé l'existence d'un effet nocif sur la santé, il n'était pas nécessaire d'établir que le mécanisme se déroulait par l'intermédiaire d'altérations du système endocrinien. Par conséquent, le Comité scientifique s'est davantage concentré sur la question de la reconnaissance des PSE potentiels, en particulier pour les substances pour lesquelles il y a pénurie de données qui constituent de plus en plus l'essentiel des efforts déployés dans le cadre du PGPC.
La figure 1 qui tient compte de la démarche actuellement suivie par le Canada pour traiter les PSE dans le cadre du PGPC et de l'incorporation des améliorations potentielles abordées par le Comité scientifique illustre les principales mesures qui pourraient être prises pour mieux traiter les PSE de l'attribution des priorités jusqu'à l'évaluation. Il s'agit notamment, dans le cadre d'une approche progressive, de l'intégration des essais préalables à haut rendement, de l'évaluation de l'exposition et de la toxicocinétique, de l'utilisation des ratios bioactivité-exposition (RBE) et, enfin, des essais in vivo. Notez que l'expression « Mesure à prendre » signifie l'attribution d'une priorité plus élevée pour une évaluation ou la réalisation concrète d'une évaluation, selon le résultat précis.
Le fait de suivre l'ordre décrit dans la figure peut guider l'établissement des priorités, l'évaluation subséquente et la protection potentielle, en particulier si l'évaluateur du risque peut accéder aux différents éléments décrits ou les produire. Une autre amélioration soulevée par certains membres du Comité scientifique, conformément aux recommandations de Thomas et de ses collègues (2013), consisterait à intégrer l'exposition à chaque nœud de décision lorsque la bioactivité est détectée. L'inclusion de l'exposition permettrait d'utiliser les RBE pour déterminer s'il est nécessaire de procéder à d'autres essais. En cas de grande incertitude dans les cases « non in vivo », il peut être nécessaire de mener des essais sur des animaux en l'absence d'un ensemble de données in vivo robuste. Cette option est d'une importance cruciale pour la reconnaissance et la réglementation des PSE potentiels, car c'est actuellement ici que l'adversité peut être la mieux confirmée. Cela dit, l'approche décrite est pragmatique en ce qui concerne la reconnaissance des PSE possibles et la confirmation des préoccupations. En résumé, l'absence de propriétés perturbatrices du système endocrinien peut souvent être fortement indiquée par des approches n'impliquant pas d'animaux, actuelles ou bientôt au point, mais dans certains cas, elle devrait être mieux confirmée par des essais in vivo. Par conséquent, « Mesures à prendre » à la figure 1 indique qu'il faut examiner plus en détail les résultats afin d'éclairer des contextes décisionnels particuliers (par exemple, établissement des priorités, évaluation des dangers ou évaluation des risques).
Figure 1. Aperçu conceptuelNote de bas de page 1
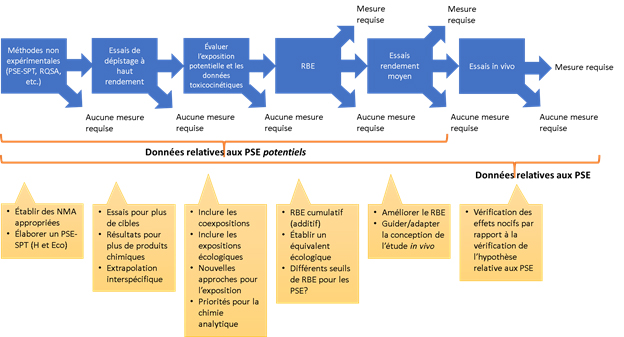
Figure 1 Description détaillée
Le diagramme illustre une stratégie conceptuelle décrivant les principales mesures qui pourraient être prises pour mieux aborder la question des PE dans le cadre du PGPC, depuis l'établissement des priorités jusqu'à l'évaluation. Le diagramme illustre une série d'étapes qui vont de gauche à droite, de manière progressive, montrant comment sont intégrés :
- les méthodes autres que les essais (p. ex. le seuil de préoccupation toxicologique (SPT) et la boîte à outils QSAR),
- les essais de criblage à haut débit (CHD),
- l'évaluation de l'exposition et de la toxicocinétique (TC),
- l'utilisation de ratios bioactivité-exposition (RBE),
- les essais à débit moyen,
- les essais in vivo.
Des flèches indiquent les décisions à prendre aux différentes étapes : « action requise », « aucune action requise » ou « passer à l'étape suivante ». Dans ce contexte, on entend par « action requise » soit l'attribution d'une priorité plus élevée à une évaluation, soit la conduite effective d'une évaluation, selon ses résultats. Le diagramme illustre également l'information provenant de chacune des étapes qui peut confirmer qu'une substance est un PE potentiel (c.-à-d. les résultats QSAR, les essais à débit élevé, les essais à débit moyen) ou un PE vrai (c.-à-d. selon les étapes précédentes avec l'ajout d'essais sur des animaux in vivo). Enfin, le diagramme comprend des suggestions ou des questions relatives à chaque étape qui nécessitent une étude ou un développement approfondis et qui sont expliquées en détail dans le corps du texte principal.
- Note de bas de page 1
-
Ceci est un aperçu conceptuel, y compris les améliorations possibles aux pratiques actuelles pouvant être appliquées aux PSE et aux PSE potentiels (le texte donne plus de détails et d'explications sur les acronymes). Pour obtenir la liste complète des acronymes, consulter la page 27). Les « méthodes non expérimentales » désignent les approches in silico. « H » dénote les humains et « Eco » renvoie aux récepteurs écologiques.
Par conséquent, en réponse à la première question à l'étude, les délibérations et les recommandations du Comité scientifique ont porté sur la façon d'améliorer ces pratiques pour l'évaluation des PSE potentiels. Le Comité scientifique a noté que le flux de travail conceptuel global illustré à la figure 1 peut améliorer les approches actuelles telles qu'elles sont décrites dans l'extrait préparé par les ministères grâce à l'intégration d'étapes supplémentaires à mesure que les nouvelles méthodologies d'approche (NMA) continuent à mûrir. Les nouvelles méthodologies d'approche ont récemment été définies comme « toute technologie, méthodologie, approche ou combinaison de celles-ci qui peut être utilisée pour donner des renseignements sur les dangers chimiques et l'évaluation des risques tout en évitant l'utilisation d'animaux intacts » (EPA, 2018). Cependant, le terme a également été considéré comme synonyme de méthodes d'essais et de stratégies de rechange pour réduire, améliorer ou remplacer les animaux vertébrés. Dans le contexte du PGPC, une définition plus générale, qui comprend, sans s'y limiter, les essais autres que sur des animaux, est appliquée. Conformément à cette approche, les NMA sont utilisées dans la communauté internationale d'évaluation des risques et de recherche pour décrire de façon générale les approches qui font appel aux méthodes in silico et aux essais in chemico ou in vitro aux fins de caractérisation des dangers chimiques et d'évaluation des risques. Les suggestions du Comité scientifique sont illustrées à la figure 1 et sont examinées plus en détail ci-dessous. Les améliorations recommandées par le Comité scientifique sont d'abord organisées en fonction des étapes du niveau conceptuel global, puis, au sein de chaque étape, les considérations soulevées ci-dessus concernant les PSE et les PSE potentiels sont traitées au besoin. Enfin, le Comité scientifique a formulé des observations sur plusieurs questions intersectorielles. Les détails des approches et des méthodes discutées ici sont expliqués plus en détail à la question à l'étude 2.
1.3 Méthodes « non expérimentales »
La case de la figure 1 relative aux méthodes non expérimentales ou in silico dénote l'utilisation de méthodes de modélisation prédictive qui ne nécessitent pas la collecte de données empiriques supplémentaires par des méthodes in vitro ou in vivo. Toutefois, ces méthodes non expérimentales reposent en grande partie sur des données empiriques déjà recueillies pour l'élaboration et l'évaluation de modèles, et elles seront probablement continûment améliorées au fur et à mesure que de nouvelles données deviendront disponibles. La relation entre les méthodes expérimentales et non expérimentales devrait être itérative, lorsque de nouvelles données sont utilisées pour améliorer les prévisions du modèle, et l'évaluation du modèle peut aider à orienter des stratégies d'essais ciblés. Il faudra faire preuve de prudence pour s'assurer que les méthodes non expérimentales seront utilisées en deçà de leur domaine d'application.
Des progrès considérables ont été réalisés dans le développement et l'utilisation de la modélisation in silico des dangers potentiels et de l'exposition des produits chimiques. Les méthodes couramment utilisées pour prévoir la bioactivité relative comprennent les modèles de relations quantitatives structure-activité (QSAR), la technique de lecture croisée (Patlewicz et coll., 2017) et les seuils de préoccupation toxicologique (SPT) qui s'appuient sur la structure chimique pour prévoir le danger potentiel ou la puissance relative. Le SPT (OMS/EFSA, 2016b; Patlewicz et coll., 2018) et les « valeurs de toxicité conditionnelle » (VTC) fondées sur les RQSA (Wignallet coll., 2018) ont été utilisés pour établir rapidement des priorités ou une évaluation préalable pour la santé humaine, notamment par les ministères contribuant au PGPC (Canada, 2016). Le SPT constitue une valeur d'exposition définie pour les produits chimiques, en dessous de laquelle aucun risque sérieux n'est attendu sur la base d'une valeur minimale de toxicité (Belanger et coll., 2015; Hartung, 2017; Hennes, 2012; Kroes et coll., 2004). L'élaboration d'approches semblables, en particulier dans le contexte des PSE (comme un PSE-SPT et un PSE-VTC), en plus d'un élargissement pour aborder la santé écologique, permettrait d'améliorer considérablement la capacité des pratiques actuelles visant à reconnaître des PSE potentiels. De plus amples renseignements sont fournis dans la réponse à la deuxième question à l'étude.
Les modèles d'estimation rapide de l'exposition et les modèles biocinétiques sont également devenus des outils utiles pour l'attribution précoce de priorités à des substances, des modèles d'exposition in silico (Biryol et coll., 2017; Wambaugh et coll., 2014) aux modèles toxicocinétiques à haut rendement (Pearce et coll., 2017) et EIVIV à haut rendement (Bell et coll., 2018; Wambaugh et coll., 2018).
Les modèles in silico pour les dangers et l'exposition actuellement disponibles ont leurs qualités et leurs limites (Cohen Hubal et coll., 2018). Quoi qu'il en soit, il est possible d'appliquer les méthodes in silico avant l'évaluation in vitro à haut rendement des risques ou de l'exposition. Par exemple, le Programme d'évaluation des substances chimiques perturbatrices du système endocrinien de l'EPA des États-Unis a été pris en compte dans la modélisation de l'exposition in silico (ExpoCast) pour des centaines de substances, qui a ensuite été combinée avec des données de bioactivité (ToxCast) pour établir des priorités et une évaluation préalable à haut rendement axées sur le risque pour la santé humaine (EPA des États-Unis, 2014; Wambaugh et coll., 2014). Plus récemment, des modèles QSAR ont été utilisés pour prévoir l'activité œstrogénique et androgénique de milliers de substances (Mansouri et coll., 2016; Trisciuzzi et coll., 2017).
Les résultats du modèle d'exposition offrent des possibilités d'améliorer les intrants pour l'établissement des priorités et les évaluations (Becker et coll., 2015). En utilisant les niveaux d'exposition dans l'environnement, une approche similaire de RBE a été utilisée pour classer par ordre de priorité les produits chimiques PSE et les sites spécifiques des récepteurs écologiques (Blackwell et coll., 2017).
1.4 Améliorer l'utilité des évaluations préalables à haut rendement
La deuxième case de la figure 1 représente les essais à haut rendement pour l'exposition, la cinétique et la bioactivité qui peuvent être effectués rapidement et économiquement par rapport aux essais in vivo. Bien que les méthodes d'évaluation préalable à haut de rendement des risques et de l'exposition actuellement disponibles présentent des avantages et des limites (Cohen Hubal et coll., 2018; Coussens et coll., 2018; Thorne, Auld, et Inglese, 2010), elles peuvent être utiles dans les évaluations des risques posés par les PSE. Parmi les exemples de méthodes ou de modèles récents, mentionnons les essais de bioactivité des programmes ToxCast et Tox21 (Attene-Ramos et coll., 2013; Kavlock et coll., 2012) et la mesure in vitro des paramètres pharmacocinétiques (Nicolas et coll., 2018).
Le Comité scientifique note qu’au cours de la dernière décennie, les programmes ToxCast et Tox21 de l’EPA des États-Unis (Dix, 2010) ont réalisé des progrès considérables relativement aux évaluations préalables à haut rendement des produits chimiques, cependant peu de données existent. Le Comité scientifique a également noté que les données ne sont pas encore disponibles pour l’ensemble de l’espace chimique et de l’espace biologique, et que combler ces lacunes impliquera inévitablement un « investissement » substantiel dans les études in vivo pertinentes pour obtenir une capacité de lecture croisée et d’extrapolation supplémentaire. Un tel investissement implique une grande utilisation d’animaux et d’importants coûts financiers. Pour étendre les essais à l’ensemble de l’espace chimique (par exemple, pour couvrir la totalité des produits chimiques et des substances à l’étude), les essais doivent inclure les substances très volatiles, les substances peu solubles dans l’eau ou le sulfoxyde de diméthyle et les produits de dégradation environnementale (Richard et coll., 2016). De plus, en raison du manque de compétence métabolique de la plupart des essais in vitro, il faut effectuer plus d’essais sur les métabolites pertinents pour l’environnement, qui peuvent être sujets à une augmentation ou une diminution de la bioactivité de la perturbation endocrinienne comparativement à la substance d’origine. Par exemple, certains PSE prototypiques ne sont pas initialement actifs, mais le deviennent après le métabolisme in vivo. De même, certaines substances prototypiques qui peuvent interagir avec les récepteurs hormonaux in vitro sont inactives in vivo parce qu’elles sont rapidement métabolisées en structures ne pouvant plus se lier au récepteur. Des travaux récents ont commencé à s’attaquer à ce problème en adaptant des essais in vitro à la compétence métabolique (par exemple, DeGroot et coll., 2018; Yu et coll., 2018). De plus, on s’inquiète de l’absence de couverture des PSE potentiels qui ne sont pas inclus dans les essais actuels des effets EATS (pour les effets non EATS; voir plus bas).
Voici quelques difficultés et questions clés qui chevauchent d'autres niveaux d'essais :
- Effets EATS et non EATS. Les effets des PSE les plus étudiés comprennent les voies d'entrée œstrogéniques et androgéniques ainsi que la stéroïdogenèse (Browne et coll., 2015; Haggard et coll., 2018; Kleinstreuer et coll., 2018). De plus, des progrès ont été réalisés dans un certain nombre d'essais à haut rendement pour les événements moléculaires déclencheurs qui pourraient prévoir les perturbations de l'homéostasie de la thyroïde. Il s'agit notamment de la thyroperoxydase (Paul et coll., 2014), des déiodinases (Hornung et coll., 2018), du symporteur sodium-iodure (Wang et coll., 2018), de la transactivation des récepteurs thyroïdiens (K. Paul-Friedman, communication personnelle, 2 janvier 2019) et du récepteur thyréostimuline et du récepteur de la thyrolibérine (Toxicity Forecaster [ToxCast] de l'EPA des États-Unis et Toxicology in the 21st Century [Tox 21] du Department of Health and Human Services des États-Unis). Il existe des technologies pour de nombreux autres événements moléculaires déclencheurs thyroïdiens, mais à l'heure actuelle, certains événements moléculaires déclencheurs n'ont pas été le sujet d'essais in vitro ou n'ont pas été utilisés pour dépister un grand nombre de substances chimiques environnementales (p. ex. les transporteurs cellulaires [Dong et Wade, 2017]; les protéines de fixation du sérum [Marchesini et coll., 2008]).
La reconnaissance et la mise à l'essai de voies d'entrée liées aux récepteurs non EATS restent un défi de taille. La transcriptomique à haut rendement, associée à des outils bioinformatiques qui s'améliorent rapidement, représente une voie prometteuse pour la reconnaissance rapide des dangers et l'établissement de priorités fondées sur la bioactivité pour les PSE, en particulier les récepteurs non EATS, ainsi que les substances non PSE, en raison de la vaste couverture biologique et de la diminution des coûts des méthodes de séquençage à haut rendement. Cette situation est traitée plus en détail à la deuxième question à l'étude. - La variabilité de la population est prise en compte dans certaines nouvelles approches à haut rendement. Il s'agit notamment de l'utilisation de populations allant jusqu'à 1000 lymphoblastes humains obtenus de divers donneurs pour simuler une vaste « population » (Abdo et coll., 2015a,b; Chiu, Wright et Rusyn, 2017), et plus récemment de cardiomyocytes dérivés de CSPi (Grimm et coll., 2018). Aucune de ces approches n'est propre aux effets liés à la perturbation endocrinienne, mais il sera possible à l'avenir d'utiliser des technologies fondées sur les CSPi. Une autre possibilité soulevée par le Comité scientifique était, telle que précisé plus haut, le discernement et la mise au point de « sentinelles », soit des individus plus sensibles ou vulnérables.
- L'extrapolation interspécifique, en particulier de la santé humaine à la santé écologique et vice versa, est actuellement possible, en principe, mais n'a pas été examinée en détail, notamment en ce qui concerne les mesures quantitatives liées à la bioactivité. De telles extrapolations sont susceptibles de donner lieu à de grandes incertitudes, qui devraient être quantifiables par des analyses appropriées (Hecker, 2018). D'autre part, il est généralement admis que l'échelle allométrique est appropriée pour les doses orales in vivo chez toutes les espèces de mammifères, avec des incertitudes résiduelles qui ont été caractérisées de façon quantitative (par exemple, Bokkers et Slob, 2007). Un travail moins important a été fait pour les concentrations d'essai in vitro, mais des approches semblables pourraient être tentées dans cet espace pour une plus grande variété d'espèces. De plus, il existe peu d'exemples d'approches in vitro utilisées avec succès pour prédire les réponses apicales d'une espèce à l'autre d'après l'activation des récepteurs, comme le récepteur d'hydrocarbure d'aryle (Doering et coll., 2018). Un autre point de départ potentiel est l'outil Sequence Alignment to Predict Across Species Susceptibility (SeqAPASS ) de l'EPA des États-Unis (LaLone et coll., 2016). Cet outil évalue les similitudes entre les séquences d'acides aminés et la structure des protéines pour estimer le degré d'homologie des gènes entre les espèces (LaLone et coll., 2013). Cette approche présente des limites : (1) l'incertitude n'est caractérisée que de façon qualitative, et (2) elle nécessite comme intrants des cibles moléculaires et des données sur la séquence génomique. Néanmoins, il s'agit d'une approche prometteuse qui peut être utilisée, avec des incertitudes reconnues, lorsqu'il n'existe pas d'autres modèles interspécifiques ou de données empiriques.
- Risques cumulatifs, mélanges et coexpositions. Les essais in vitro pourraient s'avérer prometteurs pour évaluer les dangers découlant des mélanges chimiques. Il s'agit de mélanges « conçus » (c’est-à-dire, créés délibérément aux fins d'essai) (Meek et coll., 2011), de mélanges dérivés d'échantillons environnementaux (Neale et coll., 2015) et de mélanges de produits commerciaux (Grimm et coll., 2016). L'incorporation de facteurs de stress non chimiques dans une évaluation des risques cumulatifs n'a toutefois pas fait l'objet de recherches approfondies.
- Les périodes de sensibilité, les effets multigénérationnels et l'épigénétique sont plusieurs domaines difficiles pour lesquels le comité connaissait peu d'approches, voire aucune, à haut rendement en développement qui pourraient éclairer ces questions pour les PSE.
1.5 Élargir l'évaluation de l'exposition et de la toxicocinétique
Le comité a noté que de nombreux efforts ont été récemment déployés pour améliorer l’évaluation de l’exposition, dont le PGPC pourrait tirer parti dans le contexte des PSE. Pour les substances existantes, la biosurveillance élargie et la surveillance de l’environnement fournissent une multitude de nouvelles sources de données potentielles pour estimer les expositions et appliquer des modèles d’exposition. De nouvelles méthodes de mesure émergent pour caractériser l’exposition humaine, comme les échantillonneurs passifs au silicone (par exemple, bracelets) (Hammel et coll., 2016, Okeme et coll., 2018), bien qu'elles soient utilisées à ce stade pour une évaluation qualitative et non quantitative. Des échantillonneurs d'air passifs ont également été mis au point pour les oiseaux (Sorais et coll., 2017). À l'avenir, ces efforts pourraient servir à estimer l'exposition à des mélanges de substances ciblées pour estimer les coexpositions. De plus, on s'intéresse de plus en plus à l'utilisation d'analyses chimiques non ciblées pour examiner les échantillons environnementaux, ce qui peut également contribuer à la compréhension des coexpositions et des mélanges (par exemple, Moschet et coll., 2018; Rager et coll., 2016). De plus, la toxicocinétique inversée basée sur les EIVIV fait systématiquement partie de l'évaluation chimique des produits chimiques individuels et a été limitée par les méthodes de la chimie analytique. De nouveaux modèles d'exposition fondés sur des paramètres cinétiques empiriques ou prévus limités ont été utilisés pour extrapoler les données de bioactivité in vitro à la dose quotidienne d'exposition humaine, avec des limites en matière d'incertitude, pour des milliers de produits chimiques (Wambaugh et coll., 2018) et plus particulièrement pour les PSE (des œstrogéniques [Casey et coll., 2018]; récepteur glucocorticoïde [Hartman et coll., 2018]). De plus, les approches informatiques se sont avérées utiles pour évaluer la sensibilité de la population en raison de la variabilité pharmacocinétique (Ring et coll., 2017). Notamment, les approches qui utilisent la modélisation pharmacocinétique fondée sur la physiologie ou des méthodes de dosimétrie connexes pour interpréter les données de biosurveillance humaine dans un contexte de risque, tant pour les PSE que pour les non-PSE, ont été utilisées dans l'Enquête canadienne sur les mesures de la santé (Haines et coll., 2017; St-Amand et coll., 2014) et dans la National Health and Nutrition Examination Survey (Aylward et coll., 2013) aux États-Unis.
Le Comité scientifique suggère différentes approches possibles d'amélioration dans ce domaine :
- Continuer d'appuyer la modélisation du devenir et de l'exposition. Les modèles en champ proche présenteraient un intérêt particulier pour les PSE en raison de leur résolution spatiale et temporelle généralement plus élevée, ce qui pourrait mieux éclairer les expositions pendant certaines périodes de sensibilité. Il est très important d'estimer et de prévoir l'exposition fœtale ou à un stade précoce de la vie.
- Explorer la capacité des RQSA et d'autres méthodes à haut rendement à prédire l'activité biologique des métabolites, les productions de dégradation et leurs voies d'entrée associées.
- Combiner les données sur l'exposition avec les données QSAR ou les données sur la bioactivité à haut rendement pour aider à classer par ordre de priorité les développements futurs des méthodes de chimie analytique en termes de sélection des composés et de sensibilité analytique.
- Parvenir à une meilleure compréhension de la variabilité de l'exposition, tant pour les substances individuelles que pour les coexpositions et les mélanges.
- Continuer d'appuyer l'élaboration de modèles prédictifs de cinétique et d'exposition à haut rendement.
Il faut également mettre davantage l'accent sur la toxicocinétique dans le contexte des études à rendement moyen et des études in vivo, comme on le verra plus loin.
1.6 Étendre l'utilisation des ratios bioactivité-exposition
La quatrième case de la figure 1 représente l'utilisation des estimations du RBE pour l'évaluation du risque pour l'humain à partir d'essais in vitro. Cette approche est de plus en plus utilisée comme critère important de sélection et d'établissement des priorités pour les produits chimiques peu étudiés. Dans ce domaine, les RBE sont calculés comme étant la différence entre une dose orale équivalente prédite à partir des données de bioactivité in vitro et des estimations d'exposition prévues (Sipes et coll., 2017; Wetmore et coll., 2015). Comme nous l'avons mentionné, bien que la figure 1 illustre l'utilisation du RBE à la suite d'une évaluation préalable à haut rendement, l'approche du RBE peut être utilisée à chaque nœud où la bioactivité est estimée ou mesurée, y compris par des méthodes non expérimentales telles que le SPT et les essais à rendement moyen. Le Comité scientifique a examiné plusieurs améliorations possibles de l'utilisation des RBE pour les PSE :
- Le Comité scientifique a examiné la possibilité d'exiger un RBE plus élevé pour qu'aucune mesure ne soit requise concernant les objectifs liés aux PSE par rapport à d'autres types de bioactivité en raison de préoccupations particulières liées aux neuf considérations principales énumérées plus haut (voir les points, p. 4 et 5). Certains membres ont appuyé cette idée, tandis que d'autres ont estimé qu'une approche au cas par cas était préférable. En fin de compte, le Comité scientifique a reconnu qu'il s'agit d'une politique de gestion des risques plutôt que d'une décision scientifique. Toutefois, elle pourrait s'appuyer sur des analyses rétrospectives comparant les points de départ de la bioactivité avec les points de départ in vivo pour les PSE.
- Le Comité scientifique a appuyé l'élaboration d'un risque écologique équivalent au RBE qui tiendrait compte de la toxicocinétique dans les récepteurs écologiques et serait fondé sur la voie d'exposition pertinente (p. ex. par voie alimentaire ou par immersion/contact). Une telle approche pourrait s'inspirer de celle de Blackwell et coll. (2017).
- Le Comité scientifique a abordé le soutien à la recherche sur l'élaboration d'une version axée sur les risques cumulatifs d'un RBE pour tenir compte des coexpositions à de multiples PSE potentiels. Le Comité scientifique a noté qu'un tel « projet de recherche » sur les risques cumulatifs pourrait prendre en compte à la fois les substances de puissance variable qui agissent par le même mode d'action et les substances qui agissent par des modes d'action différents, mais qui convergent vers le même résultat indésirable ou un événement clé antérieur.
- Le Comité scientifique a appuyé l'amélioration du RBE par le biais d'essais dans des systèmes plus intégrés, tels que ceux qui apparaissent comme des essais à « rendement moyen » ou à l'échelle de l'organisme entier, et qui sont examinés ci-après.
1.7 Utilisation d'essais à rendement moyen avant les essais in vivo
Un certain nombre d’essais émergents à « rendement moyen » sont très prometteurs, car ils fournissent des renseignements qualitatifs et quantitatifs sur les PSE (par exemple, Hartman et coll., 2018; Miller et coll., 2016). Ces essais viseraient plus précisément à fournir un système plus intégré pour modéliser les PSE plutôt que de ne traiter que les cibles moléculaires individuelles, ce qui pourrait ne pas permettre de caractériser précisément la relation dose-effet globale en raison de la présence de multiples voies interconnectées (Miller et coll., 2017; Yoon et coll., 2016). Parmi les approches possibles, mentionnons les suivantes :
- L'utilisation de modèles animaux non traditionnels pour la santé humaine et l'évaluation écologique (par exemple, le poisson-zèbre et la daphnie). Ces essais sont abordés plus en détail à la question à l'étude 2.
- Le choix et l'élaboration de sentinelles appropriées pour aborder à la fois les variabilités de la population et de la sensibilité (par exemple, phénotypiques). L'une des idées consiste d'abord à cartographier l'« espace » de la variabilité biologique entre les individus et les espèces, par la cartographie, par exemple, de l'expression génétique à l'aide de lignées cellulaires et de cellules ou tissus primaires provenant de sources différentes. À partir de cet « espace », on pourrait tester la variabilité de la sensibilité sur l'ensemble de la plage de variation et déterminer quels seraient dans la répartition, les « extrêmes » qui pourraient servir de sentinelles.
- Une meilleure modélisation de la dosimétrie pour l'EIVIV, qui sera un aspect important de tous les nouveaux modèles. Étant donné les préoccupations relatives à la toxicité des PSE pour le développement et la reproduction, l'EIVIV traditionnelle fondée sur la concentration plasmatique peut refléter la dosimétrie maternelle, mais ne se traduit pas nécessairement en dosimétrie tissulaire (ou embryonnaire). La prise en compte explicite de la bioactivité dans l'exposition de la mère et de l'embryon ou du fœtus devrait être étudiée.
Au fur et à mesure de leur progression, les essais à rendement moyen sont d'abord susceptibles de donner plus de confiance dans la reconnaissance des PSE potentiels. Ainsi, les résultats de ces essais peuvent être utiles pour peaufiner et éclairer des essais in vivo plus ciblés. À l'avenir (probablement en combinaison avec des modèles informatiques), de tels essais à rendement moyen permettraient de prédire avec confiance les effets nocifs et ainsi de fournir des preuves pour reconnaître les PSE en l'absence de tests in vivo.
1.8 Amélioration des essais in vivo
En raison de l'interconnectivité complexe des voies endocriniennes et de la toxicité, le Comité scientifique ne prévoit pas qu'un remplacement complet des essais in vivo sera possible dans un avenir proche. Par conséquent, des essais in vivo seront toujours nécessaires. Toutefois, le Comité scientifique estime que les approches in vitro et in silico seront non seulement utiles pour l'établissement des priorités et l'évaluation préalable, mais qu'elles fourniront également des données clés grâce auxquelles les essais in vivo pourraient être peaufinés et classés par ordre de priorité afin de mieux traiter les effets liés aux PSE et de réduire si possible l'utilisation des animaux. Bien que l'utilisation d'essais in vitro pour l'établissement des priorités et l'évaluation préalable soit actuellement mise en œuvre (par exemple, Browne et coll., 2015), le Comité scientifique prévoit que la combinaison des méthodes in silico, des essais à haut rendement et des essais à rendement moyen apportera suffisamment de renseignements pour générer des hypothèses spécifiques permettant de concentrer les essais in vivo sur les effets nocifs pour la santé (humains ou environnement). La conception des études in vivo doit ensuite être adaptée aux effets nocifs supposés sur la santé, notamment :
- Les caractéristiques de conception des essais in vivo pourraient être mieux adaptées en fonction des effets nocifs sur la santé indiqués par les essais de bioactivité et de rendement moyen en termes :
- de périodes de sensibilité
- d'utilisation de contrôles positifs et négatifs appropriés.
- L'utilisation d'un plus grand nombre de groupes de doses avec moins de répétitions par dose, combinée à la modélisation des doses repères, peut devenir un modèle d'étude in vivo plus efficace que les modèles traditionnels (lignes directrices), surtout si le but est de mieux caractériser la relation dose-réponse (notamment aux faibles doses pertinentes du point de vue environnemental pour les PSE). De plus, le choix de la dose peut être fortement guidé par :
- les estimations de l'exposition
- les niveaux cibles de dose interne basés sur les résultats des essais de bioactivité et de rendement moyen, en combinaison avec la toxicocinétique inversée
- plus de détails sur la biotransformation de la substance d'essai (si elle est connue), que ce soit en ce qui concerne la bioactivation ou la désintoxication.
La proposition consistant à réduire les répétitions a cependant ses limites. La réduction du nombre de portées peut ne pas s'avérer justifiée du point de vue de la recherche, car dans les études de toxicité pour le développement et la reproduction, la portée est l'unité expérimentale (Festing, 2006). De plus, du point de vue de la puissance statistique, Elswick, Welsch et Janszen (2000) ont noté que des paramètres très variables peuvent ne pas être adaptés à l'étude de modèles comportant un nombre inférieur d'animaux d'essai en raison de la variabilité biologique normale intraportée.
En outre, le Comité scientifique note la nécessité d'études de cas rétrospectives pour mieux comprendre la « valeur de l'information » des essais in vivo. Les points qui sont particulièrement pertinents pour les PSE pourraient être les suivants :
- La valeur découlant de l'ajout d'une étude portant sur deux générations (ou d'une étude approfondie sur une génération) en termes de niveau de protection du point de départ comparativement aux études in vitro ou à court terme (par exemple, études in vivo de toxicité aiguë, à court terme ou à doses répétées).
- L'utilisation d'effets précurseurs (par exemple, changements hormonaux) qui ne sont traditionnellement pas considérés comme « nocifs » au niveau individuel pour se protéger contre les événements indésirables en aval, ce qui pourrait être important pour discerner les effets multigénérationnels et au niveau des populations.
- Comparaison des doses équivalentes calculées à partir des nouvelles méthodologies d'approche de niveau inférieur appliquées aux points de départ découlant des études sur les effets multigénérationnels in vivo de niveau supérieur afin de déterminer si les NMA protègent la santé.
Question à l'étude 2
A) Déterminer les essais et les méthodes, y compris les NMA, qui pourraient :
- compléter les renseignements actuellement exigés en application du Règlement sur les renseignements concernant les substances nouvelles
- éclairer les évaluations effectuées pour les substances existantes
- être utiles pour répondre aux besoins de données nécessaires pour les évaluations préalables et l'évaluation du potentiel de perturbation du système endocrinien d'une substance.
B) Comment, en l'absence d'effets nocifs apicaux, devrait-on tenir compte des données sur les perturbations ou les modulations pour :
- l'établissement des priorités
- la prise de décisions réglementaires.
2.1 Thèmes généraux
En déterminant les essais et les méthodes qui pourraient être utilisés pour évaluer les substances nouvelles et existantes, le Comité scientifique a discuté des besoins à court, à moyen et à long terme du PGPC. Le Comité scientifique n'a pas formulé de commentaires sur la source potentielle des données (par exemple, le gouvernement, l'industrie ou une autre source). Les besoins immédiats ont été abordés par rapport aux approches et méthodes actuellement disponibles qui pourraient être facilement utilisées ou appliquées. Les lacunes dans les données, la recherche et l'élaboration de méthodes ont été révélées pour les besoins à moyen et à long terme.
La plupart des discussions sur la deuxième question à l'étude se sont appuyées sur des considérations sur l'utilisation et le degré d'incertitude acceptable. Le Comité scientifique a souligné qu'un énoncé clair du contexte ou des besoins réglementaires et du niveau de confiance nécessaire devrait guider le choix des méthodes et des demandes de données appropriées.
Tout au long des discussions, le Comité scientifique a reconnu que, parce que les œstrogènes et les androgènes agissent par des voies biologiques médiées par les récepteurs, le passage à une toxicologie plus mécaniste ou fondée sur un mode d'action a permis aux PSE d'ouvrir la voie à la transition des méthodologies traditionnelles, les MAT, aux NMA. Le recours au cadre du mode d'action (Boobis et coll., 2006; 2008) et au cadre du parcours de résultats nocifs (Ankley et coll., 2010) illustre le mieux ce fait. Ces cadres ont permis de mieux comprendre l'enchaînement des événements clés dans les voies d'entrée en cause qui entraînent des effets apicaux observés. De plus, les cadres ont guidé l'élaboration d'essais pour les événements moléculaires déclencheurs et d'autres événements clés en amont des paramètres apicaux pour les voies d'entrée liées aux voies EATS et non EATS.
Les NMA et MAT in vivo peuvent être utilisées pour répondre aux besoins en matière d'évaluation préalable et d'essais pour les PSE. Il est important de souligner que de nombreuses MAT tiennent compte des paramètres des PSE (voies EATS et de nombreuses voies non EATS) [Manibusan et Touart, 2016]. De plus, l'ajout de groupes satellites aux fins d'évaluation provisoire au cours d'une étude des niveaux d'hormones ou d'autres paramètres de la voie endocrinienne à des MAT permet d'avoir des renseignements supplémentaires pour éclairer davantage les modes d'action des produits chimiques PSE sans devoir réaliser d'autres essais approfondis. Comme pour toute méthode, il est essentiel de comprendre et de décrire le domaine d'applicabilité. La priorité d'inclusion devrait être accordée aux méthodes qui peuvent saisir plusieurs voies d'entrée ou paramètres pour les NMA et les MAT.
La disponibilité, l'accès et la communication des données sont essentiels pour assurer l'utilisation efficace de ressources limitées. Au fur et à mesure que les méthodes sont élaborées et que les données sont produites à l'aide des MAT et des NMA, on doit s'efforcer de publier cette information dans un format accessible pour l'ensemble du gouvernement et à l'extérieur du pays. Les bases de données ToxRef, ToxCast et Tox21 de l'EPA des États-Unis, le CompTox Dashboard de l'EPA des États-Unis et les bases de données ouvertes de l'Agence européenne des produits chimiques en sont des exemples. L'amélioration continue des données et des résultats des décisions favorisera l'élaboration d'autres MNA, y compris des RQSA et d'autres approches non expérimentales, et facilitera l'expansion de l'espace chimique testé au moyen de nouvelles méthodes.
Plusieurs des NMA et des MAT qui sont actuellement centrées sur l'identification des PSE potentiels se rapportent aux voies d'entrée liées aux voies EATS. Comme nous l'avons mentionné précédemment, des travaux supplémentaires seront nécessaires pour attribuer les priorités de l'élaboration de méthodes pour les voies non EATS. Le Comité scientifique n'a pas été en mesure de recommander la mise en œuvre d'essais et de méthodes spécifiques liés aux voies non EATS en raison de la disponibilité limitée d'essais bien validés. Ce point est discuté en profondeur à la section 2.3.2.
2.2 Recommandations à court terme
2.2.1 Exposition
Il est essentiel de comprendre l'exposition aux risques pour appliquer une approche fondée sur le risque à l'évaluation des PSE. Comme nous l'avons mentionné à la question à l'étude 1, les besoins liés à l'exposition impliquent de meilleures estimations des concentrations d'exposition externe (environnementale) résultant de la production et du rejet des produits chimiques, ainsi qu'une meilleure compréhension des concentrations dans le système expérimental (par opposition aux concentrations nominales, qui ne reflètent pas nécessairement les concentrations réelles).
Plusieurs des études in vitro et in vivo réalisées à ce jour ne portent pas sur la toxicocinétique et, par conséquent, l'EIVIV interspécifique (des rongeurs aux humains) et l'extrapolation des concentrations en laboratoire aux expositions réelles est incertaine (voir aussi la première question à l'étude). Il sera nécessaire de réduire les incertitudes des estimations liées à la toxicocinétique et de l'EIVIV afin d'éliminer la dépendance à l'égard des études in vivo pour obtenir un point de départ à utiliser dans les évaluations. La compréhension de la dose dans le système expérimental est nécessaire pour utiliser des méthodes in vitro pour la prise de décisions réglementaires.
Dans le cas du Programme des substances nouvelles, des essais de toxicité détaillés pour les paramètres des PSE ne seraient demandés que si une évaluation initiale des risques révèle un risque potentiel de perturbation du système endocrinien, s'il n'a pas déjà été communiqué. L'évaluation des risques repose sur les renseignements fournis dans un dossier de déclaration, qui est soumis par un importateur ou un fabricant avant de dépasser un seuil de volume annuel d'importation ou de fabrication (100 – 10 000 kg/an) pour une substance sous forme « pure » ou dans un produit fini formulé (articles manufacturés non inclus). On doit noter que les faibles volumes de produits chimiques préoccupants en raison d'une forte activité biologique ou d'une puissance élevée pourraient être inférieurs aux seuils de déclaration (par exemple, les composants mineurs de produits de soins personnels). En outre, les seuils de volume ne sont pas toujours des indicateurs fiables de l'exposition humaine. Le règlement n'exige pas expressément qu'un test de perturbation endocrinienne soit effectué, mais celle-ci fera l'objet d'une enquête si une activité dans ce sens était détectée, notamment s'il n'y a pas de mesure de perturbation endocrinienne plus particulièrement dans les déclarations obligatoires. Au minimum, en cas d'incertitude, des évaluations futures seront notées.
Si un problème potentiel lié de perturbation du système endocrinien est signalé, des mesures de contrôle pourraient être élaborées. À titre de mesure de contrôle, un essai endocrinien de confirmation pourrait être demandé dans un Avis de nouvelle activité, publié lorsque la substance est utilisée pour une nouvelle activité définie par le Programme des substances nouvelles. Par ailleurs, l'importation ou la fabrication d'une substance peut être interdite jusqu'à ce les résultats d'un essai endocrinien de confirmation soient fournis. Des conditions à l'importation ou à la fabrication d'une substance, ainsi que l'interdiction, peuvent également être imposées lorsque la toxicité est confirmée. Le Comité scientifique a fait remarquer que de multiples sources de données devraient être prises en compte pour les essais de toxicité requis. Plus particulièrement, certains membres du Comité scientifique ont proposé d'obtenir les estimations de l'exposition par l'intermédiaire de la surveillance ou la modélisation (comme les modèles d'exposition ou les RQSA), ou par une combinaison de plusieurs approches. L'approche à long terme permettant de déclencher les obligations d'essais devrait passer de volumes annuels à des estimations plus globales et plus pertinentes de l'exposition et donc du risque potentiel d'effets découlant de de substances perturbatrices du système endocrinien. Le comité comprend que cette évolution est en cours, mais qu'elle exige plus de travail.
2.2.2 Génération de données ciblées
Comme nous l'avons mentionné à la section 1.4, plusieurs des méthodes mises au point pour évaluer les paramètres des PSE ont été mises à l'essai, évaluées et validées pour différents produits chimiques dans le cadre de programmes à haut rendement (par exemple, ToxCast, Tox21; Dix, 2010). Les modèles de bioactivité des PSE ont donné de bons résultats pour les voies d'entrée liées aux œstrogènes et aux androgènes, produisant généralement des résultats de précision équilibrés de 0,8 à près de 1,0 par rapport aux essais de niveau 1 du Programme d'évaluation des substances chimiques perturbatrices du système endocrinien de l'EPA des États-Unis (Browne et coll., 2015; Cox et coll., 2014; Kleinstreuer et coll., 2017; Rotroff et coll., 2013). Au départ, la précision des modèles de prédiction de la stéroïdogenèse était faible (de l'ordre de 0,5), mais les nouveaux essais ont amélioré la modélisation prédictive, donnant ainsi des précisions équilibrées allant de 0,75 à 0,9 par rapport au test H295R à faible rendement validé par l'Organisation de coopération et de développement économiques (OCDE) (Haggardet coll., 2018).
En classant par ordre de priorité les besoins en matière d'essais supplémentaires afin d'élargir davantage le domaine d'applicabilité, l'accent devrait être mis sur les lacunes spécifiques en matière de données, tel que l'indique la section 1.4. Il est important de noter que toutes les données supplémentaires générées devraient être accessibles pour aider à peaufiner et à améliorer les méthodes in silico, comme nous l'indiquions à la section 1.3.
2.2.3 Utilisation du cadre des parcours de résultats néfastes pour organiser les analyses et les renseignements liés aux PSE et recenser les lacunes
Les parcours de résultats néfastes fournissent un cadre organisationnel pour les méthodes pouvant être utilisées ou élaborées afin d'aider à évaluer les PSE. L'utilisation de ce cadre pour organiser l'information peut aider à mettre en contexte les besoins en matière d'élaboration de données et de méthodes. Browne et ses collègues (2017 ) donnent un exemple de la façon dont les méthodes d'essai des PSE peuvent être harmonisées à l'aide du cadre du parcours de résultats néfastes; des exemples de voies d'entrée pertinentes et de méthodes d'essai disponibles aux divers niveaux de l'organisation biologique sont présentés (p. ex. événement moléculaire déclencheur àeffets néfastes sur la santé humaine et les récepteurs écologiques pour l'organisme ou la population). Le Comité scientifique note que, bien qu'un certain nombre de parcours de résultats néfastes endocriniens soient en cours d'élaboration, très peu d'entre eux ont été approuvés par l'OCDE à ce jour (OCDE, 2018). Il est clair qu'il reste encore du travail à faire et qu'il faudrait le faire pour élargir cette liste.
Ce cadre général peut également être utilisé pour comparer les renseignements sur les substances chimiques connues (résultats positifs ou négatifs dans les essais de perturbation du système endocrinien) avec les renseignements disponibles sur une nouvelle substance chimique pour laquelle seules des informations limitées peuvent être disponibles. Cela peut faciliter l'adoption d'une stratégie de type « lecture croisée » et permettre de déterminer dans quels cas des tests spécifiques et ciblés seraient les plus utiles (figure 2).
Figure 2. Alignement des méthodologies relatives aux PSE disponibles sur le cadre du parcours de résultats néfastes
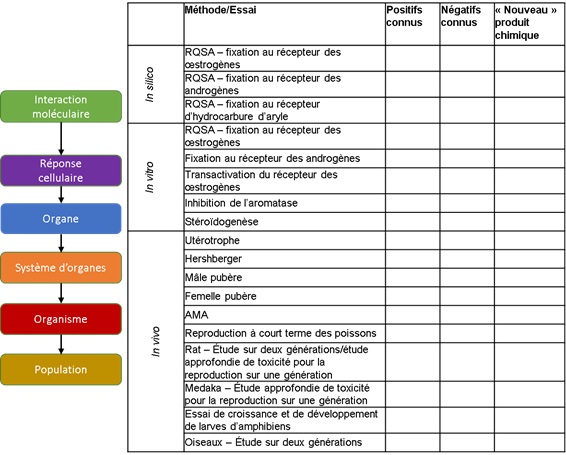
Figure 2 Description détaillée
Le diagramme montre l'alignement des niveaux d'organisation biologique qui constituent un parcours de résultats néfastes (PRN) avec un tableau contenant une gamme choisie de divers outils et essais disponibles pour tester les PE. Les récepteurs présentant des liens entre les résultats QSAR et les essais in vitro sont alignés suivant l'événement déclencheur moléculaire du PRN, tandis que les autres essais in vitro qui mesurent des événements comme l'activation transcriptionnelle sont alignés suivant le niveau de réponse cellulaire au sein du PRN. Les essais in vivo, comme l'essai utérotrophique, sont alignés suivant la réponse de l'organe, tandis que les essais comme l'étude de reproduction sur deux générations sont alignés suivant le niveau de réponse de l'organisme. Enfin, le diagramme montre que le tableau des essais comprend des colonnes dans lesquelles les résultats pour les positifs connus, les négatifs connus et les « nouveaux » produits chimiques peuvent être insérés. Une fois le tableau rempli, on peut utiliser des renseignements limités sur le nouveau produit chimique pour déterminer les lacunes et les besoins en matière d'essais, ou bien on peut employer des renseignements sur des produits chimiques connus pour effectuer une lecture croisée.
Le tableau peut être utilisé pour faciliter une stratégie de type « lecture croisée » lors de l'évaluation d'un nouveau produit chimique pour lequel on dispose de peu d'informations. Pour chaque essai, les produits chimiques que l'on sait positifs ou négatifs peuvent être inscrits sur la liste, et les renseignements limités sur le nouveau produit chimique figurant dans la dernière colonne peuvent être utilisés pour déterminer les lacunes et les besoins en matière d'essais. (Adapté de Browne et coll., 2017; et Borgert et coll., 2011.)
2.2.4 Exploration d'un « SPT-PSE »
Comme nous l'avons mentionné à la première question, une approche du seuil de préoccupation toxicologie (SPT) pourrait être utilisée pour attribuer les priorités de l'évaluation du potentiel de risque de perturbation endocrinienne de produits chimiques. Pour les applications en santé humaine, le SPT est basé sur les 5 % inférieurs de la répartition de la « dose sans effet nocif observé » chez les rongeurs pour les produits chimiques ayant des caractéristiques structurelles semblables (Kroes et coll., 2004). Le SPT est obtenu en appliquant le facteur d'incertitude couramment utilisé de 100 (10 × interspécifique et 10 × intraspécifique), en notant les incertitudes de ces facteurs (voir les commentaires précédents sur l'application de l'« incertitude »; par exemple, dans les sections 1.1.2 et 1.1.3). Pour le contexte écologique, il a été proposé, mais pas encore testé, que les valeurs soient calculées sur la base des 5 % inférieurs de la répartition de la « concentration estimée sans effet » (Belanger et coll., 2015). Le SPT peut ensuite être comparé à une estimation de l'exposition probable à un produit chimique afin d'élaborer une évaluation préalable pour une voie d'exposition donnée. Un récent examen scientifique effectué par l'Autorité européenne de sécurité des aliments et l'Organisation mondiale de la Santé (OMS/EFSA, 2016b) a révélé que le SPT représente une approche adaptée et largement applicable comme outil d'évaluation des risques. Le SPT peut être utilisé comme valeur indicative pour la santé lorsqu'aucune donnée in vivo n'est disponible et pour calculer une dose de référence de toxicité propre à un produit chimique ou une « dose journalière admissible ».
Étant donné que l’une des préoccupations des parties intéressées à l’égard des PSE est la possibilité d’une sensibilité différentielle importante (c’est-à-dire, possibilité d’effets à des doses plus faibles par rapport aux modes d’action liés aux substances non PSE), le Comité scientifique a proposé d’étudier la possibilité d’élaborer un SPT qui s’applique spécifiquement aux PSE, dans le cadre des activités du PGPC. Ce développement pourrait commencer par ces modes d’action pour lesquelles on dispose de beaucoup de données (par exemple, les voies d’entrée œstrogéniques et androgéniques); en d’autres termes, un « SPT‑PSE » pour les évaluations tant humaines qu’écologiques. Dans la mesure du possible, on pourrait s’en servir comme valeur de dépistage pour la protection de la santé dans le cas des produits chimiques pour lesquels on ne dispose pas de données sur la toxicité des PSE, et aux fins d’établissement des priorités. Des travaux fondamentaux à cet effet ont été présentés par Kroes et ses collègues (2000) pour un SPT pertinent liée à la perturbation œstrogénique, par Borgert, Matthews et Baker (2018) pour une activité humaine pertinente par rapport au 17β-estradiol, et par Gross et ses collègues (2010) pour un SPT pour les substances agissant sur le système endocrinien dans le milieu aquatique. Des données sont actuellement disponibles pour commencer l’élaboration de SPT pour les androgènes, la thyroïde et les produits chimiques stéroïdiens.
2.2.5 Biotransformation
Les efforts se poursuivent pour tenir compte de la biotransformation dans l'évaluation des produits chimiques (y compris, mais sans s'y limiter, les PSE), car la plupart des systèmes expérimentaux in vitro ne sont pas compétents du point de vue de métabolisation. Par exemple, mentionnons l'intégration de microsphères contenant des homogénats hépatiques humains dans les tests ToxCast (USEPA, 2016) et la transfection de l'ARN messager des enzymes du cytochrome P450 du foie humain dans les tests cellulaires existants de l'évaluation préalable à haut rendement (DeGroot et coll., 2018).
Comme nous l'avons mentionné à la section 1.4, il est essentiel de tenir compte de la possibilité que le produit chimique d'origine soit activé sous une forme active de PSE dans l'environnement, par transformation biotique ou abiotique.
2.2.6 Cadre fondé sur les risques pour évaluer les voies d'entrée liées aux récepteurs EATS
Le Programme d'évaluation des substances chimiques perturbatrices du système endocrinien de l'EPA et le rapport de l'OCDE Conceptual Framework for Testing and Assessment of Endocrine Disruptors (OCDE, 2012) fournissent une liste complète des essais disponibles pour évaluer principalement les PSE liés aux récepteurs EATS. L'utilisation progressive de ces méthodes fournit une approche adaptée aux ressources pour l'évaluation des PSE. Le Comité scientifique soutient les méthodes de niveau 1 (USEPA)/niveaux 1 et 2 (OCDE), examinées et traitées par Manibusan et Touart (2017), en tant que liste appropriée des méthodes disponibles pour évaluer les voies d'entrée liées aux récepteurs EATS. Toutefois, il faudrait élaborer un cadre décisionnel plus précis fondé sur le poids de la preuve pour évaluer les résultats de ces méthodes d'essai de niveau inférieur, en intégrant divers flux d'information afin de déterminer les prochaines étapes ciblées nécessaires (par exemple, si des données supplémentaires sont nécessaires ou si le niveau d'incertitude résultant des tests de niveau inférieur est acceptable pour la prise de décision). Le Comité scientifique reconnaît qu'il n'est pas possible de demander une série complète de méthodes in vitro et in vivo et qu'il faudrait s'efforcer d'élaborer une approche simplifiée, mais protectrice, qui utilise des méthodes non expérimentales, des méthodes in vitro et l'examen de l'exposition avant de demander des tests supplémentaires de niveau supérieur.
L'approche du poids de la preuve de l'EPA des États-Unis permettant d'évaluer les résultats de l'examen préalable de niveau 1 (EPA, 2011) et le document d'orientation no 150 de l'OCDE (OCDE, 2018b) peuvent constituer de bons points de départ, avec des considérations supplémentaires pour les méthodes RQSA et autres méthodes in silico aux premières étapes. L'information sur l'exposition peut également être prise en compte à ce stade.
Le Comité scientifique n'a pas discuté en détail des méthodes ou des essais spécifiques qui devraient être régulièrement exigés, et il n'a pas fourni d'évaluation critique des méthodes individuelles. Toutefois, le Comité scientifique a recommandé qu'une évaluation critique de chaque méthode soit effectuée pour s'assurer d'obtenir des renseignements utiles et adaptés.
Des progrès scientifiques considérables ont été réalisés dans l'élaboration de modèles RQSA/in silico depuis l'élaboration du cadre d'essai gradué dans le Programme d'évaluation des substances chimiques perturbatrices du système endocrinien et du cadre conceptuel à plusieurs niveaux de l'OCDE dans les années 1990 et au début des années 2000. Par conséquent, comme l'indique la figure 1, le Comité scientifique est favorable à l'utilisation de ces types de NMA. Cette approche intègre les modèles RQSA/in silico fiables, prédictifs et appropriés actuellement disponibles (c.-à-d. ceux qui respectent les principes RQSA de l'OCDE; OCDE, 2004) pour désigner les produits chimiques susceptibles d'interagir avec les récepteurs des œstrogènes (RO), les récepteurs des androgènes (RA) et les récepteurs d'hydrocarbures aryliques (RHa). Ces RQSA disponibles ont démontré une prédictivité d'environ 90 % pour les essais de fixation aux récepteurs in vitro (RO, RA et RHa) et, par conséquent, l'exécution de nouveaux essais de dépistage in vitro n'apporterait pas de renseignements supplémentaires importants (boîte à outils RQSA v4.2 de l'OCDE [OCDE, 2017]; modèle Oasis TIMES de LMC; modèle AFR des perturbateurs du système endocrinien ACD Labs) pour ce qui est de définir la bioactivité potentielle ou les modes d'action. Des modèles RQSA thyroïdiens, limités aux récepteurs thyroïdiens (RT) et à la thyroperoxydase, sont disponibles (DEPA, 2018), mais ils ne sont pas aussi robustes ni bien développés que les RQSA des RO, RA ou RHa. Mekenyan et coll. (2000), Mekenyan et Serafimova (2009), Petkov et coll. (2010), Schmieder et coll. (2003), Schmieder et coll. (2009) et Serafimova et coll. (2007) donnent de plus amples renseignements sur ces approches in silico. D'autres travaux sont en cours en vue d'élaborer et de peaufiner davantage les approches de RQSA et de modélisation fondée sur le consensus (p. ex. projet de modélisation concertée de l'activité des récepteurs androgéniques [CoMPARA; Mansouri et coll., 2017] et projet de prévision concertée de l'activité des récepteurs des œstrogènes [CERAPP; Mansouri et coll., 2016]). On s'attend à ce que cette première étape de la RQSA soit élargie pour permettre l'évaluation d'autres voies d'entrée de cette manière.
Si les modèles RQSA initiaux indiquent que le produit chimique est « positif » pour la fixation aux RO, RA ou RAh (ou que des voies d'entrée supplémentaires sont indiquées par des modèles RQSA fiables, prédictifs et appropriés), alors, davantage de renseignements sur la toxicité pourraient être produits. Ces études de suivi devraient comprendre des essais ciblés dans le but d'obtenir une relation dose-réponse afin de calculer un point de départ, puis utiliser l'EIVIV pour obtenir un équivalent de dose appliquée et l'intégrer aux résultats de la modélisation de l'exposition pour obtenir un RBE. Cela devrait se faire conformément au cadre d'approches intégrées d'essai et d'évaluation (OCDE, 2016) afin de s'assurer que toutes les nouvelles données produites pour l'exposition ou les dangers sont réalisées de manière très ciblée, sous la direction des évaluations initiales du RQSA. Le Comité scientifique estime que les RQSA actuels pour les RO, les RA et les RHa sont extrêmement fiables pour éliminer la nécessité d'essais in vitro de fixation aux récepteurs, à l'exception de certaines substances chimiques qui ne s'inscrivent pas dans le domaine d'applicabilité des modèles, comme les substances chimiques de composition inconnue ou variable et les polymères. Des essais et des données plus spécifiques sont nécessaires pour les voies d'entrée relatives à la thyroïde, à la stéroïdogenèse et aux récepteurs non EATS.
Si les modèles RQSA initiaux n'indiquent pas que le produit chimique est susceptible de se fixer au RO, RA ou RHa, il faut alors envisager des essais ciblés de niveau 1 (p. ex. essais in vitro) pour d'autres voies d'entrée potentielles liées aux récepteurs EATS et non EATS. Pour de tels négatifs concernant la RQSA pour les RO, RA ou RHa (selon d'autres facteurs spécifiques tels que la structure chimique, les alertes structurales, etc.), d'autres approches peuvent être envisagées pour répondre aux préoccupations potentielles concernant les bioactivités dans d'autres voies d'entrée endocriniennes ou par d'autres modes d'action. Il peut s'agir de tests de lecture croisée, à l'aide de la méthode généralisée de lecture croisée (GenRA) de l'EPA ou d'autres méthodes appropriées, de transcriptomique entière in vitro ou d'essais ciblés de niveau 1 (p. ex., essais in vitro). Comme nous l'avons déjà mentionné, l'augmentation de la production de données, conjuguée à l'analyse et à l'accessibilité, continuera, nous l'espérons, à susciter l'élaboration, l'application et l'évaluation d'autres approches RQSA et informatiques, en élargissant cette étape initiale au-delà des RO, des RA et des RHa et en réduisant ainsi la nécessité d'effectuer des essais de niveau 1.
Comme on l’a vu pour le flux de travail présenté à la question à l’étude 1 (figure 1), les besoins en matière de données ciblées et de niveau supérieur devraient être déterminés en fonction d’une évaluation initiale du RBE acceptable et d’un degré acceptable d’incertitude quant à l’objectif global de l’évaluation (c’est-à-dire, adapté). Cette évaluation fondée sur les risques déterminera ensuite les besoins en matière de données ciblés. Par exemple, une approche intégrée à la mise en essai et à l’évaluation pourrait commencer au niveau 1 à l’aide d’un modèle RQSA, d’un modèle de lecture croisée ou d’un SPT associé à une évaluation à haut rendement de l’exposition (par exemple, ExpoCast) pour repérer les substances qui ont un RBE suffisamment élevé, afin de pouvoir les mettre de côté dans la catégorie « Aucune mesure requise » (figure 1). Ensuite, les substances qui nécessitent une évaluation supplémentaire des dangers pourraient être examinées à l’aide d’essais mécanistes ciblés à haut rendement (par exemple, la batterie d’essais ToxCast); puis, à l'aide d'un point de départ approprié, d'une EIVIV et d'une modélisation de l'exposition, des RBE améliorés pourraient être calculés. Les substances qui justifient encore une évaluation plus approfondie pourraient faire l'objet d'un test cellulaire adapté (p. ex. test cellulaire d'œstrogénicité; Miller et coll., 2017) ou d'un test à rendement moyen (voir les sections 1.7 et 2.3) et, une fois encore, en utilisant un point de départ approprié et peut-être un modèle d'exposition amélioré, des RBE plus précis pourraient être obtenus. Si une substance doit encore faire l'objet d'essais plus importants, un essai in vivo adapté effectué sur des animaux pourrait être conçu et réalisé, comme indiqué à la question à l'étude 1.
2.2.7 Études de cas
Des études de cas sont nécessaires pour évaluer la capacité des approches de niveau inférieur (RQSA-in silico; niveau 1/2; niveau 1) à discerner correctement les PSE (voir les sections 1.8 et 3). Il serait utile d'examiner dans quelle mesure les points de départ des résultats des études de niveau inférieur correspondent aux points de départ des études de niveau supérieur pour déterminer si les résultats des études de niveau inférieur seraient protecteurs, même s'ils ne permettent pas de prévoir complètement les effets nocifs des études de niveau supérieur. Ces études de cas porteraient sur les 2 parties de la question à l’étude, car elles aideraient à évaluer l’application dans le monde réel de ces méthodes de niveau inférieur (c’est-à-dire, NMA) pour prévoir adéquatement les effets nocifs apicaux potentiels (c’est-à-dire, MAT) et aideraient également à illustrer les méthodes et les essais les plus faisables et les plus utiles. Le Comité scientifique a longuement étudié cette suggestion. Les études de cas devraient comprendre des exemples riches en données lorsqu’il existe des données de niveau supérieur (par exemple, produits chimiques existants, pesticides) et lorsqu’une analyse rétrospective pourrait être effectuée. Le perchlorate a été considéré comme perturbateur potentiel de la thyroïde, mais une détermination supplémentaire de la portée est nécessaire pour désigner les substances pouvant faire l’objet d’études de cas. L’appui à la réalisation d’études de cas est également exprimé dans la réponse à la question à l’étude 3.
L’importance de bien saisir la diversité des circonstances auxquelles sont exposés les organismes (par exemple, stress thermique, stress lié à l’habitat, stade de vie, risque cumulatif, générations multiples, cycle de reproduction) a été abordée aux sections 1.1.2 et 1.1.3. Le Comité scientifique a fait remarquer que l’examen de ces questions à l’aide d’études de cas pourrait contribuer à faire progresser les connaissances dans ce domaine, car il disposait de peu d’exemples précis de méthodes qui ont été utilisées ou qui sont en cours d’élaboration.
2.3 Recommandations à moyen et à long terme
2.3.1 Essais sur embryons
Les essais sur les embryons de poissons-zèbres pourraient constituer un domaine prometteur à explorer à court terme. Comme nous l'avons mentionné à la section 1.7, les approches fondées sur l'embryon fournissent des essais intégrés plus complexes que les méthodes cellulaires in vitro actuelles. Les essais sur l'embryon permettraient d'adopter une approche de type « biologie systémique » pour l'évaluation des effets médiés par les PSE, entre autres. Les résultats de ces essais pourraient être appliqués à des questions humaines et écologiques en utilisant les connaissances toxicogénomiques ou transcriptomiques. De plus, ces essais permettraient l'évaluation des paramètres apicaux, ce qui constitue une limite claire des méthodes in silico ou in vitro existantes qui empêchent souvent leur application au-delà du dépistage et de l'établissement de priorités. Le Comité scientifique note qu'il est important de normaliser les essais à moyen et à long terme (tel que les essais sur les poissons-zèbres) afin d'obtenir des données fiables et comparables sur la relation dose-réponse découlant des essais.
Le poisson-zèbre a été étudié et exploré en tant que modèle pour la santé humaine et écologique (Bambino et Chu, 2017; Garcia, Noyes et Tanguay, 2016). Les essais utilisant des embryons de poisson-zèbre pour prévoir la toxicité pour le développement ont été adaptés dans de nombreux cas comme une approche à « rendement moyen » dans les essais de ToxCast et du National Toxicology Program des États-Unis par exemple. L'adoption récente de l'essai sur les embryons de poissons par l'OCDE (voir : LD 236; OCDE, 2013) a également entraîné une augmentation de la capacité des laboratoires à travailler avec ce modèle, ce qui devrait faciliter l'utilisation et l'adoption de ces méthodes.
Bien qu'elle soit bien étudiée, l'application du modèle utilisant l'embryon de poisson-zèbre pour l'identification des produits chimiques PSE nécessitera une coordination supplémentaire pour élaborer une feuille de route pour les méthodes et les approches existantes. Le Comité scientifique a fait remarquer que le PGPC devrait promouvoir l'élaboration de l'essai sur le poisson-zèbre en réunissant un groupe d'experts étudiant le poisson-zèbre au Canada (et ailleurs) pour élaborer ce plan stratégique.
À l’heure actuelle, il n’existe pas de lignes directrices réglementaires sur l’utilisation recommandée du poisson-zèbre pour détecter une perturbation de la thyroïde. Cependant, il existe des essais relativement récents sur des poissons-zèbres qui sont prometteurs (par exemple, Jarque et coll., 2018; Raldúa, Thienpont et Babin, 2012), ainsi qu’un essai mené sur les têtards du genre Xenopus (Mughal, Demeneix et Fini, 2018). Ces essais, ainsi que l’essai de tératogenèse sur les embryons de grenouille (FETAX), devraient faire l’objet d’une étude plus approfondie afin de combler cette lacune en parallèle avec l’essai de toxicité pour le développement du poisson-zèbre.
En plus des modèles utilisant des animaux entiers, les modèles organotypiques en trois dimensions et les modèles d’organes sur puce offrent une voie prometteuse pour une évaluation in vitro plus complète des PSE. Les modèles en trois dimensions, comme le modèle sphéroïde du cancer du sein, permettent d’évaluer les réponses au niveau tissulaire, y compris la morphologie et la fonctionnalité (c’est-à-dire, la pathologie in vitro; Vantangoli et coll., 2015, 2016). Des modèles d’organes sur puce électronique ont été mis au point pour l’appareil reproducteur féminin. EVATAR™ est une représentation miniaturisée de l’appareil reproducteur féminin et du foie sur une plateforme portative interconnectée (Xiao et coll., 2017). Ces essais progressent vers le remplacement in vitro des modèles de toxicologie in vivo; cependant, ces types de systèmes sont encore en développement et leur mise en œuvre dans les évaluations réglementaires est entravée par la nécessité de les valider dans le contexte de la relation dose-réponse chimique.
2.3.2 Voies d'entrée liées aux récepteurs non EATS
Il existe relativement peu de lignes directrices d'essai pour les méthodes mécanistes permettant d'évaluer les voies d'entrée endocriniennes liées aux récepteurs non EATS, bien que plusieurs approches prometteuses aient été résumées dans les documents préparatoires à la réunion produits par les ministères et qu'elles aient fait l'objet d'un examen plus approfondi à la réunion (voir en particulier les sections 1.6, 2.2.6. et ci-dessous). L'évaluation de l'adipogenèse à l'aide de modèles alternatifs est un exemple d'approche prometteuse. Bien qu'il n'existe aucune norme in vivo concernant la possibilité que les produits chimiques de l'environnement affectent la maturation des adipocytes, plusieurs méthodes de substitution ont été mises au point, y compris des modèles in vitro de mammifères et de poissons-zèbres (Foley et coll., 2017; Hartman et coll., 2018; Lyssimachou et coll., 2015; sargis et coll., 2010).
Afin de mieux classer les besoins par ordre de priorité et de cibler l'élaboration de méthodes, le Comité scientifique propose que Santé Canada et Environnement et Changement climatique Canada convoquent un groupe d'experts pour discuter des voies d'entrée et des cibles endocriniennes à priorité élevée liées aux récepteurs non EATS, d'après les préoccupations écologiques et de santé publique. La neurotoxicité pour le développement, l'obésité, les troubles du comportement et le diabète sont des exemples de ces résultats concernant les voies d'entrée non liées aux récepteurs EATS. Ce groupe d'experts devrait être chargé de déterminer les parcours de résultats néfastes hautement prioritaires ainsi que les événements clés dans chacune des voies d'entrée susmentionnées qui devraient faire l'objet de la plus grande priorité pour ce qui est de l'élaboration d'une méthode, et d'évaluer la confiance dans les liens de cause à effet des relations entre les événements clés dans chaque voie d'entrée, conformément aux lignes directrices de l'OCDE (OCDE, 2018c).
Le Comité scientifique note également que les données devront être générées à grande échelle et d'une manière adaptée et ciblée une fois que les méthodes ciblées liées aux récepteurs non EATS auront été élaborées et validées. Divers mécanismes peuvent faciliter la production de telles données, notamment les programmes de subventions de projets de recherche et l'accroissement de la souplesse du gouvernement en matière de collaboration et de partage des données (voir la question à l'étude 3). Ce travail de production de données est essentiel pour accroître le domaine d'applicabilité des méthodes et pour améliorer ou alimenter les futures RQSA et autres modèles prédictifs.
2.3.3 Évaluation de la recherche au niveau de la population
Le Comité scientifique a discuté de la nécessité de mieux comprendre les considérations relatives aux points de départ en ce qui concerne les questions telles que les populations vulnérables et les effets multigénérationnels. Ici, les données empiriques pourraient être utilisées pour répondre aux préoccupations du public relatives au lien supposé entre l'exposition aux produits chimiques et les états pathologiques. Le Comité scientifique a noté l'importance de la recherche au niveau de la population, mais a formulé peu de commentaires spécifiques, bien qu'il se soit penché sur cette préoccupation dans la troisième question à l'étude.
Question à l'étude 3
Où les efforts futurs du gouvernement seraient-ils les mieux appliqués dans les domaines de la recherche, de l'évaluation des risques et de la gestion des risques pour les PSE?
Dans sa réponse aux questions à l'étude 1 et 2, le Comité scientifique a discuté de domaines particuliers pour des travaux à venir. La réponse suivante contient des observations et des commentaires de « haut niveau » pour répondre à cette question.
- Les ministères devraient procéder à un examen officiel de type forces-faiblesses-possibilités-menaces (FFPM) des questions relatives aux perturbateurs du système endocrinien (résumées comme étant les nombreux « facteurs à considérer » et orientations de recherche dans les documents produits par les ministères en préparation à la réunion) concernant lesquelles ils ont l'intention de diriger, d'exercer une influence, de faire un suivi ou une surveillance au niveau international. Cette information devrait être répartie, conformément à la question à l'étude, selon les domaines de la recherche, de l'évaluation des risques, de la gestion des risques et de la communication sur les risques. L’analyse FFPM doit être effectuée de façon rétrospective et prospective sur 2 périodes : les 5 à 10 dernières années et les 5 années subséquentes. Les résultats de cet exercice permettraient de guider les priorités scientifiques soulevées ailleurs dans le présent rapport et pourraient également servir à communiquer régulièrement avec le public et les parties intéressées, ainsi qu'à confirmer que le gouvernement joue effectivement un rôle important de leadership international en ce qui concerne les méthodes d'évaluation et la gestion des PSE.
- Le Canada devrait continuer de jouer un rôle de chef de file à l'échelle internationale en menant et en coordonnant des études de cas pertinentes et stratégiques sur les PSE. L'avantage de mener des études de cas a été soulevé dans la réponse aux questions à l'étude 1 et 2. Ainsi, le Comité scientifique a indiqué que la participation et le leadership concernant des travaux tels que l'« accélération du rythme des évaluations des risques que posent les produits chimiques » (Kavlock et coll., 2018) sont particulièrement remarquables. Les études de cas peuvent aussi être conçues pour renforcer la capacité interne et le réseautage (par exemple, les questions internes, comme on le verra plus loin). Les études de cas sont précieuses, car elles fournissent un processus formel et systématique d’examen et d’apprentissage à partir des efforts et des résultats antérieurs. Les types d’études de cas devraient viser à répondre aux besoins (1) à des fins réglementaires (par exemple, NMA par rapport à la « norme d’excellence » des études sur les animaux; la meilleure façon d’aborder la variabilité de la population); (2) aux fins de recherche scientifique (p. ex, détermination des groupes de « gènes associés aux PSE » qui représentent des signatures clés pour prévoir certains résultats endocriniens apicaux; des méthodes pour prendre en compte des facteurs de stress multiples); (3) pour la société et les parties prenantes (par exemple, de nouvelles approches, qui sont effectivement plus rapides, plus éthiques et moins coûteuses); et (4) pour confirmer que les décisions prises antérieures dans les évaluations et la gestion des risques en vertu du PGPC se sont avérées suffisamment efficaces pour assurer une protection.
- Certains membres du Comité scientifique étaient sûrs de pouvoir procéder à l'actualisation des essais de toxicité dans le paradigme du XXIe siècle, présenté à la figure 1 et abordé dans les parties précédentes du présent rapport. Toutefois, d'autres membres du comité ont plutôt soulevé la question de la conception éventuelle d'une démarche plus globale, innovatrice et visant la santé publique d'évaluation des PSE qui permettrait de mieux évaluer les expositions cumulatives et les effets multigénérationnels à l'échelle de la population (notamment les populations vulnérables) en situation d'exposition « réelle » aux multiples facteurs de stress. Certains membres du public ont exprimé des préoccupations à l'égard des PSE, y compris l'affirmation selon laquelle les approches « traditionnelles » utilisant le cadre de la LCPE 1999 pourraient ne pas être suffisantes. Cette préoccupation s'étend au-delà des PSE potentiels pour inclure des considérations plus générales des déterminants physiques, chimiques et sociaux de la santé humaine et écologique. Pour la période postérieure à 2020, le Comité scientifique propose une évaluation future de l'ensemble de l'approche et un examen des « enseignements » tirés des expériences sur les PSE (et autres substances). Cette pensée ambitieuse est particulièrement nécessaire pour relever les défis auxquels font face les PSE (et les autres mécanismes de toxicité préoccupants) dans des dimensions multidisciplinaires, notamment les incertitudes, l'exposition aux mélanges chimiques, les populations vulnérables et la communication des risques. L'adoption d'une approche « grande et audacieuse » permettrait de passer d'une approche produit par produit (qui a été au centre des préoccupations jusqu'à présent) à des scénarios plus axés sur les maladies et plus représentatifs des expositions réelles. Au fur et à mesure que progresse la compréhension scientifique de la nature multifactorielle et de la pathogenèse des maladies, ces progrès peuvent être utilisés pour mieux comprendre l'ensemble des déterminants génétiques, physiques, nutritionnels, chimiques et sociaux des maladies à tous les stades de la vie afin de déterminer les facteurs de risque, notamment l'exposition aux produits chimiques naturels et synthétiques. Ces connaissances peuvent servir à déterminer comment et dans quelle mesure ces déterminants de la maladie, individuellement et en combinaison, agissent sur la santé. Sur le plan écologique, nous pouvons tirer des leçons des programmes d'études de suivi des effets sur l'environnement qui ciblent les effluents et les mélanges complexes, et intégrer ces études aux facteurs de stress non chimiques pour tenir compte des facteurs de stress physiques, et biologiques, entre autres.
- Dans cette nouvelle ère des mégadonnées, on doit rendre les données plus ouvertes et accessibles aux paliers national et international. La traduction des données en connaissances axées sur l'utilisateur est un facteur clé à considérer. Pour rendre les données soient ouvertes et accessibles, on doit, à l'avance, examiner la conception de la base de données et prêter attention à l'expérience de l'utilisateur. De plus, l'Initiative Données ouvertes du gouvernement du Canada (Canada, 2017) encourage le partage des données. Le recours à la cryptographie numérique (chaîne de blocs) pourrait atténuer les préoccupations relatives l'indisponibilité de données constituant des renseignements commerciaux confidentiels, une telle solution constituerait une innovation canadienne.
- Un financement stratégique ciblé et d'autres ressources (dotation en personnel, par exemple) sont nécessaires pour établir les priorités et améliorer les connaissances des difficultés potentielles causées par les PSE, particulièrement en ce qui a trait aux NMA, aux études de cas, à l'examen des produits ou classes chimiques non familiers, et à l'évaluation des risques et leur gestion. Le financement ciblé devrait être régi par un processus officiel auquel participeraient toutes les parties intéressées engagées. L'Initiative de recherche sur les substances toxiques (IRST), appuyée par le gouvernement canadien dans les années 1990, a été un programme fructueux qui pourrait être reconduit en tirant parti des forces intersectorielles et interdisciplinaires; ou alors, les ministères pourraient examiner le modèle STAR de l'EPA des États-Unis et d'autres programmes existants comme modèles possibles. Il faudrait envisager le financement d'un tel programme à un palier qui rendrait cette initiative intéressante et utile.
- Le Comité scientifique encourage l'officialisation de la centralisation et de la coordination d'un noyau déjà solide d'activités liées aux PSE dans les ministères afin de s'assurer que les sous-groupes clés (par exemple, chercheurs et évaluateurs de risques, développeurs de NMA et ceux qui utilisent des tests standard, écologistes et scientifiques biomédicaux) continuent à collaborer activement. Les PSE transcendent la LCPE (1999) et le PGPC et, par conséquent, les parties prenantes qui s'intéressent à d'autres lois parlementaires régissant les PSE (comme la Loi canadienne sur la sécurité des produits de consommation, la Loi sur les produits antiparasitaires ou la Loi sur les pêches) doivent y participer.
Le Comité scientifique a discuté de nombreuses autres suggestions pour des « occasions futures », mais hésite à présenter une longue liste de desiderata. Les résultats de l'analyse FFPM, s'ils sont soigneusement délimités, définiront les principaux domaines sur lesquels il faudra se concentrer à l'avenir.
4. Résumé
- De nombreux aspects associés aux PSE potentiels sont à la fine pointe de la science. De plus, le public a tout intérêt à ce que l'exposition aux PSE perturbe la santé humaine et l'environnement. Au cours de la réunion, il est apparu clairement que certains membres du Comité scientifique estimaient que la reconnaissance, l'évaluation et la gestion des PSE peuvent être menées à bien conformément aux processus scientifiques actuels et futurs. D'autres membres du Comité scientifique ont estimé que les PSE pouvaient être uniques et ont donc conclu que des réponses supplémentaires fondées sur les politiques pourraient être souhaitables. Le Comité scientifique n'a pas été invité à se pencher sur ces points de vue divergents.
- Le comité a répondu aux 3 questions à l'étude. Les points saillants sont les suivants :
- Pour les première et deuxième questions à l'étude, le Comité scientifique offre un flux de travail formé d'un cadre d'essai et d'évaluation à plusieurs paliers, commençant par des méthodes non expérimentales (par exemple, in silico et modèles) et comprenant des essais in vitro à haut rendement, des essais à rendement moyen (qui comprennent une plus grande complexité) et, au besoin, un essai in vivo. Ce flux de travail s'aligne sur les caractérisations des risques pour les voies d'entrées liées aux substances non PSE, mais les discussions ont porté sur les voies d'entrées propres aux PSE.
- La plus grande certitude réside dans la caractérisation des voies d'entrées liées aux récepteurs EATS par des essais à haut et moyen rendement (œstrogène, androgène, thyroïde et stéroïdogénèse). Toutefois, les voies d'entrées liées aux récepteurs non EATS (comme la neurotoxicité pour le développement et l'obésité) doivent être mieux développées.
- Les questions qui ont été soulevées, mais qui n'ont pas été résolues, ou seulement en partie comprennent ce qui suit : (1) saisir adéquatement la variabilité de la population (y compris les populations vulnérables et les stades de vie), (2) effectuer une extrapolation interspécifique et (3) évaluer le risque cumulatif lié à l'exposition aux mélanges chimiques et aux facteurs de stress non chimiques. En outre, le Comité scientifique a noté la nécessité de mieux prendre en compte la gamme complète des produits chimiques, métabolites et produits de dégradation des composés d'origine.
- Le Comité scientifique a discuté de l'utilisation du cadre du parcours de résultats néfastes pour organiser les travaux futurs (en tant que paradigme à traduire entre les événements moléculaires déclencheurs et les événements clés), qui peut éclairer les paramètres d'évaluation pour les essais à haut ou moyen rendement, et les paramètres apicaux.
- En discutant de l'approche du SPT relativement à l'évaluation des risques pour l'homme, le Comité scientifique a proposé d'élaborer un PSE-SPT pour la santé humaine et écologique.
- Il faudrait envisager d'améliorer l'évaluation de l'exposition (par exemple en faisant davantage appel à la biosurveillance et à la surveillance des effets sur l'environnement).
- En réponse à la question à l'étude 3, le Comité a formulé 6 recommandations majeures, dont une analyse FFPM, des études de cas permettant de tirer des leçons, la convocation de groupes d'experts pour faire progresser les activités d'évaluation des risques liés aux PSE, un meilleur partage des données et une réflexion « ambitieuse » pour relever les défis liés aux PSE dans une optique multidisciplinaire.
Remerciements
Nous remercions les membres spéciaux du comité pour leur précieuse contribution : Markus Hecker (Université de la Saskatchewan), Rebecca Clewell (ToxStrategies, Inc.) et Kevin Crofton (R3Fellows, LLC).
Références
Abdo, N., Xia, M., Brown, C.C., et coll. 2015a. Population-based in vitro hazard and concentration–response assessment of chemicals: the 1000 genomes high-throughput screening study. Environ Health Perspect. 123(5):458-66. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4421772/pdf/ehp.1408775.pdf.
Abdo, N., Wetmore, B.A., Chappell, G.A., et coll. 2015b. In vitro screening for population variability in toxicity of pesticide-containing mixtures. Environ Int. 85:147-55. En ligne : http://www.rusynlab.org/publications/2015/Abdo%20Wetmore%20et%20al%202015.pdf.
Ankley, G.T., Bennett, R.S., Erickson R.J., et coll. 2010. Adverse outcome pathways: A conceptual framework to support ecotoxicology research and risk assessment. Environ Toxicol Chem. 29(3):730-41. En ligne : https://setac.onlinelibrary.wiley.com/doi/epdf/10.1002/etc.34.
Attene-Ramos, M.S., Miller, N., Huang, R., et coll. 2013. The Tox21 robotic platform for the assessment of environmental chemicals--from vision to reality. Drug Discov Today. 18(15-16):716-23. En ligne : https://www.sciencedirect.com/science/article/pii/S135964461300161X?via%3Dihub.
Aylward, L.L., Kirman, C.R., Schoeny, R., et coll. 2013. Evaluation of biomonitoring data from the CDC National Exposure Report in a risk assessment context: Perspectives across chemicals. Environ Health Perspect. 121(3):287-94. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3621178/.
Bambino, K., Chu. J. 2017. Zebrafish in toxicology and environmental health. Curr Top Dev Biol. 124:331-367. En ligne : https://www.sciencedirect.com/science/article/abs/pii/S0070215316301867.
Becker, R.A., Friedman, K.P., Simon, T.W., et coll. 2015. An exposure:activity profiling method for prioritizing potential EDCs interpreting high-throughput screening data for further testing estrogenic activity—proof of concept. Regul Toxicol Pharmacol. 71(3):398-408. En ligne : https://ac.els-cdn.com/S0273230015000100/1-s2.0-S0273230015000100-main.pdf?_tid=d29f4ef0-3158-400f-a013-a58e65a92f82&acdnat=1542219796_2d22ebb408bff722e73e6a7dbb0746db.
Belanger, E., Sanderson, H., Embry, M.R., et coll. 2015. It is time to develop ecological thresholds of toxicological concern to assist environmental hazard assessment. Environ Toxicol Chem. 34(12):2864-9. En ligne : https://setac.onlinelibrary.wiley.com/doi/epdf/10.1002/etc.3132.
Bell, S.M., Chang, X., Wambaugh, J.F., et coll. 2018. In vitro to in vivo extrapolation for high throughput prioritization and decision making. Toxicol In Vitro. mars; 47:213-27. DOI: 10.1016/j.tiv.2017.11.016. En ligne : https://www.sciencedirect.com/science/article/pii/S0887233317303661?via%3Dihub.
Biryol, D., Nicolas, C.I., Wambaugh, J., et coll. 2017. High-throughput dietary exposure predictions for chemical migrants from food contact substances for use in chemical prioritization.Environ Int. novembre; 108:185-94. DOI: 10.1016/j.envint.2017.08.004. En ligne : https://www.sciencedirect.com/science/article/pii/S0160412016304767?via%3Dihub.
Blackwell, B.R., Ankley, G.T., Corsi, S.R., et coll. 2017. An ‘EAR' on environmental surveillance and monitoring: A case study on the use of exposure-activity ratios (EARs) to prioritize sites, chemicals, and bioactivities of concern in Great Lakes waters. Environ Sci Technol. 51(15):8713-8724. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6132252/pdf/nihms-1504076.pdf.
Bokkers, B.G., Slob, W. 2007. Deriving a data-based interspecies assessment factor using the NOAEL and the benchmark dose approach. Crit Rev Toxicol. 37(5):355-73. En ligne : https://www.tandfonline.com/doi/pdf/10.1080/10408440701249224?needAccess=true.
Boobis, A.R., Cohen, S.M., Dellarco, V., et coll. 2006. IPCS framework for analyzing the relevance of a cancer mode of action for humans. Crit Rev Toxicol. 36(10):781-92. En ligne : https://www.tandfonline.com/doi/pdf/10.1080/10408440600977677?needAccess=true.
Boobis, A.R., Doe, J.E., Heinrich-Hirsch, B., et coll. 2008. IPCS framework for analyzing the relevance of a noncancer mode of action for humans. Crit Rev Toxicol. 38(2):87-96. En ligne : https://www.tandfonline.com/doi/pdf/10.1080/10408440701749421?needAccess=true.
Borgert, C.J., Mihaich, E.M., Ortego, L.S., et coll. 2011. Hypothesis-driven weight of evidence framework for evaluating data within the US EPA's Endocrine Disruptor Screening Program. Regul Toxicol Pharmacol. novembre; 61(2):185-91. En ligne : https://www.sciencedirect.com/science/article/pii/S0273230011001528?via%3Dihub.
Borgert, C.J., Matthews, J.C., Baker, S.P. 2018. Human-relevant potency threshold (HRPT) for ERα agonism. Arch Toxicol. 92(5):1685-1702. En ligne : https://link.springer.com/article/10.1007/s00204-018-2186-z.
Browne, P., Judson, R.S., Casey, W.M., et coll. 2015. Screening chemicals for estrogen receptor bioactivity using a computational model. Environ Sci Technol. 49(14):8804-14. En ligne : https://www.ncbi.nlm.nih.gov/pubmed/26066997.
Browne, P., Noyes, P.D., Casey, W.M., et coll. 2017. Application of adverse outcome pathways to U.S. EPA's Endocrine Disruptor Screening Progam. Environ Health Perspect. 125(9):1-11. En ligne : https://ehp.niehs.nih.gov/doi/full/10.1289/EHP1304?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dpubmed.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C. 1999, ch. 33, Gazette du Canada, Partie III, vol. 22, no 3.
[Canada] Gouvernement du Canada. 2005. Directives pour la déclaration et les essais de substances nouvelles - substances chimiques et polymères. En application de l'article 69 de la Loi canadienne sur la protection de l'environnement (1999). En ligne : http://publications.gc.ca/collections/Collection/En84-25-2005F.pdf.
[Canada] Gouvernement du Canada. 2012. Réponse de la pétition 340 : Recherches du gouvernement fédéral sur les substances hormonoperturbantes en vertu de la Loi canadienne sur la protection de l'environnement (1999). En ligne : http://www.oag-bvg.gc.ca/internet/Francais/pet_340_f_37607.html
[Canada] Gouvernement du Canada. 2016. Document sur l'approche scientifique : approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. En ligne : http://www.ec.gc.ca/ese-ees/default.asp?lang=Fr&n=326E3E17-1.
[Canada] Gouvernement du Canada. 2017. L'abc des données ouvertes. En ligne : https://ouvert.canada.ca/fr/principes-de-donnees-ouvertes.
[Canada] Gouvernement du Canada. 2017b. Approche d'identification des substances chimiques et des polymères jugés prioritaires pour l'évaluation des risques en vertu de la Partie 5 de la Loi canadienne sur la protection de l'environnement de 1999 [LCPE (1999)]. En ligne : http://www.ec.gc.ca/ese-ees/default.asp?lang=Fr&n=A10191AD-1#s7.
[Canada] Gouvernement du Canada. 2017c. Collecte de renseignements. En ligne : https://www.canada.ca/fr/sante-canada/services/substances-chimiques/approche-canada/collecte-renseignements.html
Casey, W.M., Chang, X., Allen, D.G., et coll. 2018. Evaluation and optimization of pharmacokinetic models for in vitro to in vivo extrapolation of estrogenic activity for environmental chemicals. Environ Health Perspect. 126(9):97001. En ligne : https://ehp.niehs.nih.gov/doi/pdf/10.1289/EHP1655.
[CELA] Canadian Environmental Law Association. 2017. Scientific Justification to Address Endocrine Disrupting Chemicals (EDCs): A Roadmap for Action. En ligne : http://www.cela.ca/sites/cela.ca/files/EDCs-CEPA-Review-Subm.pdf.
Chiu, W.A., Wright, F.A., Rusyn, I. 2017. A tiered, Bayesian approach to estimating of population variability for regulatory decision-making. ALTEX. 34(3):377-388. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5468494/pdf/nihms849877.pdf.
Cohen Hubal, E.A, Wetmore, B.A, Wambaugh, J.F., et coll. 2018. Advancing internal exposure and physiologically-based toxicokinetic modeling for 21st-centruy risk assessments. J Expo Sci Environ Epidemiol. DOI: 10.1038/s41370-018-0046-9. Publication en ligne le 16 août 2018. En ligne : https://www.nature.com/articles/s41370-018-0046-9.
Coussens, N.P., Sittampalam, G.S., Guha, R., et coll. 2018. Assay guidance manual: Quantitative biology and pharmacology in preclinical drug discovery. Clin Transl Sci. 11(5):461-70. En ligne : https://ascpt.onlinelibrary.wiley.com/doi/epdf/10.1111/cts.12570.
Cox, L.A., Popken, D., Marty, M.S., et coll. 2014. Developing scientific confidence in HTS-derived prediction models: Lessons learned from an endocrine study. Regul Toxicol Pharmacol. 69(3):443-50. En ligne : https://www.sciencedirect.com/science/article/pii/S0273230014000920?via%3Dihub.
DeGroot, D., Thomas, R., Simmons, S. 2016. Metabolism Retrofit Strategies for ToxCast Assays (BOSC). Présenté à la réunion du sous-comité CSS BOSC, RTP, Caroline du Nord, du 16 au 18 novembre 2016. En ligne : https://doi.org/10.23645/epacomptox.5179093.
DeGroot, D.E., Swank, A., Thomas, R.S., et coll. 2018. mRNA transfection retrofits cell-based assays with xenobiotic metabolism. J Pharmacol Toxicol Methods. 92:77-94. En ligne : https://www.sciencedirect.com/science/article/pii/S1056871918305665?via%3Dihub.
[DEPA] Danish Environmental Protection Agency. 2018. Danish (Q)SAR database. En ligne : http://qsar.food.dtu.dk/.
Dix, D. 2010. ToxCast and Tox21: High Throughput Screening for Hazard & Risk of Environmental Chemicals. Environmental Protection Agency des États-Unis, Office of Research and Development, National Center for Computational Toxicology. En ligne : https://www.toxicology.org/groups/rc/nlsot/docs/Dix.pdf.
Doering, J.A., Lee, S., Kristiansen, K., et coll. 2018. In silico site–directed mutagenesis informs species-specific predictions of chemical susceptibility derived from the Sequence Alignment to Predict Across Species Susceptibility (SeqAPASS) tool. Toxicol Sci. 166(1):131-145. En ligne : https://academic.oup.com/toxsci/advance-article/doi/10.1093/toxsci/kfy186/5060571.
Dong, H., Wade, M.G. 2017. Application of a nonradioactive assay for high throughput screening for inhibition of thyroid hormone uptake via the transmembrane transporter MCT8. Toxicol In Vitro. 40:234-42. En ligne : https://reader.elsevier.com/reader/sd/pii/S0887233317300140?token=9300F4460F3EFF657A74169F7AC09AEF43A3FD6720E38D60CE808364C908C11A1BD1E1E4AF27C65A29E75FDD94DC8059.
Elswick, B.A., Welsch, F., Janszen, D.B. 2000. Effect of different sampling designs on outcome of endocrine disruptor studies. Reprod Toxicol. 14(4):359-67. En ligne : https://ac.els-cdn.com/S0890623800000927/1-s2.0-S0890623800000927-main.pdf?_tid=b5920b3c-4373-494c-ac45-c5710039cce5&acdnat=1542314701_7e2774e70d0ee90566e76f615b25bae5.
[EPA] Environmental Protection Agency des États-Unis. 2002. Guidance on Cumulative Risk Assessment of Pesticide Chemicals that Have a Common Mechanism of Toxicity. Washington (DC) : Office of Pesticide Programs, Office of Prevention, Pesticides, and Toxic Substances. En ligne : https://www.epa.gov/sites/production/files/2015-07/documents/guidance_on_common_mechanism.pdf.
[EPA] Environmental Protection Agency des États-Unis. 2011. Endocrine Disruptor Screening Program: Weight-of-Evidence- Evaluating Results of EDSP Tier 1 Screening to Identify the Need for Tier 2 Testing. En ligne : https://www.regulations.gov/document?D=EPA-HQ-OPPT-2010-0877-0021.
[EPA] Environmental Protection Agency des États-Unis. 2014. FIFRA SAP Meeting on Endocrine Activity and Exposure-based Prioritization and Screening. En ligne : https://www.regulations.gov/docket?D=EPA-HQ-OPP-2014-0614.
Festing, M.F. 2006. Design and statistical methods in studies using animal models of development. ILAR J. 47(1):5-14. En ligne : https://academic.oup.com/ilarjournal/article/47/1/5/662269.
Foley, B., Doheny, D.L., Black, M.B., et coll. 2017. Editor's highlight: Screening ToxCast prioritized chemicals for PPARG function in a human adipose-derived stem cell model of Adipogenesis. Toxicol Sci. 155(1):85-100. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5216650/.
Garcia, G.R., Noyes, P.D., Tanguay, R.L. 2016. Advancements in zebrafish applications for 21st century toxicology. Pharmacol Ther. 161:11-21. En ligne : https://ac.els-cdn.com/S0163725816300171/1-s2.0-S0163725816300171-main.pdf?_tid=d23b2f07-3c79-4c27-9cbd-2bff236cdb37&acdnat=1539791117_2bcf2c529842fcdde842c3a37fba33f6.
Grimm, F.A., Iwata, Y., Sirenko, O., et coll. 2016. A chemical–biological similarity-based grouping of complex substances as a prototype approach for evaluating chemical alternatives. Green Chem. 18(16):4407-19. En ligne : https://www.concawe.eu/wp-content/uploads/2017/03/grimm-et-al-2016-final.pdf.
Grimm, F.A., Blanchette, A., House, J.S., et coll. 2018. A human population-based organotypic in vitro model for cardiotoxicity screening. ALTEX. 35(4):441-52. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6231908/pdf/nihms-994287.pdf.
Gross, M., Daginnus, K., Deviller, G., et coll. 2010. Thresholds of toxicological concern for endocrine active substances in the aquatic environment. Integr Environ Assess Manag. 6(1):2-11. En ligne : https://setac.onlinelibrary.wiley.com/doi/full/10.1897/IEAM_2008-092.1.
Haggard, D.E., Karmaus, A.L., Martin, M.T., et coll. 2018. High-throughput H295R steroidogenesis assay: Utility as an alternative and a statistical approach to characterize effects on steroidogenesis. Toxicol Sci. 162(2):509-34. En ligne : https://academic.oup.com/toxsci/article/162/2/509/4690670.
Haines, D.A., Saravanabhavan, G., Werry, K., et coll. 2017. An overview of human biomonitoring of environmental chemicals in the Canadian Health Measures Survey: 2007–2019. Int J Hyg Environ Health. 220(2 Pt A):13-28. En ligne : https://reader.elsevier.com/reader/sd/pii/S1438463916300888?token=49DD0D1B7C856C1ED44EBF837FD411FA2EF1261B82268A6E8158C45EA2F9D39070644D3AAE876B05455BB84D8BA518FD.
Hammel, S.C., Hoffman, K., Webster, T.F., et coll. 2016. Measuring personal exposure to organophosphate flame retardants using silicone wristbands and hand wipes. Environ Sci Technol. 50(8):4483-91. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4872512/pdf/nihms-786160.pdf.
Hartman, J.K., Beames, T., Parks, B., et coll. 2018. An in vitro approach for prioritization and evaluation of chemical effects on glucocorticoid receptor mediated adipogenesis. Toxicol Appl Pharmacol. 355:112-26. En ligne : https://reader.elsevier.com/reader/sd/pii/S0041008X18302217?token=CAE4EEF03E80F494A5797E181414040773301848866A448A7517293A81A71720072DD90F270E124742CC3C0BC309E387.
Hartung, T. 2017. Thresholds of toxicological concern—setting a threshold for testing below which there is little concern. ALTEX. 34(3):331-51. En ligne : https://www.ncbi.nlm.nih.gov/pubmed/28735337.
Hecker, M. 2018. Non-Model Species in Ecological Risk Assessment. In: A Systems Biology Approach to Advancing Adverse Outcome Pathways for Risk Assessment. Murphy, C. et Reyero, N., éd., p 107-132. New York : Springer. En ligne : https://www.springer.com/gp/book/9783319660820.
Helmreich, D.L., Tylee, D. 2011. Thyroid hormone regulation by stress and behavioral differences in adult male rats. Horm Behav. 60(3): 284-91. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3148770/pdf/nihms-304715.pdf.
Hennes, E.C. 2012. An overview of values for the threshold of toxicological concern. Toxicol Lett. 211:296-303. En ligne : https://ac.els-cdn.com/S0378427412008971/1-s2.0-S0378427412008971-main.pdf?_tid=b13ebc75-0c03-4e90-893f-f4a23be7f2b8&acdnat=1542215357_59ac5a8bd8dfb417a8d363a4de7cf656.
Hornung, M.W., Korte, J.J., Olker, J.H., et coll. 2018. Screening the ToxCast Phase 1 chemical library for inhibition of deiodinase type 1 activity. Toxicol Sci. 162(2):570-81. En ligne : https://academic.oup.com/toxsci/article/162/2/570/4706013.
Jarque, S., Fetter, E., Veneman, W.J., et coll. 2018. An automated screening method for detecting compounds with goitrogenic activity using transgenic zebrafish embryos. PLOS One 13(8). En ligne : https://journals.plos.org/plosone/article/file?id=10.1371/journal.pone.0203087&type=printable.
Kavlock, R., Chandler, K., Houck, K., et coll. 2012. Update on EPA's ToxCast program: Providing high throughput decision support tools for chemical risk management. Chem Res Toxicol. 25(7):1287-302. En ligne : https://pubs.acs.org/doi/10.1021/tx3000939.
Kavlock, R.J., Bahadori, T., Barton-Maclaren, T.S., et coll. 2018. Accelerating the pace of chemical risk assessment. Chem Res Toxicol. 31(5):287-90. En ligne : https://pubs.acs.org/doi/10.1021/acs.chemrestox.7b00339.
Kleinstreuer, N.C., Ceger, P., Watt, E.D., et coll. 2017. Development and validation of a computational model for androgen receptor activity. Chem Res Toxicol. 30(4):946-64. En ligne : https://pubs.acs.org/doi/10.1021/acs.chemrestox.6b00347.
Kleinstreuer, N.C., Browne, P., Chang, X., et coll. 2018. Evaluation of androgen assay results using a curated Hershberger database. Repord Toxicol. 81:272-80. En ligne : https://www.sciencedirect.com/science/article/pii/S0890623818302235?via%3Dihub.
Kroes, R., Galli, C., Munro, I., et coll. 2000. Threshold of toxicological concern for chemical substances present in the diet: A practical tool for assessing the need for toxicity testing. Food Chem Toxicol. 38(2-3): 255-312. En ligne : https://www.sciencedirect.com/science/article/pii/S0278691599001209?via%3Dihub.
Kroes, R., Renwick, A.G., Cheeseman, M., et coll. 2004. Structure-based thresholds of toxicological concern (TTC): Guidance for application to substances present at low levels in the diet. Food Chem Toxicol. 42(1):65-83. En ligne : https://www.sciencedirect.com/science/article/pii/S0278691503002412?via%3Dihub.
LaLone, C.A., Villeneuve, D.L., Burgoon, L.D., et coll. 2013. Molecular target sequence similarity as a basis for species extrapolation to assess the ecological risk of chemicals with known modes of action. Aquat Toxicol. 144-145:141-54. En ligne : https://www.sciencedirect.com/science/article/pii/S0166445X13002312?via%3Dihub.
LaLone, C.A., Villneuve, D.L., Lyons, D., et coll. 2016. Editor's Highlight: Sequence Alignment to Predict Across Species Susceptibility (SeqAPASS): A Web-Based Tool for Addressing the Challenges of Cross-Species Extrapolation of Chemical Toxicity. Toxicological Sciences. 153(2):228-245. En ligne : http://ct4xw3qj9z.search.serialssolutions.com/?rft_id=info%3Adoi%2F10.1093%2Ftoxsci%2Fkfw119.
Lyssimachou, A., Santos, J.G., Andre, A., et coll. 2015. The mammalian ‘Obesogen' tributyltin targets hepatic triglyceride accumulation and the transcriptional regulation of lipid metabolism in the liver and brain of zebrafish. PLOS ONE 10(12):e0143911. En ligne : https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0143911.
Manibusan, M.K., Touart, L.W. 2016. A comprehensive review of regulatory test methods for endocrine adverse health effects.Crit Rev Toxicol. 47:440-88. En ligne : https://www.tandfonline.com/doi/full/10.1080/10408444.2016.1272095.
Manibusan, M.K., Touart, L.W. 2017. A comprehensive review of regulatory test methods for endocrine adverse health effects. Crit Rev Toxicol. 47(6):433-81. En ligne : https://www.tandfonline.com/doi/pdf/10.1080/10408444.2016.1272095?needAccess=true.
Mansouri, K., Abdelaziz, A., Rybacka, A., et coll. 2016. CERAPP: Collaborative Estrogen Receptor Activity Prediction Project. Environ Health Perspect. 124(7):1023-33. En ligne : https://ehp.niehs.nih.gov/cms/attachment/525c8061-1f72-467b-9278-8dd4954b47e0/ehp.1510267.pdf.
Mansouri, K., Kleinstreuer, N., Watt, E., et coll. 2017. CoMPARA: Collaborative Modeling Project for Androgen Receptor Activity. The United States Environmental Protection Agency's National Center for Computational Toxicology. Affiche présentée à la réunion annuelle de la Society of Toxicology, du 12 au 16 mars 2017. En ligne : https://doi.org/10.23645/epacomptox.5176876.
Marchesini, G.R., Meimaridou, A., Haasnoot, W., et coll. 2008. Biosensor discovery of thyroxine transport disrupting chemicals. Toxicol Appl Pharmacol. 232(1):150-60. En ligne : https://ac.els-cdn.com/S0041008X0800269X/1-s2.0-S0041008X0800269X-main.pdf?_tid=94e2b6cf-8829-4a2a-8894-5fc725eb3c2c&acdnat=1539792267_02c32add501b4864c865e4faffc7de49.
Meek, M.E., Boobis, A.R., Crofton, K.M., et coll. 2011. Risk assessment of combined exposure to multiple chemicals: A WHO/IPCS framework. Regul Toxicol Pharmacol. 60(2):Suppl. S1–S14. En ligne : https://www.sciencedirect.com/science/article/pii/S0273230011000638?via%3Dihub.
Mekenyan, O.G., Kamenska, V., Schmieder, P.K., et coll. 2000. A computationally based identification algorithm for estrogen receptor ligands: Part 2. Evaluation of hERalpha binding affinity model. Toxicol Sci. 58(2):270-81.
Mekenyan, O., Serafimova, R. 2009. Mechanism-based modeling of estrogen receptor binding affinity: A COREPA implementation. In: Endocrine Disruption Modeling, J. Devillers, éd., p. 259-293. Boca Raton : CRC Press.
Miller, M.M., Alyea, R.A., LeSommer, C., et coll. 2016. Editor's highlight: Development of an in vitro assay measuring uterine specific estrogenic responses for use in chemical safety assessment. Toxicolo Sci. 154(1):162-73. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5091368/pdf/kfw152.pdf.
Miller, M.M., McMullen, P.D., Andersen, M.E., et coll. 2017. Multiple receptors shape the estrogen response pathway and are critical considerations for the future of in vitro-based risk assessment efforts. Crit Rev Toxicol. 47(7):564-80. En ligne : https://www.tandfonline.com/doi/pdf/10.1080/10408444.2017.1289150?needAccess=true.
Moschet, C., Anumol, T., Lew, B.M., et coll. 2018. Household dust as a repository of chemical accumulation: New insights from a comprehensive high-resolution mass spectrometric study. Environ Sci Technol. 52(5):2878-87. En ligne : https://pubs.acs.org/doi/10.1021/acs.est.7b05767.
Mughal, B.B., Demeneix, B.A., Fini, J.B. 2018. Evaluating thyroid disrupting chemicals in vivo using Xenopus laevis. Methods Mol Bio. 1801:183-92. En ligne : https://link.springer.com/protocol/10.1007%2F978-1-4939-7902-8_15.
[NASEM] National Academies of Sciences, Engineering, and Medicine. 2012. Exposure Science in the 21st Century: A Vision and a Strategy. Washington (DC) : The National Academies Press. DOI: https://doi.org/10.17226/13507. En ligne : https://www.nap.edu/catalog/13507/exposure-science-in-the-21st-century-a-vision-and-a.
[NASEM] National Academies of Sciences, Engineering, and Medicine. 2014. Review of the Environmental Protection Agency's State-of-the-Science Evaluation of Nonmonotonic Dose-Response Relationships as they Apply to Endocrine Disruptors. Washington (DC) : The National Academies Press. DOI: https://doi.org/10.17226/18608. En ligne : https://www.nap.edu/catalog/18608/review-of-the-environmental-protection-agencys-state-of-the-science-evaluation-of-nonmonotonic-dose-response-relationships-as-they-apply-to-endocrine-disruptors.
[NASEM] National Academies of Sciences, Engineering, and Medicine. 2017. Application of Systematic Review Methods in an Overall Strategy for Evaluating Low-Dose Toxicity from Endocrine Active Chemicals. Washington (DC) : The National Academies Press. DOI: https://doi.org/10.17226/24758. En ligne : https://www.nap.edu/catalog/24758/application-of-systematic-review-methods-in-an-overall-strategy-for-evaluating-low-dose-toxicity-from-endocrine-active-chemicals.
Neale, P.A., Ait-Aissa, S., Brack, W., et coll. 2015. Linking in vitro effects and detected organic micropollutants in surface water using mixture-toxicity modeling. Environ Sci Technol. 49(24):14614-24. En ligne : https://pubs.acs.org/doi/pdf/10.1021/acs.est.5b04083.
Nicolas, X., Djebli, N., Rauch, C., et coll. 2018. Population pharmacokinetic/pharmacodynamic analysis of alirocumab in healthy volunteers or hypercholesterolemic subjects using an indirect response model to predict low-density lipoprotein cholesterol lowering: Support for a biologics license application submission: Part II. Clin Pharmacokinet. Publication en ligne le 3 mai 2018, 1-16. DOI: https://doi.org/10.1007/s40262-018-0670-5. En ligne : https://link.springer.com/article/10.1007%2Fs40262-018-0670-5.
[OCDE] Organisation de coopération et de développement économiques. 2004. OECD Principles for the Validation, for Regulatory Purposes, of (Quantitative) Structure-Activity Relationship Models. En ligne : http://www.oecd.org/chemicalsafety/risk-assessment/37849783.pdf.
[OCDE] Organisation de coopération et de développement économiques. 2012. OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (as revised in 2012). En ligne : https://www.oecd.org/env/ehs/testing/OECD%20Conceptual%20Framework%20for%20Testing%20and%20
Assessment%20of%20Endocrine%20Disrupters%20for%20the%20public%20website.pdf.
[OCDE] Organisation de coopération et de développement économiques. 2013. Essai n° 236 : Poisson, essai de toxicité aiguë au stade embryonnaire. Lignes directrices de l'OCDE pour les essais de produits chimiques, Section 2. Paris : OCDE, 2013. En ligne : https://www.oecd-ilibrary.org/fr/environment/essai-n-236-poisson-essai-de-toxicite-aigue-au-stade-embryonnaire_9789264203716-fr.
[OCDE] Organisation de coopération et de développement économiques. 2016. OECD Series on Testing and Assessment No. 260: Guidance Document on the Use of Adverse Outcome Pathways in Developing Integrated Approaches to Testing and Assessment (IATA). Paris : OCDE, 2016. En ligne : https://one.oecd.org/document/ENV/JM/MONO(2016)67/en/pdf.
[OCDE] Organisation de coopération et de développement économiques. 2017. Boîte à outils QSAR. En ligne :http://www.oecd.org/fr/securitechimique/boiteaoutilsqsar.htm.
[OCDE] Organisation de coopération et de développement économiques. 2018. AOPs with OECD Status. En ligne : https://aopwiki.org/oecd_page.
[OCDE] Organisation de coopération et de développement économiques. 2018b. Revised Guidance Document 150 on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. En ligne : http://www.oecd.org/publications/guidance-document-on-standardised-test-guidelines-for-evaluating-chemicals-for-endocrine-disruption-2nd-edition-9789264304741-en.htm.
[OCDE] Organisation de coopération et de développement économiques. 2018c. OECD Series on Adverse Outcome Pathways. En ligne : https://www.oecd-ilibrary.org/environment/users-handbook-supplement-to-the-guidance-document-for-developing-and-assessing-adverse-outcome-pathways_5jlv1m9d1g32-en.
[OCDE] Organisation de coopération et de développement économiques. 2018d. OECD Work on Endocrine Disrupting Chemicals. En ligne : http://www.oecd.org/chemicalsafety/testing/OECD%20Work%20on%20Endocrine%20Disrupting%20Chemicals.pdf.
Okeme, J.O., Yang, C., Abdollahi, A., et coll. 2018. Passive air sampling of flame retardants and plasticizers in Canadian homes using PDMS, XAD-coated PDMS and PUF samplers. Environ Pollut. 239:109-17. En ligne : https://reader.elsevier.com/reader/sd/pii/S0269749118300149?token=08F16079E3291F153221D4A5871A8DC18CFBAFC4F9FDBB6FA70C4B034BFB0895E8ADE68817837326B85FB8A31B0DD329.
[OMS/EFSA] Organisation mondiale de la Santé et Autorité européenne de sécurité des aliments. 2016a. Recommandations sur la méthode du seuil de préoccupation toxicologique par l'EFSA et l'OMS. En ligne : https://www.efsa.europa.eu/fr/press/news/160310a.
[OMS/EFSA] Organisation mondiale de la Santé et Autorité européenne de sécurité des aliments. 2016b. Review of the Threshold of Toxicological Concern (TTC) approach and development of new TTC decision tree. En ligne : https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/sp.efsa.2016.EN-1006.
Parlement du Canada. 2017. Comité permanent de l'environnement et du développement durable. Un environnement sain, des canadiens et une économie en santé : renforcer la Loi canadienne sur la protection de l'environnement (1999). 42e législature, 1re session. En ligne : http://www.ourcommons.ca/Content/Committee/421/ENVI/Reports/RP9037962/envirp08/envirp08-f.pdf.
Patlewicz, G., Helman, G., Pradeep, P., et coll. 2017. Navigating through the minefield of read-across tools: A review of in silico tools for grouping. Comput Toxicol. 3:1-18. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6134855/pdf/nihms-1504045.pdf.
Patlewicz, G., Wambaugh, J.F., Felter, S.P., et coll. 2018. Utilizing threshold of toxicological concern (TTC) with high throughput exposure predictions (HTE) as a risk-based prioritization approach for thousands of chemicals. Comput Toxicol. 7:58-67. En ligne : https://www.sciencedirect.com/science/article/pii/S2468111318300689.
Paul, K.B., Hedge, J.M., Rotroff, D.M., et coll. 2014. Development of a thyroperoxidase inhibition assay for high-throughput screening. Chem Res Toxicol. 27(3):387-99. En ligne : https://pubs.acs.org/doi/10.1021/tx400310w.
Pearce, R.G., Setzer, R.W., Davis, J.L., et coll. 2017. Evaluation and calibration of high-throughput predictions of chemical distribution to tissues. J Pharmacokinet Pharmacodyn. 44(6):549-565. En ligne : https://link.springer.com/content/pdf/10.1007%2Fs10928-017-9548-7.pdf.
Petkov, P.I., Rowlands, J.C., Budinsky, R., et coll. 2010. Mechanism-based common reactivity pattern (COREPA) modelling of aryl hydrocarbon receptor binding affinity. SAR QSAR Environ Res. 21(1):187-214. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3036575/.
Rager, J.E., Strynar, M.J., Liang, S., et coll. 2016. Linking high resolution mass spectrometry data with exposure and toxicity forecasts to advance high-throughput environmental monitoring. Environ Int. 88:269-280. En ligne : https://ac.els-cdn.com/S0160412015301112/1-s2.0-S0160412015301112-main.pdf?_tid=8cd6a384-a330-4ddb-8f74-f395c18646f4&acdnat=1542305505_7ae87765bf02f7492f2c630916f96069.
Raldúa, D., Thienpont, B., Babin, P.J. 2012. Zebrafish eleutheroembryos as an alternative system for screening chemicals disrupting the mammalian thyroid gland morphogenesis and function. Reprod Toxicol. 33(2):188-97. En ligne : https://ac.els-cdn.com/S0890623811003595/1-s2.0-S0890623811003595-main.pdf?_tid=d091c37b-516f-492c-bcc4-93da419ba84e&acdnat=1539792564_cda8ae1c3cefe709c18778dc6ffd60b9.
Richard, A.M., Judson, R.S., Houck, K.A., et coll. 2016. ToxCast chemical landscape: Paving the road to 21st century toxicology. Chem Res Toxicol. 29(8):1225-51. En ligne : https://pubs.acs.org/doi/10.1021/acs.chemrestox.6b00135.
Thomas, R.S., Philbert, M.A., Auerbach, S.S., et coll. 2013. Incorporating new technologies into toxicity testing and risk assessment: Moving from 21st century vision to a data-driven framework. Toxicol Sci. 136(1):4-18. En ligne : https://academic.oup.com/toxsci/article/136/1/4/1653723.
Thorne, N., Auld, D.S., Inglese, J. 2010. Apparent activity in high-throughput screening: Origins of compound-dependent assay interference. Curr Opin Chem Biol. 14(3):315-24. En ligne : https://ac.els-cdn.com/S1367593110000463/1-s2.0-S1367593110000463-main.pdf?_tid=fe990c4c-d49b-44b4-81ae-f34a035085be&acdnat=1539792882_350877138a7450addcc67073678bdb61.
Trisciuzzi, D., Alberga, D., Mansouri, K., et coll. 2017. Predictive structure-based toxicology approaches to assess the androgenic potential of chemicals. J Chem Inf Model. 57(11):2874-2884. En ligne : https://pubs.acs.org/doi/pdf/10.1021/acs.jcim.7b00420.
Vantangoli, M.M., Madnick, S.J., Huse, S.M., et coll. 2015. MCF-7 human breast cancer cells from differentiated microtissues in scaffold-free hydrogels.PLOS One 10(8): e0135426. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4534042/.
Vantangoli, M.M., Wilson, S., Madnick, S.J., et coll. 2016. Morphologic effects of estrogen stimulation on 3D MCF-7 microtissues.Toxicol Lett. 248:1-8. En ligne : https://www.sciencedirect.com/science/article/pii/S0378427416300303?via%3Dihub.
Wambaugh, J.F., Wang, A., Dionisio, K.L., et coll. 2014. High throughput heuristics for prioritizing human exposure to environmental chemicals. Environ Sci Technol. 48(21):12760-7. En ligne : https://pubs.acs.org/doi/pdf/10.1021/es503583j.
Wambaugh, J.F., Hughes, M.F., Ring, C.L., et coll. 2018. Evaluating in vitro-in vivo extrapolation of toxicokinetics. Toxicol Sci. 163(1):152-169. En ligne : https://academic.oup.com/toxsci/article/163/1/152/4827578.
Wang, J., Hallinger, D.R., Murr, A.S., et coll. 2018. High-throughput screening and quantitative chemical ranking for sodium-iodide symporter inhibitors in ToxCast Phase I chemical library. Environ Sci Technol. 52(9):5417-5426. En ligne : https://pubs.acs.org/doi/10.1021/acs.est.7b06145.
Wetmore, B.A., Wambaugh, J.F., Allen, B., et coll. 2015. Incorporating high-throughput exposure predictions with dosimetry-adjusted in vitro bioactivity to inform chemical toxicity testing. Toxicol Sci. 148(1):121-36. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4620046/pdf/kfv171.pdf.
Wignall, J.A., Muratov, E., Sedykh, A., et coll. 2018. Conditional toxicity value (CTV) predictor: An in silico approach for generating quantitative risk estimates for chemicals. Environ Health Perspect. 126(5). En ligne : https://www.ncbi.nlm.nih.gov/pubmed/29847084.
Xiao S., Coppeta J.R., Rogers, H.B., et coll. 2017. A microfluidic culture model of the human reproductive tract and 28-day menstrual cycle. Nat Commun. 8:14584. En ligne : https://www.nature.com/articles/ncomms14584.
Yoon, M., Adeleye, Y., Clewell, R., et coll. 2016. Moving beyond prioritization toward true in vitro safety assessment. Appl In Vitro Toxicol. 2(2):67-73. En ligne : https://www.liebertpub.com/doi/pdf/10.1089/aivt.2016.29005.rtl.
Yu, K.N., Kang, S.Y., Hong, S., et coll. 2018. High-throughput metabolism-induced toxicity assays demonstrated on a 384-pillar plate. Arch Toxicol. 92(8):2501-2516. En ligne : https://link.springer.com/content/pdf/10.1007%2Fs00204-018-2249-1.pdf.
Zeise, L., Bois, F.Y., Chiu, W.A., et coll. 2013. Addressing human variability in next-generation human health risk assessments of environmental chemicals. Environ Health Perspect. 121(1):23-31. En ligne : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3553440/pdf/ehp.1205687.pdf.
Annexe 1 : Résumé de certaines approches, directives et cadres internationaux (fournis par les ministères dans la documentation préparatoire à la réunion)
On trouvera ci-dessous un résumé de certaines approches utilisées par les États-Unis, L’Europe et le Japon pour traiter la question des PSE et des PSE potentiels. Le Programme d’évaluation des substances chimiques perturbatrices du système endocrinien de l’EPA des États-Unis teste les produits chimiques par paliers afin de cerner l’activité endocrinienne et d’établir des relations dose-réponse qui sont utilisées dans les programmes réglementaires. En vertu de certaines lois européennes, les données prouvant qu’un produit chimique est un PSE peuvent être utilisées pour éclairer les restrictions basées sur les dangers (Parrott et coll., 2016; Solecki et coll., 2017). Le programme du Japon continue à élargir la portée des travaux relatifs aux PSE et a établi un cadre d’évaluation à intégrer aux pratiques existantes d’évaluation des risques. Les organismes dont il est question ici ont une influence particulière sur l’élaboration de protocoles d’essai, de cadres et d’orientations pour l’examen des PSE, et coordonnent généralement leurs efforts, y compris la contribution du gouvernement du Canada.
États-Unis
L’EPA des États-Unis a mis sur pied le Programme d’évaluation des substances chimiques perturbatrices du système endocrinien dans le cadre duquel les produits chimiques réglementés en vertu de la Federal Food, Drug and Cosmetic Act (FFDCA), de la Federal Insecticide, Fungicide, and Rodenticide Act (FIFRA) et de la Safe Drinking Water Act (SDWA) peuvent être soumis à une démarches d'essais gradués visant à déterminer leur potentiel de perturbation du système endocrinien. L'univers chimique du Programme d'évaluation des substances chimiques perturbatrices du système endocrinien comprend les pesticides (ingrédients actifs et inertes) ainsi que d'autres produits chimiques industriels ou commerciaux que l'on peut trouver dans les sources d'eau potable. La batterie de tests de niveau 1 comprend une série de tests de dépistage in vitro et in vivo permettant de déterminer le potentiel d'interaction avec les systèmes œstrogénique, androgénique ou hormonal thyroïdien. Lorsque les essais de niveau 1 révèlent un potentiel de perturbation du système endocrinien, des essais de niveau 2 (qui comprennent des protocoles d'essai pour les poissons et les amphibiens) peuvent être proposés, ce qui permet de mieux cerner les effets endocriniens nocifs causés par la substance et d'établir une relation quantitative entre la dose et cet effet nocif. Des lignes directrices d'essai ont été élaborées pour les essais de niveau 1 et de niveau 2. Jusqu'à présent, l'EPA des États-Unis a émis des ordonnances d'essai obligatoires pour 52 pesticides de niveau 1, et des essais de suivi de niveau 2 ont été proposés pour un sous-ensemble de ces produits chimiques ayant une activité endocrinienne (EPA, 2017).
Plus récemment, les activités de dépistage consistaient à mettre au point et à ajouter des méthodes de dépistage in vitro et in silico de cibles moléculaires liées à la toxicité des œstrogènes, des androgènes et de la thyroïde. Cette initiative, appelée le Programme d'évaluation des substances chimiques perturbatrices du système endocrinien au XXIe siècle, vise à accroître la quantité de données pertinentes pour un plus large éventail de produits chimiques dans le cadre des mandats des trois lois afin d'établir des priorités pour les essais ultérieurs et de remplacer certains des essais sur les animaux du niveau 1 du Programme d'évaluation des substances chimiques perturbatrices du système endocrinien. Les données de cette initiative à haut rendement sont communiquées par le biais d'une base de données publique en ligne afin d'assurer la transparence et de soutenir l'évaluation mondiale des PSE (https://comptox.epa.gov/dashboard/chemical_lists/toxcast_e1k).
Europe
L'Agence européenne des produits chimiques (ECHA) a tenu compte du potentiel de perturbation du système endocrinien lors de sa mise en œuvre du règlement REACH (Enregistrement, évaluation, autorisation et restriction des substances chimiques) visant les substances chimiques. Les propriétés de perturbation du système endocrinien peuvent être utilisées comme preuve qu'un produit chimique présente un niveau de préoccupation équivalent à celui des substances classées comme cancérogènes, mutagènes ou toxiques pour la reproduction (CMR) ou (très) persistantes, (très) bioaccumulables ou toxiques (PBT/vPvB), et sont donc considérées comme des substances extrêmement préoccupantes (SVHC). La désignation SVHC est basée sur les propriétés intrinsèques de danger, et ces substances peuvent finalement être placées sur la liste d'autorisation où leur utilisation est interdite à moins que l'autorisation ne soit accordée par l'ECHA. La priorité pour déterminer si un produit chimique doit être inscrit sur la liste d'autorisation est accordée aux substances dont l'utilisation est largement dispersive ou dont les volumes sont élevés (ou qui possèdent des propriétés PBT ou vPvB). Cette demande a récemment été déposée pour le bisphénol A, qui est considéré comme une substance SVHC et figure actuellement sur la liste des substances candidates aux fins d'autorisation en raison de ses propriétés perturbatrices du système endocrinien et de ses effets sur la reproduction (ECHA, 2018).
L'ECHA et l'Autorité européenne de sécurité des aliments (EFSA) ont récemment publié un document d'orientation provisoire, élaboré avec le soutien du Centre commun de recherche (CCR) de la Commission européenne (EFSA, 2018), visant la mise en œuvre des critères fondés sur les dangers afin de recenser les perturbateurs endocriniens. Le document d'orientation a été rédigé pour réglementer les produits de protection des plantes et l'utilisation des produits biocides. Le document d'orientation décrit un processus par étapes par lequel le potentiel de perturbation du système endocrinien d'une substance est déterminé à partir d'une évaluation de ses propriétés de danger endocrinien pertinentes. Cela comprend des étapes sur la façon de recueillir, d'évaluer et de prendre en considération toute l'information pertinente pour l'évaluation, ainsi que sur la façon d'effectuer une analyse du mode d'action et d'appliquer une méthode du poids de la preuve aux fins de détermination. La ligne directrice se limite aux modalités relatives aux œstrogènes, aux androgènes, à la thyroïde et à la stéroïdogénique (EATS).
Japon
En 1998, le ministère de la Protection de l'environnement (MEP) du Japon a créé le Programme stratégique sur les perturbateurs endocriniens de l'environnement (Strategic Program on Environmental Endocrine Disruptors, SPEED), qui est axé sur la recherche et les essais de substances présentant une exposition importante pour les humains et la faune (http://www.chemsafetypro.com/Topics/Japan/Endocrine_Disruptors_Regulations_and_Lists_in_Japan.html). Dans le cadre de ce programme, on a attribué une priorité à 67 substances pour une enquête plus approfondie en raison des soupçons en matière de perturbation du système endocrinien (il n'existe aucune liste de perturbateurs endocriniens confirmés au Japon). Le MEP a continué d'élargir le programme de travail afin d'aborder d'autres questions de réglementation avec le programme Extended Tasks on Endocrine Disruption (EXTEND) 2005 et le programme EXTEND 2010, qui visent à accélérer l'établissement et la mise en œuvre de méthodes d'évaluation visant à évaluer le risque environnemental des effets des substances chimiques qui perturbent le système endocrinien et à prendre, si nécessaire, des mesures de gestion. Le programme EXTEND 2010 reposait sur plusieurs piliers, notamment : (1) l'observation de la faune sauvage, (2) une enquête sur les concentrations dans l'environnement et la mesure des niveaux d'exposition, (3) la promotion d'études fondamentales, (4) une évaluation des dangers, (5) une évaluation des risques, (6) la gestion des risques et (7) la promotion du partage des renseignements et de la communication des risques (https://www.env.go.jp/en/chemi/ed/extend2010_full.pdf). Le Japon a maintenant mis à jour le plan stratégique dans la version finale du programme EXTEND 2016. Selon Manibusan et Touart (2017), ce quatrième programme met l'accent sur l'évaluation des dangers et des risques à l'appui des décisions réglementaires de gestion des risques. Le cadre d'évaluation sera intégré aux pratiques d'évaluation réglementaire existantes, y compris l'établissement de normes environnementales de qualité de l'eau, l'établissement d'une évaluation progressive des risques pour les produits chimiques industriels en vertu de la Loi sur le contrôle des substances chimiques et l'établissement de normes pour les décisions d'homologation en vertu de la Loi de réglementation des produits chimiques agricoles.
Appendice A : Exigences en matière de données du Règlement sur les renseignements concernant les substances nouvelles (fournies par les ministères dans les documents préparatoires à la réunion)
| Exigence relative aux données | Annexes | Exemple de méthodes d'essai acceptables |
|---|---|---|
| Toxicité aiguë chez les mammifères | 5, 6, 10, 11 | LD 402, 403, 420, 423, 425, 436 de l'OCDE |
| Irritation cutanée | 6, 11 | LD 404, 430, 431, 439, 439 de l'OCDE |
| Sensibilisation cutanée | 6, 11 | LD 406, 429, 442 (A-D) de l'OCDE |
| Toxicité à doses répétéesNote de bas de page * | 6, 11 et dans le cas de rejets ou d'exposition importants [par. 7(2), 7(3), 11(2) et 11(3) du Règlement] | LD 407, 408, 409, 410, 412, 422 de l'OCDE |
| Mutagénicité | 5, 6, 11 et dans le cas de rejets ou d'exposition importants [par. 7(3), 11(2) et 11(3) du Règlement] | LD 471, 473, 474, 475, 476,Note de bas de page ** 487,Note de bas de page ** 488, 489 de l'OCDE |
Abréviation : LD de l'OCDE, ligne directrice de l'Organisation de coopération et de développement économiques.
|
||
| Exigence relative aux données | Annexes | Méthode d'essai |
|---|---|---|
| Toxicité aiguë chez les poissons | 5, 6, 10, 11 | LD 203 de l'OCDE; méthodes SPE 1/RM/9 et SPE 1/RM/13 d'ECCC |
| Toxicité aiguë chez la daphnie | 5, 6, 10, 11 | LD 202 de l'OCDE; méthode SPE1/RM/11 d'ECCC |
| Toxicité pour les algues | 5, 6, 10, 11 | LD 201 de l'OCDE; méthode SPE1/RM/25 d'ECCC |
| Biodégradabilité immédiate | 5, 11 | LD 301 de l'OCDE |
Abréviations : ECCC, Environnement et Changement climatique Canada; LD de l'OCDE, ligne directrice de l'Organisation de coopération et de développement économiques. |
||
Appendice B : Activités de recherche du gouvernement du Canada sur les substances chimiques perturbatrices du système endocrinien (dans les documents préparatoires à la réunion fournis par les ministères)
| Projet | Description | Responsables |
|---|---|---|
| Enquête canadienne sur les mesures de la santé | Des échantillons d'urine, de sang, de cheveux et d'environnement intérieur (air et eau du robinet) ont été prélevés aux fins de biosurveillance des produits chimiques de l'environnement, ainsi que des mesures directes de la santé et des données tirées de questionnaires d'auto-évaluation auprès d'une population canadienne représentative. | SC et Statistique Canada |
| Plateforme de recherche de l'Étude mère-enfant sur les composés chimiques de l'environnement (MIREC) | Étude pancanadienne prospective de cohortes de grossesses et de naissances portant sur les expositions précoces (prénatales, petite enfance) à divers produits chimiques et sur le suivi des résultats pour la santé maternelle et infantile jusqu'à l'adolescence. | SC |
| Enquête sur la poussière domestique au Canada | Des échantillons de poussière provenant de plus de 1000 foyers dans les grandes régions urbaines du Canada ont été analysés pour y déceler la présence de métaux et de produits chimiques, y compris des PSE présumés. | SC |
| Enquête sur l'alimentation totale | Les produits chimiques (polluants organiques persistants [POP], pesticides et métaux) ont été analysés dans un ensemble d'aliments représentant une approximation d'un régime alimentaire. Produits alimentaires représentatifs achetés dans une ville donnée chaque année. | SC |
| Relevé de surveillance des œufs d'oiseaux des Grands Lacs | Des œufs d'oiseaux aquatiques (p. ex. goélands argentés) ont été prélevés dans les principales colonies de nidification et analysés à la recherche de POP, de métaux et de substances préoccupantes. Œufs de goélands collectés chaque année à partir des années 1970. | ECCC |
| Surveillance ciblée d'échantillons environnementaux | Diverses activités d'analyse des produits chimiques, y compris les PSE potentiels (dans l'air, les eaux de surface, les eaux usées, les sédiments, le biote, les tissus sauvages, etc.). Comprend l'élaboration de méthodes pour les nouveaux produits chimiques préoccupants. Un certain échantillonnage est répété pour évaluer les tendances historiques. | ECCC |
| Surveillance ciblée d'échantillons humains pertinents | Semblable à la surveillance d'échantillons environnementaux, mais inclue notamment l'analyse de l'air, des poussières provenant des environnements bâtis, des aliments, de l'eau potable et des milieux professionnels qui sont pertinents pour estimer l'exposition humaine. | SC |
Abréviations : ECCC, Environnement et Changement climatique Canada; PSE, perturbateurs du système endocrinien; SC, Santé Canada; POP, polluants organiques persistants. |
||
| Projet | Description | Responsables |
|---|---|---|
| Évaluation de la santé des poissons dans les rivières recevant des effluents | L'évaluation de la santé des poissons (croissance, développement, tumeurs, taille des gonades) est à l'étude dans les régions où les effluents des usines de pâte à papier ou les effluents municipaux sont rejetés. Des techniques semblables de surveillance des effets sur l'environnement sont utilisées dans les secteurs de l'exploitation des sables bitumineux. | ECCC |
| Études sur le cycle de vie des produits pharmaceutiques préoccupants pour Santé Canada-PGPC | Metformine (médicament contre le diabète) – étude du cycle de vie des poissons, évaluant la croissance, le développement, la reproduction, la vitellogénine, l'intersexualité. | ECCC et SC |
| Évaluation de la santé des moules et de la bioaccumulation des produits pharmaceutiques en aval des eaux usées municipales | Évaluation de la santé des moules et de l'accumulation dans les tissus de produits pharmaceutiques et de produits de soins personnels en aval d'importants rejets d'eaux usées municipales dans la rivière Grand, en Ontario. | ECCC et SC |
| Évaluation des effets des PSE des produits pharmaceutiques à l'aide de paramètres de type « –omique » dans les lignées cellulaires et les cellules. | Évaluation des changements dans l'expression génétique et les métabolites liés aux voies endocriniennes dans les cellules et les lignées cellulaires des organismes aquatiques. | ECCC et SC |
| Toxicité des produits chimiques ignifuges | Évaluation des effets de l'exposition aux produits ignifuges sur la reproduction, la croissance, le développement, le métabolisme et la physiologie des hormones dans les cultures cellulaires et divers modèles animaux. | ECCC et SC |
| Mise au point de tests standardisés pour les propriétés de perturbation du système endocrinien | Développement et validation de nouvelles méthodes pour tester l'activité de produits chimiques sur des événements moléculaires ou cellulaires clés impliqués dans la production, l'action ou le métabolisme des hormones (thyroïde, adipogenèse, etc.). Comprend la contribution à l'élaboration de parcours de résultats néfastes. | ECCC et SC |
Abréviations : ECCC, Environnement et Changement climatique Canada; PGPC, Plan de gestion des produits chimiques; PSE, perturbateurs du système endocrinien; SC, Santé Canada. |
||
| Domaine de recherche | Responsable | CPNote de bas de page * |
|---|---|---|
| Toxicologie pour la reproduction et le développement – mammifères | SC et ECCC | M. Wade I. Curran A. M. Gannon J. E. Elliott |
| Toxicité pour la reproduction et le développement – oiseaux | ECCC | K. J. Fernie D. Crump J. L. Shutt J. E. Elliott |
| Toxicité pour la reproduction et le développement – amphibien | ECCC | B. D. Pauli |
| Toxicité pour la reproduction et le développement – poisson | ECCC | J. L. Parrott M. McMaster J. Sherry |
| Toxicité de l'hormone thyroïdienne | SC et ECCC | M. G. Wade D. Crump R. J. Letcher K. J. Fernie |
| Récepteurs nucléaires et hormones stéroïdes | SC et ECCC | E. Atlas J. Sherry |
| Effets sur les usines de pâte à papier et les eaux usées | ECCC | M. McMaster L. M. Hewitt |
| Effets métaboliques | SC | E. Atlas T. E. Arbuckle |
| Toxicité de la pollution atmosphérique pour le système endocrinien et le développement | SC et ECCC | E. M. Thomson J. R. Brook |
| Épidémiologie liée à l'exposition du fœtus et du développement chez l'humain | SC | T. E. Arbuckle |
Abréviations : ECCC, Environnement et Changement climatique Canada; SC, Santé Canada; CP, chercheur principal.
|
||