Annexe traitant de la vaccination : Préparation du Canada en cas de grippe pandémique : Guide de planification pour le secteur de la santé
Les lecteurs qui désirent consulter le rapport en format PDF peuvent le télécharger ou le visualiser :
Date de la version la plus récente : mars 2017
Table des matières
- Préambule
- 1.0 Introduction
- 2.0 Contexte de la planification
- 3.0 Stratégie canadienne de vaccination en cas de pandémie
- 3.1 Objectifs
- 3.2 Approches et principes directeurs
- 3.3 Hypothèses se rapportant spécifiquement aux vaccins
- 3.4 Rôles et responsabilités en situation de pandémie
- 3.5 Principaux éléments de l'intervention
- 3.5.1 Approvisionnement en vaccins
- 3.5.2 Réglementation sur les vaccins
- 3.5.3 Recommandations sur l'utilisation du vaccin
- 3.5.4 Attribution, distribution et entreposage des vaccins
- 3.5.5 Administration des vaccins
- 3.5.6 Innocuité du vaccin
- 3.5.7 Surveillance des taux de vaccination et de l'efficacité du vaccin
- 3.6 Approche de gestion des risques
- 3.7 Décisions clés et facteurs de déclenchement
- 4.0 Intégration à d'autres éléments de l'intervention
- 5.0 Recherche
- 6.0 Mesure et évaluation
- Appendice A - Cadre de priorisation des vaccins pandémiques
- 1.0 Introduction
- 2.0 Cadre de priorisation des vaccins pandémiques
- 3.0 Considérations relatives à la priorisation des vaccins pandémiques
- 3.1 Preuves scientifiques
- 3.2 Considérations d'ordre éthique
- 3.3 Enjeux liés au programme
- 3.4. Autres facteurs stratégiques à prendre en considération
- 4.0 Processus d'élaboration des recommandations
- Appendice A1 - Renseignements requis pour la priorisation des vaccins
- Appendice A2 - Consultations publiques sur la priorisation
- 1. Projets du Canadian Program of Research on Ethics in a Pandemic (CanPREP)
- 2. Sondage de l'Université de l'Alberta sur l'attribution des ressources limitées en cas de pandémie de grippe
- 3. Objectifs et valeurs du processus de dialogue délibératif sur les antiviraux
- 4. Rapport Public Engagement on Facilitating Access to Antiviral Medications and Information in an Influenza Pandemic de l'Institute of Medicine (IOM)
- Appendice B - Conseils pour la planification des cliniques de vaccination de masse
- 1.0 Introduction
- 2.0 Planification des cliniques
- 3.0 Opérations de la clinique
- 3.1 Algorithme de la clinique de vaccination de masse
- 3.2 Contrôle des infections
- 3.3 Gestion des foules
- 3.4 Stationnement et entrée
- 3.5 Accueil et dépistage
- 3.6 Consentement et inscription
- 3.7 Évaluation et vaccination
- 3.8 Après la vaccination
- 4.0 Activités de désescalade et évaluations
- 4.1 Fermeture du site
- 4.2 Évaluation après la fermeture de la clinique
- Appendice B1 - Liste de fournitures requises pour la tenue d'une clinique de vaccination de masse
- Appendice B2 - Organisation d'une clinique de vaccination de masse
- Appendice B3 - Formulaire d'évaluation post-clinique à l'intention du personnel
- Appendice B4 - Formulaire d'évaluation à l'intention du public
Préambule
L'Annexe traitant de la vaccination du document Préparation du Canada en cas de grippe pandémique : Guide de planification pour le secteur de la santé est un document d'orientation des autorités fédérale, provinciales et territoriales (FPT) qui explique comment celles-ci travailleront de concert pour assurer une approche coordonnée et uniforme à l'échelle du secteur de la santé en ce qui concerne la stratégie de vaccination en cas de pandémie. Le document maître Préparation du Canada en cas de grippe pandémique (PCGP) et les annexes associées sont interdépendants et complémentaires, et sont destinés à être utilisés ensemble.
Alors qu'il est prévu que les orientations et directives stratégiques proposées dans le PCGP guideront la planification des gouvernements fédéral, provinciaux et territoriaux pour permettre une réponse uniforme et coordonnée dans l'ensemble des territoires de compétences, les provinces et les territoires (PT) ont l'ultime responsabilité de la planification et de la prise de décision dans leurs territoires de compétence respectifs.
Il est important de noter que le PCGP n'est pas un plan d'intervention réel. Il s'agit plutôt d'un document d'orientation traitant spécifiquement de la grippe et qui vise à appuyer une approche pancanadienne tous risques d'intervention sanitaire d'urgence.
1.0 Introduction
1.1 Historique
La vaccination contre la grippe des personnes sensibles constitue le moyen le plus efficace pour prévenir la maladie et les décès qu'elle provoque. Le Canada a pris l'engagement d'assurer l'accès à un vaccin contre la grippe pandémique à l'ensemble de la population canadienne, et les gouvernements FPT sont déterminés à travailler de concert afin de rendre le vaccin accessible au plus grand nombre de gens possible, le plus rapidement possible.
De nombreux défis doivent être relevés pour assurer une mise en œuvre fructueuse de la stratégie de vaccination en cas de pandémie. La création du premier contrat d'approvisionnement en vaccins pandémiques, en 2001, a été une grande réalisation, mais ne constitue qu'un aspect de la préparation. La présente annexe décrit les nombreuses composantes de la planification d'un programme de vaccination pancanadien et de la prestation de ce programme à l'ensemble de la population en cas de pandémie grippale.
1.2 But
Le but de l'Annexe traitant de la vaccination est de définir la stratégie canadienne de vaccination en cas de pandémie et de fournir au secteur de la santé des conseils opérationnels et techniques propres aux vaccins. Le présent document fait partie d'une série d'annexes qui complètent le PCGP.
L'Annexe traitant de la vaccination est principalement destinée aux ministères FPT de la Santé ainsi qu'aux autres ministères fédéraux responsables de la vaccination de populations choisies. L'Annexe traitant de la vaccination sert également de document de référence sur la stratégie de vaccination en cas de pandémie pour les autres ministères, les organisations non gouvernementales participant aux questions de santé et les autres intervenants. L'Annexe traitant de la vaccination est destinée à être lue conjointement avec le document maître du PCGP, qui propose une orientation stratégique et un cadre pour la préparation et les interventions en cas de pandémie.
1.3 Changements apportés dans la présente version
Le format et le contenu de la présente version de l'Annexe traitant de la vaccination ont beaucoup changé par rapport à ceux de la version de 2008. Les leçons tirées de la pandémie de 2009 ont été intégrées. Des renseignements sur l'état des contrats canadiens d'approvisionnement en vaccins pandémiques et sur les nouvelles approches réglementaires en cas de pandémie ont été ajoutés. De nouvelles sections portent sur l'attribution et la distribution des vaccins, l'administration des vaccins, la surveillance des effets secondaires suivant l'immunisation (ESSI) et la mesure de l'efficacité des vaccins. Les objectifs, les hypothèses, les rôles et les responsabilités se rapportant spécifiquement à la vaccination ont également été mis à jour.
L'ensemble de l'Annexe traitant de la vaccination met l'accent sur les approches et les principes sous-jacents décrits dans le PCGP, notamment la flexibilité dont les responsables de l'administration des vaccins doivent faire preuve en raison des échéanciers de vaccination qui peuvent être amenés à changer. L'approche de gestion des risques proposée dans le PCGP est appliquée à la stratégie de vaccination en cas de pandémie. Les scénarios de planification du PCGP servent à déterminer les facteurs à prendre en considération dans la gestion des risques spécifiques à la vaccination en cas de pandémie ayant des répercussions variées. Le document définit également les risques supplémentaires associés à la stratégie de vaccination en cas de pandémie, ainsi que les approches d'atténuation potentielles. Il décrit les principales décisions qui doivent être prises pour mettre en œuvre un programme de vaccination en cas de pandémie, ainsi que les éléments de déclenchement qui s'y rapportent.
Le Cadre de priorisation des vaccins pandémiques a été mis à jour afin de fournir plus de précision quant à son utilisation. Il est maintenant intégré à l'Annexe traitant de la vaccination et constitue l'appendice A. Des directives de planification détaillées pour l'organisation de cliniques de vaccination de masse ont été ajoutées (appendice B).
2.0 Contexte de la planification
2.1 Rôle de la vaccination dans la prévention de la grippe pandémique
La vaccination est le seul moyen, hormis l'infection naturelle, qui permette aux personnes d'acquérir une immunité prolongée contre un virus pandémique. Le vaccin contre une maladie pandémique devrait jouer un rôle important dans la prévention de la maladie et des cas graves. Des études sur la pandémie de grippe de 2009 ont montré que le vaccin avait permis de prévenir des cas de maladie grave, d'hospitalisation et de décès, même si le vaccin est arrivé alors que la deuxième vague de la maladie avait presque atteint son sommetNote de bas de page 1 Note de bas de page 2. Afin de procurer le maximum de bienfaits à l'échelle individuelle et collective, le vaccin doit être accessible en grande quantité et aussi rapidement que possible. Avec la technologie actuelle de fabrication des vaccins à base d'œufs, la production du vaccin contre la grippe pandémique devrait prendre de quatre à six mois. Les efforts continus visant à réduire ces délais de production, ainsi que les avancées des technologies de création de vaccins, pourraient accroître les retombées des vaccins durant la prochaine pandémie.
Les procédés de fabrication du vaccin contre la grippe pandémique et ceux du vaccin antigrippal saisonnier sont essentiellement les mêmes. Toutefois, on s'attend à ce que le vaccin contre la grippe pandémique soit monovalent, c'est-à-dire qu'il ne contienne que la souche de la grippe pandémique, contrairement aux vaccins antigrippaux saisonniers, qui sont trivalents ou quadrivalents.
Les fabricants feront appel à des stratégies d'économie des doses, comme l'ajout d'adjuvants aux vaccins, afin d'optimiser les stocks de vaccins. Pendant la pandémie de 2009, l'ajout d'un adjuvant huile dans l'eau (AS03) au vaccin H1N1 utilisé au Canada a permis de réduire le contenu en antigène du vaccin à 3,75 µg d'hémagglutinine, au lieu des 15 µg par souche habituellement utilisés dans les vaccins antigrippaux saisonniers. Les vaccins avec adjuvants produisent également une réponse immunitaire plus forte, plus durable et d'une plus grande portée que les doses équivalentes de vaccin antigrippal inactivé sans adjuvant. L'ajout d'un adjuvant au vaccin procure donc des avantages, à savoir une efficacité accrue du vaccin pour la population non immunisée (n'ayant jamais reçu le vaccin ou n'ayant jamais été infectée naturellement) et une protection anticipée contre la dérive antigénique de la soucheNote de bas de page 3 Note de bas de page 4 Note de bas de page 5.
2.2 Incertitudes et imprévisibilité
De nombreuses incertitudes sont associées à la mise en œuvre de la stratégie de vaccination en cas de pandémie. Les principaux éléments inconnus sont les suivants :
- Disponibilité du vaccin pandémique - Des délais imprévus ou des défaillances peuvent survenir à n'importe quel stade de développement et de fabrication d'un vaccin en raison de difficultés lors du processus d'isolement du nouveau virus de la grippe ou de préparation de la souche et des réactifs, d'une mauvaise croissance du virus vaccinal dans les œufs, ou de problèmes de contrôle de la qualité, d'assurance de la qualité et de mise en circulation des lots. Ces problèmes peuvent affecter le délai de production ou la quantité de vaccins disponibles.
- Immunogénicité du vaccin pandémique - Le manque de données historiques pour un nouveau vaccin pandémique limite la capacité à anticiper la quantité d'antigène nécessaire pour produire une réponse immunitaire dans tous les groupes d'âge et de risque. Par exemple, les vaccins contre la grippe H5N1 ont présenté à ce jour une faible immunogénicité, à moins d'être administrés avec un adjuvant approprié. De même, le schéma posologique (une ou deux doses) pourrait ne pas être connu tant que les études cliniques sur le nouveau vaccin ne sont pas terminées. En raison de ces incertitudes, il est difficile de déterminer le nombre de doses de vaccin à commander et à administrer.
- Effet de la vaccination en cas de pandémie - L'effet du programme de vaccination sur la population (en matière de prévention de la maladie et des cas graves) sera influencé par l'efficacité du vaccin, l'intérêt de la population à se faire vacciner (taux de vaccination) et la disponibilité du vaccin par rapport à l'activité pandémique. Idéalement, le vaccin devrait être administré avant que la majeure partie de la population ait été exposée au virus pandémique; toutefois, le vaccin peut quand même entraîner des effets significatifs même s'il est disponible plus tard au cours de la pandémieNote de bas de page 6.
- Émergence de problèmes importants liés à l'innocuité - Les médicaments et les vaccins peuvent tous provoquer des événements indésirables. Lorsqu'un vaccin est administré à des millions de personnes, des effets indésirables rares et parfois inattendus peuvent être détectés. Le virus de la grippe pandémique lui-même pourrait être responsable de maladies et de décès inattendus attribués à tort au vaccin pandémique si la campagne de vaccination coïncide avec une vague pandémique. Les campagnes de vaccination ciblées soulèvent également la possibilité de survenue d'événements accidentels (p. ex. une série de décès chez des personnes âgées), reliés à tort au vaccin.
Un certain nombre de mesures sont prises au cours de la période interpandémique afin d'accroître la vitesse de production et l'efficacité des vaccins. Ces mesures comprennent des recherches sur les vaccins pandémiques potentiels, les nouveaux adjuvants, l'amélioration de la capacité de remplissage de l'antigène, l'amélioration des méthodes dans le but d'accélérer la production des souches de semence et des réactifs, et l'adoption de nouvelles technologies pour remplacer les méthodes de fabrication à partir d'œufs (p. ex. fabrication de vaccins à partir de cultures cellulaires et de plantes). Toutefois, il est impossible d'éliminer toutes les incertitudes liées à la production d'un nouveau vaccin contre un nouveau virus grippal au moment d'une pandémie. La section 3.6.2 (Considérations liées à la gestion des risques dans le cadre de la stratégie de vaccination en cas de pandémie) fournit de plus amples renseignements sur les risques associés à la stratégie de vaccination en cas de pandémie et leurs répercussions, ainsi que les interventions et les mesures d'atténuation possibles.
2.3 Leçons à retenir de la pandémie de 2009
2.3.1 Résultats scientifiques pertinents
Les études sur les vaccins menées pendant et après la pandémie de 2009 ont produit certains résultats clés qui pourraient être utiles lors des prochaines pandémies :
- Le vaccin avec adjuvant AS03 produit une réponse immunitaire satisfaisante dans tous les groupes d'âge et de risque, y compris chez les enfants, les femmes enceintes, les personnes présentant une réponse immunitaire plus faible et les AutochtonesNote de bas de page 7 Note de bas de page 8 Note de bas de page 9.
- Le vaccin avec adjuvant a présenté une immunogénicité supérieure à celle du vaccin sans adjuvant, même lorsqu'il contenait une quantité inférieure d'antigèneNote de bas de page 10, et offrait une efficacité supérieure à celle du vaccin sans adjuvant utilisé dans les autres paysNote de bas de page 11 Note de bas de page 12 Note de bas de page 13 Note de bas de page 14.
- Le vaccin contre la grippe pandémique présentait un profil d'innocuité global favorableNote de bas de page 15 Note de bas de page 16.
- Le risque de syndrome de Guillain-Barré (SGB) n'était pas significativement plus élevé pour les personnes ayant reçu le vaccin pandémique avec adjuvant en EuropeNote de bas de page 17. Au Québec, le nombre de cas de SGB attribuable à la vaccination (réalisée principalement avec le vaccin avec adjuvant) a été d'environ deux cas par million de doses de vaccin, ce qui correspond au taux observé avec le vaccin antigrippal saisonnierNote de bas de page 18.
- Une augmentation du nombre de cas de narcolepsie (un trouble du sommeil rare) a été détectée chez les personnes ayant reçu le vaccin contenant l'adjuvant AS03, principalement chez les enfants et les adolescents. Au Québec, une étude a estimé le risque attribuable à 1 cas sur 1 000 000 de sujets vaccinésNote de bas de page 19 Note de bas de page 20 Note de bas de page 21 Note de bas de page 22 Note de bas de page 23.
- La vaccination des femmes enceintes au moyen du vaccin pandémique (y compris les vaccins avec les adjuvants AS03 et MF59) n'a pas été associée à une augmentation des issues fœtales et néonatales défavorables, dont la mortinaissanceNote de bas de page 24. Selon plusieurs études, la vaccination en cas de pandémie serait associée à une amélioration des issues fœtales et néonatalesNote de bas de page 25 Note de bas de page 26.
- Le vaccin contre la grippe pandémique a été administré sans danger à des personnes allergiques aux œufsNote de bas de page 27.
- Les anticorps ont persisté de manière substantielle chez les enfants un an après l'administration d'une dose unique du vaccin pandémique contenant l'adjuvant AS03; de plus, on a observé une excellente réponse dirigée contre la souche pandémique après l'administration d'une dose du vaccin antigrippal trivalent inactivé (VTI) pour la saison 2010-2011, pour lequel la sensibilisation provoquée par le vaccin contre la grippe pandémique a été démontréeNote de bas de page 28. L'efficacité du vaccin a également persisté pendant la saison 2010-2011Note de bas de page 29.
- Au cours de la première année suivant la pandémie, le VTI contenant la souche pandémique a pu être administré sans danger aux personnes ayant reçu le vaccin pandémique avec adjuvantNote de bas de page 30 Note de bas de page 31.
- Les vaccins pandémique et saisonnier de 2009 se sont avérés compatibles lorsqu'ils ont été administrés simultanément (il faut noter que ce résultat n'est pertinent que si les vaccins pandémique et saisonnier sont administrés simultanément au cours de la prochaine pandémie)Note de bas de page 32.
2.3.2 Leçons à retenir sur le plan de la programmation
De nombreux aspects du programme de vaccination contre la grippe pandémique de 2009 se sont déroulés sans problème. La campagne de vaccination contre la grippe pandémique H1N1 a rapidement atteint un taux d'acceptation élevé dans de nombreuses provinces et de nombreux territoires, particulièrement dans les communautés éloignées et isoléesNote de bas de page 35. Le vaccin a été administré par divers fournisseurs dans de nombreux milieux et des stratégies novatrices ont été élaborées pour organiser des cliniques de vaccination de masse et gérer les foules importantes.
Les défis associés aux campagnes de vaccination étaient notamment les incertitudes concernant le délai de livraison des vaccins, qui ont entraîné de grandes difficultés pour la planification de la clinique, la mise en œuvre des recommandations sur la priorisation des vaccins et la logistique des campagnes locales (qui ont été sous-estimées dans certaines provinces et certains territoires). La communication efficace des renseignements sur les vaccins (p. ex. préparations, innocuité, bienfaits) et des nouvelles recommandations concernant leur utilisation aux professionnels de la santé et au grand public s'est avérée difficile. Le programme a été critiqué par la population et les incohérences décelées dans sa mise en œuvre à l'échelle du pays ont suscité les inquiétudes et la confusion du public. Ces défis, ainsi que d'autres, sont décrits dans les rapports du gouvernement du Canada et du Comité sénatorial permanent des affaires sociales, des sciences et de la technologieNote de bas de page 36 Note de bas de page 37, ainsi que dans une analyse des stratégies de vaccination pandémique internationalesNote de bas de page 38.
Ces rapports précisent également les leçons retenues qui ont été intégrées à l'Annexe traitant de la vaccination :
- l'importance de tirer parti des comités consultatifs existants et des réseaux de recherche préétablis afin de fournir des conseils et des recommandations et de mettre en œuvre une intervention rapide en recherche;
- la nécessité d'anticiper les difficultés au moment de prévoir et d'équilibrer l'offre et la demande en vaccins;
- la nécessité de procéder à une planification solide et à une vérification de tous les aspects logistiques des campagnes de vaccination à grande échelle, y compris la capacité à gérer les temps d'attente et à mettre en œuvre les recommandations concernant la priorisation;
- l'importance de disposer de systèmes de surveillance et de registres de vaccination électroniques établis et intégrés pour gérer les stocks, faire un suivi de l'administration des vaccins, surveiller les effets indésirables et fournir des renseignements dans le cadre des études sur l'efficacité du vaccin;
- la nécessité de faire preuve de flexibilité dans la gestion des toutes dernières informations et des recommandations en constante évolution (et de disposer de stratégies de communication des changements);
- l'importance de justifier les stratégies du programme, y compris les recommandations concernant la priorisation, afin d'accroître la compréhension et la confiance du public;
- la nécessité de fournir davantage de renseignements au public concernant l'innocuité du vaccin et de contrer la désinformation rapidement, notamment au moyen des médias sociaux;
- la nécessité de faire preuve de plus de cohérence ou de clarté au moment de préciser les raisons des écarts dans certains aspects de la mise en œuvre des programmes PT (p. ex. au moment de la mise en œuvre des recommandations relatives à la priorisation) afin de dissiper les craintes et la confusion du public.
2.4 Prestation du programme dans le contexte canadien
Les PT sont responsables de l'administration du vaccin contre la grippe pandémique. C'est aussi le cas de certains ministères et organismes fédéraux (p. ex. le ministère de la Défense nationale, Affaires mondiales Canada, Service correctionnel Canada, la Direction générale de la santé des Premières nations et des Inuits [DGSPNI] de Santé Canada [SC]), qui sont responsables de la prestation directe des services de santé à des populations précises. Il faut prendre note que dans la présente annexe, les conseils de planification fournis aux programmes PT s'appliquent également à ces ministères et organismes fédéraux.
Les programmes actuels de vaccination contre la grippe saisonnière dans l'ensemble du Canada fournissent une solide plateforme pour relever les défis liés au programme de vaccination en cas de pandémie. Il est recommandé que chaque province ou territoire tire parti de ses stratégies de vaccination contre la grippe saisonnière au moyen d'approches adaptées permettant de répondre aux besoins uniques des divers milieux et des populations vulnérables. Les éléments reflétant la diversité du Canada qui pourraient avoir une influence sur la vaccination dans une province ou un territoire sont la langue, la culture, l'origine ethnique et les croyances religieuses des personnes. Des considérations particulières relatives à la planification consistant à déterminer et à satisfaire les besoins spéciaux des populations et des communautés sont recommandées afin d'assurer à tous un accès au vaccin.
Il est recommandé que le programme de vaccination permette de rejoindre les personnes vulnérables, qu'elles soient handicapées physiquement ou mentalement, de faible niveau d'alphabétisation, frêles ou confinées à la maison, sans logement, ou isolées sur le plan culturel ou social. Les stratégies utiles consistent entre autres à traduire la documentation sur la vaccination dans les langues pertinentes, à assurer un accès à des interprètes dans les cliniques, à organiser un transport à destination et en provenance des cliniques, à solliciter l'aide de membres de la famille plus jeunes et parlant plusieurs langues pour faciliter la communication, à offrir des visites à domicile si les ressources le permettent, et à rejoindre les personnes sans-abris en tenant des cliniques de vaccination près de comptoirs alimentaires, de refuges ou d'autres endroits où elles se regroupent.
Pour obtenir des conseils pratiques :
Les facteurs géographiques peuvent avoir des retombées importantes sur l'accessibilité rapide au vaccin en cas de pandémie; par conséquent, il est conseillé aux provinces et aux territoires d'être prêts à offrir efficacement le vaccin dans les communautés éloignées et isolées. Le guide de planification des cliniques de vaccination de masse dans les communautés éloignées et isolées a été élaboré dans le contexte de la pandémie de 2009. Ces lignes directrices ont été adaptées sous forme d'un outil de planification générale, tout en conservant certaines considérations particulières à l'égard de l'auditoire cible initial. Elles figurent à l'appendice B.
2.5 Considérations d'ordre éthique
Les principes et les valeurs éthiques énoncés dans le PCGP constituent un aspect important du processus décisionnel dans le cadre de la stratégie de vaccination en cas de pandémie. Ces principes et ces valeurs comprennent la confiance, la solidarité, la réciprocité, l'intendance, l'équité et l'impartialité.
Plusieurs aspects de la stratégie de vaccination en cas de pandémie ont des répercussions éthiques importantes :
- Recommandations concernant la priorisation des vaccins - Les stocks de vaccins initiaux ne seront souvent pas suffisants pour vacciner immédiatement l'ensemble de la population; les vaccins disponibles doivent toutefois être distribués de manière juste et équitable de façon à soutenir les objectifs pandémiques. Le processus d'élaboration des recommandations concernant la priorisation des stocks de vaccins initiaux sera structuré de façon à tenir compte explicitement des considérations d'ordre éthique (consultez l'appendice A).
- Enjeux internationaux concernant les vaccins - Étant donné que les pandémies constituent une menace à l'échelle mondiale, d'importantes considérations d'ordre éthique entourent les responsabilités du Canada à l'égard de la communauté mondiale, comme la coopération internationale et l'aide aux autres pays. Le Cadre de préparation en cas de grippe pandémique, qui a été adopté par l'Assemblée mondiale de la Santé en 2011, vise à favoriser l'échange d'information sur les virus grippaux susceptibles de donner lieu à une pandémie et à assurer un accès plus prévisible, plus efficace et plus équitable aux vaccins et aux médicaments pouvant sauver des vies aux pays qui en auront besoin au cours des prochaines pandémies. Les provinces et les territoires peuvent également recevoir des demandes de vaccins de la part d'autres pays; ces demandes seront étudiées en tenant compte de la situation au moment de la demande. On tiendra également compte des accords internationaux en place pour l'échange des contre-mesures médicales (p. ex. Par-delà la frontière, Plan nord-américain contre l'influenza animale et la pandémie d'influenza).
L'approche éthique en matière de prise de décisions sur la vaccination consiste également à suivre les processus de prise de décision efficaces décrits dans le PCGP, comme l'ouverture et la transparence, la responsabilisation, l'inclusion et le caractère raisonnable. Étant donné l'importance et la visibilité publique du programme de vaccination en cas de grippe pandémique, le respect de ces processus contribuera à bâtir la confiance du public et à favoriser la vaccination.
2.6 Considérations d'ordre juridique
Les questions juridiques pertinentes à la stratégie de vaccination en cas de pandémie doivent être cernées et prises en compte au cours de la période interpandémique, dans la mesure du possible. Les considérations d'ordre juridique pertinentes pour la priorisation des vaccins sont décrites à l'appendice A (section 3.4.1). Les autres aspects juridiques propres à la stratégie de vaccination en cas de pandémie comprennent ce qui suit :
- Fournisseurs de vaccin - les PT peuvent envisager d'élargir l'éventail de fournisseurs qui sont autorisés à administrer le vaccin antigrippal (p. ex. pharmaciens, ambulanciers paramédicaux);
- Obligation de signaler les ESSI - il est recommandé de rendre obligatoire le signalement des ESSI aux autorités de santé publique dans toutes les provinces et tous les territoires, plutôt qu'un signalement sur une base volontaire comme cela se fait actuellement dans certains territoires de compétence. En outre, il est recommandé que les territoires de compétences prévoient certaines dispositions dans leurs exigences en matière de déclaration afin de pouvoir a) ajouter des ESSI précises qui pourraient devenir préoccupantes au cours d'une campagne de vaccination de masse et b) déclarer tous les cas d'une maladie particulièrement préoccupante, comme le syndrome de Guillain-Barré et la narcolepsie, que la maladie soit ou non consécutive à une vaccination, afin de détecter toute association possible avec les vaccins. Ces déclarations pourraient être limitées dans le temps (par exemple, au cours de l'année suivant la campagne de vaccination en cas de pandémie);
- Collecte et partage de données - les territoires de compétences devraient posséder la capacité et, au besoin, l'autorité légale de recueillir et de partager en temps opportun des renseignements essentiels à la gestion de la campagne de vaccination en cas de pandémie, dont des données sur les stocks de vaccins, la distribution et l'administration des vaccins, le taux de vaccination et les événements indésirables liés à la vaccination.
3.0 Stratégie canadienne de vaccination en cas de pandémie
3.1 Objectifs
La stratégie de vaccination en cas de pandémie soutient les objectifs du Canada sur le plan de la préparation et des mesures d'intervention en cas de pandémie :
Premièrement, réduire au minimum la morbidité grave et la mortalité en général et, deuxièmement, atténuer les perturbations sociales que pourrait subir les Canadiens suite à une pandémie d'influenza.
Les objectifs de la stratégie de vaccination en cas de pandémie sont les suivants :
- Mettre un vaccin sûr et efficace à la disposition de l'ensemble de la population canadienne, dans les plus brefs délais.
- Attribuer, distribuer et administrer le vaccin de la façon la plus équitable et la plus efficace possible.
- Surveiller l'innocuité et l'efficacité du vaccin contre la grippe pandémique.
3.2 Approches et principes directeurs
Les principes directeurs du PCGP, à savoir la collaboration, la prise de décision fondée sur des données probantes et la flexibilité, sont particulièrement pertinents dans le contexte de l'intervention en cas de pandémie, tout comme l'adoption d'une approche de prévention et de protection fondée sur des pratiques et des systèmes établis ainsi que la prise de décision éthique. Ces principes sont décrits brièvement ci-dessous.
La collaboration entre les ordres de gouvernement et les intervenants en soins de santé est nécessaire pour mettre en œuvre la stratégie de vaccination en cas de pandémie d'une manière efficace et coordonnée. Cela signifie qu'il faut adopter des approches cohérentes concernant l'utilisation et la priorisation des vaccins de façon à assurer un programme équitable à l'échelle du Canada. Une collaboration à l'échelle internationale sera également essentielle, particulièrement en ce qui concerne la réglementation sur les vaccins et l'évaluation de l'innocuité du vaccin pandémique. Le partage d'information scientifique et d'approches réglementaires peut mener à un processus décisionnel plus rapide et plus efficace et aider les organismes de réglementation moins expérimentés dans les pays en développement.
La prise de décision fondée sur des données probantes est essentielle dans le cadre de l'évaluation réglementaire des vaccins et de l'élaboration de recommandations sur l'utilisation du vaccin pandémique. Le Cadre de priorisation des vaccins pandémiques (appendice A) fournit une méthode systématique permettant de prendre en compte les données scientifiques et épidémiologiques, ainsi que des facteurs supplémentaires comme des considérations d'ordre éthique, au cours de l'élaboration des recommandations sur la priorisation des vaccins.
La flexibilité est un principe particulièrement important compte tenu des incertitudes qui entourent la fabrication d'un nouveau vaccin. Le vaccin pourrait ne pas être mis en circulation à la date ou dans les quantités prévues, et les recommandations sur son usage pourraient changer au fil du temps à mesure que de nouvelles données sont disponibles. Les fournisseurs de vaccins doivent prévoir une certaine flexibilité dans leurs plans et être en mesure de répondre aux changements apportés aux recommandations. Un autre aspect de la flexibilité concerne l'ampleur des variations entre les programmes de vaccination des provinces et des territoires, compte tenu de la désirabilité d'une approche pancanadienne concernant l'utilisation et la priorisation des vaccins. Les provinces et les territoires devraient se montrer flexibles à l'égard de certains aspects du programme, comme les fournisseurs de vaccins, les milieux de vaccination et les mesures prises pour rejoindre des populations particulières.
L'approche de prévention et de protection est observée dans la décision d'offrir le vaccin pandémique à l'ensemble de la population canadienne et d'établir des contrats d'approvisionnement en vaccins pandémiques, y compris pour les stocks de secours.
L'utilisation de pratiques et de systèmes établis dans la mesure du possible favorisera le succès de la stratégie de vaccination en cas de pandémie. Cela comprend le recours à des procédures réglementaires bien établies, la participation de comités consultatifs d'experts existants et l'utilisation de stratégies de vaccination contre la grippe saisonnière afin de distribuer et d'administrer le vaccin pandémique et de surveiller les réactions indésirables et l'efficacité du vaccin.
La prise de décision éthique est un élément important du processus d'élaboration des recommandations sur la priorisation des vaccins; elle est abordée plus en détail à la section 2.5 et à l'appendice A.
3.3 Hypothèses se rapportant spécifiquement aux vaccins
Les hypothèses de planification constituent un moyen de faire face à l'incertitude. Bien que les hypothèses fournissent un cadre utile pour la planification et qu'elles soient, dans la mesure du possible, fondées sur des preuves, elles ne doivent pas être considérées comme des prévisions. À mesure que la pandémie évolue, de nouvelles données sont utilisées pour orienter l'intervention.
Le document maître du PCGP formule plusieurs hypothèses pertinentes à la stratégie de vaccination en cas pandémie :
- Le vaccin sera disponible à temps pour avoir des répercussions sur la pandémie globale, mais ne sera pas disponible pour la première vague. Avec les moyens technologiques actuels, il faudra entre quatre et six mois avant que le vaccin ne soit disponible. Plus le vaccin sera offert tôt, plus les effets de la vaccination seront importants.
- Les personnes ayant un risque accru de complications dues à la grippe saisonnièreNote de bas de page 39 présenteront un risque accru de maladie grave et de complications dues à l'infection par la grippe pandémique, et d'autres groupes à risque pourraient également émerger.
Des hypothèses supplémentaires ont été formulées pour aider à planifier l'intervention en matière de vaccination :
- Le vaccin pandémique sera monovalent et contiendra un adjuvant.
- Deux doses de vaccin pandémique pourraient être requises (à 21 jours jusqu'à un mois d'intervalle). Une telle exigence pourrait s'appliquer à tous les groupes d'âge ou à certains seulement (p. ex. les jeunes enfants).
- On s'attend à ce que le vaccin pandémique concorde avec la souche pandémique pendant la durée de la pandémie.
- Le vaccin sera accessible en phases, ce qui signifie que des priorités devront être établies pour les doses initiales.
- Compte tenu de la probabilité que la souche de grippe pandémique remplace les souches de grippe saisonnière au cours de la pandémie, le programme de vaccination contre la grippe saisonnière sera probablement interrompu pendant cette période.
3.4 Rôles et responsabilités en situation de pandémie
La stratégie de vaccination en cas de pandémie nécessite une approche de collaboration et une définition claire des rôles et des responsabilités. Les rôles et les responsabilités des gouvernements FPT sont décrits ci-dessous. Cette section doit être lue conjointement avec la section 3.4.2 du document maître du PCGP.
Il est important de noter que plusieurs rôles et responsabilités dépassent la portée de la présente annexe. Il s'agit notamment des processus décisionnels FPT, des processus d'approbation des recommandations sur le vaccin et des dispositions fiscales.
Le gouvernement fédéral est responsable de ce qui suit :
- évaluer l'innocuité, l'efficacité et la qualité des vaccins antigrippaux et accorder l'autorisation réglementaire pour la vente de ces vaccins;
- coordonner la collaboration entre les fabricants de vaccins et les organismes de réglementation internationaux;
- accorder l'autorisation réglementaire pour la réalisation d'essais cliniques;
- négocier avec les fabricants et établir des contrats pour l'achat de vaccins à l'échelle FPT en prévision d'une pandémie;
- fournir le vaccin aux populations relevant du gouvernement fédéral non couvertes selon les dispositions prises par les PT;
- assurer la surveillance de l'innocuité et de l'efficacité du vaccin à l'échelle nationale, superviser les enquêtes spéciales et prendre des mesures réglementaires au besoin.
Les gouvernements PT sont responsables de l'entretien, de la surveillance, de la distribution et de l'administration des vaccins dans leur territoire de compétence respectif. Ils collaboreront en vue :
- d'assurer la fourniture de vaccins, lorsqu'ils sont disponibles, aux populations proposées aux fins d'utilisation selon les recommandations convenues à l'échelle nationale;
- de communiquer les renseignements concernant la distribution et l'utilisation des vaccins au sein de leur administration respective;
- d'assurer la surveillance et la déclaration des ESSI.
Les gouvernements PT sont également responsables de la distribution des vaccins à la plupart des populations relevant du gouvernement fédéral, mais ceci varie en fonction de la population et de la province ou du territoire (voir la section 3.4.2 F du document maître du PCGP : Populations relevant du gouvernement fédéral).
Les gouvernements FPT collaboreront en vue :
- de confirmer les commandes de vaccins pandémiques en ce qui concerne les quantités;
- d'élaborer un plan d'attribution du vaccin pandémique;
- d'élaborer et de mettre en œuvre des stratégies visant à atténuer les effets d'une pénurie de vaccins ou d'un retard de livraison des vaccins, dans l'éventualité d'une telle situation;
- de faciliter la transmission de messages coordonnés et cohérents aux fournisseurs de soins de santé et au public;
- d'élaborer un plan de pharmacovigilance pour le vaccin pandémique, de signaler les ESSI conformément aux protocoles, d'analyser les rapports et de formuler des commentaires;
- de mener des études sur l'efficacité du vaccin;
- d'établir et d'appuyer les politiques et les recommandations pancanadiennes liées à l'utilisation de vaccins pendant une pandémie.
3.5 Principaux éléments de l'intervention
Cette section décrit les nombreuses étapes nécessaires pour pouvoir offrir le vaccin pandémique et pour en surveiller l'utilisation. Pour réussir, une vaste collaboration est essentielle entre les fabricants, les organismes de réglementation et le personnel de santé publique à tous les niveaux.
3.5.1 Approvisionnement en vaccins
L'obtention en temps opportun d'un approvisionnement adéquat de vaccins pandémiques est la première étape d'un programme fructueux. En 2011, le Canada a signé un nouveau contrat d'approvisionnement d'une durée de dix ans avec GlaxoSmithKline inc. (GSK) afin de garantir un accès rapide et prioritaire à des stocks suffisants de vaccins avec adjuvant contre la grippe pandémique produits au Canada (c'est-à-dire fabriqués, remplis et finis au pays). La stratégie du Canada pour la vaccination en cas de pandémie comprend également un contrat pour un approvisionnement de secours en vaccins pandémiques, au besoin.
Dans le cadre du contrat actuel d'approvisionnement en vaccins contre la grippe pandémique avec GSK, en vigueur jusqu'en 2021, le vaccin contre la grippe pandémique sera un vaccin monovalent contenant un adjuvant. D'autres aspects de la préparation et de la posologie (p. ex. quantité d'antigène, nécessité d'administrer une ou deux doses) ne peuvent être déterminés qu'au moment de la pandémie, à moins qu'un prototype de vaccin pandémique de la même souche ait reçu une autorisation réglementaire (p. ex. Arepanrix H5N1).
Le vaccin contre la grippe pandémique fourni dans le cadre du contrat actuel avec GSK devrait être offert en fioles multidoses contenant 10 doses chacune, comme ce fût le cas lors de la pandémie de 2009. L'antigène du vaccin et l'adjuvant seront fournis dans des fioles multidoses distinctes et devront être mélangés avant l'administration. Les vaccins seront fournis dans des cartons de 500 doses contenant l'antigène et l'adjuvant. Les provinces et les territoires pourraient devoir revoir la logistique de réemballage s'il faut distribuer de plus petites quantités.
La première livraison de vaccins pandémiques devrait se faire dans les 19 semaines suivant la réception par le fabricant d'une souche de semence acceptable; toutefois, de nombreux problèmes pourraient venir modifier cette date. Le contrat actuel d'approvisionnement en vaccins contre la grippe pandémique exige également que le fabricant soit en mesure de produire au moins 33 millions de doses par mois et d'approvisionner le Canada en quantité suffisante pour offrir deux doses à l'ensemble de la population.
Afin d'éviter des retards dans la mise en circulation du vaccin au moment d'une pandémie, le contrat d'approvisionnement en vaccins contre la grippe pandémique stipule que le gouvernement du Canada doit indemniser le fabricant en cas de réclamation ou de poursuite par des tiers.
3.5.2 Réglementation sur les vaccins
Santé Canada (SC) possède l'autorité nécessaire pour évaluer l'innocuité, l'efficacité et la qualité des vaccins qui seront utilisés par les Canadiens et les Canadiennes pour les aider à protéger et à préserver leur santé. Les vaccins font généralement l'objet d'une surveillance réglementaire rigoureuse puisqu'ils sont généralement administrés à un grand nombre de personnes en santé et que, dans le contexte d'une pandémie, la vaccination s'effectue sur une courte période.
Les processus réglementaires appliqués aux vaccins contre la grippe saisonnière et la grippe pandémique sont décrits ci-dessous. Pour fournir un contexte, ils sont précédés d'une brève description du processus utilisé dans le cas d'un nouveau vaccin. Il faut prendre note que le processus lié au vaccin pandémique se situe généralement entre celui décrit pour un nouveau vaccin et celui du vaccin antigrippal saisonnier
Nouveaux vaccins - Tous les vaccins destinés à être administrés au Canada sont assujettis aux dispositions de la Loi sur les aliments et drogues et du Règlement sur les aliments et drogues. Avant d'autoriser un nouveau vaccin (y compris un nouveau vaccin antigrippal saisonnier), les experts de SC évaluent les données cliniques et scientifiques soumises par le fabricant, ce qui peut mener à une évaluation sur place des installations du fabricant et à une analyse des lots de vaccins. Si SC conclut que les bienfaits du vaccin l'emportent sur les risques, le vaccin reçoit une autorisation de mise en marché et peut être vendu au Canada. L'évaluation de l'innocuité et de la qualité du vaccin se poursuit après l'autorisation, par des essais de mise en circulation des lots et la surveillance post-commercialisation des événements indésirables. Des détails sur le système utilisé pour réglementer les vaccins destinés à l'usage humain au Canada sont fournis en ligne.
Vaccin antigrippal saisonnier - Le processus suivi pour autoriser chaque année l'utilisation des vaccins antigrippaux saisonniers déjà approuvés diffère du processus complet auquel sont soumis les nouveaux vaccins, puisque le changement des vaccins saisonniers ne touche que les souches de grippe utilisées. Les fabricants doivent fournir une mise à jour du processus de fabrication employé avec les souches sélectionnées. SC effectue un examen accéléré des données et autorise les modifications. Ce processus se déroule généralement entre juillet et septembre de chaque année.
Vaccin contre la grippe pandémique - Le vaccin contre la grippe pandémique doit être évalué et autorisé par SC avant de pouvoir être utilisé au Canada. Les processus réglementaires standard ne peuvent être utilisés pour diverses raisons. Le développement d'un vaccin contre la grippe pandémique ne peut commencer tant que la souche virale n'a pas été déterminée et le vaccin doit être utilisé presque immédiatement après avoir été fabriqué pour pouvoir atténuer les répercussions de la pandémie. Puisque les pandémies sont causées par des souches de grippe complètement nouvelles qui n'ont jamais circulé auparavant chez les humains, il n'existe pas de données confirmant l'efficacité du vaccin contre cette souche ou la durée de conservation du vaccin, comme c'est le cas pour les vaccins antigrippaux saisonniers.
L'approbation réglementaire d'un vaccin contre la grippe pandémique peut également être accélérée par une autorisation de mise en marché de prototypes de vaccins reposant sur des données d'immunogénicité substitutives. En 2013, un vaccin contre la grippe H5N1 (avec l'adjuvant AS03) a reçu une autorisation de mise en marché selon le processus de réglementation des nouveaux vaccins.
Un autre mécanisme de régulation auquel SC peut faire appel pour autoriser un vaccin contre la grippe pandémique consiste à utiliser le nouveau règlement sur une drogue nouvelle pour usage exceptionnel (DNUE) qui a été adopté en 2011 en vertu de la Loi sur les aliments et les drogues. Ce règlementpermet à SC d'autoriser un vaccin en mode accéléré en cas de pandémie, sans exiger les données approfondies des essais cliniques normalement nécessaires pour l'approbation d'un nouveau vaccin (à condition qu'un ensemble complet de renseignements sur la qualité soit fourni), mais selon des exigences supplémentaires visant à assurer une surveillance post-commercialisation rigoureuse. En vertu de la réglementation sur les DNUE, SC pourra se fier aux données sur les animaux (et aux données sur les humains, le cas échéant) pour autoriser le vaccin contre la grippe pandémique. Le ministre de la Santé peut également émettre une ordonnance provisoire pendant une pandémie s'il croit que des mesures doivent être prises immédiatement pour atténuer un risque significatif direct ou indirect pour la santé, la sécurité ou l'environnement. Des ordonnances provisoires pourraient être émises pour permettre l'autorisation d'un vaccin dans certaines circonstances particulières.
3.5.3 Recommandations sur l'utilisation du vaccin
Recommandations sur les vaccins - Le Comité consultatif national de l'immunisation (CCNI) est un comité consultatif formé d'experts relevant de l'Agence de la santé publique du Canada (ASPC) et responsable de formuler des recommandations concernant l'utilisation des vaccins au Canada, dont les vaccins contre la grippe saisonnière. Par l'intermédiaire de son Groupe de travail sur l'influenza, le CCNI fournit des conseils d'expert et une orientation sur l'utilisation du vaccin contre la grippe pandémique, notamment sur la priorisation du vaccin. Ces recommandations indiqueront les doses et les calendriers établis à la lumière d'études portant sur des prototypes pertinents des vaccins et, dans la mesure du possible, d'essais cliniques rapides sur le nouveau vaccin. Ces recommandations (p. ex. la nécessité d'utiliser une deuxième dose) pourraient être mises à jour à mesure que de nouveaux renseignements seront disponibles. Les processus de mise au point et d'approbation accélérés pour les recommandations sur les vaccins sont nécessaires pour faire en sorte que les vaccins soient mis en circulation suffisamment d'avance avant le début prévu des campagnes de vaccination.
Si on utilise un vaccin avec adjuvant, plus immunogénique que le vaccin sans adjuvant, il est plus probable qu'une dose unique produira des niveaux de protection satisfaisants dans la plupart ou dans tous les groupes d'âge. Toutefois, des études devront être menées au cours de la pandémie pour déterminer si une deuxième dose est requise pour obtenir une réponse immunitaire satisfaisante dans certains segments de la population (p. ex. personnes âgées, jeunes enfants ou personnes atteintes d'une maladie immunodéficiente) ou pour toutes les personnes recevant le vaccin. Des essais cliniques sur les prototypes de vaccins, menés au cours de la période interpandémique, pourraient fournir une information pertinente si la souche du virus pandémique est similaire à une de celles utilisées dans les vaccins étudiés antérieurement.
Priorisation des vaccins - Le vaccin sera offert graduellement, sur une période d'un mois dans le meilleur des cas. Les stocks initiaux seront probablement insuffisants pour permettre d'offrir le vaccin à toute la population dès le départ, bien qu'il devrait finalement y en avoir suffisamment pour tous. Pour gérer la situation initiale de manière équitable, des recommandations nationales sur l'utilisation prioritaire des stocks de vaccins initiaux seront élaborées à partir du Cadre de priorisation des vaccins pandémiques (appendice A).
Le Cadre offre une structure ordonnée permettant d'examiner toutes les données pertinentes, tout en tenant compte des considérations d'ordre éthique, de la logistique et d'autres facteurs. Dans ces recommandations, les groupes de risque et d'âge seront répartis dans divers groupes prioritaires au moyen des stratégies les plus efficaces, afin d'atteindre les objectifs de lutte contre la pandémie à l'échelle nationale. Les groupes doivent être définis en tenant compte du nombre de vaccins anticipés et pourraient devoir être modifiés si les prévisions des approvisionnements évoluent.
Il est essentiel que le processus d'élaboration des recommandations concernant la priorisation soit fondé sur des données probantes et suive les principes de prise de décision éclairée énoncés dans le PCGP. On s'attend à ce que le CCNI entreprenne l'exercice de priorisation avec l'aide d'autres experts (p. ex. généticiens, modélisateurs) et avec la participation d'intervenants, dont des représentants des PT, qui sont les mieux placés pour cerner les problèmes de logistique.
Rôle des autres vaccins - La pneumonie bactérienne secondaire causée par Streptococcus pneumoniae et par d'autres bactéries a été un grand problème au cours des dernières pandémies. Au cours de la phase interpandémique, il faut mettre l'accent sur le renforcement des programmes de vaccination systématique, particulièrement pour améliorer le taux de vaccination contre le pneumocoque dans les groupes courant un risque élevé, comme les enfants et les personnes âgées. Ces messages doivent également être renforcés aux premiers stades de la pandémie, puisque ces mesures peuvent réduire la fréquence et la gravité des cas de pneumonie bactérienne secondaire au cours de la pandémie.
Lorsqu'une pandémie est en cours, l'Organisation mondiale de la Santé (OMS) recommande aux fabricants de passer à la production de vaccins pandémiquesNote de bas de page 40. Si un vaccin contre la grippe saisonnière a déjà été produit, le CCNI utilisera une approche d'évaluation des risques pour déterminer s'il doit recommander l'utilisation de ce vaccin pendant la pandémie. Au cours des dernières pandémies, dont celle de 2009, le nouveau virus pandémique a rapidement remplacé les autres souches de virus de la grippe en circulation. Dans ces circonstances, l'administration du vaccin antigrippal saisonnier en plus de celle du vaccin contre la grippe pandémique ne procurerait aucun bienfait supplémentaire et son administration pourrait accaparer des ressources utiles.
3.5.4 Attribution, distribution et entreposage des vaccins
Le fabricant et SC fourniront des estimations préliminaires du moment de la mise en circulation du vaccin et des quantités distribuées. Ces estimations peuvent changer considérablement au cours de la fabrication et du processus réglementaire.
Plan d'attribution des vaccins - En vue de la distribution des vaccins, un plan d'attribution sera préparé par le Groupe de travail FPT sur l'approvisionnement en vaccins, selon le protocole d'approvisionnement en vaccins du Conseil du Réseau pancanadien de santé publique. Comme ce fût le cas lors de la pandémie de 2009, le point de départ de l'attribution sera une distribution aux provinces et aux territoires en fonction du nombre d'habitants, en commençant par les premiers lots disponibles et en poursuivant ainsi pendant toute la durée du processus de fabrication et de distribution du vaccin. Les autres facteurs à prendre en considération sont la taille des groupes prioritaires, car ceux-ci peuvent représenter une proportion considérablement élevée de la population dans certains territoires et certaines provinces, ainsi que la logistique de distribution des vaccins dans les collectivités éloignées et isolées.
La distribution équitable du vaccin pandémique aux PT et aux autres fournisseurs du gouvernement doit commencer aussitôt que le vaccin est disponible. Le vaccin sera expédié directement par le fabricant à de multiples points de livraison dans l'ensemble du Canada, conformément au plan d'attribution.
Entreposage et manipulation des vaccins - Une attention toute particulière doit être accordée aux exigences relatives à la préservation de la chaîne du froid lors de la distribution et de l'entreposage des vaccins. Les administrations doivent s'assurer qu'elles possèdent les capacités requises et que les procédures adéquates de préservation de la chaîne du froid ont été mises en place en confirmant qu'elles disposent d'un espace suffisant dans des réfrigérateurs à vaccins désignés, en procédant à un entretien régulier de l'équipement et en examinant les procédures de transport des vaccins vers les cliniques périphériques. Si les vaccins doivent être fournis à des praticiens de la communauté ou à des établissements de soins de santé, les procédures d'entreposage et de manipulation doivent également être conformes. Il faut prendre les mesures nécessaires pour assurer la sécurité physique des vaccins à tous les stades de la livraison et de l'entreposage des vaccins.
Pour obtenir de plus amples renseignements sur l'entreposage et la manipulation, consultez le document qui suit :
Lignes directrices nationales sur l'entreposage et la manipulation des vaccins pour les vaccinateurs.
Il est essentiel d'assurer une gestion des stocks pour maximiser les stocks de vaccins disponibles et anticiper les besoins futurs. En connaissant avec exactitude et en temps réel les quantités de vaccins en stock, on peut ajuster au besoin les envois de vaccins ou les calendriers des cliniques. Le système d'inventaire doit permettre d'assurer un suivi des lots, puisqu'un problème d'innocuité pourrait entraîner une mise en quarantaine ou un rappel de lots particuliers. Des codes à barres sur les vaccins pourraient faciliter ce processus.
3.5.5 Administration des vaccins
L'administration des vaccins relève principalement des provinces et des territoires, mais certains ministères fédéraux (p. ex. le ministère de la Défense nationale, Affaires mondiales Canada, la DGSPNI de SC, Service correctionnel Canada) sont également responsables de l'administration des vaccins à leurs populations respectives. Au cours d'une pandémie, il est essentiel de pouvoir offrir des vaccins à toute la population aussi rapidement que possible, tout en faisant l'objet d'une surveillance étroite de la part des médias et du public. Pour être efficace, la mise en œuvre des campagnes de vaccination de masse doit être fondée sur des pratiques exemplaires et être préalablement soumise à des essais rigoureux. Les campagnes de vaccination contre la grippe saisonnière offrent chaque année l'occasion de planifier, de mettre en œuvre et d'évaluer les éléments et les stratégies de la vaccination de masse.
Il faut tirer parti de l'expertise en vaccination et des groupes existants pour offrir au gouvernement fédéral, aux provinces et aux territoires un forum de partage de l'information et de résolution des problèmes au cours des phases de planification et de mise en œuvre de la campagne de vaccination de masse en cas de pandémie.
Considérations relatives à la planification - Les PT dispensent leurs programmes de vaccination contre la grippe saisonnière de diverses manières, la plupart du temps en combinant des cliniques de santé publique communautaires, des cliniques en milieu scolaire et des programmes en milieu de travail, et en fournissant le vaccin à des cabinets de médecins, des centres de santé communautaires, des postes de soins infirmiers, des pharmacies, des hôpitaux et des centres de soins de longue durée. En partant du principe qu'il faut utiliser les systèmes établis, on peut tirer parti de ces campagnes saisonnières tout en incluant un grand nombre de cliniques de vaccination de masse organisées par les services de santé publique.
D'autres approches devraient être envisagées pour la prestation des programmes aux communautés éloignées et isolées, ou aux populations difficiles à atteindre comme les sans-abri, les immigrants ou les réfugiés, ou encore les personnes confinées à la maison (voir la section 2.4 pour obtenir plus de renseignements sur les populations vulnérables). On prévoit que les PT fourniront une orientation aux services de santé régionaux et locaux sur l'éventail de stratégies qui peuvent être utilisées pour offrir le vaccin pandémique au public.
Le vaccin antigrippal est habituellement administré par les infirmières en santé publique ou par les médecins et les infirmières exerçant dans le secteur des soins primaires. Un certain nombre de provinces ont autorisé l'élargissement du champ d'activité des pharmaciens pour qu'il inclut l'administration du vaccin contre la grippe. D'autres personnes pouvant administrer les vaccins, comme les ambulanciers paramédicaux, pourraient également assurer une capacité de mobilisation au cours de la campagne de vaccination de masse en cas de pandémie.
Les autres considérations relatives à la planification de la campagne de vaccination de masse en cas de pandémie comprennent ce qui suit :
- Les administrations doivent être prêtes à offrir une dose du vaccin à l'ensemble de leur population dans le mois qui suit la mise en circulation du vaccin.
- Les données historiques sur la pandémie de 2009 et sur les campagnes de vaccination contre la grippe saisonnière peuvent aider les administrations à estimer le taux de vaccination, mais ce taux peut être influencé par de nombreux facteurs, particulièrement les perceptions du public à l'égard des répercussions de la pandémie et de l'innocuité du vaccin. Une planification en fonction d'une limite supérieure moyenne de 75 % devrait être adéquate dans la plupart des régions, mais le taux de vaccination pourrait être plus élevé dans certains territoires de compétences ou dans certains milieux.
- On recommande de prévoir l'administration de deux doses pour s'assurer que les services de santé publique sont prêts à réagir à cette possibilité.
- Les provinces et les territoires devraient envisager ensemble l'élaboration de fiches d'information, de documentation sur le consentement éclairé et de directives médicales, en vue d'en assurer l'uniformité.
- Les administrations devraient recommander une approche standard de préparation du vaccin, en précisant notamment le moment du mélange de l'adjuvant et de l'antigène, si le produit doit être amené à la température ambiante avant l'administration, et les mesures de prévention des infections avec l'utilisation de flacons multidoses, en plus de s'assurer que les variations sur le plan de la pratique sont consignées.
- On recommande de déterminer le matériel requis dans le cadre du programme de vaccination et, s'il y a lieu, de constituer des réserves à l'avance afin de s'assurer d'avoir en main les quantités nécessaires. Les PT doivent être prêts à fournir du matériel de vaccination aux services de santé régionaux et locaux qui pourraient avoir des difficultés à se procurer ce matériel.
- Les PT doivent également déterminer les exigences en matière de ressources humaines et être prêts à mettre à exécution, s'il y a lieu, les accords d'aide mutuelle établis en vue d'intensifier la capacité de mobilisation des travailleurs de la santé.
- Les administrations peuvent envisager d'utiliser le système de gestion des incidents pour organiser et mettre en œuvre leurs campagnes de vaccination de masse.
- Dans le cadre de leurs stratégies de communication pour la campagne de vaccination de masse, les planificateurs peuvent envisager des approches spéciales s'adressant aux personnes réticentes face aux vaccins.
- Tout employé d'un service de santé publique qui pourrait être appelé à participer à l'effort de vaccination pendant une pandémie devrait recevoir une formation et avoir l'occasion de mettre en pratique ses compétences chaque année.
Ressources utilisées dans le cadre de la planification des campagnes - Un guide de planification complet des cliniques de vaccination de masse est fourni à l'appendice B de la présente annexe. Les autres ressources utiles sont les lignes directrices des Centers for Disease Control and Prevention pour la vaccination de masse pendant les éclosions de maladies transmissiblesNote de bas de page 41, les analyses des stratégies utilisées pendant la campagne de vaccination de la pandémie de 2009Note de bas de page 42 Note de bas de page 43 et les examens des facteurs associés au taux de vaccination par le vaccin pandémiqueNote de bas de page 44 Note de bas de page 45 Note de bas de page 46.
Voici quelques pratiques exemplaires se rapportant aux campagnes de vaccination de masse :
- planification détaillée et mise à l'essai rigoureuse de tous les aspects;
- centralisation de l'achat du matériel de vaccination et de respect de la chaîne du froid, et mise en place préalable du matériel;
- centralisation des fiches d'information et des outils de formation;
- campagne de marketing crédible utilisant tous les types de médias (y compris les médias sociaux);
- transmission efficace de l'information sur l'innocuité du vaccin;
- partenariats efficaces et participation des groupes d'intervenants (p. ex. les Premières nations);
- disponibilité du vaccin à plus d'un endroit (notamment dans les cabinets de médecins, les écoles, les pharmacies, les cliniques de santé communautaires et les lieux de travail) et à différents moments, y compris les soirs et les fins de semaine;
- renforcement des effectifs et recours à des bénévoles; flexibilité pour permettre l'ajustement du personnel au besoin;
- utilisation de diverses stratégies de gestion du temps d'attente (p. ex. bracelets, système de rendez-vous, mises à jour dans les médias sociaux);
- utilisation d'un système de gestion de l'inventaire biologique, avec codes à barres;
- rapports sur les taux de vaccination par âge et par groupe cible.
3.5.6 Innocuité du vaccin
En raison de l'envergure de la campagne de vaccination en cas de pandémie, il faut porter une attention particulière à l'innocuité du vaccin afin de réduire les risques au minimum et d'optimiser les bienfaits du vaccin contre la grippe pandémique. Dans le cas d'un nouveau vaccin, les études de précommercialisation ne peuvent pas détecter tous les ESSI possibles, particulièrement s'ils sont très rares. Par conséquent, une surveillance rapide et continue est essentielle pour détecter les signes indiquant un problème d'innocuité et intervenir rapidement.
L'approche à l'égard de l'innocuité du vaccin contre la grippe pandémique repose sur l'infrastructure et sur les systèmes déjà en place pour assurer la surveillance du vaccin contre la grippe saisonnière et les autres vaccins. La surveillance des ESSI est assurée par l'ASPC et par SC, en collaboration avec les partenaires PT et d'autres intervenants clés. Pour obtenir une description détaillée du réseau de surveillance de l'innocuité des vaccins du Canada, consultez le Guide canadien d'immunisation. Toutefois, vous trouverez ci-dessous une description des principaux éléments concernant l'innocuité du vaccin dans le contexte d'une pandémie.
Le Groupe de travail FPT sur la vaccinovigilance est un réseau national sur la sécurité qui compte des représentants des programmes de vaccination de toutes les provinces et de tous les territoires, du gouvernement fédéral, du réseau du programme IMPACT (Programme canadien de surveillance active de l'immunisation) et d'autres organisations. Le Groupe de travail sur la vaccinovigilance joue un rôle important pour assurer l'innocuité des vaccins au cours de la pandémie en assurant un partage et une diffusion rapide de l'information aux intervenants concernés concernant les questions ou les signes indiquant un problème d'innocuité.
En dépit de toutes les connaissances acquises sur le produit avant sa commercialisation, la surveillance post-commercialisation de l'innocuité des vaccins est essentielle pour recueillir les déclarations d'ESSI graves ou inattendus. Cette information est utilisée pour évaluer les vaccins et prendre éventuellement des dispositions réglementaires, s'il y a lieu. Plusieurs mécanismes permettent d'assurer la surveillance de l'innocuité des vaccins contre la grippe pandémique et la recherche post-commercialisation :
- Le Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) est un système FPT de surveillance post-commercialisation de l'innocuité des vaccins, administré par l'ASPC et comportant des processus spontanés, améliorés et actifs de déclaration des ESSI. Au cours d'une pandémie, ce système de surveillance servira à recevoir les déclarations d'ESSI aux fins de détection des signes indiquant un problème d'innocuité, d'analyse et de production de rapports.
- Le programme IMPACT est un réseau déployé dans les hôpitaux pédiatriques et administré par la Société canadienne de pédiatrie. Le programme IMPACT assure une surveillance syndromique active et ciblée des ESSI qui sont considérés comme ayant une importance particulière. Selon les besoins, il peut ajouter des cibles concernant la souche et la préparation de vaccin de la grippe pandémique. Le programme assure également une surveillance à l'échelle nationale des échecs vaccinaux et de certaines maladies évitables par la vaccination chez les enfants.
- Le Programme Canada Vigilance de SC recueille et évalue les déclarations d'effets indésirables soupçonnés d'être associés à des produits de santé commercialisés au Canada, y compris les vaccins. Les fabricants sont tenus de signaler les ESSI graves survenus au Canada, ainsi que les effets indésirables graves et inattendus survenus à l'échelle internationale.
Au cours d'une pandémie, il est essentiel que les renseignements sur les ESSI soient transmis rapidement à l'ASPC, qui regroupera les rapports dans une base de données nationale en accordant la priorité aux événements graves. Les signes indiquant un problème d'innocuité des vaccins qui pourraient figurer dans les rapports sur les ESSI sont par exemple l'augmentation de la fréquence ou de la gravité des événements connus comme étant attribuables au vaccin antigrippal (p. ex. les réactions allergiques ou le SGB) ou des événements indésirables dont les liens étaient auparavant inconnus (p. ex. la narcolepsie). Les signes sont étudiés pour permettre d'en déterminer les causes et, s'il y a lieu, de prendre les mesures nécessaires (p. ex. mise à jour de la monographie du produit, rappel par SC d'un lot de vaccins ou révision des recommandations sur le vaccin). Les principaux besoins en matière de surveillance de l'innocuité des vaccins et d'évaluation des déclarations de cas sont notamment des protocoles permettant de mener rapidement des enquêtes sur le terrain, des ressources analytiques et une connaissance des taux de référence des effets indésirables potentiels afin de les comparer à ceux qui sont observés.
Le Réseau canadien de recherche sur l'immunisation (RCRI), qui regroupe des chercheurs et des établissements canadiens de pointe dans le domaine de la vaccination, est issu de l'ASPC et du Réseau de recherche sur l'influenza des Instituts de recherche en santé du Canada. L'une des initiatives du RCRI en matière d'innocuité des vaccins est le Réseau national canadien d'évaluation de la sécurité des vaccins, qui a été créé pour évaluer l'innocuité des vaccins immédiatement après la mise en œuvre des campagnes annuelles de vaccination contre la grippe, mais qui s'applique également à la grippe pandémique et aux autres vaccins. Une autre initiative du RCRI en matière d'innocuité des vaccins est le Réseau de cliniques de vaccination spéciales, qui fait appel à des cliniques dans plusieurs provinces pour examiner et prendre en charge les patients présentant des ESSI ou d'autres affections sous-jacentes qui pourraient constituer une contre-indication à la vaccination.
Voici quelques pratiques exemplaires se rapportant à la surveillance des ESSI :
- affecter un coordonnateur de l'innocuité des vaccins à chaque province et chaque territoire;
- désigner une personne comme responsable des problèmes d'innocuité des vaccins dans chaque bureau régional ou local de santé publique;
- établir des critères de déclaration, des protocoles, des indicateurs de qualité et des formations dans chaque province ou territoire;
- établir une capacité de tenue des documents électroniques et de transfert des données;
- faire de la déclaration des ESSI une obligation juridique dans le territoire de compétence;
- établir des ententes sur le partage des données à l'échelle FPT.
3.5.7 Surveillance des taux de vaccination et de l'efficacité du vaccin
Les leçons tirées de la pandémie de 2009 (qui sont décrites à la section 2.3.2) ont révélé la nécessité de mettre en place, dans tous les territoires de compétence, des systèmes électroniques intégrés de gestion de l'information sur la vaccination, dont des registres d'immunisation, afin d'assurer, en temps opportun, un suivi des stocks de vaccins et une surveillance du taux de vaccination par catégorie de risque et par groupe d'âge. Ces systèmes devraient être mis en œuvre au cours de la période interpandémique, puisqu'ils sont utiles tant dans le cadre du programme continu qu'au cours des interventions d'urgence.
Des travaux sont en cours en vue d'élaborer un réseau national de registres d'immunisation. À l'heure actuelle, chaque province et chaque territoire administre son propre système de suivi de la couverture vaccinale à l'aide de bases de données électroniques, de systèmes sur papier ou d'une combinaison des deux. À l'échelle nationale, l'ASPC surveille le taux de vaccination contre la grippe saisonnière au moyen d'une enquête sur la couverture vaccinale et analyse les données recueillies au moyen de l'Enquête sur la santé dans les collectivités canadiennes.
Le Réseau canadien des registres d'immunisation FPT et le Réseau de couverture vaccinale du Comité canadien sur l'immunisation sont les mieux placés pour faciliter la collecte des données et la communication de l'ensemble des rapports sur les taux de vaccination en cas de pandémie.
Pour assurer la surveillance du taux de vaccination, il faut déterminer les éléments de données clés, comme les groupes d'âge, de genre et de risque, et recueillir tous les renseignements pertinents auprès des personnes vaccinées, y compris celles qui ont été immunisées par des fournisseurs de soins de santé du secteur privé. Cette information doit être regroupée rapidement, puis analysée. Le suivi du taux de vaccination permet aux autorités locales de santé publique de s'assurer que ce taux est conforme aux attentes et de déterminer rapidement la couverture vaccinale dans une province ou un territoire, et finalement, à l'échelle du Canada. Si le taux de vaccination n'est pas conforme aux attentes, des stratégies ou des efforts promotionnels supplémentaires pourraient être nécessaires, destinés à la population dans son ensemble ou à des groupes cibles précis. Les résultats peuvent également mener à un ajustement des recommandations concernant la priorisation si le taux de vaccination est considérablement inférieur ou supérieur au taux projeté.
La surveillance de l'efficacité du vaccin contre la grippe saisonnière s'effectue de plusieurs façons. Actuellement au Canada, divers réseaux mènent des enquêtes annuelles sur l'efficacité du vaccin contre la grippe dans les milieux hospitaliers et les milieux communautaires. Seul un certain nombre de provinces participent à ces enquêtes. Ces systèmes de surveillance sont bien placés pour fournir de l'information sur l'efficacité du vaccin pandémique. Il pourrait également être souhaitable de mener des études spéciales dans des populations particulières au cours de la pandémie.
3.6 Approche de gestion des risques
3.6.1 Aperçu
La gestion des risques est une approche systématique permettant d'établir le meilleur plan d'action possible dans un environnement incertain, en déterminant, en évaluant et en communiquant les risques et en prenant les mesures qui s'imposent.Compte tenu des incertitudes inhérentes à la stratégie de vaccination en cas de pandémie, l'approche de gestion des risques fournit un cadre utile aux fins de la planification et de l'intervention en cas de pandémie, tout en soutenant les principes et les approches de planification du PCGP. Le PCGP propose d'utiliser des hypothèses et des scénarios de planification comme outils de planification de la gestion des risques.
Les hypothèses de planification de la stratégie de vaccination en cas de pandémie ont été décrites à la section 3.3, tandis que les scénarios de planification sont décrits à la prochaine section.
3.6.2 Considérations liées à la gestion des risques dans le cadre de la stratégie de vaccination en cas de pandémie
Pendant une pandémie, le vaccin sera offert à l'ensemble de la population canadienne, indépendamment des répercussions de cette pandémie. Toutefois, on s'attend à ce que le niveau de répercussions de la pandémie influence la perception du public et la demande à l'égard du vaccin. Le tableau 1 décrit les implications possibles de pandémies ayant des répercussions variées sur la stratégie de vaccination en cas de pandémie, au moyen des quatre scénarios de planification décrits dans le PCGP.
Le tableau n'indique pas dans quelle mesure il est urgent de fournir le vaccin à la population, puisque ce facteur dépend principalement du moment où la prochaine vague pandémique est attendue par rapport à la disponibilité du vaccin, plutôt que du niveau de répercussions de la pandémie. Il est à prévoir que les communications sur le programme de vaccination en cas de pandémie devront être revues en fonction des répercussions de chaque scénario.
| Transmission | Gravité clinique | |
|---|---|---|
| Faible | Élevée | |
Élevée |
Scénario B
|
Scénario D
|
Faible |
Scénario A
|
Scénario C
|
La stratégie de vaccination en cas de pandémie comporte de nombreux risques, dont la possibilité qu'il n'y ait aucun vaccin. Des efforts considérables ont été déployés pour cerner et atténuer ces risques, avec notamment l'établissement d'un contrat d'approvisionnement de secours en vaccins pandémiques. Le tableau 2 décrit les risques et les événements qui pourraient avoir des répercussions sur la stratégie de vaccination, leurs répercussions, ainsi que les réponses et les mesures d'atténuation possibles si le risque ou l'événement se produit. Il faut prendre note que des communications ouvertes, transparentes et en temps opportun avec les fournisseurs de soins de santé et le grand public doivent faire partie intégrante de l'intervention en réponse à chacun des facteurs ou événements mentionnés ci-dessous.
| Facteur/événement | Implications | Mesure d'atténuation/réponse possible |
|---|---|---|
| Approvisionnement en vaccins | ||
Problèmes de production (p. ex. souche d'origine) |
|
|
Problèmes liés à l'approvisionnement à l'échelle mondiale |
|
|
Problèmes liés à la mise en circulation des lots. |
|
|
Problèmes liés à la distribution et à l'entreposage, y compris les ruptures de la chaîne du froid |
|
|
| Questions liées aux délais | ||
Une vague pandémique est imminente ou en cours lorsque le vaccin devient disponible. |
|
|
La production du vaccin contre la grippe saisonnière est en cours ou terminée. |
|
|
| Facteurs de risque liés à la population | ||
Mise en évidence de nouveaux facteurs de risque de maladie grave |
|
|
Certains milieux ou certaines régions du pays sont touchés beaucoup plus tôt et beaucoup plus gravement que d'autres. |
|
|
| Immunogénicité et efficacité | ||
Le vaccin est peu immunogène pour certains ou la totalité des sujets vaccinés. |
|
|
La dérive antigénique réduit le taux prévu d'efficacité du vaccin. |
|
|
Interaction avec le vaccin saisonnier. |
|
|
| Innocuité des vaccins | ||
Des préoccupations relatives à l'innocuité du vaccin émergent au Canada. |
|
|
Des préoccupations relatives à l'innocuité du vaccin émergent dans d'autres pays. |
|
|
Des événements accidentels se produisent chez des personnes ayant reçu le vaccin. |
|
|
Rumeurs et rapports concernant des réactions indésirables inattendues. |
|
|
| Opinion publique et perception du risque | ||
Innocuité du vaccin |
|
|
Couverture médiatique (p. ex. signalement de cas graves) |
|
|
| Considérations à l'échelle internationale | ||
Stratégies de vaccination, préparations vaccinales ou disponibilité des vaccins différentes aux États-Unis et dans d'autres pays. |
|
|
3.7 Décisions clés et facteurs de déclenchement
Le tableau 3 décrit les décisions clés qui doivent être prises pour mettre en œuvre un programme de vaccination en cas de pandémie, ainsi que les facteurs de déclenchement qui s'y rapportent. Certaines décisions doivent être prises tôt, comme celles concernant la commande préliminaire de vaccins pour le Canada et les exigences liées aux études cliniques. La période de quatre à six mois pendant laquelle le vaccin pandémique est produit offre une excellente occasion de finaliser la préparation des campagnes de vaccination à grande échelle, afin qu'elles puissent être rapidement mises en œuvre une fois le vaccin disponible.
Les recommandations concernant l'utilisation et la priorisation des vaccins doivent également être préparées pendant cette période; cependant, les données nécessaires pour les finaliser ne seront disponibles que beaucoup plus tard. Il faut prendre note que des communications avec le grand public et les travailleurs de la santé au sujet du programme de vaccination en cas de pandémie et de sa mise en œuvre sont nécessaires à tous les stades.
| Facteur de déclenchement/étape | Décision clé/activité | Facteurs à considérer |
|---|---|---|
Nouveau virus détecté quelque part dans le monde |
Commencer à développer une souche de semence et des réactifs. |
|
Détection d'un nouveau virus avec transmission soutenue chez l'homme |
Arrêter la fabrication du vaccin saisonnier et commencer la fabrication du vaccin pandémique. |
|
À l'intérieur d'un certain nombre de semaines après la déclaration de la pandémie (conformément au d'approvisionnement en vaccins) |
Indiquer la commande préliminaire de vaccins pour le Canada, puis la commande de vaccins finale. Déterminer l'opportunité d'un achat dans le cadre d'un contrat d'approvisionnement de secours ainsi que les quantités à acheter. |
|
Au cours du processus de production du vaccin pandémique |
Aviser le fabricant des exigences des essais cliniques. |
|
Examiner et améliorer (s'il y a lieu) le plan de surveillance de l'innocuité des vaccins. |
|
|
Élaborer ou revoir le plan d'attribution des vaccins. |
|
|
Élaborer des recommandations sur l'utilisation du vaccin. |
|
|
Élaborer des recommandations sur la priorisation. |
|
|
Finaliser les plans en vue des campagnes de vaccination. |
|
|
Le vaccin pandémique est produit et répond aux critères réglementaires |
Autoriser la mise en circulation du vaccin pandémique. Surveillance continue de la qualité du vaccin par l'entremise du programme d'autorisation de mise en circulation d'un lot de vaccins de SC. |
|
Commencer la distribution du vaccin aux PT. |
|
|
Examiner le plan de priorisation pour s'assurer qu'il correspond aux stocks anticipés (activité récurrente tout au long de la campagne). |
|
|
Début des programmes de vaccination des PT. |
|
|
Pendant et après les campagnes de vaccination |
Surveiller l'administration, l'innocuité et l'efficacité du vaccin. |
|
Signe de problème d'innocuité détecté |
Enquêter sur les signes indiquant un problème d'innocuité et prendre les mesures nécessaires. |
|
4.0 Intégration à d'autres éléments de l'intervention
4.1 Surveillance, y compris les interventions en laboratoire
Des données de surveillance opportunes sur la maladie sont nécessaires pour prendre des décisions sur le vaccin pandémique, particulièrement en ce qui concerne l'élaboration de recommandations sur l'utilisation et la priorisation des stocks de vaccins initiaux. L'ASPC sera responsable de recueillir et d'analyser les données de surveillance venant de tout le Canada et d'autres pays afin de produire des évaluations des risques et de fournir des données de surveillance opportunes et pertinentes aux décideurs des programmes de vaccination.
Les données de surveillance qui seront prises en compte dans le cadre du processus décisionnel concernant le vaccin pandémique comprennent les suivantes :
- estimation préliminaire des paramètres épidémiologiques et des répercussions potentielles de la pandémie;
- données soutenant l'élaboration de recommandations sur la priorisation et l'utilisation des vaccins :
- indicateurs de la transmissibilité et de la gravité de la maladie clinique;
- taux d'infection, de cas graves et de décès (par âge et par groupe de risque) et risque de cas graves dans la population touchée;
- facteurs de risque de maladie grave, d'hospitalisation et de décès (y compris dans les milieux où le risque est accru); proportion de cas graves parmi les personnes avec et sans problème de santé sous-jacent;
- études sur la séroprévalence selon l'âge pour détecter une immunité préexistante de la population (initialement) et évaluer l'immunité de la population à mesure que la pandémie et les campagnes de vaccination progressent;
- prédiction de l'activité de la vague pandémique;
- taux de vaccination par groupe d'âge et de risque à mesure que la campagne progresse.
La surveillance en laboratoire, qui sera assurée par le Laboratoire national de microbiologie et par d'autres laboratoires de santé publique, permettra de soutenir le programme de vaccination en cas de pandémie par les moyens suivants :
- surveillance continue des souches de grippe afin de déceler les dérives antigéniques qui pourraient réduire l'efficacité du vaccin;
- soutien du laboratoire dans le cadre des études sur l'efficacité du vaccin.
4.2 Communications
Les communications sur le vaccin se sont avérées être l'un des aspects les plus problématiques de l'intervention lors de la pandémie de 2009. Une amélioration des stratégies de communication à partir des leçons tirées de cette expérience devrait permettre d'accroître la confiance du public, ce qui favorisera le taux de vaccination.
Bien que tous les ordres de gouvernement prennent part aux communications sur les vaccins, il est important que les messages soient coordonnés et cohérents. Les réseaux FPT établis, dont le groupe de communications du Réseau de santé publique, seront mis à profit pour coordonner l'intervention de communication, notamment sur les questions relatives au vaccin pandémique. Le gouvernement fédéral s'occupera du programme en général ainsi que des questions de réglementation et d'innocuité. Les PT se concentreront sur les campagnes de vaccination dans leurs propres territoires de compétence, tandis que les services de santé régionaux et locaux fourniront des renseignements à l'échelle locale.
Il est important de favoriser la participation des décideurs en santé publique au cours de la période interpandémique afin de promouvoir 1) leur opinion sur la vaccination en tant que pilier d'une intervention efficace en cas de pandémie et 2) les exigences associées à l'intervention de vaccination de masse. Ces connaissances pourront, à leur tour, favoriser une prise de décision rapide pendant la pandémie.
Communications publiques - Les campagnes de vaccination contre la grippe saisonnière offrent l'occasion de renseigner le public sur les bienfaits de la vaccination et d'accroître l'acceptation du vaccin en cas de pandémie. Les leçons tirées de la pandémie de 2009 s'appliquent tant au contenu qu'à l'utilisation de stratégies de communication efficaces. Comme le décrit l'Annexe sur les communications du PCGP, des stratégies efficaces sont nécessaires pour communiquer le risque et modifier les recommandations. Les éléments clés d'une communication efficace du risque comprennent la transparence, la coordination et la collaboration des intervenants, les messages sur le risque fondés sur des données probantes qui abordent les incertitudes et motivent les actions personnelles, et les stratégies flexibles qui répondent à la perception du risque dans la population.
L'information sur le vaccin pandémique (p. ex. fabricant, réglementation) doit être fournie dès le début de la pandémie. Il faut communiquer efficacement le risque lié à l'infection par le virus de la grippe et les bienfaits associés à la vaccination. Il est important de fournir des renseignements détaillés sur l'innocuité du vaccin et de contrer rapidement et agressivement la désinformation sur le vaccin. Il est également important de planifier des communications au cas où des signes indiquant un problème d'innocuité des vaccins seraient décelés au Canada ou dans un autre pays.
Les messages sur la disponibilité du vaccin et l'admissibilité constituent un défi, puisque l'information qu'ils contiennent est complexe et peut être amenée à changer. Il est important de communiquer clairement que bien que l'objectif soit d'offrir le vaccin à l'ensemble de la population canadienne, celui-ci sera offert graduellement, ce qui nécessitera une distribution par ordre de priorité. Il faut diffuser des communications claires quant aux endroits où se procurer le vaccin légitime contre la grippe pandémique et aborder les allégations d'efficacité contre le virus de la grippe pandémique associées à tout autre produit de remplacement.
Plusieurs stratégies doivent être utilisées pour fournir des renseignements sur le vaccin, dont le recours aux médias traditionnels et sociaux. Des approches personnalisées pourraient être nécessaires dans les populations vulnérables, comme la communication de l'information dans plusieurs langues, ainsi que l'utilisation du Braille pour les personnes ayant une déficience visuelle et de la synthèse texte-parole pour les personnes ayant une déficience auditive. On peut demander l'aide des leaders de la communauté pour communiquer des renseignements exacts et promouvoir le programme de vaccination. Les intervenants peuvent prendre part au processus afin d'adapter le matériel et les stratégies de communication en fonction des auditoires cibles.
Communications avec le secteur des soins de santé - Qu'ils soient responsables d'administrer le vaccin ou non, les travailleurs de la santé jouent un rôle important dans l'acceptation du vaccin par le public. Il est important de s'assurer que la communauté des soins de santé est bien informée, en se servant de sources et de réseaux de confiance et en fournissant des mises à jour aux travailleurs de la santé avant d'informer le grand public. L'un des défis réside dans la communication du message sur la flexibilité, puisque les recommandations peuvent changer au fil du temps à mesure que d'autres renseignements deviennent disponibles. Il faut justifier les recommandations sur la priorisation des vaccins pandémiques ainsi que les recommandations qui diffèrent de celles des autres pays (particulièrement les États-Unis) ou de celles sur le vaccin contre la grippe saisonnière. De même, toute adaptation des recommandations nationales par une province ou un territoire doit être clairement expliquée aux praticiens dans le territoire de compétence concerné.
La communication des renseignements sur les vaccins au secteur de la santé est une responsabilité partagée. L'information fournie sur les sites Web doit comprendre des liens vers de l'information à l'échelle nationale sur le vaccin pandémique, comme le processus réglementaire, l'innocuité du vaccin, le plus récent dépliant sur le produit et les recommandations nationales en matière de vaccination, notamment celles sur la priorisation. Les PT doivent transmettre aux fournisseurs de vaccins dans leur territoire de compétence de l'information sur la campagne de vaccination en cas de pandémie, y compris sur les modifications apportées aux recommandations nationales. Les autorités régionales et locales de santé publique peuvent contribuer à ce que l'information et les lignes directrices soient transmises aux travailleurs de la santé locaux et que ces travailleurs reçoivent de l'information sur la campagne de vaccination locale.
5.0 Recherche
Les recherches continues visant à mettre au point des vaccins antigrippaux plus efficaces et à déterminer le moyen le plus efficace pour les déployer profiteront à la stratégie de vaccination en cas de pandémie. Beaucoup de travaux peuvent être accomplis pendant la période interpandémique, mais il faut également se préparer pour être en mesure de mener des recherches rapidement au moment de la pandémie afin d'éclairer la prise de décision et l'évaluation post-pandémie.
Infrastructure et logistique - Les diverses recherches menées par le RCRI, comme des essais cliniques rapides et des études sur l'innocuité et l'efficacité du vaccin, serviront à mettre au point une méthodologie qui pourra être utilisée en cas de pandémie. Les autres organisations canadiennes qui contribuent à la recherche sur la grippe et les pandémies sont le Centre d'évaluation des vaccins de la Colombie-Britannique, le Centre canadien de vaccinologie, les organismes de santé publique provinciaux de la Colombie-Britannique, de l'Ontario et du Québec, ainsi que des établissements cliniques et universitaires.
Une attention particulière doit être accordée à la planification préalable des recherches qui seront menées durant une pandémie, notamment en ce qui concerne l'élaboration de protocoles détaillés et l'approbation préalable par les comités d'éthique de la recherche pertinents, la négociation de contrats entre les commanditaires des essais et les centres participant à la recherche proposée, la formation du personnel clé et l'élaboration de méthodes fiables de gestion de la logistique et des données. Bien que l'approbation des essais cliniques ne pourra être accordée avant la survenue d'une pandémie, les chercheurs peuvent rencontrer les évaluateurs de SC afin de discuter des plans du protocole d'essai clinique. L'élaboration de registres d'immunisation reliés aux bases de données administratives dans toutes les provinces et tous les territoires permettrait d'améliorer grandement la capacité d'effectuer des recherches dans la population et d'évaluer les programmes de vaccination.
Besoins en matière de recherche - Pour être efficace, l'intervention en cas de pandémie devra être éclairée par des recherches se rapportant à l'amélioration des vaccins et des méthodes de production, aux méthodes d'évaluation de l'immunogénicité, de l'innocuité et de l'efficacité, aux stratégies de déploiement optimal des vaccins et à la recherche comportementale dans le but d'améliorer le taux de vaccination. Ces besoins sont décrits plus en détail ci-dessous :
- études définissant les indicateurs immunologiques de la protection (immunité humorale et à médiation cellulaire) après la vaccination, afin de guider la mise au point et l'évaluation des vaccins;
- mise au point de nouvelles technologies vaccinales et de méthodes de production plus rapides;
- mise au point de vaccins plus efficaces et d'un vaccin « universel »;
- mise au point et évaluation de prototypes de vaccins chez les animaux et les humains avant la survenue d'une pandémie pour mieux comprendre les schémas posologiques assurant une réponse protectrice, y compris l'efficacité de la « sensibilisation » au moyen d'un prototype de vaccin pandémique;
- mise au point et mise à l'essai de méthodes adéquates fondées sur la population permettant une évaluation rapide du taux de vaccination ainsi que de l'efficacité et de l'innocuité du vaccin après la mise en circulation d'un vaccin pour la population générale;
- utilisation d'une modélisation mathématique pour déterminer les stratégies les plus efficaces pour déployer le vaccin pandémique lorsqu'il est mis en circulation, en tenant compte d'un éventail de populations et de situations;
- recherches et stratégies comportementales afin d'améliorer le taux de vaccination dans les populations ciblées, dont les travailleurs de la santé;
- études visant à améliorer l'efficacité des campagnes de vaccination rapides et de grande envergure.
Développement et application des connaissances - Le processus d'application des connaissances comprend un certain nombre d'étapes : synthèse des résultats de recherche, diffusion de l'information auprès des publics appropriés au moyen de messages et de médias adaptés et interaction entre les utilisateurs des connaissances et le chercheur se soldant par un apprentissage mutuel et une application éthiquement saine des connaissancesNote de bas de page 47. La prise de décision fondée sur des données probantes exige de solides stratégies d'application des connaissances pour faire en sorte que les résultats des recherches soient pris en compte dans le processus décisionnel sur la vaccination en cas de pandémie.
Pour faciliter le processus d'application des connaissances, le CCNI examinera les documents relatifs aux études portant sur les vaccins et d'autres renseignements relatifs à la pandémie pour soutenir l'élaboration de recommandations sur l'utilisation du vaccin contre la grippe pandémique. Les processus permettant un examen rapide et une diffusion des résultats des nouvelles recherches liées aux vaccins pendant une pandémie doivent être établis au cours de la période interpandémique.
6.0 Mesure et évaluation
Les campagnes de vaccination contre la grippe saisonnière offrent chaque année des occasions de mettre en pratique de nombreux aspects d'un programme de vaccination à grande échelle. Par exemple, les provinces et les territoires peuvent vérifier la rapidité de distribution des vaccins et du matériel, alors que les autorités locales peuvent faire appel à leurs mécanismes de gestion des urgences sanitaires pour organiser le processus de la clinique. Les stratégies relatives aux cliniques de vaccination de masse, y compris les approches de gestion des temps d'attente, doivent être mises à l'essai et améliorées.
Après la pandémie, le programme de vaccination doit être évalué de manière approfondie par chaque administration, puis comparé afin de déterminer les leçons à en tirer et les pratiques exemplaires. L'évaluation doit comprendre ce qui suit :
- Documentation de toutes les activités entreprises, y compris les stratégies de vaccination et de communication.
- Taux de vaccination par groupe d'âge et de risque, y compris pour les travailleurs de la santé.
- Fréquence des événements indésirables.
- Recherche sur l'opinion publique et sondages auprès de groupes cibles.
- Études sur l'efficacité des vaccins.
- Incidence sur les programmes de vaccination systématique.
Appendice A - Cadre de priorisation des vaccins pandémiques
1.0 Introduction
Le Canada a conclu des contrats d'approvisionnement avec les fabricants de vaccins afin d'offrir le vaccin contre la grippe pandémique à l'ensemble de la population canadienne en cas de pandémie. Le vaccin sera offert graduellement et les stocks initiaux seront probablement insuffisants pour permettre d'offrir le vaccin à toute la population dès le départ, bien qu'il devrait finalement y en avoir suffisamment pour tous. Des recommandations sur la priorisation des vaccins à l'échelle nationale seront nécessaires pour gérer cette situation initiale d'une manière juste et équitable.
Le Cadre de priorisation des vaccins pandémiques fournit une orientation aux personnes responsables de l'élaboration des recommandations concernant la priorisation des vaccins pandémiques. Il est fondé sur le cadre d'Erickson et De WalsNote de bas de page 48, qui est bien connu des planificateurs de la santé publique au Canada. Le Cadre offre une structure ordonnée permettant d'examiner toutes les données scientifiques pertinentes, tout en tenant compte des considérations d'ordre éthique et logistique, ainsi que d'autres facteurs. Le Cadre a été utilisé avec succès pour élaborer des lignes directrices de séquençage pour le déploiement du vaccin pandémique, à l'automne 2009. Cette version mise à jour conserve le cadre de base et en élargit l'application en se fondant sur l'expérience vécue lors de la pandémie de 2009.2.0 Cadre de priorisation des vaccins pandémiques
Le Cadre de priorisation des vaccins pandémiques consiste en une série de critères organisés par catégories, accompagnés de questions clés (consultez le tableau A1). Bien que le cadre repose sur des preuves scientifiques, tous les critères sont pertinents dans le cadre du processus d'élaboration des recommandations.
| Catégorie | Critères | Questions clés |
|---|---|---|
1. Preuves scientifiques |
a. Caractéristiques et fardeau de la maladie |
|
b. Caractéristiques du vaccin |
|
|
2. Considérations d'ordre éthique |
Considérations d'ordre éthique |
|
3. Enjeux liés au programme |
a. Stratégies d'immunisation |
|
b. Logistique |
|
|
c. Acceptabilité du programme |
|
|
4. Autres facteurs stratégiques à prendre en considération |
a. Considérations d'ordre juridique |
|
b. Conformité des programmes |
|
|
c. Considérations d'ordre politique |
|
3.0 Considérations relatives à la priorisation des vaccins pandémiques
L'élaboration de recommandations concernant la priorisation des vaccins pandémiques est un processus parfois complexe. Le processus commence en prenant en considération les preuves liées à chacun des critères du cadre de priorisation et aux questions clés associées (tableau A1). Les objectifs canadiens en cas de pandémie fournissent une direction claire quant aux choix qui doivent être faits dans le cadre du processus de priorisation. La considération des principes et des valeurs éthiques et la compréhension des valeurs du public et des intervenants sont également utiles lorsque vient le temps de soupeser d'autres options.
Les besoins potentiels en matière de données et de renseignements pour chacun des critères sont décrits à l'appendice A1 et font l'objet d'une discussion plus approfondie aux sections qui suivent, qui correspondent aux critères du cadre de priorisation.
3.1 Preuves scientifiques
3.1.1 Caractéristiques et fardeau de la maladie (épidémiologie de la pandémie)
La connaissance de l'épidémiologie de la pandémie et du fardeau de la maladie est le plus important facteur à prendre en compte dans l'élaboration des recommandations concernant la priorisation des vaccins. Les mesures les plus utiles du fardeau de la maladie sont les suivantes :
- Analyses des répercussions anticipées de la pandémie - Aident à déterminer si des perturbations sociales sont susceptibles de se produire.
- Analyses épidémiologiques - Nécessaires pour évaluer le risque de maladie et la survenue des cas graves, ainsi que les décès par groupe d'âge et catégorie de risque. Idéalement, des données canadiennes seront disponibles (p. ex. des analyses de la première vague de la maladie), mais il pourrait être nécessaire d'utiliser des données d'autres pays. Les données historiques (p. ex. concernant les risques dans les communautés éloignées et les populations vulnérables) peuvent également être utiles.
- Enquêtes sur la séroprévalence - Les résultats des tests réalisés à partir des sérums recueillis avant la pandémie aident à déterminer si tous les groupes d'âge sont sensibles au virus pandémique ou si certaines parties de la population présentent une immunité préexistante, alors que les résultats obtenus après la première vague de la maladie montreront si certains groupes d'âge ont déjà acquis des taux d'immunité significatifs transmis par la maladie.
3.1.2 Caractéristiques du vaccin
Le vaccin pandémique est susceptible de différer du vaccin antigrippal saisonnier de plusieurs façons (p. ex. préparation, profil d'effets indésirables, nombre de doses requises), ce qui pourrait avoir une influence sur le programme de vaccination en cas de grippe pandémique. Compte tenu du caractère urgent de la situation, la vente du vaccin peut être autorisée en vertu de la réglementation relative aux DNUE, même si les données sur l'immunogénicité et l'innocuité guidant les recommandations concernant la priorisation sont limitées. Il faudra assurer un suivi étroit des résultats des essais sur le vaccin et modifier les stratégies de déploiement, s'il y a lieu.
Puisque le vaccin sera administré à un grand nombre de personnes en une courte période de temps, il se peut que les effets indésirables rares soient anticipés ou décelés pendant le déroulement du programme, ce qui pourrait avoir une retombée sur le rapport risques-avantages pour la population générale ou pour certains groupes de personnes vaccinées.
Il sera important de déterminer s'il faut administrer une seconde dose du vaccin à certains ou à tous les sujets à vacciner potentiels. Si une seconde dose est nécessaire, il faut tenir compte du choix du moment. La priorisation exige de savoir s'il faut donner à chacun une première dose avant de commencer à administrer les secondes (ce qui permet d'optimiser la protection communautaire) ou s'il faut plutôt commencer les secondes doses à l'intervalle efficace minimal (ce qui permet d'optimiser la protection individuelle).
3.2 Considérations d'ordre éthique
La section Considérations d'ordre éthique du PCGP décrit les principes et les valeurs éthiques qui sous-tendent la planification en cas de pandémie à l'échelle nationale. Le PCGP décrit également les principes du processus de prise de décision éclairée qui doivent être suivis au moment de formuler des recommandations concernant la priorisation. La section 2.5 du corps de la présente annexe souligne les aspects de la stratégie de vaccination en cas de pandémie ayant des répercussions éthiques importantes, parmi lesquels figurent les recommandations concernant la priorisation des vaccins. Les considérations d'ordre éthique les plus pertinentes pour la priorisation des vaccins sont les suivantes :
- Intendance - Le vaccin pandémique est une ressource précieuse et ceux à qui on en a confié la garde doivent en planifier l'utilisation de manière responsable, conformément aux objectifs pandémiques, en agissant avec intégrité et en faisant preuve de responsabilité.
- Confiance et solidarité - L'acceptation par le public et par les intervenants des recommandations concernant la priorisation repose sur la confiance et l'établissement de relations fondées sur la communication et la collaboration ouverte. La confiance est également liée à des processus de prise de décision éthiques et transparents. La solidarité à l'échelle mondiale et nationale est un facteur important pour la mise en œuvre du programme de vaccination en cas de pandémie.
- Réciprocité - La réciprocité consiste à offrir un soutien social aux personnes qui font face à un fardeau disproportionné dans l'exercice de leurs fonctions afin de protéger le public. L'administration prioritaire des vaccins pandémiques aux travailleurs de la santé est un exemple d'application de la réciprocité.
- Équité et impartialité - Une priorisation selon des critères justes et des processus de prise de décision transparents et raisonnables sont des éléments importants lorsque l'on distribue une ressource limitée comme les doses initiales du vaccin pandémique. Les décisions doivent tenir compte des inégalités en matière de santé et viser à les atténuer.
3.3 Enjeux liés au programme
3.3.1 Stratégies d'immunisation et groupes cibles potentiels
Le vaccin pandémique peut être utilisé de diverses façons pour atteindre les objectifs de la stratégie de vaccination en cas de pandémie :
- On peut favoriser l'atteinte du premier objectif (réduire au minimum la maladie grave et les décès en général) en se concentrant sur les groupes les plus susceptibles d'être touchés par la maladie et d'en mourir, ainsi que sur les travailleurs de la santé, qui sont essentiels au fonctionnement du système de santé et à l'optimisation des soins de santé auprès de la population. Une autre stratégie consisterait à prévenir la maladie (et, par conséquent, les cas graves) en réduisant la transmission de la maladie. Cela pourrait se faire en priorisant les enfants, qui sont reconnus pour transmettre la grippe au sein des familles et des communautésNote de bas de page 49.
- Le deuxième objectif (réduire au minimum la perturbation sociale) pourrait ne pas être pertinent dans le contexte d'une pandémie ayant de faibles répercussions, mais doit être pris en considération si les répercussions de la pandémie sont modérées ou graves, alors qu'un grand nombre de personnes pourraient être gravement malades et que l'absentéisme pourrait être élevé au sein de la main d'œuvre. La vaccination précoce des travailleurs des infrastructures essentielles pourrait contribuer à atténuer les répercussions découlant de la perte de services essentiels.
Les stratégies choisies doivent également tenir compte des facteurs supplémentaires suivants :
- Moment prévu auquel le vaccin sera disponible par rapport à l'activité pandémique - La disponibilité du vaccin entre les vagues pandémiques favorise les mesures visant à réduire la transmission, comme la vaccination des enfants d'âge scolaire, dans un effort pour aplatir la courbe épidémique de la deuxième vague. Si le vaccin est disponible au début d'une vague pandémique ou pendant celle-ci, cela peut favoriser les mesures visant à prioriser les personnes ayant un risque élevé de maladie grave et de complications.
- Caractéristiques de milieux particuliers - Notamment les caractéristiques géographiques, les conditions démographiques et socioéconomiques et la concentration de résidents ayant des problèmes de santé sous-jacents.
- Autres interventions planifiées, plus particulièrement l'utilisation d'antirétroviraux - L'apparition d'une résistance antivirale ou des pénuries importantes de médicaments peuvent avoir des répercussions sur la priorisation.
La modélisation mathématique peut être très utile pour déterminer la stratégie à adopter. Des études de modélisation existantes ont déjà abordé les répercussions potentielles des différentes approches de priorisation des vaccins pandémiques en regard des facteurs comme le moment de l'activité pandémique et les caractéristiques géographiques et démographiques de la communautéNote de bas de page 50 Note de bas de page 51 Note de bas de page 52 Note de bas de page 53 Note de bas de page 54. Une modélisation devrait être réalisée en temps opportun à partir des caractéristiques de la pandémie en cours pour faciliter la prise de décision concernant la priorisation.
Groupes cibles potentiels -Le processus de priorisation consiste à appliquer les stratégies sélectionnées aux segments de la population (groupes cibles) à qui le vaccin sera offert en premier, suivi des autres segments de la population, jusqu'à ce qu'il y ait suffisamment de vaccin pour toute la population.
Les groupes cibles potentiels sont décrits par catégorie au tableau A2. Ces groupes cibles peuvent être affinés au moment de la pandémie, selon l'épidémiologie de la pandémie, la disponibilité prévue du vaccin et d'autres considérations d'ordre logistique. Par exemple, les mesures suivantes pourraient être prises :
- Diviser les populations d'adultes et d'enfants en groupes d'âge plus restreints.
- Élargir la vaccination ou établir des priorités à l'intérieur d'une catégorie à risque élevé (p. ex. personnes ayant des problèmes de santé sous-jacents, femmes enceintes, enfants en santé, personnes âgées en santé).
- Cibler d'autres milieux à considérer pour la priorisation (p. ex. refuges pour les personnes sans-abris).
- Établir des priorités à l'intérieur des catégories des travailleurs de la santé ou des infrastructures essentielles (p. ex. travailleurs de la santé de première ligne).
- Dresser une liste complète des définitions et des inclusions dans chaque catégorie, particulièrement pour les travailleurs de la santé et les travailleurs des infrastructures essentielles.
| Catégorie | Groupe(s) cible(s) potentiel(s) | Commentaires |
|---|---|---|
Risque élevé (de cas grave) |
|
|
Enfants et adultes en santéNote de bas de page 56 |
|
|
Travailleurs |
Travailleurs de la santé qui jouent un rôle dans l'intervention en cas de pandémie et dans la prestation de services de santé essentiels dans tous les contextes, y compris les suivants :
|
|
Travailleurs des infrastructures essentiellesNote de bas de page 57 :
|
|
|
Principaux décideurs :
|
|
|
Milieux qui courent un risque élevé |
|
|
Personnes susceptibles de transmettre l'infection à des personnes à risque élevé |
|
|
3.3.2 Problèmes logistiques
En vertu du contrat pour l'approvisionnement primaire en vaccins pandémiques, le fabricant doit développer la capacité de fournir au minimum 33 millions de doses de vaccin pandémique par mois. À cette vitesse de production, la priorisation serait moins urgente et relativement éphémère. Toutefois, la capacité de production initiale n'est pas toujours idéale et la production pourrait être réduite inopinément si la croissance du virus vaccinal dans les œufs n'est pas optimale ou si une dose plus élevée que prévue de l'antigène viral est nécessaire pour obtenir une immunité. Les PT ont indiqué qu'ils seraient en mesure d'administrer le vaccin aussitôt qu'il est produit, par l'intermédiaire des bureaux de santé publique locaux, même si cela signifie qu'ils devront fournir une dose à l'ensemble de la population en moins d'un mois.
Comme il est important d'optimiser l'utilisation du vaccin, les estimations de la taille des groupes cibles et du taux de vaccination attendu dans chaque groupe cible sont pertinentes pour déterminer les quantités de vaccins qui devront être disponibles pour vacciner la population. Les autres considérations d'ordre logistique sont les suivantes :
- Est-il préférable de cibler plusieurs groupes simultanément? Cette approche faciliterait la tâche des familles (p. ex. si les enfants ou les conjoints ne font pas partie du même groupe d'âge) et permettrait de prioriser les groupes professionnels et ceux courant un risque élevé en même temps.
- Existe-t-il des avantages à créer plusieurs grands groupes prioritaires plutôt que de nombreux petits groupes (ce qui dépend en grande partie de la disponibilité prévue du vaccin)?
- Quelle est la logistique entourant la vaccination dans certains milieux comme les communautés éloignées, où il est plus efficient (et probablement plus efficace) de vacciner l'ensemble de la communauté au même moment?
3.3.3 Acceptabilité du programme
Il est important de tenir compte des valeurs et des perceptions du public et des intervenants et de déterminer comment ces groupes accepteront les recommandations proposées. En étant invités à participer au processus d'élaboration des recommandations concernant la priorisation, les intervenants auront l'occasion de faire part de leurs préoccupations et d'obtenir des réponses à ce sujet. On peut s'attendre à ce que plusieurs préoccupations soient soulevées par le public et les intervenants :
- Méfiance générale à l'égard des vaccins chez certains.
- Inquiétudes quant à la « nouveauté » du vaccin pandémique et à son innocuité.
- Acceptabilité générale des priorités établies (liée aux perceptions du public à l'égard du taux de mortalité et de la valeur de la vie).
- Désignation des enfants comme un groupe prioritaire.
- Risque ou avantage perçu lié au fait de recevoir le vaccin en premier.
- Réaction du public à l'égard du signalement d'événements indésirables graves associés à la vaccination.
- Taux de vaccination pendant une pandémie perçue comme ayant des répercussions faibles.
L'appendice A2 présente plusieurs sources d'information décrivant l'opinion du public à l'égard de la priorisation des ressources au cours d'une pandémie. Selon les leçons tirées de la campagne de vaccination pendant la pandémie de 2009 concernant la priorisation des vaccins, les inquiétudes du public portaient sur la mise en œuvre des recommandations plutôt que sur les recommandations elles-mêmes. Par exemple, le public s'inquiétait des différences entre les PT sur le plan de la mise en œuvre, critiquant plus particulièrement le contournement des listes d'attente.
3.4. Autres facteurs stratégiques à prendre en considération
3.4.1 Considérations d'ordre juridique
Un grand nombre de facteurs doivent être soigneusement pris en compte au cours de l'élaboration et de l'utilisation d'un cadre de priorisation en cas de pandémie. Un gouvernement qui choisit de créer des groupes particuliers qui recevront le vaccin pandémique en priorité pourrait voir sa décision remise en question en vertu de la Charte canadienne des droits et libertés. Il est donc important que les gouvernements qui décident de désigner des groupes prioritaires conservent les preuves que ces décisions étaient fondées sur des motifs stratégiques d'ordre scientifique, social, économique et éthique. Les gouvernements doivent pouvoir démontrer que la prise de décision concernant les groupes prioritaires était fondée sur des considérations raisonnables, justes et rationnelles. En outre, la décision stratégique d'accorder la priorité à certains groupes doit être largement diffusée, de manière claire et cohérente, et le cadre de priorisation doit être respecté rigoureusement et de façon précise, à moins que des modifications nécessaires ne soient apportées en raison de nouvelles données.
3.4.2 Conformité des programmes
Il peut être utile de connaître les recommandations de l'OMS et des autres pays, dont les États-Unis, en matière de priorités, ainsi que les motifs qui sous-tendent ces recommandations. Toutefois, les différences observées au Canada sur le plan de l'approvisionnement en vaccins, du type de vaccin utilisé, du moment de l'activité pandémique ou de la détermination de groupes uniques qui courent un risque élevé au Canada peuvent faire en sorte que les recommandations canadiennes divergent d'une certaine mesure par rapport à celles d'autres territoires de compétence. Il est important de reconnaître ces différences et de justifier les recommandations canadiennes pour favoriser la compréhension et le soutien des fournisseurs de soins de santé et du public.
Une approche pancanadienne en matière de priorisation des vaccins est souhaitable. L'une des leçons tirées de la pandémie de 2009 est la nécessité de formuler de façon plus cohérente ou plus claire les raisons des écarts observés pour certains aspects de la mise en œuvre du programme par les PT (p. ex. la mise en œuvre des recommandations concernant la priorisation) afin d'atténuer les inquiétudes et la confusion de la population. La collaboration dans le but d'établir et de soutenir les politiques et les recommandations pancanadiennes sur l'utilisation du vaccin en cas de pandémie a été citée comme un rôle à jouer pour les gouvernements FPT (reportez-vous à la section 3.4 de l'annexe principale sur les vaccins).
3.4.3 Considérations d'ordre politique
Les considérations d'ordre politique comprennent les controverses que pourrait provoquer, au Canada ou dans un contexte international, le plan de priorisation proposé relativement au choix et à la position de certains groupes cibles potentiels.
4.0 Processus d'élaboration des recommandations
Dans l'annexe principale du PCGP, on identifie le CCNI comme principal responsable des recommandations concernant la priorisation des vaccins. L'ASPC fournira un soutien et s'assurera que les renseignements requis sont disponibles. Le processus doit être conforme aux principes éthiques du PCGP pour la prise de décision éclairée, qui sont décrits à la section 2.5 de l'annexe principale. Une brève description du processus proposé et d'autres facteurs à prendre en compte sont fournis ci-dessous.
Élaboration des recommandations concernant la priorisation - Le processus d'élaboration des recommandations concernant la priorisation comporte un certain nombre d'étapes :
- Examen des preuves scientifiques recueillies pour chacun des critères du cadre de priorisation (tableau A1) et discussion sur les questions clés qui s'y rattachent.
- Examen des objectifs pandémiques de la stratégie de vaccination en cas de pandémie, à la lumière de l'épidémiologie et des répercussions prévues de la pandémie.
- Détermination des groupes cibles et des milieux potentiels et sélection de la stratégie la plus efficace pour atteindre les objectifs pandémiques.
- Classement par ordre de priorité des groupes cibles et des milieux proposés, suivi d'un ajustement à la lumière des considérations d'ordre éthique et logistique et d'autres facteurs, ainsi que des quantités de vaccins prévues.
- Consolidation des recommandations et formulation d'une justification écrite.
Délais - Certaines pressions pourraient exister pour que les recommandations concernant la priorisation soient produites au début de la pandémie. Toutefois, bien que l'on reconnaisse la nécessité de préparer ces recommandations aussitôt que possible, il est préférable d'attendre d'avoir recueilli suffisamment d'information sur l'épidémiologie de la pandémie, les groupes qui courent un risque de maladie grave et la disponibilité prévue du vaccin. Quoi qu'il en soit, le processus doit être planifié de façon à prévoir suffisamment de temps pour faire approuver les recommandations au moins un mois avant l'arrivée prévue du vaccin. Les recommandations concernant la priorisation doivent être examinées lorsque la mise en circulation du vaccin est imminente, puis périodiquement une fois le programme lancé. Elles doivent être ajustées au besoin pour que les groupes cibles continuent à concorder avec les quantités de vaccins disponibles.
Participation des partenaires et des intervenants - On recommande d'inclure les partenaires clés et les intervenants pertinents dans le processus d'élaboration des recommandations concernant la priorisation, afin d'obtenir leurs opinions et de répondre à leurs préoccupations. Si le temps le permet, d'autres consultations devraient être entreprises avec les intervenants avant de finaliser les recommandations.
Uniformité - Une mise en œuvre aussi uniforme que possible par les PT est nécessaire pour soutenir les stratégies sélectionnées et éviter de semer la confusion dans la population. Cela se fera par une discussion visant à déterminer l'équilibre optimal entre la normalisation et la flexibilité des PT dans la mise en œuvre des recommandations, en s'assurant qu'il y a une compréhension uniforme des définitions et des interprétations des groupes cibles et qu'on convienne des aspects où les PT peuvent faire preuve de flexibilité.
Communications des recommandations concernant la priorisation - Un plan de communication doit être élaboré à l'avance pour transmettre les recommandations concernant la priorisation. D'après les leçons tirées de la pandémie de 2009, il est recommandé que les communications sur la priorisation de la vaccination en cas de pandémie débutent dès le moment où la décision de démarrer la production de vaccins pandémiques est prise.
Pour éviter la confusion, il faut transmettre un message clair pour expliquer qu'il devrait y avoir à terme suffisamment de vaccins pour tous, mais que les vaccins ne seront pas tous prêts en même temps. Les communications doivent décrire clairement les principes éthiques qui sous-tendent les décisions, le processus utilisé pour en arriver aux recommandations concernant la priorisation, les personnes ayant pris part à l'élaboration des recommandations et les motifs justifiant ces dernières, particulièrement en ce qui a trait au choix de la stratégie générale et à la priorité accordée aux enfants. La stratégie de communication préparée doit expliquer de manière proactive pourquoi la mise en œuvre des recommandations concernant la priorisation peut varier entre les PT.
Appendice A1 - Renseignements requis pour la priorisation des vaccins
Le tableau qui suit décrit les données et les renseignements qui seront nécessaires au processus de priorisation. Ces renseignements doivent être recueillis, analysés et présentés à l'avance au CCNI afin d'offrir aux membres la possibilité de cibler, s'il y a lieu, les analyses ou les renseignements supplémentaires qui pourraient être nécessaires à la prise de décision. Il est admis que les renseignements requis pourraient ne pas être disponibles, particulièrement au début de la pandémie.
| Catégorie | Critères | Besoins en matière de données et d'information |
|---|---|---|
Preuves scientifiques |
Épidémiologie de la pandémie |
|
Information sur le vaccin |
|
|
Considérations d'ordre éthique |
Considérations d'ordre éthique |
|
Enjeux liés au programme |
Stratégies d'immunisation |
|
Logistique |
|
|
Acceptabilité |
|
|
Autres facteurs stratégiques à prendre en considération |
Conformité |
|
Considérations d'ordre juridique et politique |
|
Appendice A2 - Consultations publiques sur la priorisation
Les résultats de plusieurs consultations publiques sur la priorisation des ressources au cours d'une pandémie sont résumés ci-dessous. Bien que les deux derniers processus portent sur les antirétroviraux, leurs résultats sont également considérés comme pertinents dans le contexte de la priorisation des vaccins pandémiques.
1. Projets du Canadian Program of Research on Ethics in a Pandemic (CanPREP)Note de bas de page 59 Note de bas de page 60
Trois projets ont été réalisés pour déterminer les opinions de la population canadienne et des autres intervenants sur les questions d'ordre éthique dans le contexte d'une pandémie : des sondages d'opinion à l'échelle nationale, des séances de discussion ouverte et un forum national à l'intention des intervenants. Les principales conclusions pertinentes dans le contexte de la priorisation sont les suivantes :
Objectif principal de l'intervention en cas de pandémie - réduire le taux de mortalité lié à la grippe; la réduction du taux global de mortalité est un aspect important de cet objectif.
Principales considérations d'ordre éthique dans l'établissement des priorités :
- Les objectifs en matière d'éthique sont la légitimité, l'impartialité et l'équité, ainsi que la confiance, la solidarité et l'intendance.
- Les critères à prendre en compte pour l'établissement des priorités devraient être déterminés à l'avance, avec l'engagement des intervenants et du public.
- Les responsables des gouvernements et du secteur des soins de santé doivent justifier clairement des décisions prises concernant l'attribution des ressources, notamment en ce qui concerne les groupes prioritaires ayant accès aux ressources et aux services de santé limités. Ces motifs doivent être accessibles au public et justifiés en regard des critères définis; il faut expliquer tout écart par rapport aux critères prédéterminés.
- Des mécanismes officiels doivent être mis en place afin que les intervenants puissent transmettre de nouveaux renseignements, remettre en question les décisions concernant l'attribution ou soulever des inquiétudes à l'égard de ces décisions, et résoudre les conflits.
- Les travailleurs de la santé devraient obtenir un accès prioritaire à certaines ressources de soins de santé, les enfants venant au deuxième rang.
2. Sondage de l'Université de l'Alberta sur l'attribution des ressources limitées en cas de pandémie de grippeNote de bas de page 61
Un questionnaire en ligne a été envoyé aux étudiants, aux employés de soutien et au personnel enseignant de l'Université de l'Alberta. On a demandé aux répondants de classer onze différents groupes pour l'accès à des ressources limitées et de sélectionner l'un des sept plans d'accès prioritaire.
Classement des groupes pour l'accès à des ressources limitées :
- La priorité la plus élevée a été accordée aux travailleurs de la santé (89 % des participants), suivis de près par le personnel d'urgence.
- Une priorité plus élevée a été accordée aux enfants par rapport aux personnes ayant un problème de santé sous-jacent.
Plan d'accès prioritaire privilégié :
- Le premier choix a été l'approche permettant de sauver le plus grand nombre de vies.
- Le choix suivant consistait à sauver les gens selon un système de classement prioritaire, suivi de l'approche visant à sauver les personnes les plus susceptibles de mourir de la maladie.
- Le principe du premier arrivé, premier servi a été considéré comme l'approche la moins acceptable.
3. Objectifs et valeurs du processus de dialogue délibératif sur les antivirauxNote de bas de page 62
Le processus de dialogue délibératif du Groupe de travail sur l'utilisation des antiviraux à des fins prophylactiques s'est intéressé aux convictions et aux valeurs du public et des intervenants concernant l'utilisation des antiviraux à des fins prophylactiques.
Les participants soutenaient trois objectifs :
- Assurer le fonctionnement des services essentiels.
- Réduire au minimum la peur et la panique dans la population.
- Réduire les maladies graves et les décès au cours d'une pandémie.
Les personnes devant bénéficier en priorité des antiviraux si ceux-ci sont offerts en prévention étaient les suivantes :
- Les travailleurs de la santé ayant des contacts étroits avec les patients (consensus).
- Le personnel des services d'urgence (opinions divergentes, particulièrement en ce qui concerne les autres services essentiels).
- Les personnes les plus vulnérables, y compris les enfants, les résidents des établissements de santé, les malades chroniques et les personnes âgées (opinions divergentes; les enfants correspondent au groupe le plus souvent mentionné).
Les valeurs soulignées relativement à la prise de décision sont les suivantes :
- Commodité/efficacité/pragmatisme - réduire au minimum la maladie et les décès, protéger les travailleurs de la santé, tenir compte de la facilité de prestation.
- Impartialité et égalité - uniformité à l'échelle du pays, éviter les inégalités sur le plan de l'accès.
- Compassion à l'égard des personnes vulnérables.
- Sensibilisation et engagement du public - en obtenir la compréhension et le soutien.
- Rôle important joué par le gouvernement; confiance envers le gouvernement - il dirige et prend la responsabilité de protéger les personnes vulnérables et les travailleurs qui seront exposés.
4. Rapport Public Engagement on Facilitating Access to Antiviral Medications and Information in an Influenza Pandemic de l'Institute of Medicine (IOM)Note de bas de page 63
En 2012, l'IOM a conçu et présenté une série d'ateliers afin d'explorer la perception du public américain à l'égard des stratégies potentielles visant à faciliter l'accès aux antiviraux et aux conseils en matière de traitement pendant une pandémie de grippe. En réponse au scénario de pénurie d'antiviraux et d'engorgement des systèmes de prestation, les participants ont mentionné plusieurs valeurs et objectifs communs :
- Équité et impartialité - assurer un accès équitable aux populations vulnérables; prévenir le favoritisme, le biais et la discrimination dans la distribution des ressources, entre les communautés et au sein de chacune; assurer un accès équitable aux communications sur les antiviraux.
- Intégrité - respect des protocoles de prescription et des priorités établies; favoriser la confiance, le consentement et la coopération du public.
- Attribution des antiviraux en priorité à certains groupes.
- Transparence - partage de données précises et cohérentes par les autorités.
Appendice B - Conseils pour la planification des cliniques de vaccination de masse
1.0 Introduction
Un des objectifs de la stratégie canadienne de vaccination en cas de pandémie est d'attribuer, de distribuer et d'administrer les vaccins aussi efficacement que possible. Les cliniques de vaccination de masse permettent de vacciner un grand nombre de personnes en une courte période de temps. Au cours de la pandémie de 2009, le vaccin contre la grippe pandémique a été administré par divers fournisseurs dans divers milieux. De nombreuses stratégies novatrices ont été utilisées pour mettre sur pied des cliniques de vaccination de masse et gérer les foules importantes. Parmi les documents d'orientation élaborés pour aider les travailleurs de la santé, mentionnons le document Cliniques de vaccination de masse dans les collectivités éloignées et isoléesNote de bas de page 64. Il n'existait aucun autre document d'orientation national portant spécifiquement sur les cliniques de vaccination de masse en dehors de ce contexte.
L'objet de l'appendice B de l'annexe du PCGP traitant de la vaccination est d'aider les professionnels de la santé publique à planifier des cliniques de vaccination de masse advenant un événement de santé publique comme une pandémie d'influenza. Bien que le document décrive les principaux facteurs à prendre en compte dans la planification des cliniques de vaccination de masse en général, il décrit dans la mesure du possible les facteurs uniques propres à des milieux particuliers, comme les communautés éloignées et isolées et les cliniques en milieu scolaire. On reconnaît toutefois que les communautés éloignées et isolées pourraient ne pas avoir accès à l'ensemble des ressources (p. ex. les TI) disponibles dans les milieux urbains de plus grande envergure. Les questions liées à la disponibilité du vaccin ainsi qu'à l'établissement des critères de priorité et d'admissibilité dépassent la portée du présent appendice. Le présent guide pour la planification vient donc compléter les plans de vaccination de masse existants des provinces et des territoires.
En s'appuyant sur le guide de 2009, l'annexe B a été guidée par un examen de la documentation actuellement disponible se rapportant à la planification, à la mise en œuvre et à l'évaluation des cliniques de vaccination de masse en réponse à une situation d'urgence; cette documentation comprend des leçons tirées de la pandémie de 2009 et des documents sur la planification en cas de pandémie. Pour déterminer les pratiques pertinentes et courantes en matière de vaccination de masse, les stratégies de planification et de mise en œuvre des cliniques ont été examinées et des consultations ciblées avec les intervenants ont été entreprises auprès du personnel de santé publique de première ligne et d'un groupe de référence dont les membres provenaient de partout au Canada.
Le principal auditoire cible de l'orientation présentée à l'annexe B est composé des planificateurs de programmes d'immunisation des services de santé publique locaux, régionaux, provinciaux et territoriaux, ainsi que des ministères fédéraux de la Santé responsables des programmes de vaccination de masse. Ce document doit être lu conjointement à l'annexe du PCGP traitant de la vaccination, dont elle forme un appendice, ainsi qu'aux lois, règlements et politiques applicables aux programmes d'immunisation des territoires de compétence pertinents (fédéral, provincial, territorial et local).
2.0 Planification des cliniques
2.1 Direction et coordination
La planification et la mise en œuvre de cliniques de vaccination de masse requièrent une direction éclairée et la coordination d'un grand nombre de groupes ou de personnes au sein de la communauté participant à la campagne de vaccination. La direction de la clinique doit être établie pour assurer la gestion générale, la planification et la coordination des opérations de la clinique. Il peut être utile de se baser sur les campagnes de vaccination systémique (p. ex. pour la grippe saisonnière) pour planifier les cliniques de vaccination de masse advenant un événement de santé publique comme une pandémie d'influenza.
Un des principaux aspects de la direction et de la coordination consistera à déterminer dans quels domaines une collaboration pourrait être requise et, dans la mesure du possible, à négocier des ententes à l'avance. À titre d'exemple, mentionnons la collaboration avec des propriétaires d'installations pour réserver les sites des cliniques, avec des ressources humaines et des syndicats pour permettre une embauche rapide de personnel et atténuer les répercussions sur les effectifsNote de bas de page 65 et avec les associations de professionnels de la santé pour assurer une capacité d'appoint en ressources humaines. Des ententes doivent être prises avec les fournisseurs pour obtenir le matériel requis.
Les collaborations dans le cadre de la mise en œuvre de la clinique peuvent comprendre des ententes portant sur ce qui suit :
- Stationnement (p. ex. déneigement et dérogation aux restrictions de stationnement).
- Transport de personnes (p. ex. personnes âgées, personnes confinées à la maison, résidents de communautés éloignées et isolées, personnes ayant des besoins spéciaux).
- Transport des fournitures et des déchets biomédicaux.
- Sécurité sur le site de la clinique.
- Coordination avec les autres utilisateurs de site multiutilisateurs pour éviter les conflits et la confusion.
- Collaboration avec les directions d'école et, si possible, avec les parents et les tuteurs pour mettre en œuvre des programmes en milieu scolaire.
Au moment d'établir ces collaborations, il faut tenir compte des besoins et des ressources de la communauté.
Conseils pratiques pour les communautés éloignées et isolées :
En collaboration avec les communautés, il faut offrir des occasions d'accroître la sensibilisation et de répondre aux questions et aux préoccupations des personnes afin d'assurer le bon déroulement des plans et des activités de vaccination de masse.
On reconnaît que chaque province ou territoire possède sa propre infrastructure de système de santé; par conséquent, les planificateurs voudront aligner les plans de la clinique avec le système qui existe dans ce territoire de compétence.
2.2 Détermination du site de la clinique
Pour déterminer les sites appropriés pour les cliniques de vaccination, il faut choisir des endroits qui répondent aux besoins de la communauté et qui soutiennent en toute sécurité les objectifs et les activités de la clinique. Plusieurs sites peuvent être requis pour répondre aux besoins de la communauté. L'emplacement, l'accessibilité et les installations sont des catégories générales à prendre en compte au moment de sélectionner le site de la clinique, comme le montre le tableau ci-dessous. Dans le cas des programmes en milieu scolaire, il faut déterminer quel est le meilleur endroit pour tenir les activités de la clinique (p. ex. gymnase, bibliothèque, cafétéria) de façon à perturber le moins possible les activités de l'école. Si possible, il faut prendre des ententes préalables afin de pouvoir utiliser les sites le moment venu.
| Emplacement | Accessibilité | Installations |
|---|---|---|
|
|
|
Voici des exemples de sites potentiels pour tenir une clinique :
- Écoles
- Collèges et universités
- Centres commerciaux
- Arénas et centres communautaires
- Hôtels de ville et églises
- Centres de santé communautaires et postes de soins infirmiers
Au moment de sélectionner les sites, il faut tenir compte des difficultés qui pourraient être rencontrées et planifier en conséquence afin de les atténuer. Ce processus peut être facilité en visitant le site ou en procédant à un exercice de mise en œuvre. Ces difficultés peuvent comprendre la perturbation des activités habituelles du site (p ex. cours, activités commerciales), les problèmes de sécurité si le public entre par une zone à accès restreint, les conflits de stationnement avec les autres utilisateurs du site, les conflits avec les autres utilisateurs (p. ex. activités parascolaires dans les arénas ou les gymnases d'écoles), un espace d'entreposage limité et les dommages causés aux installations. Il faut éviter les changements de site fréquents, qui peuvent semer la confusionNote de bas de page 71.
2.3 Ressources humaines
2.3.1 Personnel des cliniques
Les cliniques de vaccination de masse ont des besoins élevés en ressources humaines pour qu'elles puissent fonctionner de façon efficace. Le nombre de membres du personnel normalement affectés aux programmes de vaccination sera probablement insuffisant pour répondre aux demandes dans le cadre d'un événement de grande envergure se déroulant à un rythme rapide; par conséquent, il sera probablement nécessaire de prévoir du personnel supplémentaire. En ce sens, un facteur important à prendre en compte sera la possibilité de suspendre temporairement les programmes réguliers afin de rediriger le personnel pour répondre aux besoins des cliniques de vaccination de masse.
Les sources de personnel supplémentaire comprennent, sans toutefois s'y limiter, les agences de soins infirmiers et les services d'aide temporaire, les écoles de sciences infirmières et les professionnels de la santé des autres corps de la communauté (p. ex. les ambulanciers paramédicaux et les pharmaciens). Lorsque le personnel provient de multiples disciplines, il est important de s'assurer que les personnes ayant des compétences spécialisées sont utilisées de façon optimale (p. ex. le personnel infirmier est affecté à des activités précises nécessitant des compétences en soins infirmiers). L'inclusion de bénévoles, de professionnels paramédicaux et de travailleurs non traditionnels permettra de remplir les rôles nécessaires au fonctionnement efficace de la clinique. L'attribution de tâches précises et les exigences sur le plan de la supervision dépendront de la réglementation et des politiques propres à chaque territoire de compétence ainsi que du niveau de compétence et d'expérience de la personne.
Voici quelques conseils pratiques pour assurer une utilisation efficace du temps et de ressources :
- Estimez le personnel requis en fonction de la taille de la communauté et des besoins cernés.
- Formez des équipes, conduites par un chef d'équipe, et affectez chaque membre du personnel à un rôle unique. Dans la mesure du possible, favorisez une application cohérente et la compréhension des rôles et des responsabilités.
- Désignez des personnes-ressources principales responsables des activités importantes de la clinique, comme le recrutement et l'affectation de personnel, la logistique, l'approvisionnement, les services cliniques, les vaccins et la chaîne du froid, la rémunération du personnel et la paie, les communicationsNote de bas de page 72 et la liaison avec la clinique.
- Élaborez des plans de dotation flexibles afin de répondre aux besoins (p. ex. prévoir la rotation des employés pour prévenir le surmenage, augmenter ou diminuer les effectifs au besoin)Note de bas de page 73.
- Assurez un soutien moral aux membres du personnel en offrant l'accès à des conseillers en santé mentale, offrez des repas sains sur place, planifiez des pauses, reconnaissez les réalisations et assurez-vous que le personnel a bien compris la gravité de la situationNote de bas de page 74 Note de bas de page 75.
- Intégrez des spécialistes des TI qui assureront la gestion des communications sur le Web et fourniront un soutien en matière de TI.
- Créez et tenez à jour une base de données regroupant du personnel qualifié que vous pourrez appeler en cas d'urgence.
- Coordonnez le transport des membres du personnel et des bénévoles qui n'ont pas leurs propres moyens de transport.
- Désignez une zone de stationnement particulière pour le personnel.
- Étudiez s'il est possible de fournir un service de garde d'enfants sur place pour les parents ou les aidants qui se font vacciner.
- Allouez suffisamment de temps à la formation du personnel et la communication des mises à jour.
« L'équipe dans une boîte » est un exemple d'outil utilisé pour estimer les besoins en personnel de la clinique :
« L'équipe dans une boîte » permet une estimation du nombre de membres du personnel nécessaire pour accomplir les différentes fonctions dans le cadre d'une clinique de vaccination de masse. Il est possible que ces estimations doivent être ajustées en fonction des exigences particulières des PT en matière de vaccination (p. ex. saisie de données électroniques). Elles devront également être adaptées en fonction des besoins de la population ou de la communauté, de l'envergure et de l'emplacement de la clinique, de la circulation dans la clinique, des ressources humaines disponibles, de l'expérience du personnel, etc.
Pour déterminer le nombre de membres du personnel nécessaire pour la vaccination, calculez le nombre de vaccins qui peuvent être administrés en une heure. Pour vacciner 2 500 personnes par jour à un site pendant une période de travail de 8 heures, le personnel recommandé se décrirait comme suit :
- 1 chef d'équipe/remplaçant.
- 20 membres du personnel clinique (infirmières, médecins, ambulanciers paramédicaux, pharmaciens, etc.) pour assurer le dépistage et l'évaluation médicale, répondre aux questions, vacciner et prendre en charge les événements indésirables.
- 8 membres du personnel (bénévoles, travailleurs en santé communautaire, etc.) : 1 personne à l'accueil, 4 personnes à l'inscription, 2 personnes pour diriger la circulation, 1 coursier.
- 2 administrateurs.
- 2 personnes chargées de la sécurité.
Adaptation du document BC Pandemic Influenza Preparedness Plan: Annex D Planning for Mass Immunization (2005) Note de bas de page 76
2.3.2 Considérations d'ordre juridique et réglementaire
Les cliniques de vaccination de masse font appel à un large éventail de personnel et de bénévoles, dont des membres de professions de la santé réglementées. Dans chaque territoire de compétence, la pratique des membres des professions de la santé est soumise à des lois et à des règlements particuliers, qui doivent être pris en compte au moment de la dotation en personnel de la clinique et de l'affectation des travailleurs à des rôles et à des responsabilités. En outre, des directives médicales devront être établies au besoin, selon le type de personnel employé dans la clinique et conformément aux exigences du territoire de compétence.
2.3.3 Rôles et responsabilités
Le tableau B2 fournit des exemples de rôles et d'activités cliniques exercés dans le cadre des opérations d'une clinique de vaccination de masse. Selon le contexte de la clinique (école, communautés éloignées et isolées, etc.), ainsi que la taille, les ressources et les besoins de la communauté, certains de ces rôles pourraient être affectés à des membres de la communauté ou à des bénévoles, ou encore être combinés ou exclus. Indiquez quels rôles et quelles activités seront exercés au siège social ou au site.
| Rôle | Activités | |
|---|---|---|
| Planification de la clinique (planification et coordination de l'organisation de la clinique, logistique courante, maintenance et fermeture) | ||
Chef ou planificateur/ |
|
|
Finances |
|
|
Logistique |
|
|
Soutien administratif |
|
|
| Activités de la clinique (activités sur place permettant d'assurer un déroulement efficace des activités de la clinique) | ||
Préposé du terrain de stationnement |
|
|
Sécurité |
|
|
Superviseur de la clinique |
|
|
Chef d'équipe de la clinique ou suppléant |
|
|
Responsable de l'accueil |
|
|
Inscription |
|
|
Vaccinateur |
*Le préremplissage des seringues peut être un rôle distinct. |
|
Soutien médical |
|
|
Promotion de la santé |
|
|
| Soutien à la clinique (soutien offert au besoin au personnel de la clinique pour assurer une prestation et un déroulement efficaces de la clinique) | ||
Coursier |
|
|
Administration |
|
|
Traducteurs et interprètes |
|
|
Entretien des installations |
|
|
Agent des communications |
|
|
Conseils pratiques pour les communautés éloignées et isolées
- En raison du nombre limité de travailleurs de la santé dans ces communautés, une capacité d'appoint provenant de l'extérieur pourrait être nécessaire en plus des bénévoles au sein de la communauté.
- Il est possible également que les rôles des travailleurs de la santé et des bénévoles soient élargis pour répondre aux besoins de la clinique.
2.3.4 Formation
La formation des membres du personnel et des bénévoles est un élément important pour assurer l'atteinte des objectifs et le bon déroulement des activités de la clinique. Cette formation, ainsi que des exercices pratiques et des simulations, doivent être préparés et vérifiés, puis mis en pratique régulièrement. Offrez une formation par le biais de différents canaux et proposez de nombreuses occasions de formation aux participants (p. ex. en ligne, autonome, en groupe). Veillez à ce que des processus soient en place, conformément aux exigences de la province ou du territoire, afin d'assurer au personnel la formation spécialisée requise (p. ex. certification en vaccination, prévention et contrôle des infections, manipulation d'objets tranchants et piquants, entreposage et manipulation, programmes d'entrée de données, renseignements sur les vaccins) avant l'ouverture de la clinique. Envisagez d'utiliser des listes de contrôle pour vous assurer de couvrir tous les aspects. Ainsi, chaque membre du personnel de la clinique sera parfaitement préparé à s'acquitter de son rôle et de ses responsabilités.
Formation supplémentaire suggérée :
- Rapports hiérarchiques, rôles et responsabilités, procédures en cas d'urgence médicale (y compris la prise en charge de l'anaphylaxie), pratiques et précautions de prévention et de contrôle des infections, organisation et déroulement de la clinique (formulaires de consentement, dépistage, documentation, etc.), gestion des déchetsNote de bas de page 77.
- Exigences et procédures en matière de collecte et de soumission de données (format papier ou électronique), y compris celles concernant les effets indésirables.
- Scénarios hypothétiques en cas de panne de courant, de dysfonctionnement ou de défaillance de l'équipement, de foules importantes, etc.Note de bas de page 78.
- Critères d'admissibilité et outils pour déterminer l'admissibilité.
- Différences culturelles (rôle des anciens et de la famille, etc.).
- Relations publiques (comme bien gérer les situations difficiles avec les clients, connaissance des facteurs qui contribuent aux perceptions et à l'expérience du client à la clinique, etc.).
- Relations avec les médias.
- Traiter avec des clients ayant des besoins particuliers.
- Stratégies de prise en charge de la douleur et des craintes des sujets recevant le vaccin, en particulier les enfants.
Pour obtenir des renseignements supplémentaires sur le contenu et les outils de formation offerts aux vaccinateurs, veuillez consulter les liens suggérés ci-dessous :
- Compétences en immunisation à l'intention des professionnels de la santé.
- Programme de formation sur les compétences en immunisation.
2.3.5 Orientation
Pour assurer le fonctionnement efficace de la clinique de vaccination de masse, il est essentiel de fournir au personnel une orientation complète avant l'ouverture de la clinique. Tous les membres du personnel et les bénévoles doivent être informés des exigences administratives pertinentes (p. ex. formulaires des ressources humaines; horaires; feuilles de temps; quelle personne contacter en cas de questions, notamment sur les périodes de travail; si de la nourriture et des boissons serons fournis au personnel) et des aspects précis de la clinique avant de participer à ses activités.
Dans la mesure du possible, on recommande d'élaborer à l'avance des manuels d'orientation décrivant tous les aspects du fonctionnement de la clinique. Ces aspects peuvent comprendre les objectifs, les rôles et les responsabilités de la clinique, l'identification du personnel et des bénévoles (utilisation d'insignes, de vestes, de foulards, de brassards, etc. avec codes de couleur), la circulation dans la clinique, le consentement des clients, le dépistage et l'admissibilité, les types de documents utilisés et leurs exigences, les directives médicales, la prise en charge des effets indésirables, la gestion de la chaîne du froid, l'entreposage et l'emballage des fournitures, l'élimination des déchets et les vêtements appropriés en fonction du rôle, les questions de santé et de sécurité au travail (prévention et lutte contre les infections, manipulation des objets tranchants et piquants et des déchets, utilisation d'équipement de protection individuelle, etc.). Un espace peut être réservé dans le manuel en prévision du contenu qui ne sera disponible qu'au moment de l'événement, comme l'épidémiologie de la maladie et des renseignements précis sur le vaccin. Lors de la préparation du manuel, il est recommandé d'utiliser un style télégraphique et un langage clair, de fournir un index et de créer une version électronique afin d'en accroître l'utilité.
Lorsque les ressources en temps et en personnel ne permettent pas l'élaboration d'un manuel d'orientation, il est recommandé de désigner un responsable qui communiquera l'information requise de manière cohérente au personnel et aux bénévoles.
2.4 Communication
Pour assurer une mise en œuvre et un déroulement réussis de la clinique de vaccination de masse, il est essentiel que les communications avec le public et les membres du personnel soient claires et fréquentes et se fassent en temps opportun. Au moment de planifier les communications de la clinique, les facteurs suivants doivent être pris en compte :
- Qui est le porte-parole responsable?
- Quelle sera la fréquence de communication des messages?
- Comment les messages seront-ils coordonnés et transmis?
- Quel est l'auditoire cible (pertinence culturelle selon la ou les langues, lisibilité, etc.)Note de bas de page 79 Note de bas de page 80 Note de bas de page 81?
Puisque les messages et l'information sont susceptibles de changer fréquemment à mesure que de nouveaux renseignements sont disponibles, il est important que les plans de communications soient aussi flexibles et dynamiques que possible. Les médias sociaux sont un moyen efficace de diffuser presque instantanément des mises à jour si les circonstances changent. Dans la mesure du possible, on recommande que le matériel de communication ciblé soit préparé et distribué aussi rapidement que possible avant la date prévue d'ouverture de la clinique.
2.4.1 Communication avec le public (externe)
Comme il a été mentionné tout au long de l'annexe du PCGP traitant de la vaccination, il est important que les messages relatifs à la vaccination en cas de pandémie soient cohérents. Voici des exemples de points clés à communiquer :
- Pourquoi les vaccins sont offerts et quelle est la disponibilité prévue?
- Quels sont les avantages que procure le vaccin?
- Quelle est l'innocuité du vaccin et quels sont les mythes sur les dangers présumés de la vaccination?
- Qui est admissible et pourquoi (p. ex. groupes prioritaires, résidents, population générale)Note de bas de page 82 Note de bas de page 83 Note de bas de page 84?
- Quelles sont les différences entre les préparations vaccinales (si plusieurs préparations sont disponibles) et quels sont les bénéficiaires visés par chacuneNote de bas de page 85?
- Emplacements de la clinique, heures d'ouverture, stationnement et indications pour s'y rendre en transports en commun.
- Aperçu des activités cliniques prévues, services offerts par la clinique, délais d'attente prévus (à mettre à jour fréquemment) et directives concernant les pièces d'identité à apporter (s'il y a lieu) et les vêtements à porter (chandail à manche courte ou chemise dont la manche peut être remontée pour dénuder l'épaule), directives pour s'assurer que les sujets ont mangé de façon appropriée pendant la journée afin de réduire au minimum le risque d'évanouissement, et la nécessité éventuelle d'apporter une carte de santéNote de bas de page 86 Note de bas de page 87.
- Confirmation que les cliniques font tout en leur possible pour offrir les vaccins au public en temps opportun et que tôt ou tard le vaccin sera offert à tous ceux qui le désirent (dans le cas d'un vaccin pandémique) Note de bas de page 88.
- Renforcement des stratégies de contrôle des infections (quoi faire en cas de symptômes ou de contact avec un cas potentiel).
| Matériel | Support | Format |
|---|---|---|
|
|
|
Grâce aux technologies comme les médias sociaux et la messagerie texte instantanée, les frustrations et les inquiétudes du public à l'égard des cliniques de vaccination de masse peuvent être rendues publiques instantanément. Il est donc nécessaire d'anticiper ces situations et de cibler les méthodes permettant d'en assurer la surveillance et d'y répondre.
Pour obtenir des conseils et des faits supplémentaires sur les communications :
- Avec le public, veuillez consulter le Guide canadien d'immunisation, Partie 1 : Information clé sur l'immunisation. Communication efficace concernant l'immunisation. 2013.
- Avec les populations vulnérables, consultez le document La saison de la grippe et les personnes les plus vulnérables.
2.4.2 Communication avec le personnel de la clinique (interne)
Comme on s'attend à ce que la situation évolue durant une pandémie, il est important de disposer de méthodes permettant de transmettre rapidement les informations nouvelles au personnel de la clinique. Les communications avec les membres du personnel doivent être claires et transmises rapidement pour permettre un déroulement efficace des opérations de la clinique. Grâce à des pratiques de communications efficaces, les membres du personnel pourront non seulement recevoir de l'information, mais également communiquer des renseignements, des rétroactions et des préoccupations.
Exemples de méthodes de communication avec le personnel
- Réunions quotidiennes avant l'ouverture de la clinique
- Babillard à l'intention du personnel (« centre de nouvelles »)
- Outil en ligne servant de répertoire de l'information partagée
- Réunions d'équipe
- Séances d'information avant et après les périodes de travail
- Téléconférences régulières
2.5 Gestion de données
Il est important de déterminer les méthodes qui seront utilisées pour la collecte, la gestion, le stockage et le transport des données (p. ex. format papier ou électronique) et de mettre en place des systèmes appropriés pour assurer une gestion sécuritaire des données, conformément aux exigences des lois et des politiques des provinces et des territoires. Ces données peuvent comprendre les horaires du personnel, les heures supplémentaires et la rémunérationNote de bas de page 90 Note de bas de page 91, les statistiques sur la clinique, comme le taux de vaccination et le taux de couverture vaccinale, le dépistage et le consentement des clients, le signalement des incidents (p. ex. blessures par piqûre d'aiguille, réactions indésirables), la rétroaction des clients et du personnel, et l'approvisionnement en vaccins et en ressources. Il est important que la formation offerte au personnel mette l'accent sur la protection de la vie privée et de la confidentialité, ainsi que sur les procédures et les politiques applicables en cas de violation.
2.6 Fournitures cliniques
Il importe de mettre en place des processus de commande des fournitures cliniques (seringues, aiguilles, etc.) et de gestion des stocks pour éviter les pénuries et le gaspillageNote de bas de page 92 Note de bas de page 93; déterminez s'il est possible de maintenir des stocks de fournitures minimaux selon une analyse du risque en fonction des besoins et des capacités de la province ou du territoire. La constitution de réserve de fournitures et de ressources permet un accès rapide aux fournitures désirées en cas de besoin, mais présente un risque de gaspillage si les fournitures ont une durée de vie déterminée ou perdent leur intégritéNote de bas de page 94 Note de bas de page 95 Note de bas de page 96. Déterminez s'il est possible de faire une rotation des réserves de fournitures. Si on ne prévoit pas constituer de réserve, il est possible de s'entendre avec les fournisseurs à l'avance pour assurer un accès aux fournitures en cas d'urgence. L'appendice 1 offre une liste de fournitures cliniques qui peuvent être adaptées aux besoins des provinces et des territoires.
2.6.1 Entreposage et manipulation
Dans le contexte des cliniques de vaccination de masse, il est possible qu'il n'y ait pas de ressources disponibles sur le site de la clinique pour entreposer les vaccins et les fournitures de façon sécuritaire. Élaborez des protocoles pour déterminer comment les vaccins et les fournitures seront transférés entre le site d'entreposage et les cliniques tout en préservant l'intégrité du produit (emballage, chaîne du froid) et en répondant aux besoins de la communauté, ainsi que les quantités à transférer et la fréquence des transferts (quotidien, hebdomadaire, etc.)Note de bas de page 97.
Une fois que les fournitures sont disponibles sur place, elles doivent être placées dans un endroit sécuritaire, mais familier, auquel le personnel peut accéder facilement et en toute sécurité au besoin. Les problèmes doivent être signalés aux personnes responsables des fournitures.
Conseils pratiques pour l'entreposage et la manipulation des vaccins et des fournitures
- Organisez les fournitures sous forme de trousses en fonction des diverses activités de la cliniqueNote de bas de page 98.
- Élaborez des procédures en cas de rupture de la chaîne du froid (défaillance du réfrigérateur, pannes de courant, etc.) et de perte, de vol et de dommages aux vaccins et aux fournituresNote de bas de page 99.
2.6.2 Gestion de la chaîne du froid
Une gestion efficace de la chaîne du froid est nécessaire pour maintenir l'intégrité du vaccin durant le transport et l'entreposage. Il faut élaborer des protocoles clairs indiquant comment se fera la surveillance de la chaîne du froid et qui en sera responsable, ainsi qu'un plan de préservation de la chaîne du froid en cas de défaillance de l'équipement et de panne de courant (p. ex. équipement de secours, génératrice ou autre emplacement). Avant de recevoir les stocks de vaccins, assurez-vous que le site d'entreposage et les équipements ont la capacité de préserver la chaîne du froid à une température entre 2 et 8 °C (pour les vaccins réfrigérés)Note de bas de page 100 Note de bas de page 101. Des ressources supplémentaires, comme des sacs de gel congelés, des glacières à vaccins et des dispositifs de surveillance de la température, peuvent être nécessaires pour préserver l'intégrité des vaccins pendant le transport et sur le site de la clinique.
Veuillez consulter les documents traitant des directives d'entreposage et de manipulation des vaccins de la province ou du territoire, ou encore les Lignes directrices nationales sur l'entreposage et la manipulation des vaccins pour les vaccinateurs pour obtenir des renseignements sur la gestion de la chaîne du froid, l'entreposage des vaccins, la surveillance de la température et les exigences relatives au transport.
2.7 Fournitures non cliniques
Une fois que les sites ont été sélectionnés, il est recommandé de dresser un inventaire des fournitures non cliniques disponibles sur place, comme l'ameublement, le matériel de signalisation ainsi que le matériel administratif et électronique, qui pourraient servir aux activités de la clinique. Ces fournitures varieront fortement d'un site à l'autre. Par exemple, une école disposera probablement de tables, de chaises et de matelas, alors qu'un aréna ou un centre commercial n'offrira pas ces fournitures, ce qui signifie qu'elles devront être achetées ou louées. Si on prévoit acheter des fournitures non cliniques, il faut déterminer à quel endroit elles seront entreposées une fois la clinique fermée. L'appendice 1 offre une liste de fournitures électroniques, administratives et d'ameublement qui peut être adaptée selon les besoins des provinces et des territoires.
Matériel de signalisation -Il est important que les cliniques installent des panneaux clairs afin de guider les patients entre les postes de la clinique et d'assurer une circulation efficace tout au long du processus de vaccination. Les panneaux doivent être bien visibles et clairs, et utiliser des polices de caractères grands format et un niveau de langue approprié. S'il y a lieu, les panneaux doivent combiner du texte et des images (p. ex. des flèches pour indiquer le chemin à suivre). Envisagez des plans et des procédures pour aider les clients ayant une déficience visuelle. Voici des exemples de panneaux qui pourraient être installés dans la clinique :
- Entrées et sorties, liste des autres cliniques et heures d'ouverture.
- Carte montrant la zone où se tient la clinique, dans le cas des édifices de grande taille comme les écoles, les centres commerciaux, les hôtels de ville, etc.
- Flèches pour diriger les clients entre les différents postes de la clinique.
- Identification des postes (inscription, vaccination, post-vaccination, premiers soins, toilettes, etc.).
3.0 Opérations de la clinique
3.1 Algorithme de la clinique de vaccination de masse
Des exemples des activités menées par les cliniques sont fournis ci-dessous. Un diagramme du déroulement de la clinique est fourni à l'appendice 2.
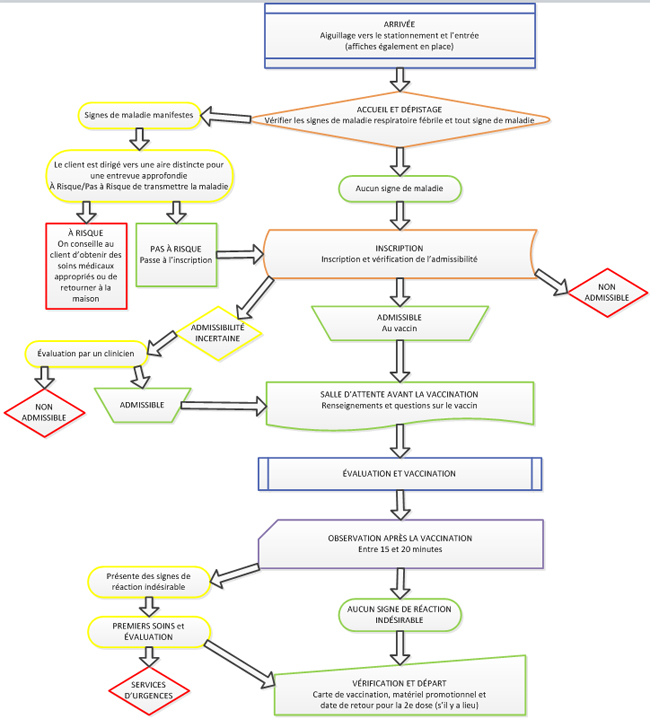
Figure B1 - Équivalent du texte
Cette figure est un organigramme illustrant le déroulement des activités de la clinique, de l'arrivée à la sortie. Il indique et décrit chaque activité.
- Arrivée : Aiguillage vers le stationnement et l'entrée (affiches également en place)
- Accueil et vérification : Vérifier les signes de maladie respiratoire fébrile et tout signe de maladie
- En l'absence de signe, poursuivre au poste 3 (Inscription)
- S'il y a des signes manifestes de maladie, diriger la personne malade vers une aire séparée et faire une entrevue approfondie visant à déterminer le risque de propagation.
- Si la personne est à risque, lui dire de partir et d'obtenir le niveau de soins médicaux approprié ou de retourner chez elle.
- Si elle n'est pas à risque, poursuivre au poste 3 (Inscription)
- Inscription : Inscription et vérification de l'admissibilité.
- Si la personne est admissible, poursuivre au poste 4 (Salle d'attente avant la vaccination)
- Si elle n'est pas admissible, elle quitte la clinique.
- Si le personnel ne parvient pas à déterminer son admissibilité, l'individu est évalué par un clinicien.
- S'il n'est pas admissible, il quitte la clinique.
- S'il est admissible, poursuivre au poste 4 (Salle d'attente avant la vaccination).
- Salle d'attente avant la vaccination : Renseignements sur les vaccins et questions
- Évaluation et vaccination
- Période d'observation suivant la vaccination : de 15 à 20 minutes afin de surveiller l'apparition d'effets indésirables.
- En l'absence d'effets indésirables, poursuivre au poste 7 (Vérification et départ).
- Si la personne présente des signes d'un effet indésirable,
- Administrer les premiers soins, faire une évaluation, puis faire l'une ou l'autre de ces actions :
- Poursuivre au poste 7 (Vérification et départ)
- Transférer au service des urgences
- Administrer les premiers soins, faire une évaluation, puis faire l'une ou l'autre de ces actions :
- Vérification et départ : Carnet de vaccination, matériel promotionnel et date de retour pour la deuxième dose (au besoin).
Adaptation du document Peterborough County-City Health Unit Pandemic Influenza PlanNote de bas de page 102
3.2 Contrôle des infections
Il est important de tenir compte des mesures de contrôle des infections visant à protéger le personnel et les clients pendant le déroulement de la clinique :
- Dépistage de la maladie chez les clients et le personnel et aiguillage en conséquence.
- Postes de désinfection et de lavage des mains, présence de désinfectant pour les mains à chaque poste de vaccinateur.
- Affiches et fiches d'information sur l'hygiène des mains, l'étiquette respiratoire et les messages sur la prévention des infections.
- Désinfection des surfaces avant et après l'utilisation par les clients et le personnel.
- Élimination et gestion appropriées des déchets.
- Réduction des foules dans la mesure du possible pour prévenir le risque de transmission en cas de pandémie.
Des renseignements complets sur les mesures de contrôle des infections sont fournis à l'annexe du PCGP intitulée Prévention et contrôle de la grippe durant une pandémie pour tous les milieux de soins et dans les outils d'évaluation et d'éducation du guide sur les pratiques de base et précautions additionnelles.
3.3 Gestion des foules
Le volume de clients est toujours difficile à prévoir et peut devenir une source de frustration pour le public et le personnel. Au cours de la planification des cliniques de vaccination de masse, il est possible d'intégrer des méthodes pour gérer les foules en fonction des besoins évaluésNote de bas de page 103 Note de bas de page 104 Note de bas de page 105 Note de bas de page 106 Note de bas de page 107 :
- Ligne d'urgence ou inscription en ligne - les clients utilisent une ligne d'urgence particulière ou un site Web pour choisir la clinique ainsi que la date et l'heure du rendez-vous.
- Invitations - les clients sont invités à se rendre à la clinique selon leur code postal, leur lieu de résidence, l'école qu'ils fréquentent ou leur nom de famille. Les invitations peuvent être effectuées par téléphone, en faisant du porte-à-porte ou par l'entremise des écoles, ce qui permet de s'assurer également que les membres de la communauté sont au courant des activités de la clinique et donne l'occasion de répondre aux questions ou aux préoccupations (cette méthode convient aux petites communautés).
- Bracelet ou billet numéroté - le client reçoit un bracelet ou un billet numéroté indiquant l'heure à laquelle il doit revenir à la clinique.
- Blocs de rendez-vous - prévoyez un bloc de temps pour les clients sans rendez-vous, les groupes spéciaux (personnes âgées, étudiants, membres de communautés éloignées et isolées, etc.).
Ces méthodes peuvent également permettre d'anticiper le volume de clients et les besoins en personnel, et de déterminer la disponibilité du vaccinNote de bas de page 108.
Conseils pratiques pour les communautés éloignées et isolées
- Envisagez la mise en place de stratégies visant à répondre aux besoins des personnes qui proviennent de l'extérieur de la communauté (p. ex. les personnes de communautés environnantes ou des Premières nations à l'extérieur des réserves).
- Envisagez d'offrir des visites à domicile aux personnes qui ne peuvent se rendre à une clinique de vaccination de masse (p. ex. les personnes confinées à la maison).
3.4 Stationnement et entrée
Les problèmes liés au stationnement et à l'accès peuvent être gérés par des bénévoles, qui dirigeront les clients vers l'entrée de la clinique tout en assurant la circulation. Envisagez les stratégies suivantes pour gérer les foules qui se forment sur place :
- Stationnement et circulation - des bénévoles dirigent et contrôlent les véhicules qui s'approchent et qui partent du terrain de stationnement.
- Files d'attente - séparez les clients en plusieurs files d'attente (p. ex. familles, personnes handicapées) et déterminez si une file express pourrait être appropriée pour certains groupes (p. ex. les travailleurs de la santé).
- Orientation de groupe - offrez de brèves séances en groupe pour fournir de l'information, répondre aux questions et remplir les formulaires.
- Mises à jour - faites une mise à jour fréquente des temps d'attente et des renseignements sur la disponibilité des vaccins afin de permettre aux clients de revenir plus tard.
Au moment d'établir les stratégies de gestion des foules, il importe également d'envisager des manières de maintenir le moral des clients en demeurant visibles et faciles d'approche autant que possible. Si les files d'attente sont longues, demandez au personnel de circuler et de répondre aux questions. Si cela est possible, prévoyez des divertissements pour les enfants. Prévoyez des sièges appropriés et des mesures particulières pour les clients qui ne peuvent rester debout longtemps.
3.5 Accueil et dépistage
Une fois que les clients sont entrés dans la clinique, il est important de les accueillir, de procéder à un dépistage de la maladie et de les aider au besoin (personnes âgées, personnes handicapées, etc.). Si des groupes prioritaires ont été désignés, on peut également déterminer l'admissibilité du client au vaccin. Toutes les questions d'ordre médical doivent être transmises au personnel formé disponible sur place.
3.6 Consentement et inscription
Au cours de l'inscription, déterminez les contre-indications qui pourraient entraîner un risque de maladie ou de réaction allergique et aiguillez le patient en conséquence (évaluation plus approfondie ou départ).
Il faut obtenir le consentement du client avant d'administrer le vaccin, conformément aux lois applicables en vigueur. Dans le cas des enfants qui ne sont pas en âge de donner leur consentement, il faut obtenir le consentement d'un parent ou d'un tuteur, conformément aux lois en vigueur. On recommande de se baser sur les pratiques existantes des programmes de vaccination systématique. Il est important que les clients qui envisagent de se faire vacciner reçoivent l'information nécessaire pour prendre une décision éclairée : information sur la maladie, le vaccin (y compris les composants et l'admissibilité), les avantages et les risques pour les personnes qui reçoivent le vaccin et celles qui ne le reçoivent pas, les contre-indications, les solutions de rechange et les effets indésirables possibles. Les clients doivent également avoir l'occasion de poser des questions.
Veuillez consulter les lois et les directives de la province ou du territoire pour obtenir de la documentation et connaître les protocoles de collecte, notamment en ce qui concerne la protection de la vie privée et de l'informationNote de bas de page 109. Si des méthodes électroniques sont utilisées, il est recommandé d'avoir en main des copies papier des formulaires dans l'éventualité d'une défaillance du matériel ou des logiciels, ou d'une panne de courantNote de bas de page 110.
3.7 Évaluation et vaccination
Une fois l'inscription terminée, les clients peuvent être vaccinés. Avant d'administrer le vaccin, le vaccinateur doit procéder à une évaluation préalable, conformément à la réglementation applicable et aux politiques des associations professionnelles de la province ou du territoire. Cette évaluation peut porter, sans toutefois s'y limiter, sur les éléments suivants : état de santé du client, compréhension du client de l'information fournie lors de l'inscription, examen et vérification du consentement avec le client, confirmation de l'absence de contre-indications à la vaccination ou de précautions particulières à prendre, et réponse aux questions restantes du client, s'il y a lieuNote de bas de page 111.
3.7.1 Préparation des vaccins
Idéalement, le vaccin doit être prélevé pour chaque client au moment de la vaccination. Toutefois, dans le contexte de cliniques de vaccination de masse, où un préremplissage pourrait être nécessaire pour assurer une administration rapide et efficace d'un vaccin unique à un grand nombre de personnes, les pratiques doivent comprendre ce qui suit :
- Entente préalable concernant la responsabilité professionnelle si le préremplissage des flacons et l'administration du vaccin sont faits par différentes personnes.
- Données sur la stabilité des produits préremplis pour une période donnée.
- Surveillance de la chaîne du froid.
Ne préparez que la quantité de vaccins préremplis nécessaire aux activités de clinique, en prenant soin d'utiliser les seringues préremplies aussitôt que possible. Un protocole clair doit être distribué aux personnel chargé de la vaccination.
Pour obtenir de plus amples renseignements sur la préparation et l'administration des vaccins, notamment les pratiques de prévention et de contrôle des infections, veuillez consulter le Guide canadien d'immunisation.
3.8 Après la vaccination
Après la vaccination, il est recommandé que les clients demeurent en observation à la clinique pendant au moins 15 minutes, pour permettre une surveillance des réactions immédiates au vaccin (p. ex. syncope et anaphylaxie). Dans le plan, on peut prévoir du personnel ou des bénévoles supplémentaires pour s'assurer que les clients respectent le délai d'attente. Certaines stratégies peuvent encourager les clients à rester jusqu'à la fin de la période d'attente : expliquer clairement les raisons qui justifient la période d'attente; offrir des rafraîchissements (p. ex. du café, du thé ou des boissons froides); offrir de la documentation pédagogique ou de promotion de la santé (traitant par exemple des stratégies de prévention des infections); fournir de l'information sur les soins après la vaccination, sur les effets secondaires courants de la vaccination (p. ex. rougeur au point d'injection, douleur au bras) et sur les procédures et les rendez-vous de suivi si une deuxième dose est nécessaire; remettre un dossier de vaccination une fois le délai d'attente terminéNote de bas de page 112. La période d'attente constitue également l'occasion pour les clients de remplir un formulaire d'évaluation de leur expérience de la clinique.
Le membre du personnel qui assurera la surveillance de la salle d'attente devrait être un professionnel de la santé possédant la formation et les compétences nécessaires pour reconnaître les réactions au vaccin et prendre les mesures appropriées (p. ex. il doit être capable de distinguer un évanouissement d'une réaction anaphylactique et intervenir en conséquence). Dans le cas des communautés de plus petite envergure, où les ressources humaines sont limitées, on peut envisager de former des bénévoles qui pourront porter les problèmes immédiatement à l'attention d'un professionnel de la santé sur place.
3.8.1 Prise en charge des événements indésirables
Bien qu'elle soit rare, une réaction anaphylactique peut se produire après la vaccination et doit être prise en charge rapidement et adéquatement. Les trousses d'urgence nécessaires pour prendre en charge les réactions anaphylactiques doivent être facilement et rapidement accessibles par le personnel de la clinique, et des protocoles doivent être mis en place pour assurer l'entretien de ces trousses. Une liste des éléments recommandés à ajouter à la trousse en cas de réaction anaphylactiqueNote de bas de page 113 est fournie dans le Guide canadien d'immunisation. Le personnel de la clinique doit recevoir une formation sur la reconnaissance et la prise en charge de tous les effets indésirables, y compris la réaction anaphylactique, la syncope et les réactions d'anxiété. Dans le plan de la clinique, les planificateurs peuvent prévoir une zone séparée pour les premiers soins et la prise en charge des effets indésirables. Les procédures cliniques pour la prise en charge des réactions anaphylactiques doivent être conformes aux protocoles de la province ou du territoire et doivent comprendre les numéros d'urgence, des directives médicales sur l'administration des médicaments appropriés et un plan clair pour assurer le transport des patients vers un établissement de santé.
3.8.2 Signalement
Les effets indésirables doivent être signalés conformément aux protocoles de déclaration des ESSI de la province ou du territoire. Le formulaire de déclaration des ESSI peut être obtenu auprès de la province ou du territoire, ou sur le site de l'ASPC, en anglais et en français.
Des formulaires de déclaration des ESSI doivent être disponibles aux postes de surveillance après la vaccination et être transmis conformément aux directives de la province ou du territoire.
4.0 Activités de désescalade et évaluations
4.1 Fermeture du site
Des plans de fermeture du site doivent être en place et les directives de fermeture doivent être suivies selon la date prévue, le volume ou les directives de la province ou du territoire. Il est important que le personnel et les bénévoles se familiarisent avec les procédures de fermeture et leurs rôles respectifs. Les activités de fermeture suivantes peuvent être envisagées :
- Communiquer la date de fermeture de la clinique au public, au personnel et aux partenaires.
- Déterminer comment les fournitures restantes seront entreposées et gérées (suivi des stocks).
- Discuter des protocoles de nettoyage avec les propriétaires du site et planifier l'élimination des déchets.
- Procédures de suivi des clients qui auront besoin d'une autre dose de vaccin une fois le point de service fermé.
- Assurer un suivi financier et effectuer les paiements.
4.2 Évaluation après la fermeture de la clinique
L'évaluation de la clinique est également un facteur important à prendre en considération dans la planification, puisqu'elle fournit des processus servant à évaluer et à documenter la réponse aux cliniques de vaccination de masse et à déterminer les aspects à améliorer. Il est important d'offrir au personnel et au public l'occasion d'évaluer leur expérience cliniqueNote de bas de page 114. Divers processus d'évaluation peuvent être utilisés, dont l'examen des notes de la clinique, des sondages officiels, des séances d'information et des sondages auprès des participants. Idéalement, les outils d'évaluation doivent être élaborés à l'avance et utilisés dans le cadre d'un processus continu tout au long de la clinique, afin d'apporter des ajustements en temps réel et pas seulement après la fermeture de la clinique. La collecte et l'analyse des évaluations doivent se faire rapidement afin d'éviter toute perte. Les appendices B3 et B4 offrent des exemples de formulaires d'évaluation destinés au personnel et au public.
Appendice B1 - Liste de fournitures requises pour la tenue d'une clinique de vaccination de masseNote de bas de page 115
Au moment de déterminer les besoins des cliniques en matière de fournitures, il faut tenir compte de la taille de la population à desservir et du nombre estimé de clients à immuniser par jour (voyez l'exemple « d'équipe dans une boîte », à la section 2.3.1).
| Élément | Quantité | Coût | Fournisseur | Commentaires |
|---|---|---|---|---|
| Fournitures des cliniques | ||||
| Seringues 3 mL de calibre 25, aiguille de 1 po | ||||
| Aiguilles de calibre 25 de 7/8 po | ||||
| Aiguilles de calibre 25 de 1 po | ||||
| Aiguilles de calibre 25 de 1 ½ po | ||||
| Aiguilles de calibre 18 de 1 po pour aspirer l'adjuvant | ||||
| Seringues à tuberculine 1 mL de calibre 25 | ||||
| Tampons d'alcool | ||||
| Pansements adhésifs | ||||
| Tampons d'ouate | ||||
| Gants jetables sans latex (tailles assorties) | ||||
| Gobelets de papier | ||||
| Dessus de table | ||||
| Désinfectant pour les mains | ||||
| Masques chirurgicaux | ||||
| Boîtes de papier mouchoir | ||||
| Blouses jetables | ||||
| Essuie-tout | ||||
| Sacs de papier (format lunch) | ||||
| Sparadrap hypoallergénique | ||||
| Lingettes désinfectantes | ||||
| Solution désinfectante | ||||
| Contenants pour objets tranchants et piquants (grand format) | ||||
| Contenants pour déchets biodangereux | ||||
| Sacs jaunes pour les matières biodangereuses | ||||
| Boîtes et sacs de transports isolants pour vaccins | ||||
| Blocs congelés ou réfrigérés | ||||
| Thermomètres maxima-minima | ||||
| Brassards de tensiomètre (pour enfants et pour adultes) | ||||
| Stéthoscope | ||||
| Adrénaline (épinéphrine) 1:1000 ou dispositifs EpiPen | ||||
| Benadryl (diphenhydramine) | ||||
| Lampe de poche | ||||
| Masque de poche pour enfant avec valve antireflux | ||||
| Masque de poche pour adulte avec valve antireflux | ||||
| Débarbouillettes | ||||
| Oreillers | ||||
| Couvertures | ||||
| Paniers à linge | ||||
| Sacs de transport | ||||
| Piles | ||||
| Cartouches d'encre de remplacement | ||||
| Numéros pour les clients qui font la file | ||||
| Numéros pour les postes de vaccination | ||||
| Blouses | ||||
| Bouteilles d'eau | ||||
| Bouteilles de jus | ||||
| Collations pour les clients qui attendent dans la salle de récupération | ||||
| Nourriture pour le personnel | ||||
| Fournitures administratives | ||||
| Planchette à pince | ||||
| Papier | ||||
| Ciseaux | ||||
| Surligneur | ||||
| Ruban adhésif | ||||
| Stylo | ||||
| Élastiques | ||||
| Blocs-notes | ||||
| Brocheuse | ||||
| Broches | ||||
| Corde | ||||
| Grandes enveloppes | ||||
| Timbres à date | ||||
| Autocollants pour l'heure d'administration | ||||
| Insignes d'identité | ||||
| Formulaires et panneaux | ||||
| Formulaire de consentement | ||||
| Formulaire de déclaration des réactions indésirables au vaccin | ||||
| Carte de vaccination | ||||
| Panneaux indicateurs | ||||
| Affiche laminée « Avant la vaccination » | ||||
| Affiche laminée « Procédure de la clinique » | ||||
| Affiche laminée « Aide-mémoire » | ||||
| Affiches | ||||
| Dépliants | ||||
| Fiche aide-mémoire sur la posologie en cas de réaction anaphylactique | ||||
| Description des tâches des bénévoles | ||||
| Papier pour fabriquer des affiches | ||||
| Rapports d'incidents | ||||
| Monographies de produits | ||||
| Manuels de formation | ||||
| Directives médicales de la province ou du territoire | ||||
| Guide canadien d'immunisation | ||||
| Papier | ||||
| Fournitures électroniques | ||||
| Ordinateurs portables | ||||
| Imprimante | ||||
| Serveur | ||||
| Télécopieur | ||||
| Téléphones cellulaires | ||||
| Accès Internet | ||||
| Photocopieur | ||||
| Rallonges électriques | ||||
| Ameublement (au besoin) | ||||
| Chaises | ||||
| Tables | ||||
| Lits de camp/matelas | ||||
| Cloisons de séparation | ||||
| Réceptacles à ordures | ||||
Appendice B2 - Organisation d'une clinique de vaccination de masse
L'organisation de la clinique variera selon la capacité du site et l'aménagement de la salle, mais elle devrait toutefois suivre une circulation unidirectionnelle logique. Si la clinique est organisée sur plusieurs sites, il est recommandé d'opter pour un aménagement standard afin d'éviter la confusion si le personnel travaille en rotation.
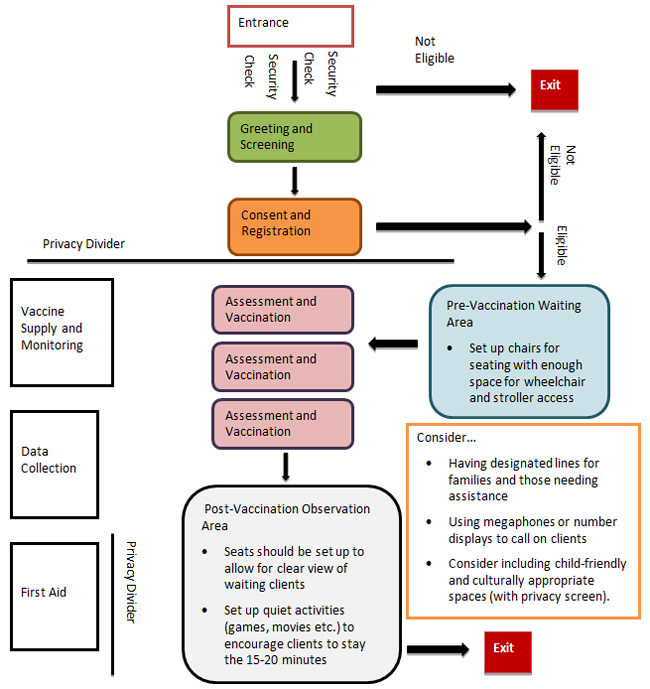
Figure B2 - Équivalent du texte
La figure représente le mode de fonctionnement d'une clinique à circulation unique vers chacun de ses postes.
- Entrée : Vérification de sécurité
- Si la personne n'est pas admissible, elle se rend à la sortie désignée, qui n'entrave pas la circulation vers les autres postes.
- Poste d'accueil et de vérification.
- Poste de consentement et d'inscription.
- Si la personne est admissible, elle se rend à Salle d'attente avant la vaccination.
- Si la personne n'est pas admissible, elle se rend à la sortie no 1 (qui n'entrave pas la circulation vers les autres postes)
Des cloisons séparent le poste 3 des autres postes de la clinique
- Salle d'attente avant la vaccination : Installer des chaises en laissant un couloir assez grand pour le passage des fauteuils roulants et des poussettes, et pour la faciliter les déplacements en général.
- Postes d'évaluation et de vaccination (la figure présente trois postes) - Des aires ou des pièces adjacentes, mais séparées, pour :
- L'approvisionnement en vaccins et la surveillance
- La collecte de données.
- Aire d'observation post-vaccination.
- Des chaises devraient être installées de façon à bien voir les clients qui attendent. Prévoir des activités tranquilles (jeux, films, etc.) pour encourager les clients à rester jusqu'à la fin de la période de 15 à 20 minutes.
- Après le temps d'attente écoulé, diriger les clients vers la sortie no 2.
- Poste de premiers soins : Séparé du poste 6 (Aire d'observation post-vaccination) par une cloison.
Aspects à considérer :
- Des files d'attente spéciales pour les familles et les personnes qui ont besoin d'aide.
- Utiliser des porte-voix ou un écran d'affichage à numéros pour appeler les clients.
- Offrir des espaces adaptés aux enfants et aux différentes cultures (séparés par des cloisons).
Appendice B3 - Échantillon Formulaire d'évaluation post-clinique à l'intention du personnel
- Quel était votre rôle dans le cadre de la clinique de vaccination?
- Était-ce votre première participation à une clinique de vaccination de masse?
- Oui
- Non
- La formation reçue dans le cadre de la clinique de vaccination de masse était-elle adéquate? Si la réponse est non, quelle autre formation aurait été nécessaire?
- Oui
- Non
- Avez-vous compris votre rôle et votre responsabilité? Si la réponse est non, quelle autre formation aurait été nécessaire?
- Oui
- Non
- Votre superviseur était-il accessible lorsque vous en aviez besoin? Si la réponse est non, qu'est-ce qui pourrait améliorer l'accessibilité?
- Oui
- Non
- La chaîne de communication était-elle claire? Si la réponse est non, quels sont les aspects qui pourraient être améliorés à cet égard?
- Oui
- Non
- Avez-vous été avisé des changements et des mises à jour concernant les activités de la clinique? Si la réponse est non, quels sont les aspects qui pourraient être améliorés à cet égard?
- Oui
- Non
- Comment évalueriez-vous le site de vaccination en général?
- Excellent
- Bien
- Correct
- Médiocre
Expliquez les facteurs qui ont contribué à cette évaluation.
- Quel a été le plus grand défi rencontré personnellement au cours de votre participation à la clinique de vaccination de masse?
- Selon vous, quels ont été les problèmes rencontrés par le site de vaccination?
- Quels ont été les éléments positifs pour votre site de vaccination?
- Avez-vous des suggestions pour améliorer les cliniques de vaccination de masse?
Appendice B4 - Échantillon Formulaire d'évaluation à l'intention du public
Veuillez remplir le formulaire d'évaluation suivant pour nous guider et nous aider à améliorer les prochaines cliniques de vaccination de masse. Vos commentaires resteront anonymes et ne seront utilisés que pour déterminer les aspects à améliorer et les pratiques les plus efficaces. Nous vous remercions à l'avance de prendre le temps de remplir le présent formulaire.
- Sexe, Veuillez préciser
- Âge
- 18-24
- 25-29
- 30-39
- 40-49
- 50-59
- 60-69
- 70+
- Ville de résidence
- Avez-vous été vacciné(e) aujourd'hui?
- Oui
- Non
- Êtes-vous venu(e) à la clinique avec une autre personne qui a été vaccinée aujourd'hui? Cochez toutes les réponses qui s'appliquent.
- Non, je suis venu(e) seul(e)
- Enfants à charge
- Conjoint(e)
- Personnes âgées
- Autre
- Comment avez-vous entendu parler de la clinique? Cochez toutes les réponses qui s'appliquent.
- Journaux
- Annonce publique
- Affiche
- Infirmière en santé communautaire
- Radio
- Infirmière de soins à domicile
- Collègue/ami(e)/membre de la famille
- Autre
- Avez-vous reçu suffisamment d'information sur le vaccin avant de le recevoir?
- Y a-t-il autre chose que vous auriez aimé savoir sur la maladie ou le vaccin?
- Est-ce que la clinique était bien située?
- Oui
- Non
Si la réponse est non, quel endroit aurait été plus approprié pour tenir la clinique?
- Quels sont les facteurs qui vous ont le plus motivé(e) à vous faire vacciner aujourd'hui? Cochez toutes les réponses qui s'appliquent.
- Vaccin gratuit
- Inquiétude concernant ma santé
- Recommandation de mon médecin
- Inquiétude concernant la santé des autres
- Moment propice
- Préparation à une situation d'urgence
- Emplacement pratique
- Autre
- Combien de temps avez-vous attendu approximativement avant de recevoir le vaccin?
- Le délai d'attente a été :
- plus court que prévu
- environ ce que j'avais prévu
- un peu plus long que prévu, mais raisonnable
- déraisonnable
- Êtes-vous satisfait(e) des soins que vous avez reçus à la clinique?
- Avez-vous des suggestions pour améliorer la circulation dans la clinique?
- Qu'avez-vous aimé de la clinique?
- Qu'avez-vous moins aimé de la clinique?
Notes de bas de page
- Note de bas de page 1
-
Sander B, Bauch CT, Fisman D, et al. Is a mass immunization program for pandemic (H1N1) 2009 good value for money? Evidence from the Canadian experience. Vaccine 2010;28:6210-20.
- Note de bas de page 2
-
Borse RH, Shrestha S, Fiore AE, et al. Effects of vaccine program against pandemic influenza A(H1N1) virus, United States, 2009-2010. Emerg Infect Dis 2013;19(3):439-48.
- Note de bas de page 3
-
Agence européenne des médicaments. Guideline on adjuvants in vaccines for human use. EMEA/CHMP/VEG/1347!6?2004. Disponible à l'adresse suivante : http://www.emea.europa.eu/docs/en_GB/document_library/Scientific_guideline/ 2009/11/WC500015469.pdf (en anglais uniquement)
- Note de bas de page 4
-
Walker WT, Faust SN. Monovalent inactivated split-virion AS03-adjuvanted pandemic influenza A (H1N1) vaccine. Expert Rev Vaccines 2010;9(12):1385-98.
- Note de bas de page 5
-
Widgren K, Magnussen M, Hagstam P, et al. Prevailing effectiveness of the 2009 influenza A(H1N1)pdm09 vaccine during the 2010/11 season in Sweden. Euro Surveill 2013;18(15):20447. Disponible à l'adresse suivante : http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=20447 (en anglais uniquement).
- Note de bas de page 6
-
Conway JM, Tuite AR, Fisman DN, et al. Vaccination against 2009 pandemic H1N1 in a population dynamical model of Vancouver, Canada: timing is everything. BMC Public Health 2011;11:932. doi: 10.1186/1471-2458-11-932.
- Note de bas de page 7
-
Scheifele DW, Ward BJ, Dionne M, et al. Evaluation of adjuvanted pandemic H1N1(2009) influenza vaccine after one and two doses in young children. Pediatr Infect Dis J 2011;30(5):402-7.
- Note de bas de page 8
-
Cooper C, Klein M, Walmsley S, et al. High-level immunogenicity is achieved vaccine with adjuvanted pandemic H1N1(2009) and improved with booster dosing in a randomized trial of HIV-infected adults. HIV Clin Trials 2012;13(1):23-32.
- Note de bas de page 9
-
Rubinstein E, Predy G, Sauvé L, et al. The responses of Aboriginal Canadians to adjuvanted pandemic (H1N1) 2009 influenza vaccine. CMAJ 2011;183(13):E1033-7. doi: 10.1503/cmaj.110196. Publication électronique, 25 juillet 2011.
- Note de bas de page 10
-
Yin JK, Khandaker G, Rashid H, et al. Immunogenicity and safety of pandemic A (H1N1) 2009 vaccine: systematic review and meta-analysis. Influenza Other Respir Viruses 2011;5(5):299-305.
- Note de bas de page 11
-
Skowronski DM, Janjua NZ, De Serres, et al. Effectiveness of AS03-adjuvanted pandemic H1N1 vaccine: case-control evaluation based on sentinel surveillance in Canada, autumn 2009. BMJ 2011;324:C7297.
- Note de bas de page 12
-
Van Buynder PG, Dhaliwal JK, Van buynder JL, et al. Protective effect of single-dose adjuvanted pandemic influenza vaccine in children. Influenza Other Respir Viruses 2010;4(4):171-8.
- Note de bas de page 13
-
Mahmud S, Hammond G, Elliott L, et al. Effectiveness of the pandemic H1N1 influenza vaccines against laboratory-confirmed H1N1 infections: population-based case-control study. Vaccine 2011;29(45):4975-81. Publication électronique, 30 août 2011.
- Note de bas de page 14
-
Borse et al. Op. cit.
- Note de bas de page 15
-
De Serres G, Gariepy MC, Coleman B, et al. Short and long-term safety of the 2009 AS03-adjuvanted pandemic vaccine. PLoS ONE 2012;7:e38563.
- Note de bas de page 16
-
Yin et al. Op. cit.
- Note de bas de page 17
-
Romio S, Weibel D, Dieleman JP, et al. Guillain-Barre syndrome and adjuvanted pandemic influenza A (H1N1) vaccines: a multinational self-controlled case series in Europe. PLoS ONE 2013:e82222.
- Note de bas de page 18
-
De Wals P, Deceuninck G, Toth E, et al. Risk of Guillain-Barré syndrome following H1N1 influenza vaccination in Quebec. JAMA 2012;308;175-81.
- Note de bas de page 19
-
Nohynek H, Jokinen J, Partinen M et al., AS03 adjuvanted AH1N1 vaccine associated with an abrupt increase in the incidence of childhood narcolepsy in Finland. PLoS ONE 2012;7(3):e33536.
- Note de bas de page 20
-
European Centre for Disease Control. Narcolepsy in association with pandemic influenza vaccination (a multi-country European epidemiological investigation) [Internet]. 2012. Disponible à l'adresse suivante : http://www.ecdc.europa.eu/en/publications/publications/ vaesco%20report%20final%20with%20cover.pdf (en anglais uniquement).
- Note de bas de page 21
-
Wijnans L, Lecomte C, de Vries C, et al. The incidence of narcolepsy in Europe: before, during, and after the influenza A(H1N1)pdm09 pandemic and vaccination campaigns. Vaccine 2013;31(8):1246-54.
- Note de bas de page 22
-
Barker CIS, Snape MD. Pandemic influenza A H1N1 vaccines and narcolepsy: vaccine safety surveillance in action. Lancet Infect Dis 2014;14:227-38.
- Note de bas de page 23
-
Montplaisir J, Petit D, Quinn MJ, et al. Risk of narcolepsy associated with inactivated adjuvanted (AS03) A/H1N1 (2009) pandemic influenza vaccine in Quebec. PLos ONE 2014;9:e108489.
- Note de bas de page 24
-
Keller-Stanislawski B, Englund JA, Kang G, et al. Safety of immunization during pregnancy: a review of the evidence of selected inactivated and live attenuated vaccines. Vaccine 2014;32;7057-64.
- Note de bas de page 25
-
Richards JL, Hansen C, Bredfeldt C, et al. Neonatal outcomes after antenatal immunization during the 2009 H1N1 influenza pandemic: impact on preterm birth, birth weight, and small for gestational age birth. Clin Infect Dis 2013;56(9):1216-22. Doi: 10.1093/cid/cit045. Publication électronique, 1er février 2013.
- Note de bas de page 26
-
Fell DB, Sprague AE, Liu N, et al. H1N1 influenza vaccination during pregnancy and fetal and neonatal outcomes. Am J Public Health 2012;102:e33-e40.
- Note de bas de page 27
-
Gagnon R, Pimeau MN, Des Roches A, et al. Safe vaccination of patients with egg allergy with an adjuvanted pandemic H1N1 vaccine. J Allergy Clin Immunol 2010;126(2):317-23. Publication électronique, 25 juin 2010.
- Note de bas de page 28
-
Gilca V, De Serres G, Hamelin ME, et al. Antibody persistence and response to 2010-2011 trivalent influenza vaccine one year after a single dose of 2009 AS03-adjuvanted pandemic H1N1 vaccine in children. Vaccine 2011;30(1):35-41. Publication électronique, 7 novembre 2011.
- Note de bas de page 29
-
Widgren et al. Op. cit.
- Note de bas de page 30
-
Scheifele DW, Ward BJ, Doinne M, et al. Compatibility of ASO3-adjuvanted H1N1pdm09 and seasonal trivalent influenza vaccines in adults: results of a randomized, controlled trial. Vaccine 2012;30(32):4728-32. Publication électronique, 28 mai 2012.
- Note de bas de page 31
-
Langley JM, Scheifele DW, Quach C, et al. Safety and immunogenicity of 2010-2011 H1N1 2009-containing trivalent inactivated influenza vaccine in children 12-59 months of age previously given AS03-adjuvanted H1N1 2009 pandemic vaccine: a PHAC/CIHR Influenza Research Network (PCIRN) study. Vaccine 2012;30(23):3389-94. Publication électronique, 30 mars 2012.
- Note de bas de page 32
-
Scheifele DW, Ward BJ, Dionne M, et al. Compatibility of AS03-adjuvanted H1N1pdm09 and seasonal trivalent influenza vaccines in adults: results of a randomized, controlled trial. Vaccine 2012;30(32);4728-32. Publication électronique, 28 mai 2012.
- Note de bas de page 33
-
Skowronski DM, De Serres G, Crowcroft NS, et al. Association between the 2008-09 seasonal influenza vaccine and pandemic H1N1 illness during spring-summer 2009: four observational studies from Canada. PLoS Med 2010;7(4):e1000258.
- Note de bas de page 34
-
Viboud C, Simonsen L. Does seasonal influenza vaccine increase the risk of illness with the 2009 A/H1N1 pandemic virus? PloS Med 2010;7(4);e1000259.
- Note de bas de page 35
-
Agence de la santé publique du Canada. Leçons à retenir : Réponse de l'Agence de la santé publique du Canada et de Santé Canada à la pandémie de grippe H1N1 de 2009. Novembre 2010. Disponible à l'adresse suivante : http://www.phac-aspc.gc.ca/about_apropos/evaluation/reports-rapports/2010-2011/h1n1/index-fra.php.
- Note de bas de page 36
-
Ibid.
- Note de bas de page 37
-
Comité sénatorial permanent des affaires sociales, des sciences et de la technologie. La réponse du Canada à la Pandémie de grippe H1N1 de 2009. Décembre 2010. Disponible à l'adresse suivante : http://www.parl.gc.ca/Content/SEN/Committee/403/soci/rep/rep15dec10-f.pdf.
- Note de bas de page 38
-
Racine T. 2009 influenza A/H1N1 mass vaccination strategy: a multinational comparison. Centre de collaboration nationale des maladies infectieuses. Juillet 2012. Disponible à l'adresse suivante : https://nccid.ca/publications/2009-influenza-ah1n1-mass-vaccination-strategy-a-multinational-comparison/ (en anglais uniquement).
- Note de bas de page 39
-
Agence de la santé publique du Canada. Partie 4. Agents d'immunisation actifs : Vaccin antigrippal. Dans : Guide canadien d'immunisation. Disponible à l'adresse suivante : http://www.phac-aspc.gc.ca/publicat/cig-gci/p04-influenza-fra.php.
- Note de bas de page 40
-
Organisation mondiale de la Santé. Pandemic influenza risk management - WHO interim guidance. 2013. Disponible à l'adresse : http://www.who.int/influenza/preparedness/pandemic/influenza_risk_management/en/index.html (en anglais uniquement).
- Note de bas de page 41
-
Centers for Disease Control and Prevention. CDC guidelines for large-scale influenza vaccination clinic planning. 2011. Disponible à l'adresse suivante : http://www.cdc.gov/flu/professionals/vaccination/vax_clinic.htm (en anglais uniquement).
- Note de bas de page 42
-
Racine T. Op cit.
- Note de bas de page 43
-
Institute of Medicine. The 2009 H1N1 influenza vaccination campaign - summary of a workshop series. Octobre 2010. Disponible à l'adresse suivante : https://www.nap.edu/read/12992/chapter/1#xiii (en anglais uniquement).
- Note de bas de page 44
-
Brien S, Kwong JC, Buckeridge DL. The determinants of 2009 pandemic A/H1N1 influenza vaccination: a systematic review. Vaccine 2012;30(7):1255-64. Publication électronique, 31 décembre 2011.
- Note de bas de page 45
-
Bish A, Yardley l, Nicoll A, et al. Factors associated with uptake of vaccination against pandemic influenza: a systematic review. Vaccine 2011;29(38):6472-84. Publication électronique, 12 juillet 2011.
- Note de bas de page 46
-
Prematunge C, Corace K, McCarthy A, et al. Factors influencing pandemic influenza vaccination of healthcare workers - a systematic review. Vaccine 2012;30:4733-43. Publication électronique, 27 mai 2012.
- Note de bas de page 47
-
Instituts de recherche en santé du Canada. À propos de l'application des connaissances aux IRSC. Novembre 2012. Accessible à l'adresse suivante : http://www.cihr-irsc.gc.ca/f/29418.html.
- Note de bas de page 48
-
Erickson LJ, De Wals P, Farand L. An analytical framework for immunization programs in Canada. Vaccine 2005;23:2468-74.
- Note de bas de page 49
-
Glezen WP. Emerging infections: pandemic influenza. Epidemiol Rev 1996;18(1):64-76.
- Note de bas de page 50
-
Tuite AR, Fisman DN, Kwong JC, Greer AL. Optimal pandemic influenza allocation strategies for the Canadian population. PLoS ONE 2010;5:e10520.
- Note de bas de page 51
-
Conway JM, Tuite AR, Fisman DN, et al. Vaccination against 2009 pandemic H1N1 in a population dynamic model of Vancouver, Canada: timing is everything. BMC Public Health 2011;11:932.
- Note de bas de page 52
-
Goldstein E, Wallinga J, Lipsitch M. Vaccine allocation in a declining epidemic. J R Soc Interface 2012;9:2798-803.
- Note de bas de page 53
-
Araz OM, Galvani A, Meyers LA. Geographic prioritization of distributing pandemic influenza vaccines. Health Care Manag Sci 2012;15:175-87.
- Note de bas de page 54
-
Laskowski M, Duvvuri VR, Buckeridge DL, et al. Influenza H3N2 variant viruses with pandemic potential: preventing catastrophe in remote and isolated Canadian communities. Prev Med 2013. Publication électronique, 28 avril 2013.
- Note de bas de page 55
-
Agence de la santé publique. Guide canadien d'immunisation. Disponible à l'adresse suivante : http://www.phac-aspc.gc.ca/publicat/cig-gci/p04-influenza-fra.php#ru.
- Note de bas de page 56
-
Dans le contexte de ce cadre, on définit les enfants et adultes en santé comme la catégorie des enfants et les adultes ne présentant aucune affection sous-jacente et non comme une catégorie basée sur l'âge.
- Note de bas de page 57
-
Sécurité publique Canada. Infrastructures essentielles. Disponible à l'adresse suivante : https://www.securitepublique.gc.ca/cnt/ntnl-scrt/crtcl-nfrstrctr/index-fr.aspx
- Note de bas de page 58
-
Agence de la santé publique du Canada. Guide canadien d'immunisation. Disponible à l'adresse suivante : http://www.phac-aspc.gc.ca/publicat/cig-gci/p04-influenza-fra.php#ru.
- Note de bas de page 59
-
CanPREP. CanPREP policy briefs. 2009. Disponible à l'adresse suivante : http://www.jcb.utoronto.ca/news/documents/CanPREP_Policy_Briefs_FINAL.pdf (en anglais uniquement).
- Note de bas de page 60
-
Ritvo P, Perez,DF, Wilson K, et al. Canadian national surveys on pandemic influenza preparations: pre-pandemic and peri-pandemic findings. BMC Public Health 2013;13:271.
- Note de bas de page 61
-
Bailey TM, Haines C, Rosychuk RJ, et al. Public engagement on ethical principles in allocating scarce resources during an influenza pandemic. Vaccine 2011;29:3111-7.
- Note de bas de page 62
-
Les Associés de recherche EKOS Inc. pour l'Agence de la santé publique du Canada. Dialogue sur l'utilisation d'antiviraux à des fins de prévention. Rapport final des résultats. 31 mars 2007. Disponible à l'adresse suivante : http://www.phac-aspc.gc.ca/influenza/ekos-fra.php (rapport complet disponible en anglais uniquement).
- Note de bas de page 63
-
Institute of Medicine.Public engagement on facilitating access to antiviral medications and information in an influenza pandemic: workshop series summary. 2012. Disponible à l'adresse suivante : https://www.nap.edu/catalog/13404/public-engagement-on-facilitating-access-to-antiviral-medications-and-information-in-an-influenza-pandemic (en anglais uniquement)
- Note de bas de page 64
-
Agence de la santé publique du Canada. Cliniques de vaccination de masse dans les collectivités éloignées et isolées. Document d'orientation de l'ASPC. 2009 (avec la reconnaissance du programme First Nation and Inuit Health Saskatchewan Region Mass Immunization Plan for H1N1 Vaccine) (document archivé).
- Note de bas de page 65
-
Mackie C. Mass distribution and vaccination clinics (présentation PowerPoint). Public Health CBRN Training Course. Centre for Excellence in Emergency Preparedness. Disponible à l'adresse suivante : www.ceep.ca/education/MassVaccinations.ppt (en anglais uniquement).
- Note de bas de page 66
-
Opondo J, Wright J, Grauer K, et al. Medical Health Officer's report on the Saskatoon Health Region's response to the global influenza pandemic 2009-2010. Saskatoon: Saskatoon Health Region, 2011. Disponible à l'adresse suivante : https://www.saskatoonhealthregion.ca/locations_services/Services/Health-Observatory/Documents/Reports-Publications/MHOH1N1Report_Final.pdf (en anglais uniquement)
- Note de bas de page 67
-
Ministère de la Santé et des Soins de longue durée. Plan ontarien de lutte contre la pandémie de grippe - Chapitre 7 : Vaccination. Gouvernement de l'Ontario, 2013. Disponible à l'adresse suivante : http://www.health.gov.on.ca/fr/pro/programs/emb/pan_flu/docs/ch_07.pdf
- Note de bas de page 68
-
Unité de santé du district de Simcoe Muskoka. Pandemic influenza plan; Part II-2 Vaccine and antivirals. Appendix A: Mass immunization plan. 2010. Disponible à l'adresse suivante : http://www.simcoemuskokahealth.org/Libraries/TOPIC_InfectiousDisease/ SMDHU_PIP_September_2010.sflb.ashx (en anglais uniquement).
- Note de bas de page 69
-
Ministère de la Santé et des Soins de longue durée (Ontario). Op. cit.
- Note de bas de page 70
-
Peterborough County-City Health Unit. Pandemic influenza plan. Annex A: Mass vaccination plan. 2013. Disponible à l'adresse suivante : http://www.peterboroughpublichealth.ca/wp-content/uploads/2011/10/Mass_Vaccination_Annex_A_July2015.pdf (en anglais uniquement).
- Note de bas de page 71
-
Bureau du médecin-hygiéniste en chef. Campagne de vaccination de 2009 contre la pandémie de grippe H1N1 - Rapport après action. Gouvernement du Nouveau-Brunswick. Disponible à l'adresse suivante : http://www2.gnb.ca/content/dam/gnb/Departments/h-s/pdf/fr/Publications/CampagneContrePandemieH1N1RapportApresAction.pdf.
- Note de bas de page 72
-
Centers for Disease Control and Prevention. CDC guidelines for large-scale influenza vaccination clinic planning. 2011. Disponible à l'adresse suivante : http://www.cdc.gov/flu/professionals/vaccination/vax_clinic.htm (en anglais uniquement).
- Note de bas de page 73
-
Bureau du médecin hygiéniste en chef (Nouveau-Brunswick). Op. cit.
- Note de bas de page 74
-
Terriplan Consultants. Evaluation of the Department of Health and Social Services planning and response to the H1N1 pandemic: final evaluation report.
- Note de bas de page 75
-
Bureau de santé publique de Toronto. Toronto Public Health plan for an influenza pandemic. 2011. Disponible à l'adresse suivante : http://www.toronto.ca/health/pandemicflu/pdf/pandemicflu_2011_plan.pdf (en anglais uniquement).
- Note de bas de page 76
-
Ministère de la Santé (Colombie-Britannique). BC pandemic influenza preparedness plan: Annex D [Internet]. Vancouver (C.-B.) : gouvernement de la Colombie-Britannique; 2005. Disponible à l'adresse suivante : http://www.bccdc.ca/resource-gallery/Documents/Epid_Guidelines_PandemicPlan_20090609.pdf (en anglais uniquement).
- Note de bas de page 77
-
Bureau du médecin hygiéniste en chef (Nouveau-Brunswick). Op. cit.
- Note de bas de page 78
-
Ministère de la Santé (Colombie-Britannique). Op. cit.
- Note de bas de page 79
-
Masotti P, Birtwhistle R, Gemmill I, et al. pH1N1: implications for practice, policy and research. Phase 2: the pH1N1 Symposium. Kingston, Frontenac and Lennox and Addington Public Health Unit & Centre for Studies in Primary Care, Queens University, 2010. Disponible à l'adresse suivante : http://www.controlauto.com.pt/Files/Research/ pH1N1_Symposium_Report_Masotti_et_al_pH1N1_ Implications_for_Practice_Policy_and_Research_Nov_2011.pdf (en anglais uniquement).
- Note de bas de page 80
-
Bureau du médecin hygiéniste en chef (Nouveau-Brunswick). Op. cit.
- Note de bas de page 81
-
Rambhia JK, Watson M, Sell TK, et al. Mass vaccination for the 2009 H1N1 pandemic: approaches, challenges, and recommendations. Biosecur Bioterr 2010;8:321-30. Publication électronique, 2 novembre 2010.
- Note de bas de page 82
-
Australia Department of Health and Aging, Review of Australia's health sector response to pandemic (H1N1) 2009: lessons identified. 2011. Disponible à l'adresse suivante : https://www.health.gov.au/internet/publications/publishing.nsf/Content/review-2011-l/$File/lessons%20identified-oct11.pdf (en anglais uniquement).
- Note de bas de page 83
-
Masotti P, et al. 2010. Op. cit.
- Note de bas de page 84
-
Comité sénatorial permanent des affaires sociales, des sciences et de la technologie. La réponse du Canada à la Pandémie de grippe H1N1 de 2009. Décembre 2010. Disponible à l'adresse suivante : http://www.parl.gc.ca/content/sen/committee/403/soci/rep/rep15dec10-f.pdf
- Note de bas de page 85
-
Rambhia JK, et al. Op. cit.
- Note de bas de page 86
-
Centers for Disease Control and Prevention. CDC guidelines for large-scale influenza vaccination clinic planning. Op. cit.
- Note de bas de page 87
-
Mackie C. Op. cit.
- Note de bas de page 88
-
Advancing practice. Immunization competencies education program. 2013. Disponible à l'adresse suivante : http://www.advancingpractice.com/p-85-education-program-for-immunization-competencies.aspx.
- Note de bas de page 89
-
Bureau du médecin-hygiéniste en chef (Colombie-Britannique). B.C.'s response to the H1N1 pandemic. Gouvernement de la Colombie-Britannique. Disponible à l'adresse suivante : http://www.health.gov.bc.ca/pho/pdf/ PHO_Report_BC_Response_to_the_H1N1_Pandemic_June2010.pdf.
- Note de bas de page 90
-
Terriplan Consultants. Op. cit.
- Note de bas de page 91
-
Bureau de santé publique de Toronto. Op. cit.
- Note de bas de page 92
-
Ministère de la Santé et des Soins de longue durée (Ontario). Op. cit.
- Note de bas de page 93
-
Terriplan Consultants. Evaluation of the Department of Health and Social Services planning and response to the H1N1 pandemic: final evaluation report. Government of the Northwest Territories, 2010. Disponible à l'adresse suivante : http://www.hss.gov.nt.ca/sites/default/files/ pan_territorial_pandemic_planning_project_environmental_scan_report.pdf (en anglais uniquement).
- Note de bas de page 94
-
Gouvernement du Manitoba. H1N1 flu in Manitoba: Manitoba's response, lessons learned. Gouvernement du Manitoba, 2010. Disponible à l'adresse suivante : http://www.gov.mb.ca/health/documents/h1n1.pdf (en anglais uniquement).
- Note de bas de page 95
-
Bureau du médecin hygiéniste en chef (Nouveau-Brunswick). Op. cit.
- Note de bas de page 96
-
Terriplan Consultants. Op. cit.
- Note de bas de page 97
-
Terriplan Consultants. Op. cit.
- Note de bas de page 98
-
Bureau du médecin-hygiéniste en chef (Colombie-Britannique). Op. cit.
- Note de bas de page 99
-
Massachusetts Department of Public Health. General protocols for vaccine storage, administration, standing orders and mass immunization clinics. Division of Epidemiology and Immunization, 2009. Disponible à l'adresse suivante : http://www.mass.gov/eohhs/docs/dph/cdc/immunization/mso-protocols-general.pdf (en anglais uniquement).
- Note de bas de page 100
-
Centre de contrôle des maladies de la Colombie-Britannique. British Columbia's pandemic influenza response plan (2012): pandemic influenza vaccine storage, transfer and security plan. 2012. Disponible à l'adresse suivante : http://www.health.gov.bc.ca/pandemic/response/pdf/bc-pandemic-influenza-vaccine-storage-transfer-security-plan.pdf (en anglais uniquement).
- Note de bas de page 101
-
Agence de la santé publique du Canada. Lignes directrices nationales sur l'entreposage et la manipulation des vaccins pour les vaccinateurs - 2015 Disponible à l'adresse suivante : http://canadiensensante.gc.ca/publications/healthy-living-vie-saine/vaccine-storage-entreposage-vaccins/index-fra.php.
- Note de bas de page 102
-
Unité de santé du comté et de la ville de Peterborough. Peterborough County-City Health Unit Pandemic Influenza Plan. Annex A: Mass vaccination plan. Peterborough (Ontario) : Unité de santé du comté et de la ville de Peterborough; 2015. Disponible à l'adresse suivante : http://www.peterboroughpublichealth.ca/my-home-environment/my-community/pandemic-planning/ (en anglais uniquement).
- Note de bas de page 103
-
Bureau du médecin hygiéniste en chef (Nouveau-Brunswick). Op. cit.
- Note de bas de page 104
-
Unité de santé du district de Perth. Perth County influenza pandemic plan. Chapter 6: mass vaccination and antivirals. 2006. Disponible à l'adresse suivante : http://www.pdhu.on.ca/health_topics.php?id=378.
- Note de bas de page 105
-
Porter D, Hal, M, Hartl B, et al. Local health department 2009 H1N1 influenza vaccination clinics - CDC staffing model comparison and other best practices. J Public Health Manag Pract 2011;17: 530-3.
- Note de bas de page 106
-
Rambhia JK, et al. Op. cit.
- Note de bas de page 107
-
Unité de santé du district de Simcoe Muskoka. Op. cit.
- Note de bas de page 108
-
108 Bureau du médecin hygiéniste en chef (Nouveau-Brunswick). Op. cit.
- Note de bas de page 109
-
Agence de la santé publique du Canada. Compétences en immunisation à l'intention des professionnels de la santé. 2008. Disponible à l'adresse suivante : http://www.phac-aspc.gc.ca/im/pdf/ichp-cips-fra.pdf.
- Note de bas de page 110
-
Unité de santé du district de Simcoe Muskoka. Op. cit.
- Note de bas de page 111
-
Agence de la santé publique du Canada. Guide canadien d'immunisation. Partie 1. Information clé sur l'immunisation : méthodes d'administration des vaccins. 2013. Disponible à l'adresse suivante : https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-1-information-cle-immunisation/page-8-methodes-administration-vaccins.html
- Note de bas de page 112
-
112 Ibid.
- Note de bas de page 113
-
Agence de la santé publique du Canada. Guide canadien d'immunisation. Partie 2. Innocuité des vaccins : réactions précoces à la vaccination, dont l'anaphylaxie. Disponible à l'adresse suivante : http://www.phac-aspc.gc.ca/publicat/cig-gci/p02-03-fra.php
- Note de bas de page 114
-
Stroud C, Nadig L, Altevogt BM. The 2009 H1N1 influenza vaccination campaign: summary of a workshop series. Institute of Medicine, 2010.
- Note de bas de page 115
-
Unité de santé du comté et de la ville de Peterborough. Op. cit.
Détails de la page
- Date de modification :