Analyse approfondie: maladie respiratoire humaine associée au coronavirus du syndrome respiratoire du Moyen-Orient

Télécharger le format de rechange
(Format PDF, 1,6 Mo, 21 pages)
Organisation : Agence de la santé publique du Canada
Publiée : 2018-08-09
Coronavirus du syndrome respiratoire du Moyen-Orient (SRMO-CoV)
En mars 2018, 17 nouveaux cas de syndrome respiratoire du Moyen-Orient (SRMO) ont été signalés. La majorité des nouveaux cas ont été signalés en Arabie saoudite (n = 16). Au total, 2 183 cas de coronavirus du syndrome respiratoire du Moyen-Orient (SRMO-CoV), dont au moins 760 décès, ont été signalés dans le monde depuis 2012. Pour de plus amples renseignements, veuillez consulter la section d'analyse approfondie ci-dessous.
Risque pour le Canada
L'Agence de la santé publique du Canada (ASPC) a effectué une évaluation des risques pour le SRMO-CoV. À ce jour, aucun cas n'a été signalé au Canada et le risque que présente le SRMO-CoV est considéré comme faible pour la santé publique des Canadiens selon les données disponibles pour le moment. On s'attend à ce que de nouveaux cas d'infection par le SRMO-CoV soient signalés au Moyen-Orient et il est probable que des cas continueront d'être exportés vers d'autres pays par des personnes susceptibles d'être infectées à la suite d'une exposition à un animal (chameaux) ou à une source humaine. La transmission interhumaine du virus a été faible et limitée à seulement quelques générations d'infection, avec une amplification occasionnelle dans les milieux de soins de santé. Il est donc important que les établissements de santé, les laboratoires de recherche et les professionnels de la santé publique restent vigilants dans la mise en œuvre et le respect systématiques des mesures de prévention et de contrôle des infections (PCI).
Des documents d'orientation, y compris un avis de santé publique, des conseils de santé aux voyageurs, des lignes directrices sur les mesures de PCI, des avis de biosécurité, des lignes directrices sur la gestion des cas et des contacts, et des définitions de cas sont disponibles sur le site Web gouvernement du Canada.
Contents
- Contexte
- Source d'exposition
- Caractéristiques du virus
- Manifestations cliniques
- Résumé de la situation: de janvier à mars 2018
- Analyse épidémiologique globale
- Répartition par âge et sexe
- Répartition temporelle
- Répartition géographique
- Vaccins contre le SRMO-CoV
- Limites
- Conclusion
- References
De Bulletin des agents pathogènes des voies respiratoires émergents numéro 15 (avril 2018).
Contexte
Le 13 juin 2012, un Saoudien âgé de 60 ans a été admis dans un hôpital privé de Jeddah, en Arabie saoudite, après s'être plaint de symptômes respiratoires (toux, expectoration, essoufflement et fièvre)Note de bas de page 1Note de bas de page 2. Onze jours après son admission, le 24 juin 2012, il est décédé d'une insuffisance respiratoire et rénale progressiveNote de bas de page 1. L'enquête sur l'agent étiologique responsable de sa maladie a débuté au laboratoire rattaché à l'hôpital. Après deux mois d'essais sur des isolats cliniques provenant du patient pour détecter divers virus (virus grippal A, virus grippal B, para-influenza, paramyxovirus, hantavirus, entérovirus et adénovirus), l'isolat a été testé pour le coronavirus à l'aide d'un test RT-PCR pancoronavirusNote de bas de page 3. Le test était positif, mais s'est avéré négatif pour les amorces spécifiques du SRAS, suggérant la découverte d'un nouveau coronavirusNote de bas de page 3. Le 20 septembre 2012, après la confirmation par un autre laboratoire (le centre médical Erasmus), la découverte d'un nouveau coronavirus a été annoncée par ProMEDNote de bas de page 3Note de bas de page 4. Ce coronavirus, l'agent étiologique du syndrome respiratoire du Moyen-Orient (SRMO), a finalement été nommé coronavirus du syndrome respiratoire du Moyen-Orient (SRMO-CoV), la 6e souche de coronavirus humain découverteNote de bas de page 5.
Depuis lors, plus de 2 000 cas ont été signalés dans le monde. Des éclosions familiales et hospitalières se sont produites au Moyen-Orient et ailleurs, et les cas se sont propagés de la région vers d'autres pays [figure 1]Note de bas de page 6. Des progrès importants ont également été réalisés dans le diagnostic en laboratoire, la caractérisation des virus, le développement de vaccins et la compréhension de l'évolution clinique de la maladie et du mécanisme de transmission [figure 1]. Cette analyse approfondie fournit un résumé de l'épidémiologie descriptive de l'infection humaine par le SRMO-CoV depuis son apparition en 2012, en mettant l'accent sur la répartition démographique, géographique et temporelle des cas signalés, ainsi qu'un examen des symptômes cliniques, des sources d'exposition et des caractéristiques du virus.
Figure 1 . Épidémie du syndrome respiratoire du Moyen-Orient (SRMO) : une chronologie des événements majeurs (2012-2018).
2012

Juin
Un homme de 60 ans est admis dans un petit hôpital privé en Arabie saoudite avec de graves symptômes respiratoires.

Septembre
Le Dr Ali Mohamed Zaki annonce via ProMED la découverte d'un nouveau coronavirus.
Septembre
Développement du premier test de RT-PCR propre au SRMO.

Novembre
Identification rétrospective de la première flambée hospitalière de SRMO en Jordanie, qui s'est produite en avril 2012.

Novembre
Caractérisation de la séquence complète du génome du SRMO-CoV isolé du premier cas humain.

Novembre
L'analyse phylogénétique du SRMO-CoV montre qu'il est étroitement lié à deux coronavirus des chauves-souris, ce qui indique qu'il s'agit d'un bétacoronavirus de la lignée C.

Novembre
Premier cas signalé d'une grappe familiale de SRMO à Riyad, en Arabie saoudite.
2013

Février
Premier cas exporté signalé au Royaume-Uni. La personne en question avait des antécédents de voyage au Moyen-Orient.

Février
Premier signalment de cas chez un groupe humain du SRMO en dehors du Moyen-Orient. Ce groupe était le résultat du premier cas exporté. Preuve d'une transmission interhumaine limitée dans la famille britannique. Le cas index avait des antécédents de voyage au Moyen-Orient.

Mars
La dipeptidyl peptidase 4 (DPP4) identifiée comme récepteur cellulaire du SRMO-CoV.

Juillet
Le directeur général de l'OMS convoque une réunion du comité d'urgence du Règlement sanitaire international concernant le SRMO. Après avoir examiné les données sur la situation actuelle, le comité détermine que les conditions pour déclarer une urgence de santé publique de portée internationale (USPPI) n'étaient pas encore réunies.

Août
Une étude sérologique comparative a trouvé des anticorps neutralisant le SRMO-CoV chez des chameaux d'Oman et d'Espagne. Il s'agit de la première étude visant à tester des animaux pour détecter des anticorps spécifiques du SRMO-CoV.

Novembre
Pour la première fois, les chameaux associés à un cas humain positif se sont révélés positifs pour le SRMO-CoV par PCR.
2014

Printemps
Deux grandes éclosions nosocomiales de SRMO-CoV se produisent à Riyad et à Djeddah, en Arabie saoudite, entraînant plus de 150 cas d'infection humaine.
Mai
Premier cas de SRMO signalé en Amérique du Nord. Il s'agissait d'un prestataire de soins de santé qui vivait et travaillait en Arabie saoudite avant de rentrer aux États-Unis.

Juin
Une étude phylogénomique menée sur des chameaux en Égypte a montré que le génome du SRMO-CoV de chameau est génétiquement similaire (> 99 % de similarité) au SRMO-CoV infectant les humains.

Décembre
Un test de provocation au SRMO-CoV effectué sur des dromadaires a montré qu'ils peuvent présenter des signes cliniques mineurs (rhinorrhée) de la maladie lorsqu'ils sont infectés et qu'ils peuvent excréter de grandes quantités du virus dans leurs sécrétions nasales.
2015

Avril
Une étude menée pour déterminer le risque de transmission du SRMO-CoV de chameaux aux humains ne trouve aucune preuve sérologique d'infection humaine après différents niveaux d'exposition à des chameaux infectés, ce qui suggère que la transmission zoonotique du virus est rare.

Avril
Une vaste étude sérologique transversale menée en Arabie saoudite a montré que la séroprévalence dans la population générale était de 0,15 %. L'étude révèle également une séroprévalence beaucoup plus élevée chez les personnes exposées aux chameaux dans le cadre de leur travail.

Mai-Juin
Une grande éclosion nosocomiale de SRMO survient en Corée du Sud impliquant quatre hôpitaux, avec 186 cas. Il s'agit de la plus grande éclosion nosocomiale de SRMO survenant en dehors du Moyen-Orient.
Août
Les chercheurs d'un groupe de recherche international dirigé par la Suisse mentionnent le premier isolement d'un anticorps neutralisant le SRMO-CoV (LCA60) d'un patient guéri du SRMO. LCA60 est un anticorps monoclonal anti-SRMO qui neutralise potentiellement l'infection par le SRMO-CoV in vitro et in vivo.

Septembre
Le comité d'urgence du RSI concernant le SRMO tient sa 10e réunion. Le comité détermine que les conditions pour déclarer une USPPI n'étaient pas encore réunies.

Décembre
Après sept mois, l'éclosion en Corée du Sud est déclarée terminée le 23 décembre 2015.
2016

Mars
Une étude décrit en détail l'émergence de SRMO-CoV mutant au cours de l'éclosion en Corée du Sud qui a réduit l'affinité pour le récepteur DPP4 humain, diminuant sa virulence.

Mars
Une étude fournit la première description autopsique, clinicopathologique, immunohistochimique et ultrastructurale d'un cas mortel de SRMO. L'autopsie, réalisée en 2014, a révélé des lésions pulmonaires importantes chez le patient.

Juin
Des anticorps du SRMO sont détectés dans un troupeau d'alpagas du Qatar. Il s'agit de la première étude qui a révélé la présence de SRMO-CoV chez des animaux domestiques autres que les chameaux.
Août
SAB Biotherapeutics inc. a annoncé que la phase 1 des essais cliniques de leur traitement du SRMO par anticorps est en cours. Il s'agit du premier traitement potentiel du SRMO ayant atteint ce stade.
2017

Mai
Une étude évaluant la mise en oeuvre de mesures d'infection, de prévention et de contrôle au cours d'une grande éclosion hospitalière révèle que le respect rigoureux des mesures de PCI permet la détection rapide des cas et une diminution importante du nombre de cas secondaires.

Juin
L'OMS signale l'apparition de trois flambées hospitalières à Riyad, en Arabie saoudite, ce qui entraîne une augmentation des cas (n > 48).
2018

Janvier
Une étude a identifié que la DPP4, le récepteur du SRMO-CoV, est surrégulée dans les poumons des fumeurs et des patients atteints de maladie obstructive respiratoire, ce qui indique une raison potentielle d'une susceptibilité accrue dans cette population.

Février
L'OMS a mis à jour sa liste de maladies prioritaires qui nécessitent une recherche et un développement plus approfondis, et garde le SRMO-CoV sur la liste.
Remarque : cette chronologie n'est pas censée indiquer tous les développements concernant l'épidémie de SRMO. Les éléments sélectionnés sont plutôt destinés à démontrer les progrès importants dans la recherche et les étapes épidémiologiques majeuresNote de bas de page 4Note de bas de page 7Note de bas de page 8Note de bas de page 9Note de bas de page 10Note de bas de page 11Note de bas de page 12Note de bas de page 13Note de bas de page 14Note de bas de page 15Note de bas de page 16Note de bas de page 17Note de bas de page 18Note de bas de page 19Note de bas de page 20Note de bas de page 21Note de bas de page 22Note de bas de page 23Note de bas de page 59Note de bas de page 84.
Source d'exposition
Les cas primaires de SRMO sont associés à la transmission zoonotique provenant de chameaux. Bien que les recherches suggèrent que l'origine du SRMO-CoV est les chauves-souris, plusieurs études sur son émergence et sa transmission soulignent le rôle des chameaux comme réservoir et source primaire d'infection zoonotique en raison de la forte prévalence des anticorps du SRMO-CoV chez les chameaux dans la péninsule arabique et en Afrique du Nord et de l'EstNote de bas de page 47Note de bas de page 62Note de bas de page 63Note de bas de page 64Note de bas de page 65. La détection de SRMO-CoV par RT-PCR dans les sécrétions respiratoires, l'urine, les excréments et le lait de dromadaires, et la démonstration de similitudes dans la séquence génomique des virus isolés de sujets et de chameaux infectésNote de bas de page 47Note de bas de page 62Note de bas de page 63Note de bas de page 64Note de bas de page 65 soutiennent le rôle des chameaux dans la transmission zoonotique du SRMO-CoV. Ces résultats soulignent également l'importance de priorisation des mesures de prévention et de contrôle sur les chameaux. Des tests de provocation effectués sur des chameaux suggèrent que leur infection par le SRMO-CoV entraîne une maladie respiratoire légère, avec peu ou pas de symptômesNote de bas de page 19. À ce jour, malgré le nombre de cas zoonotiques signalés, seules 14 flambées de SRMO associées à des chameaux ont été signalées à l'Organisation mondiale de la santé animale (OIE), ce qui signifie que les éclosions dans les troupeaux de camélidés risquent de ne pas être détectées et constituent un risque permanent de transmission aux humainsNote de bas de page 66. Selon les études séro-épidémiologiques réalisées sur d'autres animaux d'élevage, les alpagas sont les seuls autres animaux chez lesquels des anticorps spécifiques de SRMO-CoV ont été relevés; toutefois, aucun cas d'infection humaine avec exposition aux alpagas n'a été signalé à ce jourNote de bas de page 23.
Bien que la voie de transmission des chameaux aux humains ne soit pas entièrement comprise, il est probable que les infections zoonotiques causées par le SRMO-CoV soient le résultat d'un contact direct ou indirect avec des chameaux ou des produits dérivés de chameaux (p. ex., le lait cru)Note de bas de page 31. Des études sérologiques comparant la présence d'anticorps du SRMO-CoV chez des sujets avec et sans contact avec des dromadaires ont laissé une image contradictoire du rôle de l'exposition à des chameaux dans la transmission zoonotique du SRMO. Certaines études n'ont trouvé aucune preuve sérologique d'infections par le SRMO-CoV chez les humains ayant eu différents niveaux d'exposition aux dromadairesNote de bas de page 21Note de bas de page 67Note de bas de page 68. Ces résultats suggèrent que la transmission zoonotique est rareNote de bas de page 21Note de bas de page 67Note de bas de page 68. Cependant, d'autres études ont trouvé une séroprévalence beaucoup plus élevée des anticorps du SRMO-CoV chez les sujets exposés à des chameaux par rapport à la population générale, suggérant un plus grand risque d'infection par le SRMO-CoV chez ces sujetsNote de bas de page 22Note de bas de page 69. Les données actuellement disponibles suggèrent la nécessité de mener d'autres études afin de bien comprendre le rôle que l'interaction entre les humains et les animaux joue dans la transmission du SRMO-CoV.
La transmission interhumaine du SRMO-CoV a été largement associée à des flambées nosocomiales; cependant, la transmission dans un ménage a également été signaléeNote de bas de page 10Note de bas de page 70. Les flambées nosocomiales du SRMO ont joué un rôle important dans l'accroissement de l'ampleur des cas signalés. À ce jour, des flambées en milieu hospitalier à grande échelle ont été signalées en Arabie saoudite, aux Émirats arabes unis et en Corée du SudNote de bas de page 42Note de bas de page 71Note de bas de page 72. Le manque de mesures de PCI (surpeuplement, isolement tardif des cas, manque de connaissance des définitions de cas de SRMO parmi les travailleurs de la santé, etc.) ainsi que la transmission dans les hôpitaux et entre les hôpitaux, les propagateurs extrêmement efficaces de virus et les personnes asymptomatiques sont des facteurs qui ont contribué dans le passé à ces flambées en milieu hospitalierNote de bas de page 73. Une étude publiée en 2017 évaluant la mise en œuvre de mesures de PCI lors d'une éclosion importante dans un hôpital a montré que le respect rigoureux de ces mesures permettait la détection rapide des cas et la réduction importante du nombre de cas secondaires, ce qui pourrait expliquer la maîtrise rapide des flambées récentes en Arabie saouditeNote de bas de page 27Note de bas de page 28Note de bas de page 74.
Caractéristiques du virus
Le SRMO-CoV est un virus à ARN monocaténaire appartenant à la famille des CoronaviridaeNote de bas de page 2Note de bas de page 75. Bien qu'il soit causé par le même genre de coronavirus que le syndrome respiratoire aigu sévère (SRAS), le SRMO-CoV se distingue par le fait qu'il appartient à la lignée C, tandis que le SRAS appartient à la lignée B. L'entrée du SRMO-CoV dans les cellules hôtes est médiée par ses protéines de spicule (S), lesquelles sont liées au récepteur cellulaire hôte, soit la dipeptidyl peptidase 4 (DPP4)Note de bas de page 76. DDP4 est une protéine cellulaire de surface qui est principalement exprimée dans les voies respiratoires humaines, mais qui est également largement exprimée dans les cellules épithéliales des reins, de l'intestin grêle, du foie, de la prostate et des leucocytes activésNote de bas de page 55. Dans le cas du SRAS, de vastes mutations ont permis au virus de s'adapter au récepteur cellulaire humain, soit l'enzyme de conversion de l'angiotensine 2 (ECA2), ce qui a permis une augmentation de la transmission interhumaineNote de bas de page 77. Bien que des isolats viraux séquencés provenant de chameaux et d'humains aient démontré que le SRMO-CoV a fait l'objet d'une recombinaison et de changements génétiques depuis son introduction dans la population humaine en 2012, aucune de ces mutations n'a permis une adaptation plus efficace au récepteur cellulaire humain DPP4Note de bas de page 78. En fait, l'analyse des isolats viraux de la flambéeen Corée du Sud ayant une mutation dans le domaine de liaison au récepteur a démontré une affinité réduite à la DPP4 humaineNote de bas de page 79. Étant donné l'ampleur de la flambéeen Corée du Sud, ces résultats compliquent davantage le rôle que jouent la protéine S et la DPP4 dans l'adaptation humaine de ce virus. Dans l'ensemble, les coronavirus possèdent des capacités de mutation et de recombinaison efficaces, et une propension à traverser les espèces hôtes et à s'adapter à un nouvel environnement. Ces capacités font craindre que le SRMO-CoV acquière de la virulence et une capacité accrue de transmission interhumaine. Cependant, une transmission interhumaine soutenue n'a pas eu lieu dans la population générale. Les foyers potentiels de la transmission d'animal à humain et interhumaine doivent être surveillés de façon continue.
Manifestations cliniques
L'infection humaine par le SRMO-CoV présente un large éventail de tableaux cliniques, allant de l'infection asymptomatique à des cas cliniques aigusNote de bas de page 2. Parmi les symptômes cliniques communs, on compte la fièvre, la toux et l'essoufflement, lesquels peuvent évoluer rapidement en pneumonie aiguë, en syndrome de détresse respiratoire aiguë (SDRA), en choc septique, en défaillance multiviscérale (SDMV) et entraîner le décèsNote de bas de page 2Note de bas de page 56. Dans certains cas, des symptômes gastro-intestinaux tels que des douleurs abdominales, des vomissements et de la diarrhée se sont manifestésNote de bas de page 2. Comparativement à des maladies chez l'humain causées par d'autres coronavirus tels que le syndrome respiratoire aigu sévère (SRAS) (taux global de létalité de 14 %-15 %), le SRMO a un taux de létalité élevé de 35 % parmi tous les cas rapportés dans le monde et de 40 % en Arabie saouditeNote de bas de page 6Note de bas de page 32Note de bas de page 57. Des études évaluant les facteurs de risque ont révélé que les problèmes de santé préexistants, l'âge avancé, le sexe (masculin) et la co-infection par d'autres agents bactériens ou viraux constituent des facteurs de risque importants de gravité de la maladie et de mortalitéNote de bas de page 56Note de bas de page 58.
Cas pédiatriques
Selon les données disponibles, les cas pédiatriques de SRMO sont raresNote de bas de page 34Note de bas de page 60Note de bas de page 61. Jusqu'à présent, environ 2 % de tous les cas sont survenus chez des enfants (18 ans ou moins) et le taux de létalité est de 2,5 %. En 2016, Al-Tawfiq et autres ont publié une étude visant à résumer les caractéristiques épidémiologiques et cliniques des cas pédiatriques signalés de juin 2012 au 19 avril 2016 (n = 31)Note de bas de page 60. Parmi les cas pour lesquels des données cliniques étaient disponibles (n = 29), 45 % étaient asymptomatiques et 7 % présentaient des symptômes respiratoires légersNote de bas de page 60. Parmi les cas pour lesquels des données sur la source d'exposition étaient disponibles (n = 15), 68 % ont contracté l'infection par contact dans le ménageNote de bas de page 60. Bien que le nombre de cas pédiatriques soit faible, il est important de bien étudier les manifestations cliniques dans les documents scientifiques afin de mieux comprendre s'il est différent pour cette population de celui de la population générale.
Résumé de la situation: de janvier à mars 2018
Entre le 1er janvier et le 31 mars 2018, 54 cas de SRMO, dont 5 décès (taux de létalité = 36 %), de sujets dont les résultats étaient connus ont été signalés à l'Organisation mondiale de la santé (OMS) et par le ministère de la Santé du Royaume d'Arabie saoudite (KSA MOH)Note de bas de page 24. Le nombre de cas et les taux de létalité étaient comparables à ceux signalés au cours de la même période en 2016 et 2017, mais nettement inférieurs à ceux de 2015 et de 2014Note de bas de page 25. La répartition par âge et par sexe des cas est restée relativement stable par rapport aux années précédentes : la plupart des cas étaient de sexe masculin (75 %) et l'âge médian était de 59 ans (de 5 ans à 89 ans). Sur le plan géographique, les cas ont été moins dispersés que les années précédentes, seuls trois pays (Malaisie, Arabie saoudite et Oman) ayant signalé des cas à ce jour. Le cas signalé d'Oman était contracté localement, tandis que le cas signalé en Malaisie a été importé d'Arabie saoudite - le pays avec la majorité des cas signalésNote de bas de page 26. Parmi les cas pour lesquels des données sur l'exposition étaient disponibles (n = 5), 29 % ont fait état d'une exposition à des chameaux tandis que 21 % ont été exposés à un cas positif de SRMO, donnant des proportions similaires de cas secondairesNote de bas de page a et de cas primairesNote de bas de page b signalés à l'OMS cette année jusqu'à présent. Entre le 1er janvier et le 31 mars 2018, une flambée nosocomiale a été signalée dans un hôpital privé de la région d'Hafr Albatin en Arabie saoudite, alors qu'un groupe d'infections nosocomiales a été détecté dans un établissement de santé de la région de Riyad en Arabie saouditeNote de bas de page 27Note de bas de page 28.
Analyse épidémiologique globale
Depuis l'émergence du SRMO-CoV en 2012, 2 183 cas d'infection humaine, dont au moins 760 décès (taux de létalité = 35 %), ont été signalés dans 27 paysNote de bas de page 6Note de bas de page 32. Les analyses épidémiologiques du SRMO-CoV à ce jour reflètent des infections zoonotiques sporadiques, avec une transmission interhumaine amplifiée dans les milieux de soins de santé. Dans l'ensemble, les deux tiers des cas signalés (66 %) sont survenus chez des hommes dont l'âge médian était de 54 ans (de 9 mois à 109 ans). Bien que des cas de SRMO continuent d'être signalés chaque année, il y a eu une diminution du nombre de cas signalés et du taux de létalité depuis 2014 [tableau 1 ]Note de bas de page 29. Compte tenu de l'association entre la transmission interhumaine amplifiée et les éclosions dans les milieux de soins de santé, le respect strict des mesures de prévention et de contrôle des infections (PCI) est probablement le principal facteur de la réduction observée de l'incidence des cas selon l'OMSNote de bas de page 30.
| Caractéristiques | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 |
|---|---|---|---|---|---|---|
| Nombre de cas signalés (taux de létalité %) | 188 (53) | 758 (38) | 672 (33) | 251 (29) | 250 (29) | 54 (36) |
| Âge médian (plage) en années | 51 (2-94) | 48 (4-99) | 54 (9 mois-109 ans) | 54 (18-94) | 53 (10-88) | 59 (5-89) |
| % Hommes | 65 | 65 | 65 | 73 | 72 | 75 |
| Nombre de pays ayant signalé des cas | 10 | 17 | 12 | 7 | 5 | 3 |
| % de travailleurs du domaine de la santé | 20 | 26 | 10 | 13 | 17 | 4 |
| Remarque : les données sur les caractéristiques épidémiologiques des cas de SRMO de 2013-2016 proviennent du bureau régional de l'OMS pour la Méditerranée orientale (EMRO), Mise à jour de la situation du SRMO de janvier à février 2017, et comparées avec les données extraites du bulletin sur les flambées épidémiques de l'OMS le 6 juillet, sur les cas de SRMO signalés de janvier à juin 2017. Les caractéristiques épidémiologiques des cas signalés de juin 2017 à mars 2018 reposaient sur des données extraites du bulletin sur les flambées épidémiques de l'OMS le 15 mars et sur des cas signalés par le ministère de la Santé du Royaume d'Arabie saoudite jusqu'à la fin de mars 2018. Les données présentées dans ce tableau peuvent changer à la suite d'enquêtes en cours et d'une nouvelle analyseNote de bas de page 24Note de bas de page 29Note de bas de page 32. | ||||||
Répartition par âge et sexe
Dans l'ensemble, la répartition des cas selon l'âge et le sexe est biaisée en faveur des hommes plus âgés [figure 2]. Cependant, des recherches plus approfondies sur le type d'exposition révèlent des profils distinctifs selon l'âge et le sexe entre les cas primaires et les cas secondaires [figure 3]Note de bas de page 31. Les données d'exposition et démographiques étaient disponibles pour 109 cas primaires et 62 cas secondaires (total = 171) signalés par le bulletin sur les flambées épidémiques de l'OMS et le ministère de la Santé de l'Arabie saoudite entre le 1er janvier 2017 et le 31 mars 2018Note de bas de page 24Note de bas de page 32. Les cas primaires étaient biaisés en faveur des hommes plus âgés : les hommes (88 %) âgés de 50 ans et plus (67 %) constituaient une proportion beaucoup plus élevée de cas primaires. En revanche, les cas secondaires avaient une répartition plus équilibrée selon l'âge et le sexe : il n'y avait pas de différence significative entre la proportion d'hommes et de femmes ou parmi les groupes d'âgeNote de bas de page 25. De plus, l'âge moyen des cas secondaires était beaucoup plus bas que celui des cas primaires (46 ans contre 56 ans). Le profil âge-sexe observé dans les cas primaires - personnes infectées par contact direct avec des chameaux - est probablement dû à des comportements socioculturels, par exemple, l'élevage de chameaux étant une activité populaire parmi les hommes d'âge moyen et à la retraiteNote de bas de page 31.
Figure 2 . Comparaison de la répartition par âge des cas primaires et secondaires de SRMO signalés dans le monde entre le 1er janvier 2017 et le 31 mars 2018.
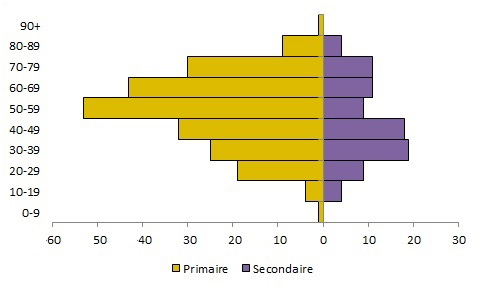
Remarque: Préparé par le Centre de l'immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada, à partir de données compilées de l'OMS et du ministère de la Santé du Royaume d'Arabie saouditeNote de bas de page 32.
Équivalent textuel
| Primaire | Secondaire | |
|---|---|---|
| 0-9 | 1 | 0 |
| 10-19 | 4 | 4 |
| 20-29 | 19 | 9 |
| 30-39 | 25 | 19 |
| 40-49 | 32 | 18 |
| 50-59 | 53 | 9 |
| 60-69 | 43 | 11 |
| 70-79 | 30 | 11 |
| 80-89 | 9 | 4 |
| 90+ | 1 | 0 |
Figure 3. Répartition par âge et sexe des cas primaires et secondaires de SRMO signalés dans le monde entre le 1er janvier 2017 et le 31 mars 2018.
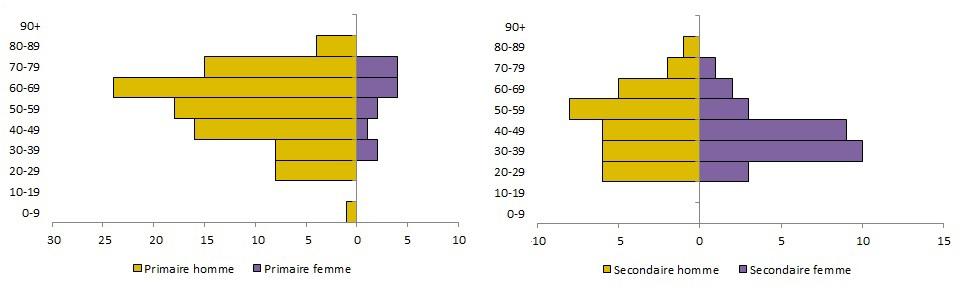
Remarque: Préparé par le Centre de l'immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada, à partir de données compilées de l'OMS et du ministère de la Santé du Royaume d'Arabie saouditeNote de bas de page 32.
Équivalent textuel
| Primaire | Secondaire | |||
|---|---|---|---|---|
| homme | femme | homme | femme | |
| 0-9 | 1 | 0 | 0 | 0 |
| 10-19 | 0 | 0 | 0 | 0 |
| 20-29 | 8 | 0 | 6 | 3 |
| 30-39 | 8 | 2 | 6 | 10 |
| 40-49 | 16 | 1 | 6 | 9 |
| 50-59 | 18 | 2 | 8 | 3 |
| 60-69 | 24 | 4 | 5 | 2 |
| 70-79 | 15 | 4 | 2 | 1 |
| 80-89 | 4 | 0 | 1 | 0 |
| 90+ | 0 | 0 | 0 | 0 |
Répartition temporelle
La répartition temporelle globale de l'épidémie de SRMO peut être caractérisée par de multiples pics intermittents correspondant à des flambées hospitalières à grande échelle ou simultanées. Entre 2014 et juin 2016, ces pics se sont produits en moyenne toutes les 12 à 26 semaines [figure 4]. Cependant, entre 2016 et 2017, il y a eu une période de 52 semaines sans pic d'activité et aucun pic n'a été signalé en 2018 jusqu'à présent. La récente augmentation de la durée entre les pics d'activité, se traduisant en une activité faible mais continue, suggère qu'il y a eu des améliorations dans la mise en œuvre des mesures de PCI et une diminution des cas hospitalisés depuis 2015, comme indiqué par l'OMSNote de bas de page 28Note de bas de page 30.
Figure 4 . Nombre de cas d'infection humaine de SRMO dans le monde selon la semaine d'apparition des symptômes ou selon la première date et le premier lieu signalés, de mars 2012 au 31 mars 2018.
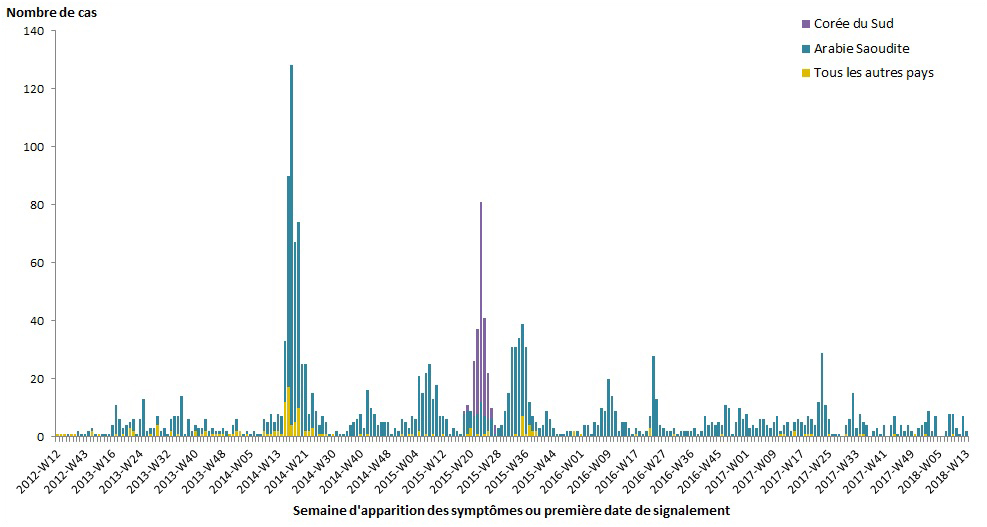
Préparé par le Centre de l'immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada, à partir de données compilées du Réseau Mondial d'Intelligence Santé Publique (RMISP), de l'OMS et du ministère de la Santé du Royaume d'Arabie saoudite.
Équivalent textuel
| Semaines | Tous les autres pays | Arabie Saoudite | Corée du Sud |
|---|---|---|---|
| 2012-W12 | 1 | - | - |
| 2012-W14 | 1 | - | - |
| 2012-W20 | 1 | - | - |
| 2012-W23 | - | 1 | - |
| 2012-W36 | 1 | - | - |
| 2012-W40 | 1 | - | - |
| 2012-W41 | - | 2 | - |
| 2012-W42 | - | 1 | - |
| 2012-W43 | - | 1 | - |
| 2013-W04 | - | 2 | - |
| 2013-W06 | 2 | 1 | - |
| 2013-W08 | - | 1 | - |
| 2013-W10 | 1 | - | - |
| 2013-W12 | - | 1 | - |
| 2013-W14 | - | 1 | - |
| 2013-W15 | - | 1 | - |
| 2013-W16 | - | 4 | - |
| 2013-W17 | 1 | 10 | - |
| 2013-W18 | - | 6 | - |
| 2013-W19 | 1 | 2 | - |
| 2013-W20 | - | 4 | - |
| 2013-W21 | 3 | 2 | - |
| 2013-W22 | 2 | 4 | - |
| 2013-W23 | - | 1 | - |
| 2013-W24 | - | 6 | - |
| 2013-W25 | - | 13 | - |
| 2013-W26 | - | 2 | - |
| 2013-W27 | 1 | 2 | - |
| 2013-W28 | - | 3 | - |
| 2013-W29 | 4 | 3 | - |
| 2013-W30 | - | 2 | - |
| 2013-W31 | - | 3 | - |
| 2013-W32 | - | 1 | - |
| 2013-W33 | 2 | 4 | - |
| 2013-W34 | - | 7 | - |
| 2013-W35 | 1 | 6 | - |
| 2013-W36 | - | 14 | - |
| 2013-W37 | - | 1 | - |
| 2013-W38 | - | 6 | - |
| 2013-W39 | - | 2 | - |
| 2013-W40 | 2 | 2 | - |
| 2013-W41 | - | 3 | - |
| 2013-W42 | 1 | 2 | - |
| 2013-W43 | 2 | 4 | - |
| 2013-W44 | - | 2 | - |
| 2013-W45 | 1 | 2 | - |
| 2013-W46 | 1 | 1 | - |
| 2013-W47 | 1 | 1 | - |
| 2013-W48 | 1 | 2 | - |
| 2013-W49 | - | 2 | - |
| 2013-W50 | 1 | - | - |
| 2013-W51 | 1 | 3 | - |
| 2013-W52 | 2 | 4 | - |
| 2014-W01 | 2 | - | - |
| 2014-W02 | - | 1 | - |
| 2014-W04 | 1 | 1 | - |
| 2014-W05 | - | 1 | - |
| 2014-W06 | - | 2 | - |
| 2014-W07 | - | 1 | - |
| 2014-W08 | - | 1 | - |
| 2014-W09 | 2 | 4 | - |
| 2014-W10 | 1 | 4 | - |
| 2014-W11 | 1 | 7 | - |
| 2014-W12 | 2 | 3 | - |
| 2014-W13 | 2 | 6 | - |
| 2014-W14 | 1 | 6 | - |
| 2014-W15 | 12 | 21 | - |
| 2014-W16 | 17 | 73 | - |
| 2014-W17 | 4 | 124 | - |
| 2014-W18 | 5 | 62 | - |
| 2014-W19 | 10 | 64 | - |
| 2014-W20 | - | 25 | - |
| 2014-W21 | 2 | 23 | - |
| 2014-W22 | 2 | 6 | - |
| 2014-W23 | 3 | 12 | - |
| 2014-W24 | - | 9 | - |
| 2014-W25 | 1 | 3 | - |
| 2014-W26 | 1 | 6 | - |
| 2014-W27 | 1 | 4 | - |
| 2014-W28 | - | 1 | - |
| 2014-W30 | 1 | - | - |
| 2014-W31 | - | 2 | - |
| 2014-W32 | - | 1 | - |
| 2014-W34 | - | 1 | - |
| 2014-W35 | - | 2 | - |
| 2014-W36 | - | 4 | - |
| 2014-W38 | - | 5 | - |
| 2014-W39 | - | 6 | - |
| 2014-W40 | 1 | 7 | - |
| 2014-W41 | - | 3 | - |
| 2014-W42 | 1 | 15 | - |
| 2014-W43 | - | 10 | - |
| 2014-W44 | - | 8 | - |
| 2014-W45 | - | 4 | - |
| 2014-W46 | - | 5 | - |
| 2014-W47 | - | 5 | - |
| 2014-W48 | - | 5 | - |
| 2014-W49 | - | 1 | - |
| 2014-W50 | - | 3 | - |
| 2014-W51 | - | 2 | - |
| 2014-W52 | 1 | 5 | - |
| 2015-W01 | - | 5 | - |
| 2015-W02 | 1 | 2 | - |
| 2015-W03 | 1 | 6 | - |
| 2015-W04 | - | 6 | - |
| 2015-W05 | 2 | 19 | - |
| 2015-W06 | - | 15 | - |
| 2015-W07 | 1 | 21 | - |
| 2015-W08 | - | 25 | - |
| 2015-W09 | 1 | 12 | - |
| 2015-W10 | - | 18 | - |
| 2015-W11 | - | 7 | - |
| 2015-W12 | 1 | 6 | - |
| 2015-W13 | - | 6 | - |
| 2015-W14 | - | 1 | - |
| 2015-W15 | - | 3 | - |
| 2015-W16 | - | 2 | - |
| 2015-W17 | - | 1 | - |
| 2015-W18 | - | 8 | 1 |
| 2015-W19 | 1 | 8 | 2 |
| 2015-W20 | 3 | 6 | - |
| 2015-W21 | - | 7 | 19 |
| 2015-W22 | 1 | 7 | 29 |
| 2015-W23 | - | 12 | 69 |
| 2015-W24 | 1 | 6 | 34 |
| 2015-W25 | 2 | 4 | 16 |
| 2015-W26 | - | 6 | 4 |
| 2015-W27 | - | 1 | 3 |
| 2015-W28 | - | 3 | - |
| 2015-W29 | - | 4 | - |
| 2015-W30 | - | 9 | - |
| 2015-W31 | - | 15 | - |
| 2015-W32 | - | 31 | - |
| 2015-W33 | 1 | 30 | - |
| 2015-W34 | - | 34 | - |
| 2015-W35 | 7 | 32 | - |
| 2015-W36 | 1 | 30 | - |
| 2015-W37 | 4 | 8 | - |
| 2015-W38 | 2 | 5 | - |
| 2015-W39 | 2 | 3 | - |
| 2015-W40 | - | 3 | - |
| 2015-W41 | - | 4 | - |
| 2015-W42 | - | 9 | - |
| 2015-W43 | - | 6 | - |
| 2015-W44 | - | 3 | - |
| 2015-W45 | - | 1 | - |
| 2015-W47 | - | 1 | - |
| 2015-W48 | - | 1 | - |
| 2015-W50 | - | 2 | - |
| 2015-W51 | - | 2 | - |
| 2015-W52 | 2 | - | - |
| 2015-W53 | - | 2 | - |
| 2016-W01 | 1 | - | - |
| 2016-W02 | - | 4 | - |
| 2016-W03 | - | 4 | - |
| 2016-W04 | - | 1 | - |
| 2016-W05 | - | 5 | - |
| 2016-W06 | - | 4 | - |
| 2016-W07 | - | 10 | - |
| 2016-W08 | - | 9 | - |
| 2016-W09 | - | 20 | - |
| 2016-W10 | - | 14 | - |
| 2016-W11 | - | 9 | - |
| 2016-W12 | - | 2 | - |
| 2016-W13 | - | 5 | - |
| 2016-W14 | - | 5 | - |
| 2016-W15 | - | 3 | - |
| 2016-W16 | - | 1 | - |
| 2016-W17 | 1 | 2 | - |
| 2016-W18 | - | 2 | - |
| 2016-W21 | - | 1 | - |
| 2016-W22 | - | 2 | - |
| 2016-W23 | 3 | 4 | - |
| 2016-W24 | - | 28 | - |
| 2016-W25 | - | 13 | - |
| 2016-W26 | - | 4 | - |
| 2016-W27 | - | 3 | - |
| 2016-W28 | - | 2 | - |
| 2016-W29 | - | 2 | - |
| 2016-W30 | 1 | 2 | - |
| 2016-W31 | - | 1 | - |
| 2016-W32 | - | 2 | - |
| 2016-W33 | - | 2 | - |
| 2016-W35 | - | 2 | - |
| 2016-W36 | - | 2 | - |
| 2016-W37 | - | 3 | - |
| 2016-W38 | - | 1 | - |
| 2016-W40 | - | 2 | - |
| 2016-W41 | - | 7 | - |
| 2016-W42 | - | 4 | - |
| 2016-W43 | - | 5 | - |
| 2016-W44 | - | 4 | - |
| 2016-W45 | - | 5 | - |
| 2016-W46 | 1 | 3 | - |
| 2016-W47 | - | 11 | - |
| 2016-W48 | - | 10 | - |
| 2016-W49 | - | 1 | - |
| 2016-W50 | - | 5 | - |
| 2016-W51 | - | 10 | - |
| 2016-W52 | - | 6 | - |
| 2017-W01 | - | 8 | - |
| 2017-W02 | - | 3 | - |
| 2017-W03 | - | 4 | - |
| 2017-W04 | - | 3 | - |
| 2017-W05 | - | 6 | - |
| 2017-W06 | - | 6 | - |
| 2017-W07 | - | 4 | - |
| 2017-W08 | - | 3 | - |
| 2017-W09 | - | 5 | - |
| 2017-W10 | - | 7 | - |
| 2017-W11 | 1 | 1 | - |
| 2017-W12 | 1 | 3 | - |
| 2017-W13 | - | 5 | - |
| 2017-W14 | - | 2 | - |
| 2017-W15 | 2 | 3 | - |
| 2017-W16 | - | 6 | - |
| 2017-W17 | - | 5 | - |
| 2017-W18 | 1 | 3 | - |
| 2017-W19 | 1 | 6 | - |
| 2017-W20 | 1 | 5 | - |
| 2017-W21 | - | 4 | - |
| 2017-W22 | - | 12 | - |
| 2017-W23 | - | 29 | - |
| 2017-W24 | - | 11 | - |
| 2017-W25 | 1 | 5 | - |
| 2017-W26 | - | 1 | - |
| 2017-W27 | - | 1 | - |
| 2017-W28 | - | 1 | - |
| 2017-W29 | - | 0 | - |
| 2017-W30 | 1 | 3 | - |
| 2017-W31 | - | 6 | - |
| 2017-W32 | - | 15 | - |
| 2017-W33 | - | 3 | - |
| 2017-W34 | 1 | 7 | - |
| 2017-W35 | 1 | 4 | - |
| 2017-W36 | - | 4 | - |
| 2017-W37 | - | 0 | - |
| 2017-W38 | - | 2 | - |
| 2017-W39 | - | 3 | - |
| 2017-W40 | - | 1 | - |
| 2017-W41 | - | 4 | - |
| 2017-W42 | - | 0 | - |
| 2017-W43 | - | 4 | - |
| 2017-W44 | 1 | 6 | - |
| 2017-W45 | - | 1 | - |
| 2017-W46 | - | 4 | - |
| 2017-W47 | - | 2 | - |
| 2017-W48 | - | 4 | - |
| 2017-W49 | - | 2 | - |
| 2017-W50 | 1 | - | - |
| 2017-W51 | - | 3 | - |
| 2017-W52 | - | 4 | - |
| 2018-W01 | 1 | 4 | - |
| 2018-W02 | - | 9 | - |
| 2018-W03 | - | 2 | - |
| 2018-W04 | - | 7 | - |
| 2018-W05 | - | 0 | - |
| 2018-W06 | - | 0 | - |
| 2018-W07 | - | 2 | - |
| 2018-W08 | - | 8 | - |
| 2018-W09 | 1 | 7 | - |
| 2018-W10 | - | 3 | - |
| 2018-W11 | - | 1 | - |
| 2018-W12 | - | 7 | - |
| 2018-W13 | - | 2 | - |
Une première analyse de la répartition temporelle des cas de SRMO entre 2012 et 2014 a suggéré une tendance saisonnière, les cas augmentant de mars à avril de chaque année. À l'époque, cette tendance saisonnière avait été liée aux modes de vêlage et de sevrage des chameaux; mais, cette tendance n'a pas été observée depuis 2014Note de bas de page 33. L'analyse de la répartition temporelle des cas annuels de SRMO signalés depuis 2014 démontre que la majorité des cas (environ 61 % à 84 %) surviennent au cours des 6 premiers mois de l'année, avec des pics correspondant aux flambées hospitalières signalées impliquant plus de 20 cas [figure 5]. Une analyse plus approfondie de la répartition temporelle des cas primaires et secondaires peut aider à déterminer si le SRMO est vraiment saisonnier.
Figure 5 . Répartition temporelle des cas de SRMO, des décès et des flambées nosocomialesFigure 5 Note de bas de page * par mois d'apparition des symptômes ou la première date signalée, de mars 2012 au 31 mars 2018.
2012

Équivalent textuel
| Mois | Cas | Déces | Total |
|---|---|---|---|
| janv. | - | - | 0 |
| févr. | - | - | 0 |
| mars | - | 1 | 1 |
| avril | - | 1 | 1 |
| mai | 1 | - | 1 |
| juin | - | 1 | 1 |
| juil. | - | - | 0 |
| août | - | - | 0 |
| sept. | - | 1 | 1 |
| oct. | 3 | 2 | 5 |
| nov. | - | - | 0 |
| déc. | - | - | 0 |
2013
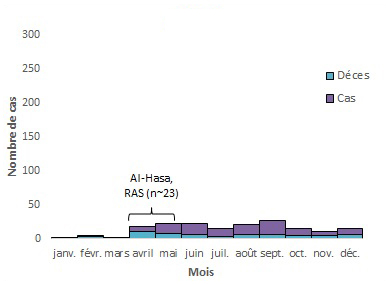
Équivalent textuel
| Mois | Cas | Déces | Total |
|---|---|---|---|
| janv. | - | 2 | 2 |
| févr. | 1 | 3 | 4 |
| mars | 1 | 1 | 2 |
| avril | 8 | 11 | 19 |
| mai | 14 | 8 | 22 |
| juin | 16 | 6 | 22 |
| juil. | 12 | 3 | 15 |
| août | 14 | 7 | 21 |
| sept. | 20 | 7 | 27 |
| oct. | 11 | 5 | 16 |
| nov. | 6 | 5 | 11 |
| déc. | 9 | 6 | 15 |
| - | - | - | 176 |
2014
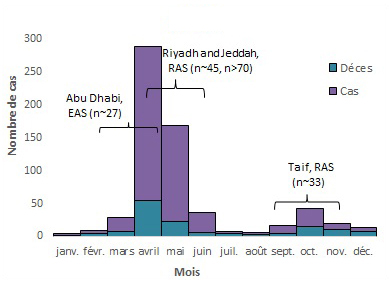
Équivalent textuel
| Mois | Cas | Déces | Total |
|---|---|---|---|
| janv. | 3 | 1 | 4 |
| févr. | 5 | 4 | 9 |
| mars | 20 | 8 | 28 |
| avril | 234 | 54 | 288 |
| mai | 146 | 22 | 168 |
| juin | 30 | 6 | 36 |
| juil. | 2 | 5 | 7 |
| août | 3 | 3 | 6 |
| sept. | 11 | 5 | 16 |
| oct. | 28 | 15 | 43 |
| nov. | 10 | 10 | 20 |
| déc. | 6 | 7 | 13 |
| - | - | - | 638 |
2015
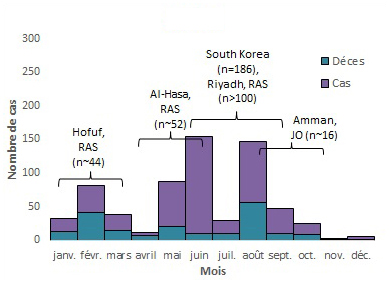
Équivalent textuel
| Mois | Cas | Déces | Total |
|---|---|---|---|
| janv. | 20 | 13 | 33 |
| févr. | 40 | 42 | 82 |
| mars | 25 | 14 | 39 |
| avril | 4 | 7 | 11 |
| mai | 67 | 21 | 88 |
| juin | 145 | 10 | 155 |
| juil. | 20 | 10 | 30 |
| août | 90 | 57 | 147 |
| sept. | 37 | 10 | 47 |
| oct. | 16 | 9 | 25 |
| nov. | 2 | 1 | 3 |
| déc. | 4 | 2 | 6 |
| - | - | - | 666 |
2016

Équivalent textuel
| Mois | Cas | Déces | Total |
|---|---|---|---|
| janv. | 11 | 1 | 12 |
| févr. | 17 | 12 | 29 |
| mars | 20 | 25 | 45 |
| avril | 11 | 5 | 16 |
| mai | 2 | 1 | 3 |
| juin | 42 | 12 | 54 |
| juil. | 7 | 3 | 10 |
| août | 4 | 2 | 6 |
| sept. | 6 | 1 | 7 |
| oct. | 13 | 5 | 18 |
| nov. | 20 | 9 | 29 |
| déc. | 15 | 12 | 27 |
| - | - | - | 256 |
2017
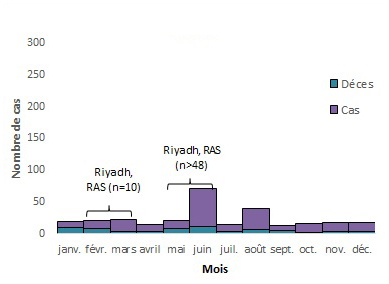
Équivalent textuel
| Mois | Cas | Déces | Total |
|---|---|---|---|
| janv. | 10 | 9 | 19 |
| févr. | 12 | 8 | 20 |
| mars | 20 | 3 | 23 |
| avril | 11 | 3 | 14 |
| mai | 13 | 8 | 21 |
| juin | 59 | 12 | 71 |
| juil. | 11 | 3 | 14 |
| août | 32 | 7 | 39 |
| sept. | 8 | 5 | 13 |
| oct. | 14 | 2 | 16 |
| nov. | 13 | 4 | 17 |
| déc. | 14 | 3 | 17 |
2018

Équivalent textuel
| Mois | Cas | Déces | Total |
|---|---|---|---|
| janv. | 17 | 11 | 28 |
| févr. | 14 | 2 | 16 |
| mars | 17 | 4 | 21 |
| avril | - | - | 0 |
| mai | - | - | 0 |
| juin | - | - | 0 |
| juil. | - | - | 0 |
| août | - | - | 0 |
| sept. | - | - | 0 |
| oct. | - | - | 0 |
| nov. | - | - | 0 |
| déc. | - | - | 0 |
- Figure 5 Note de bas de page *
Remarque : les annotations sur le graphique indiquent des flambées nosocomiales. n représente le nombre approximatif de cas associés à la flambée. L'intervalle ne reflète pas la durée réelle de l'éclosion, mais la période approximative où la majorité des cas sont survenus ou ont été signalés. KSA = Royaume d'Arabie saoudite, JO = Jordanie and UAE = Émirats arabes unis8,27,34-46.
Répartition géographique
À ce jour, 27 pays situés au Moyen-Orient, en Afrique du Nord, en Europe, en Amérique du Nord et en Asie ont signalé des cas de SRMO importés et acquis localement [figure 6]Note de bas de page 6. La majorité des cas (n = 1845, 90 %) ont été signalés dans des pays de la péninsule arabique, 92 % de ces cas ont été signalés en Arabie saoudite. Les recherches sur les interactions entre les humains et les animaux et la circulation du SRMO-CoV chez les dromadaires suggèrent qu'outre la population de dromadaires dans la péninsule arabique, les pratiques économiques, culturelles et récréatives propres à la région, comme la tendance vers l'élevage intensif de chameaux autour des zones urbaines, sont la cause de la concentration observée des casNote de bas de page 31Note de bas de page 33Note de bas de page 47Note de bas de page 48Note de bas de page 49Note de bas de page 50.
Actuellement, la majorité de la population mondiale de dromadaires (> 60 %) est située dans la Grande corne de l'Afrique, une région qui exporte régulièrement des chameaux vers les pays de la péninsule arabiqueNote de bas de page 48. Bien que des études sérologiques menées sur des dromadaires de plusieurs pays d'Afrique (Égypte, Éthiopie, Nigéria, Somalie, Soudan) aient démontré que les chameaux dans ces régions ont une séroprévalence élevée du SRMO-CoV, aucune infection zoonotique locale par le SRMO-CoV n'a été signalée dans aucun pays d'Afrique. Les 6 cas signalés en Afrique ont tous été importés ou liés à un cas importé du Moyen-OrientNote de bas de page 47. De plus, une étude sur la circulation des espèces de coronavirus en Arabie saoudite a montré que les chameaux locaux avaient des taux de portage beaucoup plus élevés que les chameaux importésNote de bas de page 49. Des tests de lignage ont montré que le SRMO-CoV trouvé chez les chameaux africains est génétiquement différent du SRMO-CoV trouvé chez les chameaux et les humains au Moyen-OrientNote de bas de page 48Note de bas de page 83. Ces données suggèrent que les cas de SRMO zoonotiques observés en Arabie saoudite et dans d'autres pays de la péninsule arabique sont liés à des facteurs spécifiques de ces régions.
Étant donné que le SRMO-CoV est endémique en Arabie saoudite depuis plus de deux décennies et que le virus est répandu dans la péninsule arabique, on peut s'attendre à ce que d'autres cas soient signalés et exportés à partir de ces régionsNote de bas de page 51. Des pays comme l'Inde et le Bangladesh, dont un grand nombre de citoyens se rendent en Arabie saoudite pour des pèlerinages religieux, ont été identifiés comme des régions potentiellement à haut risque pour l'importation du SRMO-CoVNote de bas de page 52Note de bas de page 53. À ce jour, le plus grand nombre de cas signalés à l'extérieur du Moyen-Orient s'est produit en Corée du Sud en 2015 : la majorité des 186 cas signalés étaient associés à une flambée importante dans plusieurs hôpitauxNote de bas de page 54. Dans l'ensemble, les cas étaient les plus dispersés géographiquement au cours de la saison 2014 (signalés par 17 pays) [figure 7].
Figure 6 . Répartition géographique des cas signalés de SRMO entre mars 2012 et le 31 mars 2018. (A) Dans le monde, (B) Péninsule arabique, (C) Europe, Afrique du Nord et Moyen-Orient, et (D) Asie.
Figure 6a: Dans le monde

Équivalent texuel
La figure 6 (A) montre les cas survenus globalement.
Figure 6b: Péninsule arabique

Équivalent texuel
La figure 6 (B) montre les cas dans la péninsule arabique.
Figure 6c: Europe, Afrique du Nord et Moyen-Orient
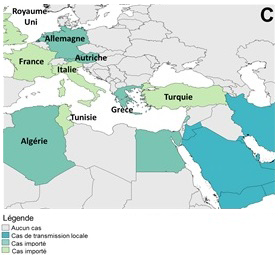
Équivalent texuel
La figure 6 (C) montre des cas en Europe, en Afrique du Nord et en Moyen-Orient.
Figure 6d: Asie

Équivalent texuel
La figure 6 (D) montre des cas en Asie.
Remarque : la carte a été préparée par le Centre de l'immunisation et des maladies respiratoires infectieuses (CIMRI) à l'aide de données compilées par l'Organisation mondiale de la santéNote de bas de page 24.
Figure 7. Répartition spatiale des cas d'infection humaine par le SRMO entre mars 2012 et le 31 mars 2018
Figure 7a: 2012

Équivalent texuel
L'Arabie Saoudite a signalé entre 2 et 5 cas.
Figure 7b: 2013
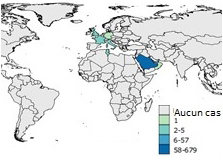
Équivalent texuel
L'Arabie Saoudite a signalé 58 à 679 cas.
Figure 7c: 2014
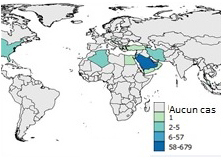
Équivalent texuel
L'Arabie Saoudite a signalé 58 à 679 cas.
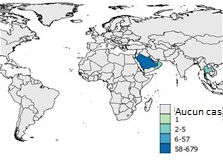
Figure 7d: 2015
Équivalent texuel
L'Arabie Saoudite a signalé 58 à 679 cas.
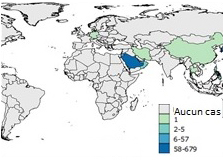
Figure 7e: 2016
Équivalent texuel
L'Arabie Saoudite a signalé 58 à 679 cas.
Figure 7f: 2017

Équivalent texuel
L'Arabie saoudite a signalé 58 à 679 cas.
Figure 7g: 2018

Équivalent texuel
Jusqu'au 31 mars, l'Arabie saoudite a signalé jusqu'à présent 5 à 67 cas.
Remarque : la carte a été préparée par le Centre de l'immunisation et des maladies infectieuses respiratoires (CIMRI) à l'aide des données compilées par l'Organisation mondiale de la santé et le ministère de la Santé de l'Arabie saouditeNote de bas de page 24Note de bas de page 32Note de bas de page 39.
Vaccins contre le SRMO-CoV
Il n'existe aucun vaccin ou traitement antiviral efficace pour le SRMO-CoV. Toutefois, des recherches sont en cours, et de nombreux vaccins expérimentaux ciblant les humains sont en développement. Ces vaccins expérimentaux utilisent un large éventail de plateformes, y compris les vaccins à virus entier (vivants atténués et inactivés), les vaccins à virus vectorisés, les vaccins à ADN, et les vaccins à base de protéines. De nombreux virus ciblent la protéine S (enveloppe) ou le domaine de liaison au récepteur DPP4 (RBD) de la protéine SNote de bas de page 80. Jusqu'à présent, un seul vaccin expérimental est passé à l'élaboration clinique : un vaccin à ADN appelé GLS-5300 ayant démontré qu'il peut générer des anticorps protecteurs contre le SRMO-CoV chez les souris, les chameaux et les singes est passé à la phase 1 des essais cliniques humains en février 2016Note de bas de page 81. Ce vaccin expérimental a également été testé et a réduit l'excrétion du virus chez les dromadairesNote de bas de page 81. Les vaccins à ADN destinés à provoquer des réactions anti-S confèrent également une protection aux primates non humainsNote de bas de page 80. Comme la protéine de spicule (spécifiquement S1) est très divergente entre les différents CoV, les anticorps neutralisants ne fournissent qu'une protection homotypique. En revanche, la séquence d'acides aminés de la protéine de spicule, spécifiquement du domaine S2, est conservée avec une variabilité minimale parmi les souches de SRMO-CoV. Par ailleurs, les souches circulantes de SRMO-CoV manquent également de variation significative de la réactivité sérologique. Comme la protéine du domaine S2 est plus conservée parmi les coronavirus, la réponse immunitaire adaptative dirigée contre la protéine S2 peut potentiellement constituer la base du développement d'un vaccin capable d'induire une protection hétérotypique contre les souches circulantes du SRMO-CoV. En outre, un essai d'innocuité de phase 1 pour un vaccin constitué du virus modifié de la vaccine d'Ankara ayant réduit l'élimination du virus et ayant généré des anticorps protecteurs et une immunité dans les muqueuses est actuellement prévuNote de bas de page 82.
Limites
Cette analyse approfondie du SRMO-CoV comporte plusieurs limites. La majorité des données de ce rapport représentent des cas confirmés en laboratoire de SRMO-CoV signalés dans le Royaume d'Arabie saoudite. Des données très limitées sont disponibles sur les manifestations cliniques, le diagnostic, les traitements et les comorbidités des cas. Il existe une possibilité de biais de sélection inconnue, car les cas primaires ne sont détectés qu'après la manifestation de la maladie. Les cas primaires asymptomatiques ou les cas avec un accès limité aux soins de santé restent non détectés. L'interprétation des facteurs de risque associés à l'acquisition du SRMO-CoV reste donc difficile, en particulier en l'absence de données probantes provenant d'études épidémiologiques de cas-témoins approfondies.
Conclusion
En 2015, l'OMS a créé une liste des maladies prioritaires qui présentent des risques majeurs pour la santé publique et nécessitent des recherches et des développements plus poussés. La liste originale et sa version mise à jour fournies en février 2018 ont considéré le SRMO-CoV comme une urgence potentielle de santé publiqueNote de bas de page 59. Depuis l'émergence du SRMO en 2012, des cas d'infection humaine, principalement dans les pays de la péninsule arabique, continuent d'être signalés. Les modes de transmission de la maladie n'ont pas changé, les introductions répétées dans la population humaine se produisant par transmission zoonotique, suivie d'une transmission interhumaine amplifiée dans les milieux des soins de santé. Une meilleure compréhension de la transmission du SRMO-CoV dans les milieux de soins de santé est nécessaire, en particulier des expositions qui entraînent une transmission interhumaine, du rôle potentiel des travailleurs de la santé infectés asymptomatiques et du rôle possible de la contamination de l'environnement, afin d'atténuer le risque de flambées nosocomiales. Bien que le nombre de cas signalés chaque année semble être en baisse, il est clair qu'une recherche et une surveillance continues sont nécessaires pour combler les lacunes dans les connaissances sur l'origine et les caractéristiques du virus, la transmission de cette maladie dans la communauté, le mode exact de la transmission zoonotique, et les sources environnementales potentielles de la maladie.
References
- Note de bas de page 1
Zaki AM, van Boheemen S, Bestebroer TM, Osterhaus A DME, Fouchier R AM. Isolation of a Novel Coronavirus from a Man with Pneumonia in Saudi Arabia. N Engl J Med 2012;367(19):1814-1820.
- Note de bas de page 2
Fehr A.R., Channappanavar R., Perlman S. Middle East Respiratory Syndrome: Emergence of a Pathogenic Human Coronavirus. Annu Rev Med 2017 14 Jan 2017;68:387-399.
- Note de bas de page 3
Hussein I. The story of the first MERS patient. 2014; Available at: http://www.natureasia.com/en/nmiddleeast/article/10.1038/nmiddleeast.2014.134. Accessed June 25, 2017.
- Note de bas de page 4
ProMED-mail. Novel coronavirus-Saudi Arabia" human isolate. Archive number 20120920.1302733. 2012; Available at: http://www.eurosurveillance.org/images/dynamic/ES/V18N02/V18N02.pdf. Accessed June 25, 2017.
- Note de bas de page 5
Darling ND, Poss DE, Schoelen MP, Metcalf-Kelly M, Hill SE, Harris S. Retrospective, epidemiological cluster analysis of the Middle East respirator syndrome coronavirus (MERS-CoV) epidemic using open source data. Epidemiol Infect 2017;145:3106-3114.
- Note de bas de page 6
World Health Organization [WHO]. Middle East respiratory syndrome coronavirus (MERS-CoV). 2018; Available at: http://www.who.int/emergencies/mers-cov/en/. Accessed April 1, 2018.
- Note de bas de page 7
Lu X., Whitaker B., Sakthivel S.K.K., Kamili S., Rose L.E., Lowe L., et al. Real-time reverse transcription-pcr assay panel for Middle East Respiratory Syndrome coronavirus. J Clin Microbiol 2014 January 2014;52(1):67-75.
- Note de bas de page 8
Hijawi B, Abdallat M, Sayaydeh A, Alqasrawi S, Haddadin A, Jaarour N, et al. Novel coronavirus infections in Jordan, April 2012: epidemiological findings from a retrospective investigation. East Mediterr Health J 2013;19 Suppl 1:S12-8.
- Note de bas de page 9
van Boheemen S., de Graaf M., Lauber C., Bestebroer T.M., Raj V.S., Zaki A.M., et al. Genomic characterization of a newly discovered coronavirus associated with acute respiratory distress syndrome in humans. mBio 2012;3(6) (pagination):ate of Pubaton: Noember/eember 2012.
- Note de bas de page 10
Memish ZA, Zumla AI, Al-Hakeem RF, Al-Rabeeah AA, Stephens GM. Brief report: Family cluster of Middle East Respiratory Syndrome coronavirus infections. N Engl J Med 2013 2013;369(6):587.
- Note de bas de page 11
Health Protection Agency (HPA) UK Novel Coronavirus Investigation team. Evidence of person-to-person transmission within a family cluster of novel coronavirus infections, United Kingdom, February 2013. Euro surveillance 2013 March 14 2013;18(11):20427.
- Note de bas de page 12
Raj VS, Mou H, Smits SL, Dekkers DH, Muller MA, Dijkman R, et al. Dipeptidyl peptidase 4 is a functional receptor for the emerging human coronavirus-EMC. Nature 2013 Mar 14;495(7440):251-254.
- Note de bas de page 13
World Health Organization [WHO]. First meeting of the IHR emergency committtee concerning MERS-CoV. 2013; Available at: http://www.who.int/ihr/procedures/statements_20130709/en/. Accessed June 20, 2017.
- Note de bas de page 14
Reusken C.B.E.M., Haagmans B.L., Muller M.A., Gutierrez C., Godeke G.J., Meyer B., et al. Middle East Respiratory Syndrome coronavirus neutralising serum antibodies in dromedary camels: A comparative serological study. The Lancet Infectious Diseases 2013 October 2013;13(10):859-866.
- Note de bas de page 15
ProMed-mail. MERS-CoV Eastern Mediterranean. 2013; Available at: http://www.promedmail.org/direct.php?id=20131112.2051424. Accessed June 12, 2017.
- Note de bas de page 16
Hastings D.L., Tokars J.I., Abdel Aziz I.Z.A.M., Alkhaldi K.Z., Bensadek A.T., Alraddadi B.M., et al. Outbreak of Middle East Respiratory Syndrome at tertiary care hospital, Jeddah, Saudi Arabia, 2014. Emerging Infectious Diseases 2016 May 2016;22(5):794-801.
- Note de bas de page 17
Drosten C., Muth D., Corman V.M., Hussain R., Al Masri M., HajOmar W., et al. An observational, laboratory-based study of outbreaks of Middle East Respiratory Syndrome coronavirus in Jeddah and Riyadh, Kingdom of Saudi Arabia, 2014. Clinical Infectious Diseases 2015 01 Feb 2015;60(3):369-377.
- Note de bas de page 18
Centers for Disease Control and Prevention [CDC]. CDC announces first case of Middle East Respiratory Syndrome Coronavirus infection (MERS) in the United States. 2014; Available at: https://www.cdc.gov/media/releases/2014/p0502-us-mers.html. Accessed June 8, 2017.
- Note de bas de page 19
Adney D.R., van Doremalen N., Brown V.R., Bushmaker T., Scott D., de Wit E., et al. Replication and shedding of MERS-CoV in upper respiratory tract of inoculated dromedary camels. Emerging Infectious Diseases 2014 01 Dec 2014;20(12):1999-2005.
- Note de bas de page 20
Chu D.K.W., Poon L.L.M., Gomaa M.M., Shehata M.M., Perera R.A.P.M., Zeid D.A., et al. MERS coronaviruses in dromedary camels, Egypt. Emerging Infectious Diseases 2014 June 2014;20(6):1049-1053.
- Note de bas de page 21
Hemida M.G., AlNaeem A., Perera R.A.P.M., Chin A.W.H., Poon L.L.M., Peiris M. Lack of Middle East Respiratory Syndrome coronavirus transmission from infected camels. Emerging Infectious Diseases 2015 2015;21(4):699-701.
- Note de bas de page 22
Muller M.A., Meyer B., Corman V.M., AlMasri M., Turkestani A., Ritz D., et al. Presence of Middle East Respiratory Syndrome coronavirus antibodies in Saudi Arabia: A nationwide, cross-sectional, serological study. The Lancet Infectious Diseases 2015 01 May 2015;15(5):559-564.
- Note de bas de page 23
Adney D.R., BielefeldtOhmann H., Hartwig A.E., Bowen RA. Infection, replication, and transmission of Middle East Respiratory Syndrome coronavirus in alpacas. Emerging Infectious Diseases 2016 June 2016;22(6):1031-1037.
- Note de bas de page 24
World Health Organization [WHO]. Disease outbreak news: Middle East Respiratory Syndrome coronavirus (MERS-CoV) - Oman. 2018; Available at: http://www.who.int/csr/don/15-march-2018-mers-oman/en/. Accessed April 1, 2018.
- Note de bas de page 25
World Health Organization Regional Office for the Eastern Mediterranean [EMRO]. MERS situation update, June 2017. 2017; Available at: http://applications.emro.who.int/docs/EMROPub_2017_EN_19887.pdf. Accessed July 15, 2017.
- Note de bas de page 26
World Health Organization [WHO]. Middle East Respiratory Syndrome coronavirus (MERS-CoV) Lebanon. 2017; Available at: http://www.who.int/csr/don/04-july-2017-mers-lebanon/en/. Accessed July 4, 2017.
- Note de bas de page 27
World Health Organization Regional Office for the Eastern Mediterranean [EMRO]. MERS situation update, January 2018. 2018; Available at: http://www.emro.who.int/pandemic-epidemic-diseases/mers-cov/mers-situation-update-january-2018.html. Accessed April, 2018.
- Note de bas de page 28
World Health Organization Regional Office for the Eastern Mediterranean [EMRO]. MERS situation update, February 2018. 2018; Available at: http://www.emro.who.int/pandemic-epidemic-diseases/mers-cov/mers-situation-update-february-2018.html. Accessed April, 2018.
- Note de bas de page 29
World Health Organization Regional Office for the Eastern Mediterranean [EMRO]. MERS situation update, January-February 2017. 2017; Available at: http://www.emro.who.int/health-topics/mers-cov/news.html. Accessed May 15, 2017.
- Note de bas de page 30
World Health Organization Regional Office for the Eastern Mediterranean [EMRO]. MERS situation update, April 2017. 2017; Available at: http://www.emro.who.int/health-topics/mers-cov/news.html. Accessed May 10, 2017.
- Note de bas de page 31
Gossner C, Danielson N, Gervelmeyer A, Berthe F, Faye B, Kaasik Aaslav K, et al. Human-Dromedary Camel Interactions and the Risk of Acquiring Zoonotic Middle East Respiratory Syndrome Coronavirus Infection. Zoonoses Public Health 2016 Feb;63(1):1-9.
- Note de bas de page 32
Kingdom of Saudi Arabia Ministry of Health [MOH] Command and Control Center. Statistics. 2018; Available at: http://www.moh.gov.sa/en/ccc/pressreleases/pages/default.aspx. Accessed April 1, 2018.
- Note de bas de page 33
Hemida MG, Elmoslemany A, Al-Hizab F, Alnaeem A, Almathen F, Faye B, et al. Dromedary Camels and the Transmission of Middle East Respiratory Syndrome Coronavirus (MERS-CoV). Transbound Emerg Dis 2017 Apr;64(2):344-353.
- Note de bas de page 34
Fagbo S.F., Skakni L., Chu D.K.W., Garbati M.A., Joseph M., Peiris M., et al. Molecular epidemiology of hospital outbreak of Middle East Respiratory Syndrome, Riyadh, Saudi Arabia, 2014. Emerging Infectious Diseases 2015 November 2015;21(11):1981-1988.
- Note de bas de page 35
Abdullah Assiri, Abedi GR, Saeed AA, Abdalla MA, AlMasry M, Choudhry AJ, et al. Multifacility outbreak of Middle East Respiratory Syndrome in Taif, Saudi Arabia. Emerging Infectious Diseases 2016;22(1):32-40. 19 ref.
- Note de bas de page 36
Cho S.Y., Kang J.M., Ha Y.E., Park G.E., Ko J.H., Lee J.Y., et al. MERS-CoV outbreak following a single patient exposure in an emergency room in South Korea: an epidemiological outbreak study. The Lancet 2016 03 Sep 2016;388(10048):994-1001.
- Note de bas de page 37
AlDorzi H.M., Aldawood A.S., Khan R., Baharoon S., Alchin J.D., Matroud A.A., et al. The critical care response to a hospital outbreak of Middle East Respiratory Syndrome coronavirus (MERS-CoV) infection: an observational study. Annals of Intensive Care 2016;6(1) (pagination):Arte Number: 101. ate of Pubaton: 01 e 2016.
- Note de bas de page 38
AlAbdallat M.M., Payne D.C., Alqasrawi S., Rha B., Tohme R.A., Abedi G.R., et al. Hospital-associated outbreak of Middle East Respiratory Syndrome coronavirus: A serologic, epidemiologic, and clinical description. Clinical Infectious Diseases 2014 01 Nov 2014;59(9):1225-1233.
- Note de bas de page 39
World Health Organization [WHO]. Middle East Respiratory Syndrome coronavirus (MERS-CoV): Summary of current situation, literature update and risk assessment, 7 July 2015. 2015 July 7 2015;15.1.
- Note de bas de page 40
European Centre for Disease Prevention and Control. Middle East Respiratory Syndrome coronavirus (MERS-CoV). 21st update, 21 October 2015. 2015 October 21 2015.
- Note de bas de page 41
World Health Organization [WHO]. Middle East Respiratory Syndrome coronavirus (MERS-CoV): WHO MERS-CoV global summary and risk assessment, 5 December 2016. 2016 5 December 2016;16.1.
- Note de bas de page 42
Hunter J.C., Nguyen D., Aden B., Al Bandar Z., Al Dhaheri W., Abu Elkheir K., et al. Transmission of Middle East Respiratory Syndrome coronavirus infections in healthcare settings, abu dhabi. Emerging Infectious Diseases 2016 April 2016;22(4):647-656.
- Note de bas de page 43
Oboho IK, Tomczyk SM, Al-Asmari AM, Banjar AA, Al-Mugti H, Aloraini MS, et al. 2014 MERS-CoV outbreak in Jeddah--a link to health care facilities. N Engl J Med 2015 Feb 26;372(9):846-854.
- Note de bas de page 44
Assiri A, McGeer A, Perl TM, Price CS, Al Rabeeah AA, Cummings DAT, et al. Hospital outbreak of Middle East Respiratory Syndrome coronavirus. N Engl J Med 2013 2013;369(5):407.
- Note de bas de page 45
Balkhy H.H., Alenazi T.H., Alshamrani M.M., BaffoeBonnie H., Arabi Y., Hijazi R., et al. Description of a hospital outbreak of Middle East Respiratory Syndrome in a large tertiary care hospital in Saudi Arabia. Infection Control and Hospital Epidemiology 2016 01 Oct 2016;37(10):1147-1155.
- Note de bas de page 46
El Bushra H.E., Abdalla M.N., Al Arbash H., Alshayeb Z., AlAli S., AlAbdel Latif Z., et al. An outbreak of Middle East Respiratory Syndrome (MERS) due to coronavirus in Al-Ahssa region, Saudi Arabia, 2015. Eastern Mediterranean Health Journal 2016 July 2016;22(7):468-475.
- Note de bas de page 47
Omrani A.S., AlTawfiq J.A., Memish ZA. Middle East Respiratory Syndrome coronavirus (Mers-coV): Animal to human interaction. Pathogens and Global Health 2015 December 2015;109(8):354-362.
- Note de bas de page 48
Younan M., Bornstein S., Gluecks IV. MERS and the dromedary camel trade between Africa and the Middle East. Trop Anim Health Prod 2016 01 Aug 2016;48(6):1277-1282.
- Note de bas de page 49
Sabir JS, Lam TT, Ahmed MM, Li L, Shen Y, Abo-Aba SE, et al. Co-circulation of three camel coronavirus species and recombination of MERS-CoVs in Saudi Arabia. Science 2016 Jan 1;351(6268):81-84.
- Note de bas de page 50
Wernery U., Lau S.K.P., Woo PCY. Middle East Respiratory Syndrome (MERS) coronavirus and dromedaries. Veterinary Journal 2017 01 Feb 2017;220:75-79.
- Note de bas de page 51
Alagaili A.N., Briese T., Mishra N., Kapoor V., Sameroff S.C., de Wit E., et al. Middle East Respiratory Syndrome coronavirus infection in dromedary camels in Saudi Arabia. mBio 2014;5(2) (pagination):Arte Number: e00884-14. ate of Pubaton: 25 Feb 2014.
- Note de bas de page 52
Ma X, Lie F, Lie L, Zhang L, Lu M, Abudukadeer A, Wang L, et al. No MERS-CoV but positive influenza viruses in returning Hajj pilgrims, China, 2013-2015. BMC Infectious Diseases 2017; 17:715
- Note de bas de page 53
Risk of global spread of Middle East respiratory syndrome coronavirus (MERS-CoV) via the air transport network. J Travel Med 2016; 23(6).
- Note de bas de page 54
The Korean Society of Infectious Diseases, Korean Society for Healthcare-associated Infection Control and Prevention. The same Middle East Respiratory Syndrome-coronavirus (MERS-CoV) yet different outbreak patterns and public health impacts on the far east expert opinion from the rapid response team of the Republic of Korea. Infection and Chemotherapy 2015 2015;47(4):247-251.
- Note de bas de page 55
Yin Y, Wunderink RG. MERS, SARS and other coronaviruses as causes of pneumonia. Respirology 2018; 23:130-137.
- Note de bas de page 56
Alsahafi A.J., Cheng AC. The epidemiology of Middle East Respiratory Syndrome coronavirus in the Kingdom of Saudi Arabia, 2012-2015. International Journal of Infectious Diseases 2016 April 01, 2016;45:1-4.
- Note de bas de page 57
World Health Organization [WHO]. Update 49 : SARS case fatality ratio, incubation period. 2003; Available at: http://www.who.int/csr/sarsarchive/2003_05_07a/en/. Accessed July 5, 2017.
- Note de bas de page 58
Banik G.R., Alqahtani A.S., Booy R., Rashid H. Risk factors for severity and mortality in patients with MERS-CoV: Analysis of publicly available data from Saudi Arabia. Virol Sin 2016 01 Feb 2016;31(1):81-84.
- Note de bas de page 59
World Health Organization [WHO]. 2018 Annual review of diseases prioritized under the Research and Development Blueprint. February 2018. Available at: http://www.who.int/emergencies/diseases/2018prioritization-report.pdf?ua=1. Accessed April 1, 2018.
- Note de bas de page 60
Al-Tawfiq JA, Kattan RF, Memish ZA. Middle East Respiratory Syndrome coronavirus disease is rare in children: An update from Saudi Arabia. World Journal of Clinical Pediatrics 2016 Nov 08;5(4):391-396.
- Note de bas de page 61
Memish Z.A., AlTawfiq J.A., Assiri A., Alrabiah F.A., Hajjar S.A., Albarrak A., et al. Middle East Respiratory Syndrome coronavirus disease in children. Pediatr Infect Dis J 2014 2014;33(9):904-906.
- Note de bas de page 62
SharifYakan A., Kanj SS. Emergence of MERS-CoV in the Middle East: Origins, Transmission, Treatment, and Perspectives. PLoS Pathogens 2014;10(12) (pagination):ate of Pubaton: 01 e 2014.
- Note de bas de page 63
Ithete NL, Stoffberg S, Corman VM, Cottontail VM, Richards LR, Schoeman MC, et al. Close relative of human Middle East Respiratory Syndrome coronavirus in bat, South Africa. Emerg Infect Dis 2013 Oct;19(10):1697-1699.
- Note de bas de page 64
Memish Z.A., Mishra N., Olival K.J., Fagbo S.F., Kapoor V., Epstein J.H., et al. Middle East Respiratory Syndrome coronavirus in Bats, Saudi Arabia. Emerging Infectious Diseases 2013 November 2013;19(11):1819-1823.
- Note de bas de page 65
Wang Q., Qi J., Yuan Y., Xuan Y., Han P., Wan Y., et al. Bat origins of MERS-CoV supported by bat Coronavirus HKU4 usage of human receptor CD26. Cell Host and Microbe 2014 10 Sep 2014;16(3):328-337.
- Note de bas de page 66
World Organisation for Animal Health (OIE). World Animal Health Informaton System (WAHIS). 2017; Available at: hhttp://www.oie.int/wahis_2/public/wahid.php/Countryinformation/Countryreports. Accessed July 8, 2017.
- Note de bas de page 67
Memish Z.A., Alsahly A., Masri M.al., Heil G.L., Anderson B.D., Peiris M., et al. Sparse evidence of MERS-CoV infection among animal workers living in Southern Saudi Arabia during 2012. Influenza and other Respiratory Viruses 2015 01 Mar 2015;9(2):64-67.
- Note de bas de page 68
Aburizaiza A.S., Mattes F.M., Azhar E.I., Hassan A.M., Memish Z.A., Muth D., et al. Investigation of anti-Middle East Respiratory Syndrome antibodies in blood donors and slaughterhouse workers in Jeddah and Makkah, Saudi Arabia, Fall 2012. J Infect Dis 2014 15 Jan 2014;209(2):243-246.
- Note de bas de page 69
Reusken C.B.E.M., Farag E.A.B.A., Haagmans B.L., Mohran K.A., Godeke G.J., Raj V.S., et al. Occupational exposure to dromedaries and risk for MERS-CoV infection, Qatar, 2013-2014. Emerging Infectious Diseases 2015 23 Jul 2015;21(8):1422-1425.
- Note de bas de page 70
Abroug F., Slim A., OuanesBesbes L., Kacem M.A.H., Dachraoui F., Ouanes I., et al. Family cluster of Middle East Respiratory Syndrome coronavirus infections, Tunisia, 2013. Emerging Infectious Diseases 2014 September 2014;20(9):1527-1530.
- Note de bas de page 71
Kim KyungMin, Ki MoRan, Cho SungIl, Sung MinKi, Hong JinKwan, Cheong HaeKwan, et al. Epidemiologic features of the first MERS outbreak in Korea: focus on Pyeongtaek St. Mary's Hospital. Epidemiology and Health; 2015.37:e2015041 2015.
- Note de bas de page 72
Balkhy HH, Alenazi TH, Alshamrani MM, Baffoe-Bonnie H, Al-Abdely HM, El-Saed A, et al. Notes from the Field: Nosocomial Outbreak of Middle East Respiratory Syndrome in a Large Tertiary Care Hospital--Riyadh, Saudi Arabia, 2015. MMWR Morb Mortal Wkly Rep 2016 Feb 19;65(6):163-164.
- Note de bas de page 73
Al-Tawfiq JA, Perl TM. Middle East Respiratory Syndrome coronavirus in healthcare settings. Curr Opin Infect Dis 2015 Aug;28(4):392-396.
- Note de bas de page 74
El Bushra HE, Al Arbash HA, Mohammed M, Abdalla O, Abdallah MN, Al-Mayahi ZK, et al. Outcome of strict implementation of infection prevention control measures during an outbreak of Middle East Respiratory Syndrome. Am J Infect Control 2017 May 1;45(5):502-507.
- Note de bas de page 75
Arabi Y.M., Balkhy H.H., Hayden F.G., Bouchama A., Luke T., Baillie J.K., et al. Middle East Respiratory Syndrome. N Engl J Med 2017 09 Feb 2017;376(6):584-594.
- Note de bas de page 76
Fehr AR, Channappanavar R, Perlman S. Middle East Respiratory Syndrome: Emergence of a Pathogenic Human Coronavirus. Annu Rev Med 2017 Jan 14;68:387-399.
- Note de bas de page 77
Chinese SARS Molecular Epidemiology Consortium. Molecular evolution of the SARS coronavirus during the course of the SARS epidemic in China. Science 2004 Mar 12;303(5664):1666-1669.
- Note de bas de page 78
Sabir JS, Lam TT, Ahmed MM, Li L, Shen Y, Abo-Aba SE, et al. Co-circulation of three camel coronavirus species and recombination of MERS-CoVs in Saudi Arabia. Science 2016 Jan 1;351(6268):81-84.
- Note de bas de page 79
Kim Y, Cheon S, Min CK, Sohn KM, Kang YJ, Cha YJ, et al. Spread of Mutant Middle East Respiratory Syndrome Coronavirus with Reduced Affinity to Human CD26 during the South Korean Outbreak. MBio 2016 Mar 1;7(2):e00019-16.
- Note de bas de page 80
Okba NM, Raj VS, Haagmans BL. Middle East Respiratory Syndrome coronavirus vaccines: current status and novel approaches. Curr Opin Virol 2017 Apr 13;23:49-58.
- Note de bas de page 81
Modjarrad K. MERS-CoV vaccine candidates in development: The current landscape. Vaccine 2016 Jun 3;34(26):2982-2987.
- Note de bas de page 82
Alharbi NK. Vaccines against Middle East Respiratory Syndrome coronavirus for humans and camels. Rev Med Virol 2017 Mar;27(2):10.1002/rmv.1917. Epub 2016 Oct 27.
- Note de bas de page 83
Chu DKW, Hui KPY, Perera RAPM, Miguel E, Niemeyer E, et al. MERS coronaviruses from camels in Africa exhibit region-dependent genetic diversity. PNAS 2018 Mar 20; 115(12):3144-3149.
- Note de bas de page 84
Seys LJM, Widagdo W, Verhamme FM, Kleinjan A, Janssens W, et al. DPP4, the Middle East Respiratory Syndrome Coronavirus Receptor, is Upregulated in Lungs of Smokers and Chronic Obstructive Pulmonary Disease Patients. Clinical Infectious Diseases. 2018 Jan; 66(1): 45-63.
Notes de bas de page
- Note de bas de page a
Les cas secondaires sont des cas ayant des antécédents de contact avec un cas positif de SRMO
- Note de bas de page b
Les cas primaires sont des cas n'ayant aucun antécédent de contact avec un cas positif de SRMO