Document supplémentaire de caractérisation des risques – Mise à jour de l’évaluation des risques pour la santé humaine de la mélamine
Titre officiel : Document supplémentaire de caractérisation des risques – Mise à jour de l’évaluation des risques pour la santé humaine de la mélamine
Santé Canada
Janvier 2025
Sommaire
Une mise à jour de l’ébauche d’évaluation préalable pour la 1,3,5-triazine-2,4,6-triamine (numéro de registre du Chemical Abstracts Service [no CAS] 108-78-1), communément appelée mélamine, a été publiée le 17 octobre 2020. Il y est proposé de conclure que la mélamine est nocive pour la santé humaine, mais pas pour l’environnement. La mélamine fait partie du Groupe de certaines substances ignifuges organiques visé par le Plan de gestion des produits chimiques, qui comprend 10 substances organiques qui ont une fonction similaire, soit leur application sur des matériaux en vue de ralentir l’allumage et la propagation du feu.
Depuis la publication de la mise à jour de l’ébauche d’évaluation préalable pour la mélamine, de nouveaux effets critiques sur la santé ont été relevés, et l’exposition à la mélamine a été réexaminée. Le présent document contient une mise à jour de la caractérisation des risques pour la santé humaine associés à l’exposition à la mélamine afin d’éclairer l’évaluation de cette substance. Le public a l’occasion de commenter les données et les analyses contenues dans ce document avant qu’elles ne soient prises en compte dans l’évaluation finale de la mélamine et, le cas échéant, dans le document correspondant sur l’approche de gestion des risques. Les données sur la mélamine relatives à la santé humaine recensées ou produites depuis la publication de la mise à jour de l’ébauche d’évaluation préalable sont incluses dans le présent document.
La mélamine n’est pas naturellement présente dans l’environnement et elle n’est pas fabriquée au Canada. Cependant, des importations de l’ordre de 10 à 100 millions de kg de mélamine pure ou mélangée à des produits ont été déclarées pour 2011. La mélamine a de nombreuses applications industrielles au Canada. Elle est surtout utilisée dans la fabrication de résines à base de mélamine, pour une application dans les stratifiés et les plastiques, et comme ignifuge dans les mousses de polyuréthane, les peintures et les revêtements. À l’échelle mondiale, la mélamine sert principalement à la synthèse de résines de mélamine-formaldéhyde pour des applications semblables et entre dans la composition d’adhésifs et de composés de moulage (par exemple, pour les articles en mélamine). En raison de sa forte teneur en azote, la mélamine est aussi utilisée mondialement comme engrais.
La population canadienne devrait principalement être exposée à la mélamine à partir de l’utilisation de produits offerts aux consommateurs, notamment la vaisselle et les ustensiles de cuisine contenant de la melamine (articles en mélamine, dont les articles en bambou), les produits contenant de la mousse (par exemple, les matelas, les meubles rembourrés, les ensembles de retenue pour bébés et enfants, et les sièges d’appoint), les textiles, les peintures, les produits d’étanchéité et les produits nettoyants pour surfaces de cuisson, ainsi qu’à partir de sources alimentaires et environnementales (l’eau et la poussière). Des données de biosurveillance recueillies auprès de la population américaine sont également disponibles.
En se fondant essentiellement sur le poids de la preuve provenant d’évaluations réalisées par des organismes internationaux et d’autres données disponibles, on a déterminé que les effets critiques associés à l’exposition à la mélamine sont la cancérogénicité, les effets sur l’appareil urinaire et la toxicité pour la reproduction. D’après les renseignements disponibles, la mélamine n’est pas génotoxique. Les comparaisons entre les concentrations associées à des effets critiques observés lors d’études menées sur des animaux et les estimations de l’exposition à partir des milieux de l’environnement, des aliments et des textiles sont jugées adéquates pour tenir compte des incertitudes liées aux données sur les effets sur la santé et l’exposition utilisées pour caractériser les risques. Toutefois, les comparaisons entre les concentrations associées à des effets critiques observés lors d’études menées sur des animaux et les estimations de l’exposition à partir d’articles en mélamine, dont les articles en bambou (par la migration de la mélamine de ces articles vers les aliments et les boissons), de produits contenant de la mousse (dont les matelas, les meubles rembourrés, les ensembles de retenue pour bébés et enfants, et les sièges d’appoint), de peintures (pour pinceau ou rouleau, ou en aérosol), de produits d’étanchéité et de produits nettoyants pour surfaces de cuisson sont jugées potentiellement inadéquates pour tenir compte des incertitudes liées aux ensembles de données sur les effets sur la santé et l’exposition.
L’évaluation des effets sur la santé humaine a tenu compte des groupes de personnes de la population canadienne qui, en raison d’une vulnérabilité accrue ou d’une plus grande exposition, peuvent être plus susceptibles de subir des effets nocifs pour la santé découlant de l’exposition à des substances. Le potentiel d’une vulnérabilité accrue durant le développement et la reproduction a été évalué, et l’exposition selon l’âge a été estimée. De façon générale, les bébés et les enfants sont davantage exposés que les adultes. Toutes ces populations ont été prises en considération lors de l’évaluation des dangers potentiels pour la santé humaine.
D’après les renseignements contenus dans le présent document de caractérisation des risques, l’exposition à la mélamine à partir d’articles en mélamine (dont les articles en bambou), de produits contenant de la mousse (dont les matelas, les meubles rembourrés, les ensembles de retenue pour bébés et enfants, et les sièges d’appoint), de peintures, de produits d’étanchéité et de produits nettoyants pour surfaces de cuisson peut être nocive pour la santé humaine.
1. Introduction
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE] (Canada, 1999), le ministre de l’Environnement et le ministre la Santé procèdent à l’évaluation de substances afin de déterminer si elles présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine.
En octobre 2020, ils ont publié la mise à jour de l’ébauche d’évaluation préalable : Groupe de certaines substances ignifuges organiques pour la 1,3,5-triazine-2,4,6-triamine (mélamine), ci-après appelée « mise à jour de l’ébauche d’évaluation préalable pour la mélamine » (ECCC, SC, 2020). Il y est proposé de conclure que la mélamine est nocive pour la santé humaine, mais pas pour l’environnement. Depuis la publication de cette évaluation, de nouveaux effets critiques sur la santé ont été relevés, et l’exposition à la mélamine a été réexaminée. Le présent document contient une mise à jour de la caractérisation des risques pour la santé humaine associés à l’exposition à la mélamine afin d’éclairer l’évaluation de cette substance.
La portée du présent document se limite à l’évaluation d’éventuelles préoccupations pour la santé humaine associées à la mélamine. Le public a l’occasion de commenter les nouvelles données et analyses contenues dans ce document avant qu’elles ne soient prises en compte dans l’évaluation finale de la mélamine et, le cas échéant, dans le document correspondant sur l’approche de gestion des risques. Depuis la publication de la mise à jour de l’ébauche d’évaluation préalable (ECCC, SC, 2020), on n’a relevé aucun changement important à l’évaluation des risques écologiques de la mélamine qui justifierait d’autres consultations publiques.
Le présent document contient des données recensées ou produites depuis la publication du dernier rapport sur la mise à jour de l’ébauche d’évaluation préalable (en octobre 2020). On a effectué des recherches ciblées dans les publications scientifiques jusqu’en février 2023 pour la composante sur la santé humaine de la présente évaluation. Toutefois, des études plus récentes ou des renseignements obtenus dans le cadre de consultations internes et externes de pairs pour cette composante pourraient également être cités. Des données empiriques d’études clés ainsi que certains résultats obtenus par modélisation ont servi à formuler les conclusions proposées. Lorsqu’ils étaient disponibles et pertinents, les renseignements contenus dans les évaluations effectuées par d’autres instances ont été pris en compte.
Le présent document supplémentaire a été préparé par le personnel du Programme des substances existantes de Santé Canada et il intègre les résultats d’autres programmes exécutés par ce ministère. Il a fait l’objet d’un examen par des pairs ou de consultations externes. Des commentaires concernant les parties techniques pertinentes pour la santé humaine ont été reçus de Tetra Tech Inc. Par ailleurs, la dernière mise à jour de l’ébauche d’évaluation préalable de la mélamine (publiée le 17 octobre 2020) a fait l’objet d’une période de commentaires du public de 60 jours. À la lumière de ces commentaires ainsi que des nouveaux renseignements reçus, une mise à jour de l’ébauche de caractérisation des risques pour la santé humaine est présentée ici. Bien que des commentaires externes aient été pris en compte, Santé Canada est responsable du contenu final du document.
Pour la détermination de la conformité des substances aux critères énoncés à l’article 64 de la LCPE, les évaluations s’appuient sur des informations scientifiques, dont les informations sur les sous-populations qui peuvent être plus vulnérables ou plus exposées, les environnements vulnérables et les effets cumulatifsNote de bas de page 1, si elles sont disponibles, et adoptent une approche fondée sur les principes du poids de la preuve et de précautionNote de bas de page 2. La présente évaluation expose les données critiques et les considérations sur lesquelles sont fondées les conclusions.
2. Identité de la substance
La substance 1,3,5-triazine-2,4,6-triamine (no CAS 108-78-1), ci-après désignée par son nom commun, mélamine, est une substance chimique organique distincte caractérisée par sa forte teneur en azote. Elle appartient au sous-groupe chimique des triazines. Il convient de noter que le nom de la substance chimique, mélamine, est aussi couramment utilisé pour désigner le plastique fait à partir de cette substance (OMS, 2009).
Les renseignements sur la mélamine sont résumés dans le tableau 2‑1.
| No CAS | Structure chimique | Masse moléculaire (g/mol) | Formule chimique |
|---|---|---|---|
| 108-78-1 | 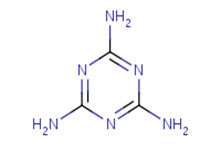 |
126,12 | C3H6N6 |
2.1 Sélection d’analogues
Une méthode de lecture croisée fondée sur les données d’analogues a été utilisée pour estimer l’absorption cutanée afin d’évaluer l’exposition à la mélamine (section 5.1.3). On a choisi des analogues dont la structure était semblable à celle de la mélamine (propriétés physicochimiques semblables) et pour lesquels on disposait de données empiriques pertinentes sur l’absorption cutanée permettant d’effectuer une lecture croisée pour la mélamine. Le tableau 2‑2 donne des renseignements sur l’identité et la structure chimique des analogues utilisés pour éclairer la présente évaluation. Pour obtenir de plus amples renseignements sur les propriétés physicochimiques des analogues, veuillez consulter l’annexe A.
| No CAS | Nom sur la Liste intérieure (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) | Référence |
|---|---|---|---|---|
| 1912-24-9 | Atrazine |  C8H14ClN5
C8H14ClN5 |
215,68 | PubChem, 2004– |
| 66215-27-8 | Cyromazine |  C6H10N6 C6H10N6 |
166,18 | PubChem, 2004– |
3. Propriétés physiques et chimiques
Le tableau 3‑1 résume les propriétés physiques et chimiques (valeurs expérimentales et modélisées) de la mélamine qui se rapportent à sa toxicité et à son devenir dans l’environnement. D’autres détails sont fournis dans la mise à jour de l’ébauche d’évaluation préalable (ECCC, SC, 2020).
| Propriété | Type de valeur | Valeura | Température (°C) | Référence |
|---|---|---|---|---|
Forme physique |
Expérimentale | Poudre blanche solide et inodore | Température ambiante | ECHA, c2007-2022 |
Point de fusion (°C) |
Expérimentale | 345* à 361 | S. O. | PubChem, 2004–; Rumble, 2018; ECHA, c2007-2022 |
Point de fusion (°C) |
Modélisée | 133 | S. O. | MPBPVP, 2010 |
Point d’ébullition (°C) |
Expérimentale | La substance se décompose avant de bouillir. | S. O. | ECHA, c2007-2022 |
Masse volumique (kg/m³) |
Expérimentale | 1,57 | 20 | ECHA, c2007-2022 |
Pression de vapeur (Pa) |
Expérimentale | 7,5 × 10-9; 4,75 × 10–8* (3,56 × 10–10 mmHg) | 20 | Hirt et coll., 1960; ECHA, c2007-2022 |
Pression de vapeur (Pa) |
Expérimentale | 9,4 × 10-8; 1,1 × 10-7 | 25 | Hirt et coll., 1960; Crews et coll., 2012 |
CH (Pa·m³/mol) |
Modélisée | 1,86 × 10-9
(pression de vapeur et solubilité dans l’eau estimées) |
25 | HENRYWIN, 2011 |
log Koe (sans dimension) |
Expérimentale | -1,14* | 25 | ECHA, c2007-2022 |
log Koe (sans dimension) |
Expérimentale | -1,22 | 22 | SWISSI, 2009; ECHA, c2007-2022 |
log Koe (sans dimension) |
Expérimentale | -1,37 | S. O. | Hansch et coll., 1995 |
log Koe (sans dimension) |
Modélisée | -0,38 | S. O. | KOWWIN, 2010 |
log Kco (sans dimension) |
Modélisée | 1,5* (méthode d’estimation de l’ICM) 0 (méthode d’estimation du Koe) | S. O. | KOCWIN, 2010 |
log D |
Modélisée | -1,22 à -1,18 (à un pH de 6,5–8,0) | S. O. | ACD/ Percepta, 2005 |
log Koa (sans dimension) |
Modélisée | 10,8 | S. O. | KOAWIN, 2010 |
Solubilité dans l’eau (mg/L) |
Expérimentale | 3190, 3230*, 3480 | 20 | Crews et coll., 2012; Yalkowsky et He, 2003; ECHA, c2007-2022; SWISSI, 2009 |
Solubilité dans l’eau (mg/L) |
Expérimentale | 4850 | 25 | ECHA, c2007-2022 |
pKa (sans dimension) |
Expérimentale | 5 | 25 | Weber, 1970 |
pKa (sans dimension) |
Expérimentale | pKa(base)1 = 7,3 pKa(base)2 = 11,4 | S. O. | SWISSI, 2009 |
pKa (sans dimension) |
Modélisée | pKa(base) = 5,3 | S. O. | ACD/ Percepta, 2005 |
Abréviations : CH, constante de Henry; log Koe : coefficient de partage octanol-eau; log Kco : coefficient de partage carbone organique-eau; log Kae : coefficient de partage air-eau; log Koa : coefficient de partage octanol-air; log D : coefficient de distribution (habituellement pour l’octanol-eau); pKa : constante de dissociation acide; S. O. : sans objet; ICM : indice de connectivité moléculaire.
a Les valeurs entre parenthèses représentent les valeurs originales rapportées par les auteurs ou estimées par les modèles.
* Valeur choisie pour la modélisation.
4. Sources et utilisations
La mélamine n’est pas naturellement présente dans l’environnement. Elle peut être fabriquée à partir d’urée – de façon commerciale, notamment (OMS, 2009) –, de dicyandiamide ou de cyanure d’hydrogène.
D’après une enquête menée en vertu de l’article 71 de la LCPE (Canada, 2013) et les renseignements communiqués volontairement par des intervenants, entre 10 et 100 millions de kg de mélamine ont été importés au Canada en 2011 (ECCC, 2013-2014). La mélamine n’a pas été fabriquée au Canada en quantités dépassant le seuil de déclaration de 100 kg (ECCC, 2013-2014)Note de bas de page 3.
Selon la Base de données sur le commerce international canadien de marchandises, environ 9 à 15 millions de kg de mélamine ont été importés au Canada entre 2011 et 2021 (Statistique Canada, 2022). La consommation canadienne de mélamine était de 9,7 millions de kg en 2019 et de 8,8 millions de kg en 2020 (Malveda et Zhang, 2020).
Les utilisations de la mélamine sont variées et touchent de nombreux secteurs industriels, tant au Canada qu’à l’étranger. Les utilisations et applications connues de la mélamine, y compris les cas de falsification de produits alimentaires et d’aliments pour animaux, sont résumées ci-dessous.
D’après les réponses à une enquête menée en vertu de l’article 71 de la LCPE pour l’année 2011 et les renseignements communiqués volontairement par des intervenants (ECCC, 2013-2014), la mélamine a été utilisée au Canada dans des peintures et revêtements commerciaux et de consommation, dans des sièges et de la literie en mousse (ce qui peut comprendre des oreillers et des matelas) ainsi que dans la résine de mélamine-formaldéhyde employée pour les stratifiés décoratifs (ECCC, 2013-2014). La substance a également été utilisée comme ignifuge au Canada (ECCC, 2013-2014). En outre, la mélamine est employée comme plastifiant dans le béton et les conduites et flexibles de freins automobiles (ECCC, 2013-2014). Une recherche en ligne de produits canadiens chez divers détaillants a aussi révélé son utilisation dans le papier et les étagères en mélamine thermofusionnés, les tableaux blancs et les panneaux de flocons, les peintures, les produits d’étanchéité pour des applications mécaniques, électriques et de plomberie, et l’encre pour impression à jet d’encre. À l’échelle mondiale, la mélamine est surtout utilisée dans la synthèse de résines de mélamine-formaldéhyde pour la fabrication de stratifiés (par exemple, pour les comptoirs de cuisine, les dessus de table), d’éponges à récurer, de plastiques, de revêtements, de filtres commerciaux, de produits offerts aux consommateurs comme les colles ou les adhésifs, de produits nettoyants et de composés de moulage pour la vaisselle et les ustensiles de cuisine contenant de la mélamine (ci-après appelés « articles en mélamine », ce qui comprend les articles en bambou) (OMS, 2009; BfR, 2019; CPID, c2001-2022).
Selon les résultats d’une enquête menée en vertu de l’article 71 de la LCPE, environ 4 % de toute la mélamine importée au Canada en 2011 a été utilisé comme ignifuge (ECCC, 2013-2014), ce qui concorde avec ce qui a été observé à l’échelle mondiale. La mélamine est utilisée comme ignifuge principalement dans les mousses en polyuréthane (EFRA, 2007). Elle est souvent employée en combinaison avec de nombreux autres ignifuges comme le phosphate de tris(2-chloro-1-méthyléthyle) [TCPP] (ECHA, 2018), le phosphate bicyclique, le décabromodiphényléther (décaBDE), l’oxyde d’antimoine, le déchlorane plus (DP) et d’autres, ainsi que dans les préparations de polyoléfines utilisées dans les plastiques et les élastomères pour améliorer la capacité ignifuge générale du produit final (Weil et Choudhary, 1995). La mélamine est aussi utilisée dans la production d’autres ignifuges, comme le cyanurate de mélamine (no CAS 37640-57-6), le phosphate de mélamine (no CAS 20208-95-1), le polyphosphate de mélamine (no CAS 218768-84-4) et le pyrophosphate de mélamine (no CAS 15541-60-3) (EFRA, 2007).
Parmi les autres utilisations mondiales de la mélamine, mentionnons son application comme résine d’imprégnation ou adhésive dans les panneaux à base de bois pour les meubles et les revêtements de sol, ainsi que dans le papier-monnaie, les magazines sur papier glacé et les textiles (DSM, 2010). Bien qu’il n’y ait aucune utilisation confirmée dans les textiles au Canada, la mélamine a été détectée dans des vêtements pour bébés et des textiles et tissus aux États-Unis (Zhu et Kannan, 2020a; Zheng et Salamova, 2020).
La mélamine est utilisée en agriculture. En raison de sa teneur élevée en azote, elle a été mise à l’essai et utilisée comme engrais à libération lente (Wehner et Martin, 1989; OMS, 2009). La mélamine n’est pas employée comme principe actif ou produit de formulation dans des produits antiparasitaires homologués au Canada (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, juin 2021, source non citée). Toutefois, la mélamine est un sous-produit métabolique de l’insecticide cyromazine, un inhibiteur de la croissance des insectes qui peut être vaporisé ou intégré à l’alimentation des animaux (Roberts et Hudson, 1999; Zhu et coll. 2009). Au Canada, la cyromazine est homologuée pour une utilisation dans les produits antiparasitaires contre le doryphore de la pomme de terre dans les cultures de pommes de terre et contre les insectes pour certaines cultures et plantes ornementales non cultivées pour la production de fleurs coupées (ARLA, 2021).
La mélamine ne figure pas sur les Listes des additifs alimentaires autorisés au Canada, qui ont été incorporées comme référence dans les autorisations de commercialisation émises en vertu de la Loi sur les aliments et drogues (Santé Canada [modifiée en 2024]), et son utilisation à cette fin ne serait pas autorisée. Les répondants à une enquête menée en vertu de l’article 71 de la LCPE n’ont déclaré aucune utilisation de la mélamine dans des matériaux qui entrent en contact avec les aliments (ECCC, 2013-2014), mais la mélamine peut être utilisée en tant que monomère dans des polymères comme les résines de mélamine-formaldéhyde pour la fabrication de produits d’emballage alimentaire au Canada (par exemple, le revêtement intérieur des boîtes de conserve, à l’exception de celles contenant des préparations pour nourrissons, le revêtement des couvercles métalliques des pots en verre pour aliments pour bébé et des bouteilles en verre et en plastique pour les préparations liquides pour nourrissons, le papier utilisé pour emballer le pain ou la margarine, les pellicules pour l’emballage du lait) (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, juillet 2021, source non citée).
En Europe, l’utilisation de la mélamine en tant que monomère est approuvée pour la fabrication de matières plastiques et d’articles destinés à entrer en contact avec les aliments, avec une limite de migration fixée à 2,5 mg/kg d’aliments (UE, 2011). Aux États-Unis, la mélamine et le copolymère de mélamine-formaldéhyde peuvent être utilisés dans la formulation d’adhésifs pouvant entrer dans la composition d’articles destinés à emballer, à transporter ou à contenir des aliments (additif alimentaire indirect), à condition que l’adhésif soit séparé de l’aliment par une barrière fonctionnelle (US eCFR, 2014a). En outre, la résine ou le polymère de mélamine-formaldéhyde peut être utilisé comme revêtement des surfaces qui sont en contact avec les aliments (additif alimentaire indirect) dans le cas des articles destinés à la production, à la fabrication, au conditionnement, à la transformation, à la préparation, au traitement, à l’emballage, au transport ou à la garde d’aliments (US eCFR, 2014b).
À la suite de l’identification de produits falsifiés avec de la mélamine (nourriture pour animaux domestiques, bétail et poissons) en Amérique du Nord en 2007 et de certains aliments falsifiés avec de la mélamine (préparation pour nourrissons en Chine et autres aliments transformés à base de lait ailleurs dans le monde) en 2008 en raison de l’utilisation d’ingrédients falsifiés provenant de Chine, des concentrations maximales (CM) de mélamine dans les aliments ont été fixées à l’échelle internationale pour assurer la sécurité des consommateurs (Santé Canada, 2008, 2016a, 2022; CCA, 2019; OMS, 2009; Gossner et coll., 2009; Dorne et coll. 2013; CIRC, 2019). D’autres précisions figurent à l’annexe B.
D’après les déclarations présentées à Santé Canada au titre du Règlement sur les cosmétiques, la mélamine n’est pas utilisée dans les cosmétiques au Canada (courriel de la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, au Bureau de l’évaluation du risque des substances existantes, Santé Canada, juin 2021, source non citée).
Au Canada, la mélamine ne figure pas dans la Base de données sur les produits pharmaceutiques (BDPP) ni dans la base de données interne sur les ingrédients non médicamenteux de la Direction des médicaments pharmaceutiques à titre d’ingrédient médicamenteux ou non médicamenteux présent dans des produits pharmaceutiques ou des médicaments vétérinaires (BDPP [modifiée en 2022]; communication personnelle, courriel de la Direction des médicaments pharmaceutiques, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, juin 2021, source non citée). La mélamine figure dans la Base de données sur les ingrédients des produits de santé naturels en tant que produit de santé non naturel, car il ne s’agit pas d’une substance naturelle visée par l’annexe 1 du Règlement sur les produits de santé naturels. Par conséquent, elle ne figure pas dans la Base de données sur les produits de santé naturels homologués comme étant présente dans les produits de santé naturels actuellement homologués au Canada (BDIPSN [modifiée en 2022]; BDPSNH [modifiée en 2021]; communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, au Bureau de l’évaluation du risque des substances existantes, Santé Canada, juin 2021, source non citée).
5. Potentiel d’effets nocifs pour la santé humaine
5.1 Évaluation de l’exposition
La présente section aborde le potentiel d’exposition à la mélamine par les milieux de l’environnement (eau potable, air, sol, poussière), les aliments, la vaisselle contenant de la mélamine et les produits offerts aux consommateurs, ainsi que les estimations de l’exposition fondées sur les données de biosurveillance. La mélamine est un métabolite et un produit de dégradation de la cyromazine (OMS, 2009; CIRC, 2019). Par conséquent, sa présence dans l’environnement, les aliments et les données de biosurveillance humaine (c'est-à-dire dans le lait maternel et l’urine) peut être attribuable à l’exposition à la cyromazine.
5.1.1 Milieux de l’environnement et aliments
5.1.1.1 Air
Aucune donnée sur les concentrations de mélamine dans l’air ambiant ou l’air intérieur résidentiel n’a été recensée.
5.1.1.2 Poussière
Aucune donnée sur les concentrations de mélamine dans la poussière au Canada n’a été recensée. La mélamine et ses dérivés ont été détectés dans 341 échantillons de poussière intérieure prélevés dans 12 pays durant la période allant de 2010 à 2014. Ces pays sont le Koweït (n = 24), la Corée du Sud (n = 30), le Japon (n = 14), la Chine (n = 50), le Vietnam (n = 18), l’Arabie saoudite (n = 31), les États-Unis (n = 15), la Roumanie (n = 23), la Grèce (n = 30), l’Inde (n = 36), le Pakistan (n = 25) et la Colombie (n = 45). Les concentrations les plus élevées ont été mesurées dans la poussière domestique prélevée aux États-Unis et allaient de 4800 ng/g à 58 000 ng/g (moyenne = 17 000 ng/g, médiane = 12 000 ng/g) (Zhu et Kannan, 2018).
En 2016, des échantillons de poussière ont été prélevés sur le plancher et les surfaces surélevées de 7 centres de la petite enfance de Seattle, dans l’État de Washington (n = 14), et d’un centre de la petite enfance de West Lafayette, en Indiana (n = 6). On y a détecté de la mélamine à des concentrations allant de 159 ng/g à 66 600 ng/g (moyenne = 6920 ± 3470 ng/g, médiane = 1620 ng/g, fréquence de détection = 100 %) (Zheng et coll., 2020).
En raison de l’absence de données canadiennes sur la présence de mélamine dans la poussière, les données américaines recueillies par Zheng et coll. (2020) ont servi à caractériser l’exposition humaine à la mélamine à partir de la poussière. L’absorption estimée était de 0,024 µg/kg p.c./j et de 0,23 µg/kg p.c./j pour les bébés âgés de 0 à 5 mois (groupe le plus exposé) d’après les concentrations moyenne et maximale, respectivement (voir l’annexe C).
5.1.1.3 Sol
Aucune donnée sur les concentrations de mélamine dans les sols nord-américains n’a été recensée, et aucune concentration environnementale estimée (CEE) dans le sol n’a été déterminée lors de l’évaluation des risques écologiques de la mélamine (ECCC, SC, 2020). Par conséquent, le sol ne devrait pas constituer une source importante d’exposition humaine à la mélamine.
5.1.1.4 Eau
Il n’y a pas de données canadiennes disponibles sur la présence de mélamine dans l’eau potable ou les eaux de surface. Les concentrations de mélamine dans l’eau potable sont tirées d’un rapport du groupe d’experts de l’Autorité européenne de sécurité des aliments (EFSA, 2010). Les données contenues dans ce rapport ont été fournies par des membres de l’industrie de diverses régions du monde (n = 20 échantillons d’eau du robinet), et les concentrations de mélamine qui y sont présentées vont de 10 µg/kg à 200 µg/kg (moyenne = 50 µg/kg; valeurs déclarées en mg/kg pour tous les groupes alimentaires, y compris l’eau du robinet, dans EFSA, 2010). Le rapport ne fait pas état des résultats par échantillon ni du nombre d’échantillons dont la concentration de mélamine était inférieure à la limite de détection (LD).
La mélamine a été mesurée dans des échantillons de diverses sources d’eau [dont les eaux de surface (n = 74), l’eau de mer (n = 10), l’eau du robinet (n = 70), l’eau embouteillée (n = 11), l’eau de pluie (n = 24), les eaux usées (n = 14) et l’eau de piscine (n = 20)] prélevés dans l’État de New York, aux États-Unis, en 2015 et en 2019. La substance a été détectée dans l’eau du robinet à des concentrations allant de moins de 0,0050 µg/L (limite de quantification de la méthode) à 0,188 µg/L, avec une concentration moyenne de 0,033 µg/L et une fréquence de détection de 91 % (Zhu et Kannan, 2020b).
En 2016, on a surveillé la présence de mélamine aux prises d’eau potable le long du Rhin et de la Meuse, aux Pays-Bas. Les concentrations annuelles moyennes dans la région du Rhin allaient de 0,97 µg/L à 1,36 µg/L à 3 points de prélèvement, et les concentrations maximales variaient entre 1,6 µg/L et 2,8 µg/L. Les concentrations maximales dans la région de la Meuse allaient de 0,98 µg/L à 5,8 µg/L à quatre points de prélèvement, et elles étaient les plus élevées entre septembre et décembre 2016 (RIVM, 2018a).
En raison de l’absence de données canadiennes sur cette source potentielle, les données américaines sur l’eau du robinet ont servi à caractériser l’exposition à la mélamine à partir de l’eau potable (Zhu et Kannan, 2020b). L’absorption estimée était de 0,004 µg/kg p.c./j et de 0,025 µg/kg p.c./j pour les bébés de 0 à 5 mois nourris aux préparations pour nourrissons (groupe le plus exposé) d’après les concentrations moyenne et maximale, respectivement (voir l’annexe C).
Les expositions cutanées et orales lors de la baignade en piscine ont été estimées au moyen des algorithmes du modèle d’évaluation de l’exposition des nageurs SWIMODEL de l’Environmental Protection Agency (EPA) des États-Unis (US EPA, 2003, 2016) et des concentrations de mélamine mesurées dans l’eau de piscine par Zhu et Kannan (2020b) (voir l’annexe C). L’exposition cutanée était négligeable (moins de 2,5 ng/kg p.c./j) pour tous les groupes d’âge, tandis que l’exposition orale était négligeable pour tous les groupes d’âge, sauf les enfants âgés de 4 à 8 ans (environ 0,0029 μg/kg p.c./j). Cette absorption orale est inférieure à la limite supérieure de l’absorption estimée par l’eau potable, qui est de 0,004 μg/kg p.c./j pour les enfants âgés de 4 à 8 ans (voir l’annexe C).
5.1.1.5 Aliments
Comme indiqué dans la section 4, Sources et utilisations, la mélamine peut être utilisée en tant que monomère dans des polymères comme les résines de mélamine-formaldéhyde pour la fabrication de produits d’emballage alimentaire au Canada (par exemple., le revêtement intérieur des boîtes de conserve, à l’exception de celles contenant des préparations pour nourrissons, le revêtement des couvercles métalliques des pots en verre pour aliments pour bébé et des bouteilles en verre et en plastique pour les préparations liquides pour nourrissons, le papier utilisé pour emballer le pain ou la margarine, les pellicules pour l’emballage du lait) (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, juillet 2021, source non citée). Santé Canada a estimé que l’absorption quotidienne probable de mélamine était de 476 ng/kg p.c. pour la population générale (12 mois et plus) d’après les données sur la migration soumises par les entreprises en lien avec l’utilisation de mélamine dans les revêtements de boîtes de conserve (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, juillet 2021, source non citée). Il convient de noter que cette estimation ne tient pas compte des expositions résultant de la migration de la substance à partir de vaisselle en mélamine (un produit de consommation) vers les aliments, qui seront abordées à la section 5.1.2. Aux États-Unis, la mélamine peut servir d’additif alimentaire indirect dans la synthèse de résines de mélamine-formaldéhyde destinées à être utilisées dans la transformation et l’emballage des aliments.
Diverses études internationales ont porté sur la migration de la mélamine présente dans le revêtement des boîtes de conserve et dans les couvercles de pots en verre vers les aliments et les boissons. Au Royaume-Uni, Bradley et coll. (2011) ont analysé la migration des résines à base de mélamine-formaldéhyde et d’analogues (mélamine méthylique) utilisées pour la réticulation des revêtements intérieurs des boîtes de conserve et des couvercles métalliques des pots en verre. Pour 13 revêtements analysés, les concentrations de la mélamine qui migrait jusque dans les aliments allaient de moins de 1,5 µg/kg à 332 µg/kg selon les conditions d’utilisation (matrice fluide, variation de la température). Dans les mêmes conditions expérimentales, 6 laboratoires en Europe ont observé des concentrations semblables de 1,5 μg/kg à 327 μg/kg résultant de la migration de la mélamine à partir du revêtement de boîtes de conserve et de couvercles (EFSA, 2010). Bradley et coll. (2011) ont également analysé la migration de la mélamine dans 3 types d’aliments (qui variaient selon l’acidité, la teneur en matières grasses et la présence de viande ou de poisson), dans diverses conditions, et les concentrations de migration variaient de moins de 23 µg/kg à 220 µg/kg. Magami et coll. (2015) ont aussi analysé quatre substances de réticulation contenant des quantités résiduelles de mélamine (moins de 0,1 à 0,2 %) utilisées dans les revêtements à base d’époxy de boîtes de conserve. Les revêtements ont été chauffés à la température élevée de 131 °C dans un simulant alimentaire (éthanol aqueux à 10 %) pendant différentes périodes (30 à 180 minutes) suivies de différentes durées de stockage (1 à 30 jours), puis réchauffés à 131 °C pendant 1 heure. Entre 7 et 60 % (sur une base molaire) de toute la mélamine contenue dans la substance réticulante utilisée avait migré depuis le revêtement. Les auteurs ont pu démontrer que le mécanisme de migration de la mélamine n’est pas la diffusion depuis le revêtement. La mélamine s’est plutôt formée par hydrolyse du revêtement, a été libérée sous forme de mélamine et n’a pas montré de tendance importante à s’hydrolyser vers des analogues tels que l’amméline, l’ammélide ou l’acide cyanurique. Les données susmentionnées montrent que la mélamine peut migrer d’un emballage alimentaire vers les aliments, et que les concentrations résultantes dans les aliments augmenteront s’ils sont chauffés, comme lors de la transformation des boîtes de conserve et des bouteilles (EFSA, 2010).
Dans de nombreux pays, la mélamine a été mesurée dans une variété d’aliments, principalement pour faire suite à l’identification d’aliments et d’ingrédients d’aliments pour animaux falsifiés avec de la mélamine provenant de Chine (par exemple lait cru, protéines végétales et de blé) qui ont ensuite été utilisés pour fabriquer d’autres aliments destinés aux humains ou aux animaux (OMS, 2009; Hilts et Pelletier, 2009; Dorne et coll., 2013). Parallèlement, il y a eu une demande accrue pour des techniques d’analyse plus rapides, plus sensibles et plus précises pour déterminer les concentrations de mélamine dans ces aliments. Dans des examens des progrès des techniques d’analyse pour doser la mélamine dans les aliments et les produits laitiers, on a fait état de LD plus faibles que celles indiquées dans l’étude de Rovina et Siddique (2015) publiée 2 ans plus tôt (on est passé de 3,7 × 10-12 ng/g à 0,6 ng/g pour les produits laitiers, et à aussi peu que 1 × 10-5 mg/L pour des échantillons d’aliments, comme l’ont indiqué Lu et coll., 2017 et Nascimento et coll., 2017).
Santé Canada a réalisé des recherches pour mesurer les concentrations de fond de mélamine dans les aliments vendus au Canada et a analysé 94 échantillons de diverses préparations pour nourrissons (analysées telles qu’elles ont été achetées), 246 échantillons de produits laitiers et de produits de substitution à base de soja, et 378 échantillons de produits contenant des œufs, de substituts de viande à base de soja, de produits à base de poissons et de crevettes, et de légumes (Santé Canada [modifié en 2024]; Tittlemier et coll., 2009, 2010a, 2010b). Ces recherches étaient axées sur les aliments ayant la plus grande probabilité de contenir des concentrations résiduelles de mélamine, comme les produits laitiers et d’autres produits contenant du lait ou du soja, les légumesNote de bas de page 4 et les produits de la merNote de bas de page 5. Elles avaient une faible limite de détection (LD = 4 μg/kg) et un taux de détection global de 27 %.
En outre, l’Agence canadienne d’inspection des aliments (ACIA) a mené diverses enquêtes pour mesurer les concentrations de mélamine dans des aliments semblables et différents. Ces enquêtes visaient à identifier les produits falsifiés (enquête menée de 2007 à 2010) ou étaient réalisées dans le cadre de programmes de surveillance (enquêtes menées de 2009 à 2020) afin d’assurer le respect continu des concentrations maximales provisoires établies par Santé Canada en 2008 pour la mélamine dans les aliments (Santé Canada, 2016a, 2020, 2024). Elles avaient des limites de détection supérieures à celles des enquêtes de Santé Canada (LD entre 50 µg/kg et 100 µg/kg) et, par conséquent, des taux de détection plus faibles (de 0 à 5,6 %).
Les enquêtes de Santé Canada étaient généralement considérées comme les plus pertinentes pour estimer l’exposition alimentaire à la mélamine (communication personnelle de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, août 2022, source non citée). Toutefois, lorsque des concentrations maximales plus élevées ont été relevées dans les enquêtes de l’ACIA pour les mêmes catégories alimentaires que celles analysées par Santé Canada, ou lorsque d’autres catégories alimentaires (que celles analysées par Santé Canada) comprenaient des échantillons contenant des concentrations détectables de mélamine, les moyennes arithmétiques de ces enquêtes de l’ACIA ont été utilisées (voir le tableau D-1 de l’annexe D).
L’exposition alimentaire à la mélamine à partir de toutes les sources alimentaires présentées dans le tableau 5‑1 a été estimée à l’aide du logiciel SAS (pour « Statistical Analysis System »), dans lequel la répartition complète des valeurs de consommation tirées de l’Enquête sur la santé dans les collectivités canadiennes (ESCC; Statistique Canada, 2008, 2017) et les données sur les concentrations moyennes arithmétiques de mélamine pour chaque type de produit alimentaire échantillonné ont été combinées. Les estimations de l’exposition moyenne et au 95e centile pour les différents groupes d’âge sont indiquées dans le tableau 5‑1 (voir l’annexe D pour les concentrations de mélamine et la méthodologie d’évaluation de l’exposition alimentaire). Les données sur la consommation alimentaire pour les personnes âgées de plus d’un an sont tirées de l’ESCC de 2015 (Statistique Canada, 2017), tandis que celles pour les bébés de moins d’un an proviennent de l’ESCC de 2004 (Statistique Canada, 2008), car l’ESCC de 2015 ne contient pas d’information sur la consommation alimentaire des bébés. Il convient de noter que ces estimations ne tiennent pas compte des expositions résultant de la migration de la substance à partir de vaisselle en mélamine (un produit de consommation), qui seront abordées à la section 5.1.2.
| Groupe d’âge (ans)a | Moyenne | 95e centile |
|---|---|---|
| 6 à 11 mois | 0,72 | 1,7 |
| 1 à 3 | 0,35 | 0,89 |
| 4 à 8 | 0,24 | 0,72 |
| 9 à 13 | 0,17 | 0,56 |
| 14 à 18 | 0,12 | 0,41 |
| 19 et plus | 0,11 | 0,37 |
a Chaque catégorie d’âge comprend les 2 sexes.
Les concentrations de mélamine dues à la migration depuis les emballages alimentaires (moins de 1,5 µg/kg à 332 µg/kg) signalées dans les études européennes susmentionnées correspondent à la plage moyenne des valeurs déclarées dans les études canadiennes de surveillance alimentaire (voir l’annexe D, plage : moins de 4 µg/kg à 667 µg/kg).
5.1.1.6 Lait maternel
Aucune donnée sur les concentrations de mélamine dans le lait maternel au Canada n’a été recensée. Yurdakok et coll. (2014, 2015) ont mesuré la mélamine dans le lait maternel de 77 mères allaitantes en bonne santé à Ankara, en Turquie, de juin à septembre 2010 (les bébés étaient âgés de 3 à 10 jours). Ils ont analysé les échantillons de lait maternel (10 mL) de chaque mère par chromatographie en phase liquide à haute performance (CLHP) et ont déterminé une LD et une limite de quantification (LQ) de 10,6 µg/L et de 41,6 µg/L, respectivement. La mélamine a été détectée dans 16 des 77 échantillons (20,8 %), à des concentrations allant de 10,1 µg/L à 76,4 µg/L (moyenne = 27,1 µg/L, ou entre la LD et la LQ), d’après les auteurs. L’indice de masse corporelle n’a eu aucune incidence sur la répartition des concentrations de mélamine (les mères étaient divisées selon leur poids : poids normal, embonpoint et obésité). Dans le cadre d’une autre étude turque, on a examiné la présence de mélamine dans le lait maternel à partir d’échantillons prélevés de mères dont les enfants sont nés à Şanlıurfa entre mai 2017 et avril 2018. La mélamine a été détectée chez 40 % des mères, mais les concentrations n’ont pas été quantifiées lors de l’étude (Yalçin et coll., 2020).
Dans le cadre de l’étude nationale sur les enfants menée aux États-Unis, on a mesuré par CLHP les concentrations de mélamine dans des échantillons de lait maternel prélevés entre 2009 et 2012 (Zhu et Kannan, 2019a). La mélamine a été détectée dans 94 % des échantillons, à des concentrations allant de non détectable (LD = 0,20 ng/mL, LQ = 0,067 ng/mL) à 7,14 ng/mL (moyenne = 0,338 ng/mL, médiane = 0,204 ng/mL).
Comme on n’a recensé aucune donnée canadienne sur la présence de mélamine dans le lait maternel, les données de l’étude américaine (Zhu et Kannan, 2019a) ont servi à caractériser l’exposition. L’absorption quotidienne estimée pour les bébés âgés de 0 à 5 mois en raison de la présence de mélamine dans le lait maternel est de 2,7 µg/kg p.c./j et de 0,89 µg/kg p.c./j pour les concentrations moyenne et maximale, respectivement.
5.1.1.7 Absorption estimée à partir des milieux de l’environnement et des aliments
L’exposition estimée de la population générale du Canada à la mélamine à partir des milieux de l’environnement et des aliments a permis d’estimer l’absorption moyenne totale et l’absorption maximale, qui allaient de 0,066 μg/kg p.c./j à 0,75 μg/kg p.c./j et de 0,38 μg/kg p.c./j à 2,0 μg/kg p.c./j, respectivement (des précisions sont fournies à l’annexe C). Les bébés de 0 à 5 mois nourris aux préparations pour nourrissons présentaient les expositions estimées les plus élevées.
5.1.2 Migration à partir d’articles en mélamine
La mélamine réagit avec le formaldéhyde pour produire un plastique thermodurci appelé « mélamine » ou « melaware » (terme anglais couramment utilisé utile pour distinguer le polymère du monomère), qui peut être utilisé pour fabriquer de la vaisselle et des ustensiles de cuisine. Lors de la fabrication de certains articles en mélamine, de la fibre de bambou est utilisée comme agent de remplissage, et le plastique qui en résulte est parfois appelé « bambooware » en anglais (BfR, 2019).
Les études portant sur la migration de la mélamine vers les aliments, l’eau et d’autres boissons à partir d’articles en mélamine et en bambou sont résumées dans le tableau 5‑2.
| Produit analysé | Lieu d’achat | Conditions expérimentales | Concentration de migration de la mélamine | Référence |
|---|---|---|---|---|
| Assiettes en mélamine (n=6), gobelets usagés en mélamine (n=11) | Danemark | Acide acétique à 3 %; température entre 20 et 95 °C | <1,500 mg/L à 2,940 mg/L | Lund et Petersen, 2006 |
| Articles en mélamine (assiettes, bols, ustensiles, etc.) (n=27) | Allemagne | Acide acétique à 3 % ou eau distillée; température entre 40 et 100 °C pendant 10 min à 24 h | 0,001 mg/kg (70 °C pendant 10 min) à 1,2 mg/kg (40 °C pendant 24 h) | BfR, 2010a, cité dans EFSA, 2010 |
| Gobelets en mélamine (n=12) | Allemagne | Acide acétique à 3 %, jus de pomme, jus de tomate, thé fait de fruits rouges, café ou cola; 2 h à une température ambiante allant jusqu’à 70 °C | 0,0007 mg/kg (température ambiante) à 1,192 mg/kga (70 °C) | BfR, 2010b, cité dans EFSA, 2010 |
| Articles en mélamine (bols, gobelets, etc.) | Allemagne, Pays-Bas, Royaume-Uni | Matrices de nourriture et de liquide; température entre 40 et 100 °C; certains articles ont été mis au four à micro-ondes; d’autres ont été exposés à des aliments ou à des liquides chauds | Non détectable à 4,194 mg/kgb | Bradley et coll., 2010 |
| Bols (n=5) et gobelets (n=5) en mélamine | Allemagne, Pays-Bas, Royaume-Uni | Acide acétique à 3 %; 2 h à 70 °C; certains articles ont été mis au four à micro-ondes; d’autres ont été exposés à du jus ou à des aliments chauds | <0,14 mg/kg à 4,60 mg/kg | FERA, 2010, cité dans EFSA, 2010 |
| Gobelets (n=6) et assiettes (n=3) en mélamine | Italie | Lait entier, soupe aux légumes, thé sans tanin, eau; articles remplis à une température variant entre 60 et 80 °C, puis refroidis pendant 2 h à la température ambiante | 0,008 mg/kg (60 °C) à 0,105 mg/kga (80 °C) | ISAN, 2010, cité dans EFSA, 2010 |
| Gobelets en mélamine (n=152) | Pays-Bas | Variété de boissons et de simulants alimentaires; 24 h à une température entre 40 et 70 °C; certains articles ont été mis au micro-ondes | Non détectable à 4,194 mg/kg (40 °C) | TNO, 2010, cité dans EFSA, 2010 |
| Gobelets en mélamine (n=25) | Taïwan | Acide acétique à 3 % ou eau distillée; température entre 20 et 90 °C | 0,030 mg/L (à 20 °C) à 19,030 mg/L (à 90 °C)c | Chien et coll., 2011 |
| Articles de vaisselle en mélamine (n=246) | Malaisie | Acide acétique à 3 % ou eau; température entre 25 et 100 °C | 0,00131 mg/L à 0,140 mg/L (à 25 °C) 0,00405 mg/L à 0,509 mg/L (à 100 °C) | Chik et coll., 2011 |
| Bols pour enfants en mélamine (n=50) | Fabriqués et commandés en Chine | Solutions de différents pH; articles chauffés à 95 °C pendant 30 min pour une série de 10 exécutionsd | <0,0041 mg/L à 0,0767 mg/L | Lynch et coll., 2015 |
| Vaisselle neuve en mélamine (n=72), vaisselle usagée en mélamine (n=18) | Italie | Acide acétique à 3 %; 2 h à 70 °C | <0,25 mg/kg à 6,5 mg/kg (vaisselle neuve) <0,25 mg/kg à 3,36 mg/kg (vaisselle usagée)b | Mannoni et coll., 2017 |
| Vaisselle en mélamine (n=5) | Iran | Acide acétique à 3 % ou eau distillée; 90 °C pendant 30 min et 90 min | 1,545 mg/kg à 5,956 mg/kg (30 min) 1,342 mg/kg à 8,737 mg/kg (90 min)e | Haghi et coll., 2019 |
| Cuillères à cuisson en mélamine (n=3) | Allemagne | Acide acétique à 3 %, jus de pomme, jus de choucroute, purée de prunes diluée avec de l’eau ou purée de tomates diluée avec de l’eau; 2 h à 100 °C | 12 mg/L à 67 mg/L (acide acétique à 3 %) 8 mg/L à 75 mg/L (jus et aliments)f | Ebner et coll., 2020 |
| Articles en mélamine généralement remplis de liquides chauds (par exemple., tasses, gobelets, bols) (n=111) | Allemagne | Acide acétique à 3 %; 2 h à 70 °C; répété 3 fois de suite et résultats rapportés pour la troisième migration | <LQ à 8,37 mg/L | BfR, 2019 |
| Articles en bambou généralement remplis de liquides chauds (par exemple, tasses, gobelets, bols) (n=180) | Allemagne | Acide acétique à 3 %; 2 h à 70 °C; répété 3 fois de suite et résultats rapportés pour la troisième migration | <LQ à 20,7 mg/L | BfR, 2019 |
| Bols en mélamine (n = 10) | États-Unis, Japon | Eau; température entre 25 °C et 100 °C Acide acétique à 1 % ou méthanol à 10 %; température de 25 °C | 0,00241 mg/L à 3,94 mg/Lg (eau à 25 °C)
0,0466 mg/L à 5,64 mg/Lg (eau entre 90 °C et 100 °C)
0,526 mg/Lg (acide acétique à 1 %) 0,565 mg/Lg (méthanol à 10 %) |
Takazawa et coll., 2020 |
a Les concentrations de migration ont été déclarées en µg/L.
b Pour les échantillons dont la masse volumique est semblable à celle de l’eau, 1 kg équivaut à environ 1 L.
c La migration était nettement plus importante dans l’acide acétique à 3 % que dans l’eau distillée.
d Dans cette étude, les taux de migration les plus élevés ont été observés dans les solutions ayant un pH de 3. Les taux de migration à tous les pH ont diminué de 85 % entre la première et la dixième exécution.
e Les concentrations de migration ont été converties à partir de l’unité ppm. Les plages des concentrations de migration mesurées dans l’eau distillée et l’acide acétique à 3 % se chevauchaient, bien que les concentrations minimales et maximales dans l’acide acétique à 3 % étaient supérieures à celles dans l’eau distillée aux 2 températures d’incubation.
f Les concentrations de migration ont été déclarées en mg/dm2.
g Les concentrations de migration ont été déclarées en ng/cm2. On les a converties en ng/mL en les multipliant par la superficie d’un bol (80,4 cm2/mL) fournie dans le document de Takazawa et coll. (2020), puis on a appliqué un facteur de conversion de 0,001 pour obtenir des mg/L.
Selon les études menées sur des aliments et des boissons mentionnées dans le tableau 5‑2, les concentrations mesurées dans les aliments chauffés dans de la vaisselle en mélamine semblent supérieures à celles mesurées dans les aliments laissés à la température ambiante. L’EFSA (2010) a étudié la migration de la mélamine dans les aliments et l’eau à partir de vaisselle en mélamine, et a cité certaines des données susmentionnées ainsi que d’autres données fournies par des pays européens (comme la Finlande, Chypre, les Pays-Bas). Elle a conclu que la migration de mélamine à partir de la vaisselle en mélamine varie grandement en fonction de divers facteurs, comme le procédé de fabrication, les altérations à la surface causées par l’usure, le temps et la température d’utilisation ainsi que les caractéristiques des aliments (acide, aqueux, gras, sec).
L’EFSA a estimé les concentrations de migration pour différentes catégories d’aliments (voir le tableau 5‑3). Les valeurs « types » sont fondées sur la migration à partir d’articles en mélamine en contact avec des aliments chauds dans des conditions d’utilisation (température et durée) types. Les valeurs « élevées » de migration sont fondées sur des conditions extrêmes d’essai de migration, comme l’utilisation de simulants alimentaires acides (par exemple, acide acétique à 3 %), l’application de chaleur et de longues expositions. Ces conditions ont été jugées équivalentes au chauffage au four à micro-ondes et à l’égratignement des articles au cours de leur durée de vie. L’Institut fédéral de l’évaluation des risques de l’Allemagne (BfR) a étudié la migration de la mélamine à partir d’articles en mélamine et en bambou (gobelets, tasses, bols). Il a mesuré une concentration moyenne de migration de 1,27 mg/L (95e centile : 4,29 mg/L) à partir d’articles en mélamine et une concentration moyenne de migration de 2,64 mg/L (95e centile : 7,71 mg/L) à partir d’articles en bambou (BfR, 2019).
| Type d’aliment | Valeur type | Valeur élevée |
|---|---|---|
| Aliments acides | 1,0 | 5,0 |
| Aliments aqueuxa | 0,6 | 3,0 |
| Aliments gras | 0,2 | 1,0 |
| Aliments secs | 0,05 | 0,05 |
a On suppose que ces aliments ont la même masse volumique que l’eau, bien que cela ne soit pas expressément énoncé dans EFSA (2010).
On a estimé l’exposition à la mélamine à partir d’articles en mélamine en présumant que tous les aliments et boissons entraient en contact avec ces articles (tableau 5‑4). On a utilisé une plage de valeurs de migration, qui comprend les valeurs les plus basses et les plus élevées mesurées à la température ambiante, les concentrations de migration « types » les plus élevées dérivées de l’EFSA (aliments acides) (voir le tableau 5‑3) ainsi que les valeurs au 95e centile indiquées dans BfR (2019). Bien qu’aucune étude sur la migration à partir d’articles en mélamine n’ait été recensée au Canada, les conditions et les résultats de migration de la mélamine à partir de ces articles devraient être semblables aux données produites ailleurs. On a estimé l’exposition de différents groupes d’âge en utilisant les quantités totales d’aliments consommés quotidiennement au Canada pour tous les groupes d’âge, à l’exception des bébés âgés de 6 à 11 mois, pour lesquels on a utilisé la consommation alimentaire présentée dans EFSA (2010) (voir le tableau 5‑4 et l’annexe C pour obtenir des précisions).
| Groupe d’âge | Consommation alimentaire totale moyenne (g/j)a | Exposition selon la plage de données de migration à température ambiante (μg/kg p.c./j)b | Exposition « type » d’après les données de migration de l’EFSA, 2010 (µg/kg p.c./j)c | Exposition d’après les données de migration du BfR, 2019 (µg/kg p.c./j)d |
|---|---|---|---|---|
| 6 à 11 mois | 1000 | 0,077 à 433 | 110 | 471 à 847 |
| 1 an | 1540,81 | 0,098 à 552 | 140 | 601 à 1080 |
| 2 à 3 ans | 1540,81 | 0,072 à 405 | 103 | 441 à 792 |
| 4 à 8 ans | 1760,47 | 0,054 à 302 | 77 | 328 à 590 |
| 9 à 13 ans | 2057,76 | 0,034 à 193 | 49 | 210 à 378 |
| 14 à 18 ans | 2550,51 | 0,029 à 162 | 41 | 176 à 317 |
| 19 ans et plus | 2771,01 | 0,026 à 148 | 37 | 161 à 289 |
a Voir le tableau C-4 pour obtenir des précisions.
b Plus faibles (BfR, 2010b, cité dans EFSA, 2010) et plus fortes (Takazawa et coll., 2020) concentrations de mélamine ayant migré à partir d’articles en mélamine observées à température ambiante parmi les études recensées (Lund et Petersen, 2006; BfR, 2010b, cité dans EFSA, 2010; Chien et coll., 2011; Chik et coll., 2011; Takazawa et coll., 2020).
c Exposition à partir d’articles en mélamine selon la concentration de migration type la plus élevée pour les aliments acides (1 mg/kg), calculée par l’EFSA (2010).
d Exposition à la mélamine estimée à partir des concentrations de migration au 95e centile depuis des articles en mélamine (4,29 mg/L) et en bambou (7,71 mg/L) (BfR, 2019). On a présumé que la masse volumique était celle de l’eau pour convertir les mg/L en mg/kg (1 L = 1 kg).
Au moyen du plus haut taux de migration énoncé dans le tableau 5‑2 (5 mg/kg), l’EFSA (2010) a estimé l’absorption due à l’exposition à la mélamine à partir d’articles en mélamine ayant un potentiel de migration élevé. L’absorption allait de 250 µg/kg p.c./j pour les adultes à 910 µg/kg pc/j pour les enfants âgés de 1,5 an. Deux autres scénarios d’exposition ont été exécutés pour préciser l’exposition chez les enfants (groupe le plus exposé). Dans le premier scénario, on a utilisé les concentrations de migration types et l’hypothèse selon laquelle l’ensemble des aliments et boissons consommés sont entrés en contact avec les articles contenant de la mélamine. L’absorption moyenne pour les enfants âgés de 1 à 6 ans allait de 30 μg/kg p.c./j à 80 μg/kg p.c./j (au 95e centile : 50 µg/kg p.c./j à 120 µg/kg p.c./j). Dans le deuxième scénario, on a utilisé les concentrations de migration élevées et l’hypothèse selon laquelle seul l’aliment le plus consommé est entré en contact avec les articles contenant de la mélamine. L’absorption moyenne pour les enfants âgés de 1 à 6 ans allait de 40 μg/kg p.c./j à 110 μg/kg p.c./j (au 95e centile : 70 µg/kg p.c./j à 230 µg/kg p.c./j).
Au moyen des taux de migration susmentionnés, le BfR (2019) a estimé l’absorption due à l’exposition à la mélamine à partir d’articles remplissables en mélamine et en bambou pour les jeunes enfants (12 à 36 mois) et les adultes (19 à 50 ans). Les données sur la consommation de boissons caféinées ont été utilisées pour les adultes, tandis que les données sur la consommation de liquides (lait, produits laitiers et autres boissons non alcoolisées) ont été utilisées pour les jeunes enfants. L’absorption moyenne allait de 90 μg/kg p.c./j à 190 μg/kg p.c./j (au 95e centile : 280 µg/kg p.c./j à 560 µg/kg p.c./j) pour les jeunes enfants et de 10 μg/kg p.c./j à 21 μg/kg p.c./j (au 95e centile : 33 µg/kg p.c./j à 69 µg/kg p.c./j) pour les adultes.
5.1.3 Autres produits offerts aux consommateurs
Comme indiqué à la section 4, la mélamine est utilisée dans divers types de produits au Canada, en plus des articles en mélamine. Mentionnons notamment les peintures et revêtements, les produits d’étanchéité, les sièges, les renforcements et les matelas en mousse, le papier et les étagères en mélamine thermofusionnés, les tableaux blancs et les panneaux de flocons, l’encre pour impression à jet d’encre et plus encore.
En raison de divers facteurs (contact limité avec la peau, utilisation commerciale et industrielle, faibles concentrations en mélamine), on n’a pas évalué l’exposition à la mélamine présente dans le papier et les étagères, les tableaux blancs et les panneaux de flocons, ainsi que les encres pour imprimantes à jet d’encre, car cette exposition devrait être faible, particulièrement par rapport aux autres scénarios présentés plus bas.
D’après les fiches de données de sécurité (FDS) sur les quelques peintures contenant de la mélamine vendues au Canada, la concentration maximale dans les peintures est de 10 % (FDS, 2019; FT, 2020). Une FDS est également disponible pour un produit d’étanchéité vendu au Canada qui contient de la mélamine à une concentration pouvant atteindre 60 % (FDS, 2022). Bien que la fiche technique (FT) semble indiquer que le produit est probablement destiné aux utilisateurs industriels et professionnels, ce produit est offert aux consommateurs en général dans des points de vente au détail (FT, 2013). On a également détecté de la mélamine dans un produit nettoyant pour surfaces de cuisson à une concentration maximale de 1 % (FDS, 2015). Lors d’une analyse de la mélamine dans 2 échantillons de cartes électroniques, on a mesuré des concentrations inférieures à 0,002 % p/p (de 8,4 mg/kg à 19,7 mg/kg) (Santé Canada, 2016b).
On a examiné l’exposition ponctuelle par inhalation et/ou par voie cutanée des utilisateurs de pistolets à peinture sous pression d’air, de peintures pour pinceau et rouleau, de produits de calfeutrage et d’étanchéité pour la maison, et de produits nettoyants pour surfaces de cuisson.
Aucune donnée sur l’absorption cutanée n’a été recensée pour la mélamine en ce qui concerne l’exposition cutanée à partir de l’utilisation de produits de consommation. Les faibles valeurs empiriques et modélisées du log Koe pour la mélamine (-1,37 à -0,38) témoignent d’une mauvaise absorption cutanée (OCDE, 2002). Il existe des données sur l’absorption cutanée d’autres substances du même sous-groupe chimique que la mélamine, les triazines. L’atrazine (no CAS 1912-24-9) a une absorption cutanée maximale de 16 % dans la peau humaine (Ademola et coll., 1993). L’absorption cutanée de la cyromazine (no CAS 66125-27-8), dont la structure est semblable à celle de la mélamine, variait d’environ 25 % dans le cadre d’une étude in vivo chez le rat (US EPA, 1985) à 38 % lors d’une étude in vitro chez l’humain et d’une étude in vivo chez le rat (JMPR, 2006). L’Agence de réglementation de la lutte antiparasitaire (ARLA, 2020a) a mentionné une absorption cutanée de 27 % dans son évaluation de la cyromazine, d’après l’étude in vivo chez le rat menée par l’EPA (1985). Les résultats de l’étude in vivo sur les effets de la cyromazine chez le rat (JMPR, 2006) donnent à penser que les résidus collés à la peau ne sont pas absorbés systématiquement dans leur totalité. Ainsi, on s’attend à ce que la valeur d’absorption cutanée de 38 % observée dans l’étude in vitro chez l’humain et l’étude in vivo chez le rat (JMPR, 2006) soit exagérément prudente, étant donné qu’environ 95 % de l’absorption estimée est attribuable aux résidus collés à la peau. En adoptant une approche fondée sur le poids de la preuve et en tenant compte des données sur les substances liées sur le plan structural ainsi que des propriétés physicochimiques de la mélamine, on a sélectionné une absorption cutanée maximale estimée de 30 % pour tous les scénarios d’absorption cutanée.
Le tableau 5‑5 résume l’exposition cutanée et par inhalation aux peintures, aux produits d’étanchéité et aux produits nettoyants pour surfaces de cuisson estimée au moyen de ConsExpo Web (ConsExpo, 2021). Pour obtenir des précisions sur les paramètres, veuillez consulter l’annexe E.
| Voie d’exposition | Source | Concentration de mélamine | Groupe d’âge | Exposition systémique à la mélamine (mg/kg p.c./événement)a,b |
|---|---|---|---|---|
| Exposition cutanéec (intermittente) | Peinture pour pinceau ou rouleau | 10 %d | 19 ans et plus | 1,5 |
| Exposition cutanée (intermittente) | Peinture en aérosol pour pistolet | 10 %d | 19 ans et plus | 3,4 |
| Inhalation (intermittente) | Peinture en aérosol pour pistolet | 10 %d | 19 ans et plus | 0,25 |
| Exposition cutanée et inhalation (intermittente) | Peinture en aérosol pour pistolet | 10 %d | 19 ans et plus | 3,7 |
| Exposition cutanéeb (intermittente) | Produit d’étanchéité | 30 à 60 %e | 19 ans et plus | 1,8 à 3,6 |
| Exposition cutanéeb (intermittente) | Produit nettoyant pour surfaces de cuisson | 1 %f | 19 ans et plus | 0,012 |
a Valeur estimée au moyen de ConsExpo Web (ConsExpo, 2021).
b Aucune donnée sur l’absorption cutanée n’a été recensée pour la mélamine. Une valeur de 30 % a été choisie d’après les données disponibles pour des composés de structure similaire (voir la section 5.1.3).
c En raison de la pression de vapeur négligeable de la mélamine, l’exposition par inhalation attribuable à l’utilisation de peintures pour pinceau ou rouleau et de produits nettoyants pour surfaces de cuisson est jugée négligeable.
d FDS, 2019; FT, 2020
e FDS, 2022; FT, 2013
f FDS, 2015
Produits en mousse (sièges, literie, etc.)
La mélamine est présente dans des produits en mousse flexible et des tissus utilisés pour les sièges et la literie (ce qui peut comprendre des oreillers et des matelas) ainsi que dans divers produits pour enfants au Canada (ECCC, 2013-2014; Santé Canada, 2015, 2019, 2023) et à l’échelle internationale (US CPSC, 2005; Ecology Center, 2015; Zheng et coll., 2020). Le tableau 5‑6 résume les renseignements disponibles sur la concentration de mélamine dans divers produits en mousse et dans les tissus associés aux produits en mousse.
| Article manufacturé | Concentration de mélamine | Référence |
|---|---|---|
| Mousse utilisée dans les sièges et les dossiers de meubles à cadre métallique | 28 à 29 % p/p | ECCC, 2013 à 2014 |
| Échantillons de mousse de polyuréthane provenant de produits pour enfants (par exemple, matelas pour lit de bébé, matelas à langer, coussin angulaire pour lit de bébé) (n=6) achetés au Canada | Non détectable (LD = 0,031 % p/p) à 0,43 % p/p | Santé Canada, 2015 |
| Mousse provenant d’ensembles de retenue pour enfants (n=10), d’autres produits pour enfants (n=10), de meubles rembourrés (n=10), de matelas en mousse (n=10), de surmatelas (n=10) et d’oreillers (n=1) achetés au Canada | < LQ (0,00012 % p/p) à 7 % p/p (mélamine détectée en concentration supérieure à la LQ dans 9 ensembles de retenue pour enfants, 10 autres produits pour enfants, 7 meubles rembourrés, 4 matelas en mousse, 3 surmatelas et 1 oreiller) | Santé Canada, 2019 |
| Produits pour enfants, dont des échantillons de mousse et de tissu (par exemple, chaises en mousse, pyjamas, tapis de sieste, surmatelas, couverture, draps pour lit de bébé, jouets, tuiles en mousse, matelas pour lit de bébé) (n=111 échantillons provenant de 41 produits), achetés au Canadab | Non détectable (LD de la méthode = 0,00009 % p/p) à 0,17 % p/p (mélamine détectée en concentration supérieure à la LD dans 4 produits [6 échantillons] : 3 échantillons de mousse provenant d’une chaise en mousse, 1 échantillon de mousse provenant d’un tapis de sieste, 1 échantillon de mousse provenant d’un jouet de bain en mousse, 1 échantillon de tissu provenant d’un jouet de dentition en tissu et en mousse) | Santé Canada, 2023 |
| Six types de mousse de rembourrage; nombreux échantillons de chaque type | Non détectable (LD = 0,005 % p/p) à 34 % p/p | US CPSC, 2005 |
| Ensembles de retenue pour enfants (n=14) achetés aux États-Unis | La mélamine a été détectée dans 3 des 14 sièges (mousse et tissu), mais les concentrations n’ont pas été quantifiées. | Ecology Center, 2015 |
| Tapis de sieste (n=26, dont la mousse et la housse en polyester) provenant de centres de la petite enfance aux États-Unis | Non détectablea à 0,0017 % p/p La mélamine a été détectée dans les échantillons de mousse et de housse. | Zheng et coll., 2020 |
a La limite de détection de la méthode (LDM) pour la mélamine n’est pas précisée. Toutefois, les LDM pour la mélamine et ses dérivés se situent entre 1,0 × 10-9 % p/p et 2,4 × 10-7 % (valeurs déclarées de 0,01 ng/g à 2,4 ng/g) (Zheng et coll., 2020).
b La présence de mélamine dans ces produits peut être attribuable à l’utilisation de divers ignifuges à base de mélamine.
Étant donné que la mélamine est un additif ignifuge et qu’elle peut migrer hors d’une matrice, une exposition cutanée peut survenir à la suite d’un contact quotidien prolongé de la peau avec des meubles rembourrés, des matelas et des ensembles de retenue pour bébés et enfants (y compris des sièges d’appoint) contenant de la mousse traitée à la mélamine. La migration peut être facilitée par la sueur (puisque la mélamine est très soluble dans l’eau) ou des composantes non aqueuses de la peau, comme les poils et les cheveux, la kératine et le sébum. La valeur du log Koe, couramment utilisée comme mesure de l’hydrophobicité, a également été prise en compteNote de bas de page 6. Comme aucune donnée sur la migration de la mélamine n’avait été recensée au moment de la publication de la mise à jour de l’ébauche d’évaluation préalable (le 17 octobre 2020), les taux de migration de la mélamine ont été extrapolés à partir des taux de migration associés à la solubilité dans l’eau et au log Koe signalés par l’Agence européenne des produits chimiques (ECHA, 2018) pour 2 ignifuges, le phosphate de tris[2-chloro-1-(chlorométhyl)éthyle] (TDCPP, no CAS 13674-87-8) et le phosphate de tris(2-chloroéthyle) (TCEP, no CAS 115-96-8), comme illustré dans le tableau 5‑7.
| Paramètre |
TDCPP |
TCEP |
Mélamine |
|---|---|---|---|
| Solubilité dans l’eau (mg/L) | 18,1 |
7820 |
3230 |
| log Koe (sans unité) | 3,69 |
1,78 |
-1,14 |
| Taux de migration à partir de mousse non recouverte (mg/cm2/h)a | 0,00297 |
0,0207 |
0,00936b 0,0217c |
a Les taux de migration du TDCPP et du TCEP ont été déterminés dans le cadre d’études de migration portant sur de la mousse de meubles traitée réalisées par l’Agence de protection de l’environnement du Danemark (2015), comme indiqué par l’ECHA (2018). L’Agence a déterminé les taux de migration du TCEP et du TDCPP pour des produits pour enfants (des ensembles de retenue pour enfants, des porte-bébé et des matelas pour bébé) en immergeant des morceaux de mousse provenant de ces produits (habituellement avec une partie du revêtement en tissu) dans une substance simulant la sueur et en les incubant à 37 °C pendant 3 heures (EPA du Danemark, 2015). Le taux de migration du TDCPP utilisé dans les présentes est la moyenne des taux déterminés pour tous les échantillons pour cet ignifuge, tandis que le taux de migration du TCEP provient d’un seul article (ECHA, 2018).
b Valeur calculée en traçant une ligne droite entre les valeurs de solubilité dans l’eau et les taux de migration pour le TDCPP et le TCEP, avec l’équation y = (2×10-06 × solubilité dans l’eau) + 2,9×10-03.
c Valeur calculée au moyen d’équations quadratiques basées sur les taux de migration, les valeurs de solubilité dans l’eau et les valeurs de log Koe du TDCPP et du TCEP. Pour le TDCPP, 0,00297 mg/cm2/h = x(log de la solubilité dans l’eau) + y(log Koe) et pour le TCEP, 0,0207 mg/cm2/h = x(log de la solubilité dans l’eau) + y(log Koe). Ainsi, 0,00297 = x(1,26) + y(3,69) et 0,0207 = x(3,89) + y(1,78). Si l’on résout ces équations, on obtient : x = 0,005863 et y = -0,0012. Le taux de migration de la mélamine est donc : (0,005863)(log de la solubilité dans l’eau) + (-0,0012)(log Koe) = (0,005863)(3,51) + (-0,0012)(-1,14) = 0,0217 mg/cm2/h.
Depuis l’extrapolation, des données sur la migration de la mélamine à partir de la mousse sont devenues disponibles. Une étude comprenant des essais de migration pour la mélamine a été présentée au gouvernement du Canada pendant la période de commentaires du public sur la mise à jour de l’ébauche d’évaluation préalable (ECCC, SC, 2020). Dans le cadre de cette étude, des échantillons de mousse contenant de la mélamine à des concentrations de 9,5 à 19,5 % ont été comprimés à 70 % de leur profondeur au moyen d’une pile de 15 papiers filtres Whatman de 50 mm trempés dans une solution de sueur artificielle. Après une incubation de 2 heures à 40 °C, les papiers filtres ont été immergés dans du méthanol, et une aliquote a été analysée par chromatographie en phase gazeuse avec détection à ionisation de flamme (CG-DIF). Les taux de migration pour la mousse non recouverte se situaient entre 0,01211 mg/cm2/h et 0,08307 mg/cm2/h, et étaient du même ordre de grandeur que ceux indiqués dans le tableau 5‑7 (calculés au moyen des valeurs de solubilité dans l’eau et de log Koe). Quand un couvre-matelas (exempt de mélamine) était placé entre la mousse et les papiers filtres, on n’a pas détecté de mélamine en concentration supérieure à la LD (0,00225 mg/cm2/h). Ce résultat appuie la théorie selon laquelle le fait de recouvrir la mousse d’un textile non traité réduirait la quantité de mélamine disponible pour exposition cutanée à la surface des articles manufacturés contenant de la mousse. Toutefois, l’étude a été réalisée avec un seul type de couvre-matelas et pourrait donc ne pas être représentative de tous les textiles utilisés pour recouvrir la mousse, et la LD était du même ordre de grandeur que le taux de migration calculé au moyen des valeurs de solubilité dans l’eau (tableau 5‑7). Dans le cadre d’une autre étude sur la migration de la mélamine à partir de la mousse réalisée avec des sous-échantillons de mousse, on a mesuré des concentrations de mélamine allant de 0,0038 à 7,0 % p/p (Santé Canada, 2019 et 2021). Les sous-échantillons de la mousse ont été placés dans un bécher, recouverts d’une pile de 3 papiers filtres, puis humectés avec 3 mL de sueur synthétique. Après 5 minutes, les échantillons et les papiers filtres ont été recouverts d’un disque de Plexiglas, et un réservoir en verre de 1,5 kg a été placé sur le dessus pendant 4 heures. Les papiers filtres ont été retirés et ont fait l’objet d’une extraction au moyen d’une solution d’acétonitrile et d’eau à 50 % (v/v). La solution a été filtrée et les aliquotes ont été analysées par chromatographie en phase liquide et spectrométrie de masse en tandem (CL-SM/SM). Les taux de migration pour la mousse non recouverte allaient de 0,00011 mg/cm2/h à 0,026 mg/cm2/h (Santé Canada, 2021), une plage qui chevauche celle des taux de migration calculés (tableau 5‑7). Étant donné que les 2 ensembles de taux de migration de la mélamine à partir de la mousse déterminés par expérimentation chevauchent les taux calculés présentés dans le tableau 5‑7, et ce, malgré des méthodes expérimentales et des concentrations de mélamine dans la mousse différentes, les taux de migration calculés sont jugés raisonnables pour estimer l’exposition.
En utilisant les taux de migration de la mélamine calculés et décrits plus haut (tableau 5‑7) ainsi qu’un facteur de pénétration textile (FPT) de 0,1 pour tenir compte de l’utilisation d’un revêtement textile (voir l’annexe E), on a estimé l’absorption par exposition cutanée pour les enfants et les adultes en contact direct avec des matelas contenant de la mousse et recouverts de tissu et d’autres articles manufacturés connexes (comme des meubles rembourrés contenant de la mousse) ainsi qu’avec la mousse et le tissu d’ensembles de retenue pour bébés et enfants (dont les sièges d’appoint). Ce scénario est jugé représentatif de l’exposition éventuelle par les renforcements textiles de meublesNote de bas de page 7. Comme illustré dans le tableau 5‑8, les estimations de l’exposition cutanée à la mélamine par un contact quotidien prolongé de la peau avec des matelas en mousse ou des meubles rembourrés étaient les plus élevées pour les enfants âgés de 0 à 5 mois (0,29 à 2,3 mg/kg p.c./j). L’absorption due à l’exposition cutanée était également la plus élevée pour les enfants de 0 à 5 mois en contact direct avec des ensembles de retenue contenant de la mousse, et variait entre 0,07 et 0,016 mg/kg p.c./j (annexe E). Enfin, en raison de la pression de vapeur négligeable de la mélamine, l’exposition par inhalation à la mélamine contenue dans les meubles et les matelas en mousse ainsi que dans la mousse et le tissu d’ensembles de retenue pour bébés et enfants (dont les sièges d’appoint) devrait être négligeable.
En raison des propriétés de la mélamine (additif ignifuge, forte solubilité dans l’eau), les enfants pourraient y être exposés en mâchonnant un objet en mousse (par exemple, coussin angulaire pour lit de bébé, chaise en mousse pour enfants). Bien qu’il existe des données sur la concentration de mélamine dans des produits en mousse, aucun taux de migration de la mélamine à partir de la mousse n’a été relevé dans la documentation scientifique. En l’absence de taux de migration pour le mâchonnement, les taux de migration utilisés pour le scénario d’exposition cutanée ont été utilisés pour estimer l’exposition orale à la mélamine par le mâchonnement d’un objet en mousse chez les enfants âgés de 0 à 3 ans (voir le tableau 5‑8 et l’annexe E).
| Voie d’exposition et durée | Source | Groupe d’âge | Exposition systémique à la mélamine (mg/kg p.c./j)a |
|---|---|---|---|
| Exposition cutanée (quotidienne) | Mousse contenue dans les matelas pour enfants ou les meubles rembourrés | 0 à 5 mois | 0,29 à 2,30 |
| Exposition cutanée (quotidienne) | Mousse contenue dans les matelas pour enfants ou les meubles rembourrés | 6 à 11 mois | 0,26 à 2,04 |
| Exposition cutanée (quotidienne) | Mousse contenue dans les matelas pour enfants ou les meubles rembourrés | 1 an | 0,25 à 2,04 |
| Exposition cutanée (quotidienne) | Mousse contenue dans les matelas pour enfants ou les meubles rembourrés | 2 à 3 ans | 0,16 à 1,66 |
| Exposition cutanée (quotidienne) | Mousse contenue dans les matelas pour enfants ou les meubles rembourrés | 4 à 8 ans | 0,13 à 1,42 |
| Exposition cutanée (quotidienne) | Mousse contenue dans les matelas pour enfants ou les meubles rembourrés | 9 à 13 ans | 0,09 à 1,08 |
| Exposition cutanée (quotidienne) | Mousse contenue dans les matelas ou les meubles rembourrés | 14 à 18 ans | 0,07 à 0,83 |
| Exposition cutanée (quotidienne) | Mousse contenue dans les matelas ou les meubles rembourrés | 19 ans et plus | 0,06 à 0,66 |
| Exposition cutanée (quotidienne) | Mousse/tissu d’ensembles de retenue pour bébés et enfants (dont les sièges d’appoint) | 0 à 5 mois | 0,07 à 0,16 |
| Exposition cutanée (quotidienne) | Mousse/tissu d’ensembles de retenue pour bébés et enfants (dont les sièges d’appoint) | 6 à 11 mois | 0,062 à 0,14 |
| Exposition cutanée (quotidienne) | Mousse/tissu d’ensembles de retenue pour bébés et enfants (dont les sièges d’appoint) | 1 an | 0,058 à 0,13 |
| Exposition cutanée (quotidienne) | Mousse/tissu d’ensembles de retenue pour bébés et enfants (dont les sièges d’appoint) | 2 à 3 ans | 0,040 à 0,092 |
| Exposition cutanée (quotidienne) | Mousse/tissu d’ensembles de retenue pour bébés et enfants (dont les sièges d’appoint) | 4 à 8 ans | 0,034 à 0,078 |
| Exposition cutanée (quotidienne) | Mousse/tissu d’ensembles de retenue pour bébés et enfants (dont les sièges d’appoint) | 9 à 13 ans | 5,3 × 10‑2 à 6,2 × 10‑2 |
| Mâchonnement (quotidien – intermittent) |
Mousse contenue dans des produits pour enfants | 0 à 5 mois | 6,1 × 10‑3 à 1,4 × 10‑2 |
| Mâchonnement (quotidien – intermittent) |
Mousse contenue dans des produits pour enfants | 6 à 11 mois | 4,2 × 10‑3 à 4,9 × 10‑2 |
| Mâchonnement (quotidien – intermittent) |
Mousse contenue dans des produits pour enfants | 1 an | 3,5 × 10‑3 à 4,0 × 10‑2 |
| Mâchonnement (quotidien – intermittent) |
Mousse contenue dans des produits pour enfants | 2 à 3 ans | 2,6 × 10‑3 à 3,0 × 10‑2 |
a Aucune donnée sur l’absorption cutanée n’a été recensée pour la mélamine. Une valeur de 30 % a été choisie d’après les données disponibles pour des composés de structure similaire (voir la section 5.1.3).
Textiles
Dans le cadre d’une étude, Zheng et Salamova (2020) ont mesuré la concentration de mélamine dans 86 vêtements finis neufs pour enfants achetés aux États-Unis, dont des chemises (n = 13), des pantalons (n = 12), des bas (n = 12), des couches en tissu (n = 20), des robes (n = 2), des cache-couches (n = 24) et des vêtements d’extérieur (n = 13), faits en coton classique et biologique, en polyester, en élasthanne et en nylon. Les concentrations médianes de mélamine variaient de 9,7 ng/g pour les articles en polyester à 17 300 ng/g pour les articles en nylon, et la médiane globale était de 35,7 ng/g pour l’ensemble des échantillons. Ces valeurs sont inférieures à celles mesurées par Zhu et Kannan (2020a), comme décrit plus bas. Les auteurs de l’étude ont estimé l’exposition cutanée à partir de textiles non lavés, laquelle variait entre 0,0121 ng/kg p.c./j pour les bébés de 6 à 12 mois et 0,015 ng/kg p.c./j pour les nouveau-nés (âgés de moins de 1 mois).
La mélamine a été mesurée dans 77 échantillons de textile provenant d’articles achetés aux États-Unis, dont des vêtements pour bébés (n = 52), des textiles bruts (n = 19) et d’autres articles (n = 6; par exemple, couches en tissu, couvertures) (Zhu et Kannan, 2020a). Des concentrations moyenne de 4900 ng/g et maximale de 81 800 ng/g ont été mesurées pour les textiles d’origine (non lavés). Zhu et Kannan (2020a) ont également détecté des concentrations de mélamine dans les échantillons de textile après qu’ils ont été lavés avec de l’eau et du détergent. Ces concentrations étaient inférieures à celles des textiles non lavés (max. = 12 400 ng/g après lavage à l’eau et 8340 ng/g après lavage avec du détergent). Les auteurs de l’étude ont estimé l’exposition cutanée à partir de textiles non lavés, laquelle variait entre 1,89 ng/kg p.c./j pour les bébés de 6 à 12 mois et 2,34 ng/kg p.c./j pour les nouveau-nés (âgés de moins de 1 mois). Comme aucune donnée sur les vêtements pour adultes n’existe, les auteurs ont adopté une approche légèrement différente de celle de Zhu et Kannan (2020a) et ont utilisé les concentrations mesurées dans les vêtements pour bébés pour estimer l’exposition orale et cutanée pour tous les groupes d’âge. Ils ont estimé que l’absorption orale et cutanée à partir de textiles non lavés se situait entre 53,9 ng/kg p.c./j pour les bébés de 6 à 12 mois et 1250 ng/kg p.c./j pour les bébés de 0 à 5 mois, soit les groupes les plus exposés (voir l’annexe E pour obtenir des précisions, notamment sur l’absorption pour d’autres groupes d’âge).
5.1.4 Biosurveillance
D’après des études menées chez des animaux, la mélamine est rapidement absorbée par le tractus gastro-intestinal et rapidement éliminée du corps, car sa demi-vie plasmatique est de quelques heures à plusieurs heures (EFSA, 2010). La principale voie d’élimination est l’urine, et le peu de renseignements disponibles donne à penser que la substance est à peine métabolisée à des doses pertinentes pour l’environnement (EFSA, 2010). La demi-vie de la mélamine dans l’urine chez diverses espèces est de quelques heures, soit de 3 h à 6 h (Panuwet et coll., 2012; Mast et coll., 1983; Baynes et coll., 2008; Wu et coll., 2013; CIRC, 2019). De plus amples renseignements sur la toxicocinétique de la mélamine sont fournis à la section 5.2.1. Dans les études de biosurveillance, la mélamine est directement mesurée dans l’urine et cette mesure est considérée comme un biomarqueur approprié de l’exposition (Panuwet et coll., 2012; Zhu et Kannan, 2019b; Sathyanarayana et coll., 2019).
Panuwet et coll. (2012) ont publié les résultats des mesures de la mélamine prises dans 492 échantillons ponctuels d’urine humaine prélevés dans la population générale des États-Unis. Ces échantillons ont été recueillis aux États-Unis en 2003 et 2004 dans le cadre de la National Health and Nutrition Examination Survey (NHANES) et provenaient d’hommes et de femmes âgés de 6 ans et plus (US CDC, 2010a). La mélamine a été détectée dans 76 % des échantillons (population : 6 ans et plus, concentration moyenne géométrique : 2,37 ng/mL, au 95e centile : 12 ng/mL, maximale : 161 ng/mL, LD = 0,66 ng/mL)Note de bas de page 8. Comme la répartition relative des groupes d’âge (soit 6 à 11 ans, 12 à 19 ans, etc.) n’était pas disponible dans la publication de Panuwet et coll. (2012), cette information a été tirée des données démographiques recueillies par la NHANES (US CDC, 2010b). Les concentrations moyennes géométriques et au 95e centile sont présentées par groupe d’âge dans le tableau 5‑9. En raison de la petite taille de l’échantillon (n = 6) pour le groupe de sujets âgés de 6 à 11 ans, l’absorption au 95e centile n’a pas été calculée pour ce groupe d’âge, car elle aurait été statistiquement instable. De plus, une concentration élevée de 161 ng/mL de mélamine a été observée dans ce groupe d’âge, alors que les autres concentrations parmi les 6 sujets variaient entre 0,5 ng/mL et 6,7 ng/mL. Panuwet et coll. (2012) n’ont pas précisé si cette valeur élevée constituait un artéfact. Elle n’a donc pas été utilisée pour estimer l’absorption maximale. La deuxième concentration en importance (6,7 ng/mL) a plutôt été utilisée.
La mélamine a été mesurée dans 213 échantillons ponctuels d’urine prélevés chez 19 participants en bonne santé âgés de 11 à 56 ans (2 sujets de moins de 18 ans) à Albany, dans l’État de New York. La substance a été détectée dans 99 % des échantillons, à des concentrations allant de non détectable à 58 ng/mL (moyenne = 3,3 ng/mL, LQ = 0,08 mg/mL) (Zhu et Kannan, 2019b).
La mélamine a également été mesurée dans des échantillons ponctuels d’urine prélevés chez 109 enfants en bonne santé âgés de 4 mois à 8 ans à Seattle (État de Washington) et à New York (État de New York). Les échantillons ont été prélevés dans le cadre de 3 études distinctes réalisées entre 2013 et 2017, et provenaient de garçons et de filles. L’âge moyen des participants était de 2,7 ans. La mélamine a été détectée dans 78 % des échantillons (concentration moyenne = 27,8 ng/mL, médiane = 4,7 ng/mL, minimale = 0,4 ng/mL, maximale = 1085 ng/mL, LD = 0,5 ng/mL, LQ = 2,0 ng/mL) (Sathyanarayana et coll., 2019). Dans leur étude, Sathyanarayana et coll. (2019) n’ont pas ventilé les données par groupe d’âge, mais ils ont indiqué que des concentrations élevées de mélamine ont été mesurées dans les échantillons de participants plus âgés. Comme les données n’étaient pas ventilées par groupe d’âge, l’absorption estimée est fondée sur une catégorie d’âge représentative comprenant des sujets âgés de 6 mois à 4 ans, d’après l’âge moyen (2,7 ans) des participants à l’étude.
La mélamine a aussi été mesurée dans des échantillons ponctuels d’urine prélevés chez 123 enfants âgés de 4 à 6 ans aux États-Unis dans le cadre d’un suivi d’enfants dont la mère a participé à l’étude Global Alliance to Prevent Prematurity and Stillbirth (GAPPS), qui visait des femmes enceintes vivant à Seattle et à Yakima (État de Washington). La mélamine a été détectée dans l’urine à des concentrations supérieures à la LD dans tous les échantillons (n = 123) (concentration moyenne = 6,1 ng/mL ± 12,4, minimale = 0,41 ng/mL, maximale = 104,3 ng/mL, LD = 0,08 ng/mL) (Melough et coll., 2022).
La mélamine a été mesurée dans l’urine de 171 femmes enceintes de la Californie, de la Géorgie, de l’Illinois, du New Hampshire, de l’État de New York et de Porto Rico. Les échantillons ont été prélevés entre 2017 et 2020 au cours des 3 trimestres de grossesse. La mélamine a été mesurée dans 99 % des échantillons (n = 170). Les concentrations de mélamine dans l’urine allaient d’une concentration inférieure à la LD (LD = 0,03 ng/mL) à 351 ng/mL (médiane = 1,6 ng/mL) (Choi et coll., 2022). À Taïwan, Wu et coll. (2020) ont mené une étude dans laquelle ils ont mesuré les concentrations de mélamine dans le sérum et l’urine de femmes enceintes. Les concentrations dans le sérum étaient inférieures à la LD, tandis que celles dans l’urine étaient semblables aux résultats de l’étude de Choi et coll. (2022), allant de 0,20 ng/mL à 284,55 ng/mL (médiane = 3,33 ng/mL). Également à Taïwan, Tsai et coll. (2021) ont mené une étude dans laquelle ils ont mesuré les concentrations de mélamine dans l’urine de femmes à leur troisième trimestre de grossesse. Les concentrations de mélamine dans l’urine étaient inférieures à celles de l’étude de Choi et coll. (2022), allant de 0,20 ng/mL à 47,69 ng/mL (médiane = 2,31 ng/mL).
La dosimétrie inverse a permis d’estimer l’absorption quotidienne à partir des concentrations dans l’urine tirées des études pertinentes. Les résultats sont présentés dans le tableau 5‑9 (des précisions sont données à l’annexe F). Bien qu’aucune étude indiquant la fraction de mélamine excrétée dans l’urine humaine n’ait été recensée, plusieurs études ont été réalisées avec des animaux. Mast et coll. (1983) ont montré que 90 % de la mélamine administrée à des rats mâles était excrétée dans leur urine sous forme de mélamine. Lipschitz et Stokey (1945) ont démontré que 60 à 86,5 % de la mélamine administrée à des chiens était excrétée sous forme de mélamine dans les 24 heures suivant une dose orale unique. Cruywagen et coll. (2011) ont montré que 54,1 % de la mélamine administrée à des moutons était éliminée sous forme de mélamine dans leur urine. Enfin, bien que Liu et coll. (2010) aient suggéré que la quantité éliminée dans l’urine des singes était nettement inférieure à la dose orale, ils n’ont pas pu présenter de bilan massique pour le profil d’excrétion ni indiquer le pourcentage de la dose de mélamine éliminé dans l’urine (plus de détails sont donnés dans la section 5.2.1).
En raison de l’absence de données humaines et de la variabilité de l’excrétion urinaire selon l’espèce (entre 54 % et 90 %), on a choisi une valeur prudente de 50 % comme fraction d’excrétion urinaire (FEU) pour calculer l’absorption à partir des données de biosurveillance humaine. De plus, comme on n’a pas recueilli de données sur le volume d’urine excrété par chaque participant, des plages de volumes d’urine moyens types sur 24 heures provenant de diverses sources ont servi à calculer l’absorption (voir l’annexe F pour les plages de volumes et les références). Des précisions sur la dosimétrie inverse sont fournies à l’annexe F, tandis que les diverses incertitudes liées à l’estimation de l’absorption à partir des données de biosurveillance disponibles sont présentées dans la section 5.4.
| Étude | Participants | Lieu | Concentration moyenne géométrique et [maximale] ou [au 95e centile] dans l’urine (ng/mL) | Absorption estimée (μg/kg p.c./j)a |
|---|---|---|---|---|
| Panuwet et coll., 2012 | 6 à 11 ans (n=6)b | États-Unis | 5,91 [6,7] | 0,23 à 0,30 [0,27 à 0,34] |
| Panuwet et coll., 2012 | 12 à 19 ans (n=162) | États-Unis | 2,06 [10,47] | 0,08 [0,42] |
| Panuwet et coll., 2012 | 20 à 59 ans (n=217) | États-Unis | 2,33 [12,44] | 0,09 [0,50] |
| Panuwet et coll., 2012 | 60 ans et plus (n=107) | États-Unis | 2,93 [11,09] | 0,12 [0,44] |
| Sathyanarayana et coll., 2019 | 4 mois à 8 ans (n=109) | États-Unis | 27,8 [1085] | 1,22 à 4,74 [47,74 à 184,88] |
| Melough et coll., 2022 | 4 à 6 ans (n=123) | États-Unis | 6,1 [104,3] | 0,37 [6,26] |
| Choi et coll., 2022 | Femmes enceintes (n=171) | États-Unis | 1,6c [351] | 0,06 [14,04] |
a L’absorption estimée est fondée sur la concentration géométrique moyenne ou la concentration médiane indiquée dans la colonne précédente. Les valeurs entre crochets représentent l’absorption estimée calculée à partir de la concentration maximale ou au 95e centile indiquée dans la colonne précédente. Veuillez consulter l’annexe F pour obtenir plus de détails sur les calculs de dosimétrie inverse.
b Chez les enfants de 6 à 11 ans (n=6), on a mesuré des concentrations de mélamine dans l’urine situées entre 0,5 ng/mL et 6,7 ng/mL chez 5 sujets, alors que cette valeur était de 161 ng/mL pour un sujet. En raison de la petite taille de l’échantillon pour ce groupe d’âge et de la possibilité que l’une des concentrations soit une valeur aberrante, le calcul de l’absorption au 95e centile serait statistiquement instable. Par conséquent, la deuxième concentration en importance a été utilisée pour déterminer l’absorption maximale.
c Concentration médiane
Bien que d’autres études de biosurveillance aient été menées à Taïwan (Wu et coll., 2010a, 2018; Liu et coll., 2011), à Hong Kong (Kong et coll., 2011) et à Shanghai (Shi et coll., 2020), les résultats fondés sur la population américaine mesurés par Panuwet et coll. (2012), Sathyanarayana et coll. (2019), Melough et coll. (2022) et Choi et coll. (2022) ont été utilisés comme substituts pour la population canadienne, car ils étaient considérés comme les plus pertinents.
5.1.5 Prise en compte des sous-populations qui peuvent être plus fortement exposées
Certains groupes de personnes vivant au Canada, en raison d’une plus grande exposition, peuvent être plus susceptibles de subir des effets nocifs pour la santé découlant de l’exposition à des substances. Le potentiel d’exposition élevée dans la population canadienne a été étudié. Les estimations d’exposition sont régulièrement évaluées selon l’âge pour tenir compte des différences physiques et comportementales à différentes étapes de la vie. Dans l’évaluation de l’exposition de fond à partir des milieux de l’environnement, des aliments et de l’eau potable, les jeunes enfants étaient associés à une exposition estimée plus élevée que les adultes, les bébés nourris aux préparations pour nourrissons étant les plus exposés. Les bébés et les enfants étaient également plus exposés par l’alimentation en raison de la migration de la mélamine à partir d’articles en mélamine. Dans l’évaluation de l’exposition à la mélamine à partir de produits offerts aux consommateurs, on a notamment évalué des matelas, des meubles rembourrés, des ensembles de retenue pour bébés et enfants (dont les sièges d’appoint) et des textiles utilisés par les enfants. Les bébés et les enfants étaient plus exposés que les adultes à la mélamine contenue dans les textiles et les articles manufacturés (par exemple, par le mâchonnement d’un objet en mousse, par contact cutané causé par le fait de s’asseoir dans un siège d’auto pour bébé ou enfant, ou de s’étendre sur un matelas en mousse). Dans cette évaluation de l’exposition, on disposait de données de biosurveillance de la mélamine pour des personnes à tous les stades de la vie, du bébé à l’adulte, y compris les femmes enceintes (Panuwet et coll., 2012; Sathyanarayan et coll., 2019; Melough et coll., 2022; Choi et coll., 2022). Les enfants présentaient des concentrations de mélamine dans l’urine plus élevées que les adultes. Les concentrations moyennes de mélamine dans l’urine pour les femmes enceintes (Choi et coll., 2022) étaient semblables à celles de l’adulte moyen (Panuwet et coll., 2012), tandis que les concentrations maximales chez les femmes enceintes étaient supérieures à celles de l’adulte moyen. Choi et coll. (2022) ont examiné les différences entre les concentrations de mélamine dans l’urine pour différentes ethnies, et ont noté que des concentrations plus élevées étaient observées chez les femmes noires non hispaniques et les femmes asiatiques non hispaniques par rapport à d’autres groupes (personnes hispaniques, personnes blanches non hispaniques et personnes non hispaniques d’une autre ethnie ou multiethniques).
5.2 Évaluation des effets sur la santé
Les renseignements sur les effets de la mélamine sur la santé sont résumés dans la présente section. D’autres détails, dont les effets de la combinaison de la mélamine avec l’acide cyanurique, sont présentés dans les documents à l’appui contenant les données supplémentaires sur la santé humaine (Santé Canada, 2024). Les études sur les effets sur la santé qui pourraient avoir une incidence sur la caractérisation des risques (c'est-à-dire qui concluent à des paramètres critiques différents ou à des points de départ plus faibles que ceux indiqués dans ECCC, SC, 2020) ont été recensées et sont présentées principalement dans la section 5.2.5section 5.2.5section 5.2.5. Le Centre international de recherche sur le cancer (CIRC) a classé la mélamine dans le groupe 2B (peut-être cancérogène pour l’homme) (CIRC, 2019). Le comité d’évaluation des risques (CER) de l’ECHA a adopté un avis proposant une classification et un étiquetage harmonisés de la mélamine à l’échelle de l’Union européenne (ECHA, 2020). Les classifications suivantes ont été adoptées par consensus : cancérogène de catégorie 2, H351, et toxicité pour certains organes cibles – expositions répétées (TCOC-ER) de catégorie 2, H373 (voies urinaires). De plus, selon les avis fournis par des entreprises à l’ECHA pour l’enregistrement aux fins de classification et d’étiquetage au titre du règlement REACH sur l’enregistrement, l’évaluation, l’autorisation et les restrictions des substances chimiques, on soupçonne que la mélamine a des effets néfastes sur la fertilité (toxicité pour la reproduction de catégorie 2, H361f) en ce qui concerne l’appareil reproducteur masculin (testicules et sperme) (ECHA, 2022).
5.2.1 Toxicocinétique après absorption par voie orale
La mélamine a été excrétée dans l’urine de rats et de singes ayant reçu des doses uniques de 1,3 et de 1,4 mg/kg p.c., respectivement. Cependant, outre la mélamine non modifiée, 2 métabolites, le monophosphate de dimélamine et le mono-oxalate de monomélamine, ont été détectés chez des rats et des chiens ayant reçu par voie orale de fortes doses uniques de 250 et de 125 mg/kg p.c., respectivement (Lipschitz et Stokey, 1945). La demi-vie pour l’élimination urinaire de la mélamine était de 6 heures chez le chien (Lipschitz et Stokey, 1945). De plus, selon des études toxicocinétiques poussées chez le rat, la mélamine n’était pas métabolisée à de faibles doses comparativement à des doses élevées (1,3 mg/kg p.c. par rapport à 250 mg/kg p.c.), ce qui donne à penser que lors d’une exposition orale aux concentrations de mélamine dans l’environnement, la substance peut ne pas être métabolisée dans l’organisme. D’après le calcul du bilan massique réalisé pour des rats ayant reçu une dose de 1,3 mg/kg p.c./j, 98 % de la dose avait été récupérée sous forme de mélamine 96 heures après l’administration, ce qui confirme l’absence de métabolisme (Mast et coll., 1983). Chez le rat, la demi-vie d’élimination, la demi-vie d’excrétion urinaire et la clairance rénale pour la mélamine étaient respectivement de 2,7 h, de 3,0 h et de 2,5 mL/min (Mast et coll., 1983). Chez les 3 singes ayant reçu par gavage oral une dose de 1,4 mg/kg p.c., la quantité éliminée dans l’urine était bien inférieure à la dose orale, mais les auteurs n’ont pu présenter un bilan massique pour le profil d’excrétion ni indiquer le pourcentage de la dose de mélamine éliminée dans l’urine, car la mélamine n’avait pas été radiomarquée dans cette étude (Liu et coll., 2010).
Chez un mouton qui a ingéré 700 mg/j de mélamine dans des aliments en boulettes pendant 7 jours, l’urine était la principale voie d’excrétion de la mélamine (54,1 % de la dose ingérée), suivie des selles (23,7 % de la dose ingérée) (Cruywagen et coll., 2011).
Il semble y avoir une saturation de l’excrétion à une dose orale de 100 mg/kg p.c./j. Après avoir administré une dose de 100 mg/kg p.c. à des rats Sprague-Dawley (SD), Wu et coll. (2010b) ont écrit ce qui suit :
« Environ 63,2 % de la dose administrée a été récupérée dans l’urine dans les 96 heures. L’étude précédente faisait mention d’une valeur d’élimination de 90 % [à une dose de 1,3 mg/kg p.c.] dans les 24 premières heures [Mast et coll., 1983], et cet écart pourrait résulter d’une dose beaucoup plus élevée (100 mg/kg, poNote de bas de page 10) administrée dans le cadre de notre étude, ce qui pourrait mener à la saturation de l’élimination urinaire et au report du moment d’élimination. Ce résultat donne à penser que la majeure partie de la dose de mélamine administrée a été absorbée, puis éliminée dans l’urine, sans être modifiée. »
La biodisponibilité orale de la mélamine variait de 73 ± 13 à 98 % chez le rat, ce qui confirme une absorption orale élevée et rapide dans le tractus gastro-intestinal (Yang et coll., 2009; Wu et coll., 2010b). D’après des études réalisées par Yang et coll. (2009), Wu et coll. (2010b) et Pang et coll. (2013), la mélamine ne se répartit pas énormément dans les tissus de rats ayant reçu par voie orale une dose unique ou répétée pendant 14 jours de 100 mg/kg p.c. et demeure principalement dans le sang. Plusieurs auteurs ont fait état de demi-vies d’élimination plasmatique allant de 1,3 h à 5 h dans diverses études menées sur des rats et des singes ayant reçu par voie orale des doses uniques de 1 mg/kg p.c. à 100 mg/kg p.c. (Wu et coll., 2010b; Jacob et coll., 2012; Dorne et coll., 2013; Pang et coll., 2013). Dorne et coll. (2013) ont jugé les taux comparables à ces doses orales et, dans tous les cas, appuient l’observation de l’excrétion rapide de la mélamine dans l’urine.
Wang et coll. (2013) ont réalisé une étude toxicocinétique à doses répétées chez le porc. Des porcs ont reçu de la mélamine dans leur alimentation à des doses de 0, 18 ou 35 mg/kg p.c./j pendant 42 jours, avec une période de récupération de 5 jours. On a observé une augmentation liée à la dose des concentrations résiduelles de mélamine dans tous les tissus analysés (plasma, cerveau, duodénum, foie, cœur, muscles et reins), et la concentration de mélamine dans les reins était nettement plus élevée que dans les autres tissus (p < 0,01), les concentrations de résidus dans les tissus diminuant après le retrait de la mélamine. Après 42 jours à 35 mg/kg p.c./j, la demi-vie était de 9,90 h, avec un volume de distribution à l’état d’équilibre de 1,07 L/kg. Bien que cette demi-vie soit légèrement plus longue que les autres demi-vies signalées pour d’autres espèces, l’étude a aussi permis de confirmer que la mélamine était principalement éliminée par filtration rénale. Les auteurs ont indiqué que la clairance de la mélamine dans cette étude (0,076 L/h/kg) concordait avec la clairance plasmatique (0,061 L/h/kg) observée chez les porcs ayant reçu des doses uniques par intraveineuse dans l’étude réalisée par Baynes et coll. (2008).
Chu et coll. (2013) ont réalisé une étude toxicocinétique chez des rattes gravides et des rats en développement. Ils ont administré par gavage une dose unique de 24 mg/kg p.c. de mélamine aux femelles gravides au jour de gestation (JG) 10, 15 ou 20 et aux petits à la 2e, 4e, 6e ou 8e semaine postnatale (respectivement 2SPN, 4SPN, 6SPN ou 8SPN). Comme l’ont indiqué les auteurs, la répartition de la mélamine dans le sérum maternel était environ 30 % plus élevée en fin de grossesse qu’en début de grossesse et elle était 2 fois plus élevée dans le sérum postnatal des petits que des jeunes adultes (2SPN contre 4SPN à 8SPN). La répartition de la mélamine dans les organes était plus élevée après la naissance qu’avant. Chez les petits, les reins après la naissance présentaient la concentration maximale la plus élevée et le plus faible taux d’élimination de mélamine parmi les organes après la naissance (Cmax = 10,85 mg/kg contre 1,06 mg/kg à 2,36 mg/kg, et clairance apparente = 0,62 L/h contre 1,85 L/h à 2,75 L/h pour le foie, les poumons, le cœur, le cerveau et la rate, respectivement, à 2SPN). La forte répartition de la mélamine dans le sérum et les reins des rats âgés de 2 semaines par rapport aux autres stades de vie semble indiquer un risque accru de toxicité de la mélamine pour les reins après la naissance, selon les auteurs. Les études de toxicité pour le développement réalisées par Kim et coll. (2011) et Stine et coll. (2014) ont révélé une toxicité rénale chez les femelles gravides recevant des doses orales de 800 mg/kg p.c./j à 1000 mg/kg p.c./j de mélamine. Toutefois, aucune toxicité rénale n’a été observée chez les fœtus aux mêmes doses (bien que d’autres effets aient été observés), et les femelles n’ont pas été autorisées à mettre bas.
L’EFSA (2010) a également signalé qu’il existe des preuves indirectes que la mélamine n’est pas métabolisée chez les humains. Dans une étude (Worzalla et coll., 1974, cité dans EFSA, 2010) lors de laquelle on a administré oralement à des humains de l’hexaméthylmélamine radiomarquée au 14C sur le cycle, 5 % de la dose d’hexaméthylmélamine (sous forme de 14C) a été excrétée dans l’urine sous forme de mélamine, mais aucun métabolite de la mélamine n’a été observé. Les auteurs ont effectué la même étude chez des rats auxquels on a administré une dose intrapéritonéale d’hexaméthylmélamine radiomarquée au 14C sur le cycle. Dans ce cas, 2 % de la dose d’hexaméthylmélamine (sous forme de 14C) a été excrétée dans l’urine sous forme de mélamine, mais aucun métabolite de la mélamine n’a été détecté. Dans les 2 études, on n’a pu déterminer l’origine de seulement 5 % de la radioactivité urinaire.
Wu et coll. (2013) ont mené une étude chez l’humain lors de laquelle les concentrations de mélamine ont été mesurées dans l’urine de 16 adultes qui ont consommé à différents moments de la soupe aux nouilles chaude servie dans des bols en mélamine ou en céramique. L’excrétion totale de la mélamine dans l’urine était de 8,35 ± 1,91 µg 12 heures après la consommation de la soupe aux nouilles dans des bols en mélamine, et de 1,31 ± 0,44 µg 12 heures après la consommation de la soupe aux nouilles dans des bols en céramique. L’excrétion urinaire maximale s’est produite pendant la période de plus de 4 à 6 heures. La demi-vie estimée pour l’élimination urinaire de la mélamine chez l’humain est d’environ 6 heures (Wu et coll., 2013).
En résumé, d’après des études menées chez des animaux, la mélamine est rapidement absorbée par le tractus gastro-intestinal et rapidement éliminée du corps, car sa demi-vie plasmatique est de quelques heures à plusieurs heures (EFSA, 2010). La principale voie d’élimination est l’urine, et le peu de renseignements disponibles donne à penser que la substance est à peine métabolisée à des doses pertinentes pour l’environnement. La demi-vie dans l’urine varie entre 3 h et 6 h selon l’espèce (Lipschitz et Stokey, 1945; Mast et coll., 1983; Wu et coll., 2013; CIRC, 2019). Dans des études menées sur diverses espèces, les rats présentaient le taux d’élimination le plus élevé (90 % de la mélamine excrétée dans l’urine après 24 h), suivis des chiens (61 % de la mélamine excrétée dans l’urine après 6 h). Le taux d’excrétion pour les singes n’a pas pu être déterminé. Les moutons présentaient le taux d’élimination le plus faible, 54 % de la mélamine étant excrétée dans l’urine (Mast et coll., 1983; Yang et coll., 2009; Liu et coll., 2010; Wu et coll., 2010b; Cruywagen et coll., 2011; Pang et coll., 2013; Wang et coll., 2013).
5.2.2 Cancérogénicité/toxicité chronique
Dans le cadre d’une étude de 2 ans, des rats Fisher 344 (F344) ont reçu de la mélamine dans leur alimentation pendant 2 ans, à des doses de 0, 126/262 ou 263/542 mg/kg p.c./j pour les mâles et les femelles, respectivement. Des carcinomes transitionnels ont été observés dans la vessie des rats mâles nettement plus fréquemment (p ≤ 0,016) dans le groupe ayant reçu une dose élevée (8 sujets sur 49) que dans le groupe témoin (0 sujet sur 45). On a aussi observé une association statistiquement significative (p < 0,001) entre les calculs vésicaux (10 sujets sur 49) et les tumeurs dans la vessie chez les rats mâles ayant reçu des doses élevées de mélamine dans leur alimentation. Aucune tumeur dans la vessie n’a été détectée chez les rats mâles ayant reçu une faible dose de mélamine (126 mg/kg p.c./j), alors que des calculs vésicaux ont été détectés chez un seul des 50 rats de ce groupe (US NTP, 1983; Melnick et coll., 1984). En raison de l’association statistiquement significative entre les calculs vésicaux et les tumeurs dans la vessie à la dose élevée (263 mg/kg p.c./j), l’histopathologie de cette étude a été réévaluée (Hard et coll., 2009). Les résultats ont révélé une augmentation importante de néphropathies de reflux chez les rats mâles [7 sur 50 contre 1 sur 49 témoins], mais aucune augmentation des calculs vésicaux [1 sur 50 contre 1 sur 45 témoins] à une dose de 126 mg/kg p.c./j (Hard et coll., 2009), ce qui confirme l’absence de tumeurs à cette dose.
Dans une autre étude de 2 ans, on a ajouté à l’alimentation de rats de souche non précisée des doses de 0, 67 ou 667 mg/kg p.c./j de mélamine. Une augmentation de la fréquence de calculs vésicaux associée à une fréquence accrue de papillomes bénins à la dose maximale a été signalée (American Cyanamid Co, 1955). Des rats F344 ont reçu de la mélamine dans leur alimentation pendant 24 à 30 mois, à des doses de 0, 5/5, 25/50 ou 50/100 mg/kg p.c./j pour les mâles et les femelles respectivement. On n’a observé aucune hausse du nombre de tumeurs de la vessie. Bien qu’à des doses de 5 mg/kg p.c./j et plus, une tendance liée à la dose a été observée sous la forme d’une dilatation des muqueuses gastriques glandulaires et d’une inflammation des muqueuses gastriques non glandulaires, les auteurs n’ont pas précisé si cette tendance s’appliquait à un seul ou aux 2 sexes. Toutefois, selon la source secondaire, la dose sans effet observé (DSEO) serait la dose élevée (Hazleton Laboratories, 1983, cité dans OCDE, 2002).
Deux études de 36 semaines ont été réalisées sur des rats F344 mâles. Dans une étude, les animaux ont reçu des doses de 0, 110, 367 ou 1100 mg/kg p.c./j de mélamine dans leur alimentation (Okumura et coll., 1992), tandis que dans l’autre, ils ont reçu des doses de 0, 430 ou 1200 mg/kg p.c./j de mélamine dans leur alimentation (Ogasawara et coll., 1995). Dans les 2 études, on a observé une augmentation liée à la dose de la fréquence de carcinomes transitionnels dans la vessie et de papillomes de la vessie, lesquels ont été associés à une augmentation liée à la dose du nombre de cas d’hyperplasie papillaire/nodulaire de l’épithélium de la vessie. Ces augmentations, ainsi qu’une hausse non liée à la dose du nombre de calculs vésicaux, ont permis de déterminer une dose minimale avec effet nocif observé (DMENO) de 110 mg/kg p.c./j dans l’étude d’Okumura et coll. (1992). Ces derniers (1992) ont observé une corrélation statistique significative entre la fréquence des calculs vésicaux et des tumeurs, et ont conclu que les calculs provoqués par la mélamine peuvent induire des carcinomes dans la vessie. Ogasawara et coll. (1995) ont déterminé que les calculs vésicaux étaient composés d’une proportion molaire égale de mélamine et d’acide urique, et conclu que les lésions prolifératives dans les voies urinaires des rats F344 mâles étaient directement causées par la stimulation irritante des calculs et non par les interactions moléculaires entre la mélamine ou ses métabolites et l’épithélium de la vessie.
Pendant 103 semaines, on a ajouté à l’alimentation de souris B6C3F1 des doses de 0, 327/523 ou 688/1065 mg/kg p.c./j de mélamine pour les mâles et les femelles, respectivement, puis elles n’ont reçu aucune mélamine pendant les 2 semaines suivantes. Une inflammation et une hyperplasie aiguës et chroniques de la vessie ainsi que des calculs vésicaux ont été observés chez les souris mâles à toutes les doses et chez les femelles à la dose élevée. Aucun effet cancérogène n’a toutefois été observé dans cette étude (US NTP, 1983; Melnick et coll., 1984).
En résumé, 5 études de cancérogénicité ont été menées chez des rats et une chez des souris. Dans tous les cas, de la mélamine a été administrée aux animaux par l’alimentation. Dans quatre des études chez le rat, on a observé des tumeurs ou des papillomes dans la vessie à des doses allant de 263 mg/kg p.c./j à 1200 mg/kg p.c./j. Des doses plus faibles (5 mg/kg p.c./j à 100 mg/kg p.c./j) ont été administrées lors de l’autre étude. Aucun effet cancérogène n’a été observé dans l’étude de 2 ans sur des souris ayant reçu par l’alimentation des doses de mélamine variant entre 327 mg/kg p.c./j et 1065 mg/kg p.c./j.
5.2.3 Génotoxicité
De nombreuses études de génotoxicité in vitro ont été réalisées pour la mélamine. Les résultats ont été négatifs dans toutes les études de mutation génique dans les cellules bactériennes (Salmonella typhimurium, Photobacterium phosphoreum, Saccharomyces cerevisiae) et de mammifères (cellules de lymphome de souris et cellules ovariennes de hamster chinois [CHO]), les tests d’aberration chromosomique et d’échange de chromatides sœurs dans les cellules CHO, un test du micronoyau réalisé avec des cellules CHO et des études de synthèse de l’ADN non programmée dans des hépatocytes de rats et des cellules bactériennes (E. coli et S. typhimurium) (Seiler, 1973; Litton Bionetics, 1977a, 1977b, 1977c; American Cyanamid Co., 1981, 1982a, 1982b; Mast et coll., 1982a; Haworth et coll., 1983; Mirsalis et coll., 1983; Galloway et coll., 1987; Zeiger, 1987; McGregor et coll., 1988; Elmore et Fitzgerald, 1990; Ishiwata et coll., 1991; Selden et coll., 1994; Yasunaga et coll., 2004; Tu et coll., 2015). Un essai non standard, qui a mesuré l’induction du prophage lambda chez E. coli comme indicateur de dommages à l’ADN, donnait un résultat positif avec et sans activation métabolique (Rossman et coll., 1991). Un test des comètes a été réalisé sur l’eucaryote unicellulaire Tetrahymena thermophila. On a constaté une augmentation liée à la dose du pourcentage de dommages à l’ADN, du pourcentage de cellules avec queue et d’unités arbitraires de dommages à l’ADN à toutes les doses, mais l’augmentation était statistiquement significative à 2000 mg/L et à 4000 mg/L.
Des études in vivo comprenant 2 tests du micronoyau (administration de mélamine à des souris par gavage oral et par injection intrapéritonéale) et un test combinant un essai de mutation Pig-a (administration de mélamine à des rats par gavage oral) ont donné des résultats négatifs pour ce qui est des aberrations chromosomiques dans la moelle osseuse et le sang périphérique des souris et aucune différence significative dans la fréquence des micronoyaux ou dans la fréquence de mutation du gène Pig-a dans les globules rouges ou les réticulocytes des rats (Pharmakon Research, 1981; Mast et coll., 1982b; Shelby et coll., 1993; Tu et coll. 2015). En général, les données sur la génotoxicité tendent à indiquer que la mélamine n’est pas génotoxique. Les examens des données réalisés par le CIRC (2019) et l’ECHA (2020) confirment également cette indication.
5.2.4 Mode d’action cancérogène
Le mode d’action de l’apparition des tumeurs observées n’a pas été totalement éclairci. On a toutefois émis l’hypothèse que les tumeurs malignes de la vessie dépendent d’un mécanisme de seuil causé par l’hyperplasie réactive qui se développe en réponse à une irritation localisée des tissus, puis qui se transforme en néoplasie de la vessie. Cette hypothèse est étayée par l’absence d’activité mutagène ou génotoxique lors de la réalisation d’essais standards, selon l’Organisation mondiale de la Santé (OMS, 2009). L’OMS (2009) a également observé qu’une minéralisation des papilles rénales a été relevée dans certaines études, mais on ignore si une telle minéralisation peut se détacher et créer un foyer pour la formation des calculs vésicaux.
5.2.5 Toxicité pour la reproduction et le développement
Dans le cadre d’une étude de 3 jours, des souris Kunming mâles (12 sujets par groupe) ont reçu par gavage oral de la mélamine en suspension dans de la carboxyméthylcellulose sodique à 1 % (30, 140 ou 700 mg/kg/j) ou un excipient (groupe témoin) (Chang et coll., 2014). La toxicité pour les testicules a été évaluée aux jours 1 et 5 après la dernière exposition. On n’a observé aucun changement clinique ou au poids corporel chez les souris témoins et les souris traitées. Il n’y avait aucune différence entre les concentrations sanguines d’azote uréique, de créatinine ou de testostérone des souris témoins et des souris traitées. Après une journée d’exposition, le taux de spermatozoïdes anormaux dans les épididymes chez tous les groupes traités était beaucoup plus élevé que chez le groupe témoin, les taux étant nettement plus élevés chez les groupes ayant reçu les doses de 30 mg/kg/j et de 700 mg/kg/j, en particulier. Cinq jours après l’exposition, le taux d’anomalies était toujours plus élevé que chez le groupe témoin.
Un jour après l’exposition, on a observé des précipités blancs dans la vessie d’une souris de chacun des 2 groupes ayant reçu les plus faibles doses (30 mg/kg/j et 140 mg/kg/j) et de la moitié des souris ayant reçu la dose la plus élevée (700 mg/kg/j).
Cinq jours après l’exposition, la glande bulbo-urétrale droite d’une souris exposée à la plus forte dose (700 mg/kg/j) était particulièrement enflée et hémorragique. On n’a relevé aucune différence importante entre les poids des testicules et des épididymes du groupe témoin et des groupes traités.
Un jour après l’exposition, l’indice apoptotique des tubules séminifères a augmenté considérablement dans le groupe ayant reçu la plus faible dose (30 mg/kg/j) seulement. Cinq jours après l’exposition, l’indice apoptotique des tubules séminifères a augmenté considérablement dans le groupe ayant reçu la plus forte dose (700 mg/kg/j) seulement.
Les sujets de tous les groupes traités présentaient des lésions marquées de la vessie. De plus, on a observé des changements morphologiques proportionnels à la dose dans les testicules et les épididymes. Un jour après l’exposition, on a observé une augmentation du grade histologique dans la queue des épididymes ainsi qu’une desquamation des cellules germinales des testicules des souris exposées à la plus forte dose. On a observé chez toutes les souris traitées une absence presque totale de spermatozoïdes ou la présence d’une masse de cellules germinales pycnotiques et nécrotiques dans la lumière des canalicules efférents.
Cinq jours après l’exposition, les changements anormaux dans les testicules et les épididymes des sujets traités sont devenus moins graves.
On n’a observé aucun changement important au grade histologique dans les testicules des sujets témoins et traités, que ce soit un jour ou 5 jours après l’exposition de 3 jours. Chez toutes les souris traitées, on a observé des dommages liés à la dose touchant la structure de la barrière hématotesticulaire, y compris les cellules endothéliales capillaires, le tissu péritubulaire et le complexe de jonction entre les cellules de Sertoli.
Lors d’une étude de 5 jours, on a examiné les anomalies des spermatozoïdes chez les souris mâles en administrant par gavage gastrique des doses de 412 mg/kg p.c./j, 824 mg/kg p.c./j et 1648 mg/kg p.c./j de mélamine à des souris Kunming mâles en bonne santé (8 sujets par groupe) (Yin et coll., 2013). Les souris ont été sacrifiées 35 jours après la première administration. Le taux d’anomalie des spermatozoïdes était de 2,31 %, 2,83 % et 5,63 % pour les souris ayant reçu des doses de 412 mg/kg p.c./j, 824 mg/kg p.c./j et 1648 mg/kg p.c./j de mélamine, respectivement. Il s’agit d’une hausse importante des anomalies des spermatozoïdes pour tous les groupes traités par rapport au groupe témoin (Yin et coll., 2013).
Dans le cadre de la même étude, on a examiné les changements histopathologiques et l’apoptose des cellules spermatogènes des testicules. Des souris Kunming mâles en bonne santé (8 sujets par groupe) ont reçu par gavage gastrique des doses de 2 mg/kg p.c./j, 10 mg/kg p.c./j ou 50 mg/kg pc./j de mélamine pendant 14 jours (Yin et coll., 2013).
À la dose de 2 mg/kg p.c./j, aucun changement important n’a été relevé chez les souris, mais certaines cellules spermatogènes présentaient des noyaux de forme irrégulière. À la dose de 10 mg/kg p.c./j, la membrane basale des tubules séminifères était indistincte et les cellules spermatogènes à tous les stades présentaient une organisation légèrement lâche comprenant un nombre réduit de couches cellulaires. De plus, des noyaux de forme irrégulière ont été observés dans des spermatocytes primaires et secondaires et des spermatozoïdes. À la dose de 50 mg/kg p.c./j, on a observé des lésions à la membrane basale de l’épithélium séminifère des tubules séminifères, un nombre réduit de couches de cellules épithéliales ainsi que des lésions structurales sur de nombreuses cellules spermatogènes à tous les stades. Lors de l’examen histopathologique, on a aussi observé un gonflement et une lyse des noyaux de spermatocytes primaires et secondaires et de spermatozoïdes. On a relevé une réduction du nombre de spermatozoïdes et l’absence de spermatozoïdes matures dans les cellules de Sertoli. Par rapport au groupe témoin, les souris traitées avec 50 mg/kg p.c./j de mélamine affichaient une hausse importante de l’indice apoptotique des cellules spermatogènes (p < 0,05).
Dans le cadre d’une étude de 28 jours, des souris ICR mâles (10 sujets par groupe) ont reçu par gavage oral des doses de 2 mg/kg p.c./j, 10 mg/kg p.c./j ou 50 mg/kg pc./j de mélamine en suspension dans une huile comestible, tandis que les souris témoins ont reçu par gavage oral l’huile comestible seule (Sun et coll., 2016a). Les animaux ont été sacrifiés après le dernier jour de traitement. Chez les souris ayant reçu la mélamine, le nombre de spermatozoïdes était considérablement plus bas et le taux de spermatozoïdes anormaux était nettement plus élevé que dans le groupe témoin. Ces changements étaient proportionnels à la dose.
Chez les souris ayant reçu des doses de 10 et de 50 mg/kg p.c./j de mélamine, on a observé une régulation négative de la protéine de régulation rapide de la stéroïdogenèse (StAR) et des enzymes synthétiques de la testostérone ainsi qu’une baisse importante des taux de testostérone. Les souris ayant reçu une dose de 10 mg/kg p.c./j présentaient de légères lésions dans les testicules ainsi qu’un nombre réduit de cellules de Leydig. Lors de l’examen histopathologique des souris traitées avec 50 mg/kg p.c./j de mélamine, on a observé une perturbation de la structure des tubules séminifères, un nombre réduit de séries de cellules spermatogènes, une pycnose des noyaux ainsi qu’un nombre réduit de spermatozoïdes et de cellules de Leydig. Il n’y avait pas de lésion macroscopique évidente dans les reins ou les testicules des souris traitées ni de différence importante dans le poids des testicules.
Dans le cadre d’une étude de 28 jours, des rats SD femelles (10 sujets par groupe) ont reçu 10 mg/kg p.c./j, 20 mg/kg p.c./j ou 40 mg/kg p.c./j de mélamine dans de l’huile de maïs une fois par jour par gavage oral (Sun et coll., 2016b). Le poids corporel des sujets a augmenté de façon constante dans les 3 groupes traités, et il n’y avait aucune différence statistiquement significative entre les 3 groupes. Il n’y avait pas de changement macroscopique évident dans les reins des autres groupes de traitement ni de différence dans la durée du cycle œstral. On a observé une baisse (non significative) liée à la dose des taux sériques d’œstrogène et de progestérone. Chez les rats traités avec 40 mg/kg p.c./j de mélamine, on a observé une nécrose du noyau des ovocytes ainsi que des cellules de la granulosa, de fines couches de cellules de la granulosa, un détachement des cellules de la granulosa de leur membrane basale, un pourcentage nettement plus élevé de cellules de la granulosa apoptotiques et un nombre sensiblement plus élevé de follicules atrétiques.
Lors d’une étude de 8 semaines, des souris femelles (120 sujets par groupe) ont reçu de la mélamine (0, 10 et 50 mg/kg/j) dans de l’eau potable (Duan et coll., 2015). Bien que les auteurs aient déclaré qu’il y avait 120 sujets par groupe, la taille de l’échantillon pour chaque enquête était différente. Le poids des ovaires des souris traitées avec 10 mg/kg/j et 50 mg/kg/j de mélamine était nettement inférieur à celui des souris témoins. Une grande proportion des ovocytes des souris traitées avec de la mélamine affichaient un cytoplasme sombre ou étaient plus petits que la normale. Le taux d’ovocytes anormaux était plus élevé chez les souris traitées à la mélamine que chez les souris témoins. Le nombre d’ovocytes ovulés n’était pas très différent entre les souris témoins et traitées. Le taux d’expulsion de globules polaires par les ovocytes était inférieur pour les souris traitées que pour les souris témoins. Chez les souris traitées à la mélamine, on a observé des cytosquelettes d’ovocytes anormaux qui présentaient des taux accrus de fuseaux aberrants ainsi qu’une expression réduite des microfilaments d’actine. La taille des portées des souris traitées à la mélamine (n = 4) faisant partie du groupe recevant la plus forte dose était nettement inférieure à celle des portées du groupe témoin (n = 4). Aucune autre précision sur la reproduction ou les portées n’est fournie.
Dans le cadre d’une étude de 65 jours, on a gavé oralement des souris Swiss mâles (10 sujets par groupe) avec de la mélamine dissoute dans de l’eau distillée (50 mg/kg/j), du formaldéhyde dissous dans de l’eau distillée (25 mg/kg/j), un mélange de mélamine et de formaldéhyde dissous dans de l’eau distillée ou un excipient témoin (Khalil et coll., 2017). Les groupes traités au formaldéhyde et au mélange ne sont pas abordés davantage dans les présentes. Aucune différence statistique quant au poids des testicules et à l’indice gonadosomatique moyen pour les testicules n’a été observée entre les groupes traités et témoin. On a observé dans le groupe traité à la mélamine une importante réduction de la concentration de spermatozoïdes et du pourcentage de motilité des spermatozoïdes, une baisse des taux de testostérone plasmatique et d’hormone lutéinisante, une réduction des changements relatifs aux niveaux de transcription de l’ARNm pour les principales enzymes stéroïdogènes ainsi qu’une importante inhibition de l’activité des enzymes testiculaires. De plus, une altération de la spermatogenèse, une dilatation kystique des tubules séminifères accompagnée d’une vacuolisation marquée des cellules de Leydig, une désorganisation étendue des spermatogonies ainsi qu’une apoptose des cellules de Sertoli ont été observées.
Lors d’une étude de 91 jours, 8 souris Kunming mâles par groupe ont reçu dans l’eau potable des doses de 0 mg/L, 12,5 mg/L, 25 mg/L et 50 mg/L de mélamine (ce qui équivaut à 2, 4 et 8 mg/kg p.c./j) (Chen et coll., 2021). Les animaux ont été sacrifiés après le dernier jour de traitement. Chez les souris traitées à la mélamine, les niveaux d’expression de l’ARNm de la protéine p38 et les facteurs de transcription en aval MAX et Sap1a dans les testicules étaient réduits. De plus, le traitement à la mélamine a régulé à la baisse l’expression relative de la protéine p38 phosphorylée dans les testicules (Chen et coll., 2021).
Le poids corporel des souris ayant reçu une dose de 8 mg/kg p.c./j a grandement diminué à 2, 8 et 13 semaines après l’exposition par rapport au groupe témoin. Bien que le poids absolu des testicules était semblable dans tous les groupes de l’expérience, leur poids relatif (g) était nettement plus élevé dans les groupes ayant reçu les doses faible et moyenne que dans le groupe témoin (Chen et coll., 2021).
La motilité des spermatozoïdes a diminué de façon importante chez les souris traitées à la mélamine par rapport aux souris témoins. Le nombre de spermatozoïdes des souris ayant reçu des doses de 4 mg/kg p.c./j et 8 mg/kg p.c./j de mélamine était nettement plus bas que celui des souris témoins.
Lors d’un examen histopathologique, on a relevé que les structures des tubules séminifères des souris ayant reçu des doses de 4 et 8 mg/kg p.c./j de mélamine étaient lâches, désordonnées et imprécises par rapport à celles des souris témoins. Chez toutes les souris traitées à la mélamine, le nombre de couches de cellules de l’épithélium séminifère et leur épaisseur étaient considérablement réduits. Chez les groupes ayant reçu les doses faible et moyenne, le diamètre des tubules séminifères était réduit par rapport au groupe témoin, tandis que chez le groupe ayant reçu la dose de 8 mg/kg p.c./j, il était sensiblement accru (Chen et coll., 2021). Il convient de noter qu’on n’a pas précisé dans l’étude comment les doses étaient calculées, combien d’animaux se trouvaient dans la même cage, comment et si le déversement d’eau était pris en compte et comment la consommation d’eau était suivie. Ainsi, les conversions de doses déclarées doivent être interprétées avec prudence.
Dans le cadre d’une étude étendue de toxicité pour la reproduction sur une génération réalisée selon la ligne directrice pour les essais (LD) 443 de l’OCDE et présentée à l’ECHA, de 10 à 28 rats Wistar Han/sexe/dose ont reçu 0, 1000, 4000 ou 12 500 ppm de mélamine dans leur alimentation (ECHA, c2007-2022). Plus précisément, 28 rats Wistar Han/sexe/dose faisaient partie de la génération F0, 20 rats Wistar Han/sexe/dose étaient dans la cohorte 1A de génération F1, 25 rats Wistar Han/sexe/dose composaient la cohorte 1B de génération F1 et 10 rats Wistar Han/sexe/dose constituaient chacune des cohortes 2A, 2B et 3 de génération F1. L’étude comportait également une composante sur la neurotoxicité et l’immunotoxicité pour le développement.
Dans la génération parentale, les auteurs ont signalé une hausse liée à la dose de la fréquence et de la gravité des cas de néphropathie rétrograde dans les reins des mâles et des femelles aux doses de 4000 ppm (équivalant en moyenne à 268 mg/kg p.c./j et à 355 mg/kg p.c./j, respectivement) et de 12 500 ppm (équivalant en moyenne à 833 mg/kg p.c./j et à 1124 mg/kg p.c./j, respectivement). Aucun effet sur le rendement de reproduction n’a été observé jusqu’à la plus forte dose mise à l’essai (12 500 ppm). L’analyse du sperme a révélé une augmentation marquée du nombre de spermatozoïdes ayant une tête détachée à 12 500 ppm (équivalant en moyenne à 833 mg/kg p.c./j).
Chez les mâles de la cohorte 1B de génération F1, de façon semblable à la génération parentale, l’analyse du sperme a révélé une augmentation marquée du nombre de spermatozoïdes ayant une tête détachée à 12 500 ppm (équivalant en moyenne à 1200 mg/kg/j). L’examen histopathologique des testicules a révélé une hausse de la fréquence et de la gravité des cas d’atrophie et de dégénérescence des tubules à partir de la dose de 4000 ppm (équivalant en moyenne à 370 mg/kg/j), ainsi que des débris cellulaires connexes dans les épididymes. Aucun autre changement lié au traitement n’a été observé pour les autres paramètres de reproduction et de développement examinés dans le cadre de cette étude (ECHA, c2007-2022).
Les auteurs ont fait état d’une dose sans effet nocif observé (DSENO) de toxicité pour la reproduction de 4000 ppm (équivalant en moyenne à 268 mg/kg/j chez les mâles F0) pour la génération parentale, d’après la dégénérescence et l’atrophie des tubules dans les testicules et les débris cellulaires minimes connexes dans les épididymes observés chez les mâles F0 à une dose de 12 500 ppm (833 mg/kg p.c./j). Ils ont établi une DSENO de toxicité pour la reproduction de 1000 ppm (équivalant en moyenne à 89 mg/kg/j chez les mâles F1) pour les mâles F1, d’après la dégénérescence et l’atrophie des tubules dans les testicules et les débris cellulaires minimes connexes dans les épididymes observés à une dose de 4000 ppm et plus (370 mg/kg p.c./j).
La DSENO de toxicité générale pour le développement, la DSENO de neurotoxicité pour le développement et la DSENO d’immunotoxicité pour le développement seraient d’au moins 12 500 ppm (équivalant en moyenne à 1200 mg/kg/j chez les mâles et à 1227 mg/kg/j chez les femelles de la génération F1), en l’absence d’effet nocif observé à cette dose.
Les glandes mammaires, les ovaires, la prostate, les vésicules séminales, les testicules et l’utérus ont été examinés de façon macroscopique et microscopique au cours d’études de toxicité chronique de 13 et de 103 semaines chez le rat et la souris, et aucune structure n’a été touchée par la mélamine à aucune des doses utilisées (Melnick et coll., 1984).
En se fondant sur l’ensemble des études susmentionnées, on a déterminé que la DMENO de toxicité pour la reproduction est de 10 mg/kg p.c./j d’après la baisse du nombre de spermatozoïdes, la hausse des anomalies des spermatozoïdes, et la perturbation des tubules séminifères et de la synthèse de la testostérone observées lors d’une étude par gavage de 28 jours chez la souris (Sun et coll., 2016a). Bien que certains effets sur la reproduction (diminution du nombre de spermatozoïdes, réduction de la motilité des spermatozoïdes et changements structuraux aux tubules séminifères) aient été relevés à une dose inférieure à 10 mg/kg p.c./j (Chen et col., 2021), une incertitude demeure quant aux doses déclarées. Ainsi, ces résultats servent à appuyer la DMENO de 10 mg/kg p.c./j.
5.2.6 Toxicité orale à doses répétées
Des études de 28 jours chez le rat ont permis d’observer une hausse proportionnelle à la dose des calculs vésicaux (contenant de la mélamine), de l’hyperplasie de la vessie (tissus non précisés), de la cristallurie et de l’élimination de l’urine acide à des doses de 266 à 12 678 mg/kg p.c./j de mélamine (RTI, 1982; American Cyanamid Co., 1984). Lors d’une étude au cours de laquelle des rats ont été gavés avec 300 mg/kg p.c./j de mélamine, on a aussi observé des défauts d’apprentissage et de mémoire (An et coll., 2011; Yang et coll., 2011). Dans une autre étude de 28 jours chez le rat, la microstructure des reins a été endommagée et les paramètres de chimie clinique ont sensiblement changé dans le sérum (azote uréique et créatinine dans le sang), les reins (glutamate, lactate, choline, glucose, acides aminés, 3-hydroxybutyrate, pyruvate), le foie (N-acétylglycoprotéine, choline, créatine, lactate, triméthylamine-N-oxyde, glutamate, glucose) et l’urine (succinate, citrate) à des doses de 250 mg/kg p.c./j à 1000 mg/kg p.c./j. Cette étude métabonomique a permis de montrer que la mélamine entraîne un dysfonctionnement rénal et perturbe le métabolisme du glucose, des protéines et de l’azote dans le foie (Sun et coll., 2012). Dans les études alimentaires par voie orale, le Research Triangle Institute (RTI, 1982) a déterminé une DSENO de 133 mg/kg p.c./j, tandis qu’on n’a observé aucun effet nocif aux doses de 40 à 357 mg/kg p.c./j dans l’autre étude (American Cyanamid Co., 1984, cité dans US EPA, 1984). Des rats femelles ont reçu de la mélamine par gavage pendant 28 jours. On n’a relevé aucune lésion toxique dans les reins à une dose de 40 mg/kg p.c./j, mais on a observé un nombre accru de follicules atrétiques, des changements morphologiques et une nécrose dans les ovocytes et les cellules de la granulosa ainsi qu’un nombre accru de cellules de la granulosa apoptotiques dans les ovaires à cette dose. La santé générale des animaux n’a pas été affectée (Sun et coll., 2016b).
Trois études alimentaires de 13 semaines chez le rat ont permis d’observer une hausse liée à la dose des calculs vésicaux, à des doses variant entre 63 mg/kg p.c./j et 1500 mg/kg p.c./j chez les 2 sexes, ainsi qu’une augmentation des dépôts calcaires dans les tubules proximaux des reins. La DMENO la plus faible était de 63 mg/kg p.c./j (plus faible dose d’essai) d’après les effets susmentionnés. La fréquence relative des calculs vésicaux chez les 2 sexes n’a pas changé lorsque les rats ont reçu une dose de 1500 mg/kg p.c./j de mélamine dans l’alimentation, que l’on ait ajouté ou non du chlorure d’ammonium à 1 % dans l’eau potable (US NTP, 1983; Melnick et coll., 1984). Deux études alimentaires de 36 semaines chez des rats mâles ayant reçu des doses de 110 mg/kg p.c./j à 1200 mg/kg p.c./j ont permis d’observer une augmentation liée à la dose de l’hyperplasie de l’épithélium de la vessie, une hausse non liée à la dose des calculs vésicaux, ainsi qu’une diminution de la prise de poids corporel à des doses de 430 mg/kg p.c./j et plus (Okumura et coll., 1992; Ogasawara et coll., 1995).
5.2.7 Prise en compte des sous-populations qui peuvent être plus vulnérables
Certains groupes de personnes vivant au Canada, en raison d’une vulnérabilité accrue, peuvent être plus susceptibles de subir des effets nocifs pour la santé découlant de l’exposition à des substances. Le potentiel de vulnérabilité à différentes étapes de la vie ou selon le sexe a été étudié à partir des études disponibles. Les données disponibles pour la mélamine comprennent des données sur la cinétique, la toxicité à court terme, la toxicité chronique, la toxicité pour la reproduction et le développement, la génotoxicité et la cancérogénicité obtenues avec des animaux de laboratoire. Des études épidémiologiques ont également été prises en compte. Dans le cadre de la présente évaluation des effets sur la santé, plusieurs études sur la mélamine ont été menées chez des animaux de laboratoire mâles et femelles. On a également tenu compte des effets neurologiques et sur le développement chez les jeunes, des effets sur la reproduction chez les mâles et les femelles ainsi que des effets chez les femelles enceintes dans le cadre d’études de toxicité pour le développement et la reproduction réalisées avec des animaux. Bien que l’effet critique sur la reproduction soit propre aux souris mâles, des effets chez les femelles ont été observés à une dose semblable dans une autre étude menée sur des souris. Ces facteurs ont été pris en compte dans la sélection des effets critiques sur la santé dans le cadre de la caractérisation des risques.
5.3 Caractérisation des risques pour la santé humaine
D’après les évaluations d’organismes internationaux (OMS, 2009; EFSA, 2010; CIRC, 2019) et les renseignements disponibles de l’ECHA (2022), les effets critiques associés à l’exposition à la mélamine sont la cancérogénicité, les effets sur l’appareil urinaire et la toxicité pour la reproduction.
Des études chez les rongeurs, en particulier les souris, ont révélé des effets sur l’appareil reproducteur. Pour caractériser les risques, on utilise une DMENO de toxicité pour la reproduction de 10 mg/kg p.c./j déterminée dans le cadre d’une étude de 28 jours par gavage chez la souris d’après les observations suivantes : nombre très réduit de spermatozoïdes, taux très élevé de spermatozoïdes anormaux, régulation négative de la protéine StAR et des enzymes synthétiques de la testostérone, baisse importante des taux sériques de testostérone, légères lésions présentes dans les testicules et nombre réduit de cellules de Leydig (Sun et coll., 2016).
Selon les données probantes disponibles, les effets sur l’appareil urinaire sont attribuables à la propension de la mélamine à former des calculs ou des cristaux dans les reins et/ou la vessie, et l’irritation causée par ces calculs entraîne d’autres effets, comme une hyperplasie réactive et des tumeurs de la vessie chez le rat.
D’après les renseignements disponibles, la mélamine n’est pas génotoxique et il existerait un mécanisme de seuil pour la cancérogénicité propre aux reins.
La dose repère à la limite de confiance inférieure pour un taux de réponse de 10 % (DRI10) de 35 mg/kg p.c./j calculée par l’OMS (2009) est fondée sur l’étude faisant état de la plus faible DMENO de néphrotoxicité (63 mg/kg p.c./j) et protège contre la formation de calculs ou de cristaux, étant donné que les tumeurs de la vessie apparaissaient à une dose de 263 mg/kg p.c./j de mélamine dans les études alimentaires à long terme chez le rat. Comme les tumeurs de la vessie semblent résulter d’une progression d’événements (hyperplasie, irritation, puis néoplasie de la vessie) liés à l’exposition orale à la mélamine, cette DRI protège également contre les événements précurseurs. On juge que la DMENO de toxicité pour la reproduction de 10 mg/kg p.c./j protège contre ces effets.
La population générale du Canada devrait principalement être exposée à la mélamine par l’utilisation de produits en mousse, comme les matelas, les meubles rembourrés, les ensembles de retenue pour bébés et enfants (dont les sièges d’appoint) et les produits pour enfants (comme les coussins angulaires pour lits de bébé et les chaises en mousse), l’utilisation de textiles, la migration depuis des articles en mélamine, l’utilisation de produits offerts aux consommateurs, dont les peintures, les produits d’étanchéité et les produits nettoyants pour surfaces de cuisson, ainsi que les sources alimentaires et environnementales (l’eau potable et la poussière).
Comme aucune étude de toxicité cutanée à doses répétées n’a été recensée, une DMENO de 10 mg/kg p.c./j provenant d’une étude orale a été utilisée pour caractériser les risques associés à l’exposition orale et cutanée à la mélamine.
Le tableau 5‑10 présente toutes les valeurs d’exposition pertinentes et la dose d’effet critique sur la santé pour la mélamine ainsi que les marges d’exposition (ME) résultantes pour la caractérisation des risques.
| Scénario | Exposition estimée (mg/kg p.c./j ou mg/kg p.c./événement)a | ME fondée sur la DMENOb de 10 mg/kg p.c./j |
|---|---|---|
| Exposition alimentaire et par les milieux de l’environnement pour un bébé de 0 à 5 mois (exposition la plus élevée) | 0,0020c | 5000 |
| Exposition alimentaire à partir d’articles en mélamine (d’après une plage de concentrations de migration mesurées à température ambiante) | 2,6 × 10-5 (19 ans et plus) à 0,552d (1 an) | 18 à 384 615 |
| Exposition alimentaire à partir d’articles en mélamine (d’après la concentration de migration « type » la plus élevée tirée des données de l’EFSA, 2010) | 0,037 (19 ans et plus) à 0,14d (1 an) | 71 à 270 |
| Exposition alimentaire à partir d’articles en mélamine et en bambou (d’après les concentrations de migration au 95e centile tirées de BfR, 2019) | 0,161 (19 ans et plus) à 1,08d (1 an) | 9 à 62 |
| Contact cutané causé par le fait de s’étendre sur un meuble rembourré ou un matelas contenant de la mousse (quotidien) (tous les groupes d’âge) | 0,06 à 2,3 | 4 à 164 |
| Contact cutané causé par le fait de s’asseoir dans un siège d’auto pour bébé ou enfant (dont les sièges d’appoint) (quotidien) (0 à 13 ans) | 0,034 à 0,16 | 63 à 1037 |
| Mâchonnement de produits en mousse (0 à 3 ans) | 2,55 × 10‑3 à 4,87 × 10‑2 | 205 à 3925 |
| Contact cutané causé par l’exposition à des textiles (0 à 5 mois) | 1,25 × 10-3 | 8000 |
| Mâchonnement de textiles (0 à 5 mois) | 7,79 × 10-5 | 128 370 |
| Contact cutané causé par l’utilisation de peinture pour pinceau ou rouleau (19 ans et plus) | 1,5 | 7 |
| Exposition cutanée et par inhalation à partir de l’utilisation de peinture en aérosol pour pistolet (19 ans et plus) | 3,7 | 2,7 |
| Contact cutané causé par l’utilisation d’un produit d’étanchéité (19 ans et plus) | 1,8 à 3,6 | 3 à 6 |
| Contact cutané causé par l’utilisation d’un produit nettoyant pour surfaces de cuisson (19 ans et plus) | 0,012 | 833 |
a Les estimations de l’exposition sont présentées sous forme de plages pour certains scénarios d’après les plages fournies dans les paramètres d’exposition.
b DMENO, dose minimale avec effet nocif observé, déterminée d’après la baisse du nombre de spermatozoïdes, la hausse des anomalies des spermatozoïdes, et la perturbation des tubules séminifères et de la synthèse de la testostérone observées lors d’une étude de 28 jours chez la souris (Sun et coll., 2016a). ME cible = 1000 (×10 pour l’extrapolation interspécifique; ×10 pour la variation intraspécifique; ×10 pour l’utilisation d’une DMENO, compte tenu de la gravité de l’effet).
c Il s’agit de la valeur maximale fondée sur les valeurs d’absorption maximale présentées dans le tableau C-1 de l’annexe C.
d La plage des estimations est tirée du tableau 5‑4.
Une comparaison des doses d’effet critique et des estimations de l’exposition à la mélamine à partir des milieux de l’environnement, des aliments et des textiles donne des ME qui sont jugées adéquates (c'est-à-dire supérieures à 1000) pour tenir compte des incertitudes liées aux bases de données sur l’exposition et les effets sur la santé utilisées pour caractériser les risques (tableau 5‑10).
Les ME calculées à partir de l’utilisation d’articles en mélamine et en bambou pour déterminer l’exposition prolongée à des produits en mousse (comme les matelas, les meubles rembourrés et les ensembles de retenue pour bébés et enfants, dont les sièges d’appoint) pour tous les groupes d’âge ainsi que celles calculées à partir de l’utilisation de produits offerts aux consommateurs (comme les peintures, les produits d’étanchéité et les produits nettoyants pour surfaces de cuisson) (tableau 5‑10) sont jugées inadéquates (c'est-à-dire inférieures à 1000) pour tenir compte des incertitudes liées aux bases de données sur l’exposition et les effets sur la santé utilisées pour caractériser les risques.
L’exposition systémique quotidienne a aussi été estimée par dosimétrie inverse à partir de plusieurs études de biosurveillance (Panuwet et coll., 2012; Sathyanarayana et coll., 2019; Melough et coll., 2022; Choi et coll., 2022) dans le cadre desquelles les concentrations de mélamine ont été mesurées dans des échantillons ponctuels d’urine (tableau 5‑9). L’absorption tirée des données de biosurveillance permet d’estimer l’exposition à partir de l’ensemble des voies et sources potentielles (NRC, 2006). Les estimations de l’exposition systémique quotidienne fondées sur les concentrations moyennes géométriques de mélamine allaient de 6 × 10‑5 mg/kg p.c./j pour les femmes enceintes à 4,74 × 10‑3 mg/kg p.c./j pour les enfants âgés de 4 mois à 8 ans. Les estimations maximales de l’exposition systémique quotidienne fondées sur les concentrations maximales ou au 95e centile de mélamine allaient de 3 × 10‑4 mg/kg p.c./j pour les enfants âgés de 6 à 11 ans à 0,185 mg/kg p.c./j pour ceux âgés de 4 mois à 8 ans. Ces valeurs d’absorption se situent dans la plage des estimations modélisées de l’exposition et soutiennent la conclusion selon laquelle les ME peuvent être inadéquates, en particulier pour les jeunes enfants.
L’évaluation des effets sur la santé humaine a tenu compte des groupes de personnes de la population canadienne qui, en raison d’une vulnérabilité accrue ou d’une plus grande exposition, peuvent être plus susceptibles de subir des effets nocifs pour la santé découlant de l’exposition à des substances. Le potentiel d’une vulnérabilité accrue durant le développement et la reproduction a été évalué, et l’exposition selon l’âge a été estimée. De façon générale, les bébés et les enfants sont davantage exposés que les adultes. Toutes ces populations ont été prises en considération lors de l’évaluation des dangers potentiels pour la santé humaine.
5.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Incidence |
|---|---|
| Il n’existe aucune donnée canadienne sur les concentrations dans l’eau potable, le lait maternel, la poussière ou le sol. Les données américaines ont servi à estimer l’absorption quotidienne à partir de l’eau potable, du lait maternel et de la poussière. Les données chinoises ont servi à estimer l’absorption quotidienne à partir du sol. Des concentrations moyennes et/ou maximales ont été utilisées. | +/- |
| Les données canadiennes sur les concentrations dans les aliments ont été utilisées pour estimer l’exposition alimentaire. Certaines enquêtes sur les aliments avaient des limites de détection élevées ou se concentraient sur les aliments les plus susceptibles de contenir de la mélamine. Lorsqu’il manquait des données pour des aliments de certaines catégories alimentaires, des produits de substitution ont été utilisés pour faire une estimation prudente. | +/- |
| L’hypothèse selon laquelle tous les aliments et toutes les boissons entrent en contact avec des articles en mélamine ou en bambou. | + |
| La détermination de l’absorption de mélamine pour les sujets âgés de 4 mois à plus de 60 ans est fondée sur des échantillons d’urine prélevés dans une population non canadienne (États-Unis) utilisée comme substitut pour la population canadienne. | +/- |
| L’incertitude associée à la source de mélamine mesurée dans l’urine. La présence de mélamine peut être attribuable à une exposition directe à la mélamine ou à d’autres sources, comme le métabolisme ou la dégradation du pesticide cyromazine ou d’autres ignifuges à base de mélamine. | + |
| L’hypothèse selon laquelle les concentrations de mélamine dans l’urine humaine représentent un taux d’excrétion de 50 % de l’absorption quotidienne (en raison du manque de données toxicocinétiques chez les humains). | +/- |
| Il y a peu d’études sur les dangers associés à l’exposition par voie cutanée et par inhalation. | +/- |
| Il manque de données sur l’absorption cutanée pour la mélamine. | +/- |
| Il manque de données empiriques sur la relation entre le taux de migration de la mélamine à partir de la mousse et sa concentration dans la mousse. | +/- |
| L’hypothèse selon laquelle le taux de migration demeure constant au fil du temps. | +/- |
| On ne connaît pas l’ampleur de l’effet de divers revêtements textiles sur la migration de la mélamine à partir de la mousse de polyuréthane. | +/- |
| L’hypothèse selon laquelle la mousse de polyuréthane est recouverte lors de l’estimation de l’exposition cutanée due à un contact avec la mousse. | - |
| Aucun facteur de contact avec la peau (FCP) propre à la mélamine n’a été recensé. On a présumé d’un facteur de 1. | + |
| Il existe peu de données toxicologiques et sur le nombre de cas d’exposition combinée à la mélamine et à l’acide cyanurique, et sur les effets toxicologiques synergiques possibles. | +/- |
+ = incertitude pouvant entraîner une surestimation de l’exposition ou du risque; - = incertitude pouvant entraîner une sous-estimation de l’exposition ou du risque; +/- = potentiel inconnu de surestimation ou de sous-estimation du risque.
Références
ACD/Percepta. 2005. Prediction Module. Toronto (ON): Advanced Chemistry Development. [Cité le 4 novembre 2013]. (Disponible en anglais seulement.)
[ACIA] Agence canadienne d'inspection des aliments. 2010. Résidus de mélamine dans le lait de consommation, les produits à base de lait et les produits à base de soja de 2009 à 2010. Résumé accessible au : 2009-2010 Résidus de mélamine dans le lait de consommation, les produits à base de lait et les produits à base de soja – Agence canadienne d'inspection des aliments (canada.ca). Rapport complet disponible sur demande à l’ACIA.
[ACIA] Agence canadienne d'inspection des aliments. 2011. Mélamine dans les produits à base de lait et à base de soja 2010 to 2011. Résumé accessible au : 2010-2011 Mélamine dans les produits à base de lait et à base de soja – Agence canadienne d'inspection des aliments (canada.ca). Rapport complet disponible sur demande à l’ACIA.
[ACIA] Agence canadienne d'inspection des aliments. 2012a. Mélamine dans des aliments sélectionnés de 2011 à 2012. Résumé accessible au : 2011-2012 Mélamine dans des aliments sélectionnés – Agence canadienne d'inspection des aliments (canada.ca). Rapport complet disponible sur demande à l’ACIA.
[ACIA] Agence canadienne d'inspection des aliments. 2012b. Rapport annuel du Programme national de surveillance des résidus chimiques 2010-2012. Résumé accessible au : Rapport annuel du Programme national de surveillance des résidus chimiques 2010-2012 – Agence canadienne d'inspection des aliments (canada.ca). Rapport complet disponible sur demande à l’ACIA.
[ACIA] Agence canadienne d'inspection des aliments. 2013. Rapport annuel du Programme national de surveillance des résidus chimiques 2012-2013. Résumé accessible au : Rapport annuel du Programme national de surveillance des résidus chimiques 2012-2013 – Agence canadienne d'inspection des aliments (canada.ca). Rapport complet disponible sur demande à l’ACIA.
[ACIA] Agence canadienne d'inspection des aliments. 2014. Programme national de surveillance des résidus chimiques - Rapport annuel 2013-2014. Résumé accessible au : Programme national de surveillance des résidus chimiques 2013-2014 – Agence canadienne d'inspection des aliments (canada.ca). Rapport complet disponible sur demande à l’ACIA.
[ACIA] Agence canadienne d'inspection des aliments. 2019. Projet sur les aliments destinés aux enfants – Rapport annuel 2019. Résumé accessible au : Projet sur les aliments destinés aux enfants – Rapport annuel 2019 – Agence canadienne d'inspection des aliments (canada.ca). Rapport complet disponible sur demande à l’ACIA.
Ademola JI, Sedik LE, Wester RC, Maibach HI. 1993. In vitro percutaneous absorption and metabolism in man of 2-chloro-4-ethylamino-6-isopropylamine-s-triazine (Atrazine). Arch Toxicol. 67:85-91. (Disponible en anglais seulement.)
American Cyanamid Co. 1955. Melamine: acute and chronic toxicity. Rapport 55-21, données inédites. [Cité dans OCDE, 2002]. (Disponible en anglais seulement.)
American Cyanamid Co. 1981. Données inédites. Numéro d’étude : étude Raltech no 81560. [Cité dans OCDE, 2002]. (Disponible en anglais seulement.)
American Cyanamid Co. 1982a. Données inédites. Rapport no PH 319-AC-002-82. Date du rapport : 1982-05-20. [Cité dans OCDE, 2002]. (Disponible en anglais seulement.)
American Cyanamid Co. 1982b. Données inédites. Numéro de rapport : étude no PH 311-AC-002-82. [Cité dans OCDE, 2002]. (Disponible en anglais seulement.)
American Cyanamid Co. 1984. Étude. [Cité dans U.S. EPA, 1984]. (Disponible en anglais seulement.)
An L, Li Z, Yang Z, Zhang T. 2011. Cognitive deficits induced by melamine in rats. Cognitive deficits induced by melamine in rats . Toxicol Lett. 206:276-280. (Disponible en anglais seulement.)
Arcus-Arth A, Krowech G, Zeise L. 2005. Breast milk and lipid intake distributions for assessing cumulative exposure and risk. J Expo Sci Environ Epidemiol 15:357-365. (Disponible en anglais seulement.)
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2020a. Cyromazine et préparations commerciales connexes : Document de consultation. PRVD2020-02. No de catalogue H113-27/2020-2F-PDF. Ottawa (Ont.), Santé Canada
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2020b. Chlorothalonil et préparations commerciales connexes, employés comme agent de préservation dans les peintures : Document de consultation. PRVD2020-06. No de catalogue H113-27/2020-6F-PDF. Ottawa (Ont), Santé Canada.
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2021. Cyromazine et préparations commerciales connexes : Décision finale. PRVD2021-08. No de catalogue H113-28/2021-8F-PDF. Ottawa (Ont.), Santé Canada.
Aylward LL, Kirman CR, Adgate JL, McKenzie LM, Hays SM. 2012. Interpreting variability in population biomonitoring data: Role of elimination kinetics. J Expo Sci Environ Epidemiol. 22:398-408. (Disponible en anglais seulement.)
Aylward LL, Hays SM, Venzina A, Deveau M, St-Amand A, Nong A. 2015. Biomonitoring equivalents for interpretation of urinary fluoride. Regul Toxicol Pharmacol. 72(1):158-167. (Disponible en anglais seulement.)
Baynes RE, Smith G, Mason SE, Barrett E, Barlow BM, Riviere JE. 2008. Pharmacokinetics of melamine in pigs following intravenous administration. Food Chem Toxicol. 46:1196–1200. (Disponible en anglais seulement.)
[BDIPSN] Base de données d'ingrédients de produits de santé naturels [base de données]. [Modifiée le 9 avril 2022]. Ottawa (Ont.), gouvernement du Canada. [Consultée en juillet 2022].
[BDPP] Base de données sur les produits pharmaceutiques [Base de données]. [Modifiée le 10 mars 2022]. Ottawa (Ont.), gouvernement du Canada. [Consultée en juillet 2022].
[BDPSNH] Base de données des produits de santé naturels homologués [BDPSNH]. [Modifiée le 8 septembre 2021]. Ottawa (Ont.), gouvernement du Canada. [Consultée en juillet 2022].
[BfR] Bundesinstitut für Risikobewertung [Institut fédéral de l’évaluation des risques de l’Allemagne]. 2007. Introduction to the problems surrounding garment textiles. BfR, information no 018/2007, 1er juin 2007. Disponible sur demande. (Disponible en anglais seulement.)
[BfR] Bundesinstitut für Risikobewertung [Institut fédéral de l’évaluation des risques de l’Allemagne 2012. Introduction to the problems surrounding garment textiles. BfR, information no 041/2012, 6 juin 2012. (Disponible en anglais seulement.)
[BfR] Bundesinstitut für Risikobewertung [Institut fédéral de l’évaluation des risques de l’Allemagne]. 2019. Fillable articles made from melamine formaldehyde resin, such as coffee-to-go cups sold as ‘bambooware’, may leak harmful substances into hot foods . BfR, opinion no 046/2019 publiée le 25 novembre 2020. (Disponible en anglais seulement.)
Bradley EL, Castle L, Day JS, Ebner I, Ehlert K, Helling R, Koster S, Leak J, Pfaff K. 2010. Comparison of the migration of melamine from melamine-formaldehyde plastic (“melaware”) into various food simulants and foods themselves . Food Addit Contam Part A Chem Anal Control Expos Risk Assess. 27(12):1755-1764. (Disponible en anglais seulement.)
Bradley EL., Castle L., Day JS, Leak J. 2011. Migration of melamine from can coatings cross-linked with melamine-based resins, into food simulants and foods. Food Addit Contam Part A Chem Anal Control Expo Risk Assess. 28(2):243-250. (Disponible en anglais seulement.)
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33, Gazette du Canada, Partie III, vol. 22, no 3.
Canada, Ministère de l’Environnement. 2013. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances ignifuges organiques. Gazette du Canada, partie I, vol. 147, no 13, p.613–633.
[CCA] Commission du Codex Alimentarius. 2010a. Avant-projet de niveaux maximaux pour la mélamine dans les aliments et aliments pour animaux (N13-2009), 4ème session du Comité du Codex sur les contaminants dans les aliments (CCCF); Izmir (Turquie), 26-30 avril 2010; Point 5 de l’ordre du jour, CX/CF 10/4/5.
[CCA] Commission du Codex Alimentarius. 2010b. Rapport de la Trente-troisième session du Programme mixte FAO/OMS sur les normes alimentaires de la Commission du Codex Alimentarius. ALINORM 10/33/REP. Centre de conférence international, Genève (Suisse), 5-9 juillet 2010
[CCA] Commission du Codex Alimentarius. 2012. Rapport de la Trente-cinquième session du Programme mixte FAO/OMS sur les normes alimentaires de la Commission du Codex Alimentarius. REP12/CAC. Siège de la FAO, Rome (Italie), 2-7 juillet 2012.
[CCA] Commission du Codex Alimentarius. 2019. Norme générale pour les contaminants et les toxines présents dans les produits de consommation humaine et animale. CXS 193-1995. Adoptée en 1995, Dernière modification en 2023.
Chang L, She R, Ma L, You H, Hu F, Wang T, Ding X, Guo Z, Soomro MH. 2014. Acute testicular toxicity induced by melamine alone or a mixture of melamine and cyanuric acid in mice. Reprod Toxicol. Doi: 10.1016/j.reprotox.2014.02.008 (Disponible en anglais seulement.)
Chen S, Yang W, Zhang X, Jin J, Liang C, Wang J, Zhang J. 2021. Melamine induces reproductive dysfunction via down-regulated the phosphorylation of p38 and downstream transcription factors Max and Sap1a in mice testes. Sci Total Environ. 770:144727. Doi: 10.1016/j.scitotenv.2020.144727 (Disponible en anglais seulement.)
Chien CY, Wu CF, Liu CC, Chen BH, Huang SP, Chou YH, Chang AW, Lee HH, Pan CH, Wu Wj. et coll. 2011. High melamine migration in daily-use melamine-made tableware . J Hazard Mater. 188:350-356. (Disponible en anglais seulement.)
Chik Z, Mohamad Haron DE, Ahmad ED, Taha H, Mustafa AM. 2011. Analysis of melamine migration from melamine food contact articles. Food Addit Contam Part A Chem Anal Control Expo Risk Assess. 28(7):967-973. (Disponible en anglais seulement.)
Choi G, Kuiper JR, Bennett DH et coll. 2022. Exposure to melamine and its derivatives and aromatic amines among pregnant women in the United States: The ECHO Program . Chemosphere. 307(Pt2) : 135599 (Disponible en anglais seulement.)
Chu CY, Chu KO, Ho CS, Kwok SS, Chan HM, Fung KP, Wang CC. 2013. Melamine in prenatal and postnatal organs in rats. Reprod Toxicol. 35:40-47. (Disponible en anglais seulement.)
[CIPR] Commission internationale de protection radiologique. 2003. Basic anatomical and physiological data for use in radiological protection: Reference values. ICRP Publication 89. Ann. ICRP 32(3-4). (Disponible en anglais seulement.)
[CIRC] Centre international de recherche sur le cancer. 1999. Melamine. In: Some chemicals that cause tumours of the kidney or urinary bladder in rodents and some other substances. IARC Monogr Eval Carcinog Risks Hum. 73:329–338. (Disponible en anglais seulement.)
[CIRC] Centre international de recherche sur le cancer. 2019. Melamine. In: Some chemicals that cause tumours of the urinary tract in rodents. IARC Monogr Eval Carcinog Risks Hum. 119:115–172. (Disponible en anglais seulement.)
[ConsExpo Web] Consumer Exposure Web Model. 2021. Bilthoven (NL): Rijksinstituut voor Volksgezondhehristopher en Milieu [Institut national de la santé publique et de l’environnement]. (Disponible en anglais seulement.)
[CPID] Consumer Products Information Database. C2001-2022. Search results for melamine, formaldehyde, sodium bisulfite polymer. McLean (VA): DeLima Associates. [Consulté le 28 juin 2022]. (Disponible en anglais seulement.)
[CPSAC] Child Passenger Safety Association of Canada. 2019. Provincial & Territorial Legislation Summary [PDF]. [Consulté en août 2023]. (Disponible en anglais seulement.)
Crews GM, Ripperger W, Kersebohm DB, Guthner T, Mertschenk B. 2012. Melamine and Guanamines. In: Ullmann’s Encyclopedia of Industrial Chemistry. Vol. 22. Weinheim (DE): Wiley-VCH Verlag GmbH & Co. KgaA. p. 377-392. (Disponible en anglais seulement.)
Cruywagen CW, van de Vyver WF, Stander MA. 2011. Quantification of melamine absorption, distribution to tissues, and excretion by sheep . J Anim Sci. 89(7):2164-9. Doi: 10.2527/jas.2010-3531. Publié électroniquement le 4 février 2011. PMID: 21297066. (Disponible en anglais seulement.)
Dorne JL, Doerge DR, Vandenbroeck M, Fink-Gremmels J, Mennes Knutsen W, Vernazza F, Castle L, Edler L, Benford D. 2013. Recent advances in the risk assessment of melamine and cyanuric acid in animal feed. Toxicol Appl Pharmacol. 370:218-229. (Disponible en anglais seulement.)
Driver J, Ross J, Mihlan G, Lunchick C and Landenberger B. 2007. Derivation of single layer clothing penetration factors from the pesticide handlers exposure database . Regul Toxicol Pharmacol. 49(2): 125-37. (Disponible en anglais seulement.)
[DSM] Royal DSM N.V. 2010. Life sciences and materials sciences: Staying the course. Annual Report 2009. Heerlen (NL): Royal DSM N.V. 196 pp. (Disponible en anglais seulement.)
Duan X, Dai X-X, Wang T, Liu H-L, Sun S-C. 2015. Melamine negatively affects oocyte architecture, oocyte development and fertility in mice . Hum Reprod. 30:1643-1652. (Disponible en anglais seulement.)
Ebner I, Haberer S, Sander S, Kappenstein O, Luch A, Bruhn T. 2020. Release of melamine and formaldehyde from melamine-formaldehyde plastic kitchenware . Molecules. 25(16):3629. (Disponible en anglais seulement.)
[ECCC] Environnement et Changement climatique Canada. 2013-2014. Données sur le Groupe de certaines substances ignifuges organiques, recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances ignifuges organiques. Données préparées par Environnement et Changement climatique Canada et Santé Canada dans le cadre du Programme des substances existantes.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2020. Mise à jour de l’ébauche d’évaluation préalable : Groupe de certaines substances ignifuges organiques 1,3,5-Triazine-2,4,6-triamine (Mélamine); no de registre du Chemical Abstracts Service 108-78-1. Ottawa (Ont.), gouvernement du Canada. 113 p.
[ECHA] Agence européenne des produits chimiques. c2007-2022. Base de données sur les substances enregistrées. Résultats de recherche pour le no CAS 108-78-1. Helsinki (FI) : ECHA. [Citée le 14 mars 2022].
[ECHA] Agence européenne des produits chimiques. 2018. Screening report: An assessment of whether the use of TCEP, TCPP and TDCP in articles should be restricted. Version 3. Helsinki (FI) : Agence européenne des produits chimiques. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. 2020. Committee for Risk Assessment (RAC) Opinion proposing harmonised classification and labelling at EU level of Melamine. No EC 203-615-4. No CAS 108-78-1. CLH-O-0000006932-69-01/F. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. 2022. Inventaire C&L; Résultats de recherche pour le no CAS 108-78-1. Helsinki (FI) : ECHA. [Consulté en mars 2022].
Ecology Center. 2015. Hidden passengers: Chemical hazards in children’s car seats . A technical report by Healthystuff.org. The Ecology Center, juin 2015. Ann Arbor (MI), États-Unis. 24 pp. (Disponible en anglais seulement.)
[EFRA] European Flame Retardants Association. 2007. Flame retardants; Frequently asked questions. Bruxelles (BE) : EFRA. 37 pp. [Cité le 19 juin 2014]. Le lien n’est plus accessible.
[EFSA] Autorité européenne de sécurité des aliments. 2010. Scientific Opinion on Melamine in Food and Feed. EFSA Journal 8(4):1573 . 145 pp. doi:10.2903/j. efsa.2010.1573. Owner company: EFSA Panel on Contaminants in the Food Chain (CONTAM) and EFSA Panel on Food Contact Materials, Enzymes, Flavourings and Processing Aids (CEF). (Disponible en anglais seulement.)
Elmore E, Fitzgerald MP. 1990. Evaluation of the bioluminescence assays as screens for genotoxic chemicals. Mutation and the Environment, Part D: 379-387. Laboratoire d’essai : Microbics Corporation, Carlsbad, Californie. (Disponible en anglais seulement.)
[EPA du Danemark] Agence de protection de l’environnement du Danemark. 2015. Chemical substances in car safety seats and other textile products for children. Survey of chemical substances in consumer products No. 135. Ministère danois de l’Environnement. (Disponible en anglais seulement.)
[EPI Suite] Estimation Programs Interface Suite for Microsoft Windows [modèle d’estimation]. 2012. Version 4.1. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2015. Weiman Cook Top Cream. Weiman Products. (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2019. 42-7XI SPEEDHIDE INTERIOR LATEX - FIRE RETARDANT FLAT WHITE. Longueuil (Qc). PPG Architectural Coatings Canada, Inc. (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2022. 3M Fire Barrier Watertight Sealant 3000 WT. 3M Company [Internet]. (Disponible en anglais seulement.)
[FT] Fiche technique. 2013. 3M Fire Barrier Watertight Sealant 3000 WT. 3M Company [Internet]. (Disponible en anglais seulement.)
[FT] Fiche technique. 2020. SPEEDHIDE® Interior Fire Retardant Latex Flat. PPG [Internet]. (Disponible en anglais seulement.)
Galloway SM, Armstrong MJ, Reuben C, Colman S, Brown B, Cannon C, Bloom AD, Nakamura F, Ahmed M, Duk S et coll. 1987. Chromosome aberrations and sister chromatid exchange in Chinese hamster ovary cells: evaluation of 108 chemicals. Environmental and Molecular Mutagenesis 10(Suppl.10):1-175. (Disponible en anglais seulement.)
Gossner CM-E, Schlundt J, Ben Embarek P, Hird S, Lo-Fo-Wong D, Beltran JJO et coll. 2009. The melamine incident: implications for international food and feed safety. Environ Health Perspect. 117(12):1803–8. (Disponible en anglais seulement.)
Grosse Y, Loomis D, Guyton KZ, El Ghissassi F, Bouvard V, Benbrahim-Tallaa L, Mattock H, Straif K. (au nom du Groupe de travail du CIRC sur les monographies). 2017. Some chemicals that cause tumours of the urinary tract in rodents . Lancet Oncol. 18(8):1003-1004. (Disponible en anglais seulement.)
Haghi E, Shakoori A, Alimohammad M, Razeghi F, Sadighara P. 2019. Melamine migration measurement through spectrophotometry device and the effect of time and tableware type on it. Interdiscip Toxicol. 12(4):163–168. (Disponible en anglais seulement.)
Hansch C, Leo A, Hoekman D. 1995. Exploring QSAR: Hydrophobic, Electronic, and Steric Constants, Washington (DC): American Chemical Society. (Disponible en anglais seulement.)
Hard GC, Flake GP, Sills RC. 2009. Re-evaluation of kidney histopathology from 13-week toxicity and two-year carcinogenicity studies of melamine in the F344 rat: morphologic evidence of retrograde nephropathy. Vet Pathol. 46:1248-1257. (Disponible en anglais seulement.)
Haworth S, Lawlor T, Mortelmans K, Speck W, Zeiger E. 1983. Salmonella mutagenicity test results for 250 chemicals. Env. Mutagen. (Suppl. 1):3-142. Laboratoire d’essai : Case Western Reserve University. (Disponible en anglais seulement.)
Hazleton Laboratories. 1983. Rapport Raltech pour l’American Cyanamid Company, 2-Year chronic feeding study of melamine in Fisher 344 rats. Données inédites. [Cité dans OCDE, 2002]. (Disponible en anglais seulement.)
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [Estimation Model] . 2011. Version 3.20. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [Cité le 5 novembre 2013]. (Disponible en anglais seulement.)
Hilts C, Pelletier L. 2009. Background paper on the occurrence of melamine in foods and feed. Bureau d'innocuité des produits chimiques, Direction des aliments, Direction générale des produits de santé et des aliments, Santé Canada, Ottawa (Ont.), Canada. Préparé pour WHO Expert Meeting on Toxicological and Health Aspects of Melamine and Cyanuric Acid. Genève (Suisse). 2009. (Disponible en anglais seulement.)
Hirt RC, Steger JE, Simard GL. 1960. Vapour Pressure of 2,4,6-Triamino-s-Triazine (Melamine). J Polym Sci. 43:319-323. (Disponible en anglais seulement.)
Ishiwata H, Sugita T, Kozaki M, Maekawa A. 1991. Inhibitory effects of melamine on the growth and physiological activities of some microorganisms. J Food Hyg Soc. Japan 32:408-413. (Disponible en anglais seulement.)
Jacob CC, Von Tungeln LS, Vanlandingham M, Beland FA, Gamboa da Costa G. 2012. Pharmacokinetics of Melamine and Cyanuric Acid and Their Combinations in F344 Rats. Toxicol Sci. 126(2):317-324. (Disponible en anglais seulement.)
[JMPR] Réunion conjointe FAO/OMS sur la gestion des pesticides dans les aliments et l'environnement. 2006. Toxicological Monograph for Cyromazine. Rome (Italie). Octobre 2006. International Program on Chemical Safety. DACO 12.5.4 (Disponible en anglais seulement.)
Khalil SR, Awad A, Ali SA. 2017. Melamine and/or formaldehyde exposures affect steroidogenesis via alteration of StAR protein and testosterone synthetic enzyme expression in male mice. Environ Toxicol and Pharmacol. 50:136–144. (Disponible en anglais seulement.)
Kim SH, Lee IC, Lim JH, Shin IS, Moon C, Kim SH, Park SC, Kim HC, Kim JCl. 2011. Effects of melamine on pregnant dams and embryo-fetal development in rats . J Appl Toxicol. 31:506-514. (Disponible en anglais seulement.)
[KOAWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2010. Version 1.10. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [Cité le 5 novembre 2013]. (Disponible en anglais seulement.)
[KOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d’estimation]. 2010. Version 2.00. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [Cité le 5 novembre 2013]. (Disponible en anglais seulement.)
Kong APS, Choi KC, Ho CS, Chan MHM, Wong CK, Liu EKH, Chu WCW, Chow VCY, Lau JTF, Chan JCN. 2011. Hong Kong Chinese school children with elevated urine melamine levels: A prospective follow up study. BMC Public Health 11:354-358. (Disponible en anglais seulement.)
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d’estimation] . 2010. Version 1.68. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [Cité le 5 novembre 2013]. (Disponible en anglais seulement.)
Lipschitz WL, Stokey E. 1945. The mode of action of three new diuretics: melamine, adenine and formoguanamine. J Pharmacol Exp Ther. 83:235-249. (Disponible en anglais seulement.)
Litton Bionetics. 1977a. Mutagenicity evaluation of melamine. Données inédites. Numéro de rapport : projet LBI no 2838. [Cité dans OCDE, 2002]. (Disponible en anglais seulement.)
Litton Bionetics. 1977b. Données inédites. [Cité dans OCDE, 2002]. (Disponible en anglais seulement.)
Litton Bionetics. 1977c. Mutagenicity evaluation of melamine. Données inédites. Numéro de rapport : projet LBI no 2838. [Cité dans OCDE, 2002]. (Disponible en anglais seulement.)
Liu C-C, Wu C-F, Chen BH, Huang SP, Goggins W, Lee HH, Chou YH, Wu WJ, Huang CH, Shiea J et coll. 2011. Low exposure to melamine increases the risk of urolithiasis in adults . Kidney Int. 80:746-752. (Disponible en anglais seulement.)
Liu G, Li S, Jia J, Yu C, He J, Yu C, Zhu J. 2010. Pharmacokinetic study of melamine in rhesus monkey after a single oral administration of a tolerable daily intake dose . Regul Toxicol. Pharmacil. 56:193-196. (Disponible en anglais seulement.)
Lu Y, Xia Y, Liu G, Pan M, Li M, Lee NA, Wang S. 2017. A review of methods for detecting melamine in food samples. Crit Rev Anal Chem. 47(1):51-66. (Disponible en anglais seulement.)
Lund KH, Petersen JH. 2006. Migration of formaldehyde and melamine monomers from kitchen- and tableware made of melamine plastic. Food Addit Contam. 23(9):948-955. (Disponible en anglais seulement.)
Lynch RA, Hollen H, Johnson DL, Bartels J. 2015. The effects of pH on the migration of melamine from children’s bowls . Int J Food Contam. 2:9. DOI 10.1186/s40550-015-0017-z (Disponible en anglais seulement.)
Magami SM, Oldring PKT, Castle L, Guthrie JT. 2015. Migration of melamine from thermally cured, amino cross-linked can coatings into an aqueous ethanol food simulant: aspects of hydrolysis, relative reactivity, and migration . Food Addit Contam Part A. 32(3):403-409. (Disponible en anglais seulement.)
Malveda M, Zhang V. 2020. Chemical Economics Handbook, Melamine, 2020 version. . Source: S&P Global Commodity Insights @2024 by S&P Global Inc. (Disponible en anglais seulement.)
Mannoni V, Padula G, Panico O, Maggio A, Arena C, Milana MR. 2017. Migration of formaldehyde and melamine from melaware and other amino resin tableware in real life service. Food Addit Contam Part A. 34(1):113-125. (Disponible en anglais seulement.)
Mast RW, Friedman MA, Finch RA. 1982a. Mutagenicity testing of melamine. Toxicologist 2:172 (Abstract No. 602). (Disponible en anglais seulement.)
Mast RW, Naismith RW, Friedman MA. 1982b. Mouse micronucleus assay of melamine. Environ Mutagen. 4:340-341 (Abstract No. Bi-8). (Disponible en anglais seulement.)
Mast RW, Jeffcoat AR, Sadler BM, Kraska RC, Friedman MA. 1983. Metabolism, disposition, and excretion of [14C]melamine in male Fischer 344 rats. Food Chem Toxicol. 21(6):807-810. (Disponible en anglais seulement.)
Matz CJ, Stieb DM, Davis K, Egyed M, Rose A, Chou B, Brion O. 2014. Effects of age, season, gender, and urban-rural status on time-activity: Canadian Human Activity Pattern Survey 2 (CHAPS 2) . Int J Environ Res Public Health 11:2108-2124. (Disponible en anglais seulement.)
McGregor DB, Brown A, Cattanach P, Edwards I, McBride D, Riach C, Caspary WJ. 1988. Responses of the L5178Y tk+/tk mouse lymphoma cell forward mutation assay: III. 72 coded chemicals. Environ Mol Mutagen. 12:85-154. (Disponible en anglais seulement.)
Melnick RL, Boorman GA, Haseman JK, Montali RJ, Huff J. 1984. Urolithiasis and bladder carcinogenicity of melamine in rodents. Toxicol Appl Pharmacol. 72:292-303. (Disponible en anglais seulement.)
Melough MM, Day DB, Fretts AM, Wang S, Flynn JT, de Boer IH, Zhu H, Kannan K, Sathyanarayana S. 2022. Associations of Dietary Intake with Urinary Melamine and Derivative Concentrations among Children in the GAPPS Cohort. Int. J. Environ.Res. Public Health. 19(9), 4964. (Disponible en anglais seulement.)
Mirsalis J, Tyson K, Beck J, Loh F, Steinmetz K, Contreras C, Austere L, Martin S, Spalding J. 1983. Induction of unscheduled DNA synthesis (UDS) in hepatocytes following in vivo and in vivo treatment. Environmental Mutagenesis 5: 482; Abstract no. Ef-5 in Abstracts of the Environmental Mutagen Society, San Antonio (Texas). 3 au 6 mars 1983. (Disponible en anglais seulement.)
[MPBPVP] Melting Point Boiling Point Program for Microsoft Windows [modèle d’estimation]. 2010. Version 1.43. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement.)
Nascimento CF, Santos PM, Pereira-Filho ER, Rocha FRP. 2017. Recent advances on determination of milk adulterants. Food Chemistry 221:1232-1244. (Disponible en anglais seulement.)
Neithardt AB, Dooley SL, Borensztajn J. 2002. Prediction of 24-hour protein excretion in pregnancy with a single voided urine protein-to-creatinine ratio. Am J Obstet Gynecol. 186:883-886. (Disponible en anglais seulement.)
Norris B, Smith S. 2002. Research into the mouthing behaviour of children up to 5 years old. London, England: Consumer and Competition Policy Directorate, Department of Trade and Industry, Londres (R.-U.). [Cité dans U.S. EPA, 2011]. (Disponible en anglais seulement.)
[NRC] National Research Council des États-Unis. 2006. Human biomonitoring for environmental chemicals. Washington (DC): The National Academies Press. (Disponible en anglais seulement.)
[OCDE] Organisation de cooperation et développement économiques. 2002. SIDS Initial Assessment Report for: Melamine; CAS RN 108-78-1. SIDS Initial Assessment Meeting 8; octobre 1998. (Disponible en anglais seulement.)
Ogasawara H, Imaida K, Ishiwata H, Toyoda K, Kawanishi T, Uneyama C, Hayashi S, Takahashi M, Hayashi Y. 1995. Urinary bladder carcinogenesis induced by melamine in F344 male rats: correlation between carcinogenicity and urolith formation. Carcinogenesis. 16:2773-2777. (Disponible en anglais seulement.)
Okumura M, Hasegawa R, Shirai T, Ito M, Yamada S, Fukushima S. 1992. Relationship between calculus formation and carcinogenesis in the urinary bladder of rats administered the non-genotoxic agents, thymine, or melamine. Carcinogenesis. 13:1043-1045. (Disponible en anglais seulement.)
[OMS] Organisation mondiale de la Santé. 2009. Toxicological and Health Aspects of Melamine and Cyanuric Acid. Rapport d’une réunion d’experts de l’OMS en collaboration avec la FAO (Organisation des Nations Unies pour l’alimentation et l’agriculture). Appuyé par Santé Canada. 66 p. (Disponible en anglais seulement.)
Pang J, Li G-Q, Li C-R, Yang X-Y, Lu X, Hu X-X, Zhai Q-Q, Zhang W-X, Jiang J-D, You X-F. 2013. Toxicokinetic study of melamine in the presence and absence of cyanuric acid in rats. J Appl Toxicol. 33:444-450. (Disponible en anglais seulement.)
Panuwet P, Nguyen JV, Wade EL, D’Souza PE, Ryan PB, Barr DB. 2012. Quantification of melamine in human urine using cation-exchange based high performance liquid chromatography tandem mass spectrometry. J Chromatogr. B 887-888:48-54. (Disponible en anglais seulement.)
Pharmakon Research. 1981. Genetic toxicology - Micronucleus test. Rapport pour l’American Cyanamid Company, étude no PH 309A-AC-001-81. Données inédites. [Cité dans OCDE, 2002]. (Disponible en anglais seulement.)
PubChem [base de données]. 2004- . Bethesda (MD): US National Library of Medicine, National Center for Biotechnology Information. [Consultée le 26 juillet 2024]. (Disponible en anglais seulement.)
Qin Y, Lv X, Li J, Qi J, Diao Q, Liu G, Xue M, Wang J, Tong J, Zhang L, Zhang K. 2010. Assessment of melamine contamination in crop, soil and water in China and risks of melamine accumulation in animal tissues and products. Environ Int. 36:446-452. (Disponible en anglais seulement.)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la santé publique et de l’environnement 2007. Paint products fact sheet: to assess the risks for the consumer: updated version for ConsExpo 4 [PDF, 264 KB]. Bilthoven (NL): RIVM. Rapport no 320104008/2007. [Consulté en 2022]. (Disponible en anglais seulement.)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la santé publique et de l’environnement]. 2018a. Water quality standards for melamine. A proposal in accordance with the methodology of the Water Framework Directive . Bilthoven (NL): RIVM. Rapport sous forme de lettre 2018-0077. [Consulté le 1er juin 2022]. (Disponible en anglais seulement.)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la santé publique et de l’environnement]. 2018b. Cleaning products fact sheet: Default parameters for estimating consumer exposure - Updated version 2018 [PDF, 3.4 MB]. Bilthoven (NL): RIVM. Rapport no 2016-0179. [Consulté en avril 2022]. (Disponible en anglais seulement.)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la santé publique et de l’environnement]. 2022. Do-it-yourself products fact sheet: Default parameters for estimating consumer exposure - Updated version 2022 [PDF, 3.8 MB] . Bilthoven (NL): RIVM. Rapport no 2022-0208. [Consulté en février 2023]. (Disponible en anglais seulement.)
Roberts TR, Hutson DH. Eds. 1999. Metabolic Pathways of Agrochemicals, Part 2: Insecticides and Fungicides . Royal Society of Chemistry, MPG Books, Ltd.: Bodmin, Cornwall (R.-U.). p. 741–743. (Disponible en anglais seulement.)
Rossman TG, Molina M, Meyer L, Boone P, Klein CB, Wang Z, Li F, Lin WC, Kinney PL. 1991. Performance of 133 compounds in the lambda prophage induction endpoint of the Microscreen assay and a comparison with S. typhimurium mutagenicity and rodent carcinogenicity assays. Mutat Res. 260:349-367. (Disponible en anglais seulement.)
Rovina K, Siddiquee S. 2015. A review of recent advances in melamine detection techniques. J Food Compos Anal. 43:25-38. (Disponible en anglais seulement.)
[RTI] Research Triangle Institute.1982. Evaluation of urolithiasis induction by melamine in male weanling Fischer 344 rats, projet no 31T-2407 réalisé pour l’American Cyanamid Company, données inédites. [Cité dans OCDE, 2002]. (Disponible en anglais seulement.)
Rumble JR, editor. 2018. CRC Handbook of Chemistry and Physics. Internet Version 2018. Boca Raton (FL): CRC Press. 1532 p. (Disponible en anglais seulement.)
Santé Canada. 2008. Évaluation des risques pour la santé humaine de Santé Canada appuyant la conception de normes pour la mélamine dans les aliments. Préparée par le Bureau d'innocuité des produits chimiques, Direction des aliments, Direction générale des produits de santé et des aliments.
Santé Canada. 2015. Determination of melamine in polyurethane foam and similar consumer products by LC-MS/MS. Rapport de projet no 2105-2122; 9 octobre 2015. Rapport inédit. Ottawa (Ont.), Santé Canada, Laboratoire de la sécurité des produits. 6 p. plus Appendix-1: Method C53. (Disponible en anglais seulement.)
Santé Canada. 2016a. Questions et réponses - Mélamine [Internet]. [Mis à jour le 4 mai 2016].
Santé Canada. 2016b. Determination of melamine in electronic boards by LC-MS/MS. Rapport de projet no 2105-2160; 26 janvier 2016. Laboratoire de la sécurité des produits, Ottawa. 5 p. plus Appendix-1: Method C53.1. (Disponible en anglais seulement.)
Santé Canada. 2018. Draft backgrounder document on default values for breast milk and formula intakes. Rapport inédit. Ottawa (Ont.) : gouvernement du Canada. (Disponible en anglais seulement.)
Santé Canada. 2019. Determination of Flame Retardants in a Survey of Consumer Products: Melamine. Rapport de projet no P2019-00015A3; 7 juin 2019. Rapport inédit. Ottawa (Ont.) : Santé Canada, Laboratoire de la sécurité des produits. 30 p. plus Appendix-1: Method C53. (Disponible en anglais seulement.)
Santé Canada. 2020. Concentrations maximales établies par Santé Canada à l'égard de contaminants chimiques dans les aliments [Internet]. [Mis à jour le 4 juillet 2020].
Santé Canada. 2021. Dermal Absorption of Flame Retardants (Triethyl phosphate (TEP), Isopropylphenyl phosphate (IPPP) and Melamine) in a Survey of Consumer Products. Rapport de projet no P2020-00120; 11 mars 2021. Rapport inédit. Ottawa (Ont.) : Santé Canada, Laboratoire de la sécurité des produits. 23 p. plus documents supplémentaires P2020-00120-A1, 7 p., et Method C53.2. (Disponible en anglais seulement.)
Santé Canada. 2022. Recommandations au sujet de la qualité des eaux utilisées à des fins récréatives au Canada - Les cyanobactéries et leurs toxines [PDF]. Document technique. ISBN : 978-0-660-41542-0 Ottawa (Ont.), Santé Canada. [Consulté en avril 2023]
Santé Canada. [Modifié le 11 février 2022]. Facteurs d’exposition utilisés dans les évaluations des risques pour la santé humaine au Canada. Ottawa (Ont.), gouvernement du Canada. [Consulté le 13 juillet 2023]
Santé Canada. 2023. 2022-2023 Chemicals Management Plan Flame Retardants in Children’s Products Survey. Rapport de projet no P2022-00074; 27 juin 2023. Rapport inédit. Ottawa (Ont.) : Santé Canada, Laboratoire de la sécurité des produits. 55 p. (Disponible en anglais seulement.)
Santé Canada. 2024. Supporting documentation: Information in support of the assessment, Certain organic flame retardants substance grouping; 1,3,5-Triazine-2,4,6-triamine (Melamine): Human health supplementary data. Ottawa (Ont.) : Environnement et Changement climatique Canada. Disponible sur demande au : substances@ec.gc.ca (Disponible en anglais seulement.)
Santé Canada. [Modifié le 28 février 2024]. Listes des additifs alimentaires autorisés. Ottawa (Ont.), Santé Canada, Direction des aliments. [Consulté le 6 mars 2024].
Sathyanarayana S, Flynn JT, Messito MJ, Gross R, Whitlock KB, Kannan K, Karthikraj R, Morrison D, Huie M, Christakis D, Trasande L. 2019. Melamine and cyanuric acid exposure and kidney injury in US children . Environl Res. 71:18-23. (Disponible en anglais seulement.)
Seiler JP. 1973. A survey on the mutagenicity of various pesticides. Experienta. 29:622-623. (Disponible en anglais seulement.)
Selden JR, Dolbeare F, Clair JH, Miller JE, McGettigan K, DiJohn JA, Dysart GR, DeLuca JG. 1994. Validation of a flow cytometric in vitro DNA repair (UDS) assay in rat hepatocytes . Mutat Res. 315(2):147-167. (Disponible en anglais seulement.)
Shelby MD, Erexson GL, Hook GJ, Tice RR. 1993. Evaluation of a three-exposure mouse bone marrow micronucleus protocol: Results with 49 chemicals . Environ Mol Mutagen. 21:160-179. (Disponible en anglais seulement.)
Shi X, Dong R, Chen J, Yuan Y, Long Q, Guo J, Li S, Chen B. 2020. An assessment of melamine exposure in Shanghai adults and its association with food consumption . Environmental International. 135: 105363. (Disponible en anglais seulement.)
Statistique Canada. 2008. Enquête sur la santé dans les collectivités canadiennes - Nutrition (ESCC). Information détaillée pour 2004 (Cycle 2.2). Ottawa (Ont.), gouvernement du Canada.
Statistique Canada. 2017. Enquête sur la santé dans les collectivités canadiennes - Nutrition (ESCC). Information détaillée pour 2015. Ottawa (Ont.), gouvernement du Canada.
Statistique Canada. 2022. Base de données sur le commerce international canadien de marchandises [Internet]. Importations – Produits chimiques organiques (Sélection de données ; 293361 mélamine) [Mise à jour en mai 2022; citée en juin 2022]. Ottawa (Ont.), gouvernement du Canada.
Stine CB, Reimschuessel R, Keltner Z, Nochetto CB, Black T, Olejnik N, Scott M, Bandele O, Nemser SM, Tkachenko A et coll. 2014. Reproductive toxicity in rats with crystal nephropathy following high doses of oral melamine or cyanuric acid. Food Chem Toxicol. 68:142–153. (Disponible en anglais seulement.)
Sun YJ, Wang HP, Liang YJ, Yang L, Li W, Wu YJ. 2012. An NMR-based metabonomic investigation of the subacute effects of melamine in rats . J Proteome Res. 11:2544-2550. (Disponible en anglais seulement.)
Sun J, Cao Y, Zhang X, Zhao Q, Bao E, Lv Y. 2016a. Melamine negatively affects testosterone synthesis in mice. Res Vet Sci. 109:135-141. (Disponible en anglais seulement.)
Sun J, Zhang X, Cao Y, Zhao Q, Bao E, Lv Y. 2016b. Ovarian toxicity in female rats after oral administration of melamine or melamine and cyanuric acid . PLOS One. DOI:10.1371/journal.pone.0149063 (Disponible en anglais seulement.)
[SWISSI] The Swiss Institute of Safety and Security. 2009. Determination of some physical-chemical properties of Melamine. Report. Assignment no.: 204611.08.0640.02. Bâle (CH): SWISSI. 7p. [Accès restreint]. (Disponible en anglais seulement.)
Takazawa W, Suzuki S, Kannan K. 2020. Leaching of melamine and cyanuric acid from melamine-based tableware at different temperatures and water-based simulants. Environmental Chemistry and Ecotoxicology. 2:91-96. (Disponible en anglais seulement.)
Ten Berge W. 2009. A simple dermal absorption model: Derivation and application. Chemosphere. 75:1440-1445. (Disponible en anglais seulement.)
Tittlemier S, Lau BP-Y, Ménard C, Corrigan C, Sparling M, Gaertner D, Pepper, K, Feeley M. 2009. Melamine in infant formula sold in Canada: Occurrence and risk assessment. J Agric Food Chem. 57:5340-5344. (Disponible en anglais seulement.)
Tittlemier S, Lau BP-Y, Ménard C, Corrigan C, Sparling M, Gaertner D, Cao X-L, Dabeka R. 2010a. Baseline levels of melamine in food items sold in Canada. I. Dairy products and soy-based dairy replacement products. Food Addit Contam Part B Surveill. 3(3):135-139. (Disponible en anglais seulement.)
Tittlemier S, Lau BP-Y, Ménard C, Corrigan C, Sparling M, Gaertner D, Cao X-L, Dabeka R, Hilts C. 2010b. Baseline levels of melamine in food items sold in Canada. II. Egg, soy, vegetable, fish, and shrimp products. Food Addit Contam Part B Surveill. 3(3):140-147. (Disponible en anglais seulement.)
Tsai H, Fu-Chen Kuo F, Wu C, Sun C, Hsieh C, Wang C, Chen M, Hsieh H, Chuang Y, Wu M. 2021. Association between two common environmental toxicants (phthalates and melamine) and urinary markers of renal injury in the third trimester of pregnant women: The Taiwan Maternal and Infant Cohort Study (TMICS). Chemosphere. 272:129925. (Disponible en anglais seulement.)
Tu H, Zhang M, Zhou C, Wang Z, Huang P, Ou H, Chang Y. 2015. Genotoxicity assessment of melamine in the in vivo Pig-a mutation assay and in a standard battery of assays. Mutat Res. 777:62-67. (Disponible en anglais seulement.)
[UE] Union européenne. 2011. RÈGLEMENT (UE) No 10/2011 DE LA COMMISSION du 14 janvier 2011 concernant les matériaux et objets en matière plastique destinés à entrer en contact avec des denrées alimentaires. p. 5
[U.S. CDC] Centers for Disease Control and Prevention des États-Unis. 2010a. National Health and Examination Survey 2003-2004. Data Documentation, Codebook, and Frequencies. Melamine (Surplus Urine) (SSMEL_C) files. Dernière révision : avril 2010. [Consulté en mars 2014]. (Disponible en anglais seulement.)
[U.S. CDC] Centers for Disease Control and Prevention des États-Unis. 2010b. National Health and Examination Survey 2003-2004. Demographic Data. [Consulté en mars 2014]. (Disponible en anglais seulement.)
[U.S. CPSC] Consumer Product Safety Commission des États-Unis. 2005. Analysis of FR Chemicals Added to Foams, Fabric, Batting, Loose Fill, and Barriers. Memorandum dated May 10, 2005. 20 p. (Disponible en anglais seulement.)
[U.S. CPSC] Consumer Product Safety Commission des États-Unis. 2006. CPSC staff preliminary risk assessment of flame retardant (FR) chemicals in upholstered furniture foam. 212 p. (Disponible en anglais seulement.)
[U.S. eCFR] U.S. Electronic Code of Federal Regulations [Internet]. 2014a. 21 CFR 175.105 [en vigueur au 30 janvier 2014]. Washington (DC): National Archives and Record Administration, Office of the Federal Register (OFR); U.S. Government Printing Office. [Cité en janvier 2014]. (Disponible en anglais seulement.)
[U.S. eCFR] U.S. Electronic Code of Federal Regulations [Internet]. 2014b. 21 CFR 175.300 and 175.320 [en vigueur au 30 janvier 2014]. Washington (DC): National Archives and Record Administration, Office of the Federal Register (OFR); U.S. Government Printing Office. [Cité en janvier 2014]. (Disponible en anglais seulement.)
[US EPA] Environmental Protection Agency des États-Unis. 1984. Cyromazine, proposed tolerance, U.S. Federal Register. 49(83):18121-18125. (Disponible en anglais seulement.)
[US EPA] Environmental Protection Agency des États-Unis. 1985. Memorandum - Cyromazin (Larvadex), Review of Dermal Absorption Study in Rats [PDF]. Washington (DC): Office of Pesticides and Toxic Substances. (Disponible en anglais seulement.)
[US EPA] Environmental Protection Agency des États-Unis. 2003. User's Manual Swimmer Exposure Assessment Model (SWIMODEL) Version 3.0 [PDF]. Washington (DC): Office of Pesticides Programs, Antimicrobials Division. (Disponible en anglais seulement.)
[U.S. EPA] Environmental Protection Agency des États-Unis. 2011. Exposure factors handbook: 2011 edition. National Center for Environmental Assessment, Washington, DC; EPA/600/R-09/052F. (Disponible en anglais seulement.)
[US EPA] Environmental Protection Agency des États-Unis. 2012. Standard Operating Procedures for Residential Pesticide Exposure Assessment [PDF]. Washington (DC): Health Effects Division, Office of Chemical Safety and Pollution Prevention, Office of Chemical Safety and Pollution Prevention. [Consulté le 3 août 2023]. (Disponible en anglais seulement.)
[US EPA] Environmental Protection Agency des États-Unis. 2016. Swimmer Exposure Assessment Model (SWIMODEL). Version tableur de SWIMODEL (1 p., 71k). Washington (DC): Environmental Protection Agency. [Consulté en janvier 2023]. (Disponible en anglais seulement.)
[U.S. NTP] National Toxicology Program des États-Unis. 1983. Carcinogenesis bioassay of melamine in F344/N rats and B6C3F1 mice (feed study); Technical Report Series No. 245 . U.S. Department of Health and Human Services. (Disponible en anglais seulement.)
Wang W, Chen H, Yu B, Mao X, Chen D. 2013. Tissue deposition and residue depletion of melamine in fattening pigs following oral administration. Food Addit Contam Part A. 31(1):7-14. (Disponible en anglais seulement.)
Weber JB. 1970. Adsorption of s-triazines by montmorillonite as a function of pH and molecular structure. Soil Sci Soc Amer Proc. 34:401-404. (Disponible en anglais seulement.)
Wehner DJ, Martin DL. 1989. Melamine/urea and oxamide fertilization of Kentucky bluegrass. Urbana (IL): University of Illinois, Dept. of Horticulture. 15 p. (Disponible en anglais seulement.)
Weil ED, Choudhary V. 1995. Flame-retarding plastics and elastomers with melamine. J Fire Sci. 13(March/April):104-126. (Disponible en anglais seulement.)
Williamson MA, Snyder LM, editors. 2011. Wallach’s Interpretation of Diagnostic Tests. 9e édition, mise à jour le 12 février 2014. Philadelphie (PA): Lippincott Williams and Wilkins. (Disponible en anglais seulement.)
Wilson R, Jones-Otazo H, Petrovic S, Mitchell I, Bonvalot Y, Williams D, Richardson GM. 2013. Revisiting dust and soil ingestion rates based on hand-to-mouth transfer. Hum Ecol Risk Assess 19(1):158–188. (Disponible en anglais seulement.)
Wu CF, Liu CC, Chen BH, Huang SP, Lee HH, Chou YC, Wu WJ, Wu MT. 2010a. Urinary melamine and adult urolithiasis in Taiwan. Clin Chim Acta. 411:184-189. (Disponible en anglais seulement.)
Wu CF, Hsieh TJ, Chen BH, Liu CC, Wu MT. 2013. A cross over study of noodle soup consumption in melamine bowls and total melamine excretion in urine. JAMA Inter Med. 173(4):317-319. (Disponible en anglais seulement.)
Wu CF, Hsiung CA, Tsai HJ, Hsieh HM, Chen BH, Wu MT. 2018. Interaction of melamine and di-(2-ethylhexyl) phthalate exposure on markers of early renal damage in children: The 2011 Taiwan food scandal. 235:453-461. (Disponible en anglais seulement.)
Wu CF, Cheng CM, Hsu YM, Li SS, Huang CY, Chen YH, Kuo FC, Wu MT. 2020. Development of analytical method of melamine in placenta from pregnant women by isotope‐dilution liquid chromatography/tandem mass spectrometry. Rapid Commun Mass Spectrom. 34(S1):e8599. (Disponible en anglais seulement.)
Wu YT, Huang CM, Lin CC, Ho WA, Lin LC, Chiu TF, Tarng DC, Lin CH, Tsai TH. 2010b. Oral bioavailability, urinary excretion and organ distribution of melamine in Sprague-Dawley rats by high-performance liquid chromatography with tandem mass spectrometry. J Agric Food Chem. 58:108-111. (Disponible en anglais seulement.)
Yalçin SS, Güneş B, Yalçin S. 2020. Presence of melamine in human milk and the evaluation of the effects on mother–infant pairs in a cohort study. Human and Experimental Toxicology. 39(5): 624–633. (Disponible en anglais seulement.)
Yalkowsky SH, He Y. 2003 Handbook of aqueous solubility data. Boca Raton (FL): CRC Press LLC. (Disponible en anglais seulement.)
Yang F, Mao Y, Zhang X, Ma Z, Zhang X. 2009. LC-MS/MS method for the determination of melamine in rat plasma: Toxicokinetic study in Sprague–Dawley rats. J Sep Sci. 32:2974-2978. (Disponible en anglais seulement.)
Yang J, An L, Yao Y, Yang Z, Zhang T. 2011. Melamine impairs spatial cognition and hippocampal synaptic plasticity by presynaptic inhibition of glutamatergic transmission in infant rats. Toxicology. 289:167-174. (Disponible en anglais seulement.)
Yasunaga K, Kiyonari A, Oikawa T, Abe N, Yoshikawa K. 2004. Evaluation of the Salmonella umu test with 83 NTP chemicals. Environ Mol Mutagen. 44:329-345. (Disponible en anglais seulement.)
Yin RH, Wang XZ, Bai WL, Wu CD, Yin RL, Li C, Liu J, Liu BS, He JB. 2013. The reproductive toxicity of melamine in the absence and presence of cyanuric acid in male mice. Res Vet Sci. 94(3):618-627. (Disponible en anglais seulement.)
Yurdakok B, Filazi A, Ekici H, Celik TH, Sireli UT. 2014. Melamine in breast milk. Toxicol Res. 3:242-246. (Disponible en anglais seulement.)
Yurdakok B, Filazi A, Ekici H, Celik TH, Sireli UT. 2015. Correction: Melamine in breast milk. Toxicol Res. 4:527. (Disponible en anglais seulement.)
Zeiger E. 1987. Carcinogenicity of mutagens: Predictive capability of the Salmonella Mutagenesis assay for rodent carcinogenicity. Cancer Research 47:1287-1296. Laboratoire d’essai : Haworth et coll. (1983) résumé dans le tableau 1. (Disponible en anglais seulement.)
Zheng G, Salamova, A. 2020. Are melamine and Its Derivatives the Alternatives for Per- and Polyfluoroalkyl Substance (PFAS) Fabric Treatments in Infant Clothes? Environ. Sci. Technol. 54:10207--10216. (Disponible en anglais seulement.)
Zheng G, Boor BE, Schreder E, Salamova A. 2020. Exposure to melamine and its derivatives in childcare facilities. Chemosphere. 244:125505. (Disponible en anglais seulement.)
Zhu X, Wang, S, Liu Q, Xu Q, Xu S, Chen H. 2009. Determination of residues of cyromazine and its metabolite, melamine, in animal-derived food by gas chromatography-mass spectrometry with derivatization. J Agric Food Chem. 57:11075-11080. (Disponible en anglais seulement.)
Zhu H, Kannan K. 2018. Distribution profiles of melamine and its derivatives in indoor dust from 12 countries and the implications for human exposure. Environ Sci Technol. 52: 12801-12808. (Disponible en anglais seulement.)
Zhu H, Kannan K. 2019a. Inter-day and inter-individual variability in urinary concentrations of melamine and cyanuric acid. Environment International. 123:375-381. (Disponible en anglais seulement.)
Zhu H, Kannan K. 2019b. Occurrence of melamine and its derivatives in breast milk from the United States and its implications for exposure in infants. Environ Sci Technol. 53:7859-7865. (Disponible en anglais seulement.)
Zhu H, Kannan K. 2020a. Occurrence and distribution of melamine and its derivatives in surface water, drinking water, precipitation, wastewater, and swimming pool water. Environmental Pollution. 258: 113743. (Disponible en anglais seulement.)
Zhu H, Kannan K. 2020b. Determination of melamine and its derivatives in textiles and infant clothing purchased in the United States. Science of the Total Environment. 710:136396. (Disponible en anglais seulement.)
Annexe A. Résumé des propriétés physicochimiques de la mélamine et de ses analogues
| Nom chimique | Mélamine | Atrazine | Cyromazine |
|---|---|---|---|
| Rôle | Substance cible | Analogue | Analogue |
| No CAS | 108-78-1 | 1912-24-9 | 66215-27-8 |
| Structure chimique |  |

|
 |
| Masse moléculaire (g/mol) | 126,12 (PubChem, 2004-) |
215,68 (PubChem, 2004-) |
166,18 (PubChem, 2004-) |
| Point de fusion (°C) | 345* à 361 (PubChem, 2004-; Rumble, 2018; ECHA, c2007-2022) |
173 à 175 (PubChem, 2004-) |
140,86 (EPI Suite, 2012) |
| Point d’ébullition (°C) | La substance se décompose avant de bouillir. (ECHA, c2007-2022) |
La substance se décompose avant de bouillir. (PubChem, 2004-) |
346,43 (EPI Suite, 2012) |
| Pression de vapeur (Pa) | 7,5 × 10-9; 4,75 × 10‑8* (3,56 × 10–10 mmHg) (Hirt et coll., 1960; ECHA, c2007-2022) |
(2,80 × 10–7 mmHg) (EPI Suite, 2012) |
(3,36 × 10–9 mmHg) (EPI Suite, 2012) |
| Solubilité dans l’eau (mg/L) | 3190, 3230*, 3480 (Crews et coll., 2012; Yalkowsky et He, 2003; ECHA, c2007-2022) |
214,1 à 25 °C (EPI Suite, 2012) | 13 000 à 25 °C (ARLA, 2020a) |
| log Koe (sans dimension) | -1,14* à 25 °C (ECHA, c2007-2022) | 2,61 à 25 °C (EPI Suite, 2012) | -0,061 à 25 °C (ARLA, 2020a) |
* Valeur utilisée dans la modélisation de l’exposition
Annexe B. Concentrations maximales de mélamine dans les aliments et concentrations de mélamine dans les aliments au Canada
Concentrations maximales dans les aliments
À la suite de l’identification de produits falsifiés avec de la mélamine (nourriture pour animaux domestiques, bétail et poissons) en Amérique du Nord en 2007 et de certains aliments falsifiés avec de la mélamine (préparation pour nourrissons en Chine et autres aliments transformés à base de lait ailleurs dans le monde) en 2008 en raison de l’utilisation d’ingrédients falsifiés provenant de Chine, des concentrations maximales (CM) de mélamine dans les aliments ont été fixées à l’échelle internationale pour assurer la sécurité des consommateurs (Santé Canada, 2008, 2016a; CCA, 2019; OMS, 2009; Gossner et coll., 2009; Dorne et coll. 2013; CIRC, 2019). Ces CM permettent de distinguer la présence de concentrations de fond de mélamine dans les aliments due à des utilisations légitimes ou autorisées de la substance ou de précurseurs qui se décomposent pour former de la mélamine (par exemple, la cyromazine) et la présence de mélamine attribuable à une falsification intentionnelle. Au Canada, les CM provisoires pour la mélamine ont été fixées en 2008 à 0,5 mg/kg pour les préparations pour nourrissons et les produits servant d’unique source d’alimentation, y compris les substituts de repas, et à 2,5 mg/kg pour les produits alimentaires contenant du lait et des ingrédients dérivés du lait afin de veiller à ce que les aliments offerts au Canada ne soient pas délibérément falsifiés (Santé Canada, 2016a, 2020).
La Commission du Codex Alimentarius (CCA) est l’organe international d’établissement de normes alimentaires constitué par l’Organisation des Nations Unies pour l’alimentation et l’agriculture et l’OMS. Elle a établi les CM pour la mélamine (CCA, 2019). À sa 33e session (CCA, 2010a, b), la CCA a adopté une CM de 1 mg/kg de mélamine dans les préparations en poudre pour nourrissons et de 2,5 mg/kg dans les autres aliments destinés aux humains et aux animaux. À sa 35e session (CCA, 2012), elle a établi une CM de 0,15 mg/kg de mélamine dans les préparations liquides pour nourrissons, telles qu’elles sont consommées.
Surveillance par Santé Canada et l’ACIA de la présence de mélamine dans les aliments vendus au détail au Canada
La Direction des aliments de Santé Canada a mené des enquêtes pour surveiller la présence de mélamine dans divers types d’aliments. Elle a analysé 94 échantillons de diverses préparations pour nourrissons vendues au Canada (Tittlemier et coll., 2009) telles qu’elles ont été achetées (et non telles que préparées pour la consommation), et la méthode d’analyse utilisée avait une LD de 4 µg/kg. On a détecté des concentrations de mélamine supérieures à la LD dans 71 échantillons (76 %), et les valeurs positives variaient entre 4,3 et 346 μg/kg. La Direction des aliments a également analysé 246 échantillons de produits laitiers et de produits de substitution à base de soja achetés dans des points de vente au détail canadiens (Tittlemier et coll., 2010a), comme du lait, du yogourt, des boissons à base de lait ou de soja, des produits laitiers en poudre, des desserts, des bonbons et des biscuits. La mélamine a été détectée dans 33 échantillons (13,4 %). À l’exception d’un échantillon de bonbons au chocolat ayant fait l’objet d’un rappel (qui n’est pas inclus dans l’estimation de l’exposition alimentaire), les échantillons ayant donné un résultat positif affichaient des concentrations de mélamine allant de 4,4 à 282 μg/kg. La Direction des aliments de Santé Canada a aussi analysé 378 échantillons de produits contenant des œufs, de substituts de viande à base de soja, de produits à base de poissons et de crevettes, et de légumes pour déterminer les concentrations de référence de mélamine (Tittlemier et coll., 2010b). La substance a été détectée dans 98 échantillons (26 %), à des concentrations variant entre 4 et 1100 μg/kg. Les concentrations de fond de mélamine dans les préparations pour nourrissons, les produits laitiers et les produits de substitution à base de soja, les produits contenant des œufs, les substituts de viande à base de soja, les produits à base de poissons et de crevettes, et les légumes sont présentées à l’annexe D.
De plus, l’ACIA a mené diverses enquêtes pour mesurer les concentrations de mélamine dans des aliments. La première enquête, un échantillonnage de conformité dirigé, a été réalisée entre 2007 et 2010 (n=818), principalement en vue d’identifier des produits falsifiés (données inédites; certains produits ont fait l’objet de rappels publiés pendant cette période par l’ACIA). Par conséquent, la sélection de l’échantillon était biaisée et la méthodologie a donné lieu à une LD relativement élevée de 1 mg/kg. L’ACIA a aussi mené des enquêtes ciblées sur la mélamine de 2009-2010 à 2011-2012 (n=1785) et analysé des produits semblables à ceux inclus dans les enquêtes de Santé Canada avec une LD de 50 µg/kg. Seulement 1,3 % des échantillons ont donné un résultat positif (ACIA, 2010, 2011, 2012a). La mélamine a également été incluse dans le Programme national de surveillance des résidus chimiques (PNSRC) de l’ACIA de 2010-2011 à 2015-2016 (n=1024), et des échantillons d’œufs, de lait liquide, de lait en poudre, de poudres protéinées à base de lait et de plantes, et de caséinate de sodium ont été analysés avec une LD de 50 μg/kg. Aucun échantillon n’a donné de résultat positif (ACIA, 2012b, 2013, 2014; données inédites sur la mélamine pour 2014 à 2015 et 2015 à 2016). Depuis la publication de la mise à jour de l’ébauche d’évaluation préalable pour la mélamine en octobre 2020, l’ACIA a réalisé 2 autres enquêtes sur la mélamine : une enquête ciblée en 2019-2020 (n=510) (données inédites, ACIA, 2019) et une enquête du Projet sur les aliments destinés aux enfants en 2019-2020 (n=47) (ACIA, 2019), les 2 ayant une LD de 100 µg/kg. La première enquête comprenait des échantillons de substituts de repas et de suppléments alimentaires, de lait en poudre, de poudres protéinées à base de lait et de plantes, de bonbons au chocolat et au lait, de sirops et de tartinades au chocolat, et de chocolat (par exemple, au lait, noir, à cuisson), dont 5,6 % ont donné un résultat positif. La deuxième visait des préparations pour nourrissons (en poudre, en liquide concentré et prêtes à servir), parmi lesquelles un seul échantillon a donné un résultat positif. Toutes les enquêtes de l’ACIA, à l’exception de la première enquête susmentionnée, visaient à assurer le respect continu des concentrations maximales provisoires établies par Santé Canada pour la mélamine dans les aliments (Santé Canada, 2016a, 2020).
Annexe C. Estimations de l’absorption quotidienne de mélamine (µg/kg p.c./j) par la population générale du Canada
| Groupe d’âge | Poids corporel (kg) | Taux d’inhalation (m3/j) | Eau potable (L/j) | Taux d’ingestion de sol (µg/j) | Taux d’ingestion de poussière (µg/j) |
|---|---|---|---|---|---|
| 0 à 5 mois | 6,3 | 3,7 | 0,83 | S. O. | 21,6 |
| 6 à 11 mois | 9,1 | 5,4 | 0,76 | 7,3 | 27,0 |
| 1 an | 11 | 8,0 | 0,36 | 8,8 | 35,0 |
| 2 à 3 ans | 15 | 9,2 | 0,43 | 6,2 | 21,4 |
| 4 à 8 ans | 23 | 11,1 | 0,53 | 8,7 | 24,4 |
| 9 à 13 ans | 42 | 13,9 | 0,74 | 6,9 | 23,8 |
| 14 à 18 ans | 62 | 15,9 | 1,09 | 1,4 | 2,1 |
| Adultes (19 ans et plus) | 74 | 15,1 | 1,53 | 1,6 | 2,6 |
a Santé Canada [modifiés en 2022].
| Voie d’exposition | 0 à 5 mois (nourris au lait maternela) | 0 à 5 mois (nourris aux préparations pour nourrissonsb) | 6 à 11 mois | 1 an | 2 à 3 ans | 4 à 8 ans | 9 à 13 ans | 14 à 18 ans | 19 ans et plus |
|---|---|---|---|---|---|---|---|---|---|
| Eau potablec | S. O. | 0,004 (0,025) | 0,003 (0,016) | 0,0011 (0,006) | 0,001 (0,005) | 0,0008 (0,004) | 0,0006 (0,003) | 0,0006 (0,003) | 0,0007 (0,004) |
| Aliments et boissonsd | 0,042 (0,89) | 0,72e (1,7) | 0,72 (1,7) | 0,35 (0,89) | 0,35 (0,89) | 0,24 (0,72) | 0,17 (0,56) | 0,12 (0,41) | 0,11 (0,37) |
| Solf | S. O. | S. O. | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 |
| Poussièreg | 0,024 (0,23) | 0,024 (0,23) | 0,021 (0,20) | 0,022 (0,21) | 0,0099 (0,095) | 0,0073 (0,071) | 0,0039 (0,038) | 0,0002 (0,0023) | 0,0002 (0,0023) |
| Absorption totale | 0,066 (1,1) | 0,75 (2,0) | 0,74 (1,9) | 0,37 (1,1) | 0,36 (0,99) | 0,25 (0,80) | 0,17 (0,60) | 0,12 (0,42) | 0,11 (0,38) |
Abréviations : S. O., sans objet.
a On présume que les bébés nourris au lait maternel ne consomment que cet aliment pendant 6 mois (Santé Canada, 2018). Aucune donnée sur les concentrations de mélamine dans le lait maternel canadien n’a été recensée. La consommation médiane de lait maternel est de 127,95 g/kg p.c./j (Arcus-Arth et coll., 2005). Les concentrations moyenne et maximale de mélamine dans le lait maternel (0,338 μg/L et 7,14 μg/L, respectivement) rapportées par Zhu et Kannan (2019a) ont servi à estimer l’absorption quotidienne à partir de cette source. L’estimation fondée sur la concentration maximale de mélamine dans le lait maternel est indiquée entre parenthèses.
b On présume que les bébés de 0 à 5 mois nourris aux préparations pour nourrissons ne consomment que cet aliment pendant 6 mois (Santé Canada, 2018).
c Aucune donnée sur les concentrations de mélamine dans l’eau potable canadienne n’a été recensée. Les concentrations moyenne et maximale de mélamine (0,033 μg/L et 0,188 μg/L, respectivement) mesurées dans des échantillons d’eau potable prélevés aux États-Unis ont servi à estimer l’exposition (Zhu et Kannan, 2020b). Les valeurs entre parenthèses sont fondées sur la concentration maximale.
d Sauf indication contraire (par exemple, pour le lait maternel), on a estimé l’absorption quotidienne à partir des aliments en multipliant la répartition complète des données de consommation et les estimations ponctuelles (moyenne arithmétique) d’occurrence (annexe D). Les valeurs moyennes et au 95e centile (entre parenthèses) sont abordées dans le texte de la section 5.1.1 et présentées dans le tableau 5‑1.
e Valeur fondée sur les valeurs du tableau 5‑1 pour les bébés âgés de 6 à 11 mois.
f Aucune donnée sur les concentrations de mélamine dans les sols nord-américains n’a été recensée. Toutefois, en Chine, on a analysé des échantillons de sol prélevés à 100 m et à environ 150 km d’usines de fabrication de mélamine. À une distance de 100 m, les concentrations de mélamine dans le sol allaient de non détectable à 41,1 mg/kg. À environ 150 km des usines, les concentrations dans les sols agricoles variaient entre non détectable et 0,176 mg/kg (Qin et coll., 2010). Étant donné que les concentrations mesurées à grande distance d’une usine de fabrication de mélamine seraient plus représentatives des concentrations dans le sol canadien, on a utilisé la concentration maximale mesurée dans des sols agricoles à 150 km d’une usine pour effectuer une estimation déterministe de l’absorption quotidienne, laquelle s’est révélée négligeable.
g Aucune donnée sur les concentrations de mélamine dans la poussière au Canada n’a été recensée. Toutefois, dans le cadre d’une étude américaine analysant la poussière de centres de la petite enfance, de la mélamine a été détectée à des concentrations allant de 150 ng/g à 66 600 ng/g, avec une valeur moyenne de 6920 ng/g (Zheng et coll., 2020). Les concentrations moyenne et maximale ont servi à estimer l’exposition. Les valeurs entre parenthèses sont fondées sur la concentration maximale.
Exposition à la mélamine à partir de l’eau de piscine
Les expositions cutanées et orales à la mélamine à partir de l’eau de piscine ont été estimées à l’aide du modèle SWIMODEL de l’EPA (2003, 2016).
| Scénario d’exposition | Hypothèses | Exposition |
|---|---|---|
| Baignade en piscine | Population : enfants de 4 à 8 ans, adultes SWIMODEL de l’EPA (US EPA, 2003, 2016) Kp : 0,001 cm/h (US EPA, 2003) Concentration de mélamine : 6,47 × 10‑4 mg/L (Zhu et Kannan, 2020b) Superficie de la peau : 8900 cm2, 18 700 cm2, corps entier Durée d’exposition : 2,7 h/j (Santé Canada, 2022) Taux d’ingestion : 0,038 L/h (Santé Canada, 2022) |
Exposition cutanée : < 2,5 ng/kg p.c./j (ce qui est négligeable) pour tous les groupes d’âge Exposition orale : Enfants âgés de 4 à 8 ans : 2,9 ng/kg p.c./j < 2,5 ng/kg p.c./j (ce qui est négligeable) pour tous les autres groupes d’âge |
Absorption estimée de mélamine à partir de l’utilisation d’articles en mélamine et en bambou
Absorption (µg/kg p.c./j) = [Migration depuis des articles en mélamine vers la matrice alimentaire (mg/g) × consommation de ce type d’aliment par jour (g/j) × 1000 μg/mg] / poids corporel
| Paramètre | Valeur |
|---|---|
| Consommation alimentaire totale moyenne (g/j)a | 1000 (6 à 11 mois)b 1540,81 (1 an) 1540,81 (2 à 3 ans) 1760,47 (4 à 8 ans) 2057,76 (9 à 13 ans) 2550,51 (14 à 18 ans) 2771,01 (19 ans et plus) |
| Migration à température ambiante à partir d’articles en mélamine (mg/g)c | 7 × 10‑7 à 3,94 × 10‑3 |
| Migration « type » à partir d’articles en mélamine (mg/g)d | 1 × 10-3 |
| Migration au 95e centile à partir d’articles en mélamine (mg/g) (BfR, 2019)e | 4,29 × 10-3 |
| Migration au 95e centile à partir d’articles en bambou (mg/g) (BfR, 2019)f | 7,71 × 10-3 |
| Poids corporel (kg) | Voir le tableau C-1 |
a Quantités totales de consommation d’aliments (moyennes pour toutes les personnes) pour divers groupes d’âge, tirées de l’ESCC de 2015 de la Direction des aliments (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2023, source non citée; Statistique Canada, 2017).
b ESCC de 2004 (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, avril 2024, source non citée; Statistique Canada, 2008). Remarque : comme d’importants coefficients de variation (CV) allant de 16,6 à 33,3 % sont associés à un certain nombre des principales catégories alimentaires additionnées pour obtenir cette valeur, les données doivent être interprétées avec prudence.
c Plus faibles (BfR, 2010b, cité dans EFSA, 2010) et plus fortes (Takazawa et coll., 2020) concentrations de mélamine ayant migré à partir d’articles en mélamine observées à température ambiante parmi les études recensées (Lund et Petersen, 2006; BfR, 2010b, cité dans EFSA, 2010; Chien et coll., 2011; Chik et coll., 2011; Takazawa et coll., 2020).
d Concentration de migration type la plus élevée pour les aliments acides (1 mg/kg), calculée par l’EFSA (2010).
e Concentration de migration au 95e centile à partir d’articles en mélamine (4,29 mg/L) et en bambou (7,71 mg/L) (BfR, 2019). On a présumé que la masse volumique était celle de l’eau pour convertir les mg/L en mg/kg (1 L = 1 kg).
Annexe D. Résumé des données sur la présence de mélamine utilisées pour estimer l’exposition alimentaire et méthodologie d’évaluation de l’exposition alimentaire
| Alimenta | Nombre d’échantillons | Concentration moyenne arithmétique de mélamine en μg/kgb | Source de l’enquête faisant état de la concentration moyenne la plus élevéec |
|---|---|---|---|
| Aliments pour bébés (pâtes et bœuf ou sauce à la viande) | 3 | < LD | SC |
| Céréales pour bébés | 2 | < LD | SC |
| Préparation pour nourrissons – poudre (lait, soja) | 64 | 43,68 | SC |
| Préparation pour nourrissons – formule concentrée (lait, soja) | 24 | 17,94 | SC |
| Préparation pour nourrissons – formule prête à consommer (lait, soja) | 6 | 28,98 | SC |
| Lait – entier, 2 %,1 %, écrémé (y compris le lait au chocolat, le lait de chèvre et le babeurre) | 68 | 4,05 | SC |
| Lait – évaporé, condensé | 17 | 8,75 | SC |
| Lait en poudre | 65 | 63,26 | ACIA |
| Poudre pour boisson maltée | 9 | 31,55 | ACIA |
| Chocolat à cuisson | 118 | 2,00 | ACIA |
| Yogourt et boissons au yogourt et probiotiques | 42 | 4,3 | SC |
| Bonbons au chocolat ou au lait | 10 | 4,90 | SC |
| Café au lait, boisson au café | 12 (liquide) 44 (poudre) | 42,11 (liquide) 24,02 (poudre) | SC (liquide) ACIA (poudre) |
| Thé au lait | 26 (liquide) 3 (poudre) | 57,38 (liquide) 4,00 (poudre) | ACIA (liquide) SC (poudre) |
| Substituts de repas | 5 (prêt à consommer; PAC) 9 (poudre) 1 (déjeuner instantané, liquide) 1 (déjeuner instantané, poudre) | 13,97 (PAC) 202,56 (poudre) 4,44 (déjeuner instantané, liquide) 12,33 (déjeuner instantané, poudre) | SC (PAC et déjeuner instantané; liquide et en poudre) ACIA (substituts de repas en poudre) |
| Poudres protéinées (à base de lait et de plantes) | 154 | 13,25 | ACIA |
| Gluten | 8 | 22,75 | ACIA |
| Fromage pané (à cuire ou à frire) | 3 | 84,97 | SC |
| Boisson à base de soja (liquide et poudre) | 39 (liquide) 6 (poudre) | 4,07 (liquide) 4,00 (poudre) | SC |
| Pâte de soja et miso | 61 | 6,84 | ACIA |
| Farine de soja | 1 | 4,08 | SC |
| Pouding | 3 | 8,01 | SC |
| Œuf (en conserve, liquide, surgelé) | 6 | 10,35 | SC |
| Pâtés impériaux | 1 | 118 | ACIA |
| Substitut de viande | 29 | 5,28 | SC |
| Mayonnaise et vinaigrettes crémeuses pour salade | 23 | 4,05 | SC |
| Pâtes et nouilles (sèches et fraîches) | 15 | 4,15 (sèches) 4,00 (fraîches) | SC |
| Barre énergétique | 14 | 5,38 | SC |
| Biscuits | 172 | 14,36 | ACIA |
| Gâteau (surgelé et prêt à consommer) | 8 | 4,54 | SC |
| Pépite de poulet, languette | 3 | 11,85 | SC |
| Crevette | 66 | 41,04 | SC |
| Poisson (tilapia, sole) | 8 | 4,1 | SC |
| Anguille | 3 | 65,68 | SC |
| Épinards (surgelés) | 4 | 8,77 | SC |
| Pommes de terre (en conserve, emballées, séchées/instantanées) | 19 (séchées/instantanées) 5 (en conserve/ emballées) | 5,07 (séchées/instantanées) 4,40 (en conserve/ emballées) | SC |
| Champignons (en conserve, séchés, marinés) | 15 (marinés et/ou en conserve) 5 (séchés) | 110,17 (marinés et/ou en conserve) 88,70 (séchés) | SC |
| Oignons (frais, surgelés, séchés, marinés, en poudre) | 6 (frais, surgelés, marinés) 4 (en poudre/séchés) | 4,68 (frais, surgelés, marinés) 4,00 (en poudre/ séchés) | SC |
| Tomates (en conserve, séchées, en pot, jus, soupe, fraîches) | 32 | 51,44 | SC |
| Préparations pour soupe, sauce et sauce brune et mélanges d’assaisonnements | 8 | 23,42 | SC |
‡ Les données sont tirées de Tittlemier et coll., 2009, 2010a, 2010b, et lorsque des concentrations maximales plus élevées ou de nouvelles catégories alimentaires ont été analysées, les données proviennent de l’ACIA (ACIA, 2010, 2011, 2012a, données d’enquête ciblée inédites de l’ACIA, 2019).
a En ce qui concerne les enquêtes de Santé Canada, les catégories alimentaires (autres que les aliments et les céréales pour bébés) dont les échantillons ne contenaient pas de mélamine ne sont pas présentées dans ce tableau. La concentration moyenne utilisée pour évaluer l’exposition pour ces catégories a été fixée à la LD de 4 µg/kg. Les catégories alimentaires pertinentes comprennent : le pain (naan); le pain (chapelure); les croissants; les céréales pour petit-déjeuner; les calmars; le chocolat chaud et les poudres pour boissons au chocolat; les poudres pour boissons chaudes aux céréales et au lait; les pâtes à biscuits et à pain; la crème; les laits frappés; les sauces à base de crème (béarnaise et tartare); les mélanges secs pour desserts; les saucisses sur bâtonnet et les roulés à la saucisse; la crème glacée et les desserts glacés au soja; les muffins; les préparations pour crêpes, gaufres, muffins et gâteaux; les crêpes et les gaufres (surgelées); la pâte à tarte; les pâtisseries Toaster Strudel; les tartes; les sauces (teriyaki, soja, hoisin); les substituts de fromage à base de soja; le tofu.
b Pour les enquêtes de Santé Canada, on a attribué une valeur équivalente à la LD de 4 µg/kg aux échantillons dans lesquels la mélamine n’a pas été détectée, tandis que pour les enquêtes de l’ACIA, on a attribué une valeur de zéro à ces échantillons dans le calcul des moyennes arithmétiques en raison des LD plus élevées de 50 et de 100 µg/kg utilisées dans ces enquêtes.
c Lors de l’évaluation de l’exposition, on a utilisé la concentration moyenne arithmétique de mélamine la plus élevée pour comparer les catégories alimentaires correspondantes entre les enquêtes de Santé Canada et celles de l’ACIA. Les enquêtes de Santé Canada et de l’ACIA n’ont pas été combinées pour calculer les moyennes arithmétiques, car les LD étaient nettement plus élevées dans celles de l’ACIA. On a plutôt utilisé la concentration moyenne la plus élevée entre les deux. Le traitement des échantillons dont la concentration est inférieure à la LD perturbe grandement les moyennes arithmétiques calculées lorsque les taux de détection sont faibles. C’est pourquoi on a utilisé la limite inférieure de la moyenne arithmétique pour les enquêtes de l’ACIA et la limite supérieure pour celles de Santé Canada.
Méthodologie d’évaluation de l’exposition alimentaire et hypothèses
Les données sur la consommation alimentaire pour les personnes âgées de plus d’un an sont tirées de l’ESCC de 2015 (Statistique Canada, 2017), tandis que celles pour les bébés de moins d’un an proviennent de l’ESCC de 2004 (Statistique Canada, 2008). Les poids corporels mesurés et autodéclarés lors de l’ESCC ont aussi été utilisés. L’évaluation de l’absorption alimentaire de la mélamine (voir la section 5.1.1.5) a été réalisée par la Direction des aliments de Santé Canada. Si les valeurs de consommation de certains aliments ne figuraient pas dans l’ESCC (café ou thé au lait), des aliments très similaires ont été utilisés (café ou thé instantané). De plus, certains types d’aliments analysés pour détecter la présence de mélamine en raison de la présence possible de protéines de lait, de soja ou d’œuf ont servi à représenter les concentrations pour l’ensemble de ces types d’aliments (c'est-à-dire tous les produits de poulet, de saucisses, d’œufs et de biscuits). Dans les 2 cas, l’exposition peut être surestimée en raison de la fréquence élevée de consommation des aliments de substitution. De même, les concentrations de mélamine détectées dans un nombre restreint de produits transformés contenant des épinards, des pommes de terre, des champignons, des oignons et des tomates ont été utilisées pour représenter, de manière prudente, les concentrations de mélamine dans tous les produits alimentaires contenant ces légumes, y compris les légumes frais. L’exposition alimentaire à la mélamine devrait également être surestimée dans ce cas.
Annexe E. Estimations de l’exposition à la mélamine à partir de produits
En se fondant sur les renseignements disponibles, on a estimé l’absorption due à l’exposition cutanée par contact direct avec des matelas et d’autres articles manufacturés connexes contenant de la mousse pour tous les groupes d’âge ainsi qu’avec les ensembles de retenue pour bébés et enfants contenant de la mousse (dont les sièges d’appoint) pour les enfants âgés de 0 à 13 ans. On a également estimé l’exposition orale pour les enfants âgés de 0 à 3 ans qui mâchonnent (suçotent) des articles manufacturés contenant de la mousse destinés aux enfants ainsi que des textiles. L’exposition cutanée et par inhalation (lorsque pertinente) aux peintures, aux produits d’étanchéité et aux produits nettoyants pour surfaces de cuisson a été estimée au moyen de ConsExpo Web (2021). Les poids corporels utilisés pour estimer les expositions sont présentés dans le tableau C-1. Les tableaux E-1 à E-5 présentent les autres valeurs et paramètres d’exposition, fondés sur des hypothèses prudentes, qui ont servi à estimer les expositions.
| Scénario d’exposition | Hypothèses |
|---|---|
| Peinture pour pinceau ou rouleau | Concentration : 10 % (FDS, 2019) Scénario : scénario de peinture pour pinceau ou rouleau à haut extrait sec tiré de la fiche d’information sur les peintures (RIVM, 2007)
Groupe d’âge : 19 ans et plus
Exposition cutanée : |
| Peinture en aérosol pour pistolet | Concentration : 10 % (FDS, 2019) Groupe d’âge : 19 ans et plus Scénario : pistolet à peinture sous pression d’air (ARLA, 2020b) Exposition par inhalation : Volume de peinture par jour : 56,7 L (19 000 mL/boîte, 3 boîtes/j) Exposition cutanée : Exposition cutanée (mg/kg p.c./j) = exposition unitaire (mg/kg p.a.) * volume de peinture (L/j) * masse volumique (kg/L) * concentration (%) * absorption cutanée (%) / poids corporel (kg) Volume de peinture par jour : 57 L (19 000 mL/boîte, 3 boîtes/j) |
| Produit d’étanchéité | Concentration : 30 à 60 % (FDS, 2022) Scénario : scénario de produit d’étanchéité pour joints tiré de la fiche d’information sur les produits de bricolage (RIVM, 2022) Groupe d’âge : 19 ans et plus Exposition cutanée :
Surface exposée : 30 cm2 |
| Produit nettoyant pour surfaces de cuisson (exposition cutanée)a | Concentration maximale signalée : 1 % (FDS, 2015) Scénario : scénario de liquide nettoyant tout usage tiré de la fiche d’information sur les produits nettoyants (RIVM, 2018b) Groupe d’âge : 19 ans et plus Exposition cutanée : |
a Exposition estimée au moyen de ConsExpo Web (2021)
Estimation de l’absorption cutanée de mélamine à partir de l’exposition à des articles manufacturés en mousse de polyuréthane
Absorption (mg/kg p.c./j) = [S (cm2) × FCP × FPT × M (mg/cm2/h) × DE (h/j) × AC] / PC (kg)
| Symbole | Description | Paramètres d’exposition cutanée causée par le fait de s’étendre sur un matelas ou un meuble rembourré contenant de la mousse | Paramètres d’exposition cutanée causée par le fait de s’asseoir dans un siège d’auto pour bébé ou enfant (dont les sièges d’appoint) |
|---|---|---|---|
| Sa | Superficie de contact avec la peau | 520 cm2 à 1750 cm2 (0 à 5 mois) 668 cm2 à 2250 cm2 (6 à 11 mois) 753 cm2 à 2650 cm2 (1 an) 705 cm2 à 3250 cm2 (2 à 3 ans) 922 cm2 à 4450 cm2 (4 à 8 ans) 1332 cm2 à 6700 cm2 (9 à 13 ans) 1642 cm2 à 8600 cm2 (14 à 18 ans) 2005 cm2 à 9350 cm2 (19 ans et plus) |
520 cm2 (0 à 5 mois) 668 cm2 (6 à 11 mois) 753 cm2 (1 an) 705 cm2 (2 à 3 ans) 922 cm2 (4 à 8 ans) 1332 cm2 (9 à 13 ans) |
| FCPc | Facteur de contact avec la peau | 1 | 1 |
| FPTd | Facteur de pénétration textile | 0,1 | 0,1 |
| Me | Taux de migration | 0,00936 mg/cm2/h à 0,0217 mg/cm2/h | 0,00936 mg/cm2/h à 0,0217 mg/cm2/h |
| DEf | Durée de l’exposition | 12,7 h/j (0 à 5 mois) 12,7 h/j (6 à 11 mois) 13 h/j (1 an) 11,8 h/j (2 à 3 ans) 11,25 h/j (4 à 8 ans) 10,4 h/j (9 à 13 ans) 9,2 h/j (14 à 18 ans) 8 h/j (19 ans et plus) |
3 h/j (0 à 13 ans) |
| AC | Absorption cutanée | 0,3g | 0,3g |
| PC | Poids corporel | Voir le tableau C-1 | Voir le tableau C-1 |
a Une plage de superficies a servi à représenter le contact cutané avec les matelas, tandis que seules les valeurs de superficie les plus faibles ont été utilisées pour représenter le contact cutané avec les ensembles de retenue pour enfant ou bébé. Pour les faibles valeurs de superficie, on a présumé qu’une personne portait des shorts et un t-shirt couvrant la moitié de ses membres. La superficie d’exposition est fondée sur l’exposition d’une fraction de la moitié inférieure des membres (bras et jambes) et de l’arrière de la tête. La superficie des membres (Santé Canada [modifié en 2022]) a été multipliée par un demi pour tenir compte de la couverture par les vêtements, puis par un tiers pour tenir compte de la forme triangulaire des membres, quand un seul côté est directement en contact avec le matelas ou l’ensemble de retenue pour enfants (US CPSC, 2006). La superficie de la tête (Santé Canada [modifié en 2022]) a été multipliée par un facteur de 0,5 afin de représenter l’exposition de l’arrière de la tête seulement. Pour la valeur élevée de superficie, on a présumé que la moitié du corps était en contact cutané avec le matelas (US EPA, 2012).
b Les règlements sur les ensembles de retenue pour bébés et enfants au Canada varient selon la province et le territoire (CPSAC, 2019). En se fondant sur des facteurs pertinents en matière d’âge et de poids, on a estimé l’exposition cutanée pour divers groupes d’âge jusqu’au groupe des enfants âgés de 9 à 13 ans, inclusivement.
c Aucun facteur de contact avec la peau (FCP) propre à la mélamine, c'est-à-dire la fraction de la substance sur une surface qui adhère à la peau, n’a été recensé dans les publications scientifiques. Par conséquent, on a choisi une valeur de 1, car on présume que l’entièreté de la substance chimique est susceptible d’être absorbée.
d On a appliqué un facteur de pénétration textile (FPT) pour la mélamine afin de tenir compte des taux de migration (du TDCPP et du TCEP) utilisés pour l’extrapolation, qui ont été déterminés pour de la mousse non recouverte (ECHA, 2018). Aucune donnée sur la pénétration textile de la mélamine n’a été recensée dans les publications scientifiques. Par conséquent, un FPT de 0,1 (Driver et coll., 2007, cité dans ECHA, 2018) a été utilisé.
e Taux de migration depuis la mousse vers la surface du rembourrage (extrapolés à partir des taux de migration du TCEP et du TDCPP, indiqués dans le tableau 5‑7).
f Les durées d’exposition pendant le sommeil ont été ajustées à partir des durées médianes de sommeil indiquées par l’EPA (2011), dans les tableaux 16-25 (0 à 6 mois) et 16-26 (tous les autres groupes d’âge). Une durée d’exposition de 3 heures/jour a été choisie pour le fait de s’asseoir dans un ensemble de retenue pour enfant ou bébé (dont les sièges d’appoint), d’après la durée de détente en position assise indiquée dans le document de la CPSC des États-Unis (2006) et la plus longue durée quotidienne passée en voiture (au 95e centile) par des enfants âgés de moins d’un an à 19 ans (soit 2 h 50 pour les 5 à 11 ans) indiquée dans l’Enquête sur les profils d’activité humaine au Canada 2 (EPAHC 2) (Matz et coll., 2014).
g Aucune donnée sur l’absorption cutanée n’a été recensée pour la mélamine. Une valeur de 30 % a été choisie d’après les données disponibles pour des composés de structure similaire (voir la section 5.1.3).
Estimation de l’absorption orale de mélamine à partir de l’exposition à la mousse de polyuréthane contenue dans des articles manufacturés
Absorption (mg/kg p.c./j) = [S (cm2) × M (mg/cm2/h) × DE (h/j)] / PC (kg)
| Symbole | Description | Valeur |
|---|---|---|
| Sa | Superficie de mâchonnement direct | 10 cm2 (0 à 5 mois) 10 cm2 à 50 cm2 (6 mois à 3 ans) |
| Mb | Taux de migration | 0,00936 mg/cm2/h à 0,0217 mg/cm2/h |
| DEc | Durée de l’exposition | 24,5 min/j (0,408 h/j) |
| PC | Poids corporel | Voir le tableau C-1 |
a On a estimé que la superficie d’un objet qui est mâchonné se situe entre 10 cm2 et 50 cm2 d’après les données de la CPSC (2006) et de l’EPA (2012) des États-Unis.
b La plage de taux de migration de 0,00936 mg/cm2/h à 0,0217 mg/cm2/h présentée dans le scénario d’exposition cutanée a également servi à estimer l’exposition orale. On suppose que la mélamine est complètement absorbée par voie orale et que la présence d’un revêtement textile sur un objet en mousse n’aurait pas d’incidence sur la migration (aucun facteur de pénétration textile [FPT] n’a été appliqué).
c La durée de mâchonnement de 24,5 min/j pour les produits en mousse pour enfants, comme les tapis de sieste, les ensembles de retenue pour bébés et enfants et de petits meubles, est fondée sur la plus longue durée moyenne pour « d’autres objets » (pour les bébés âgés de 6 à 9 mois) mentionnée par Norris et Smith (2002, cité dans US EPA, 2011).
Estimation de l’absorption cutanée à partir de l’exposition à des textiles
Absorption = [S (cm2) × MS (mg/cm2) × AC × FM × FCP × C (ng/mg)] / PC (kg)
| Symbole | Description | Paramètres d’exposition cutanée à des textiles |
|---|---|---|
| Sa | Superficie de contact avec la peau | 2670 cm2 (0 à 5 mois) 3440 cm2 (6 à 11 mois) 4130 cm2 (1 an) 5640 cm2 (2 à 3 ans) 7860 cm2 (4 à 8 ans) 12 090 cm2 (9 à 13 ans) 15 690 cm2 (14 à 18 ans) 16 620 cm2 (19 ans et plus) |
| MSb | Masse surfacique du textile | 24 mg/cm2 |
| ACc | Absorption cutanée | 0,3 |
| FMd | Fraction de migration | 0,005 |
| FCPe | Facteur de contact avec la peau | 1 |
| Cf | Concentration de mélamine | Concentration moyenne (textiles non lavés) : 4,9 ng/mg Concentration maximale (textiles non lavés) : 81,8 ng/mg |
| PC | Poids corporel | Voir le tableau C-1 |
| Absorption | Absorption de mélamine (µg/kg p.c./j) | 7,48 × 10‑5 à 1,25 × 10‑3 (0 à 5 mois) 6,67 × 10‑5 à 1,11 × 10‑3 (6 à 11 mois) 6,62 × 10‑5 à 1,11 × 10‑3 (1 an) 6,63 × 10‑5 à 1,11 × 10‑3 (2 à 3 ans) 6,3 × 10‑5 à 1,01 × 10‑3 (4 à 8 ans) 5,08 × 10‑5 à 8,48 × 10‑4 (9 à 13 ans) 4,46 × 10‑5 à 7,45 × 10‑4 (14 à 18 ans) 3,96 × 10‑5 à 6,61 × 10‑4 (19 ans et plus) |
a Superficie corporelle totale (moins la tête et les mains) (Santé Canada [modifié en 2022])
b La masse surfacique du textile correspond à celle d’un « tissu lourd en mélange de coton et de fibres synthétiques » (US EPA, 2012).
c Aucune donnée sur l’absorption cutanée n’a été recensée pour la mélamine. Une valeur de 30 % a été choisie d’après les données disponibles pour des composés de structure similaire (voir la section 5.1.3).
d BfR (2007). Zhu et Kannan (2020a) ont également mentionné cette valeur dans leur calcul de l’exposition à partir de textiles.
e Aucun facteur de contact avec la peau (FCP) propre à la mélamine, c'est-à-dire la fraction de la substance sur une surface qui adhère à la peau, n’a été recensé dans les publications scientifiques. Par conséquent, on a choisi une valeur de 1, car on présume que l’entièreté de la substance chimique est susceptible d’être absorbée.
f Zhu et Kannan (2020a)
Estimation de l’absorption orale à partir de l’exposition à des textiles
Absorption = [S (cm2) × MS (mg/cm2) × FM × C (ng/mg)] / PC (kg)
| Symbole | Description | Valeur |
|---|---|---|
| Sa | Superficie de mâchonnement direct | 10 cm2 (0 à 5 mois) 10 cm2 à 50 cm2 (6 mois à 3 ans) |
| MSb | Masse surfacique du textile | 24 mg/cm2 |
| FMc | Fraction de migration | 0,005 |
| Cd | Concentration de mélamine | Concentration moyenne (textiles non lavés) : 4,9 ng/mg Concentration maximale (textiles non lavés) : 81,8 ng/mg |
| PC | Poids corporel | Voir le tableau C-1 |
| Absorption | Absorption calculée en mg/kg p.c./j | 9 × 10‑7 à 1,56 × 10‑5 (0 à 5 mois) 6 × 10‑7 à 5,39 × 10‑5 (6 à 11 mois) 5 × 10‑7 à 4,46 × 10‑5 (1 an) 4 × 10‑7 à 3,27 × 10‑5 (2 à 3 ans) |
a On a estimé que la superficie d’un objet qui est mâchonné se situe entre 10 cm2 et 50 cm2 d’après les données de la CPSC (2006) et de l’EPA (2012) des États-Unis. On a présumé d’une valeur unique de 10 cm2 pour les bébés âgés de 0 à 5 mois étant donné leur petite taille et leur faible capacité à se déplacer.
b La masse surfacique du textile correspond à celle d’un « tissu lourd en mélange de coton et de fibres synthétiques » (US EPA, 2012).
c BfR (2012). Zhu et Kannan (2020a) ont également mentionné cette valeur dans leur calcul de l’exposition à partir de textiles.
d Zhu et Kannan (2020a)
Annexe F. Estimation de l’absorption de mélamine au moyen des données de biosurveillance (par dosimétrie inverse)
La dosimétrie inverse a permis d’estimer l’absorption quotidienne à partir des concentrations dans l’urine de sujets âgés de 0 à 5 mois, de 6 à 11 mois, de 1 an, de 2 à 3 ans, de 4 à 8 ans, de 9 à 13 ans, de 14 à 18 ans et de 19 ans et plus, ainsi que de femmes enceintes. La section 5.1.4 présente les concentrations urinaires tirées de la documentation scientifique qui ont servi à calculer l’absorption. Tous les autres paramètres sont également présentés ci-dessous. Les valeurs d’absorption quotidienne sont présentées dans la section 5.1.4 et ont été calculées par dosimétrie inverse, comme l’illustre l’équation suivante.
Absorption quotidienne (µg/kg p.c./j) = {[Urine (ng/mL)(µg/1000 ng)] × Durine (mL/kg j)} / FEU
| Symbole | Description | Valeur |
|---|---|---|
| [Urine] | Concentration de mélamine dans l’urine (ng/mL) | Voir le tableau 5‑9 de la section 5.1.4 |
| Durine | Débit urinaire quotidien (mL/kg j) | 22 à 85,2 (4 mois à 8 ans)a 30 (4 à 6 ans)b 20 à 25 (6 à 11 ans)b 20 (12 à 19 ans)b 20 (20 à 59 ans)b, c 20 (60 ans et plus)b |
| FEUd | Fraction d’excrétion urinaire | 0,5 (identique pour tous les groupes d’âge) |
a Les débits urinaires quotidiens moyens sont tirés du tableau 4 d’Aylward et coll. (2015).
b Les débits urinaires quotidiens moyens sont tirés du tableau 6 d’Aylward et coll. (2015).
c Valeur ayant servi à estimer l’absorption pour les femmes enceintes
d En raison de la variabilité de l’excrétion urinaire selon l’espèce (entre 54 % et 90 %), on a choisi une valeur prudente de 50 % pour calculer l’absorption à partir des données de biosurveillance humaine.
