Document de caractérisation des risques pour la santé humaine aux fins de l’évaluation du phosphate de triphényle (PTPh) et du phosphate de tris(2-butoxyéthyle) (PTBOE)
Titre officiel : Document de caractérisation des risques pour la santé humaine aux fins de l’évaluation du phosphate de triphényle (PTPh) et du phosphate de tris(2-butoxyéthyle) (PTBOE)
Numéros d’enregistrement du Chemical Abstracts Service:
- 78-51-3
- 115-86-6
Santé Canada
Novembre 2025
Résumé
Une ébauche d’évaluation préalable pour le groupe des substances ignifuges a été publiée le 6 novembre 2021. Le présent document contient des renseignements supplémentaires à l’appui de l’évaluation du phosphate de triphényle (NE CASNote de bas de page 1 115-86-6) et du phosphate de tris(2-butoxyéthyle) (NE CAS 78-51-3), ci-après appelés PTPh et PTBOE, respectivement, qui sont 2 des 10 substances du groupe des substances ignifuges. Les données trouvées ou produites depuis la publication de l’ébauche d’évaluation sont incluses dans le présent document.
La portée du présent document de caractérisation des risques se limite à l’évaluation des éventuelles préoccupations pour la santé humaine associées au PTPh et au PTBOE. Dans le cas du PTPh, de nouveaux effets critiques importants sur la santé ont été déterminés et les expositions ont été réexaminées. Pour le PTBOE, des paramètres d’exposition mis à jour, utilisés pour estimer l’absorption cutanée de substances présentes dans les matelas ou les meubles rembourrés et les systèmes de retenue pour bébé ou enfant contenant de la mousse, ont été intégrés. Le présent document contient une caractérisation mise à jour des risques pour la santé humaine associés à l’exposition au PTPh et au PTBOE et une ébauche de conclusion sur ces risques mise à jour. Le public a l’occasion de commenter les données et les analyses contenues dans ce document avant qu’elles ne soient prises en compte dans l’évaluation finale du PTPh et du PTBOE et, le cas échéant, dans le document correspondant sur l’approche de gestion des risques.
Au Canada, le PTPh et le PTBOE sont principalement utilisés comme additifs ignifuges ou plastifiants dans diverses applications, notamment des peintures et des revêtements (PTPh et PTBOE), de la mousse (PTPh et PTBOE), des produits en plastique et en caoutchouc (PTPh), des lubrifiants et des graisses (PTPh), des adhésifs et des produits d’étanchéité (PTPh) et des revêtements de sol (PTBOE). Ces substances sont également utilisés dans des emballages alimentaires. De plus, le PTPh est utilisé comme produit de formulation dans des produits antiparasitaires et des produits de soins des ongles au Canada.
De nouveaux renseignements importants sur les effets critiques du PTPh ont été relevés dans la littérature scientifique depuis la publication de l’ébauche d’évaluation, ce qui a entraîné un changement dans le paramètre critique utilisé pour caractériser les risques. Les effets critiques associés à l’exposition au PTPh sont des effets sur le développement. Les personnes vivant au Canada peuvent être exposées au PTPh par la poussière, la terre, l’air intérieur, l’eau potable, les aliments, le lait maternel et l’utilisation de produits de consommation, notamment des produits de soins des ongles, des lubrifiants et des graisses, des matelas ou des meubles contenant de la mousse et des systèmes de retenue pour bébé et enfant (y compris des sièges d’appoint). Les enfants peuvent également être exposés en portant à la bouche des jouets en mousse ou d’autres produits proposés aux consommateurs contenant du PTPh. Dans le cas du PTPh, il est jugé que les marges d’exposition associées aux milieux naturels, aux aliments et au mâchonnement d’objets en mousse sont adéquates pour la prise en compte des incertitudes entourant les données sur l’exposition et les effets sur la santé utilisées pour caractériser les risques. Ce n’est cependant pas le cas pour les marges d’exposition calculées pour le contact cutané avec les produits de soins des ongles, les lubrifiants et les graisses, et pour le contact cutané prolongé associé au fait de s’allonger sur des matelas ou des meubles rembourrés contenant de la mousse ou de s’asseoir sur des systèmes de retenue pour bébé ou enfant (enfants de 0 à 13 ans), qui sont jugées potentiellement inadéquates aux fins de la prise en compte de ces incertitudes.
Pour le PTBOE, aucun changement important n’a été déterminé en matière d’effets sur la santé (effets sur le foie chez les hommes), d’exposition aux milieux naturels et aux aliments, ou d’exposition aux produits de consommation (par exemple peinture antirouille). Des mises à jour ont été apportées aux paramètres d’exposition utilisés pour estimer les expositions cutanées associées au fait d’être allongé sur un matelas ou un meuble rembourré contenant de la mousse et d’être assis dans un système de retenue pour bébé ou enfant (y compris dans un siège d’appoint). Il en découle que les marges calculées pour le contact cutané prolongé avec le PTBOE qui se produit lorsque des personnes de tous les groupes d’âge s’allongent sur des matelas ou des meubles rembourrés contenant de la mousse ou que des enfants de 0 à 13 ans s’assoient dans des systèmes de retenue pour bébé ou enfant sont jugées potentiellement inadéquates aux fins de la prise en compte des incertitudes entourant les données sur l’exposition et les effets sur la santé utilisées dans la caractérisation des risques.
L’évaluation des effets sur la santé humaine a tenu compte des groupes de personnes au sein de la population canadienne qui, en raison d’une sensibilité ou d’une exposition accrues, pourraient présenter une vulnérabilité accrue aux effets nocifs. Le potentiel d’une sensibilité accrue durant le développement et la reproduction a été évalué, et l’exposition selon l’âge a été estimée. Il a été constaté qu’en général, les nourrissons et les enfants sont davantage exposés que les adultes. Toutes ces populations ont été prises en considération lors de l’évaluation des effets nocifs potentiels sur la santé humaine.
À la lumière des renseignements contenus dans le présent document, il est proposé de conclure que le PTPh et le PTBOE satisfont aux critères énoncés à l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
1. Introduction
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada, 1999), les ministres de l’Environnement et de la Santé évaluent des substances afin de déterminer si elles présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine.
L’ébauche d’évaluation préalable du groupe des substances ignifuges, ci-après appelée l’« ébauche d’évaluation » a été publiée en novembre 2021 (ECCC, SC, 2021). Elle propose de conclure que le PTPh est nocif pour l’environnement, mais pas pour la santé humaine, et que le PTBOE n’est nocif ni pour la santé humaine ni pour l’environnement. Depuis la publication de cette évaluation, de nouveaux effets critiques importants sur la santé humaine ont été déterminés pour le PTPh, ce qui a entraîné un réexamen des expositions. En ce qui concerne le PTBOE, des paramètres d’exposition mis à jour, utilisés pour estimer l’absorption cutanée des substances présentes dans les matelas ou les meubles rembourrés contenant de la mousse et les systèmes de retenue pour bébé ou enfant (y compris les sièges d’appoint), ont été intégrés. Le présent document, qui vise à éclairer l’évaluation du groupe des substances ignifuges, contient une caractérisation mise à jour des risques pour la santé humaine associés à l’exposition au PTPh et au PTBOE ainsi qu’une ébauche de conclusion mise à jour sur ces risques.
La portée du présent document se limite à l’évaluation des préoccupations potentielles pour la santé humaine associées au PTPh et au PTBOE. Les données et les analyses contenues aux présentes permettent au public de commenter la caractérisation des risques mise à jour avant qu’elle ne soit prise en compte dans l’évaluation finale du PTPh et du PTBOE et, le cas échéant, dans le document correspondant sur l’approche de gestion des risques. Depuis la publication de la mise à jour de l’ébauche d’évaluation (ECCC, SC, 2021), nous n’avons relevé aucun changement important concernant l’évaluation des risques pour l’environnement du PTPh et du PTBOE qui justifierait d’autres consultations publiques.
Ce document comprend des données trouvées ou produites depuis novembre 2021, date de la publication de l’ébauche d’évaluation. En ce qui a trait au volet sur la santé humaine de l’évaluation, nous avons fait des recherches ciblées dans les publications scientifiques jusqu’en septembre 2023. Toutefois, des études plus récentes ou des renseignements obtenus dans le cadre de consultations de pairs internes et externes pourraient également être cités pour ce volet. Les données empiriques obtenues d’études clés, ainsi que quelques résultats provenant de modèles, ont servi à formuler les conclusions proposées. Nous avons également tenu compte des renseignements présentés dans des évaluations effectuées par d’autres autorités gouvernementales, lorsqu’ils étaient disponibles et pertinents.
Le PTPh et le PTBOE ont été détectés dans des produits de vapotage, également connus sous le nom de cigarettes électroniques (Wei et al., 2020). L’évaluation des risques pour la population générale découlant de cette utilisation, y compris la comparaison aux risques des cigarettes traditionnelles, et l’examen des options d’atténuation possibles de ceux-ci sont encadrés par un cadre législatif distinct (SC [modifié, 2024a, b]).
Le présent document supplémentaire a été préparé par le personnel du Programme des substances existantes de Santé Canada, avec l’appui de renseignements provenant d’autres programmes de ce ministère. Il a fait l’objet d’un examen écrit par des pairs ou de consultations externes. Ses parties techniques portant sur la santé humaine ont été commentées par Tetra Tech Inc. De plus, l’ébauche d’évaluation (publiée le 6 novembre 2021) a fait l’objet d’une période de consultation publique de 60 jours. À la lumière de ces commentaires, de nouveaux renseignements relevés dans la littérature scientifique et des paramètres d’exposition mis à jour, une modification de l’ébauche de caractérisation des risques pour la santé humaine est présentée ici. Bien que les commentaires externes aient été pris en compte, Santé Canada est responsable du contenu final du document.
Pour établir si les substances répondent aux critères de l’article 64 de la LCPE, l’évaluation s’appuie sur des renseignements scientifiques essentiels. Ceux-ci comprennent, s’ils sont disponibles, des renseignements sur les sous-populations susceptibles d’être plus sensibles ou plus exposées, sur les environnements vulnérables et sur les effets cumulatifsNote de bas de page 2. En outre, l’évaluation repose sur une approche fondée sur le poids de la preuve et le principe de précautionNote de bas de page 3. Dans la présente évaluation, nous exposons les données essentielles et les considérations sur lesquelles se fondent les conclusions proposées.
2. Évaluation du PTPh
2.1 Identité de la substance
Le numéro d’enregistrement du Chemical Abstracts Service (NE CAS), le nom sur la Liste intérieure (LI), le nom commun et l’abréviation du PTPh sont présentés dans le tableau 2-1. Des renseignements sur l’identité des substances et de leurs composants figurent ci-dessous.
| NE CAS (abréviation) | Nom sur la LI (nom commun) | Structure chimique représentative et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 115-86-6 (PTPh) | Phosphate de triphényle (phosphate de triphényle) | 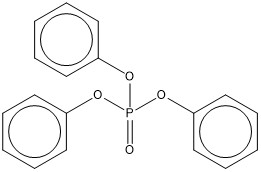 C18H15O4P |
326,29 |
Abréviations : NE CAS = numéro d’enregistrement du Chemical Abstracts Service; LI = Liste intérieure.
2.2 Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques du PTPh, obtenues par expérimentation et modélisation, est fourni dans l’ébauche d’évaluation (ECCC, SC, 2021).
2.3 Sources et utilisations
Des renseignements détaillés sur les nombreuses sources et utilisations du PTPh sont fournis dans l’ébauche d’évaluation du groupe des substances ignifuges (ECCC, SC, 2021). Les principales données sont résumées ci-dessous.
Le PTPh ne se trouve pas à l’état naturel dans l’environnement.
Le PTPh, en tant qu’organophosphate ignifuge, est le plus souvent utilisé comme produit ignifuge dans l’électronique, les lubrifiants, les plastiques, les caoutchoucs, les résines, les textiles, les élastomères, les adhésifs et les produits d’étanchéité. Cependant, il est également couramment utilisé comme plastifiant dans bon nombre des mêmes applications (US EPA, 2020a, 2020b), où il sert à améliorer la souplesse et la durabilité de certains matériaux, comme le polychlorure de vinyle (PVC), les mousses de polyuréthane souples et rigides, et les matériaux thermoplastiques (Marklund, 2005). Le PTPh a également été détecté dans des vêtements pour bébés et des textiles et tissus aux États-Unis (Zhu et al., 2020).
Le PTPh a été visé par des enquêtes menées en vertu de l’article 71 de la LCPE (Canada, 2012, 2016). Selon les renseignements fournis dans le cadre de ces enquêtes, le PTPh n’était pas fabriqué au Canada en 2011 et en 2015. Cependant, un total de 100 000 à 10 000 000 kg de PTPh a été importé au pays durant chacune de ces 2 années (Environnement Canada, 2013; ECCC, 2016)Note de bas de page 4. La mesure dans laquelle les valeurs déclarées représentent les quantités présentes dans les produits manufacturés entrant au Canada en provenance d’autres parties du monde est inconnue, car il est peu probable que ces utilisations satisfassent aux critères de déclaration de ces enquêtes. Les données recueillies en 2021 indiquaient que les quantités importées de PTPh peuvent être légèrement inférieures aux quantités déclarées dans le cadre de l’article 71 et des enquêtes de suivi volontaire (ECCC, 2022).
Selon les renseignements fournis en réponse aux enquêtes menées en vertu de l’article 71 de la LCPE (ECCC, 2016; Environnement Canada, 2013), le PTPh est principalement utilisé au Canada comme additif ignifuge ou comme plastifiant dans des produits de consommation et des produits commerciaux, comme des adhésifs et des produits d’étanchéité, des peintures et des revêtements, des lubrifiants et des graisses, ainsi que dans des formulations de plastique et de caoutchouc. Il a été détecté dans des produits contenant de la mousse proposés aux consommateurs au Canada, comme des matelas, des meubles rembourrés et des produits pour enfants, notamment des systèmes de retenue pour bébé et enfant (CCE, 2015; Santé Canada, 2019).
Au Canada, le PTPh peut être utilisé dans l’emballage des aliments, sous forme de composant de fabrication de certaines encres d’impression pouvant être appliquées sur la couche extérieure de structures en plastique stratifié servant à des applications d’emballage alimentaire (communication personnelle, courriel de la Direction de l’alimentation et de la nutrition, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, Santé Canada, daté du 28 mars 2018; source non citée). Il peut également être utilisé dans les formulations de lubrifiants; ceux-ci n’entreront pas en contact avec les aliments et, par conséquent, il n’y a pas d’exposition potentielle à ces substances en raison de cette utilisation (communication personnelle, courriel de la Direction de l’alimentation et de la nutrition, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, Santé Canada, daté du 20 mai 2022; source non citée).
D’après les déclarations soumises à Santé Canada en vertu du Règlement sur les cosmétiques, le PTPh est utilisé dans des cosmétiques au Canada, principalement des produits de soins des ongles (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, Santé Canada, daté du 16 mai 2022; source non citée).
Au Canada, le PTPh peut également être utilisé comme produit de formulation dans les produits antiparasitaires et est actuellement présent dans 2 produits antiparasitaires homologués à usage domestique, qui sont tous 2 des peintures antisalissures à applications marines (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, Santé Canada, daté du 18 mai 2022; source non citée).
2.4 Potentiel d’effets nocifs sur la santé humaine
2.4.1 Évaluation de l’exposition au PTPh
2.4.1.1 Milieux environnementaux et aliments
Aucun changement important n’a été apporté à l’exposition au PTPh provenant de l’air ambiant et intérieur, de l’eau potable, du sol et de la poussière décrite à la section 2.7.1.1 de l’ébauche d’évaluation (ECCC, SC, 2021). L’annexe A contient les données sur les divers milieux utilisées pour estimer l’absorption quotidienne chez divers groupes d’âge. Des données supplémentaires sur les concentrations de PTPh mesurées dans des aliments et le lait maternel ont été recueillies et sont résumées ci-dessous.
Il a été déterminé qu’au Canada, le PTPh était utilisé comme additif dans un petit nombre d’encres d’impression pouvant être appliquées sur la couche extérieure de structures en plastique stratifié servant à des applications d’emballage alimentaire. L’exposition potentielle au PTPh associée aux utilisations d’emballages alimentaires, lesquelles n’entraînent pas de contact direct avec les aliments, devrait être négligeable. Toute contribution à l’exposition alimentaire totale découlant de ces utilisations serait prise en compte dans les données d’occurrence dans les aliments transformés qui ont été employées dans l’évaluation (communication personnelle, courriel de la Direction de l’alimentation et de la nutrition, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, Santé Canada, daté du 2 février 2023; source non citée).
En raison de diverses utilisations anthropiques, le PTPh peut pénétrer dans l’environnement et a été détecté à des concentrations généralement faibles dans les aliments. Dans l’ensemble, très peu de données sur l’occurrence du PTPh dans les aliments au Canada sont disponibles. Il existe quelques données sur les aliments pour nourrissons provenant de l’enquête du Projet sur les aliments destinés aux enfants de l’Agence canadienne d’inspection des aliments (ACIA, 2019-2021), mais elles sont assez limitées (n = 13). Par conséquent, les données utilisées dans l’évaluation de l’exposition alimentaire provenaient principalement d’une étude américaine (Wang et Kannan, 2018) et, dans une moindre mesure, d’études menées en Australie (He et al., 2018), en Belgique (Poma et al., 2018), en Chine (Zhao et al., 2019a) et en Suède (Poma et al., 2017) (annexe B, tableau B-1). Les concentrations maximales de PTPh dans les aliments et les boissons ont été utilisées, par souci de prudence, pour estimer les expositions dans l’évaluation et sont présentées à l’annexe B (annexe B, tableau B-1). L’exposition moyenne au PTPh de « toutes les personnes », tous groupes d’âges confondus, variait de 0,021 à 0,64 μg/kg p.c./j (annexe B, tableau B-2).
Il n’existe pas de données canadiennes sur le PTPh dans le lait maternel, mais cette substance a été détectée dans le lait maternel aux États-Unis, en Suède, en Espagne, au Japon, au Vietnam, en Chine et aux Philippines (Beser et al., 2020; Chen et al., 2021; Kim et al., 2014; Ma et al., 2019; Sundkvist et al., 2010; Zheng et al., 2021) (annexe C, tableau C-1). Les études américaines sont considérées comme les plus applicables à la population générale du Canada, de sorte que la valeur maximale de 0,760 ng/mL de l’étude de Ma et al. (2019) a été utilisée, par souci de prudence, dans l’estimation de l’exposition des nourrissons nourris au lait maternel âgés de 0 à 5 mois (0,094 μg/kg p.c./j) et de 6 à 11 mois (0,053 μg/kg p.c./j; annexe A, tableau A-2).
Il n’existe pas de données canadiennes sur le PTPh dans les préparations pour nourrissons, mais cette substance a été détectée dans des échantillons de préparations achetés et analysés en Chine dans 2 études (Chen et al., 2022; Zhou et al., 2022). L’étude de Chen et al. (2022) portait sur l’analyse de 75 échantillons de préparations pour nourrissons en poudre achetés en mars 2021 dans des supermarchés de Beijing. Plusieurs des préparations achetées avaient été importées d’Europe et de Nouvelle-Zélande (53 sur 75). Sur les 75 préparations testées, 25 étaient considérées comme des « préparations de stade 1 » destinées aux nourrissons de 0 à 6 mois, tandis que 25 étaient des préparations de stade 2 (7 à 12 mois) et de stade 3 (13 à 36 mois). Le PTPh a été détecté dans 100 % des échantillons, tous stades confondus (n = 75). Des moyennes de 19,53 ng/g, 24,07 ng/g et 23,71 ng/g de PTPh ont été obtenues pour les préparations pour nourrissons de stades 1, 2 et 3, respectivement (Chen et al., 2022). Les concentrations de PTPh présentées dans l’étude de Zhou et al. (2022) (sous l’acronyme TPPA) pour les 54 échantillons de préparations pour nourrissons analysées se situaient dans la fourchette des concentrations de PTPh indiquées dans l’étude de Chen et al. (2022), mais les moyennes étaient plus faibles et la fréquence de détection s’élevait à 85,2 %. Nous avons donc utilisé les moyennes des préparations pour nourrissons de stades 1 et 2 présentées par Chen et al. (2022) pour estimer l’absorption quotidienne de PTPh chez les nourrissons de 0 à 5 mois et de 6 à 11 mois nourris aux préparations.
Les estimations de l’exposition totale au PTPh par les milieux naturels et les aliments de la population générale au Canada variaient de 0,079 μg/kg p.c./j pour les personnes âgées de 14 à 18 ans à 1,2 μg/kg p.c./j pour les nourrissons nourris aux préparations âgés de 6 à 11 mois (annexe A).
2.4.1.2 Produits de consommation
Cosmétiques
D’après les déclarations soumises à Santé Canada en vertu du Règlement sur les cosmétiques, le PTPh est utilisé dans divers produits de soins des ongles au Canada, comme des vernis de base, des protecteurs de vernis, des vernis à ongles, ainsi que des trousses de manucure. Ses concentrations y varient de moins de 0,1 % à 30 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, Santé Canada, daté du 16 mai 2022; source non citée). La fonction du PTPh dans ces produits est celle de plastifiant (Mendelsohn et al., 2016). Étant donné que le PTPh a une faible pression de vapeur (1,68 x 10-4 Pa), il est considéré que la voie cutanée est la principale voie d’exposition (Estill et al., 2021; Mendelsohn et al., 2016), une idée corroborée par des études durant lesquelles on a mesuré les concentrations de PTPh dans l’air de salons de manucure (Estill et al., 2021; Nguyen et al., 2022) et obtenu des estimations de l’exposition par inhalation (données non présentées) inférieures de plusieurs ordres de grandeur à celles indiquées ci-dessous (tableau 2-2) pour l’exposition cutanée. Par conséquent, nous présentons uniquement les estimations de l’exposition cutanée.
Des données limitées sur l’absorption cutanée du PTPh ont été tirées de 2 études à doses infinies qui portaient sur plusieurs produits ignifuges à base d’esters d’organophosphate (Frederiksen et al., 2018; Zhang et al., 2022). Les expositions au PTPh provenant de produits et d’articles manufacturés dont il est question ici sont toutes des scénarios à doses finies auxquels les études à doses infinies ont une applicabilité limitée. De plus, ces études ne tiennent pas compte de tous les résidus collés à la peau pertinents dans les coefficients de perméabilité précisés et peuvent sous-estimer l’exposition par voie cutanée. Le Comité scientifique pour la sécurité des consommateurs (CSSC) a également reconnu le manque de données pertinentes sur l’absorption cutanée du PTPh dans son ébauche d’avis sur le phosphate de triphényle et a indiqué qu’une absorption cutanée par défaut de 50 % serait donc utilisée dans ses estimations de l’exposition (CSSC, 2024). La même approche a été adoptée ici.
Le tableau 2-2 résume les doses cutanées découlant des produits de soins des ongles contenant du PTPh qui sont proposés aux consommateurs. Étant donné que le vernis de base, le vernis et le protecteur de vernis peuvent être utilisés ensemble, nous avons regroupé les expositions cutanées estimées des personnes de 14 ans et plus découlant de ces trois produits. Nous indiquons les estimations de l’exposition cutanée obtenues pour la trousse de manucure uniquement ainsi que les expositions globales calculées pour la trousse et 2 couches de vernis à ongles. Des renseignements détaillés sur la méthode et les paramètres utilisés pour estimer l’exposition cutanée externe au PTPh contenu dans les produits de soins des ongles figurent au tableau D-1 de l’annexe D.
| Groupe d’âge | Vernis de baseb | Vernis à ongles | Protecteur de vernisb | Exposition globale (vernis de base, vernis à ongles, protecteur de vernis) | Trousse de manucurec | Trousse de manucure avec vernisc,d |
|---|---|---|---|---|---|---|
| 19 ans et plus | 0,027 | 0,16 | 0,047 | 0,24 | 0,16 | 0,24 |
| 14 à 18 ans | 0,032 | 0,19 | 0,056 | 0,28 | 0,19 | 0,29 |
| 9 à 13 ans | S.O. | 0,28 | S.O. | S.O. | 0,28 | 0,43 |
| 4 à 8 ans | S.O. | 0,20 | S.O. | S.O. | S.O. | S.O. |
Abréviation : S.O. = sans objet.
a Absorption cutanée de 50 %.
b Produit qui ne devrait pas être utilisé par des enfants de moins de 14 ans.
c Produit qui ne devrait pas être utilisé par des enfants de moins de 9 ans.
d Estimation globale de l’exposition au PTPh attribuable à l’utilisation d’une trousse de manucure et de 2 couches de vernis sur les ongles des doigts (par exemple pour les adultes : 0,16 [exposition par la trousse de manucure] + (0,16/2) [deux couches de vernis sur les ongles des doigts seulement] = 0,24 mg/kg p.c. par événement.
Autres produits
Au Canada, le PTPh a été déclaré comme étant un ingrédient de fabrication de lubrifiants et de graisses offerts aux consommateurs (par exemple fluide de servodirection, huiles moteur, graisses synthétiques), à des concentrations variant entre 0,1 et 1 % (Environnement Canada, 2013; FDS, 2017; FDS, 2021; US EPA, 2020b). Les expositions cutanées ont été estimées pour les utilisateurs adultes et variaient de 4,2×10-4 à 4,2×10-3 mg/kg p.c./événement (voir l’annexe D pour en savoir plus).
Articles manufacturés
Le PTPh est l’un des nombreux produits ignifuges intégrés aux mousses de polyuréthane souples lors de leur production (Marklund, 2005). Il est couramment présent dans les mélanges ignifuges commerciaux, dont le Firemaster 550 (FM550) (McGee et al., 2013; Phillips et al., 2017). Quelques études font état de la concentration de FM550 comme la somme du PTPh et des 2 substances bromées (tétrabromobenzoate de 2-éthylhexyle [TBB] et tétrabromophtalate de bis[2-éthylhexyle] [TBPH]) qui constituent la majeure partie de ce mélange (Stapleton et al., 2012), tandis que d’autres ont utilisé un étalon authentique de FM550 pour la quantification (Cooper et al., 2016). Le PTPh a été détecté dans des produits contenant de la mousse proposés aux consommateurs au Canada, notamment des meubles comme des canapés et des produits pour enfants (tapis de sieste, porte-bébé, matelas pour bébés, systèmes de retenue pour bébé et enfant, matelas de table à langer, matelas portables et fauteuils à bascule) (CEH, 2013a, b; CCE, 2015; Cooper et al., 2016; EPA du Danemark, 2015; Santé Canada, 2019; Stapleton et al., 2011; Rodgers et al., 2021). Le tableau 2-3 résume l’information disponible sur la concentration de PTPh mesurée dans divers produits.
| Article(s) manufacturé(s) | Concentration de PTPh | Référence |
|---|---|---|
| Mousse provenant de systèmes de retenue pour enfant (n = 10), d’autres produits pour enfants (n = 10), de meubles rembourrés (n = 10), de matelas en mousse (n = 10), de surmatelas (n = 9) et d’oreillers (n = 1) achetés au Canada | Non détecté (seuil de quantification [SQ] = 0,0012 %) à 1,8 % p/p (c’est-à-dire concentration supérieure au SQ dans la mousse de polyuréthane provenant de 4 systèmes de retenue pour enfant, 4 autres produits pour enfants, un meuble rembourré et trois matelas en mousse) |
Santé Canada, 2019 |
| Produits pour enfants, dont des échantillons de mousse et de tissu (par exemple chaises en mousse, pyjamas, tapis de sieste, surmatelas, couverture, draps pour lit de bébé, jouets, tuiles en mousse, matelas pour lit de bébé) (n = 111 échantillons provenant de 41 produits), achetés au Canada | Non détecté au-dessus du SQ (0,0004 % p/p) | Santé Canada, 2023a |
| Matériaux de construction et coussins en mousse (par exemple revêtement de sol, papier peint, tapis, carreaux de plafond, stores, coussin d’allaitement, oreiller pour tout-petit) (n = 38 échantillons de 23 produits) achetés au Canada | 0,007 % (store) 0,017 % (papier peint) Détecté dans un échantillon de store et un échantillon de papier peint; seuil de détection (SD) = 0,0004 % p/p |
Santé Canada, 2023b |
| Mousse provenant de produits pour enfants (n = 27 échantillons de 19 produits) achetés au Canada | 0,0056 % p/p (livre de bain) Détecté dans un échantillon; SD = 0,0004 % p/p |
Santé Canada, 2023c |
| Mousse, tissu, rembourrage, capitonnage et garniture de divers produits d’ameublement (n = 132; par exemple chaises, canapés, poufs) achetés en 2014 et 2015 au Canada, aux États-Unis et au Mexique | 0,02 à 1,15 % p/p (dans la publication : 200 à 11 500 ppm) PTPh détecté dans 82 % des échantillons de mousse, 9 % des échantillons de tissu et 18 % des « autres » échantillons (de 11 produits) Le PTPh a été détecté dans 5 %, 0,1 % et 1 % des produits achetés au Canada, au Mexique et aux États-Unis, respectivement. |
CCE, 2015 |
| Systèmes de retenue pour enfant (n = 387 échantillons de matériaux provenant de 15 systèmes ou sièges) achetés aux États-Unis | (dans la publication : 11 000 ppm) Détecté dans la mousse d’un système de retenue pour enfant |
Miller et Gearhart, 2016 |
| Systèmes de retenue pour enfant (n = 36 échantillons, y compris mousse, tissu et composites de mousse et de tissu, 18 systèmes ou sièges) achetés aux États-Unis en 2018 | Non détecté (SD = 0,0002 %) à 0,041 % Le PTPh a été détecté dans 72 % des échantillons. |
Wu et al., 2019 |
Abréviations : SD = seuil de détection; SQ = seuil de quantification.
L’exposition cutanée prolongée au PTPh associée au fait de s’allonger sur des matelas ou des meubles rembourrés contenant de la mousse et de s’asseoir sur des systèmes de retenue pour bébé ou enfant (y compris les sièges d’appoint) contenant du PTPh est décrite dans le tableau 2-4. Des renseignements détaillés sur le scénario sont donnés à l’annexe D.
Le PTPh a également été détecté dans des jouets en plastique, en caoutchouc, en bois, en mousse et en textile à Anvers, en Belgique (Ionas et al., 2014) et dans divers produits pour enfants aux États-Unis (Stapleton et al., 2011). On s’attend à ce que certains des mêmes types de produits pour enfants que ceux qui contiennent du PTPh en Europe et aux États-Unis soient présents au Canada. Par conséquent, des estimations de l’exposition au PTPh par mâchonnement ont également été calculées (tableau 2-4), comme il est décrit à l’annexe D.
Dans une étude, Davis et al. (2021) ont évalué des chaises dotées de différentes technologies ignifuges afin de connaître l’exposition aux produits ignifuges par inhalation, ingestion et contact cutané dont elles sont à l’origine. Dans le cas d’une chaise dans un salon moyennement ventilé, l’inhalation était la voie de moindre exposition aux produits ignifuges, représentant moins de 1 % de la dose journalière moyenne totale de PTPh. Par conséquent, nous n’avons pas calculé d’exposition par inhalation.
| Voie d’exposition | Source | Groupe d’âge | Estimation de l’exposition (mg/kg p.c./j) |
|---|---|---|---|
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 0 à 5 mois | 1,3×10-2 à 8,0×10-2 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 6 à 11 mois | 1,1×10-2 à 7,1×10-2 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 1 an | 1,1×10-2 à 7,1×10-2 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 2 à 3 ans | 6,8×10-3 à 5,8×10-2 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 4 à 8 ans | 5,5×10-3 à 4,9×10-2 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 9 à 13 ans | 4,2×10-3 à 3,9×10-2 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 14 à 18 ans | 3,0×10-3 à 2,9×10-2 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 19 ans et plus | 2,7×10-3 à 2,3×10-2 |
| Cutanée | Mousse/tissu dans les systèmes de retenue pour bébé et enfant | 0 à 5 mois | 3,0×10-3 à 5,6×10-3 |
| Cutanée | Mousse/tissu dans les systèmes de retenue pour bébé et enfant | 6 à 11 mois | 2,7×10-3 à 5,0×10-3 |
| Cutanée | Mousse/tissu dans les systèmes de retenue pour bébé et enfant | 1 an | 2,5×10-3 à 4,7×10-3 |
| Cutanée | Mousse/tissu dans les systèmes de retenue pour bébé et enfant | 2 à 3 ans | 1,7×10-3 à 3,2×10-3 |
| Cutanée | Mousse/tissu dans les systèmes de retenue pour bébé et enfant | 4 à 8 ans | 1,5×10-3 à 2,7×10-3 |
| Cutanée | Mousse/tissu dans les systèmes de retenue pour bébé et enfant | 9 à 13 ansb | 1,2×10-3 à 2,2×10-3 |
| Orale | Mousse contenue dans des produits pour enfants | 0 à 5 mois | 1,6×10-4 à 1,5×10-3 |
| Orale | Mousse contenue dans des produits pour enfants | 6 à 11 mois | 1,1×10-4 à 1,0×10-3 |
| Orale | Mousse contenue dans des produits pour enfants | 1 an | 9,1×10-5 à 8,4×10-4 |
| Orale | Mousse contenue dans des produits pour enfants | 2 à 3 ans | 6,7×10-5 à 6,2×10-4 |
a Une absorption cutanée de 50 % a été supposée.
b Les règlements sur les systèmes de retenue pour bébé et enfant au Canada varient selon la province et le territoire (ASEPC, 2019). En nous fondant sur des facteurs pertinents en matière d’âge et de poids, nous avons estimé l’exposition cutanée pour divers groupes d’âge jusqu’au groupe des enfants âgés de 9 à 13 ans, inclusivement.
Le PTPh n’a pas été détecté en des concentrations supérieures au seuil de détection (SD = 0,0004 % p/p ou 4 000 ng/g) dans les tissus analysés de produits pour enfants, y compris les pyjamas achetés au Canada (Santé Canada, 2023a; voir le tableau 2-3). Il a été mesuré dans divers textiles achetés aux États-Unis, notamment des vêtements pour bébés (par exemple, chaussettes, cache-couches, pantalons, jupes, chemises) et les tissus bruts (c’est-à-dire les tissus disponibles avant couture qui sont commercialisés pour diverses applications, notamment les rideaux, les coussins et les meubles de jardin) (Zhu et al., 2020). Le seuil de détection de la méthode (SDM) de l’étude de Zhu et al. (2020), 0,24 ng/g, était inférieur à celui de l’étude de Santé Canada (2023a). Les concentrations de PTPh dans les textiles traditionnels analysés par Zhu et al. (2020), qui comprenaient des vêtements pour bébés (n = 52) et des tissus bruts (n = 29) en coton, polyester ou nylon, variaient de moins de 0,8 ng/g (seuil de quantification de la méthode [SQM]) à 3 350 ng/g. Les estimations de l’exposition cutanée des nourrissons au PTPh présent dans les vêtements, calculées dans Zhu et al. (2020) à partir des concentrations au 95e centile, variaient de 2 860 à 3 560 pg/kg p.c./j.
2.4.1.3 Biosurveillance
Du phosphate de diphényle (PDPh), un métabolite du PTPh et d’autres organophosphates ignifuges (Kosarac et al., 2016; He et al., 2018; Bjornsdotter et al., 2018), a été mesuré dans l’urine dans le cadre de nombreuses études de biosurveillance humaine au Canada, aux États-Unis et ailleurs, notamment l’Enquête canadienne sur les mesures de la santé (ECMS), une étude de l’Étude mère-enfant sur les composés chimiques de l’environnement (MIREC) et la National Health and Nutrition Examination Survey (NHANES) des États-Unis (NHANES, 2011-2018; Butt et al., 2014, 2016; Fromme et al., 2014; Cequier et al., 2015; Kosarac et al., 2016; Thomas et al., 2016; Hoffman et al., 2017; Yang et al., 2017; He et al., 2018; Ospina et al., 2018; Phillips et al., 2018; Wang et al., 2019; Hammel et al., 2020; Siddique et al., 2020; Schoeters et al., 2022; Siddique et al., 2022; Santé Canada, 2023d; Ashley-Martin et al., 2023). Il a également été mesuré dans le sérum (Li et al., 2017; Ma et al., 2017), les cheveux et les ongles (Alves et al., 2017; Liu et al., 2016).
Étant donné que le PDPh est un métabolite de plusieurs organophosphates ignifuges et qu’il peut également être utilisé lui-même dans diverses applications industrielles, l’origine du composé dans l’urine est inconnue (Kosarac et al., 2016; Bjornsdotter et al., 2018). Outre le fait que le PDPh n’est pas un biomarqueur unique du PTPh, il n’y a pas suffisamment d’information sur la cinétique et la métabolisation du PTPh pour calculer des estimations de l’exposition (voir la section 2.4.2.1). Un biomarqueur plus précis du PTPh a été déterminé par Su et al. (2016) et Zhao (2019b). Cependant, il faut obtenir des renseignements supplémentaires et des mesures des concentrations de ce métabolite chez l’humain avant de pouvoir l’utiliser pour estimer l’exposition humaine.
2.4.1.4 Prise en compte des sous-populations qui peuvent être plus fortement exposées
Certains groupes de personnes vivant au Canada peuvent être plus susceptibles de subir des effets nocifs sur la santé découlant de l’exposition à des substances, en raison d’une plus grande exposition. Nous avons donc examiné le potentiel d’exposition élevée au sein de la population canadienne. Nous avons systématiquement évalué les estimations de l’exposition en fonction de l’âge pour tenir compte des différences physiques et comportementales entre les étapes de la vie. Nous avons constaté, d’après l’évaluation de l’exposition de fond découlant des milieux naturels, de l’air intérieur, des aliments, de l’eau potable, de la poussière et du sol, que les jeunes enfants étaient plus exposés que les adultes. De plus, les nourrissons nourris au lait maternel étaient plus exposés que les nourrissons nourris aux préparations et les adultes. Les nourrissons et les enfants étaient également plus exposés au PTPh provenant d’articles manufacturés (par exemple meubles ou matelas contenant de la mousse) que les adultes. Les produits pour enfants examinés lors de l’évaluation de l’exposition au PTPh présent dans les produits de consommation comprenaient la mousse de jouets et de produits pour enfants ainsi que du vernis à ongles. Nous avons également examiné le potentiel d’exposition élevée au PTPh des personnes qui fréquentent les salons de manucure, notamment au moyen d’études menées dans des salons au Canada (Nguyen et al., 2022) et aux États-Unis (Estill et al., 2021; Mendelsohn et al., 2016).
2.4.2 Évaluation des effets du PTPh sur la santé
Le PTPh a été évalué par l’Agency for Toxic Substances and Disease Registry (ATSDR) (2012) et l’Organisation de coopération et de développement économiques (OCDE) (2002). Nous avons fait des recherches documentaires ciblées à compter d’un an avant la publication de l’ébauche d’évaluation jusqu’en février 2023, et cerné des études sur les effets sur la santé qui pourraient avoir une incidence sur la caractérisation des risques (c’est-à-dire qui aboutiraient à des paramètres critiques différents ou à des points de départ plus faibles que ceux indiqués dans ECCC, SC [2021]).
Une évaluation de l’innocuité du PTPh utilisé dans les cosmétiques était également disponible (CIR, 2018).
2.4.2.1 Toxicocinétique
Le phosphate de triphényle (PTPh) se dégrade par hydrolyse dans l’homogénat de foie de rat pour former comme principal métabolite du phosphate de diphényle (PDPh) (OCDE, 2002). D’autres métabolites ont été déterminés grâce à l’exposition in vitro de microsomes hépatiques humains; le PTPh a été converti en diester (PDPh) et en métabolites monohydroxylés et déshydroxylés par l’action du cytochrome P450 (Zhang et al., 2018). Une étude de Selmi-Ruby et al. (2020) laisse entendre que le PDPh pourrait ne pas être le principal métabolite du PTPh après une administration par gavage ou dans l’eau potable. L’absorption cutanée et la pénétration percutanée du PTPh ont été étudiées à l’aide de peau humaine dans des cellules de diffusion de Franz. Le PTPh avait tendance à s’accumuler dans les tissus cutanés, principalement dans les couches supérieures. Seules de « plus petites quantités » de PTPh ont pénétré dans la peau et ont atteint le liquide récepteur en 72 heures (Frederiksen et al., 2018). Le PTPh a le potentiel d’être absorbé par voie cutanée après une application cosmétique chez l’humain (Mendelsohn et al., 2016, cité dans CIR, 2018). Une moyenne de 41 % de PTPh est retenue dans les poumons lors d’une inhalation à un débit de 18 L/min. Ce taux de rétention augmente avec la taille des particules et le débit (Landhal et al., 1951, 1952, cités dans ATSDR, 2012).
Plusieurs voies d’élimination possibles chez l’humain ont été indiquées pour le PTPh. Le taux de clairance rénale du PTPh a été estimé à 68,9 mL/kg/j au moyen d’une comparaison d’échantillons appariés de PTPh et de PDPh (métabolite diester du PTPh) dans le plasma et l’urine humains, respectivement, de 30 personnes en Chine. La clairance hépatique du PTPh chez l’humain a été extrapolée à partir de la clairance in vitro de microsomes hépatiques humains, ce qui a donné une valeur estimée à 166 mL/kg/j. Comme la clairance hépatique du PTPh était plus élevée que la clairance rénale, les auteurs laissent entendre que d’autres méthodes d’élimination sont possibles. La liaison avec les protéines plasmatiques pourrait également influer sur la clairance du PTPh, car l’affinité de liaison du PTPh était de 97,4 % (Wang et al., 2020).
À partir d’échantillons appariés de sang total maternel et de sang total de cordon ombilical provenant de femmes enceintes en Chine, il a été déterminé que le PTPh avait une valeur d’efficacité de transfert transplacentaire de 1,06 (rapport entre la concentration dans le sang de cordon ombilical et la concentration dans le sang maternel). En se fondant sur ce rapport et le log Koe (4,70), les auteurs considèrent que la diffusion passive est le principal mode de transfert à travers le placenta, mais que le transport actif peut également jouer un rôle (Wang et al., 2021).
2.4.2.2 Cancérogénicité et toxicité génétique
Aucune étude sur la cancérogénicité du PTPh n’a été recensée. Le PTPh n’est pas considéré comme génotoxique, d’après des preuves négatives de mutagénicité dans des essais in vitro effectués sur le Salmonella typhimurium, avec et sans activation métabolique (ATSDR, 2012).
2.4.2.3 Toxicité à doses répétées
Deux études sur la toxicité par voie orale de 4 mois étaient disponibles. Des rats ont été exposés au PTPh à des doses de 0, 161, 345, 517 ou 711 mg/kg p.c./j dans leur alimentation. Une réduction statistiquement significative du poids de croissance a été constatée par Sobotka et al. (1986, cité dans OCDE, 2002) aux doses de 345 mg/kg p.c./j et plus chez les rats mâles (seul sexe mis à l’essai dans cette étude). Ce changement n’a été observé qu’à la dose de 711 mg/kg p.c./j par Hinton et al. (1987, cité dans OCDE, 2002). Cependant, seules des données limitées sont indiquées, et un certain nombre de paramètres normalisés de la toxicité à doses répétées sont manquants, notamment la mesure du poids des organes et l’histopathologie des organes autres que les organes lymphoïdes (rate, thymus, ganglions lymphatiques) ainsi que l’hématologie et les paramètres de chimie clinique autres que les protéines sériques.
Dans une étude d’exposition par voie orale de 90 jours conforme à la ligne directrice 408 de l’OCDE, des rats Wistar mâles et femelles ont reçu par leur alimentation des doses de PTPh de 0, 20, 105 et 583 mg/kg p.c./j et de 0, 22, 117 et 632 mg/kg p.c./j, respectivement (ECHA, c2007-2018). Les augmentations du poids du foie liées au traitement constatées chez les groupes ayant reçu la dose élevée (environ 30 % et 21 % pour les mâles et les femelles, respectivement) ont été considérées comme indésirables, bien qu’aucun changement histopathologique indésirable n’ait été observé dans le foie. Les auteurs ont noté que la dose minimale avec effet observé (DMEO) de cette étude était de 105 mg/kg p.c./j, d’après l’augmentation du poids du foie à la dose suivante de 583 mg/kg p.c./j.
Dans une étude de l’exposition par voie orale de courte durée conforme à la ligne directrice 407 de l’OCDE, des rats Wistar ont été exposés par leur alimentation à des doses de PTPh de 0, 23,5, 161,4 ou 701 mg/kg p.c./j pendant 28 jours (ECHA, c2007-2018). Une diminution du gain de poids corporel a été observée chez les mâles à la dose de 161,4 mg/kg p.c./j. À la dose de 701 mg/kg p.c./j, on a noté une augmentation de la consommation alimentaire chez les mâles et les femelles. Une augmentation statistiquement significative du poids du foie a également été constatée à la dose de 701 mg/kg p.c./j chez les 2 sexes. Les mâles présentaient une fréquence plus élevée d’hypertrophie du foie. Cette tendance est corrélée à l’apparition d’une légère hypertrophie ou d’un léger changement cytoplasmique des hépatocytes périportaux chez les mâles à la dose de 161,4 mg/kg p.c./j, tandis que cet effet n’a été vu qu’à la dose de 701 mg/kg p.c./j chez les femelles. À cette même dose chez les femelles, on a également observé des changements dans le foie marqués par une hypertrophie minime à légère ou un changement cytoplasmique minime à léger des hépatocytes périportaux et des hépatocytes dans les régions périportales et partiellement médianes, qui se manifestaient par des éosinophiles d’apparence enflée et un cytoplasme granuleux homogène ressemblant à de la poussière. La dose sans effet nocif observé (DSENO) a été établie à 161,4 mg/kg p.c./j, d’après la diminution du gain de poids corporel et des effets sur le foie à la dose testée suivante. Dans une autre étude, seules une légère diminution du gain de poids corporel et une augmentation du poids du foie à une dose de 350 mg/kg p.c./j ont été observées après 35 jours de traitement (Sutton et al., 1960, cité dans OCDE, 2002).
Au cours d’une étude non conforme aux lignes directrices de l’OCDE sur la toxicité à court terme menée par le National Toxicology Program (NTP), des groupes de rats mâles (Sprague-Dawley; 5 par groupe) ont reçu du PTPh par gavage à des doses de 0, 55, 110, 220, 441 et 881 mg/kg p.c./j une fois par jour pendant 4 jours consécutifs (NTP, 2018). Les animaux ont été sacrifiés un jour après l’exposition finale. Les observations cliniques, le poids corporel, le poids des organes et la chimie clinique ont été évalués. Les changements transcriptomiques du foie ont également été évalués, et il a été souligné que d’autres essais comprenant des doses plus faibles seraient nécessaires pour affiner les estimations du point de départ transcriptionnel. Tous les animaux ont survécu au traitement. Aucune différence n’a été observée dans l’incidence des observations cliniques entre les animaux traités et les animaux témoins. Les paramètres apicaux les plus sensibles pour lesquels des valeurs de dose de référence (DR) ont pu être obtenues étaient les taux sériques de cholestérol à lipoprotéines de haute densité (HDL), le poids absolu du foie, le poids relatif du foie et le taux de cholestérol sérique. La limite inférieure de l’intervalle de confiance de la dose de référence (c’est-à-dire une augmentation d’un écart-type par rapport à la concentration de fond) (et la DR) s’élevait à 39 (79), 48 (136), 71 (103) et 90 (142) mg/kg, respectivement. Bien que la cholinestérase sérique semblait être un paramètre sensible (diminution de 35 à 70 %) à toutes les doses, en commençant par celle de 55 mg/kg (la dose la plus faible avec effet observé), sa DR n’a pas pu être déterminée en raison d’un mauvais ajustement du modèle.
Lors d’une étude non conforme aux lignes directrices, la microflore rénale et intestinale a été évaluée avec et sans exposition à un régime riche en fructose et en matières grasses, et avec et sans exposition au PTPh. Les résultats de l’exposition au PTPh seul sont présentés dans la présente évaluation. Des groupes de 8 souris mâles (C57BL/6J) ont reçu une ration témoin, une dose de 0,01 mg/kg p.c./j de PTPh dans l’alimentation et une dose de 1 mg/kg p.c./j de PTPh dans l’alimentation pendant 12 semaines. Aux 2 doses de PTPh, on a observé que les souris présentaient des troubles du microbiote intestinal. Une inflammation significative, fondée sur l’augmentation des taux de cytokines, a été signalée à partir de la dose de 0,01 mg/kg p.c./j. Des lésions structurales des reins ont été observées dans le groupe recevant une dose de 1 mg/kg p.c./j (vacuolisation des cellules épithéliales des tubules rénaux, atrophie glomérulaire, formation de vacuoles cytosoliques dans le cortex), en plus d’une augmentation des taux de protéines totales dans l’urine et de protéines/créatinine dans l’urine, ce qui indique des lésions rénales. En outre, la fibrose du tissu rénal augmentait significativement à cette dose (Cui et al., 2020). Étant donné que ces effets sur les reins n’ont pas été observés dans les 2 études conformes aux lignes directrices disponibles menées chez le rat (ECHA, c2007-2018), les résultats de cette étude (Cui et al., 2020) n’ont pas été pris en compte pour la caractérisation des risques.
La santé intestinale a fait l’objet d’une étude non conforme aux lignes directrices de 28 jours sur des souris BALB/c. Des groupes de 10 souris/sexe/groupe ont été gavés par voie orale avec de l’huile de maïs (groupe témoin) ou du PTPh (dissous dans de l’huile de maïs) à raison de 2, 10 ou 50 mg/kg p.c./j (Peng et al., 2023). À la dose de 2 mg/kg p.c./j, on a observé chez les souris des 2 sexes un raccourcissement du côlon, l’infiltration de cellules inflammatoires dans le côlon et une diminution de la taille des villosités dans l’iléon, la déformation des cryptes de l’iléon, l’apparition de vacuoles dans l’iléon et l’infiltration de cellules immunitaires dans l’iléon.
Durant une étude non conforme aux lignes directrices, on a évalué les effets de l’exposition à un régime riche en fructose et en matières grasses, et de l’exposition au PTPh sur le foie de souris (Cui et al., 2022). Les résultats de l’exposition au PTPh seul sont présentés dans la présente évaluation. Des groupes de 15 souris mâles (C57BL/6J) ont reçu une ration témoin, une dose de 0,01 mg/kg p.c./j et une dose de 1 mg/kg p.c./j de PTPh dans l’alimentation pendant 12 semaines. Aux 2 doses de PTPh, on a observé que les souris présentaient des lésions histopathologiques dans le foie, notamment une compression et un rétrécissement des sinusoïdes hépatiques, un œdème et une dégénérescence des cellules hépatiques, un relâchement cytoplasmique, la formation de vacuoles et une infiltration inflammatoire, comparativement au groupe témoin. De plus, aux 2 doses de PTPh, il y avait des niveaux significatifs de condensation de la chromatine des noyaux, une diminution de la densité du cytoplasme, une expansion mitochondriale, une dispersion du réticulum endoplasmique et une réduction des organites cytoplasmiques dans le foie, ainsi qu’une augmentation des niveaux d’alanine aminotransférase (ALT/GPT) et d’aspartate aminotransférase (AST/GOT) dans le sérum par rapport au groupe témoin. À la dose de 1 mg/kg p.c./j de PTPh, on a observé une augmentation significative de l’accumulation de lipides dans le foie par rapport au groupe témoin. Une épreuve d’hyperglycémie provoquée par voie orale et une épreuve d’hypoglycémie provoquée ont été effectuées au cours de la dernière semaine d’exposition, et il a été montré que les souris traitées au PTPh présentaient un mécanisme de récupération du glucose aberrant par rapport aux souris témoins (Cui et al., 2022).
Dans le cadre d’une étude de toxicité à court terme par la voie cutanée, des lapins ont été exposés à des doses de 0, 100 ou 1 000 mg/kg p.c./j de PTPh appliquées sur leur peau rasée et intacte ou sur leur peau rasée et abrasée pendant trois semaines. Aucun effet sur le poids corporel, l’hématologie et la chimie clinique, le poids des organes ou l’histopathologie n’a été observé. Le seul effet lié au traitement était une diminution liée à la dose (statistiquement significative à la dose de 1 000 mg/kg p.c./j uniquement) de l’acétylcholinestérase dans le plasma, les érythrocytes et le cerveau chez les lapins traités au PTPh, sans aucun signe clinique d’augmentation de l’activité cholinergique. Aucun effet n’a été observé sur les organes reproducteurs des lapins ayant reçu du PTPh jusqu’à la dose maximale de 1 000 mg/kg p.c./j. La DSENO a été établie à 1 000 mg/kg p.c./j (Monsanto, 1979, cité dans OCDE, 2002).
2.4.2.4 Toxicité pour la reproduction et le développement
Aucun effet sur le développement ou la reproduction n’a été observé dans le cadre d’une étude de la toxicité pour la fertilité et le développement de 4 mois non conforme aux lignes directrices menée sur des rats recevant par voie orale des doses allant jusqu’à 690 mg/kg p.c./j (Welsh et al., 1987, cité dans OCDE, 2002).
Dans le cadre d’un essai utérotrophique, il a été constaté que le poids de l’utérus des souris et des rats femelles immatures (âgés de 17 jours) n’augmentait pas lorsque le PTPh était administré par injection sous-cutanée à des doses de 0, 200 ou 600 mg/kg une fois par jour pendant trois jours consécutifs (Wang et al., 2018).
Au cours d’une étude non conforme aux lignes directrices, des souris C57BL/6J gravides (n = 11 à 14) ont été gavées par voie orale avec de l’huile de maïs (groupe témoin) ou du PTPh (dissous dans de l’huile de maïs) à raison de 1 ou 5 mg/kg p.c./j, du jour embryonnaire 0 (JE 0), c’est-à-dire le jour de gestation 0, à la mise bas (Hong et al., 2022a). Au JE 18, 5 mères de chaque groupe ont été sélectionnées au hasard dans l’objectif d’évaluer l’accumulation de PTPh et de PDPh ainsi que les effets du PTPh sur le placenta. Les auteurs n’ont rapporté de résultats que pour les souris exposées à une dose de 1 mg/kg p.c./j et ont souligné que le PTPh et le PDPh s’étaient accumulés dans le placenta et que cette accumulation n’avait pas été observée chez les souris témoins. Les mères restantes ont continué de recevoir une dose jusqu’à la mise bas naturelle (n = 6 à 9). Aucune différence significative n’a été observée quant à la consommation alimentaire maternelle ou le poids corporel entre les groupes témoin et traités. Il n’y avait pas non plus de différences significatives concernant le nombre de petits, le poids des petits ou leur longueur corporelle entre les groupes témoin et traités. Cependant, le nombre de petits vivants par portée a diminué dans les 2 groupes exposés au PTPh par rapport au groupe témoin. La période de gestation des souris exposées à la dose de 5 mg/kg p.c./j était significativement plus courte que celle des souris témoins et des souris exposées à la dose de 1 mg/kg p.c./j. Le taux de mortinatalité chez les souris exposées à la dose de 1 mg/kg p.c./j était significativement plus élevé que chez le groupe témoin. Toutefois, il n’y avait pas de différence significative dans le taux de mortinatalité chez les souris exposées à la dose de 5 mg/kg p.c./jour de PTPh par rapport au groupe témoin (Hong et al., 2022a).
Durant une étude non conforme aux lignes directrices, des souris C57BL/6J gravides ont été gavées par voie orale avec de l’huile de maïs (groupe témoin) ou du PTPh (dissous dans de l’huile de maïs) à raison de 1 mg/kg p.c./j, du jour de gestation 0 au jour postnatal 21 (JPN 21) (Liu et al., 2023). Au JPN 56, le sérum, le foie, l’iléon et le côlon ont été prélevés sur 6 petits de chaque groupe à des fins d’examen. Comparativement au groupe témoin, le poids à la naissance des petits du groupe traité au PTPh n’était pas significativement différent. Cependant, pendant la lactation, le poids des petits du groupe traité au PTPh était significativement inférieur à celui du groupe témoin. Il n’y avait pas de différence significative de poids corporel entre les 2 groupes après le sevrage, lorsque les petits commençaient à consommer des aliments standard. Chez les petits mâles, on a observé une nécrose tissulaire dans le côlon et l’iléon, ainsi qu’une congestion des capillaires dans l’iléon. Chez les petites femelles, on a observé une nécrose tissulaire dans l’iléon, une hyperplasie des ganglions lymphatiques et une sécrétion accrue de mucus alcalin dans le côlon. Chez les petits mâles, des gouttelettes lipidiques importantes et une inflammation ont été observées dans le foie. De plus, le poids du foie avait augmenté de façon significative, et une accumulation de lipides a été observée chez les petits mâles de mères exposées au PTPh. Il y avait également une augmentation significative du cholestérol total, des triglycérides totaux et des acides biliaires totaux dans le sérum des petits mâles seulement. Enfin, l’étude a souligné que les souris exposées au PTPh présentaient des perturbations de l’homéostasie du microbiote intestinal, celles-ci étant plus prononcées chez les petits mâles (Liu et al., 2023).
Dans le cadre d’une étude non conforme aux lignes directrices de 30 jours, des groupes de 18 souris C57BL/6J mâles ont été gavés par voie orale avec de l’huile de maïs (groupe témoin) ou du PTPh (dissous dans de l’huile de maïs) à raison de 5, 50 ou 200 mg/kg p.c./j (Wang et al., 2023). Pour tous les groupes traités au PTPh, les observations comprenaient des cellules germinales détachées dans les tubules séminifères, une diminution des spermatozoïdes dans le lumen des tubules séminifères, une diminution des cellules de Leydig dans le tissu conjonctif interstitiel, une diminution significative du nombre de spermatozoïdes dans la queue des épididymes et une morphologie anormale des spermatozoïdes. Une diminution significative des taux sériques de testostérone a également été observée chez les souris ayant reçu 50 ou 200 mg/kg p.c./j de PTPh par rapport au groupe témoin. L’étude portait en outre sur un mécanisme potentiel par lequel ces effets pourraient se produire, et les auteurs avancent qu’il s’agit probablement de l’apoptose des cellules de Leydig (Wang et al., 2023).
Ma et al. (2021) ont examiné le rôle du PTPh sur la fonction ovarienne, en évaluant le moment de la puberté et le développement folliculaire. Dans leur étude, des groupes de souris femelles immatures (JPN 21; n = 6 à 15) ont reçu 0, 2, 10 ou 50 mg/kg p.c. de PTPh par gavage quotidiennement pendant 40 jours. Pour évaluer les taux d’hormones sériques, les chercheurs ont donné à des groupes de souris (n = 12) des doses de 0, 2, 20 ou 50 mg/kg p.c./j de PTPh du JPN 21 au JPN 28. Aucun changement significatif du poids corporel ou du poids des ovaires n’a été signalé au cours de la période d’étude (JPN 21 à 61). Une augmentation significative du nombre moyen de jours avant l’ouverture vaginale a été notée chez le groupe recevant la dose de 50 mg/kg p.c./j, le retard par rapport au animaux témoins étant de 2 jours. Une réduction liée à la dose du nombre total de follicules dans l’ovaire à tous les stades (primordial, pré-antral, petit antral, grand antral), qui variait de 16 à 47 % sur l’éventail de doses, a été constatée par rapport au groupe témoin. Ces diminutions étaient statistiquement significatives pour tous les types de follicules aux doses de 10 et 50 mg/kg p.c./j, mais seulement pour les follicules pré-antraux à la dose de 2 mg/kg p.c./j. Après 40 jours de traitement au PTPh, la concentration de 17 β-estradiol dans le sérum était significativement inférieure chez les souris recevant les doses de 10 et 50 mg/kg p.c./j, sans changement significatif après 7 jours d’exposition. Une augmentation significative du taux d’hormone folliculostimulante (FSH) (2,5 fois) a été signalée chez les souris exposées à 50 mg/kg p.c./j de PTPh après 40 jours de traitement. Après 7 jours de traitement, le taux sérique de FSH chez les souris avait significativement augmenté d’un facteur 2,8 et 5,4 dans les groupes recevant les doses de 10 et 50 mg/kg p.c./j, respectivement, et le taux sérique d’hormone lutéinisante avait été multiplié par 2,5 dans le groupe recevant la dose de 50 mg/kg p.c./j (Ma et al., 2021). Une dose minimale avec effet nocif observé (DMENO) de 2 mg/kg p.c./j a été envisagée pour cette étude, d’après la diminution significative du nombre de follicules pré-antraux dans l’ovaire des souris à partir de cette dose.
Dans le cadre d’une étude combinée de toxicité à doses répétées non conforme aux lignes directrices, des groupes de rates Sprague-Dawley accouplées à un moment déterminé (n = 15 à 22) ont reçu 0, 1 000, 3 000, 10 000, 15 000 et 30 000 ppm (équivalant à environ 50, 150, 500, 750 et 1 500 mg/kg p.c./jNote de bas de page 5, respectivement) de PTPh dans leur alimentation, du jour de gestation (JG) 6 au JPN 28; les petits ont été sevrés au JPN 28 et ont reçu la ration correspondante à celle de leur mère du JPN 28 au JPN 56 (Witchey et al., 2023). Toutes les mères du groupe recevant la dose de 1 500 mg/kg p.c./j ont été retirées de l’étude au JG 12 en raison de signes cliniques et de l’absence de gain de poids corporel, tandis que trois ont été retirées du groupe recevant la dose de 750 mg/kg p.c./j pendant la phase de lactation. En ce qui concerne les autres mères, on a noté des observations cliniques chez le groupe exposé à la dose de 500 mg/kg p.c./j (posture voûtée, apparence mince ou pelage froncé) ainsi qu’une diminution du poids corporel (6 à 25 %) et une augmentation de la consommation alimentaire (17 à 50 %) chez les groupes exposés à des doses de 500 mg/kg p.c./j et plus pendant la gestation ou l’allaitement. L’exposition au PTPh des mères augmente le poids relatif du foie (à partir d’une dose de 150 mg/kg p.c./j) et la taille relative du cerveau (750 mg/kg p.c./j), tout en diminuant significativement le poids relatif du thymus (500, 750 mg/kg p.c./j) sans changement pathologique macroscopique. En ce qui a trait aux effets sur le développement, une diminution du nombre de petits vivants et une diminution de la survie des petits ont été signalées pour le groupe recevant la dose de 750 mg/kg p.c./j. Le poids des petits au JPN 1 était significativement inférieur pour les groupes exposés aux doses de 500 et 750 mg/kg p.c./j. Le début de la puberté a été retardé chez les petits mâles et femelles à partir des doses de 50 mg/kg p.c./j et de 150 mg/kg p.c./j, respectivement (augmentation du nombre de jours avant la séparation balano-préputiale et l’ouverture vaginale). Il a été souligné que l’ajustement en fonction du poids corporel au moment du sevrage réduisait l’effet du retard observé. L’exposition au PTPh a également influé sur le poids des organes des petits : diminution significative du poids relatif du thymus chez les mâles et augmentation du poids relatif du cerveau à partir de la dose de 500 mg/kg p.c./j. Une évaluation supplémentaire a révélé que les petits avaient subi un transfert par la mère pendant la gestation et la lactation, et que l’exposition au PTPh avait réduit l’activité de la cholinestérase en fonction de la dose chez les petits, et ce dès le groupe à faible dose. Les auteurs n’ont pas déterminé de DSENO étant donné les effets observés à tous les niveaux d’exposition (Witchey et al., 2023). Aux fins de la présente évaluation, une DMENO de 50 mg/kg p.c./j est envisagée pour cette étude, en raison du retard important du début de la puberté (augmentation significative du nombre de jours avant la séparation balano-préputiale) chez les petits mâles exposé au PTPh.
2.4.2.5 Neurologie
Dans le cadre d’une étude non conforme aux lignes directrices visant à étudier la perméabilité de la barrière hémato-encéphalique et l’histopathologie cérébrale, des groupes de souris mâles ont reçu 0, 50 ou 150 mg/kg p.c./j de PTPh par voie orale par gavage pendant 30 jours. Après une exposition de 30 jours, le PTPh et son métabolite, le PDPh, ont été détectés dans le tissu cérébral analysé par chromatographie liquide à haute performance avec spectrométrie de masse. L’histopathologie cérébrale a montré une invasion microgliale de l’hippocampe et du cortex aux 2 doses, ainsi qu’une perte de cellules neurales dans le gyrus denté de l’hippocampe à la dose de 150 mg/kg p.c./j. Les auteurs ont fait état d’un œdème dans le tissu du thalamus, ainsi que d’une dilatation et d’une congestion des vaisseaux sanguins à la dose de 150 mg/kg p.c./j (Liu et al., 2020).
Des groupes de petits de souris ont reçu par voie orale 0, 0,5, 5 ou 50 mg/kg p.c./j de PTPh du 10e au 70e jour postnatal dans le cadre d’une étude non conforme aux lignes directrices visant à étudier la neurotoxicité et les modes d’action potentiels. Des essais comportementaux ont été effectués pour tester la mémoire spatiale (test du labyrinthe en Y) et la mémoire de reconnaissance (test de reconnaissance d’objets nouveaux). Durant le test du labyrinthe en Y, on a noté le nombre d’entrées dans chaque bras et le nombre d’alternances spontanées correctes (entrées consécutives dans les trois bras du labyrinthe) pour déterminer un pourcentage de comportement d’alternance. Durant le test de reconnaissance d’objets nouveaux, on note le temps d’exploration d’un nouvel objet et d’un objet familier et on les utilise pour calculer un indice de discrimination. Aux doses de 5 mg/kg et 50 mg/kg, des diminutions significatives de l’alternance spontanée ont été constatées lors du test du labyrinthe en Y, et des diminutions significatives du temps d’exploration et de l’indice de discrimination ont été constatées lors du test de reconnaissance d’objets nouveaux. La coloration des axones de l’hippocampe des souris avec le marqueur des axones neuronaux TUBB3 a révélé une réduction de l’épaisseur des axones et une fluorescence réduite chez les souris exposées au PTPh. L’exposition au PTPh a également entraîné des changements dans l’expression des protéines et des gènes dans l’hippocampe liés au guidage axonal, à la fonction des synapses, au transport des neurotransmetteurs et à l’exocytose par rapport aux souris témoins (Zhong et al., 2021).
Dans une étude non conforme aux lignes directrices, des souris C57BL/6J gravides (n = 11 à 14) ont été gavées par voie orale avec de l’huile de maïs (groupe témoin) ou du PTPh (dissous dans de l’huile de maïs) à raison de 1 ou 5 mg/kg p.c./j, du jour de gestation 0 à la mise bas (Hong et al., 2022b). Au JE 18, 5 mères de chaque groupe ont été sélectionnées au hasard et sacrifiées. On leur a prélevé le placenta, le cerveau fœtal et le sérum maternel. Les autres mères ont continué le traitement jusqu’à la mise bas. Ensuite, on a nourri normalement les petits mâles jusqu’au 56e jour postnatal (JPN 56) afin d’effectuer des tests neurocomportementaux, y compris un test en champ libre, un test de reconnaissance d’objets nouveaux et un test de conditionnement de la peur contextuelle (n = 6). On a observé une augmentation significative des taux d’IL-6, de TNFα et de NFκB dans le placenta des souris traitées au PTPh par rapport aux souris témoins. Aucune différence significative n’a été observée pour ces taux dans le cerveau fœtal. Les résultats suivants ont été obtenus pour les souris traitées au PTPh : indice de reconnaissance inférieur dans le test de reconnaissance d’objets nouveaux, niveau de blocage moindre pendant la récupération de souvenirs de peur récents et lointains dans le test de conditionnement de la peur contextuelle, et temps réduit passé au centre dans l’essai en champ libre, ce que les auteurs attribuent à un comportement semblable à de l’anxiété. Il n’y avait pas de changements histopathologiques significatifs dans l’hippocampe des souris traitées par PTPh, mais le nombre de corps de Nissl dans l’hippocampe du groupe traité était significativement réduit. L’analyse du transcriptome de l’hippocampe fœtal a montré que plusieurs voies de signalisation des cellules neuronales (c’est-à-dire voie de signalisation du guidage axonal, voie de signalisation des neurotrophines, voie de signalisation des synapses dopaminergiques et voie de signalisation des synapses cholinergiques) étaient perturbées par l’exposition au PTPh (Hong et al., 2022b).
2.4.2.6 Prise en compte des sous-populations qui peuvent être plus sensibles
Certains groupes de personnes vivant au Canada peuvent être plus susceptibles de subir des effets nocifs sur la santé découlant de l’exposition à des substances, en raison d’une plus grande sensibilité. Le potentiel de sensibilité à différentes étapes de la vie ou selon le sexe est examiné au moyen des études disponibles. Les données disponibles pour le PTPh comprennent des données sur la cinétique, la toxicité à court terme, la toxicité pour la reproduction et le développement, et la génotoxicité obtenues chez des animaux de laboratoire. Parmi les études sur le PTPh prises en compte dans le cadre de la présente évaluation des effets sur la santé, plusieurs avaient été menées chez des animaux de laboratoire mâles et femelles. Nous avons également examiné les effets neurologiques et sur le développement chez les jeunes, les effets sur la reproduction chez les mâles et les femelles ainsi que les effets chez les femelles gravides au moyen d’études de la toxicité pour le développement et la reproduction réalisées avec des animaux. Tout ceci a été pris en compte dans la sélection des effets critiques sur la santé qui ont servi à la caractérisation des risques.
2.4.3 Caractérisation des risques pour la santé humaine – PTPh
Aucune étude sur la cancérogénicité du PTPh n’a été recensée. Le PTPh ne devrait pas être génotoxique. Des études sur les effets sur la santé qui pourraient avoir une incidence sur la caractérisation des risques (c’est-à-dire qui aboutiraient à des paramètres critiques différents ou à des points de départ plus faibles que ceux indiqués dans ECCC, SC (2021) ont été repérées. À la lumière des études disponibles, la dose minimale avec effet nocif observé sur le développement de 2 mg/kg p.c./j, fondée sur la diminution significative du nombre de follicules pré-antraux dans l’ovaire des souris (Ma et al., 2021), a été choisie comme niveau d’effet critique pour la caractérisation des risques pour la santé humaine liés à l’exposition au PTPh. Le nombre total de follicules dans l’ovaire à tous les stades a diminué en fonction de la dose par rapport au groupe témoin à toutes les doses, et il y a eu un retard significatif de l’ouverture vaginale chez les souris du groupe exposé à 50 mg/kg p.c./j (Ma et al., 2021). Chez le rat, le début de la puberté a été retardé chez les petits mâles et femelles à partir de la dose de 50 mg/kg p.c./j et de 150 mg/kg p.c./j, respectivement (augmentation du nombre de jours avant la séparation balano-préputiale et l’ouverture vaginale) (Witchey et al., 2023). Des études ont signalé une modification du comportement en ce qui concerne la mémoire et l’apprentissage chez les souris après une exposition au PTPh en début de vie (Zhong et al., 2021; Hong et al., 2022b). Il est considéré que le paramètre sélectionné (Ma et al., 2021) permet d’assurer une protection contre les effets observés dans les études disponibles, tels qu’ils sont décrits dans l’évaluation des effets sur la santé.
Le tableau 2-5 présente les estimations de l’exposition et les points de départ des dangers pertinents, ainsi que les marges d’exposition (ME) résultantes, pour la caractérisation des risques liés à l’exposition au PTPh.
| Scénario d’exposition | Exposition systémique (mg/kg p.c./j) | Marges d’exposition fondées sur la DMENOa de 2 mg/kg p.c./j |
|---|---|---|
| Milieux de l’environnement et aliments (tous les groupes d’âge) | 7,9×10-5 à 1,2×10-3 | 1 670 à 25 300 |
| Vernis à ongles (4 ans à 19 ans et plus) | 0,16 à 0,28 | 7 à 13 |
| Vernis à ongles, vernis de base, protecteur de vernis (y compris lorsque les trois produits sont utilisés ensemble) (14 ans à 19 ans et plus; voie cutanée)b | 0,24 à 0,28 | 7 à 8 |
| Trousse à manucure, trousse à manucure avec vernis (9 ans à 19 ans et plus; voie cutanée)b | 0,16 à 0,43 | 5 à 13 |
| Lubrifiants et graisses (par exemple fluide de servodirection) (19 ans et plus; voie cutanée) | 4,2×10-4 à 4,2×10-3 | 480 à 4 760 |
| Mâchonnement d’un objet en mousse (par exemple jouet) (0 à 3 ans; quotidien, intermittent; voie orale) | 6,7×10-5 à 1,5×10-3 | 1 330 à 29 900 |
| Contact cutané par le fait de s’allonger sur des matelas ou des meubles rembourrés contenant de la mousse (tous les groupes d’âge; quotidiennement)b | 2,7×10-3 à 8,0×10-2 | 25 à 7 403 |
| Contact cutané par le fait de s’asseoir dans un système de retenue pour bébé ou enfant (0 à 13 ans; quotidiennement)b,c | 1,2×10-3 à 5,6×10-3 | 357 à 1 670 |
| Exposition cutanée par les vêtements pour bébés (0 à 11 mois) | 2,86×10-6 à 3,56×10-6 | 562 000 à 699 000 |
Abréviation : DMENO = dose minimale avec effet nocif observé.
a D’après une diminution significative du nombre de follicules pré-antraux dans l’ovaire de souris observée dans le cadre d’une étude de 40 jours (Ma et al., 2021). ME cible = 1 000 (×10 pour l’extrapolation interspécifique; ×10 pour la variation intraspécifique; ×10 pour l’utilisation d’une DMENO, compte tenu de la gravité de l’effet [toxicité pour le développement]).
b Une absorption cutanée de 50 % a été supposée.
c Les règlements sur les systèmes de retenue pour bébé et enfant au Canada varient selon la province et le territoire (ASEPC, 2019). En nous fondant sur des facteurs pertinents en matière d’âge et de poids, nous avons estimé l’exposition cutanée pour divers groupes d’âge jusqu’au groupe des enfants âgés de 9 à 13 ans, inclusivement.
Il est estimé que les comparaisons entre, d’une part, les concentrations associées aux effets critiques dans les études sur les animaux et, d’autre part, les estimations de l’exposition par les milieux naturels, les aliments, le mâchonnement des objets en mousse et les estimations de l’exposition cutanée par les vêtements pour bébés sont adéquates pour la prise en compte des incertitudes entourant les données sur l’exposition et les effets sur la santé ayant servi à caractériser les risques. Cependant, les marges d’exposition calculée pour le contact cutané qui découle du fait de s’allonger sur des matelas ou des meubles rembourrés contenant de la mousse et de s’asseoir sur des systèmes de retenue pour bébé et enfant contenant de la mousse (y compris les sièges d’appoint), ainsi que pour le contact cutané avec les produits de soins des ongles, les lubrifiants et les graisses sont considérées comme potentiellement inadéquates aux fins de la prise en compte de ces incertitudes.
L’évaluation des effets sur la santé humaine a tenu compte des groupes de personnes au sein de la population canadienne qui, en raison d’une sensibilité ou d’une exposition accrues, pourraient présenter une vulnérabilité accrue aux effets nocifs. Le potentiel d’une sensibilité accrue durant le développement et la reproduction a été évalué, et l’exposition selon l’âge a été estimée. Il a été constaté qu’en général, les nourrissons et les enfants sont davantage exposés que les adultes. Toutes ces populations ont été prises en considération lors de l’évaluation des effets nocifs potentiels sur la santé humaine.
2.4.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-après.
| Principale source d’incertitude | Incidence |
|---|---|
| Seules des données limitées sur l’occurrence du PTPh dans les aliments vendus au Canada étaient disponibles. | +/- |
| Les concentrations maximales de PTPh ont été appliquées à toutes les catégories d’aliments (à l’exception des préparations pour nourrissons). | + |
| Pour certaines catégories d’aliments, seuls des résultats de non-détection de PTPh étaient disponibles, et dans ces cas, une concentration équivalente au SD a été supposée. | + |
| Les concentrations maximales indiquées pour un aliment donné ont été présumées représentatives d’une catégorie plus large dans son ensemble. | +/- |
| Certaines des études sources utilisées pour estimer l’exposition faisaient état de très faibles taux de détection positive du PTPh. | +/- |
| Données limitées sur la mesure du PTPh dans les matelas ou les meubles contenant de la mousse vendus au Canada. Les données provenant d’autres pays ont été utilisées dans les calculs des estimations de l’exposition. | +/- |
| Absence de données sur la migration du PTPh hors des matériaux en mousse. | +/- |
| Les données sur l’absorption cutanée du PTPh étaient limitées et, par conséquent, une valeur par défaut a été utilisée conformément aux travaux d’une autre autorité gouvernementale. | +/- |
| Il n’y a pas d’études sur la toxicité chronique du PTPh. | +/- |
+ = incertitude pouvant causer la surestimation des risques ou de l’exposition; +/- = potentiel inconnu à causer une surestimation ou une sous-estimation des risques.
3. Évaluation du PTBOE
3.1 Identité de la substance
Le NE CAS, le nom sur la LI, le nom commun et l’acronyme du PTBOE sont présentés dans le tableau 3-1.
| NE CAS (abréviation) | Nom sur la LI (nom commun) | Structure chimique représentative et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 78-51-3 (PTBOE) | Phosphate de tris(2-butoxyéthyle) [phosphate de tris(2-butoxyéthyle)] | 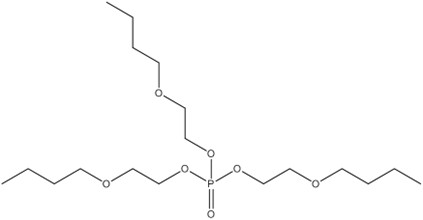 C18H39O7P |
398,47 |
Abréviations : NE CAS = numéro d’enregistrement du Chemical Abstracts Service; LI = Liste intérieure.
3.2 Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques du PTBOE, obtenues par expérimentation et modélisation, est fourni dans l’ébauche d’évaluation (ECCC, SC, 2021).
3.3 Sources et utilisations
Des renseignements détaillés sur les sources et les utilisations du PTBOE sont fournis dans l’ébauche d’évaluation du groupe des substances ignifuges (ECCC, SC, 2021). Les principales données sont résumées ci-dessous.
Le PTBOE ne se trouve pas à l’état naturel dans l’environnement.
Le PTBOE a fait l’objet d’une enquête menée en vertu de l’article 71 de la LCPE (Canada, 2012). En 2011, un total de 1 000 à 10 000 kg de la substance ont été fabriqués, et entre 10 000 et 100 000 kg ont été importés au Canada (Environnement Canada, 2013)Note de bas de page 6.
Selon les renseignements présentés en réponse à l’enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), le PTBOE est utilisé au Canada dans des peintures et des revêtements, ainsi que dans des revêtements de sol.
Le PTBOE peut également être employé comme composant dans la fabrication d’un nombre limité d’adhésifs utilisés dans les couches intermédiaires de matériaux d’emballage alimentaire au Canada (communication personnelle, courriels de la Direction de l’alimentation et de la nutrition, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, Santé Canada, datés du 28 mars 2018 et du 20 mai 2022; source non citée).
Au Canada, le PTBOE peut être utilisé comme produit de formulation dans les produits antiparasitaires, mais n’est actuellement homologué dans aucun produit antiparasitaire (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, Santé Canada, daté du 18 mai 2022; source non citée).
Le PTBOE peut également être présent dans des peintures antirouille (FDS, 2014), des solutions de réparation du cuir (FDS, 2011), des imperméabilisants pour chaussures en aérosol (FDS, 2018), des aérosols contre la moisissure marine (FDS, 2019) et des marqueurs pour le verre (FDS, 2015) au Canada.
Le PTBOE a été mesuré dans des échantillons de mousse provenant de produits tels que des oreillers, des meubles rembourrés, des systèmes de retenue pour enfant et des matériaux de construction au Canada, aux États-Unis et ailleurs (CCE, 2015; Santé Canada, 2023b; Miller et Gearhart, 2016; Wu et al., 2019). Il a également été détecté dans des vêtements pour bébés et des textiles et tissus aux États-Unis (Zhu et al., 2020).
3.4 Potentiel d’effets nocifs sur la santé humaine
3.4.1 Évaluation de l’exposition au PTBOE
Aucun changement important n’a été apporté à l’exposition au PTBOE dans l’air ambiant et intérieur, l’eau potable, le sol, la poussière, les aliments, le lait maternel et l’utilisation de produits de consommation contenant du PTBOE (par exemple, la peinture antirouille) décrite à la section 3.7.1.2 de l’ébauche d’évaluation (ECCC, SC, 2021). Cependant, des paramètres d’exposition mis à jour, utilisés pour estimer l’absorption cutanée du PTBOE présent dans la mousse ou le tissu des systèmes de retenue pour bébé et enfant ou des meubles rembourrés tels que les canapés, ont été intégrés comme il est décrit ci-dessous.
3.4.1.1 Produits de consommation
Articles manufacturés
Le PTBOE a été détecté dans divers produits en mousse au Canada, aux États-Unis et ailleurs. Le tableau 3-2 résume les renseignements disponibles sur la concentration de PTBOE mesurée dans divers produits.
| Article(s) manufacturé(s) | Concentration de PTBOE | Référence |
|---|---|---|
| Matériaux de construction et oreillers en mousse (par exemple revêtement de sol, papier peint, tapis, carreaux de plafond, stores, coussin d’allaitement, oreiller pour tout-petit) (n = 38 échantillons de 23 produits) achetés au Canada | 0,04 % Détecté dans un échantillon de papier peint; SD = 8 mg/kg |
Santé Canada, 2023b |
| Mousse, tissu, rembourrage, capitonnage et garniture de divers produits d’ameublement (n = 132; par exemple chaises, canapés, poufs) achetés en 2014 et 2015 au Canada, aux États-Unis et au Mexique | 0,08 à 0,17 % p/p (dans la publication : 750 à 1 700 ppm) Détecté dans la mousse de 2 canapés achetés au Canada |
CCE, 2015 |
| Systèmes de retenue pour enfant (n = 387 échantillons de matériaux provenant de 15 systèmes ou sièges) achetés aux États-Unis | 0,009 à 2,5 % p/p (dans la publication : 98 ppm à 25 000 ppm) Détecté dans la mousse ou le tissu de 9 systèmes de retenue pour enfant |
Miller et Gearhart, 2016 |
| Systèmes de retenue pour enfant (n = 36 échantillons, y compris mousse, tissu et composites de mousse et de tissu, 18 systèmes ou sièges) achetés aux États-Unis en 2018 | Non détecté (SD = 0,0003 %) à 0,35 % p/p Le PTBOE a été détecté dans 58 % des échantillons. |
Wu et al., 2019 |
Abréviation : SD = seuil de détection.
L’exposition cutanée prolongée au PTBOE qui découle du fait de s’allonger sur des matelas ou des meubles rembourrés contenant de la mousse et de s’asseoir sur des systèmes de retenue pour bébé ou enfant (y compris les sièges d’appoint) a été estimée et est résumée dans le tableau 3-3 (voir le tableau D-5 de l’annexe D pour obtenir des renseignements détaillés sur les paramètres).
Des données limitées sur l’absorption cutanée du PTBOE ont été trouvées dans 2 études à doses infinies qui portaient sur plusieurs produits ignifuges à base d’esters d’organophosphate (Frederiksen et al., 2018; Zhang et al., 2022). Les expositions au PTBOE provenant d’articles manufacturés dont il est question ici sont toutes des scénarios à doses finies auxquels les études à doses infinies ont une applicabilité limitée. Par ailleurs, Frederiksen et al. (2018) ont indiqué qu’il était difficile de quantifier le PTBOE. De plus, ces études ne tiennent pas compte de tous les résidus collés à la peau pertinents dans les coefficients de perméabilité précisés et peuvent sous-estimer l’exposition par voie cutanée. Étant donné le manque de données pertinentes sur l’absorption cutanée du PTBOE, y compris en provenance d’autres autorités gouvernementales, nous avons supposé une absorption cutanée de 100 % lors du calcul des estimations de l’exposition cutanée au PTBOE due aux matelas ou aux meubles rembourrés contenant de la mousse et aux systèmes de retenue pour bébé et enfant (y compris les sièges d’appoint).
En Europe, le PTBOE a également été mesuré dans des jouets en plastique, en caoutchouc, en bois, en mousse et en textile (Ionas et al., 2014). Aucune étude sur les produits pour enfants au Canada contenant du PTBOE n’a été trouvée, mais on peut s’attendre à ce que certains des mêmes types de jouets que ceux qui contiennent du PTBOE en Europe soient présents au Canada. Aucun changement important n’a été apporté aux estimations de l’exposition par voie orale (par mâchonnement) décrites à la section 3.7.1.2 de l’ébauche d’évaluation (ECCC, SC, 2021).
| Voie d’exposition | Source | Groupe d’âge | Estimation de l’exposition (mg/kg p.c./j) |
|---|---|---|---|
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 0 à 5 mois | 6,5×10-1 à 5,0 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 6 à 11 mois | 5,8×10-1 à 4,5 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 1 an | 5,6×10-1 à 4,5 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 2 à 3 ans | 3,5×10-1 à 3,6 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 4 à 8 ans | 2,8×10-1 à 3,1 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 9 à 13 ans | 2,1×10-1 à 2,5 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 14 à 18 ans | 1,5×10-1 à 1,8 |
| Cutanée | S’allonger sur un matelas ou un meuble rembourré contenant de la mousse | 19 ans et plus | 1,4×10-1 à 1,4 |
| Cutanée | Mousse/tissu dans les systèmes de retenue pour bébé et enfant | 0 à 5 mois | 1,5×10-1 à 3,5×10-1 |
| Cutanée | Mousse/tissu dans les systèmes de retenue pour bébé et enfant | 6 à 11 mois | 1,4×10-1 à 3,2×10-1 |
| Cutanée | Mousse/tissu dans les systèmes de retenue pour bébé et enfant | 1 an | 1,3×10-1 à 2,9×10-1 |
| Cutanée | Mousse/tissu dans les systèmes de retenue pour bébé et enfant | 2 à 3 ans | 8,8×10-2 à 2,0×10-1 |
| Cutanée | Mousse/tissu dans les systèmes de retenue pour bébé et enfant | 4 à 8 ans | 7,5×10-2 à 1,7×10-1 |
| Cutanée | Mousse/tissu dans les systèmes de retenue pour bébé et enfantb | 9 à 13 ans | 5,9×10-2 à 1,4×10-1 |
| Orale | Mousse contenue dans des produits pour enfants | 0 à 5 mois | 4,0×10-3 à 4,6×10-2 |
| Orale | Mousse contenue dans des produits pour enfants | 6 à 11 mois | 2,8×10-3 à 3,2×10-2 |
| Orale | Mousse contenue dans des produits pour enfants | 1 an | 2,3×10-3 à 2,7×10-2 |
| Orale | Mousse contenue dans des produits pour enfants | 2 à 3 ans | 1,7×10-3 à 1,9×10-2 |
a Nous avons supposé que l’absorption cutanée était de 100 % lors de l’estimation de l’exposition cutanée au PTBOE.
b Les règlements sur les systèmes de retenue pour bébé et enfant au Canada varient selon la province et le territoire (ASEPC, 2019). En nous fondant sur des facteurs pertinents en matière d’âge et de poids, nous avons estimé l’exposition cutanée pour divers groupes d’âge jusqu’au groupe des enfants âgés de 9 à 13 ans, inclusivement.
Le PTBOE a été détecté dans divers textiles achetés aux États-Unis, y compris des vêtements pour bébés (par exemple, chaussettes, cache-couches, pantalons, jupes, chemises) et des tissus bruts (c’est-à-dire les tissus disponibles avant couture commercialisés pour diverses applications, notamment les rideaux, les coussins et les meubles de jardin) (Zhu et al., 2020). On s’attend à ce que certains des mêmes types de textiles contenant du PTBOE soient présents au Canada. Les concentrations de PTBOE dans des textiles traditionnels, qui comprenaient des vêtements pour bébés (n = 52) et des tissus bruts (n = 29) en coton, en polyester ou en nylon, variaient de 0,108 ng/g à 1 083 ng/g (seuil de quantification de la méthode = 0,1 ng/g). Les estimations de l’exposition cutanée des nourrissons au PTBOE présent dans les vêtements, calculées dans Zhu et al. (2020) à partir des concentrations au 95e centile, variaient de 795 à 988 pg/kg p.c./j. Ces estimations de l’exposition sont considérées comme négligeables (≤ 2,5 ng/kg p.c./j).
3.4.1.2 Biosurveillance
Aucun changement important n’a été apporté à l’absorption quotidienne de PTBOE estimée à partir des données de biosurveillance humaine disponibles décrite à la section 3.7.1.5 de l’ébauche d’évaluation (ECCC, SC, 2021).
3.4.1.3 Prise en compte des sous-populations qui peuvent être plus fortement exposées
Certains groupes de personnes vivant au Canada peuvent être plus susceptibles de subir des effets nocifs sur la santé découlant de l’exposition à des substances, en raison d’une plus grande exposition. Nous avons donc examiné le potentiel d’exposition élevée au sein de la population canadienne. Nous avons systématiquement évalué les estimations de l’exposition en fonction de l’âge pour tenir compte des différences physiques et comportementales entre les étapes de la vie. Nous avons constaté, d’après l’évaluation de l’exposition de fond découlant des milieux naturels, de l’air intérieur, des aliments, de l’eau potable et de la poussière, que les jeunes enfants étaient plus exposés que les adultes. De plus, les nourrissons nourris au lait maternel étaient plus exposés que les nourrissons nourris aux préparations. L’exposition au PTBOE par les produits manufacturés est semblable dans tous les groupes d’âge.
3.4.2 Évaluation des effets sur la santé – PTBOE
La caractérisation des dangers du PTBOE est décrite dans l’ébauche d’évaluation (ECCC, SC, 2021). Aucun changement important n’a été apporté quant aux effets préoccupants cernés. Aucune étude des effets sur la santé pouvant avoir une incidence sur la caractérisation des risques (c’est-à-dire aboutir à des paramètres critiques différents ou à des points de départ plus faibles par rapport à ceux indiqués dans ECCC, SC [2021]) n’a été repérée.
3.4.2.1 Prise en compte des sous-populations qui peuvent être plus sensibles
Certains groupes de personnes vivant au Canada peuvent être plus susceptibles de subir des effets nocifs sur la santé découlant de l’exposition à des substances, en raison d’une plus grande sensibilité. Le potentiel de sensibilité à différentes étapes de la vie ou selon le sexe est examiné au moyen des études disponibles. Les données disponibles pour le PTBOE comprennent des données sur la cinétique, la toxicité à court terme, la toxicité à doses répétées, la toxicité pour la reproduction et le développement, et la génotoxicité obtenues chez des animaux de laboratoire. Parmi les études sur le PTBOE prises en compte dans le cadre de la présente évaluation des effets sur la santé, plusieurs avaient été menées chez des animaux de laboratoire mâles et femelles. Nous avons également examiné les effets sur le développement chez les jeunes au moyen d’études de la toxicité pour le développement réalisées avec des animaux. Tout ceci a été pris en compte dans la sélection des effets critiques sur la santé qui ont servi à la caractérisation des risques.
3.4.3 Caractérisation des risques pour la santé humaine – PTBOE
Comme l’indique l’ébauche d’évaluation (ECCC, SC, 2021), les autres sources d’exposition au PTBOE comprennent l’air intérieur, l’eau potable, la poussière intérieure, le sol, les aliments, le lait maternel et l’utilisation de produits de consommation contenant du PTBOE (par exemple, la peinture antirouille). La section 3.7.3.2 de l’ébauche d’évaluation traitait de la caractérisation des risques du PTBOE associés à ces sources et utilisations (ECCC, SC, 2021).
Aucune étude sur la cancérogénicité du PTBOE n’a été recensée. Le PTBOE ne devrait pas être génotoxique (ATSDR, 2012). Une étude par voie orale de 18 semaines a été choisie comme étant l’étude la plus utile à la caractérisation des risques pour la santé humaine liés à l’exposition au PTBOE (Reyna et Thake, 1987, cité dans ATSDR, 2002). Une limite inférieure de l’intervalle de confiance de la concentration qui produit une variation de 10 % de l’effet nocif par rapport à la réponse obtenue avec la concentration de fond (BMDL10) de 8,88 mg/kg p.c./j a été calculée par l’ATSDR (2012) sur la base de la vacuolisation hépatocellulaire périportale observée chez les mâles à des doses de 173 à 209 mg/kg p.c./j (DSENO = 17 à 21 mg/kg p.c./j). Étant donné qu’aucune étude à long terme de la voie cutanée n’était disponible, cette BMDL10 a été utilisée comme point de départ pour la caractérisation des risques liés à l’exposition quotidienne par voie cutanée.
Le tableau 3-4 présente les estimations mises à jour de l’exposition par contact cutané avec des matelas ou des meubles rembourrés et des systèmes de retenue pour bébé ou enfant (y compris les sièges d’appoint), ainsi que les points de départ des dangers pertinents et les ME résultantes pour le PTBOE.
| Scénario d’expositiona | Exposition systémique (mg/kg p.c./j) | Marges d’exposition fondées sur la BMDL10 de 8,88 mg/kg p.c./jb |
|---|---|---|
| Contact cutané par le fait de s’allonger sur des matelas ou des meubles rembourrés contenant de la mousse (tous les groupes d’âge; quotidiennement) | 1,3×10-1 à 5,0 | 2 à 68 |
| Contact cutané par le fait de s’asseoir sur un système de retenue pour bébé ou enfant (0 à 13 ans; quotidiennement)c | 5,9×10-2 à 3,5×10-1 | 25 à 150 |
| Mâchonnement d’un objet en mousse (par exemple jouet) (0 à 3 ans; quotidien, intermittent; voie orale) | 1,7×10-3 à 4,6×10-2 | 190 à 5 220 |
Abréviations : BMDL = dose repère.
a Nous avons supposé que l’absorption cutanée était de 100 % lors de l’estimation de l’exposition cutanée au PTBOE.
b D’après la vacuolisation hépatocellulaire périportale observée chez des rats mâles dans le cadre d’une étude de 18 semaines (Reyna et Thake, 1987, cité dans ATSDR, 2012). ME cible = 100 (x10 pour l’extrapolation interspécifique; x10 pour la variation intraspécifique).
c Les règlements sur les systèmes de retenue pour bébé et enfant au Canada varient selon la province et le territoire (ASEPC, 2019). En nous fondant sur des facteurs pertinents en matière d’âge et de poids, nous avons estimé l’exposition cutanée pour divers groupes d’âge jusqu’au groupe des enfants âgés de 9 à 13 ans, inclusivement.
Il est jugé que les ME calculées pour le mâchonnement d’objets en mousse contenant du PTBOE sont adéquates pour la prise en compte de l’incertitude entourant les données sur l’exposition et les effets sur la santé ayant servi à caractériser les risques. Cependant, les ME calculées pour une exposition cutanée prolongée au PTBOE qui découle du fait de s’allonger sur des matelas ou des meubles rembourrés contenant de la mousse (tous les groupes d’âge) et de s’asseoir sur des systèmes de retenue pour bébé ou enfant (0 à 13 ans) sont jugées potentiellement inadéquates aux fins de la prise en compte de ces incertitudes.
L’évaluation des effets sur la santé humaine a tenu compte des groupes de personnes au sein de la population canadienne qui, en raison d’une sensibilité ou d’une exposition accrues, pourraient présenter une vulnérabilité accrue aux effets nocifs. Le potentiel d’une sensibilité accrue durant le développement et la reproduction a été évalué, et l’exposition selon l’âge a été estimée. Il a été constaté qu’en général, les bébés et les enfants sont davantage exposés que les adultes. Toutes ces populations ont été prises en considération lors de l’évaluation des effets nocifs potentiels sur la santé humaine
3.4.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-après.
| Principale source d’incertitude | Incidence |
|---|---|
| Peu de données disponibles sur la présence de PTBOE dans la mousse des systèmes de retenue pour bébé et enfant et dans les matelas et meubles rembourrés contenant de la mousse au Canada. | +/- |
| Absence de données sur la migration du PTBOE hors des matériaux en mousse. | +/- |
| Aucune donnée sur l’absorption cutanée du PTBOE n’est disponible, donc une absorption de 100 % est présumée. | + |
+ = incertitude pouvant causer la surestimation des risques ou de l’exposition; +/- = potentiel inconnu à causer une surestimation ou une sous-estimation des risques.
4. Conclusion
Puisque les marges entre des estimations de l’exposition et les concentrations entraînant des effets critiques chez des animaux de laboratoire présentées dans ce document sont inadéquates, il est proposé de conclure que le PTPh et le PTBOE satisfont aux critères énoncés à l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que le PTPh et le PTBOE satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE.
Références
Abbott Nutrition. 2024. Mode d’emploi et tableaux de dilution des préparations pour nourrissons [PDF]. Saint-Laurent (Qc), Abbott. [Consulté le 23 avril 2024].
[ACIA] Agence canadienne d’inspection des aliments. 2019-2021. Projet sur les aliments destinés aux enfants. Résultats de l’enquête de 2019 à 2021.
Alves, A., Covaci, A., et Voorspoels, S. 2017. Method development for assessing the human exposure to organophosphate flame retardants in hair and nails. Chemosphere 168:692-698.
Arcus-Art, A., Krowech, G., et Zeise, L. 2005. Breast milk and lipid intake distributions for assessing cumulative exposure and risk. J. Expo. Anal. Environ. Epidemiol. 15:357-365.
[ASEPC] Association pour la sécurité des enfants passagers du Canada. 2019. Sommaire des lois provinciales et territoriales [PDF]. Ottawa (Ont.), Association pour la sécurité des enfants passagers du Canada. [Consulté le 24 avril 2024].
Ashley-Martin, J., MacPherson, S., Zhao, Z., Gaudreau, É., Provencher, G., Fisher, M., Borghese, M.M., Bouchard, M.F., Booij, L., et Arbuckle, T.E. 2023. Descriptive analysis of organophosphate ester metabolites in a pan-Canadian pregnancy cohort. Sci. Total Environ. 163327.
[ATSDR] Agency for Toxic Substances and Disease Registry. 2012. Toxicological profile for Phosphate Ester Flame Retardants [PDF]. Atlanta (GA), Department of Health and Human Services des États-Unis, Public Health Service. [Consulté le 26 octobre 2017]. (Disponible en anglais seulement)
Beser, M.I., Pardo, O., Beltrán, J., et Yusà, V. 2020. Determination of 21 perfluoroalkyl substances and organophosphorus compounds in breast milk by liquid chromatography coupled to orbitrap high-resolution mass spectrometry. Anal. Chim. Acta. 1049:123-132.
Bjornsdotter, M.K., Romera-Garcia, E., Borrull, J., de Boer, J., Rubio, S., et Ballesteros-Gomez, A. 2018. Presence of diphenyl phosphate and aryl-phosphate flame retardants in indoor dust from different microenvironments in Spain and the Netherlands and estimation of human exposure. Environ. Int. 112:59-67.
Bremmer, H.J., Prud’homme de Lodder, L.C.H., et van Engelen, J.G.M. 2006. Cosmetics Fact Sheet: to assess the risks for the consumer [PDF]. Bilthoven (Pays-Bas), Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la Santé publique et de la Protection de l’Environnement]. Rapport no 320104001/2006. (Disponible en anglais seulement)
Butt, C., Congleton, J., Hoffman, K., Fang, M., et Stapleton, H. 2014. Metabolites of organophosphate flame retardants and 2-ethylhexyl tetrabromobenzoate (EH-TBB) in urine from paired mothers and toddlers. Environ. Sci. Technol. 48:10432-10438.
Butt, C., Hoffman, K., Chen, A., Lorenzo, A., Congleton, J., et Stapleton, H. 2016. Regional comparison of organophosphate flame retardant (PFR) urinary metabolites and tetrabromobenzoic acid (TBBA) in mother-toddler pairs from California and New Jersey. Environ. Int. 94:627-634.
Canada, ministère de l’Environnement, ministère de la Santé. 2016. Loi canadienne sur la protection de l’environnement (1999) : Implication précoce des intervenants pour contribuer à fournir l’information pour le plan visant à examiner 1 550 substances restantes dans le cadre du Plan de gestion des produits chimiques [PDF]. Gazette du Canada, Partie I, vol. 150, no 6, p. 152-154.
Canada, ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF]. Gazette du Canada, Partie I, vol. 146, no 48, supplément.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C., 1999, ch. 33, Gazette du Canada, Partie III, vol. 22, no 3.
[CCE] Commission de coopération environnementale. 2015. Amélioration des connaissances trilatérales sur les ignifugeants et leur utilisation dans les produits manufacturés : Analyse de la chaîne d’approvisionnement de certains ignifugeants que contiennent des produits manufacturés utilisés à l’intérieur [PDF]. Montréal (Qc), CCE. 32 p. [Consulté le 23 mars 2018].
[CEH] Center for Environmental Health. 2013a. Playing on poisons: Harmful flame retardants in children’s furniture [PDF]. Oakland (CA), Center for Environmental Health. 19 p. [Consulté le 17 mars 2016]. (Disponible en anglais seulement)
[CEH] Center for Environmental Health. 2013b. Naptime nightmares: toxic flame retardants in child care nap mats [PDF]. Oakland (CA), CEH. 18 p. [Consulté le 17 mars 2016].(Disponible en anglais seulement)
Cequier, E., Sakhi, A.K., Marce, R.M., Becher, G., et Thomsen, C. 2015. Human exposure pathways to organophosphate triesters – A biomonitoring study of mother-child pairs. Environ. Int. 75:159-165.
Chen, N., Fan, S., Zhang, N., Zhao, Y., Yao, S., Chen, X., Liu, X., et Shi, Z. 2022. Organophosphate esters and their diester metabolites in infant formulas and baby supplementary foods collected in Beijing, China: Occurrence and the implications for infant exposure. Sci. Total Environ. 827:154272. (Disponible en anglais seulement)
Chen, X., Zhao, X., et Shi, Z. 2021. Organophosphorus flame retardants in breast milk from Beijing: Occurrence, nursing infant’s exposure and risk assessment. Sci. Total Environ. 771:145404.
[CIR] Cosmetic Ingredient Review. 2018. Safety Assessment of Triphenyl Phosphate as Used in Cosmetics. Rapport final. 18 septembre 2018. Washington (DC), CIR. [Consulté le 23 octobre 2018]. (Disponible en anglais seulement)
[ConsExpo Web] Consumer Exposure Web Model. 2021. Bilthoven (Pays-Bas), Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la Santé publique et de la Protection de l’Environnement]. (Disponible en anglais seulement)
Cooper, E.M., Kroeger, G., Davis, K., Clark, C., Ferguson, P.L., et Stapleton, H. 2016. Results from screening polyurethane foam based consumer products for flame retardant chemicals: Assessing impacts on the change in the furniture flammability standards. Environ. Sci. Technol. 50:10653-10660.
Cui, H., Chang, Y., Cao, J., Jiang, X., et Li, M. 2022. Liver immune and lipid metabolism disorders in mice induced by triphenyl phosphate with or without high fructose and high fat diet. Chemosphere 308(partie 3):136543.
Cui, H., Chang, Y., Jiang, X., et Li, M. 2020. Triphenyl phosphate exposure induces kidney structural damage and gut microbiota disorders in mice under different diets. Environ. Int. 144:106054.
Cui, K., Wen, J., Zeng, F., Li, S., Zhou, X., et Zeng, Z. 2017. Occurrence and distribution of organophosphate esters in urban soils of the subtropical city, Guangzhou, China. Chemosphere 175:514-520. (Disponible en anglais seulement)
Davis, A., Ryan, P.B., Cohen, J.A., Harris, D., et Black, M. 2021. Chemical exposures from upholstered furniture with various flame retardant technologies. Indoor Air 31(5):1473-1483.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2021. Ébauche d’évaluation préalable groupe des substances ignifuges. Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016. Données recueillies en vertu de la Loi canadienne sur la protection de l’environnement (1999) : Implication précoce des intervenants pour contribuer à fournir de l’information pour le plan visant à examiner les 1 550 substances restantes dans le cadre du Plan de gestion des produits chimiques. Données préparées par ECCC, Santé Canada; Programme des substances existantes.
[ECCC] Environnement et Changement climatique Canada. 2022. Étude préliminaire technique confidentielle inédite sur les produits contenant des substances du sous-groupe des organophosphates aryliques au Canada. Gatineau (Qc), ECCC, Direction des secteurs industriels et des produits chimiques.
[ECHA] Agence européenne des produits chimiques. 2018. Liste des substances extrêmement préoccupantes candidates en vue d’une autorisation [Internet]. Helsinki (Finlande), Agence européenne des produits chimiques.
[ECHA] Agence européenne des produits chimiques. C2007-2018. Registered substances database; résultats de recherche portant sur le NE CAS 115-86-6. Helsinki (Finlande), ECHA. [Consulté le 4 avril 2018]. (Disponible en anglais seulement)
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de laLoi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure. Données préparées par Environnement Canada, Santé Canada; Programme des substances existantes.
[EPA du Danemark] Environmental Protection Agency du Danemark. 2015. Chemical substances in car safety seats and other textile products for children. Survey of chemical substances in consumer products No. 135. Copenhague (Danemark), ministère danois de l’Environnement. 159 p. [Consulté le 13 février 2018]. (Disponible en anglais seulement)
Estill, C.F., Mayer, A., Slone, J., Chen, I.-C., Zhou, M., La Guardia, M.J., Jayatilaka, N., Ospina, M., et Calafat, A. 2021. Assessment of triphenyl phosphate (TPhP) exposure to nail salon workers by air, hand wipe, and urine analysis. Int. J. Hyg. Environ. Health. 231:113630.
[FDS] Fiche de données de sécurité. 2011. Trade Secret Pro Leather Touch Up. Lachine (Qc), Dover Finishing Products Inc. [Consulté le 20 septembre 2022].
[FDS] Fiche de données de sécurité. 2014. Trmcld 2X3.78L Water Base Gloss Black. Concord (Ont.), Rust-Oleum Consumer Brands Canada. [Consulté le 20 juin 2016]. (Disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2015. R-O 4X20ml glass marker black [PDF]. Concord (Ont.), Rust-Oleum Consumer Brands Canada. [Consulté le 20 septembre 2022]. (Disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2017. Wynn’s Engine Tune-Up. Ontario (Canada), ITW Professional Automotive Products. [Consulté le 5 novembre 2023].
[FDS] Fiche de données de sécurité. 2018. Scotchgard shoe guard (Cat. No. 1007). St. Paul (MN), 3M. [Consulté le 20 septembre 2022]. (Disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2019. Bloc anti-moisissures pour bateaux 09065 3M(MC). St. Paul (MN), 3M. [Consulté le 20 septembre 2022].
[FDS] Fiche de données de sécurité. 2021. Mobil Steering Fluid. Alberta (Canada), Imperial Oil Downstream. [Consulté le 5 novembre 2023]. (Disponible en anglais seulement)
Ficheux, A.S., Morisset, T., Chevillotte, G., Postic, C., Roudot, A.C. 2014. Probabilistic assessment of exposure to nail cosmetics in French consumers. Food Chem. Toxicol. 66:36-43.
Frederiksen, M., Stapleton, H.M., Vorkamp, K., Webster, T.F., Jensen, N.M., Sørensen, J.A., Nielsen, F., Knudsen, L.E., Sørensen, L.S., Clausen, P.A., et Nielsen, J.B. 2018. Dermal uptake and percutaneous penetration of organophosphate esters in a human skin ex vivo model. Chemosphere 197:185-192.
Fromme, H., Lahrz, T., Kraft, M., Fembacher, L., Mach, C., Dietrich, S., Burkardt, R., Völkel, W., et Göen, T. 2014. Organophosphate flame retardants and plasticizers in the air and dust in German daycare centers and human biomonitoring in visiting children (LUPE 3). Environ. Int. 71:158-163.
Hammel, S.C., Zhang, S., Lorenzo, A.M., Eichner, B., Stapleton, H.M., et Hoffman, K. 2020. Young infants’ exposure to organophosphate esters: Breast milk as a potential source of exposure. Environ. Int. 143:106009.
He, C., Wang, X., Tang, S., Thai, P., Li, Z., Baduel, C., et Mueller, J.F. 2018. Concentrations of organophosphate esters and their specific metabolites in food in Southeast Queensland, Australia: is dietary exposure an important pathway of organophosphate esters and their metabolites? Environ. Sci. Technol. 52(21):12765-12773.
Hoffman, K., Lorenzo, A., Butt, C.M., Adair, L., Herring, A.H., Stapleton, H.M., et Daniels, J.L. 2017. Predictors of urinary flame retardant concentration among pregnant women. Environ. Int. 98:96-101.
Hong, J., Jiang, M., Guo, L., Lin, J., Wang, Y., Tang, H., et Liu, X. 2022a. Prenatal exposure to triphenyl phosphate activated PPARγ in placental trophoblasts and impaired pregnancy outcomes. Environ. Pollut. 301:119039.
Hong, J., Lu, X., Wang, J., Jiang, M., Liu, Q., Lin, J., Sun, W., Zhang, J., Shi, Y., et Liu, X. 2022b. Triphenyl phosphate disturbs placental tryptophan metabolism and induces neurobehavior abnormal in male offspring. Ecotoxicol. Environ. Saf. 243:113978.
Ionas, A.C., Dirtu, A.C., Anthonissen, T., Neels, H., et Covaci, A. 2014. Downsides of the recycling process: harmful organic chemicals in children’s toys. Environ. Int. 65:54-62.
Kim, J.W., Isobe, T., Muto, M., Tue, N.M., Katsura, K., Marlarvannan, G., Sudaryanto, A., Chang, K.H., Prudente, M., Viet, P.H., et al. 2014. Organophosphorus flame retardants (PFRs) in human breast milk from several Asian countries. Chemosphere 116:91-97. (Disponible en anglais seulement)
Kosarac, I., Kubwabo, C., et Foster, W.G. 2016. Quantitative determination of nine urinary metabolites of organophosphate flame retardants using solid phase extraction and ultra-performance liquid chromatography coupled to tandem mass spectrometry (UPLC-MS/MS). J. Chromatogr. B 1014:24-30.
Li, P., Jin, J., Wang, Y., Hu, J., Xu, M., Sun, Y., et Ma, Y. 2017. Concentrations of organophosphorus, polybromobenzene, and polybrominated diphenyl ether flame retardants in human serum, and relationships between concentrations and donor ages. Chemosphere 171:654-660.
Liu, L.Y., He, K., Hites, R.A., et Salamova, A. 2016. Hair and nails as noninvasive biomarkers of human exposure to brominated and organophosphate flame retardants. Environ. Sci. Technol. 50:3065-3073.
Liu, X., Lin, J., Chen, Y., Jiang, M., Liu, Q., Zhang, J., Lu, X., Hong, J., Sun, W., Sun, Y., et Guo, L. 2023. Gestation and lactation triphenyl phosphate exposure disturbs offspring gut microbiota in a sex-dependent pathway. Food Chem. Toxicol. 172:113579.
Liu, X., Zhao, X., Wang, Y., Hong, J., Shi, M., Pfaff, D., Guo, L., et Tang, H. 2020. Triphenyl phosphate permeates the blood brain barrier and induces neurotoxicity in mouse brain. Chemosphere 252:126470. (Disponible en anglais seulement)
Ma, H., Ishida, K., Xu, C., Takahashi, K., Li, Y., Zhang, C., Kang, Q., Jia, Y., Hu, W., Matsumaru, D., Nakanishi, T., et Hu, J. 2021. Triphenyl phosphate delayed pubertal timing and induced decline of ovarian reserve in mice as an estrogen receptor antagonist. Environ. Pollut. 290:118096. (Disponible en anglais seulement)
Ma, J., Zhu, H., et Kannan, K. 2019. Organophosphorus Flame Retardants and Plasticizers in Breast Milk from the United States. Environ. Sci. Technol. Lett. 6(9):525-531.
Ma, Y., Jin, J., Li, P., Xu, M., Sun, Y., Wang, Y., et Yuan, H. 2017. Organophosphate ester flame retardant concentrations and distributions in serum from inhabitants of Shandong, China, and changes between 2011 and 2015. Environ. Toxicol. Chem. 36:414-421. (Disponible en anglais seulement)
Marklund, A. 2005. Levels and sources of organophosphorus flame retardants and plasticizers in indoor and outdoor environments [PDF]. Umeå (Suède), Université d’Umeå. [Consulté le 23 mars 2016]. (Disponible en anglais seulement)
Matz, C.J., Stieb, D.M., Davis, K., Egyed, M., Rose, A., Chou, B., et Brion, O. 2014. Effects of age, season, gender and urban-rural status on time-activity: Canadian Human Activity Pattern Survey 2 (CHAPS 2). Int. J. Environ. Res. Public Health 11:2108-2124. (Disponible en anglais seulement)
McGee, S.P., Konstantinov, A., Stapleton, H.M., et Volz, D.C. 2013. Aryl phosphate esters within a major PentaBDE replacement product induce cardiotoxicity in developing zebrafish embryos: Potential role of the aryl hydrocarbon receptor. Tox. Sci. 133(1):144-156.
Mead Johnson Nutrition. 2020. Ressources et informations produits : Renseignements sur les mesures des produits en poudre. Kanata (Ont.), Mead Johnson and Company, LLC. [Consulté le 23 avril 2024]. (Disponible en anglais seulement)
Mead Johnson Nutrition. 2023. Produits pédiatriques : Guide des produits [PDF]. Kanata (Ont.), Mead Johnson and Company, LLC. [Consulté le 23 avril 2024].
Mendelsohn, E., Hagopian, A., Hoffman, K., Butt, C.M., Lorenzo, A., Congleton, J., Webster, T.F., et Stapleton, H.M. 2016. Nail polish as a source of exposure to triphenyl phosphate. Environ. Int. 86:45-51.
Miller, G.Z., et Gearhart, J. 2016. Traveling with toxics: Flame retardants and other chemicals in children’s car seats. Michigan (États-Unis), HealthyStuff, Ecology Center. [Consulté le 29 mars 2018]. (Disponible en anglais seulement)
Navaranjan, G., Jantunene, L.M., Diamond, M.L., Harris, S.A., Bernstein, S., Scott, J.A., Takaro, T.K., Dai, R., Lefebvre, D.L., Mandhane, P.J., et al. 2021. Early life exposure to tris(2-butoxyethyl) phosphate (TBOEP) is related to the development of childhood asthma. Environ. Sci. Technol. Lett. 8:531-537. (Disponible en anglais seulement)
Nguyen, L.V., Diamond, M.L., Kalenge, S., Kirkham, T.L., Holness, D.L., et Arrandale, V.H. 2022. Occupational Exposure of Canadian Nail Salon Workers to Plasticizers Including Phthalates and Organophosphate Esters. Environ. Sci. Technol. 56:3193-3203.
[NHANES 2011-2018] Centers for Disease Control and Prevention (CDC). National Center for Health Statistics (NCHS). National Health and Nutrition Examination Survey Data. Hyattsville, (MD), Department of Health and Human Services des États-Unis, Centers for Disease Control and Prevention, [2011-2018]. (Disponible en anglais seulement)
Norris, B., et Smith, S. 2002. Research into the mouthing behaviour of children up to 5 years old. Londres (Royaume-Uni). Consumer and Competition Policy Directorate, Department of Trade and Industry.
[NTP] National Toxicology Program (États-Unis). 2018. NTP Research Report on In Vivo Repeat Dose Biological Potency Study of Triphenyl Phosphate (CAS No. 115-86-6) in Male Sprague Dawley Rats (Hsd: Sprague Dawley SD) (Gavage Studies). Research Triangle Park (NC), National Toxicology Program. NTP RR 8.
[OCDE] Organisation de coopération et de développement économiques. 2002. SIDS initial assessment profile Triphenyl phosphate: CAS No. 115-86-6. SIAM [SIDS Initial Assessment Meeting] 15. 2002; Allemagne. [Consulté le 5 avril 2018]. (Disponible en anglais seulement)
Ospina, M., Jayatilaka, N., Wong, L.Y., Restrepo, P., et Calafat, A. 2018. Exposure to organophosphate flame retardant chemicals in the U.S. general population: Data from the 2013-2014 National Health and Nutrition Examination Survey. Environ. Int. 110:32-41.
Peng, C., Zhang, X., Chen, Y., et Wang, L. 2023. Toxicity assessment of organophosphate flame retardant triphenyl phosphate (TPHP) on intestines in mice. Ecotoxicol. Environ. Saf. 268:115685. (Disponible en anglais seulement)
Phillips, A.L., Hammel, S.C., Hoffman, K., Lorenzo, A.M., Chen, A., Webster, T.F., et Stapleton, H.M. 2018. Children’s residential exposure to organophosphate ester flame retardants and plasticizers: Investigating exposure pathways in the TESIE study. Environ. Int. 116:176-185.
Phillips, A.L., Hammel, S.C., Konstantinov, A., et Stapleton, H.M. 2017. Characterization of individual isopropylated and tert-butylated triarylphosphate (ITP and TBPP) isomers in several commercial flame retardant mixtures and house dust standard reference material SRM 2585. Environ. Sci. Technol. 51:13443-13449.
Poma, G., Glynn, A., Malarvannan, G., Covaci, A., et Darnerud, P.O. 2017. Dietary intake of phosphorus flame retardants (PFRs) using Swedish food market basket estimations. Food Chem. Toxicol. 100:1-7.
Poma, G., Malysheva, S.V., Goscinny, S., Malarvannan, G., Voorspoels, S., Covaci, A., et Van Loco, J. 2018. Occurrence of selected halogenated flame retardants in Belgian foodstuff. Chemosphere 194:256-265.
Rodgers, K.M., Bennett, D., Moran, R., Knox, K., Stoiber, T., Gill, R., Young, T.M., Blum, A., et Dodson, R.E. 2021. Do flame retardant concentrations change in dust after older upholstered furniture is replaced? Environ. Int. 153:106513.
Santé Canada. [Modifié le 11 février 2022]. Facteurs d’exposition utilisés dans les évaluations des risques pour la santé humaine au Canada. Ottawa (Ont.), gouvernement du Canada. [Consulté le 4 janvier 2024].
Santé Canada. 1994. L’évaluation des risques à la santé humaine des substances d’intérêt prioritaire [PDF, 246 Ko]. Ottawa (Ont.), ministre des Approvisionnements et Services Canada. No de cat. En40-215/41F.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.), gouvernement du Canada.
Santé Canada. 2018a. Draft backgrounder document on default values for breast milk and formula intakes. Rapport inédit. Ottawa (Ont.), gouvernement du Canada.
Santé Canada. 2018b. Le Tableau de la consommation des aliments fondé sur l’Enquête sur la santé dans les collectivités canadiennes, Nutrition 2015, de Statistique Canada. Fichier de partage. Ottawa. En ligne : Le Tableau de la consommation des aliments (ESCC Nutrition 2015) – Portail du gouvernement ouvert (canada.ca).
Santé Canada. 2019. Determination of Flame Retardants in a Survey of Consumer Products: Isopropylphenyl phosphate (IPPP). Rapport de projet no P2019-00015A5; 27 juin 2019. Ottawa (Ont.), Laboratoire de la sécurité des produits. 35 p.
Santé Canada. 2023a. 2022-2023 Chemicals Management Plan Flame Retardants in Children’s Products Survey. Rapport de projet no P2022-00074; 27 juin 2023. Ottawa (Ont.), Laboratoire de la sécurité des produits. 55 p.
Santé Canada. 2023b. 2022-2023 Chemicals Management Plan Flame Retardants in Building Material and Foam Pillows Survey. Rapport de projet no P2022-00050; 18 mai 2023. Ottawa (Ont.), Laboratoire de la sécurité des produits. 48 p.
Santé Canada. 2023c. Screening for Organic Flame Retardants in Foam Children’s Products. Rapport de projet no P2023-00051; 27 octobre 2023. Ottawa (Ont.), Laboratoire de la sécurité des produits. 23 p.
Santé Canada. 2023d. Tableau de bord sur la biosurveillance canadienne. Ottawa (Ont.), Santé Canada.
[SC] Santé Canada. [Modifié le 22 janvier 2024a]. Guide à l’intention de l’industrie sur les produits de vapotage visés par la Loi canadienne sur la sécurité des produits de consommation. Ottawa (Ont.), gouvernement du Canada.
[SC] Santé Canada. [Modifié le 22 juillet 2024b]. Réglementation du tabac et des produits de vapotage. Ottawa (Ont.), gouvernement du Canada.
[SCCS] Comité scientifique pour la sécurité des consommateurs. 2024. Opinion on Triphenyl phosphate. Luxembourg, Commission européenne. [Consulté le 4 avril 2024]. (Disponible en anglais seulement)
Schoeters, G., Verheyen, V.J., Colles, A., Remy, S., Rodriguez, M.L., Govarts, E., Nelen, V., Den Hond, E., De Decker, A., Franken, C., et al.Internal exposure of Flemish teenagers to environmental pollutants: Results of the Flemish Environment and Health Study 2016-2020 (FLEHS IV) Int. J. Hyg. Environ. Health. 242:2022:113972.
Selmi-Ruby, S., Marín-Sáez, J., Fildier, A., Buleté, A., Abdallah, M., Garcia, J., Deverchère, J., Spinner, L., Giroud, B., Ibanez, S., Granjon, T., et al. 2020. In vivo characterization of the toxicological properties of DPhP, one of the main degradation products of aryl phosphate esters. Environ. Health Persp. 128(12):127006.
Shoeib, M., Ahrens, L., Jantunen, L., et Harner, T. 2014. Concentrations in air of organobromine, organochlorine and organophosphate flame retardants in Toronto, Canada. Atmos. Environ. 99:140-147.
Siddique, S., Farhat, I., Kubwabo, C., Chan, P., Goodyer, C.G., Robaire, B., Chevrier, J., et Hales, B.F. 2022. Exposure of men living in the greater Montreal area to organophosphate esters: association with hormonal balance and semen quality. Environ. Int. 166:107402. (Disponible en anglais seulement)
Siddique, S., Harris, S.A., Kosarac, I., Latifovic, L., et Kubwabo, C. 2020. Urinary metabolites of organophosphate esters in women and their relationship with serum lipids: An exploratory analysis. Environ. Pollut. 263:114110.
Stapleton, H.M., Klosterhaus, S., Keller, A., Ferguson, P.L., Van Bergen, S., Cooper, E., Webster, T.F., et Blum, A. 2011. Identification of flame retardants in polyurethane foam collected from baby products. Environ. Sci. Technol. 45:5323-5331.
Stapleton, H.M., Sharma, S., Getzinger, G., Ferguson, P.L., Gabriel, M., Webster, T.F., et Blum, A. 2012. Novel and high volume use flame retardants in US couches reflective of the 2005 PentaBDE phase out. Environ. Sci. Technol. 46:13432-13439.
Statistique Canada. 2015. Enquête sur la santé dans les collectivités canadiennes (ESCC). Ottawa (Ont.), Statistique Canada.
Su, G., Letcher, R.J., et Yu, H. 2016. Organophosphate flame retardants and plasticizers in aqueous solution: pH-dependent hydrolysis, kinetics, and pathways.Environ. Sci. Technol. 50:8103-8111.
Sundkvist, A., Olofsson, U., et Haglund, P. 2010. Organophosphorus flame retardants and plasticizers in marine and fresh water biota and in human milk. J. Envi. Monit. 12:943-951.
Thomas, M.B., Stapleton, H.M., Dills, R.L., Violette, H.D., Christakis, D.A., et Sathyanarayana, S. 2016. Demographic and dietary risk factors in relation to urinary metabolites of organophosphate flame retardants in toddlers. Chemosphere 185:918-925.
[US CPSC] US Consumer Product Safety Commission. 2005. Migration of Flame Retardant Chemicals in Upholstered Furniture Foam [PDF]. Washington (DC), Division of Chemistry, US CPSC. [Consulté le 29 mars 2018]. (Disponible en anglais seulement)
[US CPSC] US Consumer Product Safety Commission. 2006. CPSC Staff Preliminary risk assessment of flame retardant chemicals in upholstered furniture foam [PDF]. Bethesda (MD), US CPCS. [Consulté le 29 mars 2018]. (Disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2011. Exposure Factors Handbook, édition de 2011 (rapport final). Washington (DC), Office of Research and Development, National Center for Environmental Assessment. [Consulté le 29 avril 2022].
[US EPA] United States Environmental Protection Agency. 2012. Chemical Data Reporting data collected under the Environmental Protection Agency’s Toxic Substances Control Act. Washington (DC), US EPA. [Consulté le 4 juin 2020]. (Disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2020a. Final Scope of the Risk Evaluation for Triphenyl Phosphate (TPP) CASRN 115-86-6 [PDF]. Washington (DC), Office of Chemical Safety and Pollution Prevention. EPA-740-R-20-010. [Consulté le 4 janvier 2024]. (Disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2020b. Use Report for TPP (CASRN 115-86-6) [PDF]. Washington (DC), Office of Chemical Safety and Pollution Prevention. [Consulté le 4 janvier 2024]. (Disponible en anglais seulement)
Wang, D., Zhu, W., Chen, L., Yan, J., Teng, M., et Zhou, Z. 2018. Neonatal triphenyl phosphate and its metabolite diphenyl phosphate exposure induce sex-and dose-dependent metabolic disruptions in adult mice. Environ. pollut. 237:10-17.
Wang, M., Xu, J., Zhao, Z., Gong, L., Su, Y., Fang, Z., Chen, P., Liu, Y., Zhang, L., et Xu, F. 2023. Triphenyl phosphate induced apoptosis of mice testicular Leydig cells and TM3 cells through ROS-mediated mitochondrial fusion inhibition. Ecotoxicol. Environ. Saf. 256:114876.
Wang, X., Chen, P., Zhao, L., Zhu, L., et Wu, F. 2021. Transplacental behaviors of organophosphate tri-and diesters based on paired human maternal and cord whole blood: efficiencies and impact factors. Environ. Sci. Technol. 55(5):3091-3100.
Wang, X., Liu, Q., Zhong, W., Yang, L., Yang, J., Covaci, A., et Zhu, L. 2020. Estimating renal and hepatic clearance rates of organophosphate esters in humans: Impacts of intrinsic metabolism and binding affinity with plasma proteins. Environ. Int. 134:105321.
Wang, Y., et Kannan, K. 2018. Concentrations and Dietary Exposure to Organophosphate Esters in Foodstuffs from Albany, New York, United States. J. Agric. Food Chem. 66(51):13525-13532.
Wang, Y., Li, W., Martínez-Moral, M.P., Sun, H., et Kannan, K. 2019. Metabolites of organophosphate esters in urine from the United States: Concentrations, temporal variability, and exposure assessment. Environ. Int. 122:213-221.
Wei, B., O’Connor, R.J., Goniewicz, M.L., Hyland, A. 2020. Emerging chemicals of health concern in electronic nicotine delivery systems. Chem. Res. Toxicol. 33(10):2637-2646.
Witchey, S.K., Sutherland, V., Collins, B., Roberts, G., Shockley, K.R., Vallant, M., Krause, J., Cunny, H., Waidyanatha, S., Mylchreest, E., Sparrow, B., Moyer, R., et Behl, M. 2023. Reproductive and developmental toxicity following exposure to organophosphate ester flame retardants and plasticizers, triphenyl phosphate and isopropylated phenyl phosphate, in Sprague Dawley rats. Toxicol. Sci. 191(2):374-386. (Disponible en anglais seulement)
Wu, Y., Miller, G.Z., Gearhart, J., Romanak, K., Lopez-Avila, V., et Venir, M. 2019. Children’s car seats contain legacy and novel flame retardants [PDF]. Environ. Sci. Technol. 6(1):14-20. (Disponible en anglais seulement)
Yang, C., Diamond, M.L., Latifovic, L., Tsirlin, D., Harris, S.A., et Jantunen, L. 2017. Semivolatile organic compounds in Canadian homes; A comprehensive household exposure study. Rapport inédit. Toronto (Ont.), Université de Toronto, Action Cancer Ontario et Environnement et Changement climatique Canada.
Yang, C., Harris, S.A., Jantunen, L.M., Siddique, S., Kubwabo, C., Tsirlin, D., Latifovic, L., Fraser, B., St-Jean, M., De La Campa, R., You, H., Kulka, R., et Diamond, M.L. 2019. Are cell phones an indicator of personal exposure to organophosphate flame retardants and plasticizers? Environ. Int. 122:104-116.
Zhang, Q., Ji, S., Chai, L., Yang, F., Zhao, M., Liu, W., Schüürmann, G., et Ji, L. 2018. Metabolic mechanism of aryl phosphorus flame retardants by cytochromes P450: a combined experimental and computational study on triphenyl phosphate. Environ. Sci. Technol. 52(24):14411-14421.
Zhang, R., Li, N., Li, J., Zhao, C., Luo, Y., Wang, Y., et Jiang, G. 2022. Percutaneous absorption and exposure risk assessment of organophosphate esters in children’s toys. J. Hazard. Mater. 440:129728.
Zhao, F., Kang, Q., Zhang, X., Liu, J., et Hu, J. 2019b. Urinary biomarkers for assessment of human exposure to monomeric aryl phosphate flame retardants. Environ. Int. 124:259-264.
Zhao, L., Jian, K., Su, H., Zhang, Y., Li, J., Letcher, R.J., et Su, G. 2019a. Organophosphate esters (OPEs) in Chinese foodstuffs: Dietary intake estimation via a market basket method, and suspect screening using high-resolution mass spectrometry. Environ. Int. 128:343-352.
Zheng, G., Schreder, E., Dempsey, J.C., Uding, N., Chu, V., Andres, G., Sathyanarayana, S., et Salamova, A. 2021. Organophosphate Esters and Their Metabolites in Breast Milk from the United States: Breastfeeding Is an Important Exposure Pathway for Infants. Environ. Sci. Technol. Lett. 8:224-230.
Zhong, X., Yu, Y., Wang, C., Zhu, Q., Wu, J., Ke, W., Ji, D., Niu, C., Yang, X., et Wei, Y. 2021. Hippocampal proteomic analysis reveals the disturbance of synaptogenesis and neurotransmission induced by developmental exposure to organophosphate flame retardant triphenyl phosphate. J. Hazard. Mater. 404:124111.
Zhou, M., Wang, J., Yang, H., Ji, X., Qian, M., et Li, Z. 2022. Organophosphate ester concentrations in infant food and dietary risk assessment for the infant population in China. Food Control. 139:109107.
Zhu, H., Al-Bazi, M.M., Kumosani, T.A., et Kannan, K. 2020. Occurrence and Profiles of Organophosphate Esters in Infant Clothing and Raw Textiles Collected from the United States. Environ. Sci. Technol. Lett. 7:415-420.
Annexe A. Estimations de l’absorption quotidienne par groupe d’âge au sein de la population générale du Canada
| Groupe d’âge | Poids corporel (kg) | Taux d’inhalation (m3/j) | Eau potable (L/j) | Taux d’ingestion de sol (µg/j) | Taux d’ingestion de poussière (µg/j) |
|---|---|---|---|---|---|
| 0 à 5 mois | 6,3 | 3,7 | 0,83 | S.O. | 21,6 |
| 6 à 11 mois | 9,1 | 5,4 | 0,76 | 7,3 | 27,0 |
| 1 an | 11 | 8,0 | 0,36 | 8,8 | 35,0 |
| 2 à 3 ans | 15 | 9,2 | 0,43 | 6,2 | 21,4 |
| 4 à 8 ans | 23 | 11,1 | 0,53 | 8,7 | 24,4 |
| 9 à 13 ans | 42 | 13,9 | 0,74 | 6,9 | 23,8 |
| 14 à 18 ans | 62 | 15,9 | 1,09 | 1,4 | 2,1 |
| Adultes (19 ans et plus) | 74 | 15,1 | 1,53 | 1,6 | 2,6 |
a Santé Canada [modifié, 2022].
| Voie d’exposition | 0 à 5 mois (lait maternelb) | 0 à 5mois (préparation pour nourrissonsc) | 6 à 11mois (lait maternelb) | 6 à 11mois (préparation pour nourrissonsc) | 1an | 2 à 3ans | 4 à 8ans | 9 à 13ans | 14 à 18ans | 19ans et plus |
|---|---|---|---|---|---|---|---|---|---|---|
| Air intérieurd | 7,8x10-3 | 7,8x10-3 | 7,9x10-3 | 7,9x10-3 | 9,7x10-3 | 8,2x10-3 | 6,4x10-3 | 4,4x10-3 | 3,4x10-3 | 2,7x10-3 |
| Eau potablee | S.O. | 0,35 | 0,23 | 0,23 | 8,8x10-2 | 7,7x10-2 | 6,2x10-2 | 4,8x10-2 | 4,8x10-2 | 5,6x10-2 |
| Aliments et boissonsf | 9,4x10-2 | 0,38 | 0,69 | 0,94 | 0,64 | 0,64 | 6,4x10-2 | 4,1x10-2 | 2,7x10-2 | 2,4x10-2 |
| Poussièreg | 8,2x10-2 | 8,2x10-2 | 7,1x10-2 | 7,1x10-2 | 7,6x10-2 | 3,4x10-2 | 2,5x10-2 | 1,4x10-2 | 8,1x10-4 | 8,4x10-4 |
| Absorption totale | 0,18 | 0,83 | 1,0 | 1,2 | 0,81 | 0,76 | 0,16 | 0,11 | 0,079 | 0,083 |
Abréviation : S.O. = sans objet.
a Les estimations de l’absorption de PTPh à partir de l’air ambiant étaient négligeables lorsque l’on utilisait la concentration maximale de PTPh dans l’air extérieur (0,0022 μg/m3; Shoeib et al., 2014). Nous n’avons trouvé aucune donnée de surveillance des sols en Amérique du Nord. Une concentration environnementale estimée (CEE) dans le sol représentant le scénario de la pire exposition (c’est-à-dire CEE maximale de 2 400 ng/g pour tous les OP aryliques) et une concentration maximale de 46 μg/kg provenant d’une étude des sols de zones commerciales en Chine (Cui et al., 2017) étaient disponibles, mais donnaient lieu à des expositions négligeables.
b Il a été supposé que les bébés nourris au lait maternel ne consommaient que cet aliment pendant 6 mois. Aucune donnée canadienne sur la concentration de PTPh dans le lait maternel n’a été trouvée. La concentration maximale de PTPh dans le lait maternel de 0,76 ng/mL (7,6x10-4 µg/g) mesurée chez 100 femmes aux États-Unis (Ma et al., 2019) a été utilisée pour calculer les estimations de l’absorption quotidienne de PTPh chez les enfants de 0 à 5 mois et de 6 à 11 mois. La consommation médiane de lait maternel de 127,95 g/kg p.c./j pour les enfants de 0 à 6 mois indiquée par Arcus-Arth et al. (2005) a été utilisée pour calculer les estimations de l’absorption quotidienne chez les enfants de 0 à 5 mois nourris exclusivement au lait maternel. Il a été supposé que les enfants de 6 à 11 mois consommaient 632 mL/j de lait maternel, en plus de certains aliments solides (Santé Canada, 2018a). Voir la note de bas de page sur l’absorption quotidienne à partir des aliments pour en savoir plus sur les estimations de l’exposition alimentaire au PTPh provenant des aliments solides chez les enfants de 6 à 11 mois.
c Il a été supposé que les enfants de 0 à 5 mois exclusivement nourris avec des préparations pour nourrissons consommaient 826 mL/j de ces préparations et que celles-ci constituent leur seule source d’alimentation (Santé Canada, 2018a). Il a été supposé que les enfants de 6 à 11 mois nourris avec des préparations pour nourrissons consommaient 764 mL/j de préparation, en plus de certains aliments solides (Santé Canada, 2018a). Étant donné que les préparations pour nourrissons sont préparées avec de l’eau potable, il a été supposé que les enfants de 0 à 5 mois et de 6 à 11 mois consommaient respectivement 826 mL/j et 764 mL/j d’eau potable. Voir la note de bas de page sur l’absorption quotidienne à partir des aliments pour en savoir plus sur les estimations de l’exposition alimentaire au PTPh provenant d’aliments solides, et voir la note de bas de page sur l’eau potable pour en savoir plus sur les concentrations de PTPh dans l’eau utilisées pour les estimations relatives aux enfants de 6 à 11 mois. La dose journalière de préparation en poudre a été estimée en supposant que 9 g de préparation sèche étaient reconstitués avec 60 mL d’eau (Abbott Nutrition, 2024; Mead Johnson Nutrition, 2020, 2023). Les moyennes de 19,53 et 24,07 ng/g de PTPh dans les préparations en poudre de stade 1 (pour les enfants de 0 à 6 mois) et de stade 2 (pour les enfants de 7 à 12 mois), respectivement, indiquées par Chen et al. (2022), ont été utilisées pour calculer les estimations de l’absorption quotidienne de chaque groupe d’âge.
d La concentration de PTPh dans l’air intérieur au 95e centile (0,0152 μg/m3, à Toronto et Ottawa, en Ontario) (Yang et al., 2019) a été utilisée pour calculer les valeurs estimatives supérieures de l’absorption quotidienne découlant de l’exposition par l’air intérieur. Il a été supposé que les Canadiens passaient 21 heures à l’intérieur chaque jour (Santé Canada, 1998).
e Une estimation de la CEE en milieu aquatique maximale de 2,7 μg/L pour tous les OP aryliques a été choisie dans le cadre d’une approche prudente pour calculer l’absorption de PTPh à partir de l’eau potable de la population générale (ECCC, SC, 2021).
f Sauf indication contraire (par exemple, lait maternel, préparation en poudre), voir l’annexe B pour en savoir plus sur l’évaluation de l’exposition alimentaire au PTPh. Il a été supposé que l’exposition alimentaire provenant des aliments solides chez les enfants de 6 à 11 mois était la même que chez les enfants de 1 à 3 ans; cependant, les renseignements sur la consommation dans ce scénario d’exposition étaient fondés sur la catégorie plus large d’« aliments pour bébés », qui peut comprendre les préparations pour nourrissons en plus de divers aliments pour nourrissons et, par conséquent, peut entraîner une surestimation de l’exposition par les aliments solides chez les enfants de 6 à 11 mois. L’exposition alimentaire des adultes de 19 ans et plus a été calculée à l’aide de l’exposition alimentaire au PTPh estimée chez les 19 à 30 ans, ce qui peut entraîner la surestimation de l’exposition alimentaire des personnes de 31 ans et plus.
g La concentration la plus élevée de PTPh au 95e centile (23 972 ng/g) indiquée dans l’étude de cohorte CHILD (Navaranjan et al., 2021), tirée de mesures prises dans diverses villes canadiennes, a été choisie pour calculer les estimations de l’absorption quotidienne attribuable à l’exposition à la poussière.
Annexe B. Données utilisées dans les estimations de l’exposition alimentaire au PTPh
Les données sur la consommation alimentaire utilisées dans l’évaluation en question reposaient sur le Tableau de la consommation des aliments (Santé Canada, 2018b) élaboré à partir des résultats de l’Enquête sur la santé dans les collectivités canadiennes de 2015 (Statistique Canada 2015), une enquête mémoire de 24 heures sur les aliments. La Direction de l’alimentation et de la nutrition de Santé Canada a estimé de façon prudente et déterministe les expositions alimentaires totales moyennes d’une seule journée de « toutes les personnes » en multipliant la concentration maximale présumée dans une catégorie d’aliments donnée par la quantité moyenne de cet aliment consommée par chaque groupe d’âge. Les expositions aux différentes catégories d’aliments de chaque groupe d’âge ont ensuite été additionnées pour obtenir une estimation moyenne « totale » de l’exposition au PTPh de chaque groupe d’âge (tableau B-2).
| Catégorie d’aliments utilisée dans l’évaluation de l’exposition alimentaire | Concentration maximale de PTPh (ng/g) | Référence |
|---|---|---|
| Pâtes alimentaires, riz, grains céréaliers et farines; pains blancs; pains à grains entiers; autres produits céréaliers; céréales de déjeuner riches en fibres et à grains entiers; céréales de déjeuner | 4,55 | Wang et Kannan, 2018 |
| Biscuits sucrés et salés, barres granola; Brioches, gâteaux, tartes, beignes et pâtisseries (de type commercial) | 1,24 | Poma et al., 2017 |
| Lait; crèmes; produits laitiers glacés | 0,15 | Wang et Kannan, 2018 |
| Fromages | 0,15 | Wang et Kannan, 2018 |
| Yogourts | 0,15 | Wang et Kannan, 2018 |
| Matières grasses (beurre, margarine, huile végétale, shortening et graisses animales) | 0,15 | Wang et Kannan, 2018 |
| Bœuf; veau; agneau; porc, frais et jambon; volailles; foies et pâtés de foie; saucisses (fraîches et fumées); gibiers; produits de la viande transformés (conserves et viandes froides) | 0,18 | Wang et Kannan, 2018 |
| Poissons | 0,28 | Wang et Kannan, 2018 |
| Fruits de mer | 0,15 | Wang et Kannan, 2018 |
| Œufs | 0,17 | Poma et al., 2018 |
| Légumes (sauf pommes de terre) | 1,00 | He et al., 2018 |
| Pommes de terre (cuites et frites, y compris les croustilles) | 1,29 | Poma et al., 2018 |
| Fruits | 1,4 | Zhao et al., 2019a |
| Jus de fruits et liqueurs | 0,0013 | He et al., 2018 |
| Boissons aux fruits et boissons gazeuses | 0,50 | Poma et al., 2017 |
| Bière | 0,0013 | He et al., 2018 |
| Thé; café | 0,0013 | He et al., 2018 |
| Aliments pour bébés (y compris les préparations pour nourrissons) | 423 | ACIA, 2019-2021 |
| Sucres (blancs et cassonade); bonbons, gommes à mâcher; confitures, gelées et marmelades; autres sucres (sirops, mélasse, miel, etc.); popsicles, sorbet; poudres à mélanger pour gélatines, poudings et succédané de crème fouettée; barres de chocolat | 0,50 | Poma et al., 2017 |
| Soupes avec légumes; soupes sans légumes | 2,41 | Poma et al., 2018 |
| Gravies; sauces (blanches, béarnaise, soya, tartare, ketchup, etc.); vinaigrettes (avec ou sans huile) | 0,50 | Poma et al., 2017 |
| Groupe d’âge, femmes et hommes (âge) | Exposition alimentaire moyenne de « toutes les personnes » au PTPha (µg/kg p.c./j) |
|---|---|
| 1 à 3 ans | 0,64 |
| 4 à 8 ans | 0,064 |
| 9 à 13 ans | 0,041 |
| 14 à 18 ans | 0,027 |
| 19 à 30 ans | 0,024 |
| 31 à 50 ans | 0,023 |
| 51 à 70 ans | 0,021 |
| 71 ans et plus | 0,021 |
a Étant donné que les chiffres sur la consommation du Tableau de la consommation des aliments de l’Enquête sur la santé dans les collectivités canadiennes de 2015 sont fondés sur le groupe d’âge ou sur le groupe d’âge et le sexe, et que les expositions ont été additionnées pour chaque groupe d’âge plutôt que sur une base individuelle, il n’est pas approprié d’additionner les chiffres de consommation au centile supérieur ou les estimations d’exposition au centile supérieur des différentes catégories d’aliments, car ces valeurs représentent probablement des micropopulations différentes. Par conséquent, nous n’avons pas calculé d’estimation de l’exposition au centile supérieur à partir des chiffres de consommation au centile supérieur.
Annexe C. Résumé des données sur le PTPh mesuré dans le lait maternel
| Lieu | n | Taux de détection | Moyenne | Plage de concentration | Étude |
|---|---|---|---|---|---|
| États-Unis | 100 | 55 % | 0,149 ng/mL | Non détecté (SQ = 0,109 ng/mL) à 0,760 ng/mL | Ma et al., 2019 |
| États-Unis (région de Seattle) | 50 | 61 % | 0,0820 ng/mL | < 0,062 (SDM) à 0,241 ng/mL | Zheng et al., 2021 |
| Valence, Espagne | 20a | N.I. | 12,3 ng/g pl (médiane = 9,9 ng/g pl) | 17,3 ng/g pl (max.) | Beser et al., 2020 |
| Suèdeb | Cinq échantillons regroupés et un échantillon d’une seule personne | S.O. | S.O. (médiane de 8,5 ng/g pl) | 5,0 à 11 ng/g pl | Sundkvist et al., 2010 |
| Beijing, Chine | 105c | 99 % | 13,1 ng/mL (médiane de 1,07 ng/mL) | 87,1 ng/mL (max.) | Chen et al., 2021 |
| Japon, Philippines et Vietnamd | 87 | 86 %e | N.I (médianes de 1,4 à 19 ng/g pl) | Non détectéf à 140 ng/g pl | Kim et al., 2014 |
Abréviations : N.I. = non indiqué; pl = poids lipidique; SDM = seuil de détection de la méthode; S.O. = sans objet; SQ = seuil de quantification.
a Les échantillons ont été prélevés chez 14 femmes âgées de 30 à 39 ans.
b Les échantillons ont été prélevés chez 286 femmes dans 4 villes suédoises. Des échantillons composites regroupés, prélevés de 1997 à 2003, ont été analysés. La concentration la plus élevée pour un échantillon regroupé était de 10 ng/g de lipides pour 90 femmes à Uppsala en 1998. Un seul échantillon prélevé sur une femme à Umeå en 2007 a donné un taux plus élevé de PTPh dans cette étude, soit 11 ng/g de lipides.
c Échantillons prélevés chez des femmes âgées de 25 à 40 ans.
d Les échantillons provenant de Kanagawa, au Japon, ont été prélevés principalement dans des zones urbaines. Aux Philippines, des échantillons ont été prélevés à Malate (zone urbaine) et à Payatas (près d’un site de dépôt de déchets municipaux). Au Vietnam, des échantillons ont été prélevés à Hanoï (ville densément peuplée) et à Bui Dau et Trang Minh (sites de recyclage de déchets électroniques).
e L’étude de Kim et al. (2014) faisait état d’un taux global de détection de PTPh dans les échantillons de 86 % pour l’ensemble des lieux.
f L’étude de Kim et al. (2014) indiquait que les SDM pour toutes les substances visées par l’étude se situaient entre 0,01 et 0,08 ng/g pl.
Annexe D. Paramètres utilisés pour estimer l’exposition humaine due à l’utilisation de produits et d’articles manufacturés proposés aux consommateurs
Produits
Des scénarios d’exposition sentinelles ont été utilisés pour estimer l’exposition potentielle au PTPh et au PTBOE attribuable aux produits de consommation. L’exposition cutanée attribuable aux vernis à ongles, aux lubrifiants et graisses, et aux peintures a été estimée à l’aide de ConsExpo Web (2021) ou d’algorithmes (voir ci-dessous pour en savoir plus). Les poids corporels utilisés dans les estimations de l’exposition sont présentés dans le tableau A-1. Les hypothèses propres aux scénarios sont indiquées dans le tableau D-1.
| Produit (substance) | Hypothèses |
|---|---|
| Protecteur de vernis (supposition d’une couche sur les ongles des doigts et des orteils)b (PTPh) | Concentration maximale de PTPh : 10 % ConsExpo Web : cutanée – application instantanée Fréquence (utilisation/jour) : expositions calculées par événement |
| Vernis à ongles (supposition de 2 couches sur les ongles des doigts et des orteils)b (PTPh) | Concentration maximale de PTPh : 15 % ConsExpo Web : cutanée – application instantanée Fréquence (utilisation/jour) : expositions calculées par événement |
| Vernis de base (supposition d’une couche sur les ongles des doigts et des orteils)b (PTPh) | Concentration maximale de PTPh : 10 % ConsExpo Web : cutanée – application instantanée Fréquence (utilisation/jour) : expositions calculées par événement |
| Trousse de manucure (supposition de 2 couches d’activateur sur les ongles des doigts)b (PTPh) | Concentration maximale de PTPh : 30 % dans l’activateur ConsExpo Web : cutanée – application instantanée Fréquence (utilisation/jour) : expositions calculées par événement |
| Lubrifiants et graisses (par exemple fluide de servodirection) (PTPh) | Concentration de PTPh : 0,1 % à 1 % (FDS, 2017, 2021; US EPA, 2020b) Voie cutanée : Absorption = (concentration × surface × épaisseur de la pellicule × masse volumique × absorption cutanée)/poids corporel Surface exposée : 6 cm2 (surface du bout des doigts et du pouce, 19 ans et plus) |
a Absorption cutanée de 50 % utilisée dans toutes les estimations de l’exposition cutanée (voir la section 2.4.1.2).
b Il est supposé que l’exposition ne se produit pas par l’ongle, mais seulement par la peau qui l’entoure (Bremmer et al., 2006).
Articles manufacturés
En nous fondant sur les renseignements disponibles, nous avons estimé l’absorption due à l’exposition cutanée par contact direct avec des matelas et d’autres articles manufacturés connexes contenant de la mousse pour tous les groupes d’âge ainsi que l’absorption due à l’exposition cutanée par contact direct avec les systèmes de retenue pour bébé et enfant contenant de la mousse (y compris les sièges d’appoint) pour les enfants de 0 à 13 ans. Nous avons également estimé l’exposition par voie orale des enfants de 0 à 3 ans qui mâchonnent (suçotent) des articles manufacturés contenant de la mousse destinés aux enfants ainsi que des textiles. Les paramètres et les valeurs utilisés pour estimer les expositions sont présentés ci-dessous et reposent sur des hypothèses prudentes. Les poids corporels utilisés dans les estimations de l’exposition sont présentés dans le tableau A-1. Seules des données limitées ont été trouvées sur la relation entre les taux de migration hors de la mousse et les concentrations dans la mousse analysée; cet aspect n’a pu être quantifié pour les substances ignifuges faisant l’objet du présent document.
Estimations de l’absorption due à l’exposition cutanée :
Absorption (mg/kg p.c./j) = [surface (cm2) × facteur de contact cutané × facteur de pénétration textile × taux de migration (mg/cm2/h) × durée d’exposition (h/j) × absorption cutanée]/poids corporel (kg)
| Groupe d’âge | Surface de contact cutanéa (cm2) | Durée d’exposition en position allongée sur des matelas ou des meubles rembourrés contenant de la mousseb (h/j) | Durée d’exposition en position assise sur un système de retenue pour bébé ou enfant (y compris les sièges d’appoint)c,d (h/j) |
|---|---|---|---|
| 0 à 5 mois | 520 à 1 750 | 12,7 | 3 |
| 6 à 11 mois | 668 à 2 250 | 12,7 | 3 |
| 1 an | 753 à 2 650 | 13 | 3 |
| 2 à 3 ans | 705 à 3 250 | 11,8 | 3 |
| 4 à 8 ans | 922 à 4 450 | 11,25 | 3 |
| 9 à 13 ans | 1 332 à 6 700 | 10,83 | 3 |
| 14 à 18 ans | 1 642 à 8 600 | 9,17 | S.O. |
| 19 ans et plus | 2 005 à 9 350 | 8 | S.O. |
a Une plage de valeurs de surface a servi à représenter le contact cutané avec les matelas et les meubles rembourrés, tandis que seules les valeurs de surface inférieures ont été utilisées pour représenter le contact cutané avec la mousse ou le tissu des systèmes de retenue pour enfant ou bébé (y compris les sièges d’appoint). Pour calculer les valeurs de surface inférieures, nous avons présumé que la personne portait des shorts et un t-shirt couvrant la moitié de ses membres. La surface d’exposition est une fraction de la moitié inférieure des membres (bras et jambes) et de l’arrière de la tête. La surface des membres (Santé Canada [modifié, 2022]) a été multipliée par un demi pour tenir compte de la couverture par les vêtements, puis par un tiers pour tenir compte de la forme triangulaire des membres, car un seul côté est directement en contact avec l’article manufacturé contenant de la mousse (US CPSC, 2006). La surface de la tête (Santé Canada [modifié, 2022]) a été multipliée par 0,5 afin de représenter l’exposition de l’arrière de la tête seulement. Pour calculer les valeurs de surface supérieures, nous avons présumé que la moitié du corps était en contact cutané avec le matelas ou le meuble rembourré (US EPA, 2012).
b Les durées de sommeil médianes indiquées par l’US EPA (2011) dans les tableaux 16-25 (0 à 6 mois) et 16-26 (tous les autres groupes d’âge) ont été utilisées comme durées d’exposition en position allongée sur des matelas ou des meubles rembourrés contenant de la mousse.
c Une durée d’exposition de 3 h/j a été choisie pour la position assise sur un système de retenue pour enfant ou bébé (y compris les sièges d’appoint), d’après la durée de détente en position assise indiquée dans le document de l’US CPSC (2006) et la plus longue durée quotidienne passée en voiture (au 95e centile) par des enfants âgés de moins d’un an à 11 ans (soit 2 h 50 pour les 5 à 11 ans) indiquée dans l’Enquête sur les profils d’activité humaine au Canada 2 (EPAHC 2) (Matz et al., 2014).
d Les règlements sur les systèmes de retenue pour bébé et enfant au Canada varient selon la province et le territoire (ASEPC, 2019). En nous fondant sur des facteurs pertinents en matière d’âge et de poids, nous avons estimé l’exposition cutanée pour divers groupes d’âge jusqu’au groupe des enfants âgés de 9 à 13 ans, inclusivement.
| Paramètre | TDCPP | TBB | PTPh |
|---|---|---|---|
| Solubilité dans l’eau (mg/L) | 18,1 | 0,00282 | 2,25 |
| Log Koe(sans dimension) | 3,69 | 7,71 | 4,42 |
| Taux de migration hors de la mousse recouverte (mg/cm2/h)a | 5,62×10-5 | 1,97×10-5 | 2,45×10-5 b 4,54×10-5 c |
a Les taux de migration du TDCPP et du TBB ont été déterminés par l’US CPSC (2005) dans des études de migration effectuées sur de la mousse de meuble traitée. Dans le cadre de l’étude, une maquette de mini-siège composée d’un bloc de mousse recouvert d’un tissu de coton et fixé à du contreplaqué a été préparée. Le mini-siège a été mouillé avec une solution saline, pour imiter la sueur, et une pression a été appliquée pour imiter l’action de s’asseoir. Les taux de migration du TDCPP et du TBB ont été déterminés en fonction de la quantité quotidienne maximale déclarée extraite pour chaque substance (8 et 2,8 μg, respectivement) sur un papier filtre (5 cm de diamètre) au cours de la période d’essai de migration (6 heures) (US CPSC, 2005).
b Valeur calculée en traçant une ligne droite entre les valeurs de solubilité dans l’eau et les taux de migration pour le TDCPP et le TBB; l’équation étant y = (2×10-6) × solubilité dans l’eau + 2×10-5.
c Valeur calculée à l’aide d’équations différentielles reposant sur les taux de migration, les solubilités dans l’eau et les valeurs de log Koe du TDCPP et du TBB; taux de migration = x (log de la solubilité dans l’eau) + y (log Koe). Pour le TDCPP, l’équation est la suivante : 0,0000562 mg/cm2/h = x (1,26) + y (3,69). Pour le TBB, elle est la suivante : 0,0000197 = x (-2,55) + y (7,71). Si l’on résout ces équations, on obtient x = 0,0000188 et y = 0,0000088. On peut alors calculer que pour le PTPh, le taux de migration = 0,0000188 (log de la solubilité dans l’eau) + 0,0000088 (log Koe) = 0,0000188 (0,35) + 0,0000088 (4,42) = 4,54 × 10-5 mg/cm2/h.
| Paramètre | TDCPP | TCEP | PTBOE |
|---|---|---|---|
| Solubilité dans l’eau (mg/L) | 18,1 | 7 820 | 1 670 |
| Log Koe(sans dimension) | 3,69 | 1,78 | 3,81 |
| Taux de migration hors de la mousse recouverte (mg/cm2/h)a | 0,00297 | 0,0207 | 0,00624b 0,0143c |
a Les taux de migration du TDCPP et du TCEP ont été déterminés dans le cadre d’études de migration portant sur de la mousse de meubles traitée menées par l’Agence de protection de l’environnement du Danemark (2015), comme il est indiqué par l’ECHA (2018). L’Agence a déterminé les taux de migration du TCEP et du TDCPP pour des produits pour enfants (des systèmes de retenue pour enfant ou bébé, des porte-bébés et des matelas pour bébé) en immergeant des morceaux de mousse provenant de ces produits (habituellement avec une partie du revêtement en tissu) dans une substance simulant la sueur et en les incubant à 37 °C pendant trois heures (EPA du Danemark, 2015). Le taux de migration du TDCPP utilisé ici correspond à la moyenne des taux déterminés pour tous les échantillons pour cet ignifuge, tandis que le taux de migration du TCEP provient d’un seul article (ECHA, 2018).
b Valeur calculée en traçant une ligne droite entre les valeurs de solubilité dans l’eau et les taux de migration pour le TDCPP et le TCEP; l’équation étant y = (2×10-6) × solubilité dans l’eau + 0,0029.
c Valeur calculée à l’aide d’équations différentielles reposant sur les taux de migration, les solubilités dans l’eau et les valeurs de log Koe du TDCPP et du TCEP; taux de migration = x (log de la solubilité dans l’eau) + y (log Koe). Pour le TDCPP, l’équation est la suivante : 0,00297 mg/cm2/h = x (1,26) + y (3,69). Pour le TCEP, l’équation est la suivante : 0,0207 = x (3,89) + y (1,78). Si l’on résout ces équations, on obtient : x = 0,0059 et y = -0,0012. On peut alors calculer que pour le PTBOE, le taux de migration = 0,0059 (log de la solubilité dans l’eau) - 0,0012 (log Koe) = 0,0059 (3,22) - 0,0012 (3,81) = 1,43 × 10-2 mg/cm2/h.
| Paramètre | PTPh | PTBOE |
|---|---|---|
| Facteur de contact cutanéa | 1 | 1 |
| Facteur de pénétration textileb | S.O. | 0,1 |
| Taux de migrationc (mg/cm2/h) | 2,45×10-5 à 4,54×10-5 | 6,24×10-3 à 1,43×10-2 |
| Absorption cutanée | 50 %d | 100 %e |
Abréviation : S.O. = sans objet.
a Aucun facteur de contact cutané propre à la substance, c’est-à-dire la fraction de la substance présente sur une surface qui adhère à la peau, n’a été trouvé dans la littérature pour le PTPh ou le PTBOE. Une valeur de 1 a donc été choisie pour les 2 substances, ce qui suppose implicitement que tout le produit chimique en contact avec la peau peut être absorbé.
b Aucun facteur de pénétration textile n’a été appliqué pour le PTPh, car les taux de migration utilisés pour l’extrapolation ont été calculés à partir d’analyses d’échantillons de mousse recouverte (voir le tableau D-3). Un facteur de pénétration textile a été appliqué pour le PTBOE afin de tenir compte des taux de migration utilisés pour l’extrapolation (c’est-à-dire TDCPP et TCEP), qui ont été déterminés à partir d’analyses d’échantillons de mousse non recouverte (voir le tableau D-4). Aucune donnée sur la pénétration textile propre aux substances n’a été recensée dans les publications scientifiques. Par conséquent, un facteur de pénétration textile de 0,1 (Driver et al., 2007, cité dans ECHA, 2018) a été utilisé pour le PTBOE.
c Voir les tableaux D-3 et D-4 pour le calcul des taux de migration.
d L’absorption cutanée du PTPh a été établie à 50 % (voir la section 2.4.1.2).
e L’absorption cutanée du PTBOE a été supposée être de 100 % (voir la section 3.4.1.1).
Estimations de l’absorption due à l’exposition par voie orale :
Absorption (mg/kg p.c./j) = (surface mise en bouche [cm2] × taux de migration [mg/cm2/h] × durée d’exposition [h/j]) / poids corporel (kg)
Il est supposé que le PTPh et le PTBOE sont complètement absorbés par voie orale et qu’un revêtement textile sur un objet en mousse n’influerait pas sur la migration. Puisque les taux de migration estimés pour le PTPh ont été extrapolés à partir de données expérimentales obtenues en utilisant de la mousse recouverte (voir le tableau D-3), nous avons divisé les taux de migration par un facteur de pénétration textile de 0,1 (voir le tableau D-4) pour estimer l’exposition par voie orale. Pour le PTBOE, les taux de migration estimés ont été extrapolés à partir des données expérimentales obtenues sur de la mousse non recouverte (voir le tableau D-4). Par conséquent, aucun ajustement n’a été nécessaire pour tenir compte d’une couverture textile.
| Groupe d’âge | Surface mise en bouchea (cm2) | Durée d’expositionb (min/j) |
|---|---|---|
| 0 à 5 mois | 10 | 24,5 |
| 6 mois à 3 ans | 10 à 50 | 24,5 |
a Nous avons estimé que la surface de l’objet mise en bouche était comprise entre 10 et 50 cm2 d’après les données de l’US CPSC (2006) et de l’US EPA (2012). Nous avons présumé une valeur unique de 10 cm2 pour les bébés de 0 à 5 mois étant donné leur petite taille et leur capacité limitée à se déplacer.
b La durée de mâchonnement de 24,5 min/j des produits en mousse pour enfants, comme les tapis de sieste, les systèmes de retenue pour bébé et enfant et de petits meubles, est fondée sur la plus longue durée moyenne pour « d’autres objets » (pour les bébés de 6 à 9 mois) mentionnée par Norris et Smith (2002, cité dans US EPA, 2011).
