Évaluation préalable - Chlorhexidine et ses sels
Titre Officiel : Évaluation préalable - Chlorhexidine et ses sels
Environnement et Changement climatique Canada
Santé Canada
Juin 2019
No de cat. En14-379/2019F-PDF
ISBN 978-0-660-31300-9
Sommaire
En vertu des articles 68 ou 74 de la Loi canadienne sur la protection de l’environnement 1999 (LCPE), les ministres de l’Environnement et de la Santé ont procédé à une évaluation préalable de la chlorhexidine et de ses sels, y compris (sans s’y limiter) les sels figurant au tableau ci‑dessous. Ces substances ont été identifiées d’intérêt prioritaire pour une évaluation, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou ont été considérées d’intérêt prioritaire en raison d’autres préoccupations. En juillet 2013, une ébauche de l’évaluation préalable du diacétate de chlorhexidine (appelé ci-après acétate de chlorhexidine) a été publiée. Il avait été conclu que cette substance n’était pas nocive pour la santé humaine, mais qu’elle l’était pour l’environnement. Depuis, de nouveaux renseignements importants sur d’autres sources potentielles d’exposition à l’entité chlorhexidine sont devenus disponibles. En conséquence, une nouvelle ébauche d’évaluation préalable a été publiée le 19 aout 2017, dans laquelle les impacts potentiels sur l’environnement et la santé humaine dus à d’autres sources potentielles de l’entité chlorhexidine ont été pris en compte.
Le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 1), le nom sur la Liste intérieure des substances (LIS) ou le nom chimique, ainsi que le nom commun de la chlorhexidine et de ses sels sont donnés dans le tableau ci-dessous.
| No CAS | Nom sur la LIS ou nom chimique | Nom commun |
|---|---|---|
| 55-56-1a,b | 2,4,11,13-Tétraaza-1,3,12,14-tétraiminotétradécane-1,14-diylbis(p-chlorophénylamine) | Chlorhexidine |
| 56-95-1 | 2,4,11,13-Tétraaza-1,3,12,14-tétraiminotétradécane-1,14-diylbis(p-chlorophénylamine), diacétate | Diacétate de chlorhexidine |
| 3697-42-5b | 2,4,11,13-Tétraaza-1,3,12,14-tétraiminotétradécane-1,14-diylbis(p-chlorophénylamine), dichlorhydrate | Dichlorhydrate de chlorhexidine |
| 18472-51-0a | Acide D-gluconique, composé avec la N,N″-bis(4-chlorophényl)-3,12-diimino-2,4,11,13-tétraazatétradécanediamidine | Digluconate de chlorhexidine |
a Cette substance n’a pas été identifiée en vertu du paragraphe 73(1) de la LCPE, mais a été incluse dans la présente évaluation, car elle a été jugée d’intérêt prioritaire en raison d’autres préoccupations.
b Cette substance est inscrite sur la Liste des substances commercialisées révisée de la Loi sur les aliments et drogues. Le dichlorhydrate de chlorhexidine n’est pas inscrit sur la LIS ni sur la Liste extérieure des substances.
La chlorhexidine et ses sels ne sont pas naturellement présents dans l’environnement. En vertu de l’article 71 de la LCPE, des enquêtes ont été menées sur la chlorhexidine (année de déclaration 2011), le diacétate de chlorhexidine (années de déclaration 2005, 2006 et 2011), le digluconate de chlorhexidine (année de déclaration 2011) et le dichlorhydrate de chlorhexidine (année de déclaration 2015), des renseignements à déclaration volontaire sur le dichlorhydrate de chlorhexidine ayant été déclarés pour 2013. Aucune de ces substances n’a été déclarée produite au Canada pour ces années de déclaration. Du diacétate de chlorhexidine et du dichlorhydrate de chlorhexidine ont été déclarés importés au Canada en quantités allant de 100 à 1000 kg, tandis que du digluconate de chlorhexidine a été déclaré importé en une quantité allant de 10 000 à 100 000 kg. Aucune donnée sur des concentrations de ces substances mesurées dans l’environnement au Canada n’a été trouvée. La chlorhexidine et ses sels sont utilisés au Canada en tant qu’antiseptiques à large spectre et agents de conservation antimicrobiens dans des produits tels que des cosmétiques, des produits de santé naturels, des médicaments sur ordonnance ou en vente libre à usage humain ou vétérinaire, et des désinfectants pour surfaces dures.
Les rejets de chlorhexidine et de ses sels dans l’environnement canadien découlent de l’utilisation de ces substances par les consommateurs et de la préparation de produits à base de chlorhexidine. Les rejets devraient être de sources diffuses (c.-à-d., rejets à l’égout issus de l’utilisation de produits contenant de la chlorhexidine ou ses sels) et de sources ponctuelles (p. ex., à des sites où on prépare des produits contenant de la chlorhexidine ou ses sels). Lorsque rejetés dans le milieu aquatique, les sels de chlorhexidine se dissocient dans l’eau pour libérer la chlorhexidine. Selon les renseignements disponibles sur le devenir et le comportement de la chlorhexidine, cette substance persiste généralement dans l’eau, les sédiments et le sol, et a un faible potentiel de bioaccumulation dans les organismes aquatiques. Les données expérimentales de toxicité aiguë et de toxicité chronique de la chlorhexidine et de ses sels révèlent que, à faibles concentrations, la chlorhexidine pourrait causer des effets nocifs sur les organismes aquatiques. À l’aide d’une combinaison de résultant provenant de la surveillance et de la modélisation, des scénarios d’exposition environnementale ont été élaborés pour les rejets à l’égout découlant de l’utilisation de produits contenant ces substances, ainsi que pour les rejets provenant de sites industriels qui préparent des produits qui en contiennent. Des analyses du quotient de risque ont été réalisées afin de comparer les concentrations aquatiques de chlorhexidine avec les concentrations causant des effets nocifs chez les organismes aquatiques et benthiques. Selon les résultats, la chlorhexidine et ses sels posent un risque aux organismes aquatiques et benthiques lorsqu’ils sont rejetés par suite d’une utilisation industrielle, mais pas par suite de l’utilisation de produits contenant ces substances (rejets à l’égout).
Compte tenu de tous les éléments de preuve avancés dans la présente évaluation préalable, la chlorhexidine et ses sels présentent un risque d’effet nocif sur l’environnement. Il est conclu que la chlorhexidine et ses sels satisfont aux critères de l’alinéa 64(a) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui ont ou peuvent avoir un effet nocif immédiatement ou à long terme sur l’environnement ou sa diversité biologique. Cependant, il est conclu que la chlorhexidine et ses sels ne satisfont pas aux critères de l’alinéa 64(b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger pour l’environnement essentiel à la vie.
L’exposition de la population générale à la chlorhexidine et ses sels dans les milieux de l’environnement devrait être faible. Étant donné les profils d’utilisation actuels, aucune exposition ne devrait due à l’alimentation. L’exposition de la population générale peut être due à l’utilisation de cosmétiques et de produits de santé naturelle contenant ces substances.
Aucune preuve de cancérogénicité ou de génotoxicité n’a été relevé dans la base de données sur les effets sur la santé disponible pour la chlorhexidine et ses sels. Les marges entre les estimations de l’exposition dans le milieu environnemental et de l’exposition par l’utilisation de produits disponibles aux consommateurs et les concentrations associées à des effets dans les études en laboratoire sont jugées adéquates pour tenir compte des incertitudes affichées dans les bases de données sur l’exposition et les effets sur la santé. À la lumière des renseignements relatifs à la santé humaine, il est conclu que la chlorhexidine et ses sels ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc conclu que la chlorhexidine et ses sels satisfont à un ou à plusieurs des critères de l’article 64 de la LCPE.
Il a aussi été déterminé que l’entité chlorhexidine satisfait aux critères de persistance, mais pas à ceux de bioaccumulation, du Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
En vertu des articles 68 ou 74 de la Loi canadienne sur la protection de l’environnement 1999 (LCPE) (Canada 1999), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable de la chlorhexidine (no CASNote de bas de page 2 55-56-1) et de certains de ses sels afin de déterminer si ces substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Parmi les sels, on retrouve, sans s’y limiter, le diacétate de chlorhexidine (no CAS 56-95-1), le digluconate de chlorhexidine (no CAS 18472‑51-0) et le dichlorhydrate de chlorhexidine (no CAS 3697-42-5). La chlorhexidine, le diacétate de chlorhexidine et le digluconate de chlorhexidine sont inscrits sur la Liste intérieure des substances (LIS). La chlorhexidine et le dichlorhydrate de chlorhexidine sont inscrits sur la Liste des substances commercialisées (LSC) révisée de la Loi sur les aliments et drogues (LAD) (Canada 1978). Ces substances ont été identifiées comme d’intérêt prioritaire pour une évaluation, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou en raison d’autres inquiétudes (ECCC, SC [modifié 2017]). La chlorhexidine et ses sels sont évalués en tant que groupe, car les sels se dissocient dans l’eau pour produire de la chlorhexidine, cette entité ayant des effets toxicologiques préoccupants.
Une ébauche d’évaluation préalable du diacétate de chlorhexidine (alors appelé acétate de chlorhexidine) a été publiée en juillet 2013 (Environnement Canada, Santé Canada modifié en 2013). Il a été proposé de déclarer que cette substance était dangereuse pour l’environnement et satisfaisait aux critères du paragraphe 64(a) de la LCPE, mais qu’elle n’était pas dangereuse pour la santé humaine. Aucun commentaire du public sur cette ébauche d’évaluation préalable n’a été reçu. Toutefois, de nouveaux renseignements significatifs sur d’autres sources d’exposition potentielles à la chlorhexidine sont devenus disponibles ultérieurement. Ces renseignements incluaient les quantités de sels de chlorhexidine dans le commerce, sa présence dans des produits vendus au Canada et l’obtention de détails industriels sur la formulation de produits à base de chlorhexidine. En conséquence, une nouvelle ébauche d’évaluation préalable portant sur l’entité chlorhexidine a été publiée le 19 août 2017, dans laquelle il était tenu compte des impacts potentiels sur l’environnement ou la santé humaine dus aux expositions à toutes les sources d’exposition potentielles à la chlorhexidine.
La présente évaluation préalable portant sur l’entité chlorhexidine tient compte des impacts potentiels sur l’environnement ou la santé humaine dus aux expositions à toutes les sources de chlorhexidine, et elle comprend des renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, y compris des renseignements complémentaires soumis par des parties prenantes. Les données pertinentes disponibles jusqu’en juin 2016 ont été étudiées et évaluées, avec des recherches spécifiques limitées faites jusqu’en mars 2019. Nous avons utilisé des données empiriques provenant d’études clés et de surveillance, ainsi que certains résultats de modélisation pour tirer nos conclusions. Quand cela était possible et pertinent, nous avons pris en compte des renseignements présentés dans des évaluations faites par d’autres juridictions.
La présente évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE travaillant à Santé Canada et à Environnement et Changement climatique Canada. Elle comprend des intrants d’autres programmes de ces ministères. Les parties sur l’environnement et la santé humaine de la présente évaluation ont fait l’objet de revues externes et/ou de consultations. Des commentaires sur les parties techniques ayant trait à l’environnement ont été soumis par le Dr Jules Blais (Université d’Ottawa) et la Dre Connie Gaudet (consultant). Des commentaires sur les parties techniques ayant trait à la santé humaine ont été soumis par des experts scientifiques choisis et dirigés par la Toxicology Excellence for Risk Assessment (TERA)/Université de Cincinnati, dont la Dre Cynthia Bearer de l’école de médecine de l’Université du Maryland (É.-U.), le Dr Simeon West de l’University College Hospital (R.-U.), le Dr Micheal Jayjock du Lifeline Group (É.-U.) et le Dr Bernard Gadagbui de TERA/Université de Cincinnati (É.-U.). De plus, l’ébauche de la présente évaluation préalable (publiée le 19 août 2019) a fait l’objet d’une période de commentaires du public de 60 jours. Bien que des commentaires de l’extérieur aient été pris en compte, Santé Canada et Environnement et Changement climatique Canada restent responsables du contenu final et des conclusions de la présente évaluation préalable.
La présente évaluation préalable est centrée sur des renseignements critiques afin de déterminer si les substances visées satisfont aux critères de l’article 64 de la LCPE, en étudiant les renseignements scientifiques et en suivant une approche basée sur le poids de la preuve et le principe de précautionNote de bas de page 3. Nous y présentons les renseignements critiques et les éléments pris en compte qui nous ont servi à tirer notre conclusion.
2. Identité des substances
Nous donnons dans le tableau 2-1 le numéro de registre du Chemical Abstracts Service (no CAS), le nom sur la Liste intérieure des substances (LIS) (ou le nom chimique) et le nom commun de la chlorhexidine et de certains de ses sels.
| No CAS | Nom commun | Nom sur la LIS ou nom chimique |
|---|---|---|
| 55-56-1a,b | Chlorhexidine | Chlorhexidine ou hexane-1,6-diyle-bis[(4-chlorophényl)diguanide] ou 2,4,11,13-tétraaza-1,3,12,14-tétraiminodécane-1,14-diylbis(p-chlorophénylamine) |
| 56-95-1 | Diacétate de chlorhexidine | Di(acétate) de chlorhexidine |
| 3697-42-5b | Dichlorhydrate de chlorhexidine | Dichlorhydrate de N,N''-bis(4-chlorophényl)-3,12-diimino-2,4,11,13-tétraazatétradécanediimidamide |
| 18472-51-0a | Digluconate de chlorhexidine | Acide D-gluconique, composé avec la N,N''-bis(4-chlorophényl)-3,12-diimino-2,4,11,13-tétraazatétradécanediamidine (2/1) |
a Cette substance n’a pas été identifiée en vertu du paragraphe 73(1) de la LCPE, mais a été incluse dans la présente évaluation car elle est considéré d’intérêt prioritaire en raison d’autres préoccupations.
b Cette substance n’est pas inscrite sur la LSC révisée de la LAD. Le dichlorhydrate de chlorhexidine n’est pas inscrit sur la LIS ni sur la Liste extérieur des substances.
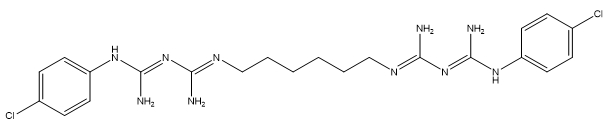
En tant que substance cationique antimicrobienne à large spectre, la chlorhexidine fait partie de la famille des bis(biguanides) (Sigma Aldrich 2015). Les groupes fonctionnels qu’elle comporte incluent les groupes guanidine, aniline, amine aromatique secondaire, et amine aliphatique. Sa structure constitue un facteur significatif de ses propriétés bactéricides (Tanzer et al. 1977). Lors d’une étude sur les antiseptiques cationiques, Gilbert et Moore (2005) ont montré que la structure de la chlorhexidine comporte des sites cationiques de liaison aux phospholipides et un groupe hexane-1,6-diyle qui contribuent à son mode d’action biocide.
Dans le tableau 2‑2, nous présentons des renseignements sur la structure chimique de la chlorhexidine et de certains de ses sels.
| Substance | Structure de la chlorhexidine, contre-ion et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|
| Chlorhexidine |
C22H30Cl2N10 |
505,5 |
| Dichlorhydrate de chlorhexidine |
C22H30Cl2N10•2(HCl) |
578,4 |
| Diacétate de chlorhexidine |
C22H30Cl2N10•2(C2H4O2) |
625,6 |
| Digluconate de chlorhexidine |
C22H30Cl2N10•2(C6H12O7) |
897,8 |
3. Propriétés physiques et chimiques
Les sels de chlorhexidine se dissocient dans l’eau pour produire les contre-ions associés et la chlorhexidine. La chlorhexidine est une base forte (pKa = 11,3) et devrait s’ioniser dans l’eau en tant que base, les protons étant attirés par les groupes amines (ACD/Percepta c1997-2012). Elle devrait se protoner dans l’eau à un pH de 4 à 9, de manière à ce que presque toute la substance (98-100 %) se présente avec deux de ses groupes amines chargés positivement. La spéciation de la chlorhexidine dans des fluides biologiques dépendra aussi du pH. Étant donné que la toxicité de la chlorhexidine (c.-à-d. la base libre) est préoccupante, ses propriétés physiques et chimiques sont des éléments importants pour la présente évaluation.
Dans le tableau 3‑1, nous présentons des données expérimentales et modélisées sur les propriétés physiques et chimiques de la chlorhexidine. Des renseignements détaillés spécifiques aux sels de chlorhexidine pourront être consultés dans le document ECCC 2016. Des modèles basés sur des relations quantitatives structure-activité (QSAR) ont été utilisés pour obtenir des données sur la pression de vapeur, la constante de Henry et le log de Koc. Ces modèles sont principalement basés sur des méthodes d’addition de fragments (c.-à-d. qu’ils s’appuient sur la structure du composé chimique) et ne fonctionnent qu’avec la forme neutre (non ionisée) du composé comme intrant (sous forme SMILES, pour simplified molecular-input line-entry system).
| Propriété | Type | Valeur | Descripteur | Référence |
|---|---|---|---|---|
| Masse volumique (g/cm3) | Estimation par calcul | 1,39 | 20 °C | ChemSpider 2011 |
| Pression de vapeur (Pa) | Modélisée (méthode de Grain modifiée) | 2,6 x 10-12 | - | MPBPWIN 2010 |
| Solubilité dans l’eau (mg/L) | Expérimentale | 800a | 20 °C | O'Neil 2013 |
| Constante de Henry (Pa·m3/mol) | Modélisée (estimation PV/HSol) | 1,7 x 10-12 | - | HENRYWIN 2008 |
| log Doe (coefficient de partage; sans dimension) | Expérimental (log Koe; octanol-eau) | 0,08b | (ionisé, pH 5) | Hansch et al.1995 |
| Koc (coefficient de partage carbone organique-eau) | Modélisé (log Koc; estimation MCI) | 5,9 | - | KOCWIN 2010 |
| Defficace (nm) | Calculé | 1,1 (moyenne) | - | CPOPs 2014 |
| Dmaximum (nm) | Calculé | 2,1 (moyenne) | - | CPOPs 2014 |
| pKa (sans dimension) | Modélisé | 11,3 | pKa le plus fort (base) | ACD/Percepta c1997-2012 |
a Valeurs retenues pour la modélisation avec EPI Suite (c2000-2010). Le SMILES pour la chlorhexidine est utilisé avec ce modèle avec les valeurs expérimentales de l’hydrosolubilité et de log Koe du présent tableau et la valeur expérimentale du point de fusion 134 °C (HSDB 1983) comme intrants.
b Le coefficient de partage ou log D tient compte de la présence des espèces ioniques. Il représente la quantité nette des formes neutre et ionique qui devraient de repartir entre les lipides et l’eau à un pH donné.
La nature ionique de la chlorhexidine est un facteur important pour l’interprétation de ses propriétés physiques et chimiques, car elle concerne son devenir et son comportement dans l’environnement (voir la section Devenir et comportement dans l’environnement pour plus de détails). La chlorhexidine étant ionique, elle a une pression de vapeur et une constante de Henry négligeables. Les données expérimentales sur la chlorhexidine indiquent une forte solubilité dans l’eau (800 mg/L; O’Neil 2001), tout comme les données sur les sels. Des valeurs expérimentales de 1,0 x 104 à 3,3 x 103 mg/L à pH 4 à 7 (Anusavice et al. 2006) et de 1,9 x 104 mg/L à 20 °C et un pH non précisé (O’Neil 2001) ont été rapportées pour le diacétate de chlorhexidine. La solubilité dans l’eau du digluconate de chlorhexidine a été rapportée > 70 % p/v à 20 °C (Senior 1973). Il a aussi été rapporté que le diacétate de chlorhexidine et le digluconate de chlorhexidine sont solubles à un certain degré dans d’autres solvants (O’Neil 2001; EPA 1996; EPA 2011b). La valeur expérimentale de log Koe pour la chlorhexidine (0,08 à pH 5) est faible et rend compte des caractéristiques d’ionisation de cette substance. Les données modélisées pour la chlorhexidine indiquent un log Koc très élevé (5,9). Toutefois, il est reconnu que la modélisation des paramètres pour les substances ionisantes est incertaine et que les interactions électrostatiques peuvent être plus importantes que le carbone organique pour la détermination des caractéristiques de partage.
De plus, la chlorhexidine peut posséder des caractéristiques tensio-actives. Sa tension superficielle (environ 50 dynes/cm; ECHA c2007-2015a) est inférieure au seuil de 60 dynes/cm indiquant des propriétés tensio-actives (Union européenne 1998–2016). Il a été rapporté que le diacétate de chlorhexidine forme des micelles en solution, avec une concentration micellaire critique de 6256-6882 mg/L (concentration molaire micellaire critique de 0,010 – 0,011) à 25 °C (Block 2001, Heard et Ashworth 1968), bien qu’une autre étude n’en soit pas arrivée à la même conclusion (Attwood et Natarajan 1979). Une concentration micellaire critique de 5925 mg/L (concentration molaire micellaire critique de 0,0066) a aussi été rapportée pour le digluconate de chlorhexidine (Heard et Ashworth 1968).
4. Sources et utilisations
Ni la chlorhexidine ni ses sels ne sont présents naturellement dans l’environnement.
Des enquêtes ont été menées en vertu de l’article 71 de la LCPE sur la chlorhexidine (année de déclaration 2011), le diacétate de chlorhexidine (années de déclaration 2005, 2006 et 2011), le digluconate de chlorhexidine (année de déclaration 2011) et le dichlorhydrate de chlorhexidine (année de déclaration 2015) (Canada 2006, 2009, 2012, 2017). Des renseignements sur le dichlorhydrate de chlorhexidine ont été soumis sur une base volontaire pour l’année de déclaration 2013 (Environnement Canada 2015). Aucune de ces substances n’a été rapportée produite au Canada en quantité supérieure au seuil de déclaration de 100 kg par an au cours de ces années. Tous les sels de chlorhexidine (diacétate, digluconate et dichlorhydrate) ont été importés au Canada pendant une ou plusieurs de ces années de déclaration, et ont aussi été identifiés comme étant utilisés dans des produits disponibles pour les consommateurs. Moins de cinq entreprises ont rapporté importer du diacétate de chlorhexidine au Canada en 2005 (Environnement Canada 2007), ainsi qu’en 2006 (Environnement Canada 2010). Dans le cas de chaque entreprise, toutes les quantités importées déclarées étaient dans la gamme de 100 à 1000 kg. Pour l’année de déclaration 2011 (Environnement Canada 2015), la quantité totale de diacétate de chlorhexidine importée dans un produit ou à des fins de traitement/formulation (sel pur) se situait entre 100 et 1000 kg. Neuf entreprises ont rapporté importer du digluconate de chlorhexidine en 2011 (y compris les importations dans un produit ou sous forme de sel pur à des fins de traitement/formulation), le total de ces importations se situant dans la gamme de 10 000 à 100 000 kg. Il n’y a eu aucune importation de chlorhexidine en quantité supérieure au seuil de déclaration de 100 kg par an en 2011. Moins de cinq entreprises ont rapporté importer de 100 à 1000 kg de dichlorhydrate de chlorhexidine en 2013 (sous forme de sel pur à des fins de traitement/formulation), ainsi que de 1000 à 10 000 kg en 2015, presque la moitié étant ensuite exportée (Environnement Canada 2015, 2018).
La chlorhexidine est inscrite sur la liste des composés chimiques produits en grand volume (PGV) de 2007 de l’Organisation de coopération et développement économiques (OCDE) (OCDE 2009), indiquant qu’elle est produite ou importée en quantités supérieures à 1000 tonnes par an dans au moins un pays ou une région membre. La consommation annuelle de chlorhexidine dans l’Union européenne a été rapportée entre 10 000 et 50 000 tonnes en 2000, alors que l’utilisation estimée de digluconate était de 7,9 tonnes en 2009 en Suède (SWECO Environment 2011). Certaines substances de type chlorhexidine ont été enregistrées dans le cadre du programme d’enregistrement, d’évaluation, d’autorisation et de restriction des composés chimiques (REACH). En particulier, la chlorhexidine a été enregistrée pour une utilisation comme intermédiaire uniquement, et le digluconate a été enregistré pour la production et/ou l’importation (10 à 100 tonnes par an; ECHA c2007-2015a,b).
La chlorhexidine et ses sels sont des antiseptiques à large spectre utilisés pour la stérilisation, le nettoyage cutané et des mains, la désinfection des blessures et la santé orale. Ils sont généralement efficaces contre une grande variété de bactéries, de virus et de levures (Chemicalland21 2010, Cheminfo Services Inc. 2014). Au Canada, ils ont été utilisés comme antiseptiques à large spectre et agents de conservation antimicrobiens dans des produits comme des cosmétiques, des produits de santé naturels, des médicaments avec ou sans ordonnance pour les humains ou les animaux et des désinfectants pour surface dure. Les utilisations permises sont décrites plus en détail dans les bases de données et listes pertinentes administrées au Canada.
Le digluconate de chlorhexidine et le diacétate de chlorhexidine (en tant qu’acétate de chlorhexidine) sont inscrits dans la Base de données sur les produits pharmaceutiques (BDPP) en tant qu’ingrédients actifs dans des médicaments avec ou sans ordonnance pour les humains ou les animaux et en tant que désinfectants pour surface dure (BDPP [modifié en 2015]). Pour des applications laitières, la chlorhexidine est principalement utilisée pour la prévention de la mastite chez les vaches et est produite sous forme de produit et lingette pour trempage des trayons, ainsi que comme produit de lavage des mamelles (BDPP [modifié en 2015]; Westagro Canada 2014a,b). Le diacétate de chlorhexidine est le principal sel utilisé, très peu de produits homologués étant basés sur le digluconate (BDPP [modifié en 2015]; Cheminfo Services Inc. 2014). Lorsque du digluconate de chlorhexidine ou du diacétate de chlorhexidine est inscrit en tant qu’ingrédient médicinal autorisé dans des médicaments avec ou sans ordonnance, l’exposition humaine à la chlorhexidine en tant qu’ingrédient actif due à l’utilisation de ces produits est couverte par la Loi sur les aliments et drogues (LAD) et n’est pas autrement prise en compte pour la présente évaluation préalable.
La chlorhexidine, le digluconate de chlorhexidine et le diacétate de chlorhexidine sont inscrits dans la Base de données d’ingrédients de produits de santé naturels (BDIPSN) avec un rôle de produit de santé non naturel. Ils ne peuvent donc pas être utilisés comme ingrédient médicinal dans des produits de santé naturels (BDIPSN [modifiée en 2019]). La chlorhexidine, le digluconate de chlorhexidine et le diacétate de chlorhexidine sont inscrits dans la BDIPSN avec un rôle non médicinal pour une utilisation topique comme agent de conservation antimicrobien dans des produits de santé naturels et sont associés respectivement à des taux maximaux de 0,14, 0,20 et 0,19 %. Ils sont aussi associés à un taux maximal de 0,01 % (calculé en tant que base libre de chlorhexidine) quand ils sont utilisés dans des produits ophtalmiques. La chlorhexidine et le digluconate de chlorhexidine sont inscrits dans la Base de données des produits de santé naturels homologués (BDPSNH) en tant qu’ingrédient non médicinal dans des produits de santé naturels actuellement homologués, dont des produits thérapeutiques pour l’acné, des produits médicamentés pour soins cutanés, des produits pour soins oraux et des écrans solaires (BDPSNH [modifiée en 2019]).
La chlorhexidine et ses sels ne sont pas inscrits sur les Listes des additifs alimentaires autorisés (Santé Canada modifié en 2013) de la Loi sur les aliments et drogues et ne sont pas associés aux autorisations de mise en marché. Ils n’ont pas non plus été identifiés comme utilisés ou présents dans des formulations de matériaux pour emballage alimentaire. Le digluconate de chlorhexidine et le diacétate de chlorhexidine peuvent être présents dans des produits de nettoyage qui n’entrent pas en contact direct avec des aliments, comme des savons pour les mains, des désinfectants et des nettoyants d’utilisation générale utilisés dans des établissements de préparation d’aliments (communication personnelle, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, de juin 2016 et février 2019; non référencé).
La chlorhexidine et ses sels sont inscrits sur la Liste critique des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiques. Cette liste est un outil administratif utilisé par Santé Canada pour communiquer aux fabricants et à d’autres que des produits contiennent certaines substances probablement non classées comme cosmétique en vertu de la Loi sur les aliments et drogues et, de plus, que certaines substances présentes dans un cosmétique à certaines concentrations peuvent enfreindre l’interdiction générale stipulée à l’article 16 de cette loi ou peuvent contrevenir à une ou plusieurs des dispositions du Règlement sur les cosmétiques. La chrorhexidine et ses sels sont inscrits en tant que substances dont la concentration est inférieure ou égale à 0,14 %, calculée en tant que base libre de chlorhexidine, ce qui correspond à 0,19 % calculée en tant que diacétate de chlorhexidine, 0,20 % calculée en tant que digluconate de chlorhexidine et 0,16 % calculée en tant que dichlorhydrate de chlorhexidine (Santé Canada modifié en 2015). D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, le digluconate de chlorhexidine et, dans une moindre mesure, le dichlorhydrate de chlorhexidine sont utilisés dans certains cosmétiques au Canada, comme des produits de maquillage, des produits pour les cheveux, des produits de soins cutanés et des lotions après rasage (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, juin 2016; non référencé).
La chlorhexidine et ses sels ne sont pas inscrits sur la Liste des formulants de pesticides de l’Agence de réglementation de la lutte antiparasitaire (ARLA) ni sur la Liste des ingrédients actifs de pesticides de l’ARLA (Santé Canada 2010; communication personnelle, courriels de l’Agence de la réglementation de la lutte antiparasitaire de Santé Canada au Bureau de l,Évaluation des risques des substances existantes, décembre 2014; non référencé; Recherche dans les étiquettes de pesticides modifié en 2016). Le diacétate de chlorhexidine a été identifié comme composant de bains pour chaussures destinés aux personnes visitant une ferme au Canada (MAAARO 2009).
Le digluconate de chlorhexidine est utilisé dans des postes pour bain oculaire en tant qu’additif bactériostatique à une concentration de 5300 ppm, 0,53 % (SDS 2015).
5. Devenir et comportement dans l’environnement
Étant donné les sources et les utilisations de la chlorhexidine et de ses sels, ces substances peuvent potentiellement être rejetées dans l’environnement. Les sections suivantes sont centrées sur le devenir et le comportement de la chlorhexidine dans l’environnement, en tant qu’entité préoccupante. La forme cationique de la chlorhexidine étant dominante aux pH pertinents pour l’environnement, sa mobilité et son devenir dans l’environnement seront fortement dépendants de sa sorption sur des particules en suspension dans l’eau et l’air et sur des sédiments et des particules du sol (Droge et Goss 2012).
5.1 Distribution dans l’environnement
La chlorhexidine ne devrait pas être rejetée dans l’air étant donné ses utilisations prévues et ses propriétés physico-chimiques. La chlorhexidine a une très faible pression de vapeur et une très faible constante de Henry, une forte hydrosolubilité, et son existence sous une forme protonée dans l’environnement indique que sa volatilisation serait négligeable à partir de surfaces de sol sec ou humide ou d’eaux de surface.
En cas de rejet dans un environnement aquatique, les sels de chlorhexidine se dissocieront, libérant de la chlorhexidine et le contre-ion associé. La chlorhexidine aura une affinité pour les particules chargées négativement de la colonne d’eau (p. ex. acides humiques et fulviques, argiles). Les processus de sorption seraient dominés par des interactions électrostatiques, résultant des sites de sorption chargés négativement sur le carbone organique dissous et les solides en suspension, bien que le carbone organique puisse jouer un petit rôle (Kah et Brown 2006; Droge et Goss 2012, 2013). Les solides en suspension peuvent en fin de compte se déposer sur le lit de sédiments, où la chlorhexidine sorbée devrait probablement rester sauf en cas de processus de mélange et de transport ayant lieu dans le lit de sédiments. En tenant compte de sa persistance (voir la section 5.2), la chlorhexidine peut être présente dans l’eau et les sédiments à proximité et loin de la source de rejet.
Bien qu’aucun rejet direct dans le sol ne soit anticipé, des rejets indirects peuvent avoir pour origine l’application sur les terres de biosolides provenant d’usines de traitement des eaux uséesNote de bas de page 4 (UTEU) recevant des eaux contenant de la chlorhexidine. Le degré d’élimination de cette substance des eaux usées sera déterminé par les cractéristiques de l’UTEU et son affinité pour des solides en suspension chargés négativement, mais elle devrait être associée dans une large mesure aux solides dissous ou en suspension.
Le devenir de la chlorhexidine dans les sols sera dicté par sa nature cationique. Bien que l’échange de cations soit complexe et pas encore entièrement compris (Droge et Goss 2012, 2013), on s’attend à ce que la chlorhexidine ait une affinité pour les particules chargées négativement et puisse ou non être mobile selon la teneur en humidité et le type du sol (p. ex. elle serait probablement moins mobile dans des sols à forte teneur en matière organique ou en argile) (Droge et Goss 2012, 2013), l’érosion du sol ou le ruissellement. De plus, pour les cations organiques comme la chlorhexidine, l’affinité de sorption dépend aussi de la compétition avec d’autres cations organiques présents dans le sol (Droge et Goss 2012). Des relations positives et négatives entre l’adsorption et la force ionique (composition et concentration de l’électrolyte) ont été rapportées dans le cas de pesticides ioniques, et les résultats suggèrent que l’application de grandes quantités de phosphore et de chaux sur des terrains agricoles pourrait faire diminuer la sorption et augmenter la concentration de pesticide en solution, en particulier dans des sols météorisés (Kah et Brown 2006). L’ajout de chaux sur un terrain pourrait conduire à une augmentation considérable de la biodisponibilité de cations organiques (Droge et Goss 2012). En plus de la force ionique, parmi d’autres facteurs ayant une influence sur l’adsorption des composés ionisables dans le sol, on retrouve les propriétés du sol, la teneur en eau et, dans un degré moindre, la température (Kah et Brown 2006).
5.2 Persistance dans l’environnement
La dégradation abiotique de la chlorhexidine ne devrait pas être significative. La chlorhexidine ne comporte pas de groupes fonctionnels qui devraient être hydrolysés (HYDROWIN 2010). Bien qu’elle ne devrait pas être rejetée dans l’air ou y demeurer en cas de rejet, les réactions avec des radicaux hydroxyles seraient le processus le plus important de son devenir dans l’atmosphère (demi-vie estimée de 25 minutes; AOPWIN 2010). Cette substance ne devrait pas réagir de manière appréciable avec d’autres espèces photo-oxydantes dans l’atmosphère (comme O3; AOPWIN 2010). Quelques études ont indiqué que les sels de chlorhexidine (diacétate et digluconate) subissent une photo-dégradation (Revelle et al. 1993, Freitag et al. 1985, Zong et Kirsch 2012).
Plusieurs études sur la dégradation microbienne immédiate ou intrinsèque de la chlorhexidine et de ses sels sont disponibles. Nombre de ces études ont mis en évidence une biodégradation limitée ou nulle, et ces résultats correspondent aux résultats de modèles. Ces résultats sont aussi cohérents avec ceux d’une étude sur le développement de biofilms microbiens en rivière, au cours de laquelle aucune minéralisation de la chlorhexidine n’a été observée après 120 jours d’incubation de [14C]chlorhexidine (Lawrence et al. 2008). Lors de quelques études avec des boues activées, une certaine biodégradation résultant des lignées de bactéries résistantes a été rapportée. Toutefois, les conditions de l’environnement seraient assez différentes de celles des tests réalisés en laboratoire (p. ex. concentrations de bactéries plus faibles, températures variables, autres conditions environnementales), et limiteraient la biodisponibilité. La dégradation microbienne ne devrait donc pas être une voie dominante pour la dégradation de la chlorhexidine et de ses sels dans l’environnement.
Aucune dégradation n’a été observée lors d’un test sur l’élimination dans des boues activées réalisé avec de la boue activée fraîchement collectée et dopée avec 50 μg/L de dichlorhydrate de [14C]chlorhexidine (Soumission d’étude 2010). Un deuxième test a été réalisé avec de la boue activée acclimatée exposée en continu à des eaux usées dopées avec 200 μg/L de dichlorhydrate de chlorhexidine pendant 31 jours. Ces deux tests ont été réalisés en suivant les procédures de test OCDE 314B (pour déterminer les vitesses de dégradation primaire et ultime), et ont été faits avec des concentrations de 50 μg/L de dichlorhydrate de [14C]chlorhexidine et une concentration de biosolides de 2500 mg/L. Les résultats de ces deux tests de dégradation n’ont mis en évidence aucune dégradation primaire significative de la matière testée (Soumission d’étude 2010).
Un test en récipient clos avec un inoculum de boue activée (1,5 mg/L) et de la chlorhexidine (5,35 ppm) a mis en évidence une demande chimique en oxygène (DCO) de 0 % après 28 jours (De Waart et Van der Most 1986, cité dans HSDB 1983). Les résultats d’un autre test avec de la [14C]chlorhexidine à 0,05 ppm incubée dans une boue activée pendant 5 jours ont montré une évolution de CO2 de 0,1 %, 94,3 % de résidus non extractibles (quantité retenue dans la boue) et une volatilisation de 0,2 % (Freitag et al. 1982).
Kodama et al. (1988) ont évalué l’effet d’un traitement par de la boue activée sur des concentrations de chlorhexidine présentes dans des eaux usées domestiques ou d’hôpitaux avant et après un prétraitement au chlorate et à la célite. Les résultats des analyses par colorimétrie et chromatographie en phase liquide haute performance (CLHP) ont mis en évidence des concentrations de chlorhexidine comparables dans l’influent et l’effluent des systèmes de traitement, indiquant de faibles taux d’élimination.
Sugio et Kojima (1992) ont étudié les caractéristiques d’une boue activée résistant au digluconate de chlorhexidine acclimatée à des eaux usées contenant cette substance, en isolant des lignées de la bactérie résistante et en inoculant la boue activée acclimatée avec 100 ppm de digluconate de chlorhexidine. Les résultats sur la demande biologique en oxygène (DBO) indiquent que la boue acclimatée ou non acclimatée ne pouvait pas dégrader la chlorhexidine ni le digluconate de chlorhexidine.
Lors d’une étude sur la biodégradation de la chlorhexidine (12 mg/L) dans des eaux usées, aucune dégradation n’a été observée après 21 jours lors de tests OCDE en milieu de culture minimum sur des détergents dans des conditions aérobies ou anaérobies (Voets et al. 1976). Comparativement, des tests OCDE en milieu organique avec boue activée ont montré une dégradation de 0 % dans des conditions anaérobies, mais de 60 à 100 % dans des conditions aérobies.
Quelques études indiquent que la chlorhexidine peut être biodégradée dans de la boue activée (Sakagami et Yokoyama (1983), Kido et al. 1988). Kido et al. ont suggéré que 2 des 7 lignées de bactéries isolées de la boue activée utilisent la chlorhexidine comme seule source d’azote pour leur croissance dans des conditions aérobies. Dans des études plus récentes, Tanaka et al. (2005, 2006) ont rapporté une dégradation microbienne du digluconate de chlorhexidine par une lignée particulière de bactéries dans des conditions de laboratoire propices à sa croissance (c.-à-d. 37 °C). Bien que cette dégradation n’ait pas été quantifiée, les auteurs ont rapporté une dégradation « significative » de la chlorhexidine en 7 jours, basés sur les résultats d’analyses par CLHP. Ces résultats indiquent un possible mécanisme de résistance de certaines lignées de bactéries à des désinfectants lors de biodégradation.
La biodégradation a été modélisée au moyen de EPI Suite (c2000-2010; voir ECCC 2018 pour les résultats de la modélisation). Les résultats pour le modèle de biodégradation primaire (sous-modèle 4; BIOWIN 2008) et les trois modèles de biodégradation ultime (sous-modèles 3, 5 et 6; BIOWIN 2008) indiquent que la biodégradation est lente. La demi-vie extrapolée dans l’eau est prédite à plus de 182 jours. En se basant sur un rapport d’extrapolation de 1/1/4 pour une demi-vie de biodégradation dans l’eau, le sol et les sédiments (Boethling et al. 1995), la demi-vie de biodégradation ultime dans l’eau est utilisée pour déterminer les demi-vies dans d’autres milieux. La demi-vie de dégradation ultime estimée dans un sol aérobie devrait donc être égale ou supérieure à 182 jours et celle dans des sédiments aérobies égale ou supérieure à 365 jours.
La 4-chloroaniline est un produit potentiel de la dégradation de la chlorhexidine. Différentes voies pour la dégradation de la chlorhexidine en 4-chloroaniline ont été rapportées dans des conditions de laboratoire, incluant des réactions d’hydrolyse et de décarboxylation (Sigma Aldrich 2003, Revelle et al. 1993) et la dégradation bactérienne (Ogase et al. 1992). Il a aussi été montré que la chlorhexidine se dégrade dans des conditions de test de chaleur (IPCS 2003, Revelle et al. 1993) et dans des conditions acides ou alcalines à haute température (Zong et Kirsch 2012, Revelle et al. 1993). La teneur résiduelle en 4-chloroaniline a été rapportée inférieure à 500 mg/kg (< 0,05 %), mais peut atteindre 2000 mg/L (0,2 %) si les solutions de chlorhexidine sont stockées pendant 2 ans ou plus à des températures ambiantes élevées (tropicales) ou stérilisées à la chaleur par inadvertance (IPCS 2003). En Suède, dans le cadre d’un programme national de criblage sur l’occurrence de la chlorhexidine et de la 4‑chloroaniline, la 4‑chloroaniline n’a été détectée dans aucun des échantillons prélevés dans l’environnement (SWECO Environment 2011). Il est improbable que de la 4‑chloroaniline soit produite dans l’environnement au Canada étant donné le faible potentiel de biodégradation de la chlorhexidine et le fait que les conditions nécessaires à la formation de la 4-chloroaniline ne sont pas pertinentes pour l’environnement.
En résumé, les renseignements disponibles indiquent que la chlorhexidine tend à persister dans l’eau, les sédiments et le sol. Les demi-vies dans l’eau et le sol sont supérieures à 182 jours et celle dans les sédiments supérieure à 365 jours. En raison de sa persistance, il existe un potentiel d’exposition prolongée à la chlorhexidine à proximité et loin des points de rejet dans l’environnement. Il existe aussi un potentiel d’exposition spatiale accrue dans l’environnement aquatique en raison de son affinité pour les particules chargées négativement et de son transport par des solides en suspension ou des sédiments. Toutefois, la chlorhexidine s’associant à des particules chargées négativement, elle peut devenir moins biodisponible avec le temps.
5.3 Potentiel de bioaccumulation
La masse moléculaire de la chlorhexidine (505,5 g/mol) et les diamètres de section calculés (Defficace et Dmaximum de 1,1 et 2,1 nm respectivement; CPOP 2014) indiquent que cette molécule est relativement grosse. Les études sur les facteurs de bioconcentration (FBC) chez le poisson et les paramètres moléculaires dimensionnels montrent que la probabilité d’une diffusion passive par les branchies diminue de manière appréciable quand le diamètre efficace d’un composé chimique est supérieur à 1,1 nm et quand le diamètre maximum est supérieur à environ 1,5 nm (et beaucoup plus pour les molécules ayant un diamètre maximum supérieur à 1,7 nm) (Dimitrov et al. 2002, 2003, Sakuratani et al. 2008).
Il existe quelques études sur le potentiel de bioconcentration de la chlorhexidine chez des organismes aquatiques. Lors de deux études, le potentiel de bioconcentration de la chlorhexidine chez Leuciscus idus melanotus a été évalué en exposant les poissons à de la chlorhexidine à raison de 0,05 mg/L pendant 3 jours (Freitag et al. 1982, 1985). L’évaluation de la concentration de chlorhexidine dans le poisson comparativement à celle de l’eau a conduit à calculer des FBC de 42 et 40, indiquant un faible potentiel de bioconcentration. Les détails sur les méthodes suivies lors de ces études étaient limités, mais leurs résultats correspondent à ce à quoi on pouvait s’attendre étant donné le faible log Koe expérimental de 0,08 (ionisé, pH 5) et le log D (0,47) de la chlorhexidine. Au cours de la même étude (Freitag et al. 1985), un FBC a été calculé à partir de la distribution de la chlorhexidine entre les algues et l’eau. Des algues vertes (Chlorella fusca var. vacuolata) ont été exposées à de la chlorhexidine à 0,05 mg/L pendant 24 heures, et un FBC modéré de 2560 a été calculé. Ce FBC modéré est probablement attribué à la forte association de la chlorhexidine aux sites anioniques exposés des surfaces des cellules.
Une étude par microscopie STXM à rayons X mous visant à cartographier la chlorhexidine relativement aux principaux composants biochimiques de biofilms naturels de rivière a montré une bioaccumulation de la chlorhexidine dans les régions riches en lipides de diatomées et de bactéries après une exposition de 8 semaines à du digluconate de chlorhexidine (Dynes et al. 2006). Cette méthode a permis de montrer que la chlorhexidine était sorbée ou associée chimiquement aux lipides des diatomées et des bactéries. La composition de la communauté des biofilms de rivière étudiés était aussi altérée en présence de chlorhexidine, l’observation la plus importante étant la suppression des brouteurs. Étant donné la nature cationique de la chlorhexidine, il est probable qu’elle interagira avec les bicouches de phospholipides chargées négativement des membranes cellulaires.
La chlorhexidine comportant des alertes structurelles pour une liaison aux protéines potentielle (OCDE QSAR Toolbox 2015), une bioaccumulation par cette voie pourrait être possible. Princz et al. (2014) ont étudié le potentiel de bioaccumulation de la phloxine B, une substance ionique qui, comme la chlorhexidine, devrait avoir un faible potentiel de bioaccumulation. Toutefois, la phloxine B est ionisée à un pH pertinent pour l’environnement et il a été montré qu’elle se lie à des tissus de protéines dermiques et internes chez le lombric, résultant en des facteurs d’accumulation biote/sol (FABS) observés élevés. Lors de leur revue des antiseptiques cationiques, Gilbert et Moore (2005) ont rapporté que, comme pour les ammoniums quaternaires (AQ), les groupes biguanides des antiseptiques bisbiguanidiques s’associent fortement aux sites anioniques exposés de la membrane cellulaire et de la paroi cellulaire de la bactérie, en particulier aux phospholipides acides et aux protéines. Toutefois, contrairement aux biocides de type AQ, la région hydrophobe de la chaîne à 6 atomes de carbone de la chlorhexidine ne devient pas solubilisée dans le noyau hydrophobe de la membrane cellulaire, car elles sont quelque peu rigides et incapables de se plier pour s’intercaler dans la bicouche. Au lieu de cela, la chlorhexidine fait des ponts entre des paires de groupes de tête phospholipidiques adjacents (Gilbert et Moore 2005).
Étant donné les renseignements susmentionnés, la chlorhexidine devrait avoir un faible potentiel de bioaccumulation, en se basant sur sa forte solubilité dans l’eau, son faible log Koe expérimental et son log Doe prédit, ainsi que sur les résultats des études expérimentales sur le FBC. Les données modélisées (FBC et facteurs de bioaccumulation (FBA)) sont en accord avec les résultats expérimentaux (ECCC 2018). La chlorhexidine et ses sels pourraient potentiellement se bioaccumuler grâce à la liaison aux protéines, de manière similaire à la phloxine B. Toutefois, aucune donnée empirique n’a été trouvée à ce sujet. Globalement, l’entité chlorhexidine a probablement un faible potentiel de bioaccumulation.
6. Potentiel d’effets nocifs sur l’environnement
6.1 Évaluation des effets sur l’environnement
Connu en tant que perturbateur de membrane, le mode d’action toxique de la chlorhexidine a été étudié chez des bactéries, et il est dû à la forte association des groupes biguanides aux sites anioniques exposés de la membrane cellulaire et de la paroi cellulaire (en particulier aux phospholipides acides et aux protéines) (Broxton et al. 1984, Fraud et al. 2003, Gilbert et Moore 2005). Au moyen de la microscopie STXM (scanning transmission X-ray microscopy), Dynes et al. (2006) ont montré que la chlorhexidine était sorbée ou, peut-être associée chimiquement, aux lipides des diatomées et des bactéries. Lors de certaines études, il a été rapporté que la chlorhexidine provoque une fuite cellulaire, une inhibition de la respiration et un transport de soluté, une perte de l’intégrité structurelle en raison de dommages à l’enveloppe cellulaire (Gilbert et Moore 2005, O’Driscoll et al. 2014). La fonction Profiler de la boîte à outils QSAR de l’OCDE (2015) a permis d’identifier des alertes structurelles pour la liaison aux protéines, suggérant que la chlorhexidine à des effets nocifs allant au-delà de son mode d’action narcotique de base. Pour l’évaluation de son potentiel d’écotoxicité, les propriétés physico-chimiques et la biodisponibilité de la chlorhexidine ont été pris en compte, ainsi que son mode d’action chez les bactéries et son mode d’action réactif prédit.
Les données aquatiques empiriques et de toxicité terrestre clés sur la chlorhexidine et ses sels sont résumées ci-après. Des renseignements détaillés sur toutes les études disponibles sont présentés sous forme de tableaux dans le document ECCC 2018. Puisque la chlorhexidine est l’entité préoccupante, les données sur la toxicité expérimentale ont été exprimées en équivalent chlorhexidine, en appliquant un rapport massique molaire au sel associé.
6.1.1 Eau
Nous avons résumé dans le tableau 6‑1 et le tableau 6‑2 les données expérimentales clés sur la toxicité aquatique aiguë (ou à court terme) et chronique (ou à long terme). Les études sont citées par ordre croissant des concentrations avec effet d’équivalent chlorhexidine.
| Organisme testé | Composé testé | Paramètre | Équivalent chlorhexidinea en mg/L | Référence |
|---|---|---|---|---|
Algue verte (Scenedesmus subspicatus) |
Digluconate de chlorhexidine | CE50 à 72 h (biomasse) |
0,0062b (0,011) |
ECHA c2007-2015b |
Algue verte (S. subspicatus) |
Digluconate de chlorhexidine | CE50 à 72 h (biomasse) |
0,021 (0,038) |
ECHA c2007-2015b |
| Pseudokirchneriella subcapitata | Digluconate de chlorhexidine | CE50 à 24 h (inhibition de la croissance) |
0,0233 (0,0413) |
Jesus et al. 2013 |
| Daphnia magna | Digluconate de chlorhexidine | CE50 à 48 h (immobilisation) |
0,025 (0,045) |
Jesus et al. 2013 |
| D. magna | Diacétate de chlorhexidine | CE50 à 48 h (immobilisation) |
0,05 (0,06) |
Murphy et Smith 1991a |
| D. magna | Digluconate de chlorhexidine | CE50 à 48 h (immobilisation) |
0,049 (0,087) |
ECHA c2007-2015b |
| D. magna | Digluconate de chlorhexidine | CE50 à 48 h | 0,24 (0,42) |
EPA 2011b |
Crapet arlequin (Lepomis macrochirus) |
Digluconate de chlorhexidine | CL50 à 96 h | 0,29 (0,51) |
EPA 2011b |
Embryons de poisson zèbre (Danio rerio) |
Digluconate de chlorhexidine | CL50 à 96 h | 0,453 (0,804) |
Jesus et al. 2013 |
Crapet arlequin (Lepomis macrochirus) |
Diacétate de chlorhexidine | CL50 à 96 h | 0,5 (0,6) |
Murphy et Smith 1991b |
Poisson zèbre (Danio rerio) |
Digluconate de chlorhexidine | CL50 à 96 h | 1,17 (2,08) |
ECHA c2007-2015b |
Truite arc-en-ciel (Oncorhynchus mykiss) |
Digluconate de chlorhexidine | CL50 à 96 h | 1,3 (2,3) |
EPA 2011b |
Poisson zèbre (Danio rerio) |
Chlorhexidine | CL50 à 96 h | 1,4 (1,4) |
ECHA c2007-2015a |
Truite arc-en-ciel (Oncorhynchus mykiss) |
Diacétate de chlorhexidine | CL50 à 96 h | 1,5 (1,9) |
Murphy et Smith 1991c |
a Les valeurs entre parenthèses sont les valeurs originales rapportées pour le composé testé.
CL50 – la concentration d’une substance estimée être létale pour 50 % des organismes testés.
CE50 - la concentration d’une substance estimée provoquer un certain effet sur 50 % des organismes testés.
b Valeur de toxicité critique
| Organisme testé | Composé testé | Paramètre | Équivalent chlorhexidinea en mg/L | Référence |
|---|---|---|---|---|
Algue verte (Scenedesmus subspicatus) |
Digluconate de chlorhexidine | CE10 à 72 h (biomasse) |
0,002 (0,003) |
ECHA c2007-2015b |
Algue verte (Scenedesmus subspicatus) |
Digluconate de chlorhexidine | CSEO à 72 h (biomasse) |
0,0042 (0,0075) |
ECHA c2007-2015b |
| P. subcapitata | Digluconate de chlorhexidine | EC20 à 24 h (inhibition de la croissance) |
0,0116 (0,0206) |
Jesus et al. 2013 |
| D. magna | Digluconate de chlorhexidine | CSEO à 21 j (mortalité) |
0,0116 (0,0206) |
ECHA c2007-2015b |
| Monoraphidium griffithii | Digluconate de chlorhexidine | CI10 à 10 j (vitesse de croissance) |
0,29 (0,52) |
ECHA c2007-2015b |
a Les valeurs entre parenthèses sont les valeurs originales rapportées pour le composé testé.
CE10 – la concentration d’une substance estimée provoquer un certain effet sur 10 % des organismes testés.
CE20 - la concentration d’une substance estimée provoquer un certain effet sur 20 % des organismes testés..
CSEO – concentration sans effet observé
CI10 – concentration inhibitoire
Les données sur la toxicité aiguë de la chlorhexidine et de ses sels indiquent que la chlorhexidine est toxique à faible concentration pour les organismes aquatiques, avec des effets nocifs rapportés lors d’études clés à des concentrations inférieures à 0,1 mg/L de chlorhexidine. Jesus et al. (2013) ont rapporté une toxicité aiguë du digluconate de chlorhexidine pour les algues (CE50 = 0,0233 mg/L) et Daphnia magna (CE50 = 0,025 mg/L). Ceci est en accord avec les études sur des algues soumises à l’ECHA (c2007-2015b) pour le digluconate de chlorhexidine et avec les études sur D. magna soumises à l’EPA (2011b) et à l’ECHA (c2007-2015b) pour le digluconate de chlorhexidine et le diacétate de chlorhexidine. Les données sur la toxicité de la chlorhexidine et de ses sels indiquent aussi que la chlorhexidine provoque des effets nocifs aigus chez le poisson, dont le crapet arlequin, le poisson zèbre et la truite arc‑en‑ciel (EPA 2011b; ECHA c2007-2015b; EPA 2011b, respectivement). Le poisson semble moins sensible aux effets de la chlorhexidine que les algues et les daphnies, à l’exception du stade de vie plus sensible des embryons de poisson zèbre, comme le montre la CL50 de 0,453 mg/L rapportée par Jesus et al. (2013). Les études originales soumises à l’EPA et à l’ECHA n’étaient pas disponibles à des fins d’examen dans le contexte de la présente évaluation.
Les données de toxicité chronique sur les sels de chlorhexidine indiquent également que les algues sont particulièrement sensibles aux effets de la chlorhexidine, probablement en raison de son mode d’action comme perturbateur de membranes, se liant aux sites anioniques à la surface des cellules. Des valeurs de 0,002 mg/L (CE10) et 0,0042 mg/L (CSEO) ont été rapportées pour Scenedesmus subspicatus lors de deux études soumises à l’ECHA (c2007-2015b). Jesus et al. (2013) ont rapporté une CE20 de 0,0116 mg/L pour Pseudokirchneriella subcapitata exposé à du digluconate de chlorhexidine, soulevant des inquiétudes quant à ses effets potentiels sur les réseaux trophiques aquatiques. Lors d’une étude à long terme, il a été montré que la composition de la communauté microbienne était sensible à la présence de faibles concentrations de chlorhexidine (10 µg/L et 100 µg/L) présentes pendant 8 semaines (Lawrence et al. 2008). L’introduction de chlorhexidine à raison de 100 µg/L a conduit à l’élimination des protozoaires et des métazoaires dans les biofilms, en plus de modifications significatives dans la biomasse d’algues, de cyanobactéries et de bactéries et dans l’utilisation du carbone. L’altération de la composition de la communauté des biofilms de rivière en présence de chlorhexidine a aussi été observée par Dynes et al. (2006), avec élimination des brouteurs. Ces études fournissent des données utiles sur les effets au niveau de la communauté dus à la présence de chlorhexidine et donnent un aperçu des modifications de la population de la communauté et de la dynamique qui pourraient se produire dans un environnement naturel.
La concentration avec effet aigu la plus faible de 0,0062 mg/L de chlorhexidine pour S. subspicatus de l’ensmble des données a été retenue comme valeur critique de toxicité (VCT) à utiliser pour le calcul d’une concentration estimée sans effet (CESE). Les deux concentrations avec effet chronique plus faibles n’ont pas été retenues comme VCT, car elles auraient conduit à une CESE moins sensible. La VCT de 0,0062 mg/L a été divisée par un facteur d’évaluation de 30, pour tenir compte du type de paramètre et du besoin d’estimer une concentration sans effet à long terme. Ce facteur tient aussi compte de la variabilité de la sensibilité inter-espèce et entre espèces ainsi que d’un mode d’action réactif, compte tenu de l’ensemble des données disponibles sur la chlorhexidine. La CESE résultante est de 0,21 µg/L (0,00021 mg/L), indiquant que la chlorhexidine peut potentiellement causer des effets nocifs chez des organismes aquatiques à faible concentration.
6.1.2 Sédiments
Une seule étude sur la toxicité des sédiments était disponible, étude soumise à l’ECHA (l’étude originale n’était pas disponible à des fins d’examen dans le contexte de la présente évaluation). Pour cette étude de 28 jours sur la toxicité chronique, les effets du digluconate de chlorhexidine ont été testés sur la mouche arlequin (Chironomus riparius), une CSEO en équivalent chlorhexidine a été rapportée à 2,44 mg/kg sédiments poids sec (teneur en carbone organique de 2 % établi dans les directives suivies), calculée en utilisant la vitesse d’émergence (ECHA c2007-2015b).
Cette étude sur la toxicité chronique a été utilisée pour calculer une CESE pour les sédiments. Un facteur d’évaluation de 100 a été appliqué pour tenir compte des variations inter-espèce et entre espèces, ainsi que de son mode d’action réactif prédit (OCDE QSAR Toolbox 2015), étant donné le manque de données sur les effets sur les organismes benthiques. Après standardisation à une teneur en carbone organique (CO) de 4 % (une teneur en CO typique dans des sédiments de fond pour les rivières et les lacs utilisée pour la caractérisation des risques; voir la section sur la caractérisation des risques pour l’environnement), la CESE est de 0,049 mg/kg poids sec.
6.1.3 Sol
Une seule étude sur la toxicité du sol a été soumise à l’ECHA (l’étude originale n’était pas disponible à des fins d’examen dans le contexte de la présente évaluation). Les résultats indiquent que le digluconate de chlorhexidine a un faible potentiel d’effets nocifs sur les plantes terrestres (Brassica napus, Avena sativa, Glycine max), en rapport avec la croissance des semis (ECHA c2007-2015b). Dans le tableau 6‑3, nous avons résumé les études clés sur la toxicité du digluconate de chlorhexidine pour le sol. Lors d’une autre étude, aucune mortalité n’a été rapportée chez le strongyle, Eisenia fetida, après une exposition de 14 jours à du digluconate de chlorhexidine à une concentration de 1000 mg/kg sol sec (ECHA c2007-2015b). Aucune relation dose‑réponse n’a été présentée.
| Organisme testé | Composé testé | Paramètre | Équivalent chlorhexidinea (mg/kg soil sec) | Référence |
|---|---|---|---|---|
| Brassica napus | Digluconate de chlorhexidine | CSEO 21 j (poids de pousse fraîche) |
35,2 (62,5) |
ECHA c2007‑2015b |
| Avena sativa | Digluconate de chlorhexidine | CSEO 21 j (hauteur de pousse) |
70 (125) |
ECHA c2007‑2015b |
| Glycine max | Digluconate de chlorhexidine | CSEO 21 j (poids de pousse fraîche) |
281 (500) |
ECHA c2007‑2015b |
a La valeur entre parenthèse est la valeur originale rapportée pour le composé testé.
CSEO – concentration sans effet observé
La valeur de la CSEO de 35,2 mg/kg sol sec à 21 jours (1,18 % de teneur en CO) pour B. napus a été retenue comme VCT chronique et un facteur d’évaluation de 100 a été appliqué pour tenir compte des variabilités inter-espèces et intra-espèces (car il n’y a que trois espèces d’un seul groupe taxonomique), de son mode d’action réactif inconnu prédit (OCDE QSAR Toolbox 2015) et du manque de données sur les effets pour les organismes du sol. Après standardisation à une teneur en CO de 3,1 % (teneur utilisée avec le modèle BASL4 pour la caractérisation des risques; voir la section sur la caractérisation des risques pour l’environnement), la CSEO résultante est de 0,93 mg/kg poids sec.
6.1.4 Faune
Les données sur la toxicité du diacétate de chlorhexidine et du digluconate de chlorhexidine pour les espèces aviaires (y compris le colin de Virginie et le canard colvert) indiquent une faible toxicité (Campbell et al. 1991; OPP Pesticide Ecotoxicity Database 1991; Long et al. 1991a,b; EPA 2011b). La CSEO sous-aiguë alimentaire la plus faible est de 1438 mg/kg chlorhexidine (OPP Pesticide Ecotoxicity Database 1991) et la valeur la plus faible pour des effets aigus (dose unique, voie orale) est de 1627 mg/kg chlorhexidine (Campbell et al. 1991). Ces données indiquent que l’exposition alimentaire à la chlorhexidine ne causera probablement pas d’effet nocif chez les espèces aviaires.
Les études sur la toxicité de la chlorhexidine et de ses sels pour les mammifères sont présentées en détail à la section sur l’évaluation des effets sur la santé. Diverses études ont été réalisées (dont des études par voie orale, dermique, par inhalation ou par voie alimentaire) chez des rats, des souris, des chiens, des lapins, des marmousets et des singes rhésus. La concentration avec effet observé la plus faible de 5 mg/kg pc par jour a été rapportée lors d’études sur la toxicité chronique par voie orale avec des rats, quand ces derniers étaient exposés à du digluconate de chlorhexidine dans l’eau et les aliments (Case 1977; Block 2001; ECHA c2007-2015b). Dans l’examen des données toxicologiques fait par l’EPA (1996), il est conclu que le diacétate de chlorhexidine a une toxicité faible à modérée pour les mammifères, par inhalation, voie orale ou voie dermique.
Bien que des oiseaux ou des animaux puissent être exposés à de la chlorhexidine dans les milieux de l’environnement par l’intermédiaire de l’eau, des aliments ou d’un contact dermique, ils ne seront probablement pas exposés à des niveaux qui pourraient causer des effets nocifs. Il existe aussi des preuves à l’effet que la chlorhexidine est faiblement absorbée par la peau et les voies gastro-intestinales (voir la section sur l’évaluation des effets sur la santé). Cette voie n’a donc pas été prise en compte lors des analyses de l’exposition.
6.2 Évaluation de l’exposition dans l’environnement
6.2.1 Concentrations mesurées dans les milieux de l’environnement et les eaux usées
Aucune donnée sur des concentrations de chlorhexidine dans l’environnement au Canada n’a été identifiée.
Toutefois, différents systems de traitement des eaux usées au Canada ont fait l’objet d’un échantillonnage en 2016-17 et en 2017-2018 dans le cadre du Programme de surveillance et de monitoring du Plan de gestion des produits chimiques. L’analyse de la chrlohexidine dans des échantillons d’influent et d’effluent prélevés dans 24 UTEU différentes pendant cette période de deux ans (communication personnelle, de la Division des priorités émergeantes d’ECCC à la Division de l’évaluation écologique d’ECCC, novembre 2018; non référencé). Ces UTEU ont été sélectionnées afin de représenter des systems de traitement typiques du Canada et divers emplacements géographiques. Des échantillons pontuels et des échantillons composite sur 24 h ont été collectés. De la chlorhexidine a été mesurée dans 79 des 96 échantillons d’influent analysés, à des concentrations allant de 0,0339 à 4,470 µg/L (limites de declaration de 0,0153 à 0,0230 µg/L). De la chlorexhidine a été mesurée dans 19 des 96 échantillons d’effluent analyses, à des concentrations allant de 0,0188 à 0,448 µg/L (limites de declaration de 0,0115 à 0,0121 µg/L). Les taux d’élimination des différentes technologies de traitement ont aussi été estimés à partir des résultats pour d’échantillons d’inluent et d’effluent appariés. Les taux d’élimination médians de la chlorhexidine étaient de 93,7 % pour des lagunes facultatives, de 94,4 % pour des lagunes aérées, de 83,6 % pour des systems de traitement primaire, de 98,0 % pour des systems de traitement secondaire et de 98,2 % pour des systems de traitement de pointe (communication personnelle, dela Division des priorités émergeantes d’ECCC à la Division de l’évaluation écologique d’ECCC, novembre 2018; non référencé).
Un échantillonnage a aussi été réalisé dans certains autres systems de traitement des eaux usées canadiens recevant des eaux usées industrielles d’installations produisant des produits à base de chlorhexidine (communication personnelle, dela Division des priorités émergeantes d’ECCC à la Division de l’évaluation écologique d’ECCC, novembre 2018; non référencé). Des échantillons ponctuels ou des échantillons composites sur 24 h ont été collectés. Ces résultats ne correspondent pas nécessairement à la production de produits à base de chlorhexidine au moment de l’échantillonnage ni, quand une telle production a été confirmée, à des concentrations pics rejetées de manière non continue. Les concentrations mesurées de chlorhexidine dans les échantillons d’influent allaient de 0,130 à 0,429 µg/L (n = 7), celles dans les échantillons d’effluent allaient de 0,152 à 0,668 µg/L (n = 15). La limite de declaration pour les échantillons d’influent et d’effluent était de 0,0115 µg/L.
D’autres juridictions ont identifié la chlorhexidine comme preoccupation potentielle pour l’environnement en raison de son utilisation ubiquiste, et ells ont souligné le besoin de renseignements supplémentaires sur les concentrations dans l’environnement (Boxall et al. 2005). En Suède, la chlorhexidine a été retenue comme paramètre pour un programme national de criblage afin d’en mesurer et rapporter son occurrence (SWECO Environment 2011). Des UTEU ont été choisies comme sites d’échantillonnage en raison de leur potentiel général à rejeter des produits chimiques domestiques dans l’environnement aquatique. Il a été déterminé qu’une seule UTEU recevait des eaux usées d’une entreprise pharmaceutique utilisant de la chlorhexidine. Dans aucun des échantillons prélevés, la présence de chlorhexidine (ni de son produit de dégradation potentiel, la 4-chloroaniline) n’a pu être mise en évidence, y compris dans des échantillons de l’influent, de l’effluent et des boues des UTEU, d’eaux de surface, de sédiments et de poisson dans des cours d’eau recevant des effluents d’UTEU, d’eaux usées d’hôpitaux ou de sols agricoles ayant été amendés avec des boues. Les limites de dosage de la chlorhexidine étaient de 0,010 µg/L dans l’influent ou l’effluent d’UTEU, dans des eaux réceptrices et dans des eaux de fond, de 0,010 mg/kg dans des boues d’eaux usées (poids sec), des sédiments et des sols agricoles recevant des boues et de 0,10 mg/kg (poids humide, muscle) dans le poisson. Des descriptions détaillées des méthodes d’analyse n’ont pas été fournies (y compris le fait de savoir si des fractions totales ou dissoutes étaient mesurées).
De la chlorhexidine a été mesurée dans des eaux usées au Japon. Kodama et al. (1988) ont rapporté une gamme de 1,62 à 10,30 mg/L (rapportée à l’origine en µg/mL) pour la concentration de chlorhexidine dans des eaux usées. Matsushima et Sakurai (1984) ont rapporté des concentrations de chlorhexidine dans des eaux usées provenant du traitement d’eaux usées médicales allant de 0,085 à 1,94 mg/L. Ces mêmes auteurs ont cité une autre étude (Yamayoshi et al. 1981) dans laquelle il était rapporté des concentrations de chlorhexidine dans des eaux usées médicales de l’ordre de centaines de µg/L. Dans une autre étude, les auteurs ont rapporté des concentrations de chlorhexidine dans des échantillons d’eaux usées d’environ 2 à 7 mg/L (rapportées à l’origine en µg/mL) (Kido et al. 1988).
6.2.2 Rejets dans l’environnement
Les rejets de substances dans l’environnement sont le fruit de diverses pertes ayant lieu lors de la production, de l’utilisation industrielle, de l’utilisation commerciale ou par des consommateurs, de la durée de vie utile et de l’élimination. Les rejets de chlorhexidine et de ses sels dans l’environnement au Canada peuvent résulter de l’utilisation par les consommateurs et de la formulation de produits à base de chlorhexidine. Les rejets devraient être diffus (p. ex. rejet à l’égout de produits contenant de la chlorhexidine) et ponctuels (p. ex. sites de formulation de produits contenant de la chlorhexidine). Les rejets associés à la formulation peuvent aussi être ponctuels dans le cas de procédés de traitement par lot ou périodiques suite à l’accumulation de déchets.
Les rejets de chlorhexidine et de ses sels devraient avoir principalement lieu dans les eaux usées municipales ou industrielles. Étant donné que les technologies de traitement ne peuvent en éliminer qu’une partie, la chlorhexidine peut être rejetée dans les eaux de surface, mais aussi dans le sol suite à l’application de biosolides (provenant d’UTEU) sur des sols agricoles et des pâturages. Des produits et des articles manufacturés contenant de la chlorhexidine et éliminés dans des sites d’enfouissement peuvent libérer ces matières, qui peuvent finir dans le lixiviat de ces sites. Aucune donnée sur la présence de chlorhexidine dans le lixiviat de sites d’enfouissement n’a été rapportée à ce jour, mais ce type de donnée pourrait aider à interpréter les rejets en fin de vie. Qu’elle soit rejetée dans l’eau ou le sol, la chlorhexidine se retrouvera en fin de compte sur des particules chargées négativement, en raison de sa nature cationique.
6.2.3 Scénarios d’exposition et concentrations environnementales estimées
Aucune donnée sur des concentrations mesurées de chlorhexidine dans les milieux de l’environnement au Canada n’a été trouvée, les concentrations environnementales ont été estimées à partir des renseignements disponibles sur les quantités de chlorhexidine et de ses sels importées et utilisées au Canada. La caractérisation de l’exposition quantitative est typiquement centrée sur des scénarios représentant la ou les situations d’exposition les plus importantes et/ou les plus représentatives de la substance rejetée. En général, l’ampleur du rejet est une fonction directe de la quantité de substance produite ou utilisée dans des applications industrielles ou de la quantité utilisée dans des produits à des fins d’utilisation commerciale ou par des consommateurs (ainsi que des profils d’utilisation et d’élimination des produits).
La présente évaluation de l’exposition est centrée sur les rejets estimés de chlorhexidine et de ses sels, résultant de la formulation industrielle de produits contenant de la chlorhexidine, ainsi que de l’utilisation commerciale ou par des consommateurs de produits contenant cette substance (p. ex. rejet à l’égout). Les rejets dus à l’utilisation de produits vétérinaires contenant de la chlorhexidine dans des fermes laitières à travers le Canada ne sont pas pris en compte, les quantités totales utilisées pendant une période donnée dans une ferme et les concentrations en résultant devant être inférieures aux concentrations des rejets évalués pour les scénarios d’exposition présentés ci-après.
6.2.4 Scénario d’exposition 1 – formulation industrielle de produits contenant de la chlorhexidine
L’exposition aquatique d’organismes à de la chlorhexidine devrait être due au rejet de cette substance lors de son utilisation industrielle. La formulation de produits à base de chlorhexidine génère des eaux usées lors du nettoyage de l’équipement de mélange et de conditionnement. Les eaux usées contenant de la chlorhexidine sont envoyées vers une UTEU afin d’en éliminer une certaine fraction. La chlorhexidine restant dans l’effluent est ensuite rejetée dans le plan d’eau récepteur. La concentration de la substance dans le plan d’eau récepteur à proximité du point de rejet de l’UTEU est utilisée comme concentration environnementale estimée (CEE). Elle peut être calculée au moyen de la formule suivante :
Ceau-ind = (1000(Q)(P)(1-T)) / ((N)(F)(D))
dans laquelle :
Ceau-ind : concentration aquatique résultant de rejets industriels, mg/L
1000 : facteur combinant la conversion du kg au mg et du m3 au L
Q : quantité totale de substance utilisée annuellement sur un site industriel, kg/an
P : perte dans les eaux usées, fraction (% indiqué dans le tableau)
T : taux d’élimination de l’UTEU, fraction (% indiqué dans le tableau)
N : nombre de jours de rejet par an, jour/an
F : flux de l’effluent de l’UTEU, m3/jour
D : facteur de dilution du plan d’eau récepteur, sans dimension
Des concentrations environnementales estimées aquatiques (CEEaquatique industrielle) ont été calculées pour un certain nombre de sites industriels sur lesquels des produits à base de chlorhexidine et de ses sels sont formulés en quantités supérieures à 100 kg par an. Ces sites ont été identifiés suite à une analyse de renseignements soumis lors d’enquêtes à déclaration obligatoire ou volontaire ayant trait à la production, à l’importation et à l’utilisation de chlorhexidine et de ses sels (Environnement Canada 2007, Environnement Canada 2010, Environnement Canada 2015). Dans le tableau 6‑4, nous donnons un résumé des intrants utilisés pour calculer ces CEE.
| Intrant | Valeur | Justification |
|---|---|---|
| Quantité annuelle de chlorhexidine (kg/an) utilisée sur chaque site | Q = < 10 000 kg/an | Quantité totale utilisée sur chaque site de formulation. Les données sur les sels ont été converties en équivalent chlorhexidinea. |
| Perte dans les eaux usées (%) | P = 0,426 % | Calcul basé sur les résultats d’un échantillonnage volontaire de réservoirs de stockage de déchets réalisé en 2015 par un des formulateurs de produits à base de chlorhexidinea. L’hypothèse est que cette perte dans les eaux usées serait la même pour tous les autres formulateurs. |
| Taux d’élimination dans les UTEU (efficacité; %) | T = 84 % (primaire) 98 % (secondaire) 94 % (lagune) |
Le taux d’élimination pour un traitement primaire, un traitement secondaire ou dans une laguneb est choisi en se basant sur le type de traitement utilisé à l’UTEU à laquelle les installations industrielles sont reliées (communication personnelledela Division des priorités émergeantes d’ECCC à la Division de l’évaluation environnementale d’ECCC; non référencé). |
| Nombre de jours de rejet par an (j/an) | N = 1 à 350 | Jours par an pendant lesquels la substance est rejetée dans les eaux usées, tel que rapporté lors d’une enquête à déclaration volontaire auprès d’importateurs et de formulateurs de produits à base de chlorhexidine pour les années de déclaration 2011 et 2013. |
| Flux d’effluent de l’UTEU (m3/d) | F = 1750 to 2 240 000 | Données spécifiques de l’UTEU qui reçoit les eaux usées des installations industrielles. |
| Facteur de dilution dans les eaux réceptrices (sans dimension) | D = 10 | En assumant une dilution instantanée de l’effluent, le facteur de dilution d’un cours d’eau récepteur a été calculé en divisant le flux d’effluent de l’UTEU (connectée à l’installation) par le 10ème percentile de la distribution annuelle du flux du cours d’eau récepteur. Quand le facteur de dilution était supérieur à 10, une valeur maximale par défaut de 10 a été utilisée. Dans tous les cas où le facteur de dilution était supérieur à 10, il était limité à 10. Ce facteur de dilution représente l’exposition près du point de rejet de l’effluent. |
a Basé sur les renseignements reçus des formulateurs et de leurs clients, soumis lors d’enquêtes à déclaration obligatoire menées en vertu de la LCPE, ainsi de d’enquêtes de suivi à déclaration volontaire (Environnement Canada 2015).
b Le taux d’élimination pour la lagune est utilisé pour le scénario de rejet par des consommateurs.
Les CEE dans l’eau calculées (CEEaquatique industrielle) pour les installations de formulation de produits à base de chlorhexidine vont de 0,0074 à 0,309 µg/L. Le fait que plusieurs formulateurs pourraient être connectés à la même UTEU a été pris en compte, et dans de tels cas les CEE dans le plan d’eau récepteur étaient additionnées. Ces CEE sont utilisées pour les analyses de quotient de risque pour l’eau (voir la section sur la caractérisation des risques pour l’environnement). Pour ce calcul, un rejet continu moyenné sur le nombre de jours de rejet par an est utilisé. Les rejets ponctuels de plus grandes quantités de chlorhexidine associés au traitement par lot ou un rejet de déchets accumulés pourraient conduire à des expositions aiguës plus importantes.
Une approche de partage sédiments-eau à l’équilibre a été suivie pour estimer la concentration de chlorhexidine dans des sédiments de fond. Cette approche est basée sur le principe de partage décrit par l’Agence européenne des produits chimiques (ECHA 2010) et comprend deux méthodes de calcul additionnelles. La première consiste à estimer la concentration de la substance dans la phase aqueuse (vraiment dissoute) des eaux sus-jacentes à partir de sa concentration totale, comme dans les études de Gobas (2007 et 2010). La deuxième méthode consiste à estimer la concentration de la substance dans des sédiments de fond à partir de sa concentration dans la phase aqueuse des eaux sus-jacentes, en faisant une hypothèse de partage à l’équilibre entre les sédiments de fond et les eaux sus-jacentes décrite, telle que décrite par le National Center for Environmental Assessment de l’EPA (EPA 2003). À l’équilibre, la CEE dans les sédiments de fond peut être corrélée linéairement avec la concentration dans la phase aqueuse des eaux sus-jacentes. Des scénarios d’exposition due aux sédiments ont été élaborés en tant que prolongement des scénarios de rejet aquatique industriel susmentionnés, afin de déterminer des concentrations d’exposition par des sédiments à l’équilibre, standardisées à 4 % de CO (une teneur en CO typique des sédiments de fond des rivières et des lacs). Les concentrations dans les sédiments de fond ainsi calculées (CEEsédiments) allaient de 0,0054 à 0,305 mg/kg ps. Ces CEE ont été utilisées pour des analyses de quotient de risque pour les sédiments (voir la section sur la caractérisation des risques pour l’environnement).
Des rejets indirects dans le sol peuvent avoir pour origine l’application de biosolides produits par des UTEU traitant des eaux usées contenant de la chlorhexidine. Comme cela a déjà été rapporté dans le cas des pesticides ioniques, l’application de grandes quantités de phosphore et de chaux sur des terres agricoles pourrait faire diminuer la sorption et accroître la concentration en solution, en particulier dans des sols météorisés (Kah et Brown 2006). Quand les électrolytes dissous de chaux ajoutés à ces terres sont pris en compte, la biodisponibilité des cations organiques peut être considérablement réduite (Droge et Goss 2012). De manière prudente, il a été assumé que la concentration maximale dans le sol estimée (CEE) est 100 % biodisponible, même si ceci peut ne pas être le cas si de la chaux a été appliquée. Nous avons utilisé le modèle BASL4 (2011), un modèle basé sur la fugacité, pour estimer une CEE dans le sol. Les scénarios d’exposition due au sol ont été élaborés en tant que prolongement des scénarios de rejet aquatique susmentionnés, en utilisant une concentration de chlorhexidine dans les biosolides (0,0007 à 0,034 g/kg) et une vitesse de production de biosolides (400 à 321 000 kg/jour) basées sur des renseignements provenant d’UTEU spécifiques. Les hypothèses incluent un taux d’application de 8300 kg/ha, avec une fréquence d’application d’une fois par an pendant 10 ans, et une demi-vie dans le sol de 8640 heures (360 jours; EPI Suite c2000-2010). La concentration maximale dans le sol (CEEsol biosolides) a été estimée à 0,46 mg/kg ps (0,37 mg/kg ph), avec une teneur en CO de 2,7 %. Cette CEE a été utilisée lors d’analyses de quotient de risque pour le sol (voir la section sur la caractérisation des risques pour l’environnement).
6.2.5 Scénario d’exposition 2 – rejet à l’égout suite à une utilisation commerciale ou par des consommateurs de produits à base de chlorhexidine
De la chlorhexidine peut se retrouver dans des UTEU suite à l’utilisation commerciale ou par des consommateurs de produits à base de chlorhexidine (pour plus de détails voir la section sur les sources et les utilisations). Des CEE pour les sédiments et le sol n’ont pas été calculées pour le scénario de rejet à l’égout, car elles devraient être inférieures à celles du scénario industriel.
Afin d’estimer le niveau d’exposition aquatique due à ces rejets à l’égout, une approche probabiliste basée sur l’utilisation per capita et des renseignements sur les UTEU au Canada a été suivie. Des renseignements sur la distribution, incluant des facteurs de dilution (dérivés du 10ème percentile du flux du plan d’eau récepteur), des niveaux de traitement des UTEU et le rejet d’eau per capita, ont été utilisés. D’autres paramètres comme la consommation de produits contenant de la chlorhexidine per capita sont pris en compte de manière déterministe. Nous présentons dans le tableau 6‑5 un résumé des intrants utilisés.
| Intrant | Valeur | Justification |
|---|---|---|
| Quantité annuelle de chlorhexidine (kg/an) utilisée dans les produits | Q = < 10 000 kg/an | Chlorhexidine totale dans les produits (sauf dans les produits utilisés dans des fermes). Les données sur les sels ont été converties en équivalent chlorhexidineb. |
| Perte dans les eaux usées (%) | P = 100% | Hypothèse prudente à l’effet que la quantité totale d’une substance contenant de la chlorhexidine est envoyée vers une UTEU. |
| Facteur de dilution dans les eaux réceptrices (sans dimension) | D = 1-10 | En assumant une dilution instantanée de l’effluent, le facteur de dilution d’un plan d’eau récepteur a été calculé en divisant le flux de l’effluent de l’UTEU (connectée à l’installation) par le 10ème percentile de la distribution annuelle du flux du plan d’eau récepteur. Quand ce facteur de dilution était supérieur à 10, une valeur maximale par défaut de 10 a été utilisée. Ce facteur de dilution représente des expositions près du point de rejet de l’effluent. |
a Les taux d’élimination des UTEU sont les mêmes que ceux utilisés pour le scénario 1 – formulation industrielle de produits contenant de la chlorhexidine (voir le tableau 6‑4).
b Basé sur les renseignements reçus des formulateurs et de leurs clients, soumis lors d’enquêtes à déclaration obligatoire menées en vertu de la LCPE, ainsi de d’enquêtes de suivi à déclaration volontaire (Environnement Canada 2015).
La masse totale de chlorhexidine (incluant la proportion présente dans ses sels) dans divers produits a été estimée en utilisant des données reçues lors d’enquêtes et de suivis auprès des importateurs et des formulateurs de chlorhexidine et de produits à base de chlorhexidine pour les années 2011 et 2013. Il a été assumé avec prudence que cette masse totale (à l’exclusion des 10 % de la masse totale représentant les produits utilisés dans des fermes) serait en fin de compte rejetée à l’égout. Des CEE aquatiques ont été calculées pour des plans d’eau recevant l’effluent de chacune des UTEU. Le 95ème percentile de cette distribution probabiliste des CEE est 0,07 µg/L et a été retenu comme scénario réaliste de pire cas d’exposition, étant donné la nature des paramètres d’entrée et du niveau de confiance qui leurs sont associées. Ce scénario peut être interprété de la manière suivante : si l’eau de surface était échantillonnée à proximité d’un point de rejet d’une UTEU choisie au hasard au Canada, 95 % du temps la concentration de chlorhexidine dans l’échantillon est estimée inférieure ou égale à 0,07 µg/L.
La concentration de chlorhexidine dans les plans d’eau recevant les effluents des 24 UTEU canadiennes a aussi été estimée en utilisant des concentrations mesurées dans les effluents des UTEU (en 2016-17 et 2017-2018) (communication personnelle de la Division des priorités émergeantes d’ECCC à la Division de l’évaluation environnementale d’ECCC, novembre 2018; non référencé). En utilisant un facteur de dilution de 10 et tous les résultats individuels des échantillons d’effluent (y compris la limite de declaration pour celles pour lesquelles il n’y avait pas de concentration mesurée), la CEEaquatique; rejet à l’égout allait de 0,00115 à 0,0448 µg/L. Ces CEE se situent dans la gamme de celles estimées pour les rejets à l’égout.
6.3 Caractérisation des risques pour l’environnement
Dans la présente évaluation préalable ayant trait à l’environnement, nous présentons des conclusions basées sur une approche du poids de la preuve et sur le principe de précaution. Divers éléments de preuve ont été pris en compte pour la chlorhexidine et ses sels. Les quantités importées de chlorhexidine et de ses sels au Canada, ainsi que des renseignements sur leurs utilisations, indiquent un potentiel de rejets périodiques et continus dans l’environnement au Canada. La chlorhexidine devrait être persistante dans les milieux de l’environnement (eau, sédiments, sol). Les demi-vies sont supérieures à 182 jours dans l’eau et le sol et à 365 jours dans les sédiments. Le potentiel pour des organismes d’être exposés spatialement et temporairement à cette entité dans l’environnement est donc plus grand. Les sels de chlorhexidine rejetés dans l’environnement aquatique se dissocieront pour libérer la chlorhexidine, l’entité posant problème. La chlorhexidine se répartira sur les solides dissous ou en suspension chargés négativement dans l’environnement aquatique, peut se déposer dans les sédiments de fond ou être transportée loin des sources de rejet. Des rejets indirects de chlorhexidine dans les sols peuvent avoir lieu suite à l’application de biosolides contenant de la chlorhexidine.
La chlorhexidine et ses sels sont utilisés comme antiseptiques à large spectre et comme agents de conservation antimicrobiens dans une large gamme de produits. La structure de la chlorhexidine comporte des sites cationiques de liaison aux phospholipides et un groupe hydrophobe qui contribuent à son mode d’action biocide. Ils sont connus pour agir comme perturbateur de membranes chez des bactéries, en raison de la forte association des groupes biguanides avec les sites anioniques exposés de la membrane cellulaire et de la paroi cellulaire (en particulier avec les phospholipides et les protéines acides). Les caractéristiques structurelles de la chlorhexidine permettent aussi d’expliquer sa forte liaison à la peau et aux muqueuses, qui résulte en une faible absorption cutanée et dans les voies gastro-intestinales chez les mammifères. Bien que les renseignements disponibles indiquent que la chlorhexidine a un faible potentiel de bioaccumulation dans les organismes aquatiques, les données sur la toxicité montrent qu’elle a le potentiel de causer des effets nocifs chez des organismes aquatiques (y compris chez des organismes benthiques) à faible concentration. Les algues sont particulièrement sensibles aux effets de la chlorhexidine, probablement en raison de son mode d’action comme perturbateur de membranes. L’altération de la composition de la communauté des biofilms de rivière a aussi été observée, avec suppression des brouteurs et élimination des protozoaires et des métazoaires.
Nous avons réalisé des analyses de quotient de risque en intégrant des estimations réalistes de pire cas d’exposition (CEE) avec des renseignements sur la toxicité pour l’environnement (CESE) afin de déterminer s’il existe ou non un potentiel d’effets nocifs sur l’environnement au Canada. Des quotients de risque (QR) ont été calculés en se basant sur les études clés sur la toxicité pour l’environnement présentées (voir la section sur l’évaluation des effets sur l’environnement), en divisant la CEE par la CESE du milieu de l’environnement associé. Dans le tableau 6‑6, nous présentons les quotients de risque obtenus pour des scénarios d’exposition développés pour des rejets dus à utilisations industrielles (dont des QR aquatiques, pour les sédiments et les biosolides dans le sol) et à des utilisations avec rejet à l’égout.
| CEE du scénario d’expositionb | Gamme de la CEE | CESE | Unité de la CEE et de la CESE | Gamme du QR |
|---|---|---|---|---|
| CEEaquatique, industrielle | 0,0074 – 0,309 | 0,21 | µg/L | 0,04 – 1,5 |
| CEEsédiments | 0,005 – 0,305 | 0,049 | mg/kg ps | 0,1 – 6,3 |
| CEEsol, biosolides | 0,46 (maximum) | 0,93 | mg/kg ps | 0,6 |
| CEEaquatique, rejet à l’égout | 0,07 (95ème percentile) | 0,21 | µg/L | 0,4 |
a Les CEE pour les sédiments ont été standardisées à 4 % de CO (une teneur typique en CO des sédiments de fond des rivières et des lacs) et les CEE pour le sol ont été modélisées pour une teneur en CO de 2,7 %. Les CESE pour les sédiments et le sol ont donc été standardisées pour les teneurs correspondantes en CO afin de déterminer le risque.
b Les CEEaquatique, industrielle, CEEsédiments et CEEsol, biosolides ont été estimées à partir du scénario de formulation industrielle de produits à base de chlorhexidine.
Les résultats indiquent que la chlorhexidine et ses sels posent un risque aux organismes aquatiques et aux organismes benthiques dans le cas de la formulation de produits à base de chlorhexidine. Une analyse des concentrations estimées dans le sol indique que le potentiel de risque pour les organismes vivant dans le sol est faible (QR inférieur à 1). Le scénario d’exposition suite au rejet à l’égout après des utilisations commerciales ou par des consommateurs de produits à base de chlorhexidine indique que la chlorhexidine ne pose pas de risque pour l’environnement aquatique (QR inférieur à 1) aux niveaux actuels d’utilisation.
En résumé, les présents renseignements indiquent que la chlorhexidine et ses sels peuvent potentiellement causer des effets nocifs sur l’environnement au Canada. Il a aussi été déterminé que l’entité chlorhexidine satisfait aux critères de performance, mais pas à ceux de bioaccumulation, du Règlement sur la persistance et la bioaccumulation de la LCPE (Canada 2000).
6.3.1 Considérations ayant trait aux éléments de preuve et aux incertitudes
Étant donné que la forme cationique de la chlorhexidine est prédominante à des pH pertinents pour l’environnement, son devenir et son comportement dans l’environnement seront fortement dépendants de sa sorption sur le carbone organique dissous et les solides en suspension de la colonne d’eau ou sur les sédiments et les particules de sol. Ces processus de sorption seront dominés par des interactions électrostatiques avec des sites de sorption chargés négativement, le carbone organique jouant un rôle. Toutefois, l’échange de cations est complexe et difficile à prédire dans l’environnement étant donné les divers facteurs pouvant influencer la sorption. Il existe donc une incertitude quant à la détermination du degré avec lequel la chlorhexidine serait sorbée ou désorbée, en particulier en ce qui a trait à son élimination lors du traitement des eaux usées. La chlorhexidine devrait se sorber fortement aux boues durant le traitement des eaux usées. Les taux d’élimination utilisés pour la présente évaluation (pour estimer la fraction de chlorhexidine qui peut être éliminée des eaux usées) sont calculés à partir des résultats sur les concentrations mesurées dans des échantillons d’influent et d’effluent appariés de 24 UTEU canadiennes.
Il n’existe pas de renseignements sur des concentrations environnementales (p. ex. données de surveillance) de chlorhexidine au Canada. Les concentrations d’exposition dans l’eau, les sédiments et le sol ont donc été estimées au moyen de modèles. Les quantités de substances dans le commerce reflètent les quantités importées déclarées lors d’enquêtes réalisées certaines années pour certaines substances et peuvent ne pas refléter les quantités réelles au Canada, en particulier étant donné l’utilisation de la chlorhexidine dans divers produits importés. Bien qu’il existe toujours une certaine incertitude liée à l’utilisation de modèles et de données limitées pour les intrants, nous avons suivi des approches prudentes et retenu des scénarios de pire cas réalistes.
Les études sur la toxicité de la chlorhexidine et de ses sels sont limitées dans le cas des sédiments et du sol. Bien que le mode d’action toxique de la chlorhexidine comme perturbateur de membranes cellulaires chez des bactéries ait été bien étudié, il existe aussi potentiellement un mode d’action réactif, y compris une liaison possible aux protéines. Des facteurs d’évaluation ont été appliqués aux valeurs critiques de toxicité dans le cas des sédiments et du sol afin de tenir compte de ces sources d’incertitude. Néanmoins, il existe une incertitude quant au degré avec lequel la chlorhexidine serait biodisponible pour des organismes vivant dans le sol ou les sédiments en raison de ses caractéristiques de sorption. Il existe donc une certaine incertitude sur les quotients de risque calculés pour le sol et les sédiments, étant donné qu’il est assumé que les concentrations environnementales estimées de chlorhexidine sont biodisponibles à 100 % afin d’obtenir des estimations prudentes des risques dans ces milieux.
7. Potentiel d’effets nocifs sur la santé humaine
7.1 Évaluation de l’exposition
Milieux de l’environnement et aliments
Nous n’avons trouvé aucune donnée sur des concentrations de chlorhexidine et de ses sels dans des milieux de l’environnement ou des aliments au Canada. Le digluconate de chlorhexidine et le diacétate de chlorhexidine sont des additifs fortuits potentiels, en raison de leur présence dans un nombre limité de produits de nettoyage utilisés dans des installations de préparation d’aliments. Aucune exposition alimentaire résultant de ces utilisations n’est attendue, puisque ces produits de nettoyage n’entrent pas en contact direct avec les aliments et que leur utilisation est suivie d’un rinçage avec de l’eau potable.
De la chlorhexidine ne devrait pas être rejetée dans l’air étant donné sa très faible pression de vapeur et sa solubilité dans l’eau élevée, et son existence sous forme protonée dans l’environnement indique que la volatilisation serait négligeable à partir de surfaces de sol humide ou sec ou d’eaux de surface.
Bien qu’il n’existe pas de donnée disponible sur les concentrations de chlorhexidine dans l’environnement au Canada, cette substance a été mesurée dans des eaux usées au Japon (voir la section sur l’évaluation de l’exposition dans l’environnement).
De la chlorhexidine peut être rejetée dans l’eau suite à son utilisation comme désinfectant et/ou agent de conservation antimicrobien dans un certain nombre de produits, dont des cosmétiques, des produits de santé naturels et des médicaments. Nous avons utilisé un scénario de rejet à l’égout pour calculer une concentration dans des eaux de surface pouvant conduire à une ingestion de contaminant.
Dans la section sur l’évaluation de l’exposition dans l’environnement, nous avons utilisé un scénario d’exposition due au rejet à l’égout de produits à base de chlorhexidine suite à leur utilisation commerciale ou par des consommateurs. Des CEE aquatiques ont été calculées pour des plans d’eau recevant l’effluent d’UTEU. Ce scénario est basé sur une approche probabiliste de consommation per capita et des renseignements sur les UTEU au Canada. Le 95ème percentile de cette distribution probabiliste des CEE est de 0,07 µg/L, et il a été retenu comme scénario réaliste de pire cas d’exposition dans l’environnement. Cette CEE a été utilisée pour faire des estimations d’ingestion due à l’eau potable, ces ingestions vont de 1,41 x10-6 mg/kg pc par jour pour des adolescents (12 à 19 ans) à 7,47 x10-6 mg/kg pc par jour pour des enfants nourris avec des préparations commerciales (0 à 6 mois).
Produits disponibles pour les consommateurs
De la chlorhexidine, sous forme de digluconate, et dans une moindre mesure sous forme de dichlorhydrate, est présente dans une variété de cosmétiques au Canada dont, entre autres, des produits de maquillage, des produits capillaires (p. ex. teintures, produits de conditionnement et de coiffure), des produits de soins cutanés (p. ex. hydratants, nettoyants et exfoliants) et des lotions après rasage. Ces renseignements sont basés sur les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, juin 2016; non référencé).
La chlorhexidine et le digluconate de chlorhexidine sont inscrits dans la BDPSNH, en tant qu’ingrédient non médicinal présent à des fins d’agent de conservation antimicrobien dans des produits de santé naturels actuellement homologués (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, juin 2016; non référencé; BDPSNH [modifiée en 2019]).
Dans le tableau 7‑1, nous donnons une liste des cosmétiques pris en compte dans un scénario d’exposition par application, alors que dans le tableau 7‑2 nous donnons une liste des produits de santé naturels considérés contribuer à une exposition quotidienne. Les paramètres génériques par défaut appliqués à chaque scénario d’exposition sont donnés dans l’Annexe A. L’absorption dermique n’a pas été prise en compte pour les estimations de l’exposition, car ces estimations seront comparées à celles d’une étude sur la toxicité dermique (voir la section sur la caractérisation des risques pour la santé humaine).
Scénario d’exposition du à une utilisation ponctuelle de cosmétiques |
Concentrationa (%) |
Exposition par applicationb,c (mg/kg pc) |
|---|---|---|
Colorant pour cheveux (permanent) |
0,1 |
0,122 |
Lubrifiant génital |
0,2 |
0,158 |
a Les concentrations sont basées sur des déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, juin 2016; non référencé) et sur les concentrations maximales permises de chlorhexidine et de ses sels de la Liste des ingrédients de cosmétiques interdits ou d’utilisation restreinte (Santé Canada [modifié en 2015]).
b Dépôt dermique
c Exposition estimée par application exprimée en équivalent chlorhexidine.
| Scénario d’exposition due à une utilisation quotidienne | Concentrationa (%) | Source | Voie | Exposition quotidiennea (mg/kg pc par jour) |
|---|---|---|---|---|
| Hydratant pour le corps (adultes) | 0,2b | DRC | Dermique | 0,0788 |
| Hydratant pour le corps (enfants) | 0,2b | DRC | Dermique | 0,355 |
| Conditionneur pour cheveux permanent (adultes) | 0,1 – 0,2b | DRC | Dermique | 0,0113 – 0,023 |
| Rouge à lèvres (adultes) | 0,1b | DRC | Orale | 0,000191 |
| Baume pour les lèvres (tout-petits) | 0,1b | DRC | Orale | 0,000214 |
| Bain de bouche (adultes) | 0,2c | DPSNMSO | Orale | 0,0270 |
| Bain de bouche (enfants) | 0,2c | DPSNMSO | Orale | 0,0310 |
| Écran solaire (adultes) | 0,05 | DPSNMSO | Dermique | 0,048 |
| Écran solaire (tout‑petits) | 0,05 | DPSNMSO | Dermique | 0,054 |
Abréviations : DRC = déclaration soumise en vertu du Règlement sur les cosmétiques (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, juin 2016; non référencé); DPSNMSO = Direction des produits de santé naturels et des médicaments sans ordonnance (communication personnelle, courriels de la Direction des produits de santé naturels et des médicaments sans ordonnance de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, juin 2016; non référencé)
a Exposition quotidienne estimée exprimée en équivalent chlorhexidine.
b Les concentrations dans les cosmétiques sont basées sur des declarations faites à Santé Canada en vertu de Règlement sur les cosmétiques (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, juin 2016; non référencé) et sur les concentrations maximales permises de chlorhexidine et de ses sels de la Liste des ingredients de cosmétiques don’t l’utilisation est interdite ou limitée (Santé Canada [modifié en 2015]).
c Concentration basée sur des produits ayant un numéro de produit naturel dans Oraldent 2015.
7.2 Évaluation des effets sur la santé
Les renseignements sur les effets sur la santé de la chlorhexidine et de ses sels, y compris ceux relatifs au diacétate de chlorhexidine, au digluconate de chlorhexidine et au dichlorhydrate de chlorhexidine, ont été pris en compte pour l’évaluation des effets sur la santé de l’entité chlorhexidine. La spéciation de l’entité chlorhexidine dans des fluides biologiques dépend du pH, mais est indépendante de la forme originale. La partie anion des sels de chlorhexidine, à savoir diacétate, dichlorhydrate et digluconate, est considérée peu préoccupante et ne pose pas de risque déraisonnable à la santé humaine (NICNAS 2014). L’entité chlorhexidine devrait donc être celle responsable des effets sur la santé de ces substances.
Plusieurs études sur la toxicité de la chlorhexidine en tant que digluconate non identifiées ailleurs dans le domaine public ont été citées dans le dossier Enregistrement, évaluation, autorisation et restriction des produits chimiques de l’ECHA (ECHA c2007-2015b).
Aucune augmentation de néoplasmes liée au traitement n’a été observée lors d’études à long terme avec des rats et des souris exposés à du digluconate de chlorhexidine jusqu’à la dose maximale tolérée, soit dans leurs aliments soit dans leur eau potable (Case 1977; ICI 1992; ECHA c2007-2015b).
Globalement, les données sur la génotoxicité in vitro et in vivo indiquent que la chlorhexidine et ses sels ne sont pas génotoxiques (Suessmuth et al. 1979; Farrow 1983; Myhr 1983; Cifone 1984; COLIPA 1984; Sakagami et al. 1986; Ribeiro et al. 2004; Hikiba et al. 2005; Miyachi et Tsutsui 2005; Grassi et al. 2007; McEvoy 2010; Li et al. 2012; ECHA c2007-2015b).
La toxicité aiguë de la chlorhexidine est considérée faible par voie orale ou dermique, étant donné la dose létale élevée (DL50) de différentes formulations de chlorhexidine observée chez diverses espèces (Miller 1993a,b; Shapiro 1993; ECHA c2007-2015b; NICNAS 2014).
La chlorhexidine ne s’est pas avérée irritante pour la peau chez le lapin lors d’études d’irritation cutanée aiguë (Greener et al. 1985; ECHA c2007-2015b).
Plusieurs cas de dermatite sévère par contact irritant chez des nouveaux-nés humains nés savant terme ont été rapportés lors de l’utilisation de solutions de digluconate de chlorhexidine pour antisepsie cutanée avant des procedures invasives comme l’insertion de cathéters vasculaires centraux. Les blessures chimiques cutanées les plus sévères et mettant la vie en danger (dont des ulcérations et des brûlures nécessitant des greffes de peau) ont été observes chez des nouveaux-nés très prématurés ( moins de 34 semaines de gestation) qui avaient moins de 14 jours et probablement une peau fonctionnellement et morphologiquement immature (Santé Canada 2015). Du digluconate de chlorhexidine étant présent comme ingrédient médicinal dans de telles solutions, les expositions dues à cette source ont été jugées hors de la portée de la présente évaluation.
La toxicocinétique de la chlorhexidine et de ses sels a été étudiée chez les humains et un certain nombre d’animaux de laboratoire (Magnusson et Heyden 1973; Winrow 1973; Case 1977; Willis 1993; EMEA 1996; Block 2001; Xue et al. 2009, 2012; FDA 2013). En raison de leur nature cationique, ces composés chimiques se lient fortement à la peau et aux muqueuses. Ils pénètrent donc peu dans la peau et les voies gastro‑intestinales (EMEA 1996; FDA 2013). La biodisponibilité orale a été rapportée à environ 1 % lors d’une évaluation récente de niveau II de santé humaine de la chlorhexidine par NICNAS (2014). De même, l’absorption dermique de la chlorhexidine et de ses sels a été rapportée inférieure à 1 à 4 % lors d’études in vitro chez des animaux ou des humains (Chow et al. 1978; Cowen et al. 1979; Case 1980; O’Neill et al. 1982; Gongwer et al. 1980; Willis 1993; EMEA 1996; Lafforgue et al. 1997; Karpanen et al. 2008).
L’apparition de cellules géantes dans les régions corticale et paracorticale des ganglions lymphatiques mésentériques a été observée chez des rats Wistar exposés à 5, 25 ou 40 mg/kg pc par jour de chlorhexidine, en tant que digluconate, dans l’eau potable pendant deux ans. Ces cellules avaient aussi été observées lors d’une étude précédente de même durée, quand des rats avaient été exposés 125 ou 158 mg/kg pc par jour de chlorhexidine, en tant que digluconate, dans l’eau potable et lors d’une étude de 90 jours pour laquelle des rats avaient reçu 50, 100 ou 200 mg/kg pc par jour de chlorhexidine dans l’eau potable (Case 1977; Block 2001). Ces modifications ont été décrites comme étant réactives, non progressives et réversibles, et ont été attribuées à des effets locaux dans les intestins dus à l’absorption de la substance (Case 1977; ECHA c2007-2015b). Des macrophages chargés de pigment (gravité de niveau II) ont aussi été observés dans les ganglions lymphatiques mésentériques de rats Wistar exposés à 5, 25 ou 50 mg/kg pc par jour de chlorhexidine, en tant que digluconate, dans leur alimentation pendant deux ans (ECHA c2007-2015b). Lors d’une étude sur le développement avec des rats, dont le principal intérêt était la détection d’effets sur les ganglions lymphatiques en développement, une histocytose faible à modérée des ganglions lymphatiques mésentériques a été observée chez les femelles et leur descendance à 0,5 mg/kg pc par jour, les femelles étant exposées à de la chlorhexidine, en tant que digluconate, pendant 50 jours à partir de la journée de gestation 15 et les petits depuis la journée post-naissance 21 jusqu’à 14 semaines ou 6 mois, par gavage. La gravité augmentait avec la durée de l’exposition, les petits apparaissant moins susceptibles que leurs mères (ECHA c2007-2015b). De tels effets n’ont pas été observés lors d’études à long terme par voie orale chez des souris ou des chiens (ECHA c2007-2015b).
Des dommages hépatiques ont été observés chez des chiens beagle exposés oralement à de la chlorhexidine, en tant que digluconate dans des capsules, à des doses de 0,5, 5 ou 25 mg/kg pc par jour pendant une durée allant jusqu’à un an (ECHA c2007-2015b). Une concentration sans effet observé (CSEO) de 0,5 mg/kg pc par jour et une dose minimale avec effet nocif observé (DMENO) de 5 mg/kg pc par jour ont été calculées, basées sur une fibrose centrolobulaire hépatique. Une dégénérescence focale, des régions irrégulières de nécrose du foie, une perte d’hépatocytes et une teneur sérique accrue d’enzymes du foie ont été observés à la dose élevée. Cependant, aucune évidence histologique d’une toxicité pour le foie n’a été observée chez des rats et des souris lors d’études à long terme (NICNAS 2014; ECHA c2007-2015b).
Lors d’une étude sur la toxicité sous-chronique par voie dermique, une DSENO systémique de 250 mg/kg pc par jour a été calculée, basée sur une activité enzymatique du foie accrue et des modifications dégénératives du foie observées chez des lapins exposés pendant 13 semaines de manière topique, sous pansement occlusif, à 250, 500 ou 1000 mg/kg pc par jour. La nécrose du foie a toutefois été qualifiée de minime lors de tous ces traitements. Cette dose est également considérée comme dose minimale avec effet observé (DMEO), basée sur une irritation cutanée (Henwood 1988). Aucun effet lié au traitement n’a été observé chez des singes rhésus nouveau-nés exposés quotidiennement pendant 5 minutes à un nettoyant pour la peau contenant 8 % de digluconate de chlorhexidine, pendant trois mois (Gongwer et al. 1980).
Aucun effet significatif lié au traitement n’a été rapporté lors d’études à dose répétée par inhalation avec le digluconate ou le diacétate de chlorhexidine (Andrews et Paul 1977; Willis 1993).
Lors d’une étude sur la toxicité pour la reproduction rapportée par EMEA (1996), une DSENO de 4,9 mg/kg pc par jour et une DMENO de 44,4 mg/kg pc par jour ont été déterminées, basées sur un poids moindre des petits au jour 4 post-partum, un gain de poids moindre de la mère et un nombre moindre de fœtus viables, quand des rates étaient graduellement exposées à 0, 4, 9 et 44,4 mg/kg pc par jour de chlorhexidine pendant deux semaines puis à la dose complète pendant les 14 jours précédant l’accouplement avec des mâles non traités. Les doses prévues de 0, 5 et 50 mg/kg pc par jour n’ont pas pu être atteintes en raison d’une diminution liée à la dose de la consommation d’eau causée par la substance. Lors d’une autre étude sur la toxicité pour la reproduction pour laquelle on a testé un certain nombre de composés connexes, il a été rapporté que la chlorhexidine réduit le nombre de portées de moitié chez des souris exposées à ces substances à raison de 400 mg/kg pc par jour pendant une semaine (les renseignements sur la toxicité de la chlorhexidine pour la mère n’ont pas été fournis) (Cutting et al. 1964).
Lors d’une étude sur la toxicité pour le développement par voie orale, une DSENO de 30 mg/kg pc par jour et une DMENO de 100 mg/kg par jour ont été déterminées, basées sur une augmentation significative de l’incidence de développement du squelette retardé à la plus forte dose, quand des rates enceintes ont été exposées par gavage à 0, 10, 30 ou 100 mg/kg pc par jour de chlorhexidine, en tant que digluconate, des jours de gestation 6 à 19. Les autres effets observés à cette dose incluaient des augmentations des résorptions hâtive, tardive et totale et un nombre moindre de fœtus. La DSENO pour la toxicité pour la mère était de 10 mg/kg pc par jour (ECHA c2007-2015b). Aucun effet toxique pour les embryons lié au traitement n’a été observé quand des rates Wistar enceintes ont été exposées à 0, 0,1, 0,5 et 5 mg/kg pc par jour de chlorhexidine, en tant que digluconate, du jour de gestation 15 jusqu’à la lactation et quand leurs descendants (0–2,5 mg/kg pc par jour) l’ont été depuis le sevrage pendant des périodes allant jusqu’à six mois. Il n’y avait aussi aucun effet lié au traitement sur le nombre de portée, la taille de la portée, le rapport des sexes et la vitesse de croissance des petits F1 (ECHA c2007-2015b). De même, aucun effet nocif n’a été rapporté chez des fœtus de rates exposées à une dose de 68,5 mg/kg pc par jour de chlorhexidine, en tant que digluconate, par gavage pendant les jours de gestation 6-15 ou chez des fœtus de rates exposées par voie orale à 10, 25 ou 50 mg/kg pc par jour (Case 1977; Gilman et De Salva 1979). Lors d’une étude sur la toxicité pour le développement de la chlorhexidine, en tant que diacétate, aucun effet nocif n’a été observé chez des rates exposées par voie orale à 0, 15,63, 31,26 ou 62,5 mg/kg pc par jour pendant les jours de gestation 6 à 15 (Lamb 1991). La toxicité pour la mère incluait un gain de poids réduit lié à la dose, des râles et une salivation accrue, observés à 31,25 mg/kg pc par jour (Lamb 1991).
Plusieurs études humaines sur des bains de bouche contenant du digluconate de chlorhexidine ont été décrite dans la Cosmetic Ingredient Review, dont une étude de six mois sur des enfants en âge scolaire (10 à 12 ans) exposés jusqu’à 6 fois par semaine à une solution contenant jusqu’à 1 %, une étude de six mois sur des adultes exposés à une solution à 0,12 %, une étude de 9 mois sur des adultes exposés à une solution à 0,12 % et des études à long terme (1 à 2 ans) sur des adultes exposés à une solution à 0,12 ou 0,2 % (Willis 1993). Seuls des effets réversibles, comme une modification de la perception du goût, une irritation mineure, une desquamation superficielle de l’épithélium de la muqueuse orale et des taches sur les dents ont été observés. Aucune réaction allergique n’a été rapportée. Suite à une exposition à long terme, aucun effet significatif lié au traitement n’a été rapporté soit pour les paramètres sanguins soit pour la muqueuse orale.
Plusieurs cas de sensibilisation chez des humains ont été rapportés dans la littérature lors de tests épicutanés ou par piqûre avec de la chlorhexidine (Broeckx et al. 1987; Nagendran et al. 2009; ECHA c2007-2015a), du diacétate de chlorhexidine (Andersen et Brandrup 1985, Reynolds et Harman 1990; Evans 1992; Wong et al. 1990; Leow et Goh 1999) et du digluconate de chlorhexidine (Roberts et al. 1981; Bechgaard et al. 1985; Bergovist-Karlsson 1988; Okano et al. 1989; Osmundsen 1982; Liippo et al. 2011). Toutefois, ces cas de sensibilisation étaient principalement observés chez des individus ayant des troubles cutanés pré-existants ou quand la substance était appliquée sur les membranes de la muqueuse. De même, dans un Résumé de l’examen d’inocuité de produits antiseptique à base de chlorhexidine sans ordonnance pour application topique, un potentiel de réactions allergiques sérieuses, incluant une anaphylaxie, a été identifié dans certaines conditions quand ils sont utilisés pour la bouche, des blessures ouvertes ou immédiatement avant ou après une chirurgie. Des 53 rapports de réactions allergiques sérieuses reçus par Santé Canada pour l’utilisation de tels produits, trois étaient des cas de réactions anaphylactiques. Dans la monographie sur les nettoyants antiseptiques pour la peau de Santé Canada, il est requis que l’étiquetage de tels produits inclut un avertissement visant à réduire au minimum le risque de réactions allergiques (Santé Canada 2016).
Lors d’une étude sur l’intolérance aux cosmétiques, seuls 15 de 5202 patients (0,3 %) testés pour dermatite par contact, au moyen d’une analyse informatique de l’historique médical et de tests épicutanés, ont développé une dermatite par contact allergique causée par la chlorhexidine (Broeckx et al. 1987). Garvey et al. (2003) ont étudié la prévalence de la sensibilisation et l’allergie à la chlorhexidine chez des travailleurs dans le domaine des soins de santé. Aucun des 104 docteurs, infirmières et membres du personnel auxiliaire n’a eu de réaction à des timbres transdermniques contenant du diacétate de chlorhexidine (1 %) et du digluconate de chlorhexidine (1%) dans l’eau (Garvey et al. 2003). Toutefois, lors de deux autres études avec des travailleurs de la santé, 3 à 4 % des individus ont été diagnostiqués avec une allergie à la chlorhexidine médiée par IgE suite à des tests épicutanés ou sérologiques ou ont exhibé des réactions positives à des timbres transdermiques avec 0,5% de diacétate de chlorhexidine ou 0,5 % de digluconate de chlorhexidine (Nagendran et al. 2009; Toholka et Nixon 2013). De même, dans le cadre d’une étude rétrospective, 82 des 8497 patients (1 %) testés avec des timbres transdermiques avec de la chlorhexidine pendant la période 2003-2013 au département de dermato-allergologie de l’hôpital de l’Université de Copenhague ont exhibé une réaction positive. De ces 82 patients, 43 (0,5 %) ont exhibé une réponse positive au test avec du diacétate de chlorhexidine, 11 (0,1 %) une réaction positive au digluconate de chlorhexidine et 28 (0,3 %) une réaction positive à ces deux substances. Des causes connues d’allergie avaient été rapportées par 19 patients (40 %) et étaient principalement attribuables à des produits utilisés dans un cadre de soins de santé (Opstrup et al. 2016). Lors d’une étude multi-centre, randomisée par grappes, pour évaluer le rôle d’une baignade quotidienne avec une débarbouillette imprégnée de chlorhexidine sur l’acquisition d’organismes résistant à plusieurs drogues et l’incidence d’infections dans la circulation sanguine acquises à l’hôpital, l’incidence globale de réactions cutanés chez les patients était de 2,0 % (78 des 3970 patients), comparativement à 3,4 % (130 des 3842) chez ceux se baignant avec le produit témoin (Climo et al. 2013).
7.3 Caractérisation des risques pour la santé humaine
Les données empiriques disponibles sur la chlorhexidine et ses sels n’ont pas permis de conclure à une évidence de carcinogénicité ni de génotoxicité. La caractérisation des risques pour la présente évaluation préalable est donc basée sur des effets non cancéreux.
Il n’y a pas d’absorption significative quand de la chlorhexidine est appliquée sur de la peau intacte et, de même, la biodisponibilité par voie orale a été rapportée être d’environ 1 % lors d’une évaluation récente de niveau II du rôle de la chlorhexidine sur la santé humaine par NICNAS (2014). Ces propriétés ont conduit à l’utilisation de la chlorhexidine principalement comme antiseptique topique.
De la chlorhexidine peut être rejetée dans l’eau suite à son utilisation comme désinfectant et/ou comme agent de conservation antimicrobien dans un certain nombre de produits, dont des cosmétiques, des produits de soins de santé naturels et des médicaments. Un scénario de rejet à l’égout a été utilisé pour calculer une concentration dans des eaux de surface conduisant à une ingestion potentielle de contaminant et a permis d’estimer l’absorption due à l’eau potable dans la gamme allant de 1,41 x10-6 mg/kg pc par jour pour des adolescents (12-19 ans) à 7,47 x10-6 mg/kg pc par jour pour des bébés nourris avec des préparations commerciales (0-6 mois).
Une DMEO de 5 mg/kg pc par jour, basée sur l’apparition de cellules géantes dans les ganglions lymphatiques mésentériques, a été calculée à partir des résultats de deux études de toxicité chronique par voie orale avec des rats exposés à du digluconate de chlorhexidine dans l’eau et les aliments. Ces effets ont été décrits comme réactifs, non progressifs et réversibles et ont été attribués à des effets localisés dans les intestins dus à l’absorption de la substance (Case 1977; Block 2001; ECHA c2007-2015b).
La comparaison des estimations d’absorption due à l’eau potable (7,47 x10-6 mg/ kg pc par jour pour des bébés de 0-6 mois nouris avec dees préparations commerciales et du niveau d’effet critique chronique par voie orale (DMEO de 5 mg/kg pc par jour basée sur des effets localisés dans les intestins de rats exposés à de la chlorhexidine pendant deux ans) a conduit à une marge d’exposition (ME) de 670 000. Cette ME est considérée adéquate pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
L’exposition de la population générale du Canada à la chlorhexidine et ses sels est principalement due à des produits utilisés par voie dermique. Aucune toxicité chronique par voie dermique n’a été observée pour la chlorhexidine et ses sels. Une DSENO systémique de 250 mg/kg pc par jour a été calculée en se basant sur des effets sur le foie de lapins exposés de manière topique, sous pansement occlusif, à de la chlorhexidine, en tant que diacétate, pendant 13 semaines (Henwood 1988). Cette dose est aussi considérée comme la DMEO dermique, basée sur une irritation cutanée minimale. Aucun effet lié au traitement n’a été observé lors d’une étude sub-chronique au cours de laquelle des singes rhésus nouveau-nés ont été exposés quotidiennement à un nettoyant pour la peau contenant 8 % de chlorhexidine, en tant que digluconate (Gongwer et al. 1980).
Dans le tableau 7-3, nous présentons les estimations des risques associés à un usage quotidien de cosmétiques et de produits de santé naturels conduisant à l’exposition la plus importante à la chlorhexidine.
La comparaison des estimations d’exposition à la chlorhexidine et ses sels par voie dermique due à une utilisation quotidienne de cosmétiques ou de produits de santé naturels conduisant aux expositions les plus importantes avec le niveau d’effet critique (DSENO systémique suc-chronique de 250 mg/kg pc par jour) conduit à des ME de 704 à 22 100. Ces ME sont considérées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. Bien qu’une étude de durée plus courte soit utilisée et qu’une ME inférieure à 1000 soit obtenue pour le scénario d’hydratant pour le corps pour enfants, cette ME est quand même considérée protectrice. Ceci est basé sur l’utilisation de valeurs par défaut prudentes et des algorithmes pour estimer les expositions et sur l’utilisation d’une DSENO systémique comme point de départ pour l’exposition dermique. De plus, étant donné l’irritation cutanée minimale observée chez certains animaux à cette dose, l’exposition devrait être auto-limitée.
| Scénario d’exposition | Source | Exposition quotidienne (mg/kg pc par jour) | Niveau d’effet critique (mg/kg pc par jour) | ME |
|---|---|---|---|---|
| Hydratant pour le corps (adultes) | DRC | 0,0788 | DSENO systémique = 250 | 3170 |
| Hydratant pour le corps (nourrissons) | DRC | 0,355 | DSENO systémique = 250 | 704 |
| Conditionneur capillaire permament (adultes) | DRC | 0,0113 – 0,023 | DSENO systémique = 250 | 22100 – 10900 |
| Écran solaire (adultes) | DPSNSO | 0,048 | DSENO systémique = 250 | 5210 |
| Écran solaire (tout-petits) | DPSNSO | 0,054 | DSENO systémique = 250 | 4630 |
Abréviations : ME = marge d’exposition; DMEO = dose minimale avec effet observé; DRC = déclarations faites en vertu de Règlement sur les cosmétiques; DPSNSO = Direction des produits de santé naturels et sans ordonnance.
Bien qu’une utilisation concurrente ou séquentielle de produits contenant de la chlorhexidine et ses sels puisse avoir lieu, l’exposition simultanée à un certain nombre de produits contenant ces substances ne devrait pas être inquiétante étant donné la nature prudente du scénario d’exposition et la très faible absorption dermique (moins de 1 à 4 %) observée régulièrement pour ces substances (Chow et al. 1978; Case 1980; EMEA 1996; Lafforgue et al. 1997; Karpanen et al. 2008; NICNAS 2014).
L’exposition de la population générale du Canada à la chlorhexidine et ses sels par voie dermique peut aussi être due à une utilisation ponctuelle de cosmétiques. Des scénarios d’exposition ayant trait à l’utilisation de colorants capillaires permanents ou de lubrifiants pour les parties génitales ont conduit à l’exposition la plus importante à la chlorhexidine. Nous présentons dans le tableau 7‑4 des estimations des risques associés à une utilisation ponctuelle de colorant capillaire permanent ou de crème pour les parties génitales.
La comparaison des estimations de l’exposition dermique à la chlorhexidine et ses sels due à des colorants capillaires permanents et des lubrifiants pour parties génitales avec le niveau d’effet critique (DSENO systémique sub-chronique de 250 mg/kg pc par jour) conduit à des ME respectivement égales ou supérieures à 2050 et supérieures à 1600. Ces ME sont considérées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
| Scénario d’exposition | Exposition par application (mg/kg pc) | Niveau d’effet critique (mg/kg pc par jour) | ME |
|---|---|---|---|
| Colorant capillaire (permanent) (adultes) | 0,122 | DSENO systémique = 250 | 2050 |
| Lubrifiant pour parties génitales (adultes) | 0,158 | DSENO systémique = 250 | 1600 |
Abréviations : ME = marge d’exposition; DSENO = dose sans effet nocif observé
L’exposition à la chlorhexidine et ses sels peut aussi avoir lieu par voie orale lors de l’utilisation d’un certain nombre de cosmétiques (p.ex. rouge à lèvres ou baume pour les lèvres) et de produits de santé naturels (p. ex. bain de bouche). Ces types de produits ne concernent chacun que très peu de produits (BDPSNH [modifiée en 2019]; communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, juin 2016, non référencé; communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, juin 2016, non référencé). Étant donné le nombre limité de produits disponibles pour la population générale et la petite part de marché de ces produits, l’exposition de la population générale du Canada à la chlorhexidine et ses sels par voie orale est donc limitée.
Les estimations de l’exposition par voie orale sont de 1,91 x 10-4 mg/kg pc par jour pour les rouges à lèvres (adultes) et de 2,14 x 10-4 mg/kg pc par jour pour les baumes pour les lèvres (tout-petits). L’exposition aux bains de bouche chez les adultes et les enfants a conduit à l’exposition la plus importante par voie orale, les estimations sont respectivement de 0,0270 et de 0,0310 mg/kg pc par jour pour les adultes et les enfants.
Plusieurs études humaines sur les bains de bouche contenant du digluconate de chlorhexidine ont été décrites dans la Cosmetic Ingredient Review, dont une étude de 6 mois avec des enfants en âge scolaire (10 à 12 ans) et des études à long terme (1 à 2 ans) avec des adultes exposés à une solution jusqu’à 1 % (Willis 1993). Les auteurs n’ont noté que des effets réversibles, comme une perception du goût modifiée, une irritation mineure, une desquamation superficielle de l’épithélium de la muqueuse orale ou des taches sur les dents. Les auteurs n’ont aussi noté aucune réaction allergique et, suite à l’exposition à long terme, aucun effet sur les paramètres sanguins ou la muqueuse orale lié au traitement.
Étant donné qu’aucun niveau d’effet critique n’a été déterminé lors des études sur les bains de bouche réalisées avec des humains, le risque pour la santé humaine de la population générale dû à des expositions par voie orale à des rouges à lèvres, des baumes pour les lèvres ou des bains de bouche devrait être faible aux niveaux actuels d’exposition.
7.4 Incertitudes de l’évaluation des risques pour la santé humaine
Il existe une incertitude quant à l’estimation de l’exposition, due au manque de concentrations mesurées représentatives de l’entité chlorhexidine dans les eaux de surface ou l’eau potable au Canada et à l’utilisation d’un modèle pour estimer les risques pour la santé humaine. Toutefois, nous sommes très confiants dans le fait que les expositions réelles à la chlorhexidine dues à l’eau potable au Canada devraient être inférieures aux expositions estimées au moyen de ce modèle. L’incertitude des estimations des risques pour les humains pourrait être réduite de manière significative en utilisant des données sur des concentrations mesurées dans des milieux de l’environnement.
La confiance dans l’évaluation des effets sur la santé de la chlorhexidine et de ses sels est considérée modérée à élevée. Les modes d’action de la chlorhexidine et de ses sels induisant les effets sur la santé observés chez des animaux n’ont pas été pleinement élucidés. Des données empiriques ont été identifiées pour les paramètres toxicologiques pertinents. De nombreuses études sur la toxicité identifiées sont basées sur des rapports non publiés décrits dans des sources secondaires, dont celles de l’ECHA (c2007-2015b), de Willis (1993) et de l’EMEA (1996). D’après l’ECHA (c2007-2015b), ces études, y compris celles sur la toxicité chronique, ont cependant été réalisées en suivant des lignes directrices similaires ou équivalentes à celles de l’OCDE et en suivant de bonnes pratiques de laboratoire. De plus, étant donné l’usage clinique de la chlorhexidine comme antiseptique et désinfectant pendant plus de 50 ans, des données empiriques pour les humains sont disponibles pour les adultes, les enfants et les nourrissons (EMEA 1996, Willis 1993).
Il existe une incertitude sur la caractérisation des risques associée à la durée de l’étude retenue pour caractériser ces risques suite à une utilisation quotidienne de cosmétiques ou de produits de santé naturels. Étant donné qu’aucune étude sur la toxicité chronique par voie dermique n’a pu être identifiée, une étude sur la toxicité sub-chronique par voie dermique a été utilisée pour calculer les ME pour les expositions chroniques par voie dermique.
Il est reconnu que la chlorhexidine et ses sels peuvent conduire à une sensibilisation chez certains individus et, dans certains cas, ils ont causé de sérieuses réactions allergiques, comme cela a été rapporté lors de tests épicutanés ou par piqûre avec ces substances et documenté dans un Résumé de l’examen de l’inocuité de Santé Canada (voir la section sur l’évaluation des effets sur la santé).
8. Conclusion
Compte tenu de tous les éléments de preuve avancés dans la présente évaluation préalable, il existe un risque d’effet nocif pour l’environnement posé par la chlorhexidine et ses sels. Nous concluons que la chlorhexidine et ses sels satisfont aux critères du paragraphe 64(a) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique. Toutefois, nous concluons aussi que la chlorhexidine et ses sels ne satisfont pas aux critères du paragraphe 64(b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger pour l’environnement nécessaire à la vie.
En se basant sur les renseignements actuellement disponibles sur leur potentiel d’effet nocif pour la santé humaine, nous concluons que la chlorhexidine et ses sels ne satisfont pas aux critères du paragraphe 64(c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la santé ou la vie humaine.
Nous concluons donc que la chlorhexidine et ses sels satisfont à un ou plusieurs des critères de l’article 64 de la LCPE. Il a aussi été déterminé que l’entité chlorhexidine satisfait aux critères de persistance, mais pas à ceux de bioaccumulation, du Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
ACD/Percepta [module de prédiction]; c1997-2012; Toronto (ON) : Advanced Chemistry Development Inc. [disponible en anglais seulement]
Andersen B.L. et Brandrup F.; 1985; Contact dermatitis from chlorhexidine; Contact Dermatitis, 13, p. 307-309 [disponible en anglais seulement]..
Andrews J.J. et Paul J.W.; 1977; Chlorhexidine fogging: a safety study in dogs; Vet. Med .Small Anim. Clin., 72(8), p. 1330-1334 [disponible en anglais seulement].
Anusavice K.J., Zhang N.Z. et Shen C.; 2006; Controlled release of chlorhexidine from UDMW-TEGDMA resin; J. Dental Res., 85(10), p. 950-954 [disponible en anglais seulement].
[AOPWIN] Atmospheric Oxidation Program for Microsoft Windows [modèle d’estimation]; 2010; ver. 1.92a; Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation [disponible en anglais seulement].
ASTreat Model [modèle sur l’élimination par les usines de traitement des eaux usées]; c1997; ver. 1.0; Cincinnati (OH): Procter & Gamble Company [disponible en anglais seulement].
Attwood D. et Natarajan R.; 1979; Micellar properties and surface activity of some bolaform drugs in aqueous solution; J. Pharm. Pharmacol., 32, p. 460-462 [disponible en anglais seulement].
[BASL4] Biosolid-Amended Soil: Level IV Model; 2011; ver. 2; Peterborough (ON) : Trent University, Canadian Centre for Environmental Modelling and Chemistry (CCEMC); préparé par le CCEMC pour Environnement Canada (contrat no : K8A43-10-0015) [disponible en anglais seulement].
[BDIPSN] Base de données d’ingrédients de produits de santé naturels; [modifiée le 22 février 2019]; Ottawa (ON) : gouvernement du Canada [consultée le 23 janvier 2018].
[BDPP] Base de données sur les produits pharmaceutiques; [modifiée le 17 juillet 2015]; Ottawa (ON) : Santé Canada [consultée en juin 2016].
[BDPSNH] Base de données des produits de santé naturels homologués; [modifiée le 6 février 2018]; Ottawa (ON) : gouvernement du Canada [consultée le 23 janvier 2018].
Bechgaard E., Ploug E. et Hjorth N.; 1985; Contact sensitivity to chlorhexidine?; Contact Dermatitis, 13, p. 53-55 [disponible en anglais seulement].
Bergovist-Karlsson A.; 1988; Delayed and immediate-type hypersensitivity to chlorhexidine; Contact Dermatitis, 18, p. 84-88 [disponible en anglais seulement].
[BERSE] Bureau d’évaluation des risques des substances existantes; 2017; DRAFT Recommended Default Values for Personal Care Product Exposure Scenarios: Module V, Sunscreens; Ottawa (ON) : Santé Canada, Bureau d’évaluation des risques des substances existantes; référence interne [disponible en anglais seulement].
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’estimation]; 2008; version 4.10; Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation [disponible en anglais seulement].
Block S.S.; 2001; Disinfection, Sterilization, and Preservation; 5ème édition, Philadelphia (PA): Lippincott Williams & Wilkins; p. 1481 [disponible en anglais seulement].
Boethling R.S., Howard P.H., Beauman J.A. et Larosche M.E.; 1995; Factors for intermedia extrapolations in biodegradability assessment; Chemosphere, 30(4), p. 741-752 [disponible en anglais seulement].
Boxall A.B.A., Fogg L.A., Baird D.J., Lewis C., Telfer T.C., Kolpin D., Gravell A., Pemberton E. et Boucard T.; 2005; Targeted monitoring study for veterinary medicines in the environment [PDF]; Environment Agency Science Report SC030183/SR, Bristol (UK): Environment Agency [disponible en anglais seulement].
Broeckx W., Blondeel A., Dooms-Goosseens A. et Achten G.; 1987; Cosmetic intolerance; Contact Dermatitis, 16, p. 189-194 [cité dans ECHA c2007-2015a] [disponible en anglais seulement].
Broxton P., Woodcock P.M., Heatley F. et Gilbert P.; 1984; Interaction of some polyhexamethylene biguanides and membrane phospholipids in Escherichia coli.; J. Appl. Bacteriol., 57, p. 115-124 [disponible en anglais seulement].
Calabrese E.J. et Kenyon E.M.; 1991; Air toxics and risk assessment; Chelsea (MI): Lewis Publishers Inc. [disponible en anglais seulement].
Campbell S., Grimes J. et Smith G.; 1991; Chlorhexidine diacetate: an acute oral toxicity study with the Northern Bobwhite; Lab. project number: 277-103; étude non publiée préparée par Wildlife International Ltd [cité dans EPA 1996] [disponible en anglais seulement].
Canada; 1978; Règlement sur les aliments et drogues, C.R.C., ch. 870.
Canada; 1999; Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33; Gazette du Canada, Partie III, vol. 22, no 3.
Canada; 2000; Loi canadienne sur la protection de l’environnement (1999) : Règlement sur la persistance et la bioaccumulation, P.C. 2000-348, 29 mars 2000, DORS/2000-107.
Canada, ministère de l’Environnement; 2006; Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances considérées comme priorités pour suivi; [PDF] Gazette du Canada, Partie I, vol. 140, no 9, p. 435-459;
Canada, ministère de l’Environnement; 2009; Loi canadienne sur la protection de l’environnement (1999) : Avis concernant les substances du groupe 12 du Défi [PDF]; Gazette du Canada, Partie I, vol. 143, no 52, p. 3813-3836.
Canada, ministère de l’Environnement; 2012; Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF]; Gazette du Canada, Partie I, vol. 146, no 48, supplément, p. 3-94.
Canada, ministère de l’Environnement; 2017; Loi canadienne sur la protection de l’environnement (1999) : Avis concernant les substances visées par la mise à jour de l’inventaire de 2017 [PDF]; Gazette du Canada, Partie I, vol. 151, no 2, p. 89-161.
Case D.E.; 1977; Safety of hibitane I. Laboratory experiments; J. Clin. Periodontol., 4(5), p. 66-72 [disponible en anglais seulement].
Case D.E.;1980; Chlorhexidine: attempts to detect percutaneous absorption in man; dans : Newsom S.W.B., Caldwell A.D.S. éditeurs; Problems in the control of hospital infection (London: Royal Society of Medicine International Congress and Symposium Series, No. 23.) London (UK): RSM/Academic Press, 1980, p. 39‑43 [cité dans Block 2001] [disponible en anglais seulement].
[Chemicalland21] Worldwide chemical information [base de données]; 2010 [consulté en août 2010] [disponible en anglais seulement].
Cheminfo Services Inc.; 2014; Chemical Management Plan 2 (CMP2) scoping project for substance information on chlorhexidine and chlorhexidine digluconate, rapport final, 28 novembre 2014, rapport non publié préparé pour Environnement Canada, Markham (ON) [disponible en anglais seulement].
ChemSpider [base de données]; 2011; London (UK): Royal Society of Chemistry [cité dans ECHA c2007-2015a] [disponible en anglais seulement].
Chow C.P., Buttar H.S. et Downie R.H.; 1978; Percutaneous absorption of chlorhexidine in rats; Toxicol. Lett.,1, p. 213-216 [disponible en anglais seulement].
Cifone M.; 1984; Mouse lymphoma forward mutation assay: chlorhexidine hydrochloride: LBI Project No. 20989 [disponible en anglais seulement].
Climo M.W., Yokoe D.S., Warren D.K., Perl T.M., Bolon M., Herwaldt L.A., Weinstein R.A., Sepkowitz K.A., Jernigan J.A., Sanogo K. et Wong E.S.; 2013; Effect of daily chlorhexidine bathing on hospital-acquired infection; N. Engl. J. Med., 368, p. 533-542 [disponible en anglais seulement].
[COLIPA] Association européenne des cosmétiques; 1984; Submission I to the EEC : Chlorhexidine and its digluconate, diacetate and dihydrochloride salts; COLIPA, p. 35; EEC: Annex VI, part 2. n. 31: 2 [cité dans Willis 1993] [disponible en anglais seulement].
[ConsExpo] Modèle d’exposition des consommateurs [Internet]; 2006; version 4.1; Bilthoven (P.-B.) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national pour la santé publique et l’environnement) [disponible en néerlandais et en anglais seulement].
Cowen J., Ellis S.H. et McAinsh; 1979; Absorption of chlorhexidine from the intact skin of newborn infants; Arch. Dis. Child., 54, p. 379-383 [disponible en anglais seulement].
Cutting W.C., Cutting J.W. et Tabar P.; 1964; Studies on the chloroguanide antifertility effect; Med. Exp., 10, p. 361-8 [cité dans Willis 1993] [disponible en anglais seulement].
De Waart J. et Van der Most M.M.; 1986; Biodegradation test for microbicides; Int. Biodeterior., 22, p. 113-120 [cité dans HSDB 1983–2016] [disponible en anglais seulement].
Dimitrov S.D., Dimitrova N.C., Walker J.D., Veith G.D. et Mekenyan O.G.; 2002; Predicting bioconcentration factors of highly hydrophobic chemicals. Effects of molecular size; Pure Appl. Chem., 74(10), p. 1823-1830 [disponible en anglais seulement].
Dimitrov S.D., Dimitrova N.C., Walker J.D., Veith G.D. et Mekenyan O.G.; 2003; Bioconcentration potential predictions based on molecular attributes – an early warning approach for chemicals found in humans, birds, fish and wildlife; QSAR Comb. Sci., 22, p. 58-68 [disponible en anglais seulement].
Droge S. et Goss K.; 2012; Effect of sodium and calcium cations on the ion-exchange affinity of organic cations for soil organic matter; Environ. Sci. Technol., 46, p. 5894-5901 [disponible en anglais seulement].
Droge S.T. et Goss K.; 2013; Development and evaluation of a new sorption model for organic cations in soil: contributions from organic matter and clay minerals; Environ. Sci. Technol., 47, p. 14233-14241 [disponible en anglais seulement].
Dynes J.J., Lawrence J.R., Korber D.R., Swerhone G.D.W., Leppard G.G. et Hitchcock A.P.; 2006; Quantitative mapping of chlorhexidine in natural river biofilms; Sci. Total Environ., 369, p. 369–363 [disponible en anglais seulement].
[ECCC] Environnement et Changement climatique Canada; 2018; Supporting documentation: Chlorhexidine and its salts; Renseignements pour l’évaluation préalable de la chlorhexidine et ses sels; Gatineau (QC) : Environnement et Changement climatique Canada, Division de l’évaluation environnementale; disponible à l’adresse suivante : substances@ec.gc.ca.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada; [modifié le 12 mars 2017]; Catégorisation des substances chimiques; Ottawa (ON) : gouvernement du Canada [consulté le 19 décembre 2017].
[ECHA] Agence européenne des produits chimiques; c2007-2015a; Registered substances database; Search results for CAS RN [55-56-1]; Helsinki (FI) : ECHA [mis à jour le 10 juillet 20130; consulté le 14 janvier 2016] [disponible en anglais seulement].
[ECHA] Agence européenne des produits chimiques; c2007-2015b; Registered substances database; Search results for CAS RN [18472-51-0]; Helsinki (FI) : ECHA [mis à jour le 10 juillet 2013; consulté le 14 janvier 2016] [disponible en anglais seulement].
[ECHA] Agence européenne des produits chimiques; 2010; Guidance on information requirements and chemical safety assessment [PDF]; Chapter R.16: Environmental exposure estimation, version 2; Helsinki (FI) : ECHA [disponible en anglais seulement].
[EMEA] Agence européenne pour l’évaluation des produits médicinaux; 1996; Comité pour les produits médicinaux vétérinaires [PDF]; Chlorhexidine Summary Report [disponible en anglais seulement].
Environnement Canada; 2007; Data for selected substances collected under the Canadian Environmental Protection Act, 1999, section 71: Notice with respect to selected substances identified as priority for action; Données préparées par le Programme des substances existantes d’Environnement Canada et de Santé Canada [disponible en anglais seulement].
Environnement Canada; 2010; Data for the Batch 12 substance, CAS RN 56-95-1, collected under the Canadian Environmental Protection Act, 1999, section 71: Notice with respect to Batch 12 Challenge substances; Données préparées par le Programme des substances existantes d’Environnement Canada et de Santé Canada [disponible en anglais seulement].
Environnement Canada; 2015; DSL Inventory Update data collected for CAS RN 55-56-1 and CAS RN 18472-51-0 under the Canadian Environmental Protection Act, 1999, section 71: Notice with respect to certain substances on the Domestic Substances List; Données préparées par le Programme des substances existantes d’Environnement Canada et de Santé Canada [disponible en anglais seulement].
Environnement Canada; 2018; DSL Inventory Update data collected for CAS RN 3697-42-5 under the Canadian Environmental Protection Act, 1999, section 71: Notice with respect to substances included as part of the 2017 Inventory Update. Données préparées par le Programme des substances existantes d’Environnement Canada et de Santé Canada [disponible en anglais seulement].
Environnement Canada, Santé Canada. 2013. Draft screening assessment for the Challenge: Chlorhexidine acetate: Chemical Abstracts Service Registry Number 56-95-1; Ottawa (ON) : Environnement Canada, Santé Canada [consulté en juillet 2015].
[EPA] Environmental Protection Agency des États-Unis; 1996; Reregistration eligibility decision. Chlorhexidine diacetate; Washington (DC): US EPA, EPA738-R-96-025 [disponible en anglais seulement].
[EPA] Environmental Protection Agency des États-Unis; 1997; Exposure factors handbook; Washington (DC): US EPA, National Center for Environmental Assessment, Office of Research and Development [disponible en anglais seulement].
[EPA] Environmental Protection Agency des États-Unis; 2003; Exposure and human health reassessment of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) and related compounds. Part I: Estimating exposure to dioxin-like compounds; Volume 3: Site-specific assessment procedures, Chapter 4: Estimating exposure media concentrations; EPA/600/P-00/001Cb; Washington (DC): US EPA, National Center for Environmental Assessment [disponible en anglais seulement].
[EPA] Environmental Protection Agency des États-Unis; 2011a; Chlorhexidine derivatives summary document: Registration review – Initial docket March 2011 (Case #3038); Washington (DC): US EPA, Chemical Safety and Pollution Prevention [consulté en juin 2011] [disponible en anglais seulement].
[EPA] Environmental Protection Agency des États-Unis; 2011b; Memorandum – Summary of product chemistry, environmental fate, and ecotoxicity data for the chlorhexidine derivatives registration review decision document; Washington (DC): US EPA, Chemical Safety and Pollution Prevention [disponible en anglais seulement].
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [estimation model]; c2000-2010; ver. 4.10; Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation [disponible en anglais seulement].
Evans R.J.; 1992; Acute anaphylaxis due to topical chlorhexidine acetate; Brit. Med. J., 304(6828), p. 686 [disponible en anglais seulement].
Farrow M.; 1983; In-vitro chromosome aberrations in Chinese hamster ovary cells assay: chlorhexidine hydrochloride: Hazleton Project No. 2191-101; étude non publiée, préparée par Hazleton Laboratories America [cité dans EPA 1996] [disponible en anglais seulement].
[FDA] Food and Drug Administration des États-Unis; 2013; Peridex-chlorhexidine gluconate mouthwash [PDF], 3M, Reference ID: 3246401 [consulté en mars 2015] [disponible en anglais seulement].
Ficheux A.S., Wesolek N., Chevillotte G. et Roudot A.C.; 2015; Consumption of cosmetic products by the French population. First part: Frequency data; Food Chem. Toxicol., 78, p. 159-169 [disponible en anglais seulement].
Ficheux A.S., Chevillotte G., Wesolek N., Morisset T., Dornic N., Bernard A., Bertho A., Romanet A., Leroy L., Mercat A.C., Creusot T., Simon E. et Roudot A.C.; 2016; Consumption of cosmetic products by the French population second part: Amount data; Food Chem. Toxicol., 90, p. 130-141 [disponible en anglais seulement].
Fraud S., Hann A.C., Maillard J.Y. et Russell A.D.; 2003; Effects of ortho-phthalaldehyde, glutaraldehyde and chlorhexidine diacetate on Mycobacterium chelonae and Mycobacterium abscessus strains with modified permeability; J. Antimicrob. Chemoth., 51, p. 575-584 [disponible en anglais seulement].
Freitag D., Geyer H., Kraus A., Viswanathan R., Kotzias D., Attar A., Klein W. et Korte F.; 1982; Ecotoxicological profile analysis: VII. Screening chemicals for their environmental behavior by comparative evaluation; Ecotoxicol. Environ. Saf., 6(1), p. 60-81 [cité dans HSDB 1983–] [disponible en anglais seulement].
Freitag D., Ballhorn L., Geyer H. et Korte F.; 1985; Environmental hazard profile of organic chemicals. An experimental method for the assessment of the behaviour of organic chemicals in the ecosphere by means of simple laboratory tests with carbon-14-labeled chemicals; Chemosphere, 14, p. 1589-1616.
Garvey L.H., Roed-Petersen J. et Husum B.; 2003; Is there a risk of sensitization an allergy to chlorhexidine in health care workers?; Acta Anaesthesiol. Scand., 47, p. 720-724 [disponible en anglais seulement].
Gilbert P. et Moore L.E.; 2005; Cationic antiseptics: diversity of action under a common epithet; J. Appl. Microbiol., 99, p. 703-715 [disponible en anglais seulement].
Gilman M.R. et De Salva S.J.; 1979; Teratology studies on benzelthonium chloride, cetyl pyridinium chloride and chlorhexidine in rats; Toxicol. Appl. Pharmacol., 48, p. A35 [cité dans Willis 1993] [disponible en anglais seulement].
Gobas F.; 2007; Development and review of a generic water–sediment modelling framework for organic chemicals; rapport préparé pour Environnement Canada; Burnaby (C.-B.) : Université Simon Fraser, Faculté d’environnement, 26 mars 2007 [disponible en anglais seulement].
Gobas F.; 2010; Comments on approach to sediment exposure approach; rapport préparé pour Environnement Canada; Burnaby (C.-B.) : Université Simon Fraser, Faculté d’environnement, 25 mars 2010 [disponible en anglais seulement].
Gongwer L.E., Hubben K., Lenkiewicz R.S., Hart E.R. et Cockrell B.Y.; 1980; The effects of daily bathing of neonatal rhesus monkeys with an antimicrobial skin cleanser containing chlorhexidine gluconate; Toxicol. Appl. Pharmacol., 52, p. 255-261 [disponible en anglais seulement].
Grassi T.F., Camargo E.A., Salvadori D.M., Marques M.E. et Ribeiro D.A.; 2007; DNA damage in multiple organs after exposure to chlorhexidine in Wistar rats; Int. J. Hyg. Environ. Health, 210(2), p. 163-7 [disponible en anglais seulement].
Greener Y., McCartney M., Jordan L., Schmitt D. et Youkilis E.J.; 1985; Assessment of the systemic effects primary dermal irritation and ocular irritation of chlorhexidine acetate solutions; J. Am. Coll. Toxicol., 4(6), p. 309-320 [disponible en anglais seulement].
Hansch C., Leo A. et Hoekman D.; 1995; Exploring QSAR - Hydrophobic, Electronic, and Steric Constants; Washington (DC): American Chemical Society, p. 178 [cité dans HSDB 1983–] [disponible en anglais seulement].
Heard D.D. et Ashworth R.W.; 1968; The colloidal properties of chlorhexidine and its interaction with some macromolecules; J. Pharm. Pharmacol., 20(7), p. 505-512 [disponible en anglais seulement].
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d’estimation]; 2008; version 3.20; Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation [disponible en anglais seulement].
Henwood S.; 1988; 13-week dermal toxicity study with chlorhexidine acetate in rabbits: final report: Laboratory Project ID HLA 6247-102; étude non publiée préparée par Hazleton Laboratories America Inc. [citée dans EPA 1996 et ECHA c2007-2015b] [disponible en anglais seulement].
Hikiba H., Watanabe E., Barrett J.C. et Tsutsui T.; 2005; Ability of fourteen chemical agents used in dental practice to induce chromosome aberrations in Syrian hamster embryo cells; J. Pharmacol. Sci., 97, p. 146-152 [disponible en anglais seulement].
[HSDB] Hazardous Substances Data Bank [base de données]; 1983–; Bethesda (MD): US National Library of Medicine [mise à jour le 18 février 2015; consultée en juillet 2015];
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d’estimation]; 2010; version 2.00; Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation [disponible en anglais seulement].
[ICI] ICI Pharmaceuticals Group; 1992; soumission de données non publiées sur la carcinogénicité de la chlorhexidine [cité dans Willis 1993] [disponible en anglais seulement].
[IPCS] Programme international sur la sécurité des produits chimiques; 2003; Concise International Chemical Assessment Document 48: 4-chloroaniline; (Suisse) : Programme des Nations Unies pour l’environnement; Organisation internationale du travail; Organisation mondiale de la santé [consulté en juin 2015]; sur la couverture : First draft prepared by Drs Boehncke A, Kielhorn J, Könnecker G, Pohlenz-Michel C, and Mangelsdorf I, Fraunhofer Institute of Toxicology and Aerosol Research, Drug Research and Clinical Inhalation, Hanover, Germany [disponible en anglais seulement].
Jesus F.T., Oliveira R., Silva A., Catarino A.L., Soares A.M., Nogueira A.J. et Domingues I.; 2013; Lethal and sub lethal effects of the biocide chlorhexidine on aquatic organisms; Ecotoxicology, 22, p. 1348-1358 [disponible en anglais seulement].
Kah M. et Brown C.D.; 2006; Adsorption of ionisable pesticides in soils; Rev. Environ. Contam. T., 188, p. 149-217 [disponible en anglais seulement].
Karpanen T.J., Worthington T., Conway B.R., Hilton A.C., Elliott T.S.J. et Lambert P.A.; 2008; Penetration of chlorhexidine into human skin; Antimicrob. Agents Ch., 52(10), p. 3633-3636 [disponible en anglais seulement].
Kido Y., Kodama H., Uraki F., Uyeda M., Tsuruoka M. et Shibata M.; 1988; Microbial degradation of disinfectants. I. Chlorhexidine-degrading bacteria isolated from activated sludge; Eisei Kagaku, 34(1), p. 10-14 [disponible en anglais seulement].
[KOCWIN] Organic Carbon Partition Coefficient Program for Microsoft Windows [modèle d’estimation]; 2010; version 2.00; Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation [disponible en anglais seulement].
Kodama H., Hashimoto T., Tsuruoka M., Kido Y., Uyeda M. et Shibata M.; 1988; Microbial degradation of disinfectants. IV. Treatment by activated sludge of chlorhexidine; Eisei Kagaku, 34(5), p. 408-413 [cité dans SWECO Environment 2011] [disponible en anglais seulement].
Lafforgue C., Carret L., Falson F. et Reverdy M.E.; 1997; Freney J. percutaneous absorption of a chlorhexidine digluconate solution; Int. J. Pharm., 147, p. 243-246 [disponible en anglais seulement].
Lamb I.; 1991; A developmental toxicity study of chlorhexidine diacetate in rats: final report: Lab Project Number: WIL-173001; étude non publiée préparée par WIL Research Labs [cité dans EPA 1996] [disponible en anglais seulement].
Lawrence J.R., Zhu B., Swerhone G.D.W., Topp E., Roy J., Wassenaar L.I., Rema T. et Korber D.R.; 2008; Community-level assessment of the effects of the broad-spectrum antimicrobial chlorhexidine on the outcome of river microbial biofilm development; Appl. Environ. Microbiol., 74(11), p. 3541–3550 [disponible en anglais seulement].
Leow Y.-H. et Goh C.-L.; 1999; Contact allergy in Singapore; Asian Pac. J. Allergy Immunol., 17(3), p. 207-217 [disponible en anglais seulement].
Li Y.C., Kuan Y.H., Huang F.M. et Chang Y.C.; 2012; The role of DNA damage and caspase activation in cytotoxicity and genotoxicity of macrophages induced by bisphenol‐A‐glycidyldimethacrylate; Int. Endod. J., 45(6), p. 499-507 [disponible en anglais seulement].
Liippo J., Kousa P. et Lammintausta K.; 2011; The relevance of chlorhexidine contact allergy; Contact Dermatitis, 64, p. 229-234 [disponible en anglais seulement].
Long R., Hoxter K. et Smith G.; 1991a; Chlorhexidine diacetate: a dietary LC50 study with the Northern Bobwhite: Lab Project Number: 277-101; étude non publiée préparée par Wildlife International Ltd [cité dans EPA 1996] [disponible en anglais seulement].
Long D., Hoxter K. et Smith G.; 1991b; Chlorhexidine diacetate: a dietary LC50 study with the Mallard: lab project number: 277-102; étude non publiée préparée par Wildlife International Ltd [cité dans EPA 1996] [disponible en anglais seulement].
Loretz L.G., Api A.M., Barraj L.M., Burdick J., Dressler W.E., Gettings S.D., Han Hsu H., Pan Y.H.L., Re T.A., Renskers K.J., Rothenstein A., Scrafford C.G. et Sewall C.; 2005; Exposure data for cosmetic products: lipstick, body lotion, and face cream; Food Chem. Toxicol., 43, p. 279–291 [disponible en anglais seulement].
[MAAARO] Ministère de l’agriculture, de l’alimentation et des affaires rurales de l’Ontario; 2009; Biosécurité strategies d’hygiène et de protection de la santé des bovins et directives visant d’autres animaux; Ministère de l’agriculture, de l’alimentation et des affaires rurales de l’Ontario [consulté le 9 août 2010].
Magnusson B. et Heyden G.; 1973; Autoradiographic studies of 14C-chlorhexidine given orally in mice; J. Periodont. Res., 8(12), p. 49-54 [disponible en anglais seulement].
Masson P.; 2002; Exposure to cosmetic products: General consideration—Calculation of exposure according to the SCCNFP Notes of Guidance; Bordeaux (FR) : EVIC France [disponible en anglais seulement].
Matsushima H. et Sakurai N.; 1984; A selected ion monitoring assay for chlorhexidine in medical waste water; Biomed. Mass Spectrom., 11(5), p. 203-206 [disponible en anglais seulement].
McEvoy G.K., éditeur; 2010; Chlorhexidine gluconate (EENT); American Hospital Formulary Service - Drug Information (2010); Bethesda (MD): American Society of Health-System Pharmacists [disponible en anglais seulement].
Miller E.; 1993a; Acute oral toxicity evaluation of chlorhexidine diacetate technical in rats: Lab Project Number: 9096-92: P952-1: KVR-P952-1; étude non publiée préparée par Stillmeadow Inc. [cité dans EPA 1996] [disponible en anglais seulement].
Miller E.; 1993b; Acute dermal toxicity evaluation of chlorhexidine diacetate technical in rabbits: Lab Project Number: 9097-92: KVR-P952-2; étude non publiée préparée par Stillmeadow Inc. [cité dans EPA 1996].
Miyachi T. et Tsutsui T.; 2005; Ability of 13 chemical agents used in dental practice to induce sister chromatid exchanges in Syrian hamster embryo cells; Odontology, 93, p. 24-29 [disponible en anglais seulement].
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [estimation model]; 2008; version 1.43; Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation [disponible en anglais seulement].
Murphy D. et Smith G.; 1991a; Chlorhexidine diacetate: a 48-hour static acute toxicity test with the cladoceran (Daphnia magna): Lab Project Number: 227A-103; étude non publiée préparée par Wildlife International Ltd [cité dans EPA 1996] [disponible en anglais seulement].
Murphy D. et Smith G.; 1991b; Chlorhexidine diacetate: a 96-hour static acute toxicity test with the bluegill (Lepomis macrochirus): Lab Project Number: 277A-102; étude non publiée préparée par Wildlife International Ltd; [cité dans EPA 1996] [disponible en anglais seulement].
Murphy D. et Smith G.; 1991c; Chlorhexidine diacetate: a 96-hour static acute toxicity test with the rainbow trout (Oncorhynchus mykiss): Lab Project Number: 277A-101; étude non publiée préparée par Wildlife International Ltd; [cité dans EPA 1996] [disponible en anglais seulement].
Myhr B.; 1983; Primary rat hepatocyte unscheduled DNA synthesis assay: chlorhexidine hydrochloride: LBI Project No. 20991; étude non publiée préparée par Litton Bionetics Inc. [cité dans EPA 1996] [disponible en anglais seulement].
Nagendran V., Wicking J., Ekbote A., Onyekwe T. et Garvey L.H.; 2009; IgE-mediated chlorhexidine allergy: a new occupational hazard?; Occup. Med-C., 59, p. 270-272 [disponible en anglais seulement].
[NCI] National Chemical Inventories [database on CD-ROM] [base de données sur CD-ROM]; 2015; Issue 1; Columbus (OH): American Chemical Society [consultée en août 2015] [disponible en anglais seulement].
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme; 2014; Inventory multi‑tiered assessment and prioritization. Human health tier II assessment for chlorhexidine [disponible en anglais seulement].
[OCDE] Organisation de coopération et de développement économiques; 2009; The 2007 OECD list of high production volume chemicals [PDF]; Paris (FR) : OCDE, Direction de l’environnement (Series on Testing and Assessment No. 112), rapport ENV/JM/MONO(2009)40, JT03272769 [consulté en juin 2015] [disponible en anglais seulement].
OCDE QSAR Toolbox [outil pour données croisées]; 2015; version 3.3.2; Paris (FR) : Organisation de coopération et de développement économiques, Laboratoire de chimie mathématique [disponible en anglais seulement].
O’Driscoll N.H., Labovitiadi O., Cushnie T.T., Matthews K.H. et Lamb A.J.; 2014; Potassium loss from chlorhexidine-treated bacterial pathogens is time-and concentration-dependent and variable between species; Curr. Microbiol., 68(1), p. 6-11 [disponible en anglais seulement].
Ogase H., Nagal I., Kameda K., Kume S. et Ono S.; 1992; Identification and quantitative analysis of degradation products of chlorhexidine with chlorhexidine-resistant bacteria with three-dimensional high performance liquid chromatography; J. Appl. Bacteriol., 73, p. 71-78 [disponible en anglais seulement].
Okano M., Nomura M., Hata S., Okada N., Sato K., Kitano Y. et Tashiro M.; 1989; Anaphylactic symptoms due to chlorhexidine glugconate; Arch. Dermatol., 125, p. 50-52 [disponible en anglais seulement].
O’Neil M.J., éditeur; 2001; The Merck Index – An encyclopedia of chemicals, drugs, and biological, 13th edition, Whitehouse Station (NJ): Merck and Co. Inc.; p. 361 [disponible en anglais seulement].
O'Neil M.J., éditeur; 2013; The Merck Index - An encyclopedia of chemicals, drugs, and biologicals; Cambridge, UK: Royal Society of Chemistry, p. 371 [cité dans HSDB 1983–2016] [disponible en anglais seulement].
O’Neill J., Hosmer M., Challop R., Driscoll J., Speck W. et Sprunt K.; 1982; Percutaneous absorption potential of chlorhexidine in neonates; Curr. Ther. Res. Clin. E, 31, p. 485-489 [disponible en anglais seulement].
OPP Pesticide Ecotoxicity Database [base de données]; 1991; Washington (DC): US Environmental Protection Agency, Office of Pesticide Programs, Ecological Fate and Effects Division [consultée en juin 2015] [disponible en anglais seulement].
Opstrup M.S., Johansen J.D., Zachariae C. et Garvey L.H.; 2016; Contact allergy to chlorhexidine in a tertiary dermatology clinic in Denmark; Contact Dermatitis, 74(1), p. 29-36 [disponible en anglais seulement].
Oraldent Pharma; 2015; Oraldent Pharma products [consulté le 1er décembre 2015] [disponible en anglais seulement].
Osmundsen P.E.; 1982; Contact dermatitis to chlorhexidine; Contact Dermatitis, 8(2), p. 81-83 [disponible en anglais seulement].
Recherche dans les étiquettes de pesticides [base de données modifiée le 4 octobre 2016]; Ottawa (ON) : Santé Canada [consultée le 19 décembre 2017].
Princz J., Bonnell M., Ritchie E., Velicogna J., Robidoux P. et Scroggins R.; 2014; Estimation of the bioaccumulation potential of a non-chlorinated bisphenol and an ionogenic xanthene dye to Eisenia Andrei in field-collected soils, in conjunction with predictive in silico profiling; Environ. Toxicol. Chem., 33(2), p. 308-316 [disponible en anglais seulement].
Revelle L.K., Doub W.H., Wilson R.T., Harris M.H. et Rutter A.M.; 1993; Identification and isolation of chlorhexidine digluconate impurities; Pharm. Res.,10(12), p. 1777-1784 [disponible en anglais seulement].
Reynolds N.J. et Harman R.R.; 1990; Allergic contact dermatitis chlorhexidine diacetate in a skin swab; Contact Dermatitis, 22(2), p. 103-4 [disponible en anglais seulement].
Ribeiro D.A., Bazo A.P., da Silva Franchi C.A., Marques M.E.A. et Salvadori D.M.F.; 2004; Chlorhexidine induces DNA damage in rat peripheral leukocytes and oral mucosal cells; J. Periodont. Res., 39, p. 358‑361 [disponible en anglais seulement].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu; 2006a; Cleaning products fact sheet: To assess the risks for the consumer [PDF], [consulté en juillet 2010]; Bilthoven (P.-B.) : RIVM (Institut national pour la santé publique et l’environnement), RIVM Report 320104003/2006 [disponible en anglais seulement].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement (P.-B.)]; 2006b; Cosmetics fact sheet: To assess the risks for the consumer. Updated version for ConsExpo 4 [PDF]; Bilthoven (P.-B.) : RIVM (Institut national pour la santé publique et l’environnement), Report No.: 320104001/2006 [disponible en anglais seulement].
Roberts D.L., Summerly R. et Byrne J.P.H.; 1981; Contact dermatitis due to the constituents of Hibiscrub; Contact Dermatitis, 7, p. 326-328 [disponible en anglais seulement].
Sakagami Y. et Yokoyama H.; 1983; Degradation of some disinfectants by activated sludge; Eisei Kagaku, 29(6), p. 342-351 [disponible en anglais seulement].
Sakagami Y., Yokoyama H., Ose Y. et Sato T.; 1986; Screening test for carcinogenicity of chlorhexidine digluconate and its metabolites; J. Hyg. Chem., 32(3), p. 171-5 [disponible en anglais seulement].
Sakagami Y., Yamasaki K., Yokoyama H., Ose Y. et Sato T.; 1988; DNA repair test of disinfectants by liquid rec-assay; Mutat. Res-DNA Repair, 193(1), p. 21-30 [disponible en anglais seulement].
Sakuratani Y., Noguchi Y., Kobayashi K., Yamada J. et Nishihara T.; 2008; Molecular size as a limiting characteristic for bioconcentration in fish; J. Environ. Biol., 29(1), p. 89-92 [disponible en anglais seulement].
Santé Canada; 1998; Exposure factors for assessing total daily intake of priority substances by the general population of Canada; rapport non publié; Ottawa (ON) : gouvernement du Canada [disponible en anglais seulement].
Santé Canada; 2010; Liste des produits de formulation de l’ARLA [PDF]; Ottawa (ON) : Santé Canada, Agence de réglementation de la lutte antiparasitaire (ARLA); SC pub. No 100460, no du catalogue : H114-22/2010F [consulté le 9 juin 2016].
Santé Canada; [modifié le 27 juin 2013]; Listes des additifs alimentaires autorisés; Ottawa (ON) : gouvernement du Canada [consultée le 15 juin 2016].
Santé Canada; 2015; Signal assessment: chemical skin injuries (including burns) in neonates with the use of non-prescription, chlorhexidine gluconate-containing skin antiseptics; rapport non publié; Ottawa (ON) : gouvernement du Canada [accès restreint] [disponible en anglais seulement].
Santé Canada; [modifié le 14 décembre 2015]; Liste critique des ingredients des cosmétiques : ingrédietns interdits et d’usage restreint; Ottawa (ON) : gouvernement du Canada [consulté le 21 décembre 2017].
Santé Canada; 2016; Résumé de l’examen de l’Inocuité – Produits antiseptiques topiques à base de chlorhexidine en vente libre – Évaluation du risqué potential de reactions allergiques graves (reactions d’hypersensibilité); Ottawa (ON) : gouvernement du Canada [consulté le 17 mai 2017].
SCCS [Scientific Committee on Consumer Safety]; 2015; The SCCS’s Notes of Guidance for the Testing of Cosmetic Ingredients and their Safety Evaluation [PDF], 9ème révision; Commission européenne, rapport numéro SCCS/1564/15, version révisée du 25 avril 2016 [disponible en anglais seulement].
[SDS] Safety Data Sheet. 2015. Encon Hydrosep Potable Water Additive [PDF]. Houston (TX): Encon Safety Products [consulté le 11 mars 2019] [disponible en anglais seulement].
Senior N.; 1973; Some observations on the formulation and properties of chlorhexidine; J. Soc. Cosmet. Chem., 24, p. 259-278 [disponible en anglais seulement].
Shapiro R.; 1993; EPA acute inhalation toxicity--defined LC50: chlorohexidine-diacetate: Lab Project Number: T-1813; étude non publiée préparée par Product Safety Labs [cité dans EPA 1996] [disponible en anglais seulement].
Sigma Aldrich; 2003; Product information sheet: Chlorhexidine diacetate salt hydrate – C6143 [consulté en juin 2015] [disponible en anglais seulement].
Sigma Aldrich; 2015; C6143 - Chlorhexidine diacetate salt hydrate [consulté en juin 2015] [disponible en anglais seulement].
Soumission d’étude; 2010; étude confidentielle non publiée, soumise à Environnement Canada dans le cadre de l’Initiative du Défi du Plan de gestion des produits chimiques; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Statistique Canada; 2012; Custom tabulation of grooming products data from the Canadian Health Measures Survey Cycle 1 (2007-2009); préparé pour le Bureau d’évaluation des risques des substances existantes de Santé Canada; non publié [disponible en anglais seulement].
[STP-EX] Sewage Treatment Plant Expanded Model; c2000-2013; ver. 1.0; Windsor (ON) : University of Windsor, Dept. of Civil and Environmental Engineering [modèle décrit dans Seth R., Webster E. et Mackay D., 2008, Continued development of a mass balance model of chemical fate in a sewage treatment plant, Water Res., 42, p. 595-604] [disponible en anglais seulement].
Suessmuth R., Ackermann B. et Lingens F.; 1979; Mutagenic effect of 1.1′-hexamethylene-bis-[(5-p-chlorophenyl)-biguanide]; Chem.-Biol. Interact., 28(2), p. 249-58 [disponible en anglais seulement].
Sugio N. et Kojima S.; 1992; Biological treatment of chlorhexidine digluconate-containing waste water. II. Chlorhexidine digluconate-acclimated bacteria; Jpn J. Tox. Env. Health., 38(4), p. 329-333 [disponible en anglais seulement].
SWECO Environment; 2011; SWECO Environment Screening Report. Chlorhexidine and p-chloroaniline; rapport mandaté par l’Agence de protection de l’environnement de la Suède; Stockholm (Suède) : SWECO, numéro de projet : 1270481000 [disponible en anglais seulement].
Tanaka T., Murayama S., Tuda N., Mishiyama M., Nakagawa K., Matsuo Y., Isohama Y. et Kido Y.; 2005; Microbial degradation of disinfectants. A new chlorhexidine degradation intermediate (CHDI), CHDI-C, produced by Pseudomonas sp. Strain No. A-3; J. Health Sci., 51, p. 357-361 [disponible en anglais seulement].
Tanaka T., Ishii M., Nakano S., Mori Y., Yano Y., Iijima T., Takeda K. et Kido Y.; 2006; Microbial degradation of disinfectants: two new aromatic degradation products of chlorhexidine, chlorhexidine aromatic degradation product (CHADP)-4 and (CHADP)-6, produced by Pseudomonas sp. Strain No. A-3; J. Health Sci., 52(1), p. 58-62 [disponible en anglais seulement].
Tanzer J.M., Slee A.M. et Kamay B.A.; 1977; Structural requirements of guanide, biguanide, and bisbiguanide agents for antiplaque activity; Antimicrob. Agents Ch., 12(6), p. 721-9 [disponible en anglais seulement].
Toholka R. et Nixon R.; 2013; Allergic contact dermatitis to chlorhexidine; Australas. J. Dermatol., 54, p. 303-306 [disponible en anglais seulement].
Union européenne; 1998–2016; Directive 92/69/CEE de la Commission, du 31 juillet 1992, portant dix‑septième adaptation au progrès technique de la directive 67/548/CEE du Conseil concernant le rapprochement des dispositions législatives, réglementaires et administratives relatives à la classification, l’emballage et l’étiquetage des substances dangereuses : A.5. Tension superficielle; Journal officiel L 383 A, 29/12/1992, p. 0113 – 0115; Luxembourg : Office des publications de l’Union européenne, document 31992L0069 [consulté en juin 2016].
Voets J.P., Pipyn P., van Lancker P. et Verstraete W.; 1976; Degradation of microbicides under different environmental conditions; J. Appl. Microbiol., 40(1), p. 67-72 [cité dans HSDB 1983–2016] [disponible en anglais seulement].
Westagro Canada; 2014a; Sani-Wash Lave-Pis 1.6%; Westagro Canada [consulté le 24 janvier 2014] [disponible en anglais seulement].
Westagro Canada; 2014b; Agro Blue; Westagro Canada [consulté le 24 janvier 2014] [disponible en anglais seulement].
Willis L.; 1993; Final report on the safety assessment of chlorhexidine/chlorhexidine diacetate/chlorhexidine dihydrochloride/chlorhexidine digluconate; J. Am. Coll. Toxicol., 12(3), p. 201-223 [disponible en anglais seulement].
Winrow M.J.; 1973; Metabolic studies with radiolabelled chlorhexidine in animals and man; J. Periodont. Res., 12, p. 45-48 [disponible en anglais seulement].
Wong W.K., Goh C.L. et Chan K.W.; 1990; Contact urticaria from chlorhexidine; Contact Dermatitis, 22, p. 52 [disponible en anglais seulement].
Wormuth M., Scheringer M., Vollenweider M. et Hungerbuhler K.; 2006; What are the sources of exposure to eight frequently used pthalic acid esters in Europeans?; Risk Anal., 26(3), p. 803-824 [disponible en anglais seulement].
Wu X., Bennett D.H., Ritz B., Cassady D.L., Lee K. et Hertz-Picciotto I.; 2010; Usage pattern of personal care products in California households; Food Chem. Toxicol., 48, p. 3109-3119 [disponible en anglais seulement].
Xue Y., Tang M., Hieda Y., Fujihara J., Takayama K., Takatsuka H. et Takeshita H.; 2009; High‑performance liquid chromatographic determination of chlorhexidine in whole blood by solid-phase extraction and kinetics following an intravenous infusion in rats; J. Anal. Toxicol., 33, p. 85-91 [disponible en anglais seulement].
Xue Y., Zhang S., Tang M., Zhang T., Wang Y., Hieda Y. et Takeshita H.; 2012; Comparative study on toxic effects induced by oral or intravascular administration of commonly used disinfectants and surfactants in rats; J. Appl. Toxicol., 32, p. 480-487 [disponible en anglais seulement].
Yamayoshi T., Doi H. et Tatsumi N.; 1981; The effect of disinfectants on waste water from medical centers; Jpn J. Infect. Dis., 55(6), p. 385-399 [disponible en anglais seulement].
Zong Z. et Kirsch L.E.; 2012; Studies on the instability of chlorhexidine, part 1: Kinetics and mechanisms; J. Pharm. Sci., 101(7), p. 2417-2427 [disponible en anglais seulement].
Annexe A – Exposition humaine estimée due à l’utilisation de produits
Des expositions ont été estimées pour différents groupes d’âges, basés sur le poids corporel, à partir des facteurs d’exposition de Santé Canada pour la population générale (Santé Canada 1998) :
Bébés (0–6 mois) : 7,5 kg
Tout-petits (0,5–4 ans) : 15,5 kg
Enfants (5–11 ans) : 31,0 kg
Adultes (20–59 ans) : 70,9 kg
Toutes les hypothèses faites pour les paramètres d’exposition par voie dermique sont données ci-après (y compris les scénarios d’exposition due aux cosmétiques et aux produits de santé naturels). Ce sont des hypothèses par défaut de ConsExpo (RIVM 2006b), sauf indication contraire. Un facteur de rétention global de 1 a été utilisé sauf indication contraire. Les expositions ont été estimées pour un adulte, sauf indication contraire.
Hydratant corporel (bébé) :
fréquence d’exposition = 1,7 fois par jour (Wormuth et al. 2006)
Quantité de produit = 1,4 g par application (Wormuth et al. 2006)
Hydratant corporel :
fréquence d’exposition = 1,13 fois par jour (Loretz et al. 2005)
Quantité de produit = 4,4 g par application (moyenne) (Loretz et al. 2005)
Lubrifiant pour parties génitales :
fréquence d’exposition = 0,005 fois par jour (communication personnelle, courriel du Bureau de contrôle et d’évaluation des substances nouvelles de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, 5 juillet 2016; non référencé)
Quantité de produit = 10 g par application (EPA 1997)
Colorant capillaire (non pulvérisé; permanent) :
Fréquence d’exposition = 0,02 fois par jour (7,99 fois par an) (Statistique Canada 2012)
Quantité de produit = 100 g par application
Facteur de rétention global = 0,10 (SCCS 2015)
Conditionneur pour cheveux permanent :
fréquence d’exposition = 1,1 fois par jour
Quantité de produit = 13,1 g par application
Facteur de rétention global = 0,1 (jugement professionnel)
Écran solaire :
quantité de produit = 12,3 g par jour basé sur 177 utilisations-jours (BERSE 2017)
Écran solaire (tout-petits) :
quantité de produit = 3 g par jour basé sur 177 utilisations-jours (BERSE 2017)
Toutes les hypothèses mentionnées ci-après concernent des paramètres d’exposition par voie orale à des cosmétiques et à des produits de santé naturels. Ce sont des hypothèses par défaut de ConsExpo (RIVM 2006b), sauf indication contraire. Tous les scénarios avec produit sont pour des adultes, sauf indication contraire.
Baume pour les lèvres (tout-petits) :
fréquence d’exposition = 0,59 fois par jour (Wu et al. 2010)
Quantité de produit = 0,01 g par application
Rouge à lèvres :
fréquence d’exposition = 2,4 fois par jour (Loretz et al. 2005)
Quantité de produit = 0,01 g par application
Bain de bouche (enfant) :
fréquence d’exposition = 0,85 fois par jour (Ficheux et al. 2015)
Quantité de produit = 10 g par application (Les étiquettes des bains de bouche pour enfants recommandent aux enfants de 6 à 12 ans d’utiliser 10 mL. On assume une masse volumique de 1 g/mL).
Facteur de rétention global = 0,1 (SCCS 2015)
Bain de bouche :
fréquence d’exposition = 1,0 fois par jour (Ficheux et al. 2015)
Quantité de produit = 17 g par application (Ficheux et al. 2016)
Facteur de rétention global = 0,1 (SCCS 2015)