Méthode d’essai biologique servant à mesurer la survie de collemboles exposés à des contaminants dans le sol : chapitre 4
Section 4
Modes opératoires universels
Les conditions et modes opératoires généraux exposés ci-après pour les essais toxicologiques avec des collemboles s’appliquent aux essais visant à évaluer la toxicité d’échantillons de sol, de déchets particulaires ou de substances chimiques, de même qu’aux essais connexes avec un toxique de référence. La section 5 décrit des modes opératoires plus spécifiques pour les essais sur des échantillons de sol ou d’autre matière particulaire semblable prélevés sur le terrain (p. ex., boues d’épuration, stériles miniers égouttés, résidus de boues de forage, compost, biosolides). La section 6 renferme des conseils et décrit des modes opératoires relativement à des essais sur un sol témoin négatif ou un sol enrichi (dopé) en laboratoire avec une ou des substances chimiques. Des indications particulières ayant trait à la réalisation d’essais sur des sols de la région boréale et de la taïga ont été intégrées dans l’ensemble de la présente méthode d’essai.
Il faut inclure dans les modes opératoires universels tous les aspects du système d’essai décrit à la section 3. Les conditions et procédures exposées à la section 2 pour l’élevage des collemboles F. candida, O. folsomi, F. fimetaria et P. minuta en vue des essais de toxicité d’un sol s’appliquent également. La liste de contrôle sommaire qui figure au tableau 2 énumère les conditions et modes opératoires recommandés et exigés pour tous les essais sur des échantillons de sol contaminé ou susceptible d’être contaminé ainsi que pour les essais portant sur des types particuliers de substances ou matières d’essai, dont des échantillons de sol de site(y compris des sols de la région boréale et de la taïga), de biosolides (p. ex., déblais de dragage, boues provenant d’une usine d’épuration des eaux usées, compost, fumier) ou de sol témoin négatif (ou d’un autre sol, contaminé ou non contaminé) enrichi en laboratoire avec une ou des substances chimiques.
La présente méthode d’essai biologique permet de mesurer les effets de l’exposition à un sol contaminé sur la survie et le succès de la reproduction de collemboles. Les organismes expérimentaux doivent être choisis parmi quatre espèces : F. candida, O. folsomi, F. fimetaria et P. minuta (v. 1.2). La durée de l’essai varie selon l’espèce choisie, soit 21 jours pour F. fimetaria et P. minuta et 28 jours pour F. candida et O. folsomiNotes de bas de page37, et les sols sont hydratés pendant l’essai, mais non renouvelés.
La version définitive de la présente méthode a été appliquée et validée par plusieurs laboratoires au cours de trois séries d’essais parallèles avec F. candida et un sol artificiel enrichi avec de l’acide borique (EC, 2007b)Notes de bas de page38.
4.1 Préparation des sols d’essai
Chaque récipient d’essai (v. 3.2.2) de l’installation d’essai doit être codé ou étiqueté clairement afin qu’on puisse identifier l’échantillon (et connaître sa concentration s’il est dilué). Il faut consigner la date et l’heure du début de l’essai, soit directement sur les étiquettes, soit sur des feuilles de données distinctes réservées à l’essai. On devrait disposer les récipients d’essai de manière à faciliter les observations et les mesures. Les traitements devraient être répartis au hasard dans l’installation d’essai, et il faudrait changer régulièrement l’emplacement des récipients pendant l’essai (p. ex., chaque semaine, au hasard) (EC, 1997a, 1997b, 2001, 2004a, 2005a, 2013a).
Le jour où les collemboles sont exposés pour la première fois aux échantillons de substance ou matière d’essai est désigné jour 0. La veille du démarrage de l’essai (jour -1), il est recommandé de mélanger soigneusementNotes de bas de39page (v. 5.3 et 6.2) chaque échantillon ou sous- échantillon de sol d’essai ou de matière particulaire semblable, y compris le sol témoin négatif et, le cas échéant, le sol de référence, afin d’obtenir un mélange homogène quant à la couleur, à la texture et à l’humidité. Si l’essai est réalisé sur des échantillons de sol de site, il est recommandé d’éliminer avant le mélange les pierres, le chaume, les bouts de bois et les débris de grande taille qu’on aura observés, de même que toute végétation ou tout macro-invertébré (v. 5.3). Pour les sols échantillonnés par horizon (p. ex., sols de la région boréale), chaque horizon doit être préparé et mis à l’essai séparément. Si on a prélevé des échantillons de sol intact et qu’on a l’intention de les mettre à l’essai dans cet état, il ne faut pas les perturber pendant la durée de l’essaiNotes de bas de page40.
Chaque lot de sol d’essai ou d’horizon pédologique devrait correspondre à la quantité dont on a besoin pour les répétitions que comporte le traitement prévu (v. tableau 2), plus une quantité additionnelle pour les analyses physicochimiques à exécuter (v. 4.6) et un surplus afin de compenser le sol inutilisé qui adhère aux parois du récipient servant au mélange. La teneur en humidité de chaque sol d’essai devrait être connue ou déterminée. S’il faut l’ajuster, il est recommandé d’ajouter de l’eau d’essai (ou, au besoin, de déshydrater le sol) jusqu’à obtention de la teneur souhaitée (v. 5.3 et 6.2). Pour évaluer quantitativement l’homogénéité d’un lot, on peut prélever des aliquotes du mélange et en analyser notamment la granulométrie, les teneurs en COT, en matière organique et en humidité ainsi que la concentration de la ou des substances chimiques d’intérêt.
Tableau 2. Liste de contrôle des conditions et modes opératoires recommandés et exigés pour les essais visant à mesurer les effets de l’exposition à un sol contaminé sur la survie et la reproduction de F. candida, d’O. folsomi, de F. fimetaria et de P. minuta
Universel
- F. candida : élevages synchrones en laboratoire, 10-12 jours après l’éclosion;
- O. folsomi : élevages synchrones en laboratoire, 28-31 jours après l’éclosion;
- F. fimetaria : élevages synchrones en laboratoire, 23-26 jours après l’éclosion;
- P. minuta : élevages synchrones en laboratoire, 13-14 jours après l’éclosion (recommandé : 14 jours)
Sol prélevé sur le terrain
Sol enrichi avec une ou des substances chimiques
Une fois le lot préparé, on devrait immédiatement en transférer 30 gNotes de bas de page41 (poids humide) dans chaque récipient de répétition. Pour lisser le sol (sans le tasser) ajouté à chaque récipient d’essai, il est recommandé d’utiliser une cuillère, de secouer doucement le récipient, à l’horizontale, ou de tapoter le bocal en verre ≥3 fois sur la table de travail ou avec la paume de la main.
Dans le cas des sols de la région boréale ou de la taïga échantillonnés par horizon, chaque horizon doit être mis à l’essai séparément dans des essais définitifs individuels. Pour les sols soumis à des essais à concentrations multiples, on mélange chaque horizon de sol d’essai avec l’horizon correspondant du sol témoin négatif ou de référence (v. section 5) aux diverses concentrations prévues (p. ex., 0 %, 6,25 %, 12,5 %, 25 %, etc.). Dans certains cas, il pourrait être impossible de prélever les mêmes horizons de sol témoin négatif et de sol d’essai. Par exemple, un sol témoin négatif peut être prélevé par horizon, mais non pas le sol de site parce qu’un ou des horizons en sont absents ou sont mélangés. Il faut alors préparer les concentrations en mélangeant le poids qui convient de sol d’essai et l’horizon (il peut y en avoir plus d’un) disponible du sol témoin négatif aux concentrations voulues.
Pour un essai à concentration unique (p. ex., sur un sol de site non dilué, sur un sol d’essai à une concentration particulière ou enrichi avec une substance chimique à la dose maximale indiquée sur l’étiquette), on doit préparer ≥5 récipients de répétition et 5 récipients témoinsnégatifs de répétition en ajoutant 30 g (poids humide) du même lot à chaque récipient de répétition. Dans le cas d’un sol de site, les répétitions devraient être constituées des réplicats prélevés individuellement dans un lieu d’échantillonnage donné (v. 5.1). Pour un essai à concentrations multiples, on doit préparer ≥5 récipients de répétition pour chaque sol témoin négatif et ≥3 récipients de répétition par traitement.
Lorsque l’incertitude entourant la toxicité d’un échantillon est appréciable, il pourrait être avantageux de procéder à un essai préliminaire pour choisir plus précisément les concentrations à utiliser dans l’essai définitif; le nombre de répétitions pourrait y être réduit (à 2, p. ex.). Pour tout essai visant à estimer la concentration inhibitrice correspondant à un pourcentage d’effet précisé (CIp) dans un essai définitif à concentrations multiples, on doit préparer ≥7 concentrations plus un ou des traitements témoins; il est toutefois recommandé d’en prévoir un plus grand nombre (≥10, plus un ou des traitements témoins) pour améliorer la probabilité d’encadrer chaque paramètreNotes de bas42de page.
On recommande de préparer ≥2 récipients d’essai supplémentaires pour chaque traitement (y compris tout sol témoin ou de référence utilisé) en vue des analyses physicochimiques à effectuer le jour 0 et à la fin de l’essai (v. 4.6)Notes de bas43de page.
Il est conseillé de choisir une large plage de concentrations, dont une faible n’ayant aucun effet nocif (comme c’est le cas avec le traitement témoin négatif) et une élevée pour laquelle l’effet est « total » ou grave. Si le paramètre prévu se situe dans une série de concentrations très rapprochées, toutes ces concentrations pourraient se révéler trop faibles ou trop élevées. Pour disposer d’une large plage de concentrations tout en obtenant des effets importants au centre de la plage, il pourrait être nécessaire de prévoir des traitements additionnels afin de subdiviser plus finement la plage choisie. Dans tous les cas, il est recommandé d’employer une série géométrique régulière (v. annexe H). On trouvera dans EC (2005b) de plus amples indications sur le choix des concentrations d’essai aux fins de la présente méthode.
Après avoir ajouté une aliquote mesurée (30 g, poids humide) de sol dans chaque récipient d’essai, on devrait boucher hermétiquement les récipients avec des couvercles (v. 3.2.2) afin de réduire au minimum la perte d’humidité. Il est recommandé de conserver les récipients d’essai pendant toute une nuit dans les conditions de température et d’éclairage prévues pour l’essai (v. 4.3) afin de permettre l’équilibrage chimique des sols d’essai (p. ex., sol enrichi avec une substance chimique ou sol de site dilué avec un sol témoin).
4.2 Mise en route de l’essai
Une fois le sol préparé, les organismes expérimentaux sont transférés dans chaque récipient d’essai le jour suivant (jour 0 de l’essai). Afin de disposer d’un nombre suffisant d’organismes, il est recommandé de préparer des élevages synchrones qui fourniront un nombre d’organismes supérieur au nombre requis (v. 2.3.8).
Pour les essais avec F. candida, on doit prélever des juvéniles âgés de 10-12 jours dans les élevages synchrones (v. 2.3.8 pour d’autres informations sur les élevages synchrones des quatre espèces) et les transférer délicatement dans les récipients d’essai, à raison de 10 individus par récipient. Pour les essais avec O. folsomi, il faut prélever des organismes âgés de 28-31 jours dans les élevages synchrones. Quinze individus (10 femelles, plus grosses et avec des abdomens arrondis, et 5 mâles, plus petits et plus élancés) sont transférés dans chaque récipient d’essaiNotes44de bas de page. Pour les essais avec F. fimetaria, on doit utiliser des organismes âgés de 23-26 jours issus d’élevages synchrones et transférer 20 individus (10 femelles, plus grosses et avec des abdomens arrondis, et 10 mâles, plus élancés et moitié moins gros que les femelles) dans chaque récipient d’essaiNotes de bas de page45. Pour les essais avec P. minuta, on doit utiliser des organismes âgés de 13-14 jours (recommandé : organismes âgés de 14 jours seulement) provenant d’élevages synchrones et transférer 10 individus (5 femelles, plus grosses et avec des abdomens arrondis, et 5 mâles, plus petits et plus élancés) dans chaque récipient d’essaiNotes de bas de page46.
Les organismes des quatre espèces peuvent être transférés délicatement des élevages sur un morceau (format lettre) de carton noirNotes de bas de page47 rigide plié en deux ou sur une barquette de pesée (préalablement lavée et séchée afin d’éliminer la pellicule cireuse dont les barquettes sont enduites) à l’aide d’un pinceau fin humide et d’une sonde ou d’un dispositif d’aspiration à faible succion (v. 2.3.7). Pour mieux séparer les mâles des femelles de l’espèce P. minuta aux fins des essais toxicologiques, il est vivement recommandé d’employer un dispositif d’aspiration à faible succion (v. annexe I) parallèlement à un microscope de dissectionNotes de bas de page48. Pour F. candida, on peut transférer les organismes en tapotant directement le récipient contenant l’élevage synchrone au-dessus du carton noir. Cette dernière méthode permet de transférer le nombre requis d’individus en réduisant au minimum les pertes dues à la propension de F. candida à sauter.
Pour O. folsomi, F. fimetaria et P. minuta, il est recommandé d’examiner soigneusement les élevages afin de repérer les mâles et les femelles. On devrait prélever délicatement les organismes, un par un, jusqu’à obtention du nombre voulu de mâles et de femelles (O. folsomi : 10 femelles et 5 mâles; F. fimetaria : 10 femelles et 10 mâles; P. minuta : 5 femelles et 5 mâles). On devrait procéder à une observation finale des collemboles afin de vérifier qu’on a prélevé le nombre correct d’organismes selon le ratio mâles/femelles précisé et que leur aspect est normal (les organismes choisis devraient sembler en bonne santé et actifs, mobiles, sans défauts ou blessures visibles et de même colorationNotes de bas de49). Tous les collemboles atypiques devraient être rejetés. Ensuite, on devrait transférer soigneusement les organismes sur la surface du sol de chaque récipient d’essai en tapotant doucement le carton ou la barquette de pesée au-dessus du récipient d’essai. Le groupe de collemboles transféré dans chaque récipient d’essai devrait être réparti au hasard dans les répétitions et les traitements.
4.3 Conditions d’essai
- Il s’agit d’un essai de toxicité d’un sol d’une durée de 21 ou 28 jours, qui ne comporte aucun renouvellement du sol des récipients d’essai. L’essai dure 21 jours dans le cas de F. fimetaria et de P. minuta et 28 jours dans celui de F. candida et d’O. folsomi.
- Le récipient d’essai est un bocal en verre à large ouverture, d’une capacité de 100-125 mL; son contenu [30 g de sol d’essai (poids humide)] est muni d’un couvercle (v. 3.2.2).
- Pour un essai à concentration unique, il faut préparer ≥5 récipients de répétition pour chaque sol d’essai (c.-à-d. chaque traitement). Pour un essai à concentrations multiples, il faut préparer ≥3 récipients de répétition pour chaque concentration d’essai et 5 récipients de répétition pour chaque sol témoin.
- Pour les essais à concentrations multiples, il faut utiliser, pour les quatre espèces, ≥7 concentrations, plus le ou les traitements témoins appropriés; toutefois, il est recommandé d’utiliser un plus grand nombre de concentrations (≥10, plus les traitements témoins).
- L’essai doit être réalisé à une température moyenne quotidienne de 20 ± 2 °C. En outre, la température instantanée doit toujours être de 20 ± 3 °C.
- Les récipients d’essai doivent être éclairés selon une photopériode fixe (p. ex., 16 h ou 12 h). Il est recommandé d’utiliser des lampes incandescentes ou fluorescentes. L’intensité lumineuse en un point adjacent à la surface du sol dans chaque récipient d’essai devrait être de 400-800 lux, la valeur minimale étant de 400 lux. Cette plage équivaut aux flux quantiques suivants : 5,6-11,2 μmol/(m2 · s) pour un éclairage fluorescent blanc froid; 6,4-12,8 μmol/(m2 · s) pour un éclairage fluorescent à spectre continu; 7,6-15,2 μmol/(m2 · s) pour un éclairage incandescent.
4.4 Critères de validité des essais
Pour que l’essai biologique soit valide, il doit satisfaire à chacun des critères suivants, particuliers à chaque espèceNotes de bas de50page:
Pour F. candida:
- le taux moyen de survie des collemboles adultes maintenus pendant 28 jours dans un sol témoin négatif doit être, à la fin de l’essai, de ≥70 % pour les essais effectués sur un sol naturel et de ≥80 % pour les essais effectués sur un sol artificiel;
- le taux moyen de reproduction des collemboles adultes maintenus pendant 28 jours dans un sol témoin négatif doit être de ≥100 juvéniles vivants par récipient témoin.
Pour O. folsomi:
- le taux moyen de survie des collemboles adultes maintenus pendant 28 jours dans un sol témoin négatif doit être, à la fin de l’essai, de ≥70 %;
- le taux moyen de reproduction des collemboles adultes maintenus pendant 28 jours dans un sol témoin négatif doit être de ≥100 juvéniles vivants par récipient témoin.
Pour F. fimetaria :
- le taux moyen de survie des collemboles adultes maintenus pendant 21 jours dans un sol témoin négatif doit être, à la fin de l’essai, de ≥70 %;
- le taux moyen de reproduction des collemboles adultes maintenus pendant 21 jours dans un sol témoin négatif doit être de ≥100 juvéniles vivants par récipient témoin.
Pour P. minuta :
- le taux moyen de survie des collemboles adultes maintenus pendant 21 jours dans un sol témoin négatif doit être, à la fin de l’essai, de ≥60 % pour les essais effectués sur un sol naturel et de ≥70 % pour les essais effectués sur un sol artificiel;
- le taux moyen de reproduction des collemboles adultes maintenus pendant 21 jours dans un sol témoin négatif doit être de ≥100 juvéniles vivants par récipient témoin.
4.5 Alimentation
Pendant l’essai toxicologique, les collemboles F. candida sont nourris le jour 0 avec ~10 mg de levure sèche granulée et le jour 14, avec ~20 mg de levure, déposés dans chaque récipient d’essai. Pour les essais avec O. folsomi, on dépose ~5 mg de levure dans chaque récipient d’essai les jours 0, 7, 14 et 21. Pour ceux avec F. fimetaria, on dépose ~10 mg de levure dans chaque récipient d’essai les jours 0 et 14. Les collemboles P. minuta sont nourris les jours 0, 7 et 14 avec ~10 mg de levure déposés dans chaque récipient d’essai. Le type de levure utilisé est une levure sèche active (p. ex., Fleischman’sMC). On répartit uniformément la levure sur la surface du sol d’essai humide, ou encore sur la surface du sol sec qu’on vaporise 3 fois pour activer la levure et humecter le sol. Il est important que les organismes de chaque récipient d’essai reçoivent la même quantité de levure. Au moment de déposer la levure dans un récipient d’essai, si on constate qu’il reste de la levure de la fois précédente, il est recommandé de ne pas enlever cette levure et de ne pas en ajouter de nouvelle pour cette fois Notes de bas de page51
4.6 Observations et mesures
Les paramètres biologiques pour l’essai sont le nombre de collemboles adultes vivants et le nombre de descendantsproduits dans chaque récipient à la fin de l’essai (jour 21 pour F. fimetaria et P. minuta; jour 28 pour F. candida et O. folsomi). Il faut observer et consigner l’état, l’aspect et le nombre des collemboles vivants transférés dans chaque récipient d’essai le jour 0. Les couvercles doivent être retirés de tous les récipients d’essai à des fins d’aération une fois par semaine ou plus fréquemment (soit ≥2 fois par semaine) au besoin, ou à mesure que l’essai avance et que le nombre d’organismes par récipient d’essai augmenteNotes de bas de page52. Il est recommandé de profiter de l’occasion pour observer et consigner toute présence de bactéries ou de champignons en quantité excessive, toute activité trophique ainsi que la présence et la quantité de nourriture non consommée.
La température ambiante dans l’installation d’essai (v. 4.3) doit être mesurée quotidiennement (p. ex., à l’aide d’un thermomètre maxima/minima) ou en continu (p. ex., à l’aide d’un enregistreur graphique).
Une fois par semaine, il faudrait vérifier l’humidité apparente du contenu de chaque récipient d’essai. Si, dans un traitement quelconque, le sol semble trop sec à n’importe quel moment de l’essai, on devrait vérifier toutes les répétitions de ce traitement. Dans chaque récipient d’essai où la surface du sol semble trop sèche, on vaporisera alors de l’eau d’essai à l’aide d’un vaporisateur à fin brouillard qui disperse ~1 mL d’eau par vaporisationNotes de bas de page53. Pour déterminer la perte d’humidité, on peut aussi peser les récipients d’essai (ISO, 1999), et ce, au début de l’essai. On peut ensuite vérifier le poids de chaque récipient d’essai toutes les deux semaines et ajouter de l’eau d’essai pour compenser la perte de poids (due à la perte d’eau) si celle-ci représente >2 % de la teneur en eau initiale (ISO, 1999). Lorsque le nombre de récipients d’essai est élevé, on peut calculer la quantité moyenne d’eau perdue en pesant 5 ou 10 récipients choisis au hasard. La quantité d’eau perdue ainsi calculée peut ensuite être ajoutée à tous les récipients d’essai.
Le pH et la teneur en humidité du sol d’essai ou de l’horizon pédologique représentant chaque traitement (y compris le sol témoin négatif et, le cas échéant, le sol de référence) doivent être mesurés et consignés au début et à la fin de l’essai. En outre, il est recommandé de mesurer la conductivité au début et à la fin de l’essai lorsqu’on s’attend à ce que le sol d’essai ait une forte teneur en sel. Les mesures initiales (jour 0) devraient être effectuées sur un échantillon composé de sous-échantillons de chaque lotdu sol d’essai ou de l’horizon pédologique utilisé pour préparer les répétitions d’un traitement donné (v. 4.3)Notes de bas de page54. Les mesures finales (jour 21 ou 28 selon l’espèce utilisée) devraient être effectuées sur des répétitions additionnelles préparées pour chaque traitement (v. 4.1) en vue des analyses à la fin de l’essai.
Le pH du sol devrait être mesuré à l’aide d’une méthode utilisant une suspension dans une solution de CaCl2 (variante d’une méthode décrite dans Hendershot et coll., 1993)Notes de bas de page55. Pour ces analyses, on dépose 4 g de sol hydratéNotes de bas de page56 dans un bécher en verre de 30 mL (~3 cm de diamètre et ~7 cm de hauteur) et on ajoute 20 mL de CaCl2 0,01 MNotes de bas de page57. La suspension devrait être agitée par intermittence pendant 30 min (p. ex., toutes les 6 min), après quoi on la laisse reposer pendant ~1 h. On plonge ensuite une sonde à pH dans le liquide surnageant et on consigne la valeur du pH une fois que la valeur indiquée ne change plus.
Pour mesurer la teneur en humidité de chaque sol d’essai ou de chaque horizon pédologique, on dépose un sous-échantillon de 3-5 g de chaque sol ou horizon dans un plateau en aluminium préalablement pesé, puis on mesure et on consigne son poids humide. Chaque sous- échantillon devrait ensuite être placé dans un four de séchage à 105 °C jusqu’à obtention d’un poids constant, ce qui demande habituellement >24 h. Le poids sec de chaque sous-échantillon devrait ensuite être mesuré et consigné. La teneur en humidité du sol doit être calculée en pourcentage du poids sec du sol à l’aide de la formule suivante :

teneur en humidité
La teneur en eau du sol est déterminée en fonction du poids sec. On soustrait le poids sec d'un échantillon de sol au poids du même échantillon avant qu'il soit séché. Le résultat obtenu est ensuite divisé par le poids sec de l'échantillon et multiplié par 100.
Il est important que la teneur en humidité soit calculée en fonction du poids sec (et non du poids humide) puisque les résultats de ces calculs sont utilisés avec les calculs de la CRE (également déterminée en fonction du poids sec) pour exprimer la teneur optimale en humidité des sols d’essai (v. 5.3).
Selon le type d’essai et le plan de l’étude, les concentrations de la ou des substances chimiques préoccupantes pourraient être mesurées, au début et à la fin de l’essai, dans les sols d’essai dilués ou non. Pour un essai sur un échantillon de sol de site, la ou les substances chimiques à doser dépendront du ou des contaminants préoccupants (v. 5.5). Pour un essai à concentrations multiples sur un sol enrichi avec une substance chimique, de telles mesures devraient être effectuées, au minimum, pour les concentrations élevée, moyenne et faible soumises à l’essai (v. 6.3). On devrait prélever des aliquotes de chaque sol ou horizon pédologique en vue de ces analyses, comme il est indiqué plus haut pour le pH et la teneur en humidité, et les analyses devraient être effectuées selon des techniques éprouvées et reconnues (p. ex., SPAC, 1992; Carter, 1993).
4.7 Fin de l’essai
L’essai prend fin après 21 jours d’exposition pour F. fimetaria et P. minuta et après 28 jours d’exposition pour F. candida et O. folsomi. On doit alors déterminer et consigner le nombre de collemboles adultes vivants et le nombre de descendants vivants dans chaque récipient d’essai. Avant d’ouvrir un récipient d’essai, il est conseillé de tapoter son couvercle (p. ex., 3 petits coups) pour déloger les individus qui auraient pu s’accrocher sous le couvercle. Pour extraire les collemboles du sol d’essai, il est recommandé d’utiliser l’une ou l’autre des deux méthodes suivantes : 1) la méthode de flottation; 2) la méthode d’extraction à la chaleurNotes de bas de page58.
Dans la méthode de flottation, on ajoute de l’eau d’essai dans le récipient d’essai jusqu’à une hauteur de ~2 cm au-dessus de la surface du sol et on agite la boue à l’aide d’une tige en verre. Les collemboles adultes et les descendants produits pendant l’essai flottent à la surface de l’eauNotes de bas de page59; on peut alors les extraire à l’aide d’un pinceau humide et les compter, ou bien on peut verser le surnageant dans une grande boîte de Petri. Les collemboles se répartissent à la surface de l’eau dans la boîte de Petri et on peut alors les compter facilementNotes de bas de page60. Une fois déterminé et consigné le nombre d’individus, on jette l’eau de la boîte de Petri. On ajoute une nouvelle fois de l’eau dans le récipient d’essai, on agite vigoureusement la boue pour séparer les particules de sol et déloger les collemboles, puis on verse l’eau (et les collemboles en suspension ou flottants) dans la boîte de Petri et on compte le nombre d’individus. On recommence jusqu’à ce qu’il n’y ait plus de collemboles flottant à la surface lorsque l’eau est ajoutée au sol qui reste dans le récipient d’essai.
Une autre méthode consiste à transvaser le sol de chaque récipient d’essai dans des béchers en verre de 500 mL (9 cm de diamètre), dans lesquels on ajoute 150 mL d’eau. On rince le récipient d’essai avec de l’eau et on verse l’eau de rinçage dans le bécher. Après avoir remué délicatement avec une spatule, on ajoute ~250 mL d’eau teintée de bromophénol bleu (ou de toute autre substance colorante foncée non toxique pour les collemboles) (l’ajout de la substance colorante sert à améliorer le contraste entre les collemboles blanchâtres et l’eau).
Après avoir remué soigneusement le mélange, on remplit les béchers avec de l’eau jusqu’au trait indiquant 500 mL et on compte manuellement le nombre de juvéniles et d’adultes à la surface de l’eau. On peut aussi prendre une photographie numérique ou une diapositive couleur de la surface de l’eau, puis on transfère l’image à un ordinateur ou on imprime la photographie, ou encore on projette la diapositive sur un écran, pour compter les adultes et les juvéniles. Si le récipient d’essai contient un grand nombre de collemboles, ceux-ci ont tendance à s’accrocher les uns aux autres et il est alors difficile de les compter. Dans ce cas, on peut déverser les organismes ou séparer le liquide surnageant en plusieurs aliquotes (p. ex., 3) avant de photographier. Il est plus facile ainsi de compter les individus sur chaque image numérique et on additionne ensuite les résultats des aliquotes pour obtenir le nombre total de collemboles dans le récipient d’essai. Il existe d’autres méthodes de dénombrement des collemboles adultes et juvéniles à la fin de l’essai, dont des méthodes qui utilisent un logiciel d’analyse d’image ou d’autres dispositifs de traitement d’image (Krogh et coll., 1998). Si les collemboles sont comptés à l’aide d’une méthode d’analyse d’image ou de toute autre méthode de comptage automatisée, on doit vérifier au préalable l’exactitude des résultats fournis par le système automatisé en comparant les résultats avec ceux obtenus par comptage manuel.
La méthode d’extraction à la chaleur décrite dans Wiles et Krogh (1998) et dans OCDE (2009) est fondée sur les principes de MacFayden et de Petersen et utilise un extracteur à gradient de température contrôlé où les collemboles sont recueillis sur 48 hNotes de bas de page61.
Becker-van Slooten et coll. (2005) ont mis au point une technique d’extraction à la chaleur plus simple et plus économique. Cette méthode, qui a ensuite été perfectionnée par Environnement Canada (2006b) avec du matériel disponible au Canada, est recommandée ici comme solution de rechange à la méthode par flottation pour extraire les collemboles du sol d’essai. La chaleur, fournie par une lampe munie d’une ampoule de 60 ou de 100 W, est régulée par la distance entre l’ampoule et la surface du sol dans le dispositif d’extraction à la chaleurNotes de bas de page62. Un dispositif d’extraction à la chaleur devrait être préparé pour chaque récipient d’essai. Une fois l’essai terminé, le sol de chaque récipient d’essai est transféré dans un dispositif d’extraction à la chaleurNotes de bas de page63. La surface du sol est égalisée au-dessus de la toile de canevas, à l’aide d’une cuillère ou d’une spatule Scoopula. Les dispositifs d’extraction à la chaleur sont placés sous les lampes, à raison de 5-6 dispositifs par lampe au maximum, afin que tous les récipients reçoivent la même lumière et la même chaleur. La distance de l’ampoule est réglée de façon que sa base se trouve à 30 cm au-dessus de la surface du sol; un thermomètre (électronique, p. ex.) est installé dans l’un des dispositifs d’extraction pour surveiller les changements de température pendant l’extraction. La température devrait être consignée toutes les 12 h ou au début et à la fin de chaque journée de travail (p. ex., 9 h et 17 h). Pour les essais avec F. candida et P. minuta, la lampe devrait être abaissée de telle sorte que la base de l’ampoule se trouve à 25 cm au-dessus de la surface du sol après 24 h d’extraction et que la température atteigne ~36 °C au bout de 48 h. Pour O. folsomi et F. fimetaria, il n’est pas nécessaire d’ajuster la hauteur de la lampe, et la température devrait atteindre ~32 °C au bout de 48 h. À la fin de la période d’extraction (c.-à-d. 48 h), on devrait éteindre les lampes et enlever la bande de Parafilm®. Les organismes qui sont passés à travers le morceau de canevas et qui se retrouvent sur le substrat de plâtre de Paris peuvent être comptés immédiatement, manuellement ou à l’aide d’un système d’analyse d’image (voir plus haut), ou être conservés (p. ex., dans de l’alcool titrant 70 %) pour être comptés plus tard.
Les laboratoires qui n’ont pas d’expérience avec la méthode d’extraction à la chaleur décrite ici doivent commencer par établir et documenter l’efficacité de leur système d’extraction à la chaleur (ils doivent recueillir des données qui démontrent que, après l’extraction à la chaleur, il ne reste pas un nombre important d’organismes expérimentaux dans le sol). Pour ce faire, ils peuvent utiliser la méthode de flottation pour vérifier s’il reste des organismes dans le sol traité à la chaleur et, par le fait même, si leur technique d’extraction à la chaleur est efficace. Une telle vérification est exigée en raison des problèmes constatés dans les études interlaboratoires de la méthode. La méthode d’extraction à la chaleur est jugée acceptable si le nombre d’organismes expérimentaux recueillis par la méthode de flottation après extraction à la chaleur représente <5 % du nombre total d’organismes extraits du sol. Une fois que le personnel du laboratoire a acquis de l’expérience avec l’extraction à la chaleur et démontré l’efficacité du système utilisé, le laboratoire devrait continuer de surveiller périodiquement cette efficacité.
En règle générale, on distingue aisément les adultes des juvéniles, en raison de leur taille nettement plus grande; cependant, chez F. fimetaria et P. minuta, les mâles et les juvénilesNotes de bas de page64 ont pratiquement la même taille et il est facile de les confondre. Avec de l’expérience, il devient plus facile de distinguer les mâles des descendants de ces espèces (Stämpfli et coll., 2005; Fraser, comm. pers, 2013). Le nombre de collemboles adultes et le nombre de descendants, vivants ou morts, doivent être consignés. Les organismes vivants des espèces F. candida, O. folsomi et F. fimetaria sont blancs et opaques, mobiles à la surface de l’eau et souvent enroulés sur eux- mêmes; il leur faut 5-60 secondes pour se dérouler. Ceux de l’espèce P. minutasont gris foncé et, comme pour les autres espèces expérimentales, il faudrait les observer pendant une courte période pour détecter la présence (ou l’absence) de mouvement. On considère qu’un collembole est mort s’il a complètement cessé de bouger, c’est-à-dire si toutes les parties du corps restent immobiles (pattes, abdomen, tête et antennes). Les collemboles morts sont transparents et étirés ou allongés, et les pattes sont complètement étendues, alors que les carapaces rejetées au moment de la mue sont translucides et fripées. Étant donné que les corps des collemboles adultes morts se décomposent rapidement et sont généralement invisibles, tous les collemboles manquants sont considérés morts. Les juvéniles vivants doivent être distingués des adultes et comptés séparément. Si on observe des juvéniles morts, le fait devrait être consigné.
Les récipients d’essai, quelles que soient les concentrations, devraient être traités au hasard. En effet, la perception de la taille ayant tendance à changer au fil du temps, la distinction entre adultes et juvéniles et le dénombrement peuvent devenir plus ou moins précis. À la fin de l’essai, on devrait analyser les répétitions supplémentaires de chaque sol d’essai (y compris le sol témoin négatif et, le cas échéant, le sol de référence) préparées aux fins des analyses physicochimiques, afin de déterminer leur pH et leur teneur en humidité (v. 4.6). Il est également recommandé d’effectuer à ce moment-là des analyses afin de déterminer les concentrations d’autres composants chimiques (contaminants) en utilisant les répétitions supplémentaires préparées pour chaque sol d’essai (v. 4.6).
4.8 Paramètres et calculs
Pour chaque essai, il faut calculer et consigner le taux de survie pour tous les groupes de collemboles adultes dans chaque récipient d’essai à la fin de l’essai (jour 21 pour F. fimetaria et P. minuta et jour 28 pour F. candida et O. folsomi). Le taux de survie moyen (± ET) pour tous les collemboles exposés à chaque concentration doit aussi être calculé et consigné à la fin de l’essai, à partir des données sur la survie recueillies pour toutes les répétitions (p. ex., moyenne des répétitions de chaque traitement).
Le paramètre biologique relatif à la reproduction est fondé sur le nombre de descendants qui ont survécu dans chaque répétition et dans chaque traitement pendant l’essai. Une réduction importante de ce nombre est considérée comme indicative d’un effet toxique nocif du traitement sur le succès de reproduction des collemboles adultes. La valeur moyenne (± ET) du nombre de descendants ayant survécu dans le sol d’essai après 21 jours (F. fimetaria et P. minuta) et 28jours (F. candida et O. folsomi) est établie pour chaque traitement, y compris les sols de référence et les sols témoins négatifs).
Le plus souvent, un plan d’expérience type comporte un des deux scénarios suivants :
- Lieux d’échantillonnage multiples - dans ce cas, on compare les réponses obtenues pour un ou des lieux d’échantillonnage à l’étude avec celles obtenues pour le lieu d’échantillonnage servant de site de référenceNotes65de bas de page65, pour d’autres lieux d’échantillonnage ou pour le sol témoin (essai à concentration unique). On a souvent recours à des tests d’hypothèse dans les évaluations statistiques, et le résultat habituel de ces tests est que, d’un lieu à unautre, la réponse est soit « différente », soit « analogue ».
- Concentrations multiples d’un sol d’essai - dans ce cas, on mélange le sol d’essai avec un sol de référence ou un sol témoin (v. 5.3), ou on l’enrichit avec une substance chimique à diverses concentrations (v. 6.2). On doit calculer et consigner la CL5021 ou 28 jours (mortalité) et la CIp (reproduction) (si les données le permettent)Notes de bas de page66.
Dans un scénario comportant de multiples lieux d’échantillonnage, il est essentiel de bien comprendre les forces de divers plans d’étude pour pouvoir appliquer les tests statistiques d’une manière fructueuse. Il faudrait définir clairement les objectifs de l’étude avant la collecte des données et avoir une idée tant de la puissance (capacité de détecter un effet) du plan d’expérience que de la facilité d’interprétation des résultats. En règle générale, on a intérêt à limiter le nombre de comparaisons à faire. À cette fin, on choisit le plus souvent un plan d’expérience et des tests statistiques comportant des comparaisons entre le ou les lieux d’échantillonnage à l’étude et un lieu d’échantillonnage de référence. La puissance du plan d’expérience se trouvera accrue si on peut supposer l’existence d’un gradient (en d’autres termes, les échantillons sont prélevés dans un ordre séquentiel loin de la source ponctuelle de contaminants; v. P.4 dans EC, 2005b). Il arrive parfois que les objectifs de l’étude et le plan d’expérience ne reçoivent pas l’attention voulue avant la collecte de données, ce qui amène l’expérimentateur à comparer, en guise de compensation, tous les lieux d’échantillonnage possibles et à maximiser ainsi le nombre de comparaisons. Cette façon de faire est vivement déconseillée, surtout lorsqu’un nombre élevé de lieux d’échantillonnage est en cause, car : 1) cela peut avoir des effets indésirables sur les taux d’erreur des types I et II; 2) l’interprétation des résultats devient souvent plus difficile; 3) une attention indue peut être accordée à des comparaisons particulières après la collecte des donnéesNotes de bas de page67. On trouvera en 5.6 des indications détaillées sur les tests d’hypothèse applicables au nombre de descendants vivants à la fin de l’essai.
Il est recommandé de suivre les explications et les conseils fournis dans EC (2005b) pour le calcul de la CLp et de la CIp; des orientations supplémentaires à ce sujet sont données en 4.8.1 et 4.8.2 ci-après. Au départ, des techniques de régression (v. 4.8.2.1) doivent être appliquées aux données sur les concentrations multiples qu’on entend utiliser pour calculer une CIpNotes de bas de page68.
Dans le cas où les données ne se prêtent pas au calcul des CIp 21 ou 28 jours de la reproduction à l’aide de l’analyse de régression appropriée, il est recommandé de recourir à une interpolation linéaire de ces données à l’aide du programme ICPIN pour tenter d’obtenir une CIp (v. 4.8.2.2).
Pour avoir une représentation visuelle des données et vérifier si les résultats obtenus sont raisonnables par rapport aux calculs statistiques ultérieurs, il est vivement recommandé de commencer par porter sur un graphique les données brutes (pourcentage de mortalité et nombre de descendants vivants) en fonction du logarithme des concentrations. Il faut résoudre tout écart important entre la CL50 ou la CIp déterminée de façon approximative par la méthode graphique et la CL50 ou la CIp calculée ultérieurement à l’aide d’un programme informatique. Le diagramme permettra également de déterminer si on a obtenu une relation logique entre la concentration logarithmique (ou, dans certains cas, la concentration) et l’effet, une caractéristique souhaitable d’un essai valide (EC, 2005b).
4.8.1 CL50
Lorsqu’on effectue un essai à concentrations multiples avec des mélanges de sols, il faut utiliser les données quantiques sur la mortalité correspondant à une période d’exposition donnée pour calculer (si les données le permettent) la CL50 appropriée, avec ses limites de confiance à 95 %. Pour F. fimetaria et P. minuta, d’une part, et pour F. candida et O. folsomi, d’autre part, il faut calculer et consigner la CL50 21 jours et la CL50 28 jours, respectivement, pour les collemboles adultes (première génération), si les données le permettentNotes de bas de page69 (v. 4.8). Pour estimer une CL50, on combine les données sur la mortalité correspondant à la durée d’exposition spécifiée pour toutes les répétitions à chaque concentration.
Il convient de consulter EC (2005b) sur les méthodes statistiques à appliquer aux données quantiques (p. ex., la CL50) lorsque vient le moment de choisir un test statistique pour de telles données obtenues dans des essais toxicologiques avec des collemboles.
L’optimisation du calcul de la CL50 (et ses limites de confiance à 95 %) se fonde sur le nombre d’effets partiels observés (EC, 2005b). En résumé, on privilégiera la méthode de la régression probit ou logit si on observe deux effets partiels, le test de Spearman-Kärber si un seul effet partiel est observé et la méthode binomiale si aucun effet partiel n’est observé (et en tant que méthode générale « par défaut »).
4.8.2 CIp
Lorsqu’on exécute un essai à concentrations multiples pour mesurer les effets de l’exposition de collemboles à des mélanges de sol prélevé sur le terrain ou de sol enrichi, on doit utiliser les données quantitatives sur l’inhibition de la reproduction pour calculer la CIp (v. paragraphes d’introduction de la sous- section 4.8 et la sous-section 6.2). La CIp est une estimation quantitative de la concentration causant un pourcentage précisé de réduction du nombre moyen de descendants produits par les collemboles adultes pendant l’essai.
La CIp est calculée sous forme de pourcentage de réduction (p. ex., CI25 ou CI20, qui correspondent à des taux de réduction de 25 % ou de 20 %, respectivement). C’est l’expérimentateur qui choisit la valeur de p, mais on privilégie actuellement 25 % et 20 %. On doit aussi inclure les limites de confiance à 95 % de toute CIp calculée et consignée.
Dans les analyses relatives à la reproduction, le nombre de descendants produits dans chaque répétition sert au calcul du nombre moyen de descendants qui ont survécu par traitement (concentration), par rapport au nombre moyen obtenu dans les répétitions de sol témoin négatif. On inscrit zéro pour le nombre de juvéniles dans une répétition si tous les collemboles adultes de cette répétition sont morts avant d’avoir produit des descendants. Si, pendant l’essai, un collembole adulte meurt après s’être reproduit, le nombre de descendants doit être utilisé dans les analyses. Si aucun descendant n’a survécu dans une répétition (récipient d’essai), on inscrit zéro dans le calcul effectué pour obtenir le nombre moyen de survivants dans le traitement (concentration). Si aucun descendant n’a survécu dans toutes les répétitions d’une concentration donnée, cette concentration reste incluse dans l’analyse, et on inscrit zéro pour le nombre moyen de juvéniles.
Comme il est indiqué précédemment, il faut calculer et consigner la CIp d’après le nombre moyen de descendants qui ont survécu dans chaque traitement (si les données le permettent) à la fin d’un essai à concentrations multiples de 21 jours avec F. fimetaria et P. minuta et de 28 jours avec F. candida et O. folsomi. Ces calculs doivent être effectués à l’aide des méthodes d’analyse de régression linéaire ou non linéaire appropriées (v. 4.8.2.1). Toutefois, si les analyses de régression fournissent des CIp inacceptables d’après le nombre moyen de descendants vivants produits, il est recommandé d’utiliser le programme ICPIN décrit en 4.8.2.2.
4.8.2.1 Analyse de régression
Une fois terminé l’essai définitif à concentrations multiples de 21 jours (F. fimetaria et P. minuta) ou de 28 jours (F. candida et O. folsomi), on doit calculer par analyse de régression la CIp (et ses limites de confiance à 95 %) d’après le nombre moyen de descendants vivants produits dans chaque traitement, à la condition que les hypothèses ci-dessous soient satisfaites. Un certain nombre de modèles permettent d’évaluer par régression les données sur la reproduction (tests statistiques quantitatifs). Les modèles proposés comprennent un modèle linéaire et les quatre modèles de régression non linéaire suivants : exponentiel, gompertzien, logistique et hormético-logistiqueNotes de bas de page70 (v. 6.5.8 dans EC, 2005b). Pour que les méthodes de régression puissent être utilisées, les données doivent satisfaire aux hypothèses de normalité et d’homoscédasticité. Il est fortement conseillé de consulter EC (2005b) pour des orientations additionnelles au sujet de l’application générale des techniques de régression linéaire et non linéaire à l’analyse des données toxicologiques quantitativesNotes de bas de page71.
Le processus général d’analyse statistique et de sélection du modèle de régression (linéaire ou non linéaire) le plus approprié pour des données toxicologiques quantitatives est présenté sous forme de logigramme à la figure 7. Le processus de sélection du modèle commence par l’examen d’un diagramme de dispersion ou d’un graphique linéaire des données d’essai afin de déterminer la forme de la courbe concentration- réponse. On compare ensuite cette forme aux modèles disponibles afin de choisir un ou des modèles convenant le mieux aux données. Ce ou ces modèles sont ensuite examinés plus en détail (v. figure O.1, annexe O de EC, 2005b, pour un exemple de cinq modèles potentiels).
Une fois le ou les modèles appropriés choisis en vue d’un examen plus approfondi, on vérifie les hypothèses de normalité et d’homoscédasticitédes résidus. Si les résultats de l’application de la technique de régression à un ou plusieurs des modèles examinés satisfont aux hypothèses, on examine les données (et la régression) afin de détecter la présence éventuelle de valeurs aberrantes. Lorsque c’est le cas, on devrait examiner soigneusement les conditions expérimentales et les notes prises pendant l’essai, à la recherche d’une erreur humaine éventuelle. On devrait aussi effectuer l’analyse avec et sans ces valeurs aberrantes et comparer les résultats des deux analyses afin d’évaluer l’effet de ces valeurs sur la régression. On doit ensuite décider s’il convient d’exclure les valeurs aberrantes de l’analyse finale. La décision devrait être fondée sur un examen de la variation biologique naturelle et des phénomènes biologiques susceptibles d’être à l’origine de l’apparente anomalie. On trouvera à la sous-section 10.2 de EC (2005b) d’autres indications relatives aux valeurs aberrantes et aux observations inhabituelles. En l’absence de valeurs aberrantes ou si aucune valeur aberrante n’a été exclue de l’analyse finale, le modèle à privilégier est celui qui présente la plus petite erreur quadratique moyenne résiduelleNotes de bas de page72.
Il est conseillé de demander l’avis d’un statisticien qui connaît bien la question des données aberrantes.
La normalité devrait être évaluée à l’aide du test de Shapiro-Wilk, décrit dans EC (2005b). On peut aussi tracer un diagramme de probabilité normale des résidus pendant l’analyse de régression, mais il n’est pas recommandé d’utiliser cette méthode en guise de test unique de normalité, car la détection d’une distribution « normale » ou « non normale » fait intervenir une évaluation subjective de la part de l’utilisateur. Si les données ne sont pas distribuées normalement, il est conseillé d’essayer un autre modèle, de demander l’avis d’un statisticien au sujet du choix du modèle ou d’utiliser la méthode d’analyse par interpolation linéaire (à l’aide du programme ICPIN, v. 4.8.2.2), qui est moins souhaitable.
Pour évaluer l’homoscédasticité des résidus, on devrait utiliser le test de Levene décrit dans EC (2005b) et examiner les graphiques des résidus par rapport aux valeurs réelles et prévues (estimées). Le test de Levene indique clairement si les données sont homogènes (p. ex., comme dans la figure O.2A, annexe O de EC, 2005b) ou non. Si les données (selon le test de Levene) présentent une hétéroscédasticité (c.-à-d. si elles ne sont pas homogènes), il convient d’examiner les graphiques des résidus. Si on observe un changement important dans la variance et que les graphiques des résidus sont incontestablement en forme d’éventail ou de « V » (on trouvera un exemple à la figure O.2B, annexe O de EC, 2005b), il est recommandé de répéter l’analyse des données à l’aide de la méthode de régression pondérée. Pour pondérer les données, on divise habituellement par l’inverse de la variance, mais d’autres méthodes sont possibles. Avant de choisir la régression pondérée, on compare l’erreur type de la CIp à celle obtenue par la méthode de régression non pondérée. Si la différence entre les deux erreurs types est de >10 %Notes de bas de page73, la régression pondérée est à privilégier. Toutefois, si la différence entre les erreurs types obtenues par les méthodes de régression pondérée et non pondérée est de <10 %, il convient de demander l’avis d’un statisticien au sujet de l’utilisation d’autres modèles, compte tenu des données d’essai, ou d’analyser de nouveau les données par la méthode d’interpolation linéaire (à l’aide du programme ICPIN, v. 4.8.2.2), qui est moins souhaitable. On compare les régressions pondérée et non pondérée pour chacun des modèles retenus, jusqu’au choix final du modèle (à savoir le modèle et la régression constituant le meilleur choix). L’absence de divergence peut parfois indiquer que le modèle est incorrect ou inapproprié (on trouvera un exemple à la figure O.2C, annexe O de EC, 2005b). Encore une fois, il est fortement conseillé de demander l’avis d’un statisticien au sujet de l’utilisation de modèles additionnels.
Les paramètres estimés par régression doivent être encadrés par les concentrations utilisées dans l’essai; l’extrapolation des paramètres au-delà de la concentration d’essai maximale ne constitue pas une pratique acceptable (EC, 2005b).
4.8.2.2 Interpolation linéaire à l’aide du programme ICPIN
Si on ne réussit pas à obtenir une valeur acceptable de la CIp de la reproduction (c.-à-d. si les hypothèses de normalité et d’homoscédasticité ne peuvent être satisfaites) à l’aide des analyses de régression des valeurs des paramètres (v. 4.8.2.1), on devrait appliquer la technique de l’interpolation linéaire à l’aide du programme informatique ICPIN. Ce programme public (Norberg-King, 1993; USEPA, 1995, 2002) peut être obtenu auprès de l’USEPA et fait partie de la plupart des progiciels utilisés en écotoxicologie, y compris TOXSTAT (1996). L’USEPA fournit également un mode d’emploi clair qui facilite l’utilisation du programme (Norberg-King, 1993)Notes de bas de page74. (Signalons que le programme ICPIN était autrefois connu sous le nom de BOOTSTRP.)
Figure 7. Logigramme du processus général d’analyse statistique et de sélection du modèle le plus approprié pour des données toxicologiques quantitatives (adaptation du logigramme présenté dans Stephenson et coll., 2000b)
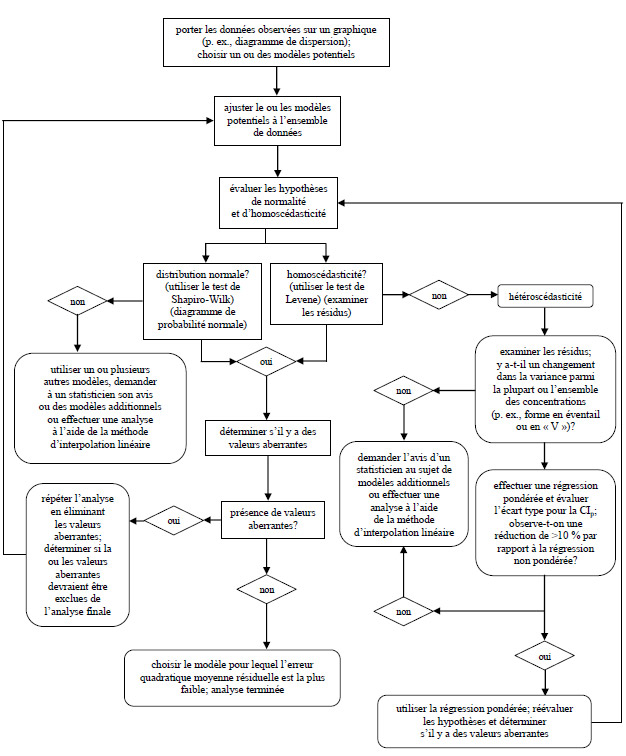
Description
Processus général d'analyse statistique et de choix du modèle le plus approprié pour des données quantitatives sur la toxicité
Cette figure illustre un arbre décisionnel conçu pour aider le lecteur à choisir le bon modèle statistique pour analyser ses données. L'arbre invite le lecteur à choisir les modèles possibles en examinant une représentation graphique des données. Ces modèles sont ensuite adaptés aux données et évalués pour vérifier les hypothèses de normalité et d'homoscédasticité. Si ces deux hypothèses sont confirmées, on demande au lecteur d'évaluer les valeurs aberrantes. S'il n'y a pas de valeurs aberrantes, le modèle ayant la valeur moyenne quadratique de l'erreur résiduelle la plus petite est le modèle plus adéquat. S'il y a des valeurs aberrantes, il faut répéter l'analyse en les supprimant, puis prendre une décision concernant leur ajout à l'analyse finale.
S'il est établi que les données ne s'inscrivent pas dans une distribution normale, le lecteur peut alors décider d'utiliser un autre modèle, d'utiliser l'interpolation linéaire ou de consulter un statisticien.
Dans le cas où les données sont hétéroscédastiques, le lecteur doit alors examiner les variances résiduelles pour voir s'il existe un changement dans la variance dans l'ensemble des concentrations. S'il y a un changement dans la variance et que l'écart-type de la concentration inhibitrice (pour un pourcentage d'effet donné, p) est réduit de plus de 10 % lorsqu'une régression pondérée est appliquée, l'hypothèse de l'homoscédasticité doit être réévaluée en utilisant cette régression pondérée. S'il n'y a pas de changement dans la variance dans l'ensemble des concentrations ou si une régression pondérée ne réduit pas l'écart-type de la concentration inhibitrice (pour un pourcentage d'effet donné, p) de plus de 10 %, l'interpolation linéaire doit alors être utilisée ou un statisticien doit être consulté.
Pour procéder aux analyses à l’aide du programme ICPIN, il n’est pas obligatoire de faire appel à un nombre égal de répétitions par concentration. On estime la CIp en lissant au besoin les données, puis en se servant des deux points voisins de la CIp choisie (USEPA, 1995, annexe L; USEPA, 2002, annexe M). Il est impossible de déterminer la CIp sans avoir une concentration d’essai plus faible et une autre plus élevée que la CIp; ces deux concentrations devraient avoir un effet suffisamment rapproché de la valeur choisie de p, de préférence avec un écart de <20 %. Le programme actuel ne comportant pas d’échelle logarithmique pour les concentrations, les utilisateurs canadiens doivent saisir les concentrations sous forme de logarithmes. Certains progiciels du commerce effectuent cette transformation (option générale), mais on devrait s’assurer que les données conservent leur forme logarithmique quand on passe au programme ICPIN. Étant donné que les méthodes habituelles ne seraient pas valides, le programme ICPIN estime les limites de confiance au moyen d’une technique « bootstrap » spéciale qui permet à l’ordinateur d’effectuer un grand nombre de rééchantillonnages à partir des mesures originelles. L’expérimentateur doit préciser ce nombre, qui peut être compris entre 80 et 1000. On recommande ici qu’il soit de ≥400, mais 1000 serait encore plus souhaitableNotes de bas de75page75.
S’il y a absence de juvéniles vivants pour plusieurs concentrations élevées adjacentes, seule la concentration la plus faible de la série devrait être utilisée dans l’analyse (c.-à-d. la concentration la plus proche du milieu de la série de concentrations utilisée dans l’essai). Normalement, l’inclusion de concentrations additionnelles ne présente aucun intérêt particulier puisque ces concentrations n’apportent rien à l’analyse (les données consistent seulement en un nombre nul de descendants).
En plus de déterminer et de consigner les CIp obtenues par ordinateur pour la reproduction des collemboles à la fin de l’essai, l’expérimentateur devrait construire un diagramme du pourcentage de réduction du nombre de descendants vivants en fonction du logarithme de la concentration, et ce, afin de vérifier les estimations mathématiques et de disposer d’une évaluation visuelle de la nature des données (EC, 2005b).
Si le programme ICPIN est utilisé lorsqu’il y a un effet hormétique, une technique de lissage inhérente au programme pourrait changer la valeur témoin et biaiser l’estimation de la CIp. En conséquence, avant de procéder à l’analyse statistique, il est recommandé de remplacer arbitrairement les valeurs hormétiques aux faibles concentrations par la valeur témoin. Cette façon de procéder est considérée comme un expédient provisoire, tant qu’une meilleure approche ne sera pas mise au point (v. option 4, sous-section 10.3.3 de EC, 2005b). La correction est apportée pour toute concentration d’essai dans laquelle l’effet moyen (c.-à-d. la moyenne géométrique des moyennes des répétitions) est plus grand (« meilleur ») que la moyenne pour le témoin. Aux fins de cette correction, on remplace le nombre moyen de descendants observés dans les répétitions à la concentration hormétique (il peut y en avoir plus d’une) par la moyenne des répétitions dans le témoin. La moyenne géométrique pour la ou les concentrations en question sera alors identique à celle obtenue pour le témoin.
4.9 Essais avec un toxique de référence
Le tableau 14 de l’annexe F résume les indications relatives à l’exécution d’essais toxicologiques de référence fournies dans d’autres documents décrivant les modes opératoires et conditions des essais de toxicité d’un sol avec des collemboles. La présente sous-section traite des conditions et modes opératoires applicables aux essais toxicologiques de référence exécutés parallèlement à un essai de toxicité d’un sol de 21 jours (F. fimetariaet P. minuta) ou de 28 jours (F. candidaet O. folsomi) avec des collemboles, de même qu’aux essais visant à déterminer si les élevages de l’espèce qu’on prévoit utiliser dans des essais de toxicité d’un sol sont acceptables et appropriés. Ces conditions et modes opératoires devraient par ailleurs être utilisés pour évaluer la précision intralaboratoire lorsqu’un laboratoire s’apprête pour la première fois à appliquer la présente méthode d’essai biologique (v. 2.3.1 et 2.3.9).
Il faut employer systématiquement un toxique de référence pour évaluer, dans des conditions d’essai normalisées, la sensibilité relative d’une fraction de la population de collemboles adultes d’un élevage particulier (v. 2.3.9) dans lequel on choisira les organismes expérimentaux aux fins de l’essai définitif (il peut y en avoir plus d’un) de toxicité d’un sol. Les essais avec un toxique de référence servent également à démontrer la précision et la fiabilité des données obtenues par le personnel du laboratoire pour le toxique en question, dans des conditions d’essai normalisées. Un essai toxicologique de référence réalisé conformément aux conditions et modes opératoires décrits ici doit être effectué selon l’une ou l’autre des fréquences suivantes :
- au moins une fois tous les deux moisNotes de bas de page76, avec des organismes provenant des élevages destinés à l’essai définitif (v. 2.3);
- au moment de l’essai définitif de toxicité d’un sol, avec des organismes provenant de la même population que celle utilisée pour cet essai (v. 2.3.8 et 2.3.9).
Un laboratoire qui élève des collemboles et qui effectue souvent des essais de toxicité des sols avec ces derniers peut choisir de vérifier régulièrement (p. ex., aux 2 mois) la sensibilité de ses élevages à un ou des toxiques de référence; il inclura alors un essai toxicologique de référence dans lequel il utilisera des collemboles de l’élevage ayant servi à démarrer un essai toxicologique définitif. Le laboratoire peut aussi choisir de vérifier moins fréquemment (p. ex., 2-3 fois par année) la sensibilité de ses élevages et d’effectuer un essai toxicologique de référence en même temps que chaque essai définitif de toxicité d’un sol.
Tout essai toxicologique de référence effectué parallèlement à un essai définitif doit prendre la forme d’un essai de létalité aiguë à concentrations multiples en conditions statiques. Celui-ci doit durer 7 jours dans le cas d’O. folsomi et de F. fimetaria, et 14 jours dans celui de F. candidaNotes de bas de page77 et de P. minuta. Les conditions et modes opératoires décrits dans la présente sous-section pour réaliser un essai de létalité aiguë (7 ou 14 jours) s’appliquent également à chaque essai toxicologique de référence. Les conditions et modes opératoires additionnels décrits ailleurs dans la présente section pour un essai à concentrations multiples sur des échantillons de sol d’essai s’appliquent également aux essais toxicologiques de référence, tout comme les méthodes décrites à la section 6 pour la préparation et la mise à l’essai d’un sol témoin négatif enrichi avec une substance chimique. Pour de plus amples renseignements, le lecteur est invité à consulter cette section. Le document d’orientation d’Environnement Canada sur l’utilisation d’un sédiment témoin enrichi (dopé) avec un toxique de référence (EC, 1995) fournit des renseignements utiles qui s’appliquent également aux essais décrits ici.
Pour l’essai toxicologique de référence, on devrait utiliser des bocaux en verre de 100-125 mL (v. 3.2.2), chacun renfermant une aliquote de 30 g (poids humide) de sol d’essai représentant chaque traitement (concentration). Il faut prévoir ≥3 récipients de répétition par concentration de toxique de référence, et ≥5 pour le sol témoin négatif. Le nombre de collemboles par récipient d’essai est de 10 pour F. candida et P. minuta (5 mâles et 5 femelles dans le cas de cette dernière espèce), comme il est indiqué en 4.2. Pour les essais toxicologiques de référence avec O. folsomi et F. fimetaria, il faut également prévoir 10 organismes (5 mâles et 5 femelles) par récipient d’essai; toutefois, il en va différemment pour l’essai définitif, qui exige 15 organismes (5 mâles et 10 femelles) par récipient pour O. folsomi et 20 organismes (10 mâles et 10 femelles) par récipient pour F. fimetaria (v. 4.2).
Les procédures de démarrage et de fin d’un essai toxicologique de référence devraient être conformes à celles décrites en 4.2 et 4.7, sauf que la durée de l’essai est plus courte (7 jours pour O. folsomi et F. fimetaria, 14 jours pour F. candida et P. minuta). Les conditions d’essai décrites en 4.3 s’appliquent également. Les observations et les mesures sont les mêmes que celles précisées en 4.6.
Pour que l’essai toxicologique de référence soit valide, le taux moyen de survie des collemboles adultes maintenus dans les aliquotes du sol témoin négatif utilisé doit être, à la fin de l’essai (jour 7 ou 14), de ≥80 % pour F. candida, O. folsomi et F. fimetaria et de ≥70 % pour P. minuta. Les paramètres d’essai à calculer et à consigner sont le taux moyen de survie dans chaque traitement à la fin de l’essai (jour 7 ou 14) et la CL50 7 ou 14 jours (y compris ses limites de confiance à 95 %), selon l’espèce. Les résultats d’un essai toxicologique de référence devraient être exprimés en milligrammes de toxique de référence par kilogramme de sol (poids sec).
Les critères convenant au choix du toxique de référence qui sera utilisé dans l’essai parallèle à l’essai définitif de toxicité d’un sol avec des collemboles incluent les suivants (EC, 1995) :
- facilité d’obtention à l’état pur;
- longue durée de conservation (stabilité);
- possibilité de répartir uniformément la substance dans un substrat non contaminé;
- bonne courbe concentration-réponse pour les organismes expérimentaux;
- stabilité en solution aqueuse et dans le sol;
- dangers minimes pour l’utilisateur;
- facilité de dosage de la substance avec précision.
L’essai toxicologique de référence (7 ou 14 jours) exige ≥6 traitements (un sol témoin négatif et 5 concentrations du toxique de référence). Il est recommandé d’employer de l’acide borique de qualité réactif comme toxique de référence, mais on peut aussi avoir recours à d’autres substances chimiques si elles s’avèrent convenablesNotes de bas de78page78. On devrait préparer chaque concentration d’essai conformément aux instructions données en 4.1 et 6.2, en utilisant un sol artificiel (v. 3.3.2) comme substrat.
Il est recommandé d’appliquer les mêmes conditions et modes opératoires décrits ici dans tous les essais toxicologiques de référence (p. ex., ceux effectués tous les deux mois ou parallèlement à chaque essai définitif de toxicité d’un sol) sur un sol témoin négatif enrichi avec de l’acide borique (ou toute autre substance chimique de référence appropriée). Il est conseillé d’effectuer des essais préliminaires pour choisir une série de concentrations d’essai qui permet d’obtenir des mortalités partielles dans ≥2 concentrations et de calculer une CL50 7 jours (O. folsomiNotes de bas de page79 ou F. fimetariaNotes de bas de page80) ou 14 jours (F. candidaNotes de bas de page81 ou P. minutaNotes de bas de page82) (v. 6.4).
Lorsque suffisamment de données ont été recueillies (EC, 1995), on doit porter successivement sur une carte de contrôle toutes les CL50 comparables obtenues à partir des essais avec un toxique de référence donné. Il est conseillé d’examiner chaque nouvelle CL50 du même toxique de référence afin de déterminer si elle se situe dans l’intervalle correspondant à ±2 ET des valeurs obtenues lors d’essais antérieurs avec le même toxique de référence et selon la même méthode d’essai (EC, 1997a, 1997b, 2001, 2004a, 2005a). On doit préparer et mettre à jour une carte de contrôle distincte pour chaque variante opératoire (p. ex., autre espèce de collembole ou autre toxique de référence). Sur chacune de ces cartes, on porte le logarithme de la concentration sur l’axe vertical, et la date ou le numéro de l’essai, sur l’axe horizontal. On devrait comparer chaque nouvelle CL50 du toxique de référence aux limites établies sur la carte; la CL50 est jugée acceptable si elle se trouve à l’intérieur des limites de contrôle de 95 %.
On devrait se servir du logarithme de la concentration (y compris de la CL50) pour tous les calculs des moyennes et des écarts types et pour tous les diagrammes. On s’assure ainsi que chaque CL50 a été estimée en fonction des logarithmes des concentrations. On peut construire la carte de contrôle en reportant les valeurs logarithmiques de la moyenne et de ±2 ET sur du papier graphique à échelle arithmétique, ou en convertissant ces données en valeurs arithmétiques et en portant ces dernières sur l’échelle logarithmique d’un papier semi-logarithmique. Si les CL50 n’obéissent pas à une distribution log-normale, il pourrait s’avérer préférable d’opter pour une moyenne et un écart type arithmétiques.
Pour chaque CL50 successive du toxique de référence, on devrait recalculer la moyenne des valeurs de log(CL50) connues ainsi que les limites de contrôle de 95 % supérieure et inférieure (±2 ET) jusqu’à ce que les statistiques se stabilisent (EC, 1995, 1997a, 1997b, 2001, 2004a, 2005a). Si une CL50 donnée tombe à l’extérieur de ces limites, il convient de mettre en doute la sensibilité des organismes expérimentaux, de même que l’exécution et la précision de l’essai. Étant donné que cette situation peut se produire dans 5 % des cas par le seul jeu du hasard, une CL50 aberrante n’est pas nécessairement un signe de sensibilité anormale de l’élevage ou d’une précision insatisfaisante des données toxicologiques. Ce serait plutôt un avertissement. On devrait procéder à un examen approfondi de toutes les conditions d’élevage et de tous les modes opératoires appliqués. Selon les constatations, on pourrait devoir reprendre l’essai toxicologique de référence, établir un nouvel élevage, choisir des collemboles provenant d’un autre élevage ou se procurer une nouvelle population d’organismes expérimentaux d’une source extérieure avant d’entreprendre d’autres essais de toxicité d’un sol.
Le fait que les résultats soient tous à l’intérieur des limites de contrôle de 95 % n’est pas nécessairement un gage de la cohérence des résultats obtenus par le laboratoire. Des données historiques extrêmement variables pour un toxique de référence donné élargiraient les limites; ainsi, une nouvelle donnée simple pourrait se trouver à l’intérieur des limites, tout en représentant une variation indésirable des résultats de l’essai. Environnement Canada (EC, 1995, 2005b) propose comme limite raisonnable un CV de ≤30 %, de préférence de ≤20 %, pour la moyenne des valeurs de log(CL50) connues (v. paragraphe précédent). Aux fins de la présente méthode d’essai biologique, on recommande d’adopter un CV de ≤30 % pour les données historiques moyennes dérivées d’essais toxicologiques de référence avec de l’acide borique.
Les concentrations du toxique de référence dans toutes les solutions mères peuvent être mesurées au moyen d’analyses chimiques appropriées [p. ex., méthodes d’analyse faisant intervenir la spectrophotométrie d’émission atomique à l’aide d’un plasma induit par haute fréquence (SEA/PIHF), pour la concentration du bore]. Pour préparer les concentrations d’essai du toxique de référence dans un sol, on ajoute une quantité mesurée de solution mère au sol témoin négatifNotes de bas de page83 et on mélange soigneusementNotes de bas de page84. Une fois les mélanges de toxique de référence et de sol préparés, il est recommandé de prélever des aliquotes au moins du sol témoin négatif et des concentrations faible, moyenne et élevéeNotes de bas de page85. Chaque aliquote devrait être soit analysée immédiatement, soit conservée en vue d’une analyse ultérieure (à la fin de l’essai), si la CL50 7 ou 14 jours calculée en fonction des concentrations nominales se situe en dehors des limites de contrôle. Le cas échéant, les aliquotes doivent être entreposées dans l’obscurité à 4 ± 2 °C. Ces aliquotes devraient être analysées peu de temps après la fin de l’essai toxicologique de référence. Le calcul de la CL50 7 ou 14 jours devrait se fonder sur les concentrations mesurées si celles-ci sont passablement différentes (soit ≥20 %) des valeurs nominales et si la précision des analyses chimiques est satisfaisante.
Si on utilise de l’acide borique comme toxique de référence, la méthode d’analyse décrite ci-après s’applique (MEEO, 1996). Un sous- échantillon de 1-5 g de sol enrichi avec de l’acide borique est mis à sécher à 105 °C jusqu’à obtention d’un poids constant. On extrait ensuite une aliquote de 1 g à l’aide d’une solution de CaCl2 0,01 M en faisant bouillir une suspension de sol dans 50 mL de cette solution d’extraction et en ajoutant une quantité supplémentaire de cette solution pour rajuster le volume final à 50 mL. L’extrait de 50 mL est ensuite filtré à travers un filtre Whatman no 4, puis dilué jusqu’à obtention d’un volume final de 100 mL. Un échantillon témoin est préparé de la même manière. On analyse ensuite le filtrat par la méthode SEA/PIHF afin de doser le bore élémentaire. On calcule la concentration d’acide borique dans le sol à l’aide de l’équation suivante :

acide borique
La concentration du sol en acide borique peut être calculée en divisant le poids moléculaire de l'acide borique par le poids moléculaire du bore, puis en multipliant le résultat obtenu par les éléments suivants : le nombre mesuré de microgrammes de bore par millilitre, le volume final (en millilitres) et 1 000 000. Ce résultat est ensuite divisé par le produit de 1 000 microgrammes et le poids de l'échantillon (poids sec en milligrammes).
où :
Vf = volume final
PM = poids moléculaire
ab = acide borique
Dans la plupart des cas, le seuil de détection pour l’acide borique dans le sol est de 1 mg d’acide borique par kilogramme de sol (poids sec) (Stephenson, 2003).
En plus d’effectuer des essais de létalité aiguë avec un toxique de référence, tout laboratoire menant des essais de 21 ou 28 jours sur des échantillons de sol contaminé (prélevé sur le terrain ou enrichi avec une substance chimique) devrait également réaliser un ou des essais de 21 ou 28 jours avec ses propres élevages de F. fimetaria/P. minuta et de F. candida/O. folsomi, respectivement, en utilisant un toxique de référence. Conformément aux orientations données dans EC (2004a, 2005a), ces essais devraient être effectués au moins deux fois par an ou, lorsque les essais de toxicité d’un sol contaminé sont moins fréquents, en parallèle avec chaque essai définitif de toxicité d’un sol. Les modes opératoires et les conditions à appliquer à ces essais toxicologiques de 21 ou 28 jours devraient être conformes à ceux décrits dans la présente section. On devrait comparer toute donnée relative à un paramètre (CL50 ou CIp 21 ou 28 jours; v. 4.8) aux valeurs obtenues antérieurement pour les mêmes espèces, par le même laboratoire et pour le même toxique de référence. Ces essais et cette comparaison permettent de s’assurer que les conditions et les méthodes d’essai du laboratoire sont adéquates dans l’exécution d’un essai de 21 ou 28 jours, et de vérifier que la réaction à long terme des collemboles au toxique de référence n’a pas sensiblement changé par rapport à celle observée dans les essais à long terme que le laboratoire a effectués antérieurement avec cette substance chimique. L’acide borique additionné à un sol artificiel est le toxique de référence recommandé pour cet essai de 21 ou 28 joursNotes de bas de page86.