L’Observateur des médicaments émergents 2021

Avril 2022
ISSN: 2562-3834
No de cat. : H79-5F-PDF
Renseignements connexes
Conseil d’examen du prix des médicaments brevetés
Centre Standard Life
Case postale L40
333, avenue Laurier Ouest
Bureau 1400
Ottawa (Ontario) K1P 1C1
Téléphone : 1-877-861-2350
ATS : 613-288-9654
Courriel : PMPRB.Information-Renseignements.CEPMB@pmprb-cepmb.gc.ca
Remerciements
Le présent rapport a été rédigé par le CEPMB au titre de l’initiative du SNIUMP.
Le CEPMB tient à remercier les membres du Comité consultatif du SNIUMP pour leur supervision spécialisée et leur orientation dans le cadre de la rédaction du présent rapport. Veuillez noter que les énoncés et les constatations du présent rapport ne reflètent pas nécessairement ceux des membres ou de leurs organisations.
Nous remercions sincèrement Patricia Carruthers-Czyzewski, B. Sc. (phm.), M. Sc., Sintera Inc., pour son expertise du domaine pharmaceutique et sa contribution à l’évaluation scientifique.
Nous remercions Allison Carey d’avoir dirigé le projet, ainsi que Tanya Potashnik et Brian O’Shea d’avoir supervisé la rédaction du rapport. Le CEPMB tient également à souligner la contribution de Sarah Parker et de Laura Fortune, membres de l’équipe rédactionnelle.
Avis de non‑responsabilité
Le SNIUMP fonctionne indépendamment des activités réglementaires du Conseil du CEPMB. Les priorités de recherche, les données, les déclarations et les opinions présentées ou reproduites dans les rapports du SNIUMP ne reflètent pas la position du CEPMB au sujet des questions réglementaires. Les rapports du SNIUMP ne contiennent pas d’information confidentielle ou protégée en vertu des articles 87 et 88 de la Loi sur les brevets, et la mention d’un médicament dans un rapport du SNIUMP ne revient pas à reconnaître ou à nier que le médicament fait l’objet d’une demande de brevet en vertu des articles 80, 81 ou 82 de la Loi sur les brevets ou encore que son prix est ou n’est pas excessif au sens de l’article 85 de la Loi sur les brevets.
Bien que ces renseignements soient en partie fondés sur des données obtenues avec l’autorisation de GlobalData et à partir de la base de données MIDAS®, propriété exclusive d’IQVIA Solutions Canada Inc. et de ses filiales (IQVIA), les énoncés, les résultats, les conclusions, les points de vue et les opinions exprimés dans le présent rapport sont exclusivement ceux du CEPMB et ne sont pas imputables à GlobalData ou à IQVIA.
Sommaire
L’Observateur des médicaments émergents (OMÉ) est un rapport d’analyse prospective qui présente une sélection de nouveaux médicaments qui en sont aux dernières étapes de l’évaluation clinique et qui pourraient avoir une incidence importante sur la pratique clinique future ou sur les dépenses en médicaments au Canada.
Les médicaments en essais cliniques de phase III ou en attente d’homologation sont considérés pour la sélection s’ils peuvent répondre à un besoin thérapeutique non comblé, offrir un mécanisme d’action nouveau ou un avantage thérapeutique par rapport aux traitements existants, ou traiter une affection grave. La sélection finale présente des médicaments provenant d’un large éventail de domaines thérapeutiques. En plus de désigner les nouveaux médicaments à inclure dans la liste, la présente édition fait le suivi de médicaments figurant dans la version précédente de l’OMÉ pour rendre compte des changements de leur état d’émergence. Une section axée sur le Canada met en évidence les médicaments potentiellement importants actuellement examinés par Santé Canada.
Cette édition du rapport comprend également une section sur la COVID‑19, qui donne un aperçu des médicaments en cours d’essais cliniques de phase I, II et III ou en attente d’homologation pour le traitement et la prévention de la nouvelle maladie à coronavirus.
Le rapport rassemble des données provenant de deux sources principales : la base de données GlobalData Healthcare est utilisée pour relever les médicaments actuellement en essais cliniques, tandis que la liste des présentations de médicaments et de produits de santé en cours d’examen (PCE) de Santé Canada fournit de l’information sur les nouveaux médicaments en cours d’examen au Canada.
Avec sa publication complémentaire, la Veille des médicaments mis en marché, cette série de rapports assure une surveillance des médicaments nouveaux ou émergents au Canada et à l’étranger et fournit des renseignements clés aux décideurs, aux chercheurs, aux patients, aux cliniciens et aux autres intervenants.
Faits saillants relatifs aux médicaments émergents en 2021
- En 2021, les médicaments émergents comprenaient près de 8 500 nouveaux médicaments à différentes étapes de l’évaluation, comparativement à un peu moins de 7 000 l’année précédente. Le nombre plus élevé que la moyenne de nouveaux médicaments émergents pourrait être attribuable à la pandémie actuelle de COVID‑19, qui a retardé les essais cliniques dans d’autres domaines thérapeutiques.
- Conformément aux années précédentes, les 1 145 nouveaux médicaments en cours d’essais cliniques de phase III et en attente d’homologation en 2021 représentaient un large éventail de domaines thérapeutiques ainsi que 13 % du nombre total de médicaments émergents.
- L’oncologie a continué de dominer l’éventail thérapeutique en 2021, les traitements contre le cancer représentant plus du tiers (35 %) des médicaments à toutes les phases des essais cliniques. Les traitements contre les maladies infectieuses ont occupé la deuxième place, représentant 14 % des médicaments émergents. Ces résultats s’expliquent par les mesures d’intervention rapide prises pour lutter contre la pandémie de COVID‑19.
- Un tiers (33 %) des médicaments en cours d’essais cliniques de phase III ou en attente d’homologation avaient une désignation rapide de médicament orphelin approuvée par la FDA des États-Unis ou l’Agence européenne des médicaments, ce qui concorde avec la tendance à la hausse de la prévalence des médicaments orphelins entrant sur le marché pharmaceutique.
- Trente et un nouveaux médicaments aux dernières étapes ont été sélectionnés pour être ajoutés à la liste de l’OMÉ 2021 en raison de leur incidence potentielle sur le système de soins de santé au Canada. Certains de ces médicaments pourraient offrir des percées dans la réponse à des besoins jusqu’ici non comblés ou encore des possibilités dans le traitement de grandes populations de patients.
- Selon les prévisions, cinq nouveaux médicaments ajoutés à l’OMÉ en 2021 devraient générer des revenus annuels mondiaux de plus d’un milliard de dollars américains d’ici 2027.
- Sur les 27 nouveaux médicaments présentés dans l’édition 2020 de l’OMÉ, neuf ont obtenu une autorisation de mise en marché, dix ont été maintenus sur la liste car ils répondaient toujours aux critères de sélection, et huit ont été supprimés car leurs essais cliniques avaient été abandonnés ou ils ne répondaient plus aux critères de sélection.
- En date de septembre 2021, 663 vaccins et traitements étaient en cours d’évaluation clinique à l’échelle mondiale pour la prévention et le traitement de la COVID‑19.
- En date de février 2022, Santé Canada examinait 18 présentations de drogues nouvelles et suppléments à une présentation de drogue nouvelle pour déterminer l’innocuité de ces médicaments et leur efficacité dans la prévention et le traitement de la COVID‑19.
Liste de termes
Les termes suivants et leurs définitions s’appliquent aux fins du présent rapport.
- Efficacité clinique :
- Réponse maximale possible d’un médicament en contexte de recherche médicale et capacité d’avoir un effet thérapeutique suffisant en contexte cliniqueNote de bas de page i.
- Thérapie génique :
- Technique utilisée pour traiter des maladies génétiques, qui consiste à remplacer un gène absent ou défectueux par un gène sain, selon la définition de Santé CanadaNote de bas de page ii.
- Autorisation de mise en marché :
- Processus d’approbation de la commercialisation d’un médicament dans un pays donné. Au Canada, l’approbation de la commercialisation est accordée à la suite d’une évaluation scientifique approfondie de l’innocuité, de l’efficacité et de la qualité d’un produit, conformément aux exigences de la Loi sur les aliments et drogues et de son RèglementNote de bas de page iii.
- Ingrédient médicinal :
- Substance chimique ou biologique responsable de l’effet pharmacologique d’un produit médicamenteux. Parfois appelé molécule, substance active ou ingrédientNote de bas de page iv.
- Médicament :
- Terme général englobant à la fois le produit médicamenteux final et les ingrédients médicinaux, notamment les substances actives et les produits biologiques fabriqués chimiquement, ainsi que les thérapies géniques. Les médicaments sont déclarés au niveau des ingrédients médicinaux et peuvent faire référence à un seul ingrédient ou à une combinaison unique d’ingrédients.
- Médicaments émergents :
- Ensemble de nouveaux médicaments candidats qui font l’objet d’un programme actif de recherche et de développement par une société de biotechnologie ou une société pharmaceutique.
- Nouveau médicament :
- Ingrédient médicinal dont la mise en marché n’a pas encore été autorisée par un organisme de réglementationNote de bas de page iv.
- Médicament orphelin :
- Médicament utilisé pour traiter une maladie rare. Pour les besoins de cette étude, les médicaments orphelins sont définis comme ayant une désignation de médicament orphelin accordée par la Food and Drug Administration (FDA) des États-Unis ou l’Agence européenne des médicaments (EMA) pour l’indication concernée.
- Phase I :
- Ces essais permettent de tester pour la première fois un médicament expérimental sur un petit groupe de personnes. L’objectif est d’examiner l’innocuité du médicament, de déterminer une gamme de doses sûres et de surveiller les éventuels effets secondaires.
- Phase II :
- Dans cette phase, le médicament est administré à un plus grand groupe de personnes (généralement 100 ou plus) en vue de recueillir des données sur l’efficacité du médicament pour traiter une maladie ou une affection, de vérifier son innocuité sur un plus grand nombre de personnes et de déterminer la meilleure doseNote de bas de page v.
- Phase III :
- Ces essais, contrôlés ou non, sont effectués après que des données préliminaires permettent de croire que l’efficacité du médicament a été démontrée. Ces essais visent à recueillir des données supplémentaires permettant de confirmer l’efficacité et l’innocuité cliniques du médicament dans les conditions d’utilisation proposéesNote de bas de page ii. Les essais de phase III sont habituellement des essais randomisés à double insu menés auprès de plusieurs centaines ou de plusieurs milliers de patients.
- En attente d’homologation :
- Un médicament est en attente d’homologation lorsque tous les essais cliniques nécessaires sont terminés et que son homologation ou l’approbation de son utilisation est en cours d’examen par un organisme de réglementationNote de bas de page vi.
Phases des essais cliniques
Introduction
La onzième édition de l’Observateur des médicaments émergents (OMÉ) présente une sélection de médicaments qui en sont à l’étape des essais cliniques de phase III ou en attente d’homologation en 2021 et qui peuvent avoir une incidence importante sur la pratique clinique ou les dépenses en médicaments au Canada.
La méthodologie, qui est décrite en détail dans la section suivante, utilise un ensemble précis de critères pour dresser la liste des médicaments candidats tirés de la base de données GlobalData Healthcare, ainsi que la liste des candidats en cours d’examen au Canada selon la liste des PCE de Santé Canada. Les médicaments mentionnés dans l’édition précédente sont également passés en revue dans la présente édition, qu’il s’agisse de ceux qui continuent à figurer sur la liste des candidats ou de ceux qui ont entre-temps reçu une autorisation de mise en marché. De même, les nouveaux médicaments figurant dans le présent rapport feront l’objet d’un suivi dans les prochaines éditions de l’OMÉ afin de relever ceux qui réussissent à faire leur entrée sur le marché.
Pour mettre en contexte la sélection des médicaments, l’OMÉ comprend un aperçu de l’ensemble des médicaments émergents, qui met l’accent sur la ventilation thérapeutique de chaque phase d’essais cliniques. Cette édition du rapport met également en lumière certains vaccins et autres médicaments en cours d’évaluation pour le traitement et la prévention de la COVID‑19, dans les marchés mondiaux ainsi qu’au Canada. Les médicaments évalués pour cette partie de l’analyse comprennent de nouveaux traitements ainsi que des traitements précédemment commercialisés qui ont été repositionnés.
L’Observateur des médicaments émergents est une publication complémentaire à la Veille des médicaments mis en marché qui analyse la dynamique du marché des médicaments nouvellement approuvés au Canada et à l’étranger. Ensemble, ces deux rapports du CEPMB permettent de surveiller le continuum post-commercialisation des médicaments émergents aux dernières étapes de développement et des nouveaux médicaments approuvés, en plus de fournir de l’information sur les médicaments émergents et les pressions changeantes sur les coûts aux décideurs, aux chercheurs, aux patients, aux cliniciens et à d’autres intervenants.
Méthodologie
Aperçu des médicaments émergents
L’aperçu des médicaments émergents permet de saisir la composition des médicaments qui en sont aux diverses étapes des essais cliniques à un moment précis. Aux fins de l’analyse, une liste complète des médicaments émergents a été extraite de la base de données GlobalData Healthcare en septembre 2021.
Les nouveaux ingrédients médicinaux sont ceux qui n’ont pas été approuvés antérieurement par la Food and Drug Administration (FDA) des États-Unis, l’Agence européenne des médicaments (EMA) ou Santé Canada. La répartition des nouveaux médicaments par domaine thérapeutique correspond à l’indication en cours d’évaluation, selon les données de GlobalData. Il convient de préciser qu’un même médicament nouveau peut faire l’objet de plusieurs essais cliniques portant sur des indications distinctes.
La liste des médicaments utilisés pour l’analyse des médicaments orphelins émergents a été extraite en septembre 2021. Pour les besoins de cette analyse, les médicaments orphelins ont été définis comme de nouveaux médicaments ayant reçu une désignation de médicament orphelin par la FDA des États-Unis ou l’Agence européenne des médicaments.
L’Observateur des médicaments émergents
L’OMÉ met l’accent sur les nouveaux médicaments qui sont en cours d’essais cliniques de phase III ou en attente d’homologation au Canada, aux États-Unis et en Europe. La sélection des médicaments émergents repose sur un processus en deux étapes (figure 1). À l’étape de la sélection initiale, les médicaments choisis en sont aux dernières étapes de l’évaluation clinique, tandis qu’à l’étape de l’examen analytique, une évaluation plus rigoureuse de chaque médicament potentiel est effectuée pour déterminer les médicaments qui pourraient avoir une incidence clinique ou budgétaire importante. La deuxième étape tient compte d’un ensemble précis de critères, ainsi que des résultats d’un examen approfondi des données cliniques et des publications scientifiques.
La méthodologie est examinée annuellement et perfectionnée au besoin.
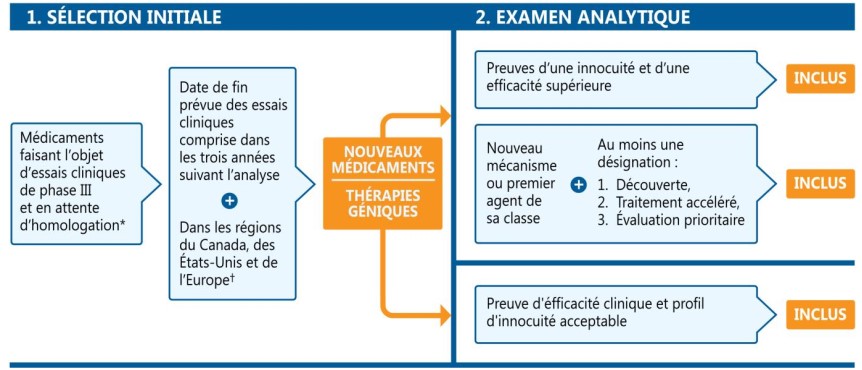
* En attente d’homologation par la Food and Drug Administration (FDA) des États-Unis.
† Essais cliniques de phase III menés au Canada, aux États-Unis ou sur le continent européen (à l’exclusion de la Russie et de la Turquie).
Description de la figure
Cet organigramme décrit la procédure de sélection des nouveaux médicaments inscrits. L’organigramme comprend deux étapes :
1. Sélection initiale
Cette étape comprend d’abord tous les médicaments faisant l’objet d’essais cliniques de phase III ou en attente d’homologation par la Food and Drug Administration des États-Unis. À l’étape suivante, les seuls médicaments retenus sont ceux dont la date de fin prévue des essais cliniques est comprise dans les trois années suivant l’analyse, dans les régions du Canada, des États-Unis et de l’Europe. Pour qu’un médicament satisfasse au critère géographique, des essais cliniques de phase III doivent être menés au Canada, aux États-Unis ou sur le continent européen (à l’exclusion de la Russie et de la Turquie).
2. Examen analytique
L’étape d’examen analytique comprend deux parties : une voie pour les nouveaux médicaments et une autre pour les thérapies géniques.
Les nouveaux médicaments doivent satisfaire au moins l’une des exigences suivantes pour figurer dans la liste :
- Preuves d’une innocuité et d’une efficacité supérieures.
- Nouveau mécanisme ou premier agent de sa classe, avec au moins une désignation parmi les suivantes : découverte, traitement accéléré ou évaluation prioritaire.
Les thérapies géniques doivent présenter un profil d’innocuité ou d’efficacité clinique prometteur pour figurer dans la liste.
Étape 1. Sélection initiale
La base de données GlobalData Healthcare est utilisée pour dresser une liste de médicaments en cours d’essais cliniques de phase III ou en attente d’homologation. Ces médicaments servent de base pour l’étape de la sélection initiale.
La géographie des médicaments, qui s’entend de la région géographique ou du pays où le médicament est commercialisé ou en développement, se limite au Canada et à d’autres pays ayant des processus de réglementation et d’approbation semblables, soit les États-Unis et le continent européen (à l’exclusion de la Russie et de la Turquie). Seuls les nouveaux ingrédients médicinaux dont l’innocuité et l’efficacité accrues démontrées dans les essais cliniques sont établies par des données adéquates peuvent être considérés pour la sélection.
Les médicaments approuvés ou vendus au Canada, aux États-Unis ou en Europe pour toute autre indication ou dans toute autre concentration ou formulation sont exclus du processus de sélection, tout comme les médicaments dont les essais cliniques sont inactifs, suspendus, retirés ou terminés.
Le processus de sélection regroupe les médicaments candidats en deux catégories : a) les nouveaux médicaments et b) les nouvelles thérapies géniques. Comme l’illustre la figure 1, le processus de sélection initiale est le même pour les deux catégories, mais l’examen analytique diffère légèrement, car les données accessibles pour les thérapies géniques sont limitées.
Étape 2. Examen analytique
Critères de sélection
La seconde étape du processus tient compte d’un certain nombre de critères de sélection pour déterminer la liste finale des médicaments émergents candidats. Ces critères sont exposés en détail dans le tableau 1.
Les thérapies géniques sont sélectionnées selon une approche plus générale, étant donné que les données cliniques accessibles sur cette catégorie sont relativement limitées. Pour rester sur la liste, une thérapie génique doit présenter des résultats préliminaires (ou définitifs) provenant d’essais de phase III, indiquant qu’il existe des données démontrant l’efficacité clinique de la thérapie et un profil d’innocuité acceptable.
Tableau 1. Critères de sélection de l’OMÉ
| Critères de sélection |
|---|
| Amélioration de l’innocuité ou de l’efficacité démontrée dans les essais cliniques : médicament qui est associé à une innocuité accrue, à de nouvelles mesures des résultats, à une espérance de vie accrue ou à une meilleure qualité de vie. |
Nouveau mécanisme/premier de sa classe : médicament qui utilise un nouveau mécanisme d’interaction biochimique pour produire un effet médical, ou médicament qui est le premier de sa classe thérapeutique. De plus, le médicament doit correspondre à l’une ou à plusieurs des trois désignations suivantes de la FDA pour le développement et l’examen accélérés :
|
Renseignements descriptifs supplémentaires
Le profil de chaque médicament candidat retenu est fourni, ce qui comprend un aperçu de l’indication et du mécanisme d’action, ainsi qu’un résumé des résultats publiés applicables provenant d’essais cliniques. Les attributs particuliers qui peuvent influer sur l’adoption éventuelle ou le coût de chaque médicament sont également énoncés. Le tableau 2 fournit une description détaillée de ces principaux attributs.
Tableau 2. Principaux attributs des nouveaux médicaments sélectionnés pour l’OMÉ
| Attribut | Pertinence | Source de données |
|---|---|---|
| Essais cliniques de phase III au Canada | Les médicaments mis à l’essai au Canada sont susceptibles d’intéresser les Canadiens. |
GlobalData Healthcare; base de données sur les essais cliniques de Santé Canada; présentations de médicaments et de produits de santé en cours d’examen par Santé Canada; registre des essais cliniques des National Institutes of Health (NIH) |
| Désignation de médicament rare ou orphelin | Les médicaments utilisés dans le traitement de maladies ou de problèmes de santé rares ont généralement des coûts de traitement élevés et peuvent entraîner des dépenses importantes. | GlobalData Healthcare |
| Produit biologique | Ces molécules complexes produites par des organismes vivants devraient avoir des coûts élevés et entraîner ainsi des dépenses importantes. | |
| Traitement d’appoint | Les médicaments conçus pour être utilisés en association avec des médicaments existants peuvent augmenter les coûts de traitement et contribuer à une augmentation des dépenses. |
Le profil précise également les répercussions possibles sur les coûts, le cas échéant, y compris les revenus mondiaux prévus déclarés par GlobalData.
Les indications et les domaines thérapeutiques des médicaments présentés correspondent à leur stade d’essai clinique de phase III ou d’attente d’homologation. Un même essai clinique peut évaluer plusieurs indications du même domaine thérapeutique. Ces médicaments peuvent avoir des indications supplémentaires à divers stades de l’évaluation clinique, qui ne sont pas mentionnées dans le présent rapport. La description scientifique et les principaux attributs présentés portent sur l’indication ou les indications précisées pour les médicaments sélectionnés.
Les médicaments mentionnés pour une année donnée sont réévalués à chaque édition de l’OMÉ. On peut les maintenir sur la liste de l’OMÉ s’ils continuent à répondre aux critères de sélection ou on peut les retirer lorsque la FDA des États-Unis, l’EMA ou Santé Canada leur accorde une autorisation de mise en marché. Les médicaments faisant l’objet d’essais cliniques ayant été interrompus ou dont les critères de sélection ne sont plus atteints ne sont pas mentionnés dans les éditions suivantes.
Pleins feux sur le Canada
Les PCE de Santé Canada sont évaluées selon une approche modifiée des critères de sélection afin d’établir une liste de médicaments susceptibles d’avoir une incidence importante sur les dépenses en médicaments au Canada.
Les médicaments de la liste des PCE comprennent les nouveaux médicaments contenant des ingrédients médicinaux qui n’ont pas été approuvés au Canada pour toute indication ou dans toute concentration ou formulation. Contrairement aux médicaments sélectionnés dans les listes de médicaments émergents, ceux-ci peuvent avoir déjà reçu une autorisation de mise en marché par la FDA des États-Unis ou l’EMA.
Critères de sélection
Après la sélection initiale, le médicament doit satisfaire à au moins un des trois critères de sélection pour figurer dans le rapport. Ces critères sont présentés dans le tableau 3.
Tableau 3. Critères de sélection pour la liste des médicaments en cours d’examen par Santé Canada
| Critères de sélection |
|---|
| Amélioration de l’innocuité ou de l’efficacité démontrée dans les essais cliniques : médicament qui est associé à une innocuité accrue, à de nouvelles mesures des résultats, à une espérance de vie accrue ou à une meilleure qualité de vie. |
| Nouveau mécanisme/premier de sa classe : médicament qui utilise un nouveau mécanisme d’interaction biochimique pour produire un effet médical, ou médicament qui est le premier de sa classe thérapeutique. |
| Thérapie génique : technique utilisée pour traiter des maladies génétiques, qui consiste à remplacer un gène absent ou défectueux par un gène sain |
Renseignements descriptifs supplémentaires
Le profil de chaque médicament en cours d’examen comprend les principaux attributs énoncés au tableau 2 et un aperçu de l’indication et du mécanisme d’action, ainsi qu’un résumé des résultats publiés pertinents des essais cliniques. Les attributs particuliers qui peuvent influer sur l’adoption éventuelle ou le coût de chaque médicament sont également énoncés, tout comme les répercussions possibles sur les coûts, le cas échéant, y compris les revenus mondiaux prévus selon GlobalData.
Bien que les désignations de la FDA pour le développement et l’examen accélérés ne constituent pas des critères de sélection pour cette liste, les désignations pertinentes (découverte, processus accéléré et examen prioritaire) sont mentionnées lorsqu’elles sont disponibles. Ces désignations sont décrites au tableau 1.
Les indications et les domaines thérapeutiques correspondent aux renseignements fournis par GlobalData. La description scientifique et les principaux attributs fournis sont axés sur l’indication précisée pour un médicament donné. Dans le cas des médicaments examinés pour plusieurs indications, c’est l’indication principale qui est retenue.
Traitements émergents contre la COVID-19
Les vaccins et les médicaments en cours de développement dans le monde entier comportant une indication pour la COVID‑19 ont été extraits pour cette section du rapport, en fonction de l’état d’avancement dans les essais cliniques de phase I, II et III ou de l’attente d’homologation. Tous ces médicaments ont été évalués pour cette analyse, qu’ils soient nouveaux ou existants. Les nouveaux médicaments ont été déterminés comme étant ceux qui n’ont pas encore été commercialisés pour une quelconque indication, tandis que les médicaments existants comprennent les traitements commercialisés antérieurement qui sont en cours d’évaluation pour de nouvelles indications liées au traitement de la COVID‑19.
Cette section met également en évidence les médicaments contre la COVID‑19 qui ont été approuvés au Canada, ainsi que les médicaments qui font actuellement l’objet d’un processus d’examen accéléré.
Sources des données
La base de données GlobalData Healthcare est la principale source de données pour la désignation des médicaments émergents et la consignation des renseignements cliniques correspondants, y compris la date de fin des essais cliniques. GlobalData Healthcare fait le suivi des médicaments depuis leur découverte préclinique, en passant par les essais cliniques, jusqu’au lancement sur le marché et aux ventes subséquentes. La base de données est une ressource complète de médicaments à divers stades de développement clinique. Les capacités de recherche permettent une sélection contrôlée d’attributs particuliers, notamment la phase de développement clinique, le domaine thérapeutique, le type de molécule, l’indication, la géographie du médicament, le mécanisme d’action et les désignations réglementaires.
Les listes des PCE de Santé Canada sont utilisées pour déterminer la sélection présentée des nouveaux médicaments en cours d’examen par Santé Canada. Les PCE constituent un ensemble de listes accessibles au public énumérant les présentations de produits pharmaceutiques et biologiques qui contiennent de nouveaux ingrédients médicinaux, lesquels n’ont pas encore été approuvés au Canada, et qui ont été acceptés pour examen. Cela s’applique aux présentations acceptées au plus tôt le 1er avril 2015.
Étant donné que la sélection se limite aux nouveaux médicaments, d’autres sources d’information sont comparées pour confirmer que les médicaments candidats n’ont pas été approuvés ou vendus auparavant. Ces sources comprennent les données de vente enregistrées de la base de données MIDAS® d’IQVIA (tous droits réservés), les dossiers d’approbation réglementaire des National Institutes of Health (NIH), de la FDA des États-Unis, de l’EMA et de Santé Canada, et des renseignements issus de la base de données sur les essais cliniques de Santé Canada et de ClinicalTrials.org.
Limites
La présente analyse donne un aperçu des médicaments émergents pour une période donnée. Bien qu’il soit censé être représentatif de la composition des médicaments au cours de l’année complète, l’ensemble des médicaments émergents est assez dynamique, et la part des médicaments dans un domaine thérapeutique particulier peut varier.
L’évaluation se limite aux médicaments en développement destinés à la commercialisation au Canada et dans d’autres pays ayant des processus de réglementation et d’approbation semblables, soit les États-Unis et l’Europe (à l’exclusion de la Russie et de la Turquie). Les médicaments qui n’ont pas encore reçu d’autorisation de mise en marché dans ces pays ont été considérés comme des médicaments candidats potentiels, même s’ils ont été approuvés ailleurs dans le monde.
Certains des médicaments sélectionnés peuvent faire l’objet d’essais cliniques pour des indications supplémentaires; la présente analyse ne fait état que des indications aux derniers stades de développement, c’est-à-dire lors des essais cliniques de phase III ou en attente d’homologation par la FDA des États-Unis, qui répondent aux critères de sélection énoncés dans la méthodologie.
Pour chaque médicament émergent sélectionné, les principaux fabricants et le nom commercial, le cas échéant, sont précisés avec l’indication. Dans certains cas, d’autres fabricants, y compris des filiales, peuvent également participer au développement du médicament avec les principales entreprises, ou d’autres fabricants peuvent mettre au point le même médicament pour d’autres indications.
Bien que le présent rapport tente de définir les médicaments émergents les plus importants, la sélection n’est pas exhaustive, et certains médicaments qui ne sont pas inclus dans cette sélection peuvent avoir une incidence importante sur la pratique clinique future ou les dépenses en médicaments au Canada.
Sauf indication contraire, les listes présentées rendent compte de la composition des médicaments émergents à partir de septembre 2021 et elles sont valides dès mars 2022. En raison de la nature imprévisible et rapide de l’entrée sur le marché des médicaments émergents, certains des médicaments énumérés dans la présente édition peuvent avoir été approuvés ou commercialisés au Canada, aux États-Unis ou en Europe après cette date. Les médicaments émergents qui n’ont pas été inclus dans le rapport en raison du calendrier de sélection peuvent actuellement répondre aux critères de sélection et ceux-ci, ainsi que le reste de la liste des médicaments émergents, seront pris en considération pour la prochaine édition du rapport.
Aperçu des médicaments émergents en 2021
L’innovation pharmaceutique transforme le développement et l’application des traitements médicaux dans le monde entier. En 2021, près de 8 500 nouveaux médicaments étaient en cours d’évaluation clinique ou en attente d’homologation.
La figure 2 donne un aperçu des médicaments émergents en 2021, y compris du nombre de nouveaux ingrédients médicinaux pour chaque phase de l’évaluation clinique. Parmi les 8 460 nouveaux médicaments, 1 145 (13 %) faisaient l’objet d’essais cliniques de phase III ou étaient en attente d’homologation.
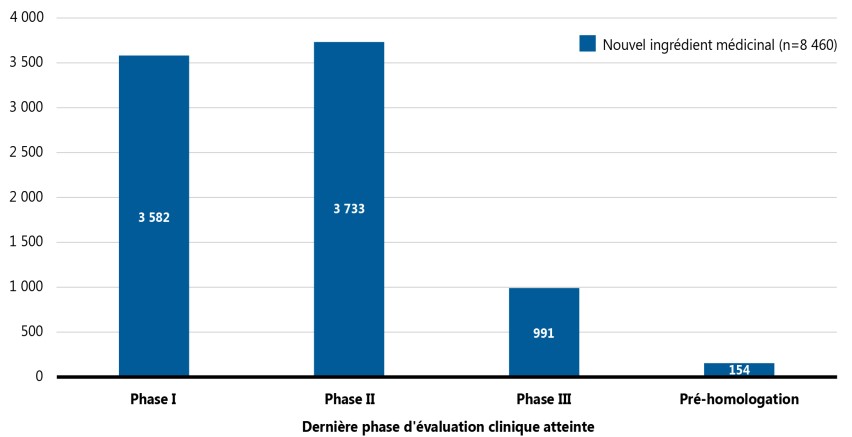
Description de la figure
Ce graphique à barres empilées illustre le nombre de nouveaux ingrédients médicinaux selon la dernière phase d’évaluation clinique atteinte en septembre 2021. Il y avait 8 460 nouveaux médicaments, dont 3 582 faisaient l’objet d’essais cliniques de phase I, 3 733 faisaient l’objet d’essais cliniques de phase II, 991 faisaient l’objet d’essais cliniques de phase III et 154 étaient à l’étape de la pré-homologation.
Source des données : Base de données de GlobalData Healthcare (consulté en septembre 2021); base de données IQVIA MIDAS®.
La figure 3 représente la répartition des nouveaux médicaments par domaine thérapeutique, de la phase I à l’attente d’homologation. Bien que les résultats montrent que les médicaments émergents correspondent à un large éventail de domaines thérapeutiques en 2021, les traitements contre le cancer dominent la combinaison thérapeutique dans l’ensemble, représentant plus du tiers (35 %) des médicaments à toutes les phases de l’évaluation clinique. D’autres domaines thérapeutiques importants comprenaient les traitements contre les maladies infectieuses (comme la COVID‑19) et contre les maladies du système nerveux central.
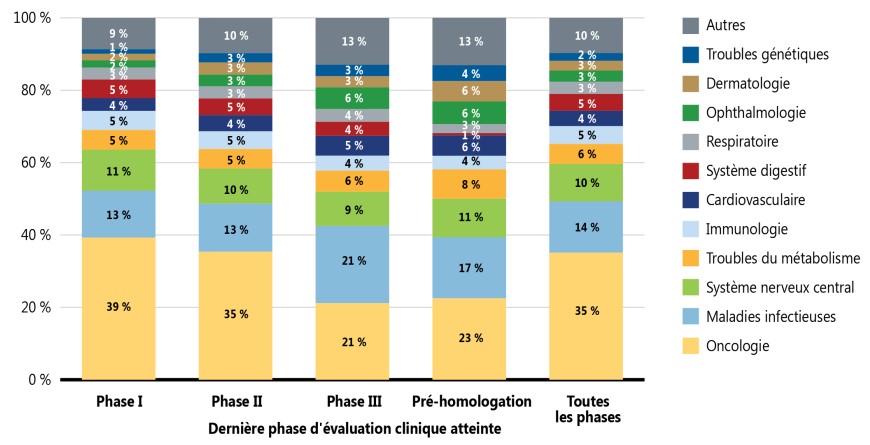
Description de la figure
Ce graphique à barres empilées illustre la répartition des nouveaux médicaments par domaine thérapeutique. La répartition est fournie sous forme de pourcentage de l’ensemble des médicaments par phase de développement, ainsi qu’en fonction du pourcentage total pour toutes les phases.
| Domaine thérapeutique | Phase I | Phase II | Phase III | Pré-homologation | Toutes les phases |
|---|---|---|---|---|---|
Oncologie |
39 % |
35 % |
21 % |
23 % |
35 % |
Maladies infectieuses |
13 % |
13 % |
21 % |
17 % |
14 % |
Système nerveux central |
11 % |
10 % |
9 % |
11 % |
10 % |
Troubles du métaboliques |
5 % |
5 % |
6 % |
8 % |
6 % |
Immunologie |
5 % |
5 % |
4 % |
4 % |
5 % |
Cardiovasculaire |
4 % |
4 % |
5 % |
6 % |
4 % |
Système digestif |
5 % |
5 % |
4 % |
1 % |
5 % |
Respiratoire |
3 % |
3 % |
4 % |
3 % |
3 % |
Ophtalmologie |
2 % |
3 % |
6 % |
6 % |
3 % |
Dermatologie |
2 % |
3 % |
3 % |
6 % |
3 % |
Troubles génétiques |
1 % |
3 % |
3 % |
4 % |
2 % |
Autres |
9 % |
10 % |
13 % |
13 % |
10 % |
Sources de données : Base de données GlobalData Healthcare (consultée en septembre 2021).
Les médicaments désignés orphelins par la Food and Drug Administration (FDA) des États-Unis ou l’Agence européenne des médicaments (EMA) représentaient une proportion considérable du total des médicaments émergents en 2021. La figure 4 présente les parts des médicaments orphelins et des autres médicaments émergents de la phase I jusqu’à l’attente d’homologation. Les médicaments orphelins représentaient une plus grande part des médicaments aux dernières étapes de l’évaluation clinique, représentant 8 % des médicaments émergents faisant l’objet d’essais cliniques de phase I et 30 % des médicaments en attente d’homologation.
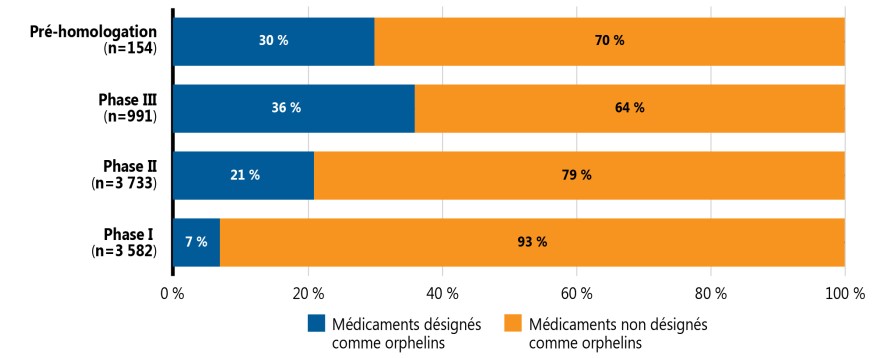
Description de la figure
Ce graphique à barres empilées indique la part des médicaments orphelins à chaque phase de développement (phase I, phase II, phase III et pré-homologation) en date de septembre 2021. Les médicaments orphelins ont été définis comme des médicaments émergents qui ont reçu une désignation de médicament orphelin par la FDA des États-Unis ou l’Agence européenne des médicaments.
| Phase I | Phase II | Phase III | Pré-homologation | |
|---|---|---|---|---|
Orphelin |
7 % |
21 % |
36 % |
30 % |
Non orphelin |
93 % |
79 % |
64 % |
70 % |
Nombre total de médicaments |
3 582 |
3 733 |
991 |
154 |
Remarque : Comprend tous les médicaments émergents ayant atteint les essais cliniques de phase I jusqu’à l’attente d’homologation, mis au point pour le marché du Canada, des États-Unis ou du continent européen (à l’exclusion de la Russie et de la Turquie). Les médicaments orphelins ont été définis comme des médicaments émergents qui ont reçu une désignation de médicament orphelin par la FDA des États-Unis ou l’Agence européenne des médicaments.
Sources de données : Base de données GlobalData Healthcare (consultée en septembre 2021).
L’observateur des médicaments émergents 2021
Les tableaux suivants présentent la sélection des nouveaux médicaments émergents en 2021, ceux conservés d’éditions antérieures de l’Observateur des médicaments émergents, ainsi que des médicaments figurant dans des éditions antérieures qui ont depuis reçu une autorisation de mise en marché. Ces médicaments émergents continueront de faire l’objet d’un suivi dans les prochaines éditions de ce rapport.
En appliquant les critères de sélection décrits dans la section « Méthodologie », 31 des 1 145 médicaments émergents aux dernières étapes de l’évaluation clinique ont été sélectionnés pour figurer dans la liste des nouveaux médicaments de 2021 (tableau 4).
Parmi les nouveaux médicaments présentés dans le rapport de 2020, 10 ont été retenus, car de récentes données continuent de soutenir d’éventuels bienfaits cliniques prometteurs et de satisfaire aux critères de sélection (tableau 5). En date de décembre 2021, neuf des médicaments émergents de 2020 avaient reçu une autorisation de mise en marché aux États-Unis, en Europe ou au Canada (tableau 6), tandis que huit ont été retirés de la liste parce que les essais cliniques dont ils faisaient l’objet ont été interrompus ou parce qu’ils ne remplissaient plus les critères de sélection.
Tableau 4. Nouveaux médicaments sélectionnés en 2021
Cardiovasculaire
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Apabétalone Resverlogix Corp.
|
Coronaropathie |
|
CSL-112 CSL Ltd
|
Syndrome coronarien aigu (SCA) |
|
Système nerveux central
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
AL-001 Alector Inc.
|
Démence |
|
Valiltramiprosate Alzheon Inc.
|
Maladie d’Alzheimer (MA) |
|
Ampion Ampio Pharmaceuticals Inc.
|
Douleur; arthrose |
|
Lécanemab Eisai Co. Ltd
|
Maladie d’Alzheimer (MA) |
|
ND-0612 Mitsubishi Tanabe Pharma Corp.
|
Maladie de Parkinson (MP) |
|
Midomafétamine [MDMA] Multidisciplinary Association for Psychedelic Studies
|
Trouble de stress post-traumatique (TSPT) |
|
Troubles gastro-intestinaux
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Brazikumab AstraZeneca PLC
|
Maladie de Crohn |
|
Lirentélimab Allakos Inc.
|
Œsophagite à éosinophiles; gastrite; gastro‑entérite |
|
RBX-2660 Rebiotix Inc.
|
Infections à Clostridium difficile (maladie associée à C. difficile) |
|
Système génito-urinaire et hormones sexuelles
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Méthyle de bardoxolone Reata Pharmaceuticals Inc.
|
Néphropathie chronique (insuffisance rénale chronique) causée par le syndrome d’Alport et diverses formes de néphropathie chronique |
|
Mésylate de gépotidacine GlaxoSmithKline PLC
|
Cystite; infections urinaires |
|
Troubles hématologiques
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Bentracimab PhaseBio Pharmaceuticals Inc.
|
Troubles du saignement et de la coagulation |
|
Danicopan Alexion Pharmaceuticals Inc.
|
Hémoglobinurie paroxystique nocturne (HPN) |
|
Dérèglements hormonaux
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
ACP-014 Ascendis Pharma AS
|
Hypoparathyroïdie |
|
Maladies infectieuses
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Otéséconazole Mycovia Pharmaceuticals Inc.
|
Candidose vulvovaginale (CVV) récidivante |
|
Ridinilazole Summit Therapeutics Ltd.
|
Infections à Clostridioides difficile (maladies associées à C. difficile) |
|
V-7 Immunitor Inc.
|
Tuberculose (TB) |
|
Santé des hommes
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Triflutate de fexapotide Nymox Pharmaceutical Corp.
|
Hypertrophie bénigne de la prostate (HBP) |
|
Troubles métaboliques
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Birtamimab Prothena Corp PLC
|
Amylose systémique primaire |
|
Donislecel CellTrans Inc.
|
Diabète de type 1 (DT1; diabète juvénile) |
|
KSI-301 Kodiak Sciences Inc.
|
Œdème maculaire diabétique; rétinopathie diabétique |
|
Oncologie
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Arfolitixorine Isofol Medical AB
|
Cancer colorectal métastatique |
|
Élacestrant A. Menarini Industrie Farmaceutiche Riunite SRL
|
Cancer du sein négatif pour le récepteur 2 du facteur de croissance épidermique humain (cancer du sein HER2); cancer du sein métastatique |
|
SGX-301 Soligenix Inc.
|
Lymphome T cutané (LTC) |
|
Motixafortide BioLineRx Ltd.
|
Myélome multiple (maladie de Kahler) |
|
Ophtalmologie
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Avacincaptad pégol sodique Iveric Bio Inc.
|
Atrophie géographique |
|
NCX-470 NicOx SA
|
Hypertension oculaire; glaucome à angle ouvert |
|
Toxicologie
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Avasopasem manganèse Galera Therapeutics Inc.
|
Mucosite buccale induite par la chimiothérapie |
|
Santé des femmes
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Fézolinétant Astellas Pharma Inc.
|
Symptômes vasomoteurs de la ménopause (bouffées de chaleur) |
|
* Les données sur les prévisions consensuelles pour les revenus globaux ont été recueillies auprès de GlobalData, T4-2021, et sont présentées en dollars américains.
Sources de données : base de données GlobalData Healthcare.
Tableau 5. Médicaments émergents conservés de l’Observateur des médicaments émergents 2020
Système nerveux central
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Ganténérumab Hoffmann-La Roche Ltd
|
Maladie d’Alzheimer |
|
Troubles génétiques
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Pégunigalsidase alfa Chiesi Farmaceutici SpA
|
Maladie de Fabry |
|
Troubles hématologiques
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Étranacogène dezaparvovec CSL Ltd
|
Hémophilie B (déficit en facteur IX) |
|
Fidanacogène élaparvovec Pfizer Inc.
|
Hémophilie B (déficit en facteur IX) |
|
Fitusiran Sanofi
|
Hémophilie A; hémophilie B |
|
Vadadustat Otsuka Holdings Co., Ltd
|
Anémie dans la maladie rénale chronique (MRC); anémie rénale |
|
Troubles métaboliques
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Téplizumab Provention Bio Inc.
|
Diabète de type 1 (DT1; diabète juvénile) |
|
Oncologie
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Ipatasertib Genentech Inc.
|
Cancer de la prostate métastatique hormono-résistant (résistant à la castration, androgéno-indépendant) |
|
Ofranergène obadénovec Vascular Biogenics Ltd
|
Cancer épithélial de l’ovaire
|
|
Ublituximab TG Therapeutics Inc.; LFB S.A.
|
Leucémie lymphoïde chronique (LLC); LLC récidivante; sclérose en plaques cyclique |
|
* Les données sur les prévisions consensuelles pour les revenus mondiaux ont été recueillies auprès de GlobalData, T4-2021, et sont présentées en dollars américains.
Sources de données : base de données GlobalData Healthcare.
Tableau 6. Médicaments émergents de l’OMÉ 2020 ayant reçu une autorisation de mise en marché
Cardiovasculaire
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Inclisiran Novartis Pharmaceuticals Corp.
|
Athérosclérose |
|
Système nerveux central
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Aducanumab Biogen Inc.
|
Maladie d’Alzheimer |
|
Immunologie
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Anifrolumab AstraZeneca PLC
|
Lupus érythémateux disséminé |
|
Maladies infectieuses
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Ibrexafungerp Scynexis Inc.
|
Candidose vulvo-vaginale |
|
Troubles métaboliques
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Dasiglucagon Zealand Pharma US Inc.
|
Hypoglycémie |
|
Oncologie
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Idecabtagene vicleucel Celgene Inc.
|
Myélome multiple réfractaire; myélome multiple récidivant |
|
Lisocabtagène maraleucel Juno Therapeutics Inc.
|
Lymphome diffus à grandes cellules B; lymphome folliculaire; lymphome primaire médiastinal à grandes cellules B. |
|
Umbralisib tosylate
|
Lymphome à cellules B de la zone marginale (tissu lymphoïde associé aux muqueuses ou lymphome du MALT); lymphome folliculaire (FL). |
|
Respiratoire
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Tézépélumab
|
Asthme |
|
* Les données sur les prévisions consensuelles pour les revenus mondiaux ont été recueillies auprès de GlobalData, T4-2021, et sont présentées en dollars américains.
Sources de données : base de données GlobalData Healthcare.
Pleins feux sur le Canada
Cette section comprend une liste de certains médicaments en cours d’examen par Santé Canada qui pourraient avoir une incidence importante sur la pratique clinique et les dépenses en médicaments à l’avenir. Les médicaments figurant sur cette liste sont nouveaux au Canada mais peuvent avoir été approuvés dans d’autres pays.
Le tableau 7 présente quatre nouveaux médicaments actuellement inscrits sur la liste des PCE de Santé Canada et qui ont un nouveau mécanisme d’action ou dont l’innocuité et l’efficacité ont été améliorées pendant des essais cliniques. Sur les six médicaments figurant dans l’édition 2020, cinq ont depuis reçu une autorisation de mise en marché de Santé Canada, tandis qu’une demande a été annulée par le promoteur.
Les PCE constituent un ensemble de documents accessibles au public énumérant les présentations de produits pharmaceutiques et biologiques qui contiennent de nouveaux ingrédients médicinaux et qui ont été acceptés pour examen au Canada.
Tableau 7. Nouveaux médicaments sélectionnés en cours d’examen par Santé Canada, 2021
Système nerveux central
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Phénylbutyrate de sodium, ursodoxicoltaurine Amylyx Pharmaceuticals Inc.
|
Sclérose latérale amyotrophique (SLA) |
|
Troubles génétiques
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Sélumétinib AstraZeneca Canada Inc.
|
Neurofibromatose de type 1 |
|
Oncologie
| Médicament (nom commercial) entreprise | Indication(s) | Description et principaux attributs |
|---|---|---|
Chlorhydrate d’asciminib Novartis Pharmaceuticals Canada Inc.
|
Leucémie myéloïde chronique (LMC) |
|
Mogamulizumab Kyowa Kirin Inc.
|
Mycose fongoïde |
|
* Les données sur les prévisions consensuelles pour les revenus mondiaux ont été recueillies auprès de GlobalData, T4-2021, et sont présentées en dollars américains.
Sources de données : base de données GlobalData Healthcare.
Traitements émergents contre la COVID-19
Cette section de l’OMÉ comprend un aperçu des médicaments émergents, nouveaux et existants, qui sont en cours d’évaluation pour des indications liées à la prévention et au traitement de la COVID‑19. Une analyse des marchés mondiaux fournit de l’information sur les médicaments contre la COVID‑19 à toutes les phases des essais cliniques et en attente d’homologation.
Marchés mondiaux
Des progrès considérables ont été réalisés dans le monde entier en ce qui concerne les médicaments émergents contre la COVID‑19. Cependant, les données publiées visant à confirmer l’innocuité et l’efficacité des divers traitements contre la COVID‑19 sont limitées, et les renseignements disponibles évoluent constamment.
En plus de la grande variété de vaccins en cours d’élaboration, de nombreux médicaments nouveaux et repositionnés sont actuellement évalués dans le cadre d’essais cliniques pour leurs bienfaits possibles dans le traitement de la COVID‑19. Ces médicaments comprennent des antiviraux, des anticorps monoclonaux, des cellules souches mésenchymateuses, des plasmas de convalescents et des adsorbeurs de cytokines202.
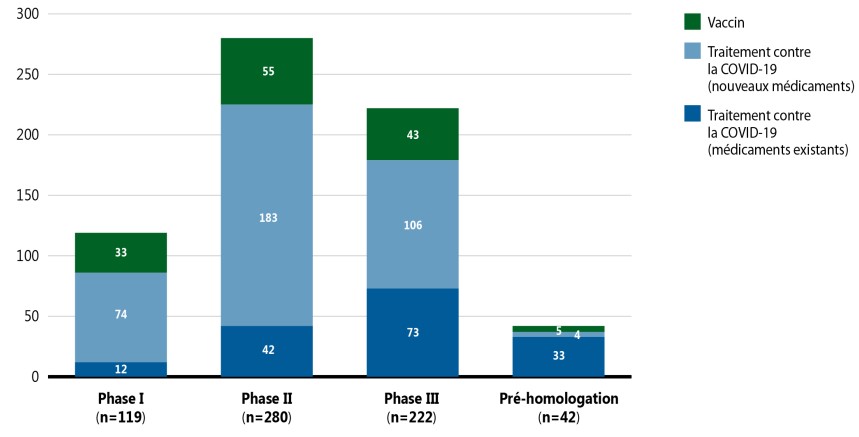
La figure 5 présente une ventilation des vaccins et des traitements émergents contre la COVID‑19 en fonction de la phase d’évaluation clinique. Pour cet aperçu, des données ont été extraites concernant les médicaments indiqués pour le traitement de la COVID‑19 en phase I, II, III ou en attente d’homologation. Ces médicaments sont présentés en trois catégories : les vaccins, qui sont utilisés pour prévenir l’infection du nouveau coronavirus; les traitements contre la COVID‑19 (nouveaux), qui sont de nouveaux médicaments utilisés pour la prévention ou la réduction de certaines complications associées à la COVID‑19 (p. ex. pneumonie ou complications respiratoires et hyperinflammation); et les traitements contre la COVID‑19 (existants), qui sont des médicaments déjà commercialisés repositionnés en vue de traiter la COVID‑19 ou ses symptômes.
Aperçu
Les médicaments émergents pour traiter la COVID‑19 prennent rapidement de l’ampleur, de nombreuses études cliniques étant menées sur les médicaments nouveaux et existants :
- Les traitements actuels contre la COVID‑19 se divisent généralement en deux catégories : les antiviraux, qui empêchent le virus de se multiplier, et les modulateurs immunitaires, qui aident le système immunitaire à combattre le virus.
- En 2020, il y avait 53 essais portant sur la COVID‑19 qui étaient catégorisés comme des études pivots ou d’homologation, alors qu’en 2021, ce nombre a diminué à 41. Un essai clinique pivot ou d’homologation est un essai visant à prouver l’efficacité de nouveaux traitements et vaccins.
- À mesure que de nouvelles souches virales, comme le variant Omicron, propulsent le nombre de cas dans le monde entier, l’accent est mis sur l’efficacité des vaccinations de rappel.
- L’OMÉ de 2020 comptait davantage d’essais cliniques en cours et terminés, tandis que celui de 2021 compte un plus grand nombre d’essais cliniques prévus.
- Après l’approbation des quatre vaccins les plus couramment utilisés au Canada et aux États-Unis – Comirnaty de Pfizer/BioNTech, Spikevax de Moderna, Vaxzevria d’AstraZeneca et le vaccin de Janssen – les promoteurs ont continué à axer les essais sur différents groupes d’âge en 2021 (p. ex. l’autorisation du vaccin Comirnaty de Pfizer/BioNTech pour les enfants âgés de 5 à 11 ans).
- Les fabricants de vaccins ont estimé qu’à la fin de l’année 2021, 12 milliards de doses de vaccin contre la COVID‑19 auront été produites dans le monde.
Source : Pharma COVID-19 Bulletin, GlobalData (30 décembre 2021); Santé Canada (décembre 2021).
La figure 5 présente une ventilation des vaccins et des traitements nouveaux ou existants contre la COVID‑19 en fonction de la dernière phase de développement atteinte. La majorité des traitements faisant l’objet d’une évaluation clinique sont de nouveaux médicaments, et une proportion croissante de médicaments existants se trouve aux derniers stades du développement clinique.
Description de la figure
Ce graphique à barres empilées illustre le nombre de traitements et de vaccins contre la COVID-19 selon la dernière phase d’évaluation clinique atteinte en septembre 2021. Il montre les totaux pour les vaccins et les traitements contre la COVID-19 ainsi que des totaux distincts pour les nouveaux médicaments et les médicaments existants.
| Phase I | Phase II | Phase III | Pré-homologation | |
|---|---|---|---|---|
Vaccin |
33 |
55 |
43 |
5 |
Traitement contre la COVID-19 (nouveaux médicaments) |
74 |
183 |
106 |
4 |
Traitement contre la COVID-19 (médicaments existants) |
12 |
42 |
73 |
33 |
Totaux |
119 |
280 |
222 |
42 |
La figure 6 présente les vaccins contre la COVID‑19 en fonction de leur mécanisme d’action (p. ex. les vaccins vivants atténués ciblent le virus entier, mais les vaccins sous‑unitaires et recombinants ciblent une partie du virus) et en fonction de la dernière phase de développement atteinteNote de bas de page vii.
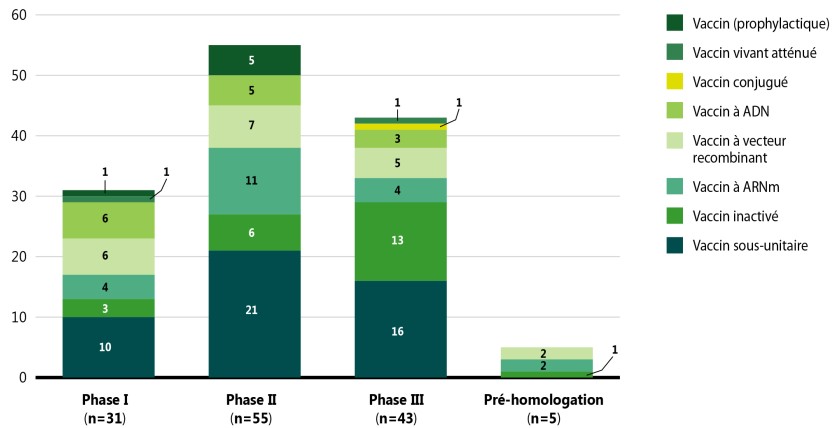
Source de données : GlobalData (consultée en septembre 2021).
Description de la figure
Ce graphique à barres empilées illustre la répartition des vaccins contre la COVID-19 à chacune des phases d’évaluation clinique, par type de vaccin, en date de septembre 2021.
| Vaccin sous-unitaire | Vaccin inactivé | Vaccin à ARNm | Vaccin à vecteur recombinant | Vaccin à ADN | Vaccin conjugué | Vaccin vivant atténué | Vaccin (prophylactique) | Totaux | |
|---|---|---|---|---|---|---|---|---|---|
Phase I |
10 |
3 |
4 |
6 |
6 |
– |
1 |
1 |
31 |
Phase II |
21 |
6 |
11 |
7 |
5 |
– |
– |
5 |
55 |
Phase III |
16 |
13 |
4 |
5 |
3 |
1 |
1 |
– |
43 |
Pré-homo-logation |
– |
1 |
2 |
2 |
– |
– |
– |
– |
5 |
Canada
L’activité de la COVID‑19 continuant de s’accélérer, les autorités sanitaires du Canada se sont engagées à respecter le plan de vaccination publié en décembre 2020. Les principaux éléments du plan de vaccination du Canada comprennent la garantie d’un approvisionnement suffisant, l’autorisation réglementaire pour des vaccins sûrs et efficaces, la gestion de la répartition et de la distribution des vaccins de manière efficace et sécuritaire, l’administration rapide et équitable des vaccins et la surveillance continue de l’innocuité, de l’efficacité et de la couverture des vaccins. Depuis décembre 2021, les règles d’admissibilité pour les doses de rappel permettent aux personnes âgées de 18 ans et plus résidant dans de nombreuses provinces canadiennes de recevoir une troisième injection.
Le tableau 8 indique le nombre de médicaments approuvés par Santé Canada pour la prévention et le traitement de la COVID‑19, tandis que le tableau 9 indique le nombre de médicaments contre la COVID‑19 actuellement à l’étude. Comme la pandémie de la COVID‑19 demeure une priorité absolue au Canada, les demandes actuelles faisant l’objet du processus d’examen de Santé Canada relatif à la COVID‑19 sont examinées selon des délais d’approbation accélérés. Cet effort a été soutenu par l’utilisation d’arrêtés d’urgence destinés à mettre en place des règlements temporaires afin de rendre les médicaments disponibles pour faire face à des urgences de santé publique de grande envergure. Par exemple, l’Arrêté d’urgence concernant l’importation, la vente et la publicité de drogues à utiliser relativement à la COVID‑19, approuvé le 23 mai 2020, présente une autre voie pour faciliter les essais cliniques de potentiels médicaments et instruments médicaux liés à la COVID‑19, tout en maintenant des exigences strictes en matière de sécurité des patients et de validité des données d’essais.
Tableau 8. Traitements et vaccins contre la COVID‑19 approuvés par Santé Canada, 2021
| Domaine thérapeutique | Demandeur | Ingrédient(s) médicinal(aux) | Résultat de la demande | Date de la décision ou du résultat |
|---|---|---|---|---|
Antiviraux à usage systémique |
Veklury |
Remdesivir (solution pour injection) |
Approuvé en vertu du |
2020-07-27 |
Antiviraux à usage systémique |
Paxlovid |
Nirmatrelvir et ritonavir (comprimés pour administration orale) |
Approuvé en vertu du |
2022-01-17 |
Antisérums et immunoglobulines |
Casirivimab et imdevimab |
Casirivimab et imdevimab (solution pour injection) |
Approuvé en vertu de |
2021-06-09 |
Antisérums et immunoglobulines |
Bamlanivimab |
Bamlanivimab (solution pour injection) |
Approuvé en vertu de |
2020-11-20 |
Antisérums et immunoglobulines |
Sotrovimab |
Sotrovimab (solution pour injection) |
Approuvé en vertu de |
2021-07-30 |
Vaccins |
Covifenz |
Particules de type viral de la protéine Spike du SRAS-CoV-2 |
Approuvé en vertu du |
2022-02-24 |
Vaccins |
Nuvaxovid |
Protéine Spike recombinante du SRAS-CoV-2 |
Approuvé en vertu du |
2022-02-17 |
Vaccins |
Vaxzevria |
ChAdOx1-S [recombinant] |
Approuvé en vertu du |
2021-11-19 |
| Approuvé en vertu de l’arrêté d’urgence | 2021-02-26 | |||
Vaccins |
Comirnaty |
Tozinameran [vaccin à ARNm, BNT162b2] (suspension pour injection) |
Approuvé en vertu du |
2021-11-19 |
| Approuvé en vertu du | 2021-11-09 | |||
Approuvé en vertu du | 2021-09-16 | |||
| Approuvé en vertu de | 2021-05-05 | |||
Approuvé en vertu de | 2020-12-20 | |||
Vaccins |
Spikevax |
Elasomeran |
Approuvé en vertu de Règlement sur les aliments et drogues; Indication pédiatrique (6-11 ans) | 2022-03-17 |
Approuvé en vertu du | 2021-11-12 | |||
Approuvé en vertu du | 2021-09-16 | |||
Approuvé en vertu de | 2021-08-27 | |||
Approuvé en vertu de | 2020-12-23 | |||
Vaccins |
Janssen Inc. |
AD26.COV2.S [recombinant] |
Approuvé en vertu du |
2021-11-23 |
Approuvé en vertu de | 2021-03-05 | |||
Vaccins |
Covishield |
ChAdOx1-S (recombinant) |
Approuvé en vertu de |
26-02-2021 (expiré le |
* L’Arrêté d’urgence concernant l’importation, la vente et la publicité de drogues à utiliser relativement à la COVID‑19, approuvé le 23 mai 2020, présente une autre voie pour faciliter les essais cliniques de potentiels médicaments et instruments médicaux liés à la COVID‑19, tout en maintenant de solides exigences strictes en matière de sécurité des patients et de validité des données d’essais.
Source de données : Autorisations de médicament et de vaccin contre la COVID‑19 : Liste des demandes reçues, Santé Canada (consultée en février 2022) : https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/covid19-industrie/medicaments-vaccins-traitements/demandes.html
Tableau 9. Traitements et vaccins contre la COVID‑19 en cours d’examen par Santé Canada, 2021
| Domaine thérapeutique | Demandeur | Ingrédient(s) médicinal(aux) | Date d’acceptation de la soumission |
|---|---|---|---|
Vaccin |
Pfizer Canada ULC/BioNTech SE |
Tozinameran |
Févr. 2022 |
Vaccins – Dose de rappel |
AstraZeneca Canada Inc. |
ChAdOx1-S; [recombinant] |
Déc. 2021 |
Vaccins – Dose de rappel |
Janssen Inc. |
Ad26.COV2.S |
Déc. 2021 |
Vaccins |
Novavax Inc. |
NVX-CoV2373 |
Août 2021 |
Vaccins |
Sanofi Pasteur Ltée. |
Protéine Spike préfusion delta TM du SRAS-CoV-2 [recombinante] |
Juil. 2021 |
Vaccins |
Vaccigen Ltd |
Coronavirus inactivé à virion entier |
Juil. 2021 |
Antisérums et immunoglobulines |
AstraZeneca Canada Inc. |
Cilgavimab, tixagevimab |
Nov. 2021 |
Antisérums et immunoglobulines |
Celltrion HealthCare Co. Ltd |
Regdanvimab |
Mai 2021 |
Antisérums et immunoglobulines |
Eli Lilly Canada Inc. |
Bamlanivimab* |
Juin 2021 |
Antisérums et immunoglobulines |
Hoffmann-La Roche Ltd |
Casirivimab, imdevimab* |
Sept. 2021 |
Antisérums et immunoglobulines |
GlaxoSmithKline Inc. |
Sotrovimab* |
Oct. 2021 |
Antisérums et immunoglobulines |
Eli Lilly Canada Inc. |
Etesevimab |
Sept. 2021 |
Immunosuppresseurs |
Eli Lilly Canada Inc. |
Baricitinib |
Sept. 2021 |
Antiviraux à usage systémique |
Gilead Sciences Canada Inc. |
Remdesivir |
Avr. 2021 |
Antiviraux à usage systémique |
Merck Canada Inc. |
Molnupiravir |
Août 2021 |
| Examens annulés | |||
Antisérums et immunoglobulines |
CytoDyn Inc. |
Leronlimab |
Mars 2021 |
Préparations contre la goutte |
Pendopharm, division de Pharmascience Inc. |
Colchicine |
Janv. 2021 |
Autres médicaments agissant sur le système nerveux |
Sanotize Research & Development Corp. |
Oxyde nitrique |
Juin 2021 |
* Le demandeur a déposé une présentation de drogue nouvelle au titre du Règlement sur les aliments et drogues afin que son produit, approuvé en vertu de l’arrêté d’urgence, puisse être autorisé en vertu du Règlement. La vente du produit demeure autorisée au Canada pendant cette période de transition.
Source de données : Autorisations de médicament et de vaccin contre la COVID‑19 : Liste des demandes reçues, Santé Canada (consulté en février 2022) : https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/covid19-industrie/medicaments-vaccins-traitements/demandes.html
Références
- Ray KK, Nicholls SJ, Buhr KA, et al.; BETonMACE Investigators and Committees. 2020. Effect of Apabetalone Added to Standard Therapy on Major Adverse Cardiovascular Events in Patients With Recent Acute Coronary Syndrome and Type 2 Diabetes: A Randomized Clinical Trial. JAMA. 323(16):1565-73. doi: 10.1001/jama.2020.3308.
- A Phase III Multi-Center, Double-Blind, Randomized, Parallel Group, Placebo-Controlled Clinical Trial in High-Risk Type 2 Diabetes Mellitus (T2DM) Subjects With Coronary Artery Disease (CAD) to Determine Whether Bromodomain Extraterminal Domain (BET) Inhibition Treatment With RVX000222 Increases the Time to Major Adverse Cardiovascular Events (MACE). ClinicalTrials.gov: NCT02586155 (terminée). https://clinicaltrials.gov/ct2/show/NCT02586155?term=NCT02586155&draw=2&rank=1
- Brandts J, Ray KK. 2020. Apabetalone — BET protein inhibition in cardiovascular disease and Type 2 diabetes. Future Cardiol. 16(5):385-95. doi: 10.2217/fca-2020-0017.
- Nicholls SJ, Schwartz GG, Buhr KA, et al.; BETonMACE Investigators. 2021. Apabetalone and hospitalization for heart failure in patients following an acute coronary syndrome: a prespecified analysis of the BETonMACE study. Cardiovasc Diabetol. 20(1):13. doi: 10.1186/s12933-020-01199-x.
- An Open-Label Study to Assess the Safety and Effect on Clinical Course and Key Biomarkers of Oral Apabetalone in Hospitalized Subjects With COVID‑19 Infection in Addition to Standard of Care (SOC). ClinicalTrials.gov: NCT04894266 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04894266?term=NCT04894266&draw=2&rank=1
- Gille A, Duffy D, Tortorici MA, Wright SD, Deckelbaum LI, D’Andrea DM. 2019. Moderate Renal Impairment Does Not Impact the Ability of CSL112 (Apolipoprotein A-I [Human]) to Enhance Cholesterol Efflux Capacity. J Clin Pharmacol. 59(3):427-36. doi: 10.1002/jcph.1337.
- Hatch P. 2019. Heart-stopper: CSL’s $800m heart attack trial. 30 Dec 2019. The Sydney Morning Herald. Consultable en ligne à l’adresse : https://www.smh.com.au/business/companies/heart-stopper-csl-s-800m-heart-attack-trial-20191210-p53iog.html
- Hatch P. 2019. Heart-stopper: CSL’s $800m heart attack trial. 30 Dec 2019. The Sydney Morning Herald. Consultable en ligne à l’adresse : https://www.smh.com.au/business/companies/heart-stopper-csl-s-800m-heart-attack-trial-20191210-p53iog.html
- A Phase 3, Multicenter, Double-blind, Randomized, Placebo-controlled, Parallel-group Study to Investigate the Efficacy and Safety of CSL112 in Subjects With Acute Coronary Syndrome. ClinicalTrials.gov: NCT03473223 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT03473223?term=NCT03473223&draw=2&rank=1
- Alector, Inc. 2021. Press Release: Alector Presents 12-Month Results from the INFRONT-2 Phase 2 Open-label Clinical Study of AL001 for the Treatment of Symptomatic Frontotemporal Dementia Patients with a Progranulin Mutation. 29 juillet 2021. Consultable en ligne à l’adresse : https://www.globenewswire.com/en/news-release/2021/07/29/2271495/0/en/Alector-Presents-12-Month-Results-from-the-INFRONT-2-Phase-2-Open-label-Clinical-Study-of-AL001-for-the-Treatment-of-Symptomatic-Frontotemporal-Dementia-Patients-with-a-Progranulin.html
- Alector, Inc. 2021. Press Release: Alector Presents 12-Month Results from the INFRONT-2 Phase 2 Open-label Clinical Study of AL001 for the Treatment of Symptomatic Frontotemporal Dementia Patients with a Progranulin Mutation. 29 juillet 2021. Consultable en ligne à l’adresse : https://www.globenewswire.com/en/news-release/2021/07/29/2271495/0/en/Alector-Presents-12-Month-Results-from-the-INFRONT-2-Phase-2-Open-label-Clinical-Study-of-AL001-for-the-Treatment-of-Symptomatic-Frontotemporal-Dementia-Patients-with-a-Progranulin.html
- A Phase 3, Multicenter, Randomized, Double Blind, Placebo Controlled Study to Evaluate the Efficacy and Safety of AL001 in Individuals at Risk for or With Frontotemporal Dementia Due to Heterozygous Mutations in the Progranulin Gene. ClinicalTrials.gov: NCT04374136 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04374136?term=NCT04374136&draw=2&rank=1
- Alector, Inc. 2021. Press Release: Alector Presents 12-Month Results from the INFRONT-2 Phase 2 Open-label Clinical Study of AL001 for the Treatment of Symptomatic Frontotemporal Dementia Patients with a Progranulin Mutation. 29 juillet 2021. Consultable en ligne à l’adresse : https://www.globenewswire.com/en/news-release/2021/07/29/2271495/0/en/Alector-Presents-12-Month-Results-from-the-INFRONT-2-Phase-2-Open-label-Clinical-Study-of-AL001-for-the-Treatment-of-Symptomatic-Frontotemporal-Dementia-Patients-with-a-Progranulin.html
- Alzheon. 2021. Press Release: Alzheon CEO Presents Overview of Oral Anti-Amyloid ALZ-801 Phase 3 Program at 9th Neurodegenerative Drug Development Summit. 24 février 2021. Consultable en ligne à l’adresse : https://alzheon.com/alzheon-ceo-presents-overview-of-oral-anti-amyloid-alz-801-phase-3-program-at-9th-neurodegenerative-drug-development-summit/
- Tolar M, Abushakra S, Hey JA, Porsteinsson A, Sabbagh M. 2020. Aducanumab, gantenerumab, BAN2401, and ALZ-801—the first wave of amyloid-targeting drugs for Alzheimer’s disease with potential for near term approval. Alzheimers Res Ther. 12(1):95. doi: 10.1186/s13195-020-00663-w.
- Alzheon. Alzheon ALZ-801 potentially the first oral disease-modifying treatment for Alzheimer’s disease. Consultable en ligne à l’adresse : https://alzheon.com/pipeline/alzheon-alz-801/
- Tolar M, Abushakra S, Sabbagh M. 2020. The path forward in Alzheimer’s disease therapeutics: Reevaluating the amyloid cascade hypothesis. Alzheimers Dement. 16(11):1553-60. doi: 10.1016/j.jalz.2019.09.075.
- Tolar M, Hey J, Power A, Abushakra S. 2021. Neurotoxic Soluble Amyloid Oligomers Drive Alzheimer’s Pathogenesis and Represent a Clinically Validated Target for Slowing Disease Progression. Int J Mol Sci. 22(12):6355. doi: 10.3390/ijms22126355.
- A Phase 3, Multicenter, Randomized, Double-blind, Placebo-controlled Study of the Efficacy, Safety and Biomarker Effects of ALZ-801 in Subjects With Early Alzheimer’s Disease and APOE4/4 Genotype. ClinicalTrials.gov: NCT04770220 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04770220?term=NCT04770220&draw=2&rank=1
- Alzheon. 2021. Press Release: Alzheon CEO Presents Overview of Oral Anti-Amyloid ALZ-801 Phase 3 Program at 9th Neurodegenerative Drug Development Summit. Business Wire. 24 février 2021. Consultable en ligne à l’adresse : https://www.businesswire.com/news/home/20210224005082/en/Alzheon-CEO-Presents-Overview-of-Oral-Anti-Amyloid-ALZ-801-Phase-3-Program-at-9th-Neurodegenerative-Drug-Development-Summit
- Alzheon. Alzheon ALZ-801 potentially the first oral disease-modifying treatment for Alzheimer’s disease. Consultable en ligne à l’adresse : https://alzheon.com/pipeline/alzheon-alz-801/
- Ampio Pharmaceuticals, Inc. ABOUT AMPION. Consultable en ligne à l’adresse : https://ampiopharma.com/pipeline/ampion/
- A Phase 3 Randomized Study to Confirm the Efficacy of an Intra-Articular Injection of Ampion™ in Adults With Pain Due to Severe Osteoarthritis of the Knee. ClinicalTrials.gov: NCT03182686 (terminée). https://clinicaltrials.gov/ct2/show/NCT03182686?term=NCT03182686&draw=2&rank=1
- A Randomized, Placebo-Controlled, Double-Blind Study to Evaluated the Efficacy and Safety of an Intra-Articular Injection of AMPION™ in Adults With Pain Due to Osteoarthritis of the Knee. ClinicalTrials.gov: NCT02556710 (terminée). https://clinicaltrials.gov/ct2/show/NCT02556710?term=NCT02556710&draw=2&rank=1
- A Randomized, Placebo-Controlled, Double-Blind Study to Evaluate the Safety and Efficacy of Three Intra-articular Injections of Ampion™ (4 mL) Administered Two Weeks Apart in Adults With Pain Due to Osteoarthritis of the Knee. ClinicalTrials.gov: NCT02242435 (terminée). https://clinicaltrials.gov/ct2/show/NCT02242435?term=NCT02242435&draw=2&rank=1
- Ampio Pharmaceuticals, Inc. 2021. Press Release: Ampio Provides Update on Osteoarthritis of the Knee (OAK) Program, Reiterates Compelling Data in Earlier Phase III Trials of Ampion in Severe OAK. BioSpace. 17 juin 2021. Consultable en ligne à l’adresse : https://www.biospace.com/article/releases/ampio-provides-update-on-osteoarthritis-of-the-knee-oak-program-reiterates-compelling-data-in-earlier-phase-iii-trials-of-ampion-in-severe-oak/
- An Open Label Extension Study to Assess the Safety of Long-Term Treatment With a 4 mL Intra-Articular Injection of Ampion in Adults With Pain Due to Severe Osteoarthritis of the Knee. ClinicalTrials.gov: NCT03349645 (étude interrompue par le promoteur en raison de l’absence de résultats significatifs en matière d’innocuité). https://clinicaltrials.gov/ct2/show/NCT03349645?term=NCT03349645&draw=2&rank=1
- A Randomized, Controlled, Double-Blind Study to Evaluate the Efficacy and Safety of an Intra-Articular Injection of Ampion in Adults With Pain Due to Severe Osteoarthritis of the Knee. ClinicalTrials.gov: NCT03988023 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT03988023?term=NCT03988023&draw=2&rank=1
- Swanson CJ, Zhang Y, Dhadda S, et al. 2021. A randomized, double-blind, phase 2b proof-of-concept clinical trial in early Alzheimer’s disease with lecanemab, an anti-Aβ protofibril antibody. Alzheimers Res Ther. 13(1):80. doi: 10.1186/s13195-021-00813-8.
- AlzForum. 2021. Lecanemab Follows Aduhelm’s Path to Accelerated Approval. AlzForum. 20 octobre 2021. Consultable en ligne à l’adresse : https://www.alzforum.org/news/research-news/lecanemab-follows-aduhelms-path-accelerated-approval.
- AHEAD 3-45 Study: A Placebo-Controlled, Double-Blind, Parallel-Treatment Arm, 216 Week Study to Evaluate Efficacy and Safety of Treatment With BAN2401 in Subjects With Preclinical Alzheimer’s Disease and Elevated Amyloid (A45 Trial) and in Subjects With Early Preclinical Alzheimer’s Disease and Intermediate Amyloid (A3 Trial). ClinicalTrials.gov: NCT04468659 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04468659?term=NCT04468659&draw=2&rank=1
- A Placebo-Controlled, Double-Blind, Parallel-Group, 18-Month Study With an Open-Label Extension Phase to Confirm Safety and Efficacy of BAN2401 in Subjects With Early Alzheimer’s Disease. ClinicalTrials.gov: NCT03887455 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT03887455?term=NCT03887455&draw=2&rank=1
- Meglio M. 2021. ND0612 Subcutaneous Levodopa Delivery System Demonstrates Efficacy in Phase 2 Setting. Proceedings of International Parkinson and Movement Disorder Society (MDS) Virtual Congress 2021; 17 Sept 2021. NeurologyLive. Consultable en ligne à l’adresse : https://www.neurologylive.com/view/nd0612-subcutaneous-levodopa-delivery-system-demonstrates-efficacy-phase-2
- The Michael J. Fox Foundation. Funded Studies: Continuous Subcutaneous Administration of Levodopa/Carbidopa (ND0612) for the Treatment of Parkinson’s Disease. Consultable en ligne à l’adresse : https://www.michaeljfox.org/grant/continuous-subcutaneous-administration-levodopacarbidopa-nd0612-treatment-parkinsons-disease
- A Multicenter, Randomized, Active-controlled, Double-blind, Double-dummy, Parallel Group Clinical Trial, Investigating the Efficacy, Safety, and Tolerability of Continuous Subcutaneous ND0612 Infusion in Comparison to Oral IR-LD/CD in Subjects With Parkinson’s Disease Experiencing Motor Fluctuations (BouNDless). ClinicalTrials.gov: NCT04006210 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04006210?term=NCT04006210&draw=2&rank=1
- Jerome L, Feduccia AA, Wang JB, et al. 2020. Long-term follow-up outcomes of MDMA-assisted psychotherapy for treatment of PTSD: a longitudinal pooled analysis of six phase 2 trials. Psychopharmacology (Berl). 237(8):2485-97. doi: 10.1007/s00213-020-05548-2.
- Jerome L, Feduccia AA, Wang JB, et al. 2020. Long-term follow-up outcomes of MDMA-assisted psychotherapy for treatment of PTSD: a longitudinal pooled analysis of six phase 2 trials. Psychopharmacology (Berl). 237(8):2485-97. doi: 10.1007/s00213-020-05548-2.
- Richard Staines. 2020. Evidence builds for use of MDMA as PTSD therapy. Pharmaphorum. 16 juin 2020. Consultable en ligne à l’adresse : https://pharmaphorum.com/news/evidence-builds-for-use-of-mdma-as-ptsd-therapy/
- Marseille E, Kahn JG, Yazar-Klosinski B, Doblin R. 2020. The cost-effectiveness of MDMA-assisted psychotherapy for the treatment of chronic, treatment-resistant PTSD. PLoS One. 15(10):e0239997. doi: 10.1371/journal.pone.0239997.
- A Randomized, Double-Blind, Placebo-Controlled, Multi-Site Phase 3 Study of the Efficacy and Safety of Manualized MDMA-Assisted Psychotherapy for the Treatment of Severe Posttraumatic Stress Disorder. ClinicalTrials.gov: NCT03537014 (terminée). https://clinicaltrials.gov/ct2/show/NCT03537014?term=NCT03537014&draw=2&rank=1
- A Multi-Site Open-Label Safety Extension Study of Manualized MDMA-Assisted Psychotherapy for the Treatment of Participants With Posttraumatic Stress Disorder. ClinicalTrials.gov: NCT04714359 (recrutement sur invitation). https://clinicaltrials.gov/ct2/show/NCT04714359?term=NCT04714359&draw=2&rank=1
- A Randomized, Double-Blind, Placebo-Controlled, Multi-Site Phase 3 Study of the Efficacy and Safety of Manualized MDMA-Assisted Psychotherapy for the Treatment of Posttraumatic Stress Disorder of Moderate or Greater Severity. ClinicalTrials.gov: NCT04077437 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04077437?term=NCT04077437&draw=2&rank=1
- Gottlieb ZS, Sands BE. 2021. Personalized Medicine with IL-23 Blockers: Myth or Reality? J Crohns Colitis. doi: 10.1093/ecco-jcc/jjab190. [En ligne avant impression.]
- Ma C, Panaccione R, Khanna R, Feagan BG, Jairath V. 2019. IL12/23 or selective IL23 inhibition for the management of moderate-to-severe Crohn’s disease? Best Pract Res Clin Gastroenterol. 38-39:101604. doi: 10.1016/j.bpg.2019.02.006.
- Wong U, Cross RK. 2019. Expert opinion on interleukin-12/23 and interleukin-23 antagonists as potential therapeutic options for the treatment of inflammatory bowel disease. Expert Opin Investig Drugs. 28(5):473-9. doi: 10.1080/13543784.2019.1597053.
- An Open-label, Long-term Extension Study of Brazikumab in Participants With Moderately to Severely Active Crohn’s Disease (INTREPID OLE). ClinicalTrials.gov: NCT03961815 (recrutement sur invitation). https://clinicaltrials.gov/ct2/show/NCT03961815?term=NCT03961815&draw=2&rank=1
- A 52-Week, Multicenter, Randomized, Double-blind, Placebo and Active-Controlled, Operationally Seamless Phase 2b/3, Parallel-group Study to Assess the Efficacy and Safety of Brazikumab in Participants With Moderately to Severely Active Crohn’s Disease (INTREPID Lead-In). ClinicalTrials.gov: NCT03759288 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT03759288?term=NCT03759288&draw=2&rank=1
- Allakos. 2019. Press Release: Allakos Announces AK002 Met All Prespecified Primary and Secondary Endpoints in Phase 2 Randomized, Double-Blind, Placebo-Controlled Study in Patients with Eosinophilic Gastritis (EG) and/or Eosinophilic Gastroenteritis (EGE). 5 août 2019. Consultable en ligne à l’adresse : https://investor.allakos.com/news-releases/news-release-details/allakos-announces-ak002-met-all-prespecified-primary-and
- Bruba K. 2021. Lirentelimab safe, effective in long-term gastritis, duodenitis treatment. Healio. 12 octobre 2021. Consultable en ligne à l’adresse : https://www.healio.com/news/gastroenterology/20211012/lirentelimab-safe-effective-in-longterm-gastritis-duodenitis-treatment.
- Apfed. 2020. Lirentelimab Shows Promise as a Future Therapy for EG/EGE/EoD. American Partnership for Eosinophilic Disorders. 8 novembre 2020. Consultable en ligne à l’adresse : https://apfed.org/lirentelimab-shows-promise-as-a-future-therapy-for-eg-ege-eod/
- A Phase 3, Multicenter, Open-Label, Extension Study to Evaluate the Efficacy and Safety of AK002 in Patients That Were Previously Enrolled in AK002-016 or AK002-012 Studies and Have Eosinophilic Gastritis and/or Eosinophilic Duodenitis (Formerly Referred to as Eosinophilic Gastroenteritis). ClinicalTrials.gov: NCT04620811 (recrutement sur invitation). https://clinicaltrials.gov/ct2/show/NCT04620811?term=NCT04620811&draw=2&rank=1
- A Phase 2/3, Multicenter, Randomized, Double-Blind, Placebo-Controlled Study to Evaluate the Efficacy and Safety of Lirentelimab (AK002) in Adult and Adolescent Patients With Active Eosinophilic Esophagitis. ClinicalTrials.gov: NCT04322708 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT04322708?term=NCT04322708&draw=2&rank=1
- A Phase 3, Multicenter, Randomized, Double-Blind, Placebo-Controlled Study to Evaluate the Efficacy and Safety of AK002 in Patients With Moderately to Severely Active Eosinophilic Duodenitis Who Have an Inadequate Response With, Lost Response to, or Were Intolerant to Standard Therapies. ClinicalTrials.gov: NCT04856891 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04856891?term=NCT04856891&draw=2&rank=1
- A Phase 3, Multicenter, Randomized, Double-Blind, Placebo-Controlled Study to Evaluate Efficacy and Safety of AK002 in Patients With Moderately to Severely Active Eosinophilic Gastritis and/or Eosinophilic Duodenitis (Formerly Referred to as Eosinophilic Gastroenteritis). ClinicalTrials.gov: NCT04322604 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT04322604?term=NCT04322604&draw=2&rank=1
- A Phase 3 Prospective, Randomized, Double-blinded, Placebo-controlled Clinical Study to Evaluate the Efficacy and Safety of RBX2660 (Microbiota Suspension) for the Prevention of Clostridium Difficile Infection. ClinicalTrials.gov: NCT03244644 (terminée). https://clinicaltrials.gov/ct2/show/NCT03244644?term=NCT03244644&draw=2&rank=1
- Walter K. 2021. RBX2660 Shows Promise as a C Difficile Treatment. HCPLive. 22 mai 2021. Consultable en ligne à l’adresse : https://www.hcplive.com/view/rbx2660-c-difficile-treatment
- Walter K. 2021. RBX2660 Shows Promise as a C Difficile Treatment. HCPLive. 22 mai 2021. Consultable en ligne à l’adresse : https://www.hcplive.com/view/rbx2660-c-difficile-treatment
- Ferring Pharmaceuticals. 2021. Ferring and Rebiotix Present Landmark Phase 3 Data Demonstrating Superior Efficacy of Investigational RBX2660 Versus Placebo to Reduce Recurrence of C. difficile Infection. Business Wire. 21 mai 2021. Consultable en ligne à l’adresse : https://www.businesswire.com/news/home/20210521005335/en/Ferring-and-Rebiotix-Present-Landmark-Phase-3-Data-Demonstrating-Superior-Efficacy-of-Investigational-RBX2660-Versus-Placebo-to-Reduce-Recurrence-of-C.-difficile-Infection
- A Phase 3 Open-Label Clinical Study to Evaluate the Safety and Tolerability of Rebiotix RBX2660 (Microbiota Suspension) in Subjects With Recurrent Clostridium Difficile Infection. ClinicalTrials.gov: NCT03931941 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT03931941?term=NCT03931941&draw=2&rank=1
- Nangaku M, Kanda H, Takama H, Ichikawa T, Hase H, Akizawa T. 2020. Randomized Clinical Trial on the Effect of Bardoxolone Methyl on GFR in Diabetic Kidney Disease Patients (TSUBAKI Study). Kidney Int Rep. 5(6):879-90. doi: 10.1016/j.ekir.2020.03.030.
- Chertow GM, Appel GB, Andreoli S, et al. 2021. Study Design and Baseline Characteristics of the CARDINAL Trial: A Phase 3 Study of Bardoxolone Methyl in Patients with Alport Syndrome. Am J Nephrol. 52(3):180-189. doi: 10.1159/000513777.
- Healio. 2019. Phase 3 trials: Bardoxolone methyl slowed progression of kidney disease in Alport patients. Healio. 27 novembre 2019. Consultable en ligne à l’adresse : https://www.healio.com/news/nephrology/20191127/phase-3-trials-bardoxolone-methyl-slowed-progression-of-kidney-disease-in-alport-patients
- GlaxoSmithKline. 2019. Press Release: GSK starts a phase III clinical programme for a potential first-in-class antibiotic, gepotidacin. 28 octobre 2019. Consultable en ligne à l’adresse : https://www.gsk.com/en-gb/media/press-releases/gsk-starts-a-phase-iii-clinical-programme-for-a-potential-first-in-class-antibiotic-gepotidacin/
- GlaxoSmithKline. 2019. Press Release: GSK starts a phase III clinical programme for a potential first-in-class antibiotic, gepotidacin. 28 octobre 2019. Consultable en ligne à l’adresse : https://www.gsk.com/en-gb/media/press-releases/gsk-starts-a-phase-iii-clinical-programme-for-a-potential-first-in-class-antibiotic-gepotidacin/
- GlaxoSmithKline. 2019. Press Release: GSK starts a phase III clinical programme for a potential first-in-class antibiotic, gepotidacin. 28 octobre 2019. Consultable en ligne à l’adresse : https://www.gsk.com/en-gb/media/press-releases/gsk-starts-a-phase-iii-clinical-programme-for-a-potential-first-in-class-antibiotic-gepotidacin/
- A Phase III, Randomized, Multicenter, Parallel-Group, Double-Blind, Double-Dummy Study in Adolescent and Adult Female Participants Comparing the Efficacy and Safety of Gepotidacin to Nitrofurantoin in the Treatment of Uncomplicated Urinary Tract Infection (Acute Cystitis). ClinicalTrials.gov: NCT04020341 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04020341?term=NCT04020341&draw=2&rank=1
- A Phase III, Randomized, Multicenter, Parallel-Group, Double-Blind, Double-Dummy Study in Adolescent and Adult Female Participants Comparing the Efficacy and Safety of Gepotidacin to Nitrofurantoin in the Treatment of Uncomplicated Urinary Tract Infection (Acute Cystitis). ClinicalTrials.gov: NCT04187144 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04187144?term=NCT04187144&draw=2&rank=1
- PhaseBio. 2021. Press Release: PhaseBio Announces Topline Results From Phase 2b Trial for Bentracimab. Business Wire. 3 novembre 2021. Consultable en ligne à l’adresse : https://www.businesswire.com/news/home/20211103005318/en/PhaseBio-Announces-Topline-Results-From-Phase-2b-Trial-for-Bentracimab
- Makhdoum A, Dhingra NK, Kirubaharan A, et al. 2021. Ticagrelor use and practice patterns among Canadian cardiac surgeons. J Card Surg. 36(8):2793-801. doi: 10.1111/jocs.15636.
- A Phase 3, Multicenter, Open-Label, Single-Arm Study of Bentracimab (PB2452) in Ticagrelor-Treated Patients With Uncontrolled Major or Life-Threatening Bleeding or Requiring Urgent Surgery or Invasive Procedure (REVERSE-IT Trial). ClinicalTrials.gov: NCT04286438 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04286438?term=NCT04286438&draw=2&rank=1.
- Risitano AM, Kulasekararaj AG, Lee JW, et al. 2020. Danicopan: an oral complement factor D inhibitor for paroxysmal nocturnal hemoglobinuria. Haematologica. doi: 10.3324/haematol.2020.261826. [En ligne avant impression.]
- Alexion Pharamceuticals, Inc. 2019. Press Release: Achillion Reports Third Quarter 2019 Financial Results and Provides Corporate Update. 25 septembre 2019. GlobeNewswire. Consultable en ligne à l’adresse : https://www.globenewswire.com/news-release/2019/09/25/1920498/0/en/Achillion-Receives-Breakthrough-Therapy-Designation-from-FDA-for-Danicopan-for-Treatment-of-Paroxysmal-Nocturnal-Hemoglobinuria.html
- Kulesekararaj A, Risitano A, Maciejewski JP, et al. 2021. Phase 2 Study of Danicopan in Paroxysmal Nocturnal Hemoglobinuria Patients with an Inadequate Response to Eculizumab. Blood. doi: 10.1182/blood.2021011388. [En ligne avant impression.]
- Kulasekararaj AG, Risitano AM, Lee JW, et al. 2020. 756 Phase 3 Study of Danicopan, an Oral Complement Factor D Inhibitor, As Add-on Therapy to a C5 Inhibitor in Patients with Paroxysmal Nocturnal Hemoglobinuria with Clinically Evident Extravascular Hemolysis [résumé]. Presented at the 62nd American Society of Hematology Annual Meeting and Exposition; 5 décembre 2020; Washington, DC. Consultable en ligne à l’adresse : https://ash.confex.com/ash/2020/webprogram/Paper134388.html
- Kulasekararaj AG, Risitano A, Lee JW, et al. 2021. Danicopan Improves Hemoglobin, Reduces Transfusion Requirements in Eculizumab-Treated Patients With PNH. 1 Sept 2021. ASH Clinical News. Consultable en ligne à l’adresse : https://www.ashclinicalnews.org/news/from-the-blood-journals/written-in-blood/danicopan-improves-hemoglobin-reduces-transfusion-requirements-eculizumab-treated-patients-pnh/
- A Phase 3 Study of Danicopan (ALXN2040) as Add-on Therapy to a C5 Inhibitor (Eculizumab or Ravulizumab) in Patients With Paroxysmal Nocturnal Hemoglobinuria Who Have Clinically Evident Extravascular Hemolysis (EVH). ClinicalTrials.gov: NCT04469465 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04469465?term=NCT04469465&draw=2&rank=1
- Khan AA, Rejnmark L, Rubin M, et al. 2021. PaTH Forward: A randomized, double-blind, placebo-controlled phase 2 trial of TransCon PTH in adult hypoparathyroidism. J Clin Endocrinol Metab. doi: 10.1210/clinem/dgab577. [En ligne avant impression.]
- Acendis Pharma. TRANSCON PTH Designed to replace parathyroid hormone to physiologic levels in patients with oypoparathyroidism. Consultable en ligne à l’adresse : https://ascendispharma.com/pipeline/endocrinology/transcon-pth/
- Khan AA, Rejnmark L, Rubin M, et al. 2021. PaTH Forward: A randomized, double-blind, placebo-controlled phase 2 trial of TransCon PTH in adult hypoparathyroidism. J Clin Endocrinol Metab. doi: 10.1210/clinem/dgab577. [En ligne avant impression.]
- PaTHway TRIAL: A Phase 3, Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel Group Trial, With an Open-Label Extension, Investigating the Safety, Tolerability and Efficacy of TransCon PTH Administered Subcutaneously Daily in Adults With Hypoparathyroidism. ClinicalTrials.gov: NCT04701203 (phase 3, active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT04701203?term=NCT04701203&draw=2&rank=1
- Gawel R. 2021. Oteseconazole proves safe, effective against recurrent vulvovaginal candidiasis. 1 Oct 2021. Healio. Consultable en ligne à l’adresse : https://www.healio.com/news/womens-health-ob-gyn/20211001/oteseconazole-proves-safe-effective-against-recurrent-vulvovaginal-candidiasis
- Mycovia Pharmaceuticals, Inc. 2021. Press Release: Mycovia Pharmaceuticals Announces U.S. FDA Acceptance and Priority Review of New Drug Application for Oteseconazole for the Treatment of Recurrent Vulvovaginal Candidiasis. 28 juillet 2021. Drugs.com. Consultable en ligne à l’adresse : https://www.drugs.com/nda/oteseconazole_210728.html
- Carlson TJ, Endres BT, Bassères E, Gonzales-Luna AJ, Garey KW. 2019. Ridinilazole for the treatment of Clostridioides difficile infection. Expert Opin Investig Drugs. 28(4):303-10. doi: 10.1080/13543784.2019.1582640.
- Qian X, Yanagi K, Kane AV, et al. 2020. Ridinilazole, a narrow spectrum antibiotic for treatment of Clostridioides difficile infection, enhances preservation of microbiota-dependent bile acids. Am J Physiol Gastrointest Liver Physiol. 319(2):G227-G237. doi: 10.1152/ajpgi.00046.2020.
- A Randomized, Double Blind, Active Controlled Study to Evaluate the Safety and Tolerability of Ridinilazole Compared With Vancomycin and to Assess the Pharmacokinetics of Ridinilazole in Adolescent Subjects (Aged 12 to <18 Years) With Clostridioides Difficile Infection. ClinicalTrials.gov: NCT04802837 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04802837?term=NCT04802837&draw=2&rank=1
- A Phase 3, Randomized, Double-blind, Active Controlled Study to Compare the Efficacy and Safety of Ridinilazole (200 mg, Bid) for 10 Days With Vancomycin (125 mg, Qid) for 10 Days in the Treatment of Clostridium Difficile Infection (CDI). ClinicalTrials.gov: NCT03595566 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT03595566?term=NCT03595566&draw=2&rank=1
- A Phase 3, Randomized, Double-blind, Active Controlled Study to Compare the Efficacy and Safety of Ridinilazole (200 mg, Bid) for 10 Days With Vancomycin (125 mg, Qid) for 10 Days in the Treatment of Clostridium Difficile Infection (CDI). ClinicalTrials.gov: NCT03595553 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT03595553?term=NCT03595553&draw=2&rank=1
- Immunitor, Inc. 2020. Press Release: Immunitor unveils breakthrough immunotherapy to treat TB in as short as one month. 1er février 2020. TB Online. Consultable en ligne à l’adresse : https://www.tbonline.info/posts/2020/2/1/immunitor-unveils-breakthrough-immunotherapy-treat/
- Phase III and Dose Ranging Trial of Heat-killed M. Vaccae (V7). ClinicalTrials.gov: NCT01977768 (terminée). https://clinicaltrials.gov/ct2/show/NCT01977768?term=NCT01977768&draw=2&rank=1
- Bourinbaiar AS, Batbold U, Efremenko Y, et al. 2019. Phase III, placebo-controlled, randomized, double-blind trial of tableted, therapeutic TB vaccine (V7) containing heat-killed M. vaccae administered daily for one month. J Clin Tuberc Other Mycobact Dis. 18:100141. doi: 10.1016/j.jctube.2019.100141.
- Shore N, Tutrone R, Roehrborn CG. 2019. Efficacy and safety of fexapotide triflutate in outpatient medical treatment of male lower urinary tract symptoms associated with benign prostatic hyperplasia. Ther Adv Urol. 11:1756287218820807. doi: 10.1177/1756287218820807.
- Nymox. Fexapotide for BPH. Consultable en ligne à l’adresse : https://nymox.com/science/fexapotide-for-bph
- Phase III Multicenter Prospective Randomized Parallel-Group Placebo-Controlled Double Blind Clinical Evaluation of NX-1207 for the Treatment of BPH NX02-0018. ClinicalTrials.gov: NCT00945490 (terminée). https://clinicaltrials.gov/ct2/show/NCT00945490?term=NCT00945490&draw=2&rank=1
- Phase III Multicenter Prospective Randomized Parallel-Group Placebo-Controlled Double Blind Clinical Evaluation of NX-1207 for the Treatment of BPH NX02-0017. ClinicalTrials.gov: NCT00918983 (terminée). https://clinicaltrials.gov/ct2/show/NCT00918983?term=NCT00918983&draw=2&rank=1
- Phase 3 Multicenter Prospective Open Label Clinical Safety Evaluation of Re-Injection of NX-1207 for the Treatment of BPH: Two Doses 1-7 Years Apart. ClinicalTrials.gov: NCT01438775 (terminée). https://clinicaltrials.gov/ct2/show/NCT01438775?term=NCT01438775&draw=2&rank=1
- Phase 3 Multicenter Prospective Open Label Clinical Safety Evaluation of Re-Injection of NX-1207 for the Treatment of BPH: Two Doses 1-8 Years Apart. ClinicalTrials.gov: NCT01846793 (terminée). https://clinicaltrials.gov/ct2/show/NCT01846793?term=NCT01846793&draw=2&rank=1
- Efficacy and Safety of a Single Transrectal Ultrasound(TRUS)-Guided Intraprostatic Injection of NX-1207 in Patients With Lower Urinary Tract Symptoms Associated With Benign Prostatic Hyperplasia: A Phase III European Study. ClinicalTrials.gov: NCT02003742. https://clinicaltrials.gov/ct2/show/NCT02003742?term=NCT02003742&draw=2&rank=1.
- Popkova T, Hajek R, Jelinek T. 2020. Monoclonal antibodies in the treatment of AL amyloidosis: co-targetting the plasma cell clone and amyloid deposits. Br J Haematol. 189(2):228-238. doi: 10.1111/bjh.16436.
- Gertz MA, Cohen AD, Comenzo RL, et al. 2019. Results of the Phase 3 VITAL Study of NEOD001 (Birtamimab) Plus Standard of Care in Patients with Light Chain (AL) Amyloidosis Suggest Survival Benefit for Mayo Stage IV Patients. Blood. 134(Supplement 1):3166. doi.org/10.1182/blood-2019-124482.
- Prothena Corporation PLC. Al Amyloidosis. Consultable en ligne à l’adresse : https://www.prothena.com/pipeline/birtamimab/
- A Phase 3, Randomized, Multicenter, Double-Blind, Placebo-Controlled, Efficacy and Safety Study of Birtamimab Plus Standard of Care vs. Placebo Plus Standard of Care in Mayo Stage IV Subjects With Light Chain (AL) Amyloidosis. ClinicalTrials.gov: NCT04973137 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04973137?term=NCT04973137&draw=2&rank=1
- FDA. 2021. Proceeding of the Cellular, Tissue, and Gene Therapies Advisory Committee Meeting. 15 avril 2021. Consultable en ligne à l’adresse : https://www.fda.gov/media/147529/download
- Expanded Access to Donislecel for Treatment Use. ClinicalTrials.gov: NCT03791567. https://clinicaltrials.gov/ct2/show/NCT03791567?term=NCT03791567&draw=2&rank=1
- Chandrasekaran PR, Madanagopalan VG. 2021. KSI-301: antibody biopolymer conjugate in retinal disorders. Ther Adv Ophthalmol. 13:25158414211027708. doi:10.1177/25158414211027708.
- Guttman Krader C. 2020. KSI-301 for exudative retinal disease showing safety, efficacy, and durability. 1er novembre 2020. Modern Retina. Consultable en ligne à l’adresse : https://www.modernretina.com/view/ksi-301-for-exudative-retinal-disease-showing-safety-efficacy-and-durability
- Kodiak Sciences Inc. 2021. Press Release: Kodiak Sciences Announces 1-Year Durability, Efficacy and Safety Data from Ongoing Phase 1b Study of KSI-301 in Patients with Wet Age-Related Macular Degeneration, Diabetic Macular Edema and Retinal Vein Occlusion at the Angiogenesis, Exudation and Degeneration 2021 Annual Meeting. 13 février 2021. Cision PR Newswire. Consultable en ligne à l’adresse : https://www.prnewswire.com/news-releases/kodiak-sciences-announces-1-year-durability-efficacy-and-safety-data-from-ongoing-phase-1b-study-of-ksi-301-in-patients-with-wet-age-related-macular-degeneration-diabetic-macular-edema-and-retinal-vein-occlusion-at-the-angiogene-301227910.html
- A Prospective, Randomized, Double-masked, Active Comparator-controlled, Multi-center, Two-arm, Phase 3 Study to Evaluate the Efficacy and Safety of Intravitreal KSI-301 Compared With Intravitreal Aflibercept in Participants With Visual Impairment Due to Treatment-naïve Macular Edema Secondary to Retinal Vein Occlusion (RVO). ClinicalTrials.gov: NCT04592419. https://clinicaltrials.gov/ct2/show/NCT04592419?term=NCT04592419&draw=2&rank=1
- A Prospective, Randomized, Double-masked, Active Comparator-controlled, Multi-center, Two-arm, Phase 3 Study to Evaluate the Efficacy and Safety of Intravitreal KSI-301 Compared With Intravitreal Aflibercept in Participants With Visual Impairment Secondary to Treatment-naïve Diabetic Macular Edema (DME). ClinicalTrials.gov: NCT04603937. https://clinicaltrials.gov/ct2/show/NCT04603937?term=NCT04603937&draw=2&rank=1
- A Prospective, Randomized, Double-masked, Active Comparator-controlled, Multi-center, Two-arm, Phase 3 Study to Evaluate the Efficacy and Safety of Intravitreal KSI-301 Compared With Intravitreal Aflibercept in Participants With Visual Impairment Secondary to Treatment-naïve Diabetic Macular Edema (DME). ClinicalTrials.gov: NCT04611152. https://clinicaltrials.gov/ct2/show/NCT04611152?term=NCT04611152&draw=2&rank=1
- A Prospective, Randomized, Double-masked, Sham-controlled, Multicenter, Two-arm, Phase 3 Study to Evaluate the Efficacy and Safety of Intravitreal KSI-301 in Participants With Moderately Severe to Severe Non-proliferative Diabetic Retinopathy (NPDR). ClinicalTrials.gov: NCT05066230. https://clinicaltrials.gov/ct2/show/NCT05066230?term=NCT05066230&draw=2&rank=1
- Tell R, Di Cara A, Odin E, et al. 2021. Folate pathway gene expression in metastatic colorectal cancer patients treated with arfolitixorin/5-FU-based chemotherapy. 22 janvier 2021. 39(3):99. J Clin Oncol. doi: 10.1200/JCO.2021.39.3_suppl.99
- Isofol Medical AB. 2021. Press Release: Isofol receives notice that Clinical Use Patent in Europe for Drug Candidate arfolitixorin will be approved. Cision PR Newswire. 22 mars 2021. Consultable en ligne à l’adresse : https://www.prnewswire.com/news-releases/isofol-receives-notice-that-clinical-use-patent-in-europe-for-drug-candidate-arfolitixorin-will-be-approved-301252744.html
- Isofol Medical AB. 2021. Arfolitixorin- A new drug candidate for colorectal cancer. Isofol Medical AB Biotech Centre. Consultable en ligne à l’adresse : https://isofolmedical.com/arfolitixorin/
- A Study to Compare the Efficacy of Arfolitixorin Versus Leucovorin in Combination With 5 Fluorouracil, Oxaliplatin, and Bevacizumab in Patients With Advanced Colorectal Cancer (AGENT). ClinicalTrials.gov: NCT03750786. https://clinicaltrials.gov/ct2/show/NCT03750786?term=NCT03750786&draw=2&rank=1
- Virgil H. 2021. First Oral SERD Elacestrant Achieves Positive Findings in EMERALD Trial for ER+/HER2– Advanced or Metastatic Breast Cancer. 21 octobre 2021. Cancer Network. Consultable en ligne à l’adresse : https://www.cancernetwork.com/view/first-oral-serd-elacestrant-achieves-positive-findings-in-emerald-trial-for-er-her2-advanced-or-metastatic-breast-cancer
- Chen YC, Yu J, Metcalfe C, et al. 2021. Latest generation estrogen receptor degraders for the treatment of hormone receptor-positive breast cancer. Expert Opin Investig Drugs. doi: 10.1080/13543784.2021.1983542. [En ligne avant impression.]
- Elacestrant Monotherapy vs. Standard of Care for the Treatment of Patients With ER+/HER2- Advanced Breast Cancer Following CDK4/6 Inhibitor Therapy: A Phase 3 Randomized, Open-label, Active-controlled, Multicenter Trial. ClinicalTrials.gov: NCT03778931 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT03778931?term=NCT03778931&draw=2&rank=1
- Stocum L. 2021. Study: SGX301 Demonstrates Efficacy for Treatment of Cutaneous T-cell Lymphoma. 6 mai 2021. DermatologyTimes. Consultable en ligne à l’adresse : https://www.dermatologytimes.com/view/study-sgx301-demonstrates-efficacy-for-treatment-of-cutaneous-t-cell-lymphoma
- PCG Digital Holdings LLC. 2021. Press Release: Soligenix Poised to Announce US Commercialization Plans of SGX301 in the Treatment of Cutaneous T-Cell Lymphoma. 25 janvier 2021. BioSpace. Consultable en ligne à l’adresse : https://www.biospace.com/article/soligenix-poised-to-announce-us-commercialization-plans-of-sgx301-in-the-treatment-of-cutaneous-t-cell-lymphoma/
- PCG Digital Holdings LLC. 2021. Press Release: Soligenix Poised to Announce US Commercialization Plans of SGX301 in the Treatment of Cutaneous T-Cell Lymphoma. 25 janvier 2021. BioSpace. Consultable en ligne à l’adresse : https://www.biospace.com/article/soligenix-poised-to-announce-us-commercialization-plans-of-sgx301-in-the-treatment-of-cutaneous-t-cell-lymphoma/
- A Phase 3 Multicenter, Randomized, Double-Blind, Placebo Controlled Study to Determine the Efficacy of Topical SGX301 (Synthetic Hypericin) and Fluorescent Bulb-Light Irradiation for the Treatment of Cutaneous T-Cell Lymphoma. ClinicalTrials.gov: NCT02448381 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT02448381?term=NCT02448381&draw=2&rank=1
- Martin M, Mayer IA, Walenkamp AME, Lapa C, Andreeff M, Bobirca A. 2021. At the Bedside: Profiling and treating patients with CXCR4-expressing cancers. J Leukoc Biol. 109(5):953-67. doi: 10.1002/JLB.5BT1219-714R.
- Sternberg A. 2021. Motixafortide Reaches Primary End Point of Improved Stem Cell Mobilization in Multiple Myeloma Trial. 5 May 2021. CancerNetwork. Consultable en ligne à l’adresse : https://www.cancernetwork.com/view/motixafortide-reaches-primary-end-point-of-improved-stem-cell-mobilization-in-multiple-myeloma-trial
- BioLineRx Ltd. 2021. Press Release: BioLineRx Announces Positive Results from Pharmacoeconomic Study Positioning Motixafortide as Potential Standard of Care in Stem Cell Mobilization. 13 Oct 2021. Cision PR Newswire. Consultable en ligne à l’adresse : https://www.prnewswire.com/news-releases/biolinerx-announces-positive-results-from-pharmacoeconomic-study-positioning-motixafortide-as-potential-standard-of-care-in-stem-cell-mobilization-301399211.html
- Jaffe GJ, Westby K, Csaky KG, et al. 2021. C5 Inhibitor Avacincaptad Pegol for Geographic Atrophy Due to Age-Related Macular Degeneration: A Randomized Pivotal Phase 2/3 Trial. Ophthalmology. 128(4):576-86. doi: 10.1016/j.ophtha.2020.08.027.
- Linnehan R. 2020. Avacincaptad pegol reduces geographic atrophy growth rate at 18 months. 17 novembre 2020. Healio. Consultable en ligne à l’adresse : https://www.healio.com/news/ophthalmology/20201117/avacincaptad-pegol-reduces-geographic-atrophy-growth-rate-at-18-months
- A Phase 2/3 Randomized, Double-Masked, Controlled Trial to Assess the Safety and Efficacy of Intravitreous Administration of Zimura™ (Anti-C5 Aptamer) in Subjects With Geographic Atrophy Secondary to Dry Age-Related Macular Degeneration. ClinicalTrials.gov: NCT02686658 (terminée). https://clinicaltrials.gov/ct2/show/NCT02686658?term=NCT02686658&draw=2&rank=1.
- A Phase 3 Multicenter, Randomized, Double Masked, Sham- Controlled Clinical Trial to Assess the Safety and Efficacy of Intravitreal Administration of Zimura (Complement C5 Inhibitor) in Patients With Geographic Atrophy Secondary to Age-Related Macular Degeneration. ClinicalTrials.gov: NCT04435366 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT04435366?term=NCT04435366&draw=2&rank=1.
- Nicox. 2021. Press Release: Nicox’s NCX 470 Demonstrates Significant Intraocular Pressure Lowering in Dolomites Phase 2 Glaucoma Trial. 1er juillet 2021. GlobeNewswire. Consultable en ligne à l’adresse : https://www.globenewswire.com/en/news-release/2021/07/01/2256215/0/en/Nicox-s-NCX-470-Demonstrates-Significant-Intraocular-Pressure-Lowering-in-Dolomites-Phase-2-Glaucoma-Trial.html
- Edison. 2021. NCX-4251 setback sharpens focus on NCX-470. 24 Sept 2021. Edison Investment Research Ltd. Consultable en ligne à l’adresse : https://www.edisongroup.com/publication/ncx-4251-setback-sharpens-focus-on-ncx-470/29966
- A Phase 3, Randomized, Multi-Regional, Double-Masked, Parallel-Group Trial Evaluating the Safety and Efficacy of NCX 470 0.1% vs. Latanoprost 0.005% in Subjects With Open-Angle Glaucoma or Ocular Hypertension (Denali). ClinicalTrials.gov: NCT04630808 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04630808?term=NCT04630808&draw=2&rank=1
- Phase 3, Randomized, Adaptive Dose-Selection, Multi-regional, Double-Masked, Parallel-Group, 3-Month Trial Evaluating the Safety and Efficacy of NCX 470 vs. Latanoprost 0.005% in Subjects With Open-Angle Glaucoma or Ocular Hypertension (Mont Blanc). ClinicalTrials.gov: NCT04445519 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04445519?term=NCT04445519&draw=2&rank=1
- Sonis ST. 2021. Superoxide Dismutase as an Intervention for Radiation Therapy-Associated Toxicities: Review and Profile of Avasopasem Manganese as a Treatment Option for Radiation-Induced Mucositis. Drug Des Devel Ther. 15:1021-9. doi: 10.2147/DDDT.S267400.
- UTSouthwestern Medical Center. 2021. Press Release: Experimental drug makes radiation therapy more effective, less damaging. 20 mai 2021. Consultable en ligne à l’adresse : https://www.utsouthwestern.edu/newsroom/articles/year-2021/avasopasem-manganese.html
- ROMAN: Reduction in Oral Mucositis With Avasopasem Manganese (GC4419) - Phase 3 Trial in Patients Receiving Chemoradiotherapy for Locally-Advanced, Non-Metastatic Head and Neck Cancer. ClinicalTrials.gov: NCT03689712 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT03689712?term=NCT03689712&draw=2&rank=1
- Santoro N, Waldbaum A, Lederman S, et al. 2020. Effect of the neurokinin 3 receptor antagonist fezolinetant on patient-reported outcomes in postmenopausal women with vasomotor symptoms: results of a randomized, placebo-controlled, double-blind, dose-ranging study (VESTA). Menopause. 27(12):1350-6. doi: 10.1097/GME.0000000000001621.
- Depypere H, Lademacher C, Siddiqui E, Fraser GL. 2021. Fezolinetant in the treatment of vasomotor symptoms associated with menopause. Expert Opin Investig Drugs. 30(7):681-694. doi: 10.1080/13543784.2021.1893305.
- A Phase 3, Randomized, Placebo-controlled, 12-week Double-blind Study, Followed by a Non-Controlled Extension Treatment Period, to Assess the Efficacy and Safety of Fezolinetant in Women Suffering From Moderate to Severe Vasomotor Symptoms (Hot Flashes) Associated With Menopause. ClinicalTrials.gov: NCT04003142 (terminée). https://clinicaltrials.gov/ct2/show/NCT04003142?term=NCT04003142&draw=2&rank=1
- A Phase 3, Randomized, Placebo-controlled, 12-week Double-blind Study, Followed by a Non-Controlled Extension Treatment Period, to Assess the Efficacy and Safety of Fezolinetant in Women Suffering From Moderate to Severe Vasomotor Symptoms (Hot Flashes) Associated With Menopause. ClinicalTrials.gov: NCT04003155 (terminée). https://clinicaltrials.gov/ct2/show/NCT04003155?term=NCT04003155&draw=2&rank=1
- A Randomized, Placebo-Controlled, Double-Blind Phase 3 Clinical Study to Investigate the Long-Term Safety of Fezolinetant in Women Suffering From Vasomotor Symptoms (Hot Flashes) Associated With Menopause. ClinicalTrials.gov: NCT04003389 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT04003389?term=NCT04003389&draw=2&rank=1
- A Phase 3, Randomized, Placebo-controlled, 12-week Double-blind Study, Followed by a Non-Controlled Extension Treatment Period, to Assess the Efficacy and Safety of Fezolinetant in Women in Asia Suffering From Moderate to Severe Vasomotor Symptoms (Hot Flashes) Associated With Menopause. ClinicalTrials.gov: NCT04234204 (active, recrutement à venir). https://clinicaltrials.gov/ct2/show/NCT04234204?term=NCT04234204&draw=2&rank=1
- A Single-Arm Phase 3 Clinical Study to Investigate the Long-Term Safety of Fezolinetant in Women in China Suffering From Vasomotor Symptoms (Hot Flashes) Associated With Menopause. ClinicalTrials.gov: NCT04451226 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT04451226?term=NCT04451226&draw=2&rank=1
- A Phase III, Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group, Efficacy, and Safety Study of Gantenerumab in Patients With Early (Prodromal to Mild) Alzheimer’s Disease. ClinicalTrials.gov: NCT03443973 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT03443973?term=gantenerumab&phase=2&draw=2&rank=1
- An Open-Label, Multicenter, Rollover Study to Evaluate the Safety and Tolerability of Long-Term Administration of Gantenerumab in Participants With Alzheimer’s Disease. ClinicalTrials.gov: NCT04339413 (active, pas de recrutement). https://clinicaltrials.gov/ct2/show/NCT04339413?term=gantenerumab&phase=2&draw=2&rank=2
- A Phase III, Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group, Efficacy, and Safety Study of Gantenerumab in Patients With Early (Prodromal to Mild) Alzheimer’s Disease. ClinicalTrials.gov: NCT03444870 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT03444870?term=gantenerumab&phase=2&draw=2&rank=3
- An Open-Label, Multicenter, Rollover Study to Evaluate the Safety, Tolerability, and Efficacy of Long-Term Gantenerumab Administration in Participants With Alzheimer’s Disease. ClinicalTrials.gov: NCT04374253 (recrutement en cours). https://clinicaltrials.gov/ct2/show/NCT04374253?term=gantenerumab&phase=2&draw=2&rank=4
- Safety and Efficacy Study of Gantenerumab in Participants With Early Alzheimer’s Disease (AD). ClinicalTrials.gov: NCT03443973. https://www.clinicaltrials.gov/ct2/show/NCT03443973?term=Gantenerumab&rank=2
- Efficacy and Safety Study of Gantenerumab in Participants With Early Alzheimer’s Disease (AD). ClinicalTrial.gov: NCT03444870. https://www.clinicaltrials.gov/ct2/show/NCT03444870?term=Gantenerumab&rank=3
- A Study of Gantenerumab in Participants With Mild Alzheimer Disease. ClinicalTrial.gov: NCT02051608. https://www.clinicaltrials.gov/ct2/show/NCT02051608?term=Gantenerumab&rank=6
- A Study of Gantenerumab in Participants With Prodromal Alzheimer’s Disease. ClinicalTrial.gov: NCT01224106. https://www.clinicaltrials.gov/ct2/show/NCT01224106?term=Gantenerumab&rank=8
- Dominantly Inherited Alzheimer Network Trial: An Opportunity to Prevent Dementia. A Study of Potential Disease Modifying Treatments in Individuals at Risk for or With a Type of Early Onset Alzheimer’s Disease Caused by a Genetic Mutation. Master Protocol DIAN-TU001 (DIAN-TU). ClinicalTrial.gov: NCT01760005. https://www.clinicaltrials.gov/ct2/show/NCT01760005?term=Gantenerumab&rank=12
- Fabry Disease News. 2021. PRX-102 (Pegunigalsidase Alfa). 20 septembre 2021. Fabry Disease News. Consultable en ligne à l’adresse : https://fabrydiseasenews.com/prx-102-pegunigalsidase-alfa/
- Schiffmann R, Goker-Alpan O, Holida M, et al. 2019. Pegunigalsidase alfa, a novel PEGylated enzyme replacement therapy for Fabry disease, provides sustained plasma concentrations and favorable pharmacodynamics: A 1-year Phase 1/2 clinical trial. J Inherit Metab Dis. 42(3):534-44. doi: 10.1002/jimd.12080.
- Protalix BioTherapeutics, Inc. 2020. Press Release: Protalix BioTherapeutics Presents Clinical Data of Pegunigalsidase Alfa for the Treatment of Fabry Disease at the 16th Annual WORLDSymposium 2020. 10 Feb 2020. Cision PR Newswire. Consultable en ligne à l’adresse : https://www.prnewswire.com/news-releases/protalix-biotherapeutics-presents-key-clinical-data-of-pegunigalsidase-alfa-for-the-treatment-of-fabry-disease-at-the-16th-annual-worldsymposium-2020-301002142.html
- Schiffmann R, Goker-Alpan O, Holida M, et al. 2019. Pegunigalsidase alfa, a novel PEGylated enzyme replacement therapy for Fabry disease, provides sustained plasma concentrations and favorable pharmacodynamics: A 1-year Phase 1/2 clinical trial. J Inherit Metab Dis. 42(3):534-44. doi: 10.1002/jimd.12080.
- UniQure Inc. 2021. Press Release: uniQure Announces Positive 52-Week Clinical Data from HOPE-B Pivotal Trial of Etranacogene Dezaparvovec Gene Therapy in Patients with Hemophilia B and Provides Regulatory Update . 22 juin 2021. GlobeNewswire. Consultable en ligne à l’adresse :https://www.globenewswire.com/en/news-release/2021/06/22/2251227/0/en/uniQure-Announces-Positive-52-Week-Clinical-Data-from-HOPE-B-Pivotal-Trial-of-Etranacogene-Dezaparvovec-Gene-Therapy-in-Patients-with-Hemophilia-B-and-Provides-Regulatory-Update.html
- CSL Behring. 2021. Press Release: CSL Behring Announces Closing of Global Commercialization and License Agreement with uniQure for etranacogene dezaparvovec . 6 mai 2021. Consultable en ligne à l’adresse :https://www.cslbehring.com/newsroom/2021/cslbehring-to-commercialize-amt-061
- Von Drygalski A, Giermasz A, Castaman G, et al. 2019. Etranacogene dezaparvovec (AMT-061 phase 2b): normal/near normal FIX activity and bleed cessation in hemophilia B. Blood Adv. 3(21):3241-7. doi: 10.1182/bloodadvances.2019000811.
- Von Drygalski A, Giermasz A, Castaman G, et al. 2019. Etranacogene dezaparvovec (AMT-061 phase 2b): normal/near normal FIX activity and bleed cessation in hemophilia B. Blood Adv. 3(21):3241-7. doi: 10.1182/bloodadvances.2019000811.
- Von Drygalski A, Giermasz A, Castaman G, et al. 2019. Etranacogene dezaparvovec (AMT-061 phase 2b): normal/near normal FIX activity and bleed cessation in hemophilia B. Blood Adv. 3(21):3241-7. doi: 10.1182/bloodadvances.2019000811.
- George LA, Sullivan SK, Rasko JEJ, et al. 2019. Efficacy and Safety in 15 Hemophilia B Patients Treated with the AAV Gene Therapy Vector Fidanacogene Elaparvovec and Followed for at Least 1 Year. Am Soc Hematol. 134(Supplement 1):3347. doi: 10.1182/blood-2019-124091.
- George LA, Sullivan SK, Rasko JEJ, et al. 2019. Efficacy and Safety in 15 Hemophilia B Patients Treated with the AAV Gene Therapy Vector Fidanacogene Elaparvovec and Followed for at Least 1 Year. Am Soc Hematol. 134(Supplement 1):3347. doi: 10.1182/blood-2019-124091.
- Spark Therapeutics. 2018. Press Release: Pfizer Initiates Pivotal Phase 3 Program for Investigational Hemophilia B Gene Therapy. 16 juillet 2018. Consultable en ligne à l’adresse :https://sparktx.com/press_releases/pfizer-initiates-pivotal-phase-3-program-for-investigational-hemophilia-b-gene-therapy/
- Talyor P. 2021. Sanofi eyes 2022 filing for haemophilia drug fitusiran, despite safety issue. 28 avril 2021. Pharmaphorum. Consultable en ligne à l’adresse : https://pharmaphorum.com/news/sanofi-eyes-2022-filing-for-haemophilia-drug-fitusiran-despite-safety-issue/
- Pasi KJ, Rangarajan S, Georgiev P, et al. 2017. Targeting of Antithrombin in Hemophilia A or B with RNAi Therapy. N Engl J Med. 377(9):819-828. doi: 10.1056/NEJMoa1616569.
- Martin ER, Smith MT, Maroni BJ, Zuraw QC, deGoma EM. 2017. Clinical Trial of Vadadustat in Patients With Anemia Secondary to Stage 3 or 4 Chronic Kidney Disease. Am J Nephrol. 45(5):380-388. doi: 10.1159/000464476.
- Haase VH, Chertow GM, Block GA, et al. 2018. Effects of vadadustat on hemoglobin concentrations in patients receiving hemodialysis previously treated with erythropoiesis-stimulating agents. Nephrol Dial Transplant. doi: 10.1093/ndt/gfy055.
- Healio. 2021. FDA accepts filing of new drug application for vadadustat. 2 juin 2021. Healio. Consultable en ligne à l’adresse : https://www.healio.com/news/nephrology/20210602/fda-accepts-filing-of-new-drug-application-for-vadadustat
- Pharamceutical Technology. 2021. FDA declines to approve Provention Bio’s teplizumab for diabetes. 7 juillet 2021. Pharamceutical Technology. Consultable en ligne à l’adresse : https://www.pharmaceutical-technology.com/news/fda-declines-teplizumab-approval/
- Herold KC, Bundy BN, Long A, et al. 2019. An Anti-CD3 Antibody, Teplizumab, in Relatives at Risk for Type 1 Diabetes. N Engl J Med. 381(7):603-13. doi: 10.1056/NEJMoa1902226.
- Hippensteele A. 2020. Study: Teplizumab Delays Progression to Type 1 Diabetes by 3 Years in High-risk Patients. 22 juin 2020. Pharmacy Times. Consultable en ligne à l’adresse : https://www.pharmacytimes.com/news/study-teplizumab-delays-progression-to-type-1-diabetes-by-3-years-in-high-risk-patients
- Mistry S. 2021. Ipatasertib Plus Abiraterone: A New Potential Treatment for Metastatic Castration-Resistant Prostate Cancer With PTEN Loss. 26 juillet 2021. Cancer Therapy Advisor. Consultable en ligne à l’adresse : https://www.cancertherapyadvisor.com/home/cancer-topics/prostate-cancer/prostate-cancer-ipatasertib-abiraterone-treatment-risk-potential/
- Sweeney C, Bracarda S, Sternberg CN, et al. 2021. Ipatasertib plus abiraterone and prednisolone in metastatic castration-resistant prostate cancer (IPATential150): a multicentre, randomised, double-blind, phase 3 trial. Lancet. 398(10295):131-142. doi: 10.1016/S0140-6736(21)00580-8.
- de Bono JS, De Giorgi U, Nava Rodrigues D, et al. 2018. Randomized Phase II Study of Akt Blockade With or Without Ipatasertib in Abiraterone-Treated Patients With Metastatic Prostate Cancer With and Without PTEN Loss. Clin Cancer Res. doi:10.1158/1078-0432.CCR-18-0981.
- Broderick JM. 2020. VB-111 Hits Milestone in Phase III Platinum-Resistant Ovarian Cancer Trial. 26 mars 2020. OncLive. Consultable en ligne à l’adresse : https://www.onclive.com/view/vb111-hits-milestone-in-phase-iii-platinumresistant-ovarian-cancer-trial
- Arend RC, Monk BJ, Herzog TJ, et al. 2021. Utilizing an interim futility analysis of the OVAL study (VB-111-701/GOG 3018) for potential reduction of risk: A phase III, double blind, randomized controlled trial of ofranergene obadenovec (VB-111) and weekly paclitaxel in patients with platinum resistant ovarian cancer. Gynecol Oncol. 161(2):496-501. doi: 10.1016/j.ygyno.2021.02.014.
- Arend RC, Beer HM, Cohen YC, et al. 2020. Ofranergene obadenovec (VB-111) in platinum-resistant ovarian cancer; favorable response rates in a phase I/II study are associated with an immunotherapeutic effect. Gynecol Oncol. 157(3):578-84. doi: 10.1016/j.ygyno.2020.02.034.
- Arend RC, Beer HM, Cohen YC, et al. 2020. Ofranergene obadenovec (VB-111) in platinum-resistant ovarian cancer; favorable response rates in a phase I/II study are associated with an immunotherapeutic effect. Gynecol Oncol. 157(3):578-84. doi: 10.1016/j.ygyno.2020.02.034.
- TG Therapeutics. 2021. Press Release: TG Therapeutics Announces Positive Results from the ULTIMATE I & II Phase 3 Trials of Ublituximab in Multiple Sclerosis to be Presented at American Academy of Neurology 73rd Annual Meeting. 16 avril 2021. GlobeNewswire. Consultable en ligne à l’adresse : https://www.globenewswire.com/news-release/2021/04/16/2211550/8790/en/TG-Therapeutics-Announces-Positive-Results-from-the-ULTIMATE-I-II-Phase-3-Trials-of-Ublituximab-in-Multiple-Sclerosis-to-be-Presented-at-American-Academy-of-Neurology-73rd-Annual-M.html
- Babiker HM, Glode AE, Cooke LS, Mahadevan D. 2018. Ublituximab for the treatment of CD20 positive B-cell malignancies. Expert Opin Investig Drugs. 27(4):407-12. doi:10.1080/13543784.2018.1459560.
- Pithadia DJ, Reynolds KA, Lee EB, et al. 2019. Tildrakizumab in the treatment of psoriasis: latest evidence and place in therapy. Ther Adv Chronic Dis. 10:2040622319865658. doi:10.1177/2040622319865658.
- Sharman JP, Farber CM, Mahadevan D, et al. 2017. Ublituximab (TG-1101), a novel glycoengineered anti-CD20 antibody, in combination with ibrutinib is safe and highly active in patients with relapsed and/or refractory chronic lymphocytic leukaemia: results of a phase 2 trial. Br J Haematol. 176(3):412-20. doi: 10.1111/bjh.14447.
- Paganoni S, Macklin EA, Hendrix S, et al. 2020. Trial of Sodium Phenylbutyrate-Taurursodiol for Amyotrophic Lateral Sclerosis. N Engl J Med. 383(10):919-30. doi: 10.1056/NEJMoa1916945.
- Paganoni S, Hendrix S, Dickson SP, et al. 2021. Long-term survival of participants in the CENTAUR trial of sodium phenylbutyrate-taurursodiol in amyotrophic lateral sclerosis. Muscle Nerve. 63(1):31-39. doi: 10.1002/mus.27091.
- Amylyx Pharamceuticals, Inc. 2021. Press Release: Amylyx Pharmaceuticals Submits New Drug Application (NDA) for AMX0035 for the Treatment of ALS. 2 novembre 2021. BusinessWire. Consultable en ligne à l’adresse : https://www.businesswire.com/news/home/20211102005320/en/Amylyx-Pharmaceuticals-Submits-New-Drug-Application-NDA-for-AMX0035-for-the-Treatment-of-ALS
- Amylyx Pharamceuticals, Inc. 2021. Press Release: Amylyx Pharmaceuticals Submits New Drug Application (NDA) for AMX0035 for the Treatment of ALS. 2 novembre 2021. BusinessWire. Consultable en ligne à l’adresse : https://www.businesswire.com/news/home/20211102005320/en/Amylyx-Pharmaceuticals-Submits-New-Drug-Application-NDA-for-AMX0035-for-the-Treatment-of-ALS
- AstraZeneca Pharmaceuticals LP. 2020. OSELUGO (selumetinib) capsules, for oral use [FDA label]. US Food and Drug Administration. Consultable en ligne à l’adresse : https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/213756s000lbl.pdf
- Gross AM, Wolters PL, Dombi E, et al. 2020. Selumetinib in Children with Inoperable Plexiform Neurofibromas. N Engl J Med. 382(15):1430-42. doi: 10.1056/NEJMoa1912735.
- Gross AM, Wolters PL, Dombi E, et al. 2020. Selumetinib in Children with Inoperable Plexiform Neurofibromas. N Engl J Med. 382(15):1430-42. doi: 10.1056/NEJMoa1912735.
- Gross AM, Dombi E, Widemann BC. 2020. Current status of MEK inhibitors in the treatment of plexiform neurofibromas. Childs Nerv Syst. 36(10):2443-52. doi: 10.1007/s00381-020-04731-2.
- AstraZenenca. 2020. Press Release: Koselugo (selumetinib) approved in US for paediatric patients with neurofibromatosis type 1 plexiform neurofibromas. 13 avril 2020. Consultable en ligne à l’adresse : https://www.astrazeneca.com/media-centre/press-releases/2020/koselugo-selumetinib-approved-in-us-for-paediatric-patients-with-neurofibromatosis-type-1-plexiform-neurofibromas.html
- Manley PW, Barys L, Cowan-Jacob SW. 2020. The specificity of asciminib, a potential treatment for chronic myeloid leukemia, as a myristate-pocket binding ABL inhibitor and analysis of its interactions with mutant forms of BCR-ABL1 kinase. Leuk Res. 98:106458. doi: 10.1016/j.leukres.2020.106458.
- Novartis. 2021. Press Release: FDA approves Novartis Scemblix® (asciminib), with novel mechanism of action for the treatment of chronic myeloid leukemia. 29 octobre 2021. Consultable en ligne à l’adresse : https://www.novartis.com/news/media-releases/fda-approves-novartis-scemblix-asciminib-novel-mechanism-action-treatment-chronic-myeloid-leukemia.
- Réa D, Mauro MJ, Boquimpani C, et al. 2021. A Phase 3, Open-Label, Randomized Study of Asciminib, a STAMP Inhibitor, vs Bosutinib in CML After≥ 2 Prior TKIs. Blood. 138(21):2031-2041. doi: 10.1182/blood.2020009984.
- FDA Approves Asciminib, Drug With Novel Action in CML. 2 novembre 2021. https://www.medscape.com/viewarticle/962073
- Novartis. 2021. Press Release: FDA approves Novartis Scemblix® (asciminib), with novel mechanism of action for the treatment of chronic myeloid leukemia. 29 octobre 2021. Consultable en ligne à l’adresse : https://www.novartis.com/news/media-releases/fda-approves-novartis-scemblix-asciminib-novel-mechanism-action-treatment-chronic-myeloid-leukemia
- Chustecka Z. 2021. FDA Approves Asciminib, Drug With Novel Action in CML. 2 novembre 2021. Medscape. Consultable en ligne à l’adresse : https://www.medscape.com/viewarticle/962073
- FDA. 2021. FDA approves asciminib for Philadelphia chromosome-positive chronic myeloid leukemia. 29 octobre 2021. US Food and Drug Administration. Consultable en ligne à l’adresse : https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-asciminib-philadelphia-chromosome-positive-chronic-myeloid-leukemia
- Kyowa Kirin, Inc. 2018. POTELIGEO® (mogamulizumab-kpkc) injection, for intravenous use [étiquette de la FDA]. US Food and Drug Administration. Consultable en ligne à l’adresse : https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/761051s000lbl.pdf
- Blackmon AL, Pinter-Brown L. 2020. Spotlight on Mogamulizumab-Kpkc for Use in Adults with Relapsed or Refractory Mycosis Fungoides or Sézary Syndrome: Efficacy, Safety, and Patient Selection. Drug Des Devel Ther. 14:3747-54. doi: 10.2147/DDDT.S185896.
- Moore DC, Elmes JB, Shibu PA, Larck C, Park SI. 2020. Mogamulizumab: An Anti-CC Chemokine Receptor 4 Antibody for T-Cell Lymphomas. Ann Pharmacother. 54(4):371-9. doi: 10.1177/1060028019884863.
- Samaddar A, Grover M, Nag VL. 2020. Pathophysiology and Potential Therapeutic Candidates for COVID‑19: A Poorly Understood Arena. Front Pharmacol. 11:585888. doi: 10.3389/fphar.2020.585888.