Consultation : Enregistrement des essais cliniques et divulgation publique des résultats : Ébauche de la ligne directrice et portail de recherche public
Par Santé Canada
État actuel : Fermé
Cette consultation a eu lieu du 23 février 2023 au 24 avril 2023.
Santé Canada a élaboré une ébauche des lignes directrices et propose un portail de recherche sur les essais cliniques. Ce portail permettrait de mettre à la disposition du public davantage de renseignements sur les essais autorisés au Canada et d'améliorer l'accessibilité à ces renseignements.
Santé Canada sollicite vos commentaires sur :
- une ébauche des lignes directrices décrivant les attentes en matière de politiques pour les promoteurs d'essais cliniques autorisés à enregistrer et à déclarer les résultats de leurs essais dans des registres internationaux
- les modèles d'images proposés pour le nouveau portail de recherche sur les essais cliniques
Qui cette consultation visait-elle
Le gouvernement du Canada a engagé un dialogue avec :
- aux professionnels de la santé
- aux patients, à leurs soignants et aux organismes de défense des droits des patients
- aux chercheurs qui étudient les médicaments, les instruments médicaux et les produits de santé naturels (PSN) chez les humains
Objectifs de la consultation
Santé Canada est déterminé à accroître la transparence des renseignements sur les essais cliniques canadiens. Cette consultation fait progresser les travaux prioritaires dans le cadre du Plan prospectif de la réglementation du Ministère de 2022-2024 qui visent à moderniser le cadre réglementaire des essais cliniques.
Au printemps 2021, Santé Canada a tenu une consultation sur son projet de modernisation de la réglementation sur les essais cliniques afin de recueillir les commentaires des intervenants. Une description des propositions de transparence était incluse. Les commentaires des intervenants ont éclairé l'élaboration de l'ébauche des lignes directrices et du portail de recherche public proposé.
Cette ébauche des lignes directrices décrivent les attentes de Santé Canada en matière de politiques pour les promoteurs d'essais cliniques autorisés visant des médicaments (pharmaceutiques, biologiques et radiopharmaceutiques), des instruments médicaux et des PSN. Cette politique devrait donner le temps aux promoteurs de s'adapter au processus d'enregistrement des essais et de déclaration des résultats au moyen de registres internationaux, avant que des règlements soient proposés au Canada.
Pour compléter ces travaux et améliorer l'accès du public, Santé Canada met au point un portail de recherche pour remplacer l'actuelle base de données sur les essais cliniques. Tous les essais cliniques autorisés au Canada seraient inclus grâce à une mise en œuvre progressive. Au cours de la première phase du portail, le Ministère publiera des renseignements sur les essais de médicaments autorisés. Les prochaines phases comprendront des renseignements concernant les essais portant sur des instruments médicaux et des PSN.
Principaux points nécessitant vos commentaires
Nous avons sollicité vos idées et vos commentaires sur les thèmes ou sujets :
- L'ébauche des lignes directrices - Enregistrement des essais cliniques et divulgation publique des résultats : Transparence des essais cliniques autorisés par Santé Canada
- Les modèles d'images du portail des essais cliniques proposé
Modèles 1
Image Texte Visualiser ou télécharger 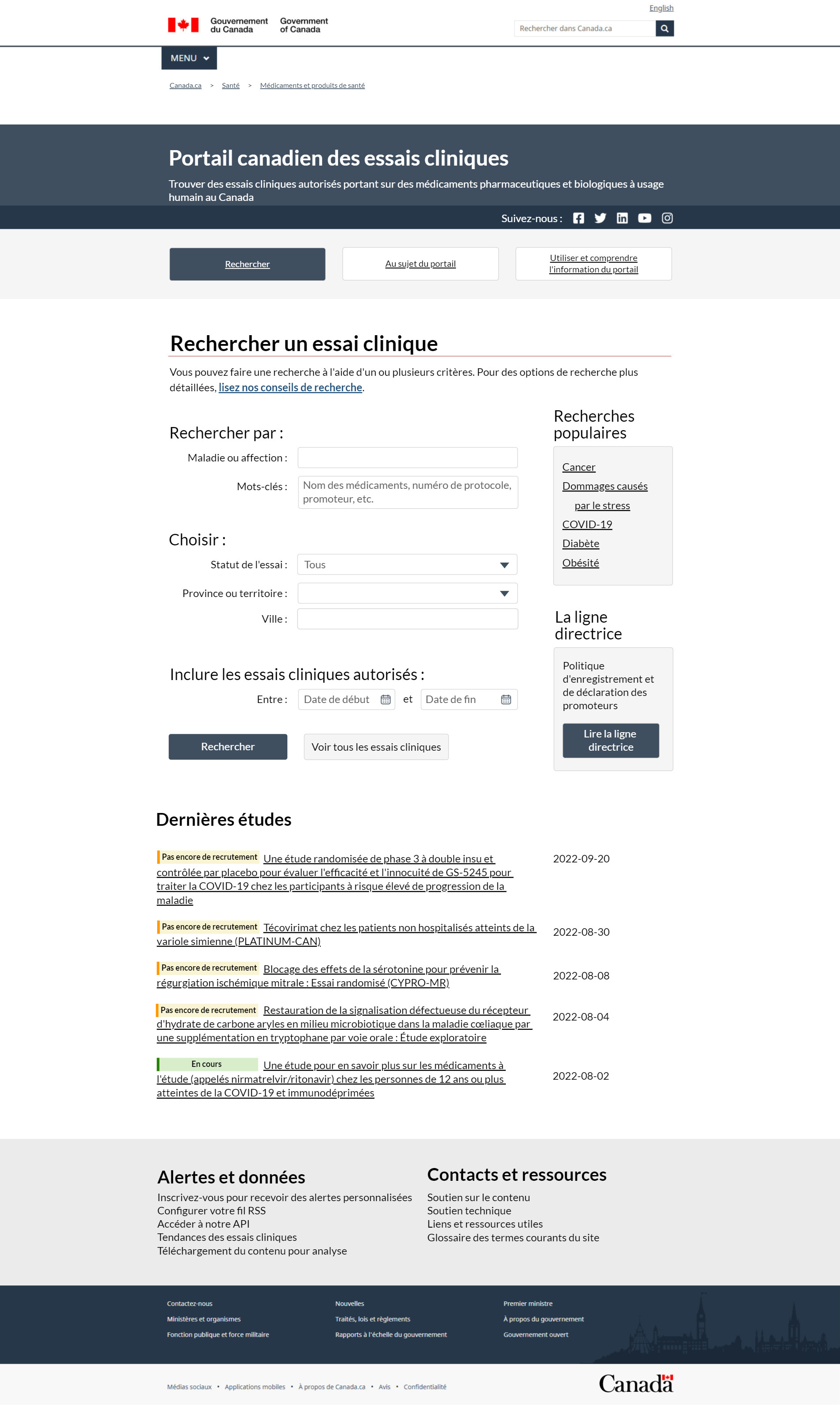
FIGURE 1 – Page d'accueil du Portail des essais cliniques – Texte descriptif
Voici une image de la nouvelle page d'accueil du Portail canadien des essais cliniques. L'en-tête supérieur sur fond bleu foncé indique que l'objectif du portail est d'aider les gens à trouver des essais cliniques autorisés sur des médicaments pharmaceutiques et biologiques pour usage humain au Canada. L'en-tête à droite contient des liens vers les chaînes Facebook, Twitter, LinkedIn, YouTube et Instagram de Santé Canada. Sous l'en-tête, 3 boutons vous permettent de naviguer rapidement entre les pages Recherche, À propos du portail et Utilisation du portail pour obtenir des renseignements. Le bouton Recherche, qui est bleu foncé, indique que vous êtes sur cette page. Le lien À propos du portail vous dirige vers des renseignements organisationnels. La page Utilisation du portail pour obtenir des renseignements fournit des instructions sur le fonctionnement de l'interface et sur la façon de naviguer dans les fonctions du système.
Sous les 3 boutons de navigation, on trouve l'interface de recherche principale du Portail des essais cliniques, où vous pouvez chercher un essai clinique canadien. La page Conseils de recherche vous prodigue des conseils pour vous aider dans votre recherche. Vous pouvez chercher des essais cliniques en utilisant les repères suivants :
- Des mots déterminés
- Un statut et un emplacement
- Une certaine plage de dates
Le premier critère sous Recherche par est Maladie ou problème de santé. Une zone de texte ouverte apparaît avec remplissage automatique afin que vous puissiez faire correspondre le problème de santé aux termes de la base de données. Le deuxième critère est Mot-clé, qui vous permet de rechercher tout le contenu d'une fiche particulière. Il peut s'agir du nom du médicament, du numéro du protocole, du promoteur ou de tout autre élément d'intérêt. La deuxième section, intitulée Choisir, vous permet de préciser votre recherche en fonction du statut de l'essai ou par province ou territoire, ou par province et territoire. Vous pouvez également cibler la Ville, pour obtenir des résultats plus pertinents. L'apparition du champ de la Ville dépend de la province ou du territoire de votre choix. Le critère de recherche final est la date, ce qui signifie que vous pouvez inclure les essais cliniques autorisés entre 2 dates de votre choix. Deux boutons suivent les critères de recherche. Le premier bouton Recherche exécute la recherche en fonction des critères saisis, ce qui vous dirige vers une nouvelle page avec vos résultats de recherche. Le deuxième bouton Voir tous les essais cliniques vous permet de sauter la recherche et de voir tous les essais cliniques canadiens disponibles dans une nouvelle page.
À droite de la section des critères de recherche, un encadré affiche les principaux termes de recherche. Cet encadré Recherches populaires énumère les 5 termes les plus recherchés par les utilisateurs pour une période donnée. Nous vous en avons donné un exemple pour en illustrer le fonctionnement. Notre exemple énumère 5 hyperliens pour 5 problèmes de santé comme options de recherche populaires possibles, soit :
- le cancer
- les dommages provoqués par le stress
- la COVID-19
- le diabète
- l'obésité
En cliquant sur l'un de ces liens, vous accéderez à une page de résultats filtrée à l'avance pour ce mot-clé précis. Sous la section Recherches populaires à droite se trouve un autre encadré intitulé Lignes directrices. On y trouve la Politique d'enregistrement et de déclaration pour les promoteurs. Sous cet encadré, il y a le bouton Lire les lignes directrices. Cliquez sur ce bouton pour accéder au document Ligne directrice sur l'enregistrement des essais cliniques et la divulgation publique des résultats.
La section suivante de la page située sous les critères de recherche se nomme Plus récentes études. Cette section mettra en évidence les 5 plus récentes demandes d'essais cliniques autorisés à recevoir une lettre de non-objection. Chaque étude affiche son statut, le titre officiel du protocole et sa date d'autorisation. Le titre comprend l'hyperlien à la fiche pour obtenir plus de détails.
Le pied de page est la dernière section de la page d'accueil du Portail des essais cliniques. On y trouve 2 sections organisées en 2 colonnes. Chaque colonne comporte un ensemble d'hyperliens utiles pour vous aider à comprendre et à utiliser le système. La première section à gauche se nomme Alertes et données et présente 5 options :
- Inscription aux alertes personnalisées
- Configuration de votre fil RSS
- Accès à notre API
- Voir les tendances en matière d'essais cliniques
- Télécharger le contenu pour l'analyse
La deuxième section du pied de page comporte les Coordonnées et ressources, où vous pouvez trouver :
- des coordonnées
- du soutien technique
- des liens et ressources utiles
- un glossaire des termes courants du site
Le pied de page standard de Canada.ca se trouve dans cette section.
Modèles 2
Image Texte Visualiser ou télécharger 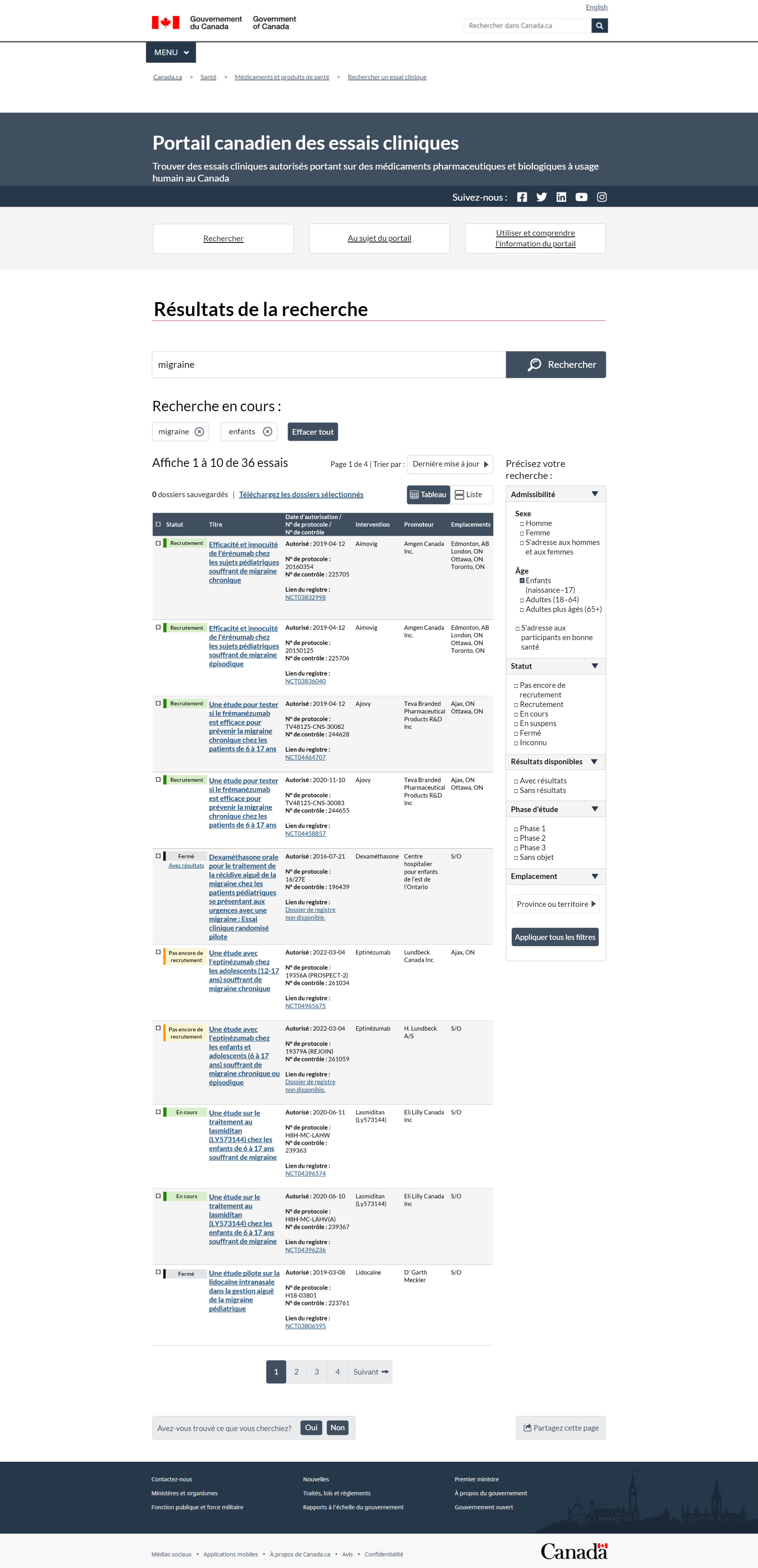
FIGURE 2 – Page des résultats de la recherche, vue de tableau
Cette image représente la page Résultats de la recherche du nouveau Portail canadien des essais cliniques. En haut, il y a un en-tête sur fond bleu foncé. Il explique que l'objectif du portail est d'aider les gens à trouver des essais cliniques autorisés sur des médicaments pharmaceutiques et biologiques pour usage humain au Canada. L'en-tête à droite contient des liens vers les chaînes Facebook, Twitter, LinkedIn, YouTube et Instagram de Santé Canada. Sous l'en-tête, 3 boutons vous permettent de naviguer rapidement entre les pages Recherche, À propos du portail et Utilisation du portail pour obtenir des renseignements. Le bouton Recherche vous amène à la recherche principale. Le lien À propos du portail vous dirige vers des renseignements organisationnels. La page Utilisation du portail pour obtenir des renseignements vous explique le fonctionnement de l'interface et la façon de naviguer dans le portail.
Dans cet exemple, nous montrons ce à quoi ressemblent les résultats si vous avez entré manuellement le terme « migraine » à partir de la page Recherche, et avez utilisé les filtres de la page Résultats de la recherche pour choisir le groupe d'âge des enfants.
Sous l'en-tête se trouve le titre de cette page, Résultats de la recherche. Le champ de recherche suit le titre de la page. Il comporte un bouton de recherche à droite, où vous pouvez entrer les termes de recherche. La zone de saisie contient le mot « migraine », qui aurait été saisi à la page de recherche des essais cliniques. Sous le champ de recherche, on voit le titre Recherche en cours. Sous ce titre apparaissent 2 zones de saisie, l'une avec le terme migraine et l'autre avec le mot enfants. Vous pouvez affiner votre recherche en excluant l'un ou l'autre des termes et en cliquant sur le X dans la zone de saisie. À droite des termes de recherche en cours se trouve le bouton Effacer tout, si vous devez réinitialiser la recherche. Les résultats se trouvent sous les termes de recherche. Le nombre total de résultats apparaît en premier. Dans le présent exemple, les résultats de la recherche indiquent 1 à 10 études sur 36. Ces résultats sont présentés sur 4 pages et vous êtes actuellement à la page 1. À droite du total des résultats, on trouve un menu déroulant. Vous pouvez utiliser le menu déroulant pour classer vos résultats selon l'une des 5 façons suivantes :
- Dernière mise à jour
- Date d'autorisation
- Statut
- Intervention
- Nom du promoteur
Le statut, l'intervention et le nom du promoteur sont classés par ordre alphabétique. Les options Dernière mise à jour et Date d'autorisation apparaissent en ordre chronologique, de la fiche la plus récente à la plus ancienne. Sous cette section, un champ à droite indique 0 fiche conservée ainsi qu'un hyperlien vers l'option Télécharger les fiches conservées. À la fin de cette section, vous trouverez une fonction qui vous permet d'alterner la présentation. Vous pouvez afficher les résultats dans un tableau, comme cette page les présente actuellement, ou dans une liste qui regroupe les renseignements au lieu de les afficher côte à côte. Le tableau des résultats est composé de 10 lignes, avec une fiche par ligne, et de 8 colonnes. Dans l'en-tête bleu foncé de la colonne 1, une case à cocher vous permet de choisir toutes les fiches affichées et de les rendre disponibles pour le téléchargement. La colonne 2 indique le statut global de l'essai. La colonne 3 est le titre abrégé. Le titre abrégé de chaque fiche contient un hyperlien vers la page plus détaillée de la fiche. La colonne 4 indique :
- la date d'autorisation, qui correspond à la date de la lettre de non-objection
- le numéro du protocole
- le numéro de contrôle
- le lien vers le registre, soit le numéro de fiche hyperlié sur ClinicalTrials.gov
La colonne Intervention indique le nom du médicament mis à l'essai. La colonne Promoteur indique le nom de l'entreprise ou de l'organisation responsable de l'essai clinique. La dernière colonne énumère tous les emplacements où se déroule un essai clinique.
Un ensemble de filtres appelé Restreindre votre recherche se situe à droite du tableau qui donne les résultats de la recherche. Vous pouvez utiliser l'un des 5 filtres pour affiner votre recherche. Le premier filtre, appelé Admissibilité, comprend les options suivantes :
- Sexe : hommes, femmes ou les deux
- Âge : enfants de 0 à 17 ans, adultes de 18 à 65 ans ou adultes de plus de 65 ans
- Si l'étude s'adresse à des volontaires en bonne santé
Dans cet exemple, on a choisi les enfants. Le deuxième filtre est celui du statut, où vous avez pu préciser votre recherche en utilisant un ou plusieurs des 6 statuts disponibles :
- Pas encore en recrutement
- En recrutement
- En cours
- En suspens
- Terminé
- Inconnu
Vous pouvez également cibler davantage la recherche si des résultats sont disponibles et par phase d'étude. La recherche par phase d'étude présente 4 options : phase 1, phase 2, phase 3 ou la phase ne s'applique pas. Le dernier filtre est l'emplacement, où vous pouvez effectuer une recherche par province et territoire. Le filtre Ville est un champ contextuel qui s'affiche en fonction de la province ou du territoire choisi. Il est suivi du bouton Appliquer qui vous permet d'activer d'autres paramètres de recherche.
Le contenu du tableau des résultats vous montre ce à quoi pourraient ressembler les résultats de recherche pour 3 scénarios différents. À la deuxième ligne, nous avons le premier exemple d'un essai clinique où l'on recrute des participants. Dans la première colonne de cette ligne, vous pouvez choisir la fiche à télécharger à l'aide de la case de sélection. Nous ne l'avons pas choisi pour cet exemple. À la colonne suivante, le statut de cette fiche est en recrutement. Il y a une case verte derrière le statut, et chaque statut est codé avec une couleur correspondante. Dans la troisième colonne, cette étude est intitulée « Efficacy and safety of erenumab in pediatric subjects with chronic migraine » (Efficacité et innocuité de l'érénumab chez les sujets pédiatriques souffrant de migraine chronique). Le titre est hyperlié à l'affichage de la fiche de cet essai clinique. À la colonne 4, on vous dit que l'étude a été autorisée le 4 avril 2019, que le numéro du protocole est le 20160354 et que son numéro de contrôle est le 225705. On indique également le numéro d'enregistrement de la fiche. Il s'agit du NCT03832998 et il est lié à ClinicalTrials.gov, où l'essai clinique a été enregistré. Le type d'intervention se trouve dans la colonne 5, il s'agit d'Aimovig pour cet essai. Le promoteur est Amgen Canada Inc., indiqué dans la colonne 6. À la dernière colonne, des essais cliniques se déroulent à Edmonton, en Alberta; à London, en Ontario; à Ottawa, en Ontario et à Toronto, en Ontario.
Le deuxième exemple est un essai clinique terminé. Dans la colonne 1, vous pouvez choisir la fiche à télécharger à l'aide de la case de sélection. On ne l'a pas choisi pour cet exemple. Dans la colonne 2, le statut de cette fiche est Terminé avec résultats. Derrière le statut, on trouve une case où les mots avec résultats sont hyperliés à la section Résultats qui comprend l'affichage des fiches. À la colonne 3, cette étude s'intitule « Oral dexamethasone for the treatment of acute migraine recurrence in paediatric patients presenting to the emergency department with migraine: a pilot randomized controlled trial ». (La dexaméthasone orale pour le traitement de la récidive de la migraine aiguë chez les patients pédiatriques se présentant aux urgences avec une migraine : un essai pilote randomisé contrôlé.) Le titre est hyperlié à l'affichage de la fiche de cet essai clinique. Dans la colonne 4, vous remarquerez que l'étude a été autorisée le 21 juillet 2016, que le numéro du protocole est le 16–27E et que son numéro de contrôle est le 196439. Cette fiche particulière n'avait pas de lien vers le registre. À la colonne 5, on trouve le type d'intervention, qui est la dexaméthasone pour cet essai. Le promoteur, soit le Centre hospitalier pour enfants de l'est de l'Ontario, figure à la colonne 6. Dans la colonne 7, il n'y a pas d'emplacement indiqué puisqu'il s'agit d'un essai terminé. Le champ est qualifié comme sans objet.
Dans le troisième et dernier exemple, il y a une étude qui n'est pas encore en recrutement. Dans la colonne 1, vous pouvez choisir la fiche à télécharger à l'aide de la case de sélection. On ne l'a pas choisi pour cet exemple. À la colonne 2, on voit que le statut de cette fiche est Pas encore en recrutement. Derrière le statut, on trouve une case. À la colonne 3, cette étude est intitulée A study with eptinezumab in children and adolescents 6 to 17 years with chronic or episodic migraine (Une étude avec l'eptinézumab chez les enfants et adolescents de 6 à 17 ans souffrant de migraine chronique ou épisodique). Le titre est hyperlié à l'affichage de la fiche de cet essai clinique. Dans la colonne 4, vous remarquerez que l'étude a été autorisée le 4 mars 2022, que le numéro du protocole est le 19356A (PROSPECT-2) et que son numéro de contrôle est le 261059. On indique également le numéro de registre de la fiche. Il s'agit du NCT04965675 et il est lié à ClinicalTrials.gov, où l'essai clinique a été enregistré. À la colonne 5 se trouve le type d'intervention, qui est l'eptinézumab pour cet essai. Le promoteur est Lundbeck Canada Inc., indiqué dans la colonne 6. Enfin, à la colonne 5, on indique que l'essai clinique se déroule à Ajax, en Ontario.
À la fin du tableau des résultats, on voit la fonction de navigation de la page qui vous permet de consulter tous les résultats. La fonction de navigation est suivie d'un mécanisme de rétroaction qui vous permet de cliquer sur oui ou non et de fournir une rétroaction écrite en cas de problème. Vous pouvez également partager les résultats de votre recherche sur divers médias sociaux en utilisant le bouton Partager cette page, qui se trouve à droite du mécanisme de rétroaction Avez-vous trouvé ce que vous cherchiez?
Modèles 3
Image Texte Visualiser ou télécharger 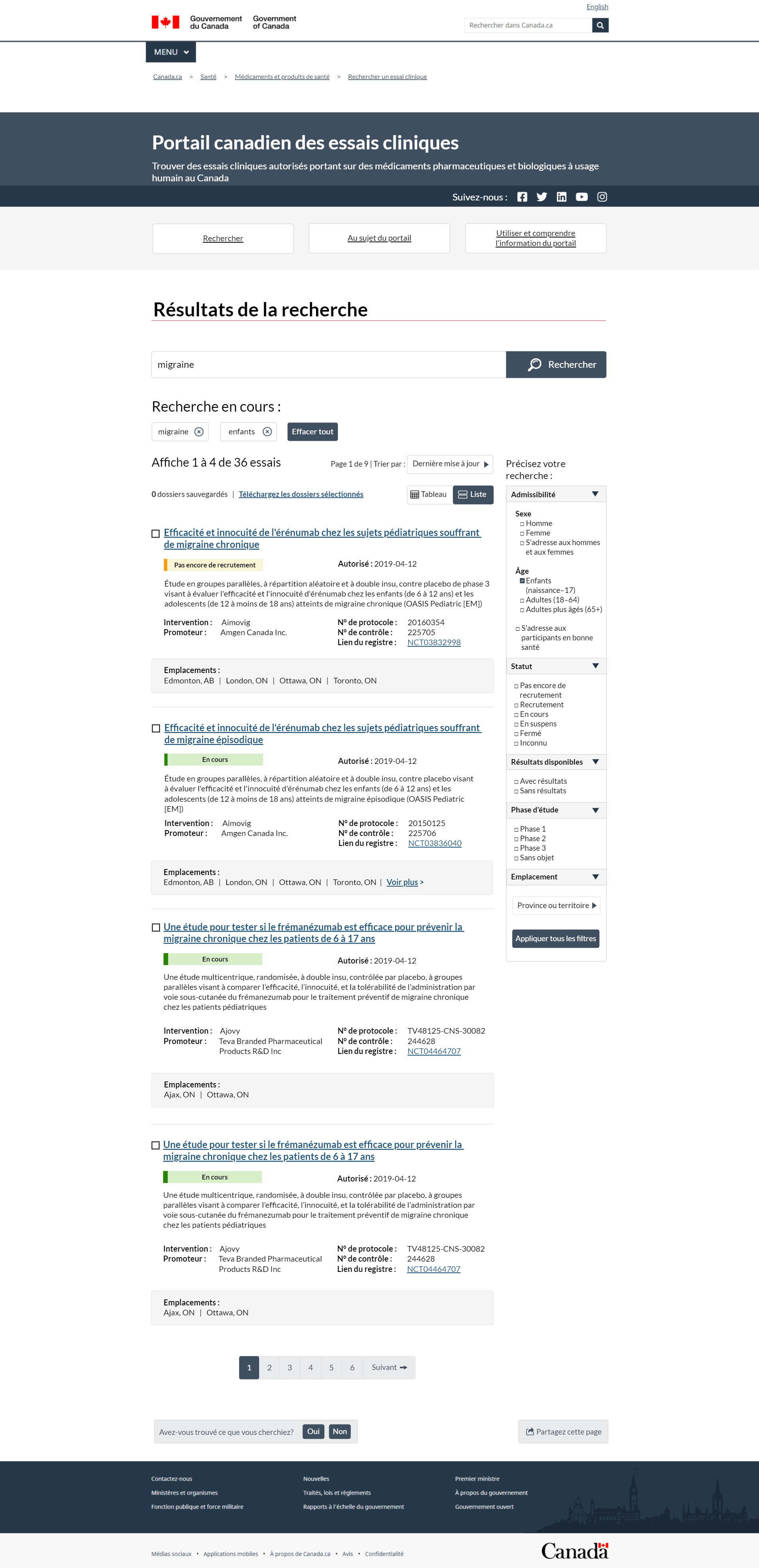
FIGURE 3 – Page des résultats de la recherche, vue en liste
Cette image représente les résultats de recherche dans une vue en liste. L'en-tête supérieur sur fond bleu foncé indique que l'objectif du portail est d'aider les gens à trouver des essais cliniques autorisés portant sur des médicaments pharmaceutiques et biologiques pour usage humain au Canada. L'en-tête à droite contient des liens vers les chaînes Facebook, Twitter, LinkedIn, YouTube et Instagram de Santé Canada. Sous l'en-tête, 3 boutons vous permettent de naviguer rapidement entre les 3 pages. Le bouton Recherche vous amène à la recherche principale. Le bouton À propos du portail vous dirige vers des renseignements organisationnels. Le bouton Utilisation du portail pour obtenir des renseignements vous redirige vers des instructions sur le fonctionnement de l'interface et sur la façon de naviguer dans le système.
Dans cet exemple, nous montrons ce à quoi ressemblent les résultats si vous avez saisi manuellement le terme « migraine » à partir de la page de recherche, puis utilisé les filtres de la page des résultats de recherche pour choisir le groupe d'âge « enfants ».
Sous l'en-tête, on voit le titre de cette page : Résultats de la recherche. Le champ de recherche comporte un bouton de recherche que vous pouvez utiliser pour entrer les termes de recherche. La zone de saisie contient le mot « migraine », qui aurait été saisi à la page de recherche des essais cliniques. Sous le champ de recherche, on trouve le deuxième titre Recherche en cours. Sous ce titre apparaissent 2 zones de saisie. L'une a le terme migraine et l'autre le mot enfant. Vous pouvez affiner les résultats de la recherche en excluant l'un ou l'autre des termes et en cliquant sur le X dans la zone de saisie. À droite des termes de recherche en cours, on trouve le bouton Effacer tout pour réinitialiser la recherche. Les résultats se trouvent sous les termes de recherche. Le nombre total de résultats apparaît en premier. Dans le présent exemple, les résultats de la recherche affichent 1 à 4 études sur 36. Ces résultats sont présentés sur 6 pages et vous êtes actuellement à la page 1. À droite du total des résultats se trouve un menu déroulant. Vous pouvez utiliser le menu déroulant pour classer vos résultats selon l'une des 5 façons suivantes :
- Dernière mise à jour
- Date d'autorisation
- Statut
- Intervention
- Nom du promoteur
Le statut, l'intervention et le nom du promoteur sont classés par ordre alphabétique. Les options Dernière mise à jour et Date d'autorisation apparaissent en ordre chronologique, de la fiche la plus récente à la plus ancienne. Sous cette section, un champ à droite indique 0 fiche conservée ainsi qu'un hyperlien vers l'option Télécharger les fiches conservées. À la fin de cette section, vous trouverez une fonction permettant d'alterner les résultats dans un tableau ou dans une liste qui regroupe les renseignements au lieu de les afficher côte à côte. Cette page est actuellement activée pour afficher la vue en liste, comme l'indique la barre de défilement bleu foncé. La liste des résultats compte 4 lignes, avec une fiche par ligne.
Un ensemble de filtres appelé Restreindre votre recherche se situe à droite de la liste des résultats de recherche. Cette section comporte 5 filtres. Votre première option est de restreindre votre recherche en fonction de l'admissibilité. Voici les critères :
- Sexe : hommes, femmes ou les deux
- Âge : enfants de 0 à 17 ans, adultes de 18 à 65 ans ou adultes de plus de 65 ans
- Si l'étude s'adresse à des volontaires en bonne santé
On a choisi les enfants dans cet exemple. Le deuxième filtre est celui du statut, où vous pouvez affiner vos résultats de recherche en ciblant les essais comme suit :
- Pas encore en recrutement
- En recrutement
- En cours
- En suspens
- Terminés
- De statut inconnu
Vous pouvez également filtrer la recherche si les résultats sont disponibles et par phase d'étude. La recherche par phase d'étude présente 4 options : phase 1, phase 2, phase 3 ou la phase ne s'applique pas. Le dernier filtre est l'emplacement, où vous pouvez effectuer une recherche par province et territoire. Le filtre Ville est un champ contextuel qui s'affiche en fonction de la province ou du territoire choisi. Vous pouvez utiliser le bouton Appliquer pour améliorer votre recherche.
La liste des résultats principaux est en format de paragraphe, conçue pour s'adapter facilement à différents appareils. Le titre abrégé est le titre de la fiche principale. Il s'agit d'un texte hyperlié qui affiche la fiche dans une nouvelle page Web. À la ligne suivante, vous pouvez voir le statut doté d'un code de couleurs. À droite du statut se trouve la date d'autorisation, qui correspond à la date de réception de la lettre de non-objection pour l'essai. Le titre officiel du protocole suit le statut et la date d'autorisation. Après cette section, il y a 2 colonnes. La colonne 1 contient le nom de l'intervention et le promoteur. La colonne 2 indique le numéro du protocole, le numéro de contrôle et le lien vers le registre. Le lien vers le registre ouvre la fiche telle qu'elle apparaît sur le site Web ClinicalTrials.gov. Dans un encadré mis en évidence sous les 2 colonnes, vous trouverez les emplacements où se déroule un essai clinique. Une ligne sépare chaque fiche. On peut consulter les fiches par pagination de la même façon que dans la vue du tableau.
Cette image présente des exemples de 2 statuts différents. Le premier est un exemple de fiche d'essai qui n'est pas encore en recrutement. Avant le titre abrégé, on trouve une case de sélection qui vous permet de choisir cette fiche pour le téléchargement. Cette étude porte le titre abrégé « Efficacy and safety of erenumab in pediatric subjects with chronic migraine » (Efficacité et innocuité de l'érénumab chez les sujets pédiatriques souffrant de migraine chronique). À la ligne suivante se trouvent le statut et la date d'autorisation. Le statut de l'étude est Pas encore en recrutement. Derrière le statut, on voit une case jaune. La date d'autorisation est le 12 avril 2019. On voit ensuite le titre officiel du protocole. Cette fiche s'intitule « A phase 3 randomized double-blind placebo controlled parallel group study to evaluate the efficacy and safety of a erenumab in children 6 to less than 12 years and adolescents 12 to less than 18 years with chronic migraine (OASIS PAEDIATRIC [CM]) » (Une étude de phase 3 randomisée à double insu contrôlée contre placebo en groupes parallèles pour évaluer l'efficacité et l'innocuité de l'érénumab chez les enfants de 6 à moins de 12 ans et les adolescents de 12 à moins de 18 ans souffrant de migraine chronique). Le nom de l'intervention est Aimovig. Le promoteur est Amgen Canada Inc. Le numéro du protocole est le 20160354 et le numéro de contrôle est le 225705. Le lien vers le registre est NCT03832998. Il ouvre la fiche sur le site Web ClinicalTrials.gov, où l'essai clinique a été enregistré à l'origine. Les emplacements où se déroule cet essai sont Edmonton, en Alberta; London, en Ontario; Ottawa, en Ontario et Toronto, en Ontario.
Le deuxième exemple dans la liste des résultats est un essai en recrutement. Cette fiche ressemble à la fiche précédente, mais ses numéros de référence sont différents. Avant le titre abrégé, une case de sélection vous permet de choisir cette fiche pour le téléchargement. Cette étude porte le titre abrégé « Efficacy and safety of erenumab in pediatric subjects with chronic migraine » (Efficacité et innocuité de l'érénumab chez les sujets pédiatriques souffrant de migraine chronique). À la ligne suivante, on voit le statut et la date d'autorisation. Le statut de l'étude est En recrutement. Derrière le statut, il y a une case verte. La date d'autorisation est le 12 avril 2019. On voit ensuite le titre officiel du protocole. Cette fiche a pour titre « A phase 3 randomized double-blind placebo controlled parallel group study to evaluate the efficacy and safety of a erenumab in children 6 to less than 12 years and adolescents 12 to less than 18 years with chronic migraine (OASIS PAEDIATRIC [CM]) » (Une étude de phase 3 randomisée à double insu contrôlée contre placebo en groupes parallèles pour évaluer l'efficacité et l'innocuité de l'érénumab chez les enfants de 6 à moins de 12 ans et les adolescents de 12 à moins de 18 ans souffrant de migraine chronique). Le nom de l'intervention est Aimovig. Le promoteur est Amgen Canada Inc.
Le numéro du protocole est le 20150125 et le numéro de contrôle est le 25706. Le lien vers le registre est NCT0386040. Il ouvre la fiche sur le site Web ClinicalTrials.gov, où l'essai clinique a été enregistré à l'origine. Les emplacements où se déroule cet essai sont Edmonton, en Alberta; London, en Ontario; Ottawa, en Ontario et Toronto, en Ontario. Cet essai clinique comporte plus d'emplacements qui ne rentraient pas dans l'encadré. Vous pouvez utiliser l'hyperlien En savoir plus afin d'obtenir toutes les personnes-ressources et tous les emplacements pour cet essai.
À la fin de la liste des résultats, la fonction de navigation de la page vous permet de consulter tous les résultats. La navigation comporte 6 pages. Après cette section, un mécanisme de rétroaction vous permet de cliquer sur oui ou non et de fournir une rétroaction écrite en cas de problème. Vous pouvez également partager les résultats sur divers médias sociaux en utilisant le bouton Partager cette page, qui se trouve à droite du mécanisme de rétroaction Avez-vous trouvé ce que vous cherchiez?
Modèles 4
Image Texte Visualiser ou télécharger 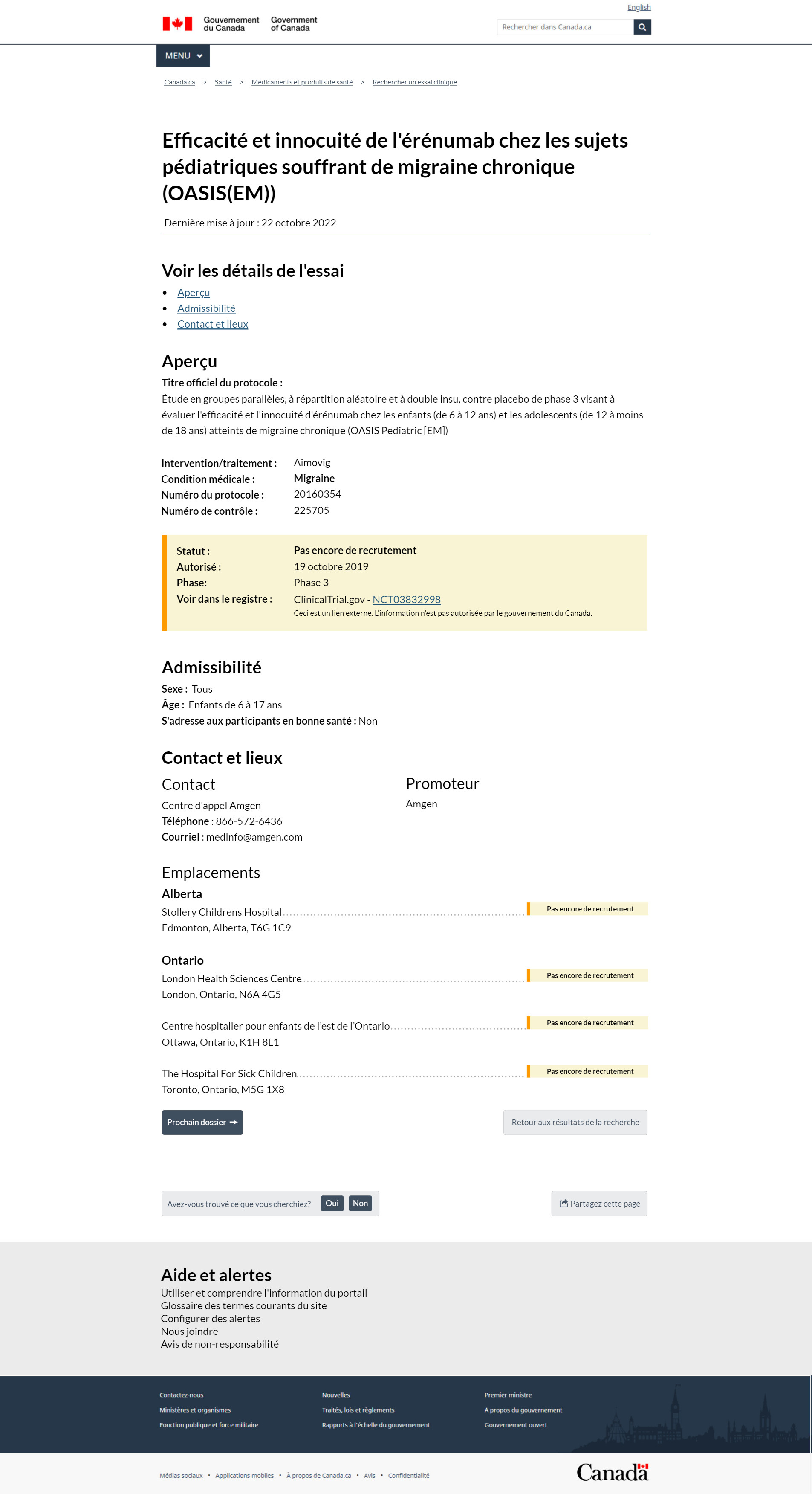
FIGURE 4 – Affichage de la fiche
Voici l'affichage d'une fiche dans le Portail des essais cliniques. Cette fiche s'intitule « Efficacy and safety of erenumab in pediatric subjects with chronic migraine (OASIS(EM)) » (Efficacité et innocuité de l'érénumab chez les sujets pédiatriques souffrant de migraine chronique (OASIS(EM)). La dernière mise à jour date du 22 octobre 2022. Le premier titre de cette fiche est Voir les essais cliniques. Vous pouvez accéder à n'importe quel titre lié qui est énuméré dans cette section. Dans cet exemple, on peut aller rapidement aux sections Aperçu, Admissibilité ou Coordonnées et emplacement. Dans la section Aperçu se trouve d'abord le titre officiel du protocole, « A phase 3 randomized double-blind placebo controlled parallel group study to evaluate the efficacy and safety of a erenumab in children 6 to less than 12 years and adolescents 12 to less than 18 years with chronic migraine (OASIS PAEDIATRIC [CM]) » (Une étude de phase 3 randomisée à double insu contrôlée contre placebo en groupes parallèles pour évaluer l'efficacité et l'innocuité de l'érénumab chez les enfants de 6 à moins de 12 ans et les adolescents de 12 à moins de 18 ans souffrant de migraine chronique). L'intervention mise à l'essai est Aimovig et le problème de santé traité est la migraine. Le numéro du protocole est le 20160354 et le numéro de contrôle est le 225705. Dans une grande case de statut jaune, le statut est Pas encore en recrutement. La case indique également la date d'autorisation ou la date de la réception de la lettre de non-objection, soit le 19 octobre 2019. Cette étude en est à la phase 3. Le lien vers le registre est NCT03832998. Cliquez sur le numéro de registre pour ouvrir la fiche sur le site Web ClinicalTrials.gov où l'étude a été enregistrée. Une note indique qu'il s'agit d'un lien externe. L'information n'est pas autorisée par le gouvernement du Canada.
Les critères d'admissibilité de cette fiche constituent le prochain titre. Les critères d'admissibilité à cet essai sont les suivants : il accepte les hommes et les femmes, il s'adresse aux enfants de 6 à 17 ans et il ne s'adresse pas aux participants en bonne santé. La section suivante, Coordonnées et emplacement, indique que la personne-ressource est le centre d'appels Amgen. Le numéro de téléphone est le 866-572-6436. Vous pouvez également communiquer avec le centre d'appels en envoyant un courriel à medinfo@amgen.com. Le promoteur de cet essai est Amgen. Cet essai se déroule à plusieurs emplacements. En dessous, nous avons énuméré les endroits au Canada où se déroule l'essai clinique. Pour chaque emplacement, un statut plus précis a été identifié à droite à l'aide d'une étiquette et de la couleur correspondante. En Alberta, cet essai sera offert au Stollery Children's Hospital d'Edmonton. Il n'est pas encore en recrutement. En Ontario, il se déroule à 3 emplacements :
- le London Health Sciences Centre à London
- le Centre hospitalier pour enfants de l'est de l'Ontario à Ottawa
- Hospital for Sick Children de Toronto
Aucun des emplacements en Ontario n'est encore en recrutement. Chaque case de statut apparaît en jaune. Les résultats suivraient cette section, s'ils étaient disponibles.
Sous l'emplacement, vous trouverez 2 boutons. Le bouton Fiche suivante à gauche vous permet de naviguer d'une fiche à l'autre à partir des résultats de votre recherche. Un bouton Retour à la recherche à droite vous permet de redémarrer votre recherche si vous souhaitez rechercher un nouvel ensemble de paramètres.
Le prochain élément est un mécanisme de rétroaction qui vous permet de signaler si vous avez trouvé ce que vous cherchiez. Vous pouvez cliquer sur oui ou non et fournir une rétroaction écrite en cas de problème. Vous pouvez également partager les résultats sur divers réseaux sociaux à l'aide du bouton Partager cette page. Ce bouton se trouve à droite du mécanisme de rétroaction Avez-vous trouvé ce que vous cherchiez?.
Après ces boutons, vous verrez un pied de page appelé Aide et alertes. Sous ce titre, 5 hyperliens vous dirigent vers 5 pages Web :
- Utilisation du portail pour obtenir des renseignements
- Glossaire
- Système d'alertes et de notification
- Coordonnées de la clinique pour le Portail des essais cliniques
- Avertissement sur le contenu
Cette section est suivie du pied de page standard de Canada.ca.
- Pratiques d'information sur les essais cliniques
Les commentaires qui ont été recueillis au moyen de ce processus seront utilisés pour :
- poursuivre la création du portail des essais cliniques
- peaufiner la politique d'enregistrement et de déclaration des résultats des essais cliniques autorisés au Canada
Renseignements connexes
Nous joindre
Bureau des politiques, de la science et des programmes internationaux
Direction des médicaments pharmaceutiques
Direction générale des produits de santé et des aliments
Santé Canada
1600, rue Scott
Holland Cross, tour B
2e étage, indice de l'adresse 3102C5
Ottawa (Ontario)
K1Y 4N7
Courriel : Policy_Bureau_Enquiries@hc-sc.gc.ca