Projet de lignes directrices sur la qualité de l’air intérieur résidentiel pour le benzène
Préambule
Santé Canada évalue les risques pour la santé que posent certains polluants dans l'air intérieur résidentiel et formule des recommandations sur les façons de réduire ces risques. Les lignes directrices sur la qualité de l'air intérieur résidentiel (LDQAIR) résument les effets connus sur la santé, les sources de polluants et les niveaux d'exposition dans les maisons canadiennes, et caractérisent les risques pour la santé à partir des meilleures données scientifiques disponibles. Des limites d'exposition proposées (aussi appelées valeurs guides) de courte ou de longue durée au polluant, qui représentent les concentrations dans l'air intérieur en dessous desquelles des effets sur la santé sont peu probables, sont également élaborées. Ces valeurs guides proposées prennent en compte la concentration de référence (CRf) ou la concentration correspondant à un risque spécifié (CCRS) du polluant et la possibilité d'atteindre de tels niveaux par le contrôle des sources intérieures. Les LDQAIR comprennent également des recommandations pour le contrôle des sources ou d'autres mesures de réduction de l'exposition à ce polluant.
Les LDQAIR et les documents d'orientation servent de base scientifique aux mesures visant à évaluer et à réduire les risques des polluants de l'air intérieur, notamment :
- les évaluations des risques pour la santé liés aux polluants de l'air intérieur effectuées par les responsables de la santé publique dans les maisons ou des milieux similaires;
- les normes de performance pouvant s'appliquer aux matériaux, aux produits et aux appareils qui émettent des polluants pour éviter que leur utilisation normale ne conduise à des concentrations de polluants dans l'air dépassant les valeurs guides proposées;
- les produits de communication visant à informer les Canadiens des mesures à prendre pour réduire leur exposition aux polluants de l'air intérieur et protéger leur santé.
Les valeurs guides proposées dans les LDQAIR sont destinées à un public professionnel pour mieux soutenir l'évaluation des risques et justifier les mesures de gestion des risques. Dans la plupart des cas, Santé Canada ne recommande pas de mesurer les concentrations de polluants dans l'air intérieur résidentiel, mais plutôt de mettre en œuvre des stratégies d'atténuation des risques pour améliorer la qualité de l'air intérieur.
Les LDQAIR et les documents d'orientation remplacent une série de valeurs limites d'exposition aux polluants de l'air intérieur publiées dans un rapport intitulé Directives d'exposition concernant la qualité de l'air des résidences (Santé Canada, 1987).En plus des mises à jour relatives aux substances apparaissant dans le rapport de 1987, des lignes directrices ou des documents d'orientation seront élaborés pour d'autres substances ayant le potentiel d'influer sur la santé humaine dans l'air intérieur.
Le présent document met à jour et remplace le précédent Document de conseils sur le benzène dans l'air intérieur résidentiel : document d'évaluation scientifique (Santé Canada, 2013a).
Table des matières
- Liste des tableaux
- Liste des figures
- Résumé
- Introduction
- 1.0 Caractéristiques physiques et chimiques
- 2.0 Concentrations dans l’air intérieur et extérieur
- 3.0 Sources dans l’air
- 4.0 Toxicocinétique
- 5.0 Effets sur la santé
- 6.0 Établissement des concentrations de références
- 6.1 Concentration de référence pour l’exposition de courte durée
- 6.2 Concentration de référence et concentration correspondant à un risque spécifié pour l’exposition de longue durée
- 6.3 Comparaison du niveau d’exposition dans les maisons canadiennes à la concentration correspondant à un risque spécifié et établissement d’une valeur guide
- 7.0 Lignes directrices proposées
- 8.0 Références
- Annexe A : liste des acronymes et des abréviations
- Annexe B : études d’exposition humaine
- Annexe C : études toxicologiques
- Annexe D : autres niveaux de référence pour les expositions par inhalation
Liste des tableaux
- Tableau 1. Propriétés physiques et chimiques du benzène
- Tableau 2. Niveaux d’exposition au benzène dans l’air intérieur, dans l’air extérieur et individuelle (μg/m3) mesurés au Canada
- Tableau 3. Variation relative des concentrations moyennes de benzène dans l’air intérieur par prédicteur selon les études canadiennes
- Tableau 4. Valeur guide proposée pour l’exposition au benzène dans l’air intérieur
- Tableau B1. Études d’exposition de courte durée chez l’homme
- Tableau B2. Études d’exposition de longue durée chez l’homme : toxicité respiratoire
- Tableau B3. Études d’exposition de longue durée chez l’homme : toxicité pour la reproduction et le développement
- Tableau B4. Études d’exposition de longue durée chez l’homme : hématotoxicité et immunotoxicité
- Tableau B5. Études d’exposition de longue durée chez l’homme : autres effets
- Tableau B6. Études de génotoxicité chez l’homme
- Tableau B7. Cancérogénicité
- Tableau C1. Études d’exposition de courte durée chez l’animal de laboratoire
- Tableau C2. Études de génotoxicité chez l’animal de laboratoire
- Tableau D1. Autres niveaux de référence pour les expositions de courte durée par inhalation
- Table D2. Autres niveaux de référence pour les expositions de longue durée par inhalation produisant des effets autres que le cancer
- Tableau D3. Autres excès de risque unitaire par inhalation pour les effets cancérogènes
Liste des figures
- Figure 1. Distribution des concentrations de benzène dans l’air intérieur par saison dans les études de Santé Canada
- Figure 2. Distribution des ratios I/E par saison dans les études de Santé Canada
- Figure 3. Voie proposée du métabolisme du benzène
Résumé
Lignes directrices sur la qualité de l'air intérieur résidentiel proposées pour le benzène
| Valeur guide | Concentration | Effet critique | |
|---|---|---|---|
| μg/m3 | ppb | ||
| Exposition de longue durée | 0,6 | 0,2 | Leucémie |
La valeur guide proposée est de 0,6 μg/m3 (0,2 ppb) pour l'exposition de longue durée au benzène. Aucune valeur guide n'a été établie pour l'exposition de courte durée dans l'air intérieur.
Au Canada, la concentration de benzène peut dépasser la valeur guide dans de nombreuses maisons et présenter un risque pour la santé. Il est donc recommandé aux propriétaires et aux résidents de réduire leur exposition au benzène par une ventilation adéquate et le contrôle ou l'élimination des sources intérieures.
Contexte
Le benzène est un composé organique volatil à pression de vapeur élevée qui s'évapore rapidement dans l'air, lorsque libéré dans l'environnement. Les concentrations de benzène sont généralement plus élevées dans l'air l'intérieur que dans l'air extérieur.
Le benzène est inscrit à l'annexe 1 de la Loi canadienne sur la protection de l'environnement. En 1993, Santé Canada a conclu que le benzène, en tant que substance cancérogène sans seuil, peut constituer un danger au Canada pour la vie ou la santé humaine. La concentration qui correspond à une augmentation de 5 % de la mortalité attribuable à la leucémie aiguë myélogène a été déterminée à 14,7 × 103 μg/m3 et l'indice exposition/potentiel au benzène correspondant au Canada à 3,0 × 10-4. En 2013, Santé Canada a publié son Document de conseils sur le benzène dans l'air intérieur résidentiel qui recommande d'adopter des mesures individuelles visant à réduire autant que possible l'exposition au benzène dans l'air intérieur en raison de l'existence d'un risque faible mais non négligeable de cancer associé aux niveaux d'exposition dans l'air intérieur. En 2021, Santé Canada a recommandé d'utiliser l'excès de risque unitaire par inhalation de 1,6 × 10-2(mg/m3)-1 comme valeur toxicologique de référence pour l'évaluation des risques d'exposition au benzène sur les sites contaminés fédéraux en se fondant en partie sur son document de conseils publié en 2013.
En 2019, le Programme sur la qualité de l'air intérieur de Santé Canada a fait du benzène une priorité pour une réévaluation des risques pour la santé humaine et l'élaboration de lignes directrices sur la qualité de l'air intérieur résidentiel sur la base de plusieurs considérations, notamment : de nouvelles données sur les effets sur la santé liés à des niveaux dans l'environnement (et non en milieu de travail) et le parachèvement de l'Étude d'intervention sur les garages attenants en milieu résidentiel, qui a examiné des approches d'atténuation de risques pour l'infiltration de benzène en provenance des garages attenants.
Le présent document de lignes directrices passe en revue les travaux de recherche sur l'exposition, la toxicologie et l'épidémiologie se rapportant au benzène publiés depuis le dernier document de conseils de Santé Canadaainsi que les conclusions tirées d'analyses détaillées menées par des organismes mondialement reconnus œuvrant dans les domaines de la santé et de l'environnement. Il propose une valeur guide pour l'exposition de longue durée au benzène dans l'air intérieur, qui vise à réduire au minimum les risques pour la santé humaine et à soutenir la mise en œuvre de mesures visant à limiter les émissions de benzène dans l'air intérieur. Ce document recommande également diverses mesures d'atténuation des risques pour réduire l'exposition au benzène dans l'air intérieur.
Exposition et sources
La médiane des concentrations de benzène mesurées de 2005 à 2019 par Santé Canada dans l'air intérieur résidentiel se situait entre 0,4 et 2,2 μg/m3 dans plusieurs villes et deux collectivités des Premières Nations du Canada et le 95e percentile entre 2,4 et 18,6 μg/m3. Les données préliminaires provenant d'une étude de Santé Canada indiquent que les concentrations de benzène dans les maisons neuves se situent également dans ces fourchettes. En 2019, la concentration moyenne nationale de benzène était de 0,5 μg/m3 dans l'air extérieur aux stations du Programme de surveillance national de la pollution atmosphérique.
Le benzène est naturellement présent dans les produits pétroliers comme l'essence et le pétrole brut et il est ajouté à l'essence sans plomb en petites quantités pour améliorer le rendement. Il est également issu de la combustion et d'autres sources anthropiques. Le Canada a produit 700 000 tonnes de benzène en 2019. Le benzène entre principalement dans la production de produits chimiques organiques servant fabriquer des produits comme les plastiques, la résine, le nylon, les fibres synthétiques, les lubrifiants, les caoutchoucs, les colorants, les détergents et les pesticides.
Dans l'air ambiant extérieur, les principales sources de benzène sont les émissions des véhicules et industrielles. Les rejets provenant des stations-service durant leur exploitation courante et ceux de la livraison de carburant par camions-citernes, les incendies de forêt et le chauffage au bois résidentiel en sont d'autres sources importantes.
Au Canada, les concentrations de benzène sont de 1,3 à 7,9 fois plus élevées dans les maisons que dans l'air extérieur, les ratios entre les concentrations intérieures et extérieures étant plus importants dans les maisons avec fumeurs. Un garage attenant ainsi que l'entreposage d'essence, de peintures et de solvants dans le garage et la maison ont tous été associés à des concentrations plus élevées de benzène dans la maison, de même que le fait de fumer à l'intérieur et une concentration accrue de benzène dans l'air extérieur. Il a été démontré qu'une meilleure ventilation – en augmentant le taux de renouvellement de l'air et en ouvrant plus souvent les fenêtres, par exemple – l'utilisation d'un ventilateur d'extraction dans le garage et une bonne étanchéité de l'interface garage-maison réduisent les concentrations de benzène dans l'air intérieur.
Effets sur la santé
Des effets sur la santé sont associés à une exposition au benzène professionnelle (très élevée, par exemple, > 3,2 mg/m3 ou 1 ppm) et environnementale (généralement très faible, par exemple, < 10 μg/m3 ou 3 ppb). Il a été démontré que l'exposition à de fortes concentrations de benzène, comme celles observées en milieu de travail et dans l'environnement, provoque des troubles du système nerveux central, neurologiques et respiratoires, et des effets hématotoxiques.
Des études épidémiologiques portant sur l'exposition au benzène dans l'air intérieur résidentiel signalent une altération de la fonction pulmonaire, une prévalence accrue de l'asthme et des symptômes de l'asthme chez l'adulte et chez l'enfant. L'exposition individuelle et ambiante au benzène durant la grossesse a été associée à des naissances prématurées et à des effets sur le développement, comme une diminution de la circonférence de la tête et un faible poids à la naissance. Des effets neurologiques liés à l'audition et à la cognition et des effets sur le métabolisme du glucose en sont d'autres effets non cancérogènes chez l'homme. En raison de la méthodologie, le rôle des co-polluants dans la présence de ces effets n'est pas clair.
L'hématotoxicité est un effet non cancérogène bien connu de l'exposition professionnelle au benzène. Une diminution de la numération globulaire et des effets sur les populations de cellules précurseurs de la moelle osseuse surviennent à des niveaux d'exposition professionnelle. Des études de biosurveillance de la population générale ont aussi signalé une altération de la numération globulaire; toutefois, certains effets ne concordent pas avec ceux signalés lors d'expositions professionnelles plus élevées.
Le benzène est génotoxique, en plus d'être classé comme substance cancérogène pour l'homme par Santé Canada (1993), la United States Environmental Protection Agency (2002) et le Centre international de Recherche sur le Cancer (1987, 2018). Ce dernier a d'ailleurs conclu que le benzène est à l'origine de la leucémie aiguë myéloïde et de la leucémie aiguë non lymphoblastique chez l'adulte et que les données soutiennent une association positive entre l'exposition au benzène et la survenue de leucémie chez l'enfant. Les évaluations précédentes du risque de cancer reposent sur des niveaux d'exposition professionnelle très élevés; il existe toutefois une certaine incertitude quant à l'adéquation de l'extrapolation des effets sur la santé d'une forte exposition professionnelle à une faible exposition résidentielle. Une extrapolation linéaire reposant sur des cohortes professionnelles indique qu'il existe un risque faible mais non négligeable de cancer dans de nombreuses maisons canadiennes.
Plusieurs populations peuvent être considérées comme sensibles ou plus exposées au benzène. Des études de biosurveillance canadiennes montrent que la concentration de benzène dans le sang et la quantité de métabolites du benzène dans l'urine sont plus importantes chez les fumeurs, les Canadiens d'origine sud-asiatique et les femmes autochtones. En raison de différences métaboliques, il semblerait que dans un contexte semblable les femmes sont plus sensibles que les hommes aux effets sur la santé de l'exposition au benzène. Les enfants devraient également être plus sensibles que les adultes en raison de différences physiologiques et métaboliques. Des polymorphismes génétiques qui influent sur le métabolisme du benzène et augmentent la sensibilité aux effets nocifs peuvent exister chez une partie importante de la population.
Valeur guide proposée pour l'exposition de longue durée au benzène dans l'air intérieur résidentiel
Parmi les effets autres que le cancer, l'hématotoxicité (une diminution du nombre de globules blancs) constitue l'effet sur la santé le plus sensible pour l'exposition de longue durée au benzène. La limite inférieure de la concentration repère pour l'hématotoxicité a été fixée à 26 μg/m3 (8,1 ppb) à partir d'une étude réalisée en milieu de travail portant sur l'exposition cumulative au benzène.
Pour établir une concentration de référence (CRf), un facteur d'incertitude de 30 a été appliqué à la limite inférieure de la concentration repère pour l'hématotoxicité pour tenir compte du fait que les sujets étaient des travailleurs en bonne santé (facteur de 10) et pour prendre en compte l'incertitude liée à la base de données en ce qui a trait à l'utilisation d'un modèle pharmacocinétique à base physiologique pour des expositions pertinentes du point de vue de l'environnement (facteur de 3). La CRf proposée pour cet effet est de 0,9 μg/m3 (0,3 ppb).
Le précédent document de conseils de Santé Canada a conclu que l'excès de risque unitaire par inhalation le plus raisonnable varie entre 2,2 × 10-6 et 1,6 × 10-5(μg/m3)-1 en se fondant sur les principales évaluations du risque de cancer.Cette fourchette correspond à des concentrations comprises entre 0,6 et 4,5 μg/m3 pour un risque de 1 × 10-5. Les évaluations plus récentes du risque de cancer se situent également dans cette fourchette, ce qui indique qu'il n'est pas nécessaire de revoir pour l'instant la conclusion précédente.
La concentration correspondant à un risque spécifié (CCRS) proposée pour le cancer de 0,6 μg/m3 (0,2 ppb) correspond à un excès de risque unitaire par inhalation de 1,6 × 10-5(μg/m3)-1 et à un risque de cancer acceptable de 10-5. L'hématotoxicité a été proposée comme précurseur potentiel des cancers liés au benzène. Le mode d'action de la toxicité du benzène n'est toutefois pas encore complètement compris et la CCRS pour la leucémie protège mieux la santé que la CRf pour l'hématotoxicité. La CCRS proposée est donc fixée à 0,6 μg/m3 (0,2 ppb) pour l'exposition de longue durée au benzène.
Pour établir les valeurs guides proposées, la CRf ou la CCRS pour l'exposition de longue durée est d'abord comparée aux données d'exposition relatives aux maisons canadiennes pour déterminer s'il est possible d'atteindre l'une ou l'autre de ces valeurs par le contrôle des sources intérieures. Si la CRf ou la CCRS peut être atteinte, la valeur identifiée est définie comme valeur guide proposée. Sinon, une concentration plus élevée peut être choisie, tout en visant une valeur guide qui protège la santé selon les données probantes actuelles.
Les critères de la présente évaluation servant à établir les valeurs guides proposées pour les expositions de longue et de courte durées au benzène sont les suivants :
- une valeur atteignable dans les maisons canadiennes en l'absence de sources importantes de benzène dans l'air intérieur;
- une valeur qui n'est pas associée à des effets appréciables sur la santé, compte tenu des niveaux d'exposition de référence établis et des données probantes actuelles.
Les données de Santé Canada indiquent que la CCRS pour l'exposition de longue durée se situe dans la fourchette des concentrations médianes mesurées dans les maisons canadiennes. La CCRS a été établie à partir des données scientifiques les plus récentes et pertinentes. En outre, les données de Santé Canada et d'autres études indiquent que les concentrations de benzène peuvent être considérablement réduites dans les maisons par la ventilation et le contrôle des sources. Comme la concentration moyenne de benzène dans l'air extérieur au Canada est inférieure à la CCRS, la ventilation, en combinaison avec le contrôle des sources, peut être considérée comme stratégie efficace pour réduire les concentrations de benzène dans l'air intérieur. La valeur guide proposée est donc de 0,6 μg/m3 (0,2 ppb) pour l'exposition de longue durée au benzène.
La durée d'échantillonnage utilisée pour comparer la concentration mesurée de benzène à la valeur guide pour l'exposition de longue durée devrait être d'au moins 24 heures. La moyenne des résultats obtenus à partir d'échantillons répétés, prélevés au cours de différentes saisons, fournira une estimation plus représentative de l'exposition de longue durée, qui sera comparée à la valeur guide pour l'exposition de longue durée.
Des niveaux de référence pour les expositions par inhalation de longue durée ou chronique au benzène produisant des effets autres que le cancer ont été établis par la United States Environmental Protection Agency (30 μg/m3; 2002), l'Agency for Toxic Substances and Disease Registry (10 μg/m3; 2007), l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (10 μg/m3; 2008), l'Office of Environmental Health Hazard Assessment (3 μg/m3; 2014) et la Texas Commission on Environmental Quality (84 μg/m3; 2015). Chacune de ces valeurs repose sur un effet hématotoxique important et précède la publication de la principale étude établissant la CRf produisant des effets autres que le cancer de la présente évaluation.
Des excès de risque unitaire par inhalation ont été proposés par la United States Environmental Protection Agency (2,2 × 10-6 à 7,8 × 10-6[μg/m3]-1), l'Organisation mondiale de la Santé (6 × 10-6[μg/m3]-1), la Texas Commission on Environmental Quality (2,2 × 10-6[μg/m3]-1), l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (6 × 10-6[μg/m3]-1), le National Institute for Public Health and the Environment (5 × 10-6[μg/m3]-1) et la German Environment Agency (1 × 10-5[μg/m3]-1) pour protéger des effets cancérogènes. Ces valeurs correspondent à des concentrations dans l'air comprises entre 1,3 et 4,5 μg/m3 (United States Environmental Protection Agency), de 1,7 μg/m3 (Organisation mondiale de la Santé), de 4,5 μg/m3 (Texas Commission on Environmental Quality), de 0,6 μg/m3 (la Division des lieux contaminés de Santé Canada), de 2 μg/m3 (Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail), de 2 μg/m3 (National Institute for Public Health and the Environment) et de 1 μg/m3 (German Environment Agency) associées à un niveau de risque acceptable de 1 × 10-5 pour le cancer.
Recommandations en matière de gestion des risques
L'exposition au benzène dans l'air intérieur devrait être réduite par une ventilation adéquate et le contrôle ou l'élimination des sources intérieures en adoptant les stratégies décrites ci-dessous. Plusieurs de ces mesures permettront également de réduire les concentrations d'autres contaminants dans l'air intérieur, améliorant ainsi la qualité de l'air intérieur.
- S'il y a un garage attenant :
- envisager d'installer et d'utiliser un ventilateur d'extraction dans le garage;
- maintenir une bonne étanchéité entre le garage attenant et la maison;
- éviter de mettre en marche les voitures, les souffleuses à neige, les tondeuses ou tout autre équipement à essence dans le garage.
- Éviter d'entreposer de l'essence, des peintures, des solvants et d'autres produits chimiques dans la maison ou le garage attenant. Ces produits devraient être entreposés dans des contenants hermétiquement fermés et, si possible, conservés dans un lieu qui n'est pas raccordé au système de ventilation de la maison.
- Remplacer l'équipement à essence comme la tondeuse, la souffleuse à feuilles et la souffleuse à neige par des appareils alimentés par batterie.
- Ne pas fumer à l'intérieur.
- Améliorer la ventilation dans la maison :
- en utilisant des stratégies de ventilation naturelle comme l'ouverture des fenêtres et des portes intérieures, si possible (vérifier d'abord les conditions locales qui affectent la qualité de l'air extérieur : Cote air santé);
- en utilisant des stratégies de ventilation mécanique comme les ventilateurs à évacuation extérieure, les systèmes de ventilation à air pulsé, les ventilateurs-récupérateurs d'énergie et les ventilateurs-récupérateurs de chaleur;
- en s'assurant que le taux de renouvellement de l'air n'est pas trop élevé (p. ex., air sec et courants d'air).
- Pour en savoir davantage, consulter la fiche de renseignements La ventilation et le milieu intérieur (Santé Canada, 2018) et l'infographie La ventilation et la qualité de l'air intérieur (Santé Canada, 2019b).
- Lorsque la qualité de l'air extérieur est mauvaise
(par exemple, en raison d'un fort volume de circulation ou de la fumée
d'un incendie de forêt) :
- garder les fenêtres et les portes fermées et se servir de la climatisation pour maintenir une température confortable à l'intérieur;
- poser des coupe-froid aux fenêtres et aux portes;
- faire fonctionner autant que possible le système de ventilation en mode recirculation et introduire de l'air frais lorsque la qualité de l'air extérieur s'améliore.
- Pour en savoir davantage, consulter l'infographie Protégez votre milieu intérieur des polluants de l'air extérieur (Santé Canada, 2020).
- Installer et entretenir adéquatement les foyers et
les poêles à bois, et évacuer les polluants à l'extérieur.
- Pour en savoir davantage, consulter Fumée de bois et air intérieur.
Introduction
Le présent document est une mise à jour du précédent Document de conseils sur le benzène dans l'air intérieur résidentiel : document d'évaluation scientifique (Santé Canada, 2013a) et examine la littérature scientifique disponible sur les effets sur la santé et l'exposition des Canadiens au benzène publiée depuis. Une recherche de la littérature scientifique publiée entre janvier 2009 et juin 2020 et portant sur les effets sur la santé et l'exposition au benzène a été effectuée. Le présent document passe en revue les principales études relevées par cette recherche ainsi que les conclusions tirées d'analyses détaillées menées par des organismes mondialement reconnus œuvrant dans les domaines de la santé et de l'environnement.
1.0 Caractéristiques physiques et chimiques
Le benzène est un liquide volatil clair ou de teinte jaune pâle ayant une odeur aromatique à la température de la pièce. Il est facilement inflammable et a un point d'ébullition relativement bas (80,1 °C). Il a une pression de vapeur élevée (entre 10,1 et 13,2 kPa à 25 °C) et s'évapore rapidement dans l'air. Le benzène est soluble dans l'eau et miscible à la plupart des solvants organiques. Le Tableau 1 résume les propriétés physiques et chimiques du benzène (Santé Canada, 2013a; ATSDR, 2007).
| Propriété | Valeur | Structure chimique |
|---|---|---|
| Numéro de registre CAS | 71-43-2 | 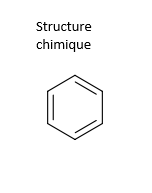 |
| Formule moléculaire | C6H 6 | |
| Poids moléculaire | 78,11 g/mol | |
| Densité | 0,878 g/cm3 à 25 °C | |
| Pression de vapeur | Entre 10,1 kPa et 13,2 kPa à 25 °C | |
| Solubilité dans l'eau | 0,188 % en poids à 25 °C | |
| Point d'ébullition | 80,1 °C | |
| Point d'éclair | -11 °C (en vase clos) | |
| Coefficient de partage octanol-eau (logKow) | 2,13 | |
| Synonymes courants | Annulène, benzol, naphte de charbon, cyclohexatriène, hydrure de phényle, pyrobenzol, pyrobenzole | |
| Facteurs de conversion | 1 ppm = 3,2 mg/m3 à 25 °C et 1 atm (760 mm Hg) 1 mg/m3 = 0,31 ppm |
2.0 Concentrations dans l'air intérieur et extérieur
2.1 Concentrations extérieures
En 2019, la concentration moyenne annuelle de benzène dans l'air extérieur, établie par 72 stations de surveillance du Programme de surveillance national de la pollution atmosphérique, était de 0,50 μg/m3 au Canada, avec des moyennes en zone rurale de 0,21 μg/m3(12 stations) et en zone urbaine de 0,40 μg/m3 (39 stations). La concentration moyenne annuelle était de 0,64 μg/m3 pour les sites urbains influencés par les transports et de 0,77 μg/m3pour les sites influencés par une importante source d'émissions fixe (par exemple, sites industriels ou situés à proximité d'une voie de circulation) (Environnement et Changement climatique Canada, 2021).
La médiane des concentrations de benzène dans l'air extérieur se situait entre 0,2 et 0,8 μg/m3 dans les études de Santé Canada menées en zones résidentielles à Edmonton, Regina, Halifax, Windsor, Ottawa et Montréal. Le 95e percentile allait de 0,6 à 2,7 μg/m3(Santé Canada, 2010a, 2010b, 2012, 2013b, 2021a; Mallach et al., 2017; Goldberg et al., 2015; Weichenthal et al., 2013; Zhu et al., 2005). Le Tableau 2 présente les données de ces études.
La concentration moyenne de benzène dans l'air extérieur est de 4,7 μg/m3 en Europe et de 6,3 μg/m3 aux États-Unis dans les zones résidentielles (Sekar, 2019). En 2013, la moyenne des concentrations de benzène mesurées par 343 stations de surveillance aux États-Unis allait de 0 μg/m3 en milieu rural à 4,4 μg/m3 en milieu urbain industriel (CIRC, 2018). En 2005, la concentration moyenne dans l'air extérieur en France était de 1 μg/m3 dans les sites périurbains et ruraux, allait de 1 à 3 μg/m3 dans les sites urbains et de 1,5 à 6,5 μg/m3dans les zones à forte circulation (Anses, 2008). En 2014, l'Agence européenne pour l'environnement n'a signalé aucun dépassement de la valeur limite de benzène dans l'air extérieur de 5 μg/m3 dans 42 pays d'Europe (CIRC, 2018).
2.2 Concentrations intérieures
La médiane des concentrations de benzène dans l'air intérieur se situait entre 0,4 et 2,2 μg/m3 et le 95e percentile entre 2,4 et 18,6 μg/m3 dans les études de Santé Canada menées à Edmonton, Halifax, Regina, Windsor, Ottawa et Montréal à l'aide de canisters passivés. Des résultats similaires ont été obtenus dans une réserve des Premières Nations du sud du Manitoba. Les concentrations les plus élevées ont été relevées à Ottawa, en Ontario, dans une maison avec garages attenants. Une surveillance individuelle effectuée à Windsor a également permis d'établir que la médiane des concentrations de benzène variait de 1,5 à 1,6 μg/m3 et le 95e percentile de 4,6 à 9,2 μg/m3 (Santé Canada, 2010a, 2010b, 2012, 2013b, 2021a; Mallach et al., 2017; Goldberg et al., 2015; Weichenthal et al., 2013; Zhu et al., 2005; Kovesi et al., 2022). Le Tableau 2 présente les données de ces études.
Des concentrations similaires de benzène ont été observées dans d'autres études canadiennes, notamment dans des maisons de Québec, du Nunavik et d'Ottawa et dans une collectivité des Premières Nations de la zone de Sioux Lookout, en Ontario, ainsi que dans l'Enquête canadienne sur les mesures de la santé (ECMS). Comme ces études ont utilisé d'autres méthodes d'échantillonnage et d'analyse, leurs résultats n'apparaissent pas dans les fourchettes mentionnées plus haut (Santé Canada, 2021a; Li et al., 2019; Héroux et al., 2008; Zhu et al., 2005; Conseil national de recherches Canada, 2021).
Une récente étude canadienne a mesuré la concentration de benzène dans les maisons de 85 personnes enceintes, dont des résidents autochtones de collectivités des Premières Nations vivant à proximité d'activités d'extraction de gaz par des méthodes non classiques dans le nord-est de la Colombie-Britannique. La médiane et le 95e percentile des concentrations étaient respectivement de 0,80 μg/m3 et de 7,40μg/m3, soit des niveaux de benzène dans l'air intérieur similaires à ceux des études canadiennes précédentes (Caron-Beaudoin et al., 2022).
Les concentrations moyennes de benzène signalées dans l'air intérieur se situaient entre 3,0 et 4,1 μg/m3 aux États-Unis et entre 1,6 et 15,3 μg/m3 en Europe (Sekar, 2019). La médiane des concentrations de benzène mesurées en Allemagne de 2015 à 2017 dans des immeubles à logements multiples était de 1,1 μg/m3 et le 95e percentile de 4,5 μg/m3 (Umweltbundesamt, 2020). La médiane des concentrations mesurées en France de 2003 à 2005 dans des habitations était de 2,1 μg/m3, le maximum observé atteignant 22,8μg/m3 (Anses, 2008).
| Lieu | Période d'échantillonnage | Méthode d'échantillonnageFootnote a | Saison | Nbre de maisons | Usage du tabac | Nbre d'échantillonsFootnote b | Médiane (μg/m3) | 95e percentile (μg/m3) | Étude de référence |
|---|---|---|---|---|---|---|---|---|---|
| Dans l'air intérieur | |||||||||
| Edmonton, Alberta | 2010 | Canisters passivés (7 jours × 24 heures) | Été Hiver |
50 50 |
N.-F. | 328 337 |
0,6 1,2 |
4,1 4,0 |
Santé Canada, 2013b |
| Halifax, Nouvelle-Écosse | 2009 | Canisters passivés (7 jours × 24 heures) | Été Hiver |
50 50 |
N.-F. | 331 312 |
0,5 0,8 |
9,0 8,2 |
Santé Canada, 2012 |
| Regina, Saskatchewan | 2007 | Canisters passivés (24 heures) | Été Hiver |
111 106 |
N.-F. F. N.-F. F. |
91 13 84 21 |
0,9 2,2 1,1 1,8 |
13,7 13,3 4,7 6,8 |
Santé Canada, 2010a |
| Windsor, Ontario | 2005-2006 | Canisters passivés (5 jours × 24 heures) |
Été Hiver |
46 47 |
N.-F. | 428 456 |
1,4 1,3 |
14,1 4,9 |
Santé Canada, 2010b |
| Ottawa, Ontario | 2014 | Canisters passivés (48 heures) | Hiver | 33Note de bas de page c | N.F. | 62 (ventilateur de garage éteint) 61 (ventilateur de garage allumé) |
1,7 1,1 |
18,6 3,3 |
Mallach et al., 2017 |
| Ottawa, Ontario (maisons neuves) | 2019-2021 | Canisters passivés (96 heures) | Toutes | 18 | — | 17Note de bas de page d 13Note de bas de page e | 1,1 0,4 |
5,9 3,6 |
Communication personnelle, Santé Canada, 2021a |
| Ottawa, Ontario (écoles) | 2013 | Canisters passivés (6,5 heures) | Automne | 4 | — | 128 | 0,5 | 2,4 | MacNeill et al., 2016 |
| Montréal, Québec | 2008-2011 | Canisters passivés (24 heures) | Toutes | 55 | — | 285 | 1,6 | 15,4 | Goldberg et al., 2015 |
| Réserve des Premières Nations, Manitoba | 2011 | Canisters passivés (7 jours) | Hiver | 20 | — | 53 | 1,2 | 11,1 | Weichenthal et al., 2013 |
| Montréal, Québec (garderies) |
2008 | Canisters passivés (6 heures) |
Hiver | 21 | — | 81 | 1,8 (MG) |
St-Jean, 2012 | |
| Zone de Sioux Lookout, Ontario | 2017-2019 | Tubes de DT (5 jours) |
Hiver | 98 | F. et N.-F. | 98 | 1,6 | 6,3 | Kovesi et al., 2022; Santé Canada, 2021a |
| Nunavik | 2017-2018 | Tubes de DT (7 jours) | Hiver et printemps | 54 | — | 54 | 0,4 –0,7 | Communication personnelle, CNRC, 2021 | |
| Nord-est de la Colombie-Britannique | 2019 | Tube de DT (7 jours) | Printemps et été | 85 | — | 85 | 0,8 | 7,4 | Caron-Beaudoin et al., 2022 |
| Partout au Canada | 2012-2013 | Tube de DT (7 jours) | Toutes | 3524 | F. et N.-F. | 3524 | 1,1 | 7,2 | Li et al., 2019 |
| Québec, Québec | 2005 | Détecteurs de vapeurs organiques 3M (7 jours) |
Hiver | 94 | F. et N.-F. | 94 | 1,2 | Héroux et al., 2008 | |
| Ottawa, Ontario | 2002-2003 | Tubes de DT (100 min) | Hiver | 75 | F. et N.-F. | 75 | 2,2 | 5,2 (90e percentile) | Zhu et al., 2005 |
| Fourchette | 0,4 – 2,2 | 2,4 - 18,6 | |||||||
| Dans l'air extérieur | |||||||||
| Edmonton, Alberta | 2010 | Canisters passivés (7 jours × 24 heures) |
Été Hiver |
50 50 |
— | 324 332 |
0,4 0,7 |
1,7 2,7 |
Santé Canada, 2013b |
| Halifax, Nouvelle-Écosse | 2009 | Canisters passivés (7 jours × 24 heures) |
Été Hiver |
50 50 |
— | 324 287 |
0,3 0,6 |
0,7 1,2 |
Santé Canada, 2012 |
| Regina, Saskatchewan | 2007 | Canisters passivés (24 heures) |
Été Hiver |
111 106 |
— | 108 95 |
0,2 0,6 |
0,6 2,0 |
Santé Canada, 2010a |
| Windsor, Ontario | 2005-2006 | Canisters passivés (5 jours × 24 heures) |
Été Hiver |
46 47 |
— | 430 415 |
0,7 0,8 |
1,9 1,6 |
Santé Canada, 2010b |
| Ottawa, Ontario | 2014 | Canisters passivés (48 heures) | Hiver | 33 c | N.-F. | 127 | 0,6 | 1,1 | Mallach et al., 2017 |
| Ottawa, Ontario (maisons neuves) |
2019-2021 | Canisters passivés (96 heures) | Toutes | 18 | — | 17Footnote d 13Footnote e | 0,3 0,3 | 1,3 2,2 | Communication personnelle, Santé Canada, 2021a |
| Montréal, Québec | 2008-2011 | Canisters passivés (24 heures) | Toutes | 55 | — | 200 | 0,6 | 1,5 | Goldberg et al., 2015 |
| Ottawa, Ontario | 2002-2003 | Tubes de DT (100 min) | Hiver | 74 | F. et N.-F. | 74 | 0,3 | 2,4 (90e percentile) | Zhu et al., 2005 |
| Fourchette | 0,2 – 0,8 | 0,6 – 2,7 | |||||||
| Individuelle | |||||||||
| Windsor, Ontario | 2005 | Canisters passivés (5 jours × 24 heures) |
Été Hiver |
45 48 |
— | 207 225 |
1,6 1,5 |
9,2 4,6 |
Santé Canada, 2010b |
| Montréal, Québec | 2009-2010 | Canisters passivés (10 jours × 24 heures) | Toutes | 72 | — | 647 | 2,1 | 3,7 (75e percentile) | Smargiassi et al., 2014 |
| Fourchette | 1,5 – 2,1 | 4,6 – 9,2 | |||||||
MG = moyenne géométrique; F., fumeurs; N.-F., non-fumeurs
|
|||||||||
La Figure 1 illustre la distribution des concentrations de benzène dans l'air intérieur par saison apparaissant dans les études menées par Santé Canada dans quatre villes. Il convient de noter que plusieurs mesures ont été relevées dans chacune des maisons des études d'Edmonton, de Halifax et de Windsor et qu'une moyenne de ces mesures a été établie pour chacune d'entre elles. Une seule mesure a été prise pour chacune des maisons de l'étude de Regina. Aucune importante variation saisonnière n'a été observée.
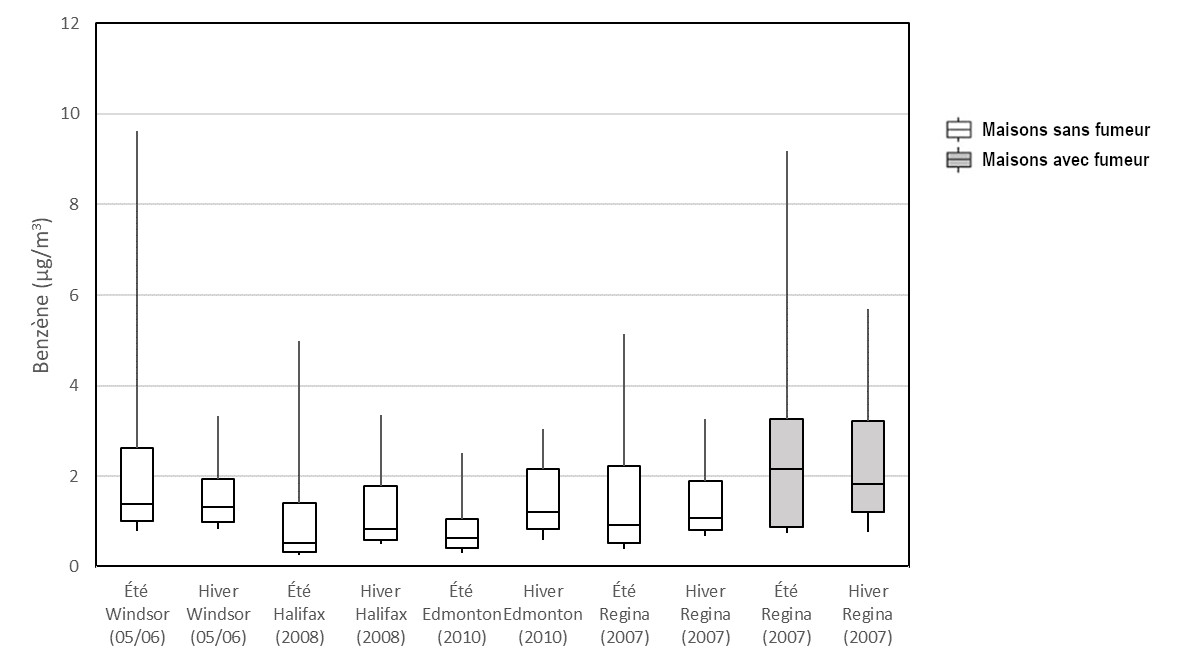
Figure 1 - Équivalent textuel
Un diagramme en boîte à moustaches où se trouvent la concentration de benzène (μg/m3) sur l’axe des x et des identificateurs des ensembles de données (saison à l’étude, lieu et année) sur l’axe des y. Les 75e, 50e et 25e percentiles sont représentés par le haut, le centre et le bas des boîtes. Les moustaches représentent les 90e et 10e percentiles. Les diagrammes sont présentés pour les maisons avec et sans fumeurs.
Figure 1. Les 75e, 50e et 25e percentiles sont représentés par le haut, le centre et le bas des boîtes, alors que les moustaches représentent les 90e et 10e percentiles. Source des données : Santé Canada (2010a, 2010b, 2012, 2013b).
2.3 Ratios intérieur/extérieur
Le ratio intérieur/extérieur (I/E) compare les concentrations de benzène mesurées dans une maison donnée à celles mesurées directement à l'extérieur de cette même maison. La Figure 2 présente la distribution des ratios I/E pour les maisons de quatre études de Santé Canada. La médiane des ratios I/E du benzène varie de 1,3 à 7,9 dans ces quatre villes canadiennes, indiquant une prédominance des sources intérieures, en particulier dans les maisons de fumeurs. Dans une étude de Santé Canada menée dans 33 maisons d'Ottawa avec garages attenants, les médianes des ratios I/E pour le benzène dans les maisons avec ventilateur de garage éteint ou allumé étaient respectivement de 2,8 et 1,6 (Mallach et al., 2017).
Le ratio I/E est d'environ 0,8 dans les études européennes, indiquant que le benzène présent dans l'air intérieur provient essentiellement de l'extérieur. Un ratio global I/E de 0,12 a été signalé dans les études nord-américaines (Sekar et al., 2019), soit une valeur inférieure à celle relevée dans les études de Santé Canada menées en milieu résidentiel. Ces études ont été effectuées à plusieurs endroits au Canada, aux États-Unis et au Mexique dans des zones industrielles et à forte circulation ainsi que dans des secteurs résidentiels.

Figure 2 - Équivalent textuel
Un diagramme en boîte à moustaches où se trouvent le ratio entre les concentrations de benzène intérieure et extérieure (sans unité) sur l’axe des x et des identificateurs des ensembles de données (saison à l’étude, lieu et année) sur l’axe des y. Les 75e, 50 e et 25e percentiles sont représentés par le haut, le centre et le bas des boîtes. Les moustaches représentent les 90 e et 10e percentiles. Les diagrammes sont présentés pour les maisons avec et sans fumeurs.
Figure 2. Les 75e, 50e et 25e percentiles sont représentés par le haut, le centre et le bas des boîtes, alors que les moustaches représentent les 90e et 10e percentiles. Source des données : Santé Canada (2012a, 2010b, 2010d).
3.0 Sources dans l'air
Cette section se concentre sur les sources de benzène dans l'air extérieur et intérieur. Bien qu'elles contribuent à l'exposition au benzène, les sources présentes dans les milieux autres que l'air comme l'eau potable et les aliments dépassent la portée du présent document.
Le benzène est naturellement présent dans les produits pétroliers, comme le pétrole brut et l'essence, et il est ajouté à l'essence sans plomb à une teneur d'environ 1 % pour améliorer le rendement (ATSDR, 2007; Santé Canada, 2013a; CIRC, 2018). Il est également issu de la combustion (naturelle et anthropique) et d'autres sources anthropiques. Le benzène entre principalement dans la production de produits chimiques organiques (p. ex., l'éthylbenzène, le styrène, le phénol, le cumène, le cyclohexane, le nitrobenzène, l'alkylbenzène et le chlorobenzène) servant à fabriquer des plastiques, de la résine, du nylon, des fibres synthétiques, des lubrifiants, des caoutchoucs, des colorants, des détergents et des pesticides. (ATSDR, 2007; OEHHA, 2014). Quarante-trois millions de tonnes de benzène ont été produites dans le monde en 2012. Le Canada en a produit 700 000 tonnes en 2019 (Umweltbundesamt, 2020; Statistique Canada, 2022).
3.1 Sources extérieures
Lorsque libéré dans l'environnement, le benzène devrait se retrouver dans l'air et les eaux de surface en raison de sa pression de vapeur relativement élevée, de sa solubilité modérée à élevée dans l'eau et de son faible coefficient de partage octanol-eau (Santé Canada, 2013a). Selon l'Inventaire national des rejets de polluants (2022) du Canada, 582 tonnes de benzène ont été libérées dans l'air tous secteurs confondus en 2020. À l'échelle nationale, les émissions de benzène ont diminué de 67 % de la fin des années 1990 jusqu'à la fin des années 2000 grâce à des mesures prises par le gouvernement dans les secteurs des transports et de l'industrie (Santé Canada, 2013a). Depuis 2006, environ 500 à 800 tonnes de benzène seraient rejetées dans l'air chaque année (INRP, 2022).
Les concentrations de benzène dans l'air extérieur varient d'une saison à l'autre au Canada, les concentrations les plus élevées étant observées en hiver dans les zones urbaines et semi-rurales (Kalenge et al., 2013; Miller et al., 2012). Les modèles de régression de l'utilisation des terres évaluent que 40 à 65 % des émissions de benzène au Canada proviennent des émissions de véhicules (Stroud et al., 2016). Les principaux prédicteurs des concentrations de benzène dans l'air extérieur des grandes villes sont la longueur des grands axes routiers, des routes express et des autoroutes avoisinants et la distance par rapport à ces grands axes routiers ainsi que le nombre de sources d'émissions industrielles et la distance séparant de ces sources (Hystad et al., 2011; Wheeler et al., 2008; Amini et al., 2017). Le benzène est libéré des stations-service par évaporation durant leur exploitation courante et des émissions de courte durée de benzène lors de la livraison de carburant par camions-citernes (Santé Canada, 2023), et des fuites d'essence des réservoirs de stockage souterrains (ATSDR, 2007). Au Canada, la transformation du pétrole, l'industrie automobile, l'élimination des déchets chimiques, l'industrie des pâtes et des papiers et la fonte des métaux sont des sources industrielles qui contribuent aux concentrations de benzène dans l'air extérieur (Xiong et al., 2020; Stroud et al., 2016; Miller et al., 2011; Levy et al., 2014; Hoffman et al., 2017). Les incendies de forêt et le chauffage au bois résidentiel peuvent également y contribuer de manière importante (Setton et al., 2015; Bari et Kindzierski, 2017; Wentworth et al., 2018). Dans les grandes villes, le trafic routier a la plus grande influence sur les concentrations de benzène, alors que dans les zones rurales comme les Prairies ce sont l'industrie pétrochimique et d'autres sources qui dominent (Stroud et al., 2016).
3.2 Sources intérieures
Une analyse de régression a été effectuée à partir des résultats des questionnaires sur le comportement des occupants et les caractéristiques des maisons administrés dans le cadre des études menées par Santé Canada à Edmonton, Halifax, Regina et Montréal (Santé Canada, 2021a). Le Tableau 3 résume les résultats statistiquement significatifs des modèles à plusieurs variables. Selon cette analyse, les principaux facteurs associés aux concentrations de benzène dans les maisons comprennent la présence d'un garage attenant, l'entreposage de peintures, de solvants et d'essence dans le garage, l'entreposage de peintures ou de solvants dans la maison, le fait de fumer à l'intérieur, l'infiltration d'air extérieur et la ventilation. Bien que ces modèles expliquent une partie de la variabilité associée aux concentrations de benzène (R 2 = 0,14 – 0,64), cette variabilité demeure essentiellement inexpliquée, ce qui laisse supposer que d'autres facteurs influencent également les concentrations de benzène dans l'air intérieur. Toutes ces études ont mesuré les niveaux de contaminants dans l'air intérieur et extérieur des maisons isolées situées dans les grandes villes canadiennes et leurs environs. Les résultats peuvent ne pas être représentatifs de tous les types de maisons au Canada. Les résultats du Tableau 3 sont présentés sous forme de changement relatif des concentrations moyennes de benzène dans l'air intérieur.
Une analyse de régression à plusieurs variables effectuée à partir des résultats d'une petite étude menée dans une collectivité des Premières Nations de la zone de Sioux Lookout a révélé que les concentrations plus élevées de benzène dans l'air intérieur étaient associées à la présence et au nombre de personnes qui fument dans la maison et à l'utilisation du bois comme combustible. Des concentrations plus faibles de benzène dans l'air intérieur ont été associées à l'utilisation d'un système de chauffage électrique, à une enveloppe de bâtiment intacte, à l'utilisation d'un ventilateur-récupérateur de chaleur et à une ventilation continue (R 2 = 0,10 – 0,05) (Santé Canada, 2021a).
| Ville | Edmonton | Edmonton | Halifax | Halifax | HalifaxNote de bas de page 1 | HalifaxNote de bas de page 1 | Regina | Regina | Montréal |
|---|---|---|---|---|---|---|---|---|---|
| Saison | Été | Hiver | Été | Hiver | Été | Été | Été | Hiver | Toute l'année |
| Étude | Santé Canada, 2013b | Santé Canada, 2013b | Santé Canada, 2012 | Santé Canada, 2012 | Santé Canada, 2012 | Santé Canada, 2012 | Santé Canada, 2010a | Santé Canada, 2010a | Goldberg et al., 2015 |
| Nombre de maisons | 52 | 48 | 51 | 50 | 19 | 19 | 103 | 74 | 49 |
| Taille de l'échantillon | 326 jours | 300 jours | 304 jours | 285 jours | 117 jours | 110 jours | soNote de bas de page 2 | soNote de bas de page 2 | 261 jours |
| R2(coefficient de détermination) | 0,49 | 0,59 | 0,46 | 0,36 | 0,43 | 0,26 | 0,46 | 0,64 | 0,14 |
| Prédicteurs | |||||||||
| Toute consommation de cigarettes dans la maison depuis la dernière visite | 2,936 | 1,833 | |||||||
| Tout solvant ou peinture conservé à la maison | 1,327 | ||||||||
| Présence d'un garage attenant | 1,981 | 2,018 | 2,635 | 2,039 | 3,426 | 2,263 | |||
| Essence entreposée dans le garage attenant | 4,949 | ||||||||
| Peintures ou solvants entreposés au garage | 4,334 | ||||||||
| TRA moyen (h-1) | 0,620 | 0,904 | 0,647 | ||||||
| Augmentation de 10 % de la concentration extérieure de benzène (μg/m3) | 0,492 | 0,591 | 0,572 | 0,604 | 0,652 | 0,419 | |||
| Fenêtre ouverte depuis la dernière visite (1 fenêtre) | 0,963 | ||||||||
| Fenêtres ouvertes depuis la dernière visite | 0,583 | ||||||||
|
|||||||||
3.2.1 Garages attenants
La présence d'un garage attenant constitue une importante source d'exposition au benzène dans l'air intérieur (Santé Canada, 2013a; Wheeler et al., 2013; Mallach et al., 2017; Cakmak et al., 2021; Gordian et al., 2010; Batterman et al., 2014). Les concentrations de benzène sont nettement plus élevées dans les garages qu'à l'intérieur ou l'extérieur de la maison, et les garages sont responsables de 40 à 65 % de l'exposition au benzène dans l'air intérieur (Santé Canada, 2013a; Mallach et al., 2017). Les gradients de température et de pression de l'air favorisent souvent la migration de l'air d'un garage plus froid où la pression de l'air est plus élevée vers une maison plus chaude dans laquelle la pression de l'air est moindre en raison des portes communicantes et des ouvertures dans l'enveloppe du bâtiment (Santé Canada, 2013a; Mallach et al., 2017). Les sources de benzène dans le garage comprennent les émissions de gaz d'échappement (combustion) et les gaz d'évaporation provenant de l'essence et d'autres produits (Santé Canada, 2013a; Mallach et al., 2017). Les propriétaires canadiens garent généralement leurs véhicules au garage et y entreposent des articles comme des produits automobiles, des appareils à essence et des solvants (Mallach et al., 2017). Lors d'essais en chambre, plusieurs de ces articles ont libéré du benzène, même lorsqu'ils étaient entreposés dans des contenants hermétiquement fermés ou qu'ils n'étaient pas en marche (Won et al., 2015).
Présence et caractéristiques des garages attenants
Après stratification par type de garage des concentrations de benzène mesurées dans les maisons des études de Santé Canada menées à Windsor, Regina et Halifax, il a été constaté que ces concentrations étaient plus élevées dans les maisons avec garages attenants que dans celles avec garages non attenants ou sans garage (Santé Canada, 2013a). Une analyse de régression des données provenant des maisons d'Edmonton, de Halifax, de Montréal et de Regina a montré que la présence d'un garage attenant est un bon prédicteur des concentrations de benzène dans l'air intérieur, quelle que soit la saison (elle était de 98 à 243 % plus élevée dans les maisons avec garage attenant) (Santé Canada, 2021a). À l'aide des données de l'ECMS, Wheeler et al. (2013) ont déterminé que « la présence d'un garage sur les lieux » était un prédicteur de concentrations accrues de benzène et constaté que la concentration moyenne de benzène était environ deux fois plus élevée dans les maisons avec garage attenant que dans celles sans garage attenant. Les concentrations de benzène étaient également nettement plus élevées dans les maisons ayant une porte communicante avec le garage que dans celles sans porte communicante (Wheeler et al., 2013; Cakmak et al., 2021). Des résultats similaires ont été obtenus dans une étude menée dans trois villes américaines (Batterman et al., 2014).
Une étude de Santé Canada menée dans 33 maisons d'Ottawa avec garages attenants a révélé que le ratio médian garage-extérieur était de 11,4 pour le benzène, ce qui indique la présence de sources dans le garage (Mallach et al., 2017). Ce même ratio était nettement plus faible (3,0) lorsque le ventilateur d'extraction au garage était allumé. Un ventilateur en marche dans le garage a également permis de réduire de manière importante la médiane des ratios I/E pour le benzène de 2,8 à 1,6, tout en réduisant de 62 % la concentration de benzène dans l'air intérieur.
La médiane des ratios garage-intérieur était de 4,1 pour le benzène dans l'étude d'Ottawa (Mallach et al., 2017), alors qu'elle était supérieure à 10 dans une étude menée dans 15 maisons du Michigan (Batterman et al., 2007). Ces ratios garage-intérieur plus faibles dans l'étude de Santé Canada ont été attribués à l'augmentation de l'effet de cheminée et de la force du vent au cours de l'échantillonnage hivernal, qui favorise le transfert de l'air du garage attenant vers la maison, alors que l'échantillonnage de l'étude de Batterman et al. (2007) a été effectué au printemps. Dans l'étude d'Ottawa, des différences significatives ont été relevées au niveau des concentrations de benzène au garage corrigées pour tenir compte de la concentration extérieure et du taux de renouvellement de l'air (TRA) au garage (non étanche vs étanche); toutefois, les concentrations de benzène n'étaient pas significativement plus faibles dans les maisons ayant des garages moins étanches (c'est-à-dire avec un taux de renouvellement de l'air par heure plus élevé). L'absence de résultats statistiquement significatifs peut être attribuable à la taille relativement petite de l'échantillon de l'étude, les tendances générales des données semblant indiquer que les concentrations de polluants dans l'air intérieur sont plus faibles dans les maisons ayant des garages moins étanches (Mallach et al., 2017).
Les études précédentes avaient révélé que l'emplacement d'un garage attenant et le lieu de stationnement des véhicules influencent les concentrations de benzène dans l'air intérieur. Les garages attenants au rez-de-chaussée ont un plus grand impact sur la présence de benzène dans l'air intérieur que les garages souterrains; toutefois, la concentration de benzène est plus élevée dans les pièces situées directement au-dessus du garage que dans celles situées à côté du garage. La concentration moyenne de benzène dans l'air intérieur était environ deux fois plus élevée lorsqu'une voiture était garée près de la maison, dans un garage attenant ou dans un abri à voitures (Santé Canada, 2013a).
Entreposage de produits dans un garage attenant
Les données provenant des études de Santé Canada indiquent que l'entreposage d'essence, de peintures et de solvants dans les garages attenants a influé de manière importante sur les concentrations de benzène dans les maisons de Halifax (Santé Canada, 2021a). L'entreposage d'essence ou de peintures et de solvants au garage a été associé à des concentrations plus élevées de benzène dans les maisons de Halifax en été, la concentration moyenne de benzène ayant augmenté de 395 % avec l'essence et de 333 % avec les peintures et les solvants (Santé Canada, 2021a).
Une étude canadienne portant sur les essais en chambre des émissions de composés organiques volatils (COV) provenant de sources d'évaporation dans les garages résidentiels a révélé que les produits liés à l'essence étaient de grands émetteurs de BTEX (benzène, toluène, éthylbenzène et xylènes) (Won et al., 2015). Les souffleuses à neige, les tondeuses à gazon, les taille-bordures et les scies à chaîne sont tous des produits fonctionnant à l'essence qui émettent des niveaux élevés de benzène. Après avoir fonctionné pendant 30 minutes, les appareils ont été éteints, essuyés et placés dans une chambre d'essai d'émission. Les facteurs d'émission de benzène des produits plus anciens (dont une souffleuse à neige, une tondeuse à gazon et un taille-bordures achetés en 2002 ou en 2003) étaient de 6 à 13 fois plus élevés que ceux du même type d'équipement acheté en 2014. Le facteur d'émission de benzène de la souffleuse à neige plus ancienne, par exemple, était de 1285 μg/h, alors que celui du modèle plus récent était de 98 μg/h. Un bidon d'essence ordinaire de 5 L avec bouchon fermé faisait également partie des grands émetteurs, son facteur d'émission de benzène étant de 1241 μg/h à 23 °C. Ce facteur d'émission variait en fonction de la température en chambre : il baissait de 50 % à 14 °C et de 70 % à 4 °C, et augmentait de 20 % à 30 °C. Les facteurs d'émission de benzène des peintures, d'un produit adhésif, d'un produit dégraissant, des produits automobiles, des cires ou des produits à polir, d'un lubrifiant, des produits d'entretien de la pelouse et des plantes, des produits pour le toit et des produits pour l'accès au garage étaient faibles (c'est-à-dire. < 0,6 μg/h). Toutefois, le facteur d'émission de benzène de l'une des peintures était 40 fois plus élevé à 30 °C qu'à 23 °C, ce qui laisse supposer que la composition individuelle du produit peut avoir de l'importance (Won et al., 2015).
Les concentrations de benzène ont été modélisées pour le garage et la maison à l'aide des facteurs d'émission de ces produits entreposés au garage. Les bidons d'essence et l'équipement à essence étaient les principales sources de benzène dans le garage, avec une contribution relativement plus importante des produits plus anciens qui devraient faire doubler les concentrations de benzène dans le garage par rapport aux produits plus récents. D'autres produits, comme les produits dégraissants, les décapants et les produits adhésifs, ont été considérés comme des sources mineures de benzène dans le garage. La principale source de benzène dans la maison était l'infiltration depuis le garage attenant. Les concentrations prévues dans la maison et le garage ne variaient que de façon minime d'une saison à l'autre, ce qui correspond aux concentrations de benzène dans l'air intérieur toutes saisons confondues observées dans les études de Santé Canada (Won et al., 2015).
Une étude portant sur plus de 500 maisons avec garages attenants en Alaska a mis en évidence une association positive entre la concentration de benzène dans l'air intérieur et la présence de bidons d'essence au garage (Gordian et al., 2010). Une forte corrélation a été observée entre la concentration de benzène et le nombre de moteurs entreposés au garage (petits moteurs et véhicules). Une étude portant sur des maisons de Detroit a révélé que plus de 30 % des maisons entreposaient leur équipement à essence au sous-sol, la plupart d'entre elles n'ayant pas de garage attenant. Les auteurs ont estimé que la contribution du sous-sol à la concentration médiane de benzène dans l'air intérieur s'élevait à 8 %; toutefois, cette contribution pouvait atteindre 40 % dans les maisons où la concentration de benzène était plus élevée (Du et al., 2015).
3.2.2 Usage du tabac
Les études de Santé Canada montrent que l'usage du tabac à la maison est le troisième facteur déterminant des concentrations de benzène dans l'air intérieur, après les garages attenants et l'entreposage d'essence, de peintures et de solvants. Les concentrations de benzène étaient plus élevées dans les maisons avec fumeurs que celles sans fumeurs (Santé Canada, 2013a; Li et al., 2019; Zhu et al., 2013; Wheeler et al., 2013; Chin et al., 2014; Schlink et al., 2010; Herberth et al., 2014). Une analyse de régression multiple (Santé Canada, 2021a) a montré que la consommation de cigarettes dans la maison était un bon prédicteur des concentrations moyennes de benzène dans l'air intérieur à Regina en été et en hiver, avec des augmentations respectives de 194 % et 83 %. De même, une étude portant sur des maisons des Premières Nations de la zone de Sioux Lookout a associé la présence de fumeurs à la maison à une augmentation de 56 % de la concentration moyenne de benzène (Santé Canada, 2021a).
La concentration moyenne de benzène était également plus élevée dans les maisons avec fumeurs que dans celles sans fumeurs dans le cycle 3 de l'ECMS allant de 2012 à 2013 (Li et al., 2019) et dans le cycle 2 allant de 2009 à 2011 (Zhu et al., 2013). Wheeler et al. (2013) ont déterminé à l'aide des données du cycle 2 de l'ECMS que la consommation régulière de cigarettes à la maison était un bon prédicteur de concentrations accrues de benzène, signalant une augmentation de 136 % des concentrations pour ce prédicteur. De même, des études menées aux États-Unis et en Europe ont montré que l'usage du tabac ou l'exposition à la fumée secondaire est associé à des concentrations accrues de benzène dans la maison (Chin et al., 2014; Schlink et al., 2010; Herberth et al., 2014).
Les facteurs d'émission du benzène peuvent varier de 296 à 610 μg par cigarette. La plupart des émissions de benzène produites par les cigarettes proviennent de la fumée latérale (c'est-à-dire la fumée provenant de l'extrémité allumée de la cigarette) (Santé Canada, 2013a). La fumée tertiaire, qui s'incruste sur les vêtements et qui est émise de nouveau dans l'air intérieur, est une autre importante source de benzène provenant de la fumée de cigarette. Une étude récente menée en Allemagne dans un cinéma non-fumeur a révélé que les occupants étaient exposés à des émissions de COV (y compris le benzène) incrustés sur leurs vêtements qui étaient équivalentes à 1 à 10 cigarettes de fumée secondaire (Sheu, 2020). Outre la fumée de cigarette, le benzène a été identifié dans les émissions de petits cigares et de cigarillos, de cigarettes électroniques, de produits du tabac chauffés et de houka (Pickworth et al., 2018; Logue et al., 2017; Cancelada et al., 2019; Kassem et al., 2014). Aucune étude n'a été repérée sur la contribution de ces produits à la concentration de benzène dans l'air intérieur.
3.2.3 Infiltration d'air extérieur
L'influence des niveaux ambiants de benzène sur les niveaux intérieurs est très variable, ce qui reflète la variabilité spatiale et temporelle du benzène ambiant (Santé Canada, 2013a). Comme indiqué à la section 3.1, le benzène présent dans l'air ambiant provient des émissions des véhicules, des gaz d'évaporation de l'essence, des émissions industrielles et de la combustion du bois. Une analyse de régression multiple a montré qu'une augmentation de 10 % de la concentration de benzène dans l'air extérieur était associée à une augmentation d'environ 4 à 6 % de la concentration moyenne de benzène dans l'air intérieur à Edmonton (4,8 % en été et 5,8 % en hiver), Halifax (5,6 % en été et 5,9 % en hiver), Regina (6,4 % en hiver) et Montréal (4,1 %, toutes saisons confondues) (Santé Canada, 2021a). La corrélation entre les concentrations de benzène dans l'air intérieur et extérieur n'a pas été investiguée dans les maisons des Premières Nations de la zone de Sioux Lookout. Toutefois, plusieurs indicateurs d'une enveloppe sûre du bâtiment qui empêcherait les infiltrations (comme des installations techniques isolées, des cadres de fenêtres ou un parement en vinyle, et des descentes pluviales avec rallonges) étaient associés à une baisse de 28 à 49 % de la concentration de benzène dans l'air intérieur (Santé Canada, 2021a).
La présence de benzène dans l'air intérieur est en partie attribuable à l'infiltration de sources extérieures de combustion des véhicules. Dans une étude portant sur quatre écoles d'Ottawa, MacNeill et al. (2016) ont montré que la concentration de benzène dans l'air intérieur diminuait de 22 à 42 % lorsque le programme de ventilation était modifié de manière à ce que les périodes de forte ventilation ne coïncident pas avec les heures de pointe. Une étude portant sur des maisons de Detroit n'a relevé qu'une faible association entre le volume de circulation à moins de 100 ou 300 m de la maison et la concentration de benzène dans l'air intérieur (Chin et al., 2014). Les résultats d'une étude portant sur 20 garderies de la Californie ont toutefois mis en évidence une corrélation entre la concentration de benzène dans l'air intérieur et la proximité du trafic routier (Hoang et al., 2017). Une étude menée en Allemagne a montré que les concentrations de benzène étaient plus élevées dans les maisons situées à proximité de routes à circulation dense (Schlink et al., 2010). Une analyse plus récente menée dans les pays et les régions développés a révélé qu'en moyenne le benzène ambiant provenant principalement des émissions dues au trafic routier pouvait représenter 84 % de la concentration de benzène dans l'air intérieur (Liu et al., 2020). Une étude menée en Grèce a indiqué que la concentration de benzène dans l'air intérieur était influencée par la proximité de routes achalandées et de stations-service (Vardoulakis, 2020).
Les données probantes sont peu nombreuses sur l'influence des sources extérieures de benzène, comme les stations d'essence et l'activité industrielle, sur les concentrations de benzène dans l'air intérieur. Les concentrations de benzène dans l'air intérieur et extérieur sont plus élevées près des sources d'émissions comme les stations d'essence (OMS, 2000). Ces rejets proviennent des pertes quotidiennes par évaporation pendant l'exploitation de la station d'essence ainsi que des rejets intermittents de vapeur d'essence pendant le remplissage des réservoirs de stockage souterrains. Une récente évaluation de Santé Canada (2023) a modélisé la concentration à long terme de benzène dans l'air extérieur attribuable aux pertes par évaporation d'une station d'essence pour des habitations situées à différentes distances de la station d'essence. À une distance de 20 m de la limite de propriété de la station d'essence, les concentrations atmosphériques modélisées étaient respectivement de 0,88, 3,5 et 9,2 μg/m3 pour les scénarios à débit de base, à débit médian et à débit élevé. Les concentrations diminuaient avec l'éloignement de la station d'essence, mais n'ont atteint la valeur de 0,29 μg/m3 associée à un niveau de risque de cancer de 1 × 10-6 qu'à plus de 70 mètres pour le scénario à débit de base, 160 mètres pour le scénario à débit médian et 290 mètres pour le scénario à débit élevé. Les hausses à court terme de la concentration de benzène attribuable au remplissage des réservoirs ont également été modélisées dans les zones résidentielles adjacentes aux stations d'essence. Cette évaluation a pris pour hypothèse que la concentration de benzène dans l'air intérieur due aux émissions de la station d'essence est égale à la concentration modélisée dans l'air extérieur.
Caron-Beaudoin et al. (2022) ont fait apparaître une corrélation possible entre la concentration de benzène dans l'air intérieur et la proximité d'opérations de fracturation hydraulique (distance et densité des puits). Les concentrations de benzène dans l'air intérieur de cette étude étaient toutefois similaires à celles d'un échantillon représentatif à l'échelle nationale (par exemple, l'ECMS).
3.2.4 Matériaux de construction et biens de consommation
L'entreposage de peintures ou de solvants dans la maison était un prédicteur des concentrations de benzène dans l'air intérieur à Regina en hiver (Santé Canada, 2021a). Le précédent document de conseils de Santé Canada (2013a) a toutefois indiqué qu'aucune association n'a été relevée entre les concentrations élevées de benzène et de récentes rénovations ou de nouveaux produits dans les études de Santé Canada menées à Halifax, Québec et Regina. En fait, l'étude menée à Québec a plutôt observé une association entre de nouveaux tapis et de récentes rénovations et des concentrations plus faibles de benzène, bien que cela puisse être dû à des facteurs secondaires comme la taille de l'échantillon (Santé Canada, 2013a). Des études menées aux États-Unis et en Europe ont indiqué que les matériaux de construction, les rénovations ou l'utilisation de peintures ou de produits adhésifs n'ont que très peu contribué aux concentrations de benzène dans l'air intérieur (Santé Canada, 2013a). De même, l'analyse de régression des données d'Edmonton, de Regina, de Halifax et de Montréal n'a montré aucune association entre les concentrations de benzène dans l'air intérieur et les travaux de peinture, de finition ou de vernissage effectués au cours de l'année précédente.
Des études reposant sur des mesures de l'air intérieur et des enquêtes sur les activités menées pour l'ECMS ont montré que la concentration de benzène dans la maison n'avait pas augmenté en raison de rénovations majeures effectuées le mois précédent (Wheeler et al., 2013; Cakmak et al., 2021). De plus, l'utilisation de teintures et de peintures ainsi que de nouveaux tapis n'ont pas été considérés comme des prédicteurs de concentration de benzène dans l'air intérieur (Cakmak et al., 2021). Les données préliminaires d'une étude en cours menée par Santé Canada semblent indiquer que les concentrations de benzène dans les maisons neuves se situent dans la même fourchette que celles mesurées dans d'autres maisons canadiennes (voir le Tableau 2; Santé Canada, 2021a).
Des études plus anciennes ont détecté du benzène dans certains produits de construction (cloisons sèches peintes, produits adhésifs, et produits d'étanchéité et d'isolation) au Canada et aux États-Unis (Santé Canada, 2013a), mais les facteurs d'émission étaient généralement faibles. Des résultats similaires ont été obtenus dans des études plus récentes. Des essais d'émissions en chambre ont détecté du benzène dans 14 à 65 % des nouveaux produits de construction, bien que la plupart des facteurs d'émission étaient faibles (Won et al., 2014, 2015; Santé Canada et Conseil national de recherches Canada, 2019). Les émissions les plus faibles (< 2,5mg/m2/h) étaient associées à des matériaux secs, comme les revêtements de sol en vinyle et les matériaux en bois, et les plus élevées à des produits d'isolation (≤ 4,2 mg/m2/h), et à des produits calfeutrants et des mousses d'étanchéité (0,4 – 1200 mg/m2/h). Une étude a détecté des concentrations de benzène inférieures à la limite de détection de la méthode (c'es-à-dire au-dessus de zéro) dans 43 % des matériaux de peinture, mais aucune n'était supérieure à cette même limite de détection (Won et al., 2014). La modélisation de la concentration atmosphérique réalisée dans cette étude a indiqué que la peinture était la principale source de benzène dans l'air intérieur, malgré des facteurs d'émission plus faibles, probablement en raison de la grande surface de mur et de plafond peinte. Le modèle ne comprenait pas de sources provenant d'un garage attenant (comme décrit à la section 3.2.1) et les concentrations modélisées moyennes sur un an de benzène étaient 10 fois plus petites que celles recensées dans la littérature, ce qui indique que les matériaux testés ne constituent probablement pas une importante source de benzène dans l'air intérieur. Dans une étude de modélisation plus récente portant sur les produits entreposés dans les garages attenants, les concentrations modélisées de benzène correspondaient aux valeurs signalées dans la littérature (Won et al., 2015). Cette étude indique que la peinture, l'isolation thermique et les poutrelles en I peuvent être d'importantes sources secondaires de benzène dans l'air intérieur après les garages attenants.
Bien que le précédent document de conseils de Santé Canada a inclus plusieurs études internationales dans lesquelles le benzène a seulement été détecté dans un petit nombre de produits ménagers ou de consommation, les concentrations de benzène dans l'air intérieur ne sont généralement pas associées à l'utilisation des produits (Santé Canada, 2013a). Une analyse de régression des données provenant de maisons d'Edmonton, de Regina, de Halifax et de Montréal n'a établi aucune association entre la concentration de benzène et l'utilisation de bougies, d'encens, de désodorisants et de produits de nettoyage (Santé Canada, 2021a). De même, l'utilisation de bougies et les passe-temps n'étaient pas des prédicteurs de la concentration de benzène dans les maisons sans fumeurs de l'ECMS (Cakmak et al., 2021). À l'aide des données provenant de toutes les maisons de l'ECMS, Wheeler et al. (2013) ont toutefois établi une association positive entre le modélisme pratiqué au cours des trois mois précédents et une augmentation de 31 % des concentrations de benzène après transformation logarithmique ainsi qu'une association non significative entre l'utilisation de chandelles au cours de la semaine précédente et une augmentation de 12 % des concentrations de benzène après transformation logarithmique.
D'autres études de modélisation ont montré que les concentrations de benzène dans l'air intérieur peuvent augmenter en utilisant des solvants à base de pétrole et en brûlant de l'encens ou des bougies (Hollins et al., 2013; Manoukian et al., 2016; Petry et al., 2014). En Corée, le benzène a été détecté dans des produits de consommation, comme les insectifuges, la colle, le correcteur liquide et les stylos (Lim et al., 2014; Rahman et Kim, 2014). Une étude menée dans des maisons coréennes où vivaient des enfants a montré que les concentrations de benzène étaient plus élevées dans les maisons se servant de désodorisants (Lee et al., 2014). Aucune donnée n'indique que la présence de benzène dans ces produits contribue à accroître la concentration de benzène dans les maisons canadiennes.
3.2.5 Autres sources
Bois et autres sources de chauffage
Les incendies de forêt et la fumée de bois sont une source de benzène dans l'air extérieur. Les études de Santé Canada menées à Edmonton, Halifax, Montréal et Regina n'ont pas établi d'association entre l'utilisation du bois ou d'autres sources de chauffage, comme le mazout ou l'électricité, et les concentrations de benzène dans l'air intérieur résidentiel (Santé Canada, 2021a). Toutefois, l'utilisation du bois comme principal système de chauffage a été associée à une augmentation de 53 % des concentrations de benzène et l'utilisation du chauffage électrique à une diminution de 48 % de ces mêmes concentrations dans les maisons des Premières Nations de la zone de Sioux Lookout. Des études internationales ont signalé que le benzène peut être émis par les chaudières à bois et les foyers décoratifs à éthanol (Aurell et al., 2012; Schripp et al., 2014). Bien que les appareils de chauffage au bois émettent du benzène, les données probantes obtenues avant la publication du précédent document de conseils de Santé Canada ne semblent pas indiquer que ces appareils sont à l'origine de fortes concentrations de benzène dans l'air intérieur (Santé Canada, 2013a). Aucune publication récente n'a relevé d'association entre l'utilisation des appareils de chauffage au bois et les concentrations de benzène dans l'air intérieur. Il est généralement considéré que les appareils de chauffage au bois bien installés et entretenus évacuent les polluants à l'extérieur et ne contribuent donc pas aux concentrations de benzène dans l'air intérieur (Santé Canada, 2013a).
Intrusion de vapeurs
Il est possible que le benzène migre des sols non saturés vers les maisons (intrusion de vapeur) dans les secteurs résidentiels du Canada où les eaux souterraines ou les sols sont contaminés par du benzène. Des associations non significatives ont été établies dans les maisons des Premières Nations de la zone de Sioux Lookout entre les concentrations plus élevées de benzène dans l'air intérieur et de l'eau stagnante à proximité ou la présence d'un plancher en terre battue au sous-sol (Santé Canada, 2021a). Des rejets accidentels de benzène peuvent survenir à chacune des étapes de la production, de l'entreposage, de l'utilisation et du transport du benzène, du pétrole brut et de l'essence (Santé Canada, 2013a).
Le taux d'intrusion des vapeurs de COV provenant de sources d'eau contaminées dépend de nombreux facteurs. La simulation de scénarios d'intrusion de vapeurs indique que, outre la concentration du contaminant dans la source d'eau, les facteurs importants comprennent la distance et la direction relative (en amont ou en aval) de la source, la présence de surfaces imperméables (comme le pavage), la profondeur de la zone d'aération au-dessus de la nappe phréatique ainsi que la profondeur et l'emplacement des brèches dans l'enveloppe du bâtiment (comme les fissures dans la fondation) (DeHate et al., 2011; Mustafa et al., 2014; Yao et al., 2011). Une simulation de transport du benzène à partir d'un aquifère contaminé à une concentration aussi faible que 5 μg/L a entraîné une percée du benzène à près de 1000 mètres de la source. Il a fallu au moins deux ans à 43 mètres de la source pour que l'air retrouve une concentration qui atteint un niveau protégeant contre le cancer (3,1 μg/m3) (Mustafa et al., 2014). Dans une étude portant sur une collectivité de l'Ohio, les concentrations de benzène dans l'air intérieur étaient de 2 à 17 fois plus élevées que la recommandation (3,1 μg/m3) dans trois des quatre maisons situées à moins de 2 kilomètres d'une station de compression (Martin et al., 2021). Le benzène faisait partie des produits chimiques les plus fréquemment détectés dans l'air intérieur dans une étude portant sur des propriétés commerciales, des maisons individuelles et des immeubles d'habitation situés à proximité de trois usines désaffectées de gaz de synthèse. Les niveaux de risque de cancer découlant du benzène allaient d'acceptables (10-6) à en deçà d'acceptables (10-4) dans cette étude (DeHate et al., 2011).
Eau potable contaminée
Le benzène présent dans l'approvisionnement en eau à usage domestique peut se volatiliser à partir de l'eau lors du bain, de la douche ou de l'ouverture des robinets. Il convient de noter qu'il est extrêmement rare au Canada que le benzène contamine l'eau. Pour en savoir davantage sur cette voie d'exposition, consulter les Recommandations pour la qualité de l'eau potable au Canada (Santé Canada 2013a, 2009).
3.3 Ventilation
La ventilation est fréquemment représentée par le TRA qui est exprimé en renouvellements d'air par heure (h-1). La ventilation dépend de plusieurs facteurs, comme le type de construction, l'utilisation de ventilateurs d'extraction, l'emplacement géographique, la saison et la mesure dans laquelle les fenêtres et les portes sont ouvertes (Santé Canada, 2013a). Le TRA est influencé par les différences de température entre l'intérieur et l'extérieur et la vitesse du vent à l'extérieur qui peuvent accroître l'infiltration ou l'exfiltration de l'air par de petites ouvertures dans l'enveloppe du bâtiment. Les maisons situées dans des climats plus froids et les maisons neuves sont généralement plus étanches que les maisons plus anciennes ou celles d'autres climats (Santé Canada, 2013a). Bien qu'un TRA plus élevé abaisse généralement les concentrations de contaminants dans l'air intérieur, il peut également avoir des effets négatifs comme la sécheresse, des courants d'air ou encore une irritation causée par le bruit des ventilateurs d'extraction.
Les études de Santé Canada ont associé les fenêtres ouvertes en été à une diminution de la concentration de benzène dans les maisons de 42 % à Regina et de 4 % à Edmonton. Un TRA moyen plus élevé a également été associé à des concentrations de benzène dans l'air intérieur significativement plus faibles à Halifax en été et en hiver, et à Edmonton en été (diminution de 10 à 38 % de la concentration de benzène avec chaque augmentation du TRA de 1 h-1). À l'aide des données de l'ECMS, Wheeler et al. (2013) ont également déterminé que « les fenêtres ouvertes au cours d'une journée de la semaine précédente » étaient un prédicteur de concentrations plus faibles de benzène dans la maison (diminution de 21 % de la concentration de benzène après transformation logarithmique). La ventilation continue et l'utilisation d'un ventilateur-récupérateur de chaleur ont été associées à de plus faibles concentrations de benzène dans les maisons des Premières Nations de la zone de Sioux Lookout (diminution de 36 % et de 47 %, respectivement) (Santé Canada, 2021a).
Des études menées aux États-Unis ont également montré que la concentration de benzène dans l'air intérieur est inversement proportionnelle au TRA et l'exposition personnelle aux fenêtres ouvertes (Hoang et al., 2017; Symanski et al. 2009). Comme indiqué à la section 3.2.1, une meilleure ventilation dans un garage attenant (installation d'un ventilateur d'extraction) réduit de manière significative la concentration de benzène dans la maison.
4.0 Toxicocinétique
4.1 Absorption, distribution, métabolisme et excrétion
La toxicocinétique du benzène a fait l'objet de nombreuses études et a été abordée en détail par l'OEHHA (2014) et l'ATSDR (2007). Les paragraphes suivants résument ces examens.
Le benzène est rapidement absorbé après inhalation, la principale voie d'exposition chez l'homme. Des études portant sur l'exposition par inhalation à des concentrations de benzène comprises entre 1 et 100 ppm indiquent qu'environ 50 % de la dose inhalée est absorbée (ATSDR, 2007; OEHHA, 2014). L'absorption se produit rapidement dès les premières minutes d'exposition, puis diminue de manière importante par la suite (ATSDR, 2007). Le benzène inhalé est distribué dans l'ensemble du corps après son absorption dans le sang. Chez le rongeur et le chien, le benzène est détecté dans la moelle osseuse, les reins, le foie, le cerveau et la rate. Il est distribué préférentiellement dans les tissus riches en lipides, et son absorption relative dans les tissus dépend du taux de perfusion sanguine. Chez l'homme, le benzène est distribué dans plusieurs tissus. Il est présent dans le sang, le cerveau, le foie, les reins, l'estomac, la bile et la graisse abdominale après l'administration de doses létales (ATSDR, 2007). Il traverse également le placenta et est présent dans le sang du cordon à des quantités égales à celles présentes dans le sang maternel (ATSDR, 2007). Les métabolites du benzène sont largement distribués dans les tissus et les organes comme les reins, les poumons, le cerveau et la moelle osseuse (ATSDR, 2007; OEHHA, 2014).
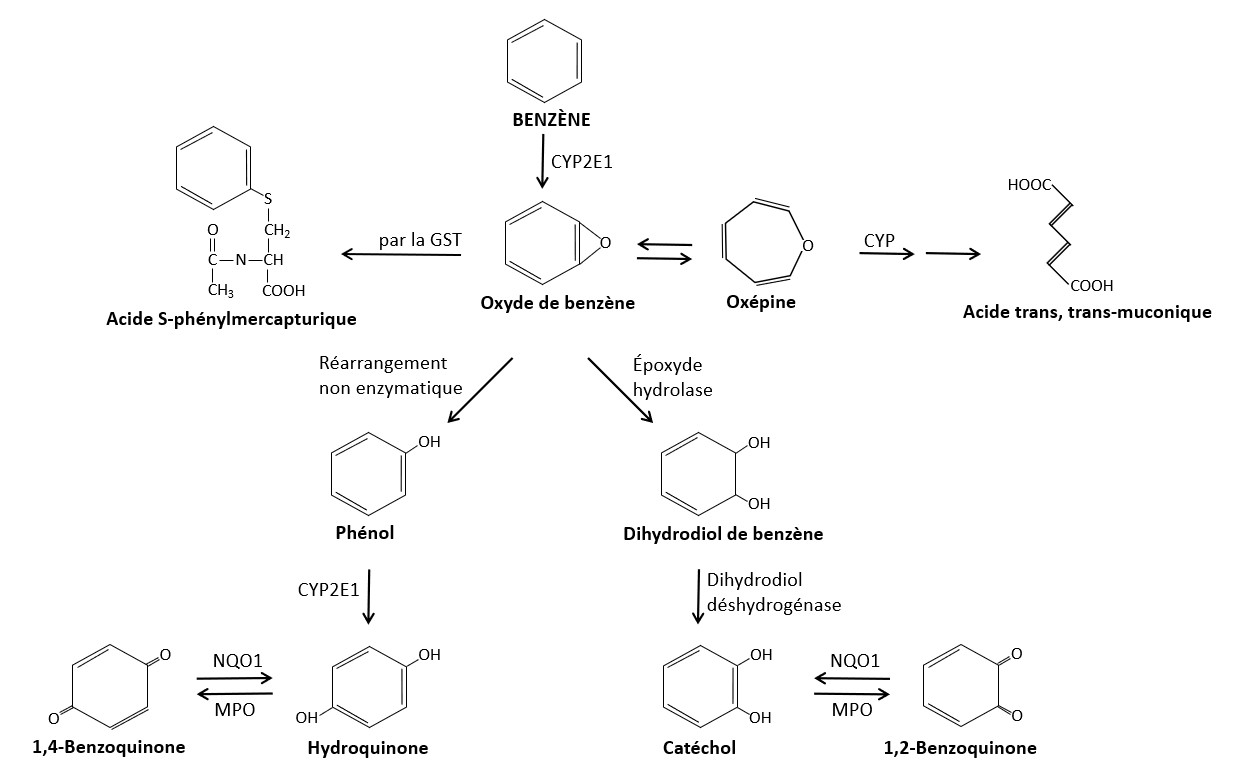
Figure 3 - Équivalent textuel
Schéma simplifié du métabolisme du benzène montrant les principales voies et enzymes du métabolisme. Les voies et métabolites principaux présentés comprennent : 1) le benzène en oxyde de benzène, puis en acide S-phénylmercapturique et en acide trans, trans-muconique; 2) l’oxyde de benzène en phénol, puis en hydroquinone et en 1,4-benzoquinone; et 3) l’oxyde de benzène en dihydrodiol de benzène, puis en catéchol et en 1,2-benzoquinone.
Schéma simplifié du métabolisme du benzène montrant les principales voies et enzymes du métabolisme (adapté de Rappaport et al., 2010). CYP2E1, cytochrome P450 2E1; CYP, enzymes du cytochrome P450; GST, glutathion S-transférase; NQO1, NAD(P)H:quinone oxydoréductase; MPO, myéloperoxydase.
La toxicité du benzène est largement considérée comme due à l'action de ses métabolites (voir la section 5.5.2). La Figure 3 illustre les principales voies du métabolisme du benzène. Le benzène est métabolisé essentiellement dans le foie, et dans une moindre mesure dans la moelle osseuse. Le CYP450 2E1 (mais aussi 1A1, 2B1, 2F1 et 2F2, à divers degrés) catalyse l'oxydation du benzène en oxyde de benzène, qui existe en équilibre avec l'oxépine (OEHHA, 2014; ATSDR, 2007). L'oxyde de benzène est ensuite métabolisé par plusieurs voies. La voie prédominante est un réarrangement non enzymatique d'oxyde de benzène conduisant à la formation de phénol, qui est ensuite oxydé par le CYP450 2E1 en hydroquinone (ATSDR, 2007). L'hydroquinone peut être ensuite oxydée en 1,4-benzoquinone par la myéloperoxydase dans la moelle osseuse (ATSDR, 2007). Dans une autre voie, l'oxyde de benzène est enzymatiquement transformé en dihydrodiol de benzène, qui est déshydrogéné en catéchol (ATSDR, 2007). Dans une troisième voie, l'oxyde de benzène réagit avec le glutathion pour former de l'acide S-phénylmercapturique (SPMA) (ATSDR, 2007). La conversion par ouverture de cycle de l'oxyde de benzène en trans, trans-muconaldéhyde, qui est ensuite oxydé en acide trans, trans-muconique (t,t-MA) est la dernière voie métabolique (OEHHA, 2014, ATSDR, 2007). Les métabolites du benzène comportant des groupes hydroxyles (c'est-à-dire, phénol, catéchol, hydroquinone et 1,2,4-benzènetriol) peuvent former des sulfates et des glucuronides et des conjugués quinol-thioéthers après réaction avec le glutathion au cours du métabolisme de phase II (OEHHA, 2014). Les polymorphismes nucléotidiques qui influencent les enzymes du métabolisme GSTT1 (glutathion S-transférase thêta-1), NQO1, CYP2E1 et époxyde hydrolase 1 (EPHX1) entraînent des changements dans les niveaux relatifs des métabolites SPMA, phénol, catéchol et hydroquinone formés au niveau du foie (OEHHA, 2014).
Le benzène est éliminé dans l'air exhalé sous forme inchangée et dans l'urine sous forme de métabolites; de petites quantités sont également excrétées sous forme du composé d'origine. La vitesse d'élimination et la quantité excrétée par les poumons dépendent de la dose et de la voie d'exposition. Dans une étude menée auprès de personnes exposées volontairement à des concentrations variant de 166 à 198 mg/m3 (52 à 62 ppm), environ un tiers du benzène absorbé a été éliminé dans l'air exhalé sous forme inchangée (OEHHA, 2014). La plupart des métabolites catéchol et phénol sont excrétés dans l'urine en moins de 24 heures et l'hydroquinone en 48 heures (OEHHA, 2014). Dans les études animales, les quantités relatives de métabolites du benzène excrétées dans l'urine varient en fonction de l'espèce et du niveau d'exposition (OEHHA, 2014). Certaines données probantes semblent indiquer que les quantités relatives de métabolites produites chez l'homme varient également en fonction du niveau d'exposition, bien que de nombreuses incertitudes résident à cet égard (voir la section 4.2).
4.2 Modélisation pharmacocinétique à base physiologique
Plusieurs modèles pharmacocinétiques à base physiologique (PBPK) ont été élaborés pour simuler l'élimination du benzène chez l'homme, la souris et le rat. Tous ces modèles comprennent des simulations du sang, de la graisse, du foie, des poumons et d'autres compartiments regroupés représentant d'autres tissus perfusés lentement (par exemple, muscle squelettique) et rapidement (par exemple, reins et autres viscères). La simulation de la moelle osseuse, la cible principale de la toxicité du benzène, est également incluse dans plusieurs modèles. L'échange de benzène est censé se produire par capillarité entre le sang et les tissus, avec élimination dans l'air exhalé et, dans un modèle, dans le lait maternel (ATSDR, 2007). Le métabolisme, la conjugaison et l'élimination sont présentésdans la plupart des modèlescomme des processus à capacité limitée ou de premier ordre. La vitesse d'élimination des métabolites dans l'urine est censée être égale à leur vitesse de formation, sinon l'élimination est modélisée par une constante de vitesse de premier ordre. La plupart des modèles attribuent au foie les réactions métaboliques, et les modèles plus récents considèrent la moelle osseuse comme site de métabolisme (ATSDR, 2007). Les modèles décrits dans le présent document abordent les expositions à des concentrations de benzène présentes en milieu de travail ou en laboratoire; aucun modèle qui traite des expositions aux concentrations plus faibles présentes dans l'environnement n'a été relevé (c'est-à-dire. < 0,1 mg/m3).
Les différences métaboliques potentielles existant au sein de la population ont été évaluées par des modèles PBPK. Selon de nombreux modèles, pour un même scénario d'exposition, les femmes métabolisent jusqu'à 26 % plus de benzène que les hommes et les concentrations sanguines de benzène sont plus élevées chez les hommes après une exposition de deux heures à 80 mg/m3 (25 ppm) (Brown et al., 1998, cité dans ATSDR, 2007 et OEHHA, 2014). Les simulations sur modèle ont montré que l'altération de l'élimination du benzène chez les souris âgées est attribuable aux changements physiologiques liés à l'âge, y compris la diminution de l'élimination des conjugués de l'hydroquinone à 18 mois (McMahon et al., 1994, cité dans OEHHA, 2014). Un modèle PBPK appliqué à une gamme d'expositions et de concentrations de benzène a indiqué que les nouveau-nés et les femmes enceintes métabolisent moins efficacement le benzène que l'adulte moyen, en particulier lorsque les niveaux d'exposition sont plus élevés (Valcke et Krishnan, 2011).
Certains modèles PBPK évaluent également les différences métaboliques en fonction des niveaux d'exposition chez l'animal et l'homme. Medinsky et al. (1989) ont créé un modèle humain à partir d'études toxicologiques pour évaluer le métabolisme à des concentrations proches de 32 mg/m3 (10 ppm). C'est ainsi que des expositions de 8 heures à des concentrations inférieures à 10 ppm entraîneraient des concentrations plus élevées d'hydroquinone et celles plus faibles de t,t-MA. Les métabolites de détoxification comme les conjugués de phényle devraient être plus nombreux lorsqu'elles sont supérieures à 10 ppm. Selon les auteurs, les expositions plus faibles peuvent favoriser la formation de métabolites toxiques (Medinsky et al, 1989; OEHHA 2014).
Divers modèles PBPK ont été créés pour simuler la forme de la courbe dose-réponse liée aux concentrations de métabolites dans l'urine résultant de concentrations plus élevées (généralement supérieures à 100 ppm, 320 mg/m3) et plus faibles (proches de 1 ppm, 3,2 mg/m3) de benzène présent dans l'air du milieu de travail. Les observations liées à la formation différentielle de métabolites à des niveaux d'expositions plus faibles dans une cohorte de travailleurs des deux sexes à Tianjin, en Chine, ont conduit à la création de modèles permettant de vérifier si le benzène est métabolisé par différentes voies à différentes concentrations. Kim et al. (2006a, 2006b) ont indiqué que les concentrations urinaires de benzène et de cinq métabolites (phénol, t,t-MA, SPMA, hydroquinone et catéchol) étaient systématiquement élevées dans cette cohorte lorsque les concentrations médianes atmosphériques de benzène se situaient entre 0,64 et 6,4 mg/m3 (0,2 et 2 ppm) selon le métabolite. La formation de métabolites aurait diminué de 2,5 à 26 fois lorsque les concentrations médianes atmosphériques de benzène ont augmenté de 0,086 à 49,3 mg/m3(0,027 à 15,4 ppm), avec une formation accrue d'hydroquinone et de t,t-MA, en particulier à de faibles expositions. Des modèles de type Michaelis-Menten ont été adaptés à chacun des métabolites urinaires du benzène et à la concentration atmosphérique correspondante de benzène (fourchette de 0 à 975 mg/m3 [0 à 299 ppm]). Selon ces données, une voie de faible affinité, qui devrait reposer sur le CYP2E1, devrait survenir à une concentration de 981 mg/m3 (301 ppm) et une voie de haute affinité à moins de 3,2 mg/m3 (1 ppm) (Rappaport et al., 2009, 2010). Ces modèles ont été critiqués en raison de l'absence de mesures ou d'intégration des concentrations de fond et des coexpositions, de leur traitement des données du groupe témoin et de leur modélisation des faibles doses d'exposition (Price et al., 2012; McNally et al., 2017; Cox et al., 2017; Boogaard, 2017). Bien qu'ils ont répondu à plusieurs de ces préoccupations, Rappaport et al. (2013) ne se sont pas penchés sur les commentaires plus récents.
Knutsen et al. (2013) ont élaboré une alternative au modèle de faible ou de haute affinité, qu'ils ont validé à l'aide des mêmes données issues de la cohorte de Tianjin. Il s'agissait d'un modèle PBPK de souris dans lequel les compartiments moelle osseuse et vessie, les taux de protéines de microsomes hépatiques humains, le CYP2E1 et les facteurs de conversion propres au métabolite ont été intégrés. Le modèle a établi des courbes en J suffisamment bien adaptées pour les cinq métabolites, dont trois (phénol, hydroquinone et catéchol) traversent l'axe des y. Un modèle plus récent, fondé sur une analyse bayésienne (Cox et al., 2021) et créé à partir de plusieurs ensembles de données, a mis en évidence une corrélation quasi linéaire entre les concentrations atmosphériques de benzène inférieures à 15 ppm (48 mg/m3) et la formation de métabolites. Les auteurs font également état d'une courbe en J pour les données relatives aux travailleurs de Tianjin, qui est saturée au-delà de 10 ppm. Ces modèles corrigent plusieurs lacunes du modèle à deux voies, mais sont également sujets à des incertitudes. Comme pour tous les modèles abordés ici, l'élaboration et la validation sont fondées sur l'exposition professionnelle au benzène, avec peu ou pas de données sur le métabolisme pour les concentrations atmosphériques inférieures à 0,5 – 1 ppm (1,6 – 3,2 mg/m3), qui sont considérées comme une très faible exposition professionnelle. Les modèles ne peuvent être validés en deçà de cette fourchette en l'absence de données relatives aux faibles expositions. Étant donné le manque de certitude dans cette fourchette, il n'est pas possible de déterminer quel modèle (entre celui à deux voies proposé par Kim et Rappaport ou ceux à voie unique proposés par Knutsen et Cox) fournit une représentation plus précise de la pharmacocinétique à de faibles concentrations (c'est-à-dire, < 1,6 mg/m3, 0,5 ppm).
L'absence de données et de modèles qui traitent de l'exposition à des concentrations de benzène similaires à celles retrouvées dans l'environnement (c'est-à-dire, < 10 μg/m3ou des concentrations typiques de l'air intérieur résidentiel au Canada) constitue une lacune importante en matière de données. Une seule étude qui commence à se préoccuper de cette question a été relevée. Une charge corporelle de t,t-MA découlant du benzène inhalé à des concentrations similaires à celles retrouvées dans l'environnement a été rapportée en Inde chez des pompistes, des conducteurs automobiles et un groupe témoin exposé dans son milieu (Majudar et al., 2016). Les niveaux d'exposition par inhalation de ces groupes ont été estimés respectivement à 137,5, 97,9 et 38,7 μg/m3, avec des taux urinaires de t,t-MA de 145,4 ± 55,3, 112,6 ± 63,5 et 60,0 ± 34,9 μg/g de créatinine. (Comme les populations étudiées consomment rarement, voire jamais, de l'acide sorbique, les concentrations de fond de t,t-MA devraient être faibles.) Les auteurs ont indiqué que la dose interne ou la charge corporelle de t,t-MA n'est pas proportionnelle au niveau d'exposition externe au benzène. L'estimation de la charge corporelle à la concentration la plus faible est légèrement plus élevée que celle à laquelle on aurait pu s'attendre d'une voie métabolique strictement linéaire. Il en résulte un risque légèrement plus élevé de cancer à des niveaux d'exposition plus faibles et un risque légèrement plus faible à des niveaux d'exposition plus élevés que ce qu'un modèle de risque linéaire aurait estimé.
4.3 Biosurveillance
Les concentrations de benzène ont été mesurées dans le sang de 2012 à 2017 au cours des cycles 3 à 5 de l'ECMS, une enquête représentative de biosurveillance nationale. Les concentrations de benzène et de ses métabolites (t,t-MA et SPMA) ont été mesurées dans l'urine au cours des cycles 2 à 4 (2009 à 2015), avant de prendre fin au cours du cycle 5 (2016 à 2017) (Santé Canada 2015, 2017, 2019a). Les concentrations de benzène dans le sang sont considérées comme un biomarqueur plus sensible et spécifique d'une exposition récente au benzène. Les métabolites urinaires peuvent être non spécifiques ou ne représenter qu'une partie de l'exposition au benzène (Hays et al., 2012; Arnold et al., 2013).
4.3.1. Benzène sanguin
Les concentrations de benzène ont été mesurées dans le sang des participants à l'ECMS âgés de 12 à 79 ans au cours des cycles 3 à 5 (Santé Canada 2015, 2017, 2019a). La moyenne géométrique (MG) des concentrations de benzène dans le sang était comprise entre 0,034 et 0,037 μg/L et le 95e percentile entre 0,20 et 0,24 μg/L. Des données de biosurveillance provenant de la National Health and Nutrition Examination Survey (NHANES) des États-Unis sont également disponibles pour le benzène sanguin. Les valeurs médianes étaient inférieures à la limite de détection (0,024 μg/L) pour les données de la NHANES recueillies entre 2011 et 2016, le 75e percentile variait de 0,027 à 0,045 μg/L et le 95e percentile de 0,25 à 0,29 μg/L (US CDC, 2017).
Au cours des cycles 3 et 4 de l'ECMS, les concentrations de benzène étaient significativement plus élevées dans le sang des fumeurs (médiane de 0,13 μg/L vs 0,025 μg/L chez les non-fumeurs), et le tabagisme était le meilleur prédicteur de benzène sanguin. Selon des études de biosurveillance menées aux États-Unis, les concentrations de benzène dans le sang étaient plus élevées chez les fumeurs que chez les non-fumeurs dans la population générale (US CDC, 2017). Parmi les non-fumeurs, les signalements par les participants d'odeur de pot d'échappement à la maison, la présence d'un garage attenant et l'utilisation récente de boules antimite ou d'un décapant à peinture étaient tous associés de façon significative aux concentrations de benzène dans le sang (Lyonnais-Gagnon et al., 2022). La vie en milieu urbain et l'exposition à l'essence ou aux produits pétroliers (par exemple, en faisant le plein d'essence d'un véhicule) étaient également associées à des concentrations plus élevées de benzène dans le sang aux États-Unis et en Italie (US CDC, 2017). D'autres analyses univariées des données de l'ECMS semblent indiquer que la concentration de benzène dans le sang est plus élevée chez les Canadiens d'origine sud-asiatique que dans la population générale (Lyonnais-Gagnon et al., 2022; Karthikeyan et al., 2022). Selon les estimations précédentes, jusqu'à 99 % de l'exposition au benzène au Canada provient de l'air (Santé Canada, 2009). Toutefois, les concentrations sanguines mesurées par l'ECMS étaient de 3,8 à 5,4 fois plus élevées que celles estimées par la modélisation PBPK (à l'aide du modèle créé par Brown [1998]) établie à partir de mesures relevées dans l'air intérieur, ce qui laisse supposer la présence d'autres sources d'exposition au benzène que l'air ou d'autres voies d'exposition (Lyonnais-Gagnon et al., 2022).
Hays et al. (2012) se sont servis d'un modèle PBPK créé par Brown et al. (1998) pour estimer un équivalent de biosurveillance pour la concentration sanguine de benzène correspondant à la CRf de 0,030 mg/m3 pour les effets autres que le cancer établie par l'US EPA. Ce modèle, qui simule l'absorption initiale par inhalation du benzène et son élimination chez l'homme, a été sélectionné du fait de sa simplicité, de sa cohérence avec les données cinétiques humaines et de sa prise en compte des différences de tissus adipeux selon le sexe. Les auteurs ont estimé que l'équivalent de biosurveillance dans le sang était de 0,15 μg/L, ce qui correspond à la concentration sanguine du benzène à l'état d'équilibre de 0,030 mg/m3. La MG des concentrations de benzène dans le sang comprise entre 0,034 et 0,037 μg/L dans la population générale du Canada entre 2012 et 2017 est inférieure à l'équivalent de biosurveillance pour les effets autres que le cancer. La MG des concentrations de benzène dans le sang de 0,14 μg/L relevée chez les fumeurs des cycles 3 et 4 s'approche toutefois de l'équivalent de biosurveillance pour les effets autres que le cancer, ce qui laisse supposer que ce groupe est à risque d'effets sur la santé liés au benzène (Faure et al., 2020; Santé Canada, 2015, 2017, 2019a). Hays et al. (2012) ont également construit des équivalents de biosurveillance correspondant à des excès de risque unitaire pour le cancer établis par l'US EPA (voir l'annexe D). Les MG et les médianes des concentrations de benzène dans le sang de la population générale du Canada entre 2012 et 2017 sont légèrement supérieures à la fourchette des équivalents de biosurveillance (0,0058 – 0,020 μg/L) qui correspond à un risque de cancer de 1 × 10-5 (avec une concentration atmosphérique correspondante comprise entre 1,3 et 4,5 μg/m3). Les MG et les médianes des concentrations de benzène dans le sang sont significativement plus élevées chez les fumeurs, ce qui indique un risque élevé de cancer (Faure et al., 2020; Santé Canada, 2015, 2017, 2019a).
4.3.2 Benzène et métabolites urinaires
Les métabolites du benzène , soit le t,t-MA et le SPMA, ont été mesurés dans l'urine des Canadiens âgés de 3 à 79 ans au cours des cycles 2, 3 et 4 de l'ECMS (Santé Canada, 2015, 2017). Comme indiqué plus haut, les conclusions tirées à partir des concentrations des métabolites urinaires du benzène devraient être formulées avec prudence en raison de plusieurs limitations. Le t,t-MA urinaire représente environ 4 % de la dose absorbée de benzène et révèle une exposition récente avec une demi-vie de 5 heures. L'acide sorbique, présent dans de nombreux aliments, est toutefois également métabolisé en t,t-MA. Le SPMA urinaire est un biomarqueur spécifique du benzène et sa demi-vie est d'environ 9 heures. Il représente moins de 1 % de l'exposition au benzène et sa formation varie en fonction des polymorphismes génétiques des enzymes du métabolisme (CIRC, 2018; Hays et al., 2012; Arnold et al., 2013). Selon l'ECMS, la MG du t,t -MA variait entre 58 et 63 μg/g de créatinine et celle du SPMA entre 0,15 et 0,20 μg/g de créatinine. Le 95e percentile du t,t -MA était compris entre 390 et 460 μg/g de créatinine et celui du SPMA entre 2,7 et 3,1 μg/g de créatinine. Une valeur de référence de 7,0 μg/g de créatinine a été fixée pour le SPMA en fonction de 426 volontaires adultes au Royaume-Uni, ce qui indique une limite supérieure de l'exposition de fond (Bevan, 2013).
Une étude sur l'exposition gestationnelle menée dans une région de la Colombie-Britannique où sont exercées d'importantes activités d'extraction de gaz naturel a révélé que la concentration médiane de SPMA chez les personnes enceintes était similaire à celle de la population générale du Canada, alors que celle de t,t-MA était environ 3,5 fois plus élevée (Caron-Beaudoin et al., 2018). Le SPMA urinaire était significativement plus élevé chez les personnes qui s'étaient identifiées comme femmes autochtones que dans la population générale. La MG des concentrations urinaires de t,t-MA et de SPMA était respectivement de 187 et de 1,0 μg/L dans les échantillons d'urine prélevés chez des adultes âgés de plus de 16 ans au cours de l'Enquête de santé auprès des Inuit du Nunavik - Quanuilirpitaa 2017. Ces deux valeurs étaient significativement plus élevées que les MG de 65,6 et 0,18 μg/L établies lors du cycle 4 de l'ECMS. Une corrélation a également été établie entre les métabolites du benzène et les niveaux de cotinine, ce qui laisse supposer que le tabagisme contribue de façon importante aux concentrations élevées de benzène (Caron-Beaudoin et al., 2022).
La concentration moyenne de t,t-MA mesurée entre 2009 et 2015 chez les enfants âgés de 6 à 11 ans dans le cadre de l'ECMS variait de 78 à 81 μg/g de créatinine, ce qui est similaire à la moyenne du même groupe d'âge issue des données de la NHANES recueillies entre 2011 et 2012 (Santé Canada, 2017; Jain, 2015). Des travaux de recherche menés en Italie ont démontré que l'exposition à la fumée secondaire et à la pollution atmosphérique urbaine joue un rôle important dans les concentrations urinaires du benzène et de ses métabolites chez l'enfant. Les enfants qui vivent dans des maisons où habitent des fumeurs excrètent des concentrations de benzène significativement plus élevées dans l'urine, même s'il n'est pas permis de fumer dans la maison ou en présence des enfants (Protano et al., 2012). Les concentrations de t,t-MA, de SPMA et de benzène seraient 1,5 fois plus élevées dans l'urine des enfants habitant en zones urbaines en Italie que dans celle de ceux vivant en zones rurales (Protano et al., 2010). Par contre, la proximité des espaces verts et de la végétation a été associée à une baisse du t,t-MA urinaire chez les adultes du Kentucky (Yeager et al., 2020).
5.0 Effets sur la santé
Cette section examine les principaux effets du benzène sur la santé chez l'homme et les études toxicologiques pertinentes menées chez l'animal de laboratoire, en plus de données justificatives provenant de systèmes d'essais in vitro. Les voies d'exposition autres que l'inhalation (c'est-à-dire, ingestion ou contact cutané) ainsi que les mélanges comprenant du benzène (comme la fumée de tabac) ont été exclus, car ils dépassent la portée du présent document. Les études épidémiologiques humaines relatives à l'exposition personnelle et dans l'air intérieur au benzène ont été passées en revue. Les études sur l'exposition professionnelle et dans l'air extérieur ont également été passées en revue pour appuyer davantage les effets observés dans les milieux intérieurs ou un effet important lorsqu'aucune étude pertinente portant sur l'exposition dans l'air intérieur ou personnelle n'a pu être relevée. Étant donné que les concentrations en milieu professionnel sont de 1000 à 10 000 fois plus élevées que celles survenant dans l'environnement, les niveaux d'exposition sont exprimés en mg/m3 (ppm) dans les études sur l'exposition professionnelle et en μg/m3 (ppb) dans les études environnementales. Les niveaux d'exposition sont exprimés en mg/m3 (ppm) dans les études toxicologiques.
Les examens suivants des effets du benzène sur la santé faisant autorité ont également permis de recueillir d'autres données pertinentes : a) Toxicological Profile for Benzène de l'ATSDR (2007); b) Toxicological Review of Benzène de l'US EPA(2002); c) Benzene Reference Exposure Levels Technical Support Documentde l'OEHHA (2014); et d) la monographie du benzène du CIRC (2018).
De plus amples détails portant sur les principales études d'exposition humaine et toxicologiques présentées ci-dessous se trouvent dans les annexes B et C.
5.1 Effets chez l'homme
Les preuves démontrant des effets à long terme de l'exposition professionnelle au benzène sont abondantes, mais peu d'entre elles concernent les effets de l'exposition aiguë. Les données épidémiologiques sont de plus en plus nombreuses à appuyer l'évaluation des effets sur la santé à des concentrations similaires à celles retrouvées dans les milieux intérieurs résidentiels.
L'exposition aiguë à de très fortes concentrations a été liée à des effets sur le système nerveux central (SNC) et à d'autres effets neurologiques, à une irritation des voies respiratoires et à l'hématotoxicité. Les doses létales peuvent provoquer l'asphyxie, un arrêt respiratoire, la dépression du SNC et une fibrillation ventriculaire. Ces études sont toutefois limitées par des lacunes en matière d'évaluation de l'exposition et de communication des résultats.
Des études épidémiologiques ont mis en évidence des liens entre la présence de benzène dans l'air intérieur résidentiel et une altération de la fonction pulmonaire, une prévalence accrue de l'asthme et des symptômes de l'asthme chez l'adulte et chez l'enfant. L'exposition personnelle et extérieure au benzène durant la grossesse a été associée à des naissances prématurées et à des effets sur le développement, comme une diminution de la circonférence de la tête et un faible poids à la naissance.
Des données probantes sur l'hématotoxicité – principalement une diminution de la numération globulaire et des effets sur les populations de cellules précurseurs de la moelle osseuse – ont été relevées dans de nombreuses études réalisées en milieu de travail. Des études de biosurveillance de la population générale et de populations exposées à des concentrations élevées de benzène (par exemple, en raison de la pollution de l'environnement) ont aussi signalé une altération de la numération globulaire. Certains effets observés dans la population générale diffèrent toutefois de ceux signalés à des niveaux d'exposition plus élevés (c'est-à-dire, en milieu de travail).
Des effets neurologiques liés à l'audition et à la cognition et des effets sur le métabolisme du glucose en sont d'autres effets non cancérogènes de l'exposition de longue durée chez l'homme.
De plus amples détails se trouvent à l'annexe B.
5.1.1 Exposition de courte durée
Chez l'homme, l'exposition de courte durée à des concentrations très élevées de benzène peut être mortelle et provoquer une toxicité respiratoire, neurologique et hématologique. Les preuves de toxicité à court terme ne proviennent toutefois que de quelques signalements d'effets après de très fortes expositions professionnelles ou des rejets dans l'environnement, dont la plupart souffrent d'une mauvaise évaluation de l'exposition. Les deux études d'exposition contrôlée portant sur le benzène relevées chez l'homme ne fournissent que des données limitées sur les effets sur la santé.
L'exposition aiguë par inhalation à des concentrations de benzène comprises entre 800 et 9600 mg/m3 (250 et 3000 ppm) a provoqué des étourdissements, des céphalées et des vertiges, de la somnolence, des tremblements, un délire et une perte de conscience. L'exposition à 64 000 mg/m3 (20 000 ppm) pendant 5 à 10 minutes peut causer la mort (US EPA, 2002). La létalité est attribuée à l'asphyxie, à un arrêt respiratoire, à la dépression du SNC ou à une fibrillation ventriculaire. Les résultats des autopsies ont révélé une cyanose, une hémolyse, une trachéite granuleuse aiguë, une laryngite, une bronchite, et une hémorragie massive et un œdème des poumons et d'autres organes (ATSDR, 2007).
Des effets respiratoires ont également été signalés après une exposition professionnelle aiguë ou de courte durée. Une irritation de la muqueuse et un essoufflement ont été signalés chez 15 travailleurs de chantiers navals de sexe masculin exposés à des concentrations de benzène supérieures à 192 mg/m3 (60 ppm) pendant près de 3 semaines (ATSDR, 2007).
Deux études d'exposition humaine contrôlée faisant état d'effets sur la santé ont été relevées. Aucun effet nocif n'a été signalé chez trois hommes et trois femmes exposés à des concentrations de benzène comprises entre 52 et 62 ppm pendant 4 heures (Nomiyama et Nomiyama, 1974, cité dans OEHHA, 2014). Dans une autre étude, des personnes volontairement exposées pendant 2 heures à une concentration de benzène ne dépassant pas 350 mg/m3 (110 ppm) n'ont signalé aucun symptôme subjectif (Srbova, 1950, cité dans OEHHA, 2014). Ces deux études ont été principalement conçues pour évaluer la pharmacocinétique du benzène et n'ont donc pas systématiquement examiné les symptômes cliniques.
Cent cinquante-sept enfants exposés à une concentration inconnue de benzène pendant 40 jours au cours d'un incident de torchage dans une raffinerie de pétrole au Texas qui a rejeté plus de 7000 kg de benzène et d'autres contaminants dans l'air ont éprouvé des problèmes neurologiques (notamment une démarche instable, une perte de mémoire et des céphalées) et des symptômes des voies respiratoires supérieures. Après une comparaison des moyennes à l'aide de tests t, une diminution du nombre de globules blancs et une augmentation du nombre de plaquettes et d'enzymes hépatiques (phosphatase alcaline, aspartate aminotransférase et alanine aminotransférase) ont également été observées chez les enfants exposés (D'Andrea et Reddy, 2014).
5.1.2 Exposition de longue durée (effets non cancérogènes)
Toxicité respiratoire
L'exposition de longue durée à des concentrations très élevées de benzène en milieu de travail peut causer une irritation respiratoire. Des études épidémiologiques menées dans l'air intérieur résidentiel auprès d'adultes et d'enfants ont fait état de nombreux effets respiratoires, notamment une diminution de la fonction pulmonaire chez les adultes et les enfants et une prévalence accrue de l'asthme et des symptômes de l'asthme chez les enfants. Plusieurs études disponibles ont obtenu des résultats mitigés. L'exposition au benzène dans l'air extérieur a été associée à une diminution de la fonction pulmonaire et à une aggravation des symptômes de l'asthme chez l'enfant. Dans d'autres études toutefois, l'exposition personnelle au benzène n'a pas été associée à la fonction pulmonaire et à la santé cardiovasculaire chez les enfants asthmatiques, et le benzène dans l'air intérieur n'a pas été associé à une infection des voies respiratoires inférieures et à des symptômes connexes chez les nourrissons et les enfants.
Peu d'effets respiratoires ont été signalés chez l'homme après une exposition professionnelle de longue durée au benzène, sans toutefois fournir plus de précisions. Des travailleurs masculins et féminins exposés respectivement à 106 et 189 mg/m3 (33 et 59 ppm) de benzène pendant plus d'un an se sont plaints d'irritations nasales et de maux de gorge (ATSDR, 2007).
Les études épidémiologiques publiées depuis 2009 font état d'effets nocifs sur le système respiratoire associés à l'exposition à des concentrations de benzène similaires à celles retrouvées dans l'environnement et comprises entre 1 et 10 μg/m3 (0,3 et 3,1 ppb). Cakmak et al. (2014) ont étudié les liens entre l'exposition au benzène et à d'autres COV dans l'air intérieur résidentiel et la fonction pulmonaire chez les non-fumeurs à l'aide de données transversales recueillies au cours du cycle 2 de l'ECMS. La MG sur 7 jours était de 1,06 μg/m3 (0,33 ppb) dans la pièce principale chez les non-fumeurs. Une diminution significative de la fonction pulmonaire (volume expiratoire maximal par seconde/capacité vitale forcée ou VEMS/CVF) a été associée à une augmentation de l'écart interquartile (EIQ) de 1,31 μg/m3 (0,0013 mg/m3) de benzène après transformation logarithmique et la prise en compte de covariables sociodémographiques. La fonction pulmonaire a significativement diminué de 1,75 % chez les hommes (intervalle de confiance [IC] à 95 % [-2,71; -0,79]), mais aucun effet similaire n'a été signalé chez les femmes. Une augmentation de l'EIQ des concentrations de benzène dans l'air intérieur a également été associée à une diminution statistiquement significative de 2,3 % du VEMS/CVF chez les enfants de moins de 17 ans (IC à 95 % [-3,7; -0,9]) et de 1,45 % chez les personnes de 39 à 64 ans (IC à 95 % [-2,44; -0,45]). Les modèles ont été corrigés en fonction de covariables sociodémographiques (âge, genre, revenu et éducation), mais pas pour les autres COV. Le benzène et neuf autres COV (décanal, furan-2-carbaldéhyde, hexanal, nonanal, octanal, styrène, a-pinène, 2-méthyl-1,2-butadiène et naphtalène) ont été négativement associés à la fonction pulmonaire.
Dans une enquête prospective par panel, Martins et al. (2012) ont évalué la relation entre la fonction pulmonaire et l'exposition dans l'air intérieur et extérieur au benzène et à d'autres polluants atmosphériques mesurés dans les maisons et les écoles d'un groupe d'enfants vivant au Portugal. Lors du calcul de l'exposition totale dans les maisons (chambres à coucher) et les écoles (cour et salle de classe), la concentration moyenne de benzène variait de 2,9 à 10,7 μg/m3 (0,9 à 3,3 ppb) en hiver et de 1,0 à 1,6 μg/m3 (0,3 à 0,5 ppb) en été. Une augmentation de 10 μg/m3 (3,3 ppb) de benzène par semaine a été associée de façon significative à une diminution de 4,33 % du VEMS (IC à 95 % [-7,13; -1,13]), à une diminution de 1,17 % du VEMS/CVF (IC à 95 % [-3,24; -0,18]), à une diminution de 5,89 % du débit expiratoire maximal 25-75 (DEM25-75) (IC à 95 % [-10,16; -1,62]), à une variation de 2,79 % du VEMS (IC à 95 % [0,92; 4,65]) et à une diminution du pH du condensat de l'air exhalé (marqueur d'inflammation des voies respiratoires). Les modèles ont été corrigés pour prendre en compte le tabagisme des parents et d'autres caractéristiques sociodémographiques et physiques, mais pas les co-polluants. Une augmentation des expositions totales aux PM10, au NO2, au toluène et à l'éthylbenzène a également été associée à une diminution de la fonction pulmonaire chez ces enfants.
L'exposition au benzène dans l'air intérieur a également été associée à la prévalence de l'asthme chez l'enfant. Dans une étude cas-témoin menée en France, la médiane des concentrations de benzène dans l'air intérieur était de 3,85 μg/m3 (1,2 ppb) dans le salon des enfants asthmatiques et de 1,9 μg/m3 (0,6 ppb) dans les maisons des enfants non asthmatiques (Rive et al., 2013). Des rapports de cotes (RC) de 8,11 pour l'asthme (IC à 95 % [1,41; 46,43]) et de 10,10 pour avoir été réveillé par une respiration sifflante (IC à 95 % [2,06; 49,78]) ont été signalés chez les enfants exposés à une concentration supérieure à la médiane de l'échantillon de 2,4 μg/m3 (0,8 ppb). Les modèles ont été corrigés pour prendre en compte l'exposition au tabagisme passif, l'atopie, les allergies familiales, l'âge et le sexe, mais pas les co-polluants. Une méta-analyse de 15 études épidémiologiques sur l'exposition au benzène dans l'air intérieur et extérieur a fait état d'un risque relatif (RR) combiné de l'asthme de 1,08 (IC à 95 % [1,02; 1,14]) pour une augmentation de 1 μg/m3 de benzène (Liu et al., 2022). Une association significative a également été établie pour les sous-groupes d'études transversales (RR combiné = 1,07; IC à 95 % [1,00; 1,14]), les enfants (RR combiné = 1,09; IC à 95 % [1,02; 1,16]) et les pays occidentaux (RR combiné = 1,08; IC à 95 % [1,03; 1,14]). Cette même étude n'a relevé aucune association statistiquement significative entre le benzène et la rhinite ou la bronchite (RR combiné de rhinite = 1,04; IC à 95 % [0,99; 1,10]; RR combiné de bronchite = 1,58, IC à 95 % [0,80; 3,09]).
L'exposition personnelle au benzène et à d'autres polluants atmosphériques a été mesurée pendant 10 jours consécutifs dans une étude par panel pour évaluer les associations entre l'exposition au benzène et à d'autres polluants atmosphériques et les changements de la fonction pulmonaire et de certains indicateurs de la santé cardiovasculaire (y compris la pression artérielle, le pouls et la saturation en oxygène) chez les enfants asthmatiques vivant dans une zone industrielle urbaine de Montréal, au Québec (Smargiassi et al., 2014). La médiane des concentrations de benzène observée chez ces enfants asthmatiques était de 2,10 μg/m3 (0,7 ppb). L'exposition au benzène n'a pas été associée à une détérioration de la fonction pulmonaire ou à des effets cardiovasculaires chez ce groupe d'enfants après la prise en compte du tabagisme des parents et d'autres facteurs de confusion. Aucun co-polluant n'a été pris en compte dans cette étude. Deux études de cohorte sur l'infection des voies respiratoires inférieures chez les nourrissons et les symptômes comme la toux et la respiration sifflante n'ont relevé aucun lien avec l'exposition à des concentrations de benzène dans l'air intérieur comprises entre 1,23 et 4,3 μg/m3 (0,4 et 1,3 ppb) après la prise en compte du tabagisme des parents, mais non de co-polluants (Ferrero et al., 2017; Vanker et al., 2017).
Des études épidémiologiques sur le benzène ambiant, avec des expositions moyennes comprises entre 0,83 et 3,0 μg/m3(0,3 et 0,9 ppb), ont également fait état de corrélations positives entre l'exposition au benzène ambiant et la diminution de la fonction pulmonaire ou l'exacerbation des symptômes de l'asthme chez les enfants vivant en Argentine, en Espagne et en France (Wichmann et al., 2009; Morales et al., 2015; Charpin et al., 2009; Zhou et al., 2013). Toutes ces études ont pris en compte le tabagisme des parents, mais pas les co-polluants ambiants. Des corrélations positives similaires ont également été observées pour l'exposition dans l'air ambiant à d'autres polluants comme les PM10, le NO2, le CO et les COV totaux.
Toxicité pour la reproduction et le développement
Seules quelques études ont fait état d'effets sur la reproduction chez les travailleurs de sexe féminin exposés professionnellement au benzène. Aucune étude épidémiologique n'a été relevée sur les effets sur la reproduction en milieu intérieur résidentiel. L'exposition personnelle et ambiante au benzène durant la grossesse a toutefois été associée à des naissances prématurées et à des effets sur le développement, comme une diminution de la circonférence de la tête et un faible poids à la naissance. Dans la plupart des études, les modèles de régression ont été corrigés pour prendre en compte l'âge, les caractéristiques physiques et les facteurs socioéconomiques ou sociodémographiques de la mère, mais pas les co-polluants.
Les études publiées avant le précédent document de conseils de Santé Canada (2013a) ont abordé la toxicité potentielle pour la reproduction découlant de l'exposition professionnelle à des concentrations relativement élevées de benzène. Certaines études ont fait état de liens entre l'exposition professionnelle au benzène et les avortements spontanés, les perturbations menstruelles et l'atrophie ovarienne chez les travailleurs de sexe féminin, tandis que les résultats d'autres études concernant la toxicité pour la reproduction et l'exposition au benzène n'étaient pas concluants (ATSDR, 2007; US EPA, 2002; Olsson et al., 2018). Une étude qui a examiné la capacité de reproduction des travailleurs de sexe masculin exposés au benzène n'a révélé aucune différence statistique dans la fréquence des avortements spontanés entre les partenaires de pères exposés au benzène avant la conception et les partenaires de pères non exposés (ATSDR, 2007).
Rares sont les études antérieures qui se sont intéressées au lien entre l'exposition au benzène et les effets sur le développement chez l'homme (ATSDR, 2007; US EPA, 2002). Dans une étude de cas, un travailleur exposé au benzène tout au long de sa grossesse a présenté une diminution de la numération globulaire et une augmentation de la fréquence des aberrations chromosomiques, alors qu'aucun effet sur les chromosomes n'a été relevé chez sa descendance (US EPA, 2002; ATSDR, 2007).
Plusieurs études hors milieu professionnel publiées depuis 2009 ont évalué le lien entre l'exposition maternelle au benzène et les effets sur le développement des nourrissons. Une étude de cohorte menée en France a évalué la relation entre l'exposition personnelle au benzène et la croissance fœtale (Slama et al., 2009). Le benzène a été mesuré pendant 7 jours au cours de la 27e semaine de grossesse par un échantillonneur d'air transporté par les participantes. La cohorte comprenait des femmes enceintes non fumeuses pour qui la médiane d'exposition au benzène était de 1,8 μg/m3 (0,0018 mg/m3). Les auteurs ont observé une diminution non significative liée à la dose du poids et de la circonférence de la tête à la naissance entre les mères exposées à plus de 1,4 μg/m3 (0,4 ppb) de benzène et celles à moins de 1,4 μg/m3 (0,4 ppb). Une fois le benzène analysé sous forme de variable continue transformée en logarithme, une diminution statistiquement significative de 68 g du poids moyen à la naissance (IC à 95 % [-135; -1]) et une diminution à la limite de la signification de 1,9 mm de la circonférence de la tête (IC à 95 % [-3,8; 0,0]) ont été constatées. Les modèles de régression ont été corrigés pour prendre en compte les facteurs de confusion, y compris ceux liés aux mesures physiques du fœtus et de la mère à la 27e semaine, à l'exposition professionnelle maternelle aux peintures et aux pesticides et au tabagisme passif maternel, mais pas les co-polluants.
Des liens ont également été signalés entre la concentration de benzène dans l'air ambiant et divers effets sur le développement, notamment le faible poids à la naissance à terme, la naissance prématurée, la taille à la naissance et la circonférence de la tête. Une étude cas-témoin menée aux États-Unis a évalué l'exposition maternelle au benzène dans l'air extérieur provenant des gaz d'échappement et le risque de faible poids à la naissance (Ghosh et al., 2012). L'exposition au benzène (moyenne = 3,5 μg/m3, 1,1 ppb) au cours du troisième trimestre a été associée à un RC à la limite de la signification de 1,03 (IC à 95 % [1,00; 1,05]) par augmentation de l'EIQ (2,6 μg/m3; 0,8 ppm) pour le faible poids à la naissance à terme chez les nourrissons. Des associations similaires ont été signalées pour le toluène, l'éthylbenzène et les xylènes. Les modèles ont été corrigés pour prendre en compte l'âge gestationnel et celui de la mère et des facteurs socioéconomiques, mais pas le tabagisme et les co-polluants. Aucune relation significative n'a été constatée entre les concentrations de benzène dans l'air extérieur (moyenne = 1,6 μg/m3, 0,5 ppm) et le poids, la taille ou la circonférence de la tête à la naissance dans une autre étude qui a évalué l'exposition au benzène dans l'air extérieur d'une cohorte multicentrique en Espagne. Les modèles ont été corrigés pour prendre en compte le tabagisme et d'autres caractéristiques maternelles, mais pas les co-polluants (Estarlich et al., 2011). Une méta-analyse de trois études épidémiologiques sur l'exposition au benzène dans l'air intérieur et extérieur a fait état d'un RR combiné de faible poids à la naissance de 1,12 (IC à 95 % [1,05; 1,19]) pour une augmentation de 1 μg/m3 de benzène (Liu et al., 2022).
Une étude cas-témoin menée aux États-Unis auprès de femmes enceintes (exposition moyenne = 2,1 μg/m3, 0,7 ppb) a fait état d'un risque accru de naissance prématurée (RC = 1,09; IC à 95 % [1,06; 1,13]) par augmentation de l'EIQ (0,64 μg/m3; 0,20 ppb) de l'exposition dans l'air extérieur au benzène provenant du trafic routier pendant toute la grossesse. Les résultats proviennent d'un modèle à un seul polluant corrigé pour prendre en compte l'âge, l'origine ethnique, l'éducation et la parité de la mère. D'autres expositions découlant du trafic routier, y compris les HAP, le carbone élémentaire et le diesel, ont été hautement corrélées à l'exposition au benzène et également associées à un risque accru de naissance prématurée (Wilhelm et al., 2011). Une étude de cohorte menée en Espagne a fait état d'un risque accru de naissance prématurée associé à l'exposition au benzène ambiant (médiane = 1,3 μg/m3, 0,4 ppb) pendant la grossesse (Estarlich et al., 2016). Après avoir pris en compte l'exposition au NO 2 et d'autres facteurs de confusion (y compris le tabagisme, les caractéristiques sociodémographiques, l'exposition dans l'environnement, les profils d'activité temporelle et les variables du mode de vie), les auteurs ont fait état d'un RC de 1,45 (IC à 95 % [1,00; 2,09]) pour chaque augmentation de 1 μg/m3 (0,3 ppb) de l'exposition au benzène au cours du troisième trimestre chez les femmes enceintes ayant passé plus de 15 heures par jour à la maison au cours de leur troisième trimestre. La méta-analyse de deux autres études n'a toutefois pas établi d'association statistiquement significative entre le benzène et la naissance prématurée (RR combiné = 1,57; IC à 95 % [0,50; 4,94]) (Liu et al., 2022).
Williams et al. (2019) ont évalué l'exposition au benzène et à d'autres COV dans l'air ambiant et le diabète gestationnel chez des femmes enceintes de quatre origines ethniques différentes dans une étude transversale américaine. Les auteurs ont constaté qu'une exposition avant la conception à une concentration de benzène supérieure ou égale à 1,1 μg/m3 (0,34 ppb) était associée à une augmentation de 25 % du risque (IC à 99 % [1,08; 1,43]) de développer un diabète gestationnel chez les personnes blanches et de 41 % (IC à 99 % [1,12; 1,77]) chez les habitants des îles du Pacifique. Les auteurs ont également constaté que l'exposition à cette même concentration durant le premier trimestre de grossesse était associée à une augmentation de 29 % du risque (IC à 99 % [1,04; 1,59]) de développer un diabète gestationnel chez les habitants des îles du Pacifique. Aucun effet similaire n'a été observé chez les personnes noires ou d'origine latino-américaine. Les modèles ont été corrigés pour prendre en compte les caractéristiques physiques, la parité, l'état matrimonial et les facteurs socioéconomiques de la mère, mais pas les co-polluants.
Hématotoxicité et immunotoxicité
Chez l'homme, l'hématotoxicité est un effet nocif important de l'exposition de longue durée au benzène dans l'air, en particulier en milieu de travail. Plusieurs types de cellules sanguines, y compris les érythrocytes, les leucocytes et les plaquettes, sont sensibles à la toxicité du benzène qui ciblerait la moelle osseuse et les cellules souches précoces (ATSDR, 2007; Santé Canada, 2013a).
Au moment de la publication du précédent document de conseils de Santé Canada (2013a), les données probantes sur l'hématotoxicité n'étaient disponibles que pour l'exposition professionnelle au benzène, qui est au moins 1000 fois plus élevée que celle dans l'environnement. Des études portant sur des travailleurs exposés au benzène ont révélé que l'exposition chronique à des concentrations de benzène dans l'air supérieures ou égales à 32 mg/m3 (10 ppm) est associée à divers effets hématologiques nocifs dont la gravité est proportionnelle au niveau d'exposition au benzène (ATSDR, 2007; Santé Canada, 2013a). Depuis lors, des études épidémiologiques ont fait état d'une hématotoxicité découlant d'expositions à des concentrations de benzènes inférieures ou égales à des valeurs comprises entre 3,2 et 6,4 mg/m3 (1 et 2 ppm) (Smith, 2010; Schnatter, 2020).
Lan et al. (2004) ont constaté des effets hématologiques chez les travailleurs exposés à une concentration de benzène inférieure à 3,2 mg/m3 (1 ppm). Cette étude portait sur 250 travailleurs de l'industrie de la chaussure exposés au benzène et 140 travailleurs de même âge et de même sexe employés dans une autre usine n'utilisant pas de benzène. Quatre groupes de travailleurs ont été déterminés selon leur exposition au benzène : non exposés; < 3,2 mg/m3 (1 ppm); 3,2 à < 32 mg/m3 (1 à < 10 ppm); et ≥ 32 mg/m3 (10 ppm). Les auteurs ont indiqué que le nombre total de globules blancs, de granulocytes, de lymphocytes, de lymphocytes B et de plaquettes diminuait significativement au fur et à mesure que l'exposition au benzène augmentait et était même plus faible chez les travailleurs exposés à moins de 1 ppm après la prise en compte par le modèle de l'âge, du sexe, de la consommation actuelle de tabac et d'alcool, de l'IMC, des infections récentes et de la concentration de toluène dans l'air après transformation logarithmique, le cas échéant. L'exposition au benzène a également diminué la formation de colonies à partir des cellules souches myéloïdes, et les cellules souches étaient plus sensibles à la toxicité du benzène que les globules blancs matures.
De récentes études épidémiologiques ont également fait état d'hématotoxicité à de faibles niveaux d'exposition professionnelle au benzène. Les travailleurs exposés à une concentration de benzène inférieure à 3,2 mg/m3 (1 ppm) ont présenté une diminution des types de cellules dérivées des cellules souches myéloïdes, y compris les granulocytes et les plaquettes, ainsi que des altérations des types de cellules lymphoïdes par rapport aux travailleurs non exposés (Bassig et al., 2016). Dans une étude transversale, Harati et al. (2017) ont également constaté des changements hématologiques, y compris la concentration corpusculaire moyenne en hémoglobine (CCMH) et la numération des éosinophiles, chez les travailleurs exposés à des concentrations atmosphériques de benzène inférieures à 3,2 mg/m3 (1 ppm). Une étude transversale réalisée dans cinq usines en Chine a révélé une diminution significative du nombre de neutrophiles et du volume moyen de plaquettes chez les travailleurs exposés à des concentrations de benzène comprises entre 25,0 et 26,2 mg/m3 (7,8 et 8,2 ppm) (Schnatter, 2010). Un risque significativement accru de diminution du nombre de globules rouges a également été constaté lorsque les concentrations étaient inférieures à 1 ppm (RC = 10,8; IC à 95 % [1,41; 82,5]) et supérieures à 10 ppm (16,0; IC à 95 % [2,11; 121]), bien que l'effet n'était pas significatif à la dose moyenne (1 à < 10 ppm).
L'effet de l'exposition cumulative sur l'hématotoxicité a été abordé dans une étude récente menée auprès de 317 travailleurs de trois usines de chaussures, stratifiés selon l'âge et le type d'emploi, employés chacun dans un secteur différent où les concentrations de benzène étaient comprises entre 5,0 mg/m3(1,57 ppm) et 8,3 mg/m3(2,60 ppm), et de 102 témoins (Zhang et al., 2016). Les travailleurs exposés ont été répartis en groupes selon l'exposition cumulative, et une valeur médiane a été attribuée à chaque groupe : 3,55 ppm-année (11,4 mg/m3-année); 6,51 ppm-année (20,8 mg/m3‒année); 10,72 ppm-année (34,3 mg/m3-année); 20,02 ppm-année (64,1 mg/m3-année); et 40,71 ppm-année (130,2 mg/m3-année). Le nombre moyen de globules blancs était plus faible chez l'ensemble des travailleurs exposés que chez les travailleurs non exposés, et une diminution statistiquement significative a été signalée dans les trois groupes les plus fortement exposés. Les tests de tendance ont indiqué une relation dose-réponse significative pour les groupes des plus jeunes, des plus âgés et tous âges confondus. La modélisation de la dose repère pour le nombre de globules blancs pour tous les groupes d'âge a été effectuée à l'aide des modèles de Hill et log-probit, les limites inférieures étant comprises entre 1,37 et 11,82 ppm-année (4,4 et 37,8 mg/m3-année).
Aucune étude n'a été relevée sur l'hématotoxicité découlant de l'exposition personnelle ou dans l'air intérieur au benzène. Dans les études de biosurveillance menées auprès de populations qui n'étaient pas professionnellement exposées au benzène, les concentrations sanguines de benzène ont toutefois été associées à des effets hématotoxiques. Il convient toutefois de noter que certains changements observés ne concordent pas avec ceux signalés dans les milieux de travail. Les concentrations moyennes sanguines de BTEX de résidents âgés vivant dans une collectivité située à moins de 3 kilomètres d'une usine pétrochimique étaient de 1,2 à 6,7 fois plus élevées que celles d'un groupe témoin issu d'une collectivité située loin de toute industrie pétrochimique. La CCMH et les plaquettes étaient inversement corrélées aux concentrations de benzène dans le sang après transformation logarithmique (Chen, Sun et al., 2019). De même, les concentrations de benzène dans le sang de résidents non fumeurs des États du golfe du Mexique ayant été exposés à des émissions issues de déversements d'hydrocarbures dans la région ont été associées à une diminution du taux d'hémoglobine et de la CCMH et à une augmentation du nombre de globules rouges par rapport à la population générale, comme l'a montré la NHANES (Doherty et al., 2017).
Dans des études menées auprès de participants à la NHANES et à l'ECMS, les concentrations accrues de benzène dans le sang ont été associées à des changements au niveau des cellules sanguines périphériques. Chez les sujets de la NHANES, une augmentation d'un écart-type de la concentration sanguine de benzène découlant de l'exposition à la fumée de tabac a été associée à une augmentation statistiquement significative du nombre d'éosinophiles et de plaquettes, et du taux d'hématocrite et d'hémoglobine (Vaughan Watson et al., 2021). Une analyse des participants aux cycles 3 et 4 de l'ECMS a mis en évidence une corrélation entre l'augmentation du taux d'hémoglobine et du nombre de globules blancs et de globules rouges et l'augmentation de la concentration de benzène dans le sang équivalente à la MG (Cakmak et al., 2020). Les personnes qui fument au sein de cette population présentent une augmentation plus importante du nombre de globules blancs par augmentation de la concentration de benzène dans le sang équivalente à la MG que celles qui ne fument pas.
Comme pour l'hématotoxicité, des effets immunotoxiques ont été signalés chez les personnes professionnellement exposées au benzène. Des études antérieures ont montré que le benzène modifie l'immunité humorale et cellulaire. Des peintres exposés de façon chronique au benzène (10 à 22 mg/m3, 3 à 7 ppm), au toluène et au xylène ont présenté des changements au niveau des taux sériques d'immunoglobulines M, G et A. En plus de la diminution du nombre de globules blancs et d'autres composants sanguins (décrits ci-dessus), les travailleurs exposés au benzène présenteraient des changements histopathologiques au niveau de la moelle osseuse et une hypertrophie de la rate à des concentrations comprises entre 3,2 et 3400 mg/m3 (1 et 1060 ppm) (ATSDR, 2007). Les données mécanistes disponibles appuient l'effet immunosuppresseur du benzène (CIRC, 2018). Une corrélation positive a été établie entre l'augmentation du taux d'immunoglobuline G et les concentrations atmosphériques de benzène et le métabolite urinaire du benzène t,t-MA (Bogadi-Šare, 2000; Dimitrova et al., 2005). Une étude récente réalisée en milieu de travail a comparé les concentrations plasmatiques de CD27 et CD30 solubles, deux marqueurs immunitaires de l'activation des lymphocytes B, de travailleurs exposés au benzène à celles de travailleurs non exposés au benzène (Bassig et al., 2016). En plus de la diminution significative liée à la dose du nombre total de lymphocytes et de cellules myéloïdes (comme les granulocytes et les plaquettes), les travailleurs exposés à une concentration médiane de benzène supérieure à 3,2 mg/m3 (1 ppm) ont présenté une baisse significative liée à la dose du nombre de lymphocytes B (15 %), de lymphocytes T CD4+ (14 %) et du rapport CD4+/CD8+ (14 %). Les niveaux d'exposition supérieurs à 32 mg/m3 (10 ppm) de benzène ont été associés à une diminution significative du CD27 soluble et à une diminution non significative du CD30 soluble par rapport aux travailleurs non exposés.
Autres effets
Neurotoxicité
Peu d'études ont examiné les effets neurologiques du benzène, bien qu'il s'agisse d'un effet bien connu de l'exposition professionnelle aux solvants en général. Les travailleurs exposés de façon chronique à des concentrations comprises entre 20 et 50 mg/m3 (6 et 15,6 ppm) pour le benzène et inférieures à 5 mg/m3 pour le toluène ont souffert d'effets neurologiques, notamment des céphalées fréquentes, une sensation de fatigue, des troubles du sommeil et une perte de mémoire. Les travailleurs exposés de façon chronique à des concentrations de benzène atteignant 671 mg/m3 (210 ppm) et qui ont développé une anémie aplasique ou une préleucémie ont également souffert d'une altération de la motricité fine et des réflexes, ce qui indique des effets sur les axones des nerfs périphériques (US EPA, 2002; ATSDR, 2007). Les études plus anciennes sur les effets neurologiques liés au benzène n'ont malheureusement pas été jugées entièrement fiables en raison de coexpositions et d'une mauvaise évaluation de l'exposition.
Les études qui ont suivi le précédent document de conseils de Santé Canada (2013a) ont également mis en évidence des effets neurologiques chez les travailleurs exposés au benzène et aux solvants à base de benzène. Dans une importante cohorte professionnelle française, les travailleurs fortement exposés à des solvants à base de benzène ont présenté un risque plus élevé de faible rendement cognitif (RC = 1,58) que les travailleurs non exposés (Berr et al., 2010). Une autre étude a examiné les déficits cognitifs chez les retraités de cette même cohorte et a conclu qu'une forte exposition professionnelle au benzène durant toute la vie était significativement associée à des troubles cognitifs (Sabbat et al., 2014). Sabbat et al. (2012) ont également constaté que les taux d'exposition aux solvants étaient plus élevés chez les travailleurs n'ayant pas terminé leurs études secondaires et qu'il existait une relation dose-réponse entre l'exposition vie entière au benzène et le risque de troubles cognitifs chez les travailleurs moins instruits. Aucune relation dose-réponse n'a été mise en évidence chez les travailleurs plus instruits. Dans ces études, l'exposition a été définie de manière semi-quantitative en se fondant sur les déclarations des travailleurs et des matrices emplois-expositions, et l'ampleur de la coexposition n'est pas clairement documentée.
Aucune étude n'a été repérée sur les associations entre les concentrations dans l'air intérieur résidentiel et les effets neurologiques. Seules quelques études de biosurveillance menées auprès des enfants, des adolescents et des adultes ont mis en évidence des associations entre l'exposition au benzène dans l'environnement et des effets neurologiques. Les auteurs d'une étude belge ont constaté un lien entre une baisse de l'attention soutenue chez les adolescents et une augmentation du niveau d'exposition au trafic routier (estimé à partir du t,t-MA urinaire et des réponses à l'enquête sur l'exposition au trafic routier) et le t,t-MA seul (Kicinski et al., 2016). Chez des enfants sud-coréens, la concentration urinaire de t,t-MA était significativement plus élevée chez les enfants présentant une otite moyenne séreuse que chez les témoins (Kim et al., 2017). Staudt et al. (2019) ont constaté une association statistiquement significative entre les concentrations sanguines de benzène et un RC accru corrigé pour la perte auditive dans les hautes fréquences chez les adultes américains.
Métabolisme du glucose et stress oxydatif
L'exposition de longue durée au benzène dans l'environnement intervient dans le métabolisme du glucose et dans l'insulinorésistance dans les études menées chez l'homme. Une association significative a été mise en évidence entre le t,t-MA urinaire et l'insulinorésistance, la glycémie à jeun et l'insulinémie à jeun chez des enfants et des adolescents en Iran (Amin et al., 2018). Des augmentations significatives de la superoxyde dismutase et du malondialdéhyde (marqueurs du stress oxydatif) ont également été signalées chez les sujets présentant des concentrations intermédiaires de t,t-MA par rapport à ceux dont les concentrations étaient faibles. Une autre étude a montré une association liée à la dose entre la concentration urinaire de t,t-MA et l'insulinorésistance (déterminée par l'indice de HOMA) et le malondialdéhyde urinaire chez les adultes de plus de 60 ans (Choi et al., 2014).
5.2 Études toxicologiques
Les études toxicologiques sur les effets de l'exposition au benzène par inhalation confirment certains effets aigus, les effets sur la reproduction et le développement, et les effets hématologiques observés chez l'homme. Un petit nombre d'études portant sur l'exposition de courte durée chez l'animal ont mis en évidence des effets respiratoires, et aucune étude n'a été repérée sur les effets neurologiques de l'exposition de longue durée au benzène.
Les niveaux élevés d'exposition au benzène (> 16 000 mg/m3) provoquent une toxicité aiguë grave chez l'animal. Des études animales ont montré que les expositions aiguës uniques au benzène par inhalation associées à cette fourchette de concentrations causent une augmentation de la fréquence respiratoire, des effets sur le SNC et la mort. Les expositions de courte durée par inhalation ont également provoqué des effets hématotoxiques et immunotoxiques ainsi que des effets neurocomportementaux comme des étourdissements, des céphalées, des vertiges, de la somnolence, des tremblements, un délire, une perte de conscience et des déficiences auditives. Les expositions de courte durée entraîneraient également l'apoptose dans les tissus pulmonaires.
L'exposition gestationnelle au benzène par inhalation a entraîné une diminution du poids du corps et des organes fœtaux, une toxicité de la moelle osseuse et des effets hématotoxiques chez la progéniture. Les effets hématotoxiques et immunotoxiques chez l'animal adulte comprennent une diminution du poids de la rate, une diminution du nombre de cellules sanguines circulantes, des lésions de la moelle osseuse et une réponse immunitaire affaiblie.
De plus amples détails se trouvent à l'annexe C.
5.2.1 Exposition de courte durée
Il a été démontré que le benzène provoque une toxicité aiguë grave chez l'animal de laboratoire lorsque les concentrations sont supérieures à 16 000 mg/m3 (5000 ppm) (Santé Canada, 2013a; OEHHA, 2014). L'exposition aiguë par inhalation à des doses uniques et élevées de benzène d'environ 32 000 mg/m3 (10 000 ppm) a causé des effets sur le SNC et la mort chez l'animal de laboratoire (Santé Canada, 2013a). Les concentrations létales 50 chez la souris et le rat étaient comprises entre 31 400 mg/m3 et 43 800 mg/m3 (9800 ppm et 13 700 ppm). Chez la souris, la fréquence respiratoire a augmenté dans les 5 minutes qui ont suivi l'exposition à une dose de 18 800 mg/m3 (5800 ppm) (OEHHA, 2014).
Chez le rat, l'inhalation de 960 mg/m3 (300 ppm) de benzène pendant 7 jours a entraîné une augmentation des changements apoptotiques dans le parenchyme pulmonaire. Une augmentation variant de 55 à 73,5 % de l'index apoptotique a été signalée pour l'épithélium des bronchioles, des bronchioles terminales et des alvéoles (Weaver, 2007). Chez la souris, des effets neurocomportementaux ont été observés après des expositions de courte durée (2,5 à 960 mg/m3; 0,8 à 300 ppm), notamment des effets sur le SNC (p. ex., la léthargie) et des effets comportementaux, comme une diminution du comportement de léchage du lait, de la force de préhension, de l'activité locomotrice et de la performance dans le labyrinthe (OEHHA, 2014; US EPA, 2002).
L'hématotoxicité et l'immunotoxicité se manifestent dans les études animales portant sur l'exposition de courte durée par inhalation. Chez la souris, les effets d'une exposition par inhalation à des concentrations de benzène comprises entre 96 et 320 mg/m3 (30 et 100 ppm), 6 heures par jour pendant 5 à 7 jours, comprennent une diminution de la cellularité splénique et médullaire, du poids de la rate, de la résistance aux infections bactériennes ainsi que du nombre de lymphocytes T et B dans la rate. L'ATSDR (2007), la TCEQ (2015) et l'Anses (2008) ont établi leurs valeurs guides pour l'exposition de courte durée à partir d'une étude dans laquelle des souris mâles ont été exposées à 0, 32, 96, 320 ou 960 mg/m3 (0, 10, 30, 100 ou 300 ppm) de benzène 6 heures par jour pendant 6 jours. Le nombre de lymphocytes circulants et de cellules souches des lymphocytes B dans la moelle osseuse fémorale était diminué, quel que soit le niveau d'exposition. Une diminution significative du nombre d'érythrocytes et de lymphocytes B dans le fémur et la rate a été observée aux concentrations de 320 et de 960 mg/m3 et une diminution des cellules souches de lymphocytes B dans la rate à 960 mg/m3(Rozen et al., 1984).
Des études plus récentes ont permis de faire la lumière sur les voies moléculaires intervenant dans l'hématotoxicité due à l'exposition au benzène. Des souris mâles, de type sauvage ou porteuses d'une délétion homozygote dans les hépatocytes du gène Ppp2r1a (codant la sous-unité de la protéine phosphatase 2a), ont été exposées à des concentrations de benzène de 0, 3,2, 32 ou 320 mg/m3 (0, 1, 10 ou 100 ppm), 6 heures par jour, 6 jours par semaine pendant 28 jours. Chez les souris de type sauvage, des diminutions significatives du nombre de lymphocytes périphériques ont été observées à toutes les doses et des diminutions de tous les paramètres sanguins mesurés (globules rouges, globules blancs, plaquettes, lymphocytes et volume corpusculaire moyen) à la dose la plus élevée. Chez les souris homozygotes, des diminutions significatives des lymphocytes n'ont été observées qu'à la concentration de 100 ppm, alors que les réductions du nombre de globules rouges et de globules blancs et du volume corpusculaire moyen étaient moins prononcées que chez les souris de type sauvage. Les souris homozygotes ont également produit des concentrations plus faibles de SPMA dans l'urine et de métabolites dans le benzène exhalé que les souris de type sauvage, ce qui laisse supposer que la protéine phosphatase 2 a un effet protecteur sur l'hématotoxicité du benzène et joue un rôle dans la régulation du métabolisme du benzène (Chen, Guo et al., 2019).
L'histone désacétylase intervient également dans l'hématotoxicité du benzène. Après avoir reçu une injection intrapéritonéale d'histone désacétylase (trichostatine A ou MCP30), des souris mâles ont été exposées à 0 ou 960 mg/m3 (300 ppm) de benzène, 6 heures par jour, 5 jours par semaine pendant 8 semaines. Le traitement au benzène seul a entraîné une diminution significative du nombre de cellules sanguines périphériques (hémoglobine, globules blancs et plaquettes) et une diminution du nombre de cellules hématopoïétiques de la moelle osseuse. Toutefois, les souris traitées avec des inhibiteurs de l'histone désacétylase ont présenté des changements moins prononcés statistiquement significatifs dans ces paramètres. L'expression et l'activité de la topoisomérase IIa, une cible de l'histone désacétylase, ont également augmenté chez les souris traitées au benzène et à la trichostatine A ou au MCP30 par rapport à celles traitées au benzène seul (Chen et al., 2016).
Chez l'animal, l'exposition aiguë ou de courte durée au benzène provoque des effets sur l'ouïe et le système cardiovasculaire. Des rats anesthésiés et trachéotomisés exposés à 9600 mg/m3 (3000 ppm) de benzène pendant deux périodes de 15 minutes chacune, séparées par une exposition de 20 minutes à de l'air frais, ont présenté des augmentations significatives de l'amplitude du réflexe de l'oreille moyenne, sans effets sur l'histologie de la cochlée (Wathier et al., 2019). Des souris mâles exposées à 0 ou 50 ppm (160 mg/m3) de benzène, 6 heures par jour pendant 6 semaines, ont présenté des effets associés aux maladies cardiovasculaires. Une réduction statistiquement significative de 48 % du nombre de cellules angiogéniques circulantes (Flk+/Sca+) a été mise en évidence chez les souris exposées au benzène par rapport à celles exposées à l'air filtré. L'exposition au benzène a induit une dyslipidémie chez les souris exposées, qui ont présenté une augmentation du cholestérol total et des taux plasmatiques de lipoprotéines de basse densité (LDL) et de lipoprotéines de haute densité (HDL) par rapport aux animaux témoins. Une augmentation de 23 % du rapport LDL/HDL a été mise en évidence chez les souris exposées au benzène (Aplanalp et al., 2017).
5.2.2 Exposition de longue durée
Toxicité respiratoire
Chez l'animal, peu d'études abordant les effets respiratoires découlant d'une exposition de longue durée au benzène ont été repérées. Aucun effet n'a été observé dans le tissu pulmonaire de souris et de rats exposésà 0, 320 ou 960 mg/m3 (0, 100 ou 300 ppm) de benzène 5 jours par semaine, 6 heures par jour durant toute leur vie. En outre, aucun effet histopathologique indésirable n'a été observé dans le tissu pulmonaire des souris exposées à 960 mg/m3(300 ppm) de benzène durant toute leur vie (ATSDR, 2007).
Toxicité pour la reproduction et le développement
Des effets embryotoxiques et fœtotoxiques, comme la diminution du poids du corps et des organes fœtaux, ont été observés dans les études animales dans lesquelles les mères ont été exposées par inhalation à des concentrations aussi faibles que 150 mg/m3(47 ppm) pendant la gestation (Santé Canada, 2013a; OEHHA, 2014). Des effets squelettiques mineurs ont été signalés à des concentrations beaucoup plus élevées. Chez la souris, l'exposition in utero à des concentrations de benzène comprises entre 16 et 64 mg/m3 (5 et 20 ppm) a entraîné une toxicité médullaire et des effets hématopoïétiques importants, comme l'élimination des cellules progénitrices érythropoïétiques, une diminution des globules rouges nucléés immatures (érythroblastes basophiles) et une augmentation de la granulopoïèse (OEHHA, 2014). Chez le lapin et le cobaye, une dégénérescence testiculaire a été observée à des niveaux d'exposition au benzène compris entre 80 et 88 ppm (261 et 277 mg/m3) pendant 8 mois (Santé Canada, 2013a, OEHHA, 2014).
Des effets hématotoxiques, notamment une diminution du nombre de précurseurs érythroïdes en circulation et tardifs, et une augmentation du nombre d'hépatoblastes hématopoïétiques et de précurseurs granulopoïétiques non mitotiques, ont été observés deux jours après la naissance chez les petits de souris femelles gravides exposées à 64 mg/m3 (20 ppm) 6 heures par jour, du 6e au 16e jour de la gestation. Ils présentaient des tendances similaires six semaines après la naissance (Keller et Snyder, 1988).
Hématotoxicité et immunotoxicité
L'hématotoxicité et l'immunotoxicité ont été observées chez l'animal de laboratoire après des expositions subchroniques et chroniques à une vaste fourchette de concentrations de benzène (< 3,2 – 9600 mg/m3 [< 1 – 3000 ppm]) (Santé Canada, 2013a). La détérioration de la fonction hématopoïétique semble être l'effet le plus sensible, comme le montrent les changements dans les cellules sanguines circulantes (leucopénie, érythrocytopénie, lymphocytopénie, thrombocytopénie, pancytopénie et anémie aplasique), les lésions de la moelle osseuse et la réponse immunitaire affaiblie (Santé Canada, 2013a). La souris est considérée comme plus sensible que le rat ou le lapin aux effets hématologiques du benzène; chez la souris, les effets aux concentrations de 32 mg/m3 (10 ppm) comprennent une diminution du poids de la rate et du nombre de leucocytes circulants ainsi qu'une diminution du nombre de lymphocytes périphériques, de globules rouges et de cellules souches dans la moelle osseuse et la rate (Santé Canada, 2013a; OEHHA, 2014).
Autres effets
Neurotoxicité
Bien que plusieurs études de neurotoxicité chez l'animal aient abordé l'exposition de courte durée au benzène (voir la section 5.2.1), aucune étude n'a été repérée sur l'exposition de longue durée.
Métabolisme du glucose et stress oxydatif
Une augmentation de 13 % de la glycémie plasmatique à jeun, de 39 % de l'insulinémie plasmatique à jeun et des scores d'évaluation du modèle d'homéostasie de l'insulinorésistance (indice de HOMA) a été observée chez les souris exposées à des concentrations de benzène de 160 mg/m3 (50 ppm) pendant 2 ou 6 semaines par rapport aux souris exposées à de l'air filtré. Les souris exposées ont également montré des signes de phosphorylation Akt stimulée par l'insuline, de phosphorylation Nf-kb et de stress oxydatif dans le foie et les muscles squelettiques. Le traitement avec un mimétique de la superoxyde dismutase (le TEMPOL) a renversé les effets induits par le benzène sur le stress oxydatif, la phosphorylation Nf-kb et l'intolérance au glucose systémique (Aplanalp et al., 2019).
5.3 Génotoxicité
Le benzène s'est révélé génotoxique dans les études chez l'animal et l'homme, induisant des micronoyaux, des aberrations chromosomiques, des échanges de chromatides sœurs et des ruptures de brin d'ADN. Dans les études animales, l'exposition au benzène induit des effets génotoxiques dans les leucocytes, les érythrocytes et les cellules médullaires. Les méta-analyses d'études réalisées en milieu de travail ont montré qu'une exposition accrue au benzène est associée à une génotoxicité plus forte. Chez l'homme, l'exposition au benzène est également associée à des effets, notamment des adduits à l'ADN, des ruptures de brin, une capacité de réparation réduite, une altération de la longueur des télomères, une perte de chromosomes, un stress oxydatif et des lésions de l'ADN.
5.3.1 Effets chez l'homme
En 2018, le CIRC a conclu qu'il existe des indications solides au niveau mécaniste de la génotoxicité du benzène chez l'homme. Les études portant sur la génotoxicité du benzène chez l'homme utilisent souvent les aberrations chromosomiques ou les micronoyaux comme marqueurs de lésions de l'ADN en milieu de travail. Dans les études de cohorte, il a été démontré que ces deux marqueurs de génotoxicité sont des prédicteurs du risque futur de cancer. Scholten et al. (2020) ont effectué une revue systématique et une méta-analyse pour évaluer la relation exposition-réponse entre l'exposition professionnelle au benzène et ses effets cytogénétiques sur les aberrations chromosomiques et les micronoyaux. Chaque augmentation de 3,2 mg/m3 (1 ppm) de l'exposition au benzène a été associée à une augmentation significative de 0,27 % de la fréquence des aberrations chromosomiques (IC à 95 % [0,08; 0,47]) et à une augmentation suggestive de 0,27 % du nombre de micronoyaux (IC à 95 % [-0,23; 0,76]). Les auteurs ont indiqué que les résultats devraient être interprétés avec prudence en raison de la forte hétérogénéité entre les études (I 2 > 90 %) et de preuves de biais de publication pour ces deux effets. Angelini et al. (2016) ont effectué une méta-analyse pour examiner l'effet de l'exposition au benzène sur les dommages génétiques, qui ont été quantifiés à l'aide du test des micronoyaux sur lymphocytes avec blocage de la cytocinèse chez les travailleurs exposés en milieu de travail au pétrole et à ses dérivés. Une différence moyenne globale statistiquement significative de 1,64 dans la fréquence des micronoyaux (IC à 95 % [0,80; 2,47]) dans les lymphocytes périphériques a été constatée chez les travailleurs exposés au benzène ou au BTX par rapport aux travailleurs non exposés (Angelini et al., 2016).
Deux études ont mis en évidence des taux plus élevés d'adduits à l'ADN dans les cellules sanguines et l'épithélium nasal chez les enfants ou les adultes vivant en zone urbaine ou industrielle et étant plus fortement exposés au benzène que ceux habitant en zone rurale (Ayi-Fanou et al., 2011; Peluso et al., 2013). Deux études professionnelles comparant des travailleurs exposés et des travailleurs non exposés au benzène ont mis en évidence des lésions plus importantes de l'ADN, quantifiées par le % d'ADN dans la queue, ou des signes accrus de ruptures de brin et une capacité de réparation réduite (Li et al., 2017; Ruchirawat et al., 2010). Plusieurs autres études professionnelles ont également signalé une perte de chromosomes associée à l'exposition au benzène (Bassig et al., 2016; Ji et al., 2012; Zhang et al., 2012).
L'exposition au benzène a également été associée à une altération de la longueur des télomères. Alors que Hoxha et al. (2009) ont constaté un raccourcissement des télomères chez les travailleurs exposés au benzène provenant du trafic routier, Bassig et al. (2014) ont observé un rallongement des télomères chez les travailleurs exposés à plus de 31 ppm de benzène.
Le CIRC (2018) a également conclu sur la base d'études professionnelles qu'il existe de solides preuves indiquant que le benzène peut provoquer un stress oxydatif et des lésions oxydatives connexes de l'ADN, comme une diminution des taux sériques de glutathion, une augmentation de la peroxydation lipidique, une augmentation des espèces réactives de l'oxygène, des dommages oxydatifs des protéines ou une diminution de la capacité antioxydante. Une étude a mis en évidence des corrélations significatives entre l'exposition au benzène et des changements au niveau de la glutathion-S-transférase, de la superoxyde dismutase, de la peroxydation lipidique et des espèces réactives de l'oxygène chez les travailleurs de stations-service par rapport aux travailleurs non exposés au benzène (Uzma et al., 2010). Une autre étude a fait état d'une augmentation du nombre de copies de l'ADN mitochondrial dans le sang de sujets exposés en milieu de travail par rapport aux témoins non exposés et semble indiquer que cette augmentation résulte des lésions et du dysfonctionnement de l'ADN mitochondrial (Carugno et al., 2012).
5.3.2 Études toxicologiques
Des études in vivo et in vitro chez l'animal ont montré que le benzène est génotoxique, provoquant des lésions de l'ADN et des altérations chromosomiques (Santé Canada, 2013a; OEHHA, 2014; CIRC, 2018). Le benzène et ses métabolites ont des effets clastogènes et aneugènes dans les cellules bactériennes, produisant des micronoyaux, des aberrations chromosomiques, des échanges de chromatides sœurs et des cassures double brin. Le benzène a démontré sa capacité à inhiber la synthèse de l'ADN et de l'ARN dans les cellules animales isolées. In vivo, le benzène induit des aberrations chromosomiques dans les lymphocytes (souris) et les cellules médullaires (rat et hamster) et accroît l'incidence de micronoyaux dans les lymphocytes (rat), la moelle osseuse (souris et hamster) et les érythrocytes périphériques (souris). Des échanges de chromatides sœurs ont été observés dans les lymphocytes chez le rat et la souris ainsi que dans le fœtus, le foie et la moelle osseuse chez la souris. Des mutations géniques et la polyploïdie ont été observées dans les lymphocytes chez la souris (Santé Canada, 2013a; OEHHA, 2014). Le benzène induit également des adduits à l'ADN dans la moelle osseuse et les leucocytes des animaux exposés in vivo. Les métabolites du benzène, en particulier l'hydroquinone et le 1,4-benzoquinone, inhibent directement la topoisomérase II chez les souris exposées (CIRC, 2018).
Deux études qui ont suivi le précédent document de conseils de Santé Canada (2013a) abordent les considérations mécanistes de la génotoxicité du benzène. L'exposition de souris non consanguines (c'est-à-dire, génétiquement diverses) à des concentrations de benzène inférieures ou égales à 320 mg/m3 (100 ppm) pendant 28 jours a entraîné d'importantes augmentations de 400 à 570 % du nombre de micronoyaux dans la moelle osseuse, les réticulocytes et les érythrocytes. Une concentration repère de benzène de 0,656 mg/m3 (0,205 ppm) a été établie pour les altérations chromosomiques induites par le benzène. La surexpression de sulfotransférases était inversement corrélée à la génotoxicité, ce qui laisse supposer un rôle protecteur des métabolites sulfatés du benzène (French et al., 2015).
Les souris exposées à 160 mg/m3 (50 ppm) de benzène, de manière continue pendant 8 jours ou intermittente pendant 8 jours répartis sur une période de 15 jours, présentaient une augmentation significative de la fréquence des micronoyaux dans la moelle osseuse. L'exposition continue a conduit à une fréquence de micronoyaux nettement plus élevée que l'exposition intermittente. La co-exposition au benzène et au toluène a également augmenté de manière significative la fréquence de micronoyaux par rapport au benzène seul. La déplétion en glutathion a réduit la fréquence de micronoyaux, impliquant le glutathion ou un conjugué benzène-glutathion dans la génotoxicité induite par le benzène (Bird et al., 2010).
5.4 Cancérogénicité
Santé Canada (Environnement Canada et Santé et Bien-être social Canada, 1993), l'US EPA (2002) et le CIRC (1987, 2018) ont classé le benzène comme substance cancérogène pour l'homme.
Le CIRC a d'ailleurs conclu, sur la base d'indications suffisantes, que le benzène est à l'origine de la leucémie aiguë myéloïde (LAM) et de la leucémie aiguë non lymphoblastique (LANL) chez l'adulte et que les données soutiennent une association positive entre l'exposition au benzène et la survenue de LAM chez l'enfant. Le niveau de preuve épidémiologique appuie l'existence d'associations positives entre l'exposition au benzène et le lymphome non hodgkinien (LNH), la leucémie lymphoïde chronique, le myélome multiple, la leucémie myéloïde chronique (LMC) et le cancer du poumon chez l'adulte (CIRC, 2018; ATSDR, 2007). Une minorité des membres du Groupe de Travail du CIRC a conclu que le benzène cause également le LNH (CIRC, 2018).
La quasi-totalité des études démontrant la cancérogénicité du benzène chez l'adulte ont été menées auprès de cohortes professionnelles ou de personnes exposées en milieu de travail dans le cadre d'études populationnelles. Les preuves du rôle du benzène dans la leucémie infantile reposent en grande partie sur des études épidémiologiques se servant du benzène comme substitut de l'exposition au trafic routier. Aucune étude n'a été repérée sur les effets cancérogènes de l'exposition au benzène dans l'air intérieur résidentiel.
5.4.1 Effets chez l'homme
Leucémie
Leucémie aiguë myéloïde et leucémie aiguë non lymphoblastique
La classification initiale du benzène comme substance cancérogène chez l'homme par le CIRC et les organismes de réglementation repose sur les données d'études portant sur l'exposition professionnelle au benzène et le risque de leucémie chez l'adulte, en particulier la LAM et la LANL. Les premières études de cohortes professionnelles, dont une étude américaine menée auprès de travailleurs du chlorhydrate de caoutchouc (Pliofilm), une étude de cohorte chinoise réalisée sur des travailleurs exposés au benzène et une étude australienne sur les travailleurs du pétrole, ont systématiquement mis en évidence des risques plus élevés de LAM et de LANL chez les travailleurs exposés au benzène (Rinsky et al., 1981, 2002; Yin et al., 1987, 1996; Glass et al., 2003, 2005). Les expositions les plus élevées ont été observées dans les cohortes Pliofilm et chinoise, avec une exposition moyenne variant de < 10 à > 1000 mg/m3 (< 3 à > 310 ppm) et une exposition cumulative de < 10 à > 400 ppm-année (< 32 à > 1280 mg/m3-année) (Rinsky et al., 1981, 2002; Hayes et al., 1996). Les expositions cumulatives étaient beaucoup plus faibles dans la cohorte australienne, variant de 0,005 à 57,3 ppm-année (0,016 à 183,4 mg/m3-année) (Glass et al., 2003, 2005).
De nouvelles données recueillies au cours des dernières années à partir de cohortes professionnelles et d'études en population générale, avec une meilleure évaluation de l'exposition au benzène, ont fourni de nouvelles preuves à l'appui de l'association entre l'exposition au benzène et le développement de la LAM et de la LANL. En outre, les preuves de tendances exposition-réponse entre les données quantitatives sur l'exposition professionnelle au benzène et le risque de LAM ou de LANL sont de plus en plus nombreuses. Les auteurs d'une analyse groupée de trois études de cas-témoins emboîtés actualisées qui avaient été menées auprès de travailleurs du pétrole au Canada, au Royaume-Uni et en Australie ont fait état d'un niveau relativement faible d'exposition au benzène par rapport à d'autres études réalisées en milieu de travail (Schnatter et al., 2012; Rushton et al., 2014). L'estimation du niveau d'exposition moyen au benzène était comprise entre 0,62 et 0,96 mg/m3 (0,2 et 0,3 ppm) dans cette étude et la médiane de l'exposition cumulative au benzène était de 1,2 ppm-année (3,84 mg/m-année) pour les cas de LAM. Des RC élevés ont été observés entre les expositions cumulative, moyenne, maximale et cutanée, les pics d'exposition et la durée d'exposition au benzène et le risque de LAM, bien qu'aucun n'était statistiquement significatif. Des rapports de risques élevés ont également été signalés pour les expositions cumulatives relativement faibles au benzène (entre 0,124 et 0,948 ppm-année [0,397 et 3,03 mg/m3-année]) dans une étude de série de cas menée auprès de travailleurs norvégiens de l'industrie pétrolière en haute mer; les résultats n'étaient toutefois pas statistiquement significatifs (Stenehjem et al., 2015).
Deux études populationnelles ont également examiné le risque de LAM en lien avec l'exposition professionnelle au benzène. Les auteurs d'une étude cas-témoin menée dans des hôpitaux de Shanghai auprès de patients atteints de LAM ont constaté que l'exposition au benzène était associée à une augmentation significative du risque de LAM (RC = 1,43; IC à 95 % [1,05; 1,93]). Ils ont également mis en évidence une relation monotone exposition-réponse significative entre l'exposition professionnelle maximale au benzène et le risque de LAM. L'exposition au benzène a été déclarée par les patients lors d'entrevues sur leurs antécédents professionnels. Une analyse catégorique a également mis en évidence un RC significativement plus élevé de 2,05 (IC à 95 % [1,05; 3,98]) lorsque les patients exposés à plus de 3,1 ppm (10 mg/m3) étaient comparés à ceux qui n'étaient pas exposés professionnellement au benzène (Wong et al., 2010). Une étude de cas-témoin emboîtés menée auprès de populations de quatre pays nordiques qui a estimé l'exposition au benzène à partir de renseignements professionnels provenant de registres de recensement n'a révélé aucune association entre l'exposition aux solvants à base de benzène et le risque de LAM (Talibov et al., 2014).
Le CIRC a effectué des méta-analyses sur l'association entre l'exposition professionnelle au benzène et le risque de LAM à l'aide de données provenant de 13 études. Un méta-RC statistiquement significatif de 1,54 (IC à 95 % [1,16; 2,05]) a été signalé pour l'exposition professionnelle au benzène et le risque d'incidence de LAM ou de mortalité due à la LAM. D'autres analyses de méta-régression effectuées à partir de six études de cohortes professionnelles ayant évalué l'exposition au benzène de manière quantitative ont permis d'étudier la tendance exposition-réponse entre l'exposition cumulative au benzène et la LAM. Les résultats appuient fortement l'existence d'une relation linéaire exposition-réponse entre la LAM et l'exposition cumulative au benzène (CIRC, 2018).
Une étude sur l'incidence de LAM et de la mortalité due à la LAM menée au Canada de 1992 à 2010 à divers niveaux (province/territoire, ville et code postal) a révélé des grappes de cas de LAM à Sarnia et dans d'autres villes industrielles ontariennes situées à proximité de la frontière américaine, y compris Sault Ste. Marie, Thunder Bay, St. Catharines et Hamilton (Ghazawi et al., 2019). Sarnia, la ville avec la plus forte concentration d'usines pétrochimiques au Canada (plus de 60 raffineries et usines chimiques), comptait 106,81 cas (IC à 95 % [70,96; 161,86]) de LAM par million de personnes par année, soit un taux plus de trois fois plus élevé que la moyenne nationale. Bien que les résultats n'ont pas associé l'exposition individuelle au benzène à la LAM dans ces villes – il s'agissait d'une étude écologique – l'étude laisse croire que la pollution provenant des usines pétrochimiques locales, un facteur connu pour le benzène ambiant, peut être un facteur de risque pour la LAM à Sarnia, en Ontario. D'autres études permettant de mieux évaluer l'exposition individuelle au benzène sont nécessaires pour confirmer cette association.
Leucémie myéloïde chronique et syndromes myéloprolifératif et myélodysplasiques
Plusieurs études professionnelles ont évalué l'exposition professionnelle au benzène et la LMC, le syndrome myéloprolifératif (SMP) ou les syndromes myélodysplasiques (SMD) chez des travailleurs de divers pays.
Deux études ont examiné les risques chez les travailleurs de LMC, de SMP et de SMD associés à des niveaux relativement faibles d'exposition au benzène à partir de données provenant des mêmes études de cas-témoins emboîtés dans trois cohortes professionnelles du Canada, de l'Australie et du Royaume-Uni décrites plus haut (Schnatter et al., 2012; Glass et al., 2014). Les niveaux d'exposition moyens signalés dans ces études étaient nettement plus faibles que ceux observés dans d'autres études sur le benzène réalisées en milieu de travail. L'exposition moyenne était de 0,3 ppm (0,96 mg/m3) pour les cas de LMC, de 0,17 ppm (0,54 mg/m3) pour les cas de SMP et se situait entre 0,2 et 0,3 ppm (0,64 et 0,96 mg/m3) pour les cas de SMD. Une tendance monotone constante a été mise en évidence entre l'exposition cumulative au benzène et les SMD. Les RC pour les SMD étaient de 4,33 (IC à 95 % [1,31; 14,3]) lorsque les travailleurs du tertile d'exposition supérieur étaient comparés à ceux du tertile d'exposition inférieur (> 2,93 vs ≤ 0,348 ppm-année; > 9,38 vs ≤ 1,11 mg/m3-année) et de 6,32 (IC à 95 % [1,32; 30,2]) lorsque les travailleurs exposés à des pics supérieurs à 3 ppm (9,6 mg/m3) étaient comparés à ceux n'étant pas exposés à ces mêmes pics. Les résultats étaient moins clairs pour la LMC et le SMP. Bien que certains RC étaient élevés pour les tertiles supérieurs d'exposition au benzène par rapport au tertile inférieur, l'augmentation du risque de LMC ou de SMP associé à l'exposition au benzène n'était en général pas statistiquement significative.
Lymphome non hodgkinien
Le LNH est un groupe hétérogène de lymphomes, notamment la leucémie lymphoïde chronique, le myélome multiple, la leucémie aiguë lymphoblastique, le lymphome folliculaire, le lymphome à cellules du manteau, le lymphome diffus à grandes cellules B et la leucémie à tricholeucocytes. La définition du LNH a changé au fil du temps en raison des changements apportés à la classification des maladies, et différentes études épidémiologiques ont examiné différents types de LNH. Les indications de cancérogénicité potentielle du LNH associé à l'exposition au benzène ne sont pas claires, et se révèlent encore plus compliquées probablement en raison de l'hétérogénéité étiologique de la maladie. Seules quelques études réalisées en milieu de travail ont fait état d'associations entre l'exposition au benzène et le risque de LNH (Koh et al., 2011, 2014; Collins et al., 2015; Linet et al., 2015). Bien que certaines études ont montré des associations positives, aucun résultat n'était statistiquement significatif.
Cancer du poumon
Les indications de cancérogénicité sont limitées en ce qui a trait à
l'association entre l'exposition au benzène et la survenue de cancer du
poumon. Le CIRC (2018) a conclu qu'il existait une association positive
entre le benzène et le cancer du poumon, bien qu'une petite minorité
des membres du Groupe de Travail a estimé qu'aucune association
positive n'avait été observée. Une étude cas-témoin canadienne a révélé
une association entre l'exposition de longue durée au benzène et à
d'autres polluants dans l'air ambiant et un risque accru de cancer du
poumon chez les Torontois (Villeneuve et al., 2014). La concentration
de benzène a été estimée à 0,65 μg/m3 (0,2 ppb) dans les cas
de cancer du poumon. Les auteurs ont observé qu'une augmentation de
l'EIQ (0,15 μg/m3; 0,05 ppb) de l'exposition moyenne au
benzène pondérée dans le temps dans les lieux de résidence antérieurs
était associée à un RC de 1,84 (IC à 95 % [1,26; 2,68]) après la prise
en compte de l'âge, du sexe, du tabagisme, de la fumée secondaire et
d'autres facteurs de confusion. Cette étude a également établi des
relations significatives avec le NO 2 et les hydrocarbures
totaux.
Leucémie infantile
Plusieurs études portant sur l'association entre l'exposition au benzène dans l'air ambiant (comme substitut de l'exposition au trafic routier) et les risques de cancers hématopoïétiques chez l'enfant ont été repérées. La plupart d'entre elles portaient sur la leucémie infantile (le type le plus courant de cancer chez l'enfant) et ont estimé l'exposition maternelle au benzène dans l'air ambiant avant ou durant la grossesse, ou celle au cours des premières années de la vie en fonction de l'adresse du domicile. Certaines études ont évalué l'exposition au benzène des enfants par le biais d'indicateurs de l'exposition à des mélanges de polluants atmosphériques, comme la proximité du trafic routier, des stations-service et des garages de réparation automobile, ou par le biais de l'exposition professionnelle parentale aux solvants à base de benzène. Aucune étude évaluant le risque de cancer chez l'enfant associé à une exposition mesurée au benzène dans l'air intérieur n'a été repérée.
Trois méta-analyses ont examiné l'association entre le benzène et la leucémie infantile (Filippini et al., 2019; Gong et al., 2019; Filippini et al., 2015). L'estimation du risque combiné de leucémie infantile était comprise entre 0,94 et 1,64. Huit des onze associations étaient positives pour le benzène, et six d'entre elles étaient statistiquement significatives ou à la limite de la signification. L'estimation du risque combiné pour l'exposition au benzène était plus élevée chez les enfants d'âge préscolaire que chez les enfants d'âge scolaire (Filippini et al., 2019). Deux des méta-analyses ont examiné la relation exposition-réponse entre l'exposition au benzène provenant du trafic routier et la leucémie infantile (Filippini et al., 2019; Gong et al., 2019) et obtenu des résultats contradictoires. Alors que Filippini et al. (2019) n'ont établi aucun seuil minimum d'exposition au benzène lié à un risque accru de leucémie infantile, Gong et al. (2019) n'ont relevé aucun risque accru associé à un niveau accru d'exposition au benzène.
Les résultats d'autres études cas-témoin confirment également l'existence d'un risque accru de LAM chez l'enfant associé à l'exposition au benzène dans l'air extérieur. Une étude cas-témoin menée en Italie chez un groupe d'enfants de moins de 5 ans a fait état d'un RC de 5,46 (IC à 95 % [1,12; 26,51]) pour la LAM associée à une augmentation de 1 μg/m3 (0,3 ppb) de l'exposition moyenne au benzène dans l'air extérieur après la prise en compte de l'exposition aux PM10 (les concentrations moyennes de benzène variaient de < 0,10 à > 0,50 μg/m3; < 0,033 à > 0,16 ppb) (Vinceti et al., 2012). Une autre étude cas-témoin, celle-ci menée aux États-Unis, a modélisé l'exposition au benzène dans l'air extérieur chez l'enfant en fonction du lieu de résidence à la naissance et a établi des concentrations moyennes de benzène comprises entre 0,11 et 2,03 μg/m3 (0,034 et 0,63 ppb). Le risque de LAM était plus élevé chez les enfants nés entre 2005 et 2010 lorsque l'exposition au benzène était plus importante, bien que les résultats ne sont pas statistiquement significatifs (Janitz et al., 2017).
5.4.2 Études toxicologiques
Le CIRC (2018) a conclu que les indications de cancérogénicité du benzène étaient suffisantes chez l'animal de laboratoire. Des études toxicologiques chroniques menées chez la souris et le rat ont mis en évidence le potentiel leucémogène de l'exposition par inhalation au benzène. Plusieurs études menées chez la souris ont signalé un lymphome thymique, une leucémie myélogène, des tumeurs hématopoïétiques et lymphatiques, et des carcinomes de la glande de Zymbal, des ovaires et des poumons après une exposition par inhalation à des concentrations de benzène comprises entre 320 et 960 mg/m3 (100 et 300 ppm) pendant 10 semaines ou toute la vie. Une augmentation significative du nombre de carcinomes de la glande de Zymbal chez la progéniture femelle et de celui de carcinomes de la cavité buccale, d'hépatomes et de tumeurs des tissus hématopoïétiques et lymphoïdes a été observée chez les rats exposés in utero et après la naissance à des concentrations de benzène comprises entre 640 et 960 mg/m3 (200 et 300 ppm) pendant 104 semaines. Des augmentations liées à l'exposition du nombre de lymphomes thymiques et non thymiques et de leucémies myéloïdes ont été observées chez des souris génétiquement modifiées dont le gène p53 était désactivé, ce qui laisse supposer que la fonction de réparation de l'ADN pourrait jouer un rôle dans la leucémogenèse (CIRC, 2018).
5.5 Résumé des effets sur la santé et mode d'action
5.5.1 Résumé des effets sur la santé
Les signalements d'effets sur la santé liés à l'exposition aiguë ou de courte durée par inhalation au benzène chez l'homme concernent principalement l'exposition professionnelle ou celle découlant d'un rejet accidentel dans l'environnement. Chez l'homme, les effets sur le SNC surviennent après une exposition aiguë par inhalation à des concentrations de benzène typiques d'une forte exposition professionnelle (800 à 9600 mg/m3; 250 à 3000 ppm). Des cas d'irritation respiratoire et d'essoufflement ont également été signalés après une exposition professionnelle de courte durée. Les enfants exposés à des concentrations inconnues de benzène et d'autres contaminants durant un rejet dans l'environnement ont présenté des effets neurologiques (p. ex., des céphalées et une perte de mémoire), des symptômes des voies respiratoires supérieures et des effets hématotoxiques et hépatotoxiques. Dans ces études, les niveaux et les durées d'exposition n'étaient toutefois pas clairement définis et pouvaient également concerner d'autres produits chimiques.
L'exposition unique aiguë par inhalation à des concentrations très élevées de benzène (> 19 000 mg/m3, 5900 ppm) entraîne une augmentation de la fréquence respiratoire, des effets sur le SNC et la mort chez l'animal. Des effets hématotoxiques et immunotoxiques, comme la diminution du nombre de cellules sanguines et immunitaires, de la cellularité splénique et de l'immunité aux infections, sont attribuables à l'exposition de courte durée par inhalation à des concentrations comprises entre 32 et 960 mg/m3 (10 et 300 ppm). Des effets neurocomportementaux, comme des étourdissements, des céphalées, des vertiges, de la somnolence, des tremblements, un délire, une perte de conscience et des déficiences auditives, ont également été observés, parfois à des niveaux d'exposition très élevés.
De récentes études épidémiologiques menées chez l'homme portant sur l'exposition au benzène dans l'air intérieur ont fait état d'associations entre les concentrations comprises entre 1,06 et 10,7 μg/m3 (0,33 et 3,3 ppb) et des effets pulmonaires et une prévalence accrue de l'asthme et des symptômes de l'asthme dans les populations générales et chez les enfants. D'autres études menées dans l'air intérieur portant sur des niveaux d'exposition similaires n'ont toutefois pas établi d'association entre la concentration de benzène et des effets sur la fonction pulmonaire ou le système cardiovasculaire chez les enfants, ou une infection des voies respiratoires inférieures chez les nourrissons. Des effets respiratoires ont été observés en milieu de travail après 3 semaines d'exposition à plus de 192 mg/m3 (60 ppm), et une irritation des voies respiratoires supérieures a été signalée après une exposition professionnelle de longue durée à des concentrations de benzène comprises entre 106 et 189 mg/m3 (33 et 59 ppm). Les expositions mortelles par inhalation provoquent de graves effets sur les organes respiratoires et d'autres organes, y compris des hémorragies et des œdèmes. Peu d'études animales abordant la toxicité respiratoire ont été repérées. Aucun effet n'a été relevé sur le tissu pulmonaire chez la souris ou le rat après une exposition vie entière par inhalation à des concentrations de benzène inférieures ou égales à 960 mg/m3 (300 ppm). Une étude plus récente a fait état d'effets apoptotiques sur le tissu pulmonaire de rats exposés à 960 mg/m3 (300 ppm) pendant 7 jours.
Des études épidémiologiques menées chez l'homme ont montré des associations entre l'exposition personnelle gestationnelle ou l'exposition dans l'air extérieur au benzène et des effets sur le développement. Aucune étude menée dans l'air intérieur n'a toutefois été repérée. Une diminution du poids à la naissance et de la circonférence de la tête a été associée à l'exposition personnelle au benzène. Des effets, notamment un faible poids à la naissance, la naissance prématurée, une petite taille à la naissance et une petite circonférence de la tête, ont été relevés après une exposition maternelle dans l'air ambiant à des concentrations de benzène comprises entre 1,3 et 3,5 μg/m3 (0,4 et 1,1 ppb). Des associations entre l'exposition professionnelle au benzène et les avortements spontanés, les perturbations menstruelles et l'atrophie ovarienne ne font l'objet que de quelques signalements. Chez le rongeur, l'exposition gestationnelle par inhalation à des concentrations de benzène comprises entre 16 et 150 mg/m3 (5 et 47 ppm) a entraîné une diminution du poids du corps et des organes fœtaux, une toxicité de la moelle osseuse et des effets hématotoxiques.
L'hématotoxicité et l'immunotoxicité sont des effets bien connus de l'exposition professionnelle au benzène; l'US EPA (2002), l'OEHHA (2014), l'ATSDR (2007), la TCEQ (2015) et l'Anses (2008) se sont servis de ces effets pour établir des niveaux de référence pour les expositions de longue durée par inhalation au benzène produisant des effets autres que le cancer (voir l'annexe D, section D2 pour en savoir davantage). Plusieurs études sur l'exposition professionnelle ont fait état de diminutions du nombre de globules rouges, de globules blancs et de plaquettes ainsi que d'effets sur les types de précurseurs et les cellules souches dans la moelle osseuse aux concentrations de benzène supérieures ou égales à 3,2 μg/m3 (1 ppm). Une étude professionnelle récente a examiné l'exposition cumulative à la limite inférieure de la concentration repère (BMCL) du benzène comprise entre 4,4 et 37,8 mg/m3-année (1,37 et 11,82 ppm-année) calculée pour les effets hématotoxiques. Des effets hématotoxiques associés à l'exposition au benzène ont également été signalés pour la population générale, mais certains effets ne concordent pas avec ceux signalés lors d'expositions professionnelles plus élevées. Parmi les cohortes de l'ECMS et de la NHANES, la concentration accrue de benzène dans le sang a été associée à une augmentation du nombre de globules blancs, de globules rouges et de plaquettes et du taux d'hémoglobine. Chez les populations exposées à des niveaux accrus de benzène dus à la pollution, la concentration accrue de benzène dans le sang a été associée à une diminution du taux d'hémoglobine, de la CCMH et du nombre de plaquettes et à une augmentation du nombre de globules rouges.
Les expositions au benzène dans l'environnement et en milieu de travail ont été associées à des effets neurologiques chez l'homme. L'exposition au benzène dans l'environnement (mesurée par la concentration urinaire de t,t-MA) est associée à un manque d'attention soutenue chez l'adolescent et à des déficiences auditives chez l'enfant et chez l'adulte. Des travailleurs ont déclaré souffrir d'une dépression du SNC après une exposition professionnelles de courte durée à plus de 800 mg/m3 (250 ppm) de benzène. Des études plus anciennes sur l'exposition professionnelle chronique ont également fait état d'une dépression du SNC ainsi que d'effets sur la motricité et les réflexes, mais les résultats pourraient ne pas être fiables en raison de lacunes dans la méthodologie et l'évaluation de l'exposition. Des études plus récentes ont révélé que l'exposition professionnelle de longue durée est associée à des troubles cognitifs. Dans les études animales, les expositions de courte durée à des concentrations de benzène comprises entre 2,5 et 960,0 mg/m3 ont provoqué des effets sur le SNC et le comportement.
Dans les études menées chez l'homme et l'animal, le benzène s'est révélé génotoxique, induisant des micronoyaux, des aberrations chromosomiques, des échanges de chromatides sœurs et des cassures double brin. Les méta-analyses d'études réalisées en milieu de travail ont montré qu'une exposition accrue au benzène est associée à une fréquence accrue d'aberrations chromosomiques et de micronoyaux. Chez l'homme, l'exposition au benzène est également associée à des effets, notamment des adduits à l'ADN, des ruptures de brin, une capacité de réparation réduite, une altération de la longueur des télomères, une perte de chromosomes, un stress oxydatif et des lésions de l'ADN. Dans les études animales, l'exposition au benzène induit des aberrations chromosomiques, des adduits à l'ADN et des micronoyaux dans les leucocytes, les érythrocytes et les cellules médullaires.
Le benzène est classé comme substance cancérogène pour l'homme par Santé Canada, l'US EPA et le CIRC, en plus d'être inscrit à l'annexe 1 de la Loi canadienne sur la protection de l'environnement. Le CIRC a conclu, sur la base d'indications suffisantes, que le benzène est à l'origine de la LAM et de la LANL chez l'adulte et que les données soutiennent une association positive entre l'exposition au benzène et la survenue de LAM chez l'enfant. L'exposition au benzène est associée à divers degrés au LNH, à la leucémie lymphoïde chronique, au myélome multiple, à la LMC et au cancer du poumon chez l'adulte. Le CIRC (2018) a également conclu que les indications de cancérogénicité du benzène étaient suffisantes chez l'animal de laboratoire.
Trois études de cohortes professionnelles, soit les cohortes Pliofilm, chinoise et australienne, appuient la leucémogenèse du benzène chez l'homme. Les méta-analyses d'études de cohorte professionnelle ont mis en évidence l'existence d'un risque accru d'incidence de LAM ou de mortalité due à la LAM lié à l'exposition professionnelle au benzène et d'une relation linéaire exposition-réponse entre l'exposition cumulative au benzène et la LAM. De récentes études réalisées en milieu de travail indiquent toutefois que le risque de développer la LAM peut être associé à de plus faibles niveaux d'exposition. Dans une cohorte combinée de participants provenant du Canada, du Royaume-Uni et de l'Australie, le risque de développer des SMD augmentait de façon significative en proportion des expositions cumulative et maximale. Une étude menée auprès de Torontois a révélé une association statistiquement significative entre l'augmentation des concentrations de benzène dans l'air extérieur et l'incidence de cancer du poumon. L'exposition au benzène provenant du trafic routier a été associée de manière positive à la leucémie infantile. L'estimation du risque combiné provenant des méta-analyses est comprise entre 0,94 et 1,64, avec un risque plus élevé chez les enfants d'âge préscolaire que chez les enfants d'âge scolaire. Des études ont signalé des risques plus élevés de développer une LAM chez les enfants exposés à des concentrations moyennes dans l'air extérieur comprises entre 0,11 et 2,03 μg/m3.
5.5.2 Mode d'action
Les modes d'action de la cancérogénicité et de l'hématotoxicité induites par le benzène sont mieux compris que ceux d'autres effets sur la santé, comme la toxicité pour le système respiratoire, la reproduction ou le développement. Des études mécanistes montrent toutefois qu'il pourrait exister des facteurs déclencheurs courants et certains événements conduisant aux effets toxiques découlant de l'exposition au benzène. Bien que les données probantes actuelles semblent indiquer que la toxicité du benzène est principalement induite par ses métabolites, le ou les métabolites responsables de cette toxicité et leur contribution demeurent mal connus.
Meek et Klaunig (2010) ont présenté les principaux événements du mode d'action de la leucémie, qui sont confirmés par plusieurs sources de données expérimentales et épidémiologiques. Le benzène est d'abord métabolisé et ses métabolites sont ensuite transportés vers la moelle osseuse où ils interagissent avec les cellules cibles, formant ainsi des cellules cibles initiéesde la moelle osseuse. Les cellules mutées subissent une prolifération clonale sélective qui conduit à la formation de tumeurs ou à la leucémie. Le mode d'action de l'hématotoxicité comporte probablement les mêmes premières étapes de métabolisme et de transport vers la moelle osseuse, où les métabolites interagissent avec les cellules hématopoïétiques pour former des populations de cellules sanguines modifiées (Wang et al., 2012).
Le mode d'action du benzène semble dépendre de sa transformation en métabolites réactifs par le CYP2E1 (ATSDR, 2007; Meek et Klaunig, 2010). Le benzène est rapidement absorbé dans le sang et métabolisé principalement dans le foie, un métabolisme secondaire ayant lieu au niveau de la moelle osseuse. Plusieurs métabolites réactifs interviennent dans la toxicité du benzène, y compris l'oxyde de benzène, le phénol, le catéchol, l'hydroquinone, et le 1,4-benzoquinone. Le rôle de chacun d'entre eux et le mécanisme précis des dommages causés aux cellules cibles ne sont pas clairs, mais les possibilités sont nombreuses.
Les métabolites du benzène provoquent des aberrations chromosomiques, des liaisons covalentes, un stress oxydatif, des altérations de l'expression génique, l'apoptose, de l'interférence avec la réparation de l'ADN, une médiation de la régulation épigénétique et une perturbation de la surveillance tumorale (Wang et al., 2012). Des adduits à l'ADN ont été observés dans la moelle osseuse et les leucocytes chez l'animal et dans les cellules hématopoïétiques chez l'homme, qui sont également le site d'induction de micronoyaux et d'aberrations chromosomiques, y compris l'aneuploïdie, les translocations et d'autres changements structurels (CIRC, 2018). L'hydroquinone et le 1,4-benzoquinone interviennent dans l'inhibition de la réparation de l'ADN en bloquant la topoisomérase I et la poly-ADP-ribose-polymérase-1 (Luo et al., 2018; Son et al., 2016). Le catéchol et l'hydroquinone réagissent avec le 1,2-benzoquinone et le 1,4-benzoquinone pour former des radicaux superoxydes (North, 2020; CIRC, 2018). La production d'espèces radicales oxygénées intervient dans l'apoptose induite par les métabolites du benzène et dans la diminution de la différenciation érythroïde (Sun et al., 2018; Sun et al., 2019; Badham et al., 2010). Le phénol, le catéchol, l'hydroquinone et le 1,4-benzoquinone peuvent également réguler l'expression génique par des mécanismes épigénétiques en modifiant les profils de méthylation de l'ADN et d'expression des microARN (Wang et al., 2012; Ravegnini et al., 2015). La régulation épigénétique entraîne des changements dans l'expression des composants des voies de signalisation impliquées dans le développement des cancers, l'inhibition de la réparation de l'ADN, l'apoptose et la différenciation érythroïde (Tian et al., 2012; Yu et al., 2017, 2019; Conti et al., 2016; Gao et al., 2010; Hu et al., 2014; Li et al., 2012, 2013; Liu et al., 2012; Luo et al., 2018; Tabish et al., 2012; Tang et al., 2016). Des données probantes provenant d'études animales indiquent que l'hématotoxicité du benzène est médiée par le récepteur aryl hydrocarbone; le benzène, l'hydroquinone et le p-benzoquinone n'activent toutefois pas directement ce récepteur (CIRC, 2018). Les effets des métabolites du benzène varient et se chevauchent, ce qui laisse supposer que de nombreux métabolites pourraient agir ensemble et influencer les effets toxiques. Le chevauchement des principaux événements moléculaires et du site de toxicité (la moelle osseuse) conduisant à l'hématopoïèse (c'est-à-dire, la différenciation érythroïde) et aux leucémies semble indiquer que l'hématotoxicité et la génotoxicité peuvent être des événements précurseurs clés des cancers induits par le benzène. Il n'existe toutefois pas de preuve directe chez l'homme et l'animal, ce qui ne permet pas de conclure à l'existence d'une causalité pour l'instant.
Le mode d'action cancérogène repose généralement sur une relation concentration-réponse linéaire, bien que la toxicocinétique et la forme de la courbe exposition-réponse à de faibles concentrations dans l'environnement soient encore mal connues, comme le mentionne la section 4.2. Les partisans d'un mode d'action non linéaire à seuil se font néanmoins toujours plus nombreux. Le Health Council of the Netherlands (2014) a conclu que le mode d'action le plus probable repose sur la génotoxicité et l'altération de l'expression génique, qui résultent de mécanismes pour lesquels un seuil existe. North et al. (2020) ont d'ailleurs soutenu que le benzène agit suivant un mécanisme à seuil non linéaire, plusieurs des mécanismes de génotoxicité observés découlant de lésions indirectes de l'ADN qui, lorsqu'elles sont peu nombreuses, peuvent ne pas perturber l'homéostasie. Par exemple, l'inhibition de la topoisomérase, qui peut résulter en la formation de ruptures de brin, est également tolérée jusqu'à un certain niveau avant que surviennent de telles ruptures, ce qui laisse croire à l'existence d'un seuil avant l'apparition d'effets indésirables. North et al. (2020) ont également indiqué que Schnatter et al. (2012) ont constaté que les pics d'exposition peuvent être davantage liés au risque de cancer chez l'homme que l'exposition cumulative (avec des résultats similaires dans les études animales), ce qui laisse supposer qu'un mécanisme à seuil peut s'appliquer à la LAM et aux SMD. Dans une publication ultérieure, North et al. (2021) ont proposé une autre approche dans laquelle le calcul du risque en deçà d'un certain seuil pour des événements clés, comme l'hématotoxicité et la génotoxicité (proposé à 2 ppm [6,4 mg/m3]), diffère de celui lié à des expositions plus élevées. Il est recommandé d'adopter une pente décroissante ou des augmentations par paliers en dessous du seuil, puis de maintenir une augmentation linéaire du risque de LAM une fois ce seuil dépassé.
Le mode d'action potentiel lié aux effets sur la reproduction et le développement découlant de l'exposition au benzène n'est pas encore clairement établi. L'ajout de benzène à des cellules de la granulosa in vitro a favorisé la prolifération cellulaire et l'apoptose, réduit la viabilité cellulaire et modifié la libération hormonale (Tarko et al., 2019; Sirotkin et al., 2020). L'exposition de sperme humain au phénol et à l'hydroquinone a provoqué une baisse significative de la motilité et de la viabilité spermatique ainsi qu'une perte de l'intégrité de l'ADN nucléaire des spermatozoïdes (Mandani et al., 2013). Mihaich et Borgert (2018) ont soutenu que la dysfonction endocrinienne ne découlait probablement pas des effets sur la reproduction et le développement induits par le benzène, le profil des effets observé dans les études animales ne correspondant pas à celui attendu d'une perturbation des mécanismes des œstrogènes, des androgènes, de la thyroïde ou des stéroïdes. Selon l'US EPA (2002), d'autres modes d'action pourraient intervenir, notamment la diminution de l'acide ascorbique chez le fœtus, une modification de la teneur en ADN et en ARN dans le placenta, le foie fœtal et le foie maternel, la détérioration des fibres nerveuses adrénergiques du système nerveux périphérique, une perturbation du flux sanguin dans les ovaires et une diminution de la production de stéroïdes dans l'utérus. La toxicité directe pour le fœtus est également un mode d'action plausible, le benzène et le phénol pouvant tous deux traverser le placenta. Le benzène peut également réduire la circulation et causer une dépression médullaire chez la mère, ce qui affecte les conditions nutritionnelles du fœtus (US EPA, 2002). Selon Sirotkin et al. (2017), le benzène peut agir sur l'appareil reproducteur par des mécanismes similaires à ceux intervenant dans l'hématotoxicité et la cancérogenèse, qui comprennent les aberrations chromosomiques, la production de radicaux libres, et les effets sur le métabolisme cellulaire et les protéines kinases intracellulaires.
Le mode d'action potentiel de la toxicité du benzène pour l'appareil respiratoire est très peu connu. Certaines données probantes semblent indiquer que des mécanismes similaires à ceux d'autres effets pourraient intervenir. Chez le rat, des changements apoptotiques ont été observés dans le parenchyme pulmonaire après une exposition au benzène (Weaver et al., 2007). Chez l'homme, l'exposition in vitro de cellules épithéliales alvéolaires (A549) au benzène a provoqué une augmentation liée à la concentration du nombre de cassures de l'ADN et de la production d'espèces radicales oxygénées (Mascelloni et al., 2015; Mögel et al., 2011; Murugesan et al., 2013; Pariselli et al., 2009). Une activité accrue de la télomérase, qui agit comme un marqueur de l'inflammation, a été observée dans les fibroblastes pulmonaires et les cellules A459 exposés à de faibles concentrations de benzène (Giuliano et al., 2009; Tas et al., 2019). L'exposition au benzène a induit un profil de mutations du gène suppresseur de tumeur TP53 dans les cellules A549 qui était similaire à celui signalé dans les cas de LAM liés au benzène chez l'homme (Billet et al., 2010).
5.6 Populations sensibles et plus fortement exposées
De nombreuses populations sont plus sensibles au benzène en raison de variations au niveau de son métabolisme. La modélisation PBPK semble indiquer que les femmesNote de bas de page 1 métabolisent jusqu'à 26 % plus de benzène que les hommes pour un même scénario d'exposition. Les observations dans une population professionnelle viennent confirmer cette hypothèse, les concentrations de benzène qui, bien que plus élevées dans le sang chez les hommes durant la période d'exposition de 5 heures, continuaient d'être plus élevées dans le sang et l'air expiré chez les femmes 4 heures après l'exposition (US EPA, 2002; ATSDR, 2007; OEHHA, 2014). Par contre, des études de surveillance personnelle ont montré que les hommesNote de bas de page 1 sont plus exposés au benzène, ce qui est attribué à des comportements comme le temps de déplacement et le temps passé à l'extérieur (Wang et al., 2009; Symanski et al., 2009). Dans les études animales, les souris mâles sont plus sensibles que les femelles aux effets génotoxiques et cellulaires dans plusieurs organes après une exposition par inhalation au benzène. Ces différences ont été attribuées à une vitesse de métabolisme du benzène plus élevée chez les mâles, qui serait associée aux taux de testostérone (US EPA, 2002). La modélisation PBPK semble indiquer que, chez la souris, le vieillissement peut réduire l'élimination des conjugués de l'hydroquinone et donc accroître la toxicité liée au benzène (OEHHA, 2014).
De nombreuses études ont montré que les polymorphismes génétiques liés au métabolisme du benzène peuvent avoir un effet positif ou négatif sur la sensibilité individuelle à la toxicité du benzène. Une relation statistiquement significative a été mise en évidence entre certains polymorphismes génétiques, notamment la NQO1, la GSTT1, la GSTM1, la MPO et le CYP2E1, et un risque accru d'effets nocifs chez les travailleurs exposés au benzène (Ramírez‐Lopera, 2021). Par exemple, l'enzyme du métabolisme NQO1 maintient sous forme réduite les quinones, comme l'hydroquinone et le catéchol, favorisant ainsi leur conjugaison et leur élimination. Les polymorphismes qui réduisent considérablement la production de NQO1 sont associés à un risque accru d'hématotoxicité lié au benzène, qui est également augmenté par une activité accrue du CYP2E1. Selon les estimations, 22 % des personnes blanches et 45 % des personnes d'origine asiatique aux États-Unis sont homozygotes pour l'allèle NQO1 (ATSDR, 2007). Des variants du gène CYP2E1 ont été associés à un risque accru de leucémie infantile (Trafalis et al., 2010). Les polymorphismes génétiques des enzymes du métabolisme GSTT1, NQO1, CYP2E1 et EPHX1 entraînent des changements dans les niveaux relatifs des métabolites SPMA, phénol, catéchol et hydroquinone formés au niveau du foie, ce qui influerait sur la toxicité du benzène (OEHHA, 2014). Les polymorphismes des gènes responsables de la réparation de l'ADN, du maintien du génome, des cytokines et des chimiokines ont également été associés à la diminution du nombre de globules blancs induite par le benzène (Wang et al., 2012).
Les enfants pourraient être plus sensibles à l'exposition au benzène en raison de facteurs physiologiques intrinsèques et de facteurs extrinsèques liés à l'exposition. Les enfants seraient plus exposés au benzène par rapport à leur poids corporel que les adultes en raison de leur fréquence respiratoire et de leur activité plus importantes et de leur petite taille. La modélisation PBPK semble indiquer que les nouveau-nés métabolisent moins efficacement le benzène que les adultes (Valcke et Krishnan, 2011). Les populations de cellules hématopoïétiques se transforment en cellules plus matures et se différencient chez les nourrissons et les enfants, ce qui peut les rendre sensibles au déclenchement de la leucémie et à l'hématotoxicité (US EPA, 2002). Une exposition précoce peut survenir lorsque le benzène traverse la barrière placentaire et se retrouve dans le sang ombilical. Les nourrissons qui allaitent peuvent également être exposés par le lait maternel (ATSDR, 2007). Des études épidémiologiques ont indiqué que l'exposition à des sources de benzène au cours de la grossesse ou de la petite enfance est associée à un risque accru de leucémie infantile. L'exposition au cours de la grossesse a également été associée à des naissances prématurées, à un faible poids à la naissance et à une petite circonférence de la tête. Dans les études animales, l'exposition gestationnelle au benzène est fœtotoxique et a provoqué des effets hématotoxiques chez les petits qui se font sentir jusqu'à l'âge adulte.
Plusieurs études de biosurveillance et d'exposition personnelle ont identifié les populations potentiellement plus exposées au benzène. Dans les ECMS, le tabagisme était le meilleur prédicteur des concentrations de benzène dans le sang, qui étaient environ cinq fois plus élevées chez les fumeurs que chez les non-fumeurs. Les données de l'ECMS semblent également indiquer que les personnes d'origine sud-asiatique sont plus exposées au benzène que la population générale (Lyonnais-Gagnon et al., 2022; Karthikeyan et al., 2022). Une étude de biosurveillance sur l'exposition gestationnelle au benzène menée auprès d'une population vivant à proximité d'activités d'extraction de gaz naturel a révélé que la concentration de SPMA dans l'urine était nettement plus élevée chez les personnes qui s'étaient identifiées comme femmes autochtones que chez les autres femmes (Caron-Beaudoin et al., 2018). Des études d'exposition personnelle menées aux États-Unis ont révélé que les Afro-Américains et les Hispano-Américains étaient beaucoup plus exposés au benzène (et à d'autres COV aromatiques) que la population générale (D'Souza et al., 2009; Symanski et al., 2009). Les enfants excrètent des concentrations plus élevées de benzène et de métabolites dans l'urine s'ils vivent avec des fumeurs ou en zone urbaine (Protano et al., 2010, 2012). Les populations vivant en milieu urbain ont également des concentrations plus élevées de benzène dans le sang (US CDC, 2017).
6.0 Établissement des concentrations de références
L'établissement des valeurs guides recommandées se fait en deux étapes. Une CRf est d'abord déterminée en appliquant des facteurs d'incertitude aux concentrations auxquelles l'effet nocif le plus sensible autre que le cancer a été observé. Il est également possible de choisir une CCRS comme valeur de longue durée en fonction de l'excès de risque unitaire par inhalation pour le cancer. Grâce à cette approche, des valeurs guides recommandées permettant de réduire les effets potentiels sur la santé comme ceux observés dans les principales études toxicologiques, d'exposition humaine contrôlée et épidémiologiques liées à la qualité de l'air intérieur peuvent être établies. En ce qui concerne la CRf pour l'exposition de courte durée, la période d'exposition est d'une heure. Quant à la CRf ou la CCRS pour l'exposition de longue durée, l'exposition peut durer des mois, des années, voire toute la vie.
Les CRf ou les CCRS pour les expositions de courte et de longue durées sont ensuite comparées aux mesures de l'exposition dans l'air intérieur résidentiel, puis évaluées en fonction de leur faisabilité technique. Dans certains cas, la valeur guide peut être fixée à une concentration plus élevée que la CRf ou la CCRS (voir la section 6.4 pour en savoir davantage). Le fait de fixer la valeur guide recommandée à une concentration plus élevée que la CRf ou la CCRS produit une marge d'exposition plus faible entre la valeur guide recommandée et la concentration à laquelle des effets sur la santé ont été observés dans les études sanitaires. Cette valeur guide recommandée représente néanmoins une mesure de protection de la santé, tout en demeurant un objectif réalisable pour l'amélioration de la qualité de l'air intérieur lors de l'évaluation des mesures de gestion du risque.
6.1 Concentration de référence pour l'exposition de courte durée
La CRf pour l'exposition de courte durée devrait s'appliquer aux expositions courtes ou intermittentes et être représentative des pics d'exposition survenant en milieu résidentiel intérieur. Il est recommandé de comparer la valeur guide pour l'exposition de courte durée à un échantillon d'air prélevé sur une période d'une heure. Une CRf pour l'exposition de courte durée repose de préférence sur des études d'expositions de courte durée, aiguës ou intermittentes menées chez l'homme faisant état d'effets sur la santé. Des données toxicologiques peuvent être prises en compte en l'absence de données humaines.
L'exposition de courte durée au benzène provoquerait des effets sur le système respiratoire et le SNC, hématoxiques et systémiques en milieu de travail et au cours d'un rejet accidentel dans l'environnement. Dans ces études, les niveaux d'exposition sont soit des dizaines de fois plus élevés que les concentrations présentes dans l'environnement (> 800 mg/m3 ou > 800 000 μg/m3), soit ils n'ont pas été précisés (comme dans le cas du rejet accidentel). Dans un cas comme dans l'autre, une coexposition à d'autres polluants est probable. Les expositions décrites durent de plusieurs jours à plusieurs semaines et ne correspondent pas à la définition d'expositions de courte durée ou intermittentes à des concentrations maximales. La seule étude d'exposition humaine contrôlée décrivant les effets sur la santé pendant une période appropriée n'a relevé aucun symptôme chez des personnes volontairement exposées pendant 2 heures à 350 mg/m3 (110 ppm) (Srbova 1950, cité dans OEHHA, 2014). Les symptômes cliniques reposaient sur une seule remarque fournie et n'ont pas été systématiquement examinés. Les études humaines disponibles n'ont donc pas été prises en compte pour obtenir une CRf pour l'exposition de courte durée (durée moyenne d'une heure) dans l'air intérieur résidentiel.
Des études toxicologiques portant sur les expositions de courte durée ou intermittentes sont disponibles chez l'animal. Des effets sur le SNC, une détresse respiratoire et la létalité ont été relevés après des expositions de courte durée à des concentrations très élevées de benzène. Dans ces études, les concentrations de benzène (c'est-à-dire > 19 000 mg/m3 ou 19 000 000 μg/m3) sont toutefois plus de 19 000 000 fois plus élevées que les niveaux d'exposition mesurés dans l'air intérieur résidentiel au Canada (niveaux moyens compris entre 0,4 et 2,2 μg/m3). La plupart des valeurs provenant des études menées dans les maisons canadiennes sont basées sur une moyenne de 24 heures. Bien qu'elles soient nettement plus élevées que la moyenne sur 24 heures, les valeurs maximales sur 1 heure devraient toujours être des dizaines de fois plus petites que les valeurs mesurées dans les études toxicologiques mentionnées ci-dessus. Par conséquent, il est peu probable qu'une CRf qui reposerait sur de tels niveaux d'exposition s'applique aux concentrations de benzène présentes dans l'air intérieur résidentiel. Des expositions répétées ou sur plusieurs jours ont été relevées chez l'animal, mais ces études n'ont pas été prises en compte pour obtenir une CRf pour l'exposition de courte durée (durée moyenne d'une heure) au benzène.
Une CRf pour l'exposition de courte durée au benzène n'a donc pas été établie par manque d'études s'appliquant à l'établissement d'une CRf pour une exposition moyenne d'une heure.
6.2 Concentration de référence et concentration correspondant à un risque spécifié pour l'exposition de longue durée
6.2.1 Concentration de référence pour l'exposition de longue durée produisant des effetsautres que le cancer
Examen des principales études
Les principaux effets non cancérogènes relevés pour l'exposition par inhalation au benzène sont la toxicité respiratoire, reproductive et hématologique. La toxicité respiratoire et la toxicité reproductive sont les deux principales catégories d'effets sur la santé signalés aux niveaux d'exposition (1 à 10 μg/m3[0,5 à 3 ppb]) généralement présents dans l'air intérieur résidentiel au Canada. D'autres organisations avaient préalablement identifié l'hématotoxicité comme étant le principal effet non cancérogène pour les niveaux d'exposition de référence. Chez l'homme, l'hématotoxicité a été principalement observée en milieu de travail où l'exposition est considérée comme « faible » lorsqu'elle est généralement supérieure ou égale à 3,2 mg/m3 (1 ppm).
Principales études sur les expositions pertinentes du point de vue de l'environnement
Des études portant sur l'exposition à des concentrations de benzène présentes dans l'air intérieur et extérieur ont fait état de toxicité respiratoire. Une étude transversale portant sur l'exposition au benzène dans l'air intérieur résidentiel au Canada dans laquelle la MG des concentrations était de 1,06 μg/m3 (0,33 ppb) a établi une association négative entre l'augmentation de l'EIQ des concentrations de benzène (1,31 μg/m3, 0,41 ppb) après transformation logarithmique et le VEMS/CVF chez les hommes, les enfants de moins de 17 ans et les personnes âgées de 39 à 64 ans (Cakmak et al., 2014). Une augmentation de la concentration de benzène de 10 μg/m3 (3,1 ppb) par semaine dans les maisons et les écoles où la concentration moyenne était comprise entre 1,0 et 10,7 μg/m3 (0,31 et 3,34 ppb) a été associée à une diminution du VEMS, du VEMS/CVF et d'autres marqueurs de la fonction pulmonaire chez les enfants au Portugal (Martins et al., 2012). Une étude menée en France a fait état d'une association entre l'exposition moyenne à 3,85 μg/m3 (1,2 ppb) de benzène dans l'air intérieur résidentiel et une exacerbation des symptômes de l'asthme chez l'enfant (Rive et al., 2013). Des études menées dans l'air intérieur ont toutefois obtenu des résultats mitigés. D'autres études portant sur l'exposition dans l'air intérieur et personnelle au benzène n'ont relevé aucune association entre l'exposition au benzène et la fonction pulmonaire chez les enfants asthmatiques, ou l'infection des voies respiratoires inférieures, la toux et la respiration sifflante chez les nourrissons (Smargiassi et al, 2014; Ferrero et al., 2017; Vanker et al., 2017). Cette association peut dépendre de l'effet mesuré, puisqu'une méta-analyse de 15 études a révélé une association statistiquement significative entre l'asthme et l'exposition au benzène, et que cette même étude n'a relevé aucune association statistiquement significative entre l'exposition au benzène et la rhinite ou la bronchite (Liu et al., 2022).
Des études menées chez l'homme et l'animal ont fait état d'effets respiratoires après une exposition à des concentrations beaucoup plus élevées de benzène. Des études animales ont fait état d'une augmentation de la fréquence respiratoire et de changements apoptotiques dans le parenchyme pulmonaire chez la souris et le rat après une exposition au benzène (OEHHA, 2014; Weaver et al., 2007). L'exposition professionnelle au benzène a été associée à des cas d'essoufflement et d'irritation respiratoire. Les autopsies ont révélé, entre autres effets, des poumons hémorragiques et œdémateux chez les personnes ayant subi une exposition aiguë létale au benzène (ATSDR, 2007).
Les études portant sur l'exposition dans l'air intérieur et personnelle ont mis en évidence une forte corrélation entre les concentrations de benzène et d'autres polluants de l'air intérieur qui peuvent avoir des effets similaires sur le système respiratoire. La plupart des études n'ont pris en compte aucun co-polluant, bien que toutes les études présentées ont tenu compte du tabagisme (lors de la sélection des sujets ou de la correction du modèle). Parmi les études menées dans l'air intérieur, seule celle de Cakmak et al. (2014) a pris en compte le NO2, l'O 3 et les PM 2,5 à la clinique (mais pas à la maison), alors que celle de Smargiassi et al. (2014) a pris en compte les effets de la moisissure. Les effets sur la santé de l'exposition au benzène n'ont pas été évalués dans les études d'exposition humaine contrôlée pour confirmer la spécificité des effets comme la toxicité respiratoire et fournir plus de données sur la relation dose-réponse pour les concentrations environnementales. Bien que les études réalisées chez l'animal et en milieu de travail soutiennent la plausibilité biologique de la toxicité respiratoire en tant qu'effet du benzène, il est impossible d'exclure la possibilité que les effets respiratoires observés au cours d'une exposition dans l'environnement soient partiellement attribuables à des coexpositions ou des effets de mélanges. La toxicité respiratoire est toutefois l'un des rares effets sur la santé associés au benzène qui est suffisamment sensible pour être observé aux concentrations présentes en milieu intérieur résidentiel. Bien que les données probantes actuelles ne permettent pas d'élaborer une CRf, cet effet devrait être considéré comme un effet sanitaire émergent préoccupant découlant de concentrations similaires à celles retrouvées dans l'environnement.
La toxicité pour la reproduction et le développement peut être un autre effet potentiel hautement sensible de l'exposition au benzène dont ont fait état les études portant sur l'exposition personnelle et dans l'air extérieur. L'exposition personnelle maternelle au benzène au cours de la grossesse a été associée à un poids plus faible à la naissance et à une plus petite circonférence de la tête chez le nouveau-né dans une étude où la médiane des concentrations était de 1,8 μg/m3 (0,56 ppb) (Slama et al., 2009). Des effets similaires sur le poids à la naissance ont été associés à une augmentation de l'exposition maternelle au benzène dans l'air extérieur résidentiel dans une vaste étude cas-témoin où la concentration moyenne de benzène dans l'air ambiant était de 3,5 μg/m3 (1,1 ppb) (Ghosh et al., 2012). Des augmentations de la concentration de benzène dans l'air comprises entre 0,64 et 1 μg/m3 (0,2 et 0,31 ppb) au cours de la grossesse ont été associées à des naissances prématurées dans des études où l'exposition au benzène se situait entre 1,3 et 2,1 μg/m3(0,41 et 0,66 ppb) (Estarlich et al., 2016; Wilhelm et al., 2011). Une méta-analyse a d'ailleurs révélé une association significative entre l'exposition au benzène et le faible poids à la naissance, mais pas entre l'exposition au benzène et les naissances prématurées (Liu et al., 2022). Ces études ont fait état d'une forte corrélation entre les concentrations de benzène et celles d'autres polluants atmosphériques ou provenant du trafic routier, et des effets similaires ont été observés parmi les co-polluants. Contrairement à Estarlich et al. (2016), les auteurs n'ont pas tenu compte de l'effet des co-polluants, dont certains (par exemple, NO 2 et PM2,5) ont été associés à des effets similaires sur la reproduction (Johnson et al., 2022). Toutes les études passées en revue ont pris en compte le tabagisme (lors de la sélection des sujets ou de la correction du modèle). Les effets mis en évidence dans les études toxicologiques confirment la plausibilité biologique de la toxicité pour la reproduction et le développement signalée dans les études épidémiologiques, bien que les niveaux d'exposition au benzène y sont des dizaines de fois plus élevés. Comme pour les études portant sur les effets respiratoires découlant de concentrations présentes dans l'environnement, l'absence de coexpositions et la forte corrélation entre des co-polluants aux effets similaires soulèvent la question de savoir si le benzène est à l'origine de ces effets. Bien que les données probantes actuelles ne permettent pas d'inclure cet effet dans l'établissement d'une CRf, la toxicité pour la reproduction et le développement devrait être considérée comme un effet sanitaire émergent préoccupant découlant de concentrations similaires à celles retrouvées dans l'environnement.
Principales études sur l'exposition professionnelle
L'hématotoxicité est un effet bien connu de l'exposition au benzène et peut être un précurseur d'affections sanguines plus graves. Bien qu'il s'agisse de l'effet le plus sensible découlant de niveaux d'exposition professionnelle, il a rarement été signalé aux concentrations présentes dans l'environnement. Aucune étude se penchant sur l'effet des concentrations de benzène dans l'air intérieur ou extérieur résidentiel et l'hématoxicité n'a été repérée. Les études animales, comme les études professionnelles, ont fait état d'une détérioration de la fonction hématopoïétique démontrée par des changements dans les cellules sanguines circulantes après des expositions allant de < 3,2 à 9600 mg/m3 (< 1 à 3000 ppm) (Santé Canada, 2013a; US EPA, 2002; ATSDR, 2007). Des associations entre des marqueurs hématologiques et la concentration de benzène dans le sang ont été signalées chez les populations exposées à la pollution environnementale ainsi que chez la population générale de la NHANES et de l'ECMS (Chen, Sun et al., 2019; Doherty et al., 2017; Watson et al., 2020, Cakmak et al., 2020). La spécificité des effets hématotoxiques de l'exposition au benzène a été établie dans les études animales ainsi que dans les études professionnelles où l'exposition à d'autres agents hématotoxiques est fréquemment prise en compte dans la méthodologie. La distribution modifiée des types de cellules observée chez les populations exposées hors milieu professionnel ne correspond pas à celle observée après une exposition professionnelle.
Les études relevées par la recherche documentaire de la littérature publiée après 2009, tout comme les études antérieures, ont fait état d'effets hématotoxiques comme une diminution des types de cellules dérivées des cellules souches myéloïdes, y compris les granulocytes, les plaquettes et les éosinophiles, après une exposition à environ 1 ppm (3,2 mg/m3) de benzène (Bassig et al., 2016; Halati et al., 2017). Toutes ces études n'ont pas bien caractérisé l'exposition des groupes témoins, qui sont souvent définis comme des travailleurs évoluant sur le lieu de travail ou un autre lieu de travail où l'exposition est beaucoup plus faible, mais pas inexistante. Des effets statistiquement significatifs sont invariablement observés dans les groupes soumis à la plus faible exposition, qui est inférieure à 1 ppm (3,2 mg/m3) (sans limite inférieure) dans le cas de Lan et al. (2004), Bassig et al. (2016) et Harati et al. (2017). Étant donné le manque de clarté dans l'identification d'une concentration minimale avec effet nocif observé (CMENO), l'utilisation d'une concentration repère constitue une approche appropriée pour établir un point de départ. Zhang et al. (2016) ont effectué une modélisation de la dose repère pour la diminution du nombre de globules blancs chez les travailleurs exposés au benzène à l'aide des modèles de Hill et log-probit, les limites inférieures de l'exposition cumulative au benzène étant comprises entre 4,4 et 37,8 mg/m3-année (1,4 et 11,8 ppm-année). Cette valeur a été sélectionnée comme niveau d'effet critique et comme point de départ pour l'hématotoxicité.
Bien que la plausibilité biologique et la spécificité de l'hématotoxicité de l'exposition au benzène soient manifestes, il subsiste des questions non résolues quant à l'extrapolation des effets des concentrations présentes en milieu de travail aux concentrations beaucoup plus faibles typiques des milieux intérieurs résidentiels. Les métabolites responsables de l'hématotoxicité et leur dosage interne pour les concentrations de benzène en milieu résidentiel ne sont pas clairs pour l'instant, ce qui expliquerait les contradictions au niveau des effets hématotoxiques relevés par l'ECMS et la NHANES par rapport à ceux signalés en milieu professionnel.
Établissement d'une concentration de référence
Les effets hématotoxiques ont été associés à une BMCL comprise entre 4,4 et 37,8 mg/m3-année (1,4 et 11,8 ppm-année) de benzène dans une étude réalisée en milieu de travail (Zhang et al., 2016), ce qui équivaut à une concentration moyenne pondérée dans le temps de benzène comprise entre 0,11 et 0,95 mg/m3 (0,034 et 0,3 ppm) au cours de 40 ans de vie professionnelle. Ces valeurs se situent dans la fourchette de points de départ utilisés par l'ATSDR (2007), l'Anses (2008) et l'OEHHA (2014) pour établir les niveaux de référence pour les expositions de longue durée par inhalation (voir l'annexe D, section D2 pour en savoir davantage).
La BMCL ajustée pour une exposition résidentielle (BMCL x 8 h/24 h x 5 j/7 j) varie entre 26 et 230 μg/m3 (8,1 et 72 ppb). Un ajustement pour la durée de l'étude n'est pas nécessaire, l'étude ayant déjà pris en compte l'exposition vie entière. Un facteur d'incertitude de 30 a ensuite été appliqué pour tenir compte du fait que les sujets étaient des travailleurs en bonne santé (facteur de 10) et prendre en compte l'incertitude liée à la base de données en ce qui a trait à l'utilisation d'un modèle PBPK pour des expositions pertinentes du point de vue de l'environnement (facteur de 3). La CRf pour l'hématotoxicité qui en résulte est de 0,9 μg/m3 (0,3 ppb).
La CRf pour l'exposition de longue durée produisant des effets autres que le cancer est ainsi de 0,9 μg/m3 (0,3 ppb).
6.2.2 Concentration correspondant à un risque de cancer
Examen des principales études et évaluations
Le benzène est classé comme substance cancérogène pour l'homme par Santé Canada (Environnement Canada et Santé et Bien-être social Canada, 1993), l'US EPA (2002) et le CIRC (2018) sur la base d'indications solides chez l'homme et l'animal de laboratoire. La première classification de la cancérogénicité du benzène reposait largement sur des études réalisées en milieu de travail, alors que cette conclusion s'appuie sur des études plus récentes portant sur des concentrations plus faibles de benzène. Plusieurs organismes de réglementation ont mené des analyses de risques auprès de deux grandes cohortes épidémiologiques, soit les cohortes Pliofilm et de travailleurs chinois, qui ont été passées en revue dans le précédent document de conseils de Santé Canada (2013a).
Environnement Canada et Santé et Bien-être social Canada (1993) ont évalué le benzène comme substance d'intérêt prioritaire. Une étude sur la mortalité au sein de la cohorte Pliofilm (Rinsky, 1987) a été considérée comme le justificatif du potentiel leucémogène et a servi de base pour déterminer une concentration tumorigène associée à une augmentation de 5 % de la mortalité attribuable aux tumeurs (CT0,05). Une concentration atmosphérique de 3,0 μg/m3 associée à un niveau de risque 1 × 10-5 est obtenue par extrapolation linéaire à partir de la CT 0,05 (Santé Canada, 2013a).
Dans ses Recommandations pour la qualité de l'eau potable au Canada : Document technique – Benzène, Santé Canada (2009) a passé en revue l'évaluation du risque de cancer par l'eau potable effectuée par l'OEHHA (2001). L'analyse du risque de cancer par inhalation publiée en 2000 par l'US EPA avait été examinée dans le précédent document de conseils de Santé Canada (2013a). Ce document a conclu que la fourchette de concentrations associée à un niveau de risque de 1 × 10-5 établie par les évaluations de l'OEHHA (2001), de Santé Canada (2009) et de l'US EPA (2000) se situe entre 0,6 et 4,5 μg/m3, et qu'il n'existe pas de différence significative entre les résultats de ces trois évaluations. La fourchette de concentrations correspondant à un niveau de risque situé entre 1 × 10-6 et 1 × 10 -4 est comprise entre 0,06 et 45 μg/m3, avec un excès de risque unitaire par inhalation variant entre 1,6 × 10-5 et 2,2 × 10-6 (μg/m3)-1.
Santé Canada a retenu l'excès de risque unitaire par inhalation de 1,6 × 10 -2 (mg/m3)-1 comme valeur toxicologique de référence (VTR) pour le benzène sur les sites contaminés fédéraux. La VTR correspondait à un excès de risque unitaire de leucémie vie entière pour la population générale selon l'analyse de risques de l'OEHHA (2001) et de celle du précédent document de conseils de Santé Canada (2013a, 2021b).
Aucune autre évaluation complète du risque de cancer n'a été publiée pour le benzène depuis celle de Santé Canada (2013a) effectuée dans l'air intérieur. Plusieurs autres agences internationales ont toutefois publié des analyses et des critiques des précédentes évaluations du risque de cancer pour soutenir l'élaboration de valeurs de référence pour le cancer. Les autorités européennes ont également établi des excès de risque unitaire par inhalation liés à la présence de benzène dans l'air intérieur reposant sur les mêmes cohortes, qui ont abouti à une plage similaire d'estimations de risque. La concentration atmosphérique correspondant à un niveau de risque de cancer de 10 -5 établie à partir de ces évaluations est comprise entre 1,0 et à 4,5 μg/m3(voir l'annexe D, section D3 pour en savoir davantage).
Les évaluations précédentes du risque de cancer ont utilisé des données reposant sur la LAM ou toutes les leucémies, et des modèles linéaires de la relation dose-réponse aux faibles doses de benzène. Ces approches font toutefois l'objet de certaines critiques dans la littérature. Des études sur l'exposition à de faibles doses menées auprès de travailleurs d'usine chinois ont conduit les auteurs à supposer que le métabolisme du benzène n'est pas linéaire lorsque les concentrations sont inférieures à 9,6 mg/m3 (3 ppm) (Kim et al., 2006a, 2006b). Ce modèle suscite de nombreuses préoccupations. Mais, s'il venait à être confirmé dans des études ultérieures, d'importants changements devraient être apportés dans les estimations de risque issues des cohortes Pliofilm et autres (Vlaanderen et al., 2011). Les effets hématotoxiques légers associés au benzène signalés dans les études de biosurveillance en population générale ainsi que les signes évocateurs d'effets cancérogènes associés à l'exposition à des concentrations de benzène présentes dans l'environnement (par exemple, les grappes de LAM dans les villes pétrolières et gazières, et les associations entre l'exposition au trafic routier ou au benzène et la leucémie infantile) indiquent également qu'il est nécessaire de mieux comprendre le métabolisme du benzène et la relation dose-réponse aux faibles doses. Outre ces considérations, des examens récents du mode d'action cancérogène du benzène plaident en faveur d'un modèle à seuil pour l'évaluation du risque de cancer, avec l'hématotoxicité et la génotoxicité comme événements précurseurs clés. Ces examens prometteurs ne constituent qu'un début, car aucune évaluation quantitative du risque de cancer fondée sur un seuil n'était disponible auprès des organismes de réglementation ni dans la littérature publiée au moment d'écrire ces lignes.
De plus, Li et Schnatter (2018) ont suggéré de faire reposer l'évaluation des risques liés au benzène sur tous les SMD plutôt que sur la LAM ou la leucémie seulement. Les auteurs indiquent que les SMD sont probablement attribuables à l'exposition au benzène (bien que le CIRC n'ait pas tiré cette même conclusion), les SMD et la LAM étant des maladies néoplasiques touchant la lignée myéloïde. Les SMD sont préconisés comme mesure plus appropriée du risque depuis que des études épidémiologiques rigoureuses ont mis en évidence un risque excédentaire de SMD chez les travailleurs exposés au benzène et que le risque de SMD peut ne pas avoir été pris en compte dans les populations précédemment étudiées du fait que les critères diagnostiques étaient moins bien développés qu'aujourd'hui. Toutefois, comme les SMD sont moins répandus que toutes les leucémies et qu'ils pourraient ne pas avoir été correctement diagnostiqués dans le passé, il existe considérablement moins de données sur leur incidence chez les populations exposées au benzène.
Établissement d'une concentration correspondant à un risque spécifié
Grâce aux principales évaluations du risque de cancer, le précédent document de conseils de Santé Canada (2013b) est arrivé à la conclusion que l'excès de risque unitaire par inhalation était compris entre 2,2 × 10-6 et 1,6 × 10-5(μg/m3)-1, ce qui correspond à une concentration allant de 0,6 à 4,5 μg/m3 associée à un niveau de risque de 1 × 10-5. Les principales questions concernant l'évaluation du risque de cancer lié au benzène, et plus particulièrement la forme de la courbe dose-réponse aux concentrations présentes dans l'environnement, demeurent sans réponse. Toutefois, les évaluations plus récentes du risque de cancer se situent également dans cette fourchette, ce qui indique qu'il n'est pas nécessaire de revoir pour l'instant la conclusion précédente.
La CCRS proposée de 0,6 μg/m3 (0,2 ppb) qui repose sur le risque de cancer représente la borne inférieure de cette plage et correspond à un excès de risque unitaire par inhalation de 1,6 x 10-5(μg/m3)-1.
6.2.3 Sélection d'une concentration correspondant à un risque spécifié pour l'exposition de longue durée
La CRf proposée pour les effets hématotoxiques non cancérogènes est de 0,9 μg/m3 (0,3 ppb). Étant de 0,6 μg/m3 (0,2 ppb), la concentration correspondant à un risque de cancer offre donc une meilleure protection pour la santé. Certains ont avancé que l'hématotoxicité est un événement déclencheur clé de la cancérogénicité du benzène. Toutefois, comme les modes d'action hématotoxique et cancérogène restent encore à établir, Santé Canada ne partage pas entièrement cette conclusion.
La CCRS proposée est donc fixée à 0,6 μg/m3 (0,2 ppb) pour l'exposition de longue durée au benzène.
6.3 Comparaison du niveau d'exposition dans les maisons canadiennes à la concentration correspondant à un risque spécifié et établissement d'une valeur guide
Au cours des dernières années, Santé Canada a mené des études d'exposition dans de nombreuses villes canadiennes, dont Edmonton, Halifax, Regina, Windsor, Ottawa et Montréal, ainsi que dans la collectivité des Premières Nations de la zone de Sioux Lookout, en Ontario, et dans une réserve des Premières Nations du sud du Manitoba (Santé Canada, 2010a, 2010b, 2012, 2013b, 2021a; Mallach et al., 2017; Goldberg et al., 2015; Weichenthal et al., 2013; Zhu et al., 2005; Kovesi et al., 2022). Ces études sont considérées comme les données les plus récentes et les plus représentatives permettant de quantifier les niveaux d'exposition de longue durée dans les maisons canadiennes. D'autres études canadiennes confirment ces données en se servant d'autres méthodes d'échantillonnage et d'analyse (Santé Canada, 2021a; Li et al., 2019; Héroux et al., 2008; Zhu et al., 2005; Conseil national de recherches Canada, 2021). Selon les données préliminaires, les concentrations de benzène dans les maisons neuves sont similaires à celles mesurées dans d'autres maisons canadiennes (Santé Canada, 2021a). Les CRf ou les CCRS pour l'exposition de longue durée reposent sur la caractérisation de la relation concentration-réponse et, le cas échéant, sur l'application de facteurs d'incertitude pour tenir compte de la variabilité et de données manquantes. Les situations dans lesquelles s'appliquent les CRf ou les CCRS, la faisabilité technique et la disponibilité des mesures d'atténuation des risques ne sont pas prises en compte dans leur établissement. Ces questions doivent toutefois être prises en considération lors de l'établissement de valeurs guides pour l'exposition de longue durée.
Pour établir les valeurs guides proposées, la CRf ou la CCRS pour l'exposition de longue durée est d'abord comparée aux données d'exposition relatives aux maisons canadiennes. La possibilité d'atteindre de tels niveaux par le contrôle des sources intérieures est ensuite évaluée. Si la CRf ou la CCRS peut être atteinte, la valeur identifiée est définie comme valeur guide proposée. Sinon, une concentration plus élevée peut être choisie, tout en ciblant une valeur guide qui protège la santé selon les données probantes actuelles.
Les critères de la présente évaluation servant à établir les valeurs guides proposées pour les expositions de longue et de courte durées au benzène sont les suivants :
- une valeur atteignable dans les maisons canadiennes en l'absence de sources importantes de benzène dans l'air intérieur;
- une valeur qui n'est pas associée à des effets appréciables sur la santé, compte tenu des niveaux d'exposition de référence établis et des données probantes actuelles.
6.3.1 Concentration correspondant à un risque spécifié et valeur guide proposée pour l'exposition de longue durée
La CCRS a été fixée à 0,6 μg/m3 (0,2 ppb) pour l'exposition de longue durée au benzène. La médiane des concentrations de benzène mesurées en moyenne pendant 24 heures dans les maisons canadiennes dans le cadre des études de la qualité de l'air intérieur résidentiel menées par Santé Canada était comprise entre 0,4 et 2,2 μg/m3 et le 95e percentile entre 2,4 et 18,6 μg/m3 (voir le Tableau 2). La médiane des concentrations de benzène mesurées en moyenne pendant 5 ou 7 jours dans les maisons des réserves de la zone de Sioux Lookout et du sud du Manitoba était comprise entre 1,2 et 1,6 μg/m3 et le 95e percentile entre 6,3 et 11,1 μg/m3. Des concentrations similaires de benzène ont été observées dans d'autres études canadiennes qui se sont servies d'autres méthodes d'échantillonnage et d'analyse (voir la section 2.2). Ces données indiquent que la CCRS pour l'exposition de longue durée pourrait être dépassée dans de nombreuses maisons canadiennes. La CCRS a néanmoins été établie à partir des données scientifiques les plus récentes et s'applique à l'exposition au benzène dans l'air intérieur.
La concentration moyenne de benzène au Canada était de 0,5 μg/m3 dans l'air extérieur en 2019, ce qui inclut les sites ruraux, urbains et à fortes émissions. Les données issues des études de Santé Canada montrent que l'infiltration à partir de sources extérieures est une importante source de benzène dans l'air intérieur et que les concentrations plus faibles de benzène sont associées à un TRA plus élevé et à des fenêtres ouvertes. La ventilation est donc une stratégie clé de réduction de l'exposition au benzène dans l'air intérieur, tout en reconnaissant que la capacité de la ventilation à réduire cette exposition est limitée par la concentration de benzène régnant à l'extérieur. Étant donné que la concentration moyenne de benzène dans l'air extérieur au Canada est inférieure à la CCRS et à la concentration présente dans bien des maisons, la ventilation peut être considérée comme une stratégie permettant d'abaisser la concentration de benzène dans l'air intérieur. Les principales sources de benzène dans l'air intérieur résidentiel comprennent les garages attenants, le fait de fumer à l'intérieur et l'entreposage de produits comme l'essence, les peintures et les solvants dans le garage ou la maison. Les données issues des études de Santé Canada démontrent également que l'entreposage sécuritaire de l'essence, des peintures et des solvants ainsi que la réduction de la consommation de tabac à la maison sont associés à une diminution de la concentration de benzène dans l'air intérieur. Considérées dans leur ensemble, ces données semblent indiquer que la ventilation et le contrôle des sources permettent de réduire les concentrations de benzène en deçà de la CCRS dans de nombreuses maisons au Canada.
Par conséquent, la valeur guide proposée de 0,6 μg/m3 (0,2 ppb) pour l'exposition de longue durée au benzène est considérée comme protégeant la santé tout en demeurant réalisable, étant donné l'efficacité attendue de la ventilation comme stratégie de réduction de la concentration de benzène dans l'air intérieur en l'absence de sources de benzène dans l'air extérieur à proximité.
7.0 Lignes directrices proposées
7.1 Valeur guide proposée
| Valeur guide | Concentration | Effet critique | |
|---|---|---|---|
| μg/m3 | ppb | ||
| Exposition de longue durée | 0,6 | 0,2 | Leucémie |
La valeur guide proposée est destinée à un public professionnel pour mieux soutenir l'évaluation des risques et justifier les mesures de gestion des risques. La durée d'échantillonnage utilisée pour comparer la concentration mesurée à la valeur guide pour l'exposition de longue durée devrait être d'au moins 24 heures dans des conditions normales. Par ailleurs, la moyenne des résultats obtenus à partir d'échantillons répétés prélevés à différents moments de l'année permettra d'obtenir une estimation plus représentative de l'exposition de longue durée.
7.2 Recommandations en matière de gestion des risques
Au Canada, la concentration de benzène dans de nombreuses maisons devrait être supérieure à la valeur guide pour l'exposition de longue durée. L'exposition au benzène dans l'air intérieur devrait être réduite par une ventilation adéquate, le contrôle ou l'élimination des sources intérieures et des changements de comportement des occupants. Santé Canada ne recommande pas de mesurer les concentrations de benzène dans l'air intérieur résidentiel, mais plutôt de mettre en œuvre les stratégies d'atténuation des risques décrites ci-dessous pour améliorer la qualité de l'air intérieur.
Les études de Santé Canada ont associé plusieurs facteurs clés à des concentrations moyennes plus ou moins élevées de benzène dans l'air intérieur. La concentration de benzène dans l'air intérieur était de 40 à 240 % plus élevée dans les maisons avec un garage attenant. L'entreposage d'essence, de peintures et de solvants au garage et à la maison a été associé à une augmentation de 33 à 390 % de la concentration de benzène dans l'air intérieur (Santé Canada, 2021a; Mallach et al., 2017). La concentration de benzène dans l'air intérieur était de 56 à 194 % plus élevée selon la saison dans les maisons où il était permis de fumer à l'intérieur. En plus des sources intérieures, chaque augmentation de 10 % de la concentration de benzène dans l'air extérieur a été associée à une augmentation de 4,1 à 6,4 % de celle dans l'air intérieur (Santé Canada, 2021a). La concentration de benzène était de 4 à 47 % plus faible dans les maisons mieux ventilées, selon la méthode de ventilation utilisée, et 62 % plus faible avec l'utilisation d'un ventilateur d'extraction posé dans un garage attenant (Santé Canada, 2021a; Mallach et al., 2017).
Compte tenu de ces observations, de nombreuses stratégies peuvent être employées pour réduire l'exposition au benzène dans l'air intérieur. Plusieurs d'entre elles contribueront également à réduire les concentrations d'autres contaminants dans l'air intérieur, améliorant ainsi la qualité de l'air intérieur.
- S'il y a un garage attenant :
- envisager d'installer et d'utiliser un ventilateur d'extraction dans le garage;
- maintenir une bonne étanchéité entre le garage attenant et la maison;
- éviter de mettre en marche les voitures, les souffleuses à neige, les tondeuses ou tout autre équipement à essence dans le garage.
- Éviter d'entreposer de l'essence, des peintures, des solvants et d'autres produits chimiques dans la maison ou le garage attenant. Ces produits devraient être entreposés dans des contenants hermétiquement fermés et, si possible, conservés dans un lieu qui n'est pas raccordé au système de ventilation de la maison.
- Remplacer l'équipement à essence comme la tondeuse, la souffleuse à feuilles et la souffleuse à neige par des appareils alimentés par batterie.
- Ne pas fumer à l'intérieur.
- Améliorer la ventilation dans la maison :
- en utilisant des stratégies de ventilation naturelle comme l'ouverture des fenêtres et des portes intérieures si possible (vérifier d'abord les conditions locales qui affectent la qualité de l'air extérieur : Cote air santé);
- en utilisant des stratégies de ventilation mécanique comme les ventilateurs à évacuation extérieure, les systèmes de ventilation à air pulsé, les ventilateurs-récupérateurs d'énergie et les ventilateurs-récupérateurs de chaleur;
- en s'assurant que le taux de renouvellement de l'air n'est pas trop élevé (p. ex., air sec et courants d'air).
- Pour en savoir davantage, consulter la fiche de renseignements La ventilation et le milieu intérieur (Santé Canada, 2018) et l'infographie La ventilation et la qualité de l'air intérieur (Santé Canada, 2019b).
- Lorsque la qualité de l'air extérieur est mauvaise (par
exemple, en raison d'un fort volume de circulation à l'heure
de pointe ou de la fumée d'un incendie de forêt) :
- garder les fenêtres et les portes fermées et se servir de la climatisation pour maintenir une température confortable à l'intérieur;
- poser des coupe-froid aux fenêtres et aux portes;
- faire fonctionner autant que possible le système de ventilation en mode recirculation et introduire de l'air frais lorsque la qualité de l'air extérieur s'améliore.
- Pour en savoir davantage, consulter l'infographie Assurer la qualité de l'air intérieur (Santé Canada, 2020).
- Installer et entretenir adéquatement les foyers et les poêles
à bois et évacuer les polluants à l'extérieur.
- Pour en savoir davantage, consulter Fumée de bois et air intérieur.
8.0 Références
Abplanalp, W., DeJarnett, N., Riggs, D.W., Conklin, D.J., McCracken, J.P., Srivastava, S., Xie, Z., Rai, S., Bhatnagar, A. et O'Toole, T.E. (2017) Benzene exposure is associated with cardiovascular disease risk. PLoS ONE, 12(9): e0183602.
Abplanalp, W.T., Wickramasinghe, N.S., Sithu, S.D., Conklin, D.J., Xie, Z., Bhatnagar, A., Srivastava, S. et O'Toole, T.E. (2019) Benzene Exposure Induces Insulin Resistance in Mice. Toxicological Sciences, 167(2): 426-437.
AGS (Ausschuss für Gefahrstoffe; Comité des substances dangereuses) (2012) Begründung zu Benzol in BekGS910. Stand: Mai 2012. Ausgabe: November 2012. https://www.baua.de/DE/Angebote/Rechtstexte-und-Technische-Regeln/Regelwerk/TRGS/pdf/910/910-benzol.pdf?__blob=publicationFile&v=2. Zugegriffen: 17. Juni 2019
Amin, M.M., Rafiei, N., Poursafa, P., Ebrahimpour, K., Mozafarian, N., Shoshtari-Yeganeh, B., Hashemi, M. et Kelishadi, R. (2018) Association of benzene exposure with insulin resistance, SOD, and MDA as markers of oxidative stress in children and adolescents. Environmental Science and Pollution Research International, 25(34): 34046-34052.
Amini, H., Yunesian, M., Hosseini, V., Schindler, C., Henderson, S.B. et Künzli, N. (2017) A systematic review of land use regression models for volatile organic compounds. Atmospheric Environment, 171: 1-16.
Angelini, S., Bermejo, J.L., Ravegnini, G., Sammarini, G. et Hrelia, P. (2016) Application of the lymphocyte Cytokinesis-Block Micronucleus Assay to populations exposed to petroleum and its derivatives: Results from a systematic review and meta-analysis. Mutation Research - Reviews in Mutation Research, 770: 58-72.
Anses (2008) Valeurs guides de qualité d'air intérieur: Le benzène. Disponibles à : https://www.anses.fr/en/system/files/AIR2004etVG004Ra.pdf
Arnold, S.M., Angerer, J., Boogaard, P.J., Hughes, M.F., O'Lone, R.B., Robison, S.H. et Robert Schnatter, A. (2013) The use of biomonitoring data in exposure and human health risk assessment: benzene case study. Critical Reviews in Toxicology, 43(2): 119-153.
ATSDR (2007) Toxicological Profile for Benzene. Agency for Toxic Substances and Disease Registry, Public Health Service, US Department of Health and Human Services, Atlanta, GA. Disponibles à : https://www.atsdr.cdc.gov/ToxProfiles/tp3.pdf
Aurell, J., Gullett, B.K., Tabor, D., Touati, A. et Oudejans, L. (2012) Semivolatile and volatile organic compound emissions from wood-fired hydronic heaters. Environmental Science & Technology, 46(14): 7898-7904.
Ayi-Fanou, L., Avogbe, P.H., Fayomi, B., Keith, G., Hountondji, C., Creppy, E.E., Autrup, H., Rihn, B.H. et Sanni, A. (2011) DNA-adducts in subjects exposed to urban air pollution by benzene and polycyclic aromatic hydrocarbons (PAHs) in Cotonou, Benin. Environmental Toxicology, 26(1): 93.
Badham, H.J. et Winn, L.M. (2010) In utero and in vitro effects of benzene and its metabolites on erythroid differentiation and the role of reactive oxygen species. Toxicology and Applied Pharmacology, 244(3): 273-279.
Bari, M.A. et Kindzierski, W.B. (2017) Concentrations, sources and human health risk of inhalation exposure to air toxics in Edmonton, Canada. Chemosphere, 173: 160-171.
Bassig, B.A., Zhang, L., Cawthon, R.M., Smith, M.T., Yin, S., Li, G., Hu, W., Shen, M., Rappaport, S., Barone-Adesi, F., Rothman, N., Vermeulen, R. et Lan, Q. (2014) Alterations in leukocyte telomere length in workers occupationally exposed to benzene. Environmental and Molecular Mutagenesis, 55(8): 673-8.
Bassig, B.A., Zhang, L., Vermeulen, R., Tang, X., Li, G., Hu, W., Guo, W., Purdue, M.P., Yin, S., Rappaport, S.M., Shen, M., Ji, Z., Qiu, C., Ge, Y., Hosgood, H.D., Reiss, B., Wu, B., Xie, Y., Li, L., Yue, F., Freeman, L.E.B., Blair, A., Hayes, R.B., Huang, H., Smith, M.T., Rothman, N. et Lan, Q.(2016) Comparison of hematological alterations and markers of B-cell activation in workers exposed to benzene, formaldehyde and trichloroethylene. Carcinogenesis, 37(7): 692-700.
Batterman, S., Jia, C. et Hatzivasilis, G. (2007) Migration of volatile organic compounds from attached garages to residences: a major exposure source. Environmental Research, 104(2): 224-240.
Batterman, S., Su, F.C., Li, S., Mukherjee, B., Jia, C. et HEI Health Review Committee. (2014) Personal exposure to mixtures of volatile organic compounds: modeling and further analysis of the RIOPA data. Research Report (Health Effects Institute), 181(181): 3-63.
Berr, C., Vercambre, M.N., Bonenfant, S., Singh, Manoux, A., Zins, M. et Goldberg, M. (2010) Occupational exposure to solvents and cognitive performance in the GAZEL cohort: Preliminary results. Dementia and Geriatric Cognitive Disorders, 30(1): 12-19.
Bevan, R., Jones, K., Cocker, J., Assem, F. et Levy, L. (2013) Reference ranges for key biomarkers of chemical exposure within the UK population. International Journal of Hygiene and Environmental Health, 216(2): 170-174.
Billet, S., Paget, V., Garçon, G., Heutte, N., André, V., Shirali, P. et Sichel, F. (2010) Benzene-induced mutational pattern in the tumour suppressor gene TP53 analysed by use of a functional assay, the functional analysis of separated alleles in yeast, in human lung cells. Archives of Toxicology, 84(2): 99-107.
Bird, M.G., Wetmore, B.A., Letinski, D.J., Nicolich, M., Chen, M., Schnatter, A.R. et Whitman, F.T. (2010) Influence of toluene co-exposure on the metabolism and genotoxicity of benzene in mice using continuous and intermittent exposures. Chemico-biological Interactions, 184(1-2): 233-9.
Bogadi-Šare, A., Zavalić, M., Trošić, I., Turk, R., Kontošić, I. et Jelčić, I. (2000) Study of some immunological parameters in workers occupationally exposed to benzene. International Archives of Occupational and Environmental Health, 73(6): 397-400.
Boogaard, P.J. (2017) The low-dose benzene debate needs a sharp blade. Chemico-biological Interactions, 278, 239-241.
Cakmak, S., Cole, C., Hebbern, C., Andrade, J. et Dales, R. (2020) Associations between blood volatile organic compounds, and changes in hematologic and biochemical profiles, in a population-based study. Environment International, 145: 106121.
Cakmak, S., Dales, R.E., Liu, L., Kauri, L.M., Lemieux, C.L., Hebbern, C. et Zhu, J. (2014) Residential exposure to volatile organic compounds and lung function: Results from a population-based cross-sectional survey. Environmental Pollution, 194: 145-151.
Cakmak, S., Kauri, L.M., Andrade, J. et Dales, R. (2021) Factors influencing volatile organic compounds in Canadian homes. Indoor and Built Environment, 30(8): 1076-1091.
Cancelada, L., Sleiman, M., Tang, X., Russell, M.L., Montesinos, V.N., Litter, M.I., Gundel, L.A. et Destaillats, H. (2019) Heated tobacco products: volatile emissions and their predicted impact on indoor air quality. Environmental Science & Technology, 53(13): 7866-7876.
Caron-Beaudoin, E., Ayotte, P., Aker, A., Blanchette, C., Ricard, S., Gilbert, V., Avard, E. et Lemire, M. (2022) Exposure to benzene, toluene and polycyclic aromatic hydrocarbons in Nunavimmiut aged 16 years and over (Nunavik, Canada) - Qanuilirpitaa 2017 survey. Environmental Research, 206: 112586.
Caron-Beaudoin, E., Valter, N., Chevrier, J., Ayotte, P., Frohlich, K. et Verner, M. (2018) Gestational exposure to volatile organic compounds (VOCs) in Northeastern British Columbia, Canada: a pilot study. Environment International, 110: 131-138.
Caron-Beaudoin, E., Whyte, K.P., Bouchard, M.F., Chevrier, J., Haddad, S., Copes, R., Frohlich, K.L., Dokkie, D., Treaty, 8.T., Juul, S., Bouchard, M. et Verner, M. (2022) Volatile organic compounds (VOCs) in indoor air and tap water samples in residences of pregnant women living in an area of unconventional natural gas operations: Findings from the EXPERIVA study. Science of the Total Environment, 805: 150242.
Carugno, M., Pesatori, A.C., Dioni, L., Hoxha, M., Bollati, V., Albetti, B., Byun, H.-N., Bonzini, M., Fustinoni, S., Cocco, P., Satta, G., Zucca, M., Merlo, D.F., Cipolla, M., Bertazzi, P.A. et Baccarelli, A. (2012) Increased mitochondrial DNA copy number in occupations associated with low-dose benzene exposure. Environmental Health Perspectives, 120(2): 210-15.
Charpin, D., Penard-Morand, C., Raherison, C., Kopferschmitt, C., Lavaud, F., Caillaud, D. et Annesi-Maesano, I. (2009) Exposition à long terme à la pollution urbaine évaluée par un modèle de dispersion et risque d'asthme et d'allergie chez l'enfant. Bulletin de l'Académie Nationale de Médecine, 193(6): 1317-29.
Chen, J., Zheng, Z., Chen, Y., Li, J., Qian, S., Shi, Y., Sun, L., Han, Y., Zhang, S. et Yu, K. (2016) Histone deacetylase inhibitors trichostatin A and MCP30 relieve benzene-induced hematotoxicity via restoring topoisomerase IIalpha. PLoS ONE, 11(4): e0153330.
Chen, L., Guo, P., Zhang, H., Li, W., Gao, C., Huang, Z., Fan, J., Zhang, Y., Li, X., Liu, X., Wang, F., Wang, S., Li, Q., He, Z., Li, H., Chen, S., Wu, X., Ye, L., Li, Q., Tang, H., Wang, Q., Dong, G., Xiao, Y., Chen, W. et Li, D.(2019) Benzene-induced mouse hematotoxicity is regulated by a protein phosphatase 2A complex that stimulates transcription of cytochrome P4502E1. Journal of Biological Chemistry, 294(7): 2486-2499.
Chen, Q., Sun, H., Zhang, J., Xu, Y. et Ding, Z. (2019) The hematologic effects of BTEX exposure among elderly residents in Nanjing: a cross-sectional study. Environmental Science and Pollution Research, 26(11): 10552-10561.
Chin, J., Godwin, C., Parker, E., Robins, T., Lewis, T., Harbin, P. et Batterman, S. (2014) Levels and sources of volatile organic compounds in homes of children with asthma. Indoor Air, 24(4): 403-415.
Choi, Y., Kim, J.H., Lee, B. et Hong, Y. (2014) Urinary benzene metabolite and insulin resistance in elderly adults. Science of the Total Environment, 482: 260-268.
CIRC (1987) Overall evaluations of carcinogenicity: an updating of IARC Monographs Volumes 1 to 42. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Suppl, 7: 1–440. PMID: 3482203
CIRC (2018) IARC monographs on the evaluation of carcinogenic risks to humans. Volume 120: Benzene. Lyon, France : Centre international de Recherche sur le Cancer. Disponible à : https://publications.iarc.fr/Book-And-Report-Series/Iarc-Monographs-On-The-Identification-Of-Carcinogenic-Hazards-To-Humans/Benzene-2018
Collins, J.J., Anteau, S.E., Swaen, G.M.H., Bodner, K.M. et Bodnar, C.M. (2015) Lymphatic and Hematopoietic Cancers Among Benzene-Exposed Workers. Journal of Occupational and Environmental Medicine, 57(2): 159-63.
Conseil national de recherches Canada (2021) – Communication personnelle
Conti, A., Rota, F., Ragni, E., Favero, C., Motta, V., Lazzari, L., Bollati, V., Fustinoni, S. et Dieci, G. (2016) Hydroquinone induces DNA hypomethylation-independent overexpression of retroelements in human leukemia and hematopoietic stem cells. Biochemical and Biophysical Research Communications, 474(4): 691-695.
Cox Jr, L.A., Ketelslegers, H.B. et Lewis, R.J. (2021) The shape of low-concentration dose–response functions for benzene: implications for human health risk assessment. Critical Reviews in Toxicology, 51(2): 95-116.
Cox, L.A., Schnatter, A.R., Boogaard, P.J., Banton, M. et Ketelslegers, H.B. (2017) Non-parametric estimation of low-concentration benzene metabolism. Chemico-biological Interactions, 278: 242-255.
D'Andrea, M.A. et Reddy, G.K. (2014) Health effects of benzene exposure among children following a flaring incident at the British Petroleum Refinery in Texas City. Pediatric Hematology and Oncology, 31(1): 1-10.
DeHate, R.B., Johnson, G.T., et Harbison, R.D. (2011) Risk characterization of vapor intrusion in former manufactured gas plant sites. Regulatory Toxicology and Pharmacology, 9(2): 353-359.
Dimitrova, N.D., Kostadinova, R.Y., Marinova, S.N., Popov, T.A. et Panev, T.I. (2005) Specific immune responses in workers exposed to benzene. International Immunopharmacology, 5(10): 1554-1559.
Doherty, B.T., Kwok, R.K., Curry, M.D., Ekenga, C., Chambers, D., Sandler, D.P. et Engel, L.S. (2017) Associations between blood BTEXS concentrations and hematologic parameters among adult residents of the U.S. Gulf States. Environmental Research, 156: 579-87.
D'Souza J.C., Jia C., Mukherjee B. et Batterman, S. (2009) Ethnicity, housing and personal factors as determinants of VOC exposures. Atmospheric Environment, 43: 2884-2892.
Du, L., Batterman, S., Godwin, C., Rowe, Z. et Chin, J. (2015) Air exchange rates and migration of VOCs in basements and residences. Indoor Air, 25(6): 598-609.
Environnement Canada et Santé et Bien-être social Canada (1993) Loi canadienne sur la protection de l'environnement – Liste des substances d'intérêt prioritaire, rapport d'évaluation : Benzène. Disponible à : https://www.canada.ca/content/dam/hc-sc/migration/hc-sc/ewh-semt/alt_formats/hecs-sesc/pdf/pubs/contaminants/psl1-lsp1/benzene/benzene-fra.pdf
Environnement et Changement climatique Canada (2021) (base de données du Réseau NSPA en ligne).
Estarlich, M., Ballester, F., Aguilera, I., Fernandez-Somoano, A., Lertxundi, A., Llop, S., Freire, C., Tardon, A., Basterrechea, M., Sunyer, J. et Iniguez, C. (2011) Residential exposure to outdoor air pollution during pregnancy and anthropometric measures at birth in a multicenter cohort in Spain. Environmental Health Perspectives, 119(9): 1333-8.
Estarlich, M., Ballester, F., Davdand, P., Llop, S., Esplugues, A., Fernandez-Somoano, A., Lertxundi, A., Guxens, M., Basterrechea, M., Tardon, A., Sunyer, J. et Iniguez, C. (2016) Exposure to ambient air pollution during pregnancy and preterm birth: A Spanish multicenter birth cohort study. Environmental Research, 147: 50-8.
Faure, S., Noisel, N., Werry, K., Karthikeyan, S., Aylward, L.L. et St-Amand, A. (2020) Evaluation of human biomonitoring data in a health risk based context: An updated analysis of population level data from the Canadian Health Measures Survey. International Journal of Hygiene and Environmental Health, 223(1): 267-280.
Ferrero, A., Esplugues, A., Estarlich, M., Llop, S., Cases, A., Mantilla, E., Ballester, F. et Iniguez, C. (2017) Infants' indoor and outdoor residential exposure to benzene and respiratory health in a Spanish cohort. Environmental Pollution, 222: 486-94.
Filippini, T., Hatch, E.E., Rothman, K.J., Heck, J.E., Park, A.S., Crippa, A., Orsini, N. et Vinceti, M. (2019) Association between outdoor air pollution and childhood leukemia: a systematic review and dose–response meta-analysis. Environmental Health Perspectives, 127(4): 46002.
Filippini, T., Heck, J.E., Malagoli, C., Giovane, C.D. et Vinceti, M. (2015) A review and meta-analysis of outdoor air pollution and risk of childhood leukemia. Journal of Environmental Science and Health, Part C, 33(1): 36-66.
French, John E., Gatti, Daniel M., Morgan, Daniel L., Kissling, Grace E., Shockley, Keith R., Knudsen, Gabriel A., Shepard, Kim G., Price, Herman C., Deborah, K., Witt, Kristine L., Pedersen, Lars C., Munger, Steven C., Svenson, Karen L. et Churchill, Gary A. (2015) Diversity Outbred Mice Identify Population-Based Exposure Thresholds and Genetic Factors that Influence Benzene-Induced Genotoxicity. Environmental Health Perspectives, 123(3): 237-245.
Gao, A., Zuo, X., Liu, Q., Lu, X., Guo, W. et Tian, L. (2010) Methylation of PARP-1 promoter involved in the regulation of benzene-induced decrease of PARP-1 mRNA expression. Toxicology Letters, 195(2-3): 114-118.
Ghazawi, F.M., Le, M., Cyr, J., Netchiporouk, E., Rahme, E., Alakel, A., Zubarev, A., Powell, M., Moreau, L. et Roshdy, O. (2019) Analysis of acute myeloid leukemia incidence and geographic distribution in Canada from 1992 to 2010 reveals disease clusters in Sarnia and other industrial US border cities in Ontario. Cancer, 125(11): 1886-1897.
Ghosh J.K.C., Wilhelm, M., Su, J., Goldberg, D., Cockburn, M., Jerrett, M. et Ritz, B. (2012) Assessing the influence of traffic-related air pollution on risk of term low birth weight on the basis of land-use-based regression models and measures of air toxics. American Journal of Epidemiology, 175(12): 1262-74.
Giuliano, M., Stellavato, A., Cammarota, M., Lamberti, M., Miraglia, N., Sannolo, N. et De Rosa, M. (2009) Effects of low concentrations of benzene on human lung cells in vitro. Toxicology Letters, 188(2): 130-136.
Glass, D.C., Gray, C.N., Jolley, D.J., Gibbons, C. et Sim, M.R. (2005) Health Watch exposure estimates: do they underestimate benzene exposure? Chemico-biological Interactions, 153: 23-32.
Glass, D.C., Gray, C.N., Jolley, D.J., Gibbons, C., Sim, M.R., Fritschi, L., Adams, G.G., Bisby, J.A. et Manuell, R. (2003) Leukemia risk associated with low-level benzene exposure. Epidemiology, 14(5): 569-577.
Glass, D.C., Schnatter, A.R., Tang, G., Irons, R.D. et Rushton, L. (2014) Risk of myeloproliferative disease and chronic myeloid leukaemia following exposure to low-level benzene in a nested case–control study of petroleum workers. Occupational and Environmental Medicine, 71(4): 266-274.
Goldberg, M.S., Wheeler, A.J., Burnett, R.T., Mayo, N.E., Valois, M., Brophy, J.M. et Giannetti, N. (2015) Physiological and perceived health effects from daily changes in air pollution and weather among persons with heart failure: A panel study. Journal of Exposure Science & Environmental Epidemiology, 25(2): 187-199.
Gong, Z., Li, J., Wang, X., Yu, Y., Ren, M. et Zhou, J. (2019) A meta-analysis of traffic-related air pollution and risk of childhood leukemia. Journal of Pediatric Hematology/Oncology, 41(4): 267-274.
Gordian, M.E., Stewart, A.W. et Morris, S.S. (2010) Evaporative gasoline emissions and asthma symptoms. International Journal of Environmental Research and Public Health, 7(8): 3051-3062.
Harati, B., Shahtaheri, S.J., Karimi, A., Azam, K., Harati, A., Ahmadi, A. et Rad, M.A. (2017) Hematologic evaluation of painting hall workers in an automobile manufacturing company. Shiraz E-Medical Journal, 18(12): e57350.
Hayes, R.B., Yin, S.N., Dosemeci, M., Li, G.L., Wacholder, S., Chow, W.H., Rothman, N., Wang, Y.Z., Dai, T.R., Chao, X.J., Jiang, Z.L., Ye, P.Z., Zhao, H.B., Kou, Q.R., Zhang, W.Y., Meng, J.F., Zho, J.S., Lin, X.F., Ding, C.Y., Li, C.Y., Zhang, Z.N., Li, D.G., Travis, L.B., Blot, W.J. et Linet, M.S. (1996) Mortality among benzene-exposed workers in China. Environmental Health Perspectives, 104 Suppl 6:1349-1352.
Hays, S.M., Pyatt, D.W., Kirman, C.R. et Aylward, L.L. (2012) Biomonitoring Equivalents for benzene. Regulatory Toxicology and Pharmacology, 62(1): 62-73.
Health Council of the Netherlands. Benzene - Health-based recommended occupational exposure limit. The Hague: Health Council of the Netherlands, 2014; publication no. 2014/03.
Herberth, G., Bauer, M., Gasch, M., Hinz, D., Röder, S., Olek, S., Kohajda, T., Rolle-Kampczyk, U., Von Bergen, M. et Sack, U. (2014) Maternal and cord blood miR-223 expression associates with prenatal tobacco smoke exposure and low regulatory T-cell numbers. Journal of Allergy and Clinical Immunology, 133(2): 543-550.
Héroux, M., Gauvin, D., Gilbert, N.L., Guay, M., Dupuis, G., Legris, M. et Lévesque, B. (2008) Housing characteristics and indoor concentrations of selected volatile organic compounds (VOCs) in Quebec City, Canada. Indoor and Built Environment, 17(2): 128-137.
Hoang, T., Castorina, R., Gaspar, F., Maddalena, R., Jenkins, P., Zhang, Q., McKone, T., Benfenati, E., Shi, A. et Bradman, A. (2017) VOC exposures in California early childhood education environments. Indoor Air, 27(3): 609-621.
Hoffman, E., Guernsey, J.R., Walker, T.R., Kim, J.S., Sherren, K. et Andreou, P. (2017) Pilot study investigating ambient air toxics emissions near a Canadian kraft pulp and paper facility in Pictou County, Nova Scotia. Environmental Science and Pollution Research, 24(25): 20685-20698.
Hollins, D.M., Kerger, B.D., Unice, K.M., Knutsen, J.S., Madl, A.K., Sahmel, J.E. et Paustenbach, D.J. (2013) Airborne benzene exposures from cleaning metal surfaces with small volumes of petroleum solvents. International Journal of Hygiene and Environmental Health, 216(3): 324-332.
Hoxha, M., Dioni, L., Bonzini, M., Pesatori, A.C., Fustinoni, S., Cavallo, D., Carugno, M., Albetti, B., Marinelli, B., Schwartz, J., Bertazzi, P.A. et Baccarelli, A. (2009) Association between leukocyte telomere shortening and exposure to traffic pollution: a cross-sectional study on traffic officers and indoor office workers. Environmental Health: a Global Access Science Source, 8: 41.
Hu, J., Ma, H., Zhang, W., Yu, Z., Sheng, G. et Fu, J. (2014) Effects of benzene and its metabolites on global DNA methylation in human normal hepatic L02 cells. Environmental Toxicology, 29(1): 108-116.
Hystad, P., Setton, E., Cervantes, A., Poplawski, K., Deschenes, S., Brauer, M., van Donkelaar, A., Lamsal, L., Martin, R., Jerrett, M. et Demers, P. (2011) Creating national air pollution models for population exposure assessment in Canada. Environmental Health Perspectives, 119(8): 1123-1129.
INRP Inventaire national des rejets de polluants (2022) Ottawa (ON) : Gouvernement du Canada. Résultats de recherche sur le benzène. [Consulté en mai 2022]. https://pollution-dechets.canada.ca/inventaire-national-rejets
Jain, R.B. (2015) Levels of selected urinary metabolites of volatile organic compounds among children aged 6-11 years. Environmental Research, 142: 461-470.
Janitz, A.E., Campbell, J.E., Magzamen, S., Pate, A., Stoner, J.A. et Peck, J.D. (2017) Benzene and childhood acute leukemia in Oklahoma. Environmental Research, 158: 167-173.
Ji, Z., Weldon, R.H., Marchetti, F., Chen, H., Li, G., Xing, C., Kurtovich, E., Young, S., Schmid, T.E., Waidyanatha, S., Rappaport, S., Zhang, L. et Eskenazi, B. (2012) Comparison of aneuploidies of chromosomes 21, X, and Y in the blood lymphocytes and sperm of workers exposed to benzene. Environmental and Molecular Mutagenesis, 53(3): 218-26.
Johnson, M., Shin, H.H., Roberts, E., Sun, L., Fisher, M., Hystad, P., Van Donkelaar, A., Martin, R.V., Fraser, W.D., Lavigne, E., Clark, N., Beaulac, V. et Arbuckle, T.E. (2022) Critical Time Windows for Air Pollution Exposure and Birth Weight in a Multicity Canadian Pregnancy Cohort.Epidemiology (Cambridge, Mass.), 33(1): 7-16.
Kalenge, S., Lebouf, R.F., Hopke, P.K., Rossner, A. et Benedict-Dunn, A. (2013) Assessment of exposure to outdoor BTEX concentrations on the Saint Regis Mohawk Tribe reservation at Akwesasne New York State. Air Quality, Atmosphere & Health, 6(1): 181-193.
Karthikeyan, S., Khoury, C., Pollock, T., Walker, M. et St-Amand, A. Opportunities for the analysis of chemical exposures in racialized populations in Canada: An investigation based on the Canadian Health Measures Survey. [Affiche du Forum scientifique de Santé Canada 2022].
Kassem, N.O., Kassem, N.O., Jackson, S.R., Liles, S., Daffa, R.M., Zarth, A.T., Younis, M.A., Carmella, S.G., Hofstetter, C.R. et Chatfield, D.A. (2014) Benzene uptake in Hookah smokers and non-smokers attending Hookah social events: regulatory implications. Cancer Epidemiology, Biomarkers & Prevention, 23(12): 2793-2809.
Keller, K.A. et Snyder, C.A. (1988) Mice exposed in utero to 20 ppm benzene exhibit altered numbers of recognizable hematopoietic cells up to seven weeks after exposure. Fundamental and Applied Toxicology, 10(2): 224-232.
Kicinski, M., Saenen, N.D., Viaene, M.K., Den, Hond, E., Schoeters, G., Plusquin, M., Nelen, V., Bruckers, L., Sioen, I., Loots, I., Baeyens, W., Roels, H.A. et Nawrot, T.S. (2016) Urinary t,t-muconic acid as a proxy-biomarker of car exhaust and neurobehavioral performance in 15-year olds. Environmental Research, 151: 521-7.
Kim, S., Vermeulen, R., Waidyanatha, S., Johnson, B.A., Lan, Q., Rothman, N., Smith, M.T., Zhang, L., Li, G. et Shen, M. (2006a) Using urinary biomarkers to elucidate dose-related patterns of human benzene metabolism. Carcinogenesis, 27(4): 772-781.
Kim, S., Vermeulen, R., Waidyanatha, S., Johnson, B.A., Lan, Q., Smith, M.T., Zhang, L., Li, G., Shen, M. et Yin, S. (2006b) Modeling human metabolism of benzene following occupational and environmental exposures. Cancer Epidemiology Biomarkers & Prevention, 15(11): 2246-2252.
Kim, S.Y., Son, B., Park, H., Oh, S.H., Lee, J.H., Suh, M. et Park, M.K. (2017) Impact of environmental volatile organic compounds on otitis media in children: Correlation between exposure and urinary metabolites. International Journal of Pediatric Otorhinolaryngology, 93: 157-162.
Knutsen, J.S., Kerger, B.D., Finley, B. et Paustenbach, D.J. (2013) A calibrated human PBPK model for benzene inhalation with urinary bladder and bone marrow compartments. Risk Analysis, 33(7): 1237-1251.
Koh, D., Chung, E., Jang, J., Lee, H., Ryu, H., Yoo, K., Kim, E. et Kim, K. (2014) Cancer incidence and mortality among temporary maintenance workers in a refinery/petrochemical complex in Korea. International Journal of Occupational and Environmental Health, 20(2): 141-145.
Koh, D., Kim, T., Yoon, Y., Shin, K. et Yoo, S. (2011) Lymphohematopoietic cancer mortality and morbidity of workers in a refinery/petrochemical complex in Korea. Safety & Health at Work, 2(1): 26-33.
Kovesi, T., Mallach, G., Schreiber, Y., McKay, M., Lawlor, G., Barrowman, N., Tsampalieros, A., Kulka, R., Root, A., Kelly, L., Kirlew, M. et Miller, J.D. (2022) Housing conditions and respiratory morbidity in Indigenous children in remote communities in Northwestern Ontario, Canada. JAMC : Journal de l'Association médicale canadienne, 194(3): E80-E88.
Lan, Q., Zhang, L., Li, G., Vermeulen, R., Weinberg, R.S., Dosemeci, M., Rappaport, S.M., Shen, M., Alter, B.P. et Wu, Y. (2004) Hematotoxicity in workers exposed to low levels of benzene. Science, 306(5702): 1774-1776.
Lee, J.H., Lee, H.S., Park, M.R., Lee, S.W., Kim, E.H., Cho, J.B., Kim, J., Han, Y., Jung, K. et Cheong, H.K. (2014) Relationship between indoor air pollutant levels and residential environment in children with atopic dermatitis. Allergy, Asthma & Immunology Research, 6(6): 517-524.
Levy, I., Mihele, C., Lu, G., Narayan, J. et Brook, J.R. (2014) Evaluating multipollutant exposure and urban air quality: pollutant interrelationships, neighborhood variability, and nitrogen dioxide as a proxy pollutant. Environmental Health Perspectives, 122(1): 65-72.
Li, J., Zhang, X., He, Z., Sun, Q., Qin, F., Huang, Z., Zhang, X., Sun, X., Liu, L., Chen, L., Gao, C., Wang, S., Wang, F., Li, D., Zeng, X., Deng, Q., Wang, Q., Zhang, B., Tang, H., Chen, W. et Xiao, Y. (2017) MGMT hypomethylation is associated with DNA damage in workers exposed to low-dose benzene. Biomarkers, 22(5): 470-5.
Li, W., et Schnatter, A.R. (2018) Benzene risk assessment: does new evidence on myelodysplastic syndrome justify a new approach? Critical Reviews in Toxicology, 48 (6): 417-432.
Li, X., Wu, X., Xue, M., Wang, Y., Wang, J., Li, Y., Zhang, G. et Yi, Z. (2012) The role of DNA methylation in catechol-enhanced erythroid differentiation of K562 cells. Toxicology and Applied Pharmacology, 265(1): 43-50.
Li, Y., Cakmak, S. et Zhu, J. (2019) Profiles and monthly variations of selected volatile organic compounds in indoor air in Canadian homes: Results of Canadian national indoor air survey 2012–2013. Environment International, 126: 134-144.
Li, Y., Wu, X., Li, X., Yu, C., Li, Y. et Yi, Z. (2013) Changes in DNA methylation of erythroid-specific genes in K562 cells exposed to phenol and hydroquinone. Toxicology, 312: 108-114.
Lim, S.K., Shin, H.S., Yoon, K.S., Kwack, S.J., Um, Y.M., Hyeon, J.H., Kwak, H.M., Kim, J.Y., Kim, T.H. et Kim, Y.J. (2014) Risk assessment of volatile organic compounds benzene, toluene, ethylbenzene, and xylene (BTEX) in consumer products. Journal of Toxicology and Environmental Health, Part A, 77(22-24): 1502-1521.
Linet, M.S., Yin, S.-N., Gilbert, E.S., Dores, G.M., Hayes, R.B., Vermeulen, R., Tian, H.-Y., Lan, Q., Portengen, L., Ji, B.-T., Li, G.-L. et Rothman, N. (2015) A retrospective cohort study of cause-specific mortality and incidence of hematopoietic malignancies in Chinese benzene-exposed workers. International Journal of Cancer, 137(9): 2184-97.
Liu, C., Huang, X. et Li, J. (2020) Outdoor benzene highly impacts indoor concentrations globally. Science of the Total Environment, 720: 137640.
Liu, L., Ling, X., Liang, H., Gao, Y., Yang, H., Shao, J. et Tang, H. (2012) Hypomethylation mediated by decreased DNMTs involves in the activation of proto-oncogene MPL in TK6 cells treated with hydroquinone. Toxicology Letters, 209(3): 239-245.
Liu, N., Bu, Z., Liu, W., et al. (2022) Health effects of exposure to indoor volatile organic compounds from 1980 to 2017: A systematic review and meta-analysis. Indoor Air. 32: e13038.
Logue, J.M., Sleiman, M., Montesinos, V.N., Russell, M.L., Litter, M.I., Benowitz, N.L., Gundel, L.A. et Destaillats, H. (2017) Emissions from electronic cigarettes: assessing vapers' intake of toxic compounds, secondhand exposures, and the associated health impacts. Environmental Science & Technology, 51(16): 9271-9279.
Luo, H., Liang, H., Chen, Y., Chen, S., Xu, Y., Xu, L., Liu, J., Zhou, K., Peng, J. et Guo, G. (2018) miR-7-5p overexpression suppresses cell proliferation and promotes apoptosis through inhibiting the ability of DNA damage repair of PARP-1 and BRCA1 in TK6 cells exposed to hydroquinone. Chemico-biological Interactions, 283: 84-90.
Lyonnais-Gagnon, P., Malowany, M., Noisel, N. et St-Amand, A. Mesures des concentrations de benzène dans l'air intérieur et analyse des facteurs d'exposition influençant la concentration du benzène sanguin dans la population canadienne. [Manuscript en préparation].
MacNeill, M., Dobbin, N., St‐Jean, M., Wallace, L., Marro, L., Shin, T., You, H., Kulka, R., Allen, R.W. et Wheeler, A.J. (2016) Can changing the timing of outdoor air intake reduce indoor concentrations of traffic‐related pollutants in schools? Indoor Air, 26(5): 687-701.
Majumdar, D., Dutta, C. et Sen, S. (2016) Inhalation exposure or body burden? Better way of estimating risk – An application of PBPK model. Environmental Toxicology and Pharmacology, 41: 54-61.
Mallach, G., St‐Jean, M., MacNeill, M., Aubin, D., Wallace, L., Shin, T., Van Ryswyk, K., Kulka, R., You, H. et Fugler, D. (2017) Exhaust ventilation in attached garages improves residential indoor air quality. Indoor Air, 27(2): 487-499.
Mandani, P., Desai, K. et Highland, H. (2013) Cytotoxic effects of benzene metabolites on human sperm function: an in vitro study. ISRN Toxicology, 2013: 397524.
Manoukian, A., Buiron, D., Temime-Roussel, B., Wortham, H. et Quivet, E. (2016) Measurements of VOC/SVOC emission factors from burning incenses in an environmental test chamber: influence of temperature, relative humidity, and air exchange rate. Environmental Science and Pollution Research, 23(7): 6300-6311.
Martin, K.A., Lin, E.Z., Hilbert, T.J., Godri Pollitt, K.J. et Haynes, E.N. (2021) Survey of airborne organic compounds in residential communities near a natural gas compressor station: Response to community concern. Environmental Advances, 5: 100076.
Martins, P.C., Valente, J., Papoila, A.L., Caires, I., Araujo-Martins, J., Matae, P., Lopes, M., Torres, S., Rosado-Pinto, J., Borrego, C., Annesi-Maesano, I. et Neuparth, N. (2012) Airways changes related to air pollution exposure in wheezing children. European Respiratory Journal, 39(2): 246-53.
Mascelloni, M., Delgado-Saborit, J.M., Hodges, N.J. et Harrison, R.M. (2015) Study of gaseous benzene effects upon A549 lung epithelial cells using a novel exposure system. Toxicology Letters, 237(1): 38-45.
McNally, K., Sams, C., Loizou, G. et Jones, K. (2017) Evidence for non-linear metabolism at low benzene exposures? A reanalysis of data. Chemico-biological Interactions, 278: 256-268.
Medinsky, M., Sabourin, P., Lucier, G., Birnbaum, L. et Henderson, R. (1989) A toxikinetic model for simulation of benzene metabolism. Experimental Pathology, 37(1-4): 150-154.
Meek, M.B. et Klaunig, J.E. (2010) Proposed mode of action of benzene-induced leukemia: Interpreting available data and identifying critical data gaps for risk assessment. Chemico-biological Interactions, 184(1-2): 279-285.
Mihaich, E.M. et Borgert, C.J. (2018) Hypothesis-driven weight-of-evidence analysis for the endocrine disruption potential of benzene. Regulatory Toxicology and Pharmacology, 100: 7-15.
Miller, L., Xu, X., Grgicak-Mannion, A., Brook, J. et Wheeler, A. (2012) Multi-season, multi-year concentrations and correlations amongst the BTEX group of VOCs in an urbanized industrial city. Atmospheric Environment, 61: 305-315.
Miller, L., Xu, X., Wheeler, A., Atari, D.O., Grgicak-Mannion, A. et Luginaah, I. (2011) Spatial variability and application of ratios between BTEX in two Canadian cities. The Scientific World Journal, 11: 2536-2549.
Mögel, I., Baumann, S., Böhme, A., Kohajda, T., von Bergen, M., Simon, J. et Lehmann, I. (2011) The aromatic volatile organic compounds toluene, benzene and styrene induce COX-2 and prostaglandins in human lung epithelial cells via oxidative stress and p38 MAPK activation. Toxicology, 289(1): 28-37.
Morales, E., Garcia-Esteban, R., de la Cruz, O.A., Basterrechea, M., Lertzundi, A., de Dicastillo, M.D., Zabaleta C. et Sunyer, J. (2015) Intrauterine and early postnatal exposure to outdoor air pollution and lung function at preschool age. Thorax, 70(1): 64-73.
Murugesan, K., Baumann, S., Wissenbach, D.K., Kliemt, S., Kalkhof, S., Otto, W., Mögel, I., Kohajda, T., von Bergen, M. et Tomm, J.M. (2013) Subtoxic and toxic concentrations of benzene and toluene induce Nrf2‐mediated antioxidative stress response and affect the central carbon metabolism in lung epithelial cells A549. Proteomics, 13(21): 3211-3221.
Mustafa, N., Mumford, K.G., Gerhard, J.I., et O'Carroll, D.M. (2014) A three-dimensional numerical model for linking community-wide vapour risks. Journal of Contaminant Hydrology, 156: 38-51.
North, C.M., Rooseboom, M., Kocabas, N.A., Schnatter, A.R., Faulhammer, F. et Williams, S.D. (2020) Modes of action considerations in threshold expectations for health effects of benzene. Toxicology Letters, 334: 78-86.
North, C.M., Schnatter, A.R., Rooseboom, M., Kocabas, N.A., Dalzell, A. et Williams, S.D. (2021) Key event-informed risk models for benzene-induced acute myeloid leukaemia. Toxicology Letters, 340: 141-152.
OEHHA (2001) Public Health Goal for Benzene in Drinking Water. Disponible à : https://oehha.ca.gov/water/public-health-goal/public-health-goal-benzene-drinking-water
OEHHA (2014) Benzene Reference Exposure Levels Technical Support Document for the Derivation of Noncancer Reference Exposure Levels Appendix D1. Disponible à : https://oehha.ca.gov/media/downloads/crnr/benzenerelsjune2014.pdf
Olsson, A., Togawa, K., Schuz, J., Le Cornet, C., Fervers, B., Oksbjerg Dalton, S., Pukkala, E., Feychting, M., Skakkebaek, N.E. et Hansen, J. (2018) Parental occupational exposure to solvents and heavy metals and risk of developing testicular germ cell tumors in sons (NORD-TEST Denmark). Scandinavian Journal of Work, Environment and Health, 44(6): 658-69.
OMS (2000) Evaluation of risks to human health – benzene. Dans : Air Quality Guidelines for Europe. 2nd ed. Copenhagen (DK) : Bureau régional de lʼOMS pour lʼEurope.
Pariselli, F., Sacco, M., Ponti, J. et Rembges, D. (2009) Effects of toluene and benzene air mixtures on human lung cells (A549). Experimental and Toxicologic Pathology, 61(4): 381-386.
Peluso, M., Munnia, A., Ceppi, M., Giese, R.W., Catelan, D., Rusconi, F., Godschalk, R.W.L. et Biggeri, A. (2013) Malondialdehyde-deoxyguanosine and bulky DNA adducts in schoolchildren resident in the proximity of the Sarroch industrial estate on Sardinia Island, Italy. Mutagenesis, 28(3): 315-21.
Petry, T., Vitale, D., Joachim, F.J., Smith, B., Cruse, L., Mascarenhas, R., Schneider, S. et Singal, M. (2014) Human health risk evaluation of selected VOC, SVOC and particulate emissions from scented candles. Regulatory Toxicology and Pharmacology, 69(1): 55-70.
Pickworth, W.B., Rosenberry, Z.R., Yi, D., Pitts, E.N., Lord-Adem, W. et Koszowski, B (2018) Cigarillo and little cigar mainstream smoke constituents from replicated human smoking. Chemical Research in Toxicology, 31(4): 251-258.
Price, P.S., Rey, T.D., Fontaine, D.D. et Arnold, S.M. (2012) A reanalysis of the evidence for increased efficiency in benzene metabolism at airborne exposure levels below 3 ppm. Carcinogenesis, 33(11): 2094-2099.
Protano, C., Andreoli, R., Manini, P., Guidotti, M. et Vitali, M. (2012) A tobacco-related carcinogen: assessing the impact of smoking behaviours of cohabitants on benzene exposure in children. Tobacco Control, 21(3): 325-329.
Protano, C., Guidotti, M., Manini, P., Petyx, M., La Torre, G. et Vitali, M. (2010) Benzene exposure in childhood: role of living environments and assessment of available tools. Environment International, 36(7): 779-787.
Rahman, M.M. et Kim, K. (2014) Potential hazard of volatile organic compounds contained in household spray products. Atmospheric Environment, 85:266-274.
Ramírez‐Lopera, V., Uribe‐Castro, D., Bautista‐Amorocho, H., Silva‐Sayago, J.A., Mateus‐Sánchez, E., Ardila‐Barbosa, W.Y. et Pérez‐Cala, T.L. (2021) The effects of genetic polymorphisms on benzene‐exposed workers: A systematic review. Health Science Reports, 4(3): e327.
Rappaport, S.M., Kim, S., Lan, Q., Li, G., Vermeulen, R., Waidyanatha, S., Zhang, L., Yin, S., Smith, M.T. et Rothman, N. (2010) Human benzene metabolism following occupational and environmental exposures. Chemico-biological Interactions, 184(1-2): 189-195.
Rappaport, S.M., Kim, S., Lan, Q., Vermeulen, R., Waidyanatha, S., Zhang, L., Li, G., Yin, S., Hayes, R.B., Rothman, N. et Smith, M.T. (2009) Evidence that humans metabolize benzene via two pathways. Environmental Health Perspectives, 117(6): 946-952.
Rappaport, S.M., Kim, S., Thomas, R., Johnson, B.A., Bois, F.Y. et Kupper, L.L. (2013) Low-dose metabolism of benzene in humans: science and obfuscation. Carcinogenesis, 34(1): 2-9.
Ravegnini, G., Sammarini, G., Hrelia, P. et Angelini, S. (2015) Key genetic and epigenetic mechanisms in chemical carcinogenesis. Toxicological Sciences, 148(1): 2-13.
Rinsky, R.A., Smith, A.B., Hornung, R., Filloon, T.G., Young, R.J., Okun, A.H. et Landrigan, P.J. (1987) Benzene and leukemia. New England Journal of Medicine, 316(17): 1044-1050.
Rinsky, R.A., Young, R.J. et Smith, A.B. (1981) Leukemia in benzene workers. American Journal of Industrial Medicine, 2(3): 217-245.
Rinsky, R., Hornung, R., Silver, S. et Tseng, C. (2002) Benzene exposure and hematopoietic mortality: A long‐term epidemiologic risk assessment. American Journal of Industrial Medicine, 42(6): 474-480.
Rive, S., Hulin, M., Baiz, N., Hassani, Y., Kigninlman, H., Toloba, Y., Caillaud, D. et Annesi-Maesano, I. (2013) Urinary S-PMA related to indoor benzene and asthma in children. Inhalation Toxicology, 25(7): 373-82.
RIVM (2001) Rijksinstituut Voor Volksgezondheid En Milieu National Institute of Public Health and the Environment. RIVM Report 711701025. Baars, A.J. et al. 2001. Re-evaluation of human-toxicological maximum permissible risk levels. Bilthoven, Pays-Bas.
RIVM (2007) Centre for Inspection Research, Emergency Response and
Drinking
Water. RIVM Report 609021044/2007. Dusseldorp, A. et al. 2007.
Health-based guideline values for the indoor environment. Bilthoven,
Pays-Bas.
Rothman, N., Li, G.L., Dosemeci, M., Bechtold, W.E., Marti, G.E., Wang, Y.Z., Linet, M., Xi, L.Q., Lu, W., Smith, M.T. et Titenko‐Holland, N. (1996) Hematotoxocity among Chinese workers heavily exposed to benzene. American journal of industrial medicine, 29(3): 236-246.
Rozen, M.G., Snyder, C.A. et Albert, R.E. (1984) Depressions in B- and T-lymphocyte mitogen-induced blastogenesis in mice exposed to low concentrations of benzene. Toxicology letters, 20(3): 343-349.
Ruchirawat, M., Navasumrit, P. et Settachan, D. (2010) Exposure to benzene in various susceptible populations: Co-exposures to 1,3-butadiene and PAHs and implications for carcinogenic risk. Chemico-biological Interactions, 184(1-2): 67-76.
Rushton, L., Schnatter, A.R., Tang, G. et Glass, D.C. (2014) Acute myeloid and chronic lymphoid leukaemias and exposure to low-level benzene among petroleum workers. British Journal of Cancer, 110(3): 783-7.
Sabbath, E.L., Glymour, M.M., Berr, C., Singh-Manoux, A., Zins, M., Goldberg, M. et Berkman, L.F. (2012) Occupational solvent exposure and cognition: does the association vary by level of education? Neurology, 78(22): 1754-60.
Sabbath, E.L., Gutierrez, L.A., Okechukwu, C.A., Singh-Manoux, A., Amieva, H., Goldberg, M., Zins, M. et Berr, C. (2014) Time may not fully attenuate solvent-associated cognitive deficits in highly exposed workers. Neurology, 82(19): 1716-1723.
Santé Canada (1987) Directives d'exposition concernant la qualité de
l'air des résidences : rapport du Comité consultatif fédéral-provincial
de l'hygiène du milieu et du travail. Ottawa :
ministre des Approvisionnements et services Canada. Disponible à : https://publications.gc.ca/site/fra/9.639527/publication.html
Santé Canada (2009) Recommandations pour la qualité de l'eau potable au Canada : Document technique – Benzène. Disponible à : https://www.canada.ca/content/dam/canada/health-canada/migration/healthy-canadians/publications/healthy-living-vie-saine/water-benzene-eau/alt/water-benzene-eau-fra.pdf
Santé Canada (2010a) Étude de la qualité de l'air intérieur à Regina (2007) : Sommaire des données d'échantillonnage des composés organiques volatils. Santé Canada, Ottawa, Ontario, n o de cat. : H128-1/10-617F-PDF.
Santé Canada (2010b) Étude d'évaluation de l'exposition à Windsor (2005-2006) : Sommaire des données d'échantillonnage des composés organiques volatils. Santé Canada, Ottawa, Ontario, n o de cat. : H128-1/10-618F-PDF.
Santé Canada (2012) Étude de la qualité de l'air intérieur à Halifax (2009) : Sommaire des données d'échantillonnage des composés organiques volatils. Santé Canada, Ottawa, Ontario, n o de cat. : H129-19/2012F-PDF.
Santé Canada (2013a) Document de conseils sur le benzène dans l'air intérieur résidentiel : Document d'évaluation scientifique. N o de cat. : H144-14/1-1-2013F-PDF. ISBN : 978-0-660-21578-5. Gouvernement du Canada, Ottawa, Canada. Disponible à : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/document-conseils-benzene-air-interieur-residentiel.html
Santé Canada (2013b) Étude de la qualité de l'air intérieur à Edmonton (2010) : Sommaire des données des composés organiques volatils (COV). Santé Canada, Ottawa, Ontario, n o de cat. : H144-15/2013F-PDF.
Santé Canada (2015) Troisième rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada : Résultats de l'Enquête canadienne sur les mesures de la santé Cycle 3 (2012 à 2013). Disponible à : /content/canadasite/content/dam/hc-sc/migration/hc-sc/ewh-semt/alt_formats/pdf/pubs/contaminants/chms-ecms-cycle3/chms-ecms-cycle3-fra.pdf
Santé Canada (2017) Quatrième rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada : Résultats de l'Enquête canadienne sur les mesures de la santé Cycle 4 (2014 à 2015). Disponible à : https://www.canada.ca/fr/sante-canada/services/sante-environnement-milieu-travail/rapports-publications/contaminants-environnementaux/quatrieme-rapport-biosurveillance-humaine-substances-chimiques-environnement-canada.html
Santé Canada (2018) Fiche de renseignements : La ventilation et le milieu intérieur. Gouvernement du Canada, Ottawa. N o de cat. : H144-54/2-2018F-PDF. Disponible à : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/fiche-de-renseignements-ventilation-milieu-interieur.html
Santé Canada (2019a) Cinquième rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada : Résultats de l'Enquête canadienne sur les mesures de la santé cycle 5 (2016 à 2017). Disponible à : https://www.canada.ca/fr/sante-canada/services/sante-environnement-milieu-travail/rapports-publications/contaminants-environnementaux/cinquieme-rapport-biosurveillance-humaine.html
Santé Canada (2019b) Infographie : La ventilation et la qualité de l'air intérieur. N o de cat. : H144-65/2019F-PDF, ISBN : 978-0-660-31852-3. Disponible à : https://publications.gc.ca/collections/collection_2019/sc-hc/H144-65-2019-fra.pdf
Santé Canada (2020) Infographie : Protégez votre milieu intérieur des polluants de l'air extérieur. N o de cat. : H144-75/2-2020F-PDF, ISBN: 978-0-660-36343-1. Disponible à : https://www.canada.ca/content/dam/hc-sc/documents/services/publications/healthy-living/protecting-indoor-air-outdoor-pollutants/infographic/infographic-protecting-indoor-air-outdoor-pollutants-fra.pdf
Santé Canada (2021a) – Communication personnelle
Santé Canada (2021b) L'évaluation des risques pour les sites contaminés fédéraux au Canada : Valeurs toxicologiques de référence (VTR), version 3.0. Disponible à: https://publications.gc.ca/collections/collection_2021/sc-hc/H129-108-2021-fra.pdf
Santé Canada (2023) Rejets de benzène provenant des stations-service : répercussions sur la santé humaine. Disponible à : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/rejets-benzene-provenant-stations-service-repercussions-sante-humaine.html
Santé Canada et Conseil national de recherches Canada (2019) Les composés organiques volatils présents dans les maisons neuves : rapport de l'étude pilote sur les émissions des produits de construction et la qualité de l'air intérieur. N o de cat. : H144-64/2019F-PDF, ISBN : 978-0-660-31605-5, Gouvernement du Canada, Ottawa, Canada. Disponible à : https://publications.gc.ca/site/eng/9.875561/publication.html
Schlink, U., Thiem, A., Kohajda, T., Richter, M. et Strebel, K. (2010) Quantile regression of indoor air concentrations of volatile organic compounds (VOC). Science of the Total Environment, 408(18): 3840-3851.
Schnatter, A.R., Glass, D.C., Tang, G., Irons, R.D. et Rushton, L. (2012) Myelodysplastic syndrome and benzene exposure among petroleum workers: an international pooled analysis. Journal of the National Cancer Institute, 104(22): 1724-1737.
Schnatter, A.R., Kerzic, P.J., Zhou, Y., Chen, M., Nicolich, M.J., Lavelle, K., Armstrong, T.W., Bird, M.G., Lin, L. et Fu, H. (2010) Peripheral blood effects in benzene-exposed workers. Chemico-Biological Interactions, 184(1-2): 174-181.
Schnatter, A.R., Rooseboom, M., Kocabas, N.A., North, C.M., Dalzell, A., Twisk, J., Faulhammer, F., Rushton, E., Boogaard, P.J. et Ostapenkaite, V. (2020) Derivation of an occupational exposure limit for benzene using epidemiological study quality assessment tools. Toxicology Letters, 334: 117-144.
Scholten, B., Vlaanderen, J., Stierum, R., Portengen, L., Rothman, N., Lan, Q., Pronk, A. et Vermeulen, R. (2020) A quantitative meta-analysis of the relation between occupational benzene exposure and biomarkers of cytogenetic damage. Environmental Health Perspectives, 128(8): 087004.
Schripp, T., Salthammer, T., Wientzek, S. et Wensing, M. (2014) Chamber studies on nonvented decorative fireplaces using liquid or gelled ethanol fuel. Environmental Science & Technology, 48(6): 3583-3590.
Sekar, A., Varghese, G.K. et Varma, M.R. (2019) Analysis of benzene air quality standards, monitoring methods and concentrations in indoor and outdoor environment. Heliyon, 5(11): e02918.
Setton, E.M., Veerman, B., Erickson, A., Deschenes, S., Cheasley, R., Poplawski, K., Demers, P.A. et Keller, C.P. (2015) Identifying potential exposure reduction priorities using regional rankings based on emissions of known and suspected carcinogens to outdoor air in Canada. Environmental Health, 14(1): 1-16.
Sheu, R., Stönner, C., Ditto, J.C., Klüpfel, T., Williams, J., Gentner, D.R. (2020) Human transport of thirdhand tobacco smoke: A prominent source of hazardous air pollutants into indoor nonsmoking environments. Science Advances 6(10): eaay4109.
Sirotkin, A.V., Fabian, D., Babel'ová, J., Vlčková, R., Alwasel, S. et Harrath, A.H. (2017) Metabolic state can define the ovarian response to environmental contaminants and medicinal plants. Applied Physiology, Nutrition, and Metabolism, 42(12): 1264-1269.
Sirotkin, A., Záhoranska, Z., Tarko, A., Popovska-Percinic, F., Alwasel, S. et Harrath, A.H. (2020) Plant isoflavones can prevent adverse effects of benzene on porcine ovarian activity: an in vitro study. Environmental Science and Pollution Research, 27(23): 29589-29598.
Slama, R., Thiebaugeorges, O., Goua, V., Aussel, L., Sacco, P., Bohet, A., Forhan, A., Ducot, B., Annesi-Maesano, I., Heinrich, J., Magnin, G., Schweitzer, M., Kaminski, M., Charles, M.A. et EDEN Mother-Child Cohort Study Group. (2009) Maternal personal exposure to airborne benzene and intrauterine growth. Environmental Health Perspectives, 117(8): 1313-1321.
Smargiassi, A., Goldberg, M.S., Wheeler, A.J., Plante, C., Valois, M., Mallach, G., Kauri, L.M., Shutt, R., Bartlett, S. et Raphoz, M. (2014) Associations between personal exposure to air pollutants and lung function tests and cardiovascular indices among children with asthma living near an industrial complex and petroleum refineries. Environmental Research, 132: 38-45.
Smith, M.T. (2010) Advances in understanding benzene health effects and susceptibility. Annual Review of Public Health, 31: 133-48.
Son, M.Y., Deng, C.X., Hoeijmarkers, J.H., Rebel, V.I. et Hasty, P. (2016) A mechanism for 1,4-Benzoquinone-induced genotoxicity. Oncotarget, 7(29): 46433-46447.
Statistique Canada (2022) Tableau 16-10-0041-01 Produits chimiques industriels et de résines synthétiques production, données annuelles. DOI: https://doi.org/10.25318/1610004101-fra [Consulté en mai 2022].
Staudt, A.M., Whitworth, K.W., Chien, L.-C., Whitehead, L.W. et Gimeno Ruiz de Porras, D. (2019) Association of organic solvents and occupational noise on hearing loss and tinnitus among adults in the U.S., 1999-2004. International Archives of Occupational and Environmental Health, 92(3): 403-13.
Stenehjem, J.S., Kjærheim, K., Bråtveit, M., Samuelsen, S.O., Barone-Adesi, F., Rothman, N., Lan, Q. et Grimsrud, T.K. (2015) Benzene exposure and risk of lymphohaematopoietic cancers in 25 000 offshore oil industry workers. British Journal of Cancer, 112(9): 1603-1612.
St-Jean, M., St-Amand, A., Gilbert, N.L., Soto, J.C., Guay, M., Davis, K. et Gyorkos, T.W. (2012) Indoor air quality in Montréal area day-care centres, Canada. Environmental Research, 118: 1-7.
Stroud, C.A., Zaganescu, C., Chen, J., McLinden, C.A., Zhang, J. et Wang, D. (2016) Toxic volatile organic air pollutants across Canada: multi-year concentration trends, regional air quality modelling and source apportionment. Journal of Atmospheric Chemistry, 73(2): 137-164.
Sun, R., Meng, X., Pu, Y., Sun, F., Man, Z., Zhang, J., Yin, L. et Pu, Y. (2019) Overexpression of HIF-1a could partially protect K562 cells from 1, 4-benzoquinone induced toxicity by inhibiting ROS, apoptosis and enhancing glycolysis. Toxicology In Vitro, 55: 18-23.
Sun, S., Zhang, C., Gao, J., Qin, Q., Zhang, Y., Zhu, H., Yang, X., Yang, D. et Yan, H. (2018) Benzoquinone induces ROS-dependent mitochondria-mediated apoptosis in HL-60 cells. Toxicology and Industrial Health, 34(4): 270-281.
Symanski, E., Stock, T.H., Tee, P.G. et Chan, W. (2009) Demographic, residential, and behavioral determinants of elevated exposures to benzene, toluene, ethylbenzene, and xylenes among the US population: results from 1999–2000 NHANES. Journal of Toxicology and Environmental Health, Part A, 72(14): 903-912.
Tabish, A.M., Poels, K., Hoet, P. et Godderis, L. (2012) Epigenetic factors in cancer risk: effect of chemical carcinogens on global DNA methylation pattern in human TK6 cells. PloS ONE, 7(4): e34674.
Talibov, M., Lehtinen-Jacks, S., Martinsen, J.I., Kjaerheim, K., Lynge, E., Sparen, P., Tryggvadottir, L., Weiderpass, E., Kauppinen, T., Kyyronen, P. et Pukkala, E. (2014) Occupational exposure to solvents and acute myeloid leukemia: A population-based, case-control study in four Nordic countries. Scandinavian Journal of Work, Environment and Health, 40(5): 511-7.
Tang, K., Yu, C., Jiang, L., Gong, M., Liu, W., Wang, Y., Cui, N., Song, W., Sun, Y. et Yi, Z. (2016) Long-term exposure of K562 cells to benzene metabolites inhibited erythroid differentiation and elevated methylation in erythroid specific genes. Toxicology Research, 5(5): 1284-1297.
Tarko, A., Štochmal'ová, A., Jedličková, K., Hrabovszká, S., Vachanová, A., Harrath, A.H., Alwasel, S., Alrezaki, A., Kotwica, J. et Baláži, A. (2019) Effects of benzene, quercetin, and their combination on porcine ovarian cell proliferation, apoptosis, and hormone release. Archives Animal Breeding, 62(1): 345-351.
Taş, İ., Zhou, R., Park, S., Yang, Y., Gamage, C.D., Son, Y., Paik, M. et Kim, H. (2019) Inflammatory and tumorigenic effects of environmental pollutants found in particulate matter on lung epithelial cells. Toxicology in Vitro, 59: 300-311.
TCEQ (2015) Benzene – Development Support Document. Disponible à : https://www.tceq.texas.gov/downloads/toxicology/dsd/final/benzene.pdf
Tian, J., Peng, C., Yu, X., Yang, X. et Yan, H. (2012) Expression and methylation analysis of p15 and p16 in mouse bone marrow cells exposed to 1, 4-benzoquinone. Human & Experimental Toxicology, 31(7): 718-725.
Trafalis, D.T., Panteli, E.S., Grivas, A., Tsigris, C. et Karamanakos, P.N. (2010) CYP2E1 and risk of chemically mediated cancers. Expert Opinion on Drug Metabolism & Toxicology, 6(3): 307-319.
Umweltbundesamt (German Environment Agency) (2020) Vorläufiger Leitwert für Benzol in der Innenraumluft. Bundesgesundheitsblatt 63: 361–367 (2020). Disponible à : https://doi.org/10.1007/s00103-019-03089-4
US CDC (2017) Centers for Disease Control and Prevention. National Biomonitoring Program: Biomonitoring Summary – Benzene. Mis à jour le 7 avril 2017. Disponible à : https://www.cdc.gov/biomonitoring/Benzene_BiomonitoringSummary.html
US EPA (2000) Integrated Risk Information System (IRIS) Chemical Assessment Summary: Benzene: CASRN 71-43-2. United States Environmental Protection Agency, Washington, D.C.
US EPA (2002) Toxicological Review of Benzene (Noncancer Effects) (CAS No. 71-43-2). In Support of Summary Information on the Integrated Risk Information System (IRIS). October 2002, United States Environmental Protection Agency, Washington, D.C.
Uzma, N., Kumar, B.S. et Hazari, M.A.H. (2010) Exposure to benzene induces oxidative stress, alters the immune response and expression of p53 in gasoline filling workers. American Journal of Industrial Medicine, 53(12): 126-70.
Valcke, M. et Krisnan, K. (2011) Assessing the impact of the duration and intensity of inhalation exposure on the magnitude of the variability of internal dose metrics in children and adults. Inhalation Toxicology, 23(14): 863-77.
Vanker, A., Barnett, W., Workman, L., Nduru, P.M., Sly, P.D., Gie, R.P. et Zar, H.J. (2017) Early-life exposure to indoor air pollution or tobacco smoke and lower respiratory tract illness and wheezing in African infants: a longitudinal birth cohort study. The Lancet Planetary Health, 1(8): e328.
Vardoulakis, S., Giagloglou, E., Steinle, S., Davis, A., Sleeuwenhoek, A., Galea, K.S., Dixon, K. et Crawford, J.O. (2020) Indoor exposure to selected air pollutants in the home environment: A systematic review. International Journal of Environmental Research and Public Health, 17(23): 8972.
Vaughan Watson, C., Naik, S., Lewin, M., Ragin-Wilson, A. et Irvin-Barnwell, E. (2021) Associations between select blood VOCs and hematological measures in NHANES 2005–2010.Journal of Exposure Science & Environmental Epidemiology, 31(2): 366-376.
Villeneuve, P.J., Jerrett, M., Brenner, D., Su, J., Chen, H. et McLaughlin, J.R. (2014) A case-control study of long-term exposure to ambient volatile organic compounds and lung cancer in Toronto, Ontario, Canada. American Journal of Epidemiology, 179(4): 443-451.
Vinceti, M., Rothman, K.J., Crespi, C.M., Sterni, A., Cherubini, A., Guerra, L., Maffeis, G., Ferretti, E., Fabbi, S. et Teggi, S. (2012) Leukemia risk in children exposed to benzene and PM10 from vehicular traffic: a case–control study in an Italian population. European Journal of Epidemiology, 27(10): 781-790.
Vlaanderen, J., Portengen, L., Rappaport, S.M., Glass, D.C., Kromhout, H. et Vermeulen, R. (2011) The impact of saturable metabolism on exposure-response relations in 2 studies of benzene-induced leukemia. American Journal of Epidemiology, 174(5): 621-629.
Wang, L., He, X., Bi, Y. et Ma, Q. (2012) Stem cell and benzene-induced malignancy and hematotoxicity. Chemical Research in Toxicology, 25(7): 1303-1315.
Wang, S-W., Majeed, M.A., Chu, P-L, et Lin, H-C. (2009) Characterizing relationships between personal exposures to VOCs and socioeconomic, demographic, behavioral variables. Atmospheric Environment, 43:2296-2302.
Wathier, L., Venet, T., Bonfanti, E., Nunge, H., Cosnier, F., Parietti-Winkler, C., Campo, P. et Pouyatos, B. (2019) Measuring the middle-ear reflex: A quantitative method to assess effects of industrial solvents on central auditory pathways. Neurotoxicology, 74: 58-66.
Weaver, C., Liu, S., Lu, J. et Lin, B. (2007) The effects of benzene exposure on apoptosis in epithelial lung cells: localization by terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling (TUNEL) and the immunocytochemical localization of apoptosis-related gene products. Cell Biology and Toxicology, 23(3): 201-220.
Weichenthal, S., Mallach, G., Kulka, R., Black, A., Wheeler, A., You, H., St‐Jean, M., Kwiatkowski, R. et Sharp, D. (2013) A randomized double‐blind crossover study of indoor air filtration and acute changes in cardiorespiratory health in a First Nations community. Indoor Air, 23(3): 175-184.
Wentworth, G.R., Aklilu, Y., Landis, M.S. et Hsu, Y. (2018) Impacts of a large boreal wildfire on ground level atmospheric concentrations of PAHs, VOCs and ozone. Atmospheric Environment, 178: 19-30.
Wheeler, A.J., Smith-Doiron, M., Xu, X., Gilbert, N.L. et Brook, J.R. (2008) Intra-urban variability of air pollution in Windsor, Ontario—measurement and modeling for human exposure assessment. Environmental Research, 106(1): 7-16.
Wheeler, A.J., Wong, S.L., Khoury, C. et Zhu, J. (2013) Predictors of indoor BTEX concentrations in Canadian residences. Health Reports, 24(5): 11-17.
Wichmann, F.A., Muller, A., Busi, L.E., Cianni, N., Massolo, L., Schlink, U., Porta, A. et Sly, P.D. (2009) Increased asthma and respiratory symptoms in children exposed to petrochemical pollution. Journal of Allergy and Clinical Immunology, 123(3): 632-8.
Wilhelm, M., Ghosh, J.K., Su, J., Cockburn, M., Jerrett, M. et Ritz, B. (2011) Traffic-related air toxics and preterm birth: a population-based case-control study in Los Angeles County, California. Environmental Health, 10(1): 1-12.
Williams, A.D., Grantz, K.L., Zhang, C., Nobles, C., Sherman, S. et Mendola, P. (2019) Ambient Volatile Organic Compounds and Racial/Ethnic Disparities in Gestational Diabetes Mellitus: Are Asian/Pacific Islander Women at Greater Risk? American Journal of Epidemiology, 188(2): 389-97.
Won D., Nong G., Yang W. et Collins P. (2014). Disponible à : Material emissions testing: VOCs from wood, paint, and insulation materials. Conseil national de recherches Canada, Ottawa, Ontario.
Won D., Nong G., Yang W. et Lusztyk E. (2015). Disponible à : VOC emissions from evaporative sources in residential garages. Conseil national de recherches Canada, Ottawa, Ontario.
Wong, O., Harris, F., Armstrong, T.W. et Hua, F. (2010) A hospital-based case-control study of acute myeloid leukemia in Shanghai: analysis of environmental and occupational risk factors by subtypes of the WHO classification. Chemico-biological Interactions, 184(1-2): 112-128.
Xiong, Y., Bari, M.A., Xing, Z. et Du, K. (2020) Ambient volatile organic compounds (VOCs) in two coastal cities in western Canada: Spatiotemporal variation, source apportionment, and health risk assessment. Science of the Total Environment, 706: 135970.
Yao, Y., Pennell, K. G. et Suuberg, E. (2011). Vapor intrusion in urban settings: effect of foundation features and source location. Procedia environmental sciences, 4:245–250.
Yeager, R., Riggs, D.W., DeJarnett, N., Srivastava, S., Lorkiewicz, P., Xie, Z., Krivokhizhina, T., Keith, R.J., Srivastava, S. et Browning, M.H. (2020) Association between residential greenness and exposure to volatile organic compounds. Science of the Total Environment, 707; 135435.
Yin, S., Hayes, R.B., Linet, M.S., Li, G., Dosemeci, M., Travis, L.B., Li, C., Zhang, Z., Li, D. et Chow, W. (1996) A cohort study of cancer among benzene‐exposed workers in China: overall results. American Journal of Industrial Medicine, 29(3): 227-235.
Yin, S.N., Li, G.L., Tain, F.D., Fu, Z.I., Jin, C., Chen, Y.J., Luo, S.J., Ye, P.Z., Zhang, J.Z. et Wang, G.C. (1987) Leukaemia in benzene workers: a retrospective cohort study. British Journal of Industrial Medicine, 44(2): 124-128.
Yu, C., Cui, N., Wang, Y., Wang, Y., Liu, W., Gong, M., Zhao, X., Rong, L. et Yi, Z. (2017) Changes in DNA methylation of erythroid-specific genes in K562 cells exposed to catechol in long term. Toxicology in Vitro, 43: 21-28.
Yu, C., Li, Y., Zhao, X., Yang, S., Li, L., Cui, N., Rong, L. et Yi, Z. (2019) Benzene metabolite 1, 2, 4-benzenetriol changes DNA methylation and histone acetylation of erythroid-specific genes in K562 cells. Archives of Toxicology, 93(1): 137-147.
Zhang, G., Ji, B., Li, Y., Zheng, G., Ye, L., Hao, Y., Ren, J., Zhou, L., Xu, X., Zhu, Y. et Xia, Z. (2016) Benchmark Doses Based on Abnormality of WBC or Micronucleus Frequency in Benzene-Exposed Chinese Workers. Journal of Occupational & Environmental Medicine, 58(2): e39-44.
Zhang, L., Lan, Q., Ji, Z., Li, G., Shen, M., Vermeulen, R., Guo, W., Hubbard, A.E., McHale, C.M., Rappaport, S.M., Hayes, R.B., Linet, M.S., Yin, S., Smith, M.T. et Rothman, N. (2012) Leukemia-related chromosomal loss detected in hematopoietic progenitor cells of benzene-exposed workers. Leukemia, 26(12): 2494-8.
Zhou, C., Baiz, N., Banerjee, S., Charpin, D.A., Caillaud, D., De Blay, F., Raherison, C., Lavaud, F. et Annesi-Maesano, I. (2013) The relationships between ambient air pollutants and childhood asthma and eczema are modified by emotion and conduct problems. Annals of Epidemiology, 23(12): 778-83.
Zhu, J., Newhook, R., Marro, L. et Chan, C.C. (2005) Selected volatile organic compounds in residential air in the city of Ottawa, Canada. Environmental Science & Technology, 39(11): 3964-3971.
Zhu, J., Wong, S.L. et Cakmak, S. (2013) Nationally representative levels of selected volatile organic compounds in Canadian residential indoor air: population-based survey. Environmental Science & Technology, 47(23): 13276-13283.
Annexe A : liste des acronymes et des abréviations
- ADN
- acide désoxyribonucléique
- Anses
- Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail
- ARN
- acide ribonucléique
- ATSDR
- Agency for Toxic substances and Disease Registry
- BMCL
- limite inférieure de la concentration repère
- BTEX
- benzène, toluène, éthylbenzène et xylènes
- CCMH
- concentration corpusculaire moyenne en hémoglobine
- CCRS
- concentration correspondant à un risque spécifié
- CIRC
- Centre international de Recherche sur le Cancer
- CMENO
- concentration minimale avec effet nocif observé
- COV
- composé organique volatil
- CRf
- concentration de référence
- CSENO
- concentration sans effet nocif observé
- CT0,05
- concentration tumorigène 0,05
- CVF
- capacité vitale forcée
- CYP2E1
- cytochrome P450 2E1
- DEM
- débit expiratoire maximal
- ECMS
- Enquête canadienne sur les mesures de la santé
- EIQ
- écart interquartile
- EPHX1
- époxyde hydrolase 1
- I/E
- ratio intérieur/extérieur
- IC
- intervalle de confiance
- LAM
- leucémie aiguë myéloïde
- LANL
- leucémie aiguë non lymphoblastique
- LDQAIR
- lignes directrices sur la qualité de l'air intérieur résidentiel
- LMC
- leucémie myéloïde chronique
- LNH
- lymphome non hodgkinien
- MG
- moyenne géométrique
- MRL
- minimal risk level
- NHANES
- National Health and Nutrition Examination Survey
- NO2
- dioxyde d'azote
- NQO1
- NAD(P)H:quinone oxydoréductase de type 1
- OEHHA
- Office of Environmental Health Hazard Assessment
- OMS
- Organisation mondiale de la Santé
- PBPK
- pharmacocinétique à base physiologique
- ppb
- partie par milliard
- ppm
- partie par million
- RC
- rapport de cotes
- REL
- reference exposure level
- RIVM
- National Institute for Public Health and the Environment
- RR
- risque relatif
- SMD
- syndromes myélodysplasiques
- SMP
- syndrome myéloprolifératif
- SNC
- système nerveux central
- SPMA
- acide S-phénylmercapturique
- t,t-MA
- acide trans, trans-muconique
- TCEQ
- Texas Commission on Environmental Quality
- TRA
- taux de renouvellement de l'air
- US EPA
- United States Environmental Protection Agency
- VEMS
- volume expiratoire maximal par seconde
- VTR
- valeur toxicologique de référence
Annexe B : études d'exposition humaine
| Étude | Participants | Exposition | Résultats | CSENO/CMENO |
|---|---|---|---|---|
D'Andrea et al., 2014 |
Étude rétrospective des effets nocifs d'un incident de torchage survenu à la British Petroleum de Texas City chez 312 enfants de moins de 17 ans dont 157 ont été exposés au benzène |
Les secteurs résidentiels touchés par l'incident de torchage survenu à la raffinerie, qui a rejeté 7000 kg de benzène et d'autres contaminants, ont permis d'évaluer l'exposition au benzène. Les enfants habitant dans ces secteurs ont été choisis pour participer à l'étude. L'exposition au benzène découlant de cet incident a duré près de 40 jours. Les enfants habitant en dehors des secteurs résidentiels touchés ont été inclus dans l'étude en tant que témoins. |
Les enfants exposés ont présenté une diminution significative du nombre de globules blancs (6,8 ± 2,1 × 103/µL) (p = 0,02) par rapport aux témoins (7,3 ± 1,7 x 103/µL). Ils présentaient également une augmentation significative de la numération plaquettaire moyenne (278,4 ± 59,9 x 103/µL) par rapport aux témoins (261,6 ± 51,7 x 103/µL) (p= 0,005). Les valeurs des enzymes hépatiques étaient aussi plus élevées dans le groupe exposé. Les taux sériques de PAL étaient de 183,7 ± 95,6 UI/L chez les participants exposés par rapport à ceux non exposés (165 ± 70,3 UI/L) (p= 0,04). Les taux moyens d'AST étaient significativement plus élevés dans le groupe exposé (23,6 ± 15,3 UI/L) que dans le groupe non exposé (20,5 ± 5,5 UI/L) (p= 0,005). Les taux moyens d'ALT sériques étaient plus élevés dans le groupe exposé (19,2 ± 7,8) que dans le groupe non exposé (16,9 ± 6,9) (p= 0,005). |
Non déterminée |
| Étude | Participants | Exposition | Résultats | CSENO/CMENO |
|---|---|---|---|---|
Cakmak et al., 2014 |
Étude transversale de la population canadienne (cycle 2 de l'ECMS); 3039 participants des deux sexes, non-fumeurs, âgés de 6 à 79 ans |
La concentration de benzène a été mesurée dans des maisons censées être représentatives de la population canadienne. Les concentrations de benzène et de 83 autres COV ont été mesurées dans les maisons par échantillonnage passif sur 7 jours. La MG des concentrations de benzène était de 1,06 μg/m3 (l'EIQ était de 1,31 μg/m3 après transformation logarithmique). |
Le benzène a été négativement associé à la fonction pulmonaire (variation en pourcentage du VEMS/CVF associée à une variation de l'EIQ du benzène = -0,98; IC à 95 % [-1,76; -0,20]). Le ratio VEMS/CVF était significativement plus bas chez les hommes (RR = -1,75; IC à 95 % [-2,71; -0,79]), mais pas chez les femmes (RR = -0,01; IC à 95 % [-0,55; 0,57]). Une variation en pourcentage du ratio VEMS/CVF associée à une variation de l'EIQ des concentrations de benzène a également été observée chez les personnes de moins de 17 ans (RR = -2,3; IC à 95 % [-3,7; -0,9]) et les personnes âgées de 39 à 64 ans (RR = -1,45; IC à 95 % [-2,44; -0,45]), mais pas chez celles de 17 à 38 ans (RR = -0,15; IC à 95 % [-1,11; 0,82]). Le benzène faisait partie des 10 COV (les autres étant le décanal, le furan-2-carbaldéhyde, l'hexanal, le nonanal, l'octanal, le styrène, l'a-pinène, le 2-méthyl-1,2-butadiène et le naphtalène) associés négativement à la fonction pulmonaire. |
La CMENO pour la détérioration de la fonction pulmonaire correspond à uneaugmentation d'un EIQ des concentrations de benzène dans l'air intérieur (1,31 μg/m3). |
Martins et al., 2012 |
Enquête prospective par panel portant sur 51 écoliers (28 garçons et 23 filles; âge moyen = 7,3 ans) |
La concentration de benzène a été mesurée quatre fois dans les écoles et les maisons à l'aide de dispositifs de prélèvement par diffusion (un échantillon pour chacune des deux saisons hivernales et chacune des deux saisons estivales). Dans les maisons, la concentration de benzène était la plus élevée en hiver avec des valeurs moyennes de 3,3 μg/m3 le premier hiver et de 11,9 μg/m3 le second, alors qu'elle était respectivement de 1,1 et 1,8 μg/m3 en été. Dans les écoles, la concentration moyenne de benzène était nettement plus faible, étant comprise entre 1,4 et 5,0 μg/m3 en hiver et entre 0,5 et 1,2 μg/m3 en été. L'exposition totale à la maison et à l'école variait de 2,9 à 10,7 μg/m3 en hiver et de 1,0 à 1,6 μg/m3 en été. |
Les auteurs ont conclu qu'une augmentation de la concentration de benzène de10 μg/m3 (3,3 ppb) par semaine est associée de façon significative à une diminution de 4,33 % du VEMS (IC à 95 % [-7,13; -1,13]), à une diminution de 1,17 % du VEMS/CVF (IC à 95 % [-3,24; -0,18]), à une diminution de 5,89 % du DEM 25-75 (IC à 95 % [-10,16; -1,62]), à une variation de 2,79 % du VEMS (DVEMS) (IC à 95 % [0,92; 4,65]) et à une diminution du pH du condensat de l'air exhalé (marqueur d'inflammation des voies respiratoires). Les modèles ont été corrigés pour prendre en compte le tabagisme des parents et d'autres caractéristiques sociodémographiques et physiques, mais pas les co-polluants. Une augmentation des expositions totales aux PM10, au NO2, au toluène et à l'éthylbenzène a également été associée à une diminution de la fonction pulmonaire chez ces enfants. |
CMENO pour les effets cliniques respiratoires chez l'enfant = une augmentation hebdomadaire de 10 μg/m3 de la concentration dans l'air intérieur à l'école ou à la maison (avec différents profils d'exposition) |
Rive et al., 2013 |
Étude cas-témoin sur le benzène et d'autres COV/PM 2,5 menée auprès de 32 enfants asthmatiques et 31 enfants non asthmatiques (âge moyen d'environ 14 ans) |
La concentration de benzène a été mesurée dans l'air intérieur résidentiel. La médiane des concentrations de benzène était de 3,85 μg/m3 dans les maisons des enfants asthmatiques et de 1,9 μg/m3 dans celles des enfants non asthmatiques. |
Des RC de 8,11 pour l'asthme (IC à 95 % [1,41; 46,43]) et de 10,10 pour avoir été réveillé par une respiration sifflante (IC à 95 % [2,06; 49,78]) ont été signalés chez les enfants exposés à une concentration supérieure à la médiane de l'échantillon. Les RC étaient supérieurs à 1 mais non significatifs pour la respiration sifflante au cours des 12 derniers mois (RC = 1,89), la toux sèche nocturne (RC = 1,25), la respiration sifflante après un effort au cours des 12 derniers mois (RC = 10,38) et plus de 4 crises de respiration sifflante au cours de la dernière année (RC = 2,95). Les modèles ont été corrigés pour prendre en compte l'exposition au tabagisme passif, l'atopie, les allergies familiales, l'âge et le sexe, mais pas les co-polluants. |
CMENO pour l'exacerbation des symptômes de l'asthme = 3,85 μg/m3 dans l'air intérieur résidentiel |
Smargiassi et al., 2014 |
Étude par panel de 10 jours menée auprès de 72 enfants asthmatiques (issus de maisons de non-fumeurs) âgés de 7 à 12 ans vivant à proximité d'un complexe industriel abritant deux raffineries à Montréal, au Québec |
Les enfants transportaient un petit sac à dos pour la surveillance personnelle du benzène (prélevé par des canisters Summa) et d'autres polluants atmosphériques. La médiane (entre les 25e et 75 e percentiles) des concentrations personnelles de benzène chez les participants était de 2,10 (1,26 à 3,67) μg/m3. |
Quelle que soit la correction apportée au modèle, l'exposition au benzène n'a pas été associée à une détérioration de la fonction pulmonaire ou à des effets cardiovasculaires chez ce groupe d'enfants après la prise en compte du tabagisme des parents et d'autres facteurs de confusion. Aucun co-polluant n'a été pris en compte dans cette étude. |
Non déterminée |
Ferrero et al., 2017 |
Étude de cohorte prospective menée en Espagne auprès de 708 nouveau-nés au cours de leur première année de vie |
Les concentrations de benzène ont été mesurées dans l'air intérieur et extérieur résidentiel par échantillonnage passif sur 15 jours. Les maisons ont été regroupées selon la zone de résidence, soit urbaine, métropolitaine, périurbaine, résidentielle et rurale. La médiane des concentrations dans l'air intérieur était comprise entre 1,23 et 2,38 μg/m3 (les zones rurales présentaient les concentrations les plus élevées). La médiane des concentrations dans l'air extérieur était plus faible, étant comprise entre 0,52 et 1,21 μg/m3 (les zones métropolitaines présentaient les concentrations les plus élevées). Les concentrations atmosphériques ont également été regroupées selon la saison, et les concentrations dans l'air intérieur avaient tendance à être plus élevées en hiver. |
Les effets respiratoires chez les nourrissons, notamment la toux persistante, l'infection des voies respiratoires inférieures et la respiration sifflante, évalués à l'aide d'un questionnaire administré aux parents, n'ont pas été associés aux niveaux d'exposition au benzène en milieu résidentiel. L'étude a pris en compte le tabagisme des parents, mais pas les co-polluants. |
Non déterminée |
Vanker et al., 2017 |
Étude de cohorte de naissance longitudinale menée auprès de 1065 nourrissons en Afrique du Sud |
Les concentrations de benzène ont été mesurées dans l'air intérieur à l'aide de tubes à diffusion passive posés dans chaque maison pendant 2 semaines : une fois au cours de la grossesse (échantillon anténatal) et une fois au cours des 4 à 6 premiers mois de vie (échantillon postnatal). La médiane des concentrations de benzène était de 4,29 μg/m3 dans les échantillons anténataux et de 3,12 μg/m3 dans les échantillons postnataux. |
Aucune augmentation significative de l'incidence des infections des voies respiratoires inférieures ni de celle de respiration sifflante n'a été relevée chez les nourrissons vivant dans des maisons où la concentration de benzène était supérieure à la norme de qualité de l'air intérieur sud-africaine de 5 μg/m3 par rapport à ceux exposés à des niveaux plus faibles. L'étude a pris en compte le tabagisme des parents, mais pas les co-polluants. |
CSENO pour une augmentation de l'incidence des infections des voies respiratoires inférieures ou de respiration sifflante après une exposition anté ou postnatale = 5 μg/m3 dans l'air intérieur résidentiel |
Wichmann et al., 2009 |
Étude transversale menée en Argentine auprès de 181 enfants âgés de 6 à 12 ans vivant à proximité d'usines pétrochimiques (n = 52), dans une région urbaine où la circulation est dense (n = 37), dans une zone semi-rurale (n = 63) et dans une zone résidentielle (n = 30) |
La médiane des concentrations de benzène dans l'air extérieur était de 19,3 μg/m3 dans la zone industrielle, de 2,9 μg/m3 dans la zone urbaine, de 1,9 μg/m3 dans la zone semi-rurale et de 5,4 μg/m3 dans la zone résidentielle. |
Les enfants vivant à proximité de la zone industrielle présentaient une augmentation significative des symptômes de l'asthme (tous symptômes confondus;p < 0,001) et une détérioration significative des résultats de spirométrie (VEMS, VEMS/CVF et DEM25-75); tous p < 0,001). Une augmentation de la concentration de benzène de 1 μg/m3 a fait croître les RC de la spirométrie de manière significative : VEMS = 1,19; CVF = 1,07; VEMS/CVF = 1,26; DEM 25-75 = 1,22; RBD = 1,07. Les modèles ont été corrigés pour prendre en compte le tabagisme des parents, mais pas les co-polluants ambiants. |
CMENO pour l'exacerbation des symptômes de l'asthme et la détérioration de la fonction pulmonaire = une augmentation de la concentration de benzène dans l'air extérieur résidentiel de 1 μg/m3 |
Morales et al., 2015 |
Étude de cohorte populationnelle menée en Espagne auprès de 620 paires mères-enfants |
Les concentrations de benzène dans l'air extérieur résidentiel ont été estimées à l'aide de concentrations mesurées par région et de modèles de régression de l'utilisation des terres spécifiques de chaque région. La concentration moyenne de benzène dans l'air extérieur était de 0,83 μg/m3. |
Au cours du deuxième trimestre et à l'aide des résultats des modèles corrigés, les concentrations de benzène ont été associées à un RR de 1,22 avec un VEMS inférieur à 80 % de la valeur prédite (p = 0,027) pour une augmentation de l'EIQ des concentrations de benzène de 0,28 μg/m3. Les modèles ont été corrigés pour prendre en compte le tabagisme des parents, mais pas les co-polluants ambiants. Des effets similaires ont été observés pour le NO2. |
CMENO pour la détérioration de la fonction pulmonaire chez les enfants d'âge préscolaire = 0,28 μg/m3 dans l'air extérieur résidentiel pendant la grossesse |
Charpin et al., 2009 |
Étude transversale menée en France auprès de 4907 enfants âgés de 9 à 11 ans |
Les concentrations de benzène dans l'air extérieur ont été estimées à l'aide de modèles de dispersion. La médiane des concentrations de benzène était de 1,7 μg/m3 pour le groupe faiblement exposé et de 3,0 μg/m3 pour le groupe fortement exposé. |
Une corrélation a été établie entre les taux de prévalence de l'asthme, de l'hyperréactivité induite par l'exercice, de la dermatite atopique et de la sensibilisation au pollen et le benzène et au moins l'une des substances entre le SO2, les PM10, les NOx, le NO 2 et le CO. Le RC le plus élevé était pour l'asthme découlant de l'exposition au benzène au cours de la dernière année (1,41) (p < 0,01). Les modèles ont été corrigés pour prendre en compte le tabagisme des parents, mais pas les co-polluants ambiants. |
Non déterminée |
Zhou et al., 2013 |
Étude transversale menée en France auprès de 4209 enfants âgés de 10 à 12 ans (2097 garçons et 2112 filles) |
Les concentrations de benzène dans l'air extérieur à l'école ont été estimées à l'aide de modèles de dispersion. La concentration moyenne de benzène dans l'air extérieur a été évaluée à 2,41 μg/m3. |
Des augmentations significatives des RC corrigés ont été signalées pour la respiration sifflante (RC = 1,22;p < 0,01), l'asthme diagnostiqué par un médecin (RC = 1,18;p= 0,01) et l'eczéma (RC = 1,48;p< 0,01) pour une augmentation de l'EIQ de 1,73 à 2,92 μg/m3 chez les enfants présentant des troubles émotionnels et comportementaux. Les modèles ont été corrigés pour prendre en compte le tabagisme des parents, mais pas les co-polluants ambiants. Toutes les autres substances évaluées, qu'il s'agisse du CO, du NO2, des NOx, des PM10 ou des COV totaux, ont également présenté des RC aussi élevés. |
CMENO pour une incidence accrue de respiration sifflante, d'asthme et d'eczéma = 2,92 μg/m3 dans l'air extérieur à l'école |
| Étude | Participants | Exposition | Résultats | CSENO/CMENO |
|---|---|---|---|---|
Olsson et al., 2018 |
Étude cas-témoin menée auprès de 3421 hommes (fils de pères ou de mères qui pourraient avoir été exposés au benzène en milieu de travail) ayant reçu un diagnostic de tumeur germinale du testicule au Danemark entre 1981 et 2014. Les témoins (n = 14 024) provenaient du registre central de la population et étaient appariés selon l'année de naissance. |
L'exposition des pères et des mères a été déterminée par la matrice emplois-exposition du Danemark (NOCCA-DANJEM). Les groupes ont été définis comme étant exposés ou non exposés. |
Aucune analyse propre au benzène n'a été effectuée. Aucune association n'a été mise en évidence entre les tumeurs germinales du testicule et l'exposition professionnelle maternelle ou paternelle aux solvants ou aux métaux lourds. |
Non déterminée |
Slama et al., 2009 |
271 femmes enceintes non fumeuses d'une cohorte mère-enfant recrutées dans deux maternités en France |
L'exposition personnelle a été mesurée pendant une semaine au cours de la 27e semaine de grossesse par un dispositif de prélèvement par diffusion. La médiane de l'exposition au benzène était de 1,8 μg/m3 (5e, 95e percentiles, 0,5, 7,5 μg/m3). Groupes d'exposition au benzène (μg/m3) : < 1,4; 1,4 – 2,59; ≥ 2,6 |
Poids à la naissance : chaque augmentation de un de l'exposition au benzène après transformation logarithmique a été associée à une diminution corrigée du poids à la naissance de 68 g (IC à 95 % [-135; -1]). (Les résultats n'étaient pas statistiquement significatifs lorsqu'ils étaient analysés par groupe). Circonférence de la tête à la naissance : diminution de 1,9 mm pour chaque augmentation de un de l'exposition au benzène après transformation logarithmique (IC à 95 % [-3,8; 0,0]). Après une analyse par groupe, les résultats n'étaient à la limite de la signification qu'au niveau d'exposition le plus élevé (≥ 2,6 μg/m3) : 3,7 mm (IC à 95 % [-7,3; 0,0]). Circonférence de la tête au cours de la grossesse : une diminution de la circonférence de la tête a été observée, mais elle n'est généralement pas significative sur le plan statistique. Les modèles de régression ont été corrigés pour prendre en compte les facteurs de confusion, y compris ceux liés aux mesures physiques du fœtus et de la mère à la 27e semaine, à l'exposition professionnelle maternelle aux peintures et aux pesticides, et au tabagisme passif maternel, mais pas les co-polluants. |
Non déterminée |
Ghosh et al., 2012 |
Étude cas-témoin portant sur des enfants nés à terme, de faible poids (8191) et de poids normal (370 922), dans le comté de Los Angeles, à moins de 5 milles de la station de surveillance de la California Air Resources Board. D'autres co-polluants comme les COV, les NO x et le CO ont été évalués. |
Les concentrations de benzène ont été mesurées à l'extérieur de la station de surveillance californienne. La concentration moyenne de benzène était de 1,1 ppb (3,5 μg/m3) et l'EIQ de 0,8 ppb (2,6 μg/m3). |
L'exposition au benzène (moyenne = 3,5 μg/m3) au cours du troisième trimestre a été associée à un RC à la limite de la signification de 1,03 (IC à 95 % [1,00; 1,05]) par augmentation de l'EIQ (2,6 μg/m3, 0,8 ppm) pour le faible poids à la naissance à terme chez les nourrissons. Les modèles ont été corrigés pour prendre en compte l'âge gestationnel et celui de la mère et des facteurs socioéconomiques, mais pas le tabagisme ni les co-polluants. Des associations similaires ont également été signalées pour le toluène, l'éthylbenzène et les xylènes. |
CMENO pour un faible poids à la naissance = augmentation de 2,6 μg/m3 |
Estarlich et al., 2011 |
Étude de cohorte multicentrique prospective menée auprès de 2337 femmes enceintes. Le NO 2 était un autre polluant évalué. |
Les concentrations de benzène ont été mesurées dans l'air extérieur résidentiel par échantillonnage passif sur 7 jours. La concentration moyenne de benzène était de 1,6 μg/m3 pour les quatre régions et la concentration régionale la plus élevée de 2,3 μg/m3. |
Aucune association n'a été relevée dans les modèles à un ou deux polluants entre le poids, la taille et la circonférence de la tête et une augmentation de la concentration de benzène de 1 μg/m3. Un modèle à deux polluants a été corrigé pour évaluer le NO 2 et le benzène de façon séparée. Tous les modèles ont été corrigés pour prendre en compte le tabagisme, l'âge de la mère, le poids de grossesse, la taille du père, la prise de poids pendant la grossesse et d'autres facteurs. |
CSENO pour les mesures anthropométriques à la naissance : augmentation de la concentration dans l'air extérieur résidentiel de 1 μg/m3 |
Wilhelm et al., 2011 |
Étude cas-témoin portant sur 241 415 naissances entre juin 2004 et mars 2006, résidant à moins de 5 milles d'une station de surveillance de l'étude MATES III du Southern California Air Quality Management District. Cette étude visait à examiner le risque de naissance prématurée chez les femmes de Los Angeles exposées à des niveaux élevés de polluants atmosphériques provenant du trafic routier. Les cas de naissance prématurée étaient n = 10 265 et n = 10 265 en fonction de l'âge gestationnel à la naissance. |
Le lieu de naissance a été déterminé à partir du certificat de naissance, et des modèles de régression de l'utilisation des terres ont permis d'attribuer une exposition à chaque polluant. Pour l'exposition au benzène, des moyennes sur 24 heures ont été recueillies tous les 3 jours auprès des services de surveillance de l'étude MATES situés à moins de 5 milles de l'habitation de chaque femme. La moyenne des données a été calculée pour différentes périodes de la grossesse en fonction de la date de naissance et de l'âge gestationnel indiqués sur le certificat de naissance. L'EIQ pour le benzène était de 0,20 ppb pendant toute la grossesse. |
Un risque accru de naissance prématurée (RC = 1,09, IC à 95 % [1,06; 1,13]) par augmentation de l'EIQ (0,64 μg/m3, 0,20 ppb) de l'exposition dans l'air extérieur au benzène provenant du trafic routier a été mis en évidence pendant toute la grossesse. Une corrélation positive a été établie entre l'exposition au benzène et les polluants suivants : le NO, le NO2,les NOx, les PM2,5, les PM10, le CE, le CO, les PM 2,5 de diesel, les HAP totaux, les PM 2,5 provenant de la combustion de biomasse et le nitrate d'ammonium. Les co-polluants ont également été associés à des risques accrus de naissance prématurée. |
Non déterminée |
Estarlich et al., 2016 |
Étude de cohorte prospective portant sur le risque de naissance prématurée menée auprès de 2409 femmes enceintes. Le benzène et le NO 2 ont tous deux été mesurés dans cette étude. |
Les concentrations de benzène ont été mesurées dans l'air extérieur résidentiel par échantillonnage passif sur 7 jours. La médiane des concentrations de benzène était de 1,3 μg/m3 pour les quatre régions. |
Les RC pour une augmentation de la concentration de benzène de 1 μg/m3 étaient supérieurs à 1 dans les scénarios évalués par les modèles à un et à deux polluants pour les premier, second et troisième trimestres et toute la grossesse. Les RC étaient les plus élevés pour toute la grossesse et le troisième trimestre chez les femmes ayant passé plus de 15 heures par jour à la maison (RC = 1,59 dans le modèle à un polluant). En se servant du modèle à deux polluants corrigé pour prendre en compte le NO2, le tabagisme, l'âge de la mère, le poids de la mère pendant la grossesse, la taille de la mère et du père, la prise de poids pendant la grossesse et d'autres facteurs, les auteurs ont fait état d'un RC de 1,45 (IC à 95 % [1,00; 2,09]) par augmentation de l'exposition au benzène de 1 μg/m3 (0,3 ppb) au cours du troisième trimestre chez les femmes enceintes ayant passé plus de 15 heures par jour à la maison au cours de leur troisième trimestre. |
CMENO pour les naissances prématurées = augmentation de 1 μg/m3 de la concentration dans l'air extérieur résidentiel |
Williams et al., 2019 |
Étude transversale sur les taux de diabète gestationnel sur 220 605 accouchements. L'analyse a tenu compte de l'origine ethnique. L'étude comprenait des personnes blanches (n = 109 396), noires (n = 49 093), d'origine latino-américaine (n = 38 241) et des îles du Pacifique (n = 9068). Treize autres COV ont été évalués en plus du benzène. |
Les participants ont été exposés au benzène dans l'air extérieur dans 15 marchés régionaux de santé. La concentration moyenne a été estimée 3 mois avant la conception et au cours du premier trimestre de grossesse : 0,24 ppb (0,77 μg/m3). |
Les auteurs ont constaté qu'une exposition avant la conception à une concentration de benzène supérieure ou égale à 1,1 μg/m3 (0,34 ppb) était associée à une augmentation du risque de diabète gestationnel de 25 % (IC à 99 % [1,08; 1,43]) chez les personnes blanches et de 41 % (IC à 99 % [1,12; 1,77]) chez les habitants des îles du Pacifique. Ils ont également constaté que l'exposition à cette même concentration de benzène durant le premier trimestre de grossesse était associée à une augmentation de 29 % du risque (IC à 99 % [1,04; 1,59]) de diabète gestationnel chez les habitants des îles du Pacifique. Aucun effet similaire n'a été observé chez les personnes noires ni celles d'origine latino-américaine. Les modèles ont été corrigés pour prendre en compte les caractéristiques physiques, la parité, l'état matrimonial et les facteurs socioéconomiques de la mère, mais pas les co-polluants. |
CMENO pour un risque accru de diabète gestationnel = concentration de benzène supérieure à 1,06 μg/m3 dans l'air extérieur d'une région sanitaire |
| Étude | Participants | Exposition | Résultats | CSENO/CMENO |
|---|---|---|---|---|
Smith, 2010 |
Analyse documentaire des effets du benzène sur les travailleurs exposés au benzène et le public |
Expositions professionnelles aux solvants industriels, exposition du public aux usines de fabrication, émissions provenant des incendies, milieu de travail et tabagisme |
Une cohorte de travailleurs de l'industrie du caoutchouc provenant de l'étude Pliofilm de 1977 a permis de découvrir les effets leucémogènes de l'exposition au benzène. Cette exposition peut également provoquer une leucémie aiguë et possiblement d'autres cancers hématologiques. De plus en plus d'éléments viennent confirmer l'association entre la leucémie infantile et l'exposition au benzène. L'exposition au benzène peut influer sur la leucémogenèse par un mécanisme multimodal. Des polymorphismes mononucléotidiques de gènes candidats provoquent une sensibilité à l'hématotoxicité du benzène. Des études d'association pangénomique seront nécessaires pour approfondir l'examen des variations génétiques au niveau de la sensibilité au benzène. De faibles niveaux d'exposition professionnelle au benzène influent sur l'hématopoïèse. Aucun seuil sécuritaire d'exposition au benzène n'a pu être établi. |
Non déterminée |
Lan et al., 2004 |
Étude transversale portant sur 250 travailleurs de l'industrie de la chaussure exposés au benzène et 140 travailleurs non exposés au benzène (de même âge et de même sexe) employés dans des usines de vêtements. Les 2/3 étaient des femmes; âge moyen de 29,9 ± 8,4 ans; à l'emploi depuis 6,1 ± 2,9 ans. |
L'exposition personnelle au benzène et au toluène a été suivie pendant près de 16 mois avant la phlébotomie et le prélèvement d'échantillons d'urine après le quart de travail. Quatre groupes de travailleurs ont été déterminés selon la concentration moyenne de benzène mesurée au cours du mois : témoins, < 1 ppm, 1 à < 10 ppm et ≥ 10 ppm. Plus de 100 travailleurs étaient exposés à moins de 1 ppm. |
Le nombre de tous les types de globules blancs et des plaquettes a diminué dans le groupe exposé à < 1 ppm et des réductions significatives ont été observées pour les lymphocytes T CD4+, le rapport CD4/CD8+ et les lymphocytes B. Le taux d'hémoglobine a diminué chez les travailleurs exposés à > 10 ppm. Les corrections apportées pour prendre en compte les facteurs de confusion (l'âge, le sexe, la consommation actuelle de tabac et d'alcool, l'IMC, les infections récentes et la concentration de toluène dans l'air après transformation logarithmique, le cas échéant) n'ont pas changé de façon significative la force des associations. Des effets hématologiques ont été observés à tous les niveaux d'exposition (< 10 ppm, < 1 ppm au cours de l'année précédente et < 40 ppm-année pour l'exposition cumulative au benzène [p < 0,05]). Le même effet a été observé dans le groupe principalement exposé au benzène (< 1 ppm). Des diminutions significatives liées à la dose de la formation de colonies à partir de cellules souches ont été observées. La diminution de la formation de colonies étant proportionnellement plus importante que celle des globules blancs et des granulocytes différenciés, les cellules souches précoces seraient plus sensibles aux effets hématotoxiques du benzène que les cellules matures. Les polymorphismes mononucléotidiques des gènes CYP2E1, MPO et NQ01 ont été examinés. Les génotypes MPO-463GG et NQ01 465CT ont présenté une diminution du nombre de globules blancs qui était encore plus importante avec l'exposition au benzène, comme en témoigne le groupe exposé. |
CMENO = < 1 ppm ou < 40 ppm-année |
Bassig et al., 2016 |
Étude transversale portant sur 250 travailleurs (164 femmes et 86 hommes) exposés au benzène dans deux usines de fabrication de chaussures. Les témoins étaient composés de140 personnes employées dans d'autres usines n'utilisant pas de benzène. |
Au départ, le benzène a été mesuré à l'aide d'échantillons individuels (badges à diffusion passive) prélevés au cours d'un quart de travail pendant près de 16 mois avant le prélèvement de sang. Des échantillons d'urine ont été prélevés après le quart de travail. La médiane des concentrations de benzène était de 1,2 ppm (3800 μg/m3) chez les travailleurs exposés. La concentration de benzène n'a pas été évaluée chez les travailleurs non exposés. Des groupes de travailleurs ont été déterminés selon la concentration de benzène : < 1 ppm (3200 μg/m3), 1 à 10 ppm (3200 à 32 000 μg/m3) et > 10 ppm (32 000 μg/m3). |
Le nombre de globules blancs (tendancep < 0,001), de granulocytes (tendancep < 0,001), de plaquettes (tendancep = 0,001) et de lymphocytes (tendancep < 0,01) était significativement plus faible chez les travailleurs exposés au benzène que chez les témoins. Les travailleurs exposés présentaient une diminution significative du nombre de lymphocytes T CD4 (tendancep < 0,05) et B (tendancep < 0,001) et du rapport CD4/CD8 (tendancep < 0,05). La perte de chromosomes (comme la fréquence moyenne de la monosomie 7) était plus importante chez les travailleurs exposés au benzène (tendancep = 0,003). Les marqueurs de l'activation des lymphocytes B (le CD27 soluble, mais pas le CD30 soluble) avaient diminué de façon significative chez les travailleurs exposés au benzène (tendancep = 0,05). Aucun autre co-polluant n'a été évalué. Les modèles ont été corrigés pour prendre en compte l'âge, le sexe, la consommation actuelle de tabac et d'alcool, l'IMC et les infections récentes. |
Non déterminée |
Harati et al., 2017 |
Étude transversale portant sur des peintres employés dans une usine automobile : 40 exposés et 40 non exposés. La durée d'exposition était comprise entre 2 et 16 ans (moyenne de 6,9 ans). |
Le benzène a été mesuré sur le lieu de travail de 20 peintres exposés (échantillons de 3 heures). La concentration moyenne de benzène dans l'air intérieur était de 0,775 ppm (2480 μg/m3) pour les peintres. Aucune concentration dans l'air n'a été mesurée pour les peintres non exposés. |
Le groupe de peintres exposés au benzène a présenté une augmentation significative de la CCMH (p < 0,001) et une diminution significative du nombre d'éosinophiles. Les autres paramètres hématologiques touchés n'ont présenté aucune signification statistique. Aucune régression/analyse n'a été effectuée pour distinguer les effets du benzène de ceux des autres solvants. Les modèles ont été corrigés pour prendre en compte l'âge, les antécédents professionnels, le tabagisme et l'IMC. Les auteurs ont conclu que les peintres présentaient des effets hématologiques lorsqu'exposés à des concentrations inférieures à 1 ppm. |
CMENO = 2480 μg/m3 dans l'air du lieu de travail (absence de mesures du benzène dans l'espace de travail des peintres non exposés) |
Zhang et al., 2016 |
Étude transversale portant sur 317 travailleurs (144 femmes et 173 hommes) employés dans trois usines de chaussures. Cent deux employés de bureau non exposés travaillant dans des banques et des écoles (52 femmes et 50 hommes) ont été inclus. |
Le benzène a été mesuré sur le lieu de travail à l'aide d'échantillons de 15 minutes prélevés 3 fois par jour dans 3 différents secteurs (couture, moulage et emballage). La médiane des concentrations de benzène était de 1,57 ppm (5024 μg/m3) à la couture, de 2,60 ppm (8320 μg/m3) au moulage et de 1,79 ppm (5278 μg/m3) à l'emballage. L'exposition cumulative des travailleurs est exprimée en μg/m3-année en tenant compte du temps passé dans chaque secteur et du nombre d'années de service avec chaque niveau d'exposition médian. Les groupes d'exposition étaient les suivants : 0 ppm-année; 3,55 ppm-année (11 400 μg/m3-année); 6,51 ppm-année (20 800 μg/m3-année); 10,72 ppm-année (34 300 μg/m3-année); 20,02 ppm-année (64 100 μg/m3-année); et 40,71 ppm-année (130 200 μg/m3-année). |
Une augmentation significative de la fréquence des micronoyaux a été observée dans tous les groupes d'exposition (p < 0,001). Le nombre moyen de globules blancs était plus faible chez l'ensemble des travailleurs exposés que chez les travailleurs non exposés, et une diminution statistiquement significative a été signalée dans les trois groupes les plus fortement exposés. Les tests de tendance ont indiqué une relation dose-réponse significative pour les groupes des plus jeunes, des plus âgés et tous âges confondus. Les modèles ont été corrigés pour prendre en compte l'âge, le sexe, et la consommation de tabac et d'alcool. Aucun autre polluant n'a été évalué. Une BMD (dose repère) et une BMDL ont été établies à l'aide du logiciel BMDS pour des réponses de 5 % et de 10 %, mais aussi pour des effets critiques. La BMDL la plus sensible était de 0,21 ppm-année (627 μg/m3-année) pour une diminution de la fréquence des micronoyaux chez les travailleurs exposés pendant 30 ans. La BMDL (limite inférieure de l'intervalle de confiance à 95 %) était de 1,6 x 10-5 ppm-année (0,0528 μg/m3-année). L'emploi d'effets critiques et d'un modèle de Hill au lieu des réponses de 5 % et de 10 % a permis d'établir la BMD la plus sensible pour la fréquence des micronoyaux, soit 1,85 ppm-année (5920 μg/m3-année) (la BMDL était de 0,22 ppm-année ou 704 μg/m3-année). La valeur limite d'exposition sera comprise entre 0,000 012 5 ppm (0,04 μg/m3) et 0,053 ppm (170 μg/m3) avec l'emploi de ces BMDL. |
Les effets hématotoxiques ont été associés à une BMCL comprise entre 110 et 950 μg/m3 (34 et 300 ppb) de benzène. |
Chen, Sun et al., 2019 |
Étude transversale portant sur 421 personnes âgées résidant à Nanjing, en Chine. Les participants du groupe d'exposition vivaient à proximité d'un complexe pétrochimique (n = 240) et ceux du groupe témoin dans des zones non contaminées (n = 181). Les participants étaient âgés de 50 à 71 ans. |
L'exposition au benzène a été mesurée sous forme de concentration sanguine avec le toluène, l'éthylbenzène, le m,p-xylène et l'o-xylène. |
Les concentrations sanguines de BTEX étaient plus élevées chez les personnes âgées résidant à proximité du complexe pétrochimique que chez celles habitant ailleurs. La concentration moyenne de BTEX était de 1,2 à 6,7 fois plus élevée chez les personnes âgées résidant à proximité du complexe pétrochimique que chez celles habitant ailleurs. Des différences significatives ont été observées au niveau des paramètres hématologiques entre les groupes exposé et non exposé. La numération plaquettaire et la CCMH étaient inversement associées aux concentrations de benzène dans le sang après transformation logarithmique. |
Non déterminée |
Doherty et al., 2017 |
Étude de cohorte prospective menée auprès de résidents de la côte du golfe du Mexique qui ont pu être exposés au benzène en milieu de travail et de témoins non exposés. Les 406 participants étaient âgés de 21 ans et plus et avaient déjà participé à l'étude sur la côte du golfe. Les personnes qui ne fument pas, les femmes et les travailleurs affectés au nettoyage ont été surréchantillonnés dans la population étudiée. |
L'exposition au benzène (mesurée à l'aide de la concentration de benzène dans le sang) était en milieu de travail (travailleurs affectés au nettoyage des déversements d'hydrocarbures) ou par le tabagisme. |
Des associations inverses ont été observées entre les concentrations de benzène dans le sang et les taux d'hémoglobine et la CCMH. Des associations positives ont été observées pour l'indice de distribution des globules rouges et les participants non exposés à la fumée de tabac (n = 146). Chez les participants exposés à la fumée de tabac (n = 247), des associations positives ont été observées entre les concentrations de COV dans le sang et d'autres paramètres hématologiques (leucocytémie et numération plaquettaire). Les associations étaient plus fortes pour le benzène que pour les autres co-polluants. |
Non déterminée |
Vaughan Watson et al., 2021 |
Étude de cohorte longitudinale représentative de la population américaine provenant des cycles de la NHANES couvrant les années 2005 à 2010. Les participants étaient âgés de 12 ans et plus et les concentrations de COV avaient été mesurées dans leurs échantillons de sang en laboratoire (n = 9203). Certains participants ont été exclus de l'étude en raison d'une grossesse, d'un traitement de l'anémie ou de l'utilisation de tabac à mâcher ou de tabac sans fumée (n = 642). |
Exposition personnelle aux COV des participants aux cycles de la NHANES des années 2005 à 2010. Les niveaux d'exposition personnelle ont été mesurés par des échantillons de sang. |
L'analyse de régression de Cox a permis de déterminer l'association entre l'hémogramme et les COV présents dans le sang. Les concentrations de COV étaient plus élevées chez les personnes exposées à la fumée de tabac que chez celles du groupe non exposé. Des associations statistiquement significatives ont été observées dans le groupe des fumeurs entre les COV BTEX (benzène, toluène, éthylbenzène, xylènes et styrène) et les paramètres hématologiques, la leucocytémie, l'hématocrite et l'hémoglobine (valeurs dep < 0,0001 à 0,016). Des associations statistiquement significatives ont été observées dans le groupe non exposé à la fumée de tabac entre les BTEX et la numération plaquettaire (valeur dep< 0,0001 à 0,02). L'association la plus forte était avec le benzène pour les groupes exposé et non exposé au tabac. |
Non déterminée |
Cakmak et al., 2020 |
Étude transversale portant sur 3950 participants du Canada (issus des provinces seulement) âgés de 12 à 79 ans provenant des cycles 3 et 4 de l'ECMS (2012 à 2015) |
Exposition personnelle aux COV (y compris le benzène) recueillie par l'intermédiaire des cycles 3 et 4 de l'ECMS (2012 à 2015). Exposition mesurée par la concentration sanguine de COV. |
Des associations ont été observées entre l'augmentation de la concentration de COV (benzène inclus) dans le sang et une augmentation de 0,68 % (IC à 95 % [0,36; 1,0]) à 0,91 % (IC à 95 % [0,52; 1,3]) du taux d'hémoglobine et une augmentation de 1,79 % (IC à 95 % [0,96; 2,62]) à 4,11 % (IC à 95 % [3,11; 5,11]) du nombre de globules blancs. Les concentrations de benzène ont entraîné une augmentation du taux d'hémoglobine de 0,89 % (IC à 95 % [0,47; 1,3]). L'augmentation des concentrations de COV a entraîné une augmentation du nombre de globules blancs; l'association la plus forte était avec les xylènes (sans ajustement pour les benzènes) et a entraîné une diminution de la créatinine. L'augmentation de la concentration de benzène dans le sang a entraîné une diminution de la gamma-glutamyl-transférase chez les hommes (-4,74 %, IC à 95 % [-9,31; -0,17]).Chez les femmes, une augmentation de la MG des concentrations de benzène a entraîné une augmentation de 8,02 % de la gamma-glutamyl-transférase (IC à 95 % [4,03; 12,01]).L'augmentation du nombre de globules blancs était plus importante chez les fumeurs (8,97 %, IC à 95 % [5,29; 12,65] que chez les non-fumeurs (1,64 %, IC à 95 % [0,02; 3,3]). |
Non déterminée |
| Étude | Participants | Exposition | Résultats | CSENO/CMENO |
|---|---|---|---|---|
Berr et al., 2010 |
Étude transversale portant sur 5242 participants âgés de 55 à 65 ans de la cohorte GAZEL. D'autres co-polluants comme les solvants pétroliers, les solvants chlorés totaux et les solvants aromatiques sans benzène ont été évalués. |
L'exposition au benzène était en milieu de travail et fondée sur la matrice emplois-expositions. L'exposition médiane était de 11,9 ppm-année. Trois groupes de participants ont été déterminés selon leur exposition : non exposé, modérément exposé (< médiane) et fortement exposé (≥ médiane). |
L'analyse de régression logistique a mis en évidence un risque plus élevé de faible rendement cognitif (score au test chiffres-symboles < 25e percentile) chez le groupe fortement exposé au benzène (RC = 1,58; IC à 95 % [1,31; 1,90]) et à d'autres polluants. (Les modèles ont été corrigés pour prendre en compte les caractéristiques sociodémographiques). Des résultats similaires ont été observés avec le mini-examen de l'état mental chez les groupes modérément (RC = 1,28; IC à 95 % [1,03; 1,59]) et fortement (RC = 1,39; IC à 95 % [1,12; 1,74]) exposés au benzène. |
Non déterminée |
Sabbath et al., 2014 |
Étude de cohorte portant sur 2143 retraités de la cohorte GAZEL (pour les tests cognitifs). L'exposition vie entière aux solvants chlorés, aux solvants pétroliers et au benzène a été évaluée à l'aide d'une matrice emplois-expositions. |
L'exposition au benzène a été estimée en fonction des appellations d'emploi et de l'année à partir du contrôle permanent de l'hygiène du travail aux postes des employés, et les données médicales professionnelles ont été appariées à des postes similaires. Des estimations annuelles ont été calculées pour les solvants. Chez les participants, 26 % n'avaient jamais été exposés au benzène, 13 % l'avaient été modérément et 13 % fortement. Chez les sujets exposés, 17 % l'avaient été avant 1980 et 9 % depuis 1980. |
L'exposition à des concentrations élevées de solvants contenant du benzène a été associée à des troubles cognitifs. Les retraités ayant été fortement exposés tout au long de leur vie – de 12 à 30 ans avant le test – présentaient le plus grand risque, alors que ceux exposés au cours des 31 à 50 dernières années présentaient un risque modéré. Les personnes ayant récemment été fortement exposées ont montré des signes de déficience dans tous les domaines, même ceux qui ne sont généralement pas associés à l'exposition. La cognition en général était significativement associée à l'exposition vie entière au benzène (RR = 1,7; IC à 95 % [1,06; 1,31]); un second test cognitif a montré un risque accru lié à l'exposition élevée au benzène (RR = 1,31; IC à 95 % [1,11; 1,56]), et cette même exposition a été associée à une diminution de la fluence verbale (1,25 [1,07; 1,47]). La catégorie la plus dangereuse, soit l'exposition élevée plus récente, a été significativement associée à un risque accru pour tous les types de solvants. |
Non déterminée |
Sabbath et al., 2012 |
Étude de cohorte prospective menée auprès de 4134 employés des services publics de gaz et d'électricité (âge moyen de 59 ans). D'autres co-polluants comme les solvants pétroliers, les solvants chlorés totaux et les solvants aromatiques sans benzène ont été évalués. |
L'exposition au benzène était en milieu de travail et son estimation reposait sur la matrice emplois-expositions. Trois groupes d'employés ont été déterminés selon leur exposition : non exposé (n = 2882), faiblement exposé (n = 626) et fortement exposé (n = 626). |
Les concentrations élevées de benzène ont été associées à un RR de 1,24 avec une tendance linéaire significative (p < 0,05) pour les travailleurs moins instruits. Aucune relation dose-réponse n'a été mise en évidence chez les travailleurs plus instruits. Aucune autre analyse n'a été effectuée pour distinguer les effets du benzène de ceux d'autres co-polluants. |
Non déterminée |
Kicinski et al., 2016 |
Étude transversale portant sur 895 élèves de neuvième année |
La concentration de benzène a été mesurée à partir du métabolite urinaire, t,t-MA. |
Une concentration de t,t-MA dix fois plus importante dans l'urine a été associée à une baisse significative de l'attention soutenue (p = 0,02), à des pertes de la mémoire à court terme (p = 0,001), à un temps de réaction moyen plus élevé (p = 0,001) et à plus d'erreurs d'omission (p = 0,028). Aucun autre polluant n'a été évalué. Des corrections ont été apportées pour prendre en compte le sang, l'éducation parentale, le genre, le tabagisme passif, l'origine ethnique, la créatinine urinaire, l'heure et le jour de l'examen. |
Non déterminée |
Kim et al., 2017 |
Étude cas-témoin portant sur 11 enfants souffrant d'otite moyenne récurrente, qui se sont rendus à l'hôpital de l'Université nationale de Séoul entre novembre 2014 et juin 2015. Les témoins étaient des enfants qui n'avaient souffert d'aucune otite moyenne pendant l'année (n = 39). |
La présence du métabolite du benzène, t,t-MA, dans les échantillons d'urine a permis de mesurer la concentration de benzène. |
Chez les enfants souffrant d'otite moyenne, le tabagisme passif était significativement plus fréquent que chez les témoins (p< 0,001). Les concentrations de t,t-MA étaient significativement plus élevées dans le groupe souffrant d'otite moyenne (126,33 mg/g de Cr) que dans le groupe témoin (52,661 mg/g de Cr;p = 0,003). Les autres métabolites n'ont pas été associés de manière significative à l'otite moyenne. |
Non déterminée |
Staudt et al., 2019 |
Étude transversale portant sur 1085 à 2471 personnes âgées de 20 à 59 ans du cycle de la NHANES couvrant les années 1999 à 2004. Il s'agit d'une analyse secondaire des données de la NHANES. Cette étude a examiné l'association entre l'exposition à chacun des solvants organiques, mesurée par des biomarqueurs sanguins des COV (incluant le benzène) et la perte auditive autodéclarée, la perte auditive évaluée par audiométrie et les acouphènes autodéclarés. |
Le benzène et d'autres COV ont été mesurés dans le sang. La médiane des concentrations de benzène dans le sang variait entre les personnes ayant déclaré une perte auditive et celles n'en n'ayant déclarée aucune (0,04 ng/mL [EIQ = 0,02; 0,11] vs 0,03 ng/mL [EIQ = 0,02; 0,09], p < 0,001). La médiane des concentrations de benzène dans le sang variait entre les personnes présentant une perte auditive évaluée par audiométrie et chez celles n'en présentant aucune (0,06 ng/mL [EIQ = 0,03; 0,11] vs 0,03 ng/mL [EIQ = 0,02;0,09], p= 0,023). |
Le benzène (RC = 1,43, IC à 95 % [1,15; 1,78]) et les autres COV ont montré une association statistiquement significative avec le rapport de cotes accru corrigé pour la perte auditive dans les hautes fréquences. Aucune association statistiquement significative n'a été observée entre les COV et le bruit en milieu de travail lors de la perte auditive à haute fréquence. Aucune association n'a été observée avec les acouphènes. |
CMENO = 0,04 ng/ml (dans le sang) |
Amin et al., 2018 |
Étude transversale portant sur 86 enfants âgés de 6 à 18 ans |
La concentration de benzène dans les échantillons d'urine a permis de mesurer un métabolite du benzène , le t,t-MA. |
Des corrections ont été apportées pour prendre en compte le sexe, l'âge et le tabagisme passif. Les résultats corrigés ont montré des associations statistiquement significatives entre let,t-MA et l'insulinorésistance (p = 0,002), la glycémie à jeun (p = 0,02) et l'insulinémie à jeun (p = 0,001). Des augmentations significatives des niveaux de superoxyde dismutase (4,49 fois;p = 0,01) et de malondialdéhyde (3,54 fois;p = 0,034) ont été observées lorsque les concentrations de benzène (t,t-MA) étaient moyennes ou faibles. |
Non déterminée |
Choi et al., 2014 |
Étude transversale portant sur 505 participants âgés de 60 ans et plus du centre communautaire Seongbuk-gu à Séoul, en Corée du Sud. Les participants ont été suivis entre août 2008 et août 2010. |
L'exposition au benzène a été mesurée par le métabolite urinairet,t-MA. L'indice d'évaluation du modèle d'homéostasie (indice de HOMA) a également été mesuré chez les participants (insulinorésistance). L'exposition au benzène dans l'air a été mesurée pendant 10 jours chez 63 participants par un dispositif de prélèvement par diffusion. Le niveau d'exposition au benzène dans l'air était inférieur à 0,0002 μg/m3. |
Chez les participants, les concentrations liées à la dose de t,t-MA ont augmenté l'insulinorésistance (tendance p <0,001) et le stress oxydatif déterminé par le malondialdéhyde urinaire (tendance p <0,001). Les quartiles supérieurs des concentrations de t,t-MA ont également été associés à une insulinorésistance accrue (Q3 : 3,33; IC à 95 % [1,90; 5,84]; Q4 : 2,07, IC à 95 % [1,02; 4,22]). |
Non déterminée |
| Étude | Participants | Exposition | Résultats | CSENO/CMENO |
|---|---|---|---|---|
Scholten et al., 2020 |
Revue systématique de 16 études sur les aberrations chromosomiques (1356 participants) et de 13 études sur les micronoyaux (2097 participants). Une méta-analyse a été effectuée pour évaluer la relation exposition-réponse entre l'exposition professionnelle au benzène et ses effets cytogénétiques sur les aberrations chromosomiques et les micronoyaux. Le benzène devait être le principal polluant pour que les études fassent partie de cette analyse. |
Cette revue systématique a analysé les études contenant suffisamment de données quantitatives sur l'exposition au benzène. |
Les articles dans lesquels le benzène était le principal polluant et qui avaient suffisamment de données ont servi à l'analyse statistique. L'ensemble des études sur les aberrations chromosomiques ont montré une augmentation des aberrations chromosomiques de 0,27 % (IC à 95 % [0,08; 0,47]) par ppm d'exposition au benzène. L'ensemble des études sur les micronoyaux ont montré une augmentation des micronoyaux de 0,27 % (IC à 95 % [-0,23; 0,76]) par ppm d'exposition au benzène. Les auteurs ont observé une importante hétérogénéité entre les études en ce qui a trait à ces deux effets (I 2 > 90 %). |
Non déterminée |
Angelini et al., 2016 |
Revue systématique et méta-analyse des populations exposées en milieu de travail au pétrole ou à ses dérivés et des modifications de la fréquence des micronoyaux. Trente-quatre ensembles de données provenant de 26 articles ont été utilisés. |
Les expositions variaient d'une étude à l'autre. L'accent a été principalement mis sur l'exposition professionnelle, qui était généralement supérieure à 100 μg/m3. Certaines études ont signalé des concentrations de benzène d'environ 10 μg/m3. |
La fréquence des micronoyaux était 1,38 fois plus élevée dans les lymphocytes périphériques des travailleurs professionnellement exposés au benzène, au toluène et/ou aux xylènes que dans ceux des travailleurs non exposés. Vingt-trois des ensembles de données présentaient une augmentation de la fréquence des micronoyaux. Une différence moyenne globale de 1,64 (IC à 95 % [0,80; 2,47]) dans la fréquence des micronoyaux a été constatée chez les travailleurs exposés par rapport à ceux non exposés. |
Non déterminée |
Ayi-Fanou et al., 2011 |
Étude transversale comparant l'exposition de personnes vivant en zone urbaine (57 chauffeurs de taxis-motos, vendeurs de cuisine de rue et pompistes) à celle de personnes vivant en zones rurale (17) et périurbaine (20). Bien que les personnes ayant déclaré être des fumeurs n'ont pas été incluses dans l'étude, celles se servant de feux de bois pour cuire les aliments ou consommant du poisson fumé peuvent l'avoir été. La plupart des participants étaient des hommes (88 %) et l'âge moyen était de 30 ans. |
Les concentrations moyennes de benzène mesurées dans l'air extérieur étaient de 76,0 μg/m3 en ville, de 4,3 μg/m3 en banlieue et de 3,4 μg/m3 en zone rurale. Les HAP ont été mesurés à l'extérieur. La concentration des HAP totaux était de 103 μg/m3 en zone urbaine, alors qu'elle était de 2,5 μg/m3en banlieue et de 1,6 μg/m3 en zone rurale. |
Les taux d'adduits à l'ADN étaient plus élevés chez les participants vivant en zone urbaine (30 adduits par 108 nucléotides) que chez ceux vivant en banlieue ou en zone rurale (de 2 à 3 adduits par 108 nucléotides). Aucun type d'analyse (régression ou autre) n'a été effectué pour distinguer les effets du benzène de ceux des autres solvants. |
Non déterminée |
Peluso et al., 2013 |
Étude transversale portant sur 148 écoliers âgés de 6 à 14 ans d'une école située en zone urbaine (Sarroch, n = 75) et d'une école située en zone rurale servant de témoin (Burcei, n = 73) (plus de filles que de garçons). L'éthylbenzène a également été évalué. |
Le benzène a été mesuré à l'extérieur pendant 3 semaines à l'aide de dispositifs de prélèvement par diffusion à Sarroch dans les jardins scolaires, en zones résidentielles, au centre-ville et en zones industrielles ainsi que dans le village rural (Burcei). En tout et pour tout, 33 échantillons ont été prélevés à 19 différents endroits. La concentration moyenne de benzène était de 1,4 μg/m3dans les jardins scolaires du village rural. Cette concentration était nettement plus élevée à Sarroch, où elle variait entre 2,7 et 3,8 μg/m3 dans tous les secteurs, sauf près du parc industriel où elle était de 5,8 μg/m3. |
Le nombre d'adduits malondialdéhyde-désoxyguanosine était significativement plus élevé chez les enfants de Sarroch que chez ceux du village rural (2,53 fois plus élevé en moyenne,p< 0,001). La concentration d'adduits volumineux à l'ADN était également significativement plus élevée chez les enfants de Sarroch que chez ceux du village rural (1,90 fois plus élevée en moyenne;p= 0,003). Les modèles ont été corrigés pour prendre en compte l'âge, le genre et le lieu de résidence. Aucune autre analyse n'a été effectuée pour distinguer les effets du benzène de ceux d'autres co-polluants. |
La CMENO semble être comprise entre 2,7 et 5,8 μg/m3. |
Li et al., 2017 |
Étude transversale portant sur 96 travailleurs de l'industrie pétrochimique (65 hommes et 31 femmes) et 100 employés de bureau appariés servant de témoins. Tous les travailleurs de l'industrie pétrochimique provenaient de la même usine. Le toluène a également été évalué. |
Il y avait 36 sites d'échantillonnage dans l'usine pétrochimique. La médiane des concentrations de benzène dans l'air intérieur était de 110 μg/m3 pour les travailleurs exposés au benzène et inférieure à 10 μg/m3 pour les travailleurs de bureau non exposés. Le SPMA a été mesurée dans l'urine comme indicateur de l'exposition (la médiane des concentrations de SPMA dans l'urine était 2,6 fois plus élevée chez les travailleurs exposés au benzène) (p< 0,001). |
Les paramètres hématologiques (nombre de leucocytes, de neutrophiles, de lymphocytes et de monocytes dans le sang) mesurés chez les travailleurs exposés n'étaient pas significativement différents de ceux des témoins. Le nombre de dommages génétiques (% d'ADN dans la queue) était 11 % plus élevé chez les travailleurs exposés (p = 0,012). Les concentrations de SPMA dans l'urine étaient inversement associées à la méthylation de la MGMT (la concentration moyenne de SPMA était de 0,001 76 mg/g de Cr chez les travailleurs et de 0,000 68 mg/g de Cr chez les témoins). Les modèles ont été corrigés pour prendre en compte l'âge, le sexe, l'IMC et la numération globulaire. |
CMENO = 110 μg/m3 pour les lésions de l'ADN |
Ruchirawat et al., 2010 |
Étude transversale portant sur des adultes non fumeurs, âgés de 18 à 45 ans, travaillant dans des laboratoires pétrochimiques (n = 31), des stations-service (n = 31) et un centre de tri postal (n = 34). Les participants étaient appariés selon le genre. Les autres polluants évalués étaient le benzo[a]pyrène et le 1,3-butadiène. La seconde partie de l'étude s'est penchée sur les enfants de la ville (n = 76 – 128) et des zones rurales (n = 55 – 69). La troisième partie de l'étude a examiné des employés de temples où de l'encens avait été brûlé (n = 35 – 41) et des employés de bureau où de l'encens n'avait pas été brûlé servant de témoins (n = 23 – 35). |
La concentration de benzène a été mesurée par échantillonnage passif dans les différents milieux de travail. La concentration moyenne de benzène était de 2,34 μg/m3 sur le lieu de travail des témoins, de 85,26 μg/m3 dans les usines pétrochimiques et de 207,94 μg/m3 dans les stations-service. La seconde partie de l'étude a mesuré les concentrations de benzène dans les zones scolaires rurales (témoins) et urbaines. La concentration moyenne de benzène a été estimée à 8,40 μg/m3 pour les écoliers des zones rurales et à 19,38 μg/m3 pour ceux des zones urbaines. La troisième partie de l'étude a mesuré les concentrations de benzène dans les bureaux (témoins) et dans les temples. La concentration moyenne de benzène a été estimée à 26,49 μg/m3pour les employés témoins et à 45,90 μg/m3 pour les employés des temples. |
Les employés des usines pétrochimiques présentaient un taux de ruptures de brin de l'ADN significativement plus élevé (moment de queue plus élevé;p < 0,01) et une capacité de réparation de l'ADN significativement plus faible (dicentriques et délétions par métaphase;p < 0,01) que les témoins. Les pompistes présentaient des taux d'adduits à l'ADN (p < 0,001) et de ruptures de brin de l'ADN (moment de queue plus élevé;p < 0,001) significativement plus élevés et une capacité de réparation de l'ADN significativement plus faible (dicentriques et délétions par métaphase;p < 0,001). La seconde partie de l'étude a montré que les écoliers des zones urbaines présentaient des taux d'adduits à l'ADN (p < 0,001) et de ruptures de brin de l'ADN (moment de queue plus élevé;p < 0,001) significativement plus élevés et une capacité de réparation de l'ADN significativement plus faible (dicentriques et délétions par métaphase;p < 0,001) que les écoliers des zones rurales. La troisième partie de l'étude a montré que les employés des temples présentaient des taux d'adduits à l'ADN (p < 0,001) et de ruptures de brin de l'ADN (moment de queue plus élevé;p < 0,001) significativement plus élevés et une capacité de réparation de l'ADN signification plus faible (dicentriques et délétions par métaphase;p < 0,01 àp < 0,001) que les témoins. Aucune autre analyse n'a été effectuée pour distinguer les effets du benzène de ceux d'autres co-polluants. |
CMENO pour des changements au niveau de l'ADN = 85,26 à 207,94 μg/m3 dans l'air du lieu de travail |
Bassig et al., 2016 |
Étude transversale portant sur 250 travailleurs (164 femmes et 86 hommes) exposés au benzène et employés dans deux usines de fabrication de chaussures. Elle comprenait 140 travailleurs témoins non exposés (88 femmes et 53 hommes) employés dans d'autres usines. |
Au départ, le benzène a été mesuré à l'aide d'échantillons individuels (badges à diffusion passive) prélevés au cours d'un quart de travail près de 16 mois avant le prélèvement de sang. Des échantillons d'urine ont été prélevés après le quart de travail. La médiane des concentrations de benzène était de 1,2 ppm (3800 μg/m3) chez les travailleurs exposés. La concentration de benzène n'a pas été évaluée chez les travailleurs non exposés. Des groupes de travailleurs ont été déterminés selon la concentration de benzène : < 1 ppm (3200 μg/m3), 1 à 10 ppm (3200 à 32 000 μg/m3) et > 10 ppm (32 000 μg/m3). |
Le nombre de globules blancs (tendancep < 0,001), de granulocytes (tendancep < 0,001), de plaquettes (tendancep = 0,001) et de lymphocytes (tendancep < 0,01) était significativement plus faible chez les travailleurs exposés au benzène que chez les témoins. Les travailleurs exposés présentaient des diminutions significatives du nombre de lymphocytes T CD4 (tendance p < 0,05) et B (tendance p < 0,001) et du rapport CD4/CD8 (tendance p < 0,05). La perte de chromosomes (comme la fréquence moyenne de la monosomie 7) était plus importante chez les travailleurs exposés au benzène (tendance p = 0,003). Les marqueurs de l'activation des lymphocytes B (le CD27 soluble, mais pas le CD30 soluble) avaient diminué de façon significative chez les travailleurs exposés au benzène (tendance p = 0,05). Aucun autre co-polluant n'a été évalué. Des corrections ont été apportées pour prendre en compte l'âge, le sexe, la consommation actuelle de tabac et d'alcool, l'IMC et les infections récentes. |
Non déterminée |
Ji et al., 2012 |
Étude transversale portant sur 33 travailleurs de sexe masculin exposés au benzène dans des usines et sur 33 travailleurs non exposés dans 3 usines à Tianjin, en Chine |
L'exposition personnelle au benzène a été mesurée à l'aide de badges à diffusion passive portés pendant 8 heures de travail et d'échantillons d'urine prélevés après le quart de travail. Un mois plus tard, les participants ont mesuré une fois de plus leur niveau d'exposition à l'aide du badge à diffusion passive et d'un échantillon d'urine. Un échantillon sanguin a également été prélevé chez les travailleurs à jeun. La concentration de benzène était inférieure à 24 ppm chez les travailleurs exposés. |
L'hybridation moléculaire in situ a permis d'examiner les anomalies au niveau des chromosomes sexuels et du chromosome 21 découlant de l'exposition au benzène. Des aneuploïdies ont été observées dans les lymphocytes et les spermatozoïdes. Dans les lymphocytes, l'ajout de chromosomes a été observé au niveau du chromosome 21, mais pas au niveau des chromosomes sexuels. Dans le sperme, l'ajout de chromosomes a été observé au niveau des chromosomes sexuels, alors que le chromosome 21 est demeuré à l'état diploïde. |
Non déterminée |
Zhang et al., 2012 |
Étude transversale portant sur 20 femmes et 8 hommes exposés provenant d'une plus vaste étude menée auprès de 250 travailleurs employés dans 2 usines de chaussures. Quatorze participants servant de témoins ont également été sélectionnés parmi les 140 témoins non exposés de l'étude transversale plus vaste. |
La concentration de benzène a été mesurée sur le lieu de travail un mois avant la collecte de sang. Les concentrations moyennes de benzène étaient les suivantes : 0,04 ppm (128 μg/m3) chez les témoins; 2,64 ppm (8448 μg/m3) pour l'exposition faible; et 24,19 ppm (77 408 μg/m3) pour l'exposition élevée. |
Le taux de monosomie (indicateur de perte de chromosomes) était plus élevé dans les CFU-GM (cellules souches sanguines) chez les travailleurs exposés à une concentration de benzène faible (augmentation de 20 à 28 % à 8448 μg/m3;p = 0,0056) ou forte (augmentation de 32 à 48 % à 77 408 μg/m3;p = 0,0045). Le nombre de globules blancs était significativement plus faible dans le groupe fortement exposé que chez les témoins (p < 0,001); la tendancep pour la diminution des globules blancs était toutefois significative à toutes les concentrations (tendancep = 0,0027). Aucun autre polluant n'a été évalué. |
CMENO pour la perte de chromosomes = 8448 μg/m3 dans l'air du lieu de travail |
Hoxha et al., 2009 |
Étude transversale portant sur 77 agents de circulation exposés au benzène (30 femmes et 47 hommes) et 57 employés de bureau non exposés (19 femmes et 38 hommes). Le toluène a également été mesuré. |
La concentration de benzène a été mesurée à l'extérieur à l'aide de badges à diffusion passive portés pendant toute la durée d'un quart de travail. La concentration moyenne de benzène était de 31,8 μg/m3 pour les agents de circulation et de 13,0 μg/m3 pour les travailleurs non exposés. Chez les agents de circulation, deux groupes d'exposition au benzène ont été déterminés selon la densité de la circulation : faible densité (n = 32; moyenne = 26,3 μg/m3) et forte densité (n = 45; moyenne = 35,7 μg/m3). |
Les agents de circulation exposés ont présenté un raccourcissement significatif des télomères par rapport aux témoins (p< 0,001). Toujours chez les agents de circulation, les télomères étaient significativement plus courts chez le groupe exposé à une forte densité de circulation que chez celui exposé à une faible densité de circulation (p < 0,001). Pour toutes les expositions, la représentation graphique du raccourcissement des télomères des leucocytes en fonction de l'augmentation de la concentration avait une valeurp de 0,004 pour le benzène et de 0,008 pour le toluène. Des corrections ont été apportées pour prendre en compte l'âge, le genre, le tabagisme et les paquets-années. Aucune autre analyse n'a été effectuée pour distinguer les effets du benzène de ceux d'autres co-polluants. |
CMENO pour le raccourcissement des télomères des leucocytes = 31,8 μg/m3 |
Bassig et al., 2014 |
Étude transversale portant sur 43 travailleurs exposés au benzène (21 femmes et 22 hommes) employés dans 3 usines et 43 travailleurs témoins appariés selon l'âge et le genre (21 femmes et 22 hommes) employés dans 2 usines qui n'utilisaient pas de benzène. Les travailleurs exposés travaillaient depuis 6 mois dans ces usines. Les autres substances mesurées comprennent le toluène, l'éthylbenzène et les xylènes. |
La concentration de benzène dans l'air intérieur a été mesurée à l'aide de badges de surveillance passive chez les travailleurs exposés et un sous-ensemble de témoins. La concentration moyenne de benzène était de 62,7 ppm (200 000 μg/m3) chez les travailleurs exposés. Deux groupes de participants ont été déterminés selon leur exposition au benzène : un groupe de 21 travailleurs exposés à une concentration moyenne de benzène de 14,0 ppm (44 800 μg/m3) et un groupe de 22 travailleurs exposés à une concentration moyenne de benzène de 109,2 ppm (349 400 μg/m3). |
Les travailleurs exposés à une concentration supérieure à 31 ppm (99 200 μg/m3) ont présenté un rallongement significatif des télomères par rapport aux témoins (p = 0,03). Aucun effet significatif n'a été observé chez les travailleurs exposés à des concentrations plus faibles. Toutes expositions confondues, une tendancep de 0,05 a toutefois été mise en évidence pour la modification de la longueur des télomères chez les travailleurs exposés au benzène. Les modèles ont été corrigés pour prendre en compte l'âge, le sexe, la consommation récente de tabac et l'IMC. Aucun type d'analyse (régression ou autre) n'a été effectué pour distinguer les effets du benzène de ceux des autres solvants. |
CSENO pour la modification de la longueur des télomères = 44 800 μg/m3 et CMENO pour la modification de la longueur des télomères = 99 200 μg/m3 en milieu de travail intérieur |
Uzma et al., 2010 |
Étude transversale menée à Hyderabad, Andhra Pradesh, en Inde auprès de 428 pompistes exposés au benzène et 70 travailleurs témoins (non exposés) |
L'exposition au benzène des travailleurs exposés a été mesurée à l'aide de moniteurs de vapeurs organiques portés pendant leur quart de travail. Les participants ont également remis deux échantillons de sang et d'urine prélevés avant et après leur quart de travail. |
La concentration de benzène était plus élevée chez les travailleurs exposés que chez ceux non exposés. Une augmentation du niveau des espèces réactives de l'oxygène et de malondialdéhyde a été observée chez les travailleurs exposés. Une diminution de la concentration de glutathion et de superoxyde dismutase totale a également été observée chez les travailleurs exposés par rapport aux témoins. Une diminution statistiquement significative du nombre de lymphocytes T CD4, du taux d'immunoglobulines et du rapport CD4/CD8 a été observée chez les travailleurs exposés par rapport aux travailleurs témoins. L'expression du gène p53 était généralement plus élevée chez les travailleurs exposés que chez les travailleurs témoins. |
Non déterminée |
Carugno et al., 2012 |
Étude transversale portant sur 519 participants adultes, y compris des personnes exposées en milieu de travail (153 chauffeurs d'autobus de Gênes, 78 pompistes et 77 policiers de Milan, et 33 travailleurs d'usine pétrochimiques de Cagliari). Le benzène était la seule substance évaluée. |
L'exposition personnelle au benzène a été mesurée à l'aide de badges à diffusion passive portés pendant 5 à 6 heures. Seul le benzène a été mesuré. La MG des concentrations était la suivante : chauffeurs d'autobus = 20,5 μg/m3; policiers = 25,0 μg/m3; pompistes = 69,9 μg/m3; et travailleurs d'usines pétrochimiques = 35,4 μg/m3. Celle des témoins était comprise entre 5,9 (aux environs de Cagliari) et 8,7 μg/m3 (à Gênes). |
Dans les trois villes, les participants exposés au benzène présentaient un nombre plus élevé de copies de l'ADN mitochondrial que les participants témoins correspondants. Les résultats étaient les suivants en unités relatives : à Gênes, 0,90 chez les chauffeurs d'autobus vs 0,75 chez les témoins (p = 0,019); à Milan, 0,90 chez les pompistes et 1,10 chez les policiers vs 0,75 chez les témoins (tendancep = 0,008); et à Cagliari, 1,63 chez les travailleurs d'usines pétrochimiques vs 1,25 chez les témoins vivant à proximité des usines et 0,90 chez ceux vivant plus loin (tendancep = 0,046). Après avoir combiné les données des trois villes, il a été estimé qu'une augmentation de l'EIQ de benzène était associée à une augmentation de 10,3 % du nombre de copies de l'ADN mitochondrial (p < 0,001). Une association a été observée entre le nombre de copies de l'ADN mitochondrial et l'hypométhylation de LINE-1 (-2,41 %;p = 0,007) et l'hyperméthylation du gène p15 (+15,95 %,p= 0,008) qui sont des marqueurs épigénétiques de leucémie. Aucune autre analyse n'a été effectuée pour distinguer les effets du benzène de ceux d'autres co-polluants. |
Non déterminée |
| Étude | Participants | Exposition | Résultats | CSENO/CMENO |
|---|---|---|---|---|
Rinsky et al., 1981 |
Étude de cohorte rétrospective portant sur des travailleurs exposés employés dans une usine de fabrication de chlorhydrate de caoutchouc. Étude examinant la mortalité par leucémies chez les travailleurs exposés. Deux groupes de participants ont été déterminés selon leur exposition, soit le groupe 1 (n = 748) et le groupe 2 (n = 258). Les travailleurs non exposés (n = 177) ont servi de témoins dans cette étude. L'étude a couvert les années 1940 à 1975. |
Le niveau d'exposition au benzène a été déterminé à partir des appellations d'emploi des participants et des concentrations de benzène présentes lors de la préparation du chlorhydrate de caoutchouc (obtenues auprès de l'Industrial Commission of Ohio, du Health Department of Ohio, de l'University of North Carolina, du NIOSH et de la surveillance des opérations de l'entreprise). Une analyse de toutes les données d'exposition a permis d'établir que les expositions au benzène répondaient chaque année aux moyennes pondérées sur 8 heures recommandées à l'échelle nationale. La moyenne d'exposition pondérée sur 8 heures était de 100 ppm en 1941, de 50 ppm en 1947, de 35 ppm en 1948, de 25 ppm en 1957, de 25 ppm en 1963 et de10 ppm en 1969. |
Les travailleurs du groupe 1 ont été employés pendant au moins un jour dans un service émetteur de benzène. Il y avait 180 décès dans ce groupe. Le nombre prévu de décès dans ce groupe était de 161 (RSM = 111). Bien qu'elle n'était pas statistiquement significative, l'augmentation du nombre de décès était toutefois inhabituelle. Le nombre de décès attribuables aux tumeurs malignes dans le système lymphohématopoïétique était statistiquement significatif dans le groupe 1 : 10 observés vs 3 prévus (p < 0,01). Sept cas de leucémie ont été relevés alors que seulement 1,25 cas était attendu (p < 0,001). Dans le groupe 1, 58 % des travailleurs étaient exposés au benzène pendant moins d'un an. Il y avait 49 décès dans le groupe 2, dont 1 était attribuable à la leucémie vs 0,46 prévu (RSM = 217). Les décès par leucémies dans le groupe 2 (n = 7) ont été associés à une exposition au benzène de plus de 5 ans, avec un RSM de 2100. Les cellules des personnes atteintes de leucémie étaient myéloïdes ou monocytes. |
Non déterminée |
Rinsky et al., 2002 |
Étude de cohorte longitudinale portant sur les travailleurs de la fabrication du chlorhydrate de caoutchouc provenant de l'étude de cohorte menée en 1981 par Rinsky et al. L'étude a couvert les années 1981 à 1996. Elle comprenait à l'origine 1165 hommes blancs auxquels se sont rajoutés 1291 travailleurs sans aucune précision de race ou de genre. |
Quatre groupes de travailleurs ont été déterminés selon leur exposition professionnelle au benzène dans l'usine : 1 ppm-jour à 39,99 ppm-année; 40 à 199,99 ppm-année; 200 à 399 ppm-année; et 400 ppm-année et plus. |
Le taux de tumeurs malignes (néoplasmes lymphatiques et hématopoïétiques) a augmenté et le RSM était de 1,64 (IC à 95 % [1,06; 2,42]) pour toute la cohorte. Le RSM pour la leucémie était de 2,56 (IC à 95 % [1,43; 4,22]) pour toute la cohorte. Quinze des décès survenus au sein de la cohorte étaient liés à une exposition cumulative d'au moins 1 ppm-jour. L'étude a recensé 8 cas de myélomes multiples. Le modèle proportionnel de Cox a montré que la durée d'exposition entraînait une augmentation de 39,2 % du RR par année d'exposition (p = 0,004). Le taux moyen d'exposition présentait une augmentation de 7,6 % du risque par ppm de benzène (p = 0,048). Le risque de myélomes multiples a augmenté d'environ 1,003 par ppm-année d'exposition au benzène ou de 1,13 après 40 ans d'exposition à une concentration de 1 ppm (IC à 95 % [0,95; 1,34]). |
Non déterminée |
Yin et al., 1987 |
Étude de cohorte rétrospective portant sur 233 usines utilisant du benzène et 83 usines témoins localisées dans 12 villes chinoises. L'étude comprenait 28 460 travailleurs exposés au benzène et 28 257 qui ne l'étaient pas. |
Parmi les participants atteints de leucémie, l'exposition au benzène était comprise entre 10 et 1000 mg/m3. Sept de ces participants avaient signalé un empoisonnement chronique au benzène avant leur diagnostic. |
Il y avait 30 cas de leucémie et 25 décès parmi les travailleurs exposés au benzène, alors qu'il n'y avait que 4 cas de leucémie chez les participants non exposés. L'âge moyen des travailleurs était de 27,8 ans au début de l'exposition et la période moyenne de latence de la leucémie de 11,4 ans. Le RSM était de 5,74 (p < 0,01) pour les cas de leucémie attribuables à l'exposition au benzène. L'incidence de la leucémie attribuable au benzène était la plus élevée chez les fabricants de peinture et de caoutchouc. |
Non déterminée |
Yin et al., 1996 |
Étude de cohorte portant sur des travailleurs exposés (n = 74 828) et des travailleurs non exposés (n = 35 805) au benzène entre 1972 et 1987. Cette étude a été menée dans 672 usines utilisant du benzène et 69 usines témoins localisées dans 12 villes chinoises. |
L'exposition au benzène a été évaluée à partir de l'appellation d'emploi, de l'unité de travail et de l'usine. L'exposition était fondée sur les données historiques issues de 1427 unités de travail et de 3179 appellations d'emploi. L'exposition professionnelle au benzène était comprise entre 25 et 33 ppm avant 1975 et entre 8 et 15 ppm par la suite. Outre l'exposition professionnelle au benzène, les zones urbaines à forte circulation présentaient une concentration de benzène comprise entre 1 et 150 mg/m3. |
Les participants ont été suivis en moyenne pendant 10,5 à 11,7 ans. Le RR (corrigé en fonction de l'âge) de mortalité par cancers chez les travailleurs exposés vs les travailleurs non exposés était compris entre 0,4 et 2,8 pour les femmes et entre 0,9 et 3,3 pour les hommes. Le RR de leucémie était de 2,8 chez les femmes et de 2,1 chez les hommes; le RR de cancer du poumon était de 1,5 chez les hommes et de 1,0 chez les femmes. Le RR de leucémie, de SMD et de lymphome était significativement plus élevé chez les travailleurs exposés (de 2,5 à 3,1). |
Non déterminée |
Glass et al., 2003 |
Étude cas-témoin menée entre 1981 et 1999 auprès de79 travailleurs australiens de l'industrie pétrolière. Les témoins (n = 395) étaient appariés selon l'âge. |
Le niveau d'exposition de chacun des travailleurs a été déterminé, qu'il s'agisse de cas ou de témoins. L'estimation de l'exposition a pris en compte les antécédents professionnels et la mesure de l'exposition par tâche dans l'industrie pétrolière. Un algorithme reposant sur les tâches et faisant intervenir des paramètres de mesure individuels, comme l'appellation d'emploi et des données spécifiques de la tâche, du lieu et de la période, a permis d'établir des niveaux d'exposition individuels. L'exposition cumulative a été calculée. |
L'exposition accrue au benzène ne s'est pas traduite par une augmentation des cas de LNH ou de myélome multiple. Les RC pour la leucémie étaient plus élevés chez les trois groupes les plus fortement exposés que chez le groupe le plus faiblement exposé (≤ 1 ppm). Le groupe le plus fortement exposé comptait 7 des 33 cas de leucémie. Le RC des deux groupes les plus fortement exposés était de 11,3 (IC à 95 % [2,85; 45,1]). L'exposition cumulative en tant que variable continue avait un RC de 1,65 (IC à 95 % [1,25; 2,17]). Il n'y avait aucune association entre la leucémie et la durée d'emploi ou la date de début. Il y avait une forte association entre le risque de leucémie et l'exposition au concentré de benzène. Il y avait une forte association entre le risque de leucémie et une forte intensité d'exposition, débutant vers 0,8 à 1,66 ppm; le risque d'être diagnostiqué avec la leucémie était 20 fois plus élevé chez les personnes exposées à une forte intensité de benzène. |
Non déterminée |
Glass et al., 2005 |
Étude de cas-témoins emboîtés d'une nouvelle analyse d'une étude portant sur l'exposition au benzène et le risque de leucémie. Cette étude a réexaminé l'étude de cohorte prospective Health Watch menée auprès de 18 000 personnes employées dans l'industrie pétrolière australienne pendant 5 ans et l'association avec le développement du LNH et du myélome multiple. |
Les niveaux d'exposition ont été estimés rétrospectivement pour chaque personne par un algorithme dans une base de données relationnelle. Les mesures de l'exposition ont été fournies par les sociétés pétrolières australiennes pour estimer l'exposition découlant de tâches particulières. Les participants avaient commencé à travailler après 1965 et avaient été exposés en moyenne pendant 20 ans. L'exposition cumulative de 85 % des participants était inférieure à 10 ppm-année et celle de 3,6 % d'entre eux supérieure à 40 ppm-année. Deux paramètres de l'exposition au benzène ont été évalués : l'exposition cumulative (en ppm-année) : ≤ 2, > 2 – 4, > 4 – 8, > 8 – 16, > 16 l'intensité d'exposition de l'emploi occupé le plus exposé (en ppm) en fonction de la durée de carrière : ≤ 0,1; > 0,1 – 0,2; > 0,2 – 0,4; > 0,4 – 0,8; > 0,8 – 1,6; > 1,6 – 3,2; > 3,2. |
La nouvelle analyse de l'étude Health Watch a montré que le RC des 7 cas de leucémie survenant après une exposition cumulative supérieure à 16 ppm-année était de 51,9 (IC à 95 % [6,6; 477]) par rapport aux deux catégories les plus faiblement exposées combinées (≤ 2 ppm-année). La même conclusion a pu être tirée avec ou sans événements à exposition élevée. Le RC pour la leucémie augmente lorsque l'exposition cumulative est considérée comme une variable continue : 1,10 (1,04 – 1,16) par ppm-année. Il diminue lors de l'ajout d'événements à exposition élevée à l'exposition cumulative : 1,03 (1,01 – 1,05) par ppm-année. La leucémie a été associée à une intensité d'exposition élevée (supérieure à 0,8 ppm) en prenant en compte la durée d'exposition. |
CMENO = 16 ppm-année ou 0,8 ppm |
Hayes et al., 1996 |
Étude de cohorte portant sur 35 805 travailleurs non exposés et 74 828 travailleurs exposés de l'industrie manufacturière. Les travailleurs exposés ont travaillé de 1972 à 1986 dans 672 usines localisées dans 12 villes chinoises. Les travailleurs non exposés ont travaillé de 1972 à 1987 dans 40 usines. Des corrections ont été apportées pour prendre en compte la date de naissance, le sexe et des données professionnelles. |
Les concentrations de benzène ont été déterminées en fonction du niveau d'exposition à l'usine et de l'appellation d'emploi de chaque participant. Six groupes d'exposition professionnelle moyenne au benzène ont été déterminés : < 1 ppm, 1 < 5 ppm, 5 < 10 ppm, 10 < 25 ppm, 25 < 50 ppm, et > 50 ppm. Des hygiénistes industriels locaux et des professionnels de la santé en milieu de travail ont estimé ces niveaux. |
La mortalité (toutes causes confondues) n'a que légèrement augmenté avec l'augmentation de l'exposition cumulative au benzène (tendancep < 0,05) et après ajustement pour les décès par cancer (tendancep < 0,01). Les décès par troubles bénins n'ont pas été associés à l'exposition cumulative au benzène. L'exposition cumulative élevée a fait accroître la mortalité par tumeurs hématopoïétiques et lymphoprolifératives et par cancer du poumon (tendance p = 0,01 dans les deux cas). Le modèle a été corrigé pour prendre en compte la date de naissance, le sexe et des données professionnelles. |
Non déterminée |
Schnatter et al., 2012 |
Étude cas-témoin regroupant trois études menées auprès de travailleurs de l'industrie pétrolière du Royaume-Uni, du Canada et de l'Australie, qui vise à explorer la relation dose-réponse entre la concentration de benzène et les cancers lymphohématopoïétiques. Les cinq cancers lymphohématopoïétiques suivants ont été retenus pour analyse : LAM (60 cas), leucémie lymphoïde chronique (LLC, 80 cas), LMC (28 cas), SMD (29 cas) et SMP (30 cas). Les cas ont été appariés selon l'âge à 4 ou 5 témoins qui n'étaient pas atteints de cancers lymphohématopoïétiques. |
L'exposition au benzène a été estimée en fonction du poste occupé par chaque participant. Les mesures de l'exposition cumulative au benzène de chaque participant ont été déterminées à partir de l'intensité et de la durée maximales de l'exposition au benzène au cours de chaque année de travail (ppm-année). Les emplois ont été évalués de manière qualitative pour déterminer la probabilité d'exposition à une concentration de benzène supérieure à 3 ppm pendant 1 à 60 minutes au moins une fois par semaine. La probabilité d'exposition cutanée (aucune, faible, moyenne ou élevée) a également été évaluée. Les médianes (25e et 75e quartiles) de l'exposition cumulative au benzène (ppm-année) parmi les cas et les témoins étaient les suivantes : -LAM : 1,2 (0,2 – 5,3) chez les cas; 0,6 (0,1 – 4,0) chez les témoins -LMC : 1,7 (0,6 – 3,4) chez les cas; 0,9 (0,2 – 4,9) chez les témoins -LLC : 1,1 (0,2 – 4,4) chez les cas; 1,1 (0,2 – 4,5) chez les témoins -SMD : 3,4 (0,4 – 8,9) chez les cas; 1,4 (0,2 – 3,8) chez les témoins -SMP : 1,7 (0,3 – 5,0) chez les cas; 1,1 (0,2 – 4,0) chez les témoins. Six paramètres d'exposition ont servi à estimer l'exposition au benzène : 1) exposition cumulative (ppm-année); groupe de référence : ≤ 0,348 ppm-année 2) durée d'emploi (années); groupe de référence : ≤ 15,6 ans 3) intensité moyenne de l'exposition (ppm); groupe de référence : ≤ 0,016 ppm 4) intensité maximale de l'exposition (ppm); groupe de référence : ≤ 0,016 ppm 5) exposition maximale (au moins un an de service à des postes où l'exposition au benzène est susceptible d'être supérieure à 3 ppm pendant 15 à 60 minutes au moins une fois par semaine); groupe de référence : jamais > 3 ppm. 6) exposition cutanée (probabilité relative la plus élevée de contact cutané pour un emploi donné pendant au moins un an); groupe de référence : aucune exposition cutanée. |
L'association entre les SMD et l'exposition cumulative au benzène a montré une relation dose-réponse monotone (tertile supérieur vs inférieur, > 2,93 vs ≤ 0,348 ppm-année, RC = 4,33, IC à 95 % [1,31; 14,3]). Pour les expositions maximales au benzène (> 3 ppm), le risque de SMD a augmenté pour les certitudes diagnostiques élevée et moyenne (exposition maximale vs aucune exposition maximale, RC = 6,32, IC à 95 % [1,32; 30,2]). Peu d'éléments établissant une relation dose-réponse avec la LAM, la LLC, la LMC ou le SMP ont été relevés. |
CSENO pour l'exposition cumulative : ≤ 0,348 ppm-année CMENO pour l'exposition cumulative : > 2,93 ppm-année CMENO pour l'exposition maximale : > 3 ppm |
Rushton et al., 2014 |
Étude cas-témoin regroupant trois études menées auprès de travailleurs de l'industrie pétrolière du Royaume-Uni, du Canada et de l'Australie. Elle comprend 60 cas de LAM appariés à 241 témoins et 80 cas de LLC appariés à 345 témoins. |
L'exposition professionnelle au benzène a été estimée de manière quantitative à l'aide des antécédents professionnels et de données spécifiques de la période. Les données spécifiques du pays et de la période ont servi à déterminer les estimations de l'exposition moyenne par quart de travail et ont été corrigées pour prendre en compte les différences dans le milieu de travail. Six mesures de l'exposition ont été établies : l'exposition cumulative (ppm-année); la durée d'emploi (années); l'intensité moyenne de l'exposition (ppm); l'intensité maximale de l'exposition (ppm); l'exposition maximale (au moins 1 an de service à un poste où l'exposition > 3 ppm pendant 15 à 60 min au moins une fois par semaine) (Oui/Non); l'exposition cutanée (probabilité relative la plus élevée de contact cutané pour un emploi donné pendant au moins un an) (aucune, faible, moyenne ou élevée). L'exposition au benzène était faible et l'intensité moyenne pour les cas de LAM était de 0,18 ppm et de 0,20 ppm pour les témoins. L'intensité moyenne pour les cas de LLC était de 0,19 ppm et de 0,21 ppm pour les témoins. |
Les analyses catégoriques ont mis en évidence une augmentation du RC de plusieurs paramètres d'exposition pour la LAM. Aucune relation n'a été établie entre l'exposition au benzène et la LLC, à l'exception d'un risque accru chez les travailleurs des raffineries en Australie. |
Non déterminée |
Linet et al., 2015 |
Étude de cohorte rétrospective portant sur des travailleurs exposés au benzène (n = 74 827) et des travailleurs non exposés. Les travailleurs venaient d'industries de peintures, de caoutchoucs, chimiques et de chaussures. |
Aucun effort n'a été déployé pour quantifier l'exposition au benzène. |
Les travailleurs exposés au benzène ont présenté un risque accru de mortalité, toutes causes confondues (RR = 1,1), par néoplasmes (RR = 1,3), par maladies respiratoires (RR = 1,7), par maladies du système hématopoïétique (RR = infini, en raison de l'absence de ces maladies dans la cohorte non exposée) et par cancer du poumon (RR = 1,5). Incidence accrue de SMD ou de LAM (RR = 2,7) et de LMC (RR = 2,5); toutes les maladies lymphoïdes comprenaient un grand nombre de LNH (RR = 3,9) et tous les cas de leucémie lymphoïde (RR = 5,4) ont été observés chez les travailleurs exposés au benzène. Des corrections ont été apportées pour prendre en compte le sexe, l'âge et l'année civile. Aucun autre polluant n'a été évalué. |
Non déterminée |
Stenehjem et al., 2015 |
Étude cas-cohorte portant sur 24 917 travailleurs de l'industrie pétrolière dont la plupart ont été exposés au benzène pendant moins de 15 ans. La population étudiée comprenait principalement des hommes et 112 cas de cancer lymphohématopoïétique ont été recensés. Une cohorte de référence composée de travailleurs qui n'étaient pas atteints de cancer lymphohématopoïétique a été incluse (n = 1661). |
L'exposition a été mesurée de nombreuses fois à l'aide de différentes techniques. L'intensité moyenne, l'exposition cumulative et l'exposition maximale ont servi à estimer l'exposition au benzène. Trois catégories ont été déterminées selon l'intensité moyenne : < 0,007 ppm (< 22 μg/m3); 0,007 à 0,013 ppm (22 à 42 μg/m3); et 0,013 à 0,040 ppm (42 à 130 μg/m3). Trois catégories ont également été déterminées selon l'exposition cumulative : < 0,037 ppm-année (120 μg/m3-année); 0,037 à 0,123 ppm-année (120 à 390 μg/m3-année); et 0,124 à 0,948 ppm-année (390 à 3030 μg/m3-année). |
Le rapport de risque frôlait la limite de la signification statistique dans les trois catégories d'intensité et d'exposition cumulative au benzène : tendance cumulative (tendancep = 0,052), intensité moyenne (tendancep = 0,092) et pic moyen (p = 0,056). Une association significative a été observée entre le rapport de risque de myélome multiple et l'exposition cumulative (tendancep = 0,024). La LLC montrait une association suggestive avec l'intensité moyenne (tendancep = 0,094). Aucune autre analyse n'a été effectuée pour distinguer les effets du benzène de ceux d'autres co-polluants. Des corrections ont été apportées pou prendre en compte l'âge, l'exposition au benzène découlant d'autres emplois et le tabagisme quotidien. |
Non déterminée |
Wong et al., 2010 |
Étude cas-témoin en milieu hospitalier portant sur 722 cas de LAM nouvellement diagnostiqués et 1444 témoins appariés selon le genre et l'âge provenant de 29 hôpitaux. D'autres polluants comme le toluène, l'éthylbenzène, les xylènes, les carburants diesel, les éthylbenzènes et les xylènes ont été évalués. |
L'exposition au benzène a été mesurée au moyen de réponses à un questionnaire et de l'appellation d'emploi des participants. Quatre groupes d'exposition (GE) ont été déterminés selon l'exposition maximale : GE0 (aucune exposition); GE1 (< 1000 μg/m3); GE2 (1000 à 10 000 μg/m3); GE3 (10 000 à 100 000 μg/m3); et GE4 (> 100 000 μg/m3). |
Les RC étaient significativement supérieurs à 1 pour l'ensemble des LAM et les sous-types de LAM, soit la LAM avec anomalies cytogénétiques récurrentes (RC = 1,61) et la leucémie aiguë promyélocytaire (RC = 1,95) chez les travailleurs exposés par rapport aux travailleurs n'ayant jamais été exposés. Les RC pour l'ensemble des LAM étaient les plus élevés lorsque l'exposition durait moins de 10 ans (RC = 1,99), alors que les RC les plus faibles survenaient lorsqu'elle était entre 10 et 20 ans (RC = 1,44) et de plus de 20 ans (RC = 0,74). Les RC pour l'ensemble des LAM augmentaient avec l'exposition maximale (RC le plus élevé était de 2,05 pour les GE3 et GE4; tendancep = 0,01). Une première exposition tardive s'est traduite par un RC plus élevé (RC = 4,18 lorsque la première exposition a eu lieu après 2000, alors que les RC étaient plus faibles lorsque cette exposition avait eu lieu plus tôt). Une analyse à plusieurs variables a établi un RC non significatif de 1,20 pour la LAM attribuable au benzène. |
Non déterminée |
Talibov et al., 2014 |
Étude de cas-témoins emboîtés de la Nordic Occupational Cancer Study (NOCCA). L'étude NOCCA portait sur 15 332 cas de LAM diagnostiqués en Finlande, en Norvège, en Suède et en Islande au cours des années 1965 à 2005. Les témoins (n = 76 660) ont été appariés aux cas selon l'année de naissance, le sexe et le pays. |
Des renseignements professionnels provenant des registres de recensement ont été enregistrés pour chaque pays et reliés à la matrice emplois-expositions (Nordic Job Exposure Matrix) pour estimer l'exposition professionnelle au benzène de manière quantitative. L'exposition au benzène a été établie à partir de la proportion de personnes exposées et du niveau moyen d'exposition parmi les personnes exposées dans le cadre de leur emploi et au cours d'une période donnée. Les auteurs ont supposé que la période d'emploi commençait à l'âge de 20 ans et se terminait à 65 ans. L'exposition cumulative au benzène a été déterminée à partir de la proportion de personnes exposées, du niveau moyen d'exposition et de la période d'emploi. Les valeurs d'exposition cumulative au benzène ont été regroupées comme suit (réf. : personnes non exposées au benzène) : faible niveau d'exposition (≤ 3,7 ppm) : < 50e percentile parmi les cas et les témoins exposés; 430 cas exposés (3 %) et 1999 témoins exposés (3 %) niveau d'exposition modéré (3,7 à 13,6 ppm) : entre les 50e et 90e percentiles inclusivement; 310 cas exposés (2 %) et 1633 témoins exposés (2 %) niveau d'exposition élevé (> 13,6 ppm) : > 90e percentile; 68 cas exposés (0,4 %) et 418 témoins exposés (0,5 %). |
Aucune association entre tout niveau d'exposition cumulative au benzène et la LAM |
Non déterminée |
Ghazawi et al., 2019 |
Étude écologique menée entre 1992 et 2010 sur l'incidence et la mortalité de LAM au Canada Trois bases de données démographiques sur le cancer ont été utilisées : le Registre canadien du cancer, le Registre québécois du cancer et la Base canadienne de données de l'état civil. Environ 18 085 patients ont reçu un diagnostic de LAM entre 1992 et 2010. |
L'exposition au benzène n'a pas été mesurée pour chaque cas. |
L'incidence de LAM était la plus élevée dans les villes frontalières entre le Canada et les États-Unis comme Sarnia, Thunder Bay, Sault Ste. Marie, St. Catharines et Hamilton. L'incidence de LAM était de 106,81 cas par million (IC à 95 % [70,96; 161,86]) au centre-ville de Sarnia, soit trois fois la moyenne canadienne. Sarnia possède également le plus grand nombre d'usines pétrochimiques au Canada, en plus de compter au-delà de 60 raffineries et 40 % des industries chimiques du Canada. Les données de CAREX Canada sur l'exposition au benzène montrent une association entre les villes où l'exposition au benzène est élevée et l'incidence et la mortalité élevées de LAM. |
Non déterminée |
Glass et al., 2014 |
Étude cas-témoin regroupant trois études menées auprès de travailleurs de l'industrie pétrolière du Canada, du Royaume-Uni et de l'Australie, qui vise à examiner la relation dose-réponse entre l'exposition au benzène et les cancers lymphohématopoïétiques. Cette étude s'est penchée sur le SMP et la LMC séparément. Elle comprend 28 cas de LMC appariés à 122 témoins et 30 cas de SMP appariés à 124 témoins. |
Une estimation quantitative de l'exposition au benzène a été déterminée pour chaque emploi des participants. Ces estimations ont permis d'estimer l'exposition de chaque participant. L'exposition cutanée et celle à un pic supérieur à 3 ppm de benzène pendant 15 à 60 minutes chaque semaine ont été évaluées. L'intensité moyenne de l'exposition était de 0,3 ppm pour les cas de LMC et de 0,17 ppm pour ceux de SMP. |
L'analyse continue ou catégorique n'a montré aucune augmentation du risque de LMC ni de SMP, quelle que soit la mesure de l'exposition au benzène. Aucun risque significativement accru n'a été mis en évidence chez les personnes fortement exposées. Les splines ont montré une certaine association entre le SMP et les expositions survenues de 2 à 20 ans avant le diagnostic lorsque les pics d'exposition et l'exposition cumulative étaient considérés comme une variable continue. Il n'y avait aucune association entre le SMP et la LMC et la faible exposition au benzène. |
Non déterminée |
Koh et al., 2011 |
Étude de cohorte rétrospective portant sur 8866 travailleurs de sexe masculin de l'industrie pétrochimique. Les travailleurs étaient employés dans une raffinerie et six sociétés pétrolières qui avaient utilisé ou produit du benzène en Corée entre 1960 et 2007. |
Cette étude n'a effectué aucune véritable estimation des niveaux d'exposition professionnelle. Les auteurs ont indiqué qu'il était impossible de produire une matrice emplois-expositions en raison du manque de données sur l'exposition en milieu de travail et les antécédents professionnels. |
Le RSM pour la leucémie (2,12; IC à 95 % [0,69; 4,96]) et les cancers lymphohématopoïétiques (1,72; IC à 95 % [0,69; 3,54]) était supérieur à celui de la population générale. Quatre groupes de travailleurs ont été déterminés selon leur appellation d'emploi : les travailleurs de la production présentaient un RSM pour la leucémie de 2,77 (IC à 95 % [0,85; 7,09]) et de 2 pour les cancers lymphohématopoïétiques (IC à 95 % [0,65; 4,66]). Le RSI pour la leucémie (1,40; IC à 95 % [0,29; 4,08] était plus élevé chez les travailleurs de l'industrie manufacturière que dans la population générale pour qui le RSI pour le LNH (0,70; IC à 95 % [0,008; 2,52]) et les cancers lymphohématopoïétiques (0,92; IC à 95 % [0,30; 2,14]) était plus élevé. Le RSI établi pour toutes les appellations d'emploi n'a montré aucun risque significativement accru de leucémie (2,24; IC à 95 % [0,46; 6,54]) ou de cancers lymphohématopoïétiques (1,47; IC À 95 % [0,48; 3,44]). |
Non déterminée |
Koh et al., 2014 |
Étude de cohorte rétrospective portant sur 14 698 travailleurs de sexe masculin de l'industrie pétrochimique, âgés de 20 à 72 ans, employés dans une usine pétrochimique en Corée de 2002 à 2007. |
Les travailleurs étaient exposés à d'autres substances cancérogènes en plus du benzène. L'étude précédente de surveillance du benzène avait déjà défini les différents niveaux d'exposition au benzène. La MG de l'exposition de longue durée au benzène était de 0,025 ppm et celle de l'exposition de courte durée de 0,020 ppm. |
Le RSI pour le LNH était de 1,83 (IC à 95 % [0,38; 5,34]) et le RSM de 1,24 (IC à 95 % [0,30; 4,27]). Aucune correction n'a été apportée pour prendre en compte la consommation d'alcool ou de cigarettes. |
Non déterminée |
Collins et al., 2015 |
Étude de cohorte professionnelle rétrospective portant sur la mortalité de 2266 travailleurs exposés au benzène à l'usine de Dow Chemical aux États-Unis. L'étude a été menée entre 1940 et 2009. 1590 décès ont été signalés pour un total de 94 892 personnes-années. |
L'exposition au benzène a été mesurée à partir de rapports d'hygiène du travail de 1944 jusqu'à la fermeture de l'usine. L'exposition de chaque employé a été déterminée à l'aide des antécédents professionnels et des niveaux d'exposition professionnelle pour établir l'exposition quotidienne moyenne au benzène. Cinq catégories ont été déterminées selon l'exposition quotidienne moyenne au benzène : moins de 1 ppm (moyenne de 0,5 ppm); 1 à 2 ppm (moyenne de 1,5 ppm); 2 à 9 ppm (moyenne de 5 ppm); 10 à 24 ppm (moyenne de 15 ppm); et 25 ppm et plus (moyenne de 30 ppm). La durée moyenne de l'exposition au benzène était de 4,9 années (de 30 jours à 44,7 années). L'exposition cumulative moyenne au benzène était de 35,1 ppm-année (de 0,5 à 499,5 ppm-année). |
L'exposition moyenne au benzène et son association avec la mortalité par leucémie ont mis en évidence un RSM de 1,21 (IC à 95 % [0,74; 1,97]) pour toutes les leucémies. Vingt décès par leucémie ont été enregistrés. Le RSM pour la LANL était de 1,04 (IC à 95 % [0,34; 2,44]). Cinq décès par LANL ont été enregistrés. Aucune tendance n'a été observée pour les niveaux d'exposition cumulative. Le RSM pour le LNH était de 0,97 (IC à 95 % [0,54; 1,60]). Le RSM des travailleurs pour qui la période de latence était supérieure à 30 ans était de 1,02 (IC à 95 % [0,53; 1,78]). |
Non déterminée |
Villeneuve et al., 2014 |
Étude cas-témoin portant sur 445 cas de cancer du poumon et 948 témoins. Le NO 2 et des COV (non précisés) ont fait partie des autres co-polluants mesurés. |
Le niveau d'exposition au benzène a été mesuré à 50 endroits dans l'air extérieur à Toronto au cours d'une étude menée en 2006. Un modèle a permis d'estimer l'exposition dans l'air intérieur résidentiel au cours de trois différentes périodes de temps : 1) l'exposition au moment de l'entrevue ou du diagnostic; 2) l'exposition 10 ans avant le diagnostic ou l'entrevue; et 3) l'exposition moyenne pondérée dans le temps dans toutes les maisons au cours des 10 années précédant le diagnostic ou l'entrevue. La médiane des concentrations de benzène était de 0,65 μg/m3 pour les cas et de 0,62 à 0,64 μg/m3 pour les témoins. |
Les auteurs ont constaté qu'une augmentation de l'EIQ (0,15 μg/m3) de l'exposition moyenne au benzène pondérée dans le temps dans les lieux de résidence antérieurs était associée à un RC de 1,84 (IC à 95 % [1,26; 2,68]) après la prise en compte de l'âge, du sexe, du tabagisme, de la fumée secondaire et d'autres facteurs de confusion. D'autres co-polluants comme le NO 2 et les hydrocarbures totaux ont établi des relations significatives avec les diagnostics de cancer du poumon. Aucune autre analyse n'a été effectuée pour distinguer les effets du benzène de ceux d'autres co-polluants. |
CMENO pour un risque accru de cancer du poumon = 0,15 µg/m3 de benzène dans l'air extérieur résidentiel |
Filippini et al., 2019 |
Examen systématique et méta-analyse de la relation dose-réponse entre la pollution de l'air extérieur et la leucémie infantile |
L'exposition au benzène a été évaluée par des mesures du trafic routier à proximité de la maison de l'enfant (nombre de véhicules sur les routes les plus proches, densité routière et distance par rapport aux principaux axes routiers). |
L'étude a évalué le risque de leucémie infantile en fonction de diverses mesures du trafic routier à proximité de la maison de l'enfant (nombre de véhicules sur les routes les plus proches, densité routière et distance par rapport aux principaux axes routiers), indépendamment du benzène et de certains autres polluants (le NO2, le 1,3-butadiène et les PM2,5). Une comparaison entre la catégorie d'exposition la plus élevée et celle la plus faible a mis en évidence une association entre le benzène et un risque accru de leucémie infantile et plus particulièrement de LAM chez les enfants de moins de 6 ans (RR de 1,39 pour toutes les leucémies; RR de 3,21 pour la LAM; et RR de 1,19 pour la leucémie aiguë lymphoblastique). L'estimation du risque combiné pour l'exposition au benzène était plus élevée chez les enfants d'âge préscolaire que chez les enfants d'âge scolaire. L'étude n'a relevé que peu d'associations entre le risque de leucémie infantile et les mesures du trafic routier à proximité de la maison de l'enfant. Les auteurs ont conclu que l'étude confirme l'existence d'un lien entre le benzène et le risque de leucémie infantile, en plus d'ajouter qu'il semble s'agir d'un effet sans seuil. Ils ont également indiqué que d'autres polluants provenant du trafic routier, y compris certains qui n'ont pas été mesurés, pourraient jouer un rôle. |
Non déterminée |
Gong et al., 2019 |
Méta-analyse de la pollution provenant du trafic routier et du risque de leucémie infantile, y compris 21 études cas-témoin |
L'exposition au benzène a été caractérisée comme toujours ou jamais, ou comme faible, moyenne ou élevée dans différentes analyses. |
Le RC pour la leucémie infantile était de 1,04 (IC à 95 % [0,71; 1,37]) avec une exposition modérée au benzène, de 1,02 (IC à 95 % [0,93; 1,10]) avec l'exposition modérée au NO 2 et de 1,01 (IC à 95 % [0,98; 1,04]) avec la densité de la circulation en général. Aucune association significative n'a été observée entre l'exposition au benzène et le risque de leucémie infantile. |
Non déterminée |
Filippini et al., 2015 |
Méta-analyse de l'association entre le benzène et le risque de leucémie infantile attribuable à l'air extérieur et à l'exposition associée à la densité de la circulation, à la pollution provenant du trafic routier ou à la proximité d'une station-service |
Diverses méthodes d'estimation du benzène dans l'air extérieur, y compris les expositions indirectes, les mesures et les modèles |
Les RC liés à un risque accru de leucémie dans la catégorie d'exposition au benzène la plus élevée étaient de 1,64 (IC à 95 % [0,9; 2,95]) pour la leucémie totale, de 1,09 (IC à 95 % [0,67; 1,77]) pour la leucémie aiguë lymphoblastique et de 2,28 (IC à 95 % [1,09; 4,75]) pour la LAM. Les RC avaient tendance à être plus élevés dans les études européennes que dans les études américaines. Le NO 2 présentait également des RC élevés (mais pas autant que le benzène). |
Non déterminée |
Vinceti et al., 2012 |
Étude cas-témoin portant sur des enfants âgés de 14 ans et moins ayant reçu un diagnostic de leucémie. L'étude comprenait 83 cas de leucémie, 64 cas de leucémie aiguë lymphoblastique et 19 cas de LAM appariés à 332 témoins. Cette étude a également évalué les PM10. |
L'exposition au benzène a été mesurée à partir des concentrations dans l'air extérieur issues de la modélisation du trafic motorisé à proximité de la maison de chaque participant au moment du diagnostic. Les concentrations de benzène ont été estimées par quartile sous forme de moyennes et de concentrations horaires maximales. Pour les concentrations moyennes, les quartiles étaient les suivants : < 0,10 μg/m3; 0,10-< 0,25 μg/m3; 0,25 < 0,50 μg/m3; et > 0,50 μg/m3. Pour les concentrations horaires maximales, les quartiles étaient les suivants : < 2 μg/m3; 2 < 4 μg/m3; 4 < 6 μg/m3; et > 6 μg/m3. |
Le RC était significativement supérieur à 1,0 pour la LAM chez les enfants de moins de 5 ans (RR corrigé = 5,46; IC à 95 % [1,12; 26,51]) après une augmentation de 1 μg/m3 de l'exposition moyenne au benzène dans l'air extérieur. Certains RC étaient supérieurs à 1 sans toutefois atteindre la signification statistique pour la LAM tous âges confondus après une augmentation de 1 μg/m3 de la concentration moyenne. Chez les enfants de 5 ans et plus, les RC étaient de 0,43 après une augmentation de 1 μg/m3 de la concentration moyenne. La comparaison entre les quartiles a mis en évidence une relation dose-réponse pour le benzène qui n'a atteint la signification statistique que pour le quartile supérieur avec un RC de 3,3. Les concentrations horaires maximales ne semblaient pas avoir autant d'effet que les concentrations moyennes. Les RC pour le benzène décrits ci-dessus ont été corrigés pour prendre en compte l'exposition aux PM10. |
La CMENO associée à une augmentation de 92 % du risque de LAM correspondait à une augmentation moyenne de 1 μg/m3 de la concentration de benzène dans l'air extérieur résidentiel. |
Janitz et al., 2017 |
Étude cas-témoin portant sur 307 cas de leucémie infantile et 1013 témoins appariés selon la semaine de naissance |
La concentration de benzène dans l'air extérieur a été modélisée au lieu de résidence à la naissance et estimée à l'aide de mesures établies par le gouvernement américain. Les concentrations ont été ordonnées en quartiles : 0,11 à < 0,39 μg/m3; 0,39 à < 0,67 μg/m3; 0,67 à < 0,91 μg/m3; et 0,91 à 2,03 μg/m3. |
Aucune différence significative découlant des niveaux d'exposition n'a été observée entre les cas et les témoins. Certaines tendances ont indiqué que les RC issus des quartiles d'exposition supérieurs étaient plus élevés que ceux du quartile inférieur. L'association était plus forte avec la LAM qu'avec la leucémie aiguë lymphoblastique. Des corrections ont été apportées pour prendre en compte l'éducation de la mère, l'urbanisation, l'origine ethnique, l'âge au moment du diagnostic, le genre, le rang de naissance, l'exposition aux champs électromagnétiques, et des variables propres à la mère concernant l'éducation, l'âge et la consommation de tabac durant la grossesse. Aucun autre polluant n'a été évalué. |
Non déterminée |
Annexe C : études toxicologiques
| Étude | Espèce, sexe, nombre | Exposition | Résultats | CSENO/CMENO |
|---|---|---|---|---|
Weaver et al., 2007 |
Rats mâles (non consanguins) Sprague Dawley 10 par groupe |
0 ou 300 ppm de benzène 23 heures par jour pendant 7 jours consécutifs |
L'exposition au benzène a induit l'apoptose des cellules du parenchyme pulmonaire. Une variation du degré de condensation de la chromatine, la segmentation des noyaux et la contraction cellulaire constituaient des signes d'apoptose. L'épithélium des grosses bronchioles présentait le taux d'apoptose le plus élevé (73,5 %), suivi des bronchioles terminales (65 %), des bronchioles respiratoires (60,8 %) et des alvéoles (55,6 %). Ces tissus ont tous présenté une même augmentation significative de l'activité apoptotique par rapport aux témoins (p ≥ 0,01). Les indicateurs de fragmentation de l'ADN étaient plus nombreux dans les voies pulmonaires par rapport aux témoins (p < 0,001). Les effets de la caspase-1 affectaient les cellules bronchiolaires, principalement au niveau de l'épithélium apical et des nouvelles cellules apoptotiques. Une augmentation significative de l'activité des caspases-1, 2, 8 et 9 a été observée dans les cellules des voies pulmonaires des rats exposés au benzène par rapport aux témoins (p < 0,001). |
CMENO = 300 ppm |
Rozen et al., 1984 |
Souris mâles C57B1 de 8 semaines 7 à 8 par groupe |
0, 10,2, 30,1, 101 ou 303 ppm de benzène 6 heures par jour pendant 6 jours |
Le taux de lymphocytes a diminué, quelle que soit la concentration. Le nombre d'érythrocytes a augmenté à 10 ppm, est demeuré inchangé à 30 ppm et a diminué à 100 et à 300 ppm. Il y avait 30 % de moins de cellules souches des lymphocytes B dans la moelle osseuse fémorale que chez les témoins, quel que soit le niveau d'exposition au benzène. Le nombre de lymphocytes B dans la moelle osseuse fémorale a diminué à 100 et à 300 ppm. Le nombre de cellules souches de lymphocytes B dans la rate a diminué à 300 ppm. Le nombre de lymphocytes B dans la rate a diminué à 100 et à 300 ppm. La stimulation des lymphocytes T dans la rate par la PHA a diminué aux concentrations supérieures à 10 ppm. Le nombre de lymphocytes T dans la rate a diminué à 100 et à 300 ppm. |
CMENO = 10,2 ppm (32,6 mg/m3) |
Chen, Guo et al., 2019 |
Souris mâles de 8 semaines, de type sauvage ou porteuses d'une délétion homozygote dans les hépatocytes du gène Ppp2r1a 6 à 10 par groupe |
0, 1 ppm (3,2 mg/m3), 10 ppm (32 mg/m3), ou 100 ppm (320 mg/m3) de benzène par inhalation, 6 heures par jour, 6 jours par semaine pendant 4 semaines. 0, 1, 10 ou 100 mg/kg par gavage 6 jours par semaine pendant 4 semaines. |
Les souris de type sauvage ont présenté une diminution significative du nombre de lymphocytes, quel que soit le type d'exposition ou la concentration de benzène (p <0,05). Aux doses élevées, tous les paramètres ont diminué dans les groupes exposés par inhalation et par voie orale, à l'exception de la numération plaquettaire (p < 0,05). Les souris mutantes porteuses d'une délétion de la PP2A étaient moins sensibles aux différents niveaux d'exposition. |
La CMENO/L pour l'hématotoxicité est de 3,2 mg/m3 et de 1 mg/kg p.c./jour. |
Chen et al., 2016 |
Souris mâles CD1 de 6 à 7 semaines 6 par groupe |
0 ou 300 ppm (960 mg/m3) de benzène, 6 heures par jour, 5 jours par semaine pendant 8 semaines. Un sous-groupe de souris a reçu une injection intrapéritonéale d'un inhibiteur de l'histone désacétylase (la trichostatine A) ou d'un mélange de protéines inactivant les ribosomes (le MCP30) avant l'exposition quotidienne au benzène. |
Une hématotoxicité a été observée chez les souris traitées au benzène, le taux d'hémoglobine et le nombre de globules blancs et de plaquettes ayant diminué par rapport aux témoins (p < 0,01 à 0,05). Des différences au niveau des taux d'ARNm et de l'acétylation des promoteurs de la topoisomérase IIa ont été observées (p < 0,01). L'apport complémentaire d'un inhibiteur de l'histone désacétylase a rétabli le nombre de cellules sanguines périphériques chez les souris exposées au benzène et augmenté l'expression de la topoisomérase IIa. |
S. O. |
Watheir et al., 2019 |
Rats mâles Brown Norway de 4 à 7 mois 5 par groupe |
0 ou 3000 ppm (9600 mg/m3) de benzène. Les animaux ont été exposés à 3000 ppm de benzène (9600 mg/m3) pendant deux périodes de 15 minutes séparées par 20 minutes d'air frais. |
L'exposition au benzène a provoqué une augmentation significative de l'amplitude du réflexe de l'oreille moyenne (p < 0,001). De tous les solvants testés, c'est le benzène qui a eu la plus grande influence sur le réflexe de l'oreille moyenne. Le benzène ne s'est pas révélé toxique pour la cochlée, aucun changement histopathologique n'ayant été relevé par rapport aux autres solvants. |
CMENO = 9600 mg/m3 |
Abplanalp et al., 2017 |
Souris mâles C57BL/6 de 10 semaines 10 par groupe |
0 ou 50 ppm (160 mg/m3) de benzène, 6 heures par jour, 5 jours par semaine pendant 6 semaines |
Les souris exposées au benzène ont présenté une réduction significative du nombre de cellules angiogéniques circulantes (Flk-1+/Sca-1+), mais une augmentation du taux de lipoprotéines de basse densité par rapport aux témoins. |
CMENO = 160 mg/m3 |
Keller et Snyder, 1988 |
Souris Swiss Webster (Cr1:CFW(SW)Br) 2 mâles et 2 femelles par groupe |
0, 5, 10 ou 20 ppm de benzène, 6 heures par jour du 6e au 15e jour de la gestation |
Une diminution du nombre des précurseurs érythroïdes en circulation (globules rouges nucléés immatures ou érythroblastes basophiles) selon une relation dose-réponse a été signalée deux jours après la naissance, quelle que soit la concentration de benzène. L'exposition à 20 ppm de benzène a fait accroître le nombre d'hépatoblastes hématopoïétiques (blastes et granulocytes en division) et de précurseurs granulopoïétiques non mitotiques (différenciés en métamyélocytes) et décroître le nombre de précurseurs érythropoïétiques tardifs (normoblastes polychromatiques et leur descendance nucléée). Quarante-deux jours après la naissance (6 semaines) et à 20 ppm, une augmentation similaire de la granulopoïèse a été observée, accompagnée d'un nombre élevé de blastes hématopoïétiques et de précurseurs granulopoïétiques spléniques et d'une diminution du nombre de précurseurs érythropoïétiques médullaires. |
CMENO = 5,1 ppm (16,3 mg/m3) |
| Étude | Espèce, sexe, nombre | Exposition | Résultats | CSENO/CMENO |
|---|---|---|---|---|
French et al., 2015 |
Essai clinique randomisé mené auprès de différentes souris mâles non consanguines; 75 souris par groupe |
Exposition par inhalation à 0, 1, 10 ou 100 ppm de benzène, 6 heures par jour, 5 jours par semaine pendant 28 jours; deux cohortes indépendantes |
Augmentation liée à la dose des altérations chromosomiques induites par le benzène. La BMCL a été évaluée à 0,205 ppm de benzène. Un locus sur le chromosome 10 (31,87 Mb) contenait une paire de sulfotransférases surexprimées qui étaient inversement corrélées à la génotoxicité. Les données sur la fréquence des micronoyaux dans les réticulocytes (MN-RET) et sur celle dans les érythrocytes matures (MN-ERC) étaient similaires. À 100 ppm, il y avait une différence significative au niveau des MN-RET dans le sang périphérique par rapport aux témoins, avec une augmentation de 573 %. La moelle osseuse a présenté une augmentation de 1 unité de MN-RET/1000 à 0 ‒ 1 ppm et 1 ‒ 10 ppm et de 9 unités à partir de 10 ‒ 100 ppm. La BMCL10 a été fixée à 1,52 ppm (manque d'ajustement significatif) et à 0,205 ppm après avoir éliminé la dose la plus élevée. Aucune modélisation n'a pas pu être effectuée à partir des résultats de MN-ERC en raison de la présence de valeurs élevées dans le groupe témoin. La BMCL10 a été établie à 3,66 ppm à partir de valeurs estimées déjà publiées pour les souris B6C3F1. |
BMCL10 = 0,205 ppm (MN-RET) |
Bird et al., 2010 |
Essai clinique randomisé mené auprès de souris mâles CD-1 de 7 semaines. 10 à 12 souris par groupe |
Les souris ont été exposées au benzène et/ou au toluène dans des chambres d'inhalation (1 m3) 6 heures par jour, de façon intermittente (pendant 8 jours échelonnés sur 15 jours) ou continue (pendant 8 jours consécutifs). La concentration de benzène était de 0, 50 ppm (160 mg/m3) ou 150 ppm (480 mg/m3) pour l'exposition intermittente, et de 0 ou 50 ppm (160 mg/m3) pour l'exposition continue. Les concentrations de toluène étaient de 0, 50 et 100 ppm. Certains animaux de la partie de l'étude portant sur l'exposition continue ont été exposés à la sulfoximine de buthionine qui favorise la déplétion du glutathion. |
La fréquence des micronoyaux a augmenté de façon significative (p < 0,05) après l'exposition continue à des concentrations de benzène de 160 mg/m3 pendant 8 jours consécutifs ou 8 jours échelonnés sur 15 jours. Bien que cette étude n'a fait aucune comparaison, il semblerait que la fréquence de micronoyaux est deux fois plus élevée dans le groupe exposé pendant 8 jours consécutifs que dans celui exposé de manière intermittente pendant 8 jours. Les taux de glutathion et de glutathion oxydé (sang total) ainsi que le ratio glutathion/glutathion oxydé n'ont pas changé de façon significative après l'exposition continue à 160 mg/m3. Par contre, certains métabolites urinaires ont augmenté de façon significative, notamment le phénol, l'acide trans, trans-muconique, l'hydroquinone, le trihydroxybenzène et l'acide S-phénylmercapturique. La co-exposition avec le toluène a fait doubler la fréquence des micronoyaux. Le prétraitement avec la sulfoximine de buthionine a réduit à la fois le taux de glutathion et la fréquence des micronoyaux. Les auteurs ont indiqué que cela concordait avec le fait qu'un conjugué benzène-glutathion était responsable de la génotoxicité. |
CMENO pour une fréquence accrue de micronoyaux = 160 mg/m3 |
Abplanalp et al., 2019 |
Essai clinique randomisé mené auprès de souris mâles C57BL/6 de type sauvage de 10 semaines. 10 à 34 souris par groupe |
Les souris ont été exposées dans des chambres d'inhalation à des concentrations de benzène de 0 (air filtré HEPA) ou 10 ppm (32 mg/m3), 6 heures par jour, 5 jours par semaine pendant 2 semaines, ou de 50 ppm (160 mg/m3), 6 heures par jour, 5 jours par semaine pendant 2 ou 6 semaines. Certains animaux ont été traités avec du TEMPOL pour déterminer si les effets du benzène pouvaient être renversés. |
Les souris exposées à 32 mg/m3 pendant 2 semaines n'ont présenté aucun effet significatif. Les souris exposées à 160 mg/m3 ont manifesté des signes importants d'intolérance au glucose pendant 2 ou 6 semaines (p < 0,05). Ces souris ont présenté des signes de phosphorylation Akt stimulée par l'insuline dans le foie et les muscles squelettiques (p < 0,05), de stress oxydatif et d'inflammation du foie et du tissu musculaire (p < 0,05) et de phosphorylation inhibée (p < 0,05). Le traitement au TEMPOL a renversé certains effets du benzène sur le stress oxydatif, la phosphorylation NF-κb, l'expression de SOCS1, la phosphorylation d'IRS2 et l'intolérance systémique au glucose. |
CMENO = 160 mg/m3 |
Annexe D : autres niveaux de référence pour les expositions par inhalation
D1. Niveaux de référence pour les expositions de courte durée par inhalation
L'ATSDR (2007) a établi un MRL (minimal risk level) aigu de 29 μg/m3 pour une exposition de 14 jours ou moins, qui repose sur une CMENO de 32,6 mg/m3 (10,2 ppm) pour une diminution de la prolifération lymphocytaire après une stimulation mitogénique chez les souris exposées au benzène 6 heures par jour pendant 6 jours (Rozen et al., 1984). La CMENO a été ajustée à une exposition continue (6 heures à 24 heures), et des facteurs d'incertitude ont été appliqués pour tenir compte des variabilités interspécifique (3) et humaine (10) et de l'utilisation d'une CMENO (10).
L'ATSDR (2007) a établi un MRL intermédiaire de 19 μg/m3 pour une exposition de 15 à 365 jours, qui repose sur une CMENO de 32 mg/m3 (10 ppm) pour un retard dans la réponse des lymphocytes de la rate aux antigènes étrangers chez les souris exposées au benzène 6 heures par jour, 5 jours par semaine pendant 4 semaines (Rosenthal et al., 1987). La CMENO a été ajustée à une exposition continue (6 heures à 24 heures et 5 jours à 7 jours), et des facteurs d'incertitude ont été appliqués pour tenir compte des variabilités interspécifique (3) et humaine (10) et de l'utilisation d'une CMENO (10).
L'Anses (2008) a choisi les mêmes effet, ajustement de la durée et facteurs d'incertitude que l'ATSDR (2007) pour le MRL aigu et a établi une valeur guide de 30 μg/m3pour l'exposition de courte durée allant de 1 à 14 jours (différence due à l'arrondissement).
L'OEHHA (2014) de la Californie a établi un niveau d'exposition de référence (REL) de 27 μg/m3 pour une exposition d'une heure, qui repose sur une CMENO de 16 mg/m3 (5 ppm) pour la diminution du nombre de globules rouges nucléés immatures chez les petits de souris exposées au benzène 6 heures par jour du 6e au 15e jour de la gestation (Keller et Snyder, 1988). Des facteurs d'incertitude ont été appliqués pour l'utilisation d'une CMENO (√10) et tenir compte des variabilités interspécifique (2*√10) et humaine (10*√10).
L'OEHHA (2014) de la Californie a établi un REL de 3 μg/m3 pour une exposition de 8 heures, qui repose sur son REL chronique. Voir la section D2 pour en savoir davantage.
La TCEQ (2015) a élaboré un ESL (effects screening level) de 170 μg/m3 pour une exposition d'une heure, qui repose sur une CMENO de 10,2 ppm pour une diminution du nombre de lymphocytes périphériques et de la blastogenèse des lymphocytes B dans la moelle osseuse fémorale induite par les mitogènes chez les souris exposées au benzène 6 heures par jour pendant 6 jours (Rozen et al., 1984). La CMENO a été ajustée à une exposition d'une heure [(CMENO)3 x (6 heures/1 heure)] 1/3 à laquelle des facteurs d'incertitude ont été appliqués pour tenir compte des variabilités interspécifique (3) et humaine (10) et de l'utilisation d'une CMENO (3) pour obtenir une valeur de référence de 580 μg/m3. Un indice de risque de 0,3 a ensuite été appliqué à cette valeur de référence pour obtenir l'ESL.
| Organisation | Niveau d'exposition de référence (μg/m3) | Durée d'exposition | Effet sur la santé | Référence(s) clé(s) |
|---|---|---|---|---|
| ATSDR (2007) | 29 | 14 jours ou moins | Hématotoxicité | Rozen et al., 1984 |
| ATSDR (2007) | 19 | 15 à 365 jours | Immunotoxicité | Rosenthal et al., 1987 |
| Anses (2008) | 30 | 1 à 14 jours | Hématotoxicité | ATSDR, 2000; Rozen et al., 1984 |
| OEHHA (2014) | 27 | 1 heure | Hématotoxicité pour le développement | Keller et Snyder, 1988 |
| OEHHA (2014) | 3 | 8 heures | Hématotoxicité | Lan et al., 2004 |
| TCEQ (2015) | 170 | 1 heure | Hématotoxicité | Rozen et al., 1984 |
D2. Niveaux de référence pour les expositions de longue durée par inhalation produisant des effets autres que le cancer
L'US EPA (2002) a établi une valeur de référence de 30 μg/m3 pour l'exposition chronique, qui repose sur une BMCL1sd (pondérée sur 8 heures) de 23,0 mg/m3 (7,2 ppm) pour la diminution du nombre de lymphocytes chez les travailleurs exposés au benzène en milieu de travail (Rothman et al., 1996). La BMCL a été ajustée à une exposition continue (10 m3 à 20 m3 et 5 jours à 7 jours), et des facteurs d'incertitude ont été appliqués pour tenir compte de l'extrapolation du niveau d'effet (3), de la variabilité humaine (10), de l'extrapolation d'une durée subchronique à chronique (3) et des lacunes dans la base de données (3).
L'ATSDR (2007) a établi un MRL chronique de 10 μg/m3, qui repose sur une BMCL0,25sd de 320 μg/m3 (100 ppb) calculée pour la diminution du nombre de lymphocytes périphériques chez les travailleurs exposés au benzène en milieu de travail (Lan et al., 2004). La BMCL 0,25sd a été ajustée à une exposition continue (8 heures à 24 heures et 6 jours à 7 jours), et un facteur d'incertitude de 10 a été appliqué pour tenir compte de la variabilité humaine.
L'Anses (2008) a choisi les mêmes effet, ajustement de la durée et facteurs d'incertitude que l'ATSDR (2007) pour construire sa valeur guide de 10 μg/m3 pour l'exposition de longue durée.
L'OEHHA (2014) de la Californie a établi un REL chronique de 3 μg/m3, qui repose sur une BMCL0,5sd de 1,523 mg/m3 (0,476 ppm) calculée pour la diminution du nombre de cellules sanguines périphériques chez les travailleurs exposés au benzène en milieu de travail (Lan et al., 2004). La BMCL0,5sd a été ajustée à une exposition continue (10 m3 à 20 m3 et 6 jours à 7 jours), et des facteurs d'incertitude ont été appliqués pour l'utilisation d'une CMENO (√10) et tenir compte de la variabilité humaine (60).
La TCEQ a établi un ESL chronique de 84 μg/m3, qui repose sur une BMCL de 23 μg/m3 (7,2 ppm) calculée pour la diminution du nombre absolu de lymphocytes chez les travailleurs exposés au benzène en milieu de travail (Rothman et al., 1996). La BMCL a été ajustée à une exposition continue (10 m3 à 20 m3 et 5 jours à 7 jours) à laquelle des facteurs d'incertitude ont été appliqués pour tenir compte de la variabilité humaine (10) et des lacunes dans la base de données (3) pour obtenir une valeur de référence de 280 μg/m3. Un indice de risque de 0,3 a ensuite été appliqué à cette valeur de référence pour obtenir l'ESL.
| Organisation | Niveau d'exposition de référence (μg/m3) | Effet sur la santé | Référence(s) clé(s) |
|---|---|---|---|
| US EPA (2002) | 30 | Hématotoxicité | Rothman et al., 1996 |
| ATSDR (2007) | 10 | Hématotoxicité | Lan et al., 2004 |
| Anses (2008) | 10 | Hématotoxicité | ATSDR, 2007; Lan et al., 2004 |
| OEHHA (2014) | 3 | Hématotoxicité | Lan et al., 2004 |
| TCEQ (2015) | 84 | Hématotoxicité | Rothman et al., 1996 |
D3. Excès de risque unitaire par inhalation pour les effets cancérogènes
L'US EPA (2000) a évalué la cohorte Pliofilm en sélectionnant une plage d'estimations de risque à partir des estimations du maximum de vraisemblance produites sur la base de la linéarité à faible dose des données de la cohorte Pliofilm, en tenant compte de toutes les données d'exposition (y compris celles supérieures à 400 ppm-année) et du risque moyen de mortalité par cancer. L'analyse a donné lieu à des estimations de risque comprises entre 8,6 x 10-5 et 2,5 x 10-2ppm-1 (2,6 x 10 -8 et 7,8 x 10-6[μg/m3]-1). Les estimations de risque se situent dans la partie inférieure de cette plage si la courbe dose-réponse est sublinéaire aux faibles doses et dans la partie supérieure si cette courbe est supralinéaire aux faibles doses. L'US EPA a établi une plage finale des estimations de risque à partir d'une extrapolation linéaire par défaut aux faibles doses en l'absence de données probantes pour l'utilisation d'un autre modèle. C'est ainsi que les excès de risque unitaire par inhalation sont compris entre 2,2 x 10-6 et 7,8 x 10-6 (μg/m3)-1, ce qui correspond à une concentration variant de 1,3 à 4,5 μg/m3 associée à un niveau de risque de 1 x 10-5.
L'OMS s'est servie du calcul de risque pour la cohorte Pliofilm établi par Crump en 1994 pour obtenir une estimation des risques cancérogènes du benzène. La quantification des risques multiplicatifs et un modèle linéaire prenant en compte l'accumulation des expositions et donnant autant de poids à la concentration qu'à la durée d'exposition ont permis à l'OMS d'établir un excès de risque unitaire par inhalation compris entre1,4 et 2,3 x 10-5ppb-1 (4,4 et 7,5 x 10-6 [μg/m3]-1). La MG des estimations de l'excès de risque à vie de leucémie est de 6 x 10 –6 pour une concentration dans l'air de 1 μg/m3. La concentration de benzène dans l'air associée à un excès de risque à vie de 1/100 000 est de 1,7 μg/m3.
La TCEQ (2015) s'est servie des analyses de risques pour le modèle linéaire de la cohorte Pliofilm effectuées par Crump (1994) pour produire une estimation du pouvoir cancérogène en lien avec la leucémie aiguë myélomonocytaire. Elle a conclu que le modèle linéaire le mieux ajusté pour la leucémie aiguë myélomonocytaire reposait sur l'utilisation de l'exposition cumulative pondérée comme mesure de l'exposition. L'excès de risque unitaire par inhalation a été fixé à 7,1 x 10-6 ppb-1 (2,2 x 10-6 [μg/m3]-1) pour un niveau de risque de 10-5. La concentration correspondante dans l'air est de 1,4 ppb (4,5 μg/m3).
Santé Canada a retenu l'excès de risque unitaire par inhalation de 1,6 x 10 -2 (mg/m3)-1 comme VTR pour le benzène sur les sites contaminés fédéraux. Cette VTR constituait un excès de risque à vie de leucémie pour la population générale, établie à partir des cohortes Pliofilm et de travailleurs chinois, et de l'analyse de risques de l'OEHHA (2001) et de celle de Santé Canada (2013a). Une régression de Poisson et des modèles linéaires de risque relatif ont été utilisés pour déterminer un excès de risque unitaire pour l'exposition par inhalation vie entière de la population générale (basé sur la MG des limites supérieures du risque de leucémie issues de ces études) (Santé Canada, 2021b).
Le RIVM (2001, 2007) a établi une valeur guide dans l'air intérieur de 20 μg/m3 pour le risque de cancer lié au benzène (pour un risque maximal de 1 cas de cancer par 10 000 personnes exposées sur 100 ans, ce qui équivaut à un excès de risque unitaire par inhalation de 5 x 10 -3 [mg/m3]-1) à l'aide d'une analyse précédente du taux de mortalité au sein de la cohorte Pliofilm menée par le Groupe de travail de l'Union européenne sur le benzène dans l'air extérieur. L'Anses a retenu un excès de risque unitaire par inhalation de 6 x 10 -3 (mg/m3)-1 comme valeur guide pour l'exposition au benzène dans l'air intérieur en se servant du modèle de l'OMS. L'Anses (2008) a considéré le fait de calculer le risque à l'aide de modèles linéaire et non linéaire comme l'approche la plus appropriée, car les connaissances actuelles ne permettent pas de déterminer exactement la forme de la courbe dose-réponse à de faibles concentrations de benzène. La German Environment Agency (2020) a récemment retenu la concentration de 20 μg/m3 correspondant à un excès de risque unitaire par inhalation de 4 x 10-5 comme valeur de référence, soit 0,1 μg/m3 pour un niveau de risque de 1 x 10-6.
| Organisation | Excès de risque unitaire par inhalation (μg/m3)-1 |
Concentration à un niveau de risque de 1 × 10 -5 | Effet sur la santé | Référence(s) clé(s) |
|---|---|---|---|---|
| US EPA (2000) | 2,2 x 10-6 à 7,8 x 10-6 | 1,3 – 4,5 μg/m3 | Leucémie | Rinsky et al., 1981, 1987; Paustenbach et al., 1993; Crump et Allen, 1984; Crump et al., 1994; US EPA, 1998 |
| OMS (2000) | 6 x 10-6 | 1,7 μg/m3 | Leucémie | Crump et al., 1994 |
| TCEQ (2015) | 2,2 x 10-6 | 4,5 μg/m3 | Leucémie aiguë myélomonocytaire | Crump et al., 1994 |
| Santé Canada, Division des lieux contaminés (2021) | 1,6 x 10-5 | 0,6 μg/m3 | Leucémie | Santé Canada, 2013; OEHHA, 2001 |
| Anses (2008) | 6 x 10-6 | 2 μg/m3 | Leucémie | OMS, 2000; Crump et al., 1994 |
| RIVM (2007) | 5 x 10-6 | 2 μg/m3 | Cancer | RIVM, 2001 |
| Umweltbundesamt (2020) | 1 x 10-5 | 1Note de bas de page * μg/m3 | Leucémie | AGS, 2012 |
|
||||
Notes de bas de page
- Note de bas de page 1
-
Les termes femmes et hommes sont employés dans le rapport d'étude original. Le rapport n'indique pas clairement si le sexe ou le genre a été pris en compte dans l'analyse.