Conseils sur l’utilisation de l’évaluation quantitative du risque microbien dans l’eau potable

Télécharger le format de rechange
(Format PDF, 664 Ko, 44 pages)
Organisation : Santé Canada
Publiée : 2018-03-09
Document de consultation publique
Préparé par le Comité fédéral-provincial-territorial sur l'eau potable
La période de consultation se termine le 11 mai 2018
Table des matières
- Conseils sur l'utilisation de l'évaluation quantitative du risque microbien dans l'eau potable 1
- Objet de la consultation
- Sommaire
- Évaluation
- Considérations internationales
- Partie A Conseils sur l'utilisation de l'ÉQRM dans l'eau potable
- A1 Introduction et contexte
- A2 Déterminer une approche d'évaluation de risques
- A3 Analyses de sensibilité : tenir compte de la variabilité et de l'incertitude dans l'évaluation de risques
- A4 Hypothèses et limites associées aux évaluations de risques
- A41 Estimations des concentrations d'agents pathogènes
- A42 Efficacité des barrières de traitement
- A43 Analyse de l'exposition
- A5 Comprendre les estimations de risques
- A6 Application de l'ÉQRM dans la gestion de la salubrité de l'eau
- Partie B Renseignements à l'appui
- Partie C Références et acronymes
Février 2018
Conseils sur l'utilisation de l'évaluation quantitative du risque microbien dans l'eau potable
Objet de la consultation
Le Comité fédéral-provincial-territorial sur l'eau potable (CEP) a élaboré le présent document afin de fournir des renseignements au sujet du modèle d'évaluation quantitative du risque microbien (ÉQRM) de Santé Canada à l'intention des autorités réglementaires et des décideurs; de décrire les principes, les équations et les valeurs tirées de publications qui ont été utilisés pour appuyer l'établissement des valeurs de recommandations pour les virus et les protozoaires entériques dans l'eau potable; et de fournir des renseignements sur les hypothèses et les limites des évaluations de risque propres à un site qui sont réalisées dans des installations de traitement d'eau potable. La présente consultation vise à obtenir des commentaires sur ce document de conseil.
Le CEP a demandé que le document soit soumis à la consultation du public. Les commentaires, avec justification pertinente le cas échéant, sont les bienvenus. Ils peuvent être envoyés au Secrétariat du CEP par courrier électronique (water_eau@hc-sc.gc.ca) ou au besoin par la poste, au Secrétariat du CEP, Bureau de la qualité de l'eau et de l'air, Santé Canada, 3e étage, 269, avenue Laurier Ouest, localisateur d'adresse 4903D, Ottawa (Ontario), K1A 0K9. Les commentaires doivent être reçus avant le 11 mai, 2018.
Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l'affiliation de leurs auteurs, aux membres concernés du CEP. Les personnes qui ne veulent pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent fournir une déclaration à cet effet avec leurs commentaires.
Il est à noter que ce document de conseils sur l'utilisation de l'ÉQRM dans l'eau potable sera révisé après évaluation des commentaires reçus; un document de conseils final sera publié. Il doit donc être considéré uniquement comme une ébauche aux fins de consultation.
Sommaire
L'évaluation quantitative du risque microbien (ÉQRM) est une approche à la disposition des agences réglementaires et des autorités en matière d'eau potable pour la quantification des risques à la santé posés par les microorganismes présents dans les sources d'eau. Elle utilise une approche courante qui comporte la détermination des dangers, l'évaluation de l'exposition, l'évaluation de la relation dose-réponse et la caractérisation des risques. L'ÉQRM comprend l'évaluation du système d'eau potable au complet, de la source d'eau jusqu'au consommateur, afin d'en comprendre les effets possibles sur la santé publique.
Santé Canada a élaboré et utilise un modèle d'ÉQRM afin d'appuyer l'établir des recommandations pour la qualité de l'eau potable pour les virus et les protozoaires entériques. Le modèle peut aussi être utilisé dans des évaluations de risques propres à chaque site au sein des installations de traitement d'eau potable.
Santé Canada a complété son examen de l'utilisation de l'ÉQRM en matière d'eau potable. Ce document de conseils donne un aperçu des considérations, des hypothèses et des limites qui sont nécessaires pour effectuer une évaluation propres à un site. Il décrit aussi les principes, les équations et les valeurs publiées qui sont utilisés dans le modèle d'ÉQRM de Santé Canada.
À sa réunion de l'automne 2016, le Comité fédéral-provincial-territorial sur l'eau potable a examiné le document de conseils sur l'utilisation de l'ÉQRM en matière d'eau potable et en a autorisé la diffusion à des fins de consultation publique.
Évaluation
L'ÉQRM peut s'avérer un outil très utile pour appuyer les décisions liées à la gestion de la salubrité de l'eau. Une ÉQRM bien formulée et réfléchie peut offrir des renseignements importants sur l'établissement des priorités en matière de dangers, la détermination des autres priorités et options en matière de gestion du risque, la sélection des interventions appropriées, l'analyse coût/bénéfice des mesures de gestion du risque et l'établissement d'objectifs de rendement en matière de santé. Il est important de se rappeler que l'ÉQRM ne calcule pas les résultats réels de maladies, mais qu'elle fournit une mesure de probabilité d'une maladie liée au système d'eau.
Le but de ce document est de fournir aux autorités réglementaires, aux décideurs, aux propriétaires de systèmes d'eau potable et aux consultants des conseils sur l'utilisation de l'ÉQRM pour les aider à comprendre les risques microbiologiques dans les systèmes d'eau au Canada.
Considérations internationales
L'ÉQRM est de plus en plus utilisé par les agences internationales et tous les paliers de gouvernement comme fondement pour une prise de décision informée en ce qui a trait aux risques à la santé posés par les microorganismes pathogènes dans l'eau potable. L'Organisation mondiale de la Santé, la Commission Européenne, les Pays-Bas, l'Australie et les États-Unis ont tous fait des progrès importants concernant la validation et la méthodologie de l'ÉQRM. Ces agences et gouvernements ont adopté des approches qui utilisent l'ÉQRM en vue d'élaborer des objectifs en matière de santé et de gestion du risque pour les contaminants microbiologiques.
Partie A. Conseils sur l'utilisation de l'ÉQRM dans l'eau potable
A.1 Introduction et contexte
Le document « Recommandations pour la qualité de l'eau potable au Canada » conseille l'adoption d'une approche à barrières multiples de la source au robinet afin de produire une eau potable salubre, sûre et fiable (Santé Canada, 2013). Une évaluation quantitative du risque microbien (ÉQRM) peut faire partie de cette approche. L'ÉQRM comprend l'évaluation du système d'eau potable au complet, de la concentration de pathogènes dans la source d'eau jusqu'au consommateur, en passant par le processus de traitement, afin d'en comprendre les effets possibles sur la santé publique. Elle s'inscrit dans une stratégie commune qui comporte quatre volets : la détermination des dangers, l'évaluation de l'exposition, l'évaluation de la relation dose-réponse et la caractérisation des risques. Selon cette approche, Santé Canada a élaboré un modèle d'ÉQRM afin d'élaborer des valeurs de recommandations pour les virus et les protozoaires entériques présents dans l'eau potable et d'inciter la mise en œuvre d'évaluations de risques propres à chaque site au sein des installations de traitement d'eau potable. Une copie du modèle est disponible sur demande en envoyant un courriel à water_eau@hc-sc.gc.ca.
L'objet du présent document comporte deux volets : donner un aperçu des facteurs, y compris les hypothèses et les limites, qui doivent être pris en considération aux fins des évaluations des risques propres à chaque site; et décrire les principes, les équations et les valeurs tirées de publications qui figurent dans le modèle d'ÉQRM de Santé Canada (ÉQRM de SC). Le document est divisé en deux sections. La partie A offre des conseils généraux sur l'utilisation de l'ÉQRM et s'adresse aux personnes qui portent un intérêt ou une responsabilité envers la qualité et la salubrité de l'eau potable. La partie B fournit des renseignements détaillés sur le modèle d'ÉQRM de SC, ainsi que quelques scénarios d'application. Ces renseignements sont destinés aux personnes qui souhaitent mieux comprendre et éventuellement utiliser l'outil d'ÉQRM qui a été élaboré par SC. En exposant dans un seul document les facteurs généraux à prendre en considération (partie A) dans le cadre de l'ÉQRM ainsi que les renseignements sur l'élaboration du modèle de SC, l'objectif est de fournir un document qui peut servir à améliorer la compréhension et la mise en œuvre de l'ÉQRM dans le cadre d'une approche de la source au robinet au Canada. Le présent document ne fournit pas d'instructions détaillées sur la façon de réaliser des évaluations de risques propres à chaque site. Pour obtenir des exemples d'analyses d'approvisionnements en eau potable spécifiques qui s'inscrivent dans le cadre d'une ÉQRM, le lecteur est prié de consulter le document Drinking Water Plant Assessments (Évaluations des usines de traitement d'eau potable) (Water Research Foundation, en cours de préparation), ou Application of Quantitative Microbial Risk Assessment for Water Safety Management (Application de l'évaluation quantitative du risque microbien pour assurer la gestion de la salubrité de l'eau) de l'Organisation mondiale de la Santé (OMS, 2016).
A.2 Déterminer une approche d'évaluation de risques
Il existe de nombreuses approches d'évaluation de risques qui peuvent faire partie d'une stratégie de la source au robinet ou d'un plan de salubrité de l'eau à l'égard de la gestion de l'eau potable. Ces stratégies varient entre des approches qualitatives et des approches quantitatives. La publication de l'OMS sur l'évaluation de risques (OMS, 2016) présente un bon aperçu des forces et des limites de chacune des différentes approches d'évaluation de risques, ainsi que des conseils généraux sur la façon de déterminer quand et comment elles devraient être appliquées.
Le type d'évaluation de risques nécessaire pour un système d'eau donné devrait être déterminé en fonction de chaque site. De façon générale, la stratégie d'évaluation de risques utilisée devrait permettre de trouver un équilibre entre le niveau de détail, de complexité et de données probantes et la nécessité d'avoir recours à des hypothèses et à des avis d'experts pour mettre en œuvre une approche qui est seulement aussi complexe que nécessaire pour permettre une prise de décision des options de gestion des risques (U.S. EPA, 2014; OMS, 2016).
La première étape d'une évaluation de risques consiste à déterminer la portée de celle-ci en ciblant les questions auxquelles il faut répondre. Les évaluations de risques peuvent être entreprises pour diverses raisons (U.S. EPA, 2014), notamment pour :
- évaluer la possibilité de risque aux êtres humains lié à l'exposition à un agent pathogène connu
- déterminer les points de contrôle critiques dans le système d'eau potable
- déterminer des processus spécifiques de traitement afin de diminuer les niveaux de différents agents pathogènes
- prévoir les conséquences qui pourraient découler des diverses options de gestion visant à réduire les risques
- cerner les besoins en matière de recherche et les classer par ordre de priorité, et
- appuyer les enquêtes épidémiologiques
Définir la portée du problème permet de sélectionner le bon type d'évaluation de risques. L'évaluation pourrait être qualitative, comme une inspection sanitaire, ou semi-quantitative, comme l'utilisation de matrices de risques. On recommande par ailleurs que toutes les évaluations de risques fournissent un certain niveau de quantification afin d'aider les gestionnaires des risques à établir les priorités en matière de tâches (OMS, 2016). Pour ce qui est des évaluations qualitatives, il peut s'agir d'une simple liste de vérification qui accompagne l'inspection sanitaire et dont le nombre de réponses « oui » et non » détermine un élément de risque élevé, moyen ou faible du système.
Les approches d'évaluations quantitatives des risques peuvent varier entre des évaluations préliminaires qui comportent des estimations ponctuelles simples et des évaluations probabilistes de risques qui comprennent une analyse d'incertitude. Les modèles d'ÉQRM qui utilisent des estimations ponctuelles des variables d'entrée, comme des valeurs de moyennes arithmétiques, sont reconnus comme étant des modèles déterministes. Les modèles probabilistes d'ÉQRM utilisent des distributions statistiques des variables d'entrée au lieu de valeurs uniques. Définir ces distributions statistiques pour chaque variable d'entrée nécessite des données et des connaissances plus exhaustives que l'utilisation d'une approche déterministe.
Les évaluations quantitatives de risques peuvent également être appliquées sous la forme d'une approche progressive. À titre d'exemple, une évaluation préliminaire pourrait être réalisée afin de fournir des indications qui permettraient de savoir si le système est bien supérieur, est bien inférieur ou respecte tout juste les exigences permises relatives à l'eau potable. Ces renseignements pourraient alors aider à établir des priorités en matière de ressources. Dans le cas de données très limitées, les ressources pourraient être mises à meilleure contribution si elles mettaient en œuvre des mesures de contrôle du système fondées sur les résultats de l'évaluation préliminaire au lieu de recueillir les données nécessaires pour mener une évaluation probabiliste approfondie.
A.3 Analyses de sensibilité : tenir compte de la variabilité et de l'incertitude dans l'évaluation de risques
Les analyses de sensibilité qui comportent des évaluations de la variabilité et de l'incertitude devraient être intégrées, dans la mesure du possible, dans l'évaluation de risques. La variabilité correspond à la variation naturelle dans les éléments d'un système et ne peut être réduite. Il s'agit toutefois d'un facteur qui peut être mieux caractérisé en recueillant des données supplémentaires. Il existe une variabilité dans tous les éléments d'une évaluation de risques, dont les concentrations d'agents pathogènes, le rendement du traitement et les caractéristiques de la relation dose-réponse. D'autre part, l'incertitude reflète le manque de compréhension ou l'incapacité de mesurer de façon précise certains éléments qui ont une incidence sur le résultat d'une évaluation de risques. L'incertitude peut découler de diverses sources, dont le manque d'information sur le système qui fait l'objet d'une évaluation; le manque de données locales, lesquelles pourraient ne pas être représentatives de l'éventail de valeurs attendues pour ce système; et les distributions statistiques qui ont été sélectionnées pour représenter les données du système (OMS, 2016). Il est possible de réduire l'incertitude grâce à une caractérisation plus poussée de paramètres d'entrée du modèle.
La variabilité et l'incertitude font régulièrement partie des évaluations probabilistes approfondies (c.-à-d., modèles stochastiques). Elles sont incorporées à l'aide des distributions statistiques des paramètres d'entrée dans le modèle d'évaluation de risques, en fonction des données disponibles sur le système. Cerner de façon appropriée la variabilité et l'incertitude dans les paramètres d'entrée aux fins d'utilisation dans les modèles probabilistes constitue l'obstacle le plus courant à l'utilisation d'une approche stochastique (U.S. EPA, 2014). La variabilité et l'incertitude peuvent également être comprises dans les évaluations préliminaires au moyen d'estimations ponctuelles (c.-à-d., modèles déterministes). Dans le cadre des modèles déterministes, la variabilité et l'incertitude sont habituellement incorporées à l'aide de scénarios (comme les hypothèses les plus optimistes et pessimistes), ce qui peut aider les gestionnaires de risques à comprendre l'éventail probable de risques. Si une évaluation préliminaire était réalisée avec seulement la limite supérieure d'incertitude de chaque paramètre, le risque estimé qui en découlerait serait beaucoup trop prudent et ne serait pas vraiment représentatif du risque à la population. Le recours à des scénarios peut aider à déterminer les prochaines étapes à suivre, notamment pour déterminer si un système tirerait avantage de l'adoption d'une approche qui s'inspire d'un modèle stochastique plus complexe afin de peaufiner l'évaluation de risques, ou si les ressources seraient mises à meilleure contribution en atténuant les moteurs de risques qui ont été identifiés lors de l'évaluation préliminaire. Les modèles stochastiques et déterministes peuvent également comprendre une analyse de sensibilité afin de déterminer les variables qui ont la plus grande incidence sur les calculs du risque global (moteurs de risque) (U.S. EPA, 2014; OMS, 2016).
A.4 Hypothèses et limites associées aux évaluations de risques
De nombreuses hypothèses et limites entourent la mise en œuvre des évaluations des risques dans le cadre de la gestion de l'eau potable. Les hypothèses sont formulées par les modélisateurs lorsque ces derniers mettent au point des modèles d'évaluation de risques, ainsi que par les analystes et les gestionnaires lorsqu'ils saisissent des données dans le cadre d'une évaluation de risques. Par exemple, les hypothèses formulées par les modélisateurs qui élaborent un modèle comprennent la sélection de la forme de la distribution à appliquer à un paramètre donné (p. ex., normal, log-normal, triangulaire) et la détermination du modèle dose-réponse qui sera utilisée pour chaque agent pathogène. Ces hypothèses ne sont habituellement pas modifiées dans le cadre d'évaluations individuelles des risques. La partie B du présent document renferme les hypothèses qui sont comprises dans l'élaboration du modèle d'ÉQRM de SC. En ce qui concerne les saisies de données, il pourrait être nécessaire de formuler des hypothèses afin de pallier les renseignements inconnus ou limités ou de minimiser le niveau de complexité de l'évaluation. De façon générale, les estimations des concentrations des agents pathogènes, l'efficacité du système de traitement et les renseignements sur l'exposition constituent les entrées de modèle qui font l'objet d'hypothèses par les analystes de risque et les gestionnaires de risque. Afin de bien interpréter les estimations de risques, les limites et les hypothèses associées à une évaluation de risques doivent être bien documentées et comprises.
A.4.1 Estimations des concentrations d'agents pathogènes
Les estimations des concentrations d'agents pathogènes d'une source d'eau sont limitées par la quantité de renseignements qui sont disponibles concernant l'incertitude et la variabilité des données recueillies. Tout d'abord, les ensembles de données concernant les agents pathogènes ont tendance à être de petite taille et, par conséquent, ne permettent pas nécessairement de bien cerner la variabilité inhérente à un système. Les faibles densités d'agents pathogènes et la nature épisodique de la charge en agents pathogènes ajoutent à la difficulté de saisir cette variabilité (U.S. EPA, 2014). En outre, plusieurs systèmes ne comportent aucune donnée sur les agents pathogènes et doivent plutôt s'appuyer sur des hypothèses, des publications, l'avis d'experts ou une combinaison de ceux-ci. Ensuite, les méthodes disponibles pour détecter les agents pathogènes ne récupèrent pas la totalité des agents pathogènes dans les échantillons, et la récupération varie entre les échantillons, ce qui doit être pris en considération dans le cadre de l'estimation des concentrations. Pour certains agents pathogènes, les données sur la récupération associée à la méthode de ne sont pas régulièrement déterminées et, par conséquent, une estimation prudente de la récupération pourrait être requise afin de ne pas sous-estimer le risque. Enfin, de nombreuses méthodes de détection ne font pas la distinction entre les agents pathogènes qui peuvent causer des maladies chez les humains et ceux qui ne le peuvent pas. Cela peut comprendre la détection d'agents pathogènes viables et non viables (p. ex., à l'aide de méthodes moléculaires) ou la détection de souches qui sont reconnues pour causer des maladies chez les humains. Ces deux situations peuvent mener à une surestimation du risque. Certains auteurs prétendent que la récupération et l'infectiosité sont d'ampleur similaire, et que l'on devrait considérer qu'ils s'annulent mutuellement (Regli et coll., 1991; Smeets et coll., 2007). Cette relation ne s'appuie toutefois pas sur un grand nombre de justifications scientifiques (OMS, 2016).
En raison des limites associées aux données sur les agents pathogènes, celles-ci devraient être utilisées en parallèle avec tous les autres renseignements concernant le système qui sont disponibles lors d'une évaluation de risques. Les autres renseignements qui pourraient être utilisés sont les informations tirées des enquêtes sanitaires, la surveillance des indicateurs fécaux, les recherches qui retracent les sources microbiennes, la modélisation du devenir et du transport des sources fécales ou les publications sur un bassin hydrographique donné ou sur d'autres bassins hydrographiques aux entrées de matières fécales similaires (Ashbolt et coll., 2010; U.S. EPA, 2014; OMS, 2016). Toutes ces sources de renseignements devraient prises en considération dans le cadre du processus décisionnel lié aux estimations de concentrations d'agents pathogènes du système, y compris la variabilité et l'incertitude qui y sont associées. D'autres renseignements sont fournis à ce sujet à la section B.2.1.
A.4.2 Efficacité des barrières de traitement
Les renseignements propres à chaque site sur le rendement des barrières de traitement fournissent la meilleure estimation des risques. Les services publics devraient déployer tous les efforts nécessaires pour recueillir le plus de renseignements possible sur leur propre système en utilisant toutes les données qu'ils ont à leur disposition, comme des paramètres de conception ou des évaluations de rendement. Beaucoup de systèmes ne détiendront pas suffisamment de renseignements pour caractériser pleinement leur rendement par rapport à leurs traitements et devront, par conséquent, formuler quelques hypothèses. Plusieurs types et configurations de barrières de traitement sont utilisés pour produire de l'eau potable sûre et fiable. La plupart des barrières de traitement couramment utilisées ont fait l'objet d'études approfondies, et des publications sont disponibles sur leur efficacité à diminuer les concentrations de contaminants microbiologiques. Malheureusement, l'éventail de taux d'enlèvement d'un même type de barrière peut s'étendre jusqu'à six ordres de grandeur, en fonction de nombreux facteurs comme les caractéristiques de la qualité de l'eau (p. ex., la température, le contenu organique, le prétraitement), la conception et le fonctionnement de l'usine de traitement (p. ex., la géométrie, les milieux, les taux de charge, l'hydrodynamisme) et les facteurs climatiques (p. ex., la température, les précipitations) (OMS, 2016). Cette variabilité en matière de rendement des barrières peut ajouter une incertitude considérable dans l'estimation des risques lorsqu'un système d'eau potable doit s'appuyer uniquement sur des valeurs tirées de publications.
Il est important de prendre en considération le niveau de détail requis pour le système de traitement et de consigner ensuite toutes les hypothèses qui ont été formulées. Les décisions liées au rendement des barrières de traitement devraient également être prises à la lumière des données qui sont régulièrement disponibles, comme les données sur la qualité générale d'une source d'eau et les données opérationnelles de l'usine de traitement.
A.4.3 Analyse de l'exposition
Lors de la détermination de l'exposition des personnes pour calculer les risques, des hypothèses sont habituellement formulées afin de simplifier l'évaluation de risques ainsi que d'appliquer l'estimation des risques à toute la population qui utilise la source d'eau potable. En règle générale, on considère que la voie d'exposition est limitée à la consommation de l'eau potable. Il est donc nécessaire d'estimer le volume d'eau consommé par une personne sur une base quotidienne. Selon le modèle d'évaluation de risques, le volume d'eau potable peut être consigné comme une estimation ponctuelle ou une distribution de valeurs. L'hypothèse selon laquelle toute personne est également vulnérable à une infection fait partie des autres hypothèses formulées. Certaines des évaluations complexes des risques peuvent comprendre des variables de l'état immunitaire de la population ainsi que la possibilité d'une propagation secondaire des agents pathogènes à d'autres personnes dans la communauté. Ce niveau de détail n'est toutefois typiquement pas disponible. En outre, lorsqu'on s'attend à ce que l'exposition environnementale soit faible, comme ce serait le cas pour l'eau potable traitée, il a été démontré que des risques similaires sont estimés avec ou sans l'ajout de variables pour la sensibilité ou pour la propagation secondaires (Soller et Eisenberg, 2008). Ces variables supplémentaires ne sont donc pas comprises dans la plupart des modèles de risques liés à l'eau potable.
A.5 Comprendre les estimations de risques
Les estimations de risques et les objectifs basés sur la santé peuvent être exprimés selon différents délais et paramètres. Les risques microbiologiques sont habituellement estimés pour les expositions quotidiennes. Les risques quotidiens sont alors combinés en une estimation annuelle des risques. Les objectifs de risque à la santé tolérable sont habituellement exprimés en objectifs annuels de risque au lieu d'objectifs quotidiens de risque. Les objectifs annuels ont pour avantage de permettre une certaine variabilité en matière de qualité de l'eau. À titre d'exemple, des expositions élevées peu fréquentes sont acceptables tant qu'elles sont compensées par des expositions beaucoup plus faibles, de manière à ce que le total combiné pour l'année n'excède pas l'objectif annuel. Si l'on utilise un objectif annuel, il est important qu'il soit établi à un niveau qui ne permet pas que la variabilité de la qualité de l'eau excède une valeur tolérable à court terme. D'autre part, un objectif quotidien peut être utilisé afin d'éviter les risques associés à un pic de présence (Signor et Ashbolt, 2009).
Les paramètres qui sont généralement utilisés pour exprimer les risques comprennent le risque d'infection ou de maladie, ou l'estimation du fardeau sanitaire comme les années de vie corrigées de l'incapacité (AVCI). Les Recommandations pour la qualité de l'eau potable au Canada utilisent une cible annuelle de risque de 1 × 10-6 AVCI par personne par année. L'OMS a adopté cette approche (2004). D'autres pays, comme les Pays-Bas, utilisent le risque annuel d'infection comme paramètre de comparaison de l'objectif sanitaire. Les objectifs quotidiens n'ont pas encore été utilisés pour établir des risques à la santé tolérables.
Plusieurs facteurs doivent être pris en considération dans le cadre de l'interprétation des estimations des risques. Tout d'abord, la qualité des données qui figurent dans l'évaluation doit être comprise, ce qui comprend les hypothèses qui ont été formulées, la manière dont celles-ci ont une incidence sur les estimations des risques et la mesure à laquelle la variabilité et l'incertitude ont été reflétées lors de l'évaluation (y compris identifier les lacunes en matière de données et les biais d'échantillonnage). Chaque entrée dans une ÉQRM peut s'appuyer, au besoin, sur des hypothèses et des avis d'experts, tant que les questions auxquelles il faut répondre s'inscrivent bien dans le cadre de cette approche. Cependant, si les questions auxquelles il faut répondre par l'évaluation de risques nécessitent une évaluation probabiliste approfondie, les coûts liés à la collecte des données requises pour l'analyse doivent être comparés aux coûts du processus décisionnel fondé sur des hypothèses.
A.6 Application de l'ÉQRM dans la gestion de la salubrité de l'eau
L'ÉQRM peut s'avérer un outil très utile pour appuyer les décisions liées à la gestion de la salubrité de l'eau. Une ÉQRM bien formulée et réfléchie peut offrir des renseignements importants sur l'établissement des priorités en matière de dangers, la détermination des autres priorités et options en matière de gestion du risque, la sélection des interventions appropriées, l'analyse coût/bénéfice des mesures de gestion du risque et l'établissement d'objectifs de rendement en matière de santé. Il est important de se rappeler que l'ÉQRM ne calcule pas les résultats réels de maladies, mais qu'elle fournit une mesure de probabilité d'une maladie liée au système d'eau (OMS, 2016). Dans l'ensemble, l'ÉQRM aide à connaître votre système d'eau et, par conséquent, peut fournir des renseignements précieux sur la gestion des risques.
Partie B. Renseignements à l'appui
B.1 Aperçu du modèle d'ÉQRM de SC
Le modèle d'ÉQRM de SC a été élaboré il y a plus de dix ans afin d'appuyer l'établissement de recommandations pour l'eau potable. Depuis son élaboration initiale, il a fait l'objet de plusieurs examens et mises à jour. Ces mises à jour visent notamment à fournir un outil qui peut aider les intervenants à évaluer, site par site, les répercussions potentielles de changements de qualité de l'eau à la source et de conditions de traitement, sur les risques à la santé estimés liés à la contamination microbiologique. Afin d'assurer l'accessibilité du modèle à un grand nombre d'utilisateurs, celui-ci a été élaboré au moyen d'une plateforme logicielle largement utilisée (Microsoft Excel).
Case B1 : Modèles mathématiques de l'ÉQRM
Des organisations internationales (U.S. EPA, 2005, 2006; Smeets et coll., 2008; Teunis et coll., 2009; Schijven et coll., 2011, 2014), ainsi que d'autres groupes au sein du Canada (Jaidi et coll., 2009), ont élaboré des modèles mathématiques afin d'évaluer, sur le plan quantitatif, les risques microbiologiques potentiels associés à un système d'eau potable. Ces modèles comprennent les risques potentiels associés aux agents pathogènes bactériologiques, protozoaires et viraux.
Tel qu'il a été mentionné à la partie A, la première étape d'une évaluation de risques consiste à définir sa portée en déterminant les questions auxquelles il faut répondre et, par conséquent, le type d'évaluation de risques requis. S'il est déterminé qu'une évaluation quantitative des risques est nécessaire, le modèle d'ÉQRM de SC peut être utilisé à titre d'évaluation préliminaire, ainsi que d'outil d'enquête afin d'estimer l'éventail de risques en fonction de nombreux scénarios ou de réaliser une analyse de sensibilité. Le modèle d'ÉQRM de SC ne fournit pas d'évaluation probabiliste approfondie. Un autre modèle devra être utilisé si ce niveau d'analyse est requis.
Le modèle utilise les renseignements sur les concentrations d'agents pathogènes dans une source d'eau et le système de traitement qui ont été saisis par l'utilisateur, ainsi que des renseignements tirés de publications sur l'ingestion et la dose-réponse des différents agents pathogènes microbiens. Ces renseignements servent à estimer le risque annuel d'infection, le risque annuel de maladie ainsi que les années de vie corrigées de l'incapacité (AVCI) par personne et par année qui sont associées aux paramètres d'entrée. Les trois indicateurs de résultats sont affichés afin de comparer non seulement la cible de 1 × 10-6 AVCI de Santé Canada par personne par année, mais également les niveaux acceptables de risque exprimés à l'aide d'autres paramètres comme le risque annuel d'infection.
Le modèle d'ÉQRM de SC vise à fournir de la souplesse aux utilisateurs afin de leur permettre d'utiliser plusieurs moyens d'analyser leur système d'eau potable. Les utilisateurs peuvent saisir des données qui reflètent leur système d'eau potable ou établir des scénarios afin d'examiner les incidences potentielles de modifications aux divers aspects de leur système d'eau potable, comme des modifications de la qualité de l'eau à la source ou du type de traitement utilisé. Les calculs du modèle sont effectués à l'aide de valeurs moyennes pour la plupart des paramètres au lieu d'une estimation plus prudente de la valeur, comme le 95e percentile. Cette approche a été adoptée afin de fournir aux utilisateurs l'occasion d'être transparents sur où et quand les facteurs de salubrité sont appliqués; ceux-ci peuvent s'appuyer sur les connaissances propres à un site lorsqu'elles sont disponibles. Afin de saisir l'éventail des estimations de risques qui sont possibles dans un système d'eau, les utilisateurs devraient établir plusieurs scénarios variant entre les conditions prévues et les situations qui représentent des estimés conservateurs. Il est important de noter que le modèle ne tient pas compte des risques associés au réseau de distribution.
Le modèle d'ÉQRM de SC peut être utilisé avec des données propres à un site, ou en fonction de plusieurs hypothèses et d'avis d'experts pour les paramètres inconnus. En raison de cette souplesse, il est important de bien documenter les renseignements qui sont saisis dans le système, y compris la mesure selon laquelle ces renseignements sont jugés représentatifs pour le système, afin d'interpréter de façon précise les estimations des risques qui sont obtenues. Les sections B.2 à B.5 donnent un aperçu des renseignements qui doivent être saisis dans le modèle d'ÉQRM de SC, des facteurs à considérer pour obtenir ces renseignements et des hypothèses sous-jacentes ainsi que des calculs réalisés pour produire des estimations du fardeau que représente une maladie. La section B.6 comporte des exemples de scénarios générés à l'aide de la version du modèle - V15_05 Final.
B.2 Concentrations d'agents pathogènes dans les sources d'eau
Les pathogènes bactériologiques et protozoaires utilisés dans ce modèle sont Cryptosporidium spp, Giardia lamblia, E. coli O157:H7 et Campylobacter spp. En ce qui concerne les virus, aucun virus n'a rempli les critères précédemment mentionnés. Par conséquent, les données sur le rotavirus, le virus de l'hépatite A et le poliovirus ont été utilisées. Elles ont été choisies à la suite d'un examen approfondi de microorganismes candidats.
Cryptosporidium spp. et Giardia lamblia ont été sélectionnés à titre de protozoaire de référence. Ils représentent le type de protozoaire entérique d'origine hydrique le plus préoccupant pour la santé humaine au Canada. Ils présentent des taux de prévalence élevés, peuvent causer des maladies et posent un défi sur le plan du traitement en raison de leur résistance au chlore. En outre, des modèles dose-réponse sont disponibles pour les deux organismes.
Case B2 : Agents pathogènes de référence
Même si tous les agents pathogènes entériques qui sont préoccupants pour la santé humaine devraient être identifiés lors d'une évaluation des dangers liés à une source d'eau potable, les modèles d'évaluation de risques ne peuvent prendre en considération chaque agent pathogène entérique. Les modèles comprennent plutôt seulement des agents pathogènes entériques spécifiques qui constituent, de par leurs caractéristiques, de bons représentants d'un groupe de microorganismes particulier ou d'un danger préoccupant. Ceux-ci sont désignés comme étant des agents pathogènes de référence. On considère que si le risque lié aux agents pathogènes de référence est réduit à un niveau acceptable, le risque lié à d'autres agents pathogènes similaires sera également réduit. Idéalement, un agent pathogène de référence fournit une estimation prudente d'un risque en représentant une combinaison du pire scénario : une grande fréquence, une concentration élevée et une longue période de survie dans l'eau à la source, ainsi qu'un faible enlèvement et (ou) inactivation au cours du traitement et un pouvoir pathogène élevé pour tous les groupes d'âge.
Comme aucun virus ne comporte toutes les caractéristiques d'un virus de référence idéal, l'évaluation de risques liés aux virus entériques s'appuie sur les caractéristiques de différents virus. Puisque le rotavirus constitue une cause courante d'infection, qu'il a été associé à des répercussions graves sur la santé et qu'il comporte un modèle dose-réponse, l'évaluation de risques associés aux virus utilise les renseignements sur les effets sur la santé du rotavirus, mais présuppose que tous les groupes d'âge sont vulnérables à une infection. En ce qui concerne le traitement de l'eau potable, les données sur l'inactivation par les rayons UV du rotavirus ont été utilisées, alors que les données sur le virus de l'hépatite A et le poliovirus ont été utilisées pour les désinfectants chimiques (U.S. EPA, 1999) afin de tenir compte des virus dont la concentration est plus difficile à réduire au cours d'un traitement d'eau potable. En raison des limites associées aux méthodes de surveillance disponibles des virus entériques, les estimations de concentration dans une source d'eau peuvent également reposer sur le nombre total de virus entériques culturables et non seulement sur le rotavirus. L'utilisation du norovirus comme virus de référence a également fait l'objet d'une évaluation, puisque celui-ci comporte plusieurs caractéristiques d'un virus de référence idéal, dont celle d'être une cause importance de gastroentérite virale dans tous les groupes d'âge et d'être associé à un modèle dose-réponse (Teunis et coll., 2008). Un grand débat subsiste toutefois au sujet du modèle, alors que certains suggèrent que celui-ci surestime l'infectiosité des norovirus (Schmidt, 2015). Ainsi, bien que le norovirus n'ait pas encore été intégré au modèle à l'heure actuelle, son ajout sera envisagé dans les futures mises à jour.
E. coli O157:H7 et Campylobacter spp. ont été choisis comme agents pathogènes bactériens de référence de ce modèle de risque pour plusieurs raisons. Ils sont la cause de maladie gastro-intestinale et de troubles beaucoup plus graves, ont des modèles dose-réponse bien établis, et leurs concentrations peuvent être réduites par l'application d'un traitement à un niveau similaire aux autres pathogènes bactériens. En outre, Campylobacter spp. présente des taux élevés de prévalence. Les deux agents pathogènes constituent également une grande source de préoccupation pour la santé humaine au Canada. La plupart des services publics de distribution d'eau potable disposent davantage de données sur la concentration totale d'E. coli qui peuvent servir à estimer la concentration d'E. coli O157:H7 dans une source d'eau, bien que cette valeur soit entachée par un niveau d'incertitude élevé.
B.2.1 Déterminer la qualité de l'eau à la source
Dans la mesure du possible, les fournisseurs d'eau sont priés de mettre en œuvre un programme de surveillance des sources d'eau qui comporte une surveillance des agents pathogènes de référence afin de fournir des renseignements propres à chaque site sur la qualité microbiologique de l'eau. D'autres renseignements sur les méthodes d'échantillonnage des agents pathogènes de référence sont fournis ailleurs (Santé Canada, 2011, 2012). Les renseignements sur la surveillance des agents pathogènes aideront les évaluateurs des risques à fournir des informations de la plus grande qualité aux gestionnaires des risques lorsqu'ils auront à prendre des décisions au sujet de l'eau potable.
Case B3 : Fréquences de surveillance des agents pathogènes
Aux Pays-Bas, où une ÉQRM doit être réalisée au moins tous les trois ans, les concentrations de quatre agents pathogènes de référence font l'objet d'une surveillance dans les eaux de surface : Cryptosporidium, Giardia, les entérovirus et Campylobacter. La fréquence de surveillance dépend du volume de production de l'usine et varie entre neuf et 35 échantillons sur trois ans, ce qui comprend des échantillons de routine ainsi que des échantillons liés à un incident. Tous les échantillons peuvent être prélevés sur un an afin de mieux saisir la variabilité (Schijven et coll., 2011). Aux États-Unis, la Long-Term 2 Surface Water Treatment Rule exige que les services publics analysent leurs sources d'eau de surface afin de détecter la présence de Cryptosporidium et de Giardia, et de déterminer le niveau de traitement requis. Les échantillons ont été prélevés le plus près possible des prises d'eau, avant un traitement, et sur une base mensuelle pendant deux ans ou toutes les deux semaines pendant un an selon la population desservie et le calendrier d'échantillonnage qui a été approuvé au préalable.
L'objectif d'un programme de surveillance pour des organismes d'intérêt est de prélever des échantillons à une mesure et une fréquence qui saisissent les sources les plus importantes de variation dans la qualité microbiologique de l'eau à la source. Tel que mentionné précédemment, la faible densité des agents pathogènes dans les sources d'eau et leur nature épisodique complexifient cette tâche. Les échantillons prélevés devraient être identifiés comme étant des échantillons de référence (de routine) ou des échantillons d'événement (incident). Les échantillons d'événement sont des échantillons qui sont prélevés lors de périodes qui sont susceptibles d'avoir une mauvaise incidence sur la qualité de l'eau, comme lors d'inondations ou d'orages. Les renseignements qui définissent l'échantillon d'événement devraient être compris de manière à ce que les conditions qui ont constitué l'événement soient claires. Les évaluateurs des risques peuvent se servir de ces renseignements pour les aider à faire la distinction entre des conditions de référence et des événements de pointe et à mener une enquête sur l'incidence que ces changements de la qualité de l'eau ont sur les estimations des risques.
Il pourrait ne pas être possible pour beaucoup des systèmes d'eau potable d'obtenir des données sur certains ou l'ensemble des agents pathogènes de référence du modèle. L'avis d'experts peut donc être utilisé afin de compenser les données manquantes sur des agents pathogènes. Les avis d'experts devraient s'appuyer sur des valeurs tirées de publications qui portent sur des types similaires de sources d'eau, le cas échéant, et tenir compte d'autres renseignements propres à chaque site comme des données sur les indicateurs fécaux. Bien que les données sur les indicateurs fécaux ne soient pas directement liées aux concentrations d'agents pathogènes, la taille habituellement accrue des ensembles de données sur les indicateurs fécaux peuvent fournir un cadre inestimable pour l'évaluation de risques en ce qui a trait à l'ampleur et aux fluctuations de la contamination fécale (OMS, 2016). En combinant les renseignements sur la contamination fécale avec les connaissances liées aux sources, au devenir et aux mécanismes de transport du bassin hydrographique, il est possible de formuler des estimations éclairées pour les données manquantes sur les agents pathogènes (Medema et coll., 2009). Comme ces estimations comprennent un haut degré d'incertitude, la portée et la complexité de l'évaluation de risques qui est menée doivent pouvoir utiliser ce type d'approche.
L'une des contraintes associées au manque de renseignements sur des agents pathogènes est la tendance à utiliser des hypothèses de pires scénarios et, par conséquent, les estimations des concentrations sont plus susceptibles de surestimer les risques. Une surestimation des risques pourrait donner lieu à des décisions très onéreuses ou à la diversion des ressources qui pourraient mieux être utilisées ailleurs afin de protéger la santé publique. Il est donc important d'inclure des scénarios qui représentent l'éventail de conditions qui pourraient se présenter outre les hypothèses de pires scénarios, ce qui devrait fournir des réponses plus éclairées aux questions posées au début du processus d'évaluation de risques. En ayant recours à divers scénarios, les évaluateurs de risques peuvent également déterminer les paramètres qui ont la plus grande incidence sur le risque global, et par conséquent, fournir une certaine orientation sur le plus grand avantage qu'il y aurait en diminuant le degré d'incertitude d'un paramètre.
B.2.2 Estimer les concentrations d'agents pathogènes de référence
Les concentrations moyennes des agents pathogènes (par 100 L d'eau) et les écarts-types sont saisis dans le modèle et utilisés pour s'intégrer dans une distribution log-normale (voir la section B.2.3). On a choisi de saisir les concentrations des agents pathogènes comme des moyennes arithmétiques et des écarts-types afin de rendre le modèle accessible à divers utilisateurs. Lorsqu'ils déterminent des moyennes et des écarts-types, les évaluateurs de risques devraient tenir compte de la manière d'intégrer la récupération de la méthode et de déterminer la façon d'inclure les données qui sont inférieures à la limite de détection (LD) dans le calcul. Le modèle suppose que les agents pathogènes sont répartis au hasard dans l'eau et ne tient donc pas compte des agglutinations d'organismes qu'il pourrait y avoir dans l'eau.
Il existe plusieurs manières d'analyser les mêmes données afin d'estimer les paramètres de concentration moyenne et d'écart-type liés à des agents pathogènes. Ces valeurs pourraient représenter les concentrations moyennes de chaque agent pathogène d'une année donnée afin de démontrer une évaluation à l'état d'équilibre, ou bien les concentrations moyennes pour chaque mois afin d'évaluer les effets saisonniers. Les utilisateurs pourraient aussi saisir des concentrations provenant de la plage de valeurs qui peut être associée à un scénario donné, ce qui pourrait comprendre des valeurs de pires scénarios ou des valeurs définies de la distribution des valeurs comme les 75e ou 90e centiles. Une estimation ponctuelle d'une concentration d'agents pathogènes peut également servir en saisissant un écart-type très faible relatif à la concentration moyenne d'agents pathogènes (p. ex., si la moyenne = 1,0 organisme /100 L, établir un écart-type = 0,001 organisme/100 L).
Le facteur de récupération d'une méthode est important, car les méthodes ne sont jamais entièrement efficaces. Prélever et analyser les grands volumes d'échantillon d'eau nécessaires pour détecter des microorganismes pathogéniques nécessitent de nombreuses étapes. Chaque étape dans la méthode peut provoquer une perte de certains organismes cibles. L'efficacité de la récupération peut varier de façon considérable entre les matrices d'eau, et ce, même si une méthode normalisée est employée. En ce qui concerne les ensembles de données sur Cryptosporidium et Giardia, la plupart des échantillons sont analysés à l'aide de la méthode 1622/23/23.1 de la U.S. EPA. Cette méthode comprend des exigences nécessaires pour déterminer la récupération dans la matrice d'eau analysée. Bien que les méthodes normales utilisées pour détecter les agents pathogènes d'origine hydrique dans le modèle ne comportent pas les mêmes exigences, il est toutefois recommandé, dans la mesure du possible, d'évaluer la récupération de ces méthodes. En l'absence de renseignements efficaces sur la récupération, les récupérations devront reposer sur d'autres publications ou seront considérées comme étant entièrement efficaces (Schijven, 2011). En ce qui concerne les modèles déterministes, la récupération est intégrée dans les modèles de risque à l'aide d'une estimation ponctuelle. Dans le cadre d'un modèle stochastique, on suppose habituellement que la variabilité de récupération d'une méthode donnée suit une distribution bêta (Teunis et coll., 1997; Makri et coll., 2004; Pouillot et coll., 2004; Signor et coll., 2006; U.S. EPA, 2014). À l'heure actuelle, le modèle de SC ne comprend pas de récupération. Il suppose que l'évaluateur des risques a tenu compte de la récupération (soit à l'aide d'une estimation ponctuelle ou d'une approche stochastique) avant de saisir les valeurs de moyenne et d'écart-type.
Les méthodes de détection ne peuvent pas nécessairement faire la distinction entre des organismes infectieux viables chez l'humain et ceux qui ne présentent pas de risque pour la santé humaine, comme des organismes non viables ou des espèces qui n'ont jamais été associés à des infections humaines, ce qui pourrait surestimer l'incidence potentielle sur la santé. Par exemple, en ce qui concerne la détection de Giardia et de Cryptosporidium, la méthode de routine détecte tous les kystes ou les oocystes qui sont récupérés, et on suppose que tous ceux détectés dans les sources d'eau sont viables et sont également infectieux pour l'homme, jusqu'à preuve du contraire (p.ex., des résultats de génotypage). En ce qui concerne les autres agents pathogènes de référence, comme les virus entériques, bien que des méthodes normales fondées sur la culture de cellules détectent des organismes infectieux, il est difficile de les mettre en œuvre. Les méthodes moléculaires qui ne font pas la distinction entre des organismes viables et non viables sont souvent employées à la place. Dans la mesure du possible, on recommande d'évaluer la viabilité et l'infectiosité des agents pathogènes de référence. Bien que le modèle d'ÉQRM de SC permet à l'utilisateur de modifier la fraction des organismes infectieux lorsqu'il saisit des données sur les concentrations des agents pathogènes dans sa source d'eau, la valeur par défaut est 1,0 (c.-à-d. tous les organismes peuvent causer une infection) afin de fournir une estimation prudente en l'absence d'autres données.
Case B4 : Transformer les valeurs inférieures à la limite de détection
De nombreuses méthodes ont été utilisées dans les publications afin de transformer des valeurs inférieures à la limite de détection en des valeurs numériques. L'approche la plus couramment utilisée pour mener des évaluations de risques préliminaires est de transformer les valeurs inférieures à la limite de détection en des valeurs numériques en présupposant qu'elles soient toutes à une concentration fixe comme à la LD ou à la moitié de la LD. La méthode choisie aura une incidence sur l'estimation des concentrations. Par exemple, une étude ayant utilisé des données de surveillance du Royaume-Uni sur l'eau traitée a transformé les résultats inférieurs à la limite de détection à l'aide de trois méthodes différentes : on a présupposé que toutes les valeurs de LD étaient à zéro (valeurs minimales), à la LD (valeurs maximales) ou extrapolées de façon linéaire sur les détections positives (meilleure estimation). On a démontré que le risque variait dans un rapport de 4 (0,6 log), des hypothèses de valeurs minimales à maximales (Smeets et coll., 2007). On a relevé que l'incidence sur les estimations des risques était plus importante lorsque les concentrations globales des agents pathogènes étaient faibles (Smeets et coll., 2007; Jaidi et coll., 2009) et lorsque les ensembles de données étaient petits (Jaidi et coll., 2009).
Théoriquement, pour obtenir les meilleures estimations des concentrations d'agents pathogènes dans des sources d'eau, il faudrait que le volume de l'échantillon analysé contienne une moyenne d'au moins 10 organismes (Emelko et coll., 2008). Cependant, dans la plupart des sources d'eau et pour la majeure partie des agents pathogènes, prélever et analyser le très grand volume d'eau requis pour récupérer une moyenne de 10 organismes par échantillon est tout simplement impossible. Les ensembles de données sur les agents pathogènes peuvent donc contenir un nombre important de résultats qui se trouvent près ou en dessous de la LD. Les échantillons inférieurs à la LD ne devraient pas être inclus comme des zéros dans le calcul de la moyenne et de l'écart-type; même si aucun organisme n'a été récupéré, cela ne signifie pas que la concentration d'agents pathogènes dans la source d'eau est nulle. Si un plus gros volume d'eau était analysé afin de baisser la LD, ou si l'efficacité de récupération de la méthode était meilleure, il se pourrait que la présence d'un agent pathogène soit détectée. Le modèle d'ÉQRM de SC suppose que la concentration de microorganismes dans la source d'eau soit distribuée de façon log-normale. La distribution log-normale utilise un logarithme naturel et, comme il est impossible de tirer un logarithme naturel d'une valeur nulle, une distribution log-normale ne peut contenir des valeurs nulles. D'autres renseignements sur la distribution log-normale sont fournis à la section B.2.4.
La LD des méthodes microbiologiques est déterminée par le volume d'eau qui est analysé et l'efficacité de la méthode de récupération. Comme les microorganismes sont des particules discrètes, la limite théorique de détection représente toujours un organisme dans un volume d'eau analysé. Intégrer l'efficacité de récupération dans la LD augmentera légèrement la LD par rapport à la limite théorique.

Équation 1 - Équivalent textuel
La limite de détection par volume de l'échantillon est égale à 1 organisme divisé par l'efficacité de récupération.
Par exemple, si le volume d'échantillon est de 100 L et que l'on suppose que l'efficacité de récupération de la méthode utilisée pour l'analyse est de 60 % (exprimée en fraction décimale, c.-à-d. 0,6), alors la LD de cet échantillon serait calculée comme 1,7 organisme par 100 L.
Les moyennes et les écarts-types peuvent être calculés après avoir décidé et documenté la façon dont les données sur la LD et l'efficacité de récupération de la méthode seront traitées. Les moyennes et les écarts-types sont saisis dans la feuille de calcul « Input_output » du modèle (voir la Figure B1). Toutes les concentrations des agents pathogènes, y compris E. coli, sont saisies en nombre d'organismes par 100 L d'eau. Le modèle de Santé Canada estime la concentration de l'E. coli pathogène à l'aide des données sur la concentration totale d'E. coli de source(s) d'eau en présupposant qu'une valeur par défaut de 3,4 % de la concentration totale d'E. coli détectée est une souche pathogène (Martins et coll., 1992). Cette estimation repose sur des échantillons d'eau brute prélevés à partir d'un mélange de sources d'eau du projet impliquant le fleuve du Colorado et des sources du projet de plans d'eau du nord de la Californie. Cette estimation ne représentera pas toutes les sources d'eau et comporte un degré élevé d'incertitude. Par conséquent, il ne s'agit pas d'une valeur fixe. Elle peut être modifiée dans la feuille de calcul de référence du modèle afin de mieux refléter la qualité de la source d'eau qui fait l'objet d'une enquête. Si un système d'eau potable a à sa disposition des données sur E. coli O157:H7 et qu'il les saisit directement, le pourcentage de 3,4 % devra être modifié à 100 %. Les paramètres d'entrée et les résultats correspondants calculés par le modèle devront être consignés ailleurs, puisque le modèle n'entrepose pas les données pour l'utilisateur.
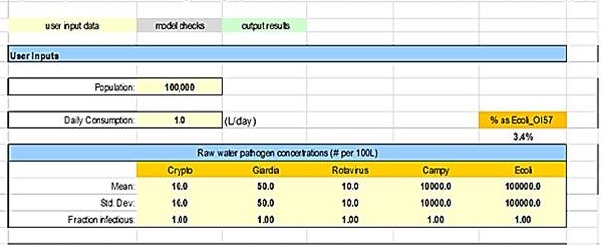
Figure 1 - Équivalent textuel
Une section du modèle AQRM pour la saisie des données de l'utilisateur est affichée. L'utilisateur peux ajouter des données dans les zones de saisie suivantes: population; consommation journalière (litres par jour); et la moyenne, l'écart-type et la fraction infectieuse pour Cryptosporium, Giardia, rotavirus, Campylobacter et E. coli. L'utilisateur peut également entrer la valeur du pourcentage de E. coli qui est E.coli O157.
Figure B1 : Exemple de cellules d'entrée de concentration et d'écart-type pour tous les agents pathogènes de référence dans le modèle d'ÉQRM (feuille de calcul « Input_Output »).
B.2.3 Calculs du modèle
À l'aide de la moyenne et de l'écart-type des concentrations des agents pathogènes dans l'eau brute qui ont été saisis dans la feuille de calcul « Input_output », le modèle intègre une distribution log-normale. Une distribution log-normale prend la forme d'une distribution normale (c.-à-d. une forme en cloche) lorsque vous prenez le logarithme naturel de la variable (x); dans ce cas-ci, il s'agit de la concentration d'agents pathogènes dans l'eau brute. Le modèle utilise les valeurs de moyenne arithmétique (μ) et d'écart-type (σ) qui ont été saisies dans la feuille de calcul « Input_output », puis estime la moyenne et l'écart-type de ln(x) à l'aide des équations suivantes :
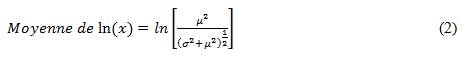
Équation 2 - Équivalent textuel
La moyenne du logarithme naturel de x (lan x) est égal à lan (crochet ouvert) le numérateur est mu au carré divisé par le dénominateur de (parenthèse ouverte) sigma au carré plus mu au carré (parenthèse fermante) à l'exposant de moitié (crochet fermant).

Équation 3 - Équivalent textuel
L'écart-type de lan x est égal à (crochet ouvert) lan (parenthèse ouverte) sigma divisé par mu (parenthèse fermante) au carré plus 1 (parenthèse fermante) (crochet fermante) à l'exposant d'une moitié
où,
- x = concentration des agents pathogènes dans l'eau brute
- μ = concentration moyenne des agents pathogènes qui a été saisie dans la feuille de calcul « Input_output »
- σ = écart-type saisi dans la feuille de calcul « Input_output »
La moyenne et l'écart-type de ln(x) décrivent la forme de la distribution log-normale. Le modèle divise la courbe de distribution log-normale en environ 500 tranches d'intégration, dont chacune est associée à une probabilité et à une concentration moyenne, ce qui donne une estimation moyenne pondérée des risques. Les probabilités ont été sélectionnées afin de diviser la fonction de distribution cumulative en des segments égaux (des tranches), totalisant l'ensemble de la zone comprise sous la courbe de distribution. La seule exception concerne la partie initiale de la courbe, qui est divisée en des sections plus petites afin de fournir une meilleure résolution à l'extrémité inférieure de la distribution. Pour chaque tranche d'intégration, le modèle utilise la probabilité de cette tranche et la fonction log-normale inverse afin de calculer la concentration moyenne associée d'eau brute. La concentration d'eau traitée est alors déterminée pour chacune des 500 tranches en fonction de l'enlèvement logarithmique et de l'inactivation logarithmique globales qui sont réalisées au cours d'un traitement (voir la section B.3). Le risque subséquent d'infection est calculé pour chaque tranche en fonction de la bonne équation de dose-réponse, puis est multiplié par la probabilité associée à cette tranche de distribution. Les estimations des risques sont alors résumées afin de donner le risque moyen pondéré d'infection (voir la section B.4).
Case B5 : Distributions servant à décrire les concentrations des agents pathogènes
Les distributions log-normales servent couramment à décrire la distribution des microorganismes dans des échantillons environnementaux et ce, pour plusieurs raisons. Tout d'abord, la distribution log-normale est l'approche utilisée dans le cas de données biaisées. C'est souvent le cas avec les données sur les concentrations des agents pathogènes dans l'eau brute lorsqu'un grand nombre d'échantillons ont atteint la LD ou s'y approchent, et que le nombre de concentrations élevées est plus faible. Ensuite, il a été démontré qu'elles s'agencent bien aux données sur les concentrations dans des sources d'eau (Smeets et coll., 2008; Ongerth, 2013). D'autres distributions ont été utilisées dans différentes publications, comme la distribution gamma, afin de décrire les données sur les agents pathogènes environnementaux (Schijven et coll., 2011, 2015). À l'instar de la distribution log-normale, la distribution gamma est également utilisée lorsque des données sont biaisées et peut également bien s'agencer avec les données sur les concentrations d'agents pathogènes dans des sources d'eau. En fait, aucune distribution ne correspondra parfaitement aux données observées, puisque les distributions constituent de simples approximations d'une relation plus complexe, ce qui signifie que plusieurs distributions différentes peuvent tout aussi bien s'agencer avec des données observées et que le choix de distribution est déterminé par les chercheurs concernés.
B.3 Détermination des effets du traitement
Les procédés de traitement dans le modèle d'ÉQRM sont séparés en deux types : 1) des méthodes d'enlèvement physique et 2) des méthodes de désinfection. Un exemple de cellules d'entrée de renseignements sur les procédés de traitement est fourni à la Figure B2. Les enlèvements physiques de chaque agent pathogène sont exprimés en enlèvement de log10, alors que la désinfection est exprimée en inactivation de log10. La détermination des valeurs de réduction logarithmique repose généralement sur des données tirées de paramètres de substitution à un traitement à échelle réelle, ou en utilisant des études au banc d'essai ou des études pilotes utilisant des souches d'agents pathogènes d'intérêt adaptées en laboratoire. On suppose que ces réductions sont comparables à celles que l'on réalise à l'usine de traitement. Les données sur l'enlèvement des agents pathogènes à partir d'un traitement à échelle réelle ne sont habituellement pas disponibles pour les calculs de réduction logarithmique, puisque les concentrations d'agents pathogènes qui sont présents naturellement dans une source d'eau sont habituellement faibles et variables.
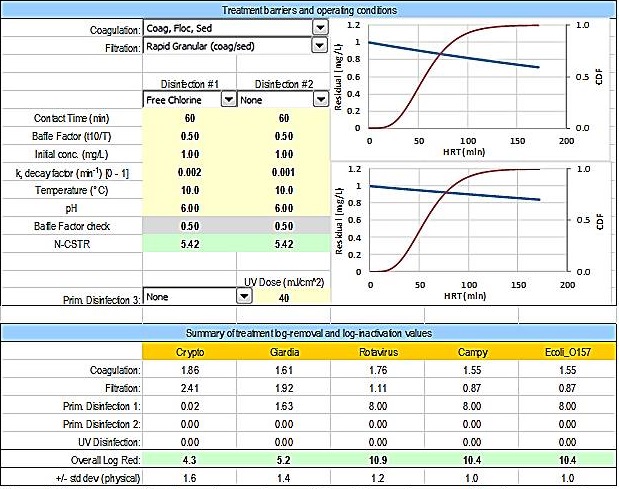
Figure 2 - Équivalent textuel
Cette figure affiche à la fois la section d'entrée de l'utilisateur pour les barrières de traitement et les conditions d'exploitation, et le résumé des valeurs logarithmiques de traitement et d'inactivation, à partir du modèle AQRM de SC. La section de saisie des données sur les barrières de traitement et des conditions de fonctionnement propose les options suivantes: un menu déroulant des options de coagulation; un menu déroulant des options pour la filtration; un menu déroulant des options pour la désinfection n ° 1; un menu déroulant d'options pour la désinfection n ° 2; boîtes de saisie pour le temps de contact en minutes, facteur de déflection en t10 sur T, concentration initiale en mg / L, facteur de décroissance k (par minute), température en degrés Celsius et pH pour chacune de désinfection n ° 1 et n ° 2; un menu déroulant des options pour la désinfection n ° 3, avec une boîte de saisie pour la dose UV en mJ par cm2. Deux graphiques sont également affichés dans cette section, représentant les informations de désinfection entrées par l'utilisateur pour la désinfection n ° 1 et n ° 2. Chaque graphique affiche le temps de séjour hydraulique en minutes sur l'axe des x et il y a deux axes y, résiduels de désinfection en mg / L et FDC (de 0 à 1). Cette section comprend également 2 boîtes de sortie qui affichent un contrôle du facteur de déflection et le N-RCAC calculé. La deuxième section de cette figure présente le résumé en log de l'élimination et l'inactivation par traitement pour Cryptosporidium, Giardia, rotavirus, Campylobacter et E. coli O157. Les valeurs affichées reflètent les barrières de traitement et les conditions de fonctionnement sélectionnées par l'utilisateur. La réduction log globale et l'écart type (basé sur les informations de suppression physique) sont également affichés.
Figure B2 : Les renseignements sur le procédé de traitement et le mode de fonctionnement sont saisis par l'utilisateur dans la feuille de calcul « Input_Output ».
B.3.1 Méthodes d'enlèvement physique
Les options d'enlèvement physique sont séparées en une étape de coagulation (Log RemC&S) et une étape de filtration (Log RemFiltr.) afin d'offrir une plus grande souplesse dans le cadre de la représentation d'un système de traitement. Les étapes de coagulation se résument comme suit :
- coagulation seulement
- coagulation et floculation
- coagulation, floculation et sédimentation
- aucun, ou
- prescrit par l'utilisateur
Les méthodes de filtration consistent en une filtration :
- rapide granulaire (aucune coagulation)
- rapide granulaire (coagulation en ligne / filtration directe)
- rapide granulaire (avec coagulation/sédimentation)
- à sable lent
- sur membrane (micro)
- sur membrane (ultra)
- aucune, ou
- identifiée par l'utilisateur
En ce qui concerne les étapes de coagulation, la seule sélection qui fournit des enlèvements logarithmiques est l'option de coagulation/floculation/sédimentation. Comme les processus restants de coagulation ne comportent pas d'étape d'enlèvement de particules, leurs contributions à l'enlèvement sont donc considérées comme faisant partie de l'étape de filtration. En ce qui concerne un traitement conventionnel, les options de coagulation/floculation/ sédimentation et de filtration granulaire (avec coagulation/sédimentation) doivent donc être sélectionnées afin de représenter un traitement conventionnel complet. En outre, pour ce qui est des systèmes de traitement d'eau potable qui utilisent la flottation à l'air dissous, les enlèvements fournis pour la coagulation/floculation/sédimentation sont considérés comme étant une estimation raisonnable de ce processus.
Les données sur l'enlèvement logarithmique intégrées dans le modèle de ces processus de traitement reposent sur la documentation disponible. Sauf en ce qui concerne l'enlèvement par filtration sur membrane, les données incluses pour chaque étape de traitement correspondent aux valeurs moyennes pondérées tirées d'un vaste examen sur la documentation existante (Hijnen et Medema, 2007). Afin de déterminer les valeurs moyennes pondérées de chaque processus de traitement, les auteurs ont utilisé un facteur de pondération sur une échelle de 1 à 5 en fonction de la qualité de l'étude afin de calculer les enlèvements logarithmiques moyens pondérés. À titre d'exemple, les études qui étaient réalisées à pleine échelle ont reçu une plus grande pondération que les études pilotes. Une pondération plus élevée a également été attribuée aux études dans lesquelles on a utilisé des agents pathogènes au lieu de substituts. En ce qui concerne la filtration sur membrane, la moyenne arithmétique et l'écart-type ont été calculés en fonction des études disponibles; aucun facteur de pondération n'a été appliqué. Le tableau des valeurs tirées de publications figure dans la feuille de calcul « Treatment » du modèle. Ces données peuvent être modifiées afin de mettre à jour les nouveaux résultats de recherche sur les études pilotes ainsi que les études à échelle réelle au fur et à mesure qu'ils deviendront disponibles. S'appuyer sur les valeurs tirées de publications peut sous-estimer ou surestimer le rendement d'un site en particulier. Les évaluateurs et les gestionnaires de risques doivent tenir compte de ce facteur dans le cadre de leurs processus décisionnels liés à la gestion de l'eau potable.
L'option de préciser des valeurs d'enlèvement /d'inactivation logarithmique au lieu d'utiliser les valeurs tirées de publications est disponible en sélectionnant « user specified » et en définissant les enlèvements logarithmiques moyens et l'écart-type de chaque agent pathogène de référence (Cryptosporidium, Giardia, rotavirus, E. coli et Campylobacter), ce qui doit être fait dans la feuille de calcul « Treatment » du modèle. Comme les enlèvements logarithmiques peuvent varier, même dans les usines de traitement bien exploitées, il est préférable d'avoir accès, dans la mesure du possible, à des renseignements propres à chaque site (Smeets et coll., 2007) au lieu de valeurs tirées de publications. Cette option s'avère très utile pour les usines de traitement qui ont mené une surveillance interne minutieuse et qui ont donc à leur disposition des données sur l'enlèvement de pathogènes qui démontrent que le rendement de leur système diffère de celui qui est décrit dans la documentation existante. Cette option fournit également l'occasion d'étudier les améliorations possibles par l'optimisation des processus ou, inversement, l'incidence des conditions comme la coagulation sous-optimale ou la fin des conditions du cycle de filtration. Toutefois, comme plusieurs usines de traitement ne disposeront pas de renseignements propres à un site, le système d'eau potable devra s'appuyer sur les valeurs prédéterminées d'enlèvement logarithmique dans le modèle.
B.3.2 Méthodes de désinfection
Le modèle comprend sept options :
- le chlore libre
- les chloramines
- l'ozonation
- le dioxyde de chlore
- la désinfection par rayonnement ultraviolet (UV)
- aucune, et
- identifiée par l'utilisateur
Le modèle permet deux étapes de désinfection chimique (Log InactDésinf1 et Log InactDésinf2). Pour calculer l'inactivation logarithmique des désinfectants chimiques (le chlore libre, les chloramines, l'ozone et le dioxyde de chlore), six paramètres doivent être saisis afin de décrire le processus de désinfection (voir la Figure B3) :
- le temps de contact (min)
- le facteur de déflexion (T10/T)
- la concentration initiale de désinfectant (mg/L)
- le facteur de dégradation du désinfectant (min-1)
- le pH, et
- la température (°C)
En ce qui concerne la désinfection par rayonnement UV, seule la dose efficace de rayons UV ou la fluence (mJ/cm2) doit être saisie pour l'usine de traitement. Comme il a été mentionné précédemment, les équations d'inactivation logarithmique ont généralement été élaborées à l'aide de souches d'agents pathogènes adaptées en laboratoire, ce qui ajoute un certain degré d'incertitude aux calculs, puisque les souches environnementales pourraient ne pas réagir de la même manière que les souches de laboratoire.
Il est important de saisir les données de chaque paramètre qui décrit le processus de désinfection. Si ces renseignements ne sont pas disponibles pour un système de traitement spécifique, il faut examiner avec soin le fonctionnement afin d'acquérir ces données. On prévoit que certains systèmes pourraient ne pas connaître leur facteur de déflexion ou leur facteur de dégradation du désinfectant. Le facteur de déflexion peut être déterminé de façon précise par l'entremise d'études par traceurs ou estimé selon la géométrie de la chambre de contact (c.-à-d. arrivée d'eau, déflecté ou non). Le facteur de dégradation du désinfectant peut être évalué à l'aide d'études dans un bocal ou de mesures de l'usine, ou être déterminé par essai et erreur en sachant le profil de concentration résiduelle dans le bassin. D'autres renseignements sont fournis à ce sujet à la section B.3.2.1.
Le modèle utilise six paramètres (lesquels sont énumérés ci-dessus) ainsi qu'une approche de réacteurs à fonctionnement continu reliés en série (N-CSTR, N étant le nombre de réacteurs à fonctionnement continu [continuous stirred tank reactors] en série) pour réaliser les calculs d'inactivation de CT de tous les désinfectants chimiques (voir les détails ci-dessous). Cette approche a été choisie afin de fournir une estimation précise de l'inactivation logarithmique réalisée dans un bassin de contact du désinfectant à échelle réelle. Il s'agissait d'un facteur particulièrement important dans le cas de l'inactivation à l'ozone en raison des taux de dégradation rapides associés à ce désinfectant.
B.3.2.1 Approche de réacteurs à fonctionnement continu reliés en série
Cas B6 : L'approche N-CSTR
L'approche N-CSTR utilisée dans le modèle d'ÉQRM de SC repose sur les travaux qui ont été publiés par Smeets et coll. (2006). En résumé, l'approche N-CSTR représente la répartition du temps de rétention hydraulique à l'aide de (N) réacteurs à fonctionnement continu reliés en série (CSTR), en fonction du rapport de T10/T (c.-à-d. le facteur de déflexion). Les facteurs de déflexion sont utilisés afin de tenir compte des courts-circuits dans les bassins de contact. Ils représentent le rapport de T10 et de T. Dans un système qui comporte un facteur de déflexion parfait, il n'y a aucun court-circuit et les valeurs de T10 et de T sont presque identiques. Dans ce cas, le facteur de déflexion est équivalent à 1,0, et est aussi appelé des conditions à « courant continu ». En fait, les bassins de contact du désinfectant ne comportent jamais un facteur de déflexion parfait. Comme il a été mentionné précédemment, les facteurs de déflexion peuvent être déterminés de façon précise grâce à des études par traceurs ou estimés en fonction de la géométrie de la chambre de contact. Puisque de nombreux systèmes n'auront pas été soumis à des études par traceurs, ils devront s'appuyer sur des estimations. Les études qui examinent les nombreuses tailles et configurations des chambres de contact ont révélé des rapports T10/T entre 0,3 et 0,7. Ces études ont été utilisées pour élaborer des descriptions visant à aider les exploitants de système d'eau à estimer un facteur de déflexion selon les caractéristiques de leur réseau. Ces descriptions et ces renseignements supplémentaires sont fournis dans l'U.S. EPA (2003) et le MOE (2006).
Le nombre de N-CSTR et le profil de temps de rétention hydraulique sont d'abord caractérisés, puis la répartition est divisée en 1 000 tranches d'intégration. L'inactivation chimique est calculée pour chaque tranche à l'aide des équations de désinfection de CT, qui tiennent habituellement compte des conditions de pH, de la température et de la concentration de désinfectant. La concentration de désinfectant de chaque tranche d'intégration est calculée à l'aide du facteur de dégradation du désinfectant. La fraction restante des organismes est calculée pour chaque tranche et est totalisée avec tout le bassin afin de calculer la fraction globale des organismes restants à la suite du processus de désinfection.
Pour les utilisateurs qui ne connaissent pas leur facteur de dégradation, celui-ci peut être estimé à l'aide de l'équation suivante :
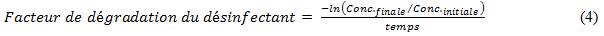
Équation 4 - Équivalent textuel
Le facteur de désintégration du désinfectant est égal à la concentration finale de lan (parenthèse ouverte) négative divisée par la concentration initiale (parenthèse fermante) divisée par le temps.
La concentration initiale de désinfectant (Conc.initiale) est la concentration (mg/L) restante à la suite de la demande immédiate en oxydant. La concentration finale du désinfectant (Conc.finale) représente la concentration (mg/L) après que le temps de contact soit écoulé, alors que le temps représente la durée de contact (min). De façon générale, les facteurs de dégradation ont tendance à se situer dans la plage de 0,001 à 0,2 min-1, selon le désinfectant appliqué. Par ailleurs, pour une estimation plus prudente de l'inactivation logarithmique, l'utilisateur peut saisir sa concentration finale de désinfectants comme concentration initiale de désinfectants et fixer le facteur de dégradation à 0 afin de conserver la concentration finale de désinfectants tout au long des calculs de l'approche N-CSTR. L'utilisateur peut également utiliser la stratégie d'essai et erreur pour estimer le facteur de dégradation du désinfectant en saisissant une valeur et en examinant le profil résiduel correspondant affiché à la droite (voir la Figure B2). Lorsque la concentration résiduelle du désinfectant à la sortie correspond aux conditions d'exploitation observées, le facteur estimé de dégradation du désinfectant est raisonnable.
B.3.2.2 Temps de contact
La valeur du temps de contact avec un désinfectant que l'on utilise dépendra du scénario qui sera modélisé. Le temps T10 serait utilisé pour obtenir une estimation prudente de l'inactivation. La valeur T10 reflète le temps de contact dépassé par 90 % de l'eau dans le bassin. On l'utilise couramment pour déterminer la valeur CT de l'inactivation dans les tableaux de valeurs CT publiés. Par ailleurs, le temps de séjour moyen (Tmoyen) dans un système peut être saisi. La valeur Tmoyen fournit une meilleure réflexion des niveaux d'inactivation atteints à échelle réelle. L'utilisateur peut également utiliser les deux scénarios (Tmoyen et T10) afin d'étudier la différence entre les réductions prévues résultant du traitement.
B.3.3 Réduction globale résultant d'un traitement
Lorsque les taux d'enlèvement et d'inactivation logarithmiques sont déterminés pour les processus de traitement, la réduction logarithmique globale de chaque agent pathogène spécifique est calculée en ajoutant les taux d'enlèvement et d'inactivation logarithmiques issus des différentes étapes de traitement.

Équation 5 - Équivalent textuel
La réduction logarithmique globale de chaque agent pathogène spécifique est calculée en ajoutant les taux d'enlèvement et d'inactivation logarithmiques issus par coagulation et sédimentation, filtration, désinfection étape 1 et désinfection étape 2.
Un sommaire des valeurs d'enlèvement et d'inactivation logarithmiques figure dans la feuille de calcul « Input_output » du modèle (voir la figure B2). On utilise ensuite la réduction logarithmique globale pour déterminer la concentration de chaque agent pathogène de référence dans l'eau potable traitée.
B.4 Calculs de dose-réponse
Le calcul de dose-réponse vise à estimer la probabilité d'infection associée à une source d'approvisionnement en eau potable. Pour ce faire, le modèle détermine les doses moyennes des cinq agents pathogènes de référence, calcule la probabilité d'ingestion de ces doses et estime enfin la probabilité d'infection. Le processus est décrit en détail ci-après.
B.4.1 Déterminer une dose d'agents pathogènes
Comme il a été mentionné à la section B.2, le modèle suppose que les données sur les concentrations d'agents pathogènes dans l'eau brute suivent une distribution log-normale. Le modèle divise cette distribution en plus de 500 tranches d'intégration afin de représenter la plage totale de la courbe de distribution. Pour chacune des tranches, le modèle estime la concentration d'agents pathogènes dans la source d'eau et utilise la réduction globale du traitement pour déterminer la concentration dans l'eau potable traitée pour chaque tranche d'intégration comme suit :
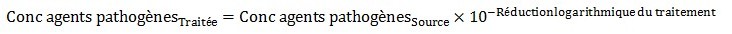
Équation 6 - Équivalent textuel
La concentration d'agents pathogènes dans l'eau potable traitée est calculée en multipliant la concentration d'agents pathogènes dans la source par 10 à l'exposant négatif (la réduction logarithmique globale de l'équation 5).
La dose moyenne d'agents pathogènes qui peut être consommée par une personne est alors calculée pour chaque concentration potentielle d'eau traitée décrite par la distribution log-normale comme suit :
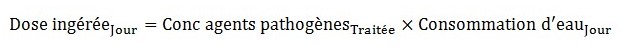
Équation 7 - Équivalent textuel
La dose moyenne d'agents pathogènes qui peut être consommée en un jour est calculée en multipliant la concentration d'agents pathogènes dans l'eau potable traitée par le volume d'eau consommé par jour.
La valeur par défaut de la consommation moyenne d'eau par jour (Consommation d'eauJour) du modèle est de 1,0 L d'eau du robinet non bouillie. Au sein d'une population, il y aura une distribution de valeurs de consommation qui ne sera pas saisie par cette estimation ponctuelle (Statistique Canada, 2004, 2008). Les données tirées de récentes enquêtes sur l'utilisation de l'eau au Canada sont fournies dans la feuille de calcul « Reference » du modèle. La valeur par défaut de 1,0 L peut être modifiée dans la feuille de calcul « Input_output » afin de tenir compte des populations associées à d'autres consommations moyennes (Figure B1).
B.4.2 Déterminer la probabilité d'infection
La probabilité d'infection est calculée à l'aide du modèle dose-réponse et des paramètres de chaque agent pathogène, tel qu'indiqué dans le tableau B1. On a sélectionné le modèle exponentiel pour Cryptosporidium et Giardia, alors qu'on utilise le modèle bêta-Poisson pour le rotavirus, E. coli O157:H7 et Campylobacter.
| Agent pathogène | Modèle dose-réponse | Constantes | Référence |
|---|---|---|---|
| Cryptosporidium | Exponentiel | r = 0,018 | (Messner et coll., 2001) |
| Giardia | Exponentiel | r = 0,01982 | (Rose et Gerba, 1991) |
| Rotavirus | Bêta-Poisson | α = 0,265
β = 0,4415 |
(Haas, 1999) |
| E. coli O157 :H7Tableau 1 note de bas de page 1 | Bêta-Poisson | α = 0,0571
β =2,2183 |
(Strachan, 2005) |
| Campylobacter | Bêta-Poisson | α = 0,145
β = 7,59 |
(Medema et coll., 1996) |
|
Notes de bas de page du Tableau 1
| |||
Case B7 : Modèles dose-réponse
Les modèles dose-réponse sont élaborés en fonction d'essais d'alimentation, d'enquêtes suite à une éclosion ou une combinaison de ceux-ci. Bien que plusieurs modèles puissent être utilisés pour décrire les résultats des études dose-réponse, les modèles qui se sont avérés décrire le mieux les données observées sont le modèle exponentiel ou le modèle bêta-Poisson. Ces deux modèles reposent sur la théorie de cible unique selon laquelle chaque organisme agit indépendamment des autres et il est seulement nécessaire qu'un seul organisme survive à l'interaction hôte-pathogène pour causer une infection (Haas, 1999).
B.4.2.1 Modèle exponentiel (pour Cryptosporidium et Giardia)
Le modèle exponentiel comporte deux principales hypothèses qui sous-tendent son calcul. Il suppose tout d'abord que le nombre d'agents pathogènes causant une infection est réparti de façon binomiale et que l'effet est le même si un seul agent pathogène ou plusieurs agents pathogènes sont responsables de l'infection. Selon cette hypothèse, la probabilité qu'au moins un agent pathogène cause une infection, dans le cas d'un nombre discret d'agents pathogènes, peut être déterminée à l'aide de l'équation suivante :

Équation 8 - Équivalent textuel
P (parenthèse ouverte) infection divisée par j (paranthèse fermante) est égale à un moins (parenthèse ouverte) 1 moins r (paranthèse fermante) à l'exposant j.
Dans cette équation, j représente un nombre distinct et exact d'agents pathogènes, alors que r représente une constante spécifique à chaque agent pathogène, calculée à partir d'études dose-réponse (tableau B1).
Le modèle exponentiel suppose également que l'on peut décrire la probabilité d'ingestion d'une dose distincte exacte d'organismes (j) selon une concentration moyenne d'agents pathogènes consommée par jour dans l'eau potable (Dose ingéréequot) par l'équation suivante (c.-à-d. une distribution de Poisson) :
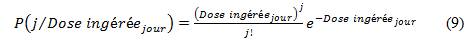
Équation 9 - Équivalent textuel
P (parenthèse ouverte) j divisé par la dose ingérée par jour (paranthèse fermante) est égal au numérateur de la dose (parenthèse ouverte)ingéré par jour (paranthèse fermante) à l'exposant j, divisé par le dénominateur de j factoriel 1, le tout multiplié par base e à l'exposant négatif de la dose ingérée par jour.
Dans le modèle d'ÉQRM de SC, on utilise les nombres distincts d'agents pathogènes (j) qui varient entre aucun organisme et un maximum de 100 organismes par incréments de un (1) organisme supplémentaire par dose. Le produit des équations (8) et (9) fournit la probabilité d'infection des paramètres saisis. La section B.4.3 décrit la façon d'utiliser ces probabilités.
B.4.2.2 Modèle bêta-Poisson (pour le rotavirus, E. coli O157:H7, Campylobacter)
Le calcul du modèle bêta-Poisson est similaire à celui du modèle exponentiel, sauf que le modèle bêta-Poisson présuppose que la probabilité d'un nombre exact connu d'agents pathogènes (j) qui n'induit pas d'effet est distribuée de façon bêta-binomiale et non de façon binomiale. Par conséquent, la probabilité qu'au moins un agent pathogène cause une infection sur un nombre connu d'agents pathogènes peut être déterminée à l'aide de l'équation suivante :
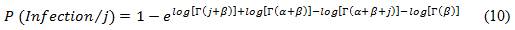
Équation 10 - Équivalent textuel
P (parenthèse ouverte) infection divisée par j (paranthèse fermante) est égale à 1 moins la base e élevée à l'exposant logarithme (crochet ouvert) Gamma multiplié par (paranthèse ouverte) j plus β (paranthèse fermante) (crochet fermant) plus le logarithme (crochet ouvert) Gamma (paranthèse ouverte) alpha plus Beta (paranthèse fermante) (crochet fermant) moins le logarithme de (crochet ouvert) Gamma (paranthèse ouverte) alpha plus Beta plus j (paranthèse fermante)(crochet fermé) moins le logarithme (crochet ouvert) Gamma multiplié par Beta (crochet fermé).
où,
- α et β sont des paramètres spécifiques d'agents pathogènes utilisés pour décrire la capacité d'un agent pathogène à survivre et à causer une infection chez une personne, calculés à partir d'études dose-réponse (tableau B1), et
- Γ représente une fonction gamma
La deuxième hypothèse du modèle bêta-Poisson est la même que celle du modèle exponentiel : la dose réelle ingérée par une personne est distribuée selon la loi Poisson et peut être décrite par l'équation (9). Le produit des équations (9) et (10) donne la probabilité d'infection des paramètres saisis. L'approximation du modèle bêta- Poisson est souvent utilisée dans les différentes publications, puisqu'elle simplifie l'équation. Elle n'a pas été utilisée dans le présent modèle, car les hypothèses à l'égard de son utilisation ne sont pas applicables pour les agents pathogènes sélectionnés. La section B.4.3 décrit la façon d'utiliser les probabilités d'infection.
B.4.3 Probabilité d'infection
Les calculs de dose-réponse à la section B.4.2 déterminent la probabilité d'infection de chaque tranche de distribution log-normale à chaque dose discrète variant entre 0 et 100 organismes. Il en résulte une grande matrice de données qui doit être résumée par le modèle afin de fournir une probabilité finale d'infection. Tout d'abord, pour chaque tranche de distribution log-normale, le modèle calcule la probabilité d'ingérer chaque dose distincte (entre 0 et 100) en tenant compte du nombre moyen d'organismes ingérés pour cette tranche. La probabilité d'ingestion est alors multipliée par la probabilité correspondante d'infection, puis additionnée pour obtenir la probabilité d'infection d'une tranche de la distribution log-normale. Ce processus est réalisé pour chacune des quelque 500 tranches d'intégration de la distribution log-normale. Chaque tranche de distribution est alors pondérée à l'aide de la probabilité de la concentration d'agents pathogènes présente dans la distribution log-normale. Les probabilités d'infection pondérées sont alors additionnées afin d'obtenir la probabilité globale d'infection par jour (Pinfection, jour). Cette valeur est affichée dans la feuille de calcul « Input_Output » (voir la Figure B3).
Afin de diminuer les durées de cycle du modèle, on a appliqué la limite de 100 organismes comme compromis entre les scénarios réalistes de traitement et de contamination de l'eau potable canadienne. Il est à prévoir que la concentration de tout agent pathogène donné présent dans l'eau potable au Canada soit bien inférieure à 100 organismes comme dose moyenne. Puisque la limite supérieure de la dose discrète a été établie à 100 organismes, ce modèle ne peut être utilisé pour examiner les scénarios selon lesquels la dose ingérée moyenne est supérieure à cette valeur. À titre d'exemple, si un utilisateur saisit des données qui représentent une source d'eau potable qui n'est pas traitée et que la source d'eau est si contaminée que la dose moyenne d'agents pathogènes ingérée est supérieure à 100, le modèle estimera à tort de très faibles taux de probabilité d'infection et de maladie, car la concentration d'agents pathogènes sort du cadre de l'analyse. Un tel scénario alerte l'utilisateur dans le cadre du modèle.
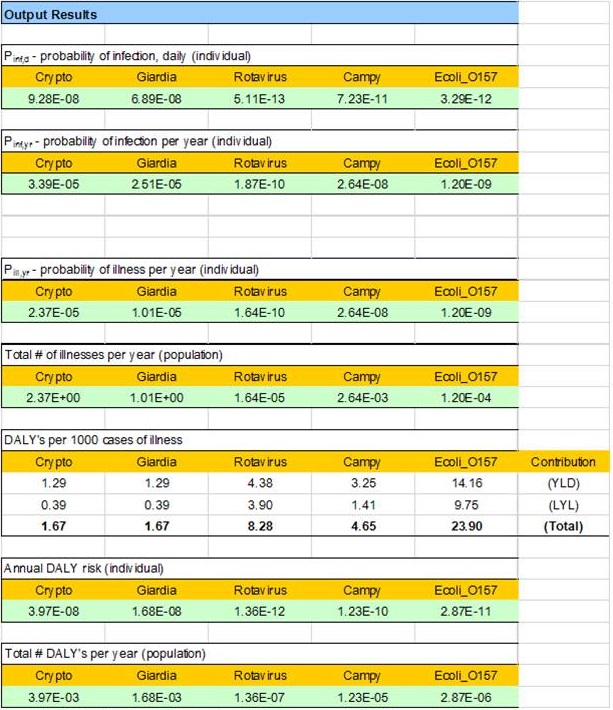
Figure B3 - Équivalent textuel
Les résultats des calculs pour le modèle AQRM de SC sont affichés. Cela inclut les valeurs calculées suivantes pour Cryptosporium, Giardia, rotavirus, Campylobacter et E. coli: la probabilité journalière d'infection pour un individu; la probabilité d'infection par an pour un individu; la probabilité de maladie par année pour un individu; le nombre total de maladies par an dans la population; les DALY pour 1000 cas de maladie, présentés comme les YLD, les LYL, et la contribution totale (respectivement); le risque annuel DALY pour un individu; et le nombre total de DALY par année dans la population.
Figure B3: Valeurs de sortie liées aux effets sur la santé qui sont déterminées à partir des données saisies par les utilisateurs
L'équation suivante sert à calculer la probabilité d'au moins une (1) infection par année, en tenant compte d'un risque d'infection quotidien (Pinfection, jour) (OMS, 2016):

Équation 11 - Équivalent textuel
La probabilité d'au moins une infection par année est calculée par soustrayant de 1, le résultat du terme (1 mois la probabilité d'une infection) à l'exposant 365.
Cette équation présuppose que le risque d'infection est le même chaque jour de l'année et que la population ne développe aucune résistance ou immunité. En fait, le risque d'infection variera d'un jour à l'autre selon les modifications de la qualité de la source d'eau, l'efficacité de traitement et le volume d'eau consommée. En outre, une infection antérieure avec certains agents pathogènes entériques fournit une immunité protectrice des infections subséquentes. Le modèle d'ÉQRM de SC ne vise toutefois pas à prédire le nombre d'infections ou de maladies dans une population, mais à fournir une probabilité d'occurrence d'une maladie en fonction des renseignements sur la qualité de la source d'eau et le système de traitement. Puisque le risque annuel prévu de tomber malade en consommant de l'eau potable est très faible, les hypothèses ci-dessus sont raisonnables.
B.5 Estimer les effets sur la santé
L'étape finale du modèle d'ÉQRM de SC consiste à déterminer la charge de morbidité exprimée en AVCI qui est associée au scénario d'entrée de chacun des agents pathogènes de référence. Les AVCI sont utilisées dans ce modèle d'évaluation de risques comme paramètre commun pour permettre de comparer des maladies avec différents effets sur la santé. Elles servent également à faire des comparaisons avec l'objectif sanitaire établi. Dans ce cas-ci, il s'agit du niveau de référence de 10-6 AVCI par personne par année. Le fardeau calculé des valeurs de maladie figure dans la feuille de calcul « Input_Output » (voir la Figure B3).
B.5.1 Déterminer la probabilité d'une maladie
Afin de déterminer le fardeau sanitaire de chaque agent pathogène de référence, il est d'abord nécessaire de calculer la probabilité de tomber malade une fois qu'une infection est établie, puisque ce ne sont pas toutes les infections qui cause une maladie. Certaines personnes infectées peuvent éliminer l'infection sans jamais développer de symptômes. D'autres peuvent être des transporteurs asymptomatiques d'infection. Ces personnes ne démontrent aucun symptôme, mais continuent de transmettre l'agent pathogène dans leurs matières fécales.
La probabilité d'une maladie liée à une infection (Pmal/inf) varie entre chaque agent pathogène de référence. Les valeurs utilisées par le modèle de Pmal/inf sont tirées de publications et sont fournies dans le tableau B2. Elles figurent également dans la feuille de calcul « Reference » du modèle. En ce qui concerne E. coli O157:H7, le modèle dose-réponse estime la probabilité de tomber malade, ce qui donne une Pmal/inf de 1,0 dans les calculs de risque. Pour ce qui est de Campylobacter, les études actuelles ne fournissent pas de valeur cohérente pour Pmal/inf. La relation semble dépendre des doses, et certaines doses démontrent une Pmal/inf de 1,0. D'autres études sont donc requises. Dans l'intervalle, la Pmal/inf a également été établie à 1,0 comme estimation prudente.
| Agent Pathogène | P(mal/inf) | Référence |
|---|---|---|
| Cryptosporidium | 0,70 | Casmen et coll., 2000 |
| Giardia | 0,40 | Nash et coll., 1987 |
| Rotavirus | 0,88 | Havelaar et Melse, 2003 |
| E. coli O157:H7 | 1,0 | Strachan, 2005 |
| Campylobacter | 1,0 | Suppose que toutes les infections mènent à une maladie |
La probabilité de tomber malade par année d'une personne (Pmaladie, an) est calculée à l'aide de l'équation suivante. Ce calcul est effectué pour chacun des cinq agents pathogènes de référence.

Équation 12 - Équivalent textuel
La probabilité de tomber malade par année d'une personne est calculée en multipliant la probabilité d'infection par la probabilité d'infection entraînant une maladie.
Le nombre total de maladies dans une population peut être calculé pour chaque agent pathogène en multipliant le risque annuel de cas de maladie dans une population.

Équation 13 - Équivalent textuel
Le nombre total de maladies dans une population est calculée en multipliant la probabilité de tomber malade d'une personne par la population.
B.5.2 Calcul des AVCI
Bien qu'il soit éclairant d'estimer la probabilité de tomber malade par personne par année, cette valeur ne fournit pas une indication claire du fardeau sanitaire associé à une source d'eau potable, puisque l'importance des effets sur la santé varie selon chaque agent pathogène de référence. Comme il a été mentionné précédemment, les AVCI sont utilisées comme paramètre commun afin de comparer les maladies ayant différents effets sur la santé. Les AVCI comprennent les années de vie perdues (AVP) visant à calculer l'incidence d'un décès précoce en raison d'une maladie, ainsi que les années vécues avec une incapacité (AVI) visant à calculer la morbidité associée à une maladie.
B.5.2.1 Calcul des AVP
Puisqu'un décès précoce élimine des années potentielles de vie saine, les AVP sont calculées comme étant la différence entre l'âge au décès et l'espérance de vie de la population, multipliée par le poids de la gravité associé à une perte de vie et la fraction de toutes les personnes qui souffre les conséquences de l'effet (appelée fraction de l'effet).
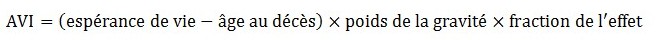
Équation 14 - Équivalent textuel
L'AVI sont calculées par multipliant la différence entre l'âge au décès et l'espérance de vie de la population par le poids de la gravité et par la fraction de l'effet.
Le modèle utilise l'espérance de vie combinée (c.-à-d. l'espérance de vie moyenne des hommes et des femmes - 80,88 ans), puisque les agents pathogènes de référence n'entraînent pas d'effets sanitaires propres au genre. En ce qui concerne Cryptosporidium, Giardia, le rotavirus et E. coli O157, l'âge médian pondéré (38,98 ans) est utilisé comme étant l'âge au moment du décès, ce qui présuppose qu'il n'y a aucune différence en matière de taux de mortalité entre les catégories d'âge. Pour ce qui est de Campylobacter, la mortalité survient principalement au sein d'une population âgée. Par conséquent, l'âge au moment du décès est présumé être l'âge médian de la catégorie de population âgée (72,94 ans). Des tableaux complets des valeurs d'espérance de vie et d'âge de la population canadienne figurent dans la feuille de calcul « Reference » du modèle. Dans tous les cas, un poids de la gravité de 1,0 est attribué à une perte de vie. Le tableau B3 fournit les poids de la gravité et les renseignements sur les fractions de l'effet pour chaque agent pathogène de référence. On présuppose que les fractions de l'effet pour la mort sont de 1 sur 100 000 pour Cryptosporidium et Giardia, et que le rotavirus et Campylobacter ont un taux de létalité de 1 sur 10 000. Pour ce qui est de E. coli O157:H7, le risque de décès est plus élevé, de 1 sur 4 000 (Havelaar et Melse, 2003).
B.5.2.2 Calcul des AVI
Pour calculer les années vécues avec une incapacité (AVI), la fraction de l'effet est multipliée par le poids de la gravité (tableau B3) et la durée de la maladie (tableau B4) pour chaque effet de maladie qui est attribué à l'agent pathogène. Ces produits sont alors additionnés afin de donner l'AVI par cas de maladie.
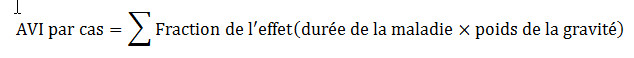
Équation 15 - Équivalent textuel
Les AVI par cas sont calculés en prenant la somme des multiplications de la fraction de l'effet par la durée de la maladie et par le poids de la gravité
| Maladie | Poids de la gravité | Fractions de l'effet | ||||
|---|---|---|---|---|---|---|
| Crypto-sporidiumTableau 3 note de bas de page c | GiardiaTableau 3 note de bas de page a | RotavirusTableau 3 note de bas de page a | CampylobacterTableau 3 note de bas de page b | E.coli O157Tableau 3 note de bas de page b | ||
| Diarrhée bénigne | 0,067 | 0,99999 | 0,99999 | 0,50 | 1,00 | 0,53 |
| Diarrhée sanglante | 0,39 | - | - | 0,50 | 0,06 | 0,47 |
| Syndrome de Guillain-Barré (SGB) clinique et résiduel | - | - | - | - | 0,0002 | - |
| SGB résiduel | - | - | - | - | 0,0002 | - |
| Arthrite réactionnelle | - | - | - | - | 0,023 | - |
| Syndrome hémolytique et urémique (SHU) | 0,93 | - | - | - | - | 0,01000 |
| Insuffisance rénale au stade ultime (IRSU) | 0,95Tableau 3 note de bas de page d | - | - | - | - | 0,00118 |
| Décès (SGB) | 1,0 | - | - | - | 0,0000046 | - |
| (1 dans 217 000) | ||||||
| Décès | 1,0 | 0,00001 | 0,00001 | 0,0001 | 0,0001 | 0,00025 |
| (1 dans 100 000) | (1 dans 100 000) | (1 dans 10 000) | (1 dans 10 000) | (1 dans 4 000) | ||
|
Notes de bas de page du Tableau 3
| ||||||
| Maladie | Cryptosporidium | Giardia | Rotavirus | Campylobacter | E. coli O157 |
|---|---|---|---|---|---|
| diarrhée bénigne | 0,01918 | 0,01918 | 0,01918 | 0,01397 | 0,00932 |
| (7 jours) | (7 jours) | (7 jours) | (5,1 jours) | (3,4 jours) | |
| diarrhée grave (c.-à-d. sanglante) | - | - | 0,01918 | 0,0230 | 0,01534 |
| (7 jours) | (8,4 jours) | (5,6 jours) | |||
| SHU | - | - | - | - | 0,0575 |
| (21 jours) | |||||
| IRSU | - | - | - | - | 9,35 |
| clinique (SGB) | - | - | - | 0,29a | - |
| résiduel (SGB) | 5,8a | ||||
| arthrite réactionnelle | 0,115 | ||||
| (42 jours) | |||||
| décès (SGB) | - | - | - | (e* - adécès) | - |
| décès | (e* - adécès) | (e* - adécès) | (e* - adécès) | (e* - adécès) | (e* - adécès) |
|
Notes de bas de page du Tableau #
| |||||
B.5.2.3 Nombre total d'AVCI
Le nombre total d'AVCI par cas de maladie constitue la somme de l'AVI et de l'AVP. Dans le cas d'un agent pathogène d'origine hydrique causant une maladie gastro-intestinale bénigne et ayant un faible taux de létalité, il est courant d'observer que le fardeau sanitaire est exprimé en AVCI par 1 000 cas afin d'illustrer plus clairement l'effet sur la santé. La figure B3 démontre les AVCI estimées par cas de maladie pour chaque agent pathogène de référence, y compris la contribution de la morbidité (AVP) et de la mortalité (AVI). Sauf en ce qui concerne le rotavirus, ces valeurs d'AVCI sont très similaires aux valeurs comparables qui sont tirées de publications (Gibney et coll., 2014). Les AVCI par 1 000 cas qui sont calculées à l'aide de ce modèle de rotavirus sont environ trois fois plus importantes que celles de l'étude tirée de la documentation en raison des hypothèses divergentes formulées au sujet de la population susceptible et de la durée de la maladie.
Les AVCI par personne par année sont alors calculés en multipliant la probabilité de maladie par personne par année par les AVCI par cas de maladie pour chaque agent pathogène. Ces valeurs peuvent être alors comparées à l'objectif sanitaire de 1 × 10-6 AVCI par personne par année comme le recommandent les Recommandations pour la qualité de l'eau potable au Canada. Les AVCI par personne par année (risque annuel [individuel] en AVCI) sont affichées dans la feuille de calcul « Input_output » du modèle (Figure B3). Le modèle affiche également le nombre total d'AVCI par année dans la population en fonction de celle qui est ajoutée par l'utilisateur dans la feuille de calcul « Input_output ».
B.6 Utiliser le modèle - un exemple d'étude de cas
Les sections suivantes présentent un bref exemple de la façon dont le modèle d'ÉQRM peut être utilisé. Cet exemple ne vise pas à fournir une procédure par étapes pour réaliser une évaluation de risques à l'aide du modèle. Il s'agit d'une approche simplifiée, présentée aux fins d'illustration seulement, afin de démontrer la façon dont le modèle d'ÉQRM peut faciliter le processus décisionnel lié à un système d'eau potable. Il est possible de trouver d'autres exemples d'évaluation de risques dans d'autres publications (U.S. EPA, 2005, 2006; Medema et coll., 2009; Schijven et coll., 2011; OMS, 2016).
B.6.1 Portée de l'évaluation de risques
Le système d'eau potable municipal dans cette étude de cas fictive est approvisionné par une usine de traitement d'eau de surface qui tire son eau brute d'une grande rivière. Depuis deux ans, la municipalité effectue une surveillance mensuelle des agents pathogènes (voir les détails ci-dessous). Les échantillons ont été prélevés selon un horaire préétabli. Les conditions d'échantillonnage (c.-à-d. de référence ou d'incident) n'ont pas été consignées. Avec son ensemble de données sur les résultats de surveillance des agents pathogènes, et des renseignements sur les processus de traitement en place, la municipalité souhaite réaliser une évaluation de risques préliminaire afin de déterminer leur rapport avec le niveau de risque acceptable de 1 × 10-6 AVCI par personne par année (estimation du risque de référence). En outre, la municipalité souhaiterait mener une enquête sur la façon dont ce niveau de risque pourrait être touché par des conditions d'eau difficiles, par la modification d'une barrière de désinfection dans des conditions de référence et dans des conditions difficiles, ainsi que par l'efficacité d'une autre méthode d'enlèvement physique. Ces analyses feront partie des données probantes utilisées pour aider à appuyer les décisions à venir au sujet des modifications qui seront apportées au système de traitement actuel, ainsi qu'aux futures expansions de celui-ci.
Le système utilisera les données de surveillance des agents pathogènes qu'il a recueillies afin d'estimer les moyennes et les écarts-types de chaque agent pathogène de référence. Puisqu'il n'y a aucun renseignement propre au site sur les réductions logarithmiques des agents pathogènes, le modèle utilisera les valeurs tirées de publications. On suppose que l'ingestion d'eau du robinet non bouillie est la seule voie d'exposition, avec une consommation moyenne par habitant de 1,0 litre d'eau du robinet non bouillie par jour.
B.6.2 Estimation des risques de fond
La rivière est entourée d'un bassin hydrographique grandement sauvage, a une turbidité généralement faible (3-5 UTN), est très colorée (35 unités de couleur vraie) et contient de l'oxygène dissous (6,5 mg/L). Seules quelques petites collectivités se trouvent en amont de la ville, et les rejets d'eaux usées sont minimaux. Un grand nombre d'oiseaux aquatiques (bernaches du Canada, goélands et mouettes, et oiseaux de rivage) se trouvent sur le cours d'eau durant la migration, et certains de ces oiseaux passent l'hiver dans les zones qui ne gèlent pas complètement. Quelques affluents principaux drainent les zones agricoles, ce qui peut contribuer à l'apport en nutriments et en pathogènes provenant des déchets d'origine animale dans le cours d'eau. Les données sur la surveillance des divers agents pathogènes dans l'eau brute ont été recueillies sur deux ans. Les ensembles de données de tous les agents pathogènes, sauf celles d'E. coli, contenaient des échantillons qui étaient inférieurs à la LD de la méthode. Tous les échantillons inférieurs à la LD ont été compris dans les estimations de concentration en présupposant que les concentrations étaient au niveau de la LD. Ils étaient également corrigés au titre de la récupération en fonction des renseignements qui avaient été reçus du laboratoire (le cas échéant).
La concentration d'agents pathogènes ne démontrait pas de tendances saisonnières claires, et puisque les échantillons n'ont pas été identifiés comme étant des échantillons de référence ou d'incident, les données tirées d'une surveillance de deux ans (24 échantillons) ont été combinées en une estimation unique de la moyenne et de l'écart-type (tableau B5). Ces estimations saisissent la variabilité des concentrations d'agents pathogènes, mais auront une certaine incertitude en raison du nombre limité d'échantillons prélevés et des limites des méthodes de détection des agents pathogènes, dont celle consistant à déterminer si les agents pathogènes comportent des risques infectieux pour l'humain. L'incertitude liée à ces valeurs ne sera toutefois pas explorée de façon plus approfondie aux fins des scénarios faisant l'objet d'enquêtes par le service public.
| Agent pathogène | Cryptosporidium
(nbre/100 L) |
Giardia
(nbre/100 L) |
Rotavirus
(nbre/100 L) |
Campylobacter
(ufc/100 mL) |
E. coli
(ufc/100 mL) |
|---|---|---|---|---|---|
| Moyenne | 8,0 | 34,0 | 56,0 | 10,0 | 55,0 |
| Écart-type | 12,0 | 72,0 | 62,0 | 22,0 | 100,0 |
|
ufc : unité formatrice de colonies | |||||
L'usine de traitement d'eau dispose d'un processus de traitement conventionnel qui comprend les étapes suivantes : tamisage grossier, coagulation, floculation, sédimentation, filtration sur lit double, désinfection au chlore (désinfection primaire), ajustement du pH et chloramination (désinfection secondaire). On suppose que l'eau du robinet ne subira pas d'autre traitement ou désinfection avant la consommation, et que la qualité de l'eau traitée ne se détériorera pas dans le réseau de distribution.
Comme le rendement de l'enlèvement physique du processus de traitement est inconnu, on utilisera les efficacités moyennes pondérées de la coagulation/sédimentation et de la filtration - rapide granulaire (avec coag./séd.) du modèle d'ÉQRM. On additionne les valeurs de ces deux étapes pour obtenir l'enlèvement logarithmique global. L'utilisation des valeurs du modèle d'ÉQRM ajoutera de l'incertitude aux risques estimés, puisque les ordres de grandeur des enlèvements logarithmiques propres à un site pourraient être différents des valeurs moyennes comprises dans le modèle. Le service public a toutefois décidé, à titre d'évaluation préliminaire, que les valeurs moyennes tirées de publications étaient acceptables pour les scénarios qu'ils veulent examiner.
En ce qui concerne la désinfection primaire, le résidu de chlore suivant immédiatement la demande initiale est de 0,50 mg/L suivi d'un temps de contact de 60 minutes (pH = 6,0, température =10 °C). Le temps de contact repose sur le temps de détention moyen, plutôt que sur la valeur T10, puisque cette évaluation vise à estimer la réduction moyenne par le processus de traitement. Les bassins de contact ont été bien construits de façon à minimiser les court-circuits, et le facteur de déflexion a été établi à 0,65. Le facteur de dégradation de désinfectant du chlore est de 0,002 dans ce système.
À l'aide du modèle d'ÉQRM et des réductions logarithmiques indiquées dans le tableau B6, les estimations moyennes de fardeau sanitaire de Cryptosporidium, de Giardia, du rotavirus, de Campylobacter et d'E. coli O157:H7 (en AVCI/personne par année) correspondaient à 3,27 × 10−8, 3,58 × 10−8, 7,63 × 10−12, 1,23 × 10−10 et 1,58 × 10−10, respectivement. La distribution des estimations est démontrée à la figure B4. Les niveaux de maladie dans cette plage, sauf l'extrémité de la courbe de la giardiase, sont bien inférieurs au niveau de risque de référence de 10−6 AVCI/personne par année.
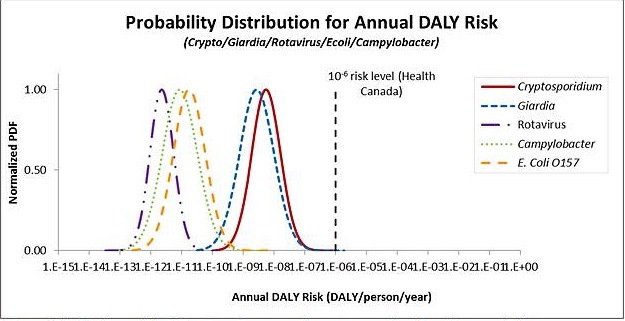
Figure 4 - Équivalent textuel
Un graphique qui montre la distribution du fardeau sanitaire annuel estimé qui est associé à la consommation d'eau potable produite au moyen des procédés de traitement de base. La distribution du fardeau estimé est montrée pour chaque pathogène, à savoir le Cryptosporidium, le Giardia, les rotavirus, le Campylobacter et E. coli O157:H7. L'axe des x du graphique correspond au risque exprimé en AVCI/personne par année. Il est présenté sur une échelle logarithmique, et les valeurs sur l'axe des x se situent entre 10-15 et 1. L'axe des y du graphique correspond à la fonction de distribution de probabilités normalisée. Il est présenté sur une échelle logarithmique, et les valeurs sur l'axe des y se situent entre 0 et 1. Le niveau de risque de référence de 10-6 AVCI/personne par année est illustré sur le graphique par une ligne pointillée verticale. La distribution du fardeau sanitaire annuel estimé pour chaque pathogène est normale. La courbe de distribution va d'environ un peu moins de 10-11 à 10-9 pour le Cryptosporidium; un peu moins de 10-12 à 10-9 pour le Giardia; 10-15 à 10-13 pour les rotavirus; un peu plus de 10-11 à un peu moins de 10-8 pour le Campylobacter; et un peu moins de 10-11 à 10-9pour E. coli O157:H7. Le pic de chaque distribution de probabilités est normalisé à 1.
Figure B4 : Risque estimé lié aux agents pathogènes de référence en présupposant des conditions de base
B.6.3 Modifications aux procédés de traitement
À l'aide des mêmes données sur les agents pathogènes (tableau B5), le modèle d'ÉQRM a servi dans le cadre d'une enquête sur comment la modification des procédés de traitement pourrait avoir une incidence sur la qualité de l'eau produite. Comme le modèle d'ÉQRM calcule les estimations des risques en fonction de l'exposition annuelle, il suppose que les valeurs utilisées reflètent les valeurs dans le système d'eau pendant chaque jour de l'année. Ces valeurs sont utilisées aux fins de comparaison avec les cibles de risque à la santé tolérables. Le modèle affiche également le risque individuel quotidien d'infection, au besoin. Bien qu'un risque quotidien constant soit peu probable, puisque la qualité de l'eau et le rendement de traitement varieront tout au long de l'année, cette hypothèse permet aux décideurs de comparer les scénarios de traitement (c.-à-d. d'examiner les risques relatifs). Le système fictif souhaitait mener une enquête sur l'effet des variations de traitement possibles dans trois scénarios distincts: 1) l'efficacité de la désinfection au chlore dans des conditions difficiles (c.-à-d. des températures d'eau froide et un temps de contact réduit), 2) l'utilisation d'ozone comme solution de rechange au désinfectant au chlore, et 3) l'efficacité d'une usine de filtration sur membrane en comparaison avec le traitement conventionnel.
En ce qui concerne le premier scénario, les entrées du modèle d'ÉQRM ont été établies afin de représenter des conditions de désinfection difficiles. Les températures d'eau dans le réseau varient entre 1 °C et 21 °C tout au long de l'année. Le réseau s'appuie sur le chlore pour désinfecter les agents pathogènes, et les taux d'inactivation de ce produit chimique dépendent de la température. Par conséquent, le modèle d'ÉQRM a été mis en œuvre à l'aide des mêmes paramètres comme estimation de référence, et comprenait les modifications suivantes : la température de l'eau a été établie à 1 °C et le temps de contact utilisé était la valeur T10 de 20 minutes afin de représenter une estimation prudente de l'inactivation au chlore. Les réductions logarithmiques sous ces conditions sont indiquées dans le tableau B6. Puisque l'inactivation au chlore est inefficace contre Cryptosporidium, les conditions de désinfection difficiles n'ont aucune incidence sur la réduction de cet agent pathogène dans le traitement. Inversement, les bactéries pathogènes sont extrêmement vulnérables à l'inactivation au chlore. Par conséquent, même en utilisant des estimations prudentes, l'inactivation maximale appliquée par le modèle (>8,0 log) est quand même atteinte. La plus grande incidence sur les risques estimés vient de Giardia (2,95 × 10-7 AVCI/personne - année) et du rotavirus (3,84 × 10-10 AVCI/personne - année). Le risque estimé de Giardia a augmenté d'environ 1 log, alors que le risque estimé annuel lié au rotavirus a augmenté d'environ 1,7 log. Les deux valeurs sont encore inférieures à la cible annuelle, bien que celle de Giardia soit maintenant à moins d'un ordre de grandeur et qu'il serait probablement justifié de déterminer le degré d'incertitude entourant les réductions logarithmiques réalisées.
| Processus (log10) | Cryptosporidium | Giardia | Rotavirus | Campylo-bacter | E. coli |
|---|---|---|---|---|---|
| Conditions de base | |||||
| Coagulation/
sédimentation |
1,86 | 1,61 | 1,76 | 1,55 | 1,55 |
| Filtration - rapide granulaire (avec coag./séd.) | 2,41 | 1,92 | 1,11 | 0,87 | 0,87 |
| Inactivation au chlore
(10°C, 60 min) |
0,0 | 1,15 | > 8,0 | > 8,0 | > 8,0 |
| Traitement modifié | |||||
| Inactivation au chlore (1°C, 20 min) | 0,0 | 0,23 | 6,3 | > 8,0 | > 8,0 |
| Inactivation à l'ozone
(10°C, 20 min) |
0,25 | 4,0 | 4,0 | 8,0 | 8,0 |
| Inactivation à l'ozone
(1°C, 20 min) |
0,10 | 3,79 | 4,0 | 8,0 | 8,0 |
| Filtre sur membrane (microfiltration) | 6,13 | 6,62 | 1,10 | 4,60 | 4,60 |
En ce qui concerne le deuxième scénario, le service public fictif souhaitait mener une enquête sur l'utilisation d'un autre désinfectant primaire, soit l'ozone. Pour ce scénario, on a supposé que la coagulation/sédimentation et la filtration sont demeurées inchangées, alors que le désinfectant primaire ajouté est de l'ozone, plutôt que du chlore. Les conditions d'eau difficiles et de référence ont été considérées aux fins de comparaison. La concentration d'ozone suivant immédiatement la demande initiale a été établie à 0,50 mg/L, suivi d'un temps de contact de 20 minutes [pH = 6,0, température = 10 °C (référence) ou 1 °C (difficile)]. Puisque l'ozone est reconnu pour réagir très rapidement dans l'eau, le temps de contact a été établi à la valeur T10 des deux scénarios. Le facteur de déflexion était encore à 0,65. On a supposé que le facteur de dégradation du désinfectant de l'ozone dans ce système était de 0,2.
En ce qui concerne le scénario de référence, les estimations du fardeau sanitaire moyen de Cryptosporidium, de Giardia, du rotavirus, de Campylobacter et d'E. coli O157:H7 (en AVCI/par personne par année) correspondaient à 1,89 × 10−8, 5,02 × 10−11, 7,63× 10−8, 1,26 × 10−10 et 1,61 × 10−10, respectivement. La distribution des estimations est démontrée dans la figure B5. Pour les conditions de qualité d'eau difficiles, seules les estimations du fardeau sanitaire moyen de Cryptosporidium et Giardia ont été modifiées, avec un risque estimé ayant augmenté d'environ 0,1 et 0,2 log, respectivement. Le service public a alors utilisé les valeurs estimées de réduction logarithmique d'ozone pour l'eau froide afin de les comparer avec les estimations de désinfection au chlore de référence. Cette comparaison a permis de démontrer que le risque estimé lié à Cryptosporidium, à Campylobacter et à E. coli O157:H7 est demeuré environ le même. L'inactivation de Cryptosporidium a atteint un niveau très bas en utilisant l'ozone (0,1 log), alors qu'il n'y en avait aucune avec le chlore. Les deux bactéries de référence ont atteint l'inactivation maximale allouée par le modèle, puisqu'elles sont très vulnérables aux deux désinfectants. Giardia, d'autre part, était plus facilement inactivée avec l'ozone et le risque estimé a diminué d'environ 3 log. Inversement, bien que le risque estimé lié au rotavirus a augmenté d'environ 4 log, le modèle limite l'inactivation logarithmique au moyen de l'ozone à 4 log de moins de chlore en fonction des études publiées disponibles, ce qui complexifie la comparaison directe. Tous les risques estimés étaient inférieurs à la l'objectif sanitaire annuel.
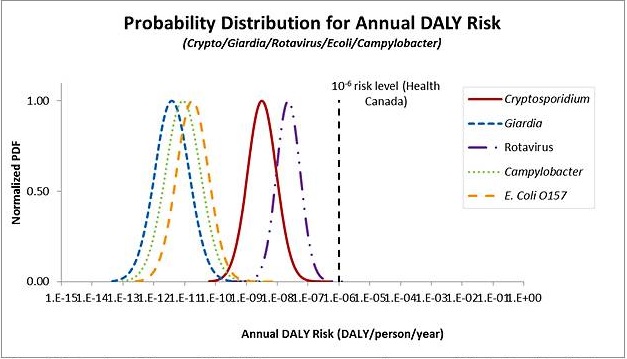
Figure 5 - Équivalent textuel
Un graphique montrant la distribution des estimations annuelles du fardeau de la maladie à partir de la consommation d'eau potable produite par désinfection à l'ozone au moyen des procédés de traitement de base. La répartition des estimations de la charge de morbidité est indiquée pour Cryptosporidium, Giardia, rotavirus, Campylobacter et E. coli O157: H7. L'axe des x du graphique représente le risque AVCI/personne par année. Il est présenté sur une échelle logarithmique et les valeurs de l'axe vont de 10-15 à 1. L'axe des y du graphique est la fonction de distribution de probabilité normalisée. Il est présenté sur une échelle linéaire et les valeurs de l'axe vont de 0 à 1. Le niveau de risque de référence de 10-6 AVCI/personne par année est illustré sur le graphique par une ligne verticale en pointillés. Les estimations annuelles de la maladie pour chaque agent pathogène sont normalement distribuées. Les courbes de distribution s'étendent approximativement de: un peu moins de 10-10 à presque 10-6 pour Cryptosporidium; un peu moins de 10-13 à 10-9 pour Giardia; un peu plus de 10-10 à un peu moins de 10-6 pour le rotavirus; 10-13 à un peu plus de 10-9 pour Campylobacter, et un peu plus de 10-13 à presque 10-8 pour E. coli O157: H7. Le pic de chaque distribution de probabilité est normalisé à 1.
Figure B5 : Fardeau sanitaire en AVCI/personne par année avec l'utilisation de la désinfection par l'ozone (référence) (scénario 2).
Dans le troisième scénario, le service public fictif souhaitait mener une enquête sur l'utilisation d'une solution de rechange au processus d'enlèvement physique dans le cadre d'un projet d'expansion d'une usine de traitement d'eau. Pour ce scénario, on a supposé que la désinfection au chlore était réalisée dans les conditions des estimations de référence (10 °C, 60 min) de l'usine actuelle. On supposait que l'autre processus d'enlèvement physique était la microfiltration (tableau B6). Les estimations du fardeau sanitaire de Cryptosporidium, de Giardia, du rotavirus, de Campylobacter et d'E. coli O157:H7 (en AVCI/personne par année) correspondaient à 4,59 × 10−10, 1,56 × 10−10, 4,50 × 10−10, 8,29 × 10−13 et 1,06 × 10−12, respectivement. La distribution des estimations est illustrée à la figure B6. Sauf en ce qui concerne le rotavirus, le scénario de microfiltration a permis d'obtenir des risques estimés équivalents ou inférieurs à l'usine de traitement conventionnelle. Les risques liés au rotavirus étaient plus élevés, mais quand même bien inférieurs à l'objectif sanitaire annuel.
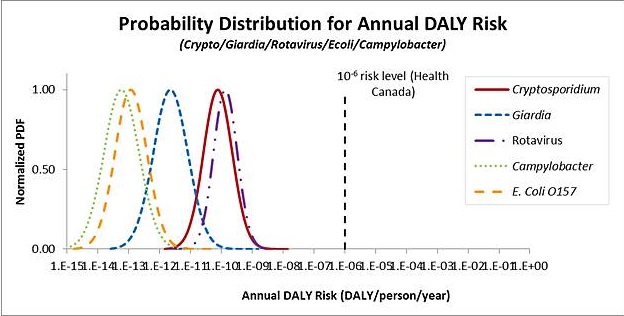
Figure 6 - Équivalent textuel
Graphique montrant la distribution des estimations annuelles de la charge de morbidité à partir de la consommation d'eau potable produite par filtration membranaire selon le scénario 3. La répartition des estimations de la charge de morbidité est indiquée pour Cryptosporidium, Giardia, rotavirus, Campylobacter et E. coli O157: H7. L'axe des x du graphique représente le risque annuel exprimés en AVCI/personne par année. Il est présenté sur une échelle logarithmique et les valeurs de l'axe vont de 10-15 à 1. L'axe des y du graphique est la fonction de distribution de probabilité normalisée. Il est présenté sur une échelle linéaire et les valeurs de l'axe vont de 0 à 1. Le niveau de risque de référence de 10-6 AVCI/personne par année est illustré sur le graphique par une ligne verticale en pointillés. Les estimations annuelles de la maladie pour chaque agent pathogène sont normalement distribuées. Les courbes de distribution s'étendent approximativement de: un peu plus de 10-12 à un peu plus de 10-8 pour Cryptosporidium; un peu plus de 10-14 à un peu plus de 10-9 pour Giardia; un peu plus de 10-12 à un peu plus de 10-9 pour le rotavirus; 10-9 pour Campylobacter, et un peu plus de 10-15 à presque 10-10 pour E. coli O157: H7. Le pic de chaque distribution de probabilité est normalisé à 1.
Figure B6 : Fardeau sanitaire en AVCI/personne par année avec l'utilisation de la filtration sur membrane (microfiltration) (scénario 3).
B.6.4 Interpréter les estimations des risques
À l'aide des scénarios de l'ÉQRM dans cette étude de cas, l'usine de traitement d'eau potable semble produire de l'eau potable d'une qualité microbiologique acceptable, en supposant que les conditions saisies dans le modèle d'ÉQRM reflètent le système d'eau potable. Si l'on tient compte des réductions de traitement appliquées dans le modèle (voir le tableau B6), il est évident que les réductions logarithmiques attribuables aux processus d'enlèvement physique sont essentielles au contrôle du risque lié à Cryptosporidium. Les taux de chlore et d'ozone dans les conditions saisies offrent un niveau d'inactivation négligeable. La concentration de Giardia, d'autre part, est réduite par l'enlèvement physique et la désinfection. Toutefois, dans des conditions de désinfection difficiles, comme la désinfection au chlore dans l'eau froide, le risque lié à Giardia pourrait s'approcher du niveau cible en fonction des données saisies dans le modèle. Ce résultat devrait inciter ce service public fictif à mener des enquêtes plus approfondies afin de mieux caractériser le risque probable lié à Giardia et de déterminer si le système respecte les objectifs sanitaires dans toutes les conditions d'eau. En ce qui concerne les agents pathogènes bactériens et viraux (Campylobacter, E. coli O157:H7 et le rotavirus), la désinfection est la barrière principale pour réduire ces organismes à des niveaux acceptables. Les résultats du scénario 2 ont démontré que les agents pathogènes viraux résistent davantage à la désinfection que les agents pathogènes bactériens. Les conditions d'eau difficiles avec la désinfection au chlore ont fourni un taux de probabilité de risque qui était presque de deux ordres de grandeur supérieurs aux conditions de référence, bien qu'il soit bien inférieur au niveau de risque acceptable. La température plus basse utilisée dans le cadre de cette étude de cas ne semble toutefois pas avoir influencé la désinfection par ozone L'ozone était également plus efficace pour contrôler les risques liés à Giardia. Le scénario 3 de ce service public fictif, qui menait une enquête sur l'utilisation de la microfiltration au lieu de la filtration conventionnelle, a démontré que la microfiltration pourrait être utilisée pour produire une qualité d'eau acceptable dans les conditions du modèle.
Les scénarios ci-dessus démontrent les effets sur les réductions d'agents pathogènes en fonction des paramètres d'entrée et des hypothèses utilisés. Comprendre les hypothèses formulées dans le modèle est essentiel à la bonne interprétation des résultats des scénarios. Par exemple, le scénario de ce service public fictif suppose que les processus d'enlèvement physique du service public atteignent les réductions moyennes logarithmiques pondérées signalées dans les études scientifiques, ce qui peut sous-estimer ou surestimer par plusieurs ordres de grandeur les réductions logarithmiques. Bien qu'il s'agisse d'un exemple d'hypothèse qui pourrait avoir une grande incidence sur les résultats du scénario, d'autres paramètres affichent une variabilité moindre et, par conséquent, auraient peu d'impact. Comprendre ces impacts fait partie de l'interprétation des résultats des scénarios analysés. Les scénarios ci-dessus seraient utilisés comme point de départ du service public fictif afin d'exécuter d'autres analyses qui explorent l'éventail d'impacts qui pourraient être prévus en modifiant le rendement des traitements. Le service public pourrait également souhaiter explorer davantage la variabilité des concentrations d'agents pathogènes afin de déterminer l'impact sur les risques estimés. Les niveaux de risque relatif pourraient alors être utiles lors de la prise de décisions sur des processus de traitement de rechange ou pour déterminer les paramètres d'entrée qui mériteraient une exploration approfondie de la variabilité propre à leur site afin de diminuer le degré d'incertitude liée aux résultats.
Partie C. Références et acronymes
C.1 Références
Armstrong, T.W. et Haas, C.N. (2008). Legionnaires' disease: Evaluation of a quantitative microbial risk assessment model. J. Water Health, 6(2): 149-166.
Ashbolt, N.J., Schoen, M.E., Soller, J.A. et Roser, D.J. (2010). Predicting pathogen risks to aid beach management: The real value of quantitative microbial risk assessment (QMRA). Water Res., 44(16): 4692-4703.
Casman, E.A., Fischhoff, B., Palmgren, C., Small, M.J. et Wu, F. (2000). An integrated risk model of a drinking-water - borne cryptosporidiosis outbreak. Risk Anal., 20(4): 495-511.
Diallo, M.B.C., Anceno, A.J., Tawatsupa, B., Houpt, E.R., Wangsuphachart, V. et Shipin, O.V. (2008). Infection risk assessment of diarrhea-related pathogens in a tropical canal network. Sci. Total Environ., 407(1): 223-232.
Emelko, M.B., Schmidt, P.J. et Roberson, J.A. (2008). Quantification of uncertainty in microbial data - reporting and regulatory implications. J. Am. Water Works Assoc., 100(3): 94-104+14.
Gibney, K.B., O'Toole, J., Sinclair, M. et Leder, K. (2014). Disease burden of selected gastrointestinal pathogens in australia, 2010. Int. J. Infect. Dis., 28: e176-e185.
Haas, C.N., Rose, J.B. et Gerba, C.P. (1999). Quantitative microbial risk assessment. Quantitative microbial risk assessment. John Wiley & Sons, Inc, New York, New York.
Havelaar, A.H. et Melse, J.M. (2003). Quantifying public health risk in the WHO Guidelines for drinking-water quality: a burden of disease approach. Rijkinstituut voor Volskgezondheid en Milieu, RIVM 734301022, Bilthoven, Pays Bas.
Hijnen, W.A.M. et Medema, G. (2007). Elimination of micro-organisms by drinking water treatment process: A review. Kiwa Water Research, Nieuwegein, Pays Bas.
Jaidi, K., Barbeau, B., Carrière, A., Desjardins, R. et Prévost, M. (2009). Including operational data in QMRA model: Development and impact of model inputs. J. Water Health, 7(1): 77-95.
Macler, B.A. et Regli, S. (1993). Use of microbial risk assessment in setting US drinking water standards. Int. J. Food Microbiol., 18(4): 245-256.
Makri, A., Modarres, R. et Parkin, R. (2004). Cryptosporidiosis susceptibility and risk: A case study. Risk Anal., 24(1): 209-220.
Mara, D.D., Sleigh, P.A., Blumenthal, U.J. et Carr, R.M. (2007). Health risks in wastewater irrigation: Comparing estimates from quantitative microbial risk analyses and epidemiological studies. J. Water Health, 5(1): 39-50.
Martins, M.T., Rivera, I.G., Clark, D.L. et Olson, B.H. (1992). Detection of virulence factors in culturable escherichia coli isolates from water samples by DNA probes and recovery of toxin-bearing strains in minimal o-nitrophenol-ß-D-galactopyranoside-4-methylumbelliferyl-ß-D- glucuronide media. Appl. Environ. Microbiol., 58(9): 3095-3100.
Medema, G., Teunis, P., Blokker, M., Deere, D., Davison, A., Charles, P., et Loret, J-F. (2009). Risk assessment of cryptosporidium in drinking water. Éditions de l'OMS, Organisation mondiale de la Santé, Genève, Suisse.
Messner, M.J., Chappell, C.L. et Okhuysen, P.C. (2001). Risk assessment for cryptosporidium: A hierarchical bayesian analysis of human dose response data. Water Res., 35(16): 3934-3940.
MOE (2006). Procedure for disinfection of drinking water in ontario. as adopted by reference by ontario regulation 170/03 under the safe drinking water act. Ontario Ministry of the Environment, PIBS 4448e01, Toronto, Ontario.
Murray, C. et Lopez, A. (1996). Global health statistics. Harvard School of Public Health, Cambridge, Massachusetts.
Murray, C.J.L. et Lopez, A.D. (1996). The global burden of disease: A comprehensive assessment of mortality and disability from disease, injury and risk factors in 1990 and projected to 2020. Harvard University Press, Cambridge, Massachusetts.
Nash, T.E., Herrington, D.A., Losonsky, G.A. et Levine, M.M. (1987). Experimental human infections with giardia lamblia. J. Infect. Dis., 156(6): 974-984.
OMS (2016). Quantitative microbial risk assessment: Application for water safety management. Organisation mondiale de la Santé, Genève, Suisse.
Ongerth, J.E. (2013). ICR SS protozoan data site-by-site: A picture of cryptosporidium and giardia in U.S. surface water. Environ. Sci. Technol., 47(18): 10145-10154.
Pouillot, R., Beaudeau, P., Denis, J.-. et Derouin, F. (2004). A quantitative risk assessment of waterborne cryptosporidiosis in france using second-order monte carlo simulation. Risk Anal., 24(1): 1-17.
Regli, S., Rose, J.B., Haas, C.N. et Gerba, C.P. (1991). Modeling the risk from giardia and viruses in drinking water. J. Am. Water Works Assoc., 83(11): 76-84.
Rose, J.B. et Gerba, C.P. (1991). Use of risk assessment for development of microbial standards. Water Sci. Technol., 24(2): 29-34.
Santé Canada (2011). Recommandations pour la qualité de l'eau potable au Canada : Document technique - les virus entériques. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa, Ontario. Disponible à : www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-virus-enteriques.html
Santé Canada (2012). Recommandations pour la qualité de l'eau potable au Canada : Document technique - les protozoaires entériques : Giardia et Cryptosporidium. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa, Ontario. Disponible à : www.canada.ca/fr/sante-canada/services/sante-environnement-milieu-travail/rapports-publications/qualite-eau/protozoaires-enteriques-giardia-cryptosporidium.html
Santé Canada (2013). Conseils sur l'utilisation des recommandations sur la qualité microbiologique de l'eau potable. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario).
Disponible à : www.canada.ca/fr/sante-canada/services/sante-environnement-milieu-travail/rapports-publications/qualite-eau/conseils-utilisation-recommandations-qualite-microbiologique-eau-potable-sante-canada-2013.html
Schijven, J., Derx, J., de Roda Husman, A.M., Blaschke, A.P. et Farnleitner, A.H. (2015). QMRAcatch: Microbial quality simulation of water resources including infection risk assessment. J. Environ. Qual., 44(5): 1491-1502.
Schijven, J.F., Teunis, P.F.M., Rutjes, S.A., Bouwknegt, M. et de Roda Husman, A.M. (2011). QMRAspot: A tool for quantitative microbial risk assessment from surface water to potable water. Water Res., 45(17): 5564-5576.
Signor, R.S. et Ashbolt, N.J. (2006). Pathogen monitoring offers questionable protection against drinking-water risks: A QMRA (quantitative microbial risk analysis) approach to assess management strategies. pp. 261-268. Available at: www.scopus.com/inward/record.url?eid=2-s2.0-33749155605&partnerID=40&md5=043744c9cf5e3b589eca03b2ba9e8313.
Signor, R.S. et Ashbolt, N.J. (2009). Comparing probabilistic microbial risk assessments for drinking water against daily rather than annualised infection probability targets. J. Water Health, 7(4): 535-543.
Smeets, P.W.M.H., van der Helm, A.W.C., Dullemont, Y.J., Rietveld, L.C., van Dijk, J.C. et Medema, G.J. (2006). Inactivation of escherichia coli by ozone under bench-scale plug flow and full-scale hydraulic conditions. Water Res., 40(17): 3239-3248.
Smeets, P.W.M.H., van Dijk, J.C., Stanfield, G., Rietveld, L.C. et Medema, G.J. (2007). How can the UK statutory cryptosporidium monitoring be used for quantitative risk assessment of cryptosporidium in drinking water? J. Water Health, 5(SUPPL. 1): 107-118.
Smeets, P.W.M.H., Dullemont, Y.J., Van Gelder, P.H.A.J.M., Van Dijk, J.C. et Medema, G.J. (2008). Improved methods for modelling drinking water treatment in quantitative microbial risk assessment; a case study of campylobacter reduction by filtration et ozonation. J. Water Health, 6(3): 301-314.
Soller, J.A. et Eisenberg, J.N.S. (2008). An evaluation of parsimony for microbial risk assessment models. Environmetrics, 19(1): 61-78.
Statistique Canada (2004). Source de données : Enquête sur la santé dans les collectivités canadiennes, cycle 2.2 - nutrition (phase 3) : Volet général sur la santé et rappel alimentaire de 24 heures. (Dossier de partage).
Statistique Canada (2008). Guide d'utilisation : Enquête sur la santé dans les collectivités canadiennes (ESCC), cycle 2.2 - nutrition : Volet général sur la santé (y compris les vitamines et les suppléments minéraux) et volets sur les rappels alimentaires de 24 heures, Statistique Canada, Ottawa, 2008.
Statistique Canada (2011). Navigateur des données du recensement - âge et sexe pour le Canada. Disponible à : www12.statcan.gc.ca/census-recensement/2011/dp-pd/map-carte/index-fra.cfm.
Statistique Canada (2012). Tables de mortalité, Canada, provinces et territoires 2007-2009, ministère de l'Industrie, ISBN : 978-1-100-21498-6.
Strachan, N.J.C., Doyle, M.P., Kasuga, F., Rotariu, O. et Ogden, I.D. (2005). Dose response modelling of escherichia coli O157 incorporating data from foodborne and environmental outbreaks. Int. J. Food Microbiol., 103(1): 35-47.
Teunis, P.F.M., Medema, G.J., Kruidenier, L. et Havelaar, A.H. (1997). Assessment of the risk of infection by cryptosporidium or giardia in drinking water from a surface water source. Water Res., 31(6): 1333-1346.
Teunis, P.F.M., Moe, C.L., Liu, P., Miller, S.E., Lindesmith, L., Baric, R.S., Le Pendu, J. et Calderon, R.L. (2008). Norwalk virus: How infectious is it? J. Med. Virol., 80(8): 1468-1476.
Teunis, P.F.M., Rutjes, S.A., Westrell, T. et de Roda Husman, A.M. (2009). Characterization of drinking water treatment for virus risk assessment. Water Res., 43(2): 395-404.
U.S. EPA (2003). LT1ESWTR disinfection profiling and benchmarking technical guidance manual. Office of Water, U.S. Environmental Protection Agency, Washington, DC.
U.S. EPA (2005). Economic analysis for the final Long Term 2 Enhanced Surface Water Treatment Rule. U.S. Environmental Protection Agency, EPA 815-R-06-001.
U.S. EPA (2006). Economic analysis for the final Groundwater Rule. U.S. Environmental Protection Agency, EPA 815-R-06-014.
U.S. EPA (2014). Microbiological risk assessment (MRA) tools, methods, and approaches for water media. Office of Water, Office of Science and Technology. U.S. Environmental Protection Agency, EPA-820-R-14-009, Washington, DC.
C.2 Acronymes
- AVCI
- années de vie corrigées de l'incapacité
- AVI
- années vécues avec une incapacité
- AVP
- années de vie perdues
- CT
- concentration × temps
- ÉQRM
- évaluation quantitative du risque microbien
- EPA
- Environmental Protection Agency (États-Unis)
- ÉQRM
- de SC évaluation quantitative du risque microbien (modèle) de Santé Canada
- IRSU
- insuffisance rénale chronique au stade ultime
- LD
- limite de détection
- OMS
- Organisation mondiale de la Santé
- RCA
- réacteur continu agité
- SGB
- syndrome de Guillain-Barré
- SHU
- syndrome hémolytique et urémique
- UV
- ultraviolet