Protocole d’essai clinique sur la croissance et la tolérance – Nouveau-nés à terme et en santé
Document d’orientation à l’intention des fabricants de préparations pour nourrissons
2021
Table des matières
- 1.0 Introduction
- 2.0 Définitions
- 3.0 Protocole pour les essais cliniques sur la croissance et la tolérance pour soutenir le processus de soumission préalable à la mise en marché des préparations pour nourrissons à terme
- 3.1 Enregistrement
- 3.2 Titre de l'étude
- 3.3 Résumé
- 3.4 Introduction et contexte
- 3.5 Conception de l'étude
- 3.5.1 Description de la conception de l'étude
- 3.5.2 Objectifs de l'étude
- 3.5.3 Choix de la marge de non-infériorité/supériorité
- 3.5.4 Admissibilité du sujet
- 3.5.5 Taille de l'échantillon
- 3.5.6 Intervention
- 3.5.7 Durée de l'étude
- 3.5.8 Affectation
- 3.5.9 Insu
- 3.5.10 Collecte de données et résultats
- 3.5.11 Événements indésirables
- 3.5.12 Règles d'arrêt, interruptions, retraits et abandons
- 3.5.13 Procédures de contrôle de la qualité
- 3.5.14 Comité indépendant de surveillance des données
- 3.5.15 Violation du protocole
- 3.5.16 Modification du protocole
- 3.5.17 Analyses statistiques planifiées
- 3.6 Résultats de l'étude
- 3.7 Discussion et conclusions
- 4.0 Normes éthiques pour les chercheurs
- 5.0 Glossaire et références
- Appendice 1. Liste de contrôle CONSORT 2010 des renseignements à inclure dans les rapports d'un essai randomisé
1.0 Introduction
Les préparations pour nourrissons doivent toutes être sûres et propres à la consommation humaine conformément à l'article 4.1 de la Loi sur les aliments et drogues. Ces aliments, destinés aux nourrissons, sont réglementés en vertu du titre 25 de la partie B du Règlement sur les aliments et drogues (RAD) et doivent faire l'objet d'une évaluation préalable à la mise en marché par Santé Canada.
Les demandeurs doivent soumettre un avis avant la vente pour toute nouvelle préparation pour nourrissons, ou pour un tel produit qui a fait l'objet d'un changement majeur à sa composition, à sa fabrication ou à son emballage. Les avis doivent inclure la preuve établissant que la préparation pour nourrissons est sûre et a une valeur nutritive adéquate pour favoriser une croissance et un développement acceptables chez les nourrissons si elle est consommée conformément au mode d'emploi.
L'objectif de ce document est de fournir des directives aux fabricants concernant la conception appropriée d'un essai clinique de croissance et de tolérance. Santé Canada encourage les fabricants à consulter le Bureau des sciences de la nutrition sur le protocole d'essai clinique pour tout essai prévu, et à solliciter une réunion préalable à la demande d'approbation pour passer en revue les données probantes requises pour une évaluation avant la mise en marché, comme les exigences peuvent varier.
2.0 Définitions
- Changement majeur dans le cas d'un succédané de lait humain (article B.25.001 du RAD)
Signifie, en ce qui concerne un fortifiant pour lait humain ou un succédané de lait humain, tout changement apporté à un ingrédient ou à la quantité d'un ingrédient ou toute modification au traitement ou à l'emballage du fortifiant pour lait humain ou du succédané de lait humain, si l'expérience du fabricant ou la théorie généralement acceptée prévoit que ce changement aurait un effet indésirable sur les niveaux ou la disponibilité des éléments nutritifs ou sur l'innocuité microbiologique ou chimique du fortifiant pour lait humain ou du succédané de lait humain.
Exemples de changements majeurs apportés à une préparation pour nourrissons:
- changement important apporté au traitement ou à l'emballage de la préparation pour nourrissons, ou modification de l'installation de fabrication ou ajout d'une nouvelle installation
- ajout d'une nouvelle source de macronutriments (protéines, lipides ou glucides)
- changement important de la teneur en protéines, en lipides ou en glucides
- ajout d'un nouvel ingrédient ou d'un aliment nouveau
- modification de la quantité ou des sources de vitamines ou de minéraux qui, selon l'expérience du fabricant ou la théorie généralement acceptée, aurait un effet indésirable sur :
- les niveaux ou la disponibilité des éléments nutritifs, ou
- l'innocuité microbiologique ou chimique.
Pour de plus amples renseignements sur les données scientifiques nécessaires pour établir la valeur nutritive adéquate d'une nouvelle préparation pour nourrissons, ou pour une telle préparation ayant subi un changement important, veuillez consulter le guide « Guide pour démontrer que la valeur nutritive est adéquate– Préparations pour nourrissons nés à terme et en santé ».
- Croissance physique normale
La croissance physique est évaluée en regard des Normes de croissance de l'enfant de l'Organisation mondiale de la Santé (2006).
- Nourrisson à terme et en santé
S'entend d'un nourrisson dont l'âge gestationnel se situe entre 37 et 42 semaines et le poids à la naissance est égal ou supérieur à 2,5 kilogrammes, et qui ne présente aucune maladie(1).
- Préparation pour nourrissons (article B.25.001 du RAD)
Il s'agit du nom usuel d'un succédané de lait humain.
- Succédané de lait humain (article B.25.001 du RAD)
Désigne tout aliment présenté a) comme un remplacement partiel ou total du lait humain et destiné à être consommé par des bébés, ou b) comme pouvant être utilisé comme ingrédient d'un aliment visé à l'alinéa a).
- Succédané de lait humain nouveau (préparations pour nourrissons) (article B.25.001 du RAD)
Désigne un succédané de lait humain :
- soit qui est fabriqué pour la première fois,
- soit qui est vendu au Canada pour la première fois,
- soit qu'une personne fabrique pour la première fois.
- Une croissance en santé
Englobe tous les aspects de la croissance physique et du développement normal, y compris la maturation des systèmes organiques et l'atteinte du développement fonctionnel normal des systèmes moteur, neurocognitif et immunitaire (1).
3.0 Protocole pour les essais cliniques sur la croissance et la tolérance pour soutenir le processus de soumission préalable à la mise en marché des préparations pour nourrissons à terme
Les sections suivantes abordent toutes les exigences générales d'un protocole d'essai clinique pour une étude sur la croissance et la tolérance chez les nourrissons à terme et en santé. Le rapport d'étude doit suivre le format précisé à l'appendice 1 (liste de contrôle CONSORT 2010).
3.1 Enregistrement
L'enregistrement des essais cliniques doit répondre aux exigences suivantes :
- Le protocole doit être inscrit dans un registre d'essai clinique. On peut trouver des exemples de registres primaires d'essais sur le site Web de l'OMS (2).
- Le registre doit inclure tous les renseignements et critères précisés dans l'Ensemble des données sur l'enregistrement des essais cliniques de l'Organisation mondiale de la Santé (OMS) (3).
- Le numéro d'enregistrement et le nom du registre d'essai doivent être déclarés.
- L'enregistrement doit indiquer où l'on peut consulter le protocole complet de l'essai (4).
- Bien que des changements au protocole soient fortement découragés une fois l'essai en cours, l'enregistrement de l'essai clinique doit être mis à jour lorsque des modifications sont apportées ou s'il y a non-respect du protocole après le début de l'essai; les détails doivent être clairement décrits dans le rapport de l'essai (5).
3.2 Titre de l'étude
Le titre de l'étude doit préciser qu'il s'agit d'un essai randomisé de non-infériorité chez des nouveau-nés à terme et en santé (5,6).
3.3 Résumé
Le protocole et le rapport d'étude doivent inclure un résumé qui décrit les objectifs, la conception et la méthode de l'essai utilisés dans la collecte et l'analyse des données, ainsi que les résultats et les conclusions de l'étude (7).
3.4 Introduction et contexte
Les renseignements suivants doivent figurer dans l'introduction :
- nom et description des produits à l'étude, y compris leur forme physique (p. ex. poudre, liquide concentré, etc.) et confirmation que le produit témoin concomitant est approprié;
- justification pour l'essai clinique et une question d'étude clairement énoncée;
- description de l'échantillon de population à étudier et de ses similitudes avec la population cible;
- référence à la littérature et aux données qui présentent un intérêt pour l'essai, y compris le contexte de celui-ci;
- résumé des résultats des études cliniques et non cliniques pertinentes;
- résumés des risques et des avantages connus et potentiels, le cas échéant, pour les sujets humains, en particulier les nourrissons.
3.5 Conception de l'étude
3.5.1 Description de la conception de l'étude
L'étude doit être conçue selon la norme d'excellence des essais cliniques : une étude prospective, randomisée, bien contrôlée, parallèle, monocentrique ou multicentrique et à double insu (8). Il faut inclure un diagramme schématique de la conception de l'essai, des procédures et des étapes.
3.5.2 Objectifs de l'étude
Les objectifs de l'étude doivent être d'évaluer les effets de la préparation expérimentale ou d'essai sur les mesures de croissance et de tolérance. Le produit témoin utilisé pour la comparaison est une préparation pour nourrissons mise en marché au Canada, qui a fait l'objet d'essais cliniques et qui s'est avérée sûre et adéquate sur le plan nutritionnel, et conforme à une norme de croissance internationale acceptable (8,9).
3.5.2.1 Objectif premier
L'objectif premier de l'essai doit être d'évaluer la valeur nutritive adéquateNote de bas de page 1, mesurée par le taux de gain de poids au cours d'une période de 16 semaines débutant durant les 14 premiers jours de vie, exprimée en grammes par jour chez des nouveau-nés à terme et en santé recevant la préparation pour nourrissons expérimentale, par rapport à ceux recevant une préparation pour nourrissons témoin concomitante, mise en marché au Canada (9).
Notes de bas de page
- Note de bas de page 1
-
Pour plus d’informations sur les données probantes requises par Santé Canada pour démontrer que les préparations pour nourrissons offrent une valeur nutritive adéquate, veuillez consulter Guide pour démontrer que la valeur nutritive est adéquate - Préparations pour nourrissons à terme.
3.5.2.2 Objectifs secondaires
Les objectifs secondaires devraient être d'évaluer les mesures de croissance et d'innocuité et de faire les comparaisons subséquentes entre le groupe d'essai, le groupe témoin et le groupe des nourrissons allaités. Le groupe des nourrissons allaités doit être considéré comme un groupe de référence. Comme la croissance des nourrissons allaités constitue la référence en matière de croissance, en comparant celle de ces nourrissons avec celle des nourrissons du groupe d'essai, nous obtiendrons des renseignements supplémentaires pour évaluer la signification physiologique d'un effet d'une nouvelle substance de la préparation sur la croissance (10).
Les paramètres de croissance et d'innocuité suivants devraient constituer les objectifs secondaires :
- comparaison des moyennes de groupe représentées sur les courbes pour le poids, la taille et le périmètre crânien à des intervalles préétablis avec les percentiles des Normes de croissance de l'enfant de l'OMS, 2006 (11);
- taux d'augmentation de la taille et du périmètre crânien, exprimés en cm/semaine;
- comparaison des écarts réduits moyens de groupe standardisés et représentés sur les courbes (et leurs intervalles de confiance à 95 %) pour le poids, la taille et le périmètre crânien par rapport à l'âge, et le poids par rapport à la taille sur la base des Normes de croissance de l'enfant de l'OMS (2006) par sexe;
- tolérance (y compris, mais sans s'y limiter, les coliques, l'irritabilité, les crampes, les habitudes de sommeil, les vomissements, les régurgitations, la constipation, la diarrhée et les caractéristiques des selles);
- volume quotidien moyen de la consommation de préparations pour nourrissons ainsi que des renseignements sur les méthodes utilisées pour déterminer cette consommation;
- types et incidence des événements indésirables et des événements indésirables graves;
- toute épreuve biochimique prévue (la nécessité de tels tests dépend de la nature de la formulation et serait déterminée au cas par cas).
3.5.3 Choix de la marge de non-infériorité/supériorité
Au moins une étude clinique suffisamment puissante doit être menée dans la population cible pour évaluer l'innocuité et la valeur nutritive adéquate de la préparation d'essai. La conception de l'essai clinique dépend de nombreux facteurs et des objectifs de l'étude.
Un essai de non-infériorité, avec une marge de non-infériorité (MNI) prédéfinie, est fortement recommandé lorsque l'objectif de l'étude est d'évaluer l'innocuité et de déterminer que la valeur nutritive est adéquate chez les nourrissons recevant la préparation d'essai par rapport à ceux recevant la préparation commerciale témoin (6,8). Si un test supplémentaire de l'efficacité de la préparation d'essai est prévu (p. ex. pour soutenir une allégation santé), une analyse de supériorité est également requise (8,12).
L'hypothèse d'essai concernant la non-infériorité des taux de croissance des nourrissons recevant la préparation d'essai par rapport à ceux recevant la préparation témoin doit être clairement énoncée, en précisant la MNI – qui doit être cliniquement justifiée (6).
Il est nécessaire de définir au préalable la MNI. Pour déterminer la MNI, il faut s'appuyer sur une combinaison de considérations statistiques et de jugement clinique. Inclure une justification et/ou la littérature scientifique pour justifier le choix de la marge dans le protocole. La marge choisie pour un essai de non-infériorité ne doit pas être supérieure à la plus petite ampleur de l'effet du produit témoin. L'importance et la variabilité de l'ampleur de l'effet du produit témoin, calculées à partir d'essais historiques, devraient être prises en considération (13). De plus, la MNI sélectionnée devrait refléter les incertitudes dans les données probantes sur lesquelles le choix est fondé, être suffisamment prudente et tenir compte de la variabilité (6, 13). Le protocole doit inclure un raisonnement ou de la littérature scientifique pour justifier le choix d'une telle marge.
En 1988, le groupe de travail de l'American Academy of Pediatrics (AAP), sur la base des données de Neilson de 1987, a recommandé qu'une différence de gain de poids liée à l'alimentation de plus de 3 g/jour au cours d'une période de 3,5 mois soit considérée comme significative sur le plan nutritionnel et clinique, et que l'écart-type du gain de poids par sexe et par préparation pour cette période de 3,5 mois soit d'environ 4,5 g/jour. Au cours des dernières décennies, plusieurs directives internationales et d'essais cliniques ont choisi la différence de 3 g/jour de gain de poids comme MNI cliniquement acceptable (p. ex. -3 g/jour) (1, 8, 14, 15, 16, 17). L'examen systématique et la méta-analyse internes de Santé Canada (Chen et al., note interne de 2020), qui ont utilisé les données regroupées de 20 études cliniques récentes sur la croissance des nourrissons (18) et l'étude de Guo et al., 1991 (19) montrent que la MNI de -3 g/jour est raisonnable et acceptable (voir la figure 1 ci-dessous). L'écart-type du gain de poids des nourrissons au cours de la période de 3,5 mois est toutefois d'environ 6,0 g/jour, ce qui est supérieur à la valeur de 4,5 g/jour de l'AAP (1988).
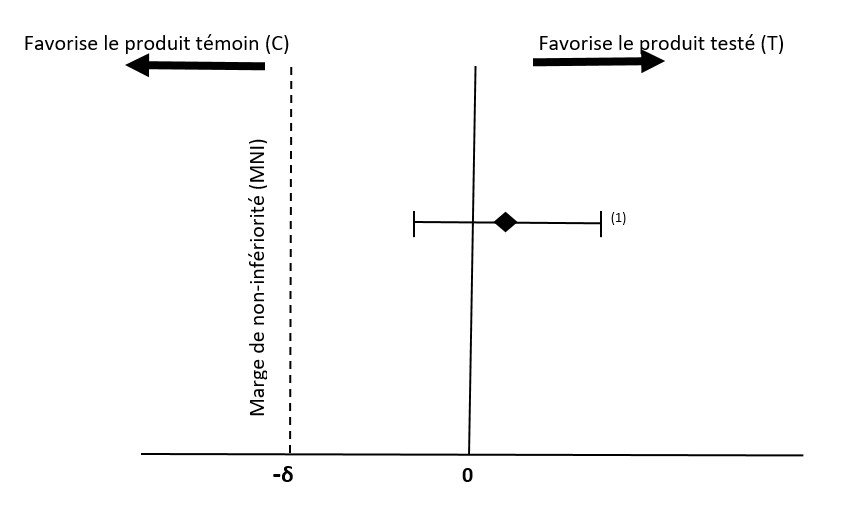
Figure 1 - Équivalent textuel
Comparaison du MNI cliniquement acceptable de -δ et de la différence moyenne estimée du taux de prise de poids (T-C) et de son intervalle de confiance à 95%. Le produit testé (T) est non-inférieur au produit témoin (C), mais pas supérieur(1) (20).
3.5.4 Admissibilité du sujet
Au début de l'étude, les sujets doivent être des nouveau-nés à terme et en santé, âgés de 0 à 14 jours, et la mère doit avoir déjà décidé de ne pas allaiter les nourrissons qui font partie des groupes recevant la préparation. Il faut inclure des nourrissons de sexe masculin et féminin dans l'étude, à des chiffres qui respectent le calcul de la taille de l'échantillon. Les méthodes de recrutement, les milieux cliniques et les lieux géographiques où les critères d'admissibilité seront recueillis doivent être déclarés (21). Les dates définissant les périodes de recrutement et de suivi, ainsi que des renseignements sur la façon dont on prévoit faire le suivi de ces sujets doivent être fournis.
Les critères d'inclusion et d'exclusion ci-dessous doivent être appliqués.
Critères d'inclusion
- Nouveau-né en santé;
- naissance unique, nouveau-né à terme (37 à 42 semaines de gestation);
- poids de naissance de 2 490 à 4 200 grammes;
- âge de 0 à 14 jours au moment de l'inscription;
- formulaire de consentement signé obtenu d'un parent ou d'un tuteur légal;
- alimentation exclusive aux préparations avant le début de l'étude et les mères acceptent de s'abstenir complètement de fumer pendant toute la période de l'étude;
- l'allaitement maternel exclusif depuis la naissance pour le groupe de nourrissons allaités et les mères acceptent d'allaiter pendant toute la période d'étude et de s'abstenir complètement de fumer pendant toute la période de l'étude.
Critères d'exclusion
- Antécédents d'une maladie, d'un problème de santé ou d'une malformation congénitale sous-jacent, qui, de l'avis du chercheur, seraient susceptibles de nuire à la croissance et au développement normaux ou à l'évaluation du participant;
- participation à un autre essai clinique qui n'a pas été approuvé par le promoteur;
- antécédents familiaux d'intolérance/allergie aux protéines du lait de vache;
- antécédents maternels ayant des effets indésirables connus sur le fœtus ou le nouveau-né, comme le diabète, la tuberculose progressive, une infection périnatale ou la toxicomanie.
3.5.5 Taille de l'échantillon
Le calcul de la taille de l'échantillon devrait être fondé sur le résultat primaire, avec des méthodes ou des critères particulièrement conçus pour un essai de non-infériorité. Différents facteurs sont pris en compte pour déterminer la bonne taille d'échantillon, y compris le choix d'une MNI et la puissance statistique.
Comme indiqué au point 3.5.3, la MNI de -3 g/jour dans le taux de gain de poids du nourrisson sur une période de 3,5 mois commençant pendant les deux premières semaines de vie est considérée comme une marge cliniquement acceptable. L'écart-type du taux de gain de poids en fonction du sexe et de la préparation pour une période de 3,5 mois est d'environ 6,0 g/jour (19,22). Une récente méta-analyse montre également que la différence de gain de poids entre les nourrissons recevant la préparation d'essai et ceux recevant une préparation témoin concomitante au cours des 3,5 premiers mois de vie n'est pas statistiquement significative (10).
Il est donc recommandé de calculer la taille de l'échantillon pour vérifier si la préparation expérimentale est inférieure à la préparation témoin. Si la MNI de -3 g/jour, et en supposant que la différence moyenne attendue de prise de poids sur 3,5 mois entre le groupe d'essai et le groupe témoin est de zéro et que l'écart-type commun est de 6,0 g/jour, le nombre de sujets d'un sexe donné nécessaire dans chaque groupe de l'étude pour déterminer que la préparation d'essai est non-inférieure à la préparation témoin en matière de taux de gain de poids avec une puissance de 90 % et un alpha de 0,025 est de 42 sujets pour chaque sexe (n = 84 par groupe). Si le taux d'abandon prévu est de 25 %, la taille minimale requise de l'échantillon serait de 112 sujets par groupe. Le calcul de la puissance statistique à la fin de l'étude est également requis. Comme il est bien établi que la croissance des nourrissons de sexe masculin et féminin est différente, les sujets doivent être stratifiés par sexe et la croissance doit être évaluée séparément (23).
3.5.6 Intervention
Les détails précis de l'intervention prévue pour chaque groupe doivent être déclarés. Il est recommandé que les sujets soient affectés aux groupes suivants selon un rapport équilibré.
- Produit d'essai
Le produit d'essai doit être celui proposé pour le marché canadien. Il doit être conforme aux exigences de l'article B.25.046 du RAD.
- Produit témoin
Un produit témoin doit être inclus dans l'étude. Il est recommandé d'utiliser une préparation commerciale canadienne pour nourrissons comme produit témoin concomitant.
Remarque : Dans le cas d'une préparation pour nourrissons à laquelle a été ajouté un nouvel ingrédient, les produits d'essai et témoin doivent être identiques, à l'exception du nouvel ingrédient.
- Comparaison
Le protocole doit relever et décrire toutes les différences dans la composition et les profils nutritionnels, y compris la densité énergétique du produit d'essai et du produit témoin.
- Groupe de référence
Un groupe de référence concomitant de nourrissons allaités doit être inclus.
3.5.7 Durée de l'étude
Les sujets doivent recevoir exclusivement la préparation assignée (environ 80 à 90 % de l'apport quotidien) pendant la période de pic de croissance (à partir de 14 jours d'âge ou moins pendant au moins 16 semaines, 112 jours). Un suivi à long terme est fortement encouragé dans certains cas pour confirmer l'innocuité et les effets nutritionnels à long terme des préparations contenant des ingrédients ajoutés nouveaux (comme les probiotiques). Santé Canada peut également demander une surveillance à plus long terme suivant la mise en marché, s'il y a lieu.
3.5.8 Affectation
La répartition des participants entre le groupe d'essai et le groupe témoin doit se faire de façon aléatoire et dissimulée, et dans le respect des lignes directrices CONSORT (7,6). La randomisation réduit le biais de sélection en contrôlant les facteurs de confusion connus et inconnus dans la population à l'étude. Le processus de randomisation comprend les aspects suivants (7,21) :
- Génération de séquence
Décrire la méthode utilisée pour générer la séquence de répartition aléatoire. Les méthodes adéquates comprennent l'utilisation d'un tableau de nombres aléatoires ou d'un générateur de nombres aléatoires informatisé (6). La randomisation des sujets devrait être stratifiée selon la catégorie de poids de naissance, le lieu (dans un essai multicentrique) et le sexe, comme les garçons n'ont pas le même taux de croissance que les filles.
- Dissimulation de la répartition
La séquence de répartition aléatoire doit être dissimulée jusqu'à ce que le recrutement soit terminé et irrévocable, et que les interventions aient été attribuées. Par exemple, la répartition du traitement pourrait être dissimulée par un outil de randomisation ou de répartition informatisé ou en dissimulant le traitement assigne dans des contenants opaques, scellées et numérotes dans l'ordre, ou dans des enveloppes opaques scellées et agrafées (21).
On recommande de bons mécanismes de dissimulation de la répartition des traitements, qui intègrent une participation externe (p. ex. deux techniques courantes sont l'utilisation d'une pharmacie ou d'un système de randomisation par téléphone central) (21).
- Mise en œuvre de la randomisation
Le protocole doit inclure des renseignements détaillés sur tout le personnel chargé de générer la séquence aléatoire, de recruter des participants et de répartir les participants entre les différents groupes de l'étude (21). Toute déviation par rapport à la répartition aléatoire doit être décrite dans le rapport d'étude.
3.5.9 Insu
Le traitement utilisé ne doit pas être révélé aux participants à l'étude (parents ou fournisseurs de soins), aux chercheurs ou aux autres employés de l'étude. Les produits d'essai et témoins doivent être identiques en termes d'apparence (p. ex. l'emballage et la texture), de goût et d'odeur (21). Des renseignements détaillés doivent être fournis au sujet de la façon dont les produits sont étiquetés (p. ex. par code de sujet individuel), les personnes qui ont accès aux codes de produits, les circonstances prédéfinies dans lesquelles l'insu pourrait être levé, le cas échéant, et les membres de l'équipe de chercheurs pour qui l'insu serait levé en cas d'un tel besoin. De plus, il faut maintenir l'insu jusqu'à la fin de l'étude. Les évaluateurs des résultats doivent participer en aveugle en tout temps.
3.5.10 Collecte de données et résultats
3.5.10.1 Calendrier de collecte
Il faut décrire le calendrier de collecte de données. Les sujets du groupe d'essai et du groupe témoin doivent être inscrits et suivis en parallèle. Les antécédents médicaux antérieurs à la première visite de l'étude doivent être recueillis dans les dossiers médicaux. Les données sur les médicaments concomitants doivent être recueillies et comparées entre les groupes. Un calendrier approprié pour la collecte des données est présenté dans le tableau 1, ci-dessous.
Type of Data |
Visite d'inscription1 |
Visite au jour2 |
||||
|---|---|---|---|---|---|---|
Jour 14 |
Jour 28 |
Jour 56 |
Jour 84 |
Jour 112 |
||
Inscription/randomisation |
Collecter l'ensemble des données de base (ci-dessus) x |
|||||
Données démographiques |
x |
|||||
Poids, taille et périmètre crânien |
x |
x |
x |
x |
x |
x |
Historique des intervalles3 |
x |
x |
x |
x |
x |
|
Événements indésirables, vérifiés par un professionnel de la santé |
x |
x |
x |
x |
x |
|
1Le jour de la naissance est le jour zéro (0) de la vie (inscription de 0 à 14 jours d'âge); l'inscription peut aller jusqu'au jour 14 de l'âge.
2Créneau de visite ± 3 jours.
3Recueil des carnets de bord des parents consignant par écrit les prises alimentaires et les données sur la tolérance, ainsi que tout événement ou réaction indésirable, collectés pendant au moins les 3 derniers jours avant chaque visite.
Les données de mesure doivent être prélevées en respectant les procédures normalisées, à l'aide d'instruments étalonnés. La formation du personnel de l'essai ainsi que les procédures d'assurance de la qualité doivent être en place pour veiller à ce que les mesures soient aussi précises et exactes que possible pour tous les participants, sites d'essai et moment d'enregistrement des données. Si les données recueillies ne sont pas complètes, la portée et l'incidence des données manquantes doivent être décrites dans le rapport d'étude, et l'approche adoptée pour tenir compte des données manquantes doit être déclarée.
3.5.10.2 Collecte des renseignements démographiques de base
Afin de permettre une évaluation scientifique complète de l'étude, les renseignements de base suivants doivent être consignés pour chaque participant :
- sexe du nourrisson;
- méthode d'accouchement (accouchement vaginal ou césarienne);
- naissance unique, jumeaux ou triplés;
- poids à la naissance en grammes;
- la gestation en semaines complètes;
- le poids de naissance par gestation (p. ex. petit pour l'âge gestationnel, adéquat pour l'âge gestationnel);
- données anthropométriques au début de l'essai, y compris le poids corporel, la taille et le périmètre crânien en valeurs absolues et en scores z, en consignant la norme de croissance utilisée pour calculer les scores z. Veuillez consulter les liens suivants pour des explications sur la façon de mesurer le poids, la taille et le périmètre crânien des nourrissons :
- http://depts.washington.edu/growing/Assess/Anthro.htm
- https://www.dhcs.ca.gov/services/chdp/Documents/HAG/4AnthropometricMeasure.pdf
- âge au recrutement, à la randomisation et au début de chaque intervention et à chaque point d'évaluation;
- race et/ou ethnicité;
- âge, niveau de scolarité et indice de masse corporelle (IMC) de la mère et du père;
- antécédents de tabagisme, de consommation d'alcool et de prise de médicaments pendant la grossesse;
- statut socio-économique (si possible).
3.5.10.3 Collecte des données sur la prise alimentaire
Les parents doivent consigner la consommation de préparation pour nourrissons pendant au moins les 3 derniers jours avant chaque visite de l'étude et la prise alimentaire moyenne doit être calculée par le coordonnateur de l'étude. Des systèmes appropriés doivent être mis en place pour évaluer le respect de la prise de la préparation assignée pendant l'étude. Ces données sont importantes pour l'interprétation des résultats de l'essai.
3.5.10.4 Mesures des résultats
Les paramètres de résultats suivants doivent être mesurés pendant la durée d'au moins 112 jours. Au minimum, les mesures doivent être prises aux moments clés suivants : à l'inscription, au jour 0, 14, 28, 56, 84 et 112 de l'étude (9,23). Les visites de l'étude doivent être effectuées aussi près que possible de celles prévues dans le protocole, en permettant un créneau maximum de ±3 jours pour les visites. Toutes les méthodes utilisées pour améliorer la qualité des mesures (p. ex. observations multiples, formation des évaluateurs, etc.) doivent être déclarées.
- Résultat principal
Taux de prise de gain de poids au cours de l'étude, exprimé en grammes par jour, entre le jour 0 de l'étude et la fin des 16 semaines (c'est-à-dire la fin de l'étude) (23).
- Résultats secondaires
Les résultats suivants sur la croissance et l'innocuité devraient faire l'objet de comparaisons entre le groupe d'essai et le groupe témoin :
- le poids corporel, la taille et le périmètre crânien de chaque participant à chaque visite de l'étude;
- le taux de gain pour la taille (millimètres par jour) et le périmètre crânien (centimètres par semaine) entre le jour 0 de l'étude et la fin des 16 semaines (fin de l'étude);
- les scores z standardisés représentés sur les courbes pour le poids par rapport à l'âge, la taille par rapport à l'âge, le périmètre crânien par rapport à l'âge et le poids par rapport à la taille, ainsi que les méthodes utilisées pour calculer les scores z sur la base des Normes de croissance de l'enfant de l'OMS (2006), de chaque participant et de la moyenne du groupe (et leurs intervalles de confiance à 95 %) au départ et à chaque visite de l'étude;
- le gain de poids par intervalle (grammes par jour) à des intervalles préétablis;
- les données de croissance brutes individuelles et les moyennes de groupe par rapport aux percentiles de croissance des Normes de croissance de l'enfant de l'OMS (2006);
- le volume moyen de la prise quotidienne de préparation pour nourrissons en millilitres;
- les mesures d'indices biochimiques/de biomarqueurs des éléments nutritifs, s'il y a lieu (p. ex. taux sérique de ferritine lorsqu'une nouvelle source de fer ou une nouvelle teneur en fer est utilisée dans la préparation pour nourrissons, et taux d'azote uréique sanguin lorsqu'une nouvelle source de protéines ou une nouvelle teneur en protéines est utilisée dans la préparation pour nourrissons);
- l'acceptation/la tolérance, soit le journal des parents et l'évaluation par les médecins de la tolérance (irritabilité, coliques, habitudes de sommeil, crampes, régurgitation, diarrhée, constipation et caractéristiques des selles), des manifestations respiratoires et dermatologiques;
- le nombre de participants présentant une allergie alimentaire et/ou des symptômes gastro-intestinaux (tels que l'urticaire, le gonflement du corps ou du visage, les vomissements);
- des registres de tous les événements indésirables et événements indésirables graves consignés dans les journaux quotidiens rédigés par les parents/fournisseurs de soins et vérifiés par un professionnel de la santé;
- la fréquence et la gravité des événements indésirables et des événements indésirables graves, ainsi que le nombre total de participants ayant subi un événement indésirable.
3.5.11 Événements indésirables
Des renseignements précis et clairs sur les événements indésirables et les effets secondaires observés durant l'étude, ou durant une période de suivi prédéterminée, doivent être soigneusement consignés et déclarés, que ces événements ou effets soient ou non immédiatement associés au traitement à l'étude (24).
Le protocole pour établir avec certitude les événements indésirables et les effets secondaires possibles doit être défini a priori et déclaré. L'information à fournir comprend la durée et la fréquence des activités de surveillance, une définition de cas pour les événements indésirables courants ou prévus avec des critères normalisés, des listes de contrôle ou bien des échelles ou des scores de diagnostic valides pour les diagnostics, le cas échéant. Il faut également indiquer le nom des personnes ayant détecté ou confirmé l'événement indésirable (p. ex. les parents, l'investigateur, le personnel clinique, le promoteur) ainsi que la manière dont les renseignements ont été recueillis (p. ex. les questionnaires, les journaux, la surveillance passive ou active). Le cas échéant, il faut également consigner la méthode pour traiter et compter les événements récurrents. Toutes les lignes directrices sur l'arrêt de l'essai en lien avec les événements indésirables doivent être définies et décrites.
En cas d'événements indésirables, pour chaque cas, les renseignements suivants doivent être consignés dans les dossiers médicaux et être confirmés par des professionnels de la santé au besoin :
- numéro du sujet, date et durée de l'événement;
- description de l'événement;
- sévérité (légère, modérée, sévère);
- gravité et fréquence;
- attribution potentielle à l'alimentation de l'essai;
- mesures prises et détails de tout médicament utilisé;
- retrait du participant après l'événement indésirable.
3.5.12 Règles d'arrêt, interruptions, retraits et abandons
Le protocole doit fournir des détails sur la procédure de surveillance des événements indésirables graves et indiquer les règles d'arrêt, ainsi que les critères d'interruption et ceux de retrait pour les sujets individuels, soit pour une partie de l'essai, soit pour toute sa durée, ainsi que le plan de suivi des sujets qui ont fait l'objet d'un retrait ou qui ont abandonné l'essai (24).
Des mécanismes doivent être en place pour réduire autant que possible les retraits de l'essai, pour des raisons autres que des événements indésirables prévus ou inattendus. Le chercheur principal doit faire des efforts raisonnables pour déterminer les raisons de l'abandon dans tous les cas où un participant se retire de l'essai avant sa fin. Les détails suivants sur les sujets qui ne se sont pas conformés aux exigences, ou qui se retirent de l'essai ou l'abandonnent doivent être bien saisis et déclarés :
- description détaillée des participants qui ne se sont pas conformés aux exigences, et de ceux qui se sont retirés de l'essai ou qui l'ont abandonné;
- description des raisons du retrait ou de l'abandon de l'essai;
- date et âge au moment de l'arrêt de la participation selon le protocole;
- détails des préparations pour nourrissons avant l'abandon ou le retrait;
- durée de participation du sujet à l'essai avant l'abandon;
- raisons de la non-conformité;
- âge au retrait ou à l'abandon de l'essai.
3.5.13 Procédures de contrôle de la qualité
Le protocole doit décrire les procédures de contrôle de la qualité avec des procédures opérationnelles normalisées (PON) écrites pour garantir que l'essai est réalisé et que les données sont produites, consignées (enregistrées) et déclarées conformément au protocole, aux bonnes pratiques cliniques (BPC) et aux exigences réglementaires pertinentes (25). Les PON garantissent également le bon déroulement du recrutement de participants à l'essai afin de minimiser les sources potentielles de « biais de sélection » et que toutes les mesures de résultat au cours de l'essai sont exactes, reproductibles, valables et fiables.
3.5.14 Comité indépendant de surveillance des données
Le promoteur doit créer un comité indépendant de surveillance des données pour évaluer périodiquement les progrès de l'essai clinique, les données sur l'innocuité et les paramètres d'efficacité, et pour recommander au promoteur s'il faut continuer l'essai, le modifier ou y mettre fin. Le comité doit avoir des procédures opérationnelles écrites et tenir des dossiers de toutes ses réunions, y compris celles concernant les résultats intermédiaires. Les membres du comité doivent inclure un biostatisticien ayant des connaissances sur la conception d'essais cliniques et sur les analyses, des scientifiques ayant de l'expérience liée aux essais cliniques et possédant des connaissances dans le domaine, et un médecin (5, 25).
3.5.15 Violation du protocole
Les violations de protocole doivent être déclarées dans le rapport de l'étude et le registre doit être mis à jour. Le rapport de l'étude doit consigner l'évaluation de l'ampleur de ces violations et la mesure dans laquelle elles pourraient influer sur l'interprétation des résultats (5).
3.5.16 Modification du protocole
Les dérogations au protocole ou toutes les modifications importantes requises pendant l'essai doivent figurer dans le rapport d'essai et le protocole d'essai, et le registre doit être mis à jour, en notant précisément qu'un changement a été apporté. La justification pour toute modification importante et son influence sur l'interprétation des résultats doivent être évaluées et déclarées dans le rapport et le protocole d'essai; l'enregistrement de l'essai doit être mis à jour (5).
3.5.17 Analyses statistiques planifiées
Dans l'ensemble, l'analyse statistique et les méthodes utilisées doivent être conformes aux principes scientifiques généralement acceptés (12).
Le protocole doit clairement indiquer les hypothèses d'essai ou les effets du traitement, qui doivent être estimés afin de satisfaire aux objectifs primaires et secondaires de l'essai. Les méthodes statistiques utilisées pour accomplir ces tâches doivent être clairement décrites pour l'analyse primaire ainsi que pour les analyses secondaires, et le modèle statistique sous-jacent doit être précisé a priori. Une description doit être donnée de toutes les intentions d'utiliser les données de référence pour améliorer la précision ou d'ajuster les estimations pour les différences de départ potentielles, par exemple au moyen d'une analyse de covariance.
La puissance de l'étude et le niveau de signification statistique doivent être déclarés avec le taux d'attrition attendu, qui doit être pris en compte pendant le calcul de la taille de l'échantillon. Le calcul de la puissance statistique à la fin de l'étude est également requis (9). Le calendrier de toutes les analyses intermédiaires prévues, le cas échéant, ainsi que les critères d'arrêt de l'essai doivent être indiqués.
Les critères d'inclusion et d'exclusion des sujets dans l'analyse par protocole doivent être prévus a priori dans le protocole. Des descriptions détaillées des raisons, de la méthode utilisée et des justifications pour toute exclusion ou tout rajustement potentiel de données (p. ex. supprimer une donnée partielle, remplacer des valeurs manquantes, rajuster les valeurs non valides, etc.) de l'analyse doivent être clairement expliquées et décrites dans le rapport d'étude.
Les résultats doivent être indiqués pour les comparaisons entre les groupes d'essai et témoin pour toutes les variables de résultats évaluées. Il faut également comparer les profils de croissance des groupes à l'étude avec les normes de croissance acceptables (26). Notamment, les renseignements suivants doivent être fournis [8] :
- statistiques descriptives et inférentielles (comme les moyennes, les écarts-types, les intervalles de confiance à 95 % et les mesures de signification statistique) de chaque résultat mesuré pour chaque groupe au début de l'étude et à toutes les visites tout au long de l'étude doivent être déclarées et analysées. Des analyses par protocole et par intention de traiter doivent être effectuées (8). La non-infériorité et la robustesse des résultats sont clairement établies lorsque l'analyse par protocole et l'analyse par intention de traiter démontrent une absence de différence statistiquement significative entre le groupe recevant la préparation pour nourrissons d'essai et celui recevant le produit témoin. Les divergences dans les résultats des deux analyses indiquent la possibilité d'un biais d'exclusion, suggérant que les raisons pour lesquelles les participants ne sont pas inclus dans l'analyse par protocole sont d'une manière ou d'une autre liées au traitement;
- les estimations de l'ampleur de l'effet (p. ex. la différence de gain de poids entre le groupe d'essai et le groupe témoin) doivent être accompagnées de leurs inférences (précision);
- le nombre de nourrissons qui ont fait l'objet d'analyses à chaque étape, pour chaque analyse;
- les modèles statistiques et les covariables utilisés dans l'analyse, avec les justifications appropriées pour leur utilisation;
- la présentation et l'interprétation des résultats selon l'intervalle de confiance (IC) en lien avec la MNI;
- les résultats de l'analyse ajustée et non ajustée;
- pour chaque sexe, la moyenne du poids corporel, de la taille et du périmètre crânien atteints représentée sur les courbes pertinentes, ainsi que leurs intervalles de confiance à 95 % par rapport à l'âge par groupe à l'étude;
- pour chaque sexe, la moyenne du poids par rapport à l'âge, de la taille par rapport à l'âge, du périmètre crânien par rapport à l'âge et du poids par rapport à la taille représentée sur les courbes, en fonction des Normes de croissance de l'enfant de l'OMS (2006), pour chaque groupe de l'étude au cours de la période d'étude;
- le nombre total et les raisons des abandons ou retraits de nourrissons de l'étude par des chercheurs pour chaque groupe d'étude, ainsi qu'une évaluation ou une explication des répercussions des abandons ou des retraits sur les résultats de l'étude;
- s'il est prévu d'effectuer une analyse de sous-groupe ou d'apporter des rajustements pour tenir compte des facteurs de confusion à l'étape d'analyse, les détails doivent être précisés a priori dans le protocole.
- Traitement des données manquantes
Si l'imputation (remplacement des valeurs manquantes par des estimations) des données manquantes est prévue, il faut déclarer l'information sur la robustesse des hypothèses. Le rapport de l'étude doit inclure des explications détaillées sur la façon dont ces estimations ou dérivations ont été calculées, le nombre et les raisons des valeurs manquantes dans chaque groupe, les hypothèses sous-jacentes qui ont été émises, et les répercussions des imputations sur les conclusions de l'essai.
- Comparaisons multiples
Pour les essais où un rajustement de plusieurs comparaisons est nécessaire, l'approche prévue au préalable pour l'ajustement de la multiplicité doit être précisée.
3.6 Résultats de l'étude
Les résultats de l'étude doivent être déclarés de manière transparente et reproductible, conformément à l'énoncé CONSORT (7).
3.6.1 Organigramme des participants et analyse des retraits et des abandons
Un organigramme est fortement recommandé, car il est utile pour illustrer le cheminement des participants tout au long de l'étude, du recrutement à la fin. Toute déviation du protocole prévu doit être décrite, et les raisons indiquées. Pour chaque groupe de l'étude, il faut indiquer les renseignements détaillés suivants dans l'organigramme :
- nombre total de sujets randomisés, qui reçoivent l'intervention prévue, qui terminent le protocole d'étude, et qui font l'objet d'analyses pour le résultat principal et les résultats secondaires;
- nombre total de sujets qui se retirent ou qui abandonnent l'étude et qui sont exclus des analyses du résultat principal et des résultats secondaires.
Un tableau présentant les caractéristiques démographiques et cliniques de base de chaque groupe doit être inclus.
3.6.2 Analyses de départ
Inclure les résultats des analyses comparant les caractéristiques sociodémographiques et les paramètres anthropométriques à la naissance et au début de l'essai entre les groupes d'essai et témoin dans le rapport (consulter l'ensemble de données de base à la section 3.5.10.2.
3.6.3 Analyses du résultat principal et des résultats secondaires
Résultats découlant de l'analyse par protocole et de l'analyse par intention de traiter des paramètres du résultat principal et des résultats secondaires (figurant dans la section 3.5.10.4 « Mesure des résultats ») entre le groupe d'essai et le groupe témoin dans le rapport final :
- groupe recevant la préparation d'essai par rapport au groupe témoin;
- groupe recevant la préparation d'essai par rapport au groupe de référence des nourrissons allaités, et groupe témoin par rapport au groupe de référence allaité.
Notamment, il faut relever clairement les résultats suivants :
- nombre de participants analysés à chaque moment prédéfini dans l'analyse par protocole et l'analyse par intention de traiter;
- statistiques descriptives, y compris la moyenne, la médiane et ses inférences pour chaque variable de résultat par sexe et par groupe d'étude;
- scores z moyens pour le poids, la taille, le périmètre crânien par rapport à l'âge, le poids par rapport à la taille et ses déductions par sexe et par groupe d'étude;
- poids, taille et périmètre crânien obtenus lors de chaque visite de l'étude et pendant la durée de l'étude, par groupe;
- estimations des différences moyennes significatives, de leurs inférences et des valeurs p pour chaque résultat évalué à l'échelle des groupes ci-dessus, ainsi que des discussions détaillées concernant ces différences significatives.
Les Normes de croissance de l'enfant de l'OMS (2006) doivent être utilisées pour comparer le poids, la taille et le périmètre crânien moyens atteints par le groupe d'étude lors de chaque visite de l'étude et sur toute la durée de l'étude (de l'âge de 14 ans ou moins à la fin de l'étude).
- Courbes de croissance individuelles
Les données anthropométriques individuelles doivent être reportées sur les Normes de croissance de l'enfant de l'OMS (2006) afin de représenter le rendement de croissance de chaque individu sur les courbes. Les courbes de croissance individuelle doivent être fournies dans la notification préalable à la mise en marché des préparations pour nourrissons.
- Scores z
Les mesures anthropométriques individuelles peuvent être transformées en scores z sur la base des courbes de croissance standard. Ces scores z indiquent la distance et l'orientation d'une observation par rapport à la moyenne de la population (écart-type supérieur et inférieur à la moyenne).
Les scores z du groupe pour le poids, la taille, le périmètre crânien par rapport à l'âge et le poids par rapport à la taille pour chaque sexe doivent être représentés sur les courbes des Normes de croissance de l'enfant de l'OMS.
3.6.4 Analyses des événements indésirables
Des renseignements détaillés, figurant dans la section des événements indésirables (3.5.11), pour les sujets ayant des incidents d'événements indésirables devraient être interprétés en comparant la manifestation d'événements indésirables dans chaque groupe de l'étude et les retraits découlant de ces événements, et aussi en évaluant la gravité par rapport au nombre d'événements. Il est fortement recommandé que l'évaluation clinique des événements indésirables et son imputation au traitement attribué se fassent en aveugle, et dans la mesure du possible, par un professionnel de la santé indépendant. Ces données devraient permettre une évaluation équilibrée des risques et des bénéfices.
Si des examens supplémentaires sont nécessaires pour évaluer la relation entre un événement indésirable grave et l'intervention, tous les examens pertinents ou conclusions de laboratoire doivent être indiqués avec leurs résultats dans un formulaire d'exposé de cas ou dans une pièce jointe à un dossier de suivi.
3.7 Discussion et conclusions
La discussion et l'interprétation des résultats de l'étude doivent bien faire la distinction entre les résultats de signification clinique et statistique. Les conclusions des auteurs doivent correspondre aux résultats des études rapportées en tenant compte des hypothèses de non-infériorité. Il convient d'indiquer si la conclusion se rapportant à la non-infériorité sont fondées sur une analyse par protocole ou une analyse par intention de traiter, ou les deux, et si ces conclusions sont cohérentes avec les deux analyses. Les conclusions doivent inclure une évaluation équilibrée des bénéfices et des risques, en mettant l'accent sur les limites de l'étude, et doivent tenir compte de toute autre donnée probante pertinente, y compris la cohérence ou l'incohérence par rapport à d'autres essais, les sources de biais potentiel ou le manque de précisions, l'insu partiel ou absence d'insu, les dangers associés à la multiplicité des analyses et des résultats, et le caractère généralisable (validité interne, applicabilité des résultats de l'étude).
4.0 Normes éthiques pour les chercheurs
4.1 Consentement éclairé (Conférence internationale d'harmonisation [ICH], E 6 [R1])
Chaque sujet potentiel (dans le cas présent, parents ou fournisseurs de soins) doit être bien informé des buts, des méthodes, des sources de financement, de tout conflit d'intérêts possible, des affiliations institutionnelles des chercheurs, des bénéfices prévus et des risques potentiels de l'étude, ainsi que de l'inconfort qui pourrait en découler. Il doit également être mis au courant des dispositions relatives au suivi après l'étude et de tous les autres aspects pertinents de l'étude. Les parents ou les fournisseurs de soins doivent être informés de leur droit de refuser de participer à l'étude ou de retirer leur consentement à la participation à tout moment sans représailles (25).
L'étude doit être menée conformément aux principes et aux règles éthiques qui trouvent leur origine dans la déclaration de Helsinki et de ses modifications subséquentes, et doit respecter les bonnes pratiques cliniques ainsi que toutes les exigences réglementaires pertinentes.
Le protocole, toute modification ainsi que le processus de consentement éclairé doivent recevoir l'approbation ou l'avis favorable du comité d'évaluation institutionnel avant le début de l'essai. L'institution qui accorde l'approbation doit être indiquée. Le nom de tout organisme de recherche sous contrat auquel on a demandé d'effectuer le travail doit être fourni.
Les produits expérimentaux doivent être fabriqués, manipulés et stockés conformément aux bonnes pratiques de fabrication applicables. Ils doivent être utilisés conformément au protocole approuvé.
4.2 Financement, parrainage et conflit d'intérêts
Le protocole doit inclure des renseignements concernant le financement, les promoteurs, les affiliations institutionnelles, les conflits d'intérêts possibles, les incitatifs pour les sujets, et l'information concernant les dispositions pour le traitement ou la rémunération des sujets qui subissent des préjudices à la suite de leur participation à l'étude de recherche. Il faut divulguer le rôle exact et les contributions du bailleur de fonds et du promoteur (p. ex. dans la conception, la réalisation, l'analyse et la production de rapports) (5).
Un chercheur, qui est indépendant de l'industrie des succédanés de lait humain, doit assumer la responsabilité globale de la réalisation de l'essai, de la planification et de l'exécution des analyses statistiques, ainsi que de la décision de publier, et de al déclaration et de l'interprétation des conclusions de l'essai (5).
4.3 Compétences des chercheurs
Le protocole doit décrire les qualifications et l'expérience que les chercheurs doivent avoir.
5.0 Glossaire et références
5.1 Glossaire
Allaitement exclusif
Allaitement sans aucun autre aliment liquide ou solide, à l'exception de médicaments ou de vitamines (30).
Ampleur de l'effet
- Terme générique pour l'estimation de l'effet du traitement pour une étude.
- Mesure sans dimension de l'effet qui est habituellement utilisée pour des données continues quand des échelles différentes (p. ex. pour mesurer la douleur) sont utilisées pour évaluer un résultat; habituellement définie comme étant la différence des moyennes entre le groupe d'intervention et le groupe témoin, divisé par l'écart-type du groupe témoin ou des deux groupes (29).
Analyse ajustée
Terme qui renvoie habituellement aux tentatives de tenir compte des inégalités des données de référence entre les groupes pour les caractéristiques importantes des patients. Renvoie parfois au rajustement de la valeur-p pour prendre en compte les tests multiples (27).
Analyse par intention de traiter
Stratégie pour analyser les données d'un essai contrôlé randomisé. Tous les participants sont inclus dans le groupe auquel ils ont été affectés, peu importe s'ils ont reçu (ou terminé) ou non l'intervention donnée à ce groupe. L'analyse par intention de traiter prévient le biais causé par la perte de participants, qui peut perturber l'équivalence de départ établie par la randomisation et qui peut refléter le non-respect du protocole. Ce terme est souvent utilisé à tort dans les publications d'essais lorsque certains participants ont été exclus (29).
Analyse intermédiaire
Toute analyse visant à comparer les groupes de traitement en ce qui concerne l'efficacité ou l'innocuité à tout moment avant la fin d'un essai (12).
Analyse par protocole
Analyse du sous-ensemble de participants d'un essai contrôlé randomisé qui se sont suffisamment conformés au protocole pour garantir que leurs données seraient susceptibles de démontrer l'effet du traitement. Ce sous-ensemble peut être défini après avoir pris en compte l'exposition au traitement, la disponibilité des mesures et l'absence de violations majeures du protocole. La stratégie d'analyse par protocole est susceptible d'être subjective, car les raisons de la non-conformité peuvent être liées au traitement (29).
Attrition
Perte de participants au cours de l'essai (également appelé « perte lors du suivi »). Les participants qui sont perdus au cours de l'essai sont souvent appelés des « abandons » (29).
Biais
Distorsion systématique de l'effet d'intervention estimé par rapport à la « vérité » causée par des lacunes dans la conception, la réalisation ou l'analyse d'un essai (27)
Biais de sélection
Erreur systématique dans la création de groupes d'interventions, qui provoque des différences de pronostic entre eux, c'est-à-dire que les caractéristiques de base mesurées ou non des groupes diffèrent en raison de la façon dont les participants ont été sélectionnés pour l'étude ou affectés à leur groupe d'étude. Ce terme est également utilisé pour indiquer que les participants ne sont pas tous représentatifs de la population de tous les participants possibles (12).
Caractère généralisable, généralisation
Mesure dans laquelle les résultats d'un essai clinique peuvent être extrapolés de manière fiable, à partir des sujets qui ont participé à l'essai à une population plus vaste de patients et à un éventail plus large de contextes cliniques (12).
Classement des événements indésirables comme étant légers, modérés et sévères
Outil souvent utilisé dans les études non oncologiques. La définition de léger, modéré et sévère peut être différente d'un protocole d'étude à un autre. La sévérité (intensité) de chaque événement indésirable, y compris les événements indésirables sévères, est attribuée à l'une des catégories suivantes:
- Léger: Événement facilement tolérable par le sujet, qui cause un inconfort minimal et qui ne nuit pas aux activités quotidiennes
- Modéré: Événement suffisamment gênant pour nuire aux activités quotidiennes normales
- Sévère: Événement qui empêche les activités quotidiennes normales
OU
- Léger :Conscience du signe ou de symptôme, mais celui-ci est facilement toléré
- Modéré : Inconfort suffisant pour nuire aux activités normales
- Sévère : Symptôme invalidant qui rend impossible la réalisation des activités normales (28).
Cliniquement significatif
Résultat (comme l'effet d'un traitement) qui est suffisamment important pour revêtir un intérêt pratique pour les patients et les professionnels de la santé. Ce n'est pas la même chose qu'un résultat statistiquement significatif. Pour évaluer la signification clinique, il faut tenir compte des facteurs comme l'ampleur de l'effet du traitement, la gravité de la maladie en cours de traitement, les effets secondaires du traitement et les coûts (29).
Comparaison confusionnelle
Une comparaison entre deux groupes de traitement qui donnera une estimation biaisée de l'effet du traitement en raison de la conception de l'étude. Pour qu'une comparaison ne soit pas confusionnelle, les deux groupes de traitement doivent être traités exactement de la même façon, à l'exception du traitement randomisé (29).
Dissimulation de la répartition
Technique utilisée pour garantir une séquence imprévisible des attributions. Il s'agit d'un processus essentiel qui empêche de connaître à l'avance le traitement attribué, et permet donc à ceux qui inscrivent les participants de ne pas être influencés par cette connaissance. La décision d'accepter ou de rejeter un participant doit être prise, et un consentement éclairé doit être obtenu du participant, dans l'ignorance de la prochaine attribution dans la séquence (27).
Écart par rapport au protocole
Un écart par rapport au protocole se produit lorsque, sans conséquences importantes, les activités d'une étude s'écartent du protocole approuvé par les comités d'examen des établissements, par exemple, un créneau de visite manqué parce que le sujet est en voyage. Cet écart n'est pas aussi grave qu'une violation du protocole (33).
Écart-type
Mesure de l'étendue ou de la dispersion d'un ensemble d'observations, calculée comme la différence moyenne par rapport à la valeur moyenne de l'échantillon (29).
Effet secondaire
Événement indésirable pour lequel il existe tout au moins une possibilité raisonnable qu'il y ait un lien de causalité entre l'intervention et l'événement (24).
Efficacité potentielle
Mesure dans laquelle une intervention donne un résultat bénéfique dans des conditions idéales. Les essais cliniques qui évaluent l'efficacité potentielle sont parfois appelés des essais explicatifs et sont limités aux participants qui coopèrent pleinement (29).
Erreur de type I
Conclusion selon laquelle un traitement fonctionne, alors que ce n'est pas réellement le cas. Le risque d'une erreur de type I est souvent appelé alpha. Dans un test statistique, il décrit la probabilité de rejeter l'hypothèse nulle alors qu'elle est en fait vraie (aussi appelé un « faux positif » (29).
Erreur de type II
Conclusion selon laquelle aucune donnée probante n'indique qu'un traitement fonctionne, alors qu'en réalité, le traitement fonctionne. Le risque d'une erreur de type I est souvent appelé bêta. Dans un test statistique, il décrit la probabilité de ne pas rejeter l'hypothèse nulle alors qu'elle est en fait fausse (aussi appelé un « faux négatif »). Le risque d'une erreur de type II diminue à mesure que le nombre de participants à une étude augmente (29).
Essai clinique
Expérience visant à comparer les effets de deux ou plusieurs interventions en matière de soins de santé. L'expression « essai clinique » est un terme générique qui désigne des essais sur les soins de santé menés selon différentes méthodologies, notamment les essais non contrôlés, les essais contrôlés et les essais contrôlés randomisés (29).
Essai de non-infériorité
Essai dont l'objectif principal est de montrer que la réponse au produit expérimental n'est pas cliniquement inférieure à celle d'un agent comparatif (témoin actif ou placebo) (12), version unilatérale d'un essai d'équivalence (29).
Essai de supériorité
Essai dont l'objectif principal est de montrer que la réponse au produit expérimental est supérieure à un produit de référence (témoin actif ou placebo) (12).
Essai multicentrique
Essai clinique mené selon un seul protocole, mais à différents emplacements, et donc, mené par plus d'un chercheur (12).
Étude prospective
Dans le contexte de l'évaluation des interventions en matière de soins de santé, étude dans laquelle les personnes sont identifiées en fonction du statut de risque ou d'exposition, et font ensuite l'objet d'un suivi au fil du temps pour observer le résultat (29).
Événement indésirable
Résultat indésirable qui survient pendant ou après l'administration d'un médicament ou une autre intervention, mais qui n'est pas nécessairement causé par le médicament ou l'intervention (27).
Événement indésirable sévère (dans le contexte d'un essai clinique)
Événement qui, de l'avis du chercheur ou du promoteur, cause l'un des résultats suivants : décès, événement indésirable mettant la vie en danger, hospitalisation nouvelle ou prolongée, incapacité persistante ou importante, ou perturbation importante de la capacité de mener les fonctions normales de la vie (25).
Facteur de confusion
Facteur qui est associé à une intervention (ou à une exposition) ainsi qu'au résultat d'intérêt (29).
Hypothèse nulle
En termes simples, l'hypothèse nulle indique que le facteur d'intérêt (p. ex. le traitement) n'a aucune incidence sur le résultat (tel que le risque de décès) (29).
Imputation
Procédure permettant de saisir une valeur pour un élément de données précis lorsque la réponse est manquante ou inutilisable. Pour ce faire, on modifie certaines réponses ou on attribue des valeurs lorsqu'elles sont manquantes dans le registre en cours d'édition afin de garantir la qualité des estimations et la création d'un registre plausible et cohérent sur le plan interne (31).
Innocuité
Preuves substantielles de l'absence de méfaits. Ce terme est souvent utilisé à tort lorsqu'il n'y a tout simplement pas de preuve de méfait (24).
Insu
Processus consistant à empêcher ceux qui participent à un essai de savoir à quel groupe de comparaison appartient un participant particulier. Pratique qui consiste à faire en sorte que les participants à l'essai, les prestataires de soins, les collecteurs de données, et parfois ceux qui analysent les données, ne sachent pas quelle intervention est administrée à quel participant (27).
Intervalle de confiance
Mesure de précision d'une valeur estimée. L'intervalle représente la plage de valeurs, en toute cohérence avec les données qui sont présumées englober la valeur « véritable » avec une probabilité élevée (habituellement 95 %). L'intervalle de confiance est exprimé dans les mêmes unités que l'estimation. De grands intervalles indiquent une précision réduite, et des intervalles étroits, une plus grande précision (27).
Marge de non-infériorité
La marge est la plus grande différence qui peut être jugée cliniquement acceptable; elle devrait être inférieure aux différences observées dans les essais de supériorité du comparateur actif (12).
Moyenne
Valeur moyenne, calculée en ajoutant toutes les observations et en divisant par le nombre d'observations (29).
Multiplicité
Prolifération des comparaisons possibles dans un essai. Les sources courantes de multiplicité sont les résultats multiples, les résultats évalués à plusieurs moments après l'intervention, les analyses de sous-groupes ou les groupes d'intervention multiples (27).
Randomisation stratifiée
Répartition aléatoire au sein de groupes définis par les caractéristiques des participants, comme l'âge ou la gravité de la maladie, visant à assurer un bon équilibre de ces facteurs dans les groupes d'intervention (27).
Résultat principal
Le résultat le plus important (29).
Score z
Il s'agit de l'écart de la valeur pour un individu par rapport à la valeur moyenne de la population de référence divisée par l'écart-type pour la population de référence (32).
Séquence de répartition
Liste d'interventions, classées de façon aléatoire, utilisées pour affecter des participants inscrits en ordre séquentiel à des groupes d'intervention (27).
Percentiles
Indicateur clinique le plus souvent utilisé pour évaluer la taille et les tendances de croissance de chaque nourrisson. Les percentiles classent la position d'un individu en indiquant quel pourcentage de la population de référence l'individu égalerait ou dépasserait. Les percentiles sont moins utiles aux limites extrêmes (> 99 et < 1) par rapport aux scores z (32).
Précision [en statistiques]
Probabilité d'erreurs aléatoires dans les résultats d'une étude, d'une méta-analyse ou d'une mesure. Plus la précision est grande, moins il y a d'erreurs aléatoires. Les intervalles de confiance autour de l'estimation de l'effet de chaque étude sont une façon d'exprimer la précision; un intervalle de confiance plus étroit signifie plus de précision (29).
Puissance
Probabilité qu'un essai détectera comme étant statistiquement significatif un effet d'intervention d'une taille précisée. La taille avant l'essai est souvent choisie pour donner à l'essai la puissance voulue (12).
Témoin
- [Dans un essai contrôlé :] Un participant dans le groupe qui sert de comparateur pour une ou plusieurs interventions expérimentales. Les sujets du groupe témoin peuvent recevoir un placebo, aucun traitement, un traitement standard ou une intervention active, comme un médicament standard.
- [Dans les statistiques :] Rajuster en fonction des observations ou des influences extérieures ou en tenir compte (29).
Test d'hypothèse
Procédure statistique pour déterminer s'il faut rejeter une hypothèse nulle sur la base des données observées (29).
Test unilatéral
Test d'hypothèse dans lequel les valeurs pour lesquelles on peut rejeter l'hypothèse nulle se situent entièrement à un extrême de la distribution de probabilité. Évaluer si un traitement est meilleur qu'un autre (plutôt qu'évaluer si un traitement est soit meilleur soit pire qu'un autre) serait un test unilatéral (29).
Validité externe
Mesure dans laquelle les résultats d'un essai constituent une base correcte pour la généralisation à d'autres circonstances (27).
Validité interne
Mesure dans laquelle la conception et la réalisation d'une étude sont susceptibles d'avoir évité les Biais (29).
Valeur-p
La probabilité (allant de zéro à un) que les résultats observés dans une étude (ou des résultats extrêmes) aient pu se produire par hasard si, en réalité, l'hypothèse nulle était vraie.
Violation du protocole
Une divergence par rapport au protocole qui, sur le plan matériel: réduit la qualité ou l'exhaustivité des données, rend le formulaire de consentement éclairé inexact, ou a une incidence sur la sécurité, les droits ou le bien-être d'un sujet (33).
5.2 Références
- Institute of Medicine (US) Committee on the Evaluation of the Addition of Ingredients New to Infant Formula. (2004). Infant formula: evaluating the safety of new ingredients. Washington (DC). National Academies Press.
- World Health Organization (WHO). (2021). WHO primary registries. [En ligne, anglais seulement]. Accès : https://www.who.int/clinical-trials-registry-platform/network/primary-registries.
- World Health Organization (WHO). (2009). International clinical trials registry platform (ICTRP). [En ligne, anglais seulement]. Accès : https://www.who.int/clinical-trials-registry-platform/network/registry-criteria.
- Boutron I, Altman DG, Moher D, Schulz KF, Ravaud P; CONSORT NPT Group. (2017). CONSORT Statement for Randomized Trials of Nonpharmacologic Treatments: A 2017 Update and a CONSORT Extension for Nonpharmacologic Trial Abstracts. Ann Intern Med. 67(1):40-47.
- Jarrold, K., Helfer, B., Eskander, M., Crawley, H., Trabulsi, J., Caulfield, L. E., Duffy, G., Garcia-Larsen, V., Hayward, D., Hyde, M., Jeffries, S., Knip, M., Leonardi-Bee, J., Loder, E., Lodge, C. J., Lowe, A. J., McGuire, W., Osborn, D., Przyrembel, H., Renfrew, M. J., … Boyle, R. J. (2020). Guidance for the Conduct and Reporting of Clinical Trials of Breast Milk Substitutes. JAMA pediatrics, 174(9), 874–881.
- Piaggio G, Elbourne DR, Pocock SJ, Evans SJ, Altman DG; CONSORT Group. (2012). Reporting of noninferiority and equivalence randomized trials: extension of the CONSORT 2010 statement. JAMA. 308(24), 2594-604.
- Schulz KF, Altman DG, Moher D; CONSORT Group. (2010). CONSORT 2010 Statement: Updated guidelines for reporting parallel group randomised trials. J Clin Epidemiol. 63(8), 834-40.
- EFSA NDA Panel (EFSA Panel on Dietetic Products, Nutrition and Allergies). (2017). Scientific and technical guidance for the preperation and presentation of an application for authorisation of an infant and/or follow-on formula manufacturer from protein hydrolysates. EFSA Journal, 15(5), 4779.
- Food and Drug Administration. (2014). Current good manufacturing practices, quality control procedures, quality factors, notification requirements, and records and reports, for infant formula. [En ligne, anglais seulement]. Accès : https://www.federalregister.gov/documents/2014/06/10/2014-13384/currentgood-manufacturing-practices-quality-control-procedures-quality-factors-notification
- Wallingford J and Barber C. (2019). A review of studies on the growth of infants fed infant formula. Current Developments in Nutrition, 3(9), nzz095.
- Center for Diseases Control and Prevention. (2010). WHO Growth Standards are recommended for use in the U.S. for infants and children 0 to 2 years of age. [En ligne, anglais seulement]. Accès : https://www.cdc.gov/growthcharts/who_charts.htm.
- International Conference on Harmonisation (ICH) of Technical Requirements for Registration of Pharmaceuticals for Human Use. (1998). ICH Harmonised Tripartite Guideline, Statistical Principles For Clinical Trials E9. [En ligne, anglais seulement]. Accès : https://database.ich.org/sites/default/files/E9_Guideline.pdf.
- U.S. Food and Drug Administration. (2016). Non-inferiority clinical trials to establish effectiveness. [En ligne, anglais seulement]. Accès : https://www.fda.gov/media/78504/download.
- European Commission. (2003). Report of the Scientific Committee on Food on the revision of essential requirements of infant formulae and follow-on formulae [En ligne, anglais seulement]. Accès : Report of the Scientific Committee on Food on the Revision of Essential Requirements of Infant Formulae and Follow-on Formulae (europa.eu).
- Puccio G, Alliet P, Cajozzo C, Janssens E, Corsello G, Sprenger N, Wernimont S, Egli D, Gosoniu L Steenhout P. (2017). Effects of infant formula with human milk oligosaccharides on growth and morbidity: A randomized multicenter trial. Journal of pediatric gastroenterology and nutrition, 64(4), 624-631.
- Béghin L, Marchandise X, Lien E, Bricout M, Bernet J, Lienhardt J, Jeannerot F, Menet V, Requillart J, Marx J, De Groot N, Jaeger J, Steenhout P, Turck D. (2019). Growth, stool consistency and bone mineral content in healthy term infants fed sn-2-palmitate-enriched starter infant formula: A randomized, double-blind, multicentre clinical trial. Clinical Nutrition, 38(3),1023-1030.
- Kouwenhoven S, Antl N, Finken M, Twisk J, van der Beek EM, Abrahamse-Berkeveld M, van de Heijning B, Schierbeek H, Holdt LM, van Goudoever JB, Koletzko BV. (2020). A modified low-protein infant formula supports adequate growth in healthy, term infants: a randomized, double-blind, equivalence trial. The American Journal of Clinical Nutrition, 111(5),962-974.
- Chen L and Nguyen L. Meta-Analysis for non-inferiority margins of weigh gains between formula-fed and breast-fed infant. Manuscript in preparation.
- Guo S, Roche A, Fomon S, Nelson S, Chumlea W, Rogers R, Baumgartner R, Ziegler E, Siervogel R. (1991). Reference data on gains in weight and length during the first two years of life. The Journal of Pediatrics, 119(3), 355-362.
- Schumi J and Wittes J. (2011). Through the looking glass: understanding non-inferiority. Trials, 12(106), 1-12.
- Moher D, Hopewell S, Schulz KF, Montori V, Gøtzsche PC, Devereaux PJ, Elbourne D, Egger M, Altman DG. (2010). CONSORT 2010 explanation and elaboration: updated guidelines for reporting parallel group randomised trials. Journal of clinical epidemiology, 63(8),e1-e37.
- Nelson S, Rogers R, Ziegler E, Fomon S. (1989). Gain in weight and length during early infancy. Early Human Development, 19(4). 223-239.
- American Academy of Pediatrics Committee on Nutrition. (1988). Clinical testing of infant formulas with respect to nutritional suitability for term infants, report to the FDA.
- Ioannidis JPA, Evans SJW, Gøtzsche PC, O'Neill RT, Altman DG, Schulz K, Moher D for the CONSORT group. (2004). Better reporting of harms in randomized trials: an extension of the CONSORT statement. Ann Intern Med, 141(10), 781-8.
- International Conference on Harmonisation (ICH) of Technical Requirements for Registration of Pharmaceuticals for Human Use, ICH harmonised guideline for good clinical practice E 6 (R2), 2016. [En ligne, anglais seulement]. Accès : https://database.ich.org/sites/default/files/E6_R2_Addendum.pdf.
- World Health Organization (WHO). (2006). Multicentre growth reference study group, WHO child growth standard based on length/heigh, weight and age. Acta Paediatrica, 76-85.
- Altman DG, Schulz KF, Moher D, Egger M, Davidoff F, Elbourne PC, GØtzsche PC, Lang T for the CONSORT Group. (2001). The revised CONSORT statement for reporting randomized trials: explanation and elaboration. Annals of internal medicine, 134(8), 663-694.
- Deng C. (2018). Grading the severity of AEs and its impact on AE reporting. [En ligne, anglais seulement]. Accès : http://onbiostatistics.blogspot.com/2018/05/grading-severity-of-aes-and-its-impact.html.
- Cochrane Collaboration. (2019). Glossary of Cochrane Terms [En ligne, anglais seulement]. Accès: https://epoc.cochrane.org/sites/epoc.cochrane.org/files/public/uploads/SURE-Guides-v2.1/Collectedfiles/source/glossary.html.
- World Health Organization (WHO), "Optimal feeding of low-birth-weight infants," 2006. [En ligne, anglais seulement]. Accès : https://apps.who.int/iris/bitstream/handle/10665/43602/9789241595094_eng.pdf;jsessionid=80736F92F581729831081B1CA71D704B?sequence=1
- Organisation for Economic Co-operation and Development, "Economic Commission of Europe of the United Nations (UNECE) Glossary of terms on statistical data editing, conference of European statisticians, methodological material.," 2000. [En ligne, anglais seulement]. Accès : https://stats.oecd.org/glossary/detail.asp?ID=3462.
- National Center for Health Statistics [En ligne, anglais seulement]. Accès : https://www.cdc.gov/nchs/index.htm.
- Bhatt A. (2012). Protocol deviation and violation. Perspectives in Clinical Research, 3(3): 117
Section/Sujet |
No du point |
Points de la liste de contrôle |
|---|---|---|
Titre |
1a |
Indication d'un essai randomisé dans le titre |
Abstract |
1b |
Résumé structuré du plan de l'essai, des méthodes, des résultats et des conclusions (pour des conseils précis, voir CONSORT pour les résumés (21,31)) |
Introduction |
||
Contexte et objectifs |
2a |
Renseignements scientifiques et explication de la justification |
2b |
Objectifs ou hypothèses précis |
|
Méthodes |
||
Conception de l'essai |
3a |
Description de la conception de l'essai (parallèle, factoriel, etc.), y compris le rapport de répartition |
3b |
Changements importants aux méthodes après le début de l'essai (comme les critères d'admissibilité) avec des raisons à l'appui |
|
Participants |
4a |
Critères d'admissibilité des participants |
4b |
Établissements et endroits où les données ont été recueillies |
|
Interventions |
5 |
Les interventions pour chaque groupe avec suffisamment de détails pour permettre leur reproduction, y compris comment et quand elles ont été effectivement administrées |
Résultats |
6a |
Mesures des résultats primaires et secondaires préalablement précisées et complètement définies, y compris comment et quand elles ont été évaluées |
6b |
Tout changement dans les résultats de l'essai après le début de celui-ci, avec les raisons à l'appui |
|
Taille de l'échantillon |
7a |
Comment la taille de l'échantillon a été déterminée |
7b |
Le cas échéant, explication des analyses intermédiaires et des directives d'arrêt |
|
Randomisation |
||
Génération de séquence |
8a |
Méthode utilisée pour générer la séquence de répartition aléatoire |
8b |
Type de randomisation; détails de toute restriction (comme le blocage et la taille des blocs) |
|
Mécanisme de dissimulation de la répartition |
9 |
Mécanisme utilisé pour mettre en œuvre la séquence de répartition aléatoire (comme des conteneurs numérotés de façon séquentielle), décrivant toute mesure prise pour dissimuler la séquence jusqu'à ce que les interventions soient affectées |
Mise en œuvre |
10 |
Qui a généré la séquence de répartition aléatoire, qui a recruté les participants et qui a affecté les participants aux interventions |
Insu |
11a |
Si c'est le cas, qui était à l'insu après l'affectation aux interventions (p. ex. les participants, les prestataires de soins, les personnes chargées d'évaluer les résultats) et comment |
11b |
Description de la similitude des interventions, le cas échéant |
|
Méthodes statistiques |
12a |
Méthodes statistiques utilisées pour comparer les groupes pour les résultats primaires et secondaires |
12b |
Méthodes pour les analyses supplémentaires, telles que les analyses de sous-groupes et les analyses ajustées |
|
Résultats |
||
Flux des participants (un diagramme est fortement recommandé) |
13a |
Pour chaque groupe, le nombre de participants qui ont été affectés de manière aléatoire, ont reçu le traitement prévu et ont fait l'objet d'analyses pour le résultat primaire |
13b |
Pour chaque groupe, les pertes et les exclusions après la randomisation, ainsi que les raisons à l'appui |
|
Recrutement |
14a |
Dates définissant les périodes de recrutement et de suivi |
14b |
Raison pour laquelle l'essai s'est terminé ou a été interrompu |
|
Données de référence |
15 |
Tableau présentant les caractéristiques démographiques et cliniques de base de chaque groupe |
Chiffres analysés |
16 |
Pour chaque groupe, le nombre de participants (dénominateur) inclus dans chaque analyse et si l'analyse a été faite par groupes assignés à l'origine |
Résultats et estimation |
17a |
Pour chaque résultat primaire et secondaire, les résultats pour chaque groupe, ainsi que l'ampleur de l'effet estimé et sa précision (comme l'intervalle de confiance à 95 %) |
17b |
Pour les résultats binaires, il est recommandé de présenter à la fois les tailles d'effet absolues et relatives |
|
Analyses secondaires |
18 |
Résultats de toute autre analyse effectuée, y compris les analyses de sous-groupes et les analyses ajustées, en distinguant les analyses préétablies des analyses exploratoires. |
Préjudices |
19 |
Tous les effets indésirables ou non voulus importants dans chaque groupe (pour des directives précises, consulter CONSORT pour les préjudices (28)) |
Discussion |
||
Limites |
20 |
Les limites de l'essai, en abordant les sources de biais potentiel, d'imprécision et, le cas échéant, la multiplicité des analyses. |
Caractère généralisable |
21 |
Caractère généralisable (validité externe, applicabilité) des résultats de l'essai |
Interprétation |
22 |
Interprétation cohérente avec les résultats, en mettant en balance les avantages et les inconvénients, et en tenant compte d'autres données probantes pertinentes. |
Autres renseignements |
||
Registration |
23 |
Numéro d'enregistrement et nom du registre d'essai |
Protocole |
24 |
Où le protocole complet de l'essai peut être consulté, s'il est disponible |
Financement |
25 |
Sources de financement et autres mesures de soutien (comme l'approvisionnement en produits pharmaceutiques), rôle des bailleurs de fonds |
| 1CONSORT 2010 Statement : updated guidelines for reporting parallel group randomised trials (en anglais seulement) (7) - Nous recommandons vivement de lire cette déclaration en même temps que le document « CONSORT 2010 Explanation and Elaboration » ou les clarifications importantes sur tous les points. | ||