Tendances annuelles dans les déclarations de cas d’effets indésirables des produits de santé et des incidents liés aux matériels médicaux à Santé Canada (2008-2017)

Organization: Santé Canada
Type: Rapport
Published: 2018-10-31
Cat.: H164-247/2018F-PDF
ISBN: 978-0-660-28280-0
Pub.: 180509
Table des matières
- Résumé
- Introduction
- Section 1.0 Déclaration de cas d'effets indésirables (EI) par l'entremise de Canada Vigilance
- 1.1 Tendances dans les déclarations de cas d'EI (2008-2017)
- 1.2 Déclarations obligatoires et volontaires de cas d'EI
- 1.3 Gravité des déclarations de cas d'EI survenus au Canada
- 1.4 Déclarations de cas d'EI survenus au Canada signalées à Santé Canada, 2017
- 1.4.1 Auteurs de déclarations obligatoires et volontaires de cas d'EI survenus au Canada, 2017
- 1.4.2 Déclarations de cas d'EI survenus au Canada par type de produit, 2017
- 1.4.3 Déclarations de cas d'EI survenus au Canada par groupes du système de classification anatomique, thérapeutique et chimique (ATC), 2017
- 1.4.4 Déclarations de cas d'EI survenus au Canada par système et par organe, 2017
- 1.5 Déclarations de cas d'EI survenus au Canada signalées à Santé Canada, 2016
- 1.5.1 Auteurs de déclarations obligatoires et volontaires de cas d'EI survenus au Canada, 2016
- 1.5.2 Déclarations de cas d'EI survenus au Canada par type de produit, 2016
- 1.5.3 Déclarations de cas d'EI survenus au Canada par groupes du système de classification anatomique, thérapeutique et chimique (ATC), 2016
- 1.5.4 Déclarations de cas d'EI survenus au Canada par système et par organe, 2016
- 1.6 Déclarations de cas d'EI survenus au Canada signalées à Santé Canada, 2015
- 1.6.1 Auteurs de déclarations obligatoires et volontaires de cas d'EI survenus au Canada, 2015
- 1.6.2 Déclarations de cas d'EI survenus au Canada par type de produit, 2015
- 1.6.3 Déclarations de cas d'EI survenus au Canada par groupes du système de classification anatomique thérapeutique chimique (ATC), 2015
- 1.6.4 Déclarations de cas d'EI survenus au Canada par système et par organe, 2015
- 1.7 Déclarations de cas d'EI survenus au Canada signalées à Santé Canada, 2014
- 1.7.1 Auteurs de déclarations obligatoires et volontaires de cas d'EI survenus au Canada, 2014
- 1.7.2 Déclarations de cas d'EI survenus au Canada par type de produit, 2014
- 1.7.3 Déclarations de cas d'EI survenus au Canada par groupes du système de classification anatomique, thérapeutique et chimique (ATC), 2014
- 1.7.4 Déclarations de cas d'EI survenus au Canada par système et par organe, 2014
- 1.8 Déclarations de cas d'EI survenus au Canada signalées à Santé Canada, 2013
- 1.8.1 Auteurs de déclarations obligatoires et volontaires de cas d'EI survenus au Canada, 2013
- 1.8.2 Déclarations de cas d'EI survenus au Canada par type de produit, 2013
- 1.8.3 Déclarations de cas d'EI survenus au Canada par groupes du système de classification anatomique, thérapeutique et chimique (ATC), 2013
- 1.8.4 Déclarations de cas d'EI survenus au Canada par système et par organe, 2013
- Section 2.0 : Déclaration obligatoire des incidents liés aux matériels médicaux par l'intermédiaire de Canada Vigilance (CV-MM)
- 2.1 Tendances dans la déclaration obligatoire des incidents liés aux matériels médicaux (2008-2017)
- 2.2 Gravité des déclarations d'incidents liés aux matériels médicaux
- 2.3 Déclarations obligatoires d'incidents liés aux matériels médicaux, 2017
- 2.3.1 Classes de matériels médicaux dans les déclarations obligatoires d'incidents liés aux matériels médicaux, 2017
- 2.3.2 Déclarations obligatoires d'incidents liés aux matériels médicaux par spécialité médicale, 2017
- 2.3.3 Déclarations obligatoires d'incidents liés aux matériels médicaux par catégorie de problème, 2017
- 2.4 Déclarations obligatoires d'incidents liés aux matériels médicaux, 2016
- 2.4.1 Classes de matériels médicaux dans les déclarations obligatoires d'incidents liés aux matériels médicaux, 2016
- 2.4.2 Déclarations obligatoires d'incidents liés aux matériels médicaux par spécialité médicale
- 2.4.3 Déclarations obligatoires d'incidents liés aux matériels médicaux par catégorie de problème, 2016
- 2.5 Déclarations obligatoires d'incidents liés aux matériels médicaux, 2015
- 2.5.1 Classes de matériels médicaux dans les déclarations obligatoires d'incidents liés aux matériels médicaux, 2015
- 2.5.2 Déclarations obligatoires d'incidents liés aux matériels médicaux par spécialité médicale, 2015
- 2.5.3 Déclarations obligatoires d'incidents liés aux matériels médicaux par catégorie de problème, 2015
- 2.6 Déclarations obligatoires d'incidents liés aux matériels médicaux, 2014
- 2.6.1 Classes de matériels médicaux dans les déclarations obligatoires d'incidents liés aux matériels médicaux, 2014
- 2.6.2 Déclarations obligatoires d'incidents liés aux matériels médicaux par spécialité médicale, 2014
- 2.6.3 Déclarations obligatoires d'incidents liés aux matériels médicaux par catégorie de problème, 2014
- 2.7 Déclarations obligatoires d'incidents liés aux matériels médicaux, 2013
- 2.7.1 Classes de matériels médicaux dans les déclarations obligatoires d'incidents liés aux matériels médicaux, 2013
- 2.7.2. Déclarations obligatoires d'incidents liés aux matériels médicaux par spécialité médicale, 2013
- 2.7.3 Déclarations obligatoires d'incidents liés aux matériels médicaux par catégorie de problème, 2013
- Section 3.0 : Déclarations par l'entremise du programme du Réseau sentinelle canadien pour les matériels médicaux (ResSCMM)
- 3.1 Tendances dans les déclarations volontaires reçues par l'entremise du ResSCMM (2009-2017)
- 3.2 Déclarations reçues par l'entremise du ResSCMM (2009-2017)
- 3.3 Classes de matériels médicaux dans les déclarations du ResSCMM (2009-2017)
- 3.4 Gravité des déclarations du ResSCMM et résultats pour les patients (2009-2017)
- 3.5 Qualité des déclarations du ResSCMM (2009-2017)
- 3.6 Déclarations d'incidents communiquées au ResSCMM par spécialité médicale (2009-2017)
- 3.7 Catégories de déclarations d'incidents liés à des matériels médicaux signalées par l'entremise du ResSCMM (2009-2017)
- Limites des données
- Glossaire
Liste des tableaux
Tableau 1 : Les 10 groupes de classification ATC les plus courants en 2017
Tableau 3 : Les 10 groupes de classification ATC les plus courants en 2016
Tableau 5 : Les 10 groupes de classification ATC les plus courants en 2015
Tableau 7 : Les 10 groupes de classification ATC les plus courants en 2014
Tableau 9 : Les 10 groupes de classification ATC les plus courants en 2013
Tableau 22 : Les 10 problèmes les plus courantes de produit déclarés au ResSCMM de 2009 à 2017
Liste des figures
Figure 4 : Déclarations de cas d'EI survenus au Canada par type de déclarant et reçues en 2017
Figure 6 : Déclarations de cas d'EI survenus au Canada par type de déclarant et reçues en 2016
Figure 8 : Déclarations de cas d'EI survenus au Canada par type de déclarant et reçues en 2015
Figure 10 : Déclarations de cas d'EI survenus au Canada par type de déclarant et reçues en 2014
Figure 12 : Déclarations de cas d'EI survenus au Canada par type de déclarant reçues en 2013
Figure 22 : Emplacement des organismes participant au ResSCMM en 2017
Figure 23 : Proportion des déclarations représentant chacune des classes de matériels médicaux
Figure 25 : Répartition des résultats pour les patients reçus par ResSCMM de 2009 à 2017
Figure 26 : Qualité des déclarations classées selon une échelle modifiée de l'OMS de 2009 à 2017
Résumé
Santé Canada est chargé de protéger la santé des Canadiens et des Canadiennes en surveillant et en évaluant la sécurité et l'efficacité des produits de santé sur le marché canadien. La surveillance active post-commercialisation des effets indésirables des médicaments et des incidents liés aux matériels médicaux est essentielle pour assurer la sécurité et l'efficacité continues de ces produits de santé. Les principaux mécanismes de surveillance de Santé Canada à cet égard sont (1) le Programme Canada Vigilance (CV) pour la déclaration des effets indésirables des médicaments, (2) Canada Vigilance - Programme de déclaration des incidents liés aux matériels médicaux (CV-SIMM) pour la déclaration des incidents liés aux matériels médicaux et (3) le Réseau sentinelle canadien pour les matériels médicaux (ResSCMM) pour la surveillance des incidents liés aux matériels médicaux dans les hôpitaux participants. Les fabricants et les importateurs de produits de santé sur ordonnance et de matériels médicaux sont tenus par règlement de soumettre des déclarations d'effets indésirables à Santé Canada par l'entremise de Canada Vigilance et de CV-SIMM. Santé Canada reçoit également des déclarations d'effets indésirables soumises volontairement par les consommateurs et les professionnels de la santé et, dans le cas d'incidents liés à des matériels médicaux, par les hôpitaux participants au ResSCMM. De plus amples informations sont disponibles dans la page suivante : Déclaration des effets indésirables ou des incidents liés aux matériels médicaux.
L'objectif principal du présent rapport consiste à fournir à Santé Canada le nombre annuel de déclarations de cas d'effets indésirables des médicaments et de déclarations d'incidents liés aux instruments médicaux déposées entre 2008 et 2017, ainsi que de lui présenter les tendances qui en découlent. Les données sont fondées sur les déclarations soumises à Santé Canada par l'entremise de Canada Vigilance, de CV-SIMM et du ResSCMM. De multiples facteurs influent sur les déclarations, notamment la durée de mise en marché du médicament ou du matériel médical, l'utilisation du médicament ou du matériel médical sur le marché, la taille et la sophistication de la force des ventes, l'information publicitaire des effets indésirables et les actions réglementaires. Dans certains cas, les données cliniques sont incomplètes et il n'y a aucune certitude voulant que le produit de santé ait causé les effets déclarés. Par conséquent, il est impossible de faire des comparaisons quantitatives quant à la sécurité du produit à partir des données, et la capacité de comparer et d'interpréter les tendances est limitée. Toutefois, le présent rapport fournit un instantané des données qui met en évidence les déclarations graves et non graves reçues à des fins descriptives.
Déclaration de cas d'effets indésirables (EI) par l'entremise de Canada Vigilance
- Plus de 64 000 déclarations de cas uniques d'EI au Canada ont été soumises à Canada Vigilance en 2017, 6,5 % de ces effets indésirables ayant entraîné la mort de patients et près de 20 % ayant entraîné l'hospitalisation de patients.
- Le nombre total de cas d'EI signalés à Santé Canada a continué d'augmenter chaque année, passant de 15 551 en 2008 à 64 617 en 2017.
- La déclaration volontaire de cas d'EI à Santé Canada est demeurée assez constante, soit environ 7 000 cas déclarés annuellement au cours de cette période.
- Le nombre de déclarations de cas d'EI graves et non graves a augmenté au cours de cette période.
- Les professionnels de la santé ont toujours soumis la majorité des déclarations de cas d'EI.
- Les produits pharmaceutiques et biotechnologiques ont toujours été les types de produits ayant fait l'objet du plus grand nombre de déclarations de cas d'EI.
Déclaration obligatoire des incidents liés aux matériels médicaux (IMM) par l'entremise du Système d'information sur les matériels médicaux (SIMM) et du ResSCMM
- Plus de 11 000 déclarations d'IMM ont été soumises à Santé Canada en 2017.
- Le nombre total de déclarations a continué d'augmenter chaque année, passant de 4 008 en 2008 à 11 307 en 2017.
- Il y a eu une augmentation constante du nombre de déclarations obligatoires non graves d'IMM (30 jours), tandis que le nombre de déclarations obligatoires graves (10 jours) est demeuré relativement constant depuis 2013, soit environ 2 000 déclarations par année.
- Santé Canada a toujours reçu le plus grand nombre de déclarations obligatoires pour des matériels médicaux des classes II et III.
- Les matériels d'hôpitaux généraux sont la spécialité médicale de matériels la plus courante dans les déclarations d'IMM soumises à Santé Canada.
- Depuis la création du ResSCMM en 2009, le nombre d'hôpitaux qui font rapport à Santé Canada par l'entremise du Réseau est passé de 10 à 16.
- Entre 2009 et 2017, 1 476 déclarations d'IMM ont été déposées par l'entremise du ResSCMM.
Tous les médicaments et produits comportent des bienfaits et des risques. Bien que les produits de santé fassent l'objet d'analyses rigoureuses avant d'être homologués au Canada, certains effets indésirables sont seulement observés lorsque les produits sont utilisés par la population. La surveillance des effets indésirables présumés au moyen de déclarations obligatoires et volontaires à Santé Canada contribue à la collecte permanente de renseignements qui est amorcée à compter du moment de la mise en marché. Ces renseignements comprennent : les effets indésirables rares ou graves qui étaient jusque-là passés inaperçus; des données nationales et internationales sur les bienfaits, les risques et l'efficacité des médicaments et des produits de santé. Santé Canada utilise les renseignements importants compris dans les déclarations d'EI et d'IMM pour s'assurer que le ratio risques-bienfaits des produits de santé au Canada demeure favorable, ainsi que pour prendre des mesures réfléchies, telles que des changements dans l'information sur la sécurité des produits ou d'autres mesures réglementaires comme le retrait d'un produit du marché canadien.
Introduction
Les effets indésirables sont des événements non intentionnels liés à l'utilisation d'un produit de santé ou d'un instrument médical qui ont causé ou auraient pu causer du tort à des personnes. Dans le cas des produits de santé, un effet indésirable peut aussi comprendre les effets secondaires du produit de santé. Dans le cas des matériels médicaux, il peut s'agir de quasi-incidents qui auraient pu entraîner des blessures graves ou la mort sans intervention opportune. Plus précisément, la survenue d'un événement indésirable ne signifie pas nécessairement qu'il y a quelque chose qui ne va pas avec le produit de santé ou le matériel médical. L'événement pourrait être le résultat d'une utilisation non conforme à l'étiquette du produit de santé, de deux matériels médicaux en bon état de fonctionnement qui n'étaient pas destinés à être utilisés ensemble ou d'un état de santé/médical sous-jacent de l'individu.
Comme l'exigent le Règlement sur les aliments et drogues, le Règlement sur les produits de santé naturels, le Règlement sur le sang, le Règlement sur les instruments médicaux et le Règlement sur la sécurité des cellules, tissus et organes humains destinés à la transplantation, les parties réglementées sont tenues de soumettre à Santé Canada des déclarations sur les effets indésirables survenus au Canada et à l'étranger, y compris les cas inhabituels d'échec de l'efficacité de nouveaux médicaments, et les déclarations d'incidents liés aux matériels médicaux. Les professionnels de la santé et les consommateurs soumettent aussi, sur une base volontaire, des déclarations sur les effets indésirables des produits de santé et des matériels médicaux directement à Santé Canada ou par l'intermédiaire de parties réglementées. Au Canada, la base de données de Canada Vigilance contient les déclarations de cas d'effets indésirables liées aux produits de santé, y compris les erreurs de médication et les plaintes relatives à la qualité des produits ayant entraîné des réactions indésirables. Le système Canada Vigilance - Matériels médicaux (CV-MM) de Santé Canada contient de l'information sur les incidents problématiques liés aux matériels médicaux, allant des pansements adhésifs aux stimulateurs cardiaques.
Le Réseau sentinelle canadien pour les matériels médicaux (ResSCMM) est un programme de surveillance active composé d'établissements de soins de santé aigus ou communautaires au Canada qui fournissent des données de haute qualité à Santé Canada sur les effets indésirables liés à tous les types de matériels médicaux.
Canada Vigilance, CV-MM et le ResSCMM sont des outils utiles pour la surveillance post-commercialisation et sont utilisés par Santé Canada pour surveiller les préoccupations potentielles en matière de sécurité qui pourraient être liées à un produit de santé commercialisé ou à un matériel médical, évaluer la conformité d'un fabricant à la réglementation en matière de déclaration et répondre aux demandes de renseignements en provenance de l'extérieur. Les événements indésirables signalés dans ces bases de données sont évalués par des examinateurs scientifiques et si un problème de sécurité potentiel est recensé, une évaluation plus poussée est effectuée. Cela peut comprendre la réalisation d'études à l'aide d'autres grandes bases de données, l'examen systématique de la documentation, la liaison avec les organismes de réglementation internationaux et la vérification des monographies de produits et de l'information sur l'étiquetage. À la suite d'une évaluation complète, Santé Canada peut prendre des mesures réglementaires pour assurer la sécurité du produit et protéger la santé publique, notamment en ajoutant des mises en garde, des précautions et des renseignements sur les effets indésirables à l'Information sur le produit et à l'information sur les médicaments à l'intention des consommateurs, en restreignant l'utilisation du produit de santé ou du matériel médical, en communiquant de nouveaux renseignements sur la sécurité au public ou, dans de rares cas, en retirant un produit de santé ou un matériel médical du marché. De plus amples renseignements sont disponibles sur le site Web MedEffetMC Canada. Ce site Web donne également accès à des avis, à des rappels, à des examens de sécurité et à la publication InfoVigilance sur les produits de santé.
Le présent rapport a pour but de fournir une analyse descriptive des types d'effets indésirables, il s'agit de déclarations de cas sur des produits de santé ainsi que d'incidents liés à des matériels médicaux, qui ont été signalés à Santé Canada entre 2008 et 2017. Les données sont présentées en trois sections.
- La section 1 donne de l'information sur les tendances dans les déclarations de cas d'effets indésirables à Santé Canada par l'entremise de Canada Vigilance entre 2008 et 2017. Une ventilation annuelle plus détaillée des données est également présentée pour la période entre 2013 et 2017.
- La section 2 présente les tendances relatives aux incidents liés aux matériels médicaux signalés à Santé Canada entre 2008 et 2017. Une ventilation annuelle plus détaillée des données est présentée pour la période entre 2013 et 2017.
- La section 3 présente des données du ResSCMM, le programme de surveillance active des incidents liés aux matériels médicaux de Santé Canada, à partir de sa création en 2009 jusqu'à 2017.
Section 1.0 Déclaration de cas d'effets indésirables (EI) par l'entremise de Canada Vigilance
Les déclarations de cas d'effets indésirables des produits de santé suivants commercialisés au Canada sont déclarés par l'entremise de Canada Vigilance : les médicaments sur ordonnance, les médicaments en vente libre, les produits de santé naturels, les produits biologiques (y compris les produits biotechnologiques, les vaccins, les produits sanguins obtenus par fractionnement, le sang et les composants sanguins humains ainsi que les cellules, les tissus et les organes humains), les produits radiopharmaceutiques, les désinfectants et les produits d'hygiène comportant des allégations de propriétés de désinfection.
Les déclarations de cas d'EI contiennent souvent de multiples réactions déclarées qui sont codées dans la base de données de Canada Vigilance à l'aide du Medical Dictionary for Regulatory Activities - MedDRA (en anglais seulement). MedDRA utilise une hiérarchie afin de regrouper des affections ou des réactions semblables.
1.1 Tendances dans les déclarations de cas d'EI (2008-2017)
Depuis 2008, les déclarations de cas d'EI pour les produits de santé commercialisés signalées à Santé Canada ont continué d'augmenter, passant de 15 551 cas en 2008 à 64 617 cas en 2017 (Figure 1).
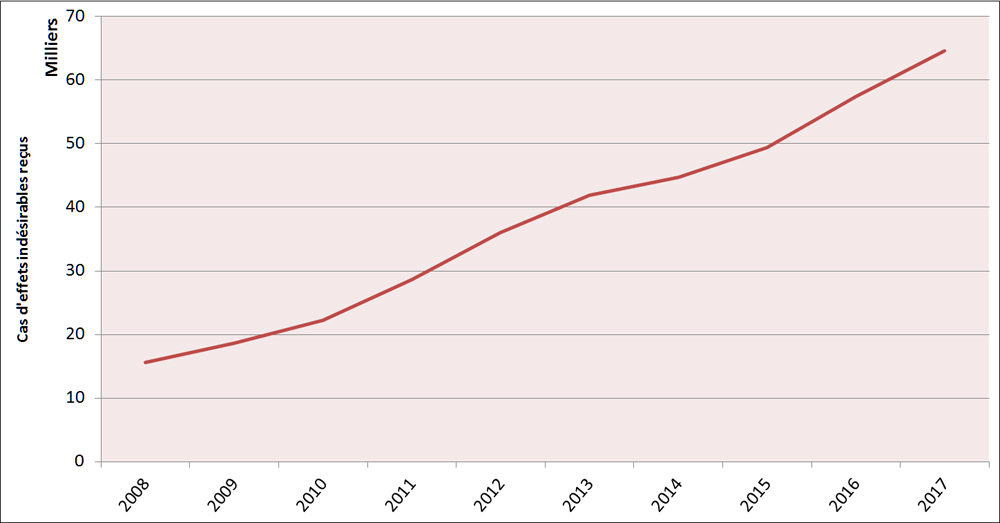
Description textuel :
| Année | Nombre de déclarations de cas canadiens |
| 2008 | 15 551 |
| 2009 | 18 607 |
| 2010 | 22 217 |
| 2011 | 28 654 |
| 2012 | 36 080 |
| 2013 | 41 872 |
| 2014 | 44 695 |
| 2015 | 49 374 |
| 2016 | 57 485 |
| 2017 | 64 617 |
1.2 Déclarations obligatoires et volontaires de cas d'EI
Les déclarations de cas sur les EI sont soumises sur une base volontaire par les professionnels de la santé et les consommateurs, soit directement à Santé Canada, soit par l'intermédiaire de parties réglementées conformément à la réglementation pertinente. Au fil du temps, on a constaté une augmentation soutenue du nombre de déclarations obligatoires de cas d'EI soumises à Santé Canada, passant de 10 124 cas en 2008 à 56 983 cas en 2017. À l'inverse, le nombre de déclarations volontaires de cas est demeuré relativement stable (entre 5 400 cas et 8 600 cas) pendant cette période (Figure 2).
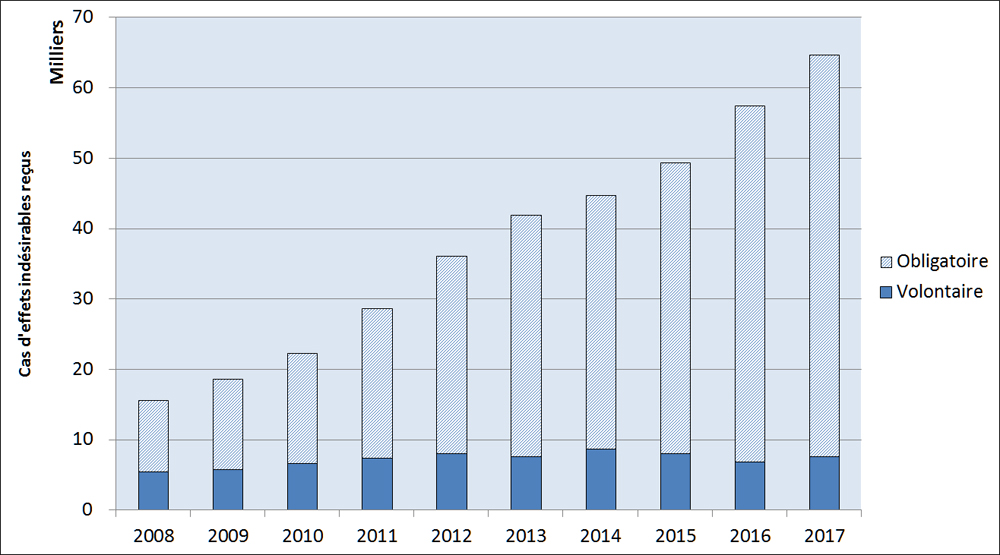
Description textuel :
| Année | Obligatoire | Volontaire |
| 2008 | 10 124 | 5 427 |
| 2009 | 12 866 | 5 741 |
| 2010 | 15 563 | 6 654 |
| 2011 | 21 310 | 7 344 |
| 2012 | 28 055 | 8 025 |
| 2013 | 34 256 | 7 616 |
| 2014 | 36 049 | 8 646 |
| 2015 | 41 342 | 8 032 |
| 2016 | 50 622 | 6 863 |
| 2017 | 56 983 | 7 634 |
1.3 Gravité des déclarations de cas d'EI survenus au Canada
Santé Canada reçoit des déclarations de cas d'EI graves et non graves sur une gamme de produits de santé avec des échéances assortis pour les déclarations distinctes. Par exemple, conformément au Règlement sur les aliments et drogues, les parties réglementées doivent signaler à Santé Canada les incidents d'EI graves survenus au Canada et qui touchent des produits de santé commercialisés et des produits de santé naturels dans les 15 jours suivant la réception ou la prise de connaissance de l'information.
Santé Canada définit une réaction indésirable grave comme une « réaction nocive et non intentionnelle à une drogue qui est provoquée par toute dose de celle-ci et qui nécessite une hospitalisation ou prolonge l'hospitalisation en cours, entraîne une malformation congénitale ou une invalidité ou incapacité persistante ou importante, met la vie en danger ou entraîne la mort. Les réactions importantes qui, dans l'immédiat, ne menacent pas le pronostic vital, n'entraînent pas la mort, ou n'exigent pas l'hospitalisation du patient, mais qui peuvent le mettre en danger ou exiger une intervention dans le but d'éviter l'une ou l'autre des conséquences énumérées ci-dessus, peuvent également être considérées comme graves. »
Bien qu'il y ait eu une augmentation des déclarations de cas graves et non graves signalées à Santé Canada, le nombre de déclarations de cas graves signalées à Santé Canada a augmenté de façon plus marquée (de 10 717 cas en 2008 à 44 910 cas en 2017 pour les déclarations de cas graves contre 4 834 cas en 2008 à 19 707 cas en 2017 pour les déclarations de cas non graves, Figure 3).
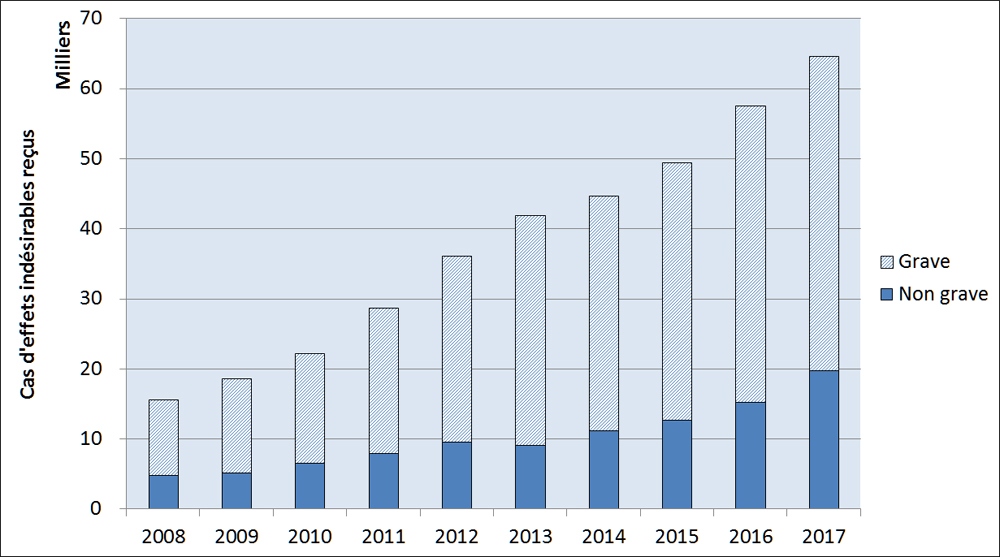
Description textuel :
| Année | Grave | Non grave |
| 2008 | 10 717 | 4 834 |
| 2009 | 13 461 | 5 146 |
| 2010 | 15 679 | 6 538 |
| 2011 | 20 683 | 7 971 |
| 2012 | 26 549 | 9 531 |
| 2013 | 32 819 | 9 053 |
| 2014 | 33 533 | 11 162 |
| 2015 | 36 715 | 12 659 |
| 2016 | 42 284 | 15 201 |
| 2017 | 44 910 | 19 707 |
1.4 Déclarations de cas d'EI survenus au Canada signalées à Santé Canada, 2017
En 2017, Santé Canada a reçu 64 617 déclarations de cas d'EI survenus au Canada et environ 500 000 déclarations de cas d'EI survenus à l'étranger. Parmi les cas au Canada, 88 % ont été signalés par l'entremise de déclarations obligatoires de la part des parties réglementées. De plus, 70 % des déclarations de cas d'EI reçues et survenus au Canada ont été cernées comme étant graves par le déclarant.
1.4.1 Auteurs de déclarations obligatoires et volontaires de cas d'EI survenus au Canada, 2017
La Figure 4 montre la répartition des auteurs de déclarations de cas d'EI au Canada. Ces déclarations de cas d'EI ont été soumises volontairement à Santé Canada directement par les déclarants ou sinon, les déclarants ont volontairement soumis le cas à une partie réglementée qui est tenue par la réglementation pertinente de le déclarer des rapports à Santé Canada. Les professionnels de la santé, qui comprennent les médecins, le personnel infirmier et les pharmaciens, ont présenté le plus grand nombre de déclarations de cas d'EI (69 %) en 2017.
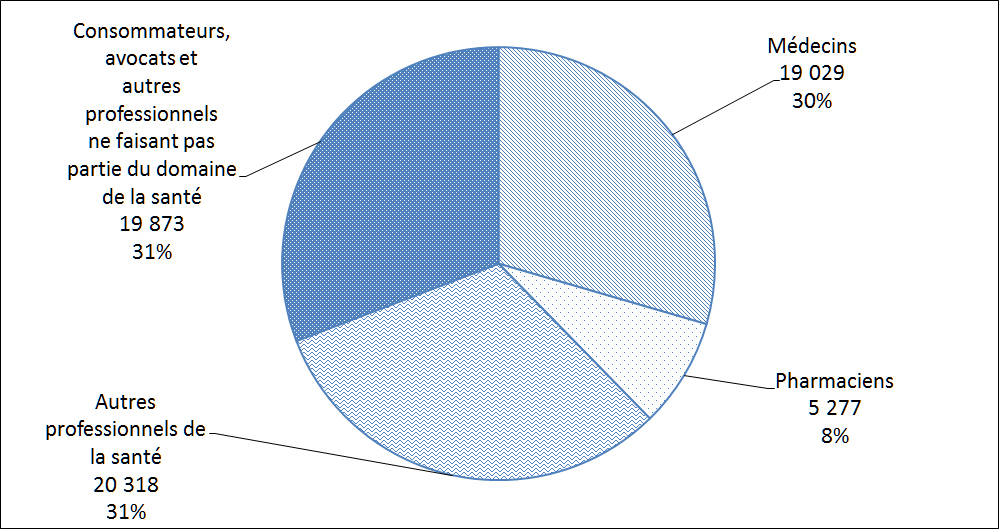
Description textuel :
| Type de déclarant | Nombre de déclarations |
| Médecins | 19 029 |
| Pharmaciens | 5 277 |
| Autres professionnels de la santé | 20 318 |
| Consommateurs avocats et autres professionnels ne faisant pas partie du domaine de la santé | 19 873 |
1.4.2 Déclarations de cas d'EI survenus au Canada par type de produit, 2017
En 2017, Santé Canada a reçu des déclarations de cas d'EI survenus au Canada pour quatre types de produits distincts : les produits pharmaceutiques, les produits radiopharmaceutiques, les produits biologiques et les produits de santé naturels. Le plus grand nombre de déclarations de cas reçues concernaient les produits pharmaceutiques (60 %), suivis par les produits biologiques (39 %, Figure 5). Une description par sous-catégorie des déclarations de cas d'EI attribuables aux produits biologiques est également présentée à la Figure 5.
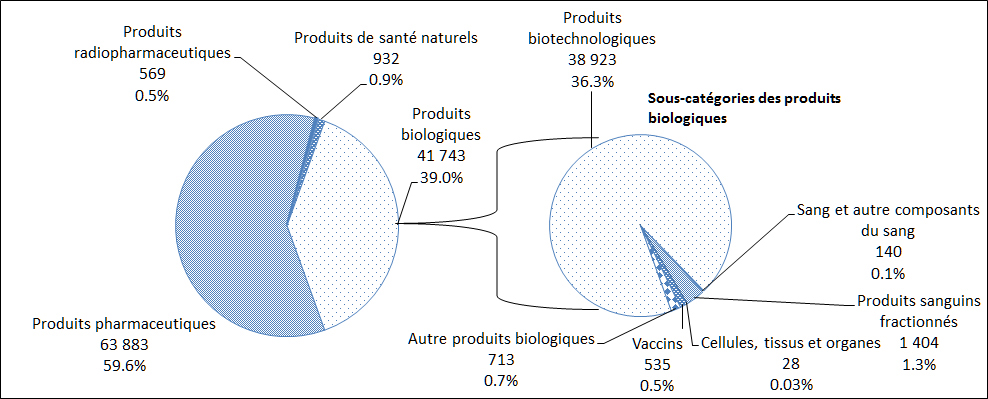
Description textuel :
| Type de produits | Nombre de déclarations |
| Produits pharmaceutiques | 63 883 |
| Produits radiopharmaceutiques | 569 |
| Produits de santé naturels | 932 |
| Produits biotechnologiques* | 38 923 |
| Sang et autres composants du sang* | 140 |
| Produits sanguins fractionnés* | 1 404 |
| Cellules tissus et organs* | 28 |
| Vaccins* | 535 |
| Autres produits biologiques* | 713 |
*Total des produits biologiques - 41 743
1.4.3 Déclarations de cas d'EI survenus au Canada par groupes du système de classification anatomique, thérapeutique et chimique (ATC), 2017
Le système de classification ATC est un outil de recherche sur l'utilisation des médicaments. Le Tableau 1 présente les 10 principaux groupes de classification ATC les plus représentés dans les produits suspects déclarés au Canada.
| Les 10 groupes de classification ATC les plus courants | Nombre de produits suspects déclarés | % de produits suspects déclarés |
| Immunosuppresseurs (L04) | 42 089 | 39,2% |
| Agents antinéoplasiques (L01)) | 16 748 | 15,6% |
| Médicaments pour les maladies obstructives des voies respiratoires (R03) | 3 018 | 2,8% |
| Psycholeptiques (N05) | 2 839 | 2,7% |
| Antidiarrhéiques anti-inflammatoires intestinaux/agents anti-infectieux (A07) | 2 694 | 2,5% |
| Produits anti-inflammatoires et antirhumatismaux (M01) | 2 678 | 2,5% |
| Médicaments pour le traitement des désordres osseux (M05) | 2 457 | 2,3% |
| Corticoïdes à usage systémique (H02) | 2 404 | 2,2% |
| Antiprotozoaires (P01) | 2 085 | 1,9% |
| Analgésiques (N02) | 1 874 | 1,8% |
1.4.4 Déclarations de cas d'EI survenus au Canada par système et par organe, 2017
Une répartition, qui fait appel au codage du Medical Dictionary for Regulatory Activities - MedDRA, par catégorie la plus générale, c'est-à-dire par système et par organe (System Organ Class), est présentée dans le Tableau 2. Ce classement par système et par organe comprend des troubles qui affectent plusieurs systèmes ou sites de l'organisme (p. ex. inefficacité du médicament, fatigue, fièvre, œdème, douleur, réactions au site d'administration). Les cas d'EI les plus souvent signalés relevaient de la catégorie Troubles généraux et anomalies au site d'administration.
| Les 10 classes par système et par organe les plus courantes | Nombre de déclarations d'EI signalées | % de déclarations d'EI signalées |
| Troubles généraux et anomalies au site d'administration | 56 625 | 22,8% |
| Affections gastro-intestinales | 25 341 | 10,2% |
| Infections et infestations | 20 560 | 8,3% |
| Affections musculosquelettiques et du tissu conjonctif | 19 923 | 8,0% |
| Enquêtes | 18 548 | 7,5% |
| Complications lésionnelles toxiques et procédurales | 16 541 | 6,7% |
| Affections du système nerveux | 15 758 | 6,3% |
| Affections respiratoires thoraciques et médiastinales | 13 765 | 5,5% |
| Affections de la peau et du tissu sous-cutané | 13 591 | 5,5% |
| Affections psychiatriques | 8 602 | 3,5% |
1.5 Déclarations de cas d'EI survenus au Canada signalées à Santé Canada, 2016
En 2016, Santé Canada a reçu 57 485 déclarations de cas d'EI survenus au Canada et environ 500 000 déclarations de cas d'EI survenus à l'étranger. Parmi les cas au Canada, 88 % ont été signalés par l'entremise de déclarations obligatoires de la part des parties réglementées. De plus, 74 % des déclarations de cas d'EI reçues et survenus au Canada étaient graves.
1.5.1 Auteurs de déclarations obligatoires et volontaires de cas d'EI survenus au Canada, 2016
La Figure 6 montre la répartition des auteurs de déclarations de cas d'EI survenus au Canada. Ces déclarations de cas d'EI ont été soumises volontairement à Santé Canada directement par les déclarants ou les déclarants ont volontairement soumis le cas à une partie réglementée qui est tenue par la réglementation pertinente de le déclarer à Santé Canada. Les professionnels de la santé, qui comprennent les médecins, le personnel infirmier et les pharmaciens, ont présenté le plus grand nombre de déclarations de cas d'EI (73 %) en 2016.
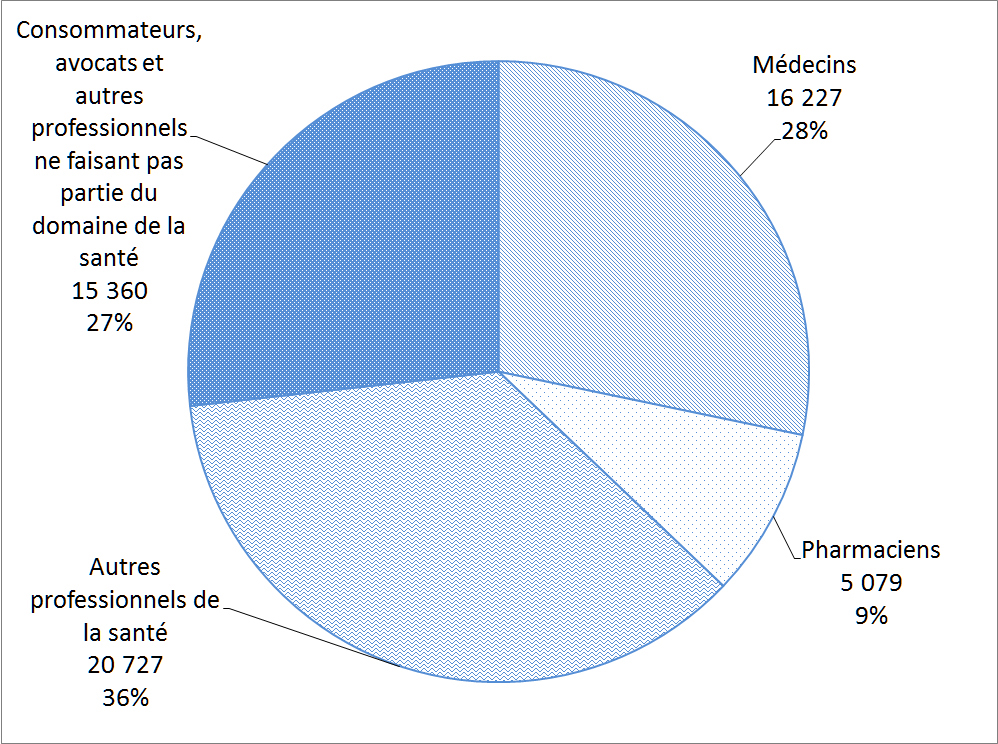
Description textuel :
| Type de déclarant | Nombre de déclarations |
| Médecins | 16 227 |
| Pharmaciens | 5 079 |
| Autres professionnels de la santé | 20 727 |
| Consommateurs avocats et autres professionnels ne faisant pas partie du domaine de la santé | 15 360 |
1.5.2 Déclarations de cas d'EI survenus au Canada par type de produit, 2016
En 2016, le plus grand nombre de déclarations de cas d'EI reçues par Santé Canada concernaient des produits pharmaceutiques (59 %), suivis par des produits biologiques (40 %, Figure 7). Une description par sous-catégorie des déclarations de cas d'EI attribuables aux produits biologiques est également présentée à la Figure 7.
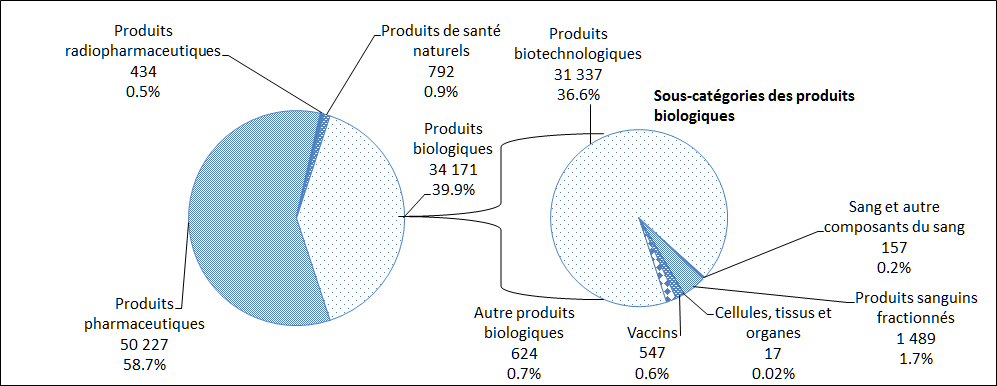
Description textuel :
| Type de produits | Nombre de déclarations |
| Produits pharmaceutiques | 50 227 |
| Produits radiopharmaceutiques | 434 |
| Produits de santé naturels | 792 |
| Produits biotechnologiques* | 31 337 |
| Sang et autres composants du sang* | 157 |
| Produits sanguins fractionnés* | 1 489 |
| Cellules tissus et organs* | 17 |
| Vaccins* | 547 |
| Autres produits biologiques* | 624 |
*Total des produits biologiques - 34 171
1.5.3 Déclarations de cas d'EI survenus au Canada par groupes du système de classification anatomique, thérapeutique et chimique (ATC), 2016
Le Système de classification ATC est un outil de recherche sur l'utilisation des médicaments. Le Tableau 3 présente les 10 principaux groupes de classification ATC les plus représentés dans les produits suspects déclarés au Canada.
| Les 10 groupes de classification ATC les plus courants | Nombre de produits suspects déclarés | % de produits suspects déclarés |
| Immunosuppresseurs (L04) | 32 811 | 38,3% |
| Agents antinéoplasiques (L01) | 12 153 | 14,2% |
| Psycholeptiques (N05) | 2 356 | 2,8% |
| Médicaments pour les maladies obstructives des voies respiratoires (R03) | 2 311 | 2,7% |
| Médicaments pour le traitement des désordres osseux (M05) | 2 305 | 2,7% |
| Antiviraux à usage systémique (J05) | 1 915 | 2,2% |
| Produits anti-inflammatoires et antirhumatismaux (M01) | 1 835 | 2,1% |
| Analgésiques (N02) | 1 623 | 1,9% |
| Psychoanaleptiques (N06) | 1 600 | 1,9% |
| Corticoïdes à usage systémique (H02) | 1 537 | 1,8% |
1.5.4 Déclarations de cas d'EI survenus au Canada par système et par organe, 2016
Une répartition, qui fait appel au codage du Medical Dictionary for Regulatory Activities - MedDRA, par catégorie la plus générale, c'est-à-dire par système et par organe (System Organ Class), est présentée dans le Tableau 4. Les cas d'EI les plus souvent signalés relevaient de la catégorie Troubles généraux et anomalies au site d'administration.
| Les 10 classes par système et par organe les plus courantes | Nombre de déclarations d'EI signalées | % de déclarations d'EI signalées |
| Troubles généraux et anomalies au site d'administration | 47 874 | 20,8% |
| Affections gastro-intestinales | 26 131 | 11,3% |
| Complications lésionnelles toxiques et procédurales | 19 755 | 8,6% |
| Enquêtes | 18 466 | 8,0% |
| Infections et infestations | 18 292 | 7,9% |
| Affections musculosquelettiques et du tissu conjonctif | 16 716 | 7,3% |
| Affections du système nerveux | 14 539 | 6,3% |
| Affections respiratoires thoraciques et médiastinales | 13 059 | 5,7% |
| Affections de la peau et du tissu sous-cutané | 12 513 | 5,4% |
| Affections psychiatriques | 7 374 | 3,2% |
1.6 Déclarations de cas d'EI survenus au Canada signalées à Santé Canada, 2015
En 2015, Santé Canada a reçu 49 374 déclarations de cas d'EI survenus au Canada et environ 450 000 déclarations de cas d'EI survenus à l'étranger. Parmi les cas au Canada, 84 % ont été signalés par l'entremise de déclarations obligatoires de la part des parties réglementées. De plus, 74 % des déclarations de cas d'EI reçues et survenus au Canada ont été identifiées comme étant graves par les déclarants.
1.6.1 Auteurs de déclarations obligatoires et volontaires de cas d'EI survenus au Canada, 2015
La Figure 8 montre la répartition des auteurs de déclarations de cas d'EI au Canada. Ces déclarations de cas d'EI ont été soumises volontairement à Santé Canada directement par les déclarants ou sinon, les déclarants ont volontairement soumis le cas à une partie réglementée qui est tenue par la réglementation pertinente de le déclarer à Santé Canada. Les professionnels de la santé, qui comprennent les médecins, le personnel infirmier et les pharmaciens, ont présenté le plus grand nombre de déclarations de cas d'EI (73 %) en 2015.
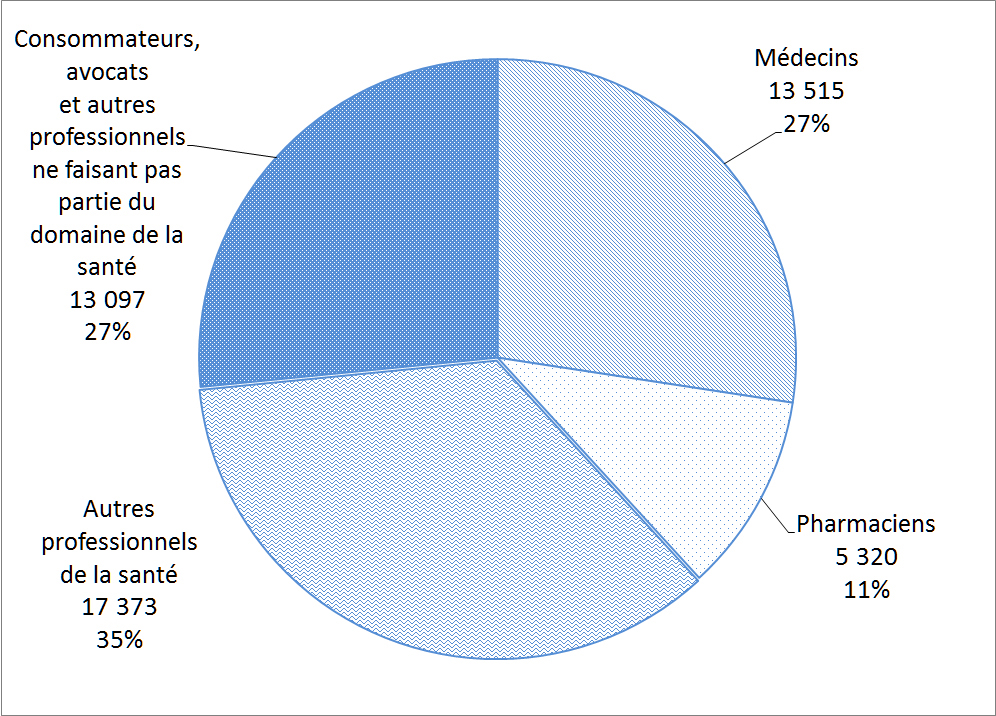
Description textuel :
| Type de déclarant | Nombre de déclarations |
| Médecins | 13 515 |
| Pharmaciens | 5 320 |
| Autres professionnels de la santé | 17 373 |
| Consommateurs avocats et autres professionnels ne faisant pas partie du domaine de la santé | 13 097 |
1.6.2 Déclarations de cas d'EI survenus au Canada par type de produit, 2015
En 2015, le plus grand nombre de déclarations de cas d'EI reçues par Santé Canada concernaient des produits pharmaceutiques (62 %), suivis par des produits biologiques (36 %, Figure 9). Une description par sous-catégorie des déclarations de cas d'EI attribuables aux produits biologiques est également présentée à la Figure 9.
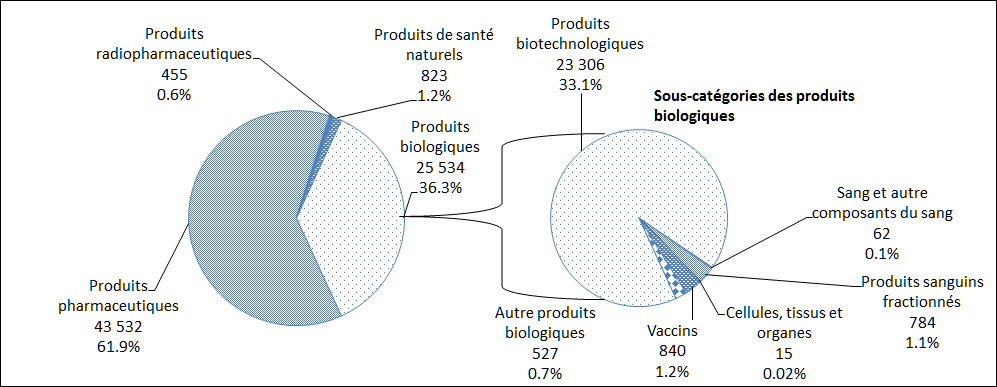
Description textuel :
| Type de produits | Nombre de déclarations |
| Produits pharmaceutiques | 43 532 |
| Produits radiopharmaceutiques | 455 |
| Produits de santé naturels | 823 |
| Produits biotechnologiques* | 23 306 |
| Sang et autres composants du sang* | 62 |
| Produits sanguins fractionnés* | 784 |
| Cellules tissus et organes* | 15 |
| Vaccins* | 840 |
| Autres produits biologiques* | 527 |
*Total des produits biologiques - 25 534
1.6.3 Déclarations de cas d'EI survenus au Canada par groupes du système de classification anatomique thérapeutique chimique (ATC), 2015
Le Système de classification ATC est un outil de recherche sur l'utilisation des médicaments. Le Tableau 5 présente les 10 principaux groupes de classification ATC les plus représentés dans les produits suspects déclarés au Canada.
| Les 10 groupes de classification ATC les plus courants | Nombre de produits suspects déclarés | % de produits suspects déclarés |
| Immunosuppresseurs (L04) | 21 923 | 31,1% |
| Agents antinéoplasiques (L01) | 9 803 | 13,9% |
| Psycholeptiques (N05) | 2 575 | 3,7% |
| Analgésiques (N02) | 2 393 | 3,4% |
| Médicaments pour le traitement des désordres osseux (M05) | 2 287 | 3,3% |
| Médicaments pour les maladies obstructives des voies respiratoires (R03) | 1 919 | 2,7% |
| Psychoanaleptiques (N06) | 1 826 | 2,6% |
| Antiviraux à usage systémique (J05) | 1 767 | 2,5% |
| Agents antithrombotiques (B01) | 1 624 | 2,3% |
| Antibactériens à usage systémique (J01) | 1 612 | 2,3% |
1.6.4 Déclarations de cas d'EI survenus au Canada par système et par organe, 2015
Une répartition, qui fait appel au codage du Medical Dictionary for Regulatory Activities - MedDRA, par catégorie la plus générale, c'est-à-dire par système et par organe (System Organ Class), est présentée dans le Tableau 6. Les cas d'EI les plus souvent signalés relevaient de la catégorie Troubles généraux et anomalies au site d'administration
| Les 10 classes par système et par organe les plus courantes | Nombre de déclarations d'EI signalées | % de déclarations d'EI signalées |
| Troubles généraux et anomalies au site d'administration | 36 951 | 19,7% |
| Affections gastro-intestinales | 19 100 | 10,2% |
| Enquêtes | 16 879 | 9,0% |
| Infections et infestations | 14 934 | 8,0% |
| Affections du système nerveux | 13 498 | 7,2% |
| Affections musculosquelettiques et du tissu conjonctif | 12 968 | 6,9% |
| Affections respiratoires thoraciques et médiastinales | 11 673 | 6,2% |
| Complications lésionnelles toxiques et procédurales | 11 401 | 6,1% |
| Affections de la peau et du tissu sous-cutané | 9 956 | 5,3% |
| Affections psychiatriques | 7 951 | 4,2% |
1.7 Déclarations de cas d'EI survenus au Canada signalées à Santé Canada, 2014
En 2014, Santé Canada a reçu 44 695 déclarations de cas d'EI survenus au Canada et environ 430 000 déclarations de cas d'EI survenus à l'étranger. Parmi les cas au Canada, 81 % ont été signalés par l'entremise de déclarations obligatoires de la part des parties réglementées. De plus, 75 % des déclarations de cas d'EI reçues et survenus au Canada ont été identifiées comme étant graves par le déclarant.
1.7.1 Auteurs de déclarations obligatoires et volontaires de cas d'EI survenus au Canada, 2014
La Figure 10 montre la répartition des auteurs de déclarations de cas d'EI au Canada. Ces déclarations de cas d'EI ont été soumises volontairement à Santé Canada directement par les déclarants ou sinon, les déclarants ont volontairement soumis le cas à une partie réglementée qui est tenue par la réglementation pertinente de le déclarer à Santé Canada. Les professionnels de la santé, qui comprennent les médecins, le personnel infirmier et les pharmaciens, ont présenté le plus grand nombre de déclarations de cas d'EI (70 %) en 2014.
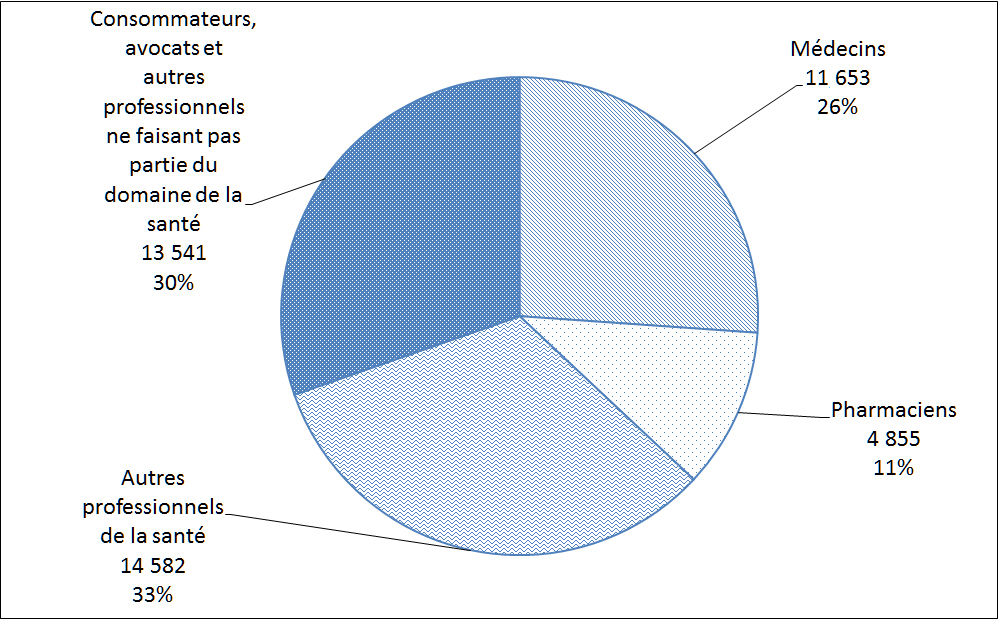
Description textuel :
| Type de déclarant | Nombre de déclarations |
| Médecins | 11 653 |
| Pharmaciens | 4 855 |
| Autres professionnels de la santé | 14 582 |
| Consommateurs avocats et autres professionnels ne faisant pas partie du domaine de la santé | 13 541 |
1.7.2 Déclarations de cas d'EI survenus au Canada par type de produit, 2014
En 2014, le plus grand nombre de déclarations de cas d'EI reçues par Santé Canada concernaient des produits pharmaceutiques (59 %), suivis par des produits biologiques (38 %, Figure 11). Une description par sous-catégorie des déclarations de cas d'EI attribuables aux produits biologiques est également présentée à la Figure 11.
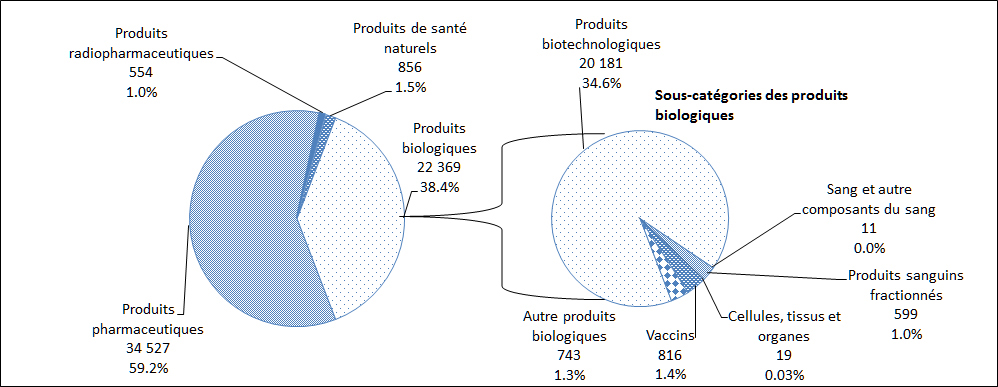
Description textuel :
| Type de produits | Nombre de déclarations |
| Produits pharmaceutiques | 34 527 |
| Produits radiopharmaceutiques | 554 |
| Produits de santé naturels | 856 |
| Produits biotechnologiques* | 20 181 |
| Sang et autres composants du sang* | 11 |
| Produits sanguins fractionnés* | 599 |
| Cellules, tissus et organes* | 19 |
| Vaccins* | 816 |
| Autres produits biologiques* | 743 |
*Total des produits biologiques - 22 369
1.7.3 Déclarations de cas d'EI survenus au Canada par groupes du système de classification anatomique, thérapeutique et chimique (ATC), 2014
Le Système de classification ATC est un outil de recherche sur l'utilisation des médicaments. Le Tableau 7 présente les 10 principaux groupes de classification ATC les plus représentés dans les produits suspects déclarés au Canada.
| Les 10 groupes de classification ATC les plus courants | Nombre de produits suspects déclarés | % de produits suspects déclarés |
| Immunosuppresseurs (L04) | 15 992 | 27,4% |
| Agents antinéoplasiques (L01) | 6 652 | 11,4% |
| Substituts du sang et solutions de perfusion (B05) | 2 393 | 4,1% |
| Médicaments pour le traitement des désordres osseux (M05) | 2 095 | 3,6% |
| Psycholeptiques (N05) | 2 080 | 3,6% |
| Analgésiques (N02) | 1 966 | 3,4% |
| Psychoanaleptiques (N06) | 1 669 | 2,9% |
| Antibactériens à usage systémique (J01) | 1,585 | 2,7% |
| Agents antithrombotiques (B01) | 1 398 | 2,4% |
| Médicaments pour les maladies obstructives des voies respiratoires (R03) | 1 392 | 2,4% |
1.7.4 Déclarations de cas d'EI survenus au Canada par système et par organe, 2014
Une répartition, qui fait appel au codage du Medical Dictionary for Regulatory Activities - MedDRA, par catégorie la plus générale, c'est-à-dire par système et par organe (System Organ Class), est présentée dans le Tableau 8. Les cas d'EI les plus souvent signalés relevaient de la catégorie Troubles généraux et anomalies au site d'administration.
| Les 10 classes par système et par organe les plus courantes | Nombre de déclarations d'EI signalées | % de déclarations d'EI signalées |
| Troubles généraux et anomalies au site d'administration | 29 045 | 18,2% |
| Affections gastro-intestinales | 17 015 | 10,7% |
| Enquêtes | 12 778 | 8,0% |
| Infections et infestations | 12 595 | 7,9% |
| Affections du système nerveux | 12 405 | 7,8% |
| Complications lésionnelles, toxiques et procédurales | 10 323 | 6,5% |
| Affections musculosquelettiques et du tissu conjonctif | 9 763 | 6,1% |
| Affections respiratoires, thoraciques et médiastinales | 8 944 | 5,6% |
| Affections de la peau et du tissu sous-cutané | 8 462 | 5,3% |
| Affections psychiatriques | 6 718 | 4,2% |
1.8 Déclarations de cas d'EI survenus au Canada signalées à Santé Canada, 2013
En 2013, Santé Canada a reçu 41 872 déclarations de cas d'EI survenus au Canada et environ 400 000 déclarations d'EI survenus à l'étranger. Parmi les cas au Canada, 82 % ont été signalés par l'entremise de déclarations obligatoires de la part des parties réglementées. De plus, 78 % des déclarations de cas d'EI survenus et reçues au Canada ont été identifiées comme étant graves par le déclarant.
1.8.1 Auteurs de déclarations obligatoires et volontaires de cas d'EI survenus au Canada, 2013
La Figure 12 montre la répartition des auteurs de déclarations de cas d'EI au Canada. Ces déclarations de cas d'EI ont été soumises volontairement à Santé Canada directement par les déclarants ou les déclarants ont volontairement soumis le cas à une partie réglementée qui est tenue par la réglementation pertinente de le déclarer à Santé Canada. Les professionnels de la santé, qui comprennent les médecins, les infirmières et les pharmaciens, ont présenté le plus grand nombre de déclarations de cas d'EI (67 %) en 2013.
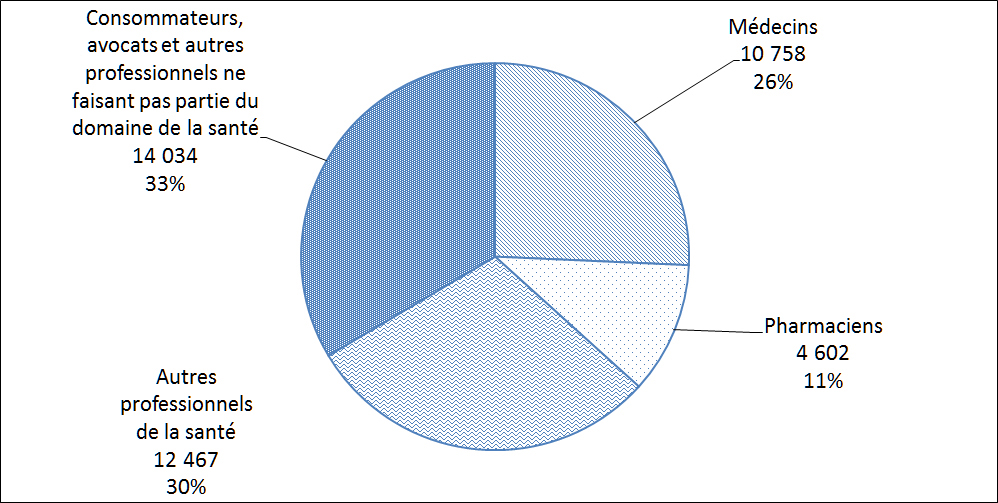
Description textuel :
| Type de déclarant | Nombre de déclarations |
| Médecins | 10 758 |
| Pharmaciens | 4 602 |
| Autres professionnels de la santé | 12 467 |
| Consommateurs, avocats et autres professionnels ne faisant pas partie du domaine de la santé | 14 034 |
1.8.2 Déclarations de cas d'EI survenus au Canada par type de produit, 2013
En 2013, le plus grand nombre de déclarations de cas d'EI reçues par Santé Canada concernaient des produits pharmaceutiques (60 %), suivis par des produits biologiques (37 %, Figure 13). Une description par sous-catégorie des déclarations de cas d'EI attribuables aux produits biologiques est également présentée à la Figure 13.
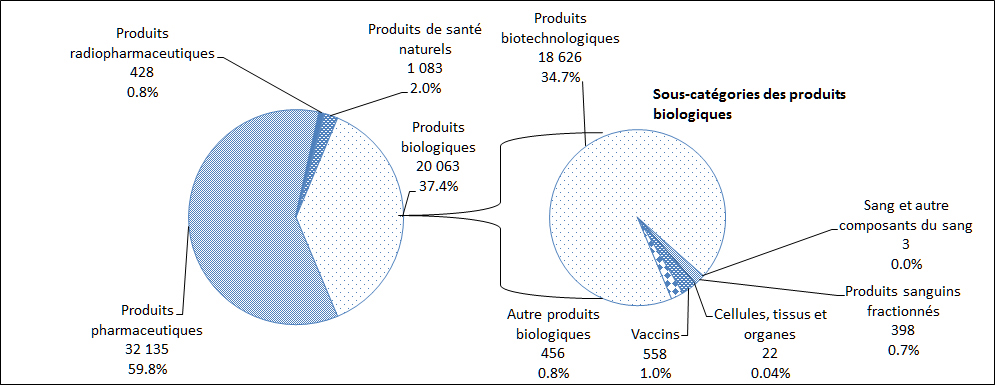
Description textuel :
| Type de produits | Nombre de déclarations |
| Produits pharmaceutiques | 32 135 |
| Produits radiopharmaceutiques | 428 |
| Produits de santé naturels | 1 083 |
| Produits biotechnologiques* | 18 626 |
| Sang et autres composants du sang* | 3 |
| Produits sanguins fractionnés* | 398 |
| Cellules, tissus et organes* | 22 |
| Vaccins* | 558 |
| Autres produits biologiques* | 456 |
*Total des produits biologiques - 20 063
1.8.3 Déclarations de cas d'EI survenus au Canada par groupes du système de classification anatomique, thérapeutique et chimique (ATC), 2013
Le Système de classification ATC est un outil de recherche sur l'utilisation des médicaments. Le Tableau 9 présente les 10 principaux groupes de classification ATC les plus représentés dans les produits suspects déclarés au Canada.
| Les 10 groupes de classification ATC les plus courants | Nombre de produits suspects déclarés | % de produits suspects déclarés |
| Immunosuppresseurs (L04) | 14 114 | 26,2% |
| Agents antinéoplasiques (L01) | 7 223 | 13,4% |
| Substituts du sang et solutions de perfusion (B05) | 2 944 | 5,5% |
| Médicaments pour le traitement des désordres osseux (M05) | 2 066 | 3,8% |
| Psycholeptiques (N05) | 1 875 | 3,5% |
| Analgésiques (N02) | 1 751 | 3,3% |
| Agents antithrombotiques (B01) | 1 554 | 2,9% |
| Psychoanaleptiques (N06) | 1 327 | 2,5% |
| Médicaments pour les maladies obstructives des voies respiratoires (R03) | 1 257 | 2,3% |
| Immunomodulateurs/Stimulants (L03) | 1 254 | 2,3% |
1.8.4 Déclarations de cas d'EI survenus au Canada par système et par organe, 2013
Une répartition, qui fait appel au codage du Medical Dictionary for Regulatory Activities - MedDRA, par catégorie la plus générale, c'est-à-dire par système et par organe (System Organ Class), est présentée dans le Tableau 10. Les cas d'EI les plus souvent signalés relevaient de la catégorie Troubles généraux et anomalies au site d'administration.
| Les 10 classes par système et par organe les plus courantes | Nombre de déclarations d'EI signalées | % de déclarations d'EI signalées |
| Troubles généraux et anomalies au site d'administration | 26 303 | 18,0% |
| Affections gastro-intestinales | 14 820 | 10,1% |
| Enquêtes | 12 738 | 8,7% |
| Infections et infestations | 11 735 | 8,0% |
| Affections du système nerveux | 11 546 | 7,9% |
| Affections musculosquelettiques et du tissu conjonctif | 9 402 | 6,4% |
| Complications lésionnelles, toxiques et procédurales | 8 859 | 6,1% |
| Affections respiratoires, thoraciques et médiastinales | 8 639 | 5,9% |
| Affections de la peau et du tissu sous-cutané | 7 552 | 5,2% |
| Affections psychiatriques | 6 598 | 4,5% |
Section 2.0 : Déclaration obligatoire des incidents liés aux matériels médicaux par l'intermédiaire de Canada Vigilance (CV-MM)
Dans le cas des matériels médicaux, une déclaration obligatoire d'un incident est exigée de la part du fabricant et de l'importateur concernant tout incident porté à leur attention, qu'il survienne à l'intérieur ou à l'extérieur du Canada, touchant un instrument médical vendu au Canada. Les déclarations obligatoires d'incidents survenus au Canada comprennent des incidents liés à la défaillance d'un instrument ou à la dégradation de son efficacité, à des erreurs dans l'étiquetage ou le mode d'emploi, ou si l'incident a entraîné le décès ou une détérioration grave de l'état de santé d'un patient, d'un utilisateur ou de toute autre personne, ou qui serait susceptible de le faire s'il se reproduisait.
Les déclarations obligatoires d'incidents liés aux matériels médicaux signalent fréquemment plus d'un problème. Ces problèmes sont compilés par Santé Canada dans la base de données sur les matériels médicaux au moyen d'un système de codage structuré. Dans ses travaux récents, l'International Medical Device Regulators Forum (IMDRF) a proposé une hiérarchie à trois niveaux pour les termes et les codes liés aux matériels médicaux. Le premier niveau répartit les problèmes dans 27 vastes catégories. Santé Canada a mené un exercice pour répertorier les codes utilisés dans la base de données en fonction de ces 27 catégories.
Les matériels médicaux sont classés selon le risque rattaché à leur utilisation; les matériels de classe I représentant le risque potentiel le plus faible (p. ex. thermomètres au mercure) et les matériels de classe IV représentant le risque potentiel le plus élevé (p. ex. certains stimulateurs cardiaques ou défibrillateurs). Avant de vendre un instrument médical au Canada, les fabricants de matériels des classes II, III et IV doivent les faire homologuer. Santé Canada tient à jour une base de données de tous les matériels médicaux homologués de classe II, III et IV en vente au Canada. La base de données MDALL (liste des matériels médicaux homologués en vigueur- Medical Devices Active Licence Listing) est consultable et disponible en ligne. Les matériels médicaux de classe I n'ont pas besoin d'être homologués et sont contrôlés par Santé Canada par le truchement de l'octroi de licences d'établissement.
2.1 Tendances dans la déclaration obligatoire des incidents liés aux matériels médicaux (2008-2017)
Depuis 2008, il y a eu une augmentation de la déclaration obligatoire des incidents liés aux matériels médicaux signalés à Santé Canada, tant au pays qu'à l'étranger, comme le montre la Figure 14. Au cours des dix dernières années, le nombre d'incidents liés aux matériels médicaux déclarés a continué d'augmenter : Santé Canada a reçu en moyenne 14 % plus d'incidents survenus au Canada par année; le nombre d'incidents survenus au Canada est passé de 4 008 en 2008 à 11 307 en 2017.
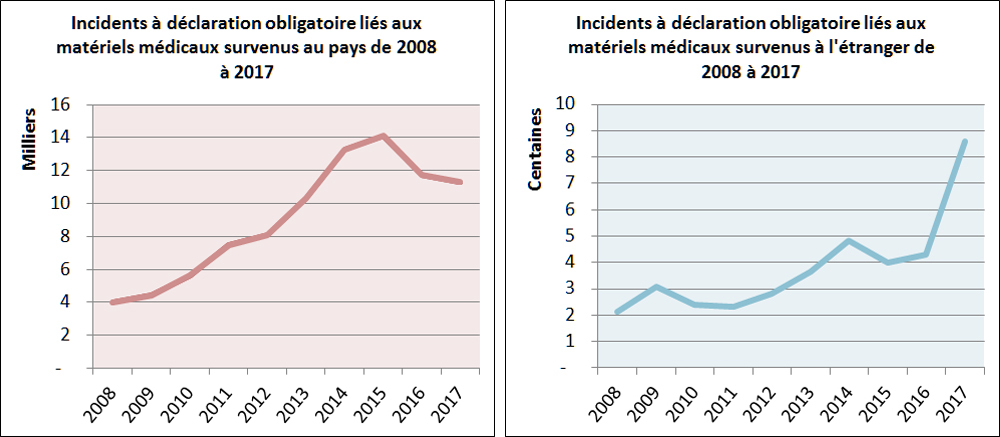
Description textuel :
| Année | Nombre d'incidents au Canada | Nombre d'incidents à l'étranger |
| 2008 | 4 008 | 211 |
| 2009 | 4 433 | 306 |
| 2010 | 5 631 | 238 |
| 2011 | 7 496 | 230 |
| 2012 | 8 106 | 283 |
| 2013 | 10 305 | 366 |
| 2014 | 13 279 | 482 |
| 2015 | 14 101 | 399 |
| 2016 | 11 707 | 431 |
| 2017 | 11 307 | 858 |
Les déclarations obligatoires d'incidents survenus à l'étranger ne sont exigées que lorsque l'incident répond aux mêmes conditions que pour un incident survenu au Canada, mais de plus, l'incident doit avoir entraîné soit l'intention du fabricant de prendre des mesures correctives, soit le fait que l'organisme de réglementation étranger exige que le fabricant prenne des mesures correctives. Comme il s'agit d'un ensemble de critères plus restrictifs, le nombre de déclarations obligatoires d'incidents survenus à l'étranger est beaucoup plus faible que le nombre de déclarations d'incidents survenus au pays.
2.2 Gravité des déclarations d'incidents liés aux matériels médicaux
La période de déclaration après avoir pris connaissance d'un incident varie selon la nature de l'incident. Un fabricant ou un importateur doit soumettre une déclaration préliminaire dans les 10 jours suivant la prise de connaissance d'un incident si l'incident a entraîné la mort ou une détérioration grave de l'état de santé d'une personne, alors que le délai de déclaration est de 30 jours lorsque l'incident n'a pas entraîné la mort ou une détérioration grave de l'état de santé d'une personne, mais que cela pourrait survenir si l'incident se reproduisait. Les déclarations dans les 10 jours sont plus graves et sont prioritaires pour l'évaluation.
Figure 15 illustre la répartition de la gravité de l'incident telle que mesurée par l'échéancier de déclaration depuis 2008. Dans l'ensemble, il y a eu une légère augmentation du nombre de cas graves (déclarations dans les 10 jours), qui est passé de 587 en 2008 à 1 721 en 2017. Bien que la tendance des déclarations non graves (30 jours) ait augmenté depuis 2008, il semble qu'il y ait eu une baisse modérée de ces déclarations depuis 2015.
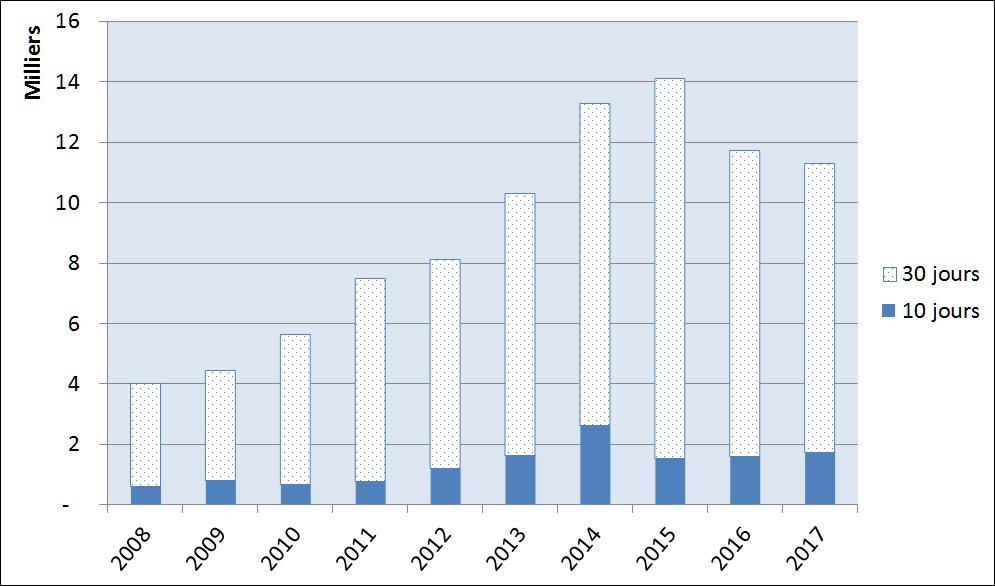
Description textuel :
| Année | Nombre de rapports déclarés dans les 30 jours | Nombre de rapports déclarés dans les 10 jours |
| 2008 | 3 406 | 587 |
| 2009 | 3 631 | 786 |
| 2010 | 4 936 | 675 |
| 2011 | 6 724 | 765 |
| 2012 | 6 913 | 1 184 |
| 2013 | 8 658 | 1 636 |
| 2014 | 10 664 | 2 606 |
| 2015 | 12 567 | 1 529 |
| 2016 | 10 122 | 1 576 |
| 2017 | 9 575 | 1 721 |
2.3 Déclarations obligatoires d'incidents liés aux matériels médicaux, 2017
En 2017, Santé Canada a reçu 11 307 déclarations obligatoires d'incidents liés aux matériels médicaux survenus au Canada et 858 déclarations obligatoires d'incidents liés aux matériels médicaux survenus à l'étranger. Les déclarations dans les 10 jours représentaient 15 % des déclarations d'incidents survenus au Canada et reçues par Santé Canada en 2017.
2.3.1 Classes de matériels médicaux dans les déclarations obligatoires d'incidents liés aux matériels médicaux, 2017
Les matériels médicaux sont classés selon le risque rattaché à leur utilisation; les matériels de classe I représentant le risque potentiel le plus faible (p. ex. thermomètres au mercure) et les matériels de classe IV représentant le risque potentiel le plus élevé (p. ex. certains stimulateurs cardiaques ou défibrillateurs). Avant de vendre un matériel médical au Canada, les fabricants de matériels des classes II, III et IV doivent les faire homologuer. La Figure 16 répartit les déclarations reçues par Santé Canada en 2017 en fonction des quatre classes de matériels médicaux.
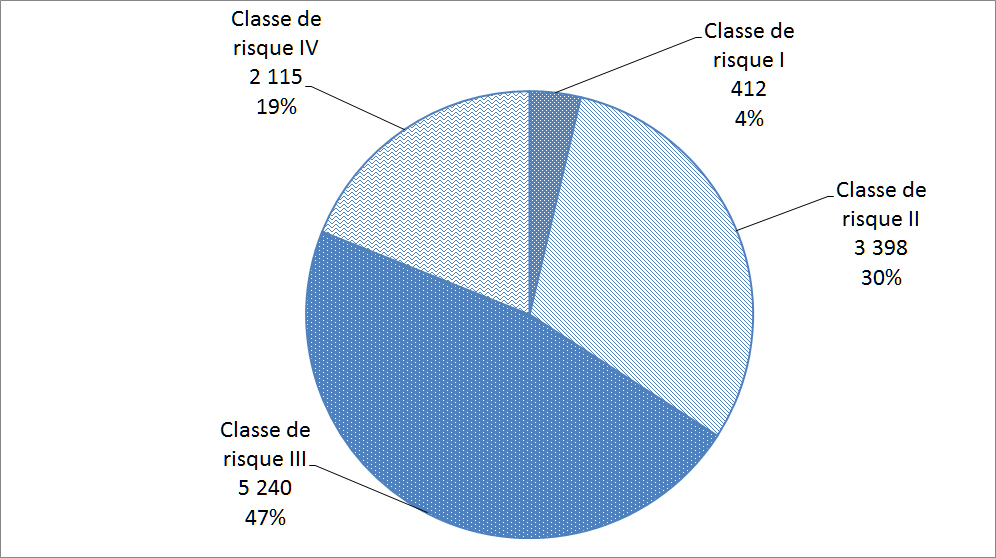
Description textuel :
| Classe de risque | Nombre d'incidents |
| Classe de risque I | 412 |
| Classe de risque II | 3 398 |
| Classe de risque III | 5 240 |
| Classe de risque IV | 2 115 |
2.3.2 Déclarations obligatoires d'incidents liés aux matériels médicaux par spécialité médicale, 2017
Les déclarations obligatoires d'incidents liés aux matériels médicaux sont reçues avec un certain nombre de spécialités médicales différentes. Le Tableau 11 présente le nombre de déclarations obligatoires d'incidents liés aux matériels médicaux pour les 10 spécialités médicales les plus courantes en 2017.
| Spécialité médicale par produit | Nombre de produits déclarés | % de produits déclarés |
| Hôpital général | 4 187 | 36,3% |
| Cardiovasculaire | 2 068 | 17,9% |
| Chimie | 1 226 | 10,6% |
| Chirurgie générale et plastique | 840 | 7,3% |
| Orthopédie | 718 | 6,2% |
| Gastroentérologie et urologie | 561 | 4,9% |
| Ophtalmologie | 447 | 3,9% |
| Obstétrique et gynécologie | 322 | 2,8% |
| Anesthésiologie | 308 | 2,7% |
| Neurologie | 228 | 2,0% |
2.3.3 Déclarations obligatoires d'incidents liés aux matériels médicaux par catégorie de problème, 2017
Les déclarations obligatoires d'incidents liés aux matériels médicaux signalent souvent des problèmes multiples au sujet d'un instrument ou d'un appareil médical. Le Tableau 12 présente les 10 catégories de problèmes signalés en 2017 selon les codes et la terminologie de l'International Medical Device Regulators Forum (IMDRF), annexe A niveau 1.
| Code de l'IMDRF | Nombre d'incidents | % d'incidents |
| A04 - Problème d'intégrité du matériel | 3 185 | 15,1% |
| A05 - Problème mécanique | 2 918 | 13,8% |
| A09 - Problème d'extraction | 2 372 | 11,2% |
| A26 - Information insuffisante | 2 023 | 9,6% |
| A07 - Problème de propriété électrique ou électronique | 1 650 | 7,8% |
| A14 - Problème d'infusion ou d'écoulement | 1 097 | 5,2% |
| A23 - Problème de l'utilisation de l'appareil | 1 065 | 5,0% |
| A02 - Problème de fabrication, d'emballage ou d'expédition | 991 | 4,7% |
| A15 - Problème d'activation, de positionnement ou de séparation | 601 | 2,8% |
| A16 - Problème de mesures de protection | 386 | 1,8% |
2.4 Déclarations obligatoires d'incidents liés aux matériels médicaux, 2016
En 2016, Santé Canada a reçu 11 707 déclarations obligatoires d'incidents liés aux matériels médicaux survenus au Canada et 431 déclarations obligatoires d'incidents liés aux matériels médicaux survenus à l'étranger. Les déclarations dans les 10 jours représentaient 13 % des déclarations d'incidents survenus au Canada et reçues par Santé Canada en 2016.
2.4.1 Classes de matériels médicaux dans les déclarations obligatoires d'incidents liés aux matériels médicaux, 2016
Les matériels médicaux sont classés selon le risque rattaché à leur utilisation; les matériels de classe I représentant le risque potentiel le plus faible (p. ex. thermomètres au mercure) et les matériels de classe IV représentant le risque potentiel le plus élevé (p. ex. certains stimulateurs cardiaques ou défibrillateurs). Avant de vendre un matériel médical au Canada, les fabricants de matériels des classes II, III et IV doivent les faire homologuer. La Figure 17 répartit les déclarations reçues par Santé Canada en 2016 en fonction des quatre classes de matériels médicaux.
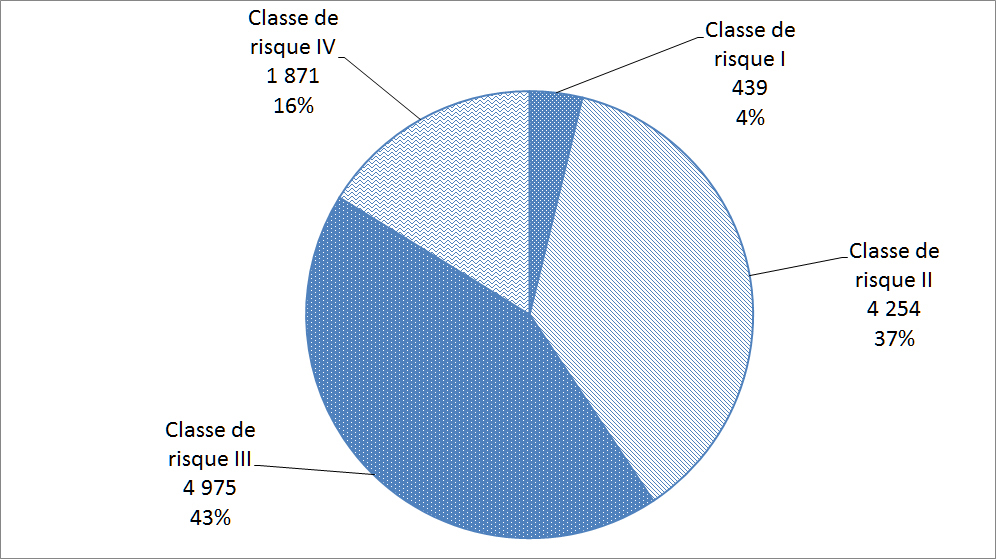
Description textuel :
| Classe de risque | Nombre d'incidents |
| Classe de risque I | 439 |
| Classe de risque II | 4 254 |
| Classe de risque III | 4 975 |
| Classe de risque IV | 1 871 |
2.4.2 Déclarations obligatoires d'incidents liés aux matériels médicaux par spécialité médicale
Les déclarations obligatoires d'incidents liés aux matériels médicaux sont reçues avec un certain nombre de spécialités médicales différentes. Le Tableau 13 présente le nombre de déclarations obligatoires d'incidents liés aux matériels médicaux pour les 10 spécialités médicales les plus communes en 2016.
| Spécialité médicale par produit | Nombre de produits déclarés | % de produits déclarés |
| Hôpital général | 5 343 | 45,5% |
| Cardiovasculaire | 1 926 | 16,4% |
| Chimie | 889 | 7,6% |
| Gastroentérologie et urologie | 633 | 5,4% |
| Chirurgie générale et plastique | 591 | 5,0% |
| Orthopédie | 508 | 4,3% |
| Ophtalmologie | 431 | 3,7% |
| Anesthésiologie | 395 | 3,4% |
| Neurologie | 221 | 1,9% |
| Obstétrique et gynécologie | 182 | 1,5% |
2.4.3 Déclarations obligatoires d'incidents liés aux matériels médicaux par catégorie de problème, 2016
Les déclarations obligatoires d'incidents liés aux matériels médicaux signalent souvent des problèmes multiples au sujet d'un instrument ou d'un appareil médical. Le Tableau 14 présente les 10 catégories de problèmes signalés en 2016 selon les codes et la terminologie de l'International Medical Device Regulators Forum (IMDRF), annexe A niveau 1.
| Code de l'IMDRF | Nombre de déclarations | % de déclarations |
| A05 - Problème mécanique | 3 479 | 16,0 % |
| A04 - Problème d'intégrité matérielle | 2 994 | 13,8% |
| A02 - Problème de fabrication, d'emballage ou d'expédition | 2 717 | 12,5% |
| A14 - Problème d'infusion ou de flux | 2 318 | 10,7% |
| A09 - Problème d'extraction | 1 711 | 7,9% |
| A07 - Problèmes de propriétés électriques ou électroniques | 1 609 | 7,4% |
| A26 - Information insuffisante | 839 | 3,9% |
| A15 - Problème d'activation, de positionnement ou de séparation | 738 | 3,4% |
| A16 - Problème de mesures de protection | 628 | 2,9% |
| A12 - Problème de connection | 525 | 2,4% |
2.5 Déclarations obligatoires d'incidents liés aux matériels médicaux, 2015
En 2015, Santé Canada a reçu 14 101 déclarations obligatoires d'incidents liés aux matériels médicaux survenus au Canada et 399 déclarations obligatoires d'incidents liés aux matériels médicaux survenus à l'étranger. Les déclarations dans les 10 jours représentaient 11 % des déclarations d'incidents survenus au Canada et reçues par Santé Canada en 2015.
2.5.1 Classes de matériels médicaux dans les déclarations obligatoires d'incidents liés aux matériels médicaux, 2015
Les matériels médicaux sont classés selon le risque rattaché à leur utilisation; les matériels de classe I représentant le risque potentiel le plus faible (p. ex. thermomètres au mercure) et les matériels de classe IV représentant le risque potentiel le plus élevé (p. ex. certains stimulateurs cardiaques ou défibrillateurs). Avant de vendre un matériel médical au Canada, les fabricants de matériels des classes II, III et IV doivent les faire homologuer. La Figure 18 répartit les déclarations reçues par Santé Canada en 2015 en fonction des quatre classes de matériels médicaux.
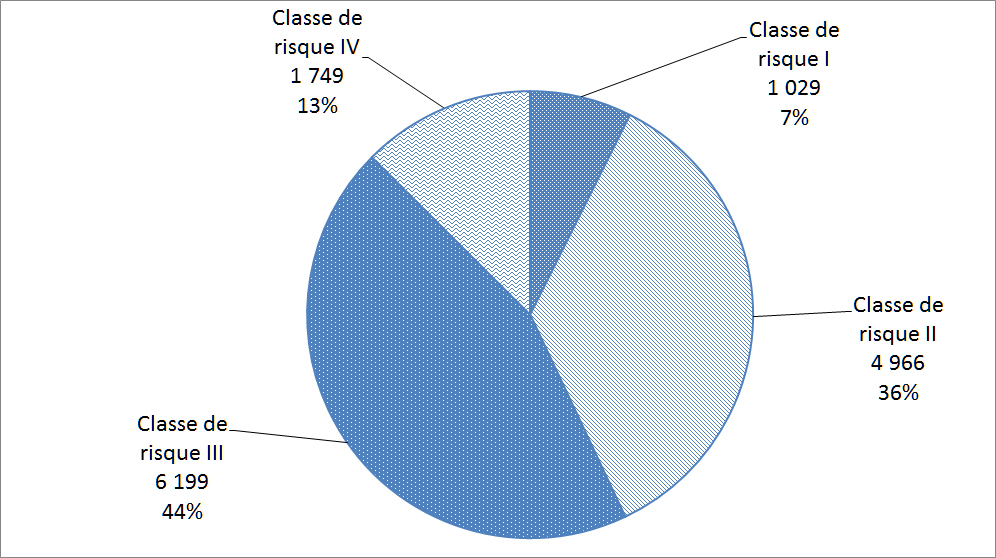
Description textuel :
| Classe de risque | Nombre d'incidents |
| Classe de risque I | 1 029 |
| Classe de risque II | 4 966 |
| Classe de risque III | 6 199 |
| Classe de risque IV | 1 749 |
2.5.2 Déclarations obligatoires d'incidents liés aux matériels médicaux par spécialité médicale, 2015
Les déclarations obligatoires d'incidents liés aux matériels médicaux sont reçues avec un certain nombre de spécialités médicales différentes. Le Tableau 15 présente le nombre de déclarations obligatoires d'incidents liés aux matériels médicaux pour les 10 spécialités médicales les plus communes en 2015.
| Spécialité médicale par produit | Nombre de produits déclarés | % de produits déclarés |
| Hôpital général | 6 046 | 42,8% |
| Cardiovasculaire | 1 919 | 13,6% |
| Gastroentérologie et urologie | 1 467 | 10,4% |
| Chimie | 1 017 | 7,2% |
| Orthopédie | 757 | 5,4% |
| Médicine physique | 701 | 5,0% |
| Chirurgie générale et plastique | 563 | 4,0% |
| Ophtalmologie | 376 | 2,7% |
| Anesthésiologie | 341 | 2,4% |
| Hématologie | 213 | 1,5% |
2.5.3 Déclarations obligatoires d'incidents liés aux matériels médicaux par catégorie de problème, 2015
Les déclarations obligatoires d'incidents liés aux matériels médicaux signalent souvent des problèmes multiples au sujet d'un matériel médical. Le Tableau 16 présente les 10 catégories de problèmes signalés en 2015 selon les codes et la terminologie de l'International Medical Device Regulators Forum (IMDRF), annexe A niveau 1.
| Code de l'IMDRF | Nombre d'incidents | % d'incidents |
| A04 - Problème d'intégrité du matériel | 4 100 | 15,5% |
| A05 - Problème mécanique | 3 579 | 13,6% |
| A02 - Problème de fabrication d'emballage ou d'expédition | 2 883 | 10,9% |
| A14 - Problème d'infusion ou de flux | 2 683 | 10,2% |
| A09 - Problème d'extraction | 1 918 | 7,3% |
| A07 - Problèmes de propriétés électriques ou électroniques | 1 752 | 6,6% |
| A16 - Problème de mesures de protection | 1 356 | 5,1% |
| A12 - Problème de connexion | 724 | 2,7% |
| A26 - Information insuffisante | 682 | 2,6% |
| A11 - Problème de logiciel informatique | 571 | 2,2% |
2.6 Déclarations obligatoires d'incidents liés aux matériels médicaux, 2014
En 2014, Santé Canada a reçu 13 279 déclarations obligatoires d'incidents liés aux matériels médicaux survenus au Canada et 482 déclarations obligatoires d'incidents liés aux matériels médicaux survenus à l'étranger. Les déclarations dans les 10 jours représentaient 20 % des déclarations d'incidents survenus au Canada et reçues par Santé Canada en 2014.
2.6.1 Classes de matériels médicaux dans les déclarations obligatoires d'incidents liés aux matériels médicaux, 2014
Les matériels médicaux sont classés selon le risque rattaché à leur utilisation; les matériels de classe I représentant le risque potentiel le plus faible (p. ex. thermomètres au mercure) et les matériels de classe IV représentant le risque potentiel le plus élevé (p. ex. certains stimulateurs cardiaques ou défibrillateurs). Avant de vendre un matériel médical au Canada, les fabricants de matériels des classes II, III et IV doivent les faire homologuer. La Figure 19 répartit les déclarations reçues par Santé Canada en 2014 en fonction des quatre classes de matériels médicaux.
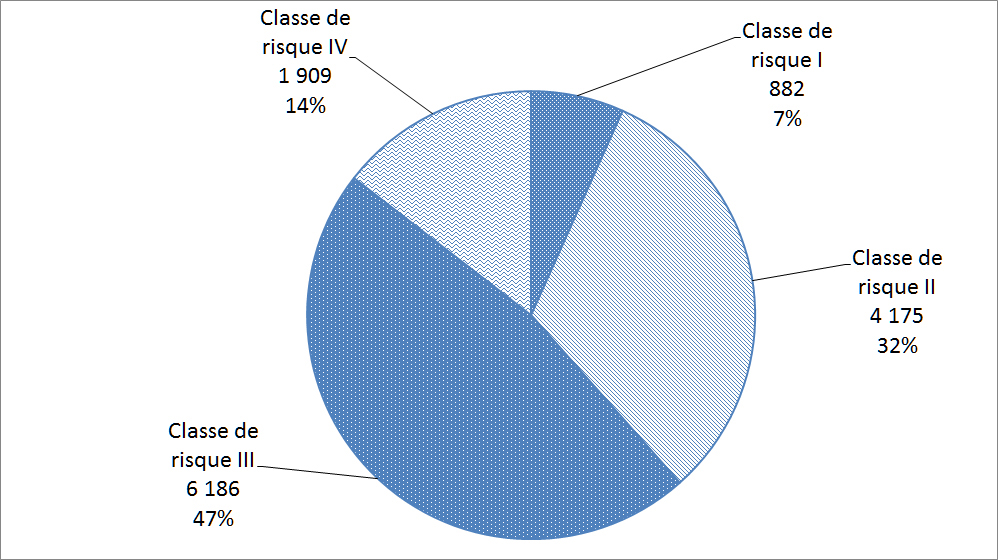
Description textuel :
| Classe de risque | Nombre d'incidents |
| Classe de risque I | 882 |
| Classe de risque II | 4 175 |
| Classe de risque III | 6 186 |
| Classe de risque IV | 1 909 |
2.6.2 Déclarations obligatoires d'incidents liés aux matériels médicaux par spécialité médicale, 2014
Les déclarations obligatoires d'incidents liés aux matériels médicaux sont reçues avec un certain nombre de spécialités médicales différentes. Le Tableau 17 présente le nombre de déclarations obligatoires d'incidents liés aux matériels médicaux pour les 10 spécialités médicales les plus communes en 2014.
| Spécialité médicale par produit | Nombre de produits déclarés | % de produits déclarés |
| Hôpital général | 4 389 | 33,0% |
| Cardiovasculaire | 2 071 | 15,6% |
| Gastroentérologie et urologie | 1 458 | 11,0% |
| Orthopédie | 1 399 | 10,5% |
| Chimie | 970 | 7,3% |
| Chirurgie générale et plastique | 528 | 4,0% |
| Médecine physique | 465 | 3,5% |
| Ophtalmologie | 453 | 3,4% |
| Dentaire | 401 | 3,0% |
| Hématologie | 293 | 2,2% |
2.6.3 Déclarations obligatoires d'incidents liés aux matériels médicaux par catégorie de problème, 2014
Les déclarations obligatoires d'incidents liés aux matériels médicaux signalent souvent des problèmes multiples au sujet d'un matériel médical. Le Tableau 18 présente les 10 catégories de problèmes signalés en 2014 selon les codes et la terminologie de l'International Medical Device Regulators Forum (IMDRF), annexe A niveau 1.
| Code de l'IMDRF | Nombre de déclarations | % de déclarations |
| A04 - Problème d'intégrité du matériel | 3 477 | 15,3% |
| A05 - Problème mécanique | 2 672 | 11,8% |
| A14 - Problème d'infusion ou d'écoulement | 1 874 | 8,3% |
| A09 - Problème d'extraction | 1 864 | 8,2% |
| A02 - Problème de fabrication d'emballage ou d'expédition | 1 851 | 8,2% |
| A23 - Problème d'utilisation | 1 581 | 7.0% |
| A07 - Problème de propriété électrique ou électronique | 1 525 | 6,7% |
| A12 - Problème de connexion | 1 379 | 6,1% |
| A16 - Problème de mesures de protection | 1 141 | 5,0% |
| A26 - Renseignements insuffisants | 548 | 2,4% |
2.7 Déclarations obligatoires d'incidents liés aux matériels médicaux, 2013
En 2013, Santé Canada a reçu 10 305 déclarations obligatoires d'incidents liés aux matériels médicaux survenus au Canada et 366 déclarations obligatoires d'incidents liés aux matériels médicaux survenus à l'étranger. Les déclarations dans les 10 jours représentaient 16 % des déclarations d'incidents survenus au Canada et reçues par Santé Canada en 2013.
2.7.1 Classes de matériels médicaux dans les déclarations obligatoires d'incidents liés aux matériels médicaux, 2013
Les matériels médicaux sont classés selon le risque rattaché à leur utilisation; les matériels de classe I représentant le risque potentiel le plus faible (p. ex. thermomètres au mercure) et les matériels de classe IV représentant le risque potentiel le plus élevé (p. ex. certains stimulateurs cardiaques ou défibrillateurs). Avant de vendre un matériel médical au Canada, les fabricants de matériels des classes II, III et IV doivent les faire homologuer. La Figure 20 répartit les déclarations reçues par Santé Canada en 2013 en fonction des quatre classes de matériels médicaux.
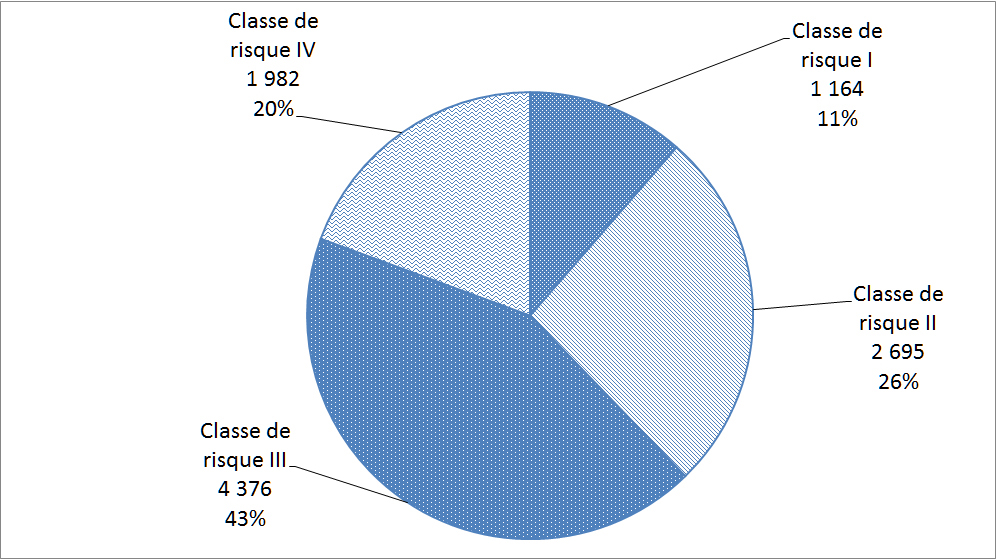
Description textuel :
| Classe de risque | Nombre d'incidents |
| Classe de risque I | 1 164 |
| Classe de risque II | 2 695 |
| Classe de risque III | 4 376 |
| Classe de risque IV | 1 982 |
2.7.2. Déclarations obligatoires d'incidents liés aux matériels médicaux par spécialité médicale, 2013
Les déclarations obligatoires d'incidents liés aux matériels médicaux sont reçues avec un certain nombre de spécialités médicales différentes. Le Tableau 19 présente le nombre de déclarations obligatoires d'incidents liés aux matériels médicaux pour les 10 spécialités médicales les plus communes en 2013.
| Spécialité médicale par produit | Nombre de produits déclarés | % de produits déclarés |
| Hôpital général | 2 988 | 29,0% |
| Cardiovasculaire | 2 090 | 20,3% |
| Gastroentérologie et urologie | 1 026 | 9,9% |
| Chimie | 931 | 9,0% |
| Médecine physique | 661 | 6,4% |
| Orthopédie | 621 | 6,0% |
| Chirurgie générale et plastique | 502 | 4,9% |
| Hématologie | 335 | 3,2% |
| Ophtalmologie | 231 | 2,2% |
| Obstétrique et gynécologie | 198 | 1,9% |
2.7.3 Déclarations obligatoires d'incidents liés aux matériels médicaux par catégorie de problème, 2013
Les déclarations obligatoires d'incidents liés aux matériels médicaux signalent souvent des problèmes multiples au sujet d'un matériel médical. Le Tableau 20 présente les 10 catégories de problèmes signalés en 2013 selon les codes et la terminologie de l'International Medical Device Regulators Forum (IMDRF), annexe A niveau 1
| Code de l'IMDRF | Nombre de déclarations | % de déclarations |
| A04 - Problème d'intégrité du matériel | 3 219 | 15,2% |
| A05 - Problème mécanique | 2 553 | 12,0% |
| A09 - Problème d'extraction | 2 121 | 10,0% |
| A07 - Problème de propriété électrique ou électronique | 2 082 | 9,8% |
| A02 - Problème de fabrication, d'emballage ou d'expédition | 1 722 | 8,1% |
| A14 - Problème d'infusion ou d'écoulement | 1 565 | 7,4% |
| A23 - Problème de l'utilisation de l'appareil | 1 052 | 5,0% |
| A12 - Problème de connection | 706 | 3,3% |
| A15 - Problème d'activation, de positionnement ou de séparation | 700 | 3,3% |
| A26 - Information insuffisante | 634 | 3,0% |
Section 3.0 : Déclarations par l'entremise du programme du Réseau sentinelle canadien pour les matériels médicaux (ResSCMM)
Le Réseau sentinelle canadien pour les matériels médicaux (ResSCMM) est un programme de surveillance active composé d'établissements de soins de santé communautaires ou de soins actifs au Canada qui fournissent des données de haute qualité sur les effets indésirables liés à tous les types de matériels médicaux. Seuls les établissements participants peuvent présenter des déclarations dans le cadre de ce programme et il n'y a aucun coût pour les établissements, mis à part le temps qu'ils consacrent à la présentation des rapports à Santé Canada. Ces rapports détaillés obtenus auprès des établissements déclarants aident à mieux caractériser la façon dont les organisations utilisent certains dispositifs, comment les problèmes sont perçus et signalés, et les facteurs qui peuvent avoir contribué à un événement particulier.
Par la création de cette communication bidirectionnelle entre Santé Canada et le milieu clinique pour mieux comprendre l'environnement, il est possible de déterminer des stratégies pratiques d'atténuation des risques, comme la sensibilisation aux dangers et aux conditions d'utilisation, l'amélioration de l'étiquetage et l'amélioration des normes de sécurité. Les objectifs généraux du programme ResSCMM sont de contribuer à améliorer la qualité des évaluations des risques et des interventions réglementaires antérieures et de fournir aux professionnels de la santé et aux citoyens des renseignements en temps opportun pour faire des choix éclairés en matière de santé qui permettront de maintenir et d'améliorer la santé des Canadiens.
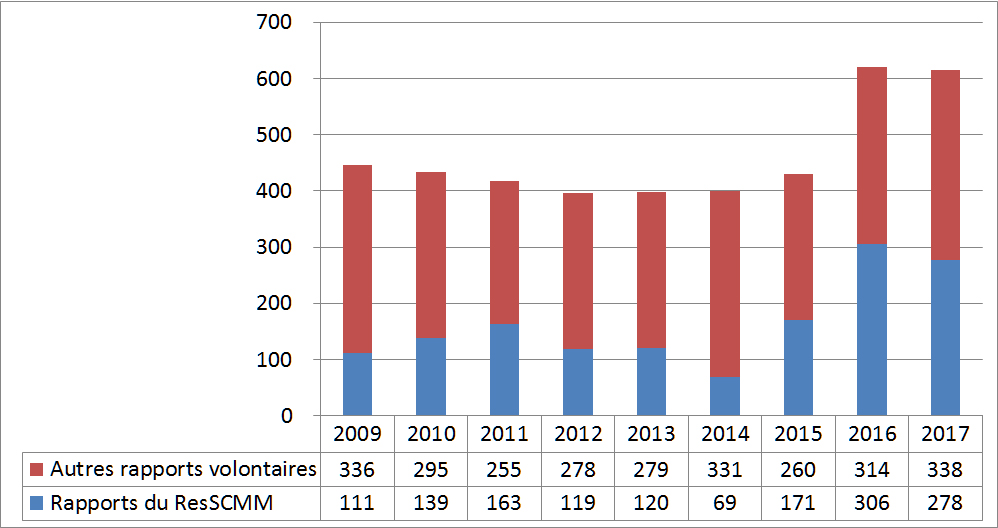
3.1 Tendances dans les déclarations volontaires reçues par l'entremise du ResSCMM (2009-2017)
Depuis le début du projet ResSCMM en 2009, Santé Canada a constaté une augmentation du nombre de déclarations volontaires reçues. Le sous-ensemble des déclarations du ResSCMM dans l'ensemble des déclarations volontaires reçues est illustré dans les statistiques de l'année civile à la Figure 21. En 2016, un nouveau site a été mis sur pied, dans lequel les déclarations automatisées sont transmises directement au ResSCMM, ce qui explique cette forte augmentation du nombre global de déclarations.
Description textuel :
| Année | Rapports du ResSCMM | Autres rapports volontaires | Total des rapports volontaires |
| 2009 | 111 | 336 | 447 |
| 2010 | 139 | 295 | 434 |
| 2011 | 163 | 255 | 418 |
| 2012 | 119 | 278 | 397 |
| 2013 | 120 | 279 | 399 |
| 2014 | 69 | 331 | 400 |
| 2015 | 171 | 260 | 431 |
| 2016 | 306 | 314 | 620 |
| 2017 | 278 | 338 | 616 |
3.2 Déclarations reçues par l'entremise du ResSCMM (2009-2017)
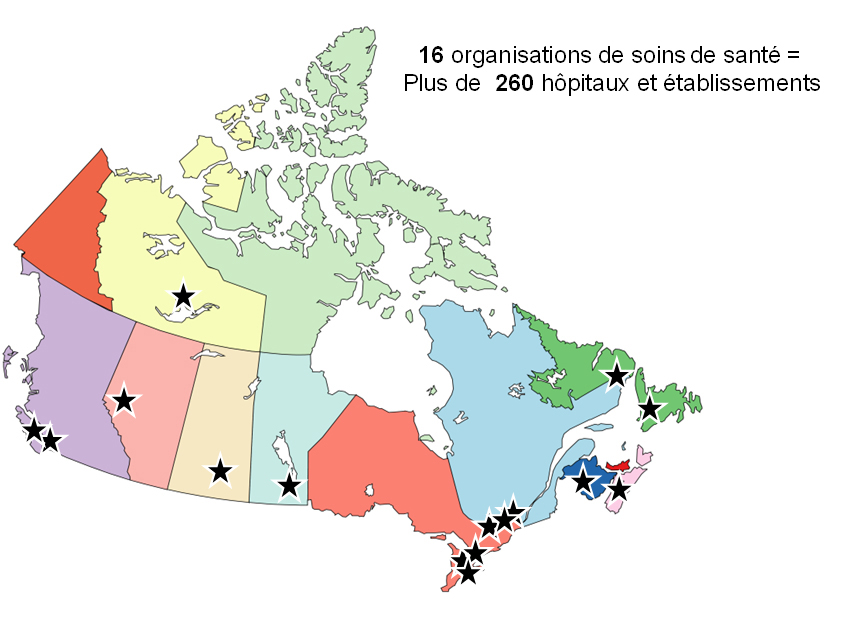
Le nombre d'organismes de soins de santé déclarants est passé de 10 dans le projet pilote à 16 en 2017. L'objectif à l'origine était de faire en sorte que l'ensemble des provinces et des territoires soient représentés. Nous continuons à chercher des hôpitaux ResSCMM au Nunavut et au Yukon. Ces organismes de santé varient en taille, allant d'un seul hôpital à une autorité sanitaire provinciale qui représente plus de 100 sites et 9 000 lits pour patients hospitalisés. Les emplacements représentant les organismes participant au ResSCMM en 2017 sont illustrés à la Figure 22.
Description textuel :
La Figure 22 : Emplacement des organismes participant au ResSCMM en 2017, montre une carte du Canada, où chaque province est d'une couleur différente. Dans chaque province, des étoiles noires indiquent les villes où un organisme de soins de santé du ResSCMM est établi. En tout, 16 organismes sont désignés par une étoile noire. En partant de la gauche de la carte, ces organismes sont la Vancouver Coastal Health Authority et la Vancouver Island Health Authority en Colombie Britannique, l'Alberta Health Authority en Alberta, la Stanton Territorial Health Authority dans les Territoires du Nord Ouest, la Regina Qu Appelle Health Authority en Saskatchewan, l'Office régional de la santé de Winnipeg au Manitoba, l'hôpital SickKids de Toronto, l'Institut de cardiologie d'Ottawa, Niagara Health et le William Osler Health Centre en Ontario, l'Université McGill et l'Hôpital général juif au Québec, le Réseau de santé Horizon au Nouveau Brunswick, Santé Î. P. É. à l'Île du Prince Édouard, la Régie de la santé de la Nouvelle Écosse et la Régie de santé de l'est à Terre Neuve et Labrador. Il est indiqué dans le coin supérieur droit de la Figure 22 que, grâce à ces 16 organismes, plus de 260 hôpitaux et établissements transmettent des rapports de données de qualité élevée à Santé Canada. Aucune étoile noire n'apparaît pour le Nunavut et le Yukon, indiquant qu'aucun organisme de soins de santé du ResSCMM n'est établi dans ces territoires.
3.3 Classes de matériels médicaux dans les déclarations du ResSCMM (2009-2017)
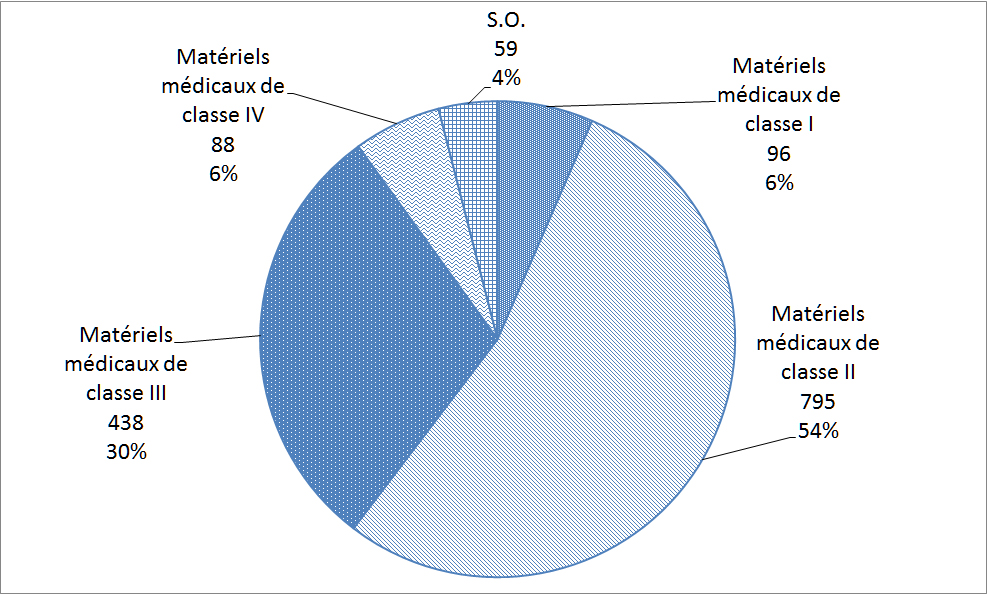
Les matériels médicaux sont classés selon le risque rattaché à leur utilisation; les matériels de classe I représentant le risque potentiel le plus faible (p. ex. thermomètres au mercure) et les matériels de classe IV représentant le risque potentiel le plus élevé (p. ex. certains stimulateurs cardiaques ou défibrillateurs). Avant de vendre un matériel médical au Canada, les fabricants de matériels des classes II, III et IV doivent les faire homologuer. La Figure 23 répartit les déclarations reçues par l'entremise du ResSCMM depuis 2009 en fonction des quatre classes de matériels médicaux. Étant donné que de nombreux matériels de classe II et III sont utilisés en milieu hospitalier, cela explique le nombre plus élevé de déclarations dans ces catégories.
Description textuel :
| Classe de matériels médicaux | Nombre de déclarations |
| Matériels médicaux de classe I | 96 |
| Matériels médicaux de classe II | 795 |
| Matériels médicaux de classe III | 438 |
| Matériels médicaux de classe IV | 88 |
| S.O. | 59 |
3.4 Gravité des déclarations du ResSCMM et résultats pour les patients (2009-2017)
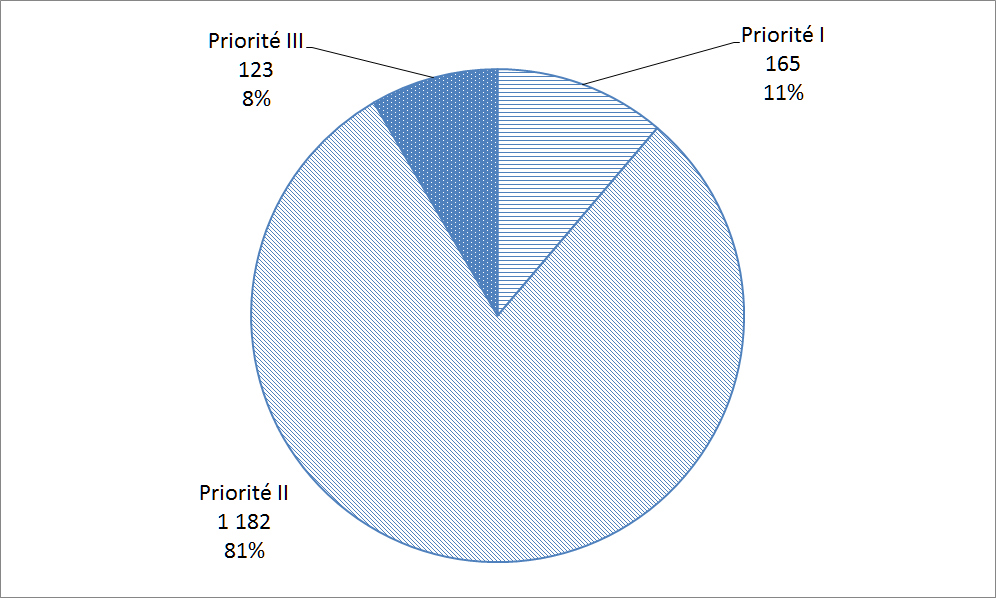
Santé Canada tient compte de tous les renseignements pertinents fournis pour évaluer le danger que présente un matériel pour la santé et attribue une priorité à l'incident signalé. Le programme comporte trois niveaux de priorité pour les incidents liés aux matériels médicaux : priorité I, priorité II et priorité III.
La Figure 24 et Figure 25 illustre la répartition de la gravité des déclarations et des résultats pour les patients reçues par l'entremise du ResSCMM depuis 2009. Comme le montre la Figure 24, les déclarations de priorité I représentent 11 % des déclarations reçues; toutefois, seulement 4 % des déclarations du ResSCMM ont en fait entraîné des blessures graves ou des décès tel que démontré dans la Figure 25. De nombreuses déclarations sur les matériels de classe II concernaient la qualité, de sorte qu'elles sont généralement moins graves. Les déclarations sur les risques de blessures sont intéressantes parce qu'il n'y a pas encore eu de blessure et qu'il est donc possible de corriger la situation avant qu'un incident qui causerait un préjudice aux patients ne se produise.
Description textuel :
| Priorité | Nombre de déclarations |
| Priorité I | 165 |
| Priorité II | 1 182 |
| Priorité III | 123 |
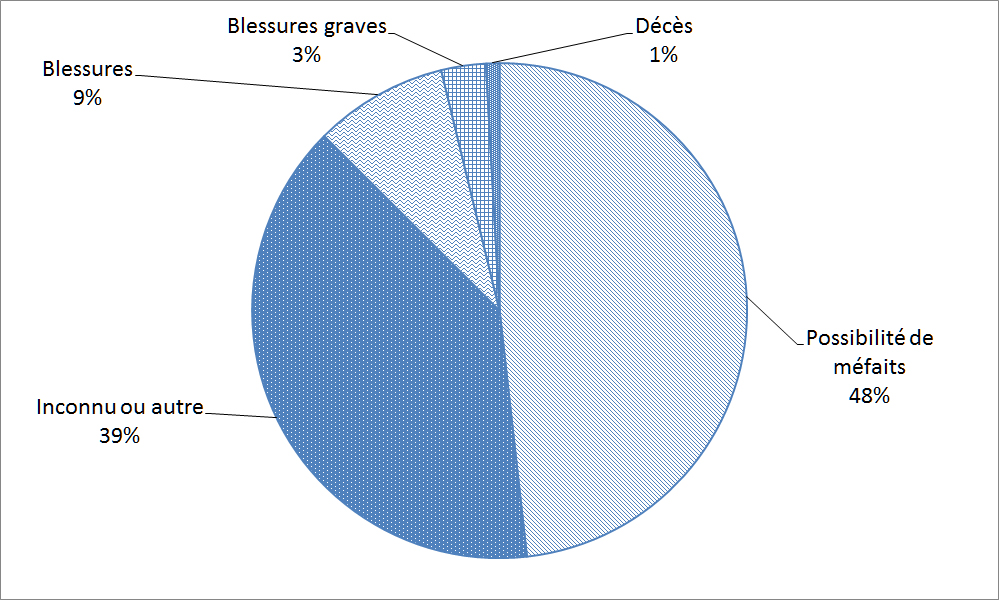
Description textuel :
| Blessures | Nombre de déclarations |
| Possibilité de méfaits | 712 |
| Inconnu ou autre | 579 |
| Blessures | 129 |
| Blessures graves | 43 |
| Décès | 13 |
3.5 Qualité des déclarations du ResSCMM (2009-2017)
Santé Canada évalue les déclarations du ResSCMM à l'aide d'une échelle modifiée élaborée par l'Organisation mondiale de la Santé (OMS). L'échelle modifiée de l'OMS est utilisée pour évaluer les déclarations sur une échelle de 1 à 5 en utilisant des critères d'évaluation établis au préalable, 5 étant la meilleure qualité et 1 étant non saisissable; 88 % étaient de la plus haute qualité selon l'échelle modifiée de l'OMS (Figure 26).
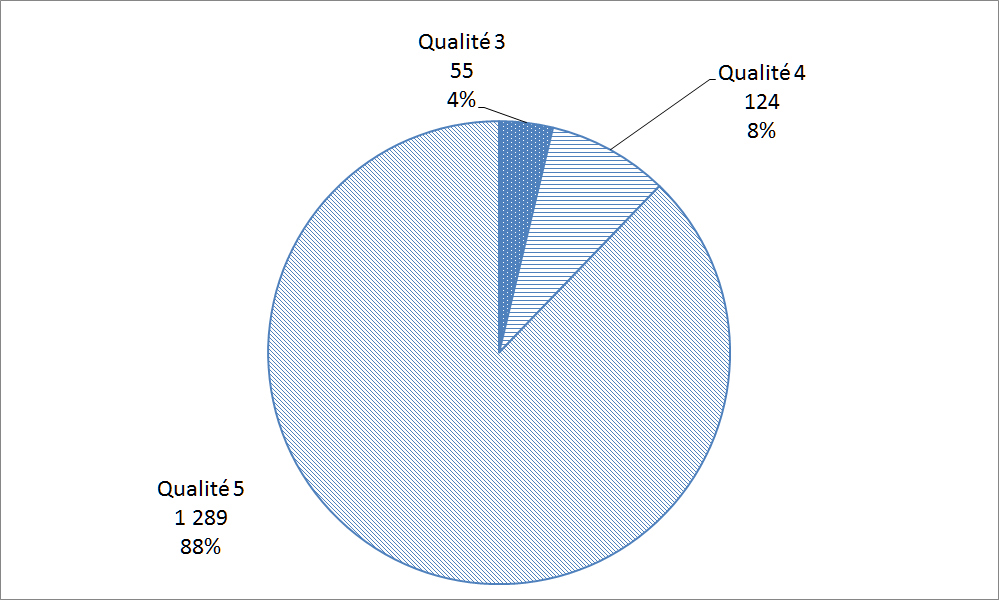
Description textuel :
| Qualité | Nombre de déclarations |
| Qualité 3 | 55 |
| Qualité 4 | 124 |
| Qualité 5 | 1 289 |
3.6 Déclarations d'incidents communiquées au ResSCMM par spécialité médicale (2009-2017)
Tableau 21 montre les 5 spécialités médicales les plus courantes de produit soumis à Santé Canada par l'entremise du ResSCMM de 2009 à 2017. La majorité (88,3 %) sont des déclarations dans les domaines suivants : hôpital (général), chirurgie, cardiovasculaire, gastroentérologie et urologie ainsi que anesthésiologie. Ces données semblent correspondre aux secteurs d'activité dans lesquels la plupart des interventions se déroulent dans les hôpitaux.
| Spécialité médicale par produit | Nombre de produits déclarés | % de produits déclarés |
| Hôpital générale | 535 | 37,9% |
| Chirurgie | 209 | 14,8% |
| Cardiovasculaire | 208 | 14,7% |
| Gastroentérologie et urologie | 174 | 12,3% |
| Anesthésiologie | 122 | 8,6% |
3.7 Catégories de déclarations d'incidents liés à des matériels médicaux signalées par l'entremise du ResSCMM (2009-2017)
Les déclarations dans le ResSCMM signalent souvent des problèmes multiples au sujet d'un matériel médical. Ces problèmes sont classés dans la base de données Matériels médicaux en utilisant les codes et la terminologie du Medical Dictionary for Regulatory Activities (MedDRA). Seuls les codes du MedDRA propres à un matériel médical sont utilisés dans les déclarations du ResSCMM. Depuis 2009, près de 70 % des incidents signalés sont classés comme défectuosité du matériel, comme illustre le tableau 22. La mauvaise utilisation du matériel ne représente que 1 % des déclarations.
| Problème du produit | Problème déclaré | % de problème déclaré |
| Défaut | 669 | 40,9% |
| Mauvais fonctionnement | 471 | 28,8% |
| Faillite | 142 | 8,7% |
| Rupture | 121 | 7,4% |
| Fuite | 61 | 3,7% |
| Inefficace | 46 | 2,8% |
| Interaction | 36 | 2,2% |
| Complication | 35 | 2,1% |
| Usage impropre | 16 | 1,0% |
| Luxation/insertion/connexion | 15 | 0,9% |
Limites des données
L'interprétation des données sur les effets indésirables présumés doit tenir compte de certaines limites concernant les données, telles que :
- Les cas d'effets indésirables sont des associations soupçonnées qui correspondent à l'opinion ou à l'observation du déclarant. Les données ne sont pas une évaluation par Santé Canada de l'association entre le produit de santé et les effets.
- Souvent, il n'est pas possible de déterminer si un effet indésirable déclaré à Santé Canada est attribuable à l'utilisation d'un produit de santé donné. D'autres facteurs contribuant à l'EI peuvent être l'état de santé d'une personne ou d'autres produits de santé qu'elle utilise simultanément.
- Plusieurs facteurs peuvent influer sur le nombre de cas reçus, comme la durée de présence d'un produit sur le marché, l'étendue de son utilisation, la couverture médiatique, les mesures réglementaires et la méthode de collecte de données (cas soumis volontairement par opposition aux systèmes structurés de collecte de données). Par exemple, les EI des produits de santé peuvent être déclarés plus fréquemment dans les systèmes structurés de collecte de données (p. ex. registres de patients, enquêtes, programmes de soutien aux patients et de gestion des maladies), ce qui peut influer sur le modèle de déclaration. Par conséquent, il n'est pas possible de comparer le risque entre les produits de santé en se fondant uniquement sur le nombre de cas.
Les considérations suivantes devraient être prises en compte dans l'interprétation de l'information relative aux déclarations d'incidents liés à des matériels médicaux :
- Les incidents liés à un matériel médical qui doivent être déclarés et qui ont touché un ou plusieurs patients, utilisateurs ou d'autres personnes, à la même date ou à des dates différentes, doivent être signalés à Santé Canada à titre d'incidents distincts, parce que chacun constitue un événement distinct.
- Les incidents liés à la défaillance d'un ou plus d'un matériel médical ayant le même numéro de lot ou un numéro de lot différent et qui ont touché le même patient ou utilisateur doivent être signalés à Santé Canada en tant qu'incidents distincts.
- Le nombre de déclarations diffère du nombre d'incidents, car pour un incident donné, nous pouvons recevoir plusieurs déclarations en provenance de plusieurs déclarants. Cela peut également entraîner des incidents en double, si les déclarations en double ne sont pas décelées.
Glossaire
Les définitions d'un certain nombre de termes employés dans le présent document sont énoncées ci-dessous.
Accident
Dans le contexte du Règlement sur la sécurité des cellules, tissus et organes humains destinés à la transplantation, on entend par « accident » un événement imprévu qui n'est pas imputable à une inobservation des procédures opérationnelles normalisées ou des lois applicables et qui peut compromettre la sécurité des receveurs de cellules, de tissus ou d'organes ou la sécurité, l'efficacité ou la qualité des cellules, des tissus ou des organes. (Accident)
Cellules
Dans le contexte du Règlement sur la sécurité des cellules, tissus et organes humains destinés à la transplantation, une cellule est l'unité fondamentale biologique de l'organisme humain destinée à la transplantation. (Cells)
Déclaration sur le cas
Dans le contexte des effets indésirables aux produits de santé, une déclaration de cas comprend tous les renseignements décrivant les effets indésirables subis par un patient à un moment donné et soupçonnés d'être liés à l'utilisation d'un ou de plus d'un produit de santé ou matériel médical; ainsi, une déclaration d'effet indésirable comprendra une déclaration initiale sur les effets indésirables ainsi que tout renseignement supplémentaire reçu par la suite à titre de déclaration de suivi. (Case Report)
Défaillance ou dégradation
Non-fonctionnement d'un instrument selon les fins prévues lorsqu'il est utilisé conformément aux instructions du fabricant. Défaillance est synonyme de « défaut ». (Malfunction or Deterioration)
Détenteur d'une autorisation de mise en marché (DAMM)
Dans le contexte des produits de santé, le détenteur d'une autorisation de mise en marché est l'entité qui détient l'Avis de conformité, le numéro d'identification du médicament (DIN), le numéro de produit naturel (NPN), le numéro de remède homéopathique (DIN-HM) ou le numéro de permis. (Market Authorization Holder)
Drogue
Dans la Loi sur les aliments et drogues, le terme « drogue » inclut les substances ou mélanges de substances fabriqués, vendus ou présentés comme pouvant servir à ce qui suit :
- au diagnostic, au traitement, à l'atténuation ou à la prévention d'une maladie, d'un trouble, d'un état physique anormal ou de leurs symptômes, chez l'être humain ou les animaux;
- à la restauration, à la correction ou à la modification des fonctions organiques chez l'être humain ou les animaux;
- à la désinfection des locaux dans lesquels les aliments sont fabriqués, préparés ou conservés. (Drug)
Effet indésirable
Un effet indésirable est une réaction nocive et inattendue à un produit de santé commercialisé (Adverse Reaction)
Effet indésirable grave
Un effet indésirable grave est une réaction nocive et inattendue à un produit de santé commercialisé qui se produit à n'importe quelle dose et nécessite une hospitalisation ou une prolongation d'une hospitalisation en cours, qui cause une malformation congénitale, entraîne une invalidité ou une incapacité persistante ou importante, qui met la vie en danger ou entraîne la mort. (Serious Adverse Reaction)
Effet indésirable survenu à l'étranger
Effet indésirable survenu à l'extérieur du Canada concernant un produit qui a la même combinaison d'ingrédients actifs que celui qui est commercialisé au Canada, sans égard aux variations dans la formulation, la forme de posologie, la force, la voie d'administration ou l'indication. (Foreign Adverse Reaction)
Effet indésirable survenu au Canada
Un effet indésirable survenu au Canada (Domestic Adverse Reaction)
Fabricant
Dans le contexte des incidents liés aux matériels médicaux, tel qu'il est défini à l'article 1 du Règlement sur les instruments médicaux, le terme désigne une personne qui vend un matériel médical sous son propre nom ou sous un nom commercial, une marque de commerce, un dessin, ou un autre nom ou marque dont elle est propriétaire ou qu'elle contrôle et qui est responsable de la conception, de la fabrication, de l'assemblage, du traitement, de l'étiquetage, de l'emballage, de la remise à neuf ou de la modification d'un matériel ou de l'assignation d'une utilisation à ce matériel, que ces opérations soient effectuées par elle ou pour son compte. (Manufacturer)
Importateur
Une personne, autre que le fabricant, qui amène au Canada un produit de santé ou un matériel médical pour la vente. (Importer)
Incident
Dans le cadre de la déclaration obligatoire d'incidents liés à des matériels médicaux, les renseignements sur l'incident se rapportent aux circonstances indiquées dans l'article 59 du Règlement sur les instruments médicaux. (Incident)
Incident lié aux matériels médicaux de priorité I :
Une situation dans laquelle il existe une probabilité raisonnable que l'utilisation d'un matériel médical, ou le fait d'y être exposé, a entraîné le décès ou une détérioration grave de l'état de santé d'un patient, d'un utilisateur ou d'une autre personne, ou qu'il est raisonnablement cru que, si le problème ou l'incident se reproduisait, il pourrait causer le décès ou une détérioration grave de l'état de santé d'un patient, d'un utilisateur ou d'une autre personne. (Medical Device Incident Priority I)
Incident lié aux matériels médicaux de priorité II :
Une situation dans laquelle l'utilisation d'un matériel médical, ou le fait d'y être exposé, peut causer une détérioration temporaire de l'état de santé d'un patient, d'un utilisateur ou d'une autre personne, ou dans laquelle il existe une faible probabilité d'une détérioration grave de l'état de santé. (Medical Device Incident Priority II)
Incident lié aux matériels médicaux de priorité III :
Une situation dans laquelle l'utilisation d'un matériel médical, ou le fait d'y être exposé, ne causera probablement pas de détérioration grave de l'état de santé d'un patient, d'un utilisateur ou d'une autre personne. (Medical Device Incident Priority III)
Manquement
Dans le contexte du Règlement sur la sécurité des cellules, tissus et organes humains destinés à la transplantation, on entend par « manquement » l'inobservation des procédures opérationnelles normalisées ou des lois applicables pouvant compromettre la sécurité des receveurs de cellules, de tissus ou des organes ou la sécurité, l'efficacité ou la qualité des cellules, des tissus ou des organes. (Error)
Médecin
Personne autorisée à exercer la médecine en vertu des lois de la province où elle fournit des services médicaux. (Physician)
MedEffetMC Canada
MedEffetMC Canada a été créé par la Direction des produits de santé commercialisés (DPSC) dans les buts suivants :
- Permettre l'accès centralisé à des renseignements fiables et pertinents sur la sécurité des produits de santé à mesure qu'ils sont disponibles en les regroupant dans un portail facile à trouver, avec une adresse facile à retenir. Ce portail fournit l'accès aux avis et aux retraits de Santé Canada, a l'InfoVigilance sur les produits de santé et aux outils de recherche et d'extraction de données en ligne du Programme Canada Vigilance;
- Fournir aux professionnels de la santé et aux consommateurs les moyens les plus simples et les plus efficaces possibles de remplir et de transmettre leurs rapports sur les effets indésirables par Internet, téléphone, télécopieur ou courrier;
- Sensibiliser la population à l'importance de signaler à Santé Canada les effets indésirables et mettre en relief le rôle que jouent ces renseignements dans la détection et la divulgation des risques potentiels. (MedEffect Canada)
Monographie de produit
Une monographie de produit est un document scientifique factuel sur un médicament. Exempte de tout contenu promotionnel, elle décrit les propriétés, les effets allégués, les indications et le mode d'emploi propres au médicament, et contient tout autre renseignement pouvant être nécessaire à son utilisation sûre, efficace et optimale. (Product Monograph)
Parties réglementées
Aux fins du présent document, une partie réglementée désigne la partie qui est mandatée par le Règlement sur les aliments et drogues, le Règlement sur les produits de santé naturels, le Règlement sur le sang, le Règlement sur les instruments médicaux ou le Règlement sur la sécurité des cellules, tissus et organes humains destinés à la transplantation de se conformer aux exigences des règlements respectifs.
Par exemple, les détenteurs d'une autorisation de mise en marché sont tenus par le Règlement sur les aliments et drogues de déclarer à Santé Canada les effets indésirables impliquant des produits de santé commercialisés; les établissements de transfusion sanguine sont tenus par le Règlement sur le sang de déclarer à Santé Canada les effets indésirables impliquant du sang humain et des composants sanguins destinés à la transfusion. (Regulated Parties)
Produit de santé
Ce terme comprend les produits réglementés en vertu du Règlement sur les aliments et drogues (« drogues ») et du Règlement sur les produits de santé naturels (« produits de santé naturels »). Les médicaments peuvent être des produits pharmaceutiques délivrés sur ordonnance ou en vente libre; des produits biotechnologiques et d'autres d'origine biologique, comme des vaccins, des sérums et des produits sanguins; des désinfectants et des produits radiopharmaceutiques. (Health Product)
Produit de santé naturel
Substance mentionnée à l'annexe 1 du Règlement sur les produits de santé naturels, combinaison de substances dont tous les ingrédients médicinaux sont des substances mentionnées à l'annexe 1 du Règlement sur les produits de santé naturels, remède homéopathique ou remède traditionnel, qui est fabriqué, vendu ou présenté comme pouvant servir à ce qui suit :
- au diagnostic, au traitement, à l'atténuation ou à la prévention d'une maladie, d'un trouble, d'un état physique anormal, ou de leurs symptômes chez l'être humain;
- à la restauration ou à la correction des fonctions organiques chez l'être humain;
- à la modification des fonctions organiques chez l'être humain, telle que la modification des fonctions de manière à maintenir ou à promouvoir la santé.
Toutefois, la présente définition exclut les substances mentionnées à l'annexe 2 du Règlement sur les produits de santé naturels, toute combinaison de substances qui contient une substance mentionnée à l'annexe 2 du Règlement sur les produits de santé naturels et tout remède homéopathique ou remède traditionnel qui est une substance mentionnée à l'annexe 2 du Règlement sur les produits de santé naturels ou qui contient l'une de ces substances. (Natural Health Product)