Déclaration du Comité consultatif national sur les infections transmissibles sexuellement et par le sang (CCN-ITSS) – Lignes directrices intérimaires pour le traitement des infections gonococciques non compliquées
Préambule
Le Comité consultatif national sur les infections transmissibles sexuellement et par le sang (CCN-ITSS) est un organisme consultatif externe qui fournit de manière continue à l'Agence de santé publique du Canada (ASPC) des conseils et des recommandations scientifiques et de santé publique pour l'élaboration des lignes directrices sur les infections transmissibles sexuellement et par le sang (ITSS), à l'appui de son mandat de prévention et de lutte contre les maladies infectieuses au Canada.
L'ASPC reconnaît que les avis et les recommandations contenus dans cet énoncé sont fondés sur les meilleures connaissances scientifiques disponibles au moment de la rédaction du présent document et diffuse ce document à des fins d'information aux fournisseurs de soins primaires et aux professionnels de la santé publique. L'Énoncé du CCN-ITSS peut aussi aider les décideurs ou servir de base à l'adaptation par d'autres concepteurs de lignes directrices. Les membres du CCN-ITSS et les membres de liaison doivent se conformer à la Politique sur les conflits d'intérêts de l'ASPC, la déclaration annuelle des intérêts et des affiliations.
Les recommandations contenues dans cet énoncé ne remplacent pas les exigences législatives, réglementaires, politiques et pratiques provinciales et territoriales ni les lignes directrices professionnelles qui régissent la pratique des professionnels de la santé dans leurs juridictions respectives, dont les recommandations peuvent différer en raison de l'épidémiologie ou du contexte local. Les recommandations contenues dans le présent énoncé peuvent ne pas refléter toutes les situations qui peuvent survenir dans la pratique professionnelle et ne se substituent pas au jugement clinique en tenant compte des circonstances individuelles et des ressources disponibles.
Table des matières
- Préambule
- Glossaire des sigles et des acronymes
- Objectifs
- Résumé
- Définitions et précisions
- Contexte
- Méthodologie
- Résumé des données probantes
- Recommandations et justification d'autres lignes directrices
- Revues systématiques et études sur les effets du traitement de l'infection à NG par bithérapie ou monothérapie
- Informations relatives à l'épidémiologie et la surveillance au Canada
- Pharmacocinétique et pharmacodynamique des céphalosporines dans les infections à NG
- Données probantes sur les valeurs et les préférences des patients, la faisabilité, l'acceptabilité pour les intervenants, l'équité et l'utilisation des ressources
- Justification
- Remerciements
- Annexes
Glossaire des sigles et des acronymes
- AIP
- Atteinte inflammatoire pelvienne
- ASHM
- Australasian Society for HIV, Viral Hepatitis and Sexual Health Medicine
- ASPC
- Agence de la santé publique du Canada
- AVAQ
- Année de vie ajustée en fonction de la qualité
- BASHH
- British Association for Sexual Health and HIV
- BCCDC
- Centre de contrôle des maladies de la Colombie-Britannique
- CCN-ITSS
- Comité consultatif national sur les infections transmissibles sexuellement et par le sang
- CDC
- Centers for Disease Control and Prevention
- CLSI
- Clinical Laboratory Standard Institute
- CMI
- Concentration minimale inhibitrice
- CT
- Chlamydia trachomatis
- ECOFF
- Seuil épidémiologique (en anglais Epidemiological Cut-Off Value, soit ECOFF)
- EUCAST
- Comité européen pour les tests de sensibilité aux antimicrobiens
- ƒT>CMI
- Moment où la concentration de médicament libre dépasse la CMI
- GASP
- Programme de surveillance de la résistance des gonocoques aux antimicrobiens (GASP – Canada)
- gbHARSAH
- Gais, bisexuels et autres hommes ayant des rapports sexuels avec des hommes
- IC
- Intervalle de confiance
- IM
- Intramusculaire
- INESSS
- Institut national d'excellence de la santé et des services sociaux
- ITS
- Infection transmissible sexuellement
- LDCITS
- Lignes directrices canadiennes sur les infections transmissibles sexuellement
- LNM
- Laboratoire national de microbiologie
- LSPQ
- Laboratoire de santé publique du Québec
- MG
- Mycoplasma genitalium
- NG
- Neisseria gonorrhoeae
- OMS
- Organisation mondiale de la Santé
- PK/PD
- Pharmacocinétique/Pharmacodynamique
- RAM
- Résistance antimicrobienne
- SARGA
- Surveillance accrue de la résistance de la gonorrhée aux antimicrobiens (ESAG)
- SR
- Sensibilité réduite
- TAAN
- Test d'amplification des acides nucléiques
- TOC
- Test de contrôle (en anglais Test of cure, soit TOC)
Objectifs
Les objectifs de ce travail sont les suivants :
- Mettre à jour les recommandations relatives aux traitements privilégiés pour les infections non compliquées à NG.
- Mettre à jour le choix du test et le moment du test de contrôle,
- Clarifier les recommandations pour demander une culture de NG.
Résumé
Cet énoncé contient des recommandations 1) sur le traitement privilégié de l'infection non compliquée à NG chez les adultes et les adolescents de 10 ans et plus (Tableau 1); 2)sur le choix du test et du moment pour effectuer le test de contrôle de l'infection à NG (tableau 2); et 3) sur la demande de culture pour obtenir la susceptibilité aux antimicrobiens de NG.
Tableau 1 : Actualisation de la recommandation sur le traitement privilégié de la gonorrhée non compliquée chez les adultes et les adolescents de 10 ans et plus
Le CCN-ITSS recommande la ceftriaxone 500 mg IM en dose unique (monothérapie) pour le traitement privilégié de toutes les infections non compliquées (urétrale, endocervicale, vaginale, rectale et pharyngée).
Les autres options de traitement, qui sont nécessaires si l'accès à l'injection IM n'est pas disponible, si la personne refuse l'injection ou si la personne est gravement allergique aux céphalosporines, font actuellement l'objet d'un examen par le CCN-ITSS. Se référer aux quatre options de traitement suivants dans le guide sur la gonorrhée de l'ASPC en attendant une revue approfondie.
- Céfixime 800 mg PO en une dose unique plus doxycycline 100 mg PO BID x 7 joursNote de bas de page *
- Céfixime 800 mg PO en une seule dose unique plus azithromycine 1 g PO en une seule dose
- Azithromycine 2 g en une seule dose PLUS gentamicine 240 mg IM en une seule doseNote de bas de page *
- Gentamicine 240 mg IM en une seule dose PLUS doxycycline 100 mg PO 2 fois par jour pendant 7 joursNote de bas de page *
Remarques :
- Si l'infection à C. trachomatis n'a pas été exclue par un test négatif, un traitement concomitant contre la chlamydiose est recommandé; se référer aux recommandations de traitement dans le Guide sur la Chlamydia et LGV : Traitement et suivi de l'ASPC.
- Consulter le Guide sur la gonorrhée : Traitement et suivi de l'ASPC pour de plus amples informations sur chaque régime de traitement alternatif, y compris les indications d'utilisation d'ertapénem, ainsi que des informations sur la notification et le traitement des partenaires.
- Le test de contrôle est recommandé pour tous les sites positifs d'infection à NG dans tous les cas (voir le tableau 2 ci-dessous).
- Les schémas thérapeutiques alternatifs suivants ont été retirés du guide sur la gonorrhée de l'ASPC.
- Ceftriaxone 250 mg IM en une seule dose plus doxycycline 100 mg PO BID x 7 joursNote de bas de page **
- Azithromycine 2 g PO en une seule dose plus ciprofloxacine 500 mg PO en une seule doseNote de bas de page **
- Azithromycine 2 g en une seule dose plus gémifloxacine 320 mg PO en une seule doseNote de bas de page **
Tableau 2 : Recommandation sur le choix du test et le moment pour effectuer le test de contrôle
Le CCN-ITSS recommande un test de contrôle pour tous les sites positifs d'infection à NG dans tous les cas. Ceci est particulièrement important lorsque des traitements autres que la ceftriaxone 500 mg IM sont utilisés.
- Un TAAN doit être effectué trois à quatre semaines après la fin du traitement, car les acides nucléiques résiduels provenant de bactéries mortes peuvent être responsables de résultats positifs moins de trois semaines après le traitement.
- Lorsqu'un test de contrôle est effectué dans les trois semaines suivant la fin du traitement, une culture doit être effectuée; les échantillons doivent être prélevés au moins trois jours après la fin du traitement.
- Lorsque l'échec au traitement est soupçonné plus de trois semaines après le traitement, le TAAN et la culture doivent être effectués (par exemple, lorsque les symptômes persistent ou réapparaissent après le traitement).
Tableau 3 : Recommandation sur la culture de NG
Bien que la culture soit moins sensible que le TAAN, elle offre la possibilité de déterminer la sensibilité aux antimicrobiens, ce qui est important pour la gestion des cas et essentiel pour la surveillance des tendances de la RAM.
Le CCN-ITSS recommande la culture de NG (avec le TAAN) dans les situations suivantes :
- Pour un test de contrôleNote de bas de page * lorsqu'on soupçonne un échec au traitement;
- En présence de symptômes compatibles avec la cervicite, l'uréthrite, l'atteinte inflammatoire pelvienne (AIP), l'orchi-épididymite, la proctite ou la pharyngite;
- Personne asymptomatique ayant déclaré avoir été en contact avec un cas d'infection à NG;
- Lorsque des abus sexuels ou des agressions sexuelles sont soupçonnés (cela peut varier selon le contexte juridique et médical de la province ou du territoire);
- Si l'infection a pu être contractée dans des pays ou des régions où les taux de RAM sont élevés (des souches résistantes à NG ont été rapportées au Canada, au Japon, en Europe et en Australie; bon nombre ont été associées à des voyages en Asie du Sud-Est).
De plus, le CCN-ITSS recommande une culture lorsque l'infection à NG est confirmée par le TAAN seulement, à condition qu'elle ne retarde pas le traitement.
Remarque:
- Pour que la culture soit réussie, il faut que des échantillons adéquats soient prélevés et transportés correctement. Consultez votre laboratoire de santé publique local pour obtenir des conseils sur la collecte et le transport des échantillons.
Définitions et précisions
- Les infections non compliquées à Neisseria gonorrhoeaeNote de bas de page a (NG) comprennent les infections anogénitales (uréthrite, cervicite et proctite) et pharyngées. Les infections asymptomatiques sont courantes dans le canal endocervical et dans les sites pharyngés et rectaux chez les hommes et les femmes. Des infections asymptomatiques surviennent également au niveau de l'urètreRéférence 1.
- Les infections compliquées à NG peuvent être locales (celles qui s'étendent localement au-delà du site primaire de l'infection, comme l'épididymite et la maladie inflammatoire pelvienne), ou disséminées (complications systémiques qui peuvent inclure le syndrome d'arthrite-dermatite et, rarement, l'endocardite ou la méningiteRéférence 1
- La concentration minimale inhibitrice (CMI) est la concentration la plus faible d'un antimicrobien qui inhibe la croissance visible d'un micro-organisme après une incubation nocturne. La CMI est utilisée pour classer une souche comme étant sensible, intermédiaire ou résistante (annexe 1 : Tableau 1).
- Selon le Clinical Laboratory Standard Institute (CLSI), il n'y a pas de point de rupture de résistance établi pour la ceftriaxone et le céfixime. Lorsque l'isolat NG a une CMI au-dessus du point de rupture de susceptibilité (0,25 mg/l pour la ceftriaxone et le céfixime), il est considéré comme « non susceptible ». Pour simplifier, le terme « résistant » a été utilisé pour décrire ces souches.
- On considère que les souches ont une sensibilité réduite (SR) à la ceftriaxone (0,125-0,25 mg/l) ou au céfixime (0,25 mg/l) si elles sont encore sensibles, mais que leur CMI est proche du point de rupture.
- Le terme thérapie combinée (ou bithérapie) est utilisé lorsque les deux antibiotiques sont dirigés vers le traitement de NG. Cela diffère de l'utilisation de deux antibiotiques pour traiter une infection présumée (dans le cadre de l'approche syndromique) ou une co-infection à Chlamydia trachomatis (CT) confirmée.
Contexte
Informations générales
L'infection gonococcique, causée par le diplocoque à Gram négatif Neisseria gonorrhoeae (NG), représente un problème de santé publique important à l'échelle mondiale en raison de l'augmentation des taux et de la résistance aux antimicrobiens (RAM) à la plupart des antibiotiques utilisés pour son traitement, de l'association avec des complications et des séquelles graves lorsque l'infection n'est pas diagnostiquée et traitée, ainsi que la transmission et l'acquisition du VIHRéférence 2Référence 3Référence 4Référence 5Référence 6Référence 7.
Le traitement de la gonorrhée a été compliqué par la capacité de la bactérie NG à développer une RAM. Les voyages internationaux peuvent contribuer à la propagation de la gonorrhée, notamment des souches résistantesRéférence 7. Le traitement antimicrobien optimal contre l'infection à NG est important, parce qu'il peut guérir la gonorrhée et prévenir les séquelles à long terme, réduire la transmission et ralentir l'émergence et la propagation de la RAM.
Variabilité des recommandations de traitement
Les régimes de traitement recommandés par l'Agence de la santé publique du Canada (ASPC), les lignes directrices provinciales et territoriales et les lignes directrices internationales varient considérablement (Annexe 2). Ces différences sont en partie attribuables aux différences dans les profils locaux de la RAM, qui exigent l'utilisation de recommandations de traitement régionalisées. Les recommandations dans les lignes directrices varient relativement à ce qui suit :
- Choix des médicaments privilégiés et autres médicaments
- Utilisation de la thérapie combinée ou de la monothérapie
- Schémas posologiques
Les recommandations de traitement peuvent également varier dans les lignes directrices en fonction de facteurs propres au patient. Par exemple, les recommandations des Lignes directrices canadiennes sur les infections transmissibles sexuellement (LDCITS) sur la gonorrhée sont fondées sur les éléments suivants :
- Le traitement d'une infection suspectée (traitement empirique chez les personnes symptomatiques) ou une infection confirmée à NG (chez les personnes symptomatiques ou asymptomatiques);
- Le syndrome associé à l'infection à NG (cervicite, atteinte inflammatoire pelvienne [AIP], proctite, urétrite, orchi-épididymite);
- Le site de l'infection (anogénital et pharyngé);
- Les populations clés (p. ex., la ceftriaxone est préférée au céfixime dans le cadre de la thérapie pour les gais, les bisexuels et les autres hommes ayant des rapports sexuels avec des hommes [gbHARSAH]).
Thérapie combinée, monothérapie et autres facteurs influant sur les recommandations thérapeutiques
On utilise la thérapie combinée dans différentes situations :
- Pour traiter l'infection suspectée à NG ou CT chez une personne symptomatique avant la confirmation de l'infection en laboratoire.
- Pour traiter une possible co-infection à CT non détectée lorsque l'infection à NG est confirmée. L'ajout d'un médicament contre l'infection à CT (azithromycine ou doxycycline) est utilisé depuis de nombreuses décennies. Cependant, avec l'introduction des tests d'amplification des acides nucléiques (TAAN) dans les années 1990 et l'amélioration de leur sensibilité analytique (capacité de détection d'un très petit nombre de bactéries) au fil du temps, ainsi que l'adoption de la recommandation de tester les sites extragénitaux (lorsque c'est indiqué), la probabilité d'une infection à CT non détectée peut être très faible.
- Pour traiter une infection potentielle à NG résistante aux antimicrobiens (RAM). Même lorsque l'infection à NG est confirmée, les résultats de la sensibilité aux antimicrobiens pour guider le traitement peuvent ne pas être disponibles au moment du traitement, pour diverses raisons (échantillon de culture non prélevé, résultats de culture négatifs ou profil de sensibilité aux antimicrobiens pas encore disponible).
Afin de lutter contre la RAM pour la gonorrhée, les recommandations des LDCITS relatives au traitement ont été mises à jour régulièrementRéférence 8Référence 9Référence 10:
Des taux élevés de résistance antimicrobienne aux pénicillines et aux tétracyclines ont été déclarés, de sorte que ces antimicrobiens ne sont plus recommandés pour le traitement des infections à NG;
- Les fluoroquinolones ont été éliminées comme traitement de première intention en 2008;
- Les doses de céphalosporines de troisième génération (ceftriaxone et céfixime) ont doublé en 2011;
- La thérapie combinée est recommandée depuis 2011;
- La dose de céfixime a été augmentée de 400 mg à 800 mg en fonction des données de surveillance des CMI plus élevées pour NG;
- La monothérapie avec azithromycine 2 g par voie orale en dose unique et comme solution de rechange chez les personnes ayant des réactions anaphylactiques à la pénicilline ou une allergie aux céphalosporines n'est plus recommandée (gentamicine 240 mg IM en combinaison avec azithromycine 2 g PO a été introduite en 2017).
Toutefois, la pertinence et le bien-fondé de la thérapie combinée, en particulier le rôle de l'azithromycine, ont récemment été remises en question pour les raisons suivantes :
- Augmentation de la résistance de NG à l'azithromycine et à d'autres antibiotiques dans de nombreux pays, y compris le Canada;
- Augmentation de la résistance d'autres micro-organismes à l'azithromycine (p. ex., M. genitalium (MG), T. pallidum) directement liée à l'utilisation de l'azithromycine, limitant ainsi les options de traitement connexesRéférence 11Référence 12Référence 13.
- D'autres considérations relatives à la gestion des antimicrobiens, comme les effets secondaires, les coûts, les préoccupations concernant les effets des antibiotiques sur le microbiome individuel et la RAM d'autres bactéries (p. ex., Streptococcus pneumoniae)Référence 14Référence 15Référence 16Référence 17Référence 18.
Compte tenu de l'incertitude croissante liée aux recommandations existantes, le Comité consultatif national sur les infections transmissibles sexuellement et par le sang (CCN-ITSS) a conseillé à l'ASPC de réévaluer les recommandations de traitement pour les infections à NG, tout en tenant compte des valeurs et des préférences des patients, de l'impact sur les fournisseurs des soins de santé et des réalités des systèmes de santé, y compris l'accès à la culture pour NG, l'accès aux médicaments injectables sur place et les coûts.
Méthodologie
Le CCN-ITSS fournit à l'ASPC des conseils et des recommandations scientifiques et de santé publique pour l'élaboration de lignes directrices sur les ITSS, à l'appui de son mandat de prévention et de contrôle des maladies infectieuses au Canada. Un Groupe de travail composé de huit experts du CCN-ITSS a été formé pour examiner les recommandations existantes de l'ASPC sur le traitement de l'infection à NG en suivant la méthodologie d'élaboration des recommandations du CCN-ITSS et de l'ASPCRéférence 19Référence 20Référence 21Référence 22. Le Groupe de travail a reçu un soutien méthodologique et technique du Secrétariat de l'ASPC et d'un spécialiste externe en méthodologie.
Les recommandations incluses dans le présent document constituent des lignes directrices intérimaires; les recommandations finales seront disponibles après l'achèvement d'une revue des études primaires en cours.
Revue des lignes directrices et de la littérature pertinentes
L'ASPC, en collaboration avec le Groupe de travail, a effectué un « scoping exercise » (une revue) des lignes directrices pertinentes sur le traitement de l'infection non compliquée à NG chez les adultes et les adolescents symptomatiques ou asymptomatiques, notamment les femmes enceintes, afin d'appuyer l'élaboration des recommandationsRéférence 23. Le moteur de recherche Google a été utilisé pour identifier les lignes directrices pertinentes. Les sites Web de plusieurs organisations internationales d'élaboration de lignes directrices, ainsi que des groupes provinciaux d'élaboration des lignes directrices ont également été consultés. L'annexe 2 présente la liste des sites Web des organisations ayant été consultés. En ce qui concerne les lignes directrices identifiées, des informations sur le type de données probantes et la justification à l'appui de l'élaboration des recommandations ont été recueillies.
L'ASPC, en collaboration avec le Groupe de travail, a également effectué une recherche de revues systématiques et un échantillon d'études primaires sur les effets du traitement de la gonorrhée non compliquée chez les adultes et les adolescents symptomatiques ou asymptomatiques, notamment les femmes enceintes, afin d'appuyer l'élaboration des recommandations. Les sources d'information, y compris Ovid MEDLINE® All, Embase et EBM Reviews – Cochrane Central Register of Controlled Trials, ont été consultées avec l'aide d'une bibliothécaire de Santé Canada du 1er janvier 2010 à février 2020, et elles ont été mises à jour en 2023. Aucune restriction quant au plan d'étude n'a été appliquée. Bien qu'aucune revue exhaustive ou systématique de la littérature n'ait été effectuée, un échantillon d'études primaires pertinentes a été identifié et examiné. L'échantillon des études primaires incluses pour appuyer l'élaboration des recommandations a été déterminé en sélectionnant les quatre premières études pertinentes pendant l'analyse des titres, des résumés et des articles en texte intégral. Une recherche ciblée de la littérature a été effectuée pour obtenir des données probantes sur les valeurs et les préférences des patients, la faisabilité, l'acceptabilité, l'équité et l'utilisation des ressources. Une recherche manuelle dans les listes de référence de l'échantillon d'études primaires, des revues et de lignes directrices a été effectuée pour identifier d'autres publications pertinentes. On a également demandé aux membres du Groupe de travail de faire part de toute étude sur le sujet qu'ils pourraient connaître. Les titres, les résumés et certains articles en texte intégral ont été sélectionnés en fonction de critères d'inclusion prédéfinis, et les données ont été extraites par un examinateur. Les revues et les études primaires de n'importe quel type qui ont été menées dans un contexte de soins de santé au Canada et dans d'autres pays à revenu élevé et qui examinaient les effets de la monothérapie ou de la thérapie combinée sur la gonorrhée non compliquée ont été incluses. Seules les études publiées en anglais ou en français ont été incluses. Une synthèse narrative a été préparée.
Données de surveillance canadiennes
Les données les plus récentes disponibles sur les cas déclarés d'infections à NGRéférence 24, de RAM et d'échecs au traitement ont été prises en compte dans l'élaboration des recommandations de traitement. Les données ont été recueillies à partir de publications de l'ASPC, de publications provinciales et de communications personnelles avec des spécialistes du Laboratoire national de microbiologie (LNM) au Canada.
Le Programme de surveillance de la résistance des gonocoques aux antimicrobiens (GASP – Canada), un programme national de surveillance passive dans le cadre duquel les partenaires provinciaux et territoriaux envoient au LNM des isolats de NG provenant de cultures, est en service depuis 1985Référence 25. Des tests de sensibilité aux antimicrobiens avec panel d'antimicrobiens et de caractérisation moléculaire sont effectués sur tous les isolats cultivés, et les résultats sont publiés chaque annéeRéférence 26.Certains laboratoires de référence provinciaux effectuent également une surveillance de la RAM. Par exemple, le Laboratoire de santé publique du Québec (LSPQ) publie des rapports annuels sur la résistance aux antimicrobiens de NG, dont le plus récent a été publié en 2021Référence 27.
L'ASPC a lancé le programme de Surveillance accrue de la résistance de la gonorrhée aux antimicrobiens (SARGA) en 2013 dans trois juridictions (Alberta, Manitoba et Nouvelle-Écosse) afin de mieux comprendre les tendances actuellesRéférence 28. En 2017, une autre juridiction, les Territoires du Nord-Ouest, a été ajoutée. Ce programme amélioré de surveillance épidémiologique en laboratoire (programme de surveillance accrue reliant des données de laboratoire à des données épidémiologiques) recueille des données qui ne sont pas disponibles dans le cadre de la surveillance de routine et de la surveillance en laboratoire, notamment des renseignements sur le traitement et les facteurs de risque. Toutes les cultures et les données des administrations participantes sont incluses dans le programme de surveillance. Le LNM effectue des tests de sensibilité aux antimicrobiens sur un ensemble standard d'antimicrobiens et de séquençage.
Un programme semblable (Réseau sentinelle de surveillance de l'infection gonococcique, de l'antibiorésistance et des échecs au traitement au Québec) est en cours et des données sont disponibles de 2015 à 2019 dans trois régions de la province de QuébecRéférence 29. Les principaux objectifs étaient les suivants : 1) promouvoir la culture des isolats pour maintenir la capacité de surveillance de la RAM; 2) recueillir des données épidémiologiques et cliniques pour examiner les facteurs associés à la sensibilité aux antibiotiques; 3) détecter et caractériser les échecs au traitement.
Autres types de données probantes
D'autres types de données probantes ont également été pris en compte, notamment l'avis de spécialistes et les études pharmacocinétiques (PK) et pharmacodynamiques (PD). Les données PK/PD ont été recueillies à partir de la littérature.
Gestion des intérêts divergents
Les conflits d'intérêts ont été gérés conformément aux lignes directrices de l'ASPC. Aucun conflit d'intérêts n'a été déclaré par le CCN-ITSS avant la discussion et le vote sur les recommandations. L'ensemble du CCN-ITSS a examiné cette déclaration et a voté sur les recommandations Des réviseurs externes (en dehors du CCN-ITSS) ayant une expertise en maladies infectieuses ont été identifiés et engagés avant la publication des recommandations.
Résumé des données probantes
Recommandations et justification d'autres lignes directrices
Comme l'indique l'Annexe 2, 13 lignes directrices publiées entre 2013 et 2021 sur le traitement de la gonorrhée ont été définies.
Les recommandations des LDCITS (2013, 2021) sont les suivantes :
Pour les infections anogénitales :
- Traitement privilégié :
- ceftriaxone 250 mg IM plus azithromycine 1 g par voie orale en dose unique; OU
- céfixime 800 mg par voie orale en dose unique, plus azithromycine 1 g par voie orale en dose unique (le régime avec céfixime est considéré comme une traitement alternatif pour les gbHARSAH).
- Autre traitement en cas de résistance aux macrolides ou une contre-indication aux macrolides :
- ceftriaxone 250 mg IM plus doxycycline 100 mg par voie orale deux fois par jour x 7 jours; OU
- céfixime 800 mg par voie orale en dose unique plus doxycycline 100 mg par voie orale deux fois par jour x 7 jours.
Pour les infections pharyngées :
- Traitement privilégié :
- ceftriaxone 250 mg IM plus azithromycine 1 g par voie orale en dose unique.
- Autre traitement :
- céfixime 800 mg par voie orale en dose unique plus azithromycine 1 g par voie orale en dose unique.
En 2020, les lignes directrices du Québec ont été mises à jour pour recommander la ceftriaxone en monothérapie à une dose de 250 mg comme seule option pour les infections pharyngées et comme l'une des deux options pour les infections anogénitales, l'autre option étant une combinaison de céfixime 800 mg et d'azithromycine 2 gRéférence 30. La décision d'offrir un traitement alternatif à la ceftriaxone IM était fondée sur la nécessité d'avoir accès à un traitement oral dans le contexte actuel du système de santé. L'ajout de 2 g d'azithromycine au céfixime était fondé sur la faible performance du traitement au céfixime seulement, en particulier dans le cas des infections pharyngées.
La dose recommandée de ceftriaxone et d'azithromycine (en thérapie combinée) varie d'une ligne directrice à l'autre. Les doses de ceftriaxone varient de 250 mg IM à 2 g IM en dose unique; et les doses d'azithromycine par voie orale varient de 1 g à 2 g. Les lignes directrices de l'Organisation mondiale de la Santé (OMS) (2016)Référence 31 recommandent en outre une bithérapie combinée associant le céfixime plus l'azithromycine comme traitement oral de première intention pour l'infection anogénitale. Les doses de céfixime à dose unique par voie orale varient de 400 mg à 800 mg. Les recommandations relatives à la thérapie combinée à la ceftriaxone et à l'azithromycine et aux diverses posologies étaient fondées sur des essais cliniques antérieurs, plus anciens, des simulations pharmacocinétiques et pharmacodynamiques, des données de surveillance de la RAM, des tendances prévues de la RAM, des rapports de cas d'échecs au traitement, des consultations et des avis d'experts.
De plus, les recommandations visant à traiter la gonorrhée à l'aide de deux antibiotiques reposent sur l'hypothèse selon laquelle l'utilisation de deux antibiotiques avec des mécanismes d'action différents peut améliorer l'efficacité du traitement, réduire la transmission de souches résistantes, et retarder l'émergence et la progression de la résistance aux céphalosporines. Les données probantes à l'appui de ces hypothèses proviennent d'études de laboratoire et de séries de casRéférence 32Référence 33Référence 34Référence 35. Malgré la rareté des données cliniques, les lignes directrices mentionnent que certaines études suggèrent que la thérapie combinée de ceftriaxone et d'azithromycine peut réduire le développement de la résistance aux céphalosporinesRéférence 36. Elles suggèrent aussi que la bithérapie combinée peut traiter les infections concomitantes à CTRéférence 37Référence 38 et une proportion des infections à MGRéférence 39.
Selon la British Association of Sexual Health and HIV (BASHH)Référence 40, l'une des raisons de retirer l'azithromycine, en plus de la gestion des antibiotiques, est la crainte d'accélérer l'induction et la propagation de la résistance pour d'autres ITS comme MG et Treponema pallidum. La BASHH recommande maintenant la monothérapie avec ceftriaxone 1 g pour tous les sites d'infection. La recommandation est appuyée par des analyses pharmacodynamiques, qui suggèrent qu'une dose de 1 g de ceftriaxone entraînerait moins d'échecs au traitementRéférence 41. Une dose élevée de céphalosporine, 1 g en dose unique (IV) a également été recommandée par d'autres lignes directrices nationales, comme les lignes directrices japonaises pour le traitement des infections gonococciquesRéférence 42Référence 43.
Les Centers for Disease Control and Prevention (CDC) des États-Unis ont également retiré l'azithromycine des traitements antérieurs en raison d'un danger potentiel pour le microbiome et d'une résistance potentielle émergente chez d'autres agents pathogènesRéférence 14. Le traitement privilégié pour tous les sites d'infection est la monothérapie à la ceftriaxone IM avec dosage basé sur le poids corporel du patient (500 mg ou 1 g pour 150 kg et plus). Si la ceftriaxone n'est pas disponible, les autres options de traitement pour les infections anogénitales sont la gentamicine 240 mg IM plus l'azithromycine 2 g par voie orale OU le céfixime 800 mg par voie orale. Les CDC ne recommandent pas d'autres traitements pour les infections pharyngées. Dans tous les cas, si la chlamydiose n'a pas été exclue, un traitement simultané à la doxycycline (100 mg par voie orale deux fois par jour pendant 7 jours) est recommandéRéférence 14.
En revanche, l'Australasian Society for HIV, Viral Hepatitis and Sexual Health Medicine (ASHM) continue de recommander 500 mg de ceftriaxone plus 1 g d'azithromycine pour les infections génitales et anorectales, mais elle a augmenté la dose d'azithromycine à 2 g pour les infections pharyngées (Annexe 2). Les membres du groupe de travail du Communicable Diseases Network of Australia ont noté que les infections oropharyngées posent un plus grand défi pour la sélection de la résistance à la ceftriaxone et à l'azithromycine, car des niveaux plus faibles de pénétration des médicaments dans la muqueuse peuvent parfois mener à des échecs au traitement, même avec des souches gonococciques sensibles à la ceftriaxone et à l'azithromycineRéférence 44. L'augmentation de la résistance de faible niveau à l'azithromycine chez les isolats gonococciques australiens est à la base de la recommandation d'augmenter la dose d'azithromycine par voie orale de 1 à 2 g, dans le cadre d'une thérapie combinée, pour le traitement de la gonorrhée pharyngée confirmée. La justification fournie pour l'augmentation de la dose était fondée sur un rapport indiquant que « les souches gonococciques jugées peu résistantes à l'azithromycine, où les concentrations minimales d'inhibition (CMI) de l'azithromycine sont au seuil ou juste au-dessus du point de rupture pour échec au traitement clinique, sont plus susceptibles de réagir à une dose orale unique de 2 g qu'à une dose orale unique de 1 g »Référence 45.
La ligne directrice européenne de 2020 sur le traitement de la gonorrhée continue de recommander une thérapie combinée avec 1 g de ceftriaxone plus 2 g d'azithromycineRéférence 36. Les auteurs de la ligne directrice ont souligné ce qui suit au sujet de la thérapie combinée :
- Elle vise à guérir tous les cas de gonorrhée et, par conséquent, à retarder l'émergence ou la propagation de la résistance à plusieurs médicaments, en particulier la résistance à la ceftriaxone;
- Son taux de guérison est très élevé; elle cible efficacement les bactéries intracellulaires et extracellulairesRéférence 46;
- Elle a probablement contribué à réduire le niveau de résistance aux céphalosporines à large spectre (principalement la ceftriaxone et le céfixime) à l'échelle internationale et à inhiber la propagation de souches gonococciques résistantes aux céphalosporines et à l'azithromycine, parce que la résistance concomitante à la ceftriaxone et à l'azithromycine a été extrêmement rare à l'échelle mondiale;
- Elle peut éradiquer efficacement les infections concomitantes à CT et une proportion d'infections à MG, et l'observance semble élevée.
Revues systématiques et études sur les effets du traitement de l'infection à NG par bithérapie ou monothérapie
Au total, 11 revues systématiquesRéférence 47Référence 48Référence 49Référence 50Référence 51Référence 52Référence 53Référence 54Référence 55Référence 56Référence 57 publiées entre janvier 2010 et février 2021 ont été recensées. De plus, bien qu'aucune revue systématique n'ait été effectuée pour les publications après août 2020 (la dernière date de recherche incluse dans les examens systématiques), quatre études primairesRéférence 43Référence 58Référence 59Référence 60 ont été jugées importantes pour orienter les recommandations provisoires. Les caractéristiques des études incluses sont présentées à l'annexe 3.
Tous les sites d'infection (urogénital, rectal et pharyngé)
Une revue systématique récente avec une méta-analyse en réseau sur la monothérapie pour le traitement des infections à NG à tous les sitesRéférence 55 a comparé les effets entre différents médicaments injectables, ainsi qu'entre différents médicaments par voie orale. Sur les 44 essais contrôlés randomisés, neuf essais retenus comptaient un total de 683 patients traités à la ceftriaxone à des doses de 125 ou 250 mg. On a constaté que la ceftriaxone entraînait une plus grande probabilité de guérison que tous les autres médicaments injectables. Lorsqu'on compare le céfixime (800 mg) à d'autres médicaments administrés par voie orale, le céfixime a entraîné une plus grande probabilité de guérison, sauf lorsqu'on le compare à l'azithromycine 1g ou à l'ofloxacine.
Une revue effectuée par Bai (2012)Référence 47 a fait état d'études publiées en 1991 et en 1992 qui ont comparé directement la ceftriaxone au céfixime; trois étudesRéférence 61Référence 62Référence 63 ont comparé la ceftriaxone 250 mg IM (n = 234) et le céfixime 400 mg (n = 348), et deux étudesRéférence 61Référence 63 ont comparé la ceftriaxone 250 mg IM (n = 157) et le céfixime 800 mg (n = 142). Les résultats comprenaient une plus grande probabilité de guérison avec la ceftriaxone 250 mg comparativement au céfixime 400 mg (RC à 1,77, IC à 95 %, 1,11 à 2,80). Cependant, aucune différence n'a été observée par rapport au céfixime 800 mg (RC 1,19, IC à 95 %, 0,19 à 7,39). Ces résultats doivent être interprétés avec prudence, car les études initiales ont été menées il y a plus de 30 ans, et les données étaient restreintes, comme le reflète le large IC à 95 %.
Depuis la publication des revues systématiques, un essai clinique contrôlé randomisé ouvert a été mené à Hai Phong, au Vietnam, auprès de 125 personnes ayant une co-infection à NG et CTRéférence 60. Les deux groupes ont reçu de la doxycycline par voie orale deux fois par jour pendant 7 jours pour traiter l'infection à CT. Dans le cas de l'infection à NG, un groupe a reçu dose unique de 1 g de ceftriaxone par IV (n = 61, dont 21 avaient une infection pharyngée) et l'autre groupe a reçu une dose unique de céfixime par voie orale de 800 mg (n = 64, dont 19 avaient une infection pharyngée). Dans l'ensemble, les taux de guérison des infections à NG étaient de 96,7 % (IC à 95 % de 88,8 à 99,1 %) avec la ceftriaxone (et la doxycycline) et de 95,3 % (IC à 95 % de 87,1 à 98,4 %) avec le céfixime (et la doxycycline). On a observé des échecs au traitement seulement chez les participants qui avaient une infection pharyngée; l'élimination de l'infection pharyngée à NG le 8e jour était de 19/21 (90 %) chez ceux qui avaient reçu de la ceftriaxone et de 14/19 (74 %) chez ceux qui avaient reçu du céfixime.
Dans une étude observationnelle rétrospectiveRéférence 59, les données de surveillance de la Chine ont été utilisées pour comparer les effets de diverses doses de ceftriaxone (250 mg IM, 500 mg IM, ≥ 1 g IV; n = 1401), dose de céfixime non spécifiée (n = 119), et d'autres céphalosporines à large spectre pour le traitement des infections non compliquées à NG chez 1686 participants. La prévalence des isolats avec SR à la ceftriaxone [CMI ≥ 0,125 mg/l] était de 9,8 % (131/1333). Tous les patients recrutés dans le cadre de cette étude ont été guéris, peu importe la sensibilité des isolats à la ceftriaxone ou la dose de ceftriaxone qu'ils ont reçue.
Site anorectal
La revue systématique de Lo et coll. (2021)Référence 57 a révélé que la proportion de guérison, en monothérapie ou en thérapie combinée, notamment la ceftriaxone à diverses doses (125 mg, 250 mg ou 500 mg) pour la gonorrhée rectale était de 100,0 % (IC à 95 % : 99,9 % à 100,0 %). Les taux de guérison obtenus avec la monothérapie (100,0 %; IC à 95 % : 99,88 % à 100,0 %) et les thérapies combinées (100,0 %; IC à 95 % : 97,65 % à 100,0 %) étaient similaires.
Site pharyngé
Kong et coll. (2020)Référence 56 ont évalué les effets du traitement de l'infection pharyngée provenant des données d'essais contrôlés randomisés. Ils ont rapporté une guérison microbiologique de 98,1 % (IC à 95 % : 93,8 % à 100 %; I2 = 57,3 %; P < 0,01) pour l'ensemble des traitements de la gonorrhée pharyngée. La proportion de guérison par monothérapie (97,1 %; IC à 95 %, 90,8 à 100,0) et thérapies combinées (98,0 %; IC à 95 %, 91,4 à 100) était similaire. Sur les 19 traitements évalués dans cette revue systématique et méta-analyse, deux comprenaient une monothérapie par ceftriaxone, un comprenait une monothérapie par céfixime et trois comprenaient la ceftriaxone combinée à l'azithromycine.
Les estimations sommaires pour la guérison microbiologique étaient les suivantes :
- Ceftriaxone 250 mg (Hook III, 2014Référence 64, n = 13) : 100 % (IC À 95 % : 77,2 à 100)
- Ceftriaxone 125 mg (Ramus, 1997Référence 65, n = 5) : 100 % (IC À 95 % : 56,6 à 100)
- Céfixime 400 mg (Ramus, 1997Référence 65, n = 6) : 100 % (IC À 95 % : 61,0 à 100)
- Ceftriaxone 500 mg avec 2 g d'azithromycine (Rob, 2019Référence 66, n = 33) : 100 % (IC À 95 % : 89,6 à 100)
- Ceftriaxone 500 mg avec 1 g d'azithromycine (Chen, 2015Référence 67, n = 19) : 100 % (IC À 95 % : 83,2 à 100)
- Ceftriaxone 500 mg avec 1 g d'azithromycine (Ross, 2016Référence 68, n = 113) : 95,6 % (IC À 95 % : 90,0 à 100)
Dans cette revue systématique, l'étude sur le céfixime a été menée il y a plus de 25 ans auprès de seulement six participants qui avaient une infection à NG et qui avaient reçu une dose de 400 mgRéférence 65. Dans le cas de la monothérapie à la ceftriaxone, seulement 18 participants ayant une infection à NG ont été inclus (125 mg ou 250 mg), avec des taux de guérison microbiologique de 100 %Référence 64Référence 65. Ces deux études ont été menées il y a plus de 10 ans. Elles ont également présenté des estimations sommaires des effets secondaires, en précisant l'hétérogénéité considérable entre les étudesRéférence 56:
- Dans l'ensemble, 13,7 % (IC à 95 % : 9,2 % à 19,0 %) ont déclaré avoir eu des nausées, qui semblaient plus fréquentes dans les cas de bithérapie comprenant 2 g d'azithromycine.
- Dans l'ensemble, 1,8 % (IC à 95 % : 0,9 à 3,0 %) ont signalé des vomissements, avec peu de variation selon les schémas thérapeutiques.
- Dans l'ensemble, 15,8 % (IC à 95 % : 9,2 % à 23,8 %) ont signalé des diarrhées, qui ont été plus fréquemment signalées dans le cas de bithérapie utilisant 2 g d'azithromycine.
Une étude observationnelle prospective a été menée auprès d'HARSAH asymptomatiques âgés de plus de 19 ans diagnostiqués pour une infection extragénitale à NG à Tokyo, au JaponRéférence 43. Les participants ont reçu 1 000 mg de ceftriaxone IV en monothérapie (158 participants ayant une infection à NG seulement : 88 par une infection pharyngée, 20 par une infection rectale et 50 par une infection pharyngée et rectale) ou en thérapie combinée (72 participants ont eu une co-infection à CT: un avec une infection pharyngée, 11 avec une infection rectale et 50 avec une infection pharyngée et rectale). La thérapie combinée consistait en 1 g de ceftriaxone IV combiné à une dose orale unique de 1 g d'azithromycine (n = 19), 100 mg de doxycycline administrée par voie orale deux fois par jour pendant 7 jours (n = 89) ou un autre antibiotique (n = 4). Le test de contrôle a été effectué au moins deux semaines après le traitement chez les participants qui avaient une infection pharyngée et au moins trois semaines après le traitement chez les participants qui avaient une infection rectale. Neuf échecs au traitement (pharynx = 5; rectal = 4) ont été relevés chez huit participants (le test de contrôle était positif aux sites pharyngé et rectal chez un participant). Chez ces participants, le test de contrôle a été pratiqué de 20 à 409 jours après le traitement, il était donc difficile de faire la distinction entre la réinfection et l'échec au traitement. L'efficacité microbiologique entre la monothérapie et la thérapie combinée était similaire. L'efficacité contre les infections pharyngées et rectales était respectivement de 97,8 % (135/138, IC à 95 % : 93,8 à 99,4 %) et 98,6 % (69/70, IC à 95 % : 92,3 à 99,9 %) dans le groupe de monothérapie, et de 96,1 % (49/51, IC à 95 % : 86,8 à 99,3 %) et 95,1 % (58/61, IC à 95 % : 86,5 à 98,7 %) dans le groupe de thérapie combinée.
Une revue de la littérature effectuée par Creighton et coll. (2014)Référence 50 a révélé un taux de guérison de l'infection pharyngée de 80 % et de 92 % pour le céfixime avec 800 mg et 400 mg respectivement. Pour la ceftriaxone à 125 mg et 250 mg, les taux de guérison sont de 94,1 % et 99 % respectivement. Ces études ont été publiées il y a un certain temps, elles pourraient donc ne pas représenter le profil de résistance actuel.
Dans l'ensemble, les revues systématiques publiées et un échantillon d'études primaires suggèrent que les pourcentages de guérison sont similaires avec la bithérapie ou la monothérapie, et que la ceftriaxone 250, 500 ou 1 000 mg peut entraîner des taux de guérison plus élevés que le céfixime 400 mg, avec ou sans ajout d'azithromycine.
Informations relatives à l'épidémiologie et la surveillance au Canada
Il y a eu une augmentation graduelle et constante des cas déclarés d'infection à NG depuis 1997. En 2019, 35 443 cas de gonorrhée ont été déclarés au Canada, ce qui correspond à un taux de 94,3 cas pour 100 000 habitants. Entre 2010 et 2019, les taux ont presque triplé (augmentation de 182 %)Référence 24.
Les taux de gonorrhée étaient systématiquement plus élevés chez les hommes que chez les femmes. En 2019, les deux tiers des cas étaient parmi des hommes, dont les taux étaient supérieurs de 228 % à ceux de 2010; chez les femmes, les taux ont augmenté de 121 % au cours de la même périodeRéférence 24. Au cours de la décennie 2010-2019, le taux le plus élevé de cas de gonorrhée a été observé chez les personnes âgées de 20 à 29 ans. Depuis 2010, les taux ont augmentés dans tous les groupes d'âge. Cependant, l'ampleur de la variation du taux au fil du temps variait selon le groupe d'âge. La plus forte augmentation relative a été enregistrée dans les groupes d'âge de 30 à 39 ans et de 40 à 59 ans, en hausse de 368 % et de 331 % respectivement depuis 2010Référence 24.
RAM de NG : situation actuelle à l'échelle internationale et au Canada
La RAM de NG est un défi de santé publique mondialRéférence 69Référence 70. Des cas de SRNote de bas de page b et de résistance de NG à la ceftriaxone ont été déclarés dans 24 % des pays participant au Programme mondial de surveillance de la résistance des gonocoques aux antimicrobiens de l'OMS de 2015 à 2016 et dans 31 % des pays de 2017 à 2018Référence 71Référence 72. Par ailleurs, davantage de pays ont signalé une résistance accrue à l'azithromycine: 81 % de 2015 à 2016 et 84 % de 2017 à 2018Référence 71Référence 72.
Sept cas de NG résistants à la ceftriaxone ont été détectés au Canada entre 2017 et 2023Référence 25Référence 73Référence 74, et tous étaient également résistants au céfixime. Le JaponRéférence 75, l'AustralieRéférence 76, la ChineRéférence 77Référence 78, le DanemarkRéférence 79 et l'IrlandeRéférence 80 sont quelques-uns des autres pays qui ont également identifié des cas de résistance de NG à la ceftriaxone. Cinq des sept isolats canadiens résistants à la ceftriaxone présentent les mêmes mutations associées à la RAM que celles observées au Japon et en AustralieRéférence 77. Les deux isolats résistants à la ceftriaxone identifiés en mars et avril 2023 provenaient du centre et de l'ouest du Canada (données non publiées). Le cas du centre du Canada était celui d'un homme symptomatique qui a signalé une relation sexuelle avec une femme. Il n'avait pas récemment quitté la province. Le traitement empirique avec 250 mg de ceftriaxone et 1 g d'azithromycine a été efficace, comme l'a démontré un test de contrôle négatif (par culture) recueilli 18 jours après le traitement. Le cas de l'Ouest canadien a été acquis en Asie du Sud-Est et a été traité avec succès à l'aide de ceftriaxone 1 g IV et de doxycycline 100 mg deux fois par jour x 14 jours, comme l'a démontré un test de contrôle négatif (par TAAN) recueilli 30 jours après le traitement. Ces deux cas n'étaient pas liés en raison de différences dans leurs résultats de typage de séquence génétique. Il est également préoccupant que le Royaume-Uni ait signalé un isolat présentant à la fois une résistance à la ceftriaxone et une résistance de haut niveau à l'azithromycine, ce qui a conduit à l'échec au traitement en 2018Référence 81. Bien qu'un isolat présentant ce type de résistance n'ait pas été identifié au Canada, 12 isolats avec SR à des céphalosporines ont été identifiés entre 2016 et 2022.
Les données du GASP-Canada indiquent que la proportion de souches avec SR à la ceftriaxone est demeurée stable entre 2017 et 2021 (0,6 % en 2021). Cependant, la SR au céfixime a augmenté entre 2017 (0,6 %) et 2020 (2,8 %), puis a diminué à 1,5 % en 2021 (annexe 1 – figure 1).
Les données du GASP-Canada montrent que la résistance à l'azithromycine a augmenté au Canada (annexe 1 – figure 2). À 7,2 % en 2016, la résistance a dépassé le seuil de résistance de 5 % recommandé par l'OMS pour donner lieu à une révision des traitements actuellement recommandésRéférence 82 Depuis, la proportion de souches résistantes à l'azithromycine a fluctué entre 6,1 % et 11,7 %. En 2021, 7,6 % des isolats de NG étaient résistants à l'azithromycine. Le point de rupture recommandé par le CLSI pour l'azithromycine est de 2 mg/lRéférence 83, avec une note indiquant que « ce point de rupture suppose que l'azithromycine (1 g en dose unique) est utilisée dans un traitement approuvé qui comprend un agent antimicrobien supplémentaire, c.-à-d. ceftriaxone 250 mg IM en dose unique ». Cependant, certains pays, dont l'Australie, ont fixé leur point de rupture à 1 mg/l, ce qui correspond également au seuil épidémiologique de l'EUCASTRéférence 84Référence 85. La proportion d'isolats de NG avec une CMI d'azithromycine de 1 mg/l a augmenté considérablement (p < 0,001) au cours des dernières années au Canada, passant de 11,6 % en 2016 à 28,1 % en 2021.
En 2021, la proportion d'isolats de NG résistants à la ciprofloxacine était de 57 %; la résistance à la tétracycline était à un niveau record de 64 %, la résistance à l'érythromycine était de 51,5 % et la résistance à la pénicilline était inférieure à 7 % (annexe 1 – figure 1).
Le système de SARGA comprend des données sur la RAM provenant de quatre provinces et territoires (l'Alberta, le Manitoba, la Nouvelle-Écosse et les Territoires du Nord-Ouest). Entre 2014 et 2017, le système de SARGA a enregistré 2 767 cultures de 2566 cas. La majorité des cas étaient de sexe masculin (81 %) et de moins de 40 ans (83 %). De 2014 à 2017, le nombre de cas d'HARSAH a diminué de 25 %. La proportion d'isolats présentant une RAM à au moins un antibiotique est passée de 54 % en 2014 à 66 % en 2016, puis a diminué à 58 % en 2017Référence 86.
Au Québec, une souche résistante à la ceftriaxone a été identifiée en 2017Référence 73. Depuis, toutes les souches analysées étaient sensibles à la ceftriaxoneRéférence 27. Les deux premières souches résistantes au céfixime ont été identifiées en 2015 (0,2 %), avec un pic de 12 souches en 2019 (0,7 %). Toutes les souches (n = 1 520) testées en 2021Référence 27 et 2022 (communication personnelle avec Brigitte Lefebvre) étaient sensibles au céfixime (CMI ≤ 0,25 mg/l). De 2011 à 2021, la SR pour la ceftriaxone (CMI 0,12-0,25 mg/l) variait de 0 à 3,9 % et la SR pour le céfixime (CMI 0,25 mg/l) variait de 0,2 à 1,9 %. Cependant, aucune tendance à la hausse n'a été observée : les taux les plus élevés de SR à la ceftriaxone ont été observés en 2014 et en 2015; ils varient de 0 % à 0,3 % depuis 2017. Par ailleurs, la résistance à l'azithromycine est passée de 1,0 % en 2011 à 39,0 % en 2021Référence 27. Il convient de noter que la plupart des souches résistantes avaient une CMI d'azithromycine de 2 mg/l, qui est le point de rupture de la résistance (les souches ayant une CMI de 1 mg/l [une dilution en dessous] sont considérées comme sensibles). Par exemple, en 2021, 561/593 (95 %) souches résistantes avaient une CMI d'azithromycine de 2 mg/lRéférence 27.
Dans l'ensemble, au Canada, la résistance à la ceftriaxone ou au céfixime a été rapportée, mais elle demeure rare. La proportion de souches avec une SR à la ceftriaxone demeure faible et stable, mais la SR au céfixime semble augmenter (elle demeure tout de même inférieure à 2 %). Une augmentation inquiétante de la résistance à l'azithromycine (7,6 %) a été observée, ce qui est supérieur au seuil de 5 % établi par l'OMS. De plus, 20,5 % des souches indiquent une CMI d'azithromycine de 1 mg/l, ce qui représente seulement un niveau de dilution en dessous du seuil de résistance.
Surveillance des échecs de traitement au Canada
Un rapport sur le programme de SARGA (2017) indique que les tests de contrôle et les échecs au traitement peuvent être difficiles à mesurer à l'aide des données de surveillance, car ils reposent sur la capacité de détecter des résultats négatifs. De plus, les gens peuvent ne pas retourner à la même clinique pour leur test de contrôle, s'ils reviennentRéférence 87.
Les données du programme de SARGA indiquent qu'en 2016 et en 2017, moins de 0,5 % des cas (5/1452) de gonorrhée avec des cultures rapportés au système ont été classés comme des échecs de traitement potentiels par l'infirmière de la santé publique qui a évalué le cas. Cependant, aucun de ces cinq cas n'a démontré une résistance aux céphalosporines (c.-à-d. céfixime ou ceftriaxone)Référence 28. Parmi les 5 cas d'échec potentiel, les sites anatomiques d'infection et de traitement reçus étaient les suivants :
- Pharyngé : une dose unique de ceftriaxone 250 mg combinée à l'azithromycine 1 g
- Pharyngé : une dose unique d'azithromycine 2 g;
- Cervical : une dose unique de céfixime 800 mg combinée à 1 g d'azithromycine
- Cervical : une dose unique de céfixime 800 mg combinée à 1 g d'azithromycine
- Pharyngé : une dose unique de céfixime 800 mg combinée à 1 g d'azithromycine.
Dans le réseau sentinelle du Québec (2015-2019), un test de contrôle a été réalisé pour 1 596 épisodes d'infection à NG (63 % de tous les cas)Référence 29. Le test de contrôle était positif pour 83 cas (5 %), parmi lesquels 57 présentaient suffisamment de renseignements recueillis pour permettre la classification (selon des définitions préétablies) entre la réinfection (réexposition documentée) ou l'échec au traitement. Parmi les 18 cas pour lesquels l'échec au traitement était considéré comme probable ou possible, les traitements reçus étaient les suivantsRéférence 29:
- Une dose unique de ceftriaxone de 250 mg combinée à 1 g d'azithromycine (n = 10)
- Une dose unique de céfixime 800 mg combinée à 1 g d'azithromycine (n = 3, dont deux avaient une infection pharyngée confirmée)
- Une dose unique de 2 g d'azithromycine en monothérapie (n = 2);
- Une dose unique de 1 g d'azithromycine en monothérapie, suivie huit jours plus tard d'une dose unique de céfixime 800 mg (n = 1)
- Traitement de sept jours de doxycycline à 100 mg deux fois par jour (n = 1)
- Une dose unique de ceftriaxone 250 mg en monothérapie (n = 1).
Dans l'ensemble, des échecs au traitement ont été rapportés au Canada, même lorsque la ceftriaxone est combinée à l'azithromycine. En raison du petit nombre d'événements, il est difficile de déterminer si un traitement particulier est davantage associé à l'échec. Pour déterminer si les échecs augmentent au fil du temps, il faudrait maintenir et élargir la surveillance.
Pharmacocinétique et pharmacodynamique des céphalosporines dans les infections à NG
Depuis 2016, l'OMS recommande l'utilisation de la céphalosporine et de l'azithromycine comme traitement principal de la gonorrhée, en raison de la possibilité que NG développe une résistance aux antimicrobiens. En général, les traitements de première intention pour les infections gonococciques non compliquées ont des taux d'efficacité de plus de 99 %. Cependant, les infections pharyngées sont plus difficiles à traiter. Les taux de guérison sont de moins de 90 % avec des traitements autres que la ceftriaxone, ce qui est peut-être dû à une pénétration réduite des tissus oropharyngésRéférence 88. Pour les infections pharyngées, la ceftriaxone reste le seul traitement recommandé, bien qu'elle soit fortement liée aux protéines et que ses concentrations dans le tissu amygdalien soient faibles, de sorte que son activité pharmacodynamique est moins bien compriseRéférence 88.
Dans le cas des antibiotiques bêta-lactamines, le paramètre pharmacocinétique-pharmacodynamique (PK-PD) associé à l'activité clinique est le moment où la concentration libre du médicament dépasse la CMI (ƒ T>CMI)Référence 89. Jaffe et coll. (1979)Référence 90 ont proposé que le ƒT >CMI optimal pour la pénicilline était de 7 à 10 heures pour l'efficacité clinique dans le traitement de l'urétrite masculine, et on a supposé que cette cible s'appliquait aux céphalosporines pour les infections gonococciquesRéférence 41Référence 91.En se fondant sur des données cliniques et de modélisation PK-PD plus récentes concernant la ceftriaxone et le céfiximeRéférence 41, Chisholm et coll. (2010) ont émis l'hypothèse qu'un ƒT >CMI cible d'environ 20 à 24 heures est nécessaire pour que l'activité soit optimaleRéférence 41Référence 92. Cependant, les critères PK-PD idéaux pour la gonorrhée pharyngée demeurent incertainsRéférence 88.
En réponse aux données de surveillance montrant une augmentation des isolats de NG avec une sensibilité réduite au céfixime, certains spécialistes ont suggéré d'utiliser une dose accrue de céfixime ou de doses multiples pour surmonter les CMI croissantes. Dans une étude pharmacocinétique, Barbee et coll. (2018)Référence 93 ont examiné l'utilisation de régimes à doses uniques de céfixime plus élevées (céfixime 400 mg, 800 mg et 1200 mg) et de céfixime 800 mg par voie orale toutes les 8 heures pendant 3 doses pour traiter les infections pharyngées théoriques à NG avec une CMI ≥ 0,5 mg/l. Ils ont constaté qu'aucun des traitements à dose unique ne permettait d'atteindre la concentration sérique totale cible proposée de 2,0 mg/l (4 fois supérieure à la CMI de 0,5 mg/l) pendant plus de 20 heures, et que seuls 50 % des cas ayant reçu le traitement à doses multiples de céfixime atteignaient l'objectif fixé. De plus, les concentrations de liquide pharyngé étaient négligeables pour tous les régimes posologiques de céfiximeRéférence 93. Il est important de souligner que les concentrations sériques totales de céfixime (et les concentrations non actives de céfixime libre non lié) ont été utilisées dans cette étude et que la concentration cible proposée de 2,0 mg/l était relativement élevée, étant donné que les souches de NG présentant une SR au céfixime ont une CMI au céfixime de 0,25 mg/lNote de bas de page c. Sur la base de ces considérations, une dose de céfixime de 800 mg par voie orale toutes les 8 heures pour 3 doses peuvent suffire à atteindre les objectifs thérapeutiques pour les souches de NG dont les CMI sont inférieures à 0,5 mg/l. Chisholm et coll. (2010)Référence 41 ont mené une étude de simulation pharmacodynamique pour déterminer si des doses uniques de céfixime plus élevées ou des doses multiples permettraient d'atteindre les valeurs ƒ T>CMI cibles de 20 à 24 heures pour NG. Les auteurs ont constaté que, pour les isolats de NG avec une CMI de 0,25 mg/l, un traitement à deux doses de céfixime à 400 mg donné à 6 heures d'intervalle atteignait la cible à 26 heures, tandis que deux doses de céfixime 200 mg administrées à 6 heures d'intervalle et des doses uniques de 400 mg et de 200 mg n'atteignaient pas la cible, suggérant l'utilité potentielle de traitements à doses multiples pour optimiser le traitementRéférence 41.
En 2013Référence 9, les LDCITS comprenaient des recommandations de ceftriaxone 250 mg IM avec 1 g d'azithromycine par voie orale en dose unique comme traitement privilégié pour une infection à NG non compliquée, et une recommandation d'augmenter le céfixime à 800 mg par voie orale combinée à 1 g d'azithromycine par voie orale en dose unique comme traitement alternatif préféré pour les infections anogénitales non compliquées (Lignes directrices canadiennes sur les ITS). La justification de cette dose plus élevée de céfixime 800 mg était fondée sur des préoccupations liées à l'augmentation de la CMI de NG à 0,125 mg/l, selon lesquelles une dose de céfixime 400 mg ne serait pas suffisante pour atteindre la cible de CMI de 20 à 24 heures. Selon la modélisation PK-PD, le Groupe de travail d'experts pour les Lignes directrices canadiennes sur les infections transmissibles sexuellement en 2013 a recommandé 800 mg de céfixime comme dose unique pour augmenter la CMI à environ 20 heures pour les isolats de NG avec une CMI allant jusqu'à 0,125 mg/l.
Dans le cas de la ceftriaxone, plusieurs organisations ont mis à jour leurs lignes directrices sur le traitement de l'infection à NG afin de recommander l'utilisation de doses plus élevéesRéférence 14Référence 40. Selon la modélisation PK-PD pour la ceftriaxone, une augmentation de la dose de 250 mg à 500 mg augmenterait la CMI de 16 heures à 24 heures, ce qui permettrait d'atteindre la cible de traitement efficace des isolats de NG avec des CMI de 0,25 mg/l ou moinsRéférence 41. Par conséquent, une dose plus élevée de ceftriaxone serait plus efficace contre des souches potentielles avec une sensibilité réduite.
En résumé, avec une augmentation des isolats de NG présentant une sensibilité réduite aux céphalosporines, de nouvelles stratégies de dosage fondées sur les principes de PK-PD sont nécessaires pour maintenir l'efficacité de ces agents tout en réduisant le développement de la résistance. Une dose unique plus élevée, comme 500 mg et des schémas posologiques multiples, peut être utile pour optimiser l'activité des céphalosporines; toutefois, d'autres études cliniques et de surveillance sont nécessaires pour vérifier leur efficacité clinique et leurs effets sur la RAM.
Données probantes sur les valeurs et les préférences des patients, la faisabilité, l'acceptabilité pour les parties prenantes, l'équité et l'utilisation des ressources
Les données disponibles sur les valeurs et les préférences des patients pour le traitement de l'infection à NG sont limitées. L'OMS (2016) n'a trouvé aucune donnée probante sur les valeurs et les préférences des patients, l'acceptabilité, l'équité ou la faisabilité spécifique au traitement des infections gonococciquesRéférence 31. De plus, le Centre Fédéral d'Expertise des soins de santé (KCE) de la Belgique (2019)Référence 94 a cité le rapport de l'OMS, indiquant le manque de données disponibles dans ce domaine. Pour la plupart des lignes directrices, l'accent a été mis sur les guérisons plutôt que sur les effets secondaires des traitements. Il existe des données dans la littérature sur l'acceptabilité des injections par rapport aux médicaments oraux chez les personnes atteintes de syphilis. Environ 10 à 20 % des patients ont refusé les traitements par injectionRéférence 31Référence 95Référence 96. En ce qui concerne les effets indésirables des médicaments, l'incidence des effets secondaires gastro-intestinaux est élevée, en particulier avec 2 g d'azithromycineRéférence 56Référence 97. Cette dose peut donc être moins acceptable pour les patients, les prestataires de soins et les cliniciensRéférence 40Référence 98. D'autres facteurs peuvent être appréciés par les patients, comme la commodité de recevoir une injection dans une clinique plutôt que d'exécuter une ordonnance à un autre endroit, ou la peur de la stigmatisation au moment d'exécuter une ordonnance pour une ITS.
L'adhésion aux recommandations publiées précédemment par les cliniciens peut varier selon la province et la disponibilité des médicaments. Par exemple, les cliniciens de la Colombie-Britannique ont tendance à prescrire le céfixime plutôt que la ceftriaxone comme premier choix (communication personnelle avec Troy Grennan, juin 2023). Dans certains milieux de soins primaires, il se peut aussi qu'ils ne disposent pas de stocks ou des ressources nécessaires pour administrer des injections de ceftriaxone. Une meilleure adhésion aux lignes directrices peut également dépendre de recommandations de traitement similaires pour les sites génitaux, anorectaux et pharyngés, plutôt que d'avoir des recommandations différentes selon le site.
La ceftriaxone est actuellement disponible sous forme de flacons de 250 mg, et si la dose devait être augmentée à 500 mg, les cliniciens pourraient utiliser 2 flacons de 250 mg ou la moitié d'un flacon de 1 000 mg. Les deux doses de 250 mg peuvent être combinées dans une seringue et administrées en une seule injection intramusculaire au patient. Il est probable que les différences de coût entre deux flacons de 250 mg ou une demi-flacon de 1 000 mg seraient négligeables.
La littérature sur le rapport coût-efficacité du traitement de l'infection à NG est très limitée. La ligne directrice de l'OMS de 2016Référence 31 pour le traitement de NG comprenait une revue des données probantes sur le rapport coût-efficacité et a conclu que le coût comparé à l'efficacité de la thérapie combinée n'était pas plus élevé que celui de la monothérapieRéférence 31. Xiridou et coll. (2016)Référence 99 ont examiné si la bithérapie pouvait retarder la propagation de la RAM et si les coûts supplémentaires de la bithérapie pouvaient être investis efficacement dans les bienfaits sur la santé qui en découlent, comparativement à la monothérapie. Ils ont utilisé un modèle de transmission et un modèle économique pour déterminer les coûts et les effets de la monothérapie et de la bithérapie chez les HARSAH. Leur cadre était fondé sur les lignes directrices relatives aux tests et aux traitements aux Pays-Bas. Pour le scénario de base, ils ont supposé que la bithérapie était introduite en l'absence de résistance à la ceftriaxone ou à l'azithromycine. Ils ont également examiné un scénario prévoyant une résistance à l'azithromycine de 5 % au départ. Ils ont calculé les coûts et utilisé les années de vie ajustées en fonction de la qualité (AVAQ) pour mesurer les bienfaits des stratégies de traitement sur la santé. Sur la base de leurs hypothèses et des paramètres utilisés dans les modèles, les auteurs ont conclu qu'en l'absence de résistance initiale, la bithérapie peut retarder la propagation de la résistance à la ceftriaxone d'au moins 15 ans, par rapport à la monothérapie. Toutefois, si la résistance à l'azithromycine est prévalente au départ (5 %), la résistance au traitement de première intention augmente de la même façon avec les deux stratégies de traitement et le rapport coût-efficacité différentiel annuel (ratio des coûts supplémentaires annuels divisé par les AVAQ annuelles obtenues) demeure extrêmement élevé (c.-à-d. qu'il ne s'agit pas d'une stratégie rentable).
En résumé, d'après la revue de la littérature et les opinions du Groupe de travail sur le traitement de la gonorrhée, les facteurs valorisés par les patients pour le traitement des infections gonococciques non compliquées peuvent inclure des effets secondaires potentiellement moins importants avec la monothérapie qu'avec la thérapie combinée, et la voie d'administration (la voie orale évite une injection douloureuse, mais elle peut être associée à la stigmatisation au moment d'exécuter une ordonnance pour une ITS, tandis que l'administration du médicament directement à la clinique peut être perçue comme étant pratique). Les cliniciens pourraient mieux adhérer aux recommandations qui sont similaires pour les différents sites infectés. Les ressources et la disponibilité des médicaments dans les provinces et les territoires canadiens pourraient constituer un solide prédicteur. Le coût et la faisabilité de fournir une dose plus élevée de ceftriaxone seraient probablement négligeables, ce qui pourrait avoir peu d'incidence sur l'équité.
Justification
Il faut tenir compte de certains points au moment de l'interprétation des résultats de la revue de littérature. La revue de littérature s'est déroulée du 1er janvier 2010 à février 2020 (mise à jour en 2023). De plus, une revue systématique des études primaires sur les effets du traitement de la gonorrhée non compliquée chez les adultes et les adolescents symptomatiques ou asymptomatiques, notamment les femmes enceintes, n'a pas été effectué pour ces lignes directrices intérimaires. Les lignes directrices et recommandations intérimaires seront mises à jour ou réaffirmées en attendant l'achèvement d'une revue plus complète et rapide des études primaires.
Le Groupe de travail a examiné des données probantes de différentes publications, notamment des revues systématiques, des recommandations de plusieurs groupes d'élaboration de lignes directrices, un échantillon d'études primaires, de l'information sur l'épidémiologie et la surveillance au Canada, des données de surveillance de la RAM au Canada, de l'information de surveillance sur les échecs de traitement au Canada, la pharmacocinétique et la pharmacodynamique des céphalosporines dans les infections à NG, et la littérature sur les valeurs et les préférences des patients, la faisabilité, l'acceptabilité, l'équité et l'utilisation des ressources.
Les données probantes suggèrent que les pourcentages de guérison sont similaires avec la thérapie combinée ou la monothérapie, et que la ceftriaxone avec des doses variant de 250 à 1 000 mg, et avec ou sans azithromycine, donne des pourcentages de guérison similaires. Une augmentation inquiétante de la résistance à l'azithromycine (7,6 %) a été observée, ce qui est supérieur au seuil de 5 % établi par l'OMS. De plus, 20,5 % des souches contiennent une CMI d'azithromycine de 1 mg/l, ce qui représente seulement un niveau de dilution sous le seuil de résistance. Des échecs au traitement ont été signalés au Canada, même lorsque la ceftriaxone était combinée à l'azithromycine. En raison du petit nombre d'événements, il est difficile de déterminer si un traitement particulier est davantage associé à l'échec. L'utilisation de l'azithromycine en association avec la ceftriaxone ou le céfixime peut également être contraire à la priorité établie au Canada pour la gérance des antimicrobiensRéférence 18. De plus, les effets secondaires (p. ex., effets secondaires gastro-intestinaux) associés à la dose plus élevée d'azithromycine peuvent limiter son utilisation.
Une dose unique plus élevée, comme 500, mg et des schémas posologiques multiples, peuvent être utiles pour optimiser l'activité des céphalosporines; toutefois, d'autres études cliniques et de surveillance sont nécessaires pour vérifier leur efficacité clinique et leurs effets sur la RAM. Dans l'ensemble, le choix de 500 mg de ceftriaxone plutôt que de 250 mg sans azithromycine pourrait favoriser de meilleures réponses au traitement chez un plus grand nombre de personnes, mais étant donné la résistance accrue à la ceftriaxone à l'échelle mondiale, il est de plus en plus important d'effectuer un test de contrôle.
Bien que les patients puissent préférer les médicaments oraux aux injections, les injections de ceftriaxone pourraient être administrées immédiatement dans une clinique et réduire potentiellement la stigmatisation si une ordonnance orale devait être exécutée. L'augmentation de la dose de ceftriaxone pour tous les sites d'infection peut être acceptable et faisable pour les cliniciens, et il y aurait peu d'impact sur les coûts ou l'équité. D'autres recherches sont en cours pour développer des recommandations de traitement alternatifs.
Compte tenu de ces éléments, le CCN-ITSS a formulé de nouvelles recommandations pour le traitement privilégié de l'infection à NG, tel que présenté dans le tableau ci-dessous. Étant donné que les études incluses ont été menées antérieurement, que la résistance à ces médicaments évolue avec le temps et que la taille de l'échantillon des études est petite, la certitude de la preuve est faible.
Actualisation de la recommandation sur le traitement privilégié de la gonorrhée non compliquée chez les adultes et les adolescents de 10 ans et plus
Le CCN-ITSS recommande la ceftriaxone 500 mg IM en dose unique (monothérapie) pour le traitement privilégié de toutes les infections non compliquées (urétrales, endocervicales, vaginales, rectales et pharyngées).
- Si l'infection à C. trachomatis n'a pas été exclue par un test négatif, un traitement concomitant contre la chlamydiose est recommandé; se référer aux recommandations de traitement dans le Guide sur la Chlamydia et LGV : Traitement et suivi de l'ASPC.
Les autres options de traitement pour les infections non compliquées, qui sont nécessaires si l'accès à l'injection IM n'est pas disponible, si la personne refuse l'injection ou si la personne est gravement allergique aux céphalosporines, sont actuellement à l'étude par le CCN-ITSS. Se référer aux quatre options de traitement suivants dans le guide sur la gonorrhée de l'ASPC en attendant une revue approfondie.
- Céfixime 800 mg PO en une seule dose plus doxycycline 100 mg PO BID x 7 joursNote de bas de page *
- Céfixime 800 mg PO en une seule dose plus azithromycine 1 g PO en une seule dose
- Azithromycine 2 g PO en une seule dose PLUS gentamicine 240 mg IM en une seule doseNote de bas de page *
- Gentamicine 240 mg IM en une seule dose PLUS doxycycline 100 mg PO 2 fois par jour pendant 7 joursNote de bas de page *
Remarques :
- Si l'infection à C. trachomatis n'a pas été exclue par un test négatif, un traitement concomitant contre la chlamydiose est recommandé; se référer aux recommandations de traitement dans le Guide sur la Chlamydia et LGV : Traitement et suivi de l'ASPC.
- Consulter le Guide sur la gonorrhée : Traitement et suivi de l'ASPC pour de plus amples informations sur chaque régime de traitement alternatif, y compris les indications d'utilisation d'ertapénem, ainsi que des informations sur la notification et le traitement des partenaires.
- Le test de contrôle est recommandé pour tous les sites positifs d'infection à NG, dans tous les cas. (voir le tableau ci-dessous).
- Les schémas thérapeutiques alternatifs suivants ont été retirés du guide sur la gonorrhée de l'ASPC.
- Ceftriaxone 250 mg IM en une seule dose plus doxycycline 100 mg PO BID x 7 joursNote de bas de page **
- Azithromycine 2 g PO en une seule dose plus ciprofloxacine 500 mg PO en une seule doseNote de bas de page **
- Azithromycine 2 g en une seule dose plus gémifloxacine 320 mg PO en une seule doseNote de bas de page **
Recommandation sur le choix du test et le moment pour effectuer le test de contrôle
Le CCN-ITSS recommande un test de contrôle pour tous les sites positifs d'infection à NG dans tous les cas. Ceci est particulièrement important lorsque des traitements autres que la ceftriaxone 500 mg IM sont utilisés.
- Un TAAN doit être effectué trois à quatre semaines après la fin du traitement, car les acides nucléiques résiduels de bactéries mortes peuvent être responsables de résultats positifs moins de trois semaines après le traitement.
- Lorsqu'un test de contrôle est effectué dans les trois semaines suivant la fin du traitement, une culture doit être effectuée; les échantillons doivent être prélevés au moins trois jours après la fin du traitement.
- Lorsque l'on soupçonne l'échec au traitement plus de trois semaines après le traitement, le TAAN et la culture doivent être effectués (p. ex., lorsque les symptômes persistent ou réapparaissent après le traitement).
Recommandation sur la culture de NG
Bien que la culture soit moins sensible que le TAAN, elle offre la possibilité de déterminer la sensibilité aux antimicrobiens, ce qui est important pour la gestion des cas et essentiel pour la surveillance des tendances de la RAM. Il est essentiel de continuer à surveiller l'émergence de la RAM au moyen d'une surveillance continue afin d'apporter des changements opportuns aux recommandations de traitementRéférence 100.
Le CCN-ITSS recommande la culture pour NG (avec le TAAN*) dans les situations suivantes :
- Pour un test de contrôleNote de bas de page * lorsqu'on soupçonne un échec au traitement;
- En présence de symptômes compatibles avec la cervicite, l'urétrite, l'AIP, l'orchi-épididymite, la proctite ou la pharyngite;
- Personne asymptomatique ayant déclaré avoir été en contact avec un cas d'infection à NG;
- Lorsqu'on soupçonne une agression sexuelle (cela peut varier selon le contexte juridique et médical de la province ou du territoire);
- Si l'infection a pu être contractée dans des pays ou des régions où les taux de RAM sont élevés (des souches résistantes à NG ont été rapportées au Canada, au Japon, en Europe et en Australie; bon nombre ont été associées à des voyages en Asie du Sud-Est).
De plus, le CCN-ITSS recommande une culture lorsque l'infection à NG est confirmée par le TAAN seulement, à condition qu'elle ne retarde pas le traitement.
Remarque :
- Pour réussir une culture, on doit prélever et transporter adéquatement les bons échantillonsRéférence 101Référence 102. Consultez votre laboratoire de santé publique local pour obtenir des conseils sur le prélèvement et le transport des échantillons.
Dépistage pour la réinfection
Aucun changement n'est apporté à la recommandation.
La reprise du test de dépistage chez des personnes atteintes d'une infection gonococcique est recommandée six mois après le traitement, en raison du risque de réinfectionRéférence 103.
Remerciements
Groupe de travail sur le traitement de la gonorrhée du CCN-ITSS
Coprésidents : Annie-Claude Labbé et Tim Lau
Membres: Jared Bullard, Troy Grennan, Todd F. Hatchette, Irene Martin, Petra Smyczek et Mark Yudin
Autres membres du CCN-ITSS
Ian M. Gemmill (président), William A. Fisher, Jennifer Gratrix, Gina Ogilvie et Marc Steben
Représentant d'office (sans droit de vote) : Ibrahim Khan
Agence de la santé publique du Canada (Secrétariat)
Ulrick Auguste, Shamila Shanmugasegaram, Annie Fleurant et Nick Giannakoulis
Collaborateur externe
Nancy Santesso (Université McMaster)
Examen externe par les pairs
Dre Jo-Anne Dillon
Dr Hunter Handsfield
Dre Ameeta Singh
Annexes
Annexe 1 : Information sur la surveillance de la résistance aux antimicrobiens (RAM)
| Antibiotiques | Norme d'interprétation CMI (mg/l) | |||
|---|---|---|---|---|
| S | SR | I | R | |
| AzithromycineFootnote a | ≤ 1,0 | - | - | ≥ 2,0 |
| CéfiximeFootnote aFootnote b | ≤ 0,125 | 0.25 | - | ≥ 0,5 |
| CeftriaxoneFootnote aFootnote b | ≤ 0,06 | 0,125 - 0,25 | - | ≥ 0,5 |
| CiprofloxacineFootnote a | ≤ 0,06 | - | 0,12 - 0,5 | ≥ 1,0 |
| GentamicineFootnote cFootnote d | ≤ 4,0 | - | 8 - 16 | ≥ 32,0 |
| PénicillineFootnote a | ≤ 0,06 | - | 0,12 - 1,0 | ≥ 2,0 |
| TétracyclineFootnote a | ≤ 0,25 | - | 0,5 - 1,0 | ≥ 2,0 |
|
Abréviations : SR, sensibilité réduite; I, intermédiaire; CMI, concentration minimale inhibitrice; R, résistant; S, sensible. Remarque : Selon le Clinical Laboratory Standard Institute (CLSI), il n'existe pas de point de rupture de résistance établi pour l'azithromycine, la ceftriaxone et le céfixime. Lorsque l'isolat NG a une CMI au-dessus du point de rupture de susceptibilité (1 mg/l pour l'azithromycine et 0,25 mg/l pour la ceftriaxone et le céfixime), il est considéré comme « non susceptible ». Pour simplifier, le terme « résistant » a été utilisé pour décrire ces souches.
|
||||

a. Pourcentage basé sur le nombre total d'isolats testés au niveau national :
2011=3,360; 2012=3,036; 2013=3,195; 2014=3,809; 2015=4,190; 2016=4,538; 2017=5,290; 2018=5,607; 2019=4,859; 2020=3,130; 2021-3,439.
b. Toutes les provinces ne testent pas la pénicilline, la tétracycline et l'érythromycine; les dénominateurs sont donc plus faibles pour ces antimicrobiens.
Figure 1 : Équivalent textuel
Cette figure est un graphique linéaire affichant le pourcentage de tous les isolats de Neisseria gonorrhoeae résistants à la pénicilline, la tétracycline, l'érythromycine, la ciprofloxacine, l'azithromycine, ayant une sensibilité réduite au céfixime et une sensibilité réduite à la ceftriaxone; pourcentage basé sur le nombre d'isolats testés à l'échelle nationale de 2011 à 2021.
| Antibiotique | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Résistance | 22,2% | 20,3% | 18,9% | 18,2% | 18,9% | 17,4% | 19,0% | 9,2% | 7,14% | 6,97% | 6,56% |
| Résistance à la tétracycline | 29,4% | 30,3% | 33% | 47,3% | 56,4% | 53,3% | 45,9% | 47,1% | 44,21% | 42,99% | 64,64% |
| Résistance à l'érythromycine | 26,6% | 23,1% | 24,3% | 32% | 32,4% | 31,7% | 57,0% | 56,0% | 37,70% | 32,50% | 51,45% |
| Résistance à la Ciprofloxacine | 29,3% | 28,5% | 29,3% | 34% | 38,9% | 47% | 50,1% | 57,3% | 56,95% | 56,45% | 49,37% |
| Résistance à l'azithromycine | 0,4% | 0,9% | 1,2% | 3,3% | 4,7% | 7,2% | 11,6% | 7,6% | 11,67% | 6,10% | 7,59% |
| Sensibilité réduite au céfixime | 4,2% | 2,2% | 1,8% | 1,1% | 1,9% | 0,3% | 0,6% | 0,5% | 1,46% | 2,77% | 1,51% |
| Sensibilité réduite au ceftriaxone | 6,2% | 5,5% | 3,5% | 2,7% | 2,7% | 1,8% | 0,6% | 0,6% | 0,82% | 0,93% | 0,61% |
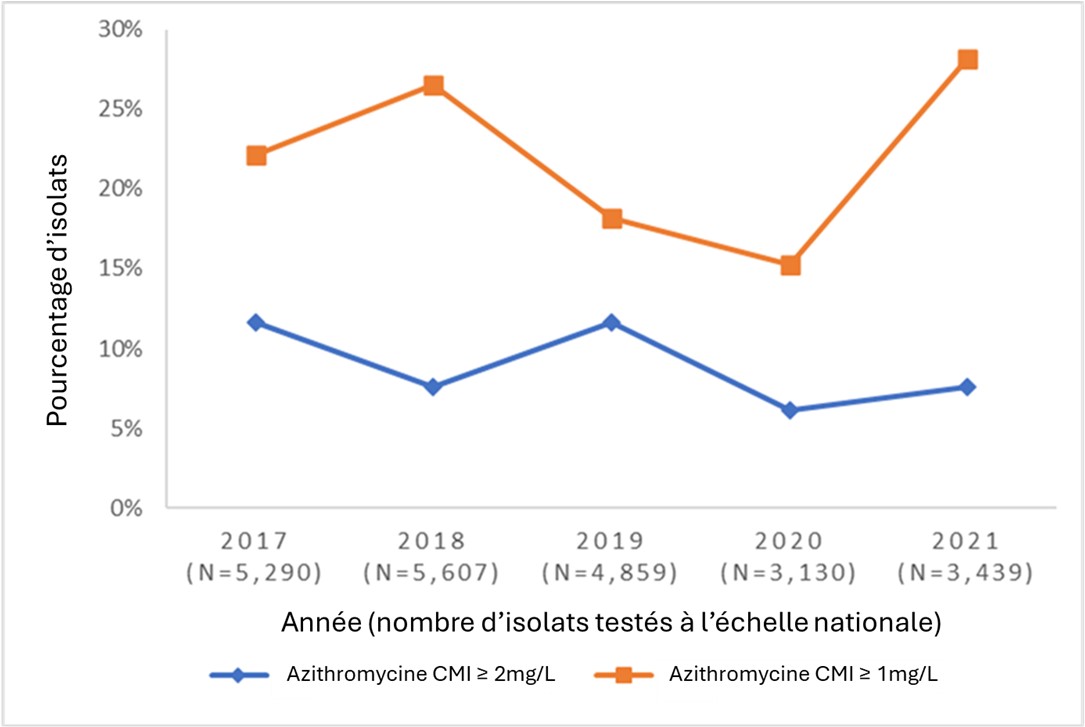
Figure 2 : Équivalent textuel
Cette figure est un graphique linéaire affichant le pourcentage de tous les isolats de Neisseria gonorrhoeae identifiés comme ayant des concentrations minimales inhibitrices (CIM) d'azithromycine de 2 mg/L et 1 mg/L; pourcentage basé sur le nombre total de cultures testées à l'échelle nationale chaque année, de 2017 à 2021.
| Azithromycine CMI | 2017 (N=5,290) |
2018 (N=5,607) |
2019 (N=4,859) |
2020 (N=3,130) |
2021 (N=3,439) |
|---|---|---|---|---|---|
| Azithromycine CMI ≥2mg/L | 11,6% | 7,6% | 11,67% | 6,10% | 7,59% |
| Azithromycine CMI ≥1mg/L | 22,2% | 26,5% | 18,17% | 15,27% | 28,14% |

a. Communication personnelle, Brigitte Lefebvre, LSPQ, 4 août 2023.
Figure 3: Équivalent textuel
Cette figure est un graphique linéaire affichant les tendances de la résistance à l'azithromycine et à la ciprofloxacine de Neisseria gonorrhoeae au Québec, de 2010 à 2021
| Antibiotique | 2010 n=920 |
2011 n=797 |
2012 n=772 |
2013 n=714 |
2014 n=906 |
2015 n=1031 |
2016 n=1260 |
2017 n=1478 |
2018 n=1836 |
2019 n=1747 |
2020 n=1167 |
2021 n=1520 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aztrhromycine | 1,2% | 1,0% | 1,7% | 1,7% | 6,7% | 12,4% | 19,9% | 30,9% | 27,6% | 27,6% | 23,7% | 39,0% |
| Ciprofloxacine | 32,2% | 35,3% | 47,5% | 38,7% | 36,6% | 46,3% | 59,5% | 67,3% | 73,6% | 74,2% | 73,0% | 50,4% |
|
n : nombre de souches testées |
||||||||||||
Annexe 2 : Liste des lignes directrices
Lignes directrices sur le traitement de la gonorrhée
| Groupe, pays et année | Population | Intervention | Résultat(s) | Recommandations (infections urogénitales-anorectales) |
Recommandations (infection pharyngée) |
Méthodes |
|---|---|---|---|---|---|---|
Organisation mondiale de la Santé (OMS) (2016) |
Adultes et adolescents (10 à 19 ans), personnes vivant avec le VIH et populations clés, y compris les travailleurs du sexe, les HARSHAH et les personnes transgenres, y compris les femmes enceintes. |
Pharmacothérapie : |
Guérison clinique et microbiologique et effets indésirables |
Traitement privilégié Niveau de preuve : données probantes de faible qualité, recommandation conditionnelle |
Traitement privilégié |
|
Monothérapie
Niveau de preuve : données probantes de faible qualité, recommandation conditionnelle |
Monothérapie
Niveau de preuve : données probantes de faible qualité, recommandation conditionnelle |
|||||
Échec au traitement :
Remarque : dose plus élevée de ceftriaxone, céfixime, azithromycine en cas d'échec au traitement |
||||||
Australasian Society for HIV, Viral Hepatitis and Sexual Health Medicine (ASHM) 2021 |
Adultes |
Pharmacothérapie : |
Non précisé En général :
|
Traitement privilégié |
Traitement privilégié |
Aucun revue systématique n'a été identifiée; |
Autres traitements |
Autres traitements |
|||||
Association des sociétés médicales scientifiques en Allemagne AWMF |
Adultes |
Pharmacothérapie : |
Non précisé En général :
|
Trois options selon les conditions suivantes : a. Site d'infection et possibilité d'identifier l'agent pathogène b. L'observance thérapeutique du patient en matière de suivi 1 - Ceftriaxone 1-2 g IM ou IV Plus Azithromycine 1,5 g PO si l'identification de l'agent pathogène n'est pas encore possible et l'observance thérapeutique n'est pas connue ou assurée. 2 - Ceftriaxone 1-2 g IM ou IV si l'identification de l'agent pathogène n'est pas encore possible, mais que l'observance thérapeutique est certaine (travail diagnostique supplémentaire et suivi après 4 semaines). 3 - Ceftriaxone (monothérapie)1-2 g IM ou IV si l'agent pathogène a été identifié, l'observance thérapeutique est certaine et la possibilité d'une co-infection a été exclue. Remarque : pour les options 2 et 3, un suivi est requis 4 semaines après le traitement pour évaluer le succès du traitement à l'aide des TAAN. |
Comme pour les infections anogénitales Céfixime est insuffisamment efficace en cas d'infection pharyngée. Dans de tels cas, un traitement avec la ceftriaxone est nécessaire. |
Non précisé. |
N. gonorrhoeae a été identifié et les résultat(s) des tests de sensibilité sont disponibles Un suivi 4 semaines après le traitement pour évaluer la réponse au traitement |
Comme pour les infections anogénitales Remarque : Céfixime n'est pas recommandé pour le traitement de l'infection pharyngée à NG |
|||||
BASHH (2019) |
Adultes |
Pharmacothérapie : |
Non précisé En général :
|
Ceftriaxone 1 g – lorsque la sensibilité aux antimicrobiens n'est pas connue avant le traitement (grade IC) Lorsque la sensibilité aux antimicrobiens est connue : Ciprofloxacine 500 mg PO |
Recherche documentaire : études et rapports de surveillance (Royaume-Uni et international); |
|
Centers for Disease Control and Prevention (CDC). Sexually Transmitted Infections Treatment Guidelines (2021) |
Nourrissons, enfants, adolescents et adultes |
Pharmacothérapie : |
Non précisé En général :
|
Traitement privilégié : Remarque : Si une infection à chlamydia n'a pas été exclue, un traitement concomitant avec la doxycycline (100 mg par voie orale deux fois par jour pendant 7 jours) est recommandé. |
Traitement privilégié Remarque : Si l'infection à chlamydia est identifiée, traiter la chlamydia avec doxycycline |
Des experts en la matière (EM) ont effectué une recherche bibliographique dans les bases de données PubMed, Embase et Medline en utilisant des paramètres liés au traitement de la gonorrhée. Revue de la documentation publiée et des données nationales de surveillance de la RAM des États-Unis, par les membres du personnel des CDC et les EM. |
Autres traitements
|
Autres traitements |
|||||
European International Union against Sexually Transmitted Infections (IUSTI) 2020 |
Adultes et adolescents |
Pharmacothérapie : |
Non précisé En général :
Prévention des complications |
Traitement privilégié
Remarque : Pour les infections à N. gonorrhoeae non compliquées de l'urètre, du col utérin et du rectum chez les adultes et les adolescents lorsque la sensibilité antimicrobienne de l'infection est inconnue |
Traitement privilégié
|
Recherche dans Medline à l'aide de PubMed pour les articles pertinents publiés depuis l'élaboration de la ligne directrice précédente de 2012. Le traitement de la co-infection par chlamydia devrait être envisagé, sauf si la co-infection a été exclue avec les tests NAAT. |
Autres traitements
Lorsque l'infection a été confirmée avant le traitement comme étant sensible à la Ciprofloxacine
Remarque : Le traitement de la co-infection par chlamydia devrait être envisagé, sauf si la co-infection a été exclue avec les tests de TAAN |
Autres traitements
Remarque : Si l'azithromycine n'est pas disponible ou si le patient est incapable de prendre un médicament par voie oral
Remarque : Lorsque l'infection a été confirmée avant le traitement comme étant sensible à la Ciprofloxacine |
|||||
Société Française de Dermatologie (SFD) et de pathologie sexuellement transmissible, 2016 |
Adultes (hommes et femmes) |
Pharmacothérapie : |
Non précisé En général :
Complications |
Ceftriaxone 500 mg IM Un traitement contre la chlamydiose doit être systématiquement associé. |
Ceftriaxone 500 mg IM Un traitement contre la chlamydiose doit être systématiquement associé. |
Non précisée |
Belgian Healthcare Knowledge Centre (KCE) |
Femmes et hommes, y compris les jeunes |
Pharmacothérapie : |
Non précisé En général :
|
Thérapie combinée
|
Thérapie combinée
|
Cette ligne directrice a été élaborée selon une approche fondée sur des preuves et en faisant intervenir un groupe d'élaboration de lignes directrices. Une analyse documentaire a été effectuée, y compris une recherche de lignes directrices existantes et de la littérature grise. La méthode ADAPTE a été utilisée pour évaluer la qualité des lignes directrices. Une exploration des revues systématiques et des études primaires concernant le traitement de la gonorrhée a été effectuée. Les données probantes ont été évaluées à l'aide de l'approche GRADE. |
Femmes enceintes |
Monothérapie |
Comme ci-dessus |
Monothérapie
|
Monothérapie
|
||
New Zealand Sexual Health Society (NZSHS, 2017) |
Adultes Remarque : Adultes et enfants dans les lignes directrices de 2014 |
Pharmacothérapie : |
Non précisé En général :
|
Ceftriaxone 500 mg plus Azithromycine 1 g PO |
Ceftriaxone 500 mg plus Azithromycine 1 g PO |
Se référer aux lignes directrices de 2014 dans lesquelles la NZSHS a réalisé une revue des lignes directrices internationales de prise en charge de la NG et des études menées en Nouvelle-Zélande. Consensus, après la discussion de groupe |
Remarque : S'il y a co-infection rectale à Chlamydia, traitement comme indiqué ci-dessus PLUS doxycycline 100 mg PO deux fois par jour pendant 7 jours. |
||||||
|
||||||
Lignes directrices existantes sur le traitement de la gonorrhée
| Groupe, province/territoire et année | Population | Intervention | Résultat(s) | Recommandations (infection anogénitale) |
Recommandations (infection pharyngée) |
Méthodes |
|---|---|---|---|---|---|---|
Alberta Health Services Alberta Treatment Guidelines for STI 2018 |
Adultes et adolescents |
Pharmacothérapie : |
Céfixime 800 mg Remarque : La ceftriaxone est recommandée pour gbHARSAH. |
Ceftriaxone 250 mg |
Adaptation des Lignes directrices canadiennes sur les infections transmissibles sexuellement. |
|
BCCDC British Columbia Treatment Guidelines for STI 2014 |
Adultes et adolescents |
Pharmacothérapie : |
Céfixime 800 mg ou Ceftriaxone 250 mg |
Comme pour les infections anogénitales |
Adaptation des Lignes directrices canadiennes sur les infections sexuellement transmissibles |
|
INESSS – Guide des ITSS sur la Chlamydia – Gonorrhoeae – |
Les personnes âgées de 14 ans ou plus |
Pharmacothérapie : |
Indiqué dans la revue de la littérature :
|
Ceftriaxone 250 mg |
Ceftriaxone 250 mg |
Revue systématique |
Santé publique Ontario Gonorrhea Testing and Treatment Guide 2018 |
Adultes |
Pharmacothérapie : |
Non précisé En général :
|
Ceftriaxone 250 mg |
Comme pour les infections anogénitales |
Recherche bibliographique et synthèse des données récentes sur le diagnostic en laboratoire et le traitement de la gonorrhée. Analyse des lignes directrices canadiennes sur le dépistage et le traitement de la gonorrhée et des lignes directrices provenant d'autres pays à revenu élevé. Analyse de la sensibilité aux antimicrobiens des isolats de N. gonorrhoeae en Ontario. Consultation d'experts avec les membres du Groupe de travail sur les mises à jour du Guide ontarien de dépistage et de traitement de la gonorrhée (en anglais seulement). |
Annexe 3 : Caractéristiques des études incluses
Revues systématiques et études primaires sur le traitement des infections gonococciques
| Référence (auteur, année) | Conception de l'étude | Population | Intervention/comparateur | Site d'infection | Résultats/constatations | Autres informations pertinentes |
|---|---|---|---|---|---|---|
Bai et coll. (2012) |
Revue systématique avec méta-analyse des ECR |
13 ECR regroupant 2557 participants; âge : de 16 à 60 ans |
5 études ont comparé la ceftriaxone avec la céfotaxime
4 études ont comparé la ceftriaxone avec le céfixime
4 études ont comparé la ceftriaxone avec la spectinomycine
|
Le site d'infection ou l'incidence de différents sites sur les taux de guérison n'est pas mentionné. |
Taux de guérison : défini comme une culture négative pour NG.
Analyse par sous-groupes – Taux de guérison
|
Taux d'effets secondaires :
|
Chico et coll. (2013) |
Revue systématique |
Personnes adultes non enceintes dans des cliniques d'ITS : 11 essais (9 essais avec 1 g et 2 essais avec 2 g d'azithromycine) |
Azithromycine en une seule dose |
Non précisé. |
Pour la période 1980 à 1999; dans 9 essais avec l'azithromycine 1 g : efficacité groupée : 97 % (IC à 95 % : 95,5 - 98,5), n = 539 Deux ECR ont étudié l'utilisation de 2 g d'azithromycine: |
|
Comunian-Carrasco et coll. (2018) |
Revue Cochrane des ECR évaluant l'efficacité et les effets indésirables des antibiotiques pour le traitement de NG pendant la grossesse |
Femmes enceintes de tout âge, à n'importe quel stade de la grossesse, recevant un diagnostic d'infection à NG 2 ECR ayant randomisé 514 femmes enceintes (347 femmes analysées); âge gestationnel moyen de 22 semaines; âge moyen de 19,8 ans; |
1) Ceftriaxone 250 mg IM comparée à l'amoxicilline 3 g PO plus probénécide 1 g PO 2) Ceftriaxone 125 mg IM comparée au céfixime 400 mg (Ramus, 2001) |
Génital, extragénital ou les deux 1) Endocol (97 %), rectum (27 %), pharynx (7 %). 77 participants (31 %) avaient des infections du rectum ou du pharynx. 2) Parmi 95 femmes, 86 (91 %) avaient une infection endocervicale à NG; 40 femmes avaient une infection gonococcique concomitante du rectum ou du pharynx à NG. 34 % avaient une infection extragénitale, principalement causée par une infection gonococcique anale concomitante. |
Efficacité clinique :
|
Effets indésirables :
Limites : les deux essais inclus étaient de petite taille, les femmes savaient quel traitement elles avaient reçu et le nombre d'abandons était élevé (28 % et 41 %). Le risque de biais était donc élevé. |
Creighton, Sarah et coll. (2014) |
Revue systématique |
7 études 1) RS : 24 200 personnes ou sites infectés, 2) RS : 2 ECR, 362 personnes, traitement de l'infection à NG pendant la grossesse |
1) Régimes antibiotiques à dose unique 2) Régimes antibiotiques à dose unique comparés entre eux |
Les sites d'infection, lorsqu'ils étaient spécifiés, comprenaient le col utérin, l'urètre, le rectum et le pharynx. |
Taux de guérison à tout site d'infection, y compris les taux de guérison microbiologique définis comme le nombre de personnes ayant une infection ou de sites infectés dont le résultat de la culture est négatif au moins 48 heures après le traitement, divisé par le nombre de personnes ayant une infection ou de sites infectés mis en culture 1 à 14 jours après le traitement. Effets indésirables Régimes antibiotiques à dose unique comparés entre eux chez les hommes et les femmes non enceintes
1er ECR : Taux d'échec jusqu'à 28 jours :
2e ECR : Taux d'échec 5 jours après le traitement
Taux de guérison (clinique et confirmé en laboratoire) 5 jours après le traitement
Effets des traitements pour les infections non compliquées chez les femmes enceintes 1er ECR : Échec de guérison au bout de 14 jours chez 267 femmes enceintes ayant des cultures positives pour NG
2e ECR :
Effets des traitements pour les infections non compliquées par site d'infections
Effets des traitements pour les infections à NG disséminées Effets du traitement combiné pour infection à NG et CT |
Les effets indésirables les plus importants sont les rares réactions d'hypersensibilité. Les effets indésirables mineurs sont les plus fréquents pour le régime de céfixime 800 mg et le régime d'azithromycine 2 g; les deux provoquent souvent des troubles gastro-intestinaux. Toutes les autres doses efficaces sont associées à une faible fréquence d'effets indésirables. Une vaste étude observationnelle de cohorte portant sur la « prise quotidienne » d'azithromycine, de céfixime, de ciprofloxacine et d'ofloxacine a révélé que peu d'effets indésirables graves avaient été observés. Une revue systématique des effets néfastes (date de recherche 2000) n'a révélé aucune pathologie du cartilage irréversible induite par la fluoroquinolone après 0,3 à 10,0 mois de suivi chez 201 adolescents traités pendant 7 à 270 jours. Un ECR sur les effets des traitements pour une infection à NG non compliquée chez les femmes enceintes a révélé des effets indésirables tels que :
|
Dowell et coll. (2012) |
Revue systématique avec méta-analyse |
367 hommes : 107 participants dans la série de cas à bras unique, 220 dans l'essai contrôlé et 40 dans l'ECR. |
Gentamicine en dose unique 240 mg IM (2 études), 280 mg IM (1 étude) |
Urétral |
Culture négative après administration de traitement en dose unique :
En limitant l'analyse aux patients traités uniquement avec 240 mg, l'efficacité était de :
Taux de guérison combiné (gentamicine 240 mg ou 289 mg IM) : 91,5 % (IC à 95 % de 88,1 % à 94,0 %) |
Il y a eu 6 études qui ne répondaient pas aux critères d'inclusion, mais qui incluaient des informations sur l'azithromycine :
|
Hathorn et coll. (2014) |
Revue systématique de 5 études dont 3 études étaient des essais randomisés, 1 était quasi randomisée et 1 n'était pas randomisée mais comprenait un groupe témoin |
5 études portant sur un total de 1063 hommes atteints d'urétrite gonococcique non compliquée. |
Gentamicine en dose unique IM 1) Gentamicine en dose unique 280 mg IM (n = 302); kanamycine en dose unique 2 g IM (n = 113) 2) Gentamicine en dose unique 240 mg IM (n = 30); 3) Gentamicine en dose unique 160 mg IM (n = 20); spectinomycine en dose unique 2 g IM (n = 20) 4) Gentamicine en dose unique 240 mg IM (n = 137); kanamycine en dose unique 2 g IM (n = 137) 5) Gentamicine en dose unique 240 mg IM (n = 40); |
Urétral |
Résultats variés : guérison microbiologique de l'infection à NG, besoin de traitements supplémentaires, effets indésirables, hospitalisation.
1) Frottis ou culture 2 semaines après le traitement : 2) Frottis au 7e jour : Gentamicine : 27/30 (90 %) Ajusté pour n'inclure que les personnes présentes au 7e jour : 52/56 (93 %) 3) Cultures réalisées les 3e, 7e, et 14e jours suivant le traitement : Gentamicine : 19/20 (95%), Spectinomycine : 16/20 (80%) 4) Coloration de Gram et test bactériologique : Gentamicine : 78/125 (62,4 %), Kanamycine : 86/126 (68,3 %) 5) Une évaluation des symptômes et des signes, une coloration de Gram d'un frottis urétral et une culture ont été obtenues de 8 à 10 jours après le traitement : Gentamicine : 38/40 (95 %) |
Le risque de biais élevé dans les études et l'hétérogénéité clinique entre les études ont rendu inappropriée le regroupement des données pour une méta-analyse. Bien que le taux de guérison, présenté sous forme de pourcentage, ait été rapporté dans chacune des études incluses, celles-ci différaient de manière significative dans la définition de la guérison (guérison clinique ou microscopie et/ou culture négative), le moment de la guérison et l'évaluation de la réinfection |
Hayward et coll. (2018) |
Revue systématique |
Adultes âgés de ≥ 18 ans. |
Dans les 3 études (2 ECR et 1 étude quasi-expérimentale) : 627/1069 participants ont reçu de la gentamicine |
Dans les études sur NG : Site urogénital |
Aucune analyse de l'efficacité de la gentamicine dans la revue systématique. |
Dans les trois études sur la gonorrhée : une seule étude (qui est un ECR) a rapporté des effets indésirables attribuables à la gentamicine en dose unique (Kirkcaldy et coll., 2014) :
Dans l'ensemble, la revue systématique conclut que :
|
Tanvir et coll. (2018) |
Revue systématique avec méta-analyse |
11 études (10 ECR et 1 étude non comparative) |
Dose unique par voie orale de céfixime 800 mg; |
Urétral, rectal et pharyngé |
Résultats principaux :
Résultats secondaires :
Taux de succès global du céfixime 800 mg en dose unique : 92-99 %
Taux de guérison par étude individuelle
|
Les auteurs ont conclu que, dans l'ensemble, les éléments de preuve ne suffisent pas à démontrer ou à réfuter les avantages du céfixime dans le traitement de l'infection gonococcique chez les adultes. |
Yang et coll. (2019) |
Revue systématique et méta-analyse en réseau |
10 204 patients adultes de 44 ECR, aucune limite d'âge incluse |
22 régimes de traitement : 12 antibiotiques administrés par injection et 11 antibiotiques administrés par voie orale. |
Rectal, urétral, endocervical et pharyngé |
Le score P a été utilisé pour classer les antibiotiques, et le RC a été produit dans toutes les comparaisons par paire.
|
Seules les études utilisant la monothérapie pour traiter la gonorrhée chez les adultes ont été incluses. |
Kong et coll. (2020) |
Revue systématique et méta-analyse des ECR Période de l'étude : 1er janvier 2000 au 17 septembre 2019 |
9 ECR comprenant 452 participants âgés de 15 ans ou plus. |
5 études ont évalué l'efficacité de la monothérapie, 3 ont évalué la bithérapie et une a comparé la monothérapie à la bithérapie. 19 régimes de traitement |
Pharyngé |
Le critère de jugement principal était l'efficacité du traitement au suivi, défini comme une guérison microbiologique basée sur une culture négative ou un TAAN. L'efficacité globale du traitement pour la gonorrhée pharyngée était de 98,1 % (IC à 95 % : 93,8 %-100 %; I2 = 57,3 %; P < 0,01). L'efficacité était similaire pour les monothérapies (97,1 %; IC à 95 % : 90,8 %-100,0 %; I2 = 15,6 %; P = 0,29) et les bithérapies (98,0 %; IC à 95 % : 91,4 %-100 %; I2 = 79,1 %; P < 0,01). Les régimes contenant de l'azithromycine 2 g ou de la ceftriaxone sont tout aussi efficaces. Les traitements (ceftriaxone avec ou sans azithromycine) ont une efficacité supérieure aux traitements émergents (gépotidacine, zoliflodacine, délafloxacine et solithromycine). |
Les auteurs ont fait état des limites suivantes :
Les effets secondaires des traitements rapportés sont les suivants :
|
Lo et coll. (2021) |
Revue systématique avec méta-analyse des ECR |
54 ECR comprenant 1813 participants. |
Efficacité du traitement selon 44 régimes de traitement |
Infection rectale à Neisseria gonorrhoea |
Efficacité du traitement, définie comme étant une guérison microbiologique, pour les thérapies actuellement recommandées (ceftriaxone ± azithromycine), les thérapies déjà disponibles ou utilisées (p. ex. ciprofloxacine) et les médicaments émergents (p. ex. zoliflodacine). L'efficacité sommaire globale du traitement contre les infections rectales à NG était de 100,0 % (IC à 95 % : 99,89 %-100,0 %; I2 = 0,00%; P = 0,86). Les estimations d'efficacité pour les monothérapies ou les bithérapies étaient similaires :
Ceftriaxone en monothérapie pour la dose de 250 mg, 100 % (IC à 95 % : 98,80 %-100,00 %, I2 = 0,00 %; P = 0,99) et pour la dose de 500 mg, 100,00 % (IC à 95 % : 68,23 %-100,00 %; I2 = 0,00 %; P = 0,96) Ceftriaxone en bithérapie L'efficacité sommaire des traitements émergents était de 97,16 % (IC à 95 % : 86,79 %-100,00 %; I2 = 0,00 %; P = 0,84) |
Médicaments utilisés actuels et précédents Les traitements actuellement utilisés contenant de la ceftriaxone, en monothérapie ou en bithérapie, sont efficaces contre les infections rectales à NG. Les traitements utilisés précédemment, comme la spectinomycine ou la ciprofloxacine, sont potentiellement efficaces contre les infections rectales à NG. Points forts et limites Les auteurs ont fait état des limites suivantes :
La RS avait également plusieurs limites :
Les effets secondaires des traitements déclarés sont les suivants : Les nausées étaient plus fréquentes avec les traitements émergents et les bithérapies incluant l'azithromycine 2 g. On a signalé des vomissements avec une estimation de 1,99 % (IC à 95 % : 1,17 %-3,00 %) et une hétérogénéité élevée entre les études ( I2 = 72,01 %, P < 0,01) Dans l'ensemble, 9,42 % (IC à 95 % : 5,59 %-14,08 %) ont signalé la diarrhée, avec une hétérogénéité élevée entre les études ( I2 = 95,22 %, P < 0,01). La diarrhée était plus fréquente avec les traitements émergents et les bithérapies incluant l'azithromycine 2 g |
| Auteur, année | Conception de l'étude | Population | Intervention/comparateur | Résultats/constatations |
|---|---|---|---|---|
Barbee et coll. (2020) É.-U. |
Essai clinique à bras unique, sans insu Période de l'étude : Septembre 2018 à mars 2019 Cadre : Clinique d'ITS |
HARSHAH ayant obtenu un résultat positif pour infection pharyngée à NG par TAAN (N=13) |
Intervention : Comparateur : |
Guérison microbiologique : Tolérance à la douleur causée par l'injection : Effets indésirables : Sécurité rénale (% de changement de créatinine entre le traitement et le test de contrôle) |
Han et coll. (2020) Chine |
Étude observationnelle rétrospective Période de l'étude : Cadre : hôpital |
Patients ayant une infection à NG non compliquée, recrutés par le réseau de surveillance (N = 1686)
|
Traitement avec céphalosporine 83,1 % (n = 1401) ont reçu de la ceftriaxone injectable
7,1 % (n = 119) ont reçu du céfixime par voie orale 8,9 % (n = 150) ont reçu d'autres céphalosporines à large spectre |
Prévalence des isolats
Guérison microbiologique et clinique
Aucun échec au traitement; les auteurs rapportent qu'une dose plus élevée de ceftriaxone a entraîné une diminution de l'échec au traitement. |
Aoki et coll. (2021) |
Étude prospective monocentrique Période de l'étude : Cadre : clinique de santé sexuelle |
HARSAH > 19 ans diagnostiqués comme ayant une infection extragénitale à NG |
Intervention
Remarque : La co-infection à Mycoplasma genitalium et à la syphilis, 100 mg de sitafloxacine par voie orale deux fois par jour pendant 7 jours et 1,5 g d'ampicilline par voie orale pendant 7 jours ont été prescrits avec la ceftriaxone, respectivement. |
La monothérapie par ceftriaxone à haute dose est aussi efficace que la thérapie combinée contre les infections extragénitales à NG chez les HARSAH. Des 320 cas diagnostiqués comme ayant une infection extragénitale à NG, 208 ont été traités par monothérapie et 112 ont été traités par bithérapie. Aucune différence significative dans l'efficacité correspondante n'a été observée entre les deux groupes (P = 0,29, P = 0,61, P = 0,34, respectivement). |
Nguyen et coll. (2022) Hai Phong, Vietnam |
Essai ouvert contrôlé randomisé/essai monocentrique contrôlé randomisé avec groupes parallèles Période de l'étude : Cadre : |
Patients âgés > 18 ans et avec gonorrhée et chlamydiose non traitées (aucun antibiotique pris au cours des 28 jours précédents pour traiter la gonorrhée et la chlamydia). Sites d'infection : Les échantillons ont été choisis en fonction du sexe et de l'orientation sexuelle du participant : échantillons urétraux d'hommes hétérosexuels; échantillons urétraux, pharyngés et rectaux d'hommes ayant des relations sexuelles avec des hommes; échantillons cervicaux, pharyngés et rectaux de femmes. |
Intervention : Comparateur : |
Critère de jugement principal : élimination de NG de tous les sites initialement infectés. Les deux régimes ont été très efficaces dans le traitement de la gonorrhée avec des taux de succès de 96,7 % (intervalle de confiance [IC] de 95 % 88,8-99,1 %) pour la ceftriaxone et de 95,3 % (IC de 95 % 87,1-98,4 %) pour le céfixime. Les profils d'innocuité des deux régimes étaient similaires. Les auteurs ont fait remarquer que le céfixime plus doxycycline peut être indiqué pour les patients qui ont une allergie à la ceftriaxone ou lorsque le traitement avec ceftriaxone n'est pas possible. |
Références
- Référence 1
-
Hook EW III et al: Gonococcal infections in adult. In: Holmes KK et al, eds: Sexually Transmitted Diseases. 4th ed. McGraw-Hill; 2008:627–645.
- Référence 2
-
Laga M, Manoka A, Kivuvu M, Malele B, Tuliza M, Nzila N, et al. Non-ulcerative sexually transmitted diseases as risk factors for HIV-1 transmission in women: results from a cohort study. AIDS 1993 Jan; 7(1):95-102.
- Référence 3
-
Johnson LF, Lewis DA. The effect of genital tract infections on HIV-1 shedding in the genital tract: a systematic review and meta-analysis. Sex Transm Dis 2008 Nov; 35(11):946-959.
- Référence 4
-
Fleming DT, Wasserheit JN. From epidemiological synergy to public health policy and practice: the contribution of other sexually transmitted diseases to sexual transmission of HIV infection. Sex Transm Infect. 1999;75(1):3-17. doi:10.1136/sti.75.1.3.
- Référence 5
-
Jarvis GA, Chang TL. Modulation of HIV transmission by Neisseria gonorrhoeae: molecular and immunological aspects. Curr HIV Res. 2012;10(3):211-217.
- Référence 6
-
Unemo M, Seifert HS, Hook EW 3rd, Hawkes S, Ndowa F, Dillon JR. Gonorrhoea. Nat Rev Dis Primers. 2019 Nov 21;5(1):79.
- Référence 7
-
Kirkcaldy RD, Weston E, Segurado AC, Hughes G. Epidemiology of gonorrhoea: a global perspective. Sex Health. 2019 Sep;16(5):401-411.
- Référence 8
-
Public Health Agency of Canada. Canadian guidelines on sexually transmitted infections. Revised version of the Canadian STI Guidelines: Gonococcal infections- Updated 2010. Ottawa, Canada: Her Majesty the Queen in Right of Canada, 2008. Catalogue number: HP40-1/2010E ISBN: 978-1-100-14956-1. Available at: https://publications.gc.ca/collections/collection_2011/aspc-phac/HP40-1-2010-eng.pdf/ Accessed 07/06, 2023.
- Référence 9
-
Public Health Agency of Canada. Canadian Guidelines on Sexually Transmitted Infections: Gonococcal Infections Chapter- revised 2013. Cat.: HP40-1/1-2013E-PDF ISBN: 978-1-100-24706-9. Available at: https://www.phac-aspc.gc.ca/std-mts/sti-its/cgsti-ldcits/assets/pdf/section-5-6-eng.pdf. Accessed 07/06, 2023.
- Référence 10
-
Public Health Agency of Canada. Canadian Guidelines on Sexually Transmitted Infections: Treatment of N. gonorrhoeae in response to the discontinuation of spectinomycin : alternative treatment guidance statement 2017. Cat.: HP40-1/2017-3E-PDF ISBN: 978-0-660-08486-2. Available at: https://publications.gc.ca/collections/collection_2018/aspc-phac/HP40-1-2017-3-eng.pdf. Accessed 07/06, 2023.
- Référence 11
-
Unemo M, Workowski K. Dual antimicrobial therapy for gonorrhoea: what is the role of azithromycin? Lancet Infect Dis. 2018;18(5):486-488. doi:10.1016/S1473-3099 (18) 30162-2
- Référence 12
-
Wi T, Lahra M, Ndowa F, et al. Antimicrobial resistance in Neisseria gonorrhoeae: Global surveillance and a call for international collaborative action. PLoS Med 2017; 14: e1002344.
- Référence 13
-
Fifer H, Natarajan U, Jones L, et al. Failure of dual antimicrobial therapy in treatment of gonorrhoea. N Engl J Med 2016; 374: 2504–06.
- Référence 14
-
St Cyr S, Barbee L, Workowski KA, et al. Update to CDC's Treatment Guidelines for Gonococcal Infection, 2020. MMWR Morb Mortal Wkly Rep. 2020;69(50):1911-1916.
- Référence 15
-
Doan T, Arzika AM, Hinterwirth A, Maliki R, Zhong L, Cummings S, Sarkar S, Chen C, Porco TC, Keenan JD, Lietman TM; MORDOR Study Group. Macrolide Resistance in MORDOR I - A Cluster-Randomized Trial in Niger. N Engl J Med. 2019 Jun 6;380(23):2271-2273.
- Référence 16
-
Doan T, Worden L, Hinterwirth A, et al. Macrolide and Nonmacrolide Resistance with Mass Azithromycin Distribution. N Engl J Med. 2020;383(20):1941-1950.
- Référence 17
-
Unemo M, Golparian D, Eyre DW. Antimicrobial Resistance in Neisseria gonorrhoeae and Treatment of Gonorrhea. Methods Mol Biol. 2019;1997:37-58. doi: 10.1007/978-1-4939-9496-0_3. PMID: 31119616.
- Référence 18
-
Public Health Agency of Canada. Pan-Canadian Action Plan on Antimicrobial Resistance. Catalogue Number: HP40-337/2023E -PDF ISBN/ISSN : 978-0-660-48616-1. 2023. Available at : https://www.canada.ca/content/dam/phac-aspc/documents/services/publications/drugs-health-products/pan-canadian-action-plan-antimicrobial-resistance/pan-canadian-action-plan-antimicrobial-resistance.pdf.
- Référence 19
-
Public Health Agency of Canada. Methods Manual for the Public Health Agency of Canada Sexually Transmitted and Blood-Borne Infections Recommendations. 2019 (updated in 2021): Internal PHAC document prepared by Shanmugasegaram, S (Unpublished).
- Référence 20
-
Public Health Agency of Canada. Interim and Rapid Advice Guideline- Methodology Section in the Methods Manual for the Public Health Agency of Canada Sexually Transmitted and Blood-Borne Infections Recommendations. 2019 (updated in 2023): Internal PHAC document prepared by Shanmugasegaram, S (Unpublished).
- Référence 21
-
Shanmugasegaram, S., & Gale-Rowe, M. (2020). Methodology for developing the Public Health Agency of Canada Sexually Transmitted and Blood-Borne Infections Guidelines [Abstract]. Cochrane Colloquium. Toronto, ON. October. Advances in Evidence Synthesis: Special Issue. Cochrane Database of Systematic Reviews, 9(Suppl. 1), 226. Available at: https://abstracts.cochrane.org/2020-abstracts/methodology-developing-public-health-agency-canada-sexually-transmitted-and-blood. Accessed February 29, 2024.
- Référence 22
-
Shanmugasegaram, S., Gadient, S., & Gale-Rowe, M. (2020). Translating evidence into practice with the National Advisory Committee on Sexually Transmitted and Blood-Borne Infections. Can Commun Dis Rep, 46(11/12), 398-402. Available at: https://doi.org/10.14745/ccdr.v46i1112a06. Accessed March 05, 2024.
- Référence 23
-
Public Health Agency of Canada. Monotherapy versus combination therapy in the treatment of uncomplicated gonococcal infections in adults and adolescents: a scoping exercise 2020): Internal PHAC document (Unpublished).
- Référence 24
-
Public Health Agency Of Canada. Report on Sexually Transmitted Infection Surveillance in Canada, 2019. 2021.Cat.: HP37-10E-PDF ISBN : 1923-2977 Pub. : 210348. Available at: https://www.canada.ca/content/dam/phac-aspc/documents/services/publications/diseases-conditions/report-sexually-transmitted-infection-surveillance-canada-2019/pub1-eng.pdf. Accessed 07/06, 2023.
- Référence 25
-
Sawatzky P, Lefebvre B, Diggle M, Hoang L, Wong J, Patel S, Van Caessele P, Minion J, Garceau R, Jeffrey S, Haldane D, Lourenco L, Gravel G, Mulvey M, Martin I. Antimicrobial susceptibilities of Neisseria gonorrhoeae in Canada, 2021. Can Commun Dis Rep 2023;49(9):388−97. https://doi.org/10.14745/ccdr.v49i09a05
- Référence 26
-
Thorington R, Sawatzky P, Lefebvre B, Diggle, M, Hoang, L, Samir P, et al. Antimicrobial susceptibilities of Neisseria gonorrhoeae in Canada, 2020. Canada Commun Dis Rep. 2022; 48 (11/12) : 571-9. doi:10.14745/ccdr.v48i1112a10.
- Référence 27
-
Lefebvre B, Labbé, A-C. Sommaire des résultats d'antibiorésistance des souches Neisseria gonorrhoeae au Québec en 2021 (inspq.qc.ca). 2023. Available at: https://www.inspq.qc.ca/sites/default/files/lspq/3290-antibioresistance-souches-neisseria-gonorrhoeae-2021.pdf. Accessed 07/07, 2023.
- Référence 28
-
Public Health Agency of Canada. Report on the Enhanced Surveillance of Antimicrobial-Resistant Gonorrhea (ESAG): Results from 2015 to 2017. 2021. https://www.canada.ca/content/dam/phac-aspc/documents/services/publications/diseases-conditions/2015-2017-report-enhanced-surveillance-antimicrobial-resistant-gonorrhea/esag-2015-2017-eng.pdf.
- Référence 29
-
Blouin K, Trudelle A, Defay F. Réseau sentinelle de surveillance de l'infection gonococcique, de l'antibiorésistance et des échecs de traitement au Québec : RÉSULTATS DU 1er SEPTEMBRE 2015 AU 31 DÉCEMBRE 2019. 2023. Available at : https://www.inspq.qc.ca/publications/3330. Accessed 07/07, 2023.
- Référence 30
-
INESSS. Uncomplicated Chlamydia trachomatis OR Neisseria gonorrhoeae Infection. 2020. Available at: https://www.inesss.qc.ca/fileadmin/doc/INESSS/Outils/Guides_ITSS/Guide_ITSS_ChlamydiaGonorrhoeae_EN_WEB_VF.pdf. Accessed 07/07, 2023.
- Référence 31
-
WHO. Guidelines for the Treatment of Chlamydia trachomatis. Geneva: World Health Organization; 2016.
- Référence 32
-
Singh AE, Gratrix J, Martin I, Friedman DS, Hoang L, Lester R, et al. Gonorrhea treatment failures with oral and injectable expanded spectrum cephalosporin monotherapy vs. dual therapy at 4 Canadian sexually transmitted infection clinics, 2010-2013. Sex Transm Dis. 2015;42(6):331-6.
- Référence 33
-
Kidd S, Workowski KA. Management of gonorrhea in adolescents and adults in the United States. Clin Infect Dis. 2015; 61 Suppl 8:S785-801.
- Référence 34
-
Furuya R, Nakayama H, Kanayama A, et al. In vitro synergistic effects of double combinations of beta-lactams and azithromycin against clinical isolates of Neisseria gonorrhoeae. J Infect Chemother. 2006;12(4):172-176.
- Référence 35
-
Sathia L, Ellis B, Phillip S, Winston A, Smith A. Pharyngeal gonorrhea – is dual therapy the way forward? Int J STD AIDS 2007;18:647 –648.
- Référence 36
-
Unemo M, Ross J, Serwin AB, Gomberg M, Cusini M, Jensen JS. 2020 European guideline for the diagnosis and treatment of gonorrhoea in adults [published online ahead of print, 2020 Oct 29]. Int J STD AIDS. 2020;956462420949126.
- Référence 37
-
Bignell C and Unemo M, European STI Guidelines Editorial Board. 2012 European guideline on the diagnosis and treatment of gonorrhoea in adults. Int J STD AIDS 2013; 24: 85–92.
- Référence 38
-
Horner PJ. Azithromycin antimicrobial resistance and genital Chlamydia trachomatis infection: duration of therapy may be the key to improving efficacy. Sex Transm Infect 2012; 88: 154–156.
- Référence 39
-
Unemo M, Ross J, Serwin AB, Gomberg M, Cusini M, Jensen JS. Background review for the '2020 European guideline for the diagnosis and treatment of gonorrhoea in adults'. Int J STD AIDS. 2021;32(2):108-126.
- Référence 40
-
Fifer H, Saunders J, Soni S, Sadiq ST, FitzGerald M. 2018 UK national guideline for the management of infection with Neisseria gonorrhoeae. Int J STD AIDS. 2020;31(1):4-15.
- Référence 41
-
Chisholm SA, Mouton JW, Lewis DA, et al. Cephalosporin MIC creep among gonococci: time for a pharmacodynamic rethink? J Antimicrob Chemother 2010; 65:2141-48.
- Référence 42
-
Yasuda M, Hatazaki K, Ito S, et al. Antimicrobial Susceptibility of Neisseria gonorrhoeae in Japan from 2000 to 2015. Sex Transm Dis. 2017;44(3):149-153.
- Référence 43
-
Aoki T, Mizushima D, Takano M, et al. Efficacy of 1 g Ceftriaxone Monotherapy Compared to Dual Therapy With Azithromycin or Doxycycline for Treating Extragenital Gonorrhea Among Men Who Have Sex With Men. Clin Infect Dis. 2021;73(8):1452-1458.
- Référence 44
-
Barbee LA. Preparing for an era of untreatable gonorrhea. Curr Opin Infect Dis. 2014;27(3):282-287.
- Référence 45
-
Bourne C, Chen M, Lahra M. Changes to Australian STI Management Guidelines for Primary Care guideline for treatment of pharyngeal gonorrhea. 2018. Available at: https://ashm.blob.core.windows.net/ashmpublic/Firstline%20change%20Ng%20Rx%20rationale%202019.pdf. Accessed 07/07, 2023.
- Référence 46
-
Kong FYS, Horner P, Unemo M, Hocking JS. Pharmacokinetic considerations regarding the treatment of bacterial sexually transmitted infections with azithromycin: a review. J Antimicrob Chemother. 2019;74(5):1157-1166.
- Référence 47
-
Bai ZG, Bao XJ, Cheng WD, Yang KH, Li YP. Efficacy and safety of ceftriaxone for uncomplicated gonorrhoea: a meta-analysis of randomized controlled trials. Int J STD AIDS. 2012;23(2):126-132.
- Référence 48
-
Chico RM, Hack BB, Newport MJ, Ngulube E, Chandramohan D. On the pathway to better birth outcomes? A systematic review of azithromycin and curable sexually transmitted infections. Expert Rev Anti Infect Ther. 2013;11(12):1303-1332.
- Référence 49
-
Comunián-Carrasco G, Peña-Martí GE, Martí-Carvajal AJ. Antibiotics for treating gonorrhoea in pregnancy. Cochrane Database Syst Rev. 2018;2(2):CD011167. Published 2018 Feb 21.
- Référence 50
-
Creighton S. Gonorrhoea. BMJ Clin Evid. 2014;2014:1604. Published 2014 Feb 21.
- Référence 51
-
Dowell D, Kirkcaldy RD. Effectiveness of gentamicin for gonorrhea treatment: systematic review and meta-analysis. Sex Transm Infect. 2012;88(8):589-594.
- Référence 52
-
Hathorn E, Dhasmana D, Duley L, Ross JD. The effectiveness of gentamicin in the treatment of Neisseria gonorrhoeae: a systematic review. Syst Rev. 2014;3:104. Published 2014 Sep 19. doi:10.1186/2046-4053-3-104.
- Référence 53
-
Hayward RS, Harding J, Molloy R, et al. Adverse effects of a single dose of gentamicin in adults: a systematic review. Br J Clin Pharmacol. 2018;84(2):223-238. doi:10.1111/bcp.13439.
- Référence 54
-
Tanvir SB, Qasim SSB, Shariq A, Najeeb S, Shah AH. Systematic review and meta-analysis on efficacy of cefixime for treating gonococcal infections. Int J Health Sci (Qassim). 2018;12(5):90-100.
- Référence 55
-
Yang J, Dhital S, Naderer T. Efficacy and Safety of Injectable and Oral Antibiotics in Treating Gonorrhea: A Systematic Review and Network Meta-Analysis. J Clin Med. 2019;8(12):2182.
- Référence 56
-
Kong, F. Y. S., Hatzis, C. L., Lau, A., Williamson, D. A., Chow, E. P. F., Fairley, C. K., & Hocking, J. S. (2020). Treatment efficacy for pharyngeal Neisseria gonorrhoeae: a systematic review and meta-analysis of randomized controlled trials. The Journal of antimicrobial chemotherapy, 75(11), 3109–3119.
- Référence 57
-
Lo, F. W. Y., Kong, F. Y. S., & Hocking, J. S. (2021). Treatment efficacy for rectal Neisseria gonorrhoeae: a systematic review and meta-analysis of randomized controlled trials. The Journal of antimicrobial chemotherapy, 76(12), 3111–3124. https://doi.org/10.1093/jac/dkab315.
- Référence 58
-
Barbee LA, Soge OO, Morgan J, et al. Gentamicin Alone Is Inadequate to Eradicate Neisseria Gonorrhoeae From the Pharynx. Clin Infect Dis. 2020; 71 (8) : 1877-1882.
- Référence 59
-
Han Y, Yin Y, Dai X, et al. Widespread Use of High-dose Ceftriaxone Therapy for Uncomplicated Gonorrhea Without Reported Ceftriaxone Treatment Failure: Results From 5 Years of Multicenter Surveillance Data in China [published correction appears in Clin Infect Dis. 2019 Nov 27;69(12):2239]. Clin Infect Dis. 2020;70(1):99-105.
- Référence 60
-
Nguyen PTT, Pham HV, Van DH, Pham LV, Nguyen HT, Nguyen HV. Randomized controlled trial of the relative efficacy of high-dose intravenous ceftriaxone and oral cefixime combined with doxycycline for the treatment of Chlamydia trachomatis and Neisseria gonorrhoeae co-infection. BMC Infect Dis. 2022;22(1):607.
- Référence 61
-
Handsfield HH, McCormack WM, Hook EW III, et al. A comparison of single-dose cefixime with ceftriaxone as treatment for uncomplicated gonorrhea. The Gonorrhea Treatment Study Group. N Engl J Med 1991;325:1337–41.
- Référence 62
-
Plourde PJ, Tyndall M, Agoki E, et al. Single-dose cefixime versus single-dose ceftriaxone in the treatment of antimicrobial-resistant Neisseria gonorrhoeae infection. J Infect Dis 1992;166:919–22.
- Référence 63
-
Portilla I, Lutz B, Montalvo M, Mogabgab WJ. Oral cefixime versus intramuscular ceftriaxone in patients with uncomplicated gonococcal infections. Sex Transm Dis 1992;19:94–98.
- Référence 64
-
Hook EW III, Golden MR, Taylor SN, et al. Efficacy and Safety of Single-Dose Oral Delafloxacin Compared With Intramuscular Ceftriaxone for Uncomplicated Gonorrhea Treatment: An Open-Label, Noninferiority, Phase 3, Multicenter, Randomized Study. Sex Transm Dis. 2019;46(5):279-286.
- Référence 65
-
Ramus RM, Sheffield JS, Mayfield JA, Wendel GD Jr. A randomized trial that compared oral cefixime and intramuscular ceftriaxone for the treatment of gonorrhea in pregnancy. Am J Obstet Gynecol. 2001;185(3):629-632.
- Référence 66
-
Rob F, Klubalová B, Nyčová E, Hercogová J, Unemo M. Gentamicin 240 mg plus azithromycin 2 g vs. ceftriaxone 500 mg plus azithromycin 2 g for treatment of rectal and pharyngeal gonorrhea: a randomized controlled trial. Clin Microbiol Infect. 2020;26(2):207-212.
- Référence 67
-
Chen MY, McNulty A, Avery A, et al. Solithromycin versus ceftriaxone plus azithromycin for the treatment of uncomplicated genital gonorrhoea (SOLITAIRE-U): a randomized phase 3 non-inferiority trial. Lancet Infect Dis. 2019;19(8):833-842.
- Référence 68
-
Ross JDC, Brittain C, Cole M, et al. Gentamicin compared with ceftriaxone for the treatment of gonorrhea (G-ToG): a randomized non-inferiority trial [published correction appears in Lancet. 2019 Jun 29;393(10191):2590] [published correction appears in Lancet. 2019 Jun 20;:] [published correction appears in Lancet. 2019 Oct 5;394(10205):1230]. Lancet. 2019;393(10190):2511-2520.
- Référence 69
-
Unemo M, Golparian D, Shafer WM. Challenges with gonorrhea in the era of multi-drug and extensively drug resistance - are we on the right track? Expert Rev Anti Infect Ther. 2014 Jun;12(6):653-6. doi: 10.1586/14787210.2014.906902. Epub 2014 Apr 4. PMID: 24702589; PMCID: PMC4520807.
- Référence 70
-
CDC. Antibiotic Resistance Threats in the United States, 2019. Atlanta, GA: U.S. Department of Health and Human Services, CDC; 2019. www.cdc.gov/DrugResistance/Biggest-Threats.htm.
- Référence 71
-
Unemo M, Lahra MM, Cole M, et al. World Health Organization Global Gonococcal Antimicrobial Surveillance Program (WHO GASP): review of new data and evidence to inform international collaborative actions and research efforts. Sex Health. 2019; 16(5): 412-425.
- Référence 72
-
Unemo M, Lahra MM, Escher M, et al. WHO global antimicrobial resistance surveillance for Neisseria gonorrhoeae 2017-18: a retrospective observational study. Lancet Microbe. 2021; 2: e627-36.
- Référence 73
-
Lefebvre B, Martin I, Demczuk W, Deshales L, Michaud S, Labbé A-C, et al. Ceftriaxone-resistant Neisseria gonorrhoeae, Canada, 2017. Emerg Infect Dis. 2018;24(2):381-383. https://doi.org/10.1016/B978-1-4377-2702-9.00128-8.
- Référence 74
-
Berenger BM, Demczuk W, Gratrix J, Pabbaraju K, Smyczek P, Martin I. Genetic characterization and enhanced surveillance of ceftriaxone-resistant Neisseria gonorrhoeae strain, Alberta, Canada, 2018. Emerg Infect Dis. 2019;25(9):1660-1667. doi:10.3201/eid2509.190407.
- Référence 75
-
Nakayama S, Shimuta K, Furubayashi K, Kawahata T, Unemo M. Strain with a Novel Mosaic penA Gene Isolated in Japan. N Engl J Med. 2016;60(7):4339-4341. doi:10.1128/AAC.00504-16.
- Référence 76
-
Lahra MM, Martin I, Demczuk W, Jennison AV, Lee K-I, Nakayama S-I, et al. Cooperative recognition of internationally disseminated ceftriaxone-resistant Neisseria gonorrhoeae strain. Emerg Infect Dis. 2018;24(4):735-740. doi:10.3201/eid2404.171873.
- Référence 77
-
Chen SC, Yuan LF, Zhu XY, van der Veen S, Yin YP. Sustained transmission of the ceftriaxone-resistant Neisseria gonorrhoeae FC428 clone in China. J Antimicrob Chemother. 2020;75(9):2499-2502. doi:10.1093/jac/dkaa196.
- Référence 78
-
Lin X, Chen W, Xie Q, Yu Y, Liao Y, Feng Z, et al. Dissemination and genome analysis of high-level ceftriaxone-resistant penA 60.001 Neisseria gonorrhoeae strains from the Guangdong Gonococcal antibiotics susceptibility Programme (GD-GASP), 2016–2019. Emerg Microbes Infect. 2022;11(1):344-350. doi:10.1080/22221751.2021.2011618.
- Référence 79
-
Terkelsen D, Tolstrup J, Johnsen CH, Lund O, Kiellberg Larsen H, Worning P, et al. Multidrug-resistant Neisseria gonorrhoeae infection with ceftriaxone resistance and intermediate resistance to azithromycin, Denmark, 2017. Eurosurveillance. 2017;22(42):1-4. doi:10.2807/1560-7917.ES.2017.22.42.17-00659.
- Référence 80
-
Golparian D, Rose L, Lynam A, Mohamed A, Bercot B, Ohnishi M, et al. Multidrug-resistant Neisseria gonorrhoeae isolate, belonging to the internationally spreading Japanese FC428 clone, with ceftriaxone resistance and intermediate resistance to azithromycin, Ireland, August 2018. Eurosurveillance. 2018;23(47):1-4. doi:10.2807/1560-7917.ES.2018.23.47.1800617.
- Référence 81
-
Eyre DW, Sanderson ND, Lord E, Regisford-Reimmer N, Chau K, Barker L, et al. Gonorrhoea treatment failure caused by a Neisseria gonorrhoeae strain with combined ceftriaxone and high-level azithromycin resistance, England, February 2018. Euro Surveill. 2018;23(27):pii=1800323. doi:10.2807/1560-7917.ES.2018.23.27.1800323 doi : 10.2807/1560-7917.ES.2018.23.27.1800323.
- Référence 82
-
World Health Organization. Global Action Plan to Control the Spread and Impact of Antimicrobial Resistance in Neisseria gonorrhoeae. Geneva, CH: WHO; 2012. https://apps.who.int/iris/handle/10665/44863.
- Référence 83
-
CLSI. Performance Standards for Antimicrobial Susceptibility Testing. 32nd ed. CLSI Supplement M100. Wayne, PA: Clinical and Laboratory Standards Institute; 2022.
- Référence 84
-
Lahra MM, Hogan TR, Shoushtari M, Armstrong BH. Australian Gonococcal Surveillance Programme Annual Report, 2020. Commun Dis Intell. 2021; 45. doi:10.33321/cdi.2021.45.24.
- Référence 85
-
The European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. Version 13.0, 2023. http://www.eucast.org.
- Référence 86
-
Alexandre S, Tomas K, Lybeck C, Martin I, Sawatzky P et al. The Enhanced Surveillance of Antimicrobial Resistant Gonorrhea (ESAG) in Canada. Sex Transm Infect 2019, 95(Suppl 1) https://sti.bmj.com/content/sextrans/95/Suppl_1/A300.2.full.pdf.
- Référence 87
-
Public Health Agency of Canada. Report on the Enhanced Surveillance of Antimicrobial resistant Gonorrhea: Results from the 2014 Pilot. Centre for Communicable Diseases and Infection Control, Infectious Disease Prevention and Control Branch, Public Health Agency of Canada; 2017. https://www.canada.ca/content/dam/phac-aspc/documents/services/publications/diseases-conditions/gonorrhea-alternate-treatment/gonorrhea-2014-pilot-surveillance-antimicrobial-resistant-eng.pdf.
- Référence 88
-
Ewers EC, Curtin JM, Ganesan A. Challenges in Managing Gonorrhea and New Advances in Prevention. Infect Dis Clin North Am. 2023;37(2):223-243.
- Référence 89
-
Sena AC, Bachmann L, Johnston C, et al. Optimising treatments for sexually transmitted infections: surveillance, pharmacokinetics and pharmacodynamics, therapeutic strategies, and molecular resistance prediction. Lancet Infect Dis 2020;20:e181-91.
- Référence 90
-
Jaffe HW, Schroeter AL, Reynods GH, et al. Pharmacokinetic determinants of penicillin cure of gonococcal urethritis. Antimicrob Agents Chemother 1979;15:587-91.
- Référence 91
-
Deguchi T, Yasuda M, Yokoi S, et al. Treatment of uncomplicated gonococcal urethritis by double-dosing of 200 mg cefixime at a 6-h interval. J Infect Chemother 2003;9:35-9.
- Référence 92
-
Connolly KL, Eakin AE, Gomez C et al. Pharmacokinetic data are predictive of in vivo efficacy for cefixime and ceftriaxone against susceptible and resistant Neisseria gonorrhoeae strains in the gonorrhea mouse model. Antimicrob Agents Chemother 2019;63:e01644-18.
- Référence 93
-
Barbee LA, Nayak SU, Blumer JL, et al. A Phase 1 Pharmacokinetic and Safety Study of Extended-Duration, High-dose Cefixime for Cephalosporin-resistant Neisseria gonorrhoeae in the Pharynx. Sex Transm Dis. 2018;45(10):677-683.
- Référence 94
-
Jespers V, Stordeur S, Desomer A, Carville S, Jones C, Lewis S, et al. Diagnosis and management of gonorrhoea and syphilis. Good Clinical Practice (GCP) Brussels: Belgian Health Care Knowledge Centre (KCE). 2019. KCE Reports 310. D/2019/10.273/21.-https://www.kce.fgov.be/sites/default/files/2021-11/KCE_310_Diagnosis_management_Gonorrhoea_and_Syphilis_Report_1.pdf.
- Référence 95
-
Crowe G, Theodore C, Forster GE, Goh BT. Acceptability and compliance with daily injections of procaine penicillin in the outpatient treatment of syphilis-treponemal infection. Sex Transm Dis. 1997 Mar;24(3):127-30.
- Référence 96
-
Chauhan M, Serisha B, Sankar KN, Pattman RS, Schmid ML. Audit of the use of benzathine penicillin, post-treatment syphilis serology and partner notification of patients with early infectious syphilis. Int J STD AIDS. 2006 Mar;17(3):200-2.
- Référence 97
-
Ong JJ, Aguirre I, Unemo M, Kong FYS, Fairley CK, Hocking JS, Chow EPF, Tieosapjaroen W, Ly J, Chen MY. Comparison of gastrointestinal side effects from different doses of azithromycin for the treatment of gonorrhoea. J Antimicrob Chemother. 2022 June 29;77(7):2011-2016.
- Référence 98
-
Handsfield HH, Dalu ZA, Martin DH, Douglas JM Jr, McCarty JM, Schlossberg D. Multicenter trial of single-dose azithromycin vs. ceftriaxone in the treatment of uncomplicated gonorrhea. Azithromycin Gonorrhea Study Group. Sex Transm Dis. 1994;21(2):107-111.
- Référence 99
-
Xiridou M, Lugnér A, de Vries HJ, et al. Cost-Effectiveness of Dual Antimicrobial Therapy for Gonococcal Infections Among Men Who Have Sex With Men in the Netherlands. Sex Transm Dis. 2016;43(9):542-548.
- Référence 100
-
Hottes TS, Lester RT, Hoang LM, et al. Cephalosporin and azithromycin susceptibility in Neisseria gonorrhoeae isolates by site of infection, British Columbia, 2006 to 2011. Sex Transm Dis. 2013;40(1):46-51.
- Référence 101
-
Ng LK, Martin IE. The laboratory diagnosis of Neisseria gonorrhoeae. Can J Infect Dis Med Microbiol. 2005;16(1):15-25.
- Référence 102
-
Ison C LD. Gonorrhea. In: Morse S, Ballard R, Holmes K, Moreland A, ed. Atlas of sexually transmitted diseases and AIDS. 4th ed ed. Netherlands: Elsevier; 2010:24-39.
- Référence 103
-
De P, Singh AE, Wong T, Kaida A. Predictors of gonorrhea reinfection in a cohort of sexually transmitted disease patients in Alberta, Canada, 1991-2003. Sex Transm Dis. 2007;34(1):30-36.
Notes de bas de page
- Notes de bas de page a
-
Les infections gonococciques oculaires n'ont pas été abordées dans ces lignes directrices intérimaires. Consultez les lignes directrices existantes sur les recommandations de traitement.
- Note de bas de page b
-
On considère que les souches ont une sensibilité réduite à la ceftriaxone (0,125-0,25 mg/l) ou au céfixime (0,25 mg/l) si elles sont encore sensibles, mais la CMI est proche du point de rupture.
- Note de bas de page c
-
Au Canada, en 2021, 98,5 % des souches analysées dans un laboratoire de référence (n = 3 054) avaient une CMI inférieure à 0,25 mg/l.