Chapitre 11-15 - Guide canadien sur la biosécurité, Deuxième édition
À partir du 1er avril 2023, la Norme canadienne sur la biosécurité, Deuxième édition (NCB2), auquel ce document fait référence, est désuète. Le Guide canadien sur la biosécurité est en cours de mise à jour afin de refléter la Norme canadienne sur la biosécurité, Troisième édition (NCB3). Nous communiquerons la publication de cette mise à jour dans le bulletin de Nouvelles sur la biosécurité et la biosûreté des agents pathogènes et des toxines.
[Page précédente] [Table des matières] [Page suivante]
Chapitre 11 - Enceintes de sécurité biologique
Lorsqu'elles sont bien entretenues et utilisées avec de bonnes pratiques microbiologiques, les enceintes de sécurité biologique (ESB) assurent un confinement primaire efficace, adapté à la manipulation des matières infectieuses ou des toxines. Les ESB de différentes catégories et de différents types fonctionnent toutes selon les mêmes grands principes. La protection du personnel est assurée par un courant continu d'air dirigé vers l'intérieur, appelé courant d'air entrant, qui contribue à empêcher les aérosols de s'échapper par l'ouverture frontale. L'air évacué, dans la zone de confinement environnante ou directement à l'extérieur du bâtiment, passe par un filtre à haute efficacité pour les particules de l'air (HEPA) afin de protéger l'environnement. Certaines catégories d'ESB assurent également la protection du produit manipulé grâce à un courant d'air descendant traité par un filtre HEPA qui expulse les contaminants en suspension dans l'air à l'intérieur de l'enceinte et qui empêche l'air entrant non filtré de s'introduire dans l'espace de travail. Le présent chapitre fournit une description générale des différents types et classes d'ESB. Les divers fabricants peuvent doter leurs ESB de caractéristiques de conception et de technologies de pointe uniques. Les exigences physiques en matière de confinement, les exigences opérationnelles, ainsi que les exigences relatives aux essais de vérification et de performance, relatives aux ESB situées dans les zones de confinement réglementées par l'Agence de la santé publique du Canada (ASPC) et l'Agence canadienne d'inspection des aliments (ACIA) sont énoncées dans les matrices 3.7, 4.6 et 5.1 de la Norme canadienne sur la biosécurité (NCB), 2e éditionNote de bas de page 1.
11.1 Catégories et descriptions
11.1.1 Catégorie I
Les ESB de catégorie I assurent la protection du personnel et de l'environnement, mais ne protègent pas le produit (figures 11-1a et 11-1b). Ce type d'enceinte est souvent utilisé pour loger des appareils (p. ex. fermenteurs, homogénéisateurs) ou pour effectuer des manipulations lors desquelles la protection du produit n'est pas un problème (p. ex. changement de cage). L'air ambiant est aspiré dans l'enceinte par l'ouverture frontale, passe directement au-dessus du plan de travail, puis est évacué de l'ESB en passant à travers un filtre HEPA. Les ESB de catégorie I reliées au système de chauffage, ventilation et air climatisé (CVAC) par des jonctions rigides étanches peuvent évacuer l'air directement à l'extérieur du bâtiment, ou recycler l'air extrait à l'intérieur de la zone de confinement. Comme l'air n'est jamais recyclé à l'intérieur de l'ESB, il est possible de travailler en toute sécurité avec des quantités infimes de produits chimiques volatiles toxiques si l'ESB est munie de jonctions rigides étanches. Les ESB de catégorie I sont adaptées à la manipulation des matières biologiques du groupe de risque 1 (GR1), du groupe de risque 2 (GR2) et du groupe de risque 3 (GR3). Dans les ESB utilisées comme stations pour le changement de cage ventilées, il peut être nécessaire de remplacer le filtre plus souvent en raison de son encrassement.
11.1.2 Catégorie II
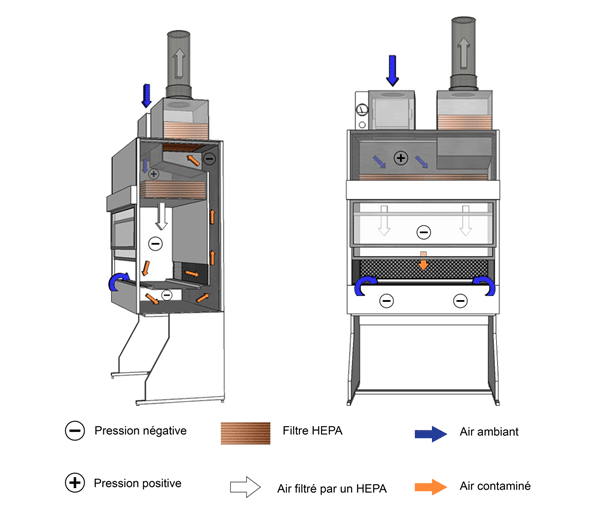
Les ESB de catégorie II assurent la protection du personnel et de l'environnement; cependant, à la différence des ESB de catégorie I, elles assurent également la protection du produit. Il existe quatre types d'ESB de catégorie II (A1, A2, B1 et B2), qui se différencient principalement par le ratio entre l'air évacué de l'ESB et l'air recyclé dans l'ESB, ainsi que par leur système d'évacuation. Certains types d'ESB peuvent recycler l'air à l'intérieur de la zone de confinement, tandis que d'autres peuvent l'évacuer directement à l'extérieur du bâtiment par des conduits réservés à cet usage. Il existe des modèles nouveaux qui peuvent être configurés soit comme une ESB de type A ou de type B pendant l'installation. Les ESB de catégorie II et de type A sont les ESB les plus utilisées dans les laboratoires de microbiologie. Les matières biologiques du GR1, du GR2 et du GR3 peuvent être manipulées en toute sécurité dans une ESB de catégorie II. Les matières biologiques du groupe de risque 4 (GR4) peuvent être manipulées dans une ESB de catégorie II, à condition que l'employé porte une combinaison à pression positive. Le tableau 11-1 résume les distinctions techniques entre les différentes enceintes de catégorie II.
11.1.2.1 Type A1
Dans ce type d'ESB, l'air ambiant et une partie de l'air recyclé issu de l'enceinte sont aspirés par la grille avant, puis traversent un filtre HEPA avant d'être dirigés vers le bas et de passer au-dessus du plan de travail (figure 11-2). À une hauteur d'environ 6 à 18 cm au-dessus du plan de travail, le courant d'air contaminé se divise en deux parties presque égales, l'une passant à travers la grille avant, et l'autre, à travers la grille arrière pour s'accumuler ensuite dans un plénum contaminé. Le plénum contaminé est soit maintenu en dépression, ou peut être maintenu en surpression et entouré de plénums ou conduits en dépression (la figure 11-2 illustre un modèle avec un plénum contaminé en surpression). À partir de ce plénum contaminé, environ 30 % de l'air passe à travers un filtre HEPA avant d'être évacué à l'extérieur de l'enceinte. La fraction restante de 70 % est recyclée et passe à travers un filtre HEPA avant d'être à nouveau dirigée vers le plan de travail. Dans les ESB de type A1, l'air peut être évacué dans la zone de confinement ou directement à l'extérieur du bâtiment par un raccord à bague. Les ESB de type A1 ne sont jamais munies de jonctions rigides étanches. Dans ce type d'enceinte, on ne peut effectuer absolument aucun travail avec des substances chimiques volatiles toxiques ou des radionucléides, car l'air recyclé peut engendrer une accumulation dangereuse de substances toxiques à l'intérieur de l'ESB ou de la zone de confinement.
11.1.2.2 Type A2
Les enceintes de type A2 sont pratiquement identiques à celles de type A1; cependant, la vitesse d'aspiration de l'air y est plus grande, et ces enceintes sont toujours dotées soit de plénums contaminés en dépression, soit de conduits ou de plénums contaminés en surpression entourés de conduits et de plénums en dépression (figure 11-3). Grâce à cet élément de conception, si une fuite se produisait dans les conduits ou les plénums en surpression, l'air contaminé serait aspiré vers l'intérieur plutôt que d'être évacué dans la zone de confinement. Ce type d'ESB est adapté au travail avec des quantités infimes de substances chimiques volatiles toxiques et de radionucléides, si l'évacuation se fait par un raccord à bague.
11.1.2.3 Type B1
Dans ce type d'ESB, l'air ambiant et une partie de l'air recyclé issu de l'ESB sont aspirés par la grille avant, puis traversent un filtre HEPA situé sous le plan de travail (figure 11-4). L'air est ensuite dirigé vers le haut, à travers les plénums latéraux et un deuxième filtre HEPA, puis est dirigé vers le bas pour passer au-dessus du plan de travail. Directement au-dessus du plan de travail et à mi-chemin entre les grilles avant et arrière, le courant d'air se divise en deux parties et plus de 50 % de ce courant d'air contaminé passe à travers la grille arrière et un filtre HEPA avant d'être évacué directement à l'extérieur du bâtiment. La fraction restante (moins de 50 %) de l'air contaminé passe à travers la grille avant et se mélange au courant d'air entrant avant de traverser le filtre HEPA situé sous le plan de travail. Les ESB de type B1 sont munies de jonctions rigides étanches. Il est possible de travailler avec de faibles quantités de substances chimiques volatiles toxiques et avec d'infimes quantités de radionucléides dans la partie arrière du plan de travail, à l'endroit où l'air est évacué directement à l'extérieur du bâtiment.
11.1.2.4 Type B2
Dans ce type d'ESB, l'air ambiant est aspiré par le ventilateur d'approvisionnement dans la partie supérieure de l'enceinte, traverse un filtre HEPA, puis est dirigé vers le bas et passe au-dessus du plan de travail (figure 11-5). Le système d'évacuation du bâtiment aspire l'air, qui passe à travers les grilles avant et arrière jusqu'à un plénum contaminé, puis traverse un filtre HEPA avant d'être évacué de l'enceinte directement à l'extérieur du bâtiment. Les ESB de type B2 sont munies de jonctions rigides étanches. Il est possible de travailler avec des substances chimiques volatiles toxiques et des radionucléides dans ce type d'enceinte, puisque l'air n'est jamais recyclé ni dans l'enceinte, ni dans la zone de confinement. Un refoulement d'air à partir de l'avant de l'ESB, aussi appelé retour d'air, peut se produire dans les ESB de catégorie II de type B2, notamment à la suite d'une défaillance du système de CVAC, d'une interruption de l'alimentation électrique ou d'une panne du ventilateur d'évacuation de l'ESB. Tous les efforts doivent être déployés pour régler mécaniquement les problèmes de retour d'air (matrice 3.7 de la NCB). Lorsqu'un retour d'air survient dans une zone de confinement élevé, le laboratoire est considéré comme contaminé, et une décontamination complète de toute la pièce pourrait être nécessaire. La quantité d'air requise pour faire fonctionner ce type d'ESB est un élément à prendre en considération, car d'autres ajustements de la quantité d'air pourraient être nécessaires pour équilibrer les échanges d'air dans la zone de confinement.
| Type A1 | Type A2 | Type B1 | Type B2 | |
|---|---|---|---|---|
| Vitesse moyenne minimale d'aspiration de l'air entrant à travers l'ouverture frontale | 0,38 m/s [75 pi/min] |
0,51 m/s [100 pi/min] |
0,51 m/s [100 pi/min] |
0,51 m/s [100 pi/min] |
| Recyclage de l'air | 30 % de l'air est évacué hors de l'ESB et 70 % de l'air est recyclé à l'intérieur de l'ESB | 30 % de l'air est évacué hors de l'ESB et 70 % de l'air est recyclé à l'intérieur de l'ESB | > 50 % de l'air est évacué hors de l'ESB et < 50 % de l'air est recyclé à l'intérieur de l'ESB | 100 % de l'air est évacué hors de l'ESB |
| Courant d'air descendant après filtration HEPA | Mélange du courant d'air descendant et du courant d'air entrant d'un plénum commun | Mélange du courant d'air descendant et du courant d'air entrant d'un plénum commun | Courant d'air entrant | Aspiré à partir de la zone de confinement ou de l'extérieur du bâtiment |
| Évacuation de l'air après filtration HEPA | Recyclé dans la zone de confinement ou évacué directement à l'extérieur du bâtiment | Recyclé dans la zone de confinement ou évacué directement à l'extérieur du bâtiment | Évacué à l'extérieur du bâtiment par des plénums réservés à cet usage | Évacué à l'extérieur du bâtiment par des plénums réservés à cet usage |
| Type d'évacuation | Raccord à bague dans certains cas | Raccord à bague dans certains cas | À jonctions rigides étanches | À jonctions rigides étanches |
| Conduits et plénums contaminés | En dépression ou entourés de conduits ou de plénums en dépression; plénums en surpression dans certains modèles | En dépression ou entourés de conduits ou de plénums en dépression | En dépression ou entourés de conduits ou de plénums en dépression | En dépression ou entourés de conduits ou de plénums en dépression |
| Travail avec des substances chimiques volatiles toxiques et des radionucléides | Non | Quantités infimes si l'évacuation se fait par un raccord à bague | Faibles quantités de substances chimiques volatiles toxiques et infimes quantités de radionucléides | Oui |
11.1.3 Catégorie III
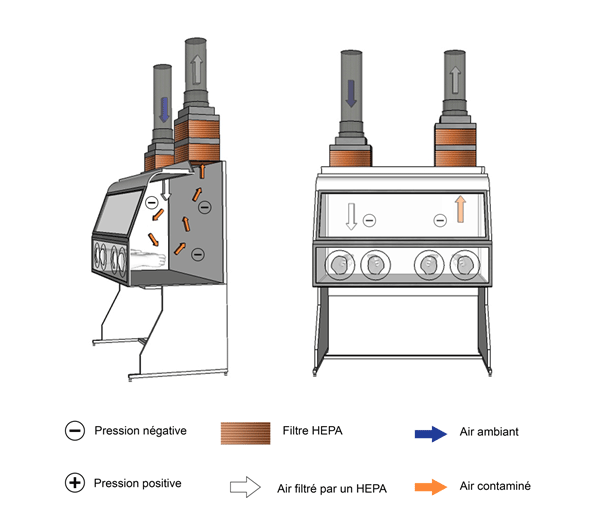
Les ESB de catégorie III assurent une protection du produit ainsi qu'une protection maximale du personnel et de l'environnement (figure 11-6). Elles sont conçues pour la manipulation d'agents pathogènes du GR4 et constituent une solution de rechange au port d'une combinaison à pression positive si les matières infectieuses sont exclusivement manipulées à l'intérieur de l'ESB de catégorie III. Ce type d'ESB est complètement étanche : toutes les pénétrations sont étanches à l'air et l'ESB est maintenue en dépression (à 200 Pa ou moins ou selon les directives du fabricant) par un système d'évacuation réservé à cet usage. Les manipulations s'effectuent au moyen de longs gants très résistants, fixés au panneau de l'enceinte, qui préviennent le contact direct avec les matières biologiques. Un courant d'air vers l'intérieur (CAVI) de 0,7 m/s devrait être maintenu lorsqu'un gant est retiré. L'air d'une ESB de catégorie III est directement évacué à l'extérieur du bâtiment après être passé à travers deux filtres HEPA consécutifs, ou passé à travers un seul filtre HEPA et ensuite incinéré. L'introduction ou le retrait du matériel peut se faire de diverses façons, notamment par le passage dans une cuve d'immersion, un autoclave à deux portes, un passe-plat décontaminé après chaque utilisation, ou encore un système de caissons de filtration de type « bag-in/bag-out ». Un mécanisme d'interverrouillage est utilisé pour empêcher l'ouverture simultanée des portes de l'autoclave ou du passe-plat (matrice 3.2 de la NCB). Il est possible de relier plusieurs ESB de catégorie III en série pour obtenir une aire de travail plus spacieuse.
11.2 Installation des ESB
En plaçant les ESB loin des zones où les mouvements qui affectent la circulation de l'air (p. ex. grilles d'admission et d'évacuation de l'air ambiant, portes, fenêtres ouvertes, zones de circulation dense, gros appareils qui produisent de la chaleur), on protège le fragile rideau d'air à l'entrée de l'enceinte (matrice 3.7 de la NCB). Les éléments suivants doivent être pris en considération lorsqu'on installe une ESB :
- L'utilisation de filtres HEPA munis de caissons de filtration de type « bag-in/bag-out » (ou un autre moyen permettant de retirer les filtres en toute sécurité) devrait être envisagée dans les situations où une décontamination efficace in situ n'est pas pratique ou est impossible. Cette façon de faire permet de décontaminer et d'éliminer ultérieurement les filtres hors des lieux (matrice 4.6 de la NCB).
- Un dégagement suffisant entre la bouche d'évacuation dans la partie supérieure de l'ESB et tout obstacle au-dessus de l'enceinte devrait être prévu.
- Un dégagement suffisant de chaque côté de l'ESB afin d'en faciliter l'accès devrait être prévu (figure 11-7).
- Les ESB ne devraient pas être installées directement vis-à-vis de postes de travail occupés par des personnes assises, d'autres ESB ou de hottes chimiques où l'on manipule des produits chimiques. Les ESB devraient être placées à une distance raisonnablement sûre, déterminée au moyen d'une évaluation locale des risques (ELR), pour que les collisions entre les utilisateurs soient évitées.
- Le raccord à bague devrait être amovible ou être conçu pour permettre la certification de l'ESB (p. ex. volet de confinement permettant de fermer hermétiquement l'enceinte pendant la décontamination, orifice d'accès pour permettre l'essai par balayage du filtre HEPA).
- Dans les ESB munies de jonctions rigides étanches, les ventilateurs d'évacuation devraient être installés à l'extrémité distale des conduits. Les pannes du système d'évacuation de l'air devraient être signalées aux utilisateurs par des avertisseurs, et activer un système d'interverrouillage qui empêche le ventilateur de l'enceinte de fonctionner dès que l'évacuation de l'air est insuffisante (p. ex. commande de débit, commande électrique) afin de prévenir la pressurisation de l'enceinte. Une protection antirefoulement dans les conduits (p. ex. volet) pourrait être nécessaire pour prévenir l'inversion du courant d'air dans le filtre HEPA.
- Le fait de brancher les ESB à un système d'alimentation de secours contribuera à assurer le maintien du confinement durant les situations d'urgence.
11.3 Essais et certification
Les éléments nécessaires aux essais et à la certification des ESB sont énoncés à la matrice 5.1 de la NCB. La mise à l'essai des ESB lors de l'installation initiale, puis à chaque année et après une réparation, une modification ou un déplacement permet de démontrer qu'elles fonctionnent comme prévu. Ces activités peuvent altérer l'intégrité des filtres HEPA et des plénums, ce qui pourrait entraîner la libération de matières infectieuses et de toxines. La plupart des types d'ESB sont mis à l'essai conformément à la norme National Sanitation Foundation (NSF)/ American National Standards Institute (ANSI) 49; toutefois, pour certains types d'ESB (p. ex. toutes ESB de catégorie I, ESB de catégorie III et ESB personnalisées), cette norme ne s'applique pas et les ESB sont mises à l'essai conformément aux directives du fabricantNote de bas de page 2. Voici un résumé des autres éléments dont il faudrait tenir compte lors des essais et de la certification des ESB :
- Les essais sur place devraient être effectués par des personnes expérimentées et qualifiées et au moyen d'un équipement de vérification pour lequel un certificat de calibration valide a été émis. Dans le cadre de son programme d'agrément, la NSF fournit une liste de personnes dont la compétence a été établie au moyen d'examens écrits et pratiques.
- Les mécanismes d'interverrouillage (c.-à-d. le ventilateur d'approvisionnement interne et le ventilateur d'évacuation des ESB de catégorie II de type B2) devraient être soumis à des essais conformément à la norme NSF/ANSI 49, essais qui confirment que le ventilateur d'approvisionnement interne s'arrête lorsque les paramètres d'évacuation d'air se trouvent hors des valeurs établies.
- Il faudrait vérifier les avertisseurs déclenchés après une panne de l'ESB ou du ventilateur d'évacuation en simulant des conditions de défaillance.
- Une étiquette devrait être apposée sur la paroi extérieure de l'enceinte indiquant la date de la certification, la date à laquelle l'enceinte doit être certifiée de nouveau, les normes ou spécifications appliquées lors des essais et le nom du technicien vérificateur.
- En cas de défaillance du ventilateur d'évacuation des ESB de catégorie II de type B2, le temps écoulé entre le moment de la détection jusqu'au moment du refoulement d'air à partir de l'avant de l'ESB (c.-à-d. retour d'air), s'il y a lieu, devrait être connu. S'ils n'ont pas été réalisés au moment de l'installation, l'essai et l'ajustement de l'avertisseur devraient se faire pour que l'utilisateur soit avisé le plus rapidement possible d'une défaillance pour qu'il dispose d'un maximum de temps avant le retour d'air.
- Les essais de perte de pression des ESB de catégorie III sont effectués au moment de l'installation initiale et lorsque des modifications sont apportées à l'enceinte, selon les directives du fabricant. Lorsqu'aucune modification n'a été apportée, on effectue un essai annuel de vérification de l'intégrité ainsi que tout autre essai recommandé par le fabricant. Un exemple d'essai de vérification de l'intégrité pourrait consister à soumettre l'ESB de catégorie III en mode de fonctionnement normal à un essai réalisé avec de la fumée diffusée à l'extérieur de l'enceinte. Si aucune fumée n'est aspirée à l'intérieur de l'enceinte à travers les joints, c'est que l'intégrité de l'ESB de catégorie III est acceptable.
Lorsqu'un boîtier personnalisé ou la conception de l'ESB ne la permet pas d'être certifiée conformément à la norme NSF/ANSI 49, il faut vérifier qu'elle satisfait bien aux spécifications du fabricant et qu'elle respecte les valeurs paramétriques minimales énoncées à la matrice 5.1 de la NCB.
11.4 Utilisation appropriée
Il est fortement recommandé d'intégrer les éléments suivants aux procédures opératoires normalisées (PON) destinées au personnel de l'installation afin d'encourager l'utilisation adéquate et méthodique d'une ESB par le personnel en vue de prévenir l'exposition aux agents pathogènes et aux toxines ainsi que leur libération.
11.4.1 Mise en marche
- Vérifier que le panneau d'observation à guillotine est à la bonne hauteur. Régler la hauteur du tabouret de façon que les aisselles de l'utilisateur soient au même niveau que le bas du panneau.
- Vérifier que les valeurs indiquées par les manomètres se situent dans l'intervalle acceptable.
- Le cas échéant, vérifier que l'avertisseur du dispositif de surveillance du courant d'air est sous tension.
- Confirmer que l'air est aspiré vers l'intérieur de l'enceinte en tenant un mouchoir en papier au milieu de l'ESB et près du bord du panneau d'observation pour vérifier que le mouchoir est aspiré.
- Désinfecter les surfaces intérieures à l'aide d'un désinfectant efficace contre les matières infectieuses et les toxines utilisées dans le laboratoire, en s'assurant que le temps de contact est suffisant. Si un désinfectant corrosif doit être utilisé, il faut rincer la surface avec de l'eau après la désinfection.
- Rassembler tout le matériel nécessaire aux manipulations et l'installer dans l'ESB. Veiller à ne pas encombrer le plan de travail ni obstruer les grilles avant ou arrière pour ne pas entraver la circulation normale de l'air.
- Si le risque de projection ou d'éclaboussures durant les manipulations de matières infectieuses ou de toxines est important, le plan de travail devrait être recouvert d'un matelas absorbant à endos plastifié.
- Placer les appareils producteurs d'aérosols (p. ex. agitateur de type vortex, sonicateur) au fond de l'ESB, en prenant garde de ne pas obstruer la grille arrière.
- Après avoir installé le matériel dans l'ESB, il faut laisser s'écouler un laps de temps suffisant pour purger l'air et pour que le courant d'air se stabilise avant de commencer à travailler. Ce laps de temps sera indiqué dans les instructions du fabricant; il est généralement de trois à cinq minutes.
11.4.2 Travail dans l'ESB
- Effectuer les manipulations le plus à l'arrière possible du plan de travail. Veiller à ce que les coudes et les bras ne touchent pas la grille ni le plan de travail.
- Éviter les mouvements brusques des mains et des bras à travers l'ouverture frontale. De tels mouvements perturbent le rideau d'air à l'avant de l'ESB, ce qui peut permettre à des contaminants de s'introduire dans l'enceinte ou d'en sortir. On doit glisser lentement les bras vers l'intérieur ou l'extérieur de l'enceinte, perpendiculairement à l'ouverture frontale.
- Conserver un flacon de produit désinfectant approprié à l'intérieur de l'ESB pendant le travail pour éviter d'avoir à sortir les mains de l'ESB.
- Séparer les articles non contaminés (« propres ») des articles contaminés (« sales »). Toujours travailler des régions « propres » vers les régions « sales » (figure 11-8).
- Le matériel devrait être jeté dans un contenant de déchets placé à l'arrière du plan de travail de l'enceinte. Ne pas jeter le matériel dans des contenants à l'extérieur de l'enceinte.
- En cas de déversement, décontaminer la surface de tous les articles se trouvant dans l'ESB. Le plan de travail, y compris la surface interne du panneau, devrait être décontaminé pendant que l'enceinte fonctionne encore.
- Le gaz naturel et le propane ne devraient pas être utilisés dans une ESB; il est interdit de recourir à une flamme nue allumée en continu (p. ex. bec Bunsen). L'utilisation de flammes allumées sur demande (p. ex. micro-brûleur à plaque de toucher) doit être évitée, car les flammes créent des turbulences dans l'ESB, entravent la circulation d'air et peuvent endommager le filtre HEPA (matrice 4.6 de la NCB). Autant que possible, des solutions de rechange sans flamme devraient être envisagées (p. ex. micro-incinérateurs ou anses d'ensemencement stériles et jetables).
- Une seule personne à la fois devrait travailler dans une ESB.
- Les appareils qui créent des courants d'air (p. ex. pompes à vide, centrifugeuses) pourraient compromettre l'intégrité du courant d'air et ne devraient pas être utilisés à l'intérieur de l'ESB.
- Les fenêtres qui s'ouvrent devraient être fermées lorsque l'ESB est utilisée.
11.4.3 Une fois le travail terminé dans l'ESB
- Une fois le travail terminé, il faut laisser s'écouler un laps de temps suffisant pour que l'air de l'enceinte soit purgé (c.-à-d. ait traversé le filtre) avant de sortir les mains ou le matériel de l'enceinte, geste qui perturbe le rideau d'air. Le temps de purge varie selon le modèle et il peut atteindre plusieurs minutes.
- Fermer ou couvrir tous les contenants.
- Décontaminer la surface des objets avant de les sortir de l'ESB.
- Désinfecter les surfaces intérieures de l'ESB, y compris les parois latérales, le fond, les lumières et la face intérieure du panneau de verre, à l'aide d'un désinfectant efficace contre les agents pathogènes utilisés, et s'assurer que le temps de contact est suffisamment long (matrice 4.6 de la NCB). Si un désinfectant corrosif doit être utilisé, la surface devrait être rincée avec de l'eau après la désinfection, car les surfaces en acier inoxydable peuvent se corroder.
- Démonter régulièrement le plan de travail et désinfecter le plateau sous-jacent.
- Nettoyer régulièrement à l'éthanol la surface des lampes à l'intérieur de l'ESB avec un nettoyeur ou un désinfectant approprié.
11.4.4 Éclairage ultraviolet
Il est fortement déconseillé d'utiliser des lampes germicides par rayonnement ultraviolet (UV), en raison de leur efficacité limitée pour désinfecter l'intérieur des ESBNote de bas de page 3Note de bas de page 4. Les employés qui souhaitent utiliser le rayonnement UV dans une ESB devraient au préalable suivre une formation sur les pratiques de travail sécuritaires requises et les dangers du rayonnement UV, comprenant les éléments suivants:
- Le rayonnement UV du plan de travail de l'enceinte ne doit être utilisé qu'à titre de méthode secondaire de désinfection. Ne jamais se fier uniquement au rayonnement UV pour désinfecter un plan de travail contaminé.
- Le rayonnement UV est inefficace si un microorganisme est protégé par de la poussière, de la saleté ou de la matière organiqueNote de bas de page 4. La désinfection à l'aide d'un désinfectant chimique liquide devrait être utilisée comme principal procédé de nettoyage et de désinfection de l'intérieur d'une ESB.
- Le rayonnement UV ne pénètre pas à l'intérieur des fissures et ne traverse pas les grilles d'une ESB.
- Le rayonnement UV peut détériorer divers matériaux, y compris certains plastiques et tuyaux.
- Ne jamais toucher une ampoule UV avec les mains nues, car les huiles naturelles des mains peuvent laisser une empreinte qui crée un espace mort sur la surface de l'ampoule.
- Les ampoules UV devraient être nettoyées fréquemment à l'aide d'un désinfectant approprié.
- On devrait vérifier régulièrement le fonctionnement de la lampe UV à l'aide d'un appareil de mesure des UV pour s'assurer qu'elle fournit l'intensité voulue (c.-à-d. 40 µW/cm2) à la longueur d'onde appropriée (c.-à-d. 254 nm) au centre du plan de travailNote de bas de page 5.
Figure 11-1a : Illustration d'une enceinte de sécurité biologique (ESB) de catégorie I
Cette ESB est utilisée conjointement avec le système de CVAC du bâtiment. L'air évacué passe par un filtre HEPA avant d'être rejeté à l'extérieur du bâtiment.
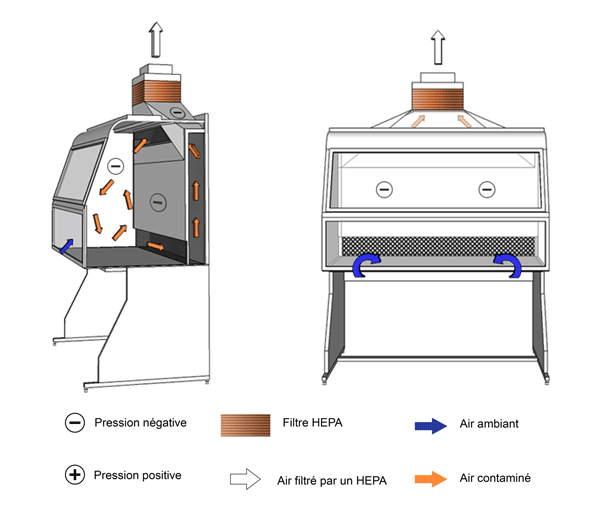
Équivalent textuel - Figure 11-1a
Dans cette figure, une ESB de catégorie I munie de jonctions rigides étanches utilise le système de CVAC du bâtiment. L’air de la pièce est aspiré par l’ouverture frontale de l’enceinte et traverse l’espace de travail en dépression. Il s’écoule ensuite à travers une grille d’air située à l’arrière de l’enceinte, puis il est dirigé vers le haut dans un plénum et traverse un filtre HEPA avant d’être rejeté vers l’extérieur.
Figure 11-1b : Illustration d'une enceinte de sécurité biologique (ESB) de catégorie I
Cette ESB dispose de son propre ensemble moteur et ventilateur interne. L'air évacué passe par un filtre HEPA, puis est rejeté dans la pièce.
Équivalent textuel - Figure 11-1b
Dans cette figure, une ESB de catégorie I est munie d’un ensemble moteur et ventilateur. L’air de la pièce est aspiré par l’ouverture frontale de l’enceinte et traverse l’espace de travail en dépression. Il s’écoule ensuite à travers une grille d’air située à l’arrière de l’enceinte, puis il est dirigé vers le haut dans un plénum et traverse un filtre HEPA avant d’être rejeté dans la zone de confinement.
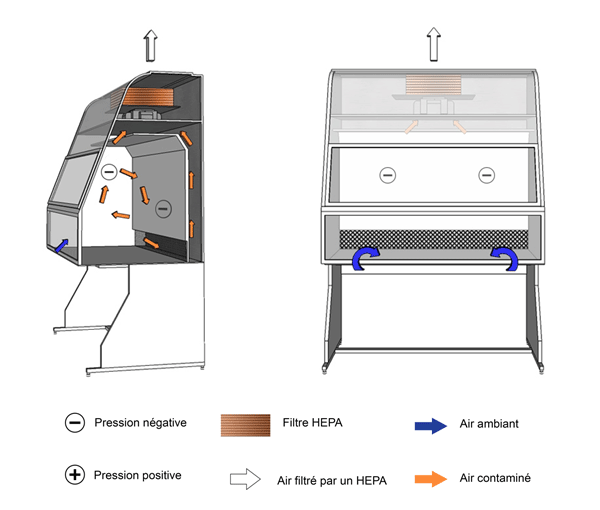
Figure 11-2 : Illustration d'une enceinte de sécurité biologique (ESB) de catégorie II et de type A1 (munie d'un plénum contaminé en surpression)
L'air évacué de l'ESB peut être recyclé dans la pièce ou évacué à l'extérieur du bâtiment par un raccord à bague. Le plénum contaminé en surpression est indiqué en mauve.
Équivalent textuel - Figure 11-2
Cette figure illustre une ESB de catégorie II et de type A1 munie d’un raccord à bague et d’un plénum en surpression. L’air filtré du haut de l’enceinte descend vers la surface de travail. Au‑dessus de la surface de travail, à mi‑chemin entre les grilles avant et arrière, le courant d’air filtré descendant se divise en deux parties. La moitié de l’air passe à travers la grille avant, et l’autre, à travers la grille arrière. L’air de la pièce est aussi aspiré à travers la grille avant. L’air de la pièce et le courant d’air descendant sont aspirés à travers les grilles, puis dans la chambre en dépression sous la surface de travail. L’air s’écoule ensuite à travers le ventilateur, puis il est soufflé vers le plénum en surpression où il se dirige vers le haut du cabinet. Une partie de l’air passe à travers le filtre HEPA du plénum avant d’être recyclé vers l’espace de travail. L’autre partie passe à travers le filtre HEPA situé à la base du raccord à bague, puis elle est évacuée dans la zone de confinement ou à l’extérieur du bâtiment par un raccord à bague. L’ESB de type A1 illustrée est munie d’un plénum contaminé en surpression.
Figure 11-3 : Illustration d'une enceinte de sécurité biologique (ESB) de catégorie II et de type A2
L'air évacué de l'ESB peut être recyclé dans la pièce ou évacué à l'extérieur du bâtiment par un raccord à bague. Cette ESB a un plénum en dépression.
Équivalent textuel - Figure 11-3
Cette figure illustre une ESB munie d’un raccord à bague et d’un plénum contaminé en surpression (entre le ventilateur et les filtres HEPA) entouré d’un plénum en dépression. L’air filtré du haut de l’enceinte descend vers la surface de travail. Au‑dessus de la surface de travail, à mi‑chemin entre les grilles avant et arrière, le courant d’air filtré descendant se divise en deux parties. La moitié de l’air passe à travers la grille avant, et l’autre, à travers la grille arrière. L’air de la pièce est aussi aspiré à travers la grille avant. L’air de la pièce et le courant d’air descendant sont aspirés à travers les grilles, puis ils remontent dans le plénum en dépression avant de traverser le ventilateur et le plénum en surpression (entre le ventilateur et les filtres HEPA) dans le haut de l’ESB. Une partie de l’air passe à travers le filtre HEPA du plénum avant d’être recyclé vers l’espace de travail. L’autre partie passe à travers le filtre HEPA situé à la base du raccord à bague, puis elle est évacuée dans la zone de confinement ou directement à l’extérieur du bâtiment par un raccord à bague.
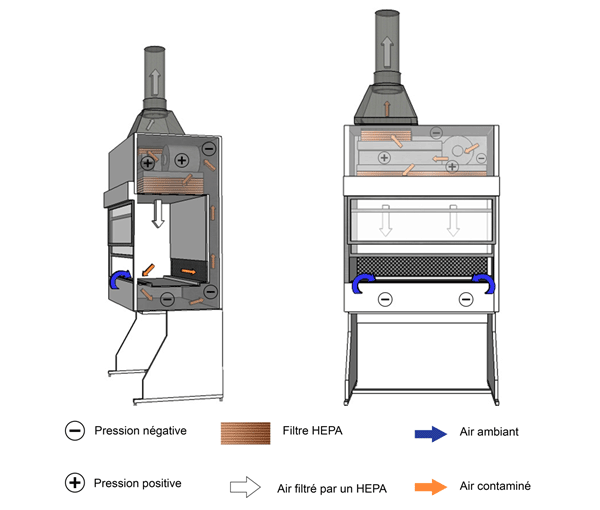
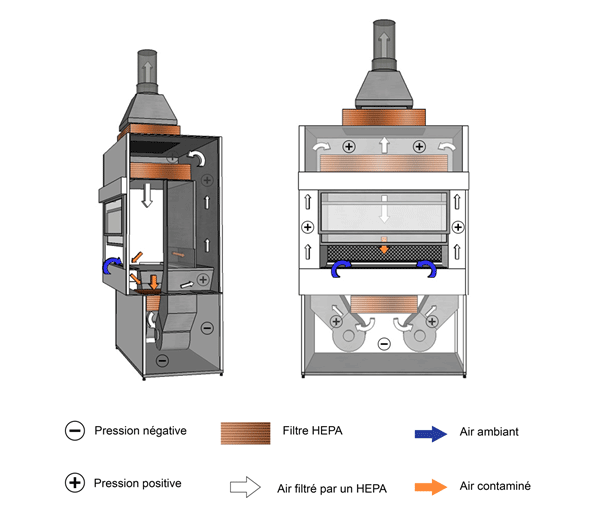
Figure 11-4 : Illustration d'une enceinte de sécurité biologique (ESB) de catégorie II et de type B1
L'air de l'ESB est évacué à l'extérieur du bâtiment par une jonction rigide étanche. Le plénum en surpression dans cet exemple n'est pas contaminé car l'air est filtré avant d'atteindre les ventilateurs d'évacuation.
Équivalent textuel - Figure 11-4
Cette figure illustre une ESB de catégorie II et de type B1 comportant une jonction rigide étanche avec le système de CVAC du bâtiment. L’air filtré du plénum s’écoule vers le bas et se divise en deux courants directement au‑dessus de la surface de travail, à mi‑chemin entre les grilles avant et arrière. L’air aspiré à travers les grilles est dirigé à travers un filtre HEPA par le ventilateur, puis il passe dans les plénums en remontant vers la partie supérieure de l’ESB. Une partie de l’air filtré est dirigé vers le bas, au‑dessus de l’espace de travail, tandis que l’autre partie passe à travers un filtre HEPA avant d’être évacuée à l’extérieur du bâtiment.
Figure 11-5 : Illustration d'une enceinte de sécurité biologique (ESB) de catégorie II et de type B2
L'air de l'ESB est évacué à l'extérieur du bâtiment par une jonction rigide étanche.
Équivalent textuel - Figure 11-5
Cette figure illustre une ESB de catégorie II et de type B2 comportant une jonction rigide étanche avec le système de CVAC du bâtiment. Un ventilateur d’approvisionnement dirige l’air de la pièce dans la partie supérieure de l’enceinte. L’air contaminé du plénum reste physiquement séparé de l’air de la pièce provenant du ventilateur d’approvisionnement. L’air de la pièce est dirigé dans la partie supérieure de l’enceinte par le ventilateur d’approvisionnement, puis il passe à travers le filtre HEPA avant d’être évacué vers le bas dans l’espace de travail de l’enceinte. Le courant d’air descendant se divise en deux parties directement au‑dessus de la surface de travail, à mi‑chemin entre les grilles avant et arrière. L’air de la pièce est aussi aspiré à travers la grille avant d’atteindre la surface de travail. L’air dirigé à travers les grilles est aspiré dans le plénum en dépression, puis remonte vers la partie supérieure de l’enceinte. Il passe ensuite à travers le filtre HEPA et est directement évacué à l’extérieur du bâtiment.
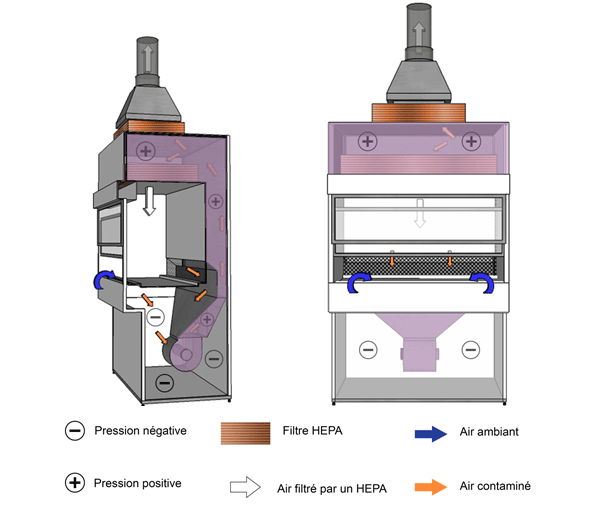
Figure 11-6 : Illustration d'une enceinte de sécurité biologique (ESB) de catégorie III
L'air de l'ESB est évacué à l'extérieur du bâtiment par une jonction rigide étanche.
Équivalent textuel - Figure 11-6
Cette figure illustre une ESB de catégorie III munie d’un conduit d’entrée d’air et d’un conduit d’évacuation d’air. L’ESB est complètement étanche : toutes les pénétrations sont étanches à l’air, et l’ESB est maintenue en dépression. Les manipulations s’effectuent au moyen de longs gants très résistants, fixés au panneau de l’enceinte. L’air passe à travers un filtre HEPA avant d’entrer dans l’enceinte et circule dans l’espace de travail. L’air de l’espace de travail est aspiré par le conduit d’évacuation d’air, passe à travers deux filtres HEPA consécutifs et est évacué à l’extérieur du bâtiment.
Figure 11-7 : Diagramme illustrant des considérations à prendre en compte en choisissant le lieu d'installation d'une enceinte de sécurité biologique (ESB)
(a) ESB installées aux bons endroits. Le dégagement minimal recommandé entre la porte et une ESB ou entre les ESB lorsque la pièce contient plus d'une ESB est illustré. Le dégagement recommandé pour certaines ESB, lequel empêche le courant d'air d'une ESB avoisinante de perturber le rideau d'air protecteur de l'ESB, pourrait être différent. (b) ESB installées aux mauvais endroits. La circulation, les portes et les ESB avoisinantes risquent de perturber le rideau d'air protecteur et de compromettre la sécurité personnelle, de l'environnement et du produit. Les ESB de catégorie II sont conçues et certifiées pour l'utilisation d'un seul utilisateur.
a) ESB installées aux bons endroits
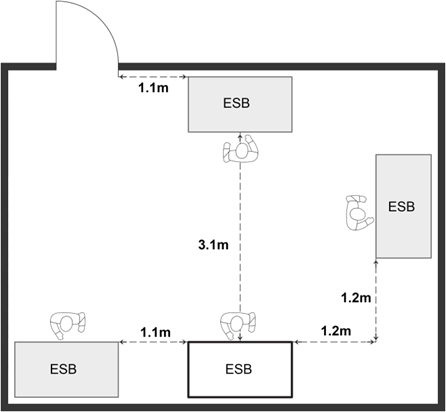
Équivalent textuel - Figure 11-7a
Cette figure montre deux pièces où sont installées des ESB. Dans la figure 11‑7(a), deux ESB sont situées le long d’un mur et deux autres ESB sont placées contre deux autres murs. Ces ESB sont installées aux bons endroits : elles respectent le dégagement minimal recommandé par rapport à la porte et aux autres ESB installées dans la pièce. Le dégagement recommandé pour certaines ESB, lequel empêche le courant d’air d’une ESB avoisinante de perturber le rideau d’air protecteur de l’ESB, pourrait être différent.
La figure 11‑7(b) montre des ESB installées aux mauvais endroits dans une pièce aménagée différemment. Dans ce cas, les deux ESB sont placées côte‑à‑côte contre un mur, à proximité d’une porte, à un endroit où la circulation, les portes et l’autre ESB risquent de perturber le rideau d’air protecteur et de compromettre la sécurité personnelle, de l’environnement et du produit. La figure montre aussi deux personnes en train de travailler dans une des ESB. Les ESB de catégorie II sont conçues et certifiées pour l’utilisation d’un seul utilisateur.
b) ESB installées aux mauvais endroits
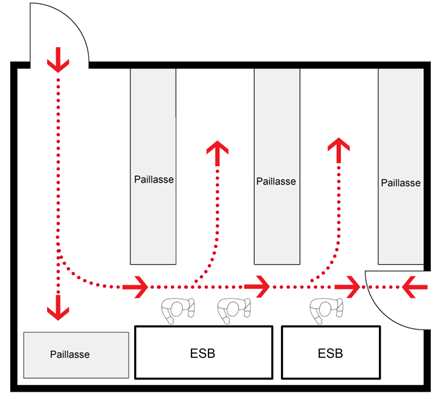
Équivalent textuel - Figure 11-7b
La figure 11‑7(b) montre des ESB installées aux mauvais endroits dans une pièce aménagée différemment. Dans ce cas, les deux ESB sont placées côte‑à‑côte contre un mur, à proximité d’une porte, à un endroit où la circulation, les portes et l’autre ESB risquent de perturber le rideau d’air protecteur et de compromettre la sécurité personnelle, de l’environnement et du produit. La figure montre aussi deux personnes en train de travailler dans une des ESB. Les ESB de catégorie II sont conçues et certifiées pour l’utilisation d’un seul utilisateur.
Figure 11-8 : Diagramme représentatif de la disposition recommandée des articles utilisés pour les manipulations dans une enceinte de sécurité biologique (ESB)
Comme il est indiqué, on devrait travailler de la région « propre » (c.-à-d. la moins contaminée) à la région « sale » (c.-à-d. la plus contaminée).
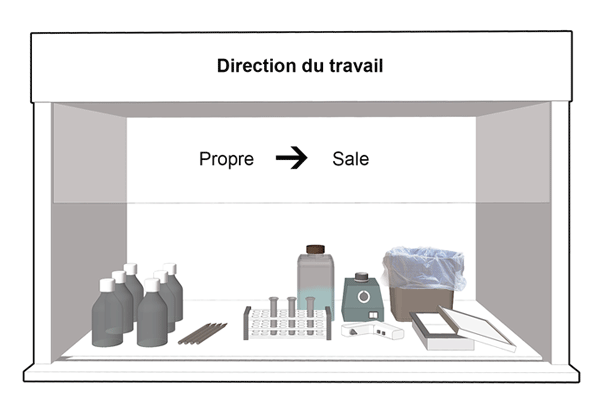
Équivalent textuel - Figure 11-8
Cette figure illustre une ESB prête pour le travail, sur laquelle se trouvent des pipettes et des réactifs propres à gauche, un plateau de tubes au centre, des contenants pour déchets solides et liquides à droite et à l’arrière, et un bac pour pipettes usagées à droite. Il y a aussi un agitateur de type vortex dans la partie arrière de l’espace de travail et un dispositif de pipetage sans fil près du centre, à proximité du plateau. Le travail est effectué de la région « propre » (c.‑à‑d. la moins contaminée) à la région « sale » (c.‑à‑d. la plus contaminée).
Références
- Note de bas de page 1
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada.
- Note de bas de page 2
- NSF/ANSI 49-2014, Biosafety Cabinetry: Design, Construction, Performance, and Field Certification. (2014). Ann Arbor, MI, États-Unis: National Sanitation Foundation / American National Standards Institute.
- Note de bas de page 3
- Burgener J. (2006). Position Paper on the Use of Ultraviolet Lights in Biological Safety Cabinets. Applied Biosafety: Journal of the American Biological Safety Association. 11(4):227-230. Consulté le 18 mars 2016 à l'adresse https://my.absa.org/tiki-index.php?page=ABJ_1104
- Note de bas de page 4
- Lawrence Berkeley National Laboratory. (2010). Biosafety Manual - Appendix F: Decontamination and Antimicrobials. Consulté le 3 novembre 2015 à l'adresse http://www2.lbl.gov/ehs/pub3000/CH26/CH26_Appx_F.html
- Note de bas de page 5
- Department of Health and Human Services des États-Unis, Centers for Disease Control and Prevention des États-Unis et les National Institutes of Health des États-Unis. (2009). Appendix A -Primary Containment for Biohazards: Selection, Installation and Use of Biological Safety Cabinets, dans Biosafety in Microbiological and Biomedical Laboratories, 5e éd., Richmond, J. Y. et McKinney, R. W. (éds), Washington, DC, États-Unis : Government Printing Office.
Chapitre 12 - Considérations relatives à la sécurité applicables aux appareils utilisés pour le travail avec des matières biologiques
Dans les espaces de travail en laboratoire et les zones de confinement d'animaux, une grande variété d'appareils peut être utilisée pour manipuler des matières infectieuses ou des toxines. Les appareils doivent être utilisés et entretenus de manière à réduire les risques d'exposition et à empêcher la libération d'agents pathogènes et de toxines dans l'environnement. Un programme d'entretien des appareils facilite le suivi et la planification des inspections et des réparations, et est une composante importante du Manuel de biosécurité de l'installation. De plus, il est essentiel que le personnel reçoive de la formation sur les procédures opératoires normalisées (PON) portant sur les appareils utilisés dans la zone de confinement, comme les centrifugeuses, les microtomes, les appareils de pipetage, les systèmes à vide et les passe-plats, pour que le milieu de travail soit sécuritaire. Le présent chapitre fournit des directives sur l'utilisation en toute sécurité de certains appareils présents dans les espaces de travail en laboratoires et les espaces de travail avec des animaux et utilisés pour mener des activités avec des matières biologiques. Des évaluations locales de risques (ELR) sont réalisées pour déceler les risques, examiner les procédures et établir des pratiques de travail sécuritaires avec tous les appareils, lesquelles, à leur tour, peuvent être transformées en PON. Les exigences minimales en matière de confinement des appareils décrits dans le présent chapitre sont énoncées dans les chapitres 3, 4 et 5 de la Norme canadienne sur la biosécurité (NCB), 2e édition; les matrices associées au type d'appareil décrit sont indiquées dans chacune des sections qui suiventNote de bas de page 1.
12.1 Centrifugeuses
Il existe un risque de formation d'aérosols (p. ex. libération d'aérosols infectieux ou de toxines aérosolisées en raison d'un bris de tubes ou d'une mauvaise utilisation des godets de sécurité ou des rotors) lors de l'utilisation d'une centrifugeuse. Les points ci-dessous soulignent certaines exigences et recommandations à suivre lorsqu'on utilise une centrifugeuse avec des matières infectieuses ou des toxines :
- décontaminer la surface extérieure des godets et des rotors, au besoin;
- utiliser les appareils selon les instructions du fabricant, notamment équilibrer les rotors pour éviter qu'ils soient endommagés et pour réduire le risque d'explosion;
- utiliser des tubes de plastique conçus pour être utilisés avec une centrifugeuse (c.-à-d. des tubes de plastique à paroi épaisse avec filetage extérieur, munis d'un bouchon);
- utiliser des godets et des rotors scellés afin de prévenir la libération d'aérosols durant la centrifugation et vérifier régulièrement l'intégrité des joints d'étanchéité des godets et des rotors (matrice 4.6 de la NCB);
- décharger les godets et les rotors contenant des échantillons de matière infectieuse ou des toxines dans une enceinte de sécurité biologique (ESB) pour que la propagation d'aérosols infectieux ou de toxines aérosolisées soit évitée (matrice 4.6 de la NCB);
- attendre assez longtemps avant d'ouvrir les godets et les rotors pour permettre aux aérosols de se déposer;
- interdire l'utilisation des centrifugeuses dans une ESB de catégorie II, car le courant d'air sera perturbé et la protection assurée par l'ESB sera réduite.
12.2 Microtomes
Le travail avec un microtome coupant un bloc contenant des matières infectieuses ou des toxines qui pourraient ne pas avoir été inactivées par la fixation devrait être effectué dans une zone prévue à cet effet et où la circulation est faible (c.-à-d. délimitée à l'aide de ruban) pour prévenir la dissémination de copeaux de cire dans la zone de confinement ou hors de cette dernière. Des couvre-chaussures jetables, réservés à cette aire de travail, peuvent aussi aider à prévenir la dissémination de copeaux de cire. Un appareil de protection respiratoire devrait également être porté, selon les résultats de l'ELR. Des auges peuvent être installées sur le bord de la table de travail afin de recueillir les copeaux de cire en trop. Il faut faire preuve de prudence au moment d'installer ou de retirer les lames des microtomes; les lames non jetables sont nettoyées au moyen d'un instrument et non à la main, pour que tout contact avec celles-ci soit évité. Au cours de la manipulation de tissus potentiellement contaminés par des agents pathogènes ou des prions, il est pertinent de porter un autre dispositif d'équipement de protection individuel (EPI) comme des gants résistants aux coupure pour réduire le risque d'exposition ou de blessure.
12.3 Mélangeurs, sonicateurs, homogénéisateurs, incubateurs-agitateurs et agitateurs
L'utilisation de mélangeurs, de sonicateurs, d'homogénéisateurs, d'agitateurs, d'incubateurs-agitateurs et d'autres appareils semblables peut produire des aérosols. Les points ci-dessous soulignent certaines exigences et recommandations à suivre lorsqu'on utilise ces types d'appareils :
- Utiliser des appareils de laboratoire ou des accessoires spécialement conçus pour confiner les aérosols pour manipuler des agents pathogènes et des toxines. Par exemple, les sonicateurs munis d'une sonde cup-horn permettent d'exposer à des ultrasons des échantillons déposés dans un récipient fermé en évitant tout contact direct avec les matières traitées.
- Si nécessaire, utiliser l'appareil dans une ESB (seulement si l'appareil ne perturbe pas la circulation de l'air) (matrice 4.6 de la NCB) ou dans un autre type de dispositif de confinement primaire.
- Attendre assez longtemps pour permettre aux aérosols de se déposer avant d'ouvrir ou de retirer le couvercle.
12.4 Becs Bunsen
Le bec Bunsen est couramment utilisé pour produire de la chaleur (p. ex. pour fixer des cellules sur une lame) et pour la stérilisation (p. ex. pour stériliser des anses d'ensemencement). Une aérosolisation des matières infectieuses peut se produire lorsque des anses d'ensemencement sont stérilisées à la flamme nue d'un bec Bunsen; il est donc recommandé d'utiliser plutôt des micro-incinérateurs ou des anses jetables. Les flammes allumées en continu sont interdites dans les ESB, parce qu'elles perturbent la circulation de l'air, réduisent la protection conférée par le rideau d'air à l'utilisateur et peuvent endommager les filtres (matrice 4.6 de la NCB). Lorsqu'aucune solution de rechange convenable sans flamme n'est disponible, un micro-brûleur à plaque de toucher permettant d'obtenir une flamme sur demande peut être utilisé. Pour savoir comment bien utiliser une ESB, consultez le chapitre 11.
12.5 Micro-incinérateurs
Les micro-incinérateurs peuvent servir de solution de rechange aux becs Bunsen, en particulier lorsque le travail doit être effectué dans une ESB. Ces appareils sont souvent munis d'un écran protecteur pour réduire au minimum la dispersion des aérosols. Lorsqu'ils sont utilisés dans une ESB, ces appareils doivent être placés au fond de l'enceinte afin de perturber le moins possible le rideau d'air situé à l'avant.
12.6 Anses jetables
Les anses jetables à usage unique sont stériles et peuvent être utilisées dans une ESB comme solution de rechange aux anses réutilisables nécessitant une stérilisation à l'aide d'un brûleur ou d'un micro-incinérateur. Elles contribueront cependant à accroître la quantité de déchets requérant une décontamination. Les anses jetables devraient être déposées dans un contenant de déchets étanche, résistant aux perforations, immédiatement après leur utilisation.
12.7 Appareils de pipetage
Lorsqu'ils sont utilisés correctement, les appareils de pipetage réduisent le risque de formation d'aérosols et éliminent le risque d'ingestion de matières infectieuses associé au pipetage à la bouche, lequel est interdit à tous les niveaux de confinement (matrice 4.6 de la NCB). Des aérosols peuvent se former lorsqu'on vide du liquide d'une pipette ou lorsqu'on mélange des cultures par aspirations et expulsions successives. Les points ci-dessous soulignent certaines exigences et recommandations à suivre pour l'utilisation sûre des appareils de pipetage :
- utiliser une ESB pour pipeter des matières infectieuses ou des toxines (matrice 4.6 de la NCB);
- travailler sur un matelas absorbant à endos plastifié; les gouttelettes seraient absorbées plutôt que de produire une éclaboussure;
- utiliser des pipettes étalonnées pour livrer, ce qui réduit le risque de création d'aérosols en conservant la dernière goutte à l'extrémité;
- utiliser des pipettes en plastique plutôt qu'en verre dans toute la mesure du possible;
- utiliser des pipettes pour sérologie munies d'un filtre avec les appareils de pipetage, et des embouts de pipettes munis d'un filtre avec les micropipettes; ceux-ci éviterons la contamination du dispositif de pipetage;
- recourir à des procédés de décontamination adaptés aux appareils de pipetage et aux micropipettes lorsqu'on utilise des embouts sans filtre ou lorsque les pores du filtre à pipette ne permettent pas de retenir l'agent pathogène ou la toxine utilisé;
- ne pas mélanger de liquides en faisant des bulles d'air dans le liquide avec la pipette ou en aspirant et en expulsant la solution avec la pipette;
- verser les liquides le plus près possible de la paroi du tube ou de la surface du milieu;
- éviter d'aspirer ou d'expulser avec force des liquides de la pipette;
- éjectés directement dans un contenant (p. ex. bouteille, bécher) les embouts de pipette pour décontamination ultérieure;
- décontaminées les pipettes à l'aide d'un désinfectant approprié immédiatement après leur utilisation;
- les pipettes sérologiques peuvent être posées horizontalement dans un plateau et complètement immergées dans un désinfectant (il faut prendre des précautions lors du déplacement du plateau pour éviter un déversement dangereux);
- les pipettes sérologiques peuvent être remplies de désinfectant et laissées à vidanger par gravité dans un verre surdimensionné en papier cirée placé dans un sac pour autoclave (le sac peut être fermé par-dessus les pipettes et la structure peut être autoclavée dans son ensemble en position verticale avant la réutilisation).
12.8 Pompes et systèmes à vide
Les systèmes à vide sont utilisés pour créer un vide dans des unités de filtration ou pour aspirer des liquides. Les systèmes à vide les plus fréquents en laboratoire sont les systèmes à vide centralisés, les pompes à vide et la trompe à eau reliée à un robinet. La principale préoccupation associée aux pompes à vide est le fait que le processus d'aspiration peut provoquer l'aérosolisation de matières infectieuses ou de toxines, et la contamination ultérieure de la canalisation et de la pompe ou du système à vide. Un dispositif (p. ex. filtres à haute efficacité pour les particules de l'air [HEPA] ou de 0,2 µm en série, avec un piège désinfectant) est mis en place pour empêcher la contamination interne du système à vide (matrice 3.7 de la NCB). Ce montage est illustré à la figure 12-1. Un programme d'entretien prévoyant l'inspection et le remplacement réguliers des filtres en série (matrice 4.6 de la NCB) contribuera à prévenir un bris du filtre et à maintenir l'intégrité du filtre et le confinement de matière infectieuse et de toxines. Dans les zones de confinement élevé, le recours à un système à vide portable au lieu d'un système central réduira le risque d'un bris de confinement. Les procédés de décontamination et les facteurs déterminant le choix d'un désinfectant chimique sont abordés au chapitre 15.
12.9 Hottes chimiques
Les hottes chimiques sont destinées à la manipulation de substances chimiques, en particulier les substances volatiles. Les matières évacuées par les hottes chimiques sont soit filtrées et remises en circulation avec l'air résiduel, soit directement évacuées à l'extérieur du bâtiment. Lorsqu'ils sont nécessaires, les filtres sont choisis en fonction du type de contaminant à éliminer, de l'efficacité requise pour respecter les limites d'exposition professionnelles ou environnementales, et du temps de séjour requis. Les filtres situés en amont du ventilateur d'évacuation et de façon à permettre le remplacement sans risque de contamination de l'environnement voisin, permet de maintenir une pression négative dans les conduits contaminés et empêche la dispersion de substances chimiques. La vérification et le remplacement des filtres devraient être plus fréquents lorsque ces derniers ont été utilisés pour piéger des substances chimiques capables de les dégrader. Il incombe aux responsables de l'installation d'évaluer la compatibilité entre les produits chimiques et les filtres et de déterminer la fréquence de remplacement appropriée. Le recours à des dispositifs de traitement de l'air évacué (p. ex. filtres au charbon activé) doit être conforme aux règlements locaux applicables.
Les hottes chimiques n'étant pas conçues pour la manipulation de matières infectieuses ou de toxines, il faudrait éviter de les placer dans des zones de confinement élevé; on devrait plutôt envisager d'installer des ESB de catégorie II et de type B2, conçues pour la manipulation de matières infectieuses et de toxines, de même que de substances chimiques volatiles et de radionucléides. Les hottes chimiques installées dans les zones de confinement élevé doivent être conformes aux exigences en matière de filtration HEPA s'appliquant à l'air évacué (matrice 3.5 de la NCB). Il est recommandé d'installer un filtre HEPA en amont du filtre à charbon afin de protéger ce dernier d'une contamination par des matières infectieuses ou des toxines. Les ESB de catégorie II et de type B2 sont présentées en détail au chapitre 11.
12.10 Passe-plats
Un passe-plat permet d'introduire des matières dans une zone de confinement ou d'en retirer des matières en toute sécurité (déplacement). Il en existe de différentes tailles et configurations, notamment des modèles muraux, des modèles de plancher avec rampes intégrées et des modèles intégrés dans une ESB de catégorie III. Les divers passe-plats offrent différentes méthodes de décontamination, comprenant la chaleur humide (autoclave), la chaleur sèche (boîte chaude) et le gaz ou la vapeur (fumigation). Le choix du procédé de décontamination dépend de la nature des articles à stériliser, de même que du type de matières infectieuses ou de toxines utilisées. Certains passe-plats possèdent d'autres caractéristiques et peuvent notamment être munis de filtres HEPA. Afin d'éviter qu'elles soient ouvertes simultanément, les portes des passe-plats sont généralement munies d'un dispositif d'interverrouillage ou d'avertisseurs visuels ou sonores (matrice 3.2 de la NCB). Les procédés de décontamination et les facteurs déterminant le choix d'un désinfectant chimique sont présentés au chapitre 15.
12.11 Trieurs de cellules
Les trieurs de cellules servent à séparer physiquement une sous-population définie de cellules faisant partie d'une population hétérogèneNote de bas de page 2Note de bas de page 3. Les risques associés aux trieurs de cellules peuvent être attribués tant à la nature de l'échantillon (c.-à-d. la présence et la nature des matières infectieuses ou des toxines contenues dans l'échantillon) qu'à l'appareil lui-même (p. ex. recours au tri cellulaire par génération de gouttelettes, qui utilise la technologie du « jet dans l'air » [jet-in-air] et qui peut produire une grande quantité de gouttelettes aérosolisées). Le tri cellulaire par génération de gouttelettes consiste à injecter un flux de liquide contenant les cellules à travers une buse étroite vibrant à haute fréquence. Les trieurs de cellules à haute vitesse avec technologie du « jet dans l'air » emploient des pressions et des fréquences de vibration de la buse encore plus élevées et, par conséquent, produisent une plus grande quantité de matières aérosolisées. Une ELR devrait être effectuée afin de déterminer les éléments de confinement physique et les pratiques opérationnelles qui permettraient de rendre sécuritaire le travail avec des matières infectieuses ou des toxines dans un trieur de cellules. Il peut être nécessaire d'installer un trieur de cellules utilisé avec des agents pathogènes et des toxines dans un boîtier personnalisé construit par un même fabricant s'il n'est pas possible de l'installer dans une ESB. Les boîtiers personnalisés doivent être certifié aux spécifications du fabricant et démontrer l'intégrité, comme décrit dans la matrice 5.1 de la NCB.
12.12 Bouteilles de gaz comprimé
Les bouteilles de gaz comprimé peuvent avoir des fuites, et elles peuvent être difficiles à entretenir, à remplacer et à décontaminer. Dans les zones de niveau de confinement 4 (NC4), il existe un risque additionnel que les combinaisons pressurisées puissent être endommagées lors du remplacement des bouteilles ou des détendeurs. Pour ces raisons, il est recommandé que les bouteilles de gaz comprimé soient situées à l'extérieur de la barrière de confinement et des zones contenant des prions, dans la mesure du possible. Des extincteurs d'incendie et des bouteilles de gaz de secours pourraient être requis dans les zones de confinement élevé pour la protection du personnel dans les situations d'urgence mortelle. Dans certaines zones de niveau de confinement 3 (NC3) où sont utilisés des appareils spécialisés (p. ex. spectrophotomètre de masse, appareil de chromatographie liquide à haute performance), il peut être nécessaire d'utiliser des petites bouteilles de gaz de référence, car il ne serait pas pratique d'acheminer le gaz dans la zone de confinement par des canalisations.
12.13 Autres considérations relatives aux appareils utilisés pour la manipulation de prions
Voici d'autres facteurs à prendre en considération pour des appareils qu'on utilise dans des zones où l'on manipule des prions :
- Utiliser des espaces de travail en laboratoire et des appareils réservés à la manipulation de prions, dans la mesure du possible;
- Recourir, de préférence à du matériel et des fournitures de laboratoire jetables lorsque les matières s'avèrent contenir des prions;
- Remplacer les aiguilles par des canules à bout arrondi; le recours à des aiguilles, des seringues et d'autres objets tranchants ou pointus doit être strictement limité (matrice 4.6 de la NCB);
- Remplacer la verrerie par des articles en plastique;
- Garder les instruments humides jusqu'à leur décontamination.
12.14 Autres considérations relatives aux appareils utilisés pour la manipulation de toxines
Autres facteurs à prendre en considération en ce qui concerne l'utilisation d'appareils pour la manipulation de toxines :
- Remplacer de préférence la verrerie par des articles en plastique;
- Éviter les articles en verre mince, dans la mesure du possible;
- Placer de préférence les colonnes de chromatographie en verre dans un deuxième contenant, si cela est possible.
Figure 12-1 : Diagramme représentatif d'un système à vide installé pour l'aspiration de liquides infectieux
Le liquide d'un tube conique à centrifugation est aspiré dans un flacon contenant une solution désinfectante utilisé pour recueillir et décontaminer les déchets liquides. Ce flacon est relié à un deuxième flacon (qui contient aussi un désinfectant) par une tubulure, flacon qui sert à recueillir les débordements et les aérosols. La source du vide (dans ce diagramme, une pompe à vide portable) est protégée des aérosols infectieux et des toxines aérosolisées par un filtre (filtre à 0,2 µm illustré) relié en série et situé entre le flacon anti-débordement et la source de vide.
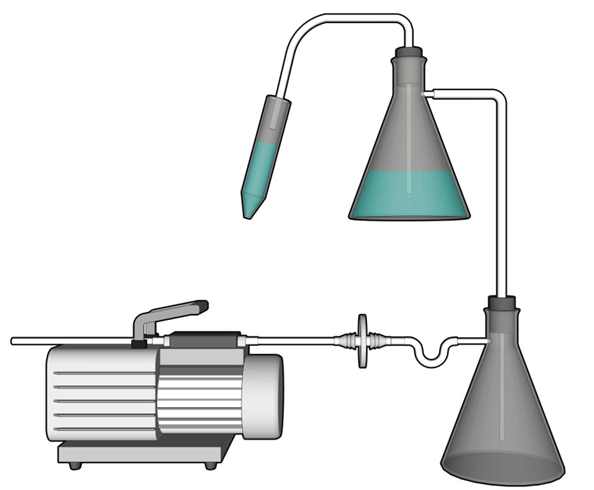
Équivalent textuel - Figure 12-1
Dans ce schéma, le liquide d’un tube conique à centrifugation est aspiré à travers un tube dans un flacon contenant une solution désinfectante utilisé pour recueillir et décontaminer les déchets liquides. Ce flacon est relié à un deuxième flacon contenant lui aussi un désinfectant par une tubulure, flacon qui sert à recueillir les débordements et les aérosols. La source du vide dans ce schéma est une pompe à vide portable, qui est protégée contre les aérosols infectieux et les toxines aérosolisées par un filtre (à 0,2 µm) relié en série et situé entre le flacon anti‑débordement et la source du vide.
Références
- Note de bas de page 1
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada.
- Note de bas de page 2
- Schmid, I., Lambert, C., Ambrozak, D. et Perfetto, S. P. (2007). Standard Safety Practices for Sorting of Unfixed Cells. Current Protocols in Cytometry. 3.6.1-3.6.20.
- Note de bas de page 3
- Schmid, I., Roederer, M., Koup, R. A., Ambrozak, D., Perfetto, S. P. et Holmes, K. L. (2009). Biohazard Sorting. Dans Darzynkiewicz, Z., Robinson, P. J. et Roederer, M. (éds), Essential Cytometry Methods, p. 183-204, Maryland Heights, MO, États-Unis: Academic Press.
Chapitre 13 - Considérations liées au travail avec des animaux
Le travail in vitro avec des agents pathogènes et des toxines dans une zone de confinement comporte des risques, mais le fait de mener des travaux in vivo (c.-à-d. avec des animaux vivants) dans une zone de confinement accroît considérablement les risques comparativement aux travaux in vitro. Les animaux, surtout ceux qui sont malades, peuvent se comporter de façon imprévisible. Par ailleurs, les animaux infectés peuvent être symptomatiques ou asymptomatiques, ou porteurs d'agents pathogènes zoonotiques capables de causer une maladie chez les humains. Des agents pathogènes ou des toxines peuvent être présents dans les grands volumes de déchets que les animaux produisent, et ils peuvent aussi être excrétés. Les morsures d'animaux, les griffures, les aérosols ou le contact direct avec un déchet ou un liquide biologique d'animal peuvent exposer la personne à des agents pathogènes hébergés par les animaux. Le risque d'exposition à ces agents pathogènes peut être réduit à l'aide d'un programme de surveillance de la santé animale, axé sur la sélection d'animaux sains et la détection et le traitement des animaux malades.
En outre, certaines personnes peuvent développer des allergies en raison d'une exposition répétée à la fourrure ou aux poils, aux squames, à la litière, à la nourriture et aux déchets des animaux. Comme il est mentionné dans Biological Safety Principles and Practices (2004), au moins un cinquième des personnes qui manipulent des rongeurs, des cobayes et des lapins en laboratoire développe des allergiesNote de bas de page 1. La réaction allergique peut se manifester immédiatement ou s'aggraver après chacune des expositions. Les symptômes peuvent aller d'une légère éruption cutanée à un asthme sévère. Il est possible de réduire l'exposition inutile aux allergènes grâce à des mesures d'ingénierie (p. ex. enceintes de sécurité biologique [ESB], station de changement de cage ventilée, ventilation, isolateurs, cages de confinement), ainsi qu'au port adéquat d'un dispositif de protection respiratoire et d'autre équipement de protection individuel (EPI).
Les gros animaux peuvent aussi causer des blessures résultant d'un coup, d'un piétinement ou d'un écrasement. Il importe aussi de prendre en considération les autres risques physiques que pourraient poser l'utilisation d'appareils et les bruits connexes. Les exigences qui s'appliquent aux zones de confinement d'animaux sont énoncées aux chapitres 3, 4 et 5 de la Norme canadienne sur la biosécurité (NCB); les exigences en matière de pratiques opérationnelles propres aux animaux sont présentées à la matrice 4.7 Note de bas de page 2.
L'utilisation d'animaux à des fins expérimentales est assujettie à des règles strictes et est très surveillée. Lorsque les travaux de recherche scientifique, les cours ou les essais nécessitent le recours à des animaux, le comité de protection des animaux de l'établissement examine et évalue les protocoles relatifs à la manipulation d'animaux pour s'assurer qu'ils sont conformes aux lignes directrices du Conseil canadien de protection des animaux (CCPA), et, s'il y a lieu, à la réglementation provinciale ou territoriale qui s'applique aux animaux utilisés en recherche.
Le CCPA est un organisme national d'évaluation par les pairs qui est responsable de l'élaboration et de la mise à jour des normes relatives à l'utilisation éthique des animaux et à leurs soins en science. Le CCPA agit dans l'intérêt des Canadiens et veille à ce que ceux qui utilisent des animaux à des fins de recherche, d'enseignement et d'essais appliquent des méthodes de soins optimales, conformément aux normes scientifiques acceptables. Le CCPA œuvre aussi afin de promouvoir et d'améliorer la connaissance des principes éthiques, ainsi que la sensibilisation et la réceptivité à ces principes. Pour obtenir de plus amples renseignements sur les programmes du CCPA, veuillez prendre contact avec le CCPA ou consulter son site Web.
13.1 Caractéristiques des animaux
Pour prédire les réactions des animaux et réduire les risques, le personnel travaillant dans les zones de confinement, ce qui comprend les vétérinaires, les scientifiques et les animaliers, doit connaître le comportement (c.-à-d. les instincts et le caractère) et les besoins psychologiques et sociaux des animaux. C'est pourquoi, dans la conception du projet, on devrait tenir compte des besoins des animaux, de leurs caractéristiques physiques, de leur sensibilité aux agents pathogènes adventices, de même que de l'excrétion et de la transmission d'agents pathogènes. Les besoins concernant les aliments, l'eau et l'environnement peuvent aussi varier d'une espèce à l'autre. Il est préférable de loger certains animaux en groupes, tandis que d'autres pourraient devoir être isolés. Il faudra observer attentivement certains animaux afin d'évaluer leur compatibilité et la dynamique du groupe afin de réduire au minimum les risques de bagarres ou de blessures. Dans tous les cas, la sécurité du personnel est primordiale et doit constituer une priorité au moment d'évaluer les options relatives à l'hébergement des animaux. Il faut accorder aux animaux une période d'adaptation (c.-à-d. une période d'acclimatation au nouveau milieu) pour réduire le stress et l'anxiété initiaux, période qui devrait être prise en compte dans le plan expérimental. Il est essentiel de se renseigner sur les besoins des animaux; les lignes directrices du CCPA, les recensions des écrits, les articles évalués par les pairs, et la consultation avec un vétérinaire peuvent fournir aux employés des renseignements essentiels sur un large éventail d'espèces animales. Il est important de s'assurer qu'il existe un juste équilibre entre les besoins des animaux et les nécessités du projet dans le plan d'étude.
Les recommandations et les mises en garde suivantes s'appliquent à la manipulation de nombreuses espèces animales :
- Lorsqu'on prévoit héberger des animaux de laboratoire, il faudrait tenir compte de leur comportement et de leurs besoins émotionnels et sociaux. Avant de regrouper des animaux dans une même cage, on devrait notamment prendre en compte la compatibilité entre animaux et la dynamique des populations de l'espèce afin de réduire les risques de bagarres et autres évènements indésirables.
- Des techniques de conditionnement du comportement, utilisées en association avec des méthodes de contention, peuvent s'avérer efficaces.
- Les animaliers devraient toujours porter un EPI, en fonction des résultats de l'évaluation locale des risques (ELR). S'il y a lieu, ils devraient porter des gants en cuir renforcés couvrant tout le bras et une combinaison ou une blouse à manches longues afin de se protéger contre les griffures.
- On devrait décontaminer les vêtements protecteurs ayant été en contact avec des animaux avant de les envoyer au lavage; l'équipement de blanchisserie situé à l'intérieur de la zone de confinement ne convient que s'il a été prouvé que la décontamination qu'il offre est efficace pour l'agent ou les agents pathogènes avérés ou potentiels (c.-à-d. qu'il a été validé).
- Les animaliers devraient immédiatement laver en profondeur toute morsure, toute égratignure et toute abrasion, et rincer toute muqueuse ayant reçu une éclaboussure. Ces expositions doivent être signalées sans délai (matrice 4.9 de la NCB), et les procédures post exposition doivent être mises en œuvre conformément au plan d'intervention d'urgence (PIU) et au programme de surveillance médicale établis.
- Les verrous de sûreté et les mécanismes de verrouillage des cages doivent tenir compte de la ténacité, des aptitudes créatrices et destructrices ainsi que de l'intelligence des espèces animales (p. ex. primates non humains [PNH], ratons laveurs), s'il y a lieu.
- Les cages devraient être dotées d'un mécanisme permettant de maîtriser et d'examiner les animaux. Des cages de transfert et d'autres appareils de contention particuliers peuvent être utilisés pour héberger les animaux en toute sécurité pendant le nettoyage de leurs cages ou pendant le déplacement des animaux.
13.2 Conception des zones de confinement d'animaux
Une zone de confinement d'animaux désigne un ensemble de salles animalières ou box situés au même endroit, ainsi que les corridors qui les relient et les zones de soutien (p. ex. salles d'entreposage et aires de préparation, salles de nécropsie) d'un même niveau de confinement. Les exigences de la NCB portent sur deux types de zones de confinement d'animaux : les zones de confinement de petits animaux (zones PA) et les zones de confinement de gros animaux (zones GA). Il est à noter que la désignation de « zone PA » et de « zone GA » dépend de la façon dont sont hébergés les animaux plutôt que de la taille physique de ces derniers. Par exemple, si une zone de confinement d'animaux sert à héberger des petits animaux, comme des souris dans des cages de confinement primaire, elle est alors considérée comme une zone PA. À l'opposé, lorsque des petits animaux sont hébergés dans une cage ouverte uniquement destinée au confinement des animaux à une zone (c.-à-d. sans filtration prévenant la propagation de matières infectieuses et de toxines, p. ex. une cage grillagée), dans laquelle les aérosols produits par les animaux peuvent contaminer la pièce, cette dernière est considérée comme une zone GA, en dépit de la taille des animaux. Dans une zone GA, les salles logeant les animaux assurent le confinement primaire (c.-à-d. les box). Dans une zone PA, les cobayes, les rats et les souris sont des exemples de petits animaux pouvant être aisément hébergés dans des cages ou des étagères renfermant des cages munies d'un système de filtration. On n'envisage de loger des PNH et autre gros animaux (p. ex. porcs, brebis et ratons laveurs) dans une zone PA que s'ils sont hébergé dans des cages de confinement primaire ou si les cages sont entièrement situées à l'intérieur d'une cage ou d'un boîtier ventilé personnalisé.
Outre la satisfaction des exigences énoncées aux chapitres 3, 4 et 5 de la NCB, les zones PA et les zones GA devraient être conçues et utilisées conformément aux Lignes directrices du CCPA sur : les animaleriesNote de bas de page 2Note de bas de page 3. Les établissements ayant recours à des animaux à des fins de recherche, d'enseignement et d'expérimentation devraient détenir un certificat de Bonnes pratiques animales BPAMD du CCPA, lequel est remis aux installations ayant subi une évaluation et dont les normes de soins et d'utilisation des animaux d'expérience respectent les lignes directrices et les politiques du CCPA.
13.2.1 Zones de confinement de petits animaux
Une zone de confinement d'animaux dans laquelle les espèces animales sont hébergées et manipulées dans des dispositifs de confinement primaire (c.-à-d. ESB et des cages de confinement munies d'un système de filtration) est qualifiée de « zone de confinement de petits animaux » ou zone PA. Les « salles animalières » désignent les pièces où les animaux sont hébergés dans des cages de confinement primaire, à l'intérieur d'une zone PA. La figure 13-1 illustre une salle animalière de base.
Il existe de nombreux types de cages de confinement primaire. Il peut s'agir de micro-isolateurs, de modèles plus complexes dotés de filtres à haute efficacité pour les particules de l'air (HEPA) ou encore d'étagères de cages entièrement ventilées. Le type de cage choisi pour le projet devrait être adapté à l'espèce animale et à la méthode de décontamination prévue. Les exigences relatives aux cages et les activités opérationnelles devront tenir compte du niveau de confinement requis pour l'agent pathogène utilisé. Il est préférable de consulter directement la matrice 3.7 de la NCB pour déterminer les exigences minimales en matière de cages de confinement primaire dans les zones PA. Grâce aux percées technologiques réalisées dans le domaine des cages, il est maintenant possible de mieux réguler certains facteurs micro-environnementaux tels que la température, l'échange d'air et l'humidité. La zone de confinement et les systèmes de soutien devraient également être conçus en fonction du type de cages qui sera utilisé, pour assurer une humidité et une ventilation suffisantes, et une alimentation électrique de secours en cas de panne.
La figure 13-2 illustre un système de cage ventilée, que l'on utilise fréquemment dans les zones PA comme cage de confinement primaire. On trouve à la figure 13-2 (a) des étagères de cages ventilées (contenant de nombreux micro-isolateurs) qui reçoivent chacune de l'air filtré. L'air évacué peut être filtré et rediffusé dans la pièce, ou envoyé directement dans le circuit d'évacuation de la pièce. La figure 13-2 (b) présente le diagramme d'un micro-isolateur ventilé muni d'un couvert filtre et qui se raccorde à un système filtré d'évacuation de l'air qui assure le confinement primaire de petits animaux (p. ex. souris). Les filtres sont nécessaires, mais le recours aux filtres HEPA dépendra de l'agent pathogène (c.-à-d. selon les résultats de l'ELR).
13.2.2 Zones de confinement de gros animaux
Une zone de confinement d'animaux dans laquelle les pièces logeant les animaux assure le confinement primaire est une « zone de confinement de gros animaux » (zone GA). Les « box » désignent les pièces ou les espaces, dans une zone GA, où les animaux sont hébergés. Contrairement aux espaces de travail en laboratoire ou aux zones PA, dans lesquelles les ESB ou les cages de confinement assurent un confinement primaire et les systèmes mécaniques, un confinement secondaire, les box situés dans une zone GA assurent à la fois le confinement primaire et secondaire. Les animaux d'une zone GA ne sont pas logés dans des cages de confinement primaire (p. ex. ils sont hébergés dans des stalles, enclos ou cages non filtrées). Une cage non filtrée (illustrée en détail à la figure 13-3) est un type de cage ouverte destiné aux petits animaux (p. ex. ratons laveurs, PNH).
Le type d'hébergement et le matériel utilisé pour la manipulation des animaux devraient être adaptés à l'espèce animale. Par exemple, une zone GA peut loger des souris, des ratons laveurs, des PNH ou des chiens dans des cages non filtrées (c.-à-d. des cages uniquement destinées à limiter le déplacement des animaux et qui ne sont pas dotées de filtres qui empêchent la dispersion de matières infectieuses ou de toxines), des poules ou des cochons dans des enclos, ou du bétail ou des chevreuils dans des stalles situées dans le box. La figure 13-4 (a) présente un exemple de box doté de cages non filtrées pouvant servir à l'hébergement d'animaux tels que des chiens, des chats, des ratons laveurs ou des PNH. À la figure 13-4 (b) est schématisé un box conçu avec un autre type de cage ouverte : trois stalles pouvant contenir jusqu'à trois gros animaux tels que des vaches, des chevreuils, des chevaux ou des chèvres.
Dans les zones GA, il peut s'accumuler des concentrations élevées d'agents pathogènes dans les box, et les animaux peuvent produire des aérosols infectieux en fortes concentrations. Le personnel qui pénètre dans un box situé dans une zone GA devrait prendre soin de porter un EPI, car il s'agit de la principale protection contre l'exposition aux agents pathogènes. Situées dans les zones GA, les salles de nécropsie sont des salles où l'on effectue l'examen et la dissection des cadavres d'animaux et il peut y avoir plusieurs salles de nécropsie dans une zone GA. Dans certains cas (p. ex. une zone GA où des petits animaux sont logés dans des cages ouvertes), les nécropsies et les dissections peuvent être réalisées hors de la zone GA, dans une ESB (c.-à-d. pas dans une salle de nécropsie). Les salles de nécropsie sont souvent les zones les plus contaminées; les activités de nécropsie sont souvent associées à un risque élevé de production d'aérosols infectieux, d'éclaboussures ou de déversement de matières infectieuses, et à une contamination grossière En outre, l'exposition à des agents pathogènes et à des toxines dans les salles de nécropsie peut être attribuable à des instruments coupants ou aux extrémités tranchantes ou pointues des os fracturés. Tout comme pour les box, il est extrêmement important que les employés portent un EPI pour se protéger d'une exposition dans la salle de nécropsie et pour prévenir la propagation de la contamination; on devrait donc tenir compte de ces facteurs dans le choix de l'EPI. Les mesures d'ingénierie, par exemple une table de travail à ventilation descendante, peuvent servir à réduire la propagation des aérosols dans la salle de nécropsie, mais ne permettront pas de contenir toutes les matières infectieuses et les toxines. Les protocoles d'entrée et de sortie des salles de nécropsie devraient comprendre des directives sur le temps nécessaire au dépôt des aérosols, avant l'ouverture des portes, en particulier s'il n'y a pas de sas attenant à la salle de nécropsie.
Les box et les salles de nécropsie situés dans une zone GA font l'objet d'exigences supplémentaires et parfois uniques concernant le confinement physique et les pratiques opérationnelles dans le but de prévenir la dispersion d'agents pathogènes et de toxines et de protéger le personnel qui doit pénétrer dans ces espaces d'une exposition éventuelle. Les exigences propres aux zones GA sont énoncées dans les chapitres 3, 4 et 5 de la NCB. On y fait une distinction entre les exigences s'appliquant aux zones GA de niveau de confinement 2 (NC2) et de niveau de confinement 3 (NC3) et les exigences d'autres aires de travail du même niveau de confinement en séparant ces exigences et en les désignant « NC2-Ag » et « NC3-Ag », respectivement (Ag pour agriculture).
13.2.3 Considérations liées à la conception des zones de confinement d'animaux
Les considérations liées à la conception de toute zone de confinement, y compris les zones de confinement d'animaux, sont présentées au chapitre 22; la présente section porte sur plusieurs concepts clés se rapportant uniquement à la conception des zones de confinement d'animaux.
13.2.3.1 Conception à un seul corridor ou à deux corridors
Dans les zones de confinement plus complexes qui renferment de nombreuses salles animalières ou de nombreux box, la présence de corridors « propres » (c.-à-d. non contaminés) et de corridors « sales » (c.-à-d. contaminés ou soupçonnés de l'être) distincts peut faciliter la circulation du personnel d'une salle ou d'un box à l'autre. Les zones GA ayant une configuration à deux corridors (c.-à-d. corridors « propres » et « sales » distincts) qui relient les box et les salles de nécropsie possèdent des avantages par rapport aux zones GA conçues avec un seul corridor (« conception à un seul corridor »). La conception à deux corridors simplifie la circulation des animaliers, du personnel, des animaux, de la nourriture, du matériel et des échantillons. Cette conception réduit aussi au minimum le risque de contamination croisée entre box. La circulation des animaux et du personnel dans les zones de confinement d'animaux conçues avec un seul corridor est très différente de celle des zones avec deux corridors. Il est essentiel que la circulation des animaux et du personnel dans les zones à un corridor et dans celles à deux corridors soit bien définie dans les procédures opératoires normalisées (PON). La figure 13-5 présente des exemples d'une conception à un seul corridor et d'une conception à deux corridors dans une zone GA de NC2 ou de NC3 (c.-à-d. NC2-Ag ou NC3-Ag).
Dans une installation conçue avec un seul corridor, on pourrait établir que le corridor est un corridor « propre » (c.-à-d. non contaminé); par conséquent, les sas permettant d'entrer dans chacun des box ou chacune des salles de nécropsie ou d'en sortir jouent un rôle important, et il est crucial de suivre rigoureusement les procédures opératoires (surtout les protocoles d'entrée et de sortie) pour empêcher la propagation d'une contamination dans la zone de confinement. On peut aussi décider que le seul corridor est un corridor « sale ». Dans ce cas, la présence d'un sas attenant à chacun des box et la mise en place de procédures opératoires ne sont pas essentielles puisque le sas ne sépare pas une zone « propre » d'une zone « sale ». Il est alors primordial de suivre à la lettre les procédures d'entrée et de sortie aux points d'entrée et de sortie de la zone de confinement pour prévenir la dispersion d'agents pathogènes. Dans la conception à un seul corridor illustrée à la figure 13-5 (a), le corridor d'accès est considéré comme « sale » (c.-à-d. contaminé). Pour accéder à la zone de confinement, les employés empruntent un sas qui se prend par le corridor (entrée et sortie). Les employés pénètrent dans chacun des box et chacune des salles de nécropsie par le corridor en traversant un sas distinct (entrée et sortie). Dans les installations où chaque box ne dispose pas d'un sas et d'une douche (p. ex. zones GA de NC2), des mesures procédurales limitant la contamination peuvent être une option si elles sont appuyées par une ELR. La formation adéquate du personnel sur la circulation entre box (p. ex. manipuler d'abord les animaux non infectés, utiliser les pédiluves et la désinfection chimique des couches externes de l'EPI après être sorti du box et être entré dans le corridor « sale ») peut prévenir efficacement la contamination.
À l'opposé, dans la conception à deux corridors (figure 13-5[b]), deux corridors distincts, l'un « propre » et l'autre « sale », réduisent au minimum la propagation de la contamination des animaux infectés vers des aires précises de la zone. Pour accéder à la zone de confinement, les employés empruntent un sas qui se prend par le corridor « propre » (entrée et sortie). L'entrée des animaux dans la zone de confinement se fait aussi par le corridor « propre ». Le corridor « sale » sert à la circulation des animaux infectés entre les box et les salles de nécropsie. En général, il est interdit d'entrer dans plus d'une salle animalière ou plus d'un box à partir d'un corridor « propre » sans changer d'EPI. Toutefois, dans certains cas, il est possible de ne pas changer d'EPI lorsqu'on se déplace des animaux non infectés vers des animaux infectés. L'entrée dans plus d'un box à partir d'un corridor « sale » est permise si le même agent pathogène est manipulé dans toutes les salles et tous les box et selon la nature du travail. Après des activités dans un box ou une salle de nécropsie, il faut enlever l'EPI à usage réservé dans le sas attenant avant d'accéder au corridor « propre ». Pour sortir de la zone de confinement, on emprunte un sas qui donne sur un corridor « propre ».
13.2.3.2 Accès et sas
L'accès aux box situés dans une zone GA se fait par un ou plusieurs sas. Selon la conception (décrite à la section 13.2.3.1) et le niveau de confinement de la zone, les sas peuvent aussi être situés aux points d'entrée ou de sortie de chacun des box et de chacune des salles de nécropsie. Les sas créent un espace tampon qui protège l'environnement extérieur des matières infectieuses et des toxines manipulées dans la zone; ils permettent au personnel de séparer les vêtements personnels des vêtements réservés au travail dans un box et de l'EPI et favorisent le maintien du courant d'air vers l'intérieur (CAVI) dans les zones de confinement d'animaux, ce qui préserve l'intégrité du confinement. On peut réaliser une ELR pour déterminer la nécessité de prendre une douche avant de sortir d'une zone GA de NC2 (c.-à-d. NC2-Ag), par exemple si l'on a de nombreux contacts quotidiens avec des animaux infectés ou si l'on manipule des animaux porteurs d'agents pathogènes qui font partie de leur flore normale, mais qui peuvent infecter les humains. Le sujet des sas est approfondi au chapitre 3.
Le fait de restreindre l'accès à une zone de confinement d'animaux accroît la sécurité du personnel, protège mieux les animaux et permet de confiner les agents pathogènes et les toxines manipulés et entreposés dans cette zone. Dans certains cas, il est parfois nécessaire d'avoir l'accès limité ou l'accès restreint à certaines aires de la zone de confinement (p. ex. salles animalières individuelles, box et salles de nécropsie) selon les agents pathogènes, les toxines et les activités menées dans la zone. Des systèmes de contrôle d'accès, comme les cartes d'accès électroniques, les codes d'accès et les serrures à clé non reproductible permettent de restreindre l'accès aux personnes autorisées. L'accès aux salles animalières, aux box ou aux salles de nécropsie peut être restreint à l'aide d'un système de contrôle d'accès ou d'autres moyens comme un affichage (p. ex. « personnes autorisées seulement »), s'ils sont jugés acceptables. L'installation de fenêtres d'observation dans les portes donnant accès à une salle animalière ou à un box est généralement recommandée pour que le personnel puisse voir à l'intérieur de la salle ou du box avant d'y entrer et s'assurer que les animaux ne sont pas en liberté.
13.2.3.3 Conservation au froid
Si les tissus et les carcasses ne sont pas éliminés immédiatement après l'euthanasie ou les activités de nécropsie, il faudra les réfrigérer pour retarder leur putréfaction et réduire au minimum les odeurs. On devrait tenir compte de la taille de l'animal utilisé et de la quantité de carcasses à conserver avant l'élimination pour s'assurer que la zone de conservation au froid ou l'équipement nécessaire sera de taille suffisante; cet équipement pourrait être une chambre froide ou un appareil de réfrigération, comme un congélateur ou un réfrigérateur, de la bonne taille, selon la grosseur de l'animal. Dans une zone GA, l'installation d'un appareil de conservation au froid dans la salle de nécropsie ou près de cette dernière réduira au minimum le déplacement des carcasses, possiblement lourdes, et limitera la dispersion de la contamination.
13.2.3.4 Exigences physiques uniques
Puisque les animaux sont curieux de nature et qu'ils peuvent mâcher ou tirer des objets, la présence d'obstacles en saillie (p. ex. dispositifs d'éclairage, appareils électriques et tuyaux apparents) dans les installations devrait être réduite au minimum, et on devrait faire en sorte qu'ils soient adéquatement recouverts. Les mécanismes de verrouillage devraient être choisis avec soin : ils doivent être assez complexes pour empêcher la fuite des animaux et tenir compte de la dextérité de ces derniers. Dans les zones de confinement d'animaux, les planchers doivent être résistants aux impacts et capables de supporter le poids des animaux et du matériel sans devenir rainurés ou fendillés (matrice 3.4 de la NCB). Ils devraient aussi être conçus pour résister à une exposition prolongée à l'urine. Les barrières, les tapis de caoutchouc et les cages devraient être assez solides pour résister à la détérioration causée par les animaux. Il faudrait concevoir l'édifice et choisir les revêtements de surface d'une zone de confinement d'animaux de façon à ce que les salles animalières, les box et les salles de nécropsie puissent résister au nettoyage, à la décontamination et au lavage sous forte pression fréquents.
Les planchers devraient être texturés et antidérapants pour que les animaux et les personnes qui manipulent ces derniers puissent y adhérer, même lorsque la surface est mouillée. Le personnel devrait aussi enfiler des chaussures antidérapantes qui adhèrent aux planchers mouillés et glissants. Comme le nettoyage de ces espaces nécessite de grandes quantités d'eau, il est recommandé que les planchers soient inclinés vers les siphons de sol pour éviter une stagnation de l'eau contaminée. Dans les zones GA de NC2 (c.-à-d. NC2-Ag) où l'on manipule des prions, les zones de NC3 où des agents zoopathogènes non indigènes sont manipulés et les zones GA de NC3 (c.-à-d. NC3-Ag), les siphons de sol doivent être séparés de ceux des zones de confinement inférieur et être directement reliés à un système de décontamination des effluents pour que tout déchet liquide soit décontaminé avant son rejet dans les égouts sanitaires.
13.3 Matériel
Les carcasses de bétail et de gros animaux (p. ex. chevreuils, orignaux) peuvent être très difficiles à déplacer dans la zone de confinement. Les grosses carcasses pourraient devoir être emportées à la salle de nécropsie ou à l'unité d'élimination à l'aide d'un système de palan et de rail surélevé. Au moment de planifier la hauteur d'une zone où l'on travaille avec de gros animaux, on devrait envisager la possibilité d'installer un rail, un palan à chaîne et un système motorisé, et de prévoir le dégagement nécessaire pour le levage des animaux. Dans les zones GA (notamment les salles de nécropsie), seul le personnel ayant reçu la formation appropriée et portant un casque de protection devrait être autorisé à utiliser le palan et le monorail électriques.
Il est recommandé que les interventions chirurgicales et les nécropsies soient effectuées dans des espaces de travail en laboratoire réservées à cette fin (c. à d. salles d'opération) ou des salles de nécropsie situées dans la zone de confinement d'animaux, séparées des salles animalières ou des box, dans la mesure du possible. Une bonne préparation est primordiale pour assurer la sécurité du personnel et une prestation adéquate de soins aux animaux; la zone de confinement devrait être équipée de tous les outils et de tout le matériel nécessaires. Pour choisir les outils et le matériel utilisés lors des chirurgies et des nécropsies, il faudrait tenir compte du risque de blessure qu'ils peuvent entraîner et de la production éventuelle d'aérosols infectieux. Par exemple, il est plus prudent de se servir d'un outil manuel (p. ex. scie à main) que d'un outil électrique (p. ex. scie Stryker) au cours d'intervention pour réduire au minimum les risques de contamination grossière et de production d'aérosols. Il faut maîtriser les techniques afin de prévenir la dispersion excessive de la contamination et la formation d'aérosols provenant des liquides et des tissus. Les personnes qui pratiquent des interventions chirurgicales et des nécropsies devraient déployer tous les efforts possibles afin de limiter la propagation de la contamination.
13.4 Formation du personnel
Les employés qui travaillent avec des animaux, les employés responsables de l'entretien et les autres employés qui peuvent avoir besoin de pénétrer dans l'installation doivent recevoir une formation axée spécifiquement sur les procédures à suivre dans les installations pour animaux (voir la matrice 4.3 de la NCB pour les exigences particulières). Les plans de formation doivent être élaborés pour chaque personne et tenir compte des tâches de cette dernière dans l'installation, des risques physiques et biologiques associés aux animaux, des techniques de contention, des caractéristiques des agents pathogènes ou des toxines utilisés, et de toutes les PON pertinentes. Ces PON devraient décrire tous les aspects des travaux proposés, notamment les entrées et les sorties, l'EPI, la communication entre le personnel, l'alimentation, l'échantillonnage, la manipulation des animaux, la fuite d'animaux (prévention et capture), les signes de maladie, le nettoyage quotidien, la décontamination, les interventions chirurgicales ou les activités de nécropsie, et tout autre protocole s'appliquant aux travaux. La formation devra aussi comprendre les protocoles se rapportant aux situations d'urgence, décrites au chapitre 17.
Le programme de formation devrait être élaboré en tenant compte des lignes directrices pertinentes du CCPA. Des visites d'autres installations de confinement et des discussions avec des employés possédant une vaste expérience de travail avec le modèle animal étudié pourraient être bénéfiques aux employés en formation. Il est recommandé que la formation comprenne des scénarios fictifs et des exercices préalables réalisés avant la véritable inoculation des animaux. Il faut veiller à ce que les coordonnées d'animaliers d'expérience soient accessibles dans toute la zone de confinement d'animaux. Le programme de formation est décrit en détail au chapitre 8.
13.5 Méthodes de manipulation et de contention
Le recours à de bonnes méthodes de manipulation et de contention aide à prévenir les blessures et réduit le risque de morsure, d'égratignure ou de toute autre exposition à des matières infectieuses, et ainsi protéger contre des transmissions secondaires dans la communauté. En outre, les méthodes de manipulation et de contention judicieuses réduisent au minimum le stress chez les animaux; les animaux stressés réagissent souvent de façon imprévisible, et d'un point de vue scientifique, peuvent subir des modifications physiologiques qui influencent les résultats. Il faudrait toujours faire preuve de vigilance et bien contenir les animaux pendant une inoculation afin d'éviter de s'inoculer par accident. Les méthodes de manipulation varient considérablement d'une espèce à l'autre. Le type d'hébergement et le matériel utilisé pour manipuler les animaux devraient être adaptés à l'espèce. Il existe de nombreuses ressources sur les techniques de manipulation adaptées aux diverses espèces animales, notamment le CCPA et les ressources d'autres paysNote de bas de page 4Note de bas de page 5Note de bas de page 6Note de bas de page 7Note de bas de page 8Note de bas de page 9Note de bas de page 10.
Lorsque les animaux sont logés dans un système de cage, on peut recourir à la contention chimique ou à un dispositif d'immobilisation (p. ex. cages munies d'un panneau mobile ou d'un faux grillage en arrière) pour immobiliser les animaux, selon l'espèce. Les cages de transfert peuvent être envisagées pour déplacer les animaux à l'intérieur d'une zone de confinement. Les employés devraient également prendre des précautions particulières afin d'éviter les blessures graves (p. ex. écrasement) lorsqu'ils travaillent avec de gros animaux. Dans les zones GA, les dispositifs tels que les systèmes d'entrée, les conduits inclinés, les tunnels, les dispositifs d'immobilisation et la contention chimique peuvent servir à immobiliser et à transférer les animaux vers d'autres salles ou box.
Idéalement, il faudrait user d'une contention minimale pour assurer la sécurité à la fois de l'animal et de la personne le manipulant et, dans la mesure du possible, il est recommandé d'habituer l'animal à la méthode de contention avant d'amorcer les manipulations relatives au projet. À titre d'exemple, le porc s'habituera à porter une écharpe si l'on utilise un renforcement positif. On peut aussi entraîner les chevaux ainsi que les bovins à accepter un licou et une laisse.
13.6 Décontamination et gestion des déchets
Pour maintenir le confinement, il est essentiel que tous les déchets soient décontaminés de façon sûre et efficace. Dans les zones GA à niveau de confinement élevé (c.-à-d. NC3-Ag et Niveau de confinement 4 [NC4]), de même que dans les zones GA de NC2 (c.-à-d. NC2-Ag) où l'on manipule des prions, les siphons de sol doivent être reliés à un système de décontamination des effluents. À l'opposé, l'écoulement de tout liquide contaminé (p. ex. provenant du lavage des cages) dans les siphons de sol est empêché en mettant en place des procédures opératoires dans les zones PA de NC3 où l'on travaille uniquement avec des agents pathogènes humains ou des agents zoopathogènes indigènes. Il est recommandé que les siphons de sol soient installés seulement en cas de nécessité, afin que le risque de rejet de liquides contaminés dans les égouts sanitaires soit réduit au minimum. Les siphons de sol qui ne sont pas utilisés doivent être scellés ou bouchés. Dans toutes les zones de confinement, les liquides contaminés doivent être décontaminés avant d'être déversés dans les égouts sanitaires; par conséquent, les procédures qui réduisent la quantité de déchets liquides produits (p. ex. utiliser le pédiluve plutôt que rincer les bottes, absorber les liquides dans de la litière) sont encouragées.
Dans les box reliés à un système de décontamination des effluents, la litière peut boucher les siphons de plancher. Les systèmes de décontamination des effluents doivent donc être munis d'un mécanisme qui les empêche de se boucher. Ce mécanisme peut être physique ou opérationnel, par exemple on peut retirer régulièrement la litière à la main et la décontaminer à l'autoclave ou l'incinérer, si l'efficacité de cette intervention a été validée. La décontamination des carcasses et des déchets anatomiques d'animaux est expliquée en détail au chapitre 15.
Le nettoyage des cages peut se faire à l'aide de divers appareils et procédés. Dans les zones PA, la manipulation des cages et l'élimination de la litière sont réalisées dans une ESB ou une station de changement de cage ventilée conçue pour confiner les aérosols, protéger l'utilisateur et préserver l'environnement. Les stations non ventilées pour le transfert d'animaux ne devraient pas être utilisées avec des animaux infectés, car elles ne protègent pas l'utilisateur et ne contribuent pas à préserver l'environnement. Les cages devraient être fermées; les surfaces des cages devraient être décontaminées avant que ces dernières soient retirées de l'ESB, puis envoyées à l'autoclave en vue de leur nettoyage final. Comme il existe divers types de cages et plusieurs façons d'éliminer la litière, il faut réaliser des recherches exhaustives avant de choisir la cage et la méthode qui conviennent.
Le lavage des cages ne peut servir de technologie de décontamination primaire que si l'efficacité de la méthode envers les agents pathogènes ou les toxines utilisées a été validée. Souvent, les cages et la litière sont décontaminées dans la zone de confinement avant d'être envoyées au lavage. Dans les zones de confinement élevé, les aires de lavage des cages sont situées hors de la zone de confinement uniquement si les cages sont décontaminées avant d'être retirées de la zone de confinement. En absence d'aire de nettoyage des cages, on peut recourir aux cages jetables.
Les appareils de nettoyage à haute pression pour nettoyer les box devraient être utilisés le moins possible et en cas de besoin seulement, car ils produisent des aérosols. On peut d'abord nettoyer les box au moyen de jets d'eau à faible pression, puis utiliser un pulvérisateur puissant. Il est recommandé de nettoyer les box chaque jour afin de réduire l'accumulation d'agents contaminants, puis de procéder à une décontamination complète des box à la fin de l'expérience.
13.7 Isolement
Le terme « isolement » est utilisé lorsque seuls certains éléments de confinement sont nécessaires. Pendant certaines périodes succédant à l'inoculation avec certains agents pathogènes, les excrétions naturelles et le simple contact avec des animaux infectés n'entraînent pas de risques de transmission de l'agent (p. ex. au cours de la période d'incubation de l'encéphalopathie spongiforme bovine chez les bovins). Par conséquent, les animaux infectés devraient demeurer bien isolés, mais il n'est pas nécessaire de les loger et de les garder dans une zone de confinement comme il est précisé dans la NCB. Les éléments d'isolement varient selon l'agent pathogène utilisé et le plan d'étude. De nombreux facteurs doivent être pris en considération, notamment la transmission de la maladie, le risque d'excrétion et le degré d'endémicité au Canada. D'après plusieurs articles récemment publiés indiquant que des prions de la tremblante du mouton peuvent été décelés dans les excréments et les sécrétions orales de moutons à l'aide de techniques sensibles dans un contexte préclinique, il n'est pas acceptable d'héberger en isolement des moutons infectés par des prions de la tremblante de mouton. Ils doivent en tout temps être hébergés dans une zone de confinement appropriéeNote de bas de page 11Note de bas de page 12Note de bas de page 13.
Il faut obtenir l'autorisation de l'Agence de la santé publique du Canada (ASPC) ou de l'Agence canadienne d'inspection des aliments (ACIA) avant d'héberger des animaux infectés en laboratoire dans des conditions d'isolement. Les éléments d'isolement fondamentaux et minimaux nécessaires dépendent des résultats de l'ELR. Voici certains autres facteurs à prendre en considération lors du travail en isolement :
- Chaque jour, on devrait observer les animaux isolés et enregistrer le nombre d'animaux. On recommande de contrôler un accès unique pour interdire toute entrée non autorisée du personnel ou d'animaux dans l'aire d'isolement ou sortie hors de celle-ci. Le contrôle d'accès devrait être vérifié pour s'assurer qu'il fonctionne de la façon prévue.
- Une méthode limitant l'accès d'animaux sauvages ou de nécrophages à l'aire d'isolement devrait être mise en place.
- Un double système d'identification des animaux devrait être en place et une vérification de l'identité devrait se faire tous les jours. Si une étiquette ou un autre dispositif d'identification est manquant, il devrait être remplacé immédiatement.
- Les matières (p. ex. fumier et litière) des enclos peuvent subir un compostage et être l'objet d'une élimination réalisée dans des conditions normales. Les paramètres du compostage doivent être validés pour que leur efficacité contre les matières infectieuses utilisées soit démontrée.
- Les animaux inoculés avec un agent pathogène humain, un agent zoopathogène ou une autre matière biologique dans le cadre d'expériences ne doivent pas entrer dans la chaîne alimentaire, qu'elle soit humaine ou animale.
13.8 Considérations liées au travail avec des animaux infectés par des prions
Les prions associés à une encéphalopathie spongiforme transmissible (EST) peuvent infecter une vaste gamme d'espèces animales, notamment les bovins, les moutons, les chevreuils et les visons, ainsi que les humains. Il ne semble pas exister de cas confirmés d'intoxication ou d'infection contractée en laboratoire (ICL) d'EST chez les humains, mais il faut prendre garde d'éviter une exposition à des matières contaminées et une dispersion de prions infectieux dans l'environnement lorsqu'on travaille avec des prions ou des animaux infectés avec des prions. Les voies de transmission les plus probables empruntées par les prions pour infecter les humains sont les suivantes : inoculation accidentelle avec des instruments contaminés, morsures et égratignures d'animaux infectés, ingestion d'une matière contenant des prions. On dispose de peu d'éléments probants indiquant que les maladies à prions peuvent être contractées par inhalation; toutefois, l'infection en raison d'une exposition à des aérosols ou à des éclaboussures est possible, surtout s'il y a eu contact avec des muqueusesNote de bas de page 14Note de bas de page 15Note de bas de page 16Note de bas de page 17.
Jusqu'à maintenant, il existe peu de données indiquant qu'une encéphalopathie spongiforme bovine peut se transmettre entre animaux ou par la mère dans un troupeau de bovins; la transmission semble plutôt se faire par ingestion d'une nourriture contaminée (viande et farine d'os)Note de bas de page 18Note de bas de page 19Note de bas de page 20Note de bas de page 21Note de bas de page 22. À l'opposé, la transmission maternelle de la tremblante, de même que la transmission d'un animal à l'autre a été documentée chez des moutons d'un même troupeauNote de bas de page 14Note de bas de page 23Note de bas de page 24. Selon des documents, les chevreuils et les wapitis contractent la maladie débilitante chronique (MDC) par contact entre animaux et par une exposition à un environnement fortement contaminé. On a décelé des prions dans de nombreux tissus de cervidés (p. ex. tissu du système nerveux central, sang, muscle cardiaque et muscles squelettiques, pancréas) et dans des sécrétions et des excrétions (p. ex. fèces, urine, salive) de cervidés infectés par l'agent de la maladieNote de bas de page 25Note de bas de page 26.
Compte tenu des connaissances sur la transmission des prions et de la longue période d'incubation des EST chez les hôtes, certains animaux inoculés avec des prions uniquement ne présentent un risque élevé de transmission de l'agent pathogène que pendant certaines périodes (c.-à-d. immédiatement après l'inoculation et à la parturition) au cours desquelles des prions peuvent être excrétés dans les sécrétions et les excrétions. Les pratiques opérationnelles suivantes sont des éléments dont il faudrait tenir compte lorsqu'on travaille avec des animaux infectés par des prions et lorsqu'on élimine des déchets :
- Encéphalopathie spongiforme bovine chez les bovins : les déchets et la litière devraient être recueillis et traités selon le risque de contamination par des prions pendant au moins quatre semaines après l'inoculation et davantage si des signes cliniques sont observés. Pendant les périodes d'incubation (c.-à-d. plus de quatre semaines après l'inoculation et avant l'apparition de signes cliniques), les excrétions naturelles et le simple contact avec des animaux infectés ne sont pas considérés comme un risque de transmission de prions. Par conséquent, lors de ces périodes sans excrétion, il pourrait être acceptable (c.-à-d. avec approbation au préalable de l'ASPC ou de l'ACIA) d'héberger les animaux hors de la zone GA de NC2 (c.-à-d. NC2-Ag), s'ils sont bien isolés et compte tenu des résultats de l'ELR menée en fonction des expériences. Pendant l'isolement, la litière et les déchets peuvent faire l'objet d'un compostage et d'une élimination réalisés dans des conditions normales.
- Tremblante chez les moutons : la litière, le liquide placentaire et tout autre déchet devraient être recueillis et décontaminés adéquatement pour que les prions soient inactivés pendant au moins quatre semaines après l'inoculation et davantage si des signes cliniques sont observés. Il est préférable de mener les expériences dans une zone GA de NC2 (c.-à-d. NC2-Ag) qui convient aux travaux avec des prions pendant l'agnelage. Il faudrait isoler les brebis gestantes pour que les matières placentaires puissent être recueillies et incinérées et les liquides placentaires soient décontaminés comme il se doit. L'aire d'agnelage doit être décontaminée au moment du retrait de la brebis et de l'agneau.
- MDC chez les cervidés (p. ex. chevreuils, wapitis et orignaux) : les animaux atteints de MDC doivent demeurer dans une zone de confinement adaptée en tout temps après l'inoculation. Tous les déchets et la litière doivent être recueillis et décontaminés pendant toute la durée de l'étude.
- EST non caractérisée (p. ex. encéphalopathie spongiforme féline, encéphalopathie spongiforme des ongulés exotiques) et espèces non hôtes inoculées avec un agent d'une maladie à prions (p. ex. MDC chez les bovins ou encéphalopathie spongiforme bovine chez les chevreuils) : lorsqu'on ignore si des prions sont excrétés dans les déchets animaux, tous les déchets animaux et la litière (en tout temps après l'inoculation) doivent être recueillis et décontaminés pendant toute la période d'étude. Il est recommandé d'incinérer les déchets animaux solides et la litière qui contiennent des prions à 850 °C pour les décontaminer. Quant aux déchets liquides renfermant des prions, on peut les traiter à la chaleur à 134 °C pendant 1 heure pour les décontaminer.
Vous trouverez d'autres précisions sur les méthodes de décontamination recommandées de déchets et d'autres matières contaminés par des prions au chapitre 15.
13.9 Travail avec des primates non humains
Le travail avec des PNH comporte des risques uniques pour les animaliers et le personnel de la zone de confinement. Non seulement les PNH peuvent être porteurs d'agents pathogènes (c.-à-d. ceux de la flore normale) dangereux pour la santé et la sécurité du personnel, mais les animaux proprement dits posent également un risque. Par exemple, en raison de leurs caractéristiques physiques (p. ex. canines, mâchoires puissantes, ongles des doigts et des orteils acérés), les PNH sont capables de causer des blessures graves aux animaliers qui peuvent occasionner une exposition à des agents pathogènes. On devrait prendre en considération ces caractéristiques lorsqu'on conçoit les salles animalières ou les box destinés à leur hébergement. Les lignes directrices du CCPA offrent des renseignements sur les exigences liées à l'hébergement et la manipulation des PNHNote de bas de page 6.
Voici certains des agents pathogènes que les PNH hébergent naturellement et qui sont associés à un risque pour le personnel manipulant ces animaux : bactéries (p. ex. Salmonella, Shigella, Campylobacter, Mycobacterium tuberculosis), virus (p. ex. virus de l'hépatite A, virus de l'immunodéficience simienne, Macacine herpesvirus1 [autrefois appelé virus de l'herpès B ou virus de l'herpès du cercopithèque du type 1]) parasites protozoaires et métazoaires (p. ex. Entamoeba, Blastocystis, Trichomonas, Balantidium). Le Macacine herpesvirus 1 est un virus enzootique présent chez les macaques captifs et pouvant être retrouvé dans jusqu'à 70 % de leur population, notamment les macaques rhésus et cynomolgusNote de bas de page 27. Bien que ce virus cause des lésions buccales chez le singe, son hôte naturel, son excrétion asymptomatique des muqueuses buccales et de l'appareil uro-génital, quoique rare, ainsi que sa présence dans le liquide conjonctival peuvent survenir sans aucun signe clinique de la maladie. Au moins 50 cas d'infection humaine ayant provoqué une maladie grave ou un décès ont été documentésNote de bas de page 28. Exception faite d'un cas de transmission de personne à personne, toutes ces infections ont été contractées par des personnes exposées à des PNH ou à des tissus de PNH. La transmission aux humains semble surtout résulter d'une exposition à de la salive contaminée de PNH, à la suite de morsures ou d'égratignures, bien qu'un cas mortel ait été signalé à la suite d'une exposition mucocutanée n'ayant causé aucune blessureNote de bas de page 27. Il existe des lignes directrices sur la manipulation en toute sécurité des macaques, la prévention d'une infection par Macacine herpesvirus 1 et le traitement de ces infections chez les personnes ayant été exposéesNote de bas de page 5. Il est donc fortement recommandé que toutes les colonies de macaques soient manipulées avec prudence et comme si les animaux étaient des porteurs présumés du Macacine herpesvirus 1, même s'ils sont séronégatifs d'après des essais détectant les anticorps.
À l'exception des PNH infectés en laboratoire avec un agent infectieux nécessitant un confinement élevé (c.-à-d. NC3 ou plus élevé) ou porteurs naturels d'un tel agent, la manipulation de PNH dans une zone de confinement d'animaux de NC2 est acceptable et jugée sûre, si les mises en garde supplémentaires précisées à la section 13.1 et les pratiques et mesures de précaution supplémentaires énumérées ci-dessous sont également mises en œuvre :
- Tout PNH ayant causé une morsure ou une égratignure devrait être immédiatement immobilisé, et sa cavité buccale devrait être examinée pour qu'on y vérifie la présence de lésions caractéristiques du Macacine herpesvirus 1;
- Un dispositif protégeant les muqueuses contre l'exposition à des aérosols et à des éclaboussures (p. ex. masque chirurgical, visière, lunettes) devrait être prévu pour les personnes qui manipulent les PNH et pénètrent dans les box où ces animaux sont hébergés;
- Une carte avec les coordonnées des personnes à rejoindre en cas d'urgence médicale doit être remise aux employés de la zone de confinement qui manipulent des PHN; les détails sont précisés au chapitre 7.
Figure 13-1 : Diagramme représentatif d'une salle animalière de base
Le médaillon illustre un système de cage ventilée et une cage de confinement primaire.

Équivalent textuel - Figure 13-1
Cette figure illustre en trois dimensions une salle animalière dans laquelle se trouvent deux étagères de cages ventilées à roulettes. Le médaillon montre un gros plan d’une étagère de cages ventilées et une cage de confinement primaire munie d’un couvert filtre.
Figure 13-2 : Diagrammes représentatifs de cages de confinement primaire
(a) Une étagère à cage ventilée (contenant de multiples micro-isolateurs). L'air évacué est soit filtré et recirculé dans la pièce ou rejeté directement dans le système d'évacuation d'air de la pièce. (b) Un micro-isolateur ventilé muni d'un couvert filtre. Lorsqu'il est relié à une étagère de cage ventilée afin d'évacuer et de filtrer l'air de la cage, ce type de cage assure le confinement primaire pour les petits animaux.
a) Étagère de cage ventilée avec plusieurs cages.

Équivalent textuel - Figure 13-2a
La figure 13-2(A) donne une vue plus détaillée d’un système de cages ventilées. Le système est constitué d’une étagère de cages ventilées qui reçoivent chacune de l’air filtré ou encore de cages de micro‑isolation. L’étagère de cages est munie d’un système de ventilation et d’un cadre en grille dans lequel des cages individuelles peuvent être glissées.
La figure 13‑2(B) illustre une souris dans une cage de micro‑isolation ventilée en plastique transparent munie d’un système d’évaluation de l’air après filtration. Ce dispositif assure le confinement primaire de petits animaux, tels que des souris.
b) Une cage de confinement primaire

Équivalent textuel - Figure 13-2b
La figure 13-2(A) donne une vue plus détaillée d’un système de cages ventilées. Le système est constitué d’une étagère de cages ventilées qui reçoivent chacune de l’air filtré ou encore de cages de micro‑isolation. L’étagère de cages est munie d’un système de ventilation et d’un cadre en grille dans lequel des cages individuelles peuvent être glissées.
La figure 13‑2(B) illustre une souris dans une cage de micro‑isolation ventilée en plastique transparent munie d’un système d’évaluation de l’air après filtration. Ce dispositif assure le confinement primaire de petits animaux, tels que des souris.
Figure 13-3 : Diagramme représentatif d'un système de cage ouverte
La figure montre une cage grillagée (non filtrée) typique qui sert à héberger des petits animaux (p. ex. des PNH ou des ratons laveurs) dans un box. Ce type de cage est uniquement destiné au confinement des animaux à un petit espace dans le box.

Équivalent textuel - Figure 13-3
Cette figure illustre de façon détaillée une cage grillagée (non filtrée) typique qui sert à héberger des petits animaux, comme des primates non humains ou des ratons laveurs, dans un box. Ce type de cage est uniquement destiné au confinement des animaux à un petit espace dans le box; il ne permet pas de confiner des agents pathogènes.
Figure 13-4 : Diagramme représentatif d'un box
(a) Box muni de plusieurs cages ouvertes (non filtrées). Cette configuration est appropriée pour l'hébergement d'animaux comme des chiens, des chats, des ratons laveurs ou des PNH. (b) Box muni de stalles et un système de portes. Cette configuration est appropriée pour héberger jusqu'à trois gros animaux, comme du bétail, des cervidés, des chevaux ou des moutons.
a) Box avec plusieurs cages ouvertes (non filtrées)
Équivalent textuel - Figure 13-4a
La figure 13‑4(a) illustre en trois dimensions un box muni de plusieurs cages ouvertes (cage grillagées non filtrées) installées contre un de ses murs. Cette configuration est appropriée pour l’hébergement d’animaux comme des chiens, des chats, des ratons laveurs ou des primates non humains. La figure 13‑4(b) illustre un box semblable muni de stalles et d’un système de portes. Cette configuration est appropriée pour héberger jusqu’à trois gros animaux, comme du bétail, des cervidés, des chevaux ou des moutons.
b) Box muni de stalles et de systèmes de portes
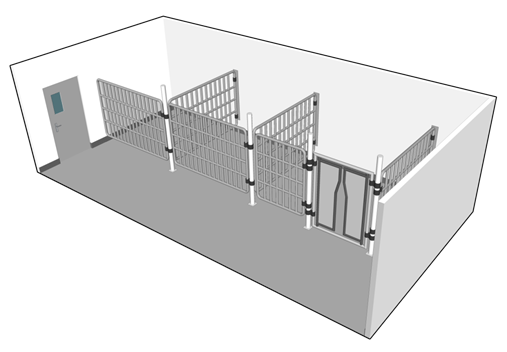
Équivalent textuel - Figure 13-4b
La figure 13‑4(a) illustre en trois dimensions un box muni de plusieurs cages ouvertes (cage grillagées non filtrées) installées contre un de ses murs. Cette configuration est appropriée pour l’hébergement d’animaux comme des chiens, des chats, des ratons laveurs ou des primates non humains. La figure 13‑4(b) illustre un box semblable muni de stalles et d’un système de portes. Cette configuration est appropriée pour héberger jusqu’à trois gros animaux, comme du bétail, des cervidés, des chevaux ou des moutons.
Figure 13-5 : Diagrammes représentatifs de zones de confinement d'animaux munies d'un seul corridor ou de deux corridors
(a) Conception d'une zone GA de NC2 ou de NC3 munie d'un seul corridor (c.-à-d. NC2-Ag ou NC3-Ag). (b) Conception d'une zone GA de NC2 ou de NC3 munie de deux corridors (c.-à-d. NC2 ou NC3). Il est à noter que dans le cas d'une zone GA de NC2, un sas est nécessaire uniquement à l'entrée de la zone de confinement ou à l'entrée de chaque box ou salle de nécropsie. De plus amples renseignements se trouvent à la section 13.2.3.
a) Zone de confinement d'animaux munie d'un seul corridor; Zone GA de NC2 ou de NC3
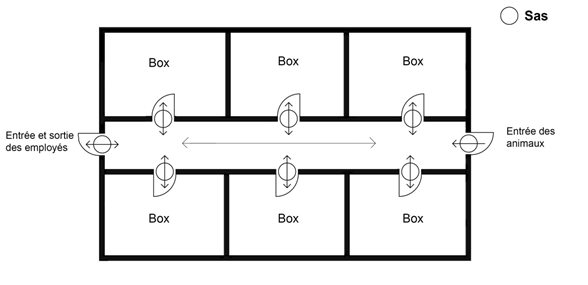
Équivalent textuel - Figure 13-5a
La figure 13‑5(a) montre la conception à un seul corridor convenant pour les aires NC2‑Ag et NC3‑Ag. Le corridor central est considéré comme « sale ». Pour accéder à la zone de confinement, les employés empruntent un sas qui se prend par le corridor (entrée et sortie). Les animaux infectés entrent dans la zone de confinement par un sas différent qui se prend aussi par le corridor. Les employés pénètrent dans chacun des box et chacune des salles de nécropsie par le corridor en traversant un sas distinct (entrée et sortie).
b) Zone de confinement d'animaux munie de deux corridors; Zone GA de NC2 ou de NC3
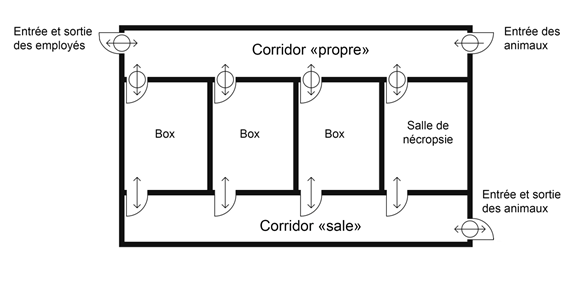
Équivalent textuel - Figure 13-5b
La figure 13‑5(b) illustre une conception à deux corridors distincts – l’un « propre » et l’autre « sale » – pour les aires NC2‑Ag et NC3‑Ag. Dans cette configuration, les box et les salles de nécropsie se situent entre un corridor « propre » et un corridor « sale ». L’accès du personnel et des animaux non infectés à la zone de confinement et hors de celle‑ci se fait par un sas qui se prend par le corridor « propre ». Les animaux infectés, eux, peuvent seulement être amenés dans la zone de confinement et en être sortis par un sas qui se prend par le corridor « sale ». Pour accéder à chacun des box et chacune des salles de nécropsie dans la zone de confinement, on doit traverser un sas qui se prend par le corridor « propre ». Il y a aussi des points d’entrée et de sortie reliant le corridor « sale » à chacun des box et chacune des salles de nécropsie.
Il importe de noter que, dans le cas des aires NC2‑Ag, un sas est nécessaire uniquement à l’un des endroits suivants : entrée ou sortie de la zone de confinement; ou entrée de chaque box ou salle de nécropsie. De plus amples détails sont présentés à la section 3.7.
Références
- Note de bas de page 1
- Phipatanakul, W. et Wood, R. A. (2004). Allergens of Animal and Biological Systems. Dans Fleming, D. O. et Hunt, D. L. (éds), Biological safety: Principles and practices, 4 e éd., p. 241-251, Washington, DC, États-Unis : ASM Press.
- Note de bas de page 2
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada.
- Note de bas de page 3
- Conseil canadien de protection des animaux. (2003). Lignes directrices sur : les animaleries - les caractéristiques, la conception et le développement, Ottawa, ON, Canada : Conseil canadien de protection des animaux.
- Note de bas de page 4
- Conseil canadien de protection des animaux. (1984). Manuel sur le soin et l'utilisation des animaux d'expérimentation, volume 2. Ottawa, ON, Canada : Conseil canadien de protection des animaux.
- Note de bas de page 5
- Olfert, E. D., Cross, B. M. et McWilliam, A. A. (éds). (1993). Guide to the Care and Use of Experimental Animals, 2e éd., volume 1, Ottawa, ON, Canada : Conseil canadien de protection des animaux.
- Note de bas de page 6
- Conseil canadien de protection des animaux. (2015). Microsite des Trois R : Soin et procédures. Consulté le 3 novembre 2015 à l'adresse http://3rs.ccac.ca/fr/soin-et-procedures/sp-procedures/
- Note de bas de page 7
- Conseil canadien de protection des animaux. (2009). Lignes directrices du CCPA sur : le soin et l'utilisation des animaux de ferme en recherche, en enseignement et dans les tests, Ottawa, ON, Canada : Conseil canadien de protection des animaux.
- Note de bas de page 8
- National Research Council of the National Academies. (2011). Guide for the Care and Use of Laboratory Animals , 8e éd., Washington, DC, États-Unis : The National Academy Press.
- Note de bas de page 9
- Federation of Animal Science Societies. (2010). Guide for the Care and Use of Agricultural Animals in Research and Training, 3e éd. Consulté le 3 novembre 2015 à l'adresse http://www.fass.org/docs/agguide3rd/Ag_Guide_3rd_ed.pdf
- Note de bas de page 10
- Hubrecht, R. C. et Kirkwood, J. (éds). (2010). The UFAW Handbook on the Care and Management of Laboratory and Other Research Animals, 8e éd., Chichester, Royaume-Uni : Wiley-Blackwell.
- Note de bas de page 11
- Maddison, B. C., Rees, H. C., Baker, C. A., Taema, M., Bellworthy, S. J., Thorne, L., Terry, L. A. et Gough, K. C. (2010). Prions are secreted into the oral cavity in sheep with preclinical scrapie. Journal of Infectious Diseases. 201:1672-1676.
- Note de bas de page 12
- Terry, L. A., Howells, L., Bishop, K., Baker, C. A., Everest, S., Thorne, L, Maddison, B. et Gough, K. C. (2011). Detection of prions in the faeces of sheep naturally infected with classical scrapie. Veterinary Research. 42:65-71.
- Note de bas de page 13
- Gough, K. C., Baker, C. A., Rees, H. C., Terry, L. A., Spiropoulos, J., Thorne, L. et Maddison, B. C. (2012). The oral secretions of infectious scrapie prions occurs in preclinical sheep with a range of PRNP genotypes. Journal of Virology . 86:566-571.
- Note de bas de page 14
- Denkers, N. D., Seelig, D. M., Telling, G. C. et Hoover, E. A. (2010). Aerosol and nasal transmission of chronic wasting disease in cervidized mice. Journal of General Virology . 91:1651-1659.
- Note de bas de page 15
- Prusiner, S. B. (2004). Prion Biology and Diseases, 2e éd., Cold Spring Harbor, NY, États-Unis : Cold Spring Harbor Laboratory Press.
- Note de bas de page 16
- Ryder, S., Dexter, G., Bellworthy, S. et Tongue, S. (2004). Demonstration of lateral transmission of scrapie between sheep kept under natural conditions using lymphoid tissue biopsy. Research in Veterinary Science. 76(2204):211-217.
- Note de bas de page 17
- Sigurdson C. J. et Miller, M. W. (2003). Other animal prion diseases. British Medical Bulletin . 66:199-212.
- Note de bas de page 18
- Smith, P. G. et Bradley, R. (2003). Bovine spongiform encephalopathy (BSE) and its epidemiology. British Medical Bulletin. 66:185-19.
- Note de bas de page 19
- Castilla, J., Brun, A., Díaz-San Segundo, F., Salguero, F. J., Gutiérrez-Adán, A., Pintado, B., Ramírez, et al. (2005). Vertical Transmission of Bovine Spongiform Encephalopathy Prions Evaluated in a Transgenic Mouse Model. Journal of Virology . 79:8665-8668.
- Note de bas de page 20
- Commission européenne. (1999). The Possible Vertical Transmission of Bovine Spongiform Encephalopathy (BSE): Report of the Working Group. Consulté le 3 novembre 2015 à l'adresse http://ec.europa.eu/food/fs/sc/ssc/out44_en.pdf
- Note de bas de page 21
- Wilesmith, J. W. et Ryan, J. B. (1997). Absence of BSE in the offspring of pedigree suckler cows affected by BSE in Great Britain. Veterinary Record . 141:250-251.
- Note de bas de page 22
- Wrathall, A. E., Brown, K. F., Sayers, A. R., Wells, G. A., Simmons, M. M., Farrelly, S. S., Bellerby, P. et al. (2002). Studies of embryo transfer from cattle clinically affected by bovine spongiform encephalopathy (BSE), Veterinary Record . 150:365-378.
- Note de bas de page 23
- Department of Agriculture des États-Unis, Animal and Plant Health Inspection Service. (2004). APHIS Factsheet: Scrapie. Consulté le 3 novembre 2015 à l'adresse http://www.aphis.usda.gov/animal_health/animal_diseases/scrapie/downloads/fs_ahscrapie.pdf
- Note de bas de page 24
- Garza, M. C., Fernandez-Borges, N., Bolea, R., Badiola, J. J., Castilla, J. et Monleon, E. (2011). Detection of PrPres in Genetically Susceptible Fetuses from Sheep with Natural Scrapie. PLoS One. 6(12):e27525
- Note de bas de page 25
- Sigurdson, C. J. (2008). A prion disease of cervids: Chronic wasting disease. Veterinary Research. 39:41.
- Note de bas de page 26
- John, T. R., Schätzl, H. M. et Gilch, S. (2013). Early detection of chronic wasting disease prions in urine of pre-symptomatic deer by real-time quaking-induced conversion assay. Prion. 7(3):253-258.
- Note de bas de page 27
- Centers for Disease Control and Prevention des États-Unis. (1998). Fatal Cercopithecine Herpesvirus 1 (B Virus) Infection Following a Mucocutaneous Exposure and Interim Recommendations for Worker Protection. MMWR. Morbidity and Mortality Weekly Report. 47(49):1073-1076, 1083.
- Note de bas de page 28
- Cohen, J., Davenport, D. S., Stewart, J. A., Deitchman, S., Hilliard, J. K., Chapman, L. E. et le B Virus Working Group. (2002). Recommendations for Prevention of and Therapy for Exposure to B Virus (Cercopithecine Herpesvirus 1). Clinical Infectious Diseases . 35:1191-1203.
Chapitre 14 - Travail à grande échelle
Les installations de production à grande échelle comme les usines spécialisées en fermentation industrielle et en production de vaccins représentent un risque accru pour le personnel et l'environnement en raison des grandes quantités de matières infectieuses ou de toxines manipulées. C'est la raison pour laquelle le travail à grande échelle est parfois assujetti à des exigences uniques ou plus strictes et à des considérations supplémentaires comparativement aux espaces de travail en laboratoire pour un même niveau de confinement. Le présent chapitre offre des principes directeurs à ceux qui souhaitent élaborer un programme de biosécurité exhaustif dans des aires de production à grande échelle.
14.1 Portée
À ce jour, il n'existe pas de définition acceptée de manière universelle de l'expression « grande échelle ». Selon la publication NIH Guidelines for Research Involving Recombinant DNA Molecules des National Institutes of Health (NIH) des États-Unis, cette expression s'applique à tout volume supérieur à 10 litresNote de bas de page 1. Dans le document Biosafety in Microbiology and Biomedical Laboratories, 4e édition (1999), préparé par les United States Centers for Disease Control and Prevention (CDC) et les NIH, on définit l'expression « quantité de production » comme étant une concentration ou un volume d'organismes infectieux considérablement supérieur à la concentration ou au volume utilisé à des fins d'identification et de typageNote de bas de page 2. Quant au United Kingdom Advisory Committee on Dangerous Pathogens, il estime que ce n'est pas le volume, mais le but des travaux qui détermine l'échelleNote de bas de page 3.
En général, selon l'Agence de la santé publique du Canada (ASPC) et l'Agence canadienne d'inspection des aliments (ACIA), les activités comportant la manipulation de toxines ou la culture in vitro de matières infectieuses à un volume égal ou supérieur à 10 litres sont considérées comme étant du travail à grande échelle. Ces activités peuvent être menées avec un seul contenant d'un volume de 10 litres ou plus ou, dans certains cas, avec plusieurs contenants dont le volume totalise 10 litres ou plus. On peut consulter l'ASPC ou l'ACIA pour déterminer les valeurs seuils utilisées en laboratoire et les volumes manipulés à grande échelle.
14.2 Considérations relatives au travail à grande échelle
En contexte de travail à grande échelle, une évaluation locale des risques (ELR) doit être effectuée dans le but de déterminer et d'examiner les risques associés aux matières infectieuses ou aux toxines manipulées ainsi qu'aux procédés et à l'équipement utilisés. Cette analyse sert à élaborer des pratiques de travail sécuritaires. Une fois l'ELR effectuée, des exemptions relatives à certaines exigences concernant le travail à grande échelle peuvent être déterminées en consultation avec l'ASPC et l'ACIA. Par ailleurs, les permis et les permis d'importation d'agents zoopathogènes accordés à certaines aires de production à grande échelle de niveau de confinement 2 (NC2) peuvent être assujettis à des exigences concernant le travail à grande échelle; cette nécessité est déterminée en consultation avec l'ASPC ou l'ACIA, en fonction des procédés et des agents pathogènes utilisés.
Voici certains facteurs à prendre en considération au moment de réaliser une ELR :
- la présence de matières infectieuses ou de toxines (p. ex. propriétés, groupe de risque, niveau de confinement);
- le type de produit biologique final (c.-à-d. virus vivant ou inactivé, ou composant pathogène inactivé);
- le volume (c.-à-d. volume total, contenant unique ou contenants multiples);
- la concentration;
- les manipulations à réaliser (p. ex. échantillonnage en cours de production, récolte des cultures, concentration, mélange, interventions préalables à l'inactivation);
- le type de procédé employé (p. ex. par lots ou en continu);
- les caractéristiques de l'équipement (p. ex. type, système de production ou de traitement ouvert ou fermé, fixe ou mobile, produisant des aérosols);
- les caractéristiques de l'installation (p. ex. conditions climatiques, entrée et évacuation de l'air, maintien d'une pression d'air différentielle, sécurité physique).
14.3 Fermenteurs
Les fermenteurs varient considérablement pour ce qui est de leur taille, de leur conception, de leurs instruments associés et de leurs caractéristiques, par exemple l'automatisation ainsi que le nettoyage et la décontamination in situ. Les appareils de fermentation destinés à une production à grande échelle comportent de nombreux points par lesquels les matières infectieuses ou les toxines peuvent s'échapper (p. ex. arbre moteur, conduits d'évacuation des gaz d'échappement, points de prélèvement). Les procédés de fermentation peuvent aussi produire des aérosols, ce qui accroît le risque d'exposition à des aérosols provenant de matières infectieuses et à des toxines. Voici les éléments à prendre en considération afin de réduire le risque de fuite et de libération d'aérosols associé à l'utilisation de ces appareils :
- l'arbre moteur devrait être muni de doubles joints d'étanchéité mécaniques; autrement, un agitateur devrait être installé sur le dessus du réservoir;
- les conduits d'évacuation des gaz d'échappement devraient être munis de filtres à haute efficacité pour les particules de l'air (HEPA), d'un incinérateur ou d'un dispositif équivalent conçu pour prévenir la libération d'agents pathogènes;
- les points d'échantillonnage devraient être couplés à un système d'échantillonnage fermé qui peut être stérilisé;
- le dispositif de décompression devrait être validé, et il faudrait porter attention aux conséquences que peut entraîner la libération;
- il est recommandé de se servir d'un produit antimousse pour prévenir un blocage des conduits d'évacuation d'air.
14.4 Considérations en matière de réglementation
Les installations qui fabriquent des produits biologiques réglementés, comme des vaccins et des produits biopharmaceutiques à usage humain ou vétérinaire, peuvent devoir respecter des normes plus strictes que celles énoncées dans la Norme canadienne sur la biosécurité (NCB), 2e édition (2015), afin d'obtenir la qualité de produits recherchéeNote de bas de page 4Note de bas de page 5. Par exemple, d'autres exigences peuvent s'appliquer aux activités menées avec des produits biologiques vétérinaires, notamment les vaccins et les trousses de diagnostic in vitro utilisées pour détecter les agents zoopathogènes. Le Centre canadien des produits biologiques vétérinaires (CCPBV) de l'ACIA est l'autorité nationale qui réglemente les produits biologiques vétérinaires au Canada. Par ailleurs, la Direction des produits biologiques et des thérapies génétiques (DPBTG) de Santé Canada est l'autorité fédérale canadienne chargée de réglementer les médicaments biologiques et les produits radiopharmaceutiques utilisés chez l'humain. On devrait consulter le CCPBV de l'ACIA et la DPBTG de Santé Canada pour connaître les exemptions relatives à la production à grande échelle de produits vétérinaires biologiques destinés aux animaux ainsi que de médicaments biologiques et de produits radiopharmaceutiques utilisés chez l'humain, respectivement. Pour obtenir de plus amples renseignements sur les exigences réglementaires s'appliquant aux produits biologiques vétérinaires destinés aux animaux, aux médicaments biologiques et aux produits radiopharmaceutiques à usage humain, veuillez contacter le CCPBV de l'ACIA ou la DPBTG de Santé Canada ou visiter leur site Internet.
References
- Note 1
- Department of Health and Human Services des États-Unis, National Institutes of Health des États-Unis. (2013). NIH Guidelines for Research Involving Recombinant or Synthetic Nucleic Acid Molecules (NIH Guidelines), Bethesda, MD, États-Unis : National Institutes of Health.
- Note 2
- Department of Health and Human Services des États-Unis, Centers for Disease Control and Prevention des États Unis et les National Institutes of Health des États-Unis. (1999). Biosafety in Microbiological and Biomedical Laboratories, 4e éd., Washington, DC, États-Unis: Government Printing Office.
- Note 3
- Advisory Committee on Dangerous Pathogens. (1998). The Large-Scale Contained Use of Biological Agents , Suffolk, Royaume-Uni : Health and Safety Executive / HSE Books.
- Note 4
- Santé Canada. (2002). Ligne directrice à l'intention de l'industrie: Bonnes pratiques de fabrication applicables aux Ingrédients pharmaceutiques actifs (ICH thème Q7A), Ottawa, ON, Canada : Publication autorisée par le ministre de la Santé. Consulté le 3 novembre 2015 à l'adresse http://www.hc-sc.gc.ca/dhp-mps/compli-conform/legislation/gazette1-q7a-fra.php
- Note 5
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada.
Chapitre 15 - Décontamination
La décontamination de tout matériel contaminé avant son élimination est un principe fondamental de la biosécurité et un élément critique du confinement. Il est indispensable d'observer les principes de stérilisation, de désinfection et de décontamination pour réduire le risque de libération d'agents pathogènes dans les zones de confinement, l'environnement et la communauté. Différents systèmes de décontamination peuvent être utilisés pour décontaminer le matériel qui quitte la zone de confinement, par exemple des autoclaves, des systèmes de décontamination des effluents, des incinérateurs, des irradiateurs, des cuves d'immersion, des digesteurs (équarrissage) et des douches chimiques. Les exigences relatives aux procédures de décontamination sont énoncées à la matrice 4.8 de la Norme canadienne sur la biosécurité (NCB), 2e éditionNote de bas de page 1.
Les parties réglementées qui emballent et étiquettent convenablement les déchets biologiques dangereux pour qu'ils soient décontaminés par un tiers dans une installation d'élimination des déchets biologiques dangereux sont responsables des déchets tant qu'ils n'ont pas été décontaminés, y compris de la validation et de la vérification de la décontamination.
15.1 Principes de stérilisation, de désinfection et de décontamination
La stérilisation est un procédé qui élimine complètement tous les microorganismes vivants, y compris les spores bactériennes. Les chances de survie d'un microorganisme après une stérilisation sont estimées inférieures à une sur un million (soit 1:106), ce que l'on appelle communément « l'assurance de stérilité »Note de bas de page 2. La stérilisation est considérée comme absolue (c.-à-d. qu'il n'existe pas de niveaux intermédiaires de stérilité). Étant donné que les toxines et les prions ne sont pas des microorganismes vivants, le concept de la stérilisation ne s'y applique pas. La décontamination des toxines et des prions est abordée respectivement aux sections 15.11 et 15.12 du présent chapitre.
La désinfection est un procédé qui élimine la plupart des formes de microorganismes vivants, mais qui est moins létal que la stérilisation. L'efficacité de la désinfection varie en fonction de plusieurs facteurs, dont la nature des microorganismes et leur quantité, la quantité de matières organiques présentes, le type et l'état des articles subissant la désinfection ainsi que la température.
La décontamination est un processus par lequel des matières et des surfaces sont traitées pour que leur manipulation soit sans danger et pour qu'elles soient raisonnablement exemptes de microorganismes, de toxines ou de prions. Le principal objectif de la décontamination est de protéger le personnel travaillant dans une zone de confinement et la communauté d'une exposition à des agents pathogènes viables et aux toxines qui pourraient causer une maladie. Selon la situation (c.-à-d. l'agent pathogène ou la toxine utilisée), pour décontaminer efficacement, il pourrait être nécessaire de procéder à une désinfection, à une inactivation ou à une stérilisation pour que le matériel, l'objet, la matière ou la surface soit considéré comme sûr et raisonnablement exempt de microorganismes, de toxines et de prions. Les procédés de décontamination représentent un élément crucial de confinement, car toute faille dans les procédés peut entraîner une exposition professionnelle à des matières infectieuses ou à des toxines, ou la libération accidentelle de celles-ciNote de bas de page 3Note de bas de page 4Note de bas de page 5. Voici les éléments que doit prendre en considération le personnel de l'installation responsable de l'élaboration des procédés et des méthodes de décontamination :
- Des désinfectants efficaces contre les matières infectieuses utilisées et des produits chimiques neutralisants efficaces contre les toxines et les prions utilisés doivent être accessibles dans la zone de confinement et être employés pour décontaminer tout le matériel contaminé ou susceptible de l'être, y compris les appareils, les contenants d'échantillons, les surfaces, les locaux et les déversements.
- Les paramètres de décontamination (p. ex. durée, température et concentration chimique, humidité) fixés pour la méthode ou l'appareil employé doivent être validés et s'avérer efficaces contre les matières infectieuses et les toxines préoccupantes, dans les conditions présentes.
- En raison de leur nature protéique, les prions et les toxines peuvent être résistants aux désinfectants chimiques fréquemment utilisés pour éliminer efficacement les microorganismes. Lorsqu'on manipule des prions ou des toxines, il est nécessaire d'employer un produit chimique neutralisant capable de dénaturer et d'inactiver les toxines ou les prions et ainsi décontaminer efficacement la zone de confinement.
- Des procédures claires et strictes doivent être en place pour faciliter la décontamination et la vérification régulières des procédés de décontamination.
- Les procédés et les méthodes de décontamination devraient être conformes aux règlements fédéraux, provinciaux, territoriaux et municipaux applicables.
- Les procédés de décontamination doivent faire partie de la formation offerte au personnel sur les dangers et les stratégies d'atténuation des risques d'exposition ou de libération associés au travail effectué. La formation devrait notamment viser à fournir des renseignements sur les produits utilisés ainsi que les facteurs qui influent sur leur efficacité.
15.2 Validation et vérification des technologies et des procédés de décontamination
15.2.1 Validation
Avant de mettre en œuvre une procédure de décontamination, il faut valider les autoclaves, les systèmes de décontamination des effluents ainsi que les autres appareils et procédés de décontamination. La validation démontre que le matériel et les méthodes permettent effectivement de décontaminer, d'inactiver ou d'éliminer les agents pathogènes et les toxines qui seront manipulés et entreposés. Cela signifie qu'une méthode validée convient à son utilisation prévue.
Des indicateurs biologiques ou des dispositifs de surveillance paramétriques (p. ex. une sonde thermométrique pour les systèmes et les procédés faisant appel à la chaleur) peuvent être utilisés pour confirmer que les paramètres de traitement ont été atteints à travers la charge représentative. En plaçant des sondes thermométriques ou des indicateurs à divers endroits à travers la charge représentative, les conditions dans les différentes parties de la charge peuvent être surveillées. Dans les autoclaves, ceci peut servir à confirmer que le centre de la charge a atteint les paramètres de temps et de température nécessaires pour une décontamination réussite.
Il est crucial de choisir un indicateur biologique approprié afin de garantir que la résistance du microorganisme utilisé pour le test représente adéquatement la résistance des agents pathogènes manipulés et entreposés dans la zone de confinement. En général, les spores de Geobacillus stearothermophilus sont adéquates dans le cas des appareils et des procédés faisant appel à la chaleur, tandis que des spores de Bacillus subtilis peuvent être utilisées pour valider les appareils et les procédés chimiques.
Si les indicateurs biologiques ou chimiques ne sont pas appropriés (p. ex. dans le cas de prions), des dispositifs de surveillance paramétriques, comme des thermocouples ou des sondes qui mesurent la durée du cycle, la température et la pression, peuvent être utilisés pour surveiller de façon précise l'efficacité de l'équipement de décontamination.
Il faut valider toutes les techniques et les procédés de décontamination avant la première utilisation et lorsque des modifications importantes ont été apportées ou lorsque de nouveaux agents pathogènes sont utilisés pour que les protocoles et les procédures opératoires normalisées (PON) relatifs à la décontamination puissent être établis, modifiés ou mis à jour au besoin (matrice 4.8 de la NCB). La validation à l'aide de charges représentatives est obligatoire une fois par année (matrice 5.1 de la NCB). Pour installer les indicateurs en toute sécurité et pour prouver que les paramètres d'une décontamination efficace ont été atteints partout dans la charge (p. ex. dans le bas, au milieu et sur le dessus du lot de fournitures), il est utile de réaliser des essais de validation avec des charges représentatives non contaminées reproduisant un lot de fournitures de même type (p. ex. gants, plastiques, liquides, équipement de protection individuel [EPI] réutilisable) et de même quantité (c.-à-d. nombre ou taille des articles) qui sera traité sur une base régulière. À la suite de cette validation à l'aide d'une charge représentative, il est possible d'extrapoler les conditions aux charges courantes (c.-à-d. les déchets contaminés) dont le type et la quantité sont semblables.
15.2.2 Vérification
Une fois que les paramètres de décontamination efficace ont été établis par le processus de validation, il est important que les protocoles et les procédés de décontamination soient surveillés (vérifiés) sur une base régulière pour confirmer que les paramètres établis ont été atteint.
La vérification est la surveillance régulière du matériel et des procédés visant à s'assurer qu'ils fonctionnent correctement et qu'ils respectent toujours les paramètres établis lors de la validation. Cette vérification peut être accomplie en se servant de dispositifs de surveillance paramétrique, d'indicateurs biologiques, d'indicateurs chimiques ou d'intégrateurs chimiques. Les renseignements saisis au moment de la vérification devraient comprendre les paramètres du cycle (p. ex. température, durée et concentration chimique), le type de charge et la taille de la charge (p. ex. lessive, déchets solides et déchets liquides) et une brève description du procédé. Les paramètres peuvent comprendre un tableau des coordonnées durée-température et les résultats des vérifications microbiologiques pour chaque cycle réalisé. Si un indicateur biologique est utilisé, les résultats des contrôles positifs d'un même lot devraient également être saisis. Une évaluation locale des risques (ELR) facilitera le choix des protocoles à utiliser à des fins de surveillance régulière (p. ex. quotidienne, hebdomadaire, mensuelle) en fonction de la fréquence d'utilisation.
15.2.3 Indicateurs, intégrateurs et dispositifs de surveillance paramétriques
Un indicateur biologique est une quantité normalisée de spores bactériennes servant à prouver que les conditions de stérilisation de la charge de déchets sont efficaces. L'atteinte de la cible voulue en ce qui concerne la réduction de la quantité de spores viables indique que le processus de décontamination a été efficace. Le choix de l'indicateur est important, car sa conception et sa fabrication varient selon l'utilisation prévue (p. ex. charge liquide ou sèche, système autonome, méthode enzymatique rapide); l'indicateur devrait donc être choisi en fonction de l'agent pathogène ou de la toxine cible.
Les indicateurs chimiques sont conçus pour être utilisés en association avec des indicateurs biologiques et des moniteurs physiques (c.-à-d. jauges de pression et de température). Ces dispositifs servent à surveiller un ou plusieurs paramètres à la fois, mais pas tous les paramètres nécessaires à une décontamination efficace. Parmi les indicateurs chimiques, citons le ruban indicateur pour autoclaves, les étiquettes et les feuilles indicatrices recouvertes d'une encre colorée sensible à la chaleur (p. ex. test de Bowie et Dick). On obtient ainsi quotidiennement un résultat immédiat attestant de la validité ou de la non-validité d'un paramètre donné (p. ex. exposition à une température, à la vapeur, à un gaz), mais ces dispositifs n'indiquent pas que la décontamination a été efficace.
Les intégrateurs chimiques sont un type d'indicateur chimique utilisé pour confirmer que tous les paramètres de décontamination ont été atteints (p. ex. température, pression et temps pour un cycle d'autoclave).
Là où un indicateur biologique ou chimique ne convient pas, des dispositifs de surveillance paramétriques peuvent enregistrer les paramètres de décontamination (p. ex. temps, température et pression) pour confirmer que les conditions d'une décontamination efficace ont été atteintes. Une sonde thermique est un exemple de dispositif de surveillance paramétrique adapté à l'application qui peut être utilisé pour la validation et la vérification de technologies de décontamination faisant appel à la chaleurNote de bas de page 6.
15.3 Désinfectants chimiques
Les désinfectants chimiques sont généralement utilisés pour décontaminer les surfaces et le matériel qui ne peuvent pas être mis à l'autoclave, les contenants d'échantillons qui doivent être retirés des zones de confinement ou de l'enceinte de sécurité biologique (ESB), les surfaces après un déversement de matières infectieuses ainsi que les salles animalières et les box. L'utilisation de désinfectants peut avoir des conséquences directes (p. ex. exposition directe à un produit chimique dangereux) ou des conséquences indirectes (p. ex. exposition à des agents pathogènes encore vivants si un mauvais désinfectant est choisi) sur la sécurité des travailleurs. Il est important que les personnes qui travaillent dans une zone de confinement connaissent les produits à utiliser pour désinfecter les articles contaminés avec les matières infectieuses ou les toxines avec lesquelles ils travailleront, y compris le mode d'emploi recommandé (p. ex. méthode d'application, concentration, durée de contact, EPI, premiers soins, élimination) et les caractéristiques chimiques du désinfectant (p. ex. toxicité, compatibilité chimique, stabilité pendant la conservation, substances actives, nature et concentration).
L'efficacité d'un produit dépend de sa ou de ses substances actives ainsi que de la nature et de la concentration des autres ingrédients dans la formulation. Il existe généralement des différences marquées dans l'activité des désinfectants entre les conditions de laboratoire réelles et les tests normalisés en milieu contrôlé (p. ex. Association of Analytical Communities [AOAC International], American Society for Testing and Materials [ASTM]) effectués pour produire des données sur l'efficacité en vue d'obtenir une homologation. L'évaluation de l'efficacité d'un désinfectant peut être quantitative, semi-quantitative ou qualitative. Ces différences sont habituellement attribuables au fait que les souches utilisées comme substituts lors des tests normalisés ne résistent pas à la désinfection de la même façon que les souches utilisées en laboratoire. De plus, les conditions ambiantes telles que la température, l'humidité relative et même la dureté de l'eau varient dans les laboratoires, mais sont contrôlées lors des tests normalisés auxquels sont soumis les désinfectants. Il est donc difficile de faire des généralisations sur les durées de contact et les concentrations nécessaires pour détruire certains agents pathogènes. Les laboratoires auraient intérêt à mener leurs propres évaluations de l'efficacité d'un désinfectant à l'interne, dans leurs conditions particulières d'utilisation.
De nombreux tests normalisés permettent d'évaluer l'efficacité des désinfectants liquides. L'AOAC International et l'ASTM ont toutes deux approuvé des méthodes de vérification de l'efficacité des désinfectants. La norme E2197-11 de l'ASTM, en particulier, décrit une méthode de base qui consiste à contaminer artificiellement une surface (disque de transport) avec des microorganismes de test, puis à exposer la surface à différentes concentrations du désinfectant liquide ou pendant différentes durées de contactNote de bas de page 7. En général, ces tests comportent quatre étapes de base qui permettent de valider l'efficacité des désinfectants utilisés en laboratoire.
- Appliquer une quantité connue du microorganisme utilisé en laboratoire sur une surface ou un support. Cette quantité devrait être représentative des concentrations généralement utilisées dans le laboratoire.
- Appliquer le désinfectant mis à l'essai sur la surface ou le support en respectant la durée de contact utilisée dans le laboratoire.
- Neutraliser le désinfectant pour stopper son action, soit en le diluant ou en y ajoutant un milieu de culture ou un autre réactif approprié connu pour neutraliser les ingrédients actifs du désinfectant.
- Évaluer la viabilité du microorganisme dans un milieu de culture approprié.
Si le microorganisme survit, il peut être nécessaire de modifier la durée de contact ou la concentration du désinfectant, ou ces deux paramètres, pour obtenir le niveau de désinfection voulu. Les facteurs qui peuvent avoir une incidence sur l'efficacité d'un désinfectant sont énoncés à la section 15.3.1.
15.3.1 Choix d'un désinfectant chimique
Le choix d'un désinfectant chimique approprié dépend d'un grand nombre de facteurs, dont la résistance des matières infectieuses ou de la toxine, la méthode d'application (p. ex. sous forme liquide ou gazeuse) et le type de matériel à désinfecter (p. ex. surface dure, matière poreuse). La charge organique, la concentration, la durée de contact, la température, l'humidité relative, le pH et la stabilité peuvent également avoir une incidence sur l'efficacité d'un désinfectant chimique. Le tableau 15-1 fournit des renseignements sur la sensibilité des agents pathogènes aux désinfectants chimiques et sur les désinfectants chimiques avérés efficaces contre ceux-ci.
| Sensibilité | Agent pathogène | Désinfectants avérés efficaces |
|---|---|---|
| Extrêmement résistants | Prions |
|
| Très résistants | Oocystes de protozoaire |
|
| Endospores bactériennes |
|
|
| Résistants | Mycobactéries |
|
| Virus non enveloppés |
|
|
| Sensibles | Spores fongiques |
|
| Bactéries Gram négatif |
|
|
| Bactéries Gram positif | ||
| Virus enveloppés | ||
| Très sensibles | Mycoplasmes |
|
Adapté de : Quinn, P. J., & Markey, B. K. (1991). Disinfection and Disease Prevention in Veterinary MedicineNote de bas de page 8
15.3.1.1 Charge organique
La matière organique (p. ex. tissus, sang, litière, excréments) empêche les microorganismes, les toxines et les prions d'entrer en contact avec le désinfectant et peut neutraliser de nombreux germicides (p. ex. NaClO). Le nettoyage avec un détergent afin d'éliminer la litière et la nourriture avant la désinfection réduit la charge organique et permet de bien désinfecter. Il est important que le nettoyage préalable soit effectué de façon à éviter une exposition personnelle aux matières infectieuses ou potentiellement infectieuses, et que tout le matériel de nettoyage soit décontaminé avant d'être éliminé. Il n'est pas toujours approprié d'effectuer un nettoyage avant de procéder à la désinfection, mais, le cas échéant, un désinfectant qui demeure actif en présence de grandes quantités de matière organique peut être une solution acceptable (p. ex. désinfectant phénolique). Dans d'autres cas, il peut être approprié de saturer la matière contaminée avec un désinfectant afin de la conserver humide pendant une longue durée de contact (p. ex. 30 minutes), puis d'éliminer la contamination grossière et de nettoyer en profondeur les surfaces avant de réappliquer du désinfectantNote de bas de page 6Note de bas de page 8Note de bas de page 9.
15.3.1.2 Concentration
La désinfection est généralement plus rapide quand une concentration élevée est utilisée. Les fortes concentrations de certains produits chimiques peuvent endommager les surfaces ou les tissus. Toutefois, si la concentration est abaissée pour éviter les dommages, il se peut que l'action germicide du désinfectant ne soit plus suffisante. Il est donc important de trouver la concentration à laquelle le désinfectant inactivera l'organisme sans endommager le reste du matérielNote de bas de page 6Note de bas de page 8Note de bas de page 9.
15.3.1.3 Durée de contact
La durée de contact est le délai pendant lequel le désinfectant sature la surface traitée. Une durée de contact efficace dépend du désinfectant ainsi que des microorganismes, des toxines ou des prions présents. Les désinfectants à action rapide sont préférables, car il peut être difficile de créer les conditions propices à de longues durées de contact. Bien que les alcools puissent avoir un effet bactéricide et fongicide quand la durée de contact est assez longue (p. ex. 10 minutes), il est peu probable qu'ils demeurent aussi longtemps sur les surfaces puisqu'ils s'évaporentNote de bas de page 6Note de bas de page 8Note de bas de page 9.
15.3.1.4 Température
Les températures élevées augmentent généralement l'action germicide; toutefois, elles peuvent accélérer l'évaporation, ce qui réduit la durée de contactNote de bas de page 8Note de bas de page 9. Les températures basses sont aussi préoccupantes, car elles peuvent réduire considérablement l'efficacité des désinfectants. Ces facteurs devraient être pris en considération au moment de décontaminer du matériel se trouvant dans un réfrigérateur, un congélateur ou une centrifugeuse à basse température.
15.3.1.5 Humidité relative
L'humidité relative peut avoir une incidence sur l'activité de certains désinfectants, en particulier le formaldéhyde. L'activité antimicrobienne d'une fumigation effectuée avec du formaldéhyde sous forme gazeuse est maximale à un taux d'humidité relative supérieur à 70 %Note de bas de page 6Note de bas de page 8Note de bas de page 9.
15.3.1.6 pH
Le pH peut avoir une incidence sur l'activité de certains désinfectants. Il est important de lire attentivement le mode d'emploi et les avis concernant l'incompatibilité avec certains produits chimiques afin de garantir l'efficacité du désinfectant et la sécurité du personnelNote de bas de page 8Note de bas de page 9.
15.3.1.7 Stabilité/entreposage
Les dilutions de certains désinfectants (p. ex. hypochlorite de sodium [NaClO], glutaraldéhyde alcaline) pourraient être instables sur de longues périodes, surtout en présence de chaleur ou de lumière. Les produits devraient donc être entreposés dans un endroit sombre et frais. Il est préférable de ne préparer que la quantité de désinfectant nécessaire pour la journée ou la semaine (selon la durée de conservation)Note de bas de page 8Note de bas de page 9.
15.3.2 Classes de désinfectants chimiques
De nombreux types de désinfectants sont offerts sur le marché; toutefois, leurs composants actifs appartiennent à un nombre relativement limité de classes de produits chimiques. La compréhension du potentiel et des limites de chacune de ces classes permettra de choisir un désinfectant efficace.
Le tableau 15-2 présente la sensibilité de différents types de microorganismes à plusieurs désinfectants chimiques, notamment leur efficacité et le temps de contact nécessaire pour obtenir une désinfection efficace. Les toxines et les prions sont résistants à de nombreux désinfectants chimiques; les points particuliers relatifs aux toxines et aux prions à prendre en considération dans le cadre d'une décontamination sont abordés aux sections 15.11 et 15.12, respectivement. Le tableau 15-3 énumère les inconvénients de ces mêmes désinfectants chimiques.
| Désinfectant chimique | Formes courantes | Efficace contre | Durée de contact | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Bactéries | Virus | Mycètes | |||||||
| Végétatives | Mycobactéries | Spores | Enveloppés | Non enveloppés | Champignons | Spores fongiques | |||
| Chlore | Liquide, poudre et comprimés | + | + | + | + | + | + | + | Généralement courte; plus longue dans le cas des spores bactériennes (≥ 30 min) |
| Iode | Solutions aqueuses, teintures et iodophores | + | L | L | + | L | + | L | Généralement courte dans le cas des bactéries végétatives et des virus enveloppés; plus longue dans le cas des mycètes et des mycobactéries |
| Alcool | Alcool éthylique ou isopropylique; solution à 70 % dans l'eau plus efficace | + | + | - | + | L | + | L | Généralement courte dans le cas des bactéries végétatives et des virus enveloppés; plus longue dans le cas des mycètes et des mycobactéries |
| Composés phénoliques | Large éventail; généralement des composés à base de phénols substitués associés à des détergents | + | V | - | + | - | V | V | |
| Composés d'ammonium quaternaire | Large éventail de composés ayant une action détergente | + | - | - | + | - | + | - | |
| Glutaraldéhyde | Solution acide à 2 % vendue avec un composé bicarbonate | + | + | + | + | + | + | + | Période ≥ 20 min requise dans le cas des virus non enveloppés et des mycobactéries; période > 3 heures requise dans le cas des spores bactériennes |
| Formaldéhyde | Commercialisé sous forme de paraformaldéhyde solide et de formaline liquide | + | + | + | + | + | + | + | |
| Peroxyde d'hydrogène (H2O2) | Formulations à action accélérée et solutions à 30 % dans l'eau | + | + | + | + | + | + | + | Durée de contact courte avec le H2O2 à 6 % pour l'ensemble des virus, les bactéries végétatives, les mycètes, les mycobactéries et certaines spores bactériennes. Concentrations plus élevées et temps de contact plus long nécessaires pour obtenir une activité sporicide. |
| Chlorhexidine | Solution de gluconate de chlorhexidine à 4 % dans une base détergente et solutions concentrées à base d'alcool | + /L* | - | - | + | - | L | - | |
+ : efficace; L : activité limitée; V : activité variable; - : aucune activité |
|||||||||
| Désinfectant chimique | Inconvénients |
|---|---|
| Chlore |
|
| Iode |
|
| Alcool |
|
| Composés phénoliques |
|
| Composés d'ammonium quaternaire |
|
| Glutaraldéhyde |
|
| Formaldéhyde |
|
| Peroxyde d'hydrogène |
|
| Chlorhexidine |
|
15.4 Autoclaves
Les matières infectieuses et les toxines, ainsi que les déchets contaminés par ces matières (boîtes de Pétri, pipettes, tubes de culture, verrerie, etc.), peuvent être efficacement décontaminées dans un autoclave à écoulement d'air par gravité ou dans un autoclave à écoulement d'air assisté (avec pompe à vide). Dans le cas des autoclaves à écoulement d'air par gravité, l'air s'échappe de l'enceinte par le bas à mesure que la vapeur pénètre par le haut. Pour que ce mode de décontamination soit efficace, les soupapes doivent demeurer dégagées et l'enceinte ne doit pas être surchargée. Dans les autoclaves à écoulement d'air assisté (avec pompe à vide), un vide créé élimine l'air de l'enceinte avant d'y laisser pénétrer une vapeur saturée (sauf durant les cycles liquides). Ce système résout les problèmes de poches d'air propres aux autoclaves à écoulement d'air par gravité lors du déplacement de l'air par gravité.
Les autoclaves peuvent être munis d'une ou de deux portes. Les autoclaves à deux portes sont installés à même la barrière de confinement, généralement dans les zones de confinement élevé, afin de faciliter la décontamination et le déplacement des déchets et autres articles contaminés hors de la zone de confinement. L'efficacité de la décontamination par autoclave à vapeur dépend de la température à laquelle l'article est soumis ainsi que de la durée d'exposition. Pour garantir la décontamination, il est essentiel que les autoclaves fonctionnent bien, que les charges soient appropriées et qu'une surveillance adéquate soit effectuée. Une attention particulière devrait être accordée à l'emballage, notamment à la taille des récipients et à leur disposition dans l'autoclave, pour que le centre des sacs et des récipients atteigne et maintienne la température nécessaire pour la stérilisation. Le fait de disposer les articles de manière à permettre à la vapeur de circuler librement et à faciliter sa pénétration favorisera la décontamination efficace des déchets.
15.4.1 Procédures recommandées pour l'utilisation des autoclaves
Les sections suivantes présentent certains éléments à prendre en considération ou à inclure lors de l'élaboration des PON sur la façon sûre et efficace d'utiliser les autoclaves dans la zone de confinement.
15.4.1.1 Avant le chargement de l'autoclave
- Avant d'ouvrir la porte d'un autoclave à deux portes situé à même une barrière de confinement, s'assurer que l'autre porte est fermée (c.-à-d. à l'aide de l'avertisseur visuel ou sonore).
- Vérifier que l'enceinte de l'autoclave est exempte d'articles laissés par l'utilisateur précédent qui pourraient être dangereux (p. ex. des objets pointus ou tranchants).
- Nettoyer la crépine du drain.
- Vérifier que les articles en plastique, y compris les sacs, les contenants et les plateaux, peuvent être traités à l'autoclave. Certains sacs empêchent la pénétration de la vapeur, et d'autres peuvent fondre pendant le cycle.
- Éviter de surcharger les contenants et les sacs (ils ne devraient jamais être remplis plus qu'aux trois quarts).
- Ne pas fermer hermétiquement les sacs pour autoclave pour permettre le passage de la vapeur.
- Desserrer les bouchons des bouteilles renfermant des solutions pour les empêcher d'éclater durant la pressurisation. Cela devrait seulement être fait immédiatement avant de charger l'autoclave afin de réduire au minimum le risque d'exposition ou de contamination si le contenant est renversé. Les bouchons ventilés pourraient être une solution de rechange convenable.
15.4.1.2 Chargement de l'autoclave
- Charger l'autoclave conformément aux recommandations du fabricant.
- Disposer les contenants, les sacs et les plateaux de manière à permettre à la vapeur de circuler librement autour d'eux. Éviter d'empiler ou de surcharger les contenants, les sacs et les plateaux.
- Placer les contenants et les sacs sur un plateau muni d'un fond et de parois solides afin de contenir les déversements.
- Éviter de disposer des contenants dans le fond de l'autoclave.
- Vérifier que la porte de l'autoclave est bien fermée (c.-à-d. verrouillée) et que le bon cycle a été sélectionné.
15.4.1.3 Déchargement de l'autoclave
- Vérifier les données du cycle d'autoclavage pour s'assurer que les paramètres de décontamination ont été respectés.
- Faire une lecture du manomètre pour vérifier que la pression a diminué à l'intérieur de l'enceinte.
- Enfiler l'EPI approprié, notamment un dispositif de protection des yeux, des gants longs résistants à la chaleur, un tablier en caoutchouc, des manchettes de protection en caoutchouc et, pour la manipulation d'objets pointus ou tranchants, des gants résistant aux perforations et aux coupures.
- Placer les articles retirés de l'autoclave après une décontamination dans des sacs à déchets indiquant clairement qu'ils ont été décontaminés, et retirer ou altérer le symbole de danger biologique qui était apposé sur les sacs.
15.4.1.4 Vérification du cycle d'autoclavage
- Après avoir retiré la matière décontaminée de l'autoclave et avant son élimination, il est important de vérifier l'efficacité du cycle (c.-à-d. que tous les paramètres validés ont été atteint). Des dispositifs de surveillance paramétriques, des indicateurs et des intégrateurs chimiques et des indicateurs biologiques peuvent servir à la surveillance régulière du procédé de décontamination.
- Retirer l'indicateur ou l'intégrateur des articles autoclavés et l'inspecter visuellement. Les indicateurs et les intégrateurs chimiques fournissent des renseignements immédiats sur les paramètres pour lesquels ils ont été conçus. Lorsqu'on utilise un indicateur biologique, les articles ne peuvent être éliminés ou réutilisés tant que l'on a pas obtenu les résultats de l'indicateur biologique.
- Il faut incuber les indicateurs biologiques pendant une période prédéterminée avant de les lire.
15.4.2 Procédures recommandées pour vérifier l'efficacité des cycles d'autoclaves
Le protocole recommandé pour surveiller l'efficacité (c.-à-d. vérifier) des cycles d'autoclavage à 121 °C est décrit ci-dessous et devrait être mis en œuvre à la fréquence établie par l'ELR, en tenant compte de la fréquence d'utilisation de l'autoclave. Dans le cas des cycles d'autoclavage pouvant aller jusqu'à 134 °C, on peut utiliser des intégrateurs chimiques ou des dispositifs de surveillance indépendants de la température (p. ex. thermocouples) pour la vérification.
- Placer les indicateurs biologiques (p. ex. ampoules contenant 104 à 106 unités formatrices de colonies [ufc] de spores de Geobacillus stearothermophilus) au centre d'une charge, c.-à-d. l'endroit le plus difficile à décontaminer. Chaque type de charge devrait être vérifié séparément (p. ex. EPI réutilisable, déchets solides, déchets liquides).
- Laisser un indicateur biologique témoin positif du même numéro de lot hors de l'autoclave.
- Traiter la charge selon les PON applicables en tenant compte du délai nécessaire à l'atteinte de la température de stérilisation au centre de la charge; ce délai dépend de la nature des déchets à stériliser. Par exemple, les spores de G. stearothermophilus exposées à une température de 121 °C sont détruites en 15 minutes; cependant, la durée du cycle et la température nécessaire dépendent du contenu de la charge.
- Récupérer les indicateurs biologiques à la fin du cycle.
- Tant que l'efficacité de la décontamination n'a pas été confirmée (c.-à-d. absence d'une prolifération dans les indicateurs biologiques autoclavés), il ne faut pas jeter les déchets.
- Incuber les indicateurs biologiques, y compris le témoin positif, pendant la période de temps nécessaire et évaluer la prolifération. La prolifération d'un indicateur biologique ayant été traité à l'autoclave indique que la stérilisation a échoué. L'absence de prolifération signifie que la stérilisation est réussi, et qu'une réduction équivalente à la concentration de départ mesurée dans le témoin positif, qui contient des spores de G. stearothermophilus, a donc été obtenue. Des indicateurs biologiques à lecture rapide contenant des spores de G. stearothermophilus peuvent aussi être utilisés. Dans le cas du fluorimètre, après une à trois heures d'incubation à 56 °C, le voyant lumineux rouge allumé indique la présence d'une fluorescence et l'échec de la stérilisation. En revanche, l'activation du voyant lumineux vert signifie une absence de fluorescence et indique la réussite de la stérilisation.
- L'échec de la stérilisation peut être attribuable à une durée, à une pression et à une température de stérilisation insuffisantes mettant en cause l'utilisateur (p. ex. recours à un mauvais programme), à une défaillance de l'appareil, à un chargement inadéquat ou à une surcharge de l'autoclave (c.-à-d. que la température nécessaire à la stérilisation n'a pas été atteinte et maintenue au centre de la charge). En cas d'échec, la cause devrait être recherchée, et le problème devrait être corrigé. Si la cause est attribuable à une défaillance de l'appareil, l'autoclave sera réparé, et le procédé sera validé de nouveau avant de répéter le cycle. Une fois le problème corrigé, les déchets sont autoclavés de nouveau (c.-à-d. que le cycle d'autoclavage est répété) avant d'être éliminés.
15.5 Décontamination gazeuse
La décontamination gazeuse est généralement utilisée dans les zones de confinement élevé et dans des circonstances particulières (p. ex. après un déversement ou la libération accidentelle de matières infectieuses ou de toxines, avant le retrait de gros appareils, avant l'entretien de systèmes contaminés ou avant la réalisation de contre-essais de systèmes de chauffage, de ventilation et d'air climatisé [CVAC]). La décontamination gazeuse des salles requiert généralement l'utilisation de produits chimiques dangereux (p. ex. formaldéhyde, peroxyde d'hydrogène vaporisé [PHV], dioxyde de chlore [ClO2], oxyde d'éthylène). Il est donc important qu'elle soit réalisée par du personnel ayant reçu une formation sur la procédure à suivre et sur l'utilisation d'EPI approprié, y compris du matériel de protection respiratoire. Le jumelage (aussi appelé « système copain-copain »), où deux personnes autorisées et dûment formées sont présentes en tout temps, s'applique à ce type de décontamination. Avant de procéder à une décontamination gazeuse, il est recommandé d'effectuer une épreuve d'étanchéité dans la pièce ou le laboratoire à l'aide d'un gaz traceur, tel que des composés volatils de la menthe, et de la colmater.
Le formaldéhyde est un gaz incolore, corrosif et inflammable qui agit comme un agent alkylant en se liant à des sites particuliers sur les protéines, l'acide ribonucléique (ARN) et l'acide désoxyribonucléique (ADN); il est produit par une dépolymérisation du paraformaldéhyde et, en présence de vapeur d'eau, il peut s'avérer un décontaminant efficaceNote de bas de page 15. Le protocole typique de décontamination réalisé avec ce bactéricide comprend les paramètres suivants : exposition de 12 heures (6 heures pour les ESB), humidité relative de 60 % à 90 % et température située entre 15 °C et 32 °C. Ces conditions garantissent un taux de survie de moins d'une spore bactérienne sur un million de spores bactériennes reconnues comme les plus résistantes au formaldéhyde sous forme gazeuse. Il est possible de neutraliser le formaldéhyde sous forme gazeuse par l'ajout de bicarbonate d'ammonium ou de carbonate d'ammonium.
Le PHV est un agent oxydant efficace contre de nombreux types d'agents pathogènes, y compris les spores bactériennes. Selon certains, la décontamination au PHV est une solution de rechange moins dangereuse que la décontamination gazeuse au formaldéhydeNote de bas de page 2. Cette méthode de décontamination ne produit pas de sous-produits dangereux, puisque le PHV se décompose en oxygène et en eau, des substances non toxiques. Le PHV est compatible avec un large éventail de matières et de matériaux de finition; toutefois, il a été établi qu'il est incompatible avec des matières telles que le caoutchouc naturel et certains plastiques et certaines peintures. Grâce aux avancées technologiques récentes reliées au PHV, il est maintenant possible de décontaminer de plus grands espaces, allant des petits passe-plats aux locaux de 280 m3 (10,000 pieds cube) et plus.
La nébulisation sèche n'est pas une technique de décontamination gazeuse : elle consiste plutôt à utiliser de très fines gouttelettes d'acide peracétique et de peroxyde d'hydrogène (H2O2). Elle produit un puissant oxydant qui décompose les composants organiques des microorganismes et détruit ainsi leur structure. Comme la décontamination au PHV, la nébulisation sèche transforme les agents infectieux en composants inoffensifs et ne laisse aucun résidu. Elle est considérée comme compatible avec la plupart des matériaux, y compris les appareils électroniques. Cependant, comme la nébulisation fait appel à des particules (d'environ 7,5 µm), elle ne pénètre pas les matériaux et ne permet pas de décontaminer efficacement les filtres à haute efficacité pour les particules de l'air (HEPA).
Le ClO2 est un oxydant sélectif qui réagit principalement avec les composés organiques fortement réduits (p. ex. alcools, aldéhydes, cétones, amines tertiaires et acides aminés contenant du soufre). Le ClO2 présente un large spectre d'action bactéricide, fongicide et virucide, et est efficace contre les spores bactériennesNote de bas de page 16. Contrairement aux vapeurs, le ClO2 est naturellement à l'état gazeux aux températures ambiantes habituelles; il ne subit donc pas les effets des gradients de température, qui peuvent entraîner des problèmes causés par la condensation et la concentration. La distribution du ClO2 est meilleure que celle du PHV. Comme il s'agit d'un oxydant sélectif, il est compatible avec de nombreux matériaux standard comme le papier, le plastique, l'acier inoxydable, le polychlorure de vinyle (PVC), l'aluminium anodisé et le boisNote de bas de page 16Note de bas de page 17.
Avant de procéder à une décontamination gazeuse, le fait de nettoyer toutes les surfaces afin d'éliminer la matière organique et la saleté déposée superficiellement permet au gaz d'entrer en contact efficacement avec les surfaces. Plus particulièrement, la décontamination au H2O2 et la décontamination par nébulisation sèche nécessitent une surface propre étant donné qu'elles ne sont pas pénétrantes. L'utilisation d'indicateurs biologiques à divers endroits, y compris les zones difficiles d'accès ou dans lesquelles le gaz pénètre peu (p. ex. coins, tiroirs, crevasses) permet de vérifier l'efficacité de la décontamination gazeuse. Les indicateurs chimiques peuvent être utilisés avec des indicateurs biologiques dans le but d'obtenir une confirmation dans l'immédiat que le gaz s'est propagé dans toutes les zones ciblées, mais la zone n'est considérée décontaminée que lorsque le résultat des indicateurs biologiques est connu. Geobacillus stearothermophilus est l'indicateur biologique à privilégier pour vérifier l'efficacité du formaldéhyde, du PHV et du ClO2. La valeur cible en ce qui concerne la décontamination de la pièce ou de l'ESB est une réduction des spores viables de l'ordre de 6 log10 (soit 99,9999 %) Note de bas de page 18Note de bas de page 19Note de bas de page 20.
15.6 Systèmes de décontamination des effluents
Les systèmes de traitement des déchets liquides sont conçus pour prévenir le rejet de matières non traitées dans les égouts sanitaires et, finalement, dans l'environnement. Les exigences relatives aux systèmes de décontamination des effluents sont énoncées à la matrice 3.8 de la NCB. Les systèmes de décontamination des effluents peuvent également être un élément à prendre en considération lors de la conception d'autres zones de confinement, selon les activités prévues et les agents pathogènes manipulés (p. ex. aires de production à grande échelle, zones de confinement de gros animaux [zones GA]). Dans les installations munies d'un système de décontamination des effluents, celui-ci sert généralement de technologie de décontamination primaire pour le traitement de tous les déchets liquides provenant de sources situées dans la zone de confinement ou desservant celle-ci, y compris les éviers, les douches, les toilettes, les autoclaves, les machines à laver et les siphons de sol. Dans certaines zones, les déchets liquides peuvent être soumis à une procédure ou à un procédé de décontamination validé avant d'être éliminés dans le système de décontamination des effluents; en pareil cas, le système de décontamination des effluents sert de système de décontamination secondaire (c.-à-d. de système de secours). Les systèmes de décontamination des effluents utilisent généralement la chaleur; toutefois, à plus petite échelle, un système chimique peut être pratique pour traiter de petits volumes d'effluents liquides.
Dans les systèmes classiques de décontamination des effluents, les déchets liquides sont recueillis dans un gros réservoir. Lorsque le réservoir est plein, le liquide est chauffé ou traité chimiquement et, après un délai suffisant pour permettre la décontamination, le réservoir est vidé dans l'égout sanitaire. Il est parfois difficile d'atteindre une température et une concentration de produits chimiques uniformes dans un gros réservoir, ce qui peut entraver la décontamination. Afin de réduire ce risque, certains systèmes sont dotés de dispositifs favorisant l'atteinte et le maintien d'une température uniforme, par exemple des pales qui garantissent un mélange constant de l'effluent, ou des chemises de vapeur qui tapissent les parois du réservoir contenant les effluents. Des systèmes de décontamination continue des effluents ont aussi récemment été mis au point. Dans ce type de système, l'effluent est recueilli dans un gros réservoir et continuellement acheminé dans un tuyau de rétention dans lequel a lieu la décontamination. À mesure qu'il passe dans le tuyau de rétention à un débit prédéterminé, l'effluent est traité à un paramètre (p. ex. une température, une concentration d'un produit chimique) cible précis pendant une période définie afin d'être décontaminé.
Les paramètres de décontamination (p. ex. durée, température, concentration chimique) du système de décontamination des effluents sont soumis à une validation visant à confirmer qu'ils permettent effectivement d'éliminer les matières infectieuses ou les toxines en question. Les paramètres tels que la température interne et la pression de l'effluent ainsi que la durée du processus de décontamination sont enregistrés tout au long du cycle afin d'évaluer l'efficacité du processus. Le système dispose d'avertisseurs qui permettent de détecter rapidement toute défaillance. Des fonctions de sécurité intégrées contribueront à prévenir le rejet de déchets non traités en cas de défaillance du système. La vérification de la performance des systèmes de décontamination des effluents devrait notamment porter sur une brève description des critères de traitement des agents pathogènes utilisés, les procédures relatives aux essais et aux vérifications microbiologiques, les graphiques sur les tendances, les imprimés d'ordinateur et toute autre donnée jugée nécessaire.
Les déchets liquides traités qui sont rejetés par le système de décontamination des effluents doivent respecter les normes de qualité fixées dans la réglementation applicable concernant l'environnement (dispositions sur la température, la teneur en produits chimiques et en métaux, les matières en suspension, les huiles et les graisses et la demande biochimique d'oxygène). Par exemple, lorsque des résidus de produits chimiques (p. ex. chlore et ozone) n'ont pas été neutralisés avant d'être rejetés, ils peuvent produire des vapeurs dangereuses et des résidus ou des sous-produits d'origine hydrique (p. ex. brome dans l'eau salée) qui peuvent être dangereux pour les animaux et les humains s'ils sont inhalés, absorbés ou ingérés. Avec d'autres types de traitement, par exemple le traitement à la chaleur, il pourrait être nécessaire de refroidir les déchets décontaminés après leur traitement, avant qu'ils ne soient rejetés dans les drains municipaux ou les voies navigables.
Bien qu'ils ne visent pas précisément la décontamination des déchets produits dans des zones de confinement, les principes et les procédés physiques et chimiques décrits dans le Manual of Diagnostic Tests for Aquatic Animals, publié par l'Organisation mondiale de la santé animale (OIE), peuvent être appliqués à la conception d'un système de traitement des déchetsNote de bas de page 21. Veuillez consulter le site Internet de l'OIE pour obtenir de plus amples renseignements.
15.7 Irradiation
L'irradiation aux rayons gamma (p. ex. cobalt-60) peut servir à décontaminer les matières thermosensibles. Il s'agit d'un procédé efficace qui permet de décontaminer les produits chimiques et les solvants pouvant être utilisés dans les zones de confinement élevéNote de bas de page 22. Cependant, l'irradiation pourrait ne pas être efficace pour la décontamination de certains agents pathogènes (p. ex. de spores bactériennes)Note de bas de page 23. Son efficacité dépend de la pénétration des rayons dans les matières traitées, qui est une fonction de la densité de la substance traitée et de la puissance de la source d'irradiation.
L'irradiation aux micro-ondes n'est pas largement utilisée comme méthode de décontamination dans les installations de confinement. À l'instar de l'autoclavage, ce procédé fait appel à la chaleur pour éliminer les microorganismes viables. Pour cette raison, la décontamination à l'autoclave est habituellement la méthode de choix. L'efficacité de l'irradiation aux micro-ondes dépend de la longueur d'onde du rayonnement, de la durée de l'exposition et de la teneur en humidité des matières à décontaminer.
L'irradiation aux ultraviolets (UV) ne devrait jamais être considérée comme la seule méthode de décontamination dans les zones de confinement. Comme les UV pénètrent peu, ils sont surtout efficaces pour les contaminants dans l'air ou sur les surfaces exposées. Si l'irradiation aux UV est utilisée conjointement avec d'autres procédés de décontamination, les lampes UV devraient être entretenues (c.-à-d. bien nettoyées) et vérifiées régulièrement pour assurer leur bon fonctionnement (p. ex. émission de l'intensité de lumière appropriée).
Pour valider les méthodes de stérilisation par irradiation, l'utilisation d'indicateurs biologiques est nécessaire (p. ex. bandelettes imprégnées de spores de Bacillus pumilus)Note de bas de page 24. Pour ce faire, plusieurs bandelettes de spores devraient être réparties dans l'échantillon à stériliser ou la chambre de stérilisation, selon le type de validation recherchée. Un témoin positif (soit une bandelette n'ayant pas subi de traitement) doit être utilisé en parallèle.
15.8 Incinération
Pour être efficace, l'incinération dépend de plusieurs facteurs : conception adéquate de l'appareil, durée, température, turbulence, air nécessaire pour obtenir une oxydation complète et chargement prudent de l'appareil. En général, les incinérateurs munis d'une seule chambre de combustion ne conviennent pas aux carcasses d'animaux et aux plastiques, car ces matières ne peuvent pas être entièrement détruitesNote de bas de page 25. Les incinérateurs modernes disposant de deux chambres, la température de la première chambre étant d'au moins 800 °C et celle de la chambre secondaire, d'au moins 1 000 °C, peuvent être efficaces. Les charges très humides peuvent réduire la température de traitement, et il est possible d'ajouter de la sciure de bois pour augmenter la stabilitéNote de bas de page 26. Il n'existe pas de normes concernant l'émission de microorganismes dans les fumées d'incinérateur, mais il en existe pour l'émission de matières particulaires et de certains contaminants chimiquesNote de bas de page 27. Les organismes de réglementation provinciaux ou territoriaux devraient être consultés pour connaître les autres critères à respecter en ce qui concerne l'incinération et les émissions.
L'autoclavage est la méthode à privilégier pour la décontamination des matières, de l'équipement et des déchets à la barrière de confinement avant leur retrait des zones de confinement élevé et leur transport vers un incinérateur. Le matériel à incinérer devrait être emballé dans des sacs de plastique étanches, même s'il a préalablement été décontaminé. Le transport de ce matériel à l'extérieur de l'installation est assujetti à la réglementation provinciale ou territoriale. Il est important que des protocoles écrits concernant l'emballage, l'étiquetage, l'entreposage et le transport des déchets à incinérer soient élaborés et suivis par tous les membres du personnel.
Le fait d'offrir aux membres du personnel de la zone de confinement une formation sur la gestion efficace des déchets permet de s'assurer qu'ils connaissent les matières qui pourraient devoir être incinérées. En effet, l'efficacité de l'incinération dépend considérablement des matières et du volume des matières à incinérer. Une formation supplémentaire doit être offerte aux employés responsables d'alimenter, de faire fonctionner et de nettoyer l'incinérateur pour s'assurer qu'ils comprennent et observent les protocoles, et qu'ils utilisent de façon appropriée l'EPI nécessaire, par exemple un dispositif de protection respiratoire pour éliminer les cendres et un harnais pour alimenter l'incinérateur. En général, les cendres produites par les incinérateurs peuvent être manipulées comme des déchets normaux.
15.9 Cuves d'immersion
Les cuves d'immersion sont situées à même la barrière de confinement et permettent de retirer sans risque du matériel et des échantillons d'une zone de confinement par décontamination de surface. Il est primordial d'employer un désinfectant efficace contre les matières infectieuses ou les toxines manipulées, d'utiliser la bonne concentration de désinfectant et une durée de contact suffisamment longue pour permettre une décontamination efficace de la surface des récipients dans la cuve d'immersion. Puisque plusieurs désinfectants peuvent être corrosif et dégrader la surface des cuves d'immersion, les cuves devraient être inspectées sur une base régulière. Il pourrait être préférable d'utiliser une cuve d'immersion avec un revêtement qui protège contre la corrosion.
La vérification régulière du niveau de désinfectant dans la cuve, niveau qui est essentiel à sa fonction, aidera à déceler tout manque. Les avertisseurs visuels ou sonores des cuves d'immersion signalant un faible niveau de désinfectant doivent être régulièrement mis à l'essai pour que leur fonctionnement soit vérifié (matrice 5.1 de la NCB). La durée de conservation des désinfectants varie, et on doit remplacer la solution contenue dans la cuve d'immersion ou en rajouter, au besoin, pour maintenir la concentration de désinfectant requise.
15.10 Carcasses d'animaux et déchets anatomiques
Les déchets animaux, les tissus prélevés lors de nécropsie ou pendant une opération chirurgicale et les carcasses entières peuvent être décontaminés par la chaleur ou des moyens chimiques. En général, l'autoclavage est efficace pour les spécimens et les tissus, comme il est décrit à la section 15.4 du présent chapitre. Les carcasses entières infectées peuvent nécessiter un équarrissage à des températures élevées, une incinération ou une décontamination à l'aide de produits chimiques (p. ex. par hydrolyse alcaline). Un procédé d'équarrissage modifié s'est révélé être une autre solution efficace pour décontaminer les carcasses animales infectéesNote de bas de page 28.
L'hydrolyse alcaline est un procédé par lequel les carcasses et les tissus animaux sont traités avec une base alcaline forte et soumis à des températures et une pression élevées. Le digesteur de tissus est un exemple de technologie de décontamination basée sur l'hydrolyse alcaline (p. ex. l'équarrissage). En général, ce procédé nécessite une température de 150 °C et une pression de 483 kPa (70 lb/po2) pendant 3 à 8 heures; toutefois, la température et la durée exactes nécessaires pour la décontamination efficace les agents pathogènes dépendent de facteurs tels que l'agent pathogène présent ainsi que la taille de la carcasse ou la quantité de tissus à décontaminerNote de bas de page 29. Les produits finaux résiduels sont des acides aminés, des peptides, des glucides, des nutriments, du savon, des os et des dents.
Au cours de l'équarrissage, les carcasses et les tissus animaux sont soumis à des températures et à des pressions élevées. Le réservoir sous pression, généralement doté d'une tige et de pales, utilise la vapeur pour stériliser les déchets et les rendre non infectieux. Quand le traitement est adéquat, le produit final est à peu près sec et peut être jeté (c.-à-d. envoyé à la décharge). L'équarrissage est le plus souvent utilisé pour les carcasses et les tissus de gros animaux.
Le compostage est un processus naturel de décomposition aérobie des tissus par des bactéries et des champignons. Il peut servir à décomposer des carcasses d'animaux et des déchets anatomiques. Le compostage est une technique de réduction des agents pathogènes bien établie et éprouvée qui permet de réduire presque l'ensemble des virus pathogènes, des bactéries, des champignons, des protozoaires (y compris les kystes) et des œufs d'helminthes à une concentration suffisamment basseNote de bas de page 30. À l'exception des bactéries formant des endospores (p. ex. Bacillus cereus) et des prions, le compostage des déchets provenant des zones GA de NC2 (c.-à-d. NC2-Ag) et des déchets d'animaux soumis à un confinement pourrait être une méthode acceptable de décontamination des déchets, s'il a été bien validé. Les protocoles de compostage devraient être mis au point et suivis, conformément à la réglementation provinciale, territoriale et municipale qui s'applique, mais le compostage n'est pas une option dans toutes les provinces et les territoires.
15.11 Décontamination thermique et chimique des toxines biologiques
Compte tenu de la grande variété de toxines biologiques et des différences considérables dans leurs propriétés physiques, il est impossible d'obtenir un ensemble normalisé de paramètres de décontamination thermique ou chimique s'appliquant à toutes les situations. Il incombe à l'installation où sont manipulées ou entreposées des toxines d'évaluer les risques et de déterminer la meilleure façon de s'en débarrasser, notamment par des méthodes d'inactivation appropriées et efficaces.
En vue de fournir une recommandation générale en ce qui concerne l'inactivation des toxines, des paramètres plus rigoureux considérés comme efficaces contre la plupart des toxines sont énumérés ci-dessous. Ces paramètres concernent la durée, les températures et les concentrations. Cependant, il existe des exceptions à ces recommandations; le cas échéant, des renseignements supplémentaires sont fournis.
15.11.1 Décontamination thermique
Les méthodes d'inactivation par la chaleur humide (p. ex. l'autoclavage) utilisées à des températures supérieures à 121 °C pendant 60 minutes permettront d'inactiver la plupart des toxines biologiques, y compris les toxines bactériennes protéiques. Cependant, cette approche n'est pas convenable pour l'inactivation des toxines thermostables de faible poids moléculaire, comme les toxines du charbon, la perfringolysine O et les mycotoxinesNote de bas de page 31. Les méthodes d'inactivation par la chaleur sèche (p. ex. l'incinération) utilisées à des températures soutenues d'au moins 815 °C pendant 10 minutes permettent d'inactiver la plupart des toxines biologiquesNote de bas de page 31Note de bas de page 32. Dans le cas des toxines thermostables, des méthodes efficaces de décontamination chimique devraient être utilisées.
15.11.2 Décontamination chimique
Pour inactiver adéquatement la plupart des toxines biologiques, y compris les toxines peptidiques et les mycotoxines, le recours à une solution qui contient de l'hypochlorite de sodium (NaOCl) à 2,5 % et de l'hydroxyde de sodium (NaOH) à 0,25 N et une durée de contact d'au moins 30 minutes sont préconisésNote de bas de page 32. Certaines toxines sont également sensibles à d'autres substances chimiques telles que le formaldéhyde, le glutaraldéhyde et l'éthanol.
15.11.3 Paramètres de décontamination
Exemples de méthodes d'inactivation thermique ou chimique utilisées pour certaines toxines :
- Les toxines A et B (Clostridium difficile) sont sensibles aux traitements à base de glutaraldéhyde à 2 %Note de bas de page 33.
- La listériolysine O (Listeria monocytogenes) est inactivée lorsqu'elle est chauffée à 80 °C pendant 3 minutesNote de bas de page 34.
- Les toxines de Pasteurella multocida sont inactivées lorsqu'elles sont chauffées à 56 °C pendant 30 minutesNote de bas de page 35.
- Les articles fortement contaminés par des mycotoxines doivent être traités avec une solution qui contient du NaOCl à 2,5 % et du NaOH à 0,25 N pendant 2 à 8 heuresNote de bas de page 31Note de bas de page 32
- Le traitement de l'aflatoxine B1 (dérivé d'Aspergillus flavus et d'Aspergillus parasiticus) avec du NaOCl peut provoquer la formation d'une substance fortement cancérogène et mutagène. Pour prévenir cette situation, la solution de traitement devrait être diluée de façon à obtenir une concentration finale de NaOCl se situant entre 1 % et 5 %, puis on devrait y ajouter de l'acétone afin d'obtenir une concentration finale de 5 % (v/v)Note de bas de page 31Note de bas de page 32Note de bas de page 36.
15.12 Autres considérations relatives à la destruction des prions
Les prions sont résistants aux conditions normales de décontamination et aux différents procédés de décontamination, y compris la chaleur humide des méthodes classiques telles que l'autoclavage, l'irradiation et l'inactivation chimique (p. ex. à la formaline, aux alcools). Ces procédés peuvent légèrement réduire l'aspect infectieux, mais peu d'entre eux (p. ex. incinération, traitements répétés à l'autoclave dans une solution alcaline de pH 13) sont très efficaces pour détruire les prions infectieuxNote de bas de page 37. Il est recommandé d'utiliser une combinaison de procédés physiques et chimiques pour décontaminer l'équipement, le matériel réutilisable et les déchets qui ne peuvent pas être incinérés, car cela est plus efficace pour inactiver les prions qu'un simple traitement avec des agents chimiques. Dans les zones de confinement où l'on manipule des prions, les autoclaves peuvent être utilisés comme méthode de décontamination à une ou à deux étapes. La décontamination par autoclavage à deux étapes (c.-à-d. à 121 °C) peut être validée à l'aide d'indicateurs biologiques, et la décontamination à une étape (c.-à-d. à 134 °C) est validée à l'aide de thermocouples ou de sondes thermométriques; on peut ainsi démontrer que l'autoclave fonctionne selon les spécifications.
Les éléments suivants sont à tenir en compte pour la décontamination des prions:
- Carcasses d'animaux, tissus, litière, excréments et certains articles de laboratoire jetables : l'incinération à 850 °C ou l'hydrolyse alcaline dans une cuve pressurisée à 150 °C sont des méthodes de traitement acceptables pour complètement inactiver les prionsNote de bas de page 5Note de bas de page 38. En général, l'incinération à 850 °C est la méthode recommandée pour obtenir une décontamination efficace de tout agent d'une maladie à prionsNote de bas de page 39.
- Instruments réutilisables non sensibles à la chaleur : l'autoclavage à 134 °C pendant 1 heure (processus de décontamination en une étape) ou un traitement chimique avec du NaOH 1 N ou du NaOCl suivi d'un autoclavage à 121 °C pendant 1 heure (processus en deux étapes) sont des méthodes acceptables pour éliminer les prionsNote de bas de page 5Note de bas de page 9.
- Instruments réutilisables et surfaces sensibles à la chaleur : un contact pendant 1 heure à 20 °C avec une solution de NaOH 2 N ou une solution de chlore actif à 2 % est recommandéNote de bas de page 5Note de bas de page 26Note de bas de page 40.
- Eaux usées : la décontamination des déchets liquides à 134 °C pendant 1 heure est la méthode indiquée pour les prionsNote de bas de page 26. Dans le cas de salles de nécropsie où les animaux ne sont pas connus comme étant infectés par des prions (p. ex. installations de diagnostic vétérinaire), un système de décontamination des effluents n'est pas exigé. Toutefois, si un animal est testé positif pour les prions, des procédures opératoires devraient être en place pour faire en sorte que les déchets liquides soient recueillis et traités. Par exemple, au cours de la nécropsie, des matelas absorbants ou en plastique peuvent servir à recueillir les liquides s'écoulant d'un animal qui présente des signes d'une maladie neurologique.
- Filtres HEPA : l'utilisation de caissons de filtration de type « bag-in/bag-out » est recommandée dans une ESB, car la fumigation au formaldéhyde est inefficace contre les prions. Il a été prouvé que le PHV peut réduire considérablement l'aspect infectieuxNote de bas de page 41Note de bas de page 42. Cependant, avant de mettre en œuvre une méthode de décontamination par le PHV, il est nécessaire de valider l'efficacité de la décontamination par le PHV ainsi que d'établir et de valider la concentration du produit et la durée d'exposition nécessaires. La décontamination des filtres à l'aide de PHV suivie d'une incinération est considérée comme une solution acceptable pour retirer et éliminer les filtres sans danger.
Des précautions additionnelles devraient être prises en considération lorsque des déchets traités chimiquement sont passés à l'autoclave. (p. ex. NaOH, NaOCl). Comme ces matières peuvent endommager l'équipement, des contenants appropriés devraient être utilisés. De plus, le personnel devrait être prudent lorsqu'il manipule le NaOH chaud, pour prévenir une possible exposition aux vapeurs de NaOH.
Références
- Note 1
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada.
- Note 2
- Favero, M. S. et Arduino, M. J. (2006). Decontamination and Disinfection. Dans Fleming, D. O. et Hunt, D. L. (éds), Biological Safety: Principles and Practices, 4e éd., p. 373-381, Washington, DC, États-Unis : ASM Press.
- Note 3
- Weber, A. M., Boudreau, U. V. et Mortimer, V. D. (2000). A Tuberculosis Outbreak Among Medical Waste Workers. Journal of the American Biological Safety Association. 2:570-588.
- Note 4
- Collins, C. H. et Kennedy, D. A. (1999). Laboratory-Acquired Infections: History, Incidence, Causes and Preventions, 4e éd., p. 1-7, Oxford, Royaume-Uni : Butterworth-Heinemann.
- Note 5
- Department of Health and Human Services des États-Unis, Centers for Disease Control and Prevention des États-Unis et les National Institutes of Health des États-Unis. (2009). Biosafety in Microbiological and Biomedical Laboratories, 5e éd., Washington, DC, États-Unis: Government Printing Office.
- Note 6
- Rutala, W. A., Weber, D. J. et le Healthcare Infection Control Practices Advisory Committee. (2008). Guideline for Disinfection and Sterilization in Healthcare Facilities, 2008, Washington, DC, États-Unis: Government Printing Office / US Centers for Disease Control and Prevention (CDC).
- Note 7
- ASTM E2197-11, Standard Quantitative Disk Carrier Test Method for Determining Bactericidal, Virucidal, Fungicidal, Mycobactericidal and Sporicidal Activities of Liquid Chemical Germicides. (2011). West Conshohocken, PA, États-Unis: American Society for Testing and Materials.
- Note 8
- Block, S. S. (éd). (2001). Disinfection, Sterilization, and Preservation, 5e éd., Philadelphie, PA, États-Unis : Lea & Febiger.
- Note 9
- McDonnell, G. (2007). Antisepsis, Disinfection, and Sterilization, Washington, DC, États-Unis: ASM Press.
- Note 10
- British Columbia Centre for Disease Control. (2003). A Guide to Selection and Use of Disinfectants. Consulté le 3 novembre 2015 à l'adresse http://www.bccdc.ca/NR/rdonlyres/EAA94ACF-02A9-4CF0-BE47-3F5817A25669/0/InfectionControl_GF_DisinfectntSelectnGuidelines_nov0503.pdf
- Note 11
- Johnson, C. H., Marshall, M. M., DeMaria, L. A., Moffet, J. M. et Korich, D. G. (2003). Chlorine Inactivation of Spores of Encephalitozoon spp. Journal of Applied and Environmental Microbiology. 69:1325-1326.
- Note 12
- Kennedy, J., Bek, J. et Griffin, D. (2000). Selection and Use of Disinfectants, États-Unis: University of Nebraska-Lincoln Extension, Institute of Agriculture and Natural Resources. Historical Materials from the University of Nebraska-Lincoln Extension. Paper 105. Consulté le 3 novembre 2015 à l'adresse http://digitalcommons.unl.edu/extensionhist/105
- Note 13
- Russel, A. D. (1986). Chlorhexidine: Antibacterial Action and Bacterial Resistance. Journal of Infection.14:212-215.
- Note 14
- Favero, M. S. (1998). Developing Indicators for Monitoring Sterilization. Dans Rutala, W. A. (éd.), Disinfection, Sterilization, and Antisepsis in Healthcare, p. 119-132, Washington, DC, États-Unis: Association for Professionals in Infection Control and Epidemiology inc.
- Note 15
- Luftman, H. S. (2005). Neutralization of Formaldehyde Gas by Ammonium Bicarbonate and Ammonium Carbonate. Applied Biosafety . 10(2):101-106.
- Note 16
- Czarneski, M. A. et Lorcheim, P. (2005). Isolator Decontamination Using Chlorine Dioxide Gas. Pharmaceutical Technology. 124-133.
- Note 17
- Luftman, H. S., Regits, M. A., Lorcheim, P., Czarneski, M. A., Boyle, T., Aceto, H., Dallap, B., et al. (2006). Chlorine Dioxide Gas Decontamination of Large Animal Hospital Intensive and Neonatal Care Units. Applied Biosafety . 11(3):144-154.
- Note 18
- National Standards Foundation (NSF). (2014). NSF/ANSI 49-2014 Annex K - Protocol for the Validation of a Gas Decontamination process for Biological Safety Cabinets. Ann Arbour, MI, États-Unis: National Sanitation Foundation / American National Standards Institute
- Note 19
- Lewis, C., Batdorf, N., Klinedinst, K., Dabisch, P. et Pitt, L. (2011). Efficacy of Vaporous Hydrogen Peroxide Against Bacillus atrophaeus and Bacillus anthracis Spores, Fort Detrick, MD, États-Unis: Center for Aerobiological Sciences, United States Army Medical Research Institute of Infectious Diseases.
- Note 20
- Luftman, H. S. et Regits, M. A. (2008). B. Atrophaeus and G. Stearothermophilus Biological Indicators for Chlorine Dioxide Gas Decontamination. Applied Biosafety. 13(3):143-157.
- Note 21
- Organisation mondiale de la santé animale / Office International des Épizooties. (2014). Manual of Diagnostic Tests for Aquatic Animals, Paris, France: Organisation mondiale de la santé animale / Office International des Épizooties.
- Note 22
- Hoile, R., Banos, C., Colella, M., Walsh, S. J. et Roux, C. (2010). Gamma Irradiation as a Biological Decontaminant and its Effect on Common Fingermark Detection Techniques and DNA Profiling. Journal of Forensic Sciences. 55(1):171-177.
- Note 23
- Reardon S. (2015). US military accidentally ships live anthrax to labs. Nature. doi:10.1038/nature.2015.17653
- Note 24
- Organisation mondiale de la Santé. (2013). Methods of Analysis: 5. Pharmaceutical technical procedures: 5.8 Methods of sterilization. In The International Pharmacopoeia (4th ed.). Consulté le 3 novembre 2015 à l'adresse http://apps.who.int/phint/en/p/docf
- Note 25
- Organisation mondiale de la Santé. (2005). Manuel de sécurité biologique en laboratoire (3e édition). Genève, Suisse, Organisation mondiale de la Santé.
- Note 26
- Organisation mondiale de la Santé. (2000). WHO Infection Control Guidelines for Transmissible Spongiform Encephalopathies, Genève, Suisse: Organisation mondiale de la Santé.
- Note 27
- Conseil canadien des ministres de l'environnement. (1992). Lignes directrices sur la gestion des déchets biomédicaux au Canada. Mississauga, ON, Canada : Association canadienne de normalisation.
- Note 28
- Thompson, L., Best, M. et Langevin, P. (1998). Biological Efficacy Testing of Liquid Effluent and Tissue/Carcass Sterilization Systems, Mundelein, IL, États-Unis: American Biological Safety Association.
- Note 29
-
National Agricultural Biosecurity Center Consortium, Carcass Disposal Working Group. (2004).
Chapter 6: Alkaline Hydrolysis. Dans
Carcass Disposal: A Comprehensive Review. Lawrence, KS, USA: Kansas State University. Consulté le 3 novembre 2015 à l'adresse http://krex.k-state.edu/dspace/handle/2097/662
- Note 30
- Wilkinson, K. G. (2007). The Biosecurity of On-Farm Mortality Composting. Journal of Applied Microbiology. 102:609-618.
- Note 31
- Kozlovac, J. P. et Hawley, R. J. (2006). Biological Toxins: Safety and Science. Dans Fleming, D. O. et Hunt, D. L. (éds), Biological Safety: Principles and Practices, 4 e éd., p 253-270, Washington, DC, États-Unis: ASM Press.
- Note 32
- Wannemacher, R. W. et Wiener, S. L. (1997). Trichothecene Mycotoxins. Dans Zajtchuk, R. et Bellamy, F. F. (éds), Medical Aspects of Chemical and Biological Warfare, p. 655-676, Washington, DC, États-Unis: Bordem Institute.
- Note 33
- Rutala, W. A. (1996). APIC Guideline for Selection and Use of Disinfectants. American Journal of Infection Control, 24:313-342.
- Note 34
- Kim, K., Murano, E. A. et Olson, D. G. (1993). Development of an Enzyme-Linked Immunosorbent assay (ELISA) for Analysis of Listeriolysin O Produced by Listeria Monocytogenes. Journal of Rapid Methods & Automation in Microbiology. 2(3):189-201.
- Note 35
- Rutter, J. M. (1983). Virulence of Pasteurella multocida in atrophic rhinitis of gnotobiotic pigs infected with Bordetella bronchiseptica. Research in Veterinary Science. 34:287-95.
- Note 36
- Castegnaro, M., Friesen, M., Michelon, J. et Walker, A. (1981). Problems Related to the Use of Sodium Hypochlorite in the Detoxification of Aflatoxin B1. American Industrial Hygienists Association Journal. 42:398-401.
- Note 37
- Department of Health du Royaume-Uni. Engineering and Science Advisory Committee into the Decontamination of Surgical Instruments Including Prion Removal (ESAC-Pr). (2008). New Technologies Working Group. Report on Prion Inactivating Agents. Londres, Royaume-Uni: Department of Health.
- Note 38
- Department of Health du Royaume-Uni, Advisory Committee on Dangerous Pathogens et le Spongiform Encephalopathy Advisory Committee. (2015). Transmissible Spongiform Encephalopathy Agents: Safe Working and the Prevention of Infection - Annex C. Londres, Royaume-Uni: Department of Health.
- Note 39
- Leunda-Casi A., Pauwels K., Herman Ph., Verheust C., Zorzi W., Thellin O., Roels S., Van Vaerenbergh B. (2009). Risk assessment of laboratories involving the manipulation of unconventional agents causing TSE. Consulté le 3 novembre 2015 à l'adresse http://www.biosafety.be/CU/PDF/Report_Prions_IPH_D_2009_2505_49.pdf
- Note 40
- Organisation mondiale de la santé animale. (2015). Chapter 2.4.6. Bovine Spongiform Encephalopathy. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. Paris, France: Organisation mondiale de la santé animale. Consulté le 3 novembre 2015 à l'adresse http://www.oie.int/fr/manuel-des-tests-de-diagnostic-et-des-vaccins-pour-les-animaux-terrestres/
- Note 41
- Fichet, G., Comoy, E., Duvall, C., Antloga, K., Dehen, C., Charbonnier, A., McDonnell, G., et al. (2004). Novel Methods for Disinfection of Prion-Contaminated Medical Devices. The Lancet. 364:521-526.
- Note 42
- Fichet, G., Antloga, K., Comoy, E., Deslys, J. P. et McDonnell, G. (2007). Prion Inactivation Using a New Gaseous Hydrogen Peroxide Sterilisation Process. Journal of Hospital Infection. 67:278-286.