Chapitre 16-20 - Guide canadien sur la biosécurité, Deuxième édition
À partir du 1er avril 2023, la Norme canadienne sur la biosécurité, Deuxième édition (NCB2), auquel ce document fait référence, est désuète. Le Guide canadien sur la biosécurité est en cours de mise à jour afin de refléter la Norme canadienne sur la biosécurité, Troisième édition (NCB3). Nous communiquerons la publication de cette mise à jour dans le bulletin de Nouvelles sur la biosécurité et la biosûreté des agents pathogènes et des toxines.
[Page précédente] [Table des matières] [Page suivante]
Chapitre 16 - Gestion des déchets
La gestion des déchets fait partie intégrante de tout programme de biosécurité; elle englobe les politiques, les plans et les procédures visant à aborder tous les aspects de la gestion des déchets, y compris la décontamination et l'élimination. Les déchets quittant la zone de confinement peuvent être destinés à l'élimination, à un déplacement ou à un transfert vers une zone de décontamination désignée située hors de la zone de confinement ou au transfert vers une installation d'élimination des déchets biologiques dangereux en vue d'être décontaminés (p. ex. incinération, stérilisation à la vapeur). Même si les déchets ont été efficacement décontaminés avant leur retrait de la zone de confinement, il pourrait ne pas être acceptable de simplement les diriger vers une voie d'élimination des déchets normaux par laquelle ils seront éventuellement transférés à une décharge locale. Selon le type de déchet, d'autres considérations ou exigences concernant la gestion des déchets établis par les autorités provinciales, territoriales ou locales (c.-à-d. municipales) pourraient aussi s'appliquer, et devraient être examinées et être respectées lorsqu'un programme de gestion des déchets est établi et mis en œuvre. Les exigences relatives à la gestion des déchets sont énoncées à la matrice 4.8 de la Norme canadienne sur la biosécurité (NCB), 2e éditionNote de bas de page 1.
Bien qu'il existe des lignes directrices pancanadiennes sur la gestion de certains types de déchets (p. ex. les Lignes directrices sur la gestion des déchets biomédicaux au Canada établies par le Conseil canadien des ministres de l'environnement [CCME]), elles ne sont pas exécutoires à moins qu'elles soient adoptées en vertu d'une loi provinciale ou d'un règlement municipalNote de bas de page 2. Les règlements locaux peuvent être plus sévères que les lignes directrices recommandées par le CCME. Certaines normes, par exemple la norme Z317.10-09 Handling of Waste Materials in Health Care Facilities and Veterinary Health Care Facilities de l'Association canadienne de normalisation, peuvent également être consultées et prises en considération au moment d'élaborer et de mettre en œuvre un solide programme de gestion des déchetsNote de bas de page 3.
Les procédures opératoires normalisées (PON) relatives à l'élimination des déchets sont conçues pour favoriser l'élimination des matières dangereuses solides et liquides de manière à limiter les risques pour les personnes, la communauté et l'environnement. Les PON décrivent tous les aspects de l'élimination des déchets, y compris les procédures de manipulation, la classification, la séparation et la décontamination des déchets infectieux, ainsi que l'entreposage et l'élimination. L'inclusion de PON relatives à l'élimination des déchets dans le Manuel de biosécurité permet au personnel de consulter les protocoles lorsqu'il en a besoin. Parmi les éléments dont il faut tenir compte au moment d'élaborer des PON sur la gestion des déchets figurent la quantité et le type de déchets qui seront produits, ainsi que les systèmes de décontamination qui pourront être utilisés. Le fait de décontaminer tous les déchets contaminés ou potentiellement contaminés avant leur élimination réduit le risque d'introduire dans l'environnement des agents pathogènes ou des toxines utilisés dans la zone de confinement. Le défaut d'observer les PON peut entraîner la libération accidentelle de matières infectieuses ou de toxines à l'extérieur de la zone de confinement ou l'exposition de personnes. Il incombe au personnel de la zone de confinement de veiller à ce que les procédures appropriées soient suivies et à ce que le confinement ne soit pas compromis. Il est aussi important de noter que le personnel de la zone de confinement demeure responsable de tous les déchets transportés hors de la zone en vue d'une décontamination, tant que ces derniers n'ont pas été complètement décontaminés. Le registre d'expédition, les rapports de validation et les rapports de vérification des appareils de décontamination utilisés par les entreprises d'élimination des déchets peuvent être conservés pour prouver la conformité aux exigences relatives à la décontamination précisées dans la NCB (matrices 4.8 et 5.1 de la NCB). Les questions de responsabilité sont abordées au chapitre 19.
Pour améliorer un programme de gestion des déchets, il faut d'abord déterminer s'il y a une façon de réduire la quantité de déchets produits. Il peut suffire de réduire le plus possible la quantité de matériel d'emballage (p. ex. boîtes en carton) qui pénètre dans la zone de confinement. Toutes les manipulations et tous les procédés qui produiront des déchets contaminés devraient être identifiés, et les déchets devraient être classés selon leur type. Le fait d'élaborer des procédures de manipulations propres à chaque type de déchets produit dans la zone de confinement fera en sorte que tous les déchets seront éliminés de façon sécuritaire. Le choix de la méthode de décontamination dépend de la nature des matières infectieuses ou des toxines ainsi que de la nature de l'article à décontaminer. Les méthodes de décontamination sont abordées au chapitre 15.
16.1 Déchets biomédicaux
Les déchets biomédicaux sont les déchets produits dans les établissements de soins destinés aux humains ou aux animaux, dans les installations de recherche et d'enseignement médicaux ou vétérinaires, dans les laboratoires de recherche ou d'essais cliniques, de même que dans les installations de production de vaccins. Les déchets biomédicaux doivent être séparés des déchets ordinaires, et ils doivent être décontaminés avant d'être éliminés. La plupart des administrations canadiennes ont déjà élaboré ou sont en train d'élaborer des lignes directrices ou des règlements sur la gestion des déchets biomédicaux. Les procédures de traitement utilisées dans chaque installation sont assujetties aux normes en vigueur dans la province ou le territoire en question. Le CCME a également établi des lignes directrices pancanadiennes sur la définition, la manipulation, le traitement et l'élimination des déchets biomédicaux : les Lignes directrices sur la gestion des déchets biomédicaux au Canada. Le but de ces lignes directrices est de promouvoir l'utilisation de pratiques uniformes et d'établir des normes minimales en ce qui concerne la gestion des déchets biomédicaux au Canada. Voir la section 16.2 pour des considérations sur l'entreposage et l'élimination des déchets biomédicaux.
Les déchets provenant de l'élevage normal d'animaux (p. ex. litière, nourriture, fumier) où les animaux ne sont pas reconnus porteur d'agent pathogène, et les déchets régis par la Loi sur la santé des animaux (LSA) ne sont pas considérés comme des déchets biomédicaux; cependant, ils devraient être soumis aux mêmes principes de séparation et d'éliminationNote de bas de page 4. Le CCME classe les déchets biomédicaux selon les cinq catégories décrites ci-dessous, que les provinces et les territoires peuvent utiliser pour élaborer leurs propres exigences.
16.1.1 Déchets anatomiques humains
Ces déchets sont constitués de tissus, d'organes et de membres humains, à l'exclusion des cheveux, des ongles et des dents. Même après sa désinfection ou sa décontamination, un déchet anatomique humain est toujours considéré comme un déchet biomédical et pourrait nécessiter des moyens d'élimination particuliers selon la règlementation provinciale, territoriale et locale qui s'applique.
16.1.2 Déchets animaux
Les déchets animaux comprennent tous les déchets anatomiques d'origine animale (carcasses, tissus, organes, membres), la litière contaminée par des microorganismes infectieux, le sang et les produits sanguins, les articles hautement contaminés par du sang, et les liquides organiques prélevés à des fins de diagnostic ou lors d'une intervention chirurgicale, d'un traitement ou d'une autopsie. Les poils, les ongles, les dents, les sabots et les plumes ne sont pas considérés comme des déchets animaux. Même après sa désinfection ou sa décontamination, un déchet d'origine animale est toujours considéré comme un déchet biomédical et pourrait nécessiter des moyens d'élimination particuliers selon la règlementation provinciale, territoriale et locale qui s'applique.
16.1.3 Déchets de laboratoire de microbiologie
Les déchets des laboratoires de microbiologie sont constitués de cultures, de bouillons, d'échantillons de microorganismes, de prions, de toxines, de vaccins atténués ou vivants, de cellules humaines ou animales en culture et de toute matière entrée en contact avec ces matières. Il est crucial d'inactiver les agents pathogènes et les toxines avant leur élimination, car on prévient ainsi le rejet de matières dangereuses dans l'environnement. Lorsqu'ils ont été efficacement décontaminés, les déchets des laboratoires de microbiologie ne sont plus considérés comme des déchets biomédicaux.
16.1.4 Sang et liquides organiques humains
Le sang et les liquides organiques humains comprennent le sang humain et tous les produits sanguins, tous les articles saturés de sang, tout liquide organique contaminé par le sang, et tout liquide organique prélevé à des fins de diagnostic au cours d'une intervention chirurgicale, d'un traitement ou d'une autopsie. D'après les lignes directrices du CCME, l'urine et fèces n'en font pas partie. Lorsqu'ils ont été efficacement décontaminés, les déchets de sang et de liquides organiques humains ne sont plus considérés comme des déchets biomédicaux.
16.1.5 Déchets pointus ou tranchants
Les aiguilles, les seringues, les lames et le verre contaminés par des matières infectieuses pouvant perforer ou couper la peau sont des déchets pointus ou tranchants. Les pipettes et les embouts de pipettes ayant été en contact avec des matières infectieuses ou des toxines peuvent en faire partie, à moins qu'ils aient été décontaminés avant leur élimination. L'installation d'un récipient à l'épreuve des perforations près du point d'utilisation réduit au minimum le risque de blessure pendant la manipulation. Il est possible de réduire la quantité de déchets pointus ou tranchants en les remplaçant par un produit de substitution pour certaines utilisations. Ce type de déchet n'est plus considéré comme un déchet biomédical une fois qu'il a été décontaminé de façon efficace.
16.2 Entreposage et élimination des déchets biomédicaux
Pour protéger la santé publique, la santé animale et l'environnement, il est essentiel de décontaminer tous les déchets biomédicaux avant de les éliminer avec les déchets ordinaires. Il est également important de séparer et d'éliminer les déchets biomédicaux près du lieu où ils sont produits. Par exemple, il est recommandé de munir chaque poste de travail de contenants à déchets incassables (p. ex. bacs ou bocaux), où seront déposés les déchets de laboratoire de microbiologie tels que les embouts de pipettes contaminés. Certains types d'agents pathogènes, comme les prions, ne sont pas inactivés par les procédés de décontamination qui permettent d'inactiver la plupart des microorganismes; par conséquent, les déchets contaminés par des prions devraient être séparés des autres types de déchets infectieux. Dans les installations où divers types de déchets biomédicaux sont produits, des sacs ou des contenants à déchets portant un code de couleur peuvent être utilisés pour différencier les types de déchets.
Il est important d'utiliser des contenants à déchets adaptés aux types de déchets infectieux produits. Les sacs de plastique, les contenants à usage unique (p. ex. cartons) et les contenants réutilisables n'ont pas tous la même utilité. Les déchets anatomiques humains, le sang et les liquides organiques, de même que les déchets animaux, devraient être mis dans des sacs à déchets imperméables, étanches et à l'épreuve des perforations. Avant de placer des tissus dans un sac à déchets, le fait d'en retirer les objets pointus ou tranchants (p. ex. aiguilles, tubes capillaires, embouts de pipettes) préviendra la perforation du sac. Les sacs à déchets devraient être scellés, déposés dans des contenants étanches et entreposés dans un congélateur, un réfrigérateur ou une chambre froide jusqu'au moment de la décontamination. Des contenants réutilisables peuvent être utilisés, pourvu qu'ils soient décontaminés et nettoyés après chaque usage. Les déchets pointus ou tranchants doivent être déposés directement dans un contenant résistant aux perforations, conformément à la Norme nationale du Canada (CAN)/Association canadienne de normalisation (CSA) Z316.6, Protection contre les blessures par perforants - Exigences et méthodes d'essai - Conteneurs pour objets coupants, tranchants et perforants de l'Association canadienne de normalisationNote de bas de page 5. Le verre brisé ne devrait jamais être manipulé avec les mains gantées ou nues. Des pinces ou une pelle à poussière devraient être utilisées pour ramasser les morceaux de verrerie brisés, et une serviette de papier mouillée manipulée à l'aide de pinces devrait être utilisée pour ramasser les particules de verre.
Les déchets qui ne sont pas décontaminés et éliminés immédiatement peuvent être entreposés temporairement, pourvu qu'ils soient placés dans une zone désignée séparée des autres zones d'entreposage et clairement identifiée à l'aide du symbole de danger biologique. Certains types de déchets (p. ex. déchets anatomiques humains, déchets animaux) doivent être entreposés dans une zone réfrigérée afin d'éviter la putréfaction. Une fois que les matières infectieuses ont été décontaminées sur place, le symbole de danger biologique qui était placé sur le contenant doit être retiré ou altéré pour indiquer que les matières ont été inactivées. Les matières décontaminées peuvent être éliminées avec les déchets ordinaires dans les zones de grande circulation ou les endroits publics, pourvu que l'installation mette en place des procédures d'étiquetage précises. Autrement, il peut être nécessaire de transporter les déchets à l'extérieur du site en vue de leur décontamination ou de leur élimination. Que les déchets soient décontaminés sur place ou à l'extérieur du site, ils devraient immédiatement être mis dans des contenants à déchets adéquats et étiquetés en conséquence pour faire en sorte que tous les déchets infectieux soient gardés séparément des déchets ordinaires jusqu'à leur décontamination ou leur élimination.
Le fait de limiter le déplacement des contenants à déchets entre le point d'utilisation dans la zone de travail ou dans les zones d'entreposage (p. ex. zone réservée à cet effet, chambre froide) ou d'élimination et les corridors de raccordement contribuera à réduire le risque que des agents pathogènes et des toxines soient libérés ainsi que le risque que des membres du personnel soient exposés. Le chapitre 20 fournit de plus amples renseignements sur le déplacement et le transport des matières biologiques.
References
- Note 1
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2 e éd., Ottawa, ON, Canada : Gouvernement du Canada.
- Note 2
- Conseil canadien des ministres de l'environnement. (1992). Lignes directrices sur la gestion des déchets biomédicaux au Canada. Mississauga, ON, Canada : Association canadienne de normalisation.
- Note 3
- CSA Z317.10-15, Manipulation des déchets de soins de santé. (2015). Mississauga, ON, Canada: Association canadienne de normalisation.
- Note 4
- Loi sur la santé des animaux (L.C. 1990, ch. 21). (2015).
- Note 5
- CAN/CSA Z316.6-F14, Protection contre les blessures par perforants - Exigences et méthodes d'essai - Conteneurs pour objets coupants, tranchants et perforants. (2014). Mississauga, ON, Canada: Association canadienne de normalisation.
Chapitre 17 - Plan d'intervention d'urgence
Il est essentiel que toutes les zones de confinement prévoient les situations d'urgence, qui pourraient donner lieu à des problèmes de biosécurité ou de biosûreté. Les situations d'urgence peuvent comprendre des événements tels qu'un incident ou un accident, une urgence médicale, un incendie, un déversement (p. ex. de produits chimiques ou biologiques, ou d'isotopes radioactifs), une panne d'électricité, la fuite d'un animal, un écart dans un inventaire d'agents pathogènes ou de toxines ou toute infraction à l'égard de celui-ci, une panne d'un dispositif de confinement primaire (p. ex. enceinte de sécurité biologique [ESB]), un bris de confinement (p. ex. panne du système de chauffage, de ventilation et d'air climatisé [CVAC]) ou une catastrophe naturelle. Le plan d'intervention d'urgence (PIU), fondé sur une évaluation globale des risques, décrit les procédures à suivre en cas d'urgence; il s'agit d'un outil essentiel à la protection des vies, des ressources et de l'environnement. Le PIU couvre l'ensemble des situations d'urgence prévisibles, et il décrit les mesures d'intervention à prendre en fonction de l'ampleur et de la nature de l'urgence. Le plan devrait tenir compte des dangers présents dans la zone géographique (p. ex. risques de phénomènes météorologiques violents ou de catastrophes naturelles). Il devrait également renfermer des plans d'urgence conçus pour assurer la continuité des opérations d'une manière sûre et sans danger. Les exigences minimales concernant le PIU à élaborer pour une zone de confinement réglementée sont énoncées dans la matrice 4.9 de la Norme canadienne sur la biosécurité (NCB), 2e éditionNote de bas de page 1. Un grand nombre de ressources additionnelles, facilement accessibles, peuvent faciliter l'élaboration d'un PIUNote de bas de page 2Note de bas de page 3Note de bas de page 4Note de bas de page 5.
17.1 Élaboration d'un plan d'intervention d'urgence
Au moment d'élaborer le PIU d'une zone de confinement, la collaboration avec des membres expérimentés du personnel de l'installation fera en sorte que le plan final sera complet et intégré aux plans élaborés pour l'ensemble de l'installation, au besoin. Différentes personnes peuvent participer à l'élaboration du PIU, dont les administrateurs de l'installation, les directeurs scientifiques, les chercheurs principaux, les employés de laboratoire, le personnel d'entretien et de soutien technique, l'agent de la sécurité biologique (ASB) ainsi que les responsables de la sécurité de l'installation. La collaboration avec les organisations locales de première intervention telles que les services de police, d'incendie et ambulanciers est recommandée.
Le PIU devrait être adapté aux besoins de l'organisation, de l'installation et du niveau de confinement de la zone visées, et il devrait être conçu pour assurer la sécurité du personnel d'intervention d'urgence qui pourrait devoir entrer dans la zone de confinement, en particulier dans le cas des zones de confinement élevé. Il peut aussi être prudent d'informer le personnel d'intervention d'urgence du type de matières infectieuses utilisées dans la zone de confinement. Enfin, on devrait envisager la mise au point de stratégies visant à réduire les problèmes de biosûreté qui pourraient être associés au fait que le personnel d'intervention d'urgence puisse avoir accès à des matières infectieuses, à des toxines ou à des renseignements de nature délicate lors d'une intervention d'urgence.
Le PIU peut comprendre les éléments suivants, sans toutefois s'y limiter :
- personnel responsable de l'élaboration, de la mise en œuvre et de la vérification du PIU;
- plan de consultation pour la création de mécanismes de coordination avec les organisations locales de première intervention et les hôpitaux ou établissements de soins de santé locaux, au besoin;
- outils d'évaluation des risques permettant de déterminer les situations d'urgence possibles et de mettre au point des stratégies d'atténuation des risques;
- identification des issues de secours/voies d'évacuation pour éviter que l'évacuation ne s'effectue par les zones de confinement dont le niveau est plus élevé;
- protocoles prévoyant la sortie, le transport et le traitement sécuritaires du personnel et des objets contaminés;
- prise en considération des urgences qui pourraient survenir pendant et après les heures normales de travail;
- procédures d'accès d'urgence tenant compte de la nécessité d'outrepasser, au besoin, les règlements en vigueur concernant les contrôles d'accès et de consigner les données sur l'entrée du personnel d'intervention d'urgence dans la zone de confinement, et plans d'urgence ou stratégies d'atténuation des risques visant à assurer le maintien de la biosécurité durant ces situations;
- plans d'urgence à mettre en œuvre pour assurer la continuité des opérations essentielles d'une manière sûre et sans danger;
- programmes de formation sur les situations d'urgence comprenant un volet sur la façon d'utiliser l'équipement d'urgence de façon sûre et efficace;
- plans d'exercices d'urgence prévoyant notamment le type et la fréquence des exercices à effectuer en fonction des risques associés à l'installation;
- production de rapports sur les situations d'urgence (p. ex. incidents/accidents) et procédures d'enquête;
- description du type d'équipement d'urgence présent dans la zone de confinement (p. ex. trousses de premiers soins, trousses d'intervention en cas de déversement, douches oculaires et douches d'urgence) et directives sur la façon de les utiliser correctement;
- procédures concernant les mesures à prendre pour aviser les principaux intervenants et les organismes fédéraux de réglementation concernés.
17.2 Mise en œuvre du plan d'intervention d'urgence
Une fois élaboré, le PIU (ou un résumé de celui-ci) peut être inclus dans le Manuel de biosécurité de l'installation et diffusé de manière appropriée à l'ensemble du personnel de l'installation. Il est essentiel d'offrir de la formation sur les procédures d'urgence pour s'assurer que les employés, en particulier les nouveaux employés, connaissent les procédures à suivre en cas d'urgence, et ce, avant qu'une situation d'urgence se produise. Cette formation doit être intégrée au programme de formation de l'installation (matrice 4.3 de la NCB). Il est jugé approprié d'offrir aux employés existants une formation d'appoint annuelle pour leur permettre d'actualiser leurs connaissances sur les procédures d'urgence; cependant, il pourrait être indiqué d'offrir des séances de formation plus fréquentes selon les résultats d'une évaluation des risques ou d'une évaluation des besoins en matière de formation. Les exercices structurés et réalistes permettent de vérifier que le personnel connaît le PIU et comprend son importance, de s'assurer de l'efficacité du plan ainsi que de cerner les lacunes ou les possibilités d'amélioration. Des procédures et des scénarios axés spécifiquement sur la biosûreté peuvent y être inclus (p. ex. procédures d'intervention en cas de vol, de perte d'agents pathogènes humains ou de toxines, de perte ou de sabotage de l'équipement ou des systèmes de confinement, ou des procédures de communication avec les autorités ou les organismes locaux responsables de l'application de la loi). De plus, tous les aspects du PIU (p. ex. élaboration, mise en œuvre, formation, exercices) devraient être soigneusement consignés aux fins de la formation et aux fins d'examen durant une vérification ou une inspection.
Il est toujours important de revoir le PIU et de le tenir à jour en fonction de tous les changements effectués dans la zone de confinement ou dans l'environnement immédiat (p. ex. utilisation d'un nouvel agent pathogène dans la zone de confinement, survenue d'un événement météorologique catastrophique). Il incombe à l'installation de déterminer la fréquence des examens, des évaluations et des mises à jour du PIU. Après chaque situation d'urgence ayant nécessité la mise à exécution du PIU, il est recommandé d'examiner celui-ci afin de corriger les lacunes, au besoin.
17.3 Mesures en cas de déversement
Les déversements sont les incidents les plus fréquent au cours desquels le personnel risque d'être exposé à des agents pathogènes ou à des toxines et par lesquels ces agents et toxines peuvent être libérés dans l'environnement. Les produits déversés peuvent contaminer les surfaces, le matériel, les échantillons et les travailleurs. Le protocole de décontamination utilisé dépend de l'endroit où a eu lieu le déversement et de son ampleur (volume déversé).
Si un déversement a lieu hors d'une ESB, toutes les personnes présentes dans la zone de travail risquent d'être exposées à des aérosols infectieux ou à des toxines aérosolisées. La sécurité du personnel est primordiale, mais il est aussi important d'empêcher la propagation de la contamination hors de la zone immédiate et de la zone de confinement. Pour intervenir de façon rapide et efficace en cas de déversement, il est conseillé de disposer d'une trousse préassemblée en cas de déversement biologique qui contient tous les articles nécessaires au confinement et au nettoyage (p. ex. gants, blouses jetables et couvre-chaussures, appareil de protection respiratoire, agent de désinfection efficace, serviettes en papier ou coussins absorbants, ramasse-poussière, balai, pinces, sacs à déchets et protocoles opératoires normalisés [PON] à l'épreuve de l'eau sur le nettoyage en cas de déversement). Le personnel doit être adéquatement formé à mettre en œuvre les mesures d'intervention en cas de déversement.
17.3.1 Procédure générale de nettoyage en cas de déversement
Après que le risque de blessure est éliminé, il convient de suivre les étapes suivantes pour contenir le déversement de matières infectieuses et décontaminer la zone touchéeNote de bas de page 6:
- Retirer tout vêtement et tout équipement de protection individuel (EPI) dont la contamination est avérée ou présumée.
- Les travailleurs contaminés retirent la couche externe de l'EPI et tout vêtement contaminé ou possiblement contaminé et suivent la procédure habituelle de sortie, y compris le lavage des mains. Dans le cas d'un déversement important, les travailleurs enlèvent la couche externe de protection à proximité du lieu du déversement. Selon l'évaluation locale des risques (ELR) et les PON, les travailleurs peuvent se rendre dans un vestiaire pour retirer la couche interne de l'EPI et la glisser dans un sac à autoclave en vue d'une décontamination. Les travailleurs lavent toute autre partie corporelle susceptible d'avoir été contaminée.
- Il faut aviser tout le personnel se trouvant à proximité qu'un déversement a eu lieu et qu'il faut quitter la zone.
- Les personnes ayant été exposées devraient être dirigées vers un médecin. Le superviseur ou l'autorité responsable du laboratoire devrait être informé le plus rapidement possible.
- Laisser les aérosols se déposer (p. ex. pendant 30 minutes) avant de pénétrer de nouveau dans la zone. Si le laboratoire n'est pas équipé d'un système central de ventilation, il faut reporter la réintégration des locaux (p. ex. de 24 heures) pour que le renouvellement de l'air permette l'élimination des aérosols et pour que les particules plus lourdes se déposent. Des panneaux devraient être apposés pour indiquer que l'entrée est interdite.
- Enfiler un EPI propre adapté aux risques, ce qui peut comprendre des gants, des vêtements de protection, un écran facial et des lunettes de protection, et un appareil de protection respiratoire.
- Rassembler tout le matériel de nettoyage (p. ex. trousse d'intervention en cas de déversement biologique) et l'apporter sur les lieux du déversement.
- Couvrir le produit déversé de linges ou de serviettes en papier pour éviter que le produit continue à se répandre.
- Verser un désinfectant adapté (c.-à-d. en concentration suffisante, efficace contre le ou les agents pathogènes déversés, fraîchement préparé) de façon concentrique en commençant par les bords, puis en se dirigeant vers le centre, par-dessus les linges ou les serviettes en papier et l'appliquer aussi dans les zones environnantes.
- Après un temps de contact suffisant (c.-à-d. compte tenu de l'agent pathogène et du désinfectant), éliminer les linges ou les serviettes et les débris. En présence de débris de verre ou d'autres objets pointus ou tranchants, se servir d'un ramasse-poussière ou d'un morceau de carton rigide pour les ramasser et les déposer dans un contenant résistant aux perforations en vue de leur élimination. Manipuler les morceaux de verre avec une pince. Passer le ramasse-poussière à l'autoclave ou le tremper dans un produit désinfectant.
- Nettoyer et désinfecter la zone du déversement. Au besoin, répéter les étapes précédentes.
- Jeter les produits contaminés dans un contenant à déchets étanche, résistant aux perforations.
- Une fois la désinfection terminée, conformément à la procédure générale de nettoyage en cas de déversement, les travailleurs retirent l'EPI contaminé et enfilent un EPI propre avant de retourner travailler dans le laboratoire.
- Après la désinfection, informer l'autorité interne compétente (p. ex. superviseur de la zone de confinement, ASB) que le site est décontaminé.
- Selon la nature et l'ampleur du déversement, une décontamination de toute la pièce pourrait être nécessaire.
17.3.2 Déversement à l'intérieur d'une enceinte de sécurité biologique
L'ampleur d'un déversement est déterminée par la surface sur laquelle le produit est répandu, et non par le volume de produit déversé. Lorsqu'un déversement mineur se produit à l'intérieur d'une ESB, le travailleur n'est pas considéré comme contaminé, sauf s'il a été éclaboussé ou si les éclaboussures se sont propagées à l'extérieur de l'ESB; cependant, les gants et les manches peuvent être contaminés. Un déversement important à l'intérieur d'une ESB peut entraîner la propagation de matières hors de l'ESB et la contamination du travailleur. Dans ce cas, la couche externe de l'EPI est considérée comme possiblement contaminée et devrait être retirée à l'ESB. La procédure générale suivante est recommandée en cas de déversement à l'intérieur d'une ESB :
- Retirer les gants et les éliminer à l'intérieur de l'ESB. Si deux paires de gants ont été portées, se défaire de la paire la plus externe. Si les manches peuvent être contaminées, le sarrau ou la blouse devrait aussi être retiré. Des gants propres devraient être enfilés et, au besoin, un sarrau ou une blouse propres.
- Laisser le ventilateur de l'ESB en marche et le panneau d'observation à guillotine dans la bonne position.
- Suivre les instructions de la section 17.3.1 décrivant les procédures générales de nettoyage en cas de déversement, et toujours garder la tête hors de l'ESB.
- Désinfecter la surface de tous les objets avant de les retirer de l'ESB, ou les insérer dans un sac pour autoclave. Retirer les gants contaminés et les éliminer à l'intérieur de l'ESB.
- Insérer l'EPI dans des sacs à autoclave.
- Si des matières ont été renversées et ont traversé la grille de l'ESB, verser du désinfectant à travers la grille pour inonder le bac collecteur en dessous de cette dernière.
- Essuyer toutes les surfaces internes avec du désinfectant.
- Soulever la surface de travail, vider le bac collecteur en dessous de la grille et remettre la surface de travail en place.
- Laisser fonctionner l'ESB au moins 10 minutes avant de reprendre le travail ou d'éteindre l'ESB.
17.3.3 Déversement à l'intérieur d'une centrifugeuse
En cas de bris certain ou présumé pendant que la centrifugeuse est en fonction, arrêter l'appareil et attendre (p. ex. pendant 30 minutes) avant d'ouvrir l'appareil pour laisser les aérosols se déposer. Si le bris est découvert après l'ouverture de la centrifugeuse, refermer immédiatement le couvercle et attendre (p. ex. pendant 30 minutes) avant de l'ouvrir de nouveau.
- Informer l'autorité compétente interne (p. ex. superviseur de la zone de confinement, ASB).
- Suivre les instructions de la section 17.3.1 décrivant les procédures générales de nettoyage en cas de déversement.
- Si possible, utiliser un désinfectant non corrosif dont on connaît l'efficacité contre l'agent pathogène concerné et se reporter aux spécifications du fabricant de la centrifugeuse pour confirmer les compatibilités chimiques.
- Les tubes cassés, les morceaux de verre, les godets, les tourillons et le rotor seront placés dans un bain désinfectant non corrosif (pour manipuler et retirer les débris de verre, on utilisera des pinces). Les tubes intacts et bouchés peuvent être placés dans un bain désinfectant et transportés dans une ESB pour y être ouverts et vidés.
- La cuve de la centrifugeuse est nettoyée avec le même désinfectant convenablement dilué, puis nettoyée une seconde fois, rincée à l'eau et séchée.
References
- Note 1
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2 e éd., Ottawa, ON, Canada : Gouvernement du Canada.
- Note 2
- Centre canadien d'hygiène et de sécurité au travail. (2014). Guide de planification des mesures d'urgence : Table des matières. Consulté le 3 novembre 2015 à l'adresse http://www.cchst.ca/products/publications/emergency.html
- Note 3
- Sécurité publique Canada. (2010). Guide pour la planification de la gestion des urgences : 2010-2011. Consulté le 3 novembre 2015 à l'adresse http://www.publicsafety.gc.ca/cnt/rsrcs/pblctns/mrgnc-mngmnt-pnnng/mrgnc-mngmnt-pnnng-fra.pdf
- Note 4
- Gouvernement du Canada. (2015). Préparez-vous. Consulté le 3 novembre 2015 à l'adresse http://www.preparez-vous.gc.ca/index-fra.aspx
- Note 5
- Tun, T., Sadler, K. E. et Tam, J. P. (2008). A Novel Approach for Development and Implementation of an Emergency Response Plan for the BSL-3 Laboratory Service in Singapore. Applied Biosafety. 13:158-163.
- Note 6
- Organisation mondiale de la Santé. (2004). Manuel de sécurité biologique en laboratoire, 3 e éd., Genève, Suisse : Organisation mondiale de la Santé.
Chapitre 18 - Déclaration des incidents et enquêtes sur les incidents
Bien que les termes « incident » et « accident » soient souvent utilisés de manière interchangeable lorsqu'il est question de procédures de déclaration, il faut veiller à ne pas les confondre. Un accident est un événement imprévu ayant causé des blessures, du mal ou des dommages, tandis qu'un incident est un événement ayant la possibilité de causer des blessures, du mal ou des dommages. Les incidents englobent les accidents, de même que les accidents évités de justesse et d'autres situations dangereuses. Dans la Norme canadienne sur la biosécurité (NCB), 2e édition, ainsi que dans le présent document, le terme « incident » s'applique à toutes les situations possibles, y compris les accidents, les expositions (pouvant avoir causé une maladie), les intoxications et les infections contractées en laboratoire (ICL), les bris de confinement, les libérations dans l'environnement (p. ex. déchets mal traités et jetés dans les égouts sanitaires) et les atteintes à la biosûreté (p. ex. vol ou utilisation malveillante d'une matière infectieuse ou d'une toxine) (voir la figure 18-1)Note de bas de page 1. Tous les incidents, même lorsqu'ils sont apparemment mineurs, devraient déclencher des processus internes de déclaration des incidents de l'établissement, comme il est décrit dans le Manuel de biosécurité et d'autres protocoles appropriés (p. ex. enquête sur l'incident, consignation). Les exigences minimales relatives aux enquêtes et à la déclaration d'incidents des zones de confinement réglementées sont précisées à la matrice 4.9 de la NCB.
Les protocoles concernant la déclaration des incidents et les enquêtes sur les incidents font partie intégrante du plan d'intervention d'urgence (PIU) d'une installation. Les incidents doivent être adéquatement déclarés, consignés et être l'objet d'une enquête afin que l'on puisse apprendre de ces événements, corriger tout problème potentiellement en cause et empêcher qu'un tel événement se reproduise. Il faut aussi aviser les autorités externes (c.-à-d. l'Agence de la santé publique du Canada [ASPC] ou l'Agence canadienne d'inspection des aliments [ACIA] au besoin). Dans une zone de confinement, une exposition peut se produire par inhalation (p. ex. inspiration d'aérosols infectieux ou de toxines aérosolisées), par ingestion (p. ex. contact entre la bouche et des mains ou des matières contaminées), par inoculation percutanée (p. ex. contamination des tissus sous-cutanés à la suite d'une piqûre d'aiguille ou d'une morsure), ou par absorption (p. ex. pénétration par contact direct avec la peau, les yeux ou les muqueuses). La survenue d'un incident peut être révélatrice de lacunes des systèmes de confinement, des procédures opératoires normalisées (PON) en matière de biosécurité, des programmes de formation ou des systèmes de biosécurité; l'enquête résultante permet au personnel de la zone de confinement de cerner la ou les lacunes et de prendre des mesures correctives. Des procédures de déclaration et d'enquête devraient être élaborées et intégrées aux programmes existants de l'installation (p. ex. programmes de santé et de sécurité au travail). Le chapitre 17 fournit de plus amples renseignements sur le PIU.
Il existe plusieurs normes visant à aider les installations à élaborer des procédures de déclaration des incidents et d'enquête sur les incidents. Ces normes comprennent entre autres la norme Occupational Health and Safety Assessment Series (OHSAS) 18001 de la British Standards Institution et les Norme nationale du Canada (CAN)/Association canadienne de normalisation (CSA)Z1000, Gestion de la santé et de la sécurité au travail et CAN/CSA Z796, Information sur les accidents de l'Association canadienne de normalisationNote de bas de page 2Note de bas de page 3Note de bas de page 4. Les exigences minimales concernant la déclaration des incidents et les enquêtes sur les incidents dans les zones de confinement réglementées sont énoncées dans la matrice 4.9 de la NCB. Les exigences concernant la conservation de dossiers sont énoncées dans la matrice 4.10 de la NCB.
18.1 Déclaration des incidents
Tous les incidents mettant en cause des matières infectieuses, des animaux infectés ou des toxines, comme une défaillance des systèmes de confinement, l'exposition à un agent pathogène humain ou à une toxine, ou la libération d'un agent pathogène animal, doivent être immédiatement déclarés au personnel approprié (p. ex. superviseur de la zone de confinement, agent de la sécurité biologique [ASB], titulaire de permis dans une installation visée par un permis) (matrice 4.2 de la NCB). D'ailleurs, toute personne qui travaille sous l'autorité d'un permis a l'obligation légale de notifier le personnel compétent de l'installation si elle a des motifs de croire qu'un incident impliquant la libération accidentelle, la production accidentelle ou la perte d'un agent pathogène ou d'une toxine, ou une maladie (c.-à-d. aucun incident d'exposition) a eu lieu (LAPHT 15). Il est important de procéder rapidement à la déclaration des incidents à l'interne, dans l'installation, pour que la direction (y compris le titulaire de permis dans une installation visée par un permis) soit informée des événements, et qu'elle puisse mettre en œuvre des stratégies de réduction et d'atténuation immédiates des dangers, et d'initier une évaluation préliminaire afin de déterminer si une exposition est probablement survenue (la figure 18-2 illustre un organigramme décisionnel qui peut servir dans l'évaluation de l'exposition). De plus, la déclaration à l'interne lance le processus de l'installation qui permet de mener une enquête au sujet de l'incident, de cerner la ou les causes fondamentales, de planifier des mesures correctives, de consigner les résultats (p. ex. personnel blessé), et de déterminer les exigences législatives en matière de présentation de rapports aux organismes de réglementation. Lorsque certains types d'incidents mettant en cause des agents pathogènes, des matières infectieuses ou des toxines se produisent, les employés des installations réglementées par l'ASPC et l'ACIA doivent aviser les autorités réglementaires concernées. Les installations réglementées doivent aussi élaborer et tenir à jour des procédures écrites relatives à la définition, à la consignation et à la déclaration des incidents mettant en cause des matières infectieuses ou des toxines (matrice 4.1 de la NCB). Ces procédures devraient aussi respecter tous règlements fédéraux, provinciaux ou territoriaux et municipaux additionnels applicables, de même que les exigences internes de l'organisation concernant la déclaration des incidents et les enquêtes sur les incidents.
18.1.1 Déclaration des incidents à l'Agence de la santé publique du Canada
Les installations visées par un permis les autorisant à mener des activités réglementées comportant la manipulation d'agents pathogènes humains et de toxines ont l'obligation d'aviser l'ASPC de la survenue d'incidents et d'expositions en vertu de la Loi sur les agents pathogènes humains et les toxines (LAPHT) et du Règlement sur les agents pathogènes humains et les toxines (RAPHT), tel que décrit précédemmentNote de bas de page 5Note de bas de page 6. Dans le cadre de ses fonctions, l'ASB doit notamment communiquer avec l'ASPC au nom du titulaire de permis (RAPHT 9[1]), et entre autres procéder à la déclaration obligatoire des incidents. Conformément à la LAPHT et au RAPHT, le titulaire de permis est tenu d'aviser immédiatement l'ASPC dans les situations suivantes :
- le titulaire de permis a des motifs de croire que des agents pathogènes humains ou des toxines ont été involontairement libérés de l'établissement (LAPHT 12[1]);
- de façon involontaire, une personne entre en possession d'agents pathogènes humains ou de toxines ou en produit sans y être autorisée (LAPHT 12[2]);
- un agent biologique à cote de sécurité élevée (ABCSE) n'est pas reçu dans les 24 heures suivant la date et l'heure de livraison prévues (RAPHT 9[1]);
- il y a des raisons de croire que des agents pathogènes humains ou des toxines ont été volés ou ont autrement disparu (LAPHT 14);
- un incident mettant en cause des agents pathogènes humains ou des toxines a causé ou peut avoir causé une maladie chez une personne (c.-à-d. tout incident d'exposition) (LAPHT 13);
- il s'est produit un incident dont l'ASPC doit être avisée, comme le précise toute condition supplémentaire dont est assorti le permis (LAPHT 18[4]).
18.1.1.1 Déclaration des expositions concernant des agents pathogènes humains ou des toxines
Les infections résultant de l'exposition à des agents pathogènes ou à des matières infectieuses manipulés dans une zone de confinement sont désignées des ICL; ce terme englobe aussi les maladies causées par l'exposition à des toxines (c.-à-d. intoxication) manipulées dans une zone de confinement. L'expression « incident d'exposition » est plus générale, et elle englobe tout incident mettant en cause un agent pathogène ou une toxine et ayant probablement causé une infection ou une intoxication et, par le fait même, présentant un risque de maladie (que la maladie se manifeste ou non). Selon l'article 13 de la LAPHT, tout incident ayant causé une ICL (maladie avérée) ou une exposition (c.-à-d. inhalation, ingestion, inoculation ou absorption probable) concernant un agent pathogène humain du groupe de risque 2 (GR2), du groupe de risque 3 (GR3) ou du groupe de risque 4 (GR4) ou à une toxine qui survient dans une installation visée par un permis doit être déclaré à l'ASPC sans délai (c.-à-d. dès que la situation est maîtrisée et que suffisamment de renseignements préliminaires sur l'incident ont été recueillis). Cette information peut être fournie électroniquement à l'ASPC par l'intermédiaire du Portail de biosûreté, accessible à partir du site Web de l'ASPC (www.santepublique.gc.ca/pathogenes), au moyen d'un formulaire de notification de l'exposition. Cette déclaration initiale de l'incident d'exposition renferme une brève description de l'incident, le nom de l'agent pathogène ou de la toxine en cause ainsi que toute autre information préliminaire au sujet de l'incident, par exemple les mesures d'atténuation immédiates et l'état actuel de la personne touchée, s'il est connu. Il n'est habituellement pas nécessaire de fournir de renseignements personnels sur la personne touchée, mais cela peut être exigé dans des circonstances exceptionnelles (p. ex. pour protéger la santé publique). Un formulaire de suivi de l'exposition faisant état des résultats de l'enquête sur l'incident doit être présenté à l'ASPC dans les 30 jours suivant la présentation du formulaire de notification de l'exposition, ou dans les 15 jours si l'incident met en cause un ABCSE. Les exigences précises concernant la déclaration des cas d'exposition à l'ASPC sont énoncées dans la matrice 4.9 de la NCB.
La figure 18-2 contient un organigramme décisionnel conçu pour faciliter l'évaluation d'un incident afin de déterminer si une exposition doit être déclarée, conformément à l'article 13 de la LAPHT. Deux scénarios sont possibles : (i) un incident reconnu qui nécessite une évaluation afin de déterminer ou d'exclure une possible exposition à des agents pathogènes humains ou aux toxines parmi le ou les individus impliqués dans l'incident; et (ii), une maladie avérée chez un ou des employées de l'installation ou autres personnes (p. ex. un visiteur ou un étudiant) pour laquelle une évaluation est appropriée afin de déterminer ou d'exclure une possible exposition manquée, non reconnue ou non déclarée qui pourrait expliquer la maladie.
Il n'est pas nécessaire de déclarer à l'ASPC un incident survenu dans une zone de confinement visée par un permis lorsque l'enquête sur l'incident et l'évaluation locale des faits ont permis de déterminer que l'incident n'a probablement pas résulté en une exposition (c.-à-d. infection ou intoxication). Il n'est pas non plus nécessaire de déclarer à l'ASPC la présence avérée d'une maladie lorsqu'il a été déterminé qu'elle n'a probablement pas été causée par un incident d'exposition survenu dans la zone de confinement, c'est-à-dire lorsque l'enquête sur l'incident et l'évaluation locale des faits ont permis d'écarter la possibilité d'une exposition dans le laboratoire et de déterminer que la maladie a probablement été causée par une exposition dans la communauté, lors d'un voyage ou dans un autre contexte. De plus, les expositions et les ICL survenues dans des zones de confinement ou des installations non visées par les exigences de la LAPHT et du RAPHT n'ont pas à être déclarer à l'ASPC, mais peuvent être déclarées sur une base volontaire. Veuillez communiquer directement avec l'ASPC pour obtenir de plus amples renseignements sur la déclaration volontaire des incidents.
18.1.1.2 Suivi de l'exposition
Le formulaire de suivi de l'exposition, qu'il est possible de se procurer auprès de l'ASPC, est une extension du formulaire de notification de l'exposition, qui permet de mettre à jour ou de compléter les renseignements préliminaires sur l'incident qui ont été fournis lors de la déclaration et qui peut être présenté électroniquement par l'intermédiaire du Portail de biosûreté en tant que formulaire de suivi de l'exposition. Ce rapport électronique est conçu pour saisir les résultats du processus d'enquête sur les incidents. Il est utile de consigner les renseignements les plus importants de l'incident, de participer à l'analyse des causes fondamentales et de disposer d'un plan de mesures correctives qui pourrait être mis en œuvre afin de réduire la probabilité que l'incident se reproduise. Un rapport sur l'enquête menée après l'incident d'exposition doit être présenté à l'ASPC dans les 30 jours civils suivant la présentation du formulaire de notification de l'exposition initiale, ou dans les 15 jours civils si l'incident met en cause un ABCSE (matrice 4.9 de la NCB).
L'ASPC examine et analyse le contenu des rapports de déclaration d'exposition et les rapports de suivi de l'exposition afin de suivre les tendances possibles, d'évaluer les risques qui pourraient se poser pour la santé publique et de déterminer si sa participation directe est justifiée. Cette décision pourrait reposer sur la prise en considération de facteurs tels que les groupes de risque auxquels appartiennent les agents pathogènes humains ou les toxines en cause dans l'incident, la transmissibilité des agents pathogènes humains, le nombre de personnes touchées et la probabilité d'une propagation dans la communauté. Si cela est jugé approprié, l'ASPC communiquera rapidement avec le titulaire de permis pour faire un suivi sur les mesures prises. Sur demande, l'ASPC peut aussi participer à l'évaluation, à la tenue de l'enquête et à la rédaction de rapports en offrant une aide, une expertise en la matière ou un soutien.
18.1.1.3 Rapport annuel sur les incidents mettant en cause des agents biologiques à cote de sécurité élevée
Les permis délivrés aux installations autorisées à travailler avec des ABCSE sont assortis d'une condition supplémentaire selon laquelle elles pourraient être obligées de présenter à l'ASPC un rapport annuel résumant tous les incidents mettant en cause des ABCSE survenus dans les 12 mois précédents (ou un rapport indiquant qu'aucun incident n'est survenu). Le rapport annuel doit comprendre les renseignements suivants : un résumé de tous les incidents qui se sont produits dans l'année précédente, une analyse des causes fondamentales de chaque incident, une description de chaque préoccupation liée aux systèmes de biosécurité, et des renseignements sur les mesures correctives qui ont été mises en œuvre pour y remédier. Le rapport annuel repose sur les exigences concernant la déclaration systématique des incidents et permet à l'ASPC de déterminer avec une meilleure précision la fréquence et les causes probables des incidents mettant en cause des ABCSE. Puisque les renseignements détaillés sur tous les incidents d'exposition mettant en cause des ABCSE sont fournis à l'ASPC au moyen du formulaire de notification de l'exposition initial obligatoire, et du formulaire de suivi de l'exposition présenté dans les 15 jours civils suivant l'incident, il n'est pas nécessaire de répéter ces renseignements dans le rapport annuel sur les incidents mettant en cause des ABCSE.
18.1.1.4 Système de déclaration des cas d'exposition
Tous les renseignements au sujet des incidents d'expositions et d'ICL concernant des agents pathogènes humains du GR2, du GR3 et du GR4 et des toxines dans une zone de confinement visée par un permis sont à présenter à l'ASPC et donc saisis dans le Système de déclaration des expositions de l'ASPC. Cela permet à l'ASPC de suivre les nouvelles tendances, et pourrait entraîner l'émission d'avis concernant la biosécurité ainsi que de contribuer à la mise à jour des pratiques exemplaires et de la formation en matière de biosécurité. L'ASPC ne recueille habituellement pas de renseignements commerciaux ou personnels confidentiels en ce qui concerne les incidents lors desquels une personne a été exposée à un agent pathogène humain ou à une toxine; cependant, si de tels renseignements étaient recueillis, ils seraient protégés conformément aux lois fédérales applicables.
L'ASPC analyse les renseignements recueillis au moyen des formulaires de notification de l'exposition et des formulaires de suivi de l'exposition qui documentent les cas d'exposition et les ICL concernant des agents pathogènes humains et des toxines afin de contribuer à l'adaptation des pratiques actuelles et à l'élaboration des pratiques futures en ce qui concerne le bioconfinement et la biosécurité au Canada.
18.1.2 Déclaration à l'Agence canadienne d'inspection des aliments
La Loi sur la santé des animaux (LSA) énonce les exigences concernant l'obligation d'aviser l'ACIA lorsqu'on découvre qu'un animal est infecté, ou présente des signes d'infection, par un agent pathogène causant une maladie à déclaration obligatoire ou par une substance toxiqueNote de bas de page 7. L'annexe du Règlement sur les maladies déclarables et les annexes VII et VIII du Règlement sur la santé des animaux (RSA) contiennent la liste des maladies déclarables et des maladies à notification immédiate dont peuvent être atteints les animaux terrestresNote de bas de page 8Note de bas de page 9. Ces maladies pourraient constituer une préoccupation dans une zone de confinement d'animaux si l'on découvrait chez un animal de laboratoire la présence imprévue de signes cliniques de l'une des maladies indiquées. Veuillez communiquer directement avec l'ACIA pour obtenir de plus amples renseignements sur les maladies déclarables et les maladies à notification immédiate.
Selon les conditions qui figurent sur le permis d'importation d'agents zoopathogènes, la déclaration à l'ACIA de tout incident impliquant un agent zoopathogène, une toxine ou tout autre matière infectieuse réglementée dans une installation où cette matière a été importée ou transférée au titre d'un permis d'importation d'agents zoopathogènes ou une autorisation de transfert délivrée par l'ACIA, ou dans une installation qui a été certifiée par l'ACIA peut être exigé. L'ACIA examinera l'information connexe à l'incident pour vérifier si une libération n'a pas eu lieu et pour assurer une conformité continue à la NCB. À cette fin, l'information reçue par l'ASPC sur les incidents impliquant des agents zoopathogènes peut aussi être transférée à l'ACIA. Les permis d'importation d'agents zoopathogènes peuvent comporter des conditions supplémentaires sur le signalement à l'ACIA. Veuillez consulter les conditions du permis d'importation d'agents zoopathogènes pour de plus amples renseignements.
18.2 Enquêtes sur les incidents
L'enquête faisant suite à un incident est nécessaire pour déterminer la ou les causes fondamentales de l'incident, autrement dit, pour déterminer les raisons premières ou sous-jacentes expliquant l'incident. Les résultats de l'enquête exhaustive sont aussi importants, car ils servent à établir et à demander les mesures correctives nécessaires à l'atténuation du ou des problèmes en cours et à éviter que des incidents similaires se reproduisent. À cette fin, les enquêtes sur les incidents fournissent un mécanisme de rétroaction crucial qui contribue à améliorer les stratégies existantes d'atténuation des risques d'incidents et de prévention des incidents. Les procédures de déclaration des incidents et d'enquête sur ces derniers permettant de relever et de consigner ces données peuvent comprendre les éléments suivants :
- définition des incidents qui pourraient se produire et des situations qui doivent être déclarées ou qui nécessitent une enquête;
- rôles et responsabilités du personnel;
- chaîne hiérarchique à suivre pour déclarer un incident;
- séquence des événements et causes fondamentales qui ont mené ou contribué à l'incident;
- façon de consigner les incidents, types de rapports et de modèles à utiliser et contenu de ces derniers;
- fréquence à laquelle les rapports sur les incidents doivent être préparés et la liste de distribution de ces rapports;
- mesures correctives à prendre pour éviter que les incidents se reproduisent;
- possibilités d'amélioration;
- évaluation de l'efficacité des mesures préventives et correctives qui ont été prises;
- communication des résultats des enquêtes et des mesures correctives qui ont été prises aux parties concernées (p. ex. personnel de l'installation, comité de santé et sécurité, haute direction, organismes de réglementation et autorités locales responsables de l'application de la loi).
La portée et l'ampleur de l'enquête sur un incident peuvent varier selon la gravité de l'incident ou du niveau de préoccupation associé à l'agent pathogène ou à la toxine en cause (p. ex. ABCSE). Avant de commencer une enquête, on devrait choisir et nommer les membres du personnel responsables de cette tâche. En fonction de la nature et de la gravité de l'incident, on peut confier cette tâche à une seule personne ou mettre sur pied une équipe pour les situations plus complexes. La ou les personnes devraient mener l'enquête en ayant l'esprit ouvert, prenant soin de n'inclure aucun a priori concernant la nature et la cause de l'incident. Les procédures d'enquête sur les incidents devraient être revues et mises à jour régulièrement, ce qui permettrait de les garder à jour et d'assurer leur efficacité. Le processus d'enquête est systématique et comprend généralement les étapes présentées ci-après.
18.2.1 Intervention initiale
L'intervention initiale peut comprendre la prestation des premiers soins ou des services d'urgence, l'évaluation de la gravité de l'incident (p. ex. risque de bris de confinement ou d'infection), le control de l'ampleur du danger immédiat et la prévention d'un incident secondaire, l'identification et la protection des éléments de preuve et la déclaration de l'incident au personnel approprié. À ce stade, une évaluation est réalisée pour déterminer s'il y a eu ou non une libération (p. ex. le résultat d'un déversement, d'une éclaboussure, d'une fuite, d'une pulvérisation ou d'une émission) d'un agent pathogène ou d'une toxine d'un système de confinement ou de la zone de confinement elle-même. Si c'est le cas, des mesure sont mise en œuvre pour contrôler et contenir la matière libérée et prévenir des incidents supplémentaires. Les incidents mettant en cause des matières infectieuses doivent être déclarés immédiatement au personnel de l'installation approprié (p. ex. superviseur de la zone de confinement, ASB), et en fonction du type d'incident, pourraient aussi nécessiter une déclaration à l'externe (voir la section 18.1). La portée et l'ampleur de l'enquête sur l'incident peuvent varier selon la gravité de l'incident.
18.2.2 Collecte des éléments de preuve et des renseignements
La collecte des éléments de preuve et des renseignements exacts est cruciale dans toute enquête portant sur un incident. Les photos, les croquis et les vidéos peuvent permettre de saisir un registre visuel des éléments de preuves, ainsi que de l'emplacement de l'incident, et sont utiles pour les analyses subséquentes. Il est important d'interroger les personnes qui peuvent savoir ce qui a contribué à l'incident aussitôt que possible afin de réduire au minimum les erreurs de mémoire. De plus, la collecte de documents en lien avec l'incident peut fournir de l'information pertinente aux fins de l'enquête. Ces documents peuvent être abondants; il s'agit notamment des dossiers de formation des employés, des registres d'entretien, des normes en matière d'approvisionnement, des PON, des politiques d'orientation à l'intention des nouveaux employés et des visiteurs, et des pratiques de travail sécuritaires.
18.2.3 Analyse et identification des causes fondamentales
L'analyse des éléments de preuve et de l'information visant à déterminer les causes fondamentales est souvent réalisée à l'aide d'une version élargie des questions habituelles : qui? quoi? quand? où? comment? et pourquoi? Voici des exemples de questions :
- Qui était impliqué dans l'incident (p. ex. membres du personnel, témoins)?
- Quelle était la matière infectieuse ou la toxine en cause dans l'incident?
- Quand et où l'incident s'est-il produit?
- Comment l'incident s'est-il produit (quels sont les facteurs qui y ont contribué)?
Cherchez à savoir pourquoi chaque événement associé aux circonstances de l'incident s'est produit. En demandant toujours « pourquoi? », vous arriverez à déterminer les causes et les facteurs qui ont mené à l'incident. En se posant une succession de questions « pourquoi? » jusqu'à ce qu'il n'y ait plus de réponse, on peut trouver la ou les causes fondamentales qui ont contribué ou mené à l'incident lorsqu'il n'y a plus de réponse. En posant la question « pourquoi? », gardez toujours en tête les éléments comme les mesures de contrôle des achats, la formation et le fonctionnement du matériel. Il peut également être utile de se demander si l'incident était isolé ou répété, ou accidentel ou intentionnel, en particulier s'il y a eu manquement aux règles de biosûreté (p. ex. une personne qui aurait à maintes reprises pris des échantillons d'ABSCE sans mettre à jour l'inventaire des échantillons).
18.2.4 Élaboration de plans d'action correctifs et préventifs
L'élaboration de plans d'action correctifs et préventifs permet de s'attaquer aux causes fondamentales de divers incidents et d'identifier des mesures appropriées pour empêcher qu'ils se reproduisent. L'enquête sur un incident peut également permettre de cerner des éléments des systèmes de biosécurité et de biosûreté qui n'ont pas réussi à prévenir l'incident et de fournir un aperçu et des opportunités qui permettent de prendre des mesures correctives. Fondés sur les résultats de l'enquête, les plans devraient indiquer les mesures à prendre pour éliminer le danger immédiat (plans correctifs) et atténuer le risque que l'incident se reproduise (plans préventifs). Les plans devraient également préciser le personnel nécessaire à leur mise en œuvre et fournir un échéancier à cette fin.
18.2.5 Évaluation et amélioration continue
Après que les plans d'action correctifs et préventifs ont été mis en œuvre, il importe d'examiner leur efficacité et de s'assurer que les causes fondamentales identifiées sont gérées de façon efficace.
La dernière étape du processus d'enquête consiste en un examen continu du programme, qui vise à cerner les possibilités d'amélioration. À cette fin, on peut revoir les rapports d'enquête sur les incidents, examiner les tendances relatives aux incidents et consulter le personnel de la zone de confinement ou la haute direction. Ceci devrait comprendre un examen des évaluations locales des risques (ELR) et des PON pour déterminer si des révisions sont nécessaires en conséquence de l'incident. Là où une formation insuffisante est identifiée comme cause fondamentale, les matériels de formations devraient être mis à jour en conséquence et une formation d'appoint prévue pour le personnel.
Figure 18-1 : Incidents, expositions, et intoxications et infections contractées en laboratoire (ICL)
Diagrammes représentatif des incidents mettant en cause des agents pathogènes humains ou des toxines, ce qui comprend les expositions ainsi que les intoxications et infections contractées en laboratoire (ICL)
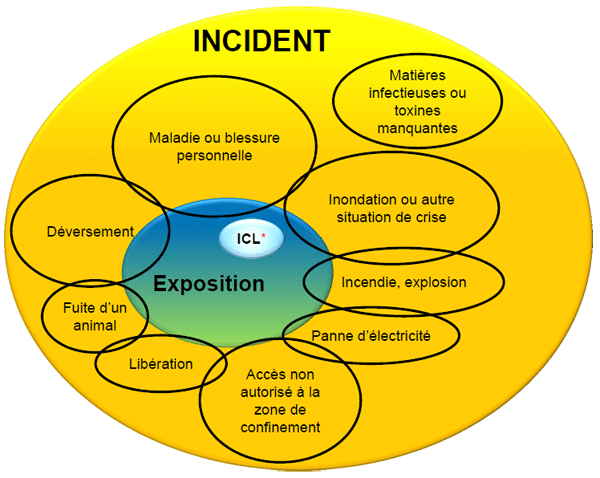
Équivalent textuel - Figure 18-1
Cette figure, qui représente les divers incidents en lien avec les agents pathogènes et les toxines, montre ceux pouvant provoquer une exposition, à savoir : maladie ou blessure personnelle; déversement; fuite d’un animal; libération; accès non autorisé à la zone de confinement; panne d’électricité; incendie ou explosion; et inondation ou autre situation de crise. Les matières infectieuses ou toxines manquantes sont le seul incident qui n’entraîne pas d’exposition. Les infections et intoxications contractées en laboratoire sont présentées comme un sous‑groupe d’expositions.
Figure 18-2: Organigramme décisionnel pour l'évaluation d'un incident
Cet organigramme aide à déterminer si une exposition est survenue et si une déclaration à l'ASPC est exigée.
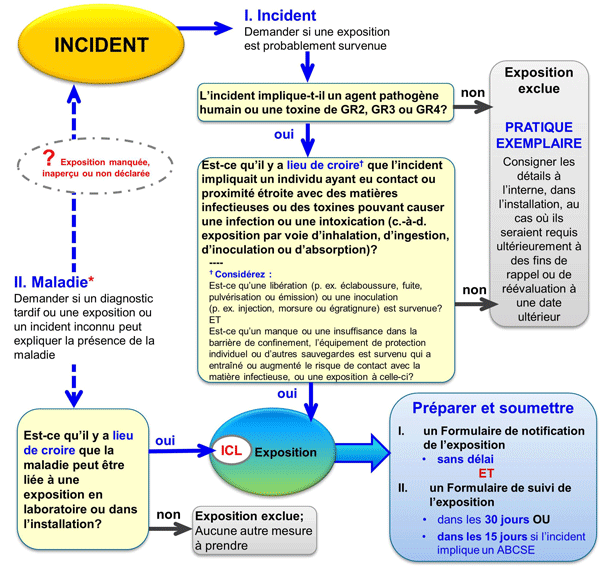
Équivalent textuel - Figure 18-2
Si un incident implique un agent pathogène ou une toxine du GR2, GR3 ou GR4 et qu’il y a lieu de croire que l’incident est dû au contact ou à la proximité étroite d’une ou plusieurs personnes avec des matières infectieuses ou des toxines pouvant causer une infection ou une intoxication (c.‑à‑d. une exposition par inhalation, par ingestion, par inoculation ou par absorption), une exposition est survenue et il faut remplir et soumettre un formulaire de notification de l’exposition sans tarder. Un formulaire de suivi de l’exposition doit aussi être présenté dans les 30 jours suivants, sauf dans le cas des ABCSE, qui nécessitent un rapport de suivi dans les 15 jours. Selon les pratiques exemplaires, si l’incident n’impliquait aucun agent pathogène ni aucune toxine du GR2, GR3 ou GR4 et que rien ne porte à croire qu’une infection ou une intoxication ait été causée par un contact ou une proximité étroite avec un agent pathogène ou une toxine, il faut en consigner les détails à l’interne, dans l’installation, au cas où ils seraient requis ultérieurement dans l’éventualité d’un rappel ou d’une réévaluation.
Si une maladie est détectée et qu’il y a lieu de croire qu’elle peut être liée à une exposition dans la zone de confinement, elle est classée comme une ICL et une exposition manquée ou non déclarée. Des formulaires de notification et de suivi de l’exposition doivent être remplis et soumis conformément aux dispositions ci‑dessus. Si rien ne porte à croire que la maladie puisse être liée à la zone de confinement, la possibilité d’une exposition peut être exclue et aucune autre mesure n’est nécessaire.
Dans la plupart des cas, l’état de maladie comprend la reconnaissance d’une infection, d’une maladie ou d’un syndrome connu. Cependant, certaines installations peuvent utiliser des pratiques de surveillance médicale capables de mettre en évidence une séroconversion, ce qui peut constituer une source d’information additionnelle pour la reconnaissance d’une infection ou d’un état de maladie.
* Dans la plupart des cas, l'état de maladie comprend la reconnaissance d'une infection, d'une maladie ou d'un syndrome connu. Cependant, certaines installations peuvent utiliser des pratiques de surveillance médicale capables de mettre en évidence une séroconversion, ce qui peut constituer une source d'information additionnelle pour la reconnaissance d'une infection ou d'un état de maladie.
Références
- Note 1
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité (2 e éd). Ottawa, ON, Canada, gouvernement du Canada.
- Note 2
- BS OHSAS 18001:2007, Occupational Health and Safety Management Systems - Requirements. (2007). Londres, Royaume-Uni: British Standards Institution.
- Note 3
- CAN/CSA-Z1000-F14, Gestion de la santé et de la sécurité au travail. (2014). Mississauga, ON, Canada : Association canadienne de normalisation.
- Note 4
- CAN/CSA Z796-F98 (C2013), Information sur les accidents. (1998). Mississauga, ON, Canada: Association canadienne de normalisation.
- Note 5
- Loi sur les agents pathogènes humains et les toxines (L.C. 2009, ch. 24). (2015).
- Note 6
- Règlement sur les agents pathogènes humains et les toxines (DORS/2015-44). (2015).
- Note 7
- Loi sur la santé des animaux (L.C. 1990, ch. 21).(2015).
- Note 8
- Règlement sur les maladies déclarables (DORS/91-2). (2014).
- Note 9
- Règlement sur la santé des animaux (C.R.C., ch. 296). (2015).
Chapitre 19 - Responsabilité à l'égard des matières infectieuses et des toxines et gestion de l'inventaire
Les bonnes pratiques en matière de biosécurité et de biosûreté comprennent des dispositions conçues pour assurer la reddition de comptes à l'égard des matières infectieuses et des toxines ainsi que leur protection contre la perte, le vol, l'utilisation délibérément malveillante, le détournement et la libération intentionnelle. Le présent chapitre décrit les mesures à prendre pour créer un environnement qui permet de se protéger contre les menaces internes et de les prévenir, et, en même temps, intégrer des pratiques exemplaires concernant les systèmes de gestion des matièresNote de bas de page 1. Les agents pathogènes et les toxines qui devraient être assujettis à des mesures concernant la responsabilité et le contrôle peuvent être identifiés au moyen de l'évaluation des risques en matière de biosûreté (qui consiste notamment à recenser les ressources, comme l'explique le chapitre 6). Les mesures de contrôle servent à confiner les ressources aux endroits désignés et à en limiter l'accès aux personnes autorisées par des moyens physiques (p. ex. barrières de sécurité) ou par des protocoles opérationnels (p. ex. procédures opératoires normalisées [PON]). Les mesures concernant la responsabilité définissent le niveau de surveillance et de responsabilité de toutes les personnes autorisées à qui est confiée la garde des ressources. En vertu de la Norme canadienne sur la biosécurité (NCB), 2e édition, les zones de confinement réglementées doivent inclure la responsabilité à l'égard des agents pathogènes et des toxines ainsi que la gestion de l'inventaire de ces matières dans le plan de biosûreté de l'installation (matrices 4.1 et 4.10 de la NCB)Note de bas de page 2. Le chapitre 6 fournit de plus amples renseignements sur la biosûreté, y compris l'évaluation des risques en matière de biosûreté et le plan de biosûreté.
19.1 Responsabilité à l'égard des agents pathogènes et des toxines
Les mesures concernant la responsabilité visent à établir la propriété des agents pathogènes et des toxines, et à préciser la responsabilité de chacune des personnes autoriséesNote de bas de page 3. Dans le contexte du programme de biosécurité et de biosûreté dont il est question dans la NCB et dans le présent document, les mesures concernant la responsabilité à l'égard des agents pathogènes peuvent et devraient englober toutes les matières qu'on sait contiennent un agent pathogène nécessitant la prise de telles mesures. Cela comprend les matières réglementées en vertu de la Loi sur les agents pathogènes humains et les toxines (LAPHT), du Règlement sur les agents pathogènes humains et les toxines (RAPHT), de la Loi sur la santé des animaux (LSA) et du Règlement sur la santé des animaux (RSA), qui contiennent des agents zoopathogènes (c.-à-d. un agent pathogène ou une toxine purs ou isolés; les animaux infectés ou intoxiqués et les produits ou les sous-produits d'origine animale qui contiennent un agent zoopathogène ou une partie de cet agent, ou d'autres organismes qui contiennent un agent zoopathogène ou une partie de ce dernier et qui a été importé en vertu d'un permis d'importation d'agents zoopathogènes; les animaux infectés au cours d'une expérience ou autrement ou les échantillons prélevés chez ces animaux; les lignées cellulaires ou les cultures de cellules contenant un agent pathogène ou une partie de ce dernier qui demeurent pathogènesNote de bas de page 4Note de bas de page 5Note de bas de page 6Note de bas de page 7. Cependant, il est généralement recommandé que les mesures concernant la responsabilité à l'égard des agents pathogènes et des toxines présents dans une zone de confinement ou une installation s'appliquent aussi à toute autre matière avérée, présumée ou soupçonnée d'être infectieuse qui n'est pas nécessairement réglementée par l'Agence de la santé publique du Canada (ASPC) et l'Agence canadienne d'inspection des aliments (ACIA). Afin de faire preuve de prudence, il faudrait que les échantillons primaires ou les lignées cellulaires obtenus au pays qui sont mal caractérisés et qui n'ont pas été analysés pour y vérifier la présence d'agents pathogènes soient assujettis au même niveau de responsabilité et de contrôle qu'un échantillon de l'agent pathogène isolé.
Un système de responsabilité établit la structure de gouvernance d'une organisation, structure dans laquelle les relations entre les personnes sont définies selon l'obligation de rendre des comptes. En résumé, le système de responsabilité crée un cadre dans lequel la personne A doit rendre des comptes à la personne B et est tenue d'informer la personne B de ses actions et de ses décisions, de les justifier et de répondre de ces actions et décisionsNote de bas de page 8. Un grand nombre de hiérarchies et d'organisations utilise ce type de relations, par exemple une institution financière (c.-à-d. « personne A ») par rapport à un client ou à un titulaire de compte (c.-à-d. « personne B »), un employé par rapport à un gestionnaire, ou un étudiant par rapport à un enseignant. Dans le contexte de la responsabilité à l'égard des agents pathogènes et des toxines, le recours à un tel système signifie entre autres que l'on confie à des personnes qualifiées et autorisées la responsabilité de superviser le contrôle des agents pathogènes, des toxines et des matières infectieuses réglementées, la tenue de registres précis et à jour ainsi que la vérification régulière des matières et des registres (p. ex. audits). Ces personnes autorisées doivent rendre des comptes au sujet de leurs actions et de leurs décisions concernant les agents pathogènes, les toxines et les matières infectieuses réglementées à leurs superviseurs, aux directeurs de la zone de confinement ou de l'installation, aux titulaires de permis ou aux titulaire de permis d'importation d'agents zoopathogènes, et peuvent aussi devoir rendre des comptes à l'ASPC et à l'ACIA.
La NCB énonce les exigences minimales relatives à la responsabilité et au contrôle à l'égard des agents pathogènes, des toxines et d'autres matières infectieuses réglementées dans les zones de confinement réglementées (matrice 4.10 de la NCB). En fonction des matières entreposées à long terme, les installations peuvent également disposer d'un moyen d'identifier les agents pathogènes et les toxines (p. ex. genre, espèce, souche, le cas échéant) et leurs groupes de risques, et de connaître leur emplacement (p. ex. pièce, réfrigérateur/congélateur, tablette). Compte tenu de la nature temporaire de nombreux échantillons de laboratoire, seuls les échantillons entreposés à long terme, c'est-à-dire pour plus de 30 jours civils, doivent être consignés dans un inventaire. Les matières entreposées à long terme ne devraient pas être manipulées activement (elles devraient par exemple être cryoconservées ou entreposées à des fins de référence ou d'utilisation future). Dans le cas des matières entreposées à court terme (moins de 30 jours), des renseignements devraient normalement être consignés ailleurs, comme dans des carnets de laboratoire, des demandes d'analyses et des journaux de saisie de données. Pour ce qui est des cultures actives d'agents pathogènes ou de matières infectieuses nécessitant une incubation de plus de 30 jours (p. ex. cultures cellulaires continues), il pourrait ne pas être nécessaire de consigner les matières en question dans l'inventaire officiel de la zone de confinement, selon le risque associé aux matières, et pourvu que les renseignements minimum requis soient consignés ailleurs (p. ex. entrées quotidiennes du carnet de laboratoire, journal de bord des cultures cellulaires), et que les renseignements consignés soient suffisamment détaillés pour qu'il soit possible de déterminer immédiatement si un échantillon a disparu ou a été volé.
19.1.1 Système de responsabilisation interne
Les installations où sont manipulés et entreposés des agents pathogènes, des toxines et des matières infectieuses réglementées sont tenues d'élaborer et de mettre en œuvre un système de responsabilisation interne pour faire en sorte que chaque membre du personnel connaisse ses propres responsabilités, les mesures de contrôle administratives en place ainsi que les sanctions infligées en cas de non-respect de ce système. La meilleure façon de procéder peut être d'établir une politique ou un code de conduite décrivant les responsabilités de l'ensemble du personnel, comme la politique de biosécurité décrite au chapitre 5. Le document devrait notamment décrire les rôles et les responsabilités des personnes autorisées, des membres de la haute direction, du comité de biosécurité de l'établissement ainsi que de l'agent de la sécurité biologique (ASB), pour faire en sorte que tous les membres du personnel connaissent leurs responsabilités juridiques, celles de leurs collègues ainsi que les attentes de l'établissement. Dans les installations visées par un permis les autorisant à mener des activités réglementées comportant la manipulation d'agents pathogènes humains et de toxines, le titulaire de permis est considéré comme la personne qui détient la responsabilité juridique ultime en vertu de la LAPHT et du RAPHT. Dans le cas des installations visées par un permis d'importation d'agents zoopathogènes, l'importateur est considéré comme la personne qui détient la responsabilité juridique ultime en vertu de la LSA. Les mesures disciplinaires (p. ex. sanctions ou pénalités) prises en cas de non-conformité au système de responsabilisation devraient être clairement consignées et communiquées à tous les membres du personnel.
Au moment d'élaborer des procédures et des outils concernant la responsabilité à l'égard des agents pathogènes et des toxines, il est important de tenir compte des matières présentes dans la zone de confinement ainsi que des risques que présentent ces matières pour la biosécurité et la biosûreté. La meilleure façon d'évaluer ces risques est de consulter l'ASB de l'installation. Le niveau de responsabilité et de contrôle dépendra du risque associé aux matières. Par exemple, dans le cas des matières biologiques et des toxines présentant un risque faible (p. ex. celles appartenant au groupe de risque 1 [GR1]), il peut être suffisant de tenir des renseignements sur leur entreposage et leur utilisation dans des carnets de laboratoire; cependant, dans le cas des agents pathogènes et des toxines à risque élevé (p. ex. ceux du groupe de risque 3 [GR3] ou du groupe de risque 4 [GR4]), il sera nécessaire de tenir des renseignements détaillés sur leur entreposage et leur transfert vers d'autres zones ou installations, de disposer de protocoles d'accès et d'autorisation écrits, et de procéder à l'examen régulier des matières et des registres (p. ex. vérifications et audits). Il est aussi encouragé que des procédures et des outils favorisant la responsabilité à l'égard des agents pathogènes et des toxines soient en place dans l'établissement pour régler les problèmes de responsabilité qui pourraient être soulevés dans l'éventualité où un titulaire de permis ou un titulaire de permis d'importation d'agents zoopathogènes n'est plus rattaché à l'établissement (p. ex. en raison d'un changement d'employeur, d'une retraite) afin de garantir que le transfert ou l'élimination de toute matière réglementée se fait conformément à toutes les exigences de la loi.
19.1.2 Mesures concernant la responsabilité durant le déplacement et le transport
Le déplacement et le transport des matières biologiques sont des procédures habituelles dans les laboratoires et les autres zones de confinement. Les bonnes pratiques microbiologiques de laboratoire préviennent généralement la contamination et les déversements accidentels; néanmoins, les dispositions relatives à la responsabilité et au contrôle à l'égard des agents pathogènes et des toxines tout au long de leur déplacement ou de leur transport constituent des facteurs importants qui contribuent à réduire le risque de perte ou de vol associé à des menaces internes ou des menaces externes. Pour cette raison, le plan de biosécurité devrait comprendre des dispositions et des politiques sur le transfert décrivant les procédures de biosécurité propres à l'expédition, à la réception, à la surveillance et à l'entreposage de colis qui contiennent des agents pathogènes, des toxines ou d'autres matières infectieuses réglementées. L'inclusion d'un plan de contingence consigné qui décrit les procédures sécuritaires en cas d'envoi inattendu (c.-à-d. une installation qui reçoit, à son insu ou sans préavis, un paquet qui contient des agents pathogènes ou des toxines) serait un bon exemple de disposition à considérer. En outre, les installations visées par un permis sont tenues d'aviser l'ASPC si elles sont en possession d'un agent pathogène humain ou d'une toxine non autorisée par le permis (LAPHT 12[2]) ou si un envoi attendu d'agents pathogènes humains ou de toxines a disparu ou n'a pas été reçu comme prévu (LAPHT 14), ou si un envoi d'agents biologiques à cote de sécurité élevé (ABCSE) n'a pas été reçu dans les 24 heures comme il a été prévu [LAPHT 14, RAPHT 9(1)(c)(iii)]. Des dispositions ou des procédures écrites sur la façon de traiter de telles situations permettront au titulaire de permis de retracer l'envoi et d'en prendre rapidement le contrôle, puis de le mettre en lieu sûr sans tarder dans une zone réglementée appropriée. De plus, dans les installations visées par un permis les autorisant à mener des activités comportant la manipulation d'ABCSE, tous les employés qui procèdent à l'emballage ou au déballage d'envois dans la zone de réception et d'expédition ou qui prévoient entreposer temporairement des ABCSE doivent être titulaires d'une Habilitation de sécurité en vertu de la LAPHT valide émise par l'ASPC (LAPHT 33, RAPHT 28). Les installations visées par un permis qui procèdent à des transferts d'agents pathogènes humains et de toxines en vertu du même permis devraient inclure dans leur plan de biosûreté une description de la façon dont ces transferts sont effectués, de même que des documents sur la chaîne de possession et des dispositions relatives à la protection des matières contre le vol, la perte ou la libération. Le chapitre 23 fournit de plus amples renseignements sur le transfert d'agents pathogènes, de toxines et d'autres matières infectieuses réglementées; le chapitre 20 aborde le déplacement et le transport des matières infectieuses et des toxines; le chapitre 23 aborde la surveillance réglementaire des agents pathogènes et des toxines, y compris les transferts.
19.2 Inventaires et systèmes de gestion de l'inventaire
Un inventaire est une liste des ressources biologiques qu'a en sa possession une installation, qui comprend une description des agents pathogènes et des toxines entreposés à long terme à l'intérieur et à l'extérieur de la zone de confinement. Les inventaires sont des registres clés dans les aires où sont menées des activités comportant la manipulation d'agents pathogènes humains et animaux ainsi que de toxines, et ils permettent aux personnes autorisées qui doivent rendre des comptes sur le contrôle de ces matières de prévenir leur utilisation délibérément malveillante, leur perte, leur vol ou leur libération. Les inventaires permettent également aux personnes qui travaillent avec des agents pathogènes humains et animaux ainsi qu'avec des toxines de connaître la nature et les effets des matières utilisées, et ainsi, de prendre les précautions appropriées pour éviter toute exposition à ces matières ou leur libération. Un système de gestion de l'inventaire est un processus qui permet de contrôler et de localiser les matières dans une installation ou une zone de confinement. Il s'agit d'un élément commun à tous les programmes d'assurance de la qualité, et il fait partie des exigences relatives aux systèmes de gestion de la qualité fixées entre autres par les normes ISO 9001 et ISO 15189 de l'Organisation internationale de normalisation (ISO), la Norme nationale du Canada (CAN)/Association canadienne de normalisation (CSA) CAN/CSA Z15190, les Bonnes pratiques de laboratoire de l'Organisation de coopération et de développement économiques (OCDE) et la Norme sur la gestion des risques biologiques en laboratoire du Comité européen de normalisation (CEN)Note de bas de page 9Note de bas de page 10Note de bas de page 11Note de bas de page 12Note de bas de page 13
19.2.1 Éléments de l'inventaire
L'inventaire des agents pathogènes et des toxines entreposés à long terme dans une zone de confinement visée par un permis doit satisfaire aux exigences minimales énoncées à la matrice 4.10 de la NCB. De plus, une description du système de gestion de l'inventaire doit être incluse dans le plan de biosûreté (matrice 4.1 de la NCB). Le niveau de détail des renseignements à consigner dans l'inventaire de même que la complexité du système de gestion de l'inventaire dépendront des risques associés aux agents pathogènes et aux toxines et des besoins de l'établissement. Au minimum, l'inventaire des agents pathogènes, des toxines, et de toute autre matière infectieuse réglementée doivent comprendre les éléments suivants (matrice 4.10 de la NCB) :
- description de l'agent pathogène ou de la toxine, suffisamment détaillée et indiquant son niveau de risque, y compris :
- nom de l'agent pathogène ou de la toxine (genre, espèce, nom de la toxine);
- groupe(s) de risque;
- emplacement (p. ex. pièce, congélateur);
- liste des agents pathogènes, des toxines et de toute autre matière infectieuse réglementée qui sont entreposés à l'extérieur de la zone de confinement (seulement pour le NC2 et le niveau de confinement 3 [NC3]);
- Pour les agents pathogènes du GR3 et GR4 et les toxines ABCSE seulement, l'inventaire doit aussi comprendre les éléments suivant :
- l'identification précise de l'agent pathogène, de la toxine ou de toute autre matière infectieuse réglementée (p. ex. genre, espèce, souche/sous-type, numéro de lot);
- des mécanismes permettant de détecter rapidement les échantillons manquants ou volés (p. ex. ajouter de l'information par rapport à la quantité, comme le nombre de fioles, ou pour les toxines ABCSE, la masse).
Il peut être avantageux pour toutes les installations d'établir un système d'inventaire afin de documenter et de gérer cette information de façon cohérente, ou d'intégrer les renseignements nécessaires dans un inventaire ou un système d'inventaire existant. Il est possible de consigner d'autres renseignements dans un système d'inventaire pour le rendre plus utile et rigoureux. Les renseignements additionnels varient selon les activités et les besoins de l'installation. Par exemple, il pourrait être nécessaire d'y intégrer des documents ou d'autres renseignements confirmant que l'installation est conforme à des normes de gestion de la qualité comme la norme ISO 9001 ou ISO 15189. Voici une liste d'éléments supplémentaires qui peuvent être envisagés pour créer un système d'inventaire complet et robuste comprenant des agents pathogènes et des toxines dans toute zone de confinement :
- informations supplémentaires sur l'agent pathogène ou la toxine, telles que
- la souche ou le sous-type;
- l'organisme parental de la toxine;
- pathogénicité de la souche (p. ex. souche de vaccin atténuée, souche hautement pathogène, variante résistante aux médicaments), le cas échéant;
- identification de la fiole ou de l'échantillon (p. ex. numéro de tube, de lot ou de code à barre);
- forme des matières (p. ex. lyophilisée, en suspension, concentrée, culot, gélose ensemencée par piqure);
- nombre de fioles, la quantité contenue dans les fioles (p. ex. concentration, volume), si cela est approprié ou pertinent;
- emplacement précis (p. ex. congélateur, étagère, tablette, boîte);
- lieu d'utilisation;
- nom et coordonnées de la personne responsable;
- caractéristiques spécifiques (p. ex. restrictions d'utilisation précisées sur un permis ou un permis d'importation d'agents zoopathogènes);
- nom du fabricant ou de la source;
- date de réception, d'acquisition ou de production de la matière;
- date d'utilisation, de transfert, d'inactivation ou d'élimination;
- date d'expiration;
- référence à la documentation associée, telle que :
- autorisations d'importation (un permis ou un permis d'importation d'agents zoopathogènes) et lettres de transfert;
- méthode de décontamination ou d'inactivation approuvée;
- Fiches techniques santé-sécurité : agents pathogènes (FTSSP);
- là où l'inventaire comprend des ABCSE :
- liste des personnes disposant d'une autorisation d'accès;
- liste des personnes titulaires d'une Habilitation de sécurité en vertu de la LAPHT (pour les ABCSE).
19.2.2 Examen et mise à jour de l'inventaire
Pour être utile, l'inventaire doit être mis à jour régulièrement; il est difficile de déterminer si un échantillon a disparu si l'inventaire ne contient pas la liste exacte des matières que l'installation a en sa possession au moment où on le consulte. L'inventaire devrait être mis à jour une fois par année et chaque fois qu'un échantillon est utilisé, transféré, inactivé ou éliminé, et chaque fois que de nouvelles matières sont identifiées à la suite de tests diagnostiques, ou lorsqu'elles sont reçues, créées ou produites. Les établissements sont encouragés à élaborer des politiques internes précisant le moment auquel l'inventaire fera l'objet d'un examen régulier ou d'un examen ponctuel visant à comparer les matières entreposées à la liste d'inventaire et à mettre celle-ci à jour en conséquence. Pour les examens réguliers de l'inventaire, la vérification d'un sous-ensemble représentatif de matières peut être une méthode acceptable.
19.2.3 Systèmes de gestion de l'inventaire et production de rapports
L'inventaire des agents pathogènes, des toxines et des autres matières infectieuses réglementées qui sont entreposés à long terme devrait être facilement accessible et consultable, qu'un système de gestion électronique ou sur papier soit utilisé. Un système tel qu'un registre, un logiciel d'inventaire ou une base de données peut être utilisé pour gérer l'inventaire des agents pathogènes et des toxinesNote de bas de page 14. Un processus de notification (p. ex. production de rapports internes et externes) devrait être utilisé pour cerner, déclarer et résoudre tout problème, y compris un écart dans l'inventaire, une défaillance de l'équipement d'entreposage, une infraction à la sécurité ou encore l'élimination ou la libération de matières. Pour des raisons liées à la sécurité et à l'entreposage, les installations sont encouragées à limiter les quantités d'agents pathogènes et de toxines dans leur inventaire, dans la mesure du possible.
Les installations visées par un permis ne sont pas obligées de présenter à l'ASPC des rapports réguliers sur leur inventaire; cependant, elles devraient être en mesure de décrire leur système de tenue de registres si on leur en fait la demande (p. ex. Comment feriez-vous pour trouver l'échantillon « X » dans vos locaux? Avez-vous l'agent pathogène « Y » dans votre inventaire?). De plus, les titulaires de permis sont tenus d'aviser immédiatement l'ASPC si un agent pathogène humain ou une toxine qu'ils ne sont pas autorisés à posséder entre en leur possession ou est produit involontairement [LAPHT 12(2)] ou s'ils ont des motifs de croire qu'un agent pathogène humain qui était en leur possession a été volé ou a autrement disparu (LAPHT 14).
19.3 Entreposage et étiquetage
Des mécanismes de contrôle devraient être mis en place pour faire en sorte que les agents pathogènes et les toxines entreposés dans l'installation soient uniquement accessibles aux personnes autorisées, pour les fins prévues. Les dispositifs de sécurité peuvent comprendre des serrures, de l'équipement d'entreposage sécuritaire, des contenants d'entreposage munis de sceaux de sécurité, des compartiments d'entreposage verrouillés dans des armoires ou des réfrigérateurs, ou encore des aires d'entreposage situées à l'intérieur des zones à accès restreint. Dans la mesure du possible, les agents pathogènes et les toxines devraient être entreposés à l'intérieur de la zone de confinement où ils sont manipulés, ou dans une zone de même niveau de confinement. Les agents pathogènes du GR2 et du GR3 et les toxines peuvent être entreposés à l'extérieur de la zone de confinement, pourvu que des mesures de sécurité additionnelles soient prises (matrice 4.6 de la NCB). Les échantillons conservés dans une banque ou entreposés pendant de longues périodes devraient être étiquetés convenablement (c.-à-d. clairement et de façon permanente) et satisfaire les exigences actuelles du Système d'information sur les matières dangereuses utilisées au travail (SIMDUT)Note de bas de page 15.
Références
- Note 1
- Salerno, R. M. et Gaudioso, J. M. (2007). Laboratory Biosecurity Handbook, Boca Raton, FL, États-Unis : CRC Press.
- Note 2
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2 e éd., Ottawa, ON, Canada : Gouvernement du Canada.
- Note 3
- AA1000, AccountAbility Principles Standard 2008. (2008). Washington, DC, États-Unis: AccountAbility Amérique du Nord.
- Note 4
- Loi sur les agents pathogènes humains et les toxines (L.C. 2009, ch. 24). (2015).
- Note 5
- Règlement sur les agents pathogènes humains et les toxines (DORS/2015-44). (2015).
- Note 6
- Loi sur la santé des animaux (L.C. 1990, ch. 21). (2015).
- Note 7
- Règlement sur la santé des animaux (C.R.C., ch. 296). (2015).
- Note 8
- Schedler, A. (1999). Conceptualizing Accountability. Dans Schedler, A., Diamond, L. et Plattner, M.F. (éds), The Self-Restraining State: Power and Accountability in New Democracies, p. 13-28, Londres, Royaume-Uni: Lynne Rienner Publishers.
- Note 9
- Organisation internationale de normalisation. (2015). ISO 9000 Resources: ISO 9001 Inventory Control Summary. Consulté le 3 novembre 2015 à l'adresse http://www.iso9000resources.com/ba/inventory-control-introduction.cfm
- Note 10
- ISO 15189:2012, Laboratoires de biologie médicale - Exigences concernant la qualité et la compétence. (2012). Genève, Suisse: Organisation internationale de normalisation.
- Note 11
- CAN/CSA-Z15190-05 (R2010), Medical Laboratories - Requirements for Safety. (2010). Mississauga, ON, Canada: Association canadienne de normalisation.
- Note 12
- ENV//MC/CHEM(98)17. (1998 ). Série de l'OCDE sur les Bonnes pratiques de laboratoire et vérification du respect de ces pratiques, Numéro 1 : Les principes de l'OCDE des Bonnes pratiques de laboratoire (révisé en 1997). Direction de l'Environnement, Organisation de Coopération et de Développement Économiques, Paris, France.
- Note 13
- CEN Workshop 31 - Laboratory biosafety and biosecurity. CEN Workshop Agreement (CWA) 15793:2011, Laboratory biorisk management. (2011). Bruxelles, Belgique : Comité Européen de Normalisation.
- Note 14
- Perkel, JM. (2015). Toolbox - Lab-inventory management: Time to Take Stock. Nature. 524:125-126
- Note 15
- Santé Canada. (2015). Système d'information sur les matières dangereuses utilisées au travail - Site national officiel. Consulté le 3 novembre 2015 à l'adresse http://www.hc-sc.gc.ca/ewh-semt/occup-travail/whmis-simdut/index-fra.php
Chapitre 20 - Déplacement et transport des matières infectieuses ou des toxines
Le déplacement et le transport des matières infectieuses et des toxines (ou des matières biologiques susceptibles d'en contenir) constituent une partie essentielle des procédures routinières dans les laboratoires, que ce soit aux fins de recherche ou de diagnostic. Pour les besoins du présent chapitre, on fait une distinction entre le déplacement et le transport : celui-là désigne l'action de déplacer de la matière à l'intérieur d'une zone de confinement ou d'un bâtiment, alors que celui-ci désigne l'action de transporter de la matière d'un endroit ou d'un bâtiment à un autre, au Canada ou à l'étranger. Cette distinction s'impose, car le transport des matières infectieuses, en plus d'être abordé différemment dans les discussions, est régi par la Loi de 1992 sur le transport des marchandises dangereuses (LTMD), le Règlement sur le transport des marchandises dangereuses (RTMD) et la Réglementation pour le transport des marchandises dangereuses (DGR) de l'Association du transport aérien international (IATA)Note de bas de page 1Note de bas de page 2Note de bas de page 3. Ce chapitre contient aussi des renseignements sur les exigences réglementaires applicables au transfert, à l'importation et à l'exportation des agents pathogènes et des toxines.
20.1 Déplacement des matières infectieuses et des toxines
Dès qu'une activité requiert le déplacement de matières infectieuses ou de toxines à l'intérieur d'une zone de confinement ou d'un bâtiment, le recours à de bonnes pratiques microbiologiques aidera à prévenir la contamination et les déversements accidentels. Des protocoles visant à prévenir les fuites, les débordements, les déversements ou des problématiques semblables au cours du déplacement des matières infectieuses ou des toxines à l'intérieur de la zone de confinement ou entre les zones de confinement du bâtiment serviront également à prévenir la libération d'agents pathogènes et de toxines. La matrice 4.6 de la Norme canadienne sur la biosécurité (NCB), 2e édition, énonce les exigences minimales concernant le déplacement de matières infectieuses ou de toxinesNote de bas de page 4.
20.1.1 Déplacement de matières infectieuses ou de toxines à l'intérieur d'une zone de confinement
Les matières infectieuses ou les toxines qui doivent être déplacées à l'intérieur d'une zone de confinement (p. ex. d'un congélateur à une enceinte de sécurité biologique [ESB], d'un incubateur à une ESB, ou d'une ESB à un microscope, ou encore, déplacer des déchets vers l'autoclave) devraient être protégées adéquatement pour éviter tout renversement, débordement ou fuite durant le déplacement. Les précautions prises par le personnel pour prévenir les accidents devraient correspondre aux risques inhérents aux matières infectieuses ou aux toxines (c.-à-d. plus le risque associé à une matière est élevé plus on devrait faire attention lors de son déplacement).
Les contenants fermés servent de confinement primaire lors du déplacement de matières infectieuses ou de toxines. Leur utilisation, en plus d'un chariot au besoin, pour déplacer des matières infectieuses ou des toxines à l'intérieur d'une zone de confinement (p. ex. pour déplacer un grand nombre ou un important volume d'échantillons, ou des articles lourds) aidera à réduire les risques de débordements, de déversements ou de fuites ainsi que leur étendue. Dans de tels cas, si les contenants sont étiquetés, le personnel sera plus en mesure de réagir rapidement et de façon appropriée. On recommande l'utilisation de contenants étanches et résistants aux chocs. De plus, des contenants munis d'attaches et expressément conçus à cette fin sont offerts sur le marché. Pour prévenir les fuites par le bouchon des tubes et ainsi réduire au minimum les risques de contaminer sa surface, on devrait utiliser les tubes à filetage extérieur munis d'un bouchon fileté plutôt que les tubes à filetage intérieur ou munis d'un bouchon-pression. Pour déplacer plusieurs échantillons ou des agents pathogènes présentant des risques élevés, on devrait utiliser un chariot à galerie dont chaque tablette aurait été recouverte d'un matériel absorbant; on peut également utiliser des plateaux à chariot. Les échantillons devraient être placés de manière à empêcher tout débordement ou déversement en cas de collision. Le personnel devrait se déplacer lentement et prudemment chaque fois qu'il transporte des matières infectieuses ou des toxines. Suivre les indications, établies à l'aide de l'évaluation locale des risques (ELR), concernant les itinéraires et la circulation à l'intérieur de la zone de confinement facilitera les déplacements du personnel et du matériel entre les zones « propres » (c.-à-d. zones à faible risque de contamination) et les zones « sales » (c.-à-d. zones à risque élevé de contamination) de manière à réduire au minimum les risques de propagation de la contamination. Par ailleurs, disposer d'une trousse d'intervention en cas de déversement biologique à l'intérieur de la zone de confinement permet au personnel, le cas échéant, de procéder rapidement au nettoyage, et ce, de façon appropriée.
20.1.2 Déplacement de matières infectieuses ou de toxines entre des zones de confinement situées dans un même bâtiment
Pour déplacer des matières infectieuses ou des toxines entre des zones de confinement à l'intérieur d'un même bâtiment, l'utilisation de contenants étanches et résistants aux chocs aidera à prévenir les déversements ou les fuites que pourrait produire leur chute. Si un incident se produit, par exemple un contenant tombe par terre, se brise ou son contenu est répandu, la présence d'une étiquette exhaustive sur le contenant permettra d'identifier le contenu et les dangers associés et facilitera les interventions. Décontaminer la surface des contenants avant de les sortir de la zone de confinement aide à prévenir les risques de propagation de matières infectieuses ou de toxines. Cette mesure s'applique notamment aux déchets à déplacer vers une zone de décontamination centralisée située à l'intérieur du bâtiment, mais à l'extérieur de la zone de confinement. Le matériel lourd ou imposant devrait être transporté sur un chariot à galerie et être placé de manière à empêcher tout renversement. Un chariot avec rebords ou à bords relevés peut être utilisé pour empêcher les articles de tomber au cours de leur transfert. Disposer d'un plan d'intervention d'urgence (PIU) pour toute matière infectieuse ou toxine entreposées en dehors de la zone de confinement, et d'une trousse d'intervention en cas de déversement également située à l'extérieur de cette zone, permettra au personnel de réagir rapidement et de façon appropriée dans l'éventualité d'un déversement. La glace ou la glace sèche servant à conserver les échantillons au froid durant leur transport devrait toujours être utilisée conformément aux exigences actuelles du Système d'information sur les matières dangereuses utilisées au travail (SIMDUT)Note de bas de page 5. Afin d'éviter l'accumulation de gaz, la glace sèche ne devrait jamais être mise dans un contenant secondaire étanche à l'air.
20.2 Transport de matières infectieuses ou de toxines
Toute matière qui contient ou qui est susceptible de contenir des matières infectieuses ou des toxines et qui doit être transportée ou confiée à un transporteur commercial est considérée comme des marchandises dangereuses sujettes aux exigences énoncées dans les règlements nationaux (c.-à-d. RTMD) et internationaux. Ces règlements décrivent de façon détaillée les exigences en matière de classification, d'emballage, d'étiquetage, de documentation et de certification, lesquelles sont élaborées dans le but de garantir que l'expédition de telles matières se fait en toute sécurité afin d'éviter une libération accidentelle et de protéger la communauté, les intervenants en cas d'urgence, les transporteurs commerciaux et le personnel à l'expédition, à la réception et durant le transport.
20.2.1 Règlements nationaux et internationaux sur le transport
Au Canada, le transport de matières biologiques, y compris des déchets, contenant des agents pathogènes ou des toxines est régi par la LTMD et le RTMD, administrés par Transports Canada. Chaque province et territoire a adopté le RTMD dans sa propre législation. Le RTMD définit les exigences en matière de classification, d'étiquetage, d'emballage et de documentation qui s'appliquent lors de l'expédition des matières biologiques et des substances infectieuses à l'intérieur du Canada. Ce règlement précise également que toute personne qui manipule l'emballage en vue de son expédition, offre de transporter, transporte ou reçoit des matières biologiques ou des substances infectieuses doit avoir suivi une formation sur le RTMD et être titulaire d'un certificat valide attestant qu'elle a réussi le cours. Enfin, les expéditeurs de matières infectieuses à risque élevé (c.-à-d. la majorité des agents pathogènes de groupe de risque 4 [GR4] et certains de groupe de risque 3 [GR3]) peuvent être tenus de disposer d'un PIU approuvé par Transports Canada leur permettant de réagir à toute situation d'urgence se produisant au Canada. Pour obtenir de plus amples renseignements sur le RTMD, y compris sur les dérogations applicables en fonction de la distance qu'il peut y avoir entre les établissements, veuillez communiquer avec Transports Canada ou visiter son site Web.
Le transport international des matières biologiques et des substances infectieuses est régi par des règlements internationaux élaborés à la lumière des Recommandations relatives au transport des marchandises dangereuses (règlement type) du Comité d'experts des Nations Unies sur le transport des marchandises dangereuses. En se fondant sur le règlement type des Nations Unies, l'Organisation de l'aviation civile internationale (OACI) a établi des normes et des exigences relatives au transport aérien des marchandises dangereuses, y compris des substances infectieuses, qui sont décrites dans les Instructions techniques pour la sécurité du transport aérien des marchandises dangereusesNote de bas de page 6. Les Instructions techniques de l'OACI ont été adoptées et elles sont appliquées dans la plupart des pays du monde, y compris au Canada. L'IATA, une organisation internationale qui représente 230 sociétés aériennes commerciales, publie chaque année la DGR. Ce document indique les exigences de l'OACI applicables à l'emballage et au transport en toute sécurité des marchandises dangereuses, notamment des substances infectieuses, dans l'industrie du transport aérien. Comme la majorité des transporteurs (de passagers et de fret) du monde sont membres de l'Organisation, ils sont tenus de respecter les exigences de l'OACI ainsi que celles énoncées dans la DGR de l'IATA, lesquelles s'appliquent au transport international des substances infectieuses. Par ailleurs, toutes les expéditions de matières biologiques ou de substances infectieuses qui transitent par un autre pays ou un autre territoire peuvent être assujetties à la réglementation sur le transport propre à ces derniers. Pour obtenir de plus amples renseignements sur les instructions techniques ou la DGR, on peut communiquer avec l'OACI ou l'IATA, respectivement, ou visiter leur site Web.
20.2.2 Éléments à prendre en considération pour l'expédition et la réception
La LTMD et le RTMD s'appliquent aux expéditions de marchandises dangereuses à partir du moment où le transporteur (c.-à-d. le consignateur) prépare ou emballe ces marchandises en vue d'un transport par un transporteur, notamment la prise de possession du colis (p. ex. cueillette par un service de messagerie), et assure leur transport, jusqu'à ce qu'il remette le colis à son destinataire (c.-à-d. le consignataire). Les installations devraient établir des procédures internes sur le déplacement et le transport de colis contenant des agents pathogènes et des toxines entre les zones d'expédition ou de réception et le reste de l'installation. Le respect de ces procédures assurera le transfert de la matière en toute sécurité, ainsi que la conformité envers la LTMD, le RTMD, la Loi sur les agents pathogènes humains et les toxines (LAPHT) et le Règlement sur les agents pathogènes humains et les toxines (RAPHT), la Loi sur la santé des animaux (LSA) et le Règlement sur la santé des animaux (RSA)Note de bas de page 7Note de bas de page 8Note de bas de page 9Note de bas de page 10. La personne qui, à sa connaissance ou à son avis, emballe de la matière pouvant contenir des agents pathogènes ou des toxines en vue d'être expédié doit avoir suivi une formation et détenir un certificat valide sur le transport de marchandises dangereuses en toute sécurité, conformément au RTMD, ou être accompagnée en tout temps d'un superviseur qui, lui, possède un certificat valide qui atteste de sa formation. Les personnes les mieux aptes à emballer les matières infectieuses ou les toxines en vue d'être transportées sont les membres du personnel d'une zone de confinement du niveau de confinement approprié. L'étape finale de l'emballage (c.-à-d. placer le colis dans une boîte d'expédition et l'étiqueter) des contenants étanches qui servent à l'expédition et qui contiennent des matières infectieuses peut être accomplie par du personnel à l'extérieur de la zone de confinement (p. ex. dans les zones d'expédition ou de réception), pourvu que le contenant primaire soit scellé et sa surface complètement décontaminée.
Tous les membres du personnel, y compris ceux affectés à l'expédition ou à la réception, qui sont responsables des expéditions (p. ex. emballage, déballage) comportant des agents biologiques à cote de sécurité élevée (ABCSE) ont besoin d'une Habilitation de sécurité en vertu de la LAPHT valide délivrée par l'Agence de la santé publique du Canada (ASPC), en plus d'avoir reçu la formation appropriée conformément au RTMD. Dans une installation, dès qu'on emballe des contenants d'ABCSE à des fins de transport dans les zones d'expédition ou de réception, celles-ci ont besoin d'être identifiées, sur le permis visant les activités réglementées comportant des agents pathogènes humains ou des toxines, comme étant une partie de l'installation où des ABCSE sont présents et accessibles. Ce n'est que lorsque l'ABCSE a été emballée conformément au RTMD et que le colis ne peut plus être reconnu comme contenant un ABCSE qu'on peut le remettre à un transporteur qui n'a pas d'Habilitation de sécurité en vertu de la LAPHT.
On ne considère pas qu'un colis a été reçu tant que le destinataire n'en a pas pris possession; ensuite, c'est ce destinataire qui est soumis au RTMD (comprenant les exigences liées à l'accréditation en formation). Les couches extérieures de l'emballage dans lesquelles se trouvent les contenants primaires étanches contenant des matières infectieuses ou des toxines peuvent être déballées dans les zones d'expédition ou de réception, conformément à l'ELR; on recommande de procéder au déballage du colis dans une ESB au cas où le contenant primaire se serait brisé ou aurait fui à l'intérieur de son emballage. Quant aux fioles contenant des matières infectieuses ou des toxines, elles ne peuvent être ouvertes que dans les aires correspondant à leur niveau de confinement (matrice 4.6 de la NCB). Les destinataires des colis contenant des ABCSE doivent être titulaires d'une Habilitation de sécurité en vertu de la LAPHT délivrée par l'ASPC. Par conséquent, les travailleurs dans les zones d'expédition ou de réception de l'installation doivent avoir une Habilitation de sécurité en vertu de la LAPHT valide s'ils participent à l'emballage ou au déballage des colis contenant des ABCSE dans ces zones ou si on y entrepose temporairement des ABCSE avant de les livrer à leur destinataire. Dans la mesure où le personnel d'expédition ou de réception n'a jamais accès aux colis contenant des ABCSE ni la possibilité d'en trouver, il est possible que les Habilitations de sécurité en vertu de la LAPHT ne soient pas nécessaires pour le personnel des zones d'expédition ou de réception. Le chapitre 6 fournit de plus amples renseignements sur les habilitations de sécurité; le chapitre 18, quant à lui, traite des enquêtes et de la déclaration des incidents comportant l'expédition d'ABCSE.
20.2.3 Transport de matières infectieuses ou de toxines d'un bâtiment à l'autre
Dans les institutions constituées de plusieurs bâtiments contenant plusieurs zones de confinement, par exemple les universités ou les collèges, il arrive qu'on transporte des matières infectieuses ou des toxines d'un bâtiment à un autre. Le cas échéant, les matières infectieuses et les toxines ont besoin d'être consignées et emballées de façon appropriée (c.-à-d. au moins dans des contenants étiquetés, scellés, étanches et résistants aux chocs) afin de prévenir les fuites durant leur déplacement ou leur transport, et conformément au RTMD s'il y a lieu. De plus, les mesures concernant la responsabilité à l'égard des matières infectieuses et des toxines (p. ex. inventaire) et les exigences concernant le transfert des matières réglementées, énoncées dans les chapitres 19 et23, respectivement, doivent être considérées lorsque la matière est transporté d'un bâtiment à l'autre à l'intérieur d'une même organisation ou d'un même organisme.
Références
- Note 1
- Loi de 1992 sur le transport des marchandises dangereuses (L.C. 1992, ch. 34). (2015).
- Note 2
- Règlement sur le transport des marchandises dangereuses (DORS/2001-286). (2015).
- Note 3
- Réglementation pour le transport des marchandises dangereuses de l'IATA, 56e éd. (2015). Montréal, QC, Canada: Association du transport aérien international.
- Note 4
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2 e éd., Ottawa, ON, Canada : Gouvernement du Canada.
- Note 5
- Santé Canada. (2015). Système d'information sur les matières dangereuses utilisées au travail - Site national officiel. Consulté le 3 novembre 2015 à l'adresse http://www.hc-sc.gc.ca/ewh-semt/occup-travail/whmis-simdut/index-fra.php
- Note 6
- Organisation de l'aviation civile internationale. (2015). Instructions techniques pour la sécurité du transport aérien des marchandises dangereuses, édition de 2015-2016, Montréal, QC, Canada: Organisation de l'aviation civile internationale.
- Note 7
- Loi sur les agents pathogènes humains et les toxines (L.C. 2009, ch. 24). (2015).
- Note 8
- Règlement sur les agents pathogènes humains et les toxines (DORS/2015-44). (2015).
- Note 9
- Règlement sur la santé des animaux (C.R.C., ch. 296). (2015).
- Note 10
- Loi sur la santé des animaux (L.C. 1990, ch. 21). (2015).