Évaluation préalable - Imidazolidine-2-thione (Éthylènethio urée)
Titre officiel : Évaluation préalable - Imidazolidine-2-thione (Éthylènethio‑urée)
Numéro d’enregistrement du Chemical Abstracts Service
96‑45‑7
Environnement et Changement climatique Canada
Santé Canada
Janvier 2023
No de cat. : En84-324/2022F-PDF
ISBN 978-0-660-45975-2
Sommaire
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont réalisé l’évaluation préalable de l’imidazoline-2-thione, ci-après appelée éthylènethio‑urée (ETU). Le numéro d’enregistrement du Chemical Abstracts Service (no CASNote de bas de page 1 ) de l’ETU est le 96‑45-7. L’ETU a fait partie de l’ébauche d’évaluation préalable des substances du Groupe des composés hétérocycliques publiée le 11 novembre 2017. Cependant, l’ETU a été exclu de la version finale de l’évaluation préalable des substances du Groupe des composés hétérocycliques afin que cette évaluation corresponde mieux avec la réévaluation de certains pesticides.
En 2008, moins de 100 kg d’ETU ont été produits au Canada, et entre 10 000 et 100 000 kg y ont été importés, d’après les données fournies dans une enquête menée conformément à un avis émis en vertu de l’article 71 de la LCPE. Les utilisations non confidentielles de l’ETU rapportées dans l’enquête étaient les suivantes : comme agent de vulcanisation, régulateur de procédés et plastifiant dans des matières plastiques et du caoutchouc, dans des pièces automobiles moulées et dans l’importation de véhicules, et comme régulateur de procédés dans les tissus, le textile et les articles en cuir. Il a également été rapporté que l’ETU serait une impureté dans des produits antiparasitaires. L’ETU est un produit de dégradation, un métabolite et un résidu dans les fongicides à base d’éthylène bis-dithiocarbamate (EBDC).
Le risque pour l’environnement associé à l’ETU a été caractérisé au moyen de l’approche de la classification du risque écologique des substances organiques (CRE). La CRE est une approche basée sur le risque qui tient compte de plusieurs paramètres liés au risque et à l’exposition et d’une pondération des éléments de preuve pour classer le risque. Les profils de danger sont principalement établis sur la base de paramètres liés au mode d’action toxique, à la réactivité chimique, à des seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité biologique et chimique. Parmi les paramètres pris en compte pour le profil d’exposition, citons le taux d’émission potentiel, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque est utilisée pour que soit assigné aux substances un risque de préoccupation faible, moyen ou élevé, selon leur profil de danger et d’exposition. D’après le résultat de l’analyse de la CRE, on estime qu’il est peu probable que l’ETU cause des effets nocifs pour l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, l’ETU présente un risque faible de causer des effets nocifs pour l’environnement. Il a été conclu que l’ETU ne satisfait pas aux critères énoncés aux alinéas 64a) et 64b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
L’EPA des États‑Unis estime que l’ETU est une substance « probablement cancérogène pour l’humain » (groupe B2). Dans le Système général harmonisé de classification et d’étiquetage des produits chimiques de l’Europe, l’ETU est classé parmi les substances qui peuvent nuire aux enfants à naître (repr. 1B: H360D). Des études en laboratoire ont montré que l’ETU causait des effets sur la glande thyroïde et qu’il était cancérogène. L’exposition de la population générale à l’ETU peut découler de l’ingestion d’aliments et d’eau potable, en raison du traitement des cultures par des fongicides à base d’éthylène bis-dithiocarbamate qui forment de l’ETU lorsqu’ils se dégradent. Ces sources d’exposition à l’ETU ont été prises en considération, en vertu de la Loi sur les produits antiparasitaires, dans la réévaluation par Santé Canada des fongicides à base d’éthylène bis-dithiocarbamate.
La population générale peut également être exposée par voie cutanée à des résidus d’ETU ayant été libérés par des produits du caoutchouc. Le risque pour la santé humaine par cette voie d’exposition a été évalué en comparant les estimations de l’exposition à l’ETU associée aux produits du caoutchouc aux concentrations ayant des effets sur la santé rapportés dans des études sur des animaux, notamment des effets cancérogènes. Le risque pour la santé humaine est considéré comme faible tant sur le plan des effets non cancérogènes que sur ceux des effets cancérogènes.
À la lumière des renseignements contenus dans la présente évaluation préalable, il est conclu que l’ETU ne satisfait pas au critère énoncé à l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est conclu que l’ETU ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE 1999), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable portant sur l’imidazoline-2-thione, ci-après appelée éthylènethio-urée (ETU) Cette substance a été jugée prioritaire pour une évaluation, car elle satisfait aux critères de catégorisation du paragraphe 73(1) de la LCPE (ECCC, SC [modifié en 2017]). L’ETU a été évalué dans l’ébauche d’évaluation préalable des substances du Groupe des composés hétérocycliques publiée le 11 novembre 2017. L’évaluation préalable des substances du Groupe des composés hétérocycliques a été achevée et publiée le 8 juin 2019 (ECCC, SC 2019). Cependant, aux fins d’une meilleure harmonisation avec la réévaluation de certains pesticides (Santé Canada 2018a, 2018b, 2020a), l’ETU a été exclu de la version finale de l’évaluation préalable. Par conséquent, la conclusion en vertu de la LCPE concernant cette substance est présentée dans la présente évaluation préalable.
Les risques pour l’environnement associés à l’ETU ont été caractérisés au moyen de l’approche de classification du risque écologique (CRE) des substances organiques (ECCC, 2016a). La CRE décrit le danger associé à une substance à l’aide de paramètres clés comme le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité biologique et chimique, et tient compte de l’exposition potentielle des organismes dans les milieux aquatique et terrestre en fonction des facteurs que sont le taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les divers éléments de preuve sont groupés pour repérer les substances qui nécessitent une évaluation approfondie en raison de leurs risques pour l’environnement ou celles dont la probabilité de nuire à l’environnement est faible.
Dans la présente évaluation préalable, on a pris en considération les données sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition. Les données pertinentes recueillies jusqu’en juillet 2021 ont été examinées. Les données empiriques tirées d’études importantes ainsi que certains résultats issus de la modélisation ont servi à tirer les conclusions. Lorsqu’elles étaient existantes et pertinentes, les données provenant d’évaluations menées par d’autres pays ont été étudiées. Dans l’approche adoptée, on a eu recours aux points de référence pour l’ETU associés à des effets pour la santé antérieurement établis par l’Agence de réglementation de la lutte antiparasitaire (ARLA).
La présente évaluation préalable a été préparée par le personnel de Santé Canada et d’Environnement et Changement climatique Canada travaillant sur les programmes d’évaluation des risques de la LCPE et comprend aussi des intrants d’autres programmes de ces ministères. Le document sur la CRE a fait l’objet d’un examen externe par des pairs et d’une période de commentaires du public de 60 jours. Les parties de l’ébauche d’évaluation préalable des substances du Groupe des composés hétérocycliques (qui comprend l’ETU) portant sur la santé humaine ont été examinées par des pairs de l’externe et ont fait l’objet d’une consultation. Les commentaires reçus sur les parties techniques concernant la santé humaine proviennent de scientifiques (Jeanelle Martinez, Pam Williams, Jennifer Sahmel, Lynne Haber) du Toxicology Excellence for Risk Assessment Center, Department of Environmental Health, College of Medicine, Université de Cincinnati. En outre, l’ébauche de l’évaluation préalable des substances du Groupe des composés hétérocycliques (publiée le 11 novembre 2017) a été soumise à une consultation publique de 60 jours. Même si les commentaires des pairs examinateurs de l’externe et du public ont été pris en compte, Environnement et Changement climatique Canada et Santé Canada demeurent responsables du contenu final et des conclusions de la présente évaluation préalable.
La présente évaluation préalable repose sur des renseignements essentiels pour déterminer si l’ETU satisfait aux critères énoncés à l’article 64 de la LCPE. À cette fin, des renseignements scientifiques ont été examinés et une approche basée sur une pondération des éléments de preuve et le principe de précautionNote de bas de page 2 a été adoptée. Dans la présente évaluation préalable, les renseignements essentiels et les éléments à partir desquels la conclusion a été tirée sont présentés.
2. Identité de la substance
Le numéro d’enregistrement du Chemical Abstracts Service (no CASNote de bas de page 3 ), le nom sur la Liste intérieure des substances (LIS), le nom commun et la structure moléculaire de l’ETU sont présentés au tableau 2‑1.
| NE CAS (abréviation) | Nom sur la LIS (nom commun) | Structure chimique et formule moléculaire | Poids moléculaire (g/mol) | Référence |
|---|---|---|---|---|
| 96‑45‑7 ETU | imidazolidine-2‑thione (éthylènethio-urée) | 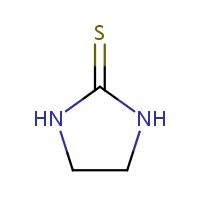 C3H6N2S C3H6N2S |
102,2 | PubChem 2004- |
3. Propriétés physico-chimiques
Un ensemble de propriétés physico‑chimiques de l’ETU figure au tableau 3-1. D’autres propriétés physico‑chimiques sont présentées dans le document d’ECCC de 2016 (b).
| Propriété | Valeur | Type de données | Référence |
|---|---|---|---|
| Point de fusion (oC) | 203 | Expérimentales | EPI Suite, 2012 |
| Point d’ébullition (oC) | 347 | Expérimentales | EPI Suite, 2012 |
| Solubilité dans l’eau (g/L) | 20 à 30 oC | Expérimentales | EPI Suite, 2012 |
| Masse volumique (g/mL) | 1,417 | Expérimentales | EPI Suite, 2012 |
| Pression de vapeur (Pa) | 0,00027 à 25 oC | Expérimentales | EPI Suite, 2012 |
| Constante de la loi d’Henry (Pa m3/mol) | 1,36 | Modélisées (méthode des liaisons) | EPI Suite, 2012 |
| Constante de la loi d’Henry (Pa m3/mol) | 3,36 x 10‑7 | Expérimentales | EPI Suite, 2012 |
| log Koe (sans dimension) | ‑0,66 | Expérimentales | EPI Suite, 2012 |
| log Kco (sans dimension) | 1,54-2,93 | Expérimentales | Santé Canada 2020a |
Abréviations : Koe, coefficient de partage octonol–eau; Kco, coefficient de partage carbone organique–eau
4. Sources et utilisation
L’ETU n’est pas présent à l’état naturel dans l’environnement. Il est principalement utilisé comme accélérateur ou agent de vulcanisation dans le durcissement du polychloroprène (néoprène) et du polyacrylate, qui sont des caoutchoucs (IARC, 1974; IARC, 2001; HSDB, 1983‑2017; Pays-Bas, 1999). L’ETU est un produit de dégradation, un métabolite et un résidu des fongicides à base d’éthylène bis‑dithiocarbamate, comme le mancozèbe et le métirame. Dans son projet de décision de réévaluation, Santé Canada a cerné un risque potentiel de cancérogénicité découlant d’une exposition à l’ETU par l’ingestion d’aliments et d’eau potable provenant de fongicides à base d’éthylène‑bis‑dithiocarbamate (Santé Canada, 2014, 2018a). Les réévaluations ont été achevées, et des mesures de réduction des risques ont été mises en œuvre en vertu de la Loi sur les produits antiparasitaires pour réduire l’exposition et les risques associés à l’ETU (Santé Canada, 2018b, 2020a).
D’après les renseignements présentés dans le cadre d’une enquête menée en vertu de l’article 71 de la LCPE (Canada, 2009), moins de 100 kg d’ETU ont été fabriqués au Canada en 2008, et entre 10 000 et 100 000 kg d’ETU ont été importés au Canada au cours de cette même année civileNote de bas de page 4 . Les utilisations non confidentielles de l’ETU rapportées dans le cadre de l’enquête comprennent les suivantes : comme agent de vulcanisation, régulateur de procédés et plastifiant dans des matières plastiques et du caoutchouc, dans des pièces automobiles moulées et dans l’importation de véhicules, et comme régulateur de procédés dans les tissus, le textile et les articles en cuir. Il a également été rapporté que l’ETU serait une impureté dans des produits antiparasitaires (Environnement Canada 2009). Aux États‑Unis, la production nationale d’ETU a été entre 0,45 million et 4,5 millions de kg en 2012 (CDAT, 2015).
Les installations qui fabriquent, transforment ou utilisent autrement l’ETU en une quantité d’au moins 10 tonnes sont tenues de le déclarer dans le cadre de l’Inventaire national des rejets de polluants (INRP, 2021). D’après les données de l’INRP de 2010 à 2017, aucune entreprise n’a déclaré de rejet d’ETU (INRP, 2018).
Compte tenu de ces utilisations, l’ETU est présente en petites quantités dans certains produits de consommation contenant du caoutchouc synthétique. D’autres renseignements sur les utilisations au Canada sont présentés au tableau 4‑1.
| Utilisation | ETU |
|---|---|
| Matériel d’emballage des alimentsa | Oui |
| Formulant dans des produits antiparasitaires homologués au Canadab | Non (contaminant préoccupant surveillé dans la matière active de l’EBDC ou son produit de dégradation formé dans l’environnement par l’utilisation de l’EBDC) |
a Communication personnelle, courriels adressés en novembre 2015 et en juillet 2021 par la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada; sans référence.
b Santé Canada 2018a.
L’ETU figure sur la Liste des contaminants et des autres substances adultérantes dans les aliments de Santé Canada, qui fait partie, par renvoi, du Titre 15 du Règlement sur les aliments et drogues. Comme énoncé à la Partie 1 de cette liste, l’ETU est interdit dans tous les aliments à l’exception des fruits, des légumes et des céréales et, pour ces aliments, si la concentration dépasse la limite de 0,05 mg/kg (ppm) énoncé à la Partie 2, ces aliments seraient considérés comme falsifiés (Santé Canada, 2020b). L’ETU pourrait également être présent dans un agent antimicrobien utilisé dans la fabrication de matériel d’emballage d’aliments, comme du papier et du carton (communication personnelle, courriels adressés en novembre 2015 et en juillet 2021 de la part de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada; sans référence).
5. Caractérisation du risque écologique
5.1 Potentiel de causer des effets nocifs pour l’environnement
Le risque pour l’environnement associé à l’ETU a été caractérisé au moyen de l’approche de la classification du risque écologique (CRE) des substances organiques (ECCC, 2016a). Il s’agit d’une approche basée sur les risques qui tient compte de plusieurs paramètres liés au risque et à l’exposition et d’une pondération des éléments de preuve pour classer le risque. Les divers éléments de preuve sont rassemblés pour que l’on puisse distinguer les substances présentant un pouvoir faible ou élevé et un risque d’exposition faible ou élevé dans divers milieux. Cette approche permet de réduire l’incertitude associée à la caractérisation des risques contrairement à une approche basée sur un seul paramètre mesuré dans un seul milieu (p. ex. la concentration létale médiane). Les paragraphes suivants résument l’approche, qui est décrite en détail dans le document d’ECCC (2016a).
Les données sur les propriétés physico‑chimiques (demi‑vie chimique dans divers milieux et biotes, coefficient de partition, bioconcentration dans les poissons), l’écotoxicité aiguë chez le poisson, et le volume de ces produits importés ou fabriqués au Canada, ont été colligées à partir de publications scientifiques, de bases de données empiriques (p. ex. la boîte à outils RQSA de l’OCDE 2014) et des réponses aux enquêtes menées en vertu de l’article 71 de la LCPE, ou ont été obtenues à partir de la relation quantitative structure‑activité (RQSA) ou des modèles du devenir du bilan massique ou de bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils de danger et d’exposition à ces substances.
Les profils de danger ont été principalement établis à l’aide de paramètres liés au mode d’action toxique, à la réactivité chimique, à des seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont aussi été élaborés à partir de plusieurs paramètres, dont le taux d’émission potentiel, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de classer le potentiel de risque et d’exposition de chaque substance organique comme faible, moyen ou élevé. D’autres règles ont été appliquées (p. ex. cohérence du classement, marge d’exposition) pour améliorer le classement préliminaire du risque et de l’exposition.
Une matrice de risque a été utilisée pour attribuer à chaque substance un risque faible, moyen ou élevé, en fonction de ce classement du risque et de l’exposition associés à chaque substance. Le classement du risque obtenu par la CRE a été vérifié en suivant une approche en deux étapes. La première étape consistait à modifier le classement du risque (qui passe de moyen ou élevé à faible) des substances présentant un faible taux d’émission estimé dans l’eau, après traitement des eaux usées, ce qui représente un faible risque d’exposition. La deuxième étape consistait à revoir les résultats de classement faible ou moyen à la lumière de scénarios de risque relativement prudents à l’échelle locale (c.‑à‑d. dans la zone à proximité du point de rejet) conçus pour protéger l’environnement, afin de déterminer si le classement du risque devrait être reclassé à un niveau supérieur.
La CRE est une approche pondérée qui vise à réduire au minimum le risque d’un surclassement ou d’un sous‑classement du danger, de l’exposition et du risque subséquent. Les approches équilibrées utilisées pour réduire les incertitudes sont décrites en détail dans le document d’ECCC (2016a). Dans ce qui suit, deux des domaines d’incertitude les plus importants sont décrits. Des valeurs de toxicité aiguë empiriques ou modélisées erronées peuvent modifier le classement du risque, en particulier dans le cas des paramètres liés à des valeurs de résidus dans les tissus (p. ex. mode d’action toxique), dont un grand nombre sont prédites à partir de modèles de RQSA (boîte à outils RQSA de l’OCDE, 2014). Toutefois, l’incidence de ce type d’erreur est atténuée par le fait qu’une surestimation de la létalité médiane donnera une valeur prudente (protectrice) de résidus dans les tissus qui servira à l’analyse critique des résidus corporels. L’erreur due à une sous‑estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, tels que le profil structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’œstrogène. Les changements ou les erreurs touchant les quantités chimiques peuvent mener à un classement différent de l’exposition, le classement de l’exposition et du risque étant très sensible au taux d’émission et aux quantités utilisées. Les classements obtenus au moyen de l’approche de la CRE représentent donc l’exposition et le risque au Canada, d’après les quantités estimées être celles utilisées actuellement, mais pourraient ne pas rendre compte des tendances futures.
Les données essentielles et les éléments pris en compte pour produire les profils et les classements de l’exposition, du danger et du risque de l’ETU sont présentés dans le document d’ECCC de 2016 (b).
Étant donné le classement de l’ETU comme danger faible et exposition faible, établi d’après les données prises en compte dans la CRE, le potentiel de risque pour l’environnement associé à la substance est faible. Il est peu probable que cette substance suscite des préoccupations pour l’environnement au Canada.
6. Potentiel de causer des effets nocifs pour l’environnement
6.1 Évaluation de l’exposition
Milieu naturel et aliments
La principale source d’exposition à l’ETU par l’ingestion d’aliments et d’eau potable devrait être l’utilisation de fongicides à base d’éthylène bis‑dithiocarbamate. Cette exposition a été évaluée, et l’ARLA de Santé Canada a caractérisé les risques pour la santé humaine (Santé Canada 2018a, 2018b, 2020a). Il est possible que le sol et la poussière contiennent de l’ETU en raison de la proximité d’exploitations ou de sites agricoles où des fongicides à base d’EBDC ont été utilisés, comme noté et pris en compte par Santé Canada (2018b, 2020a).
L’ETU peut être présent dans un agent antimicrobien utilisé dans la fabrication de certains matériels d’emballage d’aliments, comme du papier et du carton. L’exposition par voie alimentaire, le cas échéant, de ces sources devrait être négligeable (communication personnelle, courriels adressés en novembre 2015 et en juillet 2021 de la part de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada; sans référence).
Dans le cadre des cinquième (2016 et 2017) et sixième (2018 et 2019) cycles de l’Enquête canadienne sur les mesures de la santé, l’ETU (ETU total) a été mesuré dans les échantillons d’urine de 97 % des 2 704 personnes (cinquième cycle) et de 99 % des 2 508 personnes (sixième cycle) représentant la population canadienne âgée de 3 à 79 ans (Santé Canada, 2019, 2021). L’Enquête est une enquête nationale représentative continue qui permet de recueillir des données importantes sur la santé et le bien-être de même que des échantillons biologiques de personnes partout au pays. La moyenne géométrique et le 95e centile de l’ETU total (intervalles de confiance à 95 %) étaient de 0,42 (0,35 à 0,51) µg/L et de 3,5 (2,0 à 4,9) µg/L, respectivement, au cinquième cycle, et de 0,40 (0,36 à 0,45) µg/L et de 2,7 (2,1 à 3,2) µg/L, respectivement, au sixième cycle. Le seuil de détection était de 0,033 µg/L. Même si ces données ne traitent pas de l’exposition intermittente aiguë ou unique, elles confirment qu’il existe des expositions chroniques potentielles à l’ETU dans la population générale canadienne, probablement découlant probablement de l’utilisation de plusieurs pesticides à base d’EBDC (Santé Canada 2021).
Produits disponibles aux consommateurs
Comme l’ETU est utilisé pour le durcissement des caoutchoucs tels que le polychloroprène (néoprène), l’exposition potentielle par voie cutanée à l’ETU découlant de l’utilisation de produits disponibles aux consommateurs à base de caoutchouc a été examinée. Bien que le durcissement des caoutchoucs transforme l’ETU en d’autres composés, des quantités résiduelles d’ETU peuvent être présentes (IARC 1974). Par conséquent, il est possible que l’ETU migre à partir des surfaces de caoutchouc.
Les produits disponibles aux consommateurs qui contiennent du néoprène sont notamment les chaussures et certains contenants en caoutchouc (sacs à lunch) et l’équipement de plongée. Pour déterminer les concentrations de l’ETU dans le néoprène et les produits de caoutchouc associés, Santé Canada réalise une analyse de marché de 33 différents produits à base de caoutchouc disponibles aux consommateurs, dont des chaussures, des produits pour enfants, des vêtements en néoprène (p. ex., maillots de bain, combinaisons isothermes) et des manchons pour volants, bicyclettes et outils (Santé Canada 2016). Des produits sont découpés en pièces de 1 cm3 d’environ 1 gramme et incubés toute la nuit à 40 ℃ dans un mélange à parts égales de méthanol et d’eau. La concentration d’ETU libérée pour chaque produit a été déterminée, la plupart des échantillons contenant moins que 0,16 mg/kg. Seulement un produit, un manchon de volant, contenait 11,0 mg d’ETU par kg de matériel. Les produits à base de néoprène libèrent de 0,0022 à 0,0838 mg d’ETU par kilogramme de matériel (Santé Canada 2016).
Étant donné le peu de données disponibles sur la migration de l’ETU et, afin de calculer l’exposition généralisée à l’ETU par la voie cutanée à une matrice de tissu caoutchouté solide, on a pris en compte la migration de la 1,3-diéthylthiourée. La 1,3-diéthylthiourée est une substance qui peut être présente dans les produits caoutchoutés contenant du chloroprène, où sa fonction est la même que celle de l’ETU, et sa présence était plus facilement à mesurer que l’ETU dans les échantillons d’une étude réalisée par l’EPA du Danemark (2012). La vitesse de migration de la substance à partir du matériel varie en fonction de sa concentration dans le produit caoutchouté, et le ratio de la concentration par rapport à la vitesse de migration a été évalué dans plusieurs échantillons (EPA du Danemark 2012). Une analyse des données sur la 1,3‑diéthylthiourée dans cinq échantillons a révélé un éventail de ratios s’étendant de 339 000:1 à 609 000:1, reliant la concentration de 1,3-diéthylthiourée dans le matériel à la vitesse de migration. Les limites supérieures et inférieures de l’intervalle de 95 % pour le ratio de la concentration par rapport à la vitesse de migration étaient respectivement de 342 000:1 et de 635 000:1. Un ratio inférieur de 300 000:1 a été retenu pour estimer de façon prudente la vitesse de migration de l’ETU. En utilisant un ratio inférieur, on présume qu’une plus grande quantité d’ETU migrera depuis le matériel (EPA du Danemark 2012). À l’aide de ce ratio, la valeur d’absorption cutanée établie par Santé Canada est de 45 % (Santé Canada 2020a), ainsi que d’autres hypothèses décrites à l’annexe A, on a estimé l’exposition potentielle par voie cutanée à l’ETU pendant plusieurs durées pour un adulte et un enfant portant chacun une combinaison isotherme et pour un adulte se servant d’un couvre-volant (tableau 6‑1). Bien que des adolescents âgés de 16 ans et plus puissent également se servir d’un couvre-volant lorsqu’ils conduisent un véhicule, leur exposition est probablement plus faible que celle d’un adulte, car on suppose qu’ils conduisent moins souvent et moins longtemps.
| Scénario d’exposition | Adultes (19 ans et plus) (mg/kg p.c./jour) | Enfants (5 to 11 ans) (mg/kg p.c./jour) |
|---|---|---|
| Combinaison isotherme (un seul jour) | 2,4 × 10-4 | 3,15 × 10 -4 |
| Combinaison isotherme (exposition de 10 jours) | 6,0 × 10-5 | 8,0 × 10-5 |
| Combinaison isotherme (exposition de 30 jours) | 2,0 × 10-5 | 3,0 × 10-5 |
| Combinaison isotherme (exposition annuelle moyenne)a | 1,65 × 10-6 | 2,17 × 10-6 |
| Couvre-volant (un seul jour) | 4,24 x 10-4 | s.o. |
| Couvre-volant (exposition de 30 jours) | 3,74 x 10-4 | s.o. |
| Couvre-volant (exposition quotidienne pendant environ 10 ans)b | 1,34 x 10-5 | s.o. |
Abréviations : s.o., sans objet
a On présume qu’un adulte ou un enfant porterait une combinaison isotherme pendant 30 jours dans l’année.
b On présume que la durée de vie d’un couvre-volant est d’environ 10 ans (Autos.com Editor, 2013).
Il faut reconnaître que la valeur moyenne annuelle pour les enfants (5 à 11 ans) est une surestimation des expositions quotidiennes pour toute la durée de la vie, car la plupart des expositions durant toute la vie se produiraient à l’âge adulte, dans lesquelles les expositions quotidiennes calculées sont plus faibles en raison de différences de superficie de la peau et du poids corporel entre les enfants (5 à 11 ans) et les adultes.
6.2 Évaluation des effets sur la santé
Santé Canada (2018a, 2018b, 2020a), l’Environmental Protection Agency des États‑Unis (EPA des É.‑U., 2020), le National Toxicology Program (NTP, 1992) et l’International Agency for Research on Cancer (IARC, 1974, 2001) ont résumé les effets sur la santé recensés dans les publications scientifiques ou caractérisé les dangers de l’ETU. Le rapport de Santé Canada (2020a) a servi à étayer la caractérisation des effets sur la santé de la présente évaluation préalable. L’EPA (2020) des États‑Unis a classé l’ETU comme une substance probablement cancérogène pour l’humain (groupe B2), tandis que l’IARC (2001) a estimé que l’ETU n’est pas classifiable sur le plan de la cancérogénicité pour les humains (groupe 3). Dans le Système général harmonisé de classification et d’étiquetage des produits chimiques de l’Europe, l’ETU est considérée comme une substance qui pourrait nuire à l’enfant à naître (toxicité pour la reproduction 1B: H360D) (ECHA 2021). Selon la recension des écrits menée jusqu’en mai 2021, il n’existe aucune autre étude sur les effets sur la santé pouvant influer sur la caractérisation du risque (c.-à-d. pouvant entraîner différents critères de toxicité critiques ou des critères de départs plus faibles que ceux indiqués ici).
Les paragraphes suivants présentent des paramètres critiques et les doses d’ETU correspondantes, utilisés dans la caractérisation des risques, rapportés par Santé Canada (2020a). Aucune étude de toxicité à court terme par voie cutanée et par inhalation n’a été trouvée (Santé Canada 2018a).
Dans une étude étendue sur la toxicité pour la reproduction sur une génération (ETR1G) présentée à l’Agence de réglementation de la lutte antiparasitaire (ARLA), des rats Crl:CD(SD) ont reçu 0,2, 2 ou 10 mg/kg p.c./jour de ETU dans leur alimentation (Santé Canada 2020a). L’ETR1G comprenait un volet sur la neurotoxicité pour le développement et la caractérisation des effets sur la glande thyroïde à plusieurs stades de la vie. À différents stades de la vie, chez les rats mâles et femelles, des variations importantes ont été constatées dans le profil des hormones thyroïdiennes, le poids de la glande thyroïde et l’histopathologie de la glande thyroïde (hypertrophie/hyperplasie des cellules folliculaires) aux doses intermédiaire et supérieure. À 0,2 mg ETU/kg p.c./jour, on a noté un changement dans l’histopathologie de la glande thyroïde (cellules folliculaires hypertrophie) chez les mâles P1 (20 des 27 animaux ont été touchés) et les mâles F1 de la cohorte 1A (15 des 26 animaux ont été touchés), ce qui était accompagné d’une hypertrophie de l’hypophyse (très légère chez 9 des 26 animaux), révélant une perturbation de l’axe hypothalamo-hypophyso- thyroïdien (HHT) à cette dose. La dose de 0,2 mg/kg p.c./jour a été retenue comme dose minimale avec effet nocif observé (DMENO) par l’ARLA compte tenu la perturbation de l’axe HHT (hypertrophie de la glande thyroïde et de l’hypophyse chez les parents) (Santé Canada 2020a).
Même si les paramètres de la reproduction n’ont pas varié dans la génération P, on a établi la dose sans effet nocif observé (DSENO) à 2 mg/kg p.c./jour pour les effets sur la reproduction, d’après l’augmentation de la proportion de sperme anormal et du nombre de follicules ovariens dans la génération F1 chez les mâles et les femelles traités par la dose supérieure, respectivement (Santé Canada 2020a).
L’ETR1G de cohortes sur la neurotoxicité a été considérée comme un essai de détermination des doses et la dose de 2 mg/kg p.c./jour a été établie comme la DSENO pour la neurotoxicité pour le développement (Santé Canada 2020a).
Une étude sur la toxicité pour le développement menée en 2015 chez des rats Sprague-Dawley par voie orale (gavage) a été présentée à l’ARLA (Santé Canada 2020a). Aucun effet lié au traitement n’a été observé chez les mères, quelle que soit la dose à l’essai (5, 15 ou 30 mg/kg p.c./jour) administrée les jours de gestation 6 à 19. Cependant, on a noté une augmentation de l’incidence de cas d’hydrocéphalie à la dose de 15 mg/kg p.c./jour ainsi que de nombreuses malformations à la tête et au squelette des fœtus à la dose de 30 mg/kg p.c./jour. Ces effets sur les fœtus ont été observés sans aucune toxicité chez les mères. On a retenu une dose de 5 mg/kg p.c./jour pour la DSENO pour le développement d’après une augmentation de l’incidence de cas d’hydrocéphalie (Santé Canada 2020a). Ces effets concordent avec ceux constatés chez les rats après une exposition par voie cutanée à une dose d’ETU de 50 mg/kg p.c./jour administrée les jours de gestation 12 et 13 (Santé Canada 2018a). Tous les fœtus de rats affichaient des malformations marquées du squelette aux doses sans effet toxique chez les mères (Santé Canada 2018a).
6.3 Caractérisation du risque pour la santé humaine
Il a été déterminé que la principale source d’exposition à l’ETU dans la population générale du Canada devrait être les fongicides à base d’EBDC. Le risque pour la santé humaine a été caractérisé par l’ARLA de Santé Canada (Santé Canada 2018a, 2018b, 2020a).
La population générale du Canada peut également être exposée à l’ETU lors de l’utilisation de produits caoutchoutés.
L’exposition potentielle par voie cutanée à l’ETU contenu dans une combinaison isotherme à base de néoprène ou un couvre-volant à base de caoutchouc a été étudiée sur la base des effets sur la santé de la substance observés chez les animaux de laboratoire. Chez les adultes et les enfants (5 à 11 ans), on a évalué les effets d’une exposition à une dose unique et à des doses multiples (10 et 30 jours) découlant du port d’une combinaison isotherme à base de néoprène d’une durée de 8 heures. L’exposition quotidienne était dépendante de la concentration d’ETU résiduelle dans la combinaison isotherme pour un jour donné. L’exposition simple (pendant 4 heures) et annuelle (pendant 1,27 heure/jour) des adultes à l’ETU dans un couvre-volant a été évaluée.
Concernant le risque de cancérogénicité, l’exposition quotidienne moyenne annuelle la plus élevée (c.-à-d. corrigée pour le lessivage et les pertes) à l’ETU calculée découlant du port d’une combinaison isothermique en néoprène pendant 30 jours (2,16 x 10‑6 mg/kg p.c./jour chez les enfants de 5 à 11 ans) a été multipliée par un coefficient de cancérogénicité calculé par Santé Canada pour une exposition de 0,0601 (mg/kg p.c./jour)‑1 déterminé d’après l’apparition de tumeurs hépatiques chez les souris femelles, et se traduit par un niveau de risque de 1,3 x 10‑7 (moins de 1 sur 1 millionNote de bas de page 5 ). Il importe de noter que cette valeur est une surestimation de la véritable exposition quotidienne pour la durée de la vie et des risques associés, car la majeure partie des expositions pour la durée de la vie ont lieu chez l’adulte, et les expositions quotidiennes calculées sont inférieures en raison des différences de surface et de poids corporels entre l’enfant (5 à 11 ans) et l’adulte. Le risque potentiel de cancérogénicité associé à d’utilisation d’un couvre-volant en caoutchouc a été calculé à l’aide de l’exposition quotidienne moyenne à l’ETU pendant dix ans (1,34 x 10-5 mg/kg p.c./jour chez les adultes). On a multiplié cette valeur par le coefficient de cancérogénicité de 0,0601 (mg/kg p.c./jour)-1 pour obtenir un niveau de risque de 8,17 x 10-7 (moins de 1 dans 1 million).
Concernant le risque potentiel de causer des effets non cancérogènes, aucune étude de toxicité par voie cutanée à court terme n’était accessible (Santé Canada 2018a). Par contre, il existe des études de toxicité pour le développement par voie cutanée avec l’ETU. Cependant, ces études sont limitées à 1 ou 2 doses et n’évaluaient pas directement la toxicité pour la glande thyroïde comparativement aux études de toxicité par voie orale, comme l’ETR1G, où la toxicité pour la glande thyroïde a été évaluée de façon appropriée.
Dans le tableau 6‑2, on présente toutes les valeurs estimatives d’expositions pertinentes, les doses associées à un effet critique et les marges d’exposition (ME) résultantes pour la caractérisation du risque non cancérogène pour la santé humaine associé à l’ETU présent dans les produits disponibles aux consommateurs.
| Scénario d’exposition | Valeur estimative de l’exposition (mg/kg p.c./jour) | Dose associée à un effet critique (mg/kg p.c./jour) | Marge d’exposition (ME) |
|---|---|---|---|
| Combinaison isotherme (un seul jour) | 2,4 × 10-4 (adulte) – 3,15 × 10-4 (5 à 11 ans) | 5 (malformations sans toxicité chez les mères) | 15 873-20 833 |
| Couvre-volant (un seul jour) | 4,24 x 10-4 (adulte) | 5 (malformations sans toxicité chez les mères) | 11 792 |
| Combinaison isotherme (10 jours) | 6,0 × 10-5 (adulte) – 8,0 × 10-5 (5 à 11 ans) | 0,2 (perturbation de l’axe HHT [hypertrophie de la glande thyroïde et de l’hypophyse chez les parents]) | 2 500-3 333 |
| Combinaison isotherme (30 jours) | 2,0 × 10-5 (adulte) – 3,0 × 10-5 (5 à 11 ans) | 0,2 (perturbation de l’axe HHT [hypertrophie de la glande thyroïde et de l’hypophyse chez les parents]) | 6 667-10 000 |
| Couvre-volant (30 jours) | 3,74 x 10-4 (adulte) | 0,2 (perturbation de l’axe HHT [hypertrophie de la glande thyroïde et de l’hypophyse chez les parents]) | 534 |
6.4 Risque d’effets nocifs pour la santé humaine
6.4.1 Évaluation de l’exposition
Compartiments de l’environnement et aliments
La principale source d’exposition à l’ETU par l’ingestion d’aliments et d’eau potable devrait être l’utilisation de fongicides à base d’éthylène bis‑dithiocarbamate. Cette exposition subit actuellement une évaluation, et l’ARLA de Santé Canada caractérise les risques pour la santé humaine (ARLA, 2013, 2014).
L’exposition découlant de l’utilisation de l’ETU comme agent antimicrobien dans les matériaux d’emballage alimentaire, comme le papier et les matières à base de carton, devrait être négligeable (communication personnelle, courriel de novembre 2015 de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada; non cité).
Aucune autre donnée sur la concentration d’ETU dans un compartiment de l’environnement ou dans les aliments n’a été trouvée. L’ETU n’a pas été détecté dans la poussière domestique ni dans l’air intérieur. Cependant, cette substance risque d’être présente dans le sol et la poussière à proximité de fermes ou de lieux agricoles où l’on a épandu un fongicide à base d’éthylène bis‑dithiocarbamate comme l’ARLA le fait remarquer, et c’est pourquoi l’ARLA l’étudie (ARLA, 2013, 2014).
Produits de consommation
Le risque d’exposition à l’ETU découlant de l’utilisation de produits de consommation a été examiné. Comme l’ETU est utilisé dans le curage des caoutchoucs, on a étudié le risque d’exposition par voie cutanée à l’ETU contenu dans des produits à base de caoutchouc. Bien que le curage du caoutchouc transforme l’ETU en d’autres composés, des quantités résiduelles d’ETU peuvent être présentes (IARC, 1974). Par conséquent, les surfaces en caoutchouc peuvent libérer de l’ETU.
Les produits de consommation qui contiennent du néoprène comprennent les chaussures, certains contenants en caoutchouc souples (sac à lunch) et l’équipement de plongée. Pour mesurer la concentration d’ETU dans le néoprène et les produits en caoutchouc connexes, Santé Canada a mené une analyse de 33 produits différents vendus sur le marché (DSPC, 2016a). Les produits ont été coupés en morceaux de 1 cm3 d’environ 1 gramme qui ont été incubés toute la nuit à 40 °C dans une solution constituée à partie égale de méthanol et d’eau. La concentration d’ETU libérée par chacun des produits a alors été mesurée. Il a été établi que ces produits (dont 9 à base de néoprène) libéraient de 0,0022 à 0,0838 mg d’ETU par kilogramme de matière (DSPC, 2016a). La concentration la plus élevée a été choisie comme quantité totale d’ETU pouvant être libérée d’un produit à base de caoutchouc ou de néoprène.
Pour étudier l’exposition générale par voie cutanée à l’ETU contenue dans une matrice solide caoutchoutée, on a mesuré la libération de diéthylthio-urée, une substance structurellement et chimiquement semblable à l’ETU libérée par des produits à base de chloroprène, dans laquelle elle joue le même rôle. Comme la vitesse de libération de la substance hors du matériau dépend de sa concentration dans le caoutchouc, le ratio de la concentration sur la quantité libérée a été examiné dans divers échantillons (EPA du Danemark, 2012). L’analyse des données de cinq échantillons indique une gamme de ratios de la concentration dans le matériau sur la vitesse de libération variant de 339 000:1 à 609 000:1. La limite supérieure et la limite inférieure de l’intervalle de confiance à 95 % du ratio de la concentration sur la vitesse de libération étaient de 342 000:1 et de 635 000:1, respectivement. Une valeur de ratio plus faible, soit 300 000:1, a été choisie comme estimation prudente de la quantité d’ETU libérée. Un ratio plus faible suppose qu’une plus grande quantité d’ETU a été libérée du matériau (EPA du Danemark, 2012). Ce ratio a permis de calculer la vitesse de libération initiale hors d’une combinaison isothermique d’adulte de 2,268 kg (5 livres), où la concentration d’ETU provient d’une analyse de la composition de produits commercialisés qui indique que la concentration d’ETU la plus élevée (dans les chaussettes en néoprène) est de 0,0838 mg/kg. Il s’ensuit une quantité totale potentielle de 0,1901 mg d’ETU dans une combinaison isotherme d’adulte, et une vitesse initiale de libération de 2,78 x 10‑7 mg/cm2/h.
L’exposition à l’ETU d’un adulte portant une combinaison isothermique complète couvrant 16 925 cm2 (surface corporelle moins celle de la tête) (Santé Canada, 1998) pour une durée pouvant aller jusqu’à 30 jours par année a été examinée. La perte graduelle d’ETU par jour a été calculée pour chaque période d’utilisation en fonction de la vitesse de libération. On a présumé que les faces interne et externe de la combinaison isothermique libéraient de l’ETU (c.‑à‑d. libération vers la peau et libération dans l’environnement immédiat). À la suite de chaque exposition quotidienne, la concentration d’ETU dans le produit a été calculée de nouveau pour obtenir une nouvelle vitesse de libération quotidienne fondée sur la concentration résiduelle (voir les tableaux 12‑1 et 12‑2, annexe 12). De même, l’exposition d’un enfant a aussi été étudiée en présumant une surface corporelle de 8 450 cm2, un poids corporel de 27 kg et une combinaison isothermique en néoprène pesant 1,34 kg et contenant 0,095 mg d’ETU.
L’exposition sur plusieurs périodes a été estimée. L’exposition d’un adulte à l’ETU provenant d’une combinaison isothermique portée une seule journée était de 0,00024 mg/kg p.c., et a été calculée à l’aide de la vitesse de libération, d’une période d’une journée et de la valeur de l’absorption par voie cutanée préalablement établie par Santé Canada, qui est de 45 % (ARLA, 2013, 2014). À l’aide de la même méthode, on a calculé une estimation moyenne par jour de l’exposition pour une période de 10 et de 30 jours chez l’adulte de 0,00006 et 0,00002 mg/kg p.c./jour, respectivement. L’exposition d’un enfant à l’ETU durant une journée était de 0,000315 mg/kg p.c., et les doses moyennes sur 10 et 30 jours étaient de 0,00008 et 0,00003 mg/kg p.c./jour, respectivement (voir les tableaux 12‑3 et 12‑4, annexe 10). L’exposition moyenne quotidienne pour la durée de la vie à l’ETU a été calculée pour caractériser le risque de cancer, en présumant une exposition de 30 jours par année, chez l’adulte. Après 30 jours, la masse totale libérée vers la peau était de 0,0951 mg. L’application d’un facteur d’absorption cutanée de 45 % se solde par une masse absorbée de 0,0427 mg. Cette exposition a été calculée sur un an, ce qui donne une exposition moyenne quotidienne pour la durée de la vie de 1,65 x 10‑6 mg/kg p.c./jour pour un adulte de 70,9 kg. Chez l’enfant, l’exposition moyenne quotidienne résultante pour la durée de la vie était de 2,16 x 10‑6 mg/kg p.c./jour.
6.4.2 Évaluation des effets sur la santé
L’ARLA (2013, 2014), l’Environmental Protection Agency des États‑Unis (EPA des É.‑U., 2000), le National Toxicology Program (NTP, 1992) et l’International Agency for Research on Cancer (IARC, 1974) ont résumé les effets sur la santé recensés dans les publications scientifiques ou caractérisé les dangers de l’ETU. Ces rapports ont servi à étayer la caractérisation des effets sur la santé de la présente évaluation préalable.
En résumé, il a été déterminé que les paramètres critiques relevés par l’ARLA pouvaient servir à évaluer les risques de cancer et les risques autres que de cancer associés à une exposition de courte durée (un jour). Toutefois, une recension des publications menée de l’année précédant la date de publication de l’évaluation de l’ARLA (juin 2014) jusqu’en juillet 2016 a permis de mettre au jour une nouvelle étude faisant état d’effets sur la santé (Maranghi et al., 2013), pour laquelle le point de référence d’un paramètre autre que le cancer est inférieur. Il a été déterminé que cette étude pouvait servir à étayer l’évaluation du risque découlant d’une exposition de courte durée (10 à 30 jours). Les paragraphes suivants présentent des paramètres critiques et les doses d’ETU correspondantes, utilisés dans la caractérisation des risques, rapportés par l’ARLA (2014) et d’autres sources.
Dans les études sur la cancérogénicité, les souris et les rats ayant reçu de l’ETU par voie orale présentaient des tumeurs thyroïdiennes induites par la substance selon un mode d’action évident, soit la néoplasie des cellulaires folliculaires de la thyroïde causée par une sécrétion accrue de thyréostimuline (TSH) par l’hypophyse. La production de TSH découle de l’inhibition à long terme de la peroxydase de la thyroïde par l’ETU, ce qui réduit la production d’hormones thyroïdiennes. Chez la souris, l’exposition à long terme à l’ETU a aussi entraîné une néoplasie de l’hypophyse ainsi que la formation d’adénomes et de carcinomes hépatiques. D’après la tumeur la plus sensible (c.‑à‑d. tumeurs hépatiques induites chez les souris femelles), Santé Canada a précédemment calculé un coefficient de cancérogénicité de 0,06 mg/kg p.c./jour, et indique l’absence de données à l’appui d’un seuil pour l’apparition de cet effet (ARLA, 2014). L’EPA des États‑Unis a classé l’ETU comme étant un agent cancérogène humain probable (groupe 2B) et a calculé un coefficient de cancérogénicité par voie orale de 0,11 (mg/kg par jour)‑1 (EPA DES É.‑U., 2000). D’après les tumeurs thyroïdiennes chez les rats CD, d’autres équipes ont calculé des coefficients de cancérogénicité par voie orale pour l’ETU variant de 0,006 (mg/kg p.c./jour)‑1 (Frakes, 1988) à 0,045 (mg/kg p.c./jour)‑1 (OEHHA, 2009).
Au cours d’un essai de courte durée sur l’alimentation, des rats F344/N ont reçu 0,83 et 250 ppm d’ETU dans leurs aliments. Une dose minimale avec effet nocif observé (DMENO) d’environ 4,15 mg/kg p.c./jour a été calculée (en fonction d’une concentration de 83 ppm dans les aliments), et après 7 jours d’exposition à l’ETU, les rates présentaient une augmentation statistiquement significative de l’hyperplasie de la thyroïde, les rats manifestaient une concentration accrue de TSH plasmatique et une augmentation statistiquement significative du poids relatif de la thyroïde, et, chez tous les rats, on a noté un marquage statistiquement significatif des cellules folliculaires (indiquant une prolifération cellulaire dans la thyroïde) et une diminution statistiquement significative de la concentration plasmatique de T4 (Elcombe et al., 2002). Cette DMENO est inférieure à celle correspondant aux effets pour le développement relevés dans d’autres études (NTP, 1992) et est considérée comme étant appropriée pour la caractérisation des risques découlant d’une exposition d’une durée d’une journée.
Maranghi et al. (2013) ont signalé des effets sur le système endocrinien et l’appareil reproducteur découlant d’une exposition de rates Sprague Dawley (SD) gravides à l’ETU. Les mères SD ont été exposées à 0, 0,1, 0,3 et 1,0 mg/kg p.c./jour d’ETU par gavage du 7e au 20e jour de la gestation et du 1er au 22e jour après la naissance. Les mères présentaient des effets statistiquement significatifs à la dose la plus faible (0,1 mg/kg p.c./jour), notamment les effets suivants : fréquence accrue de la mise bas avant le 22e jour de la gestation, gain accru de poids corporel entre le 7e et le 21e jour de la gestation (consommation normale d’aliments, cependant), consommation accrue d’aliments et gain de poids corporel réduit du 1er au 23e jour après la naissance et poids relatif accru de la thyroïde au 23e jour suivant la naissance. Les effets non statistiquement significatifs induits à la dose de 0,1 mg/kg p.c./jour comprenaient une augmentation du nombre de mères ayant des petits mort‑nés (3 mères sur 14 contre 0 mère sur 11 chez les témoins) et un poids absolu accru de la thyroïde. Au premier jour suivant la naissance, les mères du groupe ayant reçu la dose faible présentaient une concentration sérique réduite statistiquement significative de T3 et de T4, et une tendance à une concentration de TSH réduite. Au 23e jour après la naissance, la concentration sérique de T3 et de T4 était normale, mais celle de TSH était élevée et statistiquement significative. L’histologie de la thyroïde au 23e jour après la naissance révèle des effets dépendants de la dose qui étaient statistiquement significatifs aux doses élevées, notamment une vacuolisation accrue des cellules épithéliales, une réduction de la taille de la lumière du follicule thyroïdien, une réduction ou l’absence de colloïde dans ces mêmes follicules ainsi qu’un noyau en pycnose. Ces changements étaient étayés par l’analyse histomorphométrique qui indiquait une diminution des follicules et du colloïde ainsi qu’une augmentation de la taille de l’épithélium folliculaire. Les petits (génération F1; potentiellement exposés à l’ETU dans l’utérus ou par le lait maternel) ont été gavés avec les mêmes doses que les mères, du 23e au 60e jour après la naissance pour les mâles et du 23e jour au 70e jour après la naissance pour les femelles. Les petits ont été l’objet d’un suivi après la naissance et présentaient une poussée précoce des incisives statistiquement significative, un détachement du pavillon de l’oreille et une ouverture précoce des yeux. Au 23e jour suivant la naissance, les petits mâles et femelles présentaient les mêmes changements histologiques de la thyroïde que les mères exposées, mais moins prononcés. Par la suite, l’administration directe à des petits mâles d’une dose d’ETU du 23e au 60e jour suivant la naissance a exacerbé ces effets cellulaires sur la thyroïde observés à faible dose, et le traitement des petites femelles a augmenté le nombre de noyaux en pycnose et réduit davantage le colloïde folliculaire à la dose la plus faible. Chez les adultes, les femelles F1 présentaient des effets statistiquement significatifs lorsqu’elles étaient exposées à une dose faible d’ETU (0,1 mg/kg p.c./jour), notamment la réduction dose‑dépendante du nombre de cycles œstraux mesuré du 55e au 70e jour après la naissance (1,4 contre 3,1 chez les témoins), un cycle œstral prolongé (10 contre 4,8 chez les témoins) et une diminution du nombre de jours du proœstrus (2,8 contre 3,9 chez les témoins). Le recours à la dose de 0,1 mg/kg p.c./jour comme point de référence procure une protection pour la caractérisation des risques découlant d’une exposition de courte durée (10 à 30 jours) à l’ETU.
6.4.3 Caractérisation des risques pour la santé humaine
Produits de consommation
L’exposition par voie cutanée de la population générale a été examinée pour caractériser les risques pour la santé humaine découlant d’une exposition potentielle à l’ETU provenant des produits du caoutchouc (à base de néoprène).
L’exposition potentielle par voie cutanée à l’ETU contenu dans une combinaison isotherme à base de néoprène a été étudiée sur la base des effets sur la santé à court terme de la substance observés chez les animaux de laboratoire. Chez les femmes enceintes et les enfants, on a évalué les effets d’une exposition à une dose unique et à des doses multiples (10 et 30 jours) découlant du port d’une combinaison isotherme à base de néoprène d’une durée de 8 heures. L’exposition quotidienne était dépendante de la concentration d’ETU résiduelle dans la combinaison isotherme pour un jour donné.
Pour une exposition d’une journée découlant du port d’une combinaison isothermique, on considère que la femme enceinte était exposée à 2,4 x 10‑4 mg/kg p.c. d’ETU. Compte tenu de la dose de 4,15 mg/kg p.c./jour établie d’après les effets sur la thyroïde relevés chez des rats exposés à l’ETU durant 7 jours, la marge d’exposition (ME) est de 17 300. Cette ME est considérée comme suffisante pour tenir compte des incertitudes liées aux bases de données sur les effets sur la santé et l’exposition.
On considère que l’exposition d’un enfant d’une durée d’une journée à la substance en raison du port d’une combinaison isothermique est de 3,15 x 10‑4 mg/kg p.c./jour d’ETU. Compte tenu d’une dose de 4,15 mg/kg p.c./jour établie d’après les effets sur la thyroïde relevés chez des rats exposés à l’ETU durant 7 jours, la ME est de 13 180. Cette ME est considérée comme suffisante pour tenir compte des incertitudes liées aux bases de données sur les effets sur la santé et l’exposition.
Pour les enfants et les femmes enceintes qui pourraient porter une combinaison isothermique à base de néoprène durant plusieurs jours, l’exposition à l’ETU a été examinée pour une durée de 10 et 30 jours. Les doses systémiques quotidiennes moyennes d’ETU résultantes ont été calculées et s’élèvent à 6,0 x 10‑5 et à 2,0 x 10‑5 mg/kg p.c./jour, respectivement, chez l’adulte, et à 8,0 x 10‑5 et à 3,0 x 10‑5 mg/kg p.c./jour, respectivement, chez l’enfant. Compte tenu de la DMENO de 0,1 mg/kg p.c./jour établie d’après les effets sur la thyroïde observés chez des rats ayant été exposés par voie orale au cours de la gestation et de la lactation, on obtient une marge d’exposition de 1 670 et de 4 970, respectivement, chez l’adulte et de 1 250 et de 3 330, respectivement, chez l’enfant. Ces ME sont considérées adéquates pour tenir compte des incertitudes liées aux effets sur la santé et à l’exposition.
Concernant le risque de cancérogénicité, l’exposition quotidienne moyenne la plus élevée à l’ETU calculée découlant du port d’une combinaison isothermique en néoprène durant une période de 30 jours (2,16 x 10‑6 mg/kg p.c./jour chez l’enfant) a été multipliée par un coefficient calculé par l’ARLA pour une exposition par voie orale de 0,06 (mg/kg p.c./jour)‑1 déterminé d’après les tumeurs hépatiques observées chez les souris femelles, et se traduit par un niveau de risque de 1,3 x 10‑7 (environ 1 pour 7,7 millions). Il importe de noter que cette valeur est une surestimation de la véritable exposition quotidienne pour la durée de la vie et des risques associés, car la majeure partie des expositions pour la durée de la vie ont lieu chez l’adulte, et les expositions quotidiennes calculées sont inférieures en raison des différences de surface et de poids corporels entre l’enfant et l’adulte.
On juge faibles les risques pour la santé humaine découlant d’une exposition par voie cutanée à l’ETU provenant des produits du caoutchouc et à base de néoprène.
L’exposition de la population générale à l’ETU n’est pas préoccupante aux concentrations actuelles, mais on estime que la substance est associée à des effets sur la santé inquiétants en raison de son pouvoir cancérogène. Par conséquent, l’exposition pourrait soulever des préoccupations pour la santé humaine si elle venait à augmenter.
7. Incertitudes de l’évaluation des risques pour la santé humaine
En général, le degré de confiance envers les bases de données sur l’exposition et les dangers de l’ETU est modéré.
Des incertitudes subsistent quant à la durée et à la fréquence de l’exposition à l’ETU résiduel des produits à base de caoutchouc et de néoprène. Toutefois, comme les scénarios d’exposition sont prudents, la caractérisation des risques ne devrait pas entraîner une sous‑estimation du risque.
Le recours aux critères de toxicité par voie orale pour caractériser le risque associé à l’exposition par voie cutanée à l’ETU dans la population générale comporte une incertitude. Ce critère de toxicité est considéré comme prudent et permet d’étayer la conclusion.
8. Conclusion
Compte tenu de toutes les données probantes présentées dans la présente évaluation préalable, l’ETU présente un risque faible de causer des effets nocifs pour l’environnement. Il a été conclu que l’ETU ne satisfait pas aux critères énoncés à l’alinéa 64a) et b) de la LCPE, car cette substance ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ni à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente évaluation préalable, il a été conclu que l’ETU ne satisfait pas au critère énoncé à l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il a été conclu que l’ETU ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
Références
Autos.com Editor. 2013. How Long Does a Leather Steering Wheel Wrap Last Usually? [Internet]. El Segundo (CA): MH Sub I, LLC [Consulté en octobre 2012].
[BDPP] Base de données sur les produits pharmaceutiques [base de données] [modifié le 17 juillet 2015] Ottawa (Ont.), Santé Canada. [consultée en nov. 2015]. Recherche de produits pharmaceutiques en ligne.
[BDIPSN] Base de données d’ingrédients de produits de santé naturels [base de données]. Ottawa (Ont.), Santé Canada. [consultée en avril 2017]. Resultats.
[BDPSNH] Base de données des produits de santé naturels homologués [base de données]. Ottawa (Ont.), Santé Canada. [consultée en avril 2017].
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C., 1999, ch. 33, Gazette du Canada. Partie III. Vol. 22, no 3.
Canada, ministère de l’Environnement. 2009. Loi canadienne sur la protection de l’environnement (1999) – Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Gazette du Canada, Partie I, vol. 143, no 40, p. 2945-2956.
[CDAT] Chemical Data Access Tool. 2015. Non-confidential 2012 Chemical Data Reporting Information: search results for CAS RN 108-24-7. Washington (DC): US Environmental Protection Agency. [mise à jour en juin 2014; consulté le 3 sept. 2015].
[ECCC] Environnement et Changement climatique Canada. 2016a. Documents sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa, Ont. : gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (QC) : ECCC. Renseignements à l’appui du Document sur l’approche scientifique : Classification du risque écologique des substances organiques. Offert sur demande à substances@ec.gc.ca. [Disponible en anglais seulement.]
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2017. Évaluation préalable : Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2019. Évaluation préalable - groupe des composés hétérocycliques. Ottawa (Ont.), gouvernement du Canada. [Consulté le 29 novembre 2021].
[ECHA] Agence européenne des produits chimiques. 2021. Brief profile: Imidazolidine-2-thione; CAS RN 96-45-7. Helsinki (FI): ECHA. [Mise à jour le 19 mai 2021]. [Disponible en anglais seulement.]
Elcombe CR, Odum J, Foster JR, Stone S, Hasmall S, Soames AR, Kimber I, Ashby J. 2002. Prediction of rodent nongenotoxic carcinogenesis: evaluation of biochemical and tissue changes in rodents following exposure to nine nongenotoxic NTP carcinogens. Environ Health Perspect 110(4): 363-375.
Environnement Canada. 2009. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Données préparées par : Environnement Canada, Santé Canada; Programme des substances existantes.
[EPA du Danemark] Danish Environmental Protection Agency. 2012. Survey and health assessment of thiourea compounds in chloroprene rubber. Copenhague (DE): Danish Ministry of the Environment.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [estimation model]. 2012. Version 4.1. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse Research Corporation.
Frakes RA. 1988. Drinking water guideline for ethylene thiourea, a metabolite of ethylene bisdithiocarbamate fungicides. Regul Toxicol Pharmacol. 8: 207-218.
[HSDB] Hazardous Substances Data Bank [database] 1983. Bethesda (MD): US National Library of Medicine (US). [mise à jour le 28 oct. 2016; consultée le 9 janv. 2017]. La banque de données.
[IARC] International Agency for Research on Cancer. 1974. Ethylene thiourea. IARC Monogr Eval Carcinog Risks Hum. 7:45-52.
[IARC] International Agency for Research on Cancer. 2001. Ethylene thiourea. IARC Monogr Eval Carcinog Risks Hum. 79:659-702.
[INRP] Inventaire national des rejets de polluants. 2018. Recherche en ligne des données de l’Inventaire national des rejets de polluants [Base de données dans Internet]. Gatineau (Qc), Environnement et Changement climatique Canada. [Dernière mise à jour le 13 septembre 2018].
[INRP] Inventaire national des rejets de polluants. 2021. Liste des substances, par seuil [Base de données dans Internet]. Gatineau (Qc), Environnement et Changement climatique Canada. [Dernière mise à jour le 15 novembre 2021].
Maranghi F, De Angelis S, Tassinari R, Chiarotti F, Lorenzetti S, Moracci G, Marcoccia D Gilardi E et al. 2013. Reproductive toxicity and thyroid effects in Sprague Dawley rats exposed to low doses of ethylenethiourea. Food and Chemical Toxicology. 59: 261-271.
Matz Carlyn J, Stieb David M, Davis Karelyn, Egyed Marika, Rose Andreas, Chou Benedito, Brion Orly. Effects of age, season, gender and urban-rural status on time-activity: Canadian Human Activity Pattern Survey 2 (CHAPS 2). Int J Env Res Publ Health. 11: 2108-2124.
[NTP] National Toxicology Program. 1992. Technical report on the perinatal toxicology and carcinogenesis studies of ethylene thiourea (CAS No. 96-45-7) in F344/N rats and B6C3F1 mice (feed studies). National Toxicology Program, U.S. Dept. of Health and Human Services, Public Health Service. Report no. TR 388. pp. 245.
[OCDE] Boîte à outils RQSA [outil d’extrapolation]. 2014. Version 3.3. Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry.
[OEHHA] Office of Environmental Health Hazard Assessment. 2009. Air Toxics Hot Spots Risk Assessment Guidelines Part II: Technical Support Document for Cancer Potency Factors. Appendix B. Chemical-specific summaries of the information used to derive unit risk and cancer potency values. (OEHHA) of California. Report. p. 626.
[Pays-Bas] Health Council of the Netherlands: Dutch Expert Committee on Occupational Standards
(DECOS). Ethylene thiourea. The Hague: Health Council of the Netherlands, 1999; publication no. 1999/03OSH.
PubChem [database]. 2004- . Bethesda (MD): US National Library of Medicine, National Center for Biotechnology Information.
Santé Canada. 1998. Exposure Factors for Assessing Total Daily Intake of Priority Substances by the General Population of Canada. Ottawa (Ont.), Santé Canada, Direction de l’hygiène du milieu, Bureau des dangers des produits chimiques.
Santé Canada. 2014. Métirame : Projet de décision de réévaluation. PRVD2014-03. No au catalogue 113‑27/2014-3E. Ottawa (Ont.), Santé Canada.
Santé Canada. 2016. Ethylenethiourea (ETU) Content in Consumer Products: Testing Samples with Various Matrix/Polymer Types. Laboratoire sur la sécurité des produits; Ottawa (Ont.), Santé Canada; no de projet 2016-2205. [Disponible en anglais seulement.]
Santé Canada. 2018a. Mancozèbe et préparations commerciales connexes : document de consultation. Ottawa (Ont.), Santé Canada.
Santé Canada. 2018b. Métirame et préparations commerciales connexes : décision finale. RVD2018-20. Ottawa (Ont.), Santé Canada.
Santé Canada. 2019. Cinquième rapport sur la biosurveillance humaine des substances chimiques de l’environnement au Canada : Résultats de l’Enquête canadienne sur les mesures de la santé cycle 5 (2016 à 2017) [PDF]. Ottawa (Ont.), Santé Canada. [Consulté le 13 juillet 2021].
Santé Canada. 2020a. Mancozèbe et préparations commerciales connexes. RVD2020-12. No au catalogue H113-28/2020-12-PDF. Ottawa (Ont.), Santé Canada.
Santé Canada. 2020b. Liste des contaminants et des autres substances adultérantes dans les aliments [Modifié le 3 juillet 2020]. Ottawa (Ont.), Santé Canada. [Consulté le 20 juillet 2021].
Santé Canada. 2021. Cinquième rapport sur la biosurveillance humaine des substances chimiques de l’environnement au Canada : Résultats de l’Enquête canadienne sur les mesures de la santé cycle 5 (2016 à 2017) [PDF]. Ottawa (Ont.), Santé Canada. [Consulté le 11 mai 2022].
PubChem [Base de données]. 2004- . Bethesda (MD): US National Library of Medicine, National Center for Biotechnology Information.
Tetra Tech. 2021. Biomonitoring Equivalents for Ethylene Thiourea. Final report March 19, 2021. Prepared for Health Evaluation Directorate Pest Management Regulatory Agency Health Canada. Prepared by Tetra Tech and Sean Hays Summit Toxicology Bozeman, MT. Rapport inédit.
[US EPA] United States Environmental Protection Agency. 2020. Mancozeb and Ethylene Thiourea (ETU): Draft Human Health Risk Assessment (DRA) for Registration Review. Washington (DC): US Environmental Protection Agency, Office of Chemical Safety and Pollution Prevention. Document ID: EPA-HQ-OPP-2015-0291-0022
Annexe A. Exposition à l’ETU présent dans des produits disponibles aux consommateurs
Exposition à l’ETU présent dans une combinaison isotherme à base de néoprène
L’exposition des adultes à l’ETU lorsqu’ils portent une combinaison isotherme intégrale recouvrant 16 925 cm2 (superficie du corps moins la superficie de la tête) (Santé Canada 1998) jusqu’à 30 jours par année a été prise en compte. La perte graduelle d’ETU a été calculée pour chaque période d’utilisation d’après la vitesse de migration (tableau A-1). On a estimé que l’ETU migrait vers l’intérieur et l’extérieur de la surface de la combinaison isotherme (c.-à-d. dans la peau et vers l’extérieur, dans le milieu ambiant). En supposant une exposition quotidienne de 8 heures/jour, la concentration d’ETU dans le produit a été recalculée pour le jour suivant pour obtenir une nouvelle vitesse de migration quotidienne fondée sur la concentration résiduelle (tableau A-2 et tableau A-3). Par ailleurs, l’exposition d’un enfant (5 à 11 ans) a également été calculée. La superficie du corps a été établie à 8 450 cm2 et le poids corporel à 27 kg, le poids de la combinaison isotherme en néoprène étant de 1,34 kg contenant 0,095 mg d’ETU.
| Paramètre | Adultes (19 ans et plus) | Enfants (5 à 11 ans) |
|---|---|---|
| Surface corporelle moins la tête (cm2)a | 16 925 | 8 450 |
| Poids corporel (kg)a | 70,9 | 27 |
| Concentration initiale d’ETU (mg/kg)b | 0,0838 | 0,0838 |
| Masse la combinaison isothermique (kg)c | 2,268 | 1,134 |
| Rapport initiald | 300 000-1 | 300 000-1 |
| Vitesse de migration initiale (mg/cm2/h)e | 2,793E-07 | 2,793E-07 |
| Masse d’ETU initiale dans la combinaison isothermique (mg)f | 0,1901 | 0,0950 |
| Masse totale extraite (mg)g | 0,095050 | 0,04749 |
| Absorption par voie cutanée à 45 % (mg)h | 0,042772 | 0,02137 |
| Moyenne sur un an (mg/jour)i | 0,000117 | 5,855E-05 |
| Dose chez l’adulte (mg/kg p.c./jour)j | 1,65 E-06 | 2,17 E-06 |
| Risque unitaire (sans unité)k | 9,92 E-08 | 1,30 E-07 |
a Santé Canada 1988.
b Santé Canada 2016.
c Jugement d’un professionnel fondé sur des sites Web de détaillants et du poids humide possible.
d EPA du Danemark 2012.
e Concentration initiale multipliée par le ratio initial.
f La concentration d’ETU (pour une chaussette nautique en néoprène) de 0,0838 mg/kg (Santé Canada 2016) et la masse initiale de la combinaison ont été utilisées pour calculer la masse initiale de l’ETU dans la combinaison.
g Masse totale transférée pendant 30 jours (tableau A-2 pour les adultes, tableau A-3 pour les enfants).
h Quantité d’ETU absorbée par la peau si on suppose que 45 % de l’ETU est absorbé par la peau, proportion calculée à l’aide de la masse totale extraite et de l’absorption cutanée de 45 %.
I La quantité qui était absorbée par la peau divisée par 365 jours/an.
j Calculée en divisant la quantité amortie sur un an par le poids corporel.
k La dose multipliée par le coefficient de cancérogénicité de 0,061 (mg/kg p.c./jour)-1 calculée par Santé Canada d’après l’apparition de tumeurs hépatique chez des souris femelles.
| Jour | Vitesse de migrationa (mg/cm2/h) | Masse transférée vers l’intérieurb (mg) | Masse transférée vers l’extérieurc (mg) | Masse finaled (mg) | Nouvelle concentratione (mg/kg) |
|---|---|---|---|---|---|
| 1 | 2,79E-07 | 0,03782 | 0,03782 | 0,11446 | 0,05047 |
| 2 | 1,68E-07 | 0,02278 | 0,02278 | 0,06890 | 0,03038 |
| 3 | 1,01E-07 | 0,01371 | 0,01371 | 0,04148 | 0,01829 |
| 4 | 6,10E-08 | 0,00825 | 0,00825 | 0,02497 | 0,01101 |
| 5 | 3,67E-08 | 0,00497 | 0,00497 | 0,01503 | 0,00663 |
| 6 | 2,21E-08 | 0,00299 | 0,00299 | 0,00905 | 0,00399 |
| 7 | 1,33E-08 | 0,00180 | 0,00180 | 0,00545 | 0,00240 |
| 8 | 8,01E-09 | 0,00108 | 0,00108 | 0,00328 | 0,00145 |
| 9 | 4,82E-09 | 0,00065 | 0,00065 | 0,00197 | 0,00087 |
| 10 | 2,90E-09 | 0,00039 | 0,00039 | 0,00119 | 0,00052 |
| 11 | 1,75E-09 | 0,00024 | 0,00024 | 0,00072 | 0,00032 |
| 12 | 1,05E-09 | 0,00014 | 0,00014 | 0,00043 | 0,00019 |
| 13 | 6,33E-10 | 0,00009 | 0,00009 | 0,00026 | 0,00011 |
| 14 | 3,81E-10 | 0,00005 | 0,00005 | 0,00016 | 0,00007 |
| 15 | 2,29E-10 | 0,00003 | 0,00003 | 0,00009 | 0,00004 |
| 16 | 1,38E-10 | 0,00002 | 0,00002 | 0,00006 | 0,00002 |
| 17 | 8,31E-11 | 0,00001 | 0,00001 | 0,00003 | 0,00002 |
| 18 | 5,01E-11 | 0,00001 | 0,00001 | 0,00002 | 0,00001 |
| 19 | 3,01E-11 | 0,00000 | 0,00000 | 0,00001 | 0,00001 |
| 20 | 1,81E-11 | 0,00000 | 0,00000 | 0,00001 | 0,00000 |
| 21 | 1,09E-11 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 22 | 6,57E-12 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 23 | 3,96E-12 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 24 | 2,38E-12 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 25 | 1,43E-12 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 26 | 8,63E-13 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 27 | 5,20E-13 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 28 | 3,13E-13 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 29 | 1,88E-13 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 30 | 1,13E-13 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
a La vitesse de migration au jour 1 est la vitesse de migration initiale (tableau A-1). On a ensuite calculé les vitesses de migration suivantes en multipliant la nouvelle valeur de concentration du jour précédant par la valeur du ratio initial (tableau A-1).
b La masse transférée vers l’intérieur est la quantité disponible sur la peau. On l’a calculée en multipliant la vitesse de migration par la superficie du corps moins la superficie de la tête (tableau A-1) par 8 heures.
c La masse transférée vers l’extérieur est la quantité transférée vers le milieu extérieur et est équivalente à la masse transférée vers l’intérieur.
d On a calculé la masse finale au jour 1 en soustrayant la masse transférée vers l’intérieur et la masse transférée à l’extérieur de la masse initiale de l’ETU dans la combinaison (tableau A-1). On a calculé la masse finale des jours suivants à l’aide de la masse finale du jour précédent et en soustrayant la masse transférée vers l’intérieur et la masse transférée vers l’extérieur.
e On a calculé la nouvelle concentration en divisant la masse finale par la masse initiale de la combinaison (tableau A-1).
| Jour | Vitesse de migrationa (mg/cm2/h) | Masse transférée vers l’intérieurb (mg) | Masse libérée vers l’extérieurc (mg) | Masse finaled (mg) | Nouvelle concentratione (mg/kg) |
|---|---|---|---|---|---|
| 1 | 2,79E-07 | 0,01888 | 0,01888 | 0,05723 | 0,05047 |
| 2 | 1,68E-07 | 0,01137 | 0,01137 | 0,03449 | 0,03041 |
| 3 | 1,01E-07 | 0,00685 | 0,00685 | 0,02078 | 0,01833 |
| 4 | 6,11E-08 | 0,00413 | 0,00413 | 0,01252 | 0,01104 |
| 5 | 3,68E-08 | 0,00249 | 0,00249 | 0,00755 | 0,00665 |
| 6 | 2,22E-08 | 0,00150 | 0,00150 | 0,00455 | 0,00401 |
| 7 | 1,34E-08 | 0,00090 | 0,00090 | 0,00274 | 0,00242 |
| 8 | 8,05E-09 | 0,00054 | 0,00054 | 0,00165 | 0,00146 |
| 9 | 4,85E-09 | 0,00033 | 0,00033 | 0,00099 | 0,00088 |
| 10 | 2,92E-09 | 0,00020 | 0,00020 | 0,00060 | 0,00053 |
| 11 | 1,76E-09 | 0,00012 | 0,00012 | 0,00036 | 0,00032 |
| 12 | 1,06E-09 | 0,00007 | 0,00007 | 0,00022 | 0,00019 |
| 13 | 6,40E-10 | 0,00004 | 0,00004 | 0,00013 | 0,00012 |
| 14 | 3,86E-10 | 0,00003 | 0,00003 | 0,00008 | 0,00007 |
| 15 | 2,32E-10 | 0,00002 | 0,00002 | 0,00005 | 0,00004 |
| 16 | 1,40E-10 | 0,00001 | 0,00001 | 0,00003 | 0,00003 |
| 17 | 8,44E-11 | 0,00001 | 0,00001 | 0,00002 | 0,00002 |
| 18 | 5,08E-11 | 0,00000 | 0,00000 | 0,00001 | 0,00001 |
| 19 | 3,06E-11 | 0,00000 | 0,00000 | 0,00001 | 0,00001 |
| 20 | 1,85E-11 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 21 | 1,11E-11 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 22 | 6,70E-12 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 23 | 4,04E-12 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 24 | 2,43E-12 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 25 | 1,47E-12 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 26 | 8,84E-13 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 27 | 5,33E-13 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 28 | 3,21E-13 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 29 | 1,93E-13 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
| 30 | 1,17E-13 | 0,00000 | 0,00000 | 0,00000 | 0,00000 |
a La vitesse de migration au jour 1 est la vitesse de migration initiale (tableau A-1). On a ensuite calculé les vitesses de migration suivantes en multipliant la nouvelle valeur de concentration du jour précédant par la valeur du ratio initial (tableau A-1).
b La masse transférée vers l’intérieur est la quantité disponible sur la peau. On l’a calculée en multipliant la vitesse de migration par la superficie du corps moins la superficie de la tête (tableau A-1) par 8 heures.
c La masse transférée vers l’extérieur est la quantité transférée vers le milieu extérieur et est équivalente à la masse transférée vers l’intérieur.
d On a calculé la masse finale au jour 1 en soustrayant la masse transférée vers l’intérieur et la masse transférée à l’extérieur de la masse initiale de l’ETU dans la combinaison (tableau A-1). On a calculé la masse finale des jours suivants à l’aide de la masse finale du jour précédent et en soustrayant la masse transférée vers l’intérieur et la masse transférée vers l’extérieur.
e On a calculé la nouvelle concentration en divisant la masse finale par la masse initiale de la combinaison (tableau A-1).
Exposition à l’ETU dans un couvre-volant
L’exposition des adultes à l’ETU dans un couvre-volant d’un véhicule avec lequel les deux paumes (455 cm2, Santé Canada 1998) sont en contact pendant 365 jours au plus par année a été déterminée. La perte quotidienne graduelle d’ETU a été calculée pour chaque période d’utilisation d’après la vitesse de migration (tableau A-4). On a supposé que l’ETU a migré depuis la surface extérieure du couvre-volant vers les deux paumes. Aucune donnée n’a été trouvée sur la perte possible d’ETU dans le milieu environnant. Pour chaque exposition quotidienne suivante (c.-à-d. 4 heures/jour pendant un seul jour, 1,27 heure/jour pour les autres durées [Matz et al. 2014]), on a recalculé la concentration d’ETU dans le produit pour obtenir une nouvelle vitesse de migration quotidienne d’après la concentration résiduelle (tableau A-5). Pour obtenir les valeurs estimatives, on a retenu la durée quotidienne moyenne de présence dans le véhicule pour tous les participants établie dans l’étude (Matz et al. 2014), même si cette moyenne comprenait celles des jeunes n’ayant pas l’âge de conduire (c.-à-d. personnes de moins de 15 ou 16 ans). De plus, même si la durée de « présence dans le véhicule » de l’étude (Matz et al. 2014) comprenait le temps passé comme passager dans un véhicule privé, un autobus, un taxi, un avion, un train ou une voiture de métro, en plus du temps de conduite, on a prudemment supposé pour le calcul que toutes ces situations revenaient à conduire. Par ailleurs, l’exposition d’un adolescent (14 à 18 ans) a également été calculée, mais comme le résultat était inférieur à celui d’un adulte, il n’a pas été présenté.
| Paramètre | Adultes (19 ans et plus) |
|---|---|
| Superficie cutanée des deux paumes (cm2)a | 455 |
| Poids corporel (kg)a | 70,9 |
| Concentration initiale d’ETU (mg/kg)b | 11,0 |
| Masse du couvre-volant (kg)c | 0,7 |
| Ratio initiald | 300,000-1 |
| Vitesse de migration initiale (mg/cm2/h)e | 3,67 x 10-5 |
| Masse initiale de l’ETU dans le couvre-volant (mg)f | 7,7 |
| Masse transférée vers l’intérieur le premier jour (mg)g | 6,67 x 10-2 |
| Exposition cutanée le premier jour (mg/kg p.c./jour)h | 4,24 x 10-4 |
| Masse transférée vers l’intérieur pendant 30 jours (mg)i | 1,77 |
| Exposition cutanée pendant 30 jours (mg/kg p.c./jour)j | 3,74 x 10-4 |
| Masse transférée vers l’intérieur pendant environ 10 ans ou 3650 jours (mg)k | 7,7 |
| Exposition cutanée quotidienne pendant 10 ans d’exposition (mg/kg p.c./jour)l | 1,34 x 10-5 |
| Risque unitaire (sans unité)m | 5,18 x 10-6 |
a Santé Canada 1998.
b Santé Canada 2016.
c Jugement professionnel fondé sur des sites Web de détaillants.
d EPA du Danemark 2012.
e Concentration initiale multipliée par le ratio initial.
f La concentration d’ETU (dans un couvre-volant) de 11,0 mg/kg (Santé Canada 2016) et la masse initiale du couvre-volant ont servi à calculer la masse initiale de l’ETU dans un couvre-volant.
g Masse totale transférée vers l’intérieur le premier jour, en supposant une présence de 4 heures dans un véhicule (valeur de P95 tirée de Matz et al. 2014).
h On a calculé la valeur en multipliant la « masse transférée vers l’intérieur le premier jour » par l’absorption cutanée de 45 % et en divisant par le poids corporel (6,67E-02 x 0,45/70,9 = 4,24E-04 mg/kg p.c./jour).
i Masse totale transférée vers l’intérieur pendant 30 jours (tableau A-5), en supposant une présence pendant 4 heures dans un véhicule (valeur de P95 tirée de Matz et al. 2014).
j On a calculé cette valeur en divisant la « masse transférée vers l’intérieur pendant 30 jours » par 30 jours et par l’absorption cutanée de 45 % puis en divisant par le poids corporel (1,77/30 x 0,45/70,9 = 3,74E-04 mg/kg p.c./jour).
k Étant donné que cette valeur doit être comparée à des effets possibles à long terme, on a utilisé la valeur moyenne pour la présence dans un véhicule de 1 h 16 min (ou 1,27 heures) (Matz et al. 2014) pour calculer la perte d’ETU au fil du temps. On a calculé la masse transférée pendant environ 10 ans ou 3650 jours (la durée de vie approximative du couvre-volant) (Autos.com Editor 2013) en additionnant la masse transférée vers l’intérieur pendant les 3650 jours (7,70 mg).
l Calcul : 7,7/3650 x 0,45/70,9 = 1,34E-05 mg/kg p.c./jour.
m Santé Canada a calculé cette valeur en multipliant la dose par le coefficient de cancérogénicité de 0,0601 (mg/kg p.c./jour)-1 établi d’après l’apparition de tumeurs hépatique chez des rates.
| Jour | Vitesse de migrationa (mg/cm2/h) | Masse transférée vers l’intérieurb (mg) | Masse finalec (mg) | Nouvelle concentrationd (mg/kg) |
|---|---|---|---|---|
| 1 | 3,67E-05 | 2,12E-02 | 7,68 | 10,97 |
| 2 | 3,66E-05 | 2,11E-02 | 7,66 | 10,94 |
| 3 | 3,67E-05 | 2,11E-02 | 7,64 | 10,91 |
| 4 | 3,67E-05 | 2,10E-02 | 7,62 | 10,88 |
| 5 | 3,67E-05 | 2,10E-02 | 7,59 | 10,85 |
| 10 | 3,58E-05 | 2,07E-02 | 7,49 | 10,70 |
| 30 | 3,39E-05 | 1,96E-02 | 7,09 | 10,13 |
| 365 | 1,34E-05 | 7,77E-03 | 2,82 | 4,03 |
| 3650 | 1,58E-09 | 9,11E-07 | 0,00033 | 0,00047 |
a La vitesse de migration au jour 1 est la vitesse de migration initiale (tableau A-4). On a calculé les vitesses de migration suivantes en multipliant la nouvelle concentration le jour précédent par la valeur du ratio initial (tableau A‑4).
b La masse transférée vers l’intérieur est la quantité présente sur la peau. On l’a calculée en multipliant la vitesse de migration par la superficie des paumes (tableau A-4) et par 1,27 heure (durée moyenne de la présence dans le véhicule, selon Matz et al. 2014).
c On a calculé la masse finale au jour 1 en soustrayant à la masse initiale de l’ETU dans le couvre-volant (tableau A‑4) la masse transférée vers l’intérieur. On a calculé la masse finale des jours suivants à l’aide de la masse finale du jour précédant moins la masse transférée.
d On a calculé la nouvelle concentration en divisant la masse finale par la masse initiale du couvre-volant (tableau A-4).
