Tortue mouchetée (Emydoidea blandingii) certaines populations évaluation et rapport de situation du COSEPAC 2016 : chapitre 3
Description et importance de l’espèce sauvage
Nom et classification
La tortue mouchetée (Emydoidea blandingii) a été identifiée et décrite pour la première fois par Holbrook (1838), qui l’a classée sous le genre Cistuda en raison de ses ressemblances morphologiques avec la cistude des marais (Emys orbicularis, anciennement Cistuda europea) et avec la tortue-boîte orientale (Terrapene carolina, anciennement Cistuda carolina). L’espèce a ensuite été classée sous le genre Emys, avec l’E. orbicularis, en raison de caractères morphologiques semblables comme sa carapace non carénée à plastron articulé et sa coloration (Feldman et Parham. 2002). Elle y est restée jusqu’à ce qu’on l’en distingue en la plaçant sous le genre Emydoidea, dont elle est le seul représentant (McCoy, 1973). Certains taxinomistes ont recommandé de réunir les genres Emydoidea et Emys (Feldman et Parham, 2002; Spinks et Shaffer, 2005) en raison des caractères morphologiques et écologiques décrits par Loveridge et Williams (1957), ce qui éliminerait le genre Emydoidea. Crother (2012) a recommandé que le genre Emydoidea et le genre polyphylétique Emys soient conservés pour préserver la stabilité actuelle et parce que les genres monotypiques sont importants pour fournir de l’information phylogénétique.
Description morphologique
Adultes
Si on la compare aux autres tortues d’eau douce de l’Amérique du Nord, la tortue mouchetée est de taille moyenne. Sa dossière (partie supérieure de la carapace) au dôme lisse est noire et présente des taches ou des mouchetures jaunâtres (voir la photo en couverture). Le menton et la gorge jaune vif sont les caractéristiques les plus facilement reconnaissables de l’espèce. Les écailles et la peau sont noires et jaunes. Le cou est long et la bouche s’incurve vers le haut, donnant l’impression que la tortue sourit (figure 1). Le plastron est pourvu d’une charnière antérieure, et chaque scutelle présente une tache rectangulaire foncée sur le bord extérieur (figure 2), quoique certains individus aient un plastron entièrement foncé. Chez le mâle, le plastron est légèrement concave, et le cloaque est derrière la marge de la dossière; la partie supérieure de la mâchoire est habituellement foncée. Chez la femelle, le plastron est plat, la queue est plus courte et étroite que chez le mâle, le cloaque est antérieur à la marge de la dossière et la partie supérieure de la mâchoire est striée de jaune.

Description longue de la figure 1
Photo d’une tortue mouchetée (vue de face). La dossière a un dôme lisse qui présente des taches ou des mouchetures jaunâtres sur fond noir. Le menton et la gorge jaune vif sont les caractéristiques les plus facilement reconnaissables de l’espèce. Les écailles et la peau sont noires et jaunes.

Description longue de la figure 2
Photo du dessous d’une tortue mouchetée femelle adulte, qui montre une tache rectangulaire foncée sur le bord extérieur de chaque scutelle brun jaunâtre.
Les longueurs de dossière observées sur des tortues mouchetées adultes au Canada varient de 12,6 à 26,7 cm; les individus des sous-populations du sud-ouest de l’Ontario sont, en moyenne, plus petits que ceux du Québec, du centre-sud de l’Ontario et de la Nouvelle-Écosse (longueur moyenne de 20 cm, 24 cm, 23 cm et 21 cm, respectivement) (Gillingwater et Brooks, 2001; Gillingwater et Piraino, 2004; Gillingwater, 2009; Caverhill et al., 2011; St-Hilaire et al., 2013; Nova Scotia Blanding’s Turtle Database, 2014; Équipe de rétablissement des tortues du Québec, données inédites; Edge, données inédites; Gillingwater, données inédites; Paterson, données inédites). En Nouvelle-Écosse, la taille des adultes varie grandement entre au moins deux des sous-populations (McNeil, 2002), et le dimorphisme sexuel est évident sur le plan de la taille chez cette espèce, le mâle étant habituellement plus gros que la femelle (McNeil, 2002; Caverhill, 2003; Lefebvre et al.,2011).
Nouveau-nés
Les nouveau-nés de la tortue mouchetée mesurent (longueur de dossière) entre 24 et 40 mm (Standing et al., 2000; Gillingwater et Brooks, 2001; Riley et al., 2012; Nova Scotia Blanding’s Turtle Database, 2014), et pèsent de 6 à 12 g (Gillingwater et Brooks, 2001). La dossière des nouveau-nés est souvent unie et brun-gris. Elle porte parfois des taches ou des marques pâles, mais certains individus arborent des motifs évidents (figure 3). La queue est aussi longue que la moitié ou les deux tiers de la dossière; elle est donc proportionnellement beaucoup plus longue que celle des adultes. Le plastron est orné d’une tache centrale grisâtre. La gorge et le menton sont jaune crème. Les motifs (taches et marques) de la dossière apparaissent habituellement vers 8 à 10 mois (McNeil, obs. pers.), et la charnière du plastron ne devient pleinement fonctionnelle que vers 5 ans (longueur de dossière d’environ 100 mm; Gillingwater, données inédites).

Description longue de la figure 3
Photo d’une tortue mouchetée juvénile montrant les motifs gris foncé et beige terne sur la dossière. La gorge et le menton sont jaune crème.
Structure spatiale et variabilité de la population
En Ontario, une étude (Davy et al., 2014) a été effectuée récemment pour évaluer le degré de structure populationnelle et de diversité génétique entre les sous-populations puisque les données de l’atlas pour cette espèce ont révélé une répartition discontinue à l’échelle de la province. L’étude a amplifié les échantillons à quatre locus de microsatellites établis pour la tortue mouchetée et 13 locus établis pour la tortue de Muhlenberg Glyptemys muhlenbergii (amplification croisée avec la tortue mouchetée). Au total, on a génotypé 97 individus provenant de 8 sous-populations géographiquement isolées de l’Ontario, séparées par une distance de 150 à 500 km. L’étude a révélé qu’il existe au moins deux populations génétiquement distinctes et quatre sous-populations en Ontario (lac Érié/Golden Horseshoe et baie Georgienne/est de l’Ontario); des tests d’assignation peuvent établir le lieu d’origine d’un individu avec beaucoup d’exactitude (69 à 79 %). Les résultats suggèrent également que la sous-population de tortues mouchetées de l’Ontario n’est pas menacée par une perte de diversité génétique imminente étant donné que les niveaux de variation génétique (p. ex. hétérozygosité, diversité allélique) sont comparables à ceux observés dans d’autres populations de tortues. Les auteurs ont avancé, cependant, que la longue durée de génération pourrait avoir ralenti la perte de variation génétique chez la tortue mouchetée dans la région visée par l’étude, qui pourrait cependant être exacerbée par l’importante fragmentation de l’habitat et par le déclin continu de la population (Davy et al., 2014). Aucune analyse génétique n’a été effectuée auprès de la sous-population du Québec.
La tortue mouchetée n’a été découverte que récemment (1952) en Nouvelle-Écosse (Bleakney, 1958). Cette population ne fréquente que quelques bassins hydrographiques du sud-ouest de la province, et elle est isolée géographiquement du reste de l’aire de répartition de l’espèce (Herman et al., 1995). Des études génétiques montrent que cette population s’est considérablement différenciée des autres (Mockford et al., 1999). Malgré sa petite taille et son isolement, la population de la Nouvelle-Écosse présente un degré relativement élevé de variation génétique (Mockford et al., 1999). Trois principales sous-populations présentant des différences génétiques ont été identifiées. Le flux génétique estimé est très faible (1,8 à 5,8 individus par génération), malgré la proximité (de 15 à 25 km) des 3 sous-populations (Mockford et al.,1999,2005). Mockford et al. (2005) ont signalé qu’une analyse de 5 locus de microsatellites a donné des valeurs de Fst de l’ordre de 0,042 à 0,124 (p < 0,05) dans les comparaisons par paires entre les sous-populations. Les analyses suggèrent que la structure de cette population date d’avant l’influence européenne sur le paysage, et rien n’indique la présence d’un goulot d’étranglement récent dans cette population (Mockford et al., 2005). La variation génétique est sans doute maintenue grâce à une migration petite, mais importante d’individus entre les sous-populations (Toews, 2004); toutefois, la structure génétique est évidente au sein d’une même sous-population, entre des ruisseaux séparés par aussi peu que 5 km (Toews, 2004; Mockford et al., 2005). Une sous-population de taille apparemment importante a été découverte en 2016 (NS7); on ne connaît pas encore les liens qui l’unissent aux trois autres sous-populations principales.
Unités désignables
Deux unités désignables satisfont aux critères du caractère distinct et de l’importance. La population canadienne de la tortue mouchetée est divisée en deux unités géographiquement distinctes et habite deux provinces fauniques différentes. La première unité est la population de la Nouvelle-Écosse, dans la province faunique des amphibiens et des reptiles terrestres des Appalaches et de la côte de l’Atlantique ainsi que dans l’aire écologique de l’Atlantique. La tortue mouchetée y est à la périphérie nord-est de son aire de répartition. Cette unité est séparée du reste de l’aire de répartition par plusieurs centaines de kilomètres. En raison de cet isolement, il n’existe aucune probabilité raisonnable de dispersion à partir d’autres populations du Canada ou des États-Unis. La population de la Nouvelle-Écosse est considérablement différenciée, sur le plan génétique, des populations étudiées dans l’aire de répartition principale (Mockford et al., 1999; Rubin et al., 2001); il pourrait s’agir d’une unité importante sur le plan de l’évolution, à l’échelle de la sous-espèce ou de l’espèce (Mockford et al., 2007). La deuxième unité désignable au Canada est située dans la province faunique des amphibiens et des reptiles terrestres des Grands Lacs et du Saint-Laurent ainsi que dans l’aire écologique des plaines des Grands Lacs. Elle occupe des parties de l’Ontario et du Québec.
Importance de l’espèce
La tortue mouchetée revêt une importance biologique puisqu’il s’agit d’une des tortues d’eau douce ayant la plus grande longévité (Congdon et al.,1993,2001; Rubin et al.,2001) : sa durée de vie dépasse 83 ans (University of Michigan News, 25 mai 2016). L’espèce a donc été employée dans des modèles de conservation et de démographie (Congdon et al., 1993) ainsi que pour vérifier des hypothèses concurrentes sur les raisons et les mécanismes du vieillissement (Congdon et al.,2001). Elle est également le seul représentant vivant du genre Emydoidea et possède une aire de répartition mondiale plus petite que la plupart des autres tortues nord-américaines. Il a été suggéré que la population de la Nouvelle-Écosse soit reconnue comme unité importante sur le plan de l’évolution en raison de son isolement et de la possibilité qu’elle poursuive sa différenciation génétique par rapport aux individus occupant l’aire de répartition principale de l’espèce (Mockford et al., 2007). Cette tortue est en péril à l’échelle de son aire de répartition mondiale (NatureServe, 2014) et, à ce titre, elle est devenue une espèce emblématique pour la recherche en matière de conservation. Malheureusement pour elle, la tortue mouchetée est devenue très prisée dans le commerce des animaux de compagnie, des aliments et des produits médicinaux traditionnels.
Répartition
Aire de répartition mondiale
L’aire de répartition mondiale de la tortue mouchetée est centrée sur le bassin des Grands Lacs (figure 4), et environ 20 % de sa superficie se trouve au Canada. Aux États-Unis, l’espèce est présente du Nebraska et du Dakota du Sud, à l’ouest, jusqu’en Iowa, au Minnesota, au Missouri, au Wisconsin, en Illinois, en Indiana, au Michigan, en Ohio et en Pennsylvanie, à l’est. On trouve également de petites sous-populations dans les États de New York, du Massachusetts, du New Hampshire et du Maine.
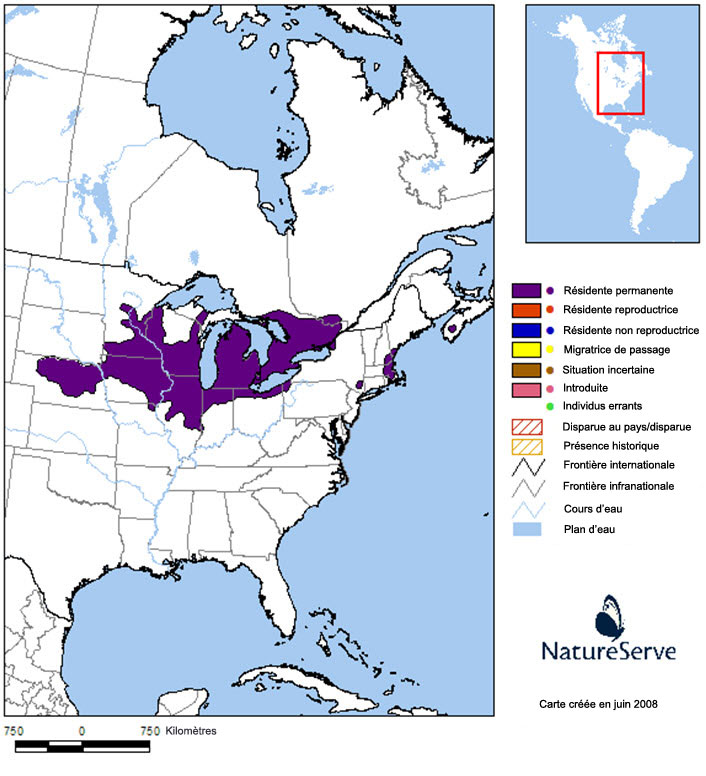
Description longue de la figure 4
Carte de l’aire de répartition mondiale de la tortue mouchetée, entrée sur le bassin des Grands Lacs en Amérique du Nord. Approximativement 20 % de l’aire de répartition se trouve au Canada, soit en Ontario, au Québec et en Nouvelle-Écosse. Aux États-Unis, l’espèce est présente du Nebraska et du Dakota du Sud, à l’ouest, jusqu’en Iowa, au Minnesota, au Missouri, au Wisconsin, en Illinois, en Indiana, au Michigan, en Ohio et en Pennsylvanie, à l’est. On trouve de petites sous-populations dans les États de New York, du Massachusetts, du New Hampshire et du Maine.
Aire de répartition canadienne
Au Canada, la tortue mouchetée est principalement présente dans les parties sud de l’Ontario, du Québec et de la Nouvelle-Écosse (Atlas des amphibiens et des reptiles du Québec; Atlas des amphibiens et des reptiles de l’Ontario [AARO; Ontario Reptile and Amphibian Atlas]; Base de données sur la tortue mouchetée de la Nouvelle-Écosse [Nova Scotia Blanding’s Turtle Database]).
En Ontario, la tortue mouchetée vit surtout de l’extrême sud-ouest de l’Ontario jusqu’à Ottawa, à l’est, et à Sault-St. Marie, au nord-ouest; quelques mentions isolées ont cependant été faites jusque dans le district de Timmins, au nord (OMNRF Timmins District, comm. pers., 2014). La répartition de l’espèce en Ontario n’est pas continue, et les mentions sont rares ou inexistantes dans de grandes parties de la province, y compris entre Sudbury et Timmins; entre les comtés de Grey et Bruce jusqu’au comté de Waterloo au sud et au lac Simcoe à l’est; à l’extrémité sud-est de l’Ontario; dans les secteurs situés à l’ouest et au sud du parc provincial Algonquin. Chose intéressante, les modèles prévoient que ces secteurs continueront de présenter un habitat moins convenable que les autres pour la tortue mouchetée (Millar et Blouin-Demers, 2012); le faible nombre de mentions à ces endroits reflètent donc peut-être une faible abondance plutôt qu’un manque de relevés suffisants.
Au Québec, la principale sous-population vit dans la région de l’Outaouais; toutefois, des individus ont également été aperçus dans les régions de l’Abitibi-Témiscamingue, de la Montérégie et de la Capitale-Nationale (Bernier, 2014).
En Nouvelle-Écosse, la majorité des individus connus appartiennent à trois principales sous-populations, dans deux bassins hydrographiques. L’existence de trois autres petites concentrations d’individus (de trois à huit adultes chacune), qui appartiennent peut-être à l’une des trois principales sous-populations, a été confirmée en 2012; l’une d’entre elles occupe d’ailleurs un bassin hydrographique où l’espèce n’avait jamais été vue avant. Une quatrième sous-population a été découverte au printemps 2016; sa taille et la superficie de son aire de répartition demeurent inconnues. D’autres populations n’ayant pas encore été découvertes pourraient exister dans la province, et des observations fortuites ont eu lieu dans plusieurs secteurs (McNeil, 2002; Herman et al., 2003; Nova Scotia Blanding’s Turtle Database, 2014). Toutefois, la plupart d’entre elles n’ont pas été vérifiées grâce à des images ou à des spécimens. Quelques mentions d’un seul individu appuyées par des photos ont été documentées à l’extérieur de l’aire de répartition connue, mais les relevés subséquents n’ont pas permis de trouver d’autres tortues. On ne sait pas si la tortue mouchetée occupe ces secteurs ou si les individus aperçus étaient des individus errants, des cas isolés possiblement placés là par des humains.
Zone d’occurrence et zone d’occupation
La zone d’occurrence de la population des Grands Lacs et du Saint-Laurent est de 405 273 km2. Si cette estimation semble indiquer que la zone s’est agrandie d’environ 331 000 km2 depuis la publication du rapport de situation de 2005, cela n’est pas représentatif d’un agrandissement réel, mais plutôt du recours à des méthodes de calcul différentes. La zone d’occurrence avait auparavant été calculée en éliminant les secteurs d’habitat non convenable, mais la méthode actuelle consiste à l’estimer en traçant le plus petit polygone convexe entourant tous les sites connus, inférés ou projetés d’occurrence actuelle de l’espèce, en excluant les secteurs se trouvant hors du Canada. Il est donc impossible de comparer les deux estimations (Wu, comm. pers., 2014). Si l’on calcule la zone d’occurrence de 2005 en fonction des nouvelles lignes directrices, on arrive à une estimation de 282 170 km2. La hausse réelle de la superficie de la zone depuis 2005 est donc d’environ 123 103 km2. Elle est due principalement à quelques mentions isolées d’individus dans le nord de l’Ontario et du Québec de même que dans la région de la Capitale-Nationale (Québec), mentions ayant grandement élargi le polygone. Si l’on exclut celles-ci, on constate que la vaste majorité des tortues mouchetées de la population des Grands Lacs et du Saint-Laurent vivent dans un secteur d’environ 222 000 km2 (c.-à-d. à peu près la moitié de la superficie de la zone d’occurrence estimative actuelle). En 2005, l’indice de zone d’occupation (IZO) pour cette population était estimé à 9 852 km2 (2 463 carrés de 2 km x 2 km); il est actuellement estimé à plus de 9 900 km2 (2 475 carrés). Il y a donc eu très peu de changement à l’IZO depuis 2005. Si l’on élimine les mentions isolées aux extrémités nord et est de la zone d’occupation, l’IZO retombe à 9 880 km2 (2 470 carrés).
La zone d’occurrence de la population de la Nouvelle-Écosse est d’environ 1 354 km2, et son IZO est de 392 km2 (98 carrés de 2 km x 2 km). Ces calculs incluent la superficie du territoire regroupant les sept sous-populations et concentrations, mais excluent les mentions non confirmées ou les mentions isolées et confirmées d’un seul individu lorsque des études subséquentes n’ont pas permis de trouver d’autres tortues. L’habitat essentiel a été désigné pour les sous-populations de la Nouvelle-Écosse (Parks Canada, 2012). Cet habitat inclut les limites géographiques connues du secteur habité par chaque sous-population, les habitats saisonniers connus utilisés par la tortue à tous les stades du cycle vital ainsi que les secteurs aquatiques et terrestres qui relient ces habitats (Parks Canada, 2012). Au sein de l’habitat essentiel, les régions fortement utilisées ont été désignées; elles incluent les sites saisonniers précis occupés par la tortue mouchetée, à l’exclusion des voies de déplacement. Ces polygones d’habitat fortement occupé représentent 57 km2, ce qui peut être considéré comme la zone d’occupation biologique minimale pour la population de la Nouvelle-Écosse. L’habitat essentiel désigné dans le programme de rétablissement n’inclut pas la sous-population découverte en 2016 (NS7) ou les petites concentrations découvertes en 2012 (NS4, NS5, NS6). L’habitat essentiel dans ces secteurs sera inclus dans le plan d’action de l’espèce, en cours de rédaction.
Activités de recherche
La présente section décrit les activités de recherche qualitative (c.-à-d. de répartition) effectuées pour trouver la tortue mouchetée aux sites (nouveaux ou connus) où elle est susceptible de se trouver afin d’aider à délimiter l’aire de répartition de l’espèce au Canada. Pour en savoir plus sur les activités et les méthodes d’échantillonnage employées pour estimer la taille et la démographie des sous-populations connues, consultez la rubrique « Taille et tendances des populations - Activités et méthodes d’échantillonnage » et le tableau 1.
Une bonne partie de l’information connue sur la répartition de la tortue mouchetée au Canada a été recueillie au cours des 30 dernières années par l’entremise des programmes volontaires suivants : Résumé herpétofaunique de l’Ontario (depuis 1984); Atlas des amphibiens et des reptiles du Québec (depuis 1988); Ontario Turtle Tally Program du zoo de Toronto (depuis 2003); Atlas des reptiles et des amphibiens de l’Ontario (depuis 2009); Base de données sur la tortue mouchetée de la Nouvelle-Écosse (depuis 1996).
| Sous-population | Taille du site étudié | Rapports mâle/femelle et adulte/juvénile | Estimation de la population adulte OU nombre d’adultes trouvés | Densité (adultes/ha) | Durée de l’étude (nombre de saisons) | Activités d’échantillonnage | Méthodes de relevés | Sources |
|---|---|---|---|---|---|---|---|---|
| Sud-ouest de l’Ontario 1 | 3 300 ha | 1M : 1,2F 20,6A : 1J |
690 Méthode de Schnabel (modèle modifié de capture pour population fermée) |
0,21 | 9 saisons (2000-2001; 2008-2014) |
> 650 jours-personne | Captures à la main/ épuisette et inventaire visuel dans les milieux humides et les aires de nidification | Gillingwater et Brooks, 2001; Davy, données inédites |
| Sud-ouest de l’Ontario 2 | 607 ha | 1,35M : 1F 9,4A : 1J |
818 D’après une estimation de 341 ±214 femelles adultes (méthode de Jolly-Seber au moyen du programme JOLLY, à partir d’un modèle A et de données de marquage-recapture de 2003 à 2006) et un rapport moyen entre les sexes de 1,4 M : 1F. |
1,35 | 21 saisons (1973; 1979; 1980; 1982; 1992-1994; 2003-2016) |
> 680 jours-personne ~ 500 jours-piège |
Captures à la main/ épuisette et inventaire visuel dans les milieux humides et les aires de nidification; verveux | Weller, 1973; Hubbs, 1979; Purves, 1980; Ashenden, 1983; Saumure, 1995; Gillingwater et Piraino, 2004, 2007; Piraino et Gillingwater, 2005, 2006; Gillingwater, 2009, 2013; Enneson, 2009 |
| Sud-ouest de l’Ontario 3 | 800 ha | 1M : 3,2F 10A : 1J |
138 Indice de Lincoln, où N = MC/R (à partir de données de 2010-2011) |
0,17 | 5 saisons (2010-2014) |
1 317 heures-personne 2 200 jours-piège |
Captures à la main/ épuisette durant des relevés par radiotélémesure, des relevés de mortalité routière et des inventaires visuels dans les milieux humides et les aires de nidification; verveux | Caverhill et al., 2011; zoo de Toronto, données inédites |
| Sud-ouest de l’Ontario 4 | 1 500 ha | 1M : 2,32F 14,5A : 1J |
82 trouvés | ~ | 2 saisons (2001-2002) |
> 200 jours-personne 2 280 jours-piège |
Captures à la main/épuisette durant des inventaires visuels dans les milieux humides et les aires de nidification; pièges flottants, verveux et capture d’individus vivants | Browne et Hecnar, 2007 |
| Sud-ouest de l’Ontario 5 | 68 ha | 1M : 1F 6A : 1J | 5 trouvés (ce nombre est considéré comme représentatif de la taille de la population adulte totale étant donné les vastes travaux d’échantillonnage effectués) |
~ | 10 saisons (2005-2014) |
1 855 heures-personne | ?? | Zoo de Toronto, données inédites |
| Sud-est de l’Ontario 1 | 3 724 ha | ?M : ?F 5,2A : 1J |
26 trouvés | ~ | 3 saisons (2012-2014) |
> 27 jours-piège (2013) > 4 500 heures-piège (2014) |
Captures à la main/ épuisette durant des relevés par radiotélémesure et des inventaires visuels dans les milieux humides; verveux | Carstairs, 2014, données inédites |
| Sud-est de l’Ontario 2 | 690 ha | 1M : 2F 4,3A : 1J |
99 (IC de 95 % : 89-124) | 0,14 | 4 saisons (2010-2013) |
5 300 heures-personne 2 360 jours-piège |
Captures à la main/ épuisette durant des relevés par radiotélémesure, des relevés de mortalité routière et des inventaires visuels dans les milieux humides; verveux | Dillon Consulting Ltd., 2014 |
| Sud-est de l’Ontario 3 | 900 ha | 1,3M : 1F 30,3A : 1J |
114 (IC de 95 % : 103-136) Modèle de capture pour population fermée dans MARK |
0,13 | 3 saisons (2007-2009) |
Les milieux humides ont fait l’objet de relevés tous les jours d’avril à septembre chaque année. Des verveux ont aussi été installés tout au long de la saison. | Captures à la main/ épuisette durant des relevés par radiotélémesure et des inventaires visuels dans les milieux humides; verveux | Millar, 2009, données inédites; Millar et Blouin-Demers, 2012 |
| Sud-est de l’Ontario 4 | 238 ha | 1M : 1F ?A : ?J |
85 (IC de 95 % : 53-206) Méthode de Schnabel (modèle modifié de capture pour population fermée) |
0,36 | 5 saisons (2010-2014) |
~ 68 jours-personne ~ 54 jours-piège |
Captures à la main/ épuisette durant des inventaires visuels dans les milieux humides; verveux | Middleton, 2014; Ontario Nature, données inédites |
| Centre-sud de l’Ontario 1 | 340 ha | 0,6M : 1F 6,3A : 1J |
41 (IC de 95 % : 39-50) | 0,12 | 5 saisons (2006-2008; 2009-2010) |
Les milieux humides ont fait l’objet de relevés plusieurs fois en avril et en mai chaque année. Des patrouilles des sites de nidification ont été faites de 19 h à 23 h tous les soirs pour 3 à 4 semaines par saison. Plusieurs captures accidentelles ont eu lieu dans le cadre de la télémesure et dans des hibernacles communautaires. | Captures à la main/ épuisette durant des inventaires visuels dans les milieux humides et les aires de nidification | Edge et al., 2009, 2010, données inédites; Paterson et al., 2014, données inédites |
| Centre-sud de l’Ontario 2 | 1 100 ha | 1,4M : 1F 9,5A : 1J |
19 trouvés | ~ | 2 saisons (2011-2012) |
150 heures-personne; 210 jours-piège |
Captures à la main/ épuisette durant des relevés par radiotélémesure et des inventaires visuels dans les milieux humides; verveux | Markle et Chow-Fraser, 2014, données inédites |
| Centre-sud de l’Ontario 3 | 90 ha | 1M : 1,2F 5,9A : 1J |
57 Estimation Lincoln-Peterson N = n1*n2/m2 |
0,63 | 2 saisons (2013-2014) |
134 heures-personne (2013) 1 128 heures-personne (2014) |
Captures à la main/ épuisette durant des inventaires visuels dans les milieux humides | Sheppard, 2013, 2014, données inédites |
| Centre-sud de l’Ontario 4 | 250 000 ha | 1M : 2,1F 13A : 1J |
102 trouvés | ~ | 2 saisons (2013-2014) |
?? heures (2013) > 2 500 heures (2014) |
Captures à la main/ épuisette durant des relevés par radiotélémesure, des relevés de mortalité routière et des inventaires visuels dans les milieux humides | Scales Nature Park, données inédites |
| Québec | > 60 000 ha | 1M : 1,1F 4,9A : 1J |
188 trouvés | ~ | 6 saisons (1996-1997; 2009-2011; 2013) |
1 500 heures-personne > 2 600 jours-piège |
Captures à la main/ épuisette durant des relevés par radiotélémesure et des inventaires visuels dans les milieux humides; verveux et casiers à crabes | NCC, 2007; Dubois, 2009; Fortin et Dubois, 2010; Dubois et al., 2011, 2012, données inédites; Bernier, 2013, données inédites; St.-Hilaire et al., 2013. |
| Nouvelle-Écosse 1 (NS1) |
942 ha | 1,2M : 1F 1,5A : 1J (juvéniles dans la nature seulement) 1A : 2,2J (en incluant les juvéniles issus du programme d’élevage) |
131 (129-134) Méthode Jolly-Seber (au moyen de données de 1987-2013, à l’exclusion de 1990-1991) |
0,14 | 46 saisons (principalement 1971-1972; 1977-1979; 1987-1988; 1992-2016) |
5 212 nuits de piégeage (> 3 300 h sur le terrain) ~ 2 100 heures-personne d’inventaire visuel > 10 000 h de relevé des nids ~ 4 000 h de radiotélémesure |
Captures à la main/ épuisette durant des relevés par radiotélémesure et des inventaires visuels dans les milieux humides et les aires de nidification; verveux | Power, 1989; Green et McNeil, 2014; Nova Scotia Blanding’s Turtle Database, 2014 |
| Nouvelle-Écosse 2 (NS2) |
260 ha | 1M : 1,1F 1,7A : 1J |
79 (60-116) Méthode de Schnabel (au moyen de données de 1997-2002) |
0,30 | 21 saisons (1995-2016) |
> 2 400 nuits de piégeage (>500 h sur le terrain) > 300 heures-personne d’inventaire visuel, 1 000 h de radiotélémesure, > 3 500 h de relevé des nids |
Captures à la main/ épuisette durant des relevés par radiotélémesure et des inventaires visuels dans les milieux humides et les aires de nidification; verveux | McNeil, 2002; Nova Scotia Blanding’s Turtle Database, 2014 |
| Nouvelle-Écosse 3 (NS3) |
877 ha | 1M : 1F 1,5A : 1J |
118 (106-139) | 0,13 | 19 saisons (1997-2015) |
6 892 nuits de piégeage (2 172 h sur le terrain) 1 254 h de radiotélémesure; 296 h d’inventaire visuel > 3 000 h de relevé des nids |
Captures à la main/ épuisette durant des relevés par radiotélémesure et des inventaires visuels dans les milieux humides et les aires de nidification; verveux | Nova Scotia Blanding’s Turtle Database, 2014 |
| Nouvelle-Écosse 4 (NS4) |
58 ha | 1M : 2F 2,2A : 1J |
8 trouvés | 0,16 | 4 saisons (2012-2015) |
200 nuits de piégeage (105 h sur le terrain) 325 h de radiotélémesure > 116 h d’inventaire visuel 67 h de relevé des nids |
Captures à la main/ épuisette durant des relevés par radiotélémesure et des inventaires visuels dans les milieux humides et les aires de nidification; verveux | Nova Scotia Blanding’s Turtle Database, 2014 |
| Nouvelle-Écosse 5 (NS5) |
37 ha | 2M : 1F 3A : 0J |
3 trouvés | 0,08 | 2 saisons (2004-2005) |
246 nuits de piégeage (77 h sur le terrain) 1,7 h d’inventaire visuel |
Verveux | Nova Scotia Blanding’s Turtle Database, 2014 |
| Nouvelle-Écosse 6 (NS6) |
66 ha | 2M : 1F 3A : 1J |
3 trouvés | 0,05 | 3 saisons (2007-2009) |
590 nuits de piégeage (318 h sur le terrain) 79,5 h d’inventaire visuel 122 h de radiotélémesure 4 h de relevé des nids |
Captures à la main/ épuisette durant des relevés par radiotélémesure et des inventaires visuels dans les milieux humides et les aires de nidification; verveux | Nova Scotia Blanding’s Turtle Database, 2014 |
| Nouvelle-Écosse 7 (NS7) |
306 ha*
|
0,6M : 1F (Aucun juvénile trouvé à ce jour) |
31 trouvés | 0,10 | 1 saison (2016) |
> 600 h de surveillance et d’inventaire visuel | Captures à la main/ épuisette durant des relevés par radiotélémesure et des inventaires visuels dans les milieux humides et les aires de nidification | Nova Scotia Blanding’s Turtle Database, 2014 |
Il est difficile de déterminer combien d’activités de recherche ciblées ont été menées en Ontario sur des sites anciennement occupés par la tortue mouchetée ou de nouveaux sites étant donné que ces travaux ne sont pas coordonnés. Au début des années 2000, des recherches limitées (environ 140 heures-personne à 10 sites) ont été effectuées dans certains milieux humides parmi les plus propices encore existants dans les comtés d’Oxford, de Middlesex et de Perth, dans le sud-ouest de l’Ontario (Gillingwater et Piraino, 2002; Gillingwater, données inédites). Seuls deux spécimens ont été trouvés en deux endroits différents du comté de Middlesex, des sites fragmentés entourés de terres agricoles. Des relevés des reptiles et des amphibiens effectués dans la région de Niagara entre 2006 et 2008 ont confirmé la présence de la tortue mouchetée à seulement 4 de 11 sites historiques (Yagi et al., 2009). Durant d’intenses relevés menés à la grandeur de la péninsule Bruce de 2007 à 2014, aucune tortue mouchetée n’a été trouvée, et ce, malgré la présence d’habitat convenable dans la région. Il est probable que les mentions isolées provenant de cette région ont trait à des individus libérés dans le secteur (Environment Canada, 2014). On ne sait pas si la recherche ciblée d’autres sites a été effectuée dans le nord de l’Ontario depuis les premières mentions isolées dans la région, en 2007. Il semble que la plupart des recherches visant cette espèce, en Ontario, consistent en des travaux d’échantillonnage à des sites connus (principalement au sein d’aires protégées) effectués dans le cadre d’études sur la tortue. Pour en savoir plus sur les conclusions de ces études, voir la rubrique « Taille et tendances de la population - Abondance » et le tableau 1.
Au Québec, des recherches de nouvelles sous-populations ont été effectuées dans les régions de l’Abitibi-Témiscamingue et de la Montérégie, où des mentions isolées ont été faites (Bernier, 2014). Un suivi a été fait en Montérégie : on a consacré un total de 338 heures-personne et 852 jours-verveux entre 2011 et 2013. Un seul individu a été observé (Rouleau et Giguère, 2012; Rouleau et Bourgeois, 2014). Des activités de recherche ont été menées par deux bandes des Anishinabe en collaboration avec le gouvernement provincial en Abitibi-Témiscamingue, en se fondant sur des observations historiques et récentes non redondantes. Les activités de recherche ont été effectuées au moyen de 14 514 heures-verveux appâté et de 252 heures-pièges flottants en 2013 et 2014 (Lapointe et Fournier, 2014; Déry, 2014, 2015); aucune tortue mouchetée n’a été capturée. De plus, des bandes de Premières Nations ont effectué de vastes relevés de tortues exposées au soleil de même que 6 744 heures de relevés ciblés fondés sur les connaissances traditionnelles autochtones au moyen de verveux appâtés dans diverses localités de la région. Bien que des tortues d’autres espèces (chélydre serpentine et tortue peinte) aient été capturées, aucune tortue mouchetée n’a été prise ni observée (Déry, 2014, 2015). La plupart des recherches sur cette espèce effectuées au Québec ont consisté en des études d’échantillonnage de la principale sous-population dans l’Outaouais, dans le cadre de travaux de recherche. La zone d’occupation connue de la sous-population de l’Outaouais s’élargit à chaque nouvelle étude (Fortin, comm. pers., 2016). Voir la rubrique « Taille et tendances des populations - Abondance » et le tableau 1 pour connaître les conclusions de ces études.
Les activités de recherche, en Nouvelle-Écosse, sont coordonnées par l’équipe de rétablissement de la tortue mouchetée de la Nouvelle-Écosse. De 1996 à 2016, on a consacré 7 870 nuits-piège et plus de 850 heures d’inventaire visuel à la recherche de nouvelles sous-populations. Des activités de piégeage ont été menées dans 95 plans d’eau (lacs, ruisseaux ou tronçons de rivières), dans 13 bassins hydrographiques (Nova Scotia Blanding’s Turtle Database, 2014). Tout au long de ces travaux, et en ajoutant les rapports d’observations du public, on a capturé environ 150 tortues mouchetées et découvert 3 nouvelles sous-populations (voir la rubrique « Taille et tendances de la population - Activités et méthodes d’échantillonnage ») ainsi que 3 petites concentrations à l’extérieur de la zone de recherche principale. Malgré de 200 à plus de 700 nuits-piège sur plus de 2 à 4 ans, seulement 3 à 8 adultes ont été trouvés dans les secteurs entourant les 3 concentrations (NS4-NS6; Nova Scotia Blanding’s Turtle Database, 2014; voir la rubrique « Taille et tendances des populations - Activités et méthodes d’échantillonnage »). Les trois adultes de la concentration NS6 semblent tous être des individus assez âgés, et on ne sait pas s’il y a recrutement dans le secteur. La présence d’un juvénile (d’environ 13 ans) dans la concentration NS5 laisse présumer qu’il y a un certain recrutement à cet endroit. La plus récente sous-population découverte (NS7) l’a été en 2016. À ce jour, plus de 600 heures d’inventaire visuel y ont été effectuées, ce qui a permis de trouver 31 adultes (Nova Scotia Blanding’s Turtle Database, 2014). Malgré les efforts déployés, seule une très petite partie des habitats potentiels de la Nouvelle-Écosse ont fait l’objet de relevés.
Habitat
Besoins en matière d’habitat
La tortue mouchetée, espèce avant tout aquatique, fréquente divers types de milieux : marécages, marais, tourbières, prés marécageux, lacs, étangs, complexes de milieux humides maintenus par les castors, ruisseaux au débit lent, terrains marécageux, chenaux artificiels et secteurs côtiers de baies de lacs (Power et al.,1994; Herman et al.,1995; Gillingwater et Brooks, 2001; Gillingwater et Piraino, 2004, 2007; Ernst et Lovich, 2009; Edge et al., 2010; Dubois et al., 2012). Les individus de la population des Grands Lacs et du Saint-Laurent préfèrent pour la plupart des milieux humides eutrophes aux eaux peu profondes (en général moins de 100 cm; fourchette de 0 à 200 cm), dotés d’un substrat riche en matières organiques, d’une végétation aquatique dense et d’un débit lent à nul (Herman et al.,1995; Gillingwater et Piraino, 2004, 2007; Ernst et Lovich, 2009; Edge et al., 2010; Duclos et Fink, 2013; St-Hilaire et al., 2013). L’habitat de marécage, d’étang, de marais, de lac et de tourbière est grandement favorisé par rapport à l’habitat lotique ou éphémère (Edge et al., 2010). En Nouvelle-Écosse, la tortue mouchetée est souvent associée à des cours d’eau acide au sol tourbeux et aux eaux riches en tannins, la productivité secondaire de ces milieux étant, dans la région, généralement plus élevée que celle des plans d’eau claire (Power et al.,1994; Bourque, 2006).
La présence de forêts de terrain élevé est un bon indice de la présence de la tortue mouchetée dans un paysage donné (Quesnelle et al., 2013). L’habitat de terrain élevé est beaucoup utilisé comme couloir de déplacement (Edge et al., 2010) ainsi que pour la dispersion des nouveau-nés vers les sites d’hivernage (Paterson et al., 2012). Les forêts humides, les mares printanières, les étangs à castors et les milieux humides aux eaux peu profondes sont également souvent fréquentés par la tortue mouchetée lorsqu’elle se déplace entre les milieux humides de résidence et durant les déplacements de nidification (Edge et al., 2010; Markle et Chow-Fraser, 2014). Les mares printanières et les milieux humides éphémères sont d’importants sites d’alimentation au printemps puisqu’il s’agit de sources riches en amphibiens et en œufs et larves d’insectes (Beaudry et al., 2009). Le caractère convenable de l’habitat de cette espèce présente une corrélation positive avec la température de l’air et la superficie des milieux humides, et une corrélation négative avec la superficie des terres cultivées (Millar et Blouin-Demers, 2012).
Les tortues mouchetées adultes se déplacent sur de longues distances à l’intérieur des milieux humides et entre ceux-ci (Rubin et al., 2001; Edge et al., 2010; Seburn, 2010; Christensen, 2013; Markle et Chow-Fraser, 2014). Elles peuvent parcourir plus de 2 000 m entre des milieux humides (Edge et al., 2010) et se servent de nombreux plans d’eau différents tout au long de la saison active (moyenne de 5; intervalle de 1 à 20) (Beaudry et al., 2009; Edge et al., 2010). Malgré ces déplacements saisonniers, la tortue mouchetée manifeste une grande fidélité aux sites qu’elle occupe (McNeil, 2002; Herman et al., 2003; Markle et Chow-Fraser, 2014). Elle passe la plus grande partie de la saison au sein d’un seul milieu humide de résidence (Congdon et al., 2011; Christensen et Chow-Fraser, 2014; Markle et Chow-Fraser, 2014). Les individus ne fréquentent que quelques milieux humides de résidence au cours de leur vie et peuvent passer des décennies dans une même localité (Congdon et al., 2011). Les juvéniles vivent dans les mêmes plans d’eau que les adultes (McMaster et Herman, 2000; Paterson et al.,2012; Gillingwater, données inédites), où on les trouve le plus souvent dans des secteurs où la végétation aquatique est dense (McMaster et Herman, 2000; McNeil, 2002; Caverhill, 2003; Gillingwater, données inédites). Après l’émergence du nid, les nouveau-nés fréquentent divers habitats sur la terre ferme et en milieu humide (Standing et al.,1997; McNeil et al.,2000; Camaclang, 2007); on les voit le plus souvent sur ou dans la litière de feuille des forêts, l’herbe, la sphaigne ou l’eau, ou encore enfouis sous terre (Camaclang, 2007). Ils peuvent faire un vaste usage de l’habitat de terrain élevé lorsqu’ils quittent le nid pour gagner des sites d’hivernage (Paterson et al.,2012).
Domaine vital
Au Canada, la superficie moyenne du domaine vital de la tortue mouchetée (d’après la méthode du plus petit polygone convexe ou la méthode équivalente du plus petit polygone) se situe généralement entre 10 et 60 ha (fourchette de 0,2 à 382 ha); la longueur moyenne du domaine vital se situe généralement entre 1 000 et 2 500 m (intervalle de 37 à 7 000 m; McNeil, 2002; Caverhill, 2003; Edge et al., 2010; Kydd, 2010; Caverhill et al., 2011; Millar et Blouin-Demers, 2011; Dubois et al., 2012; Fortin et al., 2012; Lefebvre et al., 2012; St-Hilaire et al.,2013; Christensen, 2013; Baxter-Gilbert, 2014; Christensen et Chow-Fraser, 2014; Dillon Consulting, 2014; Woods, 2014; Markle et Chow-Fraser, 2014b, données inédites; Cameron, données inédites; Edge, données inédites; OMNRF Timmins District, données inédites; Riley et al., données inédites; Rouse, données inédites; Scales Nature Park, données inédites).
Plusieurs études concluent que les données sur les déplacements qui excluent les longues migrations de nidification ou qui sont obtenues autrement que par la radiotélémesure quotidienne et/ou encore sur une seule saison active ou une partie de cette saison sous-estiment de beaucoup la taille du domaine vital et les besoins en matière d’habitat de cette espèce très mobile (Power, 1989; McNeil et al., 2000; Herman et al., 2003; Caverhill et al., 2011; Congdon et al., 2011; Christensen, 2013; Christensen et Chow-Fraser, 2014; Markle et Chow-Fraser, 2014b; Millar et Blouin-Demers, 2011; Woods, 2014). Le recours à des enregistreurs utilisant un système GPS, en particulier sur plus d’une saison, semble être la méthode la plus précise pour estimer la taille du domaine vital de la tortue mouchetée (Christensen et Chow-Fraser, 2014; Markle et Chow-Fraser, 2014 b).
Habitat d’hibernation
La tortue mouchetée adulte ou juvénile hiverne dans des plans d’eau permanents ou temporaires, notamment des marécages, des tourbières, des marécages arborés ou arbustifs, des marais, des prés de graminoïdes marécageux peu profonds, des ruisseaux, les rives de lacs et d’étangs, et des bancs d’emprunt ou des fossés inondés (Power, 1989; McNeil, 2002; Caverhill, 2003; Hartwig, 2004; Penny, 2004; Edge et al., 2009, 2010; Newton et Herman, 2009; Seburn, 2010; Caverhill et al., 2011; Dubois et al., 2012; Paterson et al., 2012; Carstairs, 2014; Dillon Consulting, 2014; Woods, 2014; Nova Scotia Blanding’s Turtle Database, 2014; Markle et Chow-Fraser, 2014b; Gillingwater, données inédites; Rouse, données inédites). La profondeur de l’eau aux sites d’hibernation connus varie entre 0 et 100 cm (Edge et al., 2009; Newton et Herman, 2009; Thiel et Wilder, 2010; St-Hilaire et al., 2013). Les sites d’hibernation se trouvent souvent au sein des secteurs utilisés pour les activités estivales (Joyal et al.,2001; Seburn, 2010; Dubois et al., 2012; Christensen, 2013; Dillon Consulting, 2014; Markle et Chow-Fraser, 2014). Les nouveau-nés choisissent des sites d’hibernation aquatiques comme terrestres, et peuvent passer l’hiver dans la cavité du nid (Paterson et al., 2012; Nova Scotia Blanding’s Turtle Database, 2014). La tortue mouchetée peut hiberner seule (Seburn, 2010; Gillingwater, données inédites; Markle, données inédites) ou en groupe (McNeil, 2002; Caverhill, 2003; Herman et al., 2003; St-Hilaire, 2003; Edge et al., 2009; Newton et Herman, 2009; Paterson et al., 2012; St-Hilaire et al., 2013; Gillingwater, données inédites; Markle, données inédites). Jusqu’à 16 individus ont été observés dans un même hibernacle (Herman et al., 2003). L’espèce manifeste souvent de la fidélité aux lieux d’hibernation (Herman et al., 2003; Edge et al., 2009; Newton et Herman, 2009; Dubois et al., 2012).
Habitat de nidification
L’habitat convenable pour la nidification doit être exposé au soleil et comporter une faible couverture végétale ainsi qu’un sol meuble. On sait que la tortue mouchetée nidifie dans divers habitats : plages et dunes de sable, crevasses emplies de terre sur des affleurements rocheux, huttes de rat musqué, monticules utilisés par des bernaches, bermes de milieux humides, jardins, cours, terres agricoles, pâturages, bordures de voies ferrées, gravières ainsi que routes de sable ou de gravier, accotements de routes et sentiers (Gillingwater et Brooks, 2001; Gillingwater et Piraino, 2004; Caverhill, 2006, 2007; Congdon et al., 2008; Ernst et Lovich, 2009; Beaudry et al., 2010; Caverhill et al., 2011; Markle et Chow-Fraser, 2014; Woods, 2014; Gillingwater, données inédites; données du Centre d’information sur le patrimoine naturel [CIPN]). En Nouvelle-Écosse, les femelles nidifient aussi souvent sur les plages de galets des lacs (Standing et al.,1999). Près de 50 % des sites de nidification de la population de la Nouvelle-Écosse (Caverhill, 2006; Nova Scotia Blanding’s Turtle Database, 2014) et environ 90 % des sites de nidification de la sous-population du Québec (Dubois et al., 2012) sont situés dans des paysages modifiés par l’humain.
Les femelles montrent souvent de la fidélité à leurs sites de nidification, mais elles peuvent aussi creuser leur nid à une distance allant jusqu’à 2 km du site de nidification précédent (McNeil, 2002; Congdon et al.,2008; Dubois et al., 2012). Elles peuvent se déplacer sur une distance pouvant atteindre 7 500 m avant de faire leur nid (en moyenne, de 1 000 à 2 000 m; Standing et al., 1999; St-Hilaire, 2003; Congdon et al., 2008; Edge et al., 2010; Millar et Blouin-Demers, 2011; Caverhill et al., 2011; Dubois et al., 2012; Christensen et Chow-Fraser, 2014; Markle et Chow-Fraser, 2014a, 2014b; Nova Scotia Blanding’s Turtle Database, 2014). La distance moyenne observée entre les sites de nidification et l’habitat de milieu humide le plus près est de 100 à 242 m (intervalle de 10 à plus de 1 000 m); toutefois, les femelles peuvent nidifier à une distance allant jusqu’à 2 580 m de leur milieu humide de résidence (Beaudry et al., 2010; Congdon et al., 2008, 2011; Dubois et al., 2012; Paterson et al., 2012; Équipe de rétablissement des tortues du Québec, données inédites). Les femelles peuvent faire de grands déplacements terrestres (de 2,5 à plus de 10 km) durant la période de nidification (Power, 1989; Nova Scotia Blanding’s Turtle Database, 2014). Là où l’habitat de nidification est limité, plusieurs femelles peuvent se réunir aux rares sites convenables (Davy, données inédites; Gillingwater, données inédites).
Tendances en matière d’habitat
La présente section porte uniquement sur les modifications historiques du paysage et sur les répercussions connexes sur l’habitat. Pour en savoir plus sur les tendances en matière d’habitat actuelles et futures, consultez la rubrique « Menaces et facteurs limitatifs ».
Avant l’établissement des Européens (vers 1800), on trouvait quelque 2 millions d’hectares de milieux humides dans le sud de l’Ontario (25 % de la superficie totale) mais, en 2002, environ 1,4 million d’hectares, soit 72 % des zones humides de 10 hectares ou plus présentes avant la colonisation, avaient disparu (Ducks Unlimited, 2010). Cela a entraîné un déclin estimé à 60 % de la population des Grands Lacs et du Saint-Laurent de la tortue mouchetée (voir l’annexe 1). Il s’agit d’une estimation très prudente des pertes de milieux humides dans le sud de l’Ontario étant donné que les zones humides de moins de 10 hectares n’ont pas été prises en compte dans l’analyse (Ducks Unlimited, 2010). Dans la plupart des comtés, de 45 à 85 % des milieux humides sont disparus mais, ailleurs, les pertes atteignent de 89 à 98 % (c.-à-d. Essex, Kent, Lambton, Middlesex, Perth et Russell; Ducks Unlimited, 2010); ces comtés sont d’ailleurs ceux où les mentions de tortues mouchetées sont rares ou inexistantes. L’exploitation forestière, l’agriculture, les terrains urbains et l’aménagement de routes et de corridors de transport d’électricité sont responsables de 94 % de ces pertes de milieux humides (Ducks Unlimited, 2010). Depuis 1951, de 16 à 68 % des milieux humides côtiers de la région sud de la baie Georgienne sont disparus dans certains secteurs (Severn Sound Remedial Action Plan, 1993b) en raison des modifications du littoral, de l’aménagement de routes et du développement de résidences et de marinas (Severn Sound Remedial Action Plan, 1993a). Des années 1980 jusqu’au début des années 2000, on a constaté des pertes d’habitat dans 17 milieux humides côtiers du lac Huron, et plus de 50 % des milieux humides côtiers situés le long de la baie Georgienne et dans la péninsule Bruce ont été touchés par l’agriculture et la construction de chalets (Environment Canada et Ontario Ministry or Natural Resources and Forestry, 2003). Dans le sud de l’Ontario, les pertes moyennes de milieux humides entre 1982 et 2002 ont été estimées à 0,17 % par année, mais il s’agit d’une estimation très prudente puisque seules les zones humides d’au moins 10 hectares ont été prises en compte dans ce calcul (Ducks Unlimited, 2010). L’habitat de milieu humide côtier longeant le lac Érié a lui aussi subi des pertes graduelles durant les années 1990 en raison de l’aménagement de chalets et de marinas, et on s’attend à ce que la tendance se maintienne (Petrie, 1998).
La cartographie de l’habitat convenable de la tortue mouchetée en Ontario montre une division très marquée entre les sous-populations du nord et du sud, les deuxièmes étant aux prises avec un risque de disparition beaucoup plus grand que les premières du fait d’un taux particulièrement élevé de perte et de fragmentation de l’habitat dans leur partie de l’aire de répartition de l’espèce (Millar et Blouin-Demers, 2012).
On sait peu de choses sur la perte historique de milieux humides dans la région de l’Outaouais, au Québec. Toutefois, on estime qu’entre 65 et 100 % des milieux humides situés du côté ontarien de la rivière des Outaouais, dans ce secteur, ont disparu (Ducks Unlimited, 2010). De plus, un examen de l’imagerie aérienne fournie par Google Earth révèle qu’environ 50 % de la superficie occupée par l’aire de répartition actuelle connue de la tortue mouchetée dans cette région a été convertie en terres agricoles.
De la même façon, on connaît peu de choses sur la superficie d’anciens milieux humides ayant disparu dans la région sud-ouest de la Nouvelle-Écosse. Malgré tout, un examen de l’imagerie aérienne fournie par Google Earth révèle que d’importantes activités d’exploitation forestière ont été menées à l’extérieur des aires protégées un peu partout dans la province, ce qui a probablement entraîné la perte d’habitat de la tortue mouchetée. Les deux principaux changements apportés à l’habitat en Nouvelle-Écosse depuis la colonisation par les Européens sont la fragmentation accrue des forêts et la modification des régimes d’écoulement des eaux (principalement pour la production d’électricité; Herman et al., 2003).
Biologie
Depuis le dernier rapport de situation, de nouvelles recherches ont été faites sur la tortue mouchetée en Ontario et au Québec, et les études sur la population de la Nouvelle-Écosse se sont poursuivies. Ces travaux ont grandement amélioré notre connaissance de la biologie de cette espèce : comportement de reproduction, déplacements annuels, succès de reproduction, démographie des populations, comportements et conditions d’hibernation, et survie des adultes, des juvéniles et des nouveau-nés.
Cycle vital et reproduction
Cycle vital annuel
La tortue mouchetée émerge des sites d’hibernation au début du printemps, peu après le début de la fonte (McMaster et Herman, 2000; McNeil, 2002; Gillingwater, données inédites). Au Canada, l’accouplement a souvent lieu lorsque les tortues sont regroupées dans les hibernacles (McNeil, 2002; Dubois et al., 2012), mais il a été observé en toutes saisons (Power, 1989; Gillingwater et Brooks, 2001; McNeil, 2002; Newton et Herman, 2009; Dubois et al., 2012). Au début du printemps (avant la période de nidification), les mâles quittent parfois leur milieu humide de résidence pour gagner des habitats éphémères (Christensen, 2013; Markle et Chow-Fraser, 2014). Avant la nidification, les femelles gestantes peuvent passer plusieurs jours en milieu terrestre (Congdon et al., 2000), ou encore de quelques jours à quelques semaines dans des haltes aquatiques situées à proximité de l’habitat de nidification (Congdon et al., 2008; Christensen et Chow-Fraser, 2014; Markle et Chow-Fraser, 2014). Il faut parfois près d’un mois à la tortue pour effectuer la migration de nidification aller-retour (Markle et Chow-Fraser, 2014 b). La période de nidification peut commencer dès la fin de mai et se poursuivre jusqu’au début de juillet, mais le point fort de la période va du début à la mi-juin (Standing et al., 1999; Gillingwater et Brooks, 2001; Millar et Blouin-Demers, 2011; Christensen, 2013; Nova Scotia Blanding’s Turtle Database, 2014; Équipe de rétablissement des tortues du Québec, données inédites; Gillingwater, données inédites). Les nouveau-nés émergent entre le début d’août et la fin d’octobre (après 56 à 133 jours d’incubation; Standing et al.,1999; Herman et al., 2003; Gillingwater et Piraino, 2004; Caverhill et al., 2011; Riley et al., 2011, 2012; Nova Scotia Blanding’s Turtle Database, 2014; Gillingwater, données inédites). Certains individus passent de quelques jours à quelques semaines en dormance pendant l’été; ils demeurent inactifs, soit dans les milieux humides ou dans les milieux terrestres, enfouis sous la litière ou des quenouilles mortes (Dubois et al., 2012; Woods, 2014). Au Canada, les adultes gagnent habituellement les sites d’hibernation entre la fin d’août et le début de novembre (Hartwig, 2004; Edge et al., 2009; Newton et Herman, 2009; Seburn, 2010; Caverhill et al.,2011; Markle et Chow-Fraser, 2014). Dans le centre-sud de l’Ontario, les nouveau-nés gagnent les hibernacles entre la mi-septembre et la mi-octobre (Paterson et al., 2011, 2012).
Écologie de la reproduction
La tortue mouchetée est polygame, et les individus peuvent s’accoupler plus d’une fois avec un ou plusieurs partenaires d’une année à l’autre ou la même année (Dubois et al., 2012; McGuire et al., 2013, 2015; Anthonysamy et al., 2014). Les femelles ont la capacité de conserver le sperme, et une même couvée peut être issue de plus d’un mâle (Patterson, 2007; McGuire et al., 2013, 2015; Anthonysamy et al., 2014). Les tentatives d’accouplement échouent souvent, et le succès de reproduction parmi les mâles d’une sous-population donnée pourrait être grandement surestimé (Anthonysamy et al., 2014). Une étude menée sur 8 ans a conclu à un nombre moyen de descendants par mâle de 11 (écart-type = 9, fourchette = 1-40, N = 32; McGuire et al.,2015). La taille des couvées, la grosseur des œufs, les paternités multiples et la fréquence de reproduction des femelles sont toutes positivement corrélées à l’âge des individus (Congdon et al., 1983, 2001, 2008; McGuire et al., 2015). Les femelles les plus âgées sont plus susceptibles de s’accoupler avec des mâles non résidants, ce qui les rend particulièrement importantes pour la préservation de la connectivité génétique entre les milieux humides (McGuire et al., 2013). La capacité de la tortue mouchetée de se déplacer sur de longues distances favorise le flux génique entre les milieux humides et pourrait augmenter de beaucoup le succès de reproduction. Les petites sous-populations arrivent à préserver la diversité génétique grâce aux individus qui se déplacent sur de longues distances, ce qui améliore les possibilités d’accouplement avec des individus non résidants, et à la migration de nidification, qui permet aux nouveau-nés de se disperser vers des milieux humides autres que ceux de résidence de leurs parents (McGuire et al., 2013). La pérennité des populations passe donc par la connectivité de l’habitat, qui facilite ces grands déplacements entre les milieux humides (McGuire et al., 2013, 2015).
La tortue mouchetée a une stratégie de reproduction très itéropare puisqu’elle passe par de nombreux cycles de reproduction au cours de sa vie. Lorsqu’elle atteint la maturité, la femelle produit une couvée tous les un à trois ans (Congdon et al., 1983). À l’échelle de l’aire de répartition, la taille moyenne des couvées est de 6 à 13 œufs (fourchette de 1 à 25 œufs; Standing et al., 1999; Gillingwater et Brooks, 2001; McNeil, 2002; Caverhill, 2006; Congdon et al.,2008; Caverhill et al., 2011; Riley et al., 2012; Nova Scotia Blanding’s Turtle Database, 2014). En Nouvelle-Écosse, la taille des couvées varie en fonction des sous-populations (Herman et al., 2004). La prédation des œufs de tortue mouchetée peut être extrêmement élevée (voir la rubrique « Menaces et facteurs limitatifs - Prédateurs favorisés par les activités humaines »). Des études de suivi des nids menées en Ontario et en Nouvelle-Écosse ont permis d’observer qu’en moyenne, de 59 % à 68 % des œufs protégés par des cages pour prévenir la prédation par les mammifères arrivent à éclosion (Gillingwater et Brooks, 2001; Nova Scotia Blanding’s Turtle Database, 2014). Bien que la larve de la mouche sarcophage soit souvent un prédateur des nouveau-nés vivants avant même que ceux-ci arrivent à émerger du nid, cette larve se nourrit principalement des œufs en décomposition (Gillingwater et Brooks, 2001) et n’a pas d’incidence importante sur la survie des nouveau-nés (Bolton et al., 2008).
Hybridation
Une hybridation intergénérique a été observée dans de rares cas, dans la nature comme en captivité, entre la tortue mouchetée et la tortue des bois (Glyptemys insculpta) là où leurs aires de répartition se chevauchent en Ontario et aux États-Unis (Harding et Davis, 1999; Knudson, comm. pers., 2004). La progéniture de ces deux espèces est viable (Harding et Davis, 1999).
Longévité et développement
La tortue mouchetée peut vivre plus de 83 ans (University of Michigan News, 25 mai 2016); il s’agit d’une des espèces de tortues d’eau douce à la maturité la plus tardive. Son taux de croissance annuelle est particulièrement élevé durant la première année, puis il diminue graduellement jusqu’à ce que l’individu atteigne la maturité sexuelle, après quoi il décline brusquement (Congdon et al., 2008). On estime que la maturité sexuelle est atteinte entre 14 et 26 ans, l’âge augmentant avec la latitude (Congdon et van Loben Sels, 1991, 1993; Congdon et al., 2001; McNeil, 2002; Herman et al. 2003; Nova Scotia Blanding’s Turtle Database, 2014; McGuire et al.,2015). La longueur de dossière minimum observée chez des femelles reproductrices est de 15,8 dans le sud-ouest de l’Ontario (MacCulloch et Weller, 1987; Gillingwater, données inédites) et de 18 cm en Nouvelle-Écosse (Nova Scotia Blanding’s Turtle Database, 2014).
La durée moyenne d’une génération de tortue mouchetée est estimée à 40 ans (intervalle de 37 à 42 ans), d’après un âge de maturité établi entre 20 et 25 ans (Congdon et al., 2001; Herman et al., 2003), un taux de survie annuel moyen des adultes de 0,94 (calculé d’après les estimations de la moyenne faites par Congdon et al., 2008, 0,94; Dillon Consulting, 2014, 0,89; Green et McNeil, 2014, 0,98) et l’équation suivante : [durée d’une génération = âge de la première reproduction + 1/mortalité adulte] (IUCN, 2014).
Structure de la population et caractéristiques démographiques
Certaines études effectuées au Canada ont conclu que la population de tortues mouchetées comportait davantage de femelles que de mâles, alors que selon d’autres, le rapport entre les sexes est de 1:1 (tableau 1). Le rapport entre adultes et juvéniles, au sein des sous-populations canadiennes, varie d’environ 1,5 à 30 adultes par juvénile; les études dans lesquelles l’échantillonnage s’est fait au moyen de pièges et celles où il s’est fait par capture manuelle ont conclu à des proportions plus élevées d’adultes par juvénile que les autres types d’études (tableau 1).
Alimentation
La tortue mouchetée est omnivore. Elle se nourrit d’invertébrés aquatiques et terrestres, de végétation aquatique, d’écrevisses, de bivalves, de poissons, d’œufs de poisson, de charogne, de grenouilles, de crapauds et de têtards (Ernst et Lovich, 2009; Gillingwater, données inédites; Herman, données inédites). Elle cherche habituellement sa nourriture sous l’eau (Harding, 1997).
Mortalité
Les sources de mortalité naturelle connues de la tortue mouchetée adulte incluent la prédation par des mammifères, les maladies et les conditions environnementales difficiles qui peuvent causer la mort d’individus durant l’hivernage (Gillingwater et Brooks, 2001; Parks Canada, 2012; Nova Scotia Blanding’s Turtle Database, 2014; Woods, 2014; Davy, données inédites; Gillingwater, données inédites). Une étude menée dans le sud-ouest de l’Ontario a révélé la mort par cause naturelle de 2 à 12 individus chaque printemps (soit 0,25 à 1,5 % de la taille estimée de la sous-population; Gillingwater, données inédites). Il pourrait cependant s’agir d’une sous-estimation considérable de la mortalité annuelle des adultes puisque ces relevés ont été effectués en avril et en mai, et que les chercheurs n’avaient alors pas accès à plusieurs secteurs des zones humides. On soupçonne que d’autres sous-populations de l’aire de répartition subissent un taux de mortalité semblable par causes naturelles. Pour en savoir plus sur les sources de mortalité anthropiques, voir la rubrique « Menaces et facteurs limitatifs ».
Des épisodes de mortalité de masse ont été signalés pour cette espèce en Ontario. Au début des années 1990, des dizaines de tortues mouchetées ont échoué sur le rivage dans une aire protégée du sud-ouest de l’Ontario au début du printemps; on a présumé qu’elles étaient mortes durant l’hiver (McCracken, comm. pers., 2014). Plus récemment, 52 individus morts (9 juvéniles et 43 adultes) ont été trouvés entre mai et juin 2013 au sein d’une aire protégée du centre-sud de l’Ontario (Sheppard, 2014a). Cet épisode semble avoir éliminé près de la moitié de la population reproductrice (Litzgus, comm. pers., 2016), et on croit qu’il aurait pu être causé par une sécheresse inhabituelle ayant facilité l’accès des prédateurs aux milieux humides (Sheppard, 2014a). Étant donné la petite taille des sous-populations, de tels phénomènes stochastiques imprévus peuvent avoir un effet dévastateur.
Le taux de survie annuel estimé des adultes varie entre 0,89 et 0,98 (Congdon et al., 1993; Herman et al., 2004; Enneson, 2009; Dillon Consulting, 2014; Green et McNeil, 2014). Les estimations les plus récentes du taux de survie annuel des juvéniles dans une sous-population de la Nouvelle-Écosse ont été calculées ainsi : 0,90 pour les individus de bonne taille (longueur de dossière de 10 à 18,5 cm), 0,73 pour les individus plutôt petits (longueur de 5 à 9,99 cm) et 0,09 pour les nouveau-nés (Green et McNeil, 2014). Le taux de mortalité observé pour les juvéniles de 2 à 3 ans issus d’un programme d’élevage (N = 22) et capturés en nature (N = 5) était en moyenne de 30 % pour les individus ayant fait l’objet d’un suivi sur 3 ans (intervalle de 0 à 80 % annuellement; Carstairs, 2014). Aucune différence n’a été observée sur le plan de la mortalité entre les individus issus d’un programme de lâchers de juvéniles et les individus capturés en nature (Arsenault, 2011; Carstairs, 2014). Sur 48 nouveau-nés suivis par radiotélémesure dans le centre-sud de l’Ontario, au moins 42 % ont survécu jusqu’à l’hiver; quant aux autres, 16 % ont été tués par des prédateurs, 2 % ont été trouvés desséchés, 2 % ont été trouvés morts sur la route et 38 % ont subi un sort inconnu puisque le signal a été perdu (Paterson 32, 2012). Les nouveau-nés les plus susceptibles de survivre étaient ceux de petite taille qui ont émergé du nid tard (et donc bénéficié d’une période d’exposition aux prédateurs réduite) et qui ont passé moins de temps en terrain élevé dégagé (Paterson et al., 2014).
Physiologie et adaptabilité
Thermorégulation et tolérance thermique
La tortue mouchetée possède le maximum thermique critique le plus bas de tous les Émydidés d’Amérique du Nord : 39,5 °C (Hutchinson et al.,1966). La température moyenne favorisée est de 22,5 °C pour les mâles et de 24,8 °C pour les femelles (Nutting et Graham, 1993). L’état de santé des animaux ectothermes est étroitement lié à la thermorégulation, tous leurs processus physiologiques dépendant de la température (Millar et al., 2012) : l’exposition au soleil rehausse l’énergie et optimise le métabolisme, la digestion, la croissance et le développement des œufs (Avery et al., 1993; Sarkar et al., 1996; Koper et Brooks, 2000; Steyermark et Spotila, 2001; Carrière et al., 2008; Dubois et al., 2009; Millar et Blouin-Demers, 2011; Millar et al. 2012). L’exposition au soleil est particulièrement importante aux latitudes septentrionales, où la saison active est courte et où l’efficacité de la reproduction est limitée par les températures fraîches (Rollinson et Brooks, 2007). D’après une étude menée dans le sud-est de l’Ontario, la température ambiante s’y trouvait rarement dans la fourchette de température corporelle optimale pour l’espèce; les tortues devaient donc pratiquer une thermorégulation active au début et à la fin de la saison active (Millar et al., 2012). La tortue mouchetée peut par ailleurs estiver durant l’été lorsque les températures sont trop élevées (voir la rubrique « Biologie - Cycle vital annuel »). La fourchette de tolérance thermique pour l’incubation des œufs est de 22 à 32 °C; la nécessité d’une température élevée entraîne un taux élevé d’échec des nids dans la partie nord de l’aire de répartition de l’espèce (Ewert et Nelson, 1991).
Détermination du sexe dépendante de la température
Le sexe de la tortue mouchetée dépend de la température : les œufs incubés à 28 °C ou moins produisent des mâles, et ceux incubés à plus de 30 °C produisent des femelles (Ewert et Nelson, 1991).
Hibernation
Une étude des conditions d’hibernation de la tortue mouchetée dans le centre-sud de l’Ontario a conclu que les individus choisissent des sites thermostables où la température de l’eau est située près de 0 °C, et que la température du corps était de 1 à 3 °C plus basse que la température de l’eau à des stations aléatoires (Edge et al., 2009). Sur les 2 années de l’étude, une couche de glace a empêché l’accès à l’oxygène de l’air pendant plus de 101 et plus de 136 jours, et les individus ont choisi d’hiberner dans des milieux humides présentant des concentrations d’oxygène dissous très faibles (Edge et al., 2009), ce qui appuie l’hypothèse selon laquelle l’espèce tolère l’anoxie (Ultsch, 2006). En Nouvelle-Écosse, la température médiane de l’eau en hiver aux sites d’hivernage choisis a varié entre 0,8 et 8,6 °C. Si une couche de glace s’est formée à la plupart des sites chaque année, un site plus chaud est demeuré libre de glace (Newton et Herman, 2009; Nova Scotia Blanding’s Turtle Database, 2014). Les concentrations d’oxygène dissous observées aux hibernacles se situe entre 0,8 et 11,3 mg/L (Edge et al., 2009; Newton et Herman 2009; St-Hilaire et al., 2013).
Déplacements et dispersion
Les distances de séparation établies (c.-à-d. distance maximale au-delà de laquelle des individus ne se déplacent pas normalement, établie d’après les déplacements typiques ou d’après le domaine vital de l’espèce) pour les sous-populations de la tortue mouchetée sont les suivantes :
- 10 km dans les secteurs d’habitat continu non aménagé aquatique ou aquatique/terrestre;
- 5 km dans les secteurs d’habitat continu non aménagé de terrain élevé;
- 2 km dans les secteurs comportant une mosaïque d’habitat de terrain élevé et de zones aménagées (NatureServe, 2014).
D’après l’IUCN (2014), un taxon peut être considéré comme gravement fragmenté lorsque la plus grande partie de la zone d’occupation totale (plus de 50 %) est constituée de parcelles d’habitat qui sont :
- plus petites que ce qui est nécessaire pour soutenir une population viable et
- éloignées des autres parcelles d’habitat par de grandes distances.
Vu cette définition et les distances de dispersion estimées de l’espèce, ni la population des Grands Lacs et du Saint-Laurent ni la population de la Nouvelle-Écosse ne semblent répondre au critère de fragmentation grave. En effet, la majorité de la zone d’occupation des deux populations est constituée de vastes secteurs d’habitat contigu. La sous-population du sud-ouest de l’Ontario pourrait toutefois probablement répondre au critère de fragmentation grave si elle était considérée comme isolée du reste de la population des Grands Lacs et du Saint-Laurent, étant donné le peu d’habitat restant dans cette partie de la province.
Relations interspécifiques
Les tortues et leurs nids ont de nombreux prédateurs connus parmi les mammifères du Canada : vison (Neovison vison), ours noir (Ursus americanus), coyote (Canis latrans), raton laveur (Procyon lotor), renard roux (Vulpes vulpes), loutre de rivière (Lontra canadensis), mouffette rayée (Mephitis mephitis), opossum de Virginie (Didelphis virginiana) et grande musaraigne (Blarina brevicauda) (Brooks et al., 1991b; Standing et Herman, 2000; Browne et Hecnar, 2007; Ernst et Lovich, 2009; Davy, données inédites; Gillingwater, données inédites). D’autres petits mammifères pourraient s’attaquer aux nids de tortue mouchetée, notamment le tamia rayé, le campagnol et la taupe (Congdon et al., 2000). Le raton laveur et le renard sont les principaux prédateurs des nids (Congdon et al., 2008). Vu leur petite taille, les nouveau-nés et les petits juvéniles sont également menacés par la crécerelle d’Amérique (Falco sparverius), la corneille, le tamia rayé (Tamias striatus), la grande musaraigne, l’écureuil roux (Tamaisciurus hudsonicus), les poissons, les grenouilles, les serpents et les échassiers (Camaclang, 2007; Ernst et Lovich, 2009; Paterson et al., 2012, 2014; Green, comm. pers., 2014).
À l’échelle de son aire de répartition au Canada, la tortue mouchetée fréquente souvent des milieux humides qui subissent l’incidence du castor (Herman et al., 2003; Millar, 2009; Dubois et al., 2012; Bernier, 2013; Duclos et Fink, 2013; Markle et Chow-Fraser, 2014; OMNRF Timmins District, données inédites). Il existe également une association positive entre l’espèce et le rat musqué (Kiviat, 1978b; Gillingwater, 2013). Les huttes et les monticules du rat musqué servent d’habitat d’hibernation, de nidification et d’exposition au soleil à la tortue, alors que cette dernière utilise les chenaux aquatiques aménagés par le rongeur comme corridors de déplacement (Kiviat, 1978b; Gillingwater, 2013). Les huttes et les chenaux aménagés par le castor fournissent eux aussi des lieux où nidifier ou s’exposer au soleil ainsi que des corridors de déplacement. La disparition de ces mammifères des milieux humides risque donc d’avoir une incidence négative sur la tortue mouchetée puisqu’elle élimine d’importantes caractéristiques de l’habitat des tortues que créent ces animaux aquatiques (Kiviat, 1978b; Gillingwater, 2013). De plus, l’enlèvement des barrages de castors constitue une menace pour la tortue mouchetée (voir la rubrique « Menaces et facteurs limitatifs - Modifications des systèmes naturels »). Pour en savoir davantage sur le parasitisme du nid par les larves de mouches, voir la rubrique « Biologie - Écologie reproductive ». Pour connaître les espèces proies de l’espèce, voir la rubrique « Biologie - Alimentation ».
Taille et tendances des populations
Activités et méthodes d’échantillonnage
Bien que les sous-populations connues de la tortue mouchetée vivant au Québec et en Nouvelle-Écosse aient fait l’objet de travaux d’échantillonnage approfondis, un nombre relativement peu élevé d’études par marquage-recapture ont été effectuées auprès des sous-populations connues de l’Ontario.
Dans le sud-ouest de l’Ontario, des activités d’échantillonnage ont été menées sur 2 à 21 ans pour 5 sous-populations, et d’autres travaux sont en cours pour 2 autres sous-populations. Dans le sud-est de la province, des activités d’échantillonnage ont été menées sur deux à cinq ans pour trois sous-populations. Dans la région de l’Outaouais, au Québec, où l’on trouve la principale sous-population de la province, des activités d’échantillonnage ont été effectuées sur neuf ans depuis 1996, et les travaux se poursuivent. En Nouvelle-Écosse, des activités d’échantillonnage ont été menées sur 1 à 46 ans pour 7 sous-populations ou concentrations, et les travaux se poursuivent. Pour obtenir un résumé des activités et méthodes d’échantillonnage visant diverses populations de l’aire de répartition de l’espèce au Canada, voir le tableau 1.
Abondance
Il est difficile d’estimer l’effectif de la tortue mouchetée dans la population des Grands Lacs et du Saint-Laurent, car très peu de recherche a été effectuée sur les tendances en matière d’abondance ou de sous-populations en Ontario, où se trouve la majeure partie de la population. Bien que l’on estime que deux sous-populations du sud de l’Ontario se maintiennent à quelque 700 à 800 adultes chacune (d’après un effort d’échantillonnage de plus de 650 jours-personnes dans chaque site), d’importantes activités d’échantillonnage effectuées au sein de six autres sous-populations dans l’ensemble de la région des Grands Lacs et du Saint-Laurent ont permis d’estimer un effectif de sous-population assez faible, soit entre 41 et 138 adultes (d’après plus de 2 200 jours-pièges et/ou 1 000 à 5 300 heures-personnes dans chaque site) (tableau 1). Même les sous-populations qui se trouvent dans des aires protégées présentant de l’habitat convenable et une forte abondance d’autres espèces de tortues sympatriques semblent présenter un faible effectif de tortues mouchetées. Par exemple, des activités d’échantillonnage effectuées au cours de cinq saisons dans un site protégé du sud-est de l’Ontario (~ 68 jours-personnes et ~ 54 jours-pièges) ont permis d’estimer à 85 le nombre d’individus au sein d’une sous-population de tortues mouchetées (le taux de recapture était de 75 %). Cependant, les estimations pour la tortue musquée (Sternotherus odoratus), la tortue peinte du Centre (Chrysemys picta marginata) et la chélydre serpentine étaient beaucoup plus élevées (1 403, 1 343 et 684, respectivement) malgré un effort d’échantillonnage semblable (Middleton, 2014). Au nord de Sudbury, l’espèce semble très rare : on ne dispose que de cinq mentions pour l’ensemble du nord de l’Ontario, et un seul individu y a été observé dans une étude de radiopistage effectuée sur trois ans dans le district de Timmins (OMNRF Timmins District, données inédites). D’après les données recueillies dans le cadre des activités d’échantillonnage ciblant l’aire de répartition de la population des Grands Lacs et du Saint-Laurent, il semble que la plupart des sous-populations soient petites (< 150 adultes) et de faible densité, particulièrement dans les latitudes les plus septentrionales (voir l’annexe 1 et le tableau 1). Si on utilise le nombre de carrés de l’atlas des reptiles et amphibiens de l’Ontario (ARAO) comme mesure de rechange pour les sous-populations (ce qui semble raisonnable, vu que chaque carré d’atlas représente une superficie de 10 km2 x 10 km2 et que la distance de séparation la plus grande que l’on connaît entre des sous-populations de tortues mouchetées est de 10 km; voir « Déplacements et dispersion »), on parvient à une estimation grossière de l’effectif total en multipliant le nombre de carrés de l’ARAO dans chaque écorégion par l’effectif moyen des sous-populations dans chaque écorégion (centre-sud = 49, sud-ouest = 72 et sud-est = 99). Si les deux sous-populations du sud-ouest de l’Ontario dont l’effectif est inhabituellement élevé sont prises en compte dans l’effectif total de la population, mais exclues à titre d’observations aberrantes de l’effectif moyen des sous-populations dans l’écorégion du lac Érié et du lac Ontario, et selon que les carrés historiques de l’ARAO sont exclus ou inclus dans le calcul (396 à 643 carrés), on obtient une estimation très grossière de l’effectif de la population des Grands Lacs et du Saint-Laurent (ce qui comprend les quelque 200 adultes dont la présence est actuellement connue au Québec) d’environ 25 000 à 45 000 adultes.
On ignore le nombre d’individus matures en Nouvelle-Écosse, mais on pense qu’il serait inférieur à 500 d’après les sous-populations connues à l’heure actuelle, chacune n’excédant probablement pas 200 adultes. L’estimation actuelle pour la sous-population NS1 est de 131 (IC de 95 % : 129 à 134), d’après les données de marquage-recapture recueillies de 1987 à 2013, excluant 1990-1991 (Green et McNeil, 2014). On estime que la sous-population NS2 contient quant à elle 79 adultes (IC de 95 % : 60 à 116), d’après les données de marquage-recapture recueillies de 1997 à 2002 (McNeil, 2002). Aucune estimation n’a encore été calculée pour la sous-population NS3 dans son ensemble, mais une estimation de 88 individus (IC de 95 % : 79 à 102) a été établie pour la concentration BA-KB au sein de la sous-population (Lefebvre et al., 2012). Cette estimation comprend les individus de toutes les classes d’âge (Lefebvre, 2009). Dans l’analyse de Lefebvre, 58 % des individus trouvés étaient des adultes matures (40 de 69 tortues). En présumant que ce rapport demeure constant, on obtient une estimation ajustée de 51 adultes (46 à 60) dans la concentration. Cette dernière représente approximativement 43 % du total des tortues marquées dans l’ensemble de la sous-population. L’extrapolation de l’estimation établie pour la concentration dans l’ensemble de la sous-population NS3 produirait une estimation d’approximativement 118 (106 à 139) individus matures, quoique les différences dans l’habitat et l’effort d’échantillonnage ne soient pas pris en compte dans cette méthode. L’analyse initiale de deux études fondées sur un échantillon limité (n = 23 et 21 nids) et un faible nombre de locus de microsatellites (n = 5 et 3) a indiqué que la population de la Nouvelle-Écosse pourrait compter peu de mâles capables de se reproduire ainsi qu’une faible incidence des portées provenant de mâles multiples par rapport à ce que l’on a observé ailleurs (Beckett, 2006; Patterson, 2007). Si c’est le cas, cela voudrait dire que la taille effective de la population (Ne) pourrait être beaucoup plus faible que la taille réelle de la population (Parcs Canada, 2012). La sous-population NS7 a été découverte en avril 2016; 31 tortues adultes ont été trouvées au cours des deux premiers mois d’échantillonnage, ce qui laisse croire que cette sous-population serait assez grande. Voir le tableau 1 pour un sommaire des activités d’échantillonnage et des estimations du nombre d’adultes dans diverses sous-populations dans l’ensemble de l’aire de répartition canadienne de l’espèce.
Fluctuations et tendances
La baisse estimée du nombre total d’individus matures dans la population des Grands Lacs et du Saint-Laurent au cours des trois dernières générations est supérieure à 60 % en raison des pertes de milieux humides à grande échelle qui se sont produites après la colonisation par les Européens (voir l’annexe 1). Il est inféré que la plupart des tortues mouchetées, avant la colonisation, vivaient dans l’écorégion du lac Érié et du lac Ontario (d’après les densités élevées d’individus qui ont été constatées dans les sous-populations faisant l’objet d’un suivi dans la région; annexe 1). La majeure partie des milieux humides dans le sud de l’Ontario a été perdue; c’est pourquoi une proportion accrue de tortues mouchetées restantes a été trouvée dans les écorégions plus au nord, moins productives (annexe 1). Comme la perte de milieux humides a été la plus intense dans le sud de l’Ontario, où les densités de sous-populations ont été inférées comme étant plus élevées, la baisse sur le plan de l’abondance globale a probablement été plus forte que le taux de conversion des milieux humides (annexe 1). Étant donné que la sous-population du Québec se trouve dans un paysage principalement agricole, on pense qu’elle a aussi subi un déclin par le passé, à la suite de la colonisation par les Européens (voir Tendances en matière d’habitat).
Un fort déclin continu est inféré et prévu pour la population des Grands Lacs et du Saint-Laurent, d’après les tendances observées dans les populations de l’Ontario faisant l’objet d’un suivi (aucune tendance actuelle n’a encore été établie pour les sous-populations du Québec; Bernier, 2014). Par exemple, une baisse considérable du nombre de tortues mouchetées a été observée dans six aires protégées de l’Ontario (d’après les activités de relevé intensives et/ou les observations fortuites de naturalistes); des déclins de 50 à 95 % ont été signalés dans certains sites au cours des 10 à 30 dernières années (< 1 génération; tableau 2, plus particulièrement les sites suivants : sud-ouest de l’Ontario 2, 4, 6 et 7; centre-sud de l’Ontario 3; sud-est de l’Ontario 6). D’importants déclins sont aussi inférés et prévus dans certaines sous-populations de l’Ontario d’après les taux annuels de mortalité routière élevés qui y ont été observés (de 6 à 23 % de la taille estimée des sous-populations), ou pire, l’absence de cas de mortalité routière au cours des dernières années dans des sites où une telle mortalité était fréquente chez l’espèce jusqu’au début des années 2000 (tableau 2, plus particulièrement les sites suivants : sud-ouest de l’Ontario 2 et 3; sud-est de l’Ontario 1; centre-sud de l’Ontario 4, 5 et 6). Les modèles de mortalité routière fondés sur le taux de mortalité le plus faible Footnote1 (estimé d’après quatre sous-populations faisant l’objet d’un suivi le long des principales routes en Ontario) et sur la plus grande estimation de la population totale, soit 45 000 adultes, prévoient que la tortue mouchetée, population des Grands Lacs et du Saint-Laurent, subira un déclin de 40 % au cours des 80 prochaines années (2 générations) et de 50 % au cours des 117 prochaines années (< 3 générations; annexe 3). Par conséquent, d’après cette modélisation prudente (déclins de 40 à 50 % sur 2 à 3 générations, respectivement, uniquement à cause de la mortalité routière) et les tendances observées/inférées ainsi que les taux élevés de mortalité routière annuelle chez les adultes dans les sites faisant l’objet d’un suivi (déclins de 50 à 95 % sur moins de 1 génération et taux élevés de mortalité routière annuelle de 6 à 23 % de la taille estimée des sous-populations), le déclin prévu pour la population des Grands Lacs et du Saint-Laurent est de plus de 40 % sur les 2 prochaines générations et de plus de 50 % sur les 3 prochaines générations (tableau 2 et annexe 3).
Il est difficile d’examiner les tendances historiques de la population de la Nouvelle-Écosse sur les trois dernières générations, puisque l’espèce n’a été découverte dans la province que dans les années 1950. Toutefois, l’effectif des femelles adultes dans la sous-population NS1 pourrait avoir diminué de 10 à 20 % entre les années 1950 et 1980 en raison de la collecte de spécimens de musée (> 10) et de la mortalité routière (au moins 3). Bien que de 30 à 60 ans se soient écoulés depuis, cette période représente un peu plus d’une génération, une durée vraisemblablement insuffisante pour permettre le rétablissement de la population, particulièrement parce que le recrutement annuel d’adultes et la mortalité naturelle sont souvent quasi équilibrés dans les populations de tortues (voir par exemple Shoemaker et al., 2013). Le plus récent modèle d’analyse de viabilité de la population (AVP) prévoit que, sans intervention, la sous-population NS1 est exposée à un risque de disparition de 42 % sur les 400 prochaines années (10 générations) et à un déclin moyen de 68 % sur 100 ans. Aucun taux de disparition sur 100 ans n’a été calculé, car on considère qu’un tel taux serait inutile pour une population dont les individus sont capables de vivre aussi longtemps. Bien que ces résultats et les résultats antérieurs de la modélisation laissent croire à un avenir sombre pour la population, on ne sait pas si les tendances prévues reflètent des lacunes dans les connaissances sur la survie et dans les paramètres d’abondance, des erreurs dans les principales hypothèses du modèle ou les tendances réelles en matière de population (Green et McNeil, 2014). L’équipe de rétablissement de la tortue mouchetée de la Nouvelle-Écosse recommande d’interpréter les modèles avec prudence, surtout à cause du taux de survie élevé des adultes qui semble caractériser cette population (Herman, comm. pers., 2015). Les activités de rétablissement ciblant la sous-population NS1 comprennent un programme annuel de protection des nids qui a produit 1 800 nouveau-nés depuis 1992 (Standing et al., 2000; Parcs Canada, 2012) et un programme de lâchers de juvéniles qui a donné lieu au lâcher de 212 juvéniles de 1 à 2 ans élevés en captivité depuis 2002 (Penny, 2004; Arsenault, 2011; Nova Scotia Blanding’s Turtle Database, 2014). Ces activités de rétablissement à grande échelle peuvent agir sur les tendances futures en matière de population pour la sous-population NS1. Un modèle initial d’AVP inédit, élaboré pour la sous-population NS2, a indiqué un risque de déclin de 44 % sur 100 ans (Bourque et al., 2006). Une analyse génétique fondée sur la statistique bayésienne laisse croire que l’ampleur et la direction du flux génétique au sein des sous-populations de la Nouvelle-Écosse pourraient avoir changé (sur 1 à 3 générations) par rapport aux tendances observées à long terme. La sous-population NS2 semble être passée d’une situation d’exportation nette de gènes à une importation nette (Howes et al., 2009); la raison de ce changement est inconnue. Les tendances en matière de population pourraient avoir été influencées par l’aménagement d’un barrage hydroélectrique en 1943 (McNeil, 2002). On dispose de peu de données sur la sous-population NS3, mais on sait qu’elle compte une proportion relativement élevée de juvéniles et de jeunes tortues, un signe positif de recrutement (Caverhill, 2006; Lefebvre et al., 2012). On en sait peu au sujet de trois petites concentrations (NS4 à NS6), mais les données actuelles indiquent que ces concentrations pourraient ne pas être viables, car elles se composent de très peu d’individus (< 10 adultes dans chaque site). La sous-population NS7 n’a été découverte qu’en 2016; c’est pourquoi on en ignore encore les tendances.
| Lieu | Tendance de la sous-population | Principales menaces observées, inférées et prévues Mortalité sur les routes et les voies ferrées |
Principales menaces observées, inférées et prévues Braconnage |
Principales menaces observées, inférées et prévues Espèces envahissantes |
Principales menaces observées, inférées et prévues Prédateurs favorisés par les activités humaines |
Principales menaces observées, inférées et prévues Développement |
Principales menaces observées, inférées et prévues Drainage et/ou modification des milieux humides |
Principales menaces observées, inférées et prévues Extraction d’agrégats |
Principales menaces observées, inférées et prévues Exploitation forestière |
Principales menaces observées, inférées et prévues Agriculture |
Principales menaces observées, inférées et prévues Activités récréatives |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Sud-ouest de l’Ontario 1 | Déclin inféré résultant de la dégradation à grande échelle de l’habitat découlant de l’envahissement par le roseau commun, de la forte prédation des nids par les prédateurs favorisés par les activités humaines, de la facilité d’accès par les braconniers et des blessures causées par les embarcations (Gillingwater et Brooks, 2001; Ontario Parks, données inédites; Davy, données inédites). | I | I | O | O | blank | blank | blank | blank | I | O |
| Sud-ouest de l’Ontario 2 | Déclin observé et prévu. 1) Baisse de ~ 85 % des captures par unité d’effort (CPUE) - À la fin des années 1980, 3 relevés visuels de 1 jour, effectués au moyen de jumelles en bordure du milieu humide, ont permis de trouver de 102 à 130 tortues mouchetées par relevé (~ 6 heures-personnes/relevé; données du CIPN; McCracken, comm. pers., 2014). En comparaison, des relevés printaniers intensifs effectués dans ce site de 2003 à 2006 (~ 70 à 120 jours-personnes/printemps à parcourir les milieux humides à pied) n’ont révélé qu’un maximum de 31 individus/relevé (~ 15 heures-personnes/relevé; Gillingwater, données inédites). Entre 2003 et 2013, le nombre moyen de captures/jour au printemps est passé de 14 à 2 malgré un effort de recherche semblable d’une année à l’autre (Gillingwater, 2013, données inédites). 2) Baisse de ~ 95 % du nombre de femelles reproductrices - En 1982, 257 femelles adultes ont été capturées sur la principale plage de nidification, sur une période de 22 jours, du 7 au 29 juin (Ashenden, 1983), tandis que seules 14 femelles ont été trouvées au cours d’un relevé de nidification de 20 jours sur la même plage entre la fin mai et le début juillet 2012 (une femelle avait été tuée sur la route; Gillingwater, 2013). 3) Entre 2003 et 2014, 64 adultes morts ont été trouvés (Gillingwater, données inédites), ce qui représente ~ 8 % de la population adulte estimée. Il s’agit d’une grossière sous-estimation de la perte réelle d’adultes durant cette période, puisque les relevés n’ont été effectués qu’au cours du printemps et non dans l’ensemble de la saison active. 4) Les modèles prévoient : i) une perte annuelle de 7 % des femelles adultes, toutes causes confondues; ii) une perte de 123 femelles adultes sur 50 ans; iii) la disparition de toutes les femelles adultes (~ 46 % de la taille estimée de la population) sur < 150 ans (< 4 générations; Enneson, 2009). |
O | O | O | O | blank | O | blank | blank | O | O |
| Sud-ouest de l’Ontario 3 | Déclin inféré. Huit adultes morts sur la route ont été fortuitement observés par un passant le 16 avril 2008. Ce nombre représente une perte de ~ 6 % de la population adulte estimée au cours des premières semaines d’une saison active (Caverhill et al., 2011; Zoo de Toronto, données inédites). | O | I | O | I | blank | I | blank | blank | O | blank |
| Sud-ouest de l’Ontario 4 | Déclin observé. La tortue mouchetée a déjà été jugée abondante dans ce site au début du 20e siècle (Patch, 1919), mais elle n’y persiste qu’en faible nombre. Les CPUE sont passées de 0,054 à 0,010, et une importante tendance vers un plus grand écart entre les classes d’âge et, on le présume, vers des classes d’âges plus avancées a été observée sur 30 ans entre le début des années 1970 et le début des années 2000 (Rivard et Smith, 1973a,b; Browne et Hecnar, 2007). | I | I | O | O | blank | blank | blank | blank | I | I |
| Sud-ouest de l’Ontario 5 | La sous-population est considérée comme étant fonctionnellement disparue. Seulement 5 adultes ont été trouvés en plus de 1 855 heures-personnes de relevé. Des lâchers de juvéniles et des activités de remise en état des milieux humides ont été entrepris (Zoo de Toronto, données inédites). | I | I | O | O | blank | blank | blank | blank | blank | I |
| Sud-ouest de l’Ontario 6 | Déclin observé. Les observations fortuites depuis le milieu des années 1990 ont diminué de > 50 % par rapport à la moyenne à long terme dégagée au cours des 30 années précédentes (Mackenzie et al., 2014). Un épisode de mortalité massive s’est produit au début des années 1990, au cours duquel des dizaines d’individus ont été trouvés échoués sur le rivage (McCracken, comm. pers., 2014). Entre 1999 et 2006, le Phragmites envahissant s’est rapidement propagé dans ce site, à un taux annuel de ~ 34 à 48 % (Badzinski et al., 2008). | blank | I | O | O | blank | O | blank | blank | blank | O |
| Sud-ouest de l’Ontario 7 | Déclin observé. La tortue mouchetée a déjà été couramment observée dans le parc, jusqu’à la fin des années 1990. Cependant, une seule a été trouvée au cours de relevés ciblés des tortues (~ 2 000 heures-personnes) effectués sur 5 ans au début des années 2000 (Davy, données inédites; Mackenzie, comm. pers., 2014). | I | I | O | O | blank | O | blank | blank | I | I |
| Sud-ouest de l’Ontario 8 | Déclin inféré. Des individus ont été trouvés dans seulement 4 de 11 sites historiques au cours de relevés ciblés effectués de 2006 à 2008 dans la région de Niagara (Yagi et al., 2009). | I | I | O | O | blank | I | blank | blank | I | I |
| Sud-ouest de l’Ontario 9 | Déclin inféré. Depuis 1994, il y a eu très peu d’observations signalées de la tortue mouchetée dans les comtés d’Elgin, de Middlesex et d’Oxford (données du CIPN). Au début des années 2000, des relevés effectués dans certains des milieux humides les plus propices à l’espèce qui existent toujours dans les comtés de Middlesex, d’Oxford et de Perth (~ 140 heures-personnes dans 10 sites) n’ont permis de trouver que 2 individus dans deux différents sites du comté de Middlesex; les deux sites étaient fragmentés et entourés de terres agricoles (Gillingwater et Piraino, 2002). | O | I | O | O | O | I | blank | blank | O | I |
| Sud-est de l’Ontario 1 | Déclin inféré en raison du grand nombre d’individus tués sur la route chaque année dans la région. D’importantes activités de recherche effectuées dans cette aire protégée n’ont permis de trouver que très peu d’adultes. Les œufs de femelles tuées sur la route sont incubés, et les jeunes sont lâchés dans le site (Carstairs, 2014, données inédites). Entre 2011 et 2014, 103 individus morts sur la route ont été observés sur 100 km de route dans la région. Il s’agit d’une estimation très prudente, étant donné que les relevés ciblant la mortalité routière ne couvrent que de 1 à 29 jours par année (Davy, données inédites; Seburn et al. 2014). | O | I | P† | blank | blank | blank | blank | blank | I | blank |
| Sud-est de l’Ontario 2 | Déclin inféré en raison des routes, de la voie ferrée, des terres agricoles et de l’aménagement urbain à proximité. On estime que le taux de survie annuelle des adultes est de 0,89 (Dillon Consulting Ltd., 2014). | O | I | P† | O | O | I | blank | blank | O | blank |
| Sud-est de l’Ontario 3 | Aucune tendance n’a été dégagée (Millar et Blouin-Demers, 2012). | blank | I | P† | I | blank | blank | blank | blank | blank | I |
| Sud-est de l’Ontario 4 | Aucune tendance n’a été dégagée (Middleton, 2014). | O | I | P† | I | O | blank | blank | blank | blank | O |
| Sud-est de l’Ontario 5 | Déclin inféré. D’après plusieurs naturalistes qui connaissent bien le parc, les densités de tortues mouchetées étaient beaucoup plus élevées il y a ~ 10 ans (milieu des années 2000; Boyle, comm. pers., 2014). | O | I | P† | I | blank | blank | blank | blank | blank | I |
| Centre-sud de l’Ontario 1 | Aucune tendance n’a été dégagée. Très peu de tortues mouchetées sont présentes dans le parc; il est donc difficile d’évaluer les tendances (Brooks, comm. pers., 2014). | O | blank | P† | blank | blank | blank | blank | O | blank | I |
| Centre-sud de l’Ontario 2 | Aucune tendance n’a été dégagée (Markle et Chow-Fraser, 2014). | blank | I | P† | I | O | blank | blank | blank | blank | I |
| Centre-sud de l’Ontario 3 | Déclin inféré en raison d’un épisode de mortalité de masse au cours duquel plus de 50 adultes ont été perdus en 2013 (Sheppard, données inédites, 2014); on croit que ce nombre représente près de 50 % de la population reproductrice (Litzgus, comm. pers., 2016). | I | I | P† | blank | P | blank | blank | blank | I | I |
| Centre-sud de l’Ontario 4 | Déclin inféré en raison du grand nombre d’individus tués sur la route chaque année dans la région. Entre 2013 et 2014, 15 % des mentions de la tortue mouchetée (N = 123) faites durant les relevés effectués dans la région étaient des individus trouvés morts sur les routes et les voies ferrées (N = 19; y compris deux juvéniles; Scales Nature Park, données inédites). | O | I | P† | I | blank | blank | blank | blank | I | I |
| Centre-sud de l’Ontario 5 | Déclin inféré en raison du taux élevé de mortalité routière. Entre 2012 et 2014, 112 adultes et juvéniles morts sur la route ont été signalés au sein d’une sous-population le long d’une route; au moins 23 adultes morts sur la route ont été signalés en 2014 uniquement (Morin et al., données inédites; Riley et al., données inédites). Si on suppose que cette sous-population comptait de 100 à 300 adultes (plus que l’effectif moyen), on peut conclure que de 8 à 23 % des adultes ont été perdus en 1 an. | O | I | P† | blank | O | blank | O | O | blank | blank |
| Centre-sud de l’Ontario 6 | Déclin inféré. Il y a environ 5 ans, on comptait 3 points chauds de mortalité routière pour la tortue mouchetée dans le district de Pembroke. Depuis 2012, aucune femelle reproductrice n’a été observée et, en 2014, aucun cas de mortalité routière n’a été observé aux points chauds, ce qui laisse croire que ces sous-populations pourraient désormais avoir fonctionnellement disparu (Kruschenske, comm. pers., 2014; données du CIPN). | O | I | P† | blank | O | blank | I | O | blank | blank |
| Québec - Outaouais | Déclin inféré en raison de la perte historique d’habitat aux fins de l’agriculture et des déclins prévus à cause de menaces soutenues, particulièrement la perte continue d’habitat causée par la destruction des barrages de castors dans la région (NCC, 2007; Dubois, 2009; Fortin et Dubois, 2010; Dubois et al., 2011, 2012, données inédites; Bernier, 2013, données inédites; St.-Hilaire et al., 2013). | O | I | P† | I | blank | O | O | blank | O | O |
| Nouvelle-Écosse 1 (NS1) |
Déclin inféré et prévu. La collecte de spécimens de musée qui a eu lieu par le passé pourrait avoir réduit de 10 à 20 % l’effectif des femelles adultes. Sans intervention, cette sous-population est exposée à un risque de disparition de 42 % sur 400 ans et à un risque moyen de déclin de 68 % sur 100 ans (Green et McNeil, 2014). | O | I | P‡ | O | blank | blank | blank | blank | blank | O |
| Nouvelle-Écosse 2 (NS2) |
Déclin prévu. Cette sous-population est exposée à un risque de déclin de 44 % sur 100 ans (Bourque et al., 2006). | I | I | P‡ | O | I | blank | O | O | blank | O |
| Nouvelle-Écosse 3 (NS3) |
Cette sous-population compte une proportion relativement élevée de juvéniles et de jeunes adultes, un signe positif de recrutement (Caverhill, 2006; Lefebvre, 2012). | O | I | P‡ | O | I | blank | O | O | O | O |
| Nouvelle-Écosse 4 (NS4) |
Aucune tendance n’a été dégagée. Il pourrait s’agir d’une extension de la sous-population ML. | O | I | P‡ | I | I | blank | O | O | blank | blank |
| Nouvelle-Écosse 5 (NS5) |
Aucune tendance n’a été dégagée, mais seuls 3 adultes ont été trouvés. | blank | blank | P‡ | blank | blank | blank | blank | blank | blank | blank |
| Nouvelle-Écosse 6 (NS6) |
Aucune tendance n’a été dégagée, mais seuls 3 adultes ont été trouvés. | blank | I | P‡ | blank | blank | blank | blank | blank | blank | blank |
| Nouvelle-Écosse 7 (NS7) |
Aucune tendance n’a été dégagée, mais seuls 3 adultes ont été trouvés. La sous-population n’a été découverte qu’en avril 2016; 31 adultes avaient été trouvés en date du 1er avril 2016. | I | blank | blank | blank | blank | blank | blank | O | blank | O |
Immigration de source externe
Une immigration de source externe dans la population des Grands Lacs et du Saint-Laurent, depuis les sous-populations des États-Unis, est très peu probable. Même s’il existe des tronçons étroits des rivières Detroit, St. Clair et St. Mary's et du fleuve Saint-Laurent où l’Ontario borde les États du Michigan et de New York, rien n’indique que des tortues traversent la frontière dans ces régions, et il est peu probable que cette espèce, qui n’est pas une grande nageuse, soit capable de traverser des eaux profondes et ouvertes où circulent de nombreuses embarcations; du moins, pas en nombre suffisant pour fournir une immigration de source externe. Une telle immigration depuis l’extérieur du Canada est impossible dans la population de la Nouvelle-Écosse, puisque la province est géographiquement isolée par l’océan Atlantique.
Menaces et facteurs limitatifs
Parmi les principales menaces qui pèsent sur la tortue mouchetée, on compte : la mortalité sur les routes ou les voies ferrées et les effets connexes des routes; la perte d’habitat découlant de l’envahissement par le roseau commun; la mortalité accrue des individus et des œufs causée par les prédateurs favorisés par les activités humaines; la collecte illégale d’individus aux fins du commerce des animaux de compagnie, de l’alimentation et des produits médicinaux traditionnels; la perte d’habitat découlant de divers types de développement et de modifications des milieux humides. Les autres menaces possibles comprennent : la mortalité des individus causée par les activités agricoles et récréatives; l’exploitation forestière et la production d’énergie; les changements climatiques; la pollution des milieux humides et l’introduction d’autres espèces végétales et animales envahissantes, plus particulièrement les poissons prédateurs. Voir l’annexe 2a - Calculateur de menaces pour les détails concernant les prévisions quant à la portée et à la gravité des menaces pour chaque population. Les plus graves menaces qui pèsent sur les sous-populations de la tortue mouchetée sont celles qui réduisent le nombre d’adultes ou limitent considérablement les possibilités de déplacement entre les milieux humides occupés. Par conséquent, la stabilité et la persistance de la population dépendent essentiellement d’un taux de survie élevé des adultes et de la connectivité de l’habitat.
Comme chez d’autres espèces de tortues au Canada, l’un des principaux facteurs limitatifs de la tortue mouchetée est la lenteur de son cycle vital (longévité extrême, maturité sexuelle tardive, faible recrutement de juvéniles et dépendance à un taux de survie annuel des adultes élevé). Cette stratégie sur le plan du cycle vital rend les tortues très vulnérables à la disparition, même après de faibles augmentations (< 5 %) du taux de mortalité annuel des adultes (Congdon et al., 1993). On s’attend à ce que la durée requise par les sous-populations pour se remettre des périodes de mortalité accrue des adultes soit longue (Congdon et al., 1994) en raison de la maturité tardive des individus et du faible taux de recrutement; cette hypothèse a été corroborée par certaines études indiquant qu’aucun signe de rétablissement n’avait été constaté même après 16 à 35 ans (Brooks et al., 1991b; Pitt et Nickerson, 2012; Howey et Dinkelacker, 2013; Keevil et al., 2015 en prép.). Toutefois, cette vulnérabilité à une mortalité accrue des adultes serait exacerbée dans le cas de la tortue mouchetée en raison de sa maturité excessivement tardive et de la faible fréquence de sa reproduction, ce qui la rend beaucoup plus vulnérable à des augmentations chroniques de la mortalité par rapport à d’autres tortues au Canada.
L’autre principal facteur limitatif de la tortue mouchetée au Canada est l’été frais et de courte durée à la limite septentrionale de l’aire de répartition de l’espèce, qui réduit le potentiel de reproduction et le succès de nidification (Brooks et al., 1991a). Le taux de développement des embryons de tortues est fortement corrélé à la température ambiante : si elle est trop faible, les embryons ne se développeront pas complètement (Obbard et Brooks, 1981b). De plus, les nouveau-nés exposés à de faibles températures durant la période d’incubation affichent une réduction de leur croissance et de leur viabilité (Brooks et al., 1991a). La survie des œufs et des nouveau-nés est la plus faible dans les sous-populations situées dans les latitudes les plus septentrionales au Canada (Brooks et al., 1991a); le recrutement dans ces régions est donc exceptionnellement faible. D’autre part, la plage de tolérance thermique étroite (voir « Physiologie et adaptabilité - Thermorégulation ») de l’espèce la rend plus sensible aux effets des changements climatiques à la limite sud de son aire de répartition canadienne par rapport à d’autres espèces de tortues (King et Niiro, 2013; voir Menaces - Changements climatiques).
Un autre facteur limitatif possible pour l’espèce est que la persistance des sous-populations semble dépendre de la propension des adultes à accomplir des déplacements sur de grandes distances, qui favorisent le maintien de la diversité génétique dans les milieux humides occupés (McGuire et al., 2013; voir « Biologie - Écologie de la reproduction »). Cela rend la tortue mouchetée particulièrement vulnérable à un déclin causé par la perte et la fragmentation de son habitat, et augmente le risque de collecte et de mortalité le long des corridors de transport durant les longs déplacements en milieu terrestre.
Enfin, comme les tortues mouchetées peuvent se regrouper à certains moments de l’année, notamment dans les sites d’hivernage, d’exposition au soleil au printemps et de nidification (voir Habitat - Besoins en matière d’habitat et Biologie - Cycle vital et reproduction), elles sont particulièrement vulnérables à la collecte, aux augmentations localisées de la prédation, aux perturbations de l’habitat et aux phénomènes liés au climat (Parks Canada, 2012), car plusieurs individus pourraient être perdus en même temps.
Routes et voies ferrées
Impact global de la menace : Grands Lacs et Saint-Laurent = élevé; Nouvelle-Écosse = faible-moyen
Les tortues mouchetées, qui parcourent de longues distances en milieu terrestre, sont particulièrement susceptibles d’être heurtées et tuées en traversant des routes et des voies ferrées. Les tortues (et les serpents) en particulier sont souvent intentionnellement ciblées par les automobilistes (Ashley et al., 2007; Gillingwater, comm. pers., 2016; Piraino, obs. pers.; McNeil, obs. pers.). Une étude sur la mortalité routière effectuée dans un site occupé par la tortue mouchetée dans le sud de l’Ontario a révélé qu’environ 2,7 % des automobilistes ciblaient délibérément des imitations de reptiles placés sur la route, et que ces efforts ciblés se produisaient environ aux 15 minutes (Ashley et al., 2007). Étant donné que les femelles adultes nidifient le long des accotements et traversent des routes plus souvent que les mâles ou les juvéniles durant la période de nidification, elles sont plus vulnérables à la mortalité routière (Gibbs et Steen, 2005; Steen et al., 2006; Walston et al., 2015), ce qui pourrait donner lieu à un rapport des sexes biaisé en faveur des mâles dans les sous-populations adjacentes à des routes (Saumure, 1995; Gibbs et Steen, 2005; Piraino et Gillingwater, 2006; Steen et al., 2006). La nidification le long des routes augmente aussi le risque de mortalité pour les nouveau-nés, dont bon nombre sont trouvés morts sur la route annuellement durant l’émergence du printemps ou de l’automne (Parks Canada, 2012; Baxter-Gilbert et al., 2013; Gillingwater, 2013, données inédites; Nova Scotia Blanding’s Turtle Database, 2014; données du CIPN), et les nids creusés en bordure des routes sont parfois détruits par les niveleuses (cas observé à un site; Edge, données inédites). La tortue mouchetée peut aussi hiberner dans les fossés inondés au bord des routes ou dans les bancs d’emprunt le long des routes d’accès forestières (Riley et al., données inédites; Rouse, données inédites; Steinberg, comm. pers., 2014), ce qui l’expose à un risque accru de mortalité associée aux véhicules et à la machinerie lourde. Les répercussions des routes et des voies ferrées sur les espèces sauvages comprennent non seulement la mortalité directe découlant des collisions avec des véhicules, mais aussi les obstacles aux déplacements ainsi que la perte, la dégradation et la fragmentation de l’habitat (Proulx et al., 2014). En outre, parce que la tortue mouchetée traverse beaucoup moins souvent les routes que si elles se déplaçaient aléatoirement par rapport à l’emplacement des routes (Proulx et al., 2014), et parce que les longs déplacements des adultes sont importants pour maintenir le flux génétique entre les milieux humides occupés (McGuire et al., 2013), une connectivité réduite entre les milieux humides risque de réduire la diversité génétique des sous-populations dans les paysages fragmentés (McGuire et al., 2013; Proulx et al., 2014).
Bien que l’on compte peu de cas documentés de mortalité routière de la tortue mouchetée en Nouvelle-Écosse, cette menace est tout de même jugée importante et en hausse, et elle est considérée comme très préoccupante dans le programme de rétablissement de l’espèce (Parks Canada, 2012). On compte 6 cas documentés d’adultes morts sur la route en Nouvelle-Écosse et plus de 15 cas documentés de mortalité de juvéniles et de nouveau-nés (Nova Scotia Blanding’s Turtle Database, 2014); d’autres cas pourraient être passés inaperçus. Comme certaines des sous-populations en Nouvelle-Écosse sont très petites (< 10 adultes), même une légère augmentation du taux de mortalité des adultes peut avoir des répercussions sur leur viabilité. Bon nombre d’adultes et de juvéniles plus âgés traversent régulièrement des routes durant leurs déplacements en direction et en provenance des sites de nidification et d’hivernage. Il est probable que le programme annuel de protection des nids ait aidé à réduire la mortalité sur les routes, car les bénévoles font souvent dévier la circulation de manière à éviter les tortues.
Au Québec, il y a une forte densité de routes dans la vallée de l’Outaouais (jusqu’à 2,9 km de route/km2; Duclos et Fink, 2013) qui présente une menace considérable pour la population provinciale de l’espèce. Plusieurs tortues mouchetées tuées sur la route ont été trouvées dans la région (Desroches et Picard, 2005; Dubois et al., 2012; St-Hilaire et al., 2013). Des 72 sites dans la région de l’Outaouais, le risque de mortalité routière est considéré comme étant élevé dans 37 sites (51 %), modéré dans 27 sites (38 %), faible dans 7 sites (10 %) et nul dans 1 site (1 %) d’après la distance qui sépare la limite du milieu humide de la route la plus proche (Dubois, 2009).
Dans le sud de l’Ontario, le nombre de grandes routes a grandement augmenté au cours des 40 dernières années (Fenech et al., 2001), et cette expansion se poursuit. En moyenne, quelque 900 km de routes forestières sont aménagés annuellement en Ontario (Ontario MNRF, 2014a), et plusieurs projets d’aménagement et de valorisation ont récemment été achevés ou sont en cours dans les milieux occupés par la tortue mouchetée dans les districts de Kemptville, de Parry Sound, de Pembroke et de Sudbury. Entre 2010 et 2016, quatre demandes de « permis d’avantage plus que compensatoire » aux termes de la LEVD ont été présentées (trois approuvées; une proposée) pour l’aménagement de routes dans l’habitat de la tortue mouchetée; chaque projet prévoyait l’installation d’écopassages comme principale méthode de compenser la perte d’habitat (Government of Ontario, 2016). Plusieurs autres projets d’aménagement à grande échelle récents ou en cours ne figurent pas dans le registre environnemental de l’Ontario, ce qui signifie que leur réalisation n’exigeait pas la délivrance d’un permis d’avantage plus que compensatoire. On pense donc que le type d’approbation exigée en vertu de la LEVD pour ces projets d’aménagement routier était une exemption réglementaire. En effet, comme l’habitat de la tortue mouchetée n’est devenu protégé en vertu de la LEP qu’en 2013, une demande d’exemption réglementaire pouvait être présentée pour les projets d’infrastructure routière dont l’approbation avait progressé jusqu’à une certaine étape en janvier 2015 (Ontario MNRF, 2013b). Voir protection, statuts et classements - Statuts et protection juridiques - Ontario pour une explication des divers types d’approbations en vertu de la LEVD et des exigences connexes pour la protection des espèces.
Même si la majorité des mentions de mortalité routière de la tortue mouchetée en Ontario proviennent des principales voies routières, beaucoup d’observations ont aussi été faites sur des routes de parcs provinciaux, des routes de comté rural, des routes d’accès forestières en gravier et même des pistes de VTT (données du CIPN). Une fois les routes utilisées pour l’exploitation forestière et les routes de comté en gravier prises en compte, on constate que peu de sous-populations de la tortue mouchetée dans le sud de l’Ontario se trouvent à plus de 10 km d’une voie routière. Dans le district de Parry Sound, on considère que le niveau de mortalité routière de la tortue mouchetée est élevé; la plupart des individus sont tués sur de grandes routes pavées, certains le sont sur de plus petites routes menant à des chalets, et quelques-uns sont tués sur des routes d’accès forestières (Rouse, comm. pers., 2015). L’utilisation par le public de la plupart des routes d’accès forestières dans cette région n’est pas réglementée; c’est pourquoi le risque de mortalité routière y est vraisemblablement semblable à ce que l’on observe sur les routes menant à des chalets. En outre, une grande proportion des femelles dans le district de Parry Sound nidifient sur des routes, et le rythme auquel les nouvelles routes sont aménagées dans la région est élevé (Rouse, comm. pers., 2015). De même, au sein du district de Pembroke, plusieurs dizaines de nouvelles routes d’accès forestières sont aménagées chaque année; ces routes attirent les femelles reproductrices, et contribuent à créer de nouveaux puits de population (Kruschenske, comm. pers., 2014). La mortalité sur les voies ferrées représente aussi une menace pour l’espèce : plusieurs observations d’individus vivants et morts ont été signalées sur des voies ferrées dans l’ensemble de l’aire de répartition de la population des Grands Lacs et du Saint-Laurent, dont la région de l’Outaouais au Québec et les comtés de Muskoka, de Parry Sound, d’Ottawa, de Simcoe et de Sudbury en Ontario (Dubois et al., 2012; Dillon Consulting, 2014; Keevil, comm. pers., 2014; Marks, comm. pers., 2014; Mills, comm. pers., 2014; Woods, 2014; Scales Nature Park, données inédites; données du CIPN). D’après les taux de mortalité routière de 0,2 à 0,3 individus/km issus de relevés normalisés effectués le long de quatre grandes voies routières en Ontario, on estime à quelque 265 à 400 le nombre de tortues mouchetées (longueur de plastron = > 15 cm) qui sont tuées chaque année sur les routes de la province (annexe 3).
Espèces envahissantes
Impact global de la menace : Grands Lacs et Saint-Laurent = moyen-élevé; Nouvelle-Écosse = faible-élevé
Le roseau commun est une plante envahissante qui peut rapidement évincer les communautés végétales naturelles en les remplaçant par de denses peuplements monospécifiques (qui atteignent une hauteur de > 5 m, une densité de > 95 % et un taux d’expansion de ~ 10 cm/jour [Wilcox et al., 2003; Jodoin et al., 2008; Gilbert, 2012]). Même si les tortues peuvent, à l’occasion, utiliser les bords inondés des peuplements de roseau commun lorsque ceux-ci poussent en petites parcelles au sein d’une mosaïque d’habitat plus vaste, l’habitat perd son caractère convenable (Gillingwater 2009, 2013) une fois que les peuplements deviennent d’impénétrables étendues monospécifiques (ce qui est habituellement inévitable, étant donné qu’il s’agit d’une plante très compétitive et agressive; Wilcox et al., 2003; Gilbert, 2012). En effet, les relevés effectués dans de denses peuplements de roseau commun ont révélé la présence de très peu de tortues, voire aucune, par rapport à d’autres activités semblables effectuées dans des milieux humides ouverts (Davy, données inédites; Gillingwater, 2009; 2013). La hauteur et la densité des peuplements de roseau commun limitent les possibilités d’exposition au soleil et de déplacement des tortues (Misfud, 2013; Gillingwater, 2009; 2013; Markle, données inédites). Des individus coincés et/ou morts ont par ailleurs été observés dans certains peuplements très denses (Mackenzie et al., 2014; Davy, données inédites; Markle, données inédites). La perte d’habitat de nidification est aussi problématique : le roseau commun peut envahir un site de nidification en quelques semaines seulement, ce qui réduit le succès d’éclosion des œufs en raison de la propagation des racines ou de la baisse de température occasionnée par l’ombrage (Bolton et Brooks, 2010). Une couverture végétale accrue a aussi pour effet d’augmenter la mortalité des nouveau-nés en hivernage, en limitant l’accumulation de neige nécessaire à l’isolation du nid contre les températures hivernales (Weisrock et Janzen, 1999). La baisse généralisée des températures d’incubation attribuable à l’ombrage risque aussi de modifier le rapport des sexes pour les espèces dont la détermination des sexes dépend de la température, comme la tortue mouchetée (Janzen, 1993; Janzen et Morjan, 2001). Les denses peuplements de roseau commun, lorsqu’ils sont morts, présentent aussi un risque de mortalité associé aux incendies (Gilbert, 2012).
Le roseau commun se propage rapidement dans l’ensemble du sud-est du Canada depuis les années 1990, et en 2010 sa présence avait été signalée dans le centre de l’Ontario (la région du Canada où la tortue mouchetée est la plus abondante). On s’attend à ce que l’aire de répartition du roseau commun s’étende considérablement dans l’ensemble du sud du Canada d’ici 2030 (Catling et Mitrow, 2011; figure 5), et elle devrait alors chevaucher entièrement celle de la tortue mouchetée. Depuis le milieu des années 2000, il s’est produit d’importantes modifications de l’habitat de la tortue mouchetée dans certains sites du sud-ouest de l’Ontario, et les observations de tortues à quelques-uns de ces sites ont considérablement diminué dans les dernières années (MacKenzie et al., 2014; Gillingwater, données inédites). On estime que le taux de propagation annuel dans ces sites a été de 34 à 48 % entre 1999 et 2006 (Badzinski et al., 2008), et il est probable que ce taux ait augmenté depuis compte tenu des modifications rapides qui ont été observées au cours des 7 dernières années seulement (Gillingwater, données inédites). L’un de ces sites du sud-ouest de l’Ontario est largement isolé (surtout entouré d’eau, avec très peu d’intrusions humaines et à une distance d’au moins 10 km de la route la plus proche); il semble donc que même les secteurs relativement non perturbés soient sujets à l’envahissement. En outre, aucun type de milieu humide ouvert n’est immunisé contre l’envahissement par le roseau commun (Gilbert, comm. pers., 2013). L’expansion continue des routes et les activités intensives d’exploitation forestière dans l’ensemble du centre de l’Ontario favoriseront probablement la propagation du roseau commun dans la région. D’après cette information, on s’attend à ce que l’habitat de la tortue mouchetée en Ontario diminue de 11 à 70 % au cours des 120 prochaines années (3 générations) à cause de la propagation continue du roseau commun (voir l’annexe 2b - Calculateur de menaces pour la population des Grands Lacs et du Saint-Laurent). Même si le roseau commun est présent au Québec dans les régions de l’Outaouais et de la Montérégie, il ne représente pas encore une menace pour l’habitat de la tortue mouchetée (Giguere, comm. pers., 2014; Toussaint, comm. pers., 2014;). De même, bien que le roseau commun ait été documenté en Nouvelle-Écosse pour la première fois au début du 20e siècle (Catling et Mitrow, 2011), les chercheurs n’ont pas encore observé cette plante envahissante dans l’habitat de la tortue mouchetée ou à proximité dans la province (Nova Scotia Blanding’s Turtle Database, 2014). On prévoit cependant que le roseau commun se propagera dans l’ensemble du sud du Canada d’ici 2030 (Catling et Mitrow, 2011); on s’attend donc à des pertes d’habitat au Québec et en Nouvelle-Écosse dans un avenir rapproché. Parmi les autres espèces envahissantes qui sont présentes dans l’habitat de la tortue mouchetée dans la région des Grands Lacs et du Saint-Laurent, on compte : l’alpiste roseau (Phalaris a. arundinacea), la glycérie aquatique (Glycerian maxima), la carpe (Cyprinus carpio) et la tortue de Floride (Trachemys scripta elegans). En Nouvelle-Écosse, les autres espèces envahissantes dont l’aire de répartition est en expansion comprennent des poissons prédateurs comme l’achigan à petite bouche (Micropterus dolomieu) et le brochet maillé (Esox niger; Parks Canada, 2012). Bien que l’on ignore à quel degré ces autres espèces envahissantes menacent les sous-populations de tortues mouchetées, on sait qu’elles sont capables de réduire la qualité de l’habitat et la disponibilité des aliments, et qu’elles peuvent constituer une menace sur le plan de la prédation pour les nouveau-nés.
Description longue de la figure 5
Carte montrant la répartition minimale prévue du roseau commun (Phragmites a. australis) au Canada d’ici 2030.
Prédateurs favorisés par les activités humaines
Impact global de la menace : Grands Lacs et Saint-Laurent = moyen; Nouvelle-Écosse = moyen
Dans les paysages dominés par les populations humaines, les prédateurs favorisés par les activités humaines (ceux dont l’abondance accrue résulte de ressources alimentaires découlant de la présence humaine; Garrott et al., 1993; Mitchell et Klemens, 2000) peuvent donner lieu à des taux de prédation anormalement élevés chez les tortues à tous les stades de leur cycle vital (voir BIOLOGIE - Mortalité). Les taux de blessures liés à la prédation qui ont été constatés dans les sous-populations de tortues mouchetées faisant l’objet d’un suivi varient entre 17 % et 31 % (Kofron et Schreiber, 1985; Gillingwater et Brooks, 2001; Dubois et al., 2012; Gillingwater, données inédites). Un nombre anormalement élevé de prédateurs dans le paysage risque aussi de donner lieu à des taux de prédation beaucoup plus importants en ce qui concerne les nids et les nouveau-nés. Des études effectuées dans le sud-ouest de l’Ontario ont révélé un taux de prédation par des mammifères de 55 à 100 % pour les nids qui n’étaient pas protégés par des cages (Saumure, 1995; Gillingwater et Brooks, 2001; Browne, 2003; Gillingwater, 2013). Le recrutement limité des juvéniles, causé par des taux de prédation élevés, serait la principale cause de la tendance vers un plus grand écart entre les classes d’âge et, on le présume, vers des classes d’âge plus avancées dans une sous-population de tortues mouchetées du sud-ouest de l’Ontario (Browne et Hecnar, 2007). Bien que l’ampleur de cette menace en Ontario soit probablement plus grande dans les zones fortement développées au sud du Bouclier canadien, on s’attend à ce que la construction accrue de chalets et de routes en étende la portée jusqu’aux sous-populations situées dans certains secteurs du Bouclier (voir l’annexe 2 - Calculateur de menaces pour la population des Grands Lacs et du Saint-Laurent). En Nouvelle-Écosse, la prédation visant les nids et les nouveau-nés non protégés peut être très élevée dans les paysages dominés par les populations humaines (Herman et al., 1995), et les nids qui sont situés le long du rivage des lacs et en bordure des routes semblent faire l’objet d’une prédation plus intense que dans les régions de l’intérieur, loin des zones de forte perturbation (McNeil, obs. pers.; Herman, comm. pers., 2015). Un programme annuel de protection des nids a été mis en œuvre dans ces régions pour réduire les taux de prédation élevés (Standing et al., 2000). Graham (in Congdon et al., 2008) a constaté que le piégeage ou l’enlèvement des mammifères en vue de protéger les nids de tortue exigeait des efforts considérables et offrait des résultats décevants; l’installation de cages sur les nids serait une méthode beaucoup plus efficace pour améliorer le recrutement des nouveau-nés.
Commerce des animaux de compagnie, de l’alimentation et des produits médicinaux traditionnels
Impact global de la menace : Grands Lacs et Saint-Laurent = moyen; Nouvelle-Écosse = faible-moyen
Des données récentes indiquent que les tortues mouchetées du Canada font l’objet d’une collecte illégale aux fins du commerce des produits alimentaires asiatiques et des produits médicinaux traditionnels, tant au Canada qu’à l’étranger (Miller, comm. pers., 2014). Les reptiles constituent une cible de choix dans le commerce illégal des espèces sauvages, et des contrebandiers fournissent régulièrement au marché noir de l’Ontario des tortues rares, tant en provenance qu’en direction du pays (Miller comm. pers., 2014). La demande de produits issus des tortues devrait augmenter en Ontario à mesure que le nombre de consommateurs et d’intervenants dans le domaine des produits médicinaux traditionnels asiatiques continuera d’augmenter (Miller, comm. pers., 2014). Il existe aussi une demande pour la tortue mouchetée dans le commerce des animaux de compagnie. En 2012, le Reptiles Magazine vantait les mérites de la tortue mouchetée comme l’une des meilleures espèces à garder en captivité grâce à sa personnalité « attachante et intéressante » (CITES, 2013). Plus une espèce devient rare et difficile à obtenir, plus sa valeur commerciale augmente; elle devient aussi plus prisée sur le marché noir (CITES, 2013; Miller, comm. pers., 2014). En 2007, un homme de Wallaceburg a été arrêté, de concert avec deux intervenants de Toronto, pour avoir eu en sa possession 26 tortues mouchetées vivantes et une tortue ponctuée provenant d’une sous-population du sud-ouest de l’Ontario (Chatham Daily News, 11 septembre 2008). En août 2014, un homme de Windsor a été arrêté à la frontière entre Detroit et Windsor alors qu’il transportait 51 tortues dans son pantalon; quelques semaines plus tard il a été détenu après que son transporteur de Toronto ait tenté de s’embarquer à l’aéroport métropolitain de Detroit avec 970 tortues cachées dans ses bagages. La cargaison était constituée de 700 Malaclemys terrapin (aussi appelé tortue à dos diamanté) ainsi que de tortues mouchetées et de tortues des bois destinées au marché asiatique des animaux de compagnie et des produits alimentaires (The Detroit News, 26 septembre 2014). Les agents fédéraux ont découvert que ce trafiquant avait marchandé des milliers de tortues durant de nombreuses années (The Detroit News, 26 septembre 2014); en avril 2016, il a reçu une sentence sans précédent de 5 ans de pénitencier (The Globe and Mail, 12 avril 2016).
En plus de la collecte aux fins du commerce des animaux de compagnie, les membres des collectivités locales ramassent souvent des individus dans la nature pour les garder comme animaux de compagnie ou pour les déplacer dans de « meilleurs » endroits, comme des propriétés rurales ou des chalets éloignés du lieu d’origine des tortues (CITES, 2013; Gillingwater, comm. pers., 2014; Marks, comm. pers., 2014; Woods, 2014; McNeil, obs. pers.) En outre, une augmentation du nombre de collectes de tortues à des fins non commerciales a été signalée dans des aires naturelles protégées aux États-Unis (Lovich, 1987; Garber et Burger, 1995; Graham, 1995). Selon ce qu’on a appris auprès de citoyens locaux en Nouvelle-Écosse, il semble que l’enlèvement temporaire de tortues afin d’utiliser celles-ci comme animaux de compagnie pour les enfants soit relativement courant et se produise de manière fortuite (McNeil, obs. pers.). Ces tortues sont souvent relâchées dans la nature, mais pas nécessairement dans leur lieu d’origine. Une tortue mouchetée a d’ailleurs été trouvée sur une île, à de nombreux kilomètres de son aire de répartition (Nova Scotia Blanding’s Turtle Database, 2014), et une autre a été photographiée sur le chemin Haines dans le sud-ouest du Yukon (Bruce Bennett, comm. pers., 2016). Les localités de la tortue mouchetée en Nouvelle-Écosse sont bien connues des membres des collectivités et sont décrites dans la documentation et dans les médias, ce qui pourrait faire courir à l’espèce un risque de collecte ciblée. L’ampleur de ces occurrences et leurs effets relatifs sur les sous-populations dans l’ensemble de l’aire de répartition de la tortue mouchetée sont inconnus. L’enlèvement des tortues de leur milieu naturel est équivalent à la mortalité du point de vue de la viabilité de la population. En effet, l’enlèvement des adultes réduit le nombre d’individus sexuellement matures qui sont disponibles pour la reproduction, et peut aussi réduire le succès de reproduction des adultes restants. Comme les femelles sont souvent les plus recueillies, la collecte pourrait donner lieu à un déséquilibre dans le rapport des sexes et réduire la stabilité des sous-populations (Congdon et al., 2008).
Développement résidentiel et commercial
Impact global de la menace : Grands Lacs et Saint-Laurent = moyen; Nouvelle-Écosse = faible
Outre l’élimination directe de l’habitat des milieux humides, le développement peut aussi mener à la fragmentation de l’habitat et à la dégradation de ce qui en subsiste (voir la rubrique « Menaces et facteurs limitatifs - Routes et voies ferrées » qui traite des effets connexes de la fragmentation de l’habitat). La tortue mouchetée fréquente abondamment les forêts de terrain élevé (voir la rubrique « Habitat ») et l’élimination de l’habitat des forêts rend le paysage moins convenable à l’espèce (Quesnelle et al., 2013). Les déplacements de la tortue mouchetée dans les zones aménagées accroissent le risque de collision avec des véhicules, la prédation ainsi que les blessures causées par l’équipement ou autres dangers anthropiques (Findlay et Bourdages, 2000; Gibbs et Shriver, 2002; Steen et Gibbs, 2004; Aresco, 2005; Ryan et al., 2008; McGuire et al., 2013). En outre, les secteurs perturbés attirent souvent la tortue mouchetée (et d’autres espèces de tortues), qui s’en sert comme habitat de nidification (voir la rubrique « Habitat - Besoins en matière d’habitat - Habitat de nidification »), mais la nidification qui a lieu dans ces endroits crée probablement un piège écologique, car les femelles et les nouveau-nés y sont exposés aux dangers anthropiques mentionnés ci-dessus. Congdon et al. (2011) laissent entendre qu’il faut prévoir des zones de protection terrestre de 450 m autour de tous les milieux humides (résidence et lieu temporaire) et de 2 000 m autour des milieux humides de résidence afin de protéger la totalité des nids de tortue mouchetée et des adultes, respectivement; toutefois, la protection d’un habitat de cette envergure est rarement réalisable à titre de mesure d’atténuation du développement [voir la rubrique « Statuts et protection juridiques - Ontario » qui traite des exigences en matière de protection de l’habitat prévues dans la Loi de 2007 sur les espèces en voie de disparition (LEVD)de la province].
Au début des années 2000, le sud de la baie Georgienne a été décrit comme la région connaissant l’expansion la plus rapide en Ontario (Watters, 2003), les projets de développement de haute densité venant y remplacer les zones d’utilisation des terres non intensive et de faible densité (MacKinnon et al., 2005). La construction de chalets sur les rives entraîne actuellement une perte d’habitat dans la région (Enneson et Litzgus, 2009; Brooks, comm. pers., 2014) et dans l’habitat confirmé de la tortue mouchetée (Government of Ontario, 2016). Dans le district de Sudbury, il y a au moins une sous-population présente dans une zone de développement résidentiel actif entourée de terres ciblées par des projets de développement (Woods, 2014). Dans le district de Kemptville, l’habitat continue d’être menacé par le développement résidentiel et d’autres activités d’exploitation des terres et, en 2014 seulement, plusieurs projets de développement visaient des terres situées dans l’habitat général de la tortue mouchetée (Thompson, comm. pers., 2014). Entre 2010 et 2014, plusieurs projets de développement dans l’habitat de la tortue mouchetée ont été approuvés en vertu de la LEVD sans qu’il ne soit nécessaire d’obtenir de permis avant le début des travaux, y compris onze demandes d’exemption des exigences réglementaires et trois accords (ces chiffres comprennent les projets de développement et les projets de visant les infrastructures routières; voir la rubrique « Protection, statuts et classements - Statuts et protection juridiques - Ontario » qui décrit les divers types d’approbation en vertu de la LEVD ainsi que les exigences réglementaires et les exigences connexes à satisfaire pour assurer la protection des espèces). Puisque l’habitat de la tortue mouchetée n’est protégé que depuis 2013 par la LEVD, il se peut que des projets de développement obtiennent une exemption des exigences réglementaires si, en janvier 2015, ils avaient été approuvés jusqu’à une certaine étape (Ontario Ministry of Natural Resources and Forestry, 2013b). Par conséquent, on présume que d’autres exemptions ont été octroyées en 2015 dans le cadre de projets de développement ayant une incidence sur la tortue mouchetée; nous n’en avons toutefois pas obtenu le nombre à temps pour l’intégrer au présent rapport. En 2015 et en 2016, trois demandes de permis d’avantage plus que compensatoire en vertu de la LEVD ont été présentées dans le cadre de projets de développement résidentiel visant l’habitat de la tortue mouchetée; chaque projet entraînera une perte nette d’environ 20 à 124 ha d’habitat. Les principales mesures de compensation proposées consistent à poser des clôtures, à réduire la mortalité routière et à améliorer l’habitat résiduel par la restauration riveraine ou la création de microhabitats de nidification ou d’hivernage (Government of Ontario, 2016).
Au Québec, la plus grande partie de l’habitat de la tortue mouchetée se trouve dans des aires protégées et des zones agricoles où la menace que pose le développement résidentiel et commercial est faible (Dubois, comm. pers., 2014; Giguère, comm. pers., 2014). En Nouvelle-Écosse, deux sous-populations sont présentes dans des paysages exploités où se construisent des résidences et des chalets (McNeil, 2002; Caverhill, 2003; Lefebvre, 2009).
Modifications des systèmes naturels
Impact global de la menace : Grands Lacs et Saint-Laurent = faible-moyen; Nouvelle-Écosse = inconnu
Le dragage des milieux humides, surtout durant la période d’hibernation, représente un risque de mortalité pour la tortue. Dans des milieux humides protégés situés dans le sud-ouest de l’Ontario, des chercheurs ont observé sept tortues mouchetées adultes mortes au début du printemps, en partie ensevelies dans des sédiments dragués l’hiver précédent; de nombreuses autres tortues étaient probablement complètement ensevelies, et donc non visibles (Gillingwater et Piraino, 2004). Depuis au moins 2009 et jusqu’en 2016, des travaux de dragage à grande échelle ont été effectués dans des aires protégées adjacentes afin de créer un habitat pour la sauvagine, ce qui a entraîné la perte d’habitat confirmé de la tortue mouchetée; les prés humides peu profonds et riches en végétation ont été remplacés par des étangs d’eaux libres profonds et ouverts au fond sableux, dépourvus d’endroits où s’abriter et se nourrir (Gillingwater, comm. pers., 2016). L’utilisation de faucheuses à plantes aquatiques pour dégager les chenaux constitue une autre menace et une cause de blessure et de mortalité dans les milieux humides côtiers où la tortue mouchetée a été observée (Bolton, comm. pers., 2015). Le dragage des milieux humides, la fauche de la végétation aquatique et la création d’habitat pour la sauvagine ont probablement lieu dans de nombreuses aires de gestion faunique et pourraient représenter une source importante de mortalité chez la tortue mouchetée.
L’élagage ou l’enlèvement des barrages de castor durant l’hiver présente aussi un risque de mortalité pour la tortue mouchetée. En 2010, l’« élagage » d’un barrage dans un parc provincial de l’Ontario a entraîné la destruction accidentelle du barrage et une baisse immédiate de 2 m du niveau d’eau. L’habitat d’hivernage a été entièrement détruit, un grand nombre de tortues mortes ont été trouvées et aucune mesure d’atténuation n’a été prise pour pallier l’impact (Davy, données inédites). La tortue mouchetée est souvent associée aux milieux humides subissant l’action du castor à l’échelle de son aire de répartition et, par conséquent, l’enlèvement des barrages de castor en hiver risque de se répercuter sur cette espèce dans toute son aire de répartition. Dans la région de l’Outaouais, au Québec, on a observé que le démantèlement de barrages de castor constituait une menace considérable pour la population; de nombreux barrages ont été démantelés à la fin de novembre 2010, ce qui a entraîné une importante perte d’habitat de la tortue mouchetée et probablement des cas de mortalité vu le moment où ont été effectués les travaux de démantèlement (Dubois et al., 2012). Dans cette région, de nombreux citoyens ont exprimé le souhait de retirer les barrages de castor de leurs propriétés (Dubois et al., 2012) et, depuis 2006, les citoyens de certaines municipalités régionales de comté du Québec sont contraints de défaire les barrages susceptibles de poser une menace à la sécurité des personnes (Duclos et Fink, 2013).
En Nouvelle-Écosse, la régulation des niveaux d’eau résultant de l’installation de barrages et/ou de l’enlèvement de barrages de castor est considérée comme une menace importante (McNeil, 2002; Mockford et al., 2005; Parks Canada, 2012). En plus d’accroître le risque de mortalité pour les tortues en hibernation, la modification des niveaux d’eau pourrait favoriser l’inondation des nids et donner lieu à un taux sous-optimal de rétention d’humidité dans les œufs, ce qui influe sur le taux d’éclosion et la valeur adaptative des nouveau-nés (Packard, 1999; Standing et al., 2000; Parks Canada, 2012). Les œufs de tortue mouchetée ne sont pas très sensibles à la sécheresse ou à l’inondation (Packard et al.,1982); cependant, une inondation prolongée peut entraîner un échec de nidification. Dans les sites de nidification situés en bordure de lacs en Nouvelle-Écosse, l’inondation des nids est fréquente et, en 2003, tous les nids d’une sous-population situés en bordure de lacs ont été détruits lors d’une inondation survenue à la fin de l’été (Nova Scotia Blanding's Turtle Database, 2014). Depuis, les chercheurs ont entrepris de déplacer les nids risquant l’inondation imminente plus haut le long des rives des lacs. En outre, la modification des régimes d’écoulement des eaux peut nuire aux déplacements saisonniers et influer sur la capacité de la tortue de nidifier, de se nourrir et d’accéder à des sites d’hivernage (Herman et al., 2003).
Exploitation forestière et récolte du bois
Impact global de la menace : Grands Lacs et Saint-Laurent = faible; Nouvelle-Écosse = faible
En Ontario, la tortue mouchetée est largement répandue dans les forêts publiques où des activités de gestion des forêts sont menées (Environment Canada, 2014; Crowley, comm. pers., 2015); au moins la moitié de l’aire de répartition de la tortue mouchetée en Ontario (c’est-à-dire toute l’écorégion de la baie Georgienne et le nord de l’Ontario) chevauche le secteur d’exploitation forestière, où ont lieu des activités d’aménagement des forêts sur les terres publiques. L’exploitation forestière peut être une cause de mortalité directe chez les tortues, qui courent le risque d’être écrasées par le matériel d’exploitation forestière, et peut aussi entraîner la destruction des mares printanières et de l’habitat d’hibernation (Natural Heritage and Endangered Species Program, 2007). Par conséquent, bon nombre de lignes directrices précises ont été intégrées au Stand and Site Guide en vertu de la Loi sur la durabilité des forêts de la Couronne de l’Ontario (S.O. 1994, c. 25) pour mieux protéger la tortue mouchetée de l’exploitation forestière. Par exemple, le matériel lourd est interdit dans l’habitat hivernal convenable (peu importe la saison), à moins de 300 m de l’habitat estival convenable durant la période de nidification (du 1er au 30 juin), à moins de 150 m de l’habitat estival convenable durant d’autres périodes de saison active lorsque la tortue mouchetée est terrestre (c.-à-d. du 1er au 30 mai, du 1er au 15 juillet et du 1er au 30 septembre), ou à moins de 30 m de l’habitat estival convenable durant le reste de la saison active, lorsque la tortue mouchetée passe moins de temps à terre (c.-à-d. du 15 au 30 avril, du 15 juillet au 31 août, du 1er au 15 octobre; Ontario Ministry of Natural Resources and Forestry, 2016). Les tortues risquent toujours de rencontrer des véhicules et du matériel lourd lorsqu’elles quittent les milieux humides et parcourent de longues distances sur la terre ferme. En outre, étant donné que ces restrictions ne s’appliquent que dans le secteur préoccupant de 1 km entourant l’habitat convenable situé dans un rayon de 2 km d’une occurrence connue ou d’une « observation fiable » récente (moins de 20 ans) (Ontario Ministry of Natural Resources and Forestry, 2016), il est possible que des sous-populations inconnues ou non confirmées ne bénéficient pas d’une protection contre l’exploitation forestière. Par ailleurs, les travaux de nettoyage des fossés par l’industrie forestière sont autorisés en octobre (Ontario Ministry of Natural Resources and Forestry, 2016), ce qui pourrait causer des blessures aux tortues qui hibernent dans les fossés inondés. Outre la mortalité directe qui pourrait découler de l’utilisation de matériel lourd, les chemins forestiers pourraient aussi être des sources de mortalité et sont considérés comme la principale menace de l’exploitation forestière pour l’espèce (voir la rubrique « Menaces et facteurs limitatifs - Routes et voies ferrées »). Pour atténuer cette menace, le Stand and Site Guide exige que les automobilistes suivent une formation de sensibilisation et qu’une stratégie soit élaborée pour réduire la vitesse et le volume de circulation sur les chemins forestiers et, dans le secteur préoccupant de 1 km, il interdit la construction de nouvelles routes à moins de 30 m des sites de nidification ou d’habitat estival convenables à moins que des techniques soient utilisées pour éviter la mortalité routière (Ontario Ministry of Natural Resources and Forestry, 2016). Ce guide prévoit donc plusieurs mesures d’atténuation importantes pour protéger la tortue mouchetée et, ainsi, on peut supposer que l’impact global des menaces résultant de l’exploitation forestière est faible pour la population des Grands Lacs et du Saint-Laurent en dépit du chevauchement étendu de l’aire de répartition de la tortue mouchetée dans les forêts publiques provinciales où se déroulent des travaux d’exploitation forestière à grande échelle. Il n’y a pas d’éléments de preuve pour prouver ou infirmer si la mise en œuvre de ces mesures d’atténuation a réduit considérablement le niveau de menace que l’exploitation forestière pose pour la tortue mouchetée.
La foresterie ne constitue pas une menace pour la sous-population du Québec étant donné que, dans cette province, l’habitat de la tortue mouchetée se trouve dans des zones protégées ou des paysages agricoles (Dubois, comm. pers., 2014; Giguère, comm. pers., 2014). En Nouvelle-Écosse, trois sous-populations sont entourées de terres privées ou publiques provinciales où les activités d’utilisation des terres comprennent l’exploitation forestière (Caverhill, 2003; Mockford et al., 2005; Lefebvre et al., 2012).
Production d’énergie et exploitation minière
Impact global de la menace : Grands Lacs et Saint-Laurent = inconnu; Nouvelle-Écosse = faible
Hormis la perte directe d’habitat provenant de l’exploitation minière du fait du drainage des milieux humides et de la conversion des terres, l’utilisation de machines lourdes dans l’habitat de la tortue mouchetée accroît le risque de blessure et de mortalité chez les individus. En outre, les routes associées aux mines et aux projets de développement énergétique augmentent le risque de mortalité routière et entraînent d’autres répercussions liées aux routes (voir la rubrique « Menaces et facteurs limitatifs - Routes et voies ferrées »). Par ailleurs, la pollution provenant des mines a été confirmée dans l’habitat de la tortue mouchetée; elle pourrait constituer une source de mortalité et entraîner l’affaiblissement des individus et réduire le succès de nidification (voir la rubrique « Menaces et facteurs limitatifs - Pollution »). Des données selon lesquelles la tortue mouchetée fréquente des zones minières ont été recueillies à l’échelle de l’aire de répartition de l’espèce. En Nouvelle-Écosse, on a observé des individus qui nidifiaient dans des résidus miniers et qui utilisaient des étangs miniers comme habitat (Caverhill, 2006), et une sous-population est présente dans un paysage où se déroulent actuellement des travaux d’extraction de gravier (Caverhill, 2003; Mockford et al., 2005; Lefebvre et al., 2012). Des droits d’extraction minière existants risquent de retarder la protection de plusieurs secteurs contenant un habitat essentiel à la tortue mouchetée en Nouvelle-Écosse, y compris un site d’hivernage crucial (Province of Nova Scotia, 2013). Au Québec, des tortues mouchetées suivies par radiotélémétrie auraient traversé des carrières durant leurs déplacements terrestres et 32 % des nids ont été construits dans des carrières (Dubois et al., 2012). En Ontario, le domaine vital d’une tortue mouchetée suivie par radiotélémétrie chevauchait considérablement une mine d’or en exploitation (OMNRF Timmins District, données inédites) et on a observé des tortues qui utilisaient des bassins de gravière comme habitat (Schueler, comm. pers., 2015).
En Ontario, il existe une multitude de concessions minières actives (Ministry of Northern Development and Mines, 2014), 29 mines d’or et de métaux communs en exploitation (Ontario Mining Association, 2014) et des centaines de carrières et sablières en exploitation (Ontario Ministry of Natural Resources and Forestry, 2012) qui se situent dans l’aire de répartition de la tortue mouchetée. Entre 2013 et 2016, il y a eu trois demandes de permis d’avantage plus que compensatoire en vertu de la LVDE pour des projets miniers (un projet a été approuvé et deux ont été proposés) dans l’habitat de la tortue mouchetée (Ontario Government, 2016). Chacun de ces projets entraînera une perte nette d’habitat (retrait de 16 à 23 ha de l’habitat résultant de deux projets et retrait d’un nombre d’hectares non précisé pour un troisième projet visant 472 ha de terres publiques); toutefois, un promoteur a accordé une servitude de conservation de 259 ha, ce qui accroîtra la superficie de l’habitat protégé à la disposition de la tortue mouchetée (Ontario Government, 2016). Au nombre d'autres mesures de compensation pour la perte d’habitat figurent l’installation de clôtures, la construction d’écopassages et l’amélioration de l’habitat restant par l’aménagement d’un exutoire de milieux humides ou de microhabitats de nidification et de structures d’exposition au soleil (Ontario Government, 2016).
Dans le sud-ouest de l’Ontario, entre 2011 et 2016, il y a eu cinq demandes d’autorisation de projet d’énergie renouvelable visant des projets d’énergie éolienne à mettre en œuvre dans l’habitat de la tortue mouchetée (Government of Ontario, 2016). Un seul de ces cinq projets nécessitait un permis d’avantage plus que compensatoire en vertu de la LEVD pour obtenir l’autorisation de projet d’énergie renouvelable (Government of Ontario, 2016). Chacune de ces de demandes d’autorisation a fait l’objet d’un appel à la lumière de « dommages graves et irréversibles à la tortue mouchetée » découlant du risque accru de mortalité sur les routes et du meilleur accès à l’habitat offert aux prédateurs et aux braconniers en raison de la construction ou de la réfection de chemins d’accès de même que l’accroissement de la prédation des nids (étant donné que les tortues pourraient commencer à nidifier dans des zones facilement accessibles comme les routes d’accès, les plateformes de grue et les bases des turbines). Le Tribunal de l’environnement a maintenu deux demandes d’autorisation de projet d’énergie éolienne (en raison d’un manque de preuves attestant le risque de dommages causés à la tortue mouchetée ou parce que l’enjeu a été soulevé trop tard durant l’instance pour permettre l’appel au motif du risque de dommages à la tortue mouchetée; Government of Ontario, 2016). Deux autres projets de production d’énergie éolienne sont toujours en appel et l’approbation d’un cinquième parc éolien a été révoquée de manière définitive en juin 2016 après quatre ans d’appels (Government of Ontario, 2016; The Toronto Star, 6 juin 2016); le Tribunal a conclu que les menaces possibles que ce projet de parc éolien de 324 ha fait peser sur la tortue mouchetée ne pouvaient pas être atténuées de façon efficace (Aware Simcoe, 5 juillet 2013). Cette décision pourrait influer sur le sort réservé aux deux projets d’énergie éolienne encore en appel. Une étude menée pendant 14 ans sur une sous-population de tortues du désert (Gopherus agassizii) dans un grand parc éolien de la Californie a révélé que les activités de production d’énergie éolienne et les travaux de construction contribuaient directement à la destruction de l’habitat et à la mortalité des tortues, mais que la sous-population semblait stable dans son ensemble et ne présentait pas de différences par rapport à d’autres sous-espèces vivant dans des milieux plus naturels pour ce qui est de la mortalité, de la densité, de la croissance, de la maturité, de la démographie ou de l’écologie de la nidification; toutefois, ces résultats n’étaient que corrélatifs étant donné qu’il ne s’agissait pas d’une étude avant-après-contrôle-impact (BACI) qui comportait des données comparatives avant les travaux sur la sous-population permettant d’établir un lien de cause à effet (Lovich et al., 2011; Ennen et al.,2012). Les répercussions sur les tortues d’eau douce découlant des projets de production d’énergie éolienne n’ont pas été étudiées; on ignore donc si les parcs éoliens causeraient des dommages graves à la tortue mouchetée ou à son habitat.
Intrusions et perturbations humaines
Impact global de la menace : Grands Lacs et Saint-Laurent = faible; Nouvelle-Écosse = faible
Dans deux sites lacustres du sud-ouest de l’Ontario, on a observé des tortues mouchetées mortes et vivantes dont la dossière portait des blessures infligées par des hélices de bateau (Gillingwater et Brooks, 2001; Davy, données inédites; Gillingwater, données inédites) et environ 10 % des tortues capturées dans l’un des sites présentaient des cicatrices sur la dossière provenant de coups d’hélice (Davy, données inédites). Il est probable que la mortalité due aux bateaux présente aussi une menace pour d’autres sous-populations où la navigation de plaisance est courante. L’envergure de la menace en Nouvelle-Écosse n’est pas connue, mais on croit qu’une tortue est morte après avoir été heurtée par une embarcation à moteur (Nova Scotia Blanding’s Turtle Database, 2014).
À l’échelle de son aire de répartition au Canada, on sait que la tortue mouchetée se déplace le long de pistes pour véhicules tout terrain (VTT) ou pour vélos ainsi que dans d’anciennes carrières utilisées par des VTT, qu’elle les traverse ou qu’elle y nidifie (Dubois et al., 2012; Nova Scotia Blanding's Turtle Database, 2014; Gillingwater, données inédites; données du CIPN). Cette situation présente un risque de mortalité chez les individus et un risque de dommages pour les nids et l’habitat. Des individus vivants ou morts ont été signalés sur des pistes de VTT actives en Ontario (données du CIPN). Dans le district de Sudbury, des VTT et des camionnettes à quatre roues motrices empruntent souvent des fossés aquatiques peu profonds ou des ornières de pistes inondées utilisés par des tortues juvéniles et adultes et traversent des sites de nidification situés le long d’un remblai de chemin de fer; il se pourrait que les femelles de cette sous-population nidifient aussi sur une voie cyclable ou à proximité de celle-ci, d’où le risque de mortalité des nouveau-nés du fait de la présence de vélos (Woods, 2014). En Nouvelle-Écosse, plusieurs nids ont été perturbés ou détruits par des VTT et des motos tout terrain dans d’anciennes carrières (Nova Scotia Blanding’s Turtle Database, 2014) et la mortalité due aux véhicules hors route est considérée comme une menace importante et accrue, qui a été désignée de source de préoccupation élevée dans le programme de rétablissement (Parks Canada, 2012).
Agriculture
Impact global de la menace : Grands Lacs et Saint-Laurent = faible; Nouvelle-Écosse = négligeable
Dans la région des Grands Lacs et du Saint-Laurent, la conversion à grande échelle des milieux humides en terres agricoles s’est produite du début du 19e siècle jusqu’au milieu du 20e siècle (voir la rubrique « Tendances en matière d’habitat »); par conséquent, l’expansion agricole se poursuit progressivement, mais on estime qu’elle n’entraînera pas d’importantes réductions de l’habitat de la tortue mouchetée au cours des dix prochaines années. L’exploitation et les machines agricoles continent de poser un risque de mortalité pour les individus, les nids et les nouveau-nés : on observe souvent des tortues mouchetées traverser des champs agricoles ou y nidifier, et même se servir de champs inondés comme aires de rassemblement avant la nidification (Caverhill, 2003; Mockford et al., 2005; Dubois et al., 2012; Lefebvre et al., 2012; Dillon Consulting, 2014; Environment Canada, 2014). En effet, il existe des mentions d’adultes qui ont été tués par des machines agricoles (données du CIPN). Une plantation d’arbres de Noël adjacente à l’une des sous-populations de la Nouvelle-Écosse pourrait entraîner la fragmentation de l’habitat, et les véhicules circulant dans les fermes peuvent poser un risque de mortalité pour les tortues, en particulier les femelles adultes qui sont attirées dans ces secteurs pour y nidifier (Caverhill, 2006; annexe 2a, Calculateur de menaces - Population de la Nouvelle-Écosse). Le ruissellement des terres agricoles peut également dégrader les milieux humides en raison de la pollution et de la sédimentation (voir la rubrique « Menaces et facteurs limitatifs - Pollution »).
Changements climatiques
Impact global de la menace : Grands Lacs et Saint-Laurent = inconnu; Nouvelle-Écosse = faible
Selon une étude récente des variations dans la répartition des reptiles dans la région des Grands Lacs attribuables aux changements climatiques, la tortue mouchetée semble très sensible aux changements climatiques (King et Niiro, 2013), possiblement en raison de son faible maximum thermique critique (Hutchinson et al., 1966). Au moyen de la modélisation de la niche écologique, on a caractérisé l’association entre les variables climatiques et la répartition actuelle de l’espèce. Les modèles ont permis de bien établir la répartition actuelle et cette information a ensuite été utilisée pour prévoir des zones futures caractérisées par des conditions climatiques très favorables. Pour la tortue mouchetée, sept variables climatiques ont été intégrées aux modèles (température annuelle moyenne, plage diurne moyenne, isothermalité, saisonnalité des températures, précipitation annuelle, précipitation du mois le plus humide, précipitation du mois le plus sec). Pour quantifier le changement de l’adéquation des conditions climatiques à la lumière de ces variables,
- on a comparé les localités connues de la tortue mouchetée par rapport à la zone en dépassement des seuils d’adéquation élevée des conditions climatiques et
- on a comparé la superficie de la zone atteignant un seuil donné par rapport à la superficie du secteur géographique afin de permettre l’augmentation de la superficie de la zone jugée à climat convenable.
Les modèles fondés sur des scénarios d’émissions de gaz à effet de serre élevées par rapport à modérées prévoyaient que, d’ici 2050, seuls 25 à 50 % des localités actuelles de la tortue mouchetée à l’échelle de son aire de répartition comporteraient toujours des conditions climatiques convenables et que ce pourcentage descendrait sous 25 % d’ici 2080. Selon le scénario d’émissions de gaz à effet de serre élevées, la majorité de la superficie occupée actuellement en Ontario présenterait des conditions climatiques peu favorables à cette espèce d’ici 2080 et, dans l’extrême sud-ouest de l’Ontario, l’adéquation des conditions climatiques serait nulle. Même selon le scénario plus prudent prévoyant des « émissions modérées », la majeure partie du sud-ouest de l’Ontario deviendrait, selon les prévisions, un secteur peu convenable d’ici 2080. Comme le paysage est très fragmenté dans le sud-ouest de l’Ontario, les individus ne pourront pas migrer vers le nord en raison du réchauffement, et il faudra peut-être procéder à leur relocalisation pour en assurer la préservation.
On a déjà signalé la persistance de bas niveaux d’eau dans les milieux humides côtiers du lac Érié et du lac Huron depuis la fin des années 1990 et le début des années 2000, respectivement (Great Lakes Wetlands, 2011; Mackenzie et al., 2014). On prévoit que le niveau d’eau des Grands Lacs diminuera d’un autre mètre d’ici 2036, ce qui mettra en péril l’existence de cet habitat côtier dynamique et des espèces qui l’utilisent (Great Lakes Wetlands, 2011).
Pollution
Impact global de la menace : Grands Lacs et Saint-Laurent = inconnu; Nouvelle-Écosse = inconnu
Les effets de la pollution sur la tortue mouchetée n’ont pas été étudiés et sont mal compris; toutefois, des études menées sur la chélydre serpentine sympatrique (une espèce qui a en commun avec la tortue mouchetée bon nombre des mêmes parcelles d’habitat et habitudes alimentaires) ont révélé une réduction du succès d’éclosion et une hausse du taux de difformité attribuables à des concentrations élevées de contaminants comme les BPC et les composés organochlorés (Bishop et al., 1991, 1998; de Solla et al., 2008). En outre, plusieurs études portant sur des tortues d’eau douce d’Amérique du Nord ont révélé une baisse du nombre de tortues, ou même l’absence de tortues, dans les secteurs caractérisés par une dégradation de la qualité de l’eau et des niveaux élevés de polluants urbains, industriels et agricoles (Moll et Moll, 2004), ce qui laisse entendre qu’une forte pollution peut être une cause de mortalité ou faire de l’habitat un endroit qui ne convient plus à l’espèce.
Dans le sud-ouest de l’Ontario, le lac Érié reçoit la majorité de son eau des rivières St. Clair, Detroit, Sydenham, Thames et Grand, lesquelles se trouvent toutes dans le paysage agricole le plus fortement utilisé au Canada, d’où l’afflux important de résidus de pesticides et la charge en éléments nutritifs provenant de l’élevage et de l’agriculture (Environment Canada et United States Environmental Protection Agency, 2008; Lake Erie LaMP, 2011; UTRCA, 2012; International Joint Commission, 2014). En outre, la contamination chimique est probablement marquée dans les milieux humides intérieurs se trouvant dans les paysages fortement urbanisés et agricoles du sud-ouest de l’Ontario et du sud-ouest du Québec. Dans le district de Sudbury, en Ontario, l’exploitation forestière et minière a eu pour effet de déverser de l’acide sulfurique et des métaux lourds dans des cours d’eau locaux fréquentés par la tortue mouchetée; quatre affluents sur cinq contenaient des effluents miniers traités ou étaient contaminés par le drainage de surface, et le lit d’un tronçon de ruisseau était fortement contaminé par du créosote avant qu’il en soit éliminé en 2007 (Woods, 2014). En Ontario et en Nouvelle-Écosse, les mines aurifères et leurs résidus posent un risque de contamination de l’eau et du sol dans l’habitat de la tortue mouchetée. Des études menées le long d’affluents du fleuve Saint-Laurent ont permis de déceler la présence de métaux lourds dans les œufs de chélydre serpentine, dont du mercure dans tous les échantillons (Bonin et al., 1995; Bishop et al., 1998). En Nouvelle-Écosse, les milieux humides, y compris ceux fréquentés par la tortue mouchetée, présentent une teneur en mercure anormalement élevée en raison de l’interaction des dépôts atmosphériques avec la géologie du secteur (Sicliano et al., 2003); des taux de mercure élevés ont été constatés chez le Plongeon huard (Gavia immer) dans cette région (Sicliano et al., 2003). Au nombre des autres sources de pollution possibles en Nouvelle-Écosse figurent une écloserie ainsi que des plantations d’arbres de Noël dans des secteurs jouxtant l’habitat de la tortue mouchetée (voir l’annexe 2, Calculateur de menaces - Population de la Nouvelle-Écosse).
Nombre de localités
Le terme « localité » désigne une zone particulière du point de vue écologique et géographique dans laquelle un seul phénomène menaçant peut affecter rapidement tous les individus du taxon considéré. La taille de la localité est fonction de la superficie touchée par le phénomène menaçant et peut comprendre une partie d’une ou de nombreuses sous-populations. Lorsqu’un taxon est touché par plus d’un phénomène menaçant, il faut définir la localité en tenant compte de la menace plausible la plus grave (IUCN, 2014).
Il est très difficile de déterminer le nombre précis de localités étant donné que les menaces qui pèsent sur la tortue mouchetée sont nombreuses et peuvent se produire selon diverses échelles spatiales. Toutefois, si nous estimons qu’un bassin hydrographique constitue l’échelle de base à laquelle un seul phénomène menaçant (p. ex., la création d’une grande route ou un hiver très rigoureux) pourrait entraîner la disparition locale de l’espèce, on peut compter qu’il y a probablement de 50 à 100 localités pour la tortue mouchetée en Ontario, de 2 à 5 localités au Québec et de 3 à 5 localités en Nouvelle-Écosse.
Protection, statuts et classements
Statuts et protection juridiques
Canada
Au Canada, la population des Grands Lacs et du Saint-Laurent a été désignée comme menacée, et la population de la Nouvelle-Écosse, comme en voie de disparition. Les deux populations sont protégées en vertu de l’annexe 1 de la Loi sur les espèces en péril du gouvernement fédéral (2002). (L.C. 2002, ch. 29); il est donc illégal de tuer, de blesser, de harceler ou de capturer cette espèce ou de détruire ses résidences sur les terres fédérales. Une proposition de programme de rétablissement conforme à la LEP pour la population des Grands Lacs et du Saint-Laurent (Environment Canada, 2016) a été affichée sur le site Web de la LEP à des fins d’examen public le 29 mars 2016; on y désigne les zones d’habitat essentiel et des mesures de rétablissement pour cette espèce (Environment Canada, 2016). En Nouvelle-Écosse, un programme de rétablissement conforme à la LEP est déjà en place (Parks Canada, 2012), et la version préliminaire d’un plan d’action est en cours d’élaboration. L’habitat essentiel a été désigné pour les sous-populations connues, à l’exception des sous-populations NS4 et NS7, nouvellement découvertes, et d’une extension récemment découverte de la sous-population NS1 (Parks Canada, 2012; Nova Scotia Blanding’s Turtle Database, 2014). L’habitat essentiel de la sous-population NS1 se trouve sur le territoire domanial; des pratiques de gestion particulières y sont mises en œuvre en saison afin de réduire les risques pour la tortue (Parks Canada, 2010). Plusieurs mesures de rétablissement visant la population de la Nouvelle-Écosse sont en cours : protection de l’habitat, programme de protection des nids annuel, programme de lâcher de juvéniles, panneaux de signalisation routière et programmes d’intendance et de sensibilisation (Caverhill, 2006; Parks Canada, 2012).
Ontario
En Ontario, la tortue mouchetée est une espèce menacée aux termes de la Loi de 2007 sur les espèces en voie de disparition (S.O. 2007, c. 6) (LEVD), ce qui signifie qu’il est interdit de tuer, de blesser, de harceler, de capturer, de collectionner, de transporter, de posséder, d’acheter, de vendre ou d’échanger une tortue mouchetée. En 2013, on a conféré à la tortue mouchetée la protection générale de son habitat en vertu de la LEVD, et le ministère des Richesses naturelles et des Forêts de l’Ontario a publié une Description générale de l’habitat et des menaces pesant sur l’espèce (Ontario Ministry of Natural Resources and Forestry, 2013a) pour fournir des conseils sur la désignation de l’habitat de la tortue mouchetée et la mise en œuvre de la protection de l’habitat de cette espèce en vertu de la LEVD. Cette description générale désigne l’habitat de cette espèce comme étant les milieux humides convenables situés à moins de 2 km d’une observation (dans la mesure où la distance qui sépare ces milieux humides n’est pas supérieure à 500 m) de même qu’une bande tampon de 250 m entourant ces milieux humides. Pour réaliser un projet de développement dans l’habitat d’une espèce protégée, les promoteurs doivent obtenir une approbation en vertu de la LEVD (c.-à-d. un permis, un accord ou une exemption réglementaire). Tous les types d’approbation accordés en vertu de la LEVD exigent la mise en œuvre de mesures d’atténuation (p. ex., échelonner le travail pour éviter certaines périodes sensibles ou poser une clôture temporaire autour des zones de construction) afin de réduire les effets négatifs sur l’espèce qui sera touchée (Ontario Ministry of Natural Resources and Forestry, 2014b). Les permis d’avantage plus que compensatoire exigent davantage : les promoteurs sont tenus de réaliser une activité qui accroîtra le nombre d’individus, l’aire de répartition, la viabilité de la population ou la qualité/quantité de l’habitat à la disposition de l’espèce (c’est-à-dire, procurer un « avantage plus que compensatoire »); les conditions du permis exigent aussi la surveillance des effets et de l’efficacité des mesures, de même que la présentation de rapports périodiques au ministère des Richesses naturelles et des Forêts pour attester la conformité (Ontario Ministry of Natural Resources and Forestry, 2014b, 2014c). Les exemptions réglementaires (Ontario Regulation 242/08) adoptées en 2013 visent plusieurs types d’industries et de projets de développement; la surveillance assurée par le ministère des Richesses naturelles et des Forêts est grandement réduite et il appartient aux promoteurs de déterminer l’admissibilité de leurs projets et d’interpréter les règles publiées sur le site Web du ministère des Richesses naturelles et des Forêts (Ontario Ministry of Natural Resources and Forestry, 2014b). Ces changements réglementaires apportés à la LEVD sont actuellement contestés devant les tribunaux (Ontario Nature, 2015). L’habitat de la tortue mouchetée jouit également de protections en vertu de la Déclaration de principes provinciale de la Loi sur l’aménagement du territoire de l’Ontario de 1990 (S.O. 1990, c. P.13) et l’espèce est inscrite à titre de reptile spécialement protégé en vertu de la Loi de 1997 sur la protection du poisson et de la faune de l’Ontario (S.O. 1997, c. 41). Le Stand and Site Guide figurant à la Loi sur la durabilité des forêts de la Couronne (S.O. 1994, c. 25) prévoit aussi des périodes d’échelonnage et d’autres conditions permettant de réduire les risques pour la tortue mouchetée et son habitat durant les travaux d’exploitation forestière (voir la rubrique « Menaces - Exploitation forestière et récolte du bois »).
Québec
Au Québec, la tortue mouchetée est inscrite comme espèce menacée à la liste de la Loi sur les espèces menacées ou vulnérables, 1989 (RLRQ, ch. E-12.01). En tant qu’espèce menacée, elle est protégée en vertu de la Loi sur la conservation et la mise en valeur de la faune, 2002 (RLRQ, ch. C-61.1) (LCMVF). Aux termes de l’article 26 de la LCMVF, nul ne peut déranger, détruire ou endommager le nid ou les œufs d’un animal. Il est également interdit de capturer, de chasser et/ou de garder en captivité toute espèce de tortue indigène au Québec. L’habitat aquatique des tortues au Québec est également indirectement protégé par l’article 128.6 de la LCMVF. Parce que cette tortue est une espèce essentiellement aquatique, son habitat bénéficie de la protection générale de la Loi sur la qualité de l'environnement (RLRQ, ch. Q-2) et en particulier de la Politique de protection des rives, du littoral et des plaines inondables (RLRQ, ch. Q-2, art. 2.1).
Nouvelle-Écosse
En Nouvelle-Écosse, la tortue mouchetée a été désignée espèce en voie de disparition par la Province en 2000 et elle jouit d’une protection en vertu de l’Endangered Species Act de la province (NSESA 1998, c. 11, s. 1), laquelle interdit de tuer, de blesser, de perturber, d’acheter, de vendre et d’échanger des espèces inscrites ainsi que de détruire ou de perturber leurs lieux de résidence. Cette loi contient également des dispositions selon lesquelles le ministre peut désigner un habitat principal et établir des règlements visant cet habitat. Il existe plusieurs autres outils législatifs pouvant procurer une protection aux tortues ou à leur habitat, notamment les suivants : Provincial Parks Act, Crown Lands Act, Wildlife Act, Environment Act, Forests Act, Special Places Protection Act, Nova Scotia Wetland Conservation Policy et Wilderness Areas Protection Act.
États-Unis
Aux États-Unis, la tortue mouchetée est considérée comme une candidate à l’inscription (catégorie 2) aux termes de l’Endangered Species Act (Congdon et al., 2008); elle jouit toutefois d’une protection à des degrés divers en vertu de règlements d’État dans tous les États où elle est présente (CITES, 2013).
International
En mars 2013, la CITES a inscrit la tortue mouchetée à son annexe II; le commerce international dont elle fait l’objet est maintenant réglementé (CITES, 2013).
Statuts et classements non juridiques
Le COSEPAC a donné le statut d’espèce menacée à la population de la Nouvelle-Écosse en 1993 et a élevé son statut à celui d’espèce en voie de disparition à l’issue d’une réévaluation de sa situation effectuée en 2005. À ce moment-là, il aussi accordé le statut d’espèce menacée à la population des Grands Lacs et du Saint-Laurent (elle n’était pas inscrite avant 2005). La cote générale attribuée à la tortue mouchetée au Canada est passée de « non en péril » en 2000, à « possiblement en péril » en 2005, puis à « en péril » en 2010 (Wild Species, 2010). Les cotes de conservation de cette espèce sont les suivantes : « gravement en péril » (S1) en Nouvelle-Écosse et au Québec et « vulnérable » en Ontario (S3) et au Canada (N3; NatureServe, 2014). Fait intéressant, la tortue mouchetée est « apparemment non en péril » aux États-Unis (N4) et dans son aire de répartition à l’échelle internationale (G4) malgré qu’elle soit inscrite comme étant à un certain niveau de péril (soit de S1 à S3) dans 14 des 15 États où elle est présente; dans 13 de ces États, la tortue mouchetée est considérée comme une « espèce nécessitant grandement des mesures de conservation » (voir le tableau 3 qui contient une liste complète des cotes de conservation). L’espèce est jugée « non en péril » (S4) uniquement dans un des 18 territoires où elle est présente en Amérique du Nord; il y a, au Nebraska, une sous-population exceptionnellement nombreuse de plus de 130 000 adultes dans une vaste réserve faunique (~ 29 000 ha) qui jouit d’une protection depuis près d’un siècle (U.S. Fish and Service Service, 2014). La taille de cette population du Nebraska témoigne de l’abondance historique caractéristique des sous-populations de tortues non perturbées, une situation qui se fait de plus en plus rare. Les autres sous-populations présentes dans l’aire de répartition de l’espèce sont souvent de petite taille et localisées, allant de quelques dizaines à une centaine de tortues (Congdon et al., 2008; van Dijk et Rhodin, 2013; le présent rapport). En 2010, le statut de la tortue mouchetée est passé, selon la liste rouge de l’IUCN, de « risque faible, quasi menacée » à « en danger » selon le critère A2cde+4ce, ce qui signifie qu’il existe des éléments de preuve attestant un vaste déclin chez la plupart des sous-populations ainsi qu’un lent rétablissement possible (van Dijk et Rhodin, 2013); d’après cette évaluation, la population générale de tortues mouchetées a diminué de ≥ 80 % sur les trois dernières générations.
| Territoire | Statut | Cote de conservation |
|---|---|---|
| Mondial | Menacée d’extinction (IUCN) | G4 |
| Pays | Pays | Pays |
| Canada | Menacée (Grands Lacs/Saint-Laurent); en voie de disparition (Nouvelle-Écosse) | N3 |
| États-Unis | Candidate à l’inscription (catégorie 2) | N4 |
| Provinces | Provinces | Provinces |
| Ontario | Menacée | S3 |
| Nouvelle-Écosse | En voie de disparition | S1 |
| Québec | Menacée | S1 |
| États | États | États |
| Illinois | En voie de disparition (endangered); SGCN | S3 |
| Indiana | En voie de disparition (endangered); SGCN | S2 |
| Iowa | Menacée (threatened); SGCN | S3 |
| Maine | En voie de disparition (endangered); SGCN | S2 |
| Massachusetts | Menacée (threatened); SGCN | S2 |
| Michigan | Protégée (protected); SGCN | S3 |
| Minnesota | Menacée (threatened); SGCN | S2 |
| Missouri | En voie de disparition (endangered); SGCN | S1 |
| Nebraska | Protégée (protected); SGCN | S4 |
| New Hampshire | En voie de disparition (endangered); SGCN | S1 |
| New York | Menacée (threatened); SGCN | S2S3 |
| Ohio | Protégée (protected) | S2 |
| Pennsylvanie | Protégée (protected) ; SGCN | S1 |
| Dakota du Sud | SGCN | S1 |
| Wisconsin | Menacée (threatened); SGCN | S3S4 |
Sources : CITES 2013; NatureServe 2014
G = Cote mondiale; N = Cote nationale; S = Cote infranationale;
1 = Gravement en péril; 2 = En péril; 3 = Vulnérable; 4 = Apparemment non en péril; 5 = Non en péril
SGCN = Désignation par l’État comme espèce nécessitant grandement des mesures de conservation (« Species of Greatest Conservation Need »)
Protection et propriété de l’habitat
En Ontario, la tortue mouchetée est présente dans au moins 119 aires protégées, dont 53 parcs provinciaux et nationaux, 34 aires de conservation, 8 réserves de faune provinciales et nationales, 6 réserves naturelles, 5 propriétés de la Défense nationale, 5 réserves de Premières Nations, 3 refuges, 2 lieux historiques nationaux, 1 réserve de gibier, 1 réserve faunique et 1 aire de gestion de la faune. En tout, il y a plus de 1 000 000 ha de terres protégées en Ontario où la tortue mouchetée est présente, du moins dans certaines parcelles de ces terres.
Au Québec, environ 21 000 ha de l’habitat de la tortue mouchetée sont protégés au sein de terres appartenant au gouvernement provincial, au gouvernement provincial et à des organismes de conservation, y compris un parc régional, une réserve nationale de faune et une réserve de Premières Nations (Bernier, comm. pers., 2014; Environment Canada, 2014).
En Nouvelle-Écosse, la sous-population NS1 se trouve principalement dans les limites d’une aire protégée, à l’exception d’une extension récemment découverte comportant une petite concentration de tortues (Parks Canada, 2012; Nova Scotia Blanding’s Turtle Database, 2014). Les sous-populations NS2 et NS3 sont présentes dans une combinaison de terres privées et publiques provinciales (McNeil, 2002; Caverhill, 2006; Lefebvre, 2009). De 2008 à 2013, le Nova Scotia Nature Trust a protégé officiellement six autres parcelles d’habitat totalisant 103 ha pour ces sous-populations (Porter, comm. pers., 2014). En 2003, une importante parcelle d’habitat essentiel (102 ha) a été protégée par l’entreprise forestière privée qui en était propriétaire. Cet habitat a depuis été acheté par la Province de la Nouvelle-Écosse. Plusieurs grandes parcelles de terres publiques provinciales où se trouve l’habitat de la tortue mouchetée, y compris la parcelle achetée par l’entreprise forestière, ont fait l’objet d’une proposition en vue de leur protection conformément à l’obligation de la Province de protéger au moins 12 % des terres provinciales d’ici 2015 (Province of Nova Scotia, 2013). Le 29 décembre 2015, la parcelle qui contenait des terres entourant l’habitat de la sous-population NS4 était officiellement désignée. Les parcelles entourant l’habitat des sous-populations de plus grande taille, NS2 et NS3, sont en attente de désignation, sous réserve d’une décision concernant les droits miniers. Si elle a lieu, la désignation de ces aires protégées accroîtra considérablement la proportion de l’habitat de la tortue mouchetée qui est protégée en Nouvelle-Écosse, ce qui comprend des sites renfermant certains des sites d’hivernage et d’estivage les plus importants pour l’espèce.
Il faut se demander si ces aires protégées au Canada peuvent servir de refuge à la tortue mouchetée; en effet, le réseau routier dense et les nombreux amateurs d’activités récréatives qui se trouvent dans bon nombre de ces aires font augmenter le risque de mortalité routière et de piégeage (voir la rubrique « Menaces et facteurs limitatifs »). La plupart des menaces constatées et des déclins observés dont il est question dans le présent rapport ont d’ailleurs été relevés dans des aires protégées. Crowley et Brooks (2005) ont constaté que la densité routière moyenne dans les parcs provinciaux se trouvant dans l’aire de répartition des reptiles de l’Ontario était près du double de la moyenne provinciale, d’où la possibilité que ces aires deviennent des puits de population provinciaux plutôt que des abris sûrs. D’après Phillips et Murray (2005), la densité des prédateurs favorisés par les activités humaines dans un parc protégé du sud-ouest de l’Ontario était quatre fois supérieure à la moyenne générale des zones rurales de la province. La plupart des sous-populations de tortues mouchetées qui ont été étudiées sont présentes dans des aires protégées; toutefois, les données disponibles donnent fortement à croire que les tortues mouchetées présentes dans plusieurs des aires protégées à l’échelle de leur aire de répartition au Canada sont en déclin en raison de diverses menaces (voir les rubriques « Menaces et facteurs limitatifs » et « Fluctuations et tendances »).
Remerciements et experts contactés
Teresa Piraino tient à remercier énormément le Zoo de Toronto qui a versé des fonds pour permettre la réalisation de deux analyses quantitatives à l’appui du présent rapport de situation, en vue d’estimer le déclin antérieur et futur de la tortue mouchetée en Ontario. Elle remercie également Matt Keevil, David Seburn et Kari Gunson d’avoir préparé ces analyses. Elle est de plus extrêmement reconnaissante au Service canadien de la faune et à Environnement Canada d’avoir retenu les services de P. A. Bernier concernant la préparation de la version anglaise d’un rapport sommaire exhaustif concernant les travaux de recherche sur la tortue mouchetée réalisés au Québec; ce document d’appui a été d’une grande utilité pour intégrer au rapport de situation les résultats des études menées au Québec. Madame Piraino souhaite aussi remercier Ontario Nature d’avoir pris le temps de fournir un résumé des registres détaillés pour cette espèce par écorégion. Elle remercie également MMM Group Ltd. de lui avoir permis d’exécuter ce contrat et d’avoir versé des fonds en nature en vue de sa réalisation. En dernier lieu, Mme Piraino souhaite exprimer sa gratitude à l’équipe de rétablissement des tortues du Québec, à Jackie Litzgus, Ph. D., à Ron Brooks, Ph. D., à Joe Crowley et à Scott Gillingwater, qui ont été une source importante de renseignements, de commentaires et de conseils au cours de la préparation du présent rapport.
Jeffie McNeil aimerait remercier l’équipe de rétablissement des tortues mouchetées de la Nouvelle-Écosse pour les conseils et le soutien qu’elle a offerts dans l’élaboration du présent rapport et la préparation du calculateur de menaces. Elle tient également à souligner la contribution des nombreux bénévoles, étudiants, stagiaires et employés aux travaux de recherche sur la tortue mouchetée et aux efforts de rétablissement au fil des années; les données qu’ils ont permis de recueillir ont été des plus précieuses pour la préparation du rapport.
Enfin et surtout, Mmes Piraino et McNeil souhaitent remercier Tom Herman, Terry Power et Brian Eaton, qui ont préparé le premier rapport de situation du COSEPAC de 1993 sur la tortue mouchetée au Canada ainsi que Chris Edge et Steve Jones, qui ont mis à jour le rapport de situation en 2005. Ces rapports ont constitué le fondement du rapport de situation mis à jour de 2015.
Experts contactés
Algar, Dave
Gestionnaire, Conservation des ressources (retraité)
Parcs Canada
Maitland Bridge (Nouvelle-Écosse)
Andrews, Carolyn
Permits and Agreements Analyst
Direction des espèces en péril
Ministère des Richesses naturelles et des Forêts de l’Ontario
Peterborough (Ontario)
Barkley, Erica
Écologiste adjointe
Parcs Ontario - zone du sud-est
Kingston (Ontario)
Baxter-Gilbert, James
Candidat au doctorat
Département des sciences biologiques
Université Macquarie
Sydney, Australie
Bennett, Amanda
Chercheuse postdoctorale
Integrative Wildlife Conservation Lab
Université Trent
Peterborough (Ontario)
Benvenuti, Jodi
Management Biologist
Ministère des Richesses naturelles et des Forêts de l’Ontario
Midhurst (Ontario)
Bernier, Pierre-André
Biologiste
Équipe de rétablissement des tortues du Québec
Québec (Québec)
Blaney, Sean
Botaniste/directeur adjoint
Centre de données sur la conservation du Canada Atlantique
Sackville (Nouveau-Brunswick)
Blouin-Demers, Gabriel, Ph. D.
Professeur titulaire de biologie
Université d’Ottawa
Ottawa (Ontario)
Boates, Sherman
Wildlife Manager, Biodiversity
Division de la faune, ministère des Ressources naturelles de la Nouvelle-Écosse
Kentville (Nouvelle-Écosse)
Brdar, Corina
Zone Ecologist
Ministère des Richesses naturelles et des Forêts de l’Ontario
Zone des parcs du sud-est
Kingston (Ontario)
Brooks, Ron
Professeur émérite
Université de Guelph
Guelph (Ontario)
Brownell, Vivian
Senior SAR Biologist
Ministère des Richesses naturelles et des Forêts de l’Ontario
Section du rétablissement des espèces en péril
Peterborough (Ontario)
Cairns, Melody
Zone Ecologist
Ministère des Richesses naturelles et des Forêts de l’Ontario
Zone des parcs du sud-ouest
London (Ontario)
Cameron, Graham
Management Biologist
Ministère des Richesses naturelles et des Forêts de l’Ontario
Bancroft (Ontario)
Carstairs, Sue
Executive and Medical Director
Kawartha Turtle Trauma Centre
Peterborough (Ontario)
Churchill, James
Gestionnaire de données
Centre de données sur la conservation du Canada Atlantique
Sackville (Nouveau-Brunswick)
Clapp, Diane
Bénévole
Smith’s Cove (Nouvelle-Écosse)
Clapp, Harold
Bénévole
Smith’s Cove (Nouvelle-Écosse)
Copeland, Todd
Spécialiste des espèces en péril
Section des ressources de la région du nord-est
Ministère des Richesses naturelles et des Forêts de l’Ontario
Timmins (Ontario)
Crowley, Joe
Herpétologue spécialiste des espèces en péril
Direction des espèces en péril
Ministère des Richesses naturelles et des Forêts de l’Ontario
Peterborough (Ontario)
Crowley, Megan
Agente de la gestion des ressources
Parcs Canada
Maitland Bridge (Nouvelle-Écosse)
Davy, Christina
Boursière postdoctorale Liber Ero
Natural Resources DNA Profiling and Forensic Centre
Université Trent
Peterborough (Ontario)
Desroches, Jean-François
Biologiste
Enseignant en techniques de bioécologie
Cégep de Sherbrooke
Sherbrooke (Québec)
Dubois, Yohann
Coordonnateur, dossiers amphibiens et reptiles
Direction de la biodiversité et des maladies de la faune
Ministère des Forêts, de la Faune et des Parcs, secteur Faune et Parcs
Québec (Québec)
Edge, Chris
Boursier postdoctoral
Université de Toronto
Toronto (Ontario)
Elderkin, Mark
Biologiste des espèces en péril
Division de la faune, ministère des Ressources naturelles de la Nouvelle-Écosse
Kentville (Nouvelle-Écosse)
Feltman, Josh
Instructeur
Collège Sir Sandford Fleming
Lindsay (Ontario)
Fortin, Gabrielle
Biologiste du rétablissement des espèces en péril
Service canadien de la faune
Environnement Canada
Québec (Québec)
Frech, Troy
Bénévole
Granville Centre (Nouvelle-Écosse)
Gauthier, Isabelle
Biologiste
Coordinatrice provinciale, espèces fauniques menacées et vulnérables
Ministère des Forêts, de la Faune et des Parcs
Québec (Québec)
Giguère, Sylvain
Biologiste des espèces en péril
Service canadien de la faune
Environnement Canada
Québec (Québec)
Gillingwater, Scott
Biologiste des espèces en péril
Office de protection de la nature de la rivière Upper Thames
London (Ontario)
Gray, Colin
Bénévole
Lunenburg (Nouvelle-Écosse)
Gould, Ron
Spécialiste des aires protégées
Ministère des Richesses naturelles et des Forêts de l’Ontario
Zone des parcs du sud-ouest
London (Ontario)
Green, Norm
Bénévole
Hammonds Plains (Nouvelle-Écosse)
Green, Sue
Bénévole
Hammonds Plains (Nouvelle-Écosse)
Hathaway, Jeff
Propriétaire et exploitant
Scales Nature Park
Orillia (Ontario)
Herman, Tom
Professeur et vice-recteur aux études
Université Acadia
Wolfville (Nouvelle-Écosse)
Jeremy, Sarah
Coordonnatrice adjointe, espèces en péril
Collectivités Mi’kmaq de Kespukwitk (Nouvelle-Écosse)
Joudry, Shalan
Gestionnaire de projet, espèces en péril
Collectivités Mi’kmaq de Kespukwitk (Nouvelle-Écosse)
Kingston, Steve
Zone Ecologist
Ministère des Richesses naturelles et des Forêts de l’Ontario
Zone des parcs du nord-ouest
Thunder Bay (Ontario)
Keevil, Matt
Candidat au doctorat
Département de biologie
Université Laurentienne
Sudbury (Ontario)
Kruschenske, Lauren
Biologiste des espèces en péril
Ministère des Richesses naturelles
Pembroke (Ontario)
Litzgus, Jacqueline
Professeure
Département de biologie
Université Laurentienne
Sudbury (Ontario)
Mackenzie, Alistair
Natural Heritage Education & Resource Management Supervisor
Parcs Ontario
Grand Bend (Ontario)
Markle, Chantal
Candidate au doctorat
Université McMaster
Hamilton (Ontario)
Marks, Steve
Spécialiste des reptiles en péril
AMEC Foster-Wheeler
Windsor (Ontario)
McCarthy, Chris
Gestionnaire de la conservation des ressources
Parcs Canada
Maitland Bridge (Nouvelle-Écosse)
McCracken, Jon
Directeur des programmes nationaux
Études d’Oiseaux Canada
Port Rowan (Ontario)
McKnight, Julie
Biologiste, rétablissement des espèces en péril
Service canadien de la faune, Direction générale de l’intendance environnementale
Dartmouth (Nouvelle-Écosse)
Millar, Catherine
Instructrice
Collège La Cité
Ottawa (Ontario)
Miller, Victor
Conservation Officer/ Intelligence, Investigations Specialist
Unité des services d’enquêtes spécialisées
Direction générale de l’application de la loi
Ministère des Richesses naturelles de l’Ontario
Peterborough (Ontario)
Mockford, Steve
Professeur agrégé
Département de biologie, Université Acadia
Wolfville (Nouvelle-Écosse)
Morin, Ryan
Biologiste des espèces en péril
Burlington (Ontario)
Morris, Edward
Zone Ecologist
Ministère des Richesses naturelles et des Forêts de l’Ontario
Zone du nord-est
Sudbury (Ontario)
Nantel, Patrick
Biologiste de la conservation
Programme des espèces en péril
Direction de l’intégrité écologique
Parcs Canada
Gatineau (Québec)
Nernberg, Dean
D Env G 4
Agent responsable des espèces en péril
Directeur général - Environnement
Direction de la gérance de l’environnement
Quartier général de la Défense nationale
Ottawa (Ontario)
O’Grady, Sally
Spécialiste de la gestion de l’information
Parcs Canada
Maitland Bridge (Nouvelle-Écosse)
Oldham, Michael
Botaniste et herpétologue
Centre d’information sur le patrimoine naturel (CIPN) de l’Ontario
Ministère des Richesses naturelles et des Forêts de l’Ontario
Peterborough (Ontario)
Paquet, Annie
Technicienne de la faune
Direction de la biodiversité et des maladies de la faune
Direction générale de l’expertise sur la faune et ses habitats
Ministère des Forêts, de la Faune et des Parcs
Québec (Québec)
Patterson, James
Candidat au doctorat
Département de biologie
Université d’Ottawa
Ottawa (Ontario)
Phillips, Julia
Coordonnatrice du programme Adopt-A-Pond
Zoo de Toronto
Toronto (Ontario)
Pulfer, Tanya
Conservation Science Manager
Ontario Nature
Toronto (Ontario)
Rasmussen, Megan
Biologiste par intérim, région de Sudbury
Ministère des Richesses naturelles et des Forêts de l’Ontario
Sudbury (Ontario)
Riley, Julia
Candidate au doctorat
Département de sciences biologiques
Université Macquarie
Sydney, Australie
Robinson, Jeff
Coordonnateur des aires protégées
Environnement Canada
Service canadien de la faune
London (Ontario)
Robinson, Suzanne
Biologiste des espèces en péril
Ministère des Richesses naturelles et des Forêts de l’Ontario
Midhurst (Ontario)
Rouleau, Sébastien
Coordonnateur de la recherche et de la conservation
Zoo Ecomuseum
Société d’histoire naturelle de la vallée du Saint-Laurent
Sainte-Anne-de-Bellevue (Québec)
Rouse, Jeremy
Biologiste des espèces en péril
Ministère des Richesses naturelles et des Forêts de l’Ontario
Parry Sound (Ontario)
Salo, John
Zone Manager
Ministère des Richesses naturelles et des Forêts de l’Ontario
Zone des parcs du Sud-Ouest
London (Ontario)
Sam, Donald
Biologiste de la faune
Région de l’Ouest (Nouvelle-Écosse)
Ministère des Ressources naturelles de la Nouvelle-Écosse
Lunenburg (Nouvelle-Écosse)
Seburn, David
Ecological Consultant
Seburn Ecological Services
Ottawa (Ontario)
Sheppard, Anna
Assistant Zone Ecologist
Parcs Ontario, zone du Nord-Est
Ministère des Richesses naturelles et des Forêts de l’Ontario
Sudbury (Ontario)
Steinberg, Brad
Management Biologist
Ministère des Richesses naturelles et des Forêts de l’Ontario
Algonquin Park (Ontario)
Taylor, Shawn
Aquatic Biologist
Dillon Consulting Limited
Oakville (Ontario)
Tessier, Nathalie
Coordonnatrice des espèces en péril
Ministère des Forêts, de la Faune et des Parcs
Montréal (Québec)
Thompson, Shaun
District Ecologist,
Ministère des Richesses naturelles et des Forêts de l’Ontario
Kemptville (Ontario)
Toms, Brad
Biologiste de la faune
Mersey Tobeatic Research Institute
Kempt (Nouvelle-Écosse)
Toussaint, Daniel
Biologiste
Direction de la gestion de la faune de l'Outaouais
Ministère des Forêts, de la Faune et des Parcs
Gatineau (Québec)
Urquhart, John
Écologiste/directeur
Blazing Star Environmental
Oshawa (Ontario)
Woods, Sarah
Gestionnaire de recherche
Junction Creek Stewardship Committee
Sudbury (Ontario)
Sources d’information
Andrews, C., comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Décembre 2014. Permits & Agreements Analyst, Direction des espèces en péril, ministère des Richesses naturelles et des Forêts de l’Ontario, gouvernement de l’Ontario, Peterborough (Ontario).
Anthonysamy, W.J.B., M.J. Dreslik, M.R. Douglas, N.K. Marioni et C.A. Phillips. 2014. Reproductive ecology of an endangered turtle in a fragmented landscape. Copeia 2014(3):437-446.
Arnold, G. W., D.E. Steven, J.R. Weeldenburg et E.A. Smith. 1993. Influences of remnant size, spacing pattern and connectivity on population-boundaries and demography in Euros macropus-robustus living in a fragmented landscape. Biological Conservation, 64: 219-230.
Arsenault, L. 2011. Headstarting Blanding’s turtles (Emydoidea blandingii) in Nova Scotia: an investigation of artificial incubation, captive-rearing and release to natural habitats. MSc thesis. Acadia University, Wolfville, NS. 90pp.
Ashenden, J.E. 1983. Mémoire de baccalauréat ès sciences avec mention, University of Waterloo, Waterloo, Ontario, Canada. 54 pp.
Ashley, E.P. et J.T. Robinson. 1996. Canadian Field Naturalist. 110:403-412.
Ashley, P.E., A. Kosloski et S.A. Petrie. 2007. Incidence of intentional vehicle-reptile collisions. Human Dimensions of Wildlife 12:137-143.
Avery, H.W., J.R. Spotila, J.D. Congdon, R.U. Fischer, E.A. Standora et S.B. Avery 1993. Roles of diet protein and temperature in the growth and nutritional energetics of juvenile slider turtles, Trachemys scripta. Physiological Zoology 66: 902-925.
Badzinkski, S., S. Proracki, S. Petrie et D. Richards. 2008. Changes in the distribution and abundance of common reed (Phragmites australis) between 1999 and 2006 in marsh complexes at Long Point - Lake Erie. Report submitted to the OMNRF. 19 pp.
Baxter-Gilbert, J.H. 2014. The long road ahead: understanding road-related threats to reptiles and testing if current mitigation measures are effective at minimizing impacts. Mémoire de maîtrise. Laurentian University. Sudbury, Ontario, Canada. 96 pp.
Baxter-Gilbert, J.H., J.L. Riley et J.D. Litzgus. 2013. Chrysemys picta marginata (Midland Painted Turtle) and Emydoidea blandingii (Blanding's Turtle): Hatchling mortality. Herpetological Review 44(2): 303-304.
Beaudry, F., P.G. DeMaynadier et M.L. Hunter Jr. 2010. Nesting movements and the use of anthropogenic nesting sites by Spotted Turtles (Clemmys guttata) and Blanding’s Turtles (Emydoidea blandingii). Herpetological Conservation and Biology 5(1): 1-8.
Beaudry, F., P.G. DeMaynadier et M.L. Hunter Jr. 2009. Seasonally dynamic habitat use by Spotted (Clemmys guttata) and Blanding’s Turtles (Emydoidea blandingii) in Maine. Journal of Herpetology 43(4): 636-645.
Beckett, J. 2006. Genetic analysis of multiple paternity and male reproductive success in a small peripheral population of Blanding’s turtle, Emydoidea blandingii. Mémoire de maîtrise. Acadia University, Wolfville, NS, Canada. 44pp.
Bennett, B.A. comm. pers., 2016. Coprésident du sous-comité de spécialistes des plantes vasculaires du COSEPAC.
Bernier, P.A. 2013. Localisation et caractérisation des habitats essentiels de la tortue mouchetée - Rapport des travaux de 2012. Conservation de la nature Canada, pour la Commission de la capitale nationale. 28 p. et 5 annexes.
Bernier, P.A. 2014. Report on various aspects of studies and reports on Blanding’s Turtle in Québec in the context of the preparation of a COSEWIC Status Report. Report prepared for COSEWIC. 52 pp.
Bernier, P.A., comm. pers., 2014.Correspondance par courriel adressée à T.Piraino. Biologiste, Équipe de rétablissement des tortues du Québec. Québec (Québec).
Bishop, C.A., R.J. Brooks, J.H. Carey, P. Ng, R.J. Norstrom et D.R.S. Lean. 1991. The case for a cause-effect linkage between environmental contamination and development in eggs of the Common Snapping Turtle Chelydra serpentina from Ontario, Canada. Journal of Toxicology and Environmental Health 33:512-547.
Bishop, C.A., P. Ng, K.E. Pettitt, S.W. Kennedy, J.J. Stegeman, R.J. Norstrom et R.J. Brooks. 1998. Environmental contamination and developmental abnormalities in eggs and hatchlings of the common Snapping Turtle (Chelydra serpentina serpentina) from the Great Lakes-St. Lawrence River basin (1989-91). Environmental Pollution 101: 143-156.
Bleakney, J.S. 1958. A Zoogeographical Study of the Amphibians and Reptiles of Eastern Canada. National Museum of Canada Bulletin No. 155. 119 pp.
Bolton, R.M. et R.J. Brooks. 2010. Impact of the seasonal invasion of Phragmites australis (Common Reed) on turtle reproductive success. Chelonian Conservation and Biology 9(2): 238-243.
Bolton, R.M., S.A. Marshall et R.J. Brooks. 2008. Opportunistic exploitation of turtle eggs by Tripanurga importuna (Walker) (Diptera: Sarcophagidae). Canadian Journal of Zoology 86:151-160.
Bolton, R.M., comm. pers., 2015. Correspondance par courriel adressée à T.Piraino. Octobre 2015. Conservation Biologist, The Art of Conservation, Bradford (Ontario).
Bonin, J., J.-L. DesGranges, C.A. Bishop, J. Rodrigue, A. Gendron et J.E. Elliot. 1995. Comparative study of contaminants in the mudpuppy (Amphibia) and the common snapping turtle (Reptilia), St. Lawrence River, Canada. Archives of Environmental Contamination and Toxicology 28: 184-194.
Bourque, G. 2006. Investigating variables affecting Blanding's turtle (Emydoidea blandingii) patch occupancy and trapping success in Nova Scotia. Mémoire de maîtrise. Acadia University, Wolfville, NS. 78pp.
Bourque, G., T. Herman et J. McNeil. 2006. Nova Scotia Blanding’s turtle (Emydoidea blandingii) PVA: history and development. Presentation to the Blanding’s turtle recovery team. March 2006.
Boyle, S., comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Septembre 2014. Candidat au doctorat, Université Laurentienne, Sudbury (Ontario).
Brooks, R.J., D.A. Galbraith, E.G. Nancekivell et C.A. Bishop. 1988. Developing management guidelines for Snapping Turtles. In R.C. Szaro, K.E. Severson and R. David ton (eds.), Management of Amphibians, Reptiles and Small Mammals in North America; Proceedings of the symposium, pp. 174-179. U.S. Dept. agriculture Forest Service. Gen. Tech. Rep. RM-166.
Brooks, R.J., M.L. Bobyn, D.A. Galbraith, J.A. Layfield et E.G. Nancekivell. 1991a. Maternal and environmental influences on growth and survival of embryonic and hatchling snapping turtles (Chelydra serpentina). Canadian Journal of Zoology 69: 2667-2676.
Brooks, R.J., G.P. Brown, et D.A. Galbraith. 1991b. Effects of a sudden increase in natural mortality of adults on a population of the Common Snapping Turtle (Chelydra serpentina). Canadian Journal of Zoology 69:1314-1320.
Brooks, R.J., D. Strickland et R.J. Russell. 2003. Reptiles and Amphibians of Algonquin Provincial Park. The Friends of Algonquin Park. 48 pp.
Brooks, R.J., comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Mai et septembre 2014. Professeur émérite, University of Guelph, Ontario.
Browne, C.L. 2003. Mémoire de maîtrise, Lakehead University, Thunder Bay, Ontario, Canada. 122 pp.
Browne, C.L. et S.J. Hecnar. 2007. Species loss and shifting population structure of freshwater turtles despite habitat protection. Biological Conservation 138: 421-429.
Bulté, G., M. Carrière et G. Blouin-Demers. 2010. Impact of recreational power boating on two populations of Northern Map Turtles (Graptemys geographica). Aquatic Conservation: Marine and Freshwater Ecosystems 20: 31-38.
Camaclang, A. 2007. Science, management and policy in conservation biology: protecting post-emergent hatchling Blanding's turtles in Nova Scotia. Mémoire de maîtrise en études environnementales. Dalhousie University, Halifax, NS.
Carrière, M.A., N. Rollinson, A.N. Suley et R.J. Brooks. 2008. Thermoregulation when the growing season is short: sex-biased basking patterns in a northern population of painted turtles (Chrysemys picta). Journal of Herpetology 42: 206-209.
Carstairs, S. 2014. Direct mitigation of threats to At-Risk turtles at a road mortality hotspot. Final report submitted to the Species at Risk Stewardship Fund. 7 pp.
Catling, P.M. et G. Mitrow. 2011. The recent spread and potential distribution of Phragmites australis in Canada. The Canadian Field-Naturalist 125: 95-104.
Caverhill, B. 2003. Mémoire de baccalauréat ès sciences avec mention. Acadia University, Wolfville, NS.
Caverhill, B. 2006. Blanding's turtle conservation in Nova Scotia: Linking science and stewardship through public education. MSc. Thesis. Acadia University, Wolfville, NS.
Caverhill, B., B. Johnson, J. Phillips, E. Nadeau, M. Kula et R. Holmes. 2011. Report to Environment Canada and the Ministry of Natural Resources. 92 pp.
Christensen, R.J. 2013. The movement patterns and home ranges of Blanding's Turtles (Emydoidea blandingii) in two protected areas in Ontario Canada. Mémoire de maîtrise. McMaster University, Hamilton, Ontario, Canada. 94 pp.
Christensen, R.J. et P. Chow-Fraser. 2014. Use of GPS loggers to enhance radio-tracking studies of freshwater turtles. Herpetological Conservation and Biology 9: 18-28.
CITES (Convention on the International Trade in Endangered Species). 2013. Sixteenth meeting of the Conference of Parties: Proposals for Amendment of Appendices I and II. [consulté en mars 2013]. (Également disponible en français : « CITES (Convention sur le commerce international des espèces de faune et de flore sauvages menacées d'extinction). 2013. Seizième session de la Conférence des Parties : Propositions d'amendement des Annexes I et II ».)
Congdon, J.D. et R.C. van Loben Sels. 1991. Growth and body size in Blanding's turtles (Emydoidea blandingi): relationships to reproduction. Canadian Journal of Zoology 69:239-245.
Congdon, J.D. et R.C. van Loben Sels. 1993. Relationships of reproductive traits and body size with attainment of sexual maturity and age in Blanding's turtles (Emydoidea blandingii). Journal of Evolutionary Biology 6:547-557.
Congdon, J.D., A.E. Dunham et R.C. van Loben Sels. 1993. Delayed sexual maturity and demographics of Blanding’s Turtles (Emydoidea blandingii): Implications for conservation and management of long-lived organisms. Conservation Biology 7:826-833.
Congdon, J.D., A.E. Dunham et R.C. van Loben Sels. 1994. Demographics of common Snapping Turtles Chelydra serpentina: Implications for conservation and management of long-lived organisms. American Zoologist 34:397-408.
Congdon, J.D., D.W. Tinkle, G.L. Breitenbach et R.C. van Loben Sels. 1983. Nesting ecology and hatching success in the turtle Emydoidea blandingii. Herpetologica. 39:417-429.
Congdon, J.D., O.M. Kinney et R.D. Nagle. 2011. Spatial ecology and core-area protection of Blanding's Turtle (Emydoidea blandingii). Canadian Journal of Zoology 89:1098-1106.
Congdon, J.D., R.D. Nagel, O.M. Kinney et R.C. van Loben Sels. 2001. Hypotheses of aging in a long-lived vertebrate, Blanding’s Turtle (Emydoidea blandingii). Experimental Gerontology 36:813-827.
Congdon, J.D., R.D. Nagel, O.M. Kinney, M. Osentoski, H.W. Avery, R.C. van Loben Sels et D.W. Tinkle. 2000. Nesting ecology and embryo mortality: Implications for hatchling success and demography of Blanding’s Turtles (Emydoidea blandingii). Chelonian Conservation and Biology 3:569-579.
Congdon, J.D., T.E. Graham, T.B. Herman, J.W. Lang, M.J. Pappas et B.J. Brecke. 2008. Emydoidea blandingii (Holbrook 1838) Blanding’s turtle. In: Rhodin, A.G.J., P.C.H. Pritchard, P.P van Dijk, R.A. Saumure, K.A. Buhlmann et J.B. Iverson. (Eds.). Conservation Biology of Freshwater Turtles and Tortoises: A Compilation Project of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group. Chelonian Research Monographs No. 5, pp. 015.1-015.12
Crother, B. I. (ed.). 2012. Scientific and standard English names of amphibians and reptiles of North America North of Mexico, with comments regarding confidence in our understanding. 7th Edition. Herpetological Circulars. Society for the Study of Amphibians and Reptiles, St. Louis, Missouri.
Crowley, J.F. et R.J. Brooks. 2005. Protected areas and the conservation of Ontario’s Reptile Species at Risk: Safe havens or false hopes? Proceedings of the Parks Research Forum of Ontario, pp. 139-152.
Davy, C.M., P.H. Bernardo et R.W. Murphy. 2014. A Bayesian approach to conservation genetics of Blanding's Turtle (Emys blandingii) in Ontario, Canada. Conservation Genetics 15:319-330.
Davy, C.M., comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Avril 2014. Boursière postdoctorale Liber Ero, Trent University, Peterborough (Ontario).
Déry, J. F. 2014. Résumé des activités effectuées en vertu du permis 2013-03-13-024-08-SF. En collaboration avec les Premières Nations Anishinabeg de Lac Simon, Kitcisakik et Timiskaming, Québec. Rapport présenté à la Direction de l’expertise Énergie-Faune-Forêts-Mines-Territoire de l’Abitibi-Témiscamingue, ministère des Ressources naturelles, Québec. 13 p.
Déry, J.F. 2015. Rapport de campagne de recherche de la tortue mouchetée (Emydoidea blandingii) - Été 2014. En collaboration avec le Conseil de la Nation Anishinabe du Lac Simon. Rapport présenté à Tourbières Berger, Ltée. 18 p.
de Solla S.R, K.J. Fernie et S. Ashpole 2008. Snapping Turtles Chelydra serpentina as bioindicators in Canadian Areas of Concern in the Great Lakes Basin. II. Changes in hatching success and hatchling deformities in relation to persistent organic pollutants. Environmental Pollution 153: 529-536.
Desroches, J.F. et I. Picard. 2005. Mortalité des tortues sur les routes de l’Outaouais. Le Naturaliste Canadien. 129: 35-41.
Dillon Consulting. 2014. Blanding's Turtle population estimate, distribution and range study, 2013 Year 4 of 4; Final Summary. Report submitted to the City of Ottawa. 121 pp.
Dubois, Y. 2009. Conservation de la nature Canada, pour la Commission de la capitale nationale. 56 p.
Dubois, Y., Blouin-Demers, G., Shipley, B. et Thomas, D. 2009. Thermoregulation and habitat selection in Wood Turtles Glyptemys insculpta: chasing the sun slowly. Journal of Animal Ecology, 78: 1023-1032.
Dubois, Y., A. Orjikh et S. Pelletier. 2011. Conservation de la nature Canada, pour la Commission de la capitale nationale. 31 p. + 6 annexes.
Dubois, Y., G. Fortin et S. Pelletier. 2012. Conservation de la nature Canada, pour la Commission de la capitale nationale. 71 p. + 7 annexes.
Dubois, Y., comm. pers., 2014. Correspondance par courriel adressée à T.Piraino. Biologiste, ministère des Forêts, de la Faune et des Parcs, Québec (Québec).
Ducks Unlimited Canada. 2010. Southern Ontario wetland conversion analysis: final report. Ducks Unlimited. Barrie, Ontario. 23 pp.
Duclos, I. et J. Fink. 2013. Rapport final. 55 p. + 9 annexes.
Edge, C. B., B.D. Steinberg, R.J. Brooks et J.D. Litzgus. 2009. Temperature and site selection by Blanding's turtles (Emydoidea blandingii) during hibernation near the species' northern range limit. Canadian Journal of Zoology 87:825-834.
Edge, C. B., B.D. Steinberg, R.J. Brooks et J.D. Litzgus. 2010. Habitat selection by Blanding's turtles (Emydoidea blandingii) in a relatively pristine landscape. Ecoscience 17:90-99.
Ennen, J.R., J.E. Lovich., K.P. Meyer, C. Bjurlin et T.R. Arundel. 2012. Nesting Ecology of a Population of Gopherus agassizii at a Utility-Scale Wind Energy Facility in Southern California. Copeia 2012: 222-228.
Enneson, J.J. et J.D. Litzgus. 2009. Stochastic and spatially explicit population viability analyses for an endangered freshwater turtle, Clemmys guttata. Canadian Journal of Zoology 87: 1241-1254.
Enneson, J.J. 2009. Report submitted to the Canadian Wildlife Service. 35 pp.
Environment Canada et Ontario Ministry of Natural Resources. 2003. The Ontario Great Lakes Coastal Wetland Atlas: A Summary of Information (1983-1997).
Environment Canada et United States Environmental Protection Agency. 2008. Lake Erie Lakewide Management Plan Updated April 2008. Prepared for the Governments of Canada and the United States of America.
Environment Canada. 2016. Recovery strategy for the Blanding's Turtle (Emydoidea blandingii) Great Lakes/St. Lawrence population in Canada [Proposed]. Species at Risk Act recovery strategy series. Environment Canada, Ottawa, vii + 49 pp. (Également disponible en français : « Environnement Canada. 2016. Programme de rétablissement de la tortue mouchetée (Emydoidea blandingii), population des Grands Lacs et du Saint-Laurent, au Canada [Proposition]. Série de Programmes de rétablissement de la Loi sur les espèces en péril. Environnement Canada, Ottawa. viii + 55 p. »)
Équipe de rétablissement des tortues du Québec, données inédites. Données de captures récoltées dans le cadre du projet « Cartographie des habitats essentiels et identification des menaces au maintien des populations de tortues mouchetées - phase II ». Printemps 2009 et 2010.
Ernst, C.H. et J.E. Lovich. 2009. Turtles of the United States and Canada, 2nd Edition. The Johns Hopkins University Press, Baltimore, Maryland. 827 pp.
Feldman C.R. et Parham J.F. 2002. Molecular phylogenetics of Emydine Turtles: Taxonomic revision and the evolution of shell kinesis. Molecular Phylogenetics and Evolution 22:388-398.
Fenech, A., B. Taylor, R. Hansell et G. Whitelaw. 2001. Major Road Changes in Southern Ontario 1935 - 1995: Implications for Protected Areas. Pp. 365-383, in S. Bondrup-Nielsen, N.W.P. Munro, G. Nelson, J.H.M. Willison, T.B. Herman, and P.F.J. Eagles (eds.). Proceedings of the Fourth International Conference on the Science and Management of Protected Areas, University of Waterloo, Waterloo, Ontario, Canada.
Fortin G., G. Blouin-Demers et Y. Dubois. 2012. Landscape composition weakly affects home range size in Blanding’s turtles (Emydoidea blandingii). Écoscience 19:191-197.
Fortin, G. et Y. Dubois. 2010. Cartographie des habitats essentiels et identification des menaces au maintien des populations de tortues mouchetées - phase I, Rapport d’étape - Résultats préliminaires suite à la première année des travaux de terrain. Conservation de la nature Canada, pour la Commission de la capitale nationale. 35 p. + 6 annexes.
Garbary, D.J., G. Bourque, T.B. Herman et J.A. McNeil. 2007. Epizoic algae from freshwater turtles in Nova Scotia. Journal of Freshwater Ecology 22:677-685.
Garber, S.D. et J. Burger. 1995. A 20-yr study documenting the relationship between turtle decline and human recreation. Ecological Applications 5:1151-1162.
Garrot, R., P. White et C. Vanderbilt White. 1993. Overabundance: An issue for conservation biologists? Conservation Biology 7:946-949.
Gibbs, J. et D. Steen. 2005. Trends in sex ratios of turtles in the United States: implications of road mortality. Conservation Biology 19:552-556.
Gibbs, J.P et W.G. Shriver. 2002. Estimating the effects of road mortality on turtle populations. Conservation Biology 16: 1647-1652.
Giguère, S., comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Novembre 2014. Biologiste des espèces en péril, Service canadien de la faune, Québec.
Gilbert, J.M. 2012. Phragmites australis Management in Ontario. Presentation at the 6th Bi-national Lake St. Clair Conference. November 29, 2012.
Gilbert, J.M., comm. pers., 2013. Correspondance par courriel adressée à T. Piraino. Novembre 2013. Wetland Ecologist, Langton (Ontario).
Gillingwater, S.D. 2009. Unpublished report submitted to Ontario Ministry of Natural Resources, Lake Erie Management Unit. 20 pp.
Gillingwater, S.D. 2013. Unpublished report submitted to Canadian Wildlife Service. 48 pp.
Gillingwater, S.D. et R.J. Brooks. 2001. Report to Endangered Species Recovery Fund (WWF). 94 pp.
Gillingwater, S.D. et T.J. Piraino. 2002. Final report submitted to the Endangered Species Recovery Fund. 48 pp.
Gillingwater, S.D. et T.J. Piraino. 2004. Final report submitted to the Canadian Wildlife Service. 65+pp.
Gillingwater, S.D. et T.J. Piraino. 2007. Final report submitted to the Canadian Wildlife Service. 32pp.
Gillingwater, S.D., comm. pers., 2014. Correspondance par courriel et communication verbale avec T. Piraino. Dates multiples en 2014. Biologiste des espèces en péril, Office de protection de la nature de la rivière Upper Thames, London (Ontario).
Government of Ontario. 2016. Environmental Registry [consulté en juillet 2016]. (Également disponible en français : « Gouvernement de l’Ontario. 2016. Registre environemental ».)
Graham, T.E. 1995. Habitat use and population parameters of the spotted turtle, Clemmys guttata, a species of special concern in Massachusetts. Chelonian Conservation and Biology 1: 207-214.
Great Lakes Wetlands. 2011. Great Lakes Wetlands: Wetland Inventories (Disponible an anglais seulement)
Green, N., comm. pers., 2014. Correspondance par courriel adressée à J. McNeil. Décembre 2014. Membre de l’équipe de rétablissement de la tortue mouchetée et coordinateur bénévole de la protection des nids, Hammonds Plains (Nouvelle-Écosse).
Green. N. et J. McNeil. 2014. Updating the Population Viability Analysis model for Blanding’s turtles in Nova Scotia. Unpublished report to Parks Canada, March 2014. 13 pp.
Harding, J. H. 1997. Amphibians and Reptiles of the Great Lakes Region. University of Michigan, Ann Arbor, MI. 378 pp.
Harding J.H. et Davis S.K. 1999. Clemmys insculpta (Wood Turtle) and Emydoidea blandingii (Blanding’s Turtle) hybridization. Herpetological Review. 30: 225-226.
Hartwig, T. S. 2004. Habitat selection of Blanding’s turtle (Emydoidea blandingii): a range-wide review and microhabitat study. Mémoire de maîtrise. Bard College. Annandale-on-Hudson, New York. 127pp.
Heppell, S.S. 1998. Application of life-history theory and population model analysis to turtle conservation. Copeia 1998:367-375.
Her Majesty the Queen in Right of Canada. 2014. The Canada Gazette, Part 1, May 3, 2014. 148 (18): 1116. (Également disponible en français : « Sa Majesté la Reine du chef du Canada. 2014. Gazette du Canada, Partie 1, le 3 mai 2014. Vol. 148, n° 18, p. 1116 ».)
Herman, T.B. et F.W. Scott. 1992. Global changes at the local level: assessing the vulnerability of vertebrate species to climatic warming. Pages 353-367 in J.M.H. Willison, S. Bondrup-Nielsen, C.D.Drysdale, T.B. Herman, N.W.P Munro, and T.L. Pollocks (eds.). Science and Management of Protected Areas. Developments in Landscape Management and Urban Planning Series. Elsevier, Amsterdam.
Herman, T.B., J.A. McNeil et D.D. Hurlburt. 2004. Blanding’s turtle population viability analysis (PVA): Development and application of a stage-classified transition matrix. Final Report to Parks Canada SARRAEF 03- KEJ03-004, October 2004. 25 pp.
Herman, T.B., J.S. Boates, C. Drysdale, S. Eaton, J. McNeil, S. Mockford, E. Alcorn, S. Bleakney, M. Elderkin, J. Gilhen, C. Jones, J. Kierstead, J. Mills, I. Morrison, S. O’Grady et D. Smith. 2003. National Recovery Plan for the Blanding’s Turtle (Emydoidea blandingii) Nova Scotia Population. January 2003. 63 pp.
Herman, T.B., comm. pers., 2015. Correspondance par courriel adressée à J. McNeil. Septembre 2015. Coprésident de l’équipe de rétablissement de la tortue mouchetée, Université Acadia, Wolfville (Nouvelle-Écosse).
Herman, T.B., T.D. Power et B.R. Eaton. 1995. Status of Blanding’s Turtles, Emydoidea blandingii, in Nova Scotia, Canada. Canadian Field-Naturalist. 109: 182-191.
Howes, B., J. Brown, L.Gibbs, T. Herman, S. Mockford, K. Prior et P. Weatherhead. 2009. Directional gene flow in disjunct populations of the black ratsnake (Pantheropis obsoletus) and the Blanding's turtle (Emydoidea blandingii). Conservation Genetics 10:407-417.
Howey, A.F. et S.A. Dinkelacker. 2013. Characteristics of a historically harvested Alligator Snapping Turtle (Macrochelys temminckii) population. Copeia 1: 58-63.
Hubbs, F.T. 1979. Unpublished report to the Canadian Wildlife Service. London, Ontario. 44p.
Hutchison, V.H., A. Vinegar et R.J. Kosh. 1966. Critical thermal maxima in turtles. Herpetologica 22:32-41.
International Joint Commission. 2014. A Balanced Diet for Lake Erie: Reducing Phosphorous Loadings and Harmful Algal Blooms. Report of the Lake Erie Ecosystem Priority.
IUCN Standards and Petitions Subcommittee. 2014. Guidelines for Using the IUCN Red List Categories and Criteria. Version 11. Prepared by the Standards and Petitions Subcommittee.
Janzen, F.J. 1993. The influence of incubation temperature and family on eggs, embryos, and hatchlings of the Smooth Softshell Turtle (Apalone mutica). Physiological Zoology 66:349-373.
Janzen, F.J. et Morjan, C.L. 2001. Repeatability of microenvironment-specific nesting behaviour in a turtle with environmental sex determination. Animal Behaviour 62:73-82.
Jodoin, Y., C. Lavoie, P. Villeneuve, M. Theriault, J. Beaulieu et F. Belzile. 2008. Highways as corridors and habitats for the invasive common reed Phragmites australis in Quebec, Canada. Journal of Applied Ecology 45:459-466.
Keevil, M.G., Brooks, R.J. et Litzgus, J.D. 2015. Patterns of long-term abundance and survival of a long-lived vertebrate before and after a population catastrophe. En préparation.
Keevil, M.G., comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Octobre 2014. Candidat au doctorat, Département de biologie, Université Laurentienne, Sudbury (Ontario).
King, R.B. et M.L. Niiro. 2013. Predicting climate-change induced distributional shifts in Great Lakes region reptiles. Ilinois Department of Natural Resources. 76 pp.
Kiviat, E. 1978b. Vertebrate use of muskrat lodges and burrows. Estuaries 1:196-200.
Knudson, B., comm. pers., 2004. Correspondance par courriel adressée à C. Edge et S. Jones. Technicien, ministère des Richesses naturelles de l’Ontario, district d’Algoma, Sault-Ste-Marie (Ontario).
Kofron, C.P. et A.A. Schreiber. 1985. Ecology of two endangered aquatic turtles in Missouri: Kinosternon flavescens and Emydoidea blandingi. Journal of Herpetology 19: 27-40.
Koper, N. et R.J. Brooks. 2000. Environmental Constraints on Growth of Painted Turtles (Chrysemys picta) in Northern Climates. Herpetologica, 56: 421-432.
Kruschenske, L., comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Septembre 2014. Biologiste des espèces en péril, ministère des Richesses naturelles et des Forêts de l’Ontario, district de Pembroke (Ontario).
Kydd, P. 2010. Movement rates, movement patterns and home ranges of endangered Blanding’s turtles (Emydoidea blandingii) in Nova Scotia. Mémoire de maîtrise. Acadia University, Wolfville, NS, Canada. 110pp.
Lake Erie LaMP. 2011. Lake Erie Binational Nutrient Management Strategy: Protecting Lake Erie by Managing Phosphorus. Prepared by the Lake Erie LaMP Work Group Nutrient Management Task Group.
Lapointe, J. et P. Fournier. 2014. Inventaire de la tortue mouchetée (Emydoidea blandingii) en Abitibi, été 2013. Direction régionale de l’Abitibi-Témiscamingue, Secteur de la faune, ministère du Développement durable, de l’Environnement, de la Faune et des Parcs, Rouyn-Noranda. 11 p. + annexes.
Lefebvre, J. 2009. Marrying Conservation and Exploitation: Combining Integrated Resource Management Plans (IRMs) and the Blanding's Turtle (Emydoidea blandingii) to Conserve and Manage Wetland Ecosystems in Nova Scotia. MSc Thesis. Acadia University, Wolfville, NS, Canada. 86 pp.
Lefebvre, J., S.W. Mockford et T. B. Herman. 2012. Canadian Field-Naturalist 126: 89-94.
Lefebvre, J., T.S. Avery et T.B. Herman. 2011. Size dimorphism and growth rates in distinct populations of Blanding's turtles (Emydoidea blandingii) in Nova Scotia in relation to environment. Herpetological Conservation and Biology 6:465:472.
Loveridge, A. et E.E. Williams. 1957. Revision of the African tortoises and turtles of the suborder Cryptodira. Bulletin of the Museum of Comparative Zoology Harvard 115: 163-557.
Lovich. J. 1987. The spotted turtles of Cedar Bog: historical analysis of a declining population. Cedar Bog Symposium II. Columbus (OH): Ohio Historical Society. November 1987.
Lovich, J.E., R.E. Ennen, S. Madrak, K. Meyer, C. Loughran, C. Bjurlin, T.R. Arundel, W. Turner, C. Jones et G.M. Groenendaal. 2011. Effects of wind enegry production on growth, demography and survivorship of a Desert Tortoise (Gopherus agassizii) population in southern California with comparisons to natural populations. Herpetological Conservation and Biology 6: 161-174.
MacCulloch, R. D. et W. F. Weller. 1988. Some aspects of reproduction in a Lake Erie population of Blanding's turtle, Emvdoidea blandingii. Canadian Journal of Zoology 66: 2317-2319.
Mackenzie, A., comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Octobre 2014. Natural Heritage Education and Resource Management Supervisor, parc provincial Pinery, Parcs Ontario, Grand Bend (Ontario).
Mackenzie, S., D. LeClair, A. Timpf, P. Catling et J. McCracken. 2014. Report submitted to OMNRF. 65 pp.
MacKinnon, C.A., L.A. Moore et R.J. Brooks. 2005. Why did the reptile cross the road? Landscape factors associated with road mortality of snakes and turtles in the South Eastern Georgian Bay area. pp. 153-166 in G. Nelson, T. Nudds, M. Beveridge, and B. Dempster (eds.), Protected Areas and Species and Ecosystems at Risk: Research and Planning Challenges. Proceedings of the Parks Research Forum of Ontario (PRFO) and Carolinian Canada Coalition (CCC) Annual General Meeting May 2005, University of Guelph.
Markle, C.E. et P. Chow-Fraser. 2014a. Habitat selection by the Blanding's Turtle (Emydoidea blandingii) on a protected island in Georgian Bay, Lake Huron. Chelonian Conservation and Biology 13: 216-226.
Markle, C.E. et P. Chow-Fraser. 2014b. Progress Report for 2014. 19 pp.
Marks, S., comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Septembre 2014. Biologiste des espèces en péril, AMEC Foster-Wheeler, Windsor (Ontario).
McCoy, C.J. 1973. Emydoidea, E. blandingii. Catalogue of American amphibians and reptiles. 136: 1-4.
McCracken, J., comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Mai 2014. Directeur des programmes nationaux, Études d’Oiseaux Canada, Port Rowan (Ontario).
McDowell, S.B. 1964. Partition of the genus Clemmys and related problems in the taxonomy of aquatic Testudinidae. Proceedings of the Zoological Society of London 143:239-279.
McGuire, J.M., K.T. Scribner et J.D. Congdon. 2013. Spatial aspects of movements, mating patterns and nest distributions influence gene flow among population subunits of Blanding's Turtles (Emydoidea blandingii). Conservation Genetics 14:1029-1042.
McGuire, J.M., J.D. Congdon, O.M. Kinney, M. Osentoski et K.T. Scribner. 2015. Influences on male reproductive success in long-lived Blanding's Turtles (Emydoidea blandingii). Canadian Journal of Zoology 93:487-497.
McMaster, N.L. et T.B. Herman. 2000. Chelonian Conservation and Biology. 3: 602-610.
McNeil, J.A., T.B. Herman et K.L. Standing. 2000. Movement of hatchling Blanding’s Turtles (Emydoidea blandingii) in Nova Scotia in response to proximity to open water: a manipulative experiment. Chelonian Conservation and Biology. 3: 611-617.
McNeil, J.M. 2002. Distribution, movements, morphology and reproduction in a population of Blanding's turtle (Emydoidea blandingii) in an unprotected landscape in southwest Nova Scotia. Mémoire de maîtrise. Acadia University, Wolfville, NS, Canada. 218 pp.
Middleton, J. 2014. Long-term reptile and amphibian research on Ontario Nature properties. Report prepared for the Environment Canada Science Horizons Youth Internship Program. 17 pp.
Millar, C. 2009. Report to Parks Canada. 25 pp.
Millar, C. et G. Blouin-Demers. 2011. Spatial ecology and seasonal activity of Blanding's Turtles (Emydoidea blandingii) in Ontario, Canada. Journal of Herpetology 45:370-378.
Millar, C. et G. Blouin-Demers. 2012. Habitat suitability modelling for species at risk is sensitive to algorithm and scale: A case study of Blanding's Turtle, Emydoidea blandingii, in Ontario, Canada. Journal for Nature Conservation 20:18-29.
Millar, C., J.P. Graham et G. Blouin-Demers. 2012. The effects of sex and season on patterns of thermoregulation in Blanding's Turtles (Emydoidea blandingii) in Ontario, Canada. Chelonian Conservation and Biology 11:24-32.
Miller, V., comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Février 2014. Conservation Officer, ministère des Richesses naturelles de l’Ontario. Peterborough (Ontario).
Mills, P., comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Septembre 2014. Naturaliste, Algonquin Provincial Park Museum and Visitor Centre, district de Nipissing (Ontario).
Ministry of Northern Development and Mines. 2014. Ontario active claims map. [consulté en octobre 2014].
Mockford, S.W., L. McEachern, T.B. Herman, M. Snyder et J.M. Wright. 2005. Population genetic structure in a disjunct population of Blanding’s turtle (Emydoidea blandingii) in Nova Scotia, Canada. Biological Conservation 123: 373-380.
Mockford, S.W., M. Snyder et T.B. Herman. 1999. A preliminary examination of genetic variation in a peripheral population of Blanding’s Turtle, Emydoidea blandingii. Molecular Ecology 8:323-327.
Mockford, S.W., T.B. Herman, M. Snyder et J.M. Wright. 2007. Conservation genetics of Blanding's turtle and its application in the identification of evolutionarily significant units. Conservation Genetics 8: 209-219.
Moll, D. et E.O. Moll. 2004. The Ecology, Exploitation and Conservation of River Turtles. Oxford University Press, New York, New York, U.S.A.
Morrison, I. 1996. A study of headstarting Blanding’s Turtle (Emydoidea blandingii) hatchlings. Parks Canada - Ecosystem monitoring and data reports. Report no. 001.
Morrison, I. et J. McNeil. 2003. Development of a monitoring protocol for juvenile Blanding's turtles (Emydoidea blandingii) in Nova Scotia. Report to Parks Canada. 36 pp.
Natural Heritage and Endangered Species Program. 2007. Massachusetts Forestry Conservation Management Practices for Spotted Turtles. Version 2007.1. Natural Heritage and Endangered Species Program, Massachusetts Division of Fisheries and Wildlife, Westborough, Massachusetts
NatureServe. 2014. NatureServe Explorer: An online encyclopedia of life [application Web]. Version 7.1. NatureServe, Arlington, Virginia. [disponible an anglais seulement, consulté en août 2014].
NCC. 2007. Commission de la capitale nationale. 35 pp.
Nernberg, D., comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Mars 2014. Agent responsable des espèces en péril, Défense nationale, Ottawa (Ontario).
Newton, E. et T. Herman. 2009. Habitat, movements and behaviour of overwintering Blanding's Turtles (Emydoidea Blandingii) in Nova Scotia. Canadian Journal of Zoology 87: 299-309.
NHIC (Natural Heritage Information Centre) data [données du CIPN]. Données fournies par le ministère des Richesses naturelles et des Forêts de l’Ontario.
Nova Scotia Blanding’s Turtle Database. 2014. Consulté le 11 septembre 2014.
Nutting, W.L. et T.E. Graham. 1993. Preferred body temperatures in five nearctic freshwater turtles: A preliminary study. Comparative Biochemistry and Physiology Part A: Physiology 104:243-246.
Obbard, M.E. 1983. Population ecology of the common Snapping Turtle, Chelydra serpentina, in north-central Ontario. Dissertation de doctorat, University of Guelph, Guelph, Ontario, Canada. 184 pp.
Obbard, M.E. et R.J. Brooks. 1981. Fate of overwintered clutches of the common Snapping Turtle Chelydra serpentina in Algonquin Park, Ontario. Canadian Field-Naturalist 95: 350-352.
Ontario Mining Association. 2014. Ontario mining operations map [disponible an anglais seulement, consulté en octobre 2014].
Ontario Nature. 2015. Campaigns: endangered species. [disponible an anglais seulement, consulté en septembre 2015].
Ontario MNRF (Ministry of Natural Resources and Forestry). 2012. Find pits and quarries map. [consulté en octobre 2014]. (Également disponible en français : « Sa Majesté la Reine du chef du Canada. 2014. Gazette du Canada, Partie 1, le 3 mai 2014. Vol. 148, n° 18, p. 1116 ».)
Ontario MNRF (Ministry of Natural Resources and Forestry). 2013a. General Habitat Description for the Blanding's Turtle (Emydoidea blandingii) (Version PDF; 299 KB) (Également disponible en français : « Ministère des Richesses naturelles et des Forêts de l’Ontario. 2013a. Description de l’habitat général de la tortue mouchetée (Emydoidea blandingii) (Version PDF; 300 KB) ».
Ontario MNRF (Ministry of Natural Resources and Forestry). 2013b. Regulation exemption for development and infrastructure projects and endangered or threatened species [consulté en juillet 2016]. (Également disponible en français : « Ministère des Richesses naturelles et des Forêts de l’Ontario. 2013b. . Projets de développement et d'infrastructures et espèces menacées ou en voie de disparition ».)
Ontario MNRF (Ministry of Natural Resources and Forestry). 2014a. Key facts about Ontario's forests. [consulté en septembre 2015]. (Également disponible en français : « Ministère des Richesses naturelles et des Forêts de l’Ontario. 2014a. Faits importants concernant les forêts de l’Ontario »).
Ontario MNRF (Ministry of Natural Resources and Forestry). 2014b. How to get an Endangered Species Act permit or authorization. [consulté en juillet 2016]. (Également disponible en français : « Ministère des Richesses naturelles et des Forêts de l’Ontario. 2014b. Comment obtenir un permis ou une autorisation en vertu de la Loi sur les espèces en voie de disparition ».)
Ontario MNRF (Ministry of Natural Resources and Forestry). 2014c. Species at risk overall benefit permits. [consulté en juillet 2016]. (Également disponible en français : « Ministère des Richesses naturelles et des Forêts de l’Ontario. 2014c. Permis d’avantage plus que compensatoire concernant les espèces en péril. ».)
Ontario MNRF (Ministry of Natural Resources and Forestry). 2016. 2016 Revisions to forest management: conserving biodiversity at the stand and site scales. [consulté en juillet 2016). (Également disponible en français : « Ministère des Richesses naturelles et des Forêts de l’Ontario. 2016. Gestion forestière : conservation de la biodiversité à l’échelle du peuplement et du site - Révisions 2016 ».)
Packard, G.C. 1999. Water relations of chelonian eggs and embryos: is wetter better? Amer. Zool. 39: 289-303.
Packard, G.C., M.J. Packard et T.J. Boardman. 1982. An experimental analysis of the water relations of eggs of Blanding’s Turtles (Emydoidea blandingii). Zoological Journal of the Linnaean Society. 75: 23-34.
Parks Canada. 2010. Parks Canada, Maitland Bridge, NS, Canada. 87 pp.
Parks Canada. 2012. Recovery Strategy for the Blanding’s turtle (Emydoidea blandingii), Nova Scotia population, in Canada. Species at Risk Act Recovery Strategy Series. Parks Canada, Ottawa. vii + 34 pp. (Également disponible en français : « Parcs Canada. 2012. Stratégie de rétablissement de la population néo-écossaise de la tortue mouchetée (Emydoidea blandingii) au Canada. Série des programmes de rétablissement - Loi sur les espèces en péril. Parcs Canada, Ottawa. viii + 39 p. ».)
Patch, C.L., 1919. Canadian Field-Naturalist 33: 60-61.
Paterson, J.E., M. McDermott, B. Steinberg et J. Litzgus. 2011. Emydoidea blandingii (Blanding's Turtle): Hatchling behaviour. Herpetological Review 42: 418-419.
Paterson, J.E., B. Steinberg et J. Litzgus. 2012. Revealing a cryptic life-history stage: differences in habitat selection and survivorship between hatchlings of two turtle species at risk (Glyptemys insculpta and Emydoidea blandingii). Wildlife Research 39: 408-418.
Paterson, J.E., B. Steinberg et J. Litzgus.2014. Effects of body size, habitat selection and exposure on hatchling turtle survival. Journal of Zoology (October 2014): 1-8.
Patterson, A. 2007. Multiple paternity and male reproductive success in the Blanding’s turtle (Emydoidea blandingii) in Nova Scotia. Mémoire de baccalauréat ès sciences. Acadia University, Wolfville, NS, Canada. 34pp.
Penny, L. 2004. Mémoire de baccalauréat ès sciences. Acadia University, Wolfville, NS.
Petrie, S. 1998. Report to the Norfolk Land Stewardship Council. 206 pp.
Phillips, J. et D. Murray. 2005. Contract report for Parks Canada.
Piraino, T. J. et S.D. Gillingwater. 2005. Unpublished report submitted to the Canadian Wildlife Service. 17pp.
Piraino, T. J. et S.D. Gillingwater. 2006. Unpublished report submitted to to the Canadian Wildlife Service. 12pp.
Pitt, A.L. et M.A. Nickerson. 2012. Reassessment of the turtle community in the North Fork of White River, Ozark County, Missouri. Copeia 2012: 367-374.
Porter, K., comm. pers., 2014. Correspondance par courriel adressée à J. McNeil. Octobre 2014. Conservation Coordinator, Nova Scotia Nature Trust, Halifax (Nouvelle-Écosse).
Power T.D., T.B. Herman et J. Kerekes. 1994. Water colour as a predictor of local distribution of Blanding’s Turtles, Emydoidea blandingii, in Nova Scotia. Canadian Field-Naturalist 108:17-21.
Power, T.D. 1989. Seasonal movements and nesting ecology of a relict population of Blanding’s turtle (Emydoidea blandingii (Holbrook)) in Nova Scotia. Mémoire de maîtrise. Acadia University, Wolfville, Nova Scotia, Canada.
Proulx, C.L., G. Fortin et G. Blouin-Demers. 2014. Blanding's Turtles (Emydoidea blandingii) avoid crossing unpaved and paved roads. Journal of Herpetology 48:267-271.
Province of Nova Scotia. 2013. Province of Nova Scotia. 2013. Our Parks and Protected Areas: A Plan for Nova Scotia. The Department of Natural Resources and Nova Scotia Environment, Nova Scotia, 57 pp.
Purves, S. 1980. Unpublished report to Canadian Wildlife Service. London, Ontario. 22pp.
Quesnelle P.E, L. Fahrig et K.E. Lindsay. 2013. Effects of habitat loss, habitat configuration and matrix composition on declining wetland species. Biological Conservation 160: 200-208.
Riley, J., M. Keevil, P. Moldowan et J. Litzgus. 2011. Emydoidea blandingii (Blanding's Turtle): Record egg size. Herpetological Review 42: 417-418.
Riley, J., J. Paterson et J. Litzgus. 2012. Emydoidea blandingii (Blanding's Turtle): Record clutch size. Herpetological Review 43: 326.
Rivard, D.H. et Smith, D.A., 1973a. Report of Contract No. 72-30 to Parks Canada.
Rivard, D.H. et D.A. Smith, 1973b. Report of Contract No. 73-23 to Parks Canada.
Rollinson, N. et R.J. Brooks. 2007. Proximate constraints on reproductive ouput in a northern population of Painted Turtles (Chrysemys picta): an empirical test of the bet-hedging paradigm. Canadian Journal of Zoology 85: 177-184.
Rouleau, S. et P.A. Bourgeois. 2014. Société d’histoire naturelle de la vallée du Saint-Laurent. Sainte-Anne de Bellevue, Québec. 36 pp.
Rouleau, S. et S. Giguère. 2012. Société d’histoire naturelle de la vallée du Saint-Laurent. Sainte-Anne de Bellevue, Québec. 27 p.
Rouse, J. comm. pers., 2015. Correspondance par courriel adressée à T. Piraino. Septembre 2015. Biologiste des espèces en péril, ministère des Richesses naturelles et des Forêts de l’Ontario, district de Parry Sound, Parry Sound (Ontario).
Rubin, C.S., R.E. Warner, J.L. Bouzat et K.N. Page. 2001. Population genetic structure of Blanding’s turtles (Emydoidea blandingii) in an urban landscape. Biological Conservation 99: 323-330.
Sarkar, S.N., K. Sarkar, P. Das et B.R. Maiti. 1996. Photothermal eVects on ovarian growth and function in the soft-shelled turtle Lissemys punctata punctata. Journal of Experimental Zoology 274: 41-55.
Saumure, R.A. 1995. Report to the Canadian Wildlife Service. 82 pp.
Schueler, F.W. comm. pers., 2015. Correspondance par courriel adressée à T. Piraino. Septembre 2015. Biologiste, Bishop Mills Natural History Centre, Bishop Mills (Ontario).
Seburn, D. 2010. Blanding's Turtle, Emydoidea blandingii, habitat use during hibernation in Eastern Ontario. Canadian Field-Naturalist 24: 263-265.
Seburn, D., K. Gunson et D. Lesbarrères. 2014. Report submitted to Species at Risk Stewardship Fund. 7 pp.
Seidel, M.E. et A.D. Adkins. 1989. Variation in turtle myoglobins (subfamily Emydinae: Testudines) examined by isoelectric focusing. Comparative Biochemistry and Physiology B. 94B: 569-573.
Severn Sound Remedial Action Plan. 1993. Severn Sound Remedial Action Plan Stage 2 Report.
Sheppard, A.C. 2014a. Emydoidea blandingii (Blanding's Turtle): Mass mortality. Herpetological Review 45: 312-313.
Sheppard, A.C. 2014b. Report to Ontario Parks, Northeast Zone. 36 pp.
Shoemaker, K. T., A.R. Breisch, J.W. Jaycox et J.P. Gibbs. 2013. Reexamining the minimum viable population concept for long-lived species. Conservation Biology 27: 542-551.
Sicliano, S.D., A. Sangster, C.J. Dauhney, L. Loseto, J.L. Germida, A.N. Rencz, N.J. O’Driscoll et D.R. Lean. 2003. Are mercury concentrations in the wetlands of Kejimkujik National Park, Nova Scotia, Canada, dependent on geology? Journal of Environmental Quality 32: 2085-2094.
Spinks P.Q. et H.B. Shaffer. 2005. Rangewide molecular analysis of the western pond turtle (Emys marmorata): cryptic variation, isolation by distance, and their conservation implications. Molecular Ecology 14: 2047-2064.
Standing, K.L., T.B. Herman et I.P. Morrison. 1999. Nesting ecology of Blanding’s Turtle (Emydoidea blandingii) in Nova Scotia, the northeastern limit of the species range. Canadian Journal of Zoology 77: 1609-1614.
Standing, K.L., T.B. Herman, D.D. Hurlburt et I.P. Morrison. 1997. Postemergence behaviour of neonates in a northern peripheral population of Blanding’s turtle, Emydoidea blandingii, in Nova Scotia. Canadian Journal of Zoology 75: 1387-395.
Standing, K.L., T.B. Herman, M. Shallow, T. Power et I.P. Morrison. 2000. Chelonian Conservation and Biology 3:637-642.
Steen, D.A., M.J. Aresco, S.G. Beilke, B.W. Compton, E.P. Condon, C.K. Dodd Jr., H. Forrester, J.W. Gibbons, J.L. Greene, G. Johnson, T.A. Langen, M.J. Oldham, D.N. Oxier, R.A. Saumure, F.W. Schueler, J.M. Sleeman, L.L. Smith, J.K. Tucker et J.P. Gibbs. 2006. Relative vulnerability of female turtles to road mortality. Animal Conservation 9:269-273.
Steinberg, B. comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Octobre 2014. Species at Risk Biologist, Ministère des Richesses naturelles et des Forêts de l’Ontario, Algonquin Provincial Park, Whitney (Ontario).
Steyermark, A.C. et J.R. Spotila. 2001. Effects of maternal identity and incubation temperature on Snapping Turtle (Chelydra serpentina) growth. Functional Ecology 15: 624-632.
St-Hilaire, D. 2003. Rapport sur la situation de la tortue mouchetee (Emydoidea blandingii blandingii) au Québec. Société de la faune et des parcs du Québec,Direction de l’aménagement de la faune de l’Outaouais. 27 pages.
St-Hilaire, D., J. Caron et Y. Dubois. 2013. Données de 1996 à 1999 sur la capture, la morphométrie, les déplacements et les habitats fréquentés par la tortue mouchetée (Emys blandingii). Ministère des Ressources naturelles, Direction de l’expertise Faune - Forêts, région de l’Outaouais. 65 p.
The Province of Nova Scotia. 2013. Our Parks and Protected Areas: A Plan for Nova Scotia. The Department of Natural Resources and Nova Scotia Environment, Nova Scotia, 57 pp.
Thompson, S. comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Octobre 2014. District Ecologist, Ministère des Richesses naturelles et des Forêts de l’Ontario, district de Kemptville, Kemptville (Ontario).
Toews, D. 2004. Quantification of fine scale genetic structure in a peripheral populations of Blanding's turtle (Emydoidea blandingii) in Nova Scotia. Mémoire de baccalauréat ès sciences. Acadia University, Wolfville NS. 38 pp.
Toussaint, D., comm. pers., 2014. Correspondance par courriel adressée à T.Piraino. Biologiste, ministère des Forêts, de la Faune et des Parcs, Gatineau (Québec).
Upper Thames River Watershed Report Cards. 2012. Upper Thames River Conservation Authority.
U.S. Fish and Wildlife Service. 2015. Valentine National Wildlife Refuge, Nebraska [disponible an anglais seulement, consulté en août 2015].
van Dijk, P.P. et A.G.J. Rhodin. 2013. Emydoidea blandingii. The IUCN Red List of Threatened Species 2013: e.T7709A12843518.
Walston, L., S.J. Najjar, K.E. LaGory et S.M. Drake. 2015. Spatial ecology of Blanding's Turtles (Emydoidea blandingii) in southcentral New Hampshire with implications to road mortality. Herpetological Conservation and Biology 10:284-296.
Watters, D. 2003. Wasaga Beach 2002 building activity highest yet.
Weisrock, D.W. et Janzen, F.J. 1999. Thermal and fitness-related consequences of nest location in Painted Turtles (Chrysemys picta). Functional Ecology 13:94-101.
Weller, W.F. 1973. Unpublished data from Canadian Wildlife Service. London, Ontario.
Wilcox, K.L., S.A. Petrie, L.A. Maynard et S.W. Meyer. 2003. Historical distribution and abundance of Phragmites australis at Long Point, Lake Erie, Ontario. Journal of Great Lakes Research 29:664-680.
Wild Species. 2010. The general status of species in Canada. (Version PDF; 4.8 MB) [consulté en septembre 2015]. (Également disponible en français : « Espèces sauvages. 2010. Les espèces sauvages 2010 : la situation générale des espèces au Canada. (Version PDF; 4.9 MB) ».)
Woods, S. 2014. Report submitted to Ontario Ministry of Natural Resources Species at Risk Stewardship Fund. 75 pp.
Wu, J. comm. pers., 2014. Correspondance par courriel adressée à T. Piraino. Septembre 2014. Agente de projet scientifique, Secrétariat du COSEPAC, Service canadien de la faune, Environnement Canada, Gatineau (Québec).
Yagi A.R, A.Brant et R.Tervo. 2009. Niagara Region Natural Areas Inventory Reptile and Amphibian Study 2006 to 2008. Ontario Ministry of Natural Resources and Land Care Niagara unpublished report for the Natural Areas Inventory prepared for the Niagara Peninsula Conservation Authority 78pp incl. separate Map Appendix.
Yagi, A., comm. pers., 2013. Correspondance par courriel adressée à T. Piraino. Septembre 2013. Management Biologist, ministère des Richesses naturelles de l’Ontario, Vineland (Ontario).
Sommaire biographique du ou des rédacteurs du rapport
Teresa Piraino travaille comme experte-conseil en écologie au sein du MMM Group Limited (une entreprise de WSP) à Kitchener, en Ontario. Elle compte 17 ans d’expérience sur le terrain dans le cadre de travaux de recherche sur les espèces en péril et de relevés d’espèces sauvages dans l’ensemble de l’Ontario. Au fil des ans, elle a acquis une expérience approfondie de la recherche sur le terrain concernant bon nombre des reptiles de l’Ontario, dont la tortue mouchetée, la tortue ponctuée, la tortue molle à épines, la tortue géographique, la chélydre serpentine et la tortue peinte du Centre, de même que la couleuvre fauve de l’Est, la couleuvre à nez plat et la couleuvre royale. Madame Piraino siège comme conseillère au sein de l’Ontario Turtle Conservation Group et est l’auteure du rapport de situation du COSEPAC sur la tortue-molle à épines (mise à jour; 2015) et du rapport de situation du COSEPAC sur la tortue géographique (mise à jour; 2012). Elle corédige également le document à venir intitulé IUCN Chelonian Research Monographs: Spotted Turtle Species Account (en préparation).
Jeffie McNeil est la biologiste des espèces en péril et coordonnatrice de la recherche au Mersey Tobeatic Research Institute. Elle est coprésidente de l’équipe de rétablissement des tortues mouchetées de la Nouvelle-Écosse et compte 20 ans d’expérience sur le terrain concernant cette espèce. Elle a obtenu une maîtrise en biologie de l’Université Acadia en 2002, et son mémoire portait sur l’écologie de la tortue mouchetée en Nouvelle-Écosse. Elle a été l’auteure principale des documents suivants : Programme de rétablissement de la population néo-écossaise de tortues mouchetées (Emydoidea blandingii) au Canada(2012), Programme de rétablissement de la population de l’Atlantique des couleuvres minces (Thamnophis sauritus) au Canada (2008), Action Plan for Mainland Moose (2007) de la Nouvelle-Écosse et rapport de situation du COSEPAC sur la couleuvre mince (mise à jour; 2012).